Некодирующий иммуномодулирующий конструкт днк с ковалентно закрытой структурой - RU2668387C2
Код документа: RU2668387C2
Чертежи
Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Изобретение относится к конструкту ДНК с ковалентно закрытой структурой, фармацевтической композиции и вакцине, а также к их применению для модуляции иммунной системы.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ
[0002] Используемый в описании настоящей патентной заявки термин «иммунотерапия» относится к лечению заболеваний за счет индуцирования, усиления или подавления иммунного ответа. Стратегией иммунотерапии является борьба с такими заболеваниями, как рак, инфекционные заболевания, аллергии и астма.
[0003] Известно множество активных агентов, так называемых иммуномодуляторов, которые могут быть использованы в иммунотерапии. К этим известным иммуномодуляторам принадлежат последовательности специфических ДНК. Самые известные иммуномодулирующие короткие последовательности ДНК содержат неметилированный мотив цитозингуанин (CG мотив), который описан Krieg et al. (Nature 1995 374: 6522 546-549). Проявление неметилированных CG мотивов по существу подавлено в геноме эукариот по сравнению с прокариотами или вирусами. Следовательно, молекулы ДНК, содержащие такой мотив, выступают как естественный «сигнал опасности» и запускают иммунную систему на борьбу с прокариотическими или вирусными патогенами. Это может быть использовано терапевтически или профилактически за счет использования таких последовательностей для лечения или профилактики инфекционных или неинфекционных заболеваний.
[0004] Конструкты ДНК, содержащие неметилированные CG мотивы, способны оказывать значительное физиологическое воздействие за счет сильной стимуляции клеток-эффекторов врожденной иммунной системы, включая дендритные клетки, макрофаги, естественные клетки-киллеры (NK) и NKT клетки. Неметилированные CG мотивы определяются Toll-подобными рецепторами 9 (TLR9) - паттерн-распознающими рецепторами врожденной иммунной системы. Хотя точный механизм распознавания еще полностью не установлен, достигнут значительный прогресс в раскрытии основополагающих путей (A. Krieg, Nat. Rev. Drug Disc, 5: 471-484, 2006).
[0005] Предполагается, что при связывании конструктов ДНК, содержащих неметилированные CG, с рецептором в реактивных клетках активируется сложный сигнальный каскад. Адаптивный иммунитет индуцирован за счет повышенной регуляции специфических поверхностных молекул и по существу Th1 паттерна секреции цитокинов. Такие конструкты могут быть использованы в комбинации, например, с антителами, химиотерапией или радиационной терапией, вакцинами или цитокинами. Аллергические заболевания и астма являются главным образом Th2-опосредованными. За счет повышения соотношения Th1/Th2 Th2-опосредованные ответы ослабляются и, следовательно, эти типы заболеваний могут лечиться или может осуществляться их профилактика.
[0006] Поверхностные молекулы включают, например, CD40, CD69, CD80 или CD86, в зависимости от типа специфических клеток. Секреция цитокинов также специфична для различных типов клеток; цитокины включают, например, воспалительный белок макрофагов (MIP)-1 альфа, MIP-1 бета, интерлейкин (IL)-6, IL-8, интерферон (IFN)-альфа, фактор некроза опухоли (TNF)-альфа, IFN-гамма, моноцитарный хемотаксический белок (МСР)-1 или IFN-гамма-индуцируемый белок 10 кДа (IP-10).
[0007] Вакцинация показала себя как очень эффективное средство для профилактики или лечения заболеваний. Для того чтобы гарантировать сильный и длительный иммунный ответ, как правило, вместе с антигеном вводят адъюванты, способные стимулировать антиген презентирующие клетки, такие как дендритные клетки, и для этой цели TLR9 агонисты проявили себя сильными иммуностимуляторами.
[0008] Доклинические и клинические исследования подтверждают применение агонистов TLR-9 в качестве иммуномодуляторов и/или адъювантов, и доказывают их противоопухолевый эффект за счет усиления обоих, и гуморального, и клеточного ответов.
[0009] Независимо от любых объяснений основополагающих механизмов, за счет которых неметилированные CG мотивы влияют на иммунный ответ или модулируют иммунный ответ, было разработано множество подходов для модуляции иммунной системы при использовании таких мотивов. В WO 1998/018810 описывается, что иммуностимулирующие последовательности, содержащие неметилированные CG мотивы, даже более эффективны, когда они являются частью одноцепочечной ДНК. Однако введение одноцепочечных с открытой цепью ДНК молекул практически не осуществимо из-за быстрой деградации одноцепочечных нуклеиновых кислот. Следовательно, были разработаны различные способы защиты одно- или двухцепочечных конструктов ДНК, содержащих неметилированный CG мотив.
[0010] Для достижения устойчивости к расщеплению ДНК нуклеазами фосфодиэфирные связи в скелете полимера нуклеиновой кислоты часто модифицируют до тиофосфатов. Помимо несколько меньшей стимулирующей активности такие тиофосфатзащищенные нуклеиновые кислоты в клинических исследованиях в последние годы показали, что токсичность тиофосфатной защиты исключает или очень сильно ограничивает применение таких нуклеиновых кислот в фармацевтических композициях или лекарственных средствах.
[0011] Из 4 классов известных активаторов с различными иммуномодулирующими профилями все члены, кроме одного, содержат линейные молекулы ДНК. Исключение описано, например, в ЕР 1196178. В этом документе описываются короткие молекулы дезоксирибонуклеиновой кислоты, содержащие частично одноцепочечные, гантелеобразные, ковалентно закрытые последовательности нуклеотидных остатков, содержащих CG мотивы («dSLIM»), состоящих полностью из природной ДНК. Согласно описанию ЕР 1196178 CG мотивы расположены в одноцепочечных петлях на обоих концах двухцепочечного стебля описанной молекулы или в двухцепочечном стебле. Одноцепочечные шпилечные петли защищают двухцепочечный стебель от разрушения ДНК нуклеазами внутри или снаружи клетки. В документе США 2009/0053250 А1 описываются такие гантелеобразные молекулы с ковалентно закрытой структурой, содержащие CG мотивы, в комбинации с химеотерапевтическими лекарственными средствами. В документе США 2007/0049546 А1 описываются гантелеобразные молекулы с ковалентно закрытой структурой, содержащие CG мотивы, ковалентно связанный с одним или более заместителем. В публикации «Schmidt М. et al., 2006, «Cytokine and Ig-production by CG-containing sequences with phosphorodiester backbone and dumbbell shape», Allergy, Vol. 61, pp. 56-63» предполагается, что такие гантелеобразные молекулы с ковалентно закрытой структурой, содержащие определенные CG, могут быть использованы для лечения аллергических заболеваний.
[0012] В документе WO 2010/039137 описаны иммунорегулирующие олигонуклеотиды в качестве антагонистов TLR опосредованных заболеваний с одной или более химической модификацией в последовательности, фланкирующей иммуностимулирующий мотив, и/или в олигонуклеотидном мотиве, который был бы иммуностимулирующим, но для целей модификации. Следовательно, целью описанных в WO 2010/039137 олигонуклеотидов является подавление иммунного ответа, вызванного TLR.
[0013] В WO 2005/042018 описан новый, так называемый С-класс CpG олигонуклеотидов, где С-класс олигонуклеотидов характеризуется CpG последовательностями, как правило, расположенными на или вблизи 5' конца или 3' конца молекулы, и GC-мотив богатый палиндромами, как правило, расположен на или вблизи другого конца молекулы. В документе описываются варианты палиндромной последовательности ДНК С-класса.
[0014] В указанной выше публикации «А. Krieg, Nat. Rev. Drug Disc, 5:471-484, 2006» описаны различные классы CpG олигодезоксинуклеотидов и их эффекты, но не описаны гантелеобразные молекулы с ковалентно закрытой структурой, содержащие CG мотивы, которые позволяют избежать тиофосфатной модификации.
[0015] В WO 2004/000873 описываются тиофосфат модифицированные одноцепочечные ДНК, содержащие CG, которые могут быть добавлены в качестве алъюванта для слияния пептидов. В этом документе не описываются гантелеобразные молекулы с ковалентно закрытой структурой, содержащие CG мотивы.
[0016] Аналогино, в US 2003/0050263 описываются олигонуклеотиды, содержащие CG, в контексте лечения ВИЧ-инфекций, но не описываются гантелеобразные молекулы с ковалентно закрытой структурой, содержащие CG мотивы в контексте последовательностей.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0017] Настоящее изобретение относится к альтернативным иммуномоделирующим конструктам ДНК с высоким иммуномоделирующим потенциалом, стабильным после перемещения в эукариотические клетки и без вредных побочных эффектов.
[0018] Настоящее изобретение относится к конструкту ДНК для иммуномодуляции, состоящему из частично одноцепочечных, гантелеобразных остатков ДНК с ковалентно закрытой структурой цепи, дважды содержащей частично гидролизованную последовательность ДНК SEQ ID NO: 1.
[0019] Другим вариантом воплощения настоящего изобретения является конструкт, в котором одноцепочечная петля содержит три CG-мотива.
[0020] Дополнительно настоящее изобретение относится к конструкту ДНК, где каждый CG-мотива с обоих сторон фланкирован дезокситимидином.
[0021] Дополнительно, одноцепочечная петля конструкта по настоящему изобретению имеет по меньшей мере 50% содержание пиримидина. Такой конструкт может содержать в качестве пиримидина дезокситимидин.
[0022] В другом варианте воплощения настоящего изобретения конструкт содержит по меньшей мере один нуклеотид, модифицированный функциональной группой, выбранной из группы, состоящей из карбоксильной, аминной, амидной, альдиминной, кетальной, ацетальной, сложного эфира, простого эфира, дисульфидной, тиоловой и альдегидной группы.
[0023] Дополнительно, модифицированный нуклеотид может быть связан с соединением, выбранным из группы, состоящей из пептидов, белков, углеводов, антител, липидов, мицелл, везикул, синтетических молекул, полимеров, микрочастиц, частиц металлов, наночастиц или твердой фазы.
[0024] Другой объект настоящего изобретения относится к фармацевтической композиции, содержащей указанный выше конструкт ДНК. Дополнительно фармацевтическая композиция может содержать химиотерапевтический химиотерапевтический агент.
[0025] Другой объект настоящего изобретения относится к вакцине, содержащей указанный выше конструкт ДНК или фармацевтическую композицию, содержащую указанный конструкт ДНК. Дополнительно вакцина может содержать конструкт ДНК в качестве адъюванта.
[0026] Другой объект настоящего изобретения относится к применению конструкта ДНК по любому из пунктов 1-7, фармацевтической композиции по пунктам 8 или 9 или вакцине по пунктам 10 или 11 для лечения рака или аутоиммунных заболеваний.
[0027] Применение конструкта ДНК по любому из пунктов 1-7, фармацевтической композиции по пунктам 8 или 9 или вакцины по пунктам 10 или 11 для модуляции иммунной системы.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0028] Используемый в описании настоящей патентной заявки термин конструкт ДНК не ограничивает длину соответствующей ДНК последовательности. Мономерные единицы конструктов ДНК представляют нуклеотиды.
[0029] Конструкт ДНК может быть получен синтетически или частично или полностью может быть биологического происхождения, где биологическое происхождение относится к генетическим способам получения последовательностей ДНК.
[0030] Используемый в описании настоящей патентной заявки термин «стебель» относится к двухцепочечной ДНК, образованной спариванием оснований в той же самой молекуле ДНК (которая тогда частично самокомплементарна) или в других молекулах ДНК (которые частично или полностью комплементарны). Внутримолекулярное спаривание оснований означает спаривание оснований в тех же самых молекулах, а спаривание оснований между другими молекулами ДНК определяется, как межмолекулярное спаривание оснований.
[0031] Используемый в описании настоящей патентной заявки термин «петля» относится к неспаренной, одноцепочечной области внутри или на конце структуры стебля. Используемый в описании настоящей патентной заявки термин «шпилька» относится к отличающейся комбинации стебля и петли, которая имеет место, когда две самокомлементарных области одной и той же молекулы ДНК гибридизуются с образованием стебля с неспаренной петлей. Гантелеобразная форма описывает линейный конструкт ДНК со шпильками на обоих концах, фланкирующих область стебля. Таким образом, «линейный конструкт ДНК» в контексте настоящего изобретения описывается как линейный с открытой цепью конструкт ДНК, содержащий одно- или двухцепочечную ДНК, или как линейный гантелеобразный конструкт ДНК, содержащий одноцепочечные петли на обоих концах двухцепочечной ДНК стебля.
[0032] Используемый в описании настоящей патентной заявки термин «твердая фаза», к которой нуклеотиды ковалентно или не ковалентно прикреплены, относится без ограничения к колонке, матрице, гранулам, стеклу, включая модифицированное или функционализированное стекло, кремнию или материалам на основе кремния, включая силикон и модифицированный силикон, пластикам (включая, полипропилен, полиэтилен и сополимеры стирола и другие материалы, акрилы, полибутилен, полиуретаны и тому подобное), нейлону или нитроцеллюлозе, смолам, полисахаридам, углероду, а также неорганическому стеклу, металлам, наночастицам и пластикам. Таким образом, микротитрационные планшеты также входят в объем твердой фазы по настоящему изобретению.
[0033] Иммуномодуляция по настоящему изобретению относится к иммуностимуляции и иммуносупрессии. Иммуностимуляция предпочтительно означает, что клетки-эффекторы иммунной системы стимулированы для пролиферации, миграции, дифференцировки или проявления активности в любой другой форме. Пролиферация клеток, например, может быть индуцирована без костимулирующих сигналов при использовании иммуностимулирующих молекул ДНК, которые в норме требуют костимулирующего сигнала от хелперных Т-клеток.
[0034] С другой стороны, иммуносупрессию следует понимать, как снижение активности или эффективности иммунной системы. Иммуносупрессия специально индуцирована для профилактики, например, отторжения трансплантированных органов, лечения реакции трансплантант против хозяина после трансплантации костного мозга или для лечения аутоиммунных заболеваний, например, ревматоидных артритов или болезни Крона.
[0035] В этом контексте иммуностимуляция также может относиться к воздействию на природу или характер иммунной реакции, либо воздействию на иммунную реакцию, которая все еще развивается или созревает или к модуляции характера устойчивой иммунной реакции.
[0036] Используемый в описании настоящей патентной заявки термин «вакцинация» относится к введению антигенного материала (вакцина) с получением иммунитета к заболеванию. Вакцины могут предотвратить или улучшить последствия инфицирования множеством патогенов таких, как вирусы, грибки, простейшие паразиты, бактерии, а также аллергические заболевания и астма, наряду с опухолями. Как правило, вакцины содержат один или более адъювант, например, иммуностимулирующие нуклеиновые кислоты, используемые для стимуляции иммунного ответа. Общепринято, что вакцины являются самым эффективным и самым экономичным способом профилактики инфекций и заболеваний.
[0037] Вводимый материал может, например, представлять живые, но ослабленные формы патогенов (бактерии или вирусы), убитые или инактивированные формы этих патогенов, очищенный материал, такой как белки, нуклеиновые кислоты, кодирующие антигены, или клетки, такие как клетки опухоли или дендритные клетки. В частности, недавно была разработана ДНК вакцинация. ДНК вакцинация работает за счет вставки (и экспрессии, запуска распознавания иммунной системой) ДНК, кодирующей антигены, в клетки человека или животного. Некоторые клетки иммунной системы, которые распознают экспрессированные белки, атакуют эти белки, и клетки, экспрессирующие их. Одним из преимуществ ДНК вакцин является простота их получения и хранения. Дополнительно, ДНК вакцины имеют множество преимуществ по сравнению с традиционными вакцинами, включая способность индуцировать широкий ряд типов иммунных ответов.
[0038] Вакцинация может быть использована в качестве профилактики, позволяющей создать иммунитет против антигена у вакцинированного здорового индивидуума после воздействия антигена. В качестве альтернативы, терапевтическая вакцинация может вызвать усиленный ответ иммунной системы вакцинированного больного индивидуума, направляя иммунную систему индивидуума против антигенов. Обе, и профилактическая и терапевтическая вакцинация, могут быть применены для людей и животных.
[0039] Используемый в описании настоящей патентной заявки термин «генная терапия» относится к временной или постоянной генетической модификации (например, вставка, изменение или удаление генов) клеток и/или биологических тканей индивидуума для лечения заболеваний, таких как опухоли или аутоиммунные заболевания. Самая распространенная форма генной терапии включает вставку функциональных генов в неспецифическую геномную локализацию для замещения мутированного гена, но другие формы включают непосредственное корректирование мутации или модифицирование нормального гена, которое создает условия для транскрипции вирусов или даже перемещение гена или фрагмента гена в клетку для его транскрипции.
[0040] Используемый в описании настоящей патентной заявки термин «аутогенная генная терапия» относится к применению тканей или клеток самого индивидуума. Выделенные клетки или ткани модифицируют при использовании генной терапии и повторно вводят донору. В противоположность, «аллогенная генная терапия» относится к применению клеток для генной терапии от индивидуума иного, чем индивидуум-акцептор. После генной модификации аллогенные клетки вводят акцептору.
[0041] Используемый в описании настоящей патентной заявки термин «ex-vivo генная терапия» относится к терапии, при которой клетки от индивидуума, например, гематопоэтические стволовые клетки или гематопоэтические клетки-предшественники генетически модифицируют ex vivo и затем вводят лечимому индивидууму. Используемый в описании настоящей патентной заявки термин «in-vivo генная терапия» относится к терапии, при которой клетки от индивидуума, например, гематопоэтические стволовые клетки или гематопоэтические клетки-предшественники генетически модифицируют in vivo при использовании, например, вирусных векторов или других конструктов экспрессии.
[0042] Генная терапия также может быть классифицирована, как «генная терапия с использованием клеток зародышевой линии» и «генная терапия соматических клеток». В случае «генной терапии с использованием клеток зародышевой линии», зародышевые клетки, то есть сперму и яйцеклетки, генетически модифицируют. Генетические изменения, как правило, интегрированы в их геномы. Следовательно, изменения, вызванные терапией, будут наследственными и перейдут последующим поколениям. Этот подход используют для лечения генетических заболеваний и наследственных заболеваний. В случае «генной терапии соматических клеток» терапевтические гены перемещают в соматические клетки индивидуума. Любые модификации и эффекты будут ограниченны только индивидуумом и не будут унаследованы потомками или последующими поколениями.
[0043] Используемый в описании настоящей патентной заявки термин «рак» относится к раковым заболеваниям или опухолям, лечимым или предотвращаемым, которые выбраны из группы, состоящей без ограничения из рака молочной железы, меланомы, неоплазии кожи, лимфомы, лейкемии, опухоли желудочно-кишечного тракта, включая карциномы толстой кишки, карциномы желудка, карциномы поджелудочной железы, колоректальный рак, рак тонкой кишки, карциномы яичников, карциному шейки матки, рак легких, рак простаты, почечно-клеточную карциному и/или метастазы в печени.
[0044] Аутоиммунные заболевания по настоящему изобретению включают ревматоидный артрит, болезнь Крона, системную красную волчанку (SLE), аутоиммунный тиреоидит, тиреоидит Хашимото, множественный склероз, диффузный токсический зоб, миастению гравис, целиакию и болезнь Аддисона.
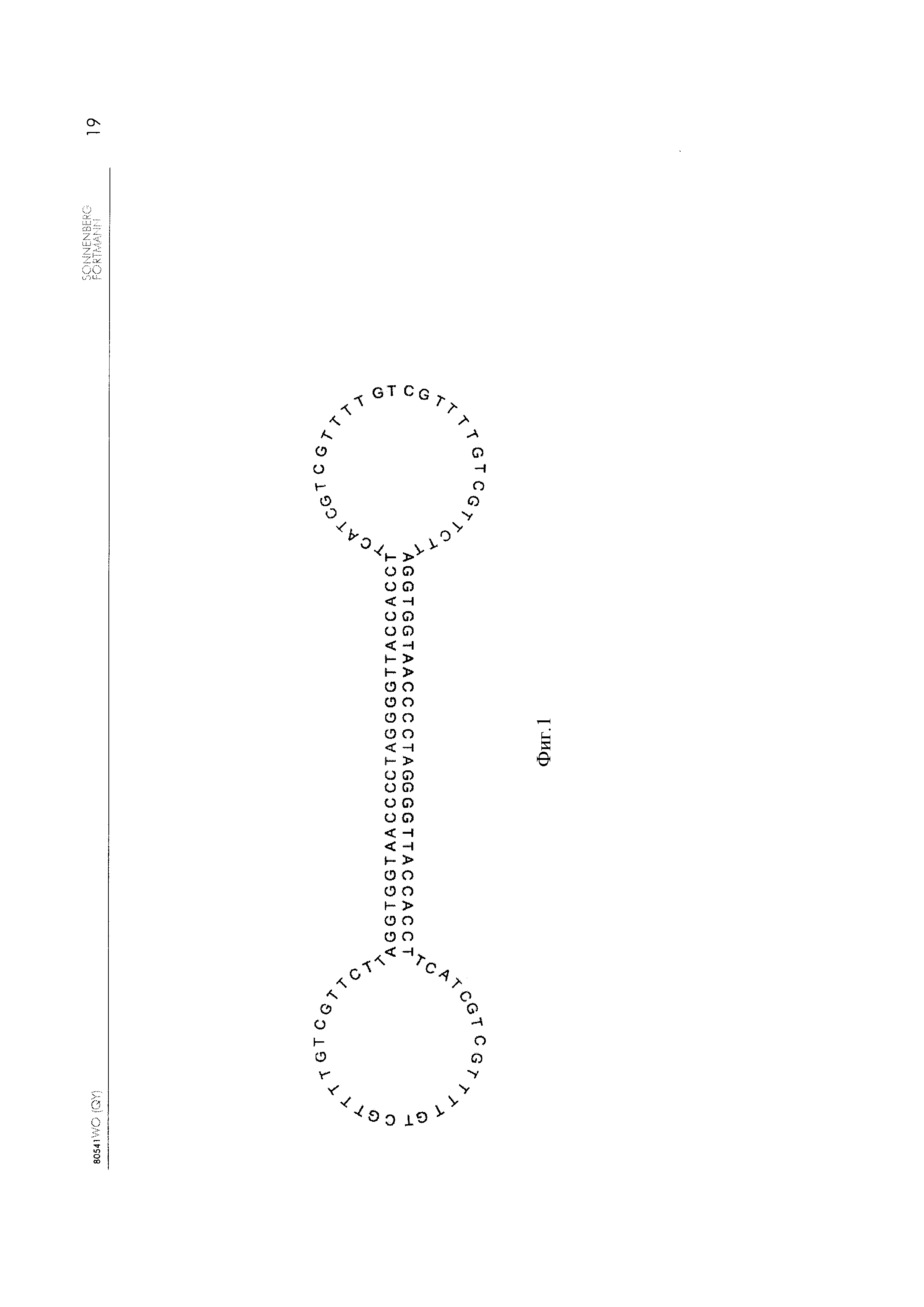
[0045] Настоящее изобретение относится к конструкту ДНК для иммуномодуляции, содержащему частично частично одноцепочечной, гантелеобразной цепи остатков ДНК с ковалентно закрытой структурой, дважды содержащей последовательность ДНК SEQ ID NO: 1. SEQ ID NO: 1 содержит CG мотивы и также так называемую ODN2006-петлю. Две олиго ODN2006-петли будут частично гибридизоваться и в результате образуется гантелеобразный линейный конструкт ДНК. Последовательность SEQ ID NO: 1 представляет следующее (сравнения на Фиг. 1):
5'-AGGTGGTAAC CCCTAGGGGT TACCACCTTC ATCGTCGTTT TGTCGTTTTG TCGTTCTT-3'
[0046] Эффект CG-содержащих конструктов ДНК зависит от их взаимодействия с TLR9. Как показано в Примерах и на чертежах, различия в профилях иммуномодуляции между классами агонистов TLR9 связаны в большей мере с их конформацией, чем с их индивидуальными нуклеотидными последовательностями, соответственно в контексте CG-мотивов.
[0047] Неожиданно индуцированный паттерн стимуляции гантелеобразного конструкта ДНК по настоящему изобретению отличается от паттерна стимуляции, индуцированного соответствующим линейным CG олигонуклеотидом или даже гантелеобразным конструктом ДНК, описанным в ЕР 1196178.
[0048] Неожиданно индуцированный паттерн стимуляции отличается даже от паттерна, индуцированного линейным тиофосфат-защищенным ДНК олиго ProMune (ODN2006). Последовательность ProMune является частью одно цепочечной петли конструкта ДНК по настоящему изобретению, усиливающей релеватность в контексте последовательности ДНК, содержащей CG-мотив.
[0049] Согласно настоящему изобретению CG мотив/ы расположен/ы в одноцепочечной и/или двуцепочечной области конструкта. Как указано в ЕР 1196178, CG мотивы способны вызвать иммунный ответ независимо от того, в одноцепочечную или двуцепочечную область молекулы они включены.
[0050] Дополнительно, настоящее изобретение включает химические модификации по меньшей мере одного нуклеотида функциональной группой, выбранной из группы, состоящей из карбоксильной, аминной, амидной, альдиминной, кетальной, ацетальной, сложного эфира, простого эфира, дисульфидной, тиоловой и альдегидной группы. Это позволяет связываться ДНК конструкту с соединением, выбранным из группы, состоящей из пептидов, белков, углеводов, антител, липидов, мицелл, визикул, синтетических молекул, полимеров, микрочастиц, частиц металлов, наночастиц или твердых фаз, посредством, например, адсорбции, ковалентного или ионного связывания. Модификация может быть подходящим образом выбрана для соответствующих целей. Следовательно, конструкт может быть использован, например, для переноски других молекул в специфические клетки, реагирующие на введенные CG мотив/ы. Дополнительно, возможно использование таких модификаций для связывания конструкта с микрочастицами, которые могут быть использованы для перемещения конструкта в клетку. Также конструкт может быть связан с твердой фазой, например, с микротитрационным планшетом.
[0051] Активация на основе Th1 включает активацию NK клеток и цитотоксических Т-клеток, и эти иммунные ответы ответы могут быть использованы для лечения рака. Поскольку ДНК конструкты, содержащие неметилированные CG мотивы, предпочтительно приводят к Th1 активации, конструкты по настоящему изобретению могут быть использованы для лечения рака. Продолжаются многочисленные клинические исследования применения TLR9 агонистов для лечения рака. Такие молекулы эффективно вводились по отдельности или в комбинации, например с радиационной терапией, хирургией, химиотерапией и криотерапией (Krieg, J. Clin. Invest. 2007 117: 1184-94). Предполагается, что ввиду сильной иммуномодуляции, малых размеров и стабильности конструкты по настоящему изобретению будут иметь в этом отношении огромные преимущества. Дополнительно, их отличающийся иммунологический профиль отличает их от других менее преимущественных TLR9 лигандов, и этот профиль может быть использован для ракспецифического лечения.
[0052] С другой стороны, TLR9 агонисты также участвуют в образовании регуляторных Т-клеток и, следовательно, могут быть использованы для лечения аутоиммунных заболеваний. Путь введения, по видимому, представляет одну из переменных, определяющих воздействие конструктов ДНК, содержащих CG мотивы in vivo (Krieg, J. Clin. Invest.2007 117: 1184-94).
[0053] Иммуностимулирующий эффект таких молекул ДНК, содержащих CG-мотивы, показал улучшение эффективности стандартных терапевтических подходов, таких как химеотерапия, при терапии рака. Следовательно, фармацевтические композиции, содержащие конструкты по настоящему изобретению, также входят в объем притязаний настоящего изобретения. Опять же преимущественные признаки конструктов по настоящему изобретению сравнимы с TLR9 агонистами предшествующего уровня техники, что делает конструкты по настоящему изобретению перспективными инструментами для лечения таких заболеваний, как рак, инфекционные заболевания, аллергии и астмы. Таким образом, лечение аллергий и астмы (главным образом Th2-опосредованных) более эффективно преимуществ Th1 активации.
[0054] Поскольку TLR9 агонисты показали себя как сильные адъюванты в вакцинах, вакцины, содержащие конструкт ДНК, также входят в объем притязаний настоящего изобретения. Конструкты по настоящему изобретению содержат релевантные последовательности для стимуляции TLR9 без необходимости введения модификаций для стабилизации ДНК, которые могут вызвать побочные эффекты. Более длительный период полураспада молекулы гарантирует эффективную стимуляцию, вызывая, таким образом, сильный иммунный ответ.
[0055] Для выявления эффекта использования конструктов ДНК были использованы следующие конструкты ДНК для приведенных в описании настоящей патентной заявки экспериментов (Таблица 1):
[0056]


КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0057] Далее описание настоящей патентной заявки будет приведено со ссылкой на иллюстрирующие Примеры и чертежи и неограничивающие варианты воплощения настоящего изобретения:
Фиг. 1 - Последовательность и структура конструкта ДНК 30L204;
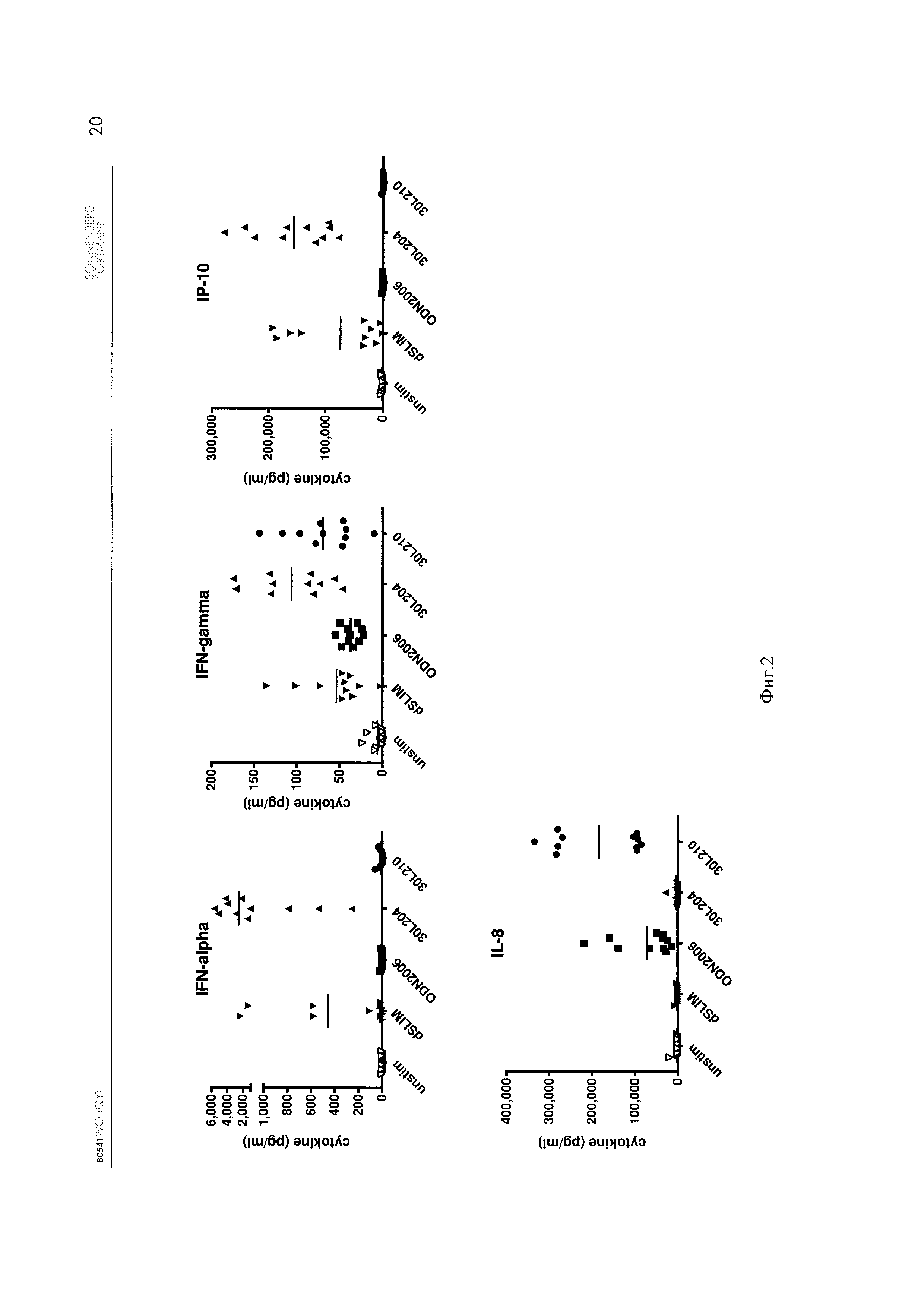
Фиг. 2 - Стимуляция РВМС цитокином;
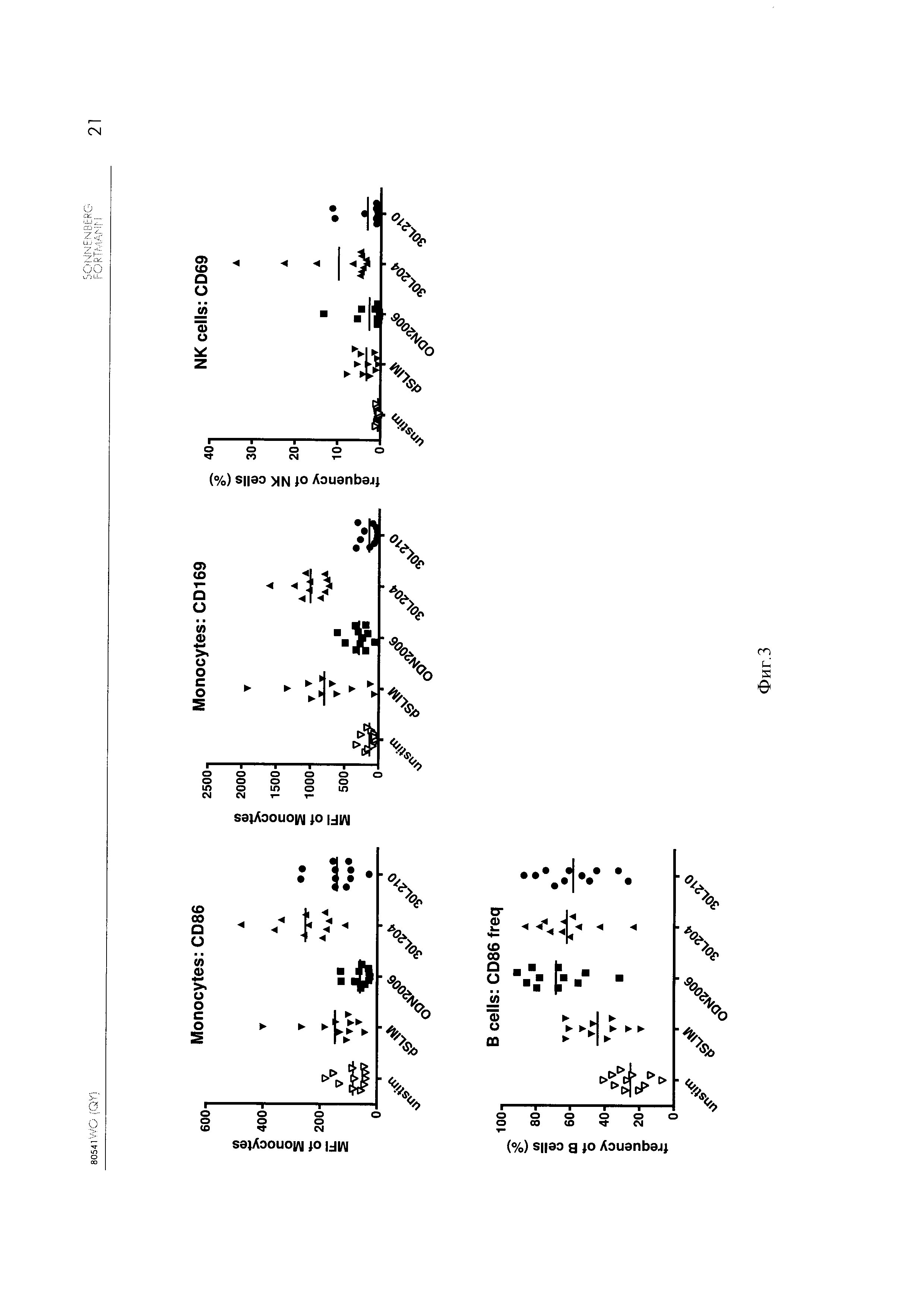
Фиг. 3 - Стимуляция моноцитов CD86 и CD 169, NK клеток CD69 и частота встречаемости CD86 в В клетках CD86.
ПОДРОБНОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0058] В ЕР 1196178 В1 описывается получение частично одноцепочечного, гантелеобразного конструкта ДНК с ковалентно закрытой структурой. Соответственно получен конструкт по настоящему изобретению.
[0059] На Фиг. 1 приведены структура и последовательность конструкта ДНК по настоящему изобретению.
[0060] На Фиг. 2 приведены результаты стимуляции РВМС 3 μМ указанного конструкта ДНК, приведенного в Таблице 1 выше.
[0061] Применение конструктов ДНК с тиофосфат модифицированными скелетами (ODN2006-2 and 30L210) не приводит к стимуляции IFN-альфа и IP-10. Неожиданно конструкт ДНК по настоящему изобретению (30L204) привел к значительно усиленной стимуляции цитокинами IFN-альфа и IP-10 по сравнению с уже известным гантелеобразным конструктом ДНК по ЕР 1 196 178 (dSLIM).
[0062] IFN-альфа известен в течение многих лет, как антивирусный цитокин. Он стимулирует развитие Th1 клеток, следовательно, промотирует эффекты ДНК молекул, содержащих CG. Также IFN-альфа демонстрирует противоопухолевую активность к опухоли ранней стадии развития у мышей и людей и способен снижать онкогенность трансплантированных опухолевых клеток, частично за счет активирования цитотоксичных Т клеток и, следовательно, повышения вероятности цитолиза опухолевых клеток. Активность NK клеток и макрофагов, обе также важны для противоопухолевой цитотоксичности и также повышаются за счет IFN-альфа (Brassard et al., J. Leukoc. Biol. 2002 71: 565-81). Следовательно, увеличение количества IFN-альфа при стимуляции конструктами ДНК по настоящему изобретению будет способствовать лечению рака.
[0063] Недавно было продемонстрированно, что IP-10 является сильным ангиостатическим белком in vivo. Следовательно, также является преимуществом индуцирование IP-10 по существу в лечении опухолевых заболеваний.
[0064] Стимуляция IFN-гамма также усиливается конструктом ДНК по настоящему изобретению по сравнению с dSLIM. Находящаяся на рассмотрении последовательность 30L210 стимулирует IFN-гамма, а также его секрецию, но также следует принимать во внимание, что 30L210 имеет тиофосфатный скелет, который может вызывать тяжелые побочные эффекты. Следовательно, конструкт ДНК по настоящему изобретению благоприятен с точки зрения безопасности.
[0065] IL-8 стимулируется обоими конструктами ДНК с тиофосфатными скелетами (ODN2006-2; 30L210). Следовательно, наблюдаемый эффект может быть вызван этой модификацией. Конструкт ДНК по настоящему изобретению не увеличивает продуцирование IL-8, что является благоприятным.
[0066] IL-8 является провосполительным цитокином, который, как известно, опосредует активацию и миграцию нейтрофилов в ткани из периферической крови. Возникающая в результате нейрофильная инфильтрация может быть частично ответственна за ингибирование роста опухоли, как было показано для рака яичников (Lee et al., J. Immunol. 2000 164: 2769-75). Дополнительно, IL-8 также гемотоксичен для Т клеток и базофил. Следовательно, для лечения и профилактики по меньшей мере некоторых типов опухолей преимущественной является селективная повышающая регуляция IL-8 в ответ на конструкты ДНК, содержащие CG. С другой стороны, было установлено, что IL-8 запускает ангиогенез, индуцируя таким образом, секрецию IL-8, что может быть контрпродуктивно. Следовательно, степень дифференцировки индукции IL-8 различными молекулами ДНК по настоящему изобретению позволяет получить наиболее подходящую молекулу для достижения заданных терапевтических эффектов.
[0067] Следовательно, специфический паттерн цитокина, индуцированный конструктом ДНК по настоящему изобретению, эффективен для лечения или профилактики опухолей различных типов. Очевидно, специфический контекст, в котором неметилированный CG мотив вводят в TLR9, включая конформацию конструкта ДНК, определяет индивидуальный соответствующий паттерн стимуляции, индуцированный в отвечающих клетках.
[0068] На Фигуре 3 приведена стимуляция моноцитов конструктами ДНК, приведенными в Таблице 1. Конструкт ДНК по настоящему изобретению улучшает активацию моноцитов относительно CD86 и CD 169 по сравнению с dSLIM и тиофосфат-защищенным линейным олиго ODN2006-2. Наилучшая активация CD69 в NK клетках также достигается при использовании конструкта ДНК по настоящему изобретению.
[0069] Хотя активация моноцитов и NK клеток более или менее сравнима с линейным ODN2006, также следует принимать во внимание, что этот олиго имеет тиофосфатный скелет, который может вызвать тяжелые побочные эффекты.
[0070] Активация В клеток более или менее сравнима с линейным ODN2006-2 и гантелеобразным конструктом ДНК по настоящему изобретению. Сравнение двух гантелеобразный конструктов ДНК dSLIM и 30L204 показало, что 30L204 неожиданно гораздо более сильный активатор, чем dSLIM.
[0071] В заключении, эксперименты показали, что гантелеобразный конструкт ДНК по настоящему изобретению неожиданно явился более лучшим активатором иммуноцитов по сравнению с уже известным гантелеобразный конструктом ДНК dSLIM и линейным олигодезоксинуклеотидом ODN2006 (PROMUNE®). Неожиданным явилось то, что введение последовательности ДНК ODN2006 без тиофосфата в одноцепочечные петли гантелеобразных линейных конструктов ДНК привело к улучшению иммуномоделирующего потенциала.
[0072] ODN2006 (ProMune®) и dSLIM оба известны, как сильные иммуномодуляторы. Введение тиофосфата ODN2006 в одноцепочечные петли dSLIM не делает его эффективным иммуномодулятором (Сравнение IFN-альфа и IP-10 приведено на Фигуре 1). Конструкт ДНК по настоящему изобретению с последовательностью ODN2006 с фосфодиэфирными связями в одноцепочечных петлях в результате приводит к получению нового конструкта с эффективностью, которая выходит за пределы просто добавления эффектов ODN2006 и dSLIM. Следовательно, можно заключить, что конструкт ДНК по настоящему изобретению является новым агонистом TLR-9, который может быть использован для лечения рака или аутоиммунных заболеваний за счет повышения секреции цитокина центрального противоракового цитокина IFN-альфа, сильного ангиостатического цитокина IP-10, или IFN-гамма, ключевого активатора NK-, NKT-, и цитотоксической Т-клеточной иммунной реакции.
[0073] Также можно видеть, что конструкт ДНК по настоящему изобретению является сильным регулятором, повышающим активность поверхностных маркеров релевантных клеток субпопуляций РВМС, включая CD80 pDCs, CD86 В-клеток, CD86 и CD169 моноцитов, CD69 NK-, NKT-наряду с Т-клетками.
Реферат
Изобретение относится к области биотехнологии. Описан конструкт ДНК для иммуномодуляции, состоящий из частично одноцепочечной, гантелеобразной цепи остатков ДНК с ковалентно закрытой структурой, дважды содержащей частично гибридизованную последовательность ДНК SEQ ID NO: 1. Также описаны фармацевтическая композиция и вакцина, содержащие вышеуказанный конструкт, и применение конструкта в фармацевтической композиции и вакцине. Изобретение позволяет модулировать иммунную систему и лечить аутоиммунные заболевания. 6 н. и 7 з.п. ф-лы, 3 ил., 1 табл.
Формула
Документы, цитированные в отчёте о поиске
Конъюгаты пептида melan-a, аналога вирусоподобной частицы

Комментарии