Векторы aav, нацеленные на центральную нервную систему - RU2727015C2
Код документа: RU2727015C2
Чертежи






Описание
Заявление о приоритете
[0001] По настоящей заявке испрашивается приоритет временной заявки на патент США No. 62/082897, поданной 21 ноября 2014, и временной заявки на патент США No. 62/218857, поданной 15 сентября 2015, полное содержание каждой из которых приведено в настоящем описании в качестве ссылки.
Область техники, к которой относится изобретение
[0002] Изобретение относится к химерным капсидам AAV, нацеленным на центральную нервную систему, к содержащим их вирусным векторам и к способам применения векторов для нацеливания на центральную нервную систему. Изобретение, кроме того, относится к химерным капсидам AAV, нацеленным на олигодендроциты, к содержащим их вирусным векторам и к способам применения векторов для нацеливания на олигодендроциты.
Уровень техники
[0003] Эффективная трансдукция мышц аденоассоциированным вирусом (AAV) впервые опубликована более десяти лет назад (Xiao et al., (1996) J. Virol. 70:8098-8108). Геном рекомбинантного AAV (р-AAV), состоящей из чужеродной экспрессирующей кассеты и последовательностей инвертированных концевых повторов (ITR) AAV, существует в эукариотических клетках в эписомальной форме, ответственной за перситентную экспрессию трансгена (Schnepp et al., (2003) J. Virol. 77:3495-3504). Векторы AAV обладают хорошим профилем безопасности. Ни одно из заболеваний человека не было ассоциировано с инфекцией AAV дикого типа, и низкую токсичность наблюдали у субъектов-людей после трансдукции р-AAV (Manno et al., (2003) Blood 101:2963-2972).
[0004] Векторы AAV использовали в клинических исследованиях нарушений центральной нервной системы (ЦНС). В то время как добились некоторого успеха, природные капсиды AAV лишены специфичности для ЦНС и являются непригодными для применения против конкретных заболеваний. Недавние успехи в конструировании и направленной эволюции AAV расширили возможность разработки новых серотипов AAV, включая векторы с измененным тропизмом (Gray et al., (2010) Mol. Ther. 18:570-578). Однако, ни одни из векторов AAV не был способен к широкомасштабному переносу генов в ЦНС с минимальным тропизмом к периферическим органам.
[0005] В головном мозге, широкое множество векторов AAV обладают преобладающей предпочтительностью для нейронов с очень низкой эффективностью для других типов клеток, таких как олигодендроциты. Векторы AAV, эффективно нацеленные на олигодендроциты, не были разработаны.
Сущность изобретения
[0006] Настоящее изобретение основано, частично, на разработке химерных последовательностей капсидов AAV, способных к широкомасштабному переносу генов в ЦНС после доставки в ЦНС с минимальным тропизмом для периферических органов. Изобретение, кроме того, относится к химерным капсидам AAV, обладающим улучшенной способностью к трансдукции у субъектов с синдромом Ретта. Химерные капсиды можно использовать для получения векторов AAV для использования в исследовательских или терапевтических применениях, когда является желательным широкомасштабный перенос генов в ЦНС без широкого биораспределения вектора в периферических органах.
[0007] Настоящее изобретение, кроме того, основано, частично, на разработке химерных последовательностей капсидов AAV, способных к предпочтительному или специфическому для олигодендроцитов переносу генов после доставки в ЦНС с минимальным тропизмом для периферических органов. Химерные капсиды можно использовать для получения векторов AAV для использования в исследовательских или терапевтических применениях, когда является желательным перенос генов в олигодендроциты без широкого биораспределения вектора в нейронах или в периферических органах.
[0008] Таким образом, один аспект изобретения относится к нуклеиновой кислоте, кодирующей капсид AAV, где нуклеиновая кислота содержит последовательность, кодирующую капсид AAV, которая является по меньшей мере на 70% идентичной: (a) нуклеотидной последовательности любой из SEQ ID NO:1-43; или (b) нуклеотидной последовательности, кодирующей любую из SEQ ID NO:44-86, наряду с клетками и вирусными частицами, содержащими нуклеиновую кислоту.
[0009] Таким образом, один аспект изобретения относится к нуклеиновой кислоте, кодирующей капсид AAV, где нуклеиновая кислота содержит последовательность, кодирующую капсид AAV, которая является по меньшей мере на 70% идентичной: (a) нуклеотидной последовательности любой из SEQ ID NO: 87-107; или (b) нуклеотидной последовательности, кодирующей любую из SEQ ID NO: 108-128, наряду с клетками и вирусными частицами, содержащими нуклеиновую кислоту.
[0010] Другой аспект изобретения относится к капсиду AAV, содержащему аминокислотную последовательность, по меньшей мере на 90% идентичную любой из SEQ ID NO:44-86, наряду с частицами AAV, содержащими геном вектора AAV и капсид AAV по изобретению.
[0011] Другой аспект изобретения относится к капсиду AAV, содержащему аминокислотную последовательность, по меньшей мере на 90% идентичную любой из SEQ ID NO: 108-128, наряду с частицами AAV, содержащими геном вектора AAV и капсид AAV по изобретению.
[0012] Следующий аспект изобретения относится к способу получения рекомбинантной частицы AAV, содержащей капсид AAV, где способ включает в себя: получение клетки in vitro, обладающей нуклеиновой кислотой по изобретению, кодирующей AAV rep последовательностью, геномом вектора AAV, содержащим гетерологичную нуклеиновую кислоту, и функциями помощника для получения продуктивной инфекции AAV; и обеспечение сборки рекомбинантной частицы AAV, содержащей капсид AAV, и заключенный в капсид геном вектора AAV.
[0013] Дополнительный аспект изобретения относится к фармацевтическому составу, содержащему нуклеиновую кислоту, вирусную частицу, капсид AAV или частицу AAV по изобретению в фармацевтически приемлемом носителе.
[0014] Другой аспект изобретения относится к способу доставки представляющей интерес нуклеиновой кислоты в клетку ЦНС, где способ включает приведение клетки в контакт с частицей AAV по изобретению.
[0015] Следующий аспект изобретения относится к способу доставки представляющей интерес нуклеиновой кислоты в клетку ЦНС пациента-млекопитающего, где способ включает введение эффективного количества частиц AAV или фармацевтического состава по изобретению пациенту-млекопитающему.
[0016] Дополнительный аспект изобретения относится к способу доставки представляющей интерес нуклеиновой кислоты в область ЦНС, граничащую с областью нарушенного гематоэнцефалического барьера у пациента-млекопитающего, где способ включает внутривенное введение эффективного количества частиц AAV или фармацевтического состава по изобретению пациенту-млекопитающему.
[0017] Другой аспект изобретения относится к способу лечения нарушения, ассоциированного с дисфункцией ЦНС, у нуждающегося в этом пациента-млекопитающего, где способ включает введение терапевтически эффективного количества частиц AAV или фармацевтического состава по изобретению пациенту-млекопитающему.
[0018] Другой аспект изобретения относится к способу лечения синдрома Ретта у пациента-млекопитающего, где способ включает введение терапевтически эффективного количества частиц AAV или фармацевтического состава по изобретению пациенту-млекопитающему.
[0019] Другой аспект изобретения относится к способу получения капсида AAV, обладающего представляющим интерес профилем тропизма, где способ включает модификацию капсида AAV по изобретению для вставки аминокислотной последовательности, обеспечивающей представляющий интерес профиль тропизма.
[0020] Один аспект изобретения относится к нуклеиновой кислоте, кодирующей капсид AAV, где нуклеиновая кислота содержит последовательность, кодирующую капсид AAV, которая является по меньшей мере на 70% идентичной: (a) нуклеотидной последовательности из любой из SEQ ID NO:129; или (b) нуклеотидной последовательности, кодирующей любую из SEQ ID NO:130-132, наряду с клетками и вирусными частицами, содержащими нуклеиновую кислоту.
[0021] Другой аспект изобретения относится к капсиду AAV, содержащему аминокислотную последовательность, по меньшей мере на 90% идентичную любой из SEQ ID NO:130-132, наряду с частицами AAV, содержащими геном вектора AAV и капсид AAV по изобретению.
[0022] Другой аспект изобретения относится к способу доставки представляющей интерес нуклеиновой кислоты в олигодендроцит, где способ включает приведение клетки в контакт с частицей AAV по изобретению.
[0023] Следующий аспект изобретения относится к способу доставки представляющей интерес нуклеиновой кислоты в олигодендроцит у пациента-млекопитающего, где способ включает введение эффективного количества частиц AAV или фармацевтического состава по изобретению пациенту-млекопитающему.
[0024] Другой аспект изобретения относится к способу лечения нарушения, ассоциированного с дисфункцией олигодендроцитов, у нуждающегося в этом пациента-млекопитающего, где способ включает введение терапевтически эффективного количества частиц AAV или фармацевтического состава по изобретению пациенту-млекопитающему.
[0025] Следующий аспект изобретения относится к нуклеиновой кислоте, кодирующей капсид AAV8, содержащий замену E532K, наряду с клетками и вирусными частицами, содержащими нуклеиновую кислоту.
[0026] Другой аспект изобретения относится к капсиду AAV8, содержащему замену E532K, наряду с частицами AAV, содержащими геном вектора AAV и капсид AAV по изобретению.
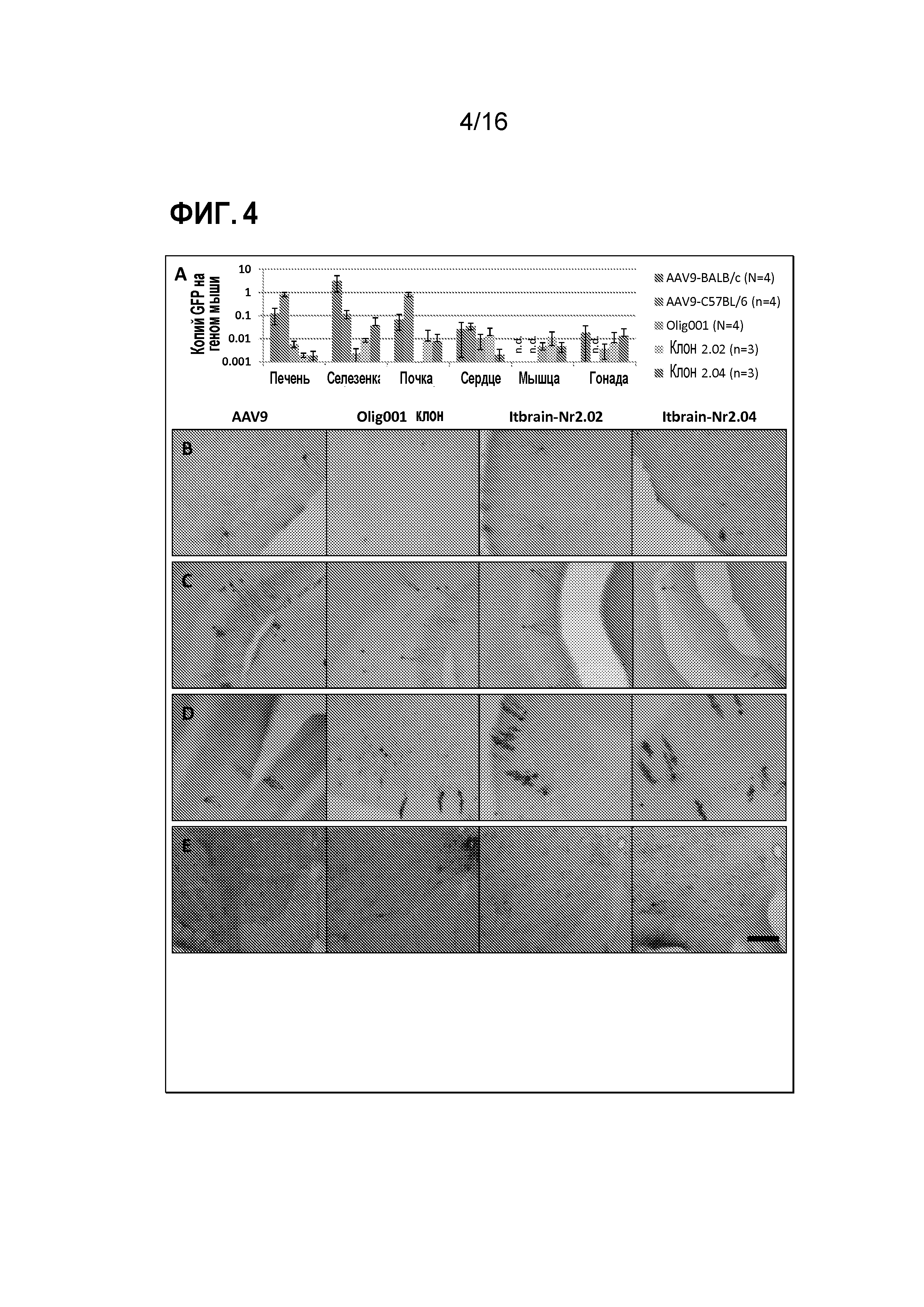
[0027] Другой аспект изобретения относится к способу доставки представляющей интерес нуклеиновой кислоты в олигодендроцит, где способ включает приведение клетки в контакт с частицей AAV по изобретению.
[0028] Следующий аспект изобретения относится к способу доставки представляющей интерес нуклеиновой кислоты в олигодендроцит пациента-млекопитающего, где способ включает введение эффективного количества частиц AAV или фармацевтического состава по изобретению пациенту-млекопитающему.
[0029] Другой аспект изобретения относится к способу лечения нарушения, ассоциированного с дисфункцией олигодендроцитов, у нуждающегося в этом пациента-млекопитающего, где способ включает введение терапевтически эффективного количества частиц AAV или фармацевтического состава по изобретению пациенту-млекопитающему.
[0030] Эти и другие аспекты изобретения приведены более подробно в описании изобретения ниже.
Краткое описание чертежей
[0031] На фиг. 1 показана химерная структура клонов капсидов AAV, выделенных из спинного мозга мышей дикого типа.
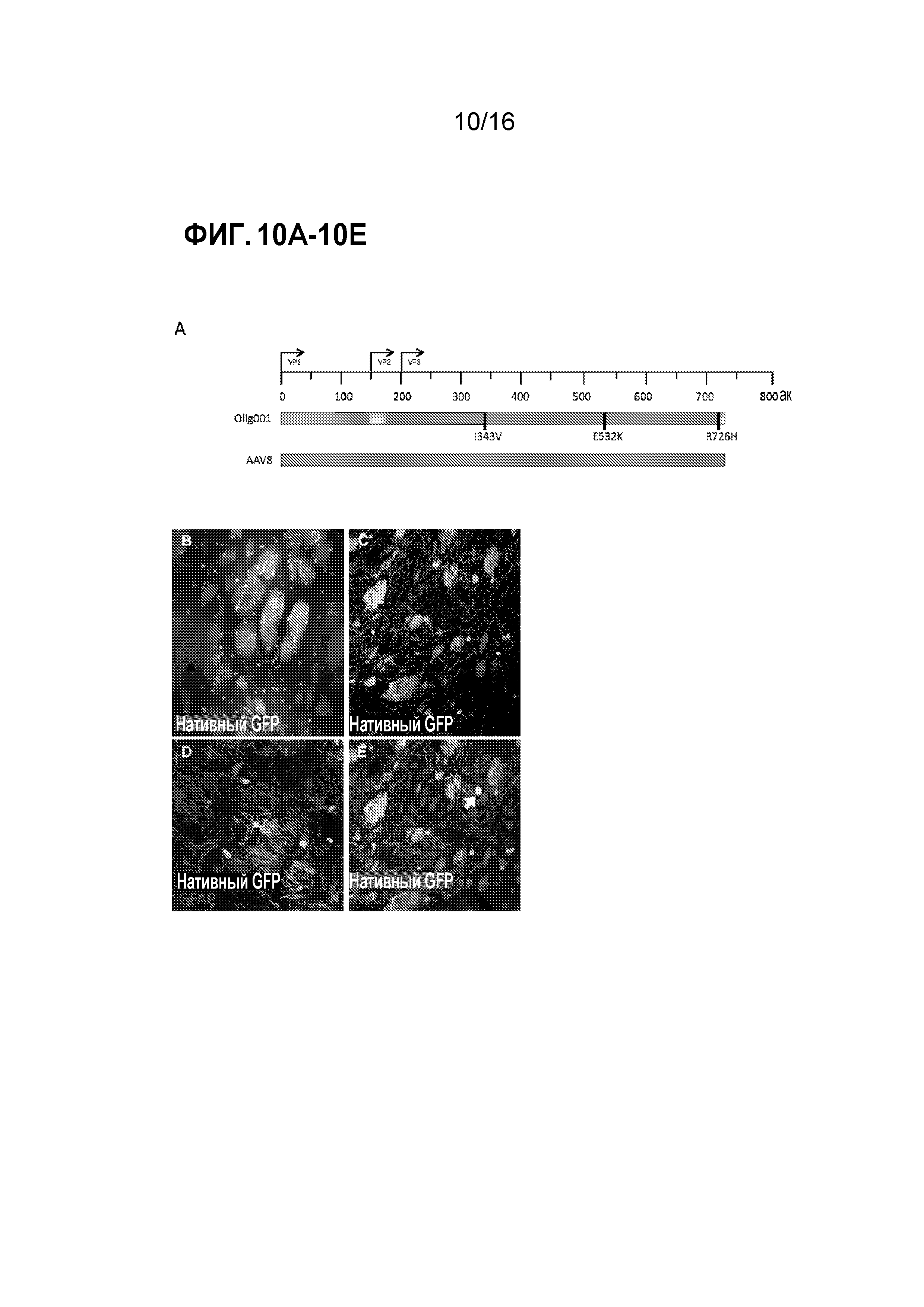
[0032] На фиг. 2 показана химерная структура клонов капсидов AAV, выделенных из головного мозга мышей дикого типа.
[0033] На фиг. 3 показана химерная структура клонов капсидов AAV, выделенных от мышей с синдромом Ретта.
[0034] На фиг. 4A-4E показан тропизм выделенных клонов.
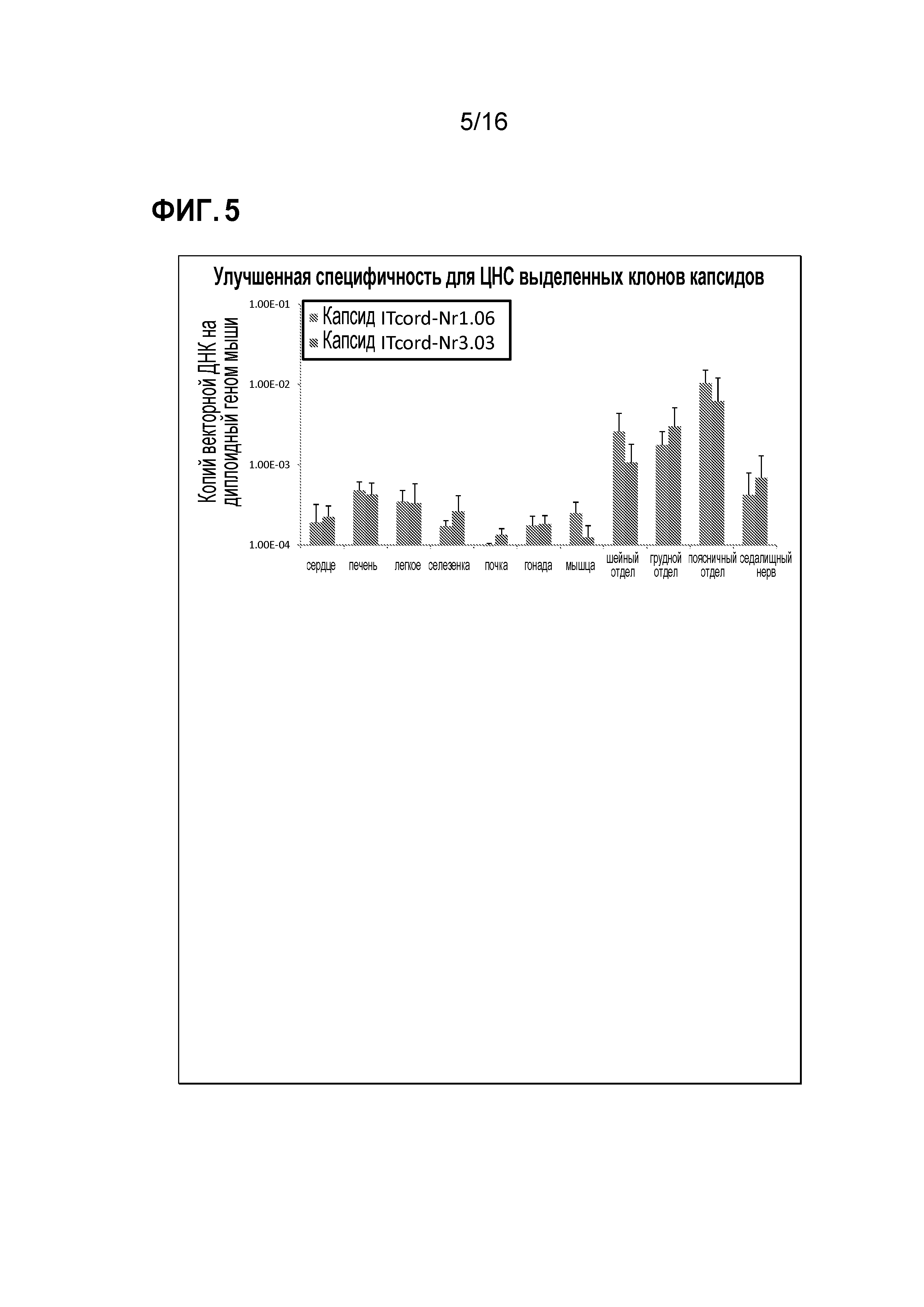
[0035] На фиг. 5 показан тропизм выделенных клонов.
[0036] На фиг. 6 показан тропизм выделенных клонов.
[0037] На фиг. 7 показана эффективность трансдукции для выделенных клонов.
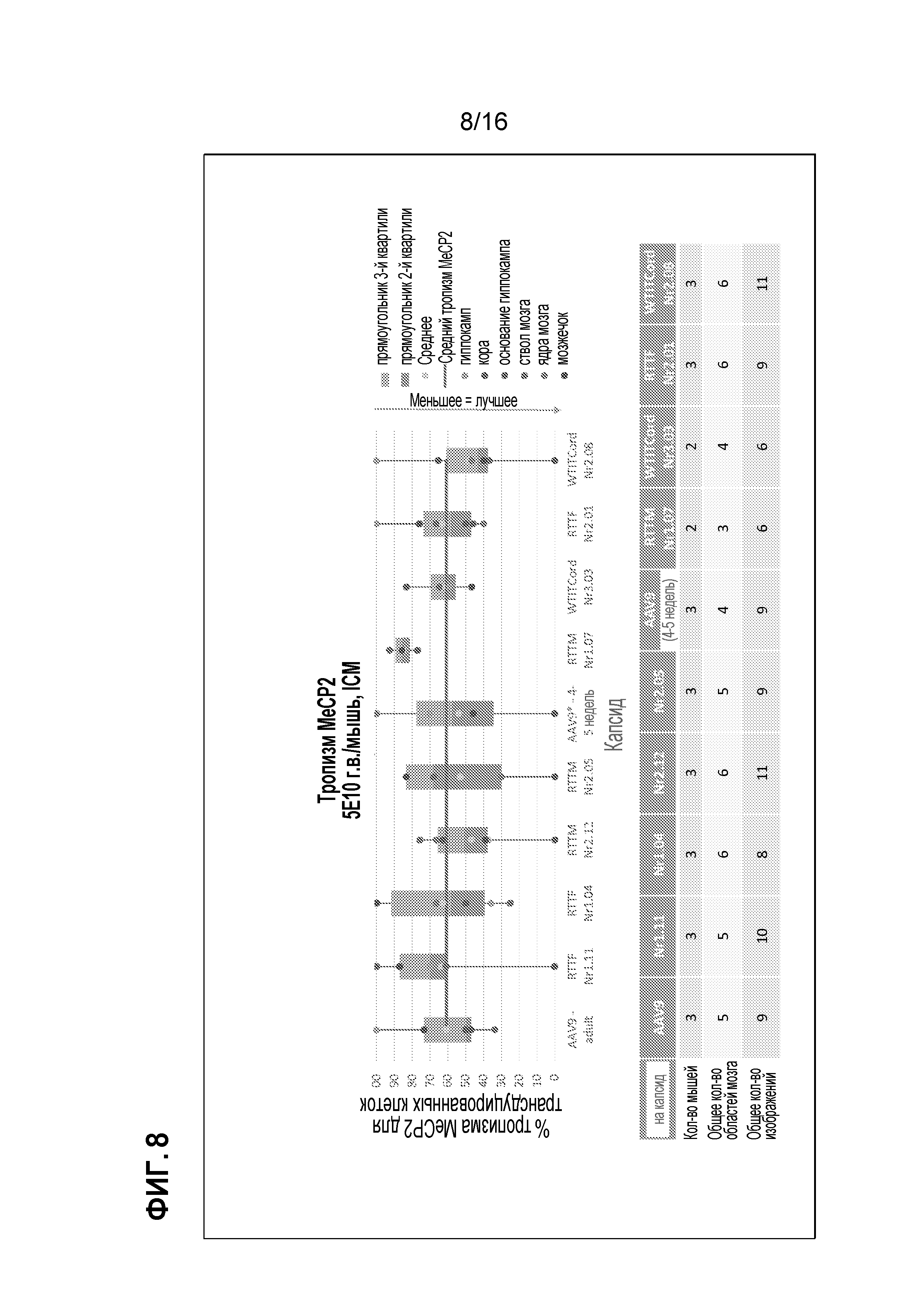
[0038] На фиг. 8 показан тропизм MeCP2 выделенных клонов.
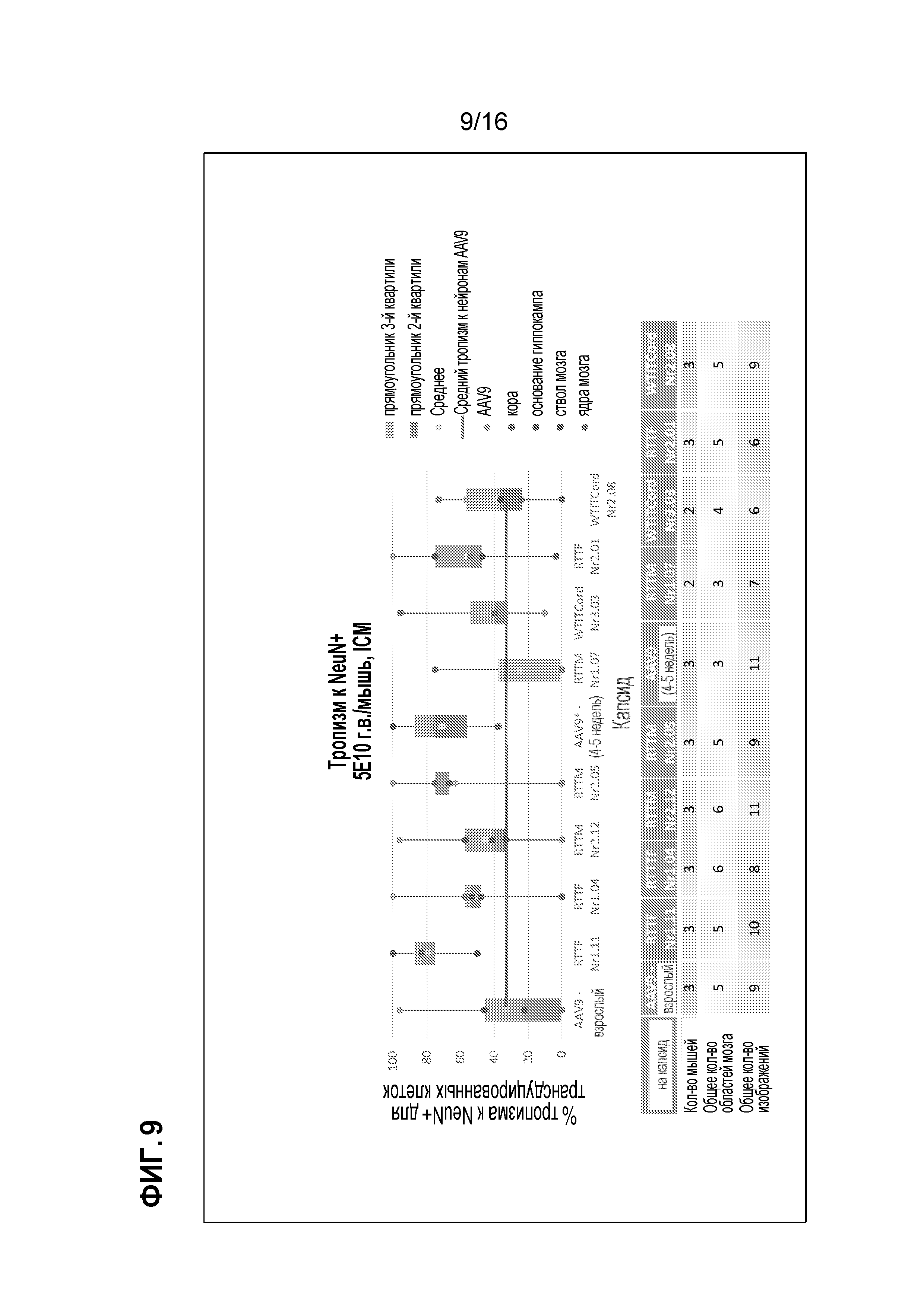
[0039] На фиг. 9 показан тропизм к NeuN выделенных клонов.
[0040] На фиг. 10A-10E показано, что Olig001 обладал предпочтительным для олигодендроцитов тропизмом. (A) Схема гена cap из Olig001 по сравнению с AAV8. Различными цветами представлен различный исходный серотип AAV (синий=AAV2, пурпурный=AAV8, красный=AAV9, желтый=AAV1 и оранжевый=AAV6), присутствующий в реакционной смеси, вводимой в библиотеку. Черные вертикальные столбцы обозначают точечные мутации. (B) трансдукция Olig001 клеток в полосатом теле крысы, обладающих характеристиками, показательными для олигодендроцитов, включая локализацию положительного по GFP миелина в пятнах из пятен/матрикса полосатого тела. (C) Конфокальное изображение трансдуцированных клеток с более высоким увеличением, которое снова отражает уникальную морфологию олигодендроцитов ЦНС. (D) Конфокальное изображение выявляет отсутствие совместной локализации положительных по GFP клеток с астроцитами, меченными GFAP (красный) внутри полосатого тела. (E) Конфокальное изображение иллюстрирует, что подавляющее большинство трансдуцированных Olig001 клеток внутри полосатого тела не является совместно локализованным с маркером нейронов, NeuN (красный). Однако, стрелкой указана единственная положительная по GFP/NeuN клетка.
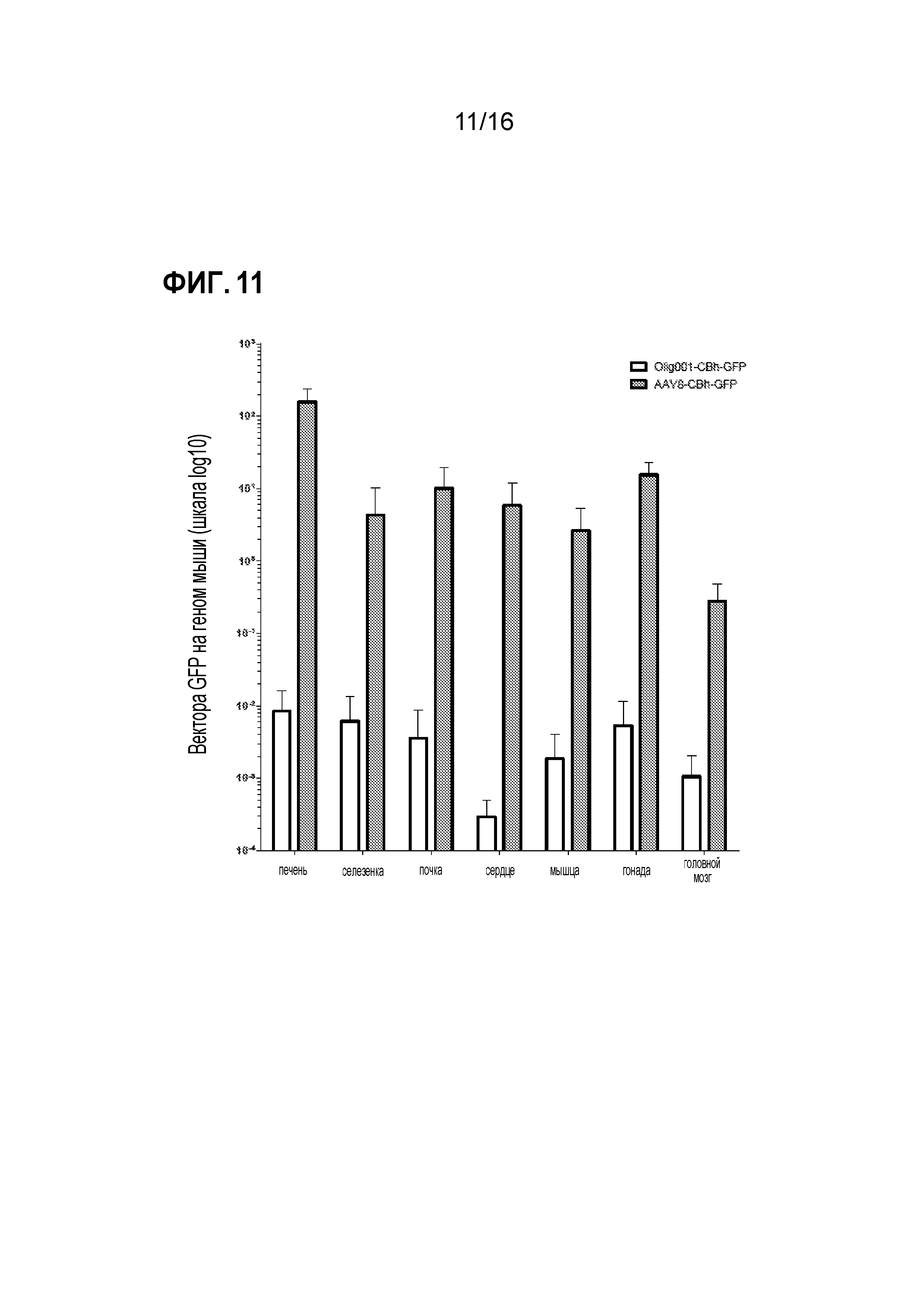
[0041]На фиг. 11 показано, что Olig001 утрачивает нацеливание на периферические ткани по сравнению с AAV8. Взрослым самкам мышей C57Bl/6 вводили внутривенную дозу 5×1010 г.в. (~2,5×1012 г.в./кг массы тела) либо Olig001-CBh-GFP (белые столбцы; n=4), либо AAV8-CBh-GFP (серые столбцы; n=5). Через десять суток распределение в органах генома GFP на диплоидный геном мыши (LaminB2) определяли посредством qПЦР. Планки погрешностей обозначают стандартную ошибку среднего.
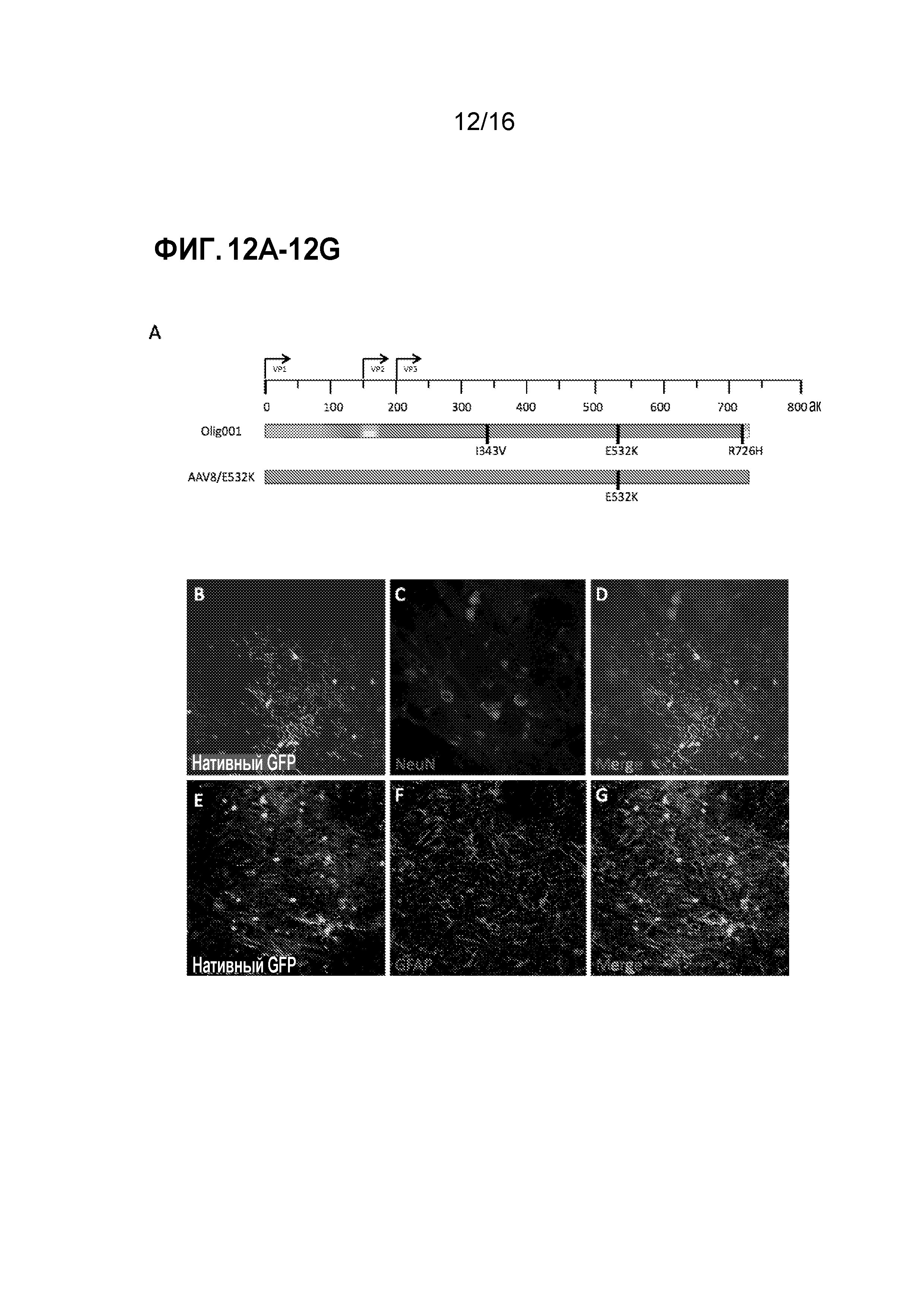
[0042]На фиг. 12A-12G показано, что AAV8 с мутацией E532K является олиготропным. (A) Схема гена cap из Olig001 по сравнению с AAV8/E532K. Различными цветами представлен различный исходный серотип AAV (синий=AAV2, пурпурный=AAV8, красный=AAV9, желтый=AAV1 и оранжевый=AAV6). Черные вертикальные столбцы обозначают точечные мутации. AAV8/E532K упаковывали с CBh-GFP, и 2×108 г.в. интракраниально инъецировали в полосатое тело самцов крыс Sprague-Dawley дикого типа. Через две недели после инъекции крыс подвергали транскардиальной перфузии, и их головной мозг фиксировали и получали корональные срезы. (B-D) Конфокальные изображения полосатого тела показывают отсутствие совместной локализации положительных по GFP клеток с нейрональными (NeuN) маркерами. (E-G) Конфокальные изображения полосатого тела показывают отсутствие совместной локализации положительных по GFP клеток и маркеров астроцитов (GFAP).
[0043]На фиг. 13A-13G показано, что предпочтительный тропизм Olig001 к олигодендроцитам является независимым от последовательности VP3. (A) Схема гена cap из Olig001 по сравнению с Olig001/AAV VP3. Различными цветами представлен различный исходный серотип AAV (синий=AAV2, пурпурный=AAV8, красный=AAV9, желтый=AAV1 и оранжевый=AAV6). Черные вертикальные столбцы обозначают точечные мутации. Мутантный Olig001 с VP3 из AAV8 (Olig001/AAV8 VP3) упаковывали с CBh-GFP при титре 2×108 г.в./мкл и интракраниально инъецировали в полосатое тело самцов крыс Sprague-Dawley дикого типа. Через две недели после инъекции крыс подвергали транскардиальной перфузии, и их головной мозг фиксировали и получали корональные срезы. (B-D) Конфокальные изображения полосатого тела показывают, что положительные по GFP клетки обладают морфологией олигодендроцитов полосатого тела и не обладают совместной локализацией с нейрональными (NeuN) маркерами. (E-G) Конфокальные изображения полосатого тела показывают, что положительные по GFP клетки обладают морфологией олигодендроцитов полосатого тела и не обладают совместной локализацией с маркером астроцитов (GFAP).
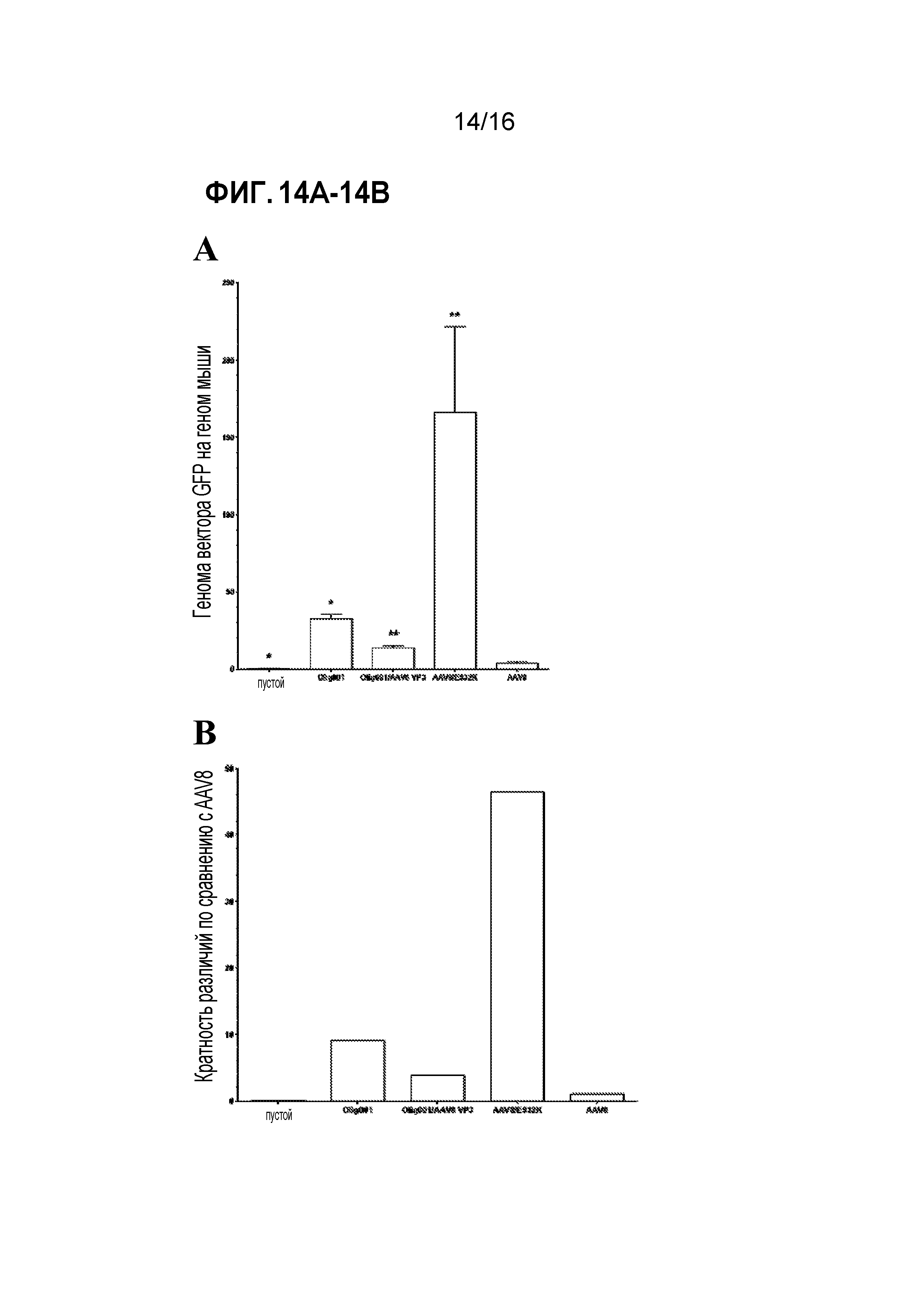
[0044] На фиг. 14A-14B показано, что анализ связывания in vitro согласуется с тропизмом in vivo. Смешанные культуры глии in vitro получали посредством диссоциации неонатального головного мозга мышей в возрасте 3 суток. Культуры инкубировали с эквивалентным количеством либо AAV8-CBh-GFP, либо Olig001-CBh-GFP в течение 1 час при 4°C, чтобы позволить связывание, но не поглощение, вектора. (A) Количество вектора, связанного с клетками, количественно оценивали посредством qПЦР для GFP и нормализовали по мышиному геномному LaminB2. Планки погрешностей обозначают стандартную ошибку среднего, * обозначает значимое различие с P<0,03, и ** обозначает значимое различие с P<0,01. (B) Кратность различий определяли с использованием среднего связывания для каждого вируса по сравнению с AAV8.
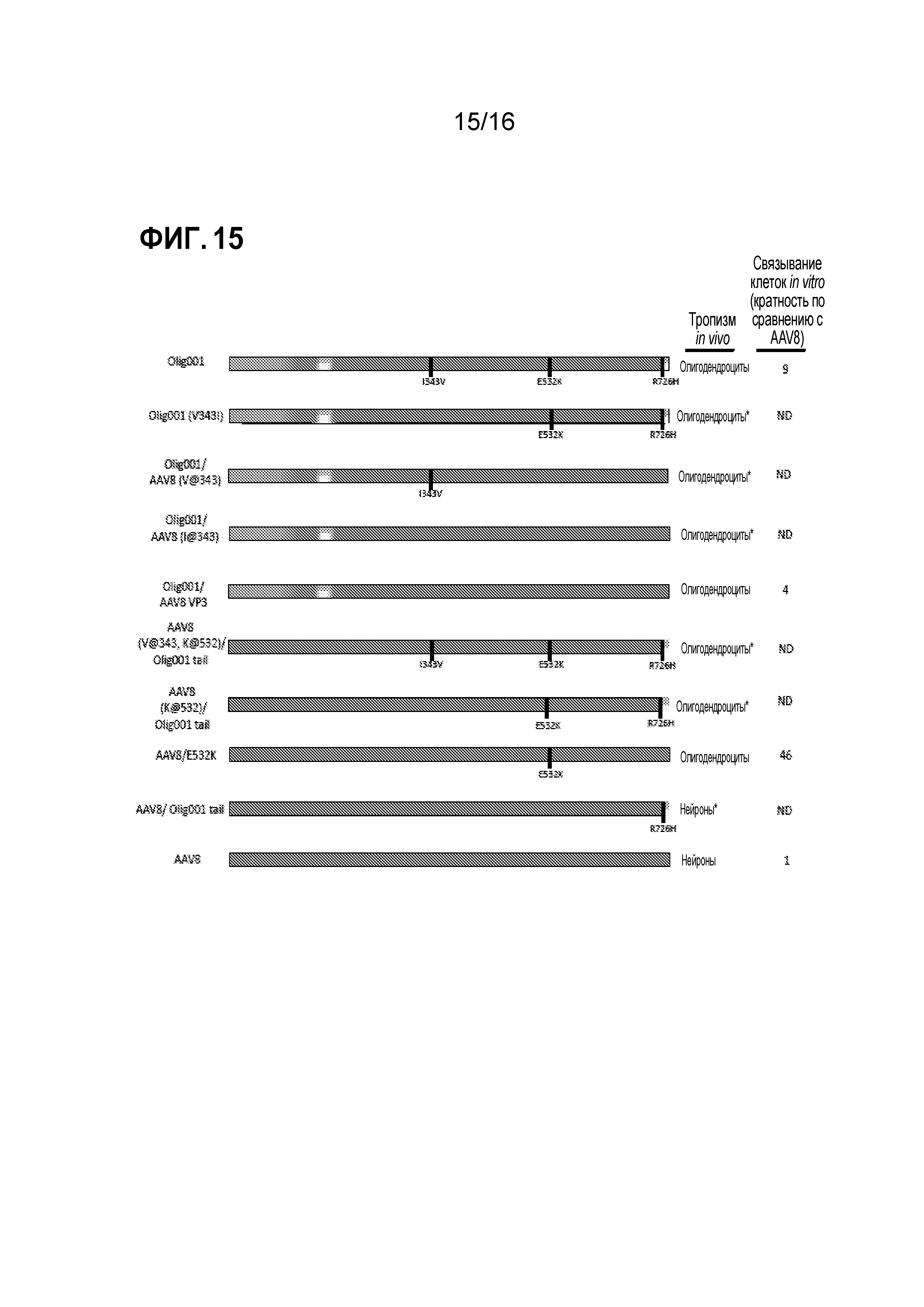
[0045] На фиг. 15 показано обобщение данных. Схемы генов cap, использованных в этом исследовании с преобладающим in vivo тропизмом при инфузии в полосатое тело взрослых крыс и с кратностью связывания in vitro по сравнению с AAV8. Различными цветами представлен различный исходный серотип AAV серотип (синий=AAV2, пурпурный=AAV8, красный=AAV9, желтый=AAV1, и оранжевый=AAV6). Черные вертикальные столбцы обозначают точечные мутации. ND=не определяли и * обозначает: данные не представлены.
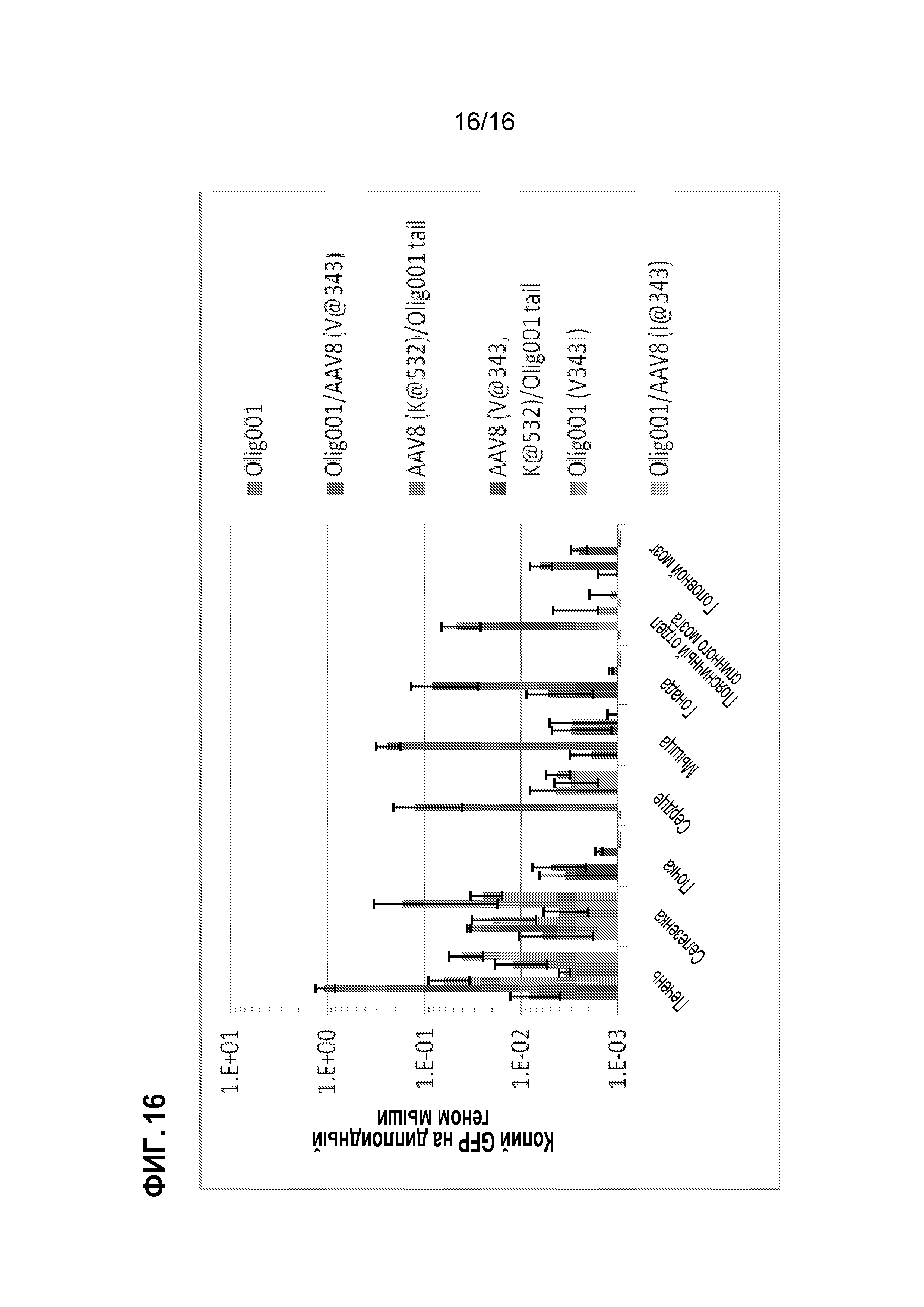
[0046] На фиг. 16 показано, что мутанты, происходящие из Olig001, утрачивают нацеливание на периферические ткани по сравнению с AAV8 (см. также фиг. 11). Взрослым самкам мышей C57Bl/6 вводили внутривенную дозу 5×1010 г.в. (~2,5×1012 г.в./кг массы тела) либо Olig001, либо одного из его мутантных производных, как указано, упаковывающих геном sc CBh-GFP. Через десять суток распределение в органах генома GFP на диплоидный геном мыши (LaminB2) определяли посредством qПЦР. Планки погрешностей обозначают стандартную ошибку среднего.
Подробное описание изобретения
[0047] Настоящее изобретение основано, частично, на разработки химерных последовательностей капсидов AAV, способных к широкомасштабному переносу генов в ЦНС после доставки в ЦНС с минимальным тропизмом для периферических органов. Изобретение, кроме того, относится к химерным капсидам AAV, обладающим увеличенной способностью к трансдукции у пациентов с синдромом Ретта. Химерные капсиды можно использовать для получения векторов AAV для использования в исследовательских или терапевтических применениях, когда является желательным широкомасштабный перенос генов в ЦНС без широкого биораспределения вектора в периферических органах.
[0048] Настоящее изобретение, кроме того, основано, частично, на разработке химерных последовательностей капсидов AAV, способных к предпочтительному или специфическому для олигодендроцитов переносу генов после доставки в ЦНС с минимальным тропизмом для периферических органов. Химерные капсиды можно использовать для получения векторов AAV для использования в исследовательских или терапевтических применениях, когда является желательным перенос генов в олигодендроциты без широкого биораспределения вектора в нейронах или в периферических органах.
[0049] Настоящее изобретение более подробно объяснено ниже. Это описание не является подробным перечнем всех различных способов, которыми можно осуществлять изобретение, или всех признаков, которые можно добавлять к настоящему изобретению. Например, признаки, проиллюстрированные в отношении одного варианта осуществления, можно включать в другие варианты осуществления, и признаки, проиллюстрированные в отношении конкретного варианта осуществления, можно удалять из этого варианта осуществления. Кроме того, многочисленные варианты и добавления к различным вариантам осуществления, предложенным в настоящем документе, будут очевидными специалистам в данной области в свете настоящего описания, которое не отклоняется от настоящего описания. Таким образом, следующее описание предназначено для иллюстрации некоторых конкретных вариантов осуществления изобретения, и не исчерпывающим образом описывает все их перетасовки, комбинации и варианты.
[0050] Если контекст не требует иного, конкретно предусмотрено, что различные признаки изобретения, описанные в настоящем документе, можно использовать в любой комбинации. Более того, по настоящему изобретению предусмотрено также, что в некоторых вариантах осуществления изобретения, любой признак или комбинацию признаков, описанных в настоящем документе, можно исключать или пропускать. Для иллюстрации, если в описании указано, что комплекс содержит компоненты A, B и C, конкретно подразумевают, что любой из A, B или C, или их комбинацию, можно пропускать и отвергать отдельно или в любой комбинации.
[0051] Если не указано иное, все технические и научные термины, используемые в настоящем описании, обладают таким же значением, которое является общепринятым для специалиста в области, к которой относится это изобретение. Терминология, используемая в описании изобретения в настоящем описании, представлена только с целью описания конкретных вариантов осуществления и не предназначена для ограничения изобретения.
[0052] Нуклеотидные последовательности представлены в настоящем описании только по одной цепи, в направлении от 5' до 3', слева направо, если конкретно не указано иначе. Нуклеотиды и аминокислоты представлены в настоящем описании способом, рекомендованным Комиссией по биохимической номенклатуре IUPAC-IUB, или (для аминокислот) посредством либо однобуквенного кода, либо трехбуквенного кода, оба в соответствии с 37 C.F.R. 1.822 и общепринятым применением.
[0053] За исключением того, что указано иначе, стандартные способы, известные специалистам в данной области, можно использовать для получения рекомбинантных и синтетических полипептидов, антител или их антигенсвязывающих фрагментов, манипуляции с последовательностями нуклеиновой кислоты, получения трансформированных клеток, конструирования конструкций р-AAV, модифицированных белков капсида, упаковывающих векторов, экспрессирующих последовательности rep и/или cap AAV, и временно и стабильно трансфицированных упаковывающих клеток. Такие способы известны специалистам в данной области. См., например, SAMBROOK et al., MOLECULAR CLONING: A LABORATORY MANUAL 2nd Ed. (Cold Spring Harbor, NY, 1989); F. M. AUSUBEL et al. CURRENT PROTOCOLS IN MOLECULAR BIOLOGY (Green Publishing Associates, Inc. и John Wiley & Sons, Inc., New York).
[0054] Полное содержание всех публикаций, патентных заявок, патентов, нуклеотидных последовательностей, аминокислотных последовательностей и других ссылок, упомянутых в настоящем описании, приведено в качестве ссылки.
I. Определения.
[0055] Обозначение всех положений аминокислот в субъединицах капсида AAV в описании изобретения и прилагаемой формуле изобретения приведено в отношении нумерации субъединицы VP1 капсида.
[0056] Как применяют в описании изобретения и прилагаемой формуле изобретения, неконкретизированные и конкретизированные формы единственного числа предназначены, чтобы включать в себя также формы множественного числа, если контекст явно не требует иного.
[0057] В рамках изобретения, «и/или» обозначает и охватывает все без исключения возможные комбинации одного или нескольких ассоциированных перечисленных объектов, так же как отсутствие комбинаций при интерпретации как альтернативы («или»).
[0058] Более того, согласно настоящему изобретению предусмотрено также, что в некоторых вариантах осуществления изобретения, любой признак или комбинацию признаков, указанных в настоящем описании, можно исключать или пропускать.
[0059] Более того, термин «приблизительно», в рамках изобретения в отношении поддающегося измерению значения, такого как количество соединения или средства по этому изобретению, доза, время, температура и т.п., предназначен, чтобы включать в себя варианты±20%,±10%,±5%,±1%,±0,5% или даже±0,1% от указанного количества.
[0060] Термин «в основном состоящий из», в рамках изобретения в отношении структуры нуклеиновой кислоты, белка или капсида, означает, что структура нуклеиновой кислоты, белка или капсида не содержит никакого элемента, отличного от перечисленного элемента(элементов), который значительно изменяет (например, более чем приблизительно на 1%, 5% или 10%) представляющую интерес функцию структуры нуклеиновой кислоты, белка или капсида, например, профиль тропизма белка или капсида, или белок или капсид, кодируемые нуклеиновой кислотой.
[0061] Термин «аденоассоциированный вирус» (AAV) в контексте настоящего изобретения включает, без ограничения, AAV типа 1, AAV типа 2, AAV типа 3 (включая типы 3A и 3B), AAV типа 4, AAV типа 5, AAV типа 6, AAV типа 7, AAV типа 8, AAV типа 9, AAV типа 10, AAV типа 11, птичий AAV, бычий AAV, собачий AAV, лошадиный AAV и овечий AAV, и любой другой AAV, который неизвестен или будет открыт позднее. См., например, BERNARD N. FIELDS et al., VIROLOGY, volume 2, chapter 69 (4th ed., Lippincott-Raven Publishers). Идентифицирован ряд дополнительных серотипов и клад AAV (см., например, Gao et al., (2004) J. Virol. 78:6381-6388 и таблицу 1), которые также включены в термин «AAV».
[0062] Геномные последовательности различных AAV и автономных парвовирусов, так же как последовательности ITR, белков Rep и субъединиц капсида известны в данной области. Такие последовательности можно обнаружить в литературе или в публичных базах данных, таких как база данных GenBank®. См., например, номера доступа в GenBank® NC 002077, NC 001401, NC 001729, NC 001863, NC 001829, NC 001862, NC 000883, NC 001701, NC 001510, AF063497, U89790, AF043303, AF028705, AF028704, J02275, J01901, J02275, X01457, AF288061, AH009962, AY028226, AY028223, NC 001358, NC 001540, AF513851, AF513852, AY530579, AY631965, AY631966; полное описание которых приведено в настоящем описании. См. также, например, Srivistava et al., (1983) J. Virol. 45:555; Chiorini et al., (1998) J. Virol. 71:6823; Chiorini et al., (1999) J. Virol. 73:1309; Bantel-Schaal et al., (1999) J. Virol. 73:939; Xiao et al., (1999) J. Virol. 73:3994; Muramatsu et al., (1996) Virology 221:208; Shade et al., (1986) J. Virol. 58:921; Gao et al., (2002) Proc. Nat. Acad. Sci. USA 99:11854; международные публикации патентов WO 00/28061, WO 99/61601, WO 98/11244; Патент США No. 6156303; полные описания которых приведены в настоящем описании. См. также таблицу 1. Первое описание последовательностей концевых повторов AAV1, AAV2 и AAV3 представлено Xiao, X., (1996), «Characterization of Adeno-associated virus (AAV) DNA replication and integration», Ph.D. Dissertation, University of Pittsburgh, Pittsburgh, PA (полное содержание приведено в настоящем описании в качестве ссылки).
[0063] «Химерные» последовательность нуклеиновой кислоты, кодирующая капсид AAV, или белок капсида AAV представляют собой те, в которых объединены части двух или более последовательностей капсида. «Химерные» вирион или частица AAV содержат химерный белок капсида AAV.
[0064] Термин «тропизм», в рамках изобретения относится к предпочтительному входу вируса в конкретный тип(ы) клеток или тканей и/или к взаимодействию с поверхностью клеток, облегчающему вход в конкретные типы клеток или тканей, необязательно и предпочтительно, с последующей экспрессией (например, транскрипцией и, необязательно, трансляцией) последовательностей, переносимых вирусным геномом в клетку, например, в случае рекомбинантного вируса, экспрессией гетерологичной нуклеотидной последовательности(последовательностей). Специалистам в данной области понятно, что инициация транскрипции гетерологичной последовательности нуклеиновой кислоты из вирусного генома может не происходить в отсутствие транс-действующих факторов, например, в случае индуцируемого промотора или иным образом регулируемой последовательности нуклеиновой кислоты. В случае генома р-AAV, экспрессия гена из вирусного генома может происходить из стабильно интегрированного провируса и/или из неинтегрированной эписомы, так же как из любой другой формы, которую нуклеиновая кислота вируса может принимать внутри клетки.
[0065] Термин «профиль тропизма» относится к паттерну трансдукции одной или нескольких клеток, тканей и/или органов-мишеней. Репрезентативные примеры химерных капсидов AAV обладают профилем тропизма, характеризуемым эффективной трансдукцией клеток ЦНС при только низкой трансдукции периферических органов.
[0066] Термин «специфический для клеток ЦНС», в рамках изобретения, относится к вирусному вектору, который, при введении непосредственно в ЦНС, предпочтительно трансдуцирует все типы клеток в ЦНС с минимальной трансдукцией клеток вне ЦНС. В некоторых вариантах осуществления, по меньшей мере приблизительно 80% из трансдуцированных клеток представляют собой клетки ЦНС, например, по меньшей мере приблизительно 85%, 90%, 95%, 96%, 97%, 98%, 99% или более клеток ЦНС.
[0067] Термин «нарушение, ассоциированное с дисфункцией ЦНС», в рамках изобретения, относится к заболеванию, нарушению или повреждению, при котором клетки ЦНС повреждены, утрачены или функционируют ненадлежащим образом. Термин включает заболевания, нарушения и повреждения, при которых клетки ЦНС непосредственно повреждены, так же как заболевания, нарушения и повреждения, при которых клетки ЦНС становятся дисфункциональными вторично по отношению к повреждению других клеток (например, инфаркт миокарда или инсульт).
[0068] Термин «специфический для олигодендроцитов», в рамках изобретения, относится к вирусному вектору, который, при введении непосредственно в ЦНС, предпочтительно трансдуцирует олигодендроциты по сравнению с нейронами, астроцитами и другими типами клеток ЦНС. В некоторых вариантах осуществления, по меньшей мере приблизительно 80% трансдуцированных клеток представляют собой олигодендроциты, например, по меньшей мере приблизительно 85%, 90%, 95%, 96%, 97%, 98%, 99% или более олигодендроцитов.
[0069] Термин «нарушение, ассоциированное с дисфункцией олигодендроцитов», в рамках изобретения, относится к заболеванию, нарушению или повреждению, при котором олигодендроциты повреждены, утрачены или функционируют ненадлежащим образом. Термин включает заболевания, нарушения и повреждения, при которых олигодендроциты непосредственно повреждены, так же как заболевания, нарушения и повреждения, при которых олигодендроциты становятся дисфункциональными вторично по отношению к повреждению других клеток (например, повреждению спинного мозга).
[0070] Термин «граничащий с областью нарушенного гематоэнцефалического барьера», в рамках изобретения, относится к клеткам ЦНС, соседним с частью гематоэнцефалического барьера, в которой барьерная функция нарушена.
[0071] В рамках изобретения, «трансдукция» клетки вирусным вектором (например, вектором AAV) обозначает вход вектора в клетку и перенос генетического материала в клетку посредством включения нуклеиновой кислоты в вирусный вектор и последующего переноса в клетку посредством вирусного вектора.
[0072] Если не указано иначе, «эффективную трансдукцию» или «эффективный тропизм», или сходные термины, можно определять со ссылкой на подходящий положительный или отрицательный контроль (например, по меньшей мере приблизительно 50%, 60%, 70%, 80%, 85%, 90%, 95% или более от трансдукции или тропизма, соответственно, положительного контроля или по меньшей мере приблизительно 110%, 120%, 150%, 200%, 300%, 500%, 1000% или более от трансдукции или тропизма, соответственно, отрицательного контроля).
[0073] Сходным образом, можно определять, если вирус «не осуществляет эффективную трансдукцию» или «не обладает эффективным тропизмом» для ткани-мишени, или сходные термины, со ссылкой на подходящий контроль. В конкретных вариантах осуществления, вирусный вектор не осуществляет эффективную трансдукцию (т.е., не обладает эффективным тропизмом для) тканей вне ЦНС, например, печени, почек, гонад и/или половых клеток. В конкретных вариантах осуществления, нежелательная трансдукция ткани(тканей) (например, печени) составляет 20% или менее, 10% или менее, 5% или менее, 1% или менее, 0,1% или менее от уровня трансдукции желательной ткани-мишени(тканей-мишеней) (например, клеток ЦНС).
[0074] В рамках изобретения, термин «полипептид» включает как пептиды, так и белки, если не указано иначе.
[0075] «Нуклеиновая кислота» или «нуклеотидная последовательность» представляет собой последовательность нуклеотидных оснований, и может представлять собой последовательности РНК, ДНК или гибридные последовательности ДНК-РНК (включая как природные, так и неприродные нуклеотиды), но предпочтительно представляет собой либо одноцепочечные, либо двухцепочечные последовательности ДНК.
[0076] В рамках изобретения, «выделенная» нуклеиновая кислота или нуклеотидная последовательность (например, «выделенная ДНК» или «выделенная РНК») обозначает нуклеиновую кислоту или нуклеотидную последовательность, отделенную или в основном свободную от по меньшей мере некоторых из других компонентов природного организма или вируса, например, структурных компонентов клетки или вируса, или других полипептидов или нуклеиновых кислот, обычно обнаруживаемых в ассоциации с нуклеиновой кислотой или нуклеотидной последовательностью.
[0077] Подобным образом, «выделенный» полипептид обозначает полипептид, отделенный или в основном свободный от по меньшей мере некоторых из других компонентов природного организма или вируса, например, структурных компонентов клетки или вируса, или других полипептидов или нуклеиновых кислот, обычно обнаруживаемых в ассоциации с полипептидом.
[0078] Под термином «лечить», «подвергать лечению» или «лечение» (или грамматически эквивалентными терминами) понимают, что тяжесть состояния пациента уменьшают или по меньшей мере частично улучшают или облегчают, и/или что достигают некоторого облегчения, смягчения или уменьшения по меньшей мере одного клинического симптома, и/или что присутствует задержка прогрессирования состояния и/или предотвращение или задержка начала заболевания или нарушения.
[0079] В рамках изобретения, термин «предотвращать», «предотвращает» или «предотвращение» (и его грамматические эквиваленты) относится к задержке начала заболевания или нарушения, или к уменьшению симптомов после начала заболевания или нарушения. Термин не предназначен, чтобы подразумевать полное устранение заболевания и включает любой тип профилактического лечения, которое уменьшает частоту возникновения состояния или задерживает начало и/или прогрессирование состояния.
[0080] «Эффективное» или «терапевтически эффективное» количество, в рамках изобретения, представляет собой количество, которое является достаточным для обеспечения некоторого улучшения или преимущества для пациента. Альтернативно указанное, «эффективное» или «терапевтически эффективное» количество представляет собой количество, которое может обеспечивать некоторое облегчение, смягчение или уменьшение по меньшей мере одного клинического симптома у пациента. Специалистам в данной области понятно, что терапевтические эффекты не обязательно должны быть полными или излечивающими, при условии, что для пациента обеспечивается некоторое преимущество.
[0081] «Гетерологичная нуклеотидная последовательность» или «гетерологичная нуклеиновая кислота» представляет собой последовательность, в природе не встречающаяся в вирусе. Как правило, гетерологичная нуклеиновая кислота или нуклеотидная последовательность содержит открытую рамку считывания, кодирующую полипептид и/или нетранслируемую РНК.
[0082] «Терапевтический полипептид» может представлять собой полипептид, который может облегчать или уменьшать симптомы, возникающие в результате отсутствия или дефекта белка в клетке или у пациента. Кроме того, «терапевтический полипептид» может представлять собой полипептид, иным образом обеспечивающий преимущество для пациента, например, противораковые эффекты или улучшение приживаемости трансплантата.
[0083] В рамках изобретения, термин «вектор», «вирусный вектор», «вектор для доставки» (и сходные термины), как правило, относится к вирусной частице, которая функционирует в качестве носителя для доставки нуклеиновой кислоты, и которая содержит вирусную нуклеиновую кислоту (т.е., геном вектора), упакованную внутри вириона. Вирусные векторы в соответствии с настоящим изобретением содержат химерный капсид AAV в соответствии с изобретением и могут упаковывать геном AAV или р-AAV, или любую другую нуклеиновую кислоту, включая вирусные нуклеиновые кислоты. Альтернативно, в некотором контексте, термин «вектор», «вирусный вектор», «вектор для доставки» (и сходные термины) можно использовать для обозначения генома вектора (например, вДНК) в отсутствие вириона и/или вирусного капсида, который действует в качестве транспортера для доставки молекул, связанных с капсидом или упакованных внутри капсида.
[0084] «Рекомбинантный геном вектора AAV» или «геном р-AAV» представляет собой геном AAV (т.е., вДНК), содержащий по меньшей мере один инвертированный концевой повтор (например, один, два или три инвертированных концевых повтора) и одну или несколько гетерологичных нуклеотидных последовательностей. Векторы р-AAV, как правило, сохраняют концевой повтор(ы) (TR) 145 оснований вцис-положении для получения вируса; однако, модифицированные TR AAV и не относящиеся к AAV TR, включая частично или полностью синтетические последовательности, также могут служить для этой цели. Все другие вирусные последовательности являются необязательными и могут быть предоставлены в транс-положении (Muzyczka, (1992) Curr. Topics Microbiol. Immunol. 158:97). Вектор р-AAV, необязательно, содержит два TR (например, TR AAV), которые, как правило, могут находиться на 5'- и 3'-концах гетерологичной нуклеотидной последовательности(последовательностей), но не обязательно должны быть смежными с ними. TR могут являться одинаковыми или отличными друг от друга. Геном вектора может также содержать один ITR на своем 3'- или 5'-конце.
[0085] Термин «концевой повтор» или «TR» включает любой вирусный концевой повтор или синтетическую последовательность, которые формируют структуру шпильки и функционируют в качестве инвертированного концевого повтора (т.е., опосредуют желательные функции, такие как репликация, упаковка, интеграция вируса и/или спасение провируса, и т.п.). TR может представлять собой TR AAV или не относящийся к AAV TR. Например, не относящуюся к AAV последовательность TR, такую как последовательность из других парвовирусов (например, собачьего парвовируса (CPV), мышиного парвовируса (MVM), человеческого парвовируса B-19) или шпильку SV40, которая служит точкой начала репликации SV40, можно использовать в качестве TR, который можно дополнительно модифицировать посредством усечения, замены, делеции, вставки и/или добавления. Кроме того, TR может являться частично или полностью синтетическим, таким как «двойная-D последовательность», как описано в Патенте США No. 5478745 от Samulski et al.
[0086] «Концевой повтор AAV» или «TR AAV» могут происходить из любого AAV, включая, но без ограничения, серотипы 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11, или любой другой AAV, который неизвестен или будет открыт позднее (см.,например, таблицу 1). Концевой повтор AAV необязательно должен представлять собой последовательность природного концевого повтора (например, последовательность природного TR AAV можно изменять посредством вставки, делеции, усечения и/или мутаций с изменением смысла), при условии, что концевой повтор опосредует желательные функции, например, репликацию, упаковку, интеграцию вируса и/или спасение провируса и т.п.
[0087] Термины «р-частица AAV» и «вирион р-AAV» используют в настоящем описании взаимозаменяемо. «Р-частица AAV» или «вирион р-AAV» содержит р-геном вектора AAV, упакованный в капсид AAV.
[0088] Структура капсида AAV описана более подробно в BERNARD N. FIELDS et al., VIROLOGY, volume 2, chapters 69 & 70 (4th ed., Lippincott-Raven Publishers).
[0089] Под «в основном сохраняет» свойство, понимают, что по меньшей мере приблизительно 75%, 85%, 90%, 95%, 97%, 98%, 99% или 100% свойства (например, активности или другой поддающейся измерению характеристики) сохраняется.
II. Химерные капсиды AAV, нацеленные на ЦНС.
[0090] Авторы изобретения идентифицировали химерные структуры капсида AAV, способные обеспечивать широкомасштабный перенос генов в ЦНС с минимальным тропизмом для периферических органов. Таким образом, один аспект изобретения относится к химерным структурам капсида AAV, способным обеспечивать перенос генов в ЦНС у пациента, например, у пациента дикого типа, например, у пациента, не обладающего нарушением ЦНС. В конкретных вариантах осуществления, изобретение относится к нуклеиновой кислоте, кодирующей капсид AAV, где нуклеиновая кислота содержит, состоит в основном из, или состоит из кодирующей капсид AAV последовательности, которая является по меньшей мере на 70% идентичной: (a) нуклеотидной последовательности из любой из SEQ ID NO:1-43; или (b) нуклеотидной последовательности, кодирующей любую из SEQ ID NO:44-86; и к вирусам, содержащим химерные капсиды AAV. В некоторых вариантах осуществления, кодирующая капсид AAV последовательность является по меньшей мере на 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичной нуклеотидной последовательности из (a) или (b). В другом варианте осуществления, кодирующая капсид AAV последовательность содержит, состоит в основном из, или состоит из нуклеотидной последовательности из (a) или (b).
[0091] В конкретных вариантах осуществления, изобретение относится к нуклеиновой кислоте, кодирующей капсид AAV, где нуклеиновая кислота содержит, состоит в основном из, или состоит из части, кодирующей VP1, VP2 или VP1/VP2, из кодирующей капсид AAV последовательности, которая является по меньшей мере на 70% идентичной: (a) нуклеотидной последовательности из любой из SEQ ID NO:1-43; или (b) нуклеотидной последовательности, кодирующей любую из SEQ ID NO:44-86; функционально связанной с кодирующей VP3 частью последовательности, кодирующей различные капсиды AAV; и к вирусам, содержащим химерные капсиды AAV. В некоторых вариантах осуществления, часть, кодирующая VP1, VP2 или VP1/VP2, из кодирующей капсид AAV последовательности, является по меньшей мере на 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичной кодирующей VP1, VP2, или VP1/VP2 части нуклеотидной последовательности из (a) или (b). В другом варианте осуществления, часть, кодирующая VP1, VP2 или VP1/VP2, из кодирующей капсид AAV последовательности содержит, состоит в основном из, или состоит части, кодирующей VP1, VP2 или VP1/VP2, из нуклеотидной последовательности из (a) или (b). В некоторых вариантах осуществления, часть, кодирующая VP3, из последовательности, кодирующей другой капсид AAV, представляет собой последовательность капсида дикого типа (например, AAV8 или AAV9) или химерную последовательность, которая отличается от любой из последовательностей капсидов по настоящему изобретению.
[0092] Другой аспект изобретения относится к химерным структурам капсидов AAV, способным обеспечивать перенос генов в ЦНС у пациента, обладающего нарушением ЦНС, например, нарушением нервно-психического развития, в частности синдромом Ретта, например, нарушением, вызванным мутацией в гене (MECP2), кодирующем связывающий метилцитозин белок 2. В конкретных вариантах осуществления, изобретение относится к нуклеиновой кислоте, кодирующей капсид AAV, где нуклеиновая кислота содержит, состоит в основном из, или состоит из кодирующей капсид AAV последовательности, которая является по меньшей мере на 70% идентичной: (a) нуклеотидной последовательности из любой из SEQ ID NO: 87-107; или (b) нуклеотидной последовательности, кодирующей любую из SEQ ID NO: 108-128; и к вирусам, содержащим химерные капсиды AAV. В некоторых вариантах осуществления, кодирующая капсид AAV последовательность является по меньшей мере на 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичной нуклеотидной последовательности из (a) или (b). В другом варианте осуществления, кодирующая капсид AAV последовательность содержит, состоит в основном из, или состоит из нуклеотидной последовательности из (a) или (b).
[0093] В конкретных вариантах осуществления, изобретение относится к нуклеиновой кислоте, кодирующей капсид AAV, где нуклеиновая кислота содержит, состоит в основном из, или состоит из части, кодирующей VP1, VP2 или VP1/VP2 из кодирующей капсид AAV последовательности, которая является по меньшей мере на 70% идентичной: (a) нуклеотидной последовательности из любой из SEQ ID NO: 87-107; или (b) нуклеотидной последовательности, кодирующей любую из SEQ ID NO: 108-128; функционально связанной с кодирующей VP3 частью последовательности, кодирующей различные капсиды AAV; и к вирусам, содержащим химерные капсиды AAV. В некоторых вариантах осуществления, часть, кодирующая VP1, VP2 или VP1/VP2, из кодирующей капсид AAV последовательности, является по меньшей мере на 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичной кодирующей VP1, VP2, или VP1/VP2 части нуклеотидной последовательности из (a) или (b). В другом варианте осуществления, часть VP1, VP2 или VP1/VP2 из кодирующей капсид AAV последовательности содержит, состоит в основном из, или состоит из кодирующей VP1, VP2, или VP1/VP2 части нуклеотидной последовательности из (a) или (b). В некоторых вариантах осуществления, часть, кодирующая VP3, из последовательности, кодирующей другой капсид AAV, представляет собой последовательность капсида дикого типа (например, AAV8 или AAV9) или химерную последовательность, которая отличается от любой из последовательностей капсидов по настоящему изобретению.
[0094] В SEQ ID NO:44-86 и 108-128 показана белковая последовательность VP1 капсида. Обозначение всех положений аминокислот в описании изобретения и прилагаемой формуле изобретения приведено в отношении нумерации VP1. Специалисту в данной области понятно, что капсид AAV, как правило, содержит также меньшие белки капсида VP2 и VP3. Из-за перекрывания последовательностей, кодирующих белки капсида AAV, кодирующие последовательности нуклеиновой кислоты и аминокислотные последовательности белков капсида VP2 и VP3 очевидны из последовательностей VP1, показанных в описанных последовательностях. В частности, VP2 начинается с положения нуклеотида 412 (acg) из SEQ ID NO:1 и треонина 138 из SEQ ID NO:44. VP3 начинается с нуклеотида 607 (atg) из SEQ ID NO:1 и метионина 203 из SEQ ID NO:44. В конкретных вариантах осуществления, предусмотрены выделенные белки капсида VP2 и VP3, содержащие последовательность из SEQ ID NO:44, и выделенные нуклеиновые кислоты, кодирующие белки VP2 или VP3, или и то, и другое.
[0095] Изобретение относится также к химерным белкам капсида AAV и к химерным капсидам, где белок капсида содержит, состоит в основном из, или состоит из аминокислотной последовательности, как показано на SEQ ID NO:44-86 и 108-128, где 1, 2 или меньше, 3 или меньше, 4 или меньше, 5 или меньше, 6 или меньше, 7 или меньше, 8 или меньше, 9 или меньше, 10 или меньше, 12 или меньше, 15 или меньше, 20 или меньше, 25 или меньше, 30 или меньше, 40 или меньше, или 50 или меньше из аминокислот внутри кодирующей белок капсида последовательности из SEQ ID NO:44-86 и 108-128 заменены на другую аминокислоту (природную, модифицированную и/или синтетическую), необязательно, посредством консервативной аминокислотной замены, и/или делетированы, и/или присутствуют вставки (включая N-концевые и C-концевые удлинения) из 1, 2 или меньше, 3 или меньше, 4 или меньше, 5 или меньше, 6 или меньше, 7 или меньше, 8 или меньше, 9 или меньше, 10 или меньше, 12 или меньше, 15 или меньше, 20 или меньше, 25 или меньше, 30 или меньше, 40 или меньше, или 50 или меньше аминокислот или любой комбинации замен, делеций и/или вставок, где замены, делеции и/или вставки не нарушают чрезмерно структуру и/или функцию вириона (например, вириона AAV), содержащего вариант белка капсида или капсида. Например, в репрезентативных вариантах осуществления изобретения, вирион AAV, содержащий химерный белок капсида, в основном сохраняет по меньшей мере одно свойство химерного вириона, содержащего химерный белок капсида, как показано в SEQ ID NO:44-86 и 108-128. Например, вирион, содержащий химерный белок капсида, может в основном сохранять профиль тропизма к ЦНС вириона, содержащего химерный белок капсида AAV, как показано в SEQ ID NO:44-86 и 108-128. Способы оценки биологических свойств, таких как трансдукция вируса, хорошо известны в данной области (см., например, примеры).
[0096] Консервативные аминокислотные замены известны в данной области. В конкретных вариантах осуществления, консервативная аминокислотная замена включает замену внутри одной или нескольких из следующих групп: глицин, аланин; валин, изолейцин, лейцин; аспарагиновая кислота, глутаминовая кислота; аспарагин, глутамин; серин, треонин; лизин, аргинин; и/или фенилаланин, тирозин.
[0097] Специалисту в данной области очевидно, что аминокислотные последовательности химерного белка капсида AAV из SEQ ID NO:44-86 и 108-128 можно далее модифицировать для включения других модификаций, как известно в данной области, для придания желательных свойств. В качестве неограничивающих возможностей, белок капсида можно модифицировать для включения нацеливающих последовательностей (например, RGD) или последовательностей, облегчающих очистку и/или детекцию. Например, белок капсида можно сливать со всем или частью глутатион-S-трансферазы, связывающего мальтозу белка, связывающего гепарин/гепарансульфат домена, поли-His, лиганда и/или репортерного белка (например, зеленого флуоресцентного белка, β-глюкуронидазы, β-галактозидазы, люциферазы и т.д.), фрагмента Fc иммуноглобулина, одноцепочечного антитела, гемагглютинина, c-myc, эпитопа FLAG и т.п. для формирования слитого белка. Способы вставки нацеливающих пептидов в капсид AAV известны в данной области (см., например, международную публикацию патента WO 00/28004; Nicklin et al., (2001) Mol. Ther. 474-181; White et al., (2004) Circulation 109:513-319; Muller et al., (2003) Nature Biotech. 21:1040-1046.
[0098] Вирусы по изобретению могут дополнительно включать в себя дуплексный вирусный геном, как описано в международной публикации патента WO 01/92551 и Патенте США No. 7465583.
[0099] Изобретение относится также к капсидам AAV, содержащим химерные белки капсида AAV по изобретению, и к содержащим их вирусным частицам (т.е., вирионам), где в вирусную частицу упакован (т.е., заключен в капсид) геном вектора, необязательно, геном вектора AAV. В конкретных вариантах осуществления, изобретение относится к частице AAV, содержащей капсид AAV, содержащий белок капсида AAV по изобретению, где в капсид AAV упакован геном вектора AAV. Изобретение относится также к частице AAV, содержащей капсид AAV или белок капсида AAV, кодированный последовательностями химерной нуклеиновой кислоты, кодирующими капсид по изобретению.
[0100] В конкретных вариантах осуществления, вирион представляет собой рекомбинантный вектор, содержащий представляющую интерес гетерологичную нуклеиновую кислоту, например, для доставки в клетку. Таким образом, настоящее изобретение можно использовать для доставки нуклеиновых кислот в клетки in vitro, ex vivo и in vivo. В репрезентативных вариантах осуществления, рекомбинантный вектор по изобретению можно преимущественным образом применять для доставки или переноса нуклеиновых кислот в клетки животного (например, млекопитающего).
[0101] Любую гетерологичную нуклеотидную последовательность(последовательности) можно доставлять посредством вирусного вектора по настоящему изобретению. Представляющие интерес нуклеиновые кислоты включают в себя нуклеиновые кислоты, кодирующие полипептиды, необязательно, терапевтические (например, для медицинского или ветеринарного применения) и/или иммуногенные (например, для вакцин) полипептиды.
[0102] В некоторых вариантах осуществления, полипептид представляет собой полипептид, стимулирующий рост и/или дифференцировку клеток ЦНС, например, нейронов, глиальных клеток, олигодендроцитов, астроцитов, микроглиии, и/или эпендимных клеток. Примеры включают в себя, без ограничения, инсулиноподобный фактор роста-1, глиальный нейротрофический фактор, нейтрофин-3, нейтрофин-4, артемин, нейртерин, персефин, нейротрофический фактор головного мозга, фактор роста нервов, цилиарный нейротрофический фактор, трансформирующий фактор роста альфа, фактор роста тромбоцитов, ингибирующий лейкоз фактор, пролактин, транспортер монокарбоксилата 1 или ядерный фактор 1A.
[0103] Терапевтические полипептиды включают в себя, но без ограничения, белок трансмембранный регулятор кистозного фиброза (CFTR), дистрофин (включая белковый продукт минигенов или микрогенов дистрофина, см.,например, Vincent et al., (1993) Nature Genetics 5:130; Публикацию патента США No. 2003017131; Wang et al., (2000) Proc. Natl. Acad. Sci. USA 97:13714-9 [мини-дистрофин]; Harper et al., (2002) Nature Med. 8:253-61 [микро-дистрофин]); мини-агрин, ламинин-α2, саркогликан (α, β, γ или δ), связанный с фукутином белок, пропептид миостатина, фоллистатин, доминатнтно-негативный аллель миостатина, ангиогенный фактор (например, VEGF, ангиопоэтин-1 или 2),антиапоптотический фактор (например, гемоксигеназа-1, TGF-β, ингибиторы проапоптотических сигналов, таких как каспазы, протеазы, киназы, рецепторы смерти [например, CD-095], модуляторы высвобождения цитохрома C, ингибиторы открытия пор и набухания митохондрий); растворимый рецептор активина типа II, противовоспалительные полипептиды, такие как доминатный мутант I каппа B, саркоспан, утрофин, мини-утрофин, антитела или фрагменты антител против миостатина или пропептида миостатина, модуляторы клеточного цикла, модуляторы киназы Rho, такие как цетрин, представляющий собой модифицированный бактериальный экзофермент C3 [доступный из BioAxone Therapeutics, Inc., Saint-Lauren, Quebec, Canada], BCL-xL, BCL2, XIAP, FLICEc-s, доминантно-негативную каспазу-8, доминантно-негативную каспазу-9, SPI-6 (см., например, Патентную заявку США No. 20070026076), фактор транскрипции PGC-α1, ген Pinch, ген ILK и ген тимозина β4), факторы свертывания крови (например, фактор VIII, фактор IX, фактор X и т.д.), эритропоэтин, ангиостатин, эндостатин, каталазу, тирозин-гидроксилазу, внутриклеточную и/или внеклеточную супероксиддисмутазу, лептин, рецептор LDL, неприлизин, липопротеинлипазу, орнитин-транскарбамилазу, β-глобин, α-глобин, спектрин, α1-антитрипсин, связывающий метилцитозин белок 2, аденозин-дезаминазу, гипоксантин-гуанин-фосфорибозил-трансферазу, β-глюкоцереброзидазу, сфингомиелиназу, лизосомальную гексозаминидазу A, дегидрогеназу кетокислот с разветвленной цепью, белок RP65, цитокин (например, α-интерферон, β-интерферон, интерферон-γ, интерлейкины-1 - -14, гранулоцитарно-макрофагальный колониестимулирующий фактор, лимфотоксин и т.п.), пептидные факторы роста, нейротрофические факторы и гормоны (например, соматотропин, инсулин, инсулиноподобные факторы роста, включая IGF-1 и IGF-2, GLP-1, тромбоцитарный фактор роста, эпидермальный фактор роста, фактор роста фибробластов, фактор роста нервов, нейротрофический фактор-3 и -4, нейротрофический фактор головного мозга, глиальный фактор роста, трансформирующий фактор роста-α и -β, и т.п.), костные морфогенетические белки (включая RANKL и VEGF), лизосомальный белок, рецептор глутамата, лимфокин, растворимый CD4, рецептор Fc, T-клеточный рецептор, ApoE, ApoC, ингибитор 1 протеинфосфатазы (I-1), фосфоламбан, serca2a, лизосомальная кислая α-глюкозидаза,α-галактозидаза A, Barkct, β2-адренергический рецептор, киназу β2-адренергического рецептора (BARK), фосфоинозитид-3-киназу (PI3 киназу), калсарцин, рецептор (например, растворимый рецептор фактора некроза опухолей-α), противовоспалительный фактор, такой как IRAP, Pim-1, PGC-1α, SOD-1, SOD-2, ECF-SOD, калликреин, тимозин-β4, индуцируемый гипоксией фактор транскрипции [HIF], ангиогенный фактор, S100A1, парвальбумин, аденилатциклазу типа 6, молекулу, вызывающую нокдаун киназы сопряженного с G-белком рецептора типа 2, такую как усеченный конститутивно активный bARKct; ингибирующие фосфоламбан или доминантно-негативные молекулы, такие как фосфоламбан S16E, моноклональное антитело (включая одноцепочечные моноклональные антитела) или продукт гена самоубийства (например, тимидинкиназу, цитозин-дезаминазу, дифтерийный токсин и факторы некроза опухолей, такие как TNF-α), и любой другой полипептид, оказывающий терапевтический эффект на нуждающегося в этом пациента.
[0104] Гетерологичные нуклеотидные последовательности, кодирующие полипептиды, включают в себя последовательности, кодирующие репортерные полипептиды (например, фермент). Репортерные полипептиды известны в данной области и включают в себя, но без ограничения, флуоресцентный белок (например, EGFP, GFP, RFP, BFP, YFP или dsRED2), фермент, образующий поддающийся детекции продукт, такой как люцифераза (например, из Gaussia, Renilla или Photinus), β-галактозидаза, β-глюкуронидаза, щелочная фосфатаза и ген хлорамфеникол-ацетилтрансферазы, или белки, которые можно детектировать напрямую. Практически любой белок можно детектировать напрямую с использованием, например, специфических антител против белка. Дополнительные маркеры (и ассоциированные антибиотики), пригодные либо для положительного, либо для отрицательного отбора эукариотических клеток, описаны в Sambrook and Russell (2001), Molecular Cloning, 3rd Ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., и Ausubel et al. (1992), Current Protocols in Molecular Biology, John Wiley & Sons, включая периодические обновления.
[0105] Альтернативно, гетерологичная нуклеиновая кислота может кодировать функциональную РНК, например, антисмысловой олигонуклеотид, рибозим (например, как описано в Патенте США No. 5877022), РНК, вызывающую опосредуемый сплайсосомой транс-сплайсинг (см., Puttaraju et al., (1999) Nature Biotech. 17:246; Патент США No. 6013487; Патент США No. 6083702), интерферирующие РНК (РНКи), включая малые интерферирующие РНК (миРНК), опосредующие выключение гена (см., Sharp et al., (2000) Science 287:2431), микроРНК или другие нетранслируемые «функциональные» РНК, такие как «направляющие» РНК (Gorman et al., (1998) Proc. Nat. Acad. Sci. USA 95:4929; Патент США No. 5869248 от Yuan et al.), и т.п. Иллюстративные нетранслируемые РНК включают в себя РНКи или антисмысловую РНК против продукта гена множественной устойчивости к лекарственным средствам (MDR) (например, для лечения опухолей и/или для введения в сердце для предотвращения повреждения посредством химиотерапии), РНКи или антисмысловую РНК против миостатина (при мышечной дистрофии Дюшенна или Беккера), РНКи или антисмысловую РНК против VEGF или иммуногена опухоли, включая, но без ограничения, иммуногены опухолей, конкретно описанные в настоящем описании (для лечения опухолей), РНКи или антисмысловые олигонуклеотиды, нацеленные на мутантные дистрофины (при мышечной дистрофии Дюшенна или Беккера), РНКи или антисмысловую РНК против гена поверхностного антигена вируса гепатита B (для предотвращения и/или лечения инфекции гепатита B), РНКи или антисмысловую РНК против генов tat и/или rev HIV (для предотвращения и/или лечения HIV) и/или РНКи или антисмысловую РНК против любого другого иммуногена из патогена (для защиты пациента от патогена) или продукта дефектного гена (для предотвращения или лечения заболевания). РНКи или антисмысловую РНК против мишеней, описанных выше, или любой другой мишени можно также применять в качестве реагента для исследований.
[0106] Как известно в данной области, антисмысловые нуклеиновые кислоты (например, ДНК или РНК) и последовательности ингибирующей РНК (например, микроРНК и РНКи, такие как миРНК или кшРНК) можно использовать для индукции «пропуска экзонов» у пациентов с мышечной дистрофией, возникающей из-за дефектов в гене дистрофина. Таким образом, гетерологичная нуклеиновая кислота может кодировать антисмысловую нуклеиновую кислоту или ингибирующую РНК, индуцирующую подходящий пропуск экзонов. Специалисту в данной области понятно, что конкретный способ пропуска экзонов зависит от природы лежащего в основе дефекта в гене дистрофина, и многочисленные такие способы известны в данной области. Иллюстративные антисмысловые нуклеиновые кислоты и ингибирующие последовательности РНК нацелены на вышележащую точку разветвления и/или нижележащий донорный участок сплайсинга, и/или внутреннюю последовательность энхансера сплайсинга из одного или нескольких экзонов дистрофина (например, экзонов 19 или 23). Например, в конкретных вариантах осуществления, гетерологичная нуклеиновая кислота кодирует антисмысловую нуклеиновую кислоту или ингибирующую РНК, направленные против вышележащей точки разветвления и нижележащнго донорного участка сплайсинга экзона 19 или 23 гена дистрофина. Такие последовательности можно включать в вектор AAV, доставляющий модифицированную мяРНК U7 и антисмысловую нуклеиновую кислоту или ингибирующую РНК (см., например, Goyenvalle et al., (2004) Science 306:1796-1799). В качестве другого способа, модифицированную мяРНК U1 можно включать в вектор AAV наряду с миРНК, микроРНК или антисмысловой РНК, комплементарной вышележащему и нижележащему участкам сплайсинга экзона дистрофина (например, экзон 19 или 23) (см., например, Denti et al., (2006) Proc. Nat. Acad. Sci.USA 103:3758-3763). Кроме того, антисмысловые нуклеиновые кислоты и ингибирующую РНК можно нацеливать на последовательности энхансеров сплайсинга в экзонах 19, 43, 45 или 53 (см., например, Патент США No. 6653467; Патент США No. 6727355; и Патент США No. 6653466).
[0107] Рибозимы представляют собой комплексы РНК-белок, расщепляющие нуклеиновые кислоты сайт-специфическим образом. Рибозимы обладают специфическими каталитическими доменами, обладающими эндонуклеазной активностью (Kim et al., (1987) Proc. Natl. Acad. Sci. USA 84:8788; Gerlach et al., (1987) Nature 328:802; Forster and Symons, (1987) Cell 49:211). Например, большое количество рибозимов ускоряет реакции переноса фосфоэфира с высокой степенью специфичности, часто расщепляя только один из нескольких фосфоэфиров в олигонуклеотидном субстрате (Michel and Westhof, (1990) J. Mol. Biol. 216:585; Reinhold-Hurek and Shub, (1992) Nature 357:173). Эту специфичность приписывают необходимости того, чтобы субстрат связывался посредством специфических взаимодействий спаривания оснований с внутренней направляющей последовательностью («IGS») рибозима перед химической реакцией.
[0108] Рибозимный катализ впервые наблюдали в качестве части специфических для последовательности реакций расщепления/лигирования, затрагивающих нуклеиновые кислоты (Joyce, (1989) Nature 338:217). Например, в Патенте США No. 5354855 опубликовано, что конкретные рибозимы могут действовать как эндонуклеазы со специфичностью к последовательности, более высокой, чем у известных рибонуклеаз, и приближающейся к специфичности ферментов рестрикции ДНК. Таким образом, специфическое для последовательности опосредованное рибозимом ингибирование экспрессии нуклеиновой кислоты может являться особенно пригодным для терапевтических применений (Scanlon et al., (1991) Proc. Natl. Acad. Sci. USA 88:10591; Sarver et al., (1990) Science 247:1222; Sioud et al., (1992) J. Mol. Biol. 223:831).
[0109] МикроРНК (mir) представляют собой природные клеточные молекулы РНК, которые могут регулировать экспрессию множества генов посредством контроля стабильности мРНК. Сверхэкспрессию или уменьшение количества конкретной микроРНК можно использовать для лечения дисфункции, и показано, что они являются эффективными для ряда состояний заболевания и моделей заболеваний на животных (см., например, Couzin, (2008) Science 319:1782-4). Химерный AAV можно использовать для доставки микроРНК в клетки, ткани и пациентам для лечения генетических и приобретенных заболеваний, или для улучшения функциональности и стимуляции роста конкретных тканей. Например, mir-1, mir-133, mir-206 и/или mir-208 можно использовать для лечения заболеваний сердечной и скелетных мышц (см., например, Chen et al., (2006) Genet. 38:228-33; van Rooij et al., (2008) Trends Genet. 24:159-66). МикроРНК можно также использовать для модуляции иммунной системы после доставки генов (Brown et al., (2007) Blood 110:4144-52).
[0110] Термин «антисмысловой олигонуклеотид» (включая «антисмысловую РНК»), в рамках изобретения, относится к нуклеиновой кислоте, которая является комплементарной указанной последовательности ДНК или РНК и специфически гибридизуется с ней. Антисмысловые олигонуклеотиды и кодирующие их нуклеиновые кислоты можно получать в соответствии с общепринятыми способами. См., например, Патент США No. 5023243 от Tullis; Патент США No. 5149797 от Pederson et al.
[0111] Специалисту в данной области понятно, что не является необходимым, чтобы антисмысловой олигонуклеотид являлся полностью комплементарным последовательности-мишени, при условии, что степень сходства последовательностей является достаточной, чтобы антисмысловая нуклеотидная последовательность специфически гибридизовалась со своей мишенью (как определено выше) и уменьшала продукцию белкового продукта (например, по меньшей мере приблизительно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или более).
[0112] Для определения специфичности гибридизации, гибридизацию таких олигонуклеотидов с последовательностями-мишенями можно проводить в условиях пониженной строгости, средней строгости или даже в строгих условиях. Пригодные условия для достижения условий пониженной строгости, средней строгости гибридизации и строгих условий гибридизации являются такими, как описано в настоящем описании.
[0113] Альтернативно указано, в конкретных вариантах осуществления, что антисмысловые олигонуклеотиды по изобретению обладают по меньшей мере приблизительно 60%, 70%, 80%, 90%, 95%, 97%, 98% или более высокой идентичностью последовательности с последовательностью, комплементарной последовательности-мишени, и уменьшают продукцию белкового продукта (как определено выше). В некоторых вариантах осуществления, антисмысловая последовательность содержит 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 несовпадений по сравнению с последовательностью-мишенью.
[0114] Способы определения процента идентичности последовательностей нуклеиновой кислоты описаны более подробно в другом месте настоящего документа.
[0115] Длина антисмыслового олигонуклеотида не является критической, при условии, что он специфически гибридизуется с намеченной мишенью и уменьшает продукцию белкового продукта (как определено выше), и ее можно определять в соответствии с общепринятыми способами. Как правило, антисмысловой олигонуклеотид имеет длину по меньшей мере приблизительно восемь, десять или двенадцать или пятнадцать нуклеотидов и/или менее, чем приблизительно 20, 30, 40, 50, 60, 70, 80, 100 или 150 нуклеотидов.
[0116] РНК-интерференция (РНКи) представляет собой другой способ, который можно использовать для уменьшения продукции белкового продукта (например, кшРНК или миРНК). РНКи представляет собой механизм пост-транскрипционного выключения гена, при котором двухцепочечную РНК (дцРНК), соответствующую представляющей интерес последовательности-мишени, вводят в клетку или в организм, что приводит к деградации соответствующей мРНК. Обзор механизма, посредством которого РНКи обеспечивает выключение гена, приведен в Sharp et al., (2001) Genes Dev 15: 485-490; и Hammond et al., (2001) Nature Rev. Gen. 2:110-119). Эффект РНКи персистирует в течение множества делений клетки, до того, как экспрессия гена восстановится. РНКи, таким образом, является действенным способом для получения намеченных нокаутов или «нокдаунов» на уровне РНК. Доказана успешность РНКи в клетках человека, включая клетки эмбриональной почки человека и клетки HeLa (см., например, Elbashir et al., Nature (2001) 411:494-8).
[0117] Первоначальные попытки использовать РНКи в клетках млекопитающих приводили к запуску механизмов противовирусной защиты, включающих в себя PKR, в ответ на молекулы дцРНК (см., например, Gil et al., (2000) Apoptosis 5:107). С тех пор показано, что короткие синтетические дцРНК из приблизительно 21 нуклеотидов, известные как «малые интерферирующие РНК» (миРНК) могут опосредовать выключение генов в клетках млекопитающих без запуска противовирусного ответа (см., например, Elbashir et al., Nature (2001) 411:494-8; Caplen et al., (2001) Proc. Nat. Acad. Sci. USA 98:9742).
[0118] Молекула для РНКи (включая молекулу миРНК) может представлять собой короткошпилечную РНК (кшРНК; см. Paddison et al., (2002), Proc. Nat. Acad. Sci. USA 99:1443-1448), которая, как считают, подвергается процессингу в клетке под действием подобного РНКазе III фермента Dicer до 20-25-членных молекул миРНК. кшРНК, как правило, обладают структурой стебель-петля, в которой две последовательности инвертированных повторов разделены короткой спейсерной последовательностью, которая выпетливается. Опубликованы кшРНК с петлями длиной в диапазоне от 3 до 23 нуклеотидов. Последовательность петли, как правило, не является критической. Иллюстративные последовательности петли включают в себя следующие мотивы: AUG, CCC, UUCG, CCACC, CTCGAG, AAGCUU, CCACACC и UUCAAGAGA.
[0119] РНКи может дополнительно включать в себя кольцевую молекулу, содержащую смысловую и антисмысловую области с двумя областями петель на каждой стороне для формирования структуры в форме «гантели» после формирования дцРНК между смысловой и антисмысловой областями. Эту молекулу можно подвергать процессингу in vitro или in vivo для высвобождения части дцРНК, например, миРНК.
[0120] В международной публикации патента WO 01/77350 описан вектор для транскрипции в двух направлениях для получения как смыслового, и так антисмыслового транскриптов гетерологичной последовательности в эукариотической клетке. Этот способ можно применять для получения РНКи для применения по изобретению.
[0121] В Shinagawa et al., (2003) Genes Dev. 17:1340 опубликован способ экспрессии длинных дцРНК с промотора CMV (промотора pol II), где способ можно применять также для тканеспецифических промоторов pol II. Подобным образом, способ Xia et al., (2002) Nature Biotech. 20:1006, исключает образование поли(A)-хвостов, и его можно использовать в сочетании с тканеспецифическими промоторами.
[0122] Способы получения РНКи включают в себя химический синтез, транскрипцию in vitro, расщепление длинной дцРНК посредством Dicer (in vitro или in vivo), экспрессию in vivo с вектора для доставки,и экспрессию in vivo с полученной посредством ПЦР экспрессирующей кассеты для РНКи (см.,например, TechNotes 10(3) «Five Ways to Produce siRNAs», от Ambion, Inc., Austin TX; доступный на www.ambion.com).
[0123] Руководства для разработки молекул миРНК являются доступными (см.,например, литературу от Ambion, Inc., Austin TX; доступный на www.ambion.com). В конкретных вариантах осуществления, последовательность миРНК обладает содержанием G/C 30-50%. Кроме того, длинных участков из более, чем четырех остатков T или A, как правило, избегают, если РНК-полимеразу III используют для транскрипции РНК. Средства для поиска мишеней миРНК онлайн являются доступными, например, из Ambion, Inc. (www.ambion.com), из Whitehead Institute of Biomedical Research (www.jura.wi.mit.edu) или из Dharmacon Research, Inc. (www.dharmacon.com).
[0124] Антисмысловая область молекулы для РНКи может являться полностью комплементарной последовательности-мишени, но не обязательно должна быть, при условии, что она специфически гибридизуется с последовательностью-мишенью (как определено выше) и уменьшает продукцию белкового продукта (например, по меньшей мере приблизительно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или более). В некоторых вариантах осуществления, гибридизацию таких олигонуклеотидов с последовательностями-мишенями можно проводить в условиях уменьшенной строгости, средней строгости или даже в строгих условиях, как определено выше.
[0125] В других вариантах осуществления, антисмысловая область РНКи обладает по меньшей мере приблизительно 60%, 70%, 80%, 90%, 95%, 97%, 98% или более высокой идентичностью последовательности с последовательностью, комплементарной последовательности-мишени, и уменьшает продукцию белкового продукта (например, по меньшей мере приблизительно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или более). В некоторых вариантах осуществления, антисмысловая область содержит 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 несовпадений по сравнению с последовательностью-мишенью. Несовпадения обычно более приемлемы на концах дцРНК, чем в центральном положении.
[0126] В конкретных вариантах осуществления, РНКи образуется посредством формирования межмолекулярных комплексов между двумя отдельными смысловой и антисмысловой молекулами. РНКи содержит дц область, сформированную посредством межмолекулярного спаривания оснований между двумя отдельными цепями. В других вариантах осуществления, РНКи содержит дц область, сформированную посредством внутримолекулярного спаривания оснований внутри одной молекулы нуклеиновой кислоты, содержащей как смысловую, так и антисмысловую области, как правило, в форме инвертированного повтора (например, кшРНК или другой структуры стебель-петля, или кольцевой молекулы РНКи). РНКи может, кроме того, содержать спейсерную область между смысловой и антисмысловой областями.
[0127] Как правило, молекулы для РНКи являются высоко избирательными. Если желательно, специалист в данной области может легко исключать кандидатов для РНКи, которые, вероятно мешают экспрессии нуклеиновых кислот, отличных от мишени, посредством поиска в имеющих отношение к делу базах данных для идентификации последовательностей для РНКи, не обладающих значительной гомологией последовательности с другими известными последовательностями, например, с использованием BLAST (доступного на www.ncbi.nlm.nih.gov/BLAST).
[0128] Наборы для получения РНКи являются коммерчески доступными, например, из New England Biolabs, Inc. и Ambion, Inc.
[0129] Рекомбинантный вирусный вектор может также содержать гетерологичную нуклеотидную последовательность, разделяющую гомологию и вступающую в рекомбинацию с локусом на хромосоме хозяина. Этот способ можно использовать для коррекции генетического дефекта в клетке-хозяине.
[0130] Настоящее изобретение также относится к рекомбинантным вирусным векторам, экспрессирующим иммуногенный полипептид, например, для вакцинации. Гетерологичная нуклеиновая кислота может кодировать любой представляющий интерес иммуноген, известный в данной области, включая, но без ограничения, иммуногены из вируса иммунодефицита человека, вируса гриппа, белки gag, антигены опухолей, антигены злокачественных опухолей, бактериальные антигены, вирусные антигены и т.п. Альтернативно, иммуноген может являться представленным на капсиде вируса (например, включенным в него) или связанным с капсидом вируса (например, посредством ковалентной модификации).
[0131] Применение парвовирусов в качестве вакцин известно в данной области (см.,например, Miyamura et al., (1994) Proc. Nat. Acad. Sci. USA 91:8507; Патент США No. 5916563 от Young et al., 5905040 от Mazzara et al., Патент США No. 5882652, Патент США No. 5863541 от Samulski et al.; полное содержание которых приведено в настоящем описании в качестве ссылки). Антиген может являться представленным на капсиде вируса. Альтернативно, антиген можно экспрессировать с гетерологичной нуклеиновой кислоты, введенной в рекомбинантный геном вектора.
[0132] Иммуногенный полипептид, или иммуноген, может представлять собой любой полипептид, пригодный для защиты пациента против заболевания, включая, но без ограничения, вызванные микроорганизмами, бактериями, простейшими, паразитами, грибами и вирусами заболевания. Например, иммуноген может представлять собой иммуноген ортомиксовируса (например, иммуноген вируса гриппа, такой как поверхностный белок гемагглютинин (HA) вируса гриппа или ген нуклеопротеина вируса гриппа, или иммуноген вируса гриппа лошадей) или иммуноген лентивируса (например, иммуноген вируса инфекционной анемии лошадей, иммуноген вируса иммунодефицита обезьян (SIV), или иммуноген вируса иммунодефицита человека (HIV), такой как белок GP160 оболочки HIV или SIV, белки матрикса/капсида HIV или SIV, и продукты генов gag, pol и env HIV или SIV). Иммуноген может представлять собой также иммуноген аренавируса (например, иммуноген вирусалихорадки Ласса, такой как ген нуклеобелка капсида вируса лихорадки Ласса и ген гликопротеина оболочки вируса лихорадки Ласса), иммуноген поксвируса (например, вируса осповакцины, такой как гены L1 или L8 осповакцины), иммуноген флавивируса (например,иммуноген вируса желтой лихорадки или иммуноген вируса японского энцефалита), иммуноген филовируса (например, вируса Эбола или иммуноген вируса марбургской болезни, такой как гены NP и GP), иммуноген буньявируса (например, вирусов RVFV, CCHF и SFS), или иммуноген коронавируса (например, иммуноген инфекционного коронавируса человека, такой как ген гликопротеина оболочки коронавируса человека, или иммуноген вируса трансмиссивного гастроэнтерита свиней, или иммуноген вируса инфекционного бронхита птиц, или иммуноген вируса тяжелого острого респираторного синдрома (SARS), такой как белок S [S1 или S2], M, E или N, или их иммуногенный фрагмент). Кроме того, иммуноген может представлять собой иммуноген вируса полиомиелита, иммуноген вируса герпеса (например, иммуногены CMV, EBV, HSV), иммуноген вируса свинки, иммуноген вируса кори, иммуноген вируса краснухи, дифтерийный токсин или другой дифтерийный иммуноген, антиген возбудителя коклюша, иммуноген вируса гепатита (например, гепатита A, гепатита B или гепатита C), или любой другой вакцинный иммуноген, известный в данной области.
[0133] Альтернативно, иммуноген может представлять собой любой антиген клетки опухоли или злокачественной опухоли. Необязательно, антиген опухоли или злокачественной опухоли экспрессирован на поверхности клетки злокачественной опухоли. Иллюстративные антигены клеток злокачественных опухолей и опухолей описаны в S.A. Rosenberg, (1999) Immunity 10:281). Иллюстративные антигены злокачественных опухолей и опухолей включают в себя, но без ограничения: продукт гена BRCA1, продукт гена BRCA2, gp100, тирозиназу, GAGE-1/2, BAGE, RAGE, NY-ESO-1, CDK-4, β-катенин, MUM-1, каспазу-8, KIAA0205, HPVE, SART-1, PRAME, p15, антигены опухоли меланомы (Kawakami et al., (1994) Proc. Natl. Acad. Sci. USA 91:3515; Kawakami et al., (1994) J. Exp. Med., 180:347; Kawakami et al., (1994) Cancer Res. 54:3124), включая антиген MART-1 (Coulie et al., (1991) J. Exp. Med. 180:35), gp100 (Wick et al., (1988) J. Cutan. Pathol. 4:201) и MAGE (MAGE-1, MAGE-2 и MAGE-3) (Van der Bruggen et al., (1991) Science, 254:1643), CEA, TRP-1; TRP-2; P-15 и тирозиназу (Brichard et al., (1993) J. Exp. Med. 178:489); продукт гена HER-2/neu (Патент США No. 4968603); CA 125; HE4; LK26; FB5 (эндосиалин); TAG 72; AFP; CA19-9; NSE; DU-PAN-2; CA50; Span-1; CA72-4; HCG; STN (сиалил-Tn-антиген); белки c-erbB-2; PSA; L-CanAg; рецептор эстрогенов; глобулин молочного жира; белок супрессор опухолей p53 (Levine, (1993) Ann. Rev. Biochem. 62:623); муциновые антигены (международная публикация патента WO 90/05142); теломеразы; белки ядерного матрикса; простатическую кислую фосфатазу; антигены вируса папилломы; и антигены, ассоциированные со следующими опухолями: меланомы, аденокарцинома, тимома, саркома, рак легкого, рак печени, колоректальный рак, неходжскинская лимфома, лимфома Ходжкина, лейкозы, рак тела матки, рак молочной железы, рак предстательной железы, рак яичника, рак шейки матки, рак мочевого пузыря, рак почки, рак поджелудочной железы, злокачественная опухоль мозга, рак почки, рак желудка, рак пищевода, рак головы и шеи и другие (см., например, Rosenberg, (1996) Annu. Rev. Med. 47:481-91).
[0134] Альтернативно, гетерологичная нуклеотидная последовательность может кодировать любой полипептид, который желательно продуцировать в клетке in vitro, ex vivo, или in vivo. Например, вирусные векторы можно вводить в культивируемые клетки и выделять из них экспрессированный белковый продукт.
[0135] Специалисту в данной области понятно, что представляющая интерес гетерологичная нуклеиновая кислота(кислоты) может являться функционально связанной с подходящими контрольными последовательностями. Например, гетерологичная нуклеиновая кислота может являться функционально связанной с контрольными элементами экспрессии, такими как контрольные сигналы транскрипции/трансляции, точки начала репликации, сигналы полиаденилирования, внутренние участки связывания рибосомы (IRES), промоторы, энхансеры и т.п.
[0136] Кроме того, специалисту в данной области понятно, что можно использовать множество промоторных/энхансерных элементов в зависимости от желательных уровня и тканеспецифичности экспрессии. Промотор/энхансер может являться конститутивным или индуцируемым, в зависимости от желательного паттерна экспрессии. Промотор/энхансер может являться нативным или чужеродным и может представлять собой природную или синтетическую последовательность. Под чужеродным подразумевают, что область инициации транскрипции не обнаружена у хозяина дикого типа, которому вводят область инициации транскрипции.
[0137] Промоторные/энхансерные элементы могут являться нативными для клетки или пациента-мишени, подлежащих лечению, и/или нативными для гетерологичной последовательности нуклеиновой кислоты. Промоторный/энхансерный элемент, как правило, выбирают таким образом, что он может функционировать в представляющей интерес клетке-мишени(клетках-мишенях). В репрезентативных вариантах осуществления, промоторный/энхансерный элемент представляет собой промоторный/энхансерный элемент млекопитающих. Промоторный/энхансерный элемент может являться конститутивным или индуцируемым.
[0138] Индуцируемые элементы контроля экспрессии, как правило, используют для тех применений, где является желательным обеспечивать регуляцию экспрессии гетерологичной последовательности(последовательностей) нуклеиновой кислоты. Индуцируемые промоторные/энхансерные элементы для доставки генов могут представлять собой тканеспецифические или предпочтительные для ткани промоторные/энхансерные элементы, и включают в себя специфические или предпочтительные для мышц (включая сердечную, скелетные и/или гладкие мышцы), специфические или предпочтительные для нервной ткани (включая специфические для головного мозга), глаза (включая специфические для сетчатки и специфические для роговицы), специфические или предпочтительные для печени, специфические или предпочтительные для костного мозга, специфические или предпочтительные для поджелудочной железы, специфические или предпочтительные для селезенки и специфические или предпочтительные для легкого промоторные/энхансерные элементы. В одном варианте осуществления, используют специфический для клеток ЦНС или предпочтительный для клеток ЦНС промотор. Примеры специфических или предпочтительных для нейронов промоторов включают в себя, без ограничения, промоторы нейрон-специфической енолазы, синапсина и MeCP2. Примеры специфических или предпочтительных для астроцитов промоторов включают в себя, без ограничения, промоторы глиофибриллярного кислого белка и S100β. Примеры специфических или предпочтительных для эпендимных клеток промоторов включают в себя, без ограничения, wdr16, Foxj1 и LRP2. Примеры специфических или предпочтительных для микроглии промоторов включают в себя, без ограничения, F4/80, CX3CR1 и CD11b. Примеры специфических или предпочтительных для олигодендроцитов промоторов включают в себя, без ограничения, промоторы основного белка миелина, фосфодиэстеразы циклических нуклеотидов, протеолипидного белка, Gtx и Sox10. Применение специфического или предпочтительного для клеток ЦНС промотора может увеличивать специфичность, достигаемую химерным вектором AAV, посредством дополнительного ограничения экспрессии гетерологичной нуклеиновой кислоты в ЦНС. Другие индуцируемые промоторные/энхансерные элементы включают в себя индуцируемые гормонами и индуцируемые металлами элементами. Иллюстративные индуцируемые промоторные/энхансерные элементы включают в себя, но без ограничения, элемент Tet вкл./выкл., индуцируемый RU486 промотор, индуцируемый экдизоном промотор, индуцируемый рапамицином промотор и промотор металлотионеина.
[0139] В вариантах осуществления, где гетерологичную последовательность(последовательности) нуклеиновой кислоты транскрибируют и затем транслируют в клетках-мишенях, специфические сигналы инициации, как правило, применяют для эффективной трансляции вставленных кодирующих белок последовательностей. Эти экзогенные последовательности контроля трансляции, которые могут включать в себя инициирующий кодон ATG и смежные последовательности, могут происходить из множества источников, как природных, так и синтетических.
[0140] Изобретение относится к химерным частицам AAV, содержащим капсид AAV и геном AAV, где геном AAV «соответствует» капсиду AAV (т.е., кодирует его). Представлены также коллекции или библиотеки таких химерных частиц AAV, где коллекция или библиотека содержит 2 или более, 10 или более, 50 или более, 100 или более, 1000 или более, 104 или более, 105 или более, или 106 или более различных последовательностей.
[0141] Настоящее изобретение, кроме того, относится к «пустым» частицам капсида (т.е., в отсутствие генома вектора), содержащим, состоящим из или в основном состоящим из химерных белков капсида AAV по изобретению. Химерные капсиды AAV по изобретению можно использовать в качестве «капсидных носителей», как описано в Патенте США No. 5863541. Молекулы, которые можно ковалентно присоединять к капсидам вируса, связывать с капсидами вируса или упаковывать посредством капсидов вируса и переносить в клетку, включают в себя ДНК, РНК, липид, углевод, полипептид, малую органическую молекулу или их комбинации. Кроме того, молекулы могут являться ассоциированными с (например, «связанными с») внешней частью капсида вируса для переноса молекул в клетки-мишени хозяина. В одном варианте осуществления изобретения молекула является ковалентно связанной (т.е., конъюгированной или химически связанной) с белками капсида. Способы ковалентного присоединения молекул известны специалистам в данной области.
[0142] Капсиды вирусов по изобретению также находят применение в стимуляции образования антител против новых структур капсидов. В качестве дополнительной альтернативы, экзогенную аминокислотную последовательность можно вставлять в капсид вируса для представления антигена клетке, например, для введения пациенту для получения иммунного ответа на экзогенную аминокислотную последовательность.
[0143] Изобретение относится также к нуклеиновым кислотам (например, выделенным нуклеиновым кислотам), кодирующим химерные капсиды вирусов и химерные белки капсида по изобретению. Кроме того, представлены векторы, содержащие нуклеиновые кислоты, и клетки (in vivo или в культуре), содержащие нуклеиновые кислоты и/или векторы по изобретению. Такие нуклеиновые кислоты, векторы и клетки можно использовать, например, в качестве реагентов (например, конструкций-помощников или упаковывающих клеток) для получения вирусных векторов, как описано в настоящем описании.
[0144] В иллюстративных вариантах осуществления, изобретение относится к последовательностям нуклеиновой кислоты, кодирующим капсид AAV из SEQ ID NO: 44-86 или 108-128, или по меньшей мере на 70% идентичным нуклеотидной последовательности из SEQ ID NO: 1-44 или 87-107. Изобретение относится также к нуклеиновым кислотам, кодирующим варианты капсида AAV, варианты белка капсида и слитые белки, как описано выше. В конкретных вариантах осуществления, нуклеиновая кислота гибридизуется с последовательностью, комплементарной последовательностям нуклеиновой кислоты, конкретно описанным в настоящем описании, в стандартных условиях, как известно специалистам в данной области, и кодирует вариант капсида и/или белка капсида. Необязательно, вариант капсида или белка капсида в основном сохраняет по меньшей мере одно свойство капсида и/или капсида или белка капсида, кодируемых последовательностью нуклеиновой кислоты из SEQ ID NO: 1-44 или 87-107. Например, вирусная частица, содержащая вариант капсида или вариант белка капсида, может в основном сохранять профиль тропизма к ЦНС вирусной частицы, содержащей капсид или белок капсида, кодируемые кодирующей последовательностью нуклеиновой кислоты из SEQ ID NO:1-44 или 87-107.
[0145] Например, гибридизацию таких последовательностей можно проводить в условиях уменьшенной строгости, средней строгости или даже в строгих условиях. Иллюстративные условия для уменьшенной строгости, средней строгости и строгой гибридизации являются следующими: (например, условия, представленные строгостью отмывки 35-40% формамид с 5x раствором Денхардта, 0,5% SDS и 1x SSPE при 37°C; условия, представленные строгостью отмывки 40-45% формамид с 5x раствором Денхардта, 0,5% SDS и 1x SSPE при 42°C; и условия, представленные строгостью отмывки 50% формамид с 5x раствором Денхардта, 0,5% SDS и 1x SSPE при 42°C, соответственно). См., например, Sambrook et al., Molecular Cloning, A Laboratory Manual (2d Ed. 1989) (Cold Spring Harbor Laboratory).
[0146] В других вариантах осуществления, последовательности нуклеиновой кислоты, кодирующей вариант капсида или белка капсида по изобретению, обладают по меньшей мере приблизительно 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, или более высокой идентичностью последовательности с последовательностью нуклеиновой кислоты из SEQ ID NO:1-44 или 87-107 и необязательно, кодируют вариант капсида или белка капсида, в основном сохраняющий по меньшей мере одно свойство капсида или белка капсида, кодируемого нуклеиновой кислотой из SEQ ID NO:1-44 или 87-107.
[0147] Как известно в данной области, ряд различных программ можно использовать для идентификации того, обладает ли нуклеиновая кислота или полипептид идентичностью последовательности с известной последовательностью. Процент идентичности, в рамках изобретения, означает, что нуклеиновая кислота или ее фрагмент разделяет указанный процент идентичности с другой нуклеиновой кислотой, при оптимальном выравнивании (с соответствующими вставками или делециями нуклеотидов) с другой нуклеиновой кислотой (или ее комплементарной цепью), с использованием BLASTN. Для определения процента идентичности между двумя различными нуклеиновыми кислотами, процент идентичности следует определять с использованием программы BLASTN «BLAST 2 sequences». Эта программа доступна для публичного использования из Национального центра биотехнологической информации (NCBI) через интернет (Altschul et al., (1997) Nucleic Acids Res. 25(17):3389-3402). Параметры, подлежащие использованию, представляют собой любую комбинацию следующего, дающую наибольший рассчитанный процент идентичности (как рассчитано ниже), где параметры по умолчанию показаны в скобках: программа - blastn, матрица - 0 BLOSUM62, вознаграждение за совпадение - 0 или 1 (1), штраф за несовпадение - 0, -1, -2 или -3 (-2), штраф за открытие пропуска - 0, 1, 2, 3, 4 или 5 (5), штраф за продление пропуска - 0 или 1 (1), пропуск x_укорочение - 0 или 50 (50) ожидание - 10.
[0148] Процент идентичности или сходства по отношению к полипептидам, показывает, что рассматриваемый полипептид обладает указанным процентом идентичности или сходства при сравнении с другим белком или его частью на протяжении длины общего участка, как определено с использованием BLASTP. Эта программа также доступна для публичного использования из Национального центра биотехнологической информации (NCBI) через интернет (Altschul et al., (1997) Nucleic Acids Res. 25(17):3389-3402). Процент идентичности или сходства для полипептидов, как правило, измеряют с использованием программного обеспечения для анализа последовательностей. См.,например, пакет программного обеспечения для анализа последовательностей от Genetics Computer Group, University of Wisconsin Biotechnology Center, 910 University Avenue, Madison, Wis. 53705. Программное обеспечение для анализа белка определяет соответствие сходных последовательностей с использованием мер гомологии, приписанных различным заменам, делециям и другим модификациям. Консервативные замены, как правило, включают в себя замены внутри следующих групп: глицин, аланин; валин, изолейцин, лейцин; аспарагиновая кислота, глутаминовая кислота; аспарагин, глутамин; серин, треонин; лизин, аргинин; и фенилаланин, тирозин.
[0149] В конкретных вариантах осуществления, нуклеиновая кислота может содержать вектор, в основном состоять из вектора или состоять из вектора, включая, но без ограничения, плазмиду, фаг, вирусный вектор (например, вектор AAV, аденовирусный вектор, вектор на основе вируса герпеса или бакуловирусный вектор), искусственную хромосому бактерий (BAC) или искусственную хромосому дрожжей (YAC). Например, нуклеиновая кислота может содержать вектор AAV, состоять из вектора AAV или в основном состоять из вектора AAV, содержащего 5'- и/или 3'-концевой повтор (например, 5'- и/или 3'-концевой повтор AAV).
[0150] В некоторых вариантах осуществления, нуклеиновая кислота, кодирующая химерный белок капсида AAV, дополнительно содержит последовательность, кодирующую rep AAV. Например, нуклеиновая кислота может представлять собой конструкцию-помощника для получения препаратов вирусов для хранения.
[0151] Изобретение относится также к упаковывающим клеткам, стабильно содержащим нуклеиновую кислоту по изобретению. Например, нуклеиновую кислоту можно стабильно вставлять в геном клетки или можно стабильно поддерживать в эписомальной форме (например, «ядерная эписома на основе EBV»).
[0152] Нуклеиновую кислоту можно вставлять в вектор для доставки, такой как вирусный вектор для доставки. Для иллюстрации, нуклеиновую кислоту по изобретению можно упаковывать в частицу AAV, в аденовирусную частицу, в частицу вируса герпеса, в бакуловирусную частицу или в любую другую подходящую вирусную частицу.
[0153] Более того, нуклеиновая кислота может являться функционально связанной с промоторным элементом. Промоторные элементы более подробно описаны в настоящем описании.
[0154] Кроме того, настоящее изобретение относится к способам получения вирусных векторов по изобретению. В репрезентативном варианте осуществления, настоящее изобретение относится к способу получения рекомбинантного вирусного вектора, где способ включает обеспечение клетки in vitro (a) матрицей, содержащей (i) гетерологичную нуклеиновую кислоту, и (ii) сигнальные последовательности для упаковки, достаточные для заключения матрицы AAV в капсиды вирусных частиц (например, один или несколько (например, два) концевых повтора, таких как концевые повторы AAV), и (b) последовательностями AAV, достаточными для репликации и заключения матрицы в капсиды вирусных частиц (например, последовательностями rep AAV и cap AAV, кодирующими капсид AAV по изобретению). Матрицу и последовательности для репликации и последовательности капсида AAV предоставляют в таких условиях, что такие рекомбинантные вирусные частицы, содержащие матрицу, упакованную внутри капсида, продуцируются в клетке. Способ может дополнительно включать в себя стадию сбора вирусных частиц из клетки. Вирусные частицы можно собирать из среды и/или посредством лизиса клеток.
[0155] В одном иллюстративном варианте осуществления, изобретение относится к способу получения частицы р-AAV, содержащей капсид AAV, где способ включает: обеспечение клетки in vitro нуклеиновой кислотой, кодирующей химерный капсид AAV по изобретению, последовательностью, кодирующей rep AAV, геномом вектора AAV, содержащим гетерологичную нуклеиновую кислоту, и функциями помощника для получения продуктивной инфекции AAV; и обеспечение сборки частиц AAV, содержащих капсид AAV и заключенный в капсид геном вектора AAV.
[0156] Клетка, как правило, представляет собой клетку, пермиссивную для репликации вируса AAV. Можно использовать любую клетку, известную в данной области, такую как клетки млекопитающих. Пригодными являются также транс-комплементирующие линии клеток, обеспечивающие функции, удаленные из дефектного по репликации вируса-помощника, например, клетки 293 или другие транс-комплементирующие E1a клетки.
[0157] Последовательности для репликации AAV и последовательности капсидов AAV можно получать любым способом, известным в данной области. В современных способах, как правило, экспрессируют гены rep/cap AAV на одной плазмиде. Последовательности для репликации и упаковки AAV не обязательно предоставлять вместе, хотя это может быть удобным. Последовательности rep и/или cap AAV можно предоставлять посредством любого вирусного или невирусного вектора. Например, последовательности rep/cap можно предоставлять посредством гибридного аденовирусного вектора или вектора на основе вируса герпеса (например, вставлять в области E1a или E3 подвергнутого делеции аденовирусного вектора). Векторы EBV можно также использовать для экспрессии генов cap и rep AAV. Одним из преимуществ этого способа является то, что векторы EBV являются эписомальными, все еще поддерживая высокое количество копий на протяжении последовательных делений клетки (т.е., являются стабильно интегрированными в клетку в форме внехромосомных элементов, обозначенных как ядерные эписомы на основе EBV.
[0158] В качестве дополнительной альтернативы, клетка может стабильно нести внутри последовательности rep/cap (эписомальные или интегрированные).
[0159] Как правило, rep/cap последовательности AAV не фланкированы последовательностями для упаковки AAV (например, ITR AAV), для предотвращения спасения и/или упаковки этих последовательностей.
[0160] Матрицу (например, геном вектора р-AAV) можно предоставлять в клетке с использованием любого способа, известного в данной области. Например, матрицу можно предоставлять посредством невирусного (например, плазмидного) или вирусного вектора. В конкретных вариантах осуществления, матрицу предоставляют посредством вектора на основе вируса герпеса или аденовирусного вектора (например, вставленную в области E1a или E3 подвергнутого делеции аденовируса). В качестве другой иллюстрации, в Palombo et al., (1998) J. Virol. 72:5025, описан бакуловирусный вектор, несущий репортерный ген, фланкированный ITR AAV. Векторы EBV также можно использовать для доставки матрицы, как описано выше по отношению к генам rep/cap.
[0161] В другом репрезентативном варианте осуществления, матрицу предоставляют посредством репликации вируса р-AAV. В других вариантах осуществления, провирус AAV является стабильно интегрированным в хромосому клетки.
[0162] Для получения максимальных титров вируса, функции вируса-помощника (например, аденовируса или вируса герпеса), необходимые для продуктивной инфекции AAV, как правило, предоставляют в клетке. Последовательности вируса-помощника, необходимые для репликации AAV, известны в данной области. Как правило, эти последовательности предоставляют посредством аденовируса-помощника или вектора на основе вируса герпеса. Альтернативно, последовательности аденовируса или вируса герпеса можно предоставлять посредством другого невирусного или вирусного вектора, например, в форме неинфекционной аденовирусной миниплазмиды, несущей все из генов-помощников, необходимых для эффективной продукции AAV, как описано в Ferrari et al., (1997) Nature Med.3:1295, и Патентах США No. 6040183 и 6093570.
[0163] Кроме того, функции вируса-помощника можно предоставлять посредством упаковывающей клетки с генами-помощниками, интегрированными в хромосому или поддерживаемыми в форме стабильного внехромосомного элемента. В репрезентативных вариантах осуществления, последовательности вируса-помощника не могут быть упакованы в вирионы AAV, например, не являются фланкированными ITR AAV.
[0164] Специалисту в данной области понятно, что может являться преимущественным предоставлять последовательности для репликации AAV и последовательности капсида AAV, и последовательности вируса-помощника (например, аденовирусные последовательности) на одной конструкции-помощнике. Эта конструкция-помощник может представлять собой невирусную или вирусную конструкцию, но необязательно, представляет собой аденовирус или гибридный вирус герпеса, содержащий гены rep/cap AAV.
[0165] В одном конкретном варианте осуществления, последовательности rep/cap AAV и последовательности аденовируса-помощника предоставляют посредством одного аденовирусного вектора-помощника. Этот вектор дополнительно содержит матрицу р-AAV. Последовательности rep/cap AAV и/или матрицу р-AAV можно вставлять в делетированную область (например, области E1a или E3) аденовируса.
[0166] В следующем варианте осуществления, последовательности rep/cap AAV и последовательности аденовируса-помощника предоставляют посредством одного аденовирусного вектора-помощника. Матрицу р-AAV предоставляют в форме плазмидной матрицы.
[0167] В другом иллюстративном варианте осуществления, последовательности rep/cap AAV и последовательности аденовируса-помощника предоставляют посредством одного аденовирусного вектора-помощника, и матрицу р-AAV интегрируют в клетку в форме провируса. Альтернативно, матрицу р-AAV предоставляют посредством вектора EBV, который поддерживают внутри клетки в форме внехромосомного элемента (например, в форме «ядерной эписомы на основе EBV», см. Margolski, (1992) Curr. Top. Microbiol. Immun. 158:67).
[0168] В следующем иллюстративном варианте осуществления, последовательности rep/cap AAV и последовательности аденовируса-помощника предоставляют посредством одного аденовируса-помощника. Матрицу р-AAV предоставляют в форме отдельного реплицирующегося вирусного вектора. Например, матрицу р-AAV можно предоставлять посредством частицы р-AAV или второй рекомбинантной аденовирусной частицы.
[0169] В соответствии с вышеописанными способами, гибридный аденовирусный вектор, как правило, содержит 5'- и 3'-цис-последовательности аденовируса, достаточные для репликации и упаковки аденовируса (т.е., концевые повторы аденовируса и последовательность PAC). Последовательности rep/cap AAV и, если присутствует, матрицу р-AAV вставляют в остов аденовируса и фланкируют 5'- и 3'-цис-последовательностями, так что эти последовательности можно упаковывать в капсиды аденовирусов. Как описано выше, в репрезентативных вариантах осуществления, последовательности аденовируса-помощника и последовательности rep/cap AAV не фланкированы последовательностями для упаковки AAV (например, ITR AAV), так что эти последовательности не упаковываются в вирионы AAV.
[0170] Вирус герпеса можно также использовать в качестве вируса-помощника в способах упаковки AAV. Гибридные вирусы герпеса, кодирующие белок(белки) rep AAV могут преимущественным образом способствовать более поддающимся масштабированию схемами продукции вектора AAV. Описан гибридный вектор на основе вируса простого герпеса типа I (HSV-1), экспрессирующий гены rep и cap AAV-2 (Conway et al., (1999) Gene Therapy 6:986 и WO 00/17377, полное содержание которого приведено в настоящем описании в качестве ссылки).
[0171] В качестве дополнительной альтернативы, вирусные векторы по изобретению можно получать в клетках насекомых с использованием бакуловирусных векторов для доставки генов rep/cap и матрицы р-AAV, как описано в Urabe et al., (2002) Human Gene Therapy 13:1935-43.
[0172] В других способах получения AAV используют стабильно трансформированные упаковывающие клетки (см., например, Патент США No. 5658785).
[0173] Препараты вектора AAV для хранения, свободные от загрязнения вирусом-помощником, можно получать любым способом, известным в данной области. Например, AAV и вирус-помощник можно легко разделять на основании размера. AAV можно также отделять от вируса-помощника на основании аффинности для гепаринового субстрата (Zolotukhin et al., (1999) Gene Therapy 6:973). В репрезентативных вариантах осуществления, используют подвергнутые делеции дефектные по репликации вирусы-помощники, так что любой загрязняющий вирус-помощник не является компетентным по репликации. В качестве дополнительной альтернативы, можно использовать аденовирус-помощник, лишенный экспрессии поздних генов, поскольку только экспрессия ранних генов аденовируса необходима, чтобы опосредовать упаковку вируса AAV. В данной области известны мутантные аденовирусы, дефектные по экспрессии поздних генов (например, мутантные аденовирусы ts100K и ts149).
[0174] Способы упаковки по изобретению можно использовать для получения препаратов вирусных частиц для хранения с высокими титрами. В конкретных вариантах осуществления, препарат вируса для хранения обладает титром по меньшей мере приблизительно 105 трансдуцирующих единиц (ТЕ)/мл, по меньшей мере приблизительно 106 ТЕ/мл, по меньшей мере приблизительно 107 ТЕ/мл, по меньшей мере приблизительно 108 ТЕ/мл, по меньшей мере приблизительно 109 ТЕ/мл, или по меньшей мере приблизительно 1010 ТЕ/мл.
[0175] Новые белки капсида и структуры капсидов находят применение для стимуляции образования антител, например, для диагностических или терапевтических применений, или в качестве реагента для исследований. Таким образом, изобретение относится также к антителам против новых белков капсидов и капсидов по изобретению.
[0176] Термин «антитело» или «антитела», в рамках изобретения, относится ко всем типам иммуноглобулинов, включая IgG, IgM, IgA, IgD и IgE. Антитело может являться моноклональным или поликлональным и может происходить из любых видов, включая (например) мышь, крысу, кролика, лошадь, козу, овцу или человека, или может представлять собой химерное антитело. См., например, Walker et al., Mol. Immunol. 26, 403-11 (1989). Антитела могут представлять собой рекомбинантные моноклональные антитела, например, полученные в соответствии со способами, описанными в Патенте США No. 4474893 или Патенте США No. 4816567. Антитела можно также конструировать химически, например, в соответствии со способом, описанным в Патенте США No. 4676980.
[0177] Фрагменты антител, включенные в объем настоящего изобретения, включают в себя, например, фрагменты Fab, F(ab')2 и Fc, и соответствующие фрагменты, полученные из антител, отличных от IgG. Такие фрагменты можно получать известными способами. Например, фрагменты F(ab')2 можно получать посредством расщепления пепcином молекулы антитела, и фрагменты Fab можно получать посредством восстановления дисульфидных мостиков фрагментов F(ab')2. Альтернативно, можно конструировать экспрессирующие библиотеки Fab, чтобы позволять быструю и простую идентификацию моноклональных фрагментов Fab с желательной специфичностью (Huse et al., (1989) Science 254, 1275-1281).
[0178] Поликлональные антитела можно получать посредством иммунизации подходящего животного (например, кролика, крысы и т.д.) антигеном, с которым связывается моноклональное антитело против мишени, сбора иммунной сыворотки от животного и отделения поликлональных антител от иммунной сыворотки, в соответствии с известными способами.
[0179] Моноклональные антитела можно получать в линии клеток гибридомы в соответствии со способом Kohler and Milstein, (1975) Nature 265, 495-97. Например, раствор, содержащий подходящий антиген, можно инъецировать мыши и, через достаточное количество времени, мышь умерщвляют и получают клетки селезенки. Затем клетки селезенки иммортализуют посредством их слияния с клетками миеломы или с клетками лимфомы, как правило, в присутствии полиэтиленгликоля, для получения клеток гибридомы. Затем клетки гибридомы выращивают в подходящей среде и проводят скрининг супернатанта по моноклональным антителам, обладающим желательной специфичностью. Моноклональные фрагменты Fab можно получать в E. coli рекомбинантными способами, известными специалистам в данной области. См., например, W. Huse, (1989) Science 246, 1275-81.
[0180] Антитела, специфические для полипептида-мишени, можно также получать способами фагового дисплея, известными в данной области.
[0181] Различные иммуноанализы можно использовать для скрининга для идентификации антител, обладающих желательной специфичностью. Многочисленные способы конкурентного связывания или радиоиммунных анализов с использованием либо поликлональных, либо моноклональных антител с установленной специфичностью, хорошо известны в данной области. Такие иммуноанализы, как правило, включают в себя измерение формирования комплекса между антигеном и специфическим для него антителом (например, формирования комплекса антиген/антитело). Можно использовать двухстадийный моноклональный иммуноанализ с использованием моноклональных антител, реакционноспособных по отношению к двум не мешающим друг другу эпитопам, так же как анализ конкурентного связывания.
[0182] Антитела можно конъюгировать с твердой подложкой (например, бусинами, планшетами, стеклами или лунками, сформированными из таких материалов, как латекс или полистирол) в соответствии с известными способами. Подобным образом, антитела можно напрямую или опосредованно конъюгировать с поддающимися детекции группами, такими как радиоактивные метки (например,35S,125I,131I), ферментные метки (например, пероксидаза хрена, щелочная фосфатаза) и флуоресцентные метки (например, флуоресцеин) в соответствии с известными способами. Определение формирования комплекса антитело/антиген в способах по этому изобретению можно осуществлять посредством детекции, например, преципитации, агглютинации, флокуляции, радиoактивности, развития или изменения окраски, флуоресценции, люминесценции и т.д., как хорошо известно в данной области.
III. Способы использования химерных капсидов AAV, нацеленных на ЦНС.
[0183] Настоящее изобретение также относится к способам доставки гетерологичных нуклеотидных последовательностей в ЦНС при минимизации доставки в периферические органы. Вирусные векторы по изобретению можно использовать для доставки представляющей интерес нуклеотидной последовательности в клетки ЦНС in vitro, например, для получения полипептида или нуклеиновой кислоты in vitro или для генотерапии ex vivo. Векторы, кроме того, можно использовать в способе доставки нуклеотидной последовательности нуждающемуся в этом пациенту, например, для экспрессии терапевтического или иммуногенного полипептида или нуклеиновой кислоты. По этому способу, полипептид или нуклеиновую кислоту можно, таким образом, получать in vivo у пациента. Пациент может нуждаться в этих полипептиде или нуклеиновой кислоте, поскольку пациент обладает дефицитом полипептида, или поскольку продукция полипептида или нуклеиновой кислоты у пациента может оказывать некоторый терапевтический эффект, в качестве способа лечения или иным образом, и как дополнительно объяснено ниже.
[0184] В конкретных вариантах осуществления, векторы можно использовать для экспрессии полипептида или нуклеиновой кислоты, которые оказывают благоприятный эффект на ЦНС, например, для стимуляции роста и/или дифференцировки нейронов или глиальных клеток. Способность нацеливания векторов на ЦНС может являться особенно полезной для лечения заболеваний или нарушений, включающих в себя дисфункцию ЦНС. В других вариантах осуществления, векторы можно использовать для экспрессии полипептида или нуклеиновой кислоты, оказывающих благоприятный эффект на клетки в ЦНС (например, нейроны и/или глиальные клетки).
[0185] Таким образом, один аспект изобретения относится к способу доставки представляющей интерес нуклеиновой кислоты в клетку ЦНС, где способ включает приведение клетки ЦНС в контакт с частицей AAV по изобретению.
[0186] В другом аспекте изобретение относится к способу доставки представляющей интерес нуклеиновой кислоты в клетку ЦНС у пациента-млекопитающего, где способ включает введение эффективного количества частиц AAV или фармацевтического состава по изобретению пациенту-млекопитающему.
[0187] Следующий аспект изобретения относится к способу лечения нарушения, ассоциированного с дисфункцией ЦНС, у нуждающегося в этом пациента, где способ включает введение терапевтически эффективного количества частиц AAV по изобретению пациенту.
[0188] Нарушения ЦНС включают в себя, но без ограничения, нарушения мышления и когнитивные нарушения, такие как шизофрения и бред; амнестические расстройства; расстройства настроения, такие как аффективные расстройства и тревожные расстройства (включая посттравматическое стрессовое расстройство, вызванное разлукой тревожное расстройство, избирательную немоту, реактивное расстройство привязанностей, расстройство стереотипных движений, панические расстройства, агорафобию, специфические фобии, социофобию, обсессивно-компульсивное расстройство, острое стрессовое расстройство, генерализованное тревожное расстройство, индуцированное химическими соединениями тревожное расстройство и/или тревожное расстройство, не уточненное иным образом); расстройства социального поведения; нарушения обучения и памяти, такие как нарушения обучения (например, дислексия); нарушения двигательных навыков; нарушения коммуникации (например, заикание); первазивное расстройство развития (например, аутическое расстройство, нарушение Ретта (синдром Ретта), дезинтегративное расстройство детского возраста, расстройство Аспергера и/или первазивное расстройство развития, не уточненное иным образом) и деменцию. Соответственно, термин «нарушение центральной нервной системы» включает нарушения, перечисленные выше, так же как депрессивные расстройства (включая большое депрессивное расстройство, дистимическое расстройство, депрессивное расстройство, не уточненное иным образом, послеродовую депрессию);сезонное аффективное расстройство; манию; биполярные расстройства (включая биполярное расстройство I, биполярное расстройство II, циклотимическое расстройство, биполярное расстройство, не уточненное иным образом); расстройства дефицита внимания и агрессивного поведения (включая расстройство дефицита внимания с синдромом гиперактивности, кондуктивное расстройство, вызывающее оппозиционное расстройство и/или расстройство агрессивного поведения, не уточненное иным образом); привыкание к чрезмерному употреблению лекарственных средств/наркотическую зависимость и токсикоманию (включая зависимость от опиатов, амфетаминов, алкоголя, галлюциногенных веществ, марихуаны, летучих веществ наркотического действия, фенциклидина, успокоительных средств, снотворных средств, анксиолитиков и/или кокаина); индуцированные алкоголем расстройства; индуцированные амфетамином расстройства; индуцированные кофеином расстройства; индуцированные марихуаной расстройства; индуцированные кокаином расстройства; индуцированные галлюциногенными веществами расстройства; расстройства, индуцированные летучими веществами наркотического действия; индуцированные никотином расстройства; индуцированные опиоидом расстройства; индуцированные фенциклидином расстройства; индуцированные успокоительными средствами, снотворными средствами или анксиолитиками расстройства; возбуждение; апатию; психозы; раздражительность; расторможенность; шизофреноформное расстройство; шизоаффективное расстройство; бредовое расстройство; кратковременное психотическое расстройство, индуцированное психотическое расстройство; психотическое расстройство, вызванное употреблением психоактивных веществ; психотическое расстройство, не уточненное иным образом; монополярные расстройства, расстройства настроения (например, расстройства настроения с психотическими признаками); соматоформные нарушения; сумеречные помрачения сознания; диссоциативные расстройства; задержку умственного развития; расстройства приема пищи и пищевого поведения в младенческом или детском возрасте; расстройства пищевого поведения, такие как нервная анорексия, нервная булимия и/или расстройство пищевого поведения, не уточненное иным образом; нарушения сна (например, диссомнии, такие как первичная бессонница, первичная гиперсомния, нарколепсия, связанное с дыханием нарушение сна и связанное с циркадным ритмом нарушение сна и/или парасомнии); расстройства контроля импульсивного поведения (например, клептомания, пиромания, трихотилломания, патологическое пристрастие к азартным играм и/или синдром эпизодического нарушения контроля); расстройства адаптации; расстройства личности (например, параноидное расстройство личности, шизоидное расстройство личности, шизотипическое расстройство личности, антисоциальное расстройство личности, пограничное расстройство личности, гистрионное расстройство личности, нарциссическое расстройство личности, уклоняющееся расстройство личности, зависимое расстройство личности и/или обсессивно-компульсивное расстройство личности);тикозные расстройства (например, расстройство Туретта, хроническое моторное или вокальное тикозное расстройство, транзиторное тикозное расстройство и/или тикозное расстройство, не уточненное иным образом); расстройства выделительных функций; и любую комбинацию вышеуказанного, так же как любое другое расстройство или группу расстройств, описанных в Diagnostic and Statistical Manual of Mental Disorders - Fourth Edition (DSM-IV; the American Psychiatric Association, Washington D.C., 1994). «Нарушения центральной нервной системы» включают в себя также другие состояния, затрагивающие ЦНС, включая, но без ограничения, нейродегенеративные нарушения, такие как болезнь Альцгеймера, нарушения с непроизвольными движениями, такие как болезнь Паркинсона, болезнь Гентингтона, боковой амиотрофический склероз (ALS) и т.п. Другие нарушения ЦНС включают в себя, без ограничения, эпилепсию, рассеянный склероз, нейрогенную боль, психогенную боль и мигрени.
[0189] В одном варианте осуществления, нарушение, ассоциированное с дисфункцией ЦНС, представляет собой демиелинизирующее заболевание. В одном варианте осуществления, нарушение, ассоциированное с дисфункцией ЦНС, представляет собой рассеянный склероз, болезнь Пелицеуса-Мерцбахера, болезнь Краббе, метахроматическую лейкодистрофию, адренолейкодистрофию, болезнь Канавана, болезнь Александера, ортохроматическую лейкодистрофию, синдром Цельвегера, синдром делеции 18q, церебральный паралич, повреждение спинного мозга, травматическое повреждение головного мозга, инсульт, фенилкетонурию или вирусную инфекцию, или любое другое нарушение, как известно, или как будет обнаружено позднее, ассоциированное с дисфункцией ЦНС. В другом варианте осуществления, способы по изобретению используют для лечения нарушения, которое не является напрямую ассоциированным с дисфункцией ЦНС, но при котором обеспечивают преимущество посредством экспрессии гетерологичного полипептида или нуклеиновой кислоты в клетках ЦНС. Примеры включают в себя, без ограничения, нейродегенеративные нарушения, такие как болезнь Альцгеймера, болезнь Паркинсона и болезнь Гентингтона, опухоли ЦНС и другие нарушения ЦНС.
[0190] В других вариантах осуществления, нарушение ЦНС включает любую подгруппу из вышеописанных заболеваний или исключает любое одно или несколько из вышеописанных состояний. В конкретных вариантах осуществления, термин «нарушение центральной нервной системы» не включает доброкачественные и/или злокачественные опухоли ЦНС.
[0191] В конкретных вариантах осуществления, нарушение ЦНС представляет собой синдром Ретта. В следующих вариантах осуществления, изобретение относится к способу лечения синдрома Ретта у нуждающегося в этом пациента-млекопитающего. В конкретных вариантах осуществления, способ включает введение терапевтически эффективного количества частиц AAV по изобретению, например, частицы AAV, содержащей нуклеиновую кислоту, кодирующую связывающий метилцитозин белок 2.
[0192] В другом аспекте по изобретению, химерный капсид AAV и векторы по изобретению представляют собой полностью или почти полностью лишенные нацеливания векторы, которые можно далее модифицировать до желательного профиля тропизма для нацеливания на один или несколько периферических органов или тканей, как обсуждают ниже. В этом аспекте, настоящее изобретение также относится к способам доставки гетерологичных нуклеотидных последовательностей в широкий диапазон клеток, включая делящиеся и не делящиеся клетки. Вирусные векторы по изобретению можно применять для доставки представляющей интерес нуклеотидной последовательности в клетку in vitro, например, для получения полипептида in vitro или для генотерапии ex vivo. Векторы, кроме того, можно использовать в способе доставки нуклеотидной последовательности нуждающемуся в этом пациенту, например, для экспрессии терапевтического или иммуногенного полипептида или нуклеиновой кислоты. В этом способе, полипептид или нуклеиновую кислоту можно, таким образом, продуцировать in vivo у пациента. Пациент может нуждаться в полипептиде или нуклеиновой кислоте, поскольку пациент обладает дефицитом полипептида, или поскольку продукция полипептида или нуклеиновой кислоты у пациента может оказывать некоторый терапевтический эффект, в качестве способа лечения или иным образом, и как дополнительно объяснено ниже.
[0193] Как правило, вирусные векторы по изобретению могут доставлять любую чужеродную нуклеиновую кислоту с биологическим эффектом для лечения или облегчения симптомов, ассоциированных с любым нарушением, относящимся к экспрессии гена. Кроме того, изобретение можно использовать для лечения любого состояния заболевания, при котором обеспечивает преимущества доставка терапевтического полипептида. Иллюстративные состояния заболевания включают в себя, но без ограничения: кистозный фиброз (белок трансмембранный регулятор кистозного фиброза) и другие заболевания легких, гемофилию A (фактор VIII), гемофилию B (фактор IX), талассемию (β-глобин), анемию (эритропоэтин) и другие нарушения крови, болезнь Альцгеймера (GDF; неприлизин), рассеянный склероз (β-интерферон), болезнь Паркинсона (выделенный из линии глиальных клеток нейротрофический фактор [GDNF]), болезнь Гентингтона (ингибирующая РНК, включая, без ограничения, РНКи такую как миРНК или кшРНК, антисмысловую РНК или микроРНК для удаления повторов), боковой амиотрофический склероз, эпилепсию (галанин, нейротрофические факторы), и другие неврологические нарушения, злокачественную опухоль (эндостатин, ангиостатин, TRAIL, FAS-лиганд, цитокины, включая интерфероны; ингибирующая РНК, включая, без ограничения, РНКи (такую как миРНК или кшРНК), антисмысловую РНК и микроРНК, включая ингибирующую РНК против VEGF, продукта гена множественной устойчивости к лекарственным средствам или иммуногену злокачественной опухоли), сахарный диабет (инсулин, PGC- α1, GLP-1, пропептид миостатина, транспортер глюкозы 4), мышечные дистрофии, включая мышечную дистрофию Дюшенна и Беккера (например, дистрофин, минидистрофин, микродистрофин, инсулиноподобный фактор роста I, саркогликан [например, α, β, γ], ингибирующая РНК [например, РНКи, антисмысловая РНК или микроРНК] против миостатина или пропептида миостатин, ламинин-альфа2, связанный с фукутином белок, доминатнтно-негативный аллель миостатина, фоллистатин, растворимый рецептор активина типа II, противовоспалительные полипептиды, такие как доминатный мутант I каппа B, саркоспан, утрофин, мини-утрофин, ингибирующая РНК [например, РНКи, антисмысловая РНК или микроРНК] против границ сплайсинга в гене дистрофина для индукции пропуска экзонов [см., например, WO/2003/095647], ингибирующая РНК (например, РНКи, антисмысловая РНК или микроРНК] против мяРНК U7 для индукции пропуска экзонов [см.,например, WO/2006/021724], и антитела или фрагменты антител против миостатина или пропептида миостатина), болезнь Гоше (глюкоцереброзидаза), болезнь Гурлера (α-L-идуронидаза), дефицит аденозин-дезаминазы (аденозин-дезаминаза), болезни накопления гликогена (например, болезнь Фабри [α-галактозидаза] и болезнь Помпе [лизосомальная кислая α-глюкозидаза]) и другие дефекты метаболизма, включая другие лизосомальные болезни накопления и болезни накопления гликогена, врожденную эмфизему (α1-антитрипсин), синдром Леша-Найхана (гипоксантин-гуанин-фосфорибозил-трансфераза), болезнь Ниманна-Пика (сфингомиелиназа), болезнь мочи с запахом кленового сиропа (дегидрогеназа кетокислот с разветвленной цепью), дегенеративные заболевания сетчатки (и другие заболевания глаза и сетчатки; например, PDGF, эндостатин и/или ангиостатин в случае дегенерации желтого пятна), заболевания солидных органов, таких как головной мозг (включая болезнь Паркинсона [GDNF], астроцитомы [эндостатин, ангиостатин и/или РНКи против VEGF], глиобластомы [эндостатин, ангиостатин и/или РНКи против VEGF]), печень (РНКи, такие как миРНК или кшРНК, микроРНК или антисмысловая РНК против генов гепатита B и/или гепатита C), почка, сердце, включая застойную сердечную недостаточность или заболевание периферических артерий (PAD) (например, посредством доставки ингибитора протеинфосфатазы I [I-1], фосфоламбан, Ca2+-ATPаза саркоэндоплазматического ретикулума [serca2a], белки с цинковыми пальцами, регулирующими ген фосфоламбана, Pim-1, PGC-1α, SOD-1, SOD-2, ECF-SOD, калликреин, тимозин-β4, индуцируемый гипоксией фактор транскрипции [HIF], βarkct, β2-адренергический рецептор, киназа β2-адренергического рецептора [βARK], фосфоинозитид-3-киназа [киназа PI3], калсарцин, ангиогенный фактор, S100A1, парвальбумин, аденилатциклаза типа 6, молекула, вызывающая нокдаун киназы сопряженного с G-белком рецептора типа 2, такая как усеченный конститутивно активный bARKct, ингибирующая РНК [например, РНКи, антисмысловая РНК или микроРНК] против фосфоламбана; ингибирующие фосфоламбан или доминантно-негативные молекулы, такие как фосфоламбан S16E и т.д.), артрит (инсулиноподобные факторы роста), повреждения суставов (инсулиноподобные факторы роста), гиперплазию интимы (например, посредством доставки enos, inos), улучшение выживаемости сердечных трансплантатов (супероксиддисмутаза), СПИД (растворимый CD4), истощение мышечной ткани (инсулиноподобный фактор роста I, пропептид миостатина, антиапоптотический фактор, фоллистатин), ишемию конечностей (VEGF, FGF, PGC-1α, EC-SOD, HIF), почечную недостаточночть (эритропоэтин), анемию (эритропоэтин), артрит (противовоспалительные факторы, такие как IRAP и TNFα растворимый рецептор), гепатит (α-интерферон), дефицит рецептора LDL (рецептор LDL), гипераммониемию (орнитин-транскарбамилаза), спинномозговые атаксии, включая SCA1, SCA2 и SCA3, фенилкетонурию (фенилаланин-гидроксилаза), аутоиммунные заболевания и т.п. Изобретение, кроме того, можно использовать после трансплантации органов для увеличения успешности трансплантации и/или для уменьшения отрицательных побочных эффектов трансплантации органов или вспомогательной терапии (например, посредством введения средств-иммунодепрессантов или ингибирующих нуклеиновых кислот для блокирования продукции цитокинов). В качестве другого примера, костные морфогенетические белки (включая RANKL и/или VEGF) можно вводить с костным аллотрансплантатом, например, после перелома или хирургического удаления у пациента с злокачественной опухолью.
[0194] Иллюстративные лизосомальные болезни накопления, которые можно лечить в соответствии с настоящим изобретением, включают в себя, без ограничения: синдром Гурлера (MPS IH), синдром Шейе (MPS IS) и синдром Гурлера-Шейе (MPS IH/S) (α-L-идуронидаза); синдром Гунтера (MPS II) (идуронат сульфат сульфатаза); синдром Санфилиппо A (MPS IIIA) (гепаран-S-сульфат-сульфаминидаза), синдром Санфилиппо B (MPS IIIB) (N-ацетил-D-глюкозаминидаза ), синдром Санфилиппо C (MPS IIIC) (ацетил-CoA-глюкозаминид-N-ацетилтрансфераза), синдром Санфилиппо D (MPS IIID) (N-ацетил-глюкозаминин-6-сульфат-сульфатаза); болезнь Моркио A (MPS IVA) (галактозамин-6-сульфат-сульфатаза), болезнь Моркио B (MPS IV B) (β-галактозидаза); болезнь Марото-Лами (MPS VI) (арилсульфатаза B); синдром Слая (MPS VII) (β-глюкуронидаза); дефицит гиалуронидазы (MPS IX) (гиалуронидаза); сиалидоз (муколипидоз I), муколипидоз II (болезнь «I-клеток») (каталитическая субъединица N-актилглюкозаминил-1-фосфотрансферазы), муколипидоз III (псевдо-полидистрофия Гурлера) (N-ацетилглюкозаминил-1-фосфотрансфераза; типа IIIA [каталитическая субъединица] и типа IIIC [субъединица узнавания субстрата]); ганглиозидоз GM1 (ганглиозид-β-галактозидаза), ганглиозидоз GM2 типа I (болезнь Тея-Сакса) (β-гексаминидаза A), GM2 ганглиозидоз типа II (болезнь Сандгоффа) (β-гексозаминидаза B); Ниманна-Пика заболевание (типы A и B) (сфингомиелиназа); болезнь Гоше (глюкоцереброзидаза); болезнь Фарбера (цераминидаза); болезнь Фабри (α-галактозидаза A); болезнь Краббе (галактозилцерамид-β-галактозидаза); метахроматическая лейкодистрофия (арилсульфатаза A); дефицит лизосомальной кислой липазы, включая болезнь Вольмана (лизосомальная кислая липаза); болезнь Баттена (ювенильный нейрональный цероидный липофусциноз) (лизосомальный транс-мембранный белок CLN3) сиалидоз (нейраминидаза 1); галактосиалидоз (синдром Гольдберга) (защитный белок/ катепсин A); α-маннозидоз (α-D-манноидаза); β-маннозидоз (β-D-маннозидоз); фукозидоз (α-D-фукозидаза); аспартилглюкозаминурия (N-аспартилглюкозаминидаза); и сиалурию (Na-фосфатный котранспортер).
[0195] Иллюстративные болезни накопления гликогена, которые можно лечить в соответствии с настоящим изобретением, включают в себя, но без ограничения, GSD типа Ia (болезнь фон Гирке) (глюкоза-6-фосфатаза), GSD типа Ib (глюкоза-6-фосфат-транслоказа), GSD типа Ic (микросомальный транспортер фосфата или пирофосфата), GSD типа Id (микросомальный транспортер глюкозы), GSD типа II, включая болезнь Помпе или детский GSD типа IIa (лизосомальная кислая α-глюкозидаза) и типа IIb (Danon) (лизосомальный мембранный белок-2), GSD типа IIIa и IIIb (фермент гидролаза точек ветвления; амилоглюкозидаза и олигоглюканотрансфераза), GSD типа IV (болезнь Андерсена) (ветвящий фермент), GSD типа V (болезнь Мак-Ардла) (фосфорилаза мышц), GSD типа VI (болезнь Герса) (фосфорилаза печени), GSD типа VII (болезнь Таруи) (фосфофруктокиназа), GSD типа VIII/IXa (киназа фосфорилазы, сцепленная с X хромосомой), GSD типа IXb (киназа фосфорилазы печени и мышц), GSD типа IXc (киназа фосфорилазы печени), GSD типа IXd (киназа фосфорилазы мышц), GSD O (гликогенсинтаза), синдром Фанкони-Бикеля (транспортер глюкозы-2), дефицит фосфоглюкоизомеразы, дефицит фосфоглицераткиназы мышц, дефицит фосфоглицератмутазы, фруктоза-1,6-дифосфатазы, дефицит фосфоенолпируват-карбоксикиназы и дефицит лактат-дегидрогеназы.
[0196] Нуклеиновые кислоты и полипептиды, которые можно доставлять в сердечную мышцу, включают в себя те, которые обеспечивают преимущество при лечении подвергнувшейся повреждению, дегенерации или атрофии сердечной мышцы и/или врожденных пороков сердца. Например, ангиогенные факторы, которые можно использовать, чтобы способствовать васкуляризации при лечении заболеваний сердца, включают в себя, но без ограничения, фактор роста эндотелия сосудов (VEGF), VEGF II, VEGF-B, VEGF-C, VEGF-D, VEGF-E, VEGF121, VEGF138, VEGF145, VEGF165, VEGF189, VEGF206, индуцируемый гипоксией фактор 1α (HIF 1α), эндотелиальную синтазу NO (eNOS), iNOS, VEFGR-1 (Flt1), VEGFR-2 (KDR/Flk1), VEGFR-3 (Flt4), ангиогенин, эпидермальный фактор роста (EGF), ангиопоэтин, фактор роста тромбоцитов, ангиогенный фактор, трансформирующий фактор роста-α (TGF-α), трансформирующий фактор роста-β (TGF-β), фактор проницаемости сосудов (VPF), фактор некроза опухолей альфа (TNF-α), интерлейкин-3 (IL-3), интерлейкин-8 (IL-8), тромбоцитарный фактор роста эндотелиальных клеток (PD-EGF), гранулоцитарный колониестимулирующий фактор (G-CSF), фактор роста гепатоцитов (HGF), рассеивающий фактор (SF), плеотрофин, пролиферин, фоллистатин, фактор роста плаценты (PIGF), мидкин, фактор роста тромбоцитов-BB (PDGF), фракталкин, ICAM-1, ангиопоэтин-1 и -2 (Ang1 и Ang2), Tie-2, нейропилин-1, ICAM-1, хемокины и цитокины, стимулирующие миграцию гладкомышечных клеток, моноцитов или лейкоцитов, антиапоптотические пептиды и белки, факторы роста фибробластов (FGF), FGF-1, FGF-1b, FGF-1c, FGF-2, FGF-2b, FGF-2c, FGF-3, FGF-3b, FGF-3c, FGF-4, FGF-5, FGF-7, FGF-9, кислый FGF, щелочной FGF, моноцитарный хемотактический белок-1, гранулоцитарно-макрофагальный-колониестимулирующий фактор, инсулиноподобный фактор роста-1 (IGF-1), IGF-2, фактор-1 раннего ответа роста (EGR-1), ETS-1, калликреин тканей человека (HK), матриксную металлопротеиназу, химазу, активатор плазминогена урокиназного типа и гепариназу. (см., например, Патентную заявку США No. 20060287259 и Патентную заявку США No. 20070059288).
[0197] Наиболее распространенным врожденным заболеванием сердца, обнаруживаемым у взрослых, является двустворчатый аортальный клапан, в то время как дефект межпредсердной перегородки является ответственным за 30-40% врожденных заболеваний сердца, обнаруживаемых у взрослых. Наиболее распространенным врожденным пороком сердца, обнаруживаемым у пациентов детского возраста, является дефект межжелудочковой перегородки. Другие врожденные заболевания сердца включают в себя синдром Эйзенменгера, незаращение артериального протока, стеноз легочной артерии, коарктацию аорты, транспозицию магистральных сосудов, атрезию трехстворчатого клапана, одножелудочковое сердце, аномалию Эбштейна и удвоение выходного отверстия правого желудочка. В ряде исследований идентифицированы предположительные генетические локусы, ассоциированные с одним или несколькими из этих врожденных заболеваний сердца. Например, предположительным геном(генами) для врожденного заболевания сердца, ассоциированного с синдромом Дауна, является 21q22.2-q22.3, между ETS2 и MX1. Подобным образом, большинство случаев синдрома Ди Георге возникают в результате делеции области хромосомы 22q11.2 (области хромосомы синдрома Ди Георге, или DGCR). Несколько генов утрачены при этой делеции, включая предположительный фактор транскрипции TUPLE1. Эта делеция ассоциирована со множеством фенотипов, например, синдромом Шпринтцена; кардиофациальным синдромом (или синдромом Такао); и отдельными дефектами выходного отдела сердца, включая тетраду Фалло, артериальный ствол и прерванную дугу аорты. Все из вышеуказанных нарушений можно лечить в соответствии с настоящим изобретением.
[0198] Считают также, что другие значительные заболевания сердца и сосудистой системы обладают генетическим, как правило, полигенным, этиологическим компонентом. Эти заболевания включают в себя, например, синдром гипоплазии левых отделов сердца, дисплазию клапанов сердца, кардиокраниальный синдром Пфейфера, окулофациокардиодентальный синдром, синдром Капура-Ториелло, синдром Сонода, синдром блефарофимоза Охдо, синдром сердце-рука, синдром Пьера Робена, болезнь Хиршспрунга, синдром Кусефа, синдром окклюзии артерий Гранжа, синдром Кирнса-Сейра, синдром Картагенера, синдром Алажиля, синдром Ритшера-Шинцеля, синдром Ивермарка, синдром Янга-Симпсона, гемохроматоз, синдром Хольцгреве, синдром Барта, синдром Смита-Лемли-Опитца, болезнь накопления гликогена, заболевание, подобное болезни Гоше, болезнь Фабри, синдром Лоури-Маклейна, синдром Ретта, синдром Опитца, синдром Марфана, синдром лиссэнцефалии Миллера-Дикера, мукополисахаридоз, синдром Бругада, позвоночно-плечевой дизостоз, синдром Фавера, синдром Мак-Донаха, марфаноидный синдром гипермобильности, атрансферринемия, синдром Корнелии де Ланге, синдром леопарда, анемия Даймонда-Блэкфана, синдром Штайнфелда, прогерию и синдром Уильямса-Бойрена. Все из этих нарушений можно лечить в соответствии с настоящим изобретением.
[0199] Антиапоптотические факторы можно доставлять в скелетные мышцы, мышцу диафрагмы и/или сердечную мышцу для лечения истощения мышечной ткани, ишемии конечностей, инфаркт миокарда, сердечной недостаточности, болезни коронарных артерий и/или диабета типа I или типа II.
[0200] Нуклеиновые кислоты, которые можно доставлять в скелетные мышцы, включают в себя те, которые обеспечивают преимущество при лечении подвергнувшейся повреждению, дегенерации и/или атрофии скелетной мышцы. Генетические дефекты, вызывающие мышечную дистрофию, известны для многих форм этого заболевания. Эти дефектные гены либо не производят белкового продукта, производят белковый продукт, неспособный функционировать надлежащим образом, либо производят дисфункциональный белковый продукт, мешающий правильному функционированию клетки. Гетерологичная нуклеиновая кислота может кодировать терапевтически функциональный белок или полинуклеотид, которые ингибируют продукцию или активность дисфункционального белка. Полипептиды, которые можно экспрессировать из доставляемых нуклеиновых кислот, или ингибировать посредством доставляемых нуклеиновых кислот (например, посредством доставки РНКи, микроРНК или антисмысловой РНК), включают в себя, без ограничения, дистрофин, мини-дистрофин или микро-дистрофин (MD Дюшенна и Беккера); ассоциированные с дистрофином гликопротеины β-саркогликан (MD тазового и плечевого пояса 2E), δ-саркогликан (MD 2 тазового и плечевого пояса 2F), α-саркогликан (MD тазового и плечевого пояса 2D) и γ-саркогликан (MD тазового и плечевого пояса 2C), утрофин, кальпаин (аутосомно-рецессивная MD тазового и плечевого пояса типа 2A), кавеолин-3 (аутосомно-доминантная MD тазового и плечевого пояса), ламинин-альфа2 (врожденная MD с дефицитом мерозина), миниагрин (врожденная MD с дефицитом ламинина-альфа2), фукутин (врожденная MD типа Фукуяма), эмерин (MD Эмери-Дрейфуса), миотилин, ламин A/C, кальпаин-3, дисферлин и/или телетонин. Кроме того, гетерологичная нуклеиновая кислота может кодировать mir-1, mir-133, mir-206, mir-208 или антисмысловую РНК, РНКи (например, миРНК или кшРНК) или микроРНК для индукции пропуска экзонов в дефектном гене дистрофина.
[0201] В конкретных вариантах осуществления, нуклеиновую кислота доставляют в мышцу языка (например, для лечения дистрофии языка). Способы доставки в язык могут представлять собой любой способ, известный в данной области, включая прямую инъекцию, пероральное введение, местное введение в язык, внутривенное введение, внутрисуставное введение и т.п.
[0202] Вышеуказанные белки можно также вводить в мышцу диафрагмы для лечения мышечной дистрофии.
[0203] Альтернативно, можно вводить вектор для переноса гена, который кодирует любой другой терапевтический полипептид.
[0204] В конкретных вариантах осуществления, вирусный вектор в соответствии с настоящим изобретением используют для доставки представляющей интерес нуклеиновой кислоты, как описано в настоящем описании, в скелетные мышцы, мышцу диафрагмы и/или сердечную мышцу, например, для лечения нарушения, ассоциированного с одной или несколькими из этих тканей, такого как мышечная дистрофия, заболевания сердца (включая PAD и застойную сердечную недостаточность) и т.п.
[0205] Перенос генов имеет значительное потенциальное применения для понимания и обеспечения терапии состояний заболевания. Существует ряд наследственных заболеваний, дефектные гены для которых известны и клонированы. Как правило, вышеуказанные состояния заболевания попадают в два класса: состояния дефицита, как правило, ферментов, как правило, наследуемые рецессивным образом, и состояния неуравновешенности, которые могут затрагивать регуляторные или структурные белки, и которые, как правило, наследуются доминантным образом. В случае заболеваний с состоянием дефицита, перенос гена можно использовать для доставки нормального гена в поврежденные ткани для заместительной терапии, так же как для получения моделей заболевания на животных с использованием ингибирующей РНК, такой как РНКи (например, миРНК или кшРНК), микроРНК или антисмысловая РНК. В случае заболеваний с состоянием неуравновешенности, перенос гена можно использовать для получения состояния заболевания в модельной системе, которую затем используют для попыток противодействия состоянию заболевания. Таким образом, вирусные векторы в соответствии с настоящим изобретением позволяют лечение генетических заболеваний. В рамках изобретения, состояние заболевания лечат посредством частичного или полного устранения дефицита или неуравновешенности, которые вызывают заболевание или делают его более тяжелым. Возможно также использование сайт-специфической рекомбинации нуклеотидных последовательностей для получения мутаций или для коррекции дефектов.
[0206] Вирусные векторы в соответствии с настоящим изобретением можно также использовать для предоставления антисмысловой нуклеиновой кислоты или ингибирующей РНК (например, микроРНК или РНКи, такой как миРНК или кшРНК) в клетке in vitro или in vivo. Экспрессия ингибирующей РНК в клетке-мишени уменьшает экспрессию конкретного белка(белков) в клетке. Соответственно, ингибирующую РНК можно вводить для уменьшения экспрессии конкретного белка у нуждающегося в этом пациента. Ингибирующую РНК можно также вводить в клетки in vitro для регуляции физиологии клетки, например, для оптимизации систем культивирования клеток или тканей.
[0207] В качестве следующего аспекта, вирусные векторы по настоящему изобретению можно использовать для получения иммунного ответа у пациента. В соответствии с этим вариантом осуществления, вирусный вектор, содержащий нуклеиновую кислоту, кодирующую иммуноген, можно вводить пациенту, и активный иммунный ответ (необязательно, защитный иммунный ответ) развивается у пациента против иммуногена. Иммуногены являются такими, как описано в настоящем описании выше.
[0208] Альтернативно, вирусный вектор можно вводить в клетку ex vivo, и измененную клетку вводят пациенту. Гетерологичную нуклеиновую кислоту вводят в клетку, и клетку вводят пациенту, где гетерологичная нуклеиновая кислота, кодирующая иммуноген, необязательно, экспрессируется и индуцирует иммунный ответ у пациента против иммуногена. В конкретных вариантах осуществления, клетка представляет собой антигенпредставляющую клетку (например, дендритную клетку).
[0209] «Активный иммунный ответ» или «активный иммунитет» характеризуется «участием тканей и клеток хозяина после встречи с иммуногеном. Он включает дифференцировку и пролиферацию иммунокомпетентных клеток в лимфоретикулярных тканях, что приводит к синтезу антитела или к развитию опосредованной клетками реакционной способности, или к тому и другому». Herbert B. Herscowitz, Cell Function and Cellular Interactions in Antibody Formation,in IMMUNOLOGY: BASIC PROCESSES 117 (Joseph A. Bellanti ed., 1985). Альтернативно установлено, что активный иммунный ответ развивается у хозяина после воздействия иммуногенов при инфекции или при вакцинации. Активный иммунитет может отличаться от пассивного иммунитета, который приобретается посредством «переноса предварительно сформированных веществ (антитела, фактора переноса, трансплантата тимуса, интерлейкина-2) от активно иммунизированного хозяина к неиммунному хозяину». Там же.
[0210] «Защитный» иммунный ответ или «защитный» иммунитет, в рамках изобретения, обозначает то, что иммунный ответ обеспечивает некоторое преимущество для пациента, в том что он предотвращает или уменьшает частоту заболевания. Альтернативно, защитный иммунный ответ или защитный иммунитет можно использовать для лечения заболевания, в частности, злокачественных опухолей или опухолей (например, посредством вызова регрессии злокачественной опухоли или опухоли и/или посредством предотвращения метастазирования и/или посредством предотвращения роста метастатических узлов). Защитные эффекты могут являться полными или частичными, при условии, что преимущество лечения превышает любые его недостатки.
[0211] Вирусные векторы по настоящему изобретению можно вводить также для иммунотерапии злокачественных опухолей посредством введения вирусного вектора, экспрессирующего антиген клетки злокачественных опухолей (или иммунологически сходную молекулу) или любой другой иммуноген, вызывающий иммунный ответ против клетки злокачественной опухоли. Для иллюстрации, иммунный ответ можно вызывать против антигена клетки злокачественной опухоли у пациента посредством введения вирусного вектора, содержащего гетерологичную нуклеотидную последовательность, кодирующую антиген клетки злокачественной опухоли, например, для лечения пациента с злокачественной опухолью. Вирусный вектор можно вводить пациенту in vivo или с использованием способов ex vivo, как описано в настоящем описании.
[0212] В рамках изобретения, термин «злокачественные опухоли» включает формирующие опухоли злокачественные новообразования. Подобным образом, термин «злокачественная ткань» включает опухоли. «Антиген клетки злокачественной опухоли» включает антигены опухолей.
[0213] Термин «злокачественная опухоль» обладает значением, понятным в данной области, например, неконтролируемый рост ткани, обладающий потенциалом для распространения к отдаленным участкам организма (т.е., метастазирования). Иллюстративные злокачественные опухоли включают в себя, но без ограничения, лейкоз, лимфому (например, лимфому Ходжкина и неходжкинские лимфомы), колоректальный рак, рак почки, рак печени, рак молочной железы, рак легкого, рак предстательной железы, рак яичка, рак яичника, рак тела матки, рак шейки матки, злокачественную опухоль мозга (например, глиомы и глиобластомы), рак кости, саркому, меланому, рак головы и шеи, рак пищевода, рак щитовидной железы и т.п. В вариантах осуществления по изобретению, изобретение осуществляют на практике для лечения и/или предотвращения формирующих опухолей злокачественных новообразований.
[0214] Термин «опухоль» также понимают в данной области, например, как аномальную массу недифференцированных клеток внутри многоклеточного организма. Опухоли могут являться злокачественными или доброкачественными. В репрезентативных вариантах осуществления, способы, описанные в настоящем описании, используют для предотвращения и лечения злокачественных опухолей.
[0215] Антигены клеток злокачественных опухолей описаны в настоящем описании выше. Под терминами «проведение лечения злокачественных опухолей» или «лечение злокачественных опухолей», подразумевают, что тяжесть злокачественной опухоли уменьшают, или злокачественную опухоль предотвращают или по меньшей мере частично уничтожают. Например, в конкретном контексте, эти термины указывают на то, что метастазирование злокачественной опухоли предотвращают или уменьшают, или по меньшей мере частично уничтожают. В следующих репрезентативных вариантах осуществления эти термины указывают на то, что рост метастатических узлов (например, после хирургического удаления первичной опухоли) предотвращают или уменьшают, или по меньшей мере частично уничтожают. Под терминами «предотвращение злокачественной опухоли» или «осуществление предотвращения злокачественной опухоли» подразумевают, что способы по меньшей мере частично исключают или уменьшают частоту встречаемости или начало злокачественной опухоли. Альтернативно указывают, что начало или прогрессирование злокачественной опухоли у пациента можно замедлять, контролировать, уменьшать возможность или вероятность их возникновения, или задерживать.
[0216] В конкретных вариантах осуществления, клетки можно удалять у пациента с злокачественной опухолью и приводить в контакт с вирусным вектором в соответствии с настоящим изобретением. Затем модифицированную клетку вводят пациенту, посредством чего стимулируют иммунный ответ против антигена клетки злокачественной опухоли. Этот способ обеспечивает особенные преимущества при использовании для пациентов с иммунной недостаточностью, которые неспособны развивать достаточный иммунный ответ in vivo (т.е., неспособны образовывать антитела в достаточных количествах).
[0217] В данной области известно, что иммунные ответы можно усиливать посредством иммуномодулирующих цитокинов (например, α-интерферона, β-интерферона, γ-интерферона, ω-интерферона, τ-интерферона, интерлейкина-1α, интерлейкина-1β, интерлейкина-2, интерлейкина-3, интерлейкина-4, интерлейкина-5, интерлейкина-6, интерлейкина-7, интерлейкина-8, интерлейкина-9, интерлейкина-10, интерлейкина-11, интерлейкина-12, интерлейкина-13, интерлейкина-14, интерлейкина-18, фактора роста B-клеток, лиганда CD40, фактора некроза опухолей-α, фактора некроза опухолей-β, моноцитарного хемоаттрактантного белка-1, гранулоцитарно-макрофагального колониестимулирующего фактора и лимфотоксина). Соответственно, иммуномодулирующие цитокины (например, индуцирующие CTL цитокины) можно вводить пациенту в сочетании с вирусными векторами.
[0218] Цитокины можно вводить любым способом, известным в данной области. Экзогенные цитокины можно вводить пациенту, или альтернативно, нуклеотидную последовательность, кодирующую цитокин, можно доставлять пациенту с использованием подходящего вектора, и продуцировать цитокин in vivo.
[0219] Вирусные векторы, кроме того, можно использовать для нацеливания на клетки ЦНС для исследовательских целей, например, для исследования функции ЦНС in vitro или у животных, или для использования для получения и/или исследования моделей заболевания на животных. Например, векторы можно использовать для доставки гетерологичных нуклеиновых кислот в нейроны в моделях повреждения нейронов на животных, например, травматического повреждения головного мозга или повреждения спинного мозга, или в моделях нейродегенеративных заболеваний на животных. Например, векторы можно использовать для доставки гетерологичных нуклеиновых кислот в олигодендроциты в моделях демиелинизирующих заболеваний на животных. Демиелинизацию можно индуцировать у животных множеством способов, включая, без ограничения, введение вирусов (например, вируса Семлики, вируса гепатита мышей или вируса энцефаломиелита мышей Тейлера) и введение химических веществ (например, купризона, бромида этидия или лизолецитина). В некоторых вариантах осуществления, вектор можно использовать также в моделях экспериментального аутоиммунного энцефаломиелита на животных. Это состояние можно индуцировать, например, посредством введения каинита, SIN-1, антител против галактоцереброзида или посредством облучения. В других вариантах осуществления, вирусный вектор можно использовать для специфической доставки в олигодендроциты токсичного средства или фермента, образующего токсичное средство (например, тимидинкиназы), для уничтожения некоторых или всех из этих клеток.
[0220] Кроме того, вирусные векторы в соответствии с настоящим изобретением находят дополнительное применение в способах диагностики и скрининга, в которых представляющий интерес ген временно или стабильно экспрессируют в системе культуры клеток, или альтернативно, в модели на трансгенных животных. Изобретение можно также осуществлять на практике для доставки нуклеиновой кислоты с целью продукции белков, например, для лабораторных, промышленных или коммерческих целей.
[0221] Рекомбинантные вирусные векторы в соответствии с настоящим изобретением находят применение как в ветеринарии, так и в медицине. Пригодные пациенты включают в себя как птиц, так и млекопитающих. Термин «птицы», в рамках изобретения, включает, но без ограничения, кур, уток, гусей, перепелов, индеек, фазанов, попугаев, попугайчиков. Термин «млекопитающее», в рамках изобретения, включает, но без ограничения, человека, приматов, нечеловекообразных приматов (например, мартышек и павианов), крупный рогатый скот, овец, коз, свиней, лошадей, кошек, собак, кроликов, грызунов (например, крыс, мышей, хомяков и т.п.) и т.д. Пациенты-люди включают в себя новорожденных, младенцев, детей и взрослых. Необязательно, пациент «нуждается в» способах по настоящему изобретению, например, поскольку пациент подвержен, или, как считают, подвержен риску возникновения нарушения, включая описанные в настоящем описании, или может получать преимущество от доставки нуклеиновой кислоты, включая описанные в настоящем описании. Например, в конкретных вариантах осуществления, пациент имеет (или имел) демиелинизирующее нарушение или повреждение спинного мозга или головного мозга, или подвержен риску их возникновения. В качестве дополнительной возможности, пациент может представлять собой лабораторное животное и/или модель заболевания на животных.
[0222] В конкретных вариантах осуществления, настоящее изобретение относится к фармацевтической композиции, содержащей вирусный вектор по изобретению в фармацевтически приемлемом носителе и, необязательно, другие лекарственные средства, фармацевтические средства, стабилизаторы, буферы, носители, адъюванты, разбавители и т.д. Для инъекции, носитель, как правило, является жидким. Для других способов введения, носитель может являться либо твердым, либо жидким. Для введения посредством ингаляции, носитель может являться пригодным для вдыхания, и предпочтительно находится в форме твердых или жидких частиц.
[0223] Под «фармацевтически приемлемым» понимают материал, который не является токсичным или иным образом нежелательным, т.е., материал можно вводить пациенту, не вызывая каких-либо нежелательных биологических эффектов.
[0224] Один аспект настоящего изобретения относится к способу переноса нуклеотидной последовательности в клетку in vitro. Вирусный вектор можно вводить в клетки при подходящей множественности инфекции в соответствии со стандартными способами трансдукции, подходящими для конкретных клеток-мишеней. Титры вирусного вектора или капсида, подлежащие введению, можно менять в зависимости от типа и количества клеток-мишеней, и конкретного вирусного вектора или капсида, и их может определять специалист в данной области без излишнего экспериментирования. В конкретных вариантах осуществления, по меньшей мере приблизительно 103 инфекционных единиц, более предпочтительно, по меньшей мере приблизительно 105 инфекционных единиц вводят в клетку.
[0225] Клетка(клетки), в которые можно вводить вирусный вектор, могут принадлежать к любому типу, включая, но без ограничения, нервные клетки (включая клетки периферической и центральной нервных систем, в частности, клетки головного мозга, такие как нейроны, олигодендроциты, глиальные клетки, астроциты), клетки легких, клетки глаза (включая клетки сетчатки, пигментный эпителий сетчатки и клетки роговицы), эпителиальные клетки (например, эпителиальные клетки кишечника и дыхательных путей), клетки скелетных мышц (включая миобласты, мышечные трубочки и мышечные волокна), клетки мышцы диафрагмы, дендритные клетки, клетки поджелудочной железы (включая клетки островков), гепатоциты, клетки желудочно-кишечного тракта (включая гладкомышечные клетки, эпителиальные клетки), клетки сердца (включая кардиомиоциты), клетки кости (например, стволовые клетки костного мозга), гематопоэтические стволовые клетки, клетки селезенки, кератиноциты, фибробласты, эндотелиальные клетки, клетки предстательной железы, клетки суставов (включая, например, хрящ, мениск, синовиальную оболочку и костный мозг), зародышевые клетки и т.п. Альтернативно, клетка может представлять собой любую клетку-предшественник. В качестве дополнительной альтернативы, клетка может представлять собой стволовую клетку (например, нервную стволовую клетку, стволовую клетку печени). В качестве дополнительной альтернативы, клетка может представлять собой клетку злокачественной опухоли или клетку опухоли (злокачественные опухоли и опухоли описаны выше). Более того, клетки могут происходить из любых видов, как указано выше.
[0226] Вирусные векторы можно вводить в клетки in vitro с целью введения модифицированной клетки пациенту. В конкретных вариантах осуществления, клетки удаляют из пациента, вводят в них вирусный вектор, и затем клетки возвращают обратно пациенту. Способы удаления клеток из пациента для обработки ex vivo, с последующим возвращением обратно пациенту, известны в данной области (см., например, Патент США No. 5399346). Альтернативно, рекомбинантный вирусный вектор вводят в клетки от другого пациента, в культивируемые клетки или в клетки из любого другого подходящего источника, и клетки вводят нуждающемуся в этом пациенту.
[0227] Пригодные клетки для генотерапии ex vivo являются такими, как описано выше. Дозы клеток для введения пациенту могут меняться в зависимости от возраста, состояния и вида пациента, типа клеток, нуклеиновой кислоты, экспрессируемой клеткой, способа введения и т.п. Как правило, по меньшей мере от приблизительно 102 до приблизительно 108 или от приблизительно 103 до приблизительно 106 клеток вводят на дозу в фармацевтически приемлемом носителе. В конкретных вариантах осуществления, клетки, трансдуцированные вирусным вектором, вводят пациенту в эффективном количестве в комбинации с фармацевтическим носителем.
[0228] В некоторых вариантах осуществления, клетки, трансдуцированные вирусным вектором, можно вводить для вызова иммуногенного ответа против доставляемого полипептида (например, экспрессированного в форме трансгена или в капсиде). Как правило, вводят количество клеток, экспрессирующее эффективное количество полипептида в комбинации с фармацевтически приемлемым носителем. Необязательно, доза является достаточной для получения защитного иммунного ответа (как определено выше). Степень обеспечиваемой защиты не должна быть полной или защита не должна быть постоянной, при условии, что преимущества от введения иммуногенного полипептида превышают любые его недостатки.
[0229] Следующий аспект изобретения относится к способу введения вирусных векторов или капсидов по изобретению пациентам. В конкретных вариантах осуществления, способ включает способ доставки представляющей интерес нуклеиновой кислоты пациенту-животному, где способ включает: введение эффективного количества вирусного вектора по изобретению пациенту-животному. Введение вирусных векторов по настоящему изобретению нуждающемуся в этом пациенту-человеку или животному можно осуществлять любыми способами, известными в данной области. Необязательно, вирусный вектор доставляют в эффективной дозе в фармацевтически приемлемом носителе.
[0230] Вирусные векторы по изобретению можно, кроме того, вводить пациенту для вызова иммуногенного ответа (например, в качестве вакцины). Как правило, вакцины по настоящему изобретению содержат эффективное количество вируса в комбинации с фармацевтически приемлемым носителем. Необязательно, доза является достаточной для получения защитного иммунного ответа (как определено выше). Степень обеспечиваемой защиты не должна быть полной или защита не должна быть постоянной, при условии, что преимущества от введения иммуногенного полипептида превышают любые его недостатки. Пациенты и иммуногены являются такими, как описано выше.
[0231] Дозы вирусных векторов, подлежащие введению пациенту, зависят от способа введения, заболевания или состояния, подлежащего лечению, состояния индивидуального пациента, конкретного вирусного вектора и нуклеиновой кислоты, подлежащей доставке, и их можно определять общепринятым способом. Иллюстративные дозы для достижения терапевтических эффектов представляют собой титры вирусов по меньшей мере приблизительно 105, 106, 107, 108, 109, 1010, 1011, 1012, 103, 1014, 1015 трансдуцирующих единиц или более, предпочтительно, приблизительно 107или 108, 109, 1010, 1011, 1012, 1013 или 1014трансдуцирующих единиц, еще более предпочтительно, приблизительно 1012 трансдуцирующих единиц.
[0232] В конкретных вариантах осуществления, более одного введения (например, два, три, четыре или более введений) можно применять для достижения желательного уровня экспрессии гена в течение периода из различных интервалов, например, ежесуточно, еженедельно, ежемесячно, ежегодно и т.д.
[0233] Иллюстративные способы введения включают в себя пероральное, ректальное, трансмукозальное, местное, интраназальное введение, ингаляцию (например, посредством аэрозоли), буккальное (например, подъязычное), вагинальное, интратекальное, внутриглазное, чрескожное введение, введение in utero (или in ovo), парентеральное (например, внутривенное, подкожное, внутрикожное, внутримышечное введение [включая введение в скелетные мышцы, в мышцу диафрагмы и/или сердечную мышцу], внутрикожное, интраплевральное, интрацеребральное и внутрисуставное), местное (например, на поверхности как кожи, так и слизистых оболочек, включая поверхности дыхательных путей, и чрескожное введение), внутрилимфатическое введение и т.п., так же как прямую инъекцию в ткани или органы (например, в печень, скелетную мышцу, сердечную мышцу, мышцу диафрагмы или головной мозг). Можно также проводить введение в опухоль (например, в опухоль или в лимфатический узел, или вблизи них). Наиболее подходящий способ в любом данном случае зависит от природы и тяжести состояния, подлежащего лечению, и от природы конкретного используемого вектора.
[0234] В некоторых вариантах осуществления, вирусный вектор вводят непосредственно в ЦНС, например, в головной мозг или в спинной мозг. Непосредственное введение может приводить к высокой специфичности трансдукции клеток ЦНС, например, где по меньшей мере 80%, 85%, 90%, 95% или более трансдуцированных клеток представляют собой клетки ЦНС. Можно использовать любой способ, известный в данной области, для введения векторов непосредственно в ЦНС. Вектор можно вводить в спинной мозг, ствол мозга (продолговатый мозг, варолиев мост), средний мозг (гипоталамус, таламус, эпиталамус, гипофиз, черную субстанцию, шишковидное тело), мозжечок, конечный мозг (полосатое тело, большой мозг, включая затылочную, височную, теменную и лобную долю, кору, базальные ганглии, гиппокамп и миндалевидное тело), лимбическую систему, неокортекс, полосатое тело, большой мозг и нижний холмик четверохолмия. Вектор можно также вводить в различные области глаза, такие как сетчатка, роговица или зрительный нерв. Вектор можно доставлять в спинномозговую жидкость (например, посредством люмбальной пункции) для более рассеянного введения вектора.
[0235] Вектор для доставки можно вводить в желательную область(области) ЦНС любым способом, известным в данной области, включая, но без ограничения, интратекальную, интрацеребральную, интравентрикулярную, интраназальную, внутриушную, внутриглазную доставку (например, доставку в стекловидное тело, субретинальную доставку, доставку в переднюю камеру) и периокулярную доставку (например, в субтеноново пространство) или любую их комбинацию.
[0236] Как правило, вирусный вектор можно вводить в жидком составе посредством прямой инъекции (например, стереотаксической инъекции) в желательную область или компартмент ЦНС. В некоторых вариантах осуществления, вектор можно доставлять посредством резервуара и/или насоса. В других вариантах осуществления, вектор можно предоставлять посредством местного введения в желательную область или посредством интраназального введения аэрозольного состава. Введение в глаз или в ухо можно осуществлять посредством местного введения жидких капель. В качестве дополнительной альтернативы, вектор можно вводить в форме твердого состава с замедленным высвобождением. Контролируемое высвобождение парвовируса и векторов AAV описано в международной публикации патента WO 01/91803.
[0237] В некоторых вариантах осуществления, где пациент обладает нарушенным гематоэнцефалическим барьером (BBB), вирусный вектор можно доставлять пациенту системно (например, внутривенно), где вектор трансдуцирует клетки ЦНС в области нарушения BBB (например, граничащей с ним). В конкретных вариантах осуществления, вектор трансдуцирует клетки в нарушенной области, но не клетки в неповрежденных областях. Таким образом, один аспект изобретения относится к способу доставки представляющей интерес нуклеиновой кислоты в область ЦНС, граничащую с областью нарушенного гематоэнцефалического барьера у пациента-млекопитающего, где способ включает внутривенное введение эффективного количества частиц AAV по изобретению.
[0238] В некоторых вариантах осуществления, нарушение BBB обусловлено заболеванием или нарушением. Примеры включают в себя, без ограничения, нейродегенеративные заболевания, такие как болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз, и рассеянный склероз, эпилепсия, опухоли ЦНС или церебральные инфаркты. В других вариантах осуществления, нарушение BBB может представлять собой индуцированное нарушение, например, для стимуляции доставки средств в ЦНС. Временные нарушения BBB можно индуцировать, например, посредством токсичных химических веществ (таких как метразол, VP-16, цисплатин, гидроксимочевина, фторурацил и этопозид), осмотических средств (таких как маннит и арабиноза), биологических средств (таких как ретиноевая кислота, ацетат форболмиристата, лейкотриен C4, брадикинин, гистамин, RMP-7 и алкилглицерины) или облучения (такого как ультразвуковое или электромагнитное облучение).
[0239] Введение в скелетную мышцу в соответствии с настоящим изобретением включает, но без ограничения, введение в скелетные мышцы в конечностях (например, в плечо, предплечье, бедро и/или голень), в спину, шею, голову (например, язык), грудную клетку, брюшную полость, почечную лоханку/промежность и/или пальцы. Пригодные ткани скелетных мышц включают в себя, но без ограничения, мышцу, отводящую мизинец (в руке), мышцу, отводящую мизинец (в ноге), отводящую мышцу, отводную мышцу пятой плюсневой кости, короткую мышцу, отводящую большой палец, длинную мышцу, отводящую большой палец, короткую приводящую мышцу, мышцу, приводящую большой палец стопы, длинную приводящую мышцу, большую приводящую мышцу, мышцу, приводящую большой палец кисти, локтевую мышцу, переднюю лестничную мышцу, суставную мышцу колена, двуглавую мышцу плеча, двуглавую мышцу бедра, плечевую мышцу, плечелучевую мышцу, щечную мышцу, клювовидно-плечевую мышцу, сморщиватель брови, дельтовидную мышцу, опускатель угла рта, мышцу, опускающую нижнюю губу, двубрюшную мышцу, дорсальную межкостную мышцу (в руке), дорсальную межкостную мышцу (в ноге), короткий лучевой разгибатель запястья, длинный лучевой разгибатель запястья, локтевой разгибатель запястья, разгибатель мизинца, разгибатель пальцев, короткий разгибатель пальцев, длинный разгибатель пальцев, короткий разгибатель большого пальца стопы, длинный разгибатель большого пальца стопы, разгибатель указательного пальца, короткий разгибатель большого пальца, длинный разгибатель большого пальца, лучевой сгибатель запястья, локтевой сгибатель запястья, короткий сгибатель мизинца (в руке), короткий сгибатель мизинца (в ноге), короткий сгибатель пальцев, длинный сгибатель пальцев, сгибатель пальцев кисти глубокий, сгибатель пальцев кисти поверхностный, короткий сгибатель большого пальца, длинный сгибатель большого пальца, короткий сгибатель большого пальца стопы, длинный сгибатель большого пальца кисти, лобную мышцу, икроножную мышцу, подбородочно-подъязычную мышцу, большую ягодичную мышцу, среднюю ягодичную мышцу, малую ягодичную мышцу, тонкую мышцу, подвздошно-реберную мышцу шеи, подвздошно-реберную мышцу поясницы, подвздошно-реберную мышцу груди, подвздошную мышцу, нижнюю близнецовую мышцу, нижнюю косую мышцу, нижнюю прямую мышцу, подостную мышцу, межостистые мышцы, межпоперечные мышцы, боковую крыловидную мышцу, боковую прямую мышцу, широчайшую мышцу спины, мышцу, поднимающую угол рта, мышцу, поднимающую верхнюю губу, мышцу, поднимающую верхнюю губу и крыло носа, мышцу, поднимающую верхнее веко, мышцу-подъемник лопатки, длинные вращатели, длиннейшую мышцу головы, длиннейшую мышцу шеи, длиннейшую мышцу груди, длинную мышцу головы, длинную мышцу шеи, червеобразные мышцы (в руке), червеобразные мышцы (в ноге), жевательную мышцу, медиальную крыловидную мышцу, медиальную прямую мышцу, среднюю лестничную мышцу, многораздельную мышцу, челюстно-подъязычную мышцу, нижнюю косую мышцу головы, верхнюю косую мышцу головы, внешнюю запирательную мышцу, внутреннюю запирательную мышцу, затылочную мышцу, лопаточно-подъязычную мышцу, мышцу, противопоставляющую мизинец, мышцу, противопоставляющую большой палец, круговую мышцу глаза, круговую мышцу рта, ладонные межкостные мышцы, короткую ладонную мышцу, длинную ладонную мышцу, гребенчатую мышцу, большую грудную мышцу, малую грудную мышцу, короткую малоберцовую мышцу, длинную малоберцовую мышцу, третью малоберцовую мышцу, грушевидную мышцу, подошвенные межкостные мышцы, подошвенные мышцы, подкожную мышцу шеи, подколенную мышцу, заднюю лестничную мышцу, квадратный пронатор, круглый пронатор, большую поясничную мышцу, квадратную мышцу бедра, квадратную мышцу подошвы, переднюю прямую мышцу головы, боковую прямую мышцу головы, большую заднюю прямую мышцу головы, малую заднюю прямую мышцу головы, прямую мышцу бедра, большую ромбовидную мышцу, малую ромбовидную мышцу, мышцу улыбки, портняжную мышцу, наименьшую лестничную мышцу, полуперепончатую мышцу, полуостистую мышцу головы, полуостистую мышцу шеи, полуостистую мышцу груди, полусухожильную мышцу, переднюю зубчатую мышцу, короткие вращатели, камбаловидную мышцу, остистую мышцу головы, остистую мышцу шеи, остистую мышцу груди, ременную мышцу головы, ременную мышцу шеи, грудино-ключично-сосцевидную мышцу, грудиноподъязычную мышцу, грудинощитовидную мышцу, шило-подъязычную мышцу, подключичную мышцу, подлопаточную мышцу, верхнюю близнецовую мышцу, верхнюю косую мышцу, верхнюю прямую мышцу, супинатор, надостную мышцу, височную мышцу, напрягатель широкой фасции бедра, большую круглую мышцу, малую круглую мышцу, торакальные мышцы, щитоподъязычную мышцу, переднюю большеберцовую мышцу, заднюю большеберцовую мышцу, трапециевидную мышцу, трехглавую мышцу плеча, промежуточную широкую мышцу бедра, боковую широкую мышцу бедра, Медиальную широкую мышцу бедра, большую скуловую мышцу и малую скуловую мышцу, и любую пригодную скелетную мышцу, как известно в данной области.
[0240] Вирусный вектор можно доставлять в скелетную мышцу любым подходящим способом, включая, без ограничения, внутривенное введение, внутриартериальное введение, внутрибрюшинное введение, изолированная перфузия конечностей (ноги и/или руки; см.,например,Arruda et al., (2005) Blood 105:3458-3464), и/или прямую внутримышечную инъекцию.
[0241] Введение в сердечную мышцу включает, без ограничения, введение в левое предсердие, правое предсердие, левое предсердие, правый желудочек и/или перегородку. Вирусный вектор можно доставлять в сердечную мышцу любым способом, известным в данной области, включая, например, внутривенное введение, внутриартериальное введение, такое как внутриаортальное введение, прямую инъекцию в сердце (например, в левое предсердие, правое предсердие, левый желудочек, правый желудочек) и/или перфузию коронарная артерия.
[0242] Введение в мышцу диафрагмы можно проводить посредством любого пригодного способа, включая внутривенное введение, внутриартериальное введение и/или внутрибрюшинное введение.
[0243] Доставку в любую из этих тканей можно также осуществлять посредством доставки депо, содержащего вирусный вектор, которое можно имплантировать в ткань скелетной мышцы, сердечной мышцы и/или мышцы диафрагмы, или ткань можно приводить в контакт с пленкой или другой матрицей, содержащей вирусный вектор. Примеры таких пригодных для имплантации матриц или субстратов описаны в Патенте США No. 7201898).
[0244] В конкретных вариантах осуществления, вирусный вектор в соответствии с настоящим изобретением вводят в скелетные мышцы, мышцу диафрагмы и/или сердечную мышцу (например, для лечения мышечной дистрофии или заболевания сердца [например, PAD или застойной сердечной недостаточности]).
[0245] Изобретение можно использовать для лечения нарушений скелетных мышц, сердечной мышцы и/или мышцы диафрагмы. Альтернативно изобретение можно осуществлять на практике для доставки нуклеиновой кислоты в скелетные мышцы, сердечную мышцу и/или мышцу диафрагмы, что используют в качестве платформы для продукции белкового продукта (например, фермента) или нетранслируемой РНК (например, РНКи, микроРНК, антисмысловой РНК), которые в норме циркулируют в крови, или для системной доставки в другие ткани для лечения нарушения (например, нарушения метаболизма, такого как диабет (например, инсулин), гемофилии (например, фактор IX или фактор VIII) или лизосомальной болезни накопления (такой как болезнь Гоше [глюкоцереброзидаза], болезнь Помпе [лизосомальная кислая α-глюкозидаза] или болезнь Фабри [α-галактозидаза A]) или a болезни накопления гликогена (такой как болезнь Помпе [лизосомальная кислая α-глюкозидаза]). Другие пригодные белки для оечения нарушений метаболизма описаны выше.
[0246] В репрезентативном варианте осуществления, изобретение относится к способу лечения мышечной дистрофии у нуждающегося в этом пациента, где способ включает: введение эффективного количества вирусного вектора по изобретению пациенту-млекопитающему, где вирусный вектор содержит гетерологичную нуклеиновую кислоту, эффективную для лечения мышечной дистрофии. В иллюстративном варианте осуществления, способ включает: введение эффективного количества вирусного вектора по изобретению пациенту-млекопитающему, где вирусный вектор содержит гетерологичную нуклеиновую кислоту, кодирующую дистрофин, мини-дистрофин, микро-дистрофин, утрофин, мини-утрофин, ламинин-α2, мини-агрин, связанный с фукутином белок, фоллистатин, доминатнтно-негативный аллель миостатина, α-саркогликан, β-саркогликан, γ-саркогликан, δ-саркогликан, IGF-1, пропептид миостатина, растворимый рецептор активина типа II, противовоспалительные полипептиды, такие как доминатный мутант I каппа B, саркоспан, антитела или фрагменты антител против миостатина или пропептида миостатина, или ингибирующую РНК (например, антисмысловую РНК, микроРНК или РНКи) против миостатина, mir-1, mir-133, mir-206, mir-208 или ингибирующую РНК (например, микроРНК, РНКи или антисмысловую РНК) для индукции пропуска экзонов в дефектном гене дистрофина. В конкретных вариантах осуществления, вирусный вектор можно вводить в скелетную мышцу, мышцу диафрагмы и/или сердечную мышцу, как описано в другом месте в настоящем описании.
[0247] Изобретение, кроме того, относится к способу лечения нарушения метаболизма у нуждающегося в этом пациента. В репрезентативных вариантах осуществления, где способ включает: введение эффективного количества вирусного вектора по изобретению в скелетную мышцу пациента, где вирусный вектор содержит гетерологичную нуклеиновую кислоту, кодирующую полипептид, где нарушение метаболизма является результатом дефицита и/или дефекта полипептида. Иллюстративные нарушения метаболизма и гетерологичные нуклеиновые кислоты, кодирующие полипептиды, описаны в настоящем описании. В качестве дополнительной возможности, гетерологичная нуклеиновая кислота может кодировать секретируемый белок.
Изобретение можно также осуществлять на практике для получения ингибирующей РНК (например, антисмысловой РНК, микроРНК или РНКи) для системной доставки.
[0248] Изобретение относится также к способу лечения врожденной сердечной недостаточности у нуждающегося в этом пациента, где способ включает введение эффективного количества вирусного вектора по изобретению пациенту-млекопитающему, где вирусный вектор содержит гетерологичную нуклеиновую кислоту, эффективную для лечения врожденной сердечной недостаточности. В репрезентативных вариантах осуществления, способ включает введение эффективного количества вирусного вектора по изобретению пациенту-млекопитающему, где вирусный вектор содержит гетерологичную нуклеиновую кислоту, кодирующую Ca2+-ATPазу саркоэндоплазматического ретикулума (SERCA2a), ангиогенный фактор, фосфоламбан, киназу PI3, калсарцин, киназу β-адренергического рецептора (βARK), βARKct, ингибитор 1 протеинфосфатазы 1, Pim-1, PGC-1α, SOD-1, SOD-2, EC-SOD, калликреин, HIF, тимозин-β4, S100A1, парвальбумин, аденилатциклазу типа 6, молекулу, вызывающую нокдаун киназы сопряженного с G-белком рецептора типа 2, такую как усеченный конститутивно активный bARKct; ингибирующие фосфоламбан или доминантно-негативные молекулы, такие как фосфоламбан S16E, mir-1, mir-133, mir-206, mir-208.
[0249] Препараты для инъекций можно получать в общепринятых формах, в форме либо жидких растворов, либо суспензий, твердых форм, пригодных для растворения или суспендирования в жидкости перед инъекцией, либо в форме эмульсий. Альтернативно, можно вводить вирусный вектор местным, а не системным способом, например, в составе депо или в составе с замедленным высвобождением. Кроме того, вирусный вектор можно доставлять высушенным в хирургически имплантируемой матрице, такой как заменитель костного трансплантата, нить, стент и т.п. (например, как описано в Патенте США 7201898).
[0250] Фармацевтические композиции, пригодные для перорального введения, можно представлять в дискретных единицах, таких как капсулы, саше, пастилки или таблетки, где каждая содержит предопределенное количество композиции по этому изобретению; в форме порошка или гранул; в форме раствора или суспензии в водной или неводной жидкости; или в форме эмульсии масло-в-воде или вода-в-масле. Пероральную доставку можно осуществлять посредством получения комплексов вирусного вектора по настоящему изобретению с носителем, способным противостоять деградации посредством пищеварительных ферментов в кишечнике животного. Примеры таких носителей включают в себя пластиковые капсулы или таблетки, как известно в данной области. Такие составы получают любым пригодным фармацевтическим способом, включающим в себя стадию получения сочетания композиции и пригодного носителя (который может содержать один или несколько вспомогательных ингредиентов, как указано выше). Как правило, фармацевтическую композицию в соответствии с вариантами осуществления настоящего изобретения получают посредством равномерного и тщательного смешивания композиции с жидким или тонкоизмельченным твердым носителем, или с обоими, и затем, при необходимости, формовки полученной смеси. Например, таблетку можно получать посредством прессовки или формовки порошка или гранул, содержащих композицию, необязательно, с одним или несколькими вспомогательными ингредиентами. Прессованные таблетки получают посредством прессовки, в подходящем устройстве, композиции в свободно текучей форме, такой как порошок или гранулы, необязательно, смешанной со связующим, смазывающим веществом, инертным разбавителем и/или поверхностно активным/диспергирующим средством(средствами). Формованные таблетки получают посредством формовки, в подходящем устройстве, порошкообразного соединения, увлажненного инертным жидким связующим.
[0251] Фармацевтические композиции, пригодные для буккального (подъязычного) введения, включают в себя леденцы, содержащие композицию по этому изобретению в основе с добавлением овкусителей, обычно сахарозе и гуммиарабике или трагаканте; и пастилки, содержащие композицию в инертной основе, такой как желатин и глицерин или сахароза и гуммиарабик.
[0252] Фармацевтические композиции, пригодные для парентерального введения, могут содержать стерильные водные и неводные растворы для инъекции композиции по этому изобретению, где препараты, необязательно, являются изотоническими с кровью намеченного реципиента. Эти препараты могут содержать средства против окисления, буферы, бактериостатики и растворенные вещества, придающие композиции изотоничность с кровью намеченного реципиента. Водные и неводные стерильные суспензии, растворы и эмульсии могут включать в себя суспендирующие средства и загустители. Примеры неводных растворителей представляют собой пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и пригодные для инъекции органические сложные эфиры, такие как этилолеат. Водные носители включают в себя воду, спиртовые/водные растворы, эмульсии или суспензии, включая солевой раствор и забуференную среду. Носители для парентерального введения включают в себя раствор хлорид натрия, декстрозу Рингера, декстрозу и хлорид натрия, раствор Рингера с лактатом или жирные масла. Носители для внутривенного введения включают в себя жидкость и питательные добавки, электролитные добавки (такие как основанные на декстрозе Рингера) и т.п. Могут присутствовать также консерванты и другие добавки, например, такие как противомикробные средства, средства против окисления, хелатирующие агенты и инертные газы и т.п.
[0253] Композиции можно предоставлять в контейнерах для единичной дозы или множественных доз, например, в герметично закрытых ампулах и флаконах, и их можно хранить в высушенном сублимацией (лиофилизированном) состоянии, требующем только добавления стерильного жидкого носителя, например, солевого раствора или воды для инъекций, непосредственно перед использованием.
[0254] Растворы и суспензии для немедленной инъекции можно получать из стерильных порошков, гранул и таблеток описанных ранее видов. Например, можно предоставлять пригодную для инъекции, стабильную, стерильную композицию по этому изобретению в единичной дозированной форме в герметично закрытом контейнере. Композицию можно предоставлять в форме лиофилизата, который можно разводить в пригодном фармацевтически приемлемом носителе для получения жидкой композиции, пригодной для инъекции пациенту. Единичная дозированная форма может содержать от приблизительно 1 мкг до приблизительно 10 грамм композиции по этому изобретению. Когда композиция является в основном нерастворимой в воде, достаточное количество эмульгатора, который является физиологически приемлемым, можно включать в достаточном количестве для эмульгирования композиции в водном носителе. Одним из таких полезных эмульгаторов является фосфатидилхолин.
[0255] Фармацевтические композиции, пригодные для ректального введения, можно представлять в форме суппозиториев с единичной дозой. Их можно получать посредством смешивания композиции с одним или несколькими общепринятыми твердыми носителями, например, такими как масло какао, и затем формовки полученной смеси.
[0256] Фармацевтические композиции по этому изобретению, пригодные для местного применения, могут принимать форму мази, крема, лосьона, пасты, геля, спрея, аэрозоля или масла. Носители, которые можно использовать, включают в себя, но без ограничения, нефтяной вазелин, ланолин, полиэтиленгликоли, спирты, усилители проникновения через кожу, и комбинации из двух или более из них. В некоторых вариантах осуществления, например, местную доставку можно осуществлять посредством смешивания фармацевтической композиции по настоящему изобретению с липофильным реагентом (например, DMSO), обладающим способностью проникать в кожу.
[0257] Фармацевтические композиции, пригодные для чрескожного введения, могут находиться в форме разделенных пластырей, адаптированных, чтобы оставаться в тесном контакте с эпидермисом пациента в течение длительного периода времени. Композиции, пригодные для чрескожного введения, можно также доставлять посредством ионтофореза (см., например, Pharm. Res. 3:318 (1986)) и они как правило, принимают форму, необязательно, забуференного водного раствора композиции по этому изобретению. Пригодные составы могут содержать цитратный или bis\tris буфер (pH 6) или этанол/воду, и могут содержать от 0,1 до 0,2 M активного ингредиента.
[0258] Вирусные векторы, описанные в настоящем описании, можно вводить в легкие пациента любыми пригодными способами, например, посредством введения аэрозольной суспензии пригодных для вдыхания частиц, содержащих вирусные векторы, которые пациент вдыхает. Пригодные для вдыхания частицы могут являться жидкими или твердыми. Аэрозоли из жидких частиц, содержащих вирусные векторы, можно получать любыми пригодными способами, например, с использованием управляемого давлением аэрозольного распылителя или ультразвукового распылителя, как известно специалистам в данной области. См.,например, Патент США No. 4501729. Аэрозоли из твердых частиц, содержащих вирусные векторы, можно подобным образом получать с использованием любого генератора аэрозолей твердых частиц, способами, известными в области фармацевтики.
IV. Применение капсида AAV для нацеливания на периферические ткани.
[0259] Показано, что капсиды AAV и векторы по настоящему изобретению полностью или почти полностью лишены нацеливания на периферические органы и ткани. Это отсутствие нацеливания делает векторы идеальными в качестве «пустого» вектора, который можно изменять для получения желательного профиля тропизма, например, для нацеливания на специфические органы и ткани и/или лишения нацеливания на другие органы и ткани. Таким образом, один аспект изобретения относится к способу получения капсида AAV, обладающего представляющим интерес профилем тропизма, где способ включает модификацию капсида AAV по настоящему изобретению для вставки аминокислотной последовательности, обеспечивающей представляющий интерес профиль тропизма. В некоторых вариантах осуществления, представляющий интерес профиль тропизма представляет собой улучшенную избирательность для ткани, выбранной из тканей скелетной мышцы, сердечной мышцы, диафрагмы, почки, печени, поджелудочной железы, селезенки, желудочно-кишечного тракта, легкого, тканей суставов, тканей языка, яичников, семенников, зародышевых клеток, клеток злокачественной опухоли или их комбинации, и/или уменьшенную избирательность для ткани, выбранной из печени, яичников, семенников, зародышевой клетки или их комбинаций.
[0260] Примеры последовательностей для специфического нацеливания и лишения нацеливания известны в данной области. Одним примером является молекулярная основа для предпочтительного тропизма к печени, которая картирована, в случае AAV2 и AAV6, на непрерывной основной характерной последовательности, по-видимому, вовлеченной во взаимодействие каждого серотипа с гепарином. Конкретно, ранее показано, что одиночный остаток лизина AAV6 (K531) определяет способность связывания гепарина и следовательно, тропизм к печени. Отсюда сделан вывод, что замещающий мутагенез соответствующего остатка глутамата/аспартата в других серотипах на остаток лизина обеспечивает связывание гепарина, возможно, посредством формирования минимальной непрерывной основной характерной последовательности на поверхности капсида. Другим примером являются мутантные капсиды, содержащие изменения по оси третьего порядка в петле 4, как описано в международной публикации No. WO 2012/093784, полное содержание которой приведено в настоящем описании в качестве ссылки. Эти мутанты обладают одним или несколькими свойствами, включая (i) уменьшенную трансдукцию печени, (ii) улучшенное продвижение через эндотелиальные клетки, (iii) системную трансдукцию; (iv) улучшенную трансдукцию мышечной ткани (например, скелетных мышц, сердечной мышцы и/или мышцы диафрагмы), и/или (v) уменьшенную трансдукцию тканей головного мозга (например, нейронов). Другие определяющие тропизм последовательности описаны в Li et al., (2012) J. Virol. 86:7752-7759; Pulicherla et al., (2011) Mol. Ther. 19:1070-1078; Bowles et al., (2012) Mol. Ther. 20:443-455; Asokan et al., (2012) Mol. Ther. 20:699-708; и Asokan et al., (2010) Nature Biotechnol. 28:79-82; полное содержание каждого из которых приведено в качестве ссылки.
[0261] В некоторых вариантах осуществления, капсид AAV по настоящему изобретению можно модифицировать посредством запутывания ДНК и/или направленной эволюции для идентификации модифицированных капсидов, обладающих желательным профилем тропизма. Способы запутывания ДНК и направленной эволюции капсидов AAV описаны в международной публикации No. WO 2009/137006, полное содержание которой приведено в настоящем описании в качестве ссылки.
V. Химерные капсиды AAV, нацеленные на олигодендроциты.
[0262] Авторы изобретения идентифицировали химерные структуры капсидов AAV, способные к предпочтительной трансдукции олигодендроцитов по сравнению с нейронами и другими клетками ЦНС. Таким образом, один аспект изобретения относится к нуклеиновой кислоте, кодирующей капсид AAV, где нуклеиновая кислота содержит, состоит в основном из, или состоит из кодирующей VP1, VP2 или VP1/VP2 части последовательности, кодирующей капсид AAV, которая является по меньшей мере на 90% идентичной: (a) нуклеотидной последовательности из SEQ ID NO:129 (BNP61); или (b) нуклеотидной последовательности, кодирующей SEQ ID NO:130 (BNP61); функционально связанной с частью VP3 из последовательности, кодирующей другой капсид AAV; и к вирусам, содержащим химерные капсиды AAV. В некоторых вариантах осуществления, часть VP1, VP2 или VP1/VP2 последовательности, кодирующей капсид AAV, является по меньшей мере на 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичной части, кодирующей VP1, VP2 или VP1/VP2, из нуклеотидной последовательности из (a) или (b). В другом варианте осуществления, кодирующая капсид AAV последовательность содержит, состоит в основном из, или состоит из части, кодирующей VP1, VP2 или VP1/VP2, из нуклеотидной последовательности из (a) или (b). В некоторых вариантах осуществления, часть, кодирующая VP3, из последовательности, кодирующей другой капсид AAV, представляет собой последовательность капсида дикого типа (например, AAV8 или AAV9) или химерную последовательность, отличную от любой из последовательностей капсида по настоящему изобретению.
[0263] В конкретных вариантах осуществления, нуклеиновая кислота по изобретению дополительно кодирует замену E532K в белке капсида (нумерация относительно последовательности капсида AAV8).
[0264] В некоторых вариантах осуществления, нуклеиновая кислота, кодирующая капсид AAV, содержит, состоит в основном из, или состоит из части, кодирующей VP1, VP2 или VP1/VP2, из последовательности, кодирующей капсид AAV, которая является по меньшей мере на 90% идентичной нуклеотидной последовательности, кодирующей SEQ ID NO:131 (BNP62) или 132 (BNP63), функционально связанной с частью, кодирующей VP3, из последовательности другого капсида AAV; и к вирусам, содержащим химерные капсиды AAV. В некоторых вариантах осуществления, часть, кодирующая VP1, VP2 или VP1/VP2 из последовательности, кодирующей капсид AAV, является по меньшей мере на 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичной части, кодирующей VP1, VP2 или VP1/VP2, из нуклеотидной последовательности, кодирующей SEQ ID NO:131 или 132. В другом варианте осуществления, последовательность, кодирующая капсид AAV, содержит, состоит в основном из, или состоит из части, кодирующей VP1, VP2 или VP1/VP2, из нуклеотидной последовательности, кодирующей SEQ ID NO:131 или 132, функционально связанной с частью VP3 из последовательности, кодирующей другой капсид AAV. В некоторых вариантах осуществления, часть, кодирующая VP3, из последовательности, кодирующей другой капсид AAV, представляет собой последовательность капсида дикого типа (например, AAV8 или AAV9), или химерную последовательность, отличающуюся от любой из последовательностей капсида по настоящему изобретению.
[0265] В конкретных вариантах осуществления, нуклеиновая кислота по изобретению дополнительно кодирует замену E532K в белке капсида (нумерация относительно последовательности капсида AAV8).
[0266] В SEQ ID NO:130-132 показаны примеры последовательностей белка VP1 капсида по изобретению. Обозначение всех положений аминокислот в описании изобретения и прилагаемой формуле изобретения приведено по отношению к нумерации VP1. Специалисту в данной области понятно. что капсид AAV, как правило, содержит также меньшие белки капсида VP2 и VP3. Из-за перекрывания последовательностей, кодирующих белки капсида AAV, кодирующие последовательности нуклеиновой кислоты и аминокислотные последовательности белков капсида VP2 и VP3 очевидны из последовательностей VP1, показанных в SEQ ID NO:129-132. В частности, VP2 начинается с нуклеотида 412 (acg) из SEQ ID NO:129 и треонина 148 из SEQ ID NO:130. VP3 начинается с нуклеотида 607 (atg) из SEQ ID NO:129 и метионина 203 из SEQ ID NO:130. В конкретных вариантах осуществления, предусмотрены выделенные белки капсида VP2 и VP3, содержащие последовательность из SEQ ID NO:130-132 и выделенные нуклеиновые кислоты, кодирующие белки VP2 или VP3, или и то, и другое.
[0267] В конкретных вариантах осуществления, капсид по изобретению дополнительно содержит замену E532K (нумерация относительно последовательности капсида AAV8).
[0268] Изобретение относится также к химерным белкам капсида AAV и к химерным капсидам, где белок капсида содержит, состоит в основном из, или состоит из аминокислотной последовательности, как показано в одном из SEQ ID NO:130-132, где 1, 2 или меньше, 3 или меньше, 4 или меньше, 5 или меньше, 6 или меньше, 7 или меньше, 8 или меньше, 9 или меньше, 10 или меньше, 12 или меньше, 15 или меньше, 20 или меньше, 25 или меньше, 30 или меньше, 40 или меньше, или 50 или меньше из аминокислот внутри кодирующей белок капсида последовательности из любой из SEQ ID NO:130-132 заменены на другую аминокислоту (природную, модифицированную и/или синтетическую), необязательно, посредством консервативной аминокислотной замены, и/или делетированы, и/или присутствуют вставки (включая N-концевые и C-концевые удлинения) из 1, 2 или меньше, 3 или меньше, 4 или меньше, 5 или меньше, 6 или меньше, 7 или меньше, 8 или меньше, 9 или меньше, 10 или меньше, 12 или меньше, 15 или меньше, 20 или меньше, 25 или меньше, 30 или меньше, 40 или меньше, или 50 или меньше аминокислот или любой комбинации замен, делеций и/или вставок, где замены, делеции и/или вставки не нарушают чрезмерно структуру и/или функцию вириона (например, вириона AAV), содержащего вариант белка капсида или капсида. Например, в репрезентативных вариантах осуществления изобретения, вирион AAV, содержащий химерный белок капсида, в основном сохраняет по меньшей мере одно свойство химерного вириона, содержащего химерный белок капсида, как показано в одной из SEQ ID NO:130-132. Например, вирион, содержащий химерный белок капсида, может в основном сохранять профиль тропизма к олигодендроцитам вириона, содержащего химерный белок капсида AAV, как показано в одной из SEQ ID NO:130-132. Способы оценки биологических свойств, таких как трансдукция вируса, хорошо известны в данной области (см.,например, примеры).
[0269] Следующий вариант осуществления изобретения относится к нуклеиновой кислоте, кодирующей AAV8, где капсид содержит замену E532K. В некоторых вариантах осуществления, нуклеиновая кислота содержит, состоит в основном из, или состоит из последовательности, кодирующей капсид AAV, которая является по меньшей мере на 90% идентичной: (a) нуклеотидной последовательности из SEQ ID NO:133 (нуклеотидная последовательность капсида AAV8 E532K); или (b) нуклеотидной последовательности, кодирующей SEQ ID NO:134 (аминокислотная последовательность капсида AAV8 E532K); и к вирусам, содержащим химерные капсиды AAV. В некоторых вариантах осуществления, последовательность, кодирующая капсид AAV, является по меньшей мере на 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичной нуклеотидной последовательности из (a) или (b). В другом варианте осуществления, последовательность, кодирующая капсид AAV, содержит, состоит в основном из, или состоит из нуклеотидной последовательности из (a) или (b). В некоторых вариантах осуществления, последовательность, кодирующая капсид AAV8 E532K, дополнительно содержит части, кодирующие VP1, VP2 или VP1/VP2, из последовательностей капсидов по изобретению.
[0270] Консервативные аминокислотные замены известны в данной области. В конкретных вариантах осуществления, консервативные аминокислотные замены включают в себя замены внутри одной или нескольких из следующих групп: глицин, аланин; валин, изолейцин, лейцин; аспарагиновая кислота, глутаминовая кислота; аспарагин, глутамин; серин, треонин; лизин, аргинин; и/или фенилаланин, тирозин.
[0271] Специалисту в данной области понятно, что аминокислотные последовательности химерного белка капсида AAV из SEQ ID NO:130-132 и/или замену AAV8 E532K можно далее модифицировать для включения других модификаций, как известно в данной области, для придания желательных свойств. В качестве неограничивающих возможностей, белок капсида можно модифицировать для включения нацеливающих последовательностей (например, RGD) или последовательностей, облегчающих очистку и/или детекцию. Например, белок капсида можно сливать со всем или частью глутатион-S-трансферазы, связывающего мальтозу белка, связывающего гепарин/гепарансульфат домена, поли-His, лиганда и/или репортерного белка (например, зеленого флуоресцентного белка, β-глюкуронидазы, β-галактозидазы, люциферазы и т.д.), фрагмента Fc иммуноглобулина, одноцепочечного антитела, гемагглютинина, c-myc, эпитоп FLAG и т.п. для формирования слитого белка. Способы вставки нацеливающих пептидов в капсид AAV известны в данной области (см.,например, международную публикацию патента WO 00/28004; Nicklin et al., (2001) Mol. Ther. 474-181; White et al., (2004) Circulation 109:513-319; Muller et al., (2003) Nature Biotech. 21:1040-1046.
[0272] Вирусы по изобретению могут дополнительно включать в себя дуплексный вирусный геном, как описано в международной публикации патента WO 01/92551 и Патенте США No. 7465583.
[0273] Изобретение относится также к капсидам AAV, содержащим химерные белки капсида AAV по изобретению, и к содержащим их вирусным частицам (т.е., вирионам), где в вирусную частицу упакован (т.е., заключен в капсид) геном вектора, необязательно, геном вектора AAV. В конкретных вариантах осуществления, изобретение относится к частице AAV, содержащей капсид AAV, содержащий белок капсида AAV по изобретению, где в капсид AAV упакован геном вектора AAV. Изобретение относится также к частице AAV, содержащей капсид AAV или белок капсида AAV, кодированный последовательностями химерной нуклеиновой кислоты, кодирующими капсид по изобретению.
[0274] В конкретных вариантах осуществления, вирион представляет собой рекомбинантный вектор, содержащий представляющую интерес гетерологичную нуклеиновую кислоту, например, для доставки в клетку. Таким образом, настоящее изобретение можно использовать для доставки нуклеиновых кислот в клетки in vitro, ex vivo и in vivo. В репрезентативных вариантах осуществления, рекомбинантный вектор по изобретению можно преимущественным образом применять для доставки или переноса нуклеиновых кислот в клетки животного (например, млекопитающего.
[0275] Любую гетерологичную нуклеотидную последовательность(последовательности) можно доставлять посредством вирусного вектора по настоящему изобретению. Представляющие интерес нуклеиновые кислоты включают в себя нуклеиновые кислоты, кодирующие полипептиды, необязательно, терапевтические (например, для медицинского или ветеринарного применения) и/или иммуногенные (например, для вакцин) полипептиды.
[0276] В некоторых вариантах осуществления, полипептид представляет собой полипептид, стимулирующий рост и/или дифференцировку олигодендроцитов. Примеры включают в себя, без ограничения, инсулиноподобный фактор роста-1, глиальный нейротрофический фактор, нейтрофин-3, артемин, трансформирующий фактор роста альфа, фактор роста тромбоцитов, ингибирующий лейкоз фактор, пролактин, транспортер монокарбоксилата 1 или ядерный фактор 1A.
[0277] Терапевтические полипептиды включают в себя, но без ограничения, полипептиды, описанные выше.
[0278] Гетерологичные нуклеотидные последовательности, кодирующие полипептиды, включают в себя последовательности, кодирующие репортерные полипептиды, как описано выше.
[0279] Альтернативно, гетерологичная нуклеиновая кислота может кодировать антисмысловой олигонуклеотид, рибозим, РНК, вызывающие опосредуемый сплайсосомой транс-сплайсинг, интерферирующие РНК (РНКи), включая малые интерферирующие РНК (миРНК), опосредующие выключение гена, микроРНК, или другие нетранслируемые «функциональные» РНК, такие как «направляющие» РНК, и т.п., как описано выше.
[0280] Настоящее изобретение также относится к рекомбинантным вирусным векторам, экспрессирующим иммуногенный полипептид, например, для вакцинации, как описано выше.
[0281] Альтернативно, гетерологичная нуклеотидная последовательность может кодировать любой полипептид, который желательно продуцировать в клетке in vitro, ex vivo или in vivo. Например, вирусные векторы можно вводить в культивируемые клетки и выделять из них экспрессированный белковый продукт.
[0282] Специалисту в данной области понятно, что представляющая интерес гетерологичная нуклеиновая кислота(кислоты) может являться функционально связанной с подходящими контрольными последовательностями, как описано выше. Преимущественным образом, специфические для олигодендроцитов химерные капсиды по настоящему изобретению позволяют использование конститутивных промоторов для экспрессии представляющей интерес гетерологичной нуклеиновой кислоты(кислот) специфическим для олигодендроцитов образом, по сравнению с векторами AAV из предшествующей области техники, которые требуют использования специфических для олигодендроцитов промоторов.
[0283] Изобретение относится также к химерным частицам AAV, содержащим капсид AAV и геном AAV, где геном AAV «соответствует» капсиду AAV (т.е., кодирует его). Представлены также коллекции или библиотеки таких химерных частиц AAV, где коллекция или библиотека содержит 2 или более, 10 или более, 50 или более, 100 или более, 1000 или более, 104 или более, 105 или более, или 106 или более различных последовательностей.
[0284] Настоящее изобретение, кроме того, относится к «пустым» частицам капсида (т.е., в отсутствие генома вектора), содержащим, состоящим из или в основном состоящим из химерных белков капсида AAV по изобретению. Химерные капсиды AAV по изобретению можно использовать в качестве «капсидных носителей», как описано в Патенте США No. 5863541. Молекулы, которые можно ковалентно присоединять к капсидам вируса, связывать с капсидами вируса или упаковывать посредством капсидов вируса и переносить в клетку, включают в себя ДНК, РНК, липид, углевод, полипептид, малую органическую молекулу или их комбинации. Кроме того, молекулы могут являться ассоциированными с (например, «связанными с») внешней частью капсида вируса для переноса молекул в клетки-мишени хозяина. В одном варианте осуществления изобретения молекула является ковалентно связанной (т.е., конъюгированной или химически связанной) с белками капсида. Способы ковалентного присоединения молекул известны специалистам в данной области.
[0285] Капсиды вирусов по изобретению также находят применение в стимуляции образования антител против новых структур капсидов. В качестве дополнительной альтернативы, экзогенную аминокислотную последовательность можно вставлять в капсид вируса для представления антигена клетке, например, для введения пациенту для получения иммунного ответа на экзогенную аминокислотную последовательность.
[0286] Изобретение относится также к нуклеиновым кислотам (например, выделенным нуклеиновым кислотам), кодирующим химерные капсиды вирусов и химерные белки капсида по изобретению. Кроме того, представлены векторы, содержащие нуклеиновые кислоты, и клетки (in vivo или в культуре), содержащие нуклеиновые кислоты и/или векторы по изобретению. Такие нуклеиновые кислоты, векторы и клетки можно использовать, например, в качестве реагентов (например, конструкций-помощников или упаковывающих клеток) для получения вирусных векторов, как описано в настоящем описании.
[0287] В иллюстративных вариантах осуществления, изобретение относится к последовательностям нуклеиновой кислоты, кодирующим капсид AAV из SEQ ID NO:130-132 или по меньшей мере на 90% идентичным нуклеотидной последовательности из SEQ ID NO:129. Изобретение относится также к нуклеиновым кислотам, кодирующим варианты капсида AAV, варианты белка капсида и слитые белки, как описано выше. В конкретных вариантах осуществления, нуклеиновая кислота гибридизуется с последовательностью, комплементарной последовательностям нуклеиновой кислоты, конкретно описанным в настоящем описании, в стандартных условиях, как известно специалистам в данной области, и кодирует вариант капсида и/или белка капсида. Необязательно, вариант капсида или белка капсида в основном сохраняет по меньшей мере одно свойство капсида и/или капсида или белка капсида, кодируемых последовательностью нуклеиновой кислоты из SEQ ID NO:129. Например, вирусная частица, содержащая вариант капсида или вариант белка капсида, может в основном сохранять профиль тропизма к олигодендроцитам вирусной частицы, содержащей капсид или белок капсида, кодируемые кодирующей последовательностью нуклеиновой кислоты из SEQ ID NO:129.
[0288] Например, гибридизацию таких последовательностей можно проводить в условиях уменьшенной строгости, средней строгости или даже в строгих условиях, как описано выше.
[0289] В других вариантах осуществления, последовательности нуклеиновой кислоты, кодирующей вариант капсида или белка капсида по изобретению, обладают по меньшей мере приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или более высокой идентичностью последовательности с последовательностью нуклеиновой кислоты из SEQ ID NO:129 и необязательно, кодируют вариант капсида или белка капсида, в основном сохраняющий по меньшей мере одно свойство капсида или белка капсида, кодируемого нуклеиновой кислотой из SEQ ID NO:129.
[0290] Как известно в данной области, ряд различных программ можно использовать для идентификации того, обладает ли нуклеиновая кислота или полипептид идентичностью последовательности с известной последовательностью, как описано выше.
[0291] В конкретных вариантах осуществления, нуклеиновая кислота может содержать вектор, в основном состоять из вектора или состоять из вектора, включая, но без ограничения, плазмиду, фаг, вирусный вектор (например, вектор AAV, аденовирусный вектор, вектор на основе вируса герпеса или бакуловирусный вектор), искусственную хромосому бактерий (BAC) или искусственную хромосому дрожжей (YAC). Например, нуклеиновая кислота может содержать вектор AAV, состоять из вектора AAV или в основном состоять из вектора AAV, содержащего 5'- и/или 3'-концевой повтор (например, 5'- и/или 3'-концевой повтор AAV).
[0292] В некоторых вариантах осуществления, нуклеиновая кислота, кодирующая химерный белок капсида AAV, дополнительно содержит последовательность, кодирующую rep AAV. Например, нуклеиновая кислота может представлять собой конструкцию-помощника для получения препаратов вирусов для хранения.
[0293] Изобретение относится также к упаковывающим клеткам, стабильно содержащим нуклеиновую кислоту по изобретению, как описано выше.
[0294] Нуклеиновую кислоту можно вставлять в вектор для доставки, такой как вирусный вектор для доставки. Для иллюстрации, нуклеиновую кислоту по изобретению можно упаковывать в частицу AAV, в аденовирусную частицу, в частицу вируса герпеса, в бакуловирусную частицу или в любую другую подходящую вирусную частицу.
[0295] Более того, нуклеиновая кислота может являться функционально связанной с промоторным элементом. Промоторные элементы более подробно описаны в настоящем описании.
[0296] Кроме того, настоящее изобретение относится к способам получения вирусных векторов по изобретению, как описано выше.
[0297] Способы упаковки по изобретению можно использовать для получения препаратов вирусных частиц для хранения с высокими титрами. В конкретных вариантах осуществления, препарат вируса для хранения обладает титром по меньшей мере приблизительно 105 трансдуцирующих единиц (ТЕ)/мл, по меньшей мере приблизительно 106 ТЕ/мл, по меньшей мере приблизительно 107ТЕ/мл, по меньшей мере приблизительно 108 ТЕ/мл, по меньшей мере приблизительно 109 ТЕ/мл, или по меньшей мере приблизительно 1010 ТЕ/мл.
[0298] Новые белки капсида и структуры капсидов находят применение для стимуляции образования антител, например, для диагностических или терапевтических применений, или в качестве реагента для исследований. Таким образом, изобретение относится также к антителам против новых белков капсидов и капсидов по изобретению, как описано выше.
VI. Способы использования химерных капсидов AAV, нацеленных на олигодендроциты.
[0299] Настоящее изобретение также относится к способам доставки гетерологичных нуклеотидных последовательностей в олигодендроциты. Вирусные векторы по изобретению можно использовать, например, для доставки представляющей интерес нуклеотидной последовательности в олигодендроцит in vitro, например, получения полипептида или нуклеиновой кислоты in vitro или для генотерапии ex vivo. Векторы, кроме того, можно использовать в способе доставки нуклеотидной последовательности нуждающемуся в этом пациенту, например, для экспрессии терапевтического или иммуногенного полипептида или нуклеиновой кислоты. По этому способу, полипептид или нуклеиновую кислоту можно, таким образом, получать in vivo у пациента. Пациент может нуждаться в этих полипептиде или нуклеиновой кислоте, поскольку пациент обладает дефицитом полипептида, или поскольку продукция полипептида или нуклеиновой кислоты у пациента может оказывать некоторый терапевтический эффект, в качестве способа лечения или иным образом, и как дополнительно объяснено ниже.
[0300] В конкретных вариантах осуществления, векторы можно использовать для экспрессии полипептида или нуклеиновой кислоты, которые оказывают благоприятный эффект на олигодендроциты, например, для стимуляции роста и/или дифференцировки олигодендроцитов. Способность нацеливания векторов на олигодендроциты может являться особенно полезной для лечения заболеваний или нарушений, включающих в себя дисфункцию олигодендроцитов и/или демиелинизацию нейронов. В других вариантах осуществления, векторы можно использовать для экспрессии полипептида или нуклеиновой кислоты, оказывающих благоприятный эффект на клетки вблизи олигодендроцитов (например, нейроны).
[0301] Таким образом, один аспект изобретения относится к способу доставки представляющей интерес нуклеиновой кислоты в олигодендроцит, где способ включает приведение олигодендроцита в контакт с частицей AAV по изобретению.
[0302] В другом аспекте изобретение относится к способу доставки представляющей интерес нуклеиновой кислоты в олигодендроцит у пациента-млекопитающего, где способ включает введение эффективного количества частиц AAV или фармацевтического состава по изобретению пациенту-млекопитающему.
[0303] Следующий аспект изобретения относится к способу лечения нарушения, ассоциированного с дисфункцией олигодендроцита, у нуждающегося в этом пациента, где способ включает введение терапевтически эффективного количества частиц AAV по изобретению пациенту. В одном варианте осуществления, нарушение, ассоциированное с дисфункцией олигодендроцитов, представляет собой демиелинизирующее заболевание. В одном варианте осуществления, нарушение, ассоциированное с дисфункцией олигодендроцитов, представляет собой рассеянный склероз, болезнь Пелицеуса-Мерцбахера, болезнь Краббе, метахроматическую лейкодистрофию, адренолейкодистрофию, болезнь Канавана, болезнь Александера, ортохроматическую лейкодистрофию, болезнь Цельвегера, синдром делеции 18q, церебральный паралич, повреждение спинного мозга, травматическое повреждение головного мозга, инсульт, фенилкетонурию или вирусную инфекцию, или любое другое нарушение, как известно, или как будет обнаружено позднее, ассоциированное с дисфункцией олигодендроцитов. В другом варианте осуществления, способы по изобретению используют для лечения нарушения, которое не является напрямую ассоциированным с дисфункцией олигодендроцитов, но при котором обеспечивают преимущество посредством экспрессии гетерологичного полипептида или нуклеиновой кислоты в олигодендроцитах в дополнение к экспрессии или вместо экспрессии в нейронах, астроцитах или других типах клеток ЦНС. Примеры включают в себя, без ограничения, нейродегенеративные нарушения, такие как болезнь Альцгеймера, болезнь Паркинсона и болезнь Гентингтона, опухоли ЦНС и другие нарушения ЦНС, как описано выше.
[0304] В другом аспекте по изобретению, химерный капсид AAV и векторы по изобретению представляют собой полностью или почти полностью лишенные нацеливания векторы, которые можно далее модифицировать до желательного профиля тропизма для нацеливания на один или несколько периферических органов или тканей, как описано выше. В этом аспекте, настоящее изобретение также относится к способам для доставки гетерологичных нуклеотидных последовательностей в широкий диапазон клеток, включая делящиеся и не делящиеся клетки. Вирусные векторы по изобретению можно применять для доставки представляющей интерес нуклеотидной последовательности в клетку in vitro, например, для получения полипептида in vitro или для генотерапии ex vivo. Векторы, кроме того, можно использовать в способе доставки нуклеотидной последовательности нуждающемуся в этом пациенту, например, для экспрессии терапевтического или иммуногенного полипептида или нуклеиновой кислоты. В этом способе, полипептид или нуклеиновую кислоту можно, таким образом, продуцировать in vivo у пациента. Пациент может нуждаться в полипептиде или нуклеиновой кислоте, поскольку пациент обладает дефицитом полипептида, или поскольку продукция полипептида или нуклеиновой кислоты у пациента может оказывать некоторый терапевтический эффект, в качестве способа лечения или иным образом, и как дополнительно объяснено ниже.
[0305] Как правило, вирусные векторы по изобретению можно использовать для доставки любой чужеродной нуклеиновой кислоты с биологическим эффектом для лечения или облегчения симптомов, ассоциированных с любым нарушением, относящимся к экспрессии гена. Кроме того, изобретение можно использовать для лечения любого состояния заболевания, при котором обеспечивает преимущества доставка терапевтического полипептида. Иллюстративные состояния заболевания включают в себя состояния, описанные выше.
[0306] Вирусные векторы в соответствии с настоящим изобретением можно также использовать для предоставления антисмысловой нуклеиновой кислоты или ингибирующей РНК (например, микроРНК или РНКи, такой как миРНК или кшРНК) в клетке in vitro или in vivo. Экспрессия ингибирующей РНК в клетке-мишени уменьшает экспрессию конкретного белка(белков) в клетке. Соответственно, ингибирующую РНК можно вводить для уменьшения экспрессии конкретного белка у нуждающегося в этом пациента. Ингибирующую РНК можно также вводить в клетки in vitro для регуляции физиологии клетки, например, для оптимизации систем культивирования клеток или тканей.
[0307] В качестве следующего аспекта, вирусные векторы по настоящему изобретению можно использовать для получения иммунного ответа у пациента. В соответствии с этим вариантом осуществления, вирусный вектор, содержащий нуклеиновую кислоту, кодирующую иммуноген, можно вводить пациенту, и активный иммунный ответ (необязательно, защитный иммунный ответ) развивается у пациента против иммуногена. Иммуногены являются такими, как описано в настоящем описании выше.
[0308] Альтернативно, вирусный вектор можно вводить в клетку ex vivo, и измененную клетку вводят пациенту. Гетерологичную нуклеиновую кислоту вводят в клетку, и клетку вводят пациенту, где гетерологичная нуклеиновая кислота, кодирующая иммуноген, необязательно, экспрессируется и индуцирует иммунный ответ у пациента против иммуногена. В конкретных вариантах осуществления, клетка представляет собой антигенпредставляющую клетку (например, дендритную клетку).
[0309] Вирусные векторы по настоящему изобретению можно вводить также для иммунотерапии злокачественных опухолей посредством введения вирусного вектора, экспрессирующего антиген клетки злокачественных опухолей (или иммунологически сходную молекулу) или любой другой иммуноген, вызывающий иммунный ответ против клетки злокачественной опухоли, как описано выше. Вирусный вектор можно вводить пациенту in vivo или с использованием способов ex vivo, как описано в настоящем описании.
[0310] В конкретных вариантах осуществления, клетки можно удалять у пациента с злокачественной опухолью и приводить в контакт с вирусным вектором в соответствии с настоящим изобретением. Затем модифицированную клетку вводят пациенту, посредством чего стимулируют иммунный ответ против антигена клетки злокачественной опухоли. Этот способ обеспечивает особенные преимущества при использовании для пациентов с иммунной недостаточностью, которые неспособны развивать достаточный иммунный ответ in vivo (т.е., неспособны образовывать антитела в достаточных количествах).
[0311] В данной области известно, что иммунные ответы можно усиливать посредством иммуномодулирующих цитокинов (например, α-интерферона, β-интерферона, γ-интерферона, ω-интерферона, τ-интерферона, интерлейкина-1α, интерлейкина-1β, интерлейкина-2, интерлейкина-3, интерлейкина-4, интерлейкина 5, интерлейкина-6, интерлейкина-7, интерлейкина-8, интерлейкина-9, интерлейкина-10, интерлейкина-11, интерлейкина 12, интерлейкина-13, интерлейкина-14, интерлейкина-18, фактора роста B-клеток, лиганда CD40, фактора некроза опухолей-α, фактора некроза опухолей-β, моноцитарного хемоаттрактантного белка-1, гранулоцитарно-макрофагального колониестимулирующего фактора и лимфотоксина). Соответственно, иммуномодулирующие цитокины (например, индуцирующие CTL цитокины) можно вводить пациенту в сочетании с вирусными векторами.
[0312] Цитокины можно вводить любым способом, известным в данной области. Экзогенные цитокины можно вводить пациенту, или альтернативно, нуклеотидную последовательность, кодирующую цитокин, можно доставлять пациенту с использованием подходящего вектора, и продуцировать цитокин in vivo.
[0313] Вирусные векторы, кроме того, можно использовать для нацеливания на олигодендроциты для исследовательских целей, например, для исследования функции ЦНС in vitro или у животных, или для использования для получения и/или исследования моделей заболевания на животных. Например, векторы можно использовать для доставки гетерологичных нуклеиновых кислот в олигодендроциты в моделях демиелинизирующих заболеваний на животных. Демиелинизацию можно индуцировать у животных множеством способов, включая, без ограничения, введение вирусов (например, вируса Семлики, вируса гепатита мышей или вируса энцефаломиелита мышей Тейлера) и введение химических веществ (например, купризона, бромида этидия или лизолецитина). В некоторых вариантах осуществления, вектор можно использовать также в моделях экспериментального аутоиммунного энцефаломиелита на животных. Это состояние можно индуцировать, например, посредством введения каинита, SIN-1, антител против галактоцереброзида или посредством облучения. В других вариантах осуществления, вирусный вектор можно использовать для специфической доставки в олигодендроциты токсичного средства или фермента, образующего токсичное средство (например, тимидинкиназы), для уничтожения некоторых или всех из этих клеток.
[0314] Кроме того, вирусные векторы в соответствии с настоящим изобретением находят дополнительное применение в способах диагностики и скрининга, в которых представляющий интерес ген временно или стабильно экспрессируют в системе культуры клеток, или альтернативно, в модели на трансгенных животных. Изобретение можно также осуществлять на практике для доставки нуклеиновой кислоты с целью продукции белков, например, для лабораторных, промышленных или коммерческих целей.
[0315] Рекомбинантные вирусные векторы в соответствии с настоящим изобретением находят применение как в ветеринарии, так и в медицине. Пригодные пациенты включают в себя как птиц, так и млекопитающих, как описано выше. Необязательно, пациент «нуждается в» способах по настоящему изобретению, например, поскольку пациент подвержен, или, как считают, подвержен риску возникновения нарушения, включая описанные в настоящем описании, или может получать преимущество от доставки нуклеиновой кислоты, включая описанные в настоящем описании. Например, в конкретных вариантах осуществления, пациент имеет (или имел) демиелинизирующее нарушение или повреждение спинного мозга или головного мозга, или подвержен риску их возникновения. В качестве дополнительной возможности, пациент может представлять собой лабораторное животное и/или модель заболевания на животных.
[0316] В конкретных вариантах осуществления, настоящее изобретение относится к фармацевтической композиции, содержащей вирусный вектор по изобретению в фармацевтически приемлемом носителе и, необязательно, другие лекарственные средства, фармацевтические средства, стабилизаторы, буферы, носители, адъюванты, разбавители и т.д. Для инъекции, носитель, как правило, является жидким. Для других способов введения, носитель может являться либо твердым, либо жидким. Для введения посредством ингаляции, носитель может являться пригодным для вдыхания, и предпочтительно находится в форме твердых или жидких частиц.
[0317] Под «фармацевтически приемлемым» понимают материал, который не является токсичным или иным образом нежелательным, т.е., материал можно вводить пациенту, не вызывая каких-либо нежелательных биологических эффектов.
[0318] Один аспект настоящего изобретения относится к способу переноса нуклеотидной последовательности в клетку in vitro. Вирусный вектор можно вводить в клетки при подходящей множественности инфекции в соответствии со стандартными способами трансдукции, подходящими для конкретных клеток-мишеней. Титры вирусного вектора или капсида, подлежащие введению, можно менять в зависимости от типа и количества клеток-мишеней, и конкретного вирусного вектора или капсида, и их может определять специалист в данной области без излишнего экспериментирования. В конкретных вариантах осуществления, по меньшей мере приблизительно 103 инфекционных единиц, более предпочтительно, по меньшей мере приблизительно 105 инфекционных единиц вводят в клетку.
[0319] Клетка(клетки), в которые можно вводить вирусный вектор, могут принадлежать к любому типу, как описано выше.
[0320] Вирусные векторы можно вводить в клетки in vitro с целью введения модифицированной клетки пациенту. В конкретных вариантах осуществления, клетки удаляют из пациента, вводят в них вирусный вектор, и затем клетки возвращают обратно пациенту. Способы удаления клеток из пациента для обработки ex vivo, с последующим возвращением обратно пациенту, известны в данной области (см., например, Патент США No. 5399346). Альтернативно, рекомбинантный вирусный вектор вводят в клетки от другого пациента, в культивируемые клетки или в клетки из любого другого подходящего источника, и клетки вводят нуждающемуся в этом пациенту.
[0321] Пригодные клетки для генотерапии ex vivo являются такими, как описано выше. Дозы клеток для введения пациенту могут меняться в зависимости от возраста, состояния и вида пациента, типа клеток, нуклеиновой кислоты, экспрессируемой клеткой, способа введения и т.п. Как правило, по меньшей мере от приблизительно 102 до приблизительно 108 или от приблизительно 103 до приблизительно 106 клеток вводят на дозу в фармацевтически приемлемом носителе. В конкретных вариантах осуществления, клетки, трансдуцированные вирусным вектором, вводят пациенту в эффективном количестве в комбинации с фармацевтическим носителем.
[0322] В некоторых вариантах осуществления, клетки, трансдуцированные вирусным вектором, можно вводить для вызова иммуногенного ответа против доставляемого полипептида (например, экспрессированного в форме трансгена или в капсиде), как описано выше.
[0323] Следующий аспект изобретения относится к способу введения вирусных векторов или капсидов по изобретению пациентам. В конкретных вариантах осуществления, способ включает способ доставки представляющей интерес нуклеиновой кислоты пациенту-животному, где способ включает: введение эффективного количества вирусного вектора по изобретению пациенту-животному. Введение вирусных векторов по настоящему изобретению нуждающемуся в этом пациенту-человеку или животному можно осуществлять любыми способами, известными в данной области. Необязательно, вирусный вектор доставляют в эффективной дозе в фармацевтически приемлемом носителе.
[0324] Вирусные векторы по изобретению можно, кроме того, вводить пациенту для вызова иммуногенного ответа (например, в качестве вакцины), как описано выше.
[0325] Дозы вирусных векторов, подлежащие введению пациенту, зависят от способа введения, заболевания или состояния, подлежащего лечению, состояния индивидуального пациента, конкретного вирусного вектора и нуклеиновой кислоты, подлежащей доставке, и их можно определять общепринятым способом. Иллюстративные дозы для достижения терапевтических эффектов представляют собой титры вирусов по меньшей мере приблизительно 105, 106, 107, 108, 109, 1010, 1011, 1012, 103, 1014, 1015 трансдуцирующих единиц или более, предпочтительно, приблизительно 107или 108, 109, 1010, 1011, 1012, 1013 или 1014трансдуцирующих единиц, еще более предпочтительно, приблизительно 1012 трансдуцирующих единиц.
[0326] В конкретных вариантах осуществления, более одного введения (например, два, три, четыре или более введений) можно применять для достижения желательного уровня экспрессии гена в течение периода из различных интервалов, например, ежесуточно, еженедельно, ежемесячно, ежегодно и т.д.
[0327] Иллюстративные способы введения включают в себя пероральное, ректальное, трансмукозальное, местное, интраназальное введение, ингаляцию (например, посредством аэрозоли), буккальное (например, подъязычное), вагинальное, интратекальное, внутриглазное, чрескожное введение, введение in utero (или in ovo), парентеральное (например, внутривенное, подкожное, внутрикожное, внутримышечное введение [включая введение в скелетные мышцы, в мышцу диафрагмы и/или сердечную мышцу], внутрикожное, интраплевральное, интрацеребральное и внутрисуставное), местное (например, на поверхности как кожи, так и слизистых оболочек, включая поверхности дыхательных путей, и чрескожное введение), внутрилимфатическое введение и т.п., так же как прямую инъекцию в ткани или органы (например, в печень, скелетную мышцу, сердечную мышцу, мышцу диафрагмы или головной мозг). Можно также проводить введение в опухоль (например, в опухоль или в лимфатический узел, или вблизи них). Наиболее подходящий способ в любом данном случае зависит от природы и тяжести состояния, подлежащего лечению, и от природы конкретного используемого вектора.
[0328] В некоторых вариантах осуществления, вирусный вектор вводят непосредственно в ЦНС, например, в головной мозг или в спинной мозг. Непосредственное введение может приводить к высокой специфичности трансдукции олигодендроцитов, например, где по меньшей мере 80%, 85%, 90%, 95% или более трансдуцированных клеток представляют собой олигодендроциты. Можно использовать любой способ, известный в данной области, для введения векторов непосредственно в ЦНС. Вектор можно вводить в спинной мозг, ствол мозга (продолговатый мозг, варолиев мост), средний мозг (гипоталамус, таламус, эпиталамус, гипофиз, черную субстанцию, шишковидное тело), мозжечок, конечный мозг (полосатое тело, большой мозг, включая затылочную, височную, теменную и лобную долю, кору, базальные ганглии, гиппокамп и миндалевидное тело), лимбическую систему, неокортекс, полосатое тело, большой мозг и нижний холмик четверохолмия. Вектор можно также вводить в различные области глаза, такие как сетчатка, роговица или зрительный нерв. Вектор можно доставлять в спинномозговую жидкость (например, посредством люмбальной пункции) для более рассеянного введения вектора.
[0329] Вектор для доставки можно вводить в желательную область(области) ЦНС любым способом, известным в данной области, включая, но без ограничения, интратекальную, интрацеребральную, интравентрикулярную, интраназальную, внутриушную, внутриглазную доставку (например, доставку в стекловидное тело, субретинальную доставку, доставку в переднюю камеру) и периокулярную доставку (например, в субтеноново пространство) или любую их комбинацию.
[0330] Как правило, вирусный вектор можно вводить в жидком составе посредством прямой инъекции (например, стереотаксической инъекции) в желательную область или компартмент ЦНС. В некоторых вариантах осуществления, вектор можно доставлять посредством резервуара и/или насоса. В других вариантах осуществления, вектор можно предоставлять посредством местного введения в желательную область или посредством интраназального введения аэрозольного состава. Введение в глаз или в ухо можно осуществлять посредством местного введения жидких капель. В качестве дополнительной альтернативы, вектор можно вводить в форме твердого состава с замедленным высвобождением. Контролируемое высвобождение парвовируса и векторов AAV описано в международной публикации патента WO 01/91803.
[0331] В некоторых вариантах осуществления, где пациент обладает нарушенным гематоэнцефалическим барьером (BBB), вирусный вектор можно доставлять пациенту системно (например, внутривенно), где вектор трансдуцирует олигодендроциты в области нарушения BBB (например, граничащей с ним). В конкретных вариантах осуществления, вектор трансдуцирует клетки в нарушенной области, но не клетки в неповрежденных областях. Таким образом, один аспект изобретения относится к способу доставки представляющей интерес нуклеиновой кислоты в область ЦНС, граничащую с областью нарушенного гематоэнцефалического барьера у пациента-млекопитающего, где способ включает внутривенное введение эффективного количества частиц AAV по изобретению.
[0332] В некоторых вариантах осуществления, нарушение BBB обусловлено заболеванием или нарушением, как описано выше. В других вариантах осуществления, нарушение BBB может представлять собой индуцированное нарушение, например, для стимуляции доставки средств в ЦНС, как описано выше.
[0333] Препараты для инъекций можно получать в общепринятых формах, в форме либо жидких растворов, либо суспензий, твердых форм, пригодных для растворения или суспендирования в жидкости перед инъекцией, или в форме эмульсий. Альтернативно, можно вводить вирусный вектор местным, а не системным способом, например, в составе депо или в составе с замедленным высвобождением. Кроме того, вирусный вектор можно доставлять высушенным в хирургически имплантируемой матрице, такой как заменитель костного трансплантата, нить, стент и т.п. (например, как описано в Патенте США 7201898).
[0334] Фармацевтический композиции, пригодные для различных способов введения, могут являться такими, как описано выше.
[0335] При наличии описания настоящего изобретения, его объясняют более подробно в следующих примерах, которые включены в настоящий документ только с целью иллюстрации, и которые не предназначены для ограничения изобретения.
Пример 1
Разработка капсидов AAV с улучшенным тропизмом к ЦНС и минимальным тропизмом к периферическим органам
[0336] Капсиды AAV разрабатывали посредством способа, называемого перетасовкой и направленной эволюцией ДНК капсида, который использовали для получения библиотеки новых последовательностей капсидов AAV. Затем эти капсиды подвергали множеству циклов селективного давления у мышей, с потенциальным дополнительным мутагенезом капсидов, происходящим между циклами отбора. Выделенные клоны капсидов использовали в качестве векторов для репортерного трансгена (GFP) или терапевтического трансгена (MeCP2 для синдрома Ретта) и оценивали биораспределение и терапевтический потенциал у мышей.
[0337] Исходная использованная библиотека состояла из перетасованных капсидов из серотипов AAV 1, 2, 6, 8, 9 и rh10. Включали также дополнительные сконструированные капсиды: AAV2.5, AAV2i8, AAV9.47, Seiz32, Seiz83 и неописанные капсиды из лаборатории др. Gray (ретроградные клоны 1 и 114). Библиотеку получали, как описано ранее (Li et al., Mol. Ther. 16:1252-1260 (2008)). Либо мышей дикого типа, либо мышей, моделирующих синдром Ретта (B6,129P2(C)-Mecp2tm1,1Bird/J) использовали для отбора in vivo. Для каждого цикла отбора, мышам (мышам WT, самцам мышей с синдромом Ретта с нокаутом, гетерозиготным самкам мышей с синдромом Ретта) вводили однократную люмбальную интратекальную инъекцию библиотеки, затем через 2-5 суток выделяли ткани из спинного мозга и множественных областей головного мозга. Ткань из этих образцов подвергали механической диссоциации для предпочтительного выделения нейронов, как описано (Li et al., Mol. Ther. 16:1252-1260 (2008)). ДНК выделяли из обогащенных нейронами образцов с использованием набора для выделения ДНК из крови и тканей DNeasy (Qiagen, cat. #69506). ПЦР с пониженной точностью применяли для обеспечения дополнительного разнообразия библиотеки между циклами, с использованием taq полимеразы с небольшим количеством исходной матрицы и 50 циклам амплификация, с праймерами, описанными ранее (Li et al., Mol. Ther. 16:1252-1260 (2008)). Объединенные продукты ПЦР клонировали обратно в остов AAV WT (pSSV9) и объединенные клоны использовали для получения исходной библиотеки для следующего цикла. Объединенными клонами трансфицировали клетки HEK293 с аденовирусной плазмидой-помощником (pXX680) и 10-кратным избытком pXR2, содержащей Rep и Cap AAV2. По этому способу, геномы химерных капсидов упаковывали в большинство капсидов AAV2. Затем инкапсулированные в AAV2 химеры добавляли к клеткам HEK293 при MOI 0,5 геномов на клетку с аденовирусом WT при MOI 5 инфекционных единиц на клетку для преимущественной упаковки каждого химерного генома AAV в его собственный капсид. Через 72 часа клетки собирали, и вирус очищали, как описано (Grieger et al., Nat. Protoc. 1:1412-28 (2006)) и титровали посредством qПЦР. Всего проводили 3 цикла отбора. Образцы выделенных капсидов после каждого цикла субклонировали в рекомбинантные остовы AAV2 (лишенные элементов ITR) и компетентные по репликации остовы SSV9, и секвенировали.
[0338] Для оценки биораспределения и (в некоторых случаях, терапевтического потенциала) выделенных капсидов, мышам вводили дозы некоторых клонов посредством однократного люмбального интратекального введения в объеме 5 микролитров. При оценке биораспределения, мышей умерщвляли через 2-4 недели после инъекции, и в образцах тканей анализировали биораспределение векторной ДНК, как описано (Li et al., Mol. Ther. 16:1252-1260 (2008)). При оценке терапевтического потенциала выделенных клонов капсидов, ген MeCP2 человека (управляемый промотором MeCP2 мыши) упаковывали в каждый капсид, затем вводили дозы самцам мышей с нокаутом с синдромом Ретта в возрасте 4-5 недель посредством люмбальной интратекальной инъекции. У мышей мониторировали время, за которое они теряют 20% от их максимальной массы тела, которое использовали в качестве предопределенной конечной точки для обозначения выживаемости, как описано ранее (Gadallaet al., Mol. Ther.21(1):18-30 (2013)).
[0339] Репрезентативные клоны показаны на ФИГ. 1-3. Тропизм к ЦНС клонов ITbrain-2.02 и ITbrain-2.04 показан на ФИГ. 4A-4E. За исключением указанного на ФИГ. 4A, взрослым мышам WT C57BL/6 инъецировали IT 1×1010 г.в. вектора scAAV/GFP, затем умерщвляли через 3 недели после инъекции для IHC экспрессии GFP и qПЦР биораспределения в периферических органах. ФИГ. 4B=средний мозг, кора. ФИГ. 4C=средний мозг, гиппокамп. ФИГ. 4D=задний мозг, мозжечок. На ФИГ. 4E показаны передние рога и центральный канал поясничного отдела спинного мозга. n.d.=нет данных. Масштабные линейки в (A) обозначают S.E.M. Масштабная линейка для (B-E) показана внизу справа и составляет 100 микрон. AAV9 представляет собой современный «золотой стандарт» для широкомасштабного переноса генов в ЦНС после введения в CSF, и Olig001 представляет собой полученный отдельно перетасованный капсид. На ФИГ. 5 показано распределение в ЦНС и периферическое распределение клонов ITcord-1.06 и ITcord3.03. Взрослым мышам WT C57BL/6 инъецировали IT 1×1010 г.в. вектора scAAV/GFP, затем умерщвляли через 3 недели после инъекции для анализа qПЦР биораспределения в тканях ЦНС и периферических органах. Планки погрешностей обозначают SEM. На ФИГ. 6 показан тропизм к ЦНС клона RTTF-1.11. На фигуре показана иммуногистохимия против GFP на срезах головного мозга от мышей, которым вводили интратекальную инъекцию клона F1.11 (упаковывающего ген GFP, 1×1010 г.в. на мышь) в возрасте 4-5 недель, затем умерщвляли через 4 недели. Изображения для мыши с синдромом Ретта (слева) показывают более сильную трансдукцию по всей рострально-каудальной оси, по сравнению с мышью WT (справа). Показаны репрезентативные результаты.
[0340] Тестировали эффективность трансдукции и тропизм 9 химерных вирусов AAV/GFP. Каждый вирус инъецировали интрацистернально (5E10 г.в. на мышь) трем самкам мышей MeCP2+/- в возрасте 5-7 месяцев (за исключением того, где указано иначе). Через три недели после инъекций, мышей подвергали перфузии и собирали головной мозг. Через 48 часов фиксации в 1X PBS, содержащем 4% параформальдегид, получали срезы головного мозга 50 мкм с использованием вибротома Leica VT 1000S. Срезы инкубировали в течение 1 час при комнатной температуре в 5% нормальной сыворотке козы в 0,3M PBST, затем инкубировали 40-48 часов при 4°C в растворе первичного антитела (5% сыворотка козы в 0,3M PBST, антитела курицы против GFP (Aves; 1:500) плюс антитела кролика против MeCP2 мыши (Cell Signaling; 1:500), или антитела курицы против GFP (Aves; 1:500) плюс антитела кролика против NeuN мыши (Cell Signaling; 1:500)). После промывки три раза с использованием 0,3M PBST, срезы инкубировали в течение 4 часов при комнатной температуре в растворе вторичного антитела (0,3 M PBST, антитело козы против антител курицы с Alexa-fluor 488 (Invitrogen; 1:1000), антитело козы против антител кролика с Alexa-fluor 594 (Invitrogen; 1:1000)), затем промывали еще три раза в 0,3M PBST. Затем срезы инкубировали с 0,5 мкг/мл DAPI в 0,3M PBST в течение 30 минут при комнатной температуре и промывали один раз с использованием 0,3M PBS. Получали изображения иммуномеченных срезов с использованием конфокального микроскопа Zeiss LSM 780. Изображения получали с использованием объектива 20X с 4X цифровым зумом.
[0341] Для определения эффективности трансдукции для конкретных областей головного мозга, соотношение экспрессирующих GFP нейронов к окрашенным DAPI ядрам рассчитывали для случайных полей (n=12-25) из срезов гиппокампа, коры, ствола мозга, основания гиппокампа, ядер мозга и мозжечка. Среднюю эффективность трансдукции на капсид рассчитывали посредством усреднения средней эффективности для всех анализов (фиг. 7). Для определения тропизма MeCP2, соотношение GFP+/MeCP2+ нейронов и GFP+ нейронов рассчитывали для каждой из следующих областей: гиппокамп, кора, ствол мозга, основание гиппокампа, ядра мозга и мозжечок (фиг. 8). Клетки с глиальной морфологией не использовали для расчета тропизма MeCP2, поскольку глиальные клетки генетически WT могут экспрессировать MeCP2 на уровнях, которые являются слишком низкими для детекции иммунофлуоресценции. Сходные способы использовали для расчета тропизма к NeuN, как выполняли для MeCP2 (фиг. 9).
Пример 2
Разработка капсидов AAV, предпочтительно нацеленных на олигодендроциты
МАТЕРИАЛЫ И МЕТОДЫ
Перетасовка ДНК капсидов AAV и спасение клонов in vivo
[0342] Библиотеку, состоящую из перетасованных капсидов из AAV серотипов 1-6, 8, 9, rh10, нескольких химерных капсидов и мутантных капсидов, и AAV8 с мутацией E533K, получали с использованием способов, как описано ранее (Li et al., Mol. Ther. 16:1252 (2008)). Перетасованную библиотеку инъецировали внутривенно крысам, которым ранее проводили обработку полосатого тела 6-гидроксидофамином. Через трое суток, крыс умерщвляли, и клетки подвергали механической диссоциации из полосатого тела. ДНК выделяли из обогащенных нейронами образцов с использованием набора для выделения ДНК из крови и тканей Qiagen DNeasy, и затем концентрировали посредством осаждения этанолом. Систему для ПЦР с удлинением длинных матриц (кат. no. 11681834001, с низким исходным количеством матрицы, 50 циклов; Roche, Indianapolis, IN) использовали для выделения интактных последовательностей библиотеки капсидов, с использованием ранее описанных праймеров (Li et al., Mol. Ther. 16:1252 (2008)). Последующую стадию ПЦР с пониженной точностью использовали для обеспечения дополнительного разнообразия библиотеки между циклами.Объединенные подвергнутые мутагенезу продукты ПЦР клонировали обратно в остов WT AAV (pSSV9), и пулированные клоны использовали для получения исходной библиотеки для следующего цикла. Объединенными клонами трансфицировали клетки HEK293 с аденовирусной плазмидой-помощником (pXX680) и 10-кратным избытком pXR2, содержащей rep и cap AAV2. По этому способу, геномы химерных капсидов упаковывали в большинство капсидов AAV2. Титр заключенной в капсиды AAV2 химерной библиотеки определяли с использованием qПЦР. Затем заключенные в капсиды AAV2 химеры добавляли к клеткам HEK293 при множественности инфекции 0,5 г.в./клетку с аденовирусом WT при множественности инфекции 5 инфекционных единиц на клетку для преимущественной упаковки каждого химерного генома AAV в его собственный капсид. Через 48 час, клетки собирали, и вирус очищали, как описано (Gray et al., Gene Ther. 20:450 (2013)) и титровали посредством qПЦР. Всего проводили два цикла отбора. Выделенные клоны выделяли после каждого цикла и субклонировали в остовы р-AAV pXR2 и компетентные по репликации остовы SSV9, и секвенировали.
Клонирование
[0343] AAV8/E532K получали для введения одиночной мутации (E532K, с использованием нумерации Olig001 VP1) в pGSK2/8 (repAAV2-capAAV8) с использованием сайт-направленного мутагенеза (набор Agilent quik change II). Праймеры разрабатывали с использованием Программы Agilent QuikChange Primer Design; прямой: 5'gggaaaaaaacgctccttgtcgtctttgtgtgttg3' (SEQ ID NO:135) и обратный: 5'CAACACACAAAGA CGACAAGGAGCGTTTTTTTCCC (SEQ ID NO:136). Выращивали отдельные колонии и верифицировали посредством секвенирования по Сэнгеру. Для получения Olig001/AAV8 VP3, N-конец Olig001, содержащий VP1 и VP2, амплифицировали с использованием прямого (F1): 5'AATGTGGATTTGGATGACTG (SEQ ID NO:137) и мутагенного обратного праймера на старте транскрипции VP3: 5'CGTTATTGTCTGCCATTGGTGCGCCACCGCCTGCAGCCATTGTAAGAGA3' (SEQ ID NO:138), получая фрагмент 659 п.о. C-концевую часть последовательности AAV8 VP3 амплифицировали с pGSK2/8 с использованием прямого праймера: 5'ACCAATGGCAGACAATAACGAAG GCGCCGACGGAGTGGGTA3' (SEQ ID NO:139) и обратного праймера (R2): 5'agagccgagaacgtac3' (SEQ ID NO:140), получая продукт 437 п.о. Два продукта ПЦР обладали перекрывающейся последовательностью друг с другом 20 п.о. Полноразмерный ген cap амплифицировали с использованием обоих фрагментов, и праймеров F1 и R2. Конечный продукт ПЦР (Olig001/AAV8 VP3) и pGSK2/8 расщепляли с использованием SwaI и BsiWI. Полосу GSK2/8 6266 п.о. и продукт химерного гена cap 1070 п.о. выделяли из геля. Фрагменты лигировали в молярном соотношении 3:1 вставка к вектору с использованием 100 нг вектора pGSK2/8. Реакционными смесями после лигирования трансформировали клетки Blue-XL (Agilent; 200249) и рассевали на чашки LB-Amp. Выращивали отдельные колонии и верифицировали посредством секвенирования по Сэнгеру.
Получение вектора AAV
[0344] Рекомбинантные AAVполучали с использованием способа трансфекции клеток HEK293 тремя плазмидами, с последующим центрифугированием в градиенте иодиксанола и ионообменной хроматографией, как описано ранее (Gray et al., Gene Ther. 20:450 (2013)). Все векторы AAV упаковывали с самокомплементарным геномом с улучшенным GFP под контролем энхансера CMV, промотора бета-актина карликовых кур (CBh) и интрона MVM (Gray et al., Hum. Gene Ther. 22:1143 (2011)). Фракции пиков подвергали диализу в фосфатно-солевом буфере (PBS) с 5% сорбитом, и NaCl добавляли до конечной концентрации 350 мМ NaCl. Титры вирусов получали посредством qПЦР (см. ниже).
qПЦР для исследований биораспределения и титра вируса
[0345] qПЦР использовали для определения титра вируса для исследований биораспределения (Gray et al., Current protocols in neuroscience/editorial board, Jacqueline N. Crawley... [et al.] Chapter 4:Unit 4 17 (2011)). Все реакции выполняли с использованием готовой реакционной смеси Lightcycler fast start DNA master mix на основе SyBR Green (Roche) в устройстве Roche 480 Lightcycler, следуя инструкциям производителя. Для подготовки образцов вируса для титрования, их обрабатывали ДНКазой I в течение 1 час, затем ДНКазу I инактивировали с помощью добавления ЭДТА и нагрева при 70°C в течение 10 мин. Для высвобождения заключенных в капсиды геномов вирусов для анализа qПЦР, реакционные смеси подвергали расщеплению протеиназой K в течение по меньшей мере 2 час при 50°C, затем кипятили в течение 10 мин для инактивации протеиназы K. Образцы разводили в воде пригодной для ПЦР квалификации и использовали в качестве матрицы для реакций qПЦР. Для количественного определения GFP вируса, плазмидную ДНК использовали в качестве стандарта. Для количественного определения геномной ДНК мыши, очищенную и подвергнутую определению количества геномную ДНК мыши использовали в качестве стандарта. Для всех успешных реакций получали одиночный продукт по анализу кривой плавления, с использованием стандартной кривой с значением R2 1, и проводили параллельную реакцию, не содержащую матрицы, в которой не получали продукта. Праймеры для GFP являлись следующими:
Прямой: 5'agcagcacgacttcttcaactcc3' (SEQ ID NO:141)
Обратный: 5'tgtagttgtactccagcttgtgcc3' (SEQ ID NO:142).
Праймеры для LaminB2 для количественного определения геномной ДНК мыши являлись следующими:
Прямой: 5'gttaacactcaggcgcatgggcc3' (SEQ ID NO:143)
Обратный: 5'ccat cagggtcacctctggttcc3' (SEQ ID NO:144).
Для титрования векторов AAV, использовали следующие праймеры:
Прямой: 5'AACATGCTACGCAGAGAGGGAGTGG3' (SEQ ID NO:145)
Обратный: 5'CATGAGACAAGGAACCCCTAGTGATGGAG3' (SEQ ID NO:146).
Процедуры на животных
[0346] Все животные, используемые в этих исследованиях, представляли собой либо самцов крыс Sprague-Dawley (Charles River, Morrisville, NC, USA, 250-250 грамм), либо взрослых самок мышей C57Bl/6 (Jackson Labs, Bar Harbor, ME), которых содержали при 12-час цикле света-темноты, и которые имели свободный доступ к воде и пище. Содержание и процедуры соответствовали Руководству по содержанию и использованию лабораторных животных Национального института здравоохранения, и все процедуры получили предварительное одобрение Институционального комитета по содержанию и использованию животных University of North Carolina.
Обработка 6-гидроксидофамином
[0347] Сначала крыс (N=2) подвергали анестезии с использованием 50 мг/кг пентобарбитала, i.p. и помещали в стереотаксическую рамку. Затем крысам проводили одностороннюю инфузию 6-гидроксидофамина (2 мкл, 20 мкг) в правую часть полосатого тела (0,5 мм вперед от брегмы, 3,5 мм вбок, 5,5 мм по вертикали, в соответствии с атласом Paxinos и Watson (Paxinos G, Watson C., The rat brain in stereotaxic coordinates, 6th ed. Academic Press/Elsevier, Amsterdam ; Boston (2007)). Эта обработка приводила к значительному уменьшению содержания дофамина в полосатом теле через 14 суток после обработки.
Введение библиотеки капсидов AAV
[0348] Библиотеку капсидовAAV вводили через 14 суток после обработки 6-гидроксидофамином. Для каждого цикла отбора 2 крыс сначала подвергали анестезии с использованием пентобарбитала (50 мг/кг i.p.), и затем вводили посредством внутривенной инъекции в хвостовую вену библиотеки капсидов вируса AAV. Через трое суток, крыс подвергали эвтаназии, и вырезали правую часть полосатого тела. Затем клетки подвергали механической диссоцации, как описано ранее (Gray et al., Mol. Ther. 18:570 (2010)), для последующего спасения клонов посредством ПЦР.
Стереотаксическое введение вектора AAV
[0349] Как выше, крыс подвергали анестезии с использованием пентобарбитала и помещали в стереотаксическую рамку. Проводили инфузию каждого из различных клонов AAV в фосфатно-солевом буфере (PBS), 5% сорбите и 350 мМ NaCl) со скоростью 1 мкл/5 мин) в полосатое тело (0,5 мм вперед от брегмы, 3,5 мм вбок, 5,5 мм по вертикали, в соответствии с атласом Paxinos и Watson (Paxinos G, Watson C., The rat brain in stereotaxic coordinates, 6th ed. Academic Press/Elsevier, Amsterdam; Boston (2007)). Крыс умерщвляли для иммуногистохимической оценки через 14 суток после инфузии вектора.
Иммуногистохимия
[0350] Через четырнадцать суток после инфузии вектора, крыс подвергали передозировке пентобарбитала (100 мг/кг, i.p.) и затем подвергали транскардиальной перфузиис использованием 100 мл ледяного 0,1 M PBS pH 7,4 (25 мл/мин), затем 180 мл ледяного 4% параформальдегида-фосфатного буфера (pH 7,4)(30 мл/мин). Затем каждый головной мозг фиксировали в 4% параформальдегиде-фосфатном буфере (pH 7,4) в течение ночи при 4°C. Получали корональные срезы фиксированного головного мозга на вибротоме Leica (толщиной 40 мкм) и хранили в ледяном 0,1 M PBS pH 7,4 до дальнейшей обработки. Для иммуноокрашивания, стекла промывали три раза в течение 5 мин в 0,1 M PBS pH 7,4, затем блокировали в 10% сыворотке козы и 0,1% Triton-X в 0,1 M PBS pH 7,4 в течение 30 мин. Первичные антитела против NeuN (1:500;Millipore; MAB377) и GFAP (1:2000; Dako; Z0334) инкубировали в 5% сыворотке козы и 0,05% Triton-X в 0,1 M PBS pH 7,4 при 4°C с осторожным покачиванием в течение ночи. Срезы промывали в 0,1 M PBS pH 7,4 и снова блокировали, как описано выше. Вторичное антитело козы против антител мыши с Alexa 594 (A11032) для NeuN или антитело козы против антител кролика с Alexa 594 (A11080) для GFAP (оба 1:500 в 5% сыворотке козы и 0,5% Triton-X in 0,1 M PBS pH 7,4 инкубировали с осторожным покачиванием при 4°C в течение 45 мин). Срезы промывали в 0,1 M PBS pH 7,4 три раза в течение 5 мин каждый. Срезы всплывали, и их помещали на предметные стекла и высушивали в течение ночи при комнатной температуре. Стекла заливали средой для флуоресцентного анализа и закрывали со скольжением. Конфокальные изображения получали в Michael Hooker Microscopy Core at UNC-Chapel Hill с использованием конфокального микроскопа Leica Sp2. Стекла визуализировали с использованием 40X объектива с использованием последовательного лазерного сканирования для получения серий срезов по оси z. Серии срезов по оси z составляли приблизительно 4 мкм с 10-12 срезами толщиной 0,36 мкм на серию. Серии делали уплощенными в программном обеспечении Leica и обрабатывали в Image J. По меньшей мере пять независимых полей использовали для подсчета положительных по GFP клеток и их совместного мечения с NeuN или GFAP для определения тропизма.
Биораспределение
[0351] Взрослым самкам мышам C57Bl/6 (Jackson labs; Bar Harbor, ME) внутривенно инъецировали в хвостовую вену 5×1010 г.в. (~2,5×1012 г.в./кг массы тела) в 200 мкл PBS с 5% D-сорбитом. Через десять суток после инъекции органы собирали. Тотальную ДНК из каждого органа выделяли с использованием набора для выделения ДНК из крови и тканей Qiagen DNeasy, и общее количество копий GFP и мышиного геномного LaminB2 определяли посредством qПЦР. Данные накапливали по 5 мышам для AAV8 и 4 мышам для Olig001.
Связывание in vitro
[0352] Смешанные культуры глиальных клеток получали из новорожденных детенышей C57BL/6J на сутки три. Передний мозг измельчали, подвергали диссоциации и промывали перед рассевом в флаконы T75. Клетки удаляли из флаконов и затем повторно высевали в 35-мм культуральные чашки приблизительно по 5×105 клетки. При 95% конфлуэнтности четыре вируса AAV, содержащие геном репортерного CBh-GFP (Olig001/AAV8 VP3; Olig001; AAV8; AAV8/ E532K), разводили и добавляли по отдельности, в четырех повторах, при MOI 100 г.в./клетку и инкубировали при 4°C с перемешиванием каждые 10 мин в течение 1 час. Планшеты промывали ледяным PBS 3 раза, клетки соскребали с планшетов, осаждали и замораживали при -80°C. Чашку только с PBS также включали в качестве пустого образца. ДНК выделяли из образцов с использованием набора для выделения ДНК из крови и тканей Qiagen DNeasy. Количество вирусного GFP и мышиного геномного LaminB2 определяли посредством qПЦР. Статистический анализ и получение графических изображений выполняли в Prism. Выпадающие значения определяли с использованием критерия Граббса и затем удаляли. Статистическую значимость (P<0,05) определяли с использованием одностороннего критерия Манна-Уитни. Определяли кратность изменения среднего для каждого вируса по сравнению с AAV8.
РЕЗУЛЬТАТЫ
Идентификация предпочтительного для олигодендроцитов капсида AAV
[0353] Перетасованную библиотеку капсидов AAV вводили внутривенно через 2 недели после одностороннего введения 6-гидроксидофамина (6-OHDA), и 3 суток спустя клоны AAV выделяли посредством ПЦР из диссоциированных клеток полосатого тела. Неожиданно, 10 из 10 выбранных клонов имели высоко сходные, если не идентичные, последовательности. Даже после второго цикла перетасовки капсидов, введения библиотеки и отбора клонов, 12 из 12 клонов имели почти идентичные последовательности, сходные с первым циклом (фиг. 10A). Когда химерный вирус (названный Olig001) вводили внутривенно крысам после односторонней обработки 6-OHDA, через 2 недели иммуногистохимически выявили только небольшое количество положительных по GFP нейронов на той же стороне полосатого тела и небольшое количество подобных олигодендроцитам клеток. С заметным отличием, через 2 недели после инфузии в полосатое тело клона Olig001 у наивных крыс, олигодендроциты составляли подавляющее большинство трансдуцированных клеток, даже несмотря на то, что экспрессией гена управлял конститутивный промотор CBh (фиг. 10B-10E). Положительные по GFP клетки обладали типичной морфологией олигодендроцитов с явным мечением миелина в пятнах/матриксе полосатого тела (фиг. 10B-10C). Более того, положительные по GFP клетки не обладали совместной локализацией с глиофибриллярным кислым белком (GFAP), маркером астроцитов (фиг. 10D), и только приблизительно 5% положительных по GFP клеток обладали совместной локализацией с NeuN, нейрональным маркером (фиг. 10E). Таким образом, почти все из положительных по GFP клеток (>95%) представляли собой олигодендроциты только с небольшим количеством нейронов и с отсутствием положительных по GFP астроцитов или микроглии. Это изменение тропизма явно отличается от тропизма к нейрональным клеткам, характерного для AAV8, который разделяет 99,3% гомологии (с отличием 7 аминокислот) со специфической для VP3 частью последовательности капсида Olig001 (фиг. 10A).
Olig001 лишен нацеливания на периферические ткани
[0354] принимая во внимание то, что способ отбора включает внутривенное введение библиотеки капсидов, авторы настоящего изобретения решили охарактеризовать биораспределение Olig001 у грызунов дикого типа по сравнению с AAV8. Взрослым самкам мышей C57Bl/6 проводили внутривенное введение равных количеств каждого вируса. Через десять суток, органы собирали, и биораспределение оценивали количественно посредством qПЦР для Olig001-CBh-GFP (белые столбцы) и AAV8-CBh-GFP (серые столбцы) (фиг. 11). Биораспределение Olig001 являлось значимо уменьшенным во всех тестированных периферических органах по сравнению с AAV8, особенно в печени (фиг. 11). Вместе с предыдущими результатами авторов настоящего изобретения, эти данные показывают, что Olig001 обладает тропизмом, сильно отличающимся от родственного AAV8, как внутри, так и вне ЦНС.
Мутация E532K в AAV8 вызывает переключение тропизма от нейронов к олигодендроцитам
[0355] Из 7 аминокислот, отличающих Olig001 от области VP3 AAV8, только для 1 остатка (E532K с использованием нумерации Olig001 VP1 или E533K с использованием нумерации AAV8 VP1) ранее показана ассоциация с изменениями взаимодействий рецептор/лиганд (Wu et al., J. Virol. 80:11393 (2006)). Wu и соавторы обнаружили, что различие в тропизме к тканям и связывании лиганда, наблюдаемое между близкородственными AAV1 и AAV6, объясняется единственно лизином или глутаматом в соответствующих остатках 532, и что мутация E533K в AAV8 придает новую способность связывания сульфата гепарина (Wu et al., J. Virol. 80:11393 (2006)). Затем авторы настоящего изобретения тестировали влияние мутации E532K на тропизм AAV8 в головном мозге (фиг. 12A). AAV8/E532K упаковывали с CBh-GFP и инъецировали с титром 2X 108 г.в./мкл в полосатое тело самцов крыс Sprague-Dawley дикого типа. Через две недели после инъекции головной мозг собирали и оценивали по совместной локализации нативного GFP с нейрональными маркерами (NeuN) и маркерами астроцитов (GFAP) (фиг. 12B-12G). Нативный GFP не обладал совместной локализацией с нейрональными маркерами (фиг. 12B-12D) или с маркерами астроцитов (фиг. 12E-12G). В отличие от этого, положительные по GFP клетки обладали характерной морфологией олигодендроцитов. В общем, AAV8 с мутацией E532K изменяет тропизм AAV8 от предпочтительного для нейронов до предпочтительного для олигодендроцитов, что позволяет предполагать роль того же самого остатка в Olig001 для направления тропизма олигодендроциты. Однако, в контексте Olig001, авторы настоящего изобретения обнаружили, что обращение мутации (K532E) не влияет на тропизм к олигодендроцитам (обобщение на фиг. 15).
Тропизм Olig001 к олигодендроцитам придают аминокислоты вне VP3
[0356] Традиционно, считали, что только остатки VP3 вносят вклад в связывание с внеклеточным рецептором и тропизм серотипов AAV, в то время как специфические для VP1 и VP2 части N-конца опосредуют избегание эндосом и импорт в ядро (Bleker et al., J. Virol. 79:2528 (2005); Grieger et al., J. Virol. 80:5199 (2006); Kronenberg et al., J. Virol. 79:5296 (2005); Sonntag et al., J. Virol. 80:11040 (2006)). Для идентификации специфических аминокислот капсида Olig001, которые вносят вклад в тропизм к олигодендроцитам, авторы настоящего изобретения получили мутанты Olig001 с возвращением отличий 7 остатков в VP3 к остаткам AAV8. Однако, никакие из отдельных мутации(мутаций) или кластеров мутаций в VP3 Olig001 не уменьшали тропизм Olig001 к олигодендроцитам в полосатом теле крысы до менее, чем 98% клеток (обобщение на фиг. 15). Подобным образом, биораспределение в периферических органах являлось сильно уменьшенным у всех тестированных мутантов, с наибольшим снижением у мутантов, сохраняющих специфическую область VP1/VP2 Olig001 (фиг. 16). В качестве следующего шага, авторы настоящего изобретения заменили всю последовательность VP3 Olig001 на последовательность VP3 AAV8 для оценки общего вклада VP3 (фиг. 13A). Мутантный Olig001 с VP3 AAV8 (Olig001/ AAV8 VP3) упаковывали с CBh-GFP и инъецировали в полосатое тело самцов крыс Sprague-Dawley дикого типа. Через две недели головной мозг собирали и оценивали по совместной локализации нативного GFP c нейрональными маркерами (NeuN) и маркерами астроцитов (GFAP) (фиг. 13B-13G). Нативный GFP редко (в 2% клеток) обладал совместной локализацией с NeuN (фиг. 13B-13D) и не обладал совместной локализацией с GFAP (фиг. 13E-13G). Кроме того, положительные по GFP клетки обладали характерной морфологией олигодендроцитов полосатого тела. Эти результаты позволяют предполагать, что специфическая часть VP1/VP2 капсида оказывает недооцененное ранее влияние на тропизм AAV.
Данные связывания in vitro
[0357] Специфические части VP1/VP2 капсида Olig001 могут направлять предпочтительную трансдукцию олигодендроцитов посредством увеличенного внеклеточного связывания с рецептором(рецепторами) на олигодендроцитах, или посредством усиленной внутриклеточной миграции по неизвестному механизму, который может являться специфическим для олигодендроцитов. Чтобы разделить эти 2 сценария, авторы настоящего изобретения провели эксперимент по связыванию in vitro с использованием смешанных культур глиальных клеток, включающий в себя Olig001, мутант Olig001/VP3 AAV8, AAV8 и мутант AAV8/E532K, все упакованные с CBh-GFP. Смешанные культуры глиальных клеток инкубировали с равным количеством каждого вируса в течение 1 час при 4°C. Этот способ обеспечивает связывание вектора с повехностью клеток, но предотвращает интернализацию (Xiao et al., Mol. Ther. 20:317 (2012)). Количество вектора, связанного с клетками, определяли посредством qПЦР для GFP и нормализовали по мышиному геномному LaminB2 (фиг. 14A). В соответствии с результатами in vivo авторов настоящего изобретения, Olig001 связывался со смешанной популяцией глиальных клеток в 9 раз сильнее, чем AAV8 (фиг. 14B). Связывание Olig001/AAV VP3 было немного ниже, чем Olig001 (в 4 раза сильнее, чем AAV8), в то время как AAV8/E532K связывался в 46 раз сильнее, чем AAV8 (фиг. 11B). Эти результаты позволяют предполагать, что каждое из мутации E532K и специфического N-концевого домена VP1/VP2 вносит вклад в тропизм олигодендроцитов Olig001 дублирующим образом. Таким образом, данные in vitro согласуются с полученными данными для тропизма in vivo.
[0358] В этих исследованиях получен новый вариант химерного капсида AAV с предпочтительным тропизмом для олигодендроцитов in vivo, это обнаружение является значительным отличием от нормального нейронального тропизма исходных химерных серотипов AAV. В прошлых исследованиях описана способность AAV2 или AAV8 трансдуцировать олигодендроциты с низкой эффективностью, однако, эти исследования требовали использования промоторов олигодендроцитов для предотвращения экспрессии в нейронах, предпочтительном типе клеток для этих векторов (Chen et al., J. Neurosci. Res. 55:504 (1999); Chen et al., Gene Ther. 5:50 (1998); Klein et al., Mol. Ther. 13:517 (2006); Lawlor et al., Mol. Ther. 17:1692 (2009)). В отличие от этого, Olig001 обладает способностью к эффективной и предпочтительной трансдукции олигодендроцитов после интракраниального введения, с использованием повсеместно распространенного промотора. Таким образом, Olig001 обладает предпочтительным тропизмом для олигодендроцитов и низким тропизмом для нейронов, что отличается от любого ранее опубликованного капсида AAV.
[0359] Авторы настоящего изобретения идентифицировали две отдельных и дублирующих друг друга области капсида Olig001, достаточные для направления этого тропизма на олигодендроциты. Интересно, что мутация одной аминокислоты, E532K, в AAV8 (AAV8/E532K) является достаточной для сильного уменьшения его нейронального тропизма в пользу приобретения тропизма для олигодендроцитов. Однако, это предпочтение олигодендроцитов не возникает единственно из-за утраты нейронального тропизма, поскольку для мутанта AAV8/E532K показано значительно увеличение связывания (в 46 раз сильнее, чем AAV8) с олигодендроцитами in vitro (фиг. 15). Второй домен Olig001, придающий ему тропизм к олигодендроцитам, является, возможно, более интересным, принимая во внимание его локализацию на специфическом для VP1/VP2 N-конце капсида ORF. Обычно считали, что специфическая для VP3 область капсида (которая насчитывает 54 из всего 60 капсидных субъединиц на вирион (Johnson et al., J. Virol. 8:860 (1971); Rose et al., J. Virol. 8:766 (1971)) содержит главные элементы, вовлеченные в связывание рецептора (обзор приведен в (Agbandje-McKenna et al., Meth. Mol. Biol. 807:47 (2011)). В сильном отличии от этого, зависимый от VP1/VP2 сдвиг тропизма AAV показывает, что манипуляция с последовательностью VP3 является не единственным фактором, вносящим вклад в тропизм вектора AAV. Данные авторов настоящего изобретения ясно показывают, что VP1 и VP2 (которые насчитывают 54 из всего 60 капсидных субъединиц на вирион (Johnson et al., J. Virol. 8:860 (1971); Rose et al., J. Virol. 8:766 (1971)), могут оказывать основное влияние на тропизм вектора AAV, возникающее в результате внеклеточного связывания, а не внутриклеточной миграции.
[0360] Вектор Olig001, описанный в настоящем описании, можно использовать для исследовательских применений in vivo и in vitro, требующих переноса генов в олигодендроциты, которые, как правило, являются невосприимчивыми к эффективной химической трансфекции или опосредованной вектором трансдукции. Более того, возможность эффективного нацеливания на олигодендроциты in vivo может обеспечивать преимущественные способы терапии демиелинизирующих заболеваний, таких как болезнь Канавана или болезнь Краббе. Эти результаты, кроме того, оспаривают общепринятое наблюдение, что тропизм AAV продиктован исключительно специфической частью VP3 капсида, а не специфическими для VP1/VP1 N-концевыми доменами.
[0361] Вышеуказанное иллюстрирует настоящее изобретение, и его не следует рассматривать как ограничивающее его. Изобретение определено посредством пунктов следующей формулы изобретения, куда включены эквиваленты пунктов формулы изобретения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> The University of North Carolina at Chapel Hill
Gray, Stephen
McCown, Thomas
<120> ВЕКТОРЫ AAV, НАЦЕЛЕННЫЕ НА ЦЕНТРАЛЬНУЮ НЕРВНУЮ СИСТЕМУ
<130> 5470-718WO
<150> US 62/218,857
<151> 2015-09-15
<150> US 62/082,897
<151> 2014-11-21
<160> 146
<170> PatentIn версии 3.5
<210> 1
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 1
atggctgccg atggttatct tccagattgg ctcgaggaca ctctctctga aggaataaga 60
cagtggtgga agctcaaacc tggcccacca ccaccaaagc ccgcagagcg gcataaggac 120
gacagcaggg gtcttgtgct tcctgggtac aagtacctcg gacccttcaa cggactcgac 180
aagggagagc cggtcaacga ggcagacgcc gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aggccggaga caacccgtac ctcaagtaca accacgccga cgccgagttc 300
caggagcggc tcaaagaaga tacgtctttt gggggcaacc tcggacgagc agtcttccag 360
gccaagaagc gggttctcga acctctcggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcgcca caagagccag actcctcctc gggcattggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg acccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcacca atggcggaca ataacgaagg cgccgatgga 660
gtgggtagtt cctcgggaaa ttggcattgc gattcccaat ggctggggga cagagtcatc 720
accaccagca cccgaacatg ggccttgccc acctataaca accacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg acttcaacag attccactgc cacttctcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccgacccaag agactcaact tcaagctctt taacattcaa 960
gtcaaggagg tcacgcagaa tgaaggcacc aagaccatcg ccaataacct caccagcacc 1020
atccaggtgt ttacggactc ggagtaccag ctgccgtacg ttctcggctc cgcccaccag 1080
ggctgcctgc ctccgttccc ggcggacgtg ttcatgattc cccagtacgg ctacctaaca 1140
ctcaacaacg gtagtcaggc cgtgggacgc tcctccttct actgcctgga atactttcct 1200
tcgcagatgc tgagaaccgg caacaacttc cagtttactt acaccttcga ggacgtgcct 1260
ttccacagca gctacgccca cagccagagc ttggaccggc tgatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaagaa aacagcaaac gctggaaccc agagattcaa 2100
tacacttcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 2
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 2
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg cgctgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc cggtcaacgc agcagacgcg gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aggccggaga caacccgtac ctcaagtaca accacgccga cgccgagttc 300
caggagcggc tcaaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaaaaaga ggcttcttga acctcttggt ctggttgagg aagcggctaa gacggctcct 420
ggaaagaaga ggcctgtaga gcagtctcct caggaaccgg actcctccgc gggtattggc 480
aaatcgggtg cacagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg acccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcacca atggcagaca ataacgaagg cgccgacgga 660
gtgggtaatg cctcaggaaa ttggcattgc gattccacat ggctgggcga cagagtcatc 720
accaccagca cccgaacctg ggccctgccc acctacaata accacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg atttcaacag attccactgc cacttttcac cacgtgactg gcagcgactc 900
atcaacaaca attggggatt ccggcccaag agactcaact tcaaactctt caacatccaa 960
gtcaaggagg tcacgcagaa tgaaggcacc aagaccatcg ccaataacct caccagcacc 1020
atccaggtgt ttacggactc ggagtaccag ctgccgtacg ttctcggctc tgcccaccag 1080
ggctgcctgc ctccgttccc ggcggacgtg ttcatgattc cccagtacgg ctacctaaca 1140
ctcaacaacg gtagtcaggc cgtgggacgc tcctccttct actgcctgga atactttcct 1200
tcgcagatgc tgagaaccgg caacaacttc cagtttactt acaccttcga ggacgtgcct 1260
ttccacagca gctacgccca cagccagagc ttggaccggc tgatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa agccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtttg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 3
<211> 2214
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 3
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg acttgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggacgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaagc gggttctcga acctctcggt ctggttgagg aaggcgctaa tacggctcct 420
ggaaagaaac gtccggtaga gcagtcgcca caagagccag actcctccgc gggtattggc 480
aaatcgggtg cacagcccgc taaaaagaga ctcaatttcg gtcagactgg cgacacagag 540
tcagtcccag accctcaacc aatcggagaa cctcccgcag ccccctcagg tgtgggatct 600
cttacaatgg cttcaggtgg tggcgcacca gtggcagaca ataacgaagg tgccgatgga 660
gtgggtagtt cctcgggaaa ttggcattgc gattcccaat ggctggggga cagagtcatc 720
accaccagca cccgaacctg ggccctgccc acctacaaca atcacctcta caagcaaatc 780
tccaacagca catctggagg atcttcaaat gacaacgcct acttcggcta cagcaccccc 840
tgggggtatt ttgacttcaa cagattccac tgccacttct caccacgtga ctggcagcga 900
ctcatcaaca acaactgggg attccggcct aagcgactca acttcaagct cttcaacatt 960
caggtcaaag aggttacgga caacaatgga gtcaagacca tcgccaataa cctcaccagc 1020
accatccagg tgtttacgga ctcggagtac cagctgccgt acgttctcgg ctccgcccac 1080
cagggctgcc tgcctccgtt cccggcggac gtgttcatga ttccccagta cggctaccta 1140
acactcaaca acggtagtca ggccgtggga cgctcctcct tctactgcct ggaatacttt 1200
ccttcgcaga tgctgagaac cggcaacaac ttccagttta cttacacctt cgaggacgtg 1260
cctttccaca gcagctacgc ccacagccag agcttggacc ggctgatgaa tcctctgatt 1320
gaccagtacc tgtactactt gtctcggact caaacaacag gaggcacggc aaatacgcag 1380
actctgggct tcagccaagg tgggcctaat acaatggcca atcaggcaaa gaactggctg 1440
ccaggaccct gttaccgcca acaacgcgtc tcaacgacaa ccgggcaaaa caacaatagc 1500
aactttgcct ggactgctgg gaccaaatac catctgaatg gaagaaattc attggctaat 1560
cctggcatcg ctatggcctc acacaaagac gacaaggagc gtttttttcc cagtaacggg 1620
atcctgattt ttggcaaaca aaatgctgcc agagacaatg cggattacag cgatgtcatg 1680
ctcaccagcg aggaagaaat caaaaccact aaccctgtgg ctacagagga atacggtatc 1740
gtggcagata acttgcagca gcaaaacacg gctcctcaaa ttggaactgt caacagtcaa 1800
ggagccttac ctggcatggt ctggcagaac cgggacgtgt acctgcaggg tcccatctgg 1860
gccaagattc ctcacacgga cggcaacttc cacccgtctc cgctgatggg cggctttggc 1920
ctgaaacatc ctccgcctca gatcctgatc aagaacacgc ctgtacctgc ggatcctccg 1980
accaccttca accagtcaaa gctgaactct ttcatcacgc aatacagcac cggacaggtc 2040
agcgtggaaa ttgaatggga gctgcagaag gaaaacagca agcgctggaa ccccgagatc 2100
cagtacacca ccaactacta caaatctaca agtgtggact ttgctgttaa tacagaaggc 2160
gtgtactctg aaccccaccc cattggcacc cgttacctca cccgtcccct gtaa 2214
<210> 4
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 4
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg cgctgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aaaggagagc cggtcaacga ggcggacgcg gcagccctcg aacacgacaa agcttacgac 240
cagcagctca aggccggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc ttcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaagc gggttctcga acctctcggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcgcca caagagccag actcctcctc gggcatcggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg acccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcacca atggcagaca ataacgaagg cgccgacgga 660
gtgggtaatg cctcaggaaa ttggcattgc gattccacat ggctgggcga cagagtcatc 720
accaccagca cccgcacctg ggccttgccc acctacaata accacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg actttaacag attccactgc cacttttcac cacgtgactg gcaaagactc 900
atcaacaaca actggggatt ccggcccaag agactcaact tcaagctctt caacatccag 960
gtcaaggagg tcacgcagaa tgaaggcacc aagaccatcg ccaataacct taccagcacg 1020
attcaggtct ttacggactc ggaataccag ctcccgtacg tcctcggctc tgcgcaccag 1080
ggctgcctcc ctccgttccc ggcggacgtg ttcatgattc cgcagtacgg ctacctaaca 1140
ctcaacaacg gtagtcaggc cgtgggacgc tcctccttct actgcctgga atactttcct 1200
tcgcagatgc tgagaaccgg caacaacttc cagtttactt acaccttcga ggacgtgcct 1260
ttccacagca gctacgccca cagccagagc ttggaccggc tgatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 5
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 5
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg cgctgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aaaggagagc cggtcaacga ggcggacgcg gcagccctcg aacacgacaa agcttacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaaga gggttctcga accttttggt ctggttgagg aaggtgctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcgcca caagagccag actcctcctc gggcattggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg acccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcacca atggcagaca ataacgaagg cgccgacgga 660
gtgggtaatg cctcaggaaa ttggcattgc gattcccaat ggctgggcga cagagtcatc 720
accaccagca ccagaacctg ggccttgccc acctataaca accacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg atttcaacag attccactgc cacttctcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcctaag cgactcaact tcaagctctt caacattcag 960
gtcaaagagg ttacggacaa caatggagtc aagaccatcg ccaataacct taccagcacg 1020
gttcaagtct tctcggactc ggagtaccag ttgccgtacg tcctcggctc tgcgcaccag 1080
ggctgcctcc ctccgttccc ggcggacgtg ttcatgattc cccagtacgg ctacctaaca 1140
ctcaacaacg gtagtcaggc cgtgggacgc tcctccttct actgcctgga atactttcct 1200
tcgcagatgc tgagaaccgg caacaacttc cagtttactt acaccttcga ggacgtgcct 1260
ttccacagca gctacgcgca cagccagagc ttggaccggc tgatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 6
<211> 2244
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<220>
<221> неопределенный признак
<222> (2241)..(2241)
<223> n представляет собой a, c, g или t
<400> 6
atggctgccg atggttatct tccagattgg ctcgaggaca ctctctctga aggaataaga 60
cagtggtgga agctcaaacc tggcccacca ccaccaaagc ccgcagagcg gcataaggac 120
gacagcaggg gtcttgtgct tcctgggtac aagtacctcg gacccttcaa cggactcgac 180
aagggagagc cggtcaacga ggcagacgcc gcggccctcg agcacgacaa agcctacgac 240
cggcagctcg acagcggaga caacccgtac ctcaagtaca accacgccga cgcggagttt 300
caggagcgcc ttaaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaaga gggttctcga accttttggt ctggttgagg aaggtgctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcgcca caagagccag actcctcctc gggcattggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg acccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcacca atggcagaca ataacgaagg cgccgacgga 660
gtgggtaatg cctcaggaaa ttggcattgc gattccacat ggctgggcga cagagtcatc 720
accaccagca cccgaacatg ggccttgccc acctataaca accacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg acttcaacag attccactgc cacttctcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcctaag cgactcaact tcaagctctt caacattcag 960
gtcaaagagg ttacggacaa caatggagtc aagaccatcg ccaataacct taccagcacg 1020
gtccaggtct tcacggactc agactatcag ctcccgtacg tgctcgggtc ggctcacgag 1080
ggctgcctcc cgccgttccc agcggacgtt ttcatgattc ctcagtacgg ctacctaaca 1140
ctcaacaacg gtagtcaggc cgtgggacgc tcctccttct actgcctgga atactttcct 1200
tcgcagatgc tgagaaccgg caacaacttc cagtttactt acaccttcga ggacgtgcct 1260
ttccacagca gctacgcgca cagccagagc ttggaccggc tgatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcaccaga tacctgactc gtaatctgta attgcttgtt 2220
aatcaataaa ccgtttaatt nttt 2244
<210> 7
<211> 2217
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 7
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg acttgaaacc tggagccccg aaacccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggacgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctcc aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcggacgagc agtcttccag 360
gcgaaaaaga gggttctcga acctctcggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaga gaccggtaga gccatcaccc cagcgttctc cagactcctc tacgggcatc 480
ggcaagaaag gccaacagcc cgccagaaaa agactcaatt ttggtcagac tggcgactca 540
gagtcagttc cagaccctca acctctcgga gaacctccag cagcgccctc tggtgtggga 600
cctaatacaa tggctgcagg cggtggcgca ccaatggcag acaataacga aggcgccgac 660
ggagtgggta gttcctcggg aaattggcat tgcgattccc aatggctggg ggacagagtc 720
atcaccacca gcacccgaac ctgggccctg cccacctaca acaatcacct ctacaagcaa 780
atctccaaca gcacatctgg aggatcttca aatgacaacg cctacttcgg ctacagcacc 840
ccctgggggt attttgactt caaccgcttc cactgccact tctcaccacg tgactggcag 900
cgactcatca acaacaactg gggattccgg cccaagagac tcagcttcaa actcttcaac 960
atccaggtca aggaggtcac gcagaatgaa ggcaccaaga ccatcgccaa taacctcacc 1020
agcaccatcc aggtgtttac ggactcggag taccagctgc cgtacgttct cggctctgcc 1080
caccagggct gcctgcctcc gttcccggcg gacgtgttca tgattcctca gtacggctac 1140
ctaacgctca acaatggcag ccaggcagtg ggacggtcat ccttttactg cctggaatat 1200
ttcccatcgc agatgctgag aacgggcaac aactttacct tcagctacac ctttgaggac 1260
gttcctttcc acagcagcta cgctcacagc cagagtctgg accgtctcat gaatcctctg 1320
attgaccagt acctgtacta cttgtctcgg actcaaacaa caggaggcac ggcaaatacg 1380
cagactctgg gcttcagcca aggtgggcct aatacaatgg ccaatcaggc aaagaactgg 1440
ctgccaggac cctgttaccg ccaacaacgc gtctcaacga caaccgggca aaacaacaat 1500
agcaactttg cctggactgc tgggaccaaa taccatctga atggaagaaa ttcattggct 1560
aatcctggca tcgctatggc aacacacaaa gacgacaagg agcgtttttt tcccagtaac 1620
gggatcctga tttttggcaa acaaaatgct gccagagaca atgcggatta cagcgatgtc 1680
atgctcacca gcgaggaaga aatcaaaacc actaaccctg tggctacaga ggaatacggt 1740
atcgtggcag ataacttgca gcagcaaaac acggctcctc aaattggaac tgtcaacagc 1800
cagggggcct tacccggtat ggtctggcag aaccgggacg tgtacctgca gggtcccatc 1860
tgggccaaga ttcctcacac ggacggcaac ttccacccgt ctccgctgat gggcggcttt 1920
ggacttaagc acccgcctcc tcagatcctc atcaaaaaca cgcctgttcc tgcggatcct 1980
ccgaccacct tcaaccagtc aaagctgaac tctttcatca cgcaatacag caccggacag 2040
gtcagcgtgg aaattgaatg ggagctgcag aaggaaaaca gcaagcgctg gaaccccgag 2100
atccagtaca cctccaacta ctacaaatct acaagtgtgg actttgctgt taatacagaa 2160
ggcgtgtact ctgaacccca ccccattggc acccgttacc tcacccgtcc cctgtaa 2217
<210> 8
<211> 2214
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 8
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg acttgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggatgca gcggccctcg agcacgacaa agcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaaga gggttctcga accttttggt ctggttgagg aaggtgctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcgcca caagagccag actcctcctc gggcattggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg acccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcaccc atgcaagaca ataacgaagg cgccgacgga 660
gtgggtagtt cctcgggaaa ttggcattgc gattccacat ggctgggcga cagagtcatc 720
accaccagca cccgaacctg ggccctgccc acctacaaca accacctcta caagcaaatc 780
tccaacggga catcgggagg agccaccaac gacaacacct acttcggcta cagcaccccc 840
tgggggtatt ttgactttaa cagattccac tgccactttt caccacgtga ctggcagcga 900
ctcatcaaca acaactgggg attccggccc aagagactca acttcaagct cttcaacatc 960
caggtcaagg aggtcacgca gaatgaaggc accaagacca tcgccaataa ccttaccagc 1020
acgattcagg tctttacgga ttcggaatac cagctcccgt acgtcctcgg ctctgcgcac 1080
cagggctgcc tccctccgtt cccggcggac gtgttcatga ttccgcagta cggctaccta 1140
acgctcaaca atggtagcca ggcagtggga cggtcatcct tttactgcct ggaatatttc 1200
ccatcgcaga tgctgagaac gggcaacaac tttaccttca gctacacctt tgaggacgtt 1260
cctttccaca gcagctacgc tcacagccag agtctggacc gtctcatgaa tcctctgatt 1320
gaccagtacc tgtactactt gtctcggact caaacaacag gaggcacggc aaatacgcag 1380
actctgggct tcagccaagg tgggcctaat acaatggcca atcaggcaaa gaactggctg 1440
ccaggaccct gttaccgcca acaacgcgtc tcaacgacaa ccgggcaaaa caacaatagc 1500
aactttgcct ggactgctgg gaccaaatac catctgaatg gaagaaattc attggctaat 1560
cctggcatcg ctatggcaac acacaaagac gacaaggagc gtttttttcc cagtaacggg 1620
atcctgattt ttggcaaaca aaatgctgcc agagacaatg cggattacag cgatgtcatg 1680
ctcaccagcg aggaagaaat caaaaccact aaccctgtgg ctacagagga atacggtatc 1740
gtggcagata acttgcagca gcaaaacacg gctcctcaaa ttggaactgt caacagccag 1800
ggggccttac ccggtatggt ctggcagaac cgggacgtgt acctgcaggg tcccatctgg 1860
gccaagattc ctcacacgga cggcaacttc cacccgtctc cgctgatggg cggctttggc 1920
ctgaaacatc ctccgcctca gatcctgatc aagaacacgc ctgtacctgc ggatcctccg 1980
accaccttca accagtcaaa gctgaactct ttcatcacgc aatacagcac cggacaggtc 2040
agcgtggaaa ttgaatggga gctgcagaag gaaaacagca agcgctggaa ccccgagatc 2100
cagtacacct ccaactacta caaatctaca agtgtggact ttgctgttaa tacagaaggc 2160
gtgtactctg aaccccaccc cattggcacc cgttacctca cccgtcccct gtaa 2214
<210> 9
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 9
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg cgctgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggacgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaagc gggttctcga acctctcggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcgcca caagagccag actcctcctc gggcatcggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg acccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcacca atggcagaca ataacgaagg cgccgacgga 660
gtgggtagtt cctcgggaaa ttggcattgc gattccacat ggctgggcga cagagtcatc 720
accaccagca cccgcacctg ggccttgccc acctacaata accacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg acttcaacag attccactgc cacttctcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcctaag cgactcaact tcaagctctt caacattcag 960
gtcaaagagg ttacggacaa caatggagtc aagaccatcg ccaataacct taccagcacg 1020
gtccaggtct tcacggactc agactatcag ctcccgtacg tgctcgggtc ggctcacgag 1080
ggctgcctcc cgccgttccc agcggacgtt ttcatgattc ctcagtacgg gtatctgacg 1140
ctcaacaatg gcagccaggc agtgggacgg tcatcctttt actgcctgga atatttccca 1200
tcgcagatgc tgagaacggg caataacttt accttcagct acaccttcga ggacgtgcct 1260
ttccacagca gctacgcgca cagccagagc ctggaccggc tgatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 10
<211> 2214
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 10
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg acttgaaacc tggagccccg aaacccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggatgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaagc gggttctcga acctctcggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaga gaccggtaga gccatcaccc cagcgttctc cagactcctc tacgggcatc 480
ggcaagaaag gccaacagcc cgccagaaaa agactcaatt ttggtcagac tggcgactca 540
gagtcagtcc ccgacccaca acctctcgga gaacctccag caacccccgc tgctgtggga 600
cctactacaa tggcttcagg cggtggcgca ccaatggcag acaataacga aggcgccgac 660
ggagtgggta atgcctcagg aaattggcat tgcgattcca catggctggg cgacagagtc 720
atcaccacca gcacccgaac atgggccttg cccacctata acaaccacct ctacaagcaa 780
atctccagtg cttcaacggg ggccagcaac gacaaccact acttcggcta cagcaccccc 840
tgggggtatt ttgatttcaa cagattccac tgccatttct caccacgtga ctggcagcga 900
ctcatcaaca acaatttggg atcccggccc aagagactca acttcaagct cttcatcatc 960
caagtcaagg aggtcacgac gaatgatggc gtcacgacca tcgctaataa ccttaccagc 1020
acggttcaag tcttctcgga ctcggagtac cagttgccgt acgtcctcgg ctctgcgcac 1080
cagggctgcc tccctccgtt cccggcggac gtgttcatga ttccgcagta cggctaccta 1140
acgctcaaca atggcagcca ggcagtggga cggtcatcct tttactgcct ggaatatttc 1200
ccatcgcaga tgctgagaac gggcaataac tttaccttca gctacacctt cgaggacgtg 1260
cctttccaca gcagctacgc gcacagccag agcctggacc ggctgatgaa tcctctcatc 1320
gaccagtacc tgtattacct gaacagaact cagaatcagt ccggaagtgc ccaaaacaag 1380
gacttgctgt ttagccgggg gtctccagct ggcatgtctg ttcagcccaa aaactggcta 1440
cctggaccct gttaccggca gcagcgcgtt tctaaaacaa aaacagacaa caacaacagc 1500
aactttacct ggactggtgc ttcaaaatat aaccttaatg ggcgtgaatc tataatcaac 1560
cctggcactg ctatggcctc acacaaagac gacaaagaca agttctttcc catgagcggt 1620
gtcatgattt ttggaaagga gagcgccgga gcttcaaaca ctgcattgga caatgtcatg 1680
atcacagacg aagaggaaat caaagccact aaccccgtgg ccaccgaaag atttgggact 1740
gtggcagtca atctccagag cagcagcaca gaccctgcga ccggagatgt gcatgttatg 1800
ggagccttac ctggaatggt gtggcaagac agagacgtat acctgcaggg tcctatttgg 1860
gccaaaattc ctcacacgga tggacacttt cacccgtctc ctctcatggg cggctttgga 1920
cttaagcacc cgcctcctca gatcctcatc aaaaacacgc ctgttcctgc gaatcctccg 1980
gcagagtttt cggctacaaa gtttgcttca ttcatcaccc agtattccac aggacaagtg 2040
agcgtggaga ttgaatggga gctgcagaaa gaaaacagca aacgctggaa tcccgaagtg 2100
cagtatacat ctaactatgc aaaatctgcc aacgttgatt tcactgtgga caacaatgga 2160
ctttatactg agcctcgccc cattggcacc cgttacctca cccgtcccct gtaa 2214
<210> 11
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 11
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg cgctgaaacc tggagccccg aaacccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggacgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aggcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaaaaaga ggcttcttga acctcttggt ctggttgagg aagcggctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcgcca caagagccag actcctcctc gggcattggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaactttg ggcagactgg cgactcagag 540
tcagtgcccg accctcaacc aatcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcacca atggcggaca ataacgaagg cgccgatgga 660
gtgggtaatt cctcgggaaa ttggcattgc gattccacat ggctgggcga cagagtcatc 720
accaccagca cccgaacctg ggccctgccc acctacaaca atcacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg atttcaacag attccactgc cacttttcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcccaag agactcaact tcaagctctt caacatccag 960
gtcaaggagg tcacgcagaa tgaaggcacc aagaccatcg ccaataacct caccagcacc 1020
atccaggtgt ttacggactc ggagtaccag ctgccgtacg ttctcggctc cgcccaccag 1080
ggctgcctgc ctccgttccc ggcggacgtg ttcatgattc cgcagtacgg ctacctaacg 1140
ctcaacaatg gcagccaggc agtgggacgg tcatcctttt actgcctgga atatttccca 1200
tcgcagatgc tgagaacggg caacaacttt accttcagct acacctttga ggacgttcct 1260
ttccacagca gctacgctca cagccagagt ctggaccgtc tcatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgatc cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 12
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 12
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg cgctgaaacc tggagccccg aagcccaaag ccaaccagca agagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggagagc ccgtcaacgc ggcggatgca gcggccctcg agcacgacaa agcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaaga gggttctcga accttttggt ctggttgagg aaggtgctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcgcca caagagccag actcctcctc gggcattggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagttccag accctcaacc tctcggagaa cctccagcag cgccctctgg tgtgggacct 600
aatacaatgg ctgcaggcgg tggcgcacca atggcagaca ataacgaagg cgccgacgga 660
gtgggtagtt cctcgggaaa ttggcattgc gattccacat ggctgggcga cagagtcatc 720
accaccagca cccgaacctg ggccctgccc acctacaaca accacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg actttaacag attccactgc cacttttcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcccaag agactcaact tcaagctctt caacatccag 960
gtcaaggagg tcacgcagaa tgaaggcacc aagaccatcg ccaataacct taccagcacg 1020
attcaggtct ttacggattc ggaataccag ctcccgtacg tcctcggctc tgcgcaccag 1080
ggctgcctcc ctccgttccc ggcggacgtg ttcatgattc cgcagtacgg ctacctaacg 1140
ctcaacaatg gtagccaggc agtgggacgg tcatcctttt tctgcctgga atatttccca 1200
tcgcagatgc tgagaacggg caacaacttt accttcagct acacctttga ggacgttcct 1260
ttccacagca gctacgctca cagccagagt ctggaccgtc tcatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccga gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 13
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 13
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg acttgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggacgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaagc gggttctcga acctctcggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcacca caagagccag actcctcctc gggcatcggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg acccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcacca atggcggaca ataacgaagg cgccgacgga 660
gtgggtaatg cctcaggaaa ttggcattgc gattccacat ggctgggcga cagagtcatc 720
accaccagca cccgaacatg ggccttgccc acctataaca accacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg atttcaacag attccactgc catttctcac cacgtgactg gcagcgactc 900
atcaacaaca attggggatt ccggcccaag agactcaact tcaagctctt caacatccaa 960
gtcaaggagg tcacgacgaa tgatggcgtc acgaccatcg ctaataacct taccagcacg 1020
gttcaagtct tctcggactc ggagtaccag ttgccgtacg tcctcggctc tgcgcaccag 1080
ggctgcctcc ctccgttccc ggcggacgtg ttcatgattc cgcagtacgg ctacctaacg 1140
ctcaacaatg gcagccaggc agtgggacgg tcatcctttt actgcctgga atatttccca 1200
tcgcagatgc tgagaacggg caataacttt accttcagct acaccttcga ggacgtgcct 1260
ttccacagca gctacgcgca cagccagagc ctggaccggc tgatgaatcc tctcatcgac 1320
cagtacctgt attacctgaa cagaactcag aatcagtccg gaagtgccca aaacaaggac 1380
ttgctgttta gccgggggtc tccagctggc atgtctgttc agcccaaaaa ctggctacct 1440
ggaccctgtt accggcagca gcgcgtttct aaaacaaaaa cagacaacaa caacagcaac 1500
tttacctgga caggtgcttc aaaatataac cttaatgggc gtgaatctat aatcaaccct 1560
ggcactgcta tggcctcaca caaagacgac aaagacaagt tctttcccat gagcggtgtc 1620
atgatttttg gaaaggagag cgccggagct tcaaacactg cattggacaa tgtcatgatc 1680
acagacgaag aggaaatcaa agccactaac cccgtggcca ccgaaagatt tgggactgtg 1740
gcagtcaatc tccagaacag cagcacagac cctgcgaccg gagatgtgca tgttatggga 1800
gccttacctg gaatggtgtg gcaagacaga gacgtatacc tgcagggtcc tatttgggcc 1860
aaaattcctc acacggatgg acactttcac ccgtctcctc tcatgggcgg ctttggactt 1920
aagcacccgc ctcctcagat cctcatcaaa aacacgcctg ttcctgcgaa tcctccggca 1980
gagttttcgg ctacaaagtt tgcttcattc atcacccagt attccacagg acaagtgagc 2040
gtggagattg aatgggagct gcagaaagaa aacagcaaac gctggaatcc cgaagtgcag 2100
tatacatcta actatgcaaa atctgccaac gttgatttca ctgtagacaa caatggactt 2160
tatactgtgc ctcgccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 14
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 14
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg cgctgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aaaggagagc cggtcaacgc ggcggacgcg gcggccctcg aacacgacaa ggcttacgac 240
cagcagctca aggcgggtga caacccctac ctgcggtata accacgccga cgccgagttc 300
caggagcggc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaaaaaga ggcttcttga acctcttggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaga ggcctgtaga gcagtctcct caagaaccgg actcctcctc gggtattggc 480
aaaacaggtg agcagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg acccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcacca atggcagaca ataacgaagg cgccgacgga 660
gtgggtagtg cctcaggaaa ttggcattgc gattccacat ggctgggcga cagagtcatc 720
accaccagca cccgaacctg ggccctgccc acctataaca accatctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg acttcaacag attccactgc cacttctcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcctaag cgactcaact tcaagctctt caacattcag 960
gtcaaagagg ttacggacaa caatggagtc aagaccatcg ccaataacct caccagcacc 1020
atccaggtgt tcacggactc agagtatcag ctgccgtacg tgctcgggtc ggctcaccag 1080
ggctgcctcc ctccgttccc agcggacgtg ttcatgattc ctcagtacgg gtatctgaca 1140
ctcaacaacg gcagtcaggc agtgggacgg tcatccttct actgcctgga atattttcca 1200
tcgcagatgc tgagaaccgg caacaacttt ccgttcagtt acaccttcga ggacgtgcct 1260
ttccacagca gctacgcgca cagccagagc ctggaccggc tgatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 15
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 15
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg cgctgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggacgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaagc gggttctcga acctctcggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaac gtccggtaga acagtcgcca caagagccag actcctcctc gggcatcggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg atccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcacca atggcagaca ataacgaagg cgccgacgga 660
gtgggtagtt cctcgggaaa ttggcattgc gattcccaat ggctggggga cagagtcatc 720
accaccagca cccgaacctg ggccctgccc acctacaaca accacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg atttcaacag attccactgc catttctcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcctaag cgactcaact tcaagctctt caacattcag 960
gtcaaagagg ttacggacaa caatggagtc aagaccatcg ccaataacct taccagcacg 1020
gtccaggtct tcacggactc ggagtaccag ttgccgtacg tcctcggctc tgcgcaccag 1080
gactgcctcc ctccgttccc ggcggacgtg ttcatgattc cgcagtacgg ctacctaacg 1140
ctcaacaatg gcagccaggc agtgggacgg tcatcctttt actgcctgga atatttccca 1200
tcgcagatgc tgagaacggg caacaacttt accttcagct acacctttga ggacgttcct 1260
ttccacagca gctacgctca cagccagagt ctggaccgtc tcatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg gacaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 16
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 16
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg acttgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggacgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaagc gggttctcga acctctcggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcacca caagagccag actcctcctc gggcatcggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg acccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcacca atggcagaca ataacgaagg tgccgacgga 660
gtgggtaatg cctcaggaaa ttggcattgc gattccacat ggctgggcga ctgagtcatc 720
accaccagca cccgcacctg ggccttgccc acctacaata accacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg atttcaacag attccactgc cacttttcac cacgtgactg gcagcgactc 900
atcaacaaca attggggatt ccggcccaag agactcaact tcaaactctt caacatccaa 960
gtcaaggagg tcacgcagaa tgaaggcacc aagaccatcg ccaataacct caccagcacc 1020
atccaggtgt ttacggactc ggagtaccag ctgccgtacg ttctcggctc tgcccaccag 1080
ggctgcctgc ctccgttccc ggcggacgtg ttcatgattc cccagtacgg ctacctaacg 1140
ctcaacaatg gcagccaggc agtgggacgg tcatcctttt actgcctgga atactttcct 1200
tcgcagatgc tgagaaccgg caacaacttc cagtttactt acaccttcga ggacgtgcct 1260
ttccacagca gctacgccca cagccagagc ttggaccggc tgatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatactc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 17
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 17
atggctgccg atggttatct tccagattgg ctcgaggaca ctctctctga aggaataaga 60
cagtggtgga agctcaaacc tggcccacca ccaccaaagc ccgcagagcg gcataaggac 120
gacagcaggg gtcttgtgct tcctgggtac aagtacctcg gacccttcaa cggactcgac 180
aagggagagc cggtcaacga ggcagacgcc gcggccctcg agcacgacaa agcctacgac 240
cggcagctcg acagcggaga caacccgtac ctcaagtaca accacgccga cgcggagttt 300
caggagcgcc ttaaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaaga gggttctcga accttttggt ctggttgagg aaggtgctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcgcca caagagccag actcctcctc gggcattggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg acccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcacca atggcagaca ataacgaagg cgccgacgga 660
gtgggtaatg cctcaggaaa ttggcattgc gattccacat ggctgggcga cagagtcatc 720
accaccagca cccgaacatg ggccttgccc acctataaca accacctcta caagcaaatc 780
tccagtactt caacgggggc cagtaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg acttcaacag attccactgc cacttctcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcctaag cgactcaact tcaagctctt caacattcag 960
gtcaaagagg ttacggacaa caatggagtc aagaccatcg ccaataacct taccagcacg 1020
gtccaggtct tcacggactc ggagtaccag ttgccgtacg tcctcggctc tgcgcaccag 1080
ggctgcctgc ctccgttccc ggcggacgtg ttcatgattc cgcagtacgg ctacctaacg 1140
ctcaacaatg gcagccaggc agtgggacgg tcatcctttt actgcctgga atatttccca 1200
tcgcagatgc tgagaacggg caacaacttt accttcagct acacttttga ggacgttcct 1260
ttccacagca gctacgctca cagccagagt ctggaccgtc tcatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg gacaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 18
<211> 2208
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 18
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg acttgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggatgca gcggccctcg agcacgacaa ggcctacgac 240
cggcagctcg acagcggaga caacccgtac ctgcggtata accacgccga cgcggagttt 300
caggagcgcc ttaaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaaga gggttctcga accttttggt ctggttgagg aaggtgctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcgcca caagagccag actcctcctc gggcattggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg acccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcacca atggcagaca ataacgaagg cgccgacgga 660
gtgggtaatg cctcaggaaa ttggcattgc gattccacat ggctgggcga cagagtcatc 720
accaccagca cccgcacctg ggccttgccc acctacaata accacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg actttaacag attccactgc cacttttcac cacgtgactg gcaaagactc 900
atcaacaaca actggggatt ccggcccaag agactcaact tcaagctctt caacatccag 960
gtcaaggagg tcacgcagaa tgaaggcacc aagaccatcg ccaataacct taccagcacg 1020
attcaggtct ttacggactc ggaataccag ctcccgtacg tcctcggctc tgcgcaccag 1080
ggctgcctcc ctccgttccc ggcggacgtg ttcatgattc cgcagtacgg ctacctaaca 1140
ctcaacaacg gtagtcaggc cgtgggacgc tcctccttct actgcctgga atactttcct 1200
tcgcagatgc tgagaaccgg caacaacttc cagtttactt acaccttcga ggacgtgcct 1260
ttccacagca gctacgccca cagccagagc ttggaccggc tgatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcact ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aggagcgttt ttttccagta ccgggatcct 1620
gattttggca aacaaaatgc tgccagagac aatgcggatt acagcgatgt catgctcacc 1680
agcgaggaag aaatcaaaac cactaaccct gtggctacag aggaatacgg tatcgtggca 1740
gataacttgc agcagcaaaa cacggctcct caaattggaa ctgtcaacag ccagggggcc 1800
ttacccggta tggtctggca gaaccgggac gtgtacctgc agggtcccat ctgggccaag 1860
attcctcaca cggacggcaa cttccacccg tctccgctga tgggcggctt tggcctgaaa 1920
catcctccgc ctcagatcct gatcaagaac acgcctgtac ctgcggatcc tccgaccacc 1980
ttcaaccagt caaagctgaa ctctttcatc acgcaataca gcaccggaca ggtcagcgtg 2040
gaaattgaat gggagctgca gaaggaaaac agcaagcgct ggaaccccga gatccagtac 2100
acctccaact actacaaatc tacaagtgtg gactttgctg ttaatacaga aggcgtgtac 2160
tctgaacccc accccattgg cacccgttac ctcacccgtc ccctgtaa 2208
<210> 19
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 19
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg cgctgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggatgca gcagccctcg aacacgacaa agcttacgac 240
cagcagctca aggccggtga caacccctac ctcaagtata accacgccga cgccgagttt 300
caggagcgtc ttcaaggaga tacgtctttt gggggcaacc tcggacgagc agtcttccag 360
gccaagaagc gggttctcga acctcttggt ctggttgagg aagcggctaa gacggctcct 420
ggaaagaaga ggcctgtaga gcagtctcct caggaaccgg actcctccgc gggtattggc 480
aaatcgggtg cacagcccgc taaaaagaga ctcaatttcg gtcagactgg cgacacagag 540
tcagtcccag accctcaacc tctcggagaa cctccagcag cgccctctgg tgtgggacct 600
aatacaatgg ctgcaggcgg tggcgcacca atggcagaca ataacgaagg tgccgatgga 660
gtgggtagtt cctcgggaaa ttggcattgc gattcccaat ggctggggga cagagtcatc 720
accaccagca cccgaacctg ggccctgccc acctacaaca accacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccttgg 840
gggtattttg acttcaacag attccactgc cacttttcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcctaag cgactcaact tcaagctctt caacattcag 960
gtcaaagagg ttacggacaa caatggagtc aagaccatcg ccaataacct taccagcacg 1020
gtccaggtct tcacggactc agactatcag ctcccgtacg tgctcgggtc ggctcacgag 1080
ggctgcctcc ctccgttccc ggcggacgtg ttcatgattc cgcagtacgg ctacctaacg 1140
ctcaacaatg gcagccaggc agtgggacgg tcatcctttt actgcctgga atactttcct 1200
tcgcagatgc tgagaaccgg caacaacttc cagtttactt acaccttcga ggacgtgcct 1260
ttccacagca gctacgctca cagccagagt ctggaccgtc tcatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgta 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 20
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 20
atggctgccg atggttatct tccagattgg ctcgaggaca ctctctctga aggaataaga 60
cagtggtgga agctcaaacc tggcccacca ccaccaaagc ccgcagagcg gcataaggac 120
gacagcaggg gtcttgtgct tcctgggtac aagtacctcg gacccttcaa cggactcgac 180
aagggagagc cggtcaacga ggcagacgcc gcggccctcg agcacgacaa agcctacgac 240
cggcagctcg acagcggaga caacccgtac ctcaagtaca accacgccga cgcggagttt 300
caggagcgcc ttaaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaaga gggttctcga accttttggt ctggttgagg aagcggctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcgcca caagagccag actcctcctc gggcattggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg acccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcacca atggcagaca ataacgaagg cgccgacgga 660
gtgggtaatg cctcaggaaa ttggcattgc gattccacat ggctgggcga cagagtcatc 720
accaccagca cccgaacatg ggccttgccc acctataaca accacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg acttcaacag attccactgc cacttctcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcctaag cgactcaact tcaagctctt caacattcag 960
gtcaaagagg ttacggacaa caatggagtc aagaccatcg ccaataacct taccagcacg 1020
gtccaggtct tcacggactc agactatcag ctcccgtacg tgctcgggtc ggctcacgag 1080
ggctgcctcc cgccgttccc agcggacgtt ttcatgattc ctcagtacgg ctacctaaca 1140
ctcaacaacg gtagtcaggc cgtgggacgc tcctccttct actgcctgga atactttcct 1200
tcgcagatgc tgagaacggg caacaacttt accttcagct acacctttga ggacgttcct 1260
ttccacagca gctacgctca cagccagagt ctggaccgtc tcatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac aaaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatt 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggactt 1920
aagcacccgc ctcctcagat cctcatcaaa aacacgcctg ttcctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 21
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 21
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg cgctgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aaaggagagc cggtcaacgc ggcggacgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaagc gggttctcga acctctcggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcgcca caagagccag actcctcctc gggcatcggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg acccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcacca atggcagaca ataacgaagg cgccgacgga 660
gtgggtagtt cctcgggaaa ttggcattgc gattccacat ggctgggcga cagagtcatc 720
accaccagca cccgcacctg ggccttgccc acctacaata accacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg acttcaacag attccactgc cacttctcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcctaag cgactcaact tcaagctctt caacattcag 960
gtcaaagagg ttacggacaa caatggagtc aagaccatcg ccaataacct taccagcacg 1020
gtccaggtct tcacggactc ggagtaccag ttgccgtacg tcctcggctc tgcgcaccag 1080
ggctgcctcc ctccgttccc ggcggacgtg ttcatgattc cgcagtacgg ctacctaacg 1140
ctcaacaatg gcagccaggc agtgggacgg tcatcctttt actgcctgga atatttccca 1200
tcgcagatgc tgagaacggg caacaacttt accttcagct acacctttga ggacgttcct 1260
ttccacagca gctacgctca cagccagagt ctggaccgtc tcatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gatgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 22
<211> 2214
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 22
atggctgccg atggttatct tccagattgg ctcgaggaca accttagtga aggaattcgc 60
gagtggtggg cgctgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggacgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaagc gggttctcga acctctcggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcgcca caagagccag actcctcctc gggcatcggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaatttcg gtcagactgg cgacacagag 540
tcagtcccag accctcaacc aatcggagaa cctcccgcag ccccctcagg tgtgggatct 600
cttacaatgg cttcaggtgg tggcgcacca gtggcagaca ataacgaagg tgccgatgga 660
gtgggtagtt cctcgggaaa ttggcattgc gattcccaat ggctggggga cagagtcatc 720
accaccagca ccagaacctg ggccttgccc acctacaata accacctcta caagcaaatc 780
tccaacagca catctggagg atcttcaaat gacaacgcct acttcggcta cagcaccccc 840
tgggggtatt ttgactttaa cagattccac tgccactttt caccacgtga ctggcagcga 900
ctcatcaaca acaactgggg attccgaccc aagagactca acttcaagct cttcaacatc 960
caggtcaagg aggtcacgca gaacgaaggc accaagacca tcgccaataa cctcaccagc 1020
accatccagg tgtttacgga ctcggagtac cagctgccgt acgttctcgg ctccgcccac 1080
cagggctgcc tgcctccgtt cccggcggac gtgttcatga ttccccagta cggctaccta 1140
acgctcaaca acggtagtca ggccgtggga cgctcctcct tctactgcct ggaatacttt 1200
ccttcgcaga tgctgagaac cggcaacaac ttccagttta cttacacctt cgaggacgtg 1260
cctttccaca gcagctacgc gcacagccag agcttggacc ggctgatgaa tcctctgatt 1320
gaccagtacc tgtactactt gtctcggact caaacaacag gaggcacggc aaatacgcag 1380
actctgggct tcagccaagg tgggcctaat acaatggcca atcaggcaaa gaactggctg 1440
ccaggaccct gttaccgcca acaacgcgtc tcaacgacaa ccgggcaaaa caacaatagc 1500
aactttgcct ggactgctgg gaccaaatac catctgaatg gaagaaattc attggctaat 1560
cctggcatcg ctatggcaac acacaaagac gacaaggagc gtttttttcc cagtaacggg 1620
atcctgattt ttggcaaaca aaatgctgcc agagacaatg cggattacag cgatgtcatg 1680
ctcaccagcg aggaagaaat caaaaccact aaccctgtgg ctacagagga atacggtatc 1740
gtggcagata acttgcagca gcaaaacacg gctcctcaaa ttggaactgt caacagccag 1800
ggggccttac ccggtatggt ctggcagaac cgggacgtgt acctgcaggg tcccatctgg 1860
gccaagattc ctcacacgga cggcaacttc cacccgtctc cgctgatggg cggctttggc 1920
ctgaaacatc ctccgcctca gatcctgatc aagaacacgc ctgtacctgc ggatcctccg 1980
accaccttca accagtcaaa gctgaactct ttcatcacgc aatacagcac cggacaggtc 2040
agcgtggaaa ttgaatggga gctgcagaag gaaaacagca agcgctggaa ccccgagatc 2100
cagtacacct ccaactacta caaatctaca agtgtggact ttgctgttaa tacagaaggc 2160
gtgtactctg aaccccaccc cattggcact cgttacctca cccgtcccct gtaa 2214
<210> 23
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 23
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg cgctgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggatgca gcagccctcg aacacgacaa agcttacgac 240
cagcagctca aggccggtga caacccctac ctcaagtata accacgccga cgccgagttt 300
caggagcgtc ttcaaggaga tacgtctttt gggggcaacc tcggacgagc agtcttccag 360
gccaagaagc gggttctcga acctcttggt ctggttgagg aagcggctaa gacggctcct 420
ggaaagaaga ggcctgtaga gcagtctcct caggaaccgg actcctccgc gggtattggc 480
aaatcgggtg cacagcccgc taaaaagaga ctcaatttcg gtcagactgg cgacacagag 540
tcagtcccag accctcaacc tctcggagaa cctccagcag cgccctctgg tgtgggacct 600
aatacaatgg ctgcaggcgg tggcgcacca atggcagaca ataacgaagg tgccgatgga 660
gtgggtagtt cctcgggaaa ttggcattgc gattcccaat ggctggggga cagagtcatc 720
accaccagca cccgaacctg ggccctgccc acctacaaca accacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccttgg 840
gggtattttg acttcaacag attccactgc cacttctcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcctaag cgactcaact tcaagctctt caacattcag 960
gtcaaagagg ttacggacaa caatggagtc aagaccatcg ccaataacct taccagcacg 1020
gtccaggtct tcacggactc ggagtaccag ttgccgtacg tcctcggctc tgcgcaccag 1080
ggctgcctcc ctccgttccc ggcggacgtg ttcatgattc cgcagtacgg ctacctaacg 1140
ctcaacaatg gcagccaggc agtgggacgg tcatcctttt actgcctgga atatttccca 1200
tcgcagatgc tgagaacggg caacaacttt accttcagct acacctttga ggacgttcct 1260
ttccacagca gctacgctca cagccagagt ctggaccgtc tcatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg acaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gatgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 24
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 24
atggctgccg atggttatct tccagattgg ctcgaggaca ctctctctga aggaataaga 60
cagtggtgga agctcaaacc tggcccacca ccaccaaagc ccgcagagcg gcataaggac 120
gacagcaggg gtcttgtgct tcctgggtac aagtacctcg gacccttcaa cggactcgac 180
aagggagagc cggtcaacga ggcagacgcc gcggccctcg agcacgacaa agcctacgac 240
cggcagctcg acagcggaga caacccgtac ctcaagtaca accacgccga cgcggagttt 300
caggagcgcc ttaaagaaga tacgtctttt gggggcaacc tcggacgagc agtcttccag 360
gcgaaaaaga gggttcttga acctctgggc ctggttgagg aacctgttaa gacggctccg 420
ggaaaaaaga ggccggtaga gcactctcct gtggagccag actcctcctc gggaaccgga 480
aaggcgggcc agcagcctgc aagaaaaaga ttgaattttg gtcagactgg cgactcagag 540
tcagtccccg acccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
aatacgatgg ctacaggcag tggcgcacca atggcagaca ataacgaggg cgccgacgga 660
gtgggtaatt cctcgggaaa ttggcattgc gattccacat ggatgggcga cagagtcatc 720
accaccagca ccagaacctg ggccctgccc acttacaaca accatctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg acttcaacag attccactgc cacttctcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcctaag cgactcaact tcaagctctt caacattcag 960
gtcaaagagg ttacggacaa caatggagtc aagaccatcg ccaataacct taccagcacc 1020
atccaggtct ttacggactc ggaataccag ctgccgtacg ttctcggctc tgcccaccag 1080
ggctgcctgc ctccgttccc ggcggacgtg ttcatgattc cccagtacgg ctacctaaca 1140
ctcaacaacg gtagtcaggc cgtgggacgc tcctccttct actgcctgga atatttccca 1200
tcgcagatgc tgagaacggg caacaacttt accttcagct acacctttga ggacgttcct 1260
ttccacagca gctacgctca cagccagagt ctggaccgtc tcatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcaaggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 25
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 25
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg cgctgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggacgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaagc gggttctcga accttttggt ctggttgagg aaggtgctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcgcca caagagccag actcctcctc gggcatcggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg acccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcacca atggcggaca ataacgaagg cgccgacgga 660
gtgggtaatg cctcaggaaa ttggcattgc gattccacat ggctgggcga cagagtcatc 720
accaccagca cccgcacctg ggccttgccc acctacaata accacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg acttcaacag attccactgc cacttttcac cacgtgactg gcaaagactc 900
atcaacaaca actggggatt ccggcctaag cgactcaact tcaagctctt caacattcag 960
gtcaaagagg ttacggacaa caatggagtc aagaccatcg ccaataacct taccagcacg 1020
gtccaggtct tcacggactc ggagtaccag ttgccgtacg tcctcggctc tgcgcaccag 1080
ggctgcctcc ctccgttccc ggcggacgtg ttcatgattc cgcagtacgg ctacctaacg 1140
ctcaacaatg gcagccaggc agtgggacgg tcatcctttt actgcctgga atatttccca 1200
tcgcagatgc tgagaacggg caacaacttt accttcagct acacctttga ggacgttcct 1260
ttccacagca gctacgctca cagccagagt ctggaccgtc tcatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacgggaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 26
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 26
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg acttgaaacc tggagccccg aaacccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggacgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaagc gggttctcga acctctcggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaga ggcctgtaga gcagtcgcca caagagccag actcctcctc gggcatcggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg atccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcacca atggcagaca ataacgaagg cgccgacgga 660
gtgggtagtt cctcgggaaa ttggcattgc gattccacat ggctgggcga cagagtcatc 720
accaccagca cccgaacatg ggccttgccc acctataaca accacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg acttcaacag attccactgc cacttctcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcctaag cgactcaact tcaagctctt caacatccag 960
gtcaaggagg tcacgcagaa tgaaggcacc aagaccatcg ccaataacct caccagcacc 1020
atccaggtgt ttacggactc ggagtaccag cttccgtacg tcctcggctc tgcgcaccag 1080
ggctgcctcc ctccgttccc ggcggacgtg ttcatgattc cgcagtacgg ctacctaacg 1140
ctcaacaatg gcagccaggc agtgggacgg tcatcctttt actgcctgga atatttccca 1200
tcgcagatgc tgagaacggg caacaacttt accttcagct acacctttga ggacgttcct 1260
ttccacagca gctacgcgca cagccagagc ttggaccggc tgatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 27
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 27
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg cgctgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggatgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaagc gggttctcga acctctcggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcgcca caagagccag actcctcctc gggcatcggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg acccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg ctgcaggcgg tggcgcacca atggcagaca ataacgaagg cgccgacgga 660
gtgggtagtt cctcgggaaa ttggcattgc gattccacat ggatgggcga cagagtcatc 720
accaccagca cccgaacctg ggccttgccc acctataaca accatctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg acttcaacag attccactgc cacttctcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcccaag agactcagct tcaagctctt caacatccag 960
gtcaaggagg tcacgcagaa tgaaggcacc aagaccatcg ccaataacct caccagcacc 1020
atccaggtgt ttacggactc ggagtaccag ctgccgtacg tcctcggctc tgcgcaccag 1080
ggctgcctcc ctccgttccc ggcggacgtg ttcatgattc cgcagtacgg ctacctaacg 1140
ctcaacaatg gcagccaggc agtgggacgg tcatcctttt actgcctgga atatttccca 1200
tcgcagatgc tgagaacggg caacaacttt accttcagct acacctttga ggacgttcct 1260
ttccacagca gctacgctca cagccagagc ttggaccggc tgatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggtttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcaa 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaacctg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 28
<211> 2214
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 28
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg cgctgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggagagc ccgtcaacgc ggcggacgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaagc gggttctcga acctctcggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaga gaccggtaga gccatcaccc cagcgttctc cagactcctc ctcgggcatc 480
ggcaagacag gccagcagcc cgctaaaaag agactcaatt ttggtcagac tggcgactca 540
gagtcagtcc ccgacccaca acctctcgga gaacctccag caacccccgc tgctgtggga 600
cctactacaa tggcttcagg tggtggcgca ccaatggcag acaataacga aggcgccgac 660
ggagtgggta atgcctcagg aaattggcat tgcgattccc aatggctggg cgacagagtc 720
atcaccacca gcacccgaac atgggccttg cccacctata acaaccacct ctacaagcaa 780
atctccagtg cttcaacggg ggccagcaac gacaaccact acttcggcta cagcaccccc 840
tgggggtatt ttgacttcaa cagattccac tgccactttt caccacgtga ctggcagcga 900
ctcatcaaca acaactgggg attccggcct aagcgactca acttcaagct cttcaacatt 960
caggtcaaag aggttacgga caacaatgga gtcaagacca tcgccaataa ccttaccagc 1020
acggtccagg tcttcacgga ctcagactat cagctcccgt acgtgctcgg gtcggctcac 1080
gagggctgcc tcccgccgtt cccagcggac gttttcatga ttccccagta cggctaccta 1140
acactcaaca acggtagtca ggccgtggga cgctcctcct tctactgcct ggaatacttt 1200
ccttcgcaga tgctgagaac cggcaacaac ttccagttta cttacacctt cgaggacgtg 1260
cctttccaca gcagctacgc tcacagccag agcttggacc ggctgatgaa tcctctgatt 1320
gaccagtacc tgtactactt gtctcggact caaacaacag gaggcacggc aaatacgcag 1380
actttgggct tcagccaagg tgggcctaat acaatggcca atcaggcaaa gaactgggtg 1440
ccaggaccct gttaccgcca acaacgggtt tcaacggcaa ccgggcaaaa caacaatagc 1500
aactttgcct ggactgctgg gaccaaatac catctgaaag gaagaaattc attggctaat 1560
cctggcatcg ctatggcaac acacaaagac gacaaggagc gtttttttcc cagtaacggg 1620
atcctgattt ttggcaaaca aaatgctgcc agagacaatg cggattacag cgatgtcatg 1680
ctcaccagcg aggaagaaat caaaaccact aaccctgtgg ctacagagga atacggtatc 1740
gtggcagata acttgcagca gcaaaacacg gctcctcaaa ttggaactgt caacagccag 1800
ggggccttac ccggtatggt ctggcagaac cgggacgtgt acctgcaggg tcccatctgg 1860
gccaagattc ctcacacgga cggcaacttc cacccgtctc cgctgatggg cggctttggc 1920
ctgaaacatc ctccgcctca gatcctgatc aagaacacgc ctgtacctgc ggatcctccg 1980
accaccttca accagtcaaa gctgaactct ttcatcacgc aatacagcac cggacaggtc 2040
agcgtggaaa ttgaatggga gctgcagaag gaaaacagca aacgctggaa cccagagatt 2100
caatacactt ccaactacta caaatctaca agtgtggact ttgctgttaa tacagaaggc 2160
gtgtactctg aaccccaccc cattggcacc cgttacctca cccgtcccct gtaa 2214
<210> 29
<211> 2214
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<220>
<221> неопределенный признак
<222> (676)..(676)
<223> n представляет собой a, c, g или t
<220>
<221> неопределенный признак
<222> (697)..(697)
<223> n представляет собой a, c, g или t
<220>
<221> неопределенный признак
<222> (715)..(715)
<223> n представляет собой a, c, g или t
<220>
<221> неопределенный признак
<222> (748)..(748)
<223> n представляет собой a, c, g или t
<220>
<221> неопределенный признак
<222> (750)..(750)
<223> n представляет собой a, c, g или t
<220>
<221> неопределенный признак
<222> (757)..(757)
<223> n представляет собой a, c, g или t
<220>
<221> неопределенный признак
<222> (763)..(763)
<223> n представляет собой a, c, g или t
<400> 29
atggctgccg atggttatct tccagattgg ctcgaggaca ctctctctga aggaataaga 60
cagtggtgga agctcaaacc tggcccacca ccaccaaagc ccgcagagcg gcataaggac 120
gacagcaggg gtcttgtgct tcctgggtac aagtacctcg gacccttcaa cggactcgac 180
aagggagagc cggtcaacga ggcagacgcc gcggccctcg agcacgacaa agcctacgac 240
cggcagctcg acagcggaga caacccgtac ctcaagtaca accacgccga cgcggagttt 300
caggagcgcc ttaaagaaga tacgtctttt gggggcaacc tcggacgagc agtcttccag 360
gcgaaaaaga gggttcttga acctctcggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcgcca caagagccag actcctcctc gggcatcggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg acccacaacc tctcggagaa cctccagcaa cgccctctgg tgtgggacct 600
aatacaatgg ctgcaggcgg tggcgctcca atggcagaca ataacgaagg cgccgacgga 660
gtgggtagtt cctcangaaa ttggcattgc gattccncat ggctgggcga cagantcatc 720
accaccagca cccgaacctg ggccctgncn acctacnaca acnacctcta caagcaaatc 780
tccaacagca catctggagg agccaccaac gacaacacct acttcggcta cagcaccccc 840
tgggggtatt ttgactttaa cagattccac tgccactttt caccacgtga ctggcagcga 900
ctcatcaaca acaactgggg attccggcct aagcgactca acttcaagct cttcaacatc 960
caggtcaagg aggtcacgca gaatgaaggc accaagacca tcgccaataa cctcaccagc 1020
accatccagg tgtttacgga ctcggagtac cagctgccgt acgttctcgg ctctgcccac 1080
cagggctgcc tgcctccgtt cccggcggac gtgttcatga ttccccagta cggctaccta 1140
acactcaaca acggtagtca ggccgtggga cgctcctcct tctactgcct ggaatacttt 1200
ccttcgcaga tgctgagaac cggcaacaac ttccagttta cttacacctt cgaggacgtg 1260
cctttccaca gcagctacgc ccacagccag agcttggacc ggctgatgaa tcctctgatt 1320
gaccagtacc tgtactactt gtctcggact caaacaacag gaggcacggc aaatacgcag 1380
actctgggct tcagccaagg tgggcctaat acaatggcca atcaggcaaa gaactggctg 1440
ccaggaccct gttaccgcca acaacgcgtc tcaacgacaa ccgggcaaaa caacaatagc 1500
aactttgcct ggactgctgg gaccaaatac catctgaatg gaagaaattc attggctaat 1560
cctggcatcg ctatggcaac acacaaagac gacaaggagc gtttttttcc cagtaacggg 1620
atcctgattt ttggcaaaca aaatgctgcc agagacaatg cggattacag cgatgtcatg 1680
ctcaccagcg aggaagaaat caaaaccact aaccctgtgg ctacagagga atacggtatc 1740
gtggcagata acttgcagca gcaaaacacg gctcctcaaa ttggaactgt caacagccag 1800
ggggccttac ccggtatggt ttggcagaac cgggacgtgt acctgcaggg tcctatctgg 1860
gccaagattc ctcacacgga cggaaacttt catccctcgc cgctgatggg aggctttgga 1920
ctgaaacacc cgcctcctca gatcctgatt aagaatacac ctgttcccgc ggatcctcca 1980
actaccttca gtcaagctaa gctggcgtcg ttcatcacgc aatacagcac aggacaagtg 2040
agtgtggaaa ttgaatggga gctgcagaaa gaaaacagca agcgctggaa tcccgaagtg 2100
cagtacacat ccaattatgc aaaatctgcc aacgttgatt ttactgtgga caacaatgga 2160
ctttatactg agcctcgccc cattggcacc cgttacctta cccgtcccct gtaa 2214
<210> 30
<211> 2214
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 30
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg acttgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggacgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaagc gggttctcga acctctcggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaga gaccggtaga gccatcaccc cagcgttctc cagactcctc tacgggcatc 480
ggcaagaaag gccagcagcc cgcgaaaaag agactcaact ttgggcagac tggcgactca 540
gagtcagtgc ccgaccctca accaatcgga gaaccccccg caggcccctc tggtgtggga 600
tctcttacaa tggcttcagg tggtggcgca ccagtggcag acaataacga aggtgccgat 660
ggagtgggta gttcctcggg aaattggcat tgcgattccc aatggctggg ggacagagtc 720
atcaccacca gcacccgaac atgggccttg cccacctata acaaccacct ctacaagcaa 780
atctccagtg cttcaacggg ggccagcaac gacaaccact acttcggcta cagcaccccc 840
tgggggtatt ttgactttaa cagattccac tgccacttct caccacgtga ctggcagcga 900
ctcatcaaca acaactgggg attccggccc aagagactca acttcaagct cttcaacatc 960
caggtcaagg aggtcacgga caatgatgga gtcaagacca tcgccaataa ccttaccagc 1020
acgattcagg tctttacgga ctcggaatac cagttgccgt acgtcctcgg ctctgcgcac 1080
cagggctgcc tgcctccgtt cccggcggac gtgttcatga ttccgcagta cggctaccta 1140
acgctcaaca atggcagcca ggcagtggga cggtcatcct tttactgcct ggaatatttc 1200
ccatcgcaga tgctgagaac gggcaacaac tttaccttca gctacacttt tgaggacgtt 1260
cctttccaca gcagctacgc tcacagccag agtctggacc gtctcatgaa tcctctgatt 1320
gaccagtacc tgtactactt gtctcggact caaacaacag gaggcacggc aaatacgcag 1380
actctgggct tcagccaagg tgggcctaat acaatggcca atcacgcaaa gaactggctg 1440
ccaggaccct gttaccgcca acaacgcgtc tcaacgacaa ccggacaaaa caacaatagc 1500
aactttgcct ggactgctgg gaccaaatac catctgaatg gaagaaattc attggctaat 1560
cctggcatcg ctatggcaac acacaaagac gacaaggagc gtttttttcc cagtaacggg 1620
atcctgattt ttggcaaaca aaatgctgcc agagacaatg cggattacag cgatgtcatg 1680
ctcaccagcg aggaagaaat caaaaccact aaccctgtgg ctacagagga atacggtatc 1740
gtggcagata acttgcagca gcaaaacacg gctcctcaaa ttggaactgt caacagccag 1800
ggggccttac ccggtatggt ctggcagaac cgggacgtgt acctgcaggg tcccatctgg 1860
gccaagattc ctcacacgga cggcaacttc cacccgtctc cgctgatggg cggctttggc 1920
ctgaaacatc ctccgcctca gatcctgatc aagaacacgc ctgtacctgc ggatcctccg 1980
accaccttca accagtcaaa gctgaactct ttcatcacgc aatacagcac cggacaggtc 2040
agcgtggaaa ttgaatggga gctgcagaag gaaaacagca agcgctggaa ccccgagatc 2100
cagtacacct ccaactacta caaatctaca agtgtggact ttgctgttaa tacagaaggc 2160
gtgtactctg aaccccaccc cattggcacc cgttacctca cccgtcccct gtaa 2214
<210> 31
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 31
atggctgccg atggttatct tccagattgg ctcgaggaca ctctctctga aggaataaga 60
cagtggtgga agctcaaacc tggcccacca ccaccaaagc ccgcagagcg gcacaaggac 120
gacagcaggg gtcttgtgct tcctgggtac aagtacctcg gacccttcaa cggactcgac 180
aagggagagc cggtcaacga ggcagacgcc gcggccctcg agcacgacaa agcctacgac 240
cggcagctcg acagcggaga caacccgtac ctcaagtaca accacgccga cgcggagttt 300
caggagcgcc ttaaagaaga tacgtctttt gggggcaacc tcggacgagc agtcttccag 360
gcgaaaaaga gggttcttga acctctgggc ctggttgagg aacctgttaa gacggctccg 420
ggaaaaaaga ggccggtaga gcactctcct gtggagccag actcctcctc gggaaccgga 480
aaggcgggcc agcagcctgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg acccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggtgg tggcgcacca atggcagaca ataacgaagg cgccgacgga 660
gtgggtaatg cctcaggaaa ttggcattgc gattccacat ggctgggcga cagagtcatc 720
accaccagca cccgcacctg ggccttgccc acctacaata accacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg acttcaacag attccactgc cacttctcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcccaag agactcaact tcaaactctt caacatccaa 960
gtcaaggagg tcacgcagaa tgaaggcacc aagaccatcg ccaataacct caccagcacc 1020
atccaggtgt ttacggactc ggagtaccag ctgccgtacg ttctcggctc tgcccaccag 1080
ggctgcctgc ctccgttccc ggcggacgtg ttcatgattc cccagtacgg ctacctaaca 1140
ctcaacaacg gtagtcaggc cgtgggacgc tcctccttct actgcctgga atactttcct 1200
tcgcagatgc tgagaaccgg caacaacttc cagtttactt acaccttcga ggacgtgcct 1260
ttccacagca gctacgcgca cagccagagc ttggaccggc tgatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 32
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 32
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg cgctgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggatgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctcc aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc ttcaaggaga tacgtctttt gggggcaacc tcggacgagc agtcttccag 360
gccaagaagc gggttctcga acctctcggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcgcca caagagccag actcctcctc gggcatcggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg acccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcacca atggcggaca ataacgaagg cgccgatgga 660
gtgggtaatg cctcaggaaa ttggcattgc gattccacat ggctgggcga cagagtcatc 720
accaccagca cccgcacctg ggccttgccc acctacaata accacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg acttcaacag attccactgc cacttctcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcctaag cgactcaact tcaagctctt caacattcag 960
gtcaaagagg ttacggacaa caatggagtc aagaccatcg ccaataacct caccagcacc 1020
atccaggtgt ttacggactc ggagtaccag ctgccgtacg ttctcggctc tgcccaccag 1080
ggctgcctgc ctccgttccc ggcggacgtg ttcatgattc cccagtacgg ctacctaaca 1140
ctcaacaacg gtagtcaggc cgtgggacgc tcctccttct actgcctgga atactttcct 1200
tcgcagatgc tgagaaccgg caacaacttc cagtttactt acaccttcga ggacgtgcct 1260
ttccacagca gctacgccca cagccagagc ttggaccggc tgatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 33
<211> 2217
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 33
atggctgccg atggttatct tccagattgg ctcgaggaca ctctctctga aggaataaga 60
cagtggtgga agctcaaacc tggcccacca ccaccaaagc ccgcagagcg gcataaggac 120
gacagcaggg gtcttgtgct tcctgggtac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggatgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgcggagttt 300
caggagcgcc ttaaagaaga tacgtctttt gggggcaacc tcggacgagc agtcttccag 360
gcgaaaaaga gggttcttga acctctcggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaga gaccggtaga gccatcaccc cagcgttctc cagactcctc tacgggcatc 480
ggcaagaaag gccaacagcc cgccagaaaa agactcaatt ttggtcagac tggcgactca 540
gagtcagttc cagaccctca acctctcgga gaacctccag cagcgccctc tggtgtggga 600
cctaatacaa tggctgcagg cggtggcgca ccaatggcag acaataacga aggcgccgac 660
ggagtgggta gttcctcggg aaattggcat tgcgattccc aatggctggg ggacagagtc 720
atcaccacca gcaccagaac ctgggccctg cccacctaca acaatcacct ctacaagcaa 780
atctccaaca gcacatctgg aggatcttca aatgacaacg cctacttcgg ctacagcacc 840
ccctgggggt attttgactt caaccgcttc cactgccact tctcaccacg tgactggcag 900
cgactcatca acaacaactg gggattccgg cccaagagac tcaacttcaa gctcttcaac 960
attcaggtca aagaggttac ggacaacaat ggagtcaaga ccatcgccaa taaccttacc 1020
agcacggtcc aggtctttac ggactcggag taccagttgc cgtacgtcct cggctctgcg 1080
caccagggct gcctccctcc gttcccggcg gacgtgttca tgattcccca gtacggctac 1140
ctaacactca acaacggtag tcaggccgtg ggacgctcct ccttctactg cctggaatat 1200
ttcccttctc agatgctgag aacgggcaac aactttacct tcagctacac ctttgaggac 1260
gttcctttcc acagcagcta cgctcacagc cagagtctgg accgtctcat gaatcctctg 1320
attgaccagt acctgtacta cttgtctcgg actcaaacaa caggaggcac ggcaaatacg 1380
cagactctgg gcttcagcca aggtgggcct aatacaatgg ccaatcaggc aaagaactgg 1440
ctgccaggac cctgttaccg ccaacaacgc gtctcaacga caaccgggca aaacaacaat 1500
agcaactttg cctggactgc tgggaccaaa taccatctga atggaagaaa ttcattggct 1560
aatcctggca tcgctatggc aacacacaaa gacgacaagg agcgtttttt tcccagtaac 1620
gggatcctga tttttggcaa acaaaatgct gccagagaca atgcggatta cagcgatgtc 1680
atgctcacca gcgaggaaga aatcaaaacc actaaccctg tggctacaga ggaatacggt 1740
atcgtggcag ataacttgca gcagcaaaac acggctcctc aaattggaac tgtcaacagc 1800
cagggggcct tacccggtat ggtctggcag aaccgggacg tgtacctgca gggtcccatc 1860
tgggcaaaga ttccacacac ggacggacat tttcacccct ctcccctcat gggtggattc 1920
ggacttaaac accctcctcc acagattctc atcaagaaca ccccggtacc tgcgaatcct 1980
ccgaccacct tcaaccagtc aaagctgaac tctttcatca cgcaatacag cacaggacaa 2040
gtgagtgtgg aaattgaatg ggagctgcag aaagaaaaca gcaagcgctg gaatcccgaa 2100
gtgcagtaca catccaatta tgcaaaatct gccaacgttg attttactgt ggacaacaat 2160
ggactttata ctgagcctcg ccccattggc acccgttacc ttacccgtcc cctgtaa 2217
<210> 34
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 34
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg cgctgaaacc tggagccccg aaacccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggacgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aggcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaaaaaga ggcttcttga acctcttggt ctggttgagg aaggggctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcgcca caagagccag actcctcctc gggcattggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaactttg ggcagactgg cgactcagag 540
tcagtgcccg atcctcaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcacca atggcggaca ataacgaagg cgccgatgga 660
gtgggtaatt cctcgggaaa ttggcattgc gattccacat ggatgggcga cagagtcatc 720
accaccagca cccgaacctg ggccctgccc acctacaaca atcacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg atttcaacag attccactgc catttttcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcccaag agactcaact tcaagctctt caacatccag 960
gtcaaggagg tcacgcagaa tgaaggcacc aagaccatcg ccaataacct taccagcacg 1020
attcaggtct ttacggattc ggaataccag ctcccgtacg tcctcggctc tgcgcaccag 1080
ggctgcctcc ctccgttccc ggcggacgtg ttcattattc cgcagtacgg ctacctaacg 1140
ctcaacaatg gtagccaggc agtgggacgg tcatcctttt actgcctgga atatttccca 1200
tcgcagatgc tgagaacggg caacaacttt accttcagct acacctttga ggacgttcct 1260
ttccacagca gctacgctca cagccagagt ctggaccgtc tcatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgccag tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 35
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 35
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg cgctgaaacc tggagccccg aaacccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggatgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aggcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaaaaaga gggttcttga accttttggt ctggttgagg aagctgctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcgcca caagagccag actcctcctc gggcattggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtgcccg accctcaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcacca atggcagaca ataacgaagg cgccgatgga 660
gtgggtaatg cctcaggaaa ttggcattgc gattccacat ggctgggcga cagagtcatc 720
accaccagca cccgaacctg ggccctgccc acctacaaca atcacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg actttaacag attccactgc cacttttcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcccaag agactcaact tcaagctctt caacatccag 960
gtcaaggagg tcacgcagaa tgaaggcacc aagaccatcg ccaataacct caccagcacc 1020
attcaggtct ttacggattc ggaataccag ctcccgtacg tcctcggctc tgcccaccag 1080
ggctgcctcc ctccgttccc ggcggacgtg ttcatgattc cgcagtacgg ctacctaacg 1140
ctcaacaatg gtagccaggc agtgggacgg tcatcctttt actgcctgga atatttccca 1200
tcgcagatgc tgagaacggg caacaacttt accttcagct acacctttga ggacgttcct 1260
ttccacagca gctacgctca cagccagagt ctggaccgtc tcatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc acgcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 36
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 36
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg cgctgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aaaggagagc ccgtcaacga ggcggacgcg gcggccctcg aacacgacaa ggcttacgac 240
cagcagctca aggccggtga caacccctac ctgcggtaca accacgccga cgccgagttc 300
caggagcggc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaaga ggcttcttga acctcttggt ctggttgagg aagcggctaa gacggctcct 420
ggaaagaaga ggcctgtaga gcagtctcct caggaaccgg actcctccgc gggtattggc 480
aaatcaggtg cacagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg acccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcacca atggcagaca ataacgaagg cgccgatgga 660
gtgggtaatg cctcaggaaa ttggcattgc gattccacat ggctgggcga cagagtcatc 720
accaccagca cccgaacctg ggccctgccc acctataaca accatctcta caagcaaatc 780
tccagtgctt caacgggggc cagtaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg actttaacag attccactgc cacttctcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcccaag cgactcaact tcaagctctt caacattcag 960
gtcaaagagg ttacggacaa cgatggagtc aagaccatcg ccaataacct taccagcacc 1020
attcaggtgt ttacggactc ggaataccag ctgccgtacg ttctcggctc cgcccaccag 1080
ggctgcctgc ctccgttccc ggcggacgtg ttcatgattc cccagtacgg ctacctaaca 1140
ctcaacaacg gtagtcaggc cgtgggacgc tcctccttct actgcctgga atactttcct 1200
tcgcagatgc tgagaactgg caacaacttc cagtttactt acaccttcga ggacgtgcct 1260
ttccacagca gctacgccca cagccagagc ttggaccggc tgatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 37
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 37
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg cgctgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggatgca gcggccctcg agcacgacaa agcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaaga gggttctcga acctttgggt ctggttgagg aaggggctaa gacggctcct 420
ggaaagaaaa ggccggtaga gcagtctcct caggaaccgg actcctccgc gggtattggc 480
aagacaggtg cacagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg acccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcacca atggcagaca ataacgaagg cgccgacgga 660
gtgggtagtg cctcgggaaa ttggcattgc gattccacat ggctgggcga cagagtcatc 720
accaccagca cccgaacctg ggccctgccc acctataaca accatctcta caagcaaatc 780
tccagtgctt caacgggggc cagtaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg acttcaacag attccactgc cacttctcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcccaag cgactcaact tcaagctctt caacattcag 960
gtcaaagagg ttacggacaa caatggagtc aagaccatcg ccaataacct taccagcacg 1020
atccaggtct ttacggactc ggagtaccag ctgccgtacg tcctcggctc tgcgcaccag 1080
ggctgcctgc ctccgttccc ggcggacgtg ttcatgattc cgcagtacgg ctacctaacg 1140
ctcaacaatg gtagccaggc agtgggacgg tcatcctttt actgcctgga atatttccca 1200
tcgcagatgc tgagaacggg caacaacttt accttcagct acacctttga ggacgttcct 1260
ttccacagca gctacgctca cagccagagt ctggaccgtc tcatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 38
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 38
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg acttgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggacgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcggacgagc agtcttccag 360
gccaaaaaga ggcttcttga acctcttggt ctggttgagg aagcggctaa gacggctcct 420
ggaaagaaga ggcctgtaga gcagtctcct caggaaccgg actcctccgc gggtattggc 480
aaatcgggtg cacagcccgc taaaaagaga ctcaatttcg gtcagactgg cgacacagag 540
tcagtcccag accctcaacc aatcggagaa cctccagcag cgccctctgg tgtgggacct 600
aatacaatgg ctgcaggcgg tggcgcacca atggcagaca ataacgaagg tgccgatgga 660
gtgggtagtt cctcgggaaa ttggcattgc gattcccaat ggctggggga cagagtcatc 720
accaccagca cccgaacctg ggccctgccc acctataaca accacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact ttggctacag caccccttgg 840
gggtattttg acttcaacag attccactgc cacttttcac cacgtgactg gcaaagactc 900
atcaacaaca actggggatt ccgacccaag agactcaact tcaagctctt caacatccag 960
gtcaaggagg tcacgcagaa tgaaggcacc aagaccatcg ccaataacct caccagcacc 1020
atccaggtgt ttacggactc ggagtaccag ctgccgtacg ttctcggctc tgcccaccag 1080
ggctgcctgc ctccgttccc ggcggacgtg ttcatgattc cccagtacgg ctacctaaca 1140
ctcaacaacg gtagtcaggc cgtgggacgc tcctccttct actgcctgga atactttcct 1200
tcgcagatgc tgagaaccgg caacaacttc cagtttactt acaccttcga ggacgtgcct 1260
ttccacagca gctacgcgca cagccagagc ttggaccggc tgatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc acgcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 39
<211> 2214
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 39
atggctgccg atggttatct tccagattgg ctcgaggaca accttagtga aggaattcgc 60
gagtggtggg cgctgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggacgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaagc gggttctcga acctctcggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcgcca caagagccag actcctcctc gggcatcggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaatttcg gtcagactgg cgacacagag 540
tcagtcccag accctcaacc aatcggagaa cctcccgcag ccccctcagg tgtgggatct 600
cttacaatgg cttcaggtgg tggcgcacca gtggcagaca ataacgaagg tgccgatgga 660
gtgggtagtt cctcgggaaa ttggcattgc gattcccaat ggctggggga cagagtcatc 720
accaccagca ccagaacctg ggccttgccc acctacaata accacctcta caagcaaatc 780
tccaacagca catctggagg atcttcaaat gacaacgcct acttcggcta cagcaccccc 840
tgggggtatt ttgactttaa cagattccac tgccactttt caccacgtga ctggcagcga 900
ctcatcaaca acaactgggg attccgaccc aagagactca acttcaagct cttcaacatc 960
caggtcaagg aggtcacgca gaacgaaggc accaagacca tcgccaataa cctcaccagc 1020
accatccagg tgtttacgga ctcggagtac cagctgccgt acgttctcgg ctccgcccac 1080
cagggctgcc tgcctccgtt cccggcggac gtgttcatga ttccccagta cggctaccta 1140
acgctcaaca acggtagtca ggccgtggga cgctcctcct tctactgcct ggaatacttt 1200
ccttcgcaga tgctgagaac cggcaacaac ttccagttta cttacacctt cgaggacgtg 1260
cctttccaca gcagctacgc gcacagccag agcttggacc ggctgatgaa tcctctgatt 1320
gaccagtacc tgtactactt gtctcggact caaacaacag gaggcacggc aaatacgcag 1380
actctgggct tcagccaagg tgggcctaat acaatggcca atcaggcaaa gaactggctg 1440
ccaggaccct gttaccgcca acaacgcgtc tcaacgacaa ccgggcaaaa caacaatagc 1500
aactttgcct ggactgctgg gaccaaatac catctgaatg gaagaaattc attggctaat 1560
cctggcatcg ctatggcaac acacaaagac gacaaggagc gtttttttcc cagtaacggg 1620
atcctgattt ttggcaaaca aaatgctgcc agagacaatg cggattacag cgatgtcatg 1680
ctcaccagcg aggaagaaat caaaaccact aaccctgtgg ctacagagga atacggtatc 1740
gtggcagata acttgcagca gcaaaacacg gctcctcaaa ttggaactgt caacagccag 1800
ggggccttac ccggtatggt ctggcagaac cgggacgtgt acctgcaggg tcccatctgg 1860
gccaagattc ctcacacgga cggcaacttc cacccgtctc cgctgatggg cggctttggc 1920
ctgaaacatc ctccgcctca gatcctgatc aagaacacgc ctgtacctgc ggatcctccg 1980
accaccttca accagtcaaa gctgaactct ttcatcacgc aatacagcac cggacaggtc 2040
agcgtggaaa ttgaatggga gctgcagaag gaaaacagca agcgctggaa ccccgagatc 2100
cagtacacct ccaactacta caaatctaca agtgtggact ttgctgttaa tacagaaggc 2160
gtgtactctg aaccccaccc cattggcacc cgttacctca cccgtcccct gtaa 2214
<210> 40
<211> 2214
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 40
atggctgccg atggttatct tccagattgg ctcgaggaca accttagtga aggaattcgc 60
gagtggtggg cgctgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggacgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgcggagttt 300
caggagcgcc ttaaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaaga gggttctcga accttttggt ctggttgagg aaggtgctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcgcca caagagccag actcctcctc gggcatcggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagttccag accctcaacc tctcggagaa cctccagcag cgccctctgg tgtgggacct 600
aatacaatgg ctgcaggcgg tggcgcacca atggcagaca ataacgaagg tgccgatgga 660
gtgggtagtt cctcgggaaa ttggcattgc gattcccaat ggctggggaa cagagtcatc 720
accaccagca cccgaacctg ggccctgccc acctacaaca atcacctcta caagcaaatc 780
tccaacagca catctggagg atcttcaaat gacaacgcct acttcggcta cagcaccccc 840
tgggggtatt ttgacttcaa cagattccac tgccacttct caccacgtga ctggcagcga 900
ctcatcaaca acaactgggg attccggccc aagagactca acttcaagct cttcaacatt 960
caggtcaaag aggttacgga caacaatgga gtcaagacca tcgccaataa ccttaccagc 1020
acggtccagg tcttcacgga ctcggagtac cagttgccgt acgtcctcgg ctctgcgcac 1080
cagggctgcc tccctccgtt cccggcggac gtgttcatga ttccgcaata cggctacctg 1140
acgctcaaca acggtagcca agccgtggga cgttcatcct tttactgcct ggaatatttc 1200
ccttctcaga tgctgagaac cggcaacaac ttccagttta cttacacctt cgaggacgtg 1260
cctttccaca gcagctacgc gcacagccag agcttggacc ggctgatgaa tcctctgatt 1320
gaccagtacc tgtactactt gtctcggact caaacaacag gaggcacggc aaatacgcag 1380
actctgggct tcagccaagg tgggcctaat acaatggcca atcaggcaaa gaactggctg 1440
ccaggaccct gttaccgcca acaacgcgtc tcaacgacaa ccgggcaaaa caacaatagc 1500
aactttgcct ggactgctgg gaccaaatac catctgaatg gaagaaattc attggctaat 1560
cctggcatcg ctatggcaac acacaaagac gacaaggagc gtttttttcc cagtaacggg 1620
atcctgattt ttggcaaaca aaatgctgcc agagacaatg cggattacag cgatgtcatg 1680
ctcaccagcg aggaagaaat caaaaccact aaccctgtgg ctacagagga atacggtatc 1740
gtggcagata acttgcagca gcaaaacacg gctcctcaaa ttggaactgt caacagccag 1800
ggggccttac ccggtatggt ctggcagaac cgggacgtgt acctgcaggg tcccatctgg 1860
gccaagattc ctcacacgga cggcaacttc cacccgtctc cgctgatggg cggctttggc 1920
ctgaaacatc ctccgcctca gatcctgatc aagaacacgc ctgtacctgc ggatcctccg 1980
accaccttca accagtcaaa gctgaactct ttcatcacgc aatacagcac cggacaggtc 2040
agcgtggaaa ttgaatggga gctgcagaag gaaaacagca agcgctggaa ccccgagatc 2100
cagtacacct ccaactacta caaatctaca agtgtggact ttgctgttaa tacagaaggc 2160
gtgtactctg aaccccaccc cattggcacc cgttacctca cccgtcccct gtaa 2214
<210> 41
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 41
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg acttgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aggggggagc ccgtcaacgc ggcggacgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaagc gggttctcga acctctcggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcgcca caagagccag actcctcctc gggcatcggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg acccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcacca atggcagaca ataacgaagg cgccgacgga 660
gtgggtaatg cctcaggaaa ttggcattgc gattccacat ggctgggcga cagagtcatc 720
accaccagca cccgaacctg ggccttgccc acctataaca accacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg acttcaacag attccactgc cacttctcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcctaag cgactcaact tcaagctctt caacattcag 960
gtcaaagagg ttacggacaa caatggagtc aagaccatcg ccaataacct caccagcacc 1020
atccaggtgt ttacggactc ggagtaccag ctgccgtacg ttctcggctc tgcccaccag 1080
ggctgcctgc ctccgttccc ggcggacgtg ttcatgattc cccagtacgg ctacctaaca 1140
ctcaacaacg gtagtcaggc cgtgggacgc tcctccttct actgcctgga atactttcct 1200
tcgcagatgc tgagaaccgg caacaacttc cagtttactt acaccttcga ggacgtgcct 1260
ttccacagca gctacgccca cagccagagc ttggaccggc tgatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 42
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 42
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg acttgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggacgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaagc gggttctcga acctctcggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcgcca caagagccag actcctcctc gggcatcggc 480
aagaaaggcc aacagcccgc cagaaaaaga ctcaattttg gtcagactgg cgactcagag 540
tcagttccag accctcaacc tctcggagaa cctcccgcag ccccctcagg tgtgggatct 600
cttacaatgg cttcaggcgg tggcgcacca atggcagaca ataacgaagg cgccgacgga 660
gtgggtaatg cctcaggaaa ttggcattgc gattccacat ggctgggcga cagagtcatc 720
accaccagca cccgaacatg ggccttgccc acttacaaca accatctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg atttcaacag attccactgc cacttttcac cacgtgactg gcaaagactc 900
atcaacaaca actggggatt ccgacccaag agactcaact tcaagctctt taacattcaa 960
gtcaaagagg tcacgcagaa tgaaggcacc aagaccatcg ccaataacct taccagcacg 1020
gtccaggtct tcacggactc agactatcag ctcccgtacg ttctcggctc cgcccaccag 1080
ggctgcctgc ctccgttccc ggcggacgtg ttcatgattc cccagtacgg ctacctaaca 1140
ctcaacaacg gtagtcaggc cgtgggacgc tcctccttct actgcctgga atactttcct 1200
tcgcagatgc tgagaaccgg caacaacttc cagtttactt acacctttga ggacgttcct 1260
ttccacagca gctacgctca cagccagagt ctggaccgtc tcatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctggaac caaataccat ctgaatggaa gaaattcatt gtctaatcct 1560
ggcatcgcta tggcgacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacatgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 43
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 43
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg cgctgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggatgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaggaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaaga gggttctcga accttttggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcgcca caagagccag actcctcctc gggcatcggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaattttg gtcagactgg cggctcagag 540
tcagtccccg acccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg ctgcaggcgg tggcgcacca atggcagaca ataacgaagg cgccgacgga 660
gtgggtagtt cctcgggaaa ttggcattgc gattccacat ggctgggcga cagagtcatc 720
accaccagca ccagaacctg ggccttgccc acctataaca accacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg atttcaacag attccactgc catttctcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcccaag agactcaact tcaaactctt caacattcag 960
gtcaaagagg ttacggacaa caatggagtc aagaccatcg ccaataacct taccagcacg 1020
gtccaggtgt ttacggactc ggagtaccag ctgccgtacg ttctcggctc tgcccaccag 1080
ggctgcctcc ctccgttccc ggcggacgtg ttcatgattc cgcagtacgg ctacctaacg 1140
ctcaacaatg gcagccaggc agtgggacgg tcatcctttt actgcctgga atatttccct 1200
tctcagatgc tgagaacggg caacaacttt accttcagct acacctttga ggaagtgcct 1260
ttccacagca gctacgcgca cagccagagc ctggaccggc tgatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcctcaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 44
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 44
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Thr Leu Ser
1 5 10 15
Glu Gly Ile Arg Gln Trp Trp Lys Leu Lys Pro Gly Pro Pro Pro Pro
20 25 30
Lys Pro Ala Glu Arg His Lys Asp Asp Ser Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Glu Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Lys Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Gln Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Gln Asn Glu Gly Thr Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 45
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 45
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Lys Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Leu Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Ala Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ala Gly Ile Gly
145 150 155 160
Lys Ser Gly Ala Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ala
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Gln Asn Glu Gly Thr Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Ala Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 46
<211> 737
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 46
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Asp Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Asn Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ala Gly Ile Gly
145 150 155 160
Lys Ser Gly Ala Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Thr Glu Ser Val Pro Asp Pro Gln Pro Ile Gly Glu Pro Pro
180 185 190
Ala Ala Pro Ser Gly Val Gly Ser Leu Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Val Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Gln Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Asn Ser Thr Ser Gly Gly Ser Ser Asn Asp Asn
260 265 270
Ala Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg
275 280 285
Phe His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn
290 295 300
Asn Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile
305 310 315 320
Gln Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn
325 330 335
Asn Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu
340 345 350
Pro Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro
355 360 365
Ala Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn
370 375 380
Gly Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe
385 390 395 400
Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr
405 410 415
Phe Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu
420 425 430
Asp Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser
435 440 445
Arg Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe
450 455 460
Ser Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu
465 470 475 480
Pro Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln
485 490 495
Asn Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu
500 505 510
Asn Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Ser His
515 520 525
Lys Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe
530 535 540
Gly Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met
545 550 555 560
Leu Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu
565 570 575
Glu Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro
580 585 590
Gln Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp
595 600 605
Gln Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro
610 615 620
His Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly
625 630 635 640
Leu Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro
645 650 655
Ala Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile
660 665 670
Thr Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu
675 680 685
Gln Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Thr
690 695 700
Asn Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly
705 710 715 720
Val Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro
725 730 735
Leu
<210> 47
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 47
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Glu Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ala
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Gln Asn Glu Gly Thr Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 48
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 48
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Glu Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Phe Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ala
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Gln Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Val Gln Val Phe Ser Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 49
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 49
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Thr Leu Ser
1 5 10 15
Glu Gly Ile Arg Gln Trp Trp Lys Leu Lys Pro Gly Pro Pro Pro Pro
20 25 30
Lys Pro Ala Glu Arg His Lys Asp Asp Ser Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Glu Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Arg Gln Leu Asp Ser Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Lys Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Phe Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ala
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Asp Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Glu Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Asn Leu
725 730 735
<210> 50
<211> 738
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 50
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Asp Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Gln Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Pro Ser Pro Gln Arg Ser Pro Asp Ser Ser Thr Gly Ile
145 150 155 160
Gly Lys Lys Gly Gln Gln Pro Ala Arg Lys Arg Leu Asn Phe Gly Gln
165 170 175
Thr Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro
180 185 190
Pro Ala Ala Pro Ser Gly Val Gly Pro Asn Thr Met Ala Ala Gly Gly
195 200 205
Gly Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser
210 215 220
Ser Ser Gly Asn Trp His Cys Asp Ser Gln Trp Leu Gly Asp Arg Val
225 230 235 240
Ile Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His
245 250 255
Leu Tyr Lys Gln Ile Ser Asn Ser Thr Ser Gly Gly Ser Ser Asn Asp
260 265 270
Asn Ala Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn
275 280 285
Arg Phe His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn
290 295 300
Asn Asn Trp Gly Phe Arg Pro Lys Arg Leu Ser Phe Lys Leu Phe Asn
305 310 315 320
Ile Gln Val Lys Glu Val Thr Gln Asn Glu Gly Thr Lys Thr Ile Ala
325 330 335
Asn Asn Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln
340 345 350
Leu Pro Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe
355 360 365
Pro Ala Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn
370 375 380
Asn Gly Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr
385 390 395 400
Phe Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Thr Phe Ser Tyr
405 410 415
Thr Phe Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser
420 425 430
Leu Asp Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu
435 440 445
Ser Arg Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly
450 455 460
Phe Ser Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp
465 470 475 480
Leu Pro Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly
485 490 495
Gln Asn Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His
500 505 510
Leu Asn Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr
515 520 525
His Lys Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile
530 535 540
Phe Gly Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val
545 550 555 560
Met Leu Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr
565 570 575
Glu Glu Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala
580 585 590
Pro Gln Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val
595 600 605
Trp Gln Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile
610 615 620
Pro His Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe
625 630 635 640
Gly Leu Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val
645 650 655
Pro Ala Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe
660 665 670
Ile Thr Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu
675 680 685
Leu Gln Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr
690 695 700
Ser Asn Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu
705 710 715 720
Gly Val Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg
725 730 735
Pro Leu
<210> 51
<211> 737
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 51
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Asp Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Phe Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Gln Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Asn Gly Thr Ser Gly Gly Ala Thr Asn Asp Asn
260 265 270
Thr Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg
275 280 285
Phe His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn
290 295 300
Asn Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile
305 310 315 320
Gln Val Lys Glu Val Thr Gln Asn Glu Gly Thr Lys Thr Ile Ala Asn
325 330 335
Asn Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu
340 345 350
Pro Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro
355 360 365
Ala Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn
370 375 380
Gly Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe
385 390 395 400
Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Thr Phe Ser Tyr Thr
405 410 415
Phe Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu
420 425 430
Asp Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser
435 440 445
Arg Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe
450 455 460
Ser Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu
465 470 475 480
Pro Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln
485 490 495
Asn Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu
500 505 510
Asn Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His
515 520 525
Lys Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe
530 535 540
Gly Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met
545 550 555 560
Leu Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu
565 570 575
Glu Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro
580 585 590
Gln Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp
595 600 605
Gln Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro
610 615 620
His Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly
625 630 635 640
Leu Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro
645 650 655
Ala Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile
660 665 670
Thr Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu
675 680 685
Gln Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser
690 695 700
Asn Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly
705 710 715 720
Val Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro
725 730 735
Leu
<210> 52
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 52
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Asp Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Glu Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Thr Phe Ser Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 53
<211> 737
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 53
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Asp Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Pro Ser Pro Gln Arg Ser Pro Asp Ser Ser Thr Gly Ile
145 150 155 160
Gly Lys Lys Gly Gln Gln Pro Ala Arg Lys Arg Leu Asn Phe Gly Gln
165 170 175
Thr Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro
180 185 190
Pro Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly
195 200 205
Gly Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn
210 215 220
Ala Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val
225 230 235 240
Ile Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His
245 250 255
Leu Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn
260 265 270
His Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg
275 280 285
Phe His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn
290 295 300
Asn Leu Gly Ser Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Ile Ile
305 310 315 320
Gln Val Lys Glu Val Thr Thr Asn Asp Gly Val Thr Thr Ile Ala Asn
325 330 335
Asn Leu Thr Ser Thr Val Gln Val Phe Ser Asp Ser Glu Tyr Gln Leu
340 345 350
Pro Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro
355 360 365
Ala Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn
370 375 380
Gly Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe
385 390 395 400
Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Thr Phe Ser Tyr Thr
405 410 415
Phe Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu
420 425 430
Asp Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Asn
435 440 445
Arg Thr Gln Asn Gln Ser Gly Ser Ala Gln Asn Lys Asp Leu Leu Phe
450 455 460
Ser Arg Gly Ser Pro Ala Gly Met Ser Val Gln Pro Lys Asn Trp Leu
465 470 475 480
Pro Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Lys Thr Lys Thr Asp
485 490 495
Asn Asn Asn Ser Asn Phe Thr Trp Thr Gly Ala Ser Lys Tyr Asn Leu
500 505 510
Asn Gly Arg Glu Ser Ile Ile Asn Pro Gly Thr Ala Met Ala Ser His
515 520 525
Lys Asp Asp Lys Asp Lys Phe Phe Pro Met Ser Gly Val Met Ile Phe
530 535 540
Gly Lys Glu Ser Ala Gly Ala Ser Asn Thr Ala Leu Asp Asn Val Met
545 550 555 560
Ile Thr Asp Glu Glu Glu Ile Lys Ala Thr Asn Pro Val Ala Thr Glu
565 570 575
Arg Phe Gly Thr Val Ala Val Asn Leu Gln Ser Ser Ser Thr Asp Pro
580 585 590
Ala Thr Gly Asp Val His Val Met Gly Ala Leu Pro Gly Met Val Trp
595 600 605
Gln Asp Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro
610 615 620
His Thr Asp Gly His Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly
625 630 635 640
Leu Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro
645 650 655
Ala Asn Pro Pro Ala Glu Phe Ser Ala Thr Lys Phe Ala Ser Phe Ile
660 665 670
Thr Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu
675 680 685
Gln Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Val Gln Tyr Thr Ser
690 695 700
Asn Tyr Ala Lys Ser Ala Asn Val Asp Phe Thr Val Asp Asn Asn Gly
705 710 715 720
Leu Tyr Thr Glu Pro Arg Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro
725 730 735
Leu
<210> 54
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 54
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Leu Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Ala Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Ile Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Gln Asn Glu Gly Thr Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Thr Phe Ser Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Asp Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 55
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 55
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Glu Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Phe Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Ala Pro Ser Gly Val Gly Pro Asn Thr Met Ala Ala Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Gln Asn Glu Gly Thr Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Phe Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Thr Phe Ser Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 56
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 56
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Asp Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ala
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Thr Asn Asp Gly Val Thr Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Val Gln Val Phe Ser Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Thr Phe Ser Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Asn Arg
435 440 445
Thr Gln Asn Gln Ser Gly Ser Ala Gln Asn Lys Asp Leu Leu Phe Ser
450 455 460
Arg Gly Ser Pro Ala Gly Met Ser Val Gln Pro Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Lys Thr Lys Thr Asp Asn
485 490 495
Asn Asn Ser Asn Phe Thr Trp Thr Gly Ala Ser Lys Tyr Asn Leu Asn
500 505 510
Gly Arg Glu Ser Ile Ile Asn Pro Gly Thr Ala Met Ala Ser His Lys
515 520 525
Asp Asp Lys Asp Lys Phe Phe Pro Met Ser Gly Val Met Ile Phe Gly
530 535 540
Lys Glu Ser Ala Gly Ala Ser Asn Thr Ala Leu Asp Asn Val Met Ile
545 550 555 560
Thr Asp Glu Glu Glu Ile Lys Ala Thr Asn Pro Val Ala Thr Glu Arg
565 570 575
Phe Gly Thr Val Ala Val Asn Leu Gln Asn Ser Ser Thr Asp Pro Ala
580 585 590
Thr Gly Asp Val His Val Met Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asp Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly His Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asn Pro Pro Ala Glu Phe Ser Ala Thr Lys Phe Ala Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Val Gln Tyr Thr Ser Asn
690 695 700
Tyr Ala Lys Ser Ala Asn Val Asp Phe Thr Val Asp Asn Asn Gly Leu
705 710 715 720
Tyr Thr Val Pro Arg Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 57
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 57
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Leu Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Glu Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser Ala
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Pro Phe Ser Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 58
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 58
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Gln Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Asp Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Thr Phe Ser Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 59
<211> 735
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 59
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Asp Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ala
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Val Ile Thr
225 230 235 240
Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu Tyr
245 250 255
Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His Tyr
260 265 270
Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe His
275 280 285
Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn Trp
290 295 300
Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln Val
305 310 315 320
Lys Glu Val Thr Gln Asn Glu Gly Thr Lys Thr Ile Ala Asn Asn Leu
325 330 335
Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro Tyr
340 345 350
Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala Asp
355 360 365
Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly Ser
370 375 380
Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro Ser
385 390 395 400
Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr Phe Glu
405 410 415
Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp Arg
420 425 430
Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg Thr
435 440 445
Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser Gln
450 455 460
Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro Gly
465 470 475 480
Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn Asn
485 490 495
Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn Gly
500 505 510
Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys Asp
515 520 525
Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly Lys
530 535 540
Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Ile Leu Thr
545 550 555 560
Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu Tyr
565 570 575
Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln Ile
580 585 590
Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln Asn
595 600 605
Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His Thr
610 615 620
Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu Lys
625 630 635 640
His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala Asp
645 650 655
Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr Gln
660 665 670
Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln Lys
675 680 685
Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn Tyr
690 695 700
Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val Tyr
705 710 715 720
Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 60
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 60
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Thr Leu Ser
1 5 10 15
Glu Gly Ile Arg Gln Trp Trp Lys Leu Lys Pro Gly Pro Pro Pro Pro
20 25 30
Lys Pro Ala Glu Arg His Lys Asp Asp Ser Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Glu Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Arg Gln Leu Asp Ser Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Lys Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Phe Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ala
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Thr Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Thr Phe Ser Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 61
<211> 735
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 61
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Asp Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Arg Gln Leu Asp Ser Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Lys Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Phe Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ala
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Gln Asn Glu Gly Thr Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Arg Ser Val Phe Phe Gln Tyr Arg Asp Pro Asp Phe Gly Lys
530 535 540
Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu Thr
545 550 555 560
Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu Tyr
565 570 575
Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln Ile
580 585 590
Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln Asn
595 600 605
Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His Thr
610 615 620
Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu Lys
625 630 635 640
His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala Asp
645 650 655
Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr Gln
660 665 670
Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln Lys
675 680 685
Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn Tyr
690 695 700
Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val Tyr
705 710 715 720
Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 62
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 62
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Gly Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Ala Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ala Gly Ile Gly
145 150 155 160
Lys Ser Gly Ala Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Thr Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Ala Pro Ser Gly Val Gly Pro Asn Thr Met Ala Ala Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Gln Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Asp Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Glu Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 63
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 63
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Thr Leu Ser
1 5 10 15
Glu Gly Ile Arg Gln Trp Trp Lys Leu Lys Pro Gly Pro Pro Pro Pro
20 25 30
Lys Pro Ala Glu Arg His Lys Asp Asp Ser Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Glu Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Arg Gln Leu Asp Ser Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Lys Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Phe Gly Leu Val Glu Glu Ala Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ala
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Asp Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Glu Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Thr Phe Ser Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 64
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 64
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Thr Phe Ser Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 65
<211> 737
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 65
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Thr Glu Ser Val Pro Asp Pro Gln Pro Ile Gly Glu Pro Pro
180 185 190
Ala Ala Pro Ser Gly Val Gly Ser Leu Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Val Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Gln Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Asn Ser Thr Ser Gly Gly Ser Ser Asn Asp Asn
260 265 270
Ala Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg
275 280 285
Phe His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn
290 295 300
Asn Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile
305 310 315 320
Gln Val Lys Glu Val Thr Gln Asn Glu Gly Thr Lys Thr Ile Ala Asn
325 330 335
Asn Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu
340 345 350
Pro Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro
355 360 365
Ala Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn
370 375 380
Gly Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe
385 390 395 400
Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr
405 410 415
Phe Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu
420 425 430
Asp Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser
435 440 445
Arg Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe
450 455 460
Ser Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu
465 470 475 480
Pro Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln
485 490 495
Asn Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu
500 505 510
Asn Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His
515 520 525
Lys Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe
530 535 540
Gly Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met
545 550 555 560
Leu Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu
565 570 575
Glu Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro
580 585 590
Gln Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp
595 600 605
Gln Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro
610 615 620
His Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly
625 630 635 640
Leu Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro
645 650 655
Ala Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile
660 665 670
Thr Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu
675 680 685
Gln Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser
690 695 700
Asn Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly
705 710 715 720
Val Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro
725 730 735
Leu
<210> 66
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 66
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Gly Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Ala Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ala Gly Ile Gly
145 150 155 160
Lys Ser Gly Ala Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Thr Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Ala Pro Ser Gly Val Gly Pro Asn Thr Met Ala Ala Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Gln Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Thr Phe Ser Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Asp
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 67
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 67
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Thr Leu Ser
1 5 10 15
Glu Gly Ile Arg Gln Trp Trp Lys Leu Lys Pro Gly Pro Pro Pro Pro
20 25 30
Lys Pro Ala Glu Arg His Lys Asp Asp Ser Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Glu Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Arg Gln Leu Asp Ser Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Lys Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Pro Val Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu His Ser Pro Val Glu Pro Asp Ser Ser Ser Gly Thr Gly
145 150 155 160
Lys Ala Gly Gln Gln Pro Ala Arg Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Asn Thr Met Ala Thr Gly Ser Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Met Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Thr Phe Ser Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Lys Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 68
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 68
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Phe Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ala
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Thr Phe Ser Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Gly Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 69
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 69
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Asp Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Gln Asn Glu Gly Thr Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Thr Phe Ser Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 70
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 70
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ala Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Met Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Ser Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Gln Asn Glu Gly Thr Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Thr Phe Ser Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Gln
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Leu Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 71
<211> 737
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 71
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Pro Ser Pro Gln Arg Ser Pro Asp Ser Ser Ser Gly Ile
145 150 155 160
Gly Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln
165 170 175
Thr Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro
180 185 190
Pro Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly
195 200 205
Gly Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn
210 215 220
Ala Ser Gly Asn Trp His Cys Asp Ser Gln Trp Leu Gly Asp Arg Val
225 230 235 240
Ile Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His
245 250 255
Leu Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn
260 265 270
His Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg
275 280 285
Phe His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn
290 295 300
Asn Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile
305 310 315 320
Gln Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn
325 330 335
Asn Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Asp Tyr Gln Leu
340 345 350
Pro Tyr Val Leu Gly Ser Ala His Glu Gly Cys Leu Pro Pro Phe Pro
355 360 365
Ala Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn
370 375 380
Gly Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe
385 390 395 400
Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr
405 410 415
Phe Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu
420 425 430
Asp Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser
435 440 445
Arg Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe
450 455 460
Ser Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Val
465 470 475 480
Pro Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Ala Thr Gly Gln
485 490 495
Asn Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu
500 505 510
Lys Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His
515 520 525
Lys Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe
530 535 540
Gly Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met
545 550 555 560
Leu Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu
565 570 575
Glu Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro
580 585 590
Gln Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp
595 600 605
Gln Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro
610 615 620
His Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly
625 630 635 640
Leu Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro
645 650 655
Ala Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile
660 665 670
Thr Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu
675 680 685
Gln Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser
690 695 700
Asn Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly
705 710 715 720
Val Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro
725 730 735
Leu
<210> 72
<211> 737
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<220>
<221> неопределенный признак
<222> (226)..(226)
<223> Xaa может представлять собой любую природную аминокислоту
<220>
<221> неопределенный признак
<222> (233)..(233)
<223> Xaa может представлять собой любую природную аминокислоту
<220>
<221> неопределенный признак
<222> (239)..(239)
<223> Xaa может представлять собой любую природную аминокислоту
<220>
<221> неопределенный признак
<222> (250)..(250)
<223> Xaa может представлять собой любую природную аминокислоту
<220>
<221> неопределенный признак
<222> (253)..(253)
<223> Xaa может представлять собой любую природную аминокислоту
<220>
<221> неопределенный признак
<222> (255)..(255)
<223> Xaa может представлять собой любую природную аминокислоту
<400> 72
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Thr Leu Ser
1 5 10 15
Glu Gly Ile Arg Gln Trp Trp Lys Leu Lys Pro Gly Pro Pro Pro Pro
20 25 30
Lys Pro Ala Glu Arg His Lys Asp Asp Ser Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Glu Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Arg Gln Leu Asp Ser Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Lys Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ser Gly Val Gly Pro Asn Thr Met Ala Ala Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser Ser
210 215 220
Ser Xaa Asn Trp His Cys Asp Ser Xaa Trp Leu Gly Asp Arg Xaa Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Xaa Thr Tyr Xaa Asn Xaa Leu
245 250 255
Tyr Lys Gln Ile Ser Asn Ser Thr Ser Gly Gly Ala Thr Asn Asp Asn
260 265 270
Thr Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg
275 280 285
Phe His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn
290 295 300
Asn Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile
305 310 315 320
Gln Val Lys Glu Val Thr Gln Asn Glu Gly Thr Lys Thr Ile Ala Asn
325 330 335
Asn Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu
340 345 350
Pro Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro
355 360 365
Ala Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn
370 375 380
Gly Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe
385 390 395 400
Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr
405 410 415
Phe Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu
420 425 430
Asp Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser
435 440 445
Arg Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe
450 455 460
Ser Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu
465 470 475 480
Pro Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln
485 490 495
Asn Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu
500 505 510
Asn Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His
515 520 525
Lys Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe
530 535 540
Gly Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met
545 550 555 560
Leu Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu
565 570 575
Glu Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro
580 585 590
Gln Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp
595 600 605
Gln Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro
610 615 620
His Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly
625 630 635 640
Leu Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro
645 650 655
Ala Asp Pro Pro Thr Thr Phe Ser Gln Ala Lys Leu Ala Ser Phe Ile
660 665 670
Thr Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu
675 680 685
Gln Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Val Gln Tyr Thr Ser
690 695 700
Asn Tyr Ala Lys Ser Ala Asn Val Asp Phe Thr Val Asp Asn Asn Gly
705 710 715 720
Leu Tyr Thr Glu Pro Arg Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro
725 730 735
Leu
<210> 73
<211> 737
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 73
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Asp Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Pro Ser Pro Gln Arg Ser Pro Asp Ser Ser Thr Gly Ile
145 150 155 160
Gly Lys Lys Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln
165 170 175
Thr Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Ile Gly Glu Pro
180 185 190
Pro Ala Gly Pro Ser Gly Val Gly Ser Leu Thr Met Ala Ser Gly Gly
195 200 205
Gly Ala Pro Val Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser
210 215 220
Ser Ser Gly Asn Trp His Cys Asp Ser Gln Trp Leu Gly Asp Arg Val
225 230 235 240
Ile Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His
245 250 255
Leu Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn
260 265 270
His Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg
275 280 285
Phe His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn
290 295 300
Asn Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile
305 310 315 320
Gln Val Lys Glu Val Thr Asp Asn Asp Gly Val Lys Thr Ile Ala Asn
325 330 335
Asn Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu
340 345 350
Pro Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro
355 360 365
Ala Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn
370 375 380
Gly Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe
385 390 395 400
Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Thr Phe Ser Tyr Thr
405 410 415
Phe Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu
420 425 430
Asp Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser
435 440 445
Arg Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe
450 455 460
Ser Gln Gly Gly Pro Asn Thr Met Ala Asn His Ala Lys Asn Trp Leu
465 470 475 480
Pro Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln
485 490 495
Asn Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu
500 505 510
Asn Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His
515 520 525
Lys Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe
530 535 540
Gly Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met
545 550 555 560
Leu Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu
565 570 575
Glu Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro
580 585 590
Gln Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp
595 600 605
Gln Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro
610 615 620
His Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly
625 630 635 640
Leu Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro
645 650 655
Ala Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile
660 665 670
Thr Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu
675 680 685
Gln Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser
690 695 700
Asn Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly
705 710 715 720
Val Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro
725 730 735
Leu
<210> 74
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 74
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Thr Leu Ser
1 5 10 15
Glu Gly Ile Arg Gln Trp Trp Lys Leu Lys Pro Gly Pro Pro Pro Pro
20 25 30
Lys Pro Ala Glu Arg His Lys Asp Asp Ser Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Glu Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Arg Gln Leu Asp Ser Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Lys Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Pro Val Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu His Ser Pro Val Glu Pro Asp Ser Ser Ser Gly Thr Gly
145 150 155 160
Lys Ala Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ala
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Gln Asn Glu Gly Thr Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 75
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 75
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Gln Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Gly Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ala
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 76
<211> 738
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 76
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Thr Leu Ser
1 5 10 15
Glu Gly Ile Arg Gln Trp Trp Lys Leu Lys Pro Gly Pro Pro Pro Pro
20 25 30
Lys Pro Ala Glu Arg His Lys Asp Asp Ser Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Lys Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Pro Ser Pro Gln Arg Ser Pro Asp Ser Ser Thr Gly Ile
145 150 155 160
Gly Lys Lys Gly Gln Gln Pro Ala Arg Lys Arg Leu Asn Phe Gly Gln
165 170 175
Thr Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro
180 185 190
Pro Ala Ala Pro Ser Gly Val Gly Pro Asn Thr Met Ala Ala Gly Gly
195 200 205
Gly Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser
210 215 220
Ser Ser Gly Asn Trp His Cys Asp Ser Gln Trp Leu Gly Asp Arg Val
225 230 235 240
Ile Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His
245 250 255
Leu Tyr Lys Gln Ile Ser Asn Ser Thr Ser Gly Gly Ser Ser Asn Asp
260 265 270
Asn Ala Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn
275 280 285
Arg Phe His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn
290 295 300
Asn Asn Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn
305 310 315 320
Ile Gln Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala
325 330 335
Asn Asn Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Glu Tyr Gln
340 345 350
Leu Pro Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe
355 360 365
Pro Ala Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn
370 375 380
Asn Gly Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr
385 390 395 400
Phe Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Thr Phe Ser Tyr
405 410 415
Thr Phe Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser
420 425 430
Leu Asp Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu
435 440 445
Ser Arg Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly
450 455 460
Phe Ser Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp
465 470 475 480
Leu Pro Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly
485 490 495
Gln Asn Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His
500 505 510
Leu Asn Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr
515 520 525
His Lys Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile
530 535 540
Phe Gly Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val
545 550 555 560
Met Leu Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr
565 570 575
Glu Glu Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala
580 585 590
Pro Gln Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val
595 600 605
Trp Gln Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile
610 615 620
Pro His Thr Asp Gly His Phe His Pro Ser Pro Leu Met Gly Gly Phe
625 630 635 640
Gly Leu Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val
645 650 655
Pro Ala Asn Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe
660 665 670
Ile Thr Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu
675 680 685
Leu Gln Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Val Gln Tyr Thr
690 695 700
Ser Asn Tyr Ala Lys Ser Ala Asn Val Asp Phe Thr Val Asp Asn Asn
705 710 715 720
Gly Leu Tyr Thr Glu Pro Arg Pro Ile Gly Thr Arg Tyr Leu Thr Arg
725 730 735
Pro Leu
<210> 77
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 77
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Leu Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Met Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Gln Asn Glu Gly Thr Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Ile Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Thr Phe Ser Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 78
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 78
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Phe Gly Leu Val Glu Glu Ala Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ala
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Gln Asn Glu Gly Thr Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Thr Phe Ser Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn His Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 79
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 79
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Glu Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Leu Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Ala Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ala Gly Ile Gly
145 150 155 160
Lys Ser Gly Ala Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ala
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Asp Asn Asp Gly Val Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 80
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 80
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ala Gly Ile Gly
145 150 155 160
Lys Thr Gly Ala Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser Ala
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Thr Phe Ser Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 81
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 81
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Asp Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Leu Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Ala Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ala Gly Ile Gly
145 150 155 160
Lys Ser Gly Ala Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Thr Glu Ser Val Pro Asp Pro Gln Pro Ile Gly Glu Pro Pro
180 185 190
Ala Ala Pro Ser Gly Val Gly Pro Asn Thr Met Ala Ala Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Gln Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Gln Asn Glu Gly Thr Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn His Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 82
<211> 737
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 82
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Thr Glu Ser Val Pro Asp Pro Gln Pro Ile Gly Glu Pro Pro
180 185 190
Ala Ala Pro Ser Gly Val Gly Ser Leu Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Val Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Gln Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Asn Ser Thr Ser Gly Gly Ser Ser Asn Asp Asn
260 265 270
Ala Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg
275 280 285
Phe His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn
290 295 300
Asn Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile
305 310 315 320
Gln Val Lys Glu Val Thr Gln Asn Glu Gly Thr Lys Thr Ile Ala Asn
325 330 335
Asn Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu
340 345 350
Pro Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro
355 360 365
Ala Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn
370 375 380
Gly Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe
385 390 395 400
Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr
405 410 415
Phe Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu
420 425 430
Asp Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser
435 440 445
Arg Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe
450 455 460
Ser Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu
465 470 475 480
Pro Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln
485 490 495
Asn Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu
500 505 510
Asn Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His
515 520 525
Lys Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe
530 535 540
Gly Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met
545 550 555 560
Leu Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu
565 570 575
Glu Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro
580 585 590
Gln Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp
595 600 605
Gln Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro
610 615 620
His Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly
625 630 635 640
Leu Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro
645 650 655
Ala Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile
660 665 670
Thr Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu
675 680 685
Gln Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser
690 695 700
Asn Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly
705 710 715 720
Val Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro
725 730 735
Leu
<210> 83
<211> 737
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 83
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Lys Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Phe Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Ala Pro Ser Gly Val Gly Pro Asn Thr Met Ala Ala Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Gln Trp Leu Gly Asn Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Asn Ser Thr Ser Gly Gly Ser Ser Asn Asp Asn
260 265 270
Ala Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg
275 280 285
Phe His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn
290 295 300
Asn Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile
305 310 315 320
Gln Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn
325 330 335
Asn Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu
340 345 350
Pro Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro
355 360 365
Ala Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn
370 375 380
Gly Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe
385 390 395 400
Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr
405 410 415
Phe Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu
420 425 430
Asp Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser
435 440 445
Arg Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe
450 455 460
Ser Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu
465 470 475 480
Pro Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln
485 490 495
Asn Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu
500 505 510
Asn Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His
515 520 525
Lys Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe
530 535 540
Gly Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met
545 550 555 560
Leu Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu
565 570 575
Glu Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro
580 585 590
Gln Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp
595 600 605
Gln Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro
610 615 620
His Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly
625 630 635 640
Leu Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro
645 650 655
Ala Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile
660 665 670
Thr Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu
675 680 685
Gln Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser
690 695 700
Asn Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly
705 710 715 720
Val Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro
725 730 735
Leu
<210> 84
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 84
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Asp Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Arg Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ala
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 85
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 85
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Asp Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Lys Gly Gln Gln Pro Ala Arg Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Ala Pro Ser Gly Val Gly Ser Leu Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ala
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Gln Asn Glu Gly Thr Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Asp Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ser Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Met Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 86
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 86
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Phe Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Gly Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ala Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Thr Phe Ser Tyr Thr Phe
405 410 415
Glu Glu Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Ser His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 87
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 87
atggctgccg atggttatct tccagattgg ctcgaggaca ctctctctga aggaataaga 60
cagtggtgga agctcaaacc tggcccacca ccaccaaagc ccgcagagcg gcataaggac 120
gacagcaggg gtcttgtgct tcctgggtac aagtacctcg gacccttcaa cggactcgac 180
aagggagagc cggtcaacga ggcagacgcc gcggccctcg agcacgacaa agcctacgac 240
cggcagctcg acagcggaga caacccgtac ctcaagtaca accacgccga cgcggagttt 300
caggagcgcc ttaaagaaga tacgtctttt gggggcaacc tcggacgagc agtcttccag 360
gcgaaaaaga gggttcttga acctctgggc ctggttgagg aacctgttaa gacggctccg 420
ggaaaaaaga ggccggtaga gcagtcgcca caagagccag actcctcctc gggcatcggc 480
aagaaaggcc agcagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg acccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcacca atggcagaca ataacgaagg cgccgacgga 660
gtgggtaatg cctcaggaaa ttggcattgc gattccacat ggatgggcga cagagtcatc 720
accaccagca cccgaacatg ggccttgccc acctataaca accacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg acttcaacag attccactgc cacttctcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcccaag agactcaact tcaggctctt caacattcag 960
gtcaaagagg ttacggacaa caatggagtc aagaccatcg ccaataacct taccagcacg 1020
gtccaggtct tcacggactc ggagtaccag cttccgtacg tcctcggctc tgcgcaccag 1080
ggctgcctcc ctccgttccc ggcggacgtg ttcatgattc cgcaatacgg ctacctgacg 1140
ctcaacaatg gcagccaagc cgtgggacgt tcatcctttt actgcctgga atatttccca 1200
tcgcagatgc tgagaacggg caacaacttt accttcagct acacctttga ggaagtgcct 1260
ttccacagca gctacgcgca cagccagagc ctggaccggc tgatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 88
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 88
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg acttgaaacc tgcatccccg aaacccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggacgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaaaaaga ggcttcttga acctcttggt ctggttgagg aagcggctaa gacggctcct 420
ggaaagaaga ggcctgtaga gcagtctcct caggaaccgg actcctccgc gggtattggc 480
aaatcgggtg cacagcccgc caaaaagaga ctcaatttcg gtcagactgg cggcacagag 540
tcagttccag accctcaacc tctcggagaa cctccagcag cgccctctgg tgtgggacct 600
aatacaatgg ctgcaggcgg tggcgcacca atggcagaca ataacgaagg cgccgacgga 660
gtgggtagtt cctcgggaaa ttggcattgc gattccacat ggctgggcga cagagtcatc 720
accaccagca ccagaacctg ggccctgccc acttacaaca accatctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg atttcaacag attccactgc cacttctcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcccaag agactcagct tcaagctctt caacatccag 960
gtcaaggagg tcacgcagaa tgaaggcacc aagaccatcg ccaataacct caccagcacc 1020
atccaggtgt ttacggactc ggagtaccag ctgccgtacg ttctcggctc tgcccaccag 1080
ggctgcctgc ctccgttccc ggcggacgtg ttcatgattc cccagtacgg atacctaaca 1140
ctcaacaacg gtagtcaggc cgtgggacgc tcctccttct actgcctgga atactttcct 1200
tcgcagatgc tgagaaccgg caacaacttc cagtttactt acaccttcga ggacgtgcct 1260
ttccacagca gctacgccca cagccagagc ttggaccggc tgatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 89
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 89
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg acttgaaacc tggagccccg aaacccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggacgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaaga gggttctcga accttttggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcgcca caagagccag actcctcctc gggcattggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg acccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggtgg tggcgcacca atggcagaca ataacgaagg cgccgacgga 660
gtgggtaatg cctcaggaaa ttggcattgc gattcccaat ggctggggga cagagtcatc 720
accaccagca cccgaacctg ggccctgccc acctacaaca atcacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg atttcaacag attccactgc catttctcac cacgtgactg gcagcgactc 900
atcaacaaca attggggatt ccggcccaag agactcaact tcaaactctt caacatccaa 960
gtcaaggagg tcacgcagaa tgaaggcacc aagaccatcg ccaataacct caccagcacc 1020
atccaggtgt ttacggactc ggagtaccag ctgccgtacg ttctcggctc cgcccaccag 1080
ggctgcctgc ctccgttccc ggcggacgtg ttcatgattc cccagtacgg ctacctaaca 1140
ctcaacaacg gtagtcaggc cgtgggacgc tcctccttct actgcctgga atactttcct 1200
tcgcagatgc tgagaaccgg caacaacttc cagtttactt acaccttcga ggacgtgcct 1260
ttccacagca gctacgccca cagccagagc ttggaccggc tgatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 90
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 90
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg acttggaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggacgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaagc gggttctcga acctctcggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcgcca caagagccag actcctcctc gggcatcggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg atccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcacca atggcagaca ataacgaagg cgccgacgga 660
gtgggtaatg cctcaggaaa ttggcattgc gattccacat ggctgggcga cagagtcatc 720
accaccagca cccgcacctg ggccttgccc acctacaata accacctcta caagcaaatc 780
tccagtgctt caacaggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg acttcaacag attccactgc cacttctcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcctaag cgactcaact tcaagctctt caacattcag 960
gtcaaagagg ttacggacaa caatggagtc aagaccatcg ccaataacct taccagcacg 1020
gtccaggtct tcacggactc ggagtaccag ttgccgtacg tcctcggctc tgcgcaccag 1080
ggctgcctcc ctccgttccc ggcggacgtg ttcatgattc cgcagtacgg ctacctaacg 1140
ctcaacaacg gtagtcaggc cgtgggacgc tcctccttct actgcctgga atactttcct 1200
tcgcagatgc tgagaaccgg caacaacttc cagtttactt acaccttcga ggacgtgcct 1260
ttccacagca gctacgccca cagccagagc ttggaccggc tgatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 91
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 91
atggctgccg atggttatct tccagattgg ctcgaggaca ctctctctga aggaataaga 60
cagtggtgga agctcaaacc tggcccacca ccaccaaagc ccgcagagcg gcataaggac 120
gacagcaggg gtcttgtgct tcctgggtac aagtacctcg gacccttcaa cggactcgac 180
aagggagagc cggtcaacga ggcagacgcc gcggccctcg agcacgacaa agcctacgac 240
cggcagctcg acagcggaga caacccgtac ctcaagtaca accacgccga cgcggagttt 300
caggagcgcc ttaaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaaga gggttctcga accttttggt ctggttgagg aaggtgctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcgcca caagagccag actcctcctc gggcattggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg acccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcacca atggcagaca ataacgaagg cgccgacgga 660
gtgggtaatg cctcaggaaa ttggcattgc gattccacat ggctgggcga cagagtcatc 720
accaccagca cccgaacatg ggccttgccc acctataaca accacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg acttcaacag attccactgc cacttctcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcctaag cgactcaact tcaagctctt caacattcag 960
gtcaaagagg ttacggacaa caatggagtc aagaccatcg ccaataacct taccagcacg 1020
gtccaggtct tcacggactc agactatcag ctcccgtacg tgctcgggtc ggctcacgag 1080
ggctgcctcc cgccgttccc agcggacgtt ttcatgattc ctcagtacgg ctacctaaca 1140
ctcaacaacg gtagtcaggc cgtgggacgc tcctccttct actgcctgga atactttcct 1200
tcgcagatgc tgagaaccgg caacaacttc cagtttactt acaccttcga ggacgtgcct 1260
ttccacagca gctacgcgca cagccagagt ctggaccggc tgatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgattttcg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcaccaga tacctgactc gtaatctgta a 2211
<210> 92
<211> 2208
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 92
atggctgccg atggttatct tccagattgg ctcgaggaca ctctctctga aggaataaga 60
cagtggtgga agctcaaacc tggcccacca ccaccaaagc ccgcagagcg gcataaggac 120
gacagcaggg gtcttgtgct tcctgggtac aagtacctcg gacccttcaa cggactcgac 180
aagggagagc cggtcaacga ggcagacgcc gcggccctcg agcacgacaa agcctacgac 240
cggcagctcg acagcggaga caacccgtac ctcaagtaca accacgccga cgcggagttt 300
caggagcgcc ttaaagaaga tacgtctttt gggggcaacc tcggacgagc agtcttccag 360
gcgaaaaaga gggttcttga acctctgggc ctggttgagg aacctgttaa gacggctccg 420
ggaaaaaaga ggccggtaga gcagtcgcca caagagccag actcctcctc gggcatcggc 480
aagaaaggcc agcagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg acccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcacca atggcggaca ataacgaagg cgccgatgga 660
gtgggtaatg cctcaggaaa ttggcattgc gattccacat ggctgggcga cagagtcatc 720
accaccagca cccgaacatg ggccttgccc acctataaca accacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg acttcaacag attccactgc cacttctcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcctaag cgactcaact tcaagctctt caacattcag 960
gtcaaagagg ttacggacaa caatggagtc aagaccatcg ccaataacct taccagcacg 1020
gtccaggtct tcacggactc agactatcag ctcccgtacg ttctcggctc tgcccaccag 1080
ggctgcctgc ctccgttccc ggcggacgtg ttcatgattc cccagtacgg ctacctaaca 1140
ctcaacaacg gtagtcaggc cgtgggacgc tcctccttct actgcctgga atactttcct 1200
tcgcagatgc tgagaaccgg caacaacttc cagtttactt acaccttcga ggacgtgcct 1260
ttccacagca gctacgccca cagccagagc ttggaccggc tgatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctg 2208
<210> 93
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 93
atggctgccg atggttatct tccagattgg ctcgaggaca ctctctctga aggaataaga 60
cagtggtgga agctcaaacc tggcccacca ccaccaaagc ccgcagagcg gcataaggac 120
gacagcaggg gtcttgtgct tcctgggtac aagtacctcg gacccttcaa cggactcgac 180
aagggagagc cggtcaacga ggcagacgcc gcggccctcg agcacgacaa agcctacgac 240
cagcagctcc aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc ttcaaggaga tacgtctttt gggggcaacc tcggacgagc agtcttccag 360
gccaaaaaga ggcttcttga acctcttggt ctggttgagg aagcggctaa gacggctcct 420
ggaaagaaga ggcctgtaga gcagtctcct caggaaccgg actcctccgc gggtattggc 480
aaatcgggtg cacagcccgc taaaaagaga ctcaatttcg gtcagactgg cgacacagag 540
tcagtcccag accctcaacc aatcggagaa cctcccgcag ccccctcagg tgtgggatct 600
cttacaatgg cttcaggtgg tggcgcacca gtggcagaca ataacgaagg tgccgatgga 660
gtgggtagtt cctcgggaaa ttggcattgc gattcccaat ggctggggga cagagtcatc 720
accaccagca cccgaacatg ggccttgccc acctataaca accacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg acttcaaccg cttccactgc cacttctcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcccaag agactcagct tcaagctctt caaccatcca 960
ggtcaaggag gtcacgcaga atgaaggcac caagaccatc gccaataacc tcaccagcac 1020
atccaggtgt ttacggactc ggagtaccag ctgccgtacg ttctcggctc tgcccaccag 1080
ggctgcctgc ctccgttccc ggcggacgtg ttcatgattc cccagtacgg ctacctaaca 1140
ctcaacaacg gtagtcaggc cgtgggacgc tcctccttct actgcctgga atactttcct 1200
tcgcagatgc tgagaaccgg caacaacttc cagttcactt acaccttcga ggacgtgcct 1260
ttccacagca gctacgcgca cagccagagc ttggaccggc tgatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt gggtaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctcatcaaa aacacacctg tacctgcgga tcctccaacg 1980
gccttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 94
<211> 2214
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 94
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg acttgaaaca tggagccccg aaacccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggatgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaaga gggttctcga accttttggt ctggttgagg aaggtgctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcgcca caagagccag actcctcctc gggcattggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg acccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcacca atggcagaca ataacgaagg cgccgacgga 660
gtgggtaatg cctcaggaaa ttggcattgc gattccacat ggctgggcga cagagtcatc 720
accaccagca cccgaacatg ggccttgccc acctataaca accacctcta caagcaaatc 780
tccaacggga cttcgggagg aagcaccaac gacaacacct acttcggcta cagcaccccc 840
tgggggtatt ttgactttaa cagattccac tgccacttct caccacgtga ctggcagcga 900
ctcatcaaca acaactgggg attccggccc aagagactca acttcaaact cttcaacatc 960
caagtcaagg aggtcacgca gaatgaaggc accaagacca tcgccaataa cctcaccagc 1020
accatccagg tgtttacgga ctcggagtac cagctgccgt acgttctcgg ctccgcccac 1080
cagggctgcc tgcctccgtt cccggcggac gtgttcatga ttccccagta cggctaccta 1140
acactcaaca acggtagtca ggccgtggga cgctcctcct tctactgcct ggaatacttt 1200
ccttcgcaga tgctgagaac gggcaacaac tttaccttca gctacacctt tgaggacgtt 1260
cctttccaca gcagctacgc tcacagccag agtctggacc gtctcatgaa tcctctgatt 1320
gaccagtacc tgtactactt gtctcggact caaacaacag gaggcacggc aaatacgcag 1380
actctgggct tcagccaagg tgggcctaat acaatggcca atcaggcaaa gaactggctg 1440
ccaggaccct gttaccgcca acaacgcgtc tcaacgacaa ccgggcaaaa caacaatagc 1500
aactttgcct ggactgctgg gaccaaatac catctgaatg gaagaaattc attggctaat 1560
cctggcatcg ctatggcaac acacaaagac gacaaggagc gtttttttcc cagtaacggg 1620
atcctgattt ttggcaaaca aaatgctgcc agagacaatg cggattacag cgatgtcatg 1680
ctcaccagcg aggaagaaat caaaaccact aaccctgtgg ctacagagga atacggtatc 1740
gtggcagata acttgcagca gcaaaacacg gctcctcaaa ttggaactgt caacagccag 1800
ggggccttac ccggtatggt ctggcagaac cgggacgtgt acctgcaggg tcccatctgg 1860
gccaagattc ctcacacgga cggcaacttc cacccgtctc cgctgatggg cggctttggc 1920
ctgaaacatc ctccgcctca gatcctgatc aagaacacgc ctgtacctgc ggatcctccg 1980
accaccttca accagtcaaa gctgaactct ttcatcacgc aatacagcac cggacaggtc 2040
agcgtggaaa ttgaatggga gctgcagaag gaaaacagca agcgctggaa ccccgagatc 2100
cagtacacct ccaactacta caaatctaca agtgtggact ttgctgttaa tacagaaggc 2160
gtgtactctg atccccaccc cattggcacc cgttacctca cccgtcccct gtaa 2214
<210> 95
<211> 2214
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 95
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg cgctgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aaaggagagc cggtcaacga ggcggacgcg gcagccctcg aacacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaagc gggttctcga acctctcggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaga gaccggtaga gccatcaccc cagcgttctc cagactcctc tacgggcatc 480
ggcaagaaag gccagcagcc cgccagaaaa agactcaatt ttggtcagac tggcgactca 540
gagtcagttc cagaccctca acctctcgga gaacctccag cagcgccctc tggtgtggga 600
cctaatacaa tggcttcagg cggtggcgca ccaatggcag acaataacga gggcgccgac 660
ggagtgggta attcctcggg aaattggcat tgcgattcca catggatggg cgacagagtc 720
atcaccacca gcacccgaac ctgggccctg cccacctaca acaaccacct ctacaagcaa 780
atctccagtg cttcaacggg ggccagcaac gacaaccact acttcggcta cagcaccccc 840
tgggggtatt ttgactttaa cagattccac tgccactttt caccacgtga ctggcagcga 900
ctcatcaaca acaactgggg attccggccc aagagactca acttcaagct cttcaacatc 960
caagtcaagg aggtcacgca gaatgaaggc accaagacca tcgccaataa cctcaccagc 1020
accatccagg tgtttacgga ctcggagtac cagctgccgt acgttctcgg ctctgcccac 1080
cagggctgcc tgcctccgtt cccggcggac gtgttcatga ttccccagta cggctaccta 1140
acactcaaca acggtagtca ggccgtggga cgctcctcct tctactgcct ggaatacttt 1200
ccttcgcaga tgctgagaac cggcaacaac ttccagttta cttacacctt cgaggacgtg 1260
cctttccaca gcagctacgc gcacagccag agcttggacc ggctgatgaa tcctctgatt 1320
gaccagtacc tgtactactt gtctcggact caaacaacag gaggcacggc aaatacgcag 1380
actctgggct tcagccaagg tgggcctaat acaatggcca atcaggcaaa gaactggctg 1440
ccaggaccct gttaccgcca acaacgcgtc tcaacgacaa ccgggcaaaa caacaatagc 1500
aactttgcct ggactgctgg gaccaaatac catctgaatg gaagaaattc attggctaat 1560
cctggcatcg ctatggcaac acacaaagac gacaaggagc gtttttttcc cagtaacggg 1620
atcctgattt ttggcaaaca aaatgctgcc agagacaatg cggattacag cgatgtcatg 1680
ctcaccagcg aggaagaaat caaaaccact aaccctgtgg ctacagagga atacggtatc 1740
gtggcagata acttgcagca gcaaaacacg gctcctcaaa ttggaactgt caacagccag 1800
ggggccttac ccggtatggt ctggcagaac cgggacgtgt acctgcaggg tcccatctgg 1860
gccaagattc ctcacacgga cggcaacttc cacccgtctc cgctgatggg cggctttggc 1920
ctgaaacatc ctccgcctca gatcctgatc aagaacacgc ctgtacctgc ggatcctccg 1980
accaccttca accagtcaaa gctgaactct ttcatcacac aatacagcac cggacaggtc 2040
agcgtggaaa ttgaatggga gctgcagaag gaaaacagca agcgctggaa ccccgagatc 2100
cagtacacct ccaactacta caaatctaca agtgtggact ttgctgttaa tacagaaggc 2160
gtgtactctg aaccccaccc cattggcacc cgttacctca cccgtcccct gtaa 2214
<210> 96
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<220>
<221> неопределенный признак
<222> (676)..(676)
<223> n представляет собой a, c, g или t
<400> 96
atggctgccg atggttatct tccagattgg ctcgaggaca ctctctctga aggaataaga 60
cagtggtgga agctcaaacc tggcccacca ccaccaaagc ccgcagagcg gcataaggac 120
gacagcaggg gtcttgtgct tcctgggtac aagtacctcg gacccttcaa cggactcgac 180
aagggagagc cggtcaacga ggcagacgcc gcggccctcg agcacgacaa agcctacgac 240
cggcagctcg acagcggaga caacccgtac ctcaagtaca accacgccga cgcggagttt 300
caggagcgcc ttaaagaaga tacgtctttt gggggcaacc tcggacgagc agtcttccag 360
gcgaaaaaga gggttcttga acctctgggc ctggttgagg aacctgttaa gacggctccg 420
ggaaaaaaga ggccggtaga gcagtcgcca caagagccag actcctcctc gggcatcggc 480
aagaaaggcc agcagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg acccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcacca atggcggaca ataacgaagg cgccgatgga 660
gtgggtaatg cctcangaaa ttggcattgc gattccacat ggctgggcga cagagtcatc 720
accaccagca cccgaacatg ggccttgcca cctataacaa ccacctctac aagcaaatct 780
ccagtgcttc aacgggggcg cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg acttcaacag attccactgc cacttctcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcctaag cgactcaact tcaagctctt caacattcag 960
gtcaaagagg ttacggacaa caatggagtc aagaccatcg ccaataacct taccagcacg 1020
gtccaggtct tcacggactc agactatcag ctcccgtacg ttctcggctc tgcccaccag 1080
ggctgcctgc ctccgttccc ggcggacgtg ttcatgattc cccagtacgg ctacctaaca 1140
ctcaacaacg gtagtcaggc cgtgggacgc tcctccttct actgcctgga atactttcct 1200
tcgcagatgc tgagaaccgg caacaacttc cagtttactt acaccttcga ggacgtgcct 1260
ttccacagca gctacgccca cagccagagc ttggaccggc tgatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtttg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacacagt actccacggg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc ggagatccag 2100
tacacttcca actactacaa atctacaaat gtggactttg ctgttaacac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 97
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<220>
<221> неопределенный признак
<222> (715)..(715)
<223> n представляет собой a, c, g или t
<400> 97
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg acttgaaacc tggagccccg aaacccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggatgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctcc aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc ttcaaggaga tacgtctttt gggggcaacc tcggacgagc agtcttccag 360
gccaagaagc gggttctcga acctctcggt ctggttgagg aagcggctaa gacggctcct 420
ggaaagaaga ggcctgtaga gcagtctcct caggaaccgg actcctccgc gggtattggc 480
aaatcgggtg cacagcccgc taaaaagaga ctcaatttcg gtcagactgg cgacacagag 540
tcagtcccag accctcaacc aatcggagaa cctcccgcag ccccctctgg tgtgggacct 600
aatacaatgg ctgcaggcgg tggcgcacca atggcagaca ataacgaagg cgccgatgga 660
gtgggtagtt cctcgggaaa ttggcattgc gattccacat ggctgggcga cagantcatc 720
accaccagca cccgaacctg ggccctgccc acctataaca accatctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg acttcaacag attccactgc cacttctcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcctaag cgactcaact tcaagctctt caacattcag 960
gtcaaagagg ttacggacaa caatggagtc aagaccatcg ccaataacct taccagcacg 1020
gtccaggtct tcacggactc ggagtaccag ttgccgtacg tcctcggctc tgcgcaccag 1080
ggctgcctgc ctccgttccc ggcggacgtg ttcatgattc cgcagtacgg ctacctaacg 1140
ctcaacaatg gcagccaggc agtgggacgg tcatcctttt actgcctgga atatttccca 1200
tcgcagatgc tgagaacggg caacaacttt accttcagct acacttttga ggacgttcct 1260
ttccacagca gctacgctca cagccagagt ctggaccgtc tcatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg gacaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact ttcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 98
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 98
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg cgctgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aaaggagagc cggtcaacga ggcggacgcg gcagccctcg aacacgacaa agcttacgac 240
cagcagctca aggccggtga caacccctac ctcaagtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaaaaaga ggcttcttga acctcttggt ctggttgagg aagcggctaa gacggctcct 420
ggaaagaaga ggcctgtaga gcagtctcct caggaaccgg actcctccgc gggtattggc 480
aaatcgggtg cacagcccgc taaaaagaga ctcaatttcg gtcagactgg cgacacagag 540
tcagtcccag acccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcacca atggcggaca ataacgaagg cgccgatgga 660
gtgggtaatg cctcaggaaa ttggcattgc gattccacat ggctgggcga cagagtcatc 720
accaccagca cccgaacatg ggccttgccc acctataaca accacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg acttcaacag attccactgc cacttctcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcccaag agactcagct tcaagctctt caacatccag 960
gtcaaggagg tcacgcagaa tgaaggcacc aagaccatcg ccaataacct caccagcacc 1020
atccaggtgt ttacggactc ggagtaccag ctgccgtacg ttctcggctc cgcccaccag 1080
ggctgcctgc ctccgttccc ggcggacgtg ttcatgattc cccagtacgg ctacctaaca 1140
ctcaacaacg gtagtcaggc cgtgggacgc tcctccttct actgcctgga atactttcct 1200
tcgcagatgc tgagaaccgg caacaacttc cagtttactt acaccttcga ggacgtgcct 1260
ttccacagca gctacgccca cagccagagc ttggaccggc tgatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 99
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 99
atggctgccg atggttatct tccagattgg ctcgaggaca ctctctctga aggaataaga 60
cagtggtgga agctcaaacc tggcccacca ccaccaaagc ccgcagagcg gcataaggac 120
gacagcaggg gtcttgtgct tcctgggtac aagtacctcg gacccttcaa cggactcgac 180
aagggagagc cggtcaacga ggcagacgcc gcggccctcg agcacgacaa agcctacgac 240
cagcagctcc aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc ttcaaggaga tacgtctttt gggggcaacc tcggacgagc agtcttccag 360
gccaaaaaga ggcttcttga acctcttggt ctggttgagg aagcggctaa gacggctcct 420
ggaaagaaga ggcctgtaga gcagtctcct caggaaccgg actcctccgc gggtattggc 480
aaatcgggtg cacagcccgc taaaaagaga ctcaatttcg gtcagactgg cgacacagag 540
tcagtcccag accctcaacc aatcggagaa cctcccgcag ccccctcagg tgtgggatct 600
cttacaatgg cttcaggtgg tggcgcacca gtggcagaca ataacgaagg tgccgatgga 660
gtgggtagtt cctcgggaaa ttggcattgc gattcccaat ggctggggga cagagtcatc 720
accaccagca cccgaacatg ggccttgccc acctataaca accacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg acttcaaccg cttccactgc cacttctcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcccaag agactcagct tcaagctctt caacatccag 960
gtcaaggagg tcacgcagaa tgaaggcacc aagaccatcg ccaataacct caccagcacc 1020
atccaggtgt ttacggactc ggagtaccag ctgccgtacg ttctcggctc tgcccaccag 1080
ggctgcctgc ctccgttccc ggcggacgtg ttcatgattc cccagtacgg ctacctaaca 1140
ctcaacaacg gtagtcaggc cgtgggacgc tcctccttct actgcctgga atactttcct 1200
tcgcagatgc tgagaaccgg caacaacttc cagtttactt acaccttcga ggacgtgcct 1260
ttccacagca gctacgccca cagccagagc ttggaccggc tgatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 100
<211> 2217
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 100
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggaataaga 60
cagtggtgga agctcaaacc tggcccacca ccaccaaagc ccgcagagcg gcataaggac 120
gacagcaggg gtcttgtgct tcctgggtac aagtacctcg gacccttcaa cggactcgac 180
aagggagagc cggtcaacgc ggcggacgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaagc gggttctcga acctctcggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaga gaccggtaga gccatcaccc cagcgttctc cagactcctc tacgggcatc 480
ggcaagaaag gccagcagcc cgctaaaaag agactcaatt ttggtcagac tggcgactca 540
gagtcagtcc ccgacccaca acctctcgga gaacctccag caacccccgc tgctgtggga 600
cctactacaa tggcttcagg cggtggcgca ccaatggcag acaataacga aggcgccgac 660
ggagtgggta atgcctcagg aaattggcat tgcgattcca catggctggg ggacagagtc 720
atcaccacca gcacccgaac ctgggccctg cccacctaca acaaccacct ctacaagcaa 780
atctccaacg ggacttcggg aggaagcacc aacgacaaca cctacttcgg ctgcgtcacg 840
ccctgggggt attttgactt taacaaattc cactgccact tttcaccgga tgactggcaa 900
cgactcatca acaacggctg gggattccgg actaagcgac tcaacttcaa gctcttcagc 960
atgaaagtca aaaagggtac ggacaacact ggaatcaaga ccatcgcgaa taaccttacc 1020
aacacggtcc atgtcttcgc ggactcggag taccagttgc cgtacgtcct cggctctgcg 1080
caccagggct gcctccctcc gttcccggcg gacgtgttca tgattccgca gtacggctac 1140
ctaacgctca acaatggcag ccaggcagtg ggacggtcat ccttttactg cctggaatat 1200
ttcccatcgc agatgctgag aacgggcaac aactttacct tcagctacac ctttgaggac 1260
gttcctttcc acagcagcta cgctcacagc cagagtctgg accgtctcat gaatcctctg 1320
attgaccagt acctgtacta cttgtctcgg actcaaacaa caggaggcac ggcaaatacg 1380
cagactctgg gcttcagcca aggtgggcct aatacaatgg ccaatcaggc aaagaactgg 1440
ctgccaggac cctgttaccg ccaacaacgc gtctcaacga caaccgggca aaacaacaat 1500
agcaactttg cctggactgc tgggaccaaa taccatctga atggaagaaa ttcattggct 1560
aatcctggca tcgctatggc aacacacaaa gacgacaagg agcgtttttt tcccagtaac 1620
gggatcctga tttttggcaa acaaaatgct gccagagaca atgcggatta cagcgatgtc 1680
atgctcacca gcgaggaaga aatcaaaacc actaaccctg tggctacaga ggaatacggt 1740
atcgtggcag ataacttgca gcagcaaaac acggctcctc aaattggaac tgtcaacagc 1800
cagggggcct tacccggtat ggtctggcag aaccgggacg tgtacctgca gggtcccatc 1860
tgggccaaga ttcctcacac ggacggcaac ttccacccgt ctccgctgat gggcggcttt 1920
ggcctgaaac atcctccgcc tcagatcctg atcaagaaca cgcctgtacc tgcggatcct 1980
ccgaccacct tcaaccagtc aaagctgaac tctttcatca cgcaatacag caccggacag 2040
gtcagcgtgg agatcgagtg ggagctgcag aaggaaaaca gcaagcgctg gaacccggag 2100
atccagtaca cctccaacta ctacaaatct acaagtgtgg actttgctgt taatacagaa 2160
ggcgtgtact ctgaacccca ccccattggc acccgttacc tcacccgtcc cctgtaa 2217
<210> 101
<211> 2214
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 101
atggctgccg atggttatct tccagattgg ctcgaggaca ctctctctga aggaataaga 60
cagtggtgga agctcaaacc tggcccacca ccaccaaagc ccgcagagcg gcataaggac 120
gacagcaggg gtcttgtgct tcctgggtac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggacgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaagc gggttctcga acctctcggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaga gaccggtaga gccatcaccc cagcgttctc cagactcctc tacgggcatc 480
ggcaagaaag gccagcagcc cgcgaaaaag agactcaact ttgggcagac tggcgactca 540
gagtcagtgc ccgaccctca accaatcgga gaaccccccg caggcccctc tggtctggga 600
tctggtacaa tggctgcagg cggtggcgct ccaatggcag acaataacga aggcgccgat 660
ggagtgggta gttcctcggg aaattggcat tgcgattcca catggctggg ggacagagtc 720
atcaccacca gcacccgaac ctgggccctg cccacctaca acaaccacct ctacaaacaa 780
atttccagcg cttcaacggg agcctcgaac gacaatcact actttggcta cagcaccccc 840
tgggggtatt ttgacttcaa cagattccac tgccacttct caccacgtga ctggcagcga 900
ctcatcaaca acaactgggg attccggcct aagcgactca acttcaagct cttcaacatt 960
caggtcaaag aggttacgga caacaatgga gtcaagacca tcgccaataa ccttaccagc 1020
acggtccagg tcttcacgga ctcggagtac cagttgccgt acgtcctcgg ctctgcgcac 1080
cagggctgcc tccctccgtt cccggcggac gtgttcatga ttccgcagta cggctaccta 1140
acgctcaaca atggcagcca ggcagtggga cggtcatcct tttactgcct ggaatatttc 1200
ccatcgcaga tgctgagaac gggcaacaac tttaccttca gctacacctt tgaggacgtt 1260
cctttccaca gcagctacgc tcacagccag agtctggacc gtctcatgaa tcctctgatt 1320
gaccagtacc tgtactactt gtctcggact caaacaacag gaggcacggc aaatacgcag 1380
actctgggct tcagccaagg tgggcctaat acaatggcca atcaggcaaa gaactggctg 1440
ccaggaccct gttaccgcca acaacgcgtc tcaacgacaa ccgggcaaaa caacaatagc 1500
aactttgcct ggactgctgg gaccaaatac catctgaatg gaagaaattc attggctaat 1560
cctggcatcg ctatggcaac acacaaagac gacaaggagc gtttttttcc cagtaacggg 1620
atcctgattt ttggcaaaca aaatgctgcc agagacaatg cggattacag cgatgtcatg 1680
ctcaccagcg aggaagaaat caaaaccact aaccctgtgg ctacagagga atacggtatc 1740
gtggcagata acctgcagca gcaaaacacg gctcctcaaa ttggaactgt caacagccag 1800
ggggccttac ccggtatggt ctggcagaac cgggacgtgt acctgcaggg tcccatctgg 1860
gccaagattc ttcacacgga cggcaacttt cacccttctc cgctgatggg agggtttgga 1920
atgaagcacc cgcctcctcc gatcctgatc aagaacacgc ctgtacctgc ggatcctccg 1980
accaccttca accagtcaaa gctgaactct ttcatcacgc aatacagcac cggacaggtc 2040
agcgtggaaa ttgaatggga gctgccgaag gaaaacagca agcgctggaa ccccgagatc 2100
cagtacacct ccaactacta caaatctaca agtgtggact ttgctgttaa tacagaaggt 2160
gtgtactatg aaccccaccc cattggcacc cgttacctca cccctcccct gtaa 2214
<210> 102
<211> 2214
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 102
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg cgctgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggacgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaagc gggttctcga acctctcggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaga gaccggtaga gccatcaccc cagcgctctc cagactcctc tacgggcatc 480
ggcaagaaag gccaacagcc cgccagaaaa agactcaatt ttggtcagac tggcgactca 540
gagtcagttc cagaccctca acctctcgga gaacctccag cagcgccctc tggtgtggca 600
cctaatacaa tggctgcagg cggtggcgca ccaatggcag acaataacga aggcgccgac 660
ggagtgggta atgcctcagg aaattggcat tgcgattcca catggctggg cgacagagtc 720
atcaccacca gcacccgaac atgggccttg cccacctata acaaccacct ctacaagcaa 780
atctccagtg cttcaacggg ggccagcaac gacaaccact acttcggcta cagcaccccc 840
tgggggtatt ttgatttcaa cagattccac tgccactttt caccacgtga ctggcagcga 900
ctcatcacaa caattggggg attccggcct aagcgactca acttcaagct cttcaacatt 960
caggtcaaag aggttacgga caacaatgga gtcaagacca tcgccaataa ccttaccagc 1020
acggtccagg tcttcacgga ctcggagtac cagttgccgt acgtcctcgg ctctgcgcac 1080
cagggctgcc tccctccgtt cccggcggac gtgttcatga ttccgcagta cggctaccta 1140
acgctcaaca atggcagcca ggcagtggga cggtcatcct tttactgcct ggaatatttc 1200
ccatcgcaga tgctgagaac gggcaacaac tttaccttca gctacacctt tgaggacgtt 1260
cctttccaca gcagctacgc tcacagccag agtctggacc ggctgatgaa tcctctgatt 1320
gaccagtacc tgtactactt gtctcggact caaacaacag gaggcacggc aaatacgcag 1380
actctgggct tcagccaagg tgggcctaat acaatggcca atcaggcaaa gaactggctg 1440
ccaggaccct gttaccgcca acaacgcgtc tcaacgacaa ccgggcaaaa caacaatagc 1500
aactttgcct ggactgctgg gaccaaatac catctgaatg gaagaaattc attggctaat 1560
cctggcatcg ctatggcaac acacaaagac gacaaggagc gtttttttcc cagtaacggg 1620
atcctgattt ttggcaaaca aaatgctgcc agagacaatg cggattacag cgatgtcatg 1680
ctcaccagcg aggaagaaat caaaaccact aaccctgtgg ctacagagga atacggtatc 1740
gtggcagata acttgcagca gcaaaacacg gctcctcaaa ttggaactgt caacagccag 1800
ggggccttac ccggtatggt ctggcagaac cgggacgtgt acctgcaggg tcccatctgg 1860
gccaagattc ctcacacgga cggcaacttc cacccgtctc cgctgatggg cggctttggc 1920
ctgaaacatc ctccgcctca gatcctgatc aagaacacgc ctgtacctgc ggatcctccg 1980
accaccttca accagtcaaa gctgaactct ttcatcacgc aatacagcac cggacaggtc 2040
agcgtggaaa ttgaatggga gctgcagaag gaaaacagca agcgctggaa ccccgagatc 2100
cagtacacct ccaactacta caaatctaca agtgtggact ttgctgttaa tacagaaggc 2160
gtgtactctg aaccccaccc cattggcacc cgttacctca cccgtcccct gtaa 2214
<210> 103
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 103
atggctgccg atggttatct tccagattgg ctcgaggaca ctctctctga aggaataaga 60
cagtggtgga agctcaaacc tggcccacca ccaccaaagc ccgcagagcg gcataaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggacgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcggacgagc agtcttccag 360
gcgaaaaaga gggttcttga acctctgggc ctggttgagg aacctgttaa gacggctccg 420
ggaaaaaaga ggccggtaga gcagtcgcca caagagccag actcctcctc gggcatcggc 480
aagaaaggcc agcagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg acccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcacca atggcagaca ataacgaagg cgccgacgga 660
gtgggtaatg cctcaggaaa ttggcattgc gattccacat ggatgggcga cagagtcatc 720
accaccagca cccgaacatg ggccttgccc acctataaca accacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg actttaacag attccactgc cacttttcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcctaag cgactcaact tcaagctctt caacattcag 960
gtcaaggagg tcacgcagaa tgaaggcacc aagaccatcg ccaataacct caccagcacc 1020
atccaggtgt ttacggactc ggagtaccag ctgccgtacg ttctcggctc cgcccaccag 1080
ggctgcctgc ctccgttccc ggcggacgtg ttcatgatcc cccagtacgg ctacctaaca 1140
ctcaacaacg gtagtcaggc cgtgggacgc tcctccttct actgcctgga atactttcct 1200
tcgcagatgc tgagaaccgg caacaacttc cagtttactt acaccttcga ggacgtgcct 1260
ttccacagca gctacgcgca cagccagagc ttggaccggc tgatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc acgcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg cttcggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 104
<211> 2214
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 104
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctca gggcattcgc 60
gagtggtggg acttgaaacc tggagccccg aaacccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggacgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcggacgagc agtcttccag 360
gccaagaagc gggttctcga acctctcggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaga gaccggtaga gccatcaccc cagcgttctc cagactcctc tacgggcatc 480
ggcaagaaag gccaacagcc cgccagaaaa agactcaatt ttggtcagac tggcgactca 540
gagtcagttc cagaccctca acctctcgga gaacctccag cagcgcccgc tgctgtggga 600
cctactacaa tggcttcagg cggtggcgca ccaatggcag acaataacga aggcgccgac 660
ggagtgggta gttcctcggg aaattggcat tgcgattccc aatggctggg ggacagagtc 720
atcaccacca gcacccgaac ctgggccctg cccacctaca acaaccacct ctacaagcaa 780
atctccagtg cttcaacggg ggccagcaac gacaaccact acttcggcta cagcaccccc 840
tgggggtatt ttgacttcaa cagattccac tgccactttt caccacgtga ctggcaaaga 900
ctcatcaaca acaactgggg attccggccc aagagactca gcttcaagct cttcaacatc 960
caggtcaagg aggtcacgca gaatgaaggc accaagacca tcgccaataa cctcaccagc 1020
accatccagg tgtttacgga ctcggagtac cagctgccgt acgttctcgg ctctgcccac 1080
cagggctgcc tgcctccgtt cccggcggac gtgttcatga ttccccagta cgggtacctg 1140
actctgaaca atggcagtca ggccgtgggc cgttcctcct tctactgcct ggagtacttt 1200
ccttctcaaa tgctgagaac cggcaacaac ttccagttta cttacacctt cgaggacgtg 1260
cctttccaca gcagctacgc ccacagccag agcttggacc ggctgatgaa tcctctgatt 1320
gaccagtacc tgtactactt gtctcggact caaacaacag gaggcacgac aaatgcgcag 1380
actctgggct tcagccaagg tgggcctaat acaatggcca atcaggcaaa gaactggctg 1440
ccaggaccct gttaccgcca acaacgcgtc tcaacgacaa ccgggcaaaa caacaatagc 1500
aactttgcct ggactgctgg gaccaaatac catctgaatg gaagaaattc attggctaat 1560
cctggcatcg ctatggcaac acacaaagac gacaaggagc gtttttttcc cagtaacggg 1620
atcctgattt ttggcaaaca aaatgctgcc agagacaatg cggattacag cgatgtcatg 1680
ctcaccagcg aggaagaaat caaaaccact aaccctgtgg ctacagagga atacggtatc 1740
gtggcagata acttgcagca gcaaaacacg gctcctcaaa ttggaactgt caacagccag 1800
ggggccttac ccggtatggt ctggcagaac cgggacgtgt acctgcaggg tcccatctgg 1860
gccaagattc ctcacacgga cggcaacttc cacccgtctc cgctgatggg cggctttggc 1920
ctgaaacatc ctccgcctca gatcctgatc aagaacacgc ctgtacctgc ggatcctccg 1980
accaccttca accagtcaaa gctgaactct ttcatcacac agtactccac gggacaggtc 2040
agcgtggaaa ttgaatggga gctgcagaag gaaaacagca agcgctggaa cccggagatc 2100
cagtacactt ccaactacta caaatctaca aatgtggact ttgctgttaa cacagaaggc 2160
gtgtactctg aaccccaccc cattggcacc cgttacctca cccgtcccct gtaa 2214
<210> 105
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 105
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg acttgaaacc tggagccccg aaacccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggacgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaaga gggttctcga accttttggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcgcca caagagccag actcctcctc gggcatcggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaatttcg gtcagactgg cgacacagag 540
tcagtcccag accctcaacc aatcggagaa cctcccgcag ccccctcagg tgtgggacct 600
aatacaatgg ctgcaggcgg tggcgcacca atggcagaca ataacgaagg cgccgacgga 660
gtgggtagtt cctcgggaaa ttggcattgc gattccacat ggatgggtga cagagtcatc 720
accaccagca cccgaacctg ggccctgccc acctacaata accacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg acttcaacag attccactgc cacttctcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcctaag cgactcaact tcaagctctt caacattcag 960
gtcaaggagg tcacgcagaa tgaaggcacc aagaccatcg ccaataacct caccagcacc 1020
atccaggtgt ttacggactc ggagtaccag ctgccgtacg ttctcggctc tgcccaccag 1080
ggctgcctgc ctccgttccc ggcggacgtg ttcatgattc cccagtacgg ctacctaaca 1140
ctcaacaacg gtagtcaggc cgtgggacgc tcctccttct actgcctgga atactttcct 1200
tcgcagatgc tgagaaccgg caacaacttc cagtttactt acaccttcga ggacgtgcct 1260
ttccacagca gctacgccca cagccagagc ttggaccggc tgatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacacagt actccacggg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc ggagatccag 2100
tacacttcca actactacaa atctacaaat gtggactttg ctgttaacac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacttcaccc gtcccctgta a 2211
<210> 106
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 106
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg acttgaaacc tggagccccg aaacccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggacgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaagc gggttctcga acctctcggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcgcca caagagccag actcctcctc gggcatcggc 480
aagacaggcc agcagcccgc taaaaaaaga ctcaattttg gtcagactgg cgactcagag 540
tcagttccag accctcaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggtgg tggcgcacca atggcagaca ataacgaggg cgccgacgga 660
gtgggtaatt cctcgggaaa ttggcattgc gattccacat ggatgggcga cagagtcatc 720
accaccagca cccgaacctg ggccctgccc acctacaaca atcacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg acttcaacag attccactgc cacttctcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcctaag cgactcaact tcaagctctt caacattcag 960
gtcaaagagg ttacggacaa caatggagtc aagaccatcg ccaataacct taccagcacg 1020
gtccaggtct tcacggactc ggagtaccag ttgccgtacg tcctcggctc tgcgcaccag 1080
ggctgcctcc ctccgttccc ggcggacgtg ttcatgattc cgcagtacgg ctacctaacg 1140
ctcaacaacg gtagtcaggc cgtgggacgc tcctccttct actgcctgga atactttcct 1200
tcgcagatgc tgagaaccgg caacaacttc cagtttactt acaccttcga ggacgtgcct 1260
ttccacagca gctacgccca cagccagagc ttggaccggc tgatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctcg acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat ctgaatggaa gaaattcatt ggctaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgctgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtatcgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtttg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtctccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacacagt actccacggg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc ggagatccag 2100
tacacttcca actactacaa atctacaaat gtggactttg ctgttaacac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 107
<211> 2211
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 107
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg acttgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggacgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca aagcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaagc gggttctcga acctctcggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaac gtccggtaga gcagtcacca caagagccag actcctcctc gggcatcggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaattttg gtcagactgg cgactcagag 540
tcagtccccg acccacaacc tctcggagaa cctccagcaa cccccgctgc tgtgggacct 600
actacaatgg cttcaggcgg tggcgcacca atggcggaca ataacgaagg cgccgatgga 660
gtgggtaatg cctcaggaaa ttggcattgc gattccacat ggctgggcga cagagtcatc 720
accaccagca cccgaacatg ggccttgccc acctataaca accacctcta caagcaaatc 780
tccagtgctt caacgggggc cagcaacgac aaccactact tcggctacag caccccctgg 840
gggtattttg actttaacag attccactgc cacttctcac cacgtgactg gcagcgactc 900
atcaacaaca actggggatt ccggcccaag agactcaact tcaagctctt caacatccag 960
gtcaaggagg tcacgcagaa tgaaggcacc aagaccatcg ccaataacct caccagcacc 1020
atccaggtgt ttacggactc ggagtaccag ctgccgtacg ttctcggctc tgcccaccag 1080
ggctgcctgc ctccgttccc ggcggacgtg ttcatgattc cccagtacgg ctacctgact 1140
ctgaacaatg gcagtcaggc cgtgggccgt tcctccttct actgcctaga gtactttcct 1200
tctcaaatgc tgagaacggg caacaacttt gagttcagct accagtttga ggacgtgcct 1260
tttcacagca gctacgcgca cagccaaagc ctggaccggc tgatgaatcc tctgattgac 1320
cagtacctgt actacttgtc tcggactcaa acaacaggag gcacggcaaa tacgcagact 1380
ctgggcttca gccaaggtgg gcctaataca atggccaatc aggcaaagaa ctggctgcca 1440
ggaccctgtt accgccaaca acgcgtctca acgacaaccg ggcaaaacaa caatagcaac 1500
tttgcctgga ctgctgggac caaataccat atgaatggaa gaaattcatt ggttaatcct 1560
ggcatcgcta tggcaacaca caaagacgac aaggagcgtt tttttcccag taacgggatc 1620
ctgatttttg gcaaacaaaa tgttgccaga gacaatgcgg attacagcga tgtcatgctc 1680
accagcgagg aagaaatcaa aaccactaac cctgtggcta cagaggaata cggtattgtg 1740
gcagataact tgcagcagca aaacacggct cctcaaattg gaactgtcaa cagccagggg 1800
gccttacccg gtatggtctg gcagaaccgg gacgtgtacc tgcagggtcc catctgggcc 1860
aagattcctc acacggacgg caacttccac ccgtcgccgc tgatgggcgg ctttggcctg 1920
aaacatcctc cgcctcagat cctgatcaag aacacgcctg tacctgcgga tcctccgacc 1980
accttcaacc agtcaaagct gaactctttc atcacgcaat acagcaccgg acaggtcagc 2040
gtggaaattg aatgggagct gcagaaggaa aacagcaagc gctggaaccc cgagatccag 2100
tacacctcca actactacaa atctacaagt gtggactttg ctgttaatac agaaggcgtg 2160
tactctgaac cccaccccat tggcacccgt tacctcaccc gtcccctgta a 2211
<210> 108
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 108
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Thr Leu Ser
1 5 10 15
Glu Gly Ile Arg Gln Trp Trp Lys Leu Lys Pro Gly Pro Pro Pro Pro
20 25 30
Lys Pro Ala Glu Arg His Lys Asp Asp Ser Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Glu Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Arg Gln Leu Asp Ser Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Lys Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Pro Val Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Lys Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ala
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Met Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Arg Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Thr Phe Ser Tyr Thr Phe
405 410 415
Glu Glu Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 109
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 109
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Asp Leu Lys Pro Ala Ser Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Leu Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Ala Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ala Gly Ile Gly
145 150 155 160
Lys Ser Gly Ala Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Gly Thr Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Ala Pro Ser Gly Val Gly Pro Asn Thr Met Ala Ala Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Ser Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Gln Asn Glu Gly Thr Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 110
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 110
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Thr Leu Ser
1 5 10 15
Glu Gly Ile Arg Gln Trp Trp Lys Leu Lys Pro Gly Pro Pro Pro Pro
20 25 30
Lys Pro Ala Glu Arg His Lys Asp Asp Ser Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Glu Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Arg Gln Leu Asp Ser Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Lys Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Phe Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ala
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Asp Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Glu Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Asn Leu
725 730 735
<210> 111
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 111
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Asp Leu Glu Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ala
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 112
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 112
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Thr Leu Ser
1 5 10 15
Glu Gly Ile Arg Gln Trp Trp Lys Leu Lys Pro Gly Pro Pro Pro Pro
20 25 30
Lys Pro Ala Glu Arg His Lys Asp Asp Ser Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Glu Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Arg Gln Leu Asp Ser Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Lys Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Phe Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ala
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Asp Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Glu Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Asn Leu
725 730 735
<210> 113
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 113
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Thr Leu Ser
1 5 10 15
Glu Gly Ile Arg Gln Trp Trp Lys Leu Lys Pro Gly Pro Pro Pro Pro
20 25 30
Lys Pro Ala Glu Arg His Lys Asp Asp Ser Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Glu Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Arg Gln Leu Asp Ser Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Lys Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Pro Val Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Lys Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ala
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Asp Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 114
<211> 734
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 114
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Thr Leu Ser
1 5 10 15
Glu Gly Ile Arg Gln Trp Trp Lys Leu Lys Pro Gly Pro Pro Pro Pro
20 25 30
Lys Pro Ala Glu Arg His Lys Asp Asp Ser Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Glu Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Gln Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Gly Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Leu Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Ala Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ala Gly Ile Gly
145 150 155 160
Lys Ser Gly Ala Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Thr Glu Ser Val Pro Asp Pro Gln Pro Ile Gly Glu Pro Pro
180 185 190
Ala Ala Pro Ser Gly Val Gly Ser Leu Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Val Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Gln Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Ser Phe Lys Leu Phe Asn His Pro
305 310 315 320
Gly Gln Gly Gly His Ala Glu Arg His Gln Asp His Arg Gln Pro His
325 330 335
Gln His Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro Tyr Val
340 345 350
Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala Asp Val
355 360 365
Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly Ser Gln
370 375 380
Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro Ser Gln
385 390 395 400
Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr Phe Glu Asp
405 410 415
Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp Arg Leu
420 425 430
Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg Thr Gln
435 440 445
Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser Gln Gly
450 455 460
Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro Gly Pro
465 470 475 480
Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn Asn Asn
485 490 495
Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn Gly Arg
500 505 510
Asn Ser Leu Gly Asn Pro Gly Ile Ala Met Ala Thr His Lys Asp Asp
515 520 525
Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly Lys Gln
530 535 540
Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu Thr Ser
545 550 555 560
Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu Tyr Gly
565 570 575
Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln Ile Gly
580 585 590
Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln Asn Arg
595 600 605
Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His Thr Asp
610 615 620
Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu Lys His
625 630 635 640
Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala Asp Pro
645 650 655
Pro Thr Ala Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr Gln Tyr
660 665 670
Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln Lys Glu
675 680 685
Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn Tyr Tyr
690 695 700
Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val Tyr Ser
705 710 715 720
Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730
<210> 115
<211> 737
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 115
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Asp Leu Lys His Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Phe Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ala
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Asn Gly Thr Ser Gly Gly Ser Thr Asn Asp Asn
260 265 270
Thr Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg
275 280 285
Phe His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn
290 295 300
Asn Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile
305 310 315 320
Gln Val Lys Glu Val Thr Gln Asn Glu Gly Thr Lys Thr Ile Ala Asn
325 330 335
Asn Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu
340 345 350
Pro Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro
355 360 365
Ala Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn
370 375 380
Gly Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe
385 390 395 400
Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Thr Phe Ser Tyr Thr
405 410 415
Phe Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu
420 425 430
Asp Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser
435 440 445
Arg Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe
450 455 460
Ser Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu
465 470 475 480
Pro Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln
485 490 495
Asn Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu
500 505 510
Asn Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His
515 520 525
Lys Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe
530 535 540
Gly Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met
545 550 555 560
Leu Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu
565 570 575
Glu Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro
580 585 590
Gln Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp
595 600 605
Gln Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro
610 615 620
His Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly
625 630 635 640
Leu Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro
645 650 655
Ala Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile
660 665 670
Thr Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu
675 680 685
Gln Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser
690 695 700
Asn Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly
705 710 715 720
Val Tyr Ser Asp Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro
725 730 735
Leu
<210> 116
<211> 737
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 116
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Glu Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Pro Ser Pro Gln Arg Ser Pro Asp Ser Ser Thr Gly Ile
145 150 155 160
Gly Lys Lys Gly Gln Gln Pro Ala Arg Lys Arg Leu Asn Phe Gly Gln
165 170 175
Thr Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro
180 185 190
Pro Ala Ala Pro Ser Gly Val Gly Pro Asn Thr Met Ala Ser Gly Gly
195 200 205
Gly Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn
210 215 220
Ser Ser Gly Asn Trp His Cys Asp Ser Thr Trp Met Gly Asp Arg Val
225 230 235 240
Ile Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His
245 250 255
Leu Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn
260 265 270
His Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg
275 280 285
Phe His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn
290 295 300
Asn Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile
305 310 315 320
Gln Val Lys Glu Val Thr Gln Asn Glu Gly Thr Lys Thr Ile Ala Asn
325 330 335
Asn Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu
340 345 350
Pro Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro
355 360 365
Ala Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn
370 375 380
Gly Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe
385 390 395 400
Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr
405 410 415
Phe Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu
420 425 430
Asp Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser
435 440 445
Arg Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe
450 455 460
Ser Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu
465 470 475 480
Pro Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln
485 490 495
Asn Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu
500 505 510
Asn Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His
515 520 525
Lys Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe
530 535 540
Gly Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met
545 550 555 560
Leu Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu
565 570 575
Glu Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro
580 585 590
Gln Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp
595 600 605
Gln Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro
610 615 620
His Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly
625 630 635 640
Leu Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro
645 650 655
Ala Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile
660 665 670
Thr Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu
675 680 685
Gln Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser
690 695 700
Asn Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly
705 710 715 720
Val Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro
725 730 735
Leu
<210> 117
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<220>
<221> неопределенный признак
<222> (226)..(226)
<223> Xaa может представлять собой любую природную аминокислоту
<400> 117
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Thr Leu Ser
1 5 10 15
Glu Gly Ile Arg Gln Trp Trp Lys Leu Lys Pro Gly Pro Pro Pro Pro
20 25 30
Lys Pro Ala Glu Arg His Lys Asp Asp Ser Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Glu Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Arg Gln Leu Asp Ser Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Lys Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Pro Val Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Lys Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ala
210 215 220
Ser Xaa Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Pro Ile Thr Thr Thr Ser
245 250 255
Thr Ser Lys Ser Pro Val Leu Gln Arg Gly Arg Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Asp Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Asn Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 118
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<220>
<221> неопределенный признак
<222> (239)..(239)
<223> Xaa может представлять собой любую природную аминокислоту
<400> 118
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Asp Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Gln Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Gly Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Ala Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ala Gly Ile Gly
145 150 155 160
Lys Ser Gly Ala Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Thr Glu Ser Val Pro Asp Pro Gln Pro Ile Gly Glu Pro Pro
180 185 190
Ala Ala Pro Ser Gly Val Gly Pro Asn Thr Met Ala Ala Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Xaa Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Thr Phe Ser Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Phe Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 119
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 119
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Glu Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Leu Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Ala Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ala Gly Ile Gly
145 150 155 160
Lys Ser Gly Ala Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Thr Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ala
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Ser Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Gln Asn Glu Gly Thr Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 120
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 120
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Thr Leu Ser
1 5 10 15
Glu Gly Ile Arg Gln Trp Trp Lys Leu Lys Pro Gly Pro Pro Pro Pro
20 25 30
Lys Pro Ala Glu Arg His Lys Asp Asp Ser Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Glu Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Gln Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Gly Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Leu Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Ala Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ala Gly Ile Gly
145 150 155 160
Lys Ser Gly Ala Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Thr Glu Ser Val Pro Asp Pro Gln Pro Ile Gly Glu Pro Pro
180 185 190
Ala Ala Pro Ser Gly Val Gly Ser Leu Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Val Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Gln Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Ser Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Gln Asn Glu Gly Thr Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 121
<211> 738
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 121
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Gln Trp Trp Lys Leu Lys Pro Gly Pro Pro Pro Pro
20 25 30
Lys Pro Ala Glu Arg His Lys Asp Asp Ser Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Pro Ser Pro Gln Arg Ser Pro Asp Ser Ser Thr Gly Ile
145 150 155 160
Gly Lys Lys Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln
165 170 175
Thr Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro
180 185 190
Pro Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly
195 200 205
Gly Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn
210 215 220
Ala Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val
225 230 235 240
Ile Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His
245 250 255
Leu Tyr Lys Gln Ile Ser Asn Gly Thr Ser Gly Gly Ser Thr Asn Asp
260 265 270
Asn Thr Tyr Phe Gly Cys Val Thr Pro Trp Gly Tyr Phe Asp Phe Asn
275 280 285
Lys Phe His Cys His Phe Ser Pro Asp Asp Trp Gln Arg Leu Ile Asn
290 295 300
Asn Gly Trp Gly Phe Arg Thr Lys Arg Leu Asn Phe Lys Leu Phe Ser
305 310 315 320
Met Lys Val Lys Lys Gly Thr Asp Asn Thr Gly Ile Lys Thr Ile Ala
325 330 335
Asn Asn Leu Thr Asn Thr Val His Val Phe Ala Asp Ser Glu Tyr Gln
340 345 350
Leu Pro Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe
355 360 365
Pro Ala Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn
370 375 380
Asn Gly Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr
385 390 395 400
Phe Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Thr Phe Ser Tyr
405 410 415
Thr Phe Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser
420 425 430
Leu Asp Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu
435 440 445
Ser Arg Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly
450 455 460
Phe Ser Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp
465 470 475 480
Leu Pro Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly
485 490 495
Gln Asn Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His
500 505 510
Leu Asn Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr
515 520 525
His Lys Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile
530 535 540
Phe Gly Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val
545 550 555 560
Met Leu Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr
565 570 575
Glu Glu Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala
580 585 590
Pro Gln Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val
595 600 605
Trp Gln Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile
610 615 620
Pro His Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe
625 630 635 640
Gly Leu Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val
645 650 655
Pro Ala Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe
660 665 670
Ile Thr Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu
675 680 685
Leu Gln Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr
690 695 700
Ser Asn Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu
705 710 715 720
Gly Val Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg
725 730 735
Pro Leu
<210> 122
<211> 737
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 122
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Thr Leu Ser
1 5 10 15
Glu Gly Ile Arg Gln Trp Trp Lys Leu Lys Pro Gly Pro Pro Pro Pro
20 25 30
Lys Pro Ala Glu Arg His Lys Asp Asp Ser Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Pro Ser Pro Gln Arg Ser Pro Asp Ser Ser Thr Gly Ile
145 150 155 160
Gly Lys Lys Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln
165 170 175
Thr Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Ile Gly Glu Pro
180 185 190
Pro Ala Gly Pro Ser Gly Leu Gly Ser Gly Thr Met Ala Ala Gly Gly
195 200 205
Gly Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser
210 215 220
Ser Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val
225 230 235 240
Ile Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His
245 250 255
Leu Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn
260 265 270
His Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg
275 280 285
Phe His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn
290 295 300
Asn Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile
305 310 315 320
Gln Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn
325 330 335
Asn Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu
340 345 350
Pro Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro
355 360 365
Ala Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn
370 375 380
Gly Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe
385 390 395 400
Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Thr Phe Ser Tyr Thr
405 410 415
Phe Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu
420 425 430
Asp Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser
435 440 445
Arg Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe
450 455 460
Ser Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu
465 470 475 480
Pro Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln
485 490 495
Asn Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu
500 505 510
Asn Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His
515 520 525
Lys Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe
530 535 540
Gly Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met
545 550 555 560
Leu Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu
565 570 575
Glu Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro
580 585 590
Gln Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp
595 600 605
Gln Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Leu
610 615 620
His Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly
625 630 635 640
Met Lys His Pro Pro Pro Pro Ile Leu Ile Lys Asn Thr Pro Val Pro
645 650 655
Ala Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile
660 665 670
Thr Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu
675 680 685
Pro Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser
690 695 700
Asn Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly
705 710 715 720
Val Tyr Tyr Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Pro Pro
725 730 735
Leu
<210> 123
<211> 737
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 123
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Pro Ser Pro Gln Arg Ser Pro Asp Ser Ser Thr Gly Ile
145 150 155 160
Gly Lys Lys Gly Gln Gln Pro Ala Arg Lys Arg Leu Asn Phe Gly Gln
165 170 175
Thr Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro
180 185 190
Pro Ala Ala Pro Ser Gly Val Ala Pro Asn Thr Met Ala Ala Gly Gly
195 200 205
Gly Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn
210 215 220
Ala Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val
225 230 235 240
Ile Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His
245 250 255
Leu Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn
260 265 270
His Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg
275 280 285
Phe His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Thr Thr
290 295 300
Ile Gly Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile
305 310 315 320
Gln Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn
325 330 335
Asn Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu
340 345 350
Pro Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro
355 360 365
Ala Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn
370 375 380
Gly Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe
385 390 395 400
Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Thr Phe Ser Tyr Thr
405 410 415
Phe Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu
420 425 430
Asp Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser
435 440 445
Arg Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe
450 455 460
Ser Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu
465 470 475 480
Pro Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln
485 490 495
Asn Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu
500 505 510
Asn Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His
515 520 525
Lys Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe
530 535 540
Gly Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met
545 550 555 560
Leu Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu
565 570 575
Glu Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro
580 585 590
Gln Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp
595 600 605
Gln Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro
610 615 620
His Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly
625 630 635 640
Leu Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro
645 650 655
Ala Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile
660 665 670
Thr Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu
675 680 685
Gln Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser
690 695 700
Asn Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly
705 710 715 720
Val Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro
725 730 735
Leu
<210> 124
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 124
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Thr Leu Ser
1 5 10 15
Glu Gly Ile Arg Gln Trp Trp Lys Leu Lys Pro Gly Pro Pro Pro Pro
20 25 30
Lys Pro Ala Glu Arg His Lys Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Pro Val Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Lys Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ala
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Met Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Gln Asn Glu Gly Thr Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn His Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 125
<211> 737
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 125
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Gln Gly Ile Arg Glu Trp Trp Asp Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Pro Ser Pro Gln Arg Ser Pro Asp Ser Ser Thr Gly Ile
145 150 155 160
Gly Lys Lys Gly Gln Gln Pro Ala Arg Lys Arg Leu Asn Phe Gly Gln
165 170 175
Thr Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro
180 185 190
Pro Ala Ala Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly
195 200 205
Gly Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser
210 215 220
Ser Ser Gly Asn Trp His Cys Asp Ser Gln Trp Leu Gly Asp Arg Val
225 230 235 240
Ile Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His
245 250 255
Leu Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn
260 265 270
His Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg
275 280 285
Phe His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn
290 295 300
Asn Trp Gly Phe Arg Pro Lys Arg Leu Ser Phe Lys Leu Phe Asn Ile
305 310 315 320
Gln Val Lys Glu Val Thr Gln Asn Glu Gly Thr Lys Thr Ile Ala Asn
325 330 335
Asn Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu
340 345 350
Pro Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro
355 360 365
Ala Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn
370 375 380
Gly Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe
385 390 395 400
Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr
405 410 415
Phe Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu
420 425 430
Asp Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser
435 440 445
Arg Thr Gln Thr Thr Gly Gly Thr Thr Asn Ala Gln Thr Leu Gly Phe
450 455 460
Ser Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu
465 470 475 480
Pro Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln
485 490 495
Asn Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu
500 505 510
Asn Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His
515 520 525
Lys Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe
530 535 540
Gly Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met
545 550 555 560
Leu Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu
565 570 575
Glu Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro
580 585 590
Gln Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp
595 600 605
Gln Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro
610 615 620
His Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly
625 630 635 640
Leu Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro
645 650 655
Ala Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile
660 665 670
Thr Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu
675 680 685
Gln Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser
690 695 700
Asn Tyr Tyr Lys Ser Thr Asn Val Asp Phe Ala Val Asn Thr Glu Gly
705 710 715 720
Val Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro
725 730 735
Leu
<210> 126
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 126
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Asp Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Phe Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Thr Glu Ser Val Pro Asp Pro Gln Pro Ile Gly Glu Pro Pro
180 185 190
Ala Ala Pro Ser Gly Val Gly Pro Asn Thr Met Ala Ala Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Met Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Gln Asn Glu Gly Thr Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Asn Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Phe Thr Arg Pro Leu
725 730 735
<210> 127
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 127
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Asp Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Met Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Asn Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 128
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 128
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Asp Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Asn Ala
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Gln Asn Glu Gly Thr Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Glu Phe Ser Tyr Gln Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Met Asn
500 505 510
Gly Arg Asn Ser Leu Val Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Val Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 129
<211> 2214
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 129
atggctgccg atggttatct tccagattgg ctcgaggaca ctctctctga aggaataaga 60
cagtggtgga agctcaaacc tggcccacca ccaccaaagc ccgcagagcg gcataaggac 120
gacagcaggg gtcttgtgct tcctgggtac aagtacctcg gacccttcaa cggactcgac 180
aagggagagc cggtcaacga ggcagacgcc gcggccctcg agcacgacaa agcctacgac 240
cggcagctcg acagcggaga caacccgtac ctcaagtaca accacgccga cgcggagttt 300
caggagcgcc ttaaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaaaaaga ggcttcttga acctcttggt ctggttgagg aagcggctaa gacggctcct 420
ggaaagaaga ggcctgtaga gcagtctcct caggaaccgg actcctcctc gggcatcggc 480
aagacaggcc agcagcccgc taaaaagaga ctcaatttcg gtcagactgg cgacacagag 540
tcagtcccag accctcaacc aatcggagaa cctcccgcag ccccctcagg tgtgggatct 600
cttacaatgg cttcaggtgg tggcgcacca gtggcagaca ataacgaagg tgccgatgga 660
gtgggtagtt cctcgggaaa ttggcattgc gattcccaat ggctggggga cagagtcatc 720
accaccagca cccgaacctg ggccctgccc acctacaaca atcacctcta caagcaaatc 780
tccaacggga catcgggagg agccaccaac gacaacacct acttcggcta cagcaccccc 840
tgggggtatt ttgactttaa cagattccac tgccactttt caccacgtga ctggcagcga 900
ctcatcaaca acaactgggg attccggccc aagagactca gcttcaagct cttcaacatc 960
caggtcaagg aggtcacgca gaatgaaggc accaagacca tcgccaataa ccttaccagc 1020
acggtccagg tcttcacgga ctcggagtac cagctgccgt acgttctcgg ctctgcccac 1080
cagggctgcc tgcctccgtt cccggcggac gtgttcatga ttccccagta cggctaccta 1140
acactcaaca acggtagtca ggccgtggga cgctcctcct tctactgcct ggaatacttt 1200
ccttcgcaga tgctgagaac cggcaacaac ttccagttta cttacacctt cgaggacgtg 1260
cctttccaca gcagctacgc ccacagccag agcttggacc ggctgatgaa tcctctgatt 1320
gaccagtacc tgtactactt gtctcggact caaacaacag gaggcacggc aaatacgcag 1380
actctgggct tcagccaagg tgggcctaat acaatggcca atcaggcaaa gaactggctg 1440
ccaggaccct gttaccgcca acaacgcgtc tcaacgacaa ccgggcaaaa caacaatagc 1500
aactttgcct ggactgctgg gaccaaatac catctgaatg gaagaaattc attggctaat 1560
cctggcatcg ctatggcaac acacaaagac gacaaggagc gtttttttcc cagtaacggg 1620
atcctgattt ttggcaaaca aaatgctgcc agagacaatg cggattacag cgatgtcatg 1680
ctcaccagcg aggaagaaat caaaaccact aaccctgtgg ctacagagga atacggtatc 1740
gtggcagata acttgcagca gcaaaacacg gctcctcaaa ttggaactgt caacagccag 1800
ggggccttac ccggtatggt ttggcagaac cgggacgtgt acctgcaggg tcccatctgg 1860
gccaagattc ctcacacgga cggcaacttc cacccgtctc cgctgatggg cggctttggc 1920
ctgaaacatc ctccgcctca gatcctgatc aagaacacgc ctgtacctgc ggatcctccg 1980
accaccttca accagtcaaa gctgaactct ttcatcacgc aatacagcac cggacaggtc 2040
agcgtggaaa ttgaatggga gctgcagaag gaaaacagca agcgctggaa ccccgagatc 2100
cagtacacct ccaactacta caaatctaca agtgtggact ttgctgttaa tacagaaggc 2160
gtgtactctg aaccccaccc cattggcacc cgttacctca cccgtcccct gtaa 2214
<210> 130
<211> 737
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 130
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Thr Leu Ser
1 5 10 15
Glu Gly Ile Arg Gln Trp Trp Lys Leu Lys Pro Gly Pro Pro Pro Pro
20 25 30
Lys Pro Ala Glu Arg His Lys Asp Asp Ser Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Glu Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Arg Gln Leu Asp Ser Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Lys Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Leu Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Ala Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Thr Glu Ser Val Pro Asp Pro Gln Pro Ile Gly Glu Pro Pro
180 185 190
Ala Ala Pro Ser Gly Val Gly Ser Leu Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Val Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Gln Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Asn Gly Thr Ser Gly Gly Ala Thr Asn Asp Asn
260 265 270
Thr Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg
275 280 285
Phe His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn
290 295 300
Asn Trp Gly Phe Arg Pro Lys Arg Leu Ser Phe Lys Leu Phe Asn Ile
305 310 315 320
Gln Val Lys Glu Val Thr Gln Asn Glu Gly Thr Lys Thr Ile Ala Asn
325 330 335
Asn Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu
340 345 350
Pro Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro
355 360 365
Ala Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn
370 375 380
Gly Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe
385 390 395 400
Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr
405 410 415
Phe Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu
420 425 430
Asp Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser
435 440 445
Arg Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe
450 455 460
Ser Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu
465 470 475 480
Pro Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln
485 490 495
Asn Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu
500 505 510
Asn Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His
515 520 525
Lys Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe
530 535 540
Gly Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met
545 550 555 560
Leu Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu
565 570 575
Glu Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro
580 585 590
Gln Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp
595 600 605
Gln Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro
610 615 620
His Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly
625 630 635 640
Leu Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro
645 650 655
Ala Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile
660 665 670
Thr Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu
675 680 685
Gln Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser
690 695 700
Asn Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly
705 710 715 720
Val Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro
725 730 735
Leu
<210> 131
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 131
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Asp Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Lys Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Thr Glu Ser Val Pro Asp Pro Gln Pro Ile Gly Glu Pro Pro
180 185 190
Ala Ala Pro Ser Gly Val Gly Ser Leu Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Val Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Gln Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Asp Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 132
<211> 736
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 132
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Thr Leu Ser
1 5 10 15
Glu Gly Ile Arg Gln Trp Trp Lys Leu Lys Pro Gly Pro Pro Pro Pro
20 25 30
Lys Pro Ala Glu Arg His Lys Asp Asp Ser Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Glu Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Arg Gln Leu Asp Ser Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Gly Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ser Gly Ile Gly
145 150 155 160
Glu Thr Gly Gln Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro Pro
180 185 190
Ala Thr Pro Ala Ala Val Gly Pro Thr Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Gln Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Ser Ala Ser Thr Gly Ala Ser Asn Asp Asn His
260 265 270
Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe
275 280 285
His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn
290 295 300
Trp Gly Phe Arg Pro Lys Arg Leu Ser Phe Lys Leu Phe Asn Ile Gln
305 310 315 320
Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn Asn
325 330 335
Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Glu Tyr Gln Leu Pro
340 345 350
Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe Pro Ala
355 360 365
Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asn Gly
370 375 380
Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe Pro
385 390 395 400
Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Thr Phe Ser Tyr Thr Phe
405 410 415
Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu Asp
420 425 430
Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser Arg
435 440 445
Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly Phe Ser
450 455 460
Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp Leu Pro
465 470 475 480
Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly Gln Asn
485 490 495
Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His Leu Asn
500 505 510
Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr His Lys
515 520 525
Asp Asp Lys Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile Phe Gly
530 535 540
Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val Met Leu
545 550 555 560
Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Glu
565 570 575
Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala Pro Gln
580 585 590
Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val Trp Gln
595 600 605
Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Leu
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro His Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
725 730 735
<210> 133
<211> 2217
<212> ДНК
<213> Искусственная
<220>
<223> Кодирующая последовательность клона рекомбинантного капсида AAV
<400> 133
atggctgccg atggttatct tccagattgg ctcgaggaca acctctctga gggcattcgc 60
gagtggtggg cgctgaaacc tggagccccg aagcccaaag ccaaccagca aaagcaggac 120
gacggccggg gtctggtgct tcctggctac aagtacctcg gacccttcaa cggactcgac 180
aagggggagc ccgtcaacgc ggcggacgca gcggccctcg agcacgacaa ggcctacgac 240
cagcagctgc aggcgggtga caatccgtac ctgcggtata accacgccga cgccgagttt 300
caggagcgtc tgcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaagaagc gggttctcga acctctcggt ctggttgagg aaggcgctaa gacggctcct 420
ggaaagaaga gaccggtaga gccatcaccc cagcgttctc cagactcctc tacgggcatc 480
ggcaagaaag gccaacagcc cgccagaaaa agactcaatt ttggtcagac tggcgactca 540
gagtcagttc cagaccctca acctctcgga gaacctccag cagcgccctc tggtgtggga 600
cctaatacaa tggctgcagg cggtggcgca ccaatggcag acaataacga aggcgccgac 660
ggagtgggta gttcctcggg aaattggcat tgcgattcca catggctggg cgacagagtc 720
atcaccacca gcacccgaac ctgggccctg cccacctaca acaaccacct ctacaagcaa 780
atctccaacg ggacatcggg aggagccacc aacgacaaca cctacttcgg ctacagcacc 840
ccctgggggt attttgactt taacagattc cactgccact tttcaccacg tgactggcag 900
cgactcatca acaacaactg gggattccgg cccaagagac tcagcttcaa gctcttcaac 960
atccaggtca aggaggtcac gcagaatgaa ggcaccaaga ccatcgccaa taacctcacc 1020
agcaccatcc aggtgtttac ggactcggag taccagctgc cgtacgttct cggctctgcc 1080
caccagggct gcctgcctcc gttcccggcg gacgtgttca tgattcccca gtacggctac 1140
ctaacactca acaacggtag tcaggccgtg ggacgctcct ccttctactg cctggaatac 1200
tttccttcgc agatgctgag aaccggcaac aacttccagt ttacttacac cttcgaggac 1260
gtgcctttcc acagcagcta cgcccacagc cagagcttgg accggctgat gaatcctctg 1320
attgaccagt acctgtacta cttgtctcgg actcaaacaa caggaggcac ggcaaatacg 1380
cagactctgg gcttcagcca aggtgggcct aatacaatgg ccaatcaggc aaagaactgg 1440
ctgccaggac cctgttaccg ccaacaacgc gtctcaacga caaccgggca aaacaacaat 1500
agcaactttg cctggactgc tgggaccaaa taccatctga atggaagaaa ttcattggct 1560
aatcctggca tcgctatggc aacacacaaa gacgacgagg agcgtttttt tcccagtaac 1620
gggatcctga tttttggcaa acaaaatgct gccagagaca atgcggatta cagcgatgtc 1680
atgctcacca gcgaggaaga aatcaaaacc actaaccctg tggctacaga ggaatacggt 1740
atcgtggcag ataacttgca gcagcaaaac acggctcctc aaattggaac tgtcaacagc 1800
cagggggcct tacccggtat ggtttggcag aaccgggacg tgtacctgca gggtcccatc 1860
tgggccaaga ttcctcacac ggacggcaac ttccacccgt ctccgctgat gggcggcttt 1920
ggcctgaaac atcctccgcc tcagatcctg atcaagaaca cgcctgtacc tgcggatcct 1980
ccgaccacct tcaaccagtc aaagctgaac tctttcatca cgcaatacag caccggacag 2040
gtcagcgtgg aaattgaatg ggagctgcag aaggaaaaca gcaagcgctg gaaccccgag 2100
atccagtaca cctccaacta ctacaaatct acaagtgtgg actttgctgt taatacagaa 2160
ggcgtgtact ctgaaccccg ccccattggc acccgttacc tcacccgtaa tctgtaa 2217
<210> 134
<211> 738
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность клона рекомбинантного капсида AAV
<400> 134
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Lys Pro
20 25 30
Lys Ala Asn Gln Gln Lys Gln Asp Asp Gly Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Phe Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Gln Ala Gly Asp Asn Pro Tyr Leu Arg Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Pro Ser Pro Gln Arg Ser Pro Asp Ser Ser Thr Gly Ile
145 150 155 160
Gly Lys Lys Gly Gln Gln Pro Ala Arg Lys Arg Leu Asn Phe Gly Gln
165 170 175
Thr Gly Asp Ser Glu Ser Val Pro Asp Pro Gln Pro Leu Gly Glu Pro
180 185 190
Pro Ala Ala Pro Ser Gly Val Gly Pro Asn Thr Met Ala Ala Gly Gly
195 200 205
Gly Ala Pro Met Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser
210 215 220
Ser Ser Gly Asn Trp His Cys Asp Ser Thr Trp Leu Gly Asp Arg Val
225 230 235 240
Ile Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His
245 250 255
Leu Tyr Lys Gln Ile Ser Asn Gly Thr Ser Gly Gly Ala Thr Asn Asp
260 265 270
Asn Thr Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn
275 280 285
Arg Phe His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn
290 295 300
Asn Asn Trp Gly Phe Arg Pro Lys Arg Leu Ser Phe Lys Leu Phe Asn
305 310 315 320
Ile Gln Val Lys Glu Val Thr Gln Asn Glu Gly Thr Lys Thr Ile Ala
325 330 335
Asn Asn Leu Thr Ser Thr Ile Gln Val Phe Thr Asp Ser Glu Tyr Gln
340 345 350
Leu Pro Tyr Val Leu Gly Ser Ala His Gln Gly Cys Leu Pro Pro Phe
355 360 365
Pro Ala Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn
370 375 380
Asn Gly Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr
385 390 395 400
Phe Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Thr Tyr
405 410 415
Thr Phe Glu Asp Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser
420 425 430
Leu Asp Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu
435 440 445
Ser Arg Thr Gln Thr Thr Gly Gly Thr Ala Asn Thr Gln Thr Leu Gly
450 455 460
Phe Ser Gln Gly Gly Pro Asn Thr Met Ala Asn Gln Ala Lys Asn Trp
465 470 475 480
Leu Pro Gly Pro Cys Tyr Arg Gln Gln Arg Val Ser Thr Thr Thr Gly
485 490 495
Gln Asn Asn Asn Ser Asn Phe Ala Trp Thr Ala Gly Thr Lys Tyr His
500 505 510
Leu Asn Gly Arg Asn Ser Leu Ala Asn Pro Gly Ile Ala Met Ala Thr
515 520 525
His Lys Asp Asp Glu Glu Arg Phe Phe Pro Ser Asn Gly Ile Leu Ile
530 535 540
Phe Gly Lys Gln Asn Ala Ala Arg Asp Asn Ala Asp Tyr Ser Asp Val
545 550 555 560
Met Leu Thr Ser Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr
565 570 575
Glu Glu Tyr Gly Ile Val Ala Asp Asn Leu Gln Gln Gln Asn Thr Ala
580 585 590
Pro Gln Ile Gly Thr Val Asn Ser Gln Gly Ala Leu Pro Gly Met Val
595 600 605
Trp Gln Asn Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile
610 615 620
Pro His Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe
625 630 635 640
Gly Leu Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val
645 650 655
Pro Ala Asp Pro Pro Thr Thr Phe Asn Gln Ser Lys Leu Asn Ser Phe
660 665 670
Ile Thr Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu
675 680 685
Leu Gln Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr
690 695 700
Ser Asn Tyr Tyr Lys Ser Thr Ser Val Asp Phe Ala Val Asn Thr Glu
705 710 715 720
Gly Val Tyr Ser Glu Pro Arg Pro Ile Gly Thr Arg Tyr Leu Thr Arg
725 730 735
Asn Leu
<210> 135
<211> 35
<212> ДНК
<213> Искусственная
<220>
<223> Последовательность праймера для мутагенеза
<400> 135
gggaaaaaaa cgctccttgt cgtctttgtg tgttg 35
<210> 136
<211> 35
<212> ДНК
<213> Искусственная
<220>
<223> Последовательность праймера для мутагенеза
<400> 136
caacacacaa agacgacaag gagcgttttt ttccc 35
<210> 137
<211> 20
<212> ДНК
<213> Искусственная
<220>
<223> Последовательность праймера для мутагенеза
<400> 137
aatgtggatt tggatgactg 20
<210> 138
<211> 49
<212> ДНК
<213> Искусственная
<220>
<223> Последовательность праймера для мутагенеза
<400> 138
cgttattgtc tgccattggt gcgccaccgc ctgcagccat tgtaagaga 49
<210> 139
<211> 41
<212> ДНК
<213> Искусственная
<220>
<223> Последовательность праймера для мутагенеза
<400> 139
accaatggca gacaataacg aaggcgccga cggagtgggt a 41
<210> 140
<211> 16
<212> ДНК
<213> Искусственная
<220>
<223> Последовательность праймера для мутагенеза
<400> 140
agagccgaga acgtac 16
<210> 141
<211> 23
<212> ДНК
<213> Искусственная
<220>
<223> Последовательность праймера для qПЦР
<400> 141
agcagcacga cttcttcaac tcc 23
<210> 142
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Последовательность праймера для qПЦР
<400> 142
tgtagttgta ctccagcttg tgcc 24
<210> 143
<211> 23
<212> ДНК
<213> Искусственная
<220>
<223> Последовательность праймера для qПЦР
<400> 143
gttaacactc aggcgcatgg gcc 23
<210> 144
<211> 23
<212> ДНК
<213> Искусственная
<220>
<223> Последовательность праймера для qПЦР
<400> 144
ccatcagggt cacctctggt tcc 23
<210> 145
<211> 25
<212> ДНК
<213> Искусственная
<220>
<223> Последовательность праймера для qПЦР
<400> 145
aacatgctac gcagagaggg agtgg 25
<210> 146
<211> 29
<212> ДНК
<213> Искусственная
<220>
<223> Последовательность праймера для qПЦР
<400> 146
catgagacaa ggaaccccta gtgatggag 29
<---
Реферат
Изобретение относится к химерным капсидам AAV, нацеленным на центральную нервную систему, к содержащим их вирусным векторам и к способам применения векторов для нацеливания на центральную нервную систему. Изобретение, кроме того, относится к химерным капсидам AAV, нацеленным на олигодендроциты, к содержащим их вирусным векторам и к способам применения векторов для нацеливания на олигодендроциты. Изобретение позволяет эффективно лечить заболевания, связанные с центральной нервной системой. 12 н. и 24 з.п. ф-лы, 1 табл., 16 ил., 2 пр.
Формула
Документы, цитированные в отчёте о поиске
Aav векторы с усовершенствованными rep-кодирующими последовательностями, используемыми в системах продукции на основе клеток насекомых

Комментарии