Модуляция экспрессии ангиопоэтин-подобного белка 3 - RU2706964C2
Код документа: RU2706964C2
Чертежи

















































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































Описание
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящее изобретение зарегистрировано вместе с перечнем последовательностей в электронном формате. Перечень последовательностей представлен в виде файла под названием BIOL0179WO_ST25.txt, созданного 22 декабря 2014 г., размером 0,98 Мб. Информация о перечне последовательностей в электронном формате включена в данный документ посредством ссылки в полном объеме.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
В данном изобретении приведены способы, соединения и композиции для снижения экспрессии ангиопоэтин-подобного белка 3 (ANGPTL3) и его мРНК в организме животного. В настоящем изобретении также приведены способы, соединения и композиции, содержащие ингибитор ANGPTL3 для ослабления связанных с ANGPTL3 заболеваний и патологических состояний в организме животного. Такие способы, соединения и композиции пригодны, к примеру, для лечения, предупреждения, задержки или облегчения любого одного или более из сердечно-сосудистых заболеваний или метаболического синдрома, или его симптома, в организме животного.
УРОВЕНЬ ТЕХНИКИ
Диабет и ожирение (иногда собирательно называемые «диажирением») являются взаимосвязанными в том, что ожирение, как известно, ухудшает патологию диабета и более 60% случаев диабета сопровождаются ожирением. Большинство случаев ожирения у людей связано с инсулинорезистентностью и лептинорезистентностью. Фактически предполагают, что ожирение может оказывать даже большее влияние на действие инсулина, чем сам диабет (Sindelka et al., Physiol Res., 2002, 51, 85-91). В дополнение к этому, известно, что некоторые соединения, присутствующие в продаже для лечения диабета, индуцируют набор веса, очень нежелательный побочный эффект при лечении этого заболевания.
Сердечно-сосудистые заболевания также взаимосвязаны с ожирением и диабетом. Сердечно-сосудистые заболевания охватывают большое разнообразие этиологии и обладают в равной степени большим разнообразием причинных агентов и взаимосвязанных факторов. Множество причинных агентов вызывают симптомы, такие как повышенные уровни холестерина в плазме, включая холестерин липопротеинов невысокой плотности (ХС-ЛП-не-ВП), а также другие связанные с липидами нарушения. Такие связанные с липидами нарушения обычно называются дислипидемией, включающей, среди других показаний, гиперлипидемию, гиперхолестеринемию и гипертриглицеридемию. Повышенный уровень холестерина ЛП-не-ВП связан с атерогенезом и его последствиями, включающими сердечнососудистые заболевания, такие как атеросклероз, ишемическая болезнь сердца, инфаркт миокарда, ишемический инсульт и другие формы заболеваний сердечно-сосудистой системы. Эти заболевания занимают положение наиболее распространенных типов болезней в промышленно развитых странах. Действительно, в США по оценкам 12 миллионов человек страдают от ишемической болезни сердца и около 36 миллионов нуждаются в лечении от повышенных уровней холестерина.
Эпидемиологические и экспериментальные данные показали, что высокие уровни циркулирующих триглицеридов (ТГ) могут вызывать сердечно-сосудистое заболевание и большое количество метаболических нарушений (Valdivielso et al., 2009, Atherosclerosis Zhang et al., 2008, Circ Res. 1; 102 (2): 250-6). ТГ, получаемые или из экзогенных или из эндогенных источников, включаются и секретируются в хиломикроны кишечника, или в липопротеины очень низкой плотности (ЛПОНП) печени. Попадая в циркуляцию, ТГ гидролизуются липопротеинлипазой (ЛпЛ) и получающиеся свободные жирные кислоты потом могут поглощаться окружающими тканями и использоваться в качестве источника энергии. Поскольку ЛпЛ оказывает сильное влияние на уровень ТГ в плазме и метаболизм в целом, то большой интерес вызывает обнаружение и разработка соединений, которые влияют на активность ЛпЛ.
Метаболический синдром представляет собой комбинацию заболеваний, которые увеличивают у пациента риск возникновения сердечно-сосудистого заболевания и диабета. Симптомы, включающие повышенное артериальное давление, высокий уровень триглицеридов, пониженный уровень ЛПВП и ожирение, у некоторых пациентов имеют склонность проявляться вместе. Они поражают большое количество людей кластерным образом. В некоторых исследованиях частота распространения заболевания в США по расчетам охватывает до 25% популяции. Метаболический синдром известен под другими различными названиями, такими как (метаболический) синдром X, инсулинорезистентный синдром, синдром Ривена или синдром CHAOS. Из-за высокой распространенности сердечно-сосудистых нарушений и метаболических нарушений остается необходимость в усовершенствованных подходах для лечения этих патологических состояний.
Ангиопоэтины представляют собой семейство секретируемых факторов роста. Вместе со своими соответствующими специфическими эндотелиальными рецепторами ангиопоэтины играют важную роль в ангиогенезе. Один представитель семейства, ангиопоэтин-подобный белок 3 (также известный как ангиопоэтин-подобный белок 3, ANGPT5, ANGPTL3 или ангиопоэтин 5), преимущественно экспрессируется в печени, и, как предполагается, играет роль в регуляции липидного метаболизма (Kaplan et al., J. Lipid Res., 2003, 44, 136-143). Полногеномные ассоциативные сканирования (GWAS), исследующие геном на наличие обычных вариантов, ассоциированных с концентрациями в плазме ЛПВП, ЛПНП и триглицеридов, выявили ассоциацию между уровнями триглицеридов и однонуклеотидными полиморфизмами (ОНП) возле гена ANGPTL3 (Wilier et al., Nature Genetics, 2008, 40 (2): 161-169). Индивиды с гомозиготными мутациями с потерей функционирования ANGPTL3 представлены низкими уровнями всех атерогенных липидов и липопротеинов в плазме, таких как общее содержание холестерина (ОХС) и ТГ, холестерина липопротеинов низкой плотности (ХС-ЛПНП), аполипопротеина В (ароВ), ХС-ЛП-не-ВП, а также ХС-ЛПВП (Romeo et al. 2009, JClin Invest, 119 (1): 70-79; Musunuru et al. 2010 N Engl J Med, 363: 2220-2227; Martin-Campos et al. 2012, Clin Chim Acta, 413: 552-555; Minicocci et al. 2012, J Clin Endocrinol Metab, 97: el266-1275; Noto et al. 2012, Arterioscler Thromb Vase Biol, 32: 805-809; Pisciotta et al. 2012, Circulation Cardiovasc Genet, 5: 42-50). Этот клинический фенотип назван семейная комбинированная гиперлипидемия (FHBL2). Несмотря на пониженную секрецию ЛПОНП, субъекты с FHBL2 не обладают увеличенным содержанием жира в печени. Оказывается, что они также не обладают пониженными уровнями глюкозы и инсулина в плазме, и что важно, и диабет и сердечно-сосудистое заболевание отсутствовали у этих субъектов. До настоящего времени не сообщалось о неблагоприятных клинических фенотипах (Minicocci et al. 2013, J of Lipid Research, 54: 3481-3490). Показано, что снижение ANGPTL3 ведет к уменьшению уровней ТГ, холестерина и ЛПНП в моделях на животных (серийный номер заявки США 13/520997; публикация согласно РСТ WO 2011/085271). Мыши, дефицитные по ANGPTL3, имеют очень низкие уровни триглицеридов (ТГ) и холестерина в плазме, в то время как сверхэкспрессия вызывает противоположные эффекты (Koishi et al. 2002; Koster 2005; Fujimoto 2006). Соответственно, потенциальная роль ANGPTL3 в липидном метаболизме делает его привлекательной мишенью для терапевтического воздействия.
До настоящего времени терапевтические стратегии лечения кардиометаболического заболевания путем прямого таргетинга уровней содержания ANGPTL3 были ограниченными. Фрагменты полипептида ANGPTL3 (серийный номер заявки США 12/128545), анти-ANGPTL3 антител (серийный номер заявки США 12/001012) и ингибиторов нуклеиновых кислот ANGPTL3, включающих антисмысловые олигонуклеотиды (серийный номер заявки США 13/520997, публикация согласно РСТ WO 2011/085271, включенные в данный документ посредством ссылки в полном объеме), были предложены или разработаны раннее, но ни одно из этих соединений, непосредственно таргетирующих ANGPTL3, не были одобрены для лечения кардиометаболического заболевания. Соответственно, существует нереализованная потребность в высокоактивных и переносимых соединениях для ингибирования ANGPTL3. Изобретение, описанное в данном документе, относится к обнаружению новых высокоактивных ингибиторов экспрессии ANGPTL3 и их применения для лечения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В данном документе представлены соединения и способы модулирования экспрессии мРНК и белка ANGPTL3. В некоторых вариантах реализации изобретения композиция представляет собой специфический ингибитор ANGPTL3. В некоторых вариантах реализации изобретения специфический ингибитор ANGPTL3 уменьшает экспрессию мРНК и белка ANGPTL3.
В некоторых вариантах реализации изобретения композиция представляет собой специфический ингибитор ANGPTL3. В некоторых вариантах реализации изобретения специфический ингибитор ANGPTL3 представляет собой нуклеиновую кислоту. В некоторых вариантах реализации изобретения нуклеиновая кислота представляет собой антисмысловое соединение. В некоторых вариантах реализации изобретения антисмысловое соединение представляет собой модифицированный олигонуклеотид.
В некоторых вариантах реализации изобретения специфический ингибитор ANGPTL3 представляет собой модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов и имеющий последовательность нуклеотидных оснований, содержащую по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19 или 20 последовательных нуклеотидных оснований нуклеотидной последовательности SEQ ID NO: 77.
В некоторых вариантах реализации изобретения специфический ингибитор ANGPTL3 представляет собой модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов и содержащий последовательность нуклеотидных оснований, содержащую часть из по меньшей мере 8 последовательных нуклеотидных оснований, комплементарных части равной длины из нуклеотидных оснований 1140-1159 SEQ ID NO: 1, в которой последовательность нуклеотидных оснований модифицированного олигонуклеотида по меньшей мере на 80% комплементарна SEQ ID NO: 1.
В некоторых вариантах реализации изобретения специфический ингибитор ANGPTL3 представляет собой модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов и содержащий последовательность нуклеотидных оснований, содержащую часть из по меньшей мере 8 последовательных нуклеотидных оснований, комплементарных части равной длины из нуклеотидных оснований 9715-9734 SEQ ID NO: 2, в которой последовательность нуклеотидных оснований модифицированного олигонуклеотида по меньшей мере на 80% комплементарна SEQ ID NO: 2.
В некоторых вариантах реализации изобретения специфический ингибитор ANGPTL3 представляет собой модифицированный олигонуклеотид, состоящий из 20 связанных нуклеозидов и имеющий последовательность нуклеотидных оснований, содержащую по меньшей мере 8 последовательных нуклеотидных оснований SEQ ID NO: 77, причем модифицированный олигонуклеотид содержит: (а) гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов; (b) сегмент 5'-крыла, состоящий из пяти связанных нуклеозидов; (с) сегмент 3'-крыла, состоящий из пяти связанных нуклеозидов, и причем гэп-сегмент расположен между сегментом 5'-крыла и сегментом 3'-крыла, при этом каждый нуклеозид каждого сегмента крыльев содержит 2'-O-метоксиэтильный сахар, причем межнуклеозидная связь представляет собой тиофосфатную связь и при этом каждый остаток цитозина представляет собой 5-метилцитозин.
В некоторых вариантах реализации изобретения специфический ингибитор ANGPTL3 представляет собой модифицированный олигонуклеотид, состоящий из 20 связанных нуклеозидов и имеющий последовательность нуклеотидных оснований, состоящую из по меньшей мере 8 последовательных нуклеотидных оснований SEQ ID NO: 77, причем модифицированный олигонуклеотид состоит из: (а) гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов; (b) сегмент 5'-крыла, состоящий из пяти связанных нуклеозидов; (с) сегмент 3'-крыла, состоящий из пяти связанных нуклеозидов, и причем гэп-сегмент расположен между сегментом 5'-крыла и сегментом 3'-крыла, при этом каждый нуклеозид каждого сегмента крыльев содержит 2'-O-метоксиэтильный сахар, причем каждая межнуклеозидная связь представляет собой тиофосфатную связь и при этом каждый остаток цитозина представляет собой 5-метилцитозин.
В некоторых вариантах реализации изобретения специфический ингибитор ANGPTL3 представляет собой модифицированный олигонуклеотид, представленный следующей структурой и обозначением ISIS 563580. В некоторых вариантах реализации изобретения специфический ингибитор ANGPTL3 содержит модифицированный олигонуклеотид ISIS 563580, представленный следующей структурой.

В некоторых вариантах реализации изобретения представлена композиция, содержащая соединение, описанное в данном документе, или его соль, и фармацевтически приемлемый носитель или растворитель.
В некоторых вариантах реализации изобретения модуляция экспрессии ANGPTL3 происходит в клетке или ткани. В некоторых вариантах реализации изобретения модуляции происходят в клетке или ткани в организме животного. В некоторых вариантах реализации изобретения животное представляет собой человека. В некоторых вариантах реализации изобретения модуляция представляет собой снижение уровня мРНК ANGPTL3. В некоторых вариантах реализации изобретения модуляция представляет собой снижение уровня белка ANGPTL3. В некоторых вариантах реализации изобретения снижаются уровни мРНК и белка ANGPTL3. Такое снижение может происходить в зависимым от времени или в зависимым от дозы образом.
В некоторых вариантах реализации изобретения представлены композиции и способы применения для терапии. В некоторых вариантах реализации изобретения представлены композиции и способы предупреждения, лечения, задержки, замедления прогрессирования и/или облегчения связанных с ANGPTL3 заболеваний, нарушений и патологических состояний. В некоторых вариантах реализации изобретения, такие заболевания, нарушения и патологические состояния являются сердечно-сосудистыми и/или метаболическими заболеваниями, нарушениями и патологическими состояниями. В некоторых вариантах реализации изобретения композиции и способы терапии включают введение специфического ингибитора ANGPTL3 нуждающемуся в нем индивиду. В некоторых вариантах реализации изобретения специфический ингибитор ANGPTL3 представляет собой нуклеиновую кислоту. В некоторых вариантах реализации изобретения нуклеиновая кислота представляет собой антисмысловое соединение. В некоторых вариантах реализации изобретения антисмысловое соединение представляет собой модифицированный олигонуклеотид.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Следует понимать, что изложенное выше общее описание и следующее подробное описание являются лишь примерными и пояснительными и не ограничивающими заявленное изобретение. В настоящем документе использование единственного числа включает множественное число, если специально не указано иное. При использовании в данном документе, термин «или» означает «и/или», если не указано иное. Кроме того, использование термина «включающий», а также других форм, таких как «включает» и «включенный», не является ограничивающим. Также, такие термины как «элемент» или «компонент» охватывают как элементы и компоненты, содержащие одну единицу, так и элементы и компоненты, которые содержат более одной субъединицы, если специально не указано иное.
Заголовки разделов используются в данном документе только для организационных целей и не должны быть истолкованы как ограничивающие объект изобретения. Все документы или части документов, цитируемые в данной заявке, включая, но не ограничиваясь, патентами, патентными заявками, статьями, книгами и трактатами, тем самым явно включены посредством ссылки как в том, что касается части документа, обсуждаемой в данном документе, так и в полном объеме.
Определения
При отсутствии конкретных определений, номенклатура, используемая в связи с ними, а также в связи с процедурами и методиками аналитической химии, синтетической органической химии, а также медицинской и фармацевтической химии, описанная в данном документе, является общеизвестной и общепринятой в данной области техники. Для химического синтеза и химического анализа могут быть использованы стандартные методики. В допустимых случаях, все патенты, заявки, опубликованные заявки и другие публикации, инвентаризационные номера GENBANK и связанная информация о последовательностях, доступная через базы данных, такие как Национальный Центр Биотехнологической Информации (NCBI) и другие данные, на которые присутствует ссылка в любом месте данного описания, включены посредством ссылки в частях документа, обсуждаемого в данном описании, а также в полном объеме.
Если не указано иное, следующие термины имеют следующие значения:
«2'-O-метоксиэтил» (а также 2'-МОЕ и 2'-O(CH2)2-ОCH3) относится к О-метоксиэтильной модификации в 2'-положении фурозильного кольца. 2'-O-метоксиэтилмодифицированный сахар представляет собой модифицированный сахар.
«2'-O-метоксиэтилнуклеотид» означает нуклеотид, содержащий а 2'-O-метоксиэтилмодифицированный сахаридный фрагмент.
«3'-целевой сайт» или «3'-сайт терминации» относится к нуклеотиду нуклеиновой кислоты-мишени, который комплементарный наиболее удаленному З'-нуклеотиду конкретного антисмыслового соединения.
«5'-целевой сайт» или «5'-сайт инициации» относится к нуклеотиду нуклеиновой кислоты-мишени, который комплементарный наиболее удаленному 5'-нуклеотиду конкретного антисмыслового соединения.
«5-метилцитозин» означает цитозин, модифицированный метальной группой, присоединенной к 5'-положению. 5-метилцитозин представляет собой модифицированное нуклеотидное основание.
«Около» означает нахождение в пределах ±10% значения. К примеру, если указано, «маркер может быть увеличен на около 50%», это подразумевает, что маркер может быть увеличен между 45%-55%.
«Активный фармацевтический агент» означает вещество или вещества в фармацевтической композиции, которые обеспечивают терапевтический эффект при введении индивиду. К примеру, в некоторых вариантах реализации изобретения антисмысловой олигонуклеотид, таргетирующий ANGPTL3, представляет собой активный фармацевтический агент.
«Активный целевой участок» или «целевой участок» означает участок, на который таргетируется одно или более активных антисмысловых соединений.
«Активные антисмысловые соединения» означают антисмысловые соединения, которые снижают уровни нуклеиновой кислоты-мишени или уровни белка.
«Адипогенез» означает развитие жировых клеток из преадипоцитов. «Липогенез» означает продуцирование или образование жира вследствие или жировой дегенерации или жировой инфильтрации.
«Адипозность» или «ожирение» относится к состоянию полноты или излишне высокого количества телесного жира или жировой ткани в отношении массы тела с низким содержанием жира. Количество телесного жира включает как понятие распределение жира во всем организме, так и размера и массы отложений жировой ткани. Распределение телесного жира может оцениваться измерениями кожных складок, соотношений обхвата талии-бедер или методов исследования, таких как ультразвук, компьютерная томография или магнитно-резонансная томография. Согласно данным Центра по контролю и профилактике заболеваемости, индивиды с индексом массы тела (ИМТ) 30 или более считаются страдающими ожирением. Термин «ожирение», применяемый в данном документе, включает патологические состояния, при которых наблюдается увеличение телесного жира за рамки природных требований, в результате избыточного накопления жировой ткани в организме. Термин «ожирение» включает, но не ограничивается следующими патологическими состояниями: ожирение зрелого возраста; алиментарное ожирение; эндогенное или метаболическое ожирение; эндокринное ожирение; семейное ожирение; гиперинсулинарное ожирение; гиперпластическое-гипертрофическое ожирение; гипогонадное ожирение; гипотиреоидное ожирение; пожизненное ожирение; морбидное ожирение и экзогенное ожирение.
«Вводятся совместно» относится к совместному введению двух агентов любым способом, при котором фармакологические эффекты обоих агентов проявляются у пациента одновременно. Сопутствующее введение не требует, чтобы оба агента вводились в одной фармацевтической композиции, в той же лекарственной форме или тем же путем введения. Эффекты обоих агентов не обязаны проявляться одновременно. Эффекты должны перекрываться только в течение периода времени и не обязаны быть одинаковыми по протяженности.
«Введение» означает обеспечение агентом животного, и включает, но не ограничивается введением медицинским работником и самостоятельным введением.
«Агент» означает действующее вещество, которое может обеспечивать терапевтический эффект при введении животному. «Первый агент» означает терапевтическое соединение по данному изобретению. К примеру, первый агент может быть антисмысловым олигонуклеотидом, таргетирующим ANGPTL3. «Второй агент» означает второе терапевтическое соединения по данному изобретению (например, второй антисмысловой олигонуклеотид, таргетирующий ANGPTL3) и/или не-ANGPTL3 терапевтическое соединение.
«Облегчение» относится к уменьшению по меньшей мере одного показателя, признака или симптома ассоциированного заболевания, нарушения или патологического состояния. Степень тяжести показателей может быть определена субъективными или объективными измерениями, которые известны специалистам в данной области.
«ANGPTL3» означает любую нуклеиновую кислоту или белок ANGPTL3.
«Экспрессия ANGPTL3» означает уровень мРНК, транскрибированной на гене, кодирующем ANGPTL3, или уровень белка, транслированного на мРНК. Экспрессия ANGPTL3 может определяться методами, известными в данной области, такими как Нозерн- или Вестерн-блот.
«Нуклеиновая кислота ANGPTL3» означает любую нуклеиновую кислоту, кодирующую ANGPTL3. Например, в некоторых вариантах реализации изобретения, нуклеиновая кислота ANGPTL3 включает последовательность ДНК, кодирующую ANGPTL3, последовательность РНК, транскрибированную с ДНК, кодирующей ANGPTL3 (включая геномную ДНК, содержащую интроны и экзоны), и последовательность мРНК, кодирующую ANGPTL3. «мРНК ANGPTL3» означает мРНК, кодирующую белок ANGPTL3.
«Животное» относится к человеку или животному, не являющемуся человеком, включая, но не ограничиваясь, мышами, крысами, кроликами, собаками, кошками, свиньями и приматами, кроме человека, включая, но не ограничиваясь, обезьянами и шимпанзе.
«Антисмысловая активность» означает любую обнаруживаемую или поддающуюся измерению активность, относящуюся к гибридизации антисмыслового соединения с его нуклеиновой кислотой-мишенью. В неких вариантах реализации, антисмысловая активность снижает количество или экспрессию нуклеиновой кислоты-мишени или белка-мишени, кодируемого такой нуклеиновой кислотой-мишенью.
«Антисмысловое соединение» означает олигомерное соединение, способное к прохождению гибридизации с нуклеиновой кислотой-мишенью при участии водородных связей.
«Антисмысловое ингибирование» означает снижение уровней нуклеиновой кислоты-мишени или уровней белка-мишени в присутствии антисмыслового соединения, комплементарного нуклеиновой кислоте-мишени, по сравнению с уровнями нуклеиновой кислоты-мишени или уровнями белка-мишени в отсутствие антисмыслового соединения.
«Антисмысловой олигонуклеотид» означает одноцепочечный олигонуклеотид, имеющий последовательность нуклеотидных оснований, обеспечивающую гибридизацию с соответствующим участком или сегментом нуклеиновой кислоты-мишени.
«АроВ-содержащий липопротеин» означает любой липопротеин, который содержит аполипопротеин В в качестве своего белкового компонента, и, как установлено, включает ЛПНП, ЛПОНП, ЛППП и липопротеин-(а) и в целом может таргетироваться снижающими содержание липидов средствами и видами терапии. «АроВ-100-содержащий ЛПНП» означает ЛПНП, содержащий изоформу АроВ-100.
«Атеросклероз» означает склерозирование артерий, поражающее артерии большого и среднего размера, и характеризующееся наличием жировых отложений. Жировые отложения называются «атеромами» или «бляшками», которые главным образом состоят из холестерина и других жиров, кальция и рубцовой ткани, и повреждают внутреннюю поверхность артерий.
«Бициклический сахар» означает фурозильное кольцо, модифицированное образованием мостика между двумя негеминальными атомами кольца. Бициклический сахар представляет собой модифицированный сахар.
«Бициклическая нуклеиновая кислота» или «BNA» относится к нуклеозиду или нуклеотиду, в котором фуранозная часть нуклеозида или нуклеотида включает мостиковое соединение двух атомов углерода на фуранозном кольце, благодаря чему образуется бициклическая кольцевая система.
«Кэп-структура» или «терминальный кэп-фрагмент» означает химические модификации, которые были введены на любом конце антисмыслового соединения.
«Сердечно-сосудистое заболевание» или «сердечно-сосудистое нарушение» относится к группе патологических состояний, связанных с сердцем, кровеносными сосудами или кровообращением. Примеры сердечно-сосудистых заболеваний или нарушений включают, но не ограничиваются, аневризмой, ангиной, аритмией, атеросклерозом, нарушением мозгового кровообращения (инсульт), ишемической болезнью сердца, гипертензией, дислипидемией, гиперлипидемией и гиперхолестеринемией.
«Кардиометаболическое заболевание» или «кардиометаболическое нарушение» представляют собой заболевания или нарушения, касающиеся как сердечно-сосудистой системы, так и метаболической системы. Примеры сердечно-сосудистых заболеваний или нарушений включают, но не ограничиваются, диабетом и дислипидемией.
«Химически отличающийся участок» относится к участку антисмыслового соединения, который некоторым образом химически отличается от другого участка того же антисмыслового соединения. Например, участок, содержащий 2'-O-метоксиэтильные нуклеотиды, является химически отличающимся от участка, содержащего нуклеотиды без 2'-О-метоксиэтильных модификаций.
«Химерное антисмысловое соединение» означает антисмысловое соединение, которое имеет по меньшей мере два химически отличающихся участка.
«Совместное введение» означает введение индивиду двух или более агентов. Два или более агентов могут быть представлены в одной фармацевтической композиции или могут быть представлены в отдельных фармацевтических композициях. Каждый из двух или более агентов может вводиться посредством тех же или разных путей введения. Совместное введение охватывает параллельное или последовательное введение.
«Холестерин» представляет собой молекулу стерола, обнаруженную в клеточных мембранах всех тканей животных. Холестерин должен транспортироваться в плазме крови животных липопротеинами, включающими липопротеин очень низкой плотности (ЛПОНП), липопротеин промежуточной плотности (ЛППП), липопротеин низкой плотности (ЛПНП) и липопротеин высокой плотности (ЛПВП). «Холестерин в плазме» относится к сумме всех липопротеинов (ЛПОНП, ЛППП, ЛПНП, ЛПВП), этерифицированных и/или неэтерифицированных холестерином, присутствующий в плазме или сыворотке.
«Ингибитор абсорбции холестерина» означает агент, который ингибирует абсорбцию экзогенного холестерина, полученного из пищевого рациона.
«Комплементарность» означает способность спаривания между нуклеотидными основаниями первой нуклеиновой кислоты и второй нуклеиновой кислоты. В некоторых вариантах реализации изобретения комплементарность между первой и второй нуклеиновой кислотой может быть между двумя цепями ДНК, между двумя цепями РНК или между цепью ДНК и РНК. В некоторых вариантах реализации изобретения несколько нуклеотидных оснований на одной цепи согласованы с комплементарными по водородным связям основаниями на другой цепи. В некоторых вариантах реализации изобретения все нуклеотидные основания на одной цепи согласованы с комплементарными по водородным связям основаниями на другой цепи. В некоторых вариантах реализации изобретения первая нуклеиновая кислота представляет собой антисмысловое соединение, а вторая нуклеиновая кислота представляет собой нуклеиновую кислоту-мишень. В некоторых таких вариантах реализации изобретения первый антисмысловой олигонуклеотид представляет собой первую нуклеиновую кислоту, а нуклеиновая кислота-мишень представляет собой вторую нуклеиновую кислоту.
«Последовательные нуклеотидные основания» означают нуклеотидные основания непосредственно примыкающие друг к другу.
«Ишемическая болезнь сердца (ИБС)» означает сужение малых кровеносных сосудов, которые снабжают сердце кровью и кислородом, что часто является результатом атеросклероза.
«Дезоксирибонуклеотид» означает нуклеотид, содержащий атом водорода в 2'-положении сахаридного фрагмента нуклеотида. Дезоксирибонуклеотиды могут быть модифицированы с помощью любого из разнообразных заместителей.
«Сахарный диабет» или «диабет» представляет собой синдром, характеризующийся нарушенным метаболизмом и аномально высоким содержанием сахара в крови (гипергликемия), возникающим вследствие недостаточных уровней инсулина или пониженной чувствительности к инсулину. Характерные симптомы представлены избыточным мочеотделением (полиурия) из-за высоких уровней глюкозы в крови, чрезмерной жаждой и повышенным потреблением жидкости (полидипсия), как попытки компенсировать увеличенное мочевыделение, размытым зрением из-за влияния высокого содержания глюкозы в крови на оптическую систему глаза, необъяснимой потерей веса и летаргией.
«Диабетическая дислипидемия» или «диабет 2 типа с дислипидемией» означает патологическое состояние, характеризующееся диабетом 2 типа, пониженными уровнями ХС-ЛПВП, повышенными уровнями триглицеридов и повышенными уровнями малых плотных частиц ЛПНП.
«Растворитель» означает ингредиент в композиции, у которого отсутствует фармакологическая активность, но который с фармацевтической точки зрения является необходимым или желательным. К примеру, растворитель в инъекционной композиции может быть жидкостью, например, солевым раствором.
«Дислипидемия» относится к нарушению метаболизма липидов и/или липопротеинов, включающему сверхпродукцию или дефицит липидов и/или липопротеинов. Дислипидемия может проявляться повышением содержания липидов, таких как холестерин и триглицериды, а также липопротеинов, таких как холестерин липопротеинов низкой плотности (ЛПНП).
«Единица дозирования» означает форму, в которой представлен фармацевтический агент, например, пилюля, таблетка или другая единица дозирования, известная в данной области. В некоторых вариантах реализации изобретения единица дозирования представляет собой флакон, содержащий лиофилизированный антисмысловой олигонуклеотид. В некоторых вариантах реализации изобретения единица дозирования представляет собой флакон, содержащий растворенный антисмысловой олигонуклеотид.
«Доза» означает установленное количество фармацевтического агента, обеспечиваемое одним введением или в течение установленного периода времени. В некоторых вариантах реализации изобретения доза может вводиться одним, двумя или более болюсными введениями, таблетками или инъекциями. Например, в некоторых вариантах реализации изобретения, когда требуется подкожное введение, а нужная доза требует объема, который не легко обеспечить одной инъекцией, то для достижения требуемой дозы могут быть использованы две или более инъекций. В некоторых вариантах реализации изобретения фармацевтический агент вводят инфузией в течение длительного периода времени или непрерывно. Дозы могут быть указаны как количество фармацевтического агента вводимого за час, сутки, неделю или месяц. Дозы могут быть выражены в виде мг/кг или г/кг.
«Эффективное количество» или «терапевтически эффективное количество» означает количество активного фармацевтического агента, достаточное для реализации требуемого физиологического последствия у нуждающегося в этом агенте индивида. Эффективное количество может варьировать среди индивидов в зависимости от состояния здоровья и физического состояния индивида, к которому применяется лечение, таксономической группы индивидов, к которым применяется лечение, рецептуры композиции, оценки медицинского показания индивида и других соответствующих факторов.
«Полностью комплементарный» или «комплементарный на 100%» означает, что каждое нуклеотидное основание последовательности нуклеотидных оснований первой нуклеиновой кислоты имеет комплементарное нуклеотидное основание во второй последовательности нуклеотидных оснований второй нуклеиновой кислоты. В некоторых вариантах реализации изобретения первая нуклеиновая кислота представляет собой антисмысловое соединение, а нуклеиновая кислота-мишень представляет собой вторую нуклеиновую кислоту.
«Гэпмер» означает химерное антисмысловое соединение, в котором внутренний участок, имеющий множество нуклеозидов, которые поддерживают расщепление РНКазой Н, располагается между наружными участками, имеющими один или более нуклеозидов, причем нуклеозиды, составляющие внутренний участок, химически отличающиеся от нуклеозида или нуклеозидов, составляющих внешние участки. Внутренний участок может называться «гэп-сегментом», а внешние участки могут называться «сегментами крыльев».
«Гэп-расширенный» означает химерное антисмысловое соединение, имеющее гэп-сегмент из 12 или более последовательных 2'-дезоксирибонуклеозидов, расположенных между и непосредственно примыкающих к сегментам 5'- и 3'-крыльев, имеющим от одного до шести нуклеозидов.
«Глюкоза» представляет собой моносахарид, используемый как источник энергии и метаболический интермедиат. «Глюкоза в плазме» относится к глюкозе, присутствующей в плазме.
«ХС липопротеинов высокой плотности (ХС-ЛПВП)» означает холестерин ассоциированный с частицами липопротеинов высокой плотности. Концентрацию ХС-ЛПВП в сыворотке (или плазме) как правило количественно измеряют в мг/дл или нмоль/л. «ХС-ЛПВП в сыворотке» и «ХС-ЛПВП в плазме» означают, соответственно, ХС-ЛПВП в сыворотке и плазме.
«Ингибитор ГМГ-КоА-редуктазы» означает агент, который действует посредством ингибирования фермента ГМГ-КоА-редуктазы, такой как аторвастатин, розувастатин, флувастатин, ловастатин, правастатин и симвастатин.
«Гибридизация» означает отжиг комплементарных молекул нуклеиновых кислот. В некоторых вариантах реализации изобретения молекулы комплементарных нуклеиновых кислот включают антисмысловое соединение и нуклеиновую кислоту-мишень.
«Гиперхолестеринемия» означает патологическое состояние, характеризующееся повышенным уровнем холестерина или циркулирующего холестерина (в плазме), холестерина-ЛПНП и холестерина-ЛПОНП, согласно руководств Отчета экспертной группы Национальной образовательной программы по холестерину (NCEP) по обнаружению, оцениванию и лечению высокого уровня холестерина у взрослых (см. Arch. Int. Med. (1988) 148, 36-39).
«Гиперлипидемия» или «гиперлипемия» представляет собой патологическое состояние, характеризующееся повышенным уровнем липидов в сыворотке или циркулирующих липидов (в плазме). В этом патологическом состоянии проявляется аномально высокая концентрация жиров. Липидные фракции в циркулирующей крови представлены холестерином, липопротеинами низкой плотности, липопротеинами очень низкой плотности и триглицеридами.
«Гипертриглицеридемия» означает патологическое состояние, характеризующееся повышенными уровнями триглицеридов.
«Идентификация» или «выбор субъекта, имеющего метаболическое или сердечнососудистое заболевание» означает идентификацию или выбор субъекта, у которого диагностировано метаболическое заболевание, сердечно-сосудистое заболевание или метаболический синдром; или идентификацию или выбор субъекта, имеющего любой симптом метаболического заболевания, сердечно-сосудистого заболевания или метаболического синдрома, включающего, но не ограниченного, гиперхолестеринемией, гипергликемией, гиперлипидемией, гипертриглицеридемией, гипертензией, повышенной инсулинорезистентностью, пониженной чувствительностью к инсулину, превышающим нормальный весом тела и/или превышающим нормальное содержание телесного жира или их любой комбинацией. Такая идентификация может выполняться любым способом, включающим, но не ограниченным, стандартными клиническими исследованиями или обследованиями, такими как измерение сывороточного или циркулирующего холестерина (в плазме), измерение сывороточной или циркулирующей глюкозы крови (в плазме), измерение сывороточных или циркулирующих триглицеридов (в плазме), измерение артериального давления, измерение содержания телесного жира, измерение веса тела и тому подобное.
«Идентификация» или «выбор субъекта с диабетом» означает идентификацию или выбор субъекта, который идентифицирован как диабетик, или идентификацию или выбор субъекта, имеющего любой симптом диабета (1 типа или 2 типа), такой как, но не ограниченный, уровнем глюкозы натощак по меньшей мере 110 мг/дл, гликозурией, полиурией, полидипсией, увеличенной инсулинорезистентностью и/или уменьшенной чувствительностью к инсулину.
«Идентификация» или «выбор субъекта с ожирением» означает идентификацию или выбор субъекта, у которого диагностировано ожирение, или идентификацию или выбор субъекта с ИМТ более 30, или окружностью талии более 102 см у мужчин или более 88 см у женщин.
«Идентификация» или «выбор субъекта, имеющего дислипидемию» означает идентификацию или выбор субъекта, у которого диагностировано нарушение метаболизма липидов и/или липопротеинов, включающее сверхпродукцию или дефицит липидов и/или липопротеинов. Дислипидемия может проявляться повышением уровня липидов, таких как холестерин и триглицериды, а также липопротеинов, таких как холестерин липопротеинов низкой плотности (ЛПНП).
«Идентификация» или «выбор» субъекта, имеющего увеличенную адипозность означает идентификацию или выбор субъекта, имеющего увеличенное количество телесного жира (или адипозность), которое включает отношение к одному или обоим распределениям жира во всем организме и размер и массу отложений жировой ткани. Распределение телесного жира может оцениваться измерениями кожных складок, соотношений обхвата талии-бедер или методов исследования, таких как ультразвук, компьютерная томография или магнитно-резонансная томография. Согласно данным Центра по контролю и профилактике заболеваемости индивиды с индексом массы тела (ИМТ) 30 или более считаются страдающими ожирением.
«Улучшенный исход сердечно-сосудистого заболевания» означает снижение частоты проявления нежелательных сердечно-сосудистых явлений или риска их возникновения. Примеры нежелательных сердечно-сосудистых явлений включают без ограничения: смерть, повторный инфаркт, инсульт, кардиогенный шок, отек легких, остановку сердца и предсердную аритмию.
«Непосредственно прилегающий» означает, что нет никаких промежуточных элементов между непосредственно прилегающими элементами.
«Индивид» или «субъект» или «животное» означает человека или животное, не являющееся человеком, выбранное для лечения или терапии.
«Ингибирование экспрессии или активности» относится к снижению или блокаде экспрессии или активности и не обязательно означает полное прекращении экспрессии или активности.
«Инсулинорезистентность» определяется как патологическое состояние, в котором нормальные количества инсулина недостаточны для воспроизведения нормального ответа на инсулин клетками, например, жировыми клетками, клетками мышц и/или печени. Инсулинорезистентность жировых клеток приводит к гидролизу запасенных триглицеридов, что повышает в плазме крови уровни свободных жирных кислот. Инсулинорезистентность мышц снижает потребление глюкозы, тогда как инсулинорезистентность печени снижает запасание глюкозы, причем оба эффекта способствуют повышению уровня глюкозы в крови. Высокие уровни инсулина и глюкозы в плазме из-за инсулинорезистентности часто приводят к метаболическому синдрому и диабету 2 типа.
«Чувствительность к инсулину» представляет собой меру с какой эффективностью организм индивида усваивает глюкозу. Индивид, имеющий высокую чувствительность к инсулину эффективно усваивает глюкозу, тогда как индивид с низкой чувствительностью к инсулину не эффективно усваивает глюкозу.
«Межнуклеозидная связь» относится к химической связи между нуклеозидами.
«Внутривенное введение» означает введение в вену.
«Связанные нуклеозиды» означают прилегающие нуклеозиды, которые связаны вместе.
«Снижение уровня липидов» означает уменьшение в организме субъекта уровня одного или более липидов. Снижение уровня липидов может происходить с применением одной или более доз с течением времени.
«Агент, снижающий уровень липидов» означает агент, к примеру, ANGPTL3-специфический модулятор, предоставляемый субъекту для достижения у субъекта снижения уровня липидов. К примеру, в некоторых вариантах реализации изобретения агент, снижающий уровень липидов, предоставляют субъекту для снижения уровня одного или более факторов из: ароВ, ароС-III, общее содержание холестерина, ХС-ЛПНП, ХС-ЛПОНП, ХС-ЛППП, ХС-ЛП-не-ВП, триглицеридов, малых плотных частиц ЛПНП и ЛП-(а) у субъекта.
«Снижение уровня липидов» означает терапевтический режим, предоставляемый субъекту для снижения у субъекта уровня одного или более липидов. В некоторых вариантах реализации изобретения снижающую уровень липидов терапию предоставляют субъекту для снижения уровня одного или более факторов из: ароВ, ароС-III, общее содержание холестерина, ХС-ЛПНП, ХС-ЛПОНП, ХС-ЛППП, ХС-ЛП-не-ВП, триглицеридов, малых плотных частиц ЛПНП и ЛП-(а) у субъекта.
«Липопротеин», такой как ЛПОНП, ЛПНП и ЛПВП, относится к группе белков, обнаруженных в сыворотке, плазме и лимфе, и являющихся важными для транспорта липидов. Химический состав каждого липопротеина отличается тем, что ЛПВП обладает большей пропорцией белка по сравнению с липидом, тогда как ЛПОНП обладает меньшей пропорцией белка по сравнению с липидом.
«Холестерин липопротеинов низкой плотности (ХС-ЛПНП)» означает холестерин, переносимый в частицах липопротеинов низкой плотности. Концентрацию ХС-ЛПНП в сыворотке (или плазме) как правило количественно измеряют в мг/дл или нмоль/л. «ХС-ЛПНП в сыворотке» и «ХС-ЛПНП в плазме» означает, соответственно, ХС-ЛПНП в сыворотке и плазме.
Термин «основные факторы риска» относится к факторам, которые вызывают высокий риск конкретного заболевания или патологического состояния. В некоторых вариантах реализации изобретения основные факторы риска для ишемической болезни сердца включают, без ограничения, сигаретный дым, гипертензию, низкий уровень ХС-ЛПВП, наследственную историю ишемической болезни сердца, возраст и другие факторы, описанные в данном документе.
«Метаболическое нарушение» или «метаболическое заболевание» относится к патологическому состоянию, характеризующемуся изменением или искажением метаболического функционирования. «Метаболический» и «метаболизм» являются терминами, хорошо известными в данной области и, в целом, включают весь диапазон биохимических процессов, которые происходят внутри живого организма. Метаболические нарушения включают, но не ограничиваются, гипергликемией, преддиабетом, диабетом (I типа и 2 типа), ожирением, инсулинорезистентностью, метаболическим синдромом и дислипидемией из-за диабета 2 типа.
«Метаболический синдром» означает патологическое состояние, характеризующееся кластеризацией липидных и нелипидных факторов риска сердечно-сосудистых заболеваний метаболического происхождения. В некоторых вариантах реализации изобретения метаболический синдром идентифицируют по наличию любых 3 из следующих факторов: окружность талии более 102 см у мужчин или более 88 см у женщин; триглицериды в сыворотке по меньшей мере 150 мг/дл; ХС-ЛПВП менее 40 мг/дл у мужчин и менее 50 мг/дл у женщин; артериальное давление по меньшей мере 130/85 мм Hg и содержание глюкозы натощак по меньшей мере 110 мг/дл. Эти детерминанты могут легко измеряться в клинической практике (JAMA, 2001, 285: 2486-2497).
«Мисматчевое» или «некомплементарное нуклеотидное основание» относится к случаю, когда нуклеотидное основание первой нуклеиновой кислоты не способно спариваться с соответствующим нуклеотидным основанием второй нуклеиновой кислоты или нуклеиновой кислоты-мишени.
«Смешанная дислипидемия» означает патологическое состояние, характеризующееся повышенными уровнями холестерина и повышенными уровнями триглицеридов.
«Модифицированная межнуклеозидная связь» относится к замещению или любому изменению встречающейся в природе межнуклеозидной связи (т.е. фосфодиэфирной межнуклеозидной связи).
«Модифицированное нуклеотидное основание» относится к любому нуклеотидному основанию, отличающемуся от аденина, цитозина, гуанина, тимидина или урацила. «Немодифицированное нуклеотидное основание» означает пуриновые основания: аденин (А) и гуанин (G), и пиримидиновые основания: тимин (Т), цитозин (С) и урацил (U).
«Модифицированный нуклеозид» означает нуклеозид, независимо содержащий один или более модифицированных сахаридных фрагментов или модифицированных нуклеотидных оснований.
«Модифицированный нуклеотид» означает нуклеотид, содержащий независимо один или более модифицированных сахаридных фрагментов, модифицированных межнуклеозидных связей или модифицированных нуклеотидных оснований. «Модифицированный нуклеозид» означает нуклеозид, независимо содержащий один или более модифицированных сахаридных фрагментов или модифицированных нуклеотидных оснований.
«Модифицированный олигонуклеотид» означает олигонуклеотид, содержащий по меньшей мере один модифицированный нуклеотид.
«Модифицированный сахар» относится к замещению и/или изменению любого из природных сахаров.
«Мотив» означает паттерн из химически отличающихся участков в антисмысловом соединении.
«Ингибитор МТР» означает агент, ингибирующий фермент микросомального белка переноса триглицеридов.
«Встречающаяся в природе межнуклеозидная связь» означает фосфодиэфирную связь 3'-5'.
«Природный сахаридный фрагмент» означает сахар, обнаруженный в ДНК (2'-Н) или РНК (2'-ОН).
«Неалкогольное жировое заболевание печени» или «НАЖЗП» означает патологическое состояние, характеризующееся жировым воспалением печени, которое происходит не из-за избыточного потребления алкоголя (к примеру, употребления алкоголя превышающее 20 г/сутки). В некоторых вариантах реализации изобретения НАЖЗП относится к инсулинорезистентности и метаболическому синдрому. НАЖЗП охватывает спектр заболеваний от простого накопления триглицеридов в гепатоцитах (стеатоз печени) до стеатоза печени с воспалением (стеатогепатит), фиброза и цирроза.
«Неалкогольный стеатогепатит» (НАСГ) происходит при прогрессировании НАЖЗП за рамки отложения триглицеридов. Для развития НАСГ требуется «второй импульс», способный индуцировать некроз, воспаление и фиброз, а фиброз необходим для развития НАСГ. Кандидаты второго импульса могут группироваться в большие категории: факторы, вызывающие увеличение окислительного стресса, и факторы, способствующие экспрессии провоспалительных цитокинов. Предполагается, что увеличенные уровни триглицеридов в печени приводят к увеличению окислительного стресса в гепатоцитах животных и людей, указывая на потенциальную причинно-следственную взаимосвязь между накоплением триглицеридов в печени, окислительным стрессом и прогрессированием стеатоза печени до НАСГ (Browning и Horton, J Clin Invest, 2004, 114, 147-152). Гипертриглицеридемия и гиперемия жирных кислот может вызывать накопление триглицеридов в периферических тканях (Shimamura et al., Biochem Biophys Res Commun, 2004, 322, 1080-1085).
«Нуклеиновая кислота» означает молекулы, состоящие из мономерных нуклеотидов. Нуклеиновая кислота включает рибонуклеиновые кислоты (РНК), дезоксирибонуклеиновые кислоты (ДНК), одноцепочечные нуклеиновые кислоты, двухцепочечные нуклеиновые кислоты, малые интерферирующие рибонуклеиновые кислоты (миРНК) и микроРНК. Нуклеиновая кислота также может содержать комбинации этих элементов в одной молекуле.
«Нуклеотидное основание» означает гетероциклический фрагмент, способный спариваться с основанием другой нуклеиновой кислоты.
«Последовательность нуклеотидных оснований» означает порядок последовательных нуклеотидных оснований независимый от любого сахарасахара, связи и/или модификации нуклеотидного основания.
«Нуклеозид» означает нуклеотидное основание связанное с сахаридом.
«Нуклеозидный миметик» включает структуры, используемые для замены сахарасахара, или сахара и основания, и необязательно связи в одном или нескольких положениях олигомерного соединения, такие как, к примеру, нуклеозидные миметики, содержащие морфолино-, циклогексенил-, циклогексил-, тетрагидропиранил-, бицикло- или трициклосахаридные миметики, например, нефуранозные сахаридные фрагменты.
«Нуклеотид» означает нуклеозид, содержащий фосфатную группу, ковалентно связанную с сахаридным фрагментом нуклеозида.
«Нуклеотидный миметик» включает структуры, используемые для замены нуклеозида и связи в одном или более положениях олигомерного соединения, такие как, к примеру, пептидные нуклеиновые кислоты или морфолины (морфолины связаны -N(H)-C(=O)-O- или другой нефосфодиэфирной связью).
«Олигомерное соединение» или «олигомер» относится к полимерной структуре, содержащей две или более субструктур, и способной к гибридизации с участком молекулы нуклеиновой кислоты. В некоторых вариантах реализации изобретения олигомерные соединения представляют собой олигонуклеозиды. В некоторых вариантах реализации изобретения олигомерные соединения представляют собой олигонуклеотиды. В некоторых вариантах реализации изобретения олигомерные соединения представляют собой антисмысловые соединения. В некоторых вариантах реализации изобретения олигомерные соединения представляют собой антисмысловые олигонуклеотиды. В некоторых вариантах реализации изобретения олигомерные соединения представляют собой химерные олигонуклеотиды.
«Олигонуклеотид» означает полимер из связанных нуклеозидов каждый из которых может быть модифицированным или немодифицированным, независимо друг от друга.
«Парентеральное введение» означает введение способом, отличающимся от введения через пищеварительный тракт. Парентеральное введение включает местное введение, подкожное введение, внутривенное введение, внутримышечное введение, внутриартериальное введение, внутрибрюшинное введение или внутричерепное введение, например, интратекальное или интрацеребровентрикулярное введение. Введение может быть непрерывным, или постоянным, или кратковременным, или периодическим.
«Пептид» означает молекулу, образованную связыванием по меньшей мере двух аминокислот посредством амидных связей. Пептид относится к полипептидам и белкам.
«Фармацевтический агент» означает вещество, которое обеспечивает терапевтический эффект при введении индивиду. К примеру, в некоторых вариантах реализации изобретения антисмысловой олигонуклеотид, таргетирующий ANGPTL3, представляет собой фармацевтический агент.
«Фармацевтическая композиция» означает смесь веществ, пригодную для введения индивиду. Например, фармацевтическая композиция может содержать один или более антисмысловых агентов и стерильный водный раствор.
«Фармацевтически приемлемый носитель» означает среду или растворитель, который не влияет на структуру или функционирование олигонуклеотида. Некоторые из таких носителей дают возможность готовить фармацевтические композиции в виде, к примеру, таблеток, пилюль, драже, капсул, жидкостей, гелей, сиропов, взвесей, суспензий и пастилок для перорального потребления субъектом. Некоторые из таких носителей дают возможность готовить фармацевтические композиции для инъекции или инфузии. К примеру, фармацевтически приемлемый носитель может быть стерильным водным раствором.
«Фармацевтически приемлемые соли» обозначают физиологически и фармацевтически приемлемые соли антисмысловых соединений, т.е. соли, которые сохраняют требуемую биологическую активность исходного олигонуклеотида и не придают им нежелательных токсикологических эффектов.
«Тиофосфатная связь» означает связь между нуклеозидами, в которой фосфодиэфирная связь модифицирована заменой одного из немостиковых атомов кислорода атомом серы. Тиофосфатная связь представляет собой модифицированную межнуклеозидную связь.
«Часть» означает определенное количество последовательных (т.е. связанных) нуклеотидных оснований нуклеиновой кислоты. В некоторых вариантах реализации изобретения часть представляет собой определенное количество последовательных нуклеотидных оснований нуклеиновой кислоты-мишени. В некоторых вариантах реализации изобретения часть представляет собой определенное количество последовательных нуклеотидных оснований антисмыслового соединения.
«Предупреждать» относится к задержке или предотвращению проявления или развития заболевания, нарушения или патологического состояния в течение периода времени от нескольких минут до неопределенного срока. Предупреждать также означает снижение риска развития заболевания, нарушения или патологического состояния.
«Пролекарство» означает терапевтический агент, который готовится в неактивной форме, которая преобразуется в активную форму внутри организма или его клетках под действием эндогенных ферментов или других химических веществ или условий.
«Побочные эффекты» означают отличающиеся от требуемых эффектов физиологические ответы, присущие лечению. В некоторых вариантах реализации изобретения побочные эффекты включают реакции в месте инъекции, аномалии функциональных анализов печени, аномалии функционирования почек, гепатотоксичность, нефротоксичность, аномалии центральной нервной системы, миопатии и недомогание. К примеру, увеличенные уровни активности аминотрансферазы в сыворотке могут указывать на гепатотоксичность или аномалию функционирования печени. К примеру, увеличенный уровень билирубина может указывать на гепатотоксичность или аномалию функционирования печени.
«Одноцепочечный олигонуклеотид» означает олигонуклеотид, который не гибридизирован с комплементарной цепью.
«Способный к специфичной гибридизации» относится к антисмысловому соединению, обладающему достаточной степенью комплементарности с нуклеиновой кислотой-мишенью для индуцирования требуемого эффекта при минимальном или отсутствии влияния на нецелевые нуклеиновые кислоты в условиях, в которых требуется специфическое связывание, т.е. в физиологических условиях в случае анализов in vivo и видов терапевтического лечения.
«Статин» означает агент, который ингибирует активность ГМГ-КоА-редуктазы.
«Подкожное введение» означает введение сразу под кожу.
«Таргетинг» или «таргетированный» означает процесс конструирования и выбора антисмыслового соединения, которое будет специфически гибридизироваться с нуклеиновой кислотой-мишенью и индуцироватьтребуемый эффект.
Все термины «нуклеиновая кислота-мишень», «РНК-мишень» и «целевой РНК-транскрипт» относятся к нуклеиновой кислоте, способной таргетироваться антисмысловыми соединениями.
«Целевой участок» определяется как часть нуклеиновой кислоты-мишени, имеющей по меньшей мере одну идентифицируемую структуру, функцию или характеристику.
«Целевой сегмент» означает последовательность нуклеотидов нуклеиновой кислоты-мишени, на которую таргетировано одно или более антисмысловых соединений. «5'-целевой сайт» или «5'-сайт инициации» относится к наиболее удаленному 5'-нуклеотиду целевого сегмента. «3'-целевой сайт» или «3'-сайт терминации» относится к наиболее удаленному 3'-нуклеотиду целевого сегмента.
«Терапевтически эффективное количество» означает количество агента, которое обеспечивает для индивида терапевтический эффект.
«Терапевтическое изменение образа жизни» означает изменения рациона питания и образа жизни, предполагающее снижение массы жировой/адипозной ткани и/или холестерина. Такие изменения могут снижать риск развития заболевания сердечно-сосудистой системы и могут включать рекомендации по диетическому потреблению общего количества калорий в сутки, общего жира, насыщенного жира, полиненасыщенного жира, мононенасыщенного жира, углеводов, белка, холестерина, нерастворимых волокон, а также рекомендации по физической активности.
«Триглицерид» означает липид или нейтральный жир, состоящий из глицерина в сочетании с тремя молекулами жирных кислот.
«Диабет 2 типа» (также известный как сахарный диабет 2 типа» или « сахарный диабет, тип 2», и ранее называвшийся «диабетом сахарным 2 типа», «инсулин-независимым диабетом (ИНЗСД)», «связанный с ожирением диабет» или «диабет зрелого возраста») представляет собой метаболическое нарушение, которое главным образом характеризуется инсулинорезистентностью, относительной недостаточностью инсулина и гипергликемией.
«Лечить» относится к введению фармацевтической композиции для получения эффекта изменения или облегчения заболевания, нарушения или патологического состояния.
«Немодифицированный нуклеотид» означает нуклеотид, состоящий из встречающихся в природе нуклеотидных оснований, фрагментов сахаров и межнуклеозидных связей. В некоторых вариантах реализации изобретения немодифицированный нуклеотид представляет собой РНК-нуклеотид (т.е. β-D-рибонуклеозид) или ДНК-нуклеотид (т.е. β-D-дезоксирибонуклеозид).
Некоторые варианты реализации изобретения
В некоторых вариантах реализации изобретения, описанных в данном документе, ANGPTL3 имеет последовательность, указанную в GENBANK, инвентаризационный номер NM 014495.2 (включена в данное описание как SEQ ID NO: 1). В некоторых вариантах реализации изобретения ANGPTL3 имеет последовательность, указанную в GENBANK, инвентаризационный номер NT_032977.9, нуклеотиды от 33032001 до 33046000 (включена в данное описание как SEQ ID NO: 2).
В некоторых вариантах реализации изобретения, описанных в данном документе, представлены соединения или композиции, содержащие модифицированный олигонуклеотид, состоящий из 12-30 нуклеозидов, имеющих последовательность нуклеотидных оснований, содержащую по меньшей мере 8 последовательных нуклеотидных оснований, комплементарных части равной длины SEQ ID NO: 1-2.
В некоторых вариантах реализации изобретения, описанных в данном документе, представлены соединения или композиции, содержащие модифицированный олигонуклеотид в длину 12-30 связанных нуклеозидов, таргетирующих ANGPTL3. Целевой ANGPTL3 может иметь последовательность, выбранную из любой из SEQ ID NO: 1-2.
В некоторых вариантах реализации изобретения, описанных в данном документе, представлены соединения или композиции, содержащие модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов и содержащий последовательность нуклеотидных оснований, содержащую часть из по меньшей мере 8 последовательных нуклеотидных оснований, комплементарных части равной длины из нуклеотидных оснований от 1140 до 1159 SEQ ID NO: 1, причем последовательность нуклеотидных оснований модифицированного олигонуклеотида по меньшей мере на 80% комплементарна SEQ ID NO: 1. В некоторых вариантах реализации изобретения модифицированный олигонуклеотид составляют по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19 или 20 последовательных нуклеотидных оснований, комплементарных части равной длины из нуклеотидных оснований от 1140 до 1159 SEQ ID NO: 1.
В некоторых вариантах реализации изобретения, описанных в данном документе, представлены соединения или композиции, содержащие модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов и содержащий последовательность нуклеотидных оснований, комплементарную нуклеотидным основаниям от 1140 до 1159 SEQ ID NO: 1, причем последовательность нуклеотидных оснований модифицированного олигонуклеотида по меньшей мере на 80% комплементарна SEQ ID NO: 1.
В некоторых вариантах реализации изобретения, описанных в данном документе, представлены соединения или композиции, содержащие модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов и содержащий последовательность нуклеотидных оснований, содержащую часть из по меньшей мере 8 последовательных нуклеотидных оснований, комплементарных части равной длины из нуклеотидных оснований от 1907 до 1926 SEQ ID NO: 1, причем последовательность нуклеотидных оснований модифицированного олигонуклеотида по меньшей мере на 80% комплементарна SEQ ID NO: 1. В некоторых вариантах реализации изобретения модифицированный олигонуклеотид составляют по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19 или 20 последовательных нуклеотидных оснований, комплементарных части равной длины из нуклеотидных оснований от 1907 до 1926 SEQ ID NO: 1.
В некоторых вариантах реализации изобретения, описанных в данном документе, представлены соединения или композиции, содержащие модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов и содержащий последовательность нуклеотидных оснований, комплементарную нуклеотидным основаниям от 1907 до 1926 SEQ ID NO: 1, причем последовательность нуклеотидных оснований модифицированного олигонуклеотида по меньшей мере на 80% комплементарна SEQ ID NO: 1.
В некоторых вариантах реализации изобретения, описанных в данном документе, представлены соединения или композиции, содержащие модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов и содержащий последовательность нуклеотидных оснований, содержащую часть из по меньшей мере 8 последовательных нуклеотидных оснований, комплементарных части равной длины из нуклеотидных оснований от 147 до 162 SEQ ID NO: 1, причем последовательность нуклеотидных оснований модифицированного олигонуклеотида по меньшей мере на 80% комплементарна SEQ ID NO: 1. В некоторых вариантах реализации изобретения модифицированный олигонуклеотид составляют по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15 или 16 последовательных нуклеотидных оснований, комплементарных части равной длины из нуклеотидных оснований от 147 до 162 SEQ ID NO: 1.
В некоторых вариантах реализации изобретения, описанных в данном документе, представлены соединения или композиции, содержащие модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов и содержащий последовательность нуклеотидных оснований, комплементарную нуклеотидным основаниям от 147 до 162 SEQ ID NO: 1, причем последовательность нуклеотидных оснований модифицированного олигонуклеотида по меньшей мере на 80% комплементарна SEQ ID NO: 1.
В некоторых вариантах реализации модифицированный олигонуклеотид состоит из 12-30, 15-30, 18-24, 19-22, 13-25, 14-25, 15-25 или от 16-24 связанных нуклеозидов. В некоторых вариантах реализации изобретения модифицированный олигонуклеотид состоит из 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 связанных нуклеозидов или диапазона, определенного любыми двумя из этих значений. В некоторых вариантах реализации модифицированный олигонуклеотид составляет в длину из 16 связанных нуклеозидов. В некоторых вариантах реализации модифицированный олигонуклеотид составляет в длину из 20 связанных нуклеозидов.
В некоторых вариантах реализации изобретения модифицированный олигонуклеотид содержит последовательность нуклеотидных оснований, содержащую часть из по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19 или 20 последовательных нуклеотидных оснований, комплементарных части равной длины SEQ ID NO: 1 или 2.
В некоторых вариантах реализации изобретения, описанных в данном документе, представлены соединения или композиции, содержащие модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов и имеющий последовательность нуклеотидных оснований, содержащую по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19 или 20 последовательных нуклеотидных оснований, выбранных из любой из SEQ ID NO:
15-27, 30-73, 75-85, 87-232, 238, 240-243, 245-247, 249-262, 264-397, 399-469, 471-541, 543-600, 604-760, 762-819, 821-966, 968-971, 973-975, 977-990, 992-1110, 1112-1186, 1188-1216, 1218-1226, 1228-1279, 1281-1293, 1295-1304, 1306-1943, 1945-1951, 1953-1977, 1979-1981, 1983-2044, 2046-2097, 2099-2181, 2183-2232, 2234-2238, 2240-2258, 2260-2265, 2267-2971, 2973-2976, 2978-4162, 4164-4329, 4331-4389, 4391-4394, 4396-4877.
В некоторых вариантах реализации изобретения, описанных в данном документе, представлены соединения или композиции, содержащие модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов и имеющий последовательность нуклеотидных оснований, содержащую по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19 или 20 последовательных нуклеотидных оснований из последовательностей нуклеотидных оснований SEQ ID NO: 77.
В некоторых вариантах реализации изобретения, описанных в данном документе, представлены соединения или композиции, содержащие модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов и имеющий последовательность нуклеотидных оснований, содержащую по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19 или 20 последовательных нуклеотидных оснований из последовательности нуклеотидных оснований SEQ ID NO: 20.
В некоторых вариантах реализации изобретения, описанных в данном документе, представлены соединения или композиции, содержащие модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов и имеющий последовательность нуклеотидных оснований, содержащую по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15 или 16 последовательных нуклеотидных оснований из последовательности нуклеотидных оснований SEQ ID NO: 110.
В некоторых вариантах реализации изобретения последовательность нуклеотидных оснований по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95% или 100% комплементарна любой из SEQ ID NO: 1-2, как измерено на всей длине модифицированного олигонуклеотида.
В некоторых вариантах реализации изобретения соединение, описанное в данном документе, представляет собой одноцепочечный олигонуклеотид. В некоторых вариантах реализации изобретения соединение, описанное в данном документе, представляет собой одноцепочечный модифицированный олигонуклеотид.
В некоторых вариантах реализации изобретения по меньшей мере одна межнуклеозидная связь указанного модифицированного олигонуклеотида представляет собой модифицированную межнуклеозидную связь. В некоторых вариантах реализации изобретения каждая межнуклеозидная представляет собой тиофосфатную межнуклеозидную связь.
В некоторых вариантах реализации изобретения по меньшей мере один нуклеозид модифицированного олигонуклеотида содержит модифицированный сахар. В некоторых вариантах реализации изобретения по меньшей мере один модифицированный сахар представляет собой бициклический сахар. В некоторых вариантах реализации изобретения по меньшей мере один модифицированный сахар содержит 2'-O-метоксиэтил, конформационно ограниченный этил, 3'-фтор-HNA или мостик 4'-(CH2)n-O-2', где n равно 1 или 2.
В некоторых вариантах реализации изобретения по меньшей мере один нуклеозид указанного модифицированного олигонуклеотида содержит модифицированное нуклеиновое основание. В некоторых вариантах реализации изобретения модифицированное нуклеотидное основание представляет собой 5-метилцитозин.
В некоторых вариантах реализации изобретения, описанных в данном документе, представлены соединения или композиции, содержащие модифицированный олигонуклеотид с: а) гэп-сегментом, состоящим из связанных дезоксинуклеозидов; b) сегмент 5'-крыла, состоящим из связанных нуклеозидов, и с) сегментом 3'-крыла, состоящим из связанных нуклеозидов. Гэп-сегмент расположен между сегментом 5'-крыла и сегментом 3'-крыла, а каждый нуклеозид каждого сегмента крыльев содержит модифицированный сахар.
В некоторых вариантах реализации изобретения модифицированный олигонуклеотид состоит из 12-30 нуклеозидов и содержит: гэп-сегмент, состоящий из связанных дезоксинуклеозидов; сегмент 5'-крыла, состоящий из связанных нуклеозидов; сегмент 3'-крыла, состоящий из связанных нуклеозидов; причем гэп-сегмент расположен между сегментом 5'-крыла и сегментом 3'-крыла, и при этом каждый нуклеозид каждого сегмента крыльев содержит модифицированный сахар.
В некоторых вариантах реализации изобретения соединения или композиции, описанные в данном документе, содержат модифицированный олигонуклеотид, состоящий из 20 связанных нуклеозидов, имеющий последовательность нуклеотидных оснований, содержащую по меньшей мере 8 последовательных нуклеотидных оснований, комплементарных части равной длины SEQ ID NO: 1-2, причем модифицированный олигонуклеотид содержит: гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов; сегмент 5'-крыла, состоящий из пяти связанных нуклеозидов, и сегмент 3'-крыла, состоящий из пяти связанных нуклеозидов; при этом гэп-сегмент расположен между сегментом 5'-крыла и сегментом 3'-крыла; причем каждый нуклеозид каждого сегмента крыльев содержит 2'-O-метоксиэтильный сахар, при этом каждая межнуклеозидная связь представляет собой тиофосфатную связь и причем каждый остаток цитозина представляет собой 5-метилцитозин.
В некоторых вариантах реализации изобретения модифицированный олигонуклеотид состоит из 20 связанных нуклеозидов и содержит: гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов; сегмент 5'-крыла, состоящий из пяти связанных нуклеозидов, и сегмент 3'-крыла, состоящий из пяти связанных нуклеозидов; причем гэп-сегмент расположен между сегментом 5'-крыла и сегментом 3'-крыла; при этом каждый нуклеозид каждого сегмента крыльев содержит 2'-O-метоксиэтильный сахар, причем каждая межнуклеозидная связь представляет собой тиофосфатную связь и при этом каждый остаток цитозина представляет собой 5-метилцитозин.
В некоторых вариантах реализации изобретения соединения или композиции, описанные в данном документе, содержат модифицированный олигонуклеотид, состоящий из 20 связанных нуклеозидов, имеющий последовательность нуклеотидных оснований, содержащую по меньшей мере 8 последовательных нуклеотидных оснований последовательности нуклеотидных оснований, выбранной из SEQ ID NO: 77, причем модифицированный олигонуклеотид содержит: гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов; сегмент 5'-крыла, состоящий из пяти связанных нуклеозидов, и сегмент 3'-крыла, состоящий из пяти связанных нуклеозидов; при этом гэп-сегмент расположен между сегментом 5'-крыла и сегментом 3'-крыла; причем каждый нуклеозид каждого сегмента крыльев содержит 2'-O-метоксиэтильный сахар, при этом каждая межнуклеозидная связь представляет собой тиофосфатную связь и причем каждый остаток цитозина представляет собой 5-метилцитозин.
В некоторых вариантах реализации модифицированный олигонуклеотид состоит из 20 связанных нуклеозидов с последовательностью нуклеотидных оснований SEQ ID NO: 77 и содержит: гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов; сегмент 5'-крыла, состоящий из пяти связанных нуклеозидов, и сегмент 3'-крыла, состоящий из пяти связанных нуклеозидов; причем гэп-сегмент расположен между сегментом 5'-крыла и сегментом 3'-крыла; при этом каждый нуклеозид каждого сегмента крыльев содержит 2'-O-метоксиэтильный сахар, причем каждая межнуклеозидная связь представляет собой тиофосфатную связь и при этом каждый остаток цитозина представляет собой 5-метилцитозин.
В некоторых вариантах реализации изобретения модифицированный олигонуклеотид представляет собой ISIS 563580. В некоторых вариантах реализации изобретения ISIS 563580 характеризуется как 5-10-5 МОЕ гэпмер, имеющий последовательность (от 5' до 3') GGACATTGCCAGTAATCGCA (включенную в данный документ как SEQ ID NO: 77), в которой каждая межнуклеозидная связь представляет собой тиофосфатную связь, каждый цитозин представляет собой 5'-метилцитозин, каждый из нуклеозидов 1-5 и 16-20 является 2'-O-метоксиэтилмодифицированными нуклеозидами, а каждый из нуклеозидов 6-15 является 2'-дезоксинуклеозидами.
В некоторых вариантах реализации изобретения ISIS 563580 описан следующим химическим обозначением: Ges Ges Aes mCes Aes Tds Tds Gds mCds mCds Ads Gds Tds Ads Ads Tes mCes Ges mCes Ae; где:
A = аденин,
mC = 5'-метилцитозин,
G = гуанин,
Т = тимин,
е = 2'-O-метоксиэтилмодифицированный нуклеозид,
d = 2'-дезоксинуклеозид и
s = тиофосфатная межнуклеозидная связь.
В некоторых вариантах реализации изобретения ISIS 563580 описан следующей химической структурой:

В некоторых вариантах реализации изобретения модифицированный олигонуклеотид содержит ISIS 563580, представленный предшествующей химической структурой.
В некоторых вариантах реализации изобретения соединения или композиции, описанные в данном документе, содержат модифицированный олигонуклеотид, состоящий из 20 связанных нуклеозидов, имеющий последовательность нуклеотидных оснований, содержащую по меньшей мере 8 последовательных нуклеотидных оснований последовательности нуклеотидных оснований, выбранной из SEQ ID NO: 20, причем модифицированный олигонуклеотид содержит: гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов; сегмент 5'-крыла, состоящий из пяти связанных нуклеозидов, и сегмент 3'-крыла, состоящий из пяти связанных нуклеозидов; при этом гэп-сегмент расположен между сегментом 5'-крыла и сегментом 3'-крыла; причем каждый нуклеозид каждого сегмента крыльев содержит 2'-O-метоксиэтильный сахар, при этом каждая межнуклеозидная связь представляет собой тиофосфатную связь и причем каждый остаток цитозина представляет собой 5-метилцитозин.
В некоторых вариантах реализации модифицированный олигонуклеотид состоит из 20 связанных нуклеозидов с последовательностью нуклеотидных оснований SEQ ID NO: 20 и содержит: гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов; сегмент 3'-крыла, состоящий из пяти связанных нуклеозидов, и сегмент 3'-крыла, состоящий из пяти связанных нуклеозидов; причем гэп-сегмент расположен между сегментом 5'-крыла и сегментом 3'-крыла; при этом каждый нуклеозид каждого сегмента крыльев содержит 2'-O-метоксиэтильный сахар, причем каждая межнуклеозидная связь представляет собой тиофосфатную связь и при этом каждый остаток цитозина представляет собой 5-метилцитозин.
В некоторых вариантах реализации изобретения соединения или композиции, описанные в данном документе, содержат модифицированный олигонуклеотид, состоящий из 16 связанных нуклеозидов, имеющих последовательность нуклеотидных оснований, содержащую по меньшей мере 8 последовательных нуклеотидных оснований последовательности нуклеотидных оснований SEQ ID NO: 110, причем модифицированный олигонуклеотид содержит: гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов; сегмент 5'-крыла, состоящий из трех связанных нуклеозидов, и сегмент 3'-крыла, состоящий из трех связанных нуклеозидов; причем гэп-сегмент расположен между сегментом 5'-крыла и сегментом 3'-крыла; при этом каждый сегмент крыльев содержит по меньшей мере один 2'-О-метоксиэтильный сахар и по меньшей мере один сахар cEt, причем каждая межнуклеозидная связь представляет собой тиофосфатную связь и при этом каждый остаток I цитозина представляет собой 5-метилцитозин.
В некоторых вариантах реализации модифицированный олигонуклеотид состоит из 16 связанных нуклеозидов с последовательностью нуклеотидных оснований SEQ ID NO: 110 и содержит: гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов; сегмент 5'-крыла, состоящий из трех связанных нуклеозидов; сегмент 3'-крыла, состоящий из трех связанных нуклеозидов; причем гэп-сегмент расположен между сегментом 5'-крыла и сегментом 3'-крыла; при этом каждый сегмент крыльев содержит по меньшей мере один 2'-О-метоксиэтильный сахар и по меньшей мере один сахар cEt, причем каждая межнуклеозидная связь представляет собой тиофосфатную связь и при этом каждый остаток цитозина представляет собой 5-метилцитозин.
В некоторых вариантах реализации изобретения представлены способы применения соединений и композиций, описанных в данном документе, для ингибирования экспрессии ANGPTL3. В некоторых вариантах реализации изобретения соединения или композиции ингибируют ANGPTL3 на по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95%. В предпочтительном варианте реализации изобретения антисмысловое соединение, содержащее модифицированный олигонуклеотид, уменьшает активность ANGPTL3 на по меньшей мере 50%. В предпочтительном варианте реализации изобретения антисмысловое соединение, содержащее модифицированный олигонуклеотид, уменьшает активность ANGPTL3 на по меньшей мере 55%. В предпочтительном варианте реализации изобретения антисмысловое соединение, содержащее модифицированный олигонуклеотид, уменьшает активность ANGPTL3 на по меньшей мере 60%. В предпочтительном варианте реализации изобретения антисмысловое соединение, содержащее модифицированный олигонуклеотид, уменьшает активность ANGPTL3 на по меньшей мере 65%. В предпочтительном варианте реализации изобретения антисмысловое соединение, содержащее модифицированный олигонуклеотид, уменьшает активность ANGPTL3 на по меньшей мере 70%. В предпочтительном варианте реализации изобретения антисмысловое соединение, содержащее модифицированный олигонуклеотид, уменьшает активность ANGPTL3 на по меньшей мере 75%. В предпочтительном варианте реализации изобретения антисмысловое соединение, содержащее модифицированный олигонуклеотид, уменьшает активность ANGPTL3 на по меньшей мере 80%. В предпочтительном варианте реализации изобретения антисмысловое соединение, содержащее модифицированный олигонуклеотид, уменьшает активность ANGPTL3 на по меньшей мере 85%. В предпочтительном варианте реализации изобретения антисмысловое соединение, содержащее модифицированный олигонуклеотид, уменьшает активность ANGPTL3 на по меньшей мере 90%. В предпочтительном варианте реализации изобретения антисмысловое соединение, содержащее модифицированный олигонуклеотид, уменьшает активность ANGPTL3 на по меньшей мере 95%.
В некоторых вариантах реализации изобретения представлены способы применения соединений и композиций, описанных в данном документе, для снижения уровня одного или более из: триглицеридов, холестерина ЛПНП, холестерина ЛП-не-ВП, холестерина ЛПОНП, общего холестерина, АроВ и АроС-III. В некоторых вариантах реализации изобретения соединения или композиции снижают уровень одного или более из: триглицеридов, холестерина ЛПНП, холестерина ЛП-не-ВП, холестерина ЛПОНП, общего холестерина, АроВ и АроС-III на по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95%.
В некоторых вариантах реализации изобретения соединения или композиции, описанные в данном документе, имеют IC50 менее 20 мкМ, менее 10 мкМ, менее 8 мкМ, менее 5 мкМ, менее 2 мкМ, менее 1 мкМ или менее 0,8 мкМ при испытании на клетках человека, к примеру, на линии клеток Нер3В, как описано в Примерах 2-3 и 7-10.
В некоторых вариантах реализации изобретения соединения или композиции, описанные в данном документе, эффективны благодаря вязкости менее 40 сП, менее 35 сП, менее 30 сП, менее 25 сП, менее 20 сП или менее 15 сП, при измерении параметров, как описано в Примере 13.
В некоторых вариантах реализации изобретения соединения или композиции, описанные в данном документе, являются высокопереносимыми, как продемонстрировано измерениями переносимости in vivo, описанными в примерах. В некоторых вариантах реализации изобретения антисмысловые соединения, описанные в данном документе, являются высокопереносимыми, как продемонстрировано не более 4-кратным, 3-кратным, 2-кратным или 1,5-кратным увеличением значений АЛТ и/или ACT по сравнению с животными, которым вводили солевой раствор.
В некоторых вариантах реализации изобретения соединения и композиции, описанные в данном документе, содержат соль модифицированного олигонуклеотида.
В некоторых вариантах реализации изобретения соединения и композиции, описанные в данном документе, дополнительно содержат фармацевтически приемлемый носитель или растворитель.
В некоторых вариантах реализации изобретения животное представляет собой человека.
В некоторых вариантах реализации изобретения представлены способы применения соединений и композиций, описанных в данном документе, для терапии. В некоторых вариантах реализации изобретения терапия применяется для лечения, предупреждения или замедления прогрессирования заболевания, связанного с повышенным уровнем ANGPTL3. В некоторых вариантах реализации заболевание представляет собой сердечно-сосудистое и/или метаболическое заболевание, нарушение или патологическое состояние. В некоторых вариантах реализации изобретения метаболическое и/или сердечно-сосудистое заболевание включает, но не ограничено, ожирением, диабетом, атеросклерозом, дислипидемией, липодистрофией, ишемической болезнью сердца, неалкогольным жировым заболеванием печени (НАЖЗП), неалкогольным стеатогепатитом (НАСГ), гиперемией жирных кислот или метаболическим синдромом, или их комбинацией. Дислипидемия может быть гиперлипидемией. Гиперлипидемия может быть комбинированной гиперлипидемией, семейной комбинированной гиперлипидемией (СКГЛ), гиперхолестеринемией, гипертриглицеридемией, или как гиперхолестеринемией, так и гипертриглицеридемией. Гиперхолестеринемия может быть семейной гомозиготной гиперхолестеринемией (ГоСГ), семейной гетерозиготной гиперхолестеринемией (ГеСГ). Гипертриглицеридемия может быть семейным хиломикронемийным синдромом (СХС) или гиперлипопротеиномией IV типа. НАЖЗП может быть стеатозом печени или стеатогепатитом. Диабет может быть диабетом 2 типа или диабетом 2 типа с дисглипидемией.
В некоторых вариантах реализации изобретения соединения и композиции, описанные в данном документе, предназначены в качестве первого агента, а способы и виды применения, описанные в данном документе, дополнительно содержат применение второго агента. В некоторых вариантах реализации изобретения первый агент и второй агент вводятся совместно. В некоторых вариантах реализации изобретения первый агент и второй агент вводятся совместно последовательно или параллельно.
В некоторых вариантах реализации изобретения второй агент представляет собой снижающий уровень глюкозы агент. Снижающий уровень глюкозы агент может включать, но не ограничиваться, терапевтическим изменением образа жизни, агонистом PPAR, ингибитором дипептидилпептидазы (IV), аналогом GLP-1, инсулином или аналогом инсулина, стимулятором секреции инсулина, ингибитором SGLT2, аналогом амилина человека, бигуанидом, ингибитором альфа-глюкозидазы или их комбинацией. Снижающий уровень глюкозы агент может включать, но не ограничиваться, метформином, сульфонилмочевиной, розиглитазоном, меглитинидом, тиазолидиндионом, ингибитором альфа-глюкозидазы или их комбинацией. Сульфонилмочевина может быть ацетогексамидом, хлорпропамидом, толбутамидом, толазамидом, глимепиридом, глипизидом, глибуридом или гликлазидом. Меглитинид может быть натеглинидом или репаглинидом. Тиазолидиндион может быть пиоглитазоном или розиглитазоном. Альфа-глюкозидаза может быть акарбозой или миглитолом.
В некоторых вариантах реализации изобретения второй агент представляет собой снижающую уровень липидов терапию. В некоторых вариантах реализации изобретения снижающая уровень липидов терапия может включать, но не ограничиваться, терапевтическим изменением образа жизни, ингибитором ГМГ-КоА-редуктазы, ингибитором абсорбции холестерина, ингибитором МТР (например, малой молекулой, полипептидом, антителом или антисмысловым соединением, таргетирующим МТР), ингибитором АроВ (например, малой молекулой, полипептидом, антителом или антисмысловым соединением, таргетирующим АроВ), ингибитором АроС3 (например, малой молекулой, полипептидом, антителом или антисмысловым соединением, таргетирующим АроС3), ингибитором PCSK9 (например, малой молекулой, полипептидом, антителом или антисмысловым соединением, таргетирующим PCSK9), ингибитором СЕТР (например, малой молекулой, полипептидом, антителом или антисмысловым соединением, таргетирующим СЕТР), фибратом, лечебным маслом (например, маслом криля или рыбьим жиром (например, VascepaR), льняным маслом или другими маслами, богатыми омега-3 жирными кислотами, такими как α-линоленовая кислота (АЛК), докозагексаеновая кислота (ДГК) или эйкозапентаеновая кислота (ЭПК)), или их любой комбинацией. Ингибитор ГМГ-КоА-редуктазы может быть аторвастатином, розувастатином, флувастатином, ловастатином, правастатином или симвастатином. Ингибитор абсорбции холестерина может быть эзетимибом. Фибрат может быть фенофибратом, безафибратом, ципрофибратом, клофибратом, гемфиброзилом и тому подобным.
В некоторых вариантах реализации изобретения введение включает парентеральное введение.
В некоторых вариантах реализации изобретения введение соединения, описанного в данном документе, приводит к снижению уровней липидов, включая уровни триглицеридов, уровни холестерина, инсулинорезистентности, уровни глюкозы или их комбинации. Один или более из уровней может независимо быть снижен на по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95%. Введение соединения может приводить к улучшению чувствительности к инсулину или чувствительности к инсулину печени. Введение соединения, описанного в данном документе, может приводить к уменьшению атеросклеротических бляшек, ожирения, глюкозы, липидов, глюкозорезистентности, холестерина или улучшения чувствительности к инсулину или любой их комбинации.
В некоторых вариантах реализации изобретения представлено применение соединения, как описано в данном документе, для изготовления лекарственного средства для лечения, облегчения, задержки или предупреждения одного или более метаболических заболеваний или сердечно-сосудистых заболеваний.
В некоторых вариантах реализации изобретения представлен набор для лечения или облегчения одного или более метаболических заболеваний или сердечно-сосудистых заболеваний, как описано в данном документе, причем набор содержит: а) соединение, описанное в данном документе, и не обязательно, b) дополнительный агент или терапию, описанную в данном документе. Набор может дополнительно включать инструкции или метку для применения набора для лечения, предупреждения или облегчения одного или более метаболических заболеваний или сердечно-сосудистых заболеваний.
Антисмысловые соединения
Олигомерные соединения включают, но не ограничиваются, олигонуклеотидами, олигонуклеозидами, аналогами олигонуклеотидов, миметиками олигонуклеотидов, антисмысловыми соединениями, антисмысловыми олигонуклеотидами и миРНК. Олигомерное соединение может быть «антисмысловым» к нуклеиновой кислоте-мишени, что означает, что оно способно проходить гибридизацию с нуклеиновой кислотой-мишенью при участии водородных связей.
В некоторых вариантах реализации изобретения антисмысловое соединение содержит последовательность нуклеотидных оснований, которая записана в направлении 5'-3', включает обратную последовательность целевого сегмента нуклеиновой кислоты-мишени, которую она таргетирует. В некоторых таких вариантах реализации изобретения антисмысловой олигонуклеотид содержит последовательность нуклеотидных оснований, которая записана в направлении 5'-3', включает обратную последовательность целевого сегмента нуклеиновой кислоты-мишени, которую она таргетирует.
В некоторых вариантах реализации изобретения антисмысловое соединение, таргетирующее нуклеиновую кислоту ANGPTL3, состоит в длину из от 10 до 30 нуклеотидов. Другими словами, антисмысловые соединения содержат от 10 до 30 связанных нуклеотидных оснований. В других вариантах реализации изобретения антисмысловое соединение содержит модифицированный олигонуклеотид, состоящий из от 8 до 80, от 10 до 80, от 12 до 50, 12-30, от 15 до 30, от 18 до 24, от 19 до 22 или 20 связанных нуклеотидных оснований. В некоторых вариантах реализации изобретения антисмысловое соединение, содержит модифицированный олигонуклеотид, стоящий в длину из 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21,22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79 или 80 нуклеотидных оснований или диапазона, определенного любыми двумя из вышеуказанных значений.
В некоторых вариантах реализации изобретения антисмысловое соединение содержит укороченный или усеченный модифицированный олигонуклеотид. Укороченный или усеченный модифицированный олигонуклеотид может иметь один нуклеозид, удаленный с 5'-конца (5'-усечение), или альтернативно с 3'-конца (3'-усечение). Укороченный или усеченный модифицированный олигонуклеотид может иметь два или более нуклеозидов, удаленных с 5'-конца, или альтернативно, может иметь два или более нуклеозидов, удаленных с 3'-конца. В альтернативном варианте, удаленные нуклеозиды могут быть распределены по всему модифицированному олигонуклеотиду, к примеру, в антисмысловом соединении, имеющем один или более нуклеозидов, удаленных с 5'-конца, и один или более нуклеозидов, удаленных с 3'-конца.
Когда один дополнительный нуклеозид присутствует в удлиненном олигонуклеотиде, то дополнительный олигонуклеотид может быть расположен на 5'-, 3'-конце или в центральной части олигонуклеотида. Когда присутствует два или более дополнительных нуклеозидов, то добавленные нуклеозиды могут быть прилегающими друг к другу, к примеру, в олигонуклеотиде, имеющем два нуклеозида, добавленных к 5'-концу (5'-добавление), или альтернативно, к 3'-концу (3'-добавление) или центральной части олигонуклеотида. В альтернативном варианте, добавленные нуклеозиды могут быть распределены по всему антисмысловому соединению, к примеру, в олигонуклеотиде, имеющем один или более нуклеозидов, добавленных к 5'-концу, один или более нуклеозидов, добавленных к 3'-концу, и/или один или более нуклеозидов, добавленных к центральной части.
Возможно увеличение или уменьшение длины антисмыслового соединения, такого как антисмысловой олигонуклеотид, и/или введение мисматчевых нуклеотидных оснований без устранения активности. Например, в Woolf et al. (Proc. Natl. Acad. Sci. USA 89: 7305-7309, 1992), ряд антисмысловых олигонуклеотидов длиной 13-25 нуклеотидных оснований были испытаны на способность индуцировать расщепление РНК-мишени в модели с инъекцией в ооцит. Антисмысловые олигонуклеотиды длиной 25 нуклеотидных оснований с 8 или 11 мисматчевыми основаниями вблизи концов антисмысловых олигонуклеотидов были способны вызывать прямое расщепление мРНК-мишени, хотя и в меньшей степени, чем антисмысловые олигонуклеотиды, которые не содержали некомплементарных оснований. Аналогичным образом, специфическое расщепление мишеней достигалось применением антисмысловых нуклеотидов из 13 нуклеотидных оснований, включавшие такие, что имели 1 или 3 мисматча.
Авторы Gautschi et al (J. Natl. Cancer Inst. 93: 463-471, March 2001) продемонстрировали способность олигонуклеотида, обладавшего 100% комплементарностью к мРНК bcl-2 и содержавшего 3 мисматча по отношению к мРНК bcl-xL, уменьшать экспрессию как bcl-2, так и bcl-xL in vitro и in vivo. Кроме того, данный олигонуклеотид продемонстрировал высокую противоопухолевую активность in vivo.
Авторы Maher и Dolnick (Nuc. Acid. Res. 16: 3341-3358, 1988) испытывали ряд тандемных антисмысловых олигонуклеотидов из 14 нуклеотидных оснований и антисмысловых олигонуклеотидов из 28 и 42 нуклеотидных оснований, состоящих, соответственно, из последовательности двух или трех тандемных антисмысловых олигонуклеотидов, на способность блокировать трансляцию ДГФР человека в анализе на ретикулоцитах кролика. Каждый из трех антисмысловых олигонуклеотидов из 14 нуклеотидных оснований в одиночку был способен ингибировать трансляцию, хотя и на более низком уровне, чем антисмысловые олигонуклеотиды из 28 или 42 нуклеотидных оснований.
Некоторые мотивы и механизмы действия антисмысловых соединений
В некоторых вариантах реализации изобретения антисмысловые соединения содержат химически модифицированные субъединицы, организованные в паттерны или мотивы, для придания антисмысловым соединениям таких свойств, как усиленная ингибирующая активность, повышенная аффинность связывания с нуклеиновой кислотой-мишенью или устойчивость к нуклеазной деградации in vivo. Химерные антисмысловые соединения обычно содержат по меньшей мере один участок модифицированный таким образом, чтобы придать повышенную устойчивость к нуклеазной деградации, повышенное клеточное поглощение, повышенную аффинность связывания с нуклеиновой кислотой-мишенью и/или повышенную ингибирующую активность. Второй участок химерного антисмыслового соединения может придавать другое требуемое свойство, например, служить в качестве субстрата для клеточной эндонуклеазы РНКазы Н, которая расщепляет цепь РНК дуплекса РНК:ДНК.
Антисмысловая активность может возникать вследствие любого механизма, включающего гибридизацию антисмыслового соединения (например, олигонуклеотида) с нуклеиновой кислотой-мишенью, причем гибридизация в конечном итоге приводит к получению биологического эффекта. В некоторых вариантах реализации изобретения количество и/или активность нуклеиновой кислоты-мишени модулируется. В некоторых вариантах реализации изобретения количество и/или активность нуклеиновой кислоты-мишени снижается. В некоторых вариантах реализации изобретения гибридизация антисмыслового соединения с нуклеиновой кислотой-мишенью в конечном итоге приводит к деградации нуклеиновой кислоты-мишени. В некоторых вариантах реализации изобретения гибридизация антисмыслового соединения с нуклеиновой кислотой-мишенью не приводит к деградации нуклеиновой кислоты-мишени. В некоторых таких вариантах реализации изобретения присутствие антисмыслового соединения, гибридизированного с нуклеиновой кислотой-мишенью (захват), приводит к модуляции антисмысловой активности. В некоторых вариантах реализации изобретения антисмысловые соединения, содержащие конкретный химический мотив или паттерн химических модификаций, особенно подходят для реализации одного или более механизмов. В некоторых вариантах реализации изобретения антисмысловые соединения функционируют посредством более одного механизма и/или посредством механизмов, которые не были выявлены. Соответственно, антисмысловые соединения, описанные в данном документе, не ограничиваются конкретным механизмом.
Антисмысловые механизмы включают, без ограничения, антисмысловые механизмы, опосредованные РНКазой Н, механизмы РНКи, которые используют механизм RISC, и включают, без ограничения, механизмы миРНК, дцРНК и микроРНК, и механизмы, основанные на захвате. Определенные антисмысловые соединения могут действовать посредством более, чем одного такого механизма и/или посредством дополнительного механизма.
Антисмысловой механизм, опосредованный РНКазой Н
В некоторых вариантах реализации изобретения антисмысловая активность возникает по меньшей мере частично вследствие деградации РНК-мишени РНКазой Н. РНКаза Н представляет собой клеточную эндонуклеазу, которая расщепляет цепь РНК дуплекса РНК:ДНК. В данной области известно, что одноцепочечные антисмысловые соединения, которые являются «ДНК-подобными», вызывают активность РНКазы Н в клетках млекопитающих. Соответственно, антисмысловые соединения, содержащие по меньшей мере часть ДНК- или ДНК-подобных нуклеозидов, могут активировать РНКазу Н, приводя к расщеплению нуклеиновой кислоты-мишени. В некоторых вариантах реализации изобретения антисмысловые соединения, которые используют РНКазу Н, содержат один или более модифицированных нуклеозидов. В некоторых вариантах реализации изобретения такие антисмысловые соединения содержат по меньшей мере один блок из 1-8 модифицированных нуклеозидов. В некоторых таких вариантах реализации изобретения модифицированные нуклеозиды не поддерживают активность РНКазы Н. В некоторых вариантах реализации изобретения такие антисмысловые соединения представляют собой гэпмеры, описанные в данном документе. В некоторых таких вариантах реализации изобретения гэп гэпмера содержит ДНК-нуклеозиды. В некоторых таких вариантах реализации изобретения гэп гэпмера содержит ДНК-подобные нуклеозиды. В некоторых таких вариантах реализации изобретения гэп гэпмера содержит ДНК-нуклеозиды и ДНК-подобные нуклеозиды.
Некоторые антисмысловые соединения, имеющие гэпмерный мотив, считаются химерными антисмысловыми соединениями. В гэпмере внутренний участок, содержащий множество нуклеотидов, которые поддерживают расщепление РНКазой Н, расположен между внешними участками, содержащими множество нуклеотидов химически отличающихся от нуклеозидов внутреннего участка. В случае, когда антисмысловой олигонуклеотид имеет гэпмерный мотив, гэп-сегмент обычно служит в качестве субстрата для расщепления эндонуклеазой, в то время как сегменты крыльев содержат модифицированные нуклеозиды. В некоторых вариантах реализации изобретения участки гэпмера различаются по типам сахаридных фрагментов в составе каждого отдельного участка. Типы сахаридных фрагментов, которые применяются для дифференциации участков гэпмера, в некоторых вариантах реализации изобретения, могут включать β-D-рибонуклеозиды, β-D-дезоксирибонуклеозиды, 2'-модифицированные нуклеозиды (такие 2'-модифицированные нуклеозиды, среди прочего, могут включать 2'-МОЕ и 2'-O-CH3) и модифицированные нуклеозиды с бициклическими сахарами (такие модифицированные нуклеозиды с бициклическими сахарами могут включать содержащие конформационно ограниченный этил). В некоторых вариантах реализации изобретения нуклеозиды в крыльях могут включать несколько модифицированных сахаридных фрагментов, включающих, к примеру, 2'-МОЕ и фрагменты бициклических сахаров, таких как конформационно ограниченный этил или LNA. В некоторых вариантах реализации крылья могут включать несколько модифицированных и немодифицированных сахаридных фрагментов. В некоторых вариантах реализации крылья могут включать различные комбинации 2'-МОЕ-нуклеозидов, фрагментов бициклических сахаров, такие как нуклеозиды с конформационно ограниченным этилом или нуклеозиды LNA, и 2'-дезоксинуклеозиды.
Каждый отдельный участок может включать одинаковые сахаридные фрагменты, отличающиеся или чередующиеся сахаридные фрагменты. Мотив крыло-гэп-крыло часто описывается как «X-Y-Z», где «X» обозначает длину 5'-крыла, «Y» обозначает длину гэпа, а «Z» обозначает длину 3'-крыла. «X» и «Z» могут содержать одинаковые, отличающиеся или чередующиеся сахаридные фрагменты. В некоторых вариантах реализации «X» и «Y» могут содержать один или более 2'-дезоксинуклеозидов. «Y» может содержать 2'-дезоксинуклеозиды. Используемый в данном документе гэпмер, описанный как «X-Y-Z», имеет конфигурацию такую, что гэп расположен непосредственно прилегающим к каждому 5'-крылу и 3'-крылу. Таким образом, не существует промежуточных нуклеотидов между 5'-крылом и гэпом, или гэпом и 3'-крылом. Любое из антисмысловых соединений, описанных в данном документе, может иметь гэпмерный мотив. В некоторых вариантах реализации изобретения «X» и «Z» одинаковые; в других вариантах реализации изобретения они различаются. В некоторых вариантах реализации изобретения «Y» состоит из между 8 и 15 нуклеозидами. X, Y или Z могут быть любыми, состоящими из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30 или более нуклеозидов.
В некоторых вариантах реализации изобретения антисмысловое соединение, таргетирующее нуклеиновую кислоту ANGPTL3, содержит гэпмерный мотив, в котором гэп состоит из 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или 16 связанных нуклеозидов.
В некоторых вариантах реализации изобретения антисмысловой олигонуклеотид имеет сахаридный мотив, описанный Формулой A следующим образом: (J)m-(B)n-(J)p-(B)r-(A)t-(D)g-(A)v-(B)w-(J)x-(B)y-(J)z
где:
каждый символ A независимо представляет собой 2'-замещенный нуклеозид;
каждый B независимо представляет собой бициклический нуклеозид;
каждый J независимо представляет собой или 2'-замещенный нуклеозид или 2'-дезоксинуклеозид;
каждый D представляет собой 2'-дезоксинуклеозид;
m равно 0-4; n равно 0-2; p равно 0-2; r равно 0-2; t равно 0-2; v равно 0-2; w равно 0-4; x равно 0-2; y равно 0-2; z равно 0-4; g равно 6-14;
при условии, что:
по меньшей мере одно из значений m, n и r отлично от 0;
по меньшей мере одно из значений w и y отлично от 0;
сумма m, n, p, r и t равна от 2 до 5 и
сумма v, w, x, y и z равна от 2 до 5.
Соединения РНКи
В некоторых вариантах реализации изобретения антисмысловые соединения представляют собой интерферирующие соединения РНК (РНКи), которые включают двухцепочечные соединения РНК (также называемые короткими интерферирующими РНК или киРНК) и одноцепочечные соединения РНКи (или оцРНК). Такие соединения работают по меньшей мере частично посредством механизма RISC для деградации и/или разрезания нуклеиновой кислоты-мишени (таким образом, они включают микроРНК/соединения имитирующие микроРНК). В некоторых вариантах реализации изобретения антисмысловые соединения включают модификации, которые делают их особенно подходящими для таких механизмов.
i. Соединения оцРНК
В некоторых вариантах реализации изобретения антисмысловые соединения, включающие особенно подходящие для применения как одноцепочечные соединения РНКи (оцРНК), содержат модифицированный 5'-терминальный конец. В некоторых таких вариантах реализации изобретения 5'-терминальный конец содержит модифицированный фосфатный фрагмент. В некоторых вариантах реализации изобретения такой модифицированный фосфат является стабилизированным (например, устойчивым к деградации/расщеплению по сравнению с немодифицированным фосфатом). В некоторых вариантах реализации изобретения такие 5'-терминальные нуклеозиды стабилизируют 5'-фосфорный фрагмент. Некоторые модифицированные 5'-терминальные нуклеозиды могут быть найдены в данной области техники, к примеру в WO/2011/139702.
В некоторых вариантах реализации изобретения 5'-нуклеозид соединения оцРНК имеет Формулу IIc:
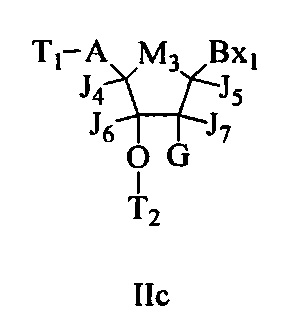
где:
T1 не обязательно представляет собой защищенный фосфорный фрагмент;
Т2 представляет собой межнуклеозидную связывающую группу, связывающую соединение с Формулой IIс с олигомерным соединением;
А обладает одной из формул:

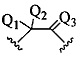
Q1 и Q2 представляют собой каждый независимо Н, галоген, С1-С6 алкил, замещенный С1-С6 алкил, С1-С6 алкокси, замещенный С1-С6 алкокси, С2-С6 алкенил, замещенный С2-С6 алкенил, С2-С6 алкинил, замещенный С2-С6 алкинил или N(R3)(R4);
Q3 представляет собой O, S, N(R5) или C(R6)(R7);
каждый R3, R4 R5, R6 и R7 независимо представляет собой Н, С1-С6 алкил, замещенный С1-С6 алкил или С1-С6 алкокси;
М3 представляет собой O, S, NR14, C(R15)(R16), C(R15)(R16)C(R17)(R18), C(R15)=C(R17), OC(R15)(R16) или OC(R15)(Bx2);
R14 представляет собой H, С1-С6 алкил, замещенный С1-С6 алкил, С1-С6 алкокси, замещенный С1-С6 алкокси, С2-С6 алкенил, замещенный С2-С6 алкенил, С2-С6 алкинил или замещенный С2-С6 алкинил;
R15, R16, R17 и R18 представляют собой каждый независимо Н, галоген, С1-С6 алкил, замещенный С1-С6 алкил, С1-C6 алкокси, замещенный С1-С6 алкокси, С2-С6 алкенил, замещенный С2-С6 алкенил, С2-С6 алкинил или замещенный С2-С6;
Bx1 представляет собой фрагмент гетероциклического основания;
или если присутствует Вх2, то Вх2 представляет собой фрагмент гетероциклического основания, a Bx1 представляет собой Н, галоген, C1-С6 алкил, замещенный С1-С6 алкил, С1-С6 алкокси, замещенный С1-С6 алкокси, С2-С6 алкенил, замещенный С2-С6 алкенил, С2-С6 алкинил или замещенный С2-С6 алкинил;
J4, J5, J6 и J7 представляют собой каждый независимо Н, галоген, С1-С6 алкил, замещенный С1-С6 алкил, С1-С6 алкокси, замещенный С1-С6 алкокси, С2-С6 алкенил, замещенный С2-С6 алкенил, С2-С6 алкинил или замещенный С2-С6;
или J4 образует мостик с одним из J5 или J7, причем указанный мостик состоит из от 1 до 3 связанных бирадикальных групп, выбранных из O, S, NR19, C(R20)(R21), C(R20)=C(R21), C[=C(R20)(R21)] и C(=O), а другие два из J5, J6 и J7 каждый независимо представляют собой Н, галоген, C1-C6 алкил, замещенный C1-C6 алкил, С1-С6 алкокси, замещенный С1-С6 алкокси, С2-С6 алкенил, замещенный С2-С6 алкенил, С2-С6 алкинил или замещенный С2-С6;
каждый R19, R20 и R21 независимо представляет собой Н, C1-C6 алкил, замещенный C1-C6 алкил, С1-С6 алкокси, замещенный С1-С6 алкокси, С2-С6 алкенил, замещенный С2-С6 алкенил, С2-С6 алкинил или замещенный С2-C6 алкинил;
G представляет собой Н, ОН, галоген или O-[C(R8)(R9)]n-[(C=O)m-X1]j-Z;
каждый R8 и R9 независимо представляет собой Н, галоген, С1-С6 алкил или замещенный C1-C6 алкил;
X1 представляет собой O, S или N(E1);
Z представляют Н, галоген, С1-С6 алкил, замещенный С1-С6 алкил, С2-C6 алкенил, замещенный С2-С6 алкенил, С2-С6 алкинил, замещенный С2-С6 алкинил или N(E2)(E3);
каждый E1, Е2 и Е3 независимо представляет собой Н, С1-С6 алкил или замещенный С1-C6 алкил;
n равно от 1 до около 6;
m равно 0 или 1;
j равно 0 или 1;
каждая замещенная группа содержит один или более не обязательно защищенных заместительных групп, независимо выбранных из галогена, OJ1, N(J1)(J2), =NJ1, SJ1, N3, CN, OC(=X2)J1, OC(=X2)N(J1)(J2) и C(=X2)N(J1)(J2);
X2 представляет собой O, S или NJ3;
каждый J1, J2 и J3 независимо представляет собой Н или С1-С6 алкил;
если j равно 1, то Z представляет собой отличный от галогена или N(E2)(E3) заместитель, и
при этом указанное олигомерное соединения содержит от 8 до 40 мономерных субъединиц и способно гибридизироваться с по меньшей мере частью нуклеиновой кислоты-мишени.
В некоторых вариантах реализации изобретения M3 представляет собой O, СН=СН, О(CH2) или ОC(Н)(Вх2). В некоторых вариантах реализации изобретения М3 представляет собой О.
В некоторых вариантах реализации изобретения каждый J4, J5, J6 и J7 являются Н. В некоторых вариантах реализации изобретения J4 образует мостик с одним из J5 или J7. В некоторых вариантах реализации изобретения A обладает одной из формул:


где:
Q1 и Q2 представляют собой каждый независимо Н, галоген, С1-С6 алкил, замещенный С1-С6 алкил, C1-C6алкокси или замещенный С1-С6 алкокси. В некоторых вариантах реализации изобретения каждый Q1 и Q2 являются Н. В некоторых вариантах реализации изобретения Q1 и Q2 представляют собой каждый независимо Н, галоген. В некоторых вариантах реализации изобретения, Q1 и Q2 представляют собой Н, а другой Q1 и Q2 представляет собой F, CH3 или ОCH3.
В некоторых вариантах реализации изобретения T1 обладает формулой:

где:
Ra и Rc каждый независимо представляют собой защищенный гидроксил, защищенный тиол, C1-C6 алкил, замещенный C1-C6 алкил, С1-С6 алкокси, замещенный С1-С6 алкокси, защищенную аминогруппу или замещенную аминогруппу и
Rb представляет собой O или S. В некоторых вариантах реализации изобретения Rb представляет собой O, a Ra и Rc каждый независимо представляет собой ОCH3, О(CH2)CH3 или СН(CH3)2.
В некоторых вариантах реализации изобретения G представляет собой галоген, ОCH3, OCH2F, OCHF2, OCF3, О(CH2)CH3, O(CH2)2F, OCH2CHF2, OCH2CF3, О(CH2)-СН=(CH2), O(CH2)2-ОCH3, O(CH2)2-SCH3, O(CH2)2-OCF3, O(CH2)3-N(R10)(R11), O(CH2)2-ON(R10)(R11), O(CH2)2-O(CH2)2-N(R10)(R11), OCH2C(=O)-N(R10)(R11), OCH2C(=O)-N(R12)-(CH2)2-N(R10)(R11) или O(CH2)2-N(R12)-C(=NR13)[N(R10)(R11)], где R10, R11, R12 и R13 каждый независимо представляет собой Н или С1-С6 алкил. В некоторых вариантах реализации изобретения G представляет собой галоген, ОCH3, OCF3, О(CH2)CH3, OCH2CF3, О(CH2)-СН=(CH2), O(CH2)2-ОCH3, O(CH2)2-O(CH2)2-N(CH3)2, OCH2C(=O)-N(H)CH3, OCH2C(=O)-N(H)-(CH2)2-N(CH3)2 или OCH2-N(H)-C(=NH)NH2. В некоторых вариантах реализации изобретения G представляет собой F, ОCH3 или O(CH2)2-ОCH3. В некоторых вариантах реализации изобретения G представляет собой O(CH2)2-ОCH3.
В некоторых вариантах реализации 5'-терминальный нуклеозид обладает Формулой IIe:

В некоторых вариантах реализации изобретения антисмысловые соединения, включающие особенно подходящие для оцРНК, содержат один или более типов модифицированных сахаридных фрагментов и/или встречающихся в природе сахаридных фрагментов, расположенных вдоль олигонуклеотида или его участка в определенном паттерне или мотиве сахаридной модификации. Такие мотивы могут содержать любые сахаридные модификации, рассмотренные в данном документе, и/или другие известные сахаридные модификации.
В некоторых вариантах реализации изобретения олигонуклеотиды включают или содержат участок, содержащий одинаковые сахаридные модификации. В некоторых таких вариантах реализации изобретения каждый нуклеозид участка содержит одинаковую РНК-подобную сахаридную модификацию. В некоторых вариантах реализации изобретения каждый нуклеозид участка представляет собой 2'-F нуклеозид. В некоторых вариантах реализации изобретения каждый нуклеозид участка представляет собой 2'-OMe нуклеозид. В некоторых вариантах реализации изобретения каждый нуклеозид участка представляет собой 2'-MOE нуклеозид. В некоторых вариантах реализации изобретения каждый нуклеозид участка представляет собой cEt нуклеозид. В некоторых вариантах реализации изобретения каждый нуклеозид участка представляет собой LNA нуклеозид. В некоторых вариантах реализации изобретения однородный участок составляет весь или практически весь олигонуклеотид. В некоторых вариантах реализации участок составляет целый олигонуклеотид, кроме 1-4 терминальных нуклеозидов.
В некоторых вариантах реализации изобретения олигонуклеотид содержит один или более участков чередующихся сахаридных модификаций, причем нуклеозиды чередуются между нуклеотидами, имеющими сахаридные модификации первого типа, и нуклеотидами, имеющие сахаридные модификации второго типа. В некоторых вариантах реализации изобретения нуклеозиды обоих типов представляют собой РНК-подобные нуклеозиды. В некоторых вариантах реализации изобретения чередующиеся нуклеозиды выбраны из: 2'-OMe, 2'-F, 2'-МОЕ, LNA и cEt. В некоторых вариантах реализации изобретения чередующиеся модификации представляют собой 2'-F и 2'-OMe. Такие участки могут быть последовательными или могут прерываться различным образом модифицированными нуклеозидами или конъюгированными нуклеозидами.
В некоторых вариантах реализации изобретения чередующийся участок из чередующихся модификаций каждый состоит из одного нуклеозида (т.е. паттерн представляет собой (АВ)xAy, где A представляет собой нуклеозид, имеющий сахаридную модификацию первого типа, а B представляет собой нуклеозид, имеющий сахаридную модификацию второго типа; x равно 1-20, а y равно 0 или 1). В некоторых вариантах реализации изобретения один или более чередующихся участков в чередующемся мотиве включают более одного типа нуклеозида. К примеру, олигонуклеотиды могут включать один или более участков любого из следующих нуклеозидных мотивов:
ААВВАА;
АВВАВВ;
ААВААВ;
АВВАВААВВ;
АВАВАА;
ААВАВАВ;
АВАВАА;
АВВААВВАВАВАА;
ВАВВААВВАВАВАА или
АВАВВААВВАВАВАА;
где, А представляет собой нуклеозид первого типа, а B представляет собой нуклеозид второго типа. В некоторых вариантах реализации изобретения каждый A и B выбран из 2'-F, 2'-OMe, BNA и MOE.
В некоторых вариантах реализации изобретения олигонуклеотиды, имеющиеся такой чередующийся мотив также содержат модифицированный 5'-терминальный нуклеозид, такие как олигонуклеотиды с формулами IIc или IIe.
В некоторых вариантах реализации олигонуклеотиды содержат участок, имеющий мотив 2-2-3. Такие участки содержат следующий мотив:
-(А)2-(В)x-(А)2-(С)y-(А)3-
где: А представляет собой первый тип модифицированного нуклеозида;
B и C представляют собой нуклеозиды, которые модифицированные другим способом, чем A, тем не менее, В и C могут иметь одинаковые или различные модификации, отличающиеся друг от друга;
x и y равны от 1 до 15.
В некоторых вариантах реализации изобретения A представляет собой 2'-ОМе модифицированный нуклеозид. В некоторых вариантах реализации изобретения B и C оба являются 2'-F модифицированными нуклеозидами. В некоторых вариантах реализации изобретения A представляет собой 2'-ОМе модифицированный нуклеозид, а B и C оба являются 2'-F модифицированными нуклеозидами.
В некоторых вариантах реализации изобретения олигонуклеозиды имеют следующий сахаридный мотив:
5'-(Q)-(AB)xAy-(D)z
где:
Q представляет собой а нуклеозид, содержащий стабилизированный фосфатный фрагмент. В некоторых вариантах реализации изобретения Q представляет собой нуклеозид, обладающий Формулой IIс или IIе;
А представляет собой первый тип модифицированного нуклеозида;
B представляет собой второй тип модифицированного нуклеозида;
D представляет собой модифицированный нуклеозид, содержащий модификацию отличающуюся от нуклеозида, прилегающему к нему. Таким образом, если y равно 0, то D должен быть модифицирован другим способом, чем B, а если y равно 1, то D должен быть модифицирован другим способом, чем А. В некоторых вариантах реализации изобретения D отличается как от A, так и от В.
X равно 5-15;
Y равно 0 или 1;
Z равно 0-4.
В некоторых вариантах реализации изобретения олигонуклеозиды имеют следующий сахаридный мотив:
5'-(Q)-(A)x-(D)z
где:
Q представляет собой нуклеозид, содержащий стабилизированный фосфатный фрагмент. В некоторых вариантах реализации изобретения Q представляет собой нуклеозид, обладающий Формулой IIc или IIe;
A представляет собой первый тип модифицированного нуклеозида;
D представляет собой модифицированный нуклеозид, содержащий модификацию отличающуюся от A.
X равно 11-30;
Z равно 0-4.
В некоторых вариантах реализации изобретения A, B, C и D в вышеуказанных мотивах выбираются из: 2'-ОМе, 2'-F, 2'-МОЕ, LNA и cEt. В некоторых вариантах реализации изобретения D представляет терминальные нуклеозиды. В некоторых вариантах реализации изобретения такие терминальные нуклеозиды не сконструированы для гибридизации с нуклеиновой кислотой-мишенью (хотя один или более могут случайно гибридизироваться). В некоторых вариантах реализации изобретения нуклеотидное основание каждого нуклеозида D представляет собой аденин независимо от идентичности нуклеотидного основания в соответствующем положении нуклеиновой кислоты-мишени. В некоторых вариантах реализации изобретения нуклеотидное основание каждого нуклеозида D представляет собой тимин.
В некоторых вариантах реализации изобретения антисмысловые соединения, включающие особенно подходящие для применения в виде оцРНК, содержат модифицированные межнуклеозидные связи, расположенные вдоль олигонуклеотида или его участка в определенном паттерне или модифицированном мотиве межнуклеозидных связей. В некоторых вариантах реализации изобретения олигонуклеотиды содержат участок, имеющий чередующийся мотив межнуклеозидных связей. В некоторых вариантах реализации изобретения олигонуклеотиды содержат участок с одинаково модифицированными межнуклеозидными связями. В некоторых таких вариантах реализации изобретения олигонуклеотид содержит участок, который одинаково связан тиофосфатными межнуклеозидными связями. В некоторых вариантах реализации изобретения олигонуклеотид одинаково связан тиофосфатными межнуклеозидными связями. В некоторых вариантах реализации изобретения каждая межнуклеозидная связь олигонуклеотида выбрана из фосфодиэфира и тиофосфата. В некоторых вариантах реализации изобретения каждая межнуклеозидная связь олигонуклеотида выбрана из фосфодиэфира и тиофосфата, и по меньшей мере одна межнуклеозидная связь представляет собой тиофосфат.
В некоторых вариантах реализации изобретения олигонуклеотид содержит по меньшей мере 6 тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации изобретения олигонуклеотид содержит по меньшей мере 8 тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации изобретения олигонуклеотид содержит по меньшей мере 10 тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации изобретения олигонуклеотид содержит по меньшей мере один блок из по меньшей мере 6 идущих подряд тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации изобретения олигонуклеотид содержит по меньшей мере один блок из по меньшей мере 8 идущих подряд тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации изобретения олигонуклеотид содержит по меньшей мере один блок из по меньшей мере 10 идущих подряд тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации изобретения олигонуклеотид содержит по меньшей мере один блок из по меньшей мере 12 идущих подряд тиофосфатных межнуклеозидных связей. В некоторых таких вариантах реализации изобретения по меньшей мере один такой блок расположен на 3'-конце олигонуклеотида. В некоторых таких вариантах реализации изобретения по меньшей мере один такой блок расположен в пределах 3 нуклеозидов 3'-конца олигонуклеотида.
Олигонуклеотиды, имеющие любой из различных сахаридных мотивов, описанных в данном документе, могут иметь любой связывающий мотив. К примеру, олигонуклеотиды, включающие, но не ограниченные описанными выше, могут иметь связывающий мотив, выбранный из неограничивающей таблицы ниже:

ii. Соединения миРНК
В некоторых вариантах реализации изобретения антисмысловые соединения представляют собой соединения двухцепочечных РНКи (миРНК). В таких вариантах реализации изобретения одна или обе цепи могут содержать любой мотив с модификацией, описанный выше для оцРНК. В некоторых вариантах реализации изобретения соединения оцРНК могут быть немодифицированными РНК. В некоторых вариантах реализации изобретения соединения миРНК могут содержать немодифицированные РНК-нуклеозиды, но модифицированные межнуклеозидныые связи.
Некоторые варианты реализации изобретения относятся к двухцепочечным композициям, причем каждая цепь содержит мотив, определенный расположением одного или более модифицированных или немодифицированных нуклеозидов. В некоторых вариантах реализации изобретения предложены композиции, содержащие первое и второе олигомерное соединение, которые являются полностью или по меньшей мере частично гибридизирующимися с образованием дуплексного участка и дополнительно содержащие участок, который комплементарен и гибридизируется с нуклеиновой кислотой-мишенью. Приемлемо, что такая композиция содержит первое олигомерное соединение, которое представляет собой антисмысловую цепь, имеющую полную или частичную комплементарность с нуклеиновой кислотой-мишенью, а второе олигомерное соединение, которое представляет собой смысловую цепь, имеющую один или более участков комплементарности и образующую по меньшей мере один дуплексный участок с первым олигомерным соединением.
Композиции по нескольким вариантам реализации изобретения модулируют экспрессию гена гибридизацией с нуклеиновой кислотой-мишенью, приводя к потере его нормального функционирования. В некоторых вариантах реализации изобретения нуклеиновая кислота-мишень представляет собой ANGPTL3. В определенном варианте реализации изобретения деградация таргетированной ANGPTL3 облегчается активированным комплексом RISC, который образуется с композицией, описанной в данном документе.
Несколько вариантов реализации изобретения направлены на использование двухцепочечных композиций, в которых одна из цепей применяется, к примеру, для воздействия на предпочитаемую загрузку противоположной цепи в комплекс RISC (или расщепления). Композиции пригодны для таргетирования выбранных молекул нуклеиновых кислот и модулирования экспрессии одного или более генов. В некоторых вариантах реализации изобретения композиции по настоящему изобретению гибридизируются с частью РНК-мишени, приводя к потере нормального функционирования РНК-мишени.
Некоторые варианты реализации изобретения приведены для двухцепочечных композиций, в которых обе цепи содержат гемимерный мотив, полностью модифицированный мотив, модифицированный в определенных положениях мотив или чередующийся мотив. Каждая цепь композиций по настоящему изобретению может быть модифицированной для выполнения конкретной роли, к примеру, в механизме миРНК. Использование различных мотивов в каждой цепи или одинакового мотива с различными химическими модификациями в каждой цепи позволяет проводить таргетинг антисмысловой цепи комплексом RISC, при этом ингибируя внедрение смысловой цепи. В пределах этой модели каждая цепь может независимо модифицироваться таким образом, чтобы усиливать свою конкретную роль. Антисмысловая цепь может быть модифицирована на 5'-конце для усиления своей роли в одном участке RISC, тогда как 3'-конец может быть модифицирован отличающимся образом для усиления своей роли в другом участке RISC.
Молекулы двухцепочечных олигонуклеотидов могут быть молекулами двухцепочечных полинуклеотидов, содержащими самокомплементарные смысловые и антисмысловые участки, причем антисмысловой участок содержит нуклеотидную последовательность, которая комплементарна нуклеотидной последовательности в молекуле нуклеиновой кислоты-мишени или ее части, а смысловой участок имеет нуклеотидную последовательность, соответствующую последовательности нуклеиновой кислоты-мишени или ее части. Молекулы двухцепочечных олигонуклеотидов могут быть собраны из двух отдельных олигонуклеотидов, когда одна цепь представляет собой смысловую цепь, а другая - представляет собой антисмысловую цепь, причем антисмысловая и смысловая цепи являются самокомплементарными (т.е. каждая цепь содержит нуклеотидную последовательность, которая комплементарна нуклеотидной последовательности на другой цепи; таким образом, что антисмысловая цепь и смысловая цепь образуют дуплексную или двухцепочечную структуру, к примеру в которой двухцепочечный участок составляет от около 15 до около 30, например, около 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 пар оснований; антисмысловая цепь содержит нуклеотидную последовательность, которая комплементарная нуклеотидной последовательности в молекуле нуклеиновой кислоты-мишени или ее части, а смысловая цепь содержит нуклеотидную последовательность, соответствующую последовательности нуклеиновой кислоты-мишени или ее части (например, от около 15 до около 25 или более нуклеотидов молекулы двухцепочечного олигонуклеотида комплементарны нуклеиновой кислоте-мишени или ее части). В альтернативном варианте двухцепочечный олигонуклеотид собран из одного олигонуклеотида, когда самокомплементарные смысловой и антисмысловой участки миРНК связаны с помощью линкера(ов) на основе нуклеиновых кислот или на основе ненуклеиновых кислот.
Двухцепочечный олигонуклеотид может быть полинуклеотидом с дуплексной, асимметричной дуплексной, шпильковой или асимметричной шпильковой вторичной структурой, имеющей самокомплементарные смысловые и антисмысловые участки, причем антисмысловой участок содержит нуклеотидную последовательность, которая комплементарна нуклеотидной последовательности в отдельной молекуле нуклеиновой кислоты-мишени или ее части, а смысловой участок имеет нуклеотидную последовательность, соответствующую последовательности нуклеиновой кислоты-мишени или ее части. Двухцепочечный олигонуклеотид может быть кольцевым одноцепочечным полинуклеотидом, содержащим две или более петлевых структур и стебель, содержащий самокомплементарные смысловые и антисмысловые участки, причем антисмысловой участок содержит нуклеотидную последовательность, которая комплементарна нуклеотидной последовательности в молекуле нуклеиновой кислоты-мишени или ее части, а смысловой участок имеет нуклеотидную последовательность, соответствующую последовательности нуклеиновой кислоты-мишени или ее части, и при этом кольцевой полинуклеотид может процессироваться или in vivo или in vitro с образованием молекулы активной миРНК, способной медиировать РНКи.
В некоторых вариантах реализации изобретения двухцепочечный олигонуклеотид содержит отдельные смысловые и антисмысловые последовательности или участки, в которых смысловые и антисмысловые участки ковалентно связаны нуклеотидными или ненуклеотидными линкерными молекулами, как известно в данной области, или поочередно нековалентно связаны ионными взаимодействиями, водородными связями, взаимодействиями Ван-дер-Ваальса, гидрофобными взаимодействиями и/или стэкинг-взаимодействиями. В некоторых вариантах реализации изобретения двухцепочечный олигонуклеотид содержит нуклеотидную последовательность, которая комплементарна нуклеотидной последовательности гена-мишени. В другом варианте реализации изобретения двухцепочечный олигонуклеотид взаимодействует с нуклеотидной последовательностью гена-мишени способом, который вызывает ингибирование экспрессии гена-мишени.
Используемый в данном документе, двухцепочечный олигонуклеотид не следует ограничивать молекулами, содержащими только РНК, но он дополнительно охватыватывает химически модифицированные нуклеотиды и ненуклеотиды. В некоторых вариантах реализации изобретения у коротких интерферирующих молекул нуклеиновой кислоты отсутствуют нуклеотиды, содержащие 2'-гидрокси-(2'-ОН). В некоторых вариантах реализации изобретения короткие интерферирующие нуклеиновые кислоты не обязательно не включают любые рибонуклеотиды (например, нуклеотиды, имеющие группу 2'-ОН). Такие двухцепочечные олигонуклеотиды, которым не требуется наличие рибонуклеотидов внутри молекулы для обеспечения РНКи, тем не менее могут содержать присоединенный линкер или линкеры или другие присоединенные или связанные группы, фрагменты или цепи, содержащие один или более нуклеотидов с группой 2'-ОН. Не обязательно, двухцепочечные олигонуклеотиды могут содержать рибонуклеотиды в около 5, 10, 20, 30, 40 или 50% нуклеотидных положений. Используемый в данном документе, термин миРНК означает эквивалент другим терминам, применяемым для описания молекул нуклеиновых кислот, которые способны медиировать последовательность-специфическую РНКи, к примеру, короткая интерферирующая РНК (киРНК), двухцепочечная РНК (дцРНК), микроРНК (миRNA), короткая шпильковая РНК (кшРНК), короткий интерферирующий олигонуклеотид, короткая интерферирующая нуклеиновая кислота, короткий интерферирующий модифицированный олигонуклеотид, химически модифицированная миРНК, РНК для посттранскрипционного сайленсинга генов (РНК ПТСГ) и другие. В дополнение к этому, используемый в данном документе, термин РНКи означает эквивалент другим терминам, применяемым для описания последовательность-специфической РНК-интерференции, такой как в посттранскрипционный сайленсинг генов, трансляционное ингибирование или эпигенетический сайленсинг. К примеру, двухцепочечные олигонуклеотиды могут применяться для эпигенетического сайленсинга генов как на посттранскрипционном уровне, так и на претранскрипционном уровне. В неограничивающем примере, эпигенетическая регуляция экспрессии генов молекулами миРНК по данному изобретению может возникать вследствие миРНК-опосредованной модификации структуры хроматина или паттерна метилирования для изменения экспрессии генов (см., к примеру, Verdel et al., 2004, Science, 303, 672-676; Pal-Bhadra et al., 2004, Science, 303, 669-672; Allshire, 2002, Science, 297, 1818-1819; Volpe et al., 2002, Science, 297, 1833-1837; Jenuwein, 2002, Science, 297, 2215-2218 и Hall et al., 2002, Science, 297, 2232-2237).
Предполагается, что соединения и композиции по некоторым вариантам реализации изобретения, предложенные в данном документе, могут таргетировать ANGPTL3 дцРНК-опосредованным сайленсингом генов или механизмом РНКи, включая, например «шпильковые» или стебле-петлевые эффекторные молекулы двухцепочечных РНК, в которых одна цепь РНК с самокомплементарными последовательностями способна принимать двухцепочечную конформацию, или эффекторные молекулы дуплексных дцРНК содержат две отдельные цепи РНК. В различных вариантах реализации изобретения дцРНК полностью состоит из рибонуклеотидов или состоит из смеси рибонуклеотидов и дезоксирибонуклеотидов, таких как гибриды РНК/ДНК, описанные к примеру в заявке WO 00/63364, поданной 19 апреля 2000 г., или заявкой США сер. №60/130377, поданной 21 апреля 1999 г. ДцРНК или эффекторная молекула дцРНК может быть одной молекулой с участком самокомплементарности, таким что нуклеотиды в одном сегменте молекулы спариваются по основаниям с нуклеотидами в другом сегменте молекулы. В различных вариантах реализации изобретения дцРНК состоит из одной молекулы, состоящей полностью из рибонуклеотидов, или включает участок из рибонуклеотидов, которые комплементарны участку из дезоксирибонуклеотидов. В альтернативном варианте дцРНК может включать две разные цепи, которые имеют участок комплементарности друг к другу.
В различных вариантах реализации изобретения обе цепи полностью состоят из рибонуклеотидов, одна цепь полностью состоит из рибонуклеотидов и одна цепь полностью состоит из дезоксирибонуклеотидов, или одна или обе цепи содержат смесь рибонуклеотидов и дезоксирибонуклеотидов. В некоторых вариантах реализации изобретения участки комплементарности являются по меньшей мере на 70, 80, 90, 95, 98 или 100% комплементарными друг другу и последовательности нуклеиновой кислоты-мишени. В некоторых вариантах реализации изобретения участок дцРНК, который представлен в двухцепочечной конформации, включает по меньшей мере 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 50, 75 100, 200, 500, 1000, 2000 или 5000 нуклеотидов, или включает все из нуклеотидов в кДНК или другой последовательности нуклеиновой кислоты-мишени, представляемой в дцРНК. В некоторых вариантах реализации изобретения дцРНК не содержит любой из одноцепочечных участков, таких как одноцепочечные концы, или дцРНК представляет собой шпильку. В других вариантах реализации изобретения дцРНК имеет один или более одноцепочечных участков или выступов. В некоторых вариантах реализации изобретения гибриды РНК/ДНК включают цепь или участок ДНК, который представляет собой антисмысловую цепь или участок (например, обладающий по меньшей мере 70, 80, 90, 95, 98 или 100% комплементарностью к нуклеиновой кислоте-мишени), и цепь или участок РНК, который представляет собой смысловую цепь или участок (например, обладающий по меньшей мере 70, 80, 90, 95, 98 или 100% идентичностью к нуклеиновой кислоте-мишени), и наоборот.
В различных вариантах реализации изобретения гибрид РНК/ДНК получен in vitro с использованием ферментных или химических способов синтеза, таких как описанные в данном документе или описанные в заявке WO 00/63364, поданной 19 апреля 2000 г., или заявке США сер. №60/130377, поданной 21 апреля 1999 г. В других вариантах реализации изобретения цепь ДНК, синтезированная in vitro, образует комплекс с цепью РНК, полученной in vivo или in vitro, перед, после или одновременно с цепью ДНК в клетке. В других вариантах реализации изобретения дцРНК представляет собой одну кольцевую нуклеиновую кислоту, содержащую смысловой и антисмысловой участок, или дцРНК включает кольцевую нуклеиновую кислоту и или вторую кольцевую нуклеиновую кислоту, или линейную нуклеиновую кислоту (см., к примеру, WO 00/63364, поданную 19 апреля 2000 г., или заявку США сер. №60/130377, поданную 21 апреля 1999 г.). Типичные кольцевые нуклеиновые кислоты включают структуры типа «лассо», в которых свободная 5'-фосфорильная группа нуклеотида становится связанной с 2'-гидроксильной группой другого нуклеотида в виде обратной петли.
В других вариантах реализации изобретения дцРНК включает один или более модифицированных нуклеотидов, в которых 2'-положение сахара содержит галоген (такой как фторидная группа) или содержит алкоксигруппу (такую как метоксигруппа), что увеличивает период полувыведения дцРНК in vitro или in vivo, по сравнению с соответствующей дцРНК, в которой соответствующее 2'-положение, содержит водородную или гидроксильную группу. В других вариантах реализации изобретения дцРНК включает одну или более связей между прилегающими нуклеотидами, отличающимися от встречающихся в природе фосфодиэфирных связей. Примеры таких связей включают фосфорамидную, тиофосфатную и дитиофосфатную связи. ДцРНК также могут быть молекулами химически модифицированных нуклеиновых кислот, как представлено в патенте США №6673661. В других вариантах реализации изобретения дцРНК содержит одну или две кэппированные цепи, как описано к примеру, в заявке WO 00/63364, поданной 19 апреля 2000 г., или заявке США сер. №60/130377, поданной 21 апреля 1999 г.
В других вариантах реализации изобретения дцРНК может быть любой из по меньшей мере молекул частичных дцРНК, описанных в WO 00/63364, а также любой из молекул дцРНК, описанных в предварительной заявке США 60/399998; и предварительной заявке США 60/419532 и заявке PCT/US2003/033466, представление которых тем самым включено посредством ссылки. Любые из дцРНК могут экспрессироваться in vitro или in vivo с использованием способов, описанных в данном документе или стандартных способов, таких как описанные в WO 00/63364.
Захват
В некоторых вариантах реализации изобретения не предполагается, что антисмысловые соединения приведут к расщеплению нуклеиновой кислоты-мишени посредством РНКазы Н или приведут к расщеплению или разрезанию посредством механизма RISC. В некоторых таких вариантах реализации изобретения антисмысловая активность может возникать вследствие захвата, при котором присутствие гибридизированного антисмыслового соединения разрушает активность нуклеиновой кислоты-мишени. В некоторых таких вариантах реализации изобретения антисмысловое соединение может быть одинаково модифицировано или может содержать смесь модификаций и/или модифицированных и немодифицированных нуклеозидов.
Нуклеиновые кислоты-мишени, целевые участки и нуклеотидные последовательности
Нуклеотидные последовательности, которые кодируют ANGPTL3, включают без ограничения, следующие: последовательность человека, указанную в GenBank, инвентаризационный №NM 014495.2 (включена в данный документ как SEQ ID NO: 1) или в GenBank, инвентаризационный №NT 032977.9, нуклеотиды от 33032001 до 33046000 (включена в данный документ как SEQ ID NO: 2). Понятно, что последовательность, указанная в каждой SEQ ID NO. в примерах, содержащихся в данном документе, является независимой от любой модификации сахаридного фрагмента, межнуклеозидной связи или нуклеотидного основания. По сути, антисмысловые соединения, определенные SEQ ID NO., могут независимо содержать одну или более модификаций сахаридного фрагмента, межнуклеозидной связи или нуклеотидного основания. Антисмысловые соединения, описанные по номеру Isis (Isis №) указывают сочетание последовательности и мотива нуклеотидных оснований.
В некоторых вариантах реализации изобретения целевой участок представляет собой структурно определенный участок нуклеиновой кислоты-мишени. Например, целевой участок может охватывать 3'-НТО, 5'-НТО, экзон, интрон, границу сплайсинга, кодирующий участок, участок инициации трансляции, участок терминации трансляции или другой определенный участок нуклеиновых кислот. Структурно определенные участки ANGPTL3 могут быть получены по инвентаризационному номеру из баз данных последовательностей, таких как NCBI, и такая информация включена в данный документ посредством ссылки. В некоторых вариантах реализации целевой участок может охватывать последовательность от 5'-целевого сайта одного целевого сегмента в пределах целевого участка до 3'-целевого сайта другого целевого сегмента в пределах того же целевого участка.
В некоторых вариантах реализации «целевой сегмент» представляет собой меньшую субчасть целевого участка в пределах нуклеиновой кислоты. К примеру, целевой сегмент может быть последовательностью нуклеотидов нуклеиновой кислоты-мишени, которую таргетируют одно или более антисмысловых соединений. «5'-целевой сайт» или «5'-сайт инициации» относится к наиболее удаленному 5'-нуклеотиду целевого сегмента. «3'-целевой сайт» или «3'-сайт терминации» относится к наиболее удаленному 3'-нуклеотиду целевого сегмента.
Таргетирование включает определение по меньшей мере одного целевого сегмента, с которым гибридизируется антисмысловое соединение, например, для достижения требуемого эффекта. В некоторых вариантах реализации требуемый эффект представляет собой снижение уровней мРНК нуклеиновой кислоты-мишени. В некоторых вариантах реализации требуемый эффект представляет собой снижение уровней белка, кодируемого нуклеиновой кислотой-мишенью, или фенотипическое изменение, связанное с нуклеиновой кислотой-мишенью.
Целевой участок может содержать один или более целевых сегментов. Несколько целевых сегментов в целевом участке могут быть перекрывающимися. В альтернативном варианте, они могут быть неперекрывающимися. В некоторых вариантах реализации целевые сегменты в целевом участке отделены друг от друга не более, чем около 300 нуклеотидами. В некоторых вариантах реализации целевые сегменты в целевом участке отделены количеством нуклеотидов равным, равным около, не более чем, не более чем около 250, 200,150, 100, 90, 80, 70, 60, 50, 40, 30, 20 или 10 нуклеотидами на нуклеиновой кислоте-мишени, или находится в диапазоне, определяемом любыми двумя из предшествующих значений. В некоторых вариантах реализации целевые сегменты в целевом участке отделены друг от друга не более или не более чем около 5 нуклеотидами на нуклеиновой кислоте-мишени. В некоторых вариантах реализации целевые сегменты являются последовательными. Предполагается, что целевые участки, определенные диапазоном, имеющим инициирующую нуклеиновую кислоту, которая представляет собой любую из 5'-целевых сайтов или 3'-целевых сайтов, перечисленных в данном документе.
Подходящие целевые сегменты могут быть найдены в 5'-НТО, кодирующем участке, в 3'-НТО, интроне, экзоне или границе сплайсинга. Целевые сегменты, содержащие кодон инициации или кодон терминации, также представляют собой подходящие целевые сегменты. Подходящий целевой сегмент может специфически исключать структурно определенный участок, такой как кодон инициации или кодон терминации.
Определение подходящих целевых сегментов может включать сравнение последовательности нуклеиновой кислоты-мишени с другими последовательностями по всему геному. Например, для идентификации участков сходства среди разных нуклеиновых кислот может быть использован алгоритм BLAST. Это сравнение может предотвратить выбор последовательностей антисмысловых соединений, которые могут гибридизироваться неспецифическим образом с последовательностями, отличающимися от выбранной нуклеиновой кислоты-мишени (т.е. нецелевых или побочных последовательностей).
Могут быть вариации активности (например, как определено процентным снижением уровней нуклеиновой кислоты-мишени) антисмысловых соединений в пределах активного целевого участка. В некоторых вариантах реализации изобретения снижения уровней мРНК ANGPTL3 являются показателем ингибирования экспрессии белка ANGPTL3. Снижения уровней белка ANGPTL3 также являются показателем ингибирования экспрессии мРНК-мишени. Дополнительно, фенотипические изменения, такие как снижение уровня холестерина, ЛПНП, триглицеридов или глюкозы, могут быть показателем ингибирования мРНК ANGPTL3 и/или экспрессии белка.
Гибридизация
В некоторых вариантах реализации гибридизация происходит между антисмысловым соединением, описанным в данном документе, и нуклеиновой кислотой ANGPTL3. Наиболее распространенный механизм гибридизации включает водородное связывание (например Уотсон-Криковское, Хугстиновское или обратное Хугстиновское водородное связывание) между комплементарными нуклеотидными основаниями молекул нуклеиновых кислот.
Гибридизация может происходить в различных условиях. Жесткие условия являются последовательность-зависимыми и определяются природой и составом гибридизируемых молекул нуклеиновых кислот.
Способ определения того, является ли последовательность специфически гибридизируемой с нуклеиновой кислотой-мишенью, хорошо известны в данной области техники (Sambrook and Russell, Molecular Cloning: A Laboratory Manual, 3rd Ed., 2001). В некоторых вариантах реализации изобретения антисмысловые соединения, представленные в данном документе, являются специфически гибридизируемыми с нуклеиновой кислотой ANGPTL3.
Комплементарность
Антисмысловое соединение и нуклеиновая кислота-мишень являются комплементарными друг к другу, когда достаточное количество нуклеотидных оснований антисмыслового соединения может образовать водородные связи с соответствующими нуклеотидными основаниями нуклеиновой кислоты-мишени, таким образом, чтобы возникал требуемый эффект (например, антисмысловое ингибирование нуклеиновой кислоты-мишени, такой как нуклеиновая кислота ANGPTL3).
Антисмысловое соединение может гибридизироваться более чем с одним или более сегментами нуклеиновой кислоты ANGPTL3 так, чтобы промежуточные или прилегающие сегменты не участвовали в гибридизации (например, петлевая структура, мисматчевая или шпильковая структура).
В некоторых вариантах реализации изобретения антисмысловые соединения, представленные в данном документе, или их указанная часть, являются или являются по меньшей мере на 70%, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% комплементарными нуклеиновой кислоте ANGPTL3, целевому участку, целевому фрагменту или их указанной части. В некоторых вариантах реализации изобретения антисмысловые соединения, представленные в данном документе, или их указанная часть, являются или являются по меньшей мере на 70%, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% комплементарными последовательности одной или более SEQ ID NO: 1-2. Процент комплементарности антисмыслового соединения с нуклеиновой кислотой-мишенью может быть определен с использованием стандартных методов.
Например, антисмысловое соединение, в котором 18 из 20 нуклеотидных оснований антисмыслового соединения являются комплементарными целевому участку, и поэтому должно специфически гибридизироваться, должно представлять 90 процентов комплементарности. В данном примере оставшиеся некомплементарные нуклеотидные основания могут быть расположены кластерно или перемежающимся образом с комплементарными нуклеотидными основаниями и не должны быть последовательными друг с другом или с комплементарными нуклеотидными основаниями. По сути, антисмысловое соединение длиной 18 нуклеотидных оснований, имеет 4 (четыре) некомплементарных нуклеотидных основания, которые фланкированы двумя участками полностью комплементарными нуклеиновой кислоте-мишени, должно иметь 77,8% общей комплементарности с нуклеиновой кислотой-мишенью и, таким образом, должно подпадать в объем настоящего изобретения. Процент комплементарности антисмыслового соединения с участком нуклеиновой кислоты-мишени может быть стандартно определен с использованием программ BLAST (основное средство поиска локального выравнивания) и программ PowerBLAST, известных в данной области техники (Altschul et al., J. Mol. Biol., 1990, 215, 403410; Zhang и Madden, Genome Res., 1997, 7, 649656). Процент гомологии, идентичность или комплементарность последовательностей могут быть определены, например, программой Gap (висконсинский пакет анализа последовательностей, версия 8 для Unix, Genetics Computer Group, Университетский исследовательский парк, г. Мэдисон, штат Висконсин), применяя настройки по умолчанию, которые использует алгоритм Смита и Уотермана (Adv. Appl. Math., 1981, 2, 482 489).
В некоторых вариантах реализации изобретения антисмысловые соединения, приведенные в данном описании, или указанные их части, полностью комплементарны (т.е. на 100% комплементарны) нуклеиновой кислоте-мишени или указанной ее части. Например, антисмысловое соединение может быть полностью комплементарным нуклеиновой кислоте ANGPTL3, или целевому участку, или целевому сегменту или ее целевой последовательности. Используемый в настоящем документе, «полностью комплементарный» означает, что каждое нуклеотидное основание антисмыслового соединения способно к точному спариванию оснований с соответствующими нуклеотидными основаниями нуклеиновой кислоты-мишени. Например, антисмысловое соединение из 20 нуклеотидных оснований полностью комплементарно целевой последовательности, которая в длину состоит из 400 нуклеотидных оснований, до тех пор, пока существует соответствующая часть из 20 нуклеотидных оснований нуклеиновой кислоты-мишени, которая полностью комплементарна антисмысловому соединению. Полностью комплементарный также может использоваться в ссылке на указанную часть первой и/или второй нуклеиновой кислоты. Например, часть из 20 нуклеотидных оснований антисмыслового соединения, состоящего из 30 нуклеотидных оснований, может быть «полностью комплементарной» целевой последовательности, которая состоит в длину из 400 нуклеотидных оснований. Часть из 20 нуклеотидных оснований олигонуклеотида, состоящего из 30 нуклеотидных оснований, полностью комплементарна целевой последовательности, если целевая последовательность имеет соответствующую часть из 20 нуклеотидных оснований, в которой каждое нуклеотидное основание комплементарно части из 20 нуклеотидных оснований антисмыслового соединения. В то же время, целое антисмысловое соединение из 30 нуклеотидных оснований может быть полностью комплементарным целевой последовательности в зависимости от того, будут ли оставшиеся 10 нуклеотидных оснований антисмыслового соединения также комплементарны целевой последовательности.
Некомплементарное нуклеотидное основание может располагаться на 5'-конце или 3'-конце антисмыслового соединения. В альтернативном варианте некомплементарное нуклеотидное основание или нуклеотидные основания могут находиться во внутреннем положении антисмыслового соединения. Если присутствуют два или более некомплементарных нуклеотидных оснований, они могут быть последовательными (т.е. связанными) или непоследовательными. В одном варианте реализации изобретения некомплементарное нуклеотидное основание располагается в сегменте крыльев гэпмера антисмыслового олигонуклеотида.
В некоторых вариантах реализации изобретения антисмысловые соединения, которые в длину состоят из или состоят из вплоть до 10, 12, 13, 14, 15, 16, 17, 18, 19 или 20 нуклеотидных оснований, содержат не более 4, не более 3, не более 2 или не более 1 некомплементарного нуклеотидного основания(ий) относительно нуклеиновой кислоты-мишени, такой как нуклеиновая кислота ANGPTL3 или ее указанная часть.
В некоторых вариантах реализации изобретения антисмысловые соединения, которые в длину состоят из или состоят из вплоть до 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28 ,29 или 30 нуклеотидных оснований, содержат не более 6, не более 5, не более 4, не более 3, не более 2 или не более 1 некомплементарного нуклеотидного основания(ий) относительно нуклеиновой кислоты-мишени, такой как нуклеиновая кислота ANGPTL3 или ее указанная часть.
Антисмысловые соединения, представленные в настоящем документе, включают также те, которые комплементарны части нуклеиновой кислоты-мишени. Используемая в настоящем документе, «часть» означает определенное количество последовательных (т.е. связанных) нуклеотидных оснований внутри участка или сегмента нуклеиновой кислоты-мишени. «Часть» также может относиться к определенному количеству последовательных нуклеотидных оснований антисмыслового соединения. В некоторых вариантах реализации изобретения антисмысловые соединения комплементарны части целевого сегмента, состоящей из по меньшей мере 8 нуклеотидных оснований. В некоторых вариантах реализации изобретения антисмысловые соединения комплементарны части целевого сегмента, состоящей из по меньшей мере 10 нуклеотидных оснований. В некоторых вариантах реализации изобретения антисмысловые соединения комплементарны части целевого сегмента, состоящей из по меньшей мере 15 нуклеотидных оснований. Предполагаются также антисмысловые соединения, которые являются комплементарными по меньшей мере 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более нуклеотидным основаниям части целевого сегмента или диапазону, определенному любым двум из указанных значений.
Идентичность
Антисмысловые соединения, представленные в данном документе, могут также содержать определенный процент идентичности к конкретной нуклеотидной последовательности, SEQ ID NO. или последовательности соединения, представленного конкретным номером Isis или его части. Используемое в данном документе, антисмысловое соединение является идентичным последовательности, описанной в данном документе, если оно имеет такую же способность к спариванию с нуклеотидными основаниями. Например, РНК, которая содержит урацил вместо тимидина в описанной последовательности ДНК, будет считаться идентичной последовательности ДНК, так как и урацил и тимидин спаривается с аденином. Предполагаются также укороченные и удлиненные варианты антисмысловых соединений, описанных в данном документе, а также соединений, обладающих неидентичными основаниями по отношению к антисмысловым соединениям, представленным в данном документе. Неидентичные основания могут быть прилегающими друг к другу или рассеянными по всему антисмысловому соединению. Процент идентичности антисмыслового соединения рассчитывается в соответствии с количеством оснований, которые имеют идентичное спаривание оснований относительно последовательности с которой происходит сравнение.
В некоторых вариантах реализации изобретения антисмысловые соединения или их части по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичны одному или более антисмысловым соединениям или SEQ ID NO., или их частям, описанным в данном документе.
Модификации
Нуклеозид представляет собой комбинацию основание-сахар. Часть нуклеотидного основания (также известного как основание) обычно представляет собой фрагмент гетероциклического основания. Нуклеотиды представляют собой нуклеозиды, которые дополнительно включают фосфатную группу, ковалентно связанную с сахаридной частью нуклеозида. Для тех нуклеозидов, которые содержат пентофуранозильный сахар, фосфатная группа может быть связана с 2', 3' или 5'-гидроксильным фрагментом сахара. Олигонуклеотиды образуются посредством ковалентной связи прилегающих друг к другу нуклеозидов, с образованием линейного полимерного олигонуклеотида. В олигонуклеотидной структуре фосфатные группы обычно предназначены для формирования межнуклеозидных связей олигонуклеотида.
Модификации антисмысловых соединений охватывают замены или изменения межнуклеозидных связей, сахаридных фрагментов или нуклеотидных оснований. Модифицированные антисмысловые соединения часто предпочтительны по сравнению с нативными формами из-за наличия требуемых свойств, таких как, например, усиленное поглощение клетками, повышенная аффинность связывания с нуклеиновой кислотой-мишенью, повышенная устойчивость в присутствии нуклеаз или повышенная ингибирующая активность.
Химически модифицированные нуклеозиды могут также применяться для увеличения аффинности связывания укороченного или усеченного антисмыслового олигонуклеотида с его нуклеиновой кислотой-мишенью. Следовательно, сопоставимые результаты часто могут быть получены с помощью более коротких антисмысловых соединений, которые имеют такие химически модифицированные нуклеозиды.
Модифицированные межнуклеозидные связи
Встречающаяся в природе межнуклеозидная связь РНК и ДНК представляет собой 3'-5' фосфодиэфирную связь. Антисмысловые соединения, имеющие одну или более модифицированных, т.е. не встречающихся в природе, межнуклеозидных связей часто выбираются из антисмысловых соединений, имеющих встречающиеся в природе межнуклеозидные связи, из-за наличия требуемых свойств, таких как, например, усиленное поглощение клетками, повышенная аффинность связывания с нуклеиновыми кислотами-мишенями и повышенная устойчивость в присутствии нуклеаз.
Олигонуклеотиды, имеющие модифицированные межнуклеозидные связи, включают межнуклеозидные связи, которые сохраняют атом фосфора, а также межнуклеозидные связи, которые не имеют атом фосфора. Иллюстративные фосфорсодержащие межнуклеозидные связи включают, но не ограничиваются, фосфодиэфирами, фосфотриэфирами, метилфосфонатами, фосфорамидатами и тиофосфатами. Способы получения фосфорсодержащих и не содержащих фосфор связей хорошо известны.
В некоторых вариантах реализации изобретения антисмысловые соединения, таргетирующие нуклеиновую кислоту ANGPTL3, включают одну или более модифицированных межнуклеозидных связей. В некоторых вариантах реализации изобретения модифицированные межнуклеозидные связи представляют собой тиофосфатные связи. В некоторых вариантах реализации изобретения каждая межнуклеозидная связь антисмыслового соединения представляет собой тиофосфатную межнуклеозидную связь.
Модифицированные сахаридные фрагменты
Антисмысловые соединения по данному изобретению не обязательно могут содержать один или более нуклеозидов, в которых сахаридная группа была модифицирована. Такие нуклеозиды с модифицированными сахарами могут придавать антисмысловым соединениям усиленную устойчивость к нуклеазам, повышенную аффинность связывания или некоторые другие полезные биологические свойства. В некоторых вариантах реализации изобретения нуклеозиды содержат химически модифицированные фрагменты рибофуранозного кольца. Примеры химически модифицированных рибофуранозных колец включают, но не ограничиваются, добавлением групп заместителей (включающих группы заместителей 5' и 2', соединением мостиком негеминальных атомов кольца с образованием бициклических нуклеиновых кислот (BNA), замену атома кислорода в рибозильном кольце на S, N(R) или C(R1)(R2) (R, R1 и R2 независимо представляют собой Н, C1-C12 алкил или защитную группу) и их комбинации. Примеры химически модифицированных сахаров включают 2'-F-5'-метилзамещенный нуклеозид (см. международную заявку РСТ WO 2008/101157, опубликованную 21.08.08 для других описанных 5',2'-бисзамещенных нуклеозидов) или замену атома кислорода рибозильного кольца атомом S с дальнейшим замещением в 2'-положении (см. опубликованную патентную заявку США US2005-0130923, опубликованную 16 июня 2005 г.) или, альтернативно, 5'-замещение в BNA (см. международную заявку РСТ WO 2007/134181, опубликованную 22.11.07, где LNA замещается, например, на 5'-метильную или 5'-винильную группу).
Примеры нуклеозидов, имеющих химически модифицированные сахаридные фрагменты включают, без ограничения, нуклеозиды, содержащие 5'-винил, 5'-метил (R или S), 4'-S, 2'-F, 2'-ОCH3, 2'-О(CH2)CH3, 2'-OCH2CH2F и 2'-O(CH2)2ОCH3 группы заместителей. Заместитель в 2'-положении также может выбираться из аллил, амино, азидо, тио, О-аллил, O-C1-C10 алкил, OCF3, OCH2F, O(CH2)2SCH3, O(CH2)2-O-N(Rm)(Rn), O-CH2-C(=O)-N(Rm)(Rn) и O-CH2-C(=O)-N(R1)-(CH2)2-N(Rm)(Rn), где каждый R1, Rm и Rn независимо является H или замещенным или незамещенным C1-C10 алкилом.
Используемые в настоящем документе, «бициклические нуклеозиды» относятся к модифицированным нуклеозидам, содержащим бициклический сахаридный фрагмент. Примеры бициклических нуклеиновых кислот (BNA) включают без ограничения нуклеозиды, содержащие мостик между 4'- и 2'-атомами рибозильного кольца. В некоторых вариантах реализации изобретения антисмысловые соединения, представленные в данном документе, включают один или более BNA-нуклеозидов, причем мостик включает одну из формул: 4'-(CH2)-O-2' (LNA); 4'-(CH2)-S-2'; 4'-(CH2)2-O-2' (ENA); 4'-СН(CH3)-O-2' и 4'-СН(CH2ОCH3)-O-2' (и их аналоги, см. патент США 7399845, опубликованный 15 июля 2008 г.); 4'-С(CH3)(CH3)-O-2' (и его аналоги, см. PCT/US2008/068922, опубликованную как WO/2009/006478, опубликованную 8 января 2009 г.); 4'-CH2-N(OCH3)-2' (и его аналоги, см. PCT/US2008/064591, опубликованную как WO/2008/150729, опубликованную 11 декабря 2008 г.); 4'-CH2-O-N(CH3)-2' (см. опубликованную патентную заявку США US 2004-0171570, опубликованную 2 сентября 2004 г.); 4'-CH2-N(R)-O-2', где R представляет собой Н, C1-C12 алкил или защитную группу (см. патент США 7427672, опубликованный 23 сентября 2008 г.); 4'-(CH2)-С(Н)(CH3)-2' (см. Chattopadhyaya et al., J. Org. Chem., 2009, 74, 118-134) и 4'-CH2-C(=CH2)-2' (и его аналоги, см. PCT/US2008/066154, опубликованную как WO 2008/154401, опубликованную 8 декабря 2008 г.).
В опубликованной литературе сообщалось о дополнительных бициклических нуклеозидах (см., например: Srivastava et al., J. Am. Chem. Soc, 2007, 129 (26) 8362-8379; Frieden et al, Nucleic Acids Research, 2003, 21, 6365-6372; Elayadi et al., Curr. Opinion Invens. Drugs, 2001, 2, 558-561; Braasch et al, Chem. Biol, 2001, 8, 1-7; Orum et al, Curr. Opinion Mol. Ther., 2001,3, 239-243; Wahlestedt et al., Proc. Natl. Acad. Sci. U.S.A., 2000, 97, 5633-5638; Singh et al., Chem. Commun., 1998, 4, 455-456; Koshkin et al., Tetrahedron, 1998, 54, 3607-3630; Kumar et al., Bioorg. Med. Chem. Lett., 1998, 8, 2219-2222; Singh et al., J. Org. Chem., 1998, 63, 10035-10039; патенты США №: 7399845; 7053207; 7034133; 6794499; 6770748; 6670461; 6525191; 6268490; патентные публикации США №: US 2008-0039618; US 2007-0287831; US 2004-0171570; патентные публикации США серийные №: 12/129154; 61/099844; 61/097787; 61/086231; 61/056564; 61/026998; 61/026995; 60/989574; международные заявки WO 2007/134181; WO 2005/021570; WO 2004/106356; WO 94/14226 и международные заявки согласно РСТ №: PCT/US2008/068922; PCT/US2008/066154 и PCT/US2008/064591). Каждый из предшествующих бициклических нуклеозидов может быть получен из одной или более стереохимических сахаридных конфигураций, включающих, к примеру, α-L-рибофуранозу и β-D-рибофуранозу (см. международную заявку согласно РСТ PCT/DK98/00393, опубликованную 25 марта 1999 г., как WO 99/14226).
Используемые в настоящем документе, «моноциклические нуклеозиды» относятся к нуклеозидам, содержащим модифицированные сахаридные фрагменты, которые не являются бициклическими сахаридными фрагментами. В некоторых вариантах реализации сахаридный фрагмент, или аналог сахаридного фрагмента, нуклеозида может быть модифицирован или замещен в любом положении.
Используемый в настоящем документе «бициклический нуклеозид 4'-2'» или «бициклический нуклеозид 4' к 2'» относится к бициклическому нуклеозиду, содержащему фуранозное кольцо, содержащее мостик, соединяющий два атома углерода фуранозного кольца, соединяя 2'-атом углерода и 4'-атом углерода сахаридного кольца.
В некоторых вариантах реализации изобретения бициклические сахаридные фрагменты BNA-нуклеозидов включают, но не ограничиваются, соединениями, имеющими по меньшей мере один мостик между 4'- и 2'-атомами углерода пентофуранозильного сахаридного фрагмента, включающего без ограничения, мостики, содержащие 1 или от 1 до 4 связанных групп, независимо выбранных из -[C(Ra)(Rb)]n-, -C(Ra)=C(Rb)-, -C(Ra)=N-, -C(=NRa)-, -C(=O)-, -C(=S)-, -О-, -Si(Ra)2-, -S(=O)x- и -N(Ra)-; где: x равно 0, 1 или 2; n равно 1, 2, 3 или 4; каждый Ra и Rb независимо представляет собой Н, защитную группу, гидроксил, C1-C12 алкил, замещенный C1-C12 алкил, C2-C12 алкенил, замещенный C2-C12 алкенил, C2-C12 алкинил, замещенный C2-C12 алкинил, C5-C20 арил, замещенный C5-C20 арил, гетероциклический радикал, замещенный гетероциклический радикал, гетероарил, замещенный гетероарил, С5-С7 алициклический радикал, замещенный С5-С7 алициклический радикал, галоген, OJ1, NJ1J2, SJ1, N3, COOJ1, ацил (С(=O)-Н), замещенный ацил, CN, сульфонил (S(=O)2-J1) или сульфоксил (S(=O)-J1); а
каждый J1 и J2 независимо представляет собой Н, C1-C12 алкил, замещенный C1-C12 алкил, C2-C12 алкенил, замещенный C2-C12 алкенил, C2-C12 алкинил, замещенный C2-C12 алкинил, C5-C20 арил, замещенный C5-C20 арил, ацил (С(=O)-Н), замещенный ацил, гетероциклический радикал, замещенный гетероциклический радикал, C1-C12 аминоалкил, замещенный C1-C12 аминоалкил или защитную группу.
В некоторых вариантах реализации изобретения мостик бициклического сахаридного фрагмента представляет собой -[C(Ra)(Rb)]n-, -[C(Ra)(Rb)]n-O-, -C(RaRb)-N(R)-O- или -C(RaRb)-O-N(R)-. В некоторых вариантах реализации изобретения мостик представляет собой 4'-CH2-2', 4'-(CH2)2-2', 4'-(CH2)3-2', 4'-(CH2)-O-2', 4'-(CH2)2-O-2', 4'-CH2-O-N(R)-2' и 4'-CH2-N(R)-O-2'-, где каждый R независимо представляет собой Н, защитную группу или C1-C12 алкил.
В некоторых вариантах реализации изобретения бициклические нуклеозиды дополнительно определяются изомерной конфигурацией. К примеру, нуклеозид, содержащий 4'-(CH2)-O-2' мостик, может находиться в конфигурации α-L или в конфигурации β-D. Раннее, α-L-метиленокси (4'-(CH2)-O-2') BNA был внедрен в антисмысловые олигонуклеотиды, которые показали антисмысловую активность (Frieden et al., Nucleic Acids Research, 2003, 21, 6365-6372).
В некоторых вариантах реализации изобретения бициклические нуклеозиды включают такие, что содержат мостик 4' к 2', причем такие мостики включают без ограничения: α-L-4'-(CH2)-O-2', β-D-4'-CH2-O-2', 4'-(CH2)2-O-2', 4'-CH2-O-N(R)-2', 4'-CH2-N(R)-O-2', 4'-СН(CH3)-O-2', 4'-CH2-S-2', 4'-CH2-N(R)-2', 4'-(CH2)-СН(CH3)-2' и 4,-(CH2)3-2', где R представляет собой Н, защитную группу или C1-C12 алкил.
В определенном варианте реализации изобретения бициклические нуклеозиды обладают формулой:

где:
Вх представляет собой фрагмент гетероциклического основания;
-Qa-Qb-Qc- представляет собой -CH2-N(Rc)-CH2-, -C(=O)-N(Rc)-CH2-, -CH2-O-N(Rc)-, -CH2-N(Rc)-O- или -N(Rc)-O-CH2;
Rc представляет собой C1-C12 алкил- или аминозащитную группу, а
Та и Tb каждый независимо представляет собой Н, гидроксилзащитную группу, группу конъюгации, реакционно-способную фосфорную группу, фосфорный фрагмент или ковалентное присоединение к субстрату.
В некоторых вариантах реализации изобретения бициклические нуклеозиды обладают формулой:

где:
Вх представляет собой фрагмент гетероциклического основания;
Та и Тb каждый независимо представляет собой Н, гидроксилзащитную группу, группу конъюгации, реакционно-способную фосфорную группу, фосфорный фрагмент или ковалентное присоединение к субстрату;
Z представляет собой C1-C6 алкил, С2-С6 алкенил, С2-C6 алкинил, замещенный С1-С6 алкил, замещенный С2-C6 алкенил, замещенный С2-C6 алкинил, ацил, замещенный ацил, замещенный амид, тиол или замещенный тиол.
В одном варианте реализации изобретения каждая из замещенных групп независимо представляет собой моно- или полизамещенную с группами заместителей независимо выбранных из галогена, оксо, гидроксил, OJc, NJcJd, SJc, N3, OC(=X)Jc и NJeC(=X)NJcJd, причем каждый Jc, Jd и Je независимо представляет собой Н, С1-С6 алкил или замещенный С1-С6 алкил, а X представляет собой O или NJc.
В некоторых вариантах реализации изобретения бициклические нуклеозиды обладают формулой:

где:
Вх представляет собой фрагмент гетероциклического основания;
Та и Тb каждый независимо представляет собой Н, гидроксилзащитную группу, группу конъюгации, реакционно-способную фосфорную группу, фосфорный фрагмент или ковалентное присоединение к субстрату;
Zb представляет собой С1-С6 алкил, С2-C6 алкенил, С2-С6 алкинил, замещенный С1-С6 алкил, замещенный С2-С6 алкенил, замещенный С2-С6 алкинил или замещенный ацил (С(=O)-).
В некоторых вариантах реализации изобретения бициклические нуклеозиды обладают формулой:
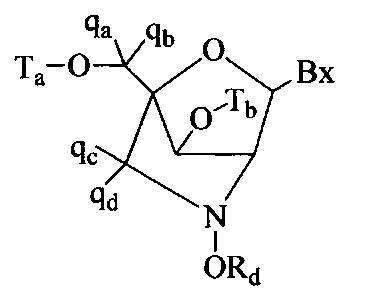
где:
Вх представляет собой фрагмент гетероциклического основания;
Та и Тb каждый независимо представляет собой Н, гидроксилзащитную группу, группу конъюгации, реакционно-способную фосфорную группу, фосфорный фрагмент или ковалентное присоединение к субстрату;
Rd представляет собой С1-С6 алкил, замещенный С1-С6 алкил, С2-С6 алкенил, замещенный С2-С6 алкенил, С2-C6 алкинил или замещенный С2-C6 алкинил;
каждый qa, qb, qc и qa независимо представляет собой Н, галоген, С1-С6 алкил, замещенный С1-С6 алкил, С2-С6 алкенил, замещенный С2-С6 алкенил, С2-С6 алкинил или замещенный С2-С6 алкинил, С1-С6 алкоксил, замещенный С1-С6 алкоксил, ацил, замещенный ацил, С1-С6 аминоалкил или замещенный С1-С6 аминоалкил;
В некоторых вариантах реализации изобретения бициклические нуклеозиды обладают формулой:
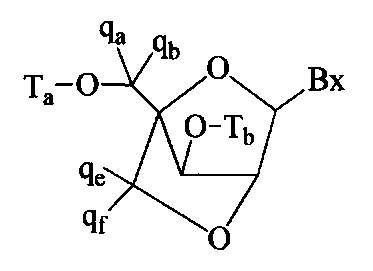
где:
Вх представляет собой фрагмент гетероциклического основания;
Та и Тb каждый независимо представляет собой Н, гидроксилзащитную группу, группу конъюгации, реакционно-способную фосфорную группу, фосфорный фрагмент или ковалентное присоединение к субстрату;
qa, qb, qе и qf каждый независимо представляет собой водород, галоген, C1-C12 алкил, замещенный C1-C12 алкил, C2-C12 алкенил, замещенный C2-C12 алкенил, C2-C12 алкинил, замещенный C2-C12 алкинил, C1-C12 алкокси, замещенный C1-C12 алкокси, OJj, SJj, SOJj, SO2Jj, NJjJk, N3, CN, C(=O)OJj, C(=O)NJjJk, C(=O)Jj, O-C(=O)NJjJk, N(H)C(=NH)NJjJk, N(H)C(=O)NJjJk или N(H)C(=S)NJjJk;
или qe и qf вместе представляют собой =C(qg)(qh);
qg и qh каждый независимо представляет собой Н, галоген, C1-C12 алкил или замещенный C1-C12 алкил.
Были описаны синтез и получение бициклических нуклеозидов с аденином, цитозином, гуанином, 5-метилцитозином, тимином и урацилом, содержащих мостик 4'-CH2-O-2', вместе с их олигомеризацией и свойствами распознавания нуклеиновых кислот (Koshkin et al., Tetrahedron, 1998, 54, 3607-3630). Синтез бициклических нуклеозидов также описан в WO 98/39352 и WO 99/14226.
Получены также аналоги различных бициклических нуклеозидов, которые содержат мостиковые группы 4' к 2', такие как 4'-CH2-O-2' и 4'-CH2-S-2' (Kumar et al., Bioorg. Med. Chem. Lett., 1998, 8, 2219-2222). Описано также получение олигодезоксирибонуклеотидных дуплексов, содержащих бициклические нуклеозиды для использования в качестве субстратов полимераз нуклеиновых кислот (Wengel et al., WO 99/14226). Кроме того, в данной области техники описан синтез 2'-aмино-BNA, нового конформационно ограниченного высокоаффинного аналога олигонуклеотидов (Singh et al., J. Org. Chem., 1998, 63, 10035-10039). В дополнение к этому, получены 2'-амино- и 2'-метиленамино-ВNA и ранее была описана термостабильность их дуплексов с комплементарными цепями РНК и ДНК.
В некоторых вариантах реализации изобретения бициклические нуклеозиды обладают формулой:

где:
Вх представляет собой фрагмент гетероциклического основания;
Та и Тb каждый независимо представляет собой Н, гидроксилзащитную группу, группу конъюгации, реакционно-способную фосфорную группу, фосфорный фрагмент или ковалентное присоединение к субстрату;
qi, qy, qk и ql каждый независимо представляет собой Н, галоген, C1-C12 алкил, замещенный C1-C12 алкил, C2-C12 алкенил, замещенный C2-C12 алкенил, C2-C12 алкинил, замещенный C2-C12 алкинил, C1-C12 алкоксил, замещенный C1-C12 алкоксил, OJj, SJj, SOJj, SO2Jj, NJjJk, N3, CN, C(=O)OJj, C(=O)NJjJk, C(=O)Jj, O-C(=O)NJjJk, N(H)C(=NH)NJjJk, N(H)C(=O)NJjJk или N(H)C(=S)NJjJk и
qi и qj или ql и qk вместе представляют собой =C(qg)(qh), причем qg и qh каждый независимо представляет собой Н, галоген, C1-C12 алкил или замещенный C1-C12 алкил.
Описан один карбоциклический бициклический нуклеозид, содержащий мостик 4'-(CH2)3-2' и мостик алкенильного аналога 4'-СН=СН-(CH2)-2' (Frier et al., Nucleic Acids Research, 1997,25(22), 4429-4443 и Albaek et al., J. Org. Chem., 2006, 71, 7731-7740). Описан также синтез и получение карбоциклических бициклических нуклеозидов вместе с их олигомеризацией и биохимическими исследованиями (Srivastava et al., J. Am. Chem. Soc. 2007, 129 (26), 8362-8379).
В некоторых вариантах реализации изобретения бициклические нуклеозиды включают, но не ограничиваются, (А) α-L-метиленокси (4'-CH2-O-2') BNA, (В) β-D-метиленокси (4'-(CH2)-O-2') BNA, (С) этиленокси (4'-(CH2)2-O-2') BNA, (D) аминоокси (4'-CH2-O-N(R)-2') BNA, (E) оксиамино (4'-CH2-N(R)-O-2') BNA, (F) метил(метиленокси) (4'-СН(CH3)-O-2') BNA (также называемый конформационно ограниченным этилом или cEt), (G) метилентио (4'-CH2-S-2') BNA, (Н) метиленамино (4'-CH2-N(R)-2') BNA, (I) метилкарбоциклической (4'-(CH2)-СН(CH3)-2') BNA, (J) пропиленкарбоциклической (4'-(CH2)3-2') BNA и (K) винил BNA, как описано ниже.

где Вх представляет собой фрагмент основания, a R независимо представляет собой Н, защитную группу, С1-С6 алкил или С1-С6 алкокси.
Используемый в настоящем документе «модифицированный тетрагидропирановый нуклеозид» или «модифицированный нуклеозид ТГП» означает нуклеозид, имеющий шестичленный тетрагидропирановый «сахар», замещенный на пентофуранозильный остаток в обычных нуклеозидах, и может называться заменителем сахара. Модифицированные нуклеозиды ТГП включают, но не ограничиваются такими, которые называются в данной области техники гекситной нуклеиновой кислотой (HNA), анитной нуклеиновой кислотой (ANA), манитной нуклеиновой кислотой (MNA) (см. Leumann, Bioorg. Med. Chem., 2002, 10, 841-854) или фтор-HNA (F-HNA), содержащими систему тетрагидропиранильного кольца, как проиллюстрировано ниже.

В определенном варианте реализации изобретения выбранные заменители сахаров обладают формулой:

где:
Вх представляет собой фрагмент гетероциклического основания;
Т3 и Т4 каждый независимо представляют собой межнуклеозидную связывающую группу, связывающую тетрагидропирановый нуклеозидный аналог с олигомерным соединением, или один из Т3 и Т4 представляет собой межнуклеозидную связывающую группу, связывающую тетрагидропирановый нуклеозидный аналог с олигомерным соединением или олигонуклеотидом, а другой из Т3 и Т4 представляет собой Н, гидроксилзащитную группу, связанную группу конъюгата или 5'- или 3'-терминальную группу;
q1, q2, q3, q4, q5, q6 и q7 каждый независимо представляет собой Н, С1-С6 алкил, замещенный С1-С6 алкил, С2-С6 алкенил, замещенный С2-С6 алкенил, С2-С6 алкинил или замещенный С2-С6 алкинил и
один из R1 и R2 представляет собой водород, а другой выбирается из галогена, замещенного или незамещенного алкокси, NJ1J2, SJ1, N3, OC(=X)J1, OC(=X)NJ1J2, NJ3C(=X)NJ1J2 и CN, где X представляет собой O, S или NJi, и каждый J1, J2 и J3 представляет собой независимо Н или С1-С6 алкил.
В некоторых вариантах реализации изобретения q1, q2, q3, q4, q5, q6 и q7 каждый представляет собой H. В некоторых вариантах реализации изобретения по меньшей мере один из q1, q2, q3, q4, q5, q6 и q7 отличается от Н. В некоторых вариантах реализации изобретения по меньшей мере один из q1, q2, q3, q4, q5, q6 и q7 представляет собой метил. В некоторых вариантах реализации изобретения предложен ТГП-нуклеозид, в котором один из R1 и R2 представляет собой F. В некоторых вариантах реализации изобретения R1 представляет собой фтор, a R2 представляет собой Н; R1 представляет собой метокси, a R2 представляет собой Н, и R1 представляет собой метоксиэтоксигруппу, a R2 представляет собой Н.
В некоторых вариантах реализации изобретения заменители сахаров содержат кольца, имеющие более 5 атомов и более одного гетероатома. Например, сообщалось о нуклеозидах, содержащих морфолиносахаридные фрагменты, и их применении в олигомерных соединениях (см. например: Braasch et al., Biochemistry, 2002, 41, 4503-4510 и патенты США 5698685; 5166315; 5185444 и 5034506). При использовании в настоящем документе, термин «морфолин» означает заменитель сахара, обладающий следующей структурой:

В некоторых вариантах реализации изобретения морфолины могут быть модифицированными, например, добавлением или изменением различных групп заместителей по сравнению с вышеупомянутой морфолиновой структурой. Такие заменители сахаров в данном документе называются «модифицированные морфолины».
Без ограничения представлены также комбинации модификаций, такие как 2'-F-5'-метилзамещенные нуклеозиды (см. международную заявку согласно РСТ WO 2008/101157, опубликованную 21/8/08, где описаны другие 5',2'-бисзамещенные нуклеозиды) и замена атома кислорода рибозильного кольца на атом S и дополнительное замещение в 2'-положении (см. опубликованную патентную заявку США US 2005-0130923, опубликованную 16 июня 2005 г.) или, альтернативно, 5'-замещение бициклической нуклеиновой кислоты (см. международную заявку согласно РСТ WO 2007/134181, опубликованную 22/11/07, в которой 4'-CH2-O-2' бициклический нуклеозид дополнительно замещен в 5'-положении 5'-метильной или 5'-винильной группой). Описан также синтез и получение карбоциклических бициклических нуклеозидов вместе с их олигомеризацией и биохимическими исследованиями (см., например, Srivastava et al., J. Am. Chem. Soc. 2007, 129 (26), 8362-8379).
В некоторых вариантах реализации изобретения антисмысловые соединения содержат один или более модифицированных циклогексенильных нуклеозидов, которые представляют собой нуклеозид, имеющий шестичленный циклогексенильный вместо пентофуранозильного остатка у встречающихся в природе нуклеозидов. Модифицированные циклогексенильные нуклеозиды включают, но не ограничиваются, описанными в данной области техники (см. к примеру находящаяся в совместном владении опубликованная заявка согласно РСТ WO 2010/036696, опубликованная 10 апреля 2010 г., Robeyns et al., J. Am. Chem. Soc, 2008, 130 (6), 1979-1984; Horvath et al., Tetrahedron Letters, 2007, 48, 3621-3623; Nauwelaerts et al., J. Am. Chem. Soc, 2007, 129 (30), 9340-9348; Gu et al., Nucleosides, Nucleotides & Nucleic Acids, 2005, 24 (5-7), 993-998; Nauwelaerts et al., Nucleic Acids Research, 2005, 33 (8), 2452-2463; Robeyns et al., Acta Crystallographica, Section F: Structural Biology and Crystallization Communications, 2005, F61 (6), 585-586; Gu et al., Tetrahedron, 2004, 60 (9), 2111-2123; Gu et al., Oligonucleotides, 2003, 13 (6), 479-489; Wang et al., J. Org. Chem., 2003, 68, 4499-4505; Verbeure et al., Nucleic Acids Research, 2001, 29 (24), 4941-4947; Wang et al., J. Org. Chem., 2001, 66, 8478-82; Wang et al., Nucleosides, Nucleotides & Nucleic Acids, 2001, 20 (4-7), 785-788; Wang et al., J. Am. Chem., 2000, 122, 8595-8602; опубликованная согласно РСТ заявка WO 06/047842 и опубликованная согласно РСТ заявка WO 01/049687; текст каждой включен в данный документ посредством ссылки в полном объеме). Некоторые модифицированные циклогексенильные нуклеозиды обладают Формулой X.

где независимо для каждого из указанного по меньшей мере одного циклогексенильного нуклеозидного аналога Формулы X:
Вх представляет собой фрагмент гетероциклического основания;
Т3 и Т4 каждый независимо представляют собой межнуклеозидную связывающую группу, связывающую циклогексенильный нуклеозидный аналог с антисмысловым соединением, или один из Т3 и Т4 представляет собой межнуклеозидную связывающую группу, связывающую тетрагидропирановый нуклеозидный аналог с антисмысловым соединением, а другой из Т3 и Т4 представляет собой Н, гидроксилзащитную группу, связанную группу конъюгата или 5'- или 3'-концевую группу; а
q1, q2, q3, q4, q5, q6, q7, q8 и q9 каждый независимо представляет собой Н, C1-C6 алкил, замещенный С1-С6 алкил, С2-C6 алкенил, замещенный С2-C6 алкенил, С2-C6 алкинил, замещенный С2-C6 алкинил или другую заместительную группу сахаров.
В данной области техники известны многие другие моноциклические, бициклические и трициклические системы колец, которые подходят в качестве заменителей сахаров, которые могут использоваться для модификации нуклеозидов для внедрения в олигомерные соединения, как предложено в данном документе (см., например, обзорную статью: Leumann, Christian J. Bioorg. & Med. Chem., 2002, 10, 841-854). Такие системы колец могут подвергаться различным дополнительным замещениям для дополнительного повышения активности.
Используемый в данном документе «2'-модифицированный сахар» означает фуранозильный сахар, модифицированный в 2'-положении. В некоторых вариантах реализации изобретения такие модификации включают заместители выбранные из: галогенидов, включающих, но не ограниченных, замещенным и незамещенным алкокси, замещенным и незамещенным тиоалкилом, замещенным и незамещенным аминоалкилом, замещенным и незамещенным алкилом, замещенным и незамещенным аллилом и замещенным и незамещенным алкинилом. В некоторых вариантах реализации изобретения 2'-модификации выбраны из заместителей, включающих, но не ограничивающихся: O[(CH2)nO]mCH3, O(CH2)nNH2, O(CH2)nCH3, O(CH2)nF, O(CH2)nONH2, OCH2C(=O)N(H)CH3, и O(CH2)nON[(CH2)nCH3]2, где n и m равны от 1 до около 10. Другие 2'-группы заместителей также могут быть выбраны из: C1-C12 алкила, замещенного алкила, алкенила, алкинила, алкарила, аралкила, О-алкарила или О-аралкила, SH, SCH3, OCN, Cl, Br, CN, F, CF3, OCF3, SOCH3, SO2CH3, ONO2, NO2, N3, NH2, гетероциклоалкила, гетероциклоалкарила, аминоалкиламино, полиалкиламино, замещенного силила, РНК-расщепляющей группы, репортерной группы, интеркалятора, группы для улучшения фармакокинетических свойств или группы для улучшения фармакодинамических свойств антисмыслового соединения, и других заместителей с подобными свойствами. В некоторых вариантах реализации изобретения модифицированные нуклеозиды содержат 2'-МОЕ боковую цепь (Baker et al., J. Biol. Chem., 1997, 272, 11944-12000). Такие 2'-MOE замещения были описаны, как улучшающие аффинность связывания по сравнению с немодифицированными нуклеозидами и другими модифицированными нуклеозидами такими, как 2'-O-метил, О-пропил и О-аминопропил. Было показано, что олигонуклеотиды, имеющие 2'-МОЕ заместитель, также являются антисмысловыми ингибиторами экспрессии генов с перспективными возможностями для применения in vivo (Martin, Helv. Chim. Acta, 1995, 78, 486-504; Altmann et al., Chimia, 1996, 50, 168-176; Altmann et al., Biochem. Soc. Trans., 1996, 24, 630-637 и Altmann et al., Nucleosides Nucleotides, 1997, 16, 917-926).
Используемый в данном документе «2'-модифицированный» или «2'-замещенный» относится к нуклеозиду, содержащему сахар, содержащий в 2'-положении заместитель, отличающийся от Н или ОН. 2'-модифицированные нуклеозиды включают, но не ограничиваются, бициклическими нуклеозидами, в которых мостиковое соединение двух атомов углерода сахаридного кольца соединяет 2'-углерод с другим углеродом сахаридного кольца; и нуклеозиды с немостиковыми 2'-заместителями, такими как аллил, амино, азидо, тио, О-аллил, О-C1-C10 алкил, -OCF3, O-(CH2)2-O-CH3, 2'-O(CH2)2SCH3, O-(CH2)2-O-N(Rm)(Rn) или O-CH2-C(=O)-N(Rm)(Rn), где каждый Rm и Rn независимо представляет собой Н или замещенный или незамещенный C1-C10 алкил. 2'-модифицированные нуклеозиды могут дополнительно содержать другие модификации, например, в других положениях сахара и/или нуклеотидного основания.
Используемый в данном документе «2'-F» относится к нуклеозиду, содержащему сахар, содержащий в 2'-положении сахаридного кольца фторогруппу.
Используемый в данном документе «2'-ОМе» или «2'-ОCH3» или «2'-O-метил» каждый относится к нуклеозиду, содержащему сахар, содержащий -OCH3 группу в 2'-положении сахаридного кольца.
Используемый в данном документе, «МОЕ» или «2'-МОЕ» или «2'-О(CH2)(CH2)ОCH3» или «2'-O-метоксиэтил» каждый относится к нуклеозиду, содержащему сахар, содержащий -O(CH2)(CH2)ОCH3 группу в 2'-положении сахаридного кольца.
Способы получения модифицированных сахаров хорошо известны специалистам в данной области техники. Некоторые типичные патенты США, которые представляют получение таких модифицированных сахаров, включают без ограничения патенты США: 4981957; 5118800; 5319080; 5359044; 5393878; 5446137; 5466786; 5514785; 5519134; 5567811; 5576427; 5591722; 5597909; 5610300; 5627053; 5639873; 5646265; 5670633; 5700920; 5792847 и 6600032 и международную заявку PCT/US2005/019219, поданную 2 июня 2005 г. и опубликованную как WO 2005/121371 22 декабря 2005 г., каждая из которых включена в данный документ посредством ссылки в полном объеме.
Используемый в данном документе «олигонуклеотид» относится к соединению, содержащему множество связанных нуклеозидов. В некоторых вариантах реализации изобретения один или более из множества нуклеозидов модифицированы. В некоторых вариантах реализации изобретения олигонуклеотид содержит один или более рибонуклеозидов (РНК) и/или дезоксирибонуклеозидов (ДНК).
В нуклеозидах, имеющих модифицированные сахаридные фрагменты, фрагменты нуклеотидных оснований (природные, модифицированные или их комбинация) обеспечивают гибридизацию с соответствующей нуклеиновой кислотой-мишенью.
В некоторых вариантах реализации изобретения антисмысловые соединения содержат один или более нуклеозидов, имеющих модифицированные сахаридные фрагменты. В некоторых вариантах реализации изобретения модифицированный сахаридный фрагмент представляет собой 2'-МОЕ. В некоторых вариантах реализации изобретения 2'-МОЕ модифицированные нуклеозиды располагаются в гэпмерном мотиве. В некоторых вариантах реализации изобретения модифицированный сахаридный фрагмент представляет собой бициклический нуклеозид, содержащий (4'-СН(CH3)-O-2') мостиковую группу. В некоторых вариантах реализации (4'-СН(CH3)-O-2') модифицированные нуклеозиды располагаются в крыльях гэпмерного мотива.
Модифицированные нуклеотидные основания
Модификации или заместители нуклеотидных оснований (или оснований) являются структурно отличимыми, но все же функционально взаимозаменяемыми с встречающимися в природе или синтетическими немодифицированными нуклеотидными основаниями. Как природные, так и модифицированные нуклеотидные основания способны принимать участие в образовании водородных связей. Такие модификации нуклеотидных оснований могут придавать антисмысловым соединениям устойчивость к нуклеазам, аффинность связывания или некоторые другие полезные биологические свойства. Модифицированные нуклеотидные основания включают синтетические и природные нуклеотидные основания, такие как, к примеру, 5-метилцитозин (5-me-С). Определенные заместители нуклеотидных оснований, включая заместители 5-метилцитозина, являются особенно пригодными для увеличения аффинности связывания антисмыслового соединения с нуклеиновой кислотой-мишенью. К примеру, показано, что заместители 5-метицитозина увеличивают стабильность дуплексов нуклеиновых кислот на 0,6-1,2°C (Sanghvi, Y.S., Crooke, S.T. and Lebleu, В., eds., Antisense Research and Applications, CRC Press, Boca Raton, 1993, pp. 276-278).
Дополнительные модифицированные нуклеотидные основания включают 5-гидроксиметилцитозин, ксантин, гипоксантин, 2-аминоаденин, 6-метил и другие алкильные производные аденина и гуанина, 2-пропил и другие алкильные производные аденина и гуанина, 2-тиоурацил, 2-тиотимин и 2-тиоцитозин, 5-галогенурацил и цитозин, 5-пропинил-(ОС≡C-CH3)-урацил и цитозин и другие алкинильные производные пиримидиновых оснований, 6-азоурацил, цитозин и тимин, 5-урацил (псевдоурацил), 4-тиоурацил, 8-галоген, 8-амино, 8-тиол, 8-тиоалкил, 8-гидроксил и другие 8-замещенные аденины и гуанины, 5-галоген, в частности, 5-бром, 5-трифторметил и другие 5-замещенные урацилы и цитозины, 7-метилгуанин и 7-метиладенин, 2-F-аденин, 2-аминоаденин, 8-азагуанин и 8-азааденин, 7-дезазагуанин и 7-дезазааденин, 2-дезазагуанин и 3-дезазааденин.
Фрагменты гетероциклических оснований также могут включать такие, в которых пуриновое или пиримидиновое основание заменено другими гетероциклами, например, 7-дезазааденином, 7-дезазагуанозином, 2-аминопиридином и 2-пиридоном. Нуклеотидные основания, которые особенно пригодны для увеличения аффинности связывания антисмысловых соединений, включают 5-замещенные пиримидины, 6-азапиримидины и N-2, N-6 и O-6 замещенные пурины, включающие 2-аминопропиладенин, 5-пропинилурацил и 5-пропинилцитозин.
В некоторых вариантах реализации изобретения антисмысловые соединения, таргетирующие нуклеиновую кислоту ANGPTL3, включают одно или более модифицированных нуклеотидных оснований. В некоторых вариантах реализации изобретения укороченные или расширенные с помощью гэпов антисмысловые соединения, таргетирующие нуклеиновую кислоту ANGPTL3, содержат одно или более модифицированных нуклеотидных оснований. В некоторых вариантах реализации изобретения модифицированное нуклеотидное основание представляет собой 5-метилцитозин. В некоторых вариантах реализации каждый цитозин представляет собой 5-метилцитозин.
Композиции и способы разработки фармацевтических композиций
Антисмысловые олигонуклеотиды могут быть смешаны с фармацевтически приемлемыми активными или инертными веществами для получения фармацевтических композиций или составов. Композиции и способы разработки фармацевтических композиций зависят от множества критериев, включающих, но не ограничивающихся, способом введения, тяжестью заболевания или дозой, подлежащей введению.
Антисмысловое соединение, таргетирующее нуклеиновую кислоту ANGPTL3, может использоваться в фармацевтических композициях сочетанием антисмыслового соединения с подходящим фармацевтически приемлемым растворителем или носителем. Фармацевтически приемлемый растворитель включает фосфатно-солевой буферный раствор (PBS). PBS представляет собой растворитель, подходящий для применения в композициях, доставляемых парентерально. Соответственно, в одном варианте реализации изобретения, применяемая в способах, описанных в данном документе, фармацевтическая композиция содержит антисмысловое соединение, таргетирующее нуклеиновую кислоту ANGPTL3, и фармацевтически приемлемый растворитель. В некоторых вариантах реализации изобретения фармацевтически приемлемый растворитель представляет собой PBS. В некоторых вариантах реализации изобретения антисмысловое соединение представляет собой антисмысловой олигонуклеотид.
Фармацевтические композиции, содержащие антисмысловые соединения, охватывают любые фармацевтически приемлемые соли, сложные эфиры или соли таких сложных эфиров, или любой другой олигонуклеотид, который, при введении животному, включая человека, способен обеспечить (прямо или косвенно) биологически активный метаболит или его остаток. Соответственно, данное описание относится, к примеру, также к фармацевтически приемлемым солям антисмысловых соединений, пролекарствам, фармацевтически приемлемым солям таких пролекарств и к другим биоэквивалентным лекарствам. Подходящие фармацевтически приемлемые соли включают, но не ограничиваются, солями натрия и калия.
Пролекарство может включать внедрение дополнительных нуклеозидов на одном или обоих концах антисмыслового соединения, которые расщепляются в организме эндогенными нуклеазами с образованием активного антисмыслового соединения.
Конъюгированные антисмысловые соединения
Антисмысловые соединения могут быть ковалентно связаны с одним или более фрагментами или конъюгатами, которые усиливают активность, клеточное распределение в клетках или поглощение клетками полученных антисмысловых олигонуклеотидов. Типичные группы конъюгации включают фрагменты холестерина и липидные фрагменты. Дополнительные группы конъюгации включают углеводы, фосфолипиды, биотин, феназин, фолат, фенантридин, антрахинон, акридин, флуоресцеины, родамины, кумарины и красители.
Антисмысловые соединения могут также быть модифицированы так, чтобы иметь одну или более стабилизирующих групп, которые обычно присоединяются к одному или обоим концам антисмысловых соединений для улучшения свойств, таких как, например, устойчивость к нуклеазам. Стабилизирующие группы включают кэп-структуры. Эти концевые модификации защищают антисмысловое соединение с терминальными нуклеиновыми кислотами от деградации экзонуклеазами и могут облегчать доставку и/или локализацию внутри клетки. Кэп может располагаться на 5'-конце (5'-кэп) или на 3'-конце (3'-кэп) или может находиться на обоих концах. Кэп-структуры хорошо известны в данной области техники и включают, к примеру, инвертированные дезоксикэпы без оснований. Дополнительно 3'- и 5'-стабилизирующие группы, которые могут быть использованы для кэпирования одного или обоих концов антисмыслового соединения для придания устойчивости к нуклеазам, включают описанные в заявке WO 03/004602 опубликованной 16 января 2003 г.
Культура клеток и применение антисмысловых соединений
Влияние антисмысловых соединений на уровень, активность или экспрессию нуклеиновых кислот ANGPTL3 может исследоваться in vitro на различных типах клеток. Типы клеток, используемые в подобных анализах, доступны у коммерческих поставщиков (например, Американская коллекция типовых культур, г. Маннасус, Вирджиния; Zen-Bio Inc., Исследовательский парк Triangle, Северная Каролина; Clonetics Corporation, г. Уолкерсвиль, Мэриленд) и клетки культивируются согласно инструкциям поставщиков с применением коммерчески доступных реагентов (например Invitrogen Life Technologies, г. Карлсбад, Калифорния). Иллюстративные типы клеток включают, но не ограничиваются ими, клетки HepG2, клетки Нер3В, клетки Huh7 (гепатоклеточная карцинома), первичные гепатоциты, клетки А549, фибробласты GM04281 и клетки LLC-MK2.
Тестирование антисмысловых олигонуклеотидов in vitro
В данном документе описаны способы обработки клеток антисмысловыми олигонуклеотидами, которые могут быть изменены соответствующим образом для обработки другими антисмысловыми соединениями.
В общем, клетки могут быть обработаны антисмысловыми олигонуклеотидами, когда в культуре клетки достигнут приблизительно 60-80% степени заполнения монослоя.
Реагент, обычно используемый для введения антисмысловых олигонуклеотидов в культивируемые клетки, включает катионный липидный трансфекционный реагент LIPOFECTIN® (Invitrogen, г. Карлсбад, Калифорния). Антисмысловые олигонуклеотиды могут быть смешаны с LIPOFECTIN® в среде OPTI-MEM® 1 (Invitrogen, г. Карлсбад, Калифорния) для достижения требуемой конечной концентрации антисмыслового олигонуклеотида и концентрации LIPOFECTIN®, которая обычно находится в диапазоне от 2 до 12 мкг/мл на 100 нМ антисмыслового олигонуклеотида.
Другой реагент, используемый для введения антисмысловых олигонуклеотидов в культивируемые клетки, включает LIPOFECTAMINE 2000® (Invitrogen, г. Карлсбад, Калифорния). Антисмысловой олигонуклеотид смешивается с LIPOFECTAMINE 2000® в среде OPTI-MEM® 1 с пониженным содержанием сыворотки (Invitrogen, г. Карлсбад, Калифорния) для достижения требуемой концентрации антисмыслового олигонуклеотида и концентрации LIPOFECTAMINE®, которая обычно находится в диапазоне от 2 до 12 мкг/мл на 100 нМ антисмыслового олигонуклеотида.
Другой реагент, используемый для введения антисмысловых олигонуклеотидов в культивируемые клетки, включает Cytofectin® (Invitrogen, г. Карлсбад, Калифорния). Антисмысловой олигонуклеотид смешивается с Cytofectin® в среде OPTI-MEM® 1 с пониженным содержанием сыворотки (Invitrogen, г. Карлсбад, Калифорния) для достижения требуемой концентрации антисмыслового олигонуклеотида и концентрации Cytofectin®, которая обычно находится в диапазоне от 2 до 12 мкг/мл на 100 нМ антисмыслового олигонуклеотида.
Другой реагент, используемый для введения антисмысловых олигонуклеотидов в культивируемые клетки, включает Oligofectamine™ (Invitrogen Life Technologies, г. Карлсбад, Калифорния). Антисмысловой олигонуклеотид смешивается с Oligofectamine™ в среде Opti-МЕМ™-1 с пониженным содержанием сыворотки (Invitrogen Life Technologies, г. Карлсбад, Калифорния) для достижения требуемой концентрации олигонуклеотида с соотношением Oligofectamine™ к олигонуклеотиду приблизительно от 0,2 до 0,8 мкл на 100 нМ.
Другой реагент, используемый для введения антисмысловых олигонуклеотидов в культивируемые клетки, включает FuGENE 6 (Roche Diagnostics Corp., г. Индианаполис, Индиана). Антисмысловое олигомерное соединение смешивали с FuGENE 6 в 1 мл бессывороточной среды RPMI для достижения требуемой концентрации олигонуклеотида с FuGENE 6 с соотношением к олигонуклеотидному соединению от 1 до 4 мкл FuGENE 6 на 100 нМ.
Еще одна методика, используемая для введения антисмысловых олигонуклеотидов в культивируемые клетки, включает электропорацию (Sambrook and Russell, Molecular Cloning: A Laboratory Manual, 3rd Ed., 2001).
Клетки обрабатывают антисмысловыми олигонуклеотидами стандартными способами. Клетки обычно выращивают 16-24 часов после обработки антисмысловыми олигонуклеотидами, после чего уровни РНК или белка нуклеиновых кислот-мишеней измеряются методами, известными в данной области техники и описанными в данном документе. В общем, когда обработки проводятся в нескольких повторениях, данные представляются как среднее значение результатов повторных обработок.
Концентрация используемого антисмыслового олигонуклеотида варьирует в зависимости от линии клеток. Способы определения оптимальной концентрации антисмыслового олигонуклеотида для конкретной линии клеток хорошо известны в данной области техники. Антисмысловые олигонуклеотиды обычно используются в концентрациях от 1 нМ до 300 нМ при трансфецировании с использованием LIPOFECTAMINE2000®, Lipofectin или Cytofectin. Антисмысловые олигонуклеотиды используются в более высоких концентрациях в диапазоне от 625 до 20000 Нм при трансфецировании с использованием электропорации.
Выделение РНК
Анализ РНК может выполняться по общей клеточной РНК или поли(А)+ мРНК. Способы выделения РНК хорошо известны в данной области техники (Sambrook and Russell, Molecular Cloning: A Laboratory Manual, 3rd Ed., 2001). РНК подготавливается с использованием способов, хорошо известных в данной области техники, например, с использованием реагента TRTZOL® (Invitrogen, г. Карлсбад, Калифорния) в соответствии с рекомендованными производителем протоколами.
Анализ ингибирования уровней или экспрессии мишени
Ингибирование уровней или экспрессии нуклеиновой кислоты ANGPTL3 может быть проанализировано различными способами, известными в данной области техники (Sambrook and Russell, Molecular Cloning: A Laboratory Manual, 3rd Ed., 2001). Например, уровни нуклеиновой кислоты-мишени можно количественно измерить, например, анализом нозерн-блот, конкурентной полимеразной цепной реакцией (ПНР) или количественной ПЦР в режиме реального времени. Анализ РНК может выполняться по общей клеточной РНК или поли(А)+ мРНК. Способы выделения РНК хорошо известны в данной области техники. Анализ нозерн-блот также является общепринятым в данной области техники. Количественная ПНР в режиме реального времени может удобно выполняться с использованием имеющейся в продаже системы детекции последовательностей ABI PRISM® 7600, 7700 или 7900, поставляемой PE-Applied Biosystems, г. Фостер-Сити, Калифорния, и используемых в соответствии с инструкциями производителя.
Количественный анализ ПЦР в режиме реального времени уровней РНК-мишени
Количественное определение уровней РНК-мишени может быть проведено путем количественной ПЦР в режиме реального времени с использованием системы детекции последовательностей ABI PRISM® 7600, 7700 или 7900 (PE-Applied Biosystems, г. Фостер-Сити, Калифорния) в соответствии с инструкциями производителя. Способы проведения количественной ПЦР в режиме реального времени хорошо известны в данной области техники.
Перед провевдением ПЦР в режиме реального времени, выделенную РНК подвергают реакции с обратной транскриптазой (ОТ), которая создает комплементарную ДНК (кДНК), которая затем используется в качестве субстрата для ПЦР-амплификации в режиме реального времени. Реакции ОТ и ПЦР в режиме реального времени выполняются последовательно в одной и тот же лунке для образца. Реагенты для ОТ и ПЦР в режиме реального времени получают в компании Invitrogen (г. Карлсбад, Калифорния). Реакции ОТ и ПЦР в режиме реального времени осуществляются способами хорошо известными специалистам в данной области техники.
Количества гена(или РНК)-мишени, полученные с помощью ПЦР в режиме реального времени могут быть нормализованы с использованием или уровня экспрессии гена, экспрессия которого постоянна, такого как циклофилин A или GADPH, или количественным определением общей РНК с использованием реагента RIBOGREEN® (Life Technologies™ Inc., г. Карлсбад, Калифорния). Экспрессия циклофилина A или GADPH может количественно определяться ПЦР в режиме реального времени, проведением одновременно с анализом мишени, мультиплексированием или анализом по отдельности. Общая РНК может количественно определяться с помощью реагента для количественного определения РНК RIBOGREEN®. Способы количественного определения РНК с использованием RIBOGREEN® изложены в статье Jones, L.J., et al., (Analytical Biochemistry, 1998, 265, 368-374). Для измерения флуоресценции RIBOGREEN® может использоваться прибор CYTOFLUOR® 4000 (РЕ Applied Biosystems).
Способы конструирования зондов для ПЦР в режиме реального времени и праймеров хорошо известны в данной области техники, и могут включать применение программного обеспечения, такого как программное обеспечение PRIMER EXPRESS® (Applied Biosystems, г. Фостер-Сити, Калифорния). Зонды и праймеры, использованные в ПЦР в режиме реального времени, были сконструированы для гибридизации со специфическими для ANGPTL3 последовательностями и описаны ниже в Примерах. Зонды для ПЦР, специфические для мишени, могут содержать FAM, ковалентно связанный с 5'-концом, и TAMRA или MGB, ковалентно связанный с 3'-концом, где FAM представляет собой флуоресцентный краситель, a TAMRA или MGB представляет собой гаситель красителя.
Анализ уровней содержания белка
Антисмысловое ингибирование нуклеиновых кислот ANGPTL3 может оцениваться измерением уровней содержания белка ANGPTL3. Уровни белка ANGPTL3 могут оцениваться или количественно определяться различными способами, хорошо известными в данной области техники, такими как иммунопреципитация, анализ вестерн-блот (иммуноблоттинг), иммуноферментный анализ (ИФА), количественные анализы белков, анализы активности белков (например, анализы активности каспазы), иммуногистохимические анализы, иммуноцитохимические анализы или флуоресцентно-активированная сортировка клеток (FACS) (Sambrook and Russell, Molecular Cloning: A Laboratory Manual, 3rd Ed., 2001). Нацеленные на мишень антитела могут быть идентифицированы и получены из различных источников, таких как каталог антител MSRS (Aerie Corporation, г. Бирмингем, Мичиган), или могут быть получены посредством методов создания обычно применяемых моноклональных или поликлональных антител, хорошо известных в данной области техники.
Испытание антисмысловых соединений in vivo
Антисмысловые соединения, например, антисмысловые олигонуклеотиды, испытывали на животных для оценки их способности ингибировать экспрессию ANGPTL3 и производить фенотипические изменения. Испытание может проводиться на нормальных животных, или в экспериментальных моделях заболеваний. Для введения животным антисмысловые олигонуклеотиды готовят в составах с фармацевтически приемлемым растворителем, таким как фосфатно-солевой буферный раствор. Введение включает парентеральные пути введения. После периода лечения с помощью антисмысловых олигонуклеотидов, РНК выделяют из ткани и измеряют изменения экспрессии нуклеиновой кислоты ANGPTL3. Измеряют также изменения уровней белка ANGPTL3.
Некоторые показания
В некоторых вариантах реализации изобретения в данном документе предложены способы лечения индивида, включающие введение одной или более фармацевтических композиций, описанных в данном документе. В некоторых вариантах реализации изобретения индивид имеет метаболическое заболевание и/или сердечно-сосудистое заболевание. В некоторых вариантах реализации изобретения индивид имеет гиперхолестеринемию (например, семейную гомозиготную гиперхолестеринемию (ГоСХ), семейную гетерозиготную гиперхолестеринемию (ГеСХ), дислипидемию, гипертриглицеридемию (например, гетерозиготную недостаточность ЛПЛ, гомозиготную недостаточность ЛПЛ), ишемическую болезнь сердца (ИБС), семейный хиломикронемийный синдром (СХС), гиперлипопротеинемию IV типа), липодистрофию, гиперлипидемию (например, комбинированную гиперлипидемию, семейную комбинированную гиперлипидемию (СКГЛ)), метаболический синдром, неалкогольное жировое заболевание печени (НАЖЗП), неалкогольный стеатогепатит (НАСГ), диабет (например, диабет 2 типа), утолщение стенок сосудов, высокое артериальное давление (например, легочная артериальная гипертензия), склероз (например, атеросклероз, системный склероз, прогрессирующий склероз кожи и пролиферативная облитерирующая васкулопатия, такая как пальцевые язвы и вовлечение легочных сосудов в опухоль).
В некоторых вариантах реализации изобретения соединения, таргетирующие ANGPTL3, описанные в данном документе, модулируют липидный и/или энергетический метаболизм в организме животного. В некоторых вариантах реализации изобретения соединения, таргетирующие ANGPTL3, описанные в данном документе, модулируют проявления физиологических маркеров или фенотипов гиперхолестеринемии, дислипидемии, гипертриглицеридемии, метаболического синдрома, НАЖЗП, НАСГ и/или диабета. К примеру, введение соединений животным может модулировать один или более из уровней ЛПОНП, неэтерифицированных жирных кислот (НЭЖК), ЛПНП, холестерина, триглицеридов, глюкозы, инсулина или ANGPTL3. В некоторых вариантах реализации изобретения модуляция физиологических маркеров или фенотипов может ассоциироваться с ингибированием ANGPTL3 данными соединениями.
В некоторых вариантах реализации изобретения соединения, таргетирующие ANGPTL3, описанные описанные в данном документе, снижают или предупреждают одно или более из: накопления ТГ в печени (например, стеатоз печени), атеросклероза, утолщения стенок сосудов (например, утолщение комплекса интима-медиа артерий), гиперхолестеринемии (например, семейной гомозиготной гиперхолестеринемии (ГоСХ), семейной гетерозиготной гиперхолестеринемии (ГеСХ)), дислипидемии, гипертриглицеридемии (например, гетерозиготной недостаточности ЛПЛ, гомозиготной недостаточности ЛПЛ), семейного хиломикронемийного синдрома (СХС), гиперлипопротеинемии IV типа), липодистрофии, гиперлипидемии (например, комбинированной гиперлипидемии, семейной комбинированной гиперлипидемии (СКГЛ)), метаболического синдрома, неалкогольного жирового заболевания печени (НАЖЗП), неалкогольного стеатогепатита (НАСГ), диабета (например, диабета 2 типа), высокого артериального давления или склероза. В некоторых вариантах реализации изобретения соединения, таргетирующие ANGPTL3, описанные в данном документе, улучшают чувствительность к инсулину.
В некоторых вариантах реализации изобретения введение антисмыслового соединения, таргетирующего нуклеиновую кислоту ANGPTL3, как описано в данном документе, приводит к снижению экспрессии ANGPTL3 на около по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 99%, или диапазон, определенный любыми двумя из этих значений.
В некоторых вариантах реализации изобретения введение антисмыслового соединения, таргетирующего нуклеиновую кислоту ANGPTL3, как описано в данном документе, приводит к снижению уровня содержания одного или более из: триглицеридов, холестерина ЛПНП, холестерина ЛП-не-ВП, холестерина ЛПОНП, общего холестерина, АроВ и АроС-III на около по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 99%, или диапазон, определенный любыми двумя из этих значений.
В некоторых вариантах реализации изобретения фармацевтические композиции, содержащие антисмысловое соединение, таргетирующее ANGPTL3, используются для получения лекарственного средства для лечения пациента, страдающего или восприимчивого к метаболическому заболеванию или сердечно-сосудистому заболеванию. В некоторых вариантах реализации изобретения фармацевтические композиции, содержащие антисмысловое соединение, таргетирующее ANGPTL3, используются при получении лекарственного средства для лечения пациента, страдающего или восприимчивого к одному или более из заболеваний: гиперхолестеринемии (например, семейной гомозиготной гиперхолестеринемии (ГоСХ), семейной гетерозиготной гиперхолестеринемии (ГеСХ)), дислипидемии, гипертриглицеридемии (например, семейного хиломикронемийного синдрома (СХС), гиперлипопротеинемии IV типа), липодистрофии, гиперлипидемии (например, комбинированной гиперлипидемии, семейной комбинированной гиперлипидемии (СКГЛ)), метаболического синдрома, неалкогольного жирового заболевания печени (НАЖЗП), неалкогольного стеатогепатита (НАСГ), диабета (например, диабета 2 типа), утолщения стенок сосудов, высокого артериального давления или склероза.
Введение
В некоторых вариантах реализации изобретения соединения и композиции, описанные в данном документе, вводятся парентерально.
В некоторых вариантах реализации изобретения парентеральное введение проводится инфузией. Инфузия может быть постоянной, или непрерывной, или кратковременной, или периодической. В некоторых вариантах реализации изобретения вводимые инфузией фармацевтические агенты доставляются с помощью насоса.
В некоторых вариантах реализации изобретения парентеральное введение проводится инъекцией. Инъекция может доставляться шприцом или насосом. В некоторых вариантах реализации изобретения инъекция представляет собой болюсную инъекцию. В некоторых вариантах реализации изобретения инъекция вводиться непосредственно в ткань или орган. В некоторых вариантах реализации изобретения инъекция является подкожной.
Некоторые виды комбинированной терапии
В некоторых вариантах реализации изобретения первый агент, содержащий модифицированный олигонуклеотид, описанный в данном документе, вводится совместно с одним или более вторичных агентов. В некоторых вариантах реализации изобретения такие вторые агенты предназначены для лечения того же заболевания, нарушения или патологического состояния, что и первый агент, описанный в данном документе. В некоторых вариантах реализации изобретения такие вторые агенты предназначены для лечения другого заболевания, нарушения или патологического состояния, чем первый агент, описанный в данном документе. В некоторых вариантах реализации изобретения такие вторые агенты предназначены для лечения нежелательного побочного эффекта одной или более фармацевтических композиций, описанных в данном документе. В некоторых вариантах реализации изобретения вторые агенты вводятся совместно с первым агентом для лечения нежелательного побочного эффекта первого агента. В некоторых вариантах реализации изобретения вторые агенты вводятся совместно с первым агентом для создания комбинированного эффекта. В некоторых вариантах реализации изобретения вторые агенты вводятся совместно с первым агентом для создания синергического эффекта.
В некоторых вариантах реализации изобретения первый агент и один или более вторых агентов вводятся в одно и то же время. В некоторых вариантах реализации изобретения первый агент и один или более вторых агентов вводятся в разные моменты времени. В некоторых вариантах реализации изобретения первый агент и один или более вторых агентов готовят вместе в одной фармацевтической лекарственной форме. В некоторых вариантах реализации изобретения первый агент и один или более вторых агентов готовят по отдельности.
В некоторых вариантах реализации изобретения вторые агенты включают, но не ограничиваются, понижающим уровень глюкозы агентом или понижающим уровень липидов агентом. Понижающий уровень глюкозы агент может включать, но не ограничиваться, терапевтическим изменением образа жизни, агонистом PPAR, ингибитором дипептидилпептидазы (IV), аналогом GLP-1, инсулином или аналогом инсулина, стимулятором секреции инсулина, ингибитором SGLT2, аналогом амилина человека, бигуанидом, ингибитором альфа-глюкозидазы или их комбинацией. Понижающий уровень глюкозы агент может включать, но не ограничиваться, метформином, сульфонилмочевиной, розиглитазоном, меглитинидом, тиазолидиндионом, ингибитором альфа-глюкозидазы или их комбинацией. Сульфонилмочевина может быть ацетогексамидом, хлорпропамидом, толбутамидом, толазамидом, глимепиридом, глипизидом, глибуридом или гликлазидом. Меглитинид может быть натеглинидом или репаглинидом. Тиазолидиндион может быть пиоглитазоном или розиглитазоном. Альфа-глюкозидаза может быть акарбозой или миглитолом. В некоторых вариантах реализации изобретения понижающая уровень липидов терапия может включать, но не ограничиваться, терапевтическим изменением образа жизни, ниацином, ингибитором ГМГ-КоА-редуктазы, ингибитором абсорбции холестерина, ингибитором МТР (например, малой молекулой, полипептидом, антителом или антисмысловым соединением, таргетирующим МТР), фибратом, ингибитором PCSK9 (например, РСSK9-антителами, полипептидами, малыми молекулами, соединениями нуклеиновых кислот, таргетирующими PCSK9), ингибитором СЕТР (например, малыми молекулами, такими как торцетрапиб и анацетрапиб, полипептидами или соединениями нуклеиновых кислот, таргетирующими СЕТР), ингибитором ароС-III (например, малой молекулой, полипептидом, антителом или антисмысловым соединением, таргетирующим ароС-III), ингибитором АроВ (например, малой молекулой, полипептидом, антителом или антисмысловым соединением, таргетирующим АроВ), богатыми омега-3 жирными кислотами лечебными маслами, омега-3 жирными кислотами или их любой комбинацией. Ингибитор ГМГ-КоА-редуктазы может быть аторвастатином, розувастатином, флувастатином, ловастатином, правастатином, симвастатином и подобным средством. Ингибитор абсорбции холестерина может быть эзетимибом. Фибрат может быть фенофибратом, безафибратом, ципрофибратом, клофибратом, гемфиброзилом и тому подобным. Лечебное масло, богатое омега-3 жирными кислотами, может быть маслом криля, рыбьим жиром (например, VascepaR), льняным маслом и тому подобным. Омега-3 жирные кислоты могут быть АЛК, ДГК, ЭПК и тому подобными.
Некоторые соединения
Антисмысловые олигонуклеотиды, таргетирующие ANGPTL3 человека, были описаны в предшествующей публикации (см. патентную публикацию согласно РСТ №WO 2011/085271, опубликованную 14 июля 2011 г., включенную в данный документ посредством ссылки в полном объеме). Несколько олигонуклеотидов (233676, 233690, 233710, 233717, 233721, 233722,337459, 337460, 337474, 337477, 337478, 337479, 337481, 337484, 337487, 337488, 337490, 337491, 337492, 337497, 337498, 337503, 337505, 337506, 337508, 337513, 337514, 337516, 337520, 337521, 337525, 337526 и 337528), описанных в данном документе, включают десять наиболее активных антисмысловых соединений in vitro, использованных в качестве эталонов для сравнения для всего отбора новых антисмысловых соединений, описанных ниже в данном документе, при скринингах in vitro. Из наиболее активных соединений, описанных в WO 2011/085271, обнаружено, что ISIS 233722 по способности ингибировать ANGPTL3, было в сильно вариабельным. Соответственно, несмотря на первоначальное использование в некоторых исследованиях in vitro, 233722 не был выбран в качестве эталона для сравнения в дальнейших исследованиях. Из ранее идентифицированных эталонных соединений активных in vitro, пять (233710, 233717, 337477, 337478, 337479 и 337487) выбраны для испытания in vivo, как описано ниже в данном документе, на трансгенных мышах huANGPTL3 для оценки наиболее активных соединений в отношении снижения экспрессии транскрипта мРНК и белка человека (Пример 11). Антисмысловой олигонуклеотид с наибольшей первоначальной активностью in vivo в отношении снижения уровней ANGPTL3 (233710) применяли как эталон для сравнения при оценке in vivo новых антисмысловых соединений, описанных ниже в данном документе.
В некоторых вариантах реализации изобретения антисмысловые соединения, описанные в данном документе, имеют преимущество по одному или более улучшенных свойств относительно антисмысловых соединений, описанных в WO 2011/085271. Эти улучшенные свойства продемонстрированы в примерах данного документа и для простоты поиска ниже представлено неисчерпывающее резюме примеров.
При первом скрининге, описанном в данном документе, около 3000 новосконструированных 5-10-5 МОЕ гэпмерных антисмысловых соединений, таргетирующих ANGPTL3 человека, испытывали на клетках Нер3В на влияние на мРНК ANGPTL3 человека in vitro (Пример 1). Уровни ингибирования мРНК новых антисмысловых соединений оценивали с некоторыми ранее сконструированными антисмысловыми соединениями (233717, 337484, 337487, 337492 и 337516), использованными как эталоны для сравнения в исследованиях по отбору. Из около 3000 новосконструированных антисмысловых соединений из этого первого скрининга, выбрали около 85 антисмысловых соединений для исследований на дозозависимое ингибирование in vitro для определения полумаксимальной ингибирующей концентрации (IC50) (Примеры 2-3). Из около 85 новых антисмысловых соединений, испытанных на полумаксимальную ингибирующую концентрацию (IC50), около 38 антисмысловых соединения, которые продемонстрировали сильное дозозависимое снижение уровня ANGPTL3, отобрали на испытание активности и переносимости (АЛТ и ACT) in vivo на мышах (Примеры 11-12) с антисмысловым соединением 233710, использованным как эталон для сравнения.
При первом скрининге, описанном в данном документе, около 2000 новосконструированных антисмысловых соединений, таргетирующих ANGPTL3 человека, с гэпмерным мотивом МОЕ или смешанным мотивом (дезокси, 5-10-5 МОЕ и сЕТ гэпмеры) также испытывали на клетках НерЗВ на влияние на мРНК ANGPTL3 человека in vitro (Примеры 4-6). Уровни ингибирования новых антисмысловых соединений оценивали с некоторыми ранее сконструированными антисмысловыми соединениями (233717, 337487, 337513, 337514 и 337516), использованными как эталоны для сравнения в исследованиях по отбору. Из около 2000 новосконструированных антисмысловых соединений из этого второго скрининга, выбрали около 147 антисмысловых соединений для исследований на дозозависимое ингибирование in vitro для определения полумаксимальной ингибирующей концентрации (IC50) (Примеры 2-3). Из около 147 новых антисмысловых соединений, из испытанных на полумаксимальную ингибирующую концентрацию (IC50), около 73 антисмысловых соединения, которые продемонстрировали сильное дозозависимое снижение уровня ANGPTL3, отобрали на испытание активности (например, АЛТ и ACT) и переносимости in vivo на мышах (Примеры 11-12) с антисмысловым соединением 233710, использованным как эталон для сравнения.
Из около 111 антисмысловых соединений из скринингов один и два, которые испытывали на активность и переносимость на мышах, 24 отобрали для более расширенного испытания на переносимость у мышей оцениванием метаболических маркеров печени, таких как аланинтрансаминаза (АЛТ), аспартаттрансаминаза (ACT), альбумин и билирубин, а также метаболических маркеров почек АМК и креатинина и массы органов (Пример 12).
Параллельно с исследованиями на мышах in vivo отбирали семнадцать антисмысловых соединений для испытания на вязкость (Пример 13). В общем, антисмысловые соединения, которые не были оптимальными по вязкости, не принимались для дальнейших исследований.
На основании результатов исследования на переносимость у мышей двадцать антисмысловых соединений отобрали для испытания на переносимость in vivo на крысах (Пример 14). Для определения переносимости соединения in vivo на крысах измеряли активность метаболических маркеров печени, таких как АЛТ, ACT, альбумина и билирубина, массу тела и органов, а также активность метаболических маркеров почек, таких как АМК, креатинина и соотношения общее содержание белка/креатинина.
Двадцать антисмысловых соединений, испытанных на крысах, также оценивали на перекрестную реактивность с последовательностью гена ANGPTL3 макака-резус (Пример 15). Хотя антисмысловые соединения в этом исследовании испытывали на яванских макаках, последовательность ANGPTL3 яванского макака не была доступной для сравнения с последовательностями полноразмерных соединений, поэтому последовательности антисмысловых соединений сравнили с последовательностями близкородственного макака-резус. Обнаружено, что последовательности восьми антисмысловых соединений имеют 0-2 мисматча с последовательностью гена ANGPTL3 макака-резус и они были дополнительно исследованы на яванских макаках (Пример 15). Эти восемь антисмысловых соединений (ISIS 563580, ISIS 560400, ISIS 567320, ISIS 567321, ISIS 544199, ISIS 567233, ISIS 561011 и ISIS 559277) испытывали на ингибирование экспрессии мРНК и белка ANGPTL3, а также на переносимость на макаках. В исследованиях на переносимость измеряли массу тела, метаболические маркеры печени (АЛТ, ACT и билирубин), метаболические маркеры почек (АМК и креатинин), гематологические параметры (количество клеток крови, гемоглобин и гематокрит) и провоспалительных маркеров (CRP и С3). В дополнение к этому, измеряли концентрацию полноразмерного олигонуклеотида, присутствовавшего в печени и почках, и рассчитывали соотношение концентрации полноразмерного олигонуклеотида в почках/печени.
Соответственно, в данном документе предложены антисмысловые соединения с одним или более улучшенными характеристиками, например, улучшенными относительно антисмысловых соединений, описанных в WO 2011/085271. В некоторых вариантах реализации изобретения в данном документе предложены антисмысловые соединения, содержащие модифицированный олигонуклеотид, описанный в данном документе, таргетирующий или специфически гибридизирующийся с участком нуклеотидов любой из SEQ ID NO: 1-2.
В некоторых вариантах реализации изобретения некоторые антисмысловые соединения, описанные в данном документе, эффективны благодаря активности для ингибирования экспрессии ANGPTL3. В некоторых вариантах реализации изобретения соединения или композиции ингибируют ANGPTL3 на по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95%.
В некоторых вариантах реализации изобретения некоторые антисмысловые соединения, описанные в данном документе, эффективны благодаря IC50 in vitro менее 20 мкМ, менее 10 мкМ, менее 8 мкМ, менее 5 мкМ, менее 2 мкМ, менее 1 мкМ, менее 0,9 мкм, менее 0,8 мкм, менее 0,7 мкм, менее 0,6 мкм или менее 0,5 мкМ при испытании на клетках человека, к примеру, на линии клеток Нер3В (как описано в Примерах 2-3 и 7-10). В некоторых вариантах реализации изобретения предпочтительные антисмысловые соединения, имеющие IC50<1,0 мкМ, включают SEQ ID NO: 15, 20, 24, 34, 35, 36, 37, 42, 43, 44,47, 50, 51, 57, 58, 60, 77, 79, 82, 87, 88, 90, 91, 93, 94, 100, 101, 104, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132,133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 169, 170, 177, 188, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231 и 232. В некоторых вариантах реализации изобретения предпочтительные антисмысловые соединения, имеющие IC50 <0,9 мкМ, включают SEQ ID NO: 15, 20, 35, 36, 42, 43, 44, 50, 57, 60, 77, 79, 87, 88, 90, 91, 93, 94, 101, 104, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 177, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231 и 232. В некоторых вариантах реализации изобретения предпочтительные антисмысловые соединения, имеющие IC50 <0,8 мкМ, включают SEQ ID NO: 15, 20, 35, 36, 42, 43, 44, 50, 57, 60, 77, 79, 87, 88, 90, 91, 93, 94, 101, 104, 110, 111, 112, 113, 114, 115, 116, 117, 118, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138,139, 140, 141, 142, 143, 144,145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 177, 209, 210, 211, 212, 213, 214, 215, 217, 218, 219, 220, 221, 222, 223, 224, 225, 228, 229, 230, 231 и 232. В некоторых вариантах реализации изобретения предпочтительные антисмысловые соединения, имеющие IC50<0,7 мкМ, включают SEQ ID NO: 15, 20, 36, 42, 43, 57, 60, 114, 117, 127, 131, 177, 209, 210, 211, 212, 213, 214, 215, 217, 218, 219, 220, 221, 222, 223, 224, 225, 228, 229, 230, 231 и 232. В некоторых вариантах реализации изобретения предпочтительные антисмысловые соединения, имеющие IC50<0,6 мкМ, включают SEQ ID NO: 15, 20, 36, 42, 43, 57, 60, 114, 117, 127, 131, 177, 209, 210, 211, 212, 213, 215, 217, 218, 219,220, 221, 222, 224, 225, 228, 229, 230, 231 и 232. В некоторых вариантах реализации изобретения предпочтительные антисмысловые соединения, имеющие IC50 <0,5 мкМ, включают SEQ ID N0: 43, 114, 117, 127, 131, 177, 209, 210, 211, 212, 215, 217, 218, 219, 220, 221, 222, 229, 230 и 232.
В некоторых вариантах реализации изобретения некоторые антисмысловые соединения, описанные в данном документе, эффективны благодаря вязкости менее 40 сП, менее 35 сП, менее 30 сП, менее 25 сП, менее 20 сП, менее 15 сП или менее 10 сП при измерении проведением анализа (как описано в Примере 13). Олигонуклеотиды, имеющие вязкостью более 40 сП, будут обладать неоптимальной вязкостью. В некоторых вариантах реализации изобретения предпочтительные антисмысловые соединения, имеющие вязкость <20 сП, включают SEQ ID NO: 16, 18, 20, 34, 35, 36, 38, 49, 77, 90, 93 и 94. В некоторых вариантах реализации изобретения предпочтительные антисмысловые соединения, имеющие вязкость <15 сП, включают SEQ ID NO: 16, 18, 20, 34, 35, 38, 49, 90, 93 и 94. В некоторых вариантах реализации изобретения предпочтительные антисмысловые соединения, имеющие вязкость<10 сП, включают SEQ ID NO: 18, 34, 35, 49, 90, 93 и 94.
В некоторых вариантах реализации изобретения некоторые антисмысловые соединения, описанные в данном документе, являются высокопереносимыми, как продемонстрировано измерениями переносимости in vivo, описанными в примерах. В некоторых вариантах реализации изобретения некоторые антисмысловые соединения, описанные в данном документе, являются высокопереносимыми, как продемонстрировано не более 3-кратным, 2-кратным или 1,5-кратным увеличением значения АЛТ и/или ACT по сравнению с животными, которым вводили солевой раствор.
В некоторых вариантах реализации изобретения некоторые антисмысловые соединения, описанные в данном документе, эффективны благодаря обладанию одним или более из параметров: активность ингибирования более 50%, IC50 in vitro менее 1 мкМ, вязкость менее 20 сП и не более, чем 3-кратное увеличение уровней АЛТ и/или ACT.
В некоторых вариантах реализации изобретения предпочтительным является соединение ISIS 563580 (SEQ ID NO: 77). Установлено, что это соединение является сильным ингибитором у ANGPTL3-трансгенных мышей и наиболее переносимым антисмысловым соединением. Оно обладало приемлемой вязкостью около 16,83 сП и значением IC50 in vitro <0,8 мкМ. У мышей оно вызвало не более, чем 3-кратное увеличение уровней АЛТ и/или ACT по сравнению с животными, которым вводили солевой раствор. У макак, оно также оказалось среди наиболее переносимых и активных соединений по ингибированию ANGPTL3 и обладало наилучшим соотношением концентраций полноразмерного олигонуклеотида.
В некоторых вариантах реализации изобретения предпочтительным является соединение ISIS 544199 (SEQ ID NO: 20). Установлено, что это соединение является активным и переносимым антисмысловым соединением. Оно обладало приемлемой вязкостью около 1,7 сП и значением IC50 in vitro <0,5 мкМ. У мышей оно вызвало не более, чем 3-кратное увеличение уровней АЛТ и/или ACT по сравнению с животными, которым вводили солевой раствор. У макак, оно также оказалось среди наиболее активных соединений по ингибированию ANGPTL3 и обладало хорошим соотношением концентраций полноразмерного олигонуклеотида.
В некоторых вариантах реализации изобретения предпочтительным является соединение ISIS 559277 (SEQ ID NO: 110). Установлено, что это соединение является активным и переносимым антисмысловым соединением. Оно обладало значением IC50 in vitro <0,8 мкМ. У мышей оно вызвало не более, чем 3-кратное увеличение уровней АЛТ и/или ACT по сравнению с животными, которым вводили солевой раствор. У макак, оно также оказалось среди наиболее активных соединений по ингибированию ANGPTL3 и обладало хорошим соотношением концентраций полноразмерного олигонуклеотида.
ПРИМЕРЫ
Неограничивающее описание и включение посредством ссылки
Несмотря на то, что некоторые соединения, композиции и способы, описанные в данном документе, были подробно описаны в соответствии с некоторыми вариантами реализации изобретения, следующие примеры служат лишь для иллюстрации соединений, описанных в настоящем документе, и их не следует считать их ограничением. Каждая из ссылок, упоминаемых в настоящей заявке, включена в данный документ посредством ссылки в полном объеме.
Пример 1. Антисмысловое ингибирование МОЕ-гэпмерами ангиопоэтин-подобного белка 3 человека в клетках Нер3В
Были сконструированы антисмысловые олигонуклеотиды, таргетирующие нуклеиновую кислоту ангиопоэтин-подобного белка 3, и испытано их воздействие на мРНК ANGPTL3 in vitro. Антисмысловые олигонуклеотиды испытывали в серии экспериментов, которые имели сходные условия культивирования. Результаты для каждого эксперимента представлены в отдельных таблицах показанных ниже. Культивированные клетки Нер3В с плотностью 20000 клеток на лунку трансфецировали 4500 нМ антисмыслового олигонуклеотида с использованием электропорации. После периода обработки приблизительно 24 часа из клеток выделяли РНК и уровни мРНК ANGPTL3 измеряли методом количественной ПЦР в режиме реального времени. Для измерения уровней мРНК использовали набор праймеров-зондов человека RTS3492_MGB (прямая последовательность CCGTGGAAGACCAATATAAACAATT, обозначенная в данном документе как SEQ ID NO: 4; AGTCCTTCTGAGCTGATTTTCTATTTCT; обратная последовательность, обозначенная в данном документе как SEQ ID NO: 5; последовательность зонда AACCAACAGCATAGTCAAATA, обозначенная в данном документе как SEQ ID NO: 6). Уровни мРНК ANGPTL3 корректировали в соответствии с содержанием общей РНК, измеренным методом RIBOGREEN®. Результаты представлены в виде процента ингибирования ANGPTL3 относительно необработанных контрольных клеток.
Новосконструированные химерные антисмысловые олигонуклеотиды в таблицах ниже были сконструированы в виде 5-10-5 МОЕ-гэпмеров. 5-10-5 МОЕ-гэпмеры состоят в длину из 20 нуклеозидов, причем центральный гэп-сегмент состоит из десяти 2'-дезоксинуклеозидов и фланкирован сегментами крыльев в 5'-направлении и 3'-направлении, содержащими по пять нуклеозидов каждый. Каждый нуклеозид в сегменте 5'-крыла и каждый нуклеозид в сегменте 3'-крыла имеет 2'-МОЕ-модификацию. Межнуклеозидные связи по всей длине каждого гэпмера представляют собой тиофосфатные (P=S) связи. Все остатки цитозина по всей длине каждого гэпмера представляют собой 5-метилцитозины. «Сайт инициации» обозначает наиболее удаленный 5'-нуклеозид, на который таргетирован гэпмер, в последовательности гена человека. «Сайт терминации» обозначает наиболее удаленный 3'-нуклеозид, на который таргетирован гэпмер, в последовательности гена человека. Каждый гэпмер, перечисленный в таблицах ниже, таргетирован или на мРНК ANGPTL3 человека, обозначенную в данном документе как SEQ ID NO: 1 (инвентаризационный № GENBANK NM_014495.2), или на геномную последовательность ANGPTL3 человека, обозначенную в данном описании как SEQ ID NO: 2 (инвентаризационный № GENBANK NT_032977.9, усеченный от нуклеотида 33032001 до 33046000). «n/а» обозначает, что антисмысловой олигонуклеотид не таргетирует конкретную последовательность гена со 100% комплементарностью.





























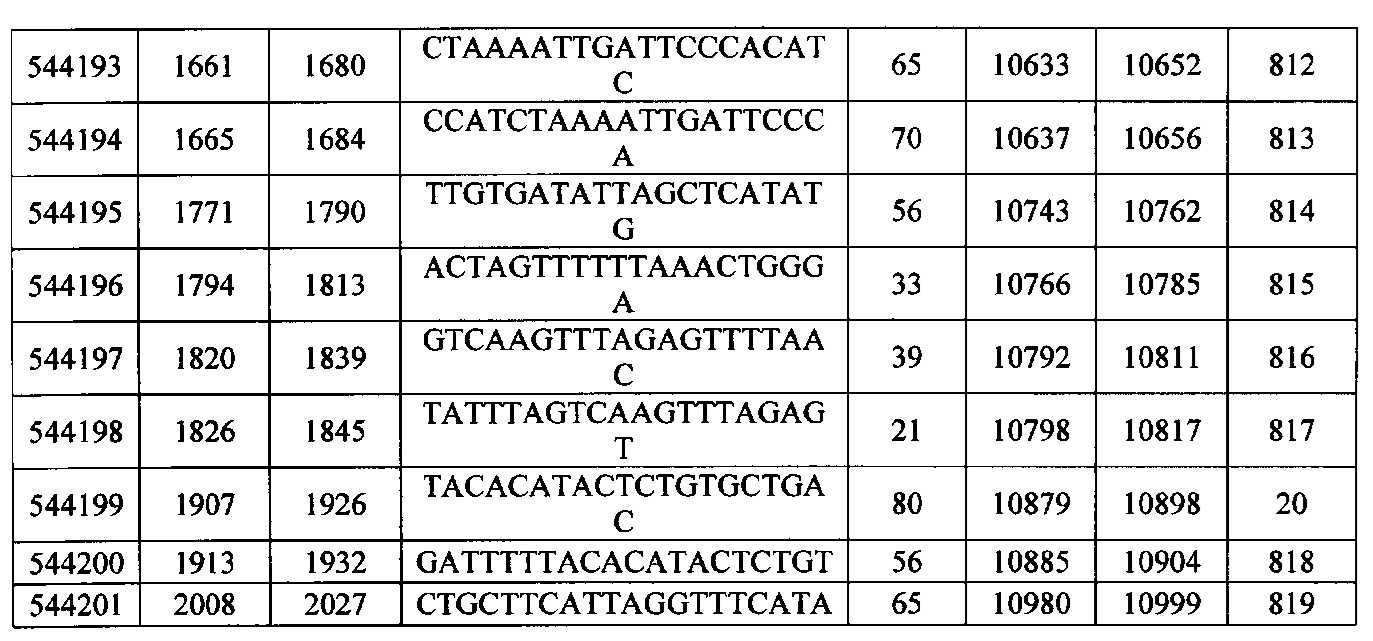




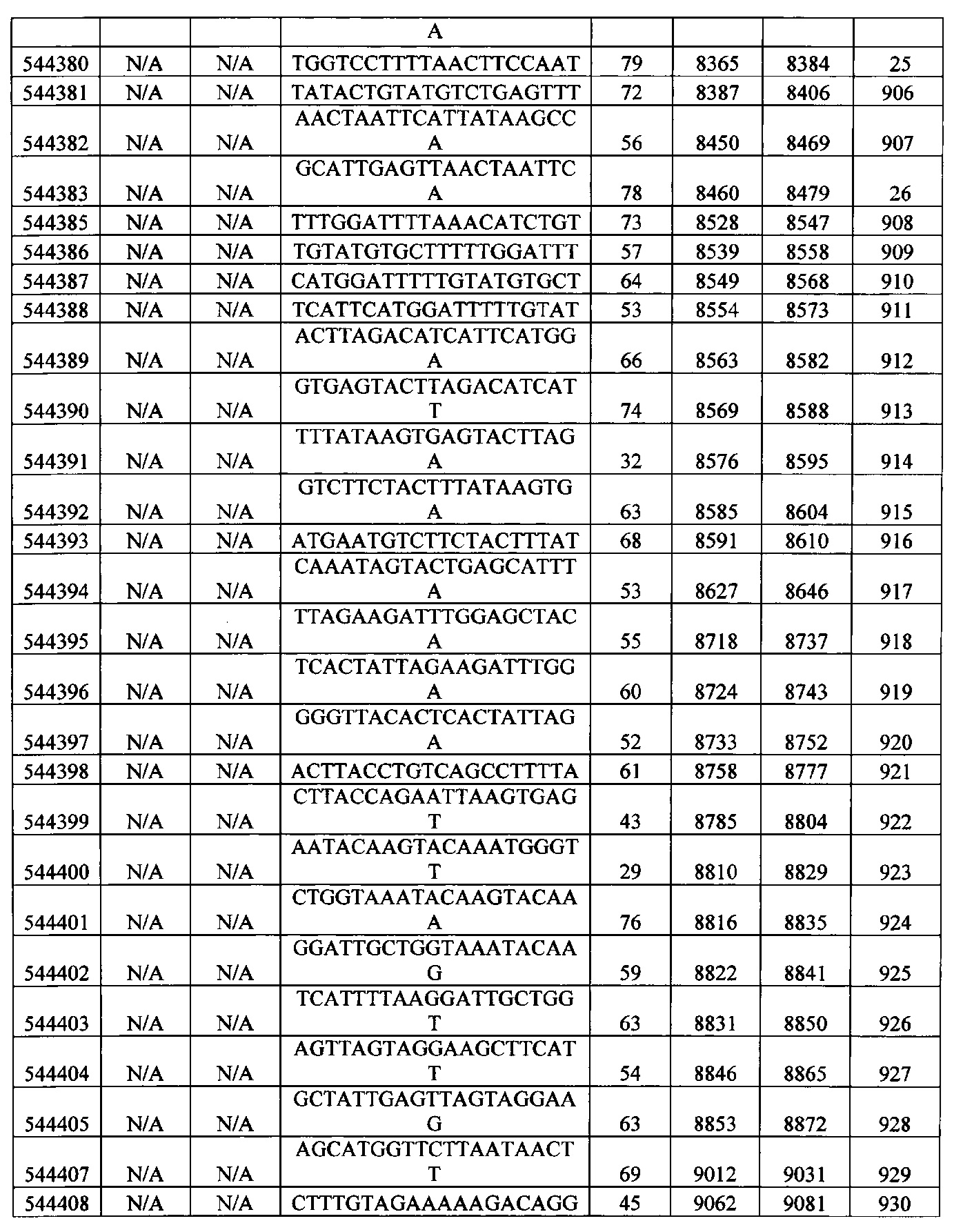















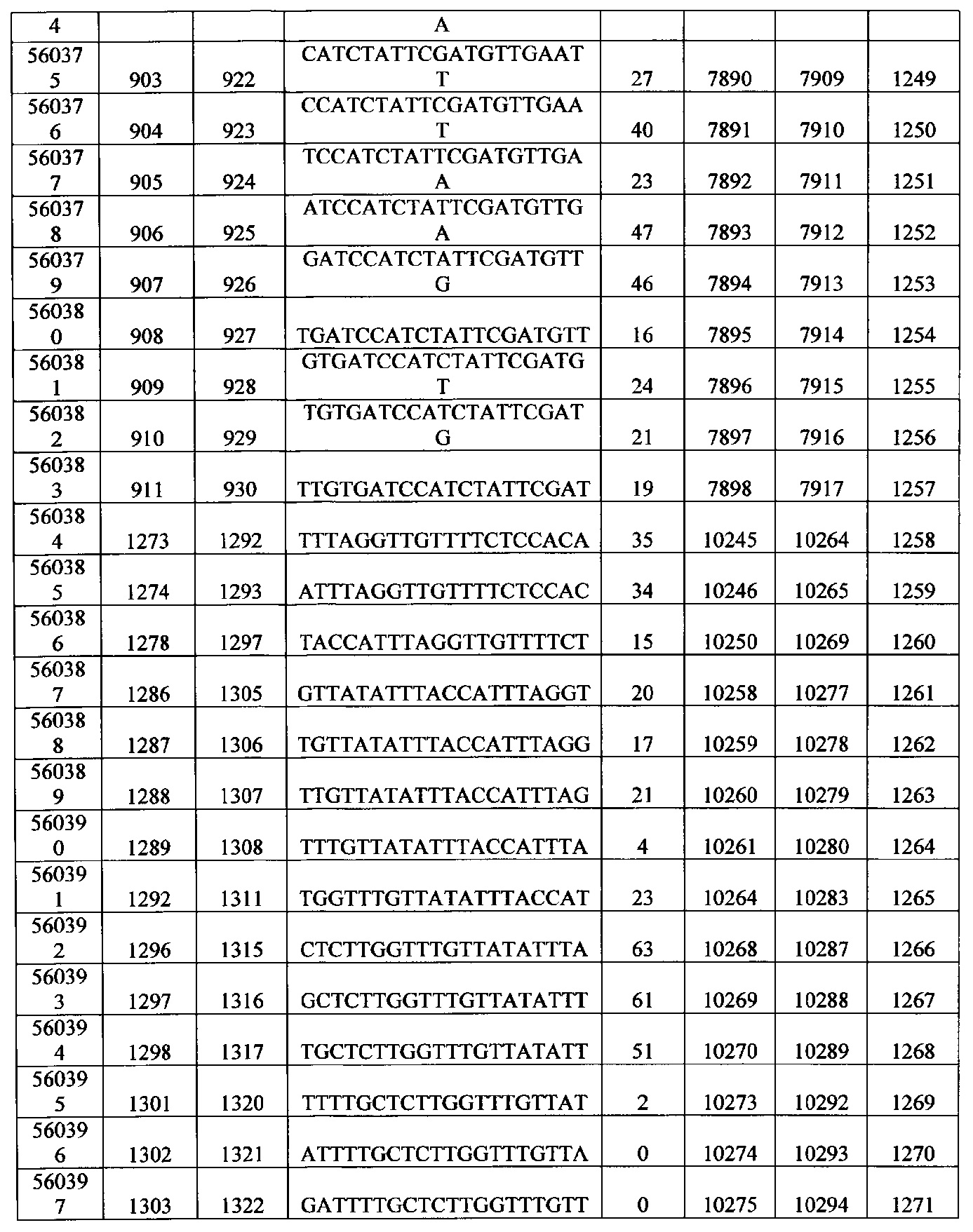


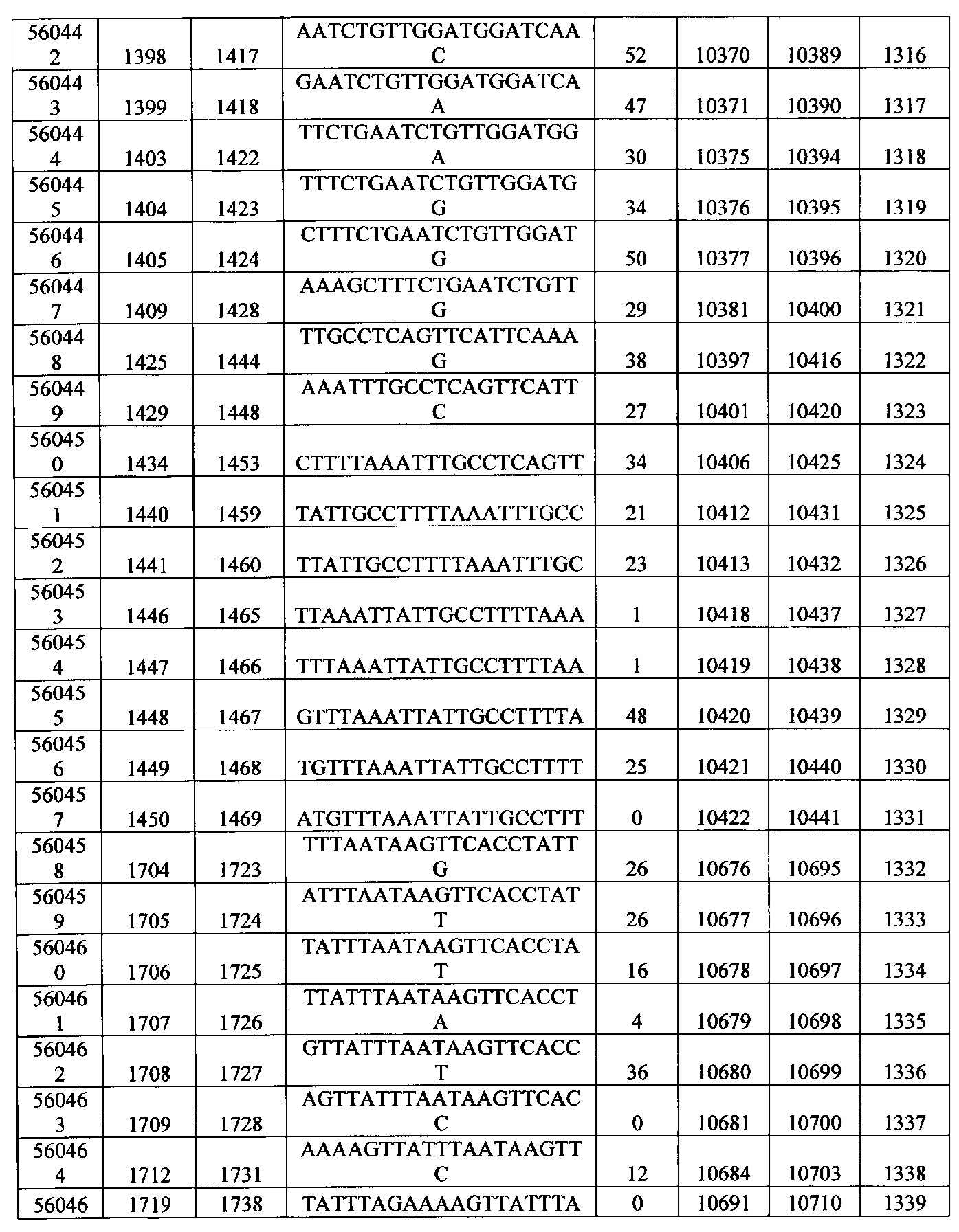
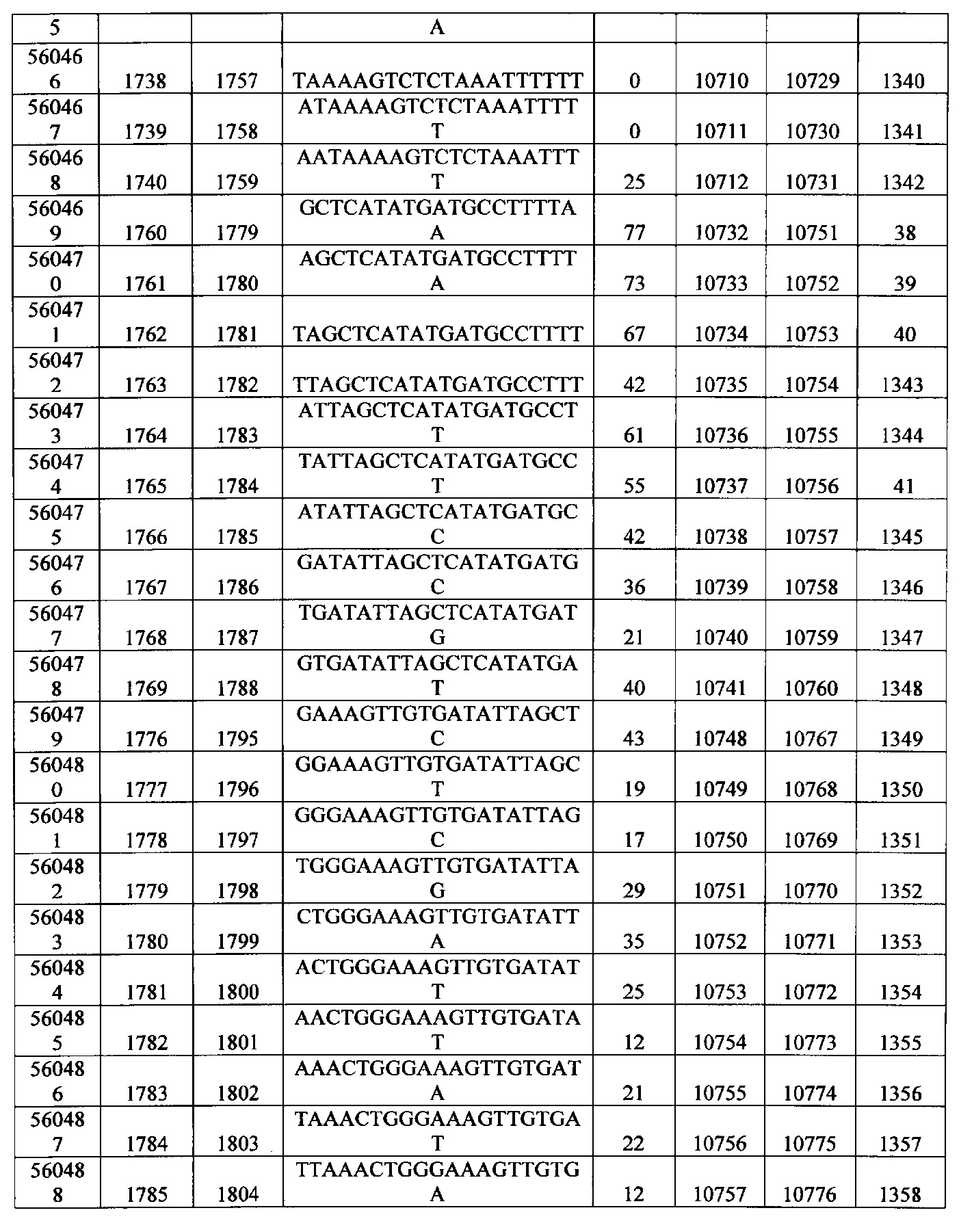






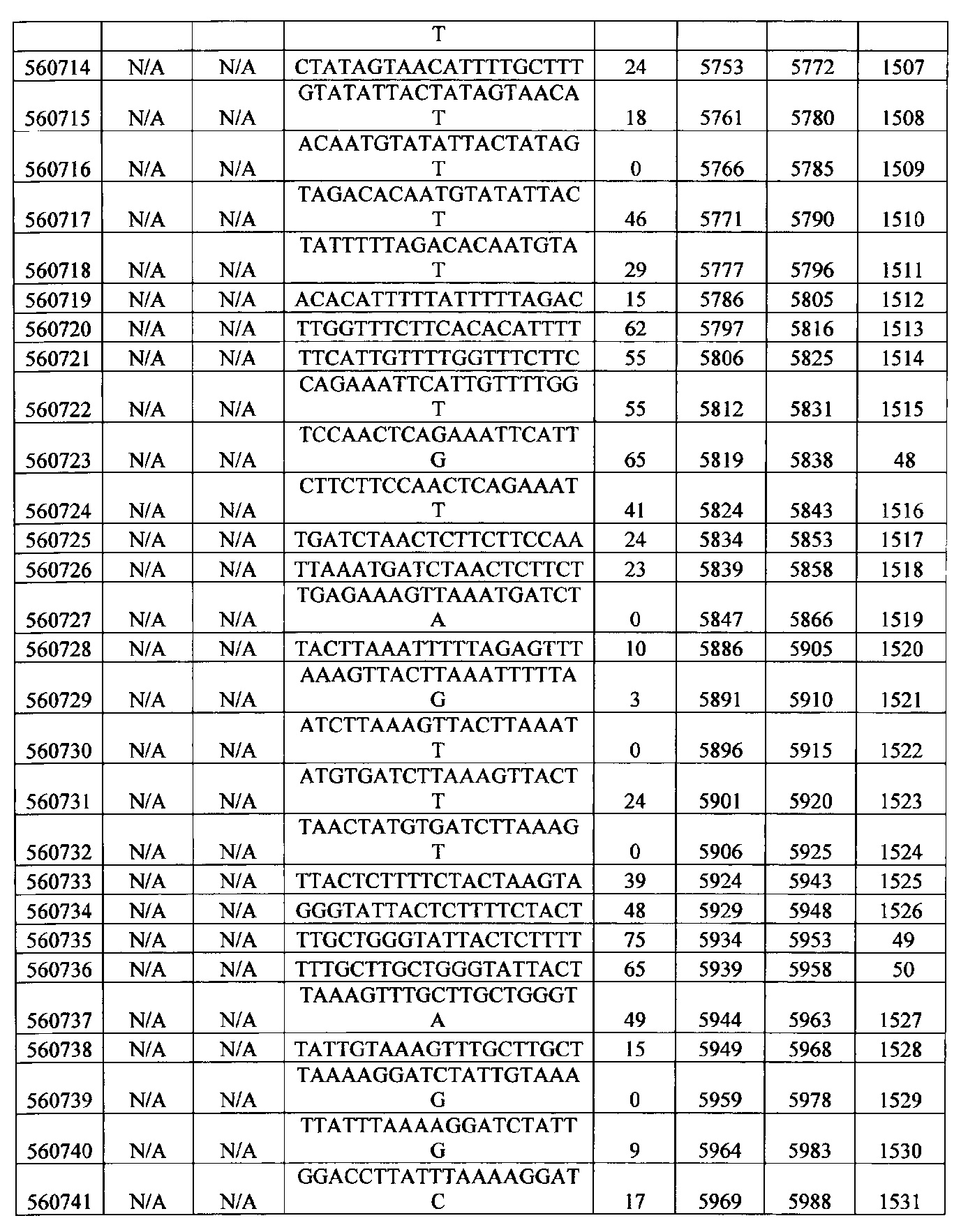





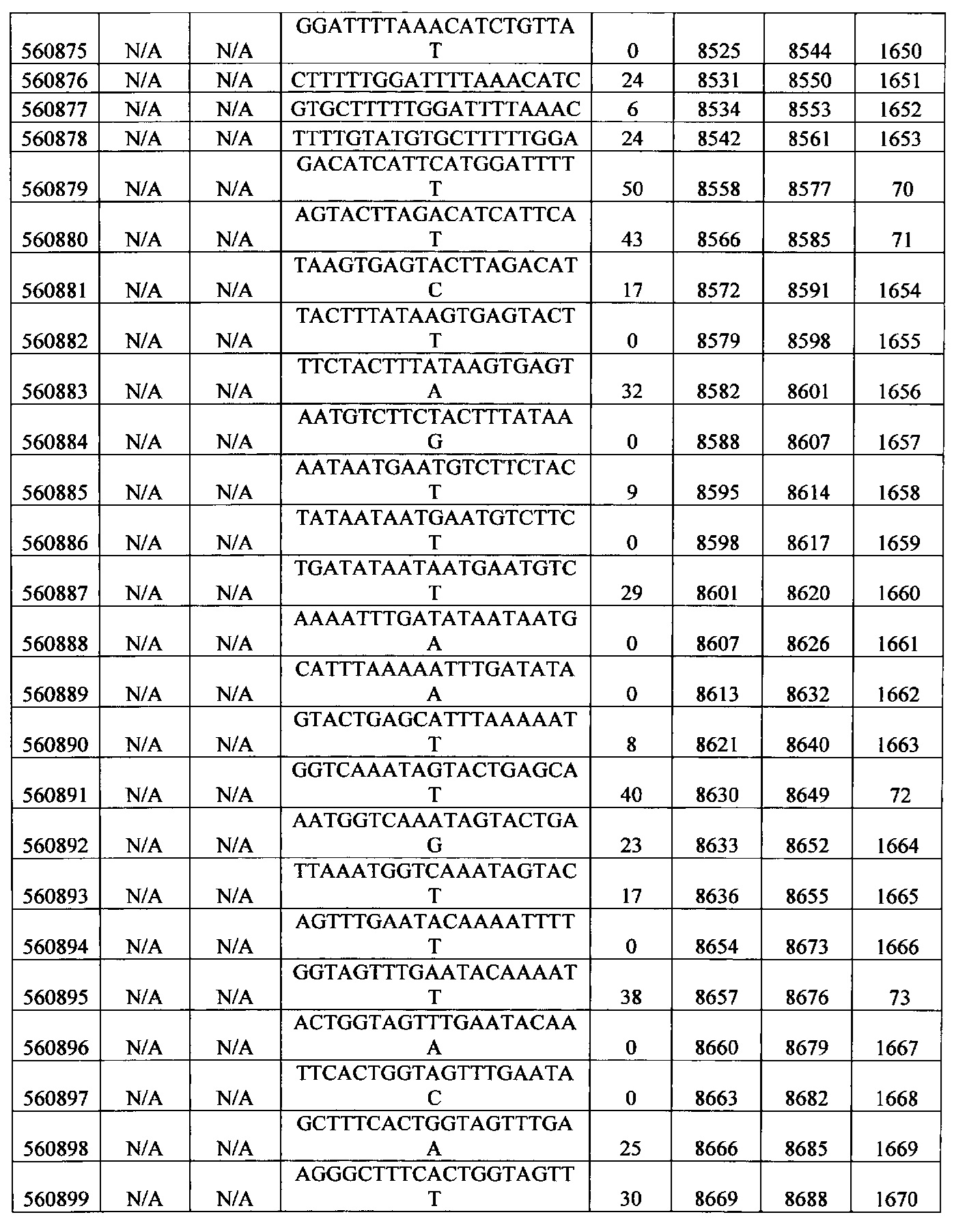
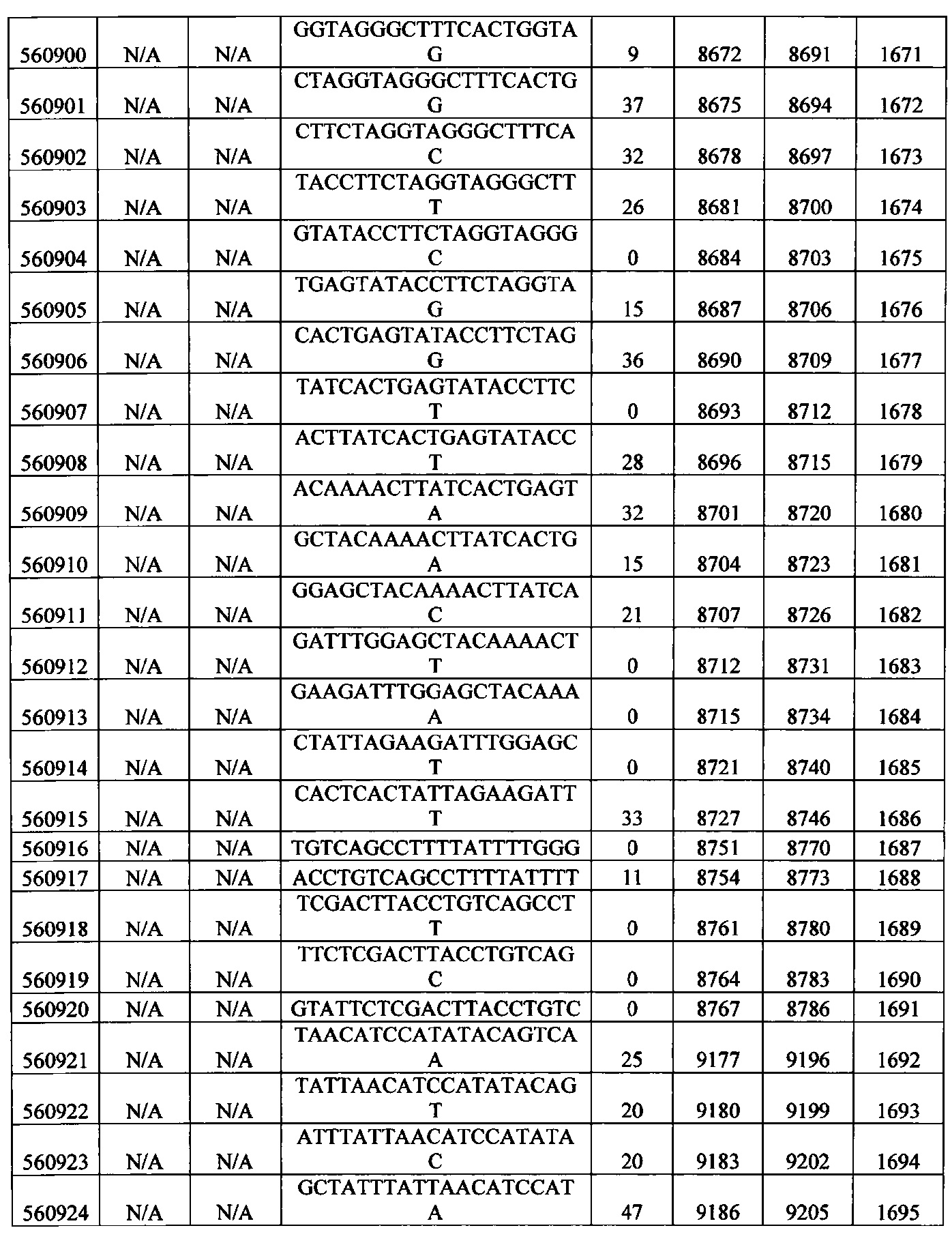













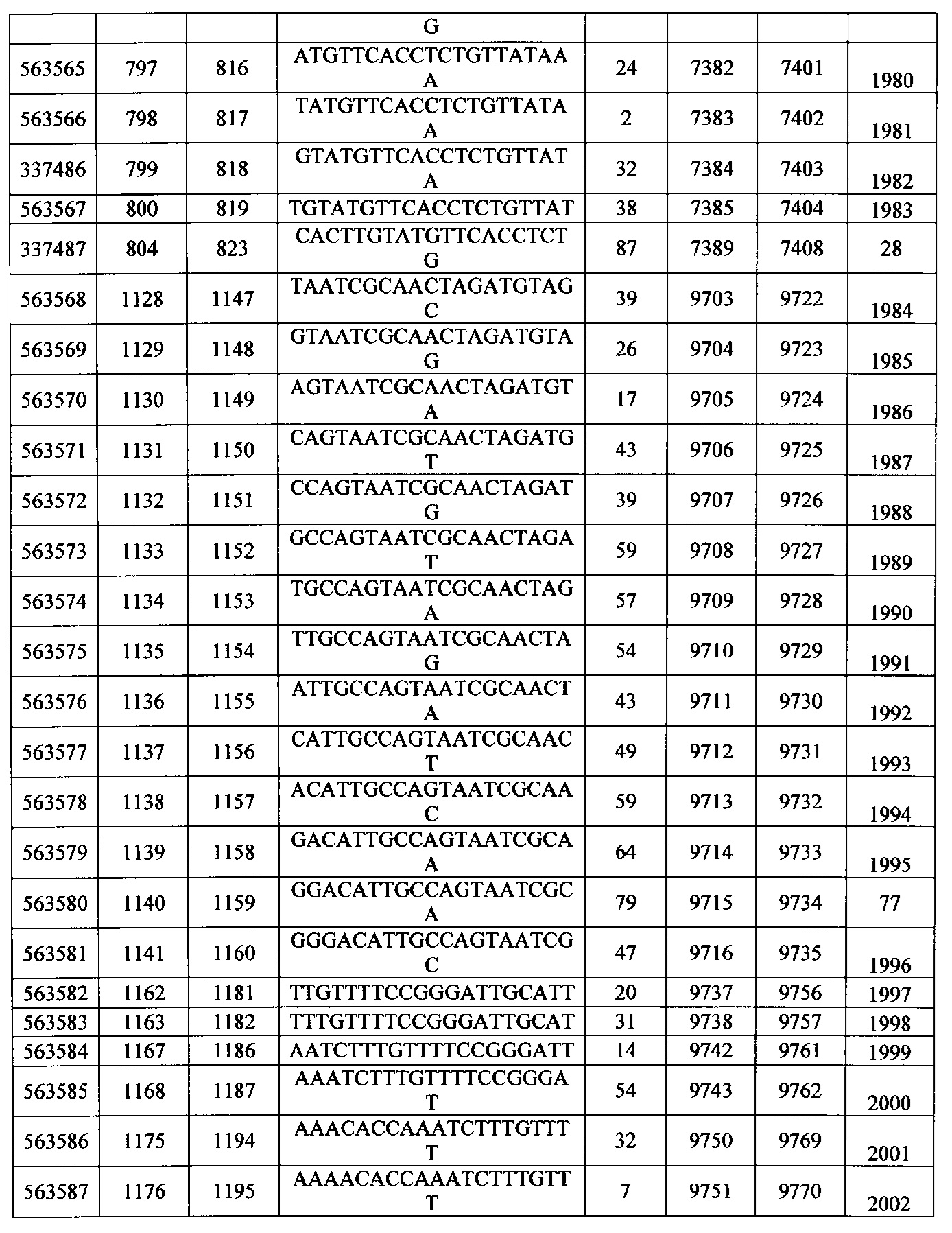




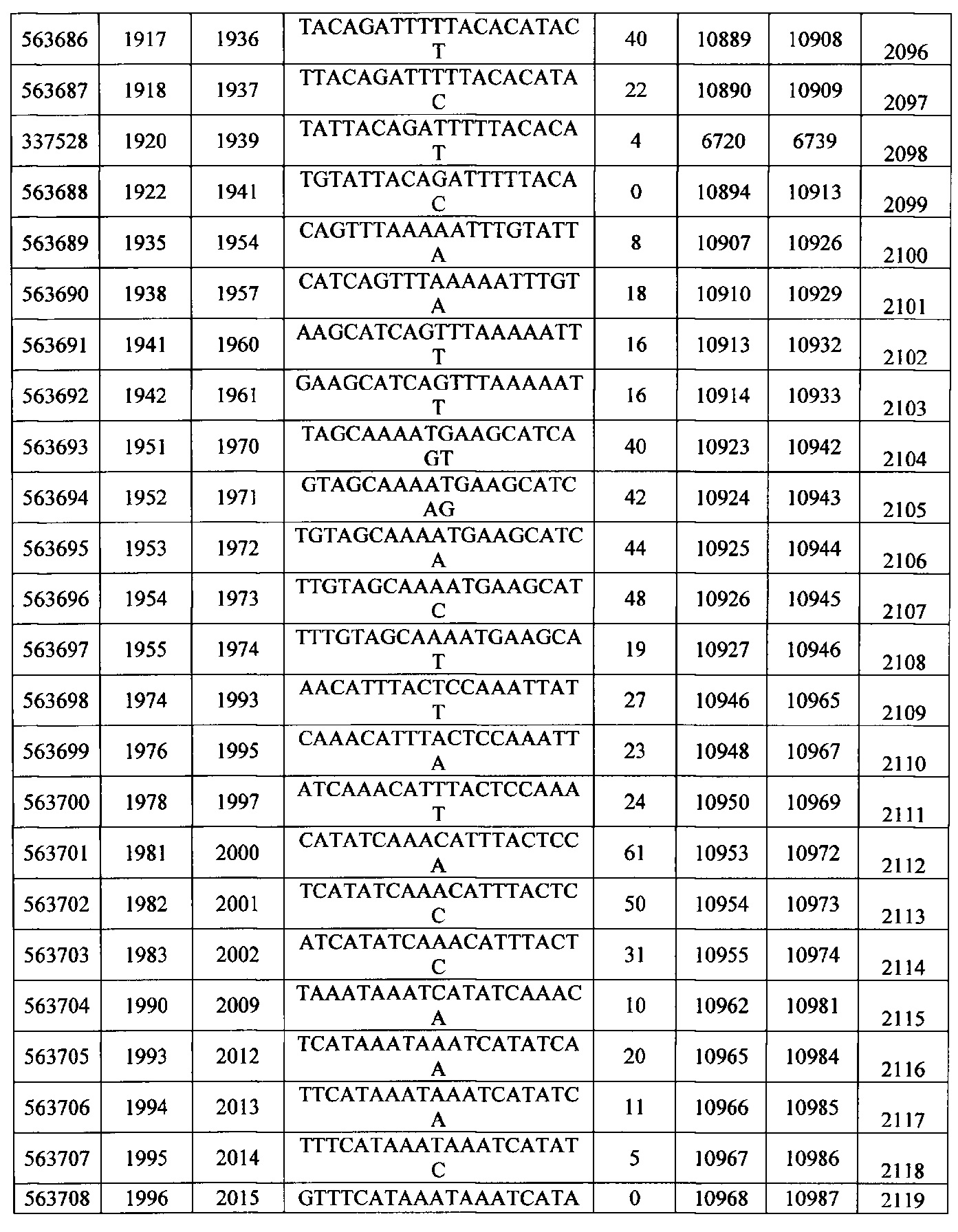




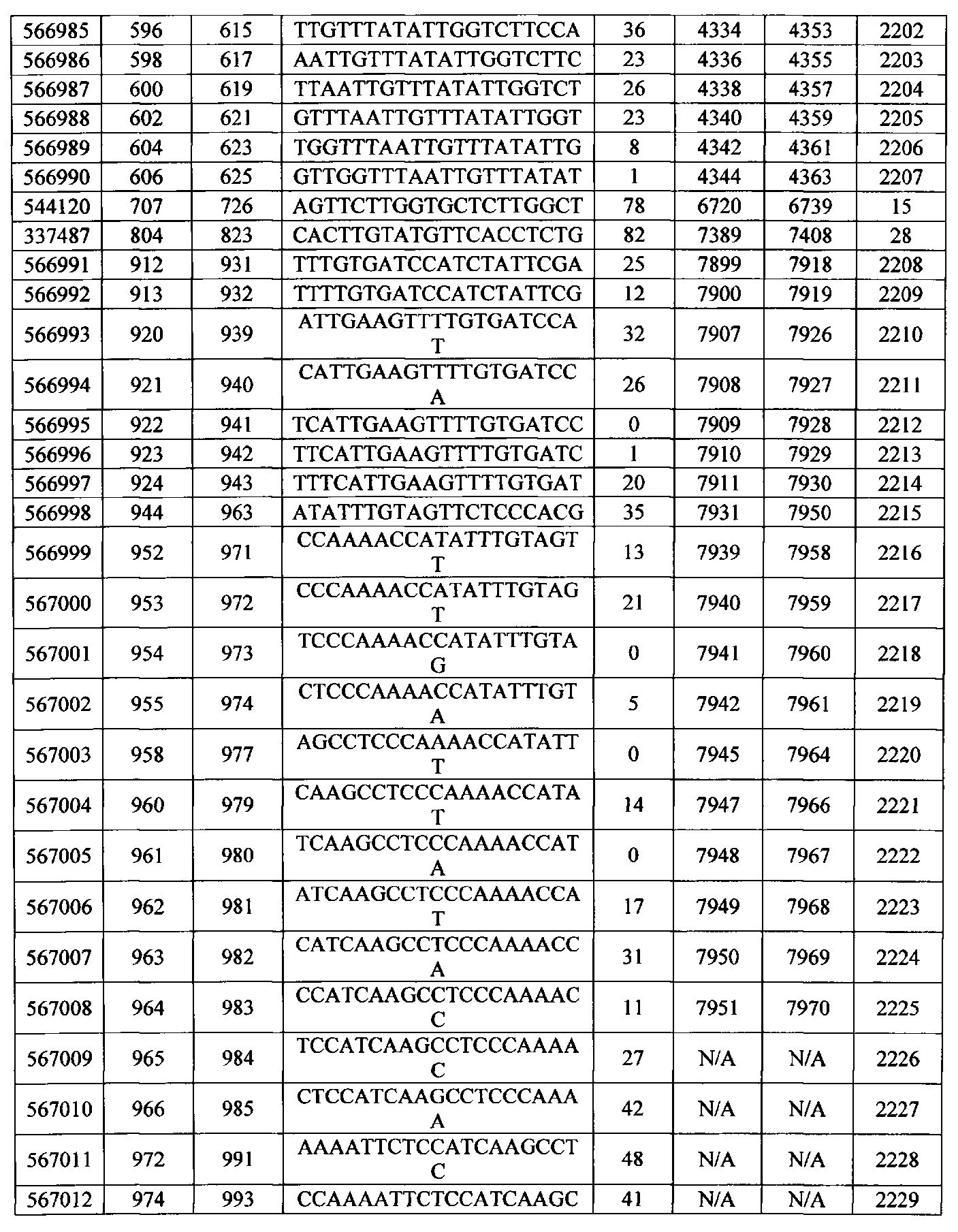

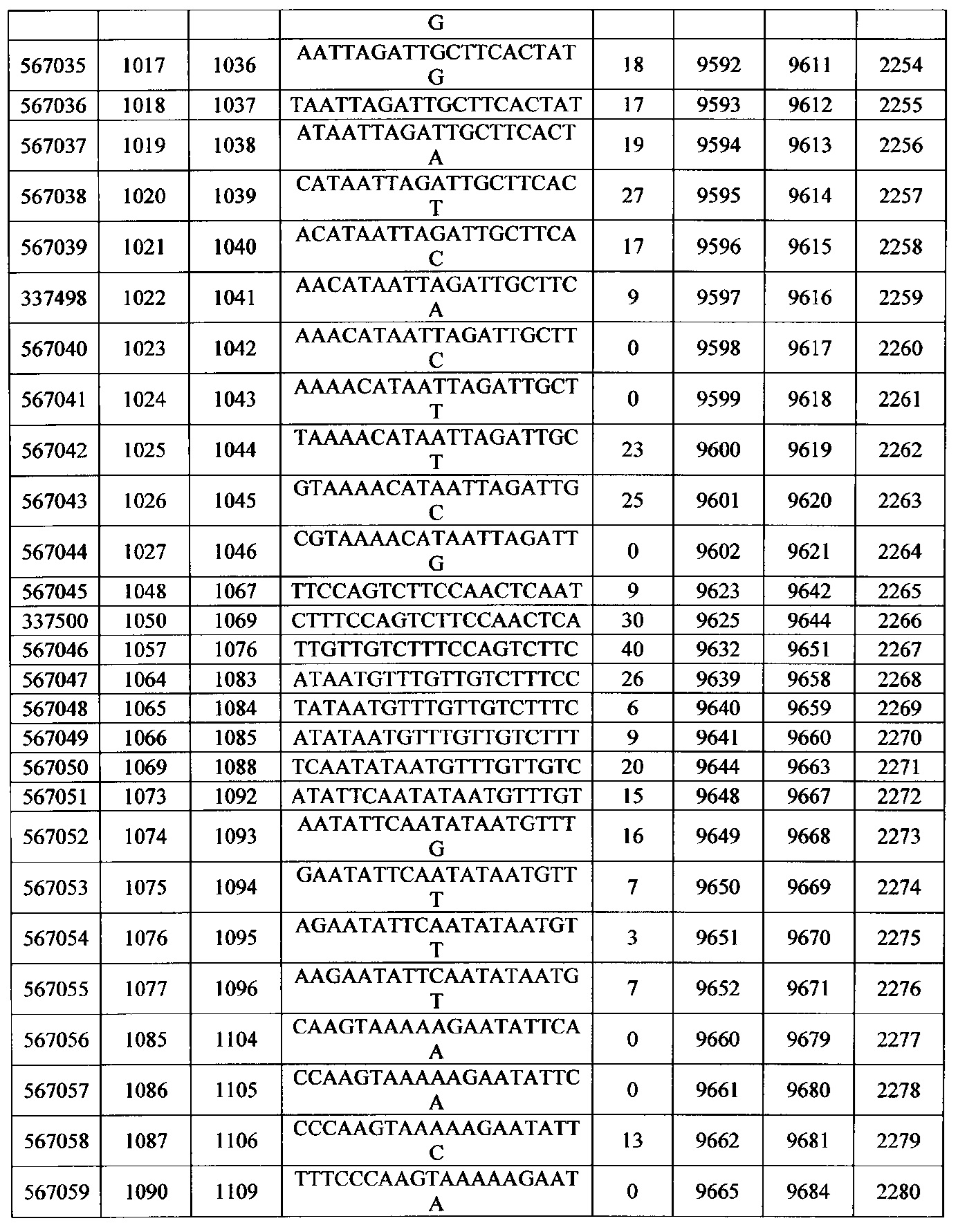

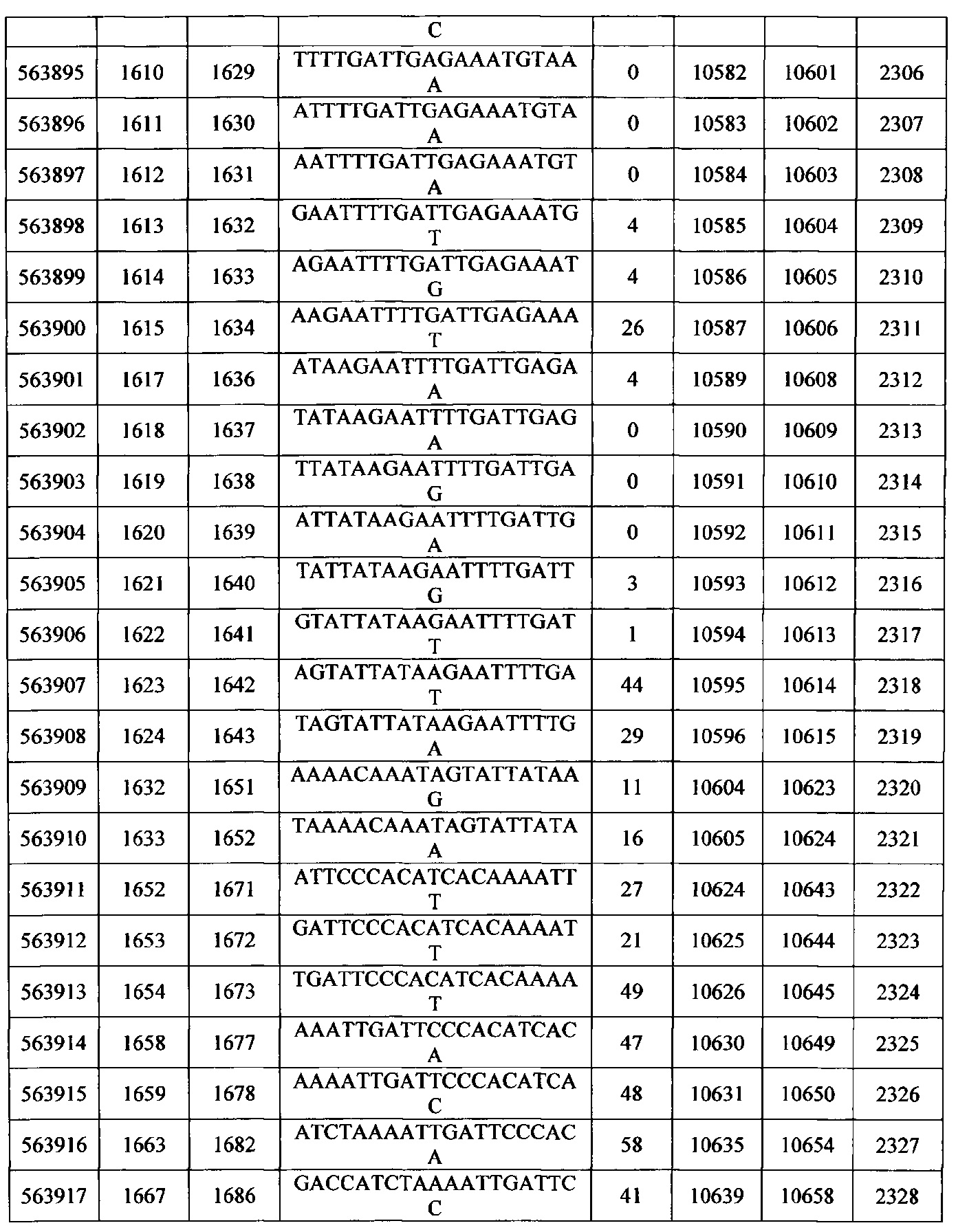
















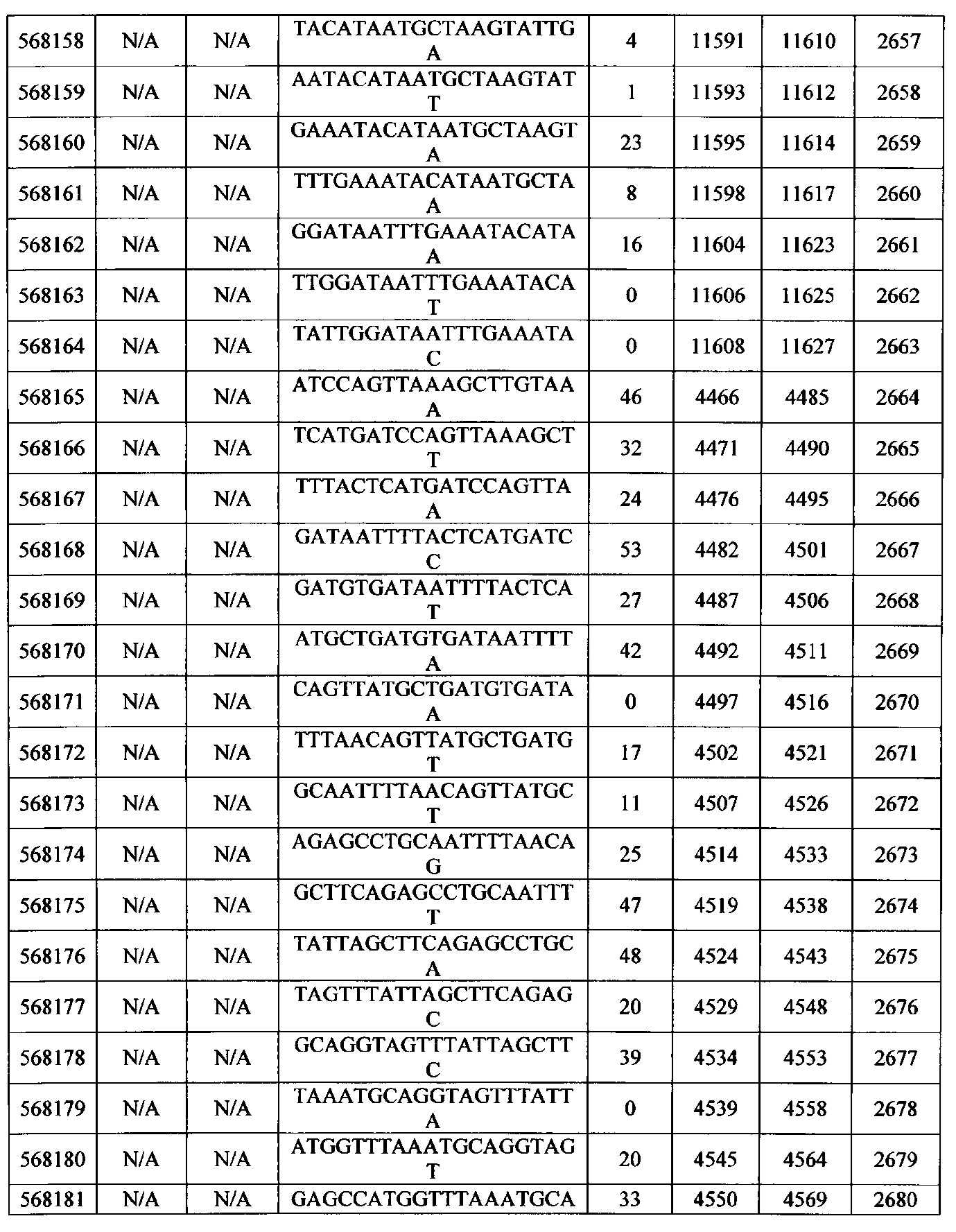
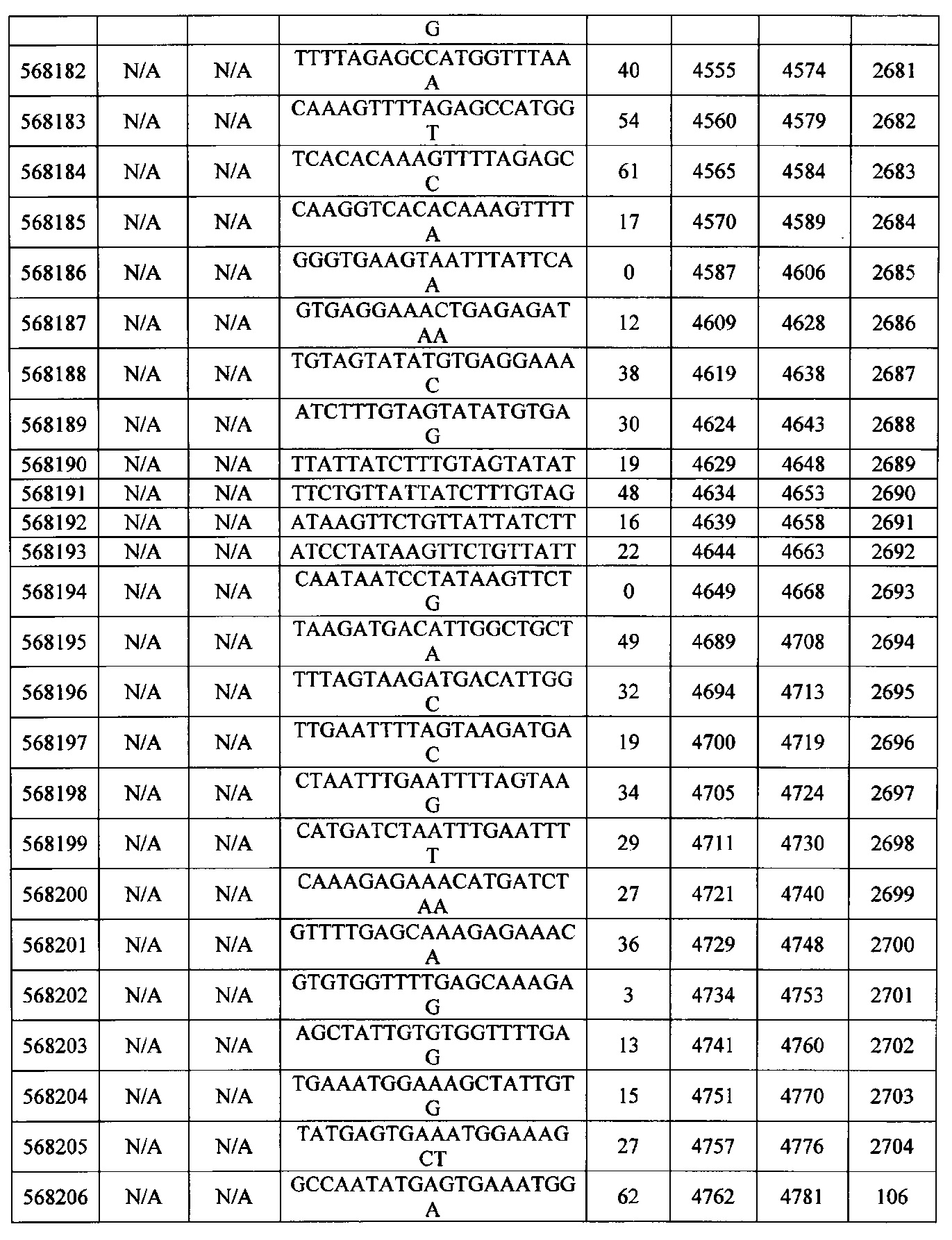

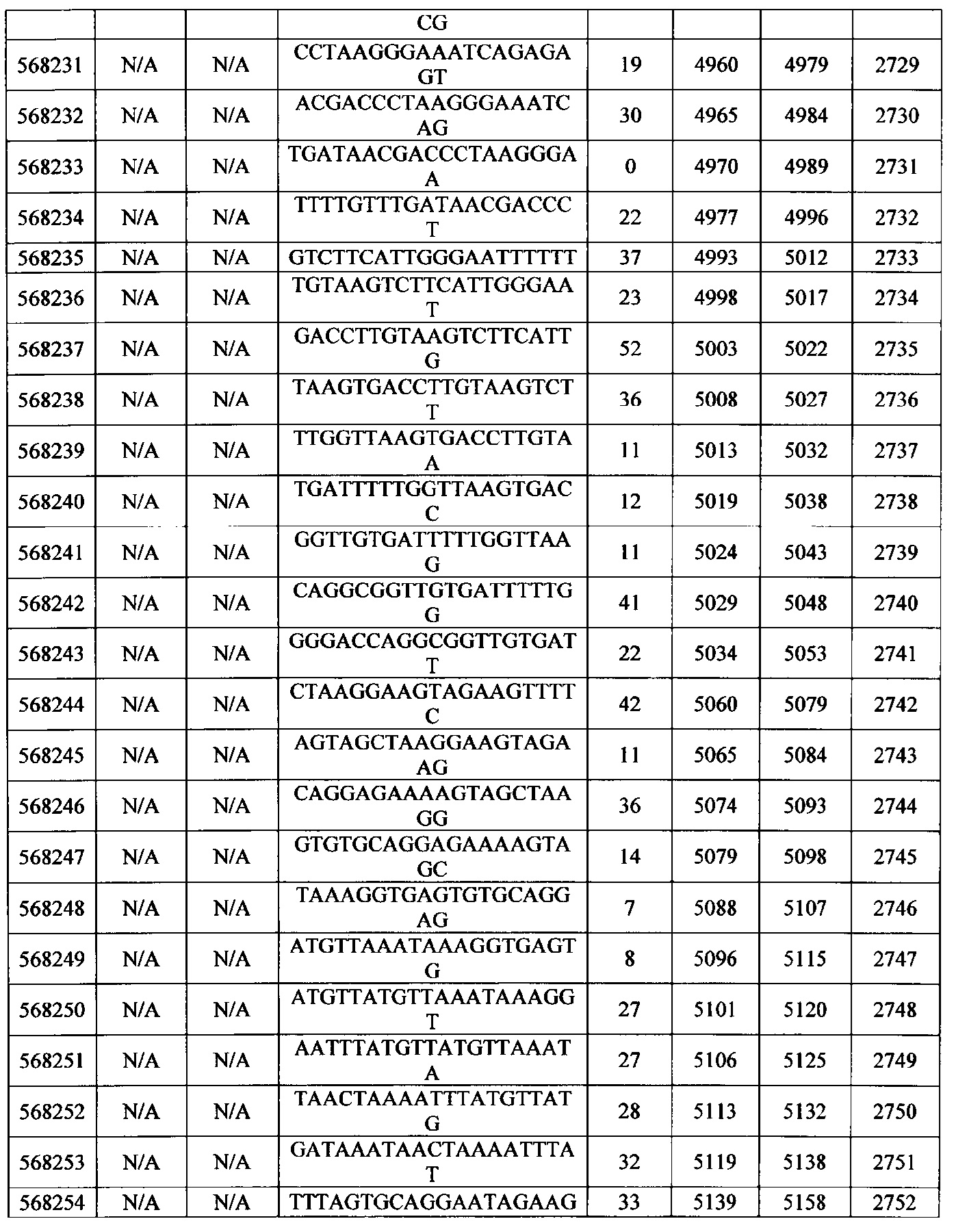


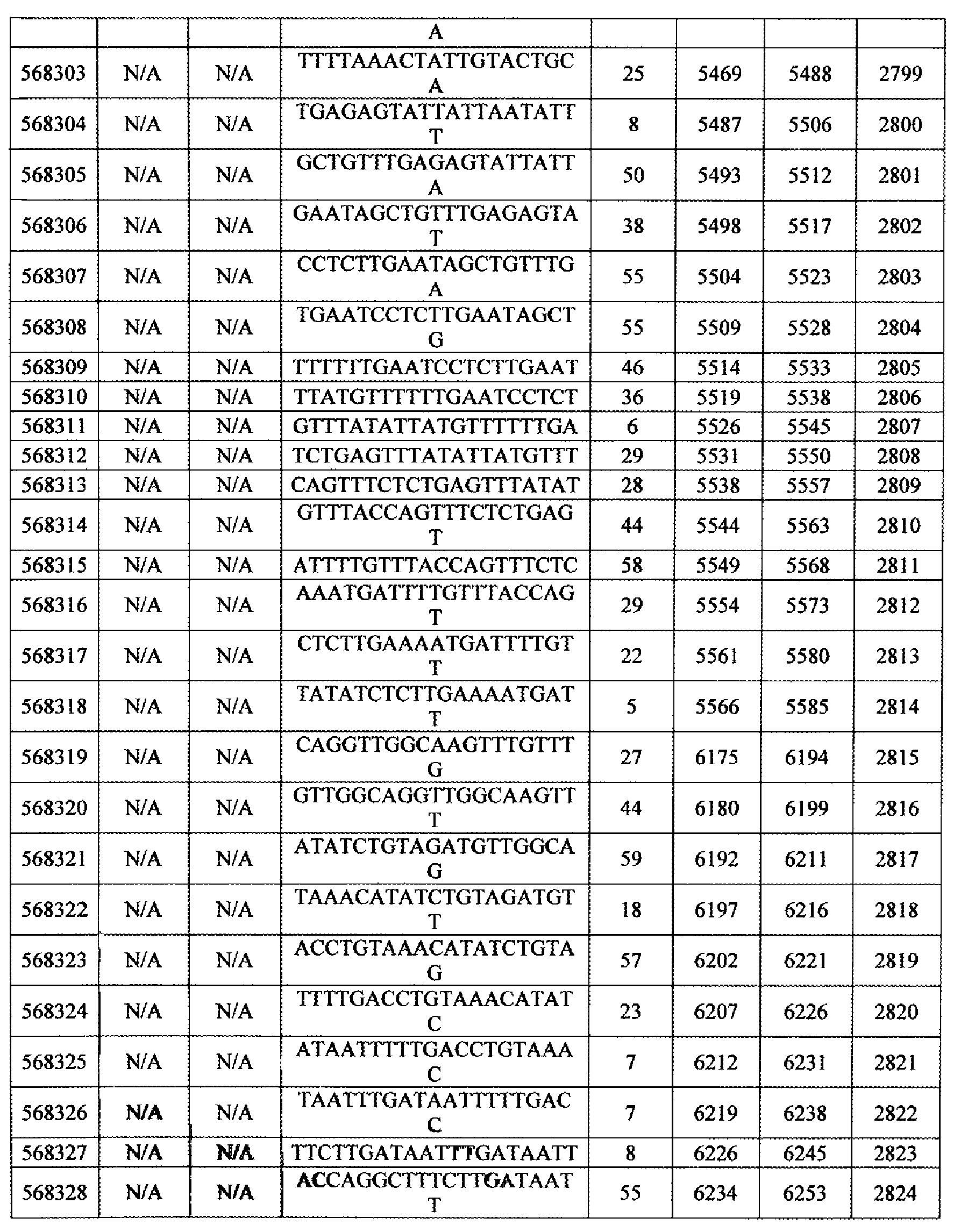











Пример 2. Дозозависимое антисмысловое ингибирование МОЕ-гэпмерами ANGPTL3 человека в клетках Нер3В
5-10-5 МОЕ-гэпмеры из описанных выше исследований, проявившие значительное ингибирование мРНК ANGPTL3 in vitro, были отобраны и испытаны в различных дозах на клетках Нер3В. Клетки высевали с плотностью 20000 клеток на лунку и трансфецировали концентрациями антисмыслового олигонуклеотида 0,75 мкМ, 1,50 мкМ, 3,00 мкМ, 6,00 мкМ и 12,00 мкМ с использованием электропорации, как указано в таблице ниже. После периода обработки приблизительно 16 часов из клеток выделяли РНК и уровни мРНК ANGPTL3 I измеряли методом количественной ПЦР в режиме реального времени. Для измерения уровней мРНК использовали набор праймеров-зондов человека RTS3492_MGB. Уровни мРНК ANGPTL3 корректировали в соответствии с содержанием общей РНК, измеренным методом RIBOGREEN®. Результаты представлены в виде процента ингибирования ANGPTL3 относительно необработанных контрольных клеток.
Для каждого олигонуклеотида также приведена полумаксимальная ингибирующая концентрация (IC50). У обработанных антисмысловым олигонуклеотидом клеток дозозависимым образом были значительно снижены уровни мРНК ANGPTL3.


Пример 3. Дозозависимое антисмысловое ингибирование МОЕ-гэпмерами ANGPTL3 человека в клетках Нер3В
5-10-5 МОЕ-гэпмеры из описанных выше исследований, проявившие значительное ингибирование мРНК ANGPTL3 in vitro, были отобраны и испытаны в различных дозах на клетках Нер3В. Клетки высевали с плотностью 20000 клеток на лунку и трансфецировали концентрациями антисмыслового олигонуклеотида 0,813 мкМ, 1,625 мкМ, 3,25 мкМ, 6,50 мкМ и 13,00 мкМ с использованием электропорации, как указано в таблице ниже. После периода обработки приблизительно 16 часов из клеток выделяли РНК и уровни мРНК ANGPTL3 измеряли методом количественной ПЦР в режиме реального времени. Для измерения уровней мРНК использовали набор праймеров-зондов человека RTS3492_MGB. Уровни мРНК ANGPTL3 корректировали в соответствии с содержанием общей РНК, измеренным методом RIBOGREEN®. Результаты представлены в виде процента ингибирования ANGPTL3 относительно необработанных контрольных клеток.
Для каждого олигонуклеотида также приведена полумаксимальная ингибирующая концентрация (IC50). У обработанных антисмысловым олигонуклеотидом клеток дозозависимым образом были значительно снижены уровни мРНК ANGPTL3.

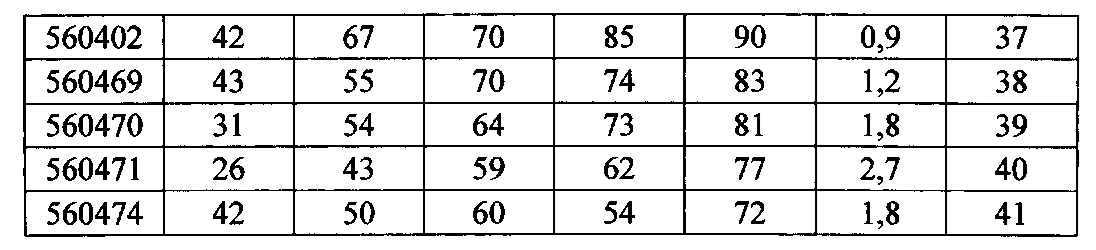




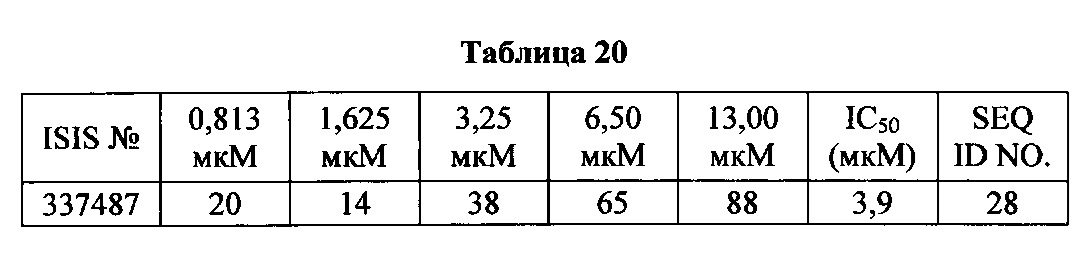





Пример 4. Антисмысловое ингибирование дезокси-, МОЕ- и (S)-cEt-гэпмерами ANGPTL3 человека в клетках Нер3В
Были сконструированы дополнительные антисмысловые олигонуклеотиды, таргетирующие нуклеиновую кислоту ангиопоэтин-подобного белка 3, и было испытано их воздействие на мРНК ANGPTL3 in vitro. Культивированные клетки Нер3В с плотностью 20000 клеток на лунку трансфецировали 4500 нМ антисмыслового олигонуклеотида с использованием электропорации. После периода обработки приблизительно 24 часов из клеток выделяли РНК и уровни мРНК ANGPTL3 измеряли методом количественной ПЦР в режиме реального времени. Для измерения уровней мРНК использовали набор праймеров-зондов человека RTS3492_MGB. Уровни мРНК ANGPTL3 корректировали в соответствии с содержанием общей РНК, измеренным методом RIBOGREEN®. Результаты представлены в виде процента ингибирования ANGPTL3 относительно необработанных контрольных клеток.
Новосконструированные химерные антисмысловые олигонуклеотиды в таблицах ниже были сконструированы в виде дезокси-, МОЕ- и (8)-сЕ1-олигонуклеотидов. Дезокси-, МОЕ- и (S)-cEt-олигонуклеотиды составляют в длину 16 нуклеозидов, причем нуклеозид содержит или МОЕ-сахаридную модификацию, (S)-сЕt-сахаридную модификацию или дезоксисахаридную модификацию. Сахаридные модификации каждого антисмыслового олигонуклеотида, описаны как «eek-d10-kke», где «k» обозначает (S)-cEt-сахаридную модификацию; «d» обозначает дезоксирибозу; число обозначает количество остатков дезоксирибозных сахаров; а «е» обозначает МОЕ-сахаридную модификацию. Межнуклеозидные связи по всей длине каждого олигонуклеотида представляют собой тиофосфатные (P=S) связи. Все остатки цитозина в каждом олигонуклеотиде представляют собой 5-метилцитозины. «Сайт инициации» обозначает наиболее удаленный 5'-нуклеозид, на который таргетирован олигонуклеотид, в последовательности гена человека. «Сайт терминации» обозначает наиболее удаленный 3'-нуклеозид, на который таргетирован олигонуклеотид, в последовательности гена человека. Каждый олигонуклеотид, перечисленный в таблицах ниже, таргетирован или на мРНК ANGPTL3 человека, обозначенную в данном документе как SEQ ID NO: 1 (инвентаризационный № GENBANK NM_014495.2), или на геномную последовательность ANGPTL3 человека, обозначенную в данном описании как SEQ ID NO: 2 (инвентаризационный № GENBANK NT_ 032977.9, усеченный от нуклеотида 33032001 до 33046000). «n/а» обозначает, что антисмысловой олигонуклеотид не таргетирует конкретную последовательность гена со 100% комплементарностью.











Пример 5. Антисмысловое ингибирование дезокси-, МОЕ- и (S)-cEt-гэпмерами ANGPTL3 человека в клетках Нер3В
Были сконструированы дополнительные антисмысловые олигонуклеотиды, таргетирующие нуклеиновую кислоту ангиопоэтин-подобного белка 3, и было испытано их воздействие на мРНК ANGPTL3 in vitro. ISIS 337487 и ISIS 233717, которые представляют собой 5-10-5 МОЕ-гэпмеры, также включали в анализы в качестве эталонных олигонуклеотидов. Культивированные клетки Нер3В с плотностью 20000 клеток на лунку трансфецировали 4500 нМ антисмыслового олигонуклеотида с использованием электропорации. После периода обработки приблизительно 24 часов из клеток выделяли РНК и уровни мРНК ANGPTL3 измеряли методом количественной ПЦР в режиме реального времени. Для измерения уровней мРНК использовали набор праймеров-зондов человека RTS3492 MGB. Уровни мРНК ANGPTL3 корректировали в соответствии с содержанием общей РНК, измеренным методом RIBOGREEN®. Результаты представлены в виде процента ингибирования ANGPTL3 относительно необработанных контрольных клеток.
Новосконструированные химерные антисмысловые олигонуклеотиды в таблицах ниже были сконструированы в виде дезокси-, МОЕ- и (S)-cEt-олигонуклеотидов или 5-10-5 МОЕ-гэпмеров. Дезокси-, МОЕ- и (S)-сЕt;-олигонуклеотиды составляют в длину 16 нуклеозидов, причем нуклеозид содержит или МОЕ-сахаридную модификацию, (S)-cEt-сахаридную модификацию или дезоксисахаридную модификацию. Сахаридные модификации каждого антисмыслового олигонуклеотида, описаны как «eek-d10-kke», где «k» обозначает (S)-cEt-сахаридную модификацию; «d» обозначает дезоксирибозу; число обозначает количество остатков дезоксирибозных Сахаров; а «е» обозначает МОЕ-модификацию. 5-10-5 МОЕ-гэпмеры состоят в длину из 20 нуклеозидов, причем центральный гэп-сегмент состоит из десяти 2'-дезоксинуклеозидов и фланкирован сегментами крыльев в 5'-направлении и 3'-направлении, содержащими по пять нуклеозидов каждый. Межнуклеозидные связи по всей длине каждого олигонуклеотида представляют собой тиофосфатные (P=S) связи. Все остатки цитозина в каждом олигонуклеотиде представляют собой 5-метилцитозины. «Сайт инициации» обозначает наиболее удаленный 5'-нуклеозид, на который таргетирован олигонуклеотид, в последовательности гена человека. «Сайт терминации» обозначает наиболее удаленный 3'-нуклеозид, на который таргетирован олигонуклеотид, в последовательности гена человека. Каждый олигонуклеотид, перечисленный в таблицах ниже, таргетирован или на мРНК ANGPTL3 человека, обозначенную в данном документе как SEQ ID NO: 1 (инвентаризационный №GENBANK NM 014495.2), или на геномную последовательность ANGPTL3 человека, обозначенную в данном описании как SEQ ID NO: 2 (инвентаризационный №GENBANK NT 032977.9, усеченный от нуклеотида 33032001 до 33046000). «n/а» обозначает, что антисмысловой олигонуклеотид не таргетирует конкретную последовательность гена со 100% комплементарностью.

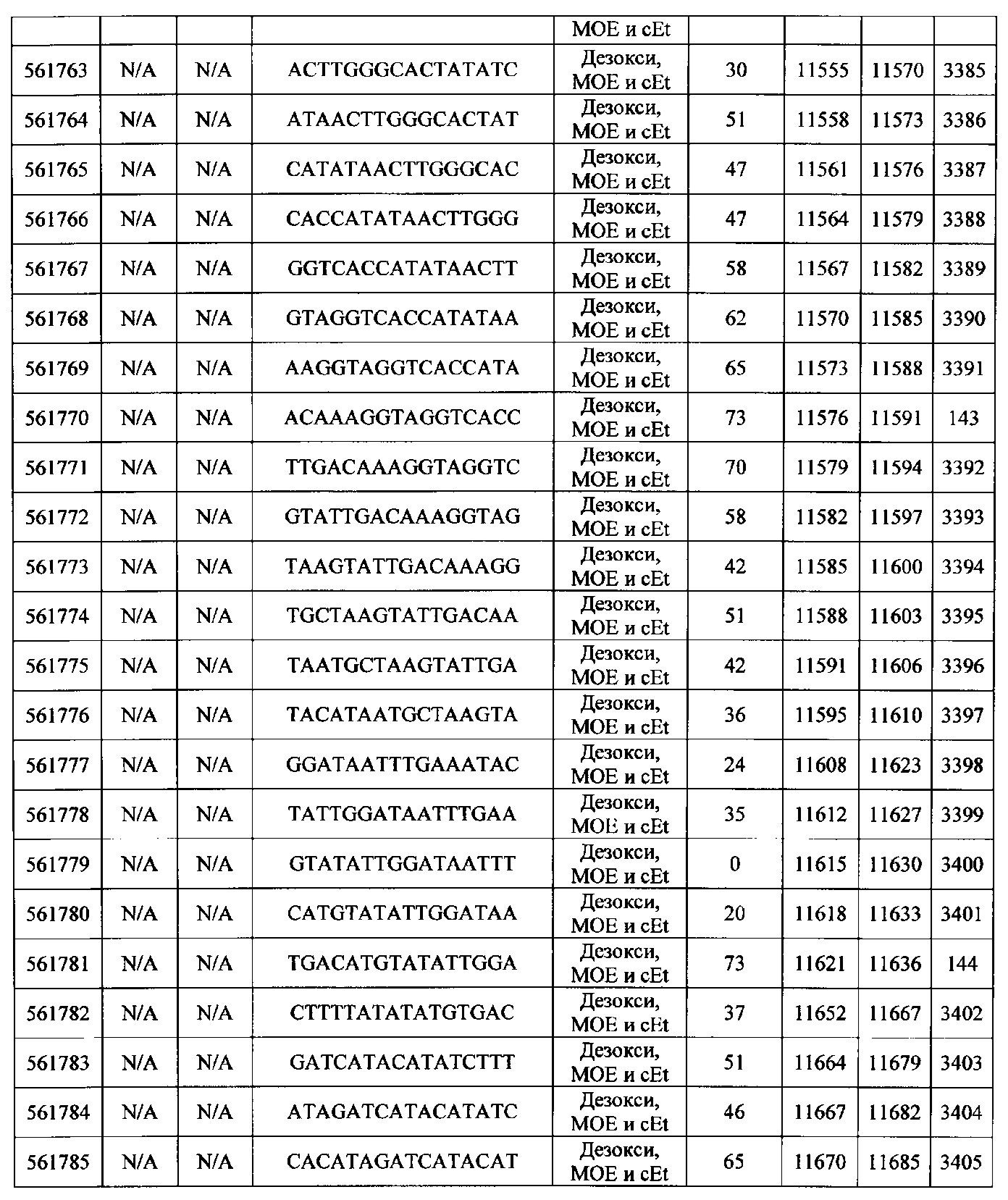









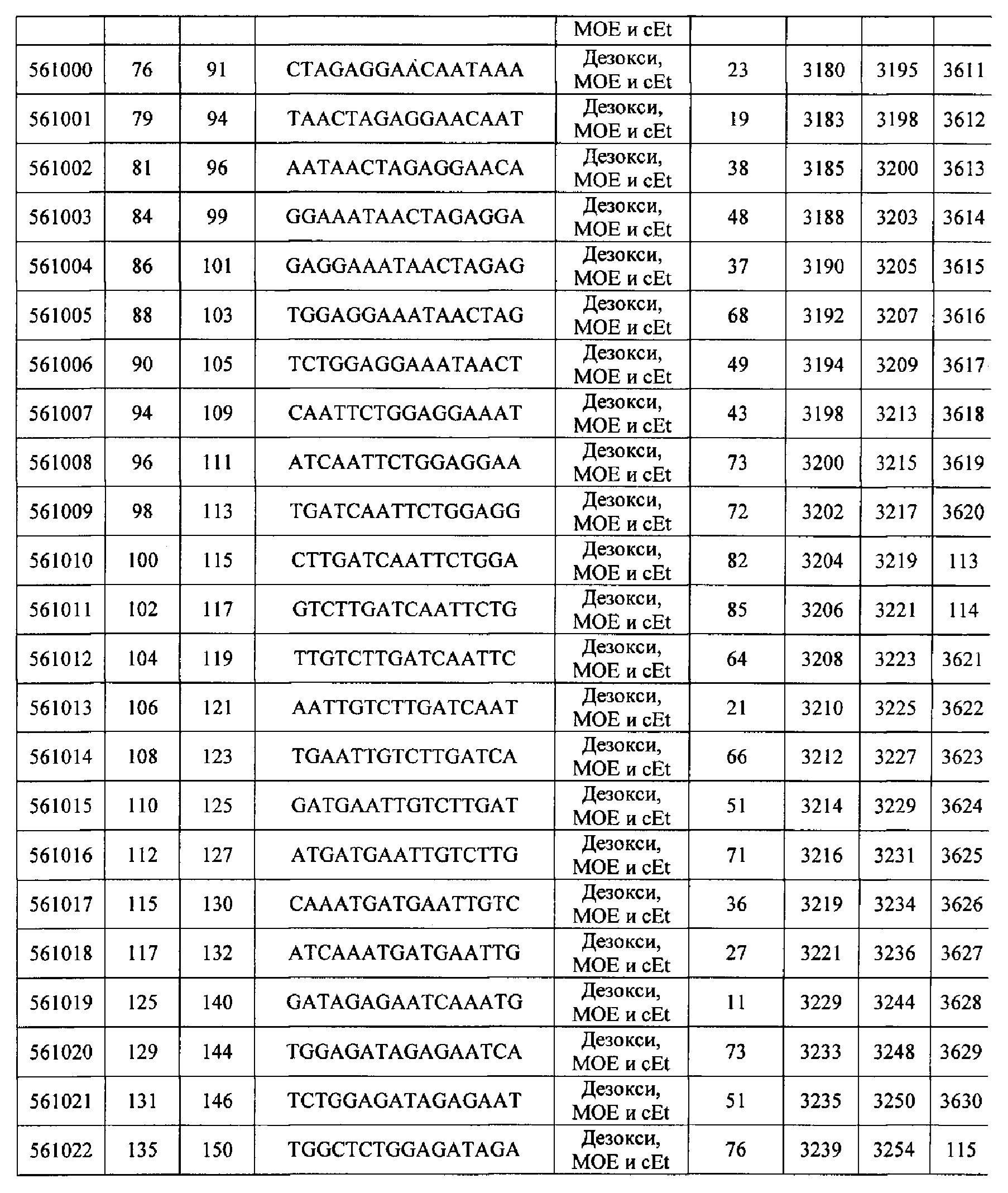


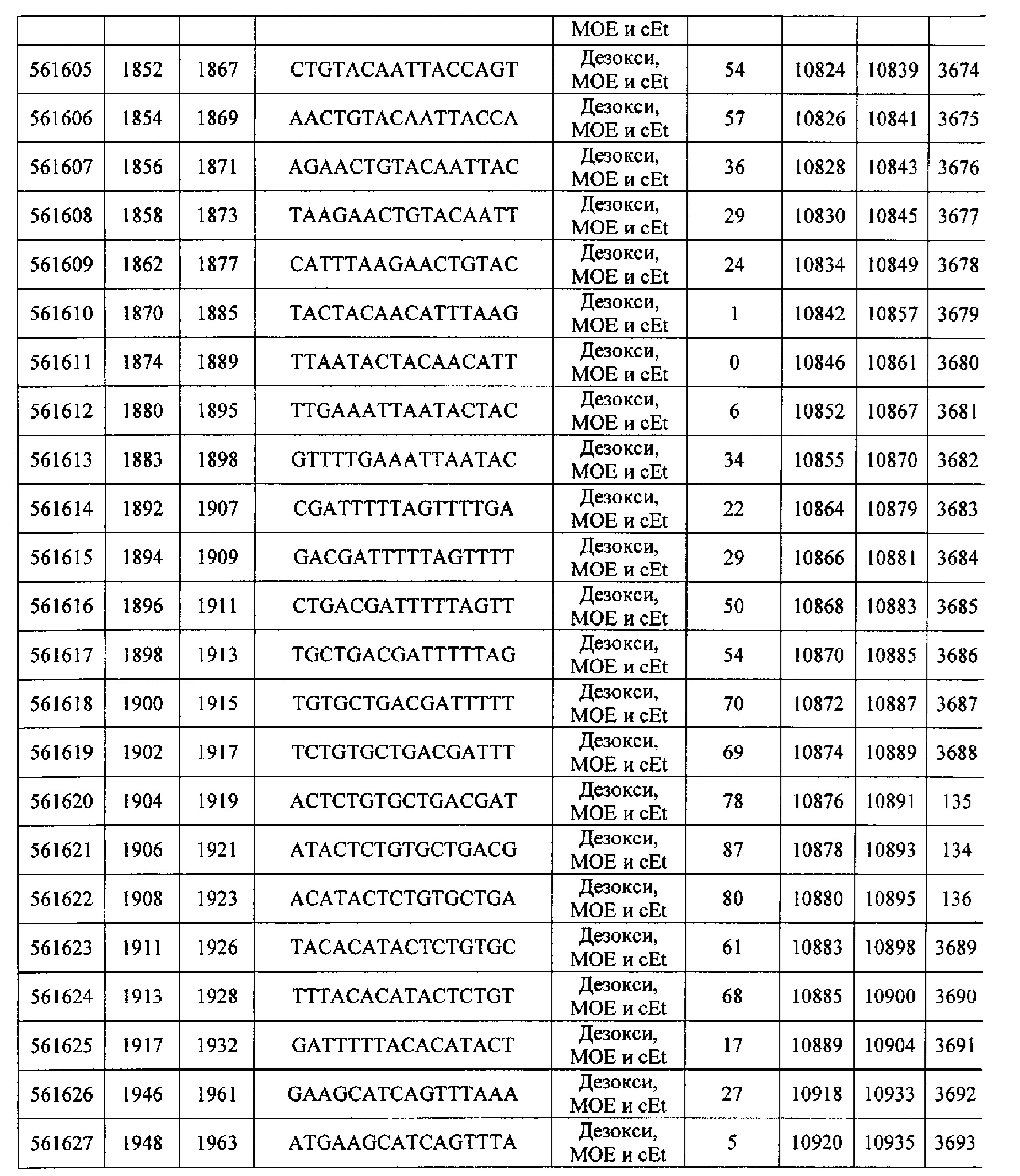






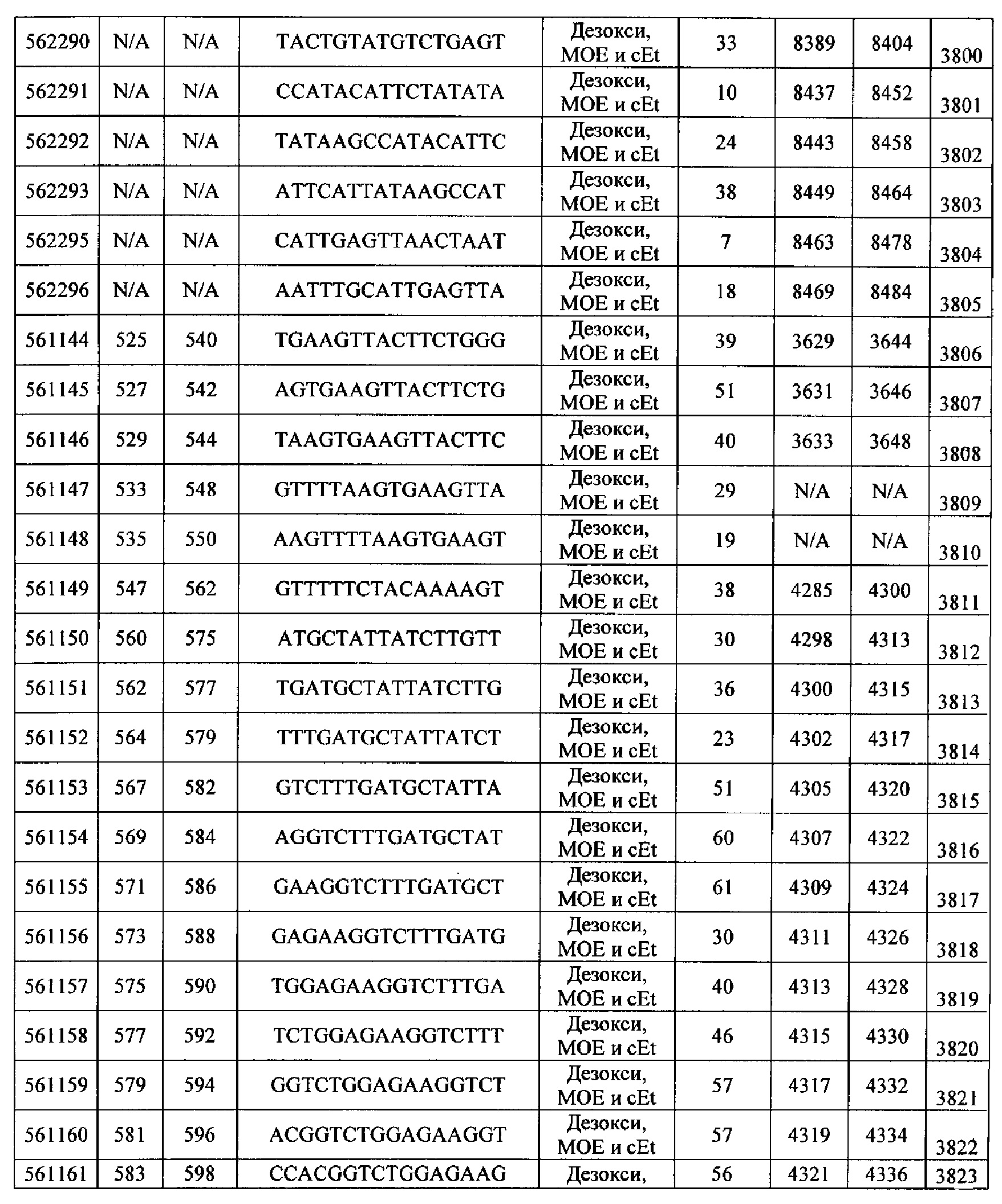
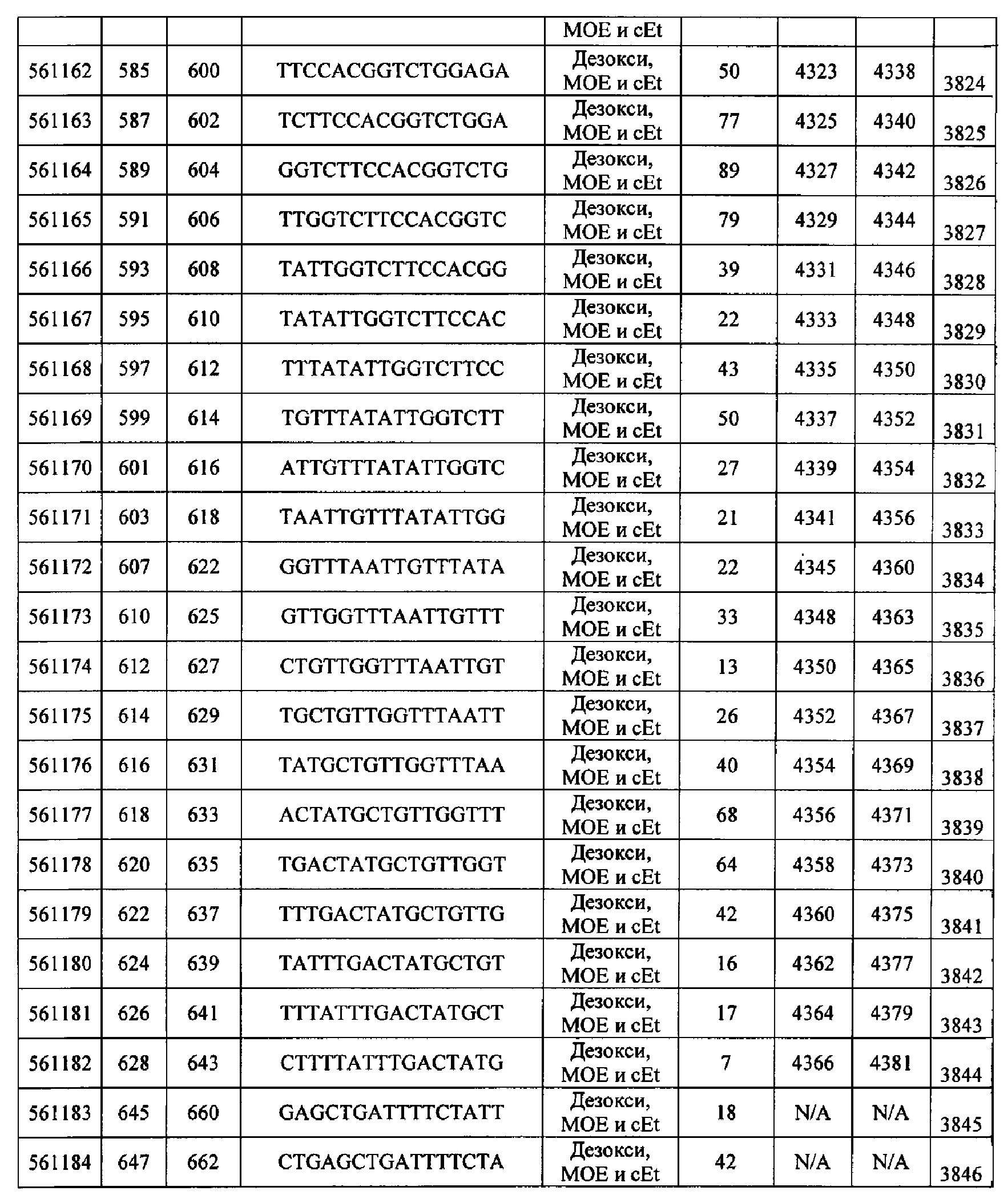






























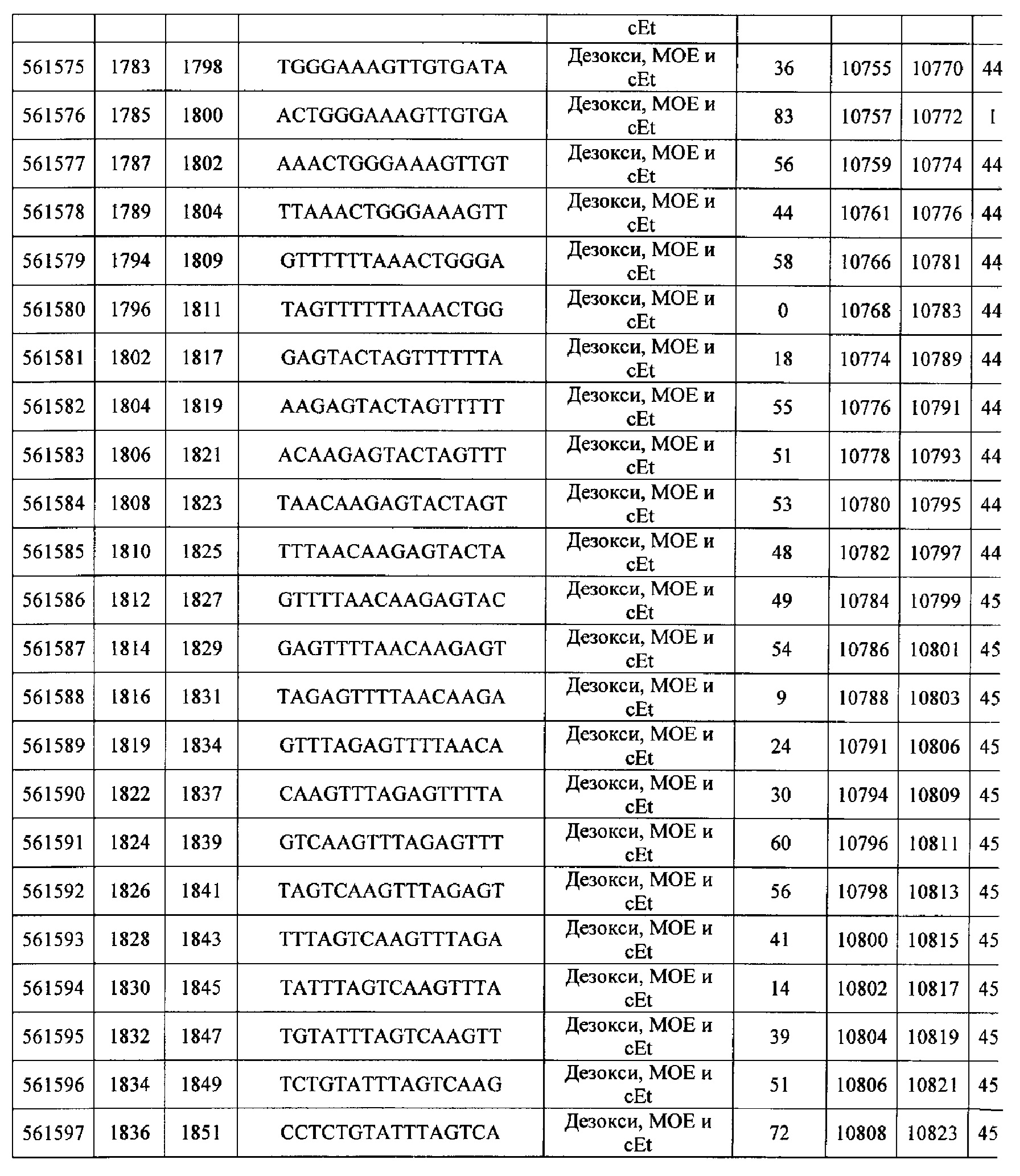







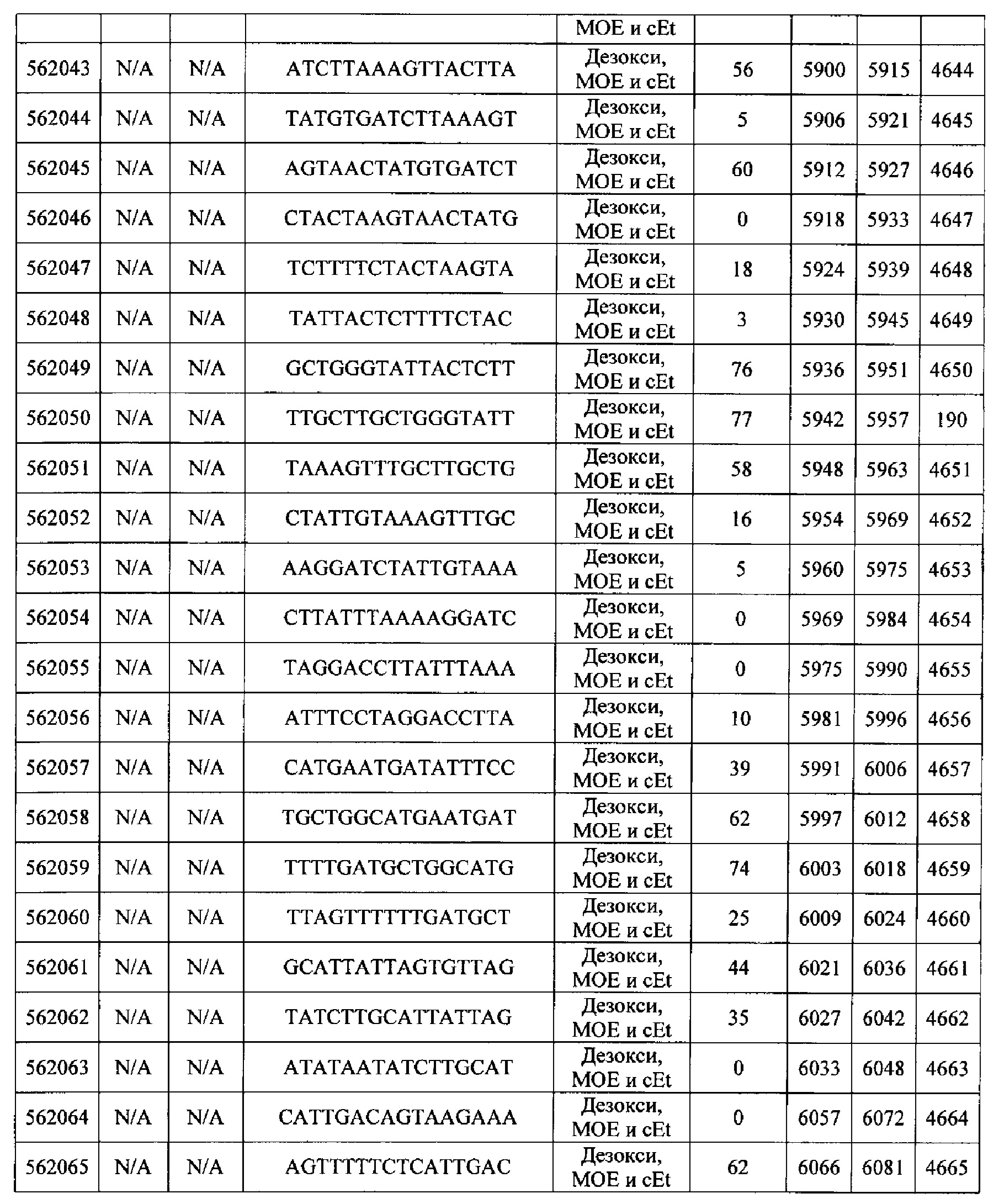






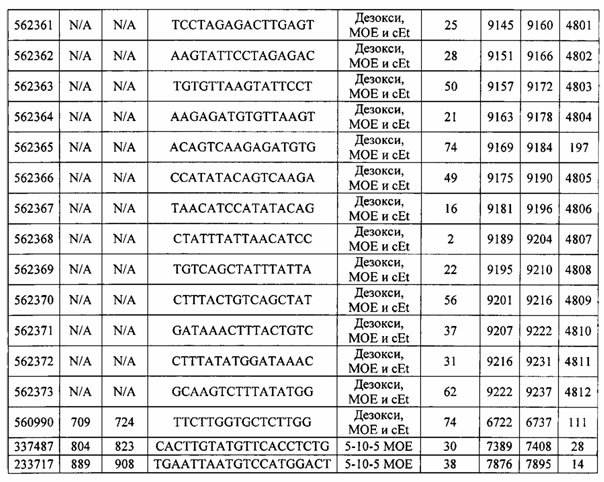
Пример 6. Антисмысловое ингибирование МОЕ-гэпмерами ANGPTL3 человека в клетках Нер3В
Были сконструированы дополнительные антисмысловые олигонуклеотиды, 5 таргетирующие нуклеиновую кислоту ангиопоэтин-подобного белка 3, и было испытано их воздействие на мРНК ANGPTL3 in vitro. Культивированные клетки Нер3В с плотностью 20000 клеток на лунку трансфецировали 4500 нМ антисмыслового олигонуклеотида с использованием электропорации. После периода обработки приблизительно 24 часа из клеток выделяли РНК и уровни мРНК ANGPTL3 измеряли методом количественной ПЦР в режиме 10 реального времени. Для измерения уровней мРНК использовали набор праймеров-зондов человека RTS3492_MGB. Уровни мРНК ANGPTL3 корректировали в соответствии с содержанием общей РНК, измеренным методом RIBOGREEN®. Результаты представлены в виде процента ингибирования ANGPTL3 относительно необработанных контрольных клеток.
Новосконструированные химерные антисмысловые олигонуклеотиды в таблицах ниже были сконструированы в виде 5-10-5 МОЕ или 3-10-4 МОЕ-гэпмеров. 5-10-5 МОЕ-гэпмеры состоят в длину из 20 нуклеозидов, причем центральный гэп-сегмент состоит из десяти 2'-дезоксинуклеозидов и фланкирован сегментами крыльев в 5'-направлении и 3'-направлении, содержащими по пять нуклеозидов каждый. Длина 3-10-4 МОЕ гэпмеров составляет 17 нуклеозидов, причем центральный гэп-сегмент содержит десять 2'-дезоксинуклеозидов и фланкирован сегментами крыла в 5'-направлении и 3' направлении, содержащими три и четыре нуклеозида, соответственно. Каждый нуклеозид в сегменте 5'-крыла и каждый нуклеозид в сегменте 3'-крыла имеет 2'-МОЕ-модификацию. Каждый нуклеозид в сегменте 5'-крыла и каждый нуклеозид в сегменте 3'-крыла имеет 2'-МОЕ-модификацию. Межнуклеозидные связи по всей длине каждого гэпмера представляют собой тиофосфатные (P=S) связи. Все остатки цитозина по всей длине каждого гэпмера представляют собой 5-метилцитозины. «Сайт инициации» обозначает наиболее удаленный 5'-нуклеозид, на который таргетирован гэпмер, в последовательности гена человека. «Сайт терминации» обозначает наиболее удаленный 3'-нуклеозид, на который таргетирован гэпмер, в последовательности гена человека. Каждый гэпмер, перечисленный в таблицах ниже, таргетирован или на мРНК ANGPTL3 человека, обозначенную в данном документе как SEQ ID NO: 1 (инвентаризационный №GENBANK NM_014495.2), или на геномную последовательность ANGPTL3 человека, обозначенную в данном описании как SEQ ID NO: 2 (инвентаризационный №GENBANK NT_032977.9, усеченный от нуклеотида 33032001 до 33046000). «n/а» обозначает, что антисмысловой олигонуклеотид не таргетирует конкретную последовательность гена со 100% комплементарностью.

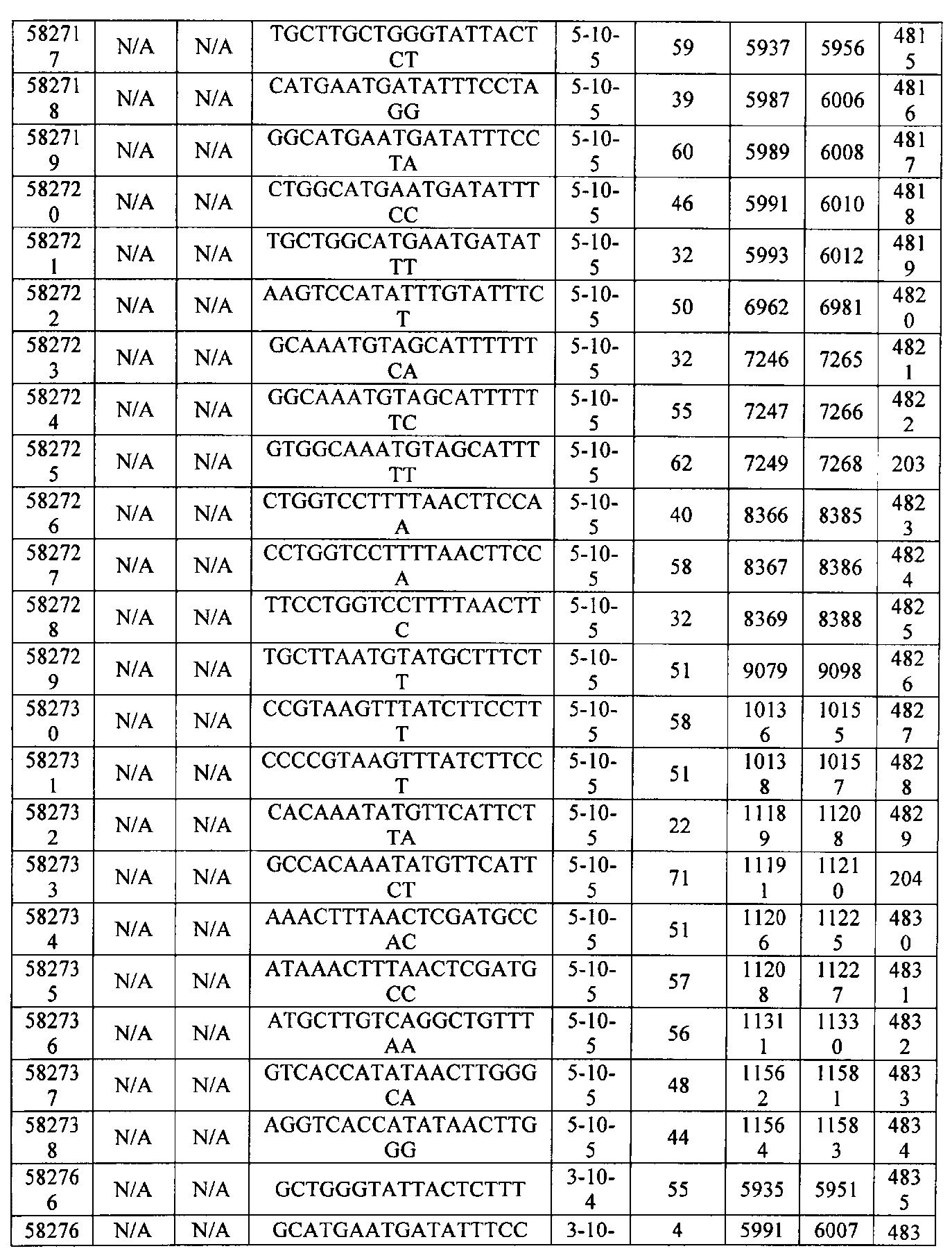



Пример 7. Дозозависимое антисмысловое ингибирование ANGPTL3 человека в клетках Нер3В
Дезокси-, МОЕ- и cEt-олигонуклеотиды из описанных выше исследований, проявившие значительное ингибирование мРНК ANGPTL3 in vitro, были отобраны и испытаны в различных дозах на клетках Нер3В. ISIS 233717 и ISIS 337847, оба представляющие собой 5-10-5 МОЕ-гэпмеры, также включены в исследования. Антисмысловые олигонуклеотиды испытывали в серии экспериментов, которые имели сходные условия культивирования. Результаты каждого эксперимента представлены в отдельных таблицах показанных ниже.
Клетки высевали с плотностью 20000 клеток на лунку и трансфецировали концентрациями антисмыслового олигонуклеотида 0,813 мкМ, 1,625 мкМ, 3,25 мкМ, 6,500 мкМ и 13,00 мкМ с использованием электропорации, как указано в таблице ниже. После периода обработки приблизительно 16 часов из клеток выделяли РНК и уровни мРНК ANGPTL3 измеряли методом количественной ПНР в режиме реального времени. Для измерения уровней мРНК использовали набор праймеров-зондов человека RTS3492_MGB. Уровни мРНК ANGPTL3 корректировали в соответствии с содержанием общей РНК, измеренным методом RIBOGREEN®. Результаты представлены в виде процента ингибирования ANGPTL3 относительно необработанных контрольных клеток.
Для каждого олигонуклеотида также приведена полумаксимальная ингибирующая концентрация (IC50). У обработанных антисмысловым олигонуклеотидом клеток дозозависимым образом были значительно снижены уровни мРНК ANGPTL3.





Пример 8. Дозозависимое антисмысловое ингибирование ANGPTL3 человека в клетках Нер3В
Дезокси-, МОЕ- и cEt-олигонуклеотиды из описанных выше исследований, проявившие значительное ингибирование мРНК ANGPTL3 in vitro, были отобраны и испытаны в различных дозах на клетках Нер3В. ISIS 337847, 5-10-5 МОЕ-гэпмер, также включен в исследования. Антисмысловые олигонуклеотиды испытывали в серии экспериментов, которые имели сходные условия культивирования. Результаты каждого эксперимента представлены в отдельных таблицах показанных ниже.
Клетки высевали с плотностью 20000 клеток на лунку и трансфецировали концентрациями антисмыслового олигонуклеотида 0,160 мкМ, 0,481 мкМ, 1,444 мкМ, 4,333 мкМ и 13,00 мкМ с использованием электропорации, как указано в таблице ниже. После периода обработки приблизительно 16 часов из клеток выделяли РНК и уровни мРНК ANGPTL3 измеряли методом количественной ПЦР в режиме реального времени. Для измерения уровней мРНК использовали набор праймеров-зондов человека RTS3492_MGB. Уровни мРНК ANGPTL3 корректировали в соответствии с содержанием общей РНК, измеренным методом RIBOGREEN®. Результаты представлены в виде процента ингибирования ANGPTL3 относительно необработанных контрольных клеток.
Для каждого олигонуклеотида также приведена полумаксимальная ингибирующая концентрация (IC50). У обработанных антисмысловым олигонуклеотидом клеток дозозависимым образом были значительно снижены уровни мРНК ANGPTL3.





Пример 9. Дозозависимое антисмысловое ингибирование МОЕ-гэпмерами ANGPTL3 человека в клетках Нер3В
МОЕ-гэпмеры из описанных выше Примеров, проявившие значительное ингибирование мРНК ANGPTL3 in vitro, были отобраны и испытаны в различных дозах на клетках Нер3В. Клетки высевали с плотностью 20000 клеток на лунку и трансфецировали концентрациями антисмыслового олигонуклеотида 0,160 мкМ, 0,481 мкМ, 1,444 мкМ, 4,333 мкМ и 13,00 мкМ с использованием электропорации, как указано в таблице ниже. После периода обработки приблизительно 16 часов из клеток выделяли РНК и уровни мРНК ANGPTL3 измеряли методом количественной ПЦР в режиме реального времени. Для измерения уровней мРНК использовали набор праймеров-зондов человека RTS3492_MGB. Уровни мРНК ANGPTL3 корректировали в соответствии с содержанием общей РНК, измеренным методом RIBOGREEN®. Результаты представлены в виде процента ингибирования ANGPTL3 относительно необработанных контрольных клеток.
Для каждого олигонуклеотида также приведена полумаксимальная ингибирующая концентрация (IC50). У обработанных антисмысловым олигонуклеотидом клеток дозозависимым образом были значительно снижены уровни мРНК ANGPTL3.


Пример 10. Дозозависимое антисмысловое ингибирование дезокси-, МОЕ- и (S)-cEt-олигонуклеотидами ANGPTL3 человека в клетках Нер3В
Дезокси-, МОЕ- и cEt-олигонуклеотиды из описанных выше исследований, проявившие значительное ингибирование мРНК ANGPTL3 in vitro, были отобраны и испытаны в различных дозах на клетках Нер3В. Клетки высевали с плотностью 20000 клеток на лунку и трансфецировали концентрациями антисмыслового олигонуклеотида 0,111 мкМ, 0,333 мкМ, 1,00 мкМ, 3,00 мкМ и 9,00 мкМ с использованием электропорации, как указано в таблице ниже. После периода обработки приблизительно 16 часов из клеток выделяли РНК и уровни мРНК ANGPTL3 измеряли методом количественной ПЦР в режиме реального времени. Для измерения уровней мРНК использовали набор праймеров-зондов человека RTS3492_MGB. Уровни мРНК ANGPTL3 корректировали в соответствии с содержанием общей РНК, измеренным методом RIBOGREEN®. Результаты представлены в виде процента ингибирования ANGPTL3 относительно необработанных контрольных клеток.
Для каждого олигонуклеотида также приведена полумаксимальная ингибирующая концентрация (IC50). У обработанных антисмысловым олигонуклеотидом клеток дозозависимым образом были значительно снижены уровни мРНК ANGPTL3.






Пример 11. Антисмысловое ингибирование ANGPTL3 у huANGPTL3-трансгенных мышей
Антисмысловые олигонуклеотиды, описанные выше в исследованиях, дополнительно оценивали на способность снижать уровень транскрипта мРНК ANGPTL3 человека у мышей С57B 1/6 с трансгеном ANGPTL3 человека (Tg-мыши).
Исследование 1
Самок Tg-мышей содержали при 12-часовом цикле освещения/темноты. До начала эксперимента животных акклиматизировали по меньшей мере в течение 7 дней в исследовательской лаборатории. Готовили антисмысловые олигонуклеотиды (АСН) в забуференном солевом растворе (PBS) и стерилизовали фильтрованием через фильтр с размером пор 0,2 микрона. Олигонуклеотиды растворяли в 0,9% растворе PBS для инъекций.
Группы мышей получали внутрибрюшинные инъекции 5-10-5 МОЕ-гэпмеров в дозе 50 мг/кг раз в неделю в течение 2 недель. Одна группа мышей получала подкожные инъекции PBS раз в неделю в течение 2 недель. Группа, которой инъецировали PBS, служила в качестве контрольной группы, с которой сравнивали соответствующие группы, которым применяли олигонуклеотиды.
Анализ РНК
В конце периода применения из печени выделяли РНК для анализа ПНР в режиме реального времени для измерения экспрессии мРНК ANGPTL3 с помощью RTS3492_MGB. Уровни мРНК также измеряли с набором праймеров-зондов человека RTS1984 (прямая последовательность CTTCAATGAAACGTGGGAGAACT, обозначенная в данном документе как SEQ ID NO: 7; обратная последовательность TCTCTAGGCCCAACCAAAATTC, обозначенная в данном документе как SEQ ID NO: 8; последовательность зонда AAATATGGTTTTGGGAGGCTTGAT, обозначенная в данном документе как SEQ ID NO: 9). Результаты представлены как процент изменения уровня мРНК относительно контроля PBS, нормализованного с помощью метода RIBOGREEN®. Как показано в таблице ниже, применение антисмысловых олигонуклеотидов ISIS приводило к значительному снижению уровней мРНК ANGPTL3, по сравнению с контролем PBS.

Анализ белка
Уровни белка ANGPTL3 человека количественно определяли с использованием коммерчески доступного набора для ИФА (№DANL30 по каталогу компании R&D Systems, г. Миннеаполис, Миннесота) с трансгенными образцами плазмы, разбавленными 1:20000, с использованием описанного производителем протокола. Результаты представлены в таблице ниже. Результаты указывают, что применение олигонуклеотидов ISIS привело к понижению уровней белка ANGPTL3.
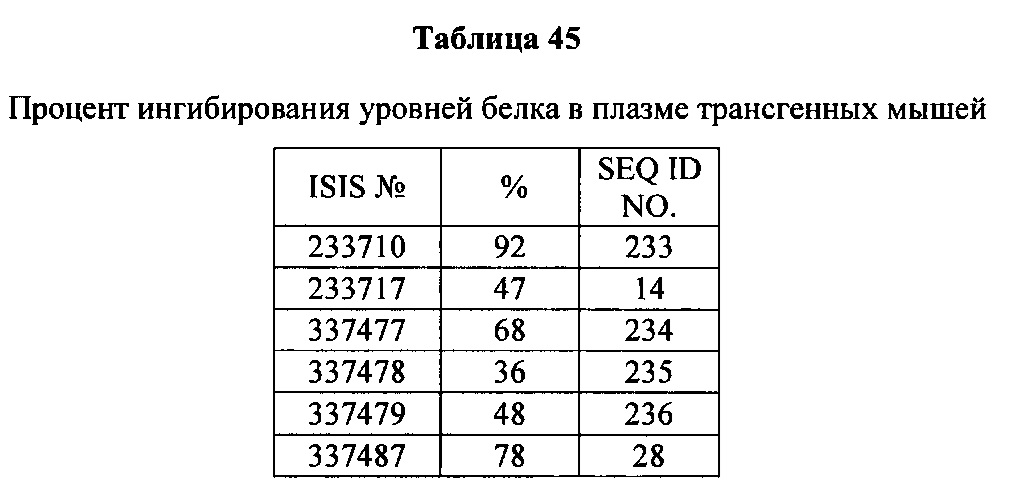
Химические маркеры плазмы
Для оценки влияния олигонуклеотидов ISIS на 10 сутки измеряли уровни трансаминаз (АЛТ и ACT) в плазме с использованием автоматизированного клинического химического анализатора (Hitachi Olympus AU400е, г. Мелвилл, Нью-Йорк). Результаты представлены в таблице ниже. Олигонуклеотиды ISIS, которые вызвали изменения уровней любого из этих функциональных маркеров печени за пределы ожидаемого для антисмысловых олигонуклеотидов диапазона, исключили из дальнейших исследований.


Исследование 2
Самцов Tg-мышей содержали при 12-часовом цикле освещения/темноты. До начала эксперимента животных акклиматизировали по меньшей мере в течение 7 дней в исследовательской лаборатории. Готовили антисмысловые олигонуклеотиды (АСН) в забуференном солевом растворе (PBS) и стерилизовали фильтрованием через фильтр с размером пор 0,2 микрона. Олигонуклеотиды растворяли в 0,9% растворе PBS для инъекций.
Группы мышей получали внутрибрюшинные инъекции 5-10-5 МОЕ-гэпмеров в дозе 50 мг/кг раз в неделю в течение 2 недель. Одна группа мышей получала подкожные инъекции PBS раз в неделю в течение 2 недель. Группы, которым инъецировали PBS, служили в качестве контрольных групп, с которыми сравнивали соответствующие группы, которым применяли олигонуклеотиды.
Анализ РНК
В конце периода применения из печени выделяли РНК для анализа ПЦР в режиме реального времени для измерения экспрессии мРНК ANGPTL3 с помощью RTS1984. Результаты представлены как процент изменения уровня мРНК относительно контроля PBS, нормализованного с помощью метода RIBOGREEN®. Как показано в таблице ниже, применение антисмысловых олигонуклеотидов ISIS приводило к значительному снижению уровней мРНК ANGPTL3, по сравнению с контролем PBS.


Анализ белка
Уровни белка ANGPTL3 человека количественно определяли с использованием коммерчески доступного набора для ИФА (№ DANL30 по каталогу компании R&D Systems, г. Миннеаполис, Миннесота) с трансгенными образцами плазмы, разбавленными 1:20000, с использованием описанного производителем протокола. Результаты представлены в таблице ниже. Результаты указывают, что применение олигонуклеотидов ISIS привело к снижению уровней белка ANGPTL3.

Химические маркеры плазмы
Для оценки влияния олигонуклеотидов ISIS на 8 сутки измеряли уровни трансаминаз (АЛТ и ACT) в плазме с использованием автоматизированного клинического химического анализатора (Hitachi Olympus AU400e, г. Мелвилл, Нью-Йорк). Результаты представлены в таблице ниже. Олигонуклеотиды ISIS, которые вызвали изменения уровней любого из этих функциональных маркеров печени за пределы ожидаемого для антисмысловых олигонуклеотидов диапазона, исключили из дальнейших исследований.
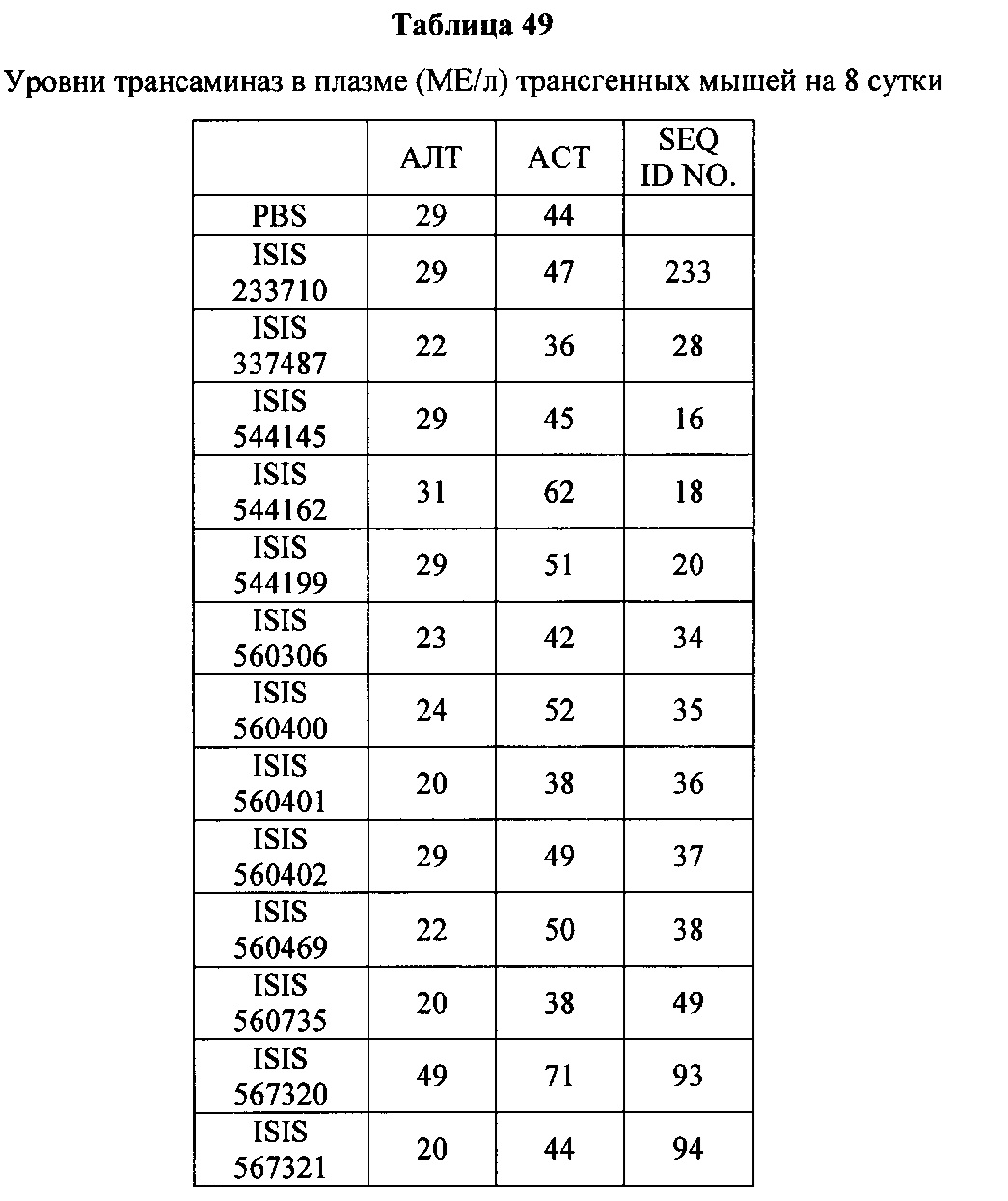
Исследование 3
Самцов и самок Tg-мышей содержали при 12-часовом цикле освещения/темноты. До начала эксперимента животных акклиматизировали по меньшей мере в течение 7 дней в исследовательской лаборатории. Готовили антисмысловые олигонуклеотиды (АСН) в забуференном солевом растворе (PBS) и стерилизовали фильтрованием через фильтр с размером пор 0,2 микрона. Олигонуклеотиды растворяли в 0,9% растворе PBS для инъекций.
Группы мышей получали внутрибрюшинные инъекции 5-10-5 МОЕ-гэпмеров в дозе 2,5 мг/кг, 12,5 мг/кг или 25 мг/кг раз в неделю в течение 3 недель. Одна группа мышей получала подкожные инъекции PBS раз в неделю в течение 2 недель. Группы, которым инъецировали PBS, служили в качестве контрольных групп, с которыми сравнивали соответствующие группы, которым применяли олигонуклеотиды.
Анализ РНК
В конце периода применения из печени выделяли РНК для анализа ПЦР в режиме реального времени для измерения экспрессии мРНК ANGPTL3 с помощью hANGPTL3_LTS01022 (прямая последовательность AAATTTTAGCCAATGGCCTCC, обозначенная в данном документе как SEQ ID NO: 10; обратная последовательность TGTCATTAATTTGGCCCTTCG, обозначенная в данном документе как SEQ ID NO: 11; последовательность зонда TCAGTTGGGACATGGTCTTAAAGACTTTGTCC, обозначенная в данном документе как SEQ ID NO: 12). Результаты представлены как процент изменения уровня мРНК относительно контроля PBS, нормализованного с помощью метода RIBOGREEN®. Как показано в таблице ниже, применение антисмысловых олигонуклеотидов ISIS приводило к значительному снижению уровней мРНК ANGPTL3, по сравнению с контролем PBS. В таблице ниже также представлена ED50 каждого гэпмера. «n/а» обозначает, что ED50 определить было невозможно.
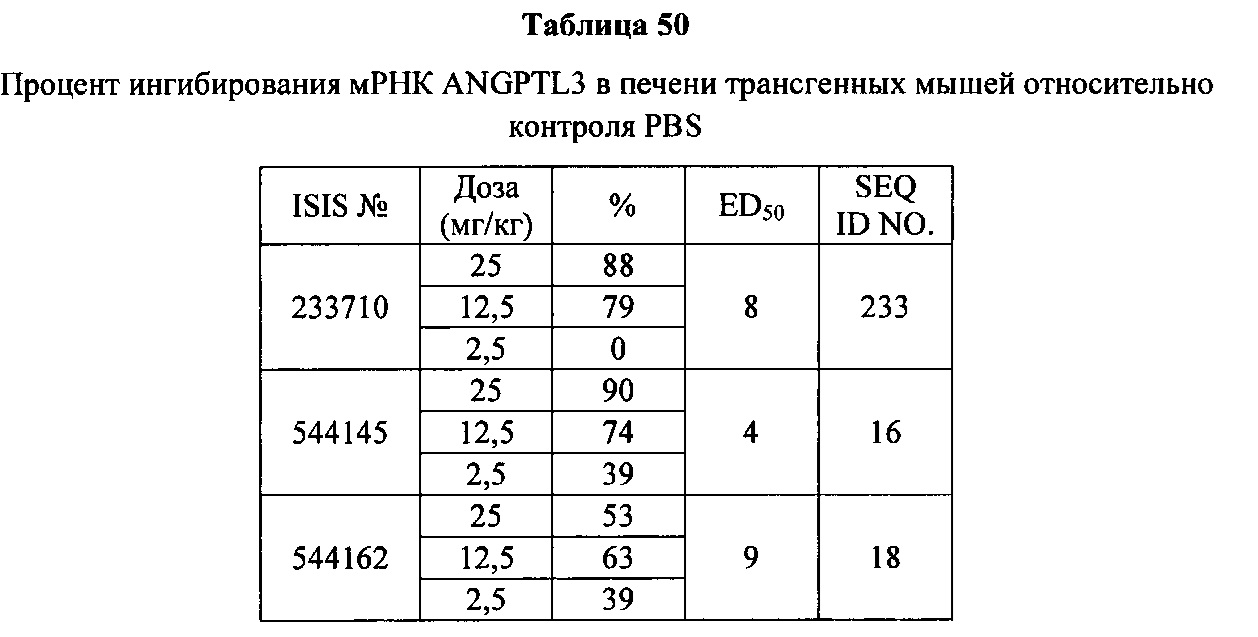

Анализ белка
Уровни белка ANGPTL3 человека количественно определяли с использованием коммерчески доступного набора для ИФА (№ DANL30 по каталогу компании R&D Systems, г. Миннеаполис, Миннесота) с трансгенными образцами плазмы, разбавленными 1:20000, с использованием описанного производителем протокола. Результаты представлены в таблице ниже. Результаты указывают, что применение олигонуклеотидов ISIS привело к снижению уровней белка ANGPTL3. «n/а» обозначает, что ED50 определить было невозможно.


Химические маркеры плазмы
Для оценки влияния олигонуклеотидов ISIS на 17 сутки измеряли уровни трансаминаз (АЛТ и ACT) в плазме с использованием автоматизированного клинического химического анализатора (Hitachi Olympus AU400e, г. Мелвилл, Нью-Йорк). Результаты представлены в таблице ниже. Олигонуклеотиды ISIS, которые вызвали изменения уровней любого из этих функциональных маркеров печени за пределы ожидаемого для антисмысловых олигонуклеотидов диапазона, исключили из дальнейших исследований.

Исследование 4
Самцов и самок Tg-мышей содержали при 12-часовом цикле освещения/темноты. До начала эксперимента животных акклиматизировали по меньшей мере в течение 7 дней в исследовательской лаборатории. Готовили антисмысловые олигонуклеотиды (АСН) в забуференном солевом растворе (PBS) и стерилизовали фильтрованием через фильтр с размером пор 0,2 микрона. Олигонуклеотиды растворяли в 0,9% растворе PBS для инъекций.
Группы мышей получали внутрибрюшинные инъекции 5-10-5 МОЕ-гэпмеров в дозе 25 мг/кг раз в неделю в течение 2 недель. Одна группа мышей получала подкожные инъекции PBS раз в неделю в течение 2 недель. Группа, которой инъецировали PBS, служила в качестве контрольной группы, с которой сравнивали соответствующие группы, которым применяли олигонуклеотиды.
Анализ РНК
В конце периода применения из печени выделяли РНК для анализа ПНР в режиме реального времени для измерения экспрессии мРНК ANGPTL3 с помощью hANGPTL3_LTS01022. Результаты представлены как процент изменения уровня мРНК относительно контроля PBS, нормализованного с помощью метода RIBOGREEN®. Как показано в таблице ниже, применение антисмысловых олигонуклеотидов ISIS приводило к значительному снижению уровней мРНК ANGPTL3, по сравнению с контролем PBS.


Химические маркеры плазмы
Для оценки влияния олигонуклеотидов ISIS на 10 сутки измеряли уровни трансаминаз (АЛТ и ACT) в плазме с использованием автоматизированного клинического химического анализатора (Hitachi Olympus AU400e, г. Мелвилл, Нью-Йорк). Результаты представлены в таблице ниже. Олигонуклеотиды ISIS, которые вызвали изменения уровней любого из этих функциональных маркеров печени за пределы ожидаемого для антисмысловых олигонуклеотидов диапазона, исключили из дальнейших исследований.


Исследование 5
Самцов и самок Tg-мышей содержали при 12-часовом цикле освещения/темноты. До начала эксперимента животных акклиматизировали по меньшей мере в течение 7 дней в исследовательской лаборатории. Готовили антисмысловые олигонуклеотиды (АСН) в забуференном солевом растворе (PBS) и стерилизовали фильтрованием через фильтр с размером пор 0,2 микрона. Олигонуклеотиды растворяли в 0,9% растворе PBS для инъекций.
Группы мышей получали внутрибрюшинные инъекции 5-10-5 МОЕ-гэпмеров или дезокси-, МОЕ- и cEt-гэпмеров в дозе 25 мг/кг раз в неделю в течение 2 недель. Одна группа мышей получала подкожные инъекции PBS раз в неделю в течение 2 недель. Группа, которой инъецировали PBS, служила в качестве контрольной группы, с которой сравнивали соответствующие группы, которым применяли олигонуклеотиды. Анализ РНК
В конце периода применения из печени выделяли РНК для анализа ПЦР в режиме реального времени для измерения экспрессии мРНК ANGPTL3 с помощью RTS1984. Результаты представлены как процент изменения уровня мРНК относительно контроля PBS, нормализованного с помощью метода RIBOGREEN®. Как показано в таблице ниже, применение антисмысловых олигонуклеотидов ISIS приводило к значительному снижению уровней мРНК ANGPTL3, по сравнению с контролем PBS.

Химические маркеры плазмы
Для оценки влияния олигонуклеотидов ISIS на 9 сутки измеряли уровни трансаминаз (АЛТ и ACT) в плазме с использованием автоматизированного клинического химического анализатора (Hitachi Olympus AU400e, г. Мелвилл Нью-Йорк). Результаты представлены в таблице ниже. Олигонуклеотиды ISIS, которые вызвали изменения уровней любого из этих функциональных маркеров печени за пределы ожидаемого для антисмысловых олигонуклеотидов диапазона, исключили из дальнейших исследований.

Исследование 6
Самцов и самок Tg-мышей содержали при 12-часовом цикле освещения/темноты. До начала эксперимента животных акклиматизировали по меньшей мере в течение 7 дней в исследовательской лаборатории. Готовили антисмысловые олигонуклеотиды (АСН) в забуференном солевом растворе (PBS) и стерилизовали фильтрованием через фильтр с размером пор 0,2 микрона. Олигонуклеотиды растворяли в 0,9% растворе PBS для инъекций.
Группы мышей получали внутрибрюшинные инъекции дезокси-, МОЕ- и cEt-олигонуклеотидов в дозе 25 мг/кг раз в неделю в течение 2 недель. ISIS 233710, 5-10-5 МОЕ-гэпмер, также включен в качестве эталона для сравнения. Одна группа мышей получала подкожные инъекции PBS раз в неделю в течение 2 недель. Группа, которой инъецировали PBS, служила в качестве контрольной группы, с которой сравнивали соответствующие группы, которым применяли олигонуклеотиды.
Анализ РНК
В конце периода применения из печени выделяли РНК для анализа ПЦР в режиме реального времени для измерения экспрессии мРНК ANGPTL3 с помощью hANGPTL3_LTS01022. Результаты представлены как процент изменения уровня мРНК относительно контроля PBS, нормализованного с помощью метода RIBOGREEN®. Как показано в таблице ниже, применение некоторых антисмысловых олигонуклеотидов ISIS приводило к значительному снижению мРНК ANGPTL3, по сравнению с контролем PBS.

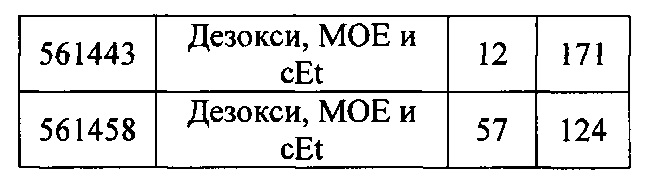
Анализ белка
Уровни белка ANGPTL3 человека количественно определяли с использованием коммерчески доступного набора для ИФА (№ DANL30 по каталогу компании R&D Systems, г. Миннеаполис, Миннесота) с трансгенными образцами плазмы, разбавленными 1:20000, с использованием описанного производителем протокола. Результаты представлены в таблице ниже. Результаты указывают, что применение некоторых олигонуклеотидов ISIS привело к снижению уровней белка ANGPTL3.

Химические маркеры плазмы
Для оценки влияния олигонуклеотидов ISIS на 10 сутки измеряли уровни трансаминаз (АЛТ и ACT) в плазме с использованием автоматизированного клинического химического анализатора (Hitachi Olympus AU400е, г. Мелвилл, Нью-Йорк). Результаты представлены в таблице ниже. Олигонуклеотиды ISIS, которые вызвали изменения уровней любого из этих функциональных маркеров печени за пределы ожидаемого для антисмысловых олигонуклеотидов диапазона, исключили из дальнейших исследований.

Исследование 7
Самцов и самок Tg-мышей содержали при 12-часовом цикле освещения/темноты. До начала эксперимента животных акклиматизировали по меньшей мере в течение 7 дней в исследовательской лаборатории. Готовили антисмысловые олигонуклеотиды (АСН) в забуференном солевом растворе (PBS) и стерилизовали фильтрованием через фильтр с размером пор 0,2 микрона. Олигонуклеотиды растворяли в 0,9% растворе PBS для инъекций.
Группы мышей получали внутрибрюшинные инъекции дезокси-, МОЕ- и cEt-олигонуклеотидов в дозе 25 мг/кг раз в неделю в течение 2 недель. ISIS 233710, 5-10-5 МОЕ-гэпмер, также включен в качестве эталона для сравнения. Одна группа мышей получала подкожные инъекции PBS раз в неделю в течение 2 недель. Группа, которой инъецировали PBS, служила в качестве контрольной группы, с которой сравнивали соответствующие группы, которым применяли олигонуклеотиды.
Анализ РНК
В конце периода применения из печени выделяли РНК для анализа ПЦР в режиме реального времени для измерения экспрессии мРНК ANGPTL3 с помощью hANGPTL3_LTS01022. Результаты представлены как процент изменения уровня мРНК относительно контроля PBS, нормализованного с помощью метода RIBOGREEN®. Как показано в таблице ниже, применение антисмысловых олигонуклеотидов ISIS приводило к значительному снижению уровней мРНК ANGPTL3, по сравнению с контролем PBS.


Анализ белка
Уровни белка ANGPTL3 человека количественно определяли с использованием коммерчески доступного набора для ИФА (№ DANL30 по каталогу компании R&D Systems, г. Миннеаполис, Миннесота) с трансгенными образцами плазмы, разбавленными 1:20000, с использованием описанного производителем протокола. Результаты представлены в таблице ниже. Результаты указывают, что применение определенных олигонуклеотидов ISIS привело к снижению уровней ANGPTL3. В данном случае, значение «0» подразумевает, что применение олигонуклеотида ISIS не ингибировало экспрессию; в некоторых случаях, могли быть зафиксированы повышенные уровни экспрессии.

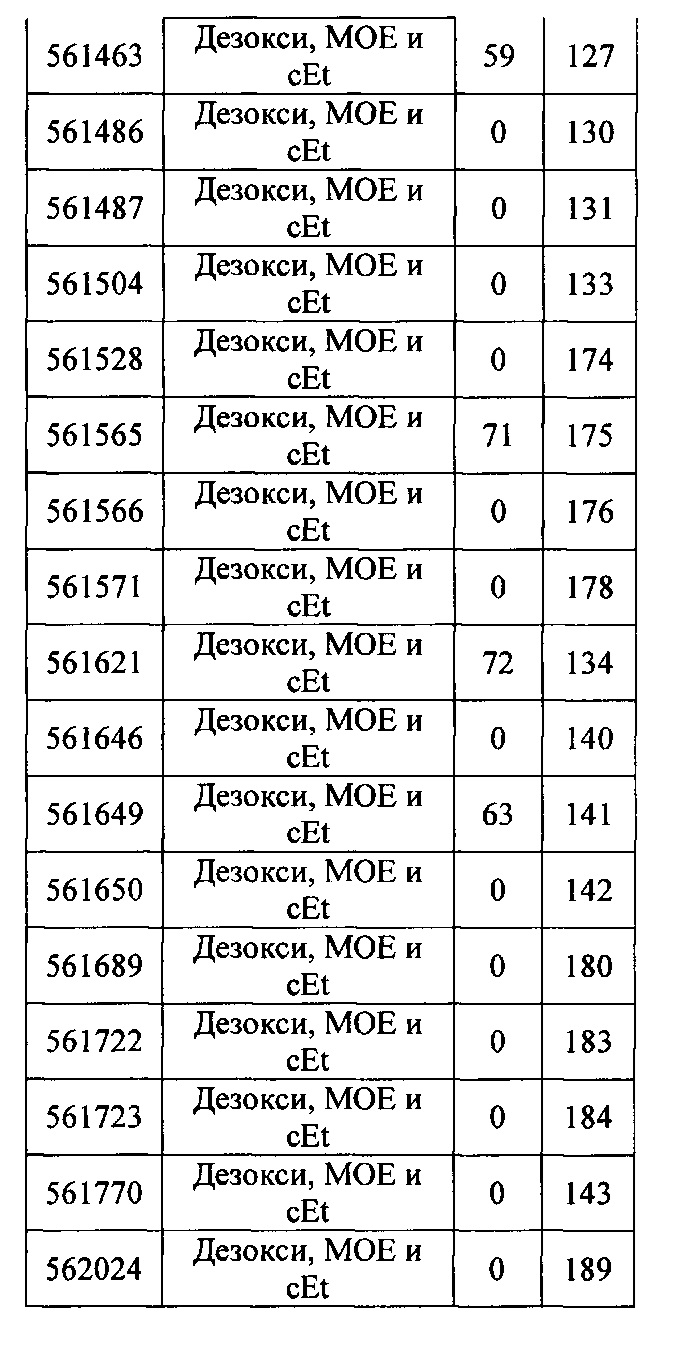
Химические маркеры плазмы
Для оценки влияния олигонуклеотидов ISIS на 9 сутки измеряли уровни трансаминаз (АЛТ и ACT) в плазме с использованием автоматизированного клинического химического анализатора (Hitachi Olympus AU400e, г. Мелвилл Нью-Йорк). Результаты представлены в таблице ниже. Олигонуклеотиды ISIS, которые вызвали изменения уровней любого из этих функциональных маркеров печени за пределы ожидаемого для антисмысловых олигонуклеотидов диапазона, исключили из дальнейших исследований.

Исследование 8
Самцов и самок Tg-мышей содержали при 12-часовом цикле освещения/темноты. До начала эксперимента животных акклиматизировали по меньшей мере в течение 7 дней в исследовательской лаборатории. Готовили антисмысловые олигонуклеотиды (АСН) в забуференном солевом растворе (PBS) и стерилизовали фильтрованием через фильтр с размером пор 0,2 микрона. Олигонуклеотиды растворяли в 0,9% растворе PBS для инъекций.
Группы мышей получали внутрибрюшинные инъекции дезокси-, МОЕ- и cEt-олигонуклеотидов в дозе 25 мг/кг раз в неделю в течение 2 недель. ISIS 233710, 5-10-5 МОЕ-гэпмер, также включен в качестве эталона для сравнения. Одна группа мышей получала подкожные инъекции PBS раз в неделю в течение 2 недель. Группа, которой инъецировали PBS, служила в качестве контрольной группы, с которой сравнивали соответствующие группы, которым применяли олигонуклеотиды.
Анализ РНК
В конце периода применения из печени выделяли РНК для анализа ПЦР в режиме реального времени для измерения экспрессии мРНК ANGPTL3 с помощью hANGPTL3_LTS01022. Результаты представлены как процент изменения уровня мРНК относительно контроля PBS, нормализованного с помощью метода RIBOGREEN®. Как показано в таблице ниже, применение антисмысловых олигонуклеотидов ISIS приводило к значительному снижению уровней мРНК ANGPTL3, по сравнению с контролем PBS.


Анализ белка
Уровни белка ANGPTL3 человека количественно определяли с использованием коммерчески доступного набора для ИФА (№ DANL30 по каталогу компании R&D Systems, г. Миннеаполис, Миннесота) с трансгенными образцами плазмы, разбавленными 1:20000, с использованием описанного производителем протокола. Результаты представлены в таблице ниже. Результаты указывают, что применение олигонуклеотидов ISIS привело к снижению уровней ANGPTL3.
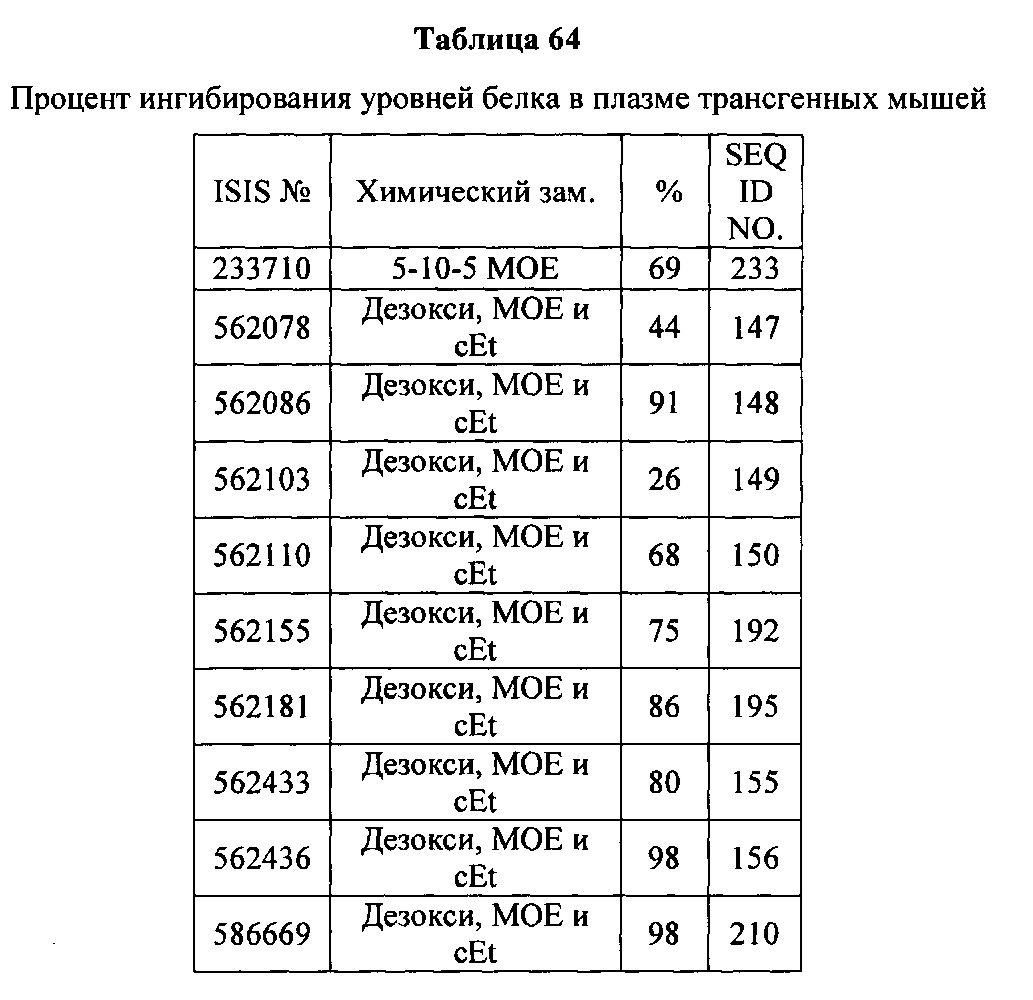
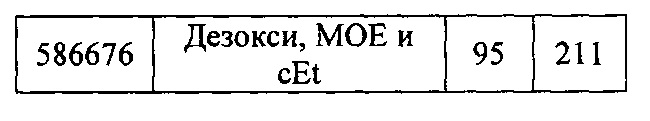
Химические маркеры плазмы
Для оценки влияния олигонуклеотидов ISIS на 8 сутки измеряли уровни трансаминаз (АЛТ и ACT) в плазме с использованием автоматизированного клинического химического анализатора (Hitachi Olympus AU400e, г. Мелвилл, Нью-Йорк). Результаты представлены в таблице ниже. Олигонуклеотиды ISIS, которые вызвали изменения уровней любого из этих функциональных маркеров печени за пределы ожидаемого для антисмысловых олигонуклеотидов диапазона, исключили из дальнейших исследований.

Исследование 9
Самцов и самок Tg-мышей содержали при 12-часовом цикле освещения/темноты. До начала эксперимента животных акклиматизировали по меньшей мере в течение 7 дней в исследовательской лаборатории. Готовили антисмысловые олигонуклеотиды (ACH) в забуференном солевом растворе (PBS) и стерилизовали фильтрованием через фильтр с размером пор 0,2 микрона. Олигонуклеотиды растворяли в 0,9% растворе PBS для инъекций.
Группы мышей получали внутрибрюшинные инъекции дезокси-, МОЕ- и cEt-олигонуклеотидов в дозе 25 мг/кг раз в неделю в течение 2 недель. ISIS 233710, 5-10-5 МОЕ-гэпмер, также включен в качестве эталона для сравнения. Одна группа мышей получала подкожные инъекции PBS раз в неделю в течение 2 недель. Группа, которой инъецировали PBS, служила в качестве контрольной группы, с которой сравнивали соответствующие группы, которым применяли олигонуклеотиды.
Анализ РНК
В конце периода применения из печени выделяли РНК для анализа ПЦР в режиме реального времени для измерения экспрессии мРНК ANGPTL3 с помощью hANGPTL3_LTS01022. Результаты представлены как процент изменения уровня мРНК относительно контроля PBS, нормализованного с помощью метода RIBOGREEN®. Как показано в таблице ниже, применение определенных антисмысловых олигонуклеотидов ISIS приводило к значительному снижению уровней мРНК ANGPTL3, по сравнению с контролем PBS. В данном случае, значение «0» подразумевает, что применение олигонуклеотида ISIS не ингибировало экспрессию; в некоторых случаях, могли быть зафиксированы повышенные уровни экспрессии.
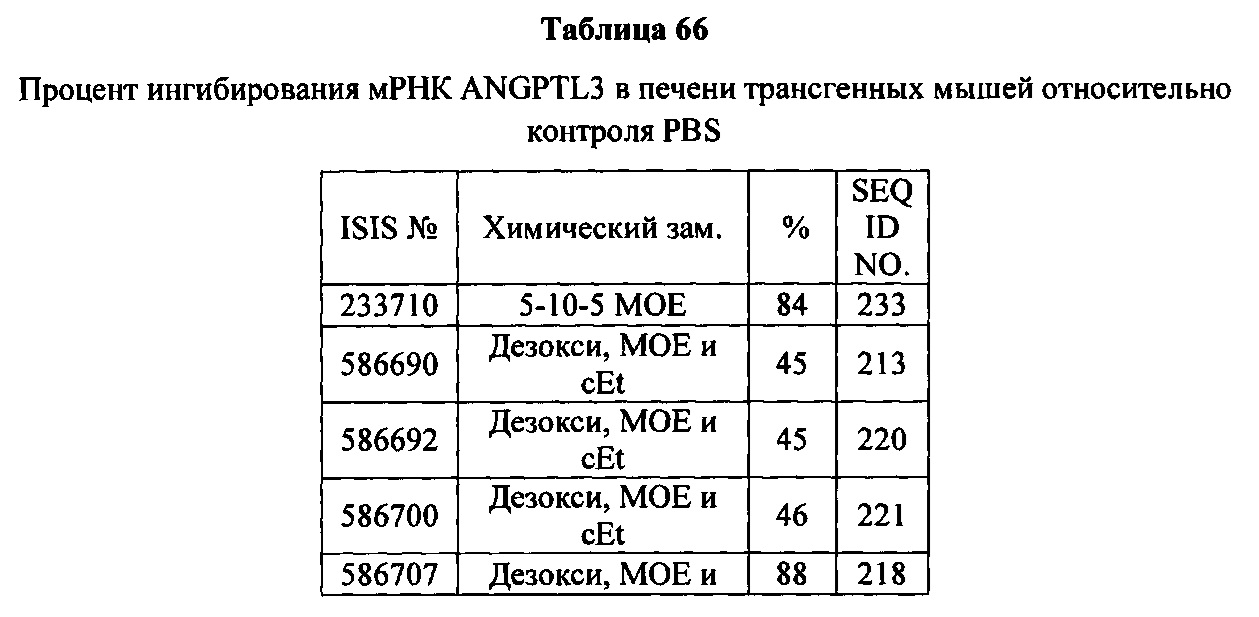

Анализ белка
Уровни белка ANGPTL3 человека количественно определяли с использованием коммерчески доступного набора для ИФА (№ DANL30 по каталогу компании R&D Systems, г. Миннеаполис, Миннесота) с трансгенными образцами плазмы, разбавленными 1:20000, с использованием описанного производителем протокола. Результаты представлены в таблице ниже. Результаты указывают, что применение определенных олигонуклеотидов ISIS привело к снижению уровней ANGPTL3. В данном случае, значение «0» подразумевает, что применение олигонуклеотида ISIS не ингибировало экспрессию; в некоторых случаях, могли быть зафиксированы повышенные уровни экспрессии.


Химические маркеры плазмы
Для оценки влияния олигонуклеотидов ISIS на 9 сутки измеряли уровни трансаминаз (АЛТ и ACT) в плазме с использованием автоматизированного клинического химического анализатора (Hitachi Olympus АU400e, г. Мелвилл Нью-Йорк). Результаты представлены в таблице ниже. Олигонуклеотиды ISIS, которые вызвали изменения уровней любого из этих функциональных маркеров печени за пределы ожидаемого для антисмысловых олигонуклеотидов диапазона, исключили из дальнейших исследований.


Исследование 10
Самцов и самок Tg-мышей содержали при 12-часовом цикле освещения/темноты. До начала эксперимента животных акклиматизировали по меньшей мере в течение 7 дней в исследовательской лаборатории. Готовили антисмысловые олигонуклеотиды (АСН) в забуференном солевом растворе (PBS) и стерилизовали фильтрованием через фильтр с размером пор 0,2 микрона. Олигонуклеотиды растворяли в 0,9% растворе PBS для инъекций.
Группы мышей получали внутрибрюшинные инъекции 5-10-5 МОЕ-гэпмеров или дезокси-, МОЕ- и cEt-олигонуклеотидов в дозе 5 мг/кг, 12,5 мг/кг и 25 мг/кг раз в неделю в течение 2 недель. Одна группа мышей получала подкожные инъекции PBS раз в неделю в течение 2 недель. Группа, которой инъецировали PBS, служила в качестве контрольной группы, с которой сравнивали соответствующие группы, которым применяли олигонуклеотиды.
Анализ РНК
В конце периода применения из печени выделяли РНК для анализа ПНР в режиме реального времени для измерения экспрессии мРНК ANGPTL3 с помощью hANGPTL3_LTS01022, а также с помощью RTS3492_MGB. Результаты представлены как процент изменения уровня мРНК относительно контроля PBS, нормализованного с помощью метода RIBOGREEN®. Как показано в таблице ниже, применение определенных антисмысловых олигонуклеотидов ISIS приводило к снижению уровней мРНК ANGPTL3, по сравнению с контролем PBS.

Химические маркеры плазмы
Для оценки влияния олигонуклеотидов ISIS на 8 сутки измеряли уровни трансаминаз (АЛТ и ACT) в плазме с использованием автоматизированного клинического химического анализатора (Hitachi Olympus AU400е, г. Мелвилл, Нью-Йорк). Результаты представлены в таблице ниже. Олигонуклеотиды ISIS, которые вызвали изменения уровней любого из этих функциональных маркеров печени за пределы ожидаемого для антисмысловых олигонуклеотидов диапазона, исключили из дальнейших исследований.

Пример 12. Переносимость антисмысловых олигонуклеотидов, таргетирующих ANGPTL3 человека, у мышей линии CD1
Мыши линии CD1® (Чарльз Ривер, Массачусетс) представляют собой многоцелевую мышиную модель, часто используемую для испытаний на безопасность и эффективность. Мышам применяли антисмысловые олигонуклеотиды ISIS, отобранные в исследованиях, описанных выше, и оценивали изменения уровней различных химических маркеров в плазме.
Исследование 1
Самцам мышей линии CD1 (одно животное на экспериментальную группу) внутрибрюшинно инъецировали одну дозу 200 мг/кг дезокси-, МОЕ- и cEt-олигонуклеотида. Одному самцу мыши линии CD1 подкожно инъецировали одну дозу PBS. Мышей умерщвляли эвтаназией через 48 часов после введения последней дозы, а органы и плазму собирали для дальнейшего анализа.
Химические маркеры плазмы
Для оценки влияния олигонуклеотидов ISIS на 4 сутки измеряли уровни трансаминаз (АЛТ и ACT) в плазме с использованием автоматизированного клинического химического анализатора (Hitachi Olympus AU400e, г. Мелвилл Нью-Йорк). Результаты представлены в таблице ниже. Олигонуклеотиды ISIS, которые вызвали изменения уровней любого из этих функциональных маркеров печени за пределы ожидаемого для антисмысловых олигонуклеотидов диапазона, исключили из дальнейших исследований.
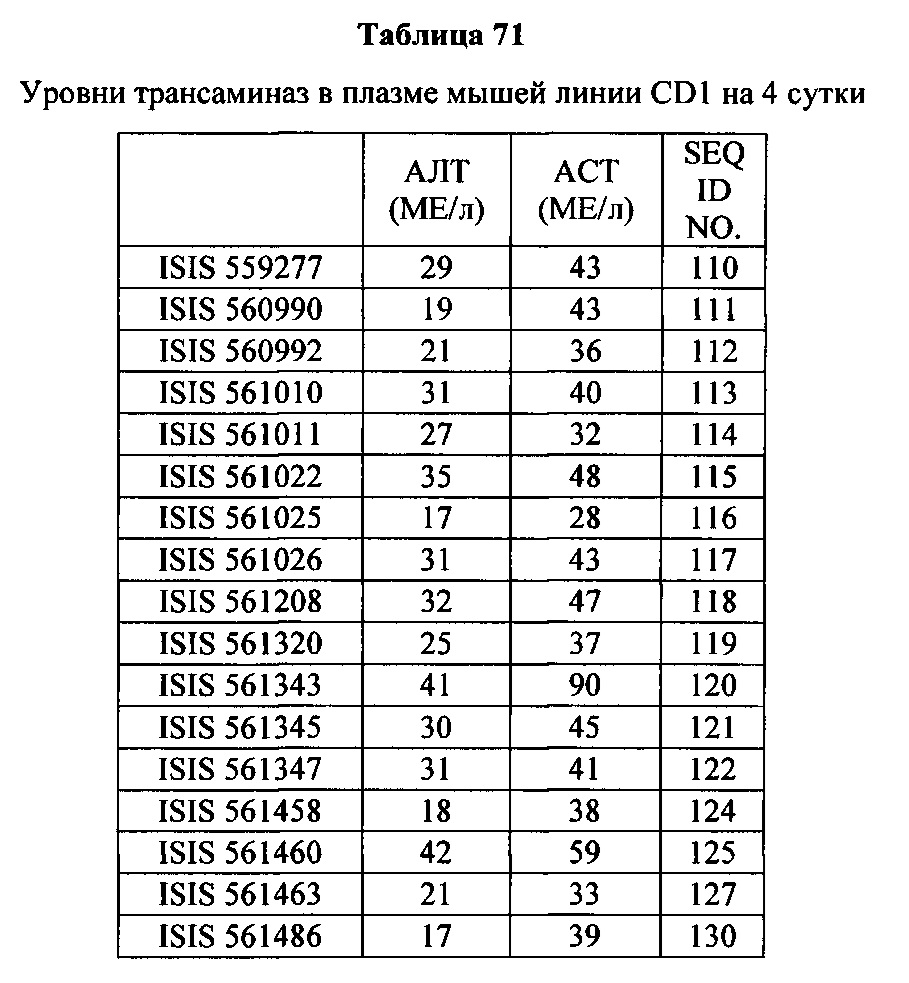

Масса тела
Массу тела измеряли через сутки после однократной дозы олигонуклеотида ISIS, а данные представлены в таблице ниже. Олигонуклеотиды ISIS, которые вызвали любые изменения массы органов за пределы ожидаемого для антисмысловых олигонуклеотидов диапазона, исключили из дальнейших исследований.

Исследование 2
Самцам мышей линии CD1 (одно животное на экспериментальную группу) внутрибрюшинно инъецировали одну дозу 200 мг/кг дезокси-, МОЕ- и cEt-олигонуклеотидов. Одному самцу мыши линии CD1 подкожно инъецировали одну дозу PBS. Мышей умерщвляли эвтаназией через 48 часов после введения последней дозы, а органы и плазму собирали для дальнейшего анализа.
Химические маркеры плазмы
Для оценки влияния олигонуклеотидов ISIS на 5 сутки измеряли уровни трансаминаз (АЛТ и ACT) в плазме с использованием автоматизированного клинического химического анализатора (Hitachi Olympus AU400e, г. Мелвилл Нью-Йорк). Результаты представлены в таблице ниже. Олигонуклеотиды ISIS, которые вызвали изменения уровней любого из этих функциональных маркеров печени за пределы ожидаемого для антисмысловых олигонуклеотидов диапазона, исключили из дальнейших исследований.

Масса тела
Массу тела измеряли на 5 сутки после однократной дозы олигонуклеотида ISIS, а данные представлены в таблице ниже. Олигонуклеотиды ISIS, которые вызвали любые изменения массы органов за пределы ожидаемого для антисмысловых олигонуклеотидов диапазона, исключили из дальнейших исследований.

Исследование 3
Самцам мышей линии CD1 (четыре животных на экспериментальную группу) внутрибрюшинно инъецировали 100 мг/кг 5-10-5 МОЕ-гэпмеров, применявшихся раз в неделю в течение 6 недель. Одной группе из 4 самцов мышей линии CD1 внутрибрюшинно инъецировали PBS, применявшийся раз в неделю в течение 6 недель. Мышей умерщвляли эвтаназией через 48 часов после введения последней дозы, а органы и плазму собирали для дальнейшего анализа.
Химические маркеры плазмы
Для оценки влияния олигонуклеотидов ISIS измеряли уровни в плазме различных функциональных маркеров печени и почек на 45 сутки с использованием автоматизированного клинического химического анализатора (Hitachi Olympus AU400e, г. Мелвилл, Нью-Йорк). Результаты представлены в таблице ниже. Олигонуклеотиды ISIS, которые вызвали изменения уровней любого из этих маркеров за пределы ожидаемого для антисмысловых олигонуклеотидов диапазона, исключили из дальнейших исследований.

Масса тела
Массу тела измеряли на 43 сутки, а данные представлены в таблице ниже. Массу почек, печени и селезенки измеряли в конце исследования на 45 сутки. Олигонуклеотиды ISIS, которые вызвали любые изменения массы органов за пределы ожидаемого для антисмысловых олигонуклеотидов диапазона, исключили из дальнейших исследований.


Исследование 4
Самцам мышей линии CD1 (четыре животных на экспериментальную группу) внутрибрюшинно инъецировали 50 мг/кг или 100 мг/кг 5-10-5 МОЕ-гэпмеров или дезокси-, МОЕ- и cEt-олигонуклеотидов, применявшихся раз в неделю в течение 6 недель. Одной группе из 4 самцов мышей линии CD1 внутрибрюшинно инъецировали PBS, применявшийся раз в неделю в течение 6 недель. Мышей умерщвляли эвтаназией через 48 часов после введения последней дозы, а органы и плазму собирали для дальнейшего анализа.
Химические маркеры плазмы
Для оценки влияния олигонуклеотидов ISIS измеряли уровни в плазме различных функциональных маркеров печени и почек на 46 сутки с использованием автоматизированного клинического химического анализатора (Hitachi Olympus AU400е, г. Мелвилл, Нью-Йорк). Результаты представлены в таблице ниже. Олигонуклеотиды ISIS, которые вызвали изменения уровней любого из этих маркеров за пределы ожидаемого для антисмысловых олигонуклеотидов диапазона, исключили из дальнейших исследований.
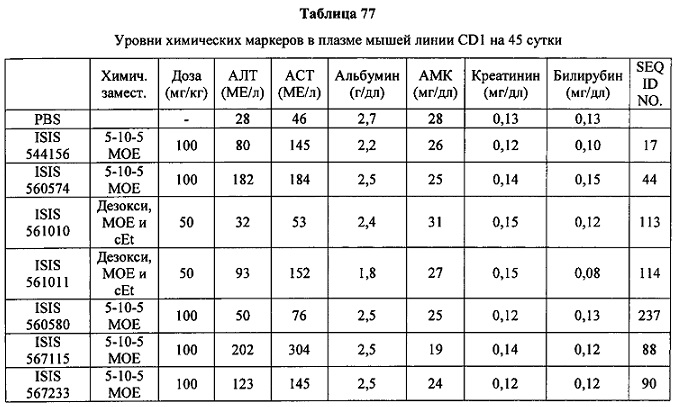
Масса тела
Массу тела измеряли на 44 сутки, а данные представлены в таблице ниже. Массу почек, печени и селезенки измеряли в конце исследования на 46 сутки. Олигонуклеотиды ISIS, которые вызвали любые изменения массы органов за пределы ожидаемого для антисмысловых олигонуклеотидов диапазона, исключили из дальнейших исследований.

Исследование 5
Самцам мышей линии CD1 (четыре животных на экспериментальную группу) внутрибрюшинно инъецировали 50 мг/кг дезокси-, МОЕ- и cEt-олигонуклеотидов, применявшихся раз в неделю в течение 6 недель. Одной группе из 4 самцов мышей линии CD1 внутрибрюшинно инъецировали PBS, применявшийся раз в неделю в течение 6 недель. Мышей умерщвляли эвтаназией через 48 часов после введения последней дозы, а органы и плазму собирали для дальнейшего анализа.
Химические маркеры плазмы
Для оценки влияния олигонуклеотидов ISIS измеряли уровни в плазме различных функциональных маркеров печени и почек на 43 сутки с использованием автоматизированного клинического химического анализатора (Hitachi Olympus AU400e, г. Мелвилл, Нью-Йорк). Результаты представлены в таблице ниже. Олигонуклеотиды ISIS, которые вызвали изменения уровней любого из этих маркеров за пределы ожидаемого для антисмысловых олигонуклеотидов диапазона, исключили из дальнейших исследований.

Масса тела
Массу тела измеряли на 41 сутки, а данные представлены в таблице ниже. Массу почек, печени и селезенки измеряли в конце исследования на 43 сутки. Олигонуклеотиды ISIS, которые вызвали любые изменения массы органов за пределы ожидаемого для антисмысловых олигонуклеотидов диапазона, исключили из дальнейших исследований.

Пример 13. Измерение вязкости антисмысловых олигонуклеотидов ISIS, таргетирующих ANGPTL3 человека
Вязкость отобранных антисмысловых олигонуклеотидов в исследованиях, описанных выше, измеряли с помощью скрининга антисмысловых олигонуклеотидов, которые имели вязкость более 40 сантипуаз (сП). Олигонуклеотиды, имеющие вязкостью более 40 сП, будут обладать неоптимальной вязкостью.
Олигонуклеотиды ISIS (32-35 мг) взвешивали в стеклянном флаконе, добавляли 120 мкл воды и растворяли антисмысловой олигонуклеотид в растворе нагреванием флакона при 50°C. Часть (75 мкл) предварительно нагретого образца пипеткой переносили в микровискозиметр (Cambridge). Температуру микровискозиметра устанавливали на 25°C и измеряли вязкость образца. Другую часть (20 мкл) предварительно нагретого образца пипеткой переносили в 10 мл воды для УФ-считывания при 260 нм при 85°C (УФ-прибор Cary). Результаты представлены в таблице ниже, в которой концентрация каждого антисмыслового олигонуклеотида составила 350 мг/мл, и указано, что большинство растворов антисмысловых олигонуклеотидов оптимальны по вязкости согласно критерию, установленного выше.

Пример 14. Переносимость антисмысловых олигонуклеотидов, таргетирующих ANGPTL3 человека, у крыс линии Спраг-Доули
Крысы линии Спраг-Доули представляют собой многоцелевую модель, используемую для оценивания безопасности и эффективности. Крысам применяли антисмысловые олигонуклеотиды ISIS из исследований, описанных в Примерах выше, и оценивали изменения уровней различных химических маркеров плазмы.
Исследование 1
Самцов крыс линии Спраг-Доули содержали при 12-часовом цикле освещения/темноты и обеспечивали свободный доступ к пище для здоровых крыс Purina, рацион 5001. Каждой в группе из 4 крыс линии Спраг-Доули подкожно инъецировали раз в неделю в течение 6 недель PBS или 100 мг/кг 5-10-5 МОЕ-гэпмеров. Через сорок восемь часов после введения последней дозы крыс умерщвляли эвтаназией, а органы и плазму собирали для дальнейшего анализа.
Функционирование печени
Для оценки влияния олигонуклеотидов ISIS на функционирование печени измеряли уровни трансаминаз в плазме с использованием автоматизированного клинического химического анализатора (Hitachi Olympus AU400e, г. Мелвилл, Нью-Йорк). Уровни АЛТ (аланинтрансаминаза) и ACT (аспартаттрансаминаза) в плазме измеряли на 45 сутки, и результаты, выраженные в МЕ/л, представлены ниже в таблице. Уровни билирубина в плазме также измеряли с использованием такого же клинического химического анализатора и результаты, выраженные в мг/дл, также представлены в таблице ниже. Олигонуклеотиды ISIS, которые вызвали изменения уровней любого из функциональных маркеров печени за пределы ожидаемого для антисмысловых олигонуклеотидов диапазона, исключили из дальнейших исследований.

Функционирование почек
Для оценки влияния олигонуклеотидов ISIS на функционирование почек измеряли в плазме уровни азота мочевины крови (АМК) и креатинина с использованием автоматизированного клинического химического анализатора (Hitachi Olympus AU400e, г. Мелвилл, Нью-Йорк). Результаты, выраженные в мг/дл, представлены в таблице ниже. Олигонуклеотиды ISIS, которые вызвали изменения уровней любого из функциональных маркеров почек за пределы ожидаемого для антисмысловых олигонуклеотидов диапазона, исключили из дальнейших исследований. Измеряли общие уровни белка мочи и креатинина мочи и оценивали соотношение общего белка мочи к креатинину. Результаты представлены в таблице ниже.

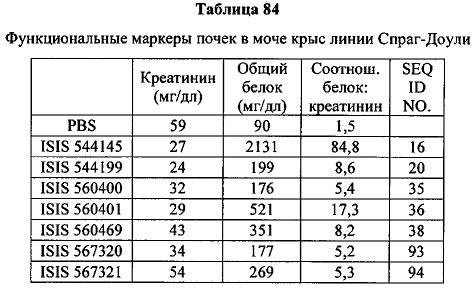
Масса тела
Массу тела измеряли на 42 сутки, а данные представлены в таблице ниже. Массу печени, селезенки и почек измеряли в конце исследования на 45 сутки, а данные представлены в таблице ниже. Олигонуклеотиды ISIS, которые вызвали любые изменения массы органов за пределы ожидаемого для антисмысловых олигонуклеотидов диапазона, исключили из дальнейших исследований.

Исследование 2
Самцов крыс линии Спраг-Доули содержали при 12-часовом цикле освещения/темноты и обеспечивали свободный доступ к пище для здоровых крыс Purina, рацион 5001. Каждой в группе из 4 крыс линии Спраг-Доули подкожно инъецировали раз в неделю в течение 6 недель PBS или 50 мг/кг или 100 мг/кг 5-10-5 МОЕ-гэпмеров или дезокси-, МОЕ- и cEt-олигонуклеотидов. Через сорок восемь часов после введения последней дозы крыс умерщвляли эвтаназией, а органы и плазму собирали для дальнейшего анализа.
Функционирование печени
Для оценки влияния олигонуклеотидов ISIS на функционирование печени измеряли уровни трансаминаз в плазме с использованием автоматизированного клинического химического анализатора (Hitachi Olympus AU400e, г. Мелвилл, Нью-Йорк). Уровни АЛТ (аланинтрансаминаза) и ACT (аспартаттрансаминаза) в плазме измеряли на 44 сутки, и результаты, выраженные в МЕ/л, представлены ниже в таблице. Уровни билирубина в плазме также измеряли с использованием такого же клинического химического анализатора и результаты, выраженные в мг/дл, также представлены в таблице ниже. Олигонуклеотиды ISIS, которые вызвали изменения уровней любого из функциональных маркеров печени за пределы ожидаемого для антисмысловых олигонуклеотидов диапазона, исключили из дальнейших исследований.

Функционирование почек
Для оценки влияния олигонуклеотидов ISIS на функционирование почек измеряли в плазме уровни азота мочевины крови (АМК) и креатинина на 44 сутки с использованием автоматизированного клинического химического анализатора (Hitachi Olympus AU400e, г. Мелвилл, Нью-Йорк). Результаты, выраженные в мг/дл, представлены в таблице ниже. Олигонуклеотиды ISIS, которые вызвали изменения уровней любого из функциональных маркеров почек за пределы ожидаемого для антисмысловых олигонуклеотидов диапазона, исключили из дальнейших исследований. Измеряли общие уровни белка мочи и креатинина мочи и оценивали соотношение общего белка мочи к креатинину. Результаты представлены в таблице ниже.

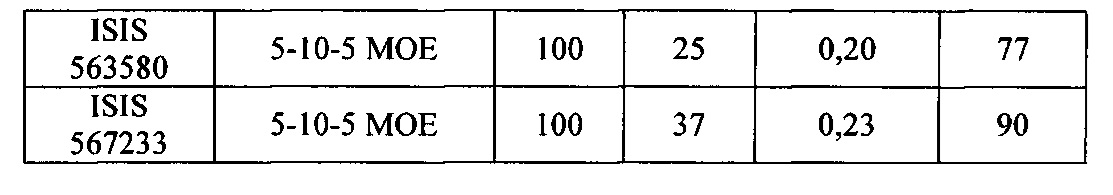

Масса тела
Массу тела измеряли на 42 сутки, а данные представлены в таблице ниже. Массу печени, селезенки и почек измеряли в конце исследования на 44 сутки, а данные представлены в таблице ниже. Олигонуклеотиды ISIS, которые вызвали любые изменения массы органов за пределы ожидаемого для антисмысловых олигонуклеотидов диапазона, исключили из дальнейших исследований.


Исследование 3
Самцов крыс линии Спраг-Доули содержали при 12-часовом цикле освещения/темноты и обеспечивали свободный доступ к пище для здоровых крыс Purina, рацион 5001. Каждой в группе из 4 крыс линии Спраг-Доули подкожно инъецировали раз в неделю в течение 6 недель PBS или 50 мг/кг дезокси-, МОЕ- и cEt-олигонуклеотидов. Через сорок восемь часов после введения последней дозы крыс умерщвляли эвтаназией, а органы и плазму собирали для дальнейшего анализа.
Функционирование печени
Для оценки влияния олигонуклеотидов ISIS на функционирование печени измеряли уровни трансаминаз в плазме с использованием автоматизированного клинического химического анализатора (Hitachi Olympus AU400e, г. Мелвилл, Нью-Йорк). Уровни АЛТ (аланинтрансаминаза) и ACT (аспартаттрансаминаза) в плазме измеряли на 44 сутки, и результаты, выраженные в МЕ/л, представлены ниже в таблице. Уровни билирубина в плазме также измеряли с использованием такого же клинического химического анализатора и результаты, выраженные в мг/дл, также представлены в таблице ниже. Олигонуклеотиды ISIS, которые вызвали изменения уровней любых маркеров функционирования печени за пределы ожидаемого для антисмысловых олигонуклеотидов диапазона, исключили из дальнейших исследований.

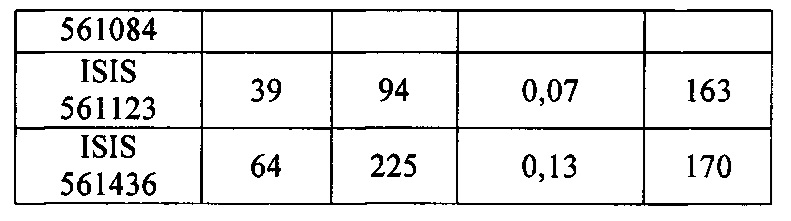
Функционирование почек
Для оценки влияния олигонуклеотидов ISIS на функционирование почек измеряли в плазме уровни азота мочевины крови (АМК) и креатинина на 44 сутки с использованием автоматизированного клинического химического анализатора (Hitachi Olympus AU400e, г. Мелвилл, Нью-Йорк). Результаты, выраженные в мг/дл, представлены в таблице ниже. Олигонуклеотиды ISIS, которые вызвали изменения уровней любого из функциональных маркеров почек за пределы ожидаемого для антисмысловых олигонуклеотидов диапазона, исключили из дальнейших исследований. Измеряли общие уровни белка мочи и креатинина мочи и оценивали соотношение общего содержания белка мочи к креатинину. Результаты представлены в таблице ниже.


Масса тела
Массу тела измеряли на 42 сутки, а данные представлены в таблице ниже. Массу печени, селезенки и почек измеряли в конце исследования на 44 сутки, а данные представлены в таблице ниже. Олигонуклеотиды ISIS, которые вызвали любые изменения массы органов за пределы ожидаемого для антисмысловых олигонуклеотидов диапазона, исключили из дальнейших исследований.

Пример 15. Влияние антисмысловых олигонуклеотидов ISIS, таргетирующих ANGPTL3 человека, у яванских макак
Яванским макакам применяли антисмысловые олигонуклеотиды ISIS, отобранные в исследованиях, описанных выше в Примерах. Была оценена эффективность и переносимость антисмысловых олигонуклеотидов, а также фармакокинетических профиль в печени и почках.
Во время проведения этого исследования геномная последовательность яванского макака была недоступна в базе данных Национального центре биотехнологической информации (NCBI); поэтому, не могла быть подтверждена перекрестная реактивность с последовательностью гена яванского макака. Вместо этого, последовательности антисмысловых олигонуклеотидов ISIS, примененных для яванских макак, сравнивали на гомологию с последовательностью макака-резус. Ожидалось, что олигонуклеотиды ISIS с гомологией с последовательностью макака-резус являются также полностью перекрестно реактивными с последовательностью яванского макака. Испытанные антисмысловые олигонуклеотиды человека являются перекрестно реактивными с геномной последовательностью макака-резус (GENBANK, инвентаризационный номер NW_001108682.1, укороченная от нуклеотида 3049001 до 3062000 и обозначенная в данном документе как SEQ ID NO: 3). Чем выше комплементарность между олигонуклеотидом человека и последовательностью макака-резус, тем вероятнее, что олигонуклеотид человека может перекрестно реагировать с последовательностью макака-резус. Сайты инициации и терминации каждого олигонуклеотида с SEQ ID NO: 3 представлены в таблице ниже. «Сайт инициации» обозначает наиболее удаленный 5'-нуклеозид, на который таргетирован гэпмер, в последовательности гена макака-резус. «Мисматчи» обозначают количество нуклеотидных оснований в олигонуклеотиде человека, которые некомплемантарны геномной последовательности макака-резус.

Применение
Перед исследованием макак держали на карантине в течение, по меньшей мере, периода 30 суток, во время которого животные ежедневно наблюдались на общее состояние здоровья. Макаки имели возраст 2-4 года и массу между 2 и 4 кг. Девять групп, каждая из 5 рандомизированно отобранных самцов яванских макак, которым подкожно инъецировали олигонуклеотид ISIS или PBS в четыре места на спине по часовой стрелке (т.е. слева, вверху, справа и внизу), по одной дозе в одно место. Макакам давали насыщающие дозы PBS или 40 мг/кг олигонуклеотида ISIS каждые двое суток в течение первой недели (сутки 1, 3, 5 и 7) и впоследствии вводили дозы PBS или 40 мг/кг олигонуклеотида ISIS раз в неделю в течение 12 недель (14, 21, 28, 35, 42, 49, 56, 63, 70, 77 и 84 сутки).
Во время периода исследования макак наблюдали ежедневно два раза на признаки заболевания или недомогания. Любое животное, испытывавшее из-за применения, повреждения или заболевания большее беспокойство, чем кратковременную или слабую боль или недомогание, после консультации руководителя исследования проходило лечение ветеринарным персоналом утвержденными анальгетиками или средствами для облегчения боли. Идентифицировали любое животное со слабым здоровьем или возможным состоянием угасания для проведения дополнительного мониторинга и возможной эвтаназии. К примеру, было обнаружено одно животное в группе применения ISIS 567321 в состоянии угасания на 45 сутки и выведено из исследования. Запланированная эвтаназия животных проводилась на 86 сутки (приблизительно через 48 часов после введения последней дозы) путем обескровливания после кетамин/ксилазин-индуцированной анестезии и введения натрия пентобарбитала. Протоколы, описанные в Примере, были одобрены Институциональным комитетом по содержанию и использованию животных (IACUC).
Снижение содержания мишени в печени
Анализ РНК
На 86 сутки из печени выделяли РНК для анализа ПЦР в режиме реального времени для измерения экспрессии мРНК ANGPTL3. Результаты представлены как процент изменения уровней мРНК относительно контроля PBS, нормализованного с помощью метода RIBOGREEN®. Как показано в таблице ниже, применение антисмысловых олигонуклеотидов ISIS приводило к значительному снижению уровней мРНК ANGPTL3, по сравнению с контролем PBS. Анализ уровней мРНК ANGPTL3 выявил, что ISIS 544199 и ISIS 559277, которые оба являются полностью перекрестно реактивными с последовательностью макака-ресус, значительно снизили уровни экспрессии. Другие олигонуклеотиды ISIS, которые таргетировали последовательность макака с мисматчами, также были способны снижать уровни мРНК ANGPTL3.

Анализ белка
На 85 сутки у всех доступных животных отбирали приблизительно 1 мл крови и помещали в пробирки, содержавшие калийную соль ЭДТА. Для получения плазмы образцы крови помещали на лед и центрифугировали (3000 об/мин в течение 10 мин при 4°C).
Уровни белка ANGPTL3 человека количественно определяли с использованием коммерчески доступного набора для ИФА (№ DANL30 по каталогу компании R&D Systems, г. Миннеаполис, Миннесота) с трансгенными образцами плазмы, разбавленными 1:20000, с использованием описанного производителем протокола. Результаты представлены в таблице ниже. Анализ ANGPTL3 в плазме выявил, что ISIS 563580, 544199 и ISIS 559277 снизили уровни подтвержденным порядком. Другие олигонуклеотиды ISIS также были способны снижать уровни мРНК ANGPTL3.


Исследования переносимости
Измерения массы тела
Для оценки влияния олигонуклеотидов ISIS измеряли общее состояние здоровья животных, массу тела и органов, а данные представлены в таблице ниже. Результаты указывают, что влияние применения антисмысловых олигонуклеотидов на массу тела, находилось в пределах ожидавшегося для антисмысловых олигонуклеотидов диапазона. Особенно применение ISIS 563580 хорошо переносилось относительно массы тела макак.

Функционирование печени
Для оценки влияния олигонуклеотидов ISIS на функционирование печени, у всех исследуемых групп отбирали образцы крови. Образцы крови отбирали через 48 часов после введения доз из цефалических, сафенозных или феморальных вен. Перед отбором крови макаки голодали в течение ночи. Для отделения сыворотки кровь собирали в пробирки без антикоагулянта. Для получения сыворотки пробирки выдерживали при комнатной температуре в течение минимум 90 минут и потом центрифугировали (приблизительно при 3000 об/мин в течение 10 мин). Уровни различных функциональных маркеров печени измеряли с использованием химического анализатора Toshiba 200FR NEO (Toshiba Co., Япония). Измеряли уровни АЛТ и ACT в плазме, и результаты, выраженные в МЕ/л, представлены ниже в таблице. Сходным образом измеряли уровень билирубина, функционального маркера печени, и результаты, выраженные в мг/дл, также представлены в таблице ниже. Результаты указывают, что большинство антисмысловых олигонуклеотидов не оказывало влияния на функционирование печени вне ожидаемого для антисмысловых олигонуклеотидов диапазона. Особенно применение ISIS 563580 хорошо переносилось у макак относительно функционирования печени.
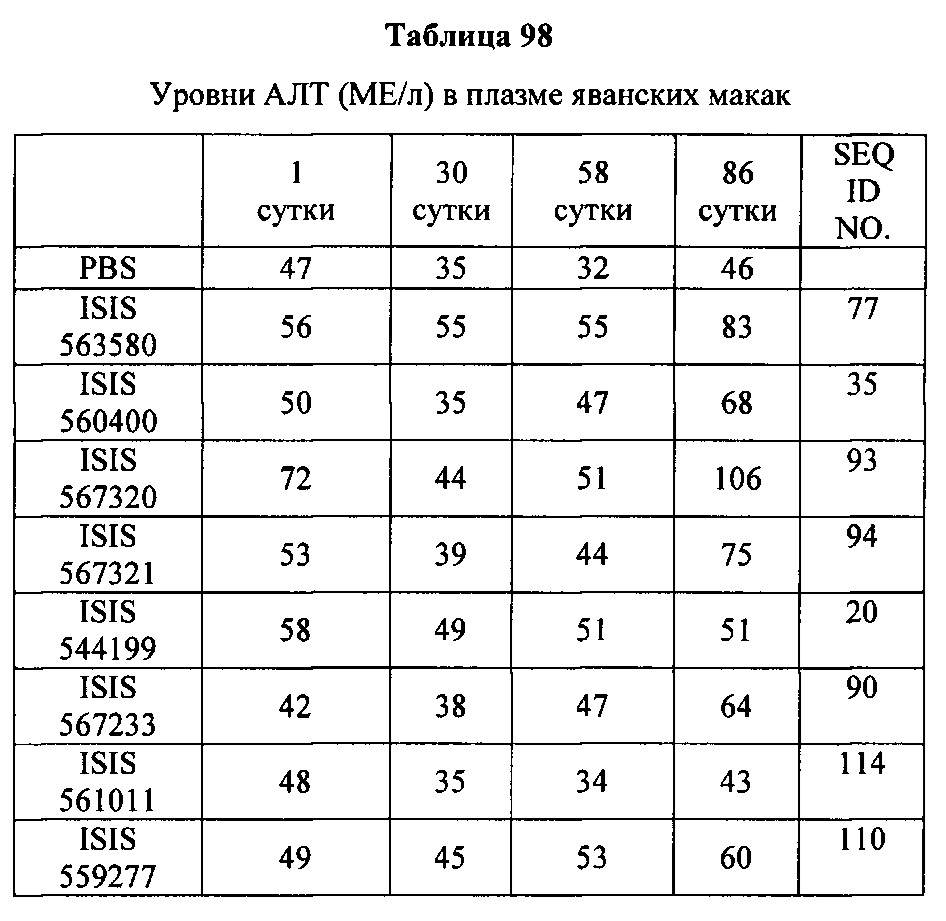


Функционирование почек
Для оценки влияния олигонуклеотидов ISIS на функционирование почек, у всех исследуемых групп отбирали образцы крови. Образцы крови отбирали через 48 часов после введения доз из цефалических, сафенозных или феморальных вен. Перед отбором крови макаки голодали в течение ночи. Для отделения сыворотки кровь собирали в пробирки без антикоагулянта. Для получения сыворотки пробирки выдерживали при комнатной температуре в течение минимум 90 минут и потом центрифугировали (приблизительно при 3000 об/мин в течение 10 мин). Уровни АМК и креатинина измеряли с использованием химического анализатора Toshiba 200FR NEO (Toshiba Co., Япония). Результаты, выраженные в мг/дл, представлены в таблице ниже.
Данные химического анализа плазмы показывают, что большинство олигонуклеотидов ISIS не оказывало какого-либо влияния на почечную функцию вне ожидаемого для антисмысловых олигонуклеотидов диапазона. Особенно применение ISIS 563580 хорошо переносилось относительно функционирования почек макак.



Гематологические анализы
Чтобы оценить какое-либо влияние олигонуклеотидов ISIS на гематологические параметры яванских макак, образцы крови объемом приблизительно 0,5 мл крови отбирали у каждого из доступных исследуемых животных в пробирки, содержащие K2-ЭДТА. Образцы анализировали на количество эритроцитов (КЭ), количество белых клеток крови (БКК), количество отдельных типов клеток крови, таких как моноциты, нейтрофилы, лимфоциты, а также количество тромбоцитов, содержание гемоглобина и гематокрит, с использованием гематологического анализатора ADVIA120 (Bayer, США). Данные представлены в таблице ниже.
Полученные данные указывают, что олигонуклеотиды в этой дозе не вызвали каких-либо изменений гематологических параметров за пределы ожидаемого для антисмысловых олигонуклеотидов диапазона. Особенно применение ISIS 563580 хорошо переносилось относительно гематологических параметров макак.



Влияние на провоспалительные молекулы
Для оценки любого воспалительного эффекта олигонуклеотидов ISIS у яванских макак отбирали образцы крови для анализа уровней C-реактивного белка и С3 на 84 сутки до введения доз. У каждого животного отбирали приблизительно 1,5 мл крови и, для отделения сыворотки, помещали в пробирки без антикоагулянта. Для получения сыворотки пробирки выдерживали при комнатной температуре в течение минимум 90 мин и потом центрифугировали при 3000 об/мин в течение 10 мин при комнатной температуре. Измеряли уровни C-реактивного белка (CRP) и комплемента С3, которые служат в качестве маркеров воспаления, с использованием химического анализатора Toshiba 200FR NEO (Toshiba Co., Япония). Результаты указывают, что применение ISIS 563580 переносилось организмом макак.


Измерение концентрации олигонуклеотидов
Измеряли концентрацию полноразмерного олигонуклеотида. Метод представляет собой модификацию ранее опубликованных способов (Leeds et al., 1996; Geary et al., 1999), которые содержат экстракцию фенолом-хлороформом (жидкость-жидкость) с последующей твердофазной экстракцией. Перед экстракцией добавляли внутренний стандарт (ISIS 355868, 27-мерный 2'-O-метоксиэтилмодифицированный тиофосфатный олигонуклеотид, GCGTTTGCTCTTCTTCTTGCGTTTTTT, обозначенный в данном документе как SEQ ID NO: 13). Концентрации образцов в ткани рассчитывали с использованием калибровочных прямых с нижним пределом количественного определения (НПКО) приблизительно 1,14 мкг/г. Результаты, выраженные в виде мкг/г ткани печени или почек, представлены в таблице ниже. Рассчитывали соотношение концентраций полноразмерного олигонуклеотида в почках по сравнению с печенью. Обнаружено, что наиболее оптимальное соотношение концентраций полноразмерного олигонуклеотида в почках по сравнению с печенью после применения перед другими оцененными соединениями было у ISIS 563580.

Пример 16. Клиническое испытание ISIS 563580
Для оценки влияния исследуемого препарата ISIS 563580 на здоровых добровольцах с нормальным липидным профилем проводили слепое рандомизированное плацебо-контролированное клиническое исследование 1 фазы с увеличением дозы. В исследовании оценивали безопасность, переносимость, фармакокинетику, влияние на уровни ANGPLT3 в плазме и липопротеиновый профиль у исследуемых субъектов после однократного или многократного введения доз исследуемого препарата ISIS 563580.
Исследуемая популяция состояла из здоровых мужчин и женщин возрастом 18-65 лет включительно. Критерии исключения включали клинически значимые аномалии в истории болезни и значения лабораторного скрининга любого из субъектов. В каждой однодозовой или многодозовой когорте для получения ISIS 563580 или плацебо субъекты рандомизировались 3:1. Субъектам подкожно (ПК) вводили исследуемый препарат или плацебо.
В течение всего исследования регулярно отбирали образцы крови и мочи для анализов на безопасность, фармакокинетические и фармакодинамические параметры. Безопасность и переносимость ISIS 563580 оценивали определением частоты возникновения, тяжести и зависимости от дозы нежелательных явлений, показателей жизнедеятельности и клинических лабораторных параметров. Результаты анализа безопасности для субъектов, получавших дозы ISIS 563580, сравнивали с результатами для субъектов, получавших дозы плацебо.
Наиболее частыми нежелательными явлениями были легкие местные реакции в месте инъекции. Применение ISIS 563580 в целом хорошо переносилось и продемонстрировало приемлемый профиль безопасности.
Исследуемый препарат и применение в однодозовом исследовании
Использовался раствор исследуемого препарата ISIS 563580 (200 мг/мл, 1,0 мл), содержавшийся в закрытых пробками стеклянных флаконах на 2 мл. Флаконы предназначались только для однократного использования. Раствор ISIS 563580 и плацебо готовил фармацевт (или квалифицированный представитель). Квалифицированный специалист каждый день применения дозы вводил однократную дозу исследуемого препарата в брюшную полость, бедро или внешнюю часть верхнего предплечья. В это исследование всего было включено 16 субъектов. План исследования представлен в таблице ниже:

Объемы подкожных инъекций составляли 0,25, 0,5, 1,0 и 2,0 мл, соответственно, для когорт A, B, C и D, где объем 2,0 мл, вводился в виде 2 непоследовательных инъекций по 1,0 мл. Для когорты A между введениями исследуемого препарата первым двум субъектам и оставшимся 2 субъектам в когорте требовался период времени по меньшей мере 24 часа. Увеличение доз происходило, когда субъекты в предыдущей однодозовой когорте завершили получение доз и оценка безопасности на 4 сутки продемонстрировала приемлемый профиль безопасности.
Продолжительность участия каждого субъекта приблизительно составила 8 недель, включая 4-х недельный период скрининга, для одной дозы, и 4-х недельный период оценки после применения. Субъекты совершали дополнительные визиты в исследовательский центр на 2, 4, 8, 15 сутки и отвечали на телефонный звонок на 30 сутки. Оценивалось влияние исследуемого препарата.
Исследуемый препарат и применение в многодозовом исследовании
Использовался раствор исследуемого препарата ISIS 563580 (200 мг/мл, 1,0 мл), содержавшийся в закрытых пробками стеклянных флаконах. Флаконы предназначались только для однократного использования. Раствор ISIS 563580 и плацебо готовил фармацевт (или квалифицированный представитель). Квалифицированный специалист каждый день применения дозы вводил исследуемый препарат в брюшную полость, бедро или внешнюю часть верхнего предплечья. В это исследование всего было включено 32 субъектов. План исследования представлен в таблице ниже.

Объемы подкожных инъекций составляли 0,5, 1,0, 1,5 и 2,0 мл, соответственно, для когорт АА, BB, СС и DD, где объем 2,0 мл, вводился в виде 2 непоследовательных инъекций по 1,0 мл. Введение доз для первой когорты (Когорта АА) начиналось после того, когда по меньшей мере 4 субъекта в однодозовой когорте (Когорта D) завершили получение доз и оценка безопасности на 4 сутки продемонстрировала приемлемый профиль безопасности. Субъекты, получившие 3 подкожные дозы исследуемого препарата в течение 1 недели в альтернативные дни (1, 3 и 5 сутки), потом получали ПК введения раз в неделю в течение следующих 5 недель (8, 15, 22, 29 и 36 сутки) в общем 8 доз.
Продолжительность участия каждого субъекта приблизительно составила 5,5 месяцев, включая 4-х недельный период скрининга, 6-х недельный период применения и 13-недельный период оценки после применения. Субъекты совершали дополнительные визиты в исследовательский центр на 37, 43, 50, 64, 78, 92, 106 и 127 сутки. Результаты липидных профилей субъектов на 36 сутки представлены в таблице ниже. Звездочками указано статистически значимые изменения (p<0,05).
Применение ISIS 563580 в целом на 36 сутки привело к дозозависимым снижениям в плазме уровней ANGPTL3, триглицеридов, холестерина ЛПНП, холестерина ЛП-не-ВП, холестерин ЛПОНП, общего холестерина, АроВ и АроС-III. В общем, величина снижений была связана с исходными уровнями липидов, большие степени снижения наблюдались у субъектов с более высокими исходными уровнями.
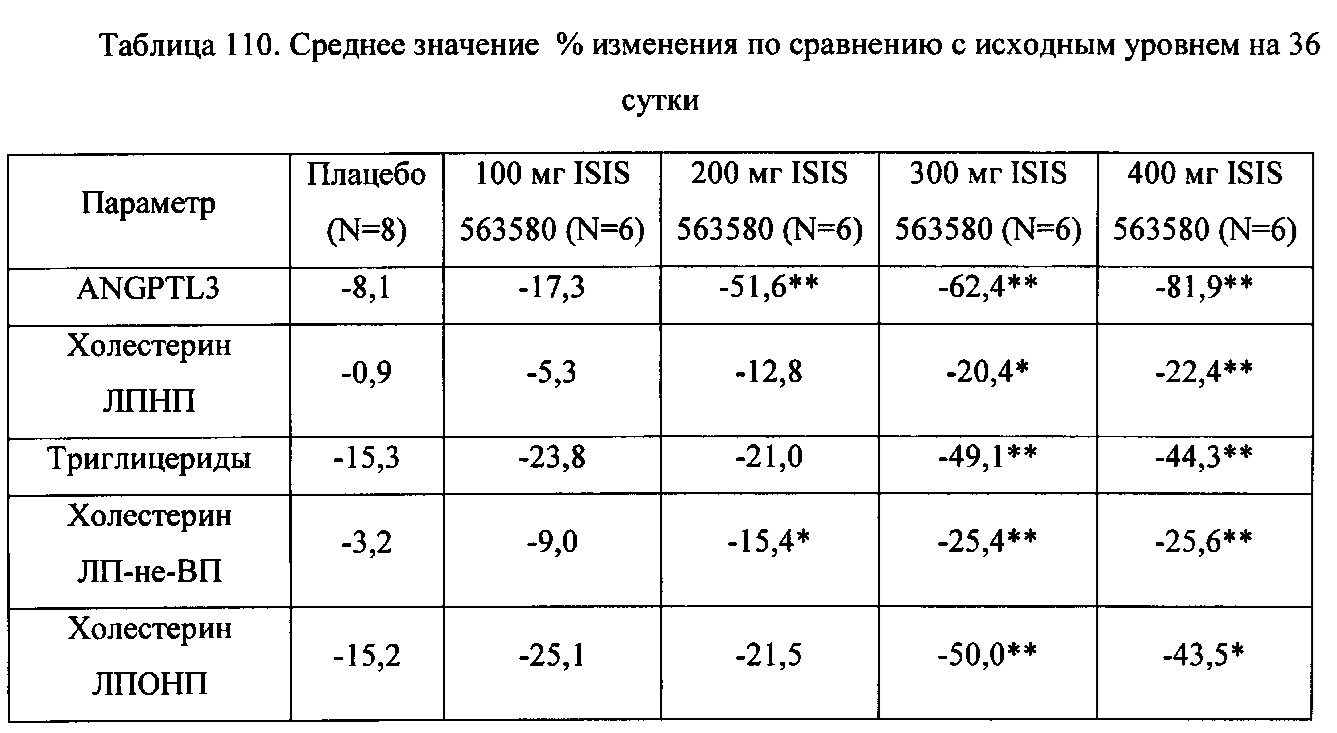

Реферат
Изобретение относится к области биотехнологии, конкретно к модифицированному олигонуклеотиду, способному специфично ингибировать экспрессию ангиопоэтин-подобного белка 3 (ANGPTL3), и может быть использовано в медицине. Изобретение пригодно для лечения, предупреждения, задержки прогрессирования или облегчения сердечно-сосудистых заболеваний и/или метаболических заболеваний, связанных с повышенным уровнем ANGPTL3. 3 н. и 18 з.п. ф-лы, 110 табл., 16 пр.
Формула
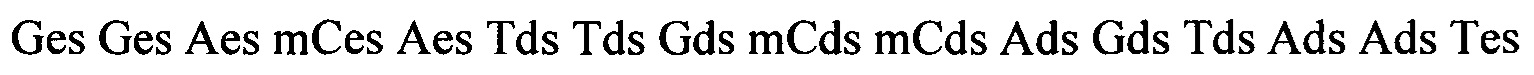
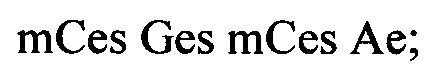
Документы, цитированные в отчёте о поиске
Одноцепочечные мультивалентные связывающие белки с эффекторной функцией

Комментарии