Одноцепочечные мультивалентные связывающие белки с эффекторной функцией - RU2487888C2
Код документа: RU2487888C2
Чертежи



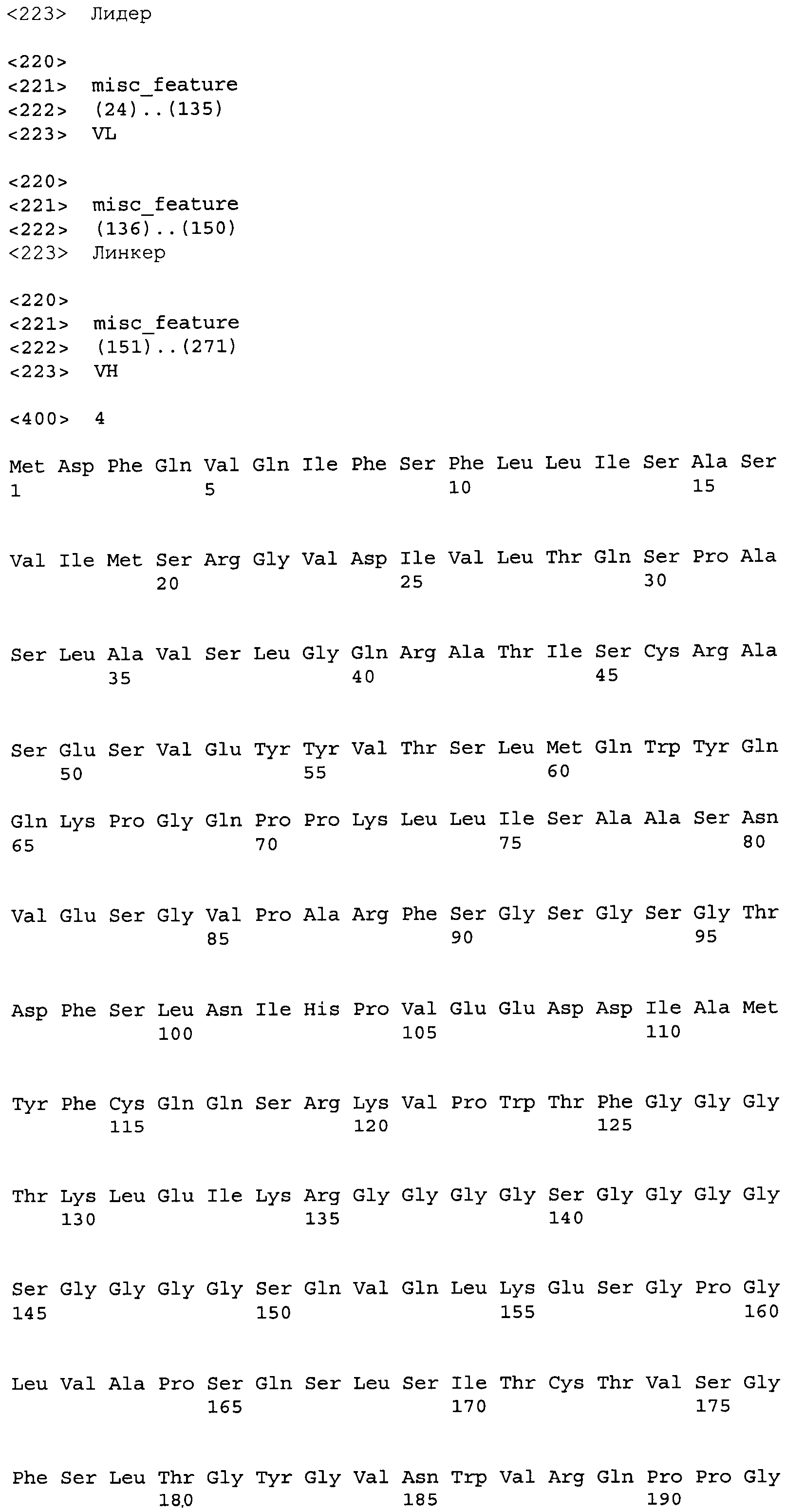









































































































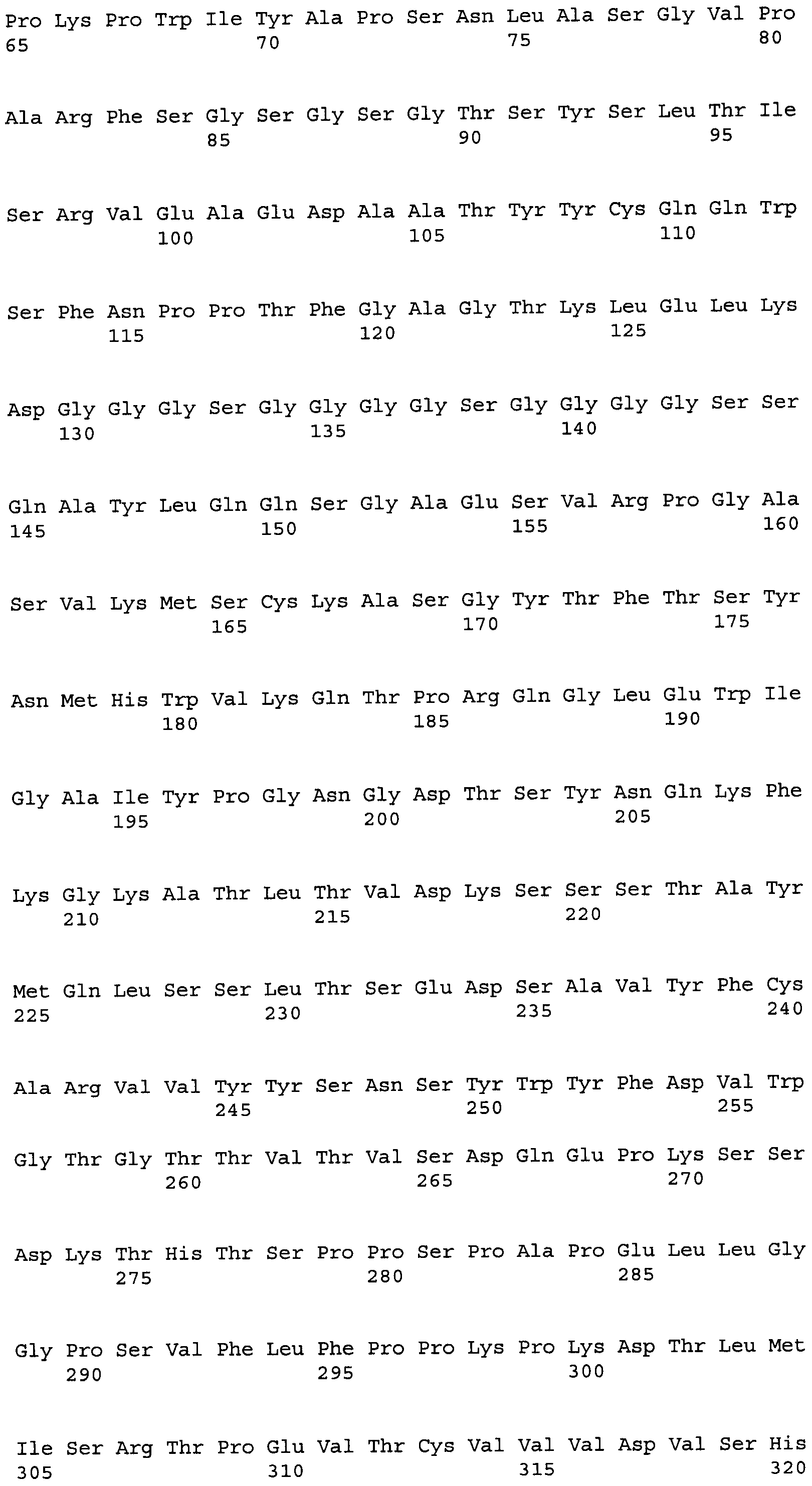




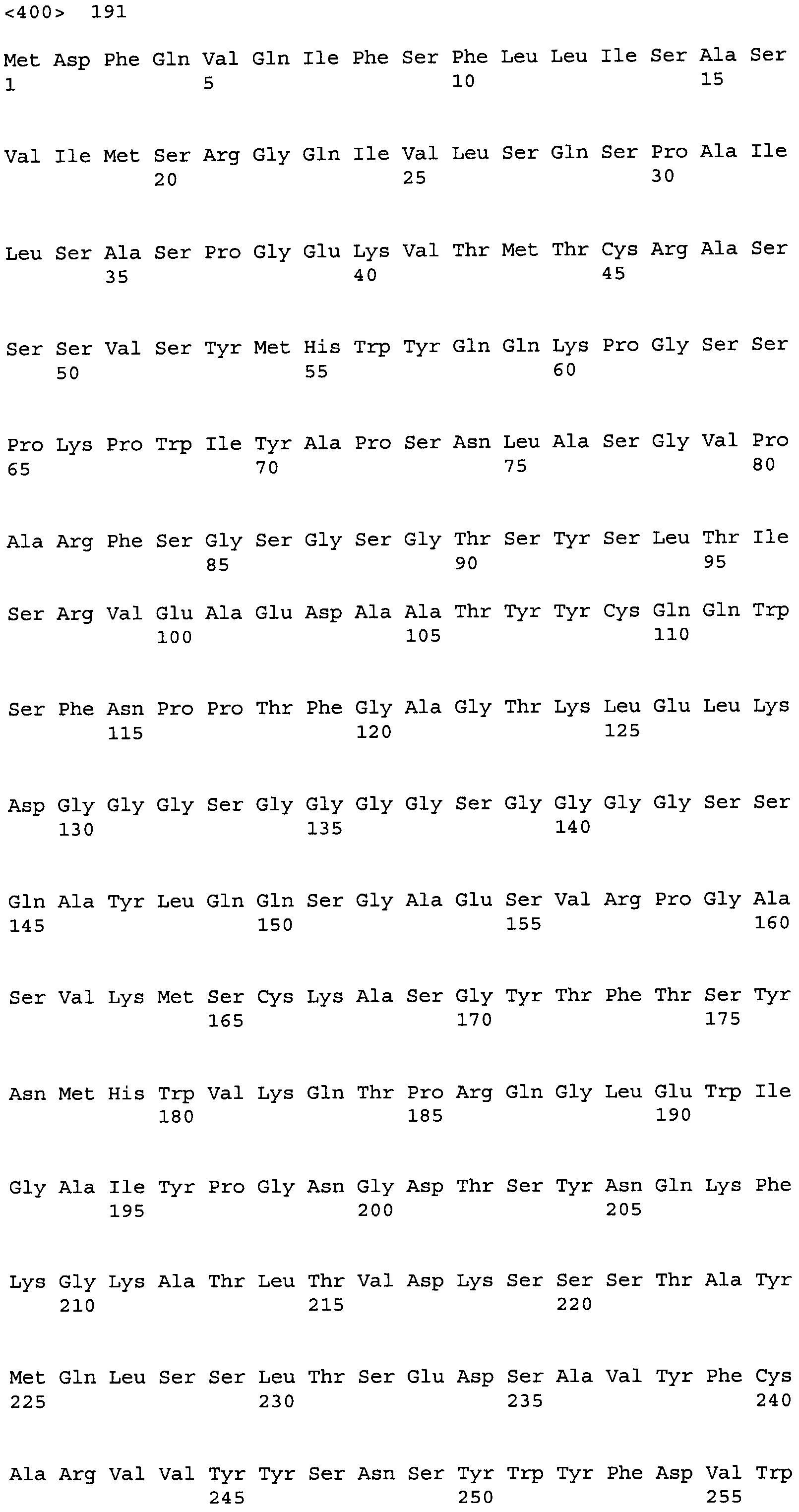















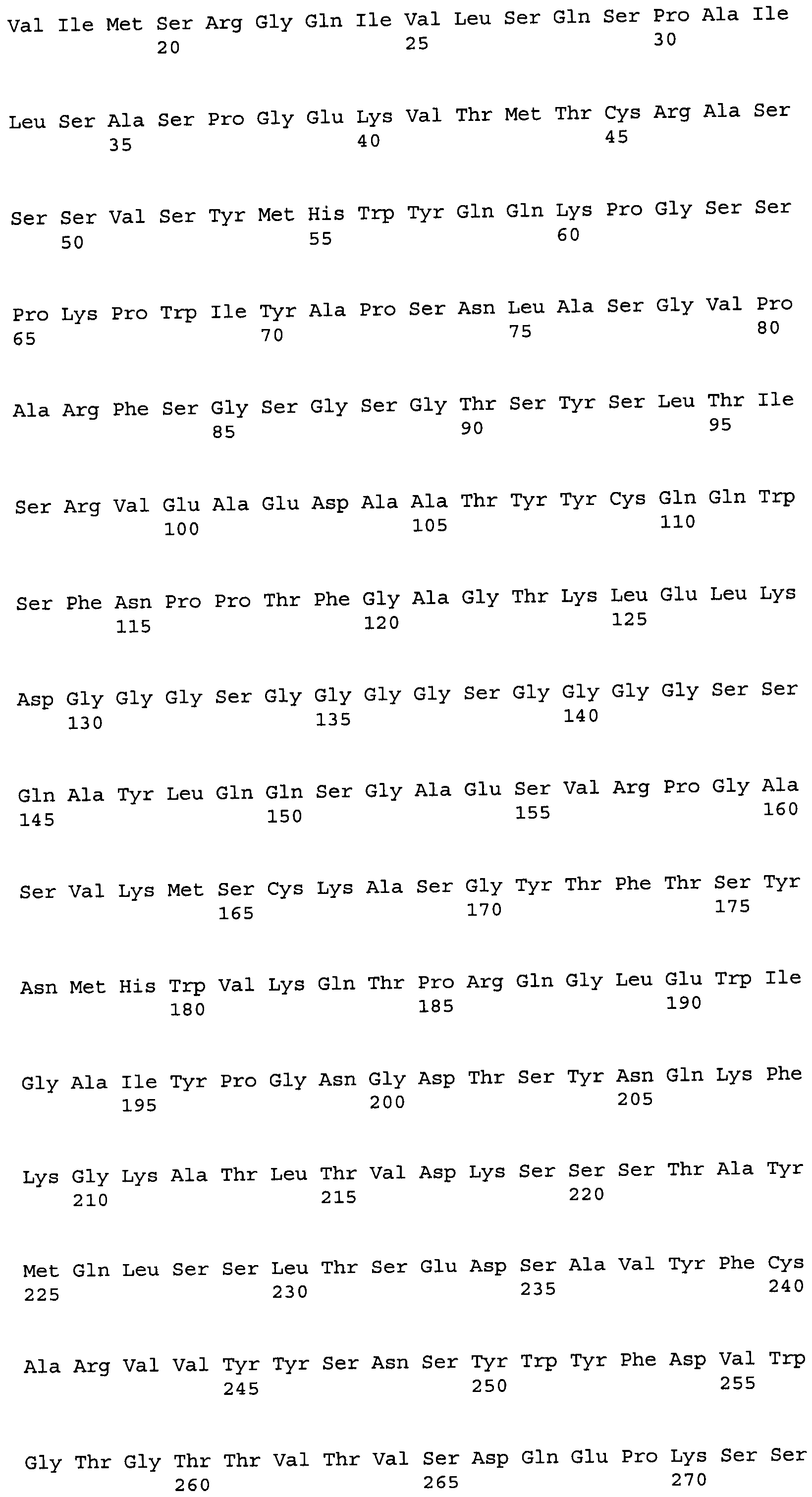









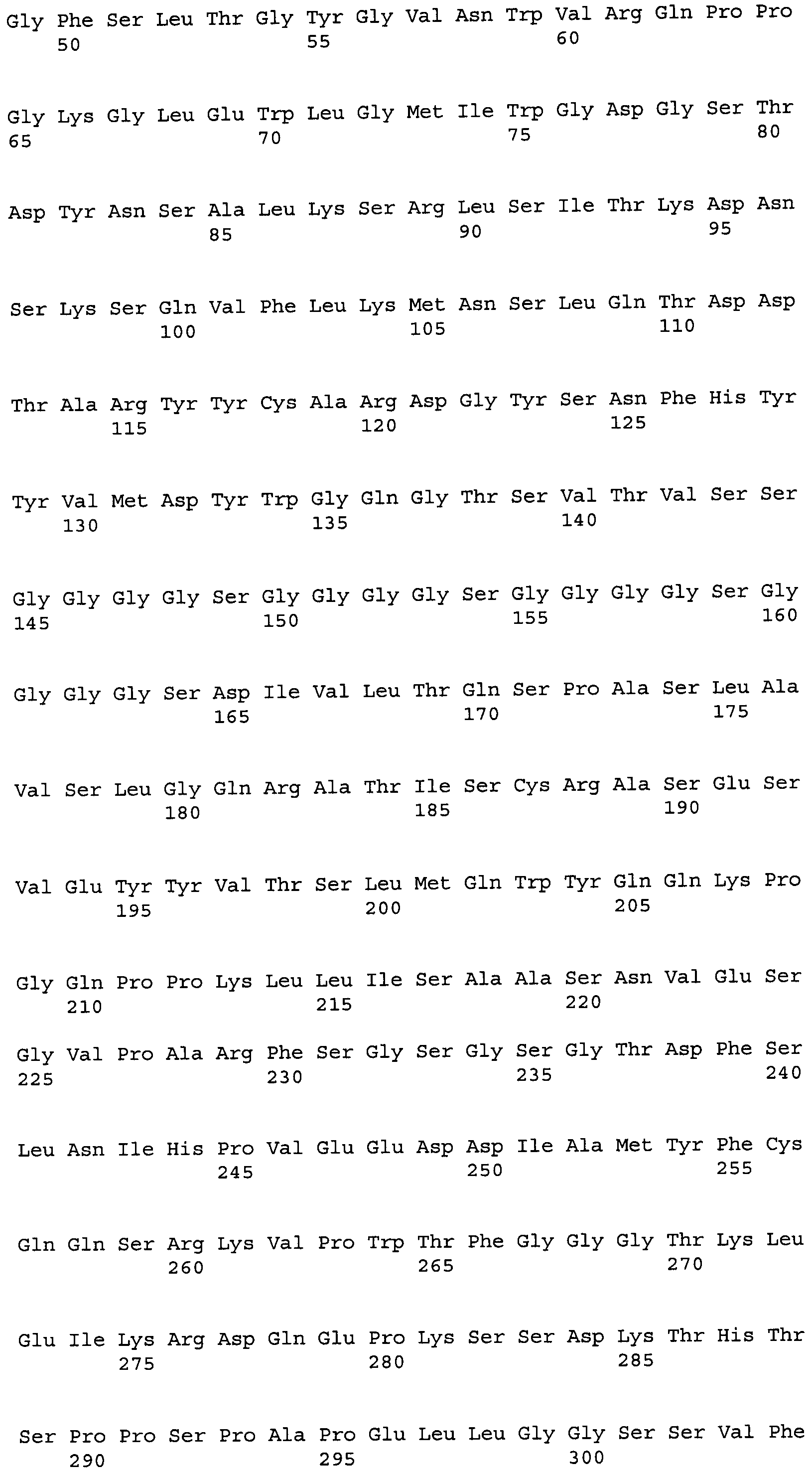

















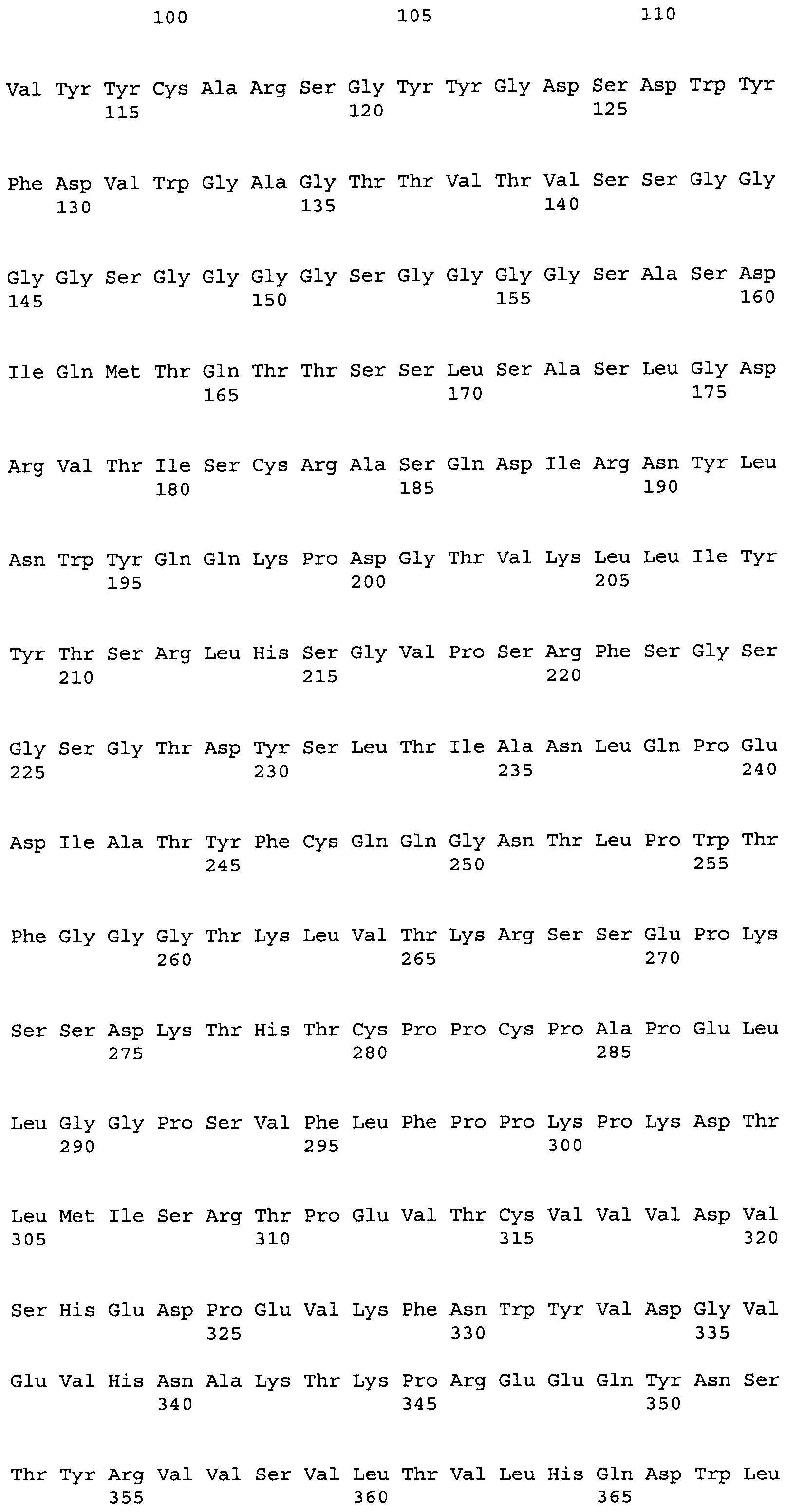














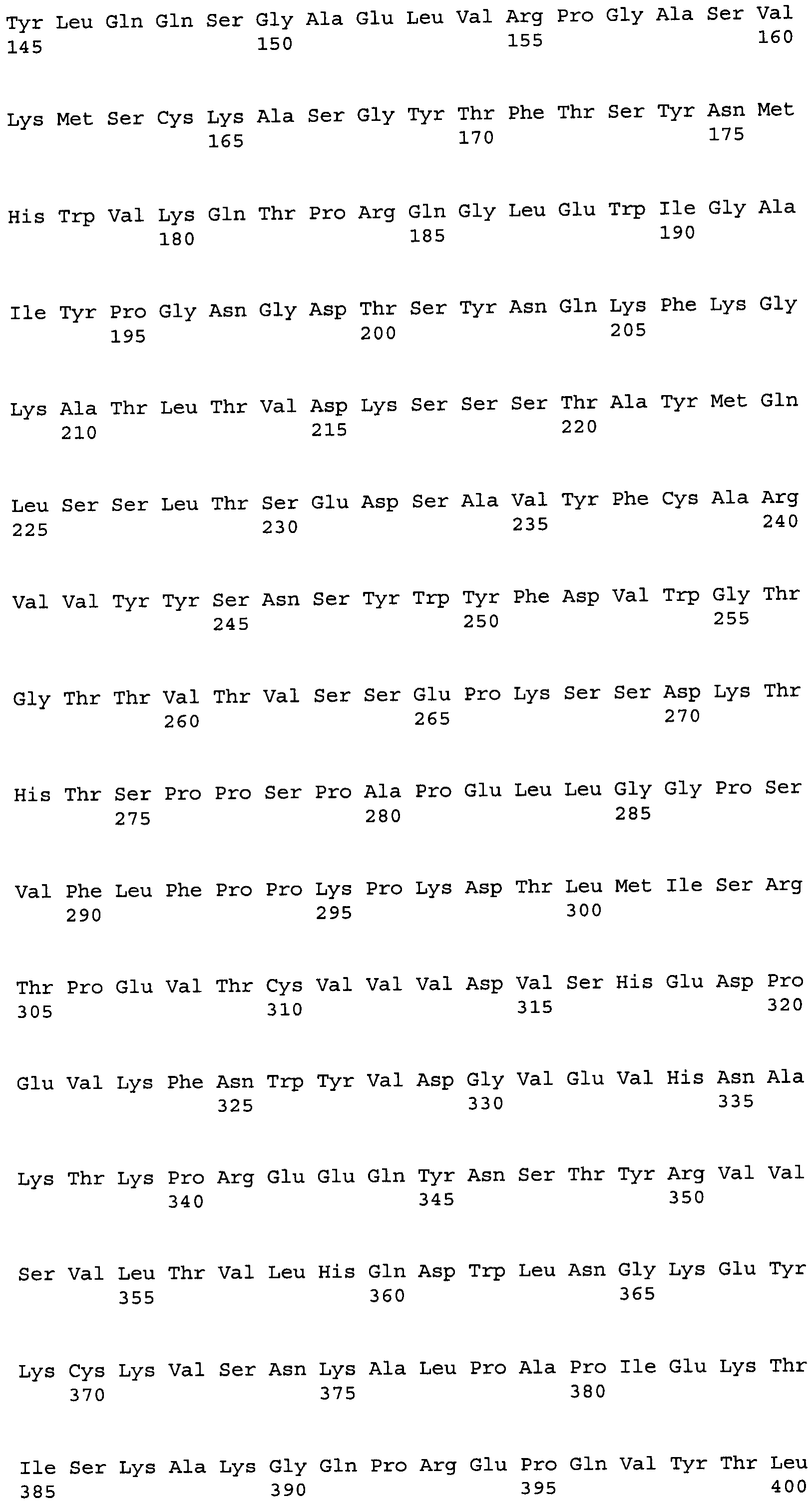

















































































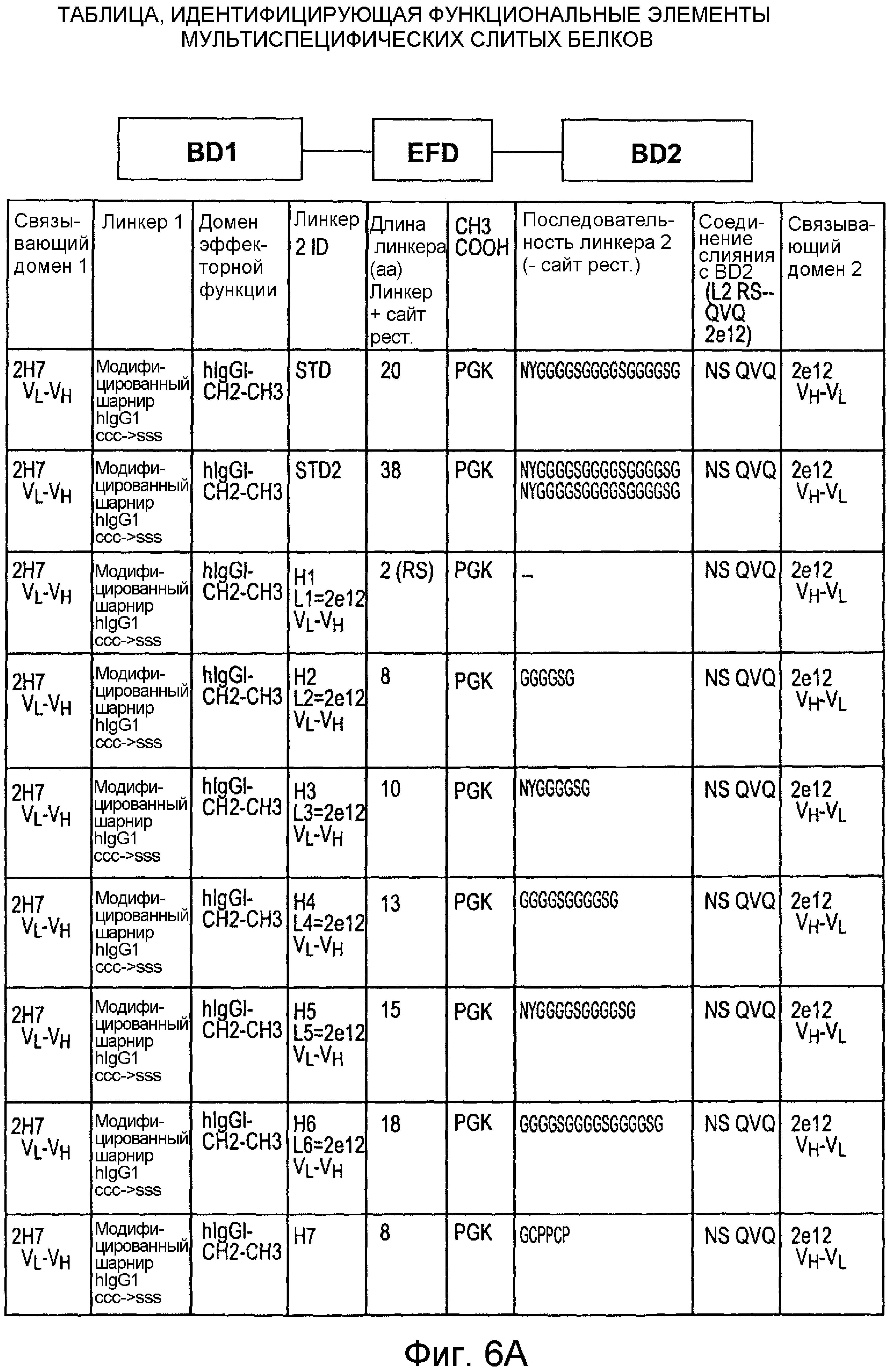
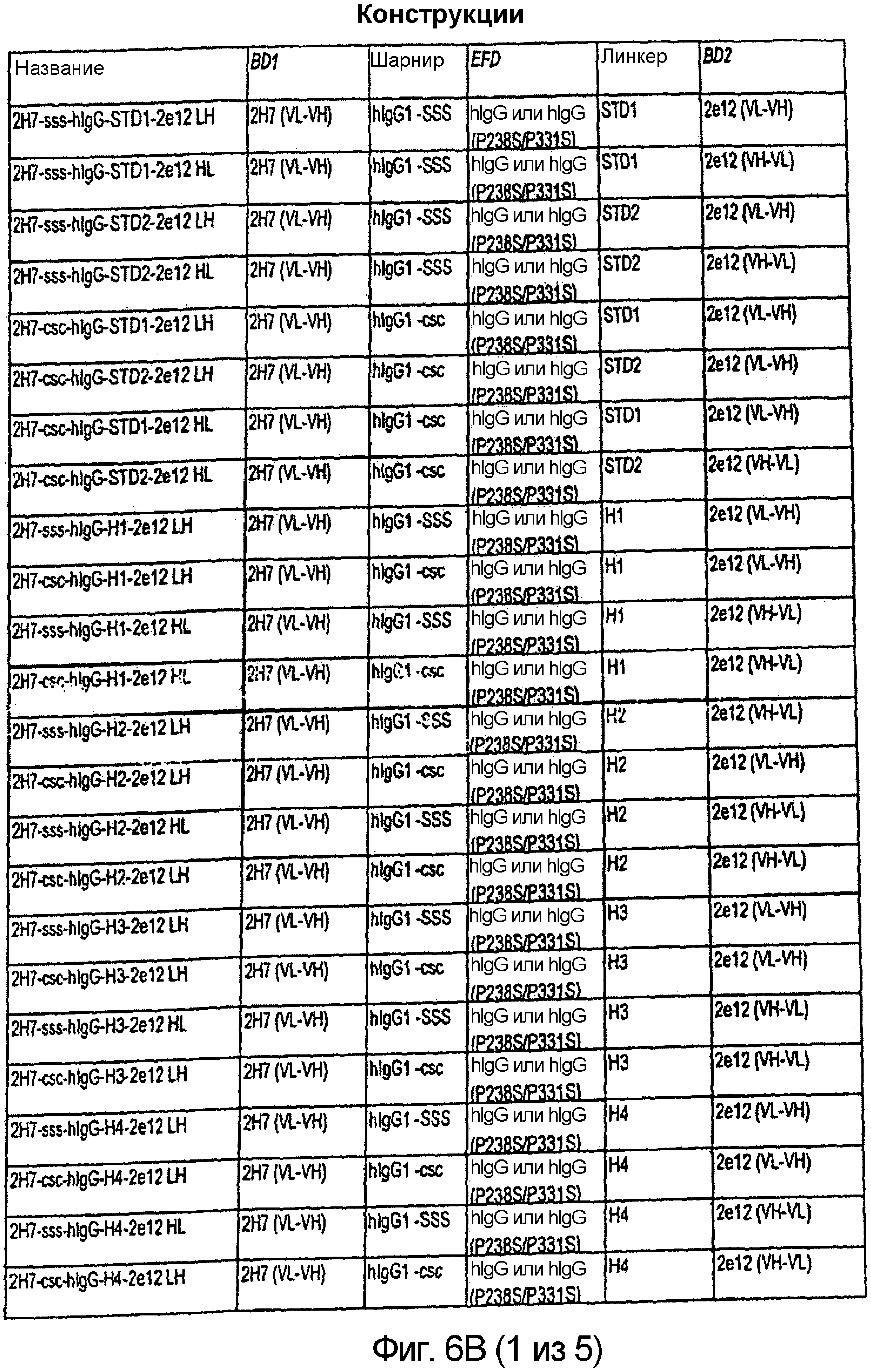
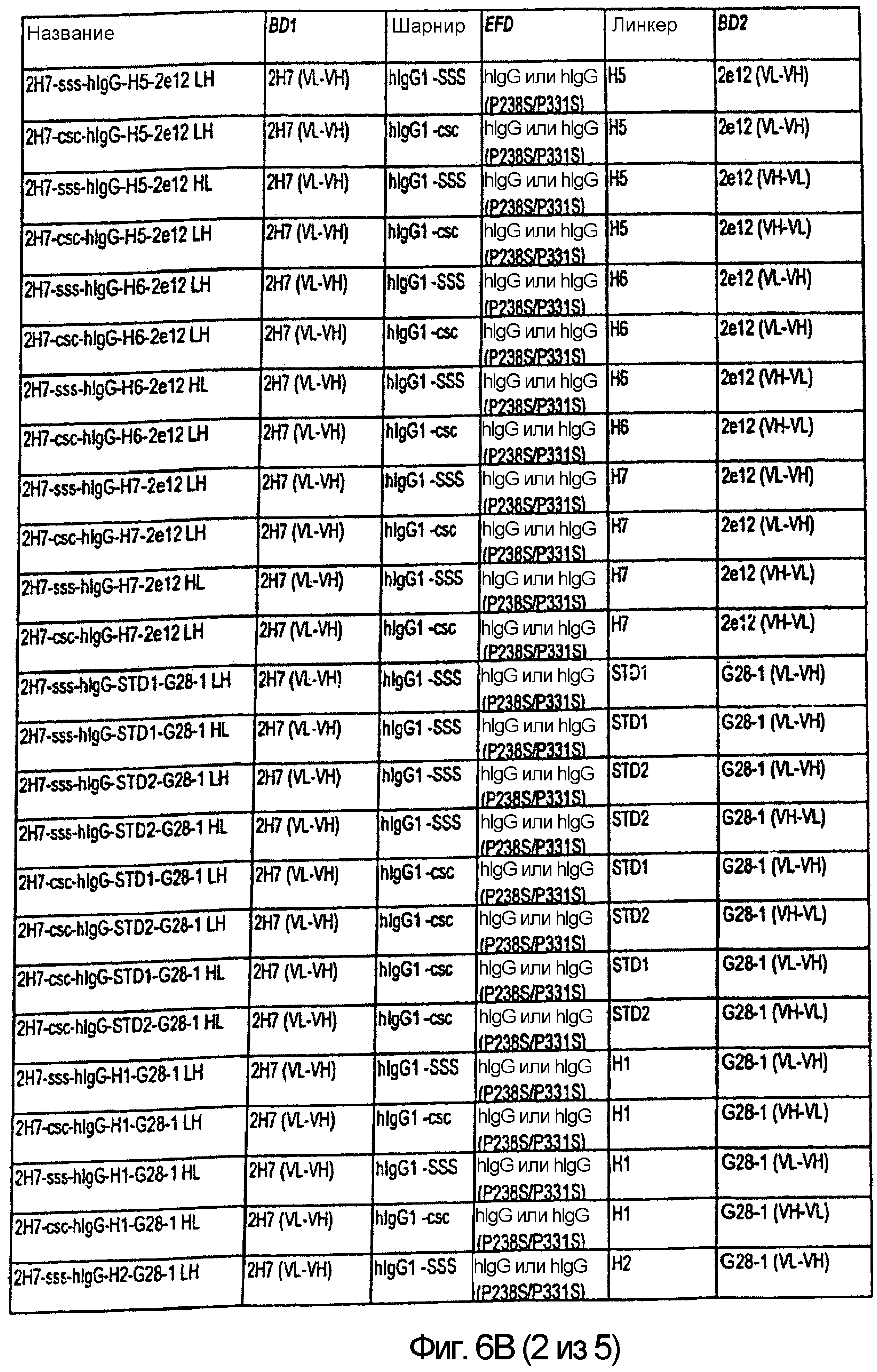


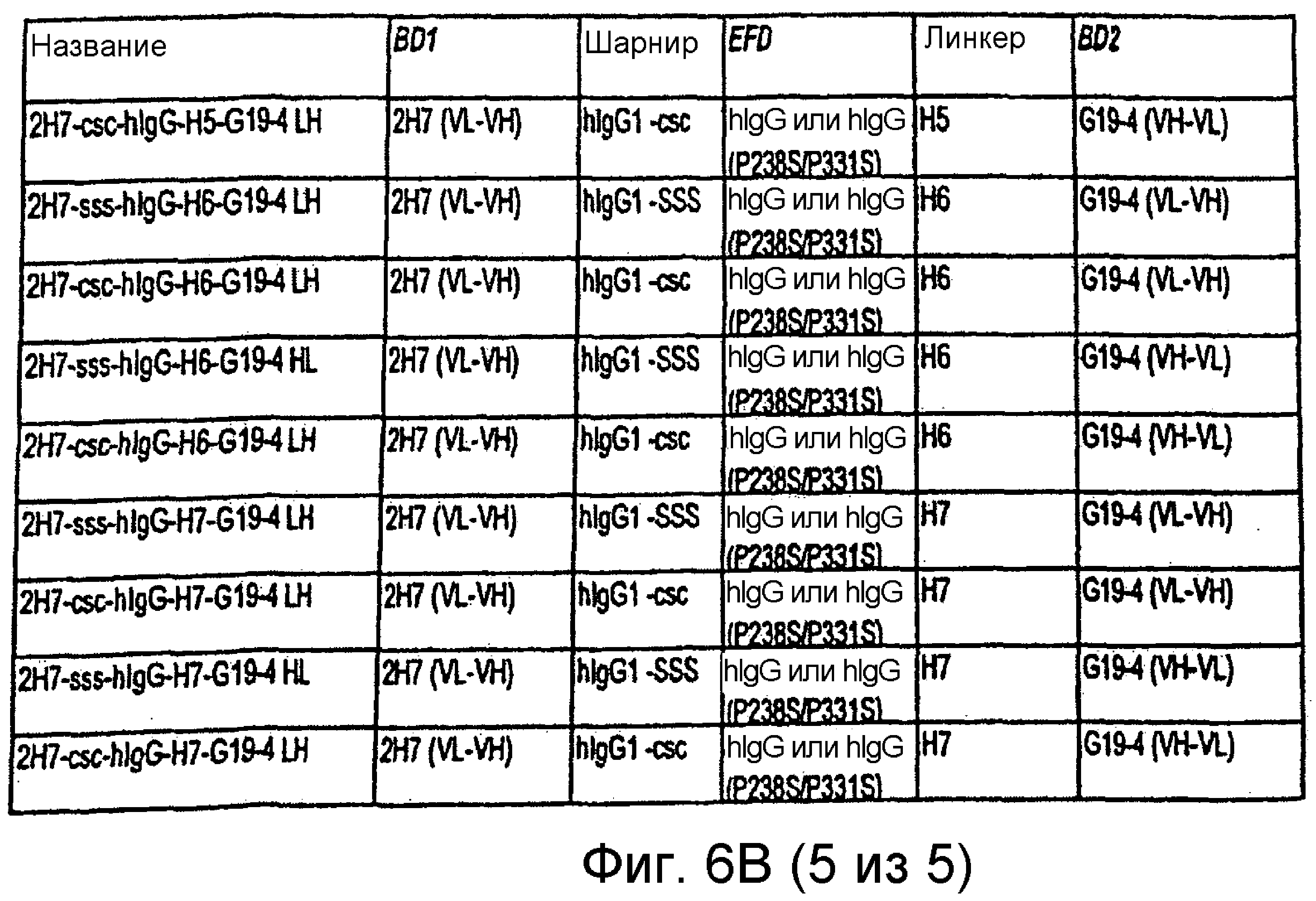




































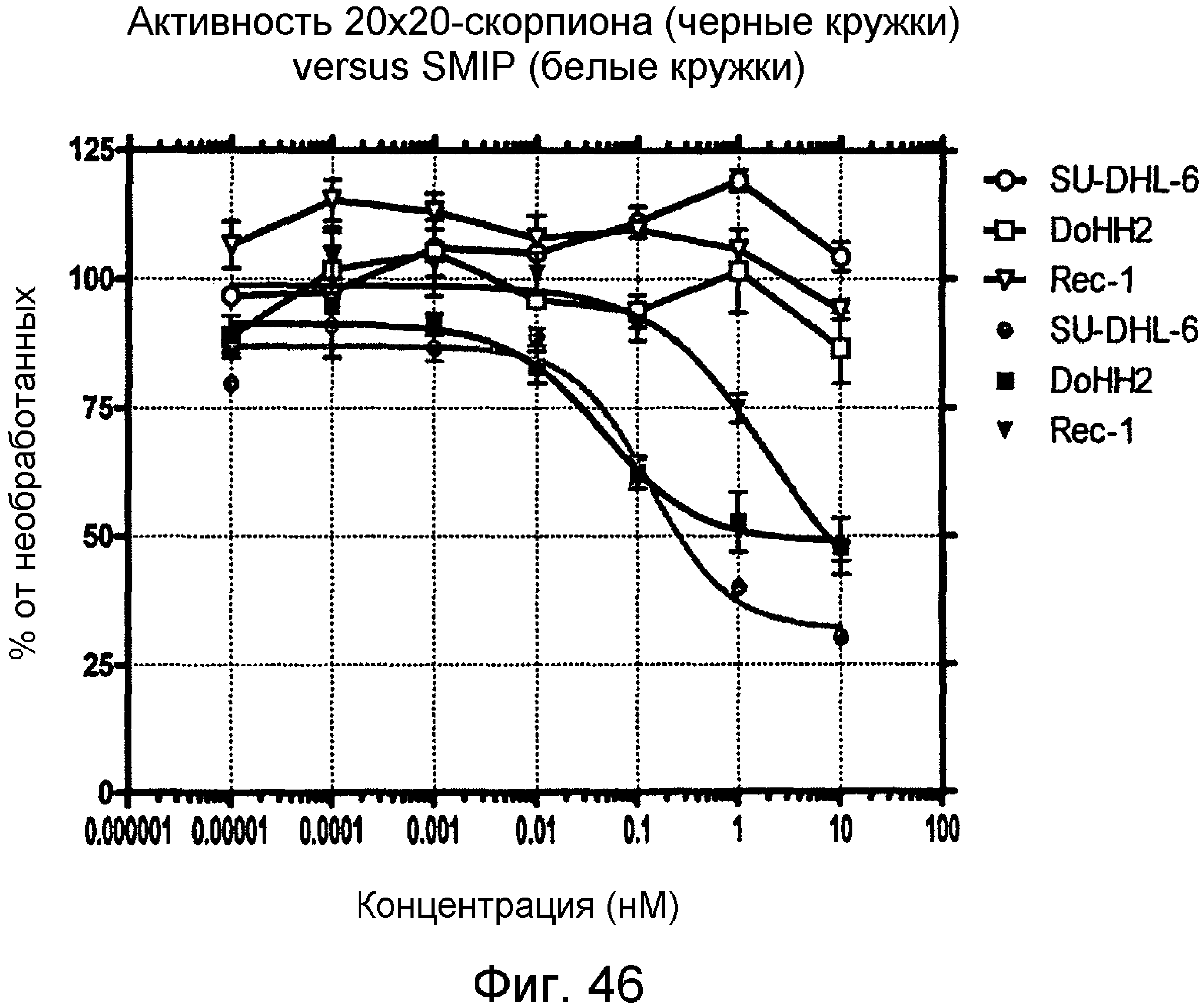
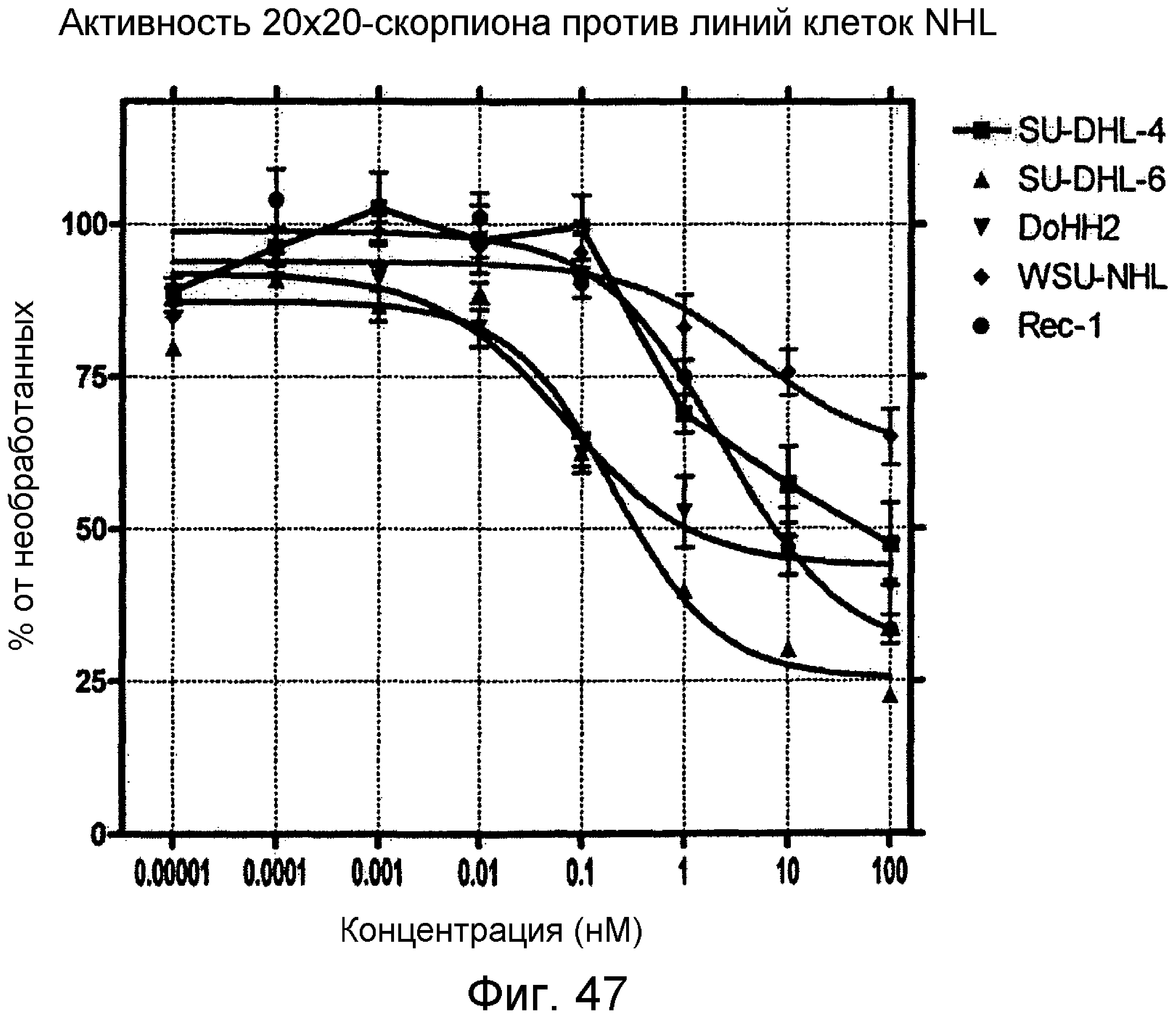



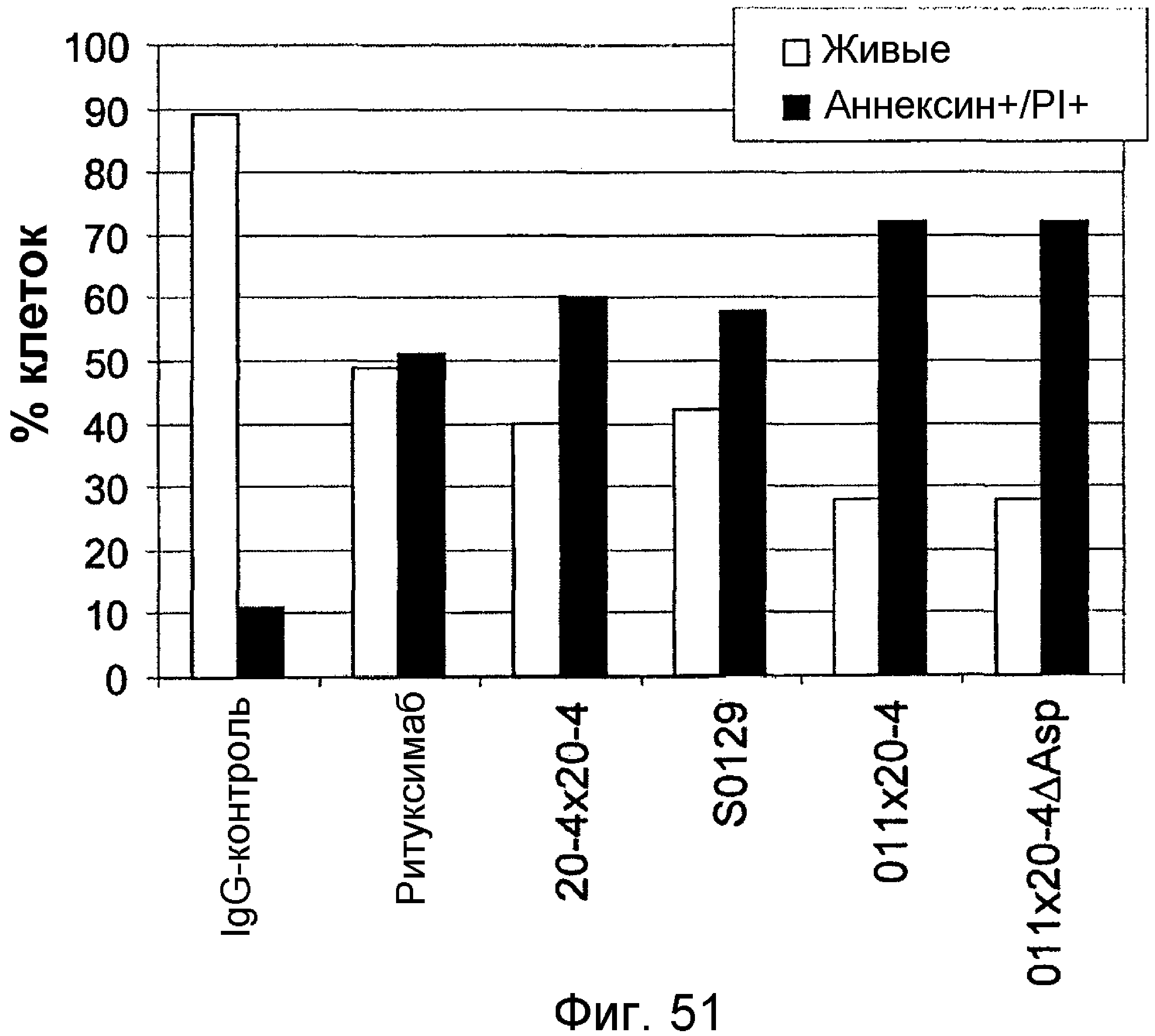


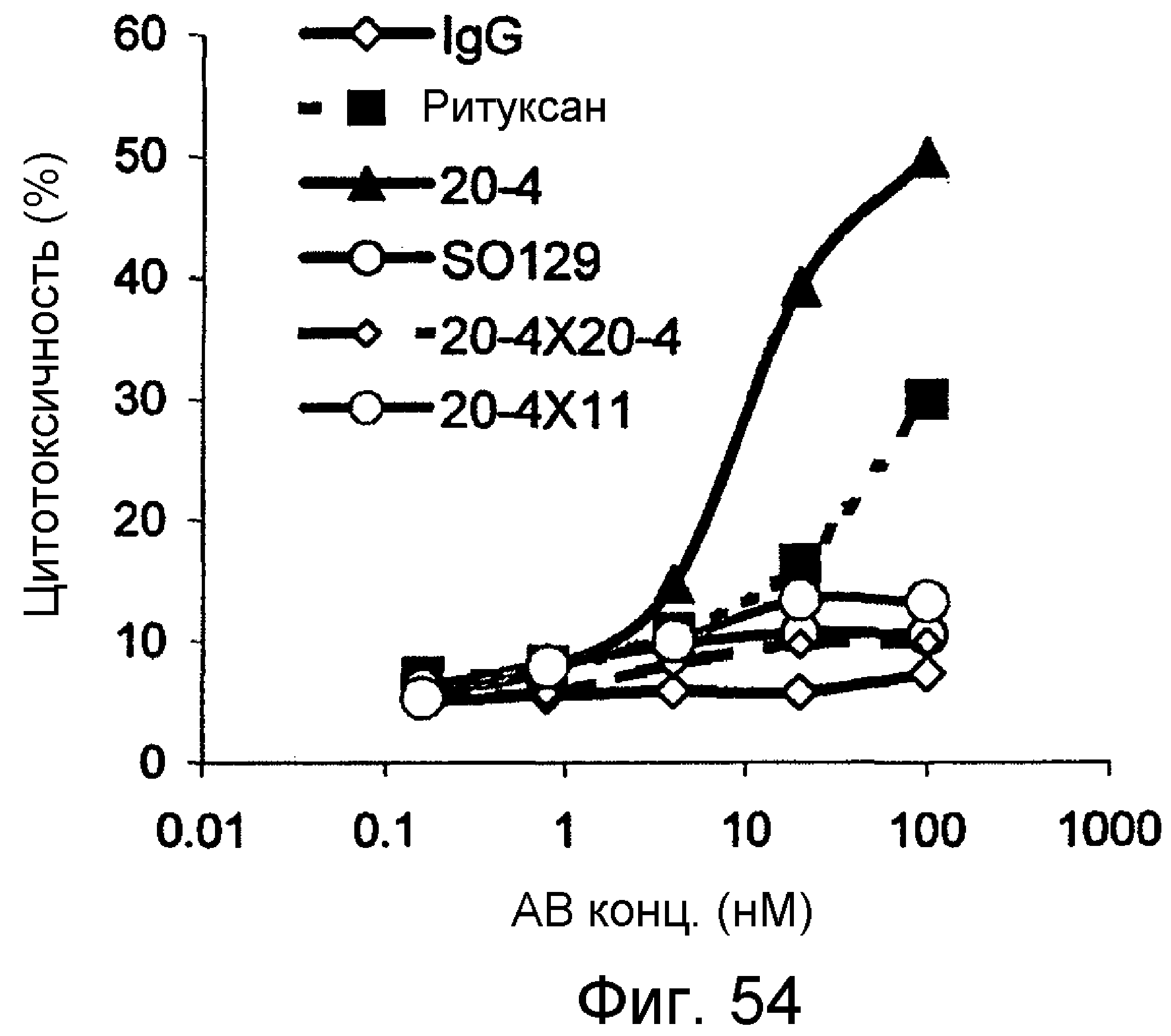






Описание
Область техники, к которой относится изобретение
Данное изобретение относится главным образом к области мультивалентных связывающих молекул и их терапевтическим применениям.
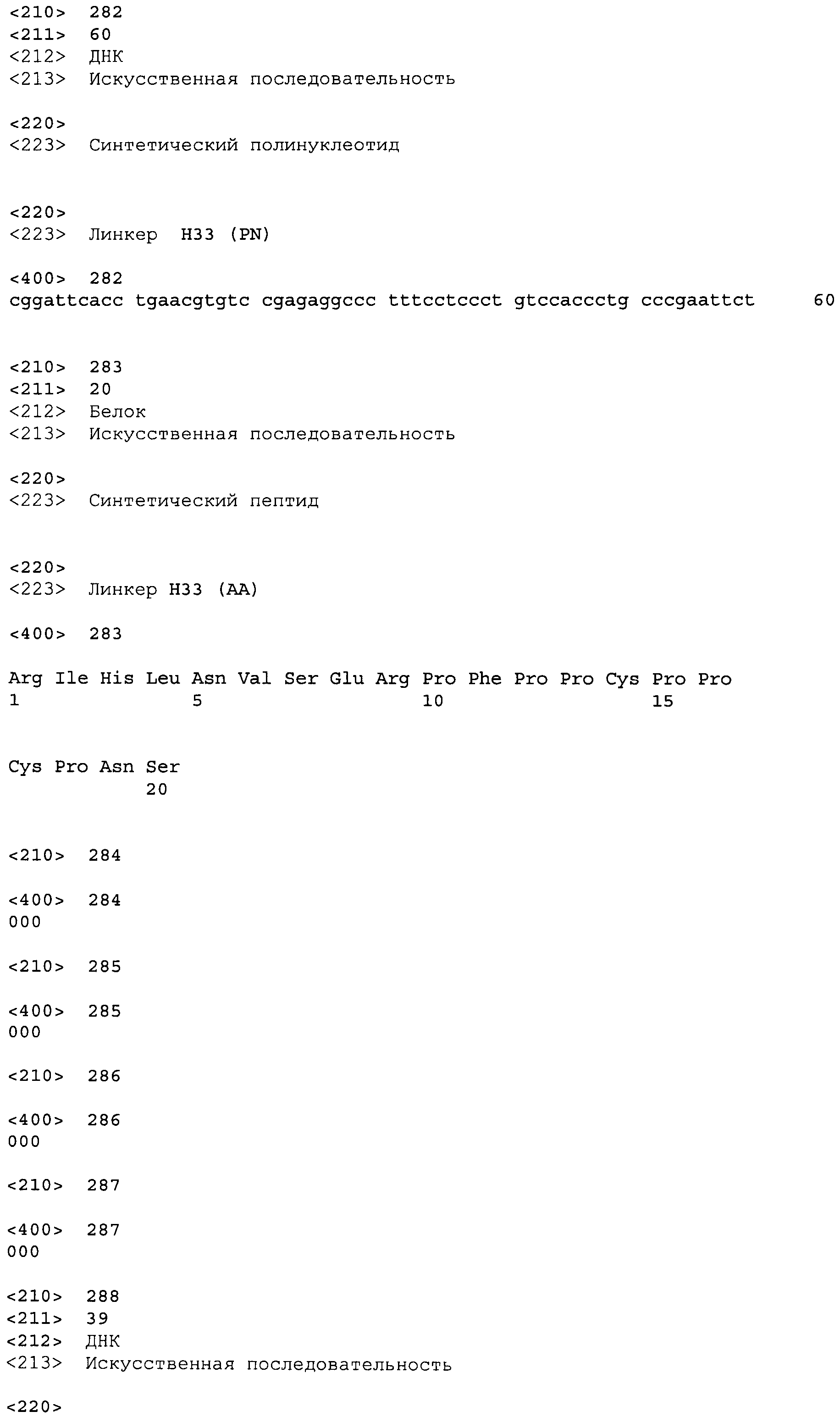
Список последовательностей представлен в виде текстового файла и в виде PDF-файла в соответствии с предъявляемыми требованиями для электронной подачи. Список последовательностей создан 12 июня 2007 года. Список последовательностей включен здесь в качестве ссылки в его полном виде.
Уровень техники
У здорового млекопитающего иммунная система защищает организм от повреждения чужеродными веществами и патогенами. Однако, в некоторых случаях иммунная система дает сбой, продуцируя травматический инсульт и/или заболевание. Например, В-клетки могут продуцировать антитела, которые узнают собственные белки, а не чужеродные белки, приводя к продуцированию аутоантител, характерных для аутоиммунных заболеваний, таких как системная красная волчанка, ревматоидный артрит и т.п. В других случаях, обычно благоприятное действие иммунной системы в борьбе с чужеродными веществами приводит к обратным результатам, например, после трансплантации органов. Эта способность иммунной системы млекопитающих и, в частности, иммунной системы человека, была обнаружена, и были предприняты попытки регуляции этой системы во избежание или для облегчения пагубных последствий для здоровья, которые происходят либо в результате нормального функционирования иммунной системы в аномальных обстоятельствах (например, при трансплантации органов), либо в результате функционирования иммунной системы в явно нормальных в остальном обстоятельствах (например, при прогрессировании аутоиммунного заболевания). Кроме того, были предприняты попытки использования иммунной системы для обеспечения ряда мишень-специфических диагностических и терапевтических методологий, основывающихся на способности антител специфически узнавать и специфически связывать антигенные мишени.
Одним путем, в котором иммунная система защищает организм, является продуцирование специализированных клеток, называемых В-лимфоцитами или В-клетками. В-клетки продуцируют антитела, которые связываются с чужеродным веществом или патогеном и в некоторых случаях опосредуют их деструкцию. Однако, в некоторых случаях иммунная система человека и, в частности, В-лимфоциты иммунной системы человека дают сбой, и возникает заболевание. Существуют многочисленные типы раков, которые вызывают неконтролируемую пролиферацию В-клеток. Существуют также многочисленные аутоиммунные заболевания, которые вызывают продуцирование В-клетками антител, которые, вместо связывания с чужеродными веществами и патогенами, связываются с частями организма. Кроме того, существуют многочисленные аутоиммунные и воспалительные заболевания, которые вызывают В-клетки в их патологии, например, через некорректную презентацию антигенов В-клеток Т-клеткам или через другие пути, в которых участвуют В-клетки. Например, мыши, предрасположенные к аутоиммунным нарушениям, дефицитные по В-клеткам, не развивают аутоиммунное заболевание почек, васкулит или аутоантитела (Shlomchik et al., J Exp. Med. 1994, 180:1295-306). Интересно, что те же самые предрасположенные к аутоиммунному заболеванию мыши, у которых имеются В-клетки, но которые являются недостаточными в отношении продуцирования иммуноглобулина, действительно развивают аутоиммунные заболевания при экспериментальной индукции (Chan et al., J Exp. Med. 1999, 189:1639-48), что указывает на то, что В-клетки играют существенную роль в развитии аутоиммунного заболевания.
В-клетки могут быть идентифицированы по молекулам на их клеточной поверхности. CD20 был первой поверхностной молекулой, специфической для В-клеточного направления дифференцировки клеток человека, идентифицированной моноклональным антителом. Он является негликозилированным, гидрофобным В-клеточным трансмембранным фосфопротеином 35 кДа, которые имеет как амино-, так и карбокси-концы, расположенные внутри клетки (Einfeld et al., EMBO J. 1988, 7:711-17). CD20 экспрессируется всеми нормальными зрелыми В-клетками, но не экспрессируется предшественниками В-клеток или плазматическими клетками. Природные лиганды для CD20 не были идентифицированы, и функция CD20 в биологии В-клеток все еще не выяснена полностью.
Другой поверхностной молекулой, специфической для В-клеточного направления дифференцировки, является CD37. CD37 является сильно гликозилированным белком 40-52 кДа, который принадлежит к трансмембранному семейству тетраспанинов антигенов поверхности клеток. Он пронизывает клеточную мембрану четыре раза, образуя две внеклеточные петли и обращая его амино- и карбокси-концы в цитоплазму. CD37 экспрессируется в высокой степени на нормальных продуцирующих антитела (sIg+)В-клетках, но не экспрессируется на пре-В-клетках или плазматических клетках. Экспрессия CD37 на покоящихся и активированных Т-клетках, моноцитах и гранулоцитах является низкой, и детектируемая экспрессия CD37 отсутствует на NK-клетках, тромбоцитах или эритроцитах. См., Belov et al., Cancer Res., 61(11):4483-4480 (2001); Schwartz-Albiez et al., J. Immunol., 140(3): 905-914 (1988) и Link et al., J. Immunol., 137(9): 3013-3018 (1988). Наряду с нормальными В-клетками, почти все злокачественные опухоли В-клеточного происхождения являются положительными по экспрессии CD37, в том числе CLL, NHL и злокачественный (гистиоцитарный) лейкоз (гистиолимфоцитоз Бернарда) (Moore et al., 1987; Merson and Brochier 1988; Faure, et al., 1900). CD37 участвует в регуляции В-клеточной функции, так как было обнаружено, что мыши, лишенные CD37, имеют низкие уровни сывороточного IgG1 и являются неполноценными в их гуморальной реакции на вирусные антигены и модельные антигены. Он действует, по-видимому, как неклассическая костимулирующая молекула или посредством прямого влияния на презентацию антигена через образование комплекса с молекулами МНС класса II. См. Knobeloch et al., Mol. Cell. Biol., 20(15):5363-5369 (2000).
Развитие исследований и лекарственных средств происходило на основе концепции, что молекулы клеточной поверхности, специфические для В-клеточного направления дифференцировки, такие как CD37 и CD20, могут сами быть мишенями для антител, которые могли бы связываться с раковыми и вызывающими аутоиммунное заболевание В-клетками, которые имеют CD37 и CD20 на их поверхностях, и опосредовать их разрушение. Названные «иммунотерапией», антитела, образованные у животного, не являющегося человеком, которые связываются с CD37 или CD20 (или полученные на основе образованных антителах), назначают пациенту для истощения раковых или вызывающих аутоиммунное заболевание В-клеток.
Технология моноклональных антител и способы генной инженерии способствовали развитию молекул иммуноглобулинов для диагностики и лечения заболеваний человека. Доменная структура иммуноглобулинов поддается конструированию, в том смысле, что антигенсвязывающие домены и домены, придающие эффекторные функции, могут быть обменены между классами и подклассами иммуноглобулинов. Структура и функция иммуноглобулинов обсуждается, например, в Harlow et al, Eds., Antibodies: A Laboratory Manual, Chapter 14, Cold Spring Harbor Laboratory, Cold Sprig Harbor (1988). Обширное введение, а также подробная информация относительно всех аспектов технологии рекомбинантных антител может быть найдена в справочнике “Recombinant Antibodies” (John Wiley & Sons, NY, 1999). Исчерпывающая коллекция подробных лабораторных протоколов конструирования антител может быть найдена в R. Kontermann and S. Dubel (eds.), “The Antibody Engineering Lab Manual” (Springer Verlag, Heidelberg/New York, 2000).
Молекула иммуноглобулина (обозначаемая как Ig) является мультимерным белком, обычно состоящим из двух идентичных полипептидов легкой цепи и двух идентичных полипептидов тяжелой цепи (Н2L2), которые соединены в макромолекулярный комплекс межцепочечными дисульфидными связями, т.е. ковалентными связями между сульфгидрильными группами соседних остатков цистеина. Пять классов иммуноглобулинов человека определены на основе состава их тяжелой цепи и названы IgG, IgМ, IgА, IgЕ и IgD. Антитела IgG-класса и IgA-класса дополнительно подразделены на подклассы, а именно, IgG1, IgG2, IgG3 и IgG4 и IgA1 и IgA2, соответственно. Внутрицепочечные дисульфидные связи соединяют разные участки одной и той же полипептидной цепи, что приводит к образованию петель, которые, вместе со смежными аминокислотами, составляют домены иммуноглобулина. В аминоконцевой части каждая легкая цепь и каждая тяжелая цепь имеет единственную вариабельную область, которая обнаруживает значительную вариацию в аминокислотном составе от одного антитела к другому. Вариабельная область легкой цепи, VL, имеет единственный антигенсвязывающий домен и связывается с вариабельной областью тяжелой цепи, VH (также содержащей единственный антигенсвязывающий домен), с образованием антигенсвязывающего сайта иммуноглобулина, Fv.
Кроме вариабельных областей, каждая из цепей полноразмерного антитела имеет константную область, содержащую один или несколько доменов. Легкие цепи имеют константную область, содержащую единственный домен. Таким образом, легкие цепи имеют один вариабельный домен и один константный домен. Тяжелые цепи имеют константную область, содержащую несколько доменов. Тяжелые цепи в антителах IgG, IgА и IgD, имеют три домена, которые названы CH1, CH2 и CH3; тяжелые цепи в антителах IgM и IgE имеют четыре домена, CН1, CH2, CН3 и CН4. Таким образом, тяжелые цепи имеют один вариабельный домен и три или четыре константных домена. Примечательной является инвариантная организация этих доменов во всех известных видах, причем константные области, содержащие один или несколько доменов, расположены при С-конце или вблизи С-конца как легкой, так и тяжелой цепей молекул иммуноглобулина, а вариабельные домены расположены в направлении N-концов легкой и тяжелой цепей. Структура и функция иммуноглобулинов рассматривается, например, в Harlow et al., Eds., Antibodies: A Laboratory Manual, Chapter 14, Cold Spring Harbor Laboratory, Cold Spring Harbor (1988).
Тяжелые цепи иммуноглобулинов могут быть также подразделены на три функциональных области: Fd-область (фрагмент, содержащий VH и CH1, т.е. два N-концевых домена тяжелой цепи), шарнирную область и Fc-область (область «кристаллизуемого фрагмента»). Fc-область содержит домены, которые взаимодействуют с рецепторами иммуноглобулинов на клетках и с начальными элементами каскада комплемента. Таким образом, Fc-область или фрагмент обычно считается ответственным за эффекторные функции иммуноглобулина, такие как ADCC (антителозависимая клеточно-опосредованная цитотоксичность), CDC (комплементзависимая цитотоксичность) и связывание (фиксация) комплемента, связывание с Fc-рецепторами, больший период полужизни in vivo относительно полипептида, лишенного Fc-области, связывание белка А и, возможно, даже переход (лекарственного средства) через плаценту (Capon et al, Nature, 337: 525-531, (1989)). Далее, полипептид, содержащий Fc-область, делает возможной димеризацию/мультимеризацию полипептида. Эти термины используются также для аналогичных областей других иммуноглобулинов.
Хотя все изотипы иммуноглобулинов человека содержат узнаваемую общую структуру, каждый изотип проявляет отличающуюся картину эффекторной функции. IgG, в качестве неисчерпывающего примера, нейтрализует токсины и вирусы, опсонизирует, фиксирует комплемент (CDC) и участвует в ADCC. IgM, в противоположность этому, нейтрализует переносимые кровью патогены и участвует в опсонизации. IgA, при ассоциации с его секреторным участком, секретируется и обеспечивает первичную защиту от микробной инфекции через слизистую оболочку; он также нейтрализует токсины и поддерживает опсонизацию. IgE опосредует воспалительные реакции, участвуя централизованно в рекрутинге других клеток, необходимых для установления полной реакции. Известно, что IgD обеспечивает иммунорегуляторную функцию, контролирующую активацию В-клеток. Эти характеристики эффекторных функций изотипов обеспечивают неисчерпывающую иллюстрацию различий, которые могут быть обнаружены среди изотипов человека.
Шарнирная область, обнаруживаемая в классах IgG, IgA, IgD, и IgE антител, действует как гибкий спейсер, позволяя Fab-части свободно перемещаться в пространстве. В противоположность константным областям, шарнирные домены являются структурно разнообразными, варьирующими как по последовательности, так и по длине, среди классов и подклассов иммуноглобулинов. Например, длина и гибкость шарнирной области варьирует среди подклассов IgG. Шарнирная область IgG1 включает аминокислоты 216-231 и, поскольку она является свободно гибкой, Fab-фрагменты могут вращаться вокруг их осей симметрии и перемещаться в сфере с центром при первом из двух дисульфидных мостиков между тяжелыми цепями. IgG2 имеет более короткий шарнир, чем IgG1, с 12 аминокислотными остатками и четырьмя дисульфидными мостиками. Шарнирная область IgG2 лишена остатка глицина, является относительно короткой и содержит негибкую полипролиновую двойную спираль, стабилизированную дополнительными дисульфидными мостиками между тяжелыми цепями. Эти свойства ограничивают гибкость молекулы IgG2. IgG3 отличается от других подклассов ее уникальной удлиненной шарнирной областью (примерно в 4 раза более длинной, чем шарнир IgG1), содержащей 62 аминокислоты (в том числе 21 пролин и 11 цистеинов), образующие негибкую полипролиновую двойную спираль. В IgG3, Fab-фрагменты находятся относительно далеко от Fc-фрагмента, что придает этой молекуле бóльшую гибкость. Удлиненный шарнир в IgG3 ответствен также за его более высокую молекулярную массу в сравнении с другими подклассами. Шарнирная область IgG4 является более короткой, чем шарнирная область IgG1, и ее гибкость является промежуточной между гибкостью IgG1 и IgG2. Сообщалось, что гибкость шарнирных областей уменьшается в следующем порядке: IgG3>IgG1>IgG4>IgG2. Эти четыре подкласса IgG отличаются также друг от друга в отношении их эффекторных функций. Это различие относится к различиям в структуре, в том числе различиям в отношении взаимодействия между вариабельными областями, Fab-фрагментами и константным Fc-фрагментом.
Согласно кристаллографическим исследованиям, шарнирная область иммуноглобулинов может быть дополнительно подразделена функционально на три области: верхнюю шарнирную область, центральную (коровую) область и нижнюю шарнирную область. Shin et at., 1992 Immunological Reviews 130:87. Верхняя шарнирная область включает аминокислоты от карбоксильного конца CH1 до первого остатка в шарнире, который ограничивает движение, обычно первого остатка цистеина, который образует межцепочечную дисульфидную связь между двумя тяжелыми цепями. Длина верхней шарнирной области коррелирует с сегментной гибкостью антитела. Центральная шарнирная область содержит дисульфидные мостики между тяжелыми цепями, а нижняя шарнирная область соединяет аминоконец CH2-домена и включает остатки в CH2·Id. Центральная (коровая) шарнирная область IgG1 человека содержит последовательность Cys-Pro-Pro-Cys, которая, при димеризации образованием дисульфидной связи, приводит к циклическому октапептиду, который, как считается, действует в качестве точки вращения, придавая таким образом гибкость. Шарнирная область может содержать также один или несколько сайтов гликозилирования, которые включают ряд структурно отличающихся типов сайтов для присоединения углеводов. Например, IgА1 содержит пять сайтов гликозилирования в состоящем из 17 аминокислот сегменте шарнирной области, придавая устойчивость полипептиду шарнирной области к кишечным протеазам, что считается предпочтительным свойством для секреторного иммуноглобулина.
Конформационные изменения, допускаемые структурой и гибкостью полипептидной последовательности шарнирной области иммуноглобулина, могут также влиять на эффекторные функции Fc-части антитела. Три основные категории эффекторных функций, ассоциированных с Fc-областью, включают (1) активацию классического каскада комплемента, (2) взаимодействие с эффекторными клетками и (3) компартментализацию иммуноглобулинов. Разные подклассы IgG человека варьируют по относительным эффективностям, с которыми они фиксируют (связывают) комплемент или активируют и усиливают стадии каскада комплемента. См., например, Kirschfink, 2001 Immunol. Rev. 180:177; Chakraborti et al., 2000 Cell Signal 12:607; Kohl et al., 1999 Mol. Immunol. 36:893; Marsh et al., 1999 Curr. Opin. Nephrol. Hypertens. 8:557; Speth et al, 1999 Wien Klin. Wochenschr. 111:378.
Исключения в отношении H2L2-структуры обычных антител встречаются в некоторых изотипах иммуноглобулинов, обнаруженных в семействе верблюдовых (верблюдах, дромедарах (одногорбых верблюдах) и ламах; Hamers-Casterman et al., 1993 Nature 363:446; Nguyen et al., 1998 J. Mol. Biol 275:413), усатых акулах-няньках (Roux et al., 1998 Proc. Nat. Acad. Sci. USA 95: 11804) и пятнистой химере (Nguyen, et al., 2002 Immunogenetics 54(l):39-47). Эти антитела могут, очевидно, образовывать антигенсвязывающие области с использованием только вариабельной области тяжелой цепи, т.е. эти функциональные антитела являются гомодимерами только тяжелых цепей (называемые «антителами тяжелой цепи» или “HCAb"). Несмотря на преимущества технологии антител в диагностике и лечении заболеваний, существуют некоторые невыгодные аспекты развития технологий полноразмерных антител в качестве диагностических и/или терапевтических реагентов. Полноразмерные антитела являются большими белковыми структурами, примером которых является гетеротетрамерная структура IgG-изотипа, содержащая две легкие и две тяжелые цепи. Такие большие молекулы являются стерически затрудненными в некоторых применениях. Например, в лечении солидных опухолей, полноразмерные антитела не могут легко проникать во внутреннюю часть опухоли. Кроме того, относительно большой размер полноразмерных антител представляет проблему для гарантии того, что введение in vivo таких молекул не индуцирует иммунную реакцию. Кроме того, генерирование активных молекул антител обычно включает культивирование рекомбинантных эукариотических клеток, способных обеспечивать подходящий посттрансляционный процессинг возникающих молекул антител, и такие клетки могут быть трудоемкими для культивирования и индукции таким образом, который обеспечивает коммерчески применимые выходы активного антитела.
Недавно, были сконструированы меньшие молекулы иммуноглобулинов для преодоления проблем, ассоциированных с методологиями полноразмерных иммуноглобулинов. Одноцепочечный вариабельный фрагмент антитела (scFv) содержит вариабельный домен тяжелой цепи антитела, соединенный через короткий пептид с вариабельным доменом легкой цепи антитела (Huston et al., Proc. Natl. Acad. Sci. USA, 1988, 85: 5879-83). Вследствие малого размера молекул scFv, они проявляют более эффективное проникновение в ткани, чем полноразмерный иммуноглобулин. Противоопухолевые scFv обнаруживали более быстрое проникновение в опухоль и более равномерное распределение по массе опухоли, чем соответствующее химерное антитело (Yokota et al, Cancer Res. 1992, 52:3402-08).
Несмотря на преимущества, которые вносят молекулы scFv в серотерапию, существуют несколько недостатков в отношении этого терапевтического подхода. scFv быстро выводится из кровотока, что может уменьшать токсические действия в нормальных клетках, но такой быстрый клиренс препятствует доставке минимальной эффективной дозы к ткани-мишени. Приготовление адекватных количеств scFv для введения пациентам было проблемой вследствие трудностей экспрессии и выделения scFv, которые неблагоприятно влияли на выход. Во время экспрессии молекулы scFv лишены стабильности и часто агрегируют вследствие спаривания вариабельных областей из разных молекул. Кроме того, уровни получения молекул scFv в экспрессионных системах млекопитающих являются низкими, что ограничивает потенциал эффективного получения молекул scFv для терапии (Davis et al, J Biol. Chem. 1990, 265:10410-18); Traunecker et al., EMBO J 1991, 10: 3655-59). Исследовались стратегии для улучшения получения, включающие добавление сайтов гликозилирования в вариабельные области (Jost, C. R. U.S. Pat. No. 5888773, Jost et al, J. Biol. Chem. 1994, 69: 26267-73).
Другим недостатком использования scFv для терапии является отсутствие эффекторной функции. scFv без цитолитической функции, такой как антителозависимая клеточно-опосредованная цитотоксичность (ADCC) и комплементзависимая цитотоксичность (CDC), ассоциированные с константной областью иммуноглобулина, могут быть неэффективными для лечения заболевания. Даже хотя развитие технологии scFv началось более 12 лет назад, в настоящее время scFv-продукты не одобрены для терапии.
Альтернативно, было сделано предположение, что слияние scFv с другой молекулой, такой как токсин, могло бы использовать преимущество специфической антигенсвязывающей активности и малого размера scFv для доставки этого токсина к ткани-мишени. Chaudary et al., Nature 1989, 339:394; Batra et al., Mol. Cell. Biol. 1991, 11:2200. Таким образом, конъюгация или слияние токсинов с scFv были предложены в качестве альтернативной стратегии для обеспечения эффективных, антиген-специфических молекул, но введение доз с такими конъюгатами или химерами может быть ограничено избыточной и/или неспецифической токсичностью вследствие присутствия токсиновой части таких препаратов. Токсические эффекты могут включать надфизиологическое повышение ферментов печени и синдром сосудистого просачивания и другие нежелательные эффекты. Кроме того, иммунотоксины сами являются высокоиммуногенными после введения хозяину, и антитела хозяина, генерированные против этого иммунотоксина, ограничивают потенциальную применимость повторяемых терапевтических курсов лечения индивидуума.
Нехирургическая противораковая терапия, такая как наружное облучение и химиотерапия, могут страдать от ограниченной эффективности вследствие токсических действий на нормальные ткани и клетки, вследствие отсутствия специфичности, которое проявляют эти способы лечения в отношении раковых клеток. Для преодоления этого недостатка, были разработаны методологии нацеленного лечения для увеличения специфичности лечения в отношении клеток и тканей, нуждающихся в лечении. Примером такой нацеленной методологии для применения in vivo является введение конъюгатов антител, с антителом, сконструированным для специфического узнавания маркера, ассоциированного с клеткой или тканью, нуждающимися в лечении, и это антитело конъюгировано с терапевтическим агентом, таким как токсин, в случае лечения рака. Антитела, в виде системных агентов, циркулируют к чувствительным и нежелательным компартментам тела, таким как костный мозг. В остром радиационном повреждении, деструкция лимфоидного и гемопоэтического компартментов является основным фактором в развитии септицемии и последующей смерти. Кроме того, антитела являются большими глобулярными белками, которые могут проявлять слабое проникновение в ткани, нуждающиеся в лечении.
Пациенты-люди и субъекты, не являющиеся людьми, страдающие от различных процессов конечной стадии заболевания, часто требуют трансплантации органов. Однако, трансплантация органов должна преодолевать неблагоприятную иммунную реакцию реципиента и сдерживать иммунологическое отторжение трансплантированного органа подавлением клеточной иммунной реакции реципиента на чужеродный орган цитотоксическими агентами, которые влияют на лимфоидную ткань и другие части гемопоэтической системы. Принятие трансплантата ограничивается толерантностью реципиента к этим цитотоксическим химикалиям, многие из которых являются сходными с противораковыми (антипролиферативными) агентами. Подобным образом, при применении цитотоксических противомикробных агентов, в частности, антивирусных лекарственных средств, или при применении цитотоксических лекарственных средств для терапии аутоиммунных заболеваний, например, в лечении системной красной волчанки, серьезным недостатком являются токсические действия терапевтических агентов на костный мозг и гемопоэтические клетки тела.
Применение нацеленных терапий, таких как нацеленная терапия конъюгатами антител, предназначено для локализации максимального количества терапевтического агента по возможности в желаемом участке действия, и успех таких терапий обнаруживают по относительно высокому отношению сигнала к фону терапевтического агента. Примеры нацеленных антител включают конъюгаты с диагностическим или терапевтическим агентом антитела или фрагментов антитела, клетко- или тканеспецифических пептидов и гормонов и других рецепторсвязывающих молекул. Например, антитела против различных детерминант, ассоциированных с патологическими и нормальными клетками, а также ассоциированных с патогенными микроорганизмами, были использованы для детектирования и лечения большого разнообразия патологических состояний или повреждений. В этих способах, нацеливающее антитело непосредственно конъюгируют с подходящим детектирующим или терапевтическим агентом, как описано, например, в Hansen et al, Патенте США № 3927193, и Goldenberg, Патентах США с номерами 4331647, 4348376, 4361544, 4468457, 4444744, 4460459, 4460561, 4624846 и 4818709.
Одной проблемой, встречающейся в способах прямого нацеливания, т.е. в способах, в которых диагностический или терапевтический агент («активный агент») конъюгирован непосредственно с нацеливающей частью молекулы, является то, что относительно малая фракция этого конъюгата действительно связывается с участком-мишенью, в то время как большинство конъюгата остается в кровотоке и ухудшает одним или другим путем функцию нацеленного конъюгата. Для гарантии максимальной локализации активного агента, вводят обычно избыток нацеленного конъюгата, гарантируя, что некоторая часть конъюгата будет оставаться несвязанной и вносить вклад в уровни фона этого активного агента. Диагностический конъюгат, например, конъюгат радиоиммуносцинтиграфической визуализации или визуализации с использованием магнитного резонанса, который не связывается с его мишенью, может оставаться в кровотоке, увеличивая посредством этого фон и уменьшая разрешение этого диагностического способа. В случае терапевтического конъюгата, имеющего токсин в качестве активного агента (например, радиоизотопа, лекарственного средства или токсического соединения), присоединенный к долгоциркулирующей нацеливающей части, такой как антитело, этот циркулирующий конъюгат может приводить к неприемлемой токсичности в хозяине, например, токсичности для костного мозга или системным вредным побочным действиям.
Патент США № 4782840 описывает способ уменьшения эффекта повышенных уровней фоновой радиации во время хирургии. Этот способ предусматривает инъекцию пациенту антител, специфических для неопластической ткани, причем эти антитела помечены радиоизотопами, имеющими подходящий период полужизни в организме, такими как125I. После инъекции радиоактивно меченого антитела операцию откладывают по меньшей мере на 7-10 дней, предпочтительно 14 дней - 21 день, чтобы любое несвязанное радиоактивно меченое антитело было выведено до низкого уровня фона.
Патент США № 4932412 описывает способы уменьшения или коррекции неспецифической фоновой радиации во время интраоперационного детектирования. Эти способы включают введение пациенту, который получил радиоактивно меченое первичное антитело, контрастного агента, субтракционного агента или вторичного антитела, которое связывает первичное антитело.
Кроме продуцирования антител, описанного выше, иммунная система включает различные типы клеток, которые имеют мощные биологические действия. Во время гемопоэза, происходящие из костного мозга стволовые клетки дифференцируются в любые зрелые клетки иммунной системы (“В”-клетки») или в предшественники клеток, которые мигрируют из костного мозга для созревания в вилочковой железе (тимусе) (“T”-клетки).
В-клетки являются центральными относительно гуморального компонента иммунной реакции. В-клетки активируются посредством соответствующей презентации антигена, чтобы стать антитело-секретирующими плазматическими клетками; презентация антигена приводит также к клональной экспансии активированной В-клетки. В-клетки являются первично ответственными за гуморальный компонент иммунной реакции. Плазматическая клетка обычно обнаруживает приблизительно 105 молекул антител (IgD и IgM) на ее поверхности.
T-лимфоциты могут быть подразделены на две категории. Цитотоксические Т-клетки, Тс-лимфоциты или CTL (CD8+ T-клетки), уничтожают клетки, несущие чужеродный поверхностный антиген, в ассоциации с МНС Класса I, и могут уничтожать клетки, которые захватывают внутриклеточных паразитов (бактерии или вирусы), пока инфицированная клетка имеет микробный антиген на ее поверхности. Tc-клетки уничтожают опухолевые клетки и ответственны за отторжение трансплантированных клеток. Tc-клетки узнают комплексы антиген-МНС Класса I на клетках-мишенях, контактируют с ними и высвобождают содержимое гранул непосредственно на мембрану клеток-мишеней, которое лизирует эту клетку.
Второй категорией T-клеток является хелперная Т-клетка или Тh-лимфоцит (CD4+ T-клетки), которая продуцирует лимфокины, являющиеся «хелперными» факторами в созревании В-клеток в секретирующие антитело плазматические клетки. Тh-клетки также продуцируют определенные лимфокины, которые стимулируют дифференцировку эффекторных Т-лимфоцитов и активность макрофагов. Тh1-клетки узнают антиген на макрофагах в ассоциации с МНС Класса II и становятся активированными (посредством IL-1) для продуцирования лимфокинов, в том числе IFN-γ, который активирует макрофаги и NK-клетки. Эти клетки опосредуют различные аспекты клеточноопосредованной иммунной реакции, в том числе реакций гиперчувствительности замедленного типа. Th2-клетки узнают антиген в ассоциации с МНС Класса II на антигенпрезентирующей клетки или APC (например, мигрирующие макрофаги и дендритные клетки) и затем продуцируют интерлейкины и другие вещества, которые стимулируют специфическую В-клеточную и Т-клеточную пролиферацию и активность.
Кроме функционирования в качестве APC, которые инициируют Т-клеточные взаимодействия, развитие и пролиферацию, макрофаги участвуют в экспрессии клеточно-опосредованного иммунитета, так как они становятся активированными IFN-γ, продуцируемым клеточно-опосредованной иммунной реакцией. Активированные макрофаги имеют увеличенный фагоцитарный потенциал и высвобождают растворимые вещества, которые вызывают воспаление и разрушают многие бактерии и другие клетки. Природные клетки-убийцы (клетки-киллеры) являются цитотоксическими клетками, которые лизируют клетки, несущие новый антиген, независимо от типа их МНС и даже лизируют клетки, которые не несут белков МНС. Природные Т-клетки-киллеры, или NK-клетки, определяют по их способности уничтожать клетки, обнаруживающие чужеродный антиген (например, опухолевые клетки), независимо от типа МНС и независимо от предыдущей сенсибилизации (подвергания действию) этого антигена. NK-клетки могут активироваться IL-2 и IFN-γ и лизируют клетки таким же образом, что и цитотоксические Т-лимфоциты. Некоторые NK-клетки имеют рецепторы для Fc-домена антитела IgG (например, CD16 или FcγRIII) и, следовательно, способны связываться с Fc-частью IgG на поверхности клетки-мишени и высвобождать цитолитические компоненты, которые уничтожают эту клетку-мишень посредством антителозависимой клеточно-опосредованной цитотоксичности.
Другой группой клеток являются гранулоциты или полиморфно-ядерные лейкоциты (PMN). Нейтрофилы, один тип PMN, уничтожают проникшие бактерии, а фагоцитоз остальное. Эозинофилы являются другим типом PMN и содержат гранулы, которые являются цитотоксическими при высвобождении на другой клетке, такой как чужеродная клетка. Базофилы, другой тип PMN, являются важными медиаторами сильных физиологических реакций (например, воспаления), которые проявляют их действия посредством высвобождения различных биологически активных соединений, таких как гистамин, серотонин, простагландины и лейкотриены. Общей для всех этих типов клеток является способность проявлять физиологическое действие в организме, часто посредством уничтожения, и необязательно утилизации, ядовитых (вредных) композиций, таких как чужеродные клетки.
Хотя различные клетки млекопитающих, в том числе клетки иммунной системы, способны проявлять непосредственно физиологическое действие (например, уничтожение клеток, примером чего служат Tc, NK, некоторые PMN, макрофаг и т.п.), другие клетки опосредованно способствуют физиологическому действию. Например, первоначальная презентация антигена необученной Т-клетке иммунной системы требует МНС-презентации, которая дает разрешение на контакт клетка-клетка. Далее, часто требуется контакт между активированной Т-клеткой и антиген-специфической В-клеткой для получения конкретной иммуногенной реакции. Третьей формой контакта клетка-клетка, часто наблюдаемой в иммунных реакциях, является контакт между активированной В-клеткой и фолликулярными дендритными клетками. Каждое из этих требований контакта клетка-клетка усложняет нацеливание биологически активного агента на конкретную мишень.
Считается, что комплементзависимая цитотоксичность (CDC) является важным механизмом клиренса конкретных клеток-мишеней, таких как опухолевые клетки. CDC является серией событий, которая состоит из совокупности ферментов, которые становятся активированными друг другом в виде каскада. Комплемент играет важную роль в клиренсе антигена, выполняемом его четырьмя основными функциями: (1) локальной вазодилатацией; (2) аттракцией иммунных клеток, особенно фагоцитов (хемотаксисом); (3) маркированием чужеродных организмов для фагоцитоза (опсонизацией) и (4) деструкцией внедрившихся организмов атакующим комплексом мембраны (MAC-атакой). Центральной молекулой является белок С3. Он является ферментом, который расщепляется на два фрагмента компонентами либо классического пути, либо альтернативного пути. Классический путь индуцируется антителами, главным образом IgG и IgМ, тогда как альтернативный путь стимулируется бактериальными продуктами, такими как липополисахарид (LPS). Вкратце, продукты расщепления С3 включают малый пептид С3а, который является хемотаксическим для фагоцитарных иммунных клеток и приводит к локальной вазодилатации, вызывая высвобождение С5а-фрагмента из С5. Другая часть С3, C3b, покрывает антигены на поверхности чужеродных организмов и осуществляет опсонизацию этого организма для деструкции. C3b реагирует также с другими компонентами системы комплемента с образованием MAC, состоящего из C5b, C6, C7, C8 и C9.
Существуют проблемы, связанные с применением антител в терапии человека, так как реакция иммунной системы на любой антиген, даже самый простой, является «поликлональной», т.е. эта система производит антитела большого диапазона структур как в их связывающих областях, так и в их эффекторных областях.
Два подхода использовали в попытке уменьшения проблемы иммуногенных антител. Первым является получение химерных антител, в которых антигенсвязывающая часть (вариабельные области) моноклонального антитела мыши слита с эффекторной частью (константной областью) антитела человека. Во втором подходе, антитела изменяли посредством способа, известного как трансплантация определяющего комплементарность области (CDR) или «гуманизация». Этот процесс был дополнительно усовершенствован для включения изменений, называемого «реконструированием» молекулы антитела (Verhoeyen, et al, 1988 Science 239:1534-1536; Riechmann, et al, 1988 Nature 332:323-337; Tempest, et al, Bio/Technol 1991 9:266-271), "гиперхимеризацией" (Queen, et al, 1989 Proc Natl Acad Sci USA 86:10029-10033; Co, et al, 1991 Proc Natl Acad Sci USA 88:2869-2873; Co, et al, 1992 J Immunol 148:1149-1154) и “облицовкой" (Mark, et al, In: Metcalf BW, Dalton BJ, eds. Cellular adhesion: molecular definition to therapeutic potential. New York: Plenum Press, 1994:291-312).
В среднем менее одного терапевтического антитела в год вводили на рынок начиная с 1986 года, спустя одиннадцать лет после публикации моноклональных антител. Пять мышиных моноклональных антител были введены в медицину человека на протяжении десятилетнего периода 1986-1995, в том числе "муромонаб-CD3" (OrthoClone OKT3®) для острого отторжения трансплантатов органов; "эдреколомаб" (Panorex®) для колоректального рака; "одулимомаб" (Antilfa®) для отторжения трансплантата; и "ибритумомаб" (Zevalin® yiuxetan) для не-ходжкинской лимфомы. Дополнительно был введен на рынок моноклональный Fab, "абциксимаб" (ReoPro®) для предотвращения рецидива окклюзии коронарной артерии. Были запущены также три химерных моноклональных антитела: "ритуксимаб" (Rituxan®) для лечения В-клеточных лимфом; "базиликсимаб" (Simulect®) для отторжения трансплантата и "инфликсимаб" (Remicade®) для лечения ревматоидного артрита и болезни Крона. Кроме того, "абциксимаб" (ReoPro®), Fab-фрагмент 47,6 кД химерного “человек-мышь” моноклонального антитела продается на рынке в качестве вспомогательного средства для чрескожного коронарного вмешательства для предотвращения сердечных ишемических осложнений у пациентов, подвергающихся чрескожному коронарному вмешательству. Наконец, на рынок были запущены семь «гуманизированных» моноклональных антител. "Даклизумаб" (Zenapax®) используют для предупреждения острого отторжения трансплантированных почек; "паливизумаб" (Synagis®) для RSV; "трастузумаб" (Herceptin®) связывает HER-2, рецептор фактора роста, обнаруженный на клетках рака молочной железы; "гемтузумаб" (Mylotarg®) для острого миелоидного лейкоза (AML) и "алемтузумаб" (MabCampath®) для хронического лимфоцитарного лейкоза; "адалимумаб" (Humira® (D2E7)) для лечения ревматоидного артрита и "омализумаб" (Xolair®) для лечения резистентной (не поддающейся лечению) астмы.
Таким образом, различные технологии с использованием антител привлекли внимание в попытке развития и выпуска на рынок более эффективных терапевтических веществ и паллиативных средств. К сожалению, каждую из этих терапий сопровождают проблемы, которые ослабляют перспективы их применения. Например, большинство раковых пациентов, лечившихся ритуксимабом, имели рецидив, обычно в пределах приблизительно 6-12 месяцев, и сообщались летальные реакции на инфузию в пределах 24 часов инфузии ритуксимаба. Острая почечная недостаточность, требующая диализа, со случаями летального исхода сообщалась также в лечениях ритцуксимабом, так же как и тяжелые, иногда летальные, кожно-слизистые реакции. Кроме того, высокие дозы ритуксимаба требуются для внутривенной инъекции, так как эта молекула является большой, приблизительно 150 кДа, и диффузия в лимфоидные ткани, где могут находиться многочисленные опухолевые клетки, является ограниченной.
Введение трастузумаба может приводить к развитию вентрикулярной дисфункции, застойной сердечной недостаточности и тяжелым аллергическим реакциям (в том числе анафилаксии), реакций на инфузию и легочных событий. Иммуносупрессивная терапия с использованием даклизумаба создает увеличенный риск развития лимфопролиферативных нарушений и оппортунистических инфекций. У пациентов, которые получали гемтузумаб, сообщалась смерть от печеночной недостаточности, возникающая из тяжелой гепатотоксичности, и от вено-окклюзивного заболевания (VOD).
Гепатотоксичность сообщалась также у пациентов, получающих алемтузумаб. Серьезные и, в некоторых редких случаях летальные, панцитопения/гипоплазия костного мозга, аутоиммунная идиопатическая тромбоцитопения и аутоиммунная гемолитическая анемия встречались у пациентов, получающих терапию в виде алемтузумаба. Алемтузумаб мог также приводить к серьезным реакциям на инфузию, а также оппортунистическим инфекциям. У пациентов, лечившихся адалимумабом, сообщались серьезные инфекции и сепсис, в том числе летальные исходы, а также обострение клинических симптомов и/или радиографическое доказательство демиелинизирующего заболевания, и пациенты, лечившиеся адалимумабом в клинических исследованиях, имели более высокую встречаемость лимфомы, чем ожидаемая частота в обычной популяции. Сообщалось, что омализумаб индуцировал злокачественности и анафилаксию.
Рак включает широкий диапазон заболеваний, поражающих приблизительно одного из четырех индивидуумов по всему свету. Быстрая и неконтролируемая пролиферация злокачественных клеток является отличительным признаком многих типов раков, в том числе гематологических злокачественностей (гемобластозов). Хотя пациенты с гематологическим злокачественным состоянием получали пользу от успехов в противораковой терапии в последние два десятилетия, Multani et al., 1998 J. Clin. Oncology 16:3691-3710, и периоды ремиссии увеличивались, большинство пациентов все еще имели рецидивы и умирали от их заболевания. Барьеры для излечения цитотоксическими средствами включают, например, резистентность опухолевых клеток и высокую токсичность химиотерапии, которая препятствует введению оптимальных доз во многих пациентов.
Сообщалось, что лечение пациентов с В-клеточной лимфомой низкой степени или фолликулярной В-клеточной лимфомой с использованием химерного CD20-моноклонального антитела индуцирует частичные или полные реакции у пациентов. McLaughlin et al., 1996 Blood 88:90a (abstract, suppl. 1); Maloney et al., 1997 Blood 90:2188-95. Однако, как отмечалось выше, рецидив опухоли имеет место в пределах шести месяцев - одного года. Дополнительные усовершенствования серотерапии необходимы для индукции более долговременных реакций, например, в В-клеточной лимфоме низкой степени, и для возможности эффективного лечения лимфомы высокой степени и других В-клеточных заболеваний.
Другим подходом было нацеливание радиоактивных изотопов на В-клеточные лимфомы с использованием моноклональных антител, специфических в отношении CD20. Сообщалось, что хотя эффективность терапии увеличивалась, ассоциированная токсичность от радиоактивного антитела с продолжительным периодом полужизни in vivo увеличивается, иногда требуя подвергания пациента спасению стволовых клеток. Press et al., 1993 N. Eng. J. Med. 329:1219-1224; Kaminski et al., 1993 N. Eng. J. Med. 329:459-65. Моноклональные антитела к CD20 также расщепляли протеазами с получением F(ab')2- или Fab-фрагментов перед присоединением радиоизотопа. Сообщалось, что это улучшает проникновение радиоизотопного конъюгата в опухоль и укорачивает период полужизни in vivo, уменьшая посредством этого токсичность в отношении нормальных тканей. Однако, эти молекулы лишены эффекторных функций, в том числе фиксации (связывания) комплемента и/или ADCC.
Аутоиммунные заболевания включают аутоиммунные заболевания щитовидной железы, которые включают болезнь Грейвса и тироидит Хашимото. Только в Соединенных Штатах приблизительно 20 миллионов человек имеют некоторую форму аутоиммунного заболевания щитовидной железы. Аутоиммунное заболевание щитовидной железы происходит из продуцирования аутоантител, которые стимулируют щитовидную железу, вызывая гипертиреоз (болезнь Грейвса), или разрушают щитовидную железу, вызывая гипотиреоз (тиреоидит Хашимото). Стимуляция щитовидной железы вызывается аутоантителами, которые связывают и активируют рецептор тиреоидстимулирующего гормона (TSH). Деструкция щитовидной железы вызывается аутоантителами, которые реагируют с другими антигенами щитовидной железы. Существующая терапия для болезни Грейвса включает хирургию, радиоактивный иод или терапию антитиреоидными лекарственными средствами. Радиоактивный иод широко используется, так как антитереоидные лекарственные средства имеют значительные вредные побочные действия, и рецидив заболевания является высоким. Хирургия ограничивается пациентами с большим зобом или случаями, когда необходима очень быстрая нормализация функции щитовидной железы. Не существует терапий, которые нацелены на продуцирование аутоантител, ответственных за стимуляцию рецептора TSH. Существующей терапией для тиреоидита Хашимото является левотироксин-натрий, и предполагается пожизненная терапия вследствие низкой вероятности ремиссии. Было показано, что супрессивная терапия вызывает сжатие зоба в тиреоидите Хашимото, но неизвестны терапии, которые уменьшают продуцирование аутоантитела, для нацеливания на механизм этого заболевания.
Ревматоидный артрит (RA) является хроническим заболеванием, характеризуемым воспалением суставов, приводящим к опуханию, боли и потере функции. RA поражает приблизительно 2,5 миллиона людей в Соединенных Штатах. RA вызывается комбинацией событий, включающих первоначальные инфекцию или повреждение, аномальную иммунную реакцию и генетические факторы. Хотя в RA присутствуют аутореактивные Т-клетки и В-клетки, детектирование высоких уровней антител, которые собираются в суставах, называемых ревматоидным фактором, используют для диагностики RA. Современная терапия для RA включает многие лекарственные средства для уменьшения боли и замедления прогрессирования этого заболевания. Не найдена терапия, которая может излечивать это заболевание. Лекарственные средства включают нестероидные противовоспалительные средства (NSAID) и модифицирующие заболевание противоревматические лекарственные средства (DMARD). NSAID применимы в доброкачественном заболевании, но не могут предотвращать прогрессирование деструкции суставов и истощения в тяжелом RA. Как NSAID, так и DMARD связаны со значительными побочными действиями. Только одно новое DMARD, лефлуномид, было одобрено на протяжении 10 лет. Лефлуномид блокирует продуцирование аутоантител, уменьшает воспаление и замедляет прогрессирование RA. Однако, это лекарственное средство вызывает также тяжелые побочные действия, в том числе тошноту, рвоту, потерю волос и повреждение печени.
Системная красная волчанка (SLE) является аутоиммунным заболеванием, вызываемым повторяющимися повреждениями кровеносных сосудов во множественных органах, в том числе почке, коже и суставах. Согласно приближенной оценке, SLE поражает более 500000 людей в Соединенных Штатах. У пациентов со SLE, неправильное взаимодействие между Т-клетками и В-клетками приводит к продуцированию аутоантител, которые атакуют ядро клеток. Они включают антитела против двухцепочечной ДНК и антитела против Sm. Аутоантитела, которые связывают фосфолипиды, также обнаружены приблизительно у половины SLE-пациентов и являются ответственными за повреждение кровеносных сосудов и низкое число форменных элементов крови. Иммунные комплексы накапливаются в почках, кровеносных сосудах и суставах SLE-пациентов, где они вызывают воспаление и повреждение тканей. Для лечения этого заболевания (SLE) не было найдено лечение. NSAID и DMARD используют для терапии в зависимости от тяжести заболевания. Плазмаферез с обменом плазмы для удаления аутоантител может вызывать временное улучшение у SLE-пациентов. Существует общее согласие в отношении того, что аутоантитела ответственны за SLE, так что новые терапии, которые истощают В-клеточное направление дифференцировки, позволяя вернуть иммунную систему в исходное положение, когда новые В-клетки генерируются из предшественников, позволили бы надеяться на долговременную пользу в случае SLE-пациентов.
Синдром Шегрена является аутоиммунным заболеванием, характеризуемым деструкцией продуцирующих жидкости тела желез. Синдром Шегрена является одним из наиболее часто встечающихся аутоиммунных нарушений, поражающих приблизительно 4 миллиона людей в Соединенных Штатах. Приблизительно половина людей, пораженных синдромом Шегрена, имеют также заболевание соединительной ткани, такое как RA, в то время как другая половина имеет первичный синдром Шегрена без другого одновременного аутоиммунного заболевания. Аутоантитела, в том числе антиядерные антитела, ревматоидный фактор, анти-фодрин-антитела и антитела против мускаринового рецептора, часто присутствуют у пациентов с синдромом Шегрена. Общепринятая терапия включает кортикостероиды, и были бы полезными дополнительные более эффективные терапии.
Иммунная тромбоцитопеническая пурпура (ITP) вызывается аутоантителами, которые связываются с тромбоцитами крови и вызывают их деструкцию. Некоторые случаи ITP вызываются лекарственными средствами, а другие ассоциируются с инфекцией, беременностью или аутоиммунным заболеванием, таким как SLE. Приблизительно половина всех случаев классифицируются как заболевания идиопатического происхождения. Лечение ITP определяется тяжестью симптомов. В некоторых случаях, не требуется терапии, хотя в большинстве случаев предоставляются иммуносупрессивные лекарственные средства, в том числе кортикостероиды, или внутривенные инфузии иммуноглобулина для истощения Т-клеток. Другим лечением, которое обычно приводит к увеличенному количеству тромбоцитов, является удаление селезенки, органа, который разрушает покрытые антителами тромбоциты. Более эффективные иммуносупрессивные лекарственные средства, в том числе циклоспорин, циклофосфамид или азатиоприн, используют для пациентов с тяжелыми случаями. Удаление аутоантител пропусканием плазмы пациентов через Белок А-колонку, используют в качестве лечения второй очереди у пациентов с тяжелым заболеванием. Требуются дополнительные более эффективные терапии.
Рассеянный склероз (MS) также является аутоиммунным заболеванием. Он характеризуется воспалением центральной нервной системы и деструкцией миелина, который изолирует волокна нервной ткани в головном мозге, спинном мозге и теле. Хотя причина MS неизвестна, имеется широко распространенное мнение, что аутоиммунные Т-клетки являются первичными факторами, способствующими патогенезу этого заболевания. Однако, высокие уровни антител присутствуют в цереброспинальной жидкости пациентов с MS, и некоторые исследователи предсказывают, что для опосредования этого заболевания важной является В-клеточная реакция, приводящая к продуцированию антител. Терапии истощения В-клеток не исследовались на пациентах с MS, и излечение MS не является возможным. Существующей терапией являются кортикостероиды, которые могут уменьшать продолжительность и тяжесть приступов, но не влияют на протекание MS на протяжении времени. Новые биотехнологические терапии с использованием интерферона (IFN) для MS были недавно одобрены, но требуются дополнительные более эффективные терапии.
Тяжелая псевдопаралитическая миастения (MG) является хроническим аутоиммунным нервно-мышечным нарушением, которое характеризуется слабостью произвольных групп мышц. MG поражает приблизительно 40000 людей в Соединенных Штатах. MG вызывается аутоантителами, которые связываются с рецепторами ацетилхолина, экспрессируемыми в нервно-мышечных соединениях. Эти аутоантитела уменьшают число или блокируют рецепторы ацетилхолина, препятствуя передаче сигналов от нервов к мышцам. Излечение для MG неизвестно. Обычные терапии включают иммуносупрессию кортикостероидами, циклоспорином, циклофосфамидом или азатиоприном. Хирургическое удаление вилочковой железы часто используют для уменьшения аутоиммунной реакции. Плазмаферез, используемый для уменьшения уровней аутоантител в крови, является эффективным в MG, но кратковременным вследствие продолжения продуцирования аутоантител. Плазмаферез обычно используют для тяжелой мышечной слабости перед хирургией. Были бы полезными новые и эффективные терапии.
Псориаз поражает приблизительно пять миллионов людей в Соединенных Штатах и характеризуется аутоиммунным воспалением в коже. Псориаз также ассоциируется с артритом в 30% пациентов (псориатическим артритом). Использовали многие способы лечения, в том числе стероиды, УФ-свет, ретиноиды, производные витамина D, циклоспорин и метотрексат, но также ясно, что новые и эффективные терапии могут принести пользу при псориазе.
Склеродермия является хроническим аутоиммунным заболеванием соединительной ткани, которое также известно как системный склероз. Склеродермия характеризуется сверхпродуцированием коллагена, приводящим к утолщению кожи, и приблизительно 300000 людей в Соединенных Штатах имеют склеродермию, которым новые и эффективные терапии могли бы принести пользу.
Из предыдущего обсуждения очевидными являются потребности в улучшенных композициях и способах для лечения, ослабления или предотвращения различных заболеваний, нарушений и состояний, в том числе рака и аутоиммунных заболеваний.
Сущность изобретения
Данное изобретение соответствует по меньшей мере одной из вышеупомянутых потребностей в данной области обеспечением белков, содержащих по меньшей мере два специфических связывающих домена, где эти два домена связаны константной субобластью, полученной из молекулы антитела, присоединенной на его С-конце к линкеру, называемому здесь линкером-скорпионом, и нуклеиновых кислот, кодирующих такие белки, а также получения, диагностических и терапевтических применений таких белков и нуклеиновых кислот. Эта константная субобласть содержит домен, полученный из CH2-домена иммуноглобулина, и предпочтительно домен, полученный из CH3-домена иммуноглобулина, но не содержит домена или области, полученного(ной) из CH1-домена иммуноглобулина или соответствующего СН1-домену иммуноглобулина. Ранее считали, что помещение константной области, полученной из антитела, во внутреннюю часть белка будет препятствовать функции антитела, такой как эффекторная функция, по аналогии с общепринятым помещением константных областей антител на карбокси-концах цепей антител. Кроме того, помещение линкера-скорпиона, который может быть пептидом, подобным шарнирной области иммуноглобулина, с С-конца относительно константной субобласти, является организацией, которая отличается от организации природных иммуноглобулинов. Однако, помещение константной субобласти (с линкером-скорпионом, присоединенным с С-конца относительно константной области) во внутреннюю часть цепи полипептида или белка в соответствии с данным изобретением приводило к белкам, проявляющим эффекторную функцию и мультивалентные (моно- или мультиспецифические) способности связывания, относительно не затрудненные стерическими препятствиями. Как будет очевидно специалисту в данной области после рассмотрения этого описания, такие белки являются модульными (модулярными) по конструкции и могут быть сконструированы отбором любого из различных связывающих доменов для связывающего домена 1 и связывающего домена 2 (или для любых дополнительных связывающих доменов, обнаруженных в конкретном белке в соответствии с этим изобретением), отбором константной субобласти, имеющей эффекторную функцию, и отбором линкера-скорпиона, подобного шарнирной области или не подобного шарнирной области (например, пептидов области «стебля» рецептора лектина С типа II), с белком, проявляющим общую организацию N-связывающий домен 1 - константная субобласть - линкер-скорпион - связывающий домен 2-С. Специалистам в данной области будет также понятно, что белки такой структуры и нуклеиновые кислоты, кодирующие эти белки, найдут большое разнообразие применений, в том числе применений в медицине и ветеринарии.
Один аспект настоящего изобретения относится к мультивалентному одноцепочечному связывающему белку с эффекторной функцией, или скорпиону (эти термины используются взаимозаменяемо), содержащему первый связывающий домен, полученный из иммуноглобулина (например, антитела) или иммуноглобулин-подобной молекулы, константную субобласть, обеспечивающую эффекторную функцию, причем эта константная субобласть расположена с С-конца относительно первого связывающего домена; линкер-скорпион, расположенный с С-конца относительно константной субобласти; и второй связывающий домен, полученный из иммуноглобулина (такого как антитело) или иммуноглобулин-подобной молекулы, расположенный с С-конца относительно константной субобласти; посредством чего константная субобласть помещена между первым связывающим доменом и вторым связывающим доменом. Этот одноцепочечный связывающий белок может быть мультиспецифическим, например, биспецифическим, в том смысле, что он может связывать две или более отличающихся мишеней, или он может быть моноспецифическим, например, с двумя сайтами связывания для одной и той же мишени. Кроме того, все домены этого белка обнаруживаются в единой цепи, но этот белок может образовывать гомо-мультимеры, например, образованием межцепочечной дисульфидной связи. В некоторых вариантах осуществления, первый связывающий домен и/или второй связывающий домен получен/получены из вариабельных областей легкой и тяжелой цепей иммуноглобулина из одного и того же иммуноглобулина или из различных иммуноглобулинов (например, антител). Иммуноглобулин (иммуноглобулины) может быть иммуноглобулином любого позвоночного животного, такого как млекопитающее, в том числе человек, и может быть химерным, гуманизированным антителом, фрагментами, вариантами или производными природных иммуноглобулинов.
Это изобретение рассматривает белки, в которых первый и второй связывающие домены получены из одного и того же иммуноглобулина или различных иммуноглобулинов (например, антител) и в которых первый и второй связывающие домены узнают одинаковые или различные молекулярные мишени (например, поверхностные маркеры клеток, такие как мембраносвязанные белки). Кроме того, первый и второй связывающие домены могут узнавать одинаковые или различные эпитопы. Эти первая и вторая молекулярные мишени могут быть ассоциированы с первой и второй клетками-мишенями, вирусами-мишенями, носителями-мишенями и/или объектами-мишенями. В предпочтительных вариантах осуществления согласно этому аспекту данного изобретения, каждый из первого связывающего домена, второго связывающего домена и константной субобласти получены из иммуноглобулина человека, такого как IgG-антитело. В других вариантах осуществления, этот мультивалентный связывающий белок с эффекторной функцией имеет по меньшей мере один из первого связывающего домена и второго связывающего домена, который узнает по меньшей мере одну бесклеточную молекулярную мишень, например, белок, не ассоциированный с клеткой, такой как депонированный белок или растворимый белок. Бесклеточные молекулярные мишени включают, например, белки, которые никогда не были ассоциированы с клеткой, например, введенные соединения, такие как белки, а также белки, которые секретируются, отщепляются, присутствуют в экзосомах или другим образом выбрасываются или выделяются из клетки.
Молекулы-мишени, узнаваемые первым и вторым связывающими доменами, могут быть обнаружены на одинаковых или различных прокариотических клетках, эукариотических клетках, вирусах (в том числе бактериофаге), органических или неорганических молекулах-носителях-мишенях и чужеродных объектах, или могут быть связаны с ними. Кроме того, эти молекулы-мишени могут находиться на физически различных клетках, вирусах или объектах одного и того же типа (например, на двух различных эукариотических клетках, прокариотических клетках, вирусах или носителях) или эти молекулы-мишени могут находиться на клетках, вирусах, носителях или объектах, которые отличаются по типу (например, на эукариотической клетке и вирусе). Клетками-мишенями являются клетки, ассоциированные с молекулой-мишенью, узнаваемой связывающим доменом, и включают эндогенные или аутологичные клетки, а также экзогенные или чужеродные клетки (например, инфекционные микробные клетки, трансплантированные клетки млекопитающих, в том числе трансфузированные клетки крови). Это изобретение включает мишени для первого и/или второго связывающих доменов, которые обнаруживаются на поверхности клетки-мишени (клеток-мишеней), ассоциированные с заболеванием, нарушением или состоянием млекопитающего, такого как человек. Примерные клетки-мишени включают раковую клетку, клетку, ассоциированную с аутоиммунным заболеванием или нарушением, и инфекционную клетку (например, инфекционную бактерию). Клетка инфекционного организма, такого как паразит млекопитающего, также считается клеткой-мишенью. В некоторых вариантах осуществления, белок по изобретению является мультивалентным (например, мультиспецифическим) связывающим белком с эффекторной функцией, где по меньшей мере один из первого связывающего домена и второго связывающего домена узнает мишень, выбранную из группы, состоящей из опухолевого антигена, В-клетки-мишени, члена суперсемейства рецепторов TNF, члена семейства Hedgehog, рецепторной тирозинкиназы, родственной протеогликану молекулы, члена суперсемейства TGF-β, Wnt-родственной молекулы, лиганда рецептора, Т-клетки-мишени, дендритной клетки-мишени, NK-клетки-мишени, моноцита/макрофага-мишени и мишени ангиогенеза.
В некоторых вариантах вышеописанного белка, опухолевый антиген выбран из группы, состоящей из антигена 1 плоскоклеточной карциномы (SCCA-I), (PROTEIN T4-A), антигена 2 плоскоклеточной карциномы (SCCA-2), антигена CA125 рака яичника (1A1-3B) (KIAA0049), муцина 1 (ассоциированного с опухолью муцина), (ассоциированного с раком муцина), (полиморфного эпителиального муцина), (PEM), (PEMT), (эписиалина), (ассоциированного с опухолью антигена эпителиальной мембраны), (EMA), (H23 AG), (соя-реактивного мочевого муцина), (PUM), (ассоциированного с раком молочной железы антигена DF3), CTCL-опухолевого антигена se1-1, CTCL-опухолевого антигена se14-3, CTCL-опухолевого антигена se20-4, CTCL-опухолевого антигена se20-9, CTCL-опухолевого антигена se33-1, CTCL-опухолевого антигена se37-2, CTCL-опухолевого антигена se57-1, CTCL-опухолевого антигена se89-1, простата-специфического мембранного антигена, 5T4-онкофетального трофобластного гликопротеина, герпесвируса, ассоциированного с саркомой Капоши Orf73, MAGE-C1 (антигена рака яичка CT7), антигена MAGE-B1 (антигена MAGE-XP) (DAM10), антигена MAGE-B2 (DAM6), антигена MAGE-2, антигена MAGE-4a, антигена MAGE-4b, антигена NY-CO-45 рака толстой кишки, варианта А антигена NY-LU-12 рака легкого, ассоциированного с раком поверхностного антигена, антигена ART1 аденокарциномы, паранеопластического ассоциированного с раком головного мозга/яичка антигена (онконейронного антигена MA2; паранеопластического нейронного антигена), нейро-онкологического вентрального антигена 2 (NOVA2), гена 520 антигена печеночноклеточной карциномы, ассоциированного с опухолью антигена CO-029, ассоциированного с опухолью антигена MAGE-X2, точечного разрыва 2 X синовиальной саркомы, антигена плоскоклеточной карциномы, узнаваемого Т-клеткой, серологически определенного антигена 1 рака толстой кишки, серологически определенного антигена NY-BR-15 рака молочной железы, серологически определенного антигена NY-BR-16 рака молочной железы, Хромогранина А; паратиреоидного секреторного белка 1, DUPAN-2, CA 19-9, CA 72-4, CA 195 и L6.
Варианты вышеописанного способа включают В-клетку-мишень, выбранную из группы, состоящей из CD10, CD19, CD20, CD21, CD22, CD23, CD24, CD37, CD38, CD39, CD40, CD72, CD73, CD74, CDw75, CDw76, CD77, CD78, CD79a/b, CD80, CD81, CD82, CD83, CD84, CD85, CD86, CD89, CD98, CD126, CD127, CDw130, CD138 и CDw150.
В других вариантах вышеописанного способа член суперсемейства рецепторов TNF выбран из группы, состоящей из 4-1BB/TNFRSF9, NGF R/TNFRSF16, BAFF R/TNFRSF13C, Остеопротегерин/TNFRSF11B, BCMA/TNFRSF17, OX40/TNFRSF4, CD27/TNFRSF7, RANK/TNFRSF11A, CD30/TNFRSF8, RELT/TNFRSF19L, CD40/TNFRSF5, TACI/TNFRSF13B, DcR3/TNFRSF6B, TNF RI/TNFRSF1A, DcTRAIL R1/TNFRSF23, TNF RII/TNFRSF1B, DcTRAIL R2/TNFRSF22, TRAIL R1/TNFRSF10A, DR3/TNFRSF25, TRAIL R2/TNFRSF10B, DR6/TNFRSF21, TRAIL R3/TNFRSF10C, EDAR, TRAIL R4/TNFRSF10D, Fas/TNFRSF6, TROY/TNFRSF19, GITR/TNFRSF18, TWEAK R/TNFRSF12, HVEM/TNFRSF14, XEDAR, Лимфотоксин бета R/TNFRSF3, 4-1BB Лиганд/TNFSF9, Лимфотоксина, APRIL/TNFSF13, Лимфотоксин бета/TNFSF3, BAFF/TNFSF13C, OX40 Лиганд/TNFSF4, CD27 Лиганд/TNFSF7, TL1A/TNFSF15, CD30 Лиганд/TNFSF8, TNF-альфа/TNFSF1A, CD40 Лиганд/TNFSF5, TNF-бета/TNFSF1B, EDA-A2, TRAIL/TNFSF10, Fas Лиганд/TNFSF6, TRANCE/TNFSF11, GITR Лиганд/TNFSF18, TWEAK/TNFSF12 и LIGHT/TNFSF14.
Вышеописанный способ включает также варианты, в которых член семейства Hedgehog выбран из группы, состоящей из Patched и Smoothened. В других вариантах, родственная протеогликану молекула выбрана из группы, состоящей из протеогликанов и их регуляторов.
Дополнительные варианты осуществления этого способа относятся к процессам, в которых рецепторная тирозинкиназа выбрана из группы, состоящей из Ax1, FGF R4, C1q R1/CD93, FGF R5, DDR1, Flt-3, DDR2, HGF R, Dtk, IGF-I R, EGF R, IGF-II R, Eph, INSRR, EphA1, Инсулин R/CD220, EphA2, M-CSF R, EphA3, Mer, EphA4, MSP R/Ron, EphA5, MuSK, EphA6, PDGF R альфа, EphA7, PDGF R бета, EphA8, Ret, EphB1, ROR1, EphB2, ROR2, EphB3, SCF R/c-kit, EphB4, Tie-1, EphB6, Tie-2, ErbB2, TrkA, ErbB3, TrkB, ErbB4, TrkC, FGF R1, VEGF R1/Flt-1, FGF R2, VEGF R2/Flk-1, FGF R3 и VEGF R3/Flt-4.
В других вариантах осуществления этого способа член семейства трансформирующего фактора роста (TGF)-бета выбран из группы, состоящей из Активин RIA/ALK-2, GFR альфа-1, Активин RIB/ALK-4, GFR альфа-2, Активин RIIA, GFR альфа-3, Активин RIIB, GFR альфа-4, ALK-1, MIS RII, ALK-7, Ret, BMPR-IA/ALK-3, TGF-бета RI/ALK-5, BMPR-IB/ALK-6, TGF-бета RII, BMPR-II, TGF-бета RIIb, Эндоглин/CD105 и TGF-бета RIII.
Другие варианты осуществления этого способа содержат Wnt-родственную молекулу, выбранную из группы, состоящей из Frizzled-1, Frizzled-8, Frizzled-2, Frizzled-9, Frizzled-3, sFRP-1, Frizzled-4, sFRP-2, Frizzled-5, sFRP-3, Frizzled-6, sFRP-4, Frizzled-7, MFRP, LRP 5, LRP 6, Wnt-1, Wnt-8a, Wnt-3a, Wnt-10b, Wnt-4, Wnt-11, Wnt-5a, Wnt-9a и Wnt-7a.
В других вариантах осуществления этого способа, лиганд рецептора выбран из группы, состоящей из 4-IBB Лиганд/TNFSF9, Лимфотоксина, APRIL/TNFSF13, Лимфотоксин бета/TNFSF3, BAFF/TNFSF13C, OX40 Лиганд/TNFSF4, CD27 Лиганд/TNFSF7, TL1A/TNFSF15, CD30 Лиганд/TNFSF8, TNF-альфа/TNFSFIA, CD40 Лиганд/TNFSF5, TNF-бета/TNFSFIB, EDA-A2, TRAIL/TNFSF10, Fas Лиганд/TNFSF6, TRANCE/TNFSF11, GITR Лиганд/TNFSF18, TWEAK/TNFSF12, LIGHT/TNFSF14, Амфирегулина, изоформы GGF2 NRG1, Бетацеллулина, Изоформы SMDF NRG1, EGF, NRG1-альфа/HRG1-альфа, Эпигена, NRG1-бета 1/HRG1-бета 1, Эпирегулина, TGF-альфа, HB-EGF, TMEFF 1/Томорегулин-1, Нейрегулина-3, TMEFF2, IGF-I, IGF-II, Инсулина, Активина A, Активина B, Активина AB, Активина C, BMP-2, BMP-7, BMP-3, BMP-8, BMP-3b/GDF-10, BMP-9, BMP-4, BMP-15, BMP-5, Decapentaplegic, BMP-6, GDF-1, GDF-8, GDF-3, GDF-9, GDF-5, GDF-11, GDF-6, GDF-15, GDF-7, Артемина, Нейртурина, GDNF, персефина, TGF-бета, TGF-бета 2, TGF-бета 1, TGF-бета 3, LAP (TGF-бета 1), TGF-бета 5, латентного TGF-бета 1, латентного TGF-бета bp1, TGF-бета 1.2, Lefty, Nodal, MIS/AMH, кислого FGF, FGF-12, основного FGF, FGF-13, FGF-3, FGF-16, FGF-4, FGF-17, FGF-5, FGF-19, FGF-6, FGF-20, FGF-8, FGF-21, FGF-9, FGF-23, FGF-10, KGF/FGF-7, FGF-11, Нейропилина-1, P1GF, Нейропилина-2, P1GF-2, PDGF, PDGF-A, VEGF, PDGF-B, VEGF-B, PDGF-C, VEGF-C, PDGF-D, VEGF-D и PDGF-AB.
В других вариантах осуществления, T-клетка-мишень выбрана из группы, состоящей из 2B4/SLAMF4, IL-2 R альфа, 4-1BB/TNFRSF9, IL-2 R бета, ALCAM, B7-1/CD80, IL-4 R, B7-H3, BLAME/SLAMF8, BTLA, IL-6 R, CCR3, IL-7 R альфа, CCR4, CXCR1/IL-8 RA, CCR5, CCR6, IL-10 R альфа, CCR7, IL-10 R бета, CCR8, IL-12 R бета 1, CCR9, IL-12 R бета 2, CD2, IL-13 R альфа 1, IL-13, CD3, CD4, ILT2/CD85j, ILT3/CD85k, ILT4/CD85d, ILT5/CD85a, Интегрин альфа 4/CD49d, CD5, Интегрин альфа E/CD103, CD6, Интегрин альфа M/CD11b, CD8, Интегрин альфа X/CD11c, Интегрин бета 2/CD18, KIR/CD158, CD27/TNFRSF7, KIR2DL1, CD28, KIR2DL3, CD30/TNFRSF8, KIR2DL4/CD158d, CD31/PECAM-1, KIR2DS4, CD40 Лиганд/TNFSF5, LAG-3, CD43, LAIR1, CD45, LAIR2, CD83, Лейкотриена B4 R1, CD84/SLAMF5, NCAM-L1, CD94, NKG2A, CD97, NKG2C, CD229/SLAMF3, NKG2D, CD2F-10/SLAMF9, NT-4, CD69, NTB-A/SLAMF6, Обычная гамма-цепь/IL-2 R гамма, Остеопонтина, CRACC/SLAMF7, PD-1, CRTAM, PSGL-I, CTLA-4, RANK/TNFRSF11A, CX3CR1, CX3CL1, L-Селектина, CXCR3, SIRP бета 1, CXCR4, SLAM, CXCR6, TCCR/WSX-1, DNAM-1, Тимопоэтина, EMMPRIN/CD147, TIM-1, EphB6, TIM-2, Fas/TNFRSF6, TIM-3, Fas лиганд/TNFSF6, TIM-4, Fc гамма RIII/CD16, TIM-6, GITR/TNFRSF18, TNF RI/TNFRSF1A, Гранулизина, TNF RII/TNFRSF1B, HVEM/TNFRSF14, TRAIL R1/TNFRSF10A, ICAM-1/CD54, TRAIL R2/TNFRSF10B, ICAM-2/CD102, TRAIL R3/TNFRSF10C, IFN-гамма R1, TRAIL R4/TNFRSF10D, IFN-гамма R2, TSLP, IL-1 RI и TSLP R.
В других вариантах осуществления, рецептор NK-клеток выбран из группы, состоящей из 2B4/SLAMF4, KIR2DS4, CD155/PVR, KIR3DL1, CD94, LMIR1/CD300A, CD69, LMIR2/CD300c, CRACC/SLAMF7, LMIR3/CD300LF, DNAM-1, LMIR5/CD300LB, Fc эпсилон RII, LMIR6/CD300LE, Fc гамма RI/CD64, MICA, Fc гамма RIIB/CD32b, MICB, Fc гамма RIIC/CD32c, MULT-1, Fc гамма RIIA/CD32a, Нектин-2/CD112, Fc гамма RIII/CD16, NKG2A, FcRH1/IRTA5, NKG2C, FcRH2/IRTA4, NKG2D, FcRH4/IRTA1, NKp30, FcRH5/IRTA2, NKp44, Fc-рецептор-подобный 3/CD16-2, NKp46/NCR1, NKp80/KLRF1, NTB-A/SLAMF6, Rae-1, Rae-1 альфа, Rae-1 бета, Rae-1 дельта, H60, Rae-1 эпсилон, ILT2/CD85j, Rae-1 гамма, ILT3/CD85k, TREM-1, ILT4/CD85d, TREM-2, ILT5/CD85a, TREM-3, KIR/CD158, TREML1/TLT-1, KIR2DL1, ULBP-1, KIR2DL3, ULBP-2, KIR2DL4/CD158d и ULBP-3.
В других вариантах осуществления клетка-мишень моноцит/макрофаг выбрана из группы, состоящей из B7-1/CD80, ILT4/CD85d, B7-H1, ILT5/CD85a, обычной бета-цепи, Интегрин альфа 4/CD49d, BLAME/SLAMF8, Интегрин альфа X/CD11c, CCL6/C10, Интегрин бета 2/CD18, CD155/PVR, Интегрин бета 3/CD61, CD31/PECAM-1, Латексина, CD36/SR-B3, Лейкотриена B4 R1, CD40/TNFRSF5, LIMPII/SR-B2, CD43, LMIR1/CD300A, CD45, LMIR2/CD300c, CD68, LMIR3/CD300LF, CD84/SLAMF5, LMIR5/CD300LB, CD97, LMIR6/CD300LE, CD163, LRP-1, CD2F-10/SLAMF9, MARCO, CRACC/SLAMF7, MD-1, ECF-L, MD-2, EMMPRIN/CD147, MGL2, Эндоглин/CD105, Остеоактивин/GPNMB, Fc гамма RI/CD64, Остеопонтина, Fc гамма RIIB/CD32b, PD-L2, Fc гамма RIIC/CD32c, Siglec-3/CD33, Fc гамма RIIA/CD32a, SIGNR1/CD209, Fc гамма RIII/CD16, SLAM, GM-CSF R альфа, TCCR/WSX-1, ICAM-2/CD102, TLR3, IFN- гамма R1, TLR4, IFN- гамма R2, TREM-1, IL-1 RII, TREM-2, ILT2/CD85j, TREM-3, ILT3/CD85k, TREML1/TLT-1, 2B4/SLAMF4, IL-10 R альфа, ALCAM, IL-10 R бета, Аминопептидаза N/ANPEP, ILT2/CD85j, обычной бета-цепи, ILT3/CD85k, C1q R1/CD93, ILT4/CD85d, CCR1, ILT5/CD85a, CCR2, Интегрин альфа 4/CD49d, CCR5, Интегрин альфа M/CD11b, CCR8, Интегрин альфа X/CD11c, CD155/PVR, Интегрин бета 2/CD18, CD14, Интегрин бета 3/CD61, CD36/SR-B3, LAIR1, CD43, LAIR2, CD45, Лейкотриена B4 R1, CD68, LIMPII/SR-B2, CD84/SLAMF5, LMIR1/CD300A, CD97, LMIR2/CD300c, CD163, LMIR3/CD300LF, Фактор коагуляции III/тканевый фактор, LMIR5/CD300LB, CX3CR1, CX3CL1, LMIR6/CD300LE, CXCR4, LRP-1, CXCR6, M-CSF R, DEP-1/CD148, MD-1, DNAM-1, MD-2, EMMPRIN/CD147, MMR, Эндоглин/CD105, NCAM-L1, Fc гамма RI/CD64, PSGL-1, Fc гамма RIII/CD16, RP105, G-CSF R, L-Селектина, GM-CSF R альфа, Siglec-3/CD33, HVEM/TNFRSF14, SLAM, ICAM-1/CD54, TCCR/WSX-1, ICAM-2/CD102, TREM-1, IL-6 R, TREM-2, CXCR1/IL-8 RA, TREM-3 и TREML1/TLT-1.
В других вариантах осуществления этого способа, дендритная клетка-мишень выбрана из группы, состоящей из CD36/SR-B3, LOX-1/SR-E1, CD68, MARCO, CD163, SR-AI/MSR, CD5L, SREC-I, CL-P1/COLEC12, SREC-II, LIMPII/SR-B2, RP105, TLR4, TLR1, TLR5, TLR2, TLR6, TLR3, TLR9, 4-1BB Лиганд/TNFSF9, IL-12/IL-23 p40, 4-амино-1,8-нафталимида, ILT2/CD85j, CCL21/6Ckin, ILT3/CD85k, 8-оксо-dG, ILT4/CD85d, 8D6A, ILT5/CD85a, A2B5, Интегрин альфа 4/CD49d, Aag, Интегрин бета 2/CD18, AMICA, Лангерина, B7-2/CD86, Лейкотриена B4 R1, B7-H3, LMIR1/CD300A, BLAME/SLAMF8, LMIR2/CD300c, C1q R1/CD93, LMIR3/CD300LF, CCR6, LMIR5/CD300LB, CCR7, LMIR6/CD300LE, CD40/TNFRSF5, MAG/Siglec-4a, CD43, MCAM, CD45, MD-1, CD68, MD-2, CD83, MDL-1/CLEC5A, CD84/SLAMF5, MMR, CD97, NCAM-L1, CD2F-10/SLAMF9, Остеоактивин/GPNMB, Chem 23, PD-L2, CLEC-1, RP105, CLEC-2, Siglec-2/CD22, CRACC/SLAMF7, Siglec-3/CD33, DC-SIGN, Siglec-5, DC-SIGNR/CD299, Siglec-6, DCAR, Siglec-7, DCIR/CLEC4A, Siglec-9, DEC-205, Siglec-10, Дектин-1/CLEC7A, Siglec-F, Дектин-2/CLEC6A, SIGNR1/CD209, DEP-1/CD148, SIGNR4, DLEC, SLAM, EMMPRIN/CD147, TCCR/WSX-1, Fc гамма RI/CD64, TLR3, Fc гамма RIIB/CD32b, TREM-1, Fc гамма RIIC/CD32c, TREM-2, Fc гамма RIIA/CD32a, TREM-3, Fc гамма RIII/CD16, TREML1/TLT-1, ICAM-2/CD102 и Ваниллоида R1.
В других вариантах осуществления этого способа мишень ангиогенеза выбрана из группы, состоящей из Ангиопоэтина-1, Ангиопоэтин-подобного белка 2, Ангиопоэтина-2, Ангиопоэтин-подобного белка 3, Ангиопоэтина-3, Ангиопоэтин-подобный 7/CDT6, Ангиопоэтина-4, Tie-1, Ангиопоэтин-подобного белка 1, Tie-2, Ангиогенина, iNOS, Фактор коагуляции III/Тканевый фактор, nNOS, CTGF/CCN2, NOV/CCN3, DANCE, OSM, EDG-1, Plfr, EG-VEGF/PK1, Пролиферина, Эндостатина, ROBO4, Эритропоэтина, Тромбоспондина-1, Кининостатина, Тромбоспондина-2, MFG-E8, Тромбоспондина-4, оксида азота, VG5Q, eNOS, EphA1, EphA5, EphA2, EphA6, EphA3, EphA7, EphA4, EphA8, EphB1, EphB4, EphB2, EphB6, EphB3, Эфрина-A1, Эфрина-A4, Эфрина-A2, Эфрина-A5, Эфрина-A3, Эфрина-B1, Эфрина-B3, Эфрина-B2, кислого FGF, FGF-12, основного FGF, FGF-13, FGF-3, FGF-16, FGF-4, FGF-17, FGF-5, FGF-19, FGF-6, FGF-20, FGF-8, FGF-21, FGF-9, FGF-23, FGF-10, KGF/FGF-7, FGF-11, FGF R1, FGF R4, FGF R2, FGF R5, FGF R3, Нейропилина-1, нейропилина-2, Семафорина 3A, Семафорина 6B, Семафорина 3C, Семафорина 6C, Семафорина 3E, Семафорина 6D, Семафорина 6A, Семафорина 7A, MMP, MMP-11, MMP-1, MMP-12, MMP-2, MMP-13, MMP-3, MMP-14, MMP-7, MMP-15, MMP-8, MMP-16/MT3-MMP, MMP-9, MMP-24/MT5-MMP, MMP-10, MMP-25/MT6-MMP, TIMP-1, TIMP-3, TIMP-2, TIMP-4, ACE, IL-13 R альфа 1, IL-13, C1q R1/CD93, Интегрин альфа 4/CD49d, VE-кадгерина, Интегрин бета 2/CD18, CD31/PECAM-1, KLF4, CD36/SR-B3, LYVE-1, CD151, MCAM, CL-P1/COLEC12, Нектин-2/CD112, Фактор коагуляции III/Тканевый фактор, E-Селектина, D6, P-Селектина, DC-SIGNR/CD299, SLAM, EMMPRIN/CD147, Tie-2, Эндоглин/CD105, TNF RI/TNFRSF1A, EPCR, TNF RII/TNFRSF1B, Эритропоэтина R, TRAIL R1/TNFRSF10A, ESAM, TRAIL R2/TNFRSF10B, FABP5, VCAM-1, ICAM-1/CD54, VEGF R2/Flk-1, ICAM-2/CD102, VEGF R3/Flt-4, IL-1 RI и VG5Q.
Другие варианты осуществления этого способа обеспечивают мультивалентные связывающие белки, в которых по меньшей мере один из связывающего домена 1 и связывающего домена 2 специфически связывает мишень, выбранную из группы, состоящей из простата-специфического мембранного антигена (фолатгидролазы 1), рецептора эпидермального фактора роста (EGFR), рецептора конечных продуктов усиленного гликозилирования (RAGE, также известного как рецептор продуктов усиленного гликозилирования или AGER), IL-17 A, IL-17 F, P19 (IL23A and IL 12B), Dickkopf-1 (Dkk1), NOTCH1, NG2 (хондроитинсульфат-протеогликан 4 или CSPG4), IgE (IgHE или IgH2), IL-22R (IL22RA1), IL-21, олигомеров амилоида β (Ab-олигомеров), белка-предшественника амилоида β (APP), NOGO-рецептора (RTN4R), белка 5, родственного рецептору липопротеина низкой плотности (LRP5), IL-4, Миостатина (GDF8), очень позднего Антигена 4, альфа 4, бета 1-интегрина (VLA4 или ITGA4), альфа 4, бета 7-интегрина, обнаруженного на лейкоцитах, и IGF-1R. Например, VLA4-мишень может узнаваться мультивалентным связывающим белком, в котором по меньшей мере один из связывающего домена 1 и связывающего домена 2 является связывающим доменом, полученным из натализумаба (Antegren).
В некоторых вариантах осуществления, раковой клеткой является трансформированная, или раковая, гемопоэтическая клетка. В некоторых из этих вариантов осуществления, по меньшей мере один из первого связывающего домена и второго связывающего домена узнает мишень, выбранную из группы, состоящей из B-клетки-мишени, моноцит/макрофаг-мишени, дендритной клетки-мишени, NK-клетки-мишени и T-клетки-мишени, каждая из которых определена здесь. Далее, по меньшей мере один из первого связывающего домена и второго связывающего домена может узнавать миелоидные мишени, в том числе, но не только, CD5, CD10, CD11b, CD11c, CD13, CD14, CD15, CD18, CD19, CD20, CD21, CD22, CD23, CD25, CD27, CD29, CD30, CD31, CD33, CD34, CD35, CD38, CD43, CD45, CD64, CD66, CD68, CD70, CD80, CD86, CD87, CD88, CD89, CD98, CD100, CD103, CD111, CD112, CD114, CD115, CD116, CD117, CD118, CD119, CD120a, CD120b, CDw123, CDw131, CD141, CD162, CD163, CD177, CD312, IRTA1, IRTA2, IRTA3, IRTA4, IRTA5, B-B2, B-B8 и рецептор B-клеточного антигена.
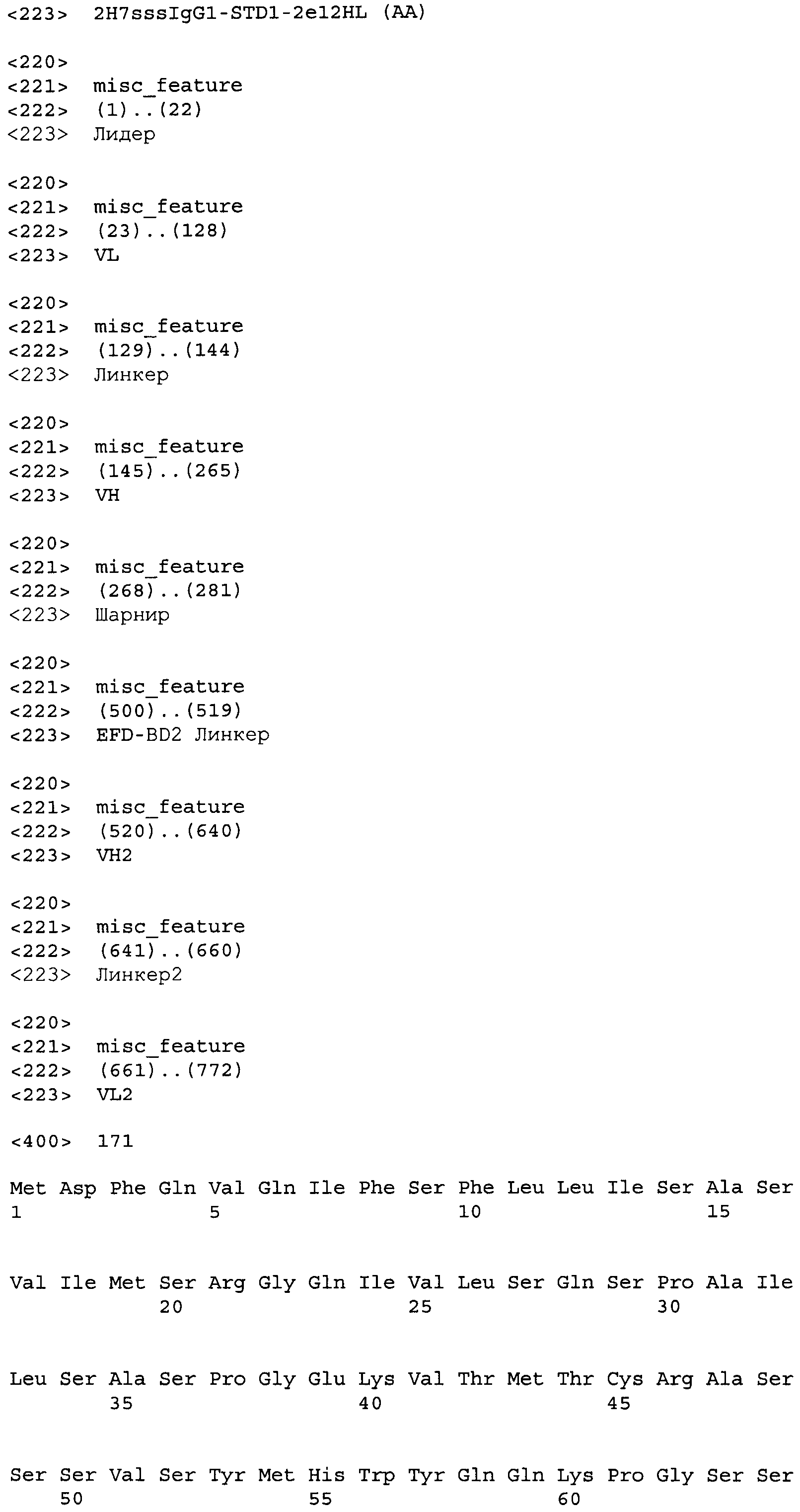
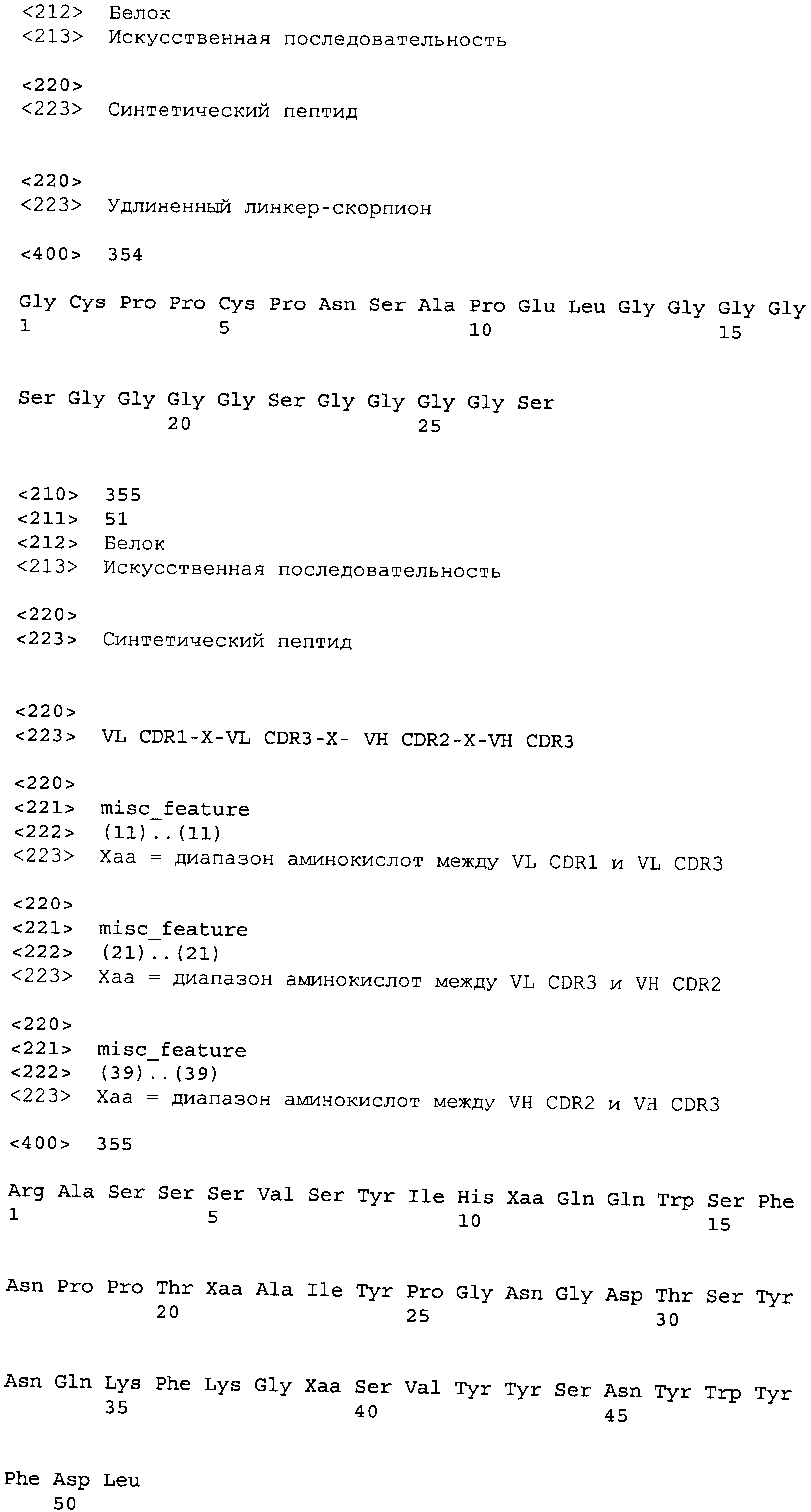
Другие варианты осуществления этого изобретения относятся к мультивалентному связывающему белку, описанному здесь, содержащему последовательность, выбранную из группы, состоящей из SEQ ID NO:2, 4, 6, 103, 105, 107, 109, 332, 333, 334 и 345. Другие варианты осуществления относятся к мультивалентному связывающему белку, содержащему последовательность, выбранную из группы, состоящей из SEQ ID NO:355, 356, 357, 358, 359, 360, 361, 362, 363, 364 и 365.
В других вариантах осуществления, этот мультивалентный и мультиспецифический связывающий белок с эффекторной функцией имеет первый связывающий домен и второй связывающий домен, которые узнают пару мишеней, выбранную из группы, состоящей из EPHB4-KDR и TIE-TEK. В таких вариантах осуществления, этот белок имеет первый связывающий домен, узнающий EPHB4, и второй связывающий домен, узнающий KDR, или первый связывающий домен, узнающий KDR, и второй связывающий домен, узнающий EPHB4. Аналогично, этот белок может иметь первый связывающий домен, узнающий TIE, и второй связывающий домен, узнающий TEK, или первый связывающий домен, узнающий TEK, и второй связывающий домен, узнающий TIE.
В родственном аспекте, это изобретение обеспечивает мультивалентный связывающий белок с эффекторной функцией, в котором константная субобласть узнает Fc-рецептор эффекторной клетки (например, FcγRI, FcγRII, FcγRIII, FcαR и FcεRI). В конкретных вариантах осуществления, эта константная субобласть узнает белок поверхности эффекторной клетки, выбранный из группы, состоящей из CD2, CD3, CD16, CD28, CD32, CD40, CD56, CD64, CD89, FCεRI, KIR, тромбоспондина R, NKG2D, 2B4/NAIL и 41BB. Эта константная субобласть может содержать CH2-домен и CH3-домен, полученные из одинаковых или различных иммуноглобулинов, изотипов антител или аллельных вариантов. В некоторых вариантах осуществления, CH3-домен является укороченным и содержит С-концевую последовательность, выбранную из группы, состоящей из SEQ ID NO:366, 367, 368, 369, 370 и 371. Предпочтительно, CH2-домен и линкер-скорпион получены из одного и того же класса или из одного и того же подкласса иммуноглобулина, когда этот линкер является подобным шарнирной области пептидом, полученным из иммуноглобулина.
Обсуждаются также некоторые белки согласно этому изобретению, дополнительно содержащие линкер-скорпион по меньшей мере из приблизительно 5 аминокислот, присоединенный к константной субобласти и присоединенный ко второму связывающему домену, посредством чего этот линкер-скорпион располагается между константной субобластью и вторым связывающим доменом. Обычно длина пептида линкера-скорпиона составляет 5-45 аминокислот. Линкеры-скорпионы включают подобные шарниру пептиды, полученные из шарнирных областей иммуноглобулинов, такие как шарнирные области IgG1, IgG2, IgG3, IgG4, IgA и IgE. Предпочтительно, подобный шарниру линкер-скорпион будет сохранять по меньшей мере один цистеин, способный образовывать межцепочечную дисульфидную связь при физиологических условиях. Линкеры-скорпионы, полученные из IgG1, могут иметь 1 цистеин или 2 цистеина и будут предпочтительно сохранять цистеин, соответствующий N-концевому цистеину шарнирной области IgG1. В некоторых вариантах осуществления, линкер-скорпион является удлиненным относительно соответствующей шарнирной области иммуноглобулина и, в примерных вариантах осуществления, содержит последовательность, выбранную из группы, состоящей из SEQ ID NO:351, 352, 353 и 354. Не подобные шарнирной области пептиды также рассматриваются в качестве линкеров-скорпионов, при условии, что такие пептиды обеспечивают пространственное размещение и гибкость для обеспечения одноцепочечного белка, способного образовывать два связывающих домена, один из которых расположен в направлении к каждому концу белка (N и C) относительно более центрально расположенного домена константной субобласти. Примерные не подобные шарниру линкеры-скорпионы включают пептиды из области «стебля» С-лектинов типа II, такого как области «стебля» CD69, CD72, CD94, NKG2A и NKG2D. В некоторых вариантах осуществления, этот линкер-скорпион содержит последовательность, выбранную из группы, состоящей из SEQ ID NOS:373, 374, 375, 376 и 377.
Эти белки могут также содержать линкер по меньшей мере из приблизительно 5 аминокислот, присоединенный к константной субобласти и присоединенный к первому связывающему домену, посредством чего этот линкер располагается между константной субобластью и первым связывающим доменом. В некоторых вариантах осуществления, линкеры обнаруживаются между константной субобластью и каждым из двух связывающих доменов, и эти линкеры могут иметь одинаковую последовательность или разные последовательности и иметь одинаковую или разную длину.
Константная субобласть белков по данному изобретению обеспечивает по меньшей мере одну эффекторную функцию. Рассматривается любая эффекторная функция, о которой известно, что она ассоциирована с иммуноглобулином (например, антителом), такая как эффекторная функция, выбранная из группы, состоящей из антителозависимой клеточно-опосредованной цитотоксичности (ADCC), комплементзависимой цитотоксичности (CDC), относительно удлиненного периода полужизни in vivo (относительно той же самой молекулы, лишенной константной субобласти), связывания FcR, связывания белка А и т.п. В некоторых вариантах осуществления, эти удлиненные периоды полужизни белков настоящего изобретения составляют по меньшей мере 28 часов у человека. Конечно, белки, предназначенные для введения субъектам не являющимся людьми, будут проявлять относительно удлиненные периоды полужизни у субъектов (не являющихся людьми) и, необязательно, у людей.
Обычно, белки (в том числе полипептиды и пептиды) данного изобретения проявляют аффинность связывания менее 10-9 M или по меньшей мере 10-6 M, по меньшей мере для одного из первого связывающего домена и второго связывающего домена.
Другой аспект настоящего изобреиения относится к фармацевтической композиции, содержащей описанный здесь белок и фармацевтически приемлемый адъювант, носитель или наполнитель. Любой адъювант, носитель или наполнитель, известный в данной области, применим в фармацевтических композициях настоящего изобретения.
Еще один аспект настоящего изобретения обеспечивает способ получения вышеописанного белка, предусматривающий введение нуклеиновой кислоты, кодирующей этот белок, в клетку-хозяина при условиях, подходящих для экспрессии этого белка, с экспрессией посредством этого данного белка предпочтительно при уровне по меньшей мере 1 мг/литр. В некоторых вариантах осуществления, способ дополнительно предусматривает выделение белка отделением его по меньшей мере от одного белка, с которым он ассоциирован после внутриклеточной экспрессии. Подходящие клетки-хозяева для экспрессии нуклеиновых кислот для получения белков настоящего изобретения, включают, но не ограничиваются ими, клетку-хозяина, выбранную из группы, состоящей из клетки VERO, клетки HeLa, клетки CHO, клетки COS, клетки W138, клетки BHK, клетки HepG2, клетки 3T3, клетки RIN, клетки MDCK, клетки A549, клетки PC12, клетки K562, клетки HEK293, клетки N, клетки Spodoptera frugiperda, клетки Saccharomyces cerevisiae, клетки Pichia pastoris, любых из различных грибных клеток и любых из различных бактериальных клеток (включающих, но не ограничивающихся ими, Escherichia coli, Bacillus subtilis, Salmonella typhimurium и Streptomycete).
Это изобретение обеспечивает также способ получения нуклеиновой кислоты, кодирующей белок, описанный выше, предусматривающий ковалентное связывание 3'-конца полинуклеотида, кодирующего первый связывающий домен, полученный из вариабельной области иммуноглобулина, с 5'-концом полинуклеотида, кодирующего константную субобласть, ковалентное связывание 5'-конца полинуклеотида, кодирующего линкер-скорпион, с 3'-концом полинуклеотида, кодирующего константную субобласть, и ковалентное связывание 5'-конца полинуклеотида, кодирующего второй связывающий домен, полученный из вариабельной области иммуноглобулина, с 3'-концом полинуклеотида, кодирующего линкер-скорпион, с генерированием таким образом нуклеиновой кислоты, кодирующей мультивалентный связывающий белок с эффекторной функцией. Каждая из этих кодирующих областей может быть отделена кодирующей областью для линкера или подобного шарнирной области пептида в виде части одноцепочечной структуры по данному изобретению. В некоторых вариантах осуществления, этот способ обеспечивает полинуклеотид, кодирующий первый связывающий домен, который содержит последовательность, выбранную из группы, состоящей из SEQ ID NO:2 (вариабельной области анти-CD20-антитела, ориентированной VL-VH), SEQ ID NO:4 (вариабельной области анти-CD28-антитела, ориентированной VL-VH) и SEQ ID NO:6 (вариабельной области анти-CD28-антитела, ориентированной VH-VL) в одноцепочечной форме, не требующий сборки из раздельно кодируемых полипептидов, как это должно иметь место для гетеромультимерных белков, в том числе природных антител. Примерами полинуклеотидных последовательностей, кодирующих первые связывающие домены, являются полинуклеотиды, содержащие любую из SEQ ID NO:1, 3 или 5.
Этот аспект настоящего изобретения обеспечивает также способы получения кодирующих нуклеиновых кислот, которые содержат линкерный полинуклеотид, встроенный между полинуклеотидом, кодирующим первый связывающий домен, и полинуклеотидом, кодирующим константную субобласть, причем этот линкерный полинуклеотид кодирует пептидный линкер по меньшей мере из 5 аминокислот. Предпочтительно, кодируемые пептидные линкеры содержат 5-45 аминокислот.
Идентичные линкерные области, присутствующие либо между BDl и EFD, либо между EFD и BD2, могут быть получены из других последовательностей, идентифицированных из гомологичных членов Ig-суперсемейства. В разрабатываемых новых линкерах, полученных из существующих последовательностей, присутствующих в гомологичных членах Ig-суперсемейства, может быть предпочтительным избегание участков последовательностей, сходных с участками последовательностей, расположенными между концом С-подобного домена и трансмембранным доменом, так как такие последовательности часто являются субстратами для протеазного отщепления поверхностных рецепторов от клетки с созданием растворимых форм. Сравнения последовательностей между различными членами Ig-суперсемейства и субсемейств может выполняться на сходства между молекулами в линкерных последовательностях, которые соединяют множественные V-подобные домены, и между V и C-подобными доменами. Из этого анализа могут появиться консервативные, природные распределения последовательностей; эти последовательности, при использовании в качестве линкеров между субдоменами мультивалентных слитых белков, должны быть более устойчивыми к протеазам, могут облегчать правильную укладку между областями Ig-петель и могут не быть иммуногенными, так как они встречаются во внеклеточных доменах поверхностных молекул эндогенных клеток.
Нуклеиновые кислоты как таковые составляют другой аспект настоящего изобретения. Рассматриваются нуклеиновые кислоты, кодирующие любой из белков этого изобретения, описанных здесь. Как таковые, нуклеиновые кислоты по изобретению содержат, в направлении 5'-3', кодирующую область для первого связывающего домена, последовательности константной субобласти и кодирующую область для второго связывающего домена. Также рассматриваются нуклеиновые кислоты, которые кодируют белковые варианты, где последовательности этих двух связывающих доменов и константной субобласти являются по меньшей мере на 80% и предпочтительно по меньшей мере на 85%, 90%, 95% или 99% идентичными по аминокислотной последовательности объединенным последовательностям известной последовательности вариабельной области иммуноглобулина и известной последовательности константной субобласти. Альтернативно, белковые варианты этого изобретения кодируются нуклеиновыми кислотами, которые гибридизуются с нуклеиновой кислотой, кодирующей невариантный белок этого изобретения при строгих условиях гибридизации 0,015 М хлориде натрия, 0,0015 M цитрате натрия при 65-68ºC или 0,015 M хлориде натрия, 0,0015 M цитрате натрия и 50% формамиде при 42ºC. Вариантные нуклеиновые кислоты этого изобретения проявляют способность гибридизоваться при условиях, определенных только что выше, или проявляют 90%, 95%, 99% или 99,9% идентичность последовательности с нуклеиновой кислотой, кодирующей невариантный белок по изобретению.
В родственных аспектах, настоящее изобретение обеспечивает вектор, содержащий нуклеиновую кислоту, описанную выше, а также клетки-хозяева, содержащие вектор или нуклеиновую кислоту, описанную здесь. Может быть использован любой вектор, известный в данной области (например, плазмиды, фагмиды, фазмиды, космиды, вирусы, искусственные хромосомы, челночные векторы и т.п.) и специалистам в данной области будет понятно, какие векторы особенно пригодны для конкретной цели. Например, в способах получения белка согласно данному изобретению, выбирают предпочтительно экспрессирующий вектор, функциональный в клетке-хозяине. Подобным образом, рассматривается любая клетка-хозяин, способная генетически трансформироваться нуклеиновой кислотой или вектором по изобретению. Предпочтительными клетками-хозяевами являются эукариотические клетки-хозяева, хотя рассматриваются также низшие эукариотические (например, дрожжи) и прокариотические (бактериальные) клетки-хозяева.
Другим аспектом этого изобретения является способ индукции повреждения клетки-мишени, предусматривающий контактирование клетки-мишени с терапевтически эффективным количеством описанного здесь белка. В некоторых вариантах осуществления, клетку-мишень приводят в контакт in vivo введением этого белка, или кодирующей нуклеиновой кислоты, в организм, нуждающийся в этом. В этом аспекте данного изобретения обсуждаются способы, в которых мультивалентный одноцепочечный связывающий белок индуцирует аддитивную величину повреждения в отношении клетки-мишени, которая является величиной повреждения, ожидаемой от суммы повреждений, приписываемых отдельным антителам, содержащим один или другой из связывающих доменов. Обсуждаются также способы, в которых мультивалентный одноцепочечный связывающий белок индуцирует синергетическую величину повреждения в отношении клетки-мишени в сравнении с суммой повреждений, индуцируемых первым антителом, содержащим первый связывающий домен, но не содержащим второй связывающий домен, и вторым антителом, содержащим второй связывающий домен, но не содержащим первый связывающий домен. В некоторых вариантах осуществления, этот мультивалентный одноцепочечный связывающий белок является мультиспецифическим и содержит пару связывающих доменов, специфически узнающую пару антигенов, выбранных из группы, состоящей из CD19/CD20, CD20/CD21, CD20/CD22, CD20/CD40, CD20/CD79a, CD20/CD79b, CD20/CD81, CD21/CD79b, CD37/CD79b, CD79b/CD81, CD19/CL II (т.е. MHC класса II), CD20/CL II, CD30/CL II, CD37/CL II, CD72/CL II и CD79b/CL II.
Этот аспект данного изобретения обсуждает также способы, в которых мультивалентный одноцепочечный связывающий белок индуцирует ингибированную величину повреждения в отношении клетки-мишени в сравнении с суммой повреждений, индуцируемых первым антителом, содержащим первый связывающий домен, но не содержащим второй связывающий домен, и вторым антителом, содержащим второй связывающий домен, но не содержащим первый связывающий домен. Примерные варианты осуществления, включают способы, в которых этот мультиспецифический, мультивалентный одноцепочечный связывающий белок содержит пару связывающих доменов, специфически узнающую пару антигенов, выбранных из группы, состоящей из CD20/CL II, CD21/CD79b, CD22/CD79b, CD40/CD79b, CD70/CD79b, CD72/CD79b, CD79a/CD79b, CD79b/CD80, CD79b/CD86, CD21/CL II, CD22/CL II, CD23/CL II, CD40/CL II, CD70/CL II, CD80/CL II, CD86/CL II, CD19/CD22, CD20/CD22, CD21/CD22, CD22/CD23, CD22/CD30, CD22/CD37, CD22/CD40, CD22/CD70, CD22/CD72, CD22/79a, CD22/79b, CD22/CD80, CD22/CD86 и CD22/CL II.
В родственном аспекте это изобретение обеспечивает способ лечения нарушения пролиферации клеток, например, рака, предусматривающий введение терапевтически эффективного количества белка (описанного здесь), или кодирующей нуклеиновой кислоты, в организм, нуждающийся в этом. Лица с квалификацией в этой области, в том числе профессиональные врачи и ветеринары, являются специалистами в идентификации организмов, нуждающихся в лечении. Нарушения, обсуждаемые этим изобретением, поддающиеся лечению, включают нарушение, выбранное из группы, состоящей из рака, аутоиммунного нарушения, инфекции вируса саркомы Рауса и воспаление. В некоторых вариантах осуществления, этот белок вводят экспрессией in vivo нуклеиновой кислоты, кодирующей описанный здесь белок. Это изобретение включает также введение белка способом, выбранным из группы, состоящей из внутривенной инъекции, внутриартериальной инъекции, внутримышечной инъекции, подкожной инъекции, внтрибрюшинной инъекции и прямой инъекции в ткань.
Другой аспект изобретения относится к способу уменьшения симптомов, ассоциированных с нарушением пролиферации клеток, предусматривающему введение терапевтически эффективного количества белка, описанного здесь, в организм, нуждающийся в этом. Лица с квалификацией в этой области являются также специалистами в идентификации этих нарушений или заболеваний или состояний, проявляющих симптомы, поддающиеся их уменьшению. В некоторых вариантах осуществления, этот симптом выбран из группы, состоящей из боли, лихорадки, опухания и тугоподвижности суставов.
Еще один аспект этого изобретения относится к способу лечения инфекции, ассоциированной с инфекционным агентом, предусматривающему введение терапевтически эффективного количества белка по этому изобретению пациенту, нуждающемуся в этом, где этот белок содержит связывающий домен, который специфически связывает молекулу-мишень этого инфекционного агента. Инфекционные агенты, поддающиеся лечению в соответствии с этим аспектом данного изобретения, включают прокариотические и эукариотические клетки, вирусы (в том числе бактериофаг), чужеродные объекты и инфекционные организмы, такие как паразиты (например, паразиты млекопитающих).
Родственный аспект этого изобретения относится к способу уменьшения интенсивности симптома инфекции, ассоциированной с инфекционным агентом, предусматривающему введение эффективного количества белка по данному изобретению пациенту, нуждающемуся в этом, где этот белок содержит связывающий домен, который специфически связывает молекулу-мишень этого инфекционного агента. Лица с квалификацией в области медицины и ветеринарии, будут способны определить эффективное количество белка на основе хода лечения в каждом случае с использованием рутинного экспериментирования.
Еще одним аспектом изобретения является способ уменьшения риска инфекции, свойственной инфекционному агенту, предусматривающий введение профилактически эффективного количества белка по данному изобретению пациенту при риске развития этой инфекции, где этот белок содержит связывающий домен, который специфически связывает молекулу-мишень этого инфекционного агента. Лица с квалификацией в области медицины и ветеринарии, будут способны определить профилактически эффективное количество белка на основе хода лечения в каждом случае с использованием рутинного экспериментирования.
Другой аспект этого изобретения относится к вышеописанному мультивалентному одноцепочечному связывающему белку, где по меньшей мере один из первого связывающего домена и второго связывающего домена связывает антиген, выбранный из группы, состоящей из CD19, CD20, CD21, CD22, CD23, CD30, CD37, CD40, CD70, CD72, CD79a, CD79b, CD80, CD81, CD86 и пептида класса II главного комплекса гистосовместимости.
В некоторых вариантах осуществления, один из первого связывающего домена и второго связывающего домена специфически связывает CD20, и в некоторых из этих вариантов осуществления, другой связывающий домен специфически связывает антиген, выбранный из группы, состоящей из CD19, CD20, CD21, CD22, CD23, CD30, CD37, CD40, CD70, CD72, CD79a, CD79b, CD80, CD81, CD86 и пептида класса II главного комплекса гистосовместимости. Например, в одном варианте осуществления, первый связывающий домен способен специфически связывать, например, CD20, в то время как второй связывающий домен способен специфически связывать, например, CD19. В другом варианте осуществления, первый связывающий домен связывает CD19, в то время как второй связывающий домен связывает CD20. Рассматривается также один вариант, в котором оба связывающих домена связывают CD20.
В некоторых других вариантах в соответствии с этим аспектом данного изобретения, один из первого связывающего домена и второго связывающего домена специфически связывает CD79b, и в некоторых из этих вариантов осуществления, другой связывающий домен связывает антиген, выбранный из группы, состоящей из CD19, CD20, CD21, CD22, CD23, CD30, CD37, CD40, CD70, CD72, CD79a, CD79b, CD80, CD81, CD86 и пептида класса II главного комплекса гистосовместимости. Примерные варианты осуществления включают различные мультиспецифические, мультивалентные одноцепочечные связывающие белки, в которых первый связывающий домен:второй связывающий домен специфически связывает CD79b:CD19 или CD19:CD79b. Рассматривается также один мультивалентный связывающий белок, имеющий первый и второй связывающие домены, узнающие CD79b.
В некоторых других вариантах осуществления, один из первого связывающего домена и второго связывающего домена специфически связывает пептид класса II главного комплекса гистосовместимости, и в некоторых из этих вариантов осуществления, другой связывающий домен связывает антиген, выбранный из группы, состоящей из CD19, CD20, CD21, CD22, CD23, CD30, CD37, CD40, CD70, CD72, CD79a, CD79b, CD80, CD81, CD86 и пептида класса II главного комплекса гистосовместимости. Например, в одном варианте осуществления, первый связывающий домен способен специфически связывать пептид класса II главного комплекса гистосовместимости, в то время как второй связывающий домен способен специфически связывать, например, CD19. В другом варианте осуществления, первый связывающий домен связывает CD19, в то время как второй связывающий домен связывает пептид класса II главного комплекса гистосовместимости. Рассматривается также вариант осуществления, в котором оба связывающие домены связывают пептид класса II главного комплекса гистосовместимости.
В других вариантах осуществления в соответствии с этим аспектом данного изобретения, один из первого связывающего домена и второго связывающего домена специфически связывает CD22, и в некоторых из этих вариантов осуществления, другой связывающий домен специфически связывает антиген, выбранный из группы, состоящей из CD19, CD20, CD21, CD22, CD23, CD30, CD37, CD40, CD70, CD72, CD79a, CD79b, CD80, CD81, CD86 и пептида класса II главного комплекса гистосовместимости. Примерные варианты осуществления включают различные мультиспецифические, мультивалентные одноцепочечные связывающие белки, в которых первый связывающий домен:второй связывающий домен специфически связывает CD22:CD19 или CD19:CD22. Включен также один мультивалентный связывающий белок, имеющий первый и второй связывающие домены, узнающие CD22.
Родственный аспект этого изобретения относится к вышеописанному мультивалентному одноцепочечному белку, где белок обладает синергетическим действием на поведение клетки-мишени, относительно суммы этих действий каждого из этих связывающих доменов. В некоторых вариантах осуществления, белок содержит пару связывающих доменов, специфически узнающих пару антигенов, выбранную из группы, состоящей из CD20-CD19, CD20-CD21, CD20-CD22, CD20-CD40, CD20-CD79a, CD20-CD79b и CD20-CD81.
Это изобретение включает дополнительно мультивалентный одноцепочечный связывающий белок, описанный выше, где белок обладает аддитивным действием на поведение клетки-мишени относительно суммы действий каждого из связывающих доменов. Варианты осуществления в соответствии с этим аспектом данного изобретения включают мультиспецифические белки, содержащие пару связывающих доменов, специфически узнающую пару антигенов, выбранную из группы, состоящей из CD20-CD23, CD20-CD30, CD20-CD37, CD20-CD70, CD20-CD80, CD20-CD86, CD79b-CD37, CD79b-CD81, пептид класса II главного комплекса гистосовместимости -CD30 и пептид класса II главного комплекса гистосовместимости -CD72.
Еще одним родственным аспектом этого изобретения является мультивалентный одноцепочечный связующий белок, описанный выше, где белок обладает ингибирующим действием на поведение клетки-мишени относительно суммы действий каждого из связывающих доменов. В некоторых вариантах осуществления, белок является мультиспецифическим и содержит пару связывающих доменов, специфически узнающую пару антигенов, выбранных из группы, состоящей из CD20-пептид класса II главного комплекса гистосовместимости, CD79b-CD19, CD79b-CD20, CD79b-CD21, CD79b-CD22, CD79b-CD23, CD79b-CD30, CD79b-CD40, CD79b-CD70, CD79b-CD72, CD79b-CD79a, CD79b-CD80, CD79b-CD86, CD79b-пептид класса II главного комплекса гистосовместимости, пептид класса II главного комплекса гистосовместимости -CD19, пептид класса II главного комплекса гистосовместимости -CD20, пептид класса II главного комплекса гистосовместимости -CD21, пептид класса II главного комплекса гистосовместимости -CD22, пептид класса II главного комплекса гистосовместимости -CD23, пептид класса II главного комплекса гистосовместимости -CD37, пептид класса II главного комплекса гистосовместимости -CD40, пептид класса II главного комплекса гистосовместимости -CD70, пептид класса II главного комплекса гистосовместимости -CD79a, пептид класса II главного комплекса гистосовместимости -CD79b, пептид класса II главного комплекса гистосовместимости -CD80, пептид класса II главного комплекса гистосовместимости -CD81, пептид класса II главного комплекса гистосовместимости -CD86, CD22-CD19, CD22-CD40, CD22-CD79b, CD22-CD86 и CD22-пептид класса II главного комплекса гистосовместимости.
Другим аспектом этого изобретения является способ идентификации по меньшей мере одного из связывающих доменов мультивалентной связывающей молекулы, такой как мультиспецифическая связывающая молекула, описанная выше, предусматривающий: (а) контактирование антиизотипического антитела с антителом, специфически узнающим первый антиген, и антителом, специфически узнающим второй антиген; (b) последующие контактирование мишени, содержащей по меньшей мере один из указанных антигенов, с композицией стадии (a); и (c) измерение активности мишени, где активность используют для идентификации по меньшей мере одного из связывающих доменов мультивалентной связывающей молекулы. В некоторых вариантах осуществления, этой мишенью является пораженная болезнью клетка, такая как раковая клетка (например, раковая В-клетка) или продуцирующая аутоантитело В-клетка.
В каждом из предыдущих способов настоящего изобретения предполагается, что этот способ может дополнительно предусматривать множество мультивалентных одноцепочечных связывающих белков. В некоторых вариантах осуществления, связывающий домен первого мультивалентного одноцепочечного связывающего белка и связывающий домен второго мультивалентного связывающего белка индуцируют синергетическое, аддитивное или ингибирующее действие на клетку-мишень, такое как синергетическое, аддитивное или ингибирующее количество повреждения в отношении этой клетки-мишени. Синергетическое, аддитивное или ингибирующее действия множества мультивалентных одноцепочечных белков определяют сравнением этого действия такого множества белков с объединенным действием антитела, содержащего один из этих связывающих доменов, и антитела, содержащего другой связывающий домен.
Один родственный аспект настоящего изобретения относится к композиции, содержащей множество мультивалентных одноцепочечных связывающих белков, описанных выше. В некоторых вариантах осуществления, эта композиция содержит множество мультивалентных одноцепочечных связывающих белков, где связывающий домен первого мультивалентного одноцепочечного связывающего белка и связывающий домен второго мультивалентного одноцепочечного связывающего белка способны индуцировать синергетическое, аддитивное или ингибирующее действие на клетке-мишени, такое как синергетическое, аддитивное или ингибирующее количество повреждения клетки-мишени.
Это изобретение относится также к фармацевтической композиции, содержащей описанную выше композицию и фармацевтически приемлемый носитель, разбавитель или наполнитель. Кроме того, это изобретение включает набор, содержащий композицию, описанную здесь, и комплект инструкций в отношении введения указанной композиции для проявления действия на клетке-мишени, такого как повреждение этой клетки-мишени.
Наконец, это изобретение включает также набор, содержащий белок, описанный здесь, и комплект инструкций для введения этого белка для лечения нарушения пролиферации клеток или для уменьшения интенсивности симптома этого нарушения пролиферации клеток.
Другие признаки и преимущества данного изобретения будут более понятными посредством ссылки на следующее подробное описание, включающее примеры.
Краткое описание фигур
Фигура 1 показывает схематическое представление мультивалентных одноцепочечных молекул, рассматриваемых этим изобретением. Отдельные субдомены этой экспрессионной кассеты слитого белка указаны отдельными формами/блоками на этой фигуре. BD1 относится к связывающему домену 1, линкер 1 обозначает любой потенциальный линкер или подобный шарниру пептид между BD1 и «доменом эффекторной функции», показанным как EFD. Этот субдомен является обычно сконструированной формой Fc-домена IgG1 человека, но может включать другие субдомены с одной или несколькими эффекторными функциями, как описано здесь. Линкер 2 обозначает последовательность линкера, если он имеется, присутствующую между карбокси-концом EFD и связывающим доменом 2, BD2.
Фигура 2 показывает Вестерн-блот невосстановленных белков, экспрессированных в клетках COS. Белок секретировался в культуральную среду и культуральные супернатанты выделяли после 48-72 часов из транзиторно трансфицированных клеток центрифугированием. Тридцать микролитров неочищенного супернатанта наносили в каждую лунку геля. Идентификации дорожек: 1 - маркеры молекулярной массы, с цифрами, указывающими килодальтоны; 2 - 2H7-IgG-STD1-2E12 LH; 3 - 2H7-IgG-STD1-2E12 HL, 4 - 2H7-IgG-STD2-2E12 LH; 5 - 2H7-IgG-STD2-2E12 HL; 6 - 2E12 LH SMIP; 7 - 2E12 HL SMIP; 8 - 2H7 SMIP. "2H7" относится к одноцепочечной конструкции, где BD1 кодирует CD20-специфический связывающий домен (2H7) в ориентации VL-VH; "2E12" относится к связывающему домену, специфическому для CD28; -IgG- относится к одноцепочечной конструкции, с шарниром, кодирующим последовательность, где все С мутированы в S (sss) и домены CH2 и CH3 IgG1 содержат мутации, которые элиминируют эффекторные функции как ADCC, так и CDC (P238S и P331S), "STD1” относится к состоящему из 20 аминокислот линкеру (идентифицированному на фигуре 7) как "STD1=20aa"), инсертированному рядом с BD2 в ориентации VL-VH, или 2E12 (VL-VH). "STD1-HL" относится к конструкции, сходной с только что описанной, но с V-областями BD2 в ориентации VН-VL следующим образом: 2H7-sssIgG (P238/331S)-20-аминокислотный линкер-2E12 (VH-VL). "STD2-LH" относится к 2H7-sssIgG (P238/331S)-38-аминокислотный линкер-2E12 (VL-VH); "STD2-LH" относится к 2H7-sssIgG (P238/331SS)-38-аминокислотный линкер-2E12 (VH-VL); "SMIP" относится к малому модульному иммунофармацевтическому средству; и "H" обычно относится к VH, тогда как "L" обычно относится к VL. Если нет другого указания, все ориентации белков являются ориентациями N-конец - C-конец.
Фигура 3 показывает две диаграммы в виде столбцов, иллюстрирующие связывающие свойства производных 2H7-sssIgG (P238S/P331S)-STD1-2e12 LH и HL, экспрессируемых из клеток COS. Эти эксперименты выполняли на неочищенных культуральных супернатантах, а не на очищенных белках. Серийные разведения из неразведенных - 16Х культуральных супернатантов инкубировали либо с CD20-экспрессирующими клетками (WIL-2S), либо с CD28-экспрессирующими клетками (CD28+ CHO). Связывающую активность в этих супернатантах сравнивали с контрольными пробами, тестирующими связывание SMIP с релевантной единственной специфичностью, таких как TRU-015- или 2e12 VLVH- или 2e12 VHVL-SMIP. Связывание в каждой пробе детектировали с использованием конъюгированного с флуоресцеинизотиоцианатом (FITC) антитела козы против IgG человека при разведении 1:100.
Фигура 4 является гистограммой, показывающей распределение связывания белок А-очищенных версий белков, испытанных на фигуре 3, с клетками WIL-2S. "TRU015" является SMIP, специфическим в отношении CD20. Также анализировали два мультиспецифических связывающих белка с эффекторной функцией: "2H7-2E12 LH" имеет связывающий домен 2, специфический в отношении CD28, в ориентации VL-VR; "2H7-2E12 HL" имеет связывающий домен 2, специфически в отношении CD28, в ориентации VH-VL. Каждый из этих белков испытывали на связывание при 5 мкг/мл и связывание детектировали FITC-козьим антителом против IgG человека при 1:100. См. описание для фигуры 2 выше в отношении более полных описаний испытанных молекул.
Фигура 5 показывает две гистограммы, иллюстрирующие связывание белок А-очищенных мультиспецифических связывающих белков с эффекторной функцией с клетками СНО, экспрессирующими CD28. "2H7-2E12 LH" имеет связывающий домен 2, специфический в отношении CD28, в ориентации VL-VH; "2H7-2E12 HL" имеет связывающий домен 2, специфический в отношении CD28, в ориентации VH-VL. Каждый из этих белков испытывали на связывание при 5 мкг/мл и связывание детектировали FITC-козьим антителом против IgG человека при 1:100. См. описания на фигуре 2 в отношении более полных описаний испытанных молекул.
Фигура 6 A) показывает таблицу, которая идентифицирует линкеры, соединяющие константную субобласть и связывающий домен 2. Эти линкеры идентифицированы по названию, последовательности, идентификатору последовательности, длине последовательности и последовательности слияния со связывающим доменом 2. В) показывает таблицу, идентифицирующую различные конструкции, идентифицирующие элементы примерных молекул в соответствии с этим изобретением. Кроме идентификации мультивалентных связывающих молекул по названию, элементы этих молекул описаны на основе связывающего домена 1 (BD1), константной субобласти (шарнирного и эффекторного домена или EFD), линкера (см. фиг.6A в отношении дополнительной информации, касающейся этих линкеров) и связывающего домена 2 (BD2). Обеспечены эти последовательности ряда примерных мультивалентных белков, и они идентифицированы на этой фигуре идентификатором последовательности. Другие мультивалентные связывающие белки имеют измененные элементы или порядки элементов с предсказанными изменениями последовательности относительно описанных последовательностей.
Фигура 7 показывает композиционную диаграмму в виде столбцов, иллюстрирующую связывание очищенных белков при единственной фиксированной концентрации с CD20-экспрессирующими клетками WIL-2S и с клетками CHO, экспрессирующими CD28. "H1-H6" относится к молекулам 2H7-sss-hIgG-Hx-2e12 с линкерами H1-H6 и 2e12 V-областями в ориентации VR-VL. "L1-L6" относится к молекулам 2H7-sss-hIgG-Lx-2el2 с линкерами L1-L6 2e12 V-областями в ориентации VL-VH. Все эти молекулы испытывали при концентрации 0,72 мкг/мл и связывание детектировали с использованием FITC-конъюгированных антител козы против IgG человека при 1:100. Затем среднюю интенсивность флуоресценции для каждой пробы строили в виде парных столбцов для двух испытанных типов клеток-мишеней против каждой из тестируемых мультивалентных конструкций, L1-L6 или H1-H6.
Фигура 8 показывает фотографии окрашенных Кумасси невосстанавливающих и восстанавливающих гелей электрофореза в ДСН-ПААГ. Эти гели показывают действие последовательности/длины вариантного линкера на белке 2H7-sss-hIgG-Hx-2e12 HL на количества двух преобладающих белковых полос, визуализированных на этом геле.
Фигура 9 показывает Вестерн-блоты слитых белков [2H7-sss-hIgG-H6-2e12] и SMIP с релевантной единственной специфичностью, зондированные либо (a) CD28mIgG, либо (b) Fab, реактивным с 2H7-специфичностью. Эти результаты показывают, что присутствие линкера H6 приводит к генерированию расщепленных форм мультивалентных конструкций, которые лишены CD28-связывающей специфичности.
Фигура 10 показывает кривые связывания различных вариантов линкеров для линкерных форм Н1-Н6 [TRU015-sss-IgG-Hx-2e12 HL]. Первая панель показывает кривые связывания для связывания с CD20-экспрессирующими клетками WIL-2S. Вторая панель показывает кривые связывания для связывания других форм с клетками CD28+ СНО. Эти кривые связывания получали с серийными разведениями белок А-очищенного слитого белка и связывание детектировали с FITC-конъюгированными антителом козы против IgG человека при 1:100.
Фигура 11 показывает таблицу, суммирующую результаты SEC-фракционирования мультиспецифических слитых белков 2H7-sss-IgG-2e12 HL с вариантными линкерами H1-H7. Каждый ряд в этой таблице дает перечень различных линкерных вариантов слитых белков [2H7-sss-IgG-Hx-2e12-HL]. В таблице приведены также время удерживания представляющего интерес пика (POI) и процент слитого белка, присутствующего в POI, и процент белка, обнаруженного в других формах. Приведено также расщепление этих молекул с указанием степени расщепления качественным путем с использованием (Да), Да и Да или Нет для четырех возможностей.
Фигура 12 показывает два графика с кривыми связывания для мультиспецифических слитых белков [2H7-sss-hIgG-Hx-2e12] с вариантными линкерами Н3, Н6 и Н7 с клетками, экспрессирующими CD20 или CD28. Серийные разведения белок А-очищенных слитых белков от 10 мкг/мл до 0,005 мкг/мл инкубировали либо с CD20-экспрессирующими клетками WIL-2S, либо с клетками CD28+ CHO. связывание детектировали с FITC-конъюгированными антителом козы против IgG человека при 1:100. Панель А показывает связывание с клетками WIL-2S, а панель В показывает связывание с клетками CD28 CHO.
Фигура 13 показывает результаты альтернативного анализа связывания, генерируемого молекулами, использованными для фигуры 12. В этом случае, слитые белки сначала связывали с CD20-экспрессирующими клетками WIL-2S, и затем связывание детектировали с использованием CD28mIgG (5 мкг/мл) и FITC-антимышиного реагента при 1:100. Эти результаты демонстрируют одновременное связывание как с CD20, так и с CD28 в одной и той же молекуле.
Фигура 14 показывает результаты, полученные с использованием другого варианта мультиспецифической слитой конструкции. В этом случае, производили модификации в специфичности в отношении BD2, так что V-области для антитела G28-1 использовали для создания CD37-специфического связывающего домена. Показаны два графика, которые иллюстрируют относительную способность CD20- и/или CD37-антител блокировать связывание мультиспецифического слитого белка [2H7-sss-IgG-Hx-G28-1] с клетками Ramos или BJAB, экспрессирующими CD20- и CD37-мишени. Каждый тип клеток предынкубировали либо с CD20-специфическим антителом (25 мкг/мл), либо с CD37-специфическим антителом (10 мкг/мл) или с обоими реагентами (которые являются мышиными реагентами против IgG человека) перед инкубацией с мультиспецифическим слитым белком. Затем связывание этого мультиспецифического слитого белка детектировали FITC-конъюгированным козьим реагентом против IgG человека при 1:100 (предварительно адсорбированным для элиминации перекрестной реактивности в отношении мышиных антител).
Фигура 15 показывает результаты анализа ADCC, выполняемого с клетками-мишенями BJAB, эффекторными клетками PBMC и CD20-hIgG-CD37-специфическим слитым белком в качестве тест-реагента. В отношении полного описания этой процедуры см. соответствующий пример. Этот график показывает концентрацию слитого белка против %-ного специфического уничтожения при каждой испытанной дозе для реагентов SMIP с единственной специфичностью и для [2H7-sss- hIgG-STD1-G28-1]-LH- и HL-вариантов. Каждая серия данных построена в виде кривой зависимости реакции от дозы (эффекта доза-ответ) для каждого из белков с единственной специфичностью или мультиспецифических одноцепочечных слитых белков.
Фигура 16 показывает таблицу, суммирующую результаты эксперимента со-культивирования, где PBMC культивировали в присутствии TRU 015, G28-1 SMIP, обеих молекул вместе или [2H7-sss-IgG-H7-G28-1HL]-варианта. Эти слитые белки использовали при 20 мкг/мл и инкубировали в течение 24 часов или 72 часов. Затем пробы окрашивали CD3-антителами, конъюгированными с FITC, и либо CD19-, либо CD40-специфическими антителами, конъюгированными с РЕ, затем подвергали проточной цитометрии. После этого строили таблицу процента клеток в каждом окне возбуждения флуоресценции.
Фигура 17 показывает две диаграммы в виде столбцов действий на апоптоз В-клеточной линии после 24 часовой инкубации с молекулой [2H7-sss-hIgG-H7-G28-1 HL] или с контрольными SMIP с единственной CD20- и/или CD37-специфичностью отдельно или в комбинации. Процент аннексин V-иодид пропидия-положительных клеток строили в виде функции типа тест-реагента, используемого для экспериментов с одновременной инкубацией. Панель А показывает результаты, полученные с использованием клеток Ramos, а панель B показывает результаты для клеток Daudi. Каждый отдельный CD20- или CD37-специфический SMIP показан при указанных концентрациях; кроме того, при использовании комбинаций этих двух реагентов относительное количество каждого реагента показано в скобках. Для мультиспецифического СD20-CD37-слитого белка испытывали концентрации 5, 10 и 20 мкг/мл.
Фигура 18 показывает два графика вариантов молекулы [2H7-hIgG-G19-4] и их связывание либо с CD3-экспрессирующими клетками (Jurkats), либо с CD20-экспрессирующими клетками (WIL-2S). Эти молекулы включают [2H7-sss-hIgG-STDl-G19-4 HL], LH, и [2H7-csc-hIgG-STD1-G19-4 HL]. Белок А-очищенные слитые белки разводили от 20 мкг/мл до 0,05 мкг/мл и связывание детектировали с использованием FITC-конъюгированного антитела козы против IgG человека при 1:100. MFI (среднюю интенсивность флуоресценции) строили как функцию концентрации белка.
Фигура 19 показывает результаты анализов ADCC, выполненных с вариантами молекулы [2H7-hIgG-STD1-G19-4 HL] либо с шарниром SSS, либо с шарниром CSC, клетками-мишенями BJAB и либо с тотальными PBMC человека в качестве эффекторных клеток, либо с истощенными по NK-клеткам PBMC в качестве эффекторных клеток. Уничтожение оценивали в баллах как функцию концентрации мультиспецифических слитых белков. Уничтожение, наблюдаемое с этими молекулами, сравнивали с уничтожением, наблюдаемым с использованием G19-4, TRU 015 или комбинации этих двух реагентов. Каждая серия данных показывает отличающийся тест-реагент, причем процентное специфическое уничтожение построено в виде функции концентрации белка.
Фигура 20 показывает процент В-клеток Ramos, которые окрашивались положительно Аннексином V (Ann) и/или иодидом пропидия (PI) после ночной инкубации с каждым членом панели-матрицы В-клеточных антител (2 мкг/мл) в присутствии или в отсутствие анти-CD20-антитела (присутствующего при 2 мкг/мл, в случае его добавления). Вторичное антитело козы против мыши всегда присутствовало при 2-кратном отношении относительно других антител (либо только антитела матрицы, либо антитела матрицы и анти-CD20-антитела). Вертикально заштрихованные столбцы - антитело матрицы (2 мкг/мл), указанное на Х-оси, и козье антимышиное антитело (4 мкг/мл). Горизонтально заштризованные столбцы - антитело матрицы (2 мкг/мл), указанное на Х-оси, анти-CD20-антитело (2 мкг/мл) и козье антимышиное антитело (4 мкг/мл). Состояние "2-ая стадия" служило в качестве контроля и включало добавление антитела козы против мыши при 4 мкг/мл (вертикально заштрихованный столбец) или 8 мкг/мл (горизонтально заштрихованный столбец), без антитела матрицы или анти-CD20-антитела. "CL II" (класс II МНС) на этих фигурах обозначает моноклональное антитело, перекрестно реактивное с HLA DR, DQ и DP, т.е. с антигенами Класса II МНС.
Фигура 21 показывает процент В-клеток Ramos, которые окрашивались положительно Аннексином V (Ann) и/или иодидом пропидия (PI) после ночной инкубации с каждым членом панели-матрицы В-клеточных антител (2 мкг/мл) в присутствии или в отсутствие анти-CD79b-антитела (присутствующего при 0,5 или 1,0 мкг/мл, в случае его добавления). См. описание фигуры 20 в отношении идентификации проб "CL II" и "2-ая стадия". Вертикально заштрихованные столбцы - антитело матрицы (2 мкг/мл) и козье антимышиное антитело (4 мкг/мл); горизонтально заштрихованные столбцы - антитело матрицы (2 мкг/мл), анти-CD79b-антитело (10 мкг/мл) и козье антимышиное антитело (6 мкг/мл); пунктирно заштрихованные столбцы - антитело матрицы (2 мкг/мл), анти-CD79b-антитело (0,5 мкг/мл) и козье антимышиное антитело (5 мкг/мл).
Фигура 22 показывает процент В-клеток Ramos, которые окрашивались положительно Аннексином V (Ann) и/или иодидом пропидия (PI) после ночной инкубации с каждым членом панели-матрицы В-клеточных антител (2 мкг/мл) в присутствии или в отсутствие анти-CL II-антитела (присутствующего при 0,25 или 0,5 мкг/мл, в случае его добавления). См. описание фигуры 20 в отношении идентификации проб "CL II" и "2-ая стадия". Вертикально заштрихованные столбцы - антитело матрицы (2 мкг/мл) и козье антимышиное антитело (4 мкг/мл); горизонтально заштрихованные столбцы - антитело матрицы (2 мкг/мл), анти-CL II-антитело (0,5 мкг/мл) и козье антимышиное антитело (5 мкг/мл); пунктирно заштрихованные столбцы - антитело матрицы (2 мкг/мл), анти-CL II-антитело (0,25 мкг/мл) и козье антимышиное антитело (4,5 мкг/мл).
Фигура 23 показывает процент В-клеток DHL-4, которые окрашивались положительно Аннексином V (Ann) и/или иодидом пропидия (PI) после ночной инкубации с каждым членом панели-матрицы В-клеточных антител (2 мкг/мл) в присутствии или в отсутствие анти-CD22-антитела (присутствующего при 2 мкг/мл, в случае его добавления). См. описание фигуры 20 в отношении идентификации проб "CL II" и "2-ая стадия". Черные столбцы - антитело матрицы (2 мкг/мл) и козье антимышиное антитело (4 мкг/мл); наклонно заштрихованные столбцы - антитело матрицы (2 мкг/мл), анти-CD22-антитело (2 мкг/мл) и козье антимышиное антитело (8 мкг/мл).
Фигура 24 обеспечивает график, демонстрирующий прямое ингибирование роста линий клеток лимфомы Su-DHL-6 (треугольники) и DoHH2 (квадраты) свободным CD20-SMIP (черные символы) или моноспецифическим CD20xCD20-скорпионом (белые символы).
Фигура 25 является графиком, показывающим прямое ингибирование роста линий клеток лимфомы Su-DHL-6 (треугольники) и DoHH2 (квадраты) свободным CD37-SMIP (черные символы) или моноспецифическим анти-CD37-скорпионом (белые символы).
Фигура 26 представляет график, показывающий прямое ингибирование роста линий клеток лимфомы Su-DHL-6 (треугольники) и DoНН2 (квадраты) комбинацией двух разных моноспецифических SMIP (черные символы) или биспецифическим CD20-CD37-скорпионом (белые символы).
Фигура 27 является графиком, показывающим прямое ингибирование роста линий клеток лимфомы Su-DHL-6 (треугольники) и WSU-NHL (квадраты) комбинацией свободных CD20 SMIP и CD37 SMIP (черные символы) или биспецифическим CD20xCD37-скорпионом (белые символы).
Фигура 28 обеспечивает гистограммы, показывающие действия скорпионов на клеточный цикл. Пробы клеток лимфомы DoHH2 по отдельности оставляли необработанными, обрабатывали SMIP 016 или обрабатывали моноспецифическим CD37 x CD37-скорпионом. Белые столбцы: фаза суб-G1 клеточного цикла; черные столбцы: фаза G0/G1; затемненные: фаза S; и заштрихованные: фаза G2/M.
Фигуоа 29 представляет графики данных, устанавливающих, что обработка клеток лимфомы скорпионами приводила к увеличенной способности передачи сигнала в сравнении со свободными SMIP, как измерено по поступлению кальция.
Фигура 30 обеспечивает графики, демонстрирующие скорпион-зависимую клеточную цитотоксичность.
Фигура 31 показывает графики данных, указывающие на то, что скорпионы опосредуют комплемент-зависимую цитотоксичность.
Фигура 32 обеспечивает данные, показывающие в графической форме сравнительное связывание ELISA SMIP и скорпиона с низкоаффинными (В) и высокоаффинными (А) изоформами FcγRIII (CD16).
Фигура 33 представляет графики, устанавливающие связывание SMIP и скорпиона с низкоаффинными (А) и высокоаффинными (В) аллелотипами FcγRIII (CD 16) в присутствии клеток-мишеней.
Фигура 34 является гистограммой, показывающей уровень экспрессии CD20 x CD20-скорпиона в двух экспериментах (колба 1 и колба 2) при шести различных условиях культивирования. Черные столбцы: колба 1; заштрихованные столбцы: колба 2.
Фигура 35 обеспечивает гистограмму, показывающую выход продукции CD20 x CD37-скорпиона.
Фигура 36 представляет гели электрофореза в ДСН-ПААГ (при восстанавливающих и невосстанавливающих условиях) SMIP и скорпиона.
Фигура 37 обеспечивает график, показывающий, что скорпионы сохраняют способность связываться с клетками-мишенями. Черные квадраты: CD20 SMIP; черные треугольники: CD37 SMIP; черные кружки: гуманизированный CD20 (2Lm20-4) SMIP; белые ромбы: CD37 x CD37 моноспецифический скорпион; белые квадраты: CD20 x CD37 биспецифический скорпион; и белые треугольники: гуманизированный CD20 (2Lm20-4) x гуманизированный CD20 (2Lm20-4) скорпион.
Фигура 38 содержит графики, показывающие результаты анализов конкурентного связывания, устанавливающие, что как N-концевой, так и С-концевой связывающие домены скорпиона участвуют в связывании клетки-мишени.
Фигура 39 представляет данные в форме графиков, показывающие, что скорпионы имеют более низкие скорости диссоциации, чем SMIP.
Фигура 40 показывает график, устанавливающий, что скорпионы являются стабильными в сыворотке in vivo, отличающимися воспроизводимым, постоянным периодом полужизни в кровотоке для скорпиона.
Фигура 41 обеспечивает график доза-ответ для CD20 x CD37 биспецифического скорпиона, демонстрирующий in vivo эффективность введения скорпиона.
Фигура 42 показывает связывание В-клетки-мишени моноспецифическим CD20 x CD20 скорпионом (S0129) и гликовариантами.
Фигура 43 обеспечивает графики, иллюстрирующие CD20 x CD20 скорпионы (исходный и гликоварианты), индуцирующие ADCC-опосредованное уничтожение В-клеток BJAB.
Фигура 44 показывает гель, выявляющий действия на стабильность скорпиона, возникающие из изменений в линкере-скорпионе, в том числе изменения последовательности этого линкера и удлинения этого линкера добавлением последовательности Н7 к линкеру, указанного “+” в линии Н7 под гелем.
Фигура 45 показывает связывание с клетками WIL-2S CD20xCD20-скорпиона (S0129) и вариантов линкеров-скорпионов.
Фигура 46 показывает прямое клеточное уничтожение различных В-клеток CD20xCD20-скорпионом и CD20 SMIP.
Фигура 47 показывает прямое клеточное уничтожение дополнительных линий В-клеток моноспецифическим CD20xCD20-скорпионом.
Фигура 48 показывает способности прямого клеточного уничтожения каждого из двух моноспецифических скорпионов, т.е. CD20xCD20 и CD37xCD37, и одного биспецифического CD20xCD37-скорпиона, причем последний проявляет отличающуюся форму кривой уничтожения.
Фигура 49 изображает графически реакцию В-клеток Su-DHL-6 на каждый из скорпионов CD20xCD20 (S0129), CD37xCD37 и CD20xCD37.
Фигура 50 показывает способность биспецифического CD19xCD37-скорпиона и Ритуксана® непосредственно уничтожать В-клетки Su-DHL-6.
Фигура 51 обеспечивает гистограммы, показывающие прямое уничтожение В-клеток DHL-4 различными CD20-связывающими скорпионами и SMIP, а также Ритуксаном®, как указано на этой фигуре. Синие столбцы: живые клетки; темно-бордовые столбцы справа от каждой пары: Аннексин+/PI+.
Фигура 52 обеспечивает графическое изображение прямого клеточного уничтожения различными CD20-связывающими скорпионами и SMIP, а также Ритуксаном (Rituxan®), как указано на этой фигуре.
Фигура 53 обеспечивает графики активности ADCC, индуцированной различными CD20-связывающими скорпионами и SMIP, как указано на этой фигуре, а также Ритуксаном®.
Фигура 54 обеспечивает графики активности СDC, индуцированной различными CD20-связывающими скорпионами и SMIP, как указано на этой фигуре, а также Ритуксаном®.
Фигура 55 обеспечивает гистограммы, показывающие уровни C1q-связывания с CD20-связывающими скорпионами, связанными с В-клетками Ramos.
Фигура 56 обеспечивает диаграммы рассеяния FACS-анализов, показывающие потерю потенциала митохондриальной мембраны, приписываемую CD20-связывающим скорпионам (2Lm20-4x2Lm20-4 и 011x2Lm20-4) и Ритуксану®, относительно контролей (верхняя панель); гистограммы процента клеток с нарушенным потенциалом митохондриальной мембраны (нарушенный MMP: черные столбцы) показаны в нижней панели.
Фигура 57 обеспечивает гистограммы, показывающие относительное отсутствие активации каспазы 3 CD20-связывающими скорпионами (2Lm20-4x2Lm20-4 и 011x2Lm20-4), Ритуксимабом, CD95 и контролями.
Фигура 58 обеспечивает композиционный материал четырех Вестерн-блот-анализов поли(АДФ-рибозо)полимеразы и каспаз 3, 7 и 9 из В-клеток, обнаруживающих малую деградацию любого из этих белков, приписываемую связыванию CD20-связывающих скорпионов с этими клетками.
Фигура 59 является гель-электрофореграммой хромосомных ДНК В-клеток, показывающей степень фрагментации, приписываемой связыванию CD20-связывающих скорпионов с этими клетками.
Фигура 60 является гель-электрофореграммой иммунопреципитатов, полученных с каждым из анти-фосфотирозин-антитела и анти-SYK-антитела. Эти иммунопреципитаты получали из лизатов В-клеток, контактированных с CD20-связывающими скорпионами, как указано на этой фигуре.
Фигура 61 обеспечивает графики комбинационного индекса CD20-связывающих скорпионов в комбинированных терапиях с каждым из доксорубицина, винкристина и рапамицина.
Подробное описание
Данное изобретение обеспечивает композиции относительно малых пептидов, имеющих по меньшей мере две связывающих области или два домена, которые могут обеспечивать одну или несколько связывающих специфичностей, полученных из вариабельных связывающих доменов иммуноглобулинов, таких как антитела, расположенных терминально относительно эффекторного домена, содержащего по меньшей мере часть константной области иммуноглобулина (т.е. источника, из которого может быть получена субобласть, определенная здесь), а также нуклеиновые кислоты, векторы и клетки-хозяева, участвующие в рекомбинантном получении таких пептидов, и способы применения этих пептидных композиций в различных диагностических и терапевтических применениях, в том числе в лечении нарушения, а также уменьшении по меньшей мере одного симптома такого нарушения. Эти пептидные композиции преимущественно помещают второй связывающий домен с С-конца относительно эффекторного домена, причем это помещение неожиданно обеспечивает стерически не затрудненное или менее затрудненное связывание по меньшей мере этими двумя связующими доменами этого пептида, при сохранении эффекторной функции или эффекторных функций расположенного центрально эффекторного домена.
Эти первый и второй связывающие домены мультивалентных пептидов согласно этому изобретению могут быть одинаковыми (т.е. иметь идентичные или по существу идентичные аминокислотные последовательности и быть моноспецифическими) или различными (и быть мультиспецифическими). Хотя и различные в смысле первичной структуры, эти первый и второй связывающие домены могут узнавать один и тот же эпитоп и связываться с одним и тем же эпитопом молекулы-мишени и, следовательно, быть моноспецифическими. Однако, во многих случаях эти связывающие домены будут различаться структурно и будут связываться с разными сайтами, приводя к мультивалентному мультиспецифическому белку. Эти разные сайты связывания могут существовать на единственной молекуле-мишени или на разных молекулах-мишенях. В случае двух связывающих молекул, узнающих разные молекулы-мишени, эти молекулы-мишени могут существовать, например, на одной и той же или в одной и той же структуре (например, поверхности одной и той же клетки), или эти молекулы-мишени могут существовать на отдельных или в отдельных структурах или местах действия. Например, мультиспецифический связывающий белок по этому изобретению может иметь связывающие домены, которые специфически связываются с молекулой-мишенью на поверхности разных типов клеток. Альтернативно, один связывающий домен может специфически связываться с мишенью на поверхности клетки, а другой связывающий домен может специфически связываться с мишенью, не обнаруживаемой в виде ассоциированной с клеткой мишени, такой как внеклеточный структурный белок (белок матрикса) или свободный (например, растворимый или стромальный) белок.
Эти первый и второй связывающие домены получены из одного или нескольких областей одинаковых или различных структур белка иммуноглобулина, таких как молекулы антител. Эти первый и/или второй связывающий домен могут обнаруживать последовательность, идентичную последовательности области иммуноглобулина, или могут быть модификацией такой последовательности для обеспечения, например, измененных связывающих свойств или измененной стабильности. Такие модификации известны в данной области и включают изменения в аминокислотной последовательности, которые способствуют непосредственно этому измененному свойству, такому как измененное связывание, например, приводя к измененной вторичной структуре или структуре более высокого порядка в отношении пептида. Рассматриваются также модифицированные аминокислотные последовательности, происходящие из включения неприродных аминокислот, таких как неприродные обычные аминокислоты, необычные аминокислоты и иминокислоты. В некоторых вариантах осуществления, эта измененная последовательность приводит к измененному посттрансляционному процессингу, например, приводя к измененной картине гликозилирования.
Любые из большого разнообразия связывающих доменов, полученных из иммуноглобулина или иммуноглобулин-подобного полипептида (например, рецептора), рассматриваются для применения в скорпионах. Связывающие домены, полученные из антител, содержат CDR-области VL- и VH-домена, наблюдаемые, например, в контексте использования связывающего домена из гуманизированного антитела. Связывающие домены, содержащие полные VL- и VH-домены, полученные из антитела, могут быть организованы в любой ориентации. Скорпион по данному изобретению может иметь любые из описанных здесь связывающих доменов. Для скорпионов, имеющих по меньшей мере один связывающий домен, узнающий В-клетку, примеры скорпионов имеют по меньшей мере один связывающий домен, полученный из CD3, CD10, CD19, CD20, CD21, CD22, CD23, CD24, CD37, CD38, CD39, CD40, CD72, CD73, CD74, CDw75, CDw76, CD77, CD78, CD79a/b, CD80, CD81, CD82, CD83, CD84, CD85, CD86, CD89, CD98, CD126, CD127, CDw130, CD138 или CDwl50. В некоторых вариантах осуществления, скорпион является мультивалентным связывающим белком, содержащим по меньшей мере один связывающий домен, имеющий последовательность, выбранную из группы, состоящей из SEQ ID NO: 2, 4, 6, 103, 105, 107 и 109. В некоторых вариантах осуществления, скорпион содержит связывающий домен, содержащий последовательность, выбранную из группы, состоящей из любой из SEQ ID NOS:332-345. В некоторых вариантах осуществления, скорпион содержит связывающий домен, содержащий последовательность, полученную из VL- и VH-доменов иммуноглобулина, где эта последовательность выбрана из группы, состоящей из SEQ ID NO:355-365. Это изобретение дополнительно рассматривает скорпионы, содержащие связывающий домен, который имеет противоположную ориентацию VL- и VH-имеющих последовательностей, выведенных из любой из SEQ ID NOS:355-365.
Для вариантов, в которых каждый связывающий домен или оба связывающих домена получены из более, чем одной области иммуноглобулина (например, VL-области Ig и VH-области Ig), это множество областей может быть соединено линкерным пептидом. Кроме того, линкер может быть использован для соединения первого связывающего домена с константной субобластью. Соединение константной субобласти со вторым связывающим доменом (т.е. связывающим доменом 2, расположенным в направлении С-конца скорпиона) выполняется линкером-скорпионом. Эти линкеры-скорпионы имеют предпочтительно 2-45 аминокислот или 2-38 аминокислот или 5-45 аминокислот. Например, линкер Н1 имеет длину 2 аминокислоты, а линкер STD2 имеет длину 38 аминокислот. За пределами обычных рассмотрений длины, область линкера-скорпиона, подходящий для применения в скорпионах в соответствии с этим изобретением, включает шарнирную область антитела, выбранную из группы, состоящей из шарнирных областей (шарниров) IgG, IgA, IgD и IgE и их вариантов. Например, линкер-скорпион может быть шарнирной областью антитела, выбранной из группы, состоящей из шарниров IgG1 человека, IgG2 человека, IgG3 человека и IgG4 человека и их вариантов. В некоторых вариантах осуществления, область линкера-скорпиона имеет единственный остаток цистеина для образования межцепочечной дисульфидной связи. В других вариантах осуществления, линкер-скорпион имеет два остатка цистеина для образования межцепочечных дисульфидных связей. В некоторых вариантах осуществления область линкера-скорпиона получена из шарнира иммуноглобулина или области стебля С-лектина и содержит последовательность, выбранную из группы, состоящей из SEQ ID NO:111, 113, 115, 117, 119, 121, 123, 125, 127, 129, 131, 133, 135, 149, 151, 153, 155, 157, 159, 161, 163, 165, 167, 169, 231, 233, 235, 237, 239, 241, 243, 245, 247, 249, 251, 253, 255, 257, 259, 261, 263, 265, 267, 269, 271, 273, 275, 277, 279, 281, 287, 289, 297, 305, 307, 309, 310, 311, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 346, 351, 352, 353, 354, 373, 374, 375, 376 и 377. В более общем виде, любая последовательность аминокислот, идентифицированная в списке последовательностей как последовательность, обеспечивающая последовательность, происходящую из шарнира, рассматривается как линкер-скорпион в молекулах скорпионов согласно этому изобретению. Кроме того, линкер-скорпион, полученный из шарнира Ig, является шарнир-подобным пептидным доменом, имеющим по меньшей мере один свободный цистеин, способный участвовать в межцепочечной дисульфидной связи. Предпочтительно, линкер-скорпион, полученный из шарнирного пептида Ig, сохраняет цистеин, который соответствует цистеину шарнира, расположенному в направлении N-конца этого шарнира. Предпочтительно, линкер-скорпион, полученный из шарнира IgG1, имеет один цистеин или имеет два цистеина, соответствующих цистеинам шарнира. Кроме того, линкер-скорпион является областью «стебля» (ножки) молекулы С-лектина Типа II. В некоторых вариантах осуществления, скорпион содержит линкер-скорпион, имеющий последовательность, выбранную из группы, состоящей из SEQ ID NO:373-377.
Расположенная центрально константная субобласть получена из константной области белка иммуноглобулина. Константная субобласть обычно получена из CН2-части CН-области иммуноглобулина теоретически, хотя она может быть получена из CH2-CH3-части. Необязательно, константная субобласть может быть получена из шарнир-СН2- или шарнир-СН2-СН3-части иммуноглобулина с помещением пептида, соответствующего шарнирной области Ig, с N-конца относительно константной субобласти и расположенного между константной субобластью и связывающим доменом 1. Кроме того, части константной субобласти могут быть получены из CH-областей разных иммуноглобулинов. Далее, пептид, соответствующий СН3, может быть укорочен с оставлением С-концевой аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:366-371. Однако, предпочтительно, в вариантах, в которых шарнир скорпиона является шарнир-подобным пептидом, полученным из шарнира иммуноглобулина, линкер-скорпион и константная субобласть должны быть получены из одного и того же типа иммуноглобулина. Константная субобласть обеспечивает по меньшей мере одну активность, ассоциированную с СН-областью иммуноглобулина, такую как антителонезависимая клеточно-опосредованная цитотоксичность (ADCC), комплементзависимая цитотоксичность (CDC), связывание белка А, связывание по меньшей мере с одним Fc-рецептором, воспроизводимо детектируемую стабильность в отношении белка по данному изобретению, за исключением отсутствия константной субобласти, и возможно, переход через плаценту, когда генерационный переход молекулы по данному изобретению мог бы быть предпочтительным, как известно специалистам в данной области. Как и в случае вышеописанных связывающих доменов, константная субобласть получена по меньшей мере из одной молекулы иммуноглобулина и обнаруживает идентичную аминокислотную последовательность с областью или областями по меньшей мере одного иммуноглобулина. В некоторых вариантах осуществления, константная субобласть модифицирована из последовательности или последовательностей по меньшей мере одного иммуноглобулина (заменой одной или нескольких неприродных обычных или необычных, например, синтетических, аминокислот или иминокислот), что приводит к первичной структуре, которая может давать измененную вторичную структуру или структуру более высокого порядка с измененными свойствами, ассоциированными с ней, или может приводить к изменениям в посттрансляционном процессинге, например, гликозилировании.
Для этих связывающих доменов и константных субобластей, обнаруживающих идентичную или по существу идентичную аминокислотную последовательность с одним или несколькими полипептидами иммуноглобулина, посттрансляционные модификации молекулы по данному изобретению могут приводить к молекуле, модифицированной относительно иммуноглобулина (иммуноглобулинов), служащих в качестве основы для модификации. Например, с использованием известных в данной области способов, клетка-хозяин, например, клетка СНО, может быть модифицирована таким образом, что это приводит к измененной картине гликозилирования полипептида относительно гликозилирования полипептида в немодифицированной клетке-хозяине (например, клетке СНО).
Посредством обеспечения такими молекулами и способами рекомбинантного получения их in vivo были открыты пути нацеленных диагностических средств и терапевтических средств, например, для создания возможности нацеленного рекрутинга эффекторных клеток иммунной системы (например, цитотоксических Т-лимфоцитов, природных клеток-киллеров и т.п.) к клеткам, тканям, агентам и чужеродным объектам для их разрушения или секвестрирования, таким как раковые клетки и инфекционные агенты. Кроме локализации терапевтических клеток в сайте лечения, эти пептиды применимы в локализации терапевтических соединений, таких как радиоактивно меченые белки. Кроме того, эти пептиды применимы также в элиминации вредных композиций, например, ассоциацией вредной композиции, такой как токсин, с клеткой, способной разрушать или элиминировать этот токсин (напр, макрофагом). Молекулы данного изобретения применимы в модуляции активности молекул-партнеров связывания, таких как рецепторы клеточной поверхности. Это показано на фигуре 17, где апоптотическая передача сигнала через CD20 и/или CD37 заметно усиливается молекулой этого изобретения. Эффектом этой передачи сигнала является смерть клетки-мишени. Заболевания и состояния, в которых элиминация определенных клеточных популяций является полезной, включают инфекции и паразитарные болезни, воспалительные и аутоиммунные состояния, злокачественности и т.п. Специалисту с квалификацией в данной области будет понятно, что нет ограничения этого подхода к усилению апоптотической передачи сигнала. Митотическая передача сигнала и передача сигнала, приводящая к дифференцировке, активации или инактивации определенных клеточных популяций, может индуцироваться молекулами данного изобретения через подходящий выбор молекул-партнеров связывания. Дополнительное обсуждение описания этого изобретения будет облегчено обсуждением экспресс-определений используемых здесь терминов.
«Одноцепочечный связывающий белок» является единым смежным расположением ковалентно связанных аминокислот, причем цепь, способная к специфическому связыванию одного или нескольких партнеров связывания, имеет общие достаточные детерминанты сайта связывания, которые должны детектируемо связываться с этим одноцепочечным связывающим белком. Примерные партнеры связывания включают белки, углеводы, липиды и малые молекулы.
Для легкости представления, «производные» и «варианты» белков, полипептидов и пептидов по данному изобретению описаны исходя из отличий от белков и/или полипептидов и/или пептидов по данному изобретению, в том смысле, что эти производные и варианты, которые являются белками/полипептидами/пептидами по данному изобретению, отличаются от недериватизированных или невариантных белков, полипептидов или пептидов этого изобретения определенным здесь образом. Специалисту будет понятно, что эти производные и варианты сами являются белками, полипептидами и пептидами по данному изобретению.
"Антителу" дается самое широкое определение в соответствии с его значением в данной области, и этот термин включает белки, полипептиды и пептиды, способные связываться по меньшей мере с одним партнером связывания, таким как белковый или небелковый антиген. Термин "антитело" в данном контексте включает члены суперсемейства белков иммуноглобулинов любых видов, одноцепочечной или мультицепочечной композиции и вариантов, аналогов, производных и фрагментов таких молекул. Конкретно, «антитело» включает любую форму антитела, известную в данной области, в том числе, но не только, моноклональные и поликлональные антитела, химерные антитела, CDR-трансплантированные антитела, гуманизированные антитела, одноцепочечные вариабельные фрагменты, биспецифические антитела, диатела, слияния антител и т.п.
"Связывающий домен" является пептидной областью, такой как фрагмент или полипептид, полученный из иммуноглобулина (например, антитела), который специфически связывает один или несколько партнеров специфического связывания. Если существуют множество партнеров связывания, эти партнеры имеют общие детерминанты связывания, достаточные для детектируемого связывания с этим связывающим доменом. Предпочтительно, связывающий домен является смежной последовательностью аминокислот.
"Эпитопу” придается здесь его обычное значение единственного антигенного сайта, т.е. антигенной детерминанты, на субстрате (например, белке), с которым специфически взаимодействует антитело, например, посредством связывания. Другие термины, которые приобрели хорошо установившиеся значения в области иммуноглобулинов (например, антител), такие как «вариабельная легкая область», «вариабельная тяжелая область», «константная легкая область», «константная тяжелая область», «шарнирная область антитела», «определяющая комплементарность область», «каркасная область», «изотип антитела», «Fc-область», «одноцепочечный вариабельный фрагмент» или «scFv», «димерное тело», «химера, «CDR-трансплантированное антитело», «гуманизированное антитело», «shahped антитело», «слияние антител» и т.п., каждый, имеют хорошо установившиеся значения, известные в данной области, если нет явного другого указания.
Термины, понимаемые специалистами в данной области как относящиеся к технологии антител, каждый, имеют значения, приобретенные в данной области, если нет явного другого указания. Примерами таких терминов являются "VL" и "VH", относящиеся к вариабельной связывающей области, полученной из легкой и тяжелой цепи антитела, соответственно; и CL и CH, относящиеся к "константной области иммуноглобулина»" т.е. к константной области, полученной из легкой или тяжелой цепи, соответственно, причем последняя область понимается как дополнительно разделяемая на домены CHI, CH2, CH3 и CH4 константной области, в зависимости от изотипа антитела (IgA, IgD, IgE, IgG, IgM), из которого была получена эта область. CDR обозначает "определяющая комплементарность область". "Шарнирная область" получена из аминокислотной последовательности, вставленной между областями CHI и CН2 и соединяющей эти области отдельной цепи антитела, которая, как известно в данной области, обеспечивает гибкость, в форме «шарнира», полным антителам.
"Константная субобласть»" является термином, определенным здесь как термин, относящийся к последовательности пептида, полипептида или белка, который соответствует одному или нескольким доменам константной области антитела или получен из них. Таким образом, константная субобласть может включать любой или все из следующих доменов: CHI-домен, шарнирную область, CH2-домен, CH3-домен (IgA, IgD, IgG, IgE и IgM) и CH4-домен (IgE, IgM). Константной субобластью, определенной здесь, может называться область полипептида, соответствующая полной константной области антитела или ее части. Обычно, константная субобласть полипептида, или кодирующая нуклеиновая кислота, имеет шарнирную область, CH2-домен и CH3-домен.
"Эффекторной функцией" является функция, ассоциированная с константной областью или обеспечиваемая константной областью антитела. Примерные эффекторные функции включают антителозависимую клеточно-опосредованную цитотоксичность (ADCC), активацию комплемента и комплементзависимую цитотоксичность (CDC), связывание Fc-рецептора и увеличенный период полужизни в плазме, а также переход через плаценту. Эффекторная функция композиции согласно данному изобретению является дектектируемой; предпочтительно, эта специфическая активность композиции по данному изобретению в отношении этой функции является приблизительно такой же, что и специфическая активность антитела дикого типа в отношении этой эффекторной функции, т.е. константная субобласть мультивалентной связывающей молекулы предпочтительно не потеряла эффекторной функции относительно антитела дикого типа.
"Линкер" является пептидом или полинуклеотидом, который присоединяет или связывает другие пептиды или полинуклеотиды. Обычно пептидный линкер является олигопептидом из приблизительно 2-50 аминокислот, причем типичные полинуклеотидные линкеры кодируют такой пептидный линкер и, следовательно, имеют длину приблизительно 6-150 нуклеотидов. Линкеры соединяют первый связывающий домен с доменом константной субобласти. Примером пептидного линкера является (Gly4Ser)3. Для соединения С-концевой стороны константной субобласти со вторым связывающим доменом используется линкер-скорпион. Этот линкер-скорпион может быть получен из шарнира иммуноглобулина или из области стебля (ножки) С-лектина типа II, как описано более подробно ниже.
"Мишень" имеет более одного значения в зависимости от контекста использования, определяющего недвусмысленное значение в каждом случае. В самом узком смысле, "мишень" обозначает сайт связывания, т.е. связывающий домен партнера связывания для пептидной композиции согласно данному изобретению. В более широком смысле, "мишень" или "молекулярная мишень" относится к полному партнеру связывания (например, белку), который обязательно обнаруживает сайт связывания. Конкретные мишени, такие как “CD20”, “CD37" и т.п., имеют обычное значение этого термина, приобретенное в данной области. “Клетка-мишень" является любой прокариотической или эукариотической клеткой, здоровой или пораженной болезнью, которая ассоциирована с молекулой-мишенью согласно данному изобретению. Конечно, молекулы-мишени обнаруживаются также в не ассоциированном с какой-либо клеткой виде (т.е. в виде бесклеточной мишени) или в ассоциации с другими композициями, такими как вирусы (в том числе бактериофаги), органические или неорганические носители молекулы-мишени и чужеродные объекты.
Примеры материалов, с которыми может быть ассоциирована молекула-мишень, включают аутологичные клетки (например, раковые клетки или другие пораженные болезнью клетки), инфекционные агенты (например, инфекционные клетки и инфекционные вирусы) и т.п. Молекула-мишень может быть ассоциирована с энуклеированной клеткой, клеточной мембраной, липосомой, губкой, гелем, капсулой, таблеткой и т.п., которые могут быть использованы для доставки, транспорта или локализации молекулы-мишени, независимо от предполагаемого применения (например, медицинского лечения, как результата легких или непреднамеренных мер предосторожности или, кроме того, в случае угрозы биотерроризма (использования биологических агентов в террористических целях). Обозначения "бесклеточные", "безвирусные", "не содержащие носителя", "не содержащие чужеродных объектов" и т.п. относятся к молекулам-мишеням, которые не ассоциированы с указанной композицией или материалом.
“Аффинность связывания" обозначает прочность нековалентного связывания пептидных композиций данного изобретения и их партнеров связывания. Предпочтительно аффинностью связывания называют количественную меру аттракции между членами пары связывания.
“Адъювантом" является вещество, которое увеличивает функциональное действие или способствует функциональному действию соединения, с которым он находиться в ассоциации, например, в форме фармацевтической композиции активного агента и адъюванта. “Наполнитель” является инертным веществом, используемым в качестве разбавителя в приготовлении фармацевтической композиции. “Носитель” является обычно инертным веществом, используемым для обеспечения транспортера для доставки фармацевтической композиции.
“Клетка-хозяин" относится к любой клетке, прокариотической или эукариотической, в которой находится полинуклеотид, белок или пептид согласно этому изобретении.
"Введение" нуклеиновой кислоты или полинуклеотида в клетку-хозяина означает обеспечение вхождения нуклеиновой кислоты или полинуклеотида в эту клетку любым способом, известным в данной области, включающим, но не ограничивающимся ими, опосредованные солью осаждения in vitro и другие формы трансформации депротеинизированной нуклеиновой кислоты/полинуклеотида или несомой в векторе нуклеиновой кислоты/полинуклеотида, вирус-опосредованную инфекцию и необязательно трансдукцию, с «хелперной» молекулой или без «хелперной» молекулы, баллистическую доставку «ДНК-снарядов», конъюгацию и т.п.
"Инкубирование" клетки-хозяина означает поддержание этой клетки в условиях среды, известных в данной области, подходящей для конкретной цели, такой как экспрессия генов. Такие условия, в том числе температура, ионная сила, давление кислорода (кислородный потенциал), концентрация диоксида углерода, состав нутриентов и т.п., хорошо известны в данной области.
“Выделение" соединения, такого как белок или пептид по этому изобретению, означает отделение этого соединения по меньшей мере от одного отличающегося соединения, с которым он обнаружен ассоциированным в природе, например, в клетке-хозяине, экспрессирующей подлежащее выделению соединение, например, отделением истощенной культуральной среды, содержащей это соединение, от клеток-хозяев, росших в этой среде.
“Организм, нуждающийся (в лечении)" является любым организмом, находящимся при риске или страдающим от любого заболевания, нарушения или состояния, которое поддается лечению или уменьшению симптомов композицией согласно данному изобретения, в том числе, но не только, разных форм рака, любого ряда аутоиммунных заболеваний, радиационного отравления вследствие радиоактивно меченых белков, пептидов и подобных соединений, принятых внутрь или продуцируемых внутри токсинов, и т.п., как станет очевидно после рассмотрения полного описания. Предпочтительно, нуждающимся в лечении организмом является пациент-человек.
“Уменьшение" симптома заболевания означает детектируемое уменьшение тяжести этого симптома заболевания, как известно в данной области. Примеры симптомов включают боль, повышенную температуру, опухание и тугоподвижность суставов.
Если контекст не дает более конкретного указания, термины "белок," "пептид" и "полипептид" используются здесь взаимозаменяемо, причем каждый обозначает по меньшей мере одну смежную цепь аминокислот. Аналогично, термины "полинуклеотид", "нуклеиновая кислота" и "молекула нуклеиновой кислоты" используются взаимозаменяемо, пока из контекста не станет ясно, что предполагается конкретное, а не взаимозаменяемое, значение.
"Фармацевтически приемлемая соль" обозначает соли соединений по данному изобретению, полученные из комбинации таких соединений и органической или неорганической соли (кислотно-аддивные соли) или органического или неорганического основания (основно-аддитивные соли).
С использованием определенных выше терминов, ниже обеспечено общее описание различных аспектов данного изобретения. После этого общего описания представлены рабочие примеры для обеспечения дополнительного доказательства функциональности и применимости описанного здесь изобретения.
Белки и полипептиды
В некоторых вариантах осуществления этого изобретения, обеспечены любые из описанных здесь мультивалентных связывающих белков с эффекторной функцией, включающие слитые белки связывающий домен-иммуноглобулин, где мультивалентный связывающий белок или пептид с эффекторной функцией содержит две или более полипептидных последовательностей связывающих доменов. Каждая из полипептидных последовательностей связывающих доменов способна связываться или специфически связываться с мишенью (мишенями), такими как антиген (антигены), причем мишень (мишени) или антиген (антигены) могут быть одинаковыми или могут буть различными. Полипептидная последовательность связывающего домена может быть получена из вариабельной области антигена или она может быть получена из иммуноглобулин-подобных молекул, например, рецепторов, которые укладываются таким образом, что они имитируют молекулы иммуноглобулинов. Антитела, из которых получены эти связывающие домены, могут быть антителами, которые являются поликлональными, в том числе моноспецифическими поликлональными, моноклональными (mAb), рекомбинантными, химерными, гуманизированными (например, CDR-трансплантированными), человеческими, одноцепочечными, каталитическими антителами и любой другой формой антитела, известной в данной области, а также их фрагментами, вариантами или производными. В некоторых вариантах осуществления, каждый из этих связывающих доменов белка по данному изобретению получен из полноразмерной вариабельной области иммуноглобулина. В предпочтительных вариантах осуществления, связывающие домены, каждый, основаны на вариабельной области Ig человека. В других вариантах осуществления, этот белок получен из фрагмента вариабельной области Ig. В таких вариантах осуществления, предпочтительно, чтобы каждая полипептидная последовательность связывающего домена соответствовала последовательностям каждого из определяющих комплементарность областей вариабельной области конкретного Ig. В данном изобретении рассматриваются также связывающие домены, которые соответствуют менее, чем всем CDR вариабельной области конкретного Ig, при условии, что такие связывающие домены сохраняют способность специфического связывания по меньшей мере с одной мишенью.
Мультивалентный связывающий белок с эффекторной функцией имеет также последовательность константной субобласти, полученную из константной области иммуноглобулина, предпочтительно константной области тяжелой цепи антитела, ковалентно расположенной бок о бок между двумя связывающими доменами в мультивалентном связывающем белке с эффекторной функцией.
Этот мультивалентный связывающий белок с эффекторной функцией имеет также линкер-скорпион, который соединяет С-концевую сторону константной субобласти с N-концевой стороной связывающего домена 2. Этот линкер-скорпион не является спиральным пептидом и может быть получен из шарнира иммуноглобулина, из области «стебля» (ножки) С-лектинов типа II. Линкер-скорпион может быть получен из шарнирной области иммуноглобулина дикого типа, например, шарнирной области IgG1, IgG2, IgG3, IgG4, IgA, IgD или IgE. В других вариантах осуществления, это изобретение обеспечивает мультивалентные связывающие белки с измененными шарнирами. Одной категорией измененных шарнирных областей, подходящих для включения в мультивалентные связывающие белки, является категория шарниров с измененным количеством остатков цистеина, в частности, остатков цистеина, о которых в данной области известно, что они участвуют в образовании межцепочечных дисульфидных связей в молекулах-копиях иммуноглобулинов, имеющих шарниры дикого типа. Таким образом, белки могут иметь шарнир IgG1, в котором один из трех остатков Cys, способных участвовать в образованиях межцепочечных дисульфидных связей, отсутствует. Для указания Cys-субструктуры измененных шарниров, эта цистеин-субструктура представлена от N-конца к C-концу. С использованием этой системы идентификации, мультивалентные связывающие белки с измененными IgG-шарнирами включают шарнирные структуры, характеризуемые как cxc, xxc, ccx, xxc, xcx, cxx и xxx. Этот остаток Cys может быть либо делетирован, либо заменен аминокислотой, которая приводит к консервативной замене или неконсервативной замене. В некоторых вариантах осуществления, цистеин заменен серином. Для белков с линкерами-скорпионами, содержащими шарнирные области IgG1, количество цистеинов, соответствующих шарнирным цистеинам, уменьшают до 1 или 2, предпочтительно с одним из этих цистеинов, соответствующих цистеинам шарнира, расположенным наиболее близко к N-концу этого шарнира.
Для белков с линкерами-скорпионами, содержащими шарниры IgG2, могут иметься 0, 1, 2, 3 или 4 остатка Cys. Для линкеров-скорпионов, содержащих измененные шарниры IgG2, содержащие 1,2 или 3 остатка Cys, рассматриваются все возможные субпопуляции остатков Cys. Таким образом, для таких линкеров, имеющих один Cys, мультивалентные связывающие белки могут иметь следующий Cys-мотив в шарнирной области: cxxx, xcxx, xxcx или xxxc. Для линкеров-скорпионов, содержащих IgG2, имеющих 2 или 3 остатка Cys, рассматриваются все возможные комбинации сохраненных и замененных (или делетированных) остатков Cys. Для мультивалентных связывающих белков с линкерами-скорпионами, содержащими измененные шарнирные области IgG3 или IgG4, обсуждается уменьшение остатков Cys от 1 до количества, меньшего на 1, чем общее количество остатков Cys в шарнирной области, независимо от того, происходит ли это уменьшение посредством делеции или замены консервативными или неконсервативными аминокислотами (например, серином). Подобным образом, рассматриваются мультивалентные связывающие белки, имеющие линкер-скорпион, содержащий шарнир IgA, IgD или IgE дикого типа, как и соответствующие измененные шарнирные области, имеющие уменьшенное количество остатков Cys от 1 до количества, меньшего на 1, чем общее количество остатков Cys, обнаруживаемого в шарнире дикого типа. В некоторых вариантах осуществления, имеющих шарнир IgG1, первый, или N-концевой, остаток Cys сохраняется. Для белков с шарнирными областями либо дикого типа, либо измененными, предполагается, что мультивалентные связывающие белки будут одноцепочечными молекулами, способными образовывать гомомультимеры, такие как димеры, например, посредством образования дисульфидных связей. Кроме того, белки с измененными шарнирами могут иметь изменения на концах шарнирной области, например, потерю или замену одного или нескольких аминокислотных остатков на N-конце, C-конце или на обоих концах конкретной области или домена, такого как домен шарнирной области, описанный здесь.
В другом примерном варианте осуществления, константная субобласть получена из константной области, которая содержит природную или сконструированную шарнирную область IgD. Шарнир IgD дикого типа человека имеет один цистеин, который образует дисульфидную связь с легкой цепью в нативной структуре IgD. В некоторых вариантах осуществления, цистеин в шарнире IgD мутирован (например, делетирован) для генерирования измененного шарнира для применения в качестве соединяющей области между связывающими доменами, например, биспецифической молекулы. Другие аминокислотные изменения или делеции или изменения в шарнире IgD, которые не приводят к нежелательной негибкости шарнира, также входят в объеме настоящего изобретения. Природные или сконструированные шарнирные области из других видов также находятся в объеме этого изобретения, как и шарниры гуманизированного природного или сконструированного IgD из видов не человека, и шарнирные области (другие, чем IgD) из других изотипов антител человека или не человека (такие как шарнир IgG2 ламы).
Это изобретение дополнительно включает константные субобласти, присоединенные к линкерам-скорпионам, которые могут быть получены из шарнирных областей, которые соответствуют известной шарнирной области, такой как шарнир IgG1 или шарнир IgD, как отмечалось выше. Эта константная субобласть может содержать модифицированную или измененную (относительно дикого типа) шарнирную область, в которой по меньшей мере один остаток цистеина, о котором известно, что он участвует в межцепочечной дисульфидной связи, заменен другой аминокислотой в консервативной замене (например, Ser вместо Cys) или неконсервативной замене. Константная субобласть не включает пептидную область или домен, который соответствует CHI-домену иммуноглобулина.
Альтернативные шарнирные и линкерные последовательности, которые могут быть использованы в качестве соединяющих областей, происходят из частей рецепторов клеточной поверхности, которые соединяют V-подобный или С-подобный домены иммуноглобулина. Области между V-подобными доменами Ig, где рецептор клеточной поверхности содержит множественные V-подобные домены Ig в тандеме, и между С-подобными доменами Ig, где рецептор клеточной поверхности содержит множественные тандемные С-подобные области Ig, также рассматриваются как соединяющие области. Шарнирные и линкерные последовательности обычно имеют длину 5-60 аминокислот и могут быть первично гибкими, но могут также обеспечивать более жесткие свойства. Кроме того, линкеры часто обеспечивают размещение в пространстве, которое способствует минимизации стерического затруднения между связывающими доменами. Предпочтительно, эти шарнирные и линкерные пептиды являются первично α-спиральными в структуре, с минимальной β-складчатой структурой. Предпочтительные последовательности являются стабильными в плазме и сыворотке и устойчивы к протеолитическому расщеплению. Эти предпочтительные последовательности могут содержать природный или добавленный мотив, такой как мотив CPPC, который придает дисульфидную связь для стабилизации образования димера. Предпочтительные последовательности могут содержать один или несколько сайтов гликозилирования. Примеры шарнирных и линкерных последовательностей включают, но не ограничиваются ими, области интердомена между V-подобной и C-подобной Ig-областями CD2, CD4, CD22, CD33, CD48, CD58, CD66, CD80, CD86, CD150, CD166 и CD244.
Константная субобласть может быть получена из константной области Ig верблюдовых, например, либо IgG2, либо IgG3 ламы или верблюда.
Конкретно рассматривается константная субобласть, имеющая CH2-CH3-область из любого класса Ig или из любого подкласса IgG, такого как IgG1 (например, IgG1 человека). В предпочтительных вариантах осуществления, константная субобласть и линкер-скорпион, полученный из шарнира иммуноглобулина, оба, получены из одного и того же класса Ig. В других предпочтительных вариантах осуществления, константная субобласть и линкер-скорпион, полученный из шарнира иммуноглобулина, оба, получены из одного и того же подкласса Ig. Константная субобласть может быть также CH3-доменом из любого класса или подкласса Ig, такого как IgG1 (например, IgG1 человека), при условии, что он ассоциирован по меньшей мере с одной эффекторной функцией иммуноглобулина человека.
Константная субобласть не соответствует полной константной области иммуноглобулина (т.е. CН1-шарнир-CН2-CН3) класса IgG. Константная субобласть может соответствовать полной константной области иммуноглобулина других классов. Константные домены IgA, такие как шарнир IgA1, шарнир IgA2, домены IgA CH2 и IgA CH3 с мутированным или отсутствующим участком хвоста также считаются константными субобластями. Кроме того, любой константный домен легкой цепи может функционировать в качестве константной субобласти, например, CK или любой CL. Эта константная субобласть может также включать JH или JK, с шарниром или без шарнира. Константная субобласть может также соответствовать сконструированным антителам, в которых, например, был сконструирован трансплантат петли посредством создания выбранных аминокислотных замен с использованием каркаса IgG для генерирования сайта связывания для рецептора, отличного от природного FСR (CD16, CD32, CD64, FcεR1), как понятно специалистам в данной области. Примером константной субобласти этого типа является CH2-CH3-область IgG, модифицированный таким образом, что он имеет сайт связывания CD89.
Этот аспект данного изобретения обеспечивает мультивалентный связывающий белок или пептид, имеющий эффекторную функцию, содержащий, по существу состоящий или состоящий из (а) N-терминально расположенной полипептидной последовательности связывающего домена, полученной из иммуноглобулина, который слит или другим образом соединен с (b) полипептидной последовательностью константной субобласти, полученной из константной области иммуноглобулина, которая предпочтительно включает последовательность шарнирной области, где этот полипептид шарнирной области может быть таким, какой описан здесь, и может содержать, по существу состоять или состоять, например, из альтернативной полипептидной последовательности шарнирной области, в свою очередь, слитой или другим образом соединенной с (с) С-терминально расположенной полипептидной последовательностью второго связывающего домена, полученной из иммуноглобулина.
Эта расположенная центрально полипептидная последовательность константной субобласти, полученная из константной области иммуноглобулина способна проявлять по меньшей мере одну иммунологическую активность, выбранную из группы, состоящей из антителозависимой клеточно-опосредованной цитотоксичности (ADCC), CDC, фиксации комплемента и связывания Fc-рецептора, и эти полипептиды связывающих доменов, каждый, способны связываться или специфически связываться с мишенью, такой как антиген, причем эти мишени могут быть одинаковыми или различными и могут быть обнаружены в эффективно одной и той же физиологической среде (например, поверхности одной и той же клетки) или в разных средах (например, на поверхностях разных клеток, в разных местоположениях клеточной поверхности и в бесклеточном окружении, например, в растворе).
Этот аспект данного изобретения включает также вариантные белки или полипептиды, проявляющие эффекторную функцию, которые являются по меньшей мере на 80% и предпочтительно на 85%, 90%, 95% или 99% идентичными мультивалентному белку с эффекторной функцией специфической последовательности, как описано здесь.
Полинуклеотиды
Это изобретение обеспечивает также полинуклеотиды (выделенные или очищенные или чистые полинуклеотиды), кодирующие белки или пептиды в соответствии с этим изобретением, векторы (в том числе клонирующие векторы и экспрессирующие векторы), содержащие такие полинуклеотиды, и клетки (например, клетки-хозяева), трансформированные или трансфицированные полинуклеотидом или вектором по изобретению. В кодировании белков или полипептидов этого изобретения, эти полинуклеотиды кодируют первый связывающий домен, второй связывающий домен и Fc-домен, все из которых получены из иммуноглобулинов, предпочтительно иммуноглобулинов человека. Каждый связывающий домен может содержать последовательность, соответствующую полноразмерной последовательности вариабельной области (тяжелой цепи и/или легкой цепи) или ее частичной последовательности, при условии, что каждый такой связывающий домен сохраняет способность специфического связывания. Fc-домен может иметь последовательность, которая соответствует полноразмерной последовательности Fc-домена иммуноглобулина или ее частичной последовательности, при условии, что Fc-домен обнаруживает по меньшей мере одну эффекторную функцию, определенную здесь. Кроме того, каждый из этих связывающих доменов может быть присоединен к Fc-домену через линкерный пептид, который обычно имеет длину по меньшей мере 8 и предпочтительно по меньшей мере 13 аминокислот. Предпочтительной линкерной последовательностью является последовательность на основе мотива Gly4Ser, такая как (Gly4Ser)3.
Варианты мультивалентного связывающего белка с эффекторной функцией также включены в это изобретение. Вариантные полинуклеотиды являются по меньшей мере на 90% и предпочтительно по меньшей мере на 95%, 99% или 99,9% идентичными одному из полинуклеотидов определенной последовательности, описанной здесь, или гибридизуются с одним из этих полинуклеотидов определенной последовательности при строгих условиях гибридизации: 0,015 M хлорид натрия, 0,0015 M цитрат натрия при 65-68ºC или 0,015 M хлорид натрия, 0,0015M цитрат натрия и 50% формамид при 42ºC. Полинуклеотидные варианты сохраняют способность кодировать мультивалентный связывающий белок с эффекторной функцией.
Термин «строгие» относится в данном контексте к условиям, которые обычно понимаются в данной области как строгие. Строгость гибридизации в принципе определяется температурой, ионной силой и концентрацией денатурирующих агентов, таких как формамид. Примерами строгих условий для гибридизации и промывания являются: 0,015 M хлорид натрия, 0,0015 M цитрат натрия при 65-68ºC или 0,015 M хлорид натрия, 0,0015 M цитрат натрия и 50% формамид при 42ºC. См. Sambrook et al, Molecular Cloning: A Laboratory Manual, 2nd Ed., Cold Spring Harbor Laboratory, (Cold Spring Harbor, N.Y. 1989).
Могут быть также использованы более строгие условия (такие как более высокая температура, более высокая ионная сила, более высокая концентрация формамида или другой денатурирующий агент); однако, эти условия будут влиять на скорость гибридизации. В случаях, когда речь идет о гибридизации дезоксиолигонуклеотидов, дополнительные примерные условия строгой гибридизации включают промывание в 6х SSC, 0,05% пирофосфате натрия при 37ºС (для олигонуклеотидов из 14 оснований), 48°C (для олигонуклеотидов из 17 оснований), 55°C (для олигонуклеотидов из 20 оснований) и 60ºC (для олигонуклеотидов из 23 оснований).
В родственном аспекте этого изобретения обеспечен способ получения полипептида или белка или другой конструкции по изобретению, например, включающих мультивалентный связывающий белок или пептид, имеющий эффекторную функцию, предусматривающий стадии (а) культивирования клетки-хозяина, описанной и обеспеченной здесь, в условиях, которые позволяют экспрессию этой конструкции; и (b) выделения продукта экспрессии, например, мультивалентного связывающего белка или пептида с эффекторной функцией из клетки-хозяина или культуры клетки-хозяина.
Конструкции
Данное изобретение относится также к векторам и к конструкциям, полученным из известных векторов, каждый из которых включает полинуклеотид или нуклеиновую кислоту этого изобретения, и, в частности, рекомбинантным экспрессионным конструкциям, включающим любые из различных известных конструкций, в том числе конструкций доставки, применимых для генной терапии, которые включают любые нуклеиновые кислоты, кодирующие мультивалентные, например, мультиспецифические, в том числе биспецифические, связывающие белки и полипептиды с эффекторной функцией, как обеспечено здесь; к клеткам-хозяевам, которые генетически сконструированы с использованием векторов и/или других конструкций этого изобретения, и к способам введения экспрессионных или других конструкций, содержащих последовательности нуклеиновых кислот, кодирующие мультивалентные, например, мультиспецифические, в том числе биспецифические, связывающие белки с эффекторной функцией или их фрагменты или варианты, рекомбинантными способами.
Различные конструкции настоящего изобретения, включающие мультивалентные, например, мультиспецифические, связывающие белки с эффекторной функцией, могут быть экспрессированы фактически в любой клетке-хозяине, в том числе в клетках-хозяевах in vivo в случае генной терапии, под контролем подходящих промоторов, в зависимости от природы конструкции (например, типа промотора, как описано выше), и от природы желаемой клетки-хозяина (например, постмитотического терминально дифференцированного или активного деления; например, сохранения экспрессируемой конструкции в виде эписомы или интегрированной в геном клетки-хозяина).
Подходящие клонирующие и экспрессирующие векторы для применения с прокариотическими и эукариотическими хозяевами описаны, например, в Sambrook, et al., Molecular Cloning: A Laboratory Manual, Second Edition, Cold Spring Harbor, NY, (1989). Примерные клонирующие/экспрессирующие векторы включают, но не ограничиваются ими, клонирующие векторы, челночные векторы, которые могут быть на основе плазмид, фагмид, фазмид, космид, вирусов, искусственных хромосом или любого носителя нуклеиновых кислот, подходящего для амплификации, переноса и/или экспрессии полинуклеотида, содержащегося в них, которые известны в данной области. Как отмечалось здесь, в предпочтительных вариантах осуществления настоящего изобретения, рекомбинантную экспрессию проводят в клетках млекопитающих, которые были трансфицированы, трансформированы или трансдуцированы нуклеиновой кислотой в соответствии с этим изобретением. См., также, например, Machida, CA., "Viral Vectors for Gene Therapy: Methods and Protocols"; Wolff, JA, "Gene Therapeutics: Methods and Applications of Direct Gene Transfer" (Birkhauser 1994); Stein, U and Walther, W (eds., "Gene Therapy of Cancer: Methods and Protocols" (Humana Press 2000); Robbins, PD (ed.), "Gene Therapy Protocols" (Humana Press 1997); Morgan, JR (ed.), "Gene Therapy Protocols" (Humana Press 2002); Meager, A (ed.), "Gene Therapy Technologies, Applications and Regulations: From Laboratory to Clinic" (John Wiley & Sons Inc. 1999); MacHida, CA and Constant, JG, "Viral Vectors for Gene Therapy: Methods and Protocols" (Humana Press 2002); "New Methods Of Gene Therapy For Genetic Metabolic Diseases NIH Guide," Volume 22, Number 35, October 1, 1993. См. также Патенты США с номерами 6384210; 6384203; 6384202; 6384018; 6383814; 6383811; 6383795; 6383794; 6383785; 6383753; 6383746; 6383743; 6383738; 6383737; 6383733; 6383522; 6383512; 6383481; 6383478; 6383138; 6380382; 6380371; 6380369; 6380362; 6380170; 6380169; 6379967 и 6379966.
Обычно, экспрессионные конструкции получают из плазмидных векторов. Одной предпочтительной конструкцией является модифицированный вектор pNASS (Clontech, Palo Alto, CA), который имеет последовательности нуклеиновых кислот, кодирующие ген устойчивости к ампициллину, сигнал полиаденилирования и сайт промотора Т7. Хорошо известны другие подходящие экспрессионные векторы млекопитающих (см., например, Ausubel et al., 1995; Sambrook et al., supra; см. также, например, каталоги из Invitrogen, San Diego, CA; Novagen, Madison, WI; Pharmacia, Piscataway, NJ). Могут быть получены предпочтительные в настоящее время конструкции, которые включают последовательность, кодирующую дигидрофолатредуктазу (DHFR), при подходящем регуляторном контроле, для стимуляции увеличенных уровней продуцирования мультивалентного связывающего белка с эффекторной функцией, причем эти уровни происходят из амплификации гена после применения подходящего агента селекции (отбора) (например, метотрексата).
Обычно, рекомбинантные экспрессирующие векторы будут включать сайт инициации репликации и селектируемые маркеры, делающие возможной трансформацию клетки-хозяина, и промотор, полученный из высоко экспрессируемого гена для управления транскрипцией, справа от структурной последовательности, как описано выше. Вектор в функциональной связи с полинуклеотидом по данному изобретению дает клонирующую или экспрессирующую конструкцию. Примерные клонирующие/экспрессирующие конструкции содержат по меньшей мере один регуляторный элемент экспрессии, например, промотор, функционально связанный с полинуклеотидом настоящего изобретения. Дополнительные регуляторные элементы экспрессии, такие как энхансеры, фактор-специфические сайты связывания, терминаторы и сайты связывания рибосом также предполагаются в этих векторах и клонирующих/экспрессирующих конструкциях согласно этому изобретению. Гетерологичная структурная последовательность полинуклеотида по данному изобретению собирается в подходящей фазе с последовательностями инициации и терминации трансляции. Так, например, кодирующие мультивалентный связывающий белок нуклеиновые кислоты, обеспеченные здесь, могут быть включены в любую из разнообразных конструкций экспрессирующих векторов в качестве рекомбинантной экспрессирующей конструкции для экспрессии такого белка в клетке-хозяине. В некоторых предпочтительных вариантах осуществления, эти конструкции включены в готовые формы, которые вводят in vivo. Такие векторы и конструкции включают хромосомные, нехромосомные и синтетические ДНК-последовательности, например, производные SV40; бактериальные плазмиды; ДНК фага; плазмиды дрожжей; векторы, полученные из комбинаций плазмид и ДНК фага, вирусные ДНК, такие как вирус коровьей оспы, аденовирус, вирус дифтерита птиц и псевдобешенства, или недостаточные по репликации ретровирусы, описанные ниже. Однако, любой другой вектор может быть использован для получения рекомбинантной экспрессионной конструкции, и в предпочтительных вариантах осуществления такой вектор будет реплицируемым и жизнеспособным в хозяине.
Подходящая ДНК-последовательность (подходящие ДНК-последовательности) могут быть инсертированы в вектор, например, с использованием различных процедур. Обычно, ДНК-последовательность инсертируют в подходящий сайт(ы) расщепления рестрикционной эндонуклеазы процедурами, известными в данной области. Обсуждаются стандартные способы для клонирования, выделения ДНК, амплификации и очистки, для ферментативных реакций с участием ДНК-лигазы, ДНК-полимеразы, рестрикционных эндонуклеаз и т.п., и различные способы выделения. Ряд стандартных способов описаны, например, в Ausubel et al. (1993 Current Protocols in Molecular Biology, Greene Publ. Assoc. Inc. & John Wiley & Sons, Inc., Boston, MA); Sambrook et al. (1989 Molecular Cloning, Second Ed., Cold Spring Harbor Laboratory, Plainview, NY); Maniatis et al. (1982 Molecular Cloning, Cold Spring Harbor Laboratory, Plainview, NY); Glover (Ed.) (1985 DNA Cloning Vol. I and II, IRL Press, Oxford, UK); Hames and Higgins (Eds.), (1985 Nucleic Acid Hybridization, IRL Press, Oxford, UK) и в другом месте.
ДНК-последовательность в экспрессирующем векторе функционально связана по меньшей мере с одной подходящей регуляторной последовательностью экспрессии (например, конститутивным промотором или регулируемым промотором) для управления синтезом мРНК. Иллюстративные примеры таких регуляторных последовательностей экспрессии включают промоторы эукариотических клеток или их вирусов, описанные выше. Промоторные области могут быть выбраны из любого желаемого гена с использованием векторов САТ (хлорамфениколтрансферазы) или других векторов с селектируемыми маркерами. Эукариотические промоторы включают немедленно ранние промоторы CMV, промотор тимидинкиназы HSV, ранний и поздний промоторы SV40, промотор LTR из ретровируса и промотор металлотионеина-I мыши. Выбор подходящего вектора и промотора находится в рамках обычной квалификации в данной области, и здесь описано получение некоторых особенно предпочтительных рекомбинантных экспрессионных конструкций, содержащих по меньшей мере один промотор или регулируемый промотор, функционально связанный с нуклеиновой кислотой, кодирующей белок или полипептид согласно этому изобретению.
Транскрипция ДНК, кодирующей белки и полипептиды этого изобретения, высшими эукариотами может быть увеличена встраиванием энхансерной последовательности в этот вектор. Примеры включают энхансер SV40 на поздней стороне сайта инициации репликации 100-270 п.н., энхансер раннего промотора цитомегаловируса, энхансер полиомы на поздней стороне сайта инициации репликации и энхансеры аденовируса.
Обсуждаются также генные терапии с использованием нуклеиновых кислот этого изобретения, предусматривающие стратегии замены дефектных генов или добавления новых генов клеткам и/или тканям и развивавшиеся для применения в лечении рака, коррекции метаболических нарушений и в области иммунотерапии. Генные терапии настоящего изобретения включают применение различных конструкций этого изобретения, с отдельным носителем или средством доставки, или конструкций для лечения заболеваний, нарушений и/или состояний, указанных здесь. Такие конструкции могут быть также использованы в качестве вакцин для лечения или предотвращения заболеваний, нарушений и/или состояний, указанных здесь. ДНК-вакцины, например, используют полинуклеотиды, кодирующие детерминанты иммуногенных белков и нуклеиновых кислот для стимуляции иммунной системы против патогенов или опухолевых клеток. Такие стратегии могут стимулировать приобретенный или врожденный иммунитет или могут включать модификацию иммунной функции через экспрессию цитокинов. Генная терапия in vivo включает прямую инъекцию генетического материала пациенту или животному, обычно для лечения, предупреждения или уменьшения симптомов заболевания или симптомов, ассоциированных с заболеванием. Вакцины и иммунная модуляция являются системными терапиями. В случае тканеспецифических терапий in vivo, таких как терапии, которые нацелены на лечение рака, предпочтительными являются локализованная доставка генов и/или системы экспрессии/нацеливания. Разнообразные векторы генной терапии, которые нацелены на специфические ткани, известны в данной области, и были разработаны процедуры для физического нацеливания на специфические ткани, например, с использованием технологий на основе катетеров, все из которых обсуждаются здесь.
Ex vivo подходы к генной терапии также рассматриваются здесь и включают извлечение, генетическую модуляцию, размножение и повторное введение собственных клеток субъекта, например, пациента-человека. Примеры включают трансплантацию костного мозга для лечения рака или генетическую модификацию лимфоидных клеток-предшественников. Ex vivo генную терапию предпочтительно применяют для лечения клеток, которые являются легко доступными и могут выживать в культуре во время процесса переноса генов (такие как клетки крови или кожи).
Применимые векторы генной терапии включают аденовирусные векторы, лентивирусные векторы, аденоассоциированные вирусные (AAV) векторы, векторы вируса простого герпеса и ретровирусные векторы. Генные терапии могут также проводиться с использованием «голой» ДНК, доставки на основе липосом, доставки на основе липидов (в том числе ДНК, присоединенной к положительно заряженным липидам), электропорации и баллистической трансфекции.
В некоторых вариантах осуществления, в том числе, но не только, вариантах генной терапии, вектором может быть вирусный вектор, такой как, например, ретровирусный вектор. Miller et al., 1989 Bio Techniques 7:980; Coffin and Varmus, 1996 Retroviruses, Cold Spring Harbor Laboratory Press, NY. Например, ретровирусы, из которых могут быть получены ретровирусные плазмидные векторы, включают, но не ограничиваются ими, вирус мышиного лейкоза Молони, вирус некроза селезенки, ретровирусы, такие как вирус саркомы Рауса, вирус птичьего лейкоза, вирус лейкоза обезьян семейства гиббоновых, вирус иммунодефицита человека, аденовирус, вирус миелопролиферативной саркомы и вирус опухоли молочной железы.
Ретровирусы являются РНК-вирусами, которые могут реплицироваться и интегрировать в геном клетки-хозяина через промежуточный ДНК-продукт. Этот промежуточный ДНК-продукт, или провирус, может быть стабильно интегрирован в ДНК клетки-хозяина. Согласно некоторым вариантам осуществления данного изобретения, экспрессионная конструкция может содержать ретровирус, в который включен чужеродный ген, кодирующий чужеродный белок, вместо нормальной ретровирусной РНК. При вхождении ретровирусной РНК в клетку-хозяина при инфекции этот чужеродный ген также вводится в эту клетку и может затем интегрироваться в ДНК клетки-хозяина в виде части ретровирусного генома. Экспрессия этого чужеродного гена в хозяине приводит к экспрессии этого чужеродного белка.
Большинство ретровирусных векторных систем, которые были разработаны для генной терапии, основаны на мышиных ретровирусах. Такие ретровирусы существуют в двух формах, в виде свободных вирусных частиц, называемых вирионами, или в виде провирусов, интегрированных в ДНК клетки-хозяина. Форма вириона этого вируса содержит структурные и ферментативные белки этого ретровируса (в том числе фермент обратную транскриптазу), две РНК-копии вирусного генома и части плазматической мембраны клетки-источника, содержащей гликопротеин оболочки вируса. Ретровирусный геном организован в четыре основных области: длинный концевой повтор (LTR), который содержит цис-действующие элементы, необходимые для инициации и терминации транскрипции и расположен как 5' (слева), так и 3' (справа) относительно кодирующих генов, и три гена, кодирующие gag, pol и env. Эти три гена, gag, pol и env, кодируют, соответственно, внутренние вирусные структуры, ферментативные белки (такие как интеграза) и гликопротеин оболочки (обозначаемый gp70 и p15e), который придает инфекционность и специфичность в отношении диапазона хозяев этого вируса, а также "R"-пептид невыясненной функции.
Были разработаны отдельные пакующие клеточные линии и продуцирующие вектор клеточные линии по соображениям безопасности, касающимся применений ретровирусов, в том числе применений в экспрессионных конструкциях. Вкратце, эта методология использует применение двух компонентов, ретровирусного вектора и пакующей клеточной линии (PCL). Ретровирусный вектор содержит длинные концевые повторы (LTR), чужеродную ДНК, подлежащую переносу, и пакующую последовательность (y). Этот ретровирусный вектор не будет репродуцироваться сам, так как гены, которые кодируют структурные белки и белки оболочки, не включены в геном вектора. PCL содержит гены, кодирующие белки gag, pol и env, но не содержит сигнал упаковки “y." Таким образом, PCL сама может образовывать только пустые частицы вириона. В этом общем способе, ретровирусный вектор вводят в PCL, создавая посредством этого продуцирующую вектор клеточную линию (VCL). Эта VCL производит частицы вирионов, содержащие только чужеродный геном ретровирусного вектора и, следовательно, рассматривается как безопасный ретровирусный вектор для терапевтического применения.
Термин "ретровирусная векторная конструкция” относится к упорядоченной структуре, которая, в предпочтительных вариантах осуществления этого изобретения, способна управлять экспрессией представляющих интерес последовательности (последовательностей) или гена (генов), таких как кодирующие мультивалентный связывающий белок последовательности нуклеиновых кислот. Вкратце, конструкция ретровирусного вектора должна включать 5'-LTR, сайт связывания тРНК, сигнал упаковки, сайт инициации синтеза второй цепи ДНК и 3'-LTR. В эту векторную конструкцию может быть включено большое разнообразие гетерологичных последовательностей, включающих, например, последовательности, которые кодируют белок (например, цитотоксический белок, ассоциированный с заболеванием антиген, иммунную вспомогательную молекулу, или ген замещения) или применимы самостоятельно в качестве молекулы (например, рибозима или антисмысловой последовательности).
Конструкции ретровирусного вектора данного изобретения могут быть легко сконструированы из большого разнообразия ретровирусов, включающих, например, ретровирусы типа В, С и D, а также спумавирусы и лентивирусы (см. например, RNA Tumor Viruses, Second Edition, Cold Spring Harbor Laboratory, 1985). Такие ретровирусы могут быть легко получены из депозитариев или коллекций, таких как Американская Коллекция Типовых Культур ("ATCC"; Rockville, Maryland), или выделены из известных источников с использованием обычных доступных способов. Любой из вышеуказанных ретровирусов может быть легко использован для сборки или конструирования конструкций ретровирусных векторов, пакующих клеток или клеток-продуцентов этого изобретения, в соответствии с обеспеченным здесь описанием и с использованием стандартных рекомбинантных способов (например, Sambrook et al, Molecular Cloning: A Laboratory Manual, 2d ed., Cold Spring Harbor Laboratory Press, 1989; Kunkle, 1985 Proc. Natl. Acad. Sci. (USA) 52:488).
Подходящие промоторы для применения в вирусных векторах могут включать, но не ограничиваются ими, ретровирусные LTR; промотор SV40; и промотор цитомегаловируса человека (CMV), описанный в Miller, et al., 1989 Biotechniques 7:980-990, или любой другой промотор (например, клеточные промоторы, такие как эукариотические клеточные промоторы, включающие, но не ограничивающиеся ими, промоторы гистона, pol III, и β-актина). Другие вирусные промоторы, которые могут быть использованы, включают, но не ограничиваются ими, промоторы аденовируса, промоторы тимидинкиназы (TK) и промоторы парвовируса В19. Выбор подходящего промотора будет очевидным специалистам в данной области из содержащихся здесь описаний и может быть выбором среди регулируемых промоторов или вышеописанных промоторов.
Этот ретровирусный плазмидный вектор используют для трансдукции пакующих клеточных линий для образования линий клеток-продуцентов. Примеры пакующих клеток, которые могут быть трансфицированы, включают, но не ограничиваются ими, линии клеток PE501, PA317, ψ-2, ψ-AM, PA12, T19-14X, VT-19-17-H2, ψCRE, ψCRIP, GP+E-86, GP+envAml2 и DAN, описанные в Miller, Human Gene Therapy, 7:5-14 (1990). Этот вектор может трансдуцировать эти пакующие клетки любыми способами, известными в данной области. Такие способы включают, но не ограничиваются ими, электропорацию, применение липосом и CaPO4-осаждение. В другой альтернативе, ретровирусный плазмидный вектор может быть инкапсулирован в липосому или связан с липидом и затем введен хозяину.
Линия клеток-продуцентов генерирует инфекционные частицы ретровирусного вектора, которые включают последовательность (последовательности) нуклеиновой кислоты, кодирующие мультивалентные связывающие белки с эффекторной функцией. Затем такие частицы ретровирусного вектора могут быть использованы для трансдукции эукариотических клеток либо in vitro, либо in vivo. Трансдуцированные эукариотические клетки будут экспрессировать последовательность нуклеиновой кислоты (последовательности нуклеиновых кислот), кодирующие этот белок или полипептид. Эукариотические клетки, которые могут быть трансдуцированы, включают, но не ограничиваются ими, эмбриональные стволовые клетки, а также гемопоэтические стволовые клетки, гепатоциты, фибробласты, циркулирующие мононуклеарные и полиморфно-ядерные клетки периферической крови, в том числе миеломоноцитарные клетки, лимфоциты, миобласты, тканевые макрофаги, дендритные клетки, клетки Купфера, лимфоидные и ретикулоэндотелиальные клетки лимфатических узлов и селезенки, кератиноциты, эндотелиальные клетки и бронхиальные эпителиальные клетки.
Клетки-хозяева
Следующий аспект настоящего изобретения обеспечивает клетку-хозяина, трансформированную или трансфицированную любым из полинуклеотидов или клонирующих/экспрессирующих конструкций этого изобретения (или другим образом содержащую их). Эти полинуклеотиды или клонирующие/экспрессирующие конструкции вводят в подходящие клетки с использованием любого способа, известного в данной области, в том числе трансформации, трансфекции и трансдукции. Клетки-хозяева включают клетки субъекта, подвергающегося клеточной терапии ex vivo, в том числе генной терапии ex vivo. Эукариотические клетки-хозяева, рассматриваемые в качестве одного аспекта этого изобретения, когда они являются хозяевами полинуклеотида, вектора или белка этого изобретения, включают, наряду с собственными клетками субъекта (например, собственными клетками человека), клетки VERO, клетки HeLa, клеточные линии яичника Китайского хомячка (CHO) (в том числе модифицированные клетки СНО, способные модифицировать картину гликозилирования экспрессируемых мультивалентных связывающих молекул, см. Опубликованную заявку на патент США № 2003/0115614 A1), включенную здесь в качестве ссылки, клетки COS (такие как COS-7), W138, BHK, HepG2, 3T3, RIN, MDCK, A549, PC12, K562, клетки НEK293, клетки HepG2, N-клетки, клетки 3T3, клетки Spodoptera frugiperda (например, клетки Sf9), клетки Saccharomyces cerevisiae и любую другую эукариотическую клетку, о которой известно в данной области, что она применима в экспрессии и необязательно выделении белка или пептида согласно этому изобретению. Обсуждаются также прокариотические клетки, в том числе, но не только, клетки Escherichia coli, Bacillus subtilis, Salmonella typhimurium, стерптомицетов или любая прокариотическая клетка, о которой известно в данной области, что она применима в экспрессии и необязательно выделении белка или пептида согласно этому изобретению. В частности, в выделении белка или пептида из прокариотических клеток обсуждается, что могут быть использованы способы, известные в данной области для экстракции белка из тел включений. Выбор подходящего хозяина с использованием приведенных здесь описаний находится в пределах квалификации специалистов в данной области.
Сконструированные клетки-хозяева могут культивироваться в общепринятой среде нутриентов, модифицированной для активации промоторов, отбора трансформантов или амплификации конкретных генов. Условия культивирования для конкретных клеток-хозяев, выбранных для экспрессии, такие как температура, рН и т.п., будут вполне очевидными для специалистов с обычной квалификацией в данной области. Различные системы культивирования клеток млекопитающих также могут быть использованы для экспрессии рекомбинантного белка. Примеры экспрессионных систем млекопитающих включают линию COS-7 почечных фибробластов обезьяны, описанные в Gluzman, 1981 Cell 23:175, и другие клеточные линии, способные экспрессировать совместимый вектор, например, линии клеток C127, 3T3, CHO, HeLa и BHK. Экспрессирующие векторы млекопитающих будут содержать сайт инициации репликации, подходящий промотор и, необязательно, энхансер, а также любые из необходимых сайтов связывания рибосом, сайта полиаденилирования, донорного и акцепторного сайтов сплайсинга, последовательностей терминации транскрипции и 5'-фланкирующих нетранскрибируемых последовательностей, например, описанных здесь в отношении получения экспрессионных конструкций мультивалентных связывающих белков. ДНК-последовательности, полученные из сайтов сплайсинга SV40 и сайтов полиаденилирования, могут быть использованы для обеспечения требуемых нетранскрибируемых генетических элементов. Введение этой конструкции в клетку-хозяина может выполняться различными способами, которые будут известны специалистам в данной области, в том числе кальций-фосфатной трансфекцией, ДЭАЭ-Декстран-опосредованной трансфекцией или электропорацией (Davis et al., 1986 Basic Methods in Molecular Biology).
В одном варианте осуществления, клетку-хозяина трансдуцируют рекомбинантной вирусной конструкцией, управляющей экспрессией белка или полипептида согласно этому изобретению. Эта трансдуцированная клетка-хозяин продуцирует вирусные частицы, содержащие экспрессированный белок или полипептид, полученный из частей мембраны клетки-хозяина, включенной вирусными частицами во время баддинга вируса (захвата вирусом фрагмента клеточной мембраны при проникновении в клетку).
Фармацевтические композиции
В некоторых вариантах осуществления, композиции по изобретению, такие как мультивалентный связывающий белок или композиция, содержащая полинуклеотид, кодирующий такой белок, как описано здесь, пригодны для введения при условиях и в течение времени, достаточных для разрешения экспрессии кодируемого белка в клетке-хозяине in vivo или in vitro, для генной терапии и т.п. Такие композиции могут быть приготовлены в фармацевтические композиции для введения в соответствии с хорошо известными методологиями. Фармацевтические композиции обычно содержат одну или несколько рекомбинантных экспрессионных конструкций и/или продукты экспрессии таких конструкций, в комбинации с фармацевтически приемлемым носителем, наполнителем или разбавителем. Такие носители будут нетоксичными для реципиентов при используемых дозах и концентрациях. Для композиций на основе нуклеиновых кислот или для композиций, содержащих продукты экспрессии согласно этому изобретению, будут вводиться приблизительно 0,01 мкг/кг - приблизительно 100 мг/кг массы тела, например, интрадермальным, подкожным, внутримышечным или внутривенным способом или любым способом, о котором известно в данной области, что он пригоден в конкретной серии обстоятельств. Предпочтительная доза, например, равна приблизительно 1 мкг/кг - приблизительно 1 мг/кг, особенно предпочтительно приблизительно 5 мкг/кг - приблизительно 200 мкг/кг.
Для специалистов в данной области будет очевидно, что число и частота введений будет зависеть от реакции хозяина. Фармацевтически приемлемые носители для терапевтического применения хорошо известны в области фармацевтики и описаны, например, в Remingtons Pharmaceutical Sciences, Mack Publishing Co. (A.R. Gennaro edit. 1985). Например, могут быть использованы стерильный солевой раствор и забуференный фосфатом солевой раствор при физиологическиом рН. В этой фармацевтической композиции могут быть обеспечены консерванты, стабилизаторы, красители и т.п. Например, в качестве консервантов могут быть добавлены бензоат натрия, сорбиновая кислота и эфиры п-гидроксибензойной кислоты. Id. в 1449. Кроме того, могут быть использованы антиоксиданты и суспендирующие агенты. Id. Соединения данного изобретения могут быть использованы либо в свободной форме, либо в форме солей, причем обе формы считаются включенными в объем данного изобретения.
Фармацевтические композиции, которые содержат одну или несколько конструкций этого изобретения или белки, соответствующие продуктам, кодируемым такими конструкциями нуклеиновых кислот, могут быть в любой форме, которая делает возможным введение этой конструкции пациенту. Например, эта композиция может быть в форме твердого вещества, жидкости или газа (аэрозоля). Обычные способы введения включают, без ограничения, пероральный, местный, парентеральный (например, сублингвальный или буккальный), сублингвальный, ректальный, вагинальный и интраназальный способы введения. Термин парентеральный в данном контексте включает подкожные инъекции, внутривенный, внутримышечный, интрастернальный (внутригрудинный), внутриполостной, внутриоболочечный, интрамеатальный (внутриканальный), интрауретральный или инфузионный способы. Фармацевтическую композицию готовят таким образом, чтобы позволить содержащимся в ней активным ингредиентам быть доступными после введения этой композиции пациенту. Композиции, которые будут вводиться пациенту, имеют форму одной или нескольких дозированных единиц, где, например, таблетка может быть единицей дозы на один прием, а контейнер одного или нескольких соединений этого изобретения в аэрозольной форме может содержать множество дозированных единиц.
Для перорального введения, могут присутствовать наполнители и/или связывающий агент. Примерами являются сахароза, каолин, глицерин, декстрины крахмала, альгинат натрия, карбоксиметилцеллюлоза и этилцеллюлоза. Могут присутствовать красящие и/или улучшающие вкус и запах агенты. Может быть использована оболочка-покрытие.
Композиция может быть в форме жидкости, например, в форме эликсира, сиропа, раствора, эмульсии или суспензии. Эта жидкость может быть жидкостью для перорального введения или для доставки инъекцией, в качестве двух примеров. При предназначении для перорального введения предпочтительные композиции содержат, наряду с одной или несколькими слитыми конструкциями связывающий домен-иммуноглобулин или продуктами экспрессии, один или несколько из подслащивающего агента, консервантов, красителей/окрашивающих добавок и усилителя вкуса. В композиции, предназначенной для введения инъекцией, могут быть включены один или несколько из поверхностно-активного вещества, консерванта, увлажняющего агента, диспергирующего агента, суспендирующего агента, буфера, стабилизатора и изотонического агента.
Жидкая фармацевтическая композиция, используемая здесь, либо в форме раствора, суспензии, либо в другой подобной форме, может включать один или несколько из следующих адъювантов: стерильных разбавителей, таких как вода для инъекций, солевого раствора, предпочтительно физиологического раствора, раствора Рингера, изотонического хлорида натрия, нелетучих масел, таких как синтетические моно- и диглицериды, которые могут служить в качестве растворителя или суспендирующей среды, полиэтиленгликолей, глицерина, пропиленгликоля или других растворителей; антибактериальных агентов, таких как бензиловый спирт или метилпарабен; антиоксидантов, таких как аскорбиновая кислота или бисульфит натрия; хелатообразующих агентов, таких как этилендиаминтетрауксусная кислота; буферов, таких как ацетаты, цитраты или фосфаты, и агентов для коррекции тоничности, таких как хлорид натрия или декстроза. Парентеральный препарат может быть заключен в ампулы, одноразовые шприцы или многодозовые флаконы из стекла или пластика. Физиологический раствор является предпочтительным адъювантом. Инъецируемая фармацевтическая композиция предпочтительно является стерильной.
Может быть желательным включение других компонентов в этот препарат, таких как средства доставки, включающие, но не ограничивающиеся ими, соли алюминия, эмульсии типа вода-в-масле, биодеградируемые масляные носители, эмульсии типа масло-в-воде, биодеградируемые микрокапсулы и липосомы. Примеры иммуностимулирующих веществ (адъювантов) для применения в таких носителях, включают N-ацетилмурамил-L-аланин-D-изоглутамин (MDP), липополисахариды (LPS), глюкан, IL-12, GM-CSF, гамма-интерферон и IL-15.
Хотя любой подходящий носитель, известный специалистам с обычной с квалификацией в данной области, может быть использован в фармацевтических композициях этого изобретения, тип носителя будет варьировать в зависимости от способа введения и от того, является ли желательным пролонгированное высвобождение. Для парентерального введения, такого как подкожная инъекция, этот носитель предпочтительно содержит воду, солевой раствор, спирт, жир, воск или буфер. Для перорального введения, может быть использован любой из вышеуказанных носителей или твердый носитель, такой как маннит, лактоза, крахмал, стеарат магния, натрий-сахарин, тальк, целлюлоза, глюкоза, сахароза и карбонат магния. Биодеградируемые микросферы (например, из полилактик-галактида) могут также использоваться в качестве носителей для фармацевтических композиций этого изобретения. Подходящие биодеградируемые микросферы описаны, например, в Патентах США № 4897268 и 5075109. В этом отношении, предпочтительно, эта микросфера имеет размер, больший, чем приблизительно 25 микрон.
Фармацевтические композиции могут также содержать разбавители, такие как буферы, антиоксиданты, такие как аскорбиновая кислота, низкомолекулярные (менее 10 остатков) полипептиды, белки, аминокислоты, углеводы (например, глюкоза, сахароза или декстрины), хелатообразующие агенты (например, ЭДТА), глутатион и другие стабилизаторы и наполнители. Примерами подходящих разбавителей являются нейтрально забуференный солевой раствор или солевой раствор, смешанный с неспецифическим сывороточным альбумином. Предпочтительно, продукт готовят в виде лиофилизата с использованием подходящих растворов наполнителей (например, сахарозы) в качестве разбавителей.
Фармацевтические композиции по данному изобретению включают также стабилизированные белки и стабильные жидкие фармацевтические готовые формы в соответствии с технологией, известной в данной области, в том числе технологией, описанной в Опубликованной заявке на патент США № 2006/0008415 A1, включенной здесь в качестве ссылки. Такие технологии включают дериватизацию белка, где белок содержит тиоловую группу, связанную с N-ацетил-L-цистеином, N-этилмалеимидом или цистеином.
Как описано выше, рассматриваемое изобретение включает композиции, способные доставлять молекулы нуклеиновых кислот, кодирующие мультивалентные связывающие белки с эффекторной функцией. Такие композиции включают рекомбинантные вирусные векторы, например, ретровирусы (см. WO 90/07936, WO 91/02805, WO 93/25234, WO 93/25698 и WO 94/03622), аденовирус (см. Berkner, 1988 Biotechniques 6:616-627; Li et al, 1993 Hum. Gene Ther. 4:403-409; Vincent et al, Nat. Genet. 5:130-134; и Kolls et al, 1994 Proc. Natl Acad. Sci. USA 91:215-219), поксвирус (см. Патент США № 4769330; Патент США № 5017487; и WO 89/01973)), молекулы нуклеиновых кислот рекомбинантной экспрессионной конструкции в комплексе с поликатионной молекулой (см. WO 93/03709) и нуклеиновые кислоты, ассоциированные с липосомами (см. Wang et al, 1987 Proc. Natl Acad. Sci. USA 84:7851). В некоторых вариантах осуществления, эта ДНК может быть связана с уничтоженным или инактивированным аденовирусом (см. Curiel et al, 1992 Hum. Gene Ther. 3:147-154; Cotton et al, 1992 Proc. Natl Acad. Sci. USA 89:6094). Другие подходящие композиции включают комбинации ДНК-лиганд (см. Wu et al, 1989 J. Biol Chem. 264: 16985-16987) и комбинации липид-ДНК (см. Feigner et al, 1989 Proc. Natl Acad. Sci. USA 84:7413-7417).
Кроме прямых процедур in vivo, могут быть использованы процедуры ex vivo, в которых клетки извлекают из хозяина (например, субъекта, такого как пациент-человек), модифицируют и помещают в того же самого или другого животного-хозяина. Будет очевидно, что можно использовать любые вышеописанные композиции для введения конструкций этого изобретения, либо белков/полипептидов, либо нуклеиновых кислот, кодирующих их, в клетки ткани в контексте ex vivo. Протоколы для вирусных, физических и химических способов поглощения хорошо известны в данной области.
Получение антител
Поликлональные антитела, направленные на антигенный полипептид, обычно продуцируются у животных (например, кроликов, хомячков, коз, овец, лошадях, свиней, крыс, песчанок, морских свинок, мышей или любых других подходящих млекопитающих, а также других видах (не млекопитающих)) посредством множественных подкожных или внутрибрюшинных инъекций антигенного полипептида или его фрагмента и адъюванта. Адъюванты включают, но не ограничиваются ими, полный или неполный адъювант Фрейнда, минеральные гели, такие как гидроксид алюминия, и поверхностно-активные вещества, такие как лизолецитин, полиолы плуроников, полианионы, пептиды, масляные эмульсии и динитрофенол. BCG (бациллы Кальметта-Герена) и Corynebacterium parvum являются также потенциально применимыми в качестве адъювантов. Может быть применимо конъюгирование антигенного полипептида с белком-носителем, который является иммуногенным в подлежащем иммунизации виде; типичные носители включают гемоцианин морского блюдечка, сывороточный альбумин, бычий тироглобулин или ингибитор трипсина сои. Агрегирующие агенты, такие как квасцы, также применимы для усиления иммунной реакции. После иммунизации, у этих животных берут кровь и сыворотку анализируют на титр антитела против антигенного полипептида с использованием общепринятых способов. Поликлональные антитела могут быть использованы в сыворотках, в которых они были детектированы, или могут быть очищены из сывороток с использованием, например, антиген-аффинной хроматографии.
Моноклональные антитела, направленные против антигенных полипептидов, получают с использованием любого способа, который обеспечивает продуцирование молекул антител клеточными линиями в культуре. Например, моноклональные антитела могут быть получены гибридомным способом, как описано в Kohler et al., Nature 256:495 [1975]; способом В-клеточных гибридом человека (Kosbor et al., Immunol Today 4:72, 1983; Cote et al., Proc Natl Acad Sci 80: 2026-2030, 1983) и EBV-гибридомным способом (Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R Liss Inc, New York N.Y., pp 77-96, (1985).
При использовании гибридомного способа могут быть использованы линии клеток миеломы. Линии клеток, подходящие для применения в процедурах продуцирующего гибридомы слияния, предпочтительно не продуцируют эндогенное антитело, имеют высокую эффективность слияния и проявляют ферментные недостаточности, которые делают их неспособными к росту в некоторых селективных средах, которые поддерживают рост только желаемых слитых клеток (гибридом). Например, если иммунизируемым животным является мышь, можно использовать P3-X63/Ag8, P3-X63-Ag8.653, NS1/1.Ag 4 1, Sp210-Ag14, FO, NSO/U, MPC-11, MPC11-X45-GTG 1.7 и S194/5XX0 Bu1; для крыс можно использовать R210.RCY3, Y3-Ag 1.2.3, IR983F и 4B210; и U-266, GM1500-GRG2, LICR-LON-HMy2 и UC729-6, все, применимы в связи со слияниями клеток.
В альтернативном варианте осуществления, антитела человека могут быть получены из библиотек фагового дисплея (Hoogenboom et al, J. Mol. Biol. 227: 381 [1991]; Marks et al, J. Mol. Biol. 222: 581, см. также Патент США № 5885793). Эти процессы имитируют иммунный отбор посредством дисплея набора антител на поверхности нитеобразного бактериофага и последующего отбора фагов по их связыванию с выбранным антигеном. Один подобный способ описан в Заявке РСТ № PCT/US98/17364, поданной от имени Adams et al., которая описывает выделение высокоаффинных и функциональных агонистических антител для MPL- и msk-рецепторов с использованием такого подхода. В этом подходе, полный спектр генов антител человека может быть создан клонированием природно реаранжированных V-генов человека из лимфоцитов периферической крови, как описано ранее (Mullinax, et al., Proc. Natl. Acad. Sci. (USA) 87: 8095-8099 [1990]).
Альтернативно, полный спектр синтетических тяжелых цепей человека может быть создан из неаранжированных сегментов V-гена сборкой каждого VH-сегмента человека с D-сегментами произвольных нуклеотидов вместе с J-сегментом человека (Hoogenboom, et al., J. Mol. Biol. 227:381-388 [1992]). Подобным образом, спектр легких цепей человека может быть сконструирован объединением каждого V-сегмента человека с J-сегментом (Griffiths, et al, EMBO J. 13:3245-3260 [1994]). Нуклеотиды, кодирующие полное антитело (т.е. как тяжелую, так и легкую цепи), связывают в виде одноцепочечного Fv-фрагмента и этот полинуклеотид лигируют с нуклеотидом, кодирующим малый белок оболочки нитеобразного фага. При экспрессии этого слитого белка на поверхности этого фага полинуклеотид, кодирующий специфическое антитело, может быть идентифицирован отбором при помощи иммобилизованного антигена.
Кроме этих классических способов генерирования поликлональных и моноклональных антител, рассматривается любой способ для генерирования любой известной формы антитела. Кроме поликлональных и моноклональных антител, формы антител включают химерные антитела, гуманизированные антитела, CDR-трансплантированные антитела и фрагменты и варианты антител.
Варианты и производные специфических связывающих агентов
В одном примере обеспечены инсерционные варианты, в которых один или несколько аминокислотных остатков дополняют аминокислотную последовательность специфического связывающего агента. Инсерции могут быть помещены либо на одном, либо на обоих концах белка или могут быть расположены во внутренних областях аминокислотной последовательности специфического связывающего агента. Вариантные продукты этого изобретения также включают зрелые продукты специфического связывающего агента, т.е. продукты специфического связывающего агента, в которых удалены лидерная или сигнальная последовательности, и полученный белок имеет дополнительные аминоконцевые остатки. Эти дополнительные аминоконцевые остатки могут быть получены из другого белка или могут включать один или несколько остатков, которые не идентифицируются как полученные из специфического белка. Обсуждаются полипептиды с дополнительным остатком метионина в положении -1 (например, Met-1-мультивалентные связывающие пептиды с эффекторной функцией), а также полипептиды этого изобретения с дополнительными остатками метионина и лизина в положениях -2 и -1 (Met-2-Lys-1-мультивалентные связывающие белки с эффекторной функцией). Варианты полипептидов этого изобретения, имеющие дополнительные остатки Met, Met-Lys или Lys (или, в общем виде, один или несколько основных остатков) являются особенно применимыми для усиленного продуцирования рекомбинантого белка в бактериальных клетках-хозяевах.
Это изобретение включает также специфические полипептиды этого изобретения, имеющие дополнительные аминокислотные остатки, которые возникают из применения специфических систем экспрессии. Например, применение коммерчески доступных векторов, которые экспрессируют желаемый полипептид в виде части глутатион-S-трансфераза (GST)-слитого продукта, обеспечивает желаемый полипептид, имеющий дополнительный остаток глицина в положении -1 после отщепления GST-компонента от этого желаемого полипептида. Варианты, которые происходят из экспрессии в других векторных системах, также рассматриваются, в том числе варианты, в которых в эту аминокислотную последовательность включены гистидиновые метки, обычно на карбокси- и/или амино-конце этой последовательности.
В другом аспекте, это изобретение обеспечивает делеционные варианты, в которых удалены один или несколько аминокислотных остатков в полипептиде этого изобретения. Делеции могут выполняться на одном или на обоих концах этого полипептида или посредством удаления одного или нескольких остатков внутри этой аминокислотной последовательности. Делеционные варианты обязательно включают все фрагменты полипептида по этому изобретению.
Фрагментами антител называют полипептиды, имеющие последовательность, соответствующую по меньшей мере части последовательности вариабельной области иммуноглобулина. Фрагменты могут быть генерированы, например, ферментативным или химическим расщеплением полипептидов, соответствующих полноразмерным антителам. Другие связывающее фрагменты включают фрагменты, генерированные синтетическими способами или способами рекомбинантных ДНК, такими как экспрессия рекомбинантных плазмид, содержащих последовательности нуклеиновых кислот, кодирующие частичные вариабельные области антител. Предпочтительные полипептидные фрагменты проявляют иммунологические свойства, уникальные или специфические в отношении мишени, описанной здесь. Фрагменты этого изобретения, имеющие желаемые иммунологические свойства, могут быть получены любым из способов, хорошо известных и рутинно используемых в данной области.
Еще в одном аспекте, это изобретение обеспечивает варианты с заменами мультивалентных связывающих полипептидов, имеющих эффекторную функцию. Варианты с заменами включают полипептиды, в которых один или несколько аминокислотных остатков в аминокислотной последовательности удалены и заменены альтернативными остатками. В некоторых вариантах осуществления, эти замены являются консервативными по характеру; однако, это изобретение включает также замены, которые являются неконсервативными. Аминокислоты могут классифицироваться в соответствии с их физическими свойствами и вкладом во вторичную и третичную структуру белка. Консервативной заменой считается в данной области замена одной аминокислоты другой аминокислотой, которая имеет сходные свойства. Примерные консервативные замены представлены в таблице А (см. WO 97/09433, страница 10, опубликованный 13 марта 1997 года (PCT/GB96/02197, поданный 9/6/96), непосредственно ниже.
Альтернативно, консервативные аминокислоты могут быть подразделены на группы, как описано в Lehninger, [Biochemistry, Second Edition; Worth Publishers, Inc. NY:NY (1975), pp.71-77], как представлено в таблице В, непосредственно ниже.
Это изобретение обеспечивает также производные полипептидов специфических связывающих агентов. Производные включают полипептиды специфических связывающих агентов, несущие модификации, другие чем инсерция, делеция или замена аминокислотных остатков. Предпочтительно, эти модификации являются ковалентными по характеру и включают, например, химическое связывание с полимерами, липидами, другими органическими и неорганическими частями молекул. Производные этого изобретения могут быть получены для увеличения периода полужизни полипептида специфического связывающего агента, или они могут быть сконструированы для увеличения нацеливающей способности этого полипептида на желаемые клетки, ткани или органы.
Это изобретение дополнительно включает мультивалентные связывающие бекли с эффекторной функцией, которые ковалентно модифицированы или дериватизованы для включения одного или нескольких присоединений водорастворимого полимера, такого как полиэтиленгликоль, полиоксиэтиленгликоль или полипропиленгликоль, как описано в Патентах США с номерами 4640835, 4496689, 4301144, 4670417, 4791192 и 4179337. Другие применимые полимеры, известные в данной области, включают монометоксиполиэтиленгликоль, декстран, целлюлозу и другие полимеры на основе углеводов, поли-(N-винилпирролидон)полиэтиленгликоль, гомополимеры пропиленгликоля, сополимер полипропиленоксида и этиленоксида, полиоксиэтилированные полиолы (например, глицерин) и поливиниловый спирт, а также смеси этих полимеров. Особенно предпочтительными являются полиэтиленгликоль (ПЭГ)-дериватизованные белки. Водорастворимые полимеры могут быть связаны в специфических положениях, например, на амино-конце белков и полипептидов по данному изобретению, или случайным образом присоединены к одной или нескольким боковым цепям этого полипептида. Применение ПЭГ для улучшения терапевтических свойств описано в Патенте США № 6133426, выданном Gonzales, et al.
Сайты-мишени для мутагенеза иммуноглобулинов
Некоторые стратегии доступны для манипуляции неотъемлемыми свойствами антиген-специфического иммуноглобулина (например, антитела), которые являются недоступными для связывающих молекул не на основе иммуноглобулина. Хорошим примером стратегий, благоприятных, например, для молекул на основе антител, в сравнении с этими альтернативами является in vivo модуляция аффинности антител в отношении его мишени посредством созревания аффинности, которая имеет преимущество в сравнении с соматической гипермутацией генов иммуноглобулинов, для получения антител увеличивающейся аффинности по мере прогрессирования иммунной реакции. Кроме того, были разработаны рекомбинантные технологии для изменения структуры иммуноглобулинов и областей и доменов иммуноглобулинов. Так, могут быть получены полипептиды, полученные из антител, которые проявляют измененную аффинность в отношении конкретного антигена, и в данной области известны ряд протоколов очистки и скринингов-мониторингов для идентификации и очистки или выделения этих полипептидов. С использованием этих известных способов могут быть получены полипептиды, содержащие полученные из антител связывающие домены, которые обнаруживают уменьшенную или увеличенную аффинность в отношении антигена. Стратегии для генерирования вариантов полипептидов, проявляющих измененную аффинность, включают применение сайт-специфического или неспецифического мутагенеза ДНК, кодирующей это антитело, для изменения аминокислот, присутствующих в этом белке, с последующей стадией скрининга, предназначенной для извлечения вариантов антител, которые обнаруживают желаемое изменение, например, увеличенную или уменьшенную аффинность относительно немодифицированного исходного или ссылочного антитела.
Аминокислотными остатками, наиболее часто являющимися мишенями в мутагенных стратегиях для изменения аффинности, являются аминокислотные остатки в определяющей комплементарность области (CDR) или гипервариабельной области вариабельных областей легкой или тяжелой цепи антитела. Эти области содержат остатки, которые физико-химически взаимодействуют с антигеном, а также другие аминокислоты, которые влияют на пространственное размещение этих остатков. Однако, было показано, что аминокислоты в каркасных областях этих вариабельных доменов вне CDR-областей вносят существенный вклад в антигенсвязывающие свойства антитела и могут быть мишенями для манипуляции такими свойствами. См. Hudson, PJ. Curr. Opin. Biotech., 9: 395-402 (1999) и ссылки в этой работе.
Меньшие и более эффективно скринируемые библиотеки вариантов антител могут быть получены ограничением неспецифического или сайт-направленного мутагенеза сайтами в CDR, которые соответствуют зонам, склонным к «гипермутации» во время процесса соматического созревания аффинности. См. Chowdhury, et al., Nature Biotech., 17: 568-572 (1999) и ссылки в этой работе. Типы элементов ДНК, которые, как известно, определяют сайты гипермутации таким образом, включают прямые и инвертированные повторы, определенные консенсусные последовательности, вторичные структуры и палиндромы. Консенсусные последовательности ДНК включают последовательность из четырех оснований Пурин-G-Пиримидин-A/T (т.е. A или G - G - C или T - A или T) и кодон серина AGY (где Y может быть C или T).
Таким образом, другим аспектом этого изобретения является ряд мутагенных стратегий для модификации аффинности антитела в отношении его мишени. Эти стратегии включают мутагенез всей вариабельной области тяжелой и/или легкой цепи, мутагенез только CDR-областей, мутагенез консенсусных сайтов гипермутации в CDR, мутагенез каркасных областей или любую комбинацию этих подходов («мутагенез» в этом контексте может быть неспецифическим или сайт-направленным). Определенная трансдифференцировка CDR-областей и идентификация остатков, содержащих сайт связывания антитела, могут выполняться посредством выяснения структуры рассматриваемого антитела и комплекса антитело:лиганд, при помощи способов, известных специалистам в данной области, таких как рентгеновская кристаллография. Различные способы на основе анализа и характеристики таких кристаллических структур антител известны специалистам в данной области и могут быть использованы для приближенного определения CDR-областей. Примеры таких обычно используемых способов включают определение Кабата, Хотиа, AbM и контактные определения.
Определение Кабата основывается на вариабельности последовательности и является наиболее часто используемым определением для предсказания CDR-областей. Johnson, et al., Nucleic Acids Research, 28: 214-8 (2000). Определение Хотиа основывается на местоположении областей структурных петель. (Chothia et al., J. Mol. Biol, 196: 901-17 [1986]; Chothia et al., Nature, 342: 877-83 [1989].) AbM-определение является компромиссом между определениями Кабата и Хотиа. AbM является интегральным комплектом программ для моделирования структуры антитела, производимым Oxford Molecular Group (Martin , et al., Proc. Natl. Acad. Sci (USA) 86:9268-9272 [1989]; Rees, et al, ABMTM, a computer program for modeling variable regions of antibodies, Oxford, UK; Oxford Molecular, Ltd.). Комплект программ AbM моделирует третичную структуру антитела из первичной последовательности с использованием комбинации баз знаний и способов ab initio. Недавно было введено дополнительное определение, известное как контактное определение. См. MacCallum et al., J. Mol. Biol, 5:732-45 (1996). Это определение основано на анализе доступных комплексных кристаллических структур.
Для удобства, CDR-домены в тяжелой цепи обычно называют H1, H2 и H3 и нумеруют последовательно в порядке перемещения от амино-конца к карбокси-концу. CDR-области в легкой цепи обычно называют L1, L2 и L3 и обычно нумеруют последовательно от амино-конца к карбокси-концу.
CDR-H1 имеет длину приблизительно 10 - 12 остатков и обычно начинается после 4 остатков после Cys согласно определениям Хотиа и AbM или обычно на 5 остатков позднее согласно определению Кабата. За этим H1 обычно следует Trp, обычно Trp-Val, но также Trp-Ile или Trp-Ala. Длина Н1 составляет приблизительно 10 - 12 остатков согласно определению AbM, тогда как определение Хотиа исключает последние 4 остатка.
CDR-H2 обычно начинается после 15 остатков после конца Н1 согласно определениям Кабата и AbM. Остатками, предшествующими H2, обычно являются Leu-Glu-Trp-Ile-Gly, но имеется ряд вариаций. За H2 обычно следует аминокислотная последовательность Lys/Arg-Leu/Ile/Val/Phe/Thr/Ala-Thr/Ser/Ile/Ala. Согласно определению Кабата, длина H2 равна приблизительно 16 - 19 остаткам, причем определение AbM предсказывает, что эта длина равна обычно приблизительно 9 - 12 остаткам.
CDR-H3 обычно начинается после 33 остатков после конца H2 и обычно ему предшествует аминокислотная последовательность Cys-Ala-Arg. За H3 обычно следует аминокислота Gly. Длина H3 находится в диапазоне 3-25 остатков.
CDR-L1 обычно начинается приблизительно при остатке 24 и за ним обычно будет следовать Cys. Остатком после CDR-L1 всегда является Trp и будет обычно начинаться одна из следующих последовательностей: Trp-Tyr-Gln, Trp-Leu-Gln, Trp-Phe-Gln, или Trp-Tyr-Leu. Длина CDR-L1 равна приблизительно 10-17 остаткам.
CDR-L2 начинается обычно приблизительно после 16 остатков после конца L1. Затем обычно следуют остатки Ile-Tyr, Val-Tyr, Ile-Lys или Ile-Phe. Длина CDR-L2 равна приблизительно 7 остаткам.
CDR-L3 обычно начинается после 33 остатков после конца L2 и обычно следует за Cys. За L3 обычно следует аминокислотная последовательность Phe-Gly-XXX-GIy. Длина L3 равна приблизительно 7-11 остаткам.
Различные способы модификации антител были описаны в данной области, в том числе, например, способы получения гуманизированных антител, в которых последовательность каркаса вариабельной области тяжелой цепи гуманизированизированного иммуноглобулина является на 65%-95% идентичной последовательности каркаса вариабельной области тяжелой цепи донорского иммуноглобулина. Каждая цепь гуманизированного иммуноглобулина будет обычно содержать, наряду с CDR, аминокислоты из каркаса донорского иммуноглобулина, которые, например, способны взаимодействовать с CDR для осуществления связывающей аффинности, например, с одной или несколькими аминокислотами, которые являются непосредственно смежными с CDR в донорском иммуноглобулине или в пределах приблизительно 3 ангстрем, согласно предсказанию молекулярного моделирования. Тяжелая и легкая цепи, каждая, могут быть сконструированы с использованием любого одного или всех различных критериев положения. При объединении в интактное антитело, гуманизированные иммуноглобулины являются по существу неиммуногенными людей и сохраняют по существу ту же самую аффинность, что и донорский иммуноглобулин в отношении антигена, такого как белок или другое соединение, содержащее эпитоп.
В одном примере, описаны способы получения антител и фрагментов антител, которые имеют специфичность связывания, сходную со специфичностью связывания исходного антитела, но которые имеют увеличенные характеристики человека. Гуманизированные антитела получают перетасовкой цепей с использованием, например, технологии фагового дисплея и полипептида, содержащего вариабельную область тяжелой и легкой цепи антитела не человека, специфического в отношении представляющего интерес антигена, который затем объединяют со спектром вариабельных областей комплементарных (легкой или тяжелой) цепей человека. Гибридные спаривания, которые являются специфическими в отношении представляющего интерес антигена, идентифицируют и цепи человека из отобранных спариваний объединяют со спектром комплементарных вариабельных доменов (тяжелых или легких). В другом варианте осуществления, компонент CDR из антитела не человека объединяют со спектром частей компонентов CDR из антител человека. Из полученной библиотеки димеров полипептидов антител, отбирают гибриды, и они могут быть использованы во второй стадии перетасовки гуманизации; альтернативно, эту вторую стадию исключают, если этот гибрид является гибридом с достаточным характером иммуноглобулина человека, чтобы иметь терапевтическую ценность. Способы модификации увеличения характера антитела человека (в гуманизированном антителе) известны в данной области.
Другим примером является способ получения гуманизированных антител заменой аминокислотной последовательностью CDR соответствующей аминокислотной последовательности CDR человека и/или заменой аминокислотной последовательностью FR соответствующих аминокислотных последовательностей FR человека.
Еще один пример обеспечивает способы идентификации аминокислотных остатков вариабельного домена антитела, которые могут быть модифицированы без уменьшения природной аффинности антигенсвязывающего домена при уменьшении его иммуногенности в отношении гетерологичного вида, и способы получения этих модифицированных вариабельных областей антитела, применимых для введения в гетерологичный вид.
Модификация иммуноглобулина, такого как антитело, любым из способов, известных в данной области, предназначена для увеличенной или уменьшенной аффинности связывания в отношении антигена и/или уменьшения иммуногенности этого антитела в реципиенте и/или для модуляции уровней эффекторной активности. В одном подходе, гуманизированные антитела могут быть модифицированы для элиминации сайтов гликозилирования для увеличения аффинности этого антитела к его соответствующему антигену (Co, et al., Mol. Immunol. 30:1361-1367 [1993]). Способы, такие как “реконструирование", “гиперхимеризация” и “облицовка/переделка поверхности”, давали гуманизированные антитела с более высоким терапевтическим потенциалом. Vaswami, et al., Annals of Allergy, Asthma, & Immunol 81:105 (1998); Roguska, et al., Prot. Engineer. 9:895-904 (1996)]. См. также Патент США № 6072035, который описывает способы реконструирования антител. Хотя эти способы уменьшают иммуногенность антитела уменьшением количества чужеродных остатков, они не предотвращают антиидиотипические и антиаллотипические реакции после повторяемого введения этих антител. Альтернативы этим способам для уменьшения иммуногенности описаны в Gilliland et al., J. Immunol. 62(6):3663-71 (1999).
Во многих случаях, гуманизация антител приводит к потере антигенсвязывающей способности. Таким образом, предпочтительно «обратно мутировать» гуманизированное антитело для включения одного или нескольких аминокислотных остатков, обнаруживаемых в исходном (наиболее часто антителе грызуна) антителе в попытке восстановления связывающей аффинности этого антитела. См., например, Saldanha et al, Mol Immunol. 36:709-19 (1999).
Было показано, что гликозилирование иммуноглобулинов влияет на эффекторные функции, структурную стабильность и скорость секреции из антителопродуцирующих клеток (см. статью Leatherbarrow et al., Mol. Immunol. 22:407 (1985), включенную здесь в качестве ссылки). Углеводные группы, ответственные за эти свойства, обычно присоединены к константным областям антител. Например, гликозилирование IgG при Asn 297 в CН2-домене способствует полной способности этого IgG активировать комплемент-зависимый цитолиз (Tao et al., J. Immunol. 143:2595 (1989)). Гликозилирование IgM при Asn 402 в CH3-домене, способствует, например, правильной сборке и цитолитической активности этого антитела (Muraoka et al., J. Immunol. 142:695 (1989)). Удаление сайтов гликозилирования в положениях 162 и 419 в CH1- и CН3-доменах антитела IgA приводит к внутриклеточной деградации и по меньшей мере 90% ингибированию секреции (Taylor et al., Wall, Mol. Cell. Biol. 8:4197 (1988)). Таким образом, молекулы этого изобретения включают мутационно измененные иммуноглобулины, проявляющие измененные картины гликозилирования, мутацией специфических остатков, например, в константной субобласти, для изменения эффекторной функции. См. работы Co et al., Mol. Immunol. 30:1361-1367 (1993), Jacquemon et al., J. Thromb. Haemost. 4:1047-1055 (2006), Schuster et al., Cancer Res. 65:7934-7941 (2005) и Warnock et al., Biotechnol Bioeng. 92:831-842 (2005), каждая из которых включена здесь в качестве ссылки.
Это изобретение включает также мультивалентные связывающие молекулы, имеющие по меньшей мере один связывающий домен, который по меньшей мере на 80%, предпочтительно 90% или 95% или 99% идентичен по последовательности известной последовательности вариабельной области иммуноглобулина и который имеет по меньшей мере один остаток, который отличается от такой вариабельной области иммуноглобулина, где измененный остаток добавляет сайт гликозилирования, изменения местоположения одного или нескольких сайта (сайтов) гликозилирования или предпочтительно удаляет сайт гликозилирования относительно вариабельной области иммуноглобулина. В некоторых вариантах осуществления, это изменение удаляет N-связанный сайт гликозилирования в каркасе вариабельной области иммуноглобулина или удаляет N-связанный сайт гликозилирования, который встречается в каркасе вариабельной области тяжелой цепи иммуноглобулина в области, охватывающим приблизительно аминокислотный остаток 65 - приблизительно аминокислотный остаток 85, с использованием конвенции нумерации Co et al., J. Immunol. 148: 1149, (1992).
Любой способ, известный в данной области, обсуждается для получения мультивалентных связывающих молекул, проявляющих измененные распределения гликозилирования относительно ссылочной последовательности иммуноглобулина. Например, любой из различных генетических способов может быть использован для изменения одного или нескольких конкретных остатков. Альтернативно, клетки-хозяева, используемые для получения, могут быть сконструированы для получения измененного распределения гликозилирования. Например, один способ, известный в данной области, обеспечивает измененное гликозилирование в форме двурассеченных, нефукозилированных вариантов, которые увеличивают ADCC. Эти варианты происходят из экспрессии в клетке-хозяине, содержащей олигосахаридмодифицирующий фермент. Альтернативно, предполагается, что Potelligent-технология BioWa/Kyowa Hakko уменьшает содержание фукозы гликозилированных молекул по этому изобретению. В одном известном способе, обеспечена клетка-хозяин СНО для рекомбинантного получения иммуноглобулина, которая модифицирует распределение гликозилирования Fc-области иммуноглобулина продуцированием GDP-фукозы. Эта технология доступна для модификации распределения гликозилирования константной субобласти мультивалентной связывающей молекулы согласно этому изобретению.
Кроме модификации связывающих свойств связывающих белков, таких как связывающие домены иммуноглобулинов, и, кроме таких модификаций, как гуманизация, это изобретение включает модуляцию эффекторной функции изменением или мутацией остатков, способствующих эффекторной функции, такой как эффекторная функция константной субобласти. Эти модификации могут выполняться с использованием любого способа, известного в данной области, такого как подход, описанный в работе Presta et al., Biochem. Soc. Trans. 30:487-490 (2001), включенной здесь в качестве ссылки. Примерные подходы могли бы включать использование протокола, описанного в Presta et al., для модификации специфических остатков, о которых известно, что они влияют на связывание в одном или нескольких константных субобластях, соответствующих FcγRI, FcγRII, FcγRIII, FCαR и FcεR.
В другом подходе, технология Xencor XmAb доступна для конструирования константных субобластей, соответствующих Fc-доменам, для усиления эффекторной функции уничтожения клеток. См. статью Lazar et al., Proc. Natl. Acad. Sci. (USA) 103(11):4005-4010 (2006), включенную здесь в качестве ссылки. С использованием этого подхода можно, например, генерировать константные субобласти, оптимизированные в отношении FcγR-специфичности и связывания, усиливая посредством этого эффекторную функцию уничтожения клеток.
Получение мультивалентных связывающих белков с эффекторной функцией
Различные системы экспрессирующий вектор/хозяин могут быть использованы для содержания и экспрессии мультивалентного связывающего белка (с эффекторной функцией) этого изобретения. Эти системы включают, но не ограничиваются ими, микроорганизмы, такие как бактерии, трансформированные рекомбинантным бактериофагом, плазмидой, космидой или другими экспрессирующими векторами; дрожжи, трансформированные дрожжевыми экспрессирующими или челночными векторами; системы клеток насекомых инфицированные вирусными экспрессирующими векторами (например, бациловирусами), системы клеток растений трансфицированные вирусными экспрессирующими векторами (например, вирусом мозаичной болезни цветной капусты, СaMV; вирусом мозаики табака, TMV) или трансформированные бактериальными экспрессирующими векторами (например, Ti-плазмидой или плазмидой pBR322); или системы клеток животных. Клетки млекопитающих, которые применимы в получениях рекомбинантного мультивалентного связывающего белка, включают, но не ограничиваются ими, клетки VERO, клетки HeLa, клеточные линии яичника Китайского хомячка (CHO), клетки COS (такие как COS-7), клетки W138, BHK, HepG2, 3T3, RIN, MDCK, A549, PC12, K562 и HEK293. Примеры протоколов для рекомбинантной экспрессии этого мультивалентного связывающего белка описаны здесь ниже.
Экспрессирующий вектор может содержать транскрипционную единицу, содержащую упорядоченную структуру (1) генетического элемента или генетических элементов, имеющих регуляторную роль в экспрессии генов, например, промотор, энхансер или фактор-специфический сайт связывания, (2) структурную последовательность или последовательность, которая кодирует связывающий агент, которая транскрибируется в мРНК и транслируется в белок, и (3) подходящие последовательности инициации и терминации транскрипции. Структурные единицы, предназначенные для применения в дрожжевых или эукариотических системах экспрессии, предпочтительно включают лидерную последовательность, делающую возможной внеклеточную секрецию транслированного белка клеткой-хозяином. Альтернативно, когда рекомбинантный мультивалентный связывающий белок экспрессируется без лидерной или транспортной последовательности, он может включать аминоконцевой остаток метионина. Этот остаток может быть или может не быть затем отщеплен от этого экспрессированного рекомбинантного белка с обеспечением конечного мультивалентного связывающего белка.
Например, эти мультивалентные связывающие белки могут быть рекомбинантно экспрессированы в дрожжах с использованием коммерчески доступной системы экспрессии, например, Системы Экспрессии Pichia (Invitrogen, San Diego, CA), в соответствии с инструкциями изготовителя. Эта система основывается также на пре-про-альфа-последовательности для управления секрецией, но транскрипция этого инсерта запускается промотором алкогольоксидазы (AOXl) после индукции метанолом. Этот секретированный мультивалентный связывающий пептид может быть очищен из среды для выращивания дрожжей, например, способами, используемыми для очистки этого пептида из супернатантов бактериальных клеток и клеток млекопитающих.
Альтернативно, кДНК, кодирующая мультивалентный связывающий пептид, может быть клонирована в бакуловирусный экспрессирующий вектор pVL1393 (PharMingen, San Diego, CA). Этот вектор может быть использован в соответствии с инструкциями изготовителя (PharMingen) для инфицирования клеток Spodoptera frugiperda в не содержащей белка среде SF9 и для продуцирования рекомбинантного белка. Этот мультивалентный связывающий белок может быть очищен и концентрирован из этой среды с использованием колонки гепарин-Сефарозы (Pharmacia, Piscataway, NJ). Системы насекомых для экспрессии белка, такие как система SF9, хорошо известны специалистам в данной области. В одной такой системе, вирус ядерного полиэдроза Autographa californica (AcNPV) может быть использован в качестве вектора для экспрессии чужеродных генов в клетках Spodoptera frugiperda или в личинках Trichoplusia. Кодирующая последовательность этого мультивалентного связывающего пептида может быть клонирована в заменимую область вируса, такого как ген полиэдрина, и помещена под контроль промотора полиэдрина. Успешная инсерция мультивалентного связывающего пептида будет делать ген полиэдрина неактивным и продуцировать рекомбинантный вирус, лишенный белка оболочки. Эти рекомбинантные вирусы могут быть использованы для инфицирования клеток S. frugiperda или личинок Trichoplusia, в которых пептид экспрессируется (Smith et al, J Virol 46: 584, 1983; Engelhard et al, Proc Nat Acad Sci (USA) 91: 3224-7, 1994).
В другом примере, ДНК-последовательность, кодирующая мультивалентный связывающий пептид, может быть амплифицирована при помощи ПЦР и клонирована в подходящий вектор, например, pGEX-3X (Pharmacia, Piscataway, NJ). Вектор pGEX сконструирован для продуцирования слитого белка, содержащего глутатион-S-трансферазу (GST), кодируемую этим вектором, и мультивалентного связывающего белка, кодируемого ДНК-фрагментом, встроенным в клонирующий сайт этого вектора. Праймеры для этой ПЦР могут быть сконструированы таким образом, что они включают, например, подходящий сайт расщепления. Если слитый мультивалентный связывающий белок используется только для облегчения экспрессии или является в остальном нежелательным в качестве присоединения к представляющему интерес пептиду, то этот слитый рекомбинантный мультивалентный связывающий белок может быть отщеплен от GST-части этого слитого белка. Конструкцию pGEX-3X/мультивалентный связывающий белок трансформируют в клетки E. coli XL-I Blue (Stratagene, La Jolla CA) и индивидуальные трансформанты выделяют и выращивают. Плазмидную ДНК из индивидуальных трансформантов очищают, и она может быть секвенирована с использованием автоматизированного секвенатора для подтверждения присутствия желаемого инсерта нуклеиновой кислоты, кодирующего мультивалентный связывающий белок в правильной ориентации.
Слитый мультивалентный связывающий белок, который может быть получен в виде нерастворимого тельца включения в бактериях, может быть очищен следующим образом. Клетки-хозяева могут быть собраны центрифугированием; промыты в 0,15 M NaCl, 10 мМ Трисе, pH 8, 1 мМ ЭДТА и обработаны 0,1 мг/мл лизоцима (Sigma Chemical Co.) в течение 15 минут при комнатной температуре. Лизат может быть осветлен обработкой ультразвуком и остаток клеток может быть осажден центрифугированием в течение 10 минут при 12000g. Этот содержащий слитый мультивалентный связывающий белок осадок может быть ресуспендирован в 50 мМ Трисе, pH 8, и 10 мМ ЭДТА, нанесен на 50% глицерин и центрифугирован в течение 30 минут при 6000g. Этот осадок может быть ресуспендирован в стандартном забуференном фосфатом солевом растворе (ЗФР), не содержащем Mg++ и Ca++. Слитый мультивалентный связывающий белок может быть дополнительно очищен фракционированием ресуспендированного осадка в денатурирующем ДСН-полиакриламидном геле (Sambrook et al.). Этот гель пропитывают в 0,4 M KCl для визуализации этого белка, который вырезают и электроэлюируют в рабочем буфере для геля, не содержащем ДСН. Если слитый белок GST/мультивалентный связывающий пептид продуцируется в бактериях в виде растворимого белка, он может быть очищен с использованием Модуля Очистки GST (Pharmacia Biotech).
Этот мультивалентный связывающий белок предпочтительно подвергают расщеплению для отщепления GST от мультивалентного связывающего пептида этого изобретения. Реакционная смесь расщепления (20-40 мкг слитого белка, 20-30 единиц тромбина человека (4000 Е/мг (Sigma) в 0,5 мл ЗФР) может быть инкубирована 16-48 часов при комнатной температуре и нанесена на денатурирующий гель ДСН-ПААГ для электрофореза для фракционирования продуктов реакции. Этот гель может быть пропитан в 0,4 M KCl для визуализации белковых полос. Идентичность белковой полосы, соответствующей ожидаемой молекулярной массе мультивалентного связывающего пептида, может быть подтверждена аминокислотным анализом с использованием автоматизированного секвенатора (Applied Biosystems Model 473 A, Foster City, CA). Альтернативно, идентичность может быть подтверждена выполнением ВЖХ и/или масс-спектрометрии этих пептидов.
Альтернативно, ДНК-последовательность, кодирующая мультивалентный связывающий пептид, может быть клонирована в плазмиду, содержащую желаемый промотор и, необязательно, лидерную последовательность (см., например, Better et al., Science, 240:1041-43, 1988). Последовательность этой конструкции может быть подтверждена автоматизированным секвенированием. Затем эту плазмиду трансформируют в подходящий штамм E. coli, например, штамм MC 1061, с использованием стандартных процедур, использующих CaCl2-инкубацию и обработку тепловым шоком бактерий (Sambrook et al.). Трансформированные бактерии могут выращиваться в LB-среде, дополненной карбенициллином, или другой подходящей формой отбора, известной в данной области, и продуцирование этого экспрессируемого белка может быть индуцировано выращиванием в подходящей среде. Если присутствует лидерная последовательность, она может влиять на секрецию мультивалентного связывающего пептида и отщепляться во время секреции. Секретированный рекомбинантный белок может быть очищен из бактериальной культуральной среды описанными здесь ниже способами.
Системы хозяев-млекопитающих для экспрессии этого рекомбинантного белка хорошо известны специалистам в данной области и являются предпочтительными системами. Штаммы клеток-хозяев могут быть отобраны на конкретную способность процессировать экспрессированный белок или продуцировать определенные посттрансляционные модификации, которые будут применимы в обеспечении активности белка. Такие модификации этого полипептида включают, но не ограничиваются ими, ацетилирование, карбоксилирование, гликозилирование, фосфорилирование, липидирование и ацилирование. Различные клетки-хозяева, такие как CHO, HeLa, MDCK, 293, WI38 и т.п., имеют специфический клеточный аппарат и характерные механизмы для таких посттрансляционных активностей и могут быть выбраны для гарантии правильной модификации и правильного процессинга этого чужеродного белка.
Предпочтительно, трансформированные клетки должны использоваться для долгосрочного, высокопроизводительного продуцирования белка и должна быть желательной стабильная экспрессия. После трансформации таких клеток векторами, которые предпочтительно содержат по меньшей мере один селектируемый маркер вместе с желаемой экспрессионной кассетой, эти клетки выращивают в течение 1-2 дней в обогащенной среде перед переключением на селективную среду. Селектируемый маркер конструируют для придания устойчивости к отбору, и его присутствие позволяет выращивание и извлечение клеток, которые успешно экспрессируют чужеродный белок. Резистентные скопления стабильно трансформированных клеток могут быть подвергнуты пролиферации с использованием способов культуры ткани, подходящих для этих клеток.
Могут быть использованы ряд систем отбора для извлечения клеток, которые были трансформированы для продуцирования рекомбинантного белка. Такие системы отбора включают, но не ограничиваются ими, гены тимидинкиназы HSV, гипоксантин-гуанинфосфорибозилтрансферазы и аденинфосфорибозилтрансферазы, в tk-, hgprt- или aprt-клетках, соответственно. Может быть использована также резистентность против антиметаболитов в качестве основы для отбора на dhfr, который придает устойчивость к метотрексату; gpt, который придает устойчивость к микофеноловой кислоте; neo, который придает устойчивость к аминогликозиду G418 и придает устойчиваость к хлорсульфурону; и hygro, который придает устойчивость к гигромицину. Дополнительные селектируемые гены, которые могут быть применимы, включают trpB, который позволяет клеткам использовать индол вместо триптофана, или hisD, который позволяет клеткам использовать гистинол вместо гистидина. Маркеры, которые дают визуальное указание в отношении идентификации трансформантов, включают антоцианины, β-глюкуронидазу и ее субстрат, GUS, и люциферазу и ее субстрат, люциферин.
Очистка белков
Способы очистки белков хорошо известны специалистам в данной области. Эти способы включают, на одном уровне, грубое фракционирование полипептидной и неполипептидной фракций. После отделения мультивалентного связывающего полипептида по меньшей мере от одного другого белка, представляющий интерес полипептид очищают, но часто является желательной дополнительная очистка с использованием хроматографических и электрофоретических способов для получения частичной или полной очистки (или очистки до гомогенности). Аналитическими способами, особенно подходящими для получения чистого мультивалентного связывающего пептида, являются ионообменная хроматография, вытеснительная хроматография; электрофорез в полиакриламидном геле и изоэлектрическое фокусирование. Особенно эффективными способами очистки пептидов являются жидкостная экспресс-хроматография белков и ВЖХ.
Некоторые аспекты данного изобретения относятся к очистке и, в конкретных вариантах осуществления, к существенной очистке, кодируемого мультивалентного связывающего белка или пептида. Термин «очищенный мультивалентный связывающий белок или пептид» относится в данном контексте к композиции, которая может быть отделена от других компонентов, где мультивалентный связывающий белок или пептид очищен до любой степени относительно его природно получаемого состояния. Таким образом, очищенным мультивалентным связывающим белком или пептидом называют также мультивалентный связывающий белок или пептид, не содержащий среды, в которой он может природно встречаться.
Обычно, «очищенной» будет называться композиция мультивалентного связывающего белка, которая была подвергнута фракционированию для удаления различных других компонентов и которая по существу сохраняет ее экспрессируемую биологическую активность. При использовании термина «по существу очищенная» этот термин относится к композиции мультивалентного связывающего белка, в которой этот мультивалентный связывающий белок или пептид образует основной компонент этой композиции, например, составляет приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 90%, приблизительно 95%, приблизительно 99% или более этого белка, в расчете на массу, в этой композиции.
Различные способы количественного определения степени очистки мультивалентного связывающего белка будут известны специалистам в данной области в свете данного описания. Они включают, например, определение удельной связывающей активности активной фракции или оценку количества мультивалентных связывающих полипептидов во фракции анализа при помощи электрофореза в ДСН-ПААГ. Предпочтительным способом оценки чистоты фракции мультивалентного связывающего белка является расчет связывающей активности этой фракции для сравнения ее со связывающей активностью исходного экстракта и, следовательно, расчет степени очистки, оцениваемой здесь «-кратным числом очистки». Фактические единицы, используемые для представления величины связывающей активности, будут, конечно, зависеть от конкретного способа анализа, выбранного для прослеживания очистки, и от того, проявляет или не проявляет экспрессированный мультивалентный связывающий белок или пептид детектируемую связывающую активность.
Различные способы, подходящие для применения в очистке мультивалентного связывающего белка, хорошо известны специалистам в данной области. Они включают, например, осаждение сульфатом аммония, ПЭГ, антителами и т.п. или денатурацией нагреванием с последующим центрифугированием; стадии хроматографии, такие как ионообменная, гель-фильтрационная, обращено-фазовая, гидроксилапатитная и аффинная хроматография; изоэлектрическое фокусирование; гель-электрофорез; и комбинации этих и других способов. Как обычно известно в данной области, считается, что порядок проведения различных стадий очистки может быть изменен или что некоторые стадии могут быть опущены и все еще приводить к подходящему способу получения по существу очишенного мультивалентного связывающего белка.
Не существует общего требования, что этот мультивалентный связывающий белок всегда должен быть обеспечен в его наиболее чистом состоянии. Действительно, предполагается, что менее существенно очищенные мультивалентные связывающие белки будут иметь применение в некоторых вариантах осуществления. Частичная очистка может выполняться с использованием меньшего числа стадий в комбинации или с использованием отличающихся форм одной и той же общей схемы очистки. Например, понятно, что катионообменная хроматография, выполняемая с использованием прибора ВЖХ, будет обычно приводить к большей очистке, чем тот же самый способ, использующий систему хроматографии низкого давления. Способы, обнаруживающие более низкую степень очистки, могут иметь преимущества в общем извлечении мультивалентного связывающего белкового продукта или в сохранении связывающей активности экспрессируемого мультивалентного связывающего белка.
Известно, что миграция полипептида может варьировать, иногда значительно, с различными условиями электрофореза в ДСН-ПААГ SDS/PAGE (Capaldi et al., Biochem. Biophys. Res. Comm., 76:425, 1977). Таким образом, понятно, что при отличающихся условиях электрофореза средние молекулярные массы очищенных или частично очищенных продуктов экспрессии мультивалентного связывающего белка могут различаться.
Эффекторные клетки
Эффекторные клетки для индукции, например, ADCC, ADCP (антителозависимого клеточного фагоцитоза) и т.п., против клетки-мишени включают лейкоциты, макрофаги, моноциты, активированные нейтрофилы, активированные природные клетки-киллеры (НК) и эозинофилы человека. Эффекторные клетки экспрессируют FcαR (CD89), FcγRI, FcγRII, FcγRIII и/или FcεR1 и включают, например, моноциты и активированные нейтрофилы. Например, было обнаружено, что экспрессиия FcγRI является регулируемой повышающим образом интерфероном гамма (IFN-γ). Эта увеличенная экспрессия увеличивает цитотоксическую активность моноцитов и нейтрофилов против клеток-мишеней. Таким образом, эффекторные клетки могут быть активированы IFN-γ или другими цитокинами (например, TNF-α или β, колониестимулирующим фактором, IL-2) для увеличения присутствия FcγRI на поверхности этих клеток перед контактированием с мультивалентным белком этого изобретения.
Мультивалентные белки по изобретению обеспечивают эффекторную функцию антител, такую как антителозависимая клеточно-опосредованная цитотоксичность (ADCC), для применения против клетки-мишени. Мультивалентные белки с эффекторной функцией вводят отдельно, как описано здесь, или после связывания с эффекторной клеткой, с образованием посредством этого «активированной эффекторной клетки». «Активированная эффекторная клетка» является эффекторной клеткой, определенной здесь, связанной с мультивалентным белком с эффекторной функцией, также определенным здесь, так что эта эффекторная клетка эффективно обеспечивается нацеливающей функцией перед введением.
Активированные эффекторные клетки вводят in vivo в виде суспензии клеток в физиологически приемлемом растворе. Количество вводимых клеток имеет порядок 108-109, но будет варьировать в зависимости от терапевтической цели. Обычно, это количество должно быть достаточным для получения локализации эффекторной клетки и обеспечения желаемого уровня функции эффекторной клетки в этом месте действия, такой как уничтожение клеток посредством ADCC и/или фагоцитоза. Термин физиологически приемлемый раствор, в данном контексте, включает любой раствор-носитель, который стабилизирует нацеленные эффекторные клетки для введения in vivo, в том числе, например, солевой и водный буферные растворы, растворители, антибактериальные и противогрибковые агенты, изотонические агенты и т.п.
Таким образом, другой аспект этого изобретения обеспечивает способ индукции эффекторной функции специфического антитела, такой как ADCC, против клетки в субъекте, предусматривающий введение этому субъекту мультивалентного белка (или кодирующей его нуклеиновой кислоты) или активированной эффекторной клетки в физиологически приемлемой среде. Способы введения могут варьировать и подходящие способы введения будут определяться специалистами в данной области на основе учета специфических для конкретного случая переменных и рутинных процедур, известных в данной области.
Бесклеточные эффекты
Бесклеточные эффекты также обеспечены мультивалентными молекулами этого изобретения, например, обеспечением CDC-функциональности. Система комплемента является биохимическим каскадом иммунной системы, который способствует выведению чужеродного материала, такого как патогенны, из организма. Она получена из многих малых белков плазмы, которые работают вместе в индукции цитолиза клетки-мишени разрыванием плазматической мембраны клетки-мишени. Система комплемента состоит из более 35 растворимых и связанных клеткой белков, 12 из которых непосредственно участвуют в этих путях комплемента. Эти белки являются активными в трех биохимических путях, приводящих к активации системы комплемента: классическом пути комплемента, альтернативном пути комплемента и маннозусвязывающем лектиновом пути. Антитела, в частности, класса IgG1, могут также «фиксировать» (связывать) комплемент. Подробное понимание этих путей было достигнуто в данной области и не будет повторяться здесь, но стоит отметить, что комплемент-зависимая цитотоксичность не зависит от взаимодействия связывающей молекулы с клеткой, например, В-клеткой, иммунной системы. Также стоит отметить, что система комплемента регулируется регулирующими комплемент белками. Эти белки присутствуют в более высоких концентрациях в плазме крови, чем белки комплемента. Регулирующие комплемент белки найдены на поверхностях собственных клеток и обеспечивают механизм для предотвращения нацеливания белков комплемента на собственные клетки. Ожидается, что система комплемента играет роль в нескольких заболеваниях с иммунным компонентом, например, синдроме Барракера-Симонса, болезни Альцгеймера, астме, системной красной волчанке, различных формах артрита, аутоиммунной болезни сердца и рассеянном склерозе. Недостаточности в этом терминальном пути вызывают предрасположение индивидуума как к аутоиммунному заболеванию, так и к инфекциям (в частности, менингиту).
Заболевания, нарушения и состояния
Это изобретение обеспечивает мультивалентные связывающие белки с эффекторной функцией и их варианты и производные, которые связываются с одним или несколькими партнерами связывания, и эти события связывания применимы для лечения, предупреждения или уменьшения симптома, ассоциированного с заболеванием, нарушением или патологическим состоянием, в частности, поражающим людей. В предпочтительных вариантах осуществления этих способов, мультивалентный (и мультиспецифический) связывающий белок с эффекторной функцией ассоциирует клетку, несущую мишень, такую как опухолеспецифический маркер клеточной поверхности, с эффекторной клеткой, такой как клетка иммунной системы, проявляющая цитотоксическую активность. В других вариантах осуществления, этот мультиспецифический, мультивалентный связывающий белок с эффекторной функцией специфически связывает два разных маркера клеточной поверхности, специфических для заболевания, нарушения или состояния, для гарантии того, что точная мишень ассоциируется с эффекторной клеткой, такой как цитотоксическая клетка иммунной системы. Дополнительно, мультивалентный связывающий белок с эффекторной функцией может быть использован для индукции или увеличения антигенной активности или для ингибирования антигенной активности. Мультивалентные связывающие белки с эффекторной функцией пригодны также для комбинированных терапий и паллиативных схем лечения.
В одном аспекте, данное изобретение обеспечивает композиции и способы, применимые для лечения или предупреждения заболеваний и состояний, харктеризуемых аберрантными уровнями антигенной активности, ассоциированной с клеткой. Эти заболевания включают раковые заболевания и другие гиперпролиферативные состояния, такие как гиперплазия, псориаз, контактный дерматит, иммунологические нарушения и бесплодие. Большое разнообразие раковых заболеваний, в том числе солидных опухолей и лейкозов, поддаются лечению композициями и способами, описанными здесь. Типы рака, которые могут лечиться, включают, но не ограничиваются ими: аденокарциному молочной железы, предстательной железы и толстой кишки; все формы бронхогенной карциномы легкого; миелоид; гепатому; нейробластому; папиллому; апудому; хористому; бранхиому; синдром злокачественного карциноида; карциноидное сердечное заболевание; и карциному (например, базально-клеточную, базально-плоскоклеточную, Брауна-Пирса, внутрипротоковую, опухоль Эрлиха, krebs 2, карциному клеток Меркеля, слизеобразующую карциному, немелкоклеточный рак легкого, овсяноклеточный рак, папиллокарциному, фиброзный рак (скирр), бронхиолярный рак, бронхогенный рак, плоскоклеточный рак и переходноклеточный рак). Дополнительные типы рака, которые могут лечиться, включают: гистиоцитарные нарушения; лейкоз; злокачественный гистиоцитоз; болезнь Ходжкина; иммунопролиферативную малую; не-ходжкинскую лимфому; плазмацитому; ретикулоэндотелиоз; меланому; хондробластому; хондрому; хондросаркому; фиброму; фибросаркому; гигантоклеточные опухоли; гистиоцитому; липому; липосаркому; мезотелиому; миксому; миксосаркому; остеому; остеосаркому; хордому; краниофарингиому; дисгерминому; гамартому; мезенхимому; мезонефрому; миосаркому; амелобластому; цементому; одонтому; тератому; тимому; трофобластную опухоль. Кроме того, следующие типы рака также рассматриваются как поддающиеся лечению: аденома; холангиома;; холестеатома; циклиндрома; цистаденокарцинома; цистаденома; гранулезоклеточная опухоль; гинандробластома; гепатома; гидраденома; инсулома; опухоль из клеток Лейдига; папиллома; сертоликлеточная опухоль; текаклеточная опухоль (текома); лейомиома; лейосаркома; миобластома; миома; миосаркома; рабдомиома; рабдомиосаркома; эпендимома; ганглионеврома; глиома; медуллобластома; менингиома; неврилеммома; невробластома; невроэпителиома; неврофиброма; неврома; параганглиома; нехромаффинная параганглиома. Типы рака, которые могут лечиться, включают также, но не ограничиваются ими, ангиокератому; ангиолимфоидную гиперплазию с эозинофилией; склерозирующую ангиому; ангиоматоз; гломангиому; гемангиоэндотелиому; гемангиому; гемангиоперицитому; гемангиосаркому; лимфангиому; лимфангиомиому; лимфангиосаркому; пинеалому; карциносаркому; хондросаркому; листовидную цистосаркому; фибросаркому; гемангиосаркому; лейомиосаркому; лейкосаркому; липосаркому; лимфоангиосаркому; миосаркому; миксосаркому; рак яичника; рабдомиосаркому; саркому; неообразования; нейрофиброматоз и цервикальную дисплазию. Это изобретение дополнительно обеспечивает композиции и способы, применимые в лечении других состояний, в которых клетки становятся иммортализованными или гиперпролиферативными вследствие необычно высокой экспрессии антигена.
Примерами различных гиперпролиферативных нарушений, поддающихся лечению композициями и способами этого изобретения, являются В-клеточные раковые заболевания, в том числе В-клеточные лимфомы (такие как различные формы болезни Ходжкина, не-ходжкинская лимфома (NHL) или лимфомы центральной нервной системы), лейкозы (такие как острый лейкобластный лейкоз (ALL), хронический лимфоцитарный лейкоз (CLL), ретикулоэндотелиоз и хронический миелобластный лейкоз) и миеломы (такие как множественная миелома). Дополнительные В-клеточные раковые заболевания включают лимфоцитарную саркому с малыми лимфоцитами, В-клеточный пролимфоцитарный лейкоз, лимфоплазмацитарную лимфому, лимфому маргинальной зоны селезенки, миелому плазматических клеток, солитарную плазмацитому кости, экстракостную плазмацитому, В-клеточную лимфому мукоза-ассоциированной лимфоидной ткани (MALT) с экстралимфатической (внеузловой) маргинальной зоной, В-клеточную лимфому лимфатической (узловой) маргинальной зоны, фолликулярную лимфому, лимфому клеток коры головного мозга, диффузную крупноклеточную В-клеточную лимфому, медиастинальную (тимусную) крупноклеточную В-клеточную лимфому, интраваскулярную крупноклеточную В-клеточную лимфому, первичную эффузионную лимфому, лимфому/лейкоз Беркитта, В-клеточные пролиферации неопределенного злокачественного потенциала, лимфоматоидный грануломатоз и пост-трансплантационное лимфопролиферативное нарушение.
Нарушения, характеризуемые продуцированием аутоантител, часто рассматриваются как аутоиммунные заболевания. Аутоиммунные заболевания включают, но не ограничиваются ими: артрит, ревматоидный артрит, ювенильный ревматоидный артрит, остеоартрит, полихондрит, псориатический артрит, псориаз, дерматит, полимиозит/дерматомиозит, миозит с тельцами включения, воспалительный миозит, токсический эпидермальный некролиз, системная склеродермия и склероз, синдром CREST, реакции, ассоциированные с воспалительным заболеванием кишечника, болезнь Крона, язвенный колит, респираторный дистресс-синдром, респираторный дистресс-синдром взрослых (ARDS), менингит, энцефалит, увеит, колит, гломерулонефрит, аллергические состояния, экзему, астму, состояния, включающие инфильтрацию Т-клеток и хронические воспалительные реакции, атеросклероз, аутоиммунный миокардит, недостаточность адгезии лейкоцитов, системную красную волчанку (SLE), подострую кожную красную волчанку, дискоидную красную волчанку, волчаночный миелит, волчаночный энцефалит, инсулинзависимый юношеский сахарный диабет, рассеянный склероз, аллергический энцефаломиелит, нейромиелит зрительного нерва, ревматическую атаку, малую хорею Сиденгама, иммунные реакции, ассоциированные с острой гиперчувствительностью и гиперчувствительностью замедленного типа, опосредованные цитокинами и Т-лимфоцитами, туберкулез, саркоидоз, гранулематоз, в том числе грануломатоз Вегенера и болезнь Черджа-Стросса, агранулоцитоз, васкулит (в том числе аллергический васкулит/ангиит, ANCA и ревматоидный васкулит), апластическую анемию, анемию Даймонда-Блэкфана, иммунную гемолитическую анемию, в том числе аутоиммунную гемолитическую анемию (AIHA), пернициозную анемию Аддисона-Бирмера, истинную эритроцитарную аплазию (PRCA), недостаточность Фактора VIII, гемофилию A, аутоиммунную нейтропению, панцитопению, лейкопению, заболевания, включающие лейкоцитарный диапедез, воспалительные нарушения центральной нервной системы (CNS), синдром повреждения множественных органов, тяжелую паралитическую миастению, заболевания, опосредованные комплексом антиген-антитело, антигломерулярное заболевание базальной мембраны, антифосфолипидный синдром, аллергический неврит, болезнь Бехчета, синдром Кэстлмана, синдром Гудпасчера, миастенический синдром Ламберта-Итона, синдром Рейно, синдром Шегрена, синдром Стивенса-Джонсона, отторжение трансплантатов солидных органов, болезнь трансплантат против хозяина (GVHD), буллезный пемфигоид, пемфигус (пузырчатку), аутоиммунные полиэндокринопатии, серонегативные спондилоартропатии, болезнь Рейтера, синдром скованного (ригидного) человека, гигантоклеточный артериит, иммунный комплексный нефрит, IgA-нефропатию, IgM-полиневропатии или IgM-опосредованную невропатию, идиопатическую тромбоцитопеническую пурпуру (ITP), тромботическую тромбоцитопеническую пурпуру (TTP), пурпуру Геноха-Шенлейна, аутоиммунную тромбоцитопению, аутоиммунное заболевание яичка и яичника, в том числе аутоиммунный орхит и оофорит (оварит), первичный гипотиреоз; аутоиммунные эндокринные заболевания, в том числе аутоиммунный тиреоидит, хронический тиреоидит (тиреоидит Хашимото), подострый тиреоидит, идиопатический гипотиреоз, болезнь Аддисона, болезнь Грейвса, аутоиммунные плюригландулярные синдромы (или синдромы плюригландулярной эндокринопатии), диабет типа I, также называемый сахарным диабетом (IDDM), и синдром Шихана; аутоиммунный гепатит, лимфоидный интерстициальный пневмонит (ВИЧ), облитерирующий бронхиолит (не-трансплантат) vs NSIP, синдром Гийена-Барре, васкулит больших сосудов (в том числе ревматическую полимиалгию и гигантоклеточный артериит (Такаяши)), васкулит средних сосудов (в том числе болезнь Кавасаки и нодозный полиартериит (PAN)), анкилозирующий спондилит, болезнь Бергера (IgA-нефропатию), быстро прогрессирующий гломерулонефрит, первичный билиарный цирроз, чревный (брюшной) спру (глютеновую энтеропатию), криоглубулинемию, криоглобулинемию, ассоциированную с гепатитом боковой амиотрофический склероз (ALS), заболевание коронарной артерии, семейную средиземноморскую лихорадку, микроскопический полиангиит, синдром Когана, синдром Вискотта-Олдрича и облитерирующий тромбоангиит.
Ревматоидный артрит (RA) является хроническим заболеванием, характеризуемым воспалением суставов, приводящим к опуханию, боли и потере функции. Пациенты, имеющие RA в течение продолжительного периода, обычно обнаруживают прогрессирующую деструкцию, деформацию суставов, потерю трудоспособности и даже преждевременную смерть. Кроме RA, воспалительные заболевания, нарушения и состояния обычно поддаются лечению, предупреждению или уменьшению симптомов (например, повышенной температуры, боли, опухания), ассоциированных с процессом воспаления, и композиции и способы этого изобретения являются полезными в лечении, предупреждении или уменьшении аберрантных или анормальных воспалительных процессов, в том числе RA.
Болезнь Крона и родственное заболевание, язвенный колит, являются двумя основными категориями заболевания, которые относятся к группе болезней, называемых воспалительным заболеванием пищеварительного тракта (IBD). Болезнь Крона является хроническим нарушением, которое вызывает воспаление пищеварительного или желудочно-кишечного (GI) тракта. Хотя она может включать любую зону GI-тракта от рта до ануса, наиболее часто она поражает тонкую кишку и/или толстую кишку. В язвенном колите участие GI ограничено толстой кишкой. Болезнь Крона может характеризоваться антителами против нейтрофильных антигенов, т.е. “перинуклеарным анти-нейтрофил-антителом" (pANCA), и антителом против Saccharomyces cervisiae, т.е. “анти-Saccharomyces cerevisiae-антителом" (ASCA). Многие пациенты с язвенным колитом имеют антитело pANCA в их крови, но не антитело ASCA, в то время как пациенты с болезнью Крона обнаруживают антитела ASCA, но не антитела pANCA. Одним способом оценивания болезни Крона является использование индекса активности болезни Крона (CDAI), основанного на 18 прогностических факторах (предикторах) собранных врачами. Величины CDAI 150 и ниже ассоциированы со статическим (латентным) заболеванием; более высокие величины указывают на активное заболевание и величины более 450 наблюдаются при крайне тяжелом заболевании [Best et al., "Development of a Crohn's disease activity index." Gastroenterology 70:439-444 (1976)]. Однако, после первоначального исследования, некоторые исследователи используют «субъективную величину» 200-250 в качестве оценки здорового состояния.
Системная красная волчанка (SLE) является аутоиммунным заболеванием, вызываемым рецидивирующими повреждениями кровеносных сосудов во множественных органах, в том числе почке, коже и суставах. У пациентов с SLE, патологическое взаимодействие между Т-клетками и В-клетками приводит к продуцированию аутоантител, которые атакуют ядро клетки. Существует общее мнение, что эти аутоантитела являются ответственными за SLE, так что новые терапии, которые истощают В-клеточную линию дифференцировки, позволяющие произвести переустановку (настройку) иммунной системы при генерировании новых В-клеток из предшественников, могли бы дать надежду долгосрочной пользы пациентам с SLE.
Рассеянный склероз (MS) является также аутоиммунным заболеванием. Он характеризуется воспалением центральной нервной системы и деструкцией миелина, который изолирует волокна нервных клеток в головном мозге, спинном мозге и теле. Хотя причина MS неизвестна, широко распространено мнение, что аутоиммунные Т-клетки являются первичными факторами патогенеза этого заболевания. Однако, высокие уровни антител присутствуют в цереброспинальной жилкости у пациентов с MS, и некоторые теории предсказывают, что В-клеточная реакция, приводящая к продуцированию антител, является важной для опосредования этого заболевания.
Аутоиммунное тиреоидное заболевание происходит из продуцирования аутоантител, которые либо стимулируют щитовидную железу, вызывая гипертиреоз (болезнь Грейвса), либо разрушают щитовидную железу, вызывая гипотиреоз (тиреоидит Хашимото). Стимуляция щитовидной железы вызывается аутоантителами, которые связывают и активируют рецептор тиреостимулирующего гормона (TSH). Деструкция щитовидной железы вызывается аутоантителами, которые взаимодействуют с другими антигенами щитовидной железы.
Дополнительные заболевания, нарушения и состояния, поддающиеся благоприятным действиям композиций и способов этого изобретения, включают синдром Шегрена, который является аутоиммунным заболеванием, характеризующимся деструкцией производящих влагу желез. Далее, иммунная тромбоцитопеническая пурпура (ITP) обусловлена аутоантителами, которые связываются с тромбоцитами крови и вызывают их деструкцию, и это состояние поддается применению материалов и способов этого изобретения. Тяжелая псевдопаралитическая миастения (MG), хроническое аутоиммунное нервно-мышечное нарушение, характеризующееся аутоантителами, которые связываются с рецепторами ацетилхолина, экспрессируемыми в нервно-мышечных соединениях, приводя к слабости контролируемых групп мышц, является заболеванием, имеющим симптомы, которые могут лечиться с использованием композиции и способов этого изобретения, и ожидается, что это изобретение будет полезным в лечении и/или предупреждении MG. Кроме того, ожидается, что инфекции вируса саркомы Рауса поддаются лечению или уменьшению по меньшей мере одного симптома композициями и способами этого изобретения.
Другим аспектом данного изобретения является использование материалов и способов этого изобретения для предупреждения и/или лечения любого гиперпролиферативного состояния кожи, в том числе псориаза и контактного дерматита или другого гиперпролиферативного заболевания. Псориаз характеризуется аутоиммунным воспалением в коже и ассоциирован также с артритом в 30% случаев, а также склеродермией, воспалительным заболеванием пищеварительного тракта, в том числе болезнью Крона и язвенным колитом. Было показано, что пациенты с псориазом и контактным дерматитом имеют увеличенную антигенную активность в этих повреждениях (Ogoshi et al., J. Inv. Dermatol., 110:818-23 [1998]). Мультиспецифические, мультивалентные связывающие белки могут доставлять цитотоксическую клетку иммунной системы, например, непосредственно в клетки в повреждениях, экспрессирующие высокие уровни антигена. Эти мультивалентные, например, мультиспецифические связывающие белки могут вводиться подкожно вблизи повреждений или с использованием любого из различных способов введения, описанных здесь, и других способов, хорошо известных специалистам в данной области.
Предполагается также лечение идиопатической воспалительной миопатии (IIM), в том числе дерматомиозита (DM) и полимиозита (РМ). Воспалительные миопатии были классифицированы с использованием ряда схем классификаций. Схема классификации Миллера (Miller, Rheum Dis Clin North Am. 20:811-826, 1994) идентифицирует 2 идиопатические воспалительные миопатии (IIM), полимиозит (РМ) и дерматомиозит (DM).
Полимиозит и дерматомиозит являются хроническими, изнуряющими воспалительными заболеваниями, которые поражают мышцы и, в случае DM, кожу. Эти нарушения являются редкими, с сообщенной ежегодной встречаемостью приблизительно 5-10 случаев на миллион взрослых и 0,6-3,2 случаями на миллион детей в год в Соединенных Штатах (Targoff, Curr Probl Dermatol. 1991, 3:131-180). Идиопатическая воспалительная миопатия ассоциирована с существенной распространенностью и смертностью, причем отмечено, что половина пораженных взрослых страдали от существенного ухудшения здоровья (Gottdiener et al., Am J Cardiol. 1978, 41:1141-49). Статья Miller (Rheum Dis Clin North Am. 1994, 20:811-826 and Arthritis and Allied Conditions, Ch. 75, Eds. Koopman and Moreland, Lippincott Williams and Wilkins, 2005) устанавливает пять групп критериев, используемых для диагностики IIM, т.е. оценивание критериев идиопатической воспалительной миопатии (IIMC), включающих мышечную слабость, наличие дегенерации, обнаруживаемое с использованием мышечной биопсии, повышение сывороточных уровней связанных с мышцами ферментов, электромагнитную триаду миопатии, наличие высыпаний (сыпи) в дерматомиозите, а также наличие аутоантител в качестве вторичных критериев.
IIM-ассоциированные факторы, включающие ассоциированные с мышцами ферменты и аутоантитела, включают, но не ограничиваются ими, креатинкиназу (СК), лактатдигидрогеназу, альдолазу, С-реактивный белок, аспартатаминотрансферазу (AST), аланинаминотрансферазу (ALT) и антиядерное аутоантитело (ANA), миозит-специфические антитела (MSA) и антитело к экстрагируемым ядерным антигенам.
Предпочтительные аутоиммунные заболевания, поддающиеся лечению способами этого изобретения, включают болезнь Крона, синдром Гийена-Барре (GBS; также известный как острая воспалительная демиелинизирующая полиневропатия, острый идиопатический полирадикулонефрит, острый идиопатический полиневрит и быстро прогрессирующий паралич Ландри), системную красную волчанку, рассеянный склероз, тяжелую псевдопаралитическую миастению, неврит зрительного нерва, псориаз, ревматоидный артрит, гипертиреоз (например, болезнь Грейвса), гипотиреоз (например, болезнь Хашимото), тиреоидит Орда (тиреоидит, сходный с болезнью Хашимото), сахарный диабет (типа 1), апластическую анемию, синдром Рейтера, аутоиммунный гепатит, первичный билиарный цирроз, антифосфолипидный синдром (APS), опсоклонус-миоклонус-синдром (OMS), темпоральный артериит (также известный как «гигантоклеточный артериит»), острый диссеминированный энцефаломиелит (ADEM), синдром Гудпасчера, гранулематоз Вегенера, чревную болезнь, пузырчатку (пемфигус), собачий полиартрит, аутоиммунную гемолитическую анемию. Кроме того, данное изобретение рассматривает способы лечения или уменьшения симптома, ассоциированного со следующими заболеваниями: эндометриозом, интерстициальным циститом, нейромиотонией, склеродермией, витилиго, вульводинией, болезнью Шагаса, приводящей к кардиопатии (кардиомегалии) Шагаса, саркоидозом, синдромом хронической усталости и дисавтономией.
Считается, что система комплемента играет роль во многих заболеваниях с иммунным компонентом, таких как болезнь Альцгеймера, астма, системная красная волчанка, различные формы артрита, аутоиммунное заболевание сердца и рассеянный склероз, все из которых рассматриваются как заболевания, нарушения или состояния, поддающиеся лечению или уменьшению симптомов, с использованием способов согласно этому изобретению.
Некоторые константные субобласти являются предпочтительными в зависимости от конкретной эффекторной функции или функций, которые должны проявляться мультивалентной одноцепочечной связывающей молекулой. Например, IgG (IgG1, 2 или 3) и IgM являются предпочтительными для активации комплемента, IgG любого подтипа является предпочтительным для опсонизации и нейтрализации токсинов; IgA является предпочтительным для связывания патогена и IgЕ является предпочтительным для связывания таких паразитов, как черви.
В качестве примера, FcR, узнающие константную область IgG-антител, были обнаружены на лейкоцитах человека в виде трех разных типов Fcγ-рецепторов, которые различаются структурными и функциональными свойствами, а также антигенными структурами, детектируемыми CD-моноклональными антителами. Они известны как FcγRI, FcγRII и FcγRIII и дифференциально экспрессируются на (соответствующих) субпопуляциях лейкоцитов.
FcγRI (CD64), высокоаффинный рецептор, экспрессируемый на моноцитах, макрофагах, нейтрофилах, предшественниках миелоидов и дендритных клетках, состоит из изоформ 1а и 1b. FcγRI имеет высокую аффинность в отношении мономерного IgG1 и IgG3 человека. Его аффинность в отношении IgG4 является приблизительно в 10 раз более низкой, тогда как он не связывает IgG2. FcγRI не обнаруживает генетического полиморфизма.
FcγRII (CD32), состоящий из изоформ IIa, IIb1, IIb2, IIb3 and IIc, является наиболее широко распространенным типом FcγR человека, экспрессирующимся на большинстве типов лейкоцитов крови, а также на клетках Лангерганса, дендритных клетках и тромбоцитах. FcγRII является низкоаффинным рецептором, который связывает только агрегированный IgG. Он является единственным классом FcγR, способным связывать IgG2. FcγRIIa обнаруживает генетический полиморфизм, приводя к двум разным аллотипам, FcγRIIa-H131 и FcγRIIa-R131, соответственно. Этот функциональный полиморфизм приписывается различию единственной аминокислоты: остатка гистидина (H) или аргинина (R) в положении 131, которое является критическим для связывания IgG. FcγRIIa легко связывает IgG и IgG3 человека и, по-видимому, не связывается с IgG4. FcγRIIa-H131 имеет гораздо более высокую аффинность в отношении находящегося в комплексе IgG2, чем аллотип FcγRIIa-R131.
FcγRIII (CD16) имеет две изоформы или два аллелотипа, обе (оба) из которых способны связывать IgG1 и IgG3. FcγRIIa, с промежуточной аффинностью в отношении IgG, экспрессируется на макрофагах, моноцитах, природных клетках-киллерах (NK) и субпопуляциях Т-клеток. FcγRIIIb является низкоаффинным рецептором для IgG, селективно экспрессируемым на нейтрофилах. Он является высокомобильным рецептором с эффективным взаимодействием с другими мембранными рецепторами. Исследования с миеломными IgG-димерами показали, что только IgG1 и IgG3 связываются с FcγRIIIb (с низкой аффинностью), тогда как связывание IgG2 и IgG4 не было обнаружено. FcγRIIIb несет кодоминантный, биаллельный полиморфизм, причем аллотипы названы NA1 (антиген нейтрофилов) и NA2.
Еще одним аспектом этого изобретения является применение материалов и способов этого изобретения для преодоления, предотвращения или облегчения действий инфекции, происходящих из большого разнообразия инфекционных агентов. Мультивалентные, мультиспецифические связывающие молекулы этого изобретения предназначены для производительного и эффективного рекрутинга иммунной системы организма-хозяина для противостояния инфекции, возникающей из чужеродного организма, чужеродной клетки, чужеродного вируса или чужеродного неодушевленного объекта. Например, мультиспецифическая связывающая молекула может иметь один связывающий домен, который специфически связывается с мишенью на антигенпрезентирующей клетке, такой как CD40, CD80, CD86, DC-SIGN, DEC-205, CD83 и т.п.). Альтернативно, каждый связывающий домен мультивалентной связывающей молекулы может специфически связываться с инфекционным агентом, тем самым более эффиктивно нейтрализуя этот агент. Кроме того, это изобретение рассматривает мультиспецифические, мультивалентные связывающие молекулы, которые специфически связываются с мишенью на инфекционном агенте и с не ассоциированным партнером связывания, который может быть эффективным вместе с эффекторной функцией мультиспецифической связывающей молекулы, в лечении или предупреждении инфекции, возникающей из инфекционного агента.
Инфекционные клетки, рассматриваемые этим изобретением, включают любую известную инфекционную клетку, в том числе, но не только, любую из различных бактерий (например, патогенные E. coli, S. typhimurium, P. aeruginosa, B. anthracis, C. botulinum, C. difficile, C. perfringens, H. pylori, V. Cholerae и т.п.), микобактерий, микоплазм, грибов (в том числе дрожжей и плесеней) и паразитов (в том числе любого известного паразитарного члена Protozoa, Trematoda, Cestoda и Nematoda). Инфекционные вирусы включают, но не ограничиваются ими, эукариотические вирусы (например, аденовирус, буньявирус, герпесвирус, паповавирус, парамиксовирус, пикорнавирус, поксвирус, реовирус, ретровирус и т.п.), а также бактериофаг. Чужеродные объекты включают объекты, внедряющиеся в организм, предпочтительно человека, независимо от способа вхождения и независимо от того, являются ли они вредными. Ввиду увеличивающегося преобладания устойчивых к множественным лекарственным средствам инфекционных агентов (например, бактерий), особенно в качестве причинных агентов нозокомиальной (внутрибольничной) инфекции, материалы и способы этого изобретения обеспечивают подход к лечению, который лишен трудностей, создаваемых увеличением устойчивости к антибиотикам.
Заболевания, состояния или нарушения, ассоциированные с инфекционными агентами и поддающиеся лечению (профилактическому или терапевтическому) материалами и способами, описанными здесь, включают, но не ограничиваются ими, сибирскую язву, аспергиллез, бактериальный менингит, бактериальную пневмонию (например, Сhlamydia pneumoniae), бластомикоз, ботулизм, бруциллез, кандидоз, холеру, циццидиоидомикоз, криптококкоз, вызывающие диарею, энтерогеморрагические или энтеротоксигенные E. coli, дифтерию, сап, гистоплазмоз, болезнь легионеров (легионелез), проказу, листериоз, нокардиоз, коклюш, сальмонеллез, скарлатину, споротрихоз, острый фарингит, синдром токсического шока, диарею путешественников и сальмонеллез.
Дополнительные аспекты и детали этого изобретения будут очевидны из следующих примеров, которые предназначены для иллюстрации, а не для ограничения. Пример 1 описывает рекомбинантное клонирование вариабельных областей тяжелой и легкой цепи иммуноглобулина. Пример 2 описывает конструирование малых модульных иммунофармацевтических средств. Пример 3 описывает конструирование кассеты-прототипа для мультивалентного связывающего белка с эффекторной функцией. Пример 4 описывает исследования связывания и экспрессии с первоначальной молекулой-прототипом. Пример 5 описывает конструирование альтернативных конструкций, полученных из этой первоначальной молекулы-прототипа, где последовательность линкерной области между EFD и BD2 изменяли как по длине, так и по последовательности. Кроме того, он описывает альтернативные формы, в которых изменяли также ориентацию V-областей в связывающем домене 2. Пример 6 описывает последующие исследования связывания и функциональные исследования на этих альтернативных конструкциях с вариантными линкерными формами, идентифицирующие расщепление в линкерной области в нескольких из этих полученных форм, и новые варианты последовательности, развитые для преодоления этой проблемы. Пример 7 описывает конструирование альтернативного предпочтительного варианта осуществления мультиспецифических, мультивалентных слитых белков, где оба BD1 и BD2 связываются с антигенами на одном и том же типе клеток (CD20 и CD37) или на другом мультиспецифическом слитом белке, где антигенсвязывающая специфичность в отношении BD2 была заменена в CD3 человека вместо CD28. Пример 8 описывает исследования связывания и функциональные исследования, выполняемые с мультиспецифическими конструкциями CD20-hIgG-СD37. Пример 9 описывает связывание и функциональные исследования с мультивалентными конструкциями слитого белка CD20-hIgG-CD3. Пример 10 описывает мультивалентные связывающие молекулы, имеющие линкеры на основе специфических областей внеклеточных доменов членов суперсемейства иммуноглобулинов. Пример 11 описывает анализы для идентификации связывающих доменов, которые, как ожидается, должны быть эффективными в мультивалентных связывающих молекулах в достижении по меньшей мере одного полезного эффекта, идентифицированного как эффект, ассоциированный с такими молекулами (например, лечение заболевания).
Пример 1
Клонирование вариабельных областей тяжелой и легкой цепи иммуноглобулина
Любые способы, известные в данной области, могут быть использованы для индукции антител для конкретной антигенной мишени. Далее, любые способы, известные в данной области, могут быть использованы для клонирования вариабельных областей легкой и/или тяжелой цепи иммуноглобулина, а также константной субобласти антитела или антител. Следующий способ обеспечивает примерный способ клонирования.
А. Выделение тотальной РНК
Для клонирования вариабельных областей тяжелой и легкой цепи иммуноглобулина или константной субобласти тотальную РНК выделяют из гибридомных клеток, секретирующих соответствующее антитело. Клетки (2×107) из линии гибридомных клеток промывают в 1х ЗФР и осаждают центрифугированием в 12×75 мм круглодонной полипропиленовой пробирке (Falcon no. 2059). Реагент для выделения тотальной РНК TRIzol™ (Gibco BRL, Life Technologies, Cat no. 15596-018) добавляют (8 мл) в каждую пробирку и эти клетки лизируют повторяемым пипетированием. Лизат инкубируют в течение 5 минут при комнатной температуре перед добавлением 1,6 мл (0,2 × объем) хлороформа и сильно встряхивают в течение 15 секунд. После стояния 3 минуты при комнатной температуре лизаты центрифугируют при 9000 об/мин в течение 15 минут в предварительно охлажденном при 4ºС роторе Beckman JA-17 для разделения водной и органической фаз. Верхнюю водную фазу (приблизительно 4,8 мл) переносят в новую пробирку и смешивают осторожно с 4 мл изопропанола. После 10-минутной инкубации при комнатной температуре РНК осаждают центрифугированием при 9000 об/мин в роторе JA-17 при 4ºС в течение 11 минут. Осадок РНК промывают 8 мл охлажденного на льду 75% этанола и повторно осаждают центрифугированием при 7000 об/мин в течение 7 минут в роторе JA-17 4ºC. Этанольную промывку декантируют и осадки РНК сушат на воздухе в течение 10 минут. Эти осадки РНК ресуспендируют в 150 мкл обработанной диэтилпирокарбонатом (DEPC) ddH2O, содержащей 1 мкл ингибитора РНКаз (Catalog No. 799017; Boehringer Mannheim/Roche) на 1 мл DEPC-обработанной ddH2O. Эти осадки ресуспендируют осторожным пипетированием и инкубируют в течение 20 минут при 55ºC. Пробы РНК подвергают количественному определению измерением OD260 разведенных аликвот (1,0 OD260 нм единица = 40 мкг/мл РНК).
В. Быстрая амплификация концов кДНК
Проводят 5'-RACE для амплификации концов вариабельных областей тяжелой и легкой цепи или константной субобласти. Систему 5'-RAGE версии 2.0 для быстрой амплификации концов кДНК (Life Technologies, cat. no. 18374-058) используют в соответствии с инструкциями изготовителя. Вырожденные олигонуклеотидные праймеры 5'-RAGE конструируют таким образом, что они соответствуют, например, константным областям двух обычных классов тяжелых цепей иммуноглобулина мыши (IgG1 и IgG2b), с использованием программы конструирования олигонуклеотидов Oligo version 5.1 (Molecular Biology Insights, Cascade CO). Конструируют также праймеры, которые соответствуют константной области легкой цепи каппа IgG мыши. Она является единственным классом легкой цепи иммуноглобулина, так что вырожденность не требуется в конструировании этого праймера. Последовательности этих праймеров являются следующими:
Для амплификации компонента тяжелой цепи иммуноглобулина мыши реакцию обратной транскриптазы проводят в пробирке для ПЦР на 0,2 мл с тонкими стенками, содержащей 2,5 пмоль праймера тяжелой цепи GSP1 (SEQ ID NO:7), 4 мкг тотальной RNA, выделенной из подходящего гибридомного клона (например, либо клона 4А5, либо клона 4В4), и 12 мкл обработанной DEPC ddH2О. Подобным образом, для компонента легкой цепи мыши реакцию обратной транскриптазы проводят в пробирке для ПЦР на 0,2 мл с тонкими стенками, содержащей 2,5 пмоль праймера легкой цепи GSP1 (SEQ ID NO:9), 4 мкг тотальной РНК, выделенной из подходящего гибридомного клона (например, либо клона 4А5, либо клона 4В5), и 12 мкл обработанной DEPC ddН2О.
Эти реакции проводят в программируемом термоциклере PTC-100 (MJ research Inc., Waltham, MA). Эту смесь инкубируют при 70ºC в течение 10 минут для денатурации РНК и затем охлаждают на увлажненном льду в течение 1 минуты. Пробирки центрифугируют в течение непродолжительного времени для сбора влаги с крышек этих пробирок. Затем добавляют следующие компоненты реакции: 2,5 мкл 10× ПЦР-буфера (200 мМ Трис-HCl, pH 8,4, 500 мМ KCl), 2,5 мкл 25 мМ MgCl2, 1 мкл 10 мМ dNTP-смеси и 2,5 мкл 0,1 M ДТТ. После перемешивания каждой пробирки осторожным пипетированием эти пробирки помещают в термоциклер PTC-100 при 42ºC на 1 минуту для предварительного нагревания смеси. Затем в каждую пробирку добавляют 1 мкл (200 единиц) обратной транскриптазы SuperScript™ II (Gibco-BRL; cat no. 18089-011), осторожно перемешивают пипетированием и инкубируют в течение 45 минут при 42ºС. Реакции повторяют циклически до 70ºC в течение 15 минут для терминации реакции и затем повторяют циклически до 37°C. Затем в каждую реакционную пробирку добавляют смесь РНКаз (1 мкл), осторожно перемешивают и инкубируют при 37ºC в течение 30 минут.
кДНК первой цепи, генерированную реакцией обратной транскриптазы, очищают с использованием патронного фильтра (картриджа) для центрифугирования GlassMAX DNA Isolation Spin Cartridge (Gibco-BRL) в соответствии с инструкциями изготовителя. К каждой реакции первой цепи добавляют 120 мкл связывающего раствора 6 M NaI. Затем раствор кДНК/NaI переносят в патрон GlassMAX spin и центрифугируют в течение 20 секунд при 13000g. Вкладыши патрона осторожно вынимают и прошедший раствор выбрасывают из этих пробирок. Затем эти патроны помещают обратно в пустые пробирки и в каждый патрон добавляют 0,4 мл холодного (4ºС) 1х промывочного буфера. Пробирки центрифугируют при 13000g в течение 20 секунд и прошедший раствор выбрасывают. Эту стадию промывки повторяют еще три раза. Затем патроны GlassMAX промывают 4 раза 0,4 мл холодного (4ºC) 70% этанола. После выбрасывания прошедшего раствора из конечной промывки 70% этанолом патроны помещают обратно в пробирки и центрифугируют при 13000g в течение дополнительной 1 минуты для полного высушивания патронов. Затем вкладыши центрифугируемых патронов переносят в пробирку выделения свежей пробы, где 50 мкл предварительно нагретой при 65°C DEPC-обработанной ddH2O быстро добавляют в каждый откручиваемый патрон. Эти патроны центрифугируют при 13000g в течение 30 секунд для элюции кДНК.
С. Наращивание цепи терминальной дезоксинуклеотидилтрансферазой
Для каждой пробы кДНК первой цепи в тонкостенную ПЦР-пробирку на 0,2 мл добавляют следующие компоненты: 6,5 мкл DEPC-обработанной ddH2O, 5,0 мкл 5x буфера для наращивания цепи, 2,5 мкл 2 мМ dCTP и 10 мкл соответствующей GlassMAX-очищенной кДНК-пробы. Каждую реакцию 24 мкл инкубируют 2-3 минуты в термоциклере при 94ºC для денатурации ДНК и охлаждают на увлажненном льду в течение 1 минуты. Содержимое пробирок собирают непродолжительным центрифугированием. Затем в каждую пробирку добавляют 1 мкл терминальной дезоксинуклеотидилтрансферазы (TdT). Пробирки перемешивают осторожным пипетированием и инкубируют в течение 10 минут при 37°C в термоциклере PTC-100. После 10-минутной инкубации TdT инактивируют нагреванием посредством проведения цикла до 65ºC в течение 10 минут. Реакции охлаждают на льду и кДНК первой цепи с наращенным TdT-хвостом хранят при -20ºC.
D. ПЦР dC-наращенной кДНК первой цепи
ПЦР-амплификации в двух повторностях (две независимые ПЦР-реакции для каждой пробы dC-наращенной кДНК первой цепи) выполняют в объеме 50 мкл, содержащем 200 мкМ dNTP, 0,4 мкМ 5'- RACE-сокращенный якорный праймер (SEQ ID NO:11) и 0,4 мкM либо вмонтированной тяжелой цепи GSP2 (SEQ ID NO:8), либо вмонтированной легкой цепи GSP2 (SEQ ID NO:10), 10 мМ Трис-HCl (pH 8,3), 1,5 мМ MgCl2, 50 мМ KCl, 5 мкл dC-наращенной кДНК и 5 единиц ДНК-полимеразы Expand™ Hi-Fi (Roche/Boehringer Mannheim GmbH, Germany). Эти ПЦР-реакции амплифицировали с использованием протокола температур отжига "Touch-down/Touch-up" в программируемом термоциклере PTC-100 (MJ Research Inc.) со следующими условиями: начальная денатурация 95°C в течение 40 секунд, 5 циклов при 94C в течение 20 секунд, 61ºC - 2ºC/цикл в течение 20 секунд, 72ºC в течение 40 секунд + 1 секунда/цикл, с последующими 5 циклами при 94ºC в течение 25 секунд, 53ºC + 1°C/цикл в течение 20 секунд, 72ºC в течение 46 секунд + 1 секунда/цикл, с последующими 20 циклами при 94ºC в течение 25 секунд, 55ºC в течение 20 секунд, 72ºC в течение 51 секунды + 1 секунда/цикл, и конечной инкубацией при 72ºC в течение 5 минут.
E. TOPO TA-клонирование
Полученные продукты ПЦР очищают при помощи геля из 1,0% агарозного геля с использованием системы очистки QIAQuick Gel (QIAGEN Inc., Chatsworth, CA), TA-клонируют в pCR2.1 с использованием набора для клонирования TOPO TA Cloning® (Invitrogen, San Diego, CA, cat. no. K4550-40) и трансформируют в клетки TOP10F' cells (Invitrogen) в соответствии с инструкциями изготовителя. Клоны с инсертами идентифицируют скринингом синие/белые в соответствии с инструкциями изготовителя, где белые клоны считаются положительными клонами. Культуры 3,5 мл жидкого бульона Луриа (LB), содержащие 50 мкг/мл ампициллина, инокулируют белыми колониями и выращивают при 37°C в течение ночи (приблизительно 16 часов) с встряхиванием при 225 об/мин.
Набор QIAGEN Plasmid Miniprep Kit (QIAGEN Inc., cat. no. 12125) используют для очистки плазмидной ДНК из этих культур в соответствии с инструкциями изготовителя. Эту плазмидную ДНК суспендируют в 34 мкл 1x TE-буфера (pH 8,0) и затем положительные клоны секвенируют, как описано ранее, флуоресцентным дидезоксинуклеотид-секвенированием и автоматическим детектированием с использованием реагентов ABI Big Dye Terminator 3.1 при разведениях 1:4-l:8 и анализируют с использованием ДНК-секвенатора ABI 3100. Используемые секвенирующие праймеры включают праймеры T7 (5'GTAATACGACTCACTATAGG3'; SEQ ID NO:12) и M13 Обратный (5'CAGGAAACAGCTATGACCS3'; SEQ ID NO:13). Результаты секвенирования будут подтверждать, что эти клоны соответствуют IgG-последовательностям мыши.
F. De novo синтез генов с использованием ПЦР с удлинением растущей цепи перекрывающимися олигонуклеотидами
Этот способ включает применение перекрывающихся олигонуклеотидных праймеров и ПЦР, использующей либо ДНК-полимеразу высокой точности, либо смесь полимераз для синтеза V-области иммуноглобулина или другого гена. Начиная с середины последовательности V-области, конструируют праймеры из 40-50 оснований, так что растущая цепь удлиняется на 20-30 основания, в любом положении, и смежные праймеры перекрываются минимально 20 основаниями. Каждая стадия ПЦР требует двух праймеров, один из которых праймирует антисмысловую цепь (прямой или смысловой праймер) и один праймирует смысловую цепь (обратный или антисмысловой праймер) для создания растущего двухцепочечного продукта ПЦР. Во время конструирования праймеров, могут быть получены изменения в этих двух нуклеотидных последовательностях конечного продукта для создания сайтов рестрикционных ферментов, разрушения существующих сайтов рестрикционных ферментов, добавления гибких линкеров, замены, делеции или инсерции оснований, которые изменяют аминокислотную последовательность, оптимизации общей ДНК-последовательности для усиления синтеза праймеров и приспособления правил частоты использования кодонов в отношении организма, предполагаемого для использования в экспрессии этого синтетического гена.
Пары праймеров объединяют и разводят таким образом, что первая пара присутствует при 5 мкМ и каждая последующая пара имеет в 2 раза большую концентрацию и так до 80 мкМ. Один мкл из каждой из этих смесей праймеров амплифицируют в 50 мкл реакции ПЦР с использованием смеси ПЦР высокой точности Platinum PCR SuperMix-High Fidelity (Invitrogen, San Diego, CA, cat. no. 12532-016). После 2-минутной начальной денатурации при 94ºC, выполняют 30 циклов ПЦР с использованием циклической схемы 94ºC в течение 20 секунд, 60ºC в течение 10 секунд и 68ºC в течение 15 секунд. Продукты ПЦР очищают с использованием колонок для очистки Qiaquick PCR (Qiagen Inc., cat. no. 28704) для удаления избытка праймеров и фермента. Затем продукт ПЦР повторно амплифицируют со следующим набором подобным образом разведенных пар праймеров с использованием условий ПЦР, точно совпадающих с описанными выше, но с увеличением времени удлинения каждого цикла до 68°C в течение 30 секунд. Полученный продукт ПЦР опять очищают от праймеров и ферментов, как описано выше, и TOPO-TA-клонируют и секвенируют точно так же, как описано в разделе Е выше.
Пример 2
Конструирование малых модульных иммунофармацевтических веществ (SMIP)
Был сконструирован мультиспецифический, мультивалентный связывающий белок с эффекторной функцией, который содержал связывающий домен 1 в форме одноцепочечного рекомбинантного (мышь/человек) scFv, названный 2Н7 (VL-линкер-VH). Этот scFv 2H7 является малым модульным иммунофармацевтическим веществом (SMIP), которое специфически узнает CD20. Это связывающий домен основан на публично доступной последовательности CD20-антитела человека с номерами доступа GenBank M17953 для VH и M17954 для VL. CD20-специфические SMIP описаны в находящихся в совместном владении Публикациях патентов США 2003/133939, 2003/0118592 и 2005/0136049, включенных здесь в их полном объеме в качестве ссылки. Пептидным линкером, разделяющим VL и VH, был состоящий из 15 аминокислот линкер, кодирующий последовательность: Asp-Gly3Ser-(Gly4Ser)2. Связывающий домен 1 был локализован на N-конце этого мультиспецифического связывающего белка, причем С-конец этого домена связан непосредственно с N-концом константной субобласти, содержащей шарнирную область, CH2- и CH3-домены (в ориентации амино → карбокси). Константную субобласть производили из антитела IgG1, которое выделяли ПЦР-амплификацией IgG1 человека из PBMC человека. Шарнирную область модифицировали заменой тремя Ser трех остатков Cys, присутствующих в версии дикого типа шарнирного домена IgG1 человека, имеющего последовательность из 15 аминокислот: EPKSCDKTHTCPPCP (SEQ ID NO:14; три остатка Cys, замененные остатками Ser, показаны жирным шрифтом). В альтернативных вариантах осуществления, шарнирную область модифицировали в одном или нескольких из этих цистеинов, так что были получены шарниры типа SSS и CSC. Кроме того, концевой пролин иногда заменяли серином, а также цистеиновыми заменами.
C-концевую сторону CH3-домена ковалентно присоединяли к ряду альтернативных линкерных доменов, расположенных смежно между С-концом константной субобласти и амино-концом связывающего домена 2. Предпочтительные мультивалентные связывающие белки с эффекторной функцией будут иметь один из этих линкеров для оставления промежутка между константной субобластью и связывающим доменом 2, хотя этот линкер не является существенным компонентом композиций этого изобретения, зависящим от свойств фолдинга BD2. Для некоторых конкретных мультивалентных молекул этот линкер может быть важным для разделения доменов, тогда как для других он может быть менее важным. Этот линкер присоединяли к N-концевой стороне scFv 2E12 ((VН-линкер-VL), которая специфически узнает CD28. Линкером, разделяющим домены VH и VL этой scFv 2E12-части мультивалентной связывающей молекулы, был линкер из 20 аминокислот (Gly4Ser)4, а не стандартный линкер (Gly4Ser)3, обычно встраиваемый между V-доменами scFv. Наблюдали, что этот более длинный линкер улучшает связывающие свойства scFv 2el2 в ориентации VH-VL.
Сконструированная мультиспецифическая, мультивалентная связывающая молекула содержала связывающий домен 1, который содержит лидерную пептидную последовательность 2Е12 из аминокислот 1-23 SEQ ID NO:171; вариабельную область легкой цепи мышиного антитела 2Н7 против CD20 человека, которая отражена в положении 24 в SEQ ID NO:171; линкер Asp-Gly3-Ser-(Gly4Ser)2, начинающийся в остатке 130 в SEQ ID NO:171, вариабельную область тяжелой цепи мышиного антитела 2Н7 против CD20 человека с аминокислотной заменой лейцина на серин (VHL11S) в положении 11 в вариабельном домене для VH, и который имеет единственный остаток серина в конце этой области тяжелой цепи (т.е. VTVS, где канонической последовательностью была бы последовательность VTVSS) (Genbank Ace. No. M17953), и между этими двумя связывающими доменами BD1 (2H7) и BD2 (2E12) расположен константный субдомен IgG1 человека, включающий модифицированную шарнирную область, содержащую последовательность "CSC" или "SSS", и CH2- и CH3-домены дикого типа. Нуклеотидная и аминокислотная последовательности этого мультивалентного связывающего белка с эффекторной функцией представлены в SEQ ID NO:228 и 229 для форм CSC, соответственно, и SEQ ID NO:170 и 171, для форм SSS.
Стабильно экспрессирующие клеточные линии создавали трансфекцией посредством электропорации неразрезанной или линеаризованной рекомбинантной экспрессионной плазмиды в клетки яичника Китайского хомячка (клетки СНО DG44) с последующим отбором в метотрексат-содержащей среде. Массовые культуры и основные лунки, продуцирующие наивысший уровень мультивалентного связывающего белка, амплифицировали в увеличивающихся уровнях метотрексата и адаптированные культуры затем клонировали лимитирующим разведением. Трансфицированные клетки СНО, продуцирующие мультивалентный связывающий белок, культивировали в биореакторах или wave-мешках с использованием бессывороточной среды, получаемой из JRH Biosciences (Excell 302, cat. no. 14324-1000M, дополненной 4 мМ глутамином (Invitrogen, 25030-081), пируватом натрия (Invitrogen 11360-070, разведенным до 1х), заменимыми аминокислотами (Invitrogen, 11140-050, конечное разведение до 1х), пенициллином-стрептомицином 100 МЕ/мл (Invitrogen, 15140-122) и рекомбинантным инсулином при концентрации 1 мкг/мл (Invitrogen, 97-503311). Другие бессывороточные базальные среды для СНО могут быть использованы для получения, например, CD-СНО, и т.п.
Слитый белок очищали от истощенных супернатантов культуры СНО Белок А-аффинной хроматографией. Мультивалентный связывающий белок очищали с использованием ряда стадий хроматографии и фильтрации, в том числе фильтра редукции (уменьшения) вирусов. Супернатанты культуры клеток фильтровали, затем подвергали Белок-А-Сефарозной аффинной хроматографии через колонку GE Healthcare XK 16/40. После связывания белка с колонкой, колонку промывали в дЗФР, затем 1,0 М NaCl, 20 мМ фосфате натрия рН 6,0 и затем 25 мМ NaCl, 25 мМ NaOAc, pH 5,0 для удаления белков неспецифического связывания. Связанный белок элюировали из этой колонки в 100 мМ глицин (Sigma), pH 3,5 и доводили до рН 5,0 0,5 М 2-(N-морфолино)этансульфоновой кислотой (MES), pH 6,0. Пробы белка концентрировали до 25 мг/мл в препарате для GPC-очистки. Вытеснительную хроматографию выполняли на приборе GE Healthcare AKTA Explorer 100 Air, с использованием колонки GE healthcare XK и Superdex 200 препаративной категории (GE healthcare).
Затем этот материал концентрировали и готовили с 20 мМ фосфатом натрия и 240 мМ сахарозой с полученным рН 6,0. Эту композицию фильтровали перед заполнением стерильных флаконов при различных концентрациях в зависимости от количества извлеченного материала.
Пример 3
Конструирование экспрессионной кассеты скорпиона
Нуклеиновая кислота, содержащая синтетический scFv 2Н7 (анти-CD20; SEQ ID NO:1), связанный с константной субобластью, как описано в примере 2, была названа TRU-015. Нуклеиновую кислоту TRU-015, а также нуклеиновые кислоты синтетического scFv 2E12 (анти-CD28 VL-VH; SEQ ID NO:3) и синтетического scFv 2E12 (анти-CD28 VH-VL; SEQ ID NO:5), кодирующие малые модульные иммунотерапевтические вещества (SMIP), использовали в качестве матриц для ПЦР-амплификации различных компонентов кассет скорпионов. Матрицу, или каркас, для связывающего домена 1 и константной субобласти обеспечивали посредством TRU-015 (нуклеиновой кислоты, кодирующей scFv 2H7 (анти-CD20), связанной с константной субобластью), и эту матрицу конструировали в экспрессирующем векторе pD18. Вышеуказанные нуклеиновые кислоты, содержащие scFv 2E12 в любой из двух ориентаций (VL-VH и VH-VL), обеспечивали кодирующую область для связывающего домена 2.
TRU 015 SSS шарнир CН2CН3 для инсерции BD2/линкера
Версию синтетического 2H7 scFv IgG1, содержащего шарнир SSS, использовали для создания кассеты-скорпиона с использованием в качестве матрицы для добавления сайта EcoRI для замены существующих стоп-кодона и сайта XbaI. Эту молекулу амплифицировали при помощи ПЦР с использованием праймера 9 (SEQ ID NO:23; см. таблицу 1) и праймера 87 (SEQ ID NO:40; см. таблицу 1), а также смеси Platinum PCR High Fidelity (Invitrogen). Полученный фрагмент 1,5 т.п.н. очищали и клонировали в вектор pCR2.1-TOPO (Invitrogen), трансформировали в штамм E. coli TOP10 (Invitrogen) и последовательность этой ДНК подтверждали.
Таблица 1. Олигонуклеотидные праймеры, используемые для конструирования кассеты-скорпиона CD20-CD28. Праймеры разделены на 2 группы, праймеры ПЦР и праймеры секвенирования. Праймеры ПЦР использовали для конструирования кассеты, а праймеры секвенирования использовали для подтверждения ДНК-последовательности всех промежуточных продуктов и конечных конструкций.
Слияние n2H7 VК и лидерной последовательности VK3 человека
Олигонуклеотид-направленный ПЦР-мутагенез использовали для введения сайта рестрикции AgeI (ACCGGT) в 5'-конце кодирующей области для TRU 015 VK и сайта рестрикции NheI (GCTAGC) в 3'-конце кодирующей области для линкера (G4S)3 с использованием праймеров 3 и 5 из таблицы 1. Поскольку праймер 3 кодирует также последние 6 аминокислот лидера VK3 человека (gb:X01668), перекрывающуюся ПЦР использовали для последовательного добавления N-концевых последовательностей этого лидера, в том числе конесенсусный блок Козака и сайт рестрикции HindIII (AAGCTT) с использованием праймеров 1, 2 и 5 из таблицы 1.
Конструирование n2H7 IgG1 SSS шарнир-СН2СН3
Праймеры 4 и 6 (SEQ ID NO:18 и 20, соответственно; таблица 1) использовали для повторной репликации TRU-015 VH с сайтом NheI 5' (слева) для слияния с VK для TRU-015 и сайта XhoI (5'-CTCGAG-3') на 3'-концевом соединении с доменами шарнир-CН2CН3 IgG1. Подобным образом, область шарнир-CН2CН3 IgG1 амплифицировали с использованием праймеров 8 и 9 из таблицы 1, введением 5' (слева) сайта XhoI и заменой существующего 3' (справа) сайта EcoRI (5'-GAATTC-3') для клонирования и разрушением стоп-кодона для создания возможности трансляции связывающего домена 2, присоединенного ниже по ходу транскрипции (справа) от СН3-домена. Эта версия кассеты-скорпиона отличается от ранее описанной кассеты префиксом “n".
Кроме мультивалентного связывающего белка, описанного выше, белок по данному изобретению может иметь связывающий домен, либо связывающий домен 1, либо 2, или оба, которые соответствуют единственной вариабельной области иммуноглобулина. Примерные варианты осуществления этого аспекта данного изобретения могли бы включать связывающие домены, соответствующие VH-домену антитела животного из семейства верблюдовых, или единственной модифицированной или немодифицированной V-области антитела другого вида, способной связываться с антигеном-мишенью, хотя любой единственный вариабельный домен рассматривается как применимый в белках этого изобретения.
Конструкции 2Е12 VL-VH и VH-VL
Для получения scFv 2Е12, совместимых с этой кассетой, внутренний сайт XbaI (5'-TCTAGA-3') должен быть разрушен с использованием перекрывающихся праймеров 17 и 18 из таблицы 1. Эти два праймера в комбинации с парой праймеров 14/16 (VL-VH) или 13/15 (VH-VL) использовали для амплификации двух противоположно ориентированных связывающих доменов, так что они несут сайты EcoRI и XbaI на их 5'- и 3'-концах, соответственно. Праймеры 13 и 16 также кодируют стоп-кодон (TAA) непосредственно перед сайтом XbaI.
Конструкция 2H7 SSS IgG1 2e12 LH/HL
Добавление линкера к конструкции эффекторный домен - связывающий домен 2. (STD-линкеры - STD1 и STD2)
Комплементарные праймеры 11 и 12 из таблицы 1 объединяли, нагревали до 70ºC и медленно охлаждали до комнатной температуры для отжига этих двух цепей. 5'-фосфатные группы добавляли с использованием полинуклеотидкиназы Т4 (Roche) в 1х буфере для лигирования с 1 мМ АТФ (Roche) с использованием протокола изготовителя. Затем полученный двухцепочечный линкер лигировали в сайт EcoRI между кодирующими областями для СН3-конца IgG1 и начала связывающего домена 2 с использованием ДНК-лигазы Т4 (Roche). Полученные ДНК-конструкции подвергали скринингу на присутствие сайта EcoRI в месте соединения линкер-BD2 и нуклеотидной последовательности GAATTA в месте соединения CН3-линкер. Затем эту точную конструкцию линкера STD 1 повторно расщепляли EcoRI и лигирование линкера повторяли с получением молекулы, которая имела линкер, состоящий из двух (STD 2) идентичных повторений последовательности Lx1. ДНК-конструкции опять подвергали скринингу, как описано выше.
Пример 4
Исследования экспрессии
Исследования экспрессии выполняли на вышеописанных нуклеиновых кислотах, которые кодируют мультивалентные связывающие белки с эффекторной функцией. Нуклеиновые кислоты, кодирующие мультивалентные связывающие белки, транзиторно трансфицировали в клетки COS и трансфицированные клетки поддерживали при хорошо известных условиях, пермиссивных для экспрессии гетерологичных генов в этих клетках. ДНК транзиторно трансфицировали в клетки COS с использованием PEI или ДЭАЭ-Декстрана, как описано ранее (PEI= статья Boussif O. et al, PNAS 92: 7297-7301, (1995), включенная здесь в качестве ссылки; статья Pollard H. et al, JBC 273: 7507-7511, (1998), включенная здесь в качестве ссылки). Выполняли множественные независимые трансфекции каждой новой молекулы для определения среднего уровня экспрессии для каждой новой формы. Для трансфекции с использованием PEI, клетки COS высевали на чашки 60 мм для культуры ткани в среде DMEM/10% ФТС и инкубировали в течение ночи, так чтобы они были приблизительно на 90% конфлюэнтными в день трансфекции. Среду заменяли бессывороточной DMEM, не содержащей антибиотиков, и инкубировали в течение 4 часов. Среда для трансфекции (4 мл на чашку) содержала бессывороточную DMEM с 50 мкг PEI и 10-20 мкг представляющей интерес ДНК-плазмиды. Среду для трансфекции перемешивали с использованием вортекса, инкубировали при комнатной температуре в течение 15 минут и добавляли в чашки после аспирации присутствующей среды. Культуры инкубировали в течение 3-7 дней перед сбором супернатантов. Культуральные супернатанты анализировали на экспрессию белка электрофорезом в ДСН-ПААГ, Вестерн-блоттингом, связывание подтверждали проточной цитометрией и функцию анализировали с использованием различных анализов, в том числе ADCC, CDC и экспериментов сокультивирования.
Анализ электрофореза в ДСН-ПААГ и Вестерн-блоттинг-анализ
Пробы готовили либо из неочищенных культуральных супернатантов (обычно 30 мкг на лунку), либо из аликвот очищенного белка, содержащих 8 мкг на лунку, и добавляли 2х Трис-Глицин-ДСН-буфер (Invitrogen) в конечной концентрации 1х. Десять (10) мкл маркера SeeBlue (Invitrogen, Carlsbad, CA) подвергали электрофорезу для обеспечения стандартов MW-размера. Варианты мультивалентных связывающих (слитых) белков подвергали анализу электрофорезом в ДСН-ПААГ на 4-20% Novex Трис-глицин гелях (Invitrogen, San Diego, CA). Пробы наносили с использованием буфера для проб Novex Трис-глицин-ДСН (2х) при восстанавливающих или невосстанавливающих условиях после нагревания при 95ºC в течение 3 минут с последующим электрофорезом при 175В в течение 60 минут. Электрофорез выполняли с использованием буфера для электрофореза 1х Novex Трис-Глицин-ДСН (Invitrogen).
После электрофореза белки переносили на мембраны PVDF с использованием устройства полусухого электроблоттера (Ellard, Seattle, WA) в течение 1 часа при 100 мАмп. Буферы для Вестерн-переноса включают следующие три буфера, присутствующие на пропитанной фильтровальной бумаге Ватман и нанесенные в следующей последовательности: № 1 содержит 36,34 г/литр Tрис, pH 10,4, и 20% метанол; № 2 содержит 3,02 г/литр Трис, pH 10,4, и 20% метанол; и № 3 содержит 3,03 г/литр Трис, pH 9,4, 5,25 г/литр ε-аминокапроевой кислоты и 20% метанол. Мембраны блокировали в смеси BLOTTO=5% обезжиренное молоко в ЗФР в течение ночи при перемешивании. Мембраны инкубировали с HRP-конъюгированным антителом козы против IgG человека (Fc-специфическим, Caltag) при 5 мкг/мл в BLOTTO в течение одного часа, затем промывали 3 раза в течение 15 минут каждый раз в ЗФР-0,5% Твин 20. Влажные мембраны инкубировали с раствором ECL в течение 1 минуты с последующим экспонированием на пленке X-omat в течение 20 секунд. Фигура 2 показывает Вестерн-блот белков, экспрессированных в культуральном супернатанте клеток COS (30 мкл/лунка), подвергнутых электрофорезу при невосстанавливающих условиях. Дорожки указаны цифрами 1-8 и содержат следующие пробы: Дорожка 1 (предел= маркеры See Blue, кДа показаны сбоку от блота. Дорожка 2=2Н7-sssIgG P238S/P331S-STD1-2e12 VLVH; дорожка 3=2H7-sssIgG P238S/P331S-STD1-2e12 VHVL, Дорожка 4=2H7-sssIgG P238S/P331S-STD2-2e12 VLVH; Дорожка 5=2H7-sssIgG P238S/P331S-STD2-2e12 VHVL; Дорожка 6=2e12 VLVH SMIP; Дорожка 7=2e12 VHVL SMIP; Дорожка 8=2H7 SMIP. 2H7 в этих конструкциях всегда находится в VLVH-ориентации, sssIgG указывает идентичность шарнира/линкера, расположенного в положении 1 линкера, как показано на фигуре 5, P238S/P331S показывает версию IgG1 человека с мутациями от дикого типа (первые перечисленные аа (аминокислоты)) до мутанта (вторые перечисленные аа) и положение аминокислот, при котором они встречаются в доменах СН2 и СН3 IgG1 дикого типа человека, STD1 показывает 20-аминокислотный (18 + сайт рестрикции) линкер, расположенный в положении 2 линкера, показанный на фигуре 5, и STD2 показывает 38-аминокислотный (36 + сайт рестрикции) линкер, расположенный в положении 2 линкера, показанный на фигуре 6.
Исследования связывания
Исследования связывания выполняли для оценки свойств биспецифического связывания CD20/CD28-мультиспецифических, мультивалентных связывающих пептидов. Сначала клетки WIL2-S добавляли в 96-луночные планшеты и центрифугировали для осаждения клеток. К засеянным планшетам добавляли очищенный белок CD20/CD28 с использованием серии 2-кратных разведений поперек планшета от 20 мкг/мл вниз до 0,16 мкг/мл. Серии 2-кратных разведений очищенного белка TRU-015 (источника связывающего домена) также добавляли в лунки засеянного планшета, причем концентрация TRU-015 простиралась от 20 мкг/мл вниз до 0,16 мкг/мл. Одна лунка, не содержащая белка, служила в качестве контроля-фона.
Засеянные планшеты, содержащие белки, инкубировали на льду в течение одного часа. Затем лунки промывали один раз 200 мкл 1% ФТС в ЗФР. Антитело козы против Ig человека, меченое FITC, (Fc Sp) при 1:100 добавляли в каждую лунку, и планшеты опять инкубировали на льду в течение одного часа. Затем планшеты промывали один раз 200 мкл 1% ФТС в ЗФР и клетки ресуспендировали в 200 мкл 1% ФТС и анализировали при помощи FACS.
Для оценки связывающих свойств анти-CD28-пептид-2E12 VHVL, CD28-экспрессирующие клетки СНО высевали в отдельные лунки культурального планшета. Затем CD20/CD28-очищенный белок добавляли в отдельные лунки с использованием схемы 2-кратных разведений, простирающихся от 20 мкг/мл вниз до 0,16 мкг/мл. Очищенный белок 2E12IgG-VHVL SMIP добавляли в отдельные засеянные лунки, опять с использованием схемы 2-кратных разведений, т.е. от 20 мкг/мл вниз до 0,16 мкг/мл. Одна лунка не получала белка для обеспечения контроля-фона. Затем планшеты инкубировали на льду в течение одного часа, промывали один раз 200 мкл 1% ФТС в ЗФР, в каждую лунку добавляли антитело козы против Ig человека, меченое FITC (Fc Sp, CalTag, Burlingame, CA) при 1:100. Планшеты опять инкубировали на льду в течение одного часа и затем промывали один раз 200 мкл 1% ФТС в ЗФР. После ресуспендирования клеток в 200 мкл 1% ФТС, выполняли анализ FACS. Результаты показали, что мультивалентные связывающие белки с N-концевым CD20-связывающим доменом 1 связывали CD20; белки, имеющие C-концевой CD28-связывающий домен 2 в ориентации N-VH-VL-C также связывали CD28.
Было показано, что экспрессированные белки связываются с CD20, презентируемым на клетках WIL-2S (см. фигуру 3) и с CD28, презентируемым на клетках СНО (см. фигуру 3), согласно проточной цитометрии (FACS), демонстрируя посредством этого, что либо BD1, либо BD2 мог функционировать, связывая специфический антиген-мишень. Каждый набор данных на диаграммах на фигуре 3 показывает связывание серийных разведений разных мультивалентных связывающих (слитых) белков на протяжении диапазонов титрования. Данные, полученные с использованием этих первоначальных конструкций, указывают на то, что мультивалентные связывающие (слиты) белки с версией связывающего домена 2, использующей 2е12 в ориентации VHVL, экспрессируют лучше и связываются лучше с CD28, чем формы с ориентацией VLVH, при эквивалентных концентрациях.
Фигура 4 показывает представление в виде графика результатов исследований связывания, выполненных с очищенными белками из каждой из этих трансфекций/конструкций. Эта фигура показывает профили связывания белков с CD20-экспрессирующими клетками WIL-2S, демонстрируя, что мультивалентная молекула связывается с CD20, так же как SMIP с единственной специфичностью при той же самой концентрации. Верхняя и нижняя панели на фигуре 5 показывают профили связывания BD2-специфичности (2e12=CD28) с клетками CD28 CHO. Для связывания связывающего домена 2 с CD28, ориентация V-областей влияла на связывание 2e12. Мультивалентные связывающие белки 2H7-sss-hIgG-STD1-2e12 с 2e12 в ориентации VH-VL (HL) обнаруживали связывание на уровне, эквивалентном уровню SMIP с единственной специфичностью, в то время как молекула 2e12 LH обнаруживала менее эффективное связывание при той же самой концентрации.
Пример 5
Конструирование различных форм линкеров мультивалентных слитых белков
Этот пример описывает конструирование различных форм линкеров, перечисленных в таблице, показанной на фигуре 6.
Конструирование линкеров CН3-BD2 H1 - H7
Для выяснения действия длины и состава линкера CH3-BD2 на экспрессию и связывание молекул-скорпионов, проводили эксперимент для сравнения существующей молекулы 2H7sssIgG1-Lx1-2e12HL с большим набором сходных конструкций с различными линкерами. С использованием 2H7sssIgG1-Lx1-2e12HL в качестве матрицы выполняли ряд ПЦР-реакций с использованием праймеров, перечисленных в таблице 2 олигонуклеотидов, которые создавали линкеры, варьирующие по длине от 0 до 16 аминокислот. Эти линкеры конструировали в виде фрагментов нуклеиновых кислот, которые включают кодирующую область для CН3 от сайта BsrGI до конца нуклеиновой кислоты, кодирующей место соединения линкер-BD2 в сайте EcoRI.
Таблица 2. Последовательности праймеров, использованных для генерирования вариантов линкеров CH3-BD2
Фигура 6 показывает диаграммы схематической структуры мультивалентного связывающего (слитого) белка и показывает ориентацию областей V для каждого связывающего домена, последовательность, присутствующую в положении линкера 1 (перечислены только остатки Cys), и последовательность и идентификатор для линкера (линкеров), расположенных в положении линкера 2 этих молекул.
Пример 6
Исследования связывания и функции с вариантными формами линкеров прототипа 2H7-IgG-2e12 мультивалентных слитых белков.
Этот пример показывает результаты ряда исследований экспрессии и связывания на конструкции-«прототипе» 2H7-sssIgG-Hx-2el2 VHVL с различными линкерами (H1-H7), присутствующими в положении линкера 2. Каждый из этих белков экспрессировали крупномасштабной транзиторной трансфекцией клеток COS и очисткой этих молекул с использованием Белок А-аффинной хроматографии, как описано в предыдущих примерах. Затем очищенные белки подвергали анализу, включающему электрофорез в ДСН-ПААГ, Вестерн-блоттинг, исследования связывания, анализируемого проточной цитометрией, и функциональные анализы на биологическую активность.
Исследования связывания, сравнивающие различные ориентации BD2
Исследования связывания выполняли, как описано в предыдущих примерах, за исключением того, что использовали Белок-А-очищенный материал, и постоянное количество связывающего (слитого) белка использовали для каждого исследуемого варианта, т.е. 0,72 мкг/мл. Фигура 7 показывает диаграмму в виде столбцов, сравнивающую связывающие свойства каждого варианта линкера и варианта ориентации 2е12 как для CD20-, так и для CD28-клеток-мишеней. H1-H6 являются конструкциями с линкерами H1-H6 и 2e12 в ориентации VH-VL. L1-L6 являются конструкциями с линкерами H1-H6 и 2e12 в ориентации VL-VH. Эти данные демонстрируют, что связывающий домен 2 со специфичностью в отношении 2e12 связывает гораздо более эффективно, когда присутствует в ориентации HL (пробы H1-H6), чем когда присутствует в ориентации LH (пробы L1-L6). Действие длины линкера осложнено открытием, что, как показано в следующей серии фигур, молекулы с более длинными линкерами содержат некоторые расщепленные молекулы с единственной специфичностью, которые лишены CD28-связывающей специфичности на карбокси-конце. Выполняли и другие эксперименты, которые относятся к связыванию выбранных линкеров, причем эти результаты показаны на фигурах 10, 12 и 13.
Анализ электрофореза в ДСН-ПААГ очищенных вариантов линкеров H1-H7
Пробы готовили из аликвот очищенных белков, содержащих 8 мкг белка на лунку, и добавляли 2х Трис-глицин-ДСН-буфер (Invitrogen) до конечной концентрации 1х. Для восстанавленных проб/гелей, 10х восстанавливающий буфер добавляли до 1х к пробам плюс Трис-Глицин-ДСН-буфер. Десять (10) мкл маркера SeeBlue (Invitrogen, Carlsbad, CA) подвергали электрофорезу для обеспечения стандартов MW-размера. Варианты мультивалентных связывающих (слитых) белков подвергали анализам электрофореза в ДСН-ПААГ на 4-20% Novex Трис-глицин-гелях (Invitrogen, San Diego, CA). Пробы наносили с использованием буфера для проб Novex Трис-глицин-ДСН (2х) при восстанавливающих или невосстанавливающих условиях после нагревания при 95ºC в течение 3 минут с последующим электрофорезом при 175В в течение 60 минут. Электрофорез выполняли с использованием буфера для электрофореза 1х Novex Трис-глицин-ДСН (Invitrogen). Гели окрашивали после электрофореза в красителе Кумасси ДСН ПААГ R-250 в течение 30 минут при перемешивании и обесцвечивали в течение по меньшей мере одного часа. Фигура 8 показывает невосстанавливающие и восстанавливающие окрашенные Кумасси гели вариантов мультивалентных связывающих (слитых) белков вместе с TRU-015 и 2e12 HLSMIP в качестве контрольных проб. По мере увличения длины линкера, количество белка, мигрирующего приблизительно при величине SMIP (или 52 кДа) увеличивается. Это увеличение количества белка в этой полосе соответствует уменьшению количества белка в верхней полосе, мигрирующей приблизительно при 90 кДа. Эти данные гелей свидетельствуют о том, что полноразмерная молекула расщепляется при линкере или вблизи линкера с образованием молекулы, которая лишена области BD2. Меньший фрагмент BD2 не присутствует, что указывает на то, (1) что нуклеотидная последовательность в линкерной последовательности может создавать скрытый сайт расщепления, который удаляет этот меньший фрагмент из сплайсированого РНК-транскрипта, или (2) что этот белок является протеолитически расщепленным после трансляции полноразмерного полипептида и что меньший фрагмент BD2 является нестабильным, т.е. чувствительным к протеолитическому процессингу. Вестерн-блоттинг некоторых из этих молекул показывает, что все эти белки содержат последовательность CD20 BD1, но эта меньшая полоса лишена CD28 BD2-реактивности. Не наблюдали меньшей полосы, мигрирующей в размере одного scFv (25-27 кДа), на любых гелях или блотах, что указывает на то, что этот меньший пептидный фрагмент не присутствует в этих пробах.
Связывание в Вестерн-блоте BD1 и BD2 2H7-специфическими Fab или CD28mIg
Фигура 9 показывает результаты Вестерн-блоттинга мультивалентных связывающих (слитых) белков 2H7-sss-hIgG-H6 в сравнении с каждым SMIP с единственной специфичностью.
Электрофорез выполняли при невосстанавливающих условиях и без кипячения проб перед нанесением. После электрофореза, белки переносили на мембраны PVDF с использованием устройства полусухого электроблоттера (Ellard, Seattle, WA) в течение 1 часа при 100 мАмп. Мембраны блокировали в смеси BLOTTO (5% обезжиренное молоко в ЗФР) в течение ночи при перемешивании. Фигура 9А: Мембраны инкубировали с AbyD02429.2, Fab, направленным на антитело 2H7, при 5 мкг/мл в BLOTTO в течение одного часа, затем промывали 3 раза в течение 5 минут каждый раз в ЗФР-0,5% Твин 20. Затем мембраны инкубировали в 6х His-HRP в течение одного часа при концентрации 0,5 мкг/мл. Блоты промывали три раза в течение 15 минут каждый раз в ЗФРТ. Влажные мембраны инкубировали с раствором ECL в течение 1 минуты с последующим экспонированием на пленке X-omat в течение 20 секунд.
Фигура 9В: Мембраны инкубировали с CD28Ig (Ancell, Bayport, MN) при 10 мкг/мл в BLOTTO, затем промывали три раза в течение 15 минут каждый раз в ЗФР-0,5% Твин 20. Затем мембраны инкубировали в конъюгате антитело козы против Ig мыши-HRP (CalTag, Burlingame, CA) при 1:3000 в BLOTTO. Затем мембраны промывали три раза в течение 15 минут каждый раз, затем инкубировали в растворе ECL в течение 1 минуты с последующим экспонированием на пленке X-omat в течение 20 секунд. Результаты из Вестерн-блотов показали, что CD28-связывающий домен присутствовал во фракции мультивалентных «мономеров», мигрирующей приблизительно при 90 кДа, и в формах более высокого порядка. Не детектировалась полоса, мигрирующая в положении, ожидаемом для единственного SMIP или фрагмента с размером одного scFv. При использовании CD20 анти-идиотипического Fab, детектировали фрагмент с размером SMIP, что указывало на присутствие пептидного фрагмента, содержащего (2H7-sss-hIgG), и отсутствие CD28 scFv-BD2-части этого слитого белка.
Исследования связывания на выбранных линкерах
Фигура 10 показывает результаты исследований связывания, выполненных на очищенных слитых белках 2H7-sss-hIgG-Hx-2e12. Исследования связывания выполняли для оценивания биспецифических связывающих свойств CD20/CD28 мультиспецифических связывающих пептидов. Сначала, клетки WIL2-S высевали с использованием общепринятых способов. К засеянным планшетам добавляли CD20/CD28 очищенный белок с использованием двухкратных титрований по планшету от 20 мкг/мл вниз до 0,16 мкг/мл. Серию 2-кратных разведений очищенного белка TRU-015 (источника связывающего домена) также добавляли в лунки засеянного планшета, причем концентрация TRU-015 простиралась от 20 мкг/мл вниз до 0,16 мкг/мл. Одна лунка, не содержащая белка, служила в качестве контроля-фона.
Засеянные планшеты, содержащие белки, инкубировали на льду в течение одного часа. Затем лунки промывали один раз 200 мкл 1% ФТС в ЗФР. Антитело козы против Ig человека, меченое FITC, (Fc Sp) при 1:100 добавляли в каждую лунку и планшеты опять инкубировали на льду в течение одного часа. Затем планшеты промывали один раз с 200 мкл 1% ФТС в ЗФР и эти клетки ресуспендировали в 200 мкл 1% ФТС и анализировали при помощи FACS.
Для оценивания связывающих свойств анти-CD28-пептид-2E12 VHVL, CD28-экспрессирующие клетки СНО высевали в отдельные лунки культурального планшета. Затем CD20/CD28-очищенный белок добавляли в отдельные лунки с использованием схемы 2-кратных разведений, простирающихся от 20 мкг/мл вниз до 0,16 мкг/мл. Очищенный белок 2E12IgGVHVL SMIP добавляли в отдельные засеянные лунки, опять с использованием схемы 2-кратных разведений, т.е. от 20 мкг/мл вниз до 0,16 мкг/мл. Одна лунка не получала белка для обеспечения контроля-фона. Затем планшеты инкубировали на льду в течение одного часа, промывали один раз 200 мкл 1% ФТС в ЗФР и в каждую лунку добавляли антитело козы против Ig человека, меченое FITC (Fc Sp) при 1:100. Планшеты опять инкубировали на льду в течение одного часа и затем промывали один раз 200 мкл 1% ФТС в ЗФР. После ресуспендирования этих клеток в 200 мкл 1% ФТС, выполняли анализ FACS. Было показано, что экспрессированные белки связываются с CD20, презентируемым на клетках WIL-2S (см. фигуру 10A), и с CD28, презентируемым на клетках СНО (см. фигуру 10B), проточной цитометрией (FACS), демонстрируя посредством этого, что либо BD1, либо BD2 мог функционировать, связывая специфический антиген-мишень. Кроме того, было обнаружено что используемый линкер (Н1-Н6) не влияет значимо на авидность связывания с антигеном-мишенью.
SEC-фракционирование мультивалентных связывающих (слитых) белков
Связывающий (слитый) белок очищали из супернатантов клеточных культур Белок-А-Сефароза-аффинной хроматографией через колонку GE Healthcare XK 16/40. После связывания белка с колонкой, эту колонку промывали в dPBS, затем 1,0 М NaCl, 20 мМ фосфате натрия, pH 6,0, и затем 25 мМ NaCl, 25 мМ NaOAc, pH 5,0, для удаления белков неспецифического связывания. Связанный белок элюировали из этой колонки в 100 мМ глицин (Sigma), pH 3,5 и доводили до рН 5,0 0,5 М 2-(N-морфолино)этансульфоновой кислотой (MES), pH 6,0. Пробы белка концентрировали до 25 мг/мл в препарате для GPC-очистки. Вытеснительную хроматографию (SEC) выполняли на приборе GE Healthcare AKTA Explorer 100 Air, с использованием колонки GE healthcare XK и Superdex 200 препаративной категории (GE healthcare).
Фигура 12 показывает таблицу, суммирующую результаты SEC-фракционирования различных связывающих (слитых) белков. С увеличением длины линкера комплексность этих молекул в растворе также увеличивается, делая трудным выделение представляющего интерес пика, или PОI из форм более высокого порядка при помощи ВЖХ. Линкер H7, по-видимому, устраняет большую часть этой комплексности образованием более гомогенной формы в растворе, так что эти растворимые формы мигрируют в основном в виде единственного POI приблизительно при 172 кДа.
Дополнительные исследования связывания
Выполняли вторую серию экспериментов (см. фигуры 12 и 13) с меньшей субпопуляцией мультивалентных связывающих (слитых) белков, в этот раз со сравнением линкеров Н3, Н6 и Н7. Эти результаты демонстрируют, что уровень связывания падает более значительно для CD28-, чем для CD20-связывания, но оба падают слабо с увеличением длины линкеров. Кроме того, эти результаты показали, что линкер Н7 проявлял наивысший уровень связывания с обоими антигенами. Эти данные получали с использованием Белок А-очищенных мультивалентных связывающих (слитых) белков, но они не были дополнительно очищены при помощи SEC, так что в растворе могли присутствовать множественные формы этих молекул. Эти результаты показали также, что укороченная форма, возможно, была менее стабильной, чем истинный мультивалентный полипептид, так как кривые связывания, по-видимому, не отражают полностью значимое количество формы единственной специфичности, присутствующее в растворе для линкера Н6.
Демонстрация мультиспецифического связывания из единственной молекулы
Выполняли альтернативный анализ связывания (см. фигуру 13), где связывание с CD20 на поверхности клеток WIL-2S детектировали реагентом, специфическим в отношении CD28 BD2, демонстрируя посредством этого, что одновременное связывание может происходить с обоими антигенами-мишенями, с участием как BD1, так и BD2 на одном и том же мультиспецифическом связывающем (слитом) белке (см. фигуру 12). Этот анализ демонстрирует свойство мультиспецифического связывания этих белков.
Пример 7
Конструирование мультиспецифических связывающих (слитых) белков с альтернативными специфичностями в BD2
Кроме прототипа, мультиспецифической связывающей CD20-CD28 молекулы, были получены две другие формы с альтернативными областями связывающего домена 2, в том числе CD37 и CD3 связывающими доменами. Эти молекулы были также получены с несколькими линкерными доменами, описанными для [2H7-sss-IgG-Hx/STDx-2e12 HL] мультиспецифических связывающих (слитых) белков. Конструирование дополнительных мультиспецифических (слитых) связывающих молекул описано ниже.
Конструирование анти-CD37-связывающего домена
Таблица 3. Олигонуклеотидные праймеры, использованные для генерирования G28-1 анти-CD37-связывающих доменов как для молекул SMIP, так и для скорпионов.
G28-1 scFv (SEQ ID NO:102) превращали в G28-1 LH SMIP при помощи ПЦР с использованием праймеров в таблице Х выше. Объединив праймеры 23 и 25 с 10 нг G28-1 scFv, эти VK амплифицировали в течение 30 циклов при 94ºС в течение 20 секунд, при 58ºС в течение 15 секунд, при 68ºС в течение 15 секунд, с использованием смеси для ПЦР высокой точности Platinum PCR Supermix Hi-Fidelity PCR mix (Invitrogen, Carlsbad, CA) в термоциклере ABI 9700. Продукт ПЦР имел сайты рестрикции PinAI (AgeI) на 5'-конце VK и NheI на конце scFv (G4S)3 линкера. VH сходным образом изменяли объединением праймеров 24 и 26 с 10 нг G28-1 scFv в ПЦР, проводимой при тех же самых условиях, что и условия ПЦР с VK выше. Этот продукт ПЦР имел сайты рестрикции NheI на 5-конце VH и XhoI на 3'-конце. Поскольку существенное перкрывание идентичности последовательности конструировали в праймеры 23 и 24, VK и VH разводили в 5 раз и затем добавляли при соотношении 1:1 в ПЦР, использующую фланкирующие праймеры 25 и 26, и полноразмерный scFv амплифицировали, как описано выше, удлинением времени удлинения при 68ºС с 15 секунд до 45 секунд. Этот продукт ПЦР представлял полный G28-1 scFv в виде PinAI-XhoI-фрагмента, и его очищали очисткой с использованием колонки MinElute (Qiagen) для удаления избытка праймеров, ферментов и солей. Этот элюат расщепляли полностью PinAI (Invitrogen) и XhoI (Roche) в 1х H-буфере (Roche) при 37ºС в течение 4 часов в объеме 50 мкл. Затем расщепленный продукт ПЦР подвергали электрофорезу в 1% агарозном геле, фрагмент извлекали из геля и повторно очищали на колонке MinElute с использованием буфера QG и инкубированием смеси гель-буфер при 50ºС в течение 10 минут при периодическом смешивании для растворения агарозы, после чего очистка на колонке была идентичной для пост-ПЦР-удаления праймеров. 3 мкл PinAI-XhoI-расщепленного G28-1 LH объединяли с 1 мкл PinAI-XhoI-расщепленным pD18-n2H7sssIgG1 SMIP в реакции с объемом 10 мкл с 5 мкл 2х LigaFast буфера для лигирования (Promega, Madison, WI) и 1 мкл ДНК-лигазы T4 (Roche), хорошо перемешивали и инкубировали при комнатной температуре в течение 10 минут. Затем 3 мкл реакционной смеси для лигирования трансформировали в компетентный TOP 10 (Invitrogen) с использованием протокола изготовителя. Эти трансформанты высевали на планшеты с LB-агаром с 100 мкг/мл карбенициллина (Teknova) и инкубировали в течение ночи при 37ºС. После 18 часов роста колонии выскребали и инокулировали в 1 мл Т-бульона (Teknova), содержащего 100 мкг/мл карбенициллина, в 96-луночном планшете с глубокими лунками и выращивали в течение ночи в термостате при 37ºС со встряхиванием. После 18-24 часов роста, из каждой ночной культуры выделяли ДНК с использованием набора QIAprep 96 Turbo Kit (Qiagen) на BioRobot8000 (Qiagen). Затем 10 мкл из каждого клона расщепляли рестрикционными ферментами HindIII и Xhol в 1х B-буфере в 15 мкл реакционного объема. Расщепленную ДНК подвергали электрофорезу на 1%-ных агарозных Е-гелях (Invitrogen, CA) для анализа сайтов рестрикции. Клоны, которые содержали HindIII-XhoI-фрагмент правильного размера, подвергали подтверждению последовательности. G28-1 HL SMIP конструировали сходным образом помещением сайта PinAI на 5'-конце и (G4S)4-линкера в сайте NheI G28-1 VH с использованием праймеров 29, 30 31 и 32 из таблицы Х выше. VK изменяли при помощи ПЦР с использованием праймеров 33 и 34 из таблицы Х, так что сайт NheI вводили на 5'-конце VK и сайт XhoI на 3'-конце. Затем эти ПЦР комбинировали, как описано выше, и амплифицировали с фланкирующими праймерами 29 и 34 с получением интактной ДНК G28-1 scFv в ориентации VH-VL, которую клонировали в PinAI-XhoI-расщепленный pD18-(n2H7)sssIgG1 SMIP точно так же, как и в случае G28-1 LH SMIP.
Конструирование 2H7sssIgG1-STD1-G28-1 LH/HL
С использованием G28-1 LH и G28-1 HL SMIP в качестве матриц, LH и HL анти-CD37-связывающие домены изменяли при помощи ПЦР таким образом, что их фланкирующие сайты рестрикции были совместимы с кассетой-скорпионом. Сайт EcoRI вводили на 5'-конце каждого scFv с использованием либо праймера 27 (LH), либо праймера 36 (HL) и стоп-кодона/сайта XbaI на 3'-конце с использованием либо праймера 28 (LH), либо 35 (HL). Полученные ДНК клонировали в EcoRI-XbaI-расщепленный pD18-2H7sssIgG-STD1.
Конструирование 2H7sssIgG1-Hx-G28-1 HL
ДНК 2H7sssIgG1-Hx-2e12 HL расщепляли BsrGI и EcoRI и получали фрагмент 325 п.н., состоящий из C-концевой стороны IgG1 и линкера. Ими заменяли эквивалентную область в 2H7sssIgG1-STD1-G19-4 HL удалением STD1-линкера с использованием BsrGI-EcoRI и заменой его соответствующими линкерами из клонов 2H7sssIgG1-Hx-2e12 HL.
Конструирование анти-CD3-связывающего домена
Таблица 4. Олигонуклеотиды, используемые для генерирования анти-CD3-связывающего домена из последовательности G19-4 scFv.
G19-4-связывающий домен синтезировали удлинением перекрывающихся олигонуклеотидных праймеров, как описано ранее. ПЦР легкой цепи выполняли в двух стадиях, начиная с объединения праймеров 43/44, 42/45, 41/46 и 40/47 в концентрациях 5 мкМ, 10 мкМ, 20 мкМ и 40 мкМ, соответственно, в смеси Platinum PCR Supermix Hi-Fidelity в течение 30 циклов 94°C, 20 секунд, 60ºC, 10 секунд, 68C, 15 секунд. 1 мкл полученного продукта ПЦР повторно амплифицировали с использованием смеси праймеров 39/48 (10 мкМ), 38/49 (20 мкМ) и 37/50 (40 мкМ) для ориентации LH или 66/67 (40 мкМ) для ориентации HL, с использованием тех же самых условий ПЦР, за исключением 68ºС-удлинения, которое увеличивали до 25 секунд. VK в ориентации LH связывали с PinAI на 5-конце и NheI на 3'-конце, в то время как ориентация HL имела NheI на 5-конце и XhoI на 3-конце.
Для синтеза тяжелой цепи смеси праймеров с теми же самыми концентрациями, что и описанные выше, готовили объединением праймеров 56/57, 55/58, 54/59 и 53/60 для первой стадии ПЦР. Во второй ПЦР праймеры 52/61 (20 мкМ) и 51/62 (50 мкМ) амплифицировали с 1 мкл из первой ПЦР с использованием тех же условий ПЦР, что и в случае второй ПЦР легкой цепи, для получения ориентации LH с NheI на 5-конце и XhoI на 3'-конце. Праймеры 52/61(10 мкМ), 63/64 (20 мкМ), 63 (20 мкМ)/65 (40 мкМ) и 63(20 мкМ)/5 (80 мкМ) объединяли во второй ПЦР с 1 мкл из предыдущей ПЦР для создания тяжелой цепи в ориентации HL с PinAI на 5-конце и NheI на 3'-конце. Как и с предыдущими конструкциями, конструировали достаточное перекрывание в праймеры, сосредоточенные около сайта NheI, так что G19-4 LH синтезировали объединением ПЦР тяжелой цепи и легкой цепи в ориентации LH и повторной амплификацией с фланкирующими праймерами, 37 и 62, а G19-4 HL синтезировали объединением ПЦР HL и повторной амплификацией с праймерами 63 и 67.
Полноразмерные продукты ПЦР G19-4 LH/HL разделяли электрофорезом в агарозном геле, вырезали из этого геля и очищали с использованием колонок Qiagen MinElute, как описано ранее. Затем эти ДНК (DNA) TOPO-клонировали в pCR2.1 (Invitrogen), трансформировали в TOP10 и колонии подвергали скринингу сначала по размеру EcoRI-фрагмента, затем посредством ДНК-секвенирования. Затем G19-4 LH/HL клонировали в pD18-IgG1 с использованием PinAI-XhoI для экспрессии в клетках млекопитающих.
Конструирование 2H7sssIgG1-STD1-G19-4 LH/HL
С использованием G19-4 LH и G19-4 HL SMIP в качестве матриц, LH и HL анти-CD3-связывающие домены изменяли при помощи ПЦР таким образом, что их фланкирующие сайты рестрикции были совместимы с кассетой-скорпионом. Сайт EcoRI вводили на 5'-конце каждого scFv с использованием праймера 27 (LH) или 36 (HL) и стоп-кодон/сайт XbaI на 3'-конце с использованием праймера 28 (LH) или 35 (HL). Полученные ДНК клонировали в EcoRI-XbaI-расщепленный pD18-2H7sssIgG-STD1.
Конструирование 2H7sssIgG1-Hx-G19-4 HL
ДНК 2H7sssIgG1-Hx-2e12 HL расщепляли BsrGI и EcoRI и получали фрагмент 325 п.н., состоящий на С-концевой стороне из IgG1 и линкера. Ими заменяли эквивалентную область в 2H7sssIgG1-STD1-G19-4 HL удалением STD1-линкера с использованием BsrGI-EcoRI и заменой его соответствующими линкерами из клонов 2H7sssIgG1-Hx-2e12 HL.
Из рассмотрения различных мультивалентных связывающих белков, описанных здесь, очевидными являются признаки молекул, которые поддаются объединению в образовании молекул этого изобретения. Эти признаки включают связывающий домен 1, константную субобласть, включающую шарнир или шарнир-подобный домен, линкерный домен и связывающий домен 2. Внутренняя модульность в построении этих новых связывающих белков делает простым для специалиста в данной области манипулирование этой ДНК-последовательностью на N-концевой и/или C-концевой сторонах любого желаемого модуля таким образом, что он может быть введен почти в любом положении с образованием новой молекулы, проявляющей измененную или увеличенную функциональность в сравнении с исходной молекулой (исходными молекулами), из которой он получен. Например, любой связывающий домен, полученный из члена суперсемейства иммуноглобулинов, рассматривается как либо связывающий домен 1, либо связывающий домен 2 молекул по этому изобретению. Эти полученные связывающие домены включают домены, имеющие аминокислотные последовательности, и даже кодирующие полинуклеотидные последовательности, которые имеют соответствие один-к-одному с последовательностью члена суперсемейства иммуноглобулинов, а также варианты и производные, которые предпочтительно имеют 80%, 90%, 95%, 99% или 99,5%-ную идентичность с членом суперсемейства иммуноглобулинов. Эти связывающие домены (1 и 2) предпочтительно связаны с другими модулями молекул по данному изобретению через линкеры, которые могут варьировать по последовательности и длине, как описано в другом месте здесь, при условии, что эти линкеры являются достаточными для обеспечения размещения в пространстве и гибкости, необходимых для этой молекулы для достижения функциональной третичной структуры. Другим модулем мультивалентных связывающих белков является шарнирная область, которая может соответствовать шарнирной области члена суперсемейства иммуноглобулинов, но может быть ее вариантом, таким как шарнирные области “CSC” или “SSS”, описанные здесь. Константная субобласть также содержит модуль белков данного изобретения, который может соответствовать субобласти константной области члена суперсемейства иммуноглобулинов, примером которого является структура константной субобласти шарнирная область-СН2-СН3. Рассматриваются также варианты и производные константных субобластей, предпочтительно имеющие аминокислотные последовательности, которые имеют 80%, 90%, 95%, 99% или 99,5%-ную идентичность с членом суперсемейства иммуноглобулинов.
Примерные первичные структуры признаков таких молекул представлены в таблице 5, которая описывает полинуклеотидную и соответствующую аминокислотную последовательность иллюстративных связывающих доменов 1 и 2, а также первичную структуру константной субобласти, включающей шарнирный или шарнир-подобный домен, и линкер, который может быть введен, например, между C-концевой стороной константной субобласти и N-концевой стороной участка связывающего домена 2 мультивалентного связывающего белка. Дополнительные примеры молекул по данному изобретению включают вышеописанные признаки, в которых, например, любой или оба связывающих доменов 1 и 2 содержат домен, полученный из VL или VL-подобного домена члена суперсемейства иммуноглобулинов, а VH или VH-подобный домен получен из того же самого или другого члена суперсемейства иммуноглобулинов, причем домены разделены линкером, таким как любой из описанных здесь линкеров. Рассматриваются молекулы, в которых ориентация доменов является ориентацией VL-VH или VH-VL для BD1 и/или BD2. Более полное представление первичных структур различных признаков мультивалентных связывающих молекул согласно этому изобретению можно найти в таблице, прилагаемой в конце этого описания. Это изобретение включают дополнительно полинуклеотиды, кодирующие такие молекулы.
Таблица 5




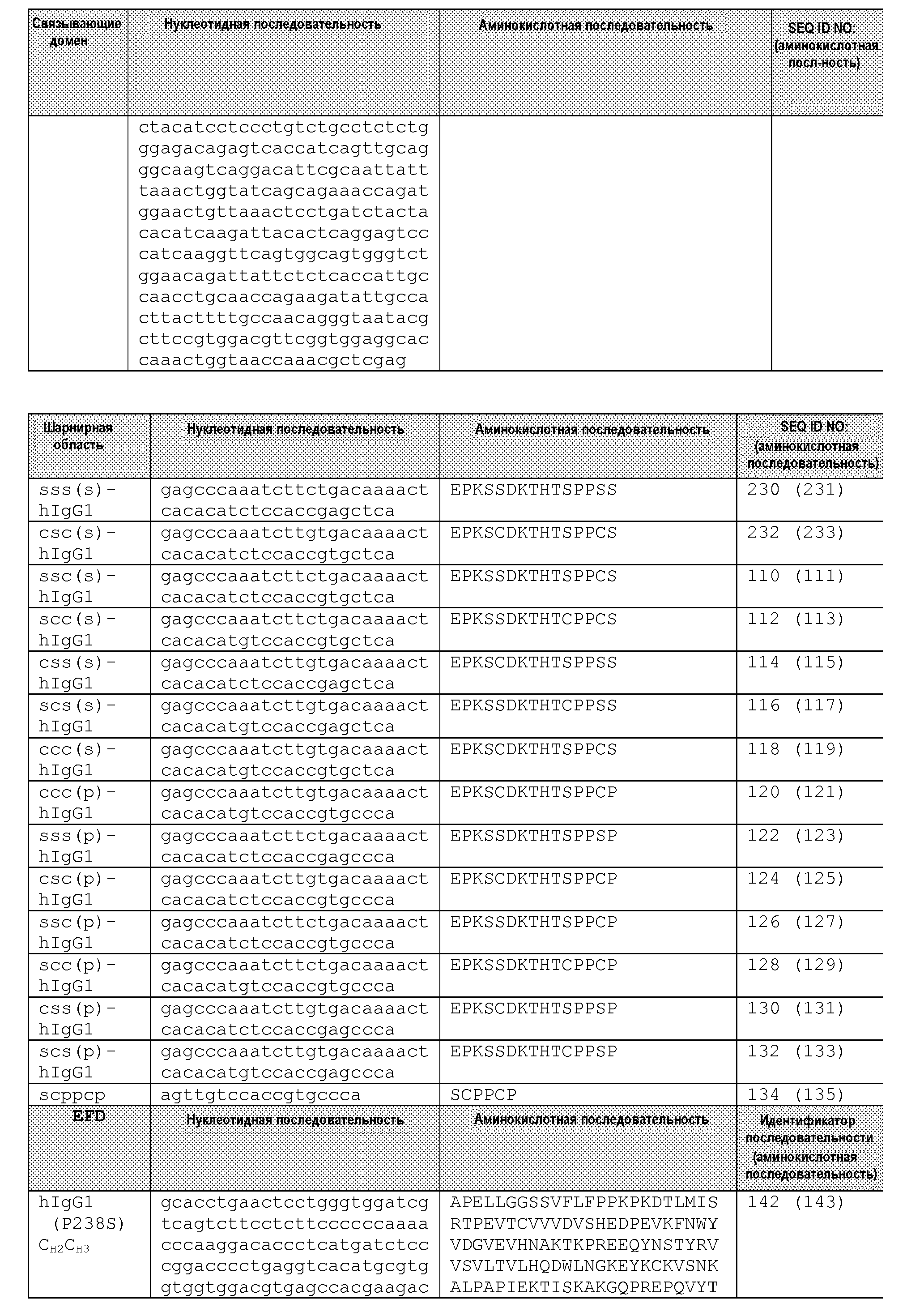


Таблица 5. Первичные структуры (полинуклеотидные и соответствующие аминокислотные последовательности) примерных признаков мультивалентных связывающих молекул.
Пример 8
Исследования связывания и функциональные исследования с альтернативными мультиспецифическими слитыми белками
Эксперименты, которые соответствуют вышеописанным экспериментам для молекулы-прототипа, мультиспецифической связывающей (слитой) молекулы CD20-IgG-CD28, проводили для каждой из дополнительных мультивалентных связывающих молекул, описанных выше. В целом, данные, полученные для дополнительных молекул, соответствуют результатам, наблюдаемым для этой молекулы-прототипа. Некоторые из ярких результатов этих экспериментов описаны ниже. Фигура 14 показывает результаты исследований блокирования, выполненных на одной из новых молекул, где как BD1, так и BD2 связываются с антигенами-мишенями на одной и той же клетке или на одном и том же типе клеток, в данном случае, CD20 и CD37. Этот мультиспецифический, мультивалентный связывающий (слитый) белок конструировали со связывающим доменом 1, связывающим CD20 (2H7; ориентация VL-VH), и связывающим доменом 2, связывающим CD37, G28-1 VL-VH (LH) или VH-VL (HL). Этот эксперимент выполняли для демонстрации мультиспецифических свойств этого белка.
Исследования блокирования:
В-лимфобластоидные клетки Ramos или BJAB B (2,5×105) предынкубировали в 96-луночных V-донных планшетах в окрашивающей среде (ЗФР с 2%-ными сыворотками мыши) с мышиным анти-CD20-антителом (25 мкг/мл) или мышиным анти-CD37-антителом (10 мкг/мл), обоими вместе или только с окращивающей средой в течение 45 минут на льду в темноте. Блокирующие антитела предынкубировали с клетками в течение 10 минут при комнатной температуре перед добавлением мультиспецифического связывающего (слитого) белка в указанных диапазонах концентраций, обычно от 0,02 мкг/мл до 10 мкг/мл, и инкубировали в течение дополнительных 45 минут на льду в темноте. Клетки промывали 2 раза в окрашивающей среде и инкубировали в течение одного часа на льду с Caltag (Burlingame, CA) FITC-козьими антителами против IgG человека (1:100) в окрашивающей среде для детектирования связывания этих мультиспецифических связывающих (слитых) белков с этими клетками. Затем клетки промывали 2 раза ЗФР и фиксировали 1% параформальдегидом (cat. no. 19943, USB, Cleveland, Ohio). Клетки анализировали проточной цитометрией с использованием прибора FACsCalibur и программы CellQuest (BD Biosciences, San Jose, CA). Каждая серия данных показывает в виде кривой связывание слитого белка 2H7-sss-hIgG-STD1-G28-1 HL в присутствии CD20, CD37 или как CD20-, так и CD37-блокирующих антител. Даже хотя этот эксперимент использовал один из расщепляемых линкеров, только присутствие обоих блокирующих антител полностью элиминирует связывание этим мультиспецифическим связывающим (слитым) белком, демонстрируя, что масса данных молекул обладает связывающей функцией как в отношении CD20, так и в отношении CD37. Эти данные были сходными для двух линий клеток, испытанных в панелях А и В, Ramos и BJAB, где CD20-блокирующее антитело было более эффективным, чем CD37-блокирующее антитело, в уменьшении уровня связывания, наблюдаемого в случае мультиспецифического связывающего (слитого) белка.
Анализы ADCC
Фигура 15 показывает результаты анализов ADCC, выполненных на мультиспецифических CD20-CD37-связывающих (слитых) белках. Анализы ADCC выполняли с использованием лимфобластоидных В-клеток BJAB в качестве мишеней и клеток PBMC человека в качестве эффекторных клеток. Клетки BJAB метили 500 мкКи/мл51Cr-хромата натрия (250 мкКи/мкг) в течение 2 часов при 37ºС в IMDM/10% ФТС. Эти меченые клетки промывали три раза в RPMI/10% ФТС и ресуспендировали при 4×105 клеток/мл в RPMI. Гепаринизированную цельную кровь человека получали из анонимных внебольничных доноров и PBMC выделяли фракционированием через градиенты сред для разделения лимфоцитов (LSM, ICN Biomedical). Лейкоцитные пленки собирали и промывали дважды в RPMI/10% ФТС перед повторным суспендированием в RPMI/10% ФТС при конечной концентрации 5×106 клеток/мл. Клетки считали по вытеснению трипанового синего с использованием гемоцитометра перед применением в последующих анализах. Пробы реагента добавляли к среде RPMI с 10% ФТС при концентрации, в 4 раза превышающей конечную концентрацию, и готовили 10-кратные серийные разведения для каждого реагента. Эти реагенты затем добавляли в 96-луночные U-донные планшеты при 50 мкл на лунку для указанных конечных концентраций.51Cr-меченые клетки BJAB добавляли в эти планшеты при 50 мкл на лунку (2×104 клеток на лунку). Затем в эти планшеты добавляли PBMC при 100 мкл на лунку (5×105 клеток на лунку) для конечного отношения 25:1 эффектор (PBMC):мишень (BJAB). Эффекторы и мишени добавляли к среде по отдельности для измерения фонового уничтожения.51Cr-меченые клетки добавляли к среде по отдельности для измерения спонтанного высвобождения51Cr и к среде с 5% NP40 (cat. no.28324, Pierce, Rockford, IL) для измерения максимального высвобождения51Cr. Реакции проводили в трех повторностях лунок 96-луночного планшета. Мультиспецифические связывающие (слитые) белки добавляли в лунки в конечной концентрации в диапазоне 0,01 мкг/мл - 10 мкг/мл, как указано на этих графиках. Каждая серия данных дает кривую отличающегося мультиспецифического связывающего (слитого) белка или соответствующих SMIP с единственной специфичностью при описанных диапазонах титрования. Реакциям давали протекать в течение 6 часов при 37ºС в 5% CO2 перед сбором и счетом. Затем двадцать пять мкл супернатанта из каждой лунки переносили в планшет Luma Plate 96 (cat. no. 6006633, Perkin Elmer, Boston, Mass) и сушили в течение ночи при комнатной температуре. Высвобожденные имп/мин измеряли в Packard TopCounNXT. Процентное специфическое уничтожение рассчитывали вычитанием (имп/мин {среднее трех повторностей проб} пробы - имп/мин спонтанное высвобождение)/(имп/мин максимальное высвобождение - имп/мин спонтанное высвобождение) × 100. Данные строили в виде зависимости %-ного специфического уничтожения от концентрации белка. Эти данные демонстрируют, что этот мультиспецифический связывающий (слитый) белок способен опосредовать активность ADCC против клеток, экспрессирующих антиген-мишень (антигены-мишени), так же как и SMIP с единственной специфичностью в отношении CD20 и/или CD37, но не обнаруживают увеличения уровня этой эффекторной функции.
Эксперименты по сокультивированию
Фигура 16 показывает результаты экспериментов, предназначенных для выяснения других свойств этого типа мультиспецифического связывающего (слитого) белка, где наличие двух связывающих доменов против мишеней, экспрессируемых на одной и той же клетке или на одном и том же типе клеток приводит к синергетическим действиям посредством передачи сигнала/связывания через два связанных поверхностных рецептора. Эти эксперименты сокультивирования выполняли с использованием PBMC, выделенных, как описано для анализов ADCC выше. PBMC ресуспендировали в культуральной среде при 2×106 клеток/мл в конечном объеме 500 мкл на лунку и культивировали отдельно или инкубировали со SMIP с единственной специфичностью в отношении CD20, CD37, CD20+CD37 или с мультиспецифическим связывающим (слитым) белком, использующим линкер Н7, [2H7-sss-IgG-H7-G28-1 HL]. Каждый из этих тест-реагентов добавляли при конечной концентрации 20 мкг/мл. После 24 часов культивирования, не наблюдали несомненных различий в % В-клеток в культуре; однако, когда эти клетки подвергали проточной цитометрии, скопление клеток наблюдали в картине окрашивания FWD X 90 для культур, содержащих мультиспецифический связывающий (слитый) белок, что указывало на то, что В-клетки, экспрессирующие два антигена-мишени, участвовали в гомотипической адгезии. После 72 часов в культуре, мультиспецифический связывающий (слитый) белок приводил к смерти почти всех присутствующих В-клеток. Объединение двух SMIP с единственной специфичностью также разительно уменьшало процент В-клеток, но не до уровня, наблюдаемого с мультиспецифической связывающей молекулой. Эти данные предполагают, что участие обоих связывающих доменов для CD20 и CD37 на одной и той же мультиспецифической молекуле, приводит к гомотипической адгезии между В-клетками и может также приводить к связыванию как CD20-, так и CD37-антигенов на одной и той же клетке. Не желая быть связанными теорией, авторы считают, что синергетическое действие в элиминации клеток-мишеней может быть обусловлено (1) связыванием через связывающие домены 1 и 2 на одних и тех же типах клеток и/или (2) взаимодействиями домена эффекторной функции (константной субобласти) мультивалентных связывающих молекул с моноцитами или другими типами клеток в культуре PBMC, которые приводят к задержанному уничтожению. Кинетики этого уничтожающего действия не являются быстрыми, занимая более 24 часов до их достижения, что указывает на то, что это действие может быть вторичным эффектом, требующим продуцирования цитокинов или других молекул, прежде чем наблюдаются эти эффекты.
Анализы апоптоза
Фигура 17 показывает результаты экспериментов, предназначенных для выяснения индукции апоптоза после обработки В-клеточных линий либо мультиспецифическими, мультивалентными связывающими (слитыми) белками [2H7-sss-hIgG-H7-G28-1 HL], либо CD20 и/или CD37 SMIP с единственной специфичностью, по отдельности или в комбинации друг с другом. Клетки Ramos (панель A; ATCC No. CRL-1596) и клетки Дауди (панель B; ATCC No. CCL-213) инкубировали в течение ночи (24 часа) при 37ºC в 5% CO2 в полной среде Исков (Gibco) с 10% ФТС при 3×105 клеток/мл и 5, 10 или 20 мкг/мл слитых белков. Для комбинированных экспериментов с SMIP с единственной специфичностью, эти белки использовали в следующих концентрациях: TRU-015 (CD20-направленный SMIP) = 10 мкг/мл, с 5 мкг/мл G28-1 LH (CD37-направленный SMIP). Альтернативно, TRU-015 = 20 мкг/мл объединяли с G28-1 LH при 10 мкг/мл. Затем клетки окрашивали Аннексином V-FITC и иодидом пропидия с использованием набора для детектирования апоптоза BD Pharmingen Apoptosis Detection Kit I (cat. no. 556547) и обрабатывали в соответствии с инструкциями набора. Эти клетки острожно перемешивали на вортексе, инкубировали в темноте при комнатной температуре в течение 15 минут и разводили в 400 мкл буфера для связывания перед анализом. Пробы анализировали проточной цитометрией на приборе FACsCalibur (Becton Dickinson) с использованием программного обеспечения Cell Quest (Becton Dickinson). Эти данные представлены диаграммами в виде столбцов, представляющих процент Аннексин V/иодид пропидий-положительных клеток в зависимости от типа обработки. Ясно видно, что мультиспецифический связывающий (слитый) белок способен индуцировать значимо более высокий уровень апоптотической смерти в обеих клеточных линиях, чем реагенты с единственной специфичностью, даже при совместном применении. Эта увеличенная функциональная активность отражает взаимодействие координированного связывания рецепторов BD1 и BD2 (специфических в отношении CD20 и CD37) на клетках-мишенях.
Пример 9
Связывание и функциональные свойства мультиспецифических связывающих (слитых) белков 2H7-hIgG-G19-4
Этот пример описывает связывание и функциональные свойства мультиспецифических слитых белков 2H7-hIgG-G19-4. Конструирование этих молекул описано в примере 7. Экспрессия и очистка являются такими, какие описаны в предыдущих примерах.
Эксперименты по связыванию выполняли, как описано для предыдущих молекул, за исключением того, что клетками-мишенями для измерения связывания CD3 были клетки Jurkat, экспрессирующие CD3 на их поверхности. См. фигуру 18, где верхний график показывает кривые связывания, полученные для связывания мультиспецифических молекул CD20-CD3 с клетками Jurkat с использованием очищенных белков, серийно разведенных от 20 до 0,05 мкг/мл. Ориентация HL G19-4-специфичности, по-видимому, связывается лучше с антигеном CD3, чем ориентация LH. Нижняя панель показывает кривые связывания, полученные для BD1, связывающего домена, узнающего CD20. Все из этих молекул связывают хорошо и на уровне, приблизительно эквивалентном связыванию SMIP с единственной специфичностью в отношении CD20.
Анализы ADCC
Для данных, представленных на фигуре 19, анализы ADCC выполняли, как описано в предыдущем примере. В этом случае, слитые белки были все 2H7-hIgG-G19-4-вариантами или комбинациями SMIP с единственной специфичностью (2H7, специфические в отношении CD20) или антителами (G19-4, специфические в отношении CD3). Кроме того, для данных, представленных в нижней панели фигуры 19, NK-клетки были элиминированы (истощены) из PBMC перед использованием истощением при помощи магнитных гранул с использованием прибора для разделения с колонкой MACS (Miltenyi Biotec, Auburn, CA) и магнитных гранул, специфических для CD16 NK-клеток (cat no.: 130-045-701). Данные, представленные в этих двух панелях, демонстрируют, что все мультиспецифические молекулы CD20-hIgG-CD3 опосредуют ADCC, независимо от того, истощены ли NK-клетки, или используют тотальные PBMC в этом анализе. Для TRU015 или комбинаций G19-4 и TRU015, только культуры, содержащие NK-клетки, могли опосредовать ADCC. G19-4 не работал хорошо ни в одном анализе против BJAB-мишеней, которые не экспрессируют CD3, хотя G19-4 мог связываться с CD3-экспрессирующими NК-Т-клетками и активировать эти клетки в первом показанном анализе. Уничтожение, наблюдаемое в нижней панели для мультиспецифических связывающих (слитых) белков, опосредуется, возможно, через активацию цитотоксичности в популяции Т-клеток связыванием CD3, против мишеней BJAB, экспрессирующих антиген CD20. Уничтожающая актиность является, по-видимому, нечувствительной к дозе этих молекул на протяжении использованного диапазона концентраций, и все еще является значимо отличающейся от других испытанных молекул, даже при концентрации 0,01 мкг/мл.
Пример 10
Мультивалентные связывающие молекулы
Другие варианты осуществления включают линкерные домены, полученные из иммуноглобулинов. Более конкретно, последовательности-источники для этих линкеров являются последовательностями, полученными сравнением областей, присутствующих между V-подобными доменами или V- и C-подобными доменами других членов суперсемейства иммуноглобулинов. Поскольку эти последовательности обычно экспрессируются в виде части внеклеточного домена рецепторов клеточной поверхности, ожидается, что они являются более стабильными к протеолитическому расщеплению и должны также не быть иммуногенными. Один тип последовательности, в отношении которой не ожидается, что она является применимой в роли линкера для мультивалентных связывающих (слитых) белков, является тип последовательности, экспрессируемый на поверхностно экспрессируемых членах -Ig-суперсемейства, но не встречающийся в промежуточной области между С-подобным доменом и трансмембранным доменом. Многие из этих молекул наблюдались в растворимой форме, и они расщепляются в этих промежуточных областях вблизи клеточной мембраны, что указывает на то, что эти последовательности являются более чувствительными к расщеплению, чем остальная часть молекулы.
Описанные выше линкеры либо встраивают в SMIP с единственной специфичностью, между связывающим доменом и доменом с эффекторной функцией, либо встраивают в одно из двух возможных линкерных положений в мультивалентном связывающем (слитом) белке, как описано здесь.
Полный список последовательностей, описанных в этой заявке, прилагается и включен здесь в качестве ссылки в его полном виде. Цветное кодирование, указывающее последовательность различных областей или доменов конкретных полинуклеотидов и полипептидов, применимо в идентификации соответствующей области или домена в последовательности любых из описанных здесь молекул.
Пример 11
Матрица для скрининга на кандидаты-скорпионы, поражающие В-клетки
Введение
В качестве средства идентификации комбинаций спаренных связывающих доменов моноклональных антител, которые с наибольшей вероятностью могли бы давать применимые и сильные мультивалентные связывающие молекулы, или скорпионы, против популяции-мишени, ряд моноклональных антител против В-клеточных антигенов испытывали в комбинированной матрице против В-клеточных линий, представляющих различные не-ходжкинские лимфомы. Для гарантии, что анализируются все возможные парные сравнения антител, в отношении которых известно или предполагается, что они связываются с представляющей интерес клеткой, может быть использована двухмерная матрица (шаблон) для проведения исследований этого плана с использованием конкретного типа клеток. Моноклональные антитела против многочисленных В-клеточных антигенов, известные по их кластерным обозначениям (CD), регистрируюся в левом столбце. Некоторые из этих антител (обозначенных по антигену (антигенам) с которыми они специфически связываются), т.е. CD19, CD20, CD21, CD22, CD23, CD30, CD37, CD40, CD70, CD72, CD79a, CD79b, CD80, CD81, CD86 и CL II (MHC Class II), инкубировали, по отдельности или в комбинации с другими членами этого набора моноклональных антител, с антиген-положительными клетками-мишениями. Вариабельные домены этих антител рассматриваются как связывающие домены в примерных вариантах мультивалентных связывающих молекул. С использований знаний в этой области и рутинных процедур специалисты в данной области способны идентифицировать последовательности антител (нуклеиновых кислот, кодирующих последовательности, а также аминокислотные последовательности), например, в публично доступной базе данных, для генерирования подходящего антитела или его фрагмента (например, клонированием на основе гибридизации, ПЦР, пептидным синтезом и т.п.) и конструировать мультивалентные связывающие молекул с использованием таких соединений. Источники примерных антител, из которых получали связывающие домены, как описано здесь, обеспечены в таблице 6. Обычно, будет использоваться стратегия клонирования или синтеза, которая реализует CDR-области цепи антитела, хотя рассматривается любое антитело, его фрагмент или его производное, котоые сохраняют способность специфически связываться с антигеном-мишенью.
Более подробно, клонирование вариабельных областей тяжелой и/или легкой цепи антител из гибридом является стандартным в данной области. Для получения такой области с использованием общепринятых способов клонирования не требуется, чтобы последовательность представляющей интерес вариабельной области была известной. См., например, Gilliland et al., Tissue Antigens 47(1): 1-20 (1996). Для получения одноцепочечных полипептидов, содержащих вариабельную область, узнающую антиген мышиных или человеческих лейкоцитов, был придуман способ для быстрого клонирования и экспрессии, который давал функциональный белок в пределах двух-трех недель выделения РНК из гибридомных клеток. Вариабельные области клонировали наращиванием поли-G-хвоста кДНК первой цепи с последующей якорной ПЦР с прямым поли-С-якорным праймером и обратным праймером, специфическим в отношении последовательности константной области. Оба праймера содержат фланкирующие сайты рестриктаз для встраивания в pUC19. Были генерированы наборы праймеров для выделения генов VL и VH мышиных, хомячка и крысы. После определения консенсусных последовательностей для конкретной пары VL и VH, эти гены VL и VH связывали при помощи ДНК, кодирующей промежуточный пептидный линкер (обычно кодирующий (Gly4Ser)3), и эти кассеты генов VL-линкер-VH переносили в экспрессирующий вектор млекопитающих pCDM8. Эти конструкции трансфицировали в клетки COS и scFv извлекали из супернатанта кондиционированной культуральной среды. Этот способ был успешно использован для генерирования функциональных scFv к CD2, CD3, CD4, CD8, CD28, CD40, CD45 человека и к CD3 и gp39 мыши, из гибридом, продуцирующих мышиные, крысиные антитела или антитела хомячка. Сначала эти scFv экспрессировали в виде слитых белков с доменами шарнир-СН2-СН3 IgG1 человека для облегчения быстрой характеристики и очистки с использованием реагентов антитело козы против IgG человека или белок А. Активные scFv могли быть также экспрессированы с малым пептидом, например, меткой, или в не содержащей хвоста форме. Экспрессия не имеющих хвоста форм CD3 (G19-4) scFv показала увеличенную клеточную передачу сигнала и обнаружила, что scFv имеют потенциал для активации рецепторов.
Альтернативно, идентификация первичной аминокислотной последовательности вариабельных доменов моноклональных антител может быть достигнута, например, ограниченным протеолизом антитела с последующим N-концевым пептидным секвенированием, например, с использованием способа деградации Эдмана или фрагментирующей масс-спектроскопии. Способы N-концевого секвенирования хорошо известны в данной области. После определения первичной аминокислотной последовательности, вариабельных доменов, кДНК, кодирующую эту последовательность, собирают способами синтеза нуклеиновых кислот (например, ПЦР) с последующим генерированием scFv. Эти необходимые или предпочтительные способы манипуляции нуклеиновыми кислотами являются стандартными в данной области.
Фрагменты, производные и аналоги антител, описанные выше, также рассматриваются в качестве подходящих связывающих доменов. Далее, рассматриваются любые из описанных выше константных субобластей, в том числе константные субобласти, содержащие любые из вышеописанных шарнирных областей. Кроме того, мультивалентные одноцепочечные связывающие молекулы, описанные в этом примере, могут включать любой или все из описанных здесь линкеров.
Моноклональные антитела сначала подвергали действию клеток и затем сшивали с использованием антитела козы против мышиного Ig второй стадии (2-ая стадия). Необязательно, можно сшивать эти антитела перед контактированием клеток с этими антителами, например, сшиванием этих антител в растворе. В качестве другой альтернативы, моноклональные антитела могут быть сшиты в твердой фазе адсорбцией на пластиковое дно лунок для культуры ткани или «уловлены» на этом пластике с использованием антитела козы против мыши, адсорбированного на этом пластике, с последующими анализами на основе планшета для оценки, например, остановки роста или жизнеспособности клеток.
Смещение фосфатидилсерина из цитозольной стороны клеточной мембраны на наружную клеточную поверхность клеточной мембраны является общепризнанным показателем проапоптотических событий. Прогрессирование апоптоза приводит к потере целостности клеточной мембраны, которая может быть детектирована по вхождению не проникающего в целую клетку интеркалярного красителя, например, иодида пропидия (PI). После контактирования клеток с моноклональными антителами отдельно или в комбинации выполняют двойной, проапопототический анализ и обработанныеые популяции клеток оценивают в баллах на положительный в отношении клеточной поверхности аннексин V (ANN) и/или включение PI.
Анализ связывания аннексина V/интернализации иодида пропидия
Клетки и условия культивирования клеток. Выполняли эксперименты для испытания действия сшивания двух разных моноклональных антител против мишеней, экспрессируемых на четырех В-клеточных линиях. Действия на клеточных линиях измеряли определением уровней окрашивания ANN и/или PI после контактирования. В-клеточные линии человека BJAB, Ramos (ATCC#CRL-1596), Daudi (ATCC#CCL-213) и DHL-4 (DSMZ#ACC495) инкубировали в течение 24 часов при 37ºC в 5% CO2 в полной среде Исков (Gibco) с 10% ФТС. Клетки поддерживали при плотности 2-8 x 105 клеток/мл и жизнеспособности обычно >95% перед исследованием.
Эксперименты проводили при плотности 2×105 клеток/мл и 2 мкг/мл каждого сравниваемого моноклонального антитела из матрицы против В-клеточных антигенов. Каждое сравниваемое моноклональное антитело добавляли при 2 мкг/мл отдельно или индивидуально при объединении с каждым моноклональным антителом матрицы, также при 2 мкг/мл. Таблица 6 дает список номеров по каталогу и источников моноклональных антител, используемых в этих экспериментах. Для сшивания этих моноклональных антител в растворе, антитело козы против IgG мыши (Jackson Labs catalog no.115-001-008) добавляли в каждую лунку при соотношении концентраций 2:1 (козье антимышиное антитело:каждое моноклональное антитело), например, лунка только с одним моноклональным антителом 2 мкг/мл будет иметь козье антимышиное антитело, добавленное до конечной концентрации 4 мкг/мл, в то время как лунки как со сравниваемым моноклональным антителом (2 мкг/мл), так и с моноклональным антителом из матрицы (2 мкг/мл) будут иметь 8 мкг/мл антитела козы против мыши, добавленного в эту лунку.
После 24 часов инкубирования при 37ºС в 5% CO2, клетки окрашивали смесью Аннексина V-FITC и иодида пропидия с использованием набора для детектирования апоптоза BD Pharmingen Annexin V-FITC Apoptosis Detection Kit I (#556547). Вкратце, клетки промывали дважды холодным ЗФР и ресуспендировали в «буфере для связывания» при 1 × 106 клеток/мл. Затем сто микролитров этих клеток в буфере для связывания окрашивали 5 мкл Aннексина V-FITC и 5 мкл иодида пропидия. Эти клетки осторожно перемешивали и инкубировали в темноте при комнатной температуре в течение 15 минут. Затем к каждой пробе добавляли четыреста микролитров буфера для связывания. Затем эти пробы считывали на FACsCalibur (Becton Dickinson) и анализировали с использованием программного обеспечения Cell Quest software (Becton Dickinson).
Таблица 6. Антитела против В-клеточных антигенов, используемые в этом исследовании и их источники
Добавление сшитого антитела (например, антитела козы против мыши) к моноклональному антителу А отдельно приводило к увеличенной клеточной чувствительности, что предполагает, что мультивалентная связывающая молекула, или скорпион, сконструированная с двумя связывающими доменами, узнающими один и тот же антиген, могла бы быть эффективной в увеличении клеточной чувствительности. Без связывания теорией, авторы считают, что эта увеличенная чувствительность могла бы быть обусловлена образованием кластеров антигенов и измененной передачей сигнала. Члены семейства рецепторов TNF, например, требуют гомомультимеризации для передачи сигнала, и скорпионы с эквивалентными связывающими доменами на каждом конце этой молекулы могли бы облегчать это взаимодействие. Это образование кластеров и последующая передача сигнала CD40 является примером это феномена в В-клеточной системе.
Как показано на фигурах 20, 21 и 22, добавление моноклонального антитела А и моноклонального антитела В против различных антигенов будет производить аддитивные или в некоторых комбинациях более, чем аддитивные (т.е. синергетические) проапоптотические действия на обработанные клетки. На фигуре 20, например, комбинация анти-CD20 с моноклональными антителами против других В-клеточных антигенов приводила, до варьирующих степеней, к увеличенной клеточной чувствительности. Однако некоторые комбинации, такие как анти-CD20-антитело, объединенное с анти-CD19-антителом, или анти-CD20-антитело, объединенное с анти-CD21-антителом, производили более чем аддитивные проапоптотические действия, показывая, что мультивалентные связывающие молекулы, или скорпионы, составленные из этих связывающих доменов, должны быть особенно эффективными в элиминации перерожденных (малигнизированных) В-клеток. Согласно фигуре 20, процент клеток, проявляющих проапоптотические активности при подвергании действию одного анти-CD20-антитела, равен приблизительно 33% (вертикально заштрихованный столбец, соответствующий «20», т.е. анти-CD20-антителу); процент проапоптотических клеток после подвергания действию анти-CD19-антитела равен приблизительно 12% (вертикально заштрихованный столбец на фиг.20, соответствующий «19», т.е. анти-CD19-антителу); и процент проапоптотических клеток после подвергания действию как анти-CD20-антитела, так и анти-CD19-антитела равен приблизительно 73% (горизонтально заштрихованный столбец на фиг.20, соответствующий «19»). 73% проапоптотических клеток после подвергания действию обоих антител, является существенно большей величиной, чем сумма 45% (33% + 12%) действий, приписываемых каждому индивидуальному антителу, что свидетельствует о синергетическом действии, приписываемом паре анти-CD19 и анти-CD-20. Применимые мультивалентные связывающее молекулы включают молекулы, в которых эти два связывающих домена приводят к аддитивному действию на поведение В-клеток, так же как и две связывающие молекулы, в которых эти два связывающих домена приводят к синергетическим действиям на поведение В-клеток. В некоторых вариантах осуществления, один связывающий домен не будет иметь детектируемого действия на измеряемый параметр поведения клеток, причем каждый из спаренных связывающих доменов вносит вклад в разные аспекты активностей этой мультивалентной связывающей молекулы, такой как мультиспецифическая, мультивалентная связывающая молекула (например, связывающий домен А связывается с клеткой-мишенью и стимулирует апоптоз, в то время как связывающий домен В связывается с растворимым терапевтическим веществом, таким как цитотоксин). В зависимости от строения мультивалентной связывающей молекулы, полученный тип объединенного действия (аддитивный, синергетический или ингибирующий) этих двух связывающих доменов на клетку-мишень может не быть релевантным (соответствующим простому расчету), так как один из связывающих доменов является специфическим в отношении неклеточного (например, растворимого) партнера связывания или является специфическим в отношении ассоциированного с клеткой партнера связывания, но на другом типе клеток.
Примерные спаривания связывающих доменов, производящие аддитивные, синергетические или ингибирующие действия, как показано на фигурах 20-23, являются очевидными из таблиц 7 и 8. Таблица 7 обеспечивает количественные данные, взятые из каждой из фигур 20-23, в процентах клеток, окрашивающихся положительно на ANN и/или PI. Таблица 8 обеспечивает расчеты с использованием данных таблицы 7, которые обеспечили основу для определения, приводило ли взаимодействие конкретной пары антител к аддитивному, синергетическому или ингибирующему действию, опять, как оценивалось по проценту клеток, окрашивающихся положительно на ANN и/или PI.
В некоторых вариантах осуществления, эти два связывающих домена взаимодействуют ингибирующим, аддитивным или синергетическим образом в сенсибилизации (или десенсибилизации) клетки-мишени, такой как В-клетка. Фигура 23 показывает защитные, или ингибирующие, действия, происходящие из объединения анти-CD22-антитела с сильно действующими проапоптотическими моноклональными антителами, такими как анти-CD79b-антитело или анти-MHC класса II (т.е. анти-CL II)-антитело. Например, фигура 23 и таблица 7 показывают, что анти-CD22-антитело одно индуцирует не более приблизительно 10% клеток для проявления проапоптотического поведения (черный столбец, соответствующий "22" на фигуре 23), а анти-CD79b индуцирует приблизительно 26% проапоптотических клеток (черный столбец, соответствующий "CD79b" на фигуре 23). Однако, в комбинации анти-CD22 и анти-CD79b индуцируют только приблизительно 16% проапоптотических клеток (наклонно заштрихованный столбец, соответствующий "79b" на фигуре 23). Таким образом, эти объединенные антитела индуцируют 16% проапоптотических клеток, что составляет менее 38% суммы индивидуальных эффектов, приписываемых анти-CD22 (12%) и анти-CD79b (26%). С использованием этого подхода, исследование фигуры 23 и/или таблиц 7-8 выявляет, что анти-CD22-антитело и, в более широком плане, мультиспецифическая, мультивалентная связывающая молекула, содержащая анти-CD22-связывающий домен, при применении в отдельной комбинации с каждым из следующих антител (или соответствующих связывающих доменов): анти-CD19, анти-CD20, анти-CD21, анти-CD23, анти-CD30, анти-CD37, анти-CD40, анти-CD70, анти-CD72, анти-CD79a, анти-CD79b, анти-CD80, анти-CD81, анти-CD86 и анти-MHC класса II-антитела/связывающие домены, будет приводить к ингибированому общему действию.
Не желая связывать себя с теорией, авторы считают, что эти данные могут быть интерпретированы как указание на то, что анти-CD22-антитело, или мультиспецифическая, мультивалентная связывающая молекула, содержащая анти-CD22-связывающий домен, будет защищать против действия или ослаблять действие, любого из антител, перечисленных непосредственно выше. В более общем виде, мультиспецифическая, мультивалентная связывающая молекула, содержащая анти-CD22-связывающий домен, будет ингибировать действие, возникающее из взаимодействия с любой из молекул CD19, CD20, CD21, CD23, CD30, CD37, CD40, CD70, CD72, CD79a, CD79b, CD80, CD81, CD86 и молекул МНС класса II. На фигуре 23 и в таблице 8 можно видеть, что анти-CD22-антитело и, в более широком плане, связывающий домен, содержащий анти-CD22-связывающий домен, будет действовать в качестве ингибитора или ослабителя активности любого антитела/связывающего домена, узнающего маркер В-клеточной поверхности, такой как CD-антиген. Ожидается, что мультивалентные связывающие молекулы, в том числе мультиспецифические, мультивалентные связывающие молекулы, являются применимыми в улучшении схем лечения для различных заболеваний, в которых активность связывающего домена требует ослабления или контролирования.
Кроме ингибирующего, аддитивного или синергетического объединенного действия двух связывающих доменов, взаимодействующих с клеткой-мишенью, обычно через связывание лигандов клеточной поверхности, описанные здесь экспериментальные результаты установили, что конкретная пара связывающих доменов может обеспечивать разный тип объединенного действия в зависимости от относительных концентраций этих двух связывающих доменов, увеличивая тем самым многосторонность этого изобретения. Например, таблица 8 раскрывает, что анти-CD21 и анти-CD79b взаимодействуют ингибирующим образом при более высокой испытанной концентрации анти-CD79b, но эти два антитела взаимодействуют синергетическим образом при более низкой испытанной концентрации анти-CD79b. Хотя некоторые варианты осуществления будут использовать единственный тип мультивалентной связывающей молекулы, т.е. мультиспецифическую, мультивалентную связывающую молекулу, содержащую, например, единственный CD21-связывающий домен и единственный CD79b-связывающий домен, это изобретение включает смеси мультивалентных связывающих молекул, которые позволят коррекции относительных концентраций связывающих доменов для получения желаемого эффекта, такого как ингибирующий, аддитивный или синергетический эффект. Кроме того, способы этого изобретения включают применение единственной мультивалентной связывающей молекулы в комбинации с другой связывающей молекулой, такой как молекула обычного антитела, для коррекции или оптимизации относительных концентраций связывающих доменов. Специалисты в данной области смогут определить применимые относительные концентрации связывающих доменов с использованием стандартных способов (например, созданием экспериментальных матриц (шаблонов) двух серий разведений, по одному для каждого связывающего домена).
Без связывания себя теорией, авторы считают, что связывание одного лиганда может индуцировать или модулировать появление на поверхности второго лиганда на том же самом типе клеток, или оно может изменять контекст поверхности второго лиганда таким образом, что изменяется ее чувствительность к связыванию специфической связывающей молекулой, такой как антитело или мультивалентная связывающая молекула.
Хотя представленные здесь с использованием В-клеточных линий и антигенов, эти способы определения оптимально эффективных мультивалентных связывающих молекул (т.е. скорпионов) применимы к другим патологическим картинам и популяциям клеток-мишеней, в том числе к другим нормальным клеткам, их аберрантным копиям, включающим хронически стимулируемые гемопоэтические клетки, раковые клетки и инфицированные клетки.
Другие фенотипы передачи сигналов, такие как мобилизация Ca2+; фосфорегуляция тирозина; активация каспаз; активация NF-κB; высвобождение цитокинов, факторов роста или хемокинов; или экспрессия генов (например, в репортерных системах), также подлежат применению в способах скрининга на прямые эффекты комбинаций моноклональных антител.
В качестве альтернативы применению вторичного антитела для сшивания первичных антител и имитации мультивалентной связывающей молекулы или структуры скорпиона, другие молекулы, которые связывают Fc-часть антител, включающие растворимые Fc-рецепторы, белок А, компоненты комплемента, в том числе С1q, маннозусвязывающий лектин, гранулы или матриксы, содержащие реактивные или сшивающие агенты, бифункциональные химические сшивающие агенты и адсорбцию на пластике, могли бы использоваться для сшивания множественных моноклональных антител против одинаковых или различных антигенов.
Пример 12
Структуры мультивалентного связывающего белка с эффекторной функцией, или скорпиона
Общей схематической структурой полипептида-скорпиона является H2N-связывающий домен 1 - линкер-скорпион - константная субобласть - связывающий домен 2. Скорпионы могут также иметь шарнир-подобную область, обычно пептидную область, полученную из шарнира антитела, расположенную с N-конца относительно связывающего домена 1. В некоторых вариантах скорпионов, связывающий домен 1 и связывающий домен 2, каждый, получены из связывающего домена иммуноглобулина, например, получены из VL и VH. VL и VH обычно соединены линкером. Были проведены эксперименты для демонстрации, что полипептиды-скорпионы могут иметь связывающие домены, которые отличаются от связывающего домена иммуноглобулина, в том числе Ig-связывающего домена, из которого был получен связывающий домен скорпиона, различиями аминокислотной последовательности, которые приводят к расхождению, обычно меньшему, чем 5% и предпочтительно меньшему, чем 1%, относительно связывающего домена Ig-источника.
Часто, эти различия последовательности приводят к измепнениям отдельных аминокислот, таким как замены. Предпочтительным местоположением для таких аминокислотных изменений является один или несколько областей связывающего домена скорпиона, которые соответствуют по меньшей мере 80% и предпочтительно 85% или 90% последовательности или проявляют по меньшей мере 80% и предпочтительно 85% или 90%-ную идентичность последовательности с определяющим комплементарность областью (CDR) связыающего домена Ig, из которого был получен связывающий домен скорпиона. Дополнительное руководство обеспечивается сравнением моделей пептидов, связывающих ту же самую мишень, такую как CD20. Что касается CD20, картирование эпитопов выявило, что антитело 2Н7, которое связывает CD20, узнает мотив Ala-Asn-Pro-Ser (ANPS) CD20, и ожидается, что CD20-связывающие скорпионы будут также узнавать этот мотив. Ожидается, что изменения аминокислотной последовательности, которые приводят к мотиву ANPS, глубоко погруженному в карман, образуемый областями связывающих доменов скорпиона, соответствующими CDR Ig, является функциональными связывающими агентами CD20. Исследования по моделированию выявили также, что области скорпиона, соответствующие CDR3 (VL), CDR1-3 (VH), контактируют с CD20, и ожидается, что изменения, которые поддерживают или облегчают эти контакты, дают скорпионы, которые связывают CD20.
Кроме облегчения взаимодействия скорпиона с его мишенью, рассматриваются изменения последовательностей связывающих доменов скорпиона (относительно последовательностей связывающих доменов соответствующего Ig), которые стимулируют взаимодействие между областями связывающих доменов скорпиона, которые соответствуют доменам VL and VH Ig. Например, в CD20-связывающей области скорпиона, соответствующем VL, последовательность SYIV может быть изменена заменой одной аминокислоты, такой как Val (V33), гистидином His, что приводит к последовательности SYIH. Ожидается, что это изменение улучшает взаимодействие между областями скорпиона, соответствующими доменам VL и VH. Далее, ожидается, что добавление остатка на N-конце области скорпиона, соответствующего VH-CDR3, будет изменять ориентацию этой области скорпиона, влияя, возможно на его свойства связывания, так как этот N-концевой Ser VH-CDR3 вступает в контакт с CD20. Рутинные анализы будут выявлять ориентации, которые дают желаемые изменения в свойствах связывания. Обсуждается также, что мутации в областях скорпиона, соответствующих VR-CDR2 и/или VR-CDR3, будут создавать потенциальные новые контакты с мишенью, такой как CD20. Например, на основе исследований по моделированию, ожидается, что замены либо Y105, либо W106 (обнаруженных в последовательности NSYW) в области, соответствующем VH-CDR3, будут изменять характеристики связывания скорпиона таким образом, что будет возможен рутинный анализ для идентификации скорпионов с модифицированными характеристиками связывания. В качестве дополнительного примера, ожидается, что изменение в последовательности связывающего домена скорпиона, соответствующего VL-CDR3 Ig, такое как, Trp (W) в последовательности CQQW, будет влиять на связывание. Обычно, изменения в области скорпиона, соответствующем CDR Ig, будет подвергнуто скринингу на скорпионы, обнаруживающие изменение в аффинности в отношении этой мишени.
На основе модельной структуры связывающего домена 20-4 гуманизированного CD20-scFv, на основе опубликованной информации, относящейся к структуре внеклеточной петли CD20 (Du, et al, J Biol. Chem. 282(20): 15073-80 (2007)) и на основе связывающего эпитопа CD20, узнаваемого мышиным антителом 2Н7 (которое является источником CDR для связывающего домена гуманизированного 20-4 scFv) генерировали мутации в CDR-областях скорпиона 2Lm20-4x2Lm20-4 с целью улучшения аффинности его связывания с CD20. Во-первых, эти мутации были сконструированы для влияния на конформацию 20-4 CDR и для стимуляции более эффективного связывания с внеклеточной петлей CD20. Во-вторых, введенные изменения были сконструированы для обеспечения новых межмолекулярных взаимодействий между скорпионом 2Lm20-4x2Lm20-4 и его мишенью. Эти мутации включают: VL CDR1 V33H, т.е. замену Val на His в положении 33 CDR1 в VL-области), VL CDR3 W90Y, VH CDR2 D57E, VH CDR3 инсерцию V после остатка S99, VH CDR3 Y101K, VH CDR3 N103G, VH CDR3 N104G и VH CDR3 Y105D. Вследствие ожидаемых синергетических эффектов комбинирования этих мутаций были сконструированы 11 мутантов, объединяющих различные мутации, показанные в таблице 9 (введенные мутацией остатки показаны жирным шрифтом и подчеркнуты).
Мутации вводили в связывающие домены CD20xCD20-скорпиона (2Lm20-4x2Lm20-4) ПЦР-мутагенезом с использованием праймеров, кодирующих измененную область последовательности. После подтверждения последовательности, ДНК-фрагменты, кодирующие scFv-фрагменты 2Lm20-4 с соответствующими мутациями, клонировали в обычный экспрессирующий вектор, содержащий кодирующую область константной субобласти скорпиона, что приводило к полинуклеотиду, содержащему полную последовательность ДНК новых версий скорпиона 2Lm20-4x2Lm20-4. Эти варианты скорпиона 2Lm20-4x2Lm20-4 с мутациями CDR получали экспрессией в транзиторной системе клеток COS и очищали Белок А хроматографией и вытеснительной (гель-фильтрационной) (SEC) хроматографией. Связывающие свойства вариантов скорпиона 2Lm20-4x2Lm20-4 оценивали FACS-анализом с использованием первичных В-клеток и линии клеток В лимфомы WIL2-S.
Другие мутанты также генерировали с использованием сходного подхода для оптимизации CD20-связывающих доменов. Эти CD20 SMIP, названные TRU015, служили в качестве субстрата для генерирования мутантов, и если нет других указаний, все домены были доменами человека. Было обнаружено, что следующие мутанты содержат ценные и функциональные CD20-связывающие домены. Молекула 018008 содержала замену Q вместо S (однобуквенный код аминокислот) в положении 27 CDR1 в VL, замену S вместо Т в положении 28 в CDR1 VH и замену L вместо V в положении 102 в CDR3 VH. Следующие частичные последовательности линкера-скорпиона, соответствующие последовательности CCCP в шарнирной области IgG1, отдельно комбинировали с мутированными VL и VH: CSCS, SCCS и SCCP, в соответствии с модульным строением скорпионов. Эта молекула 018009 содержала замену Q вместо S в положении 27 CDR1 VL, замену S вместо Т в положении 28 CDR1 VH и замены S вместо V в положении 96, L вместо V в положении 102 и делецию V в положении 95, все в CDR3 VH. Те же самые субпоследовательности линкеров-скорпионов, описанные выше как обнаруженные в линкерах-скорпионах, используемых в 018008, использовали в 018009. Эта молекула 018010 содержала замены Q вместо S в положении 27, I вместо М в положении 33 и V вместо Н в положении 34, все в CDR1 VL, вместе с заменой S вместо Т в положении 28 CDR1 VH и заменой L вместо V в положении 102 в CDR3 VH. Линкеры-скорпионы, определяемые субпоследовательностями CSCS и SCCS, использовали с 018010. 018011 содержала те же самые мутации CDR1 VL и в CDR1 VH, что и описанные для 018010, вместе с делецией V в положении 95, заменой S вместо V в положении 96 и заменой L вместо V в положении 102, все в CDR3 VH. Линкеры-скорпионы, определяемые субпоследовательностями CSCS, SCCS и SCCP, использовали в молекулах 018014. Этот VL 018014 был немутированным мышиным VL, причем VH человека содержал изменение S вместо Т в положении 28 в CDR1 и изменение L вместо V в положении 102 в CDR3. Молекула 018015 также содержала немутированный VL мыши вместе с VH человека, содержащим изменение S вместо Т в положении 28 CDR1 и, в CDR3, делецию V в положении 95, замену S вместо V в положении 96 и замену L вместо V в положении 102. Молекула 2Lm5 имела Q вместо S в положении 27 в CDR1 VL, F вместо Y в положении 27 и S вместо T в положении 30, обе в CDR1 VH, а также делецию V в положении 95, S вместо V в положении 96 и L вместо V в положении 102, все в CDR3 VH. Линкеры-скорпионы, определяемые CSCS, SCCS и SCCP, использовали по отдельности в каждой из молекул 018014 и 018015. 2Lm5-1 был таким же, что и 2Lm5, за исключением того, что 2Lm5-1 не имел мутаций в CDR1 VH, и использовали только линкер-скорпион, определяемый субпоследовательностью CSSS. 2Lm6-1 имел мутации 2Lm5 и замену T вместо S в 92 и S вместо F при 93 в CDR3 VL, и использовали только линкер-скорпион, определяемый субпоследовательностью CSSS. Единственными мутациями в 2LmI6 были мутации в CDR3 VH, перечисленные выше для 2Lm5-1. Линкеры-скорпионы, определяемые субпоследовательностями CSCS, SCCS и SCCP, по отдельности использовали в 2Lml6. 2Lm16-1 имел замену Q вместо S в 27 в CDR1 VL и замену T вместо S в 92 и S вместо F в 93, обе в CDR3 VL, и, в CDR3 VH, делецию V в 95, замену S вместо V в 96 и замену L вместо V в 102; использовали только линкер-скорпион, определяемый субпоследовательностью CSSS. 2Lm19-3 имел замену Q вместо S в 27, I вместо M в 33 и V вместо H в 34, все в CDR1 VL, вместе с мутациями в CDR3 VH, перечисленными для 2Lm16-1. Линкеры-скорпионы, определяемые субпоследовательностями CSCS, SCCS и SCCP, по отдельности использовали в 2Lm19-3. Молекула 2Lm20-4 содержала замену I вместо M в 33 и V вместо H в 34, обе в CDR1 VL, вместе с мутациями CDR3 VH, перечисленными для 2Lm16-1. Для 2Lm5-l, 2Lm6-l, 2Lm16, 2Lm16-1, 2Lm19-3 и 2Lm20-4, была также замена S вместо L в положении 11 в каркасной области VH. Линкеры-скорпионы, определяемые субпоследовательностями CSCS, SCCS и SCCP, использовали по отдельности в 2Lm20-4. Наконец, замена S вместо P в положении 331 присутствовала в следующих мутантах: 018008 с линкером-скорпионом, определяемым CSCS, 018009 с каждым из линкеров-скорпионов, определяемых CSCS и SCCP, 018010 с линкером-скорпионом, определяемым CSCS, 018011 с линкером-скорпионом, определяемым SCCP, 018014 с линкером-скорпионом, определяемым CSCS, 018015 с линкером-скорпионом, определяемым CSCS, 2Lm16 с линкером-скорпионом, определяемым любым из CSCS, SCCS и SCCP, 2Lm19-3 с линкером-скорпионом, определяемым CSCS или SCCP, и 2Lm20-4 с линкером-скорпионом, определяемым CSCS или SCCP.
Кроме того, рассматриваются изменения длины линкера, соединяющего две области связывающего домена, такие как области связывающего домена скорпиона, которые соответствуют VL и VH Ig. Например, ожидается, что удаление С-концевого Asp в междоменных линкерах, где оно обнаружено, влияет на характеристики связывания скорпиона, как и замена Gly вместо Asp.
Рассматриваются также скорпионы, которые имеют линкер-скорпион (расположенный с С-конца относительно константной субобласти и с N-конца относительно связывающего домена 2), который является удлиненным относительно шарнирной области Ig, причем аминокислотные остатки добавляются с С-конца относительно любого цистеина в этом скорпионе, который соответствует цистеину шарнирной области Ig, причем цистеин этого скорпиона способен образовывать межцепочечную дисульфидную связь. Скорпионы, имеющие эти признаки, были сконструированы и характеризуются здесь ниже.
Были предприняты попытки для улучшения экспрессии, стабильности и терапевтической эффективности скорпионов посредством оптимизации линкера-скорпиона ковалентным связыванием константной субобласти и расположенного с С-конца связывающего домена 2. Скорпион-прототип, использованный для исследований по оптимизации, содержал анти-CD20-scFV (связывающий домен 1), слитый с N-конца относительно константной субобласти, полученной из CH2 и CH3 Ig, со вторым анти-CD20-scFv, слитым с C-конца относительно этой константной субобласти. Ожидается, что этот скорпион, подобно молекулам иммуноглобулина, ассоциируется через константную область (или субобласть) с образованием гомодимерного комплекса с пептидными цепями, связанными дисульфидными связями. Для получения высокого уровня экспрессии стабильной, четырехвалентной молекулы с высокой аффинностью в отношении его CD20-мишени, линкер-скорпион между константной субобластью и вторым связывающим доменом должен соответствовать следующим соображениям. Во-первых, стерическое затруднение между гомологичными связывающими доменами, несомыми двумя scFv-фрагментами (по одному scFv-фрагменту на каждом из двух мономеров скорпиона) должно быть минимизировано для облегчения сохранения нативных конформаций каждого связывающего домена. Во-вторых, конфигурации и ориентации связывающих доменов должны позволять продуктивную ассоциацию доменов и высокоаффинное связывание каждого связывающего домена с его мишенью. В-третьих, сам линкер-скорпион должен быть относительно устойчивым к протеазам и неиммуногенным.
В примерной конструкции CD20xCD20-скорпиона S0129, C-конец CH3 и второй анти-CD20-scFv-домен были связаны линкером-скорпионом 2Н7, пептидом, полученным из фрагмента, или соответствующим фрагменту, природной шарнирной области IgG1 человека. Этот линкер-скорпион 2Н7 служил в качестве основы для попыток конструирования с использованием компьютерного моделирования, которые были направлены на улучшение экспрессии скорпионов и улучшение характеристик связывания этих экспрессируемых молекул.
Для анализа линкера-скорпиона 2Н7, 3-мерную структуру димерной формы шарнирной области IgG1 человека моделировали с использованием программы (программного обеспечения) Insight II. Кристаллическая структура анти-CD20-scFv в ориентации VH-VL была выбрана в качестве ссылочной структуры для связывающих доменов 20-4 (RCSB Protein Data Bank entry code: 1A14). В интактном IgG1, этот шарнир соединяет C-конец домена CН1 с N-концом домена CH2, причем конфигурация каждого домена является такой, что остатки цистеина шарнирной области могут спариваться с образованием гомодимера. В примерной молекуле-скорпионе, полученный из шарнира линкер 2Н7 соединял С-концевую сторону домена скорпиона, полученного из домена CH3 IgG1, с N-концевой стороной части связывающего домена 2 скорпиона, полученной из домена VH2 IgG1. С использованием трехмерной (3-D) смоделированной структуры VH-VL scFv на ожидания оптимального расстояния между С-концевыми сторонами линкеров 2Н7 влияли следующие соображения. Во-первых, должна сохраняться стабильность шарнира, и стабильность улучшается димеризацией, например, гомодимеризацией, которая означает, что цистеины шарнирной области должны быть способны спариваться в присутствии этих двух уложенных связывающих доменов. В-вторых, два связывающих домена, например, scFv, должны вмещать С-концы линкеров 2Н7 без стерического затруднения для создания возможности правильной укладки белка. В-третьих, CDR каждого связывающего домена должны быть ориентированы в том же самом направлении, что и в природном антителе, так как каждый связывающий домен скорпиона-прототипа может связывать смежные рецепторы (CD20) на одной и той же клеточной поверхности. С учетом этих соображений, ожидается, что расстояние между двумя N-концевыми сторонами scFv равно приблизительно 28 Ангстрем. Ожидается, что расстояние между С-концевыми сторонами этих теоретически сконструированных линкеров 2Н7 в димерных формах скорпионов равно приблизительно 16 Ангстрем. Для соответствия расстояниям, которые, как ожидается, необходимы для оптимизации работы скорпиона, С-конец линкера 2Н7 удлиняли по меньшей мере на 3 аминокислоты. Ожидается, что такое удлинение делает возможным образование дисульфидных связей между остатками цистеина линкера 2Н7 для правильной укладки С-концевого связывающего домена 2 и облегчения правильной ориентации CDR. Кроме того, в интактном IgG1, вследствие присутствия доменов CH1 и VL1 между шарнирной областью и связывающими доменами, расстояние между связывающими доменами, несомыми этими двумя цепями, дополнительно увеличивается, и ожидается, что это дополнительно благоприятствует сшиванию соседних (смежных) рецепторов на одной и той же поверхности. Ввиду описанных выше соображений, конструировали ряд линкеров с разной длиной (таблица 10). Для минимизации иммуногенности, природные остатки, присутствующие на N-концевой стороне домена CH2 (Ala-Pro-Glu-Leu или APEL) использовали для удлинения линкера-скорпиона 2Н7 добавлением последовательности к С-концу этого линкера-скорпиона. Известно, что эти более длинные конструкции, содержащие одну или множество (Gly4Ser) линкерных единиц, являются устойчивыми к протеазам и гибкими.
Конструкции CD20xCD20-скорпионов, содержащие удлиненные линкеры-скорпионы между доменом CH3 константной субобласти и С-концевым связывающим доменом scFv, конструировали при помощи ПЦР-мутагенеза и субклонировали в общепринятый экспрессирующий вектор млекопитающих. Действие длины линкера на экспрессию CD20хCD20-скорпиона можно было анализировать сравнением выхода секретируемого белка в экспериментах с транзиторной экспрессией с использованием клеток COS или HEK293 или анализом синтеза белка и накапливания белка в клетках при помощи Вестерн-блот-анализа или пульс-чейс-исследований с35S-меченым метионином/цистеином.
Обсуждаются также гликозилированные скорпионы и, в данном контексте, обсуждается, что клетки-хозяева, экспрессирующие скорпион, могут культивироваться в присутствии углеводного модификатора (модулятора), который определен здесь как малое органическое соединение, предпочтительно с молекулярной массой менее 1000 дальтон, которое ингибирует активность фермента, участвующего в присоединении, удалении или модификации сахаров, которые являются частью углевода, присоединенной к полипептиду, как это имеет место во время созревания N-связанного углевода белка. Гликозилирование является комплексным процессом, который имеет место в эндоплазматическом ретикулуме («коровое (центральное) гликозилирование» и в тельцах Гольджи («концевое гликозилирование»). Различные ингибиторы глюкозидазы и/или маннозидазы обеспечивают один или несколько желаемых действий увеличения активности ADCC, увеличения связывания Fc-рецептора и изменения картины (распределения) гликозилирования. Примерные ингибиторы включают, но не ограничиваются ими, кастаноспермин и кифуненсин. Эффекты экспрессии скорпионов в присутствии по меньшей мере одного такого ингибитора описаны в следующем примере.
Пример 13
Уровни экспрессии и характеристика белков-скорпионов
Определяли уровни экспрессии белков-скорпионов и экспрессируемые белки характеризовали для демонстрации, что строение этого белка приводит к продуктам, имеющим практическую пользу. Моноспецифический скорпион CD20xCD20 и биспецифический скорпион CD20xCD37 экспрессировали в культуре клеток CHO DG44 с использованием общепринятых способов.
Фоновый уровень, стабильную экспрессию скорпиона CD20xCD20 S0129 (21m20-4x21m20-4) в клетках СНО DG44, культивируемых в присутствии различных питательных добавок, наблюдали, как показано на фигуре 34. Все культуральные среды содержали 50 нМ метотрексат, концентрацию, которая поддерживала число копий кодирующего скорпион полинуклеотида. Этот полинуклеотид содержал кодирующую область для белка-скорпиона, который не был оптимизирован в отношении кодонов для экспрессии в клетках CHO DG44. Этот полинуклеотид вводили в клетки с использованием вектора, как видно из фиг.34, и получали уровни экспрессии приблизительно 7-46 мкг/мл.
Определяли также уровни экспрессии после амплификации полинуклеотида, кодирующего биспецифический скорпион CD20xCD37. Вектор pD18 использовали для клонирования кодирующей области скорпиона CD20xCD37 и эту плазмиду вводили в клетки СНО DG44. Амплификация этого кодирующего полинуклеотида достигалась с использованием dhfr-метотрексатного способа, известного в данной области, где увеличение концентраций MTX используют для отбора на увеличенную копийность гена дигидрофолатредуктазы (dhfr), которая приводит к ко-амплификации прочно связанного представляющего интерес полинуклеотида. Фигура 35 показывает, что обычно наблюдались стабильные уровни экспрессии приблизительно 22-118 мкг/мл биспецифического скорпиона CD20xCD37. При разных условиях, в том числе при разных концентрациях метотрексата, наблюдали вариабельность в выходе, но эти переменные могут быть оптимизированы специалистами в данной области. Различные другие молекулы-скорпионы, описанные здесь, также подвергали анализам на экспрессию в клетках СНО и/или COS, причем эти результаты обеспечены в таблице 11 ниже. Эти результаты демонстрируют, что значительные выходы белков-скорпионов могут быть получены с использованием общепринятых способов и рутинной оптимизации способа амплификации.
Экспрессируемые белки были также охарактеризованы при помощи анализа электрофореза в ДСН-ПААГ для оценки степени гомогенности и целостности экспрессированных белков и для подтверждения молекулярной массы мономерных пептидов. Электрофорез в денатурирующих полиакриламидных гелях (4-20% Трис-Глицин) проводили в восстанавливающих и невосстанавливающих условиях. Результаты, представленные на фиг.36, выявляют единственные белковые полосы для каждого из 2Lm20-4 SCC SMIP и моноспецифического скорпиона S1000 (CD20(21m20-4)xCD20(21m20-4), S0126) с ожидаемыми мономерными молекулярными массами при восстанавливающих условиях. Эти данные устанавливают, что SMIP и скорпионы поддаются очистке в интактной форме. При невосстанавливающих условиях наблюдали следовое количество пептида, что согласуется с ожидаемым размером мономерного SMIP, с огромным большинством этого белка, появляющимся в виде единственной хорошо определенной полосы, согласующейся с димерной структурой. При этих невосстанавливающих условиях, моноспецифический белок-скорпион обнаруживал единственную хорошо определенную полосу молекулярной массы, согласующейся с димерной структурой. Эти димерные структуры как для SMIP, так и для скорпиона согласуются с их мономерными структурами, каждая из которых содержит шарнир-подобный линкер-скорпион, содержащий по меньшей мере один цистеин, способный участвовать в образовании дисульфидной связи.
Оценивали также действие линкеров-скорпионов на экспрессию и целостность скорпионов, и эти результаты показаны в Таблице 12. Эта таблица дает список вариантов линкеров-скорпионов моноспецифического скорпиона CD20xCD20 (2Lm20-4x2Lm20-4) S0129 и скорпиона CD20xCD28 S0033 (2H7sccpIgGl-H7-2el2), их целостность в виде одноцепочечных молекул и их транзиторные уровни экспрессии в клетках COS относительно исходного скорпиона S0129 или S0033, соответственно, с линкером H7 (взятым за 100%). Таблица 13 обеспечивает данные, полученные из оценки вариантов линкеров-скорпионов, включенных в скорпион CD20xCD20, вместе с аналогичными данными для скорпиона CD20xCD28. Таблица 13 обеспечивает данные полученные из оценки вариантов S0129, содержащих линкеры-скорпионы, которые являются не подобными шарнирной области линкерами, содержащими по меньшей мере один цистеин, способный к образованию дисульфидной связи; предпочтительно линкеры-скорпионы в этих молекулах получены из стеблей С-лектина Типа II. Из данных, представленных в таблице 13, очевидно, что шарнир-подобные линкеры-скорпионы могут быть ассоциированы со скорпионами, экспрессируемыми при более высоких или более низких уровнях, чем уровни немодифицированного исходного линкера-скорпиона, в анализах транзиторной экспрессии. Кроме того, некоторые из этих вариантов линкеров обнаруживают большую устойчивость к протеолитическому расщеплению, проблеме для всех или почти всех экспрессируемых белков, чем немодифицированный исходный линкер. Данные таблицы 13 показывают, что не подобные шарниру линкеры, такие как линкеры, полученные из стебля С-лектинов Типа II, обнаруживаются в скорпионах, которые проявляют характеристики связывания, которые слабо отличаются от характеристик связывания скорпионов, содержащих шарнир-подобные линкеры-скорпионы. Кроме того, скорпион, содержащий не подобный шарниру линкер-скорпион, проявляет эффекторную функцию (ADCC), которая равна или превышает ADCC, ассоциированную со скорпионами, имеющими шарнир-подобные линкеры-скорпионы.
Таблица 11

Как отмечалось в предыдущем примере, обсуждается получение посредством экспрессии скорпионов в культурах, содержащих углеводный модификатор (модулятор). В примерных вариантах осуществления, кастаноспермин (MW 189,21) добавляют в культуральную среду до конечной концентрации приблизительно 200 мкМ (что соответствует приблизительно 37,8 мкг/мл), или до диапазонов концентраций, больших, чем приблизительно 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140 или 150 мкМ и до приблизительно 300, 275, 250, 225, 200, 175, 150, 125, 100, 75, 60 или 50 мкг/мл. Например, рассматриваются диапазоны 10-50 или 50-200 или 50-300 или 100-300 или 150-250 мкМ. В других примерных вариантах осуществления, в культуральную среду добавляют DMJ, например, DMJ-HCl (MW 199,6) до конечной концентрации приблизительно 200 мкМ (соответствующей приблизительно 32,6 мкг DMJ/мл) или диапазонов концентраций, больших, чем приблизительно 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140 или 150 мкМ и до приблизительно 300, 275, 250, 225, 200, 175, 150, 125, 100, 75, 60 или 50 мкг/мл. Например, обсуждаются диапазоны 10-50 или 50-200 или 50-300 или 100-300 или 150-250 мкМ. В других примерных вариантах осуществления, кифуненсин (MW 232,2) добавляют в культуральную среду до конечной концентрации приблизительно 10 мкМ (соответствующей приблизительно 2,3 мкг/мл) или диапазонов концентраций, больших, чем приблизительно 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 мкМ и до приблизительно 50, 45, 40, 35, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12 или 11 мкМ. Например, обсуждаются диапазоны 1-10 или 1-25 или 1-50 или 5-10 или 5-25 или 5-15 мкМ.
В одном эксперименте, моноспецифический скорпион CD20xCD20 (S0129) экспрессировали в клетках, культивируемых в 200 мкМ кастаноспермина 200 μM (S0129 CS200) или 10 мкМ (избыток) кифуненсина (S0129 KF 10) и измеряли связывание или окрашивание клеток WIL2S экспрессируемым скорпионом, как показано на фиг.42. Кроме того, в сравнительных исследованиях связывания гликозилированый скорпион S0129 связывал CD16 (FCγRIII) приблизительно в три раза лучше, чем негликозилированный скорпион S0129.
В другом исследовании, исследовали ADCC-опосредованное уничтожение В-клеток BJAB гуманизированным CD20xCD20-скорпионом (S0129). Эти результаты, показанные на фиг.43, устанавливают, что этот скорпион, при экспрессии в клетках, культивируемых в присутствии либо кастаноспермина, либо кифуненсина, приводил к значимо более сильной ADCC-опосредованной смерти В-клеток BJAB для указанной концентрации воздействующего скорпиона.
Пример 14
Связывание скорпиона
a. Размещение доменов
Биспецифические скорпионы способны связывать по меньшей мере две мишени одновременно, с использованием пар связывающих доменов на N-конце и C-конце этой молекулы. Таким путем, для мишеней клеточной поверхности, эта композиция может сшивать или вызывать физическое совместное сближение этих мишеней. Специалистам в данной области будет понятно, что многие рецепторные системы активируются после такого сшивания, приводя к индукции сигнала, вызывающего изменения в клеточном фенотипе. Создание описанных здесь композиций была, частично, предназначена для максимизации такой передачи сигнала и для контроля полученного фенотипа.
Приблизительные размеры доменов композиций (составов) скорпионов, а также ожидания междоменной гибкости в смысле диапазонов междоменных углов, известны и учитывались в конструировании архитектуры скорпионов. Для скорпионов, использующих scFv-связывающие домены для связывающих доменов 1 и 2 (BD1 и BD2), N-концевой шарнир (H1) IgG1 и линкер Н7 PIMS, описанных здесь, связывающий домен на N-конце и связывающий домен на C-конце могут находиться максимально на расстоянии приблизительно 150-180 Ангстрем и минимально на расстоянии приблизительно 20-30 Ангстрем друг от друга. Связывающие домены на N-конце могут находиться максимально на расстоянии приблизительно 90-100 Aнгстрем друг от друга и минимально на расстоянии приблизительно 10-20 Aнгстрем друг от друга (статьи Deisenhofer, et al, 1976, Hoppe-Seyler's Z. Physiol. Chem. Bd. 357, S. 435-445; Gregory, et al., 1987, Mol. Immunol. 24(8):821-9; Poljak, et al., 1973, Proc. Natl. Acad. Sci., 1973, 70: 3305-3310; Bongini, et al., 2004, Proc. Natl. Acad. Sci. 101: 6466-6471; Kienberger, et al., 2004, EMBO Reports, 5: 579-583, каждая из которых включена здесь в качестве ссылки). Выбор этих размеров выполняли отчасти для того, чтобы сделать возможным расстояние рецептор-рецептор меньшим, чем это может быть оптимальным для максимальной передачи сигнала некоторых олигомеров-рецепторов (статья Paar, et al., 2002, J. Immunol, 169: 856-864, включенная здесь в качестве ссылки), с позволением включения Fc-структур, необходимых для эффекторной функции.
Связывающие домены на N- и C-конце скорпионов конструировали таким образом, что они являются гибкими структурами, для облегчения связывания мишени и получения возможности диапазона геометрий связанных мишеней. Специалистам в данной области будет также понятно, что гибкость между N- или C-концевыми связывающими доменами (BD1 и BD2, соответственно) и между этими связывающими доменами и Fc-доменом этой молекулы, а также максимальное и минимальное расстояние между рецепторами, связанными BD1 и/или BD2, может быть модифицировано, например, выбором N-концевого шарнирного домена (H1) и, посредством структурной гомологии, более C-терминально расположенного домена линкера-скорпиона (H2). Например, шарнирные домены из IgGl, IgG2, IgG3, IgG4, IgE, IgA2, синтетические шарниры и шарнир-подобный домен CH2 IgM обнаруживают различные степени гибкости, а также различные длины. Специалистам в данной области будет понятно, что оптимальный выбор Н1 и линкера-скорпиона (Н2) будет зависеть от рецепторной системы (рецепторных систем) скорпиона, сконструированных для взаимодействия с желаемым фенотипом передачи сигнала, индуцированным связыванием скорпиона.
В некоторых вариантах осуществления, скорпионы имеют линкер-скорпион (Н2), который является шарнир-подобным линкером, соответствующим шарнирному домену Ig, такому как шарнир IgG1. Эти варианты осуществления включают скорпионы, имеющие аминокислотную последовательность шарнира скорпиона, которая находится на N-терминально удлиненной последовательности, родственной, например, последовательности Н7 или последовательности шарнира IgG1 дикого типа. Примерные линкеры-скорпионы этого типа могли бы иметь последовательность шарнира H7, N-терминально удлиненную H2N-APEL(X)y-CO2H, где x обозначает звено (единицу) линкера Gly4Ser, а y обозначает число 0-3. Примером влияния линкера-скорпиона на стабильность скорпиона является исследование, выполненное с использованием двух скорпионов, биспецифического CD20xCD28-скорпиона и моноспецифического CD20xCD20-скорпиона. Для каждой из этих двух конструкций скорпиона, встраивают различные линкеры-скорпионы. В частности, линкеры-скорпионы H16 и H17, которые прежде всего различаются тем, что Н17 имеет последовательность Н16 с последовательностью Н7, присоединенной на С-конце, и линкеры-скорпионы Н18 и 19, в которых аналогично последовательность Н7 присоединяют на С-конце Н18 в генерировании Н19. Для каждого из этих двух скелетов скорпионов (20×28 и 20×20), каждый из четырех описанных выше линкеров-скорпионов встраивали в подходящем местоположении. Транзиторную (временную) экспрессию этих конструкций получали в клетках COS и белки-скорпионы, обнаруженные в этих культуральных супернатантах, очищали на покрытых белком А/G лунках (Pierce SEIZE IP kit). Очищенные белки фракционировали электрофорезом на гелях ДСН/ПААГ и визуализировали содержащим серебро красителем. Рассмотрение фиг.44 выявляет, что добавленная последовательность Н7 в линкере-скорпионе способствует стабильности каждого типа линкера-скорпиона и каждого типа белка-скорпиона. Другими словами, присоединение Н7 к С-концу Н16 или Н18 увеличивало стабильность молекулы-скорпиона, и это наблюдение сохраняется, независимо от того был ли этот скорпион CD20xCD28 или CD20xCD20. В отношении связывания мишени, белки-скорпионы, имеющие архитектуру CD20xCD20, обнаруживали сходные свойства связывания с исходным моноспецифическим гуманизированным CD20xCD20-скорпионом S0129, как показано на фиг.45.
Однако, за пределами предыдущих вариантов осуществления, может быть желательным предотвращение приближения связанных рецепторов в пределах приблизительно 50 Ангстрем друг от друга для преднамеренного создания субмаксимальных сигналов (Paar, et al, J. Immunol., 169: 856-864). В таком случае, можно было бы ожидать, что подходящим будет выбор Н1 и линкера-скорпиона (H2), которые являются более короткими и менее гибкими, чем описанные выше.
Те же самые соображения в отношении размещения в пространстве применимы к линкерам-скорпионам, которые не являются шарнир-подобными. Примером этих линкеров-скорпионов является класс пептидов, имеющих аминокислотную последовательность области «стебля» С-лектина. Примерами линкеров-скорпионов, содержащих область «стебля» С-лектина, являются шарниры-скорпионы, полученные из области стебля CD72, области стебля CD94 и области стебля NKG2A. Скорпионы, содержащие такие шарниры-скорпионы, были сконструированы и охарактеризованы в отношении экспрессии, чувствительности к расщеплению и пригодности для очистки. Эти данные представлены в таблице 14.
b. Связывание N- и C-концевых связывающих доменов
КакN-, так и C-концевые домены участвуют в связывании клетки-мишени
Связывающие клетку-мишень свойства CD20 SMIP (TRU015), CD37 SMIP (SMIP016), комбинации CD20 и CD37 SMIP (TRU015+SMIP016) и СD20xCD37 биспецифического скорпиона (015x016) оценивали измерением способности каждой из этих молекул блокировать связывание антитела, специфически конкурирующего за связывание с соответствующей мишенью, либо CD37, либо CD20. Конкурирующие антитела были FITC-меченым моноклональным анти-CD37-антителом или PE-меченым моноклональным анти-CD20-антителом, согласно необходимости. Мишенями были В-клетки Ramos.
В-клетки Ramos при 1,2×107/мл в ЗФР с 5% мышиными сыворотками (#100-113, Gemini Bio-Products, West Sacramento, CA) (окрашивающих средах) добавляли в 96-луночные V-донные планшеты (25 мкг на лунку). Разные SMIP и скорпионы разбавляли до 75 мкг/мл в окрашивающих средах и готовили 4-кратные разведения до концентраций, указанных на фиг.38. Разведенные соединения добавляли к посеянным клеткам, наряду с одной средой для контрольных лунок. Клетки инкубировали в течение 10 минут с этими соединениями и затем добавляли вместе FITC-анти-CD37-антитело (#186-040, Ancell, Bayport, MN) при 5 мкг/мл и PE-анти-CD20-антитело (#555623, BD Pharmingen, San Jose, CA) при 3 мкг/мл (неразбавленные) в 25 мкл окрашивающих сред. Эти клетки инкубировали на льду в темноте в течение 45 минут и затем промывали 2,5 раза ЗФР. Клетки фиксировали 1% параформальдегидом (#19943 1 LT, USB Corp, Cleveland, OH) и затем пропускали через FACs Calibur (BD Biosciences, San Jose, CA). Эти данные анализировали с использованием программного обеспечения Cell Quest (BD Biosciences, San Jose, CA). Результаты, показанные на фиг.38, устанавливают, что все SMIP, комбинации SMIP и скорпионы, содержащие сайт связывания CD20, успешно конкурировали с FITC-меченым анти-CD20-антителом за связывание с В-клетками Ramos (верхняя панель); все SMIP, комбинации SMIP и скорпионы, содержащие сайт связывания CD37, успешно конкурировали с FITC-меченым анти-CD37-антителом за связывание с В-клетками Ramos (нижняя панель). Таким образом, было показано, что биспецифический CD20xCD37-скорпион имеет функциональные N- и C-концевые сайты связывания для мишеней на В-клетках.
c. Персистенция на клеточной поверхности
Исследование персистенции на клеточной поверхности связанных SMIP и скорпионов (моноспецифических и биспецифических) на поверхности В-клеток выявило, что скорпионы проявляли более высокую персистенцию на клеточной поверхности, чем SMIP. В-клетки Ramos при 6×106/ml (3×105/лунка) в окрашивающей среде (2,5% козьи сыворотки, 2,5% мышиные сыворотки в ЗФР) добавляли в 96-луночные V-донные планшеты. Тест-реагенты готовили при двухкратной конечной концентрации в окрашивающей среде с получением 5-кратных серийных разведений 500 нМ исходного раствора и затем добавляли 1:1 к В-клеткам Ramos. Кроме того, засевали также среды-контроли. Клетки инкубировали в темноте на льду в течение 45 минут. Затем эти планшеты промывали 3,5 раза холодным ЗФР. Затем добавляли вторичный реагент, антитела козы против IgG человека-FITC (#H10501, Caltag/Invitrogen, Carlsbad,CA) в разведении 1:100 в окрашивающей среде. Эти клетки инкубировали в течение 30 минут в темноте на льду. Затем клетки промывали 2,5 раза центрифугированием с холодным ЗФР, фиксировали раствором 1% параформальдегида (#19943 1 LT, USB Corp, Cleveland, OH) и затем пропускали через FACs Calibur (BD Biosciences, San Jose, CA). Данные анализировали с использованием программного обеспечения CellQuest (BD Biosciences, San Jose, CA). Результаты этого анализа данных представлены на фиг.37, который показывает связывание нескольких SMIP, моноспецифического CD20xCD20-скорпиона и биспецифического CD20xCD37-скорпиона с их мишенями на В-клетках Ramos.
Две пробирки В-клеток Ramos (7×105/ml) инкубировали в течение 30 минут на льду с каждым из двух исследуемых соединений, т.е. гуманизированным CD20-(2Lm20-4)-SMIP и гуманизированным CD20xCD20-(2Lm20-4x2Lm20-4)-скорпионом, каждым при 25 мкг/мл в среде Исков с 10% ФТС. В конце инкубационного периода обе пробирки промывали 3 раза центрифугированием. Затем одну пробирку клеток высевали в 96-луночный плоскодонный планшет при 2×105 клеток на лунку в 150 мкл среды Исков, причем один планшет затем переносили в термостат с 37ºС, а другой планшет инкубировали на льду. Вторую пробирку каждого набора ресуспендировали в холодном ЗФР с 2% мышиной сывороткой и 1% азидом натрия (окрашивающая среда) и высевали в 96-луночный V-донный планшет при 2×105 клеток на лунку для немедленного окрашивания вторичным антителом, т.е. козьим FITC-анти-IgG человека (#H10501, Caltag/Invitrogen, Carlsbad, CA). Это вторичное антитело добавляли при конечном разведении 1:100 в окрашивающей среде и клетки окрашивали на льду в темноте в течение 30 минут. Затем клетки промывали 2,5 раза холодным ЗФР и фиксировали раствором 1% параформальдегида (#19943 1 LT, USB Corp, Cleveland, OH).
Во временных точках, указанных на фиг.39, брали пробы из 96-луночных плоскодонных планшетов, инкубированных либо при 37ºС, либо на льду, и помещали в 96-луночные V-донные планшеты (2×105 клеток на лунку). Эти клетки промывали один раз холодной окрашивающей средой, ресуспендировали и добавляли вторичное антитело в конечном разведении 1:100 в окрашивающей среде. Эти клетки инкубировали на льду в темноте в течение 30 минут. Затем клетки промывали 2,5 раза центрифугированием в холодном ЗФР и затем фиксировали 1% параформальдегидом. Пробы пропускали через FACS Calibur (BD Biosciences, San Jose, CA) и данные анализировали с использованием программного обеспечения CellQuest (BD Biosciences, San Jose, CA). Результаты, представленные на фиг.39, демонстрируют, что связывание SMIP и скорпиона с поверхностью B-клеток сохраняется в течение по меньшей мере шести часов, причем моноспецифический huCD20xCD20(2Lm20-4x2Lm20-4)-скорпион имеет более высокую степень персистенции, чем huCD20 (2Lm20-4)-SMIP.
Пример 15
Прямое уничтожение клеток моноспецифическими и биспецифическими скорпионами
Выполняли эксперименты для оценки способности моноспецифических и биспецифических молекул скорпионов непосредственно уничтожать клетки лимфомы, т.е. уничтожать клетки без участия ADCC или CDC. В частности, линии клеток лимфомы Su-DHL-6 и DoHH2 отдельно подвергали действию моноспецифического скорпиона, т.е. CD20xCD20-скорпиона, или биспецифического скорпиона, или CD37xCD37-скорпиона.
Культуры клеток лимфомы Su-DHL-6, DoHH2, Rec-1 и WSU-NHL устанавливали с использованием общепринятых способов и затем некоторые из этих культур индивидуально подвергали действию моноспецифического CD20-SMIP, моноспецифического скорпиона (CD20xCD20 или CD37xCD37) или биспецифического скорпиона (CD20xCD37 или CD19xCD37). Подвергание этих клеток действию SMIP или скорпионов проводили при условиях, которые не приводили к сшиванию. Эти клетки оставляли в контакте с этими молекулами в течение 96 часов, после чего рост измеряли детектированием АТФ, как известно в данной области. Уничтожение клеток, приписываемое CD20-SMIP и CD20xCD20 моноспецифическому скорпиону, можно видеть на фиг.24 и в таблице 15. Способность уничтожения клеток CD37xCD37-моноспецифического скорпиона можно видеть из фиг.25 и таблицы 15, спрособность CD20xCD37-биспецифического скорпиона уничтожать клетки лимфомы можно видеть из фиг.26 и таблицы 15 и способность CD19xCD37-биспецифического скорпиона уничтожать клетки лимфомы можно видеть из фиг.27 и таблицы 15. Данные из трех независимых экспериментов объединяли и точки представляют среднее ± SEM. Величины IC50 в таблице 15 определяли из кривых на фиг.24, 25 и 26, как отмечается в подписи к таблице 15, и они определяются как концентрация, приводящая к 50% ингибированию в сравнении с необработанными культурами. Данные на фигурах и в таблице демонстрируют, что скорпионы являются более чем в 10 раз более эффективными в уничтожении этих клеточных линий, чем свободные SMIP, использующие те же самые связывающие домены.
Дополнительные эксперименты с гуманизированным CD20xCD20-скорпионом S0129 проводили в клетках Su-DHL-4, Su-DHL-6, DoHH2, Rec-1 и WSU-NHL. Эти результаты представлены на фиг.46 и фиг.47. Данные, представленные на этих фигурах, расширяют вышеописанные открытия, обсуждаемые выше, показывая, что скорпионы обладают способностью прямого уничтожения различных клеточных линий.
Приведенные выше открытия распространяются на другие моноспецифические и биспецифические скорпионы, причем каждый скорпион демонстрирует способность непосредственно уничтожать В-клетки. В-клетки DoHH2 подвергали действию in vitro моноспецифического CD20xCD20-скорпиона, моноспецифического CD37xCD37-скорпиона или биспецифического CD20xCD37-скорпиона. Эти результаты, представленные на фиг.48, демонстрируют, что биспецифические скорпионы имеют кривые уничтожения, которые отличаются по форме от кривых уничтожения моноспецифических скорпионов.
Культивирование клеток Su-DHL-6 в присутствии 70 нМ CD20xCD20-скорпиона (S0129), CD20xCD37-скорпиона или CD37xCD37-скорпиона также приводит к прямому уничтожению В-клеток (фиг.49). Клетки Su-DHL-6, подвергнутые действию либо биспецифического CD19xCD37-скорпиона, либо Ритуксана®, приводило к прямому уничтожению клеток, причем биспецифический скорпион проявлял летальность при более низких дозах, как видно из фиг.50.
Другая демонстрация прямого уничтожения клеток была получена подверганием клеток DHL-4 действию четырех независимых моноспецифических скорпионов, узнающих CD20. Конструировали две версии скорпиона CD20xCD20 для включения двух 20-4-связывающих доменов (20-4x20-4 и S0129) и две вторые версии включали гибрид 011- и 20-4-связывающих доменов. Все четыре независимо сконструированные и очищенные версии этих двух конструкций CD20xCD20-скорпионов, (20-4x20-4 и S0129), и гибрида (011x20-4 и 011x20-4ΔAsp), эффективно уничтожали клетки DHL-4 прямым образом. Для этого исследования клетки DHL-4 обрабатывали in vitro 1 мкг/мл указанных белков в течение 24 часов. Затем клетки окрашивали Аннексином V и иодидом пропидия, ранним и поздним маркерами смерти клеток, соответственно, и популяции клеток определяли количественно при помощи FACS. Результаты, представленные на фиг.51, показывают способность прямого уничтожения каждой из CD20xCD20-конструкций, как доказывается увеличенным окрашиванием, показанным в виде черных столбцов. Кроме того, эти результаты демонстрируют, что гибридные 011x20-4-белки проявляли слабое увеличение в прямом уничтожении относительно скорпионов на основе 20-4x20-4, несмотря на то, что каждый из этих сокрпионов моноспецифически узнавал CD20. В отдельной серии экспериментов, определяли реакцию доза-ответ этих четырех независимых конструкций скорпионов анализом FACS окрашенных Аннексином V и иодидом пропидия популяций клеток. Результаты, показанные на фиг.52, демонстрируют зависимые от дозы увеличения смерти клеток, происходящие из обработки клеток DHL-4 каждой из этих независимых конструкций скорпионов.
Пример 16
Дополнительные функции, опосредуемые скорпионами (ADCC и CDC)
a. Скорпион-зависимая клеточная цитотоксичность
Проводили эксперименты для определения, могут ли скорпионы опосредовать уничтожение клеток В-лимфомы BJAB. Наблюдали, что клетки В-лимфомы BJAB уничтожаются CD20- и/или CD37-скорпионами.
Сначала, 1×107/мл В-клеток BJAB метили 500 мкКи/мл51Cr-хромата натрия (#CJS1, Amersham Biosciences, Piscataway, NJ) в течение 2 часов при 37ºC в среде Исков с 10% ФТС. Затем51Cr-меченые В-клетки BJAB промывали 3 раза в среде RPMI с 10% ФТС и ресуспендировали при 4×105/мл в RPMI. Мононуклеарные клетки периферической крови (PBMC) из доноров больницы выделяли из гепаринизированной цельной крови центрифугированием через среду для отделения лимфоцитов (#50494, MP Biomedicals, Aurora, Oh), промывали 2 раза средой RPMI и ресуспендировали при 5×106/мл в RPMI с 10% ФТС. Пробы реагентов добавляли к средам RPMI с 10% ФТС при 4-кратной конечной концентрации и готовили три 10-кратных разведения для каждого реагента. Затем эти реагенты добавляли в 96-луночные U-донные планшеты при 50 мкл на лунку до указанных конечных концентраций. Затем51Cr-меченые BJAB добавляли в эти планшеты при 50 мкл/лунка (2×104/лунка). Затем в эти планшеты добавляли PBMC при 100 мкл/лунка (5×105/лунка) для конечного соотношения 25:1 эффекторы (PBMC):мишень (BJAB). Эффекторы и мишени добавляли к средам по отдельности для измерения фонового уничтожения.51Cr-меченые BJAB добавляли к средам по отдельности для измерения спонтанного высвобождения51Cr и к средам с 5% NP40 (#28324, Pierce, Rockford, 111) для измерения максимального высвобождения51Cr. Эти планшеты инкубировали в течение 6 часов при 37ºC в 5% CO2. Затем пятьдесят мкл (25 мкл также было бы подходящим количеством) супернатанта из каждой лунки переносили в LumaPlate-96 (#6006633, Perkin Elmer, Boston, Mass) и сушили в течение ночи при комнатной температуре.
После высушивания, радиоактивные излучения определяли количественно в виде имп/мин на Packard TopCount-NXT. Величины проб были средними из трех повторностей проб. Процент специфического уничтожения рассчитывали с использованием следующего урванения: % уничтожения = ((высвобождение пробы - спонтанное высвобождение)/(максимальное высвобождение - спонтанное высвобождение)) × 100. Графики на фиг.30 показывают, что В-клетки BJAB уничтожались моноспецифическими скорпионами CD20xCD20 и CD37xCD37. Комбинация CD20-SMIP и CD37-SMIP также уничтожала В-клетки BJAB. Эти результаты демонстрируют, что эти скорпионы проявляют скорпион-зависимую клеточную цитотоксичность, и ожидается, что эта функциональность обеспечена константной субобластью скорпиона, обеспечивающей активность ADCC.
b. Роль скорпионов в комплементзависимой цитотоксичности
Эксперименты показали также, что скорпионы имеют активность комплементзависимой цитотоксичности (CDC). Эксперимент включал подвергание В-клеток Ramos действию CD19- и/или CD37-SMIP и скорпионов, как описано ниже и как показано на фиг.31.
Этот эксперимент начинали добавлением 5-2,5×105 В-клеток Ramos в лунки 96-луночных V-донных планшетов в 50 мкл среды Исков. Тест-соединения в Исков (или только среду Исков) добавляли в эти лунки в 50 мкл при двойной указанной конечной концентрации. Эти клетки и реагенты инкубировали в течение 45 минут при 37ºC. Клетки промывали 2,5 раза в среде Исков без ФТС и ресуспендировали в среде Исков с сывороткой человека (# A113, Quidel, San Diego, CA) в 96-луночных планшетах при указанных концентрациях. Затем эти клетки инкубировали в течение 90 минут при 37ºC. Клетки промывали центрифугированием и ресуспендировали в 125 мкл холодного ЗФР. Затем клетки переносили в кластерные пробирки FACS (#4410, CoStar, Corning, NY) и добавляли 125 мкл ЗФР с иодидом пропидия (# P-16063, Molecular Probes, Eugene, OR) при 5 мкг/мл. Эти клетки инкубировали с иодидом пропидия в течение 15 минут при комнатной температуре в темноте и затем помещали на лед и анализировали при помощи FACsCalibur с использованием программного обеспечения CellQuest (Becton Dickinson). Результаты, представленные на фиг.31, устанавливают, что CD19-SMIP, но не CD37-SMIP, проявляет CDC-активность, причем комбинация этих двух SMIP проявляет приблизительно тот же самый уровень CDC-активности, что и один CD19-SMIP. Однако, CD19хCD37-скорпион проявлял значимо более высокую CDC-активность, чем SMIP отдельно или в комбинации, показывая, что архитектура скорпиона обеспечивает более высокий уровень комплементзависимой цитотоксичности, чем другие молекулярные конструкции.
c. ADCC/CDC-активность CD20xCD20-моноспецифических скорпионов
Три разных CD20xCD20-моноспецифических скорпиона исследовали на ADCC- и CDC-функциональность вместе с общепринятыми контролями. ADCC оценивали с использованием общепринятых способов, и эти результаты представлены на фиг.53. Из этой фигуры видно, что видимая, но не идентичная, ADCC-активность ассоциирована с каждым из исследованных CD20xCD20-моноспецифических скорпионов.
Для оценки CDC, пробы В-клеток Ramos (4×105) инкубировали с каждым из CD20xCD20-скорпионов (0, 0,5, 5, 50 и 500 нМ) и сывороткой (10%) в течение 3,5 часов при 37ºC. Смерть клеток оценивали окрашиванием 7-AAD и FACS-анализом. Эти результаты представлены на фиг.54, который выявляет, что эти скорпионы проявляют некоторую CDC-активность. В сходном эксперименте, пробы В-клеток Ramos (4×105) инкубировали с CD20xCD20-белком-скорпионом (5, 50, 100 нМ) и сывороткой (10%) в течение 2 часов при 37ºC. Клетки промывали 2х и инкубировали с анти-С1q-FITC-антителом. Связанный С1q оценивали при помощи FACS-анализа, и эти результаты представлены на фиг.55. Эти результаты согласуются с результатами, представленными на фиг.54, в том смысле, что каждый из CD20xCD20-моноспецифических скорпионов был ассоциирован с некоторой CDC-активностью, хотя меньшая активность была ассоциирована с CD20-SMIP.
d. Взаимодействия скорпионов с FcγRIII
Исследования при помощи ELISA показали, что скорпионы связывались с низкоаффинным FcγRIII (CD16) (изоформой или аллелотипом низкой аффинности) при увеличенных уровнях в отсутствие клеток-мишеней. Планшеты ELISA сначала покрывали низкоаффинным или высокоаффинным CD16mIgG с использованием общепринятых способов. Оценивали способность этого иммобилизованного слитого белка захватывать либо CD20-SMIP, либо CD20xCD20-моноспецифический скорпион. Связанные SMIP и скорпионы детектировали вторичным антителом козы против IgG (HRP) человека и определяли среднюю интенсивность флуоресценции (MFI). Один ЗФР (отрицательный контроль) показан в виде единственной точки. Эти результаты представлены на фиг.32А (захват слитой CD16-высокоаффинной изоформой) и 32B (захват CD16-низкоаффинной изоформой). Из рассмотрения фиг.32A и 32B видно, что как CD20-SMIP, так и CD20xCD20-моноспецифический скорпион показали увеличенное связывание как высоко-, так и низкоаффинной слитыми CD16-изоформами, причем CD20xCD20-скорпион обнаруживает разительное увеличение связывания с низкоаффинной слитой изоформой с увеличением концентрации белка.
Оценивали также связывание скорпионов с FcγRIII-изоформой в присутствии клеток-мишеней. Эти данные показывают увеличенное связывание скорпионов как с низкоаффинной, так и с высокоаффинной изоформами или аллелотипами FcγRIII (CD16) в присутствии клеток-мишеней с увеличением концентрации белка.
В проведении этого эксперимента, CD20-положительные клетки-мишени подвергали действию CD20-SMIP или CD20xCD20-моноспецифических скорпионов при условиях, которые делают возможным связывание SMIP или скорпиона с CD20-положительной клеткой-мишенью. Затем несущую SMIP или скорпион клетку-мишень подвергали действию либо CD16-высокоаффинной, либо CD16-низкоаффинной изоформы, меченой мышиным IgFc. Затем козий антимышиный Fc добавляли в качестве вторичного антитела для мечения иммобилизованного CD16, меченого мышиным IgFc. Затем клетки детектировали с использованием проточной цитометрии на приборе FACs Calibur (BD Biosciences, San Jose, CA) и анализировали с использованием программного обеспечения Cell Quest software (BD Biosciences, San Jose, CA). Как показано на фиг.33, увеличенные концентрации каждого из CD20-SMIP и CD20xCD20-моноспецифического скорпиона приводили к увеличенному связыванию CD16-изоформ в присутствии клеток-мишеней, причем увеличение связывания CD20xCD20-скорпиона является более значительным, что увеличенное связывание, наблюдаемое с CD20-SMIP.
Пример 17
Действия скорпионов на клеточный цикл на клетках-мишенях лимфомы
Действия скорпионов на клеточный цикл оценивали подверганием клеток лимфомы действию SMIP, моноспецифических скорпионов и биспецифических скорпионов. Более конкретно, клетки лимфомы DoHH2 (0,5×106) обрабатывали в течение 24 часов 0,4 нМ ритуксимабом, CD20xCD37-скорпионом, комбинацией TRU-015 (CD20-SMIP) + SMIP-016 (0,2 нМ каждый), 100 нМ SMIP-016 или 100 нМ CD37xCD37-скорпионом. Эти концентрации представляют приблизительно в 10 раз большую величину, чем величина IC50 этого скорпиона в 96-часовом анализе ингибирования роста (см. фиг.24-27). Культуры метили в течение 20 минут при 37ºC 10 мкМ BrdU (бромдезоксиуридином). После фиксации, клетки окрашивали анти-BrdU-FITC-антителом и контрастно окрашивали иодидом пропидия. Величины на фиг.28 являются средним ± SD 4 повторных культур из 2-3 независимых экспериментов. Все данные проб анализировали в одно и то же время и объединяли для представления с использованием точечных графиков как включения BrdU, так и включения PI. Графики демонстрируют, что основным эффектом обработки скорпионом является истощение клеток в S-фазе, а также увеличение в компартменте G0/G1.
Пример 18
Физиологические действия скорпионов
a. Митохондриальный потенциал
CD20xCD20-скорпионы индуцировали потерю потенциала митохондриальной мембраны в В-клетках DHL-4, как обнаружено в JC-1-анализе. JC-1 является катионным карбоцианиновым красителем, который обнаруживает зависимое от потенциала накапливание в митохондриях (Mitoprobe® JC-1 Assay Kit for Flow Cytometry from Molecular Probes). JC-1 является более специфическим в отношении митохондриальной мембраны, чем в отношении плазматической мембраны, и используется для определения изменений в потенциале митохондриальной мембраны. Накапливание в митохондриях обнаруживается по смещению флуоресценции от зеленой (529 нм) к красной (590 нм).
В проведении этого эксперимента, В-клетки DHL-4 (5×105 клеток/мл) сначала культивировали в 24-луночных планшетах и обрабатывали в течение 24 часов 1 мкг/мл CD20xCD20-скорпиона, Ритуксимаба, контрольного IgG-антитела или 5 мкМ стауроспорином при 37о, 5% CO2, в стандартном термостате для культуры ткани. Добавляли краситель JC-1 (10 мкл/мл, 2 мкМ конечная концентрация) и клетки инкубировали еще в течение 30 минут при 37ºC. Клетки собирали центрифугированием (5 минут при 1200 об/мин), промывали 1 мл ЗФР и ресуспендировали в 500 мкл ЗФР. Клетки анализировали проточной цитометрией (FACSCalibur, BD) с фильтрами 488 нм возбуждения и 530 нм и 585 нм испускания. Для репрезентативных диаграмм разброса (рассеивания), показанных на фиг.56, красную флуоресценцию измеряли на Y-оси, а зеленую флуоресценцию измеряли на Х-оси. Деполяризацию митохондриальной мембраны измеряли в виде уменьшения красной флуоресценции, как видно в случае положительного контроля СССР (карбонилцианид-3-хлорфенилгидразона), известного разрушающего агента митохондриальной мембраны. Для подтверждения, что JC-1 был ответственным за изменение потенциала мембраны, В-клетки DHL-4 обрабатывали двумя концентрациями CCCP (50 мкМ и 250 мкМ) в течение 5 минут при 37ºC, 5% CO2. Дополнительным положительным контролем были клетки, обработанные ингибитором киназ широкого спектра, стауроспорином, для индукции апоптоза. Результатами, показанными на фиг.56, являются точковые диаграммы из 10000 отсчетов, причем красная флуоресценция отложена на the Y-оси, а зеленая флуоресценция отложена на Х-оси. Суммарная гистограмма процента клеток с разрушенным потенциалом митохондриальной мембраны (разрушенная ММР: черные столбцы) показана на фиг.56. Эти результаты демонстрируют, что обработка либо 20-4x20-4-скорпионом либо 011x20-4-скорпионом генерировала уменьшение потенциала в митохондриальной мембране, ассоциированное со смертью клеток.
b. Приток кальция
Молекулы скорпиона анализировали на влияния на пути передачи сигналов клетки, с использованием мобилизации Ca++, общего признака передачи сигналов клетки, в качестве меры передачи сигнала. Клетки лимфомы SU-DHL-6 метили красителем Кальцием 4 и обрабатывали тест-молекулами, идентифицированными ниже. Клетки считывали в течение 20 секунд для определения флуоресценции фона и затем добавляли SMIP/скорпионы (первая пунктирная линия на фиг.28) и флуоресценцию измеряли до 600 секунд. При 600 секундах, добавляли 8-кратный избыток сшитого антитела козы против F(ab')2 человека и флуоресценцию измеряли в течение дополнительных 300 секунд. Панель (A) фиг.28 показывает результаты, полученные с комбинацией CD20-SMIP и CD37-SMIP (красная линия); или полученные с CD20xCD37-биспецифическим скорпионом (черная линия), в сравнении с нестимулированными клетками (синяя линия). В панели B фиг.28, результаты обработки клеток только CD20-SMIP (красная линия) приводили к мобилизации Ca++, но эта мобилизация не была такой сильной, как сигнал, генерированный моноспецифическим CD20xCD20-скорпионом (черная линия). Диаграммы мобилизации Ca++ фиг.28 представляют флуоресценцию из трех повторных лунок, обработанных эквимолярными количествами скорпиона и комбинаций SMIP/SMIP.
с. Каспазы 3, 7 и 9
Способность CD20-связывающих скорпионов непосредственно уничтожать В-клетки, как показано увеличенным окрашиванием Аннексином V и иодидом пропидия и потерей потенциала митохондриальной мембраны, привела к дополнительному исследованию дополнительных связанных с апоптозом эффектов CD20-связывающих скорпионов в В-клетках. Предпринятым подходом было выполнение Apo1-анализов на В-клетках DHL-4, подвергнутых действию CD20xCD20-скорпионов или подходящих контролей. Этот Apo1-анализ основан на синтетическом пептидном субстрате для каспазы 3 и 7. Компоненты этого анализа доступны из Promega (Apo-ONE® Homogeneuous Caspase-3/7 Assay). Опосредованное каспазой расщепление меченого пептида Z-DEVD-Родамина 110 высвобождает флуоресцентную метку, родамин 110, которую измеряют с использованием возбуждения при 485 нм и детектирования при 530 нм.
В этом эксперименте, 100 мкл В-клеток DHL-4 (1×106 клеток/мл) высевали в черные 96-луночные плоскодонные планшеты для культуры ткани и обрабатывали в течение 24 часов или 48 часов 1 мкг/мл CD20xCD20-скорпиона, Ритуксимаба, контрольного IgG-антитела или 5 мкМ стауроспорина при 37ºC, 5% CO2 в стандартном термостате для культуры ткани. (Стауроспорин является малой молекулой, ингибитором протеинкиназ широкого спектра, который известен в данной области как сильнодействующий индуктор классического апоптоза в большом разнообразии типов клеток). Спустя 24 или 48 часов, в каждую лунку добавляли 100 мкл 100-кратно разведенного субстрата, осторожно перемешивали в течение одной минуты на планшет-шейкере (300 об/мин) и инкубировали при комнатной температуре в течение двух часов. Флуоресценцию измеряли с использованием фильтров возбуждения 485 нм и детектирования 527 нм. (Fluoroskan Ascent FL, Thermo Labsystems). Диаграммы, показывающие среднюю интенсивность флуоресценции трехкратных обработок плюс/минус стандартное отклонение после 24 часов и 48 часов (только 24 часа для стауроспорина), представлены на фиг.57. Эти результаты подтверждают, что CD20-связывающие скорпионы не уничтожают непосредственно В-клетки по апоптотическому пути с участием активации каспаз 3/7.
Результаты, полученные в Apo-1-анализе, были подтверждены Вестерн-блот-анализами, предназначенными для детектирования расщепления прокаспазы, приводящего к активированной каспазе, или для детектирования расшепления PARP (Поли (АДФ-рибозополимеразы), белка, о котором известно, что он расщепляется активированной каспазой 3. В-клетки DHL-4 подвергали действию CD20-связывающего скорпиона или контроля в течение 4, 24 или 48 часов и клеточные лизаты фракционировали электрофорезом в ДСН-ПААГ и блоттировали для Вестерн-анализов с использованием общепринятых способов. Фиг.58 представляет результаты в форме коллекции Вестерн-блотов. Три нижние Вестерн-блота использовали антикаспазные антитела для детектирования смещений молекулярной массы каспазного фермента, отражающих протеолитическую активацию. Для каспаз 3, 7 и 9, не было доказательств активации каспаз какими-либо CD20-связывающими молекулами. Стауроспорин служил в качестве положительного контроля для этого анализа и индуцировал расщепление прокаспазы до активной каспазы для каждой из каспаз 3, 7 и 9. Четвертый Вестерн-блот, показанный на фиг.58, выявляет, что PARP, известный субстрат активированной каспазы 3, не расщеплялся, что находится в согласии с неспособностью CD20-связывающих скорпионов активировать каспазу 3. Результаты всех этих экспериментов согласуются между собой, показывая, что активация каспазы 3 не является существенным признаком прямого уничтожения В-клеток DHL-4, индуцируемого CD20-связывающими скорпионами.
Кроме того, проводили исследование временных рядов для определения действия CD20-связывающщих белков, в том числе CD20xCD20-скорпиона, на каспазе 3. В-клетки DoHH2 или В-клетки Su-DHL-6 инкубировали с 10 нМ CD20-связывающим белком (скорпионом S0129, 2Lm20-4 SMIP или Ритуксаном®) +/- растворимый CD16-Ig (40 нМ), одним растворимым CD16-Ig или средой. Эти клетки культивировали в полной RPMI с 10% ФТС при 3×l05/лунка/300 мкл и собирали при 4 часах, 24 часах или 72 часах. Пробы 72-часовых временных точек высевали в 500 мкл тест-агента. Клетки промывали ЗФР и затем окрашивали на внутриклеточную активную каспазу-3 с использованием каспазы 3 BD Pharmingen, активной формы, набора mAB Apoptosis KitFITC (cat no.55048, BD Pharmingen, San Jose, CA). Вкратце, после 2 дополнительных промывок в холодном ЗФР, эти клетки суспендировали в холодном растворе cytofix/cytoperm и инкубировали на льду в течение 20 минут. Затем клетки промывали центрифугированием, аспирировали и промывали два раза буфером Perm/Wash при комнатной температуре. Затем эти пробы окрашивали 20 мкл FITC-анти-каспаза-3-антителом в 100 мкл буфера Perm-Wash при комнатной температуре в темноте в течение тридцати минут. Затем пробы промывали два раза буфером Perm-Wash и ресуспендировали в 500 мкл буфера Perm-Wash. Затем промытые клетки переносили в пробирки для FACS и подвергали проточной цитометрии при помощи FACS Calibur (BD Biosciences, San Jose, CA) и анализировали с использованием программного обеспечения Cell Quest (BD Biosciences, San Jose, CA). Эти результаты показаны в таблице 16.
Результаты всех этих экспериментов согласуются в том смысле, что имеется ограниченная активация каспазы 3 в отсутствие CD16, что не позволяет считать активацию каспазы 3 существенным признаком прямого уничтожения клеток, индуцируемого CD20-связывающими скорпионами.
d. Фрагментация ДНК
Индукция классических апоптотических путей передачи сигнала приводит в конечном счете к конденсации и фрагментированной деградации хромосомной ДНК. Для определения, уничтожали ли CD20-связывающие скорпионы В-клетки непосредственно через классический апоптотический механизм, состояние хромосомной ДНК В-клеток исследовали после подвергания этих клеток действию CD20-связывающих скорпионов или контролей. Сначала, В-клетки DHL-4 обрабатывали in vitro в течение 4, 24 или 48 часов CD20-связывающей молекулой, т.е. моноспецифическим скорпионом CD20xCD20 (2Lm20-4x2Lm20-4), скорпионом CD20xCD20 (01lx2Lm20-4) или Ритуксимабом, или контролем. Затем клетки лизировали и хромосомную ДНК очищали с использованием общепринятых способов. Затем эту хромосомную ДНК фракционировали по размеру гель-электрофорезом. Гель-электрофореграмма, показанная на фиг.59, выявляет отсутствие фрагментации ДНК, что свидетельствует о том, что смерть клеток, генерируемая CD20-связывающими скорпионами, не была опосредована классическим апоптотическим путем. В этих анализах в качестве положительного контроля использовали обработанные стауроспорином клетки.
e. Фосфорилирование SYK
SYK представляет собой фосфорегулируемый белок с несколькими сайтами фосфорилирования, который функционирует как транскрипционный репрессор. SYK локализован в ядре клетки, но способен быстро перемещаться в мембрану после активации. Для активации, SYK должен сохранять его последовательность ядерной локализации. Активированный SYK играет роль в супрессии опухолей молочной железы и SYK активируется проапоптотическими сигналами, такими как ионизирующая радиация, BCR-лигирование и сшивание МНС класса II. Далее, было показано, что SYK влияет на пути PLC-γ и Ca++. На основании этих наблюдений, исследовали способность CD20-связывающих скорпионов действовать на SYK.
В-клетки DHL-6 подвергали действию биспецифического CD20xCD37-скорпиона в течение 0, 5, 7 или 15 часов и эти клетки лизировали. Лизаты иммунопреципитировали либо анти-фосфотирозин-антителом, либо анти-SYK-антителом. Иммунопреципитаты фракционировали гель-электрофорезом, и результаты показаны на фиг.60. Из рассмотрения фиг.60 видна неспособность биспецифического CD20xCD37-скорпиона индуцировать фосфорилирование SYK с активацией тем самым этого белка. В соответствии с вышеописанными исследованиями по активации каспазы и фрагментации ДНК, CD20-связывающие скорпионы, по-видимому, не уничтожают В-клетки непосредственно с использованием классического апоптотического пути, такого как каспаза-зависимый путь. Хотя авторы не желают быть связанными теорией, они ожидают, что эти CD20-связывающие скорпионы непосредственно уничтожают В-клетки через каспаза- и SYK-независимый путь, который явно не проявляет фрагментацию хромосомной ДНК, по меньшей мере в одной и той же временной рамке, в которой имеет место фрагментация во время каспаза-зависимого апоптоза.
Пример 19
Применения скорпионов
a. Активность скорпионов in vivo
Активность скорпионов оценивали также с использованием модели мыши.
Измерения активности скорпионов in vivo включали введение 10-300 мкг скорпиона и последующие определения временных рядов концентраций этого скорпиона в сыворотке. Результаты этих исследований, представленные в виде кривых концентраций в сыворотке для каждого из двух биспецифических скорпионов (т.е. S0033, CD20xCD27-скорпиона и CD20xCD37-скорпиона), из трехнедельных фармакокинетических исследований в мышах представлены на фиг.40. Данные на фиг.40 показывают, что почти 500 часов после введения требуются для того, чтобы уровни в сыворотке каждого из этих двух биспецифических скорпионов упали опять до фоновых уровней. Таким образом, скорпионы обнаруживают стабильность в сыворотке и воспроизводимые, замедленные полупериоды циркуляции в кровотоке in vivo.
Оценивали также эффективность скорпионов in vivo. Агрессивную модель ксенотрансплантатов Ramos использовали в параллельных экспериментах со SMIP против исторических контролей иммуноглобулина. Кривые выживаемости, обеспеченные на фиг.41, выявляют, что введение 10 мкг биспецифического скорпиона имеет незначительное влияние на выживание, но введение 100-300 мкг оказывало значимое положительное действие на выживаемость мышей, несущих ксенотрансплантаты Ramos.
b. Комбинированные терапии
Ожидается, что скорпионы найдут применение в предотвращении, лечении или ослаблении симптома большого разнообразия состояний, поражающих людей, других млекопитающих и другие организмы. Например, ожидается, что CD20-связывающие скорпионы является полезными в лечении или предупреждении различных заболеваний, ассоциированных с избыточными или аберрантными В-клетками. Фактически, любое заболевание, поддающееся лечению, включающему истощение В-клеток, может быть поддающимся лечению CD20-связывающим скорпионом. Кроме того, скорпионы, например, CD20-связывающие скорпионы, могут быть использованы в комбинированных терапиях с другими терапевтическими средствами. Для иллюстрации возможности большого разнообразия комбинированных терапий, моноспецифический CD20xCD20-скорпион (S0129) вводили в В-клетки Su-DHL-6 в комбинации с доксорубицином, винкристином или рапамицином. Доксорубицин является ядом топоизомеразы II, который препятствует биохимии ДНК и принадлежит к классу лекарственных средств, обсуждаемых для противораковой терапии. Рапамицин (Sirolimus) является макролидным антибиотиком, который ингибирует инициацию белкового синтеза и подавляет иммунную систему, находя применение в трансплантации органов и в качестве антипролиферативного средства, используемого для коронарных стентов для ингибирования или предотвращения рестеноза. Винкристин является алкалоидом барвинка, который ингибирует образование канальцев и был использован для лечения рака.
Экспериментальные результаты, показанные на фиг.61, представлены в виде величин комбинационного индекса для каждой комбинации на протяжении диапазона уровней действия. Взаимодействия этого моноспецифического CD20xCD20-скорпиона S0129 являются разными для каждого класса лекарственных средств, в то время как с Ритуксаном® (RTXN) формы графиков являются сходными. Действие, наблюдаемое с доксорубицином при высоких концентрациях, может отражать смещение в направлении моновалентного связывания. Эти данные показывают, что CD20-связывающие скорпионы могут быть использованы в комбинации с различными другими терапевтическими веществами, и такие комбинации будут очевидными специалисту в данной области в свете данного описания.
Вариации структурных тем для мультивалентных связывающих молекул с эффекторной функцией, или скорпионов, будут очевидными после рассмотрения данного изобретения, и такие вариантные структуры находятся в объеме этого изобретения.
Реферат
Изобретение относится к иммунологии. Предложен одноцепочечный мультиспецифический связывающий белок для связывания или модулирования активности одной или нескольких молекул-партнеров связывания. Он содержит от N-конца к С-концу: первый связывающий домен, полученный из вариабельных областей легкой и тяжелой цепей иммуноглобулина; константную субобласть, полученную из иммуноглобулина, содержащую шарнирный или шарнир-подобный домен, C-домен и C-домен; пептид линкера-скорпиона, где указанный пептид содержит аминокислотную последовательность из шарнира иммуноглобулина или области «стебля» («stalk») белка лектина С типа II; и второй связывающий домен, полученный из вариабельных областей легкой и тяжелой цепей иммуноглобулина. Описаны: кодирующая нуклеиновая кислота, а также экспрессирующий вектор на ее основе и клетка-хозяин для экспрессии белка на основе вектора. Предложены: фармацевтическая композиция для лечения нарушения пролиферации клеток на основе одноцепочечного белка и белковый димер для связывания или модулирования активности одной или нескольких молекул-партнеров связывания - на основе двух одноцепочечных связывающих белков. Изобретение обеспечивает мультиспецифические молекулы, сохраняющие эффекторные функции, нечувствительные к протеолитическому расщеплению, и может найти применение в терапии различных заболеваний. 7 н. и 24 з.п. ф-лы, 61 ил., 16 табл., 19 пр.
Формула
(a) первый связывающий домен, полученный из вариабельных областей легкой и тяжелой цепей иммуноглобулина;
(b) константную субобласть, полученную из иммуноглобулина, содержащую шарнирный или шарнироподобный домен, CH2-домен и CH3-домен;
(c) пептид линкера-скорпиона, где указанный пептид линкера-скорпиона содержит аминокислотную последовательность из шарнира иммуноглобулина или области «стебля» («stalk») белка лектина С типа II; и
(d) второй связывающий домен, полученный из вариабельных областей легкой и тяжелой цепей иммуноглобулина.

Комментарии