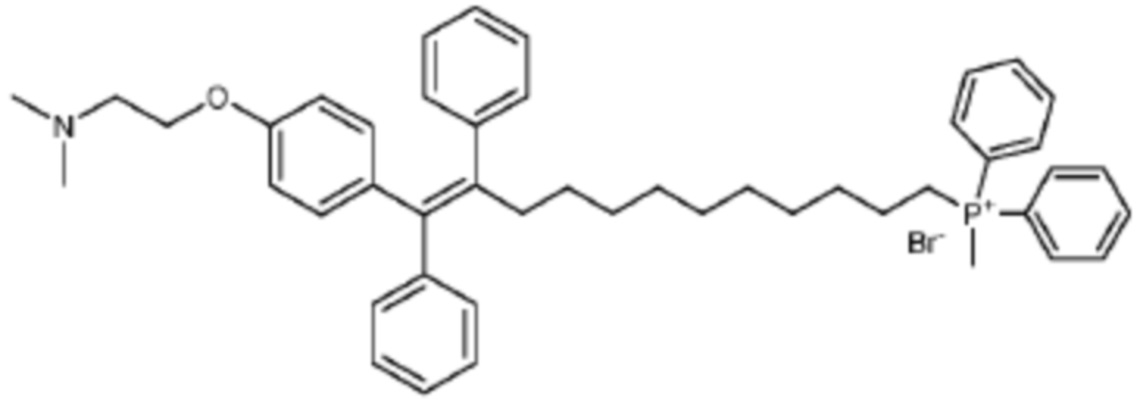
Соединения для лечения нарушений, связанных со старением - RU2727901C1
Код документа: RU2727901C1
Описание
Область изобретения
Настоящее изобретение относится к новым соединениям, способным устранять стареющие клетки в живых организмах, и они являются применимыми в лечении нарушений, связанных со старением.
Уровень техники
Предполагается, что клеточное старение является первой линией защиты от онкогенеза, предотвращающей деление клеток с поврежденными геномами. С другой стороны, персистенция стареющих клеток в организме, как полагают, является вредоносной из-за веществ, продуцируемых самими этими клетками. Через полвека после предположения, сформулированного Леонардом Хейфликом, современные публикации бесспорно подтверждают вклад стареющих клеток в возрастные изменения в организме (Baker et al., Naturally occurring p16(Ink4a)-positive cells shorten healthy lifespan. Nature. 2016 530: 184-189). Учитывая тот факт, что блокирование цикла деления стареющих клеток не является полностью необратимым, персистенция стареющих клеток в тканях может представлять собой зависимый от времени фактор риска обхода старения и перехода ускользнувших от старения клеток с повреждением ДНК, неподдающимся репарации, в клетки с потенциалом к индуцированию патологий.
Изменения в экспрессии генов, характерные для старения, сопровождаются стойким повышением уровней мРНК и секрецией ряда цитокинов, хемокинов, факторов роста и протеаз. Это явление называется ассоциированный со старением секреторный фенотип (SASP). Поскольку SASP возникает главным образом в результате ответа на повреждения генома, одной из его преимущественных функций может быть обмен информацией с клетками иммунной системы посредством секреции провоспалительных цитокинов, в частности, TNFa, IL6, IL8 и IL1β, с целью оповещения о присутствии поврежденных клеток, имеющих потенциальный риск патологического развития. Помимо данной функции, также была установлена роль SASP в регенерации тканей после повреждения. Матриксные металлопротеиназы, секретируемые стареющими клетками в поврежденных тканях, защищают скопление коллагена и фибронектина, двух белков, принимающих участие в распространении фиброза.
С другой стороны, накопление стареющих клеток у пожилых людей или у пациентов, получающих иммуносупрессивную химиотерапию, у которых иммунная система ослаблена, приводит к подавлению функций разных органов зависимым от возраста образом (Vasto et al., Inflammatory networks in ageing, age-related diseases and longevity. Mech Ageing Dev. 2007 128: 83-91) или к повреждению тканей, обусловленному повышенной активацией сигнального пути провоспалительных цитокинов за счет усиления оксидативного стресса, вызванного нарушениями в митохондриях соседних клеток (Campisi et al., Senescent cells, tumor suppression, and organismal aging: good citizens, bad neighbors. Cell. 2005 120: 513-522). Было описано, что стареющие клетки играют роль в патогенезе диабета 2 типа посредством непосредственного влияния на функцию панкреатических бета-клеток, SASP-опосредованного повреждения тканей и вовлечения в нарушение функции жировой ткани (смотри обзор у Palmer et al., Cellular Senescence in Type 2 Diabetes: A Therapeutic Opportunity. Diabetes. 2015 64: 2289-2298). Поскольку, в свою очередь, изменения метаболических путей и сигнальных путей, наблюдаемые при диабете, могут стимулировать старение, является очевидным, что стареющие клетки представляют собой часть «патогенетической петли» при диабете, которая является и причиной, и следствием метаболических изменений и повреждения тканей, и при этом терапевтическое целенаправленное воздействие на них может оказывать большое влияние на предупреждение прогрессирования заболевания. Также было выявлено, что SASP усиливает фенотип, связанный со старением, с помощью aутокринного или паракринного пути, что в результате приводит к распространению связанных со старением изменений в тканях и органах.
До недавних пор лишь две группы ученых сообщили об устранении стареющих клеток и о последствии этого. Во-первых, Baker и соавт. (Baker et al., Clearance of pl6Ink4a-positive senescent cells delays ageing-associated disorders. Nature. 2011 479: 232-236) использовали специальных трансгенных мышей, несущих плазмиду, кодирующую каспазу 8, под контролем промотора p16, которая активирует апоптоз, когда клетка подвергается старению, за счет чего эти клетки устраняются в организме. Они демонстрируют роль устранения стареющих клеток в улучшении качества жизни и продлении срока жизни.
С целью собственной защиты от апоптоза стареющие клетки повышают экспрессию белков семейства Bcl-2. Yosef и соавт. (Yosef et al., Directed elimination of senescent cells by inhibition of BCL-W and BCL-XL. Nat Commun. 7: 11190) впервые показали, что стареющие клетки можно устранять фармакологически с использованием ингибитора Bcl-2, ABT-737, который клинически не тестировали из-за его неблагоприятных фармакологических свойств.
Способность к фармакологическому устранению стареющих клеток in vivo открывает возможность изучения роли стареющих клеток в широком диапазоне физиологических условий, при которых их выявляют. Химиотерапевтическое устранение стареющих клеток может быть преимущественным, поскольку накопление таких клеток в разных тканях способствует развитию патологий, связанных с возрастными изменениями.
Выведение стареющих клеток из организма, таким образом, играет роль в лечении и/или предупреждении заболеваний, связанных со старением, таких как идиопатический фиброз легких, саркопения, диабет, ожирение, остеоартрит, хронические воспаления, глаукома, катаракта, индуцированный ионизирующим излучением мукозит полости рта, трансплантация почки (Munoz-Espin and Serrano, Cellular senescence: from physiology to pathology. Nat Rev Mol Cell Biol. 2014, 15: 482-496) и гиперплазия предстательной железы (Castro et al., Cellular senescence in the pathogenesis of benign prostatic hyperplasia. Prostate, 55, 30-8. (2003),).
Раскрытие настоящего изобретения
В настоящем изобретении представлено новое поколение соединений общей формулы I, которые должны рассматриваться как включающие все изомерные структуры (и где перекрещенная двойная связь в общей формуле I указывает на то, что двойная связь может иметь E- и/или Z-конфигурацию) и фармацевтически приемлемые соли,

где Z представляет собой линейную углеводородную цепь, выбранную из алкилена, алкенилена или алкинилена, содержащих 1-20 атомов углерода, предпочтительно 4-14 атомов углерода, более предпочтительно 8-12 атомов углерода, где необязательно одна или более пар атомов углерода в углеводородной цепи могут быть заменены одним или более из 5-членных или 6-членных ароматических колец или гетероароматических колец, содержащих гетероатомы O, S и/или N, предпочтительно фенилeнами, или пиридиленами, или триазолами, и/или один или более атомов углерода в углеводородной цепи могут быть заменены одним или более гетероатомами, выбранными из O, S, NH; и где углеводородная цепь может быть не замещена или замещена одним или более заместителями, независимо выбранными из группы, включающей C1-C4алкил, N(H или C1-C4алкил)2, где алкилы являются одинаковыми или отличающимися; фенил, бензил, OH, =О, SH, =S, F, Cl, Br, I, C1-C4алкокси, C1-C4ацилокси, C1-C4меркапто;
и при этом каждый из R1, R2, R3 независимо выбран из группы, включающей C1-C10алкил, C6-C12арил, C6-C12арил-Cl-C2алкил, C5-C12гетероарил, C3-C8циклоалкил, где каждый из R1, R2, R3 может быть необязательно (и независимо от остальных) замещен одним или более заместителями, независимо выбранными из группы, включающей C1-C4алкил, C1-C4алкокси, N(H или C1-C4алкил)2, где алкилы являются одинаковыми или отличающимися; OH, =О, SH, =S, F, Cl, Br, I, C1-C4меркапто.
Предпочтительно Z представляет собой линейную углеводородную цепь, выбранную из алкилена, алкенилена или алкинилена (предпочтительно алкилена), содержащих 4-14 атомов углерода, более предпочтительно 8-12 атомов углерода, наиболее предпочтительно 8, или 10, или 12 атомов углерода.
Предпочтительно Z представляет собой линейную углеводородную цепь, выбранную из алкилена, алкенилена или алкинилена (предпочтительно алкилена), содержащих 4-14 атомов углерода, более предпочтительно 8-12 атомов углерода, где один или более атомов углерода в углеводородной цепи заменены одним или более гетероатомами, выбранными из O, S, NH (предпочтительно O).
Предпочтительно Z представляет собой линейную углеводородную цепь, выбранную из алкилена, алкенилена или алкинилена (предпочтительно алкилена), содержащих 4-14 атомов углерода, более предпочтительно 8-12 атомов углерода, где один или более атомов углерода в углеводородной цепи замещены одним или более заместителями, выбранными из C1-C4алкила, N(H или C1-C4алкил)2, где алкилы являются одинаковыми или отличающимися; OH, =O, SH, =S, F, Cl, Br, I, C1-C4алкокси, C1-C4меркапто.
Предпочтительно Z представляет собой линейную углеводородную цепь, выбранную из алкилена, алкенилена или алкинилена (предпочтительно алкилена), содержащих 4-14 атомов углерода, более предпочтительно 8-12 атомов углерода, где один или более атомов углерода в углеводородной цепи заменены одним или более гетероатомами, выбранными из O, S, NH (предпочтительно N), и один или более атомов углерода в углеводородной цепи замещены одним или более заместителями, выбранными из OH, =О, SH, =S, C1-C4алкокси, C1-C4меркапто.
Предпочтительно Z представляет собой линейную углеводородную цепь, выбранную из алкилена, алкенилена или алкинилена (предпочтительно алкилена), содержащих 4-14 атомов углерода, более предпочтительно 8-12 атомов углерода, где одна или более пар атомов углерода в углеводородной цепи заменены одним или более 5-членными или 6-членными ароматическими кольцами или гетероароматическими кольцами, предпочтительно фениленами, и/или пиридиленами и/или триазолами.
Предпочтительно Z замещен одним или более заместителями, выбранными из C1-C4алкила, N(H или C1-C4алкил)2, где алкилы являются одинаковыми или отличающимися; OH, =O, SH, =S, F, Cl, Br, I, C1-C4алкокси, C1-C4меркапто; более предпочтительно Z замещен одним или более заместителями, выбранными из OH, =O, SH, =S, F, Cl, Br, I.
С целью защиты собственно этих соединений Rl, R2 и R3 не являются одновременно незамещенными фенилами.
Предпочтительно каждый из R1, R2, R3 независимо выбран из группы, включающей метил, бутил, октил, фенил, метоксифенил, бензил, циклогексил, трет-бутил.
X- представляет собой фармацевтически приемлемый анион, в частности анион неорганической или органической кислоты, в частности подходящие анионы выбраны из группы органических солей, таких как цитрат, ацетат, лактат, тартрат, оксалат, аскорбат, мезилат, тозилат, или неорганических солей, таких как сульфат, галогенид, фосфат, и/или их смесей.
Вышеприведенные варианты осуществления могут быть свободно объединены.
Соединения по настоящему изобретению получают с помощью следующих процедур синтеза.
Предпочтительный способ получения производных 2-(4-(l,2-дифенилвинил)фенокси)-N,N-диметилэтан-1-амина общей формулы I, являющийся, в частности, подходящим в том случае, если Z представляет собой алкилен, основан на реакции илида, полученного из трет-бутилдиметилсилил-окси-алкил-трифенилфосфония общей формулы II,

где n = 1-19,
и Y представляет собой I, Br, CI или мезил,
при обработке органическим основанием (предпочтительно бутиллитием) в тетрагидрофуране (THF) в атмосфере аргона при температуре -78°C и с дальнейшей конденсацией с альдегидом формулы III,

с получением силилированного производного общей формулы IV,

Силилированное производное общей формулы IV обрабатывают тетрабутиламмония фторидом с получением алкенола общей формулы V,

который восстанавливают в атмосфере водорода в присутствии катализатора гидрогенизации до спирта общей формулы VI,

спирт общей формулы VI замещают соответствующим производным общей формулы VII,

который превращают в фосфонийное производное 2-(4-(l,2-дифенилвинил)фенокси)-Ν,Ν-диметилэтан-1-амина (или его соответствующей соли) общей формулы I путем совместного нагревания с фосфином общей формулы VIII,

где каждый из R1, R2, R3 характеризуется значением, определенным в формуле I.
В одном предпочтительном способе проводят реакцию производного формулы III в одной реакционной емкости с полученным in-situ илидом, полученным в результате реакции спирта общей формулы IX,

где Y представляет собой уходящую группу (или группу, определенную в соединении II),
и трифенилфосфина в присутствии основания (предпочтительно лития бис(триметилсилил)амида) в органическом растворителе (предпочтительно в смеси диметилформамид/диметилсульфоксид), с непосредственным получением спирта общей формулы V.
В другом предпочтительном способе производное формулы VII превращают в амин общей формулы X при обработке аммиаком, предпочтительно в растворе DMF/метанoл,

который вступает в реакцию с производным карбоновой кислоты общей формулы XI и фосфином общей формулы VIII, предпочтительно в DCM,

с образованием фосфонийного производного 2-(4-(l,2-дифенилвинил)фенокси)-N,N-диметилэтан-1-амина общей формулы I,
где Y представляет собой уходящую группу (или группу, определенную в соединении II).
В другом предпочтительном способе альдегид III превращают в алкиновое производное XII с использованием реагента Охиры-Бестмана или другого подходящего реагента,

и подвергают реакции с азидным производным общей формулы XIII в стандартных условиях клик-реакции, предпочтительно с использованием CuSO4.5H2O и аскорбата натрия, предпочтительно в смеси этанoл/DMF,

получая соответствующее производное общей формулы I.
В настоящем изобретении дополнительно представлены соединения формулы I для применения в способе лечения и преодоления неспособности организма устранять стареющие клетки. Данное лекарственное средство воздействует главным образом на стареющие клетки, произошедшие из разных тканей, в частности тканей молочной железы, поджелудочной железы и предстательной железы.
Таким образом, соединения формулы I применимы в лечении и/или предупреждении заболеваний, связанных со старением, и нарушений здоровья, таких как идиопатический фиброз легких, саркопения, диабет, ожирение, остеоартрит, хронические воспаления, глаукома, катаракта, индуцированный ионизирующим излучением мукозит полости рта, трансплантация почки (Munoz-Espin and Serrano, Cellular senescence: from physiology to pathology. Nat Rev Mol Cell Biol. 2014, 15: 482-496) и гиперплазия предстательной железы (Castro et al., Cellular senescence in the pathogenesis of benign prostatic hyperplasia. Prostate, 55, 30-8. (2003)).
Как указано выше, хронические заболевания, связанные с возрастными изменениями, как, например, диабет, могут быть отчасти вызваны совмещением основных механизмов старения, что в результате приводит к нарушению функции тканей, связанному с возрастными изменениями, хроническому «безмикробному» воспалению, повреждению на уровне макромолекул или нарушению функций клеток-предшественников. Используя in vitro и in vivo модели, наблюдали специфическое устранение стареющих клеток, обусловленное применением соединений формулы I. Выявили ключевую роль белка, адениннуклеотидтранслоказы 2 (ANT2), повышение экспрессии которого повышает устойчивость стареющих клеток к соединениям формулы I.
Соединения формулы I избирательно индуцируют клеточную смерть стареющих клеток. Они эффективно уничтожают и первичные стареющие клетки, накопившиеся в органах с возрастными изменениями, и преждевременно состарившиеся клетки, присутствующие в более молодых организмах, в ответ на генетические мутации, воздействия окружающей среды или, очевидно, что самое важное, патологические состояния.
Примеры осуществления настоящего изобретения
Сокращения:
ANT2 – адениннуклеотидтранслоказа 2
ATP – аденозинтрифосфат
B-gal – бета-галактозидаза
BrdU – 5-бром-2-дезоксиуридин
DCM – дихлорметан
DMF – диметилформамид
DMSO – диметилсульфоксид
FCCP – карбонилцианид-4-(трифторметокси)фенилгидразон
IBX – 2-йодоксибензойная кислота
LiHMDS – лития гексаметилдисилазан
mtATP – митохондриальный аденозинтрифосфат
NAC – N-ацетилцистеин
ЯМР – ядерный магнитный резонанс
PAI – ингибитор активатора плазминогена
qRT PCR – количественная полимеразная цепная реакция с обратной транскрипцией
ROS – активные формы кислорода
TBAF – тетрабутиламмония фторид
THF – тетрагидрофуран
TLC – тонкослойная хроматография
Альдегид формулы III, который получали в соответствии с процедурой, опубликованной в 2003 ((Z)-Tamoxifen and Tetrasubstituted Alkenes and Dienes via a Regio- and Stereospecific Three-Component Magnesium Carbometalation Palladium(O) Cross-Coupling Strategy; Pierre E. Tessier, Andrea J. Penwell,Fabio E. S. Souza, and Alex G. Fallis*; ORGANIC LETTERS, 2003, Vol. 5, No. 17, 2989-2992.), использовали в качестве исходного материала, предназначенного для получения (Z)-2-(4-(l,2-дифенилвинил)фенокси)-N,N-диметилэтан-l-амина, связанного с линкером, имеющим концевую фосфониевую соль общей формулы I

Исходный альдегид IIIa можно получить с применением другого окислителя, отличающегося от используемого в вышеприведенной публикации. Применение стабилизированной 2-йодбензойной кислоты (SIBX) вместо реагента Десса-Мартина приводит к образованию изомера лишь с одной двойной связью. Выход является сопоставимым. SIBX (250 г, 401,757 ммоль) и исходный аллиловый спирт (100,00 г, 267,744 ммоль) (смотри вышеприведенную публикацию) растворяли в этилацетате (1 л). Суспензию нагревали с обратным холодильником в течение периода времени, составляющего 1,5 часа, при постоянном взбалтывании. Реакционную смесь охлаждали до комнатной температуры, фильтровали и промывали толуолом (2,5 л) и гидроксидом натрия (2 M, 1 л). Органический слой высушивали над сульфатом магния с добавлением активированного угля (25 г), фильтровали и концентрировали под вакуумом с получением 93 г (93%) альдегида IIIa в виде коричневатого твердого вещества.
Пример 1
(9-((Трет-бутилдиметилсилил)окси)нонил)трифенилфосфония бромид (634 мг, 1,057 ммоль) растворяли в сухом тетрагидрофуране (THF) (6 мл), помещали в атмосферу аргона и охлаждали до -78°C. Бутиллитий (1,2 мл, 0,9 M раствор в THF) медленно по каплям добавляли в реакционную смесь в атмосфере аргона. Обеспечивали нагревание раствора до 0°C, при этом цвет изменялся до темно-красного, снова охлаждали до -78°C и добавляли по каплям альдегид формулы IIIa (160 мг, 0,430 ммоль), растворенный в сухом THF (3 мл). Затем обеспечивали нагревание реакционной смеси до температуры окружающей среды в лаборатории и взбалтывали в течение 16 часов в атмосфере аргона. Прохождение реакции контролировали с помощью тонкослойной хроматографии (TLC) в смеси хлороформ-метанoл (10:1). Затем насыщенный раствор хлорида аммония и воды добавляли в реакционную смесь и экстрагировали этилацетатом. Слой этилацетата промывали солевым раствором и высушивали над сульфатом магния. Раствор фильтровали и концентрировали при пониженном давлении. В результате хроматографии концентрата на колонке с силикагелем в системе дихлорметан (DCM)/метанoл (градиент от 0 до 10% метанoла) получили 147 мг продукта формулы 4 (выход 56%).

1H ЯМР (500 MГц, CDCl3) δ 7,42-7,36 (m, 5H), 7,18-7,28 (m, 5H), 6,94 (d, J = 8,7, 2H), 6,73 (d, J = 8,7, 2H), 6,19 (d, J = 11,5, 1H), 5,47 (dt, J = 11,5, 7,4, 1H), 4,09 (t, J = 5,8, 2H), 3,72 (t, J = 6,6, 2H), 2,80 (t, J = 5,8, 2H), 2,42 (s, 6H), 1,69–1,57 (m, 4H), 1,48-1,13 (m, 10H), 1,03 (s, 9H), 0,18 (s, 6H). Масс-спекрометрия с ионизацией электрораспылением (ESI MS): 612.
13C ЯМР (101 MГц, CDCl3) δ 156,64, 143,81, 142,75, 140,29, 138,42, 135,65, 131,80, 129,58, 129,51, 128,04, 127,83, 126,45, 125,94, 113,38, 77,34, 77,02, 76,71, 65,49, 63,34, 58,04, 45,61, 35,88, 32,90, 29,71, 29,65, 29,56, 29,45, 29,41, 29,24, 28,84, 26,00, 25,80, 18,39, -5,23.
HRMS: расчетн. для C40H60O2NSi 614,43878, выявленная 614,43869.
ИК (пеллета из KBr): v = 3056, 3025, 2927, 2855, 2821, 2771, 1943, 1886, 1607, 1508, 1471, 1463, 1443, 1246, 1174, 1098, 1031, 835, 774, 703.
(9-((Трет-бутилдиметилсилил)окси)нонил)трифенилфосфония бромид получали в соответствии с процедурой, опубликованной в литературном источнике. (Tetrahedron Letters, 2010, 51, 49, 6426-6428.)
Пример 2
Способ A
Силилированное производное формулы 4 (147 мг, 2,240 ммоль) растворяли в THF (5 мл), затем помещали в атмосферу аргона и тетрабутиламмония фторид (TBAF) (260 мкл, 1 M раствор в THF) добавляли по каплям при температуре 0°C при взбалтывании. Затем обеспечивали нагревание реакционной смеси до температуры окружающей среды в лаборатории и взбалтывали в течение дополнительных 6 часов. Прохождение реакции контролировали с помощью TLC в смеси хлороформ-метанoл (10:1). Затем добавляли воду и смесь экстрагировали этилацетатом. Слой этилацетата промывали насыщенным раствором соды и солевым раствором и высушивали над сульфатом магния. Десиккант фильтровали, и раствор концентрировали при пониженном давлении. Концентрат очищали с помощью колоночной хроматографии на силикагеле в системе хлороформ/метанoл (градиент от 0 до 10% метанoла) с получением 115 мг (выход 96%) требуемого алкенола формулы 5.
Способ B
Трифенилфосфин (161,5 г, 615,8 ммоль) добавляли в раствор бромононанола (125 г, 559,8 ммоль) в диметилформамиде (500 мл). Реакционную смесь взбалтывали в атмосфере аргона при 80°C в течение 16 часов, а затем охлаждали до 35°C. Перед добавлением (период 10 минут) раствора лития бис(триметилсилил)амида в тетрагидрофуранe (1 M, 1 л) добавляли дополнительный растворитель (диметилсульфоксид 1 л и тетрагидрофуран 1 л). После 10 минут взбалтывания проявлялось отчетливое оранжево-красное окрашивание, после чего раствор альдегида IIIa (100 г, 269,2 ммоль) в тетрагидрофуранe (500 мл) добавляли в течение периода 5 минут. Полученный в результате раствор взбалтывали 1 час при комнатной температуре. TLC-анализ нескольких капель реакционной смеси, промытых этилацетатом и насыщенным раствором хлорида аммония (разделение в хлороформе/метанoле/аммиаке, 95:5:0,5), указывал на полное превращение исходного материала. Реакцию гасили льдом (0,5 кг) и ледяным насыщенным раствором хлорида аммония (1 л). Смесь самопроизвольно разделялась на два слоя. Нижний водный слой повторно экстрагировали простым диэтиловым эфиром (1000 + 500 мл). Объединенный органический слой подкисляли эфирным раствором HCl (1 M, 500 мл), разбавленной гептаном (1 л), и промывали насыщенным хлоридом аммония (1 л). Продукт в виде коричневого осадка образовывался между верхним органическим и нижним водным слоями. Все слои разделяли в делительной воронке. Коричневый маслянистый осадок растворяли в дихлорметанe и снова промывали насыщенным хлоридом аммония (1 л), простым диэтиловым эфиром (1 л) и гептаном (2 л). Продукт в виде коричневого осадка, который образовывался между верхней органической и нижней водной фазами, разделяли в делительной воронке, растворяли в дихлорметанe (1 л) и загружали на колонку (1 л диоксида кремния). С помощью хроматографии в дихлорметанe (2 л) → хлороформ/метанoл 100:10 (4 л)→ 100:15 (2 л) получили очищенный продукт в виде светлого масла, содержащий значительное количество диметилсульфоксида. Затем очищенный продукт растворяли в метанoле (1,5 л), разбавляли гидрокарбонатом натрия (4%, 1 л) и экстрагировали гептаном (8 x 2 л). Объединенные слои гептана концентрировали под вакуумом с получением 108,5 г соединения 5 в виде белого твердого вещества.

1H ЯМР (500 MГц, CDCl3) δ 7,43–7,14 (m, 5H), 6,94 (d, J = 8,5, 2H), 6,72 (d, 7 = 8,5, 2H), 6,20 (d, J = 11,5, 1H), 5,48 (dt, J = 11,5, 7,4, 1H), 4,12 (t, J = 5,9, 2H), 3,72 (t, J = 6,6, 2H), 2,86 (t, J = 5,9, 2H), 2,46 (s, 6H), 1,71-1,58 (m, 4H), 1,51–1,10 (m, 10H). ESI MS: 498.
13C ЯМР (101 MГц, CDCl3) δ 157,18, 143,73, 142,70, 141,09, 133,83, 132,52, 131,04, 130,96, 130,65, 127,73, 127,56, 126,84, 126,05, 113,50, 77,38, 77,06, 76,74, 65,71, 62,93, 58,25, 45,86, 32,81, 29,36, 29,32, 29,25, 29,08, 28,96, 25,74.
HRMS: расчетн. для C34H44О2N 498,33666, выявленная 498,33656.
ИК (пеллета из KBr): v = 3411, 3054, 3019, 2926, 2853, 2772, 1605, 1507, 1464, 1442, 1287, 1243, 1172, 1031, 963, 827, 764.
Пример 3
Алкенольное производное формулы 5 (115 мг, 0,231 ммоль) растворяли в абсолютном этанoле (6 мл) и помещали в атмосферу аргона. 10% Pd/C (10 мг) добавляли к смеси и колбу с реакционной суспензией вакуумировали и помещали в атмосферу водорода несколько раз в повторяющемся режиме. Затем реакционную смесь взбалтывали при температуре окружающей среды в лаборатории в атмосфере водорода в течение 24 часов. Прохождение реакции контролировали с помощью TLC в смеси хлороформ-метанoл (10:1). Смесь фильтровали через слой целита и промывали несколько раз этанoлом. Этанoл выпаривали с получением 101 мг (выход 87%) требуемого спирта формулы 6, который использовали на следующей стадии синтеза без какой-либо дополнительной очистки.

1H ЯМР (500 MГц, CD3OD) δ 7,40–7,01 (m, 10H), 6,85 (d, J = 8,1, 2H), 6,68 (d, J = 8,1, 2H), 4,20 (s, 2H), 3,55 (t, J = 6,4, 2H), 3,46 (s, 2H), 2,89 (s, 6H), 2,42 (t, J = 7,8, 2H), 1,57–1,48 (m, 2H), 1,38–1,11 (m, 12H). ESI MS: 500.
13C ЯМР (101 MГц, CDCl3) δ 156,7, 143,8, 142,7, 140,3, 138,4, 135,6, 131,8, 129,6, 129,5, 128,0, 127,8, 126,5, 126,0, 113,4, 77,4, 77,1, 76,7, 65,6, 63,0, 58,1, 45,7, 35,9, 32,8, 29,6, 29,5, 29,4, 29,4, 29,2, 28,8, 25,8.
HRMS: расчетная для C34H46О2N 500,35231, выявленная 500,35208.
ИК (пеллета из KBr): v = 3411, 3055, 2925, 2853, 2773, 1607, 1508, 1465, 1442, 1284, 1242, 1174, 1100, 1031, 962, 835, 772, 703, 606.
Пример 4
Спирт формулы 6 (230 мг, 0,460 ммоль) растворяли в DCM (10 мл). CBr4 (480 мг, 1,447 ммоль) добавляли к смеси при температуре окружающей среды в лаборатории в атмосфере аргона. Затем добавляли по каплям трифенилфосфин (400 мг, 1,525 ммоль), растворенный в DCM (3 л). Смесь взбалтывали при температуре окружающей среды в лаборатории в течение 2 часов, а затем концентрировали при пониженном давлении. Прохождение реакции контролировали с помощью TLC в смеси хлороформ-метанoл (10:1). В результате хроматографии концентрата на колонке с силикагелем в системе DCM/метанoл (градиент 0-10%) получили 273 мг (выход 92%) требуемого бромида формулы 7. Бромид использовали в следующей реакции без какого-либо его длительного хранения.

1H ЯМР (400 MГц, CDCl3) δ 7,46–6,96 (m, 10H), 6,78 (d, J = 8,9 Гц, 2H), 6,53 (d, J = 8,8 Гц, 2H), 4,29 (t, J = 6,6 Гц, 2H), 3,47–3,28 (m, 4H), 2,82 (s, 6H), 2,38 (t, J = 7,8 Гц, 2H), 1,80 (q, 7 = 7,8 Гц, 2H), 1,46–0,98 (m, 14H). ESI MS: 561.
13C ЯМР (101 MГц, CDCl3) δ 155,1, 143,5, 142,5, 140,8, 138,0, 136,9, 132,0, 129,5, 129,5, 128,1, 127,9, 126,6, 126,1, 113,4, 77,4, 77,1, 76,7, 62,6, 56,6, 43,8, 35,9, 34,1, 32,8, 29,6, 29,3, 29,2, 28,8, 28,7, 28,1.
HRMS: расчетная для C34H45NOBr 562,26790, выявленная 562,26787.
ИК (пеллета из KBr): v = 3417, 3017, 2609, 2456, 1605, 1574, 1508, 1465, 1441, 1284, 1238, 1174, 1111, 1071, 1029, 993, 832, 770, 704, 604.
Пример 5
Общая процедура:
фосфин общей структуры VIII (3 экв.) добавляли к бромиду формулы 7 (1 экв.), и смесь взбалтывали при температуре 85°C в атмосфере аргона в течение периода времени, составляющего 12 часов. Прохождение реакции контролировали с помощью TLC в смеси хлороформ-метанoл (10:1). Реакционную смесь охлаждали до температуры окружающей среды в лаборатории, растворяли в минимальном количестве DCM добавляли по каплям к раствору гексана (50 мл) при постоянном взбалтывании при температуре 0°C. Образовавшийся осадок фильтровали, снова растворяли в минимальном количестве DCM и добавляли по каплям к раствору простого диэтилового эфира (50 мл) при постоянном взбалтывании при температуре 0°C. Осадок фильтровали и высушивали под вакуумом. Показатели выхода варьировали от 55 до 85%.
Пример 6
Используя процедуру, описанную в примере 5, и трифенилфосфин, получали соединение формулы 8 в виде желтоватого порошка.

1H ЯМР (400 MГц, метанoл-d4) δ 7,98–7,68 (m, 15H), 7,37–7,29 (m, 2H), 7,28–7,05 (m, 8H), 6,82 (d, J = 8,8 Гц, 2H), 6,67 (d, J = 8,8 Гц, 2H), 4,27–4,07 (t, J = 5,2 Гц, 2H), 3,44 (t, J = 5,2 Гц, 2H), 3,42–3,34 (m, 2H), 2,87 (s, 6H), 2,38 (t, J = 8,0 Гц, 2H), 1,70-1,57 (m, 2H), 1,51 (q, J = 7,4 Гц, 2H), 1,43–1,21 (m, 4H), 1,21–1,06 (m, 6H).
13C ЯМР (101 MГц, метанoл- d4) δ 157,19, 144,91, 143,93, 141,89, 139,94, 137,98, 136,25 (d, J = 3,0 Гц), 134,78 (d, J = 9,9 Гц), 132,99, 131,51 (d, J = 12,6 Гц), 130,72, 130,43, 129,21, 128,93, 127,71, 127,19, 119,97 (d, J = 86,2 Гц), 114,65, 63,32, 57,88, 49,64, 49,43, 49,21, 49,00, 48,79, 48,57, 48,36, 44,12, 36,76, 31,50 (d, J = 15,9 Гц), 30,55, 30,24, 30,18, 29,74 (d, J = 5,4 Гц), 23,50, 23,46, 22,94, 22,43.
HRMS: расчетн. для C52H59NOP 744,43288, выявленная 744,43311.
ИК (пеллета из KBr): v = 3397, 3051, 3016, 2923, 2853, 2596, 2455, 1605, 1507, 1485, 1465, 1438, 1240, 1174, 1112, 1072, 1028, 995, 751,723, 705, 691.
Пример 7
Используя процедуру, описанную в примере 5, и трибензилфосфин, получали соединение формулы 9 в виде желтоватой пены.

1H ЯМР (500 MГц, CD3OD) δ 7,45–7,37 (m, 9H), 7,37–7,31 (m, 2H), 7,30–7,19 (m, 9H), 7,19–7,05 (m, 5H), 6,78 (d, J = 8,8 Гц, 2H), 6,58 (d, J = 8,9 Гц, 2H), 3,96 (t, J = 5,5 Гц, 2H), 3,80 (d, J = 14,7 Гц, 6H) – сигналы метиленфосфония могут существенно смещаться из-за сольватации или гидратации, 2,69 (t, J = 5,5 Гц, 2H), 2,45–2,38 (m, 2H), 2,30 (s, 3H), 2,06–1,96 (m, 2H), 1,42–1,27 (m, 6H), 1,27–1,08 (m, 8H).
13C ЯМР (126 MГц, cd3od) δ 158,17, 145,09, 144,04, 141,45, 140,17, 136,96, 132,88, 131,44 (d, J = 5,2 Гц), 130,76, 130,71 (d, J = 3,0 Гц), 130,49, 129,80, 129,77, 129,18, 128,92, 127,66, 127,15, 114,45, 66,38, 59,05, 45,78, 36,76, 31,64 (d, J = 15,3 Гц), 30,58, 30,24, 30,11(2C), 29,76, 29,61, 29,9(2C), 22,26 (d, J = 4,9 Гц).
HR-MS: масса/заряд = 393,74333 расчетн. для C55H66NOP2+ 393,74355.
ИК-1602, 1584, 1574, 1508, 1496, 1442, 1174, 1031, 702.
Пример 8
Используя процедуру, описанную в примере 5, и трициклогексилфосфин, получали соединение формулы 10 в виде желтоватой пены.

1H ЯМР (500 MГц, CD3OD) δ 7,38–7,32 (m, 2H), 7,29–7,24 (m, 1H), 7,23–7,05 (m, 7H), 6,77 (d, J = 8,9 Гц, 2H), 6,58 (d, J = 8,9 Гц, 2H), 3,96 (t, J = 5,5 Гц, 2H), 2,70 (t, J = 5,5 Гц, 2H), 2,53 (qt, J = 12,5 5 Гц, J = 2,5 Гц, 3H), 2,44–2,39 (m, 2H), 2,31 (s, 6H), 2,26–2,18 (m, 2H), 1,96 (m, 12H), 1,80 (m, 3H), 1,66–1,11 (m, 31H).
13C ЯМР (126 MГц, cd3od) δ 158,14, 145,07, 144,02, 141,45, 140,14, 136,95, 132,86, 130,73, 130,48, 129,15, 128,89, 127,62, 127,12, 114,43, 66,33, 59,03, 45,76, 36,73, 32,14 (d, J = 14,0 Гц), 30,80 (d, J = 41,2 Гц), 30,60, 30,33, 30,30, 30,25, 29,76, 29,72, 27,98 (d, J = 3,8 Гц), 27,50 (d, J = 11,9 Гц), 26,55, 26,54, 23,36 (d, J = 5,1 Гц), 16,09 (d, J = 43,3 Гц).
HR-MS: масса/заряд = 2, 381,78974, расчетн. для C52H78NOP2+: 381,790505; масса/заряд = 1, 762,57242, расчетн. для C52H77NOP+: 762,57373.
ИК: 2929, 2853, 2772, 1638, 1606, 1574, 1508, 1492, 1473, 1445,1443, 1363, 1243, 1174, 1113, 1030, 963, 750, 703.
Пример 9
Используя процедуру, описанную в примере 5, и трис(о-метоксифенил)фосфин, получали соединение формулы 11 в виде желтоватой пены.

1H ЯМР (500 MГц, CD3OD) δ 7,86–7,78 (m, 3H), 7,37–7,01 (m, 19H), 6,80–6,73 (m, 2H), 6,61–6,55 (m, 2H), 3,97 (t, J = 5,5 Гц, 2H), 3,76 (s, 9H), 3,17–3,06 (m, 2H), 2,71 (t, J = 5,5 Гц, 2H), 2,42–2,37 (m, 2H), 2,31 (s, 6H), 1,53–1,39 (m, 4H), 1,32–1,27 (m, 2H), 1,25–1,19 (m, 2H), 1,19–1,05 (m, 8H).
13C ЯМР (126 MГц, CD3OD) δ 163,07 (d, J = 2,4 Гц), 158,13, 145,08, 144,02, 141,44, 140,14, 138,14 (d, J = 2,1 Гц), 136,96, 135,90 (d, J = 8,20 Гц), 132,86, 130,74, 130,48, 129,15, 128,90, 127,62, 127,12, 123,12 (d, J = 12,7 Гц), 114,44, 113,87 (d, J = 6,6 Гц), 107,59 (d, J = 92,3 Гц), 66,30, 59,02, 56,62, 45,74, 36,69, 31,61 (d, J = 17,6 Гц), 30,50, 30,18 (d, J = 3,5 Гц), 30,11, 29,90, 29,67, 25,13 (d, J = 54,2 Гц), 25,04, 25,00.
HR-MS: масса/заряд = 2, 417,73529, расчетн. для C55H66NO4P2+: 417,735952; масса/заряд = 1, 834,46307, расчетн. для C55H66NO4P+: 834,46457.
ИК: 2924, 2853, 2845, 2771, 1640, 1605, 1589, 1575, 1508, 1479, 1432, 1368, 1172, 1030, 962, 757, 703.
Пример 10
Используя процедуру, описанную в примере 5, и метилдифенилфосфин, получали соединение формулы 12 в виде желтоватой пены.
1H ЯМР (500 MГц, CD3OD) δ 7,92–7,78 (m, 6H), 7,76–7,68 (m, 4H), 7,38–7,30 (m, 2H), 7,28–7,04 (m, 8H), 6,77 (d, J = 8,8 Гц, 2H), 6,58 (d, J = 8,9 Гц, 2H), 3,96 (t, J = 5,5 Гц, 2H), 3,01–2,91 (m, 2H), 2,70 (t, J = 5,5 Гц, 2H), 2,59 (d, J = 13,9 Гц, 3H), 2,42-2,37 (m, 2H), 2,30 (s, 6H), 1,60–1,51 (m, 2H), 1,50–1,43 (m, 2H), 1,34–1,23 (m, 4H), 1,22–1,05 (m, 8H).
13C ЯМР (126 MГц, CD3OD) δ 158,15, 145,07, 144,02, 141,46, 140,14, 136,97, 135,83 (d, J = 3,0 Гц), 133,38 (d, J = 10,0 Гц), 132,86, 131,28 (d, J = 12,5 Гц), 130,74, 130,47, 129,16, 128,90, 127,63, 127,13, 121,42 (d, J = 85,6 Гц), 114,44, 66,35, 59,04, 45,77, 36,73, 31,43 (d, J = 16,1 Гц), 30,56, 30,27, 30,19 (d, J = 2,8 Гц), 29,80, 29,73, 23,09 (d, J = 51,5 Гц), 22,84, 22,81, 6,29 (d, J = 56,2 Гц).
HR-MS: масса/заряд = 2, 341,71149, расчетн. для C47H58NOP2+: 341,71225; масса/заряд = 1, 682,41522, расчетн. для C47H57NOP+: 682,41723.
ИК: 2924, 2853, 2771, 1606, 1589, 1574, 1508, 1491, 1464, 1438, 1369, 1242, 1174, 1116, 1030, 997, 746, 704, 692.
Пример 11
Используя процедуру, описанную в примере 5, и диметилфенилфосфин, получали соединение формулы 13 в виде желтоватой пены.

1H ЯМР (500 MГц, CD3OD) δ 7,98–7,89 (m, 2H), 7,84–7,76 (m, 1H), 7,74–7,68 (m, 2H), 7,37–7,31 (m, 2H), 7,29–7,05 (m, 8H), 6,77 (d, J = 8,8 Гц, 2H), 6,58 (d, J = 8,8 Гц, 2H), 3,96 (t, J = 5,5 Гц, 2H), 2,69 (t, J = 5,5 Гц, 2H), 2,56–2,46 (m, 2H), 2,43–2,36 (m, 2H), 2,29 (s, 6H), 2,23 (d, J = 14,3 Гц, 6H), 1,55–1,45 (m, 2H), 1,44–1,35 (m, 2H), 1,34–1,22 (m, 4H), 1,21–1,07 (m, 8H).
13C ЯМР (126 MГц, CD3OD) δ 158,16, 145,07, 144,02, 141,46, 140,14, 136,96, 135,52 (d, J = 3,0 Гц), 132,86, 132,41 (d, J = 9,9 Гц), 131,09 (d, J = 12,4 Гц), 130,74, 130,47, 129,16, 128,90, 127,63, 127,13, 121,93 (d, J = 84,9 Гц), 114,44, 66,39, 59,06, 45,79, 36,73 31,41 (d, J = 15,9 Гц), 30,57, 30,30, 30,20 (d, J = 3,6 Гц), 29,79, 29,74, 24,61 (d, J = 51,6 Гц), 22,57, 22,54, 7,21 (d, J = 55,6 Гц).
HR-MS: масса/заряд = 2, 310,70419, расчетн. для C42H56NOP2+: 310,704425; масса/заряд = 1, 620,40099, расчетн. для C42H55NOP+: 620,40158.
ИК: 2922, 2852, 2824, 2774, 1636, 1608, 1574, 1508, 1491, 1465, 1452, 1437, 1368, 1247, 1175, 1120, 1028, 964, 744, 690, 480.
Пример 12
Используя процедуру, описанную в примере 5, и трибутилфосфин, получали соединение формулы 14 в виде желтоватого масла.

1H ЯМР (500 MГц, CD3OD) δ 7,38–7,32 (m, 2H), 7,30–7,06 (m, 8H), 6,77 (d, J = 8,9 Гц, 2H), 6,58 (d, J = 8,9 Гц, 2H), 3,96 (t, J = 5,5 Гц, 2H), 2,69 (t, J = 5,5 Гц, 2H), 2,44 -2,38 (m, 2H), 2,30 (s, 6H), 2,27–2,15 (m, 8H), 1,63–1,50 (m, 14H), 1,49–1,42 (m, 2H), 1,39–1,12 (m, 12H), 1,01 (t, J = 7,1 Гц, 12H).
13C ЯМР (126 MГц, CD3OD) δ 158,14, 145,07, 144,02, 141,45, 140,14, 136,95, 132,86, 130,74, 130,48, 129,15, 128,90, 127,63, 127,12, 114,43, 66,36, 59,04, 45,77, 36,74, 31,74 (d, J = 15,0 Гц), 30,62, 30,37, 30,28 (d, J = 6,8 Гц), 29,83, 29,77, 24,95 (d, J = 15,6 Гц), 24,39 (d, J = 4,6 Гц), 22,34, 22,31, 19,31 (d, J = 47,7 Гц), 19,12 (d, J = 48,0 Гц), 13,71 HR-MS: масса/заряд = 2, 342,76669, расчетн. для C46H72NOP2+: 342,76703; масса/заряд = 1, 684,52576, расчетн. для C46H71NOP+: 684,52678.
ИК: 2957, 2928, 2858, 2772, 1606, 1574, 1492, 1465, 1410, 1381, 1243, 1174, 1030, 704.
Пример 13
Используя процедуру, описанную в примере 5, и триоктилфосфин, получали соединение формулы 15 в виде желтоватого масла.

1H ЯМР (500 MГц, CD3OD) δ 7,35 (t, J = 7,4 Гц, 2H), 7,29–7,24 (m, 1H), 7,24–7,07 (m, 7H), 6,77 (d, J = 8,8 Гц, 2H), 6,58 (d, J = 8,8 Гц, 2H), 3,97 (t, J = 5,4 Гц, 2H), 2,72 (t, J = 5,4 Гц, 2H), 2,46–2,38 (m, 2H), 2,32 (s, 6H), 2,27–2,09 (m, 8H), 1,64–1,54 (m, 6H), 1,53–1,45 (m, 6H), 1,43–1,11 (m, 24H), 0,96–0,87 (m, 9H).
13C ЯМР (126 MГц, CD3OD) δ 158,11, 145,07, 144,01, 141,45, 140,13, 136,97, 132,87, 130,73, 130,48, 129,15, 128,90, 127,64, 127,13, 114,43, 79,47, 66,25, 59,01, 45,73, 36,75, 32,92, 31,77 (d, J = 14,8 Гц), 31,68 (d, J = 14,8 Гц), 30,62, 30,39, 30,28, 30,25, 30,13, 29,89, 29,80, 29,78, 23,69, 22,35 (d, J = 4,7 Гц), 22,30 (d, J = 4,7 Гц), 19,28 (d, J = 47,6 Гц), 19,22 (d, J = 47,6 Гц), 14,45.
HR-MS: масса/заряд = 2, 426,86991, расчетн. для C58H96NOP2+: 426,86093.
ИК: 3075(w), 3051(w), 3019(w), 2953(sh)2924(s), 2868(s), 2854(s), 2802(sh), ~2500(br) NH+, 1605(m), 1575(m), 1508(s), 1490(m), 1466(m), 1442(m), 1410(m), 1378(m), 1241(s), 1175(s), 1030(m), 834(m), 720(sh), 704(s).
Пример 14
Используя процедуру, описанную в примере 5, и триметилфосфин, получали соединение формулы 16 в виде желтоватого порошка.

1H ЯМР (500 MГц, CD3OD) δ 7,35 (t, J = 7,4 Гц, 2H), 7,29–7,24 (m, 1H), 7,24–7,06 (m, 6H), 6,79 (d, J = 8,8 Гц, 2H), 6,60 (d, J = 8,8 Гц, 2H), 4,02 (t, J = 5,4 Гц, 2H), 2,88 (t, J = 5,4 Гц, 2H), 2,44 (s, 6H), 2,43–2,37 (m, 2H), 2,27–2,13 (m, 2H), 1,87 (d, J = 14,4 Гц, 9H), 1,67–1,53 (m, 2H), 1,45 (dq, J = 8,8, 6,9 Гц, 2H), 1,39–1,10 (m, 12H).
13C ЯМР (126 MГц, CD3OD) δ 157,90, 145,03, 143,99, 141,58, 140,08, 137,22, 132,89, 130,73, 130,46, 129,17, 128,91, 127,66, 127,14, 114,49, 65,62, 58,75, 45,37, 36,75, 31,74, 31,61, 30,62, 30,41, 30,34, 30,23, 29,93, 29,75, 24,06 (d, J = 52,4 Гц), 22,35 (d, J = 4,3 Гц), 7,86 (d, J = 54,9 Гц).
HR-MS: масса/заряд = 2, 276,69702, расчетн. для C37H54NOP2+: 276,69660.
ИК: 3074(w), 3050(w), 3015(w), 2959(sh)2923(s), 2853(s), 2790(sh), 1605(m), 1594(sh), 1587 (m), 1574(m), 1507(s), 1490(sh), 1484(m), 1466(m), 1438(m), 1238(s), 1175(s), 1030(m), 996(m), 723(m), 705(s), 690(m).
Пример 15
Реагент Охиры-Бестмана добавляли в ледяной (4°C) раствор/суспензию альдегида (0,1 г; 0,269 ммоль) и K2CО3 (0,372 г; 2,694 ммоль). Обеспечивали нагревание реакционной смеси до комнатной температуры и взбалтывали в течение 1 часа. TLC-анализ (хлороформ/метанoл 10:1) показал новое появление оранжевого цвета при окрашивании нингидрином или синего цвета при окрашивании фосфомолибденовой кислотой. Смесь затем фильтровали, концентрировали под вакуумом и промывали Et2O (2 x 30 мл) и водой (30 мл). Объединенный органический слой высушивали над MgSО4 и концентрировали под вакуумом. Неочищенный продукт загружали на колонку (V(SiО2) = 10 мл) в смеси хлороформ/простой петролейный эфир (1:1). С помощью хроматографии (50 мл хлороформа → 50 мл хлороформа/метанoла/аммиака 100:1:0,1 → 50 мл хлороформа/метанoла/аммиака 100:2:0,2) получали 77 мг (76%) соединения формулы 17 в виде бесцветного масла.

1H ЯМР (500 MГц, хлороформ-d) δ 7,52–7,46 (m, 2H), 7,41–7,08 (m, 8H), 6,87 (d, J = 8,7 Гц, 2H), 6,67 (d, J = 8,7 Гц, 2H), 3,99 (t, J = 5,8 Гц, 2H), 2,69 (t, J = 5,8 Гц, 2H), 2,32 (s, 6H).
13C ЯМР (126 MГц, хлороформ-d) δ 193,53, 158,14, 150,10, 142,58, 139,55, 133,40, 132,27, 130,28, 129,84, 127,92, 127,70, 126,90, 119,28, 113,75, 85,89, 80,55, 65,83, 58,25, 45,91.
HR-MS: масса/заряд = 1, 368,19998, расчетн. для C26H26NO1+: 368,20089.
Пример 16
Азид натрия (231 мг, 0,3556 ммоль) добавляли к раствору (10-бромдецил)трифенилфосфония в смеси диметилформамид/вода (1:1, 1 мл). Смесь нагревали до 90°C в течение ночи. Реакционную смесь затем разделяли между дихлорметаном (2 x 15 мл) и водой (10 мл). Органический слой концентрировали под вакуумом, и растворяли в воде (10 мл), и разбавляли солевым раствором (20 мл). Полученную в результате эмульсию экстрагировали дихлорметаном (4 x 10 мл). Объединенный органический слой высушивали над MgSО4, фильтровали и концентрировали под вакуумом. Продукт характеризовался по сути таким же Rf (коэффициентом удерживания), как и исходный материал (хлороформ/метанoл 10:1), но отличался по цвету при окрашивании c помощью pernot. С помощью хроматографии (10 мл диоксида кремния) в хлороформе/метанoле 100:0 (100 мл) → 100:2 (200 мл) → 100:4 (200 мл) получали 128 мг соединения формулы 18 в виде бесцветного масла.

1H ЯМР (500 MГц, метанoл-d4) δ 7,91 (td, J = 7,3, 1,8 Гц, 3H), 7,86–7,73 (m, 12H), 3,49–3,38 (m, 2H), 3,27 (t, J = 6,8 Гц, 2H), 1,76–1,63 (m, 2H), 1,57 (p, J = 7,2 Гц, 4H), 1,43–1,22 (m, 10H).
13C ЯМР (126 MГц, метанoл-d4) δ 136,23 (d, J = 3,0 Гц), 134,77 (d, J = 10,0 Гц), 131,50 (d, J = 12,5 Гц), 119,98 (d, J = 86,3 Гц), 52,41, 31,53 (d, J = 16,0 Гц), 30,34, 30,21, 30,12, 29,85, 29,81 (d, J = 1,3 Гц), 27,73, 23,51 (d, J = 4,4 Гц), 22,65 (d, J = 50,9 Гц).
Пример 18
Алкин формулы 17 (0,020 г; 0,0544 ммоль) и (10-азидодецил)трифенилфосфония бромид 18 (0,026 г; 0,0544 ммоль) растворяли в этанoле/DMF (2 + 1 мл). Реакционный сосуд закрывали алюминиевой фольгой, а атмосферу азота поддерживали на протяжении следующих операций. CuSО4.5H2О (40 мг) добавляли одной порцией с последующим добавлением аскорбата натрия (40 мг). Реакционную смесь взбалтывали в течение 1 часа при комнатной температуре, после чего образовывался оранжевый осадок. TLC-анализ (хлороформ/метанoл/аммиак 100:10:1) после краткого исследования нескольких капель (промывка дихлорметаном/солевым раствором) показал полный расход исходного материала и несколько новых точек (Rp = 0,15) продукта. Реакционную смесь промывали солевым раствором (50 мл) и дихлорметаном (3 x 30 мл). Объединенный органический слой высушивали над MgSО4 и концентрировали под вакуумом. Неочищенный продукт загружали в колонку (V(SiO2) = 10 мл) в смеси (хлороформ/метанoл/аммиак, 100:5:0,5)/простой петролейный эфир 1:1. С помощью хроматографии в 180 мл (хлороформ/метанoл/аммиак, 100:5:0,5) → 200 мл хроматографии в 180 мл (хлороформ/метанoл/аммиак, 100:7:0,7) получали продукт формулы 19 (35 мг; 78%) в виде желтого масла.

1H ЯМР (500 MГц, CDCl3) δ 7,90–7,74 (m, 12H), 7,74–7,59 (m, 3H), 7,24–7,00 (m, 10H), 6,87 (d, J = 8,6 Гц, 2H), 6,65 (s, 1H), 6,61 (d, J = 8,6 Гц, 2H), 4,11 (t, J = 6,8 Гц, 2H), 3,98 (t, J = 5,6 Гц, 2H), 3,74 (m, 2H), 2,71 (t, J = 5,5 Гц, 3H), 2,33 (s, 6H), 2,07–1,97 (m, 2H), 1,71–1,51 (m, 6H), 1,47–0,98 (m, 8H).
13C ЯМР (126 MГц, CDCl3) δ 157,42, 149,21, 143,85, 142,27, 141,18, 139,17, 134,88 (d, J = 2,8 Гц), 133,57 (d, J = 10,0 Гц), 132,06, 130,94, 130,38 (d, J = 12,5 Гц), 130,27, 129,48, 128,11, 127,76, 126,97, 126,59, 123,71, 118,37 (d, J = 85,7 Гц), 113,60, 70,46, 65,62, 58,12, 45,74, 33,72, 31,83, 30,28 (d, J = 15,7 Гц), 29,59, 28,86, 28,45, 25,88, 22,59, 22,40 (d, J = 54,1 Гц).
ИК: 2924, 2853, 2772, 1640, 1605, 1587, 1573, 1507, 1493, 1464, 1438, 1375, 1244, 1172, 1112, 1029, 996, 691.
HR-MS: масса/заряд = 2, 406,22778, расчетн. для C54H61NOP2+: 406,22860.
Пример 19
Гидробромид бромидного промежуточного продукта 7 (125 мг, 0,1942 ммоль) растворяли в метанольном аммиаке (2 мл, 7 н.) и DMF (0,5 мл). Реакционную смесь в течение 2 часов нагревали до 50°C и добавляли дополнительное количество метанольного аммиака (8 мл, 7 н.). Смесь нагревали в течение ночи, концентрировали под вакуумом. Хроматография на 12 мл диоксида кремния (хлороформ → хлороформ/метанoл/аммиак 100:2:0,2 (50 мл) → 100:4:0,4 (150 мл). Получали 21 мг (22%) соединения формулы 20 в виде бесцветного масла.

1H ЯМР (500 MГц, CD3OD) δ 7,33 (d, 2H), 7,29–7,24 (m, 1H), 7,23–7,18 (m, 2H), 7,18–7,06 (m, 5H), 6,77 (d, J = 8,9 Гц, 1H), 6,57 (d, J = 8,9 Гц, 1H), 3,95 (t, J = 5,5 Гц, 2H), 2,67 (t, J = 5,5 Гц, 2H), 2,63 (t, J = 7,4 Гц, 2H), 2,44–2,37 (m, 1H), 2,28 (s, 6H), 1,52–1,40 (m, 2H), 1,38–1,05 (m, 14H).
13C ЯМР (126 MГц, CD3OD) δ 158,15, 145,08, 144,04, 141,49, 140,12, 136,97, 132,88, 130,75, 130,49, 129,16, 128,90, 127,64, 127,12, 114,43, 66,42, 59,07, 45,82, 42,43, 36,75, 33,44, 30,60, 30,58, 30,53, 30,45, 30,25, 29,74, 27,98.
HR-MS: масса/заряд = 2, 250,18761, расчетн. для C34H48N2O: 250,187785.
Пример 20
Амин 20 (50 мг, 0,100 ммоль) растворяли в сухом дихлорметанe (2 мл) и добавляли раствор бромацетилбромида (20 мкл, 0,23 ммоль) в дихлорметанe (1 мл). TLC-анализ (хлороформ/метанoл/аммиак, 100:5:0,5) через 30 минут после проведения реакции показал полное превращение исходного материала в амид. Реакционную смесь разбавляли дихлорметаном (50 мл) и промывали NaOH (50 мл, 1 M). Водный слой повторно экстрагировали дихлорметаном (30 мл). Объединенный органический слой подкисляли метанoльной HBr (22 мкл HBr в 1 мл метанoла), высушивали над MgSO4 и концентрировали под вакуумом. Неочищенный продукт растворяли в диметилформамиде (1 мл) и добавляли трифенилфосфин (263 мг, 1,00 ммоль). Полученную в результате смесь нагревали до 50°C в течение 1 часа. TLC (хлороформ/метанoл/аммиак 100:10:1) показала полное превращение исходного материала. Затем смесь разбавляли смесью простого диэтилового эфира/простого петролейного эфира (50 мл, 1:1) и осаждали на ледяной бане в течение 2 часов. Затем растворитель отстаивали и полученное в результате масло загружали непосредственно в хроматографическую колонку (10 мл диоксида кремния). С помощью хроматографии (хлороформ/метанол 10:1, 100 мл) получали 90 мг (выход продукта 93%).

1H ЯМР (500 MГц, CD3OD) δ 7,94–7,65 (m, 12H), 7,35 (td, J = 7,4, 2,9 Гц, 3H), 7,30 -7,01 (m, 10H), 6,84 (d, J = 8,5 Гц, 2H), 6,69 (d, J = 8,8 Гц, 2H), 4,75 (d, J = 14,6 Гц,2H), 4,22 (t, J = 4,9 Гц, 2H), 3,54 (t, J = 4,8 Гц, m, 2H), 3,25 (t, J = 7,2 Гц, 1H), 3,05 (t, J = 7,0 Гц, 1H), 2,94 (s, 6H), 2,43-2,38 (m, 2H), 1,57–1,50 (m, 2H), 1,42–1,25 (m, 6H), 1,23–1,10 (m, 8H).
13C ЯМР (126 MГц, CD3OD) δ 158,15, 145,08, 144,04, 141,49, 140,12, 136,97, 132,88, 130,62 (d, J = 32,5 Гц), 129,03 (d, J = 32,6 Гц), 127,38 (d, J = 64,7 Гц), 114,43, 66,42, 59,07, 45,82, 42,43, 36,75, 33,44, 30,60, 30,58 (2C), 30,53, 30,45, 30,25, 29,74, 27,98 ИК-3377, 2463, 1669, 1605, 1588, 1574,1543,1507, 1485, 1438, 1415, 1365, 1240, 1175, 1113, 996, 704, 690.
HR-MS: масса/заряд = 2, 401,23091, расчетн. для C54H63N2О2P+: 401,23081.
Пример 21
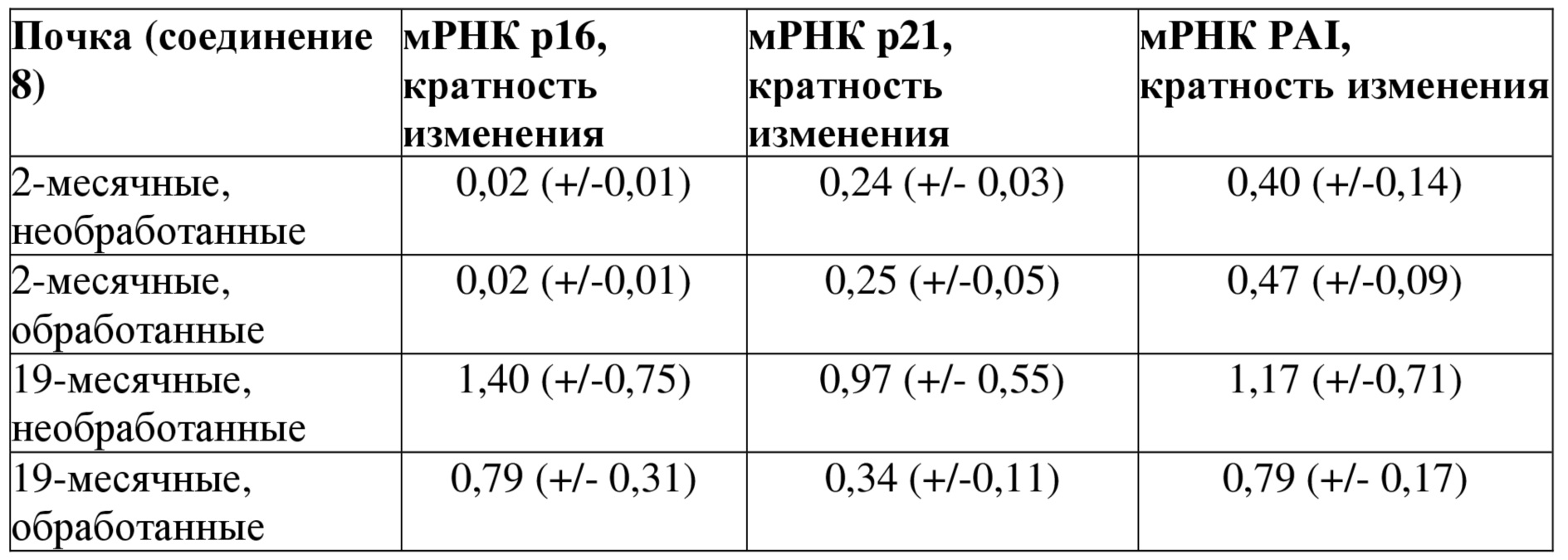
Чтобы также доказать роль соединений формулы I в устранении стареющих клеток in vivo, использовали стареющих естественным путем мышей FVB (19 месяцев) в сравнении с молодыми мышами 2-месячного возраста. Сперва анализировали присутствие стареющих клеток (использовали окрашивание на B-галактозидазу (B-gal)) в органах в этих двух группах. Среди всех тестированных органов (легкие, головной мозг, белая жировая ткань и желудок) наибольшее различие по присутствию B-gal-позитивных клеток выявили в легких (данные не показаны). На следующей стадии обрабатывали мышей (6 мышей 19-месячного возраста + 6 мышей 2-месячного возраста) с использованием 1 дозы соединения 8 (1 мкг соединения 8/l г мыши) один раз в неделю в течение периода 4 недель. Мышей (5 мышей 19-месячного возраста + 6 мышей 2-месячного возраста), которых обрабатывали только кукурузным маслом без соединения 8, использовали в качестве контроля. Через 4 недели извлекали легкие и определяли процент B-gal-положительных клеток в тканях. В таблице 1 показано повышение количества B-gal-положительных клеток у старых мышей по сравнению с молодыми мышами и снижение их количества после обработки соединением 8, что количественно определяли на ультратонких срезах с использованием специальной компьютерной программы. Этот результат подтверждается данными, полученными с помощью qRT PCR, посредством которой определяли уровни мРНК ряда других маркеров старения, таких как p16, p21 и ингибитор активатора плазминогена (PAI) в легких, почке и селезенке (таблица 2). Эти данные снова показывают увеличение количества стареющих клеток в тканях старых мышей и их устранение после обработки соединением 8, поскольку уровни тестируемых маркеров снизились практически до контрольных уровней.
Таблица 1

Таблица 2


Пример 22
Тестировали влияние соединения 8 на культивируемые стареющие клетки поджелудочной железы. Использовали три линии клеток поджелудочной железы (PANC-1, PaTu и BxPC-3), которые обрабатывали 100 мкМ BrdU в течение 6 дней для индуцирования старения. Данные стареющие клетки обрабатывали соединением 8 в течение 48 ч. и оценивали их жизнеспособность. В таблице 3 показано повышение смертности клеток в случае более высоких доз соединения 8 (определено по снижению количества аннексин V/Хехст-негативных клеток). Клетки RPE, как наиболее чувствительные тестируемые клетки, использовали в качестве контроля для определения концентрации, при которой соединение 8 не является токсичным для нестареющих клеток.
Таблица 3


Пример 23
Неожиданно, в отличие от других используемых в клинической практике химиотерапевтических лекарственных средств, соединения формулы I не индуцировали старение опухолевых клеток, что является важной характеристикой этих средств, поскольку этот побочный эффект многих утвержденных химиотерапевтических средств значительно ухудшает исход лечения. При использовании мышей Balb-c с опухолями, полученными из клеток 4T1, или мышей FVB с самопроизвольно появившимися опухолями, обработанными соединением 8 (0,2 мг соединения 8/мышь дважды в неделю в течение периода 2-3 недель), не выявили какого-либо повышения маркеров старения p16, p21 и PAI на уровне мРНК (таблица 4).
Таблица 4



Важно то, что этот эксперимент повторили с использованием полученных от пациентов ксенотрансплантатов (PDX; трижды негативный рак молочной железы), трансплантированных мышам NOD/SCID/gamma, и которых обрабатывали соединением 8 (0,375 мг соединения 8/мышь дважды в неделю в течение периода 2-3 недель). Используя qRT PCR со специфическими для человека праймерами, выявили, что даже в этом случае отсутствовало повышение маркеров старения (таблица 5).
Таблица 5

Пример 24
Поскольку стареющие клетки, обработанные соединением 8, способны индуцировать гликолиз, о чем свидетельствует их свойство повышать продуцирование лактата, являющегося продуктом гликолиза (таблица 6 для клеток RPE), сосредоточили внимание на их способности использовать АТФ, продуцируемую в ходе гликолиза. Адениннуклеотидтранслоказа 2 (ANT2) представляет собой белок, играющий важную роль в перемещении АТФ из цитоплазмы в митохондрии, в противоположность двум другим представителям семейства ANT, ANT1 и ANT3, участвующим в каноническом перемещении АДФ в митохондрии за счет комплекса V в ходе митохондриального дыхания. ANT2 играет ключевую роль в поддержании митохондриального потенциала и в сохранении митохондрий интактными, в частности, в опухолевых клетках. Измерение уровня мРНК выявило снижение ANT2 в стареющих клетках (таблица 7, клетки RPE, данные для клеток BJ не показаны). Понижающая регуляция ANT2 в устойчивых контрольных клетках при использовании специфической миРНК, привела в результате к повышенной смертности данных клеток после обработки соединением 8 (таблица 8, клетки RPE, данные для клеток BJ не показаны), что свидетельствует о роли ANT2 в устойчивости к соединению 8. Для доказательства этой гипотезы получали клетки RPE, трансфицированные индуцируемой ANT2, с целью повышения ее уровней в стареющих клетках. В таблице 9 показана повышенная устойчивость стареющих клеток с индуцированной ANT2 по отношению к обработке соединением 8. Во всех этих экспериментах показана ключевая роль ANT2 в устойчивости к соединению 8.
Таблица 6

Таблица 7

Таблица 8

Таблица 9

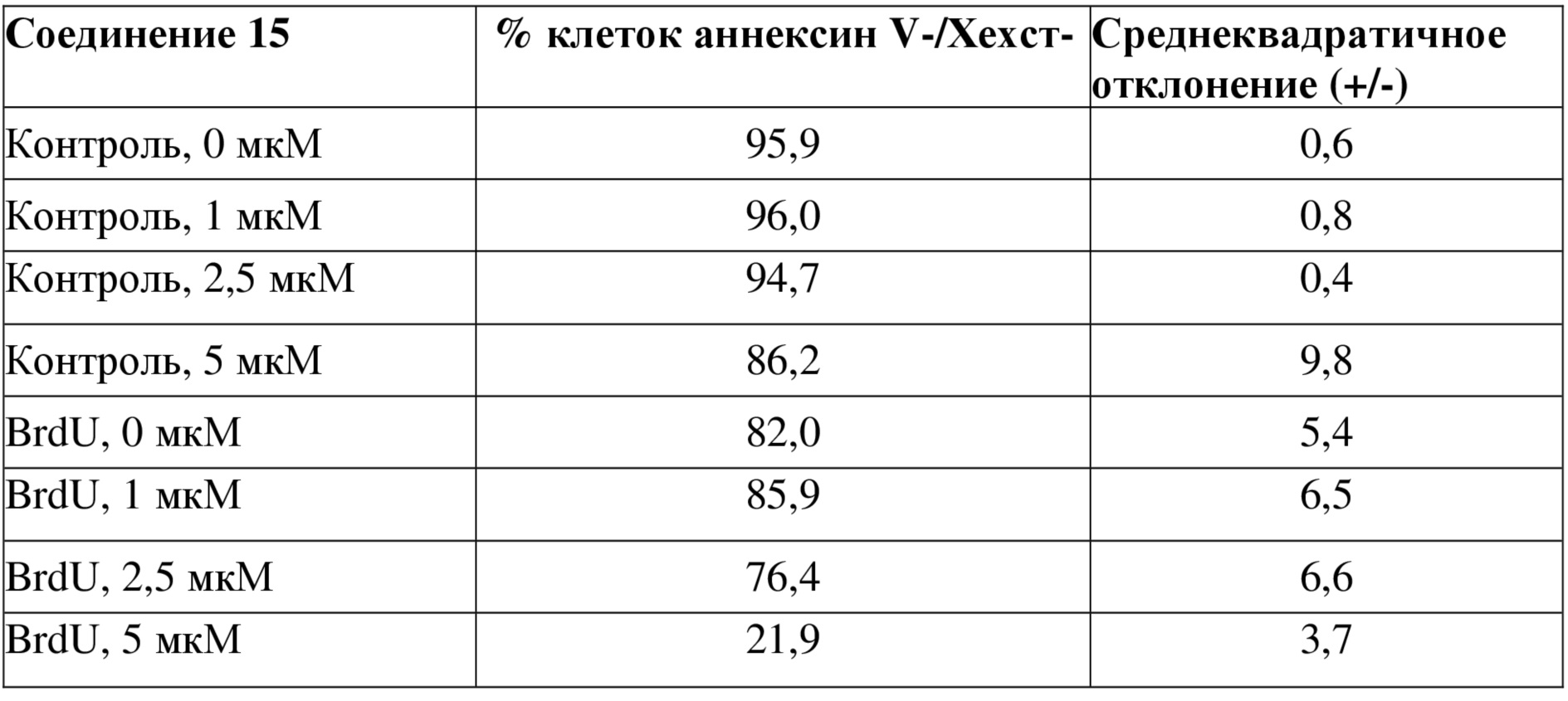
Пример 26
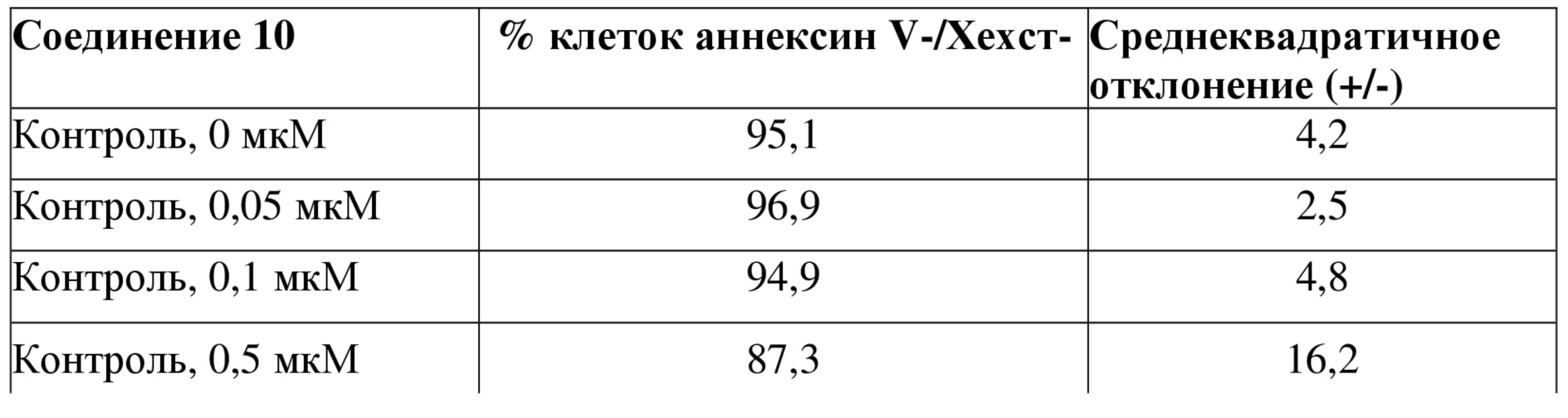
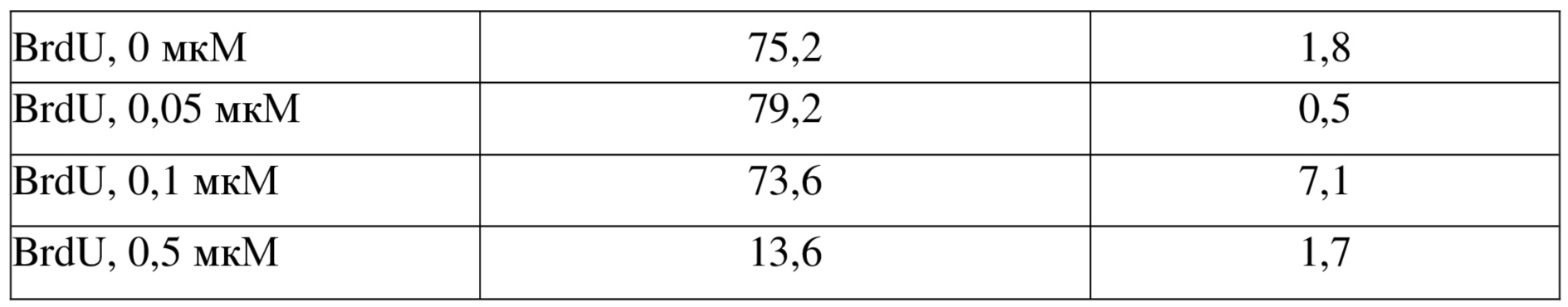
Тестировали влияние соединений 7, 8, 10, 15 на первичные стареющие клетки (клетки пигментного эпителия сетчатки (RPE), которые обрабатывали в течение 8 дней с использованием 100 мкМ 5-бром-2-дезоксиуридина (BrdU)). Только соединения формулы I (соединения 8, 10 и 15) продемонстрировали специфическое влияние на устранение стареющих клеток (выявлено по уменьшению количества аннексин V/Хехст-негативных клеток, таблица 10) без какого-либо влияния на контрольные клетки. Все данные эксперименты также подтвердили при использовании клеток BJ и HPF-1, получив такие же результаты (данные не показаны).
Таблица 10


Такой же эксперимент повторили с тамоксифеном (известен из патентного документа US2015/0151001 для применения в лечении старения), получив следующие результаты:


Данные результаты показывают, что соединения по настоящему изобретению избирательно являются более цитотоксичными по отношению к стареющим клеткам (по сравнению, в частности, со значениями жизнеспособности для контрольных и стареющих (BrdU) клеток в случае соединения 8, концентрация 2,5 мкМ, в случае соединения 7, концентрация 0,5 мкМ; в случае соединения 10, концентрация 0,5 мкМ; в случае соединения 15, концентрация 5 мкМ). Тамоксифен, соединение из предшествующего уровня техники, при любых тестированных концентрациях не проявлял значимо высокой токсичности по отношению к стареющим клеткам, чем по отношению к контрольным клеткам. До концентрации 5 мкМ включительно тамоксифен не проявляет цитотоксичность, при 10 мкМ он снижает жизнеспособность и стареющих, и контрольных клеток приблизительно на половину, а при 20 мкМ он проявляет высокую цитотоксичность по отношению и к стареющим, и к контрольным клеткам. Соединения по настоящему изобретению также демонстрируют значимый цитотоксический эффект по отношению к стареющим клеткам при более низких концентрациях, чем тамоксифен.
Реферат
Настоящее изобретение относится к соединению для устранения стареющих клеток, лечения и предупреждения диабета и ожирения формулы Ia:,где Z представляет собой линейный Салкилен, где необязательно одна пара атомов углерода в углеводородной цепи может быть заменена одним триазолом, и/или один атом углерода в углеводородной цепи может быть заменен группой NH; где углеводородная цепь не замещена или замещена =О; каждый из R1, R2, R3 независимо выбран из Cалкила, Cарила, Cарил-Cалкила, Cциклоалкила, где каждый из R1, R2, R3 необязательно и независимо может быть замещен одним или более Cалкокси; Xпредставляет собой фармацевтически приемлемый анион; где перекрещенная двойная связь в общей формуле Ia указывает на то, что двойная связь может иметь E- и/или Z-конфигурацию; при условии, что все из R1, R2 и R3 не представляют собой одновременно незамещенные фенилы; или его фармацевтически приемлемой соли. 2 н. и 6 з.п. ф-лы, 26 пр., 10 табл.
Формула



Комментарии