Способ воздействия на организм путем адресной доставки биологически активных веществ в митохондрии,фармацевтическая композиция для его осуществленияи соединение, применяемое для этой цели - RU2318500C2
Код документа: RU2318500C2
Чертежи












Описание
Область техники, к которой относится изобретение
Данное изобретение относится к области биологии и медицины, и в частности может быть использовано в медицине для приготовления фармацевтической композиции для адресной (направленной) доставки биологически активных веществ в митохондрии, осуществляемой за счет электрохимического потенциала ионов водорода в митохондрии. Кроме того, изобретение относится к способу воздействия на организм, который предусматривает указанную доставку требуемых биологически активных веществ в митохондрии.
Уровень техники
Митохондрии живой клетки играют ключевую роль в ряде важнейших внутриклеточных процессов, таких как энергетический обмен в клетке (самая главная функция митохондрии - обеспечение клетки энергией), метаболизм определенных веществ (например, жирных кислот) и др. Также митохондрии участвуют в образовании и утилизации свободных радикалов и активных форм кислорода (СР и АФК) - крайне реакционно способных веществ, способных влиять на множество процессов в клетке. Наконец, в последнее десятилетие была доказана ключевая роль митохондрии в процессе запрограммированной клеточной смерти.
Известно большое количество заболеваний, связанных с нарушением нормального функционирования митохондрий. К ним относят все заболевания, связанные с повышенным образованием СР и АФК, одиночной или массовой гибелью клеток в составе ткани или органа, нарушением программы клеточного самоубийства - апоптоза, нарушением в обмене жирных кислот и так далее.
Полагают, что, воздействуя на митохондрии, можно влиять на самые разные аспекты жизнедеятельности клетки и всего организма.
В рамках этого изобретения предлагается новая технология воздействия на митохондрии живой клетки при помощи направленной, адресной доставки и накопления в этих органеллах различных биологически активных веществ.
Преимущества такого подхода очевидны - направленное накопление вещества позволяет увеличить эффективность его применения, снизить общую дозировку (так как эффективная концентрация достигается за счет многократного накопления вещества в определенном компартменте клетки), снизить вероятность и силу побочных эффектов.
Само устройство митохондрий предоставляет уникальную возможность для такой адресации - функционирующие митохондрии активно выкачивают из себя в цитоплазму ионы водорода и, таким образом, создают на своей внутренней мембране мощнейший электрохимический потенциал ионов водорода - протонный потенциал.
Исследования в области биоэнергетики позволили к настоящему времени создать большое количество веществ, способных проникать сквозь мембраны и накапливаться в митохондриях за счет энергии протонного электрохимического потенциала - такие вещества получили название "ионов Скулачева" (Green DE, "The electromechanochemical model for energy coupling in mitochondria", 1974, Biochem. Biophys. Acta., 346:27-78). Эти ионы, как правило, не обладают ярко выраженной биологической активностью. Настоящее изобретение заключается в использовании ионов Скулачева в составе нового соединения, содержащего, помимо самого иона, другое желательное вещество для адресной доставки в митохондрии этого другого вещества, которое в контексте данного изобретения названо эффектором.
К настоящему моменту известно крайне ограниченное количество биологически активных соединений, адресно доставляемых в митохондрии за счет энергии электрохимического потенциала ионов водорода. К таким веществам можно отнести, например, антиоксиданты, описанные в US 6331532 и ЕР 1047701 (вещества митохинол (MitoQ), митовитамин Е (MitoVitE) и ЕР 1534720 (миметики супероксиддисмутазы или глутатионпероксидазы, соединенные с трифенилфосфонием). Некоторые из этих веществ и их активность описаны в работах, упомянутых ниже.
Вещества, содержащие миметики супероксиддисмутазы или глутатионпероксидазы заявлены в ЕР 1534720 как митохондриально адресованные антиоксиданты для лечения и профилактики болезней, связанных с окислительным стрессом и т.п. В экспериментальных примерах описания изобретения ЕР 1534720 приведены данные об их способности проникать в митохондрии и их антиоксидантном действии в растворе и при взаимодействии с изолированными митохондриями. Никаких данных о действии этих веществ на клетки или на организм в целом не приведено. В то же время есть данные о высокой реакционной способности указанных миметиков по отношению к сульфгидрильным группам белков. Такая реакционная способность должна вызывать резкое снижение эффективности митохондриально адресованных антиоксидантов, содержащих миметики супероксиддисмутазы или глутатионпероксидазы (эбселен), что, в свою очередь, ставит под сомнение их применимость. Это подтверждается данными, приведенными в статье Filipovska A, Kelso GF, Brown SE, Beer SM, Smith RA, Murphy MP. J. Biol. Chem. 2005, 280(25):24113-26. В этой работе было показано, что эбселен, соединенный с остатком, адресно доставляющим его в митохондрии (все соединение названо митоэбселен) обладает той же эффективностью, что и обычный эбселен. Другими словами, адресация соединений типа митоэбселена, если и повышает их антиоксидантное действие, то такое преимущество нивелируется нежелательной побочной активностью митоэбселена.
MitoVitE также представляет собой митохондриально адресованный антиоксидант, содержащий трифенилфосфоний в качестве адресующей группы и остаток витамина Е в качестве антиоксиданта. В описании изобретения ЕР 1047701 приведены данные об антиоксидантном действии этого вещества в гомогенате мозга крысы, способности MitoVitE вещества проникать в изолированные митохондрии и в клетки в культуре; также показано, что в концентрации до 10 мкМ MitoVitE не влияет на жизнеспособность клеток в культуре, а дальнейшее повышение концентрации MitoVitE приводит к снижению выживаемости клеток. Однако никакого антиоксидантного действия MitoVitE на отдельные клетки, а также на ткани, органы или целый организм показано не было. Действие MitoVitE на клетки в культуре описано в статье Jauslin ML, Meier Т, Smith RA, Murphy MP, FASEB J. 2003 17(13):1972-4. Из данной работы следует, что действие MitoVitE по предотвращению запрограммированной гибели клеток не исчезает на фоне разобщителя FCCP (3-флюорометил-карбонилцианид фенилгидразон), то есть в условиях, когда направленное накопление MitoVitE в митохондриях невозможно. Эти данные свидетельствуют о том, что митохондриальная адресация MitoVitE если и имеет место, то не играет решающей роли в биологической активности этого соединения.
Митохондриально адресованный антиоксидант MitoQ и его варианты (MitoQ5, MitoQ3) представляют собой убихинон (убихинол в восстановленной форме), соединенный с трифенилфосфонием через С-10 линкерную группу (С-5, С-3 соответственно). В описании изобретения US 6331532 MitoQ заявлен как действующее вещество композиций, предназначенных для лечения и профилактики заболеваний, связанных с окислительным стрессом. В экспериментах, приведенных в описании изобретения, показаны антиоксидантные свойства MitoQ в растворе, способность этого вещества проникать в изолированные митохондрии, влияние на эффективность дыхания изолированных митохондрии. Однако не приводится никаких данных о действии MitoQ на отдельные клетки, ткани, органы, о наличии или отсутствии токсичности.
Дополнительные данные по активности MitoQ приведены в WO 2005019233 той же группы изобретателей, где показана эффективность MitoQ для предотвращения перекисного окисления липидов на изолированных митохондриях, а также в работе (Adlam VJ, Harrison JC, Porteous CM, James AM, Smith RA, Murphy MP, Sammut IA, 2005, FASEB J. 19:1088-95). В этой статье приведен единственный пример действия MitoQ на организм в эксперименте по скармливанию этого вещества крысам, с последующим изучением свойств их сердца на системе Лагендорфа (изолированного перфузионного сердца). Приведенные данные косвенно подтверждают заявление, что MitoQ можно использовать для профилактики или лечения ишемического повреждения миокарда. Однако в описываемой работе есть целый ряд неточностей и неопределенных мест, которые не позволяют убедительно доказать такое заявление. Так, используемая авторами работы 30-минутная нормотермическая ишемия с последующей реперфузией - это часто применяемая модель ишемического повреждения миокарда. Однако ее существенным недостатком является электрическая нестабильность сердца во время реперфузии. Известно, что часть сердец не восстанавливает свою активность вовсе из-за периодической или постоянной фибрилляции, и практически в каждом опыте такой серии возникает периодическая аритмия. В цитируемой статье нет указаний ни об аритмии, ни о фибрилляции. Поэтому остается неясным, характеризуют ли полученные авторами средние величины целую группу образцов или только те опыты, в которых аритмия была менее выраженной. Кроме того, по приведенным выше причинам, количество животных в каждой серии (6) явно недостаточно для данной модели.
Отчасти предположение о некорректности полученных авторами данных подтверждается довольно странным наблюдением значительного прироста сократительной функции как в контрольной, так и в опытных сериях в условиях реперфузии, которая неизбежно должна была бы сопровождаться гибелью кардиомиоцитов. Такой результат возможен, если при расчете сократительной функции использовали только те сердца, которые продолжали работать, исключая "выключившиеся", вошедшие, однако, в подсчет скорости перфузии. Такой способ очевидно некорректен. Хотя средние данные на любом сроке реперфузии в группе, обработанной MitoQ выше, чем в группах, обработанных контрольными препаратами, эти группы между собой не сопоставлены и достоверны ли различия между ними, неясно. Таким образом, основной вывод авторов о том, что только MitoQ является кардиопротекторным соединением, выглядит не вполне убедительным. Такое мнение подкрепляется отсутствием в группах, обработанных контрольными веществами, результатов исследования ультраструктуры, выхода лактатдегидрогеназы, цитохрома С, каспазы 3, комплекса 1 и аконитазной активности в митохондриях.
В общем, детальное изучение данной работы показывает наличие весьма слабых мест на этапе отбора и анализа результатов. Вероятно, авторский коллектив не имеет большого опыта работы на данной модели. Таким образом, можно утверждать, что кардиопротекторное действие MitoQ остается недоказанным.
Кроме того, следует отметить, что при наличии весьма обнадеживающих результатов по действию MitoQ на культуры клеток, есть несколько наблюдений, ставящих под сомнение возможность практического применения этого соединения. В опытах на культурах клеток было показано, что свое аитиоксидантное и противоапоптозное действие MitoQ оказывает при его концентрации в среде около 1 мкМ. На данный момент считается доказанным, что в этих условиях концентрация MitoQ в митохондриях может достигать 1 мМ. В то же время в работе Smith RA, Porteous CM, Gane AM, Murphy MP, Proc Natl Acad Sci USA, 2003, 100(9):5407-12 было показано, что при скармливании MitoQ лабораторным животным его накопление в тканях мозга и в сердечной мышце - местах, наиболее уязвимых для окислительного стресса - происходит до максимальной концентрации 100 пмоль на грамм живого веса. Расчеты показывают, что при такой концентрации MitoQ в ткани, даже максимально насыщенной митохондриями (сердечной мышце), концентрация MitoQ внутри митохондрий не превышает 100 нмоль. То есть более чем в 1000 раз меньше, чем концентрация, при которой достигались эффекты, продемонстрированные на культуре клеток. При этом увеличить дозировку, назначаемую лабораторным животным, хотя бы в 10 раз не позволяет токсичность препарата.
Таким образом, существующий уровень техники раскрывает только один тип митохондриально адресованных соединений - вещества, заявляемые как митохондриально адресованные антиоксиданты. Никаких других митохондриально адресованных биологически активных соединений к настоящему моменту неизвестно. Следует отметить, что и раскрытые вещества, заявляемые как митохондриально адресованные антиоксиданты, не решают поставленной задачи, поскольку их биологическая активность описана крайне слабо и перспективы практического применения для заявленных целей неопределенны. Кроме того, для большинства из раскрытых соединений уже доказана их неэффективность.
Сущность изобретения
В основе изобретения лежит принцип концентрации биологически активных веществ в митохондриях живой клетки за счет использования энергии электрохимического потенциала ионов водорода и ионов Скулачева. Такой подход неожиданно позволил многократно снизить дозировку используемых биологически активных веществ, направленно эффективно воздействовать на митохондрии, которые являются ключевым элементом в важнейших внутриклеточных процессах, что предоставляет возможность многократно снизить вероятность и силу нежелательных побочных эффектов.
Таким образом, одним из аспектов настоящего изобретения является способ воздействия на организм при помощи биологически активных веществ, адресно доставляемых в митохондрии за счет энергии электрохимического потенциала ионов водорода.
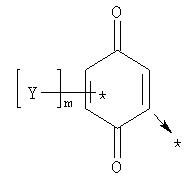
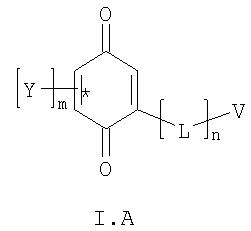
Другим аспектом изобретения является композиция для адресной доставки биологически активного вещества в митохондрии клетки, включающая в себя соединение, состоящее из адресующей части, обеспечивающей доставку всего соединения в митохондрии, линкерной группы и эффектора - вещества, обладающего требуемой биологической активностью. В целом такое соединение может быть представлено общей формулой:

где А - эффекторная группа, представляющая собой:
а) антиоксидант (II)

и/или его восстановленная форма,
где m - целое число 1-3; Y - одинаковые или разные заместители, представляющие собой низший алкил или низший алкокси; или два вицинальных Y связаны между собой таким образом, что образуют структуру:

и/или его восстановленную форму,
где R1 и R2 одинаковые или разные заместители, независимо друг от друга представляющие собой низший алкил или низший алкокси;
б) прооксидант,
в) индуктор апоптоза,
г) ингибитор антиапоптозных белков митохондриальной локализации,
д) фотосенсибилизатор.
В этом аспекте изобретения в соединении композиции:
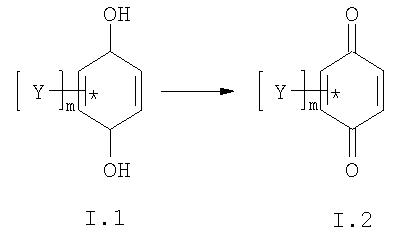
антиоксидант представляет собой соединение, способное взаимодействовать с СР и АФК, нейтрализуя их опасные свойства. Предпочтительно, чтобы при этом в своей радикальной форме это соединение могло взаимодействовать с дыхательной цепью митохондрий и таким образом восстанавливать свои антиоксидантные свойства для следующего взаимодействия с СР и/или АФК. Предпочтительным антиоксидантом, отвечающем структуре II является 2,3-диметил-1, 4-бензохинол (остаток пластохинона - сильнейшего антиоксиданта из тилакоидов протопластов, то есть одного из самых насыщенных СР и АФК мест в живой природе);
прооксидант представляет собой соединение, способное образовывать и/или стимулировать образование свободных радикалов и/или активных форм кислорода при попадании в клетку: паракват, менадион, органические гидропериксные соединения;
индуктор апоптоза представляет собой соединение, которое будучи доставленным в митохондрии тем или иным образом активирует запрограммированную гибель клетки (апоптоз), предпочтительным индуктором апоптоза в составе соединения (I) является фениларсеноксид, известный как наиболее успешный в настоящее время - индуктор образования поры;
ингибитор антиапоптозных белков митохондриальной локализации представляет собой соединение, способное взаимодействовать с одним или более антиапоптозных белков, находящимися в митохондрии (в том числе встроенными в митохондриальную мембрану) и подавлять активность этих белков. Предпочтительным ингибитором антиапоптозных белков митохондриальной локализации является АВТ737. Полагают, что они особенно полезны для использования в комбинации с химиотерапийным агентом для облегчения индукции апоптоза;
фотосенсибилизатор представляет собой соединение, способное образовывать синглетный кислород или другие АФК или СР при облучении светом, предпочтительными фотосенисибилизаторами являются фталоцианин, содержащий или не содержащий металлический заместитель и его комплексы: порфирин и его производные, в частности, BDP-Mac или BDP-MaD; фоскан (mTHPC).
L - линкерное звено, представляющее собой:
а) простую или разветвленную углеводородную цепь, не обязательно замещенную одним или более заместителем и которая при необходимости содержит одну или более двойную или тройную связь;
б) природную изопреноидную цепь;
n - целое число 1-20;
В - адресующая группа, представляющая собой:
а) Скулачев-ион Sk:
Sk+Z-,
где Sk - липофильный катион, Z - фармакологически приемлемый анион;
б) заряженный гидрофобный пептид из 1-20 аминокислот;
за исключением соединений, в которых А представляет собой убихинон (то есть 2-метил-4,5-диметокси-3,6-диоксо-1,4-циклогексадиенил) или токоферол или миметик супероксиддисмутазы или эбселен, при том что L - дивалентный децил или дивалентный пентил или дивалентный пропил, а В - трифенилфосфоний;
а также его сольваты, изомеры или пролекарственные формы и фармакологически приемлемый носитель.
Следующим аспектом изобретения является терапевтический или профилактический (предотвращающий) агент - соединение, отвечающее структуре (I), - полезный при заболеваниях, для устранения, предупреждения или облегчения которых эффективным является снижение количества свободных радикалов и/или активных форм кислорода в отдельных клетках, тканях, участках, органах, во всем организме, с помощью митохондриально адресованных антиоксидантов. В связи с этим аспектом изобретения предлагается:
применение митохондриально адресованных антиоксидантов, отвечающих структуре (I) для увеличения продолжительности жизни человека или другого животного;
применение терапевтического или профилактического агента, полезного при заболевании, связанном со старением организма и усилением окислительного стресса;
в частности применение митохондриально адресованных антиоксидантов для борьбы с заболеваниями глаз, связанными с окислительным стрессом и/или массовой гибелью клеток сетчатки или других типов клеток, вовлеченных в процессы, обеспечивающие зрение; для борьбы с катарактой, макулодистрофией сетчатки;
применение митохондриально адресованных антиоксидантов, отвечающих структуре (I), для лечения или профилактики заболеваний, связанных с массовой запрограммированной смертью клеток в тканях и органах и и/или связанных с распространением в пораженной ткани сигналов, инициирующих запрограммированную гибель клеток;
применение митохондриально адресованных антиоксидантов, отвечающих структуре (I) для профилактики и/или лечения сердечно-сосудистых заболеваний, для которых показана ключевая роль запрограммированной гибели клетки, апоптоза или некроза; для профилактики и/или лечения инфаркта, инсульта; для предотвращения вредных последствий реоксигенации;
применение митохондриально адресованных антиоксидантов, отвечающих структуре (I), во время хирургических операций для защиты здоровых тканей от повреждения;
применение митохондриально адресованных антиоксидантов, отвечающих структуре (I), в трансплантологии для борьбы с отторжением тканей и для сохранения трансплантационного материала;
применение митохондриально адресованных антиоксидантов, отвечающих структуре (I), в косметологии для преодоления последствий ожогов, улучшения заживания ран и хирургических швов;
применение митохондриально адресованных антиоксидантов в качестве противовоспалительного средства.
Кроме того, аспектом изобретения является терапевтический или профилактический (предотвращающий) агент, отвечающий структуре (I), для онкологических заболеваний. В связи с этим аспектом изобретения предлагается:
применение митохондриально адресованных антираковых препаратов для борьбы с метастазированием, ангиогенезом, в том числе для направленного запуска запрограммированной клеточной смерти в раковых клетках;
применение качестве митохондриально адресованных антираковых препаратов митохондриально адресованных прооксидантов отвечающих структуре (I), предпочтительно митохондриально адресованный паракват, митохондриально адресованный менадион, или митохондриально адресованные антиоксиданты, неспособные восстанавливаться дыхательной цепью митохондрий и таким образом проявляющие прооксидантные свойства (например, дезмитоксимито Q);
применение в качестве митохондриально адресованных антираковых препаратов митохондриально адресованных индукторов апоптоза, отвечающих структуре (I). Такой подход предпочтителен по сравнению с использованием традиционных индукторов апоптоза, поскольку митохондрии предоставляют большое количество возможностей для запуска запрограммированной клеточной смерти. Одним из предпочтительных способов такого запуска является сшивание сульфгидрильных групп белков, располагающихся в мембране митохондрий через эффекторную группу митохондриально адресованного индуктора апоптоза. Предпочтительной эффекторной группой такого соединения является фениларсеноксид;
применение в качестве митохондриально адресованных антираковых препаратов, отвечающих структуре (I), митохондриально адресованных ингибиторов антиапоптозных белков митохондриальной локализации. Предпочтительными белками, активность которых должны подавлять такие препараты, являются bc1-2 и родственные белки. Одним из предпочтительных ингибиторов является АВТ737.
Также аспектом изобретения является использование в качестве митохондриально адресованного антиракового препарата композиции, включающей в себя отвечающие структуре (I) митохондриально адресованные ингибиторы антиапоптозных белков митохондриальной локализации и обычные препараты, индуцирующие запрограммированную гибель раковых клеток.
Также аспектом изобретения является использование в качестве митохондриально адресованного антиракового препарата композиции, включающей в себя отвечающие структуре (I) митохондриально адресованные антиоксиданты и обычные препараты, индуцирующие запрограммированную гибель раковых клеток. В этом аспекте изобретения предпочтительным является использование антиоксидантов, соединенных с липофильными катионами, поскольку в раковых клетках наблюдается повышенная, по сравнению со здоровыми клетками, активность ферментов, способных откачивать липофильные катионы из этих клеток (ферменты системы множественной лекарственной устойчивости). Таким образом, митохондриально адресованный антиоксидант будет преимущественно накапливаться в здоровых клетках, что приведет к их преимущественному выживанию в условиях антираковой терапии, что в свою очередь снизит силу нежелательных последствий такой терапии;
применение митохондриально адресованных антиоксидантов для увеличения эффективности химиотерапии и радиотерапии рака;
применение в качестве митохондриально адресованного антиракового препарата митохондриально адресованного фотосенсибилизатора;
применение в фотодинамической терапии рака митохондриально адресованного фотосенсибилизатора, позволяющего уничтожать раковые клетки за счет митохондриальной индукции апоптоза. Такой подход имеет ряд существенных преимуществ перед традиционными методами фотодинамической терапии, поскольку а) позволяет уничтожать раковые клетки с помощью запрограммированной клеточной смерти, а не некротизации (приводящей к целому ряду нежелательных последствий), б) позволяет существенно снизить концентрацию применяемого фотосенсибилизатора, что снижает вероятность возникновения и силу побочных эффектов;
применение митохондриально адресованного антиоксиданта SkQ1 в качестве предпочтительного антиракового агента.
Еще одним аспектом изобретения является применение митохондриально адресованного антиоксиданта, содержащего в качестве адресной группы остаток структуры (III), для лечения заболеваний, связанных с обменом веществ; диабета.
Также аспектом изобретения является метод обеззараживания ткани, крови, другой субстанции, содержащей клетки и клеточные элементы, при помощи свободных радикалов. В рамках этого метода нужные клетки и клеточные элементы защищены от окислительного стресса при помощи митохондриально адресованного антиоксиданта, а болезнетворные агенты уничтожаются свободными радикалами.
Другим аспектом изобретения является применение митохондриально адресованных антиоксидантов в биотехнологии для увеличения жизнеспособности клеток животных или человека в культуре для исследовательских или технологических нужд. Этот аспект изобретения основывается на факте, что в большом количестве случаев концентрация кислорода в культуральной среде при выращивании клеток в культуре существенно превышает концентрацию кислорода в ткани, что резко увеличивает вероятность окислительного стресса у клеток, что, в свою очередь, ведет к повышенной вероятности апоптоза или некроза, снижает жизнеспособность таких клеток. Обработка клеток митохондриально адресованным антиоксидантом резко снижает остроту окислительного стресса. Также обработка митохондриально адресованным антиоксидантом значительно увеличивает биомассу клеток, что приводит к их большей продуктивности. В связи с этим аспектом предлагается:
применение митохондриально адресованных антиоксидантов для увеличения продуктивности животных (в том числе человеческих), растительных или грибковых клеток в культуре, при использовании для продукции фармакологических препаратов; белков; антител;
применение митохондриально адресованных антиоксидантов для увеличения продуктивности целых растений, при использовании для продукции фармакологических репаратов: белков, антител;
применение митохондриально адресованных антиоксидантов для увеличения продуктивности клеток дрожжей и других грибов родов Saccharomyces, Pichia, Hansenula, Endomyces, Yarrowia в культуре, при использовании для продукции фармакологических препаратов: белков, антител;
применение митохондриально адресованных антиоксидантов для увеличения жизнеспособности растительных протопластов в культуре, при использовании для продукции фармакологических препаратов: белков, антител; при использовании для получения генетически модифицированных растений;
применение митохондриально адресованных антиоксидантов при получении генетически модифицированных растений для увеличения жизнеспособности регенерирующих растений, клеток в каллусах;
применение митохондриально адресованных прооксидантов для борьбы с болезнетворными микроорганизмами - грибами, простейшими, бактериями;
применение митохондриально адресованных индукторов апоптоза для борьбы с болезнетворными микроорганизмами - грибами, простейшими, бактериями;
Следующим аспектом изобретения является метод синтеза митохондриально адресованных антиоксидантов, использующих липофильный катион в качестве адресной группы.
Краткое описание фигур
На фиг.1 показано проникновение SkQ1 через искусственную мембрану.
На фиг.2 продемонстрировано; спонтанное окисление производных хинолов MitoQ и SkQ1.
На фиг.3 показано увеличение скорости окисления производных хинолов "MitoQ" и "SkQ1" при введении в систему супероксидного радикала. А - скорость окисления восстановленных форм кислородом воздуха и супероксидным радикалом; Б - скорость окисления восстановленных форм только супероксидным радикалом.
На фиг.4 представлено восстановление "MitoQ" и "SkQ1" дыхательной цепью митохондрий печени крысы (0,2 мг/мл белка), энергизованных сукцинатом (5 мМ) в присутствии 2 μM ротенона.
На фиг.5 описывается окисление хинолов "MitoQ" и "SkQ1" дыхательной цепью митохондрий печени крысы. "MitoQ" и "SkQ" за счет дыхательной цепи митохондрий, энергизованных сукцинатом (5 мМ) в присутствии 2 μМ ротенона. После полного восстановления производных хинола дыхательную цепь блокировали 25 мМ малонатом и измеряли скорость реокисления "MitoQ" и "SkQ"
На фиг.6 показано цитотоксическое действие SkQ1 и mitoQ на клетки линии Hela. % живых клеток пропорционален ОП492 МТТ-формазана.
На фиг.7 показано влияние SkQ и других препаратов на заболеваемость крыс OXYS макулодистрофией. По оси ординат - % глаз с дегеративными изменениями макулярной области сетчатки.
На фиг.8 приведен процент глаз с изменениями макулы 2-й степени. Прием SkQ1 не только снизил заболеваемость макулодистрофией, но и существенно снизил выраженность изменения сетчатки. По оси ординат - % глаз со 2-й стадией заболевания.
На фиг.9 описываются дегенеративные изменения в макулярной области сетчатки OXYS до приема препаратов и после 45-дневного курса KBr, SkQ1 или витамина Е.
На фиг.10 описано влияние SkQ1 и других препаратов на заболеваемость крыс OXYS катарактой. По оси ординат - % глаз с изменениями хрусталиков.
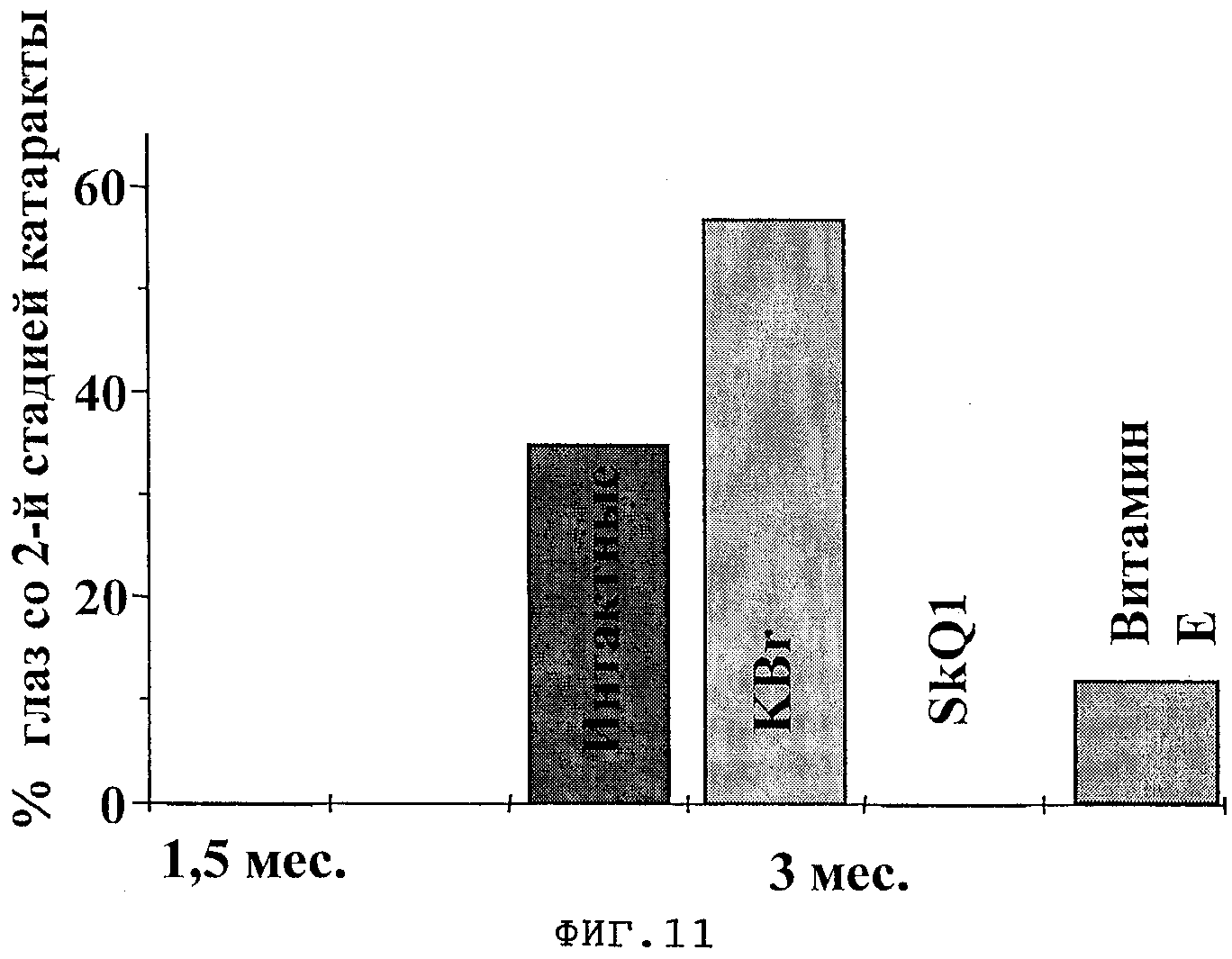
На фиг.11 приведен процент глаз с изменениями хрусталиков 2-й степени. Прием SkQ1 не только снизил заболеваемость, но и существенно снизил выраженность тяжести течения катаракты. По оси ординат - % глас с изменениями, соответствующими 2-й стадии заболевания.
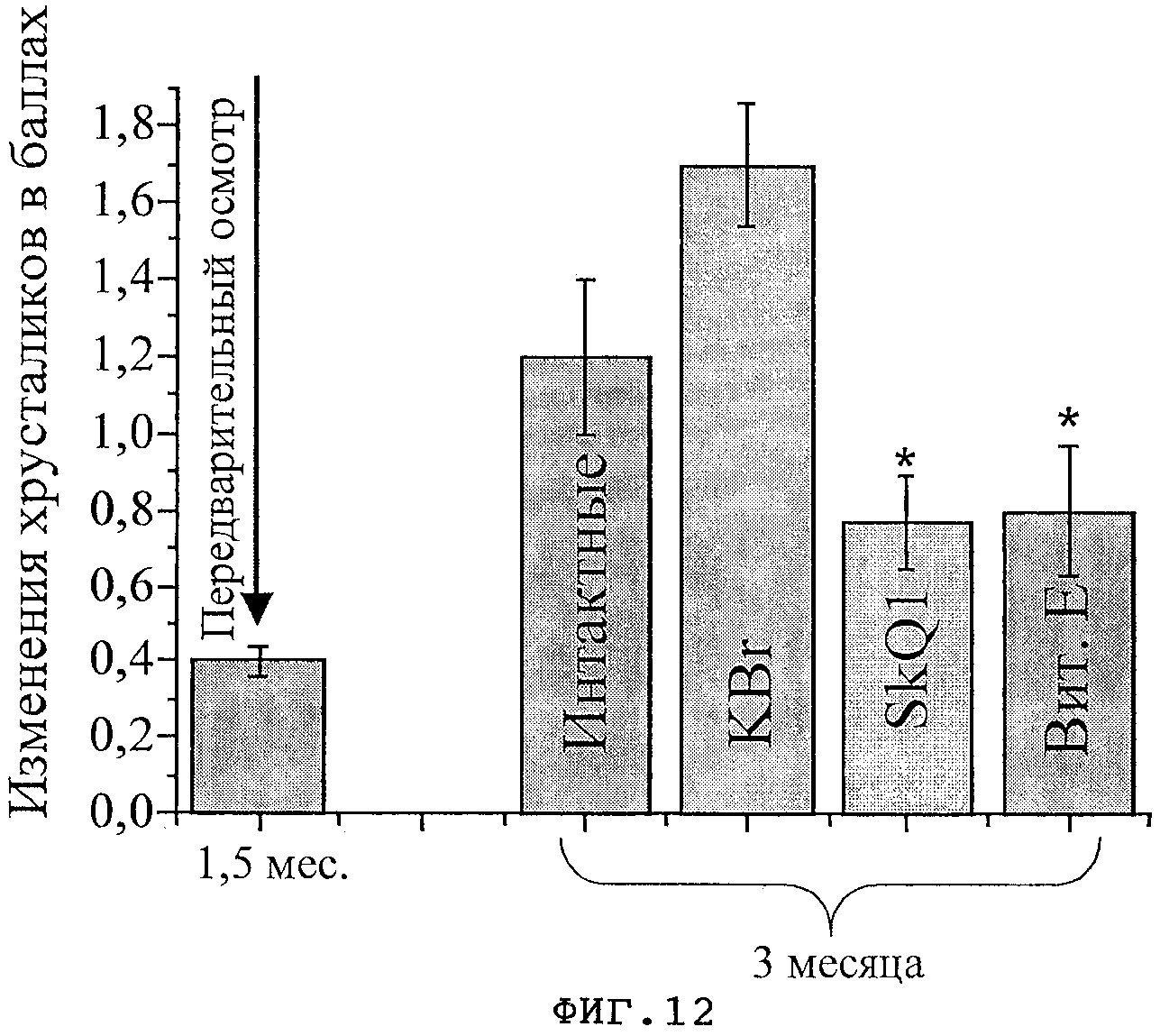
На фиг.12 показано состояние хрусталиков крыс OXYS перед началом приема препаратов и после 45-дневного курса KBr, SkQ1 и витамина Е.
На фиг.13 описано влияние трех концентраций SkQ1 на выживаемость мышей с привитой асцитной карциномой Эрлиха.
На фиг.14 показано действие ингибитора синтеха белка, циклогексимида Д (ЦгД) и антиоксидантов на клетки Yarrowia lipolytica, обработанные 5 мМ перекисью водорода. Выживаемость оценивали по количеству образовавшихся колоний на твердой среде. На твердую среду клетки переносили через 3 часа инкубации.
Осуществление изобретения
Ниже приведены ряд экспериментальных примеров, чтобы проиллюстрировать возможность осуществления изобретения, в частности действие веществ, отвечающих структуре (I), в соответствии с изобретением. Эти примеры призваны лишь подтвердить обоснованность притязаний и не должны восприниматься как ограничивающие область его использования или применения.
Экспериментальный пример I: синтез веществ структуры (I) - 2, 3-диметил-1,4-бензохинон-5-децилового эфира родамина G.
Было синтезировано соединение SkQR1, отвечающее структуре (I) и содержащее в качестве адресующей группы остаток родамина G, а в качестве антиоксидантной эффекторной группы - остаток пластохинона, выбранного поскольку он является природным антиоксидантом, присутствующим в наиболее насыщенном СР и АФК месте в живой природе - тилакоидах хлоропластов растений.

В работе использовали следующие реагенты и растворители: 2,3-Диметил-гидрохинон, 11-бромундекановая кислота, родамин G, N,N'-дициклогексилкарбодиимид, бромноватистокислый калий, азотнокислое серебро, персульфат аммония, карбонат цезия фирм Fluka, Aldrich, Sigma, Merck; Silicagel 60 (0,063-0,2 мм) фирмы Merck и растворители отечественного производства: диметилформамид, дихлорметан, хлороформ, метанол, изопропанол, этилацетат, бензол, ацетонитрил и другие. Очистку и абсолютирование растворителей проводили по стандартным методикам
В работе использовали метод тонкослойной хроматографии (ТСХ) на пластинах Kieselgel 60 F254 (Merck). Соединения, содержащие группы, поглощающие в УФ-области, обнаруживали с помощью хемископа Брумберга. Соединения, содержащие хиноновое кольцо, обнаруживали в парах аммиака. Соединения, содержащие родамин, обнаруживали визуально.
Ультафиолетовые спектры поглощения регистрировали на спектрофотометре "Cary 50 Bio" фирмы "Varian".
Высокоэффективная жидкостная хроматография (ВЭЖХ) выполнялась на приборе Adjilent 1100 в градиенте ацетонитрила в 10 мМ Н3PO4.
Масс-спектрометрометрические анализы проводили методом TOF MALDI MS на масс-спектрометрах Ultraflex и Autoflex фирмы Bruker Daltonik (Германия), оснащенных лазером 337 нм и методом ESI MS.
ИК-спектры регистрировали в пленке на приборе Specord 40.
ПМР и С13-ЯМР были зарегистрированы при температуре 303К на приборе Brucker Avance-400.
Синтез SkQR1 представлен на схеме (Схема 1)

Синтез 2,3-диметил-1,4-бензохинона (2)
В раствор 0.34 г (2 ммоль) бромноватистокислого калия в 6 мл воды и 0.3 мл 5Н серной кислоты при перемешивании и нагревании при 60°С прибавили 0.83 г (6 ммоль) 2,3-диметилгидрохинона. Затем температуру реакции подняли до 80°С. После завершения реакции реакционную смесь охладили до комнатной температуры и экстрагировали эфиром. Эфирный экстракт промыли водой и сушили безводным хлористым кальцием. Осушитель отфильтровали, фильтрат упарили в вакууме. Вес остатка 0.74 г (90%). Вещество растворили в 20 мл эфира и пропустили через слой силикагеля (30×30 мм), дополнительно промыли силикагель эфиром несколько раз. Эфир упарили и получили 0.67 г хроматографически чистого (99.37% по ВЭЖХ) 2,3-диметил-1,4-бензохинона.
ТСХ: Rf 0.46 (хлороформ); ВЭЖХ: τ=17.6 мин (0-90% В за 26.4 мин; А: 10 мМ Н3PO4; В: ацетонитрил); Т.пл. 60°С; УФ-спектр (метанол): λmax 209 нм, 256 нм, 344 нм.
Синтез 2, 3-диметил- 5-(10'-бромдецил)-1,4-бензохинона (3)
136 мг (1 ммоль) 2,3-Диметил-1,4-бензохинона (2) растворили в 10 мл смеси ацетонитрила и воды (1:1) и прибавили 292 мг (1.1 ммоль) 11-бромундекановой кислоты и 170 мг (1 ммоль) азотнокислого серебра. Смесь нагрели до 60-70°С и в раствор по каплям добавили раствор 228 мг (1 ммоль) персульфата аммония в 10 мл воды. Нагревание продолжали еще 1 час, реакционную смесь охладили и экстрагировали эфиром. Эфирный раствор промыли разбавленным раствором бикарбоната натрия, сушили сернокислым магнием и упаривали. Остаток очищали флаш-хроматографией на колонке с силикагелем. Выход соединения 3 в виде темно-красного масла 70%.
ТСХ: Rf 0.62 (хлороформ); ВЭЖХ: τ=23 мин (79-90% В за 26.4 мин; А: 10 мМ Н3PO4; В: ацетонитрил); УФ-спектр (метанол): λmax 207 нм, 258 нм, 344 нм; MALDI-TOF MS: вычислено для C18H27O2Br: 355.3; найдено m/z 356.1 (МН+; 100%); ИК: 2928, 2336, 1600, 1496, 1304 см-1.
Синтез цезиевой соли родамина G (4)
200 мг (0.48 ммоль) Родамина G растворяли в 6 мл метанола, добавляли 1 мл 2 М водного раствора карбоната цезия. Продукт выделяли фильтрованием, промывали эфиром, сушили в вакууме при 60°С. Выход соединения 4 в виде темно-фиолетового кристаллического вещества 210 мг (80%).
Т.пл. >250°С (разл.).
Синтез 10-(2',3'-диметил-1',4'-бензохинон-5'-деканоил)родамина G
190 мг Соединения 4 суспендировали в 5 мл ДМФА, добавили 200 мг (0.56 ммоль) соединения 3. Смесь нагревали до 50°С и перемешивали 48 часов при этой температуре, после чего растворитель удаляли в вакууме. Выделение продукта проводили методом колоночной хроматографии на силикагеле в системе хлороформ-метанол (4:1). Фракцию, содержащую основной продукт, упаривали, к остатку добавляли 150 мкл 5Н раствора хлористого водорода в диоксане, снова упаривали, полученное масло кристаллизовали под бензолом. Выход: 160 мг (65%).
ТСХ: Rf 0.68 (хлороформ-метанол, 4:1); Rf 0,80 (хлороформ-метанол-вода, 65:25:4);
ВЭЖХ: τ=23.9 мин. (0-90% В за 26.4 мин; А: 10 мМ Н3PO4; В: ацетонитрил);
Т.пл. 178-180°С (разл.);
УФ (этанол): λmax 250, 350, 535 нм, ε535=80000;
Элементный анализ: вычислено для С44Н53ClN2O5: С, 72.86; Н, 7.36; С1, 4.89; N, 3.86; найдено: С, 72.53; Н, 7.21; Cl, 4.22; N, 3.61;
ES MS: вычислено для C44H51N2O5 688,89; найдено m/z 689,4 (MH+; 100%);
ИК (пленка): 3200, 2928, 2336, 1700, 1685, 1600, 1496, 1304 см-1;

1Н-ЯМР (400 МГц; DMSO-d6; нумерация атомов указана на структуре, приведенной ниже): 0,95-1,25 м.д. (неразр.м., 14Н, 2'', 3'', 4'', 5'', 6'', 7'', 8'' -(СН2)7); 1,24 м.д. (т., 6Н, J=6,8 Гц, 2'''', 2''''' -(СН3)2); 1,41 м.д. (квинт., 2Н, J=7,5 Гц); 1,92 и 1,94 м.д. (каждый сигнал - с., 3Н, 4''', 5''' -(СН3)2); 2,09 м.д. (с., 6Н, 2,7 -(СН3)2); 3,48 м.д. (квинт., 4Н, - 1'''', 1'''' -(СН2)2); 3,85 м.д. (т., 2Н, J=6,3 Гц, 1'' -СН2); 6,57 м.д. (с., 1Н, Н3,); 6,80 и 6,91 м.д. (каждый сигнал - с., 3Н, H1, Н5 и Н4, Н8); 7,44 м.д. (дд., 1Н; J1=7,8, J2=1 Гц; Н6,,,); 7,74 м.д. (т., 2Н, J=5,8 Гц; 3,6 -NH); 8,60-8,70 м.д. (м. 2Н, Н4,,, и Н5,,,); 8,22 м.д. (дд, 1Н, J1=8,2; J2=1,1 Гц, Н3,,,).
13С-ЯМР (400 МГц; DMSO-d6): 11,59 и 11,98 м.д. (4''', 5''' -(СН3)2); 13,45 м.д. (2'''' и 2''''' -(СН3)2); 17,29 м.д. (2,7 -(СН3 )2); 25,07, 27,29, 27,57, 28,25, 28,39, 28,51, 28,55, 28,56 и 28,65 м.д. (2'', 3'', 4'', 5'', 6'', 7'', 8'' 9'', 10'' -(CH2)9); 37,86 м.д. (1'''', 1''''' -(N-CH2)2); 64,96 м.д. (1'' -СН2); 93,45 м.д. (С4 и С5); 112,78 м.д. (C1 и C8); 125,32 м.д. (С4,); 128, 38 м.д. (С5,); 129,78 и 130,75 м.д. (С1, и С2,); 130,20 и 130,22 м.д. (С5,, C8a и С9а); 131,77 м.д. (С2); 132,85 м.д. (С9,,,); 132,88 м.д. (С3,); 139,79 и 140,36 м.д. (С4,,, и С5,,,); 148,40 м.д. (С1,,,); 155,71 и 156,6 м.д. (С4а-С10а и С3,,,-С6,,,); 164,98 м.д. (COOR); 186,91 и 187,00 м.д. (С3,,, и С6,,,).
По аналогичной методике было получено другое соединение, отвечающее структуре (I) - SkQ1: представляющее собой 2,3-диметил-1,4-бензохинон-5-децил-трифенил фософоний бромид. Это соединение отличается от описанного выше SkQR1 тем, что в качестве адресующей группы в нем использован трифенилфосфоний. Эффекторная и линкерная группы оставлены те же, что и в ранее описанном соединении
Синтез митохондриального антиоксиданта SkQ1 представлен на схеме (Схема 2):

Синтез включает в себя следующие стадии:
1. Окисление 2,3-диметилгидрохинона (1) в соответствующий 2,3-диметил-1,4-бензохинон (2) бромноватистокислым калием.
2. Присоединение 11-бромундекановой кислоты (3) к полученному 2,3-диметил-1,4-бензохинону (2) в присутствии нитрата серебра и персульфата натрия.
3. Образование целевого соединения (5) в результате реакции с трифенилфосфином в атмосфере кислорода.
Полученное вещество представляет собой сухое вещество желто-коричневого цвета с высокой степенью гигроскопичности.
По результатам исследований строения вещества методами ядерного магнитного резонананса, высокоэффективной жидкостной хроматографии, масс-спектрометрии была установлена тождественность строения полученного вещества заданной формуле. Чистота образца не менее 98,5%.
Контроль чистоты продукта проводился двумя методами: при помощи высокоэффективной жидкостной хроматографии высокого давления - ВЭЖХ и с помощью ПМР высокого разрешения (500 МГц). Два способа регистрации чистоты продукта SkQ1 потребовались в связи с выраженными поверхностно-активными свойствами этого соединения, при которых затруднен процесс хроматографии веществ.
Содержание SkQ1 в полученном препарате, определенное методом ВЭЖХ, составляет 98.55%. Данные ядерного магнитного резонанса представлены ниже:

1H-NMR (CDCl3; δ, ppm): 7.82-7.58 (m, 15H aromatics); 6.38 (s, 1H, H-5); 3,6 (m, 2H, СН2Р(Ph)3); 2.25 (m, 2H, СН2СН2СН2СН2СН2СН2 СН2СН2СН2СН2Р(Ph)3); 1.90 (br s, 6H, СН3); 1.55, 1.32, 1.15 (3m, 6H, 3СН2).
HQSC (DMSO; δ, ppm): 8.15 (br s, 1H, tautomeric ОН), 7.88-7.20 (m, 15H, aromatics); 7.08 (br s, 1H, tautomeric OH), 6.38 (s, 1H, H-5); 3.55 (m, 2H, СН2Р(Ph)3); 2.4 (m, 2H, СН2СН2 СН2СН2СН2СН2СН2СН2СН2СН2Р(Ph)3); 2.05, 1.90 (2s, each of 3H, СН3); 1.5 (m, 6H, 3СН2).
13C-NMR (DMSO; δ, ppm): 147.83, 144.65 (C-1, С-4); 134.75-129.97 (Ph); 113.01 (СН2Р(Ph)3; 12.72-11.89 (СН3).
ESI-MS (m/z): [M]+ calc. 537.7, found 537.4.
Также по аналогичной методике было синтезировано соединение, отвечающее структуре (I), 10-(2-метил-5-метокси-3, 6-диоксо-1,4-циклогексадиенил)-децил-трифенилфосфоний бромид (DMMQ). В этом соединении в качестве эффекторной группы использован дезметоксиубихинон. Это вещество способно взаимодействовать с СР, АФК и кислородом, но на основании его структуры и имеющихся знаний о функционировании митохондрий можно заключить, что оно не будет восстанавливаться дыхательной цепью митохондрий, а следовательно будет проявлять прооксидантные, цитотоксичные свойства.

Экспериментальный пример 2: "Перенос соединений, отвечающих структуре (I), через искусственную липидную мембрану".
Было показано, что тестовое соединение, отвечающее структуре I (было использовано соединение SkQ1), проникает сквозь бислойную фосфолипидную мембрану, двигаясь по градиенту концентрации и распределяясь по обе стороны мембраны в соответствии с уравнением Нернста. Следовательно SkQ1 является проникающим катионом.
Методика эксперимента применялась в целом ряде работ по изучению способности различных ионов проникать сквозь билипидную мембрану и подробно описана в статье Starkov АА, Bloch DA, Chernyak BV, Dedukhova VI, Mansurova SA, Symonyan RA, Vygodina TV, Skulachev VP, 1997, Biochem. Biophys Acta, 1318, 159-172. Этот метод заключается в использовании двух заполненных водным раствором камер, разделенных бислойной мембраной, и регистрации перемещения заряженного вещества, способного проникать сквозь такую мембрану, из одной камеры в другую.
В описываемом эксперименте мембрана изготавливалась из смеси фосфотидилхолина и дифитонаила, растворенных в декане, камеры по обе стороны мембраны заполнялись буфером 50 mM TrisHCl, рН 7.4, содержащим 10-7 М SkQ1.
Проводили титрование SkQ1 в концентрациях от 10-7 М до 10-5 М. Показано, что в отрезке от 4·10-6 М до 4·10-5 М распределение SkQ1 отвечает уравнению Нернста для идеально проникающих сквозь мембрану заряженных молекул. При меньших концентрациях уравнение Нернста не выполняется (результаты приведены на фиг.1).
Следовательно, соединение SkQ1 (2,3-диметил-1,4-бензохинон-5-децил-трифенил фософоний) является жирорастворимым веществом, способным проникать через биологические мембраны в катионной форме.
Экспериментальный пример 3: "Антиоксидантные свойства соединений, отвечающих структуре (I)".
Было показано, что тестовое соединение, отвечающее структруре (I) - митохондриальный антиоксидант SkQ1, является сильнейшим антиоксидантом, превышающим по активности опубликованные ранее антиоксиданты, заявленные как митохондриально адресованные в изобретении US 6331532 (вещество MitoQ).
Стабильность во времени восстановленных (хинольных) форм SkQ1 и MitoQ исследовали методом анализа абсолютных спектров поглощения данных соединений в диапазоне от 240 до 310 нм, полученных при помощи двухлучевого спектрофотометра Pye Unicam SP1100, Англия. Производные хинонов восстанавливали тетрагидроборатом натрия в среде измерения, содержавшей 20 мМ MOPS-KOH, рН=7,6. Кювета сравнения не содержала SkQ1 или MitoQ, восстановитель вносили в обе кюветы, измерения проводили по окончании выделения водорода. Степень восстановленности хинонов оценивали по величине площади пика методом взвешивания, для сравнения измеряли абсолютное значение поглощения в максимуме при 267 нм. Как следует из данных, представленных на фиг.2, восстановленная (хинольная) форма SkQ1 более устойчива к окислению кислородом воздуха, чем MitoQ.
Для ответа на вопрос о сравнении антиоксидантной активности восстановленных форм мы измерили скорость окисления хинолов супероксид-анион радикалом, генерируемым в системе ксантиноксидаза/гипоксантин. Полученные данные, представленные на фиг.3а, свидетельствуют, что скорость окисления SkQ1 примерно вдвое превышает таковую для MitoQ. Это может послужить указанием, что SkQ1 более активен как антиоксидант и его восстановленная (активная) форма более устойчива к спонтанному окислению кислородом воздуха, чем MitoQ и обладает большим сродством к супероксидному радикалу. Фиг.3б отражает скорость окисления восстановленных хинольных форм супероксидным радикалом за вычетом вклада окисления за счет атмосферного кислорода. Легко заметить, насколько SkQ1 лучше взаимодействует с супероксидным радикалом, чем MitoQ.
Проведенные эксперименты убедительно демонстрируют, что SkQ1 обладает более сильными антиоксидантными свойствами, чем его аналоги. В растворе SkQ1 способен эффективно реагировать с АФК и нейтрализовать их. При этом существенным преимуществом этого антиоксиданта является его низкая реакционная способность по отношению к обычному кислороду, а, следовательно, низкие прооксидантные свойства.
Экспериментальный пример 4: "Изучение взаимодействия соединений, отвечающих структуре (I) с митохондриями".
Ключевым преимуществом митохондриально адресованных антиокисдантов, предложенных в рамках этого изобретения, является их способность восстанавливаться дыхательной цепью митохондрий. Этим свойством обусловлено принципиальное отличие этих соединений от традиционных антиоксидантов - возможность безопасной нейтрализации радикальной формы изобретенных соединений и многократного их использования для нейтрализации СР и АФК.
Для изучения возможности восстановления тестовых соединений (SkQ1 и его аналога MitoQ) дыхательной цепью митохондрий измеряли скорость изменения соотношения окисленной и восстановленной форм в присутствии субстратов дыхания в среде выделения митохондрий печени крысы. Измерения проводили в присутствии митохондрий (концентрация белка 0,2 мг/мл).
Полученные данные (см. фиг.4, 5) свидетельствуют, что оба соединения в одинаковой степени успешно восстанавливаются энергизованными митохондриями и впоследствии окисляются со скоростями, существенно превышающими скорость спонтанного окисления (кислородом воздуха).
Также этот экспериментальный пример позволяет сделать вывод о том, что SkQ1 в области концентраций вплоть до 10 мкМ не подавляет дыхание митохондрий, при этом стимулируя "сопряженное" дыхание митохондрий - то есть их нормальное функционирование. Также было показано, что SkQ1 стабилен в условиях инкубации в биологических средах во временах, соответствующих длительности экспериментов (десятки минут). Аспектом, подтверждаемым этим примером является то, что SkQ1 в опытах in vitro с индукцией окисления восстановленного митохондриями хинола посредством генерируемых АФК (супероксидного радикала в ксантиноксидазной реакции) продемонстрировал явное преимущество, в сравнении с MitoQ, в отношении сродства к АФК и стабильности во времени.
Экспериментальный пример 5: "Сравнение токсичности различных митохондриальных антиоксидантов для клеток в культуре".
В этом экспериментальном примере сравниваются степень токсичности митохондриального антиоксиданта MitoQ, раскрываемого уровнем техники, и соединения SkQ1, предложенного в рамках изобретения.
В ходе эксперимента равные концентрации SkQ и MitoQ добавлялись к культуре клеток и через 2 час подсчитывался процент живых клеток. Полученные результаты, приведенные на фиг.6, однозначно свидетельствуют о существенно меньшей токсичности SkQ. Так ЛД50 (концентрация при которой гибнет 50% клеток) для SkQ составляет около 20 мкМ, в то время как для MitoQ ЛД50 более чем в 3 раза меньше - около 7 мкМ. Эти результаты также подтверждаются другим экспериментом, в котором изучалось токсическое действие SkQ и MitoQ на клетки в присутствии перекиси водорода (в концентрации 50, 100 или 200 мкМ). Так же как и в предыдущем случае, MitoQ оказался существенно более токсичным соединением. ЛД50 на фоне 100 мкМ перекиси водорода в для MitoQ составляла 4 мкМ, в то время как для SkQ она была равна 20 мкМ, то есть не отличалась от ЛД50 чистого препарата. Следовательно, на фоне сильного окислительного стресса токсичность SkQ более чем в 5 раз меньше, чем токсичность MitoQ.
Таким образом, можно утверждать, что обеспечиваемые настоящим изобретением митохондриальные антиоксиданты, отвечающие структуре (I), обладают существенно более низкой токсичностью, по сравнению с веществами, раскрываемыми уровнем техники и заявленными в качестве митохондриальных антиоксидантов. Это различие может быть легко объяснено с учетом результатов экспериментального примера 3, где были продемонстрированы более сильные антиоксидантные и менее выраженные прооксидантные свойства SkQ по сравнению с MitoQ.
Экспериментальный пример 6: "Защитное действие соединений, отвечающих структуре (I), на различные типы человеческих клеток".
В этом примере нами установлено, что соединение, отвечающее структуре (I) с антиоксидантной функцией (митохондриально адресованный антиоксидант), защищает клетки в культуре от окислительного стресса, вызванного Н2О2.
В экспериментах использовали нормальные диплоидные фибробласты из кожи и легких человека, клетки карциномы матки человека линии HeLa и клетки лимфомы человека линии U937. Клетки культивировали в стандартных средах (DMEM или RPMI) в присутствии 10% фетальной сыворотки при 37°С в атмосфере 5% СО2. Эксперименты проводили на культурах, достигших 30-50% конфлюэнтности. H2O2 вносили однократно и анализировали клетки через 18-24 ч после добавки. Апоптотическую гибель регистрировали по конденсации хроматина и фрагментации ядер после окраски клеток Hoechst 33342 (1 мкг/мл, 15 мин). Подсчитывали по 300-500 клеток на препарат и усредняли данные по 3-5 независимым опытам. Некротическую гибель определяли по окрашиванию ядер йодистым пропидием (2 мкг/мл, 5 мин).
В предварительных экспериментах были определены дозы Н2O2 (от 50 мкМ до 200 мкМ), вызывающие значительный (60-80%) апоптоз без заметного некроза в различных типах клеток. Было подтверждено, что апоптоз во всех случаях сопровождается падением мембранного потенциала митохондрий, выходом цитохрома с из митохондрий в цитоплазму и активацией каспаз.
В экспериментах с антиоксидантом SkQ1 были определены оптимальные условия для защитного антиапоптозного действия. Показано, что инкубация клеток с 20 нМ SkQ1 в течение 6 дней значительно повышает резистентность клеток к Н2O2. Присутствие антиоксиданта в среде инкубации с H2O2 не требовалось и не усиливало защитный эффект. В частности, в опытах с фибробластами легкого человека 100 мкМ Н2O2 вызывала апоптоз в 60+/-5% клеток, а после преинкубации с 20 нМ SkQ1 это значение составляло 7+/-3%. Практически полная защита наблюдалась и при 200 мкМ H2О2 (80+1-5% апоптоза в контроле и клеток, а это значение составляло 12+1-5%. после преинкубации с 20 нМ SkQ1). При повышении дозы Н2O2 до 500 мкМ защитное действие SkQ1, но в этих условиях наблюдалась массовая некротическая гибель клеток. Аналогичные результаты были получены и с другими типами клеток.
Таким образом, антиоксиданты типа SkQ1 в чрезвычайно низких концентрациях эффективно защищают клетки различного типа от апоптоза, вызванного окислительным стрессом. Следовательно, такие соединения и композиции на их основе должны быть эффективны для предотвращения запрограммированной гибели клеток в различных тканях, органах, во всем организме. Это обнаруженное свойство SkQ может быть использовано для лечения или профилактики заболеваний, в которых эффективным терапевтическим методом является снижение окислительного стресса и/или блокирование запрограммированной клеточной смерти.
Экспериментальный пример 7: "Предотвращение распространения апоптозного сигнала соединениями, отвечающими структуре (I)"
Передача апоптозного сигнала от клеток к клеткам на значительные расстояния блокируется антиоксидантами типа SkQ1.
В экспериментах использовали клетки линии HeLa. Клетки, выращенные на покровном стекле, обрабатывали различными апоптогенами (фактор некроза опухолей (ФНО), ставроспорин, Н2O2) в течение 3 ч. Затем реагенты отмывали и помещали стекло с клетками (индуктор) в чашку Петри вплотную к стеклу, на котором клетки не были обработаны (реципиент). Через 16-18 ч совместного культивирования анализировали апоптоз на обоих стеклах, окрашивая клетки Hoechst 33342, как описано выше.
Предварительные опыты показали, что в условиях, когда на стекле-индукторе апоптоз составлял 80-90%, на стекле-реципиенте 30-50% клеток так же имели апоптозную морфологию. Контрольные эксперименты показали, что в этой модели не происходит переноса первичного апоптогена к клеткам-реципиентам. Передача апоптозного сигнала не требовала прямого контакта клеток и ослаблялась при увеличении объема среды. Добавление в среду совместной инкубации каталазы (2500 Е/мл) предотвращало апоптоз клеток-реципиентов, практически не влияя на апоптоз (вызванный ФНО или ставроспорином) клеток-индукторов. Таким образом, основным переносчиком сигнала апоптоза являлась Н2O2.
Клетки-индукторы инкубировали с 20 нМ SkQ1 в течение 6 дней, что не препятствовало развитию апоптоза, вызванного ФНО (10-50 нг/мл, с добавлением 1 мкМ эметина) или ставроспорина (2 мкМ). После совмещения стекол и совместной инкубации апоптоз, вызванный ФНО, на стекле-индукторе составлял 95+/-5% в контроле и 90+/-5% после инкубации с SkQ1. На стекле-реципиенте апоптоз в контроле составлял 37+/-4%, а в случае преинкубации индуктора с SkQ1 - 17+1-3%. Следует учитывать, что апоптоз в контрольном опыте без ФНО составлял 12+/-3% на обоих стеклах, что было связано с токсическим действием эметина. Таким образом, защитное действие SkQ1 было почти полным. Сходные результаты были получены, когда с SkQ1 проинкубировали клетки-реципиенты. Апоптоз в этом случае снижался до 16+/-4%. Аналогичный защитный эффект наблюдался и при индукции апоптоза ставроспорином.
Измерения показали, что при совместной инкубации клеток-индукторов (обработанных ФНО) и клеток-реципиентов, содержание Н2O2 в среде значительно возрастает (по сравнению с контролем, где инкубировались необработанные клетки) уже через 2-3 ч после совмещения стекол. Измеренная через 24 ч концентрация Н2O2 составила 140+/-20 нМ. Если клетки-индукторы были принкубированы с SkQ1, то концентрация Н2O2 составила лишь 40+/-10 нМ. Преинкубация клеток-реципиентов с SkQ1 не вызывала снижения концентрации H2O2.
Следовательно, антиоксиданты типа SkQ1 в чрезвычайно низких концентрациях предотвращают выработку апоптозного сигнала клетками, подвергшимися обработке апоптогенами различной природы. Эти же антиоксиданты эффективно защищают клетки-реципиенты от апоптоза вызванного сигналом, передающимся через среду от клеток-индукторов.
Передача апоптозного сигнала может лежать в основе патогенеза заболеваний (инфарктов, инсульта, посттравматические патологии), при которых участки ткани, подвергшиеся повреждению, окружены расширяющейся зоной апоптозных клеток.
Экспериментальный пример 8: "Защитное действие соединений, отвечающих структуре (I), при фотодинамическом повреждении клеток"
Антиоксиданты типа SkQ1 ингибируют токсическое действие синглетного кислорода, возникающего при фотоактивации фотосенсибилизаторов, и предотвращают некротическую гибель клеток, вызванную фотодинамическим воздействием на митохондрии.
Защиту от повреждающего действия синглетного кислорода изучали в искусственной липидной мембране, содержащей грамицидин и фталоцианиновый фотосенсибилизатор. Измерения тока ионов через грамицидиновый канал показали, что активация фото сенсибилизатора короткой вспышкой света приводит к быстрой инактивации канала. Эффект полностью снимался азидом натрия, что указывает на определяющую роль синглетного кислорода в инактивации грамицидина.
Защиту от фотодинамического действия изучали на культуре клеток HeLa. Клетки инкубировали с фотосенсибилизатором хлорметил Х-розамином (0,5 мкМ, 15 мин), который избирательно накапливался в митохондриях. Клетки освещали зеленым светом (в максимуме поглощения фотосенсибилзатора 580 нм) через объектив микроскопа Axiovert 200М (Zeiss, Германия) в течение 1-2 мин и анализировали через 5 ч. Некротическую гибель определяли по окрашиванию ядер йодистым пропидием (2 мкг/мл, 5 мин).
Было обнаружено, что SkQ1 в концентрации 1 мкМ полностью предотвращает светозависимую инактивацию грамицидина в искусственной липидной мембране, содержащей фталоцианиновый фотосенсибилизатор.
При фотодинамической обработке клеток наблюдалась 100% некротическая гибель клеток. Если клетки проинкубировали с 20 нМ SkQ1 в течение 6 дней, то некроз после фотодинамической обработки составлял 25+/-5%. В опытах, где 1 мкМ SkQ добавляли за 1 ч до освещения, некроз составлял 15+/-5%. Повышение концентрации SkQ не давало дополнительной защиты, а понижение до 0,5 мкМ заметно ослабляло эффект.
Из полученных результатов можно заключить, что антиоксиданты типа SkQ1 в чрезвычайно низких концентрациях предотвращают повреждающее действие синглетного кислорода, возникающего при освещении фотосенсибилизаторов. Если фотосенсибилизатор локализуется в митохондриях, то такие антиоксиданты эффективно защищают клетки от некроза, вызванного фотодинамической обработкой.
Экспериментальный пример 9: "Защитное действие соединений, отвечающих структуре (I), при катаракте и макулодистрофии, связанных со старением"
Увеличение продолжительности жизни в развитых странах ведет к постарению населения и сопровождается ростом заболеваемости "болезнями пожилого возраста", среди которых в наступившем столетии, по данным ВОЗ, на третье место после онкологических заболеваний и остеопороза выйдут дистрофия сетчатки и катаракта. Выявление факторов риска этих заболеваний, разработка способов их профилактики имеют огромное экономическое значение, поскольку именно они становятся основной причиной потери зрения у людей старшего возраста. В литературе активно обсуждается вопрос о влиянии характера питания на вероятность развития этих патологий органа зрения. Как показывают эпидемиологические исследования, она существенно снижается при высоком уровне потребления антиоксидантов, но, в то же время, попытки с их помощью затормозить развитие катаракты и макулодистрофии далеко не всегда оказываются успешными.
Число рекламируемых фармакологических препаратов и биологически активных добавок, обладающих свойствами антиоксидантов, растет, однако объективная оценка их эффективности, как правило, не проводится. И это не удивительно - корректную оценку результатов терапии профилактики существенно затрудняют позднее выявление и индивидуальные особенности течения этих заболеваний. В такой ситуации традиционно на помощь приходят биологические модели и, как показали наши исследования, уникальные возможности для оценки эффективности препаратов может дать использование преждевременно стареющих крыс OXYS, которая может служить универсальной моделью старения органа зрения. Эти животные были получены селекцией и инбридингом крыс Вистар, чувствительных к катарактогенному эффекту галактозы. Генетически обусловленный дефект метаболизма, выражающийся в сниженной устойчивости крыс OXYS к окислительному стрессу, приводит к таким изменениям в их организме, которые могут рассматриваться как синдром ускоренного старения. Изменения хрусталиков появляются у них к 2 мес, в 6 мес обнаруживаются у 100% крыс OXYS (у крыс Вистар - 5%), в 12 мес катарактой поражаются оба глаза. По данным офтальмоскопических, биомикроскопических и морфологических исследований, катаракта у крыс OXYS по характеру соответствует сенильной катаракте человека и развивается на фоне прогрессирующей макулодистрофии. Первые признаки заболевания регистрируются в 6 недель и достигают выраженных стадий к 4-6 месячному возрасту. По характеру проявлений картина поражений глазного дна у крыс OXYS соответствует наблюдаемым в клинической практике изменениям сетчатки пациентов с макулодистрофией - центральной инволюционной хориоретинальной дегенерацией.
Целью этой части изобретения явилось исследование влияния препарата SkQ на развитие у крыс OXYS катаракты и макулярной дегенерации.
Работа проведена на 120 крысах-самцах OXYS и Вистар. Животные содержались по 5 особей при естественном освещении и получали стандартный гранулированный корм и воду без ограничения. В возрасте 1,5 мес. после предварительного расширения зрачков 1% тропикамидом крысы были осмотрены с помощью прямого офтальмоскопа "Betta" (Германия). С 1,5 до 3 мес, в возрасте, критическом для развития выраженных изменений в органе зрения крыс OXYS, часть животных получала SkQ1 (50 нмоль на кг массы тела), КВг (50 нмоль на кг) или витамин Е - альфа-токоферола ацетат ("Уралбиофарм") по 20 мг на кг. Последний традиционно используется нами как препарат сравнения. Препараты животные получали перед едой на сухарике стандартного размера, группы интактного контроля получали только сухарик. После окончания курса животные были повторно осмотрены. Для предупреждения субъективности в оценке результатов приема препаратов все соответствующие надписи с клеток были заранее удалены.
Состояние хрусталиков оценивали в соответствии с принятой в клинической практике классификацией в баллах: 0 баллов - хрусталик прозрачный, 1 - очаговые нежные помутнения, 2 - множественные очаги помутнения и 3 - интенсивное помутнение коры или ядра хрусталика. Наличие и степень выраженности очаговых изменений в макулярной области оценивали согласно общепринятой классификации: 0 - изменения отсутствуют; 1 - 1-я стадия заболевания, при которой появляются друзы в заднем полюсе глаза, 2 - 2-я стадия, развитие в макуле и парамакулярной области проминирующего очага желтого цвета с четкими контурами размером до 0,5-1 диаметра диска (экссудативная отслойка ретинального пигментного эпителия) и 3 - 3-я стадия с обширными кровоизлияниями в макулярную область.
Результаты
Офтальмоскопический осмотр не выявил изменений в хрусталиках и макулярной области сетчатки крыс Вистар ни в 1,5, ни в 3 мес. В то же время уже в 1,5 мес. 20% глаз крыс OXYS уже имели начальную стадию катаракты (1 балл), а 10% - макулярную дегенерацию 1 стадии.
В возрасте 3 мес. в группе интактного контроля в 90% глаз у крыс OXYS выявлялись изменениями хрусталиков, в том числе в 35% глаз изменения соответствовали 2 стадии катаракты. 85% глаз интактных животных было поражено макулодистрофией, 16% из них - второй стадии (фиг.8).
В группе крыс OXYS, получавших КВг, 93% глаз имели изменения хрусталиков, при этом 57% хрусталиков (от общего количества глаз) имели изменения, соответствующие 2-й стадии катаракты. В 87% глаз крыс этой группы были выявлены изменения в макулярной области сетчатки, в 13% случаев изменения сетчатки соответствовали 2 стадии заболевания.
У животных, получавших SkQ1, изменения хрусталиков регистрировались в 46% глаз, однако все они соответствовали 1 стадии. Изменения макулярной области сетчатки выявлены у 38% крыс OXYS этой группы, по степени все они также соответствовали 1 стадии.
У крыс, получавших витамин Е, в возрасте 3 мес в 58% глаз регистрировались изменения хрусталиков, 12% глаз - с изменениями, соответствующими 2 стадии заболевания. Изменения макулярной области сетчатки выявлены у 54% крыс OXYS этой группы, в том числе в 8% глаз заболевание соответствовало 2 стадии макулодистрофии. В графическом виде результаты этих экспериментов приведены на фиг.7-12.
Таким образом, этот экспериментальный пример убедительно демонстрирует эффективность использования SkQ1 в профилактике возрастных заболеваний органа зрения, а, следовательно, и эффективность митохондриальных антиоксидантов, отвечающих структуре (I), для борьбы с заболеваниями, связанными с окислительным стрессом.
Экспериментальный пример 10: Защитное действие митохондриального антиоксиданта SkQ1 на сердечную мышцу.
Известно, что активные формы кислорода (АФК) в малых концентрациях оказывают на сердечную мышцу регуляторное, а в высоких - токсическое действие. При испытании препарата SkQ1 обнаружена его способность модулировать действие АФК. Опыты проведены на изолированном сердце крыс, получавших препарат внутривенно или с пищей (50 мкг/кг). После внутривенного введения сердце брали в опыт через 2 часа, а после добавления к пище - через 2 недели. Сердце перфузировали ретроградно по стандартной методике раствором Кребса с постоянной скоростью, регистрируемое при этом перфузионное давление (ПД) характеризовало тонус коронарных сосудов. Измеряли также спонтанную частоту сокращений и изоволюмическое давление в левом желудочке. Регистрировали изменение указанных показателей при 40-минутном введении 150 мкМ Н2O2 - стандартного генератора АФК.
В серии с однократным внутривенным введением SkQ1 после двукратного увеличения скорости потока перфузионное давление в обеих группах повысилось примерно одинаково (120-125 мм рт.ст.). Введение Н2O2 оказывало обычное двухфазное действие - начальное снижение ПД сменялось его повышением. В контрольной группе минимальный уровень ПД составил 95+5 мм рт.ст., а в группе получавших SkQ1 - 77+2 мм рт.ст. (р< 0,02). Максимальное снижение ПД по сравнению с исходным уровнем до введения в среднем составило 28+3 мм рт.ст и -43+5 мм рт.ст., соответственно (р<0,05). В серии с длительным приемом SkQ максимальное снижение ПД в среднем в контрольной группе составило 21+5 мм рт.ст., а в группе получавших SkQ1 38+5 мм рт.ст. (р<0,03). Достоверная разница между группами сохранялась и в конце введения Н2O2 5+6 мм рт.ст. и 29+6 мм рт.ст. соответственно (р<0,03). Таким образом, как однократное, так и длительное применение SkQ1 потенцировало начальный вазодилататорный эффект Н2O2-. Кроме того, при длительном применении SkQ1 уменьшалось токсическое действие Н2O2 на коронарные сосуды.
Таким образом, можно заключить, что препарат SkQ1 потенцирует регуляторное и уменьшает токсическое действие АФК на коронарные сосуды изолированного сердца. Это действие SkQ1 может быть использовано для борьбы с сердечно-сосудистыми заболеваниями.
Экспериментальный пример 11: "Действие соединений, отвечающих структуре (I), на морфологию и подвижность нормальных и опухолевых клеток"
Антиоксиданты типа SkQ1 вызывают морфологические изменения клеток в культуре, что сопровождается уменьшением их подвижности и усилением прикреплености клеток к подложке.
Нормальные фибробласты кожи и легких человека и клетки HeLa культивировали при низкой плотности клеток (20-30% конфлюэнтности). Морфометрию клеток проводили, измеряя площадь клеток, дисперсию и элонгацию. Структуры цитоскелета изучали, окрашивая фиксированные препараты клеток фаллоидин-родамином (актиновые филаменты), антителами на тубулин (микротрубочки) и винкулин (контакты с подложкой). Подвижность клеток изучали с помощью микровидеосъемки.
Фибробласты, проинкубированные с 20 нМ SkQ1 в течение 6 дней, имели резко измененную морфологию. Средняя площадь клеток возрастала в 2,9 раза, индекс дисперсии снижался в 2,4 раза, а индекс элонгации уменьшался с 2,34 до 0,69. Содержание актиновых филаментов возрастало в 3,7 раза, так что их плотность на единицу площади составляла 136% от контроля. Актиновые филаменты были собраны в мощные пучки - стресс-фибриллы. Значительно возрастало количество контактов с подложкой. Подвижность фибробластов резко падала. Все наблюдавшиеся изменения не замедляли пролиферацию фибробластов. Аналогичные измерения, проведенные на клетках HeLa, показали, что их средняя площадь возрастает в 2,6 раза (без изменения параметров дисперсии и элонгации), а содержание актиновых филаментов растет так, что средняя плотность сохраняется.
Таким образом, морфологические изменения клеток, а также уменьшение их подвижности под действием антиоксидантов типа SkQ1 указывает на снижение способности клеток к распространению и метастазированию.
Экспериментальный пример 12: "Цитотоксическое действие соединений, отвечающих структуре (I), на опухолевые клетки"
Соединения, отвечающие структуре (I), и несущие прооксидантные и белок-модифицирующие функции, могут вызывать открытие неселективной поры в митохондриях, набухание митохондрий, выход цитохрома с из межмембранного пространства в цитоплазму и апоптоз. Направленные в митохондрии ингибиторы антиапоптозных белков могут усиливать апоптоз, вызванный этими соединениями и известными препаратами химиотерапии.
Показано, что прооксиданты и вещества сшивающие вицинальные дитиолы (фениларсен оксид, ФАО) индуцируют открытие неселективной поры и набухание митохондрий как в бесклеточной системе, так и в клетках. В частности, в опытах на лимфоцитах тимуса индукция поры ФАО приводила к выходу ионов Са2+ из митохондрии в цитоплазму. В этих клетках с помощью электронной микроскопии были видны митохондрии с набухшим матриксом. ФАО обладает высокой неспецифической токсичностью, что не позволяет исследовать механизм выхода цитохрома с и связанного с этим апоптоза. В ряде клеточных моделей показано, что агенты, индуцирующие пору, вызывают выход цитохрома с в цитоплазму и апоптоз. Можно полагать, что адресная доставка ФАО и подобных соединений в митохондрии уменьшит их неспецифическую токсичность и позволит индуцировать апоптоз в клетках-мишенях. Ранее было показано, что соединения, несущие положительный заряд (производные фосфония и родамина), накапливаются и удерживаются в митохондриях быстрорастущих опухолевых клеток значительно эффективнее, чем в нормальных клетках. Все это позволяет рассчитывать на получение эффективных и селективных антираковых препаратов на основе соединений, отвечающих структуре (I).
Экспериментальный пример 13: "Антиопухолевое действие соединений, отвечающих структуре (I), на примере асцитной карциномы"
Для проверки способности соединений, отвечающих структуре (I), помогать при онкологических заболеваниях было проверено действие вещества SkQ1 на мышей с искусственно привитой асцитной карциномой Эрлиха - обычную модель развития острого онкологического заболевания.
SkQ1 давался мышам линии NMRI вместе с питьем в различных концентрациях - 10, 1, или 0,1 мкМ. Результаты (выживаемость мышей с предварительно привитой асцитной карциномой) приведены на фиг.13. Отрицательным контролем в эксперименте служила вода, положительным - известный антираковый препарат цисплатин.
Полученные результаты демонстрируют противоопухолевое действие митохондриально адресованных антираковых препаратов, отвечающих структуре (I).
Экспериментальный пример 14: "Фотодинамическое действие соединений, избирательно направленных в митохондрии"
Соединения, отвечающие структуре (I) и несущие фотосенсибилизаторные функции, могут вызывать выход цитохрома с из межмембранного пространства в цитоплазму и апоптоз.
Показано, что прототипы фотосенсибилизаторов, несущие положительный заряд (родамины, хлорметил-Х-розамин), накапливаются в митохондриях и при умеренном освещении вызывают апоптоз в опухолевых клетках различного типа. Аналогичные молекулы, не адресованные в митохондрии, вызывают при освещении преимущественно некротическую гибель (что сопряжено с потенциальными осложнениями воспалительной природы при фотодинамической терапии). Исследованные прототипы не используются в практике, т.к. имеют низкий квантовый выход и максимум поглощения в зеленой области спектра. Применяемые в клинике фотосенсибилизаторы на основе производных протопорфирина и фталоцианинов имеют высокий квантовый выход, максимум поглощения в красной области (что повышает эффективность воздействия на углубленные ткани), но накапливаются в основном в лизосомах и индуцируют некроз. Адресная доставка подобных молекул в митохондрии в составе соединений, отвечающих структуре (I), позволит индуцировать апоптоз опухолевых клеток светом низкой интенсивности и в красной области спектра.
Показано, что соединения, несущие положительный заряд (производные родамина и фосфония), накапливаются и удерживаются в митохондриях быстрорастущих опухолей в значительно большей степени, чем в клетках нормальных тканей. Можно полагать, что фотосенсибилизаторы на основе соединений, отвечающих структуре (I), будут избирательно накапливаться в опухолях, что повысит их эффективность при использовании в фотодинамической терапии.
Экспериментальный пример 15: Защитное действие митохондриального антиоксиданта SkQ1 на клетки грибов на примере клеток дрожжей Yarrowia lipolytica.
Нами было показано, что SkQ1, митохондриальный антиоксидант отвечающий структуре (I) частично предотвращает гибель клеток Yarrowia lipolytica, вызванную перекисью водорода в концентрации 10 мМ.
Как видно из фиг.14, эффект циклогексимида Д, токоферола и SkQ сопоставимы по значению. Действие циклогексимида было продемонстрировано нами ранее, и оно объясняется необходимостью нормального функционирования синтеза белка в клетках для протекания апоптоза. Концентрация альфа-токоферола была взята равной 25 мкМ, поскольку именно эта концентрация давала максимальный эффект по защите от феромон- и амиодарон-индуцированной программируемой клеточной смерти на клетках Saccharomyces cerevisiae (Pozniakovsky AI, Knorre DA, Markova 0V, Hyman AA, Skulachev VP, Severin FF., 2005, J Cell Biol. 168(2):257-69). Такая концентрация оказалась настолько же эффективна, насколько эффективны на порядок меньшая концентрация SkQ1. Полученные результаты свидетельствуют о полезности митохондриально адресованных антиоксидантов для клеток грибов, о том, что вещества типа SkQ1 можно применять для защиты промышленных продуцентных культур дрожжей, других грибов и микроорганизмов.
Экспериментальный пример 16: Действие митохондриального антиоксиданта SkQ1 на развитие высших растений.
При выращивании расчеренкованных растений на искусственной агаризованной среде MS с добавлением 1 мкМ SkQ1 (3 растения) и без добавления этого вещества в контрольных растениях (3 шт). Растения (черешки) помещались в 50 мл пробирки с прозрачными стенками и в течение 3-х недель находились в климокамере с постоянной температурой 27 градусов, периодическим освещением (14 часов света, 10 часов темноты). Далее растения подвергались темновому стрессу - в течение 7 дней они находились в полной темноте.
При этом контрольные растения обесцветились, а растения, выросшие на среде с добавлением SkQ1 сохранили зеленую окраску. Далее растения были возвращены в нормальный световой режим и выращивались еще 20 дней. В результате растения, выращиваемые на среде с добавлением SkQ1 более чем в 3 раза превосходили по размерам контрольные.
Этот экспериментальный пример демонстрирует полезное действие митохондриально адресованных антиоксидантов на растения в целом. Следовательно, такие соединения могут быть применены для выращивания растений на искусственных средах (необходимая стадия при получении генетически модифицированных растений), для увеличения жизнеспособности культур растительных клеток, в сельском хозяйстве для увеличения жизнеспособности сельскохозяйственных культур.
Специалисту в данной области должно быть понятно, что на основании этих примеров, а также описания заявки могут быть сделаны очевидные дополнения или изменения, которые позволят получить все заявленные соединения и композиции, полезные для целей данного изобретения. Все эти очевидные дополнения и изменения входят в объем притязаний по данному изобретению, отраженный в формуле изобретения, приведенной далее.
Реферат
Изобретение относится к области биологии и медицины. Предлагается соединение общей формулы (I):

где А - эффекторная группа, L - линкерное звено, В - представляет собой Скулачев-ион Sk или заряженный гидрофобный пептид. Соединение может быть использовано для приготовления фармацевтической композиции для адресной (направленной) доставки биологически активных веществ в митохондрии, осуществляемой за счет электрохимического потенциала ионов водорода в митохондрии. Изобретение также может быть полезным при лечении заболеваний и состояний, связанных с нарушением нормального функционирования митоходрий, в частности заболеваний, связанных с повышенным образованием свободных радикалов и активных форм кислорода. Заявленное изобретение, благодаря направленному накоплению биологически активного вещества в митохондриях, позволяет увеличить эффективность последнего, снизить общую дозировку, вероятность и силу побочных эффектов: 6 н. и 20 з.п. ф-лы, 14 ил.
Формула







Документы, цитированные в отчёте о поиске
Фармацевтическая композиция и способ предупреждения, подавления или лечения заболевания, ассоциированного с присутствием свободных радикалов

Комментарии