Оксазольные производные тетрациклинов - RU2415844C2
Код документа: RU2415844C2
Описание
Область техники
Настоящее изобретение относится к новым оксазольным производным тетрациклинов, которые пригодны в качестве агентов-антибиотиков и проявляют антибактериальную активность против широкого спектра организмов, в том числе против организмов, устойчивых к тетрациклину и другим антибиотикам. Кроме того, настоящее изобретение относится к новым тетрациклиновым промежуточным соединениям, пригодным для создания новых соединений и новых способов получения новых соединений и промежуточных соединений.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
Начиная с 1947 г. различные тетрациклиновые антибиотики были синтезированы и описаны для лечения инфекционных заболеваний людей и животных. Тетрациклины ингибируют белковый синтез посредством присоединения к 30S субъединице бактериальной рибосомы, тем самым предотвращая ее связывание с аминоацетилированной РНК. (Chopra, Руководство по экспериментальной фармакологии, том 78, 317-392, Springer-Verlag, 1985.)
Резистентность к тетрациклинам появилась среди множества клинически важных организмов, которые ограничивают использование этих антибиотиков. Существуют два основных механизма бактериальной устойчивости к тетрациклинам: а) энергетически-зависимое активное выведение антибиотика под действием белков, локализованных в цитоплазматической мембране, которые предотвращают внутриклеточное накопление тетрациклина (S.В.Levy и др.., Antimicrob. Agents Chemotherapy 33, 1373-1374 (1989); и б) защита рибосомы посредством цитоплазматического белка, который взаимодействует с рибосомой и, тем самым, не давая тетрациклину присоединяться к рибосоме или ингибировать белковый синтез (A.A.Salyers, В.S.Speers and N.В.Shoemaker, Mol. Microbiol, 4:151-156, 1990). Резистентность, связанная с механизмом активного выведения антибиотика, кодируется детерминантнами резистентности, названными tetA-tetL. Эти детерминанты являются общими для многих грамотрицательных бактерий (гены резистентности Класс А-Е), таких как Enterobacteriaceae, Pseudomonas, Haemophilus and Aeromonas и для грамположительных бактерий (гены резистентности Класс К и L), таких как Staphylococcus, Bacillus and Streptococcus. Резистентность, связанная с механизмом защиты рибосомы, кодируется детерминантами резистентности, названными TetM, N и О, при этом указанный механизм является общим для Staphylococcus, Streptococcus, Campylobacter, Gardnerella, Haemophilus и Mycoplasma Mycoplasma (A.A.Salyers, B.S.Speers and N.B.Shoemaker, Mol. Microbiol, 4:151-156 1990).
Наиболее успешно применяемым является тетрациклиновое соединение 7-(диметиламино)-6-деметил-6-дезокситетрациклин, известное как миноциклин (см. патент США 3148212, патент США № RE 26253 и патент США №3226436 обсуждаемый далее). Тем не менее штаммы, содержащие tetB (механизм активного выведения в Грам-отрицательных бактериях), но не tetK (активное выведение в Staphylococcus), резистентны к миноциклину. Также штаммы, содержащие tetM (защита рибосомы), резистентны к миноциклину. Настоящее изобретение описывает способы синтеза новых тетрациклиновых соединений, которые проявляют значительную активность in vitro и in vivo против тетрациклин и миноциклин чувствительных штаммов и против тетрациклин и миноциклин резистентных штаммов, содержащих детерминанты резистентности tetM (защита рибосомы). В Duggar (патент США №2482055) раскрыт способ получения Ауреомицина RTM (зарегистрированный товарный знак) путем ферментации, обладающего антибактериальной активностью. В Growich и др., патент США №3007965, раскрыты способы улучшения ферментативного получения. В Beereboom и др., патент США №3043875, раскрыты производные тетрациклина. В Boothe и др., патент США №3148212, переиздано как патент США № RE 26253, и Petisi и др., патент США №3226436, раскрыты производные тетрациклина, которые пригодны для лечения бактериальных инфекций. В Blackwood и др., патент США №3200149, раскрыты производные тетрациклина, которые обладают микробиологической активностью. В Petisi и др., патент США №3338963, раскрыты тетрациклиновые соединения, которые обладают широким спектром антибактериальной активности. В Bitha и др., патент США №3341585, раскрыты тетрациклиновые соединения, которые обладают широким спектром антибактериальной активности. В Shu, патент США №3,360,557, раскрыты тетрациклиновые производные, которые обладают антибактериальной активностью in vivo. В патенте США №5021407 раскрыт способ преодоления резистентности у тетрациклин резистентных бактерий. Способ включает применение блокирующего агента (химического соединения) в сочетании с антибиотиком тетрациклинового типа. Этот патент не раскрывает новые тетрациклиновые соединения, которые обладают активностью против резистентных организмов. Описанные в патенте США №5494903 7-замещенные-9-замещенные амино-6-деметил-6-дезокситетрациклины обладают широким спектром антибактериальной активности.
В заключение ни в одном из приведенных выше патентов не указывается и не говорится о новых соединениях, описанных в этой заявке. В дополнение, ни в одном из приведенных выше патентов не указывается и не говорится о новых тетрациклиновых соединениях, описанных в настоящем изобретении, обладающих активностью как против тетрациклин и миноциклин резистентных штаммов, так и против штаммов, которые обычно чувствительны к тетрациклинам.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
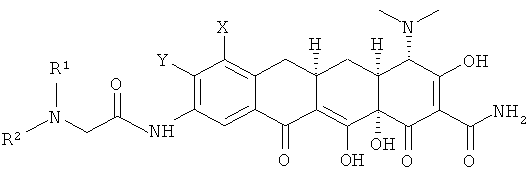
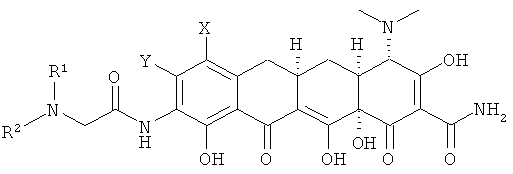
В соответствии с настоящим изобретением химические соединения представлены формулой (I);
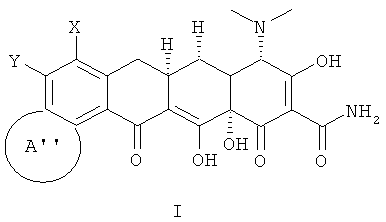
где:
Х выбран из водорода, амино, NR11R12, алкила с 1-12 необязательно замещенными атомами углерода, арила с 6, 10 или 14 необязательно замещенными атомами углерода, необязательно замещенного винила, алкинила с 2-12 необязательно замещенными атомами углерода и галогена;
А'' выбран из:
R11 и R12 являются независимо друг от друга водородом или алкилом с 1-12 атомами углерода или R11 и R12, когда необязательно выбраны вместе с атомом азота, с которым каждый из них связан, образуют 3-7-членное насыщенное углеводородное кольцо;
Y выбран из водорода, алкила с 1-12 необязательно замещенными атомами углерода; арила с 6, 10 или 14 необязательно замещенными атомами углерода; алкенила с 2-12 необязательно замещенными атомами углерода, винила, алкинила с 2-12 необязательно замещенными атомами углерода, галогена;
R выбран из алкила с 1-12 необязательно замещенными атомами углерода, алкенила с 2-12 необязательно замещенными атомами углерода; алкинила с 2-12 необязательно замещенными атомами углерода; -CH2NR1R2, арила с 6,10 или 14 необязательно замещенными атомами углерода; аралкила с 7-16 необязательно замещенными атомами углерода, ароила с 7-13 необязательно замещенными атомами углерода, SR3, гетероарила с 5 или 6 необязательно замещенными кольцевыми атомами, содержащими от 1 до 4 гетероатомов, которые могут быть одинаковы или различны и независимо выбираемыми из азота, кислорода, серы и гетерокарбонила с 5 или 6 необязательно замещенными кольцевыми атомами, содержащими от 1 до 4 гетероатомов, которые могут быть одинаковы или различны и независимо выбраны из азота, кислорода или серы;
R1 и R2 являются независимо друг от друга Н или алкилом с 1-12 атомами углерода или R1 и R2, когда необязательно выбраны вместе с атомом азота, с которым каждый из них связан, образуют 3-7-членное насыщенное углеводородное кольцо;
R3 - это алкил с 1-12 необязательно замещенными атомами углерода, необязательно замещенный -CH2-арил, аралкил с 7-16 необязательно замещенными атомами углерода, ароил, необязательно замещенный -СН2(СО)ОСН2арил, -СН2-алкенил с 2-12 необязательно замещенными атомами углерода, -СН2-алкенил с 2-12 необязательно замещенными атомами углерода;
При условии, что если Х - это NR1R2 и R1 - это водород, тогда R2 - это метил, этил, н-пропил, н-бутил, 1-метил, 1-метилпропил, 2-метилпропил или 1,1-диметилэтил; и если R1 - это метил или этил, тогда R2 - это метил, этил, н-пропил, 1-метилэтил, н-пропил, 1-метилпропил или 2-метилпропил; или таутомер или его фармацевтически приемлемая соль.
Описание изобретения
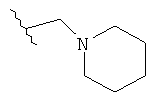
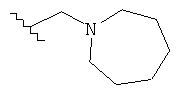
Под термином «алкил» в качестве группы или части группы понимается неразветвленная или разветвленная алкильная группа, содержащая от 1 до 12 атомов углерода, которые могут быть необязательно, независимо друг от друга замещенными 1-3 замещающими атомами, выбранными из галогена, амино, циано, циклоалкила с 3-6 атомами углерода, алкила с 1-12 атомами углерода, необязательно замещенного арила, фенила, гидроксила, алкокси с 1-12 атомами углерода, необязательно замещенного NН-(алкил с 1-12 атомами углерода)-арила, и гетероциклила с 3-8-членным кольцом. В некоторых вариантах выполнения данного изобретения алкил представляет собой группу, содержащую от 1 до 6 атомов углерода. В других вариантах выполнения данного изобретения алкил представляет собой группу, содержащую от 1 до 3 атомов углерода. В других вариантах выполнения изобретения алкил замещен гетероциклилом с 4-7-членным кольцом (например, пирролидинил).
Под термином «алкенил» понимается разветвленная или неразветвленная углеродная цепь, состоящая из 2-12 атомов углерода, которая имеет, по меньшей мере, одну ненасыщенную связь; атомы углерода, необязательно независимо друг замещенные 1-3 заместителями, выбранными из группы необязательно замещенного арила, фенила, гетероарила, галогена, амино, циано, алкила, содержащего от 1 до 12 атомов углерода, гидроксила и алкокси, содержащего от 1 до 12 атомов углерода.
Под термином «винил» понимается группа СН2=СН-.
Термин "алкокси», употребляемый в описании, в качестве группы или части группы относится к алкилам-0-, определение которых дано ранее.
Под термином «арил», употребляемым в описании для группы или части группы, например, аралкил, ароил, понимается ароматическая группа с 6, 10 или 14 атомами углерода, предпочтительно с 6-10 атомами углерода, которые могут быть необязательно замещенными 1-3 заместителями, выбранными из галогена, нитро, циано, алкенила, гидроксила, алкила, галоалкила, алкокси, бензилокси, амино, алкиламино, диалкиламино, карбоксила, алкоксикарбонила, метилендиокси и фенила. В частности, арил - это фенил или нафтил, необязательно замещенные 1-3 заместителями. Необязательно, что замещенный фенил может являться группой.
Под употребляемом в описании термином «аралкил» с 7-16 атомами углерода понимается алкил, замещенный арильной группой. Определения арильной и алкильной группы были даны ранее. Типичные аралкильные группы включают в себя, но не ограничивываются бензилом, фенэтилом и т.п.
Фенил, употребляемый в описании, относится к 6-членному углеродному ароматическому кольцу.
Употребляемый в описании термин «алкинил» включает как неразветвленную цепь, так и разветвленные группы, содержащие от 2 до 12 атомов углерода, по меньшей мере, с одной углерод-углерод тройной связью; атомы углерода, необязательно замещенные 1-3 заместителями, независимо выбранными из группы галогена, амино, циано, алкила с 1-12 атомами углерода, гидроксила и алкокси с 1-12 атомами углерода.
Под употребляемым в описании термином «галоген» или «гало» понимается F, Cl, Вr или I.
Под употребляемым в описании термином «циклоалкил» понимается насыщенное моноциклическое кольцо с 3-6 атомами углерода. Типичные циклоалкильные кольца включают в себя, но не ограничиваются циклопропилом, циклобутилом, циклопентилом и циклогексилом. В варианте выполнения данного изобретения циклоалкил представляет собой группу из 5 или 6 атомов углерода.
Употребляемые в описании R1, R2, R11 и R12, когда необязательно выбраны вместе с атомом азота, с которым каждый из них связан, образуют 3-7-членное насыщенное углеводородное кольцо, где не ограничивающим примером является пирролидинил
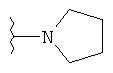
Под термином «ароил» понимается арил-С(O)-группа. Определение арильной группы было дано ранее. Типичные ароилы включают в себя, но не ограничиваются бензоилом и нафтоилом.
Под термином «гетероарил» понимается ароматическое гетероциклическое, моноциклическое кольцо с 5 или 6 атомами, включающими от 1 до 4 гетероатомов, независимо выбранных из О, N и S. Гетероарильные кольца могут быть необязательно замещенными 1-3 заместителями, выбранными из группы галогена, циано, нитро, гидрокси, амино, алкиламино, диалкиламино, алкокси, арилокси, -СН2OСОСН3 и карбокси. Гетероарильные группы включают в себя, но не ограничиваются необязательно замещенным: фуранилом, тиенилом, пиридилом, тетразолилом, имидазолом, тиазолом и т.п.
Дополнительно могут включать в себя бензофуранил, бензотиенил и хинолинил.
Под термином «гетероарилкарбонил» понимается гетероарил-С(О)-группа. Определение гетероарильной группы было дано ранее.
Под употребляемым в описании термином «гетероциклил» понимается насыщенное 3-8-членное кольцо, содержащее от одного до трех гетероатомов, выбранных из азота и серы. Типичные гетероциклилы включают в себя пирролидил, пиперидил, пиперазинил, морфолинил, тиоморфолинил, азиридинил, тетрагидрофуранил и т.п.
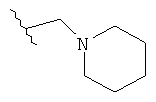
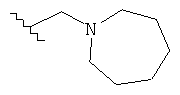
Под термином «алкилгетероциклил» пониматся алкил-гетероциклильная группа. Определения алкильной и гетероциклильной группы были даны ранее. Типичные алкилгетероциклилы включают в себя, но не ограничиваются группами:
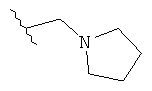
Некоторые соединения формулы (I) могут существовать в их таутомерных формах. Хотя такие формы не указаны в вышеприведенной формуле в явном виде, предполагается, что они будут включены в данное изобретение. Например, соединения формулы (I), которые существуют в виде таутомеров, представлены ниже:
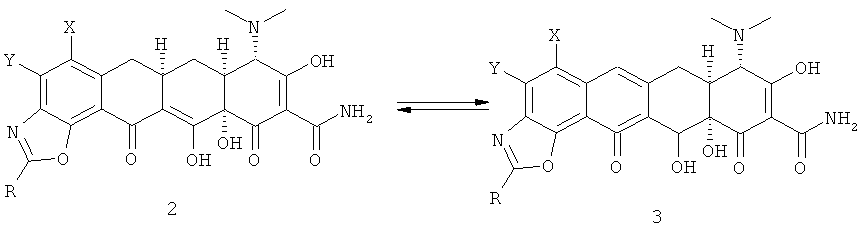
В одном варианте выполнения настоящего изобретения R в формуле (I) выбран из группы, включающей алкил с 1-6 атомами углерода, алкенил с 2-6 атомами углерода и алкил-(гетероциклил), выбранный из этой группы
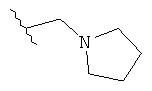
В другом варианте выполнения изобретения R в формуле (I) - это фенил, необязательно замещенный 1-3 заместителями. В предпочтительном варианте выполнения изобретения R выбран из этой группы
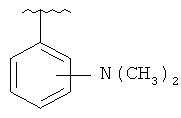
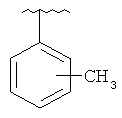
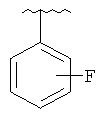
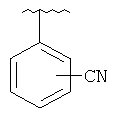
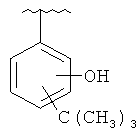
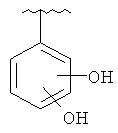
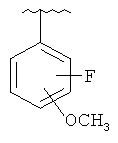
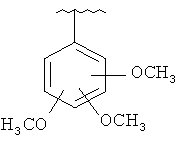

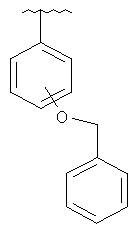
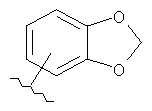
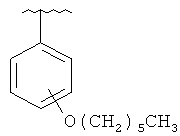
and
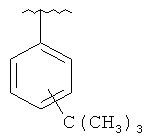
В дальнейшем предпочтительном варианте выполнения изобретения R - это гетероарил. В предпочтительном варианте выполнения изобретения R выбран из этой группы
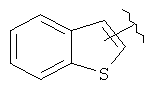
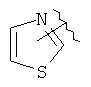
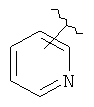
В дополнительном варианте выполнения изобретения R в формуле (I) - это алкил с 1-6 необязательно замещенными атомами углерода, алкенил с 2-6 необязательно замещенными атомами углерода,
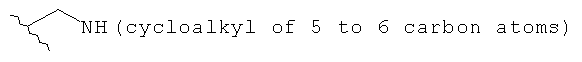
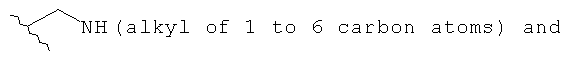

В предпочтительном варианте выполнения изобретения R выбран из этой группы
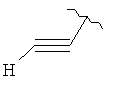
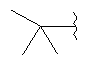
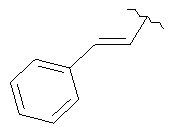
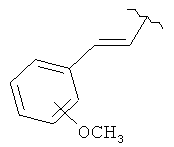
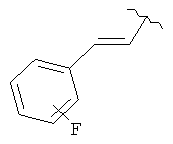
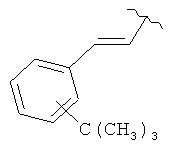

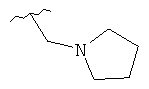
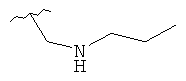
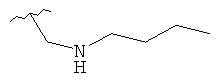
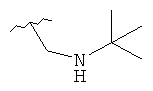
В дополнительном варианте выполнения изобретения R в формуле (I) - это S-алкил с 1-12 атомами углерода, необязательно замещенный S-СH2-арил и необязательно замещенный S-CH2(CO)OCH2 арил. В предпочтительном варианте выполнения изобретения R выбран из этой группы
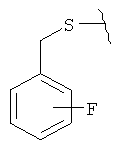
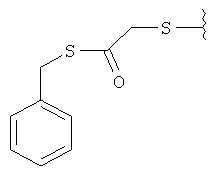
Предпочтительные соединения изобретения выбраны из группы:
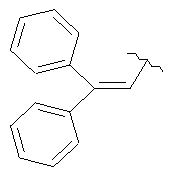
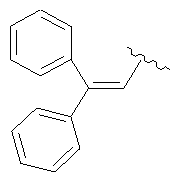
(6aR,7aS,8S,11аS)-5,8-бис(диметиламино)-2-(2,2-дифенилвинил)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-b]оксазол-10-карбоксамид,
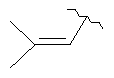
(7аS,8S,11аS)-8-(диметиламино)-9,11а,13-тригидрокси-2-(2-метил-1-пропенил)-11,12-диоксо-7,7а,8,11,11а,12-гексагидронафтацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-2-трет-бутил-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-2-[(Е)-2-(2-фурил)этенил]-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а, 13-октагидротетрацен[2,1-а][1,3]оксазол-10-карбоксамид,
(6aR,7aS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-2-[(Е)-2-фенилэтенил]-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-2-[(Е)-2-(4-метоксифенил)этенил]-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6aR,7aS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-2-[(Е)-2-(3-метоксифенил)-этенил]-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-2-[(Е)-2-(2-метоксифенил)этенил]-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-2-[(Е)-2-(4-фторфенил)этенил]-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-2-[(Е)-2-(2-фторфенил)этенил]-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-2-(хлорметил)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-2-[(диметиламино)метил]-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6aR,7aS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-2-(пирролидин-1-илметил)-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6aR,7aS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-2-[(пропиламино)метил]-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-2-[(бутиламино)метил]-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6aR,7aS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-2-[(пропиламино)метил]-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид и
(6аR,7аS,8S,11аS)-2-1(трет-бутиламино)метил]-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид.
Предпочтительные соединения изобретения выбраны из группы:
(7aS,8S,11аS)-8-(диметиламино)-2-[4-(диметиламино)фенил]-9,11а,13-тригидрокси-11,12-диоксо-7,7а,8,11,11а,12-гексагидронафтацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-2-трет-бутил-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6aR,7aS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-2-(4-метилфенил)-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(7aS,8S,11аS)-5,8-бис(диметиламино)-2-(3-фторфенил)-9,11а,13-тригидрокси-11,12-диоксо-7,7а,8,11,11а,12-гексагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-2-(4-цианофенил)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-2-[4-(диметиламино)фенил]-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-2-(5-трет-бутил-2-гидроксифенил)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6aR,7aS,8S,11аS)-2-[4-(бензилокси)фенил]-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-2-(2,4-дигидроксифенил)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-2-(3-фтор-4-метоксифенил)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-2-(1,3-бензодиоксол-5-ил)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-2-(2,4,6-триметоксифенил)-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6aR,7aS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-2-(2,4,5-триэтоксифенил)-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-2-(1-метил-1Н-индол-2-ил)-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-2-(4-трет-бутилфенил)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид и
(6aR,7aS,8S,11аS)-5,8-бис(диметиламино)-2-[4-(гексилокси)фенил]-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид.
Предпочтительные соединения выбраны из группы:
(6aR,7aS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-2-тиен-3-ил-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1 -d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-2-(1-бензофуран-2-ил)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-2-(2-фурил)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
{5-[(6аR,7аS,8S,11аS)-10-(аминокарбонил)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротерацен[2,1-d][1,3]оксазол-2-ил]-2-фурил}метил ацетат,
(6aR,7aS,8S,11аS)-2-(1-бензотиен-3-ил)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6aR,7aS,8S,11аS)-5,8-бис(диметиламино)-9,11a,12-тригидрокси-11,13-диоксо-2-(1,3-тиазол-2-ил)-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6aR,7aS,8S,11аS)-5,8-бис(диетиламино)-9,11а,12-тригидрокси-11,13-диоксо-2-пиридин-4-ил-6,6а,7,7а,8,11,11а,13-октагидротерацен[2,1-d][1,3]оксазол-10-карбоксамид и
(6aR,7aS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-2-пиридин-3-ил-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид.
Дополнительным вариантом выполнения изобретения является способ получения соединения формулы
или его фармацевтически приемлемой соли
где:
Х выбран из галогена, амино, NR1R2, алкила с 1-12 необязательно замещенными атомами углерода, арила с 6, 10 или 14 необязательно замещенными атомами углерода, необязательно замещенного винила, алкинила с 2-12 необязательно замещенными атомами углерода и галогена;
R1 и R2 - это независимо друг от друга Н или алкил с 1-12 атомами углерода или R1 and R2, когда необязательно выбраны вместе с атомом азота, с которым каждый из них связан, образуют 3-7-членное насыщенное углеводородное кольцо;
Y выбран из галогена, алкила с 1-12 необязательно замещенными атомами углерода, арила с 6, 10 или 14 необязательно замещенными атомами углерода, алкенила с 2-12 необязательно замещенными атомами углерода, винила, алкинила с 2-12 необязательно замещенными атомами углерода и галогена,
включающий стадии:
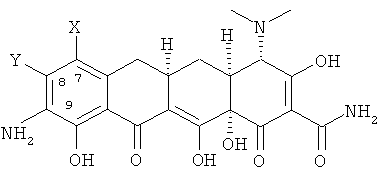
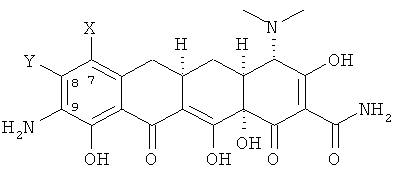
а. взаимодействие 7,8-(замещенного)-9-амино-6-деметил-6-дезокситетрациклина формулы
или его фармацевтически приемлемой соли
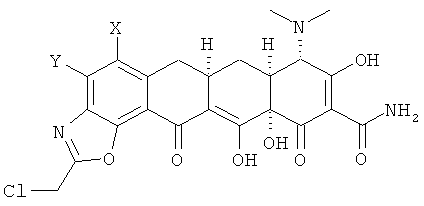
с 2-хлортриметоксиэтаном в апротонном растворителе с получением хлорсоединения формулы
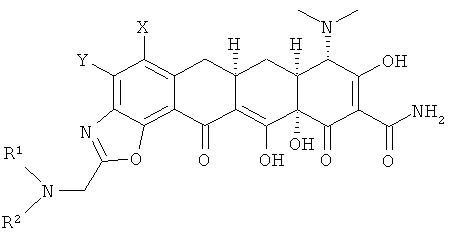
b. взаимодействие хлор соединения с амином R1R2NH с получением замещенного амина формулы
с. гидролиз замещенного амина кислотой с получением соединения формулы
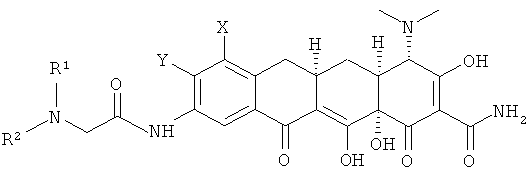
d. выделение соединения или его фармацевтически приемлемой соли.
В предпочтительном варианте выполнения способа Х - это N(СН3)2 и амин R1R2NH - это трет-бутил амин.
В предпочтительном варианте выполнения способа получили соединение [4S-(4α,4аα,5аα,12аα)]-4,7-бис(диметиламино)-9-[2-(1,1-диметилэтиламино)ацетиламино]-1,4,4а,5,5а,6,11,12а-октагидро-3,10,12,12а-тетрагидрокси-1,11-диоксо-2-нафтаценкарбоксамид или его фармацевтически приемлемую соль.
Дальнейшим вариантом выполнения изобретения является способ получения соединения формулы
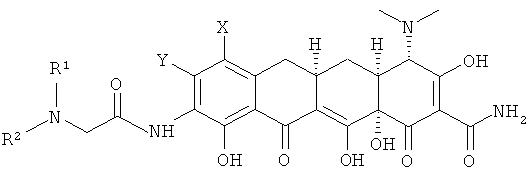
где:
Х выбран из водорода, амино, NR1R2, алкила с 1-12 необязательно замещенными атомами углерода, арила с 6,10 или 14 необязательно замещенными атомами углерода, необязательно замещенного винила, алкинила с 2-12 необязательно замещенными атомами углерода и галогена;
R1 и R2 - это независимо друг от друга Н или алкил с 1-12 атомами углерода или R1 и R2, когда необязательно выбраны вместе с атомом азота, с которым каждый из них связан, образуют 3-7-членное насыщенное углеводородное кольцо;
Y выбран из водорода, алкила с 1-12 необязательно замещенными атомами углерода, арила с 6, 10 или 14 необязательно замещенными атомами углерода, алкенила с 2-12 необязательно замещенными атомами углерода, винила, алкинила с 2-12 необязательно замещенными атомами углерода и галогена,
или его фармацевтически приемлемую соль,
включающий стадии:
а. взаимодействие 7,8-(замещенного)-9-амино-6-деметил-6-дезокситетрациклина формулы
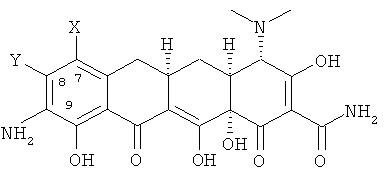
или его фармацевтически приемлемой соли
с 2-хлортриметоксиэтаном в апротонном растворителе с получением хлорсоединения формулы
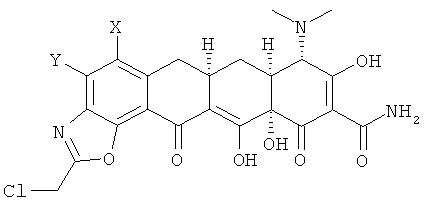
b. взаимодействие хлорсоединения с кислотой с получением 9-(2-хлорметилкарбониламино)замещенного-6-деметил-6-дезокситетрациклина формулы
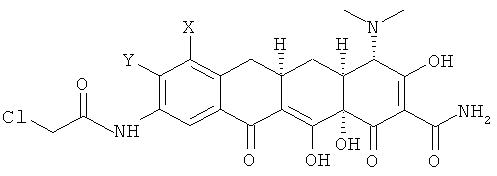
с. взаимодействие 9-(2-хлорметилкарбониламино)замещенного-6-деметил-6-дезокситетрациклина с амином R1R2NH с получением соединения формулы
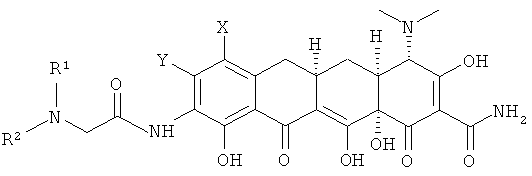
d. выделение соединения или его фармацевтически приемлемой соли.
В предпочтительном варианте выполнения способа Х - это N(CH3)2 и амин - это трет-бутил амин.
В предпочтительном варианте выполнения способа получают соединение [4S-(4α,4аα,5аα,12аα)]-4,7-бис(диметиламино)-9-[2-(1,1-диметилэтиламино)ацетиламино]-1,4,4а,5,5а,6,11,12а-октагидро-3,10,12,12а-тетрагидрокси-1,11-диоксо-2-нафтаценкарбоксамид или его фармацевтически приемлемую соль.
Дополнительным вариантом выполнения изобретения является соединение формулы
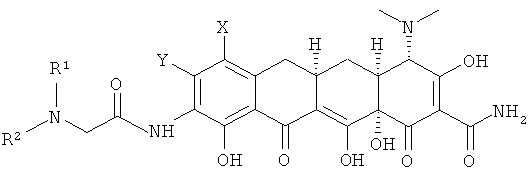
или его фармацевтически приемлемая соль,
где:
Х выбран из водорода, амино, NR1R2, алкила с 1-12 необязательно замещенными атомами углерода, арила с 6,10 или 14 необязательно замещенными атомами углерода, необязательно замещенного винила, алкинила с 2-12 необязательно замещенными атомами углерода и галогена;
R1 и R2- это независимо друг от друга Н или алкил с 1-12 атомами углерода или R1 и R2, когда необязательно выбраны вместе с атомом азота, с которым каждый из них связан, образуют 3-7-членное насыщенное углеводородное кольцо;
Y выбран из водорода, алкила с 1-12 необязательно замещенными атомами углерода, арила с 6, 10 или 14 необязательно замещенными атомами углерода, алкенила с 2-12 необязательно замещенными атомами углерода, винила, алкинила с 2-12 необязательно замещенными атомами углерода и галогена,
полученное способом, включающим стадии:
а. взаимодействия 7,8-(замещенного)-9-амино-6-деметил-6-тдезокситетрацеклина формулы
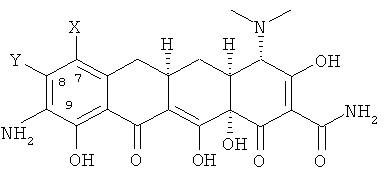
или его фармацевтически приемлемой соли
с 2-хлортриметоксиэтаном в апротонном растворителе с получением хлорсоединения формулы
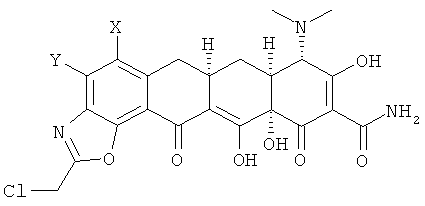
b. взаимодействие хлорсоединения с амином R1R2NH с получением замещенного амина формулы
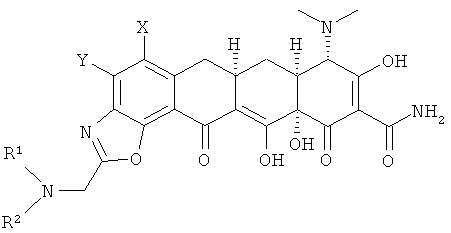
с. гидролиз замещенного амина кислотой с получением соединения формулы
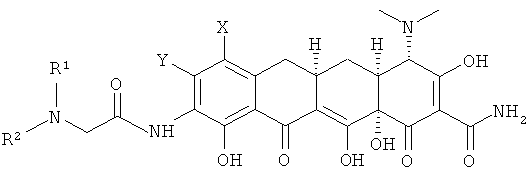
d. выделение соединения или его фармацевтически приемлемой соли.
В предпочтительном варианте выполнения способа Х - это N(СН3)2 и амин R1R2NН - это трет-бутил амин.
В предпочтительном варианте выполнения способа получили соединение 4S-(4α,4aα,5aα,12аα)]-4,7-бис(диметиламино)-9-[2-(1,1-диметилэтиламино)ацетиламино]-1,4,4а,5,5а,6,11,12а-октагидро-3,10,12,12а-тетрагидрокси-1,11-диоксо-2-нафтаценкарбоксамид или его фармацевтически приемлемую соль.
В дополнительном варианте выполнения изобретения соединение формулы

где:
Х выбран из водорода, амино, NR1R2, алкила с 1-12 необязательно замещенными атомами углерода, арила с 6,10 или 14 необязательно замещенными атомами углерода, необязательно замещенного винила, алкинила с 2-12 необязательно замещенными атомами углерода и галогена;
R1 и R2 - это независимо друг от друга Н или алкил с 1-12 атомами углерода или R1 и R2, когда необязательно выбраны вместе с атомом азота, с которым каждый из них связан, образуют 3-7-членное насыщенное углеводородное кольцо;
Y выбран из водорода, алкила с 1-12 необязательно замещенными атомами углерода, арила с 6, 10 или 14 необязательно замещенными атомами углерода, алкенила с 2-12 необязательно замещенными атомами углерода, винила, алкинила с 2-12 необязательно замещенными атомами углерода и галогена,
или его фармацевтически приемлемая соль
получены способом, включающим стадии:
а. взаимодействие 7,8-(замещенного)-9-амино-6-деметил-6-дезокситетрациклина формулы
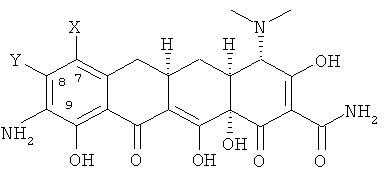
или его фармацевтически приемлемой соли
с 2-хлортриметоксиэтаном в апротонном растворителе с получением хлорсоединения формулы
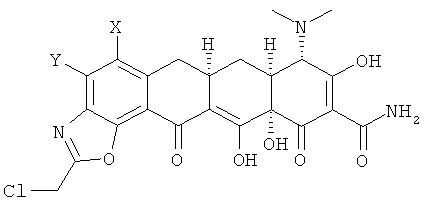
b. взаимодействие хлорсоединения с кислотой с получением 9-(2-хлорметилкарбониламино)замещенного-6-деметил-6-дезокситетрациклина формулы
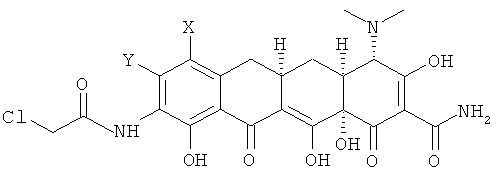
с. взаимодействие 9-(2-хлорметилкарбониламино)замещенного-6-деметил-6-дезокситетрациклина с амином R1R2NH с получением соединения формулы
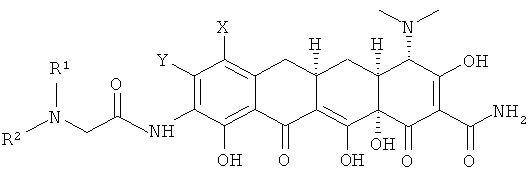
d. выделение соединения или его фармацевтически приемлемой соли.
В предпочтительном варианте выполнения способа Х - это N(СН3)2 и амин - это трет-бутил амин.
I
В предпочтительном варианте выполнения способа получили соединение [4S-(4α,4aα,5aα,12аα)]-4,7-бис(диметиламино)-9-[2-(1,1-диметилэтиламино)ацетиламино]-1,4,4а,5,5а,6,11,12а-октагидро-3,10,12,12а-тетрагидрокси-1,11-диоксо-2-нафтаценкарбоксамид или его фармацевтически приемлемую соль.
ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ.
Новые соединения настоящего изобретения могут быть легко приготовлены в соответствии со следующей схемой I.
Сначала 7,8-(замещенные)-9-амино-6-деметил-6-дезокситетрациклины 1 или их фармацевтически приемлемые соли, где Х и Y были определены ранее, реагируют с альдегидом RCHO в присутствии 2,3-дихлор-5,6-дициано-1,4-бензохиноном с получением бензоксазола 2 и 3 (Методика А). Как описано далее, 7,8-(замещенные)-9-амино-6-деметил-6-дезокситетрацеклины 1 или их фармацевтически приемлемые соли, где Х и Y были определены ранее, реагируют с 2-хлор-1,1,1-триметокси-этаном в апротонном растворителе, таком как N,N-диметилформамид (ДМФА) с получением необязательно замещенного хлорметилбензоксазола 4 и последующей реакцией с амином 9 получают замещенный амин 5 (Методика В). Гидролизуют амин 5 с получением 9-(2-замещенного аминометилкарбониламино)замещенного-6-деметил-6-дезокситетрациклина 6 (Методика D). Гидролизуют хлорметилбензоксазол 4 с получением 9-(2-хлорметилкарбониламино)замещенного-6-деметил-6-дезокситетрациклина 7, который может далее реагировать с амином 9 с получением 9-(2-замещенного аминометил карбониламино)замещенного-6-деметил-6-дезокситетрациклина 6
Дополнительно, взаимодействие 7,8-(замещенных)-9-амино-6-деметил-6-дезокситетрациклинов 1 или их фармацевтически приемлемых солей с тиокарбонилдиимидазолом с получением тио 8 и с последующим алкилированием при помощи RCH2Br в присутствии амина (N,N-диизопропилэтиламин) с получением оксазола 10 (Методика С).
Предпочтительно, амин 9 в реакции получения 9-(2-замещенного аминометилкарбониламино) замещенного-6-деметил-6-дезокситетрациклина 6, в схеме I является трет-бутиламином.
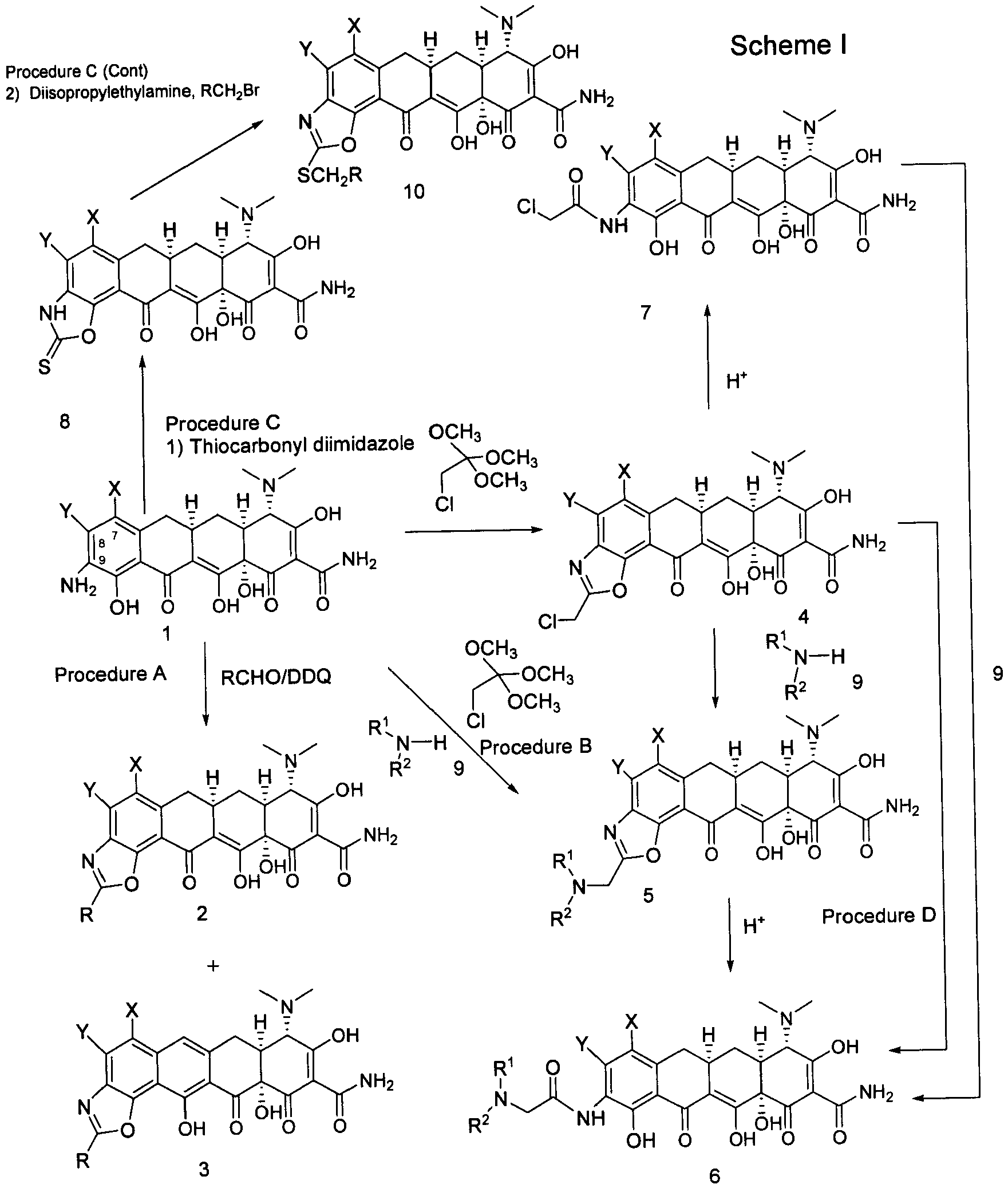
На схеме II показано, что 7,8-(замещенные)-9-амино-6-деметил-6-дезокситетрациклины 1 или их фармацевтически приемлемые соли, где Х и Y были определены ранее, реагируют с метиловым ортоэфиром с получением производного метил бензоксазола 11. Кислотный гидролиз производного метилбензоксазола 11 приводит к получению N-ацетил производного 12.
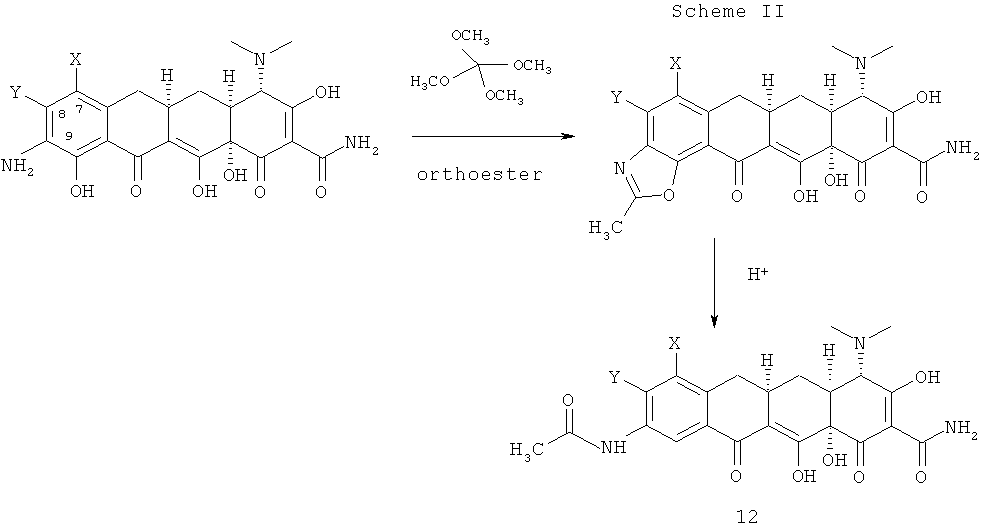
Реакции проводят в растворителях, пригодных для реагентов, и материалах, применяющихся и пригодных для эффективного превращения. Квалифицированным специалистам в органическом синтезе понятно, что присутствующие на молекуле функциональные группы должны соответствовать предполагаемым химическим превращениям. При этом необходимо определить порядок стадий синтеза, защитные группы, если требуется, и условия снятия защиты. Заместители на исходных веществах могут быть несовместимы с некоторыми условиями реакции. Такие ограничения на совместимость заместителей с условиями реакции будут очевидны квалифицированным специалистам в данной области.
Некоторые соединения, описанные на схемах ранее, обладают центрами асимметрии. Следовательно, соединения могут существовать, как минимум, в двух и чаще в более стереизомерных формах. Настоящее изобретение охватывает все стереизомерные формы соединений, чистые ли от других стереизомеров или смешанные с другими стереизомерами в любых пропорциях. Например, как рацемические смеси энантиомеров, так и диастереизомерные смеси изомеров. Точную конфигурацию любого содинения можно определить стандартным рентгеноструктурным анализом.
Фармацевтически приемлемые соли соединений изобретения можно получить в виде комплексов с металлами, с такими как алюминий, кальций, железо, магний, марганец, и в виде комплексных солей (неорганические и органические соли и соответствующие аддукты основания Манниха), используя методы, известные квалифицированным специалистам в данной области (Richard С.Larock, Comprehensive Organic Transformations, VCH Publishers, 411-415, 1989).
Предпочтительно, соединения настоящего изобретения получены в виде солей неорганических кислот, таких как соляной, бромистоводородной, йодистоводородной, фосфорной, азотной или серной; или в виде солей органических кислот, таких как уксусной, бензойной, лимонной, цистеина или других аминокислот, фумаровой, гликолевой, малеиновой, янтарной, винной, алкилсульфоновой или арилсульфоновой. Предпочтительно, образование неорганической соли происходит при участии С(4)-диметиламиновой группы. Предпочтительно, соли применяют для перорального и парентерального введения.
Стандартные фармакологические испытания
Методы оценки антибактеральной активности in vitro.
Минимальная ингибирующая концентрация (МИК).
Измерение антимикробной чувствительности. Активности антибиотиков in vitro определяют способом микроразведений бульона, как рекомендовано Национальным комитетом по клиническим лабораторным стандартам (NCCLS) (1). Mueller-Hinton II бульон (MHBII)(BBL Cockeysville, MD) является средой, используемой в измерительных методиках. Титрационные микропланшеты, содержащие серийные разведения каждого антимикробного агента, инокулируют каждым организмом до соответствующей плотности (105КОЕ/мл) в конечном объеме 100 мкл. Микропланшеты инкубируют в течение 18-22 часов при 35°С в аэробных условиях. Минимальную ингибирующую концентрацию для всех изолятов определяют как наименьшую концентрацию антимикробного агента, при которой полностью ингибируется рост организмов, что определяется невооруженным взглядом.
NCCLS.2000 Тесты измерения антимикробной чувствительности методами разведения для аэробных бактерий; подтверждено стандартами: М7-А5, том 20. Национальный комитет по клиническим лабораторным стандартам, Wayne, PA.








В случае применения соединений согласно изобретению в качестве антибактериальных средств они могут быть скомбинированы с одним или более фармацевтически приемлемыми носителями, например растворителями, разбавителями и т.п., и могут вводиться перорально в форме таблеток, капсул, диспергируемых порошков, гранул или суспензий, содержащих, например, от 0,05 до 5% суспендирующего агента, сиропов, содержащих, например, около 10-50% сахара, и эликсиров, содержащих, например, около 20-50% этанола, и др. Соединения изобретения могут вводиться и парентерально в форме стерильных инъекционных растворов или суспензий, содержащих от 0,05 до 5% суспендирующего агента в изотонической среде. Такие фармацевтические препараты могут содержать, например, от 25 до 90% активного ингредиента в сочетании с носителем, составляющим по весу от 5 до 60%.
Эффективное количество соединения от 2,0 мг на 1 кг веса тела до 100,0 мг на 1 кг веса тела может быть введено 1-5 раз в день любым обычным способом введения, включающим, но не ограничивающимся пероральным, парентеральным (включающим подкожные, внутривенные, внутримышечные, интрастернальные инъекции и вливание), ректальным введением и местным применением в единичных дозах лекарственных форм, содержащих традиционные нетоксичные фармацевтически приемлемые носители, вспомогательные вещества и среды. Однако следует понимать, что индивидуальная дозировка и частота приема дозы для конкретного пациента может варьироваться и будет зависеть от различных факторов, включающих в себя активность конкретного применяемого соединения, метаболическую стабильность и продолжительность действия соединения, возраст, вес, общее состояние здоровья, пол, питание, способ и время введения, степень выведения, сочетаемость с препаратами, степень тяжести состояния и проводимое лечение.
Эти активные соединения можно вводить как перорально, так и внутривенно, внутримышечно, подкожно. Твердые носители содержат крахмал, лактозу, дикальцийфосфат, микрокристаллическую целлюлозу, сахарозу и каолин, в то время как жидкие носители содержат стерильную воду, полиэтиленгликоли, неионогенные поверхностно-активные вещества (ПАВ) и пищевые масла, такие как кукурузное, арахисовое и кунжутное масла, что соответствует природе активного ингредиента и конкретному желаемому способу введения, обычно используемые в приготовлении фармацевтических композиций, преимущественно могут являться ароматизаторами, красителями, консервантами и антиоксидантами, например, витамин Е, аскорбиновая кислота, бутилокситолуол (ВНТ), бутилоксианизол (ВНА), которые традиционно применяются при приготовлении фармацевтических лекарственных форм.
Предпочтительными фармацевтическими композициями соединений данного изобретения с точки зрения удобства приготовления и введения являются твердые композиции, в частности таблетки и капсулы с твердыми или жидкими наполнителями. Предпочтительно пероральное введение соединений.
Эти активные соединения могут также вводиться парентерально или интраперитонеально. Растворы или суспензии этих активных соединений в качестве свободных оснований или фармакологически приемлемых солей можно приготовить в воде, соответствующим образом перемешав с ПАВ, таким как гидроксипропилцеллюлоза. Также можно получить в глицерине, в жидких полиэтиленгликолях и их смесях с маслами. При обычных условиях хранения и применения эти препараты содержат консервант для предотвращения роста микроорганизмов.
Фармацевтические формы, пригодные для инъекций, содержат стерильные водные растворы или дисперсии, стерильные порошки для экстемпорального приготовления инъекционных растворов или дисперсий. Во всех случаях лекарственная форма должна быть стерильной и жидкой для легкого введения через шприц. Она должна быть устойчива в условиях изготовления и хранения, а также защищена от заражения микроорганизмами, такими как бактерии и грибы. Носитель может представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль), их применимые смеси и растительные масла.
Настоящее изобретение более полно описано в следующих конкретных примерах, которые не следует рассматривать как ограничение настоящего изобретения.
Пример, Методика А
ПРИМЕР 1
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-2-(2,2-дифенилвинил)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
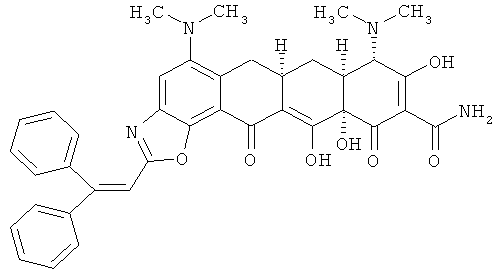
Сульфат 9-аминоминоциклина (0,500 г, 0,748 ммоль) растворяют в безводном ДМФА и добавляют β-фенилциннамальдегид (0,779 г, 3,74 ммоль, 5 эквивалентов). Затем к раствору добавляют DDQ (0,085 г, 0,374 ммоль, 0,5 эквивалентов) и перемешивают при комнатной температуре в течение 5 минут. При помощи масс-спектрометрии (электроспрей) показывают соотношение исходного вещества и продукта 1:1. Добавляют вторую порцию DDQ (0,068 г, 0,300 ммоль, 0,4 эквивалента). Примерно через 5 минут добавляют ацетонитрил (7,5 мл) и всю реакционную смесь медленно вливают в эфир (750 мл). Розовый осадок отбирают с помощью фильтрации, промывают свежим эфиром и получают 0,480 г неочищенного продукта. Материал растворяют в воде (75 мл) и получают раствор с рН 2,2, который экстрагируют дихлорметаном (2×100 мл). С помощью водного аммония повышают рН водной фазы до 3,0 и снова экстрагируют дихлорметаном (2×100 мл). Четыре органических экстракта высушивают над Na2SO4, профильтровывают и концентрируют до объема примерно в 2 мл. Добавляют небольшую порцию метанола (1 мл) и к концентрированному раствору добавляют по каплям 1М HCl в эфире. Твердый осадок отфильтровывают, промывают свежим эфиром и высушивают под вакуумом. Продукт получают в форме соли НСl.
Получают ЯМР1H сигналы: δ 4,26 (s, 1Н), 7,13 (s, 1H), 7,26-7,45 (m, 8H), 7,63 (s, 1 H), 9,08 (s,1H), 9,54 (s, 1H).
Соединения настоящего изобретения, перечисленные ниже в примерах 2-37, в основном были получены с помощью способа, описанного подробно выше в Примере 1, используя методику А.
ПРИМЕР 2
(7аS,8S,11аS)-8-(диметиламино)-9,11а,13-тригидрокси-2-(2-метил-1-пропенил)-11,12-диоксо-7,7а,8,11,11а,12-гексагидронафтацен[2,1-d][1,3]оксазол-10-карбоксамид
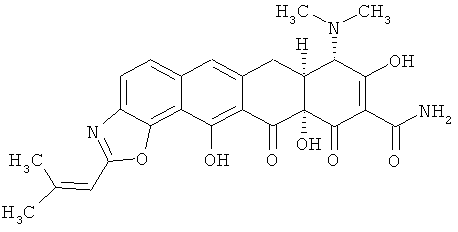
МС (электроспрей) M/z 492 (М+Н);
МСВР (Масс-спектр высокого разрешения): рассчитано для С26H26N3O7, 491,16925; получено (электроспрей (ESI+)), 492,1765.
ПРИМЕР 3
7aS,8S,11аS)-8-(диметиламино)-2-[4-(диметиламино)фенил]-9,11a,13-тригидрокси-11,12-диоксо-7,7а,8,11,11а,12-гексагидронафтацен[2,1-d][1,3]оксазол-10-карбоксамид
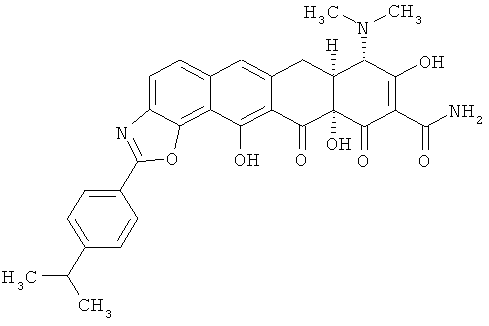
МСВР: рассчитано для C30H29N3O7, 566,1958;
получено (электроспрей (ЕSI+)), 557,2030.
ПРИМЕР 4
6аR,7аS,8S,11аS)-2-трет-бутил-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
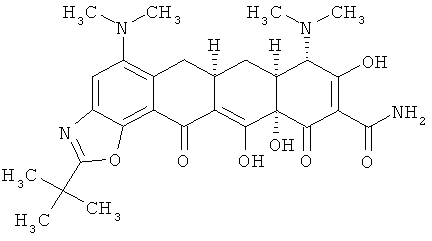
МСВР: рассчитано для С28Н34N4O7·НСl, 574,2194;
получено (электроспрей(ЕSI-)), 537,23462.
ПРИМЕР 5
6aR,7aS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-2-(4-метилфенил)-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
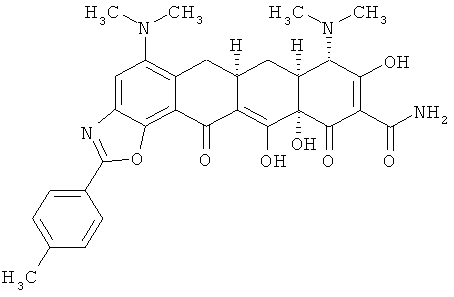
МСВР: рассчитано для C31H32N4O7·НСl
ПРИМЕР 6
7aS,8S,11аS)-5,8-бис(диметиламино)-2-(3-фторфенил)-9,11а,13-тригидрокси-11,12-диоксо-7,7а,8,11,11а,12-гексагидронафтацен[2,1-d][1,3]оксазол-10-карбоксамид
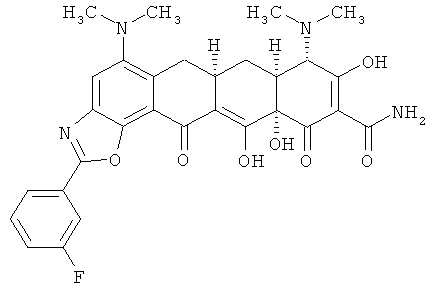
ПРИМЕР 7
(6aR,7aS,8S,11аS)-2-(4-цианофенил)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
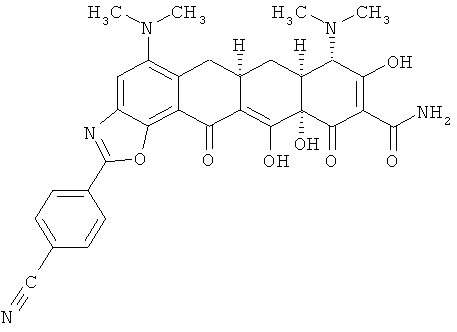
МС (электроспрей) M/z 584,4 (М+Н);
МСВР рассчитано для С31H29N5О7·HCl
ПРИМЕР 8
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-2-[4-(диметиламино)фенил]-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
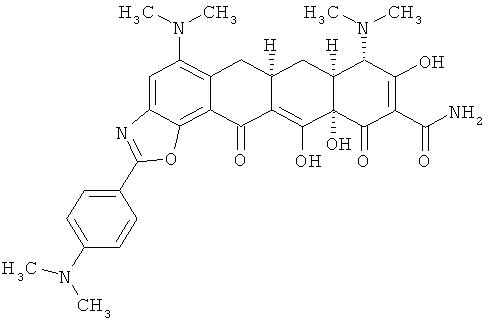
МСВР: рассчитано для С32Н36N5O7·HCl, 637,2303;
получено (электроспрей(ЕSI-)), 600,24521.
ПРИМЕР 9
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-2-(2,2-дифенилвинил) -9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид

МСВР: рассчитано для С38Н36N4O7·НСl
ПРИМЕР 10
(6aR,7aS,8S,11аS)-2-(5-трет-бутил-2-гидроксифенил)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
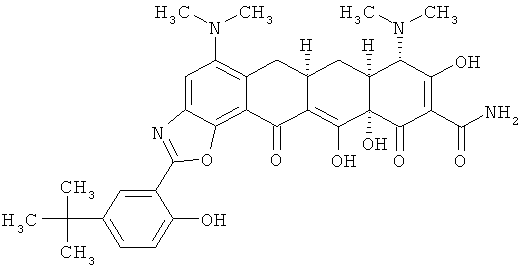
МС (электроспрей) M/z 631,4 (М+Н);
МСВР: рассчитано для С34Н38N4O8·НСl.
ПРИМЕР 11
(6aR,7aS,8S,11аS)-2-[4-(бензилокси)фенил]-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
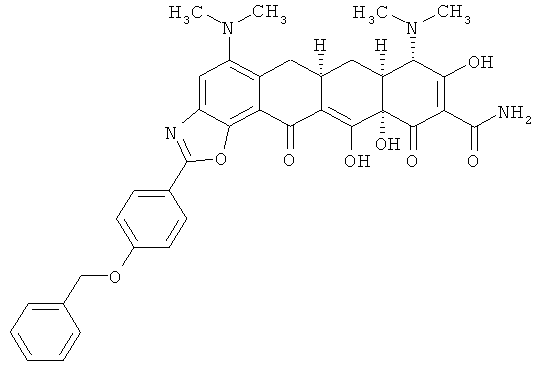
рассчитано для С37Н36N4О8.
ПРИМЕР 12
(6аR,7аS,8S,11аS)-2-(2,4-(дигидроксифенил)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
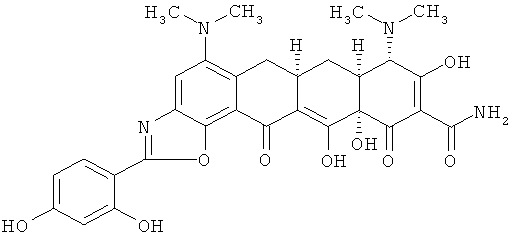
МС (электроспрей) M/z 591,2 (М+Н);
МСВР: рассчитано для С30Н30N4O9·HCl, 626,1780;
получено (электроспрей(ЕSI-)), 589,1927.
ПРИМЕР 13
6aR,7aS,8S,11аS)-5,8-бис(диметиламино)-2-(3-фтор-4-метоксифенил)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
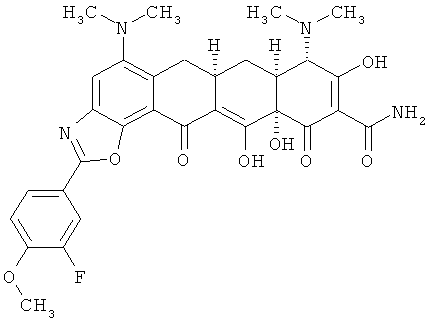
МСВР: рассчитано для С31H31N4O8
ПРИМЕР 14
(6аR,7аS,8S,11аS)-2-(1,3-бензодиоксол-5-ил)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
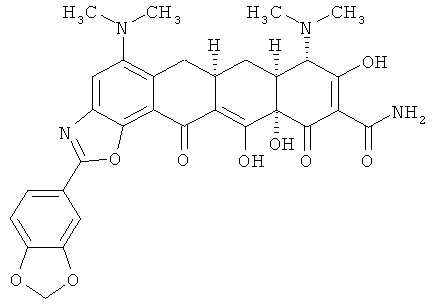
МСВР: рассчитано для С31H30N4О9 638,1780;
получено (электроспрей(ЕSI-)), 603,20953.
ПРИМЕР 15
(6aR,7aS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-2-(2,4,6-триметоксифенил)-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]oкcaзoл-10-кapбoкcaмид
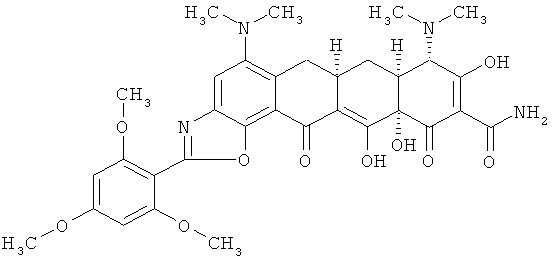
МС (электроспрей) M/z 649,2 (М+Н);
МСВР: рассчитано для С33Н36N4О10·HCl, 684,2198;
получено (электроспрей(ЕSI-)), 647,23441.
ПРИМЕР 16
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-2-(2,4,5-триэтоксифенил)-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
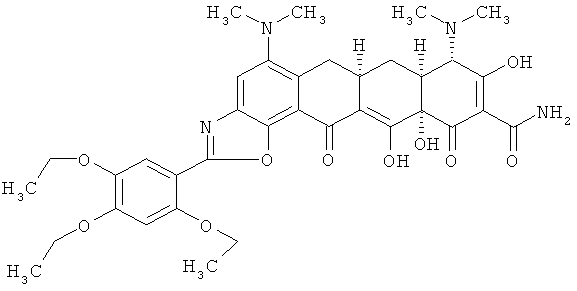
МС (электроспрей) M/z 691,3 (М+Н);
МСВР: рассчитано для С36Н42N4O10
ПРИМЕР 17
(6aR,7aS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-2-тиен-3-ил-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-а][1,3]оксазол-10-карбоксамид
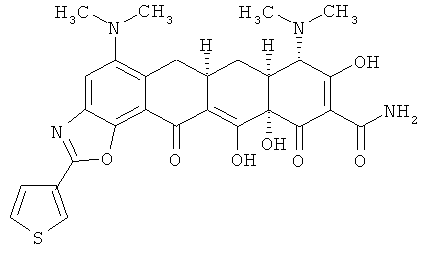
МСВР: рассчитано для C28H28N4O7.
ПРИМЕР 18
(6аR,7аS,8S,11аS)-2-(1-бензофуран-2-ил)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
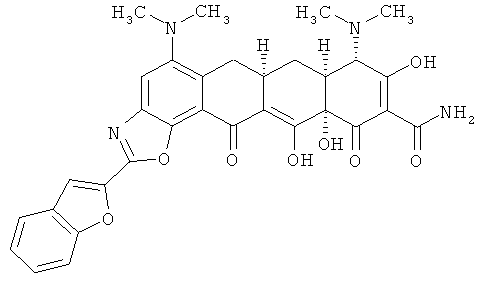
МС (электроспрей) M/z 599,3 (М+Н);
МСВР: рассчитано для С32Н30N4O8 НСl, 634,1830;
получено (электроспрей(ЕSI-)), 597,19811.
ПРИМЕР 19
(6aR,7aS,8S,11aS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-2-(1-метил-1Н-индол-2-ил)-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид

МС (электроспрей) M/z 612,2 (М+Н);
МСВР: рассчитано для С33Н33N5О7.
ПРИМЕР 20
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-2-(фурил)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид

МС (электроспрей) M/z 549,3 (М+Н);
МСВР: рассчитано для C28H28N4O8HCl, 584,1674;
получено (электроспрей(ЕS1-)), 547,1822.
ПРИМЕР 21
(6aR,7aS,8S,11аS)-10-(аминокарбонил)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
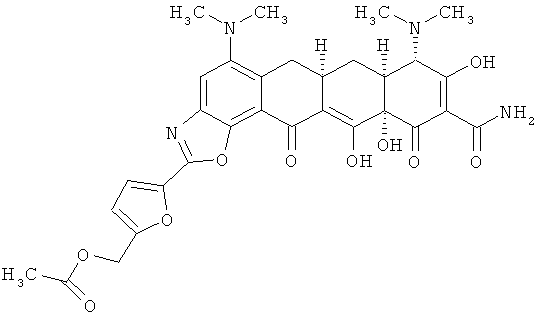
МС (электроспрей) M/z 621,2 (М+Н);
МСВР: рассчитано для С31Н32N4O10.
ПРИМЕР 22
(6aR,7aS,8S,11аS)-5,8-бис(диметиламино)-2-[(Е)-2-(2-фурил)этенил]-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
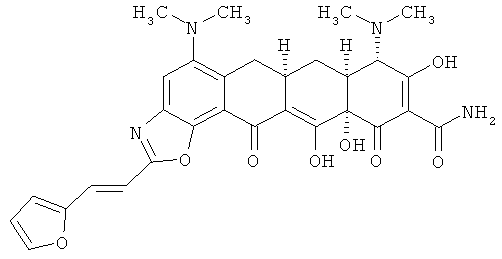
МСВР: рассчитано для C30H30N4O8.
ПРИМЕР 23
(6аR,7аS,8S,11аS)-2-(1-бензотиен-3-ил)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
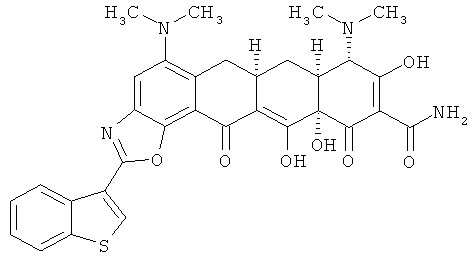
МС (электроспрей(ЕSI+)) M/z 615,1 (М+Н);
МСВР: рассчитано для С32Н30N4O7.
ПРИМЕР 24
(6aR,7aS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-2-(1,3-тиазол-2-ил)-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
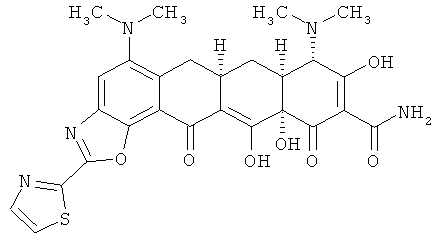
МСВР: рассчитано для С27Н27N5O7.
ПРИМЕР 25
(6aR,7aS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-2-[(Е)-2-фенилэтенил1]-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид

МСВР: рассчитано для С32Н32N4O7 НСl, 620,2038;
получено (электроспрей(ЕSI+)), 585,2329.
ПРИМЕР 26
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-2-[(Е)-2-(4-метоксифенил)этенил]-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
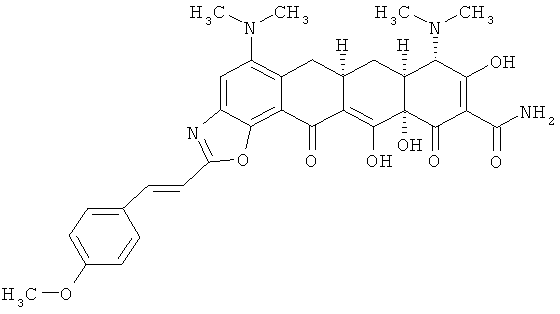
МСВР: рассчитано для С33Н34N4О8 HCl, 650,2143;
получено (электроспрей(ЕSI+)), 615,24413.
ПРИМЕР 27
(6aR,7aS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-2-[(Е)-2-(3-метоксифенил)этенил]-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
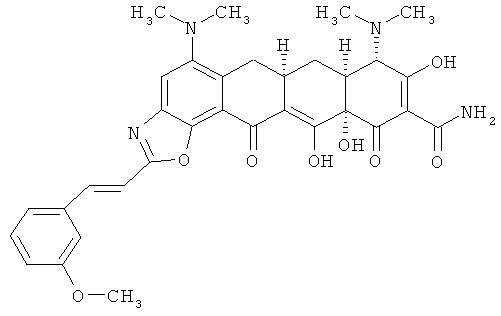
МСВР: рассчитано для С33Н34N4O8 HCl, 650,2143;
получено (электроспрей(ЕSI+)), 615,24419.
ПРИМЕР 28
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-2-[(Е)-2-(2-метоксифенил)этенил]-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
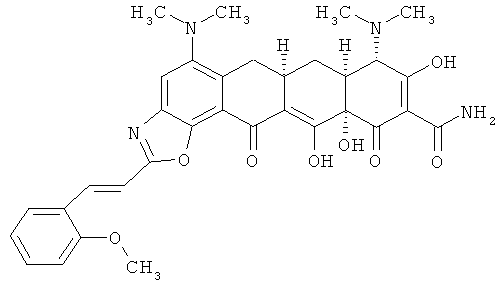
МСВР: рассчитано для С33Н34N4O8 HCl, 650,2143;
получено (электроспрей(ЕSI+)), 615,24408.
ПРИМЕР 29
(6aR,7aS,8S,11аS)-5,8-бис(диметиламино)-2-[(E)-2-(4-фторфенил)этенил]-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а, 13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
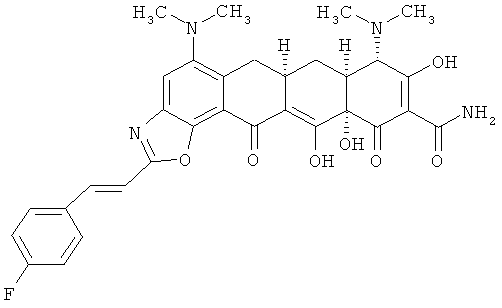
МСВР: рассчитано для С32Н31N4O7НСl, 638,1944;
получено (электроспрей(ЕSI+)), 603,22476.
ПРИМЕР 30
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-2-[(Е)-2-(2-фторфенил)этенил]-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
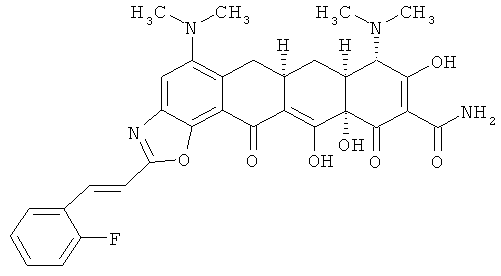
МС (электроспрей) M/z 603,2 (М+Н);
МС (электроспрей) M/z 302,3 (М+2Н);
МСВР: рассчитано для С32Н32FN4O8 HCl, 638,1944;
получено (электроспрей(ЕSI+)), 603,22469.
ПРИМЕР 31
(6аR,7аS,8S,11аS)-2-(4-трет-бутилфенил)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
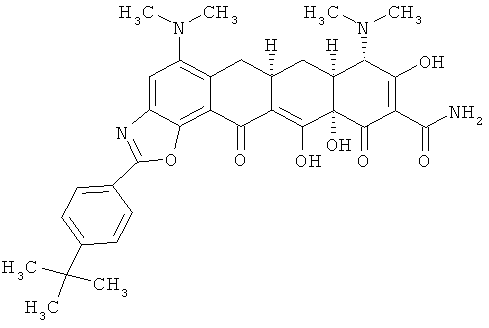
МСВР: рассчитано для С34Н38N4O7 HCl, 650,2507;
получено (электроспрей(ЕSI+)), 615,28057.
ПРИМЕР 32
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-2-[4-(гексилокси)фенил]-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
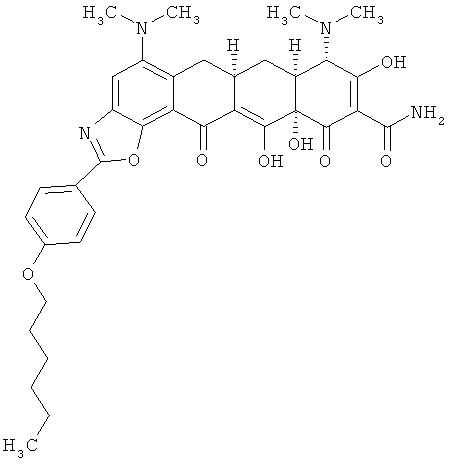
МСВР: рассчитано для C36H42N4O8HCl, 694,2769;
получено (электроспрей (ESI+)), 659,30693.
ПРИМЕР 33
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-2-пиридин-4-ил-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
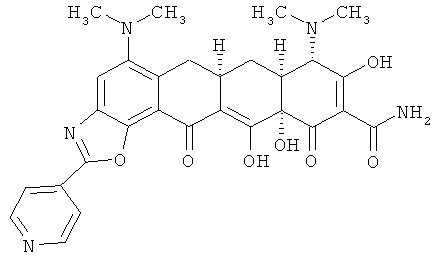
MS (ESI-) m/z 558.4 ((M-H)-).
ПРИМЕР 34
(6aR,7aS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-2-пиридин-3-ил-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
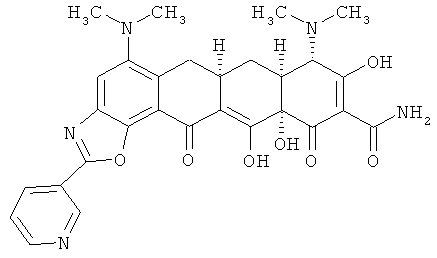
МСВР: рассчитано для C29H29N5O7 НСl, 595,1834;
получено (электроспрей (ESI+)), 560,21353.
ПРИМЕР 35
(6аR,7аS,8S,11аS)-2-(хлорметил)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
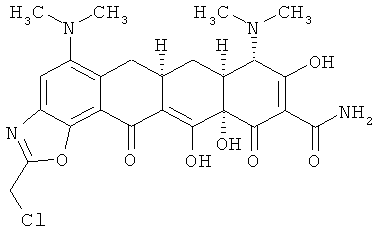
ПРИМЕР 36
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-2-[(диметиламино)метил]-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
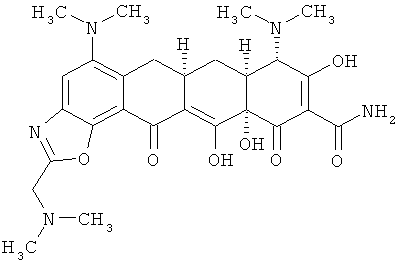
МСВР: рассчитано для С27Н33N5O7 HCl, 575,2147;
получено (электроспрей (ESI+)), 540,24506.
ПРИМЕР 37
(6aR,7aS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-2-(пирролидин-1-илметил)-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
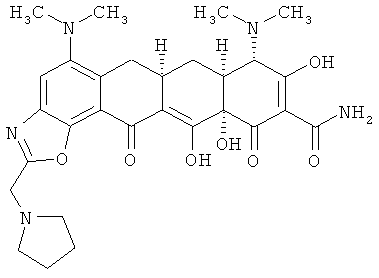
МСВР: рассчитано для C29H35N5O7 HCl, 601,2303;
получено (электроспрей(ЕSI+)), 566,26066.
Пример Методики В
ПРИМЕР 38
(6aR,7aS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-2-[(пропиламино)метил]-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
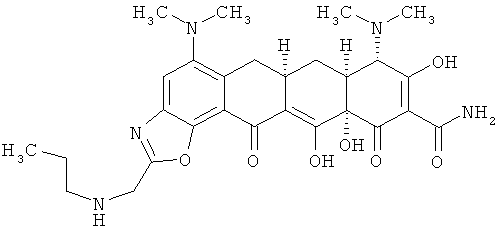
Сульфат 9-аминоминоциклина (1,0 г, 1,50 ммоль) растворяют в ДМФА (50 мл) и добавляют раствор 2-хлор-1,1,1-триметоксиэтана (0,463 г, 3,00 ммоль, 2 эквивалента). Реакцию перемешивают при комнатной температуре до тех пор, пока масс-спектр не подтвердит образование производного хлорметилбензоксазола. Затем к раствору добавляют н-пропиламин (10 мл, избыток) и перемешивают до тех пор, пока масс-спектр не подтвердит образование н-пропиламинометилбензоксазола. Смесь концентрируют при пониженном давлении для удаления избытка н-пропиламина, затем медленно вливают в эфир и добавляют HCl/эфир, чтобы осадить соль. Твердую фазу промывают свежим эфиром и высушивают под вакуумом. Неочищенный осадок растворяют в воде (100 мл) и получают раствор с рН 2. С помощью водного аммония последовательно повышают рН на 0,5 единицы и экстрагируют дихлорметаном. Фракции, экстрагированные при рН 4-4,5, объединяют, высушивают над Na2SO4, профильтровывают и концентрируют почти досуха. Добавляют немного метанола и раствор обрабатывают 1М HCl в эфире. Выпавший твердый продукт отбирают с помощью фильтрации, промывают свежим эфиром и высушивают под вакуумом. Выход продукта, в форме соли HCl, составляет 0,067 г.
Получают ЯМР 1Н сигналы: δ 0,94 (t, 3Н), 1,73 (m, 2H), 4,31 (s, 1H), 4,65 (s, 2H), 7,78 (s, 1H), 9,15 (s, 1H), 9,67 (s, 1H).
Соединения настоящего изобретения, перечисленные ниже в примерах 39-41, главным образом получают по способу, подробно описанному выше в Примере 38, используя методику В.
Получили по Методике В
ПРИМЕР 39
(6аR,7аS,8S,11аS)-2-[(бутиламино)метил]-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
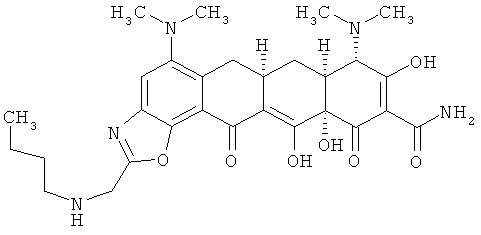
МСВР: рассчитано для С29Н37N5O7 HCl, 603,2460;
получено (электроспрей (ESI+)), 568,27616.
(Методика В)
ПРИМЕР 40
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-2-[(пропиламино)метил1]-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид

МСВР: рассчитано для C28H35N5O7 HCl, 589,2303;
получено (электроспрей (ESI+)), 554,2604.
(Методика В)
ПРИМЕР 41
(6аR,7аS,8S,11аS)-2-[(трет-бутиламино)метил]-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
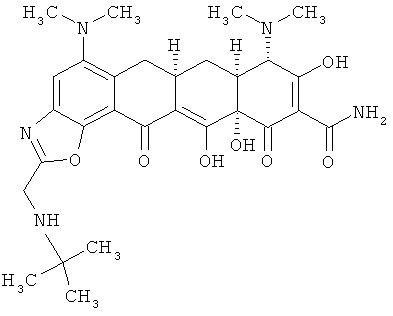
Сульфат 9-аминоминоциклина (1,0 г, 1,50 ммоль) растворяют в ДМФА (20 мл) и добавляют раствор 2-хлор-триметоксиэтана (0,35 г, 2,2 ммоль, 1,46 эквивалента. Реакцию перемешивают при комнатной температуре до тех пор, пока масс-спектр не подтвердит образование производного хлорметилбензоксазола. Затем к раствору добавляют трет-бутиламин (7,3 мл, избыток) и перемешивают до тех пор, пока масс-спектр не подтвердит образование трет-бутиламинометилбензоксазола. Смесь концентрируют при пониженном давлении для удаления избытка трет-бутиламина, затем медленно вливают в эфир (1L) и добавляют HCl/эфир, чтобы осадить соль. Осадок промывают свежим эфиром и высушивают под вакуумом. Неочищенный осадок растворяют в воде (100 мл) и получают раствор с рН 2. С помощью водного аммония последовательно повышают рН на 0,5 единицы и экстрагируют дихлорметаном. Фракции, экстрагированные при рН 4-4,5, объединяют, высушивают над Na2SO4, профильтровывают и концентрируют почти досуха. Добавляют немного метанола, раствор обрабатывают 1М HCI в эфире. Выпавшую твердую фазу отбирают с помощью фильтрации, промывают свежим эфиром и высушивают под вакуумом с получением продукта в виде его соли.
МС (электроспрей(ЕSI+)) M/z 568,4 ((М+Н)+);
МС (электроспрей(ЕSI+)) M/z 284,9 ((М+2Н)2+);
МС (электроспрей(ЕSI+) M/z 146,3 ((М'+Н)+);
МСВР: рассчитано для С29H37N5O7 HCl, 603,2460;
получено (электроспрей(ЕSI-)), 566,26087.
Пример Методики В
ПРИМЕР 42
(6aR,7aS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-2-тиоксо-2,3,6а,7,7а,8,11,11а,13-декагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
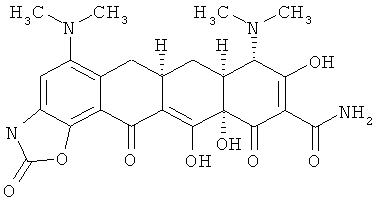
К раствору 9-амино-мино дисульфата (0,668 г, 1 ммоль) в ДМСО (30 мл) добавляют 2 эквивалента 1,1-тиокарбонилдиимидазола. Затем реакцию перемешивают при комнатной температуре в течение 2-12 часов (с последующим анализом МС (электроспрей)). Затем смесь измельчают в порошок с диэтиловым эфиром и отбирают твердую фазу. Материал используют на следующей стадии без дальнейшей очистки.
МС (электроспрей) M/z 515,2 (М+Н) МСВР: рассчитано для C24H26N4O7S H2SO4, 612,1196; получено (электроспрей(ЕSI+)), 515,15934.
Соединения настоящего изобретения, перечисленные ниже в примерах 43-44, главным образом получают по способу, подробно описанному выше в Примере 42, используя методику В.
Пример Методики С
(Методика С)
ПРИМЕР 43
Бензил {[(6aR,7aS,8S,11aS)-10-(аминокарбонил)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-2-ил]тио}ацетат
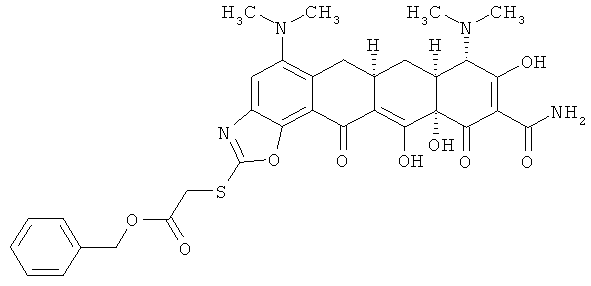
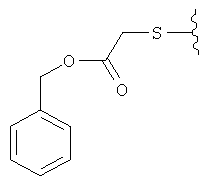
К раствору (6aR,7aS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-2-тиоксо-2,3,6,6а,7,7а,8,11,11а,13-декагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамида (Пример 42) в N,N-диметилформамиде (ДМФА) добавляют 2 эквивалента диизопропилэтиламина, после перемешивания в течение 5 минут добавляют 1,2 эквивалента бензил-2-бромацетата. Реакционную смесь перемешивают в течение 1 часа, затем смесь измельчают в порошок с диэтиловым эфиром и отбирают твердую фазу. Твердую фазу очищают экстракцией.
МСВР: рассчитано для С33H34N4O9S HCl, 698,1813; получено (электроспрей(ЕSI+)), 663,2115.
ПРИМЕР 44
(6aR,7aS,8S,11аS)-5,8-бис(диметиламино)-2-[(4-(фторбензил)тио]-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид
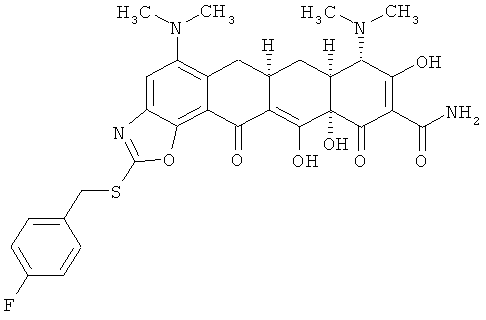
Соединение примера получают по методике D в примере 43, используя 4-фторбензилбромид.
МС (электроспрей) M/z 622,9 (М+Н);
МСВР: рассчитано для C31H31FN4O7S HCl, 658.1664; получено (электроспрей(ЕSI+)), 623.19689.
Пример методики D (Соединение 1-4-6)
ПРИМЕР 45
[4S-(4α,4aα,5aα,12аα)]-4,7-бис(диметиламино)-9-[2-(1,1-диметилэтиламино)ацетиламино]-1,4,4а,5,5а,6,11,12а-октагидро-3,10,12,12а-тетрагидрокси-1,11-диоксо-2-нафтаценкарбоксамид
(моно HCl); (свободное основание)
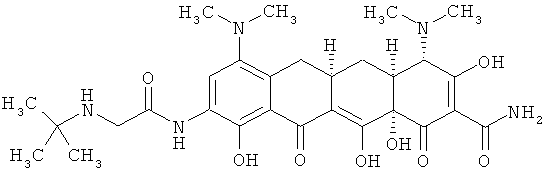
Сульфат 9-аминоминоциклина (1,0 г, 1,50 ммоль) растворяют в ДМФА (20 мл) и добавляют раствор 2-хлор-триметоксиэтана (0,35 г, 2,2 ммоль, 1,47 эквивалента). Реакцию перемешивают при комнатной температуре до тех пор, пока масс-спектр не подтвердит образование производного хлорметилбензоксазола. Затем к раствору добавляют трет-бутила мин (7,3 мл, избыток) и перемешивают до тех пор, пока масс-спектр не подтвердит образование трет-бутиламинометилбензоксазола. Смесь концентрируют при пониженном давлении для удаления избытка трет-бутиламина, затем медленно вливают в эфир (1L) и добавляют HCl/эфир, чтобы осадить соль. Твердую фазу промывают свежим эфиром и высушивают под вакуумом. Неочищенную твердую фазу растворяют в воде (100 мл) и получают раствор с рН 2. С помощью водного аммония последовательно повышают рН на 0,5 единицы и экстрагируют дихлорметаном. Фракции, экстрагированные при рН 4-4,5, объединяют, высушивают над Na2SO4, профильтровывают и концентрируют почти досуха. Добавляют немного метанола, раствор обрабатывают 1М HCI в эфире. Выпавшую твердую фазу отбирают с помощью фильтрации, промывают свежим эфиром и высушивают под вакуумом с получением продукта в виде его соли.
Продукт из примера 41 обрабатывают водной кислотой в течение 1-24 часов с получением моно HCI соли продукта примера 45.
МС (электроспрей(ЕSI+)) M/z 586,4 ((М+Н)+.
Последующие примеры получают подобным способом, описанным в методике D.
Пример 46
48-(4α,4аα,5аα,12аα)]-4,7-бис(диметиламино)-9-[(диметиламино)ацетиламино]-1,4,4а,5,5а,6,11,12а-октагидро-3,10,12,12а-тетрагидрокси-1,11-диоксо-2-нафтаценкарбоксамид
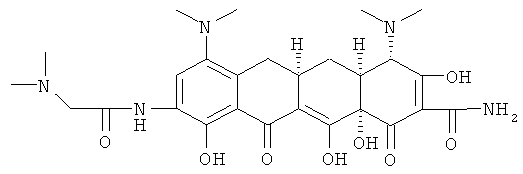
МС (бомбардировка быстрыми атомами(FАВ)) M/z 558 ((М+Н)+.
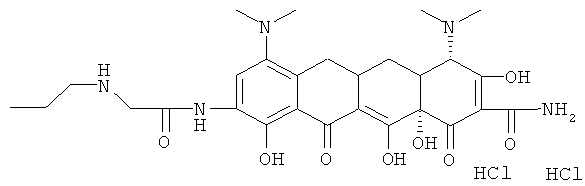
Пример 47
4S-(4α,4аα,5аα,12аα)]-4,7-бис(диметиламино)-9-[[(н-бутиламино)ацетил]амино]-1,4,4а,5,5а,6,11,12а-октагидро-3,10,12,12а-тетрагидрокси-1,11-диоксо-2-нафтаценкарбоксамид
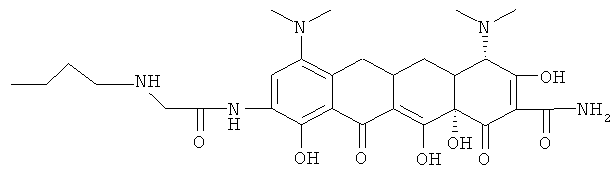
МС (бомбардировка быстрыми атомами(FАВ)) M/z 586 ((М+Н)+;
Пример 48
4S-(4α,4аα,5аα,12аα)]-4,7-бис(диметиламино)-9-[[(пропиламино)ацетил]амино]-1,4,4а,5,5а,6,11,12а-октагидро-3,10,12,12а-тетрагидрокси-1,11-диоксо-2-нафтаценкарбоксамид
МС (бомбардировка быстрыми атомами(FАВ)) M/z 572 ((М+Н)+.
Пример 49
4S-(4α,4аα,5аα,12аα)]-4,7-бис(диметиламино)-9-[(хлорацетил)амино]-1,4,4а,5,5а,6,11,12а-октагидро-3,10,12,12а-тетрагидрокси-1,11-диоксо-2-нафтаценкарбоксамид
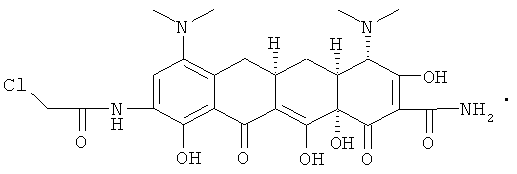
МС (бомбардировка быстрыми атомами(FАВ)) M/z 549 ((М+Н)+.
Реферат
Настоящее изобретение относится к соединению формулы (I), его таутомерам и фармацевтически приемлемым солям. В формуле (I) ! ! Х выбран из водорода, -NR11R12, А" является группой, выбранной из: и ; R11 и R12 независимо выбраны из алкила с 1-6 атомами углерода; Y представляет собой водород; R выбран из алкила, содержащего от 1 до 6 атомов углерода, которые могут необязательно, независимо друг от друга иметь 1-2 заместителя, представляющих собой галоген, алкенила с 2-6 атомами углерода, которые необязательно, независимо друг от друга содержат 1-2 заместителя, выбранные из фенила, возможно замещенного алкокси с 1 до 6 атомами углерода, галогена, гетероарила с 5 атомами кольца, содержащего 1 гетероатом, представляющий собой кислород; -CH2NR1R2; арила с 6 атомами углерода, который необязательно содержит 1-3 заместителя, независимо выбранных из галогена, циано, гидроксила, алкила с 1-6 атомами углерода, алкокси с 1-6 атомами углерода, бензилокси, ди(алкил с 1-6 атомами углерода)амино, и метилендиокси; гетероарила с 5 или 6 кольцевыми атомами, содержащего 1-2 гетероатома, которые могут быть одинаковыми или различными и независимо выбраны из азота, кислорода, серы, необязательно содержащего 1 заместитель, представляющий собой -СН2ОСОСН3; бензофурила и бензотиенила; или группы, состоящей из -SR3; R1 и R2 являются независимо друг от друга Н или алкилом с 1-6 атомами углерода, или R1 и R2 вместе с атомом азота, с которым каждый из них связан, образуют 5- или 6-членное насыщенное кольцо, содержащее один гетероатом N; R3 выбран из -СН2-фенила, необязательно замещенного галогеном; -СН2(СО)ОСН2фенила; при условии, что, если Х - это NR11R12, а R11 - это водород, тогда R12 - это метил, этил, н-проп
Формула
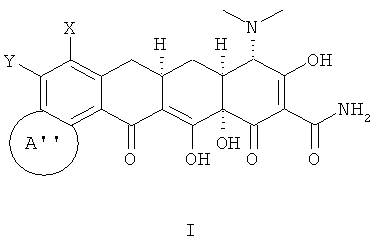
где X выбран из:
водорода, -NR11R12,
А'' является группой, выбранной из:
R11 и R12 независимо выбраны из алкила с 1-6 атомами углерода;
Y представляет собой водород;
R выбран из:
алкила, содержащего от 1 до 6 атомов углерода, которые могут необязательно, независимо друг от друга иметь 1-2 заместителя, представляющих собой галоген,
алкенила с 2-6 атомами углерода, которые необязательно независимо друг от друга содержат 1-2 заместителя, выбранные из фенила, возможно замещенного алкокси с 1 до 6 атомами углерода, галогена, гетероарила с 5 атомами кольца, содержащего 1 гетероатом, представляющий собой кислород;
-CH2NR1R2;
арила с 6 атомами углерода, который необязательно содержит 1-3 заместителя, независимо выбранных из галогена, циано, гидроксила, алкила с 1-6 атомами углерода, алкокси с 1-6 атомами углерода, бензилокси, ди(алкил с 1-6 атомами углерода)амино, и метилендиокси;
гетероарила с 5 или 6 кольцевыми атомами, содержащего 1-2 гетероатома, которые могут быть одинаковыми или различными и независимо выбраны из азота, кислорода, серы, необязательно содержащего 1 заместитель, представляющий собой
-СН2ОСОСН3;
бензофурила и бензотиенила; или
группы, состоящей из -SR3;
R1 и R2 являются независимо друг от друга Н или алкилом с 1-6 атомами углерода, или R1 и R2 вместе с атомом азота, с которым каждый из них связан, образуют 5- или 6-членное насыщенное кольцо, содержащее один гетероатом N;
R3 выбран из:
-СН2-фенила, необязательно замещенного галогеном,
-СН2(СО)ОСН2фенила,
при условии, что, если Х - это NR11R12, а R11 - это водород, тогда R12 - это метил, этил, н-пропил, н-бутил, 1-метилэтил, 1-метилпропил, 2-метилпропил или 1,1-диметилэтил; и если R11 - это метил или этил, тогда R12 - это метил, этил, н-пропил, 1-метилэтил, н-пропил, 1-метилпропил или 2-метилпропил;
или таутомер или его фармацевтически приемлемая соль.
или его фармацевтически приемлемая соль.
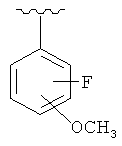
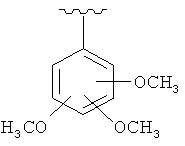
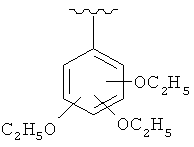
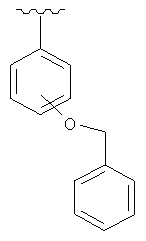
и
или его фармацевтически приемлемая соль.
или его фармацевтически приемлемая соль.
алкила, содержащего от 1 до 6 атомов углерода, которые могут быть необязательно независимо друг от друга иметь 1-2 заместителя, представляющих собой галоген,
алкенила с 2-6 атомами углерода, которые необязательно независимо друг от друга замещены 1-2 заместителями, выбранными из фенила, алкокси, содержащего от 1 до 6 атомов углерода; или
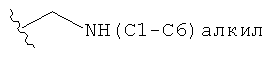
или его фармацевтически приемлемая соль.

или его фармацевтически приемлемая соль.
или его фармацевтически приемлемая соль.
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-2(2,2-дифенилвинил)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d)[1,3]оксазол-10-карбоксамид,
(7aS,8S,11а5)-8-(диметиламино)-9,11а,13-тригидрокси-2-(2-метил-1-пропенил)-11,12-диоксо-7,7а,8,11,11а,12-гексагидронафтацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6aR,7aS,8S,11аS)-2-трет-бутил-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]-оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-2[(Е)-2-(-2-фурил)этенил]-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-2-[(Е)-2-фенилэтенил]-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3] оксазол-10-карбоксамид,
(6aR,7aS,8S,11aS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-2-[(Е)-2-(4-метоксифенил)этенил]-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-2-[(Е)-2-(3-метоксифенил)этенил]-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d[1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-2-[(Е)-2-(2-метоксифенил)этенил]-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-2[(Е)-2-(4-фторфенил)этенил]-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6aR,7aS,8S,11aS)-5,8-бис(диметиламино)-2[(Е)-2-(2-фторфенил)этенил]-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-2-(хлорметил)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6aR,7aS,8S,11aS)-5,8-бис(диметиламино)-2[(диметиламино)метил]-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d[1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-2-(пирролидин-1-илметил)-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-2-[(пропиламино)метил]-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-2-[(бутиламино)метил]-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-2-[(пропиламино)метил]-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид и
(6аR,7аS,8S,11аS)-2-[(трет-бутиламино)метил]-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
или их фармацевтически приемлемые соли.
(7aS,8S,11аS)-8-(диметиламино)-2-[4-(диметиламино)фенил]-9,11a,13-тригидрокси-11,12-диоксо-7,7а,8,11,11а,12-гексагидронафтацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6aR,7aS,8S,11аS)-2-трет-бутил-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6aR,7aS,8S,11aS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-2-(4-метилфенил)-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(7аS,8S,11аS)-5,8-бис(диметиламино)-2-(3-фторфенил)-9,11а,13-тригидрокси-11,12-диоксо-7,7а,8,11,11а,12-гексагидронафтацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-2-(4-цианофенил)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-2[4-(диметиламино)фенил]-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-2-(5-трет-бутил-2-гидроксифенил)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-2-[4-(бензилокси)фенил]-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d[1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-2-(2,4-дигидроксифенил)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-2(3-фтор-4-метоксифенил)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6aR,7aS,8S,11aS)-2-(1,3-бензодиоксол-5-ил)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-2-(2,4,6-триметоксифенил)-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-2-(2,4,5-триэтоксифенил)-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6aR,7aS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-2-(1-метил-1Н-индол-2-ил)-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-2-(4-трет-бутилфенил)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид и
(6aR,7aS,8S,11aS)-5,8-бис(диметиламино)-2[4-(гексилокси)фенил]-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
или их фармацевтически приемлемые соли.
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-9,11a,12-тригидрокси-11,13-диоксо-тиен-3-ил-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-2-(1-бензофуран-2-ил)-5,8-бис(диметиламино)-9,11a,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-2(2-фурил)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
{5-[(6aR,7aS,8S,11aS)-10-аминокарбонил)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-2-ил]-2-фурил}метил ацетат,
(6аR,7аS,8S,11аS)-2-(1-бензотиен-3-ил)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-2-(1,3-тиазол-2-ил)-6,6а,7,7а,8,11,11a,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
(6аR,7аS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-2-пиридин-4-ил-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид и
(6aR,7aS,8S,11аS)-5,8-бис(диметиламино)-9,11а,12-тригидрокси-11,13-диоксо-2-пиридин-3-ил-6,6а,7,7а,8,11,11а,13-октагидротетрацен[2,1-d][1,3]оксазол-10-карбоксамид,
или фармацевтически приемлемые соли.
или его фармацевтически приемлемой соли,
где радикалы X, Y, R1 и R2 определены в п.1, включающий в себя стадии:
а. взаимодействие 7,8-(замещенного)-9-амино-6-деметил-6-дезокситетрациклина формулы
или его фармацевтически приемлемой соли
с 2-хлортриметоксиэтаном в апротонном растворителе с получением хлорсоединения формулы
b. взаимодействие хлорсоединения с амином R1R2NH с получением замещенного амина формулы
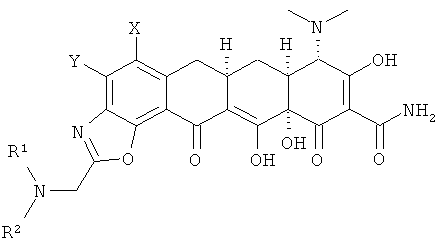
с. гидролиз замещенного амина кислотой с получением соединения формулы

и
d. выделение соединения или его фармацевтически приемлемой соли.

где радикалы X, Y, R1 и R2 определены в п.1,
или его фармацевтически приемлемой соли, включающий в себя стадии:
а. взаимодействие 7,8-(замещенного)-9-амино-6-деметил-6-дезокситетрациклина формулы

или его фармацевтически приемлемой соли
с 2-хлортриметоксиэтаном в апротонном растворителе с получением хлорсоединения формулы

b. взаимодействие хлорсоединения с кислотой с получением 9-(2-хлорметилкарбониламино)замещенного-6-деметил-6-дезокситетрациклина формулы
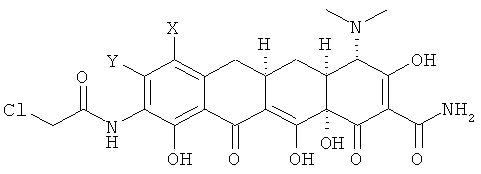
с. взаимодействие 9-(2-хлорметилкарбониламино)замещенного-6-деметил-6-дезокситетрацеклина с амином R1R2NH с получением соединения формулы

d. выделение соединения или его фармацевтически приемлемой соли.

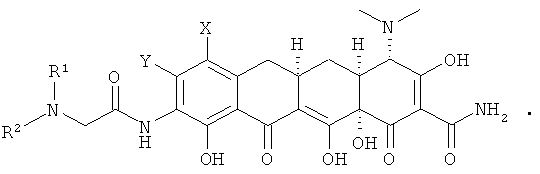
где X, Y, R1 и R2 определены в п.1;
включающий в себя: гидролиз замещенного амина формулы

кислотой с получением соединения формулы
Документы, цитированные в отчёте о поиске
7-(замещенные)-9-(замещенные-глицил)амидо-6-деметил-6-дезокситетрациклины, промежуточные соединения, способы их получения, способ лечения и композиция

Комментарии