7-(замещенные)-9-(замещенные-глицил)амидо-6-деметил-6-дезокситетрациклины, промежуточные соединения, способы их получения, способ лечения и композиция - RU2125986C1
Код документа: RU2125986C1
Чертежи
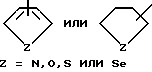
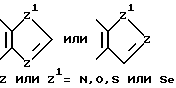

Описание
Изобретение касается ранее неизвестных [4S-(4-альфа, 12-альфа)] -4-(диметиламино)-7-(замещенных) -9-[(замещенных-глицил)амидо] -1,4,4a, 5,5a, 6,11,12a-октагидро-3,10,12, 12a-тетрагидрокси-1,11-диоксо-2-нафтаценкарбоксиамидов, далее названных 7-(замещенные)-9-[(замещенные-глицил)амидо]-6-деметил-6- дезокситетрациклины, которые обнаруживают антибиотическую активность в отношении широкого спектра организмов, включая организмы, которые являются резистентными к тетрациклинам и являются полезными в качестве антибиотических средств.
Изобретение также касается ранее неизвестных 9-[(галоацил)амидо] -7-(замещенных)-6-деметил-6-дезокситетрациклиновых промежуточных продуктов, полезных для получения ранее неизвестных соединений, отвечающих настоящему изобретению, и ранее неизвестных способов получения ранее неизвестных соединений и промежуточных соединений.
Настоящее изобретение касается ранее неизвестных 7-(замещенных)-9-[(замещенных-глицил)амидо]-6-деметил-6- дезокситетрациклинов, представленных формулами I и II, которые обладают антибактериальной активностью, способов терапии инфекционных болезней у теплокровных животных с применением этих новых соединений, фармацевтических препаратов, содержащих эти соединения, ранее неизвестных промежуточных соединений и способов получения этих соединений. Точнее, настоящее изобретение касается соединений с формулами I и II, которые усиливают антибактериальную активность в отношении штаммов, резистентных к тетрациклину, а также обнаруживают высокий уровень активности в отношении штаммов, которые обычно являются восприимчивыми к тетрациклинам.
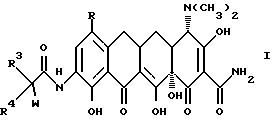
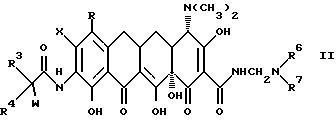
В формулах I и II R - галоген, выбранный из группы, в которую входят бром, хлор, фтор и иод, или R - группа - NR1R2, и, если R - группа - NR1R2, и R - водород;
R2 - метильная, этильная, н-пропильная, 1-метилэтильная, н-бутильная, 1-метилпропильная, 2-метилпропильная или 1,1-диметилэтильная группа,
и, если R1 - метильная или этильная группа, то тогда
R2 - метильная, этильная, н-пропильная, 1-метилэтильная, н-бутильная, 1-метилпропильная или 2-метилпропильная группа,
и, если R1 - н-пропильная группа, то тогда
R2 - н-пропильная, 1-метилэтильная, н-бутильная, 1-метилпропильная или 2-метилпропильная группа,
и, если R1 - метилэтильная группа, то тогда
R2 - н-бутильная, 1-метилпропильная или 2-метиопропильная группа,
и, если R1 - н-бутильная группа, то тогда
R2 - н-бутильная, 1-метилпропильная или 2-метилпропильная группа,
и, если R1 - 1-метилпропильная группа, то тогда
R2 - 2-метилпропильная группа;
R3 - выбирается из группы, в которую входят водород;
(C4-C8) алкильная группа с прямой и разветвленной цепью, выбранная из группы, в которую входят бутильная, изобутильная, пентильная, гексильная, гептильная и октильная группа;
α - меркапто (C1-C4) алкильная группа, выбранная из группы, в которую входят меркаптометильная, α- меркаптоэтильная, α- меркапто-1-метилэтильная и α - меркаптопропильная группа;
α- гидрокси (C1-C4) алкильная группа, выбранная из группы, в которую входят гидроксиметильная, α-гидроксиэтильная, α - гидрокси-1-метилэтильная и α- гидроксипропильная группа;
карбоксил (C1-C8) алкильная группа;
(C6-C10) арильная группа, выбранная из группы, в которую входят фенильная, α- нафтильная и β- нафтильная группа;
замещенная (C6-C10) арильная группа (замещение производится из группы, в которую входят гидроксигруппа, галоген, (C1-C4)-алкоксигруппа, тригало (C1-C3) алкильная группа, нитро-, амино-, цианогруппа, (C1-C4) алкоксикарбонильная группа, (C1-C3) алкиламиногруппа карбоксигруппа);
(C7-C9) аралкильная группа, выбранная из группы, в которую входят бензильная, 1-фенилэтильная, 2-фенилэтильная и фенилпропильная группа;
замещенная (C7-C9) аралкильная группа (замещение производится из группы, в которую входят галогруппа, (C1-C4) алкильная группа, нитрогруппа, гидроксигруппа, аминогруппа, моно- или дизамещенная ( C1 -C4 ) алкиламиногруппа, (C1-C4) алкоксигруппа, (C1-C4) алкилсульфонильная группа, цианогруппа и карбоксигруппа);
R4 выбирается из водорода и (C1-C6) алкильной группы, выбранной из группы, в которую входят метильная, этильная, пропильная, изопропильная, бутильная, изобутильная, пентальная и гексильная группа;
если группа R3 не является одинаковой с группой R4, то тогда стереохимическое состояние асимметричного углерода (т.е. углерода, несущего заместитель W) может отвечать либо рацемату (DL), либо индивидуальным энантиомерам (L или D);
W выбирается из группы, в которую входят гидркосиламиногруппа; (C7-C12) алкильная монозамещенная аминогруппа с прямой или разветвленной алкильной группой, причем замещение производится из группы, в которую входят гептильная, октильная, нонильная, децильная, ундецильная, додецильная группа и диастереоизомеры и энантиомеры упомянутой разветвленной алкильной монозамещенной аминогруппы; (C1-C4) фторалкиламиногруппа с прямой или разветвленной цепью, которая выбирается из группы, куда входят трифторметильная, 2,2,2-трифторэтильная, 3,3, 3-трифторпропильная, 3,3,3,2,2-пентафторпропильная, 2,2-дифторпропильная, 4,4,4-трифторбутильная и 3,3-дифторбутильная группа; монозамещенная (C3-C8) циклоалкиламиногруппа, причем заместитель выбирается из группы, в которую входят циклопропильная, транс-1,2-диметилциклопропильная, цис-1,2-диметилциклопропильная, циклобутильная, циклопентильная, циклогексильная, циклогептильная, циклооктильная, бицикло[2.2.1]гепт -2-ильная, бицикло[2.2.2] окт-2-ильная группа и диастереоизомеры и энантиомеры упомянутой монозамещенной (C3-C8) циклоалкиламиногруппы;
(C4-C10) циклоалкил алкильная монозамещенная аминогруппа, причем замещение производится из группы, в которую входят (циклопропил)метильная, (циклопропил)этильная, (циклобутил)метильная, (транс-2-метилциклопропил)метильная и (цис-2-метилциклобутил)метильная группа; (C3-C10)алкенильная и алкинильная монозамещенная аминогруппа, причем заместитель выбирается из группы, в которую входят аллильная, 3-бутенильная (в цис- или трансположении), 2-пентенильная, пропинильная, 4-октенильная, 2,3-диметил-2-бутенильная, 3-метил-2-бутенильная, 2-циклопентенильная и 2-циклогексенильная группа;
(C6-C10) арильная монозамещенная аминогруппа, причем замещение производится из группы, в которую входят фенильная и нафтильная группа; (C7-C10) аралкиламиногруппа, причем замещение производится из группы, в которую входят бензильная, 2-фенилэтильная, 1-фенилэтильная, 2-(нафтил)метильная, 1-(нафтил)метильная и фенилпропильная группа; замещенная (C6-C10)арильная монозамещенная аминогруппа (замещение производится из группы, в которую входят (C1-C5)ацильная группа, (C1-C5) ациламиногруппа, (C1-C4) алкильная группа, моно- или дизамещенная (C1-C8) алкиламиногруппа, (C1-C4) алкоксигруппа, (C1-C4) алкоксикарбонильная группа, (C1-C4) алкилсульфонильная группа, аминогруппа, карбоксигруппа, цианогруппа, галоген, гидроксигруппа, нитрогруппа и тригалоид (C1-C3) алкильная группа; дизамещенная (C6-C14) алкиламиногруппа с прямой или разветвленной симметричной цепью, причем замещение производится из группы, в которую входят дибутильная, диизобутильная, ди-втор-бутильная, дипентильная, диизопентильная, ди-втор-пентильная, дигексильная, диизогексильная и ди-втор-гексильная группа;
симметричная дизамещенная (C6-C14) циклоалкиламиногруппа, причем замещение производится из группы, в которую входят дициклопропильная, дициклобутильная, дициклопентильная, ди(дициклопропильная, дициклобутильная, дициклопентильная, ди(дициклопропил) метильная, дициклогексильная и дициклогептильная группа; дизамещенная (C3-C14) алкиламиногруппа с прямой или разветвленной несимметричной цепью, у которой более число атомов углерода при замещении не превышает 14; несимметричная дизамещенная (C4-C14) циклоалкиламиногруппа, у которой общее число атомов углерода при замещении не превышает 14; (C2-C8) азациклоалкильная и замещенная (C2-C8) азациклоалкильная группа, причем замещение производится из группы, в которую входят 4-метилпиперидиновая, 4-гидроксипиперидиновая, 4-(гидроксиметил)пиперидиновая, 4-(аминометил)пиперидиновая, цис-3,4-диметилпирролидинильная, транс-3,4-диметилпирролидинильная, 2-азабицикло[2.1.1] гекс-2-ильная, 5-азабицикло[2.1.1] гекс-5-ильная, 2-азабицикло[2.2.1] гепт-2-ильная, 7-азабицикло[2.2.1] гепт-7-ильная, 2-азабицикло[2.2.2] окт-2-ильная группа и диастереоизомеры и энантиомеры упомянутой (C2-C8) азациклоалкильной и замещенной (C2 -C6) азациклоалкильной группы; замещенная 1-азаоксациклоалкильная группа, причем замещение производится из группы, в которую входят 2-(C1-C3) алкилморфолинильная, 3-(C1-C3) алкилизоксазолидинильная, тетрагидрооксазинильная и 3,4-дигидрооксазинильная группа; [1,n]-диазациклоалкильная и замещенная [1, n]-диазациклоалкильная группа, выбранная из группы, в которую входят пиперазинильная, 2-(C1-C3) алкилпиперазинильная, 4-(C1-C3) алкилпиперазинильная, 2,4-диметилпиперазинильная, 4-(C1 -C4) алкоксипиперазинильная, 4-(C6-C10) арилоксипиперазинильная, 4-гидроксипиперазинильная, 2,5-диазабицикло[2.2.1]гепт-2-ильная, 2, 5-диаза-5-метилбицикло[2.2.1]-гепта-2-ильная, 2,3-диаза-3-метилбицикло[2.2.2] -окт-2-ильная, 2,5-диаза-5,7-диметилбицикло[2.2.2]-окт-2-ильная группа и диастереоизомеры или энантиомеры упомянутой [1, n]-диазациклоалкильной и замещенной [1,n]-диазациклоалкильной группы; 1-азатиациклоалкильная и замещенная 1-азатиациклоалкильная группа, выбранная из группы, в которую входят тиаморфолинильная, 2-(C1-C3) алкилтиоморфолинильная и 3-(C3-C6) циклоалкилтиоморфолинильная группа; N-азолильная и замещенная N-азолильная группа, выбранная из группы, в которую входят 1-имидазолильная, 2-(C1-C3) алкил-имидазолильная, 3-(C1-C3) алкил-1-имидазолильная, 1-пирролильная, 2-(C1-C3) алкил-1-пирролильная, 3-(C1-C3) алкил-1-пирролильная, 1-пиразолильная, 3-(C2-C3) алкил-1-пиразолильная, индолильная, 1-(1,2,3-триазолильная); 4-(C1-C3) алкил-1-(1,2,3-триазолильная), 5-(C1-C3) алкил-1-(1,2,3-триазолильная), 4-(1,2,4-триазолильная, 1-тетразолильная, 2-тетразолильная и бензимидазолильная группа; (гетероцикло) аминогруппа упомянутой гетероциклической группы, выбранная из группы, в которую входят 2- или 3-фуранильная, 2- или 3-тиенильная, 2-, 3- или 4-пиридильная, 2- или 5-пиридазинильная, 2-пиразинильная, 2-(имидазолильная), (бензимидазолильная) и (бензтиазолильная) группа и замещенная (гетероцикло) аминогруппу (замещение производится (C-C) алкильной группой с прямой или разветвленной цепью) (гетероцикло)метиламиногруппа, выбранная из группы, в которую входят 2- или 3-фурилметиламиногруппа, 2- или 3-тиенилметиламиногруппа, 2-, 3- или 4-пиридилметиламиногруппа, 2- или 5-пирилазинилметиламиногруппа, 2-пиразинилметиламиногруппа, 2-(имидазолил)метиламиногруппа, (бензимидазолил)метиламиногруппа и (бензотиазолил)метиламиногруппа и замещенная (гетероцикло) метиламиногруппа (замещение производится (C1-C6) алкильной группой с прямой или разветвленной цепью); карбокси (C2-C4) алкиламиногруппа, выбранная из группы, в которую входят аминоуксусная кислота, α- аминопропионовая кислота, β- аминопропионовая кислота, α- масляная кислота, β- аминомасляная кислота и энантиомеры упомянутой карбокси (C2-C4) алкиламиногруппы; 1,1-замещенная гидразиногруппа, выбранная из группы, в которую входят 1,1-диметилгидразиногруппа, N-аминопиперидинильная группа, 1, 1-диэтилгидразиногруппа и N-аминопирролидинильная группа; (C1-C4) алкоксиаминогруппа, причем замещение производится из группы, в которую входят метоксигруппа, этоксигруппа, н-пропоксигруппа, 1-метилэтоксигруппа, н-бутоксигруппа, 2-метилпропоксигруппа, и 1,1-диметилэтоксигруппа, (C3-C8) циклоалкоксиаминогруппа, выбранная из группы, в которую входят циклопропоксигруппа, транс-1,2-диметилциклопропоксигруппа, цис-1,2-диметилциклопропоксигруппа, циклобутоксигруппа, циклопентоксигруппа, циклогексоксигруппа, циклогептоксигруппа, циклооктоксигруппа, бицикло[2.2.1] гепт-2-илоксигруппа, бицикло[2.2.2] -окт-2-илоксигруппа и диастереоизомеры и энантиомеры упомянутой (C3-C8) циклоалкоксиаминогруппы; (C6-C10) арилоксиаминогруппа, выбранная из группы, в которую входят феноксиаминогруппа, 1-нафтилоксиаминогруппа и 2-нафтилоксиаминогруппа; (C7-C11) - арилалкоксиаминогруппа, причем замещение производится из группы, в которую входят бензилоксигруппа, 2-фенилэтоксигруппа, 1-фенилэтоксигруппа, 2-(нафтил)метоксигруппа, 1-(нафтил)метоксигруппа и фенилпропоксигруппа; [ β- или γ- (C1-C3) - ациламидо] алкиламиногруппа, причем замещение производится из группы, в которую входят 2-(формамидо) этильная, 2-(ацетамидо) этильная, 2-(пропиониламидо)этильная, 2-(ацетамидо) пропильная, 2-(формамидо) пропильная группа и энантиомеры упомянутой [β- или γ- (C1-C3) ациламидо] алкиламиногруппы; β- или γ- (C1-C3) - алкоксиалкиламиногруппа, причем замещение производится из группы, в которую входят 2-метоксиэтильная, 2-эткосиэтильная, 2,2-диэтоксиэтильная, 2-метоксипропильная, 3-метоксипропильная, 3-этоксипропильная, 3,3-диэтоксипропильная группа и энантиомеры упомянутой β- или γ- (C1-C3) алкоксиалкиламиногруппы; β-,γ- или δ- (C2-C4) гидроксиалкиламиногруппа, причем замещение производится из группы, в которую входят 2-гидроксиэтильная, 2-гидроксипропильная, 3-гидроксипропильная и 4-гидроксибутильная группа;
или R3 и W взятые совместно, выбираются из -(CH2)n(R5)N - при n от трех до четырех и -CH2CH(OH)CH2(R5)N -, где R5 выбирается из водорода и (C1-C3) ацильной группы, причем ацильная группа выбирается из формальной, ацетильной, пропиональной и (C2-C3) галоацильной группы, причем последняя выбирается из хлорацетильной, бромацетильной, трифторацетильной, 3,3,3-трифторпропиональной и 2,3, 3-трифторпропионильной группы;
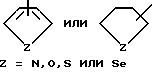
R6 выбирается из группы, в которую входят водород; (C1-C3) алкильная группа с прямой или разветвленной цепью, выбранная из группы, в которую входят метильная, этильная, н-пропильная или 1-метилэтильная группа; (C6-C10) арильная группа, выбранная из группы, в которую входят фенильная, α - нафтильная или β- нафтильная группа; (C7-C9) аралкильная группа, такая как бензильная, 1-фенилэтильная, 2-фенилэтильная или фенилпропильная группа; гетероциклическая группа с пятичленным ароматическим или насыщенным кольцом, содержащим один гетероатом азота, кислорода, серы или селена, необязательно имеющим бензоло- или пиридокольцо, сконденсированное с:

такая как пирролильная, N-метилиндолильная, индолильная, 2-пирролидинильная, 3-пирролидинильная, 2-пирролинильная, тетрагидрофуранильная, бензофуранильная, тетрагидротиенильная, тиенильная, бензотиенильная или селеназолильная группа, или с пятичленным ароматическим кольцом, содержащим два таких гетероатома, как азот, кислород, сера или селен, необязательно имеющим бензо- или пиридокольцо, сконденсированное с:
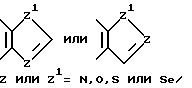
такая как имидазолильная, пиразолильная, бензимидазолильная, оксазолильная, бензоксазолильная, индазолильная, триазолильная, бензотиазолильная, 3-алкил-3H-имидазо[4,5-b] пиридильная или пиридилимидазолильная, или с пятичленным насыщенным кольцом, содержащим один или два таких гетероатома, как азот, кислород, сера или селен, и соседний присоединенный гетероатом кислорода, т.е.

(где
A выбирается из группы, в которую входят водород; (C1-C4) алкильная группа с прямой или разветвленной цепью; C6 - арильная группа; замещенная C6 - арильная группа (замещение производится из группы, в которую входят галогруппа, (C1-C4) - алкоксигруппа, тригало (C1-C3) алкильная группа, нитрогруппа, аминогруппа, цианогруппа, (C1-C4) алкоксикарбонильная группа, (C1-C3) алкиламиногруппа или карбоксигруппа); (C7-C9) аралкильная группа, выбранная из группы, в которую входят бензильная, 1-фенилэтильная, 2-фенилэтильная или фенилпропильная группа, такая как γ- бутиролактам, γ- бутиролактон, имидазолидинон или N-аминоимидазолдинон, или с шестичленным ароматическим кольцом, содержащим от одного до трех гетероатомов азота, такая как пиридильная, пиридазинильная, пиразинильная, сим-триазинильная, ансим-триазинильная, пиримидинильная или (C1-C3) - алкилтиопиридазинильная группа, или с шестичленным насыщенным кольцом, содержащим один или два гетероатома, таких как азот, кислород, сера или селен, и соседний присоединенный гетероатом кислорода, такая как 2,3-диоксо-1-пиперазинильная, 4-этил-2,3-диоксо-1-пиперазинильная, 4-метил-2,3-диоксо-1-пиперазинильная, 4-циклопропил-2-диоксо-1-пиперазинильная, 2-диоксоморфолинильная, 2-диоксотиоморфолинильная группа; или группа -(CH2)COOR8 с величиной n в пределах от нуля до четырех, где R8 выбирается из группы, в которую входят водород: алкильная (C1-C3) группа с прямой или разветвленной цепью, выбранная из группы, в которую входят метильная, этильная, н-пропильная или 1-метилэтильная группа; или (C6-C10) арильная группа, выбранная из группы, в которую входят фенильная, α- нафтильная или β- нафтильная группа;
R7 выбирается из группы, в которую входят водород; (C1-C3) алкильная группа с прямой или разветвленной цепью, выбранная из группы, в которую входят метильная, этильная, н-пропильная или 1-метилэтильная группа; (C6-C10) арильная группа, выбранная из группы, в которую входят фенильная, α- нафтильная или β- нафтильная группа; (C7-C9) аралкильная группа, такая как бензильная, 1-фенилэтильная, 2-фенилэтильная или фенилпропильная группа; гетероциклическая группа с пятичленным ароматическим или насыщенным кольцом, содержащая один гетероатом, такой как азот, кислород, сера или селен, необязательно имеющим бензо- или пиридокольцо, сконденсированное с:
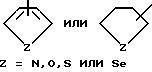
такая как пирролильная, N-метилиндолильная, индолильная, 2-пирролидинильная, 3-пирролидинильная, 2-пирролинильная, тетрагидрофуранильная, фуранильная, бензофуранильная, тетрагидротиенильная, тиенильная, бензотиенильная или селеназолильная группа, или с пятичленным ароматическим кольцом, содержащим два гетероатома, таких как азот, кислород, сера или селен, необязательно имеющим - бензо- или пиридокольцо, сконденсированное с:
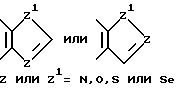
такая как имидазолильная, пиразолильная, бензимидазолильная, оксазолильная, бензоксазолильная, тиазолильная, бензотиазолильная, 3-алкил-3H-имидазо[4,5-b]пиридильная или пиридилимидазолильная группа, или с пятичленным насыщенным кольцом с одним или двумя гетероатомами, такими как азот, кислород, сера или селен, и соседним присоединенным атомом кислорода, т.е.

(где
A выбирается из группы, в которую входят водород; (C1-C4) алкильная группа с прямой или разветвленной цепью; C6 - арильная группа; замещенная C6 - арильная группа (замещение производится из группы, в которую входят галогруппа, (C1-C4) - алкоксигруппа, тригало (C1-C3) алкильная группа, нитрогруппа, аминогруппа, цианогруппа, (C1-C4) алкоксикарбонильная группа, (C1-C3) алкиламиногруппа или карбоксигруппа); (C7-C9) аралкильная группа, выбранная из группы, в которую входят бензильная, 1-фенилэтильная, 2-фенилэтильная или фенилпропильная группа, такая как γ- бутиролактам, γ- бутиролактон, имидазолидинон или N-аминоимидазолидинон, или с шестичленным ароматическим кольцом, содержащим от одного до трех азотных гетероатомов, такая как пиридильная, пиридазинильная, пиразинильная, сим-триазинильная, несим-триазинильная, пиримидинильная или (C1-C3) алкилтиопиридазинильная группа; или с шестичленным насыщенным кольцом, содержащим один или два гетероатома, таких как азот, кислород, сера или селен, и соседний присоединенный гетероатом кислорода, такая как 2,3-диоксо-1-пиперазинильная, 4-этил-2, 3-диоксо-1-пиперазинильная, 4-метил-2,3-диоксо-1-пиперазинильная, 4-циклопропил-2-диоксо-1-пиперазинильная, 2-диоксоморфолинильная, 2-диоксотиоморфолинильная группа;
или группа -(CH2)nCOOR8 с n в пределах от нуля до четырех, где R8 выбирается из группы, в которую входят водород; (C1-C3) алкильная группа с прямой или разветвленной цепью, выбранная из группы, в которую входят метильная, этильная, н-пропильная или 1-метилэтильная группа; или (C6-C10)арильная группа, выбранная из группы, в которую входят фенильная, α- нафтильная или β- нафтильная группа; с условием, что R6 и R7 не могут быть одновременно водородом или что R6 и R7, взятые совместно, представляют собой группу -(CH2)2B (CH2)2-, где B выбирается из группы, в которую входят (CH2)n с величиной n в пределах от нуля до единицы, -NH-N(C1-C3) алкильная группа (с прямой или разветвленной цепью), N (C1-C4) алкоксигруппа, кислород, сера или замещенные родственные атомные образования, выбранные из группы, в которую входят (L- или D-) - пролин, этил (L- или D-) пролинат, морфолин, пирролидин или пиперидин; и фармакологически приемлемые органические или неорганические соли или металлические комплексы.
Предпочтительными соединениями являются соединения, отвечающие приведенным выше формулам I и II, у которых
R - галоген,
выбранный из группы, в которую входят бром, хлор, фтор и иод; или R представляет собой группу -NR1R2, и, когда R представляет собой группу -NR1R2,
R1 - водород;
R2 - метильная, этильная, н-пропильная, 1-метилэтильная, н-бутильная, 1-метилпропильная, 2-метилпропильная или 1,1-диметилэтильная группа; и, когда R1 - метильная или этильная группа,
R2 - метильная, этильная, н-пропильная, 1-метилэтильная, н-бутильная, 1-метилпропильная или 2-метилпропильная группа;
R3
выбирается из группы, в которую входят водород; (C4-C8) алкильная группа с прямой или разветвленной цепью, выбранная из группы, в которую входят бутильная, изобутильная,
пентильная, гексильная, гептильная и октильная группа; α- гидрокси (C1-C4) алкильная группа, выбранная из группы, в которую входят гидроксиметильная, α
- гидроксиэтильная, α-гидрокси-1-метилэтильная и α- гидроксипропильная группа; карбоксил- (C1-C8) алкильная группа; (C6-C10) арильная группа,
выбранная из группы, в которую входят фенильная, α- нафтильная и β- нафтильная группа; замещенная (C6-C10) арильная группа (замещение производится из группы, в
которую входят гидроксигруппа, галоген, (C1-C4) алкоксигруппа, (C1-C4) алкоксикарбонильная группа и карбоксигруппа); (C7-C9)
аралкильная группа, выбранная из группы, в которую входят бензильная, 1-фенилэтильная, 2-фенилэтильная и фенилпропильная группа; замещенная (C7-C9) - аралкильная группа
(замещение производится из группы, в которую входят галогруппа, (C1-C4) алкильная группа, (C1 -C4) алкоксигруппа, (C1
-C4)
алкилсульфонильная группа, цианогруппа и карбоксигруппа);
R4 выбирается из группы, в которую входят водород и (C1-C4) алкильная группа, выбранная из группы, в
которую входят метильная, этильная, пропильная, изопропильная, бутильная и изобутильная группа;
когда группа R3 не отвечает группе R4, стереохимическое состояние
асимметричного углерода (т. е. углерода, несущего заместитель W) может отвечать либо рацемату (DL), либо индивидуальным энантиомерам (L или D);
W выбирается из группы, в которую входят
гидроксиаминогруппа; (C7-C12) алкильная (с прямой или разветвленной цепью) монозамещенная аминогруппа, причем замещение производится из группы, в которую входят гептильная,
октильная, нонильная, децильная, ундецильная, додецильная группа и диастереоизомеры и энантиомеры упомянутой разветвленной алкильной монозамещенной аминогруппы; (C3-C8)
циклоалкильная монозамещенная аминогруппа, группа, причем замещение производится из группы, в которую входят циклопропильная, транс-1,2-диметилциклопропильная, цис-1,2-диметилциклопропильная,
циклобутильная, циклопентильная, циклогексильная, циклогептильная, циклооктильная группа и диастереоизомеры и энантиомеры упомянутой (C3-C8) циклоалкильной монозамещенной
аминогруппы; (C1-C4) фторалкиламиногруппа с прямой или разветвленной цепью, выбранная из группы, в которую входят 2,2,2-трифторэтильная, 3,3-трифторпропильная, 2,
2-дифторпропильная и 3,3-дифторбутильная группа; [(C4-C10)циклоалкил] алкильная монозамещенная аминогруппа, причем замещение производится из группы, в которую входят
(циклопропил) метильная, (циклопропил)этильная, (циклобутил)метильная, (транс-2-метилциклопропил)метильная и (цис-2-метилциклобутил)метильная группа; (C3-C10) алкенильная и
алкинильная монозамещенная аминогруппа, причем замещение производится из группы, в которую входят аллильная, 3-бутильная, 2-бутенильная (C цис- или транс-положением), 2-пентенильная, пропинильная,
4-октенильная, 2,3-диметил-2-бутенильная и 3-метил-2-бутенильная группа; (C6-C10) арильная монозамещенная аминогруппа, причем замещение производится из группы, в которую входят
фенильная и нафтильная группа; (C7-C10) аралкиламиногруппа, причем замещение производится из группы, в которую входят бензильная, 2-фенилэтильная, 1-фенилэтильная, 2-(нафтил)
метильная, 1-(нафтил) метильная и фенилпропильная группа; дизамещенная (C6-C14) алкиламиногруппа с прямой или разветвленной симметричной цепью, причем замещение производится из
группы, в которую входят дибутильная, диизобутильная, ди-втор-бутильная, дипентильная, диизопентильная и ди-втор-пентильная группа; симметричная дизамещенная (C6-C14)
циклоалкиламиногруппа, причем замещение производится из группы, в которую входят дициклопропильная, дициклобутильная, дициклопентильная и ди(дициклопропил)метильная группа; дизамещенная (C3
-C14) алкиламиногруппа с прямой или разветвленной несимметричной цепью, у которой при замещении общее число атомов углерода не превышает 14; несимметричная дизамещенная (C4-C14)-циклоалкиламиногруппа, у которой при замещении общее число атомов углерода не превышает 14; (C2-C8) азациклоалкильная группа и замещенная (C2-C8)
азациклоалкильная группа, причем замещение производится из группы, в которую входят 4-метилпиперидин, 4-гидроксипиперидин, 4-(гидроксиметил) пиперидин, 4-(аминометил) пиперидин, цис-3,
4-диметилпирролидинил, транс-3,4-диметилпирролидинил, 2-азабицикло[2.2.1] гепт-2-ил, 7-азабицикло[2.2.1] гепт-7-ил, 2-азабицикло[2.2.2] окт-2-ил и диастереоизомеры и энантиомеры упомянутой (C2-C8) азациклоалкильной группы; замещенная 1-азаоксициклоалкильная группа, причем замещение производится из группы, в которую входят 2-((C1-C3)
алкилморфолинильная, 3-(C1-C3) алкилизоксазолидинильная и тетрагидрооксазинильная группа; [1,n]-диазациклоалкильная группа и замещенная [1,n]-диазациклоалкильная группа,
выбранная из группы, в которую входят пиперазинильная, 2-(C1-C3) алкилпиперазинильная, 4-(C1-C3) алкилпиперазинильная, 2,4-диметилпиперазинильная, 4-(C1-C4) алкоксипиперазинильная, 4-(C6-C10) арилоксипиперазинильная, 4-гидроксипиперазинильная, 2,3-диаза-3-метилбицикло[2.2.2] окт-2-ильная, 2,5-диаза-5,
7-диметилбицикло[2.2.2]-окст-2-ильная группа и диастереоизомеры и энантиомеры упомянутой [1,n]-диазациклоалкильной группы и замещенной [1,n]-диазациклоалкильной группы; 1-азатиациклоалкильная группа и
замещенная 1-азатиациклоалкильная группа, выбранная из группы, в которую входят тиоморфолинильная, 2-(C1-C3) алкилтиоморфолинильная и 3-(C3-C6)
циклоалкилтиоморфолинильная группа; N-азолильная группа и замещенная N-азолильная группа, выбранная из группы, в которую входят 1-имидазолильная, 1-пирролильная, 1-пиразолильная, 3-(C1
-C3) алкилпиразолильная, индолильная, 1-(1,2,3-триазолильная), 4-(1,2,4-триазолильная), 1-тетразолильная, 2-тетразолильная и бензимидазолильная группа; (гетероцикло) метиламиногруппа,
выбранная из группы, в которую входят 2- или 3-фурилметиламиногруппа, 2- или 3-тиенилметиламиногруппа, 2-, 3- или 4-пиридилметиламиногруппа, 2- или 5-пиридизинилметиламиногруппа,
2-пиперазинилметиламиногруппа, 2-(имидазолил)метиламиногруппа, (бензимидазолил) метиламиногруппа и (бензтиазолил) метиламиногруппа и замещенная (гетероцикло)метиламиногруппа (замещение производится
(C1-C6) алкильной группой с прямой или разветвленной цепью); карбокси (C2-C4) алкиламиногруппа, выбранная из группы, в которую входят аминоуксусная кислота,
α- аминопропионовая кислота, β- аминопропионовая кислота, α- масляная кислота и β- аминомасляная кислота и энантиомеры упомянутой карбокси (C2-C4)
алкиламиногруппы; 1,1-замещенная гидразиногруппа, выбранная из группы, в которую входят 1,1-диметилгидразиногруппа, N-аминопиперидинильная группа и 1,1-диэтилгидразиногруппа; (C1-C4) алкоксиаминогруппа, причем замещение производятся из группы, в которую входят метоксигруппа, эткосигруппа, н-пропоксигруппа, 1-метилэтоксигруппа, н-бутоксигруппа, 2-метилпропоксигруппа и 1,
1-диметилэтоксигруппа; (C3-C8) циклоалкоксиаминогруппа, выбранная из группы, в которую входят циклопропоксигруппа, транс-1,2-диметилциклопропоксигруппа, цис-1,
2-диметилциклопропоксигруппа, циклобутоксигруппа и диастереоизомеры и энантиомеры упомянутой (C3-C8) циклоалкоксиаминогруппы; (C6-C10)-арилоксиаминогруппа,
выбранная из группы, в которую входят феноксиаминогруппа, 1-нафтилоксиаминогруппа и 2-нафтилоксиаминогруппа; (C7-C11)арилалкоксиаминогруппа, причем замещение производится из
группы, в которую входят бензилоксигруппа, 2-фенилэтоксигруппа, 1-фенилэтоксигруппа, 2-(нафтил) метоксигруппа, 1-(нафтил) метоксигруппа и фенилпропоксигруппа; [β- или γ- (C1
-C3) ациламидо]алкиламиногруппа, причем замещение производится из группы, в которую входят 2-(формамидо) этильная, 2-(ацетамидо) этильная, 2-(пропиониламидо) этильная, 2-(ацетамидо)
пропильная, 2-(формамидо) пропильная группа и энантиомеры упомянутой [β- или γ- (C1-C3) ациламидо]алкиламиногруппы; β- или γ- (C1-C3) алкоксиалкиламиногруппа, причем замещение производится из группы, в которую входят 2-метоксиэтильная, 2-этоксиэтильная, 2,2-диэтоксиэтильная, 2-метоксипропильная, 3-метоксипропильная,
3-этоксипропильная, 3,3-диэтиоксипропильная группа и энантиомеры упомянутой β- или γ- (C1-C3) алкоксиалкиламиногруппы; β-, γ- или δ- (C2-C4) гидроксиалкиламиногруппа, причем замещение производится из группы, в которую входят 2-гидроксиэтильная, 3-гидроксипропильная и 4-гидроксибутильная группа;
или R3 и W, взятые совместно, выбираются из группы, в которую входят группа (CH2)n(R5)N - с величиной n, равной трем или четырем, и группа -CH2CH(OH)CH2)(R5)N-, где R5 выбирается из водорода и (C1-C3) ацильной группы, причем ацильная группа выбирается из группы, в которую входят формильная,
ацетильная, пропионильная и (C2-C3) галоацильная группа, выбранная из хлорацетильной, бромацетильной, трифторацетильной, 3,3,3-трифторпропионильной, 2,3,3-трифторпропионильной
группы;
R2 выбирается из группы, в которую входят водород и (C1-C3) алкильная группа с прямой или разветвленной цепью, выбранная из группы, в которую входят
метильная, этильная, н-пропильная или 1-метилэтильная группа; (C6-C10) арильная группа, выбранная из группы, в которую входят фенильная, α-нафтильная или β
- нафтильная группа; (C7-C9) аралкильная группа, такая как бензильная, 1-фенилэтильная, 2-фенилэтильная или фенилпропильная группа; гетероциклическая группа с пятичленным
ароматическим или насыщенным кольцом, содержащим один гетероатом, такой как азот, кислород, сера или селен, необязательно имеющим бензо- или пиридокольцо, сконденсированное с:
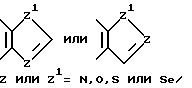
такая как пирролильная, N-метилиндолильная, индолильная, 2-пирролидинильная, 3-пирролидинильная, 2-пирролидильная, тетрагидрофуранильная, фуранильная, бензофуранильная, тетрагидротиенильная, тиенильная, бензотиенильная или селеназолильная группа; или с пятичленным ароматическим кольцом, содержающим два гетероатома, таких как азот, кислород, сера или селен, необязательно имеющих бензо- или пиридокольцо, сконденсированное с:
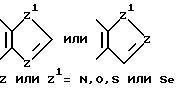
такая как имидазолильная, пиразолильная, бензимидазолильная, оксазолильная, бензоксазолильная, индазолильная, тиазолильная, бензотиазолильная, 3-алкил-3H-имидазо[4,5-b] пиридильная или пиридилимидазолильная группа; или с пятичленным насыщенным кольцом, содержащим один или два гетероатома, таких как азот, кислород, сера или селен, и соседний присоединенный гетероатом кислорода, т.е.
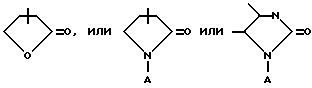
(где A выбирается из группы, в которую входят водород; (C1-C4) алкильная группа с прямой или разветвленной цепью; C6-арильная группа; (C7-C9) аралкильная группа, выбранная из группы, в которую входят бензильная, 1-фенилэтильная, 2-фенилэтильная или фенилпропильная группа),
такая как γ- бутиролактамная, γ- бутиролактонная, имидазолдинонная или N-аминоимидазолидинонная группа; или группа -(CH2)nCOOR8 с величиной n в пределах от нуля до четырех, где R8 выбирается из группы, в которую входят водород; (C1-C3) алкильная группа с прямой или разветвленной цепью, выбранная из группы, в которую входят метильная, этильная, н-пропильная или 1-метилэтильная группа; или (C6 -C10) арильная группа, выбранная из группы, в которую входят фенильная, α- нафтильная или β- нафтильная группа;
R7 выбирается из группы, в которую входят водород; (C1-C3) алкильная группа с прямой или разветвленной цепью, выбранная из группы, в которую входят метильная, этильная, н-пропильная или 1-метилэтильная группа; (C6-C10)арильная группа, выбранная из группы, в которую входят фенильная, α- нафтильная или β- нафтильная группа; (C7-C9) аралкильная группа, такая как бензильная, 1-фенилэтильная, 2-фенилэтильная или фенилпропильная; гетероциклическая группа с пятичленным ароматическим или насыщенным кольцом, содержащим один гетероатом, такой как азот, кислород, сера или селен, необязательно имеющим бензо- или пиридокольцо, сконденсированное с:
такая как пирролильная, N-метилиндолильная, индолильная, 2-пирролидинильная, 3-пирролидинильная, 2-пиррлидильная, тетрагидрофуранильная, фуранильная, бензофуранильная, тетрагидротиенильная, тиенильная, бензотиенильная или селеназолильная; или с пятичленным ароматическим кольцом, содержащим два гетероатома, таких как азот, кислород, сера или селен, необязательно имеющим бензо- или пиридокольцо, сконденсированное с:
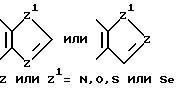
такая как имидазолильная, пиразолильная, бензимидазолильная, оксазолильная, бензоксазолильная, индазолильная, тиазолильная, бензотиазолильная, 3-алкил-3H-имидазо[4,5-b] пиридильная или пиридилимидазолильная группа; или с пятичленным насыщенным кольцом, содержащим один или два гетероатома, таких как азот, кислород, сера или селен, и соседний присоединенный гетероатом кислорода, т.е.

(где A выбирается из группы, в которую входят водород; (C1-C4) алкильная группа с прямой или разветвленной цепью; C6-арильная группа; (C7-C9) аралкильная группа, выбранная из группы, в которую входят бензильная, 1-фенилэтильная, 2-фенилэтильная или фенилпропильная группа)
такая как γ- бутиролактамная, γ- бутиролактонная, имидазолдинонная или N-аминоимидазолидинонная группа; или группа -(CH2)nCOOR8 с величиной n в пределах от нуля до четырех, где R8 выбирается из группы, в которую входят водород; (C1-C3) алкильная группа с прямой или разветвленной цепью, выбранная из группы, в которую входят метильная, этильная, н-пропильная или 1-метилэтильная группа; или (C6-C10) арильная группа, выбранная из группы, в которую входят фенильная, α- нафтильная или β- нафтильная; с условием, что R6 и R7 не могут быть одновременно водородом;
или R6 и R7, взятые совместно, представляют собой группу -(CH2)2B(CH2)2-, в которой B выбирается из группы, в которую входят (CH2)n с величиной n в пределах от нуля до единицы, -NH-N (C1-C3) алкильная группа (с прямой или разветвленной цепью), -N (C1-C4) алкоксигруппа, кислород, сера или замещенные родственные образования, выбранные из группы, в которую входят (L- или D-) пролин, этил (L- или D-)пролинат, морфолин, пирролидин или пиперидин; и фармакологически приемлемые органические и неорганические соли или комплексы металлов.
Особенно предпочтительными соединениями являются соединения с формулами I и II, в которых
R - галоген, выбранный из группы, в которую входят бром, хлор, фтор и иод; или R
представляет собой группу -NR1R2, и, когда R представляет собой группу -NR1R2 и R1 представляет собой водород,
R2 - метильная,
этильная, н-пропильная, 1-метилэтильная, н-бутильная, 1-метилпропильная, 2-метилпропильная или 1,1-диметилэтильная группа; и, когда R1 - метильная или этильная группа,
R2 - метильная, этильная н-пропильная, 1-метилэтильная, н-бутильная, 1-метилпропильная или 2-метилпропильная группа;
R3 выбирается из группы, в которую входят водород; (C4-C6) алкильная группа с прямой или разветвленной цепью, выбранная из группы, в которую входят бутильная, изобутильная, пентильная и гексильная группа; (C6-C10)
арильная группа, выбранная из группы, в которую входят фенильная, α- нафтильная и β- нафтильная группа; (C7-C9) аралкильная группа, выбранная из группы, в которую
входят бензильная, 1-фенилэтильная, 2-фенилэтильная и фенилпропильная группа;
R4 выбирается из группы, в которую входят водород и (C1-C3) алкильная группа,
выбранная из группы, в которую входят метильная, этильная, пропильная, и изопропильная группа; когда R3 не отвечает R4, стереохимическое состояние асимметричного углерода (т.е.
углерода, несущего заместитель W) может отвечать рацемату (DL) или индивидуальным энантиомерам (L или D);
W выбирается из группы, в которую входят (C7-C12) алкильная
монозамещенная аминогруппа с прямой или разветвленной цепью, причем замещение производится из группы, в которую входят гептильная, октильная, нонильная, децильная, ундецильная, додецильная группа и
диастереоизомеры и энантиомеры упомянутой разветвленной алкильной монозамещенной аминогруппы; (C1-C4) фторалкиламиногруппа с прямой или разветвленной цепью, выбранная из группы,
в которую входят 2,2,2-трифторэтильная, 3,3,3-трифторпропильная и 2,2-дифторпропильная группа; (C3-C8) - циклоалкильная монозамещенная аминогруппа, причем замещение производится
из группы, в которую входят циклопропильная, транс-1,2-диметилциклопропильная, цис-1,2-диметилциклопропильная, циклобутильная, циклопентильная, циклогексильная группа и диастереоизомеры и энантиомеры
упомянутой (C3-C8) циклоалкильной монозамещенной аминогруппы; (C4-C10)циклоалкил алкильная монозамещенная аминогруппа, причем замещение производится из
группы, в которую входят (циклопропил)метильная, (циклопропил) этильная и (циклобутил)метильная группа; (C3-C10)-алкенильная и алкинильная монозамещенная аминогруппа, причем
замещение производится из группы, в которую входят аллильная, пропинильная, 3-бутенильная, 2-бутенильная (с цис- или транс-положением) и 2-пентенильная группа; (C7-C10)
аралкиламиногруппа, причем замещение производится из группы, в которую входят бензильная, 2-фенилэтильная, 1-фенилэтильная 2-(нафтил)метильная, 1-(нафтил)метильная и фенилпропильная группа;
дизамещенная (C6-C14) алкиламиногруппа с прямой или разветвленной симметричной цепью, причем замещение производится из группы, в которую входят дибутильная, диизобутильная,
ди-втор-бутильная и дипентильная группа; симметричная дизамещенная (C6-C14)-циклоалкиламиногруппа, причем замещение производится из группы, в которую входят дициклопропильная,
дициклобутильная, дициклопентильная и дициклопропилметильная группа; дизамещенная (C3-C14) алкиламиногруппа с прямой или разветвленной несимметричной цепью, у которой при
замещении общее число атомов углерода не превышает 14; несимметричная дизамещенная (C4-C14)циклоалкиламиногруппа, у которой при замещении общее число атомов углерода не превышает
14; (C2-C8) азациклоалкильная и замещенная (C2-C8) азациклоалкильная группа, причем замещение производится из группы, в которую входят 4-метилпиперидиновая,
4-гидроксипиперидиновая, 4-(гидроксиметил)пиперидиновая, 4-(аминометил)пиперидиновая, цис-3,4-диметилпирролидинильная, транс-3,4-диметилпирролидинильная группа и диастереоизомеры и энантиомеры
упомянутой (C2-C8) азациклоалкильной и замещенной (C2-C8) азациклоалкильной группы; замещенная 1-азаоксициклоалкильная группа, причем замещение производится
из группы, в которую входят 2-(C1-C3) алкилморфолинильная и 3-(C1-C3) - алкилизоксазолидинильная группа; [1,n]-диазациклоалкильная и замещенная [1,
n]-диазациклоалкильная группа, выбранная из группы, в которую входят пиперазинильная, 2-(C1-C3) алкилпиперазинильная, 4-(C1-C3) алкилпиперазинильная, 2,
4-диметилпиперазинильная, 4-гидроксипиперазинильная группа и энантиомеры упомянутого [1,n]-диазациклоалкильного и замещенного [1,n]-диазациклоалкильного образования; 1-азатиациклоалкильная и
замещенная 1-азатиациклоалкильная группа, выбранная из группы, в которую входят тиоморфолинильная и 2-(C1-C3) алкилтиоморфолинильная группа; (гетероцикло) метиламиногруппа,
выбранная из группы, в которую входят 2- или 3-фурилметиламиногруппа, 2- или 3-тиенилметиламиногруппа, 2-, 3- или 4-пиридилметиламиногруппа, 2- или 5-пиридазинилметиламиногруппа,
2-пиразинилметиламиногруппа, 2-(имидазолил) метиламиногруппа и замещенная (гетероцикло) метиламиногруппа (замещение производится (C1-C6) алкильной группой с прямой или
разветвленной цепью);
1,1-замещенная гидразиногруппа, выбранная из группы, в которую входят 1,1-диметилгидразиногруппа, N-аминопипердинильная группа и 1,1-диэтилгидразиногруппа; (C1
-C4) алкоксиаминогруппа, причем замещение производится из группы, в которую входят метоксигруппа, этоксигруппа, н-пропоксигруппа, 1-метилэтоксигруппа, н-бутоксигруппа, 2-метилпропоксигруппа
и 1,1-диметилэтоксигруппа; (C7-C11) арилалкоксиаминогруппа, причем замещение производится из группы, в которую входят бензилоксигруппа, 2-фенилэтоксигруппа, 1-фенилэтоксигруппа,
2-(нафтил)метоксигруппа, 1-(нафтил)метоксигруппа и фенилпропоксигруппа; [β- или γ-(C1-C3) ациламидо] алкиламиногруппа, причем замещение производится из группы, в
которую входят 2-(формамидо) этильная, 2-(ацетамидо)этильная, 2-(пропиониламидо)этильная, 2-(ацетамидо)пропильная и 2-(формамидо) пропильная группа и энантиомеры упомянутой [β- или γ
-(C1-C3)-ациламидо] алкиламиногруппы; β- или γ- (C1-C3) алкоксиалкиламиногруппа, причем замещение производится из группы, в которую входят
2-метоксиэтильная, 2-этоксиэтильная, 2,2-диэтоксиэтильная, 2-метоксипропильная, 3-метоксипропильная, 3-этоксипропильная и 3,3-диэтоксипропильная группа и энантиомеры упомянутой β- или γ
- (C1-C3) алкоксиалкиламиногруппы;
β-,γ- или δ-(C2-C4) гидроксиалкиламиногруппа, выбранная из группы, в которую входят
3-гидроксипропильная и 4-гидроксибутильная группа; или R3 и W, взятые совместно, выбираются из группы, в которую входят группа - (CH2)n(R5)N- с величиной n
в пределах от трех до четырех и группа -CH2CH(OH)-CH2(R5)N-, у которой R5 выбирается из группы, в которую входят водород и (C1-C3)
ацильная группа, причем ацильная группа выбирается из формильной, ацетильной, пропионильной группы, и (C2-C3) галоацильная группа, выбранная из группы, в которую входят
трифторацетильная, 3,3,3-трифторпропионильная и 2,3,3-трифторпропионильная группа;
R6 выбирается из группы, в которую входят водород, (C1-C3) алкильная группа
с прямой или разветвленной цепью, выбранная из группы, в которую входят метильная, этильная, н-пропильная или 1-метилэтильная группа; (C6-C10)арильная группа, выбранная из группы,
в которую входят фенильная, α- нафтильная или β- нафтильная группа; (C7-C9) аралкильная группа, такая как бензильная, 1-фенилэтильная, 2-фенилэтильная или
фенилпропильная группа; гетероциклическая группа с пятичленным ароматическим или насыщенным кольцом, содержащая один гетероатом, такой как азот, кислород, сера или селен, необязательно имеющим
бензо- или пиридокольцо, сконденсированное с:
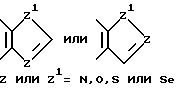
такая как пирролильная, N-метилиндолильная, индолильная, 2-пирролидинильная, 3-пирролидинильная, 2-пирролидинильная, тетрагидрофуранильная, фуранильная, бензофуранильная, тетрагидротиенильная, тиенильная, бензотиенильная или селеназолильная группа; или с пятичленным ароматическим кольцом, содержащим два гетероатома, таких как азот, кислород, сера или селен, необязательно имеющим бензо- или пиридокольцо, сконденсированное с:

такая как имидазолильная, пиразолильная, бензимидазолильная, оксазолильная, бензоксазолильная, индазолильная, тиазолильная, бензотиазолильная, 3-алкил-3H-имидазо[4,5-b] пиридильная или пиридилимидазолильная группа; или группа -(CH2)nCOOR8 с величиной n в пределах от нуля до четырех, где R8 выбирается из группы, в которую входят водород; (C1-C3) алкильная группа с прямой или разветвленной цепью, выбранная из группы, в которую входят метильная, этильная, н-пропильная или 1-метилэтильная группа; или (C6-C10) арильная группа, выбранная из группы, в которую входят фенильная, α- нафтильная или β- нафтильная группа;
R7 выбирается из группы, в которую входят водород; (C1-C3) алкильная группа с прямой или разветвленной цепью, выбранная из группы, в которую входят метильная, этильная, н-пропильная или 1-метилэтильная группа; (C6-C10) арильная группа, выбранная из группы, в которую входят фенильная, α - нафтильная или β- нафтильная группа; (C7-C9) аралкильная группа, такая как бензильная, 1-фенилэтильная, 2-фенилэтильная или фенилпропильная группа; гетероциклическая группа с пятичленным ароматическим или насыщенным кольцом, содержащим один гетероатом, такой как азот, кислород, сера или селен, необязательно имеющим бензо- или пиридокольцо, сконденсированное с:
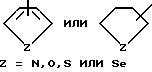
такая как пирролильная, N-метилиндолильная, индолильная, 2-пирролидинильная, 3-пирролидинильная, 2-пирролинильная, тетрагидрофуранильная, фуранильная, бензофуранильная, тетрагидротиенильная, тиенильная, бензотиенильная или селеназолильная группа; или с пятичленным ароматическим кольцом, содержащим два гетероатома, таких как азот, кислород, сера или селен, необязательно имеющим бензо- или пиридокольцо, сконденсированное с:

такая как имидазолильная, пиразолильная, бензимидазолильная, оксазолильная, бензоксазолильная, индазолильная, тиазолильная, бензотиазолильная, 3-алкил-3H-имидазо[4,5-b] пиридильная или пиридилимидазолильная; или группа -(CH2)nCOOR8 с величиной n в пределах от нуля до четырех, где R8 выбирается из группы, в которую входят водород; (C1-C3) алкильная группа с прямой или разветвленной цепью, выбранная из группы, в которую входят метильная, этильная, н-пропильная или 1-метильная группа; или (C6-C10)арильная группа, выбранная из группы, в которую входят фенильная, α- нафтильная или β- нафтильная группа; с условием, что R6 и R7 не могут быть одновременно водородом; или R6 и R7, взятые совместно, представляют собой группу -(CH2)2B(CH2)2 -, у которой B выбирается из группы, в которую входят (CH2)n с величиной n, равной нулю или единице, -NH, -N(C1-C3) алкильная группа (с прямой или разветвленной цепью), -N(C1-C4) алкоксигруппа, кислород, сера или замещенные родственные образования, выбранные из группы, в которую входят (L- или D-) пролин, этил (L- или D-)пролинат, морфолин, пирролидин или пиперидин; и фармакологически приемлемые органические и неорганические соли и комплексы металлов.
К соединениям, представляющим особый интерес,
относятся соединения с формулами I и II, у которых
R - галоген, выбранный из группы, в которую входят бром, хлор и иод; или R - группа -NR1R2, и, когда R - группа
-NR1R2 и R1 - метильная или этильная группа, тогда
R2 - метильная или этильная группа;
R3 - водород;
R4
- выбирается из водорода и (C1-C2) алкильной группы, выбираемой из метильной и этильной группы;
когда R3 не соответствует R4, стереохимическое
состояние асимметричного углерода (т.е. углерода, несущего заместитель W) может соответствовать либо рацемату (DL), либо индивидуальным энантиомерам (L или D);
W выбирается из группы, в
которую входит (C7-C12) алкильная (с прямой или разветвленной цепью) монозамещенная аминогруппа, выбранная из группы, в которую входят гептильная, октильная, нонильная, децильная,
ундецильная, додецильная группа и диастереизомеры и энантиомеры упомянутой разветвленной алкильной монозамещенной аминогруппы; (C2) фторалкиламиногруппа, выбранная из группы, в которую
входят 2,2,2-трифторэтильная и 3,3,3-трифторпропильная группа; (C3-C8) циклоалкильная монозамещенная аминогруппа, причем замещение производится из группы, в которую входят
циклопропильная, циклобутильная, циклопентильная, циклогексильная группа и диастереоизомеры и энантиомеры упомянутой (C3-C8) циклоалкильной монозамещенной аминогруппы; [(C4-C5) циклоалкил] алкильная монозамещенная аминогруппа, причем замещение производится из группы, в которую входят (циклопропил)метильная и (циклопропил)этильная группа; (C3
-C4) алкенильная и алкинильная монозамещенная аминогруппа, причем замещение производится из группы, в которую входят аллильная и пропинильная группа; (C2-C7
)азациклоалкильная и замещенная (C2-C7)азациклоалкильная группа, причем замещение производится из группы, в которую входят 4-метилпиперидин, 4-гидроксипиперидин и
4-(гидроксиметил) пиперидин; замещенная 1-азаоксациклоалкильная группа, причем замещение производится из группы, в которую входят 2-(C1-C3) алкилморфолинильная группа; [1, n]
-диазациклоалкильная и замещенная [1,n]-диазациклоалкильная группа, выбранная из пиперазинильной и 4-(C1-C3) алкилпиперазинильной группы; 1-азатиациклоалкильная и замещенная
1-азатиациклоалкильная группа, выбранная из тиоморфолинильной и 2-(C1-C3) алкилтиоморфолинильной группы; (гетероцикло) метиламиногруппа, выбранная из группы, в которую входят
2- или 3-тиенилметиламиногруппа и 2-, 3- или 4-пиридилметиламиногруппа; 1,1-дизамещенная гидразиногруппа, выбранная из 1,1-диметилгидразиногруппы и N-аминопиперидинильной группы; [β- или
γ-(C1-C3)ациламидо] алкиламиногруппа с замещением, производимом из 2-(ацетамидо) этильной группы; β- или γ-(C1-C3)
алкоксиалкиламиногруппа, причем замещение производится из группы, в которую входят 2-метоксиэтильная, 2-эткосиэтильная, 2,2-диэтоксиэтильная, 2-метоксипропильная и 3-метоксипропильная группа; β
-,γ- или δ-(C2-C4) гидроксиалкиламиногруппа, выбранная из 4-гидроксибутильной и 3-гидроксипропильной группы; или R3 и W, взятые совместно, выбираются из
группы -(CH2)n(R5) - с величиной n, равной трем, и R5 выбирается из водорода и трифторацетильной группы;
R6 выбирается из группы, в
которую входят водород; (C1-C3) алкильная группа с прямой или разветвленной цепью, выбранная из группы, в которую входят метильная, этильная, н-пропильная или 1-метилэтильная
группа;
R7 выбирается из группы, в которую входят водород; (C1-C3) алкильная группа с прямой или разветвленной цепью, выбранная из группы, в которую входят
метильная, этильная, н-пропильная или 1-метилэтильная группа; с условием, что R6 и R7 одновременно не могут представлять собой водород; или R6 и R7 взятые
совместно, представляют собой группу -(CH2)2B(CH2)2-, у которой B выбирается из группы, в которую входят (CH2)n с величиной n, равной
нулю или единице, -NH, -N(C1-C3) алкильная группа (с прямой или разветвленной цепью), -N(C1-C4) алкоксигруппа, кислород, сера или замещенные родственные
образования, выбранные из группы, в которую входят (L- или D-)пролин, этил (L- или D-) пролинат, морфолин, пирролидин или пиперидин; и фармакологически приемлемые органические и неорганические соли
или комплексы металлов.
Кроме того, под настоящее изобретение подпадают также соединения, полезные в качестве промежуточных продуктов при получении соединений, отвечающих формулам I и
II. К таким промежуточным соединениям относятся соединения с формулой III:
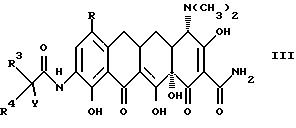
в которой
Y выбирается из (CH2)nX с величиной n в пределах от нуля до пяти; X - галоген выбирается из группы, в которую входят бром, хлор, фтор или иод;
R - галоген, выбранный из группы, в которую вхолят бром, хлор, фтор и иод; или R - группа -NR1R2 и когда R -NR1R2 и R1 - водород, тогда
R2 - метильная, этильная, н-пропильная, 1-метилэтильная, н-бутильная, 1-метилпропильная, 2-метилпропильная или 1,1-диметилэтильная группа;
и, когда R1 - метильная или этильная группа,
R2 - метильная, этильная, н-пропильная, 1-метилэтильная, н-бутильная, 1-метилпропильная или 2-метилпропильная группа; и, когда R1 - н-пропильная группа,
R2 - н-пропильная, 1-метилэтильная, н-бутильная, 1-метилпропильная или 2-метилпропильная группа;
и, когда R1 - 1-метилэтильная группа,
R2 - н-бутильная, 1-метилпропильная или 2-метилпропильная группа;
и, когда R1 - н-бутильная группа,
R2 - н-бутильная, 1-метилпропильная или 2-метилпропильная группа;
и, когда R1 - метилпропильная группа,
R2 - 2-метилпропильная группа;
R3 выбирается из группы, в которую входят водород (C4-C8) алкильная группа с прямой или разветвленной цепью, выбранная из группы, в которую входят бутильная, изобутильная, пентильная, гексильная, гептильная и октильная группа; α- меркапто (C1-C4) алкильная группа, выбранная из группы, в которую входят меркаптометильная, α- меркаптоэтильная, α- меркапто-1-метилэтильная и α- меркаптопропильная группа; α- гидрокси-(C1-C4) алкильная группа, выбранная из группы, в которую входят гидркосиметильная, α- гидроксиэтильная, α- гидрокси-1-метилэтильная и α - гидроксипропильная группа; карбоксил-(C1-C8) алкильная группа; (C6-C10) арильная группа, выбранная из группы, в которую входят фенильная, α - нафтильная и β- нафтильная группа; замещенная (C6-C10) арильная группа (замещение производится из группы, в которую входят гидроксигруппа, галооген, (C1-C4) алкоксигруппа, тригало (C1-C3) алкильная группа, нитрогруппа, аминогруппа, цианогруппа, (C1-C4) алкоксикарбонильная группа, (C1-C3) алкиламиногруппа и карбоксигруппа); (C7-C9) аралкильная группа, выбранная из группы, в которую входят бензильная, 1-фенилэтильная, 2-фенилэтильная и фенилпропильная группа; замещенная (C7-C9) аралкильная группа (замещение производится из группы, в которую входят галогруппа, (C1-C4) алкильная группа, нитрогруппа, гидроксигруппа, аминогруппа, моно- или дизамещенная (C1-C4) алкиламиногруппа, (C1-C4) алкоксигруппа, (C1-C4) алкилсульфонильная группа, цианогруппа и карбоксигруппа);
R4 выбирается из водорода и (C1-C6) алкильной группы, выбранной из группы, в которую входят метильная, этильная, пропильная, изопропильная, бутильная, изобутильная, пентильная и гексильная группа;
когда R3 не отвечает R4, стереохимическое состояние асимметричного углерода (т.е. углерода, несущего заместитель W) может отвечать либо рацемату (DL), либо индивидуальным энантиомерам (L или D); и фармакологически приемлемые органические и неорганические соли или комплексы металлов.
Предпочтительными соединениями являются соединения с формулой III, в которой
Y выбирается из (CH2)nX с величиной n в пределах от нуля до пяти, где X - галоген,
выбранный из группы, в которую входят бром, хлор, фтор или иод;
R - галоген, выбранный из группы, в которую входят бром, хлор, фтор и иод; или R - группа -NR1R2, и,
когда R - группа -NR1R2 и R1 - водород,
R2 - метильная, этильная, н-пропильная, 1-метилэтильная, н-бутильная, 1-метилпропильная, 2-метилпропильная
или 1,1-диметилэтильная группа;
и, когда R1 - метильная или этильная группа,
R2 - метильная, этильная, н-пропильная, 1-метилэтильная, н-бутильная,
1-метилпропильная или 2-метилпропильная группа;
R3 выбирается из группы, в которую входят водород; (C4-C8) алкильная группа с прямой или разветвленной цепью,
выбранная из группы, в которую входят бутильная, изобутильная, пентильная, гексильная, гептильная и октильная группа; α- гидрокси (C1-C4) алкильная группа, выбранная из
группы, в которую входят гидроксиметильная, α- гидроксиэтильная, α- гидрокси-1-метилэтильная и α- гидроксипропильная группа; карбоксил-(C1-C8) алкильная
группа; (C6-C10)арильная группа, выбранная из группы, в которую входят фенильная, α- нафтильная и β- нафтильная группа; замещенная (C6-C10)
арильная группа (замещение производится из группы, в которую входят гидроксигруппа, галоген, (C1-C4) алкоксигруппа, (C1-C4) алкоксикарбонильная группа и
карбоксигруппа); (C7-C9) аралкильная группа, выбранная из группы, в которую входят бензильная, 1-фенилэтильная, 2-фенилэтильная и фенилпропильная группа; замещенная (C7
-C9) аралкильная группа (замещение производится из группы, в которую входят галогруппа, (C1-C4) алкильная группа, (C1-C4) алкоксигруппа, (C1-C4) алкилсульфонильная группа, цианогруппа, (C1-C4) алкилсульфенильная группа, цианогруппа и карбоксигруппа);
R4 выбирается из водорода и
(C1-C4) алкильной группы, выбранной из группы, в которую входят метильная, этильная, пропильная, изопропильная, бутильная и изобутильная группа; когда R3 не
соответствует R4, стереохимическое состояние асимметричного углерода (т.е. углерода, несущего заместитель W) может отвечать либо рацемату (DL), либо индивидуальным энантиомерам (L или D); и
фармакологически приемлемые органические и неорганические соли и комплексы металлов.
Особенно предпочтительными соединениями являются соединения с формулой III, в которой
Y
выбирается из (CH2)nX с величиной n в пределах от нуля до пяти, где X - галоген, выбранный из группы, в которую входят бром, хлор, фтор или иод;
R - галоген, выбранный
из группы, в которую входят бром, хлор, фтор и иод; или R - группа -NR1R2, и, когда R - группа -NR1R2 и R1 - водород,
R2
- метильная, этильная, п-пропильная, 1-метилэтильная, н-бутильная, 1-метилпропильная, 2-метилпропильная или 1,1-диметилэтильная группа;
и, когда R1 - метильная или этильная группа,
R2 - метильная, этильная, н-пропильная, 1-метилэтильная, н-бутильная, 1-метилпропильная или 2-метилпропильная группа;
R3 выбирается из группы, в которую входят
водород; (C4-C6) алкильная группа с прямой или разветвленной цепью, выбранная из группы, в которую входят бутильная, изобутильная, пектильная и гексильная группа; (C6
-C10)арильная группа, выбранная из группы, в которую входят фенильная, α- нафтильная и β-/ нафтильная группа; (C7-C9) аралкильная группа, выбранная из
группы, в которую входят бензильная, 1-фенилэтильная, 2-фенилэтильная и фенилпропильная группа;
R4 выбирается из водорода и (C1-C3) алкильной группы, в
которую входят метильная, этильная, пропильная и изопропильная группа;
когда R3 не соответствует R4, стереохимическое состояние асимметричного углерода (т. е. углерода,
несущего заместитель W) может отвечать либо рацемату (DL), либо индивидуальным энантиомерам (L или D); и фармакологически приемлемые органические и неорганические соли или комплексы металлов.
Соединениями, представляющими особый интерес, являются соединения с формулой III, в которой
Y выбирается из (CH2)nX с величиной n в пределах от нуля до пяти,
где X - галоген, выбранный из группы, в которую входят бром, хлор, фтор или иод;
R - галоген, выбранный из группы, в которую входят бром, хлор или иод; или R - группа -NR1R2, и, когда R - группа -NR1R2 и R1 - метильная или этильная группа,
R2 - метильная или этильная группа;
R3 - водород;
R4 - выбирается из водорода и (C1-C2) алкильной группы, выбранной из метильной и этильной группы;
когда R3 не соответствует R4,
стереохимическое состояние асимметричного углерода (т. е. углерода, несущего заместитель W) может отвечать либо рацемату (DL), либо индивидуальным энантиомерам (L или D); и фармакологически приемлемые
органические и неорганические соли или комплексы металлов.
Описание предпочтительных вариантов осуществления
Ранее неизвестные соединения, отвечающие настоящему изобретению,
могут быть легко получены по следующим схемам.
Предпочтительный способ получения 7-(замещенных)-9-[(замещенных- глицил)амидо] -6-диметил-6-дезокситетрациклинов или солей минеральных
кислот (3) показан на схеме 1. В этом способе используются обычные промежуточные соединения, которые могут быть легко получены взаимодействием промышленно выпускаемых галоацильных галидов с
формулой

где
Y, R3 и R4 являются такими, какими они были определены выше, и Q - галоген, выбранный из группы, в которую входят бром, хлор, иод и фтор, с 9-амино-7-(замещенным)-6-диметил-6- дезокситетрациклином или его солью минеральной кислоты (1), в результате чего с почти количественным выходом получаются 9-[(галоацил)амидо]-7-(замещенные)-6-диметил-6-дезокситетрациклины с прямой или разветвленной цепью или соли минеральных кислот (2). Указанные выше промежуточные соединения, а именно, 9-[(галоацил)амидо]-7-(замещенные)-6-диметил-6-дезокситетрациклины или соли минеральных кислот (2), взаимодействуют со многими нуклеофильными соединениями, особенно с аминами, имеющими формулу WH, где группа W является такой, какой она была определена ранее, в результате чего образуются новые 7-(замещенные)-9-[(замещенные- глицил)амидо] -7-(замещенные)-6-диметил-6-дезокситетрациклины или соли минеральных кислот (3), отвечающие настоящему изобретению.
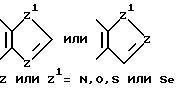
В соответствии со схемой 1,9-амино-7-(замещенный)-6-диметил-6- дезокситетрациклин или его соль минеральной кислоты (I) смешивают с:
а) полярным апротонным растворителем, таким как 1,3-диметил-3,4,5,6-тетрагидро-2(1H)пиримидоном, называемым далее ДМПУ, гексаметилфосфорамидом, называемым далее ГМФА, диметилформамидом, диметилацетамидом, N-метилпирролидоном, 1,2-диметоксиэтаном, или подобными соединениями;
б) инертным растворителем, таким как ацетонитрил, хлористый метилен, тетрагидрофуран, хлороформ, четыреххлористый углерод, 1,2-дихлорэтан, тетрахлорэтан, простой диэтиловый эфир, простой трет-бутилметиловый эфир, простой изопропиловый эфир, или подобными соединениями;
в) основаниями, такими как карбонат натрия, бикарбонат натрия, ацетат натрия, карбонат калия, бикарбонат калия, триэтиламин, карбонат цезия, карбонат лития или равноценные бикарбонаты; и
г) галоацильным галидом с прямой или разветвленной цепью с формулой вида:

где Y, R3, R4 и Q являются такими, как они были определены выше, такими как бромистый бромацетил, хлористый хлорацетил, бромистый 2-бромпропионил или им подобными; галогруппа Y и галид Q у галоацильного галида могут быть с одинаковыми или различными галогенами, выбранными из группы, в которую входят бром, хлор, иод и фтор; Y - группа (CH2)nX с величиной n в пределах от нуля до пяти, где X - галоген;
д) на протяжении от 0,5 до 5 ч при комнатной температуре с нагреванием до температуры взаимодействия в сосуде с обратным холодильником, в результате чего происходит образование соответствующего 9-[(галоацил)амидо]-7-(замещенного)-6-деметил-6- дезокситетрациклина (2) или его соли минеральной кислоты.
Промежуточное соединение, а именно
9-[(галоацил)амидо]-7- замещенный)-6-диметил-6-дезокситетрациклин или его соль минеральной кислоты (2), обрабатывают в инертной среде из гелия, аргона или азота
а) нуклеофильным соединением
WH, таким как амин, замещенный амин или им подобное соединение, например метиламином, диметиламином, этиламином, н-бутиламином, пропиламином или н-гексиламином;
б) полярным апротонным
растворителем, таким как 1,3-диметил-3,4,5,6-тетрагидро-2(1H)пиримидон (ДМПУ), гексаметилфосфорамидом (ГМФА), диметилформамидом, диметилацетамидом, N-метилпирролидоном или 1,2-диметоксиэтаном;
в) на протяжении от 0,5 до 2 ч при комнатной температуре или при температуре нагревания в сосуде с обратным холодильником, чтобы получился требуемый 7-(замещенный)-9-[(замещенный
глицил)амидо]-6-диметил-6-дезокситетрациклин (3) или его соль минеральной кислоты.
Схема II

В соответствии со схемой II соединения с формулой 3 оказываются N-алкилированными в присутствии формальдегида и либо первичного амина, такого как метиламин, этиламин, бензиламин, метилглицинат, (L- или D-)аланин, (L- или D-)-лизин, или их замещенных родственных соединений, либо вторичного амина, такого как морфолин, пирролидин, пиперидин, или замещенных родственных соединений, в результате чего образуется соответствующий аддукт основания Манниха (Mannich) 4.
7-(замещенные)-9-[(замещенные-глицил)амидо] -6-диметил-6- дезокситетрациклины могут быть получены в виде комплексов таких металлов, как алюминий, кальций, железо, магний, марганец, и в виде комплексных солей, неорганических и органических солей и соответствующих аддуктов оснований Манниха, для чего используют способы, известные специалистам, работающим в этой области техники (Richard C. Larock, Comprehensive Organic Transformations, VCH Publishers, 411 - 415, 1989). Специалистам, работающим в этой области техники, хорошо известно, что надлежащая солевая форма выбирается, основываясь на физической и химической стабильности, текучести, гигроскопичности и растворимости. Желательно, чтобы 7-(замещенные)-9-[(замещенные-глицил)амидо]-6-деметил-6- дезокситетрациклины получались в виде неорганической соли, такой как хлоридная, бромидная, иодная, фосфатная, нитратная или сульфатная, или в виде органической соли, такой как ацетатная, бензоатная, цитратная, цистеинатная, или в виде соли других аминокислот, такой как фумаратная, гликолатная, малеатная, сукцинатная, тартратная, алкилсульфонатная или арилсульфонатная. В зависимости от стехиометрии используемых кислот образование соли происходит с взаимодействием с C(4)-диметиламиногруппой (1 эквивалент кислоты) или как с C(4)-диметиламиногруппой, так и с W-группой (2 эквивалента кислоты). Эти соли пригодны для орального и парентерального введения.
Некоторые соединения, описанные в приведенных выше схемах, имеют центры асимметрии на углероде, несущем заместитель W. Эти соединения могут, следовательно, существовать по крайней мере в двух (2) стереоизомерных формах. Настоящее изобретение распространяется на рацемическую смесь стереоизомеров, а также на все стереоизомеры соединений независимо от того, свободны ли они от других стереоизомеров или находятся в смеси со стереоизомерами при любых соотношениях энантиомеров. Истинная конфигурация любого соединения может быть установлена методом обычной рентгеновской кристаллографии.
Стереохимические центры, существующие у тетрациклинового образования (т. е. C-4, C-4a, C-5a и C-12a), остаются нетронутыми на протяжении всех взаимодействий.
Биологическая активность
Способы проведения
антибактериальной оценки in vitro (табл. 1)
Минимальная ингибирующая концентрация (MIC), т.е. наинизшая концентрация антибиотика, при которой происходит ингибирование роста тестируемого
организма, определяется агаровым методом разбавления с использованием 0,1 мл агара II Мюллера-Хинтона (Muller-Hinton II agar) (Балтиморские биологические лаборатории) в расчете на углубление. Были
использованы инокулятная плотность величиной (1-5)•105 колониеобразующих единиц на 1 мл и антибиотическая концентрация с диапазоном 32 - 0,004 мкг/мл. Минимальную ингибирующую
концентрацию определяли после инкубирования пластин в течение 18 ч при 35oC в инкубаторе с принудительной циркуляцией воздуха. Тестируемые организмы представляли собой штаммы,
чувствительные к тетрациклину, и генетически установленные штаммы, резистетные к тетрациклину в силу неспособности связывать бактериальные рибосомы (tetM).
E. coli белковая
трансляционная система in vitro (табл. II)
Была разработана in vitro свободная от клеток белковая трансляционная система, что делали с использованием экстрактов штамма МРЕ600 культуры E.coli
(восприимчивого к тетрациклину) и производного от штамма МРЕ600, содержащего tetM-детерминанту; систему разрабатывали на основе литературных методов (J. M. Pratt, Coupled Transcription-translation in
Prokaryotic Cell-free Systems, Transcription and Translation, a Practical Approach, (B.D. Hames and S. J. Higgins. eds) p. 179 - 209, IRL Press, Oxford-Washington, 1984).
Используя систему, описанную выше, тетрациклиновые соединения, отвечающие настоящему изобретению, тестировали на их способность ингибировать белковый синтез in vitro. Короче говоря, в каждом случае 10 мкл реакционной смеси содержали S30-экстракт (полный экстракт), приготовленный либо из чувствительных к тетрациклину клеток, либо из изогенного резистентного к тетрациклину (tetM) штамма, низкомолекулярные компоненты, необходимые для протекания транскрипции и трансляции (т.е. АТФ и ГТФ), смесь 19 аминокислот (без метионина), метионин с меткой в виде серы-35, ДНК-матрицу (либо pBP322, либо p C119) и либо диметилсульфоксид (DMSO) (контрольный опыт), либо ранее неизвестное тетрациклиновое соединение, подвергаемое тестированию ("novel TC"), которое было растворено в диметилсульфоксиде.
Реакционные смеси инкубировали в течение 30 мин при 37oC. Время отсчитывали с момента добавления S30-экстракта, который добавляли последним. По истечении 30 мин извлекали 2,5 мкл реакционной смеси, и ее смешивали с 0,5 мл 1 н. раствора гидроксида натрия, что было необходимо для разрушения РНК и тРНК. Добавляли 2 мл 25%-ной трихлоуксусной кислоты, и смесь инкубировали при комнатной температуре в течение 15 мин. Вещество, осевшее под воздействием трихлоруксусной кислоты, собирали на GF/C-фильтрах Уотмана (Whatman) и промывали раствором 10%-ной трихлоруксусной кислоты. Фильтры сушили, и удерживаемую радиоактивность, вызванную захватом 35S-метионина полипептидами, измеряли, используя стандартные жидкостные сцинтилляционные методы.
Процентное ингибирование белкового синтеза определяли по формуле

Антибактериальная оценка in vivo.
Терапевтическое действие тетрациклинов устанавливали по отношению к острой детальной инфекции, для чего использовали штамм Смита (Smith) культуры Staphulococcus aureus (восприимчивый к тетрациклину). Мужским мышиным особям линии CD-1 (Чарлз Ривер лабораториз) с весом 20 ± 2 г делали интраперитонеальную инъекцию бактерий (суспендированных в свином слизистом секрете) в количестве, достаточном, чтобы убить необработанные контрольные особи за 24 - 48 ч. Антибактериальные средства, содержащиеся в 0,5 мл 0,2%-ного водного агара, вводили подкожно или орально за 30 мин до инъекции. При оральном введении дозированных препаратов животных лишали пищи за 5 ч до и в течение 2 ч после инъекции. При каждом уровне дозировки обрабатывали пять мышей. Для расчета половинной эффективной дозы (ED50) использовали коэффициенты 7-дневной выживаемости, найденные в трех раздельных тестах.
Результаты тестирования
Заявленные
соединения обнаруживают антибактериальную активность в отношении широкого спектра восприимчивых к тетрациклину и резистентных грамположительных и грамотрицательных бактерий, особенно в отношении
штаммов культур E. coli, S. aureus и E. faecalis, содержащих tetM - и tetD - резистентные детерминанты, и культуры E. coli, содержащих tetB и tetD резистентные детерминанты. Особо следует отметить
соединения D, G и K, указанные в табл. I, которые обнаруживают очень высокую активность in vitro в отношении резистентных к тетрациклину штаммов, содержащих tetM-резистентную детерминанту (таких как
S. aureus VBMS 88-5, S. aureus VBMDS 90-1 и 90-2, E. coli VBMS 89-1 и 90-4), и резистентных к тетрациклину штаммов, содержащих tetB-резистентную детерминанту (таких как E. coli VBMS 88-1 и E.coli
TNIOC tetB). Эти соединения обладают также хорошей активностью в отношении E. coli tetA, E. coli tetC и E. coli tetD и является в такой же мере эффективными, как миноциклин, в отношении восприимчивых
штаммов и превосходят миноциклин в отношении ряда недавно выделенных бактерий, как это известно из клинических источников (табл. I).
Миноциклин и соединения B, C, D, G и H исследовали in vitro в отношении их способности ингибировать белковый синтез, происходящий либо у дикого типа, либо у tetM-защищенных рибосом, для чего использовали совместную транскрипционную и трансляционную систему. Установлено, что все соединения эффективно ингибируют белковый синтез, происходящий на рибосомах дикого типа, обладая равноценными уровнями активности. Миноциклин не обладает способностью ингибировать белковый синтез, протекающий на tetM-защищенных рибосомах. В противоположность сказанному соединения B, C, D, G и H являются эффективными в отношении ингибирования белкового синтеза, происходящего на tetM-защищенных рибосомах (табл. II).
Соединения B, C, D, G и H обратимо связывает свои мишени (рибосому), поскольку бактериальный рост возобновляется при удалении соединения из культур посредством промывки организма. Следовательно, складывается впечатление, что способность этих соединений ингибировать бактериальный рост является прямым следствием их способности ингибировать белковый синтез на рибосомном уровне.
Активность соединения G в отношении восприимчивых к тетрациклину организмов также демонстрируется in vivo на животных, инфектированных штаммом Смита культуры S. aureus, величинами ED50, лежащими в области 1-2 мг/кг при внутривенном введении, и величинами ED50, лежащими в области 4-8 мг/кг при оральном введении.
Повышенная эффективность действия соединений D, G и K демонстрируется in vitro активностью в отношении ингибирования изогенных штаммов, у которых клонированы резистентные детерминанты, такие как tetM и tetB (табл. I), и в отношении ингибирования белкового синтеза tetM-рибосомами (табл. II).
Как можно видеть из табл. I и II, соединения, отвечающие настоящему изобретению, могут быть также использованы для предупреждения и воздействия на протекание важных ветеринарных болезней, таких как диарея, болезни, вызванные попаданием инфекции в мочевые пути, болезни, вызванные воздействием инфекции на кожу и ее состояние, болезни, связанные с попаданием инфекции в уши, нос и горло, болезни, вызванные раневыми инфекциями, маститы и им подобные болезни.
Описание соединений, фигурирующих в таблицах
A [7S-(7альфа, 10a альфа)]-N-[9-(аминокарбонил)-4,7-бис(диметиламино)- 5,5a, 6,6a, 7,10,10a,12-октагидро-1,8,10a,
11-тетрагидрокси-10,12- диоксо-2-нафтаценил]-1-(трифторацетил)-2-пирролидинкарбоксиамиддигидрохлорид
B [4S-(4 альфа, 12a альфа)] -4,7-бис(диметиламино)-1,4,4a, 5,5a, 6,11,12н-октагидро-3,10,
12,12a-тетрагидрокси-9-[[[(2- метоксиэтил)амино] ацетил]амино]-1,11-диоксо-2- нафтаценкарбоксамиддигидрохлорид
C [4S-(4альфа, 12a альфа)]-9-[[[(2,2-диэтоксиэтил)амино] ацетил]амино] -4,
7-бис(диметиламино)-1,4, a, 5,5a, 6,11,12a- октагидро-3,10,12,12a-тетрагидрокси-1,11,диоксо-2- нафтаценкарбоксамиддигидрохлорид
D [4S-(4альфа, 12a альфа)]-4,7-бис(диметиламино)-1,4,4a, 5,5a,
6,11,12a-октагидро-3,10,12,12a-тетрагидрокси-1,11-диоксо- 9-[[(2-пропениламино)ацетил]амино]-2- нафтаценкарбоксамиддигидрохлорид
E [4S-(4альфа, 12a альфа)]-4,7-бис(диметиламино)-1,4,4a, 5,5a,
6,11,12a-октагидро-3,10,12,12a-тетрагидрокси-1,11-диоксо 9-[[[(2-пиридинилметил)амино]ацетил]амино]-2- нафтаценкарбоксамиддигидрохлорид
F [7S-(7-альфа, 10a альфа)]-N-[9-(аминокарбонил)-4,
7-бис(диметиламино)-5,5a,6,6a, 7,10,10a,12-октагидро-1,8,10a,11-тетрагидрокси-10,12-диоксо-2- нафтаценил]-4-тиоморфолинацетамиддигидрохлорид
G [7S-(7альфа, 10a альфа)]-N-[9-(аминокарбонил)-4,
7-бис(диметиаламино)-5,5a,6,6a, 7,10,10a,12-октагидро-1,8,10a,11-тетрагидрокси-10,12-диоксо-2- нафтаценил]-4-метил-1-пиперидинацетамиддигидрохлорид
H [4S-(4альфа, 12a альфа)]-4,
7-бис(диметиламино)-1,4,4a, 5,5a, 6,11,12a-октагидро-3,10,12,12a-тетрагидрокси-9-[[[(3- метоксипропил)амино] ацетил]амино]-1,11-диоксо-2- нафтаценкарбоксамиддигидрохлорид
I 7[7S-(7альфа, 10a
альфа)]-N-[9-(аминокарбонил)-4,7-бис (диметиламино)-5,5a, 6,6a, 7,10,10a, 12-октагидро-1,8,10a,11 тетрагидрокси-10,12-диоксо-2-нафтаденил]-4-метил-1- пиперазинацетамиддигидрохлорид
J
[4S-(4-альфа, 12a альфа)]-4,7-бис(диметиламино)-9- [[(гептиламино)ацетил] амино] -1,4,4a, 5,5a,6,11,12a-октагидро-3,10,12,12a-тетрагидрокси-1,11-диоксо-2- нафтаценкарбоксамиддигидрохлорид
K
[4S-(4-альфа, 12a альфа)]-9-[[[(циклопропилметил)амино] ацетил]-амино] 4,7-бис(диметиламино)-1,4,4a, 5,5a, 6,11,12a-октагидро-3,10,12,12a-тетрагидрокси-1,
11-диоксо-2- нафтаценкарбоксамиддигидрохлорид
L [4S-(4-альфа, 12a альфа)] -4,7-бис(диметиламино)-1,4,4a, 5,5a, 6,11,12a-октагидро-3,10,12,12a-тетрагидрокси-1,
11-диоксо-9- [[(ундециламино)ацетил]амино]-2-нафтаценкарбоксамиддигидрохлорид
M [4S-(4-альфа, 12a альфа)]-9-[(бромацетил)амино]-4,7-бис (диметиламино)-1,4,4a, 5,5a, 6,11,12a-октагидро-3,10,12,
12a- тетрагидрокси/1,11-диоксо-2-нафтаценкарбоксамиддигидрохлорид
N тетрациклин
O миноциклин
P [4S-(4альфа, 12a альфа)]-4,7-бис(диметиламино)-1,4,4a,5,5a,6,11,
12a-октагидро- 3,10,12,12a-тетрагидрокси-9-[[[(2-гидроксиэтил)амино] ацетил] амино]-1,11-диоксо-2-нафтаценкарбоксамиддигидрохлорид
Q [4S-(4-альфа, 12a альфа)] -4,7-бис(диметиламино)- 1,4,4a,
5,5a, 6,11,12a-октагидро-3,10,12,12a-тетрагидрокси-9-[[[(2- гидроксиэтил)метиламино]ацетил]амино]-1,11-диоксо-2- нафтаценкарбоксамид
R [4S-(4 альфа, 12a альфа)]-4,
7-бис(диметил-4-амино-1-амино) 1,4,4a, 5,5a,6,11,12a-октагидро-3,10,12,12a-тетрагидрокси-9-[[[(4- (гидроксибутил)амино]ацетил]амино]-1,11-диоксо-2-нафтаценкарбоксамид
S [4S-(4 альфа, 12a
альфа)] -4,7-бис(диметиламино)- 1,4,4a, 5,5a, 6,11,12a-октагидро-3,10,12,12a-тетрагидрокси-1,11- диоксо-9-[[[(2,2,2-трифторэтил)амино]ацетил]амино]-2-нафтаценкарбоксамид
T [4S-(4альфа, 12a
альфа)] -4,7-бис(диметиламино)-9- [[[(2-фторэтил)амино] ацетил] амино]-1,4,4a,5,5a,6,11,12a- октагидро-3,10,12,12a-тетрагидрокси-1,11-диоксо-2-нафтаценкарбоксамид
U [4S-(4-альфа, 12a альфа)]
-4,7-бис(диметиламино) -1,4,4a, 5,5a, 6,11,12a-октагидро-3,10,12,12a-тетрагидрокси-1,11- диоксо-9-[[[[2-(пиперидил)этил]амино]ацетил]амино]-2- нафтаценкарбоксамид
V [4S-(4 альфа, 12a альфа)]
-4,7-бис(диметиламино) -1,4,4a, 5,5a, 6,11,12a-октагидро-3,10,12,12a-тетрагидрокси- 9-[[[метил-2-пропиниламино] ацетил]амино]-1,11-диоксо-2- нафтаценкарбоксамид
W [4S-(4 альфа, 12a альфа)]-4,
7-бис(диметиламино) 1,4,4a,5,5a, 6,11,12a-октагидро-3,10,12,12a-тетрагидрокси- гидрокси-1,11-диоксо-9-[[(1-пиперидиниламино)ацетил]амино]-2- нафтаценкарбоксамид
X [4S-(4 альфа, 12a альфа)]-4,
7-бис(диметиламино) 1,4,4a,5,5a, 6,11,12a-октагидро-3,10,12,12a-тетрагидрокси- 1,11-диоксо-9-[[[(фенилметокси)амино]ацетил]амино]-2- нафтаценкарбоксамид.
При использовании соединений в качестве антибактериальных средств они могут быть соединены с одним или несколькими фармацевтически приемлемыми носителями, например растворителями, разбавителями и им подобными веществами, и могут быть введены орально в таких формах, как таблетки, капсулы, диспергируемые порошки, гранулы или суспензии, содержащие, например, примерно от 0,05 до 5% суспендирующего вещества, сиропы, содержащие, например, примерно от 10 до 50% сахара, и эликсиры, содержащие, например, примерно от 20 до 50% этанола, и им подобные вещества, или парентерально в форме стерильных инъектируемых растворов или суспензий, содержащих примерно от 0,05 до 5% суспендирующего вещества, находящегося в изотонической среде. Такие фармацевтические препараты могут содержать, например, примерно от 25 и примерно до 90% активного ингредиента в сочетании с носителем, содержание которого по весу чаще всего составляет примерно от 5 до 60%.
Эффективно действующее количество соединения в пределах от 2,0 мг на 1 кг веса тела и до 100,0 мг на 1 кг веса тела должно вводиться от одного до пяти раз при любом типичном способе приема, включая, но не ограничиваясь этим, оральный, парентеральный (включая подкожные, внутривенные, внутримышечные, интрастернальные инъекции или способы введения посредством вливания), локальный или ректальный, при рецептурах состава для разового приема, содержащих обычные нетоксичные фармацевтически приемлемые носители, адъюванты и наполнители. Следует, однако, понимать, что конкретная величина дозы и частота приема в отношении пациента могут колебаться и зависят от различных факторов, включая активность специфического применяемого соединения, метаболическую стабильность и продолжительность действия такого препарата, возраст, вес тела, общее состояние, пол, режим питания, способ и время введения, скорость экскреции, сочетание принимаемых лекарственных средств, остроту данного состояния и характер проводимой терапии.
Эти активные соединения могут быть введены орально, а также внутривенным, внутримышечным или подкожным способами. К твердым носителям относятся крахмал, лактоза, двухкальциевый фосфат, микрокристаллическая целлюлоза, сахароза и каолин, тогда как к жидким носителям относятся стерильная вода, полиэтиленгликоли, нетоксичные поверхностно-активные вещества и съедобные масла, такие как кукурузное, арахисовое и кунжутное масло, которые используются с учетом природы активного ингредиента и принятой конкретной формы введения. Могут быть с успехом введены адъюванты, обычно применяемые при приготовлении фармацевтических составов, такие как пахучие вещества, окрашивающие вещества, консервирующие вещества и антиокислители, например витамин E, аскорбиновая кислота, 2,6-ди-трет-бутил-п-крезол (ВНТ) и трет-бутил-4-метоксифенол (ВНА).
Предпочтительными фармацевтическими составами с точки зрения простоты приготовления и введения являются твердые составы, в частности таблетки или капсулы, наполненные твердым или жидким веществом. Оральный способ введения соединений является предпочтительным.
Эти активные соединения могут быть также введены парентерально или интраперитонеально. Растворы или суспензии этих активных соединений, таких как свободное основание или фармакологически приемлемая соль, могут быть приготовлены в гликоле, жидкости, полиэтиленгликолях и смесях таковых в маслах. При обычных условиях хранения и использования эти препараты содержат консервант, препятствующий росту микроорганизмов.
К фармацевтическим формам, пригодным для инъекционного использования, относятся стерильные водные растворы или дисперсии и стерильные порошки, предназначенные для мгновенного приготовления стерильных инъекционных растворов или дисперсий. Во всех случаях форма должна быть стерильной и должна быть текучей в той мере, в какой обеспечивается легкость забора шприцом. Форма должна быть стабильной в условиях производства и хранения и должна быть защищена от загрязняющего воздействия микроорганизмов, таких как бактерии и грибки. Носитель может представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль), подходящие смеси таковых и растительное масло.
Полнее изобретение будет описано с использованием следующих специфических примеров, которые не направлены на ограничение рамок изобретения.
Пример 1
[4S-(4альфа, 12a альфа)]-9-[(хлорацетил)амино]-4,7-бис (диметиламино)-1,4,4a, 5,5a, 6,
11,12a-октагидро-3,10,12,12a- тетрагидрокси-1,11-диоксо-2-нафтаденкарбоксиамиддигидрохлорид
К находящемуся при комнатной температуре раствору, содержащему 0,334 г 9-амино-4,
7-бис(диметиламино)-6-диметил-6- дезокситетрациклиндисульфата, 6 мл 1,3-диметил-3,4,5,6-тетрагидро-2(1H)-пиримидинона, называемого далее ДМПУ, и 2 мл ацетонитрила, добавляли 0,318 г карбоната натрия.
Смесь перемешивали в течение 5 мин, после чего добавляли 0,068 г хлорацетилхлорида. Реакционную смесь перемешивали в течение 30 мин, фильтровали, и фильтрат по каплям добавляли к 100 мл простого
диэтилового эфира, содержащего 1 мл 1М хлористоводородной кислоты в виде раствора в простом диэтиловом эфире. Результирующее твердое вещество собирали и сушили, в результате чего получали 0,340 г
требуемого промежуточного соединения. Методом масс-спектрометрии (бомбардировка быстрыми атомами) установлено, что отношение массы к заряду m/z составляет 549 (M + H (молекулярное образование и
водород)).
Пример 2
[4S-(4альфа, 12a альфа)]-9-[(бромацетил)амидо]-4,7-бис (диметиламино)-1,4,4a, 5,5a, 6,11,12a-октагидро-3,10,12,12a- тетрагидрокси-1,
11-диоксо-2-нафтаценкарбоксиамидмоногидробромид
Названное соединение готовили по методике примера 1, используя 6,68 г 9-амино-4,7-бис(диметиламино)-6-диметил-6- дезокситетрациклиндисульфата,
50 мл, 1,3-диметил-3,4,5,6- тетрагидро-2(1H)пиримидинона, 30 мл ацетонитрила, 6,68 г карбоната натрия и 0,215 г бромистого бромацетила. Получили 5,72 г требуемого промежуточного соединения. Методом
масс-спектрометрии (бомбардировка быстрыми атомами) установлено, что отношение массы к заряду m/z составляет 593 (M + H (молекулярное образование, удерживающее водород)).
Пример 3
[4S-(4альфа,12a альфа)]-9-[(2-бром-1-оксопропил)амино]-4,7- бис(диметиламино)-1,4,4a, 5,5a, 6,11,12a-октагидро-3,10,12,12a- тетрагидрокси-1,11-диоксо-2-нафтаценкарбоксамидсульфат
Названное соединение готовили по методике примера 1, используя 1,00 г 9-амино-4,7-бис(диметиламино)-6-диметил-6- дезокситетрациклиндисульфата, 1,0 г карбоната натрия и 0,648 г бромистого
2-бромпропионила, в результате чего получили 0,981 г требуемого продукта. Методом масс-спектрометрии (бомбардировка быстрыми атомами) установлено, что отношение массы к заряду m/z составляет 607 (M +
H (молекулярное образование, удерживающее водород)).
Пример 4
[4S-(4альфа, 12a альфа)]-9-[(4-бром-1-оксобутил)амино]- 4,7-бис(диметиламино)-1,4,4a, 5,5a, 6,11,12a-октагидро- 3,
10,12,12a-тетрагидрокси-1,11-диоксо-2- нафтаценкарбоксиамиддигидрохлорид
Названное соединение готовили по методике примера 1, используя 1,34 г 9-амино-4,
7-бис(диметиламино)-6-диметил-6- дезокситетрациклиндисульфата, 1,3 г карбоната натрия, 24 мл 1,3-диметил-3,4,5,6-тетрагидро-2(1H)пиримидинона, 8 мл ацетонитрила и 0,389 г хлористого 4-бромбутирила, в
результате чего получали 1,45 г требуемого продукта.
Пример 5
[7S-(7 альфа, 10a альфа)]-N-[9-(аминокарбонил)-4,7-бис (диметиламино)-5,5a, 6,7,10a, 12-октагидро-1,8,10a,
11-тетрагидрокси- 10,12-диоксо-2-нафтаценил]-1-трифторацетил)-2- пирролидинкарбоксамиддигидрохлорид
Названное соединение готовили по методике примера 1, используя 0,334 г 9-амино-4,
7-бис(диметиламино)-6-диметил-6- дезокситетрациклиндисульфата, 10 мл 1,3-диметил-3,4,5,6-тетрагидро-2(1H)пиримидинона, 2 мл ацетонитрила, 0,34 г карбоната натрия и 7,5 мл 0,1М хлористого
(S)-(-)-N-(трифторацетил) пролила, в результате чего получали 0,292 г требуемого продукта. Методом масс-спектрометрии (бомбардировка быстрыми атомами) установлено, что отношение массы к заряду m/z
составляет 666 (M + H (молекулярное образование, удерживающее водород)).
Пример 6
[4S-(4альфа, 12a альфа)]-9-[[[(циклопропилметил)амино]- ацетил]-амино] -4,
7-бис(диметиламино)-1,4,4a, 5,5a, 6,11,12a- октагидро-3,10,12,12a-тетрагидрокси-1,11-диоксо-2- нафтаценкарбоксамиддигидрохлорид
Смесь, содержащую 0,20 г продукта, взятого из примера 2, 0,50 г
(аминометил) циклопропана и 5 мл 1,3-диметил-3,4,5,6-тетрагидро-2(1H) пиримидинона, перемешивали в среде аргона при комнатной температуре в течение 1 ч. Избыточный амин удаляли в вакууме, и остаток
разбавляли небольшим объемом метилового спирта. Разбавленный реакционный раствор по каплям добавляли к смеси простого диэтилового эфира с 5 мл 2-пропанола. Хлористоводородную кислоту с концентрацией
1М, находящуюся в диэтиловом простом эфире, добавляли до образования твердого вещества. Результирующее твердое вещество собирали и сушили, в результате чего получали 0,175 г требуемого продукта.
Методом масс-спектрометрии (бомбардировка быстрыми атомами) установлено, что отношение массы к заряду m/z составляет 584 (M + H (молекулярное образование, удерживающее водород)).
В основном по способам, подробно описанным выше в примере 6, готовили соединения, отвечающие настоящему изобретению, которые перечислены ниже в примерах 7 - 16 9см. табл. 3).
Пример 7
[4S-(альфа, 12a альфа)]-9-[[[(2,2-диэтоксиэтил)амино]ацетил]- амино]-4,7-бис(диметиламино)1,4,4a, 5,5a, 6,11,12a-октагидро- 3,10,12,12a-тетрагидрокси-1,
11-диоксо-2-нафтаценкарбоксамиддигидрохлорид
Пример 8
[4S-(4альфа, 12a альфа)]-4,7-бис(диметиламино)-1,4,4a,5,5a,6,11,12a-октагидро- 3,10,12,
12a-тетрагидрокси-9-[[[2-(метоксиэтил)амино] ацетил]амино]- 1,11-диоксо-2-нафтаденкарбоксамиддигидрохлорид
Пример 9
[4S-(4альфа, 12a альфа)]-4,7-бис(диметиламино)-1,4,4a,5,5a, 6,11,
12a-октагидро-3,10,12,12a-тетрагидрокси-1,11-диоксо-9- [[(2-пропениламино)ацетил]амино]-2-нафтаценкарбоксамиддигидрохлорид
Пример 10
[4S-(4альфа, 12a альфа)]-4,7-бис(диметиламино)-1,
4a,4,5, 5a,6,11,12a-октагидро-3,10,12,12a-тетрагидрокси-9-[[[(3- метоксипропил)амино] ацетил] амино]-1,11-диоксо-2- нафтаценкарбоксамиддигидрохлорид
Пример 11
[7S-(7альфа, 10a
альфа)]-N-[9-(аминокарбонил)-4,7-бис (диметиламино)-5,5a, 6,6a, 7,10,10a,12-октагидро-1,8,10a,11- тетрагидрокси-10,12-диоксо-2-нафтаценил]-4- тиоморфолинацетамиддигидрохлорид
Пример 12
[7S-(7альфа, 10a альфа)]-N-[9-(аминокарбонил)-4,7-бис (диметиламино)-5,5a, 6,6a, 7,10,10a,12-октагидро-1,8,10a,11- тетрагидрокси-10,
12-диоксо-2-нафтаценил]-4-метил-1- пиперидинацетамиддигидрохлорид
Пример 13
[7S-(7альфа, 10a альфа)]-N-[9-(аминокарбонил)-4,7-бис (диметиламино)-5,5a, 6,6a, 7,10,10a,12-октагидро-1,8,
10a,11- тетрагидрокси-10,12-диоксо-2-нафтаценил]-4-метил-1- пиперазинацетамиддигидрохлорид
Пример 14
[4S-(4альфа, 12a альфа)] -4,7-бис(диметиламино)-9-[[(гептил- амино)ацетил] амино]
-1,4,4a, 5,5a,6,11,12a-октагидро-3,10,12,12a- тетрагидрокси-1,11-диоксо-2-нафтаценкарбоксамиддигидрохлорид
Пример 15
[4S-(4-альфа, 12a альфа)]-4,7-бис(диметиламино)- 1,4,4a,5,5a,6,11,
12a-октагидро-3,10,12,12a-тетрагидрокси-1,11- диоксо-9-[[(ундециламино)ацетил] амино]-2- нафтаценкарбоксамиддигидрохлорид
Пример 16
[4S-(4-альфа, 12a альфа)]-4,7-бис(диметиламино)- 1,
4,4a,5,5a,6,11,12a-октагидро-3,10,12,12a-тетрагидрокси-1,11- диоксо-9-[[[(2-пиридинилметил)амино]ацетил]амидо]-2- нафтаценкарбосамиддигидрохлорид
Пример 17
[4S-(4альфа, 12a альфа)]
-4,7-бис(диметиламино)-1,4,4a,5,5a,6,11,12a-октагидро- 3,10,12,112a-тетрагидрокси-9-[[[(2-гидроксиэтил)амино] ацетил] амино]- 1,11-диоксо-2-нафтаценкарбоксамидмоногидрохлорид
К раствору,
содержащему 0,10 г продукта, взятого из примера 7А, который находился в 2 мл 1,3-диметил-2-имидазолидинона, добавляли 0,70 мл 2-амино-1-этанола. Раствор перемешивали при комнатной температуре в
течение 20 мин, добавляли к 100 мл простого диэтилового эфира, и результирующий осадок собирали, в результате чего получали 0,055 г требуемого продукта. Методом масс-спектрометрии (бомбардировка
быстрыми атомами) установлено, что отношение массы к заряду m/z составляет 574 (M+ + H (молекулярное образование, удерживающее водород)). В основном по способу, подробно описанному выше в примере 17,
готовили соединения, отвечающие настоящему изобретению, которые перечислены ниже в примерах 18 - 24 (см. табл. 4).
Пример 18
[4S-(4альфа, 1a альфа)] -4,7-бис(диметиламино)- 1,
4,4a,5,5a,6,11,12a-октагидро-3,10,12,12a-тетрагидрокси-9- [[[(2-гидроксиэтил)метиламино]ацетил] амино]-1,11-диоксо-2- нафтаценкарбоксамид
Пример 19
[4S-(4альфа, 12a альфа)]-4,
7-бис(диметиламино)- 1,4,4a,5,5a,6,11,12a-октагидро-3,10,12,12a-тетрагидрокси-9- [[[(4-(гидроксибутил)амино] ацетил] амино]-1,11-диоксо-2- нафтаденкарбоксамид
Пример 20
[4S-(4альфа,
12a альфа)]-4,7-бис(диметиламино)- 1,4,4a,5,5a,6,11,12a-октагидро-3,10,12,12a-тетрагидрокси-1,11- диоксо-9-[[(2,2,2-трифторэтил)амино]ацетил]-2-нафтаценкарбоксамид
Пример 21
[4S-(4
альфа, 12a альфа)]-4,7-бис(диметиламино)-9-[[[(2- фторэтил)амино] ацетил] амино] -1,4,4a, 5,5a,6,11,12a-октагидро- 3,10,12,12a-тетрагидрокси-1,11-диоксо-2-нафтаценкарбоксамид
Пример 22
[4S-(4альфа, 12a альфа)]-4,7-бис(диметиламино)- 1,4,4a,5,5a,6,11,12a-октагидро-3,10,12,12a-тетрагидрокси-1,11- диоксо-9-[[[[(2-(1-пиперидинил)этил]амино]ацетил]амино]-2- нафтаценкарбоксамид
Пример 23
[4S-(4альфа, 12a, альфа)]-4,7-бис(диметиламино)- 1,4,4a,5,5a,6,11,12a-октагидро-3,10,12,12a-тетрагидрокси-9- [[[метил-2-пропиламино]ацетил]амино] -1,
11-диоксо-2- нафтаценкарбоксамид
Пример 24
[4S-(4 альфа, 12a альфа)]-4,7-бис(диметиламино)- 1,4,4a,5,5a,6,11,12a-октагидро-3,10,12,12a-тетрагидрокси-1,
11- диоксо-9-[[(1-пиперидиниламино)ацетил]амино]-2- нафтаценкарбоксамид
Пример 25
[4S-(4альфа, 12a альфа)] -4,7-бис(диметиламино)- 1,4,4a,5,5a,6,11,12a-октагидро-3,10,12,
12a-тетрагидрокси-1,11- диоксо-9-[[[(фенилметокси)амино] ацетил]амино]-2- нафтаценкарбоксамид
К 0,50 г о-бензилгидроксиламина и 2,5 мл 1,3-диметил-2-имидазолидинона добавляли 0,80 г
бикарбоната натрия. Смесь перемешивали при комнатной температуре в течение 2 ч, фильтровали, и фильтрат добавляли к 0,10 г продукта, взятого из примера 7А. Реакционный раствор перемешивали при
комнатной температуре в течение 2 ч и затем добавляли к 100 мл простого диэтилового эфира. Результирующий осадок собирали и сушили, в результате чего получали 0,90 г требуемого продукта. Методом
масс-спектрометрии (бомбардировка быстрыми атомами) установлено, что отношение массы к заряду m/z составляет 636 (M + H) (молекулярное образование, удерживающее водород).
Примеры препаративных форм фармацевтической композиции.
1. Раствор для инъекций
Ингредиенты - Количество
Соединение примера 6 - 110 мг
Вода для инъекций - 5 мл
Высушенное вымораживанием активное соединение в ампулах разводят водой для инъекций, pH раствора 2,0 - 2,8.
2. Твердые желатиновые капсулы
Ингредиенты - Количество
Соединение примера 17 - 50 мг
Микрокристаллическая целлюлоза - 70
Желатин - 25
Диоксид титана - 3,5
Красители (Blue 1, Yellow 10) - 1,5
Всего
- 100р
Реферат
6-Деметил-6-дезокситетрациклины формулы 1, где R - галоген или NR1R2, когда R1 - водород, R2 - метил, этил, н-пропил, и когда R1 - метил или этил, R2 - метил, этил, н-пропил, н-бутил; R3 - водород, С4-8 - алкил, R4 - водород, метил, этил; W - гидроксиламино, C7-12 - алкил-монозамещенной аминогруппы или R3 и W, взятые вместе, представляют -(CH2)n(R5)N-, n=3; R5 - трифторацетил или их фармацевтически приемлемые соли или комплексы металлов. Соединения 1 обнаруживают антибиотическую активность в отношении широкого спектра организмов, включая организмы, которые являются резистентными к тетрациклинам и являются полезными в качестве антибиотических средств. 6 с. и 5 з.п. ф-лы, 4 табл.
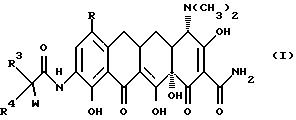
Формула
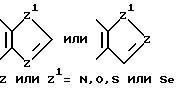
где R представляет сбой галоген, выбранный из брома, хлора, фтора или йода, или группу NR1R2 и, когда R представляет группу NR1R2 и R1 представляет собой водород, R2 представляет собой метильную, этильную, н-пропильную группу, и когда R1 представляет собой метильную или этильную группу, R2 представляет собой метильную, этильную, н-пропильную, н-бутильную группу;
R3 выбирают из группы, включающей водород, (С4 - С8)алкильную группу с прямой или разветвленной цепью, выбранную из бутила, изобутила, пентила, карбоксил (С1 - С8)алкильную группу;
R4 выбирают из водорода, метила или этила; когда R3 не тождественен R4, стереохимия асимметричного углерода (т.е.углерода, несущего заместитель W) может отвечать либо рацемату (DL), либо индивидуальным энантиомерам (L или D);
W выбран из гидроксиламино; (С7 - С12) алкил (с прямой или разветвленной цепью)монозамещенной аминогруппы, причем заместители выбраны из гептила, октила, ундецила и диастереомеров и энантиомеров упомянутой разветвленной алкил монозамещенной аминогруппы; (С1 - С4) фторалкиламиногруппы с прямой или разветвленной цепью, выбранной из трифторметила, 2,2,2-трифторэтила; аминогруппы, монозамещенной циклопропилом, пропенилом; 2-фенилэтиламиногруппы, замещенной (С6 - С10) арил монозамещенной аминогруппы (заместители выбраны из (С1 - С4)-алкокси, (С1 - С4)алкоксикарбонила; (С2 - С8 )-азациклоалкильной и замещенной (С2 - С8)азациклоалкильной группы, причем заместители выбраны из 4-метилпиперидина, 4-гидроксипиперидина; 2-(С1 - С3 )алкилпиперазинила; тиоморфолинила; 2-пиридилметиламиногруппы; бензилоксиаминогруппы;
или R3 и W, взятые вместе, представляют -(CH2)n(R5)N-, где n равно трем, где R5 является трифторацетилом,
или их фармакологически приемлемые органические или неорганические соли, или комплексы металлов.

где Y выбран из (CH2)nX, n = 0, 1, Х представляет собой галоген, выбранный из брома, хлора, фтора или йода;
R представляет собой группу -NR1R2, где R1 представляет собой водород, метил, этил,
R2 представляет собой метил, этил, н-пропил;
R3 выбран из водорода, прямой или разветвленной (С4 - С8)-алкильной группы, выбранной из бутила, изобутила, пентила, карбоксил (С1 - С8)алкильной группы;
R4 выбран из водорода, метила, этила, пропила; когда R3 не идентичен R4, стереохимия асимметричного углерода (т.е. углерода, несущего заместитель Y) может отвечать либо рацемату (DL), либо индивидуальным энантиомерам (L или D),
или его фармакологически приемлемые органические или неорганические соли, или комплексы металлов.
[4S-(4альфа, 12а альфа)]-9-[[[(циклопропилметил амино]-ацетил]амино]-4,7-бис(диметиламино)-1,4,4а, 5,5а, 6,11,12а-октагидро-3,10,12,12а-тетрагидрокси-1, 11-диоксо-2-нафтаценкарбоксамид дигидрохлорид;
[4S-(4альфа, 12а альфа)]-9-[[[(2,2-диэтоксиэтил)амино]-ацетил]амино]-4,7-бис(диметиламино)-1,4,4а, 5,5а, 6,11,12а-октагидро-3,10,12, 12а-тетрагидрокси-1,11-диоксо-2-нафтаценкарбоксамид дигидрохлорид;
[4S-(4альфа, 12а альфа)]-4,7-бис(диметиламино)-1,4,4а,5,5а,6,11,12а-октагидро-3,10,12, 12а-тетрагидрокси-9-[[[2-(метоксиэтил)амино] ацетил] амино-1,11-диоксо-2-нафтаценкарбоксамид дигидрохлорид;
[4S-(4альфа, 12а альфа)]-4,7-бис(диметиламино)-1,4,4а,5,5а,6,11,12а-октагидро-3,10, 12,12а-тетрагидрокси-1,11-диоксо-9-[[(2-пропениламино)ацетил] амино]-2-нафтаценкарбоксамид дигидрохлорид;
[4S-(4альфа, 12а альфа)]-4,7-бис(диметиламино)-1,4,4а,5,5а,6,11,12а-октагидро-3,10,12, 12а-тетрагидрокси-9-[[[(3-метоксипропил)амино] ацетил]амино] -1,11-диоксо-2-нафтаценкарбоксамид дигидрохлорид;
[7S-(7альфа, 10а альфа)] -N-[9-(аминокарбонил)-4,7-бис(диметиламино)-5,5а,6,6а,7, 10,10а,12-октагидро-1,8,10а,11-тетрагидрокси-10,12,-диоксо-2-нафтаценил]-4-тиоморфолинацетамид дигидрохлорид;
[7S-(7 альфа, 10а альфа)]-N-[9-(аминокарбонил)-4,7-бис(диметиламино)-5,5а, 6,6а, 7,10,10а, 12-октагидро-1,8,10а,11-тетрагидрокси-10,12-диоксо-2-нафтаценил]-4-метил-1-пиперидинацетамид дигидрохлорид;
[7S-(7альфа, 10а альфа)] -N-[9-(аминокарбонил)-4,7-бис(диметиламино)-5,5а, 6,6а,7,10,10а,12-октагидро-1,8,10а,11-тетрагидрокси-10,12,-диоксо-2-нафтаценил]-4-метил-1-пиперазинацетамид дигидрохлорид;
[4S-(4альфа, 12а альфа)]-4, 7-бис(диметиламино)-9-[[(гептиламино)ацетил] амино] -1,4,4а, 5,5а,6,11,12а-октагидро-3,10,12а-тетрагидрокси-1,11-диоксо-2-нафтаценкарбоксамид дигидрохлорид;
[4S-(4альфа, 12а альфа)]-4, 7-бис(диметиламино)-1,4,4а,5,5а,6,11,12а-октагидро-3,10,12,12а-тетрагидрокси-1,11-диоксо-9-[[(ундециламино)ацетил] амино]-2-нафтаценкарбоксамид дигидрохлорид;
[4S-(4альфа, 12а альфа)]-4, 7-бис(диметиламино)-1,4,4а,5,5а,6,11,12а-октагидро-3,10,12,12а-тетрагидрокси-1,11-диоксо-9-[[[(2-пиридинилметил)амино] ацетил]амино]-2-нафтаценкарбоксамид дигидрохлорид;
[4S-(4альфа, 12а альфа)]-4,7-бис(диметиламино)-1,4,4а,5,5а,6,11,12а-октагидро-3,10,12,12а-тетрагидрокси-9-[[[(2-гидроксиэтил)амино] ацетил] амино] -1,11-диоксо-2-нафтаценкарбоксамид моногидрохлорид;
[4S-(4альфа, 12а альфа)]-4,7-бис(диметиламино)-1,4,4а,5,5а,6,11,12а-октагидро-3,10,12,12а-тетрагидрокси-9-[[[(2-гидроксиэтил)метиламино] ацетил] амино]-1,11-диоксо-2-нафтаценкарбоксамид;
[4S-(4альфа, 12а альфа)]-4,7-бис(диметиламино)-1,4,4а,5,5а,6,11,12а-октагидро-3,10,12,12а-тетрагидрокси-9-[[[(4-гидроксибутил)амино] ацетил]амино] -1,11-диоксо-2-нафтаценкарбоксамид;
[4S-(4альфа, 12а альфа)]-4,7-бис(диметиламино)-1,4,4а,5,5а,6,11,12а-октагидро-3,10,12,12а-тетрагидрокси-1,11-диоксо-9-[[(2,2,2-трифторэтил)амино] -2-нафтаценкарбоксамид;
[4S-(4альфа, 12а альфа)]-4,7-бис(диметиламино)-9-[[[(2-фторэтил)амино] ацетил] амино] -1,4,4а, 5,5а, 6,11,12а-октагидро-3,10,12,12а-тетрагидрокси-1,11-диоксо-2-нафтаценкарбоксамид;
[4S-(4альфа, 12а альфа)]-4, 7-бис(диметиламино)-1,4,4а,5,5а,6,11,12а-октагидро-3,10,12,12а-тетрагидрокси-1,11-диоксо-9-[[[(2-(1-пиперидинил)этил] ацетил]амино-2-нафтаценкарбоксамид;
[4S-(4альфа, 12а альфа)]-4, 7-бис(диметиламино)1,4,4а,5,5а,6,11,12а-октагидро-3,10,12,12а-тетрагидрокси-9-[[[метил-2-пропиниламино] ацетил] амино]-1,11-диоксо-2-нафтаценкарбоксамид;
[4S-(4альфа, 12а альфа)]-4, 7бис(диметиламино)-1,4,4а,5,5а,6,12а-октагидро-3,10,12,14а-тетрагидрокси-гидрокси-1,11-диоксо-9-[[(1-пиперидиниламино)ацетил]амино]-2-нафтаценкарбоксамид; или
[4S-(4альфа, 12а альфа)]-4, 7-бис(диметиламино)-1,4,4,4а,5,5а,6,11,12а-октагидро-3,10,12,12а-тетрагидрокси-1,11-диоксо-9-[[[(фенилметокси)амино] ацетил]амино]-2-нафтаценкарбоксамид.
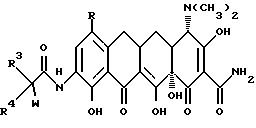
где R

отличающийся тем, что 9-[(галоидацил)амидо]-7-(замещенный)-6-деметил-6-дезокситетрациклин, или его органическую или неорганическую соль, или комплекс металла формулы
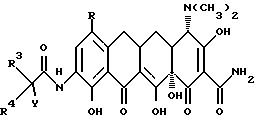
где R, R3 и R4 такие, как определены в п.3,
подвергают взаимодействию с нуклеофильным соединением формулы WH, где W имеет значения, определенные в п.1, в полярном апротонном растворителе и в атмосфере инертного газа.

где R, R3 и R4 такие, как определены в п.3,
отличающийся тем, что 9-амино-7-(замещенный)-6-диметил-6-дезокситетрациклин, или его органическую или неорганическую соль, или комплекс металла формулы
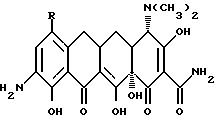
подвергают подвергают взаимодействию с галоидацильным галогенидом с прямой или разветвленной цепью формулы

где Y, R3 и R4 имеют значения, определенные в п.1;
Q представляет собой галоген, выбранный из брома, хлора, йода и фтора,
в инертном растворителе, в полярном апротонном растворителе и в присутствии основания.

Комментарии