Оксистеролы и способы их применения - RU2744267C2
Код документа: RU2744267C2
Описание
Родственные заявки
По данной заявке испрашивается приоритет согласно предварительным заявкам США номер 62/189048, поданной 6 июля 2015, и 62/280394, поданной 19 января 2016, содержание каждой из которых включено в данное описание посредством ссылки во всей своей полноте.
Предпосылки создания изобретения
NMDA рецепторы представляют собой гетеромерные комплексы, содержащие NR1, NR2 и/или NR3 субъединицы и обладают особыми сайтами распознавания экзогенных и эндогенных лигандов. Эти сайты распознавания включают сайты связывания глицина и агонистов и модуляторов глутамата. NMDA рецепторы экспрессированы в периферических тканях и ЦНС, где они участвуют в синаптической передаче возбуждения. Активация этих рецепторов способствует синаптической пластичности в некоторых обстоятельствах и эксайтотоксичности в других. Эти рецепторы представляют собой лиганд-управляемые ионные каналы, которые распознают Ca2+ после связывания глутамата и глицина, и являются основополагающими для стимулирования нейротрасмиссии и нормального функционирования ЦНС. Позитивные модуляторы могут быть полезны в качестве терапевтических средств с потенциалом клинического использования в качестве усилителей познавательных функций и при лечении психических расстройств, при которых глутаматергическая передача снижена или нарушена (см., например, Horak et al., J. of Neuroscience, 2004, 24(46), 10318-10325). В противоположность этому, негативные модуляторы могут быть полезны в качестве терапевтических средств с потенциалом клинического использования при лечении психических расстройств, при которых глутаматергическая передача патологически увеличена (например, при лечении устойчивой депрессии).
Оксистеролы являются производными холестерина, и было доказано, что они эффективно и селективно модулируют функции NMDA-рецепторов. Существует необходимость в новых и улучшенных оксистеролах, модулирующих NMDA-рецепторы, для профилактики и лечения состояний, связанных с экспрессией и функцией NMDA. Соединения, композиции и способы, описанные в данном описании, направлены на эту цель
Сущность изобретения
В настоящем изобретении предоставлены замещенные оксистеролы, полезные при профилактике и/или лечении широкого спектра расстройств, включая, но, не ограничиваясь ими, NMDA-опосредованные расстройства. Эти соединения, как ожидается, показывают повышенную потенциальную возможность in vivo, фармакокинетические свойства (PK), биодоступность, формулируемость, стабильность и безопасность, по сравнению с другими оксистеролами. Далее представлены фармацевтические композиции, содержащие соединения настоящего изобретения, и способы их применения и лечения.
В одном из аспектов, представленных в данном описании, обеспечены соединения, соответствующие формуле (I):

или их фармацевтически приемлемая соль, где: R1 представляет собой C1-6алкил; каждый из R2 и R3 независимо представляет собой водород, C1-6алкил или карбоциклил; или R2 и R3, вместе с атомом углерода, к которому они присоединены, образуют 3-8-членное кольцо; R6 отсутствует или представляет собой водород; каждый из R7 и R8 независимо представляет собой водород, галоген, C1-6алкил или карбоциклил; или каждый из R7 и R8, вместе с атомом углерода, к которому они присоединены, образуют 3-8-членное кольцо; или R2 и R7, вместе с атомами углерода, к которым они присоединены, образуют 3-8-членное кольцо; n равен 1, 2 или 3; и




В некоторых вариантах осуществления R1 представляет собой замещенный C1-6алкил. В некоторых вариантах осуществления R1 представляет собой незамещенный C1-6алкил. В некоторых вариантах осуществления R1 представляет собой метил (например, -CHF2, -CH3, -CF3, -CH2OCH3 или -CH2OCH2CH3), этил или изопропил. В некоторых вариантах осуществления R1 представляет собой -CH3. В некоторых вариантах осуществления R1 представляет собой этил.
В некоторых вариантах осуществления каждый из R2 и R3 независимо представляет собой водород, C1-6алкил или карбоциклил, и когда R2 и R3 взяты вместе с атомом углерода, к которому они присоединены, образуют 3-8-членное кольцо. В некоторых вариантах осуществления 3-8-членное кольцо представляет собой карбоциклильное кольцо (например, циклопропил). В некоторых вариантах осуществления каждый из R2 и R3 независимо представляет собой водород, C1-6алкил или карбоциклил. В некоторых вариантах осуществления каждый из R2 и R3 независимо представляет собой водород, метил (например, -CH3, -CF3), этил (например, -CH2CH3, CH2CF3), пропил, изопропил, циклопропил или бутил.
В некоторых вариантах осуществления R2 представляет собой замещенный C1-6алкил. В некоторых вариантах осуществления R2 представляет собой незамещенный C1-6алкил.
В некоторых вариантах осуществления R2 представляет собой водород, метил (например, -CH3, -CF3), этил или изопропил-.
В некоторых вариантах осуществления R3 представляет собой замещенный C1-6алкил. В некоторых вариантах осуществления R3 представляет собой незамещенный C1-6алкил.
В некоторых вариантах осуществления R3 представляет собой метил (например, -CH3, -CF3), этил (например, -CH2CH3, CH2CF3), пропил, изопропил, циклопропил или бутил.
В некоторых вариантах осуществления R2 и R3 представляют собой водород. В некоторых вариантах осуществления R2 представляет собой водород, и R3 представляет собой C1-6алкил (например, метил (например, -CH3, -CF3), этил, изопропил). В некоторых вариантах осуществления R2 представляет собой C1-6алкил, и R3 представляет собой C1-6алкил. В некоторых вариантах осуществления R2 и R3 представляют собой -CH3. В некоторых вариантах осуществления R2 представляет собой -CH3, и R3 представляет собой -CF3. В некоторых вариантах осуществления R2 представляет собой -CH3, и R3 представляет собой этил. В некоторых вариантах осуществления R2 представляет собой -CH3, и R3 представляет собой изопропил.
В некоторых вариантах осуществления каждый из

В некоторых вариантах осуществления R6 представляет собой водород. В некоторых вариантах осуществления R6 находится в альфа положении. В некоторых вариантах осуществления R6 находится в бета положении.
В некоторых вариантах осуществления R6 отсутствует.
В некоторых вариантах осуществления R7 и R8 представляют собой водород.
В некоторых вариантах осуществления n равен 1. В некоторых вариантах осуществления n равен 1, и R7 и R8 представляют собой водород.
В некоторых вариантах осуществления n равен 2. В некоторых вариантах осуществления n равен 2, и каждый из R7 и R8 независимо представляет собой водород, галоген, C1-6алкил или карбоциклил.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (II):

или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (II) представляет собой соединение формулы (II-A) или формулы (II-B):

или их фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (II-B-i) или формулы (II-B-ii):

или их фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (II-B-iii):

или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (III):

или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (III) представляет собой соединение формулы (III-A) или формулы (III-B):


или их фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (III-B) представляет собой соединение формулы (III-C) или формулы (III-D):
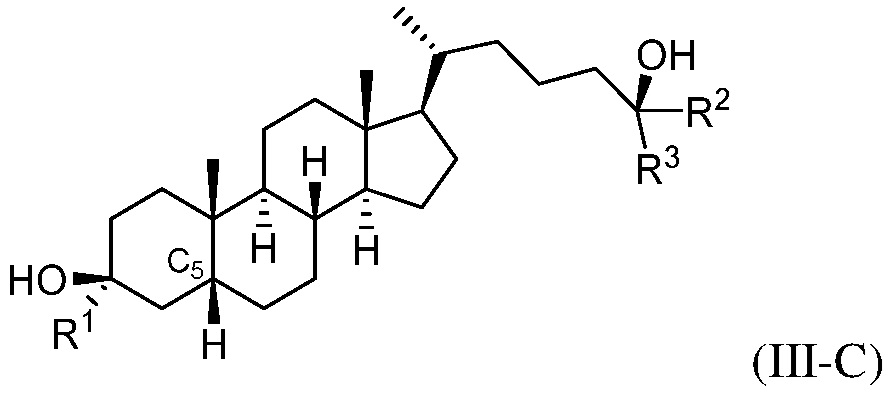
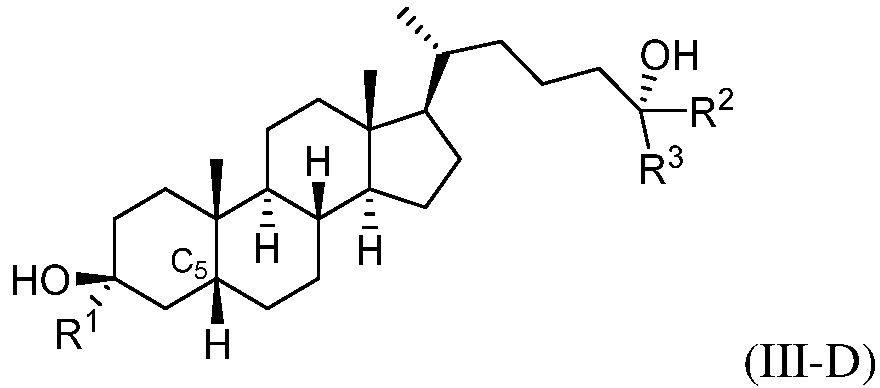
или их фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (III-A) представляет собой соединение формулы (III-E) или формулы (III-F):

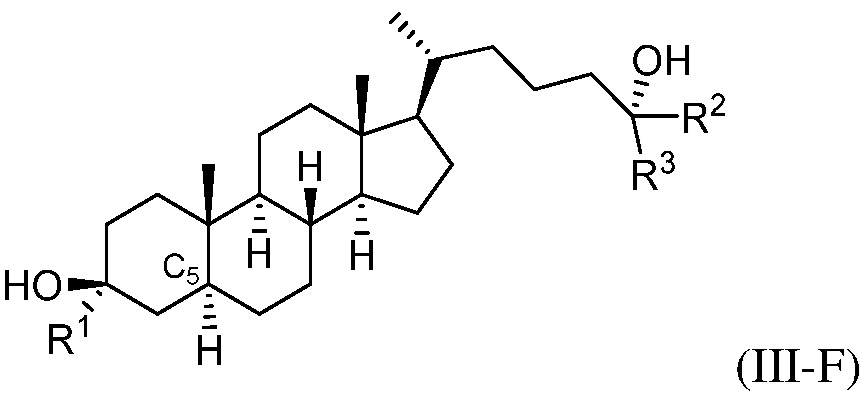
или их фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (III) представляет собой соединение формулы (III-A-i-a) или формулы (III-B-i-a):


или их фармацевтически приемлемую соль.
В некоторых вариантах осуществления R1 представляет собой метил (например, -CHF2, -CF3, -CH2OCH3 или -CH2OCH2CH3), этил или изопропил.
В некоторых вариантах осуществления каждый из R2 и R3 независимо представляет собой водород, C1-6алкил или карбоциклил, и когда R2 и R3 взяты вместе с атомом углерода, к которому они присоединены, образуют 3-8-членное кольцо.
В некоторых вариантах осуществления каждый из R2 и R3 независимо представляет собой водород, C1-6алкил или карбоциклил.
В некоторых вариантах осуществления каждый из R2 и R3 независимо представляет собой водород, метил (например, -CH3, -CF3), этил (например, -CH2CH3, -CH2CF3), пропил, изопропил, циклопропил или бутил.
В некоторых вариантах осуществления R2 представляет собой водород, метил (например, -CH3, -CF3) или этил.
В некоторых вариантах осуществления R3 представляет собой метил (например, -CH3, -CF3), этил (например, -CH2CH3, -CH2CF3), пропил, изопропил, циклопропил или бутил.
В некоторых вариантах осуществления соединение выбрано из группы, состоящей из:
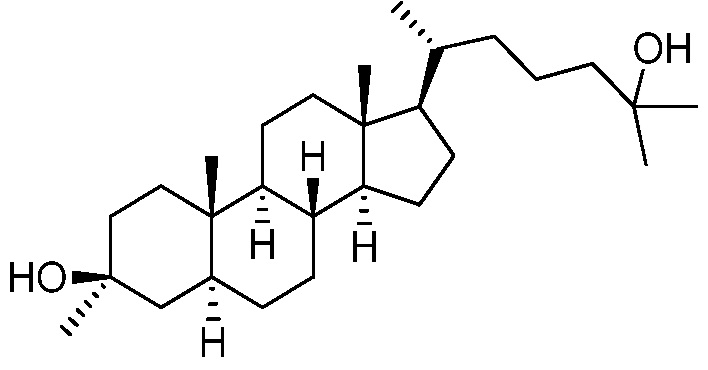
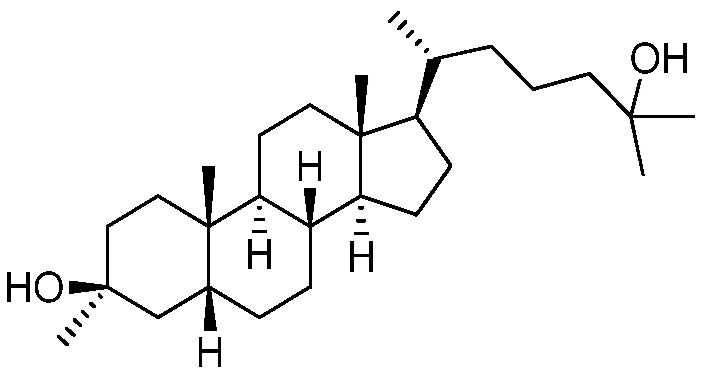
или их фармацевтически приемлемой соли.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (IV):

или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления R1 представляет собой метил (например, -CHF2, -CF3, -CH2OCH3 или -CH2OCH2CH3), этил или изопропил.
В некоторых вариантах осуществления каждый из R2 и R3 независимо представляет собой водород, C1-6алкил или карбоциклил, или когда R2 и R3 взяты вместе с атомом углерода, к которому они присоединены, образуют 3-8-членное кольцо.
В некоторых вариантах осуществления каждый из R2 и R3 независимо представляет собой водород, C1-6алкил или карбоциклил.
В некоторых вариантах осуществления каждый из R2 и R3 независимо представляет собой водород, метил (например, -CH3, -CF3), этил (например, -CH2CH3, CH2CF3), пропил, изопропил, циклопропил или бутил.
В некоторых вариантах осуществления R2 представляет собой водород, метил (например, -CH3, -CF3) или этил.
В некоторых вариантах осуществления R3 представляет собой метил (например, -CH3, -CF3), этил (например, -CH2CH3, -CH2CF3), пропил, изопропил, циклопропил, бутил.
В некоторых вариантах осуществления соединение представляет собой:

или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (V):

или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (V-A):

или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (V-B):

или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (III) представляет собой соединение формулы (V-C) или формулы (V-D):


или их фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (V-E):

или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (V-E) представляет собой соединение формулы (V-E-i):

или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (V-E-ii) или (V-E-iii):


или их фармацевтически приемлемую соль. В некоторых вариантах осуществления соединение выбрано из:















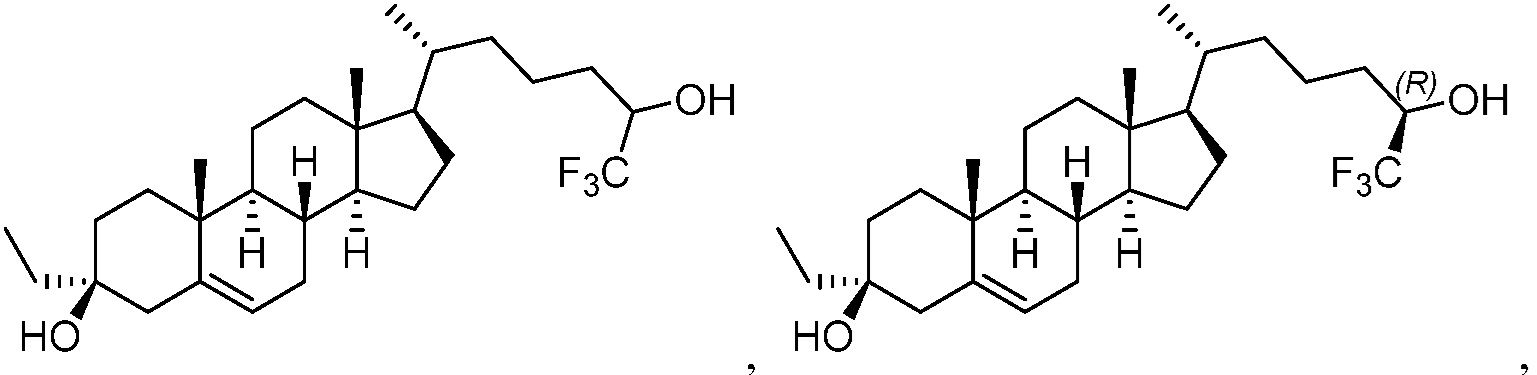



или их фармацевтически приемлемая соль.
В аспекте, предоставленном в данном описании, обеспечена фармацевтическая композиция, содержащая соединение, описанное в данном описании, или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
В аспекте, предоставленном в данном описании, обеспечен способ индуцирования седации или анестезии, включающий введение субъекту эффективного количества соединения, описанного в данном описании, или его фармацевтически приемлемой соли, или их фармацевтической композиции.
В аспекте, предоставленном в данном описании, обеспечен способ лечения или профилактики расстройства, описанного в данном описании, включающий введение субъекту, нуждающемуся в этом, эффективного количества соединения, описанного в данном описании, или его фармацевтически приемлемой соли, или их фармацевтической композиции.
В некоторых вариантах осуществления расстройством является метаболическое расстройство.
В некоторых вариантах осуществления расстройством является желудочно-кишечное (GI) расстройство, например, запор, синдром раздраженного кишечника (IBS), воспалительное заболевание кишечника (IBD) (например, язвенный колит, болезнь Крона), структурные расстройства, затрагивающие GI, анальные расстройства (например, геморрой, внутренний геморрой, внешний геморрой, анальные трещины, перианальные абсцессы, анальный свищ), полипы толстой кишки, рак, колит.
В некоторых вариантах осуществления расстройством является воспалительное заболевание кишечника.
В некоторых вариантах осуществления расстройство представляет собой рак, диабет или нарушение синтеза стеролов.
В аспекте, предоставленном в данном описании, обеспечен способ лечения или профилактики связанного с ЦНС состояния, включающий введение субъекту, нуждающемуся в этом, эффективного количества соединения, описанного в данном описании, или его фармацевтически приемлемой соли, или их фармацевтической композиции. В некоторых вариантах осуществления связанным с ЦНС состоянием является расстройство адаптации, тревожное расстройство (включая обсессивно-компульсивное расстройство, посттравматическое стрессовое расстройство и социальную фобию), когнитивное расстройство (включая болезнь Альцгеймера и другие формы деменции, например фронтотемпоральную деменцию), диссоциированное расстройство, расстройство питания, расстройство настроения (включая депрессию, например послеродовую депрессию), биполярное расстройство, дистимическое расстройство, суициидальность), шизофрения или другие психотические расстройства (включая шизоаффективное расстройство), расстройство сна (включая бессонницу), расстройство, связанное с употреблением психоактивных веществ, расстройство личности (включая обсессивно-компульсивное расстройство личности), расстройства аутистического спектра (включая связанные с мутациями Shank группы белков (например, Shank3)), связанное с неврологическим развитием расстройство (включая синдром Ретта, комплекс туберозного склероза), рассеянный склероз, расстройства синтеза стерола, боль (включая острую и хроническую боль; головные боли, например, мигреневые головные боли), энцефалопатия, как вторичное заболевание (включая печеночную энцефалопатию и анти-NMDA рецепторную энцефалопатию), припадочное расстройство (включая эпилептический статус и моногенные формы эпилепсии, такие как болезнь Драветса), инсульт, черепно-мозговая травма, нарушение движений (включая болезнь Хантингтона и болезнь Паркинсона), ухудшение зрения, потеря слуха и тиннитус.
В некоторых вариантах осуществления расстройством является болезнь Хантингтона. В некоторых вариантах осуществления расстройством является болезнь Паркинсона. В некоторых вариантах осуществления расстройством является воспалительное заболевание (например, волчанка).
В некоторых вариантах осуществления расстройством является расстройство синтеза стерола.
В некоторых вариантах осуществления расстройством является синдром Смита-Лемли-Опица (SLOS). В некоторых вариантах осуществления расстройством является десмостеролоз (desmosterolosis). В некоторых вариантах осуществления расстройством является ситостеролемия. В некоторых вариантах осуществления расстройство представляет собой церебросухожильный ксантоматоз (CTX). В некоторых вариантах осуществления расстройством является недостаточность мевалонаткиназы (MKD). В некоторых вариантах осуществления расстройством является мутация гена SC4MOL (дефицит SMO). В некоторых вариантах осуществления расстройством является болезнь Нимана-Пика. В некоторых вариантах осуществления расстройством являются расстройства аутистического спектра (ASD). В некоторых вариантах осуществления расстройство связано с фенилкетонурией.
Другие аспекты и преимущества станут очевидны для специалистов в данной области из рассмотрения последующего подробного описания, примеров и пунктов формулы изобретения.
Определения
Химические определения
Определения конкретных функциональных групп и химических терминов описаны более подробно ниже. Химические элементы определены в соответствии с периодической таблицей элементов, CAS версии, Handbook of Chemistry and Physics, 75th Ed., для внутреннего распространения, и конкретные функциональные группы, как правило, определены так, как описано в данном описании. Дополнительно, общие принципы органической химии, а также конкретные функциональные группы и реакционная способность, описаны в Thomas Sorrell, Organic Chemistry, University Science Books, Sausalito, 1999; Smith and March, March's Advanced Organic Chemistry, 5th Edition, John Wiley & Sons, Inc., New York, 2001; Larock, Comprehensive Organic Transformations, VCH Publishers, Inc., New York, 1989; и Carruthers, Some Modern Methods of Organic Synthesis, 3rd Edition, Cambridge University Press, Cambridge, 1987.
Соединения, описанные в данном описании, могут содержать один или более асимметрических центров и, таким образом, могут существовать в различных изомерных формах, например, энантиомерных и/или диастереоизомерных. Например, соединения, описанные в данном описании, могут быть в форме индивидуального энантиомера, диастереомера или геометрического изомера, или могут быть в форме смеси стереоизомеров, включая рацемические смеси и смеси, обогащенные одним или более стереоизомерами. Изомеры могут быть выделены из смесей способами, известными специалистам в данной области, включающими хиральную высокоэффективную жидкостную хроматографию (ВЭЖХ) и образование и кристаллизацию хиральных солей; или предпочтительные изомеры могут быть получены асимметрическим синтезом. См., например, Jacques et al., Enantiomers, Racemates and Resolutions (Wiley Interscience, New York, 1981); Wilen et al., Tetrahedron 33:2725 (1977); Eliel, Stereochemistry of Carbon Compounds (McGraw-Hill, NY, 1962); и Wilen, Tables of Resolving Agents and Optical Resolutions p. 268 (E.L. Eliel, Ed., Univ. of Notre Dame Press, Notre Dame, IN 1972). Настоящее изобретение дополнительно включает соединения, описанные в данном описании, в виде индивидуальных изомеров, по существу свободных от других изомеров, и, альтернативно, в виде смесей различных изомеров.
Соединение, описанное в данном описании, также может содержать один или более изотопных заместителей. Например, H может быть в любой изотопной форме, включая1H,2H (D или дейтерий), и3H (T или тритий); C может быть в любой изотопной форме, включая12C,13C и14C; O может быть в любой изотопной форме, включая16O и18O; и тому подобное.
Когда указан диапазон значений, имеется в виду включение каждого значения и поддиапазона в данном диапазоне. Например, ʺC1-6алкилʺ предназначен для включения C1, C2, C3, C4, C5, C6, C1-6, C1-5, C1-4, C1-3, C1-2, C2-6, C2-5, C2-4, C2-3, C3-6, C3-5, C3-4, C4-6, C4-5 и C5-6алкила.
Следующие термины предназначены для того, чтобы пользоваться представленными ниже значениями и быть полезными в понимании описания и предполагаемого объема настоящего изобретения. При описании настоящего изобретения, которое включает соединения, фармацевтические композиции, содержащие такие соединения, и способы применения таких соединений и композиций, следующие термины, если присутствуют, имеют следующие значения, если не указано иное. Следует также понимать, что при описании любые группы, определенные ниже, могут быть замещены различными заместителями, и что соответствующие определения предназначены для включения таких замещенных групп в их объем, как изложено ниже. Если не указано иное, термин ʺзамещенныйʺ должен быть определен, как изложено ниже. Следует также понимать, что термины ʺгруппыʺ и ʺрадикалыʺ можно считать взаимозаменяемыми при употреблении в данном описании. Единственное число используется в данном описании для обозначения одного или более чем одного (т.е. по меньшей мере один) грамматических объектов. В качестве примера, ʺаналогʺ означает один аналог или более чем один аналог.
ʺАлифатическийʺ относится к алкильной, алкенильной, алкинильной или карбоциклильной группе, как определено в данном описании.
ʺАлкилʺ относится к радикалу насыщенной углеводородной группы с прямой или разветвленной цепью, имеющей от 1 до 20 атомов углерода (ʺC1-20алкилʺ). В некоторых вариантах осуществления алкильная группа имеет 1-12 атома углерода (ʺC1-12алкилʺ). В некоторых вариантах осуществления алкильная группа имеет 1-10 атомов углерода (ʺC1-10алкилʺ). В некоторых вариантах осуществления алкильная группа имеет 1-9 атомов углерода (ʺC1-9алкилʺ). В некоторых вариантах осуществления алкильная группа имеет 1-8 атомов углерода (ʺC1-8алкилʺ). В некоторых вариантах осуществления алкильная группа имеет 1-7 атомов углерода (ʺC1-7алкилʺ). В некоторых вариантах осуществления алкильная группа имеет 1-6 атомов углерода (ʺC1-6алкилʺ, также называемая в данном описании ʺнизшим алкиломʺ). В некоторых вариантах осуществления алкильная группа имеет 1-5 атомов углерода (ʺC1-5алкилʺ). В некоторых вариантах осуществления алкильная группа имеет 1-4 атома углерода (ʺC1-4алкилʺ). В некоторых вариантах осуществления алкильная группа имеет 1-3 атома углерода (ʺC1-3алкилʺ). В некоторых вариантах осуществления алкильная группа имеет 1-2 атома углерода (ʺC1-2алкилʺ). В некоторых вариантах осуществления алкильная группа имеет 1 атом углерода (ʺC1алкилʺ). В некоторых вариантах осуществления алкильная группа имеет 2-6 атомов углерода (ʺC2-6алкилʺ). Примеры C1-6алкильной группы включают метил (C1), этил (C2), н-пропил (C3), изопропил (C3), н-бутил (C4), трет-бутил (C4), втор-бутил (C4), изобутил (C4), н-пентил (C5), 3-пентанил (C5), амил (C5), неопентил (C5), 3-метил-2-бутанил (C5), третичный амил (C5) и н-гексил (C6). Дополнительные примеры алкильной группы включают н-гептил (C7), н-октил (C8) и тому подобное. Если специально не указано иное, в каждом отдельном случае, алкильная группа независимо является необязательно замещенной, т.е. незамещенной (ʺнезамещенный алкилʺ), или замещена (ʺзамещенный алкилʺ) одним или более заместителями; например, от 1 до 5 заместителями, 1-3 заместителями или 1 заместителем. В некоторых вариантах осуществления алкильная группа представляет собой незамещенный C1-10алкил (например, -CH3). В некоторых вариантах осуществления алкильная группа представляет собой замещенный C1-10алкил. Общепринятые аббревиатуры алкила включают Me (-CH3), Et (-CH2CH3), iPr (-CH(CH3)2), nPr (-CH2CH2CH3), n-Bu (-CH2CH2CH2CH3) или i-Bu (-CH2CH(CH3)2).
ʺАлкиленʺ относится к алкильной группе, где два водорода удалены с обеспечением двухвалентного радикала, и которая может быть замещенной или незамещенной. Незамещенные алкиленовые группы включают, но, не ограничиваясь ими, метилен (-CH2-), этилен (-CH2CH2-), пропилен (-CH2CH2CH2-), бутилен (-CH2CH2CH2CH2-), пентилен (-CH2CH2CH2CH2CH2-), гексилен (-CH2CH2CH2CH2CH2CH2-) и тому подобное. Примеры замещенных алкиленовых групп, например, замещенных одной или более алкильными (метил) группами, включают, но, не ограничиваясь ими, замещенный метилен (-CH(CH3)-, (-C(CH3)2-), замещенный этилен (-CH(CH3)CH2-, -CH2CH(CH3)-, -C(CH3)2CH2-, -CH2C(CH3)2-), замещенный пропилен (-CH(CH3)CH2CH2-, -CH2CH(CH3)CH2-, -CH2CH2CH(CH3)-, -C(CH3)2CH2CH2-, -CH2C(CH3)2CH2-, -CH2CH2C(CH3)2-) и тому подобное. Когда диапазон или число атомов углерода указан для конкретной алкиленовой группы, следует понимать, что данный диапазон или число относится к диапазону или числу атомов углерода в линейной двухвалентной углеродной цепи. Алкиленовые группы могут быть незамещенными или замещены одним или более заместителями, как описано в данном описании.
ʺАлкенилʺ относится к радикалу углеводородной группы с прямой или разветвленной цепью, имеющей от 2 до 20 атомов углерода, одну или более двойных углерод-углеродных связей (например, 1, 2, 3 или 4 двойные углерод-углеродных связи), и необязательно одну или более тройных углерод-углеродных связей (например, 1, 2, 3 или 4 тройные углерод-углеродных связи) (ʺC2-20алкенилʺ). В некоторых вариантах осуществления алкенил не содержит каких-либо тройных связей. В некоторых вариантах осуществления алкенильная группа имеет 2-10 атомов углерода (ʺC2-10алкенилʺ). В некоторых вариантах осуществления алкенильная группа имеет 2-9 атомов углерода (ʺC2-9алкенилʺ). В некоторых вариантах осуществления алкенильная группа имеет 2-8 атомов углерода (ʺC2-8алкенилʺ). В некоторых вариантах осуществления алкенильная группа имеет 2-7 атомов углерода (ʺC2-7алкенилʺ). В некоторых вариантах осуществления алкенильная группа имеет 2-6 атомов углерода (ʺC2-6алкенилʺ). В некоторых вариантах осуществления алкенильная группа имеет 2-5 атомов углерода (ʺC2-5алкенилʺ). В некоторых вариантах осуществления алкенильная группа имеет 2-4 атома углерода (ʺC2-4алкенилʺ). В некоторых вариантах осуществления алкенильная группа имеет 2-3 атома углерода (ʺC2-3алкенилʺ). В некоторых вариантах осуществления алкенильная группа имеет 2 атома углерода (ʺC2алкенилʺ). Одна или более углерод-углеродных связей могут быть внутренними (такими как в 2-бутениле) или концевыми (такими как в 1-бутениле). Примеры C2-4алкенильной группы включают этенил (C2), 1-пропенил (C3), 2-пропенил (C3), 1-бутенил (C4), 2-бутенил (C4), бутадиенил (C4) и тому подобное. Примеры C2-6алкенильной группы включают приведенные выше C2-4алкенильные группы, а также пентенил (C5), пентадиенил (C5), гексенил (C6) и тому подобное. Дополнительные примеры алкенила включают гептенил (C7), октенил (C8), октатриенил (C8) и тому подобное. Если специально не указано иное, в каждом отдельном случае, алкенильная группа независимо является необязательно замещенной, т.е. незамещенной (ʺнезамещенный алкенилʺ), или замещена (ʺзамещенный алкенилʺ) одним или более заместителями, например, от 1 до 5 заместителями, 1-3 заместителями или 1 заместителем. В некоторых вариантах осуществления алкенильная группа представляет собой незамещенный C2-10алкенил. В некоторых вариантах осуществления алкенильная группа представляет собой замещенный C2-10алкенил.
ʺАлкинилʺ относится к радикалу углеводородной группы с прямой или разветвленной цепью, имеющей от 2 до 20 атомов углерода, одну или более тройных углерод-углеродных связей (например, 1, 2, 3 или 4 тройные углерод-углеродные связи), и необязательно одну или более двойных углерод-углеродных связей (например, 1, 2, 3 или 4 двойные углерод-углеродные связи) (ʺC2-20 алкинилʺ). В некоторых вариантах осуществления алкинил не содержит каких-либо двойных связей. В некоторых вариантах осуществления алкинильная группа имеет 2-10 атомов углерода (ʺC2-10алкинилʺ). В некоторых вариантах осуществления алкинильная группа имеет 2-9 атомов углерода (ʺC2-9алкинилʺ). В некоторых вариантах осуществления алкинильная группа имеет 2-8 атомов углерода (ʺC2-8алкинилʺ). В некоторых вариантах осуществления алкинильная группа имеет 2-7 атомов углерода (ʺC2-7алкинилʺ). В некоторых вариантах осуществления алкинильная группа имеет 2-6 атомов углерода (ʺC2-6алкинилʺ). В некоторых вариантах осуществления алкинильная группа имеет 2-5 атомов углерода (ʺC2-5алкинилʺ). В некоторых вариантах осуществления алкинильная группа имеет 2-4 атома углерода (ʺC2-4алкинилʺ). В некоторых вариантах осуществления алкинильная группа имеет 2-3 атома углерода (ʺC2-3алкинилʺ). В некоторых вариантах осуществления алкинильная группа имеет 2 атома углерода (ʺC2алкинилʺ). Одна или более тройных углерод-углеродных связей могут быть внутренними (такими как в 2-бутиниле) или концевыми (такими как в 1-бутиниле). Примеры C2-4алкинильной группы включают, но без ограничения, этинил (C2), 1-пропинил (C3), 2-пропинил (C3), 1-бутинил (C4), 2-бутинил (C4) и тому подобное. Примеры C2-6алкенильной группы включают приведенные выше C2-4алкинильные группы, а также пентинил (C5), гексинил (C6) и тому подобное. Дополнительные примеры алкинила включают гептинил (C7), октинил (C8) и тому подобное. Если специально не указано иное, в каждом отдельном случае, алкинильная группа независимо является необязательно замещенной, т.е. незамещенной (ʺнезамещенный алкинилʺ), или замещена (ʺзамещенный алкинилʺ) одним или более заместителями; например, от 1 до 5 заместителями, 1-3 заместителями или 1 заместителем. В некоторых вариантах осуществления алкинильная группа представляет собой незамещенный C2-10алкинил. В некоторых вариантах осуществления алкинильная группа представляет собой замещенный C2-10алкинил.
Термин ʺгетероалкилʺ, как использовано в данном описании, относится к алкильной группе, как определено в данном описании, которая дополнительно содержит 1 или более (например, 1, 2, 3 или 4) гетероатомов (например, кислорода, серы, азота, бора, кремния, фосфора) в основной цепи, где один или более гетероатомов вставлены между соседними атомами углерода в основной углеродной цепи и/или один или более гетероатомов вставлены между атомом углерода и основной молекулой, т.е. между точками присоединения. В некоторых вариантах осуществления гетероалкильная группа относится к насыщенной группе, имеющей от 1 до 10 атомов углерода и 1, 2, 3 или 4 гетероатома (ʺгетероC1-10алкилʺ). В некоторых вариантах осуществления гетероалкильная группа представляет собой насыщенную группу, имеющую 1-9 атомов углерода и 1, 2, 3 или 4 гетероатома (ʺгетероC1-9алкилʺ). В некоторых вариантах осуществления гетероалкильная группа представляет собой насыщенную группу, имеющую 1-8 атомов углерода и 1, 2, 3 или 4 гетероатома (ʺгетероC1-8алкилʺ). В некоторых вариантах осуществления гетероалкильная группа представляет собой насыщенную группу, имеющую 1-7 атомов углерода и 1, 2, 3 или 4 гетероатома (ʺгетероC1-7алкилʺ). В некоторых вариантах осуществления гетероалкильная группа представляет собой группу, имеющую 1-6 атомов углерода и 1, 2 или 3 гетероатома (ʺгетероC1-6алкилʺ). В некоторых вариантах осуществления гетероалкильная группа представляет собой насыщенную группу, имеющую 1-5 атомов углерода и 1 или 2 гетероатома (ʺгетероC1-5алкилʺ). В некоторых вариантах осуществления гетероалкильная группа представляет собой насыщенную группу, имеющую 1-4 атома углерода и 1 или 2 гетероатома (ʺгетероC1-4алкилʺ). В некоторых вариантах осуществления гетероалкильная группа представляет собой насыщенную группу, имеющую 1-3 атома углерода и 1 гетероатом (ʺгетероC1-3алкилʺ). В некоторых вариантах осуществления гетероалкильная группа представляет собой насыщенную группу, имеющую 1-2 атома углерода и 1 гетероатом (ʺгетероC1-2алкилʺ). В некоторых вариантах осуществления гетероалкильная группа представляет собой насыщенную группу, имеющую 1 атом углерода и 1 гетероатом (ʺгетероC1алкилʺ). В некоторых вариантах осуществления гетероалкильная группа представляет собой насыщенную группу, имеющую 2-6 атомов углерода и 1 или 2 гетероатома (ʺгетероC2-6алкилʺ). Если специально не указано иное, в каждом отдельном случае, гетероалкильная группа независимо является незамещенной (ʺнезамещенный гетероалкилʺ), или замещена (ʺзамещенный гетероалкилʺ) одним или более заместителями. В некоторых вариантах осуществления гетероалкильная группа представляет собой незамещенный гетероC1-10алкил. В некоторых вариантах осуществления гетероалкильная группа представляет собой замещенный гетероC1-10алкил.
ʺАрилʺ относится к радикалу моноциклической или полициклической (например, бициклической или трициклической) 4n+2 ароматической кольцевой системы (например, имеющей 6, 10 или 14 π электронов, распределенных в циклической группе), имеющей 6-14 атомов углерода кольца и ноль гетероатомов в ароматической кольцевой системе (ʺC6-14арилʺ). В некоторых вариантах осуществления арильная группа имеет шесть атомов углерода кольца (ʺC6арилʺ; например, фенил). В некоторых вариантах осуществления арильная группа имеет десять атомов углерода кольца (ʺC10арилʺ; например, нафтил, такой как 1-нафтил и 2-нафтил). В некоторых вариантах осуществления арильная группа имеет четырнадцать атомов углерода кольца (ʺC14арилʺ; например, антрацил). ʺАрилʺ также включает кольцевые системы, где арильное кольцо, как определено выше, конденсировано с одним или более карбоциклильными или гетероциклильными группами, где радикал или точка присоединения находится на арильном кольце, и в таких случаях, число атомов углерода продолжает определяться числом атомов углерода в данной арильной кольцевой системе. Конкретные арильные группы включают, но, не ограничиваясь ими, группы производные ацеантрилена, аценафталина, ацефенантрилена, антрацена, азулена, бензола, хризена, коронена, флуорантена, флуорена, гексацена, гексафена, гексалена, ас-индацена, втор-индацена, индана, индена, нафталина, октацена, октафена, окталена, овалена, пента-2,4-диена, пентацена, пенталена, пентафена, перилена, феналена, фенантрена, пицена, плеиадена, пирена, пирантрена, рубицина, трифенилена и тринафталина. Особенные арильные группы включают фенил, нафтил, инденил и тетрагидронафтил. Если специально не указано иное, в каждом отдельном случае, арильная группа независимо является необязательно замещенной, т.е. незамещенной (ʺнезамещенный арилʺ), или замещена (ʺзамещенный арилʺ) одним или более заместителями. В некоторых вариантах осуществления арильная группа представляет собой незамещенный C6-14арил. В некоторых вариантах осуществления арильная группа представляет собой замещенный C6-14арил.
В некоторых вариантах осуществления арильная группа замещена одной или более группами, выбранными из галогена, C1-C8алкила, C1-C8галогеналкила, циано, гидрокси, C1-C8алкокси и амино.
Примеры иллюстративных замещенных арилов включают следующие:

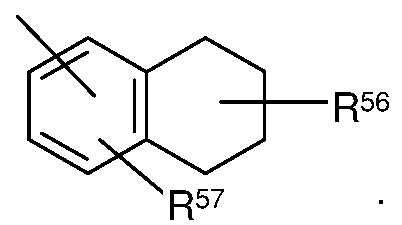
где один из R56 и R57 может представлять собой водород, и по меньшей мере один из R56 и R57, каждый независимо, выбран из C1-C8алкила, C1-C8галогеналкила, 4-10-членного гетероциклила, алканоила, C1-C8алкокси, гетероарилокси, алкиламино, ариламино, гетероариламино, NR58COR59, NR58SOR59, NR58SO2R59, COOалкила, COOарила, CONR58R59, CONR58OR59, NR58R59, SO2NR58R59, S-алкила, SOалкила, SO2алкила, Sарила, SOарила, SO2арила; или R56 и R57могут соединяться с образованием циклического кольца (насыщенного или ненасыщенного) из 5-8 атомов, необязательно содержащего один или более гетероатомов, выбранных из группы N, O или S. R60 и R61 независимо представляют собой водород, C1-C8алкил, C1-C4галогеналкил, C3-C10циклоалкил, 4-10-членный гетероциклил, C6-C10арил, замещенный C6-C10арил, 5-10-членный гетероарил или замещенный 5-10-членный гетероарил.
ʺКонденсированный арилʺ относится к арилу, имеющему два его кольцевых углерода общих со вторым арилом или гетероарильным кольцом или с карбоциклильным или гетероциклильным кольцом.
ʺАралкилʺ является подмножеством алкила и арила, как определено в данном описании, и относится к необязательно замещенной алкильной группе, замещенной необязательно замещенной арильной группой.
ʺГетероарилʺ относится к радикалу 5-10-членной моноциклической или бициклической 4n+2 ароматической кольцевой системы (например, имеющей 6 или 10 π электронов, распределенных в циклической группе), имеющей атомы углерода в кольце и 1-4 кольцевых гетероатома в ароматической кольцевой системе, где каждый гетероатом независимо выбран из азота, кислорода и серы (ʺ5-10-членный гетероарилʺ). В гетероарильных группах, которые содержат один или более атомов азота, точкой присоединения может быть атом углерода или азота, если позволяет валентность. Гетероарильные бициклические кольцевые системы могут включать один или более гетероатомов в одном или обоих кольцах. ʺГетероарилʺ включает кольцевые системы, где гетероарильное кольцо, как определено выше, конденсировано с одним или более карбоциклильными или гетероциклильными группами, где точка присоединения находится на гетероарильном кольце, и в таких случаях, число членов кольца продолжает определяться числом членов кольца в гетероарильной кольцевой системе. ʺГетероарилʺ также включает кольцевые системы, где гетероарильное кольцо, как определено выше, конденсировано с одним или более арильными группами, где точка присоединения находится либо на арильном, либо на гетероарильном кольце, и в таких случаях, число членов кольца обозначает число членов кольца в конденсированной (арил/гетероарил) кольцевой системе. Точка присоединения бициклических гетероарильных групп, где одно кольцо не содержит гетероатом (например, индолил, хинолинил, карбазолил и тому подобное), может быть на любом кольце, т.е. любом кольце, несущем гетероатом (например, 2-индолил), или любом кольце, не содержащем гетероатом (например, 5-индолил).
В некоторых вариантах осуществления гетероарильная группа представляет собой 5-10-членную ароматическую кольцевую систему, имеющую атомы углерода в кольце и 1-4 кольцевых гетероатома в ароматической кольцевой системе, где каждый гетероатом независимо выбран из азота, кислорода и серы (ʺ5-10-членный гетероарилʺ). В некоторых вариантах осуществления гетероарильная группа представляет собой 5-8-членную ароматическую кольцевую систему, имеющую атомы углерода в кольце и 1-4 кольцевых гетероатома в ароматической кольцевой системе, где каждый гетероатом независимо выбран из азота, кислорода и серы (ʺ5-8-членный гетероарилʺ). В некоторых вариантах осуществления гетероарильная группа представляет собой 5-6-членную ароматическую кольцевую систему, имеющую атомы углерода в кольце и 1-4 кольцевых гетероатома в ароматической кольцевой системе, где каждый гетероатом независимо выбран из азота, кислорода и серы (ʺ5-6-членный гетероарилʺ). В некоторых вариантах осуществления 5-6-членный гетероарил имеет 1-3 кольцевых гетероатома, выбранных из азота, кислорода и серы. В некоторых вариантах осуществления 5-6-членный гетероарил имеет 1-2 кольцевых гетероатома, выбранных из азота, кислорода и серы. В некоторых вариантах осуществления 5-6-членный гетероарил имеет 1 кольцевой гетероатом, выбранный из азота, кислорода и серы. Если специально не указано иное, в каждом отдельном случае, гетероарильная группа независимо является необязательно замещенной, т.е. незамещенной (ʺнезамещенный гетероарилʺ), или замещена (ʺзамещенный гетероарилʺ) одним или более заместителями. В некоторых вариантах осуществления гетероарильная группа представляет собой незамещенный 5-14-членный гетероарил. В некоторых вариантах осуществления гетероарильная группа представляет собой замещенный 5-14-членный гетероарил.
Примеры 5-членной гетероарильной группы, содержащей один гетероатом, включают, но без ограничения, пирролил, фуранил и тиофенил. Примеры 5-членной гетероарильной группы, содержащей два гетероатома, включают, но без ограничения, имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил и изотиазолил. Примеры 5-членной гетероарильной группы, содержащей три гетероатома, включают, но без ограничения, триазолил, оксадиазолил и тиадиазолил. Примеры 5-членной гетероарильной группы, содержащей четыре гетероатома, включают, но без ограничения, тетразолил. Примеры 6-членной гетероарильной группы, содержащей один гетероатом, включают, но без ограничения, пиридинил. Примеры 6-членной гетероарильной группы, содержащей два гетероатома, включают, но без ограничения, пиридазинил, пиримидинил и пиразинил. Примеры 6-членной гетероарильной группы, содержащей три или четыре гетероатома, включают, но без ограничения, триазинил и тетразинил, соответственно. Примеры 7-членной гетероарильной группы, содержащей один гетероатом, включают, но без ограничения, азепинил, оксепинил и тиепинил. Примеры 5,6-бициклических гетероарильных групп включают, но без ограничения, индолил, изоиндолил, индазолил, бензотриазолил, бензотиофенил, изобензотиофенил, бензофуранил, бензоизофуранил, бензимидазолил, бензоксазолил, бензизоксазолил, бензоксадиазолил, бензтиазолил, бензизотиазолил, бензтиадиазолил, индолизинил и пуринил. Примеры 6,6-бициклических гетероарильных групп, включают, но без ограничения, нафтиридинил, птеридинил, хинолинил, изохинолинил, циннолинил, хиноксалинил, фталазинил и хиназолинил.
Примеры иллюстративных гетероарилов включают следующие:



где каждый Z выбран из карбонила, N, NR65, O и S; и R65 независимо представляет собой водород, C1-C8алкил, C3-C10циклоалкил, 4-10-членный гетероциклил, C6-C10арил и 5-10-членный гетероарил.
ʺГетероаралкилʺ является подмножеством алкила и гетероарила, как определено в данном описании, и относится к необязательно замещенной алкильной группе, замещенной необязательно замещенной гетероарильной группой.
ʺКарбоциклилʺ или ʺкарбоциклическийʺ относится к радикалу неароматической циклической углеводородной группы, имеющей от 3 до 10 атомов углерода кольца (ʺC3-10карбоциклилʺ) и ноль гетероатомов в неароматической кольцевой системе. В некоторых вариантах осуществления карбоциклильная группа имеет 3-8 атомов углерода кольца (ʺC3-8карбоциклилʺ). В некоторых вариантах осуществления карбоциклильная группа имеет 3-6 атомов углерода кольца (ʺC3-6карбоциклилʺ). В некоторых вариантах осуществления карбоциклильная группа имеет 3-6 атомов углерода кольца (ʺC3-6карбоциклилʺ). В некоторых вариантах осуществления карбоциклильная группа имеет 5-10 атомов углерода кольца (ʺC5-10карбоциклилʺ). Примеры C3-6карбоциклильной группы включают, но без ограничения, циклопропил (C3), циклопропенил (C3), циклобутил (C4), циклобутенил (C4), циклопентил (C5), циклопентенил (C5), циклогексил (C6), циклогексенил (C6), циклогексадиенил (C6) и тому подобное. Примеры C3-8карбоциклильной группы включают, но без ограничения, приведенные выше C3-6карбоциклильные группы, а также циклогептил (C7), циклогептенил (C7), циклогептадиенил (C7), циклогептатриенил (C7), циклооктил (C8), циклооктенил (C8), бицикло[2,2,1]гептанил (C7), бицикло[2,2,2]октанил (C8) и тому подобное. Примеры C3-10карбоциклильной группы включают, но без ограничения, приведенные выше C3-8карбоциклильные группы, а также циклононил (C9), циклононенил (C9), циклодецил (C10), циклодеценил (C10), октагидро-1H-инденил (C9), декагидронафталенил (C10), спиро[4,5]деканил (C10) и тому подобное. Как показывают приведенные выше примеры, в некоторых вариантах осуществления карбоциклильная группа либо является моноциклической (ʺмоноциклический карбоциклилʺ), или содержит конденсированную, мостиковую или кольцевую спиросистему, такую как бициклическая система (ʺбициклический карбоциклилʺ), и может быть насыщенной или может быть частично ненасыщенной. ʺКарбоциклилʺ также включает кольцевые системы, где карбоциклильное кольцо, как определено выше, конденсировано с одним или более арильными или гетероарильными группами, где точка присоединения находится на карбоциклильном кольце, и в таких случаях, число атомов углерода продолжает определяться числом атомов углерода в карбоциклической кольцевой системе. Если специально не указано иное, в каждом отдельном случае, карбоциклильная группа независимо является необязательно замещенной, т.е. незамещенной (ʺнезамещенный карбоциклилʺ), или замещена (ʺзамещенный карбоциклилʺ) одним или более заместителями. В некоторых вариантах осуществления карбоциклильная группа представляет собой незамещенный C3-10карбоциклил. В некоторых вариантах осуществления карбоциклильная группа представляет собой замещенный C3-10карбоциклил.
В некоторых вариантах осуществления ʺкарбоциклилʺ представляет собой моноциклическую насыщенную карбоциклильную группу, имеющую от 3 до 10 атомов углерода кольца (ʺC3-10циклоалкилʺ). В некоторых вариантах осуществления циклоалкильная группа имеет 3-8 атомов углерода кольца (ʺC3-8циклоалкилʺ). В некоторых вариантах осуществления циклоалкильная группа имеет 3-6 атомов углерода кольца (ʺC3-6циклоалкилʺ). В некоторых вариантах осуществления циклоалкильная группа имеет 5-6 атомов углерода кольца (ʺC5-6циклоалкилʺ). В некоторых вариантах осуществления циклоалкильная группа имеет 5-10 атомов углерода кольца (ʺC5-10циклоалкилʺ). Примеры C5-6циклоалкильной группы включают циклопентил (C5) и циклогексил (C5). Примеры C3-6циклоалкильной группы включают приведенные выше C5-6циклоалкильные группы, а также циклопропил (C3) и циклобутил (C4). Примеры C3-8циклоалкильной группы включают приведенные выше C3-6циклоалкильные группы, а также циклогептил (C7) и циклооктил (C8). Если специально не указано иное, в каждом отдельном случае, циклоалкильная группа независимо является незамещенной (ʺнезамещенный циклоалкилʺ), или замещена (ʺзамещенный циклоалкилʺ) одним или более заместителями. В некоторых вариантах осуществления циклоалкильная группа представляет собой незамещенный C3-10циклоалкил. В некоторых вариантах осуществления циклоалкильная группа представляет собой замещенный C3-10циклоалкил.
ʺГетероциклилʺ или ʺгетероциклическийʺ относится к радикалу 3-10-членной неароматической кольцевой системы, имеющей атомы углерода в кольце и 1-4 кольцевых гетероатома, где каждый гетероатом независимо выбран из азота, кислорода, серы, бора, фосфора и кремния (ʺ3-10-членный гетероциклилʺ). В гетероциклильных группах, которые содержат один или более атомов азота, точкой присоединения может быть атом углерода или азота, если позволяет валентность. Гетероциклильная группа либо может быть моноциклической (ʺмоноциклический гетероциклилʺ), либо конденсированной, мостиковой или кольцевой спиросистемой, такой как бициклическая система (ʺбициклический гетероциклилʺ), и может быть насыщенной или может быть частично ненасыщенной. Гетероциклильные бициклические кольцевые системы могут включать один или более гетероатомов в одном или обоих кольцах. ʺГетероциклилʺ также включает кольцевые системы, где гетероциклильное кольцо, как определено выше, конденсировано с одним или более карбоциклильными группами, где точка присоединения находится на карбоциклильном или гетероциклильном кольце, или кольцевые системы, где гетероциклильное кольцо, как определено выше, конденсировано с одним или более арильными или гетероарильными группами, где точка присоединения находится на гетероциклильном кольце, и в таких случаях, число членов кольца продолжает определяться числом членов кольца в гетероциклильной кольцевой системе. Если специально не указано иное, в каждом отдельном случае, гетероциклил независимо является необязательно замещенным, т.е. незамещенный (ʺнезамещенный гетероциклилʺ), или замещен (ʺзамещенный гетероциклилʺ) одним или более заместителями. В некоторых вариантах осуществления гетероциклильная группа представляет собой незамещенный 3-10-членный гетероциклил. В некоторых вариантах осуществления гетероциклильная группа представляет собой замещенный 3-10-членный гетероциклил.
В некоторых вариантах осуществления гетероциклильная группа представляет собой 5-10-членную неароматическую кольцевую систему, имеющую атомы углерода в кольце и 1-4 кольцевых гетероатома, где каждый гетероатом независимо выбран из азота, кислорода, серы, бора, фосфора и кремния (ʺ5-10-членный гетероциклилʺ). В некоторых вариантах осуществления гетероциклильная группа представляет собой 5-8-членную неароматическую кольцевую систему, имеющую атомы углерода в кольце и 1-4 кольцевых гетероатома, где каждый гетероатом независимо выбран из азота, кислорода и серы (ʺ5-8-членный гетероциклилʺ). В некоторых вариантах осуществления гетероциклильная группа представляет собой 5-6-членную неароматическую кольцевую систему, имеющую атомы углерода в кольце и 1-4 кольцевых гетероатома, где каждый гетероатом независимо выбран из азота, кислорода и серы (ʺ5-6-членный гетероциклилʺ). В некоторых вариантах осуществления 5-6-членный гетероциклил имеет 1-3 кольцевых гетероатома, выбранных из азота, кислорода и серы. В некоторых вариантах осуществления 5-6-членный гетероциклил имеет 1-2 кольцевых гетероатома, выбранных из азота, кислорода и серы. В некоторых вариантах осуществления 5-6-членный гетероциклил имеет один кольцевой гетероатом, выбранный из азота, кислорода и серы.
Примеры 3-членных гетероциклильных групп, содержащих один гетероатом, включают, но без ограничения, азиридинил, оксиранил, тиоренил. Примеры 4-членных гетероциклильных групп, содержащих один гетероатом, включают, но без ограничения, азетидинил, оксетанил и тиетанил. Примеры 5-членных гетероциклильных групп, содержащих один гетероатом, включают, но без ограничения, тетрагидрофуранил, дигидрофуранил, тетрагидротиофенил, дигидротиофенил, пирролидинил, дигидропирролил и пирролил-2,5-дион. Примеры 5-членных гетероциклильных групп, содержащих два гетероатома, включают, но без ограничения, диоксоланил, оксасульфуранил, дисульфуранил и оксазолидин-2-он. Примеры 5-членных гетероциклильных групп, содержащих три гетероатома, включают, но без ограничения, тиазолинил, оксадиазолинил и тиадиазолинил. Примеры 6-членных гетероциклильных групп, содержащих один гетероатом, включают, но без ограничения, пиперидинил, тетрагидропиранил, дигидропиридинил и тианил. Примеры 6-членных гетероциклильных групп, содержащих два гетероатома, включают, но без ограничения, пиперазинил, морфолинил, дитианил, диоксанил. Примеры 6-членных гетероциклильных групп, содержащих два гетероатома, включают, но без ограничения, триазинанил. Примеры 7-членных гетероциклильных групп, содержащих один гетероатом, включают, но без ограничения, азепанил, оксепанил и тиепанил. Примеры 8-членных гетероциклильных групп, содержащих один гетероатом, включают, но без ограничения, азоканил, оксеканил и тиоканил. Примеры 5-членных гетероциклильных групп, конденсированных с C6арильным кольцом (также называемым в данном описании 5,6-бициклическим гетероциклическим кольцом), включают, но без ограничения, индолинил, изоиндолинил, дигидробензофуранил, дигидробензотиенил, бензоксазолинонил и тому подобное. Примеры 6-членных гетероциклильных групп, конденсированных с арильным кольцом (также называемым в данном описании 6,6-бициклическим гетероциклическим кольцом), включают, но без ограничения, тетрагидрохинолинил, тетрагидроизохинолинил и тому подобное.
ʺАзотсодержащая гетероциклильнаяʺ группа означает 4-7-членную неароматическую циклическую группу, содержащую по меньшей мере один атом азота, например, но без ограничения, морфолин, пиперидин (например, 2-пиперидинил, 3-пиперидинил и 4-пиперидинил), пирролидин (например, 2-пирролидинил и 3-пирролидинил), азетидин, пирролидон, имидазолин, имидазолидинон, 2-пиразолин, пиразолидин, пиперазин и N-алкилпиперазины, такие как N-метилпиперазин. Конкретные примеры включают азетидин, пиперидон и пиперазон.
ʺГетероʺ, когда используется для описания соединения или группы, присутствующей на соединении, означает, что один или более атомов углерода в соединении или группе заменен гетероатомом азота, кислорода или серы. Гетеро может применяться для любой углеводородной группы, описанной выше, такой как алкил, например, гетероалкил, циклоалкил, например, гетероциклил, арил, например, гетероарил, циклоалкенил, например, циклогетероалкенил, и тому подобное, имеющей от 1 до 5 и, в частности, от 1 до 3 гетероатомов.
ʺАцилʺ относится к радикалу -C(O)R20, где R20 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, или замещенный или незамещенный гетероарил, как определено в данном описании. ʺАлканоилʺ представляет собой ацильную группу, где R20 представляет собой группу, отличную от водорода. Репрезентативные ацильные группы включают, но, не ограничиваясь ими, формил (-CHO), ацетил (-C(=O)CH3), циклогексилкарбонил, циклогексилметилкарбонил, бензоил (-C(=O)Ph), бензилкарбонил (-C(=O)CH2Ph), -C(O)-C1-C8алкил, -C(O)-(CH2)t(C6-C10арил), -C(O)-(CH2)t(5-10-членный гетероарил), -C(O)-(CH2)t(C3-C10циклоалкил) и -C(O)-(CH2)t(4-10-членный гетероциклил), где t равен целому числу от 0 до 4. В некоторых вариантах осуществления R21 представляет собой C1-C8алкил, замещенный галогеном или гидрокси; или C3-C10циклоалкил, 4-10-членный гетероциклил, C6-C10арил, арилалкил, 5-10-членный гетероарил или гетероарилалкил, каждый из которых замещен незамещенным C1-C4алкилом, галогеном, незамещенным C1-C4алкокси, незамещенным C1-C4галогеналкилом, незамещенным C1-C4гидроксиалкилом или незамещенным C1-C4галогеналкокси или гидрокси.
ʺАлкоксиʺ относится к группе -OR29, где R29 представляет собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил. Особенные алкоксигруппы представляют собой метокси, этокси, н-пропокси, изопропокси, н-бутокси, трет-бутокси, втор-бутокси, н-пентокси, н-гексокси и 1,2-диметилбутокси. Особые алкоксигруппы представляют собой низший алкокси, т.е. с 1-6 атомами углерода. Дополнительные особые алкоксигруппы имеют от 1 до 4 атомов углерода.
В некоторых вариантах осуществления R29 представляет собой a группу, которая имеет 1 или более заместителей, например, от 1 до 5 заместителей и особенно от 1 до 3 заместителей, в частности 1 заместитель, выбранные из группы, состоящей из амино, замещенного амино, C6-C10арила, арилокси, карбоксила, циано, C3-C10циклоалкила, 4-10-членного гетероциклила, галогена, 5-10-членного гетероарила, гидроксила, нитро, тиоалкокси, тиоарилокси, тиола, алкил-S(O)-, арил-S(O)-, алкил-S(O)2- и арил-S(O)2-. Примеры 'замещенной алкоксигруппы' включают, но, не ограничиваясь ими, -O-(CH2)t(C6-C10арил), -O-(CH2)t(5-10-членный гетероарил), -O-(CH2)t(C3-C10циклоалкил) и -O-(CH2)t(4-10-членный гетероциклил), где t равен целому числу от 0 до 4, и любые присутствующие арильные, гетероарильные, циклоалкильные или гетероциклильные группы могут быть сами по себе замещены незамещенным C1-C4алкилом, галогеном, незамещенным C1-C4алкокси, незамещенным C1-C4галогеналкилом, незамещенным C1-C4гидроксиалкилом или незамещенным C1-C4галогеналкокси или гидрокси. Конкретные примеры 'замещенной алкоксигруппы' представляют собой -OCF3, -OCH2CF3, -OCH2Ph, -OCH2-циклопропил, -OCH2CH2OH и -OCH2CH2NMe2.
ʺАминоʺ относится к радикалу -NH2.
ʺЗамещенный аминоʺ относится к аминогруппе формулы -N(R38)2, где R38 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил или аминозащитную группу, где по меньшей мере один из R38 не является водородом. В некоторых вариантах осуществления каждый R38 независимо выбран из водорода, C1-C8алкила, C3-C8алкенила, C3-C8алкинила, C6-C10арила, 5-10-членного гетероарила, 4-10-членного гетероциклила или C3-C10циклоалкила; или C1-C8алкила, замещенного галогеном или гидрокси; C3-C8алкенила, замещенного галогеном или гидрокси; C3-C8алкинила, замещенного галогеном или гидрокси, или -(CH2)t(C6-C10арила), -(CH2)t(5-10-членного гетероарила), -(CH2)t(C3-C10циклоалкила) или -(CH2)t(4-10-членного гетероциклила), где t равен целому числу от 0 до 8, каждый из которых замещен незамещенным C1-C4алкилом, галогеном, незамещенным C1-C4алкокси, незамещенным C1-C4галогеналкилом, незамещенным C1-C4гидроксиалкилом или незамещенным C1-C4галогеналкокси или гидрокси; или обе R38 группы соединены с образованием алкиленовой группы.
Примеры ʺзамещенной аминогруппыʺ включают, но, не ограничиваясь ими, -NR39-C1-C8алкил, -NR39-(CH2)t(C6-C10арил), -NR39-(CH2)t(5-10-членный гетероарил), -NR39-(CH2)t(C3-C10циклоалкил) и -NR39-(CH2)t(4-10-членный гетероциклил), где t равен целому числу от 0 до 4, например, 1 или 2, каждый R39 независимо представляет собой H или C1-C8алкил; и любые присутствующие алкильные группы могут быть сами по себе замещены галогеном, замещенным или незамещенным амино или гидрокси; и любые присутствующие арильные, гетероарильные, циклоалкильные или гетероциклильные группы могут быть сами по себе замещены незамещенным C1-C4алкилом, галогеном, незамещенным C1-C4алкокси, незамещенным C1-C4галогеналкилом, незамещенным C1-C4гидроксиалкилом или незамещенным C1-C4галогеналкокси или гидрокси. Во избежание сомнений, термин 'замещенный амино' включает группы алкиламино, замещенный алкиламино, алкилариламино, замещенный алкилариламино, ариламино, замещенный ариламино, диалкиламино и замещенный диалкиламино, как описано выше. Замещенный амино включает как группы монозамещенного амино, так и дизамещенного амино.
ʺКарбоксиʺ относится к радикалу -C(O)OH.
ʺЦианоʺ относится к радикалу -CN.
ʺГалоʺ или ʺгалогенʺ относится к фтору (F), хлору (Cl), брому (Br) и йоду (I). В некоторых вариантах осуществления группа галогена представляет собой либо фтор, либо хлор.
ʺГидроксиʺ относится к радикалу -OH.
ʺНитроʺ относится к радикалу -NO2.
ʺЦиклоалкилалкилʺ относится к алкильному радикалу, в котором алкильная группа замещена циклоалкильной группой. Обычные циклоалкилалкильные группы включают, но, не ограничиваясь ими, циклопропилметил, циклобутилметил, циклопентилметил, циклогексилметил, циклогептилметил, циклооктилметил, циклопропилэтил, циклобутилэтил, циклопентилэтил, циклогексилэтил, циклогептилэтил и циклооктилэтил, и тому подобное.
ʺГетероциклилалкилʺ относится к алкильному радикалу, в котором алкильная группа замещена гетероциклильной группой. Обычные гетероциклилалкильные группы включают, но, не ограничиваясь ими, пирролидинилметил, пиперидинилметил, пиперазинилметил, морфолинилметил, пирролидинилэтил, пиперидинилэтил, пиперазинилэтил, морфолинилэтил и тому подобное.
ʺТиокетоʺ относится к группе =S.
Алкильные, алкенильные, алкинильные, карбоциклильные, гетероциклильные, арильные и гетероарильные группы, как определено в данном описании, являются необязательно замещенными (например, ʺзамещеннойʺ или ʺнезамещеннойʺ алкильной, ʺзамещеннойʺ или ʺнезамещеннойʺ алкенильной, ʺзамещеннойʺ или ʺнезамещеннойʺ алкинильной, ʺзамещеннойʺ или ʺнезамещеннойʺ карбоциклильной, ʺзамещеннойʺ или ʺнезамещеннойʺ гетероциклильной, ʺзамещеннойʺ или ʺнезамещеннойʺ арильной или ʺзамещеннойʺ или ʺнезамещеннойʺ гетероарильной группой). Как правило, термин ʺзамещенныйʺ, сопровождаемый термином ʺнеобязательноʺ или не, означает, что по меньшей мере один из присутствующих в группе водород (например, на атоме углерода или азота) заменен допустимым заместителем, например, заместителем, который в результате замещения приводит к стабильному соединению, например, соединению, которое не подвергается спонтанному преобразованию, такому как перегруппировка, циклизация, отщепление или другой реакции. Если не указано иное, ʺзамещеннаяʺ группа имеет заместители в одном или более замещаемых положениях данной группы, и когда более чем одно положение в любой данной структуре является замещенным, заместители в каждом положении являются одинаковыми или различными. Термин ʺзамещенныйʺ предусмотрен для включения замещения всеми допустимыми заместителями органических соединений, любыми заместителями, описанными в данном описании, которые в результате приводят к формированию стабильного соединения. Настоящее изобретение рассматривает любые и все такие комбинации для того, чтобы привести к стабильному соединению. Для целей настоящего изобретения, гетероатомы, такие как азот, могут иметь заместители водорода и/или любые подходящие заместители, как описано в данном описании, которые удовлетворяют валентности гетероатомов и в результате приводят к формированию стабильных групп.
Примеры заместителей на атоме углерода включают, но, не ограничиваясь ими, галоген, -CN, -NO2, -N3, -SO2H, -SO3H, -OH, -ORaa, -ON(Rbb)2, -N(Rbb)2, -N(Rbb)3+X-, -N(ORcc)Rbb, -SH, -SRaa, -SSRcc, -C(=O)Raa, -CO2H, -CHO, -C(ORcc)2, -CO2Raa, -OC(=O)Raa, -OCO2Raa, -C(=O)N(Rbb)2, -OC(=O)N(Rbb)2, -NRbbC(=O)Raa, -NRbbCO2Raa, -NRbbC(=O)N(Rbb)2, -C(=NRbb)Raa, -C(=NRbb)ORaa, -OC(=NRbb)Raa, -OC(=NRbb)ORaa, -C(=NRbb)N(Rbb)2, -OC(=NRbb)N(Rbb)2, -NRbbC(=NRbb)N(Rbb)2, -C(=O)NRbbSO2Raa, -NRbbSO2Raa, -SO2N(Rbb)2, -SO2Raa, -SO2ORaa, -OSO2Raa, -S(=O)Raa, -OS(=O)Raa, -Si(Raa)3, -OSi(Raa)3 -C(=S)N(Rbb)2, -C(=O)SRaa, -C(=S)SRaa, -SC(=S)SRaa, -SC(=O)SRaa, -OC(=O)SRaa, -SC(=O)ORaa, -SC(=O)Raa, -P(=O)2Raa, -OP(=O)2Raa, -P(=O)(Raa)2, -OP(=O)(Raa)2, -OP(=O)(ORcc)2, -P(=O)2N(Rbb)2, -OP(=O)2N(Rbb)2, -P(=O)(NRbb)2, -OP(=O)(NRbb)2, -NRbbP(=O)(ORcc)2, -NRbbP(=O)(NRbb)2, -P(Rcc)2, -P(Rcc)3, -OP(Rcc)2, -OP(Rcc)3, -B(Raa)2, -B(ORcc)2, -BRaa(ORcc), C1-10алкил, C1-10пергалогеналкил, C2-10алкенил, C2-10алкинил, C3-10карбоциклил, 3-14-членный гетероциклил, C6-14арил и 5-14-членный гетероарил, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 Rdd группами;
или два геминальных водородов на атоме углерода заменены группой =O, =S, =NN(Rbb)2, =NNRbbC(=O)Raa, =NNRbbC(=O)ORaa, =NNRbbS(=O)2Raa, =NRbb или =NORcc;
в каждом отдельном случае, Raa независимо выбран из C1-10алкила, C1-10пергалогеналкила, C2-10алкенила, C2-10алкинила, C3-10карбоциклила, 3-14-членного гетероциклила, C6-14арила и 5-14-членного гетероарила, или две Raa группы соединены с образованием 3-14-членного гетероциклила или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 Rdd группами;
в каждом отдельном случае, Rbb независимо выбран из водорода, -OH, -ORaa, -N(Rcc)2, -CN, -C(=O)Raa, -C(=O)N(Rcc)2, -CO2Raa, -SO2Raa, -C(=NRcc)ORaa, -C(=NRcc)N(Rcc)2, -SO2N(Rcc)2, -SO2Rcc, -SO2ORcc, -SORaa, -C(=S)N(Rcc)2, -C(=O)SRcc, -C(=S)SRcc, -P(=O)2Raa, -P(=O)(Raa)2, -P(=O)2N(Rcc)2, -P(=O)(NRcc)2, C1-10алкила, C1-10пергалогеналкила, C2-10алкенила, C2-10алкинила, C3-10карбоциклила, 3-14-членного гетероциклила, C6-14арила и 5-14-членного гетероарила, или две Rbb группы соединены с образованием 3-14-членного гетероциклила или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 Rdd группами;
в каждом отдельном случае, Rcc независимо выбран из водорода, C1-10алкила, C1-10пергалогеналкила, C2-10алкенила, C2-10алкинила, C3-10карбоциклила, 3-14-членного гетероциклила, C6-14арила и 5-14-членного гетероарила, или две Rcc группы соединены с образованием 3-14-членного гетероциклила или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 Rdd группами;
в каждом отдельном случае, Rdd независимо выбран из галогена, -CN, -NO2, -N3, -SO2H, -SO3H, -OH, -ORee, -ON(Rff)2, -N(Rff)2, -N(Rff)3+X-, -N(ORee)Rff, -SH, -SRee, -SSRee, -C(=O)Ree, -CO2H, -CO2Ree, -OC(=O)Ree, -OCO2Ree, -C(=O)N(Rff)2, -OC(=O)N(Rff)2, -NRffC(=O)Ree, -NRffCO2Ree, -NRffC(=O)N(Rff)2, -C(=NRff)ORee, -OC(=NRff)Ree, -OC(=NRff)ORee, -C(=NRff)N(Rff)2, -OC(=NRff)N(Rff)2, -NRffC(=NRff)N(Rff)2,-NRffSO2Ree, -SO2N(Rff)2, -SO2Ree, -SO2ORee, -OSO2Ree, -S(=O)Ree, -Si(Ree)3, -OSi(Ree)3, -C(=S)N(Rff)2, -C(=O)SRee, -C(=S)SRee, -SC(=S)SRee, -P(=O)2Ree, -P(=O)(Ree)2, -OP(=O)(Ree)2, -OP(=O)(ORee)2, C1-6алкила, C1-6пергалогеналкила, C2-6алкенила, C2-6алкинила, C3-10карбоциклила, 3-10-членного гетероциклила, C6-10арила, 5-10-членного гетероарила, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 Rgg группами, или два геминальных Rdd заместителя могут быть соединены с образованием =O или =S;
в каждом отдельном случае, Ree независимо выбран из C1-6алкила, C1-6пергалогеналкила, C2-6алкенила, C2-6алкинила, C3-10карбоциклила, C6-10арила, 3-10-членного гетероциклила и 3-10-членного гетероарила, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 Rgg группами;
в каждом отдельном случае, Rff независимо выбран из водорода, C1-6алкила, C1-6пергалогеналкила, C2-6алкенила, C2-6алкинила, C3-10карбоциклила, 3-10-членного гетероциклила, C6-10арила и 5-10-членного гетероарила, или две Rff группы соединены с образованием 3-14-членного гетероциклила или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 Rgg группами; и
в каждом отдельном случае, Rgg независимо представляет собой галоген, -CN, -NO2, -N3, -SO2H, -SO3H, -OH, -OC1-6алкил, -ON(C1-6алкил)2, -N(C1-6алкил)2, -N(C1-6алкил)3+X-, -NH(C1-6алкил)2+X-, -NH2(C1-6алкил)+X-, -NH3+X-, -N(OC1-6алкил)(C1-6алкил), -N(OH)(C1-6алкил), -NH(OH), -SH, -SC1-6алкил, -SS(C1-6алкил), -C(=O)(C1-6алкил), -CO2H, -CO2(C1-6алкил), -OC(=O)(C1-6алкил), -OCO2(C1-6алкил), -C(=O)NH2, -C(=O)N(C1-6алкил)2, -OC(=O)NH(C1-6алкил), -NHC(=O)( C1-6алкил), -N(C1-6алкил)C(=O)( C1-6алкил), -NHCO2(C1-6алкил), -NHC(=O)N(C1-6алкил)2, -NHC(=O)NH(C1-6алкил), -NHC(=O)NH2, -C(=NH)O(C1-6алкил), -OC(=NH)(C1-6алкил), -OC(=NH)OC1-6алкил, -C(=NH)N(C1-6алкил)2, -C(=NH)NH(C1-6алкил), -C(=NH)NH2, -OC(=NH)N(C1-6алкил)2, -OC(NH)NH(C1-6алкил), -OC(NH)NH2, -NHC(NH)N(C1-6алкил)2, -NHC(=NH)NH2, -NHSO2(C1-6алкил), -SO2N(C1-6алкил)2, -SO2NH(C1-6алкил), -SO2NH2, -SO2C1-6алкил, -SO2OC1-6алкил, -OSO2C1-6алкил, -SOC1-6алкил, -Si(C1-6алкил)3, -OSi(C1-6алкил)3 -C(=S)N(C1-6алкил)2, C(=S)NH(C1-6алкил), C(=S)NH2, -C(=O)S(C1-6алкил), -C(=S)SC1-6алкил, -SC(=S)SC1-6алкил, -P(=O)2(C1-6алкил), -P(=O)(C1-6алкил)2, -OP(=O)(C1-6алкил)2, -OP(=O)(OC1-6алкил)2, C1-6алкил, C1-6 пергалогеналкил, C2-6алкенил, C2-6алкинил, C3-10карбоциклил, C6-10арил, 3-10-членный гетероциклил, 5-10-членный гетероарил; или два геминальных Rgg заместителя могут быть соединены с образованием =O или =S; где X- представляет собой противоион.
ʺПротивоионʺ или ʺанионный противоионʺ представляет собой отрицательно заряженную группу, связанную с катионной четвертичной аминогруппой для сохранения нейтральности. Примеры противоионов включают ионы галогенидов (например, F-, Cl-, Br-, I-), NO3-, ClO4-, OH-, H2PO4-, HSO4-, SO4-2сульфонатные ионы (например, метансульфонат, трифторметансульфонат, п-толуолсульфонат, бензолсульфонат, 10-камфорсульфонат, нафталин-2-сульфонат, нафталин-1-сульфоновая кислота-5-сульфонат, этан-1-сульфоновая кислота-2-сульфонат и тому подобное) и карбоксилатные ионы (например, ацетат, этаноат, пропаноат, бензоат, глицерат, лактат, тартрат, гликолят и тому подобное).
Атомы азота могут быть замещенными или незамещенными, если позволяет валентность, и включают первичные, вторичные, третичные и четвертичные атомы азота. Примеры заместителей на атоме азота включают, но, не ограничиваясь ими, водород, -OH, -ORaa, -N(Rcc)2, -CN, -C(=O)Raa, -C(=O)N(Rcc)2, -CO2Raa, -SO2Raa, -C(=NRbb)Raa, -C(=NRcc)ORaa, -C(=NRcc)N(Rcc)2, -SO2N(Rcc)2, -SO2Rcc, -SO2ORcc, -SORaa, -C(=S)N(Rcc)2, -C(=O)SRcc, -C(=S)SRcc, -P(=O)2Raa, -P(=O)(Raa)2, -P(=O)2N(Rcc)2, -P(=O)(NRcc)2, C1-10алкил, C1-10пергалогеналкил, C2-10алкенил, C2-10алкинил, C3-10карбоциклил, 3-14-членный гетероциклил, C6-14арил и 5-14-членный гетероарил, или две Rcc группы, связанные с атомом азота, соединены с образованием 3-14-членного гетероциклила или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 Rdd группами, и где Raa, Rbb, Rcc и Rdd являются такими, как определено выше.
Эти и другие примеры заместителей описаны более подробно в подробном описании, примерах и пунктах формулы изобретения. Настоящее изобретение не предназначено для ограничения каким-либо образом перечисленными выше примерами заместителей.
Другие определения
Термин ʺфармацевтически приемлемая сольʺ относится к таким солям, которые, с медицинской точки зрения, подходят для использования в контакте с тканями человека и мелких животных без чрезмерной токсичности, раздражения, аллергических реакций и тому подобное, и сопоставимы с целесообразным соотношением польза/риск. Фармацевтически приемлемые соли известны в данной области. Например, у Berge et al. подробно описаны фармацевтически приемлемые соли в J. Pharmaceutical Sciences (1977) 66:1-19. Фармацевтически приемлемые соли соединений по настоящему изобретению включают их производные подходящих неорганических и органических кислот и оснований. Примерами фармацевтически приемлемых, нетоксичных кислотно-аддитивных солей являются соли аминогрупп, сформированных с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота и перхлорная кислота, или с органическими кислотами, такими как уксусная кислота, щавелевая кислота, малеиновая кислота, винная кислота, лимонная кислота, янтарная кислота или малоновая кислота, или путем применения других способов, известных в данной области, такими как ионообмен. Другие фармацевтически приемлемые соли включают адипинатные, альгинатные, аскорбатные, аспартатные, бензоласульфонатные, бензоатные, бисульфатные, боратные, бутиратные, камфоратные, камфорсульфонатные, цитратные, циклопентанпропионатные, биглюконатные, додецилсульфатные, этансульфонатные, формиатные, фумаратные, глюкогептонатные, глицерофосфатные, глюконатные, полусульфатные, гептаноатные, гексаноатные, гидройодидные, 2-гидроксиэтансульфонатные, лактобионатные, лактатные, лауратные, лаурилсульфатные, малатные, малеатные, малонатные, метансульфонатные, 2-нафталинсульфонатные, никотинатные, нитратные, олеатные, оксалатные, пальмитатные, памоатные, пектинатные, персульфатные, 3-фенилпропионатные, фосфатные, пикратные, пивалатные, пропионатные, стеаратные, сукцинатные, сульфатные, тартратные, тиосианатные, п-толуолсульфонатные, ундеканоатные, валератные соли и тому подобное. Фармацевтически приемлемые соли производные соответствующих оснований включают соли щелочных металлов, щелочноземельных металлов, аммония и N+(C1-4алкил)4. Репрезентативные соли щелочных или щелочноземельных металлов включают соли натрия, лития, калия, кальция, магния и тому подобное. Дополнительные фармацевтически приемлемые соли включают, при необходимости, нетоксичные соли аммония, четвертичного аммония и аминных катионов, образованных при использовании противоионов, таких как галогенид, гидроксид, карбоксилат, сульфат, фосфат, нитрат, низший алкилсульфонат и арилсульфонат.
ʺСубъектомʺ, которому предусматривается введение, является, но без ограничения, человек (т.е. мужчина или женщина любой возрастной группы, например, педиатрический субъект (например, младенцы, дети, подростки) или взрослый субъект (например, молодой взрослый, среднего возраста взрослый или старшего возраста взрослый человек)) и/или животное не человек, например, млекопитающее, такое как приматы (например, яванский макак, мака-резус), крупный рогатый скот, свиньи, лошади, овцы, козы, грызуны, кошки и/или собаки. В некоторых вариантах осуществления субъектом является человек. В некоторых вариантах осуществления субъектом является животное не человек. Термины ʺчеловекʺ, ʺпациентʺ и ʺсубъектʺ используются взаимозаменяемо в данном описании.
Заболевание, расстройство и состояние используются взаимозаменяемо в данном описании.
Как использовано в данном описании и если специально не указано иное, термины ʺлечитьʺ, ʺобработкаʺ и ʺлечениеʺ подразумевают действие, которое происходит в то время, как субъект страдает указанным заболеванием, расстройством или состоянием, которое уменьшает выраженность заболевания, расстройства или состояния, или задерживает или замедляет прогрессирование заболевания, расстройства или состояния (ʺтерапевтическое лечениеʺ), а также предусматривает действие, которое оказывается на субъекта, который начинает страдать указанным заболеванием, расстройством или состоянием (ʺпрофилактическое лечениеʺ).
Как правило, ʺэффективное количествоʺ соединения относится к количеству, достаточному для получения желаемого биологического ответа. Как будет очевидно специалисту в данной области, эффективное количество соединения по настоящему изобретению может варьироваться в зависимости от таких факторов, как желаемый биологический конечный эффект, фармакокинетика соединения, заболевание, подвергаемое лечению, способ введения и возраст, здоровье и состояние данного субъекта. Эффективное количество включает терапевтическое и профилактическое лечение.
Как использовано в данном описании и если специально не указано иное, ʺтерапевтически эффективным количествомʺ соединения является количество, достаточное для обеспечения преимущества терапевтического лечения заболевания, расстройства или состояния, или замедления или минимизации одного или более симптомов, связанных с заболеванием, расстройством или состоянием. Терапевтически эффективное количество соединения означает количество терапевтического средства, как такового или в комбинации с другими терапиями, которое обеспечивает терапевтическую пользу при лечении заболевания, расстройства или состояния. Термин ʺтерапевтически эффективное количествоʺ может включать количество, которое улучшает общую терапию, уменьшает или не допускает симптомов или причин заболевания или состояния, или усиливает терапевтическую эффективность другого терапевтического средства.
Как использовано в данном описании и если специально не указано иное, ʺпрофилактически эффективным количествомʺ соединения является количество, достаточное для предотвращения заболевания, расстройства или состояния, или одного или более симптомов, связанных с заболеванием, расстройством или состоянием, или предотвращения их повторения. Профилактически эффективное количество соединения означает количество терапевтического средства, как такового или в комбинации с другими средствами, которое обеспечивает профилактическую пользу в предотвращении заболевания, расстройства или состояния. Термин ʺпрофилактически эффективное количествоʺ может включать количество, которое улучшает общую профилактику или усиливает профилактическую эффективность другого профилактического средства.
Подробное описание некоторых вариантов осуществления настоящего изобретения
Как, в общем, описано в данном описании, настоящее изобретение предоставляет замещенные оксистеролы, полезные при профилактике и/или лечении широкого диапазона расстройств, включая, но, не ограничиваясь ими, NMDA-опосредованные расстройства. Такие соединения, как ожидалось, показывают улучшенную эффективность in vivo, фармакокинетические (PK) свойства, пероральную биодоступностью, формулируемость, стабильность и/или безопасность, по сравнению с другими оксистеролами.
Соединения
В одном из аспектов настоящее изобретение предоставляет соединение формулы (I):

или его фармацевтически приемлемую соль, где: R1 представляет собой C1-6алкил; каждый из R2 и R3 независимо представляет собой водород, C1-6алкил или карбоциклил; или R2 и R3, вместе с атомом углерода, к которому они присоединены, образуют 3-8-членное кольцо; R6 отсутствует или представляет собой водород; каждый из R7 и R8 независимо представляет собой водород, галоген, C1-6алкил или карбоциклил; или каждый из R7 и R8, вместе с атомом углерода, к которому они присоединены, образуют 3-8-членное кольцо; или R2 и R7, вместе с атомами углерода, к которым они присоединены, образуют 3-8-членное кольцо; n равен 1, 2 или 3; и




В некоторых вариантах осуществления R1 представляет собой замещенный C1-6алкил. В некоторых вариантах осуществления R1 представляет собой незамещенный C1-6алкил. В некоторых вариантах осуществления R1 представляет собой метил (например, -CHF2, -CH3, -CF3, -CH2OCH3 или -CH2OCH2CH3), этил или изопропил. В некоторых вариантах осуществления R1 представляет собой -CH3. В некоторых вариантах осуществления R1 представляет собой этил.
В некоторых вариантах осуществления каждый из R2 и R3 независимо представляет собой водород, C1-6алкил или карбоциклил, и когда R2 и R3 взяты вместе с атомом углерода, к которому они присоединены, образуют 3-8-членное кольцо. В некоторых вариантах осуществления 3-8-членное кольцо представляет собой карбоциклильное кольцо (например, циклопропил). В некоторых вариантах осуществления каждый из R2 и R3 независимо представляет собой водород, C1-6алкил или карбоциклил. В некоторых вариантах осуществления каждый из R2 и R3 независимо представляет собой водород, метил (например, -CH3, -CF3), этил (например, -CH2CH3, CH2CF3), пропил, изопропил, циклопропил или бутил.
В некоторых вариантах осуществления R2 представляет собой замещенный C1-6алкил. В некоторых вариантах осуществления R2 представляет собой незамещенный C1-6алкил.
В некоторых вариантах осуществления R2 представляет собой водород, метил (например, -CH3, -CF3), этил или изопропил.
В некоторых вариантах осуществления R3 представляет собой замещенный C1-6алкил. В некоторых вариантах осуществления R3 представляет собой незамещенный C1-6алкил.
В некоторых вариантах осуществления R3 представляет собой метил (например, -CH3, -CF3), этил (например, -CH2CH3, -CH2CF3), пропил, изопропил, циклопропил или бутил.
В некоторых вариантах осуществления R2 и R3 представляют собой водород. В некоторых вариантах осуществления R2 представляет собой водород, и R3 представляет собой C1-6алкил (например, метил (например, -CH3, -CF3), этил, изопропил). В некоторых вариантах осуществления R2 представляет собой C1-6алкил, и R3 представляет собой C1-6алкил. В некоторых вариантах осуществления R2 и R3 представляют собой -CH3. В некоторых вариантах осуществления R2 представляет собой -CH3, и R3 представляет собой -CF3. В некоторых вариантах осуществления R2 представляет собой -CH3, и R3 представляет собой этил. В некоторых вариантах осуществления R2 представляет собой -CH3, и R3 представляет собой изопропил.
В некоторых вариантах осуществления каждый из

В некоторых вариантах осуществления R6 представляет собой водород. В некоторых вариантах осуществления R6 находится в альфа положении. В некоторых вариантах осуществления R6 находится в бета положении.
В некоторых вариантах осуществления R6 отсутствует.
В некоторых вариантах осуществления R7 и R8 представляют собой водород.
В некоторых вариантах осуществления n равен 1. В некоторых вариантах осуществления n равен 1, и R7 и R8 представляют собой водород.
В некоторых вариантах осуществления n равен 2. В некоторых вариантах осуществления n равен 2, и каждый из R7 и R8 независимо представляет собой водород, галоген, C1-6алкил или карбоциклил.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (II):

или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (II) представляет собой соединение формулы (II-A) или формулы (II-B):

или их фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (II-B-i) или формулы (II-B-ii):

или их фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (II-B-iii):

или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (III):

или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (III) представляет собой соединение формулы (III-A) или формулы (III-B):


или их фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (III-B) представляет собой соединение формулы (III-C) или формулы (III-D):


или их фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (III-A) представляет собой соединение формулы (III-E) или формулы (III-F):


или их фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (III) представляет собой соединение формулы (III-A-i-a) или формулы (III-B-i-a):


или их фармацевтически приемлемую соль.
В некоторых вариантах осуществления R1 представляет собой метил (например, -CHF2, -CF3, -CH2OCH3 или -CH2OCH2CH3), этил или изопропил.
В некоторых вариантах осуществления каждый из R2 и R3 независимо представляет собой водород, C1-6алкил или карбоциклил, и когда R2 и R3 взяты вместе с атомом углерода, к которому они присоединены, образуют 3-8-членное кольцо.
В некоторых вариантах осуществления каждый из R2 и R3 независимо представляет собой водород, C1-6алкил или карбоциклил.
В некоторых вариантах осуществления каждый из R2 и R3 независимо представляет собой водород, метил (например, -CH3, -CF3), этил (например, -CH2CH3, -CH2CF3), пропил, изопропил, циклопропил или бутил.
В некоторых вариантах осуществления R2 представляет собой водород, метил (например, -CH3, -CF3) или этил.
В некоторых вариантах осуществления R3 представляет собой метил (например, -CH3, -CF3), этил (например, -CH2CH3, -CH2CF3), пропил, изопропил, циклопропил или бутил.
В некоторых вариантах осуществления соединение выбрано из группы, состоящей из:


или их фармацевтически приемлемой соли.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (IV):

или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления R1 представляет собой метил (например, -CHF2, -CF3, -CH2OCH3 или -CH2OCH2CH3), этил или изопропил.
В некоторых вариантах осуществления каждый из R2 и R3 независимо представляет собой водород, C1-6алкил или карбоциклил, и когда R2 и R3 взяты вместе с атомом углерода, к которому они присоединены, образуют 3-8-членное кольцо.
В некоторых вариантах осуществления каждый из R2 и R3 независимо представляет собой водород, C1-6алкил или карбоциклил.
В некоторых вариантах осуществления каждый из R2 и R3 независимо представляет собой водород, метил (например, -CH3, -CF3), этил (например, -CH2CH3, CH2CF3), пропил, изопропил, циклопропил или бутил.
В некоторых вариантах осуществления R2 представляет собой водород, метил (например, -CH3, -CF3) или этил.
В некоторых вариантах осуществления R3 представляет собой метил (например, -CH3, -CF3), этил (например, -CH2CH3, -CH2CF3), пропил, изопропил, циклопропил, бутил.
В некоторых вариантах осуществления соединение представляет собой:

или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (V):

или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (V-A):

или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (V-B):

или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (III) представляет собой соединение формулы (V-C) или формулы (V-D):


или их фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (V-E):

или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (V-E) представляет собой соединение формулы (V-E-i):

или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (V-E-ii) или (V-E-iii):


или их фармацевтически приемлемую соль. В некоторых вариантах осуществления соединение выбрано из:



















или их фармацевтически приемлемая соль.
Фармацевтические композиции
В другом аспекте настоящее изобретение предоставляет фармацевтическую композицию, содержащую фармацевтически приемлемый носитель и эффективное количество соединения формулы (I).
При применении в качестве фармацевтического средства, соединения, предоставленные в данном описании, обычно вводятся в форме фармацевтической композиции. Такие композиции могут быть получены способом, хорошо известным в фармацевтической области, и содержат по меньшей мере одно активное соединение.
В одном из вариантов осуществления, касающихся фармацевтической композиции, носитель представляет собой парентеральный носитель, пероральный или местный носитель.
Настоящее изобретение также относится к соединению формулы (I) или его фармацевтической композиции для применения в качестве фармацевтического препарата или лекарственного средства.
Как правило, соединения, предоставленные в данном описании, вводят в терапевтически эффективном количестве. Фактически вводимое количество соединения обычно определяется врачом, в соответствии с имеющимися обстоятельствами, включая состояние, подвергаемое лечению, выбранный путь введения, конкретно вводимое соединение, возраст, массу и реакцию конкретного пациента, выраженность симптомов у пациента и тому подобное
Фармацевтические композиции, предоставленные в данном описании, могут быть введены различными путями, включая пероральное, ректальное, трансдермальное, подкожное, внутривенное, внутримышечное и интраназальное введение. В зависимости от предполагаемого пути доставки, соединения, предоставленные в данном описании, предпочтительно сформулированы в форме инъекционных либо пероральных композиций, или в форме мази, лосьонов или пластырей, все для трансдермального введения. Композиций для перорального введения могут принимать форму нерасфасованных жидких растворов или суспензий, или нерасфасованных порошков. В большинстве случаев, однако, композиции представлены в единичных дозированных формах для облегчения точной дозировки. Термин ʺединичные дозированные формыʺ относится к физически дискретным единицам, подходящим для однократной дозировки субъектам-людям и другим млекопитающим, где каждая единица содержит заранее рассчитанное количество активного вещества для получения желаемого терапевтического эффекта, совместно с подходящим фармацевтическим эксципиентом. Конкретные единичные дозированные формы включают предварительно заполненные, предварительно отмеренные ампулы или шприцы с жидкими композициями или, в случае твердых композиций, пилюли, таблетки, капсулы или тому подобное. В таких композициях соединение обычно представляет собой основной компонент (приблизительно от 0,1 до около 50% по массе или предпочтительно от 1 до около 40% по массе) с остатком наполнителей или носителей и включенными добавками, полезными для формулирования желаемой дозированной формы.
Жидкие формы, подходящие для перорального введения, могут включать подходящий водный или неводный наполнитель с буферирующими, суспендирующими и диспергирующими агентами, красителями, ароматизаторами и тому подобное. Твердые формы могут включать, например, любой из следующих ингредиентов или соединений аналогичного характера: связующее, такое как микрокристаллическая целлюлоза, трагантовая камедь или желатин; эксципиент, такой как крахмал или лактоза, дезинтегрирующий агент, такой как альгиновая кислота, примогель или кукурузный крахмал; лубрикант, такой как стеарат магния; глидант, такой как коллоидный диоксид кремния; подслащивающий агент, такой как сахароза или сахарин; или вкусовое вещество, такое как мята перечная, метилсалицилат, или апельсиновый ароматизатор.
Инъецируемые композиции, как правило, основаны на инъецируемых стерильных солевых растворах или забуференных фосфатом солевых растворах или других инъецируемых носителях, известных в данной области техники. Как указано выше, активное соединение в таких композициях, как правило, представляет собой основной компонент, часто составляющий примерно от 0,05 до 10% по массе с остальным инъецируемым носителем и тому подобное.
Трансдермальные композиции, как правило, формулируются в виде местной мази или крема, содержащей активный ингредиент(ы), как правило, в количестве в диапазоне примерно от 0,01 до примерно 20% по массе, предпочтительно примерно от 0,1 до примерно 20% по массе, предпочтительно примерно от 0,1 до примерно 10% по массе и более предпочтительно примерно от 0,5 до примерно 15% по массе. При формулировании в виде мази, активные ингредиенты обычно комбинируются либо с парафиновой, либо со смешиваемой с водой мазевой основой. Альтернативно, активные ингредиенты могут быть сформулированы в виде крема, например, с кремовой основой масло-в-воде. Такие трансдермальные составы хорошо известны в данной области техники и, как правило, включают дополнительные ингредиенты для усиления стабильности проникновения в кожу активных ингредиентов или препаратов. Все такие известные трансдермальные препараты и ингредиенты включены в предоставленный в данном описании объем.
Соединения, предоставленные в данном описании, также могут быть введены при помощи трансдермального устройства. Соответственно, трансдермальное введение может быть достигнуто при использовании пластырей любого резервуарного или пористо-мембранного типа или различных твердых матриц.
Описанные выше компоненты для перорально вводимых, инъецируемых или местно вводимых композиций являются только иллюстративными. Другие материалы, а также методики изготовления и тому подобное изложены в части 8 Remington's Pharmaceutical Sciences, 17th edition, 1985, Mack Publishing Company, Easton, Pennsylvania, которая включена в данное описание посредством ссылки.
Описанные выше компоненты для перорально вводимых, инъецируемых или местно вводимых композиций являются только иллюстративными. Другие материалы, а также методики изготовления и тому подобное изложены в части 8 Remington's The Science and Practice of Pharmacy, 21st edition, 2005, Publisher: Lippincott Williams & Wilkins, которая включена в данное описание посредством ссылки.
Соединения по настоящему изобретению также могут быть введены в форме замедленного высвобождения или в форме длительного высвобождения лекарственного средства систем доставки. Описание репрезентативных веществ длительного высвобождения можно найти в Remington's Pharmaceutical Sciences.
Настоящее изобретение также относится к фармацевтически приемлемым препаратам соединения формулы (I). В одном из вариантов осуществления данный препарат содержит воду. В других вариантах осуществления данный препарат содержит производное циклодекстрина. Большинство общепринятых циклодекстринов представляют собой α-, β- и γ-циклодекстрины, состоящие из 6, 7 и 8 α-1,4-связанных единиц глюкозы, соответственно, необязательно содержащей один или более заместителей на связанных сахарных фрагментах, которые включают, но, не ограничиваясь ими, метилированное, гидроксиалкилированное, ацилированное и сульфоалкилэфирное замещение. В некоторых вариантах осуществления циклодекстрин представляет собой простой сульфоалкиловый эфир β-циклодекстрина, например, простой сульфобутиловый эфир β-циклодекстрина, также известный как Captisol®. См., например, США 5376645. В некоторых вариантах осуществления данный препарат содержит гексапропил-β-циклодекстрин. В более конкретном варианте осуществления данный препарат содержит гексапропил-β-циклодекстрин (10-50% в воде).
Настоящее изобретение также относится к фармацевтически приемлемым кислотно-аддитивным солям соединения формулы (I). Кислота, которую можно использовать при получении фармацевтически приемлемой соли, является такой, которая формирует нетоксичную кислотно-аддитивную соль, т.е. соль, содержащую фармакологически приемлемые анионы, такие как гидрохлорид, гидройодид, гидробромид, нитрат, сульфат, бисульфат, фосфат, ацетат, лактат, цитрат, тартрат, сукцинат, малеат, фумарат, бензоат, пара-толуолсульфонат и тому подобное.
Следующие примеры препаратов иллюстрируют репрезентативные фармацевтические композиции, которые могут быть получены согласно настоящему изобретению. Настоящее изобретение, однако, не ограничено следующими фармацевтическими композициями.
Пример композиции 1 - Таблетки: Соединение формулы (I) или его фармацевтически приемлемую соль смешивают в виде сухого порошка с сухим желатиновым связующим в массовом соотношении приблизительно 1:2. Незначительное количество стеарата магния добавляют в качестве лубриканта. Смесь формируют в 240-270 мг таблетки (80-90 мг активного соединения на таблетку) в таблеточном прессе.
Пример композиции 2 - Капсулы: Соединение формулы (I) или его фармацевтически приемлемую соль, смешивают в виде сухого порошка с крахмальным разбавителем в массовом соотношении приблизительно 1:1. Смесью заполняют 250 мг капсулы (125 мг активного соединения на капсулу).
Пример композиции 3 - Жидкость: Соединение формулы (I) или его фармацевтически приемлемую соль (125 мг) смешивают с сахарозой (1,75 г) и ксантановой камедью (4 мг), и полученную в результате смесь перемешивают, пропускают через сита № 10 меш США и затем смешивают с предварительно подготовленным раствором микрокристаллической целлюлозы и натрийкарбоксиметилцеллюлозы (11:89, 50 мг) в воде. Бензоат натрия (10 мг), вкусовую добавку и краситель разбавляют водой и добавляют при перемешивании. Достаточное количество воды затем добавляют для достижения общего объема 5 мл.
Пример композиции 4 - Таблетки: Соединение формулы (I) или его фармацевтически приемлемую соль смешивают в виде сухого порошка с сухим желатиновым связующим в массовом соотношении приблизительно 1:2. Незначительное количество стеарата магния добавляют в качестве лубриканта. Смесь формируют в 450-900 мг таблетки (150-300 мг активного соединения) в таблеточном прессе.
Пример композиции 5 - Инъекция: Соединение формулы (I) или его фармацевтически приемлемую соль растворяют или суспендируют в забуференной стерильной солевой инъецируемой водной среде до концентрации приблизительно 5 мг/мл.
Пример композиции 6 - Таблетки: Соединение формулы (I) или его фармацевтически приемлемую соль смешивают в виде сухого порошка с сухим желатиновым связующим в массовом соотношении приблизительно 1:2. Незначительное количество стеарата магния добавляют в качестве лубриканта. Смесь формируют в 90-150 мг таблетки (30-50 мг активного соединения на таблетку) в таблеточном прессе.
Пример композиции 7 - Таблетки: Соединение формулы (I) или его фармацевтически приемлемую соль смешивают в виде сухого порошка с сухим желатиновым связующим в массовом соотношении приблизительно 1:2. Незначительное количество стеарата магния добавляют в качестве лубриканта. Смесь формируют в 30-90 мг таблетки (10-30 мг активного соединения на таблетку) в таблеточном прессе.
Пример композиции 8 - Таблетки: Соединение формулы (I) или его фармацевтически приемлемую соль смешивают в виде сухого порошка с сухим желатиновым связующим в массовом соотношении приблизительно 1:2. Незначительное количество стеарата магния добавляют в качестве лубриканта. Смесь формируют в 0,3-30 мг таблетки (0,1-10 мг активного соединения на таблетку) в таблеточном прессе.
Пример композиции 9 - Таблетки: Соединение формулы (I) или его фармацевтически приемлемую соль смешивают в виде сухого порошка с сухим желатиновым связующим в массовом соотношении приблизительно 1:2. Незначительное количество стеарата магния добавляют в качестве лубриканта. Смесь формируют в 150-240 мг таблетки (50-80 мг активного соединения на таблетку) в таблеточном прессе.
Пример композиции 10 - Таблетки: Соединение формулы (I) или его фармацевтически приемлемую соль смешивают в виде сухого порошка с сухим желатиновым связующим в массовом соотношении приблизительно 1:2. Незначительное количество стеарата магния добавляют в качестве лубриканта. Смесь формируют в 270-450 мг таблетки (90-150 мг активного соединения на таблетку) в таблеточном прессе.
Уровни инъекционных доз составляют диапазон примерно от 0,1 мг/кг/час до по меньшей мере 10 мг/кг/час, в общей сложности примерно в течение от 1 до примерно 120 часов и особенно от 24 до 96 часов. Для достижения адекватных уровней устойчивого состояния также можно вводить предварительно нагруженный болюс примерно от 0,1 мг/кг до примерно 10 мг/кг или более. Максимальная общая доза, как ожидается, не должна превышать примерно 2 г/день для пациента человека массой от 40 до 80 кг.
Для профилактики и/или лечения долгосрочных состояний процесс лечения обычно затягивается на многие месяцы или годы, так что пероральная дозировка является предпочтительной для удобства пациента и переносимости. При пероральном дозировании, одна-пять и особенно две-четыре, и, как правило, три пероральные дозы в день являются репрезентативными режимами. При использовании таких режимов дозирования, каждая доза обеспечивает примерно от 0,01 до примерно 20 мг/кг соединения, предоставленного в данном описании, с предпочтительными дозами, которые обеспечивают примерно от 0,1 до примерно 10 мг/кг и особенно примерно от 1 до примерно 5 мг/кг.
Трансдермальные дозы, как правило, выбраны таким образом, чтобы обеспечивать аналогичные или низкие уровни в крови, чем достигаются с помощью инъекционного дозирования.
При использовании для предотвращения возникновения расстройства ЦНС, соединения, предоставленные в данном описании, будут вводиться субъекту с риском развития данного состояния, обычно по рекомендации и под наблюдением врача, на уровнях дозирования, описанных выше. Субъекты с риском развития конкретного состояния, как правило, включают такие, у которых имеется семейная история данного состояния, или такие, у которых была идентифицирована, путем генетического тестирования или скрининга, особенная предрасположенность к развитию данного состояния.
Способы лечения и применения
Соединения настоящего изобретения, например, соединение формулы (I) и их фармацевтически приемлемые соли, как описано в данном описании, как правило, предназначены для модуляции NMDA функции и, таким образом, воздействовать в качестве оксистеролов при лечении и профилактике, например, связанных с ЦНС состояний у субъекта. В некоторых вариантах осуществления соединения, описанные в данном описании, например, соединение формулы (I) и их фармацевтически приемлемые соли, как описано в данном описании, как правило, предназначены для преодоления гематоэнцефалического барьера (например, предназначены для транспортировки через гематоэнцефалический барьер). Модуляция, как использовано в данном описании, относится, например, к ингибированию или потенциации функции NMDA рецептора. В некоторых вариантах осуществления соединение формулы (I) или его фармацевтически приемлемая соль может выступать в качестве негативного аллостерического модулятора (NAM) NMDA и ингибировать функцию NMDA рецептора. В некоторых вариантах осуществления настоящее изобретение, например, соединение формулы (I) или его фармацевтически приемлемая соль, может выступать в качестве позитивного аллостерического модулятора (PAM) NMDA и потенцировать функцию NMDA рецептора. В некоторых вариантах осуществления соединение формулы (I) или его фармацевтически приемлемая соль модулирует функцию NMDA, но не выступает в качестве отрицательного аллостерического модулятора (NAM) или позитивного аллостерического модулятора (PAM) NMDA.
В некоторых вариантах осуществления расстройство представляет собой рак. В некоторых вариантах осуществления расстройством является диабет. В некоторых вариантах осуществления расстройством является расстройство синтеза стерола. В некоторых вариантах осуществления расстройством является желудочно-кишечное (GI) расстройство, например, запор, синдром раздраженного кишечника (IBS), воспалительное заболевание кишечника (IBD) (например, язвенный колит, болезнь Крона), структурные расстройства, затрагивающие GI, анальные расстройства (например, геморрой, внутренний геморрой, внешний геморрой, анальные трещины, перианальные абсцессы, анальный свищ), полипы толстой кишки, рак, колит. В некоторых вариантах осуществления расстройством является воспалительное заболевание кишечника.
В некоторых вариантах осуществления расстройством является сидром Смита-Лемли-Опица (SLOS). В некоторых вариантах осуществления расстройством является десмостеролоз (desmosterolosis). В некоторых вариантах осуществления расстройством является ситостеролемия. В некоторых вариантах осуществления расстройство представляет собой церебросухожильный ксантоматоз (CTX). В некоторых вариантах осуществления расстройством является недостаточность мевалонаткиназы (MKD). В некоторых вариантах осуществления расстройством является мутация гена SC4MOL (SMO дефицит). В некоторых вариантах осуществления расстройством является болезнь Нимана-Пика. В некоторых вариантах осуществления расстройством является расстройство аутического спектра (ASD). В некоторых вариантах осуществления расстройством является заболевание, связанное с фенилкетонурией.
Примеры состояний, связанных с модуляцией NMDA, включают, но, не ограничиваясь ими, желудочно-кишечное (GI) расстройство, например, запор, синдром раздраженного кишечника (IBS), воспалительное заболевание кишечника (IBD) (например, язвенный колит, болезнь Крона), структурные расстройства, затрагивающие GI, анальные расстройства (например, геморрой, внутренний геморрой, внешний геморрой, анальные трещины, перианальные абсцессы, анальный свищ), полипы толстой кишки, рак, колит и состояния ЦНС, например, как описано в данном описании.
Примеры состояний ЦНС, связанных к модуляцией NMDA, включают, но, не ограничиваясь ими, расстройства адаптации, тревожные расстройства (включая обсессивно-компульсивное расстройство, посттравматическое стрессовое расстройство, социальную фобию, генерализованное тревожное расстройство), когнитивные расстройства (включая болезнь Альцгеймера и другие формы деменции (например, фронтотемпоральную деменцию)), диссоциированные расстройства, расстройства питания, расстройства настроения (включая депрессию (например, послеродовую депрессию), биполярное расстройство, дистимическое расстройство, суициидальность), шизофрению или другие психотические расстройства (включая шизоаффективное расстройство), расстройства сна (включая бессонницу), связанные со злоупотреблением психоактивных веществ расстройства, расстройства личности (включая обсессивно-компульсивное расстройство личности), расстройства аутистического спектра (включая связанные с мутациями Shank группы белков (например, Shank3)), связанные с неврологическим развитием расстройства (включая синдром Ретта), рассеянный склероз, расстройства синтеза стерола, боль (включая острую и хроническую боль; головные боли, например, мигреневые головные боли), припадочные расстройства (включая эпилептический статус и моногенные формы эпилепсии, такие как болезнь Драветса и комплекс туберозного склероза (TSC)), инсульт, черепно-мозговую травму, нарушения движений (включая болезнь Хантингтона и болезнь Паркинсона) и тиннитус. В некоторых вариантах осуществления соединение настоящего изобретения, например, соединение формулы (I) или его фармацевтически приемлемая соль, может быть использовано для воздействия на седацию или анестезию. В некоторых вариантах осуществления соединение формулы (I) или его фармацевтически приемлемая соль полезны при лечении или предупреждении расстройств адаптации, тревожных расстройств, когнитивных расстройств, диссоциированных расстройств, расстройств питания, расстройств настроения, шизофрении или других психотических расстройств, расстройств сна, расстройств, связанных с употреблением психоактивных веществ, расстройств личности, расстройств аутистического спектра, связанных с неврологическим развитием расстройств, расстройств синтеза стерола, боли, припадочных расстройств, инсульта, черепно-мозговых травм, нарушений движений и ухудшения зрения, потери слуха и тиннитуса. В некоторых вариантах осуществления расстройством является болезнь Хантингтона. В некоторых вариантах осуществления расстройством является болезнь Паркинсона. В некоторых вариантах осуществления расстройством является воспалительное заболевание (например, волчанка).
В другом аспекте предоставлен способ лечения или профилактики возбудимости мозга у субъекта, восприимчивого к или страдающего состоянием, связанным с возбудимостью мозга, включающий введение данному субъекту эффективного количества соединения настоящего изобретения, например, соединения формулы (I) или его фармацевтически приемлемой соли.
В еще одном аспекте настоящее изобретение предоставляет комбинацию соединения настоящего изобретения, например, соединения формулы (I) или его фармацевтически приемлемой соли, и другого фармакологически активного средства. Соединения, предоставленные в данном описании, могут быть введены как единственное активное средство или они могут быть введены в комбинации с другими средствами. Введение в комбинации можно проводить методом, очевидным специалисту в данной области, включающим, например, отдельное, последовательное, одновременное и чередуемое введение.
Заболевания и расстройства
В данном описании описаны способы лечения нарушений синтеза стеролов. Примеры расстройств описаны в данном описании. Данные способы включают введение субъекту, например, субъекту, страдающему нарушением синтеза стеролов, таким как SLOS, соединения, модулирующего NMDA рецептор. Примеры таких соединений описаны в данном описании.
Расстройства синтеза стерола
В одном из аспектов данного описания описаны способы лечения нарушений синтеза стеролов. Холестерин играет существенную роль в росте и развитии. Он представляет собой мембранный липид и является источником многих молекул, которые играют важную роль в клеточном росте и дифференциации, гликозилировании белка и сигнальных путях. Биосинтез холестерина включает в себя ряд ферментов и полупродуктов. Расстройства, являющиеся результатом дефицита любого из ферментов, вовлеченных в биосинтезе холестерина, приводят к накоплению промежуточных продуктов и дисбалансу в биомолекулах, что приводит к расстройствам, включающим врожденные пороки развития скелета, телесные дисморфобии, задержку психомоторного развития и потерю веса, и отставание в физическом развитии. В одном из вариантов осуществления нарушение синтеза стеролов или синдром нарушения синтеза стеролов может быть подвергнут лечению путем введения субъекту, страдающего нарушением синтеза стеролов, соединения, описанного в данном описании, в качестве соединения, модулирующего NMDA рецептор, как описано в данном описании. Дополнительные расстройства описаны ниже.
Синдром Смита-Лемли-Опица
В одном из аспектов данного описания описаны способы лечения синдрома Смит-Лемли-Опица (или SLOS, или дефицита 7-дегидрохолестеринредуктазы). SLOS представляет собой врожденную ошибку синтеза холестерина. В дополнение к микроцефалии, умеренная и тяжелая умственная отсталость, сенсорная гиперчувствительность, стереотипное поведение, телесная дисморфобия и синдактилия второго/третьего пальцев являются признаками сокращения уровней церебростерола (24(S)-гидроксихолестерин). SLOS представляет собой аутосомно-рецессивное генетическое состояние, являющееся результатом дефицита целевого фермента на пути синтеза холестерина, и является причиной низких или низко-нормальных уровней холестерина в плазме или повышения уровней 7- и 8-дегидрохолестерина (DHC; 7DHC и 8DHC). Общепринятые в настоящее время применяемые терапии включают пищевые холестериновые добавки, лечение ингибиторами 3-гидрокси-3-метилглутарил-кофермента А редуктазы (ингибиторы HMG-CoA редуктазы, также известны как статины) и лечение средствами, которые усиливают продуцирование холестерина и/или аккрецию; и уменьшают накопление 7DHC и 8DHC, потенциально токсичных предшественников холестерина.
Десмостеролоз
Десмостеролоз представляет собой дефицит десмостеролредуктазы и имеет фенотип, аналогичный SLOS. В одном из аспектов данного описания описаны способы лечения десмостеролоза соединениями, описанными в данном описании.
Ситостеролемия
Ситостеролемия представляет собой редкое аутосомно-рецессивное расстройство, вызванное мутациями в двух ATP-связующих кассетных транспортерных генов (ABC) (ABCG5 и ABCG8). Ситостеролемия усиливает поглощение растительных стеринов и холестерина из кишечника. У пациентов, как правило, определяется сухожильные и туберозные ксантомы и преждевременное заболевание коронарной артерии. В одном из аспектов данного описания описаны способы лечения ситостеролемии соединениями, описанными в данном описании.
Церебросухожильный ксантоматоз (CTX)
В одном из аспектов данного описания описаны способы лечения церебросухожильного ксантоматоза (также называемого церебральным холестерозом, или синдромом Ван Богерта-Шерера-Эпштейна) соединениями, описанными в данном описании. CTX может быть вызван мутацией гена CYP27A1, который продуцирует стерол 27-гидроксилазный фермент. Стерол 27-гидроксилаза метаболизирует холестерин в желчные кислоты (например, хенодезоксихолевую кислоту), которые являются важными в поглощении жиров в кишечнике. Ферментная дисфункция может привести к накоплению холестерина в тканях. CTX характеризуется диареей у детей, катарактой, сухожильной ксантомой, снижением умственной способности и аномальной подвижностью у взрослых.
Синдромы недостаточности мевалонаткиназы (MKD)
Недостаточность мевалонаткиназы (также называемая мевалоновой ацидурией (более тяжелая форма MKD) или гипер IgD синдромом (HIDS, или гипериммуноглобулинемией D) с синдромом периодической лихорадки (более доброкачественная форма MKD)) вызывает накопление мевалоновой кислоты в моче в результате недостаточной активности мевалонаткиназы. MKD может привести к задержке развития, гипотонии, анемии, гепатоспленомегалии, дисморфическим признакам, умственной отсталости и общей задержке в развитии. Мевалоновая ацидурия характеризуется задержкой физического и умственного развития, отсутствием прибавки в весе, повторяющимися эпизодами лихорадки с рвотой и поносом, увеличением печени, селезенки и лимфатических узлов, микроцефалией (небольшой размер головы), катарактой, низким мышечным тонусом, малым ростом, выраженными фациальными признаками, атаксией и анемией. HIDS характеризуется повторяющимися эпизодами лихорадки, связанными с увеличением лимфатических узлов, болью в суставах, желудочно-кишечными проблемами и кожной сыпью. В одном из аспектов данного описания описаны способы лечения MKD соединениями, описанными в данном описании.
Мутация гена SC4MOL (дефицит SMO)
Дефицит гена SC4MOL представляет собой генетическое расстройство на пути биосинтеза холестерина (например, мутации гена SC4MOL, кодирующего новую стеролоксидазу). Дефицит гена SC4MOL характеризуется накоплением диметил и монометилстеролов, которые могут быть обнаружены в крови, в тонком слое кожи или первичных кожных фибробластах. В одном из аспектов данного описания описаны способы лечения дефицита SMO соединениями, описанными в данном описании.
Болезнь Нимана-Пика
Болезнь Нимана-Пика представляет собой лизосомальное хроническое заболевание, являющееся результатом генетической мутации, которая влияет на метаболизм. Болезнь Нимана-Пика приводит к аномальному накоплению холестерина и других жирных веществ (липидов) из-за неспособности организма переносить эти вещества. Такое накопление вредит поврежденным участкам.
Аутизм
В одном из аспектов данного описания описаны способы лечения расстройства аутистического спектра или аутизма. Расстройства аутистического спектра (ASD) и аутизм относится к группе комплексных расстройств мозгового развития. Аутизм, как правило, характеризуется трудностями в социальном взаимодействии, например, в вербальном и невербальном общении. Повторяющееся поведение также часто встречается у индивидуумов, имеющих аутизм. Аутизм может быть связан с умственной отсталостью, трудностью в координации движений и внимания, и проблемами физического здоровья, например, нарушениями сна и желудочно-кишечного тракта. Индивидуумы, имеющие аутизм, также могут проявлять себя в зрительной памяти, музыке, математике и искусстве. Аутизм может относиться к аутистичному расстройству, дезинтегративному расстройству в детском возрасте, неуточненному первазивному расстройству развития (PDD-NOS) и синдрому Аспергера. Аутизм также связан с моногенетическими причинами аутизма, такими как синаптопатические, например, синдром Ретта, синдром фрагильной X-хромосомы, синдром Ангельмана.
Расстройства, связанные с фенилкетонурией
В одном из аспектов данного описания описаны способы лечения расстройств, связанных с фенилкетонурией (например, когнитивных расстройств) соединениями, описанными в данном описании. Фенилкетонурия может привести к гипохестеролимии и низкому статусу витамина D. Холестерины общей и низкой плотности и 25-гидроксивитамин D были обнаружены пониженными у субъектов, страдающих фенилкетонурией, по сравнению с субъектами не страдающими фенилкетонурией (Clin. Chim. Acta 2013, 416: 54-59). Было показано, что 24S-гидроксихолестерин и 27S-гидроксихолестерин, и 7α-гидроксихолестерин (например, представляющие собой периферийный и выводимый печенью холестерин, соответственно) значительно сократился в субъектов, страдающих фенилкетонурией, в то время как 7β-гидроксихолестерин (например, отражающий оксидативный стресс) был значительно увеличен у субъектов, страдающих фенилкетонурией. Изменения в уровнях 24S-OHC и 7β-гидроксихолестерина коррелируют с уровнем фенилаланина, и уровни 27S-гидроксихолестерина можно соотнести с уровнем 25-гидроксивитамина D у субъектов, страдающих фенилкетонурией.
Аббревиатуры
PCC: хлорхромат пиридиния; t-BuOK: трет-бутоксид калия; 9-BBN: 9-боабицикло[3,3,1]нонан; Pd(t-Bu3P)2: бис(три-трет-бутилфосфин)палладий(0); AcCl: ацетилхлорид; i-PrMgCl: изопропилмагнийхлорид; TBSCl: трет-бутил(хлор)диметилсилан; (i-PrO)4Ti: тетраизопропоксид титана; BHT: 2,6-ди-трет-бутил-4-метилфеноксид; Me: метил; Ph: фенил; Et: этил; Bz: бензоил; DCC: дициклогексилкарбодиимид; DCM: дихлорметан; DMAP: 4-диметиламинопиридин; DMP: периодинан Десса-Мартина; EtOAc: этилацетат; TEA: триэтиламин; AlaOH: аланин; Boc: трет-бутоксикарбонил. Py: пиридин; TBAF: тетра-н-бутиламмонийфторид; ТГФ: тетрагидрофуран; TMS: триметилсилил. MAD: бис(2,6-ди-трет-бутил-4-метилфеноксид) метилалюминия; Na2SO4: сульфат натрия; Na2S2O3: тиосульфат натрия; PE: петролейный эфир; MeCN: ацетонитрил; MeOH: метанoл; Py: пиридин, Boc: трет-бутоксикарбонил; MTBE: метил-трет-бутиловый эфир.
Примеры
Для более полного понимания настоящего изобретения, описанного в данном описании, предлагаются следующие примеры. Синтетические и биологические примеры, описанные в данном описании, предлагаются для иллюстрации соединений, фармацевтических композиций и способов, предоставленных в данном описании, и не должны толковаться каким-либо образом как ограничивающие их объем.
Стереохимия, представленная в данном описании (например, обозначение ʺRʺ или ʺSʺ в положении C27 или C25 стероида) может иметь предварительное (например, произвольное) обозначение. Например, C25 положение может быть обозначено в конфигурации ʺRʺ, когда абсолютной конфигурацией является ʺSʺ. C25 положение также может быть обозначено в конфигурации ʺSʺ, когда абсолютной конфигурацией является ʺRʺ.
Пример 1. Синтез соединения 1

Стадия 1. К раствору реагента A1 (700 мг, 1,73 ммоль) в сухом CH2Cl2 (5 мл) порциями добавляли реагент Десса-Мартина (1,09 г, 2,59 ммоль) при 0°C. Полученную реакционную смесь перемешивали при 25°C в течение 3 часов. Смесь гасили добавлением насыщенного водного NaHCO3/Na2S2O3 (1:3, 15 мл) и экстрагировали EtOAc (2×50 мл). Органическую фазу затем промывали насыщенным раствором соли (50 мл), сушили над Na2SO4 и концентрировали, с получением соединения A2 в виде неочищенного остатка (700 мг), который непосредственно использовали на следующей стадии без дополнительной очистки.
Стадия 2. К раствору BHT (2,29 г, 10,4 ммоль) в толуоле (10 мл) добавляли раствор AlMe3 (2,61 мл, 5,22 ммоль) в 2М толуоле при 25°C. Полученную в результате смесь перемешивали при 25°C в течение 1 часа, после чего добавляли раствор соединения A2 (700 мг, 1,74 ммоль) в толуоле (5 мл) при -78°C в атмосфере азота. Смесь перемешивали в течение дополнительных 30 мин, после чего по каплям добавляли MeMgBr (3,0М в Et2O, 1,74 мл, 5,22 ммоль) при -78°C. Полученную реакционную смесь перемешивали при этой температуре в течение 3 часов, затем гасили добавлением насыщенного водного раствора NH4Cl (30 мл) при -78°C. Полученную в результате суспензию фильтровали, и осадок на фильтре промывали EtOAc (2×50 мл). Объединенные органические фазы сушили над Na2SO4, концентрировали и очищали на силикагеле (PE/EtOAc=10/1 до 8/1), с получением соединения 1 (120 мг, 17%) в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 5,30 (д, J=3,6 Гц, 1H), 2,40-2,30 (м, 1H), 1,99-1,98 (м, 3H), 1,70-1,57 (м, 4H), 1,46-1,17 (м, 28H), 1,11-0,92 (м, 8H), 0,67 (с, 3H). ЖХМС Rt=1,503 мин при 2 мин хроматографии, 10-80AB, МС ESI вычислено для C28H49O2 [M+H]+ 417, найдено C28H45 [M-2H2O+H]+ 381.
Пример 2. Синтез соединений 2 и 3

Стадия 1. К раствору соединения 1 (55 мг, 0,131 ммоль) в EtOAc (10 мл) добавляли Pd/C (50 мг). Полученную реакционную смесь перемешивали в атмосфере водорода (50 ф./кв.д.) при 50°C в течение 12 часов, по истечении этого времени фильтровали через рыхлый слой целита. Фильтрат концентрировали при пониженном давлении, и полученный в результате остаток очищали на силикагеле (PE/EtOAc=10/1), с получением как соединения 2 (5 мг, 9%), так и соединения 3 (47,8 мг, 87%), каждое в виде не совсем белого твердого вещества. Соединение 2:1H ЯМР (400 МГц, CDCl3) δ 1,96 (д, J=12,4 Гц, 1H), 1,80-1,62 (м, 1H), 1,60-1,57 (м, 3H), 1,46-1,24 (м, 28H), 1,21-0,92 (м, 10H), 0,90 (с, 3H), 0,70-0,64 (м, 4H). ЖХМС Rt=1,568 мин при 2 мин хроматографии, 10-80AB, МС ESI вычислено для C28H51O2 [M+H]+ 419, найдено C28H47 [M-2H2O+H]+ 383. Соединение 3:1H ЯМР (400 МГц, CDCl3) δ 1,98-1,79 (м, 5H), 1,75-1,57 (м, 2H), 1,55-0,98 (м, 34H), 0,96 (с, 3H), 0,91 (д, J=8,4 Гц, 3H), 0,64 (с, 3H). ЖХМС Rt=1,590 мин при 2 мин хроматографии, 10-80AB, МС ESI вычислено для C28H51O2 [M+H]+ 419, найдено C28H47 [M-2H2O+H]+ 383.
Пример 3. Синтез соединений 4, 5 и 6





Стадия 1. Смесь пропиоловой кислоты B1 (20 г, 285 ммоль) в 40% HBr (150 мл) перемешивали при 110°C в течение 2 часов. Смесь охлаждали в ледяной воде. Выпавшее в осадок твердое вещество отфильтровывали и промывали избытком воды, что давало соединение B2 (25 г, 58%) в виде коричневого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 9,69 (шир.с, 1H), 7,76 (д, J=14,4 Гц, 1H), 6,54 (д, J=13,6 Гц, 1H).
Стадия 2. К суспензии соединения B2 (8,5 г, 56,3 ммоль) в MeOH (15 мл) добавляли 98% H2SO4 (2,80 г, 28,1 ммоль). Смесь перемешивали при 25°C в течение 24 часов. Реакционную смесь упаривали в вакууме. Остаток промывали водой (20 мл). Органический слой отделяли и сушили над Na2SO4, что давало соединение B3 (7 г, 75%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3) δ 7,61 (д, J=14,0 Гц, 1H), 6,53 (д, J=14,0 Гц, 1H), 3,76 (с, 3H).
Стадия 3. К суспензии Ph3PMeBr (67,5 г, 189 ммоль) в безводном ТГФ (300 мл) в атмосфере N2 добавляли t-BuOK (21,2 г, 189 ммоль). После перемешивания при 60°C в течение 30 мин, добавляли соединение A3 (20 г, 63,1 ммоль). Полученную в результате смесь перемешивали при 60°C в течение 4 часов. Реакционную смесь выливали в ледяную воду (500 мл), экстрагировали EtOAc (2×500 мл). Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (PE/EtOAc=15/1), что давало соединение A4 (18 г, 91%) в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 5,39-5,32 (м, 1H), 4,85 (с, 1H), 4,71 (с, 1H), 3,59-3,47 (м, 1H), 2,36-2,17 (м, 2H), 2,07-1,94 (м, 2H), 1,89-1,65 (м, 9H), 1,60-1,39 (м, 6H), 1,26-0,92 (м, 8H), 0,59 (с, 3H).
Стадия 4. К раствору соединения A4 (18 г, 57,2 ммоль) в безводном DCM (150 мл) добавляли Ac2O (8,75 г, 85,8 ммоль) и DMAP (13,9 г, 114 ммоль). Смесь перемешивали при 25°C в течение 2 часов. Реакционную смесь разбавляли водой (200 мл), экстрагировали DCM (3×150 мл). Объединенный органический слой промывали насыщенным раствором NaHCO3 (150 мл) и насыщенным раствором соли (150 мл), сушили над безводным Na2SO4, фильтровали и концентрировали, что давало соединение A5 (20 г, 99%) в виде не совсем белого твердого вещества.
Стадия 5. К раствору соединения A5 (30 г, 84,1 ммоль) в безводном ТГФ (150 мл) в атмосфере азота при 30°C добавляли 9-BBN (0,5M в ТГФ, 185 мл, 92,5 ммоль). Смесь перемешивали при 75°C в течение 3 часов. Реакционную смесь охлаждали до 30°C, и добавляли (E)-метил 3-бромакрилат (15,2 г, 92,5 ммоль), CsF (25,5 г, 168 ммоль) и Pd(t-Bu3P)2 (4,55 г, 8,40 ммоль). Полученную в результате смесь перемешивали при 75°C в течение 16 часов. Реакционную смесь охлаждали, гасили водой (300 мл), экстрагировали EtOAc (3×300 мл). Объединенный органический слой сушили над Na2SO4, фильтровали через рыхлый слой силикагеля и концентрировали. Остаток растирали в MeOH, что давало соединение A6 (20 г, 54%) в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 7,00-6,90 (м, 1H), 5,81 (д, J=15,6 Гц, 1H), 5,37 (д, J=4,5 Гц, 1H), 4,66-4,53 (м, 1H), 3,73 (с, 3H), 2,36-2,24 (м, 3H), 2,03 (с, 3H), 2,00-1,79 (м, 6H), 1,65-1,38 (м, 8H), 1,34-1,05 (м, 6H), 1,01 (с, 3H), 0,95 (д, J=6,5 Гц, 3H), 0,69 (с, 3H).
Стадия 6. К суспензии соединения A6 (20 г, 45,1 ммоль) в безводном MeOH (250 мл) добавляли AcCl (2,82 г, 36,0 ммоль). Смесь перемешивали при 25°C в течение 16 часов. Реакционную смесь концентрировали для удаления излишка MeOH, разбавляли EtOAc (500 мл), промывали насыщенным раствором NaHCO3 (500 мл), насыщенным раствором соли (300 мл), сушили над безводным Na2SO4, фильтровали и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (PE/EtOAc/DCM=8/1/1), что давало соединение A7 (12 г, 67%) в виде не совсем белого твердого вещества.
Стадия 7. К раствору соединения A7 (12 г, 29,9 ммоль) в ТГФ (150 мл) добавляли 5% Pt/C (2 г). Смесь дегазировали и продували некоторое время H2, перемешивали в атмосфере H2 из баллона при 25°C в течение 4 часов. Реакционную смесь фильтровали через рыхлый слой целита, и фильтрат концентрировали, что давало соединение A8 (12 г, 100%) в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 5,34 (д, J=5,0 Гц, 1H), 3,66 (с, 3H), 3,57-3,45 (м, 1H), 2,33-2,21 (м, 4H), 2,05-1,65 (м, 7H), 1,48-1,32 (м, 6H), 1,31-0,88 (м, 17H), 0,67 (с, 3H).
Стадия 8. К раствору соединения A8 (27 г, 67,0 ммоль) в DCM (300 мл) добавляли DMP (85,2 г, 201 ммоль) при 25°C. Реакционную смесь перемешивали при 25°C в течение 1 часа. Реакционную смесь перемешивали при 25°C в течение 1 часа. Смесь выливали в насыщенный раствор Na2S2O3 (400 мл) при 0°C и экстрагировали EtOAc (3×300 мл). Объединенные органические слои промывали насыщенным раствором NaHCO3 (2×250 мл), насыщенным раствором соли (200 мл), сушили над Na2SO4, фильтровали и концентрировали в вакууме, что давало соединение A9 (27 г, crude) в виде масла, которое непосредственно использовали на следующей стадии без дополнительной очистки.
Стадия 9. К раствору BHT (88,8 г, 403 ммоль) в толуоле (250 мл) по каплям добавляли AlMe3 (100 мл, 201 ммоль, 2M в толуоле) при ниже 25°C. Полученный раствор перемешивали при 25°C в течение 1 часа. Раствор соединения A9 (27 г, 67,3 ммоль) в толуоле (250 мл) по каплям добавляли при -78°C. После перемешивания при -78°C в течение 1 часа, по каплям добавляли MeMgBr (67,0 мл, 201 ммоль, 3M в этиловом эфире) при -78°C. Полученный в результате раствор перемешивали при температуре от -78°C до -50°C в течение 3 часов. Реакцию гасили насыщенным раствором лимонной кислоты (400 мл) при -78°C. После перемешивания при 25°C в течение 0,5 часа, полученную в результате смесь фильтровали, и фильтрат экстрагировали EtOAc (3×300 мл). Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали на колонке с силикагелем (PE/EtOAc=5/1), с получением продукта (18,5 г, 66%), и 70 мг полученного продукта перекристаллизовывали (PE/EtOAc=10 мл/2 мл), что давало соединение A27 (67 мг) в виде не совсем белого твердого вещества. Соединение A27:1H ЯМР (400 МГц, CDCl3) δ 5,30-5,28 (м, 1H), 3,65 (с, 3H), 2,40-0,91 (м, 37H), 0,66 (с, 3H). ЖХМС Rt=1,562 мин при 2 мин хроматографии, 10-80AB, МС ESI вычислено для C27H43O2 [M+H-H2O]+ 399, найдено 399.
Стадия 10. К раствору LiAlH4 (6,11 г, 161 ммоль) в ТГФ (135 мл) по каплям добавляли раствор соединения A27 (27 г, 64,8 ммоль) в ТГФ (135 мл) при 0°C. Смесь перемешивали при 25°C в течение 1 часа. Добавляли H2O (100 мл) при 0°C. Реакционную смесь фильтровали, промывали ТГФ (2×100 мл). Фильтрат концентрировали в вакууме, что давало неочищенный продукт, который промывали EtOAc (100 мл), с получением соединения 4 (25 г, 100%), и 30 мг полученного продукта перекристаллизовывали (EtOAc, 3 мл), с получением соединения 4 (27 мг) в виде не совсем белого твердого вещества.
Соединение 4:1H ЯМР (400 МГц, CDCl3) δ 5,31-5,29 (м, 1H), 3,70-3,60 (м, 2H), 2,43-2,40 (м, 1H), 2,20-0,90 (м, 37H), 0,67 (с, 3H). ЖХМС Rt=1,402 мин при 2 мин хроматографии, 10-80AB, МС ESI вычислено для C26H45O2 [M+H]+389, найдено 371 C26H43O [M+H-H2O].
Стадия 11. К раствору соединения 4 (18 г, 46,3 ммоль) в DCM (180 мл) добавляли DMP (58,5 г, 138 ммоль) при 0°C. Реакционную смесь перемешивали при 25°C в течение 1 часа. Смесь выливали в насыщенный раствор Na2S2O3 (100 мл) при 0°C. Смесь экстрагировали EtOAc (3×100 мл). Объединенные органические слои промывали насыщенным раствором NaHCO3 (2×150 мл), насыщенным раствором соли (100 мл), сушили над Na2SO4, фильтровали и концентрировали в вакууме, что давало неочищенный продукт, который очищали на колонке с силикагелем (PE/EtOAc=5/1), что давало соединение A10 (13 г, 73%) в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 9,76 (т, J=1,8 Гц, 1H), 5,33-5,27 (м, 1H), 2,46-2,31 (м, 3H), 2,10-0,72 (м, 34H), 0,67 (с, 3H).
Стадия 12. К раствору соединения A10 (10 г, 25,8 ммоль) в ТГФ (100 мл) добавляли MeMgBr (51 мл, 154 ммоль) при 0°C в атмосфере N2. Реакционную смесь перемешивали при 25°C в течение 1 часа. Реакционную смесь гасили насыщенным раствором NH4Cl (30 мл) и экстрагировали EtOAc (3×100 мл). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над Na2SO4, фильтровали и концентрировали в вакууме, что давало неочищенный продукт, который очищали на колонке с силикагелем (PE/EtOAc=10/1), что давало соединение A11 (4,1 г, 40%) в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 5,30-5,29 (м, 1H), 3,81-3,77 (м, 1H), 2,43-2,39 (м, 1H), 1,99-0,76 (м, 40H), 0,67 (с, 3H).
Стадия 13. Смесь соединения A11 (400 мг, 0,993 ммоль) очищали сепаративной SFC (колонка: Chiralpak AD 250×30 мм В.Д., 5 мкм; подвижная фаза: сверхкритический CO2/MeOH+NH3H2O=55/45; скорость потока: 60 мл/мин; длина волны: 220 нм), с получением соединения 5 (пик 1, 120 мг, 30%) в виде не совсем белого твердого вещества и соединения 6 (пик 2, 150 мг, 38%) в виде не совсем белого твердого вещества.
Соединение 5:1H ЯМР (400 МГц, CDCl3) δ 5,32-5,27 (м, 1H), 3,85-3,72 (м, 1H), 2,45-2,40 (м, 1H), 2,06-1,91 (м, 3H), 1,88-1,65 (м, 3H), 1,54-1,33 (м, 12H), 1,32-0,87 (м, 22H), 0,68 (с, 3H). ЖХМС Rt=1,267 мин при 2 мин хроматографии, 30-90AB, МС ESI вычислено для C27H47O2 [M+H]+ 403, найдено C27H45O [M-H2O+H]+ 385.
Соединение 6:1H ЯМР (400 МГц, CDCl3) δ 5,33-5,27 (м, 1H), 3,84-3,75 (м, 1H), 2,45-2,40 (м, 1H), 2,06-1,92 (м, 3H), 1,89-1,64 (м, 3H), 1,56-0,79 (м, 34H), 0,67 (с, 3H). ЖХМС Rt=1,262 мин при 2 мин хроматографии, 30-90AB, МС ESI вычислено для C27H47O2 [M+H]+ 403, найдено C27H45O [M-H2O+H]+ 385.
Пример 4. Синтез соединений 7 и 8


Стадия 1. К раствору соединения A11 (3,6 г, 8,94 ммоль) в DCM (40 мл) добавляли DMP (11,3 г, 26,8 ммоль) при 0°C. Реакционную смесь перемешивали при 25°C в течение 1 часа. Смесь выливали в насыщенный раствор Na2S2O3 (60 мл) при 0°C и экстрагировали EtOAc (3×50 мл). Объединенные органические слои промывали насыщенным водным раствором NaHCO3 (2×50 мл), насыщенным раствором соли (50 мл), сушили над Na2SO4, фильтровали и концентрировали в вакууме, что давало неочищенный продукт, который очищали на колонке с силикагелем (PE/EtOAc=15/1), что давало соединение A13 (1,4 г, 39%) в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 5,33-5,31 (м, 1H), 2,50-2,30 (м, 3H), 2,16 (с, 3H), 2,02-0,94 (м, 34H), 0,69 (с, 3H).
Стадия 2. К раствору соединения A13 (288 мг, 0,718 ммоль) в безводном ТГФ (10 мл) при -10°C в атмосфере N2 по каплям добавляли EtMgBr (3M в диэтиловом эфире, 1,43 мл, 4,30 ммоль). Смесь перемешивали при 25°C в течение 3 часов. Смесь гасили насыщенным раствором NH4Cl (10 мл), экстрагировали EtOAc (3×10 мл). Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали колоночной хроматографией на силикагеле, при элюировании DCM, что давало соединение A14 (105 мг, 34%) в виде не совсем белого твердого вещества.
Стадия 3. Соединение A14 (105 мг, 0,244 ммоль) отделяли SFC (колонка: Chiralpak AD 250×30 мм В.Д., 5 мкм; подвижная фаза: сверхкритический CO2/EtOH+NH3H2O=70/30; скорость потока: 60 мл/мин; длина волны: 220 нм), с получением соединения 7 (пик 1, 21,4 мг, 28%) в виде не совсем белого твердого вещества и соединения 8 (пик 2, 12,4 мг, 16%) в виде не совсем белого твердого вещества.
Соединение 7:1H ЯМР (400 МГц, CDCl3) δ 5,32-5,28 (м, 1H), 2,45-2,40 (м, 1H), 2,04-1,93 (м, 3H), 1,81-1,65 (м, 3H), 1,52-0,79 (м, 39H), 0,68 (с, 3H). ЖХМС Rt=1,378 мин при 2 мин хроматографии, 30-90AB, МС ESI вычислено для C29H51O2 [M+H]+ 431, найдено C29H47 [M+H-2H2O]+ 395.
Соединение 8:1H ЯМР (400 МГц, CDCl3) δ 5,32-5,28 (м, 1H), 2,45-2,40 (м, 1H), 2,05-1,94 (м, 3H), 1,88-1,63 (м, 4H), 1,52-0,83 (м, 38H), 0,68 (с, 3H). ЖХМС Rt=1,374 мин при 2 мин хроматографии, 30-90AB, МС ESI вычислено для C29H51O2 [M+H]+ 431, найдено C29H47 [M+H-2H2O]+ 395.
Пример 5. Синтез соединений 9 и 10

Стадия 1. К раствору соединения A13 (500 мг, 1,24 ммоль) в безводном ТГФ (5 мл) при 0°C в атмосфере N2 по каплям добавляли i-PrMgCl (2M в ТГФ, 6,2 мл, 12,3 ммоль). Полученную реакционную смесь перемешивали при 25°C в течение 16 часов. Реакционную смесь охлаждали до 0°C, гасили насыщенным раствором NH4Cl (10 мл), экстрагировали EtOAc (3×10 мл). Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (DCM/Ацетон=500/1), что давало соединение A16 (160 мг, 29%) в виде не совсем белого твердого вещества.
Стадия 2. Соединение A16 (100 мг, 0,224 ммоль) отделяли SFC (колонка: Chiralpak AD 250×30 мм В.Д., 5 мкм; подвижная фаза: сверхкритический CO2/EtOH+NH3H2O=65/35; скорость потока: 60 мл/мин; длина волны: 220 нм), с получением соединения 9 (пик 1, 26,2 мг, 26%) в виде не совсем белого твердого вещества и соединения 10 (пик 2, 18,8 мг, 19%) в виде не совсем белого твердого вещества.
Соединение 9:1H ЯМР (400 МГц, CDCl3) δ 5,33-5,27 (м, 1H), 2,45-2,40 (м, 1H), 2,06-1,92 (м, 3H), 1,88-1,64 (м, 5H), 1,52-0,78 (м, 39H), 0,68 (с, 3H). ЖХМС Rt=1,444 мин при 2 мин хроматографии, 30-90AB, МС ESI вычислено для C30H53O2 [M+H]+ 445, найдено C30H49 [M+H-2H2O]+ 409.
Соединение 10:1H ЯМР (400 МГц, CDCl3) δ 5,32-5,28 (м, 1H), 2,45-2,40 (м, 1H), 2,05-1,93 (м, 3H), 1,88-1,65 (м, 5H), 0,84-1,52 (м, 39H), 0,68 (с, 3H). ЖХМС Rt=1,442 мин при 2 мин хроматографии, 30-90AB, МС ESI вычислено для C30H53O2 [M+H]+ 445, найдено C30H49 [M+H-2H2O]+ 409.
Пример 6. Синтез соединений 11 и 12

Стадия 1. К раствору соединения A13 (300 мг, 0,748 ммоль) в ТГФ (5 мл) добавляли TMSCF3 (106 мг, 0,748 ммоль) при 25°C. Реакционную смесь перемешивали при 25°C в течение 1 часа. TBAF (271 мг, 1,04 ммоль) добавляли при 25°C. Реакционную смесь выливали в воду, экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным раствором NaHCO3 (2×20 мл), насыщенным раствором соли (20 мл), сушили над Na2SO4, фильтровали и концентрировали в вакууме, что давало соединение A18 (100 мг) в виде не совсем белого твердого вещества.
Стадия 2. Соединение A18 (100 мг, 212 мкмоль) очищали сепаративной SFC (колонка: Chiralpak AD 250×30 мм В.Д., 5 мкм; подвижная фаза: сверхкритический CO2/MeOH+NH3H2O=70/30; скорость потока: 60 мл/мин; длина волны: 220 нм), с получением соединения 11 (пик 1, 25,6 мг, 26%) и соединения 12 (пик 2, 30 мг, 30%) в виде не совсем белых твердых веществ.
Соединение 11:1H ЯМР (400 МГц, CDCl3) δ 5,33-5,28 (м, 1H), 2,45-2,40 (м, 1H), 2,06-1,93 (м, 3H), 1,90-1,61 (м, 6H), 1,56-1,38 (м, 9H), 1,35 (с, 3H), 1,32-0,82 (м, 19H), 0,68 (с, 3H). ЖХМС Rt=1,327 мин при 2 мин хроматографии, 30-90 AB, МС ESI вычислено для C28H44F3O [M-H2O+H]+ 453, найдено 453.
Соединение 12:1H ЯМР (400 МГц, CDCl3) δ 5,34-5,28 (м, 1H), 2,45-2,40 (м, 1H), 2,06-1,92 (м, 3H), 1,90-1,66 (м, 5H), 1,56-1,33 (м, 13H), 1,31-0,87 (м, 19H), 0,68 (с, 3H). ЖХМС Rt=1,320 мин при 2 мин хроматографии, 30-90 AB, МС ESI вычислено для C28H44F3O [M-H2O+H]+ 453, найдено 453.
Пример 7. Синтез соединений 13 и 14

Стадия 1. К раствору соединения A10 (400 мг, 1,03 ммоль) в ТГФ (5 мл) добавляли TMSCF3 (365 мг, 2,57 ммоль) при 25°C. Смесь перемешивали при 25°C в течение 1 часа. Добавляли TBAF (806 мг, 3,09 ммоль). Смесь перемешивали при 25°C в течение 1 часа. Смесь выливали в воду (30 мл), промывали насыщенным раствором насыщенным раствором соли (2×20 мл), сушили над Na2SO4 и концентрировали в вакууме, что давало соединение A20 (190 мг, 40%) в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 5,33-5,28 (м, 1H), 4,00-3,85 (м, 1H), 2,50-2,35 (м, 1H), 2,11-1,93 (м, 4H), 1,89-1,61 (м, 5H), 1,53-1,35 (м, 8H), 1,31-1,05 (м, 11H), 1,01 (с, 9H), 0,68 (с, 3H). ЖХМС Rt=1,301 мин при 2 мин хроматографии, 30-90 AB, МС ESI вычислено для C27H42F3O [M-H2O+H]+ 439, найдено 439.
Стадия 2. Соединение A20 (190 мг, 0,416 ммоль) очищали SFC (колонка: Chiralpak AD 250×30 мм В.Д., 5 мкм; подвижная фаза: сверхкритический CO2/MeOH+NH3H2O=65/35; скорость потока: 60 мл/мин; длина волны: 220 нм) при 25°C, что давало соединение 13 (пик 1, 38,4 мг, 20%) и соединение 14 (пик 2, 47,6 мг, 25%) в виде не совсем белых твердых веществ.
Соединение 13:1H ЯМР (400 МГц, CDCl3) δ 5,34-5,27 (м, 1H), 3,98-3,84 (м, 1H), 2,45-2,40 (м, 1H), 2,08-1,92 (м, 4H), 1,89-1,64 (м, 6H), 1,53-1,36 (м, 7H), 1,33-1,21 (м, 3H), 1,21-1,08 (м, 7H), 1,07-0,90 (м, 10H), 0,68 (с, 3H). ЖХМС Rt=1,302 мин при 2 мин хроматографии, 30-90 AB, МС ESI вычислено для for C27H44F3O2 [M+H]+ 457, найдено C27H42F3O [M+H-H2O]+ 439.
Соединение 14:1H ЯМР (400 МГц, CDCl3) δ 5,34-5,28 (м, 1H), 3,95-3,89 (м, 1H), 2,45-2,40 (м, 1H), 2,06-1,92 (м, 4H), 1,89-1,59 (м, 7H), 1,54-1,34 (м, 8H), 1,32-1,21 (м, 2H), 1,20-1,05 (м, 8H), 1,04-0,90 (м, 8H), 0,68 (с, 3H). ЖХМС Rt=1,299 мин при 2 мин хроматографии, 30-90 AB, МС ESI вычислено для C27H44F3O2 [M+H]+ 457, найдено C27H42F3O [M+H-H2O]+ 439.
Пример 8. Синтез соединения 17
Стадия 1. К раствору соединения A27 (500 мг, 1,20 ммоль) и (i-PrO)4Ti (341 мг, 1,20 ммоль) в безводном ТГФ (10 мл) в атмосфере N2 при 25°C по каплям добавляли EtMgBr (3M в диэтиловом эфире, 1,39 мл, 4,19 ммоль). Смесь перемешивали при 25°C в течение 16 часов. Реакционную смесь гасили насыщенным раствором соли (15 мл), разбавляли EtOAc (20 мл), фильтровали через рыхлый слой целита и фильтрат экстрагировали EtOAc (2×20 мл). Объединенный органический слой сушили над безводным Na2SO4, фильтровали и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (PE/EtOAc=20/1), с получением соединения 17 (220 мг, 44%) в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 5,33-5,27 (м, 1H), 2,50-2,40 (м, 1H), 2,06-1,92 (м, 3H), 1,88-1,63 (м, 5H), 1,54-1,34 (м, 10H), 1,29-0,90 (м, 19H), 0,76-0,65 (м, 5H), 0,47-0,40 (м, 2H). ЖХМС Rt=1,294 мин при 2 мин хроматографии, 30-90AB, МС ESI вычислено для C28H47O2 [M+H]+ 415, найдено C28H45O [M+H-H2O]+ 397.
Пример 9. Синтез соединений 18, 19 и 20


Стадия 1. К раствору соединения A8 (1,4 г, 3,47 ммоль) в DCM (20 мл) добавляли DMP (2,94 г, 6,94 ммоль) при 25°C. Смесь перемешивали при 25°C в течение 2 часов. Смесь выливали в насыщенный раствор Na2S2O3 (100 мл) при 0°C и экстрагировали EtOAc (2×100 мл). Объединенные органические слои промывали насыщенным раствором NaHCO3 (2×80 мл), насыщенным раствором соли (100 мл), сушили над Na2SO4 и концентрировали в вакууме, что давало соединение A9 (1,5 г, неочищенной) в виде не совсем белого твердого вещества.
Стадия 2. К раствору BHT (4,93 г, 22,4 ммоль) в толуоле (20 мл) по каплям добавляли AlMe3 (5,60 мл, 2M в толуоле, 11,2 ммоль) при 0°C. Полученную реакционную смесь перемешивали при 25°C в течение 1,5 часов. Раствор соединения A9 (1,5 г, 3,74 ммоль) в толуоле (20 мл) добавляли при -70°C. Полученную в результате смесь перемешивали при -70°C в течение 1 часа. Добавляли EtMgBr (3,73 мл, 3,0М в диэтиловом эфире, 11,2 ммоль) при -70°C. Полученную реакционную смесь перемешивали при -70°C в течение еще 1 часа. Реакционную смесь гасили NH4Cl (100 мл), экстрагировали EtOAc (2×100 мл). Объединенные органические слои промывали насыщенным раствором соли (100 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении, что давало неочищенный продукт, который очищали хроматографией на силикагеле, элюируя PE/EtOAc=10/1, что давало соединение A30 (600 мг, 35%) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 5,31-5,26 (м, 1H), 3,67 (с, 3H), 2,41-2,19 (м, 3H), 2,07-1,91 (м, 3H), 1,88-1,61 (м, 5H), 1,55-1,33 (м, 11H), 1,31-1,01 (м, 10H), 1,00-0,80 (м, 7H), 0,67 (с, 3H).
Стадия 3. К раствору соединения A30 (550 мг, 1,27 ммоль) в ТГФ (5 мл) добавляли MeLi (3,17 мл, 5,08 ммоль) при -70°C. Смесь перемешивали при -70°C в течение 10 минут. Реакционную смесь гасили насыщенным раствором NH4Cl (20 мл), экстрагировали EtOAc (2×20 мл). Объединенные органические слои промывали насыщенным раствором соли (30 мл), сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Полученную смесь объединяли с другой партией, синтезированной из 50 мг исходного вещества. Остаток очищали хроматографией на силикагеле (PE/EtOAc=10/1), с получением соединения 18 (270 мг, 49% выход) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 5,28 (д, J=5,0 Гц, 1H), 2,36 (д, J=13,1 Гц, 1H), 2,08-1,91 (м, 3H), 1,89-1,69 (м, 3H), 1,65-1,60 (м, 3H), 1,51-1,32 (м, 8H), 1,30-1,17 (м, 11H), 1,15-1,01 (м, 8H), 0,99-0,81 (м, 9H), 0,68 (с, 3H). ЖХМС Rt=1,372 мин при 2 мин хроматографии, 30-90 AB, МС ESI вычислено для C29H51O2 [M+H]+ 431, найдено C29H47 [M+H-2H2O]+ 395.
Стадия 4. К раствору соединения 18 (200 мг, 0,464 ммоль) в EtOAc (10 мл) добавляли Pd/C (100 мг) при 25°C. Смесь перемешивали в атмосфере H2 при 55°C в течение 12 часов. Реакционную смесь фильтровали, и осадок на фильтре промывали EtOAc (2×40 мл). Смесь концентрировали при пониженном давлении, что давало неочищенный продукт, который очищали хроматографией на силикагеле, элюируя PE/EtOAc=10/1, что давало соединение 19 (6,6 мг) и соединение 20 (10,2 мг) в виде не совсем белых твердых веществ.
Соединение 19:1H ЯМР (400 МГц, CDCl3) δ 2,02-1,95 (м, 1H), 1,94-1,72 (м, 4H), 1,52-1,31 (м, 14H), 1,27-1,16 (м, 14H), 1,14-0,99 (м, 7H), 0,97 (с, 3H), 0,95-0,89 (м, 6H), 0,65 (с, 3H). ЖХМС Rt=1,432 мин при 2 мин хроматографии, 30-90 AB, МС ESI вычислено для C29H53O2 [M+H]+ 433, найдено C29H49 [M+H-2H2O]+ 397.
Соединение 20:1H ЯМР (400 МГц, CDCl3) δ 1,96 (д, J=12,5 Гц, 1H), 1,86-1,75 (м, 1H), 1,58-1,50 (м, 5H), 1,49-1,29 (м, 10H), 1,21 (с, 13H), 1,13-0,95 (м, 8H), 0,94-0,84 (м, 7H), 0,82 (с, 3H), 0,64 (с, 4H). ЖХМС Rt=1,431 мин при 2 мин хроматографии, 30-90 AB, МС ESI вычислено для C29H53O2 [M+H]+ 433, найдено C29H49 [M+H-2H2O]+ 397.
Пример 10. Синтез соединения 22


Стадия 1. К раствору соединения A7 (3 г, 7,48 ммоль) в ТГФ (30 мл) добавляли Pd/C (10%, 600 мг). Смесь дегазировали и продували некоторое время H2 три раза. Полученную в результате смесь перемешивали при 25°C в атмосфере H2 в течение 16 часов. Реакционную смесь фильтровали через рыхлый слой целита, и фильтрат концентрировали, что давало соединение A32 (3 г, 99%) в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 3,66 (с, 3H), 3,63-3,53 (м, 1H), 2,34-2,18 (м, 2H), 1,99-1,91 (м, 1H), 1,82-1,62 (м, 5H), 1,56-1,43 (м, 3H), 1,42-1,18 (м, 10H), 1,14-0,77 (м, 15H), 0,68-0,57 (м, 4H).
Стадия 2. К раствору соединения A32 (3 г, 7,41 ммоль) в DCM (30 мл) добавляли PCC (3,19 г, 14,8 ммоль) и силикагель (4 г, 66,6 ммоль) при 25°C. Смесь перемешивали при 25°C в течение 1,5 часов. Смесь фильтровали. Фильтрат концентрировали в вакууме, очищали колоночной хроматографией на силикагеле (PE/EtOAc=50/1 до 10/1), что давало соединение A33 (2,4 г) в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 3,66 (с, 3H), 2,44-2,19 (м, 5H), 2,13-1,94 (м, 3H), 1,89-1,64 (м, 3H), 1,53-0,82 (м, 24H), 0,76-0,66 (м, 4H).
Стадия 3. К раствору BHT (7,88 г, 35,7 ммоль) в толуоле (25 мл) добавляли AlMe3 (8,9 мл, 17,8 ммоль, 2M в толуоле) при 0°C в атмосфере N2. Смесь перемешивали при 25°C в течение 1 часа. Добавляли раствор соединения A33 (2,4 г, 5,96 ммоль) в толуоле (5 мл) при -70°C. Смесь перемешивали при -78°C в течение 1 часа. Добавляли MeMgBr (5,93 мл, 17,8 ммоль, 3M в диэтиловом эфире) при -78°C. Смесь перемешивали при -78°C в течение 1 часа. Реакционную смесь гасили насыщенным раствором лимонной кислоты (100 мл). Смесь экстрагировали EtOAc (3×100 мл), промывали насыщенным раствором соли (3×300 мл), сушили над Na2SO4, концентрировали в вакууме, что давало неочищенный продукт соединения A, который очищали колоночной хроматографией на силикагеле (PE/EtOAc=30/1 до 10/1), что давало соединение A34 (2 г) в виде желтого твердого вещества. Соединение A34:1H ЯМР (400 МГц, CDCl3) δ 3,67 (с, 3H), 2,36-2,18 (м, 2H), 2,01-1,92 (м, 1H), 1,86-1,77 (м, 1H), 1,72-1,61 (м, 3H), 1,55-1,46 (м, 4H), 1,40-1,21 (м, 13H), 1,18-0,99 (м, 7H), 0,95-0,86 (м, 5H), 0,81 (с, 3H), 0,70-0,60 (м, 4H). ЖХМС Rt=1,372 мин при 2 мин хроматографии, 30-90 AB, МС ESI вычислено для C27H47O2 [M+H]+ 418,3, найдено 401 [M+H-H2O]+.
Стадия 4. К раствору соединения A34 (300 мг, 0,716 ммоль) и Ti(i-PrO)4 (203 мг, 0,716 ммоль) в ТГФ (10 мл) добавляли EtMgBr (3M в диэтиловом эфире, 713 мкл, 2,14 ммоль). Смесь перемешивали при 25°C в течение 16 часов. Реакционную смесь гасили насыщенным раствором NH4Cl (5 мл). Смесь фильтровали через рыхлый слой целита. Фильтрат экстрагировали EtOAc (2×20 мл). Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (PE/EtOAc=20/1~10/1), с получением соединения 22 (77 мг, 26%) в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 2,00-1,92 (м, 1H), 1,84-1,61 (м, 6H), 1,53-0,83 (м, 30H), 0,80 (с, 3H), 0,76-0,71 (м, 2H), 0,69-0,60 (м, 4H), 0,47-0,40 (м, 2H). ЖХМС Rt=1,317 мин при 2 мин хроматографии, 30-90AB, МС ESI вычислено для C28H49O2 [M+H]+ 417, найдено C28H47O [M+H-H2O]+ 399.
Пример 11. Синтез соединений 23 и 24

Стадия 1. К раствору соединения 6 (50 мг, 0,124 ммоль) в MeOH (10 мл) добавляли Pd/C (10% масс, 26,6 мг, 24,8 ммоль). После трехразовой дегазации H2, полученную реакционную смесь перемешивали в течение 72 часов при 50°C в атмосфере H2 (55 ф./кв.д.). Реакционную смесь фильтровали, и фильтрат концентрировали, что давало неочищенный продукт, который очищали на колонке с силикагелем (PE/EtOAc=15/1), с получением соединения 23 (10 мг, 20%) в виде белого твердого вещества и соединения 24 (10 мг, 20%) в виде белого твердого вещества. Соединение 23:1H ЯМР (400 МГц, CDCl3) δ 3,81-3,75 (м, 1H), 1,96-0,90 (м, 38H), 0,92 (с, 3H), 0,90 (д, J=6,4 Гц, 3H), 0,64 (с, 3H). ЖХМС Rt=1,293 мин при 2,0 мин хроматографии, 30-90 AB, МС ESI вычислено для C27H49O2 [M+H]+ 405, найдено C27H45 [M-2H2O+H]+ 369.
Соединение 24:1H ЯМР (400 МГц, CDCl3) δ 3,80-3,75 (м, 1H), 2,00-1,90 (м, 1H), 1,90-1,75 (м, 1H), 1,75-0,70 (м, 38H), 0,80 (с, 3H), 0,70-0,60 (м, 4H). ЖХМС Rt=1,282 мин при 2,0 мин хроматографии, 30-90 AB, МС ESI вычислено для C27H49O2 [M+H]+ 405, найдено C27H45 [M-2H2O+H]+ 369.
Пример 12. Синтез соединений 25 и 26


Стадия 1. К раствору t-BuOK (838 мг, 7,47 ммоль) в ТГФ (10 мл) добавляли Ph3PMeBr (2,66 г, 7,47 ммоль) при 60°C. Смесь перемешивали при 60°C в течение 1 часа. Соединение A13 (1 г, 2,49 ммоль) добавляли при 60°C. Смесь перемешивали при 60°C в течение 2 часов. Реакционную смесь выливали в воду (30 мл) при 0°C. Смесь экстрагировали EtOAc (2×20 мл), промывали насыщенным раствором соли (30 мл), сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении, что давало соединение A36 (0,9 г, 90%) в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 5,33-5,28 (м, 1H), 4,70-4,65 (м, 2H), 2,45-2,40 (м, 1H), 2,06-1,91 (м, 5H), 1,89-1,74 (м, 2H), 1,74-1,67 (м, 4H), 1,56-1,20 (м, 11H), 1,19-1,06 (м, 6H), 1,06-0,99 (м, 5H), 0,99-0,78 (м, 6H), 0,68 (с, 3H).
Стадия 2. К раствору соединения A36 (800 мг, 2 ммоль) в ТГФ (5 мл) добавляли 9-BBN (40 мл, 20,0 ммоль) при 0°C. Смесь перемешивали при 25°C в течение 1 часа. NaOH (13,3 мл, 40 ммоль, 3M) и H2O2 (1,2 мл, 40 ммоль) добавляли при 0°C. Смесь перемешивали при 25°C в течение 2 часов. Реакционную смесь выливали в воду. Смесь экстрагировали EtOAc (2×50 мл). Объединенные органические слои промывали насыщенным раствором Na2S2O3 (2×50 мл), насыщенным раствором соли (50 мл), сушили над Na2SO4, фильтровали и концентрировали в вакууме, что давало соединение A37 (400 мг) в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 5,35-5,27 (м, 1H), 4,00-3,90 (м, 1H), 3,90-3,80 (м, 1H), 2,45-2,40 (м, 1H), 2,04-1,91 (м, 3H), 1,88-1,66 (м, 5H), 1,53-1,21 (м, 10H), 1,20-0,87 (м, 23H), 0,68 (с, 3H).
Стадия 3. К раствору соединения A37 (500 мг, 1,19 ммоль) в DCM (10 мл) добавляли TEA (240 мг, 2,38 ммоль) и Ac2O (181 мг, 1,78 ммоль) при 25°C. Реакционную смесь перемешивали при 25°C в течение 2 часов. Реакцию гасили насыщенным раствором NaHCO3 (10 мл). Смесь экстрагировали DCM (2×10 мл), промывали насыщенным раствором соли (2×10 мл), сушили над Na2SO4 и концентрировали, что давало соединение A38 (450 мг, 82%) в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 5,35-5,25 (м, 1H), 3,56-3,38 (м, 2H), 2,45-2,40 (м, 1H), 2,07-1,91 (м, 3H), 1,89-1,67 (м, 3H), 1,65-1,53 (м, 5H), 1,49-1,32 (м, 8H), 1,32-1,09 (м, 10H), 1,09-0,97 (м, 7H), 0,97-0,87 (м, 7H), 0,68 (с, 3H).
Стадия 4. Соединение A38 (450 мг) очищали SFC (колонка: Chiralpak AD 250×30 мм В.Д., 5 мкм; подвижная фаза: сверхкритический CO2/MeOH+NH3H2O=60/40; скорость потока: 60 мл/мин; длина волны: 220 нм), что давало соединение A39 (200 мг) и соединение A40 (150 мг) в виде не совсем белых твердых веществ.
Стадия 5. К раствору соединения A39 (200 мг, 0,435 ммоль) в MeOH (10 мл) добавляли AcCl (17,0 мг, 0,217 ммоль) при 25°C. Смесь перемешивали при 25°C в течение 2 часов. Реакционную смесь выливали в воду (10 мл), экстрагировали ТГФ (2×20 мл). Органический слой промывали насыщенным раствором соли (30 мл), сушили над Na2SO4 и концентрировали, что давало соединение 25 (100 мг, 55%) в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 5,33-5,28 (м, 1H), 3,57-3,36 (м, 2H), 2,46-2,38 (м, 1H), 2,05-1,92 (м, 3H), 1,87-1,57 (м, 6H), 1,52-1,34 (м, 7H), 1,28-1,20 (м, 3H), 1,18-0,89 (м, 22H), 0,68 (с, 3H). ЖХМС Rt=1,328 мин при 2 мин хроматографии, 30-90 AB_E, МС ESI вычислено для C28H49O2 [M+H]+ 417, найдено C28H47O [M+H-H2O]+ 399.
Стадия 6. К раствору соединения A40 (150 мг, 0,326 ммоль) в MeOH (10 мл) добавляли AcCl (12,7 мг, 0,163 ммоль) при 25°C. Смесь перемешивали при 25°C в течение 2 часов. Реакционную смесь выливали в воду (10 мл), экстрагировали ТГФ (2×20 мл). Органический слой промывали насыщенным раствором соли (30 мл), сушили над Na2SO4 и концентрировали, что давало неочищенный продукт, который очищали колоночной хроматографией на силикагеле (PE/EtOAc=20/1 до 8/1), с получением соединения 26 (90 мг, 66%) в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 5,33-5,28 (м, 1H), 3,55-3,38 (м, 2H), 2,46-2,38 (м, 1H), 2,05-1,93 (м, 3H), 1,87-1,58 (м, 5H), 1,51-0,89 (м, 33H), 0,68 (с, 3H). ЖХМС Rt=1,320 мин при 2 мин хроматографии, 30-90 AB_E, МС ESI вычислено для C28H49O2 [M+H]+ 417, найдено C28H47O [M+H-H2O]+ 399.
Пример 13. Синтез соединения 33

Стадия 1. К раствору BHT (32,6 г, 148 ммоль) в толуоле (100 мл) по каплям добавляли триметилалюминий (37,2 мл, 2M в толуоле, 74,4 ммоль) при 0°C. Полученную реакционную смесь перемешивали при 15°C в течение 1,5 часов. Соединение A33 (10 г, 24,8 мл) в толуоле (100 мл) по каплям добавляли при -70°C. Полученную в результате смесь перемешивали при -70°C в течение 1 часа. EtMgBr (28,4 мл, 3,0М в диэтиловом эфире, 74,4 ммоль) по каплям добавляли при -70°C. Полученную реакционную смесь перемешивали при -70°C в течение еще 1 часа. Реакционную смесь выливали в насыщенный водный раствор лимонной кислоты (2 л). Водную часть экстрагировали EtOAc (3×1,5 л). Объединенную органическую фазу промывали насыщенным раствором соли (2 л), сушили над Na2SO4, фильтровали и концентрировали в вакууме, что давало неочищенный продукт, который очищали хроматографией на силикагеле, элюируя PE:EtOAc=10:1, что давало соединение A41 (8 г, 75%) в виде желтого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 3,66 (с, 3H), 2,30-2,15 (м, 2H), 2,00-1,90 (м, 1H), 1,85-1,60 (м, 5H), 1,50-1,15 (м, 15H), 1,14-0,80 (м, 18H), 0,69-0,55 (м, 4H). ЖХМС Rt=1,376 мин при 2,0 мин хроматографии, 30-90 AB, чистота 100%, МС ESI вычислено для C28H47O2 [M+H-H2O]+ 415, найдено 415.
Стадия 2. К раствору соединения A41 (2 г, 4,62 ммоль) в ТГФ (50 мл) в атмосфере N2 при 0°C порциями добавляли LiAlH4 (263 мг, 6,93 ммоль). Реакционную смесь перемешивали при 0°C в течение 30 минут. Реакцию гасили 1M HCl (30 мл) при 0°C, экстрагировали EtOAc (3×30 мл). Объединенную органическую фазу промывали насыщенным раствором соли (100 мл), сушили над Na2SO4, фильтровали и концентрировали, что давало неочищенное соединение 33 (1,3 г, 70%) в виде не совсем белого твердого вещества. 100 мг неочищенного соединения 33 перекристаллизовывали из MeCN/DCM (10 mL/10 мл), с получением соединения 33 (30 мг) в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 3,68-3,60 (м, 2H), 2,00-1,91 (м, 1H), 1,86-1,74 (м, 1H), 1,70-1,58 (м, 4H), 1,56-1,44 (м, 6H), 1,42-1,31 (м, 6H), 1,30-1,18 (м, 7H), 1,14-0,95 (м, 7H), 0,93-0,81 (м, 9H), 0,93-0,79 (м, 1H), 0,68-0,58 (м, 4H). ЖХМС Rt=1,279 мин in 2,0 мин chromatography, 30-90 AB, МС ESI вычислено для C27H47O [M+H-H2O]+ 387, найдено 387.
Пример 14. Синтез соединений 34, 35 и 36


Стадия 1. К раствору соединения A30 (2 г, 4,64 ммоль) в ТГФ (30 мл) добавляли LiAlH4 (260 мг, 6,85 ммоль) при 0°C. Смесь перемешивали при 20°C в течение 10 минут. Добавляли смесь вода/ТГФ (20 мл, 1/1). Смесь экстрагировали EtOAc (2×30 мл), промывали насыщенным раствором соли (2×100 мл), сушили над Na2SO4, фильтровали, концентрировали в вакууме, что давало неочищенный продукт соединения A42 (1,7 г) в виде не совсем белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки.1H ЯМР (400 МГц, CDCl3) δ 5,35-5,25 (м, 1H), 3,70-3,60 (м, 2H), 2,40-2,30 (м, 1H), 2,05-1,60 (м, 7H), 1,60-1,35 (м, 10H), 1,25-1,15 (м, 5H), 1,10-0,80 (м, 17H), 0,67 (с, 3H).
Стадия 2. К раствору соединения A42 (1,7 г, 4,22 ммоль) в DCM (150 мл) добавляли DMP (3,2 г, 7,6 ммоль) при 30°C. Смесь перемешивали при 30°C в течение 30 минут. Добавляли воду (100 мл), с последующим добавлением NaHCO3(4 г, твердый). Органическую фазу отделяли и промывали насыщенным Na2S2O3 (2×200 мл), насыщенным раствором соли (2×200 мл), сушили над Na2SO4, фильтровали и концентрировали в вакууме, что давало неочищенный продукт соединения A43 (2,1 г) в виде желтого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 9,77 (с, 1H), 5,35-5,25 (м, 1H), 2,45-2,30 (м, 3H), 2,05-1,90 (м, 4H), 1,85-0,90 (м, 28H), 0,85-0,75 (м, 4H), 0,68 (с, 3H).
Стадия 3. К раствору соединения A43 (1 г, неочищенное) в ТГФ (20 мл) добавляли метилмагнийбромид (2,5 мл, 7,5 ммоль, 3M в простом эфире) при -70°C в атмосфере N2. Смесь перемешивали при 20°C в течение 1 часа. К полученной смеси добавляли насыщенный NH4Cl (20 мл), EtOAc (20 мл) и H2O (10 мл). Смесь экстрагировали EtOAc (3×20 мл), промывали насыщенным раствором NaCl (2×60 мл), сушили над Na2SO4, фильтровали и концентрировали в вакууме, что давало неочищенный продукт, который очищали колоночной хроматографией на силикагеле (PE:EtOAc=100:1-12:1), с получением соединения 34 (520 мг, нечистый) в виде не совсем белого твердого вещества. Соединение 34 (520 мг, неочищенное) растирали в CH3CN (50 мл) при 80°C, что давало 27 мг чистого соединения 34 в виде не совсем белого твердого вещества, и 400 мг неочищенного соединения 34 использовали для SFC.
1H ЯМР (400 МГц, CDCl3) δ 5,35-5,25 (м, 1H), 3,85-3,75 (м, 1H), 2,40-2,30 (м, 1H), 2,05-1,90 (м, 3H), 1,85-1,55 (м, 6H), 1,55-1,30 (м, 10H), 1,25-0,90 (м, 20H), 0,85-0,75 (м, 3H), 0,67 (с, 3H). ЖХМС Rt=1,295 мин при 2 мин хроматографии, 30-90AB_E, МС ESI вычислено для C28H47O [M-H2O+H]+ 399, найдено 399.
Стадия 3. Соединение 35 (400 мг, неочищенное) очищали SFC (колонка: AD (250 мм×30 мм, 5 мкм); условия: 0,1% NH3H2O MeOH, 40% B; скорость потока (мл/мин): 60), с получением соединения 35 (79 мг) и соединения 36 (59 мг) в виде не совсем белого твердого вещества.
Соединение 35:1H ЯМР (400 МГц, CDCl3) δ 5,30-5,25 (м, 1H), 3,85-3,75 (м, 1H), 2,40-2,30 (м, 1H), 2,10-1,95 (м, 3H), 1,90-1,60 (м, 4H), 1,45-1,28 (м, 11H), 1,25-0,90 (м, 17H), 0,88-0,82 (м, 4H), 0,78 (т, J=7,2 Гц, 3H), 0,67 (с, 3H). ЖХМС Rt=1,295 мин при 2 мин хроматографии, 30-90AB_E, МС ESI вычислено для [M-H2O+H]+ 399, найдено 399.
Соединение 36:1H ЯМР (400 МГц, CDCl3) δ 5,30-5,25 (м, 1H), 3,85-3,75 (м, 1H), 2,40-2,30 (м, 1H), 2,10-1,95 (м, 3H), 1,90-1,60 (м, 4H), 1,50-1,17 (м, 11H), 1,14-0,90 (м, 17H), 0,88-0,82 (м, 4H), 0,78 (т, J=7,2 Гц, 3H), 0,67 (с, 3H). ЖХМС Rt=1,295 мин при 2 мин хроматографии, 30-90AB_E, МС ESI вычислено для C28H47O [M-H2O+H]+399, найдено 399.
Пример 16. Синтез соединений 37, 37-A и 37-B


Стадия 1. К раствору соединения 33 (500 мг, 1,23 ммоль) в DCM (20 мл) добавляли DMP (1,04 г, 2,46 ммоль) при 20°C. Полученную реакционную смесь перемешивали при 20°C в течение 1,5 часов. Реакционную смесь гасили насыщенным раствором NaHCO3 (10 мл) при 20°C. Смесь фильтровали и разделяли. Водную фазу экстрагировали DCM (20 мл). Объединенную органическую фазу промывали насыщенным раствором Na2S2O3 (50 мл), насыщенным раствором соли (50 мл), сушили над Na2SO4, фильтровали и концентрировали, что давало соединение A44 (500 мг, неочищенное) в виде желтого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 9,76 (с, 1H), 2,44-2,34 (м, 2H), 1,99-1,92 (м, 1H), 1,63-1,51 (м, 9H), 1,43-1,31 (м, 6H), 1,30-1,18 (м, 6H), 1,12-0,97 (м, 7H), 0,94-0,85 (м, 7H), 0,82 (с, 3H), 0,66-0,62 (м, 4H).
Стадия 2. К раствору соединения A44 (500 мг, 1,24 ммоль) в ТГФ (20 мл) в атмосфере N2 одной порцией добавляли MeMgBr (2,06 мл, 3,0M, 6,19 ммоль) при 0°C. После перемешивания при 20°C в течение 30 мин, смесь гасили 50 мл насыщенного NH4Cl и экстрагировали 50 мл EtOAc. Отделенную органическую фазу промывали 100 мл насыщенного раствора соли, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали при помощи Combi-flash (EtOAc в PE, 0%~40%), с получением соединения 37 (350 мг, 67%) в виде не совсем белого твердого вещества. 27 мг отделяли.1H ЯМР (400 МГц, CDCl3) δ 3,85-3,72 (м, 1H), 1,99-1,91 (м, 1H), 1,86-1,74 (м, 1H), 1,69-1,59 (м, 3H), 1,56-1,50 (м, 3H), 1,50-1,27 (м, 11H), 1,26-1,16 (м, 8H), 1,14-0,95 (м, 7H), 0,93-0,79 (м, 11H), 0,67-0,59 (м, 4H). ЖХМС Rt=1,297 мин при 2,0 мин хроматографии, 30-90 AB, МС ESI вычислено для C28H47 [M+H-2H2O]+ 383, найдено 383.
Стадия 3. К раствору соединения 37 (300 мг, 0,716 ммоль) в пиридине (10 мл) добавляли бензоилхлорид (501 мг, 3,57 ммоль). Реакционную смесь перемешивали при 20°C в течение 2 часов. Реакционную смесь разбавляли H2O (50 мл), экстрагировали EtOAc (3×20 мл). Объединенную органическую фазу промывали 1Н HCl (100 мл), насыщенным раствором соли (100 мл), сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали комбинированной флэш-хроматографией (0%~15% EtOAc в PE), с получением соединения A45 (270 мг, 72%) в виде прозрачного масла.1H ЯМР (400 МГц, CDCl3) δ 8,10-8,00 (м, 2H), 7,60-7,50 (м, 1H), 7,50-7,40 (м,2H), 5,70-5,55 (м, 1H), 2,00-1,90 (м, 1H), 1,85-1,15 (м, 23H), 1,10-0,75 (м, 20H), 0,70-0,50 (м, 4H).
Стадия 4. Соединение A45 (270 мг, 0,516 ммоль) очищали SFC (колонка: AD(250 мм×30 мм, 5 мкм); Условия: 0,1%NH3.H2O EtOH; градиент 35%B; время удерживания (мин): 30; скорость потока (мл/мин): 60), с получением соединения A46 (пик 1, 90 мг) в виде белого твердого вещества и соединения A47 (пик 2, 100 мг) в виде белого твердого вещества
Соединение A46:1H ЯМР (400 МГц, CDCl3) δ 8,10-8,00 (м, 2H), 7,60-7,50 (м, 1H), 7,50-7,40 (м,2H), 5,70-5,55 (м, 1H), 2,00-1,60 (м, 6H), 1,55-1,25 (м, 14H), 1,20-1,10 (м, 7H), 1,10-0,75 (м, 17H), 0,70-0,50 (м, 4H).
Соединение A47:1H ЯМР (400 МГц, CDCl3) δ 8,10-8,00 (м, 2H), 7,60-7,50 (м, 1H), 7,50-7,40 (м,2H), 5,70-5,55 (м, 1H), 2,00-1,60 (м, 7H), 1,55-1,20 (м, 20H), 1,20-0,80 (м, 17H), 0,70-0,50 (м, 4H).
Стадия 5. К раствору соединения A46 (90 мг, 0,17 ммоль) в ТГФ (5 мл) добавляли MeOH (2 мл) и раствор LiOH.H2O (72 мг, 1,72 ммоль) при 25°C. Смесь перемешивали при 25°C в течение 17 часов. Добавляли воду (5 мл). Смесь экстрагировали EtOAc (2×8 мл), промывали насыщенным раствором соли (2×10 мл), сушили над Na2SO4, фильтровали, концентрировали в вакууме, что давало неочищенный продукт соединения A, который очищали колоночной флэш-хроматографией (0-30% EtOAc в PE, 50 мин), с получением соединения 37-A (28 мг, 39%) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 3,90-3,70 (м, 1H), 2,00-1,60 (м, 5H), 1,55-1,40 (м, 5H), 1,35-1,20 (м, 17H), 1,20-0,80 (м, 18H), 0,70-0,50 (м, 4H). ВЭЖХ Rt=6,82 мин при 8 мин хроматографии, 30-90_AB_1,2ml_E, МС MS ESI вычислено для C28H47 [M+H-2H2O]+383, найдено 383.
Стадия 6. К раствору соединения A47 (100 мг, 0,19 ммоль) в ТГФ (5 мл) добавляли MeOH (2 мл) и раствор LiOH.H2O (80 мг, 1,91 ммоль) при 25°C. Смесь перемешивали при 25°C в течение 17 часов. Добавляли воду (5 мл). Смесь экстрагировали EtOAc (2×8 мл), промывали насыщенным раствором соли (2×10 мл), сушили над Na2SO4, фильтровали, концентрировали в вакууме, что давало неочищенный продукт соединения A, который очищали колоночной флэш-хроматографией (0-30% EtOAc в PE, 50 мин), с получением соединения 37-B (57 мг,71%) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 3,90-3,70 (м, 1H), 2,00-1,60 (м, 7H), 1,55-1,30 (м, 11H), 1,25-1,15 (м, 9H), 1,10-0,75 (м, 18H), 0,70-0,50 (м, 4H). ВЭЖХ Rt=6,78 мин при 8 мин хроматографии, 30-90_AB_1,2ml_E, МС MS ESI вычислено для C28H47 [M+H-2H2O]+383, найдено 383.
Пример 17. Синтез соединений 38, 39 и 40
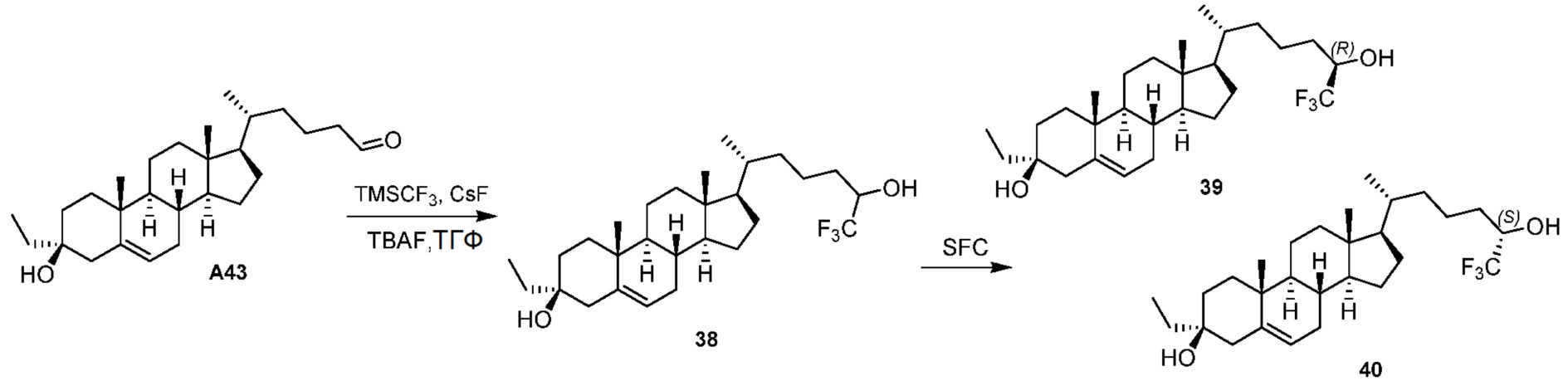
Стадия 1. К раствору соединения A43 (1 г, неочищенный) и CsF (200 мг, 1,31 ммоль) в ТГФ (15 мл) добавляли TMSCF3 (1,76 г, 12,4 ммоль) при 0°C в атмосфере азота. Смесь перемешивали при 20°C в течение 1 часа. Добавляли TBAF (15 мл, 1M в ТГФ). Смесь перемешивали при 20°C в течение еще 16 часов. Смесь концентрировали до 10 мл смеси в вакууме, и добавляли DCM (30 мл). Смесь промывали водой (3×50 мл), насыщенным раствором соли (2×50 мл), сушили над Na2SO4, фильтровали и концентрировали в вакууме, что давало неочищенный продукт соединения A, который очищали колоночной флэш-хроматографией (0-25% EtOAc в PE, 80 мин), с получением соединения 38 (400 мг, неочищенное) в виде не совсем белого твердого вещества.
Соединение 38 (400 мг, неочищенное) растирали в CH3CN (30 мл) при 80°C, что давало соединение 38 (310 мг) в виде не совсем белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 5,32-5,25 (м, 1H), 3,95-3,85 (м, 1H), 2,40-2,30 (м, 1H), 2,10-1,60 (м, 10H), 1,55-1,30 (м, 9H), 1,25-0,90 (м, 17H), 0,85 (т, J=7,6 Гц, 3H), 0,67 (с, 3H). ЖХМС Rt=1,308 мин при 2 мин хроматографии, 30-90AB_E, МС ESI вычислено для C28H44F3O [M-H2O+H]+ 453, найдено 453.
Стадия 2. Соединение 38 (300 мг) очищали SFC (колонка: AD (250 мм×30 мм, 5 мкм; условия: 0,1% NH3H2O IPA, 35% B; скорость потока (мл/мин): 60;), с получением соединения 39 (68 мг, 23%) и соединения 40 (39 мг, 13%) в виде не совсем белого твердого вещества.
Соединение 39:1H ЯМР (400 МГц, CDCl3) δ 5,32-5,25 (м, 1H), 3,95-3,85 (м, 1H), 2,40-2,30 (м, 1H), 2,10-1,60 (м, 10H), 1,55-1,30 (м, 10H), 1,25-0,90 (м, 16H), 0,85 (т, J=7,6 Гц, 3H), 0,68 (с, 3H). ЖХМС Rt=1,307 мин при 2 мин хроматографии, 30-90AB_E, МС ESI вычислено для C28H44F3O [M-H2O+H]+ 453, найдено 453.
Соединение 40:1H ЯМР (400 МГц, CDCl3) δ 5,32-5,25 (м, 1H), 3,95-3,85 (м, 1H), 2,40-2,30 (м, 1H), 2,10-1,60 (м, 10H), 1,55-1,25 (м, 13H), 1,20-0,90 (м, 13H), 0,85 (т, J=7,2 Гц, 3H), 0,68 (с, 3H). ЖХМС Rt=1,302 мин при 2 мин хроматографии, 30-90AB_E, МС ESI вычислено для C28H44F3O [M-H2O+H]+ 453, найдено 453.
Пример 18. Синтез соединения 41

К суспензии соединения A30 (100 мг, 0,232 ммоль) и Ti(i-PrO)4 (65,9 мг, 0,232 ммоль) в ТГФ (10 мл) в атмосфере N2 по каплям добавляли EtMgBr (0,27 мл, 0,812 ммоль) при 20°C. После перемешивания при 20°C в течение 1 часа, смесь гасили добавлением 0,4 мл насыщенного NH4Cl. Смесь фильтровали. Фильтрат концентрировали. Остаток очищали комбинированной флэш-хроматографией (EtOAc в PE, 0%~30%), с получением соединения 41 (42 мг, 42%) в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 5,33-5,23 (м, 1H), 2,41-2,31 (м, 1H), 2,07-1,91 (м, 3H), 1,88-1,67 (м, 3H), 1,66-1,57 (м, 3H), 1,53-1,35 (м, 11H), 1,33-1,00 (м, 11H), 0,99-0,81 (м, 8H), 0,76-0,71 (м, 2H), 0,67 (с, 3H), 0,47-0,41 (м, 2H). ЖХМС Rt=1,309 мин при 2,0 мин хроматографии, 30-90 AB, МС ESI вычислено для C29H47O [M+H-H2O]+ 411, найдено 411.
Пример 19. Синтез соединения 42

К суспензии соединения A41 (150 мг, 0,346 ммоль) и Ti(i-PrO)4 (98,3 мг, 0,346 ммоль) в ТГФ (10 мл) в атмосфере N2 по каплям добавляли EtMgBr (0,4 мл, 1,21 ммоль) при 20°C. После перемешивания при 20°C в течение 1 часа, смесь гасили 0,4 мл насыщенного NH4Cl. Смесь фильтровали. Фильтрат концентрировали. Остаток очищали комбинированной флэш-хроматографией (EtOAc в PE, 0%~30%), с получением соединения 42 (78 мг, 52%) в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 2,00-1,92 (м, 1H), 1,86-1,71 (м, 2H), 1,69-1,56 (м, 6H), 1,53-1,33 (м, 10H), 1,29-1,16 (м, 5H), 1,14-0,96 (м, 7H), 0,94-0,81 (м, 11H), 0,75-0,71 (м, 2H), 0,67-0,60 (м, 4H), 0,46-0,42 (м, 2H). ЖХМС Rt=1,343 мин при 2,0 мин хроматографии, 30-90 AB, МС ESI вычислено для C29H47 [M+H-2H2O]+ 395, найдено 395.
Пример 20. Синтез соединений 43, 43-A и 43-B


Стадия 1. К суспензии соединения A44 (800 мг, 1,98 ммоль) и CsF (150 мг, 0,99 ммоль) в ТГФ (20 мл) в атмосфере N2 одной порцией добавляли TMSCF3 (843 мг, 5,93 ммоль) при 0°C. После перемешивания при 20°C в течение 1 часа, добавляли TBAF (9,89 мл, 9,89 ммоль, 1M в ТГФ). Смесь перемешивали при 20°C в течение еще 16 часов. Смесь гасили 50 мл насыщенного NH4Cl и экстрагировали 50 мл EtOAc. Отделенную органическую фазу дважды промывали 100 мл насыщенного раствора соли, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали комбинированной флэш-хроматографией (EtOAc в PE, 0%~40%), с получением соединения 43 (400 мг, 42%) в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 3,98-3,85 (м, 1H), 1,99-1,92 (м, 2H), 1,87-1,74 (м, 1H), 1,69-1,56 (м, 7H), 1,53-1,31 (м, 10H), 1,28-1,16 (м, 5H), 1,15-0,95 (м, 7H), 0,94-0,85 (м, 7H), 0,82 (с, 3H), 0,68-0,60 (м, 4H). ЖХМС Rt=1,351 мин при 2,0 мин хроматографии, 30-90 AB, МС ESI вычислено для C28H46F3O [M+H-H2O]+ 455, найдено 455.
Стадия 2. К раствору соединения 43 (350 мг, 0,740 ммоль) в пиридине (10 мл) добавляли бензоилхлорид (416 мг, 2,96 ммоль). Реакционную смесь перемешивали при 50°C в течение 48 часов. Реакционную смесь разбавляли H2O (50 мл), экстрагировали EtOAc (3×20 мл). Объединенную органическую фазу промывали 1Н. HCl (100 мл), насыщенным раствором соли (100 мл), сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали комбинированной флэш-хроматографией (0%~20% EtOAc в PE), с получением соединения A48 (200 мг, 47%) в виде прозрачного масла.1H ЯМР (400 МГц, CDCl3) δ 8,20-8,05 (м, 2H), 7,15-7,05 (м, 1H), 7,50-7,40 (м, 2H), 5,60-5,50 (м, 1H), 2,00-1,70 (м, 3H), 1,55-1,40 (м, 12H), 1,35-1,15 (м, 9H), 1,10-0,90 (м, 8H), 0,90-0,75 (м, 9H), 0,70-0,50 (м, 4H).
Стадия 3. Соединение A48 (200 мг) очищали SFC (колонка: AD (250 мм×30 мм, 5 мкм); условия: 0,1% NH3H2O MeOH, 40% B; скорость потока (мл/мин): 60), что давало соединение A49 (40 мг, 20%) в виде масла и соединение A50 (70 мг, 35%) в виде не совсем белого твердого вещества.
Стадия 4. К раствору соединения A49 (40 мг) в ТГФ (2 мл) добавляли MeOH (1 мл) и раствор LiOH.H2O (16,6 мг, 0,69 ммоль) в H2O (1 мл) при 25°C. Смесь перемешивали при 25°C в течение 17 часов. Смесь экстрагировали EtOAc (2×5 мл), промывали насыщенным раствором соли (2×10 мл), сушили над Na2SO4, фильтровали, очищали колоночной флэш-хроматографией (0-30% EtOAc в PE), что давало соединение 43-A (20 мг, неочищенное) в виде не совсем белого твердого вещества, которое растирали в CH3CN (2 мл) при 25°C, затем осадок на фильтре растворяли в CH3CN (20 мл) при 80°C. Полученный раствор концентрировали в вакууме, что давало соединение 43-A (6 мг, 31%) в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 4,00-3,85 (м, 1H), 2,10-1,75 (м, 3H), 1,70-1,60 (м, 5H), 1,55-1,20 (м, 16H), 1,15-0,75 (м, 18H), 0,70-0,55 (м,4H). ЖХМС Rt=1,319 мин при 2 мин хроматографии, 30-90AB_E, МС ESI вычислено для C28H46F3O [M+H-H2O]+ 455, найдено 455.
Стадия 5. К раствору соединения A50 (70 мг) в ТГФ (3 мл) добавляли MeOH (2 мл) и раствор LiOH.H2O (50,7 мг, 1,2 ммоль) в H2O (2 мл) при 25°C. Смесь перемешивали при 25°C в течение 17 часов. Смесь экстрагировали EA (2×6 мл), промывали насыщенным раствором соли (2×10 мл), сушили над Na2SO4, фильтровали, очищали колоночной флэш-хроматографией (0-30% EtOAc в PE, 1 час), что давало соединение 43-B(40 мг, неочищенное) в виде масла, которое перекристаллизовывали из 4 мл CH3CN при 80°C, что давало соединение 43-B (23 мг, 58%) в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 4,00-3,85 (м, 1H), 2,10-1,75 (м, 3H), 1,70-1,60 (м, 5H), 1,55-1,20 (м, 16H), 1,15-0,75 (м, 18H), 0,70-0,55 (м,4H). ЖХМС Rt=1,315 мин при 2 мин хроматографии, 30-90AB_E, МС ESI вычислено для C28H46F3O [M+H-H2O]+ 455, найдено 455.
Материалы и способы
Соединения, предоставленные в данном описании, могут быть получены из легкодоступных исходных веществ, при использовании следующих общих методик и способов. Следует иметь в виду, что там, где приведены конкретные или предпочтительные условия процесса (т.е. реакционные температуры, время, мольные соотношения реагентов, растворители, давление и т.д.), также могут быть использованы другие условия процесса, если специально не указано иное. Оптимальные реакционные условия могут варьироваться в отношении используемого растворителя или конкретных реагентов, но такие условия могут быть определены специалистом в данной области путем обычной оптимизации.
Кроме того, как будет очевидно специалисту в данной области, могут потребоваться обычные защитные группы, чтобы избежать нежелательных реакций определенных функциональных групп. Выбор подходящей защитной группы для конкретной функциональной группы, а также подходящих условий для защиты и ее удаления известны в данной области. Например, многочисленные защитные группы и их введение и удаление описаны в T. W. Greene and P. G. M. Wuts, Protecting Groups in Organic Synthesis, Second Edition, Wiley, New York, 1991, и приведенных там ссылках.
Соединения, предоставленные в данном описании, могут быть выделены и очищены известными стандартными методами. Такие методы включают (но, не ограничиваясь ими) перекристаллизацию, колоночную хроматографию, ВЭЖХ или сверхкритическую жидкостную хроматографию (SFC). Ниже представлены следующие подробные схемы, касающиеся получения репрезентативных нейроактивных стероидов, которые были перечислены в данном описании. Соединения, предоставленные в данном описании, могут быть получены из известных или коммерчески доступных веществ и реагентов специалистом в области органического синтеза. Примеры хиральных колонок доступных для использования в разделении/очистке энантиомеров/диастереомеров, предоставленных в данном описании, включают, но, не ограничиваясь ими, ChiralPak® AD-10, CHIRALCEL® OB, CHIRALCEL® OB-H, CHIRALCEL® OD, CHIRALCEL® OD-H, CHIRALCEL® OF, CHIRALCEL® OG, CHIRALCEL® OJ и CHIRALCEL® OK.
1H-ЯМР, о котором сообщалось в данном описании (например, для области δ (м.д.) от около 0,5 до около 4 м.д.), понимается в качестве примера интерпретации ЯМР спектра (например, примеры интегрированных пиков) соединения. Примеры общего метода препаративной ВЭЖХ: колонка: Waters RBridge prep 10 мкм C18, 19*250 мм. Подвижная фаза: ацетонитрил, вода (NH4HCO3) (30 л воды, 24 г NH4HCO3, 30 мл NH3.H2O). Скорость потока: 25 мл/мин.
Примеры общего метода аналитической ВЭЖХ: подвижная фаза: A: вода (10 мМ NH4HCO3), B: ацетонитрил, градиент: 5%-95% B в 1,6 или 2 мин, скорость потока: 1,8 или 2 мл/мин; колонка: XBridge C18, 4,6*50 мм, 3,5 мкм при 45°C.
NMDA потенцирование
NMDA потенцирование оценивали методом локальной фиксации потенциала на целой клетке клеток млекопитающих, которые экспрессировали NMDA рецепторы.
Локальная фиксация потенциала на клетках млекопитающих (Ionworks Barracuda (IWB)
Методику фиксации клеточного потенциала использовали для исследования воздействий соединений на GlunN1/GluN2A глутаматные рецепторы? экспрессированные в клетках млекопитающих. Результаты показаны в таблице 1.
HEK293 клетки трансформировали с аденовирусом 5 ДНК и трансфицировали с cДНК кодирующей гены GRIN1/GRIN2A человека. Стабильные трансфектанты отбирали с использованием генов G418 и зеоцин-резистентных генов, включенных в плазмиду экспрессии, и выбора давления? поддерживаемого с G418? и в среде зеоцина. Клетки культивировали в модифицированной среде Дульбекко Игла/Питательная смесь (D-MEM/F-12), дополненной 10% фетальной бычьей сывороткой, 100 мкг/мл пенициллина G натрий, 100 мкг/мл стрептомицина сульфата, 100 мкг/мл зеоцина, 5 мкг/мл бластицидина и 500 мкг/мл G418.
Эффекты тестируемых образцов оценивали в 8-точечном формате концентрация-ответ (4 повтора лунки/концентрация). Все тестируемые и контрольные растворы содержали 0,3% ДМСО и 0,01% Kolliphor® EL (C5135, Sigma). Составы тестируемых образцов помещали в 384-луночные планшеты с использованием автоматизированной системы дозирования жидкостей (SciClone ALH3000, Caliper LifeScienses). Измерения осуществляли с использованием платформы автоматической системы Ion Works Barracuda по следующей методике:
Электрофизиологические методики:
a) Внутриклеточный раствор (мМ): 50 мМ CsCl, 90 мМ CsF, 2 мМ MgCl2, 5 мМ EGTA, 10 мМ HEPES. Доведен до pH 7,2 при помощи CsOH.
b) Внеклеточный раствор, HB-PS (составлен в мМ): NaCl, 137; KCl, 1,0; CaCl2, 5; HEPES, 10; глюкоза, 10; pH, доведенный до 7,4 при помощи NaOH (в холодильнике до использования).
c) Исходный потенциал: -70 мВ, потенциал во время применения агонист/PAM: -40 мВ.
Методика записи:
a) Внеклеточный буфер загружают в PPC луночный планшет (11 мкл на лунку). Суспензию клеток пипетируют в лунки (9 мкл на лунку) PPC плоского электрода.
b) Поклеточная запись конфигурации создают через патч перфорации с токами мембраны, записанными встроенным амплификатором фиксации потенциала.
c) Выполняют две записи (сканирование). Первую во время предварительного применения только тестируемого образца (продолжительность предварительного применения 5 мин), и вторую во время совместного применения тестируемого образца и агониста (EC20 L-глутамата и 30 мкм глицина) для детекции положительных модулирующих эффектов тестируемого образца.
Введение тестируемого образца: Сначала предварительное применение состоит из добавления 20 мкл 2Х концентрированного раствора тестируемого образца, и, затем, 20 мкл 1X концентрированного тестируемого образца и агониста при 10 мкл/с (2 второе общее время применения).
Для таблицы 1: ʺAʺ обозначает 10-100%, и ʺBʺ обозначает потенциацию >100%; и ʺNDʺ обозначает не определяема или не определяли.
Другие варианты осуществления
В пунктах формулы изобретения единственное число может означать один или более чем один, если не указано иное или, в противном случае, видно из контекста. Пункты формулы изобретения или описание, которые включают ʺилиʺ между одним или более членами группы, считаются выполненными, если один, более чем один или все члены группы присутствуют в, применимы к или в ином отношении к данному продукту или способу, если не указано иное или, в противном случае, видно из контекста. Настоящее изобретение включают варианты осуществления, в которых более чем один или все члены группы присутствуют в, применимы к или в ином отношении к данному продукту или способу.
Кроме того, настоящее изобретение включает все варианты, комбинации и перестановки, в которых одно или более ограничений, элементов, предложений и описательных терминов из одного или более перечисленных пунктов формулы изобретения вводятся в другой пункт формулы изобретения. Например, любой пункт формулы изобретения, который зависим от другого пункта формулы изобретения, может быть модифицирован для включения одного или более ограничений, находящихся в любом другом пункте формулы изобретения, который зависим от того же основного пункта формулы изобретения. Когда элементы представлены в виде списка, например, в формате групп Маркуша, каждая подгруппа элементов также раскрывается, и любой элемент(ы) может(гут) быть удален(ы) из данной группы. Следует понимать, что, как правило, когда настоящее изобретение или аспекты настоящего изобретения относятся к конкретным элементам и/или признакам, некоторые варианты осуществления настоящего изобретения или аспекты настоящего изобретения состоят или по существу состоят из таких элементов и/или признаков. В целях простоты, такие варианты осуществления конкретно не изложены в тех же выражениях в данном описании. Также следует отметить, что термины ʺвключающийʺ и ʺсодержащийʺ предназначены для открытия и разрешения включения дополнительных элементов или стадий. Когда даются диапазоны, конечные точки включаются. Кроме того, если не указано иное или, в противном случае, видно из контекста и понимается специалистом в данной области, значения, которые выражены в виде диапазонов, могут быть приняты как любое конкретное значение или поддиапазон в указанных диапазонах в различных вариантах осуществления настоящего изобретения до десятой доли единицы нижнего предела диапазона, если только контекст явно диктует иное.
В настоящем описании имеются ссылки на различные опубликованные патенты, публикации патентных заявок, журнальные статьи и другие публикации, все из которых включены в данное описание посредством ссылок. При возникновении конфликта между любой из включенных ссылок и настоящим описанием изобретения, настоящее описание должно быть контрольным. Кроме того, любой конкретный вариант осуществления настоящего изобретения, который попадает в известный уровень техники, может быть явно исключен из любого одного или более пунктов формулы изобретения. Поскольку такие варианты осуществления считаются известными для специалистов в данной области, они могут быть исключены, даже если исключение явным образом не указано в настоящем описании. Любой конкретный вариант осуществления настоящего изобретения может быть исключен из любого пункта формулы изобретения, по любой причине, связана ли она или нет с существующим уровнем техники.
Специалисту в данной области техники будет очевидно или он будет иметь возможность убедиться, используя не более чем обычное экспериментирование, во многих эквивалентах конкретных вариантов осуществления, описанных в данном описании. Настоящие варианты осуществления, описанные в данном описании, не предназначены для ограничения объема приведенного выше описания изобретения, которое ограничивается только предложенными пунктами прилагаемой формулы изобретения. Специалисту в данной области техники будет очевидно, что в данном описании возможны различные варианты изменений и модификаций, не отходя от существа и объема настоящего изобретения, как определено в следующих пунктах формулы изобретения.
Реферат
Изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли. В формуле (I) R1представляет собой C1-6алкил; каждый из R2и R3независимо представляет собой водород, -CF3или C1-6алкил; или R2и R3вместе с атомом углерода, к которому они присоединены, образуют C3-6карбоциклил; R6отсутствует или представляет собой водород; каждый из R7и R8независимо представляет собой водород; n равен 1, 2 или 3; ипредставляет собой простую или двойную связь, где, когда одинпредставляет собой двойную связь, другойпредставляет собой простую связь; и, когда один изпредставляет собой двойную связь, R6отсутствует. Изобретение также относится к фармацевтической композиции и к способу позитивной аллостерической модификации рецептора NMDA. Технический результат: получены новые соединения формулы (I), которые обладают позитивной аллостерической модификацией рецептора NMDA и могут применяться при лечении NMDA-опосредованных расстройств. 3 н. и 53 з.п. ф-лы, 1 табл., 20 пр.
Формула









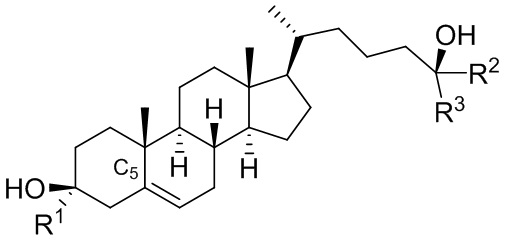

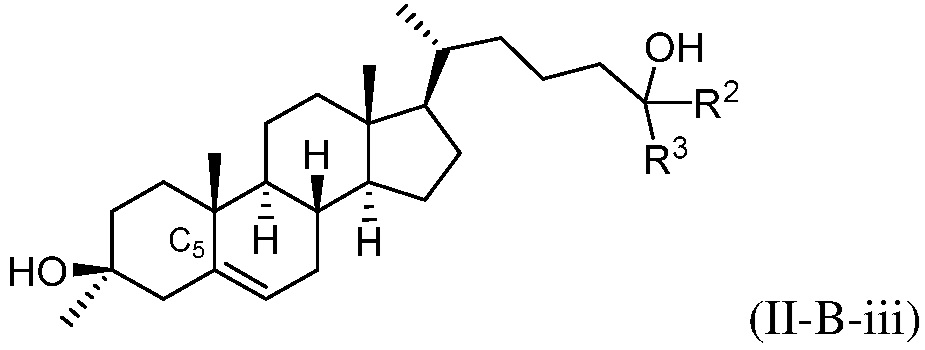
















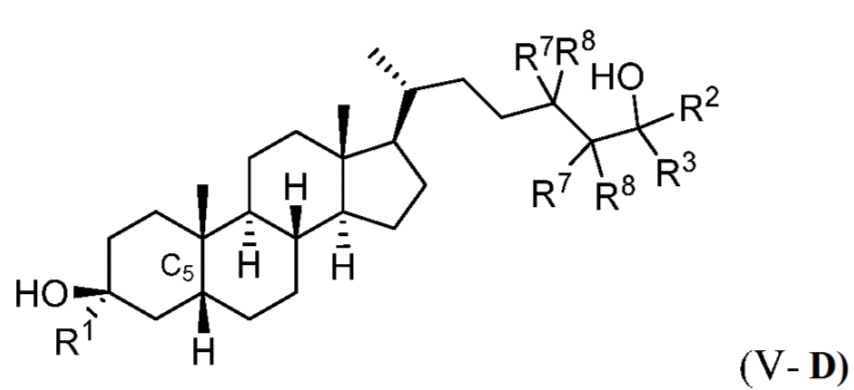














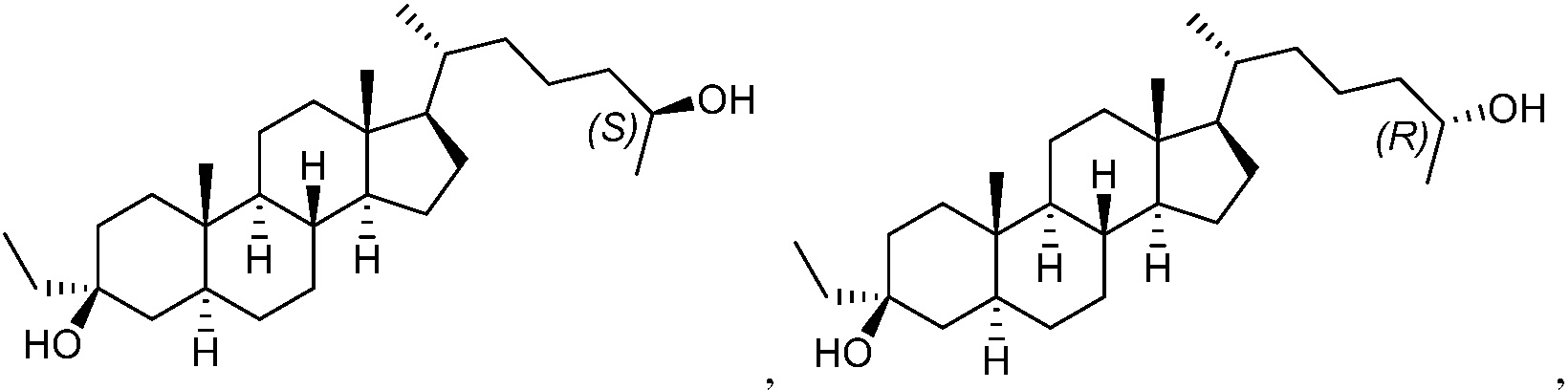
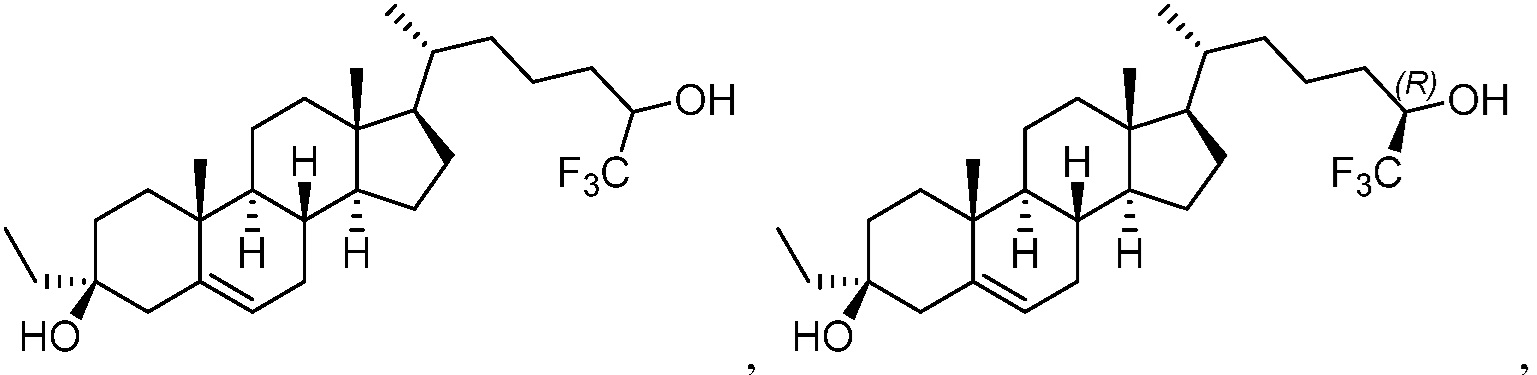








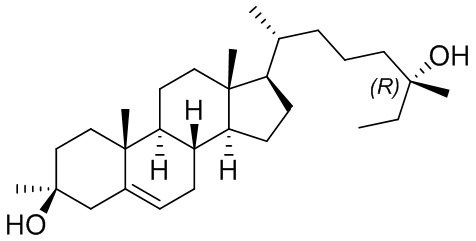


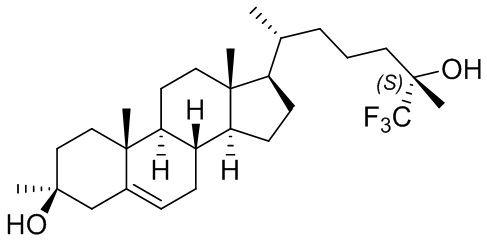
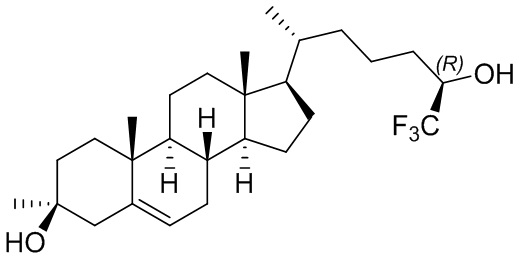

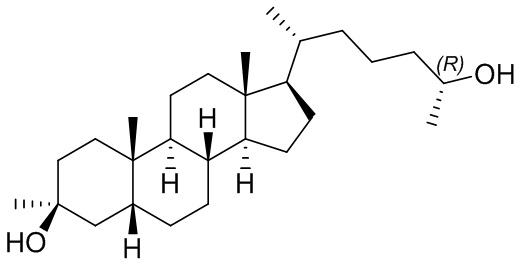


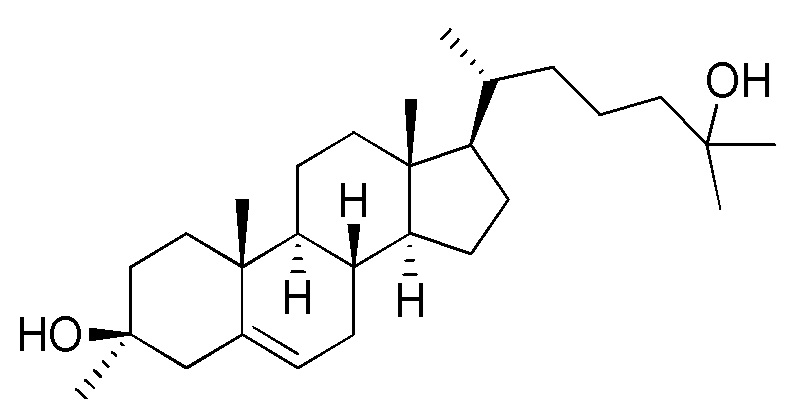

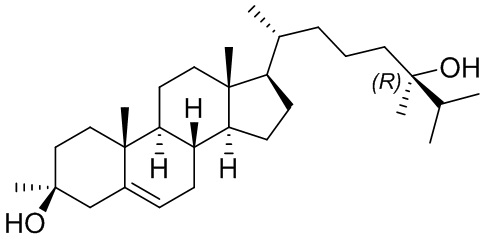

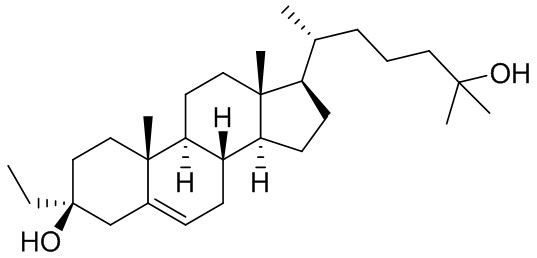
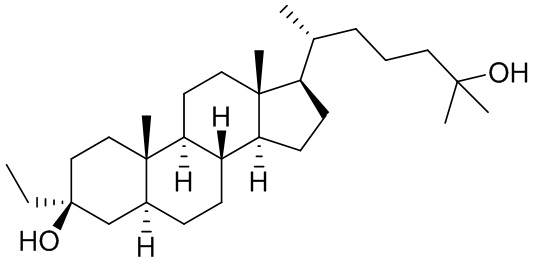











Комментарии