Нейроактивные стероиды, фармацевтический препарат, способ лечения или профилактики различных нарушений, способ индукции сна и способ индукции анестезии с их использованием, способ модулирования комплекса рецептор гамкa-хлоридный ионофор - RU2194712C2
Код документа: RU2194712C2
Чертежи


















Описание
Область техники
Изобретение относится к новым стероидным производным рядов андростана и прегнана, а также к фармацевтическим препаратам и способам модуляции возбудимости головного мозга.
Более конкретно изобретение
касается 3α-гидрокси, 17-(не)замещенных производных ряда андростана и 3α-гидрокси, 21-замещенных производных ряда прегнана.
Уровень техники
Возбудимость головного
мозга определяется как уровень возбуждения животного, состояние в диапазоне от комы до судорог, и регулируется различными нейромедиаторами. В общем случае нейромедиаторы
ответственны за регуляцию
проводимости ионов через нейронные мембраны. В состоянии покоя нейронная мембрана обладает потенциалом (или мембранным напряжением) приблизительно -80 мВ, при этом
внутренняя часть клетки является
отрицательно заряженной по сравнению с наружной частью клетки. Потенциал (напряжение) является результатом равновесия ионов (K+, Na+, Сl-, органические ионы) в
полупроницаемой нейронной мембране. Нейромедиаторы находятся в пресинаптических пузырьках и высвобождаются под влиянием потенциалов действия нейрона. При выходе в
синаптическое углубление химический
медиатор раздражения, такой как ацетилхолин, будет вызывать деполяризацию мембраны (изменение потенциала от -80 до -50 мВ). Этот эффект передается
постсинаптическими никотиновыми рецепторами, которые
стимулируются ацетилхолином, с целью повышения проницаемости мембраны для ионов Na+. Пониженный мембранный потенциал стимулирует
нейронное возбуждение в форме потенциала постсинаптического
действия.
В случае комплекса рецептора ГАМК (GRC) эффект возбудимости головного мозга переносится нейромедиатором ГАМК. ГАМК имеет сильное влияние на общую возбудимость головного мозга, потому что до 40% нейронов головного мозга используют ГАМК как нейромедиатор. ГАМК регулирует возбудимость отдельных нейронов изменением проводимости ионов хлорида через нейронную мембрану. ГАМК взаимодействует со своим участком узнавания на GRC для облегчения проникновения ионов хлорида по электрохимическому градиенту GRC в клетку. Повышение содержания этого аниона внутри клетки вызывает гиперполяризацию трансмембранного потенциала, делая нейрон менее чувствительным к возбуждающим сигналам (например, пониженная возбудимость нейронов). Другими словами, чем выше концентрация иона хлорида в нейроне, тем ниже возбудимость головного мозга (уровень возбуждения).
Широко описано, что GRC отвечает за проявление состояния тревоги, припадочной активности и седативного эффекта. Таким образом, ГАМК и лекарственные средства, которые действуют как ГАМК или облегчают эффекты ГАМК (например, терапевтически используемые барбитураты и бензодиазепины (BZs), такие как валиум), проявляют свои терапевтически полезные эффекты при взаимодействии с специфическими регуляторными сайтами на GRC.
Накопленные доказательства теперь указывают, что кроме участка связывания бензодиазепина и барбитурата GRC содержит отдельный участок для нейроактивных стероидов (Lan N.C. et al., Neurochem. Res. 16:347-356 (1991)). Наиболее активными эндогенными нейроактивными стероидами являются 3α-гидрокси-5-восстановленный прегнан-20-он и 3α,21-дигидрокси-5-восстановленный прегнан-20-он, метаболиты гормональных стероидов прогестерона и дезоксикортикостерона соответственно. Способность этих стероидных метаболитов изменять возбудимость головного мозга обнаружена в 1986 г. (Majewska M.D. et al., Science 232: 1004-1007 (1986); Harrison N.L et al., J. Pharmacol. Exp. Ther. 241: 346-353 (1987)). Однако терапевтическая полезность этих стероидных метаболитов и их производных (нейроактивных стероидов) не была признана исследователями, работающими в данной области, вследствие неполного понимания активности и области действия этих нейроактивных стероидов. Изобретение заявителей частично связано с фармацевтическим применением знаний, полученных из более полного понимания активности и области действия определенных стероидных соединений.
Было продемонстрировано, что гормон яичников прогестерон и его метаболиты обладают сильным действием на возбудимость головного мозга (Backstrom Т. et al., Acta Obstet. Gynecol. Stand. Suppl. 130:19-24 (1985); Pfaff D.W. and McEwen B.S., Science 219:808-814 (1983); Gyermek et al., J. Med. Chem. 11:117 (1968); Lambert J. et al., Trends Pharmacol. 8:224-227 (1987). Уровни прогестерона и его метаболитов изменяются в зависимости от фазы менструального цикла. Было широко описано, что содержание прогестерона и его метаболитов снижается перед началом менструации. Ежемесячное повторение определенных физических симптомов перед началом менструации также было описано. Эти симптомы, которые стали ассоциироваться с предменструальным синдромом (PMS), включают стресс, состояние тревоги и мигрени (Dalton К., Premenstrual Syndrome and Progesterone Therapy, 2nd edition, Chicago: Chicago yearbook, 1984). Пациенты с PMS имеют ежемесячный рецидив симптомов, которые наблюдаются перед менструацией и отсутствуют после менструации.
Подобным образом снижение прогестерона также временно коррелирует с увеличением частоты припадков у женщин-эпилептиков, т.е. менструальной эпилепсией (Laidlaw J. , Lancet, 1235-1237 (1956)). Более прямая корреляция была отмечена в отношении снижения метаболитов прогестерона (Rosciszewska et al., J. Neurol. Neurosurg. Psych. 49:47-51 (1986)). Кроме того, у пациентов с первичной генерализованной малой эпилепсией время припадков коррелировало с возникновением симптомов предменструального синдрома (Backstorm Т. et al., J. Psychosom. Obstet. Gynaecol. 2:8-20 (1983)). Было обнаружено, что стероид дезоксикортикостерон эффективен при лечении пациентов с эпилептическими приступами, коррелирующими с их менструальными циклами (Aird R.B. и Gordan G., J. Amer. Med. Soc. 145:715-719(1951)).
Синдромом, также связанным с низкими уровнями прогестерона, является послеродовая депрессия (PND). Сразу после родов уровни прогестерона резко падают, приводя к началу PND. Симптомы PND варьируют от мягкой депрессии до психоза, требующего госпитализации; PND ассоциируется с состоянием острой тревоги и раздражительностью. PND-ассоциированная депрессия не поддается лечению классическими антидепрессантами, а у женщин с PND повышена частота возникновения PMS (Dalton К., Premenstrual Syndrome and Progesteron Therapy, 2nd edition, Chicago Yearbook, Chicago (1984)).
Вместе взятые, эти наблюдения подразумевают существенную роль прогестерона и дезоксикортикостерона и, более специфически, их метаболитов в гомеостатической регуляции возбудимости головного мозга, которая проявляется как усиление эпилептической активности или симптомов, ассоциированных с менструальной эпилепсией, PMS и PND. Корреляция между пониженными уровнями прогестерона и симптомами, ассоциированными с PMS, PND и менструальной эпилепсией (Backstorm et al., J. Psychosom. Obstet. Gynaecol. 2:8-20 (1983); Dalton К., Premenstrual Syndrome and Progesteron Therapy, 2nd edition, Chicago Yearbook, Chicago (1984)), подсказала применение прогестерона в их лечении (Mattson et al., "Medroxyprogesteron Therapy of catamenial epilepsy" в Advances in epileptology: XVth Epilepsy International Symposium, Raven Press, New York (1984), 279-282, 1984 и Dalton K., Premenstrual Syndrome and Progesteron Therapy, 2nd edition, Chicago Yearbook, Chicago (1984)). Однако прогестерон не является постоянно эффективным при лечении вышеупомянутых синдромов. Например, не существует связи доза-ответ для прогестерона при лечении PMS (Maddocks etal., Obstet. Gynecol. 154:573-581 (1986); Dennerstein, etal., Brit. Med. J., 290:16-17(1986)).
Templeton et al., Steroids 48:339-346 (1986) описывают стереоселективное и региоселективное восстановление стероидных кетонов с образованием аксиальных спиртов по С-3. Соединение 17β-метокси-2β-метил-5α-андростан-3α-ол получено из 17β -метокси-2α, 3α-эпокси-5α-андростана.
Grieco et al., J. Am. Chem. Soc. 11:7799-7801 (1990) описывают использование 17β-метокси-5α-андростан-3α -ола в качестве исходного материала для получения конъюгатов, содержащих металлопорфирины, связанные с стероидными субстратами.
Babcock et al., Патент США 4297350, выданный 27 октября 1991 г., широко описывают 17-эфиры стероидных андростана и андростена и их применение в качестве мужских противозачаточных средств.
Neef et al. Tetrahedron Letters 21:903-906 (1980) описывают соединение 17β-метоксиметокси-3β-(1-пропинил)-5α -андростен-3α-ол в качестве промежуточного соединения при получении стероидных производных.
FR 1437361, опубликованный 6 мая 1966 г., и Патент США 3135744, выданный 2 июня 1964 г., описывают 17-(2-метил-2-бутенил)овый и циклоалкениловый сложные эфиры 5α-андростан-3α, 17β -диола и их 3-эфиры низших алканоилов. Показано, что соединения обладают андрогенной и/или анаболической активностью.
Phillips et al., Патент США 4197296, выданный 8 апреля 1980 г., описывают стероиды ряда андростана, которые содержат 3α-гидрокси-группу, 5α- или 5β-атом водорода и 11α-замещенную аминогруппу, в которой положение 17 может быть незамещенным. Описано соединение 11α-N, N,-диметиламино-2β-этокси-5α -андростан-3α-ол. В патенте описано, что такие соединения обладают анестезирующей активностью.
Phillips et al., Патент США 3882151, выданный 6 мая 1975 г., и Phillips et al. , Патент США 3969345, выданный 13 июля 1976 г., описывает 21-эфиры 3α-оксигенированного прегнана, содержащие 3α-гидроксил или его эфир, кето-группу в положении 20 и этерифицированный гидроксил в положении 21. 21-эфирный заместитель предпочтительно представлен алкокси-, циклоалкокси-арилалкокси или арилокси-группой, которая может содержать дополнительные заместители. Патенты раскрывают, что такие соединения обладают анестезирующей активностью.
Phillips et al., Патент США 3959260, выданный 25 мая 1976 г., описывают стероидные анестезирующие соединения из рядов прегнана и 19-норпрегнана, которые содержат 3α-гидроксил, 20-оксо-группу и в положении 21 - остаток содержащего серу нуклеофила или сульфоновую или сульфоксидную группы. 3β -заместитель может быть либо водородом, либо алкилом.
Clayton et al., Патент США 3822298, выданный 2 июля 1974 г., описывают способ получения 3α-гидрокси-5α-стероидов. В патенте описано получение 21-бензилокси-3α-гидрокси-5α-прегнан-11,20-диона.
Настоящая заявка является частичным продолжением заявки 08/467404, поданной 6 июня 1995 г., содержание которой полностью включено в виде ссылки.
Сущность изобретения
Настоящее изобретение посвящено новым стероидным производным из рядов андростана и прегнана, а также
фармацевтическим препаратам и способам модулирования возбудимости головного мозга. Более
конкретно, изобретение касается 3α-гидрокси, 17-(не)замещенных производных из ряда андростана и
21-замещенных производных из ряда прегнана. Эти производные способны действовать на недавно
идентифицированный участок на GRC, модулируя, следовательно, возбудимость головного мозга таким образом,
чтобы облегчить стресс, состояние тревоги, бессонницу, нарушения настроения, обусловленные
активными в отношении GRC агентами (например, депрессию), и эпилептическую активность.
Нейроактивные стероидные производные, представленные в данном изобретении, имеют общую
структурную формулу (I),

где R означает водород или низшую алкоксигруппу;
R1 означает водород, С1-10алкил, С2-10алкенил, С2-10 алкинил, галоген-С1-10алкил, тригалогенС1-10алкил, гидроксиС2-10алкинил, алкоксиС1-10алкил, необязательно замещенный фенил, алкоксиС2-10алкинил, оксоалкинил или его кеталь, необязательно замещенный фенилалкинил, сложный гемиэфир гидроксиалкинилдикарбоновой кислоты;
R2 означает водород или кетогруппу;
R3 означает необязательно замещенную алкокси-, алкинилокси-, необязательно замещенную фенилалкинилоксигруппу, -C(O)-CH2-Y-G, -С(O)-CH2-O-D, -C(O)-CH2-O-E, -C(O)-CH2-Z-G или -C(O)-CH2-Y-Z-A, где
Y обозначает О, S, SO или SO2;
Z обозначает С1-10алкил;
G обозначает пиридил или необязательно замещенный фенил;
D обозначает хинолин, присоединенный к атому углерода;
Е - необязательно замещенный фенил;
А обозначает гидроксил, карбоксил или сульфонат;
R4 обозначает водород или метил;
R5 - водород;
R6 - водород;
R7 - водород или гидроксил;
R8 - водород;
R9 - водород;
R10 - водород;
при условии, что:
когда R3 - С1-3алкоксигруппа и R - водород, то R1 отличен от водорода. Структура, имеющая формулу I, включает андростаны, прегнаны (R4 = метил), 19-норандростаны и норпрегнаны (R4 = Н).
Настоящее изобретение также включает фармацевтически приемлемые эфиры и соли соединений формулы I, в том числе соли кислот. Считают, что 3α-гидроксил может быть также замаскирован фармацевтически приемлемым эфиром вследствие того факта, что эфир будет расщепляться по мере того, как пролекарственное вещество превращается в лекарственную форму. В описании их обозначают как расщепляемые эфиры.
Соединения, представленные в настоящем изобретении, являются модуляторами возбудимости центральной нервной системы, как следует из их способности регулировать каналы ионов хлорида, ассоциированные с комплексом рецептора ГАМК. В экспериментах заявителей установлено, что эти соединения обладают активностью против судорог, состояния тревоги и седативной снотворной активностью, подобной действию известных агентов, таких как BZ (бензодиазепины), но они действуют на отличающийся участок на GRC.
Связь эндогенных метаболитов прогестерона с процессами, ассоциированными с размножением (цикл эструса и беременность), хорошо установлена (Marker R. E. et al. , J. Am. Chem. Soc. 59:616-618 (1937)). Однако лишь недавно было выяснено, как лечить нарушения модуляцией возбудимости головного мозга посредством применения стероидных метаболитов и их производных. См. Патент США 5208227, выданный 4 мая 1993 г., Патент США 5120723, выданный 9 июня 1992 г. , и Патент США 5232917, выданный 3 августа 1993 г.
Желательными объектами фармацевтических препаратов и способов, представленных в этом изобретении, являются лечение стресса, состояния тревоги, PMS, PND и припадков, таких как вызываемые эпилепсией, с целью облегчить или предотвратить приступы тревоги, напряженность мышц и депрессии, обычные для пациентов, страдающих этими аномалиями центральной нервной системы. Дополнительным желательным объектом препаратов и способов является лечение бессонницы и получение снотворного действия. Другим желательным объектом соединений и способов является индукция анестезии, особенно посредством внутривенного введения. Настоящее изобретение направлено на новые соединения и их применение в фармацевтических препаратах и способах лечения таких нарушений модуляцией возбудимости головного мозга.
Другой аспект настоящего изобретения касается способа индукции сна и практического поддержания уровня REM (парадоксального или быстрого) сна, который обнаруживается при нормальном сне, при котором не индуцируется реактивная, как определено здесь, бессонница. Этот способ предусматривает введение эффективного количества соединения, представленного в изобретении. Соединения, представленные в изобретении, способны удлинять NREM (медленный) сон и общий период сна без существенного влияния на количество REM сна.
Перечень фигур
чертежей
Настоящее изобретение может быть лучше понято и его преимущества оценены с помощью
сопровождающего чертежа, на котором дана схема зависимости от времени антиметразольной активности
пролекарства 3α-гидрокси-17β-метокси-5α-андростана (вводимого внутрибрюшинно в
дозе 20,0 мг/кг).
Сведения, подтверждающие возможность осуществления изобретения
Соединения, представленные в настоящем изобретении, являются производными различных 3α
-гидроксилированных-прегнанов и 3α-гидроксилированных андростанов и их простыми и сложными
эфирами, сульфонатами, сульфатами, фосфонатами, фосфатами, оксимовыми, тиосульфатными,
гетероциклическими и гетероарильными производными, и производными, которые описаны как пролекарства. Выражение
"пролекарство" относится к производному известного лекарственного средства прямого
действия, которое имеет улучшенные характеристики доставки и терапевтической ценности по сравнению с лекарственным
средством и трансформируется в активное лекарственное средство энзиматическим или
химическим способом; см. Notari R. E., Methods in Enzymology, 112: 309-323 (1985); Bodor N., Drugs of the Future,
6(3):165-182 (1981) и Bundgaard H., "Design of Prodrugs: Bioreversible Derivatives
for Various Functional Groups and Chemical Entities" в Design of prodrugs, H. Bundgaard, ed., Elsevier, New York
(1985). Следует отметить, что некоторые из синтетических производных, составляющих
часть настоящего изобретения, могут не быть настоящими пролекарствами, потому что в дополнение к упомянутым
характеристикам они также обладают собственной активностью. Однако в рамках этой заявки они
будут упоминаться как пролекарства.
Ранние исследования (Gee K.W. et al., European Journal of Pharmacology, 136: 419-423 (1987)) продемонстрировали, что 3α-гидроксилированные стероиды на несколько порядков более активны, как модуляторы GRC, чем ранее описанные (Majewska M.D. et al. Science 232:1004-1007 (1986); Harrison N.L. et al., J. Pharmacol Exp. Ther. 241:346-353 (1987)). Majewska M.D. et al. и Harrison N. L. et al. показали, что 3α -гидроксилированные-5-восстановленные стероиды способны давать значительно более низкие уровни эффективности. Экспериментальные данные in vitro и in vivo демонстрируют, что высокая активность этих стероидов позволяет их терапевтическое применение для модуляции возбудимости головного мозга через GRC (Gee K.W. et al., European Journal of Pharmacology, 136: 419-423 (1987)); Wieland et al., Psychopharmacology 118(1):65-71 (1995)). Различные синтетические стероиды были получены как нейроактивные стероиды. См. , например, Патент США 5232917, выданный 3 августа 1993 г., который описывает нейроактивные стероидные соединения, применяемые для лечения стресса, состояния тревоги, эпилептических нарушений и нарушений настроения, поддающихся воздействию агентов, активных в отношении GRC, таких как депрессия, терапевтически благоприятным образом. Далее, ранее было показано, что эти стероиды взаимодействуют с уникальным участком на GRC, который отличается от других известных участков взаимодействия (т.е. барбитуратного, BZ и ГАМК), для которых ранее установлены терапевтически благоприятные воздействия на стресс, состояние тревоги, сон, нарушения настроения и эпилептические нарушения (Gee K.W., Yamamura H.I. "Benzodiazepines and Barbiturates: Drugs for the Treatment of Anxiety, Insomnia and Seizure Disorders" в Central Nervous System Disorders, D.C. Horvell, ed., Marcel-Dekker, New York (1985), 123-147; Lloyd K.G. and Morselli P.L., Psychopharmacology: The Third Generation of Progress, H.Y. Meltzer, ed. Raven Press, N.Y. (1987), 183-195 и Gee K.W. et al., European Journal of Pharmacology, 136: 419-423 (1987). Эти соединения являются желательными вследствие продолжительности их действия, эффективности и активности при пероральном применении (наряду с другими формами введения).
Определения
В соответствии с данным изобретением и
как применяется здесь, следующие термины, которые появляются отдельно или как часть целого, имеют
следующее значение, если не указано четко иное.
Термин "алкил", как употребляется здесь во всех случаях, означает насыщенные алифатические группы, включая группы с неразветвленной цепью, разветвленной цепью и циклические группы, все из которых могут быть необязательно замещены. Предпочтительные алкильные группы содержат 1-10 атомов углерода. Подходящие алкильные группы представлены метилом, этилом и подобными группами и могут быть необязательно замещены.
Термин "алкенил", как употребляется здесь во всех случаях, означает ненасыщенные группы, которые содержат по меньшей мере одну углерод-углеродную двойную связь, и включает группы с неразветвленной цепью, разветвленной цепью и циклические группы, которые могут быть необязательно замещены. Предпочтительные алкенильные группы содержат 2-10 атомов углерода.
Термин "алкинил", как употребляется здесь во всех случаях, означает ненасыщенные углеводородные группы, которые содержат по меньшей мере одну углерод-углеродную тройную связь, и включает группы с неразветвленной цепью и разветвленной цепью, которые могут быть необязательно замещенными. Предпочтительные алкинильные группы содержат от двух до восемнадцати атомов углерода. Более предпочтительные алкинильные группы содержат от двух до двенадцати атомов углерода. Наиболее предпочтительные алкинильные группы содержат от двух до семи атомов углерода. Подходящие алкинильные группы представлены этинилом, пропинилом, бутинилом, пентинилом и т.п., которые могут быть необязательно замещены циано-, ацетокси-, гало-, гидрокси- или кетогруппой.
Термин "алкокси" означает эфир-О-алкил, где алкил определен выше.
Термин "арилокси" означает эфир-О-арил, где арил, как определено ниже.
Термин "арил" означает ароматические группы, которые содержат по меньшей мере один цикл с конъюгированной пи-электронной системой и включает карбоциклический арил и биарил, оба из которых могут быть необязательно замещены. Предпочтительные арильные группы содержат 6-10 атомов углерода. Подходящие арилы представлены фенилом и нафтилом.
Термин "карбоциклический арил" означает группы, в которых атомами ароматического цикла являются атомы углерода. Карбоциклические арильные группы включают фенильные и нафтильные группы, которые могут быть необязательно замещены. Замещенный фенил предпочтительно содержит от одного до трех, четырех или пяти заместителей, преимущественно представленных низшим алкилом, аминогруппой, аминокарбонилом, цианогруппой, карбоксилированным эфиром, гидроксилом, низшим алкоксилом, галогеном, низшим ацилом и нитрогруппой.
Термин "арилалкил" означает алкильную группу, замещенную арильной группой. Подходящие арилалкильные группы представлены бензилом и подобными группами и могут быть необязательно замещены.
Термин "алканоилокси-группа" означает -O-C(O)Ra, где Ra - алкил, алкенил, алкинил или арил-алкил.
Термин "карбалкокси-группа" означает -O-C(O)Rb, где Rb - алкил, алкенил, алкинил или арилалкил.
Термин "карбоксамидогруппа" означает -О-С(O)NRcRd, где Rc и Rd независимо выбраны из водорода, алкила, алкенила, алкинила, арила или арилалкила.
Термин "аминогруппа" означает -NRhRi, где Rh и Ri независимо представлены водородом или низшим алкилом или связанные вместе (с атомом азота, к которому они присоединены) образуют 5- или 6-членный цикл, например пирролидиновый, морфолиновый или пиперидиновый циклы. Термин "диалкиламиногруппа" означает NReRf, где Re и Rf независимо представлены низшими алкильными группами, или вместе с атомом азота, к которому они присоединены, образуют остаток морфолиновой группы. Подходящие диалкиламиногруппы представлены диметиламино-, диэтиламино- и морфолиновой группами.
Термин "тиогруппа" означает -SRm, где Rm - водород, алкил, алкенил, алкинил или арил(низший)алкил.
Термин "сульфинил" означает -SORn, где Rn - алкил, алкенил, алкинил или арил(низший)алкил.
Термин "сульфонил" означает -SO2Ro, где Ro - водород, алкил, алкенил, алкинил или арил(низший)алкил.
Термин "сульфонамидогруппа" означает -SO2NRkRl , где Rk и Rl - независимо водород или низший алкил.
Термин "необязательно замещенный" или "замещенный", если специально не указано иное, здесь означает группы, замещенные одним - пятью заместителями, независимо выбранными из низшего алкила (нециклического или циклического), арила (карбоарила или гетероарила), алкенила, алкинила, алкоксила, галогена, галогеналкила (включая тригалогеналкил, например трифторметил), амино-, меркапто-, алкилтио-, алкилсульфинил-, алкилсульфонил-, нитрогруппы, алканоила, алканоилоксигруппы, алканоилоксиалканоила, алкоксикарбоксила, карбалкоксигруппы (-COORj, где Rj - низший алкил), карбоксамидогруппы (-CONRkRl, где Rk и Rl обозначены выше), формила, карбоксила, гидроксила, цианогруппы, азидо- и кетогруппы и ее циклических кеталей, алканоиламидогруппы, гетероарилоксигруппы, гетерокарбоциклилоксигруппы и солей эфира гемисукцината.
Термин "низший", как обозначено здесь в отношении органических радикалов или соединений, означает таковые, содержащие до десяти включительно, предпочтительно до шести включительно и преимущественно до четырех атомов углерода. Такие группы могут иметь неразветвленную цепь, разветвленную цепь или быть циклическими.
Термин "гетероциклический" означает углерод, содержащий радикалы с трех-, четырех-, пяти-, шести- или семичленными циклами и один или два гетероатома О, N или S, например тиазолидин, тетрагидрофуран, 1,4-диоксан, 1,3,5-триоксан, пирролидин, пиперидин, хинуклидин, дитиан, тетрагидропиран, ε-капролактон, ε-капролактам, ω-тиокапролактам и морфолин.
Термин "гетероалкил" означает углерод, содержащий 5-14-членные циклические ненасыщенные радикалы, содержащие один, два, три или четыре атома О, N или S и имеющие 6, 10 или 14 π-электронов, делокализованных в одном или более циклов, например пиридин, оксазол, индол, пурин, пиримидин, имидазол, бензимидазол, индазол, 2H-1,2,4-триазол, 1,2,3-триазол, 2Н-1,2,3,4-тетразол, 1Н-1,2,3,4-тетразол, бензотриазол, 1,2,3-триазоло[4,5-β] пиридин, тиазол, изоксазол, пиразол, хинолин, цитозин, тимин, урацил, аденин, гуанин, пиразин, пиколиновая кислота, пиколин, фуроевая кислота, фурфураль, фуриловый спирт, карбазол, 9Н-пиридо[3, 4-β]индол, изохинолин, пиррол, тиофен, фуран, 9(10Н)-акридон, феноксазин и фенотиазин, каждый из которых может быть необязательно замещенным, как обсуждалось выше.
Термин "четвертичная соль аммония" означает четвертичные соли аммония аминосоединений и гетероарильных соединений, описанных выше, которые образуются при реакции аминосоединения или гетероарильного соединения с электрофильным реагентом, таким как алкил, алкенил, алкинил, циклоалкилалкил, арил-алкил или арил-алкинил, галогенид, тозилат, сульфат, мезилат или подобными им. Специфические примеры электрофильных реагентов включают метилиодид, этилиодид, н-бутилиодид и фенетилиодид.
Термин "ЭДА" означает этилендиамин.
Термин "фармацевтически приемлемые эфиры или соли" означает эфир или соли формулы I, полученные при сочетании комбинации соединения, представленного в данном изобретении, и органической или неорганической кислоты или основания. Основные соли получают смешиванием раствора определенного соединения, представленного в данном изобретении, с раствором фармацевтически приемлемого нетоксичного основания, такого как гидроксил натрия, гидроксид калия, бикарбонат натрия, карбонат натрия или аминосоединения, такого как гидроксид холина, Трис, бис-Трис, N-метилглюкамин, аргинин и им подобные. Кислые соли получают смешиванием раствора определенного соединения, представленного в данном изобретении, с раствором фармацевтически приемлемой нетоксичной органической кислоты или дикарбоновой кислоты, такой как уксусная, пропионовая, малеиновая, фумаровая, аскорбиновая, пимелиновая, янтарная, глутаровая, бисметиленсалициловая, метансульфоновая, этандисульфоновая, щавелевая, винная, салициловая, лимонная, глюконовая, итаконовая, гликолевая, п-аминобензойная, аспарагиновая, глутамовая, γ-аминомасляная, α -(2-гидроксиэтиламино)пропионовая, глицин и другие γ-аминокислоты, фосфорная, серная, глюкуроновая и 1-метил-1,4-дигидроникотиновая. Эфиры получают из стероидныхспиртов и соответствующим образом активированных кислот. Эфиры обсуждаются ниже.
Термин "дикарбоновые кислоты" означает С1-5 алкиленовые группы, замещенные двумя карбоксилами, например, малоновая кислота, янтарная кислота, глутаровая кислота, адипиновая кислота, пимелиновая кислота и субериновая кислота. Геми-эфирные соли дикарбоновых кислот включают их соли натрия, лития, калия, магния и кальция.
В соответствии с данным изобретением кетали включают диэфиры низших алканолов, например диметил- и диэтилкетали, а также циклические кетали, которые представлены диэфирами С1-3 алкандиолов, которые могут быть необязательно замещены, например этиленкетали и пропиленкетали.
Вариант осуществления изобретения 1а.
В своем самом
широком аспекте настоящее изобретение относится к стероидным производным основной формулы I

где R - водород, амино-, тио-группа, сульфинил, сульфонил, галоген, низший алкоксил, алкил, замещенный алкил, алкенил, алкинил или замещенный алкинил;
R1 - водород, алкил, алкенил, алкинил, галоген-алкил, дигалоген-алкил, тригалоген-алкил, необязательно замещенный арил-алкинил, алкоксиалкил, аминоалкил, циано-группа, цианоалкил, тиоцианоалкил, азидоалкил, необязательно замещенный арилалкил, арилалкенил, необязательно замещенный арил, необязательно замещенный арилалкилалкинил, алканоилоксиалкинил, необязательно замещенный гетероарилоксиалкинил, оксоалкинил или их кеталь, цианоалкинил, необязательно замещенный гетероарилалкинил, гидроксиалкинил, алкоксиалкинил, аминоалкинил, ациламиноалкинил, меркаптоалкинил, гемиэфир гидроксиалкинилдиоевой дикарбоновой кислоты или его соль или алкинилоксиалкинил;
R2 - водород, гидроксил, алкоксил, алканоилокси-группа, карбалкокси-группа, кетогруппа или аминогруппа;
R3 - водород, алкокси-, замещенный алкокси-, алкенилокси-группа, аминокарбонил, моноалкиламинокарбонил, диалкиламинокарбонил, сульфинил, сульфонил, тиогруппа, сульфонамидо-группа, алкинилокси-группа, необязательно замещенный арилоксил, необязательно замещенный арилалкилоксил, необязательно замещенный 1,3-диоксолан-4-он ацетильной группы, необязательно замещенный 1,3-диоксан-4-он ацетильной группы, необязательно замещенный 1,3-оксатиолан-5-он ацетильной группы, необязательно замещенный 1,3-оксатиоан-5-он ацетильной группы, -О-С(О)-NR'R'', -C(O)-CH2-Y-G, -C(O)-CH2-O-D, -C(O)-CH2-O-E, -C(O)-CH2-Z-G, -C(O)-CH2-Y'-Z-G, -C(O)-CH2-Y'-Z-A, где
R' и R'' независимо представлены водородом или необязательно замещенным алкилом, или вместе с азотом, к которому они присоединены, образуют 3-6-членное гетероциклическое кольцо;
Y - S, SO или SO2;
Y' - O, S, SO или SO2;
Z - алкил, алкенил или алкинил;
G - гетероарил, присоединенный к атому углерода, необязательно замещенный арил, соль четвертичного аммония азотсодержащей гетероарильной группы или четвертичная соль амино-замещенной арильной группы;
D - гетероарил, присоединенный к атому углерода, или соль четвертичного аммония азотсодержащей гетероарильной группы;
Е - необязательно замещенный арил или соль четвертичного аммония аминозамещенной арильной группы;
А - амино-, амидо-, циано-, тиоциано-, азидо-, нитрогруппа, гидроксил, галоген, карбоксил, алкоксигруппа, алкоксикарбонил, алканоилокси-группа, водород, сульфат, тиосульфат, сульфонат, алкилтиогруппа, алкилсульфинил-, алкилсульфонил или меркаптогруппа;
R4 - водород или низший алкил;
R5 - водород или, если двойная связь присутствует между С4 и С5 стероидной циклической системы, R5 отсутствует;
R6 - водород, алканоил, аминокарбонил или алкоксикарбонил;
R7 - водород, галоген, гидроксил, алкокси-, алканоилокси- или карбалкоксигруппа;
R8 - водород или галоген;
R9 - водород, галоген, алкил, алкокси-, арилалкокси- или аминогруппа;
R10 - водород, галоген, алкил, галогеналкил, гидроксил, алкокси-, алканоилокси-, карбалкокси-, циано-, тиоциано- или меркаптогруппа; и пунктирные линии обозначают, что может присутствовать простая или двойная связь;
при условии, что:
когда R3 - С1-3 алкоксигруппа или С1-6 алкенилоксигруппа и R - водород или α-метил, то R1 - заместитель, отличный от водорода; или
когда R3 - С1-4алкокси(С1-4 )алкоксигруппа, то R1 - заместитель, отличный от водорода или 1-пропинила; или
когда R3 - водород и R2 - водород, гидроксил, кетогруппа или аминогруппа, то R1 не является водородом, алкилом или цианоалкилом; или
когда R3 - аминокарбонил, моноалкиламинокарбонил, диалкиламинокарбонил, то R1 не является водородом или алкилом; или
когда R3 - -C(O)-CH2-Y-G и G - гетероарил, присоединенный к атому углерода, или необязательно замещенный арил, то R1 отличен от водорода или алкила; или
когда R3 - -С(O)-СН2-O-Е и Е необязательно замещенный арил, то R1 отличен от водорода; или
когда R3 - -C(O)-CH2 -Y'-Z-G и Y' - O, и G - арил, то R1 отличен от водорода; или
когда R3 - -C(O)-CH2-Y'-Z-G и Y' - S, SO или SO2 и G - арил, то R1 отличен от водорода или алкила; или
когда R3 - -C(O)-CH2-Z-G, то R1 отличен от водорода; или
когда R3 - -C(O)-CH2-Y'-Z-A и Y' - О и А - водород, галоген, карбоксил, алкоксикарбонил, алкокси-, циано- или аминогруппа, то R1 отличен от водорода; или
когда R3 - -C(O)-CH2-Y'-Z-A и Y' - S, SO или SO2 и А - водород, галоген, карбоксил, алкоксикарбонил, или аминогруппа, тогда R1 отличен от водорода или алкила.
Настоящее изобретение также включает фармацевтически приемлемые сложные эфиры и соли соединений формулы I, включая соли кислот. Полагают, что 3α-гидроксил также может быть защищен в виде фармацевтически приемлемого сложного эфира вследствие того, что эфир будет отщепляться, по мере превращения пролекарства в лекарственную форму. Здесь они обозначаются как расщепляемые эфиры.
Вариант осуществления изобретения 1b.
Одна группа полезных соединений, охватываемая широким аспектом настоящего изобретения, содержит соединения
формулы I, где:
связь между С4 и С5 стероидной циклической
системы является простой связью;
R - водород, галоген, низшая алкоксигруппа, алкил, замещенный алкил, алкинил или
замещенный алкинил;
R1, R2, R4,
R6, R7, R8, R9 и R10, как определено выше;
R3
- водород, алкокси-, замещенная алкокси-, алкенилокси-, алкинилокси-,
необязательно замещенная арилокси-, необязательно замещенная арилалкилоксигруппа, -O-C(O)-NR'R'', -C(O)-CH2-Y-G,
-C(O)-CH2-O-D -C(O)-CH2-O-E, -C(O)-CH2
-Y'-Z-G или -C(O)-CH2-Y'-Z-A, где
R' и R'' независимо представляют водород или необязательно замещенный алкил,
или вместе с азотом, к которому они присоединены, образуют 5- или
6-членное гетероциклическое кольцо;
Y, Y', Z, G, D, E и А, как определено выше;
R5 - водород; и где
все относящиеся к делу условия, которые описаны выше для
Варианта 1а, применимы к этому виду соединений.
Варианты осуществления изобретения 1а' и 1b'.
В
предпочтительных аспектах Вариантов 1а и 1b стероидные производные
имеют основную формулу I, где R, R1, R2, R3, R', R'', Y, Y', Z, G, D, E, A, R4, R5, R6, R7, R8, R9 и
R10 определены выше для Вариантов 1а или 1b. Однако следующие условия применяются для каждого из более ранних
вариантов:
когда R3 - С1-6 алкокси- или С1-6 алкенилоксигруппа, то R1 отличен от водорода или метила; или
когда R3 - водород и
R2 - водород, гидроксил, кето- или аминогруппа, то R1
не является водородом, алкилом или цианоалкилом; или
когда R3 - -C(O)-CH2-Y-G и G
- гетероарил, присоединенный к атому углерода, или необязательно замещенный арил, то
R1 - заместитель, отличный от водорода или алкила; или
когда R3 - -C(O)-CH2-Z-G, то R1 отличен от водорода или алкила; или
когда R3 - -C(O)-CH2-O-Е и Е - необязательно замещенный арил, то R1 отличный от водорода или
метила; или
когда R3 - -C(O)-CH2-Y'-Z-G и G
- необязательно замещенный арил, то R1 - заместитель, отличный от водорода или алкила; или
когда R3 - -C(O)-CH2-Y'-Z-A и Y' - О и А - водород, галоген,
карбоксил, алкоксикарбонил, алкокси-, циано- или аминогруппа, то R1 - заместитель, отличный от водорода или алкила.
Предпочтительные значения для всех вариантов
осуществления изобретения
Каждая из следующих групп предпочтительных значений относится ко всем вариантам настоящего изобретения,
если специально не оговорено иное. Предпочтительные
соединения формулы I представляют собой соединения, в которых R является водородом или низшим алкоксилом, где водород более предпочтителен; R3, как определен выше и предпочтительно
является одной из нижеописанных групп; R5, R6, R7, R8, R9 и R10 являются водородом; и
R1 является замещенным арилалкинилом,
например, R1 - это 4-замещенный фенилалкинил, такой как 4-ацетилфенилэтинил, 4-метоксифенилэтинил, 4-N, N-диметиламинофенилэтинил,
4-цианофенилэтинил, этиловый эфир 4-карбоксифенилэтинила,
4-N,N-диалкиламидофенилэтинил, или где R1 - оксоалкинил, гидроксиалкинил, ацетоксиалкинил, цианоалкинил или алкоксиалкинил.
Другими предпочтительными соединениями являются соединения формулы I, в которых R - водород, галоген, низший алкоксил, алкинил или замещенный алкинил; R1 - замещенный арилэтинил; R2 - водород, кетогруппа или диметиламиногруппа; R4 - водород или метил; каждый из R5, R6, R7, R8, R9 и R10 является водородом и все пунктирные линии представляют простые связи.
Дальнейшими предпочтительными соединениями являются соединения формулы I, представляющие собой сложные эфиры гидроксильных групп в положении 3. Предпочтительные сложные эфиры - это те, которые получены из их соответствующих кислот и дикарбоновых кислот: уксусной, пропионовой, малеиновой, фумаровой, аскорбиновой, пимелиновой, янтарной, глутаровой, бисметиленсалициловой, метансульфоновой, этандисульфоновой, щавелевой, винной, салициловой, лимонной, глюконовой, итаконовой, гликолевой, пара-аминобензойной, аспарагиновой, глутаминовой, гамма-аминомасляной, α-(2-гидроксиэтиламино)пропионовой, глицина и других α-аминокислот, фосфорной, серной, глюкуроновой и 1-метил-1, 4-дигидроникотиновой.
17-эфирные производные 3α-гидроксиандростанов.
Первый подрод соединений, согласно настоящему изобретению, содержит 17-эфирные производные
3α-гидроксиандростанов. Стероидные
производные согласно этому аспекту настоящего изобретения содержат соединения, имеющие структурную формулу I, как показано выше, где
R, R1,
R2, R4, R5, R6, R7, R8, R9 и R10, как определено выше для Варианта 1а; и
R3 - алкокси-,
замещенная алкокси-, алкенилокси-,
алкинилокси-, необязательно замещенная арилокси-, необязательно замещенный арилалкилокси-группа или -OC(O)NR'R'', где
R' и R'' независимо представлены
водородом, необязательно замещенным
алкилом или вместе образуют 5- или 6-членное гетероциклическое кольцо;
при условии, что:
когда R3 - С1-6 алкокси- или C1-6 алкенилокси-группа и R
- водород или α-метил, то R1 отличен от водорода; и
когда R3 - С1-4алкокси(С1-4)алкокси-группа, то R1 отличен от водорода
или 1-пропинила.
Предпочтительные значения согласно этому аспекту настоящего изобретения включают те значения, которые обозначены выше, как
основные предпочительные, и также
следующие:
R3 - алкоксигруппа, такая как метокси-, этокси- или пропокси- или замещенная алкоксигруппа, такая как -OCH2CH2OH,
-OCH2C≡CH или
-OCH2C≡C-PhCOMe;
R4 - водород или низший алкил, более предпочтительно водород или метил;
R5, R6,
R7, R8,
R9 и R10 - каждый предпочтительно водород; и
все пунктирные линии представляют простые связи.
Предпочтительные вещества
согласно этому аспекту
настоящего изобретения представляют собой: 3α-гидрокси-3β-фенилэтинил-17β-метокси-5β-андростан; 3α-гидрокси-3β-фенилэтинил-17β
-метокси-5α
-андростан; 3α-гидрокси-3β-(3', 4'-диметоксифенил)этинил-17β-метокси-5β-андростан; 3α-гидрокси-3β(4'-метилфенил)этинил-17β
-метокси-5β-андростан;
3α-гидрокси-3β(2'-метоксифенил)этинил-17β-метокси-5β-андростан; этиловый эфир 3α-гидрокси-3β(4'-карбоксифенил)этинил-17β
-метокси-5β-андростана;
3α-гидрокси-3β(4'-ацетоксиацетилфенил))этинил-17β-метокси-5β-андростан; 3β(4'-ацетилфенил)этинил-3α-гидрокси-17β
-метокси-5α-андростан;
3β(4'-ацетилфенил)этинил-3α-гидрокси-17β-метокси-5β-андростан; 3β(4'-диметиламинофенил)этинил-3α-гидрокси-17β
-метокси-5β-андростан; 3β
(4'-бифенил)этинил-3α-гидрокси-17β-метокси-5β-андростан; 3α-гидрокси-3β-(4'-нитрофенил)этинил-17β-метокси-5β
-андростан;
3α
-гидрокси-3β-(4'-
метоксифенил)этинил-17β-метокси-5β-андростан; 3β(4'-трифторметилфенил)этинил-3α-гидрокси-17β
-метокси-5β-андростан; 3β
(4'-хлорфенил)этинил-3α-гидрокси-17β-метокси-5β-андростан; 3β(4'-цианофенил)этинил-3α-гидрокси-17β-метокси-5β
-андростан;3β
(4'(R/S)-гидроксипентинил)-3α-гидрокси-17β-метокси-5β-андростан; 3α-гидрокси-3β-фенил-17β-метокси-5β-андростан; 3α
-гидрокси-3β
-бензил-17β-метокси-5β-андростан;3α-гидрокси-3β-(2'-фенилэтил)-17β-метокси-5β-андростан; 3α-гидрокси-3β-[2-(3',
4'-диметоксифенил)этил]-17β-метокси-5β-андростан; 3α-гидрокси-3β-[6'-оксо-1'-гептинил]-17β-метокси-5β-андростан;
3α-гидрокси-3β
-(7'-оксо-1'-октинил)-17β-метокси-5β-андростан; 3α-гидрокси-3β-(4'-оксо-1'-пентинил)-17β-метокси-5β-андростан; 3β-[5'-(R/S)-гидроксигексинил]
-3α
-гидрокси-17β-метокси-5β-андростан; 3β-(4'-гидроксибутинил)-3α-гидрокси-17β-метокси-5β-андростан; 3β-(4'-гидроксибутинил)-3α
-гидрокси-17β
-метокси-5β-андростан; 3β-(4'-ацетоксифенилэтинил)-3α-гидрокси-17β-метокси-5β-андростан; 3β-(4'-ацетилфенилэтинил)-3α
-гидрокси-19-нор-17β
-метокси-5β-андростан; этиловый эфир 3β-(4'-карбоксифенилэтинил)-3α-гидрокси-19-нор-17β-метокси-5β-андростана; этиловый эфир 3β
-(4'-карбоксифенилэтинил)-3α-гидрокси-17β-метокси-5α-андростана; 3β-[4'-(N,N-диэтилкарбоксамидо)фенил] этинил-3α-гидрокси-17β-метокси-5β-андростан;
3α-гидрокси-3β-[5-оксо-1-гексинил] -17β-метокси-5β-андростан; 3α-гидрокси-3β-[5'-оксо-1'-гексинил]-17β-метокси-5β-андростанциклический 5'-(1,
2-этандиил ацеталь); 3β-(5-циано-1-пентинил)-3α-гидрокси-17β-метокси-5β-андростан; 3α-гидрокси-3β-(2-пиридил)этинил-17β-метокси-5β-андростан;
3β-(6-гидрокси-1-гексинил)-3α-гидрокси-17β-метокси-5β-андростан; натриевую
соль6'-гемисукцината3β-(6'-гидрокси-1'-гексинил)-3α-гидрокси-17β
-метокси-5β-андростана; 3β-(5'-гидрокси-1'-пентинил)-3α-гидрокси-17β-метокси-5β-андростан; натриевую соль 5'-гемисукцината 3β
-(5'-гидрокси-1'-пентинил)-3α-гидрокси-17β-метокси-5β-андростана; натриевую соль 4'-гемисукцината 3β-(4'-гидрокси-1'-бутинил)-3α-гидрокси-17β
-метокси-5β
-андростана; 3β-(4'-циано-1'-бутинил)-3α-гидрокси-17β-метокси-5β-андростан; 3β-(5'-ацетокси-1'-пентинил)-3α-гидрокси-17β
-метокси-5β-андростан;
3β-(4'-ацетокси-1'-бутинил)-3α-гидрокси-17β7-метокси-5β-андростан; 3β-(4'-ацетокси-1'-бутинил)-3α-гидрокси-17β
-метокси-5α-андростан; 3β
-(6'-ацетокси-1'-гексинил)-3α-гидpoкcи-17β-мeтoкcи-5β-aндpocтaн; 3α-гидpoкcи-3β-[3-(2'-пpoпинилoкcи)-1-пропинил] -17β
-метокси-5β-андростан; 3α
-гидрокси-3β-(3-метокси-1-пропинил] -17β-метокси-5β-андростан; 3α-гидрокси-3β-(3-метокси-1-пропинил]-17β
-метокси-5α-андростан; 3α
-гидрокси-3β-[3-(4'-пиридинилокси)-1-пропинил] -17β-метокси-5β-андростан; 3α-гидрокси-3β-[3-(1'Н-1,2,
3-триазол-1'-ил)-1-пропинил] -17β-метокси-5β
-андростан; 3α-гидрокси-3β-[3-(2'Н-1,2,3-триазол-2'-ил)-1-пропинил]-17β-метокси-5β-андростан; 3α
-гидрокси-3β-(2'-тиенил)этинил-17β-метокси-5β
-андростан; 3α-гидpoкcи-3β-(3'-фeнил-1'-пропинил)-17β-метокси-5β-андростан; 3α-гидрокси-3β
-(3'-фенилпропил)-17β-метокси-5β-андростан;
3α-гидрокси-3β-[3-(1'Н-пиразол-1'-ил)-1-пропинил]-17β-метокси-5β-андростан;
3β
-(3'-ацетилфенилэтинил)-3α-гидрокси-17β-метокси-5β
-андростан и 3β-(3'-ацетокси-3'-пропинил)-3α-гидрокси-17β-метокси-5β-андростан.
Более предпочтительные нейроактивные стероиды согласно данному аспекту
настоящего изобретения представляют собой 3β-(4'-
ацетилфенил)этинил-3α-гидрокси-17β
-метокси-5α-андростан; этиловый эфир 3β
-(4'-карбоксилфенил)этинил-3α-гидрокси-17β-метокси-5α-андростана; 3β-(4'-ацетилфенил)этинил-3α
-гидрокси-17β-метокси-5β-андростан; этиловый эфир
3β-(4'-карбоксилфенил)этинил-3α-гидрокси-17β-метокси-5β-андростана; 3β
-(4'-ацетилфенил)этинил-3α-гидрокси-17β-метокси-5β-19-норандростан;
этиловый эфир 3β-(4'-карбоксилфенил)этинил-3α-гидрокси-17β-метокси-5β
-19-норандростана;
3β-(4'-диметиламинофенил)этинил-17β-метокси-5β
-андростан; 3β-(4'-бифенил)этинил-3α-гидрокси-17β-метокси-5β-андростан;
3α-гидрокси-3β-(4'-метоксифенил)этинил-17β-метокси-5β-андростан;
3β-(4'-трифторметилфенил)этинил-3α-гидрокси-17β-метокси-5β-андростан; 3β
-(4'-хлорфенил)этинил-3α-гидрокси-17β-метокси-5β-андростан; 3β
-[4'(R/S)-гидроксипентинил] -3α-гидрокси-17β-метокси-5β-андростан; 3β
-(4'-гидроксибутинил)-3α-гидрокси-17β-метокси-5β-андростан; 3β
-(4'-гидроксибутинил)-3α-гидрокси-17β-метокси-5α-андростан и 3α-гидрокси-3β
-[3-(2'Н-1,2,3-триазол-2'-ил)-1-пропинил] -17β-метокси-5β-андростан.
Особенно предпочтительные нейроактивные стероиды по этому аспекту настоящего изобретения представляют
собой 3β-(4'-ацетилфенил)этинил-3α-гидрокси-17β-метокси-5α
-андростан; 3β-(4'-ацетилфенил)этинил-3α-гидрокси-17β-метокси-5β-андростан; этиловый
эфир 3β-(4'-карбоксилфенил)этинил-3α-гидрокси-17β-метокси-5α
-андростана; этиловый эфир 3β-(4'-карбоксифенил)этинил-3α-гидрокси-17β-метокси-5β
-андростана; 3β-(4'-диметиламинофенил)этинил-17β-метокси-5β-андростан;
3β-(4'-бифенил)этинил-3α-гидрокси-17β-метокси-5β-андростан; 3β
-(4'-гидроксибутинил)-3α-гидрокси-17β-метокси-5β-андростан;
3β
-(4'-
гидроксибутинил)-3α-гидрокси-17β-метокси-5α-андростан;3α
-гидрокси-3β-[3-(2'Н-1,2,3-триазол-2'-ил)-1-пропинил] -17β-метокси-5β-андростан;
3β-(4'-ацетилфенил)этинил-3α-гидрокси-17β-метокси-5β-19-норандростан
и 3β-[4'(R/S)-гидроксипентинил]-3α-гидрокси-17β-метокси-5β-андростан.
Производные 3α-гидроксиандростана
Второй предпочтительный подрод
веществ согласно настоящему изобретению содержит 3α-гидрокси-производные андростана, которые не
замещены в положении 17β стероидной циклической системы, то есть R3
представляет собой водород. Стероидные производные согласно этому аспекту настоящего изобретения содержат таковые,
имеющие структурную Формулу I, как показано выше, где
R3
- водород; и R, R1, R2, R4, R5, R6, R7, R8,
R9 и R10, как определено выше для Варианта 1а;
при условии, что:
R1 не является водородом, алкилом или цианалкилом.
Предпочтительные значения для R, R1, R2, R4, R5, R6, R7, R8, R9 и R10 такие же, как указано выше для всех вариантов изобретения.
Производные 21-замещенного 3α
-гидроксипрегнана
Третья категория полезных соединений, согласно настоящему изобретению, содержит производные 3α
-гидроксипрегнана, которые содержат 21-эфирный или 21-тиоэфирный, или
21-алкильный, 21-алкенильный или 21-алкинильный заместители. Соединения, которые могут применяться согласно этому аспекту
настоящего изобретения, содержат таковые, имеющие структурную Формулу I,
представленную выше, где
R, R1, R2, R4, R5, R6, R7,
R8, R9 и R10 определены выше для
Формулы I;
R3 - -C(O)-CH2-Y-G, -C(O)-CH2-O-D, -C(O)-CH2-O-E, -C(O)-CH2
-Y'-Z-G, -C(O)-CH2-Y'-Z-A;
Y - S, SO или
SO2;
Y' - S, SO или SO2;
Z - алкил, алкенил или алкинил;
G - гетероарил, присоединенный к
атому углерода, необязательно замещенный арил, соль
четвертичного аммония азотсодержащей гетероарильной группы или соль четвертичного аммония аминозамещенной арильной группы;
D - гетероарил,
присоединенный к атому углерода, или соль
четвертичного аммония азотсодержащей гетероарильной группы;
Е - необязательно замещенный арил или соль четвертичного аммония аминозамещенной арильной
группы;
А - амино-, амидо-,
циано-, тиоциано-, азидо-, нитрогруппа, галоген, карбоксил, алкоксигруппа, алкоксикарбонил, алканоилоксигруппа, водород, сульфат, тиосульфат, сульфонат,
алкилтиогруппа, алкилсульфинил, алкилсульфонил
или меркаптогруппа;
при условии, что
когда R3 - -C(O)-CH2-Y-G, и G - гетероарил, присоединенный к атому углерода,
или необязательно замещенный арил, то R1 отличен от водорода или алкила; или
когда R3 - -С(O)-СН2-O-Е, то R1 отличен от водорода; или
когда R3 - -C(O)-CH2
-Y'-Z-G, и Y ' - О, и G - арил, то R1 отличен от водорода; или
когда R3 - -C(O)-CH2-Y'-Z-G, и Y' - S, SO или SO2, и G - арил, то R1
отличен от водорода или алкила; или
когда R3 - -C(O)-CH2-Y'-Z-A, и Y'-О, и А - водород, галоген, карбоксил, алкоксикарбонил,
алкокси-, циано- или аминогруппа, то R1 отличен от водорода; или
когда R3 - -C(O)-CH2-Y'-Z-A, и Y' - S, SO или SO2, и А - водород, галоген,
карбоксил, алкоксикарбонил или аминогруппа, то
R1 отличен от водорода или алкила.
Альтернативно R3 может также быть -C(O)-CH2-Z-G, где Z и G определены выше, при условии, что, когда R3 - -C(O)-CH2-Z-G, то R1 отличен от водорода.
Когда D или G - гетероарил, присоединенный к атому углерода, гетероарильная структура предпочтительно представляет собой пиридил, пиримидинил, пиразинил, имидазолил, триазолил, тетразолил, хинолинил, индолил, бензимидазолил и изохинолинил.
Когда Е или G - замещенный арил, предпочтительные группы представляют собой фенил, замещенный одной, двумя или тремя, наиболее предпочтительно одной, нитро-, амино-, диметиламиногруппой, карбоксилом, метилом, гидроксилом, метокси группой, фтором, хлором, бромом, цианогруппой или пирролидинилом.
Примеры подходящих значений заместителей, которые могут применяться в положении R3 в этом аспекте изобретения, представляют собой
-COCH2S-(4-PhNH2), -СОСН2О-(4-РhN+Ме3)l-, -СОСН2О-4-пиридил,
-СОСН2О-3-пиридил, -СОСН2
S-(4-пиридил)-N-метилиодид, -СОСН2SСН2СН2ОН, -COCH2OCH2CH2OH, -COCH2SCH2CH2CH2OH,
-СОСН2SОСН2СН2СН2ОН, -COCH2SO2CH2CH2CH2OH,
-COCH2SCH2COO-
Na+, -COCH2SCH2CH2COO-Na+, -COCH2
SCH2CH2OSO3-TMA+ (TMA
- аббревиатура триметиламмония), -COCH2SCH2CH2CH2OSO3-Na+, -COCH2
SCH2CH2SO3-Na+, -COCH2SCH2CH2CH2SO3-Na+, -COCH2SO2CH2
CH2CH2SO3-Na+ и -COCH2OCH2CH2CH2SO3-Na+.
Дополнительные пригодные значения представляют собой -COCH2S-(4-фторфенил), -СОСН2O-(6-хинолинил), -СОCH2SО2 -(4-фторфенил), -COCH2 SO2-(4-пирролидинфенил), -СОСН2СН2-(4-пиридил), -СОСН2O-(4-нитрофенил), -СОСН2O-(4-диметиламинофенил), -СОСН2SO-(4-нитрофенил) и -COCH2SO2-(4-нитрофенил).
Предпочтительные соединения согласно этому аспекту настоящего изобретения представляют собой: 3α
-гидрокси-3β
-(4-гидроксибутинил)-21-(пирид-4-илтио)-5β-прегнан-20-он; 3α-гидрокси-21-(пирид-4-илокси)-5β-прегнан-20-он; натриевую соль 3α-гидрокси-2β
-пропокси-21-тиопропансульфонат-5α'-прегнан-20-она; 3β-этинил-3α-гидрокси-21-(3'-гидроксипропилтио)-5β-прегнан-20-он; натриевую соль 3β-этинил-3α
-гидрокси-21-(тиопропансульфат)-5β-прегнан-20-она; 3α-гидрокси-2β-пропокси-21-(пирид-4-илтио)-5α-прегнан-20-он-N-метилиодид; 3α
-гидрокси-21-(2'-гидроксиэтилтио)-5β-прегнан-20-он; 3β-этинил-3α-гидрокси-21-(2'-гидроксиэтилтио)-5β-прегнан-20-он; 3α-гидрокси-21-(пирид-4-илтио)-5α
-прегнан-20-он-N-метилиодид; 3α-гидрокси-21-(пирид-4-илтио)-5β-прегнан-20-oн-N-метилиодид; триметиламмонийную соль 3β-этинил-3α-гидрокси-21-тиоэтансульфат-5β
-прегнан-20-она; 3α-гидрокси-3β-метоксиметил-21-(пирид-
4-илтио)-5α-прегнан-20-он; 21-(4'-аминофенилтио)-3α-гидрокси-3β-метоксиметил-5α
-прегнан-20-он;
21-(4'-диметиламинофенилтио)-3α-гидрокси-3β-метоксиметил-5α-прегнан-20-он; 3α-гидрокси-3β-метоксиметил-21-(4'-нитрофенилтио)-5α-прегнан-20-он;
3α
-гидрокси-3β-метоксиметил-21-(4'-нитрофенилсульфинил)-5α-прегнан-20-он; 3α-гидрокси-3β-метоксиметил-21-(4'-нитрофенилсульфонил)-5α-прегнан-20-он;
21-(4'-диметиламинофенокси)-3α-гидрокси-3β-метил-5α-прегнан-20-он; 3α-гидрокси-3β-метил-21-(4'-нитрофенокси)-5α-прегнан-20-он; иодид 3α
-гидрокси-3β-метил-21-(4'-триметиламмонийфенокси)-5α-прегнан-20-она; натриевую соль 3β-этинил-3α-гидрокси-21-тиопропансульфонат-5β-прегнан-20-она; 3β
-этинил-3α-гидрокси-21-(3'-гидроксипропилсульфонил))-5β-прегнан-20-он; 3α-гидрокси-21-(3'-гидроксипропилтио)-2β-пропокси-5α-прегнан-20-он; 3α
-гидрокси-21-(3'-гидроксипропилсульфонил)-2β-пропокси-5α-прегнан-20-он; натриевую соль 3α-гидрокси-2β-пропокси-21-сульфонилпропансульфат-5α-прегнан-20-она;
21-(4'-фторфенилтио)-3α-гидрокси-3β-метоксиметил-5α-прегнан-20-он; 3β-этинил-3α-гидрокси-21-(пирид-4-илтио)-5α-прегнан-20-он; 3β
-(4'-ацетилфенил)этинил-3α-гидрокси-21-(пирид-4-илтио)-5β-прегнан-20-он; иодид 3α-гидрокси-2β-пропокси-21-(4'-N,N, N-триметиламмонийфенокси)-5α-прегнан-20-она;
3α-гидрокси-3β-метил-21-(4'-хинолин-6-илокси)-5α-прегнан-20-он-N-метилиодид;3α-гидрокси-3β-метил-21-(4'-хинолин-6-илокси)-5α-прегнан-20-он;
21-(4'-фторфенил)сульфонил-3α-гидрокси-3β-метоксиметил-5α-прегнан-20-он и 3α-гидрокси-3β-метоксиметил-21-(4'-пирролидинфенил)сульфонил-5α-прегнан-20-он.
Более предпочтительные нейроактивные стероиды согласно данному
аспекту настоящего изобретения представляют собой 3α-гидрокси-3β
-(4'-гидроксибутинил)-21-(пирид-4-илтио)-5β-прегнан-20-он; 3α-гидрокси-21-(пирид-4-илокси)-5β-прегнан-20-он; натриевую соль 3α-гидрокси-2β
-пропокси-21- тиопропансульфонат- 5α-прегнан-20-она; 3β-этинил-3α-гидрокси-21-(3'-гидроксипропилтио)-5β-прегнан-20-он; 3α-гидрокси-3β
-метоксиметил-21-(пирид-4-илтио)-5α-прегнан-20-он; 3α-гидрокси-3β-метоксиметил-21-(4'-нитрофенилсульфинил)-5α-прегнан-20-он; 3α-гидрокси-3β
-метоксиметил-21-(4'-нитрофенилсульфонил)-5α-прегнан-20-он; 3α-гидрокси-3β-метил-21-(4'-нитрофенокси)-5α-прегнан-20-он;3α
-гидрокси-21-(3'-гидроксипропилтио)-2β
-пропокси-5α-прегнан-20-он;3α-гидрокси-21-(3'-гидроксипропилсульфонил)-2β-пропокси-5α-прегнан-20-он и натриевую соль 3α
-гидрокси-2β
-пропокси-21-сульфонилпропансульфат-5α-прегнан-20-она.
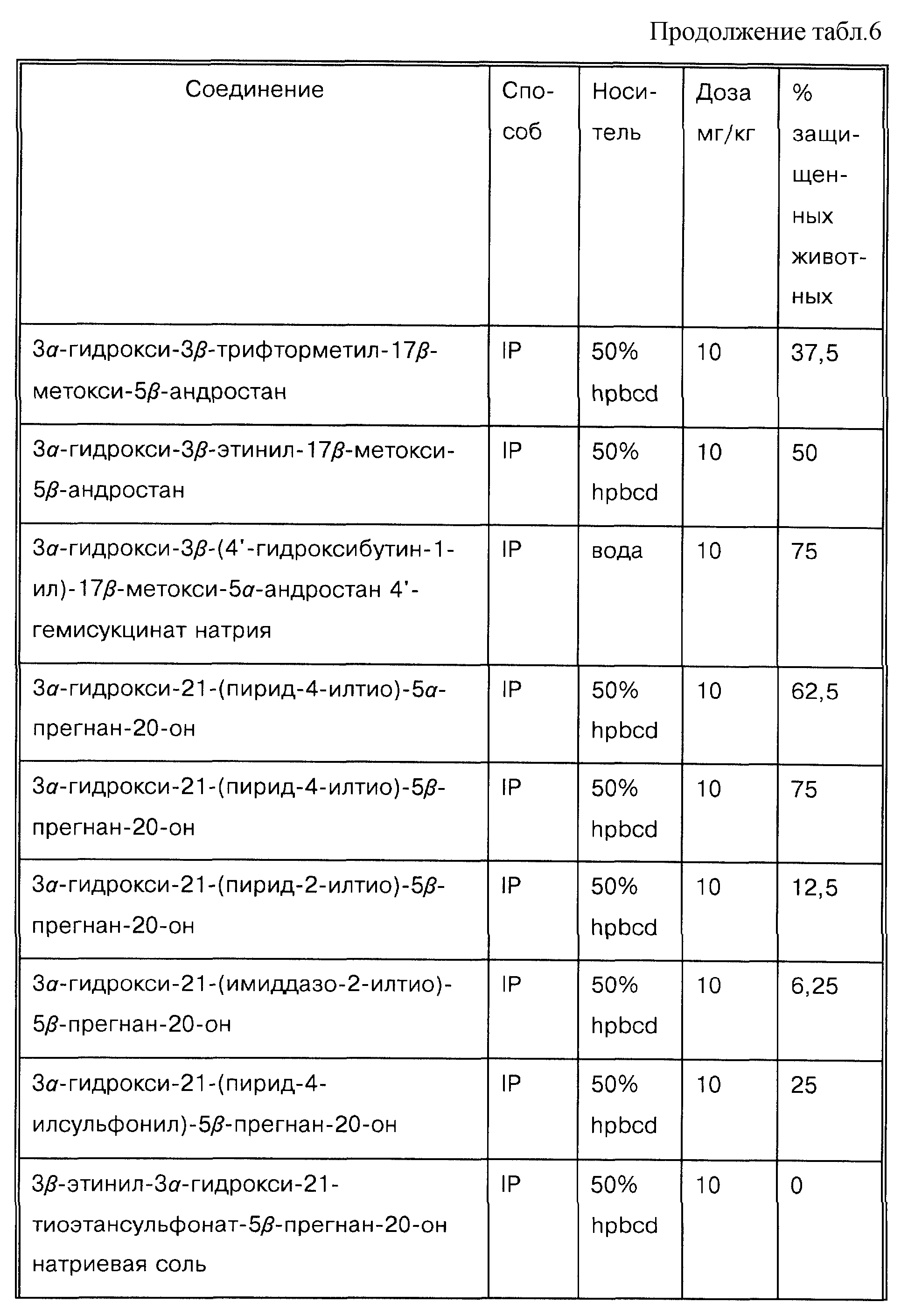
Особенно предпочтительные нейроактивные стероиды согласно этому аспекту данного изобретения представляют собой: 3α -гидрокси-3β-(4-гидроксибутинил)-21-(пирид-4-илтио)-5β-прегнан-20-он; 3α-гидрокси-3β-метоксиметил-21-(пирид-4-илтио)-5α-прегнан-20-он; 3α -гидрокси-21-(3'-гидроксипропилсульфонил)-2β-пропокси-5α-прегнан-20-они3α-гидрокси-21-(пирид-4-илокси)-5β-прегнан-20-он.
Диастереоизомеры
Для
специалиста очевидно, что описанные выше соединения могут присутствовать в виде смесей диастереоизомеров, которые могут быть разделены на индивидуальные диастереоизомеры. Разделение
диастереоизомеров
может быть осуществлено газовой или жидкостной хроматографией или выделением из естественных источников. Если специально не оговорено иное, в ссылках в описании и формуле
изобретения имеется в виду,
что соединения, представленные в изобретении, как обсуждалось выше, включают все изомеры, как разделенные, так и их смеси.
Когда изомеры разделены, желаемая фармакологическая активность часто будет преобладать в одном из диастереоизомеров. Как здесь указано, эти соединения показывают высокий уровень стереоспецифичности. В частности, те соединения, которые имеют наибольшее сродство к комплексу рецептора ГАМК, являются соединениями с стероидными скелетами 3β-замещенного-3α-гидроксипрегнана.
Способы
синтеза
Вещества согласно
изобретению могут быть получены любым подходящим способом, например, с использованием известных способов, таких как описано в Djerassi, Steroid reactions,
Holden-Day, Inc., San Francisco (1963), или
Fried and Edwards, Organic Reactions in Steroid Chemistry, Van Nostrand-Reinhold Co., New York (1972).
C17-эфиры, представленные в настоящем изобретении, получают из 17β -гидрокси-соединений способами, хорошо известными специалистам для получения эфиров из соответствующих спиртов. Большинство этих способов описано в Larock, Comprehensive Organic Transformations VCH Publishers, New York (1989). 17β-гидрокси-исходные материалы хорошо известны специалистам. Желательно защитить 3-кетогруппу путем предварительного образования кеталя. Кеталь затем может реагировать известными способами с образованием С17-эфира и при гидролизе кеталя получают 3-кето-17-эфирные соединения. Различные нуклеофилы могут быть добавлены к 3-ону этих соединений для получения 3β-замещенных-3α-гидрокси-С17-эфирных производных.
Другой способ получения С17-эфиров представляет собой реакцию С17-кеталей, полученных из соответствующих С17-онов, с литийалюминийгидридом и АlСl3, как описано Cross et al., Steroids 5:557 (1965).
Фенилэтинильные заместители могут быть получены путем катализированного палладием (Pd) связывания соответствующих этинильных производных с фенилиодидами или фенилбромидами в присутствии амина.
Все С21-бромиды, использованные в примерах в качестве исходных материалов, были приготовлены способом, используемым для получения α-бром-кетонов из метилкетонов. Этот способ хорошо известен специалистам.
Фармацевтическое применение
Соединения,
представленные в изобретении и использованные в нем, являясь нетоксичными, фармацевтически приемлемыми, природными и синтетическими,
непосредственно действующими и "пролекарственными" формами, имеют
неизвестную до настоящего времени активность в головном мозге в отношении комплекса рецептора ГАМКA. Настоящее изобретение
использует преимущество этого, ранее неизвестного, механизма и
активности.
Фармацевтические препараты, представленные в настоящем изобретении, получают в известных дозированных формах путем введения активного соединения, представленного в настоящем изобретении, или смеси таких веществ, в нетоксичный фармацевтический носитель, согласно принятым процедурам, в нетоксичном количестве, достаточном для получения желаемой фармакодинамической активности в объекте, животном или человеке. Предпочтительно композиция содержит активный ингредиент в активном, но нетоксичном количестве, выбранном из интервала от приблизительно 1 мг до приблизительно 500 мг активного ингредиента на унифицированную дозу. Это количество зависит от желаемой специфической биологической активности и состояния пациента.
Применяемый фармацевтический носитель может быть, например, либо твердым, жидким либо с замедленным выделением (см. Remington's Pharmaceutical Sciences, 14th Edition (1970)). Представителями твердых носителей являются лактоза, каолин, сахароза, тальк, желатин, агар, пектин, камедь, стеарат магния, стеариновая кислота, микрокристаллическая целлюлоза, полимерные гидрогели и т.п. Типичными жидкими носителями являются пропиленгликоль, гликофурол, водные растворы циклодекстринов, патока, арахисовое масло и оливковое масло и тому подобные эмульсии. Подобным образом, носитель или разбавитель может включать любой материал с замедленным выделением, известный из уровня техники, такой как моностеарат глицерина или дистеарат глицерина, один или с воском, микрокапсулами, микросферами, липосомами, и/или гидрогелями.
Может быть использован широкий круг фармацевтических форм. Так, при применении твердого носителя препарат может быть необработанным, измельченным, микронизированным, содержащимся в масле, таблетированным, помещенным в твердую желатиновую капсулу или капсулу в оболочке для перорального применения в микронизированном порошке или в форме пилюли, или в форме таблетки или лепешки. Соединения, представленные в настоящем изобретении, могут также применяться в форме суппозиториев для ректального введения. Соединения могут быть смешаны с такими материалами, как масло какао и полиэтиленгликоли, или другим подходящим нераздражающим материалом, твердым при комнатной температуре, но жидким при ректальной температуре. При применении жидкого носителя препарат может быть в форме жидкости, как ампульная форма, или как водная или неводная жидкая суспензия. Жидкие дозированные лекарственные формы также нуждаются в фармацевтически приемлемых консервантах. Кроме того, из-за того, что требуются низкие дозы, как это обосновано представленными здесь данными, парентеральное введение, назальное распыление, подъязычное и защечное введение, и кожные пластыри с замедленным высвобождением также являются подходящими фармацевтическими формами для местного применения.
Способ вызывания противотревожной, противосудорожной, изменяющей настроение (такой как антидепрессивная) или снотворной активности, в соответствии с настоящим изобретением, предусматривает введение объекту, нуждающемуся в такой активности, соединения, представленного в изобретении, обычно приготовленного в препарате, как описано выше, в сочетании с фармацевтическим носителем, в нетоксическом количестве, достаточном для получения указанного действия.
В период менструации, уровни выделяемых метаболитов прогестерона изменяются приблизительно в четыре раза (Rosciszewska et al., J. Neurol. Neurosurg. Psych. 49:47-51 (1986). Таким образом, контролирующая симптомы терапия подразумевает поддержание у пациента повышенного уровня метаболитов прогестерона, по сравнению с нормальным в предменструальном состоянии у пациентов с PMS. Уровни активных и основных метаболитов в плазме наблюдают в течение предменструального и постменструального периодов у пациента. Количество вводимых соединений, представленных в изобретении, как отдельно, так и в виде их смесей, рассчитывают таким образом, чтобы достигнуть уровня, который дает активность ГАМКA-рецептор, равную или превышающую уровень метаболитов прогестерона у нормального субъекта в предменструальном состоянии.
Способ индуцирования сна и поддержания в значительной степени уровня REM-сна, который обнаруживают при нормальном сне, когда не индуцирована значительная реактивная бессоница, в соответствии с настоящим изобретением, предусматривает введение нуждающемуся в такой активности субъекту эффективного количества описанного здесь стероидного производного. Соединения, представленные в изобретении, способны увеличить период NREM-сна и общее время сна, не влияя значительно на продолжительность REM-сна. Реактивная бессоница определяется как сокращение NREM-сна после того, как снотворное действие лечения возвращается на контрольные уровни. Способы оценки эффектов соединений, представленных в изобретении, на REM- и NREM-сон представлены в WO94/27608, опубликованном 8 декабря 1994 года, содержание которого полностью включается здесь в виде ссылки.
Способом введения может быть любой способ, который эффективно доставляет активное соединение к рецепторам ГАМКA, которые подлежат стимуляции. Введение может быть проведено парентерально, перорально, ректально, внутривагинально, внутрикожно, внутримышечно, подъязычно или назально; предпочтительными являются пероральный, внутримышечный и накожный способы. Например, одна доза в кожном пластыре может доставлять активный ингредиент пациенту в течение периода до одной недели. Однако, при эпилепсии парентеральный способ предпочтителен.
Последующие примеры иллюстрируют, но не ограничивают, способ и препараты настоящего изобретения. Другие подходящие модификации и адаптации разнообразия условий и параметров, встречающиеся обычно и очевидные специалистам, находятся в пределах данного изобретения.
Пример 1
3α
-гидрокси-17β-метокси-3β-(3'-метилбут-3'-ен-1'-инил)-5β-андростан
Раствор 2-метил-1-бутен-3-ина
(150 мг, 0,21 мл, 2,25 ммоль) в сухом ТГФ (тетрагидрофуране) (20 мл)
обрабатывают n-BuLi (2,5 М в ТГФ, 2,25 ммоль, 0,9 мл) при -70oС. После перемешивания смеси при температуре -75oС в течение 0,5 ч добавляют раствор 17β-метокси-5β
-андростан-3-она (228 мг, 0,75 ммоль) в ТГФ (20 мл) и смесь перемешивают при температуре -78oС в течение 30 мин.
Охлаждающую баню удаляют и смесь гасят раствором NH4Cl (2 мл).
Растворитель удаляют, а остаток экстрагируют ЕtOАс. Органический слой промывают водой и затем солевым раствором. После
высушивания над безводным МgSO4 раствор фильтруют и упаривают, получая
сырец. Этот сырец затем растворяют в небольшом количестве CH2Cl2 и наносят на колонку с
силикагелем. Элюция смесью гексан: ацетон (9: 1) дает 3α-гидрокси-17β
-метокси-3β-(3'-метилбут-3'-ен-1'-инил)-5β-андростан в виде бесцветного твердого продукта;
Т.пл.145-147oС, TCX-Rf (гексан:ацетон 85:15)=0,21.
Пример 2
3α-(4'-гидрокси-1'-бутинил)-3β-гидрокси-17β-метокси-5β
-андростан и 3β-(4'-гидрокси-1'-бутинил)-3α-гидрокси-17β-метокси-5β
-андростан
Раствор 3-бутин-1-ола (0,114 мл, 1,5 ммоль) в сухом ТГФ (15 мл) обрабатывают n-BuLi
(1,2 мл, 2,5 М в ТГФ, 3 ммоль) при -75oС. После перемешивания смеси при температуре
-78oС в течение 0,5 ч добавляют раствор 17β-метокси-5β-андростан-3-она (152 мг,
0,5 ммоль) в ТГФ (20 мл) и смесь перемешивают при температуре -78oС в течение 30
мин. Охлаждающую баню удаляют и перемешивание продолжают при комнатной температуре в течение 45 мин. Смесь
затем гасят раствором NН4Cl (5 мл). Растворители удаляют, а остаток экстрагируют
ЕtOАс. Органический слой промывают водой и солевым раствором. После высушивания над безводным МgSO4 раствор фильтруют и упаривают, получая сырец. Этот сырец затем растворяют в небольшом
количестве CH2Cl2 и наносят на колонку с силикагелем. Элюция смесью толуол:ацетон
(4:1) дает 3α-(4'-гидрокси-1'-бутинил)-3β-гидрокси-17β-метокси-5β
-андростан (20 мг) и затем 3β-(4'-гидрокси-1'-бутинил)-3α-гидрокси-17β
-метокси-5β-андростан (70 мг) в виде бесцветного твердого продукта; Т.пл. 132-134oС,
TCX-Rf (толуол:ацетон 4:1)=0,19.
Пример 3
4'-гемисукцинат
3β-(4'-гидрокси-1'-бутинил)-3α-гидрокси-17β-метокси-5α-андростана и его
натриевая соль
Раствор 3β-(4'-гидрокси-1'-бутинил)-3α-гидрокси-17β
-метокси-5α-андростана (350 мг, 0,93 ммоль) в пиридине (6 мл) обрабатывают янтарным ангидридом
(372 мг, 3,7 ммоль) и 4-(N,N-диметил)аминопиридином (20 мг). Смесь нагревают до 70-75o
С в течение 3 ч. ТСХ показывает 100% превращение. Смесь охлаждают до комнатной температуры и выливают в
ледяную 2N HCl. Органический остаток экстрагируют ЕtOАс. Органический слой промывают 0,2N HCl,
водой и солевым раствором. После высушивания над безводным МgSO4 раствор фильтруют и упаривают,
получая сырец. Этот сырец затем растворяют в небольшом количестве CH2Cl2 и наносят на колонку с силикагелем. Элюция смесью гексан: ацетон (7:3) дает 4'-гемисукцинат 3β
-(4'-гидрокси-1'-бутинил)-3α-гидрокси-17β-метокси-5α-андростана (360
мг).
Смесь указанного выше гемисукцината (360 мг, 0,76 ммоль), NaHCO3 (64 мг, 0,76 ммоль), воды (3 мл) и CH2Cl2 (5 мл) смешивают при комнатной температуре в течение 1 часа. Растворитель удаляют и остаток суспендируют в ацетоне (5 мл). Затем фильтрацией получают белый твердый продукт и высушивают до получения натриевой соли в виде бесцветного твердого продукта (210 мг).
Пример 4
3β-(4'-гидрокси-1'-бутинил)-3α
-гидрокси-17β-метокси-5α-андростан и 3α
-(4'-гидрокси-1'-бутинил)-3β-гидрокси-17β-метокси-5α-андростан
Раствор 3-бутин-1-ола (0,15 мл, 2 ммоль) в
сухом ТГФ (15 мл) обрабатывают n-ВuLi (1,6 мл, 2,5 М в ТГФ, 4
ммоль) при -75oС. После перемешивания смеси при температуре -78oС в течение 0,5 ч добавляют раствор 17β
-метокси-5α-андростан-3-она (304 мг, 1 ммоль) в ТГФ (20 мл)
и смесь перемешивают при температуре -78oС в течение 5 мин. Охлаждающую баню удаляют и перемешивание продолжают при
комнатной температуре в течение 45 мин. Смесь затем гасят раствором
NH4Cl (5 мл). Растворители удаляют, а остаток экстрагируют ЕtOАс. Органический слой промывают водой и затем солевым
раствором. После высушивания над безводным MgSO4 раствор
фильтруют и упаривают, получая сырец. Этот сырец затем растворяют в небольшом количестве CH2Cl2 и наносят на
колонку с силикагелем. Элюция смесью толуол:ацетон (4:1) дает
3β-(4'-гидрокси-1'-бутинил)-3α-гидрокси-17β-метокси-5α-андростан (50 мг); Т.пл. 184-186oС,
ТСХ-Rf (толуол: ацетон 4:1)=0,35; и затем 3α
-(4'-гидрокси-1'-бутинил)-3β-гидрокси-17β-метокси-5α-андростан (225 мг) в виде бесцветного твердого продукта; Т. пл.
185-187oС, TCX-Rf (толуол: ацетон
4:1)=0,24.
Пример 5
3α-гидрокси-17β-метокси-3β-метил-5α-андростан и 3β
-гидрокси-17β-метокси-3α-метил-5α-андростан
Раствор 17β-метокси-5α-андростан-3-она (101 мг, 0,33 ммоль) в сухом ТГФ (20 мл) обрабатывают MeLi (1 мл, 1,5М в
ТГФ, 1,5 ммоль) при -75oС. После перемешивания смеси при
-78oС в течение 0,5 ч смесь гасят раствором NH4Cl (5 мл). Растворители удаляют, а остаток экстрагируют ЕtOАс.
Органический слой промывают водой и затем солевым раствором. После
высушивания над безводным МgSO4 раствор фильтруют и упаривают, получая сырец. Этот сырец затем растворяют в небольшом
количестве СН2Сl2 и наносят на колонку с
силикагелем. Элюция смесью толуол: ацетон (95: 5) дает 3β-метил-3α-гидрокси-17β-метокси-5α-андростан (35 мг);
Т.пл. 151-154oС, ТСХ-Rf (гексан:ацетон
7:3)=0,43; и затем 3α-метил-3β-гидрокси-17β-метокси-5α-андростан (30 мг) в виде бесцветного твердого продукта;
TCX-Rf (гексан:ацетон 7:3)=0,27.
Пример 6
3α-гидрокси-17β-метокси-3β-трифторметил-5α-андростан и 3β-гидрокси-17β
-метокси-3α-трифторметил-5α-андростан
Раствор
17β-метокси-5α-андростан-3-она (220 мг, 0,75 ммоль) в сухом ТГФ (20 мл) обрабатывают трифторметилтриметилсиланом (3
мл, 0,5М в ТГФ, 1,5 ммоль) и фторидом тетрабутиламмония (ТБАФ) (10
мг) при 0oС. После перемешивания смеси при 23oС в течение 2 ч смесь повторно охлаждают до 0oС. Смесь
перемешивают при комнатной температуре в течение 10 мин, затем
гасят раствором NH4Cl (5 мл). Растворители удаляют, а остаток экстрагируют EtOAc. Органический слой промывают водой и солевым
раствором. После высушивания над безводным МgSO4
раствор фильтруют и упаривают, получая сырец. Этот сырец затем растворяют в небольшом количестве CH2Cl2 и наносят на
колонку с силикагелем. Элюция смесью гексан: этилацетат
(9:1) дает 3β-трифторметил-3α-гидрокси-17β-метокси-5α-андростан (9 мг); TCX-Rf (гексан:ЕtOАс 8:2)=0,51; и
затем 3α-трифторметил-3β
-гидрокси-17β-метокси-5α-андростан (170 мг) в виде бесцветного твердого продукта; TCX-Rf (гексан: EtOAc 8:2)=0,45.
Пример 7
3α
-гидрокси-17β-метокси-3β-трифторметил-5β-андростан
Раствор 17β-метокси-5β-андростан-3-она (304 мг, 1 ммоль) в сухом ТГФ (20 мл)
обрабатывают
трифторметилтриметилсиланом (7 мл, 0,5М в ТГФ, 3,5 ммоль) и ТБАФ (10 мг) при 0oС. После перемешивания смеси при 23oС в течение 2 ч смесь повторно охлаждают до 0oС.
Добавляют раствор ТБАФ (1М в ТГФ, 3,5 мл, 3,5 ммоль). Смесь перемешивают при комнатной
температуре в течение 10 мин и затем гасят раствором NH4Cl (5 мл). Растворители
удаляют, а
остаток экстрагируют ЕtOАс. Органический слой промывают водой и солевым раствором. После высушивания над безводным MgSO4 раствор фильтруют и упаривают, получая сырец. Этот сырец
затем
растворяют в небольшом количестве CH2Cl2 и наносят на колонку с силикагелем. Элюция смесью гексан: этилацетат (9:1) дает 3β-трифторметил-3α-гидрокси-17β
-метокси-5β-андростан (220 мг); Т.пл. 122-127oС, TCX-Rf (гексан: ЕtOАс 8:2)=0,38.
Пример 8
3α-гидрокси-17β-метокси-5β
-андростан
Раствор 17β-метокси-5β-андростан-3-она (130 мг, 0,42 ммоль) в сухом ТГФ (15 мл) обрабатывают гидридом литийтри(трет-бутокси)алюминия (1 мл, 1М в ТГФ, 1 ммоль) при
-73oС. После перемешивания смеси при -75oС в течение 3 ч и затем при -10oС в течение 1,5 ч смесь гасят раствором NaOH (1N, 2 мл). Растворители удаляют, а остаток
экстрагируют ЕtOАс. Органический слой промывают водой и солевым раствором. После высушивания над безводным MgSO4 раствор фильтруют и упаривают, получая сырец. Этот сырец затем растворяют в
небольшом количестве CH2Cl2 и наносят на колонку с силикагелем. Элюция смесью толуол: ацетон (9:1) дает 3α-гидрокси-17β-метокси-5β-андростан (107 мг); Т.пл.
151-156oС, TCX-Rf (гексан:ацетон 7:3)=0,18.
Пример 9
17β-(2-пропинилокси)-5α-андростан-3-он
Раствор циклического 3-(1,
2-этандиилацеталя) 17β-гидрокси-5α-андростан-3-она (1,03 г, 3 ммоль) в сухом ТГФ (20 мл) обрабатывают KOt-Bu (12 мл, 1М в ТГФ, 12 ммоль) при 23oС. После перемешивания смеси
при 55oС в течение 2,5 ч ее охлаждают до -50oС. Добавляют пропаргилбромид (80% раствор в толуоле, 1,3 мл, 11 ммоль) и продолжают перемешивание при 50-55oС в течение 2,
5 ч. Растворители удаляют, а осадок обрабатывают ацетоном (25 мл). После подкисления смеси 2N HCl ее перемешивают при комнатной температуре в течение 15 ч. Смесь нейтрализуют 2N раствором NaOH.
Растворители удаляют, а остаток экстрагируют ЕtOАс. Органический слой промывают водой и солевым раствором. После высушивания над безводным МgSO4 раствор фильтруют и упаривают, получая
сырец. Этот сырец затем растворяют в небольшом количестве CH2Cl2 и наносят на колонку с силикагелем. Элюция смесью гексан:ацетон (8:2) дает 17β-(2-пропинилокси)-5α
-андростан-3-он (700 мг).
Пример 10
3α-гидрокси-3β-метил-17β-(2-пропинилокси)-5α-андростани3α-метил-17β-(2-пропинилокси)-5α
-андростан
Раствор 17β-(2-пропинилокси)-5α-андростан-3-она (230 мг, 0,7 ммоль) в сухом ТГФ (20 мл) обрабатывают MeLi (5 мл, 1 М в ТГФ, 5 ммоль) при -70oС. После
перемешивания смеси при -70oС в течение 0,5 ч охлаждающую баню удаляют и смесь нагревают до 10oС. Смесь затем гасят раствором NH4Cl (5 мл). Растворители удаляют, а
остаток экстрагируют ЕtOАс. Органический слой промывают водой и солевым раствором. После высушивания над безводным MgSO4 раствор фильтруют и упаривают, получая сырец. Этот сырец затем
растворяют в небольшом количестве CH2Cl2 и наносят на колонку с силикагелем. Элюция смесью толуол: ацетон (98: 2) дает 3α-гидрокси-3β-метил-17β
-(2-пропинилокси)-5α-андростан (40 мг); TCX-Rf (толуол: ацетон 95:5)=0,31; и затем 3α-метил-17β-(2-пропинилокси)-5α-андростан (70 мг) в виде бесцветного
твердого
продукта; TCX-Rf (гексан:ацетон 7:3)=0,27.
Пример 11
17β-[3-(4-ацетилфенил)-2-пропинилокси]-3α-гидрокси-3β-метил-5α
-андростан
Раствор 4-иодоацетофенона (16 мг, 0,06 ммоль), 3α-гидрокси-3β-метил-17β-(2-пропинилокси)-5α-андростана (22 мг, 0,06 ммоль) в сухом дегазированном
триэтиламине (1 мл)
перемешивают в атмосфере аргона при 23oС. Добавляют хлорид бис(трифенилфосфин)палладия (2 мг) и Cul (2 мг) и перемешивают смесь при этой температуре в течение 45 мин.
Добавляют CH2Cl2 (4 мл) и смесь перемешивают при 23oС в течение 1 ч. Когда ТСХ показывает 100% конверсию исходного материала, растворитель удаляют и остаток очищают
хроматографией на
силикагеле. Элюция гексан: ацетон (85:15) дает 17β-[3-(4-ацетилфенил)-2-пропинилокси] -3α-гидрокси-3β-метил-5α-андростан (19 мг) в виде бесцветного
твердого осадка; Т.пл.
52-55oС, ТСХ-Rf (гексан:ацетон 85:15)=0,15.
Пример 12
17β-(2-гидроксиэтокси)-3α-гидрокси-5α-андростан
Раствор цикличекого
17-(1,2-этандиилацеталя) 3α-гидрокси-5α-андростан-17-она (166 мг, 0,5 ммоль) в сухом ТГФ (10 мл) обрабатывают LAH (18 мг, 0,5 ммоль) и АlСl3 (266 мг,
2 ммол) при 23o
С. После перемешивания смеси при 45oС в течение 2 ч ее гасят раствором NH4Cl (2 мл). Растворители удаляют, а остаток экстрагируют ЕtOАс. Органический
слой промывают разбавленной
HCl, водой и солевым раствором. После высушивания над безводным MgSO4 раствор фильтруют и упаривают, получая сырец. Этот сырец затем растворяют в небольшом
количестве CH2Cl2 и наносят на колонку с силикагелем. Элюция смесью гексан: ацетон (8: 2) дает 17β-(2-гидроксиэтокси)-3α-гидрокси-5α-андростан (123 мг);
Т.пл. 181-183oС,
TCX-Rf (гексан:ацетон 7:3)=0,31.
Пример 13
3β-этинил-3α-гидрокси-17β-метокси-5β-андростан
Раствор
1,2-дибромэтилена (1,6 мл, 3,
7 г, 19,71 ммоль) в сухом ТГФ (10 мл) обрабатывают n-BuLi (16,4 мл, 2,4М в ТГФ, 39,4 ммоль) при -75oС. После перемешивания смеси при -78oС в течение
0,25 ч добавляют раствор
17β-метокси-5β-андростан-3-она (2 г, 6,57 ммоль) в ТГФ (20 мл) и смесь перемешивают при -78oС в течение 15 мин. Охлаждающую баню затем убирают и
смесь гасят раствором NH4Cl (3 мл). Растворители удаляют, а остаток экстрагируют ЕtOАс. Органический слой промывают водой и солевым раствором. После высушивания над безводным MgSO4 раствор фильтруют и
упаривают, получая сырец. Этот сырец затем растворяют в небольшом количестве CH2Cl2 и наносят на колонку с силикагелем. Элюция смесью толуол:ацетон
(95:5) дает 3β
-этинил-3α-гидрокси-17β-метокси-5β-андростан (1,70 г) в виде бесцветного твердого продукта; Т.пл. 62-65oС, TCX-Rf (толуол:ацетон
95:5)=0,23.
Пример 14
3β-(4'-ацетилфенилэтинил)-3α-гидрокси-17β-метокси-5β-андростан
Раствор 4-иодацетофенона (112 мг, 0,45 ммоль) и
3β-этинил-3α
-гидрокси-17β-метокси-5β-андростана (155 мг, 0,45 ммоль) в сухом дегазированном триэтиламине (1 мл) перемешивают под аргоном при 23oС. Добавляют
хлорид
бис(трифенилфосфин)палладия (5 мг) и Cul (5 мг) и перемешивают смесь при этой температуре в течение 45 мин. Добавляют CH2Cl2 (5 мл) и смесь перемешивают при 23o
С в
течение 1 ч. Когда ТСХ показывает 100% конверсию исходного материала, растворитель удаляют и остаток очищают хроматографией на силикагеле. Элюция гексан:ЕtOАс (7:3) дает 3β
-(4'-ацетилфенилэтинил)-3α-гидрокси-17β-метокси-5β-андростан (130 мг) в виде бесцветного твердого продукта; Т. пл. 189-191oС, TCX-Rf (гексан:ацетон 4:1)=0,
31.
Пример 15
3α-этинил-3β-гидрокси-17β-метокси-5α-андростан и 3β-этинил-3α-гидрокси-17β-метокси-5α-андростан
Раствор 1,2-дибромэтилена (1,7 мл, 21 ммоль) в сухом ТГФ (25 мл) обрабатывают n-BuLi (16,8 мл, 2,5М в ТГФ, 42 ммоль) при -65oС. После перемешивания смеси при -70oС в течение 0,
25
ч добавляют раствор 17β-метокси-5α-андростан-3-она (2,128 г, 7 ммоль) в ТГФ (22 мл) и смесь перемешивают при -78oС в течение 30 мин. Охлаждающую баню
затем убирают и
смесь
гасят раствором NH4Cl (3 мл). Растворители удаляют, а остаток экстрагируют ЕtOАс. Органический слой промывают водой и солевым раствором. После высушивания над безводным MgSO4
раствор фильтруют и упаривают, получая сырец. Этот сырец затем растворяют в небольшом количестве CH2Cl2 и наносят на колонку с силикагелем. Элюция смесью толуол:ацетон
(95:5)
дает 3β-этинил-3α-гидрокси-17β-метокси-5α-андростан (100 мг) в виде бесцветного твердого продукта; Т.пл. 138-145oС, TCX-Rf (гексан: ацетон 7:
3)= 0,45;
и затем 3α-этинил-3β-гидрокси-17β-метокси-5α-андростан (1,6 г) в виде бесцветного твердого продукта.
Пример 16
3β
-этинил-3α
-гидрокси-17β-метокси-19-нор-5β-андростан
Раствор 1,2-дибромэтилена (0,9 мл, 2,0 г, 10,85 ммоль) в сухом ТГФ (10 мл) обрабатывают n-BuLi (9 мл, 2,4М в ТГФ, 21,
7 ммоль) при
-75oС. После перемешивания смеси при -70oС в течение 0,25 ч добавляют раствор 17β-метокси-19-нор-5β-андростан-3-она (1 г, 3,62 ммоль) в ТГФ (20 мл) и
смесь
перемешивают при -78oС в течение 20 мин. Охлаждающую баню затем убирают и смесь гасят раствором NН4Сl (3 мл). Растворители удаляют, а остаток экстрагируют EtOAc.
Органический
слой промывают водой и солевым раствором. После высушивания над безводным MgSO4 раствор фильтруют и упаривают, получая сырец. Этот сырец затем растворяют в небольшом
количестве CH2Cl2 и наносят на колонку с силикагелем. Элюция смесью толуол: ацетон (98: 2) дает 3β-этинил-3α-гидрокси-17β-метокси-19-нор-5β-андростан
(750 мг) в виде
бесцветного твердого продукта; Т.пл. 152-154oС, TCX-Rf (гексан:ацетон 7:3)=0,58.
Пример 17
3β-(4'-ацетилфенилэтинил)-3α
-гидрокси-17β
-метокси-19-нор-5β-андростан
Раствор 4-иодацетофенона (117 мг, 0,47 ммоль) и 3β-этинил-3α-гидрокси-17β-метокси-19-нор-5β-андростана
(150 мг, 0,47 ммоль) в
сухом дегазированном триэтиламине (1 мл) перемешивают под аргоном при 23oС. Добавляют хлорид бис(трифенилфосфин)палладия (5 мг) и Cul (5 мг) и перемешивают смесь при
этой температуре в
течение 45 мин. Добавляют CH2Cl2 (5 мл) и смесь перемешивают при 23oС в течение 1 ч. Когда ТСХ показывает 100% конверсию исходного материала,
растворитель удаляют и
осадок очищают хроматографией на силикагеле. Элюция толуол:ацетон (95:5) дает 3β-(4'-ацетилфенилэтинил)-3α-гидрокси-17β-метокси-19-нор-5β-андростан
(105 мг) в виде
бесцветного твердого продукта; Т.пл. 148-150oС, TCX-Rf (гексан:ацетон 4:1)=0,52.
Пример 18
3α-гидрокси-17β
-метокси-3β
-трифторметил-19-нор-5β-андростан
Раствор 17β-метокси-19-нор-5β-андростан-3-она (300 мг, 1,08 ммоль) в сухом ТГФ (15 мл) обрабатывают
трифторметилтриметилсиланом (5 мл, 0,
5М в ТГФ, 2,5 ммоль) и ТБАФ (5 мг) при 0oС. После перемешивания смеси при 23oС в течение 2 ч смесь снова охлаждают до 0oС.
Добавляют раствор ТБАФ (1М в ТГФ, 3,5 мл, 3,
5 ммоль). Смесь перемешивают при комнатной температуре и затем гасят раствором NН4Сl (5 мл). Растворители удаляют, а остаток экстрагируют EtOAc.
Органический слой промывают водой и солевым
раствором. После высушивания над безводным MgSO4 раствор фильтруют и упаривают, получая сырец. Этот сырец затем растворяют в небольшом
количестве CH2Cl2 и наносят на
колонку с силикагелем. Элюция смесью гексан:ацетон (9:1) дает 3α-гидрокси-17β-метокси-3β-трифторметил-19-нор-5β
-андростан (210 мг); Т.пл. 40-42oС, TCX-Rf (гексан:ацетон 7:3)=0,66.
Пример 19
3(R)-спиро-2'-оксиран-17β-метокси-5α-андростан
Раствор иодида триметилсульфоксония (2,42 г, 11 ммоль) и
KOt-Bu (1,12 г, 10 ммоль) в сухом ТГФ (40 мл) перемешивают с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры
добавляют 17β-метокси-5α-андростан-3-он (2,
432 г, 8 ммоль) и смесь перемешивают при этой температуре в течение 3 ч. Затем ее гасят водой (5 мл). Растворители удаляют, а остаток
экстрагируют EtOAc. Органический слой промывают разбавленной HCl,
водой и солевым раствором. После высушивания над безводным MgSO4 раствор фильтруют и упаривают, получая сырец
3(R)-спиро-2'-оксиран-17β-метокси-5α-андростана (2,5 г). Этот
сырец затем используют для следующей стадии.
Пример 20
3α-гидрокси-17β
-метокси-3β-(2-пропинил)-5α-андростан
Раствор сырца
3(R)-спиро-2'-оксиран-17β-метокси-5α-андростана (318 мг, 1 ммоль) и комплекс литийацетилид • EDA (95%,
485 мг, 5 ммоль) в ДМСО (10 мл) перемешивают при комнатной температуре в
течение 15 ч. Затем гасят водой (30 мл) и экстрагируют EtOAc. Органический слой промывают водой и солевым раствором. После
высушивания над безводным MgSO4 раствор фильтруют и упаривают,
получая сырец. Этот сырец затем
растворяют в небольшом количестве CH2Cl2 и наносят на колонку
с силикагелем. Элюция смесью гексан: ацетон (8: 2) дает 3α
-гидрокси-17β-метокси-3β-(2-пропинил)-5α-андростан (200 мг); Т.пл. 145-150oС, TCX-Rf
(гексан:ацетон 7: 3)=0,6.
Пример 21
3α
-гидрокси-17β-метокси-3β-метоксиметил-5α-андростан
Раствор сырца 3(R)-спиро-2'-оксиран-17β
-метокси-5α-андростана (318 мг, 1 ммоль) и натрия (29 мг, 1,3
ммоль) в МеОН (10 мл) нагревают с обратным холодильником в течение 2,5 ч. Затем гасят водой (1 мл). Растворители удаляют и остаток
экстрагируют EtOAc. Органический слой промывают водой и солевым
раствором. После высушивания над безводным МgSO4 раствор фильтруют и упаривают, получая сырец. Этот сырец затем растворяют в
небольшом количестве CH2Cl2 и наносят на
колонку с силикагелем. Элюция смесью гексан:ацетон (8:2) дает 3α-гидрокси-17β-метокси-3β-метоксиметил-5β
-андростан (230 мг); Т.пл. 93-99oС, TCX-Rf
(гексан:ацетон 7:3)=0,56.
Пример 22
3β-хлорметил-3α-гидрокси-17β-метокси-5α
-андростан
Раствор сырца 3(R)-спиро-2'-оксиран-17β
-метокси-5α-андростана (318 мг, 1 ммоль), хлорид тетраметиламмония (166 мг, 1,5 ммоль) и уксусную кислоту (0,5 мл) в ДМФ
(диметилформамид) (10 мл) перемешивают при 90-95oС в течение
2,5 ч. Его охлаждают до комнатной температуры и затем гасят водой (25 мл). После нейтрализации 2N NaOH смесь экстрагируют
EtOAc. Органический слой промывают водой и солевым раствором. После
высушивания над безводным MgSO4 раствор фильтруют и упаривают, получая сырец. Этот сырец затем растворяют в небольшом
количестве CH2Cl2 и наносят на колонку с
силикагелем. Элюция смесью гексан: ацетон (95:5) дает 3β-хлорметил-3α-гидрокси-17β-метокси-5β-андростан (138
мг); Т.пл. 138-145oС, TCX-Rf
(гексан:ацетон 8:2)=0,26.
Пример 23
3β-этенил-3α-гидрокси-17β-метокси-5β-андростан
Раствор иодида триметилсульфония (632 г, 3,1 ммоль) в
сухом ТГФ (10 мл) обрабатывают n-BuLi (2,5 М в ТГФ, 3 ммоль, 1,2 мл) при -5oС. После перемешивания смеси при 0oС в течение
0,5 ч добавляют раствор 3(R)-спиро-2'-оксиран-17β
-метокси-5α-андростана (318 мг, 1 ммоль) в ТГФ (10 мл). Охлаждающую баню убирают и смесь перемешивают при комнатной температуре в
течение 2 ч. Затем смесь гасят раствором NH4Cl (2
мл). Растворители удаляют, а остаток экстрагируют EtOAc. Органический слой промывают водой и солевым раствором. После высушивания над
безводным MgSO4 раствор фильтруют и упаривают, получая
сырец. Этот сырец затем растворяют в небольшом количестве CH2Cl2 и наносят на колонку с силикагелем. Элюция
смесью гексан:ацетон (7:3) дает 3β-этинил-3α
-гидрокси-17β-метокси-5β-андростан (220 мг) в виде бесцветного твердого продукта; Т.пл. 104-111oС, TCX-Rf
(гексан:ацетон 7:3)=0,5.
Пример 24
3α-гидрокси-2β-изопропокси-17β-метокси-5α-андростан
Раствор 17-диметилацеталя 3α
-гидрокси-2β-изопропокси-5α-андростан-17-она
(приготовленный размыканием эпоксидной группы 2α,3α-эпокси-5α-андростан-17-она изопропоксидом с последующей
кетализацией 17-она) (490 мг, 1,25 ммоль) в сухом ТГФ (15 мл)
обрабатывают LAH (48 мг, 1,33 ммоль) и АlСl3 (332 мг, 2,5 ммоль) при -30oС. После перемешивания смеси при 23oС в течение 1 ч ее гасят раствором NH4Cl (2
мл). Растворители удаляют, а остаток экстрагируют EtOAc. Органический слой промывают разбавленной HCl, водой и солевым раствором. После
высушивания над безводным МgSO4 раствор фильтруют и
упаривают, получая сырец. Этот сырец затем растворяют в небольшом количестве СН2Сl2 и наносят на колонку с
силикагелем. Элюция смесью гексан:ацетон (9:1) дает 3α
-гидрокси-2β-изопропокси-17β-метокси-5α-андростан (43 мг) в виде пены; TCX-Rf (гексан:ацетон 7:3)=0,41.
Пример 25
3α-гидрокси-3β
-(4-гидроксибутинил)-21-(пирид-4-илтио)-5β-прегнан-20-он
Раствор 21-бром-3α-гидрокси-3β
-(4-гидроксибутинил)-5β-прегнан-20-она (230 мг, 0,494 ммоль),
4-меркаптопиридина 90% (77 мг, 0,618 ммоль) и триэтиламина (86 мкл, 0,618 ммоль) в 10 мл ацетонитрила перемешивают при к.т. в
течение 3 ч. Смесь распределяется между EtOAc и водой. Органический слой
промывают насыщенным водным NaCl, сушат Na2SO4 и концентрируют под вакуумом. Сырец подвергают
хроматографии на испарительной колонне. Элюция с 35-50% ацетона в CH2
Cl2 приводит к получению 3α-гидрокси-3β-(4-гидроксибутинил)-21-(пирид-4-илтио)-5β
-прегнан-20-она (196 мг) в виде пены желтого цвета. TCX-Rf (ацетон: СН2Сl2 45:55)=0,36.
Аналогично получают:
3α
-гидрокси-21-(пирид-4-илтио)-5β-прегнан-20-он; Т.пл. 193-195oС, ТСХ-Rf
(гексан:EtOAc 1:1)=0,11;
3α-гидрокси-21-(пирид-4-илтио)-5α-прегнан-20-он;
Т.пл. 154-156oС, ТСХ-Rf (СН2Cl2:ацетон 4:1)=0,18;
3α-гидрокси-3β-метоксиметил-21-(пирид-4-илтио)-5α-прегнан-20-он;
21-(4'-аминофенилтио)-3α-гидрокси-3β-метоксиметил-5α-прегнан-20-он; Т. пл.
150-156oС, ТСХ-Rf (гексан:EtOAc 3:1)=0,045;
3α-гидрокси-3β
-метоксиметил-21-(4'-нитрофенилтио)-5α-прегнан-20-он; TCX-Rf (гексан:EtOAc
3:1)=0,17;
21-(4'-фторфенилтио)-3α-гидрокси-3β-метоксиметил-5α-прегнан-20-он;
TCX-Rf (гексан:ацетон 85:15)=0,25;
3β-этинил-3α
-гидрокси-21-(пирид-4-илтио)-5α-прегнан-20-он; TCX-Rf (гексан:EtOAc 1:1)=0,26 и
3β
-(4'-ацетилфенил)этинил-3α-гидрокси-21-(пирид-4-илтио)-5β
-прегнан-20-он; TCX-Rf (гексан:EtOAc 2:1)=0,15.
Пример 26
N-метилиодид 3α
-гидрокси-21-(пирид-4-илтио)-5β-прегнан-20-она
Раствор 3α
-гидрокси-21-(пирид-4-илтио)-5β-прегнан-20-она (62 мг, 0,145 ммоль) и 1 мл метилиодида в 5 мл EtOAc нагревают с
обратным холодильником в течение нескольких часов до окончания реакции,
подтверждаемого ТСХ. Смесь затем охлаждают до комнатной температуры и концентрируют под вакуумом до образования сырца. Остаток
растирают в порошок с эфиром и высушивают под вакуумом для получения
N-метилиодида 3α-гидрокси-21-(пирид-4-илтио)-5β-прегнан-20-она (70 мг) в виде твердого продукта оранжевого цвета.
Пример 27
N-метилиодид 3α
-гидрокси-21-(пирид-4-илтио)-5α-прегнан-20-она
Раствор 3α-гидрокси-21-(пирид-4-илтио)-5α-прегнан-20-она (29 мг, 0,
068 ммоль) и 100 мкл метилиодида в 5 мл ТГФ нагревают с
обратным холодильником. Через 15 минут осаждается твердый продукт и нагревание с обратным холодильником продолжают в течение нескольких часов.
Смесь охлаждают до комнатной температуры и позволяют
избытку метилиодида испариться. Твердый продукт затем фильтруют, промывают холодным ТГФ, что приводит к получению N-метилиодида 3α
-гидрокси-21-(пирид-4-илтио)-5α-прегнан-20-она в виде
твердого продукта светло-оранжевого цвета.
Пример 28
N-метилиодид 3α-гидрокси-2β
-пропокси-21-(пирид-4-илтио)-5α-прегнан-20-она
Раствор 3α
-гидрокси-2β-пропокси-21-(пирид-4-илтио)-5α-прегнан-20-она (50 мг, 0,103 ммоль) и 130 мкл метилиодида в 5
мл ТГФ нагревают с обратным холодильником в течение нескольких часов, пока
окончание реакции не подтверждается ТСХ. Смесь затем охлаждают до комнатной температуры и концентрируют под вакуумом, что
приводит к получению N-метилиодида 3α-гидрокси-2β
-пропокси-21-(пирид-4-илтио)-5α-прегнан-20-она (64 мг) в виде светло-желтого твердого продукта.
Аналогично
получают:
иодид3α-гидрокси-3β
-метил-21-(4'-триметиламмонийфенокси)-5α-прегнан-20-она;
иодид 3α-гидрокси-2β-пропокси-21-(4'-N, N,
N-триметиламмонийфенокси)-5α-прегнан-20-она и
N-метилиодид 3α-гидрокси-3β-метил-21-(хинолин-6-илокси)-5α-прегнан-20-она.
Пример 29
3β-этинил-3α-гидрокси-21-гидроксиэтинилтио-5β
-прегнан-20-он
Раствор 21-бром-3β-этинил-3α-гидрокси-5β-прегнан-20-она (150 мг, 0,356 ммоль),
2-меркаптоэтанол (31 мкл, 0,445 ммоль) и триэтиламин (62 мкл, 0,445 ммоль) в
5 мл ТГФ перемешивают при комнатной температуре в течение ночи. Смесь разделяется между EtOAc и водой. Органический слой
промывают насыщенным водным NaCl, высушивают Nа2SO4 и
концентрируют под вакуумом, что приводит к получению 3β-этинил-3α-гидрокси-21-гидроксиэтинилтио-5β
-прегнан-20-она (141 мг) в виде белого твердого продукта; Т.пл. 122-126oС, TCX-Rf (гексан: ацетон 3:1)=0,11.
Аналогично получают:
3β
-этинил-3α-гидрокси-21-гидроксипропилтио-5β-прегнан-20-он; ТСХ-Rf
(гексан:ацетон 3:1)=0,12;
3α-гидрокси-21-гидроксипропилтио-2β-пропокси-5α
-прегнан-20-он; Т. пл. 133-136oС, TCX-Rf (гексан:ацетон 3:1)=0,175 и
3α-гидрокси-21-гидроксиэтилтио-5β-прегнан-20-он; Т.пл. 150-152oС.
Пример 30
Натриевая соль 3β-этинил-3α
-гидрокси-21-тиоэтаноат-5β-прегнан-20-она
Раствор 21-бром-3β-этинил-3α-гидрокси-5β
-прегнан-20-она (150 мг, 0,356 ммоль), меркаптоуксусную кислоту (31 мкл, 0,445
ммоль) и триэтиламин (62 мкл, 0,445 ммоль) в 5 мл ДМФ перемешивают при комнатной температуре в течение нескольких часов.
Смесь распределяется между EtOAc и 2N HCl. Органический слой промывают
насыщенным водным NaCl, высушивают Na2SO4 и концентрируют под вакуумом до образования осадка. Осадок
растворяют в 5 мл CH2Cl2 и добавляют 1 экв. бикарбоната
натрия в 1 мл воды. Смесь перемешивают в течение 30 мин и затем концентрируют досуха под высоким вакуумом, что приводит к
получению натриевой соли 3β-этинил-3α
-гидрокси-21-тиоэтаноат-5β-прегнан-20-она (120 мг) в виде белого твердого продукта; Разл.>120oС.
Аналогично получают:
натриевую соль 3β
-этинил-3α-гидрокси-21-тиопропаноат-5β-прегнан-20-она;
натриевую соль 3β-этинил-3α
-гидрокси-21-тиоэтансульфонат-5β-прегнан-20-она; разл.>85oС, TCX-Rf (хлороформ:метанол 4:1)=0,25;
натриевуюсоль3β-этинил-3α
-гидрокси-21-тиопропансульфонат-5β-прегнан-20-она; TCX-Rf (хлороформ:метанол
4:1)=0,21 и
натриевуюсоль3α-гидрокси-2β-пропокси-21-тиопропансульфонат-5α
-прегнан-20-она; TCX-Rf (хлороформ:метанол 85:15)=0,22.
Пример 31
Триметиламмониевая соль 3β-этинил-3α-гидрокси-21-тиоэтансульфонат-5β
-прегнан-20-она
Раствор 3β-этинил-3α-гидрокси-21-гидроксиэтилтио-5β
-прегнан-20-она (140 мг, 0,335 ммоль), комплекс триоксида серы с триметиламином (100 мг, 0,736 ммоль)
и комплекс триоксида серы с пиридином (50 мг) в 4 мл хлороформа перемешивают при комнатной
температуре в течение ночи. Твердый продукт фильтруют и фильтрат концентрируют до малого объема. Остаток
подвергают хроматографии на испарительной колонне. Элюция смесью хлороформ:метанол 85:15
приводит к получению триметиламмоний 3β-этинил-3α-гидрокси-21-тиоэтансульфонат-5β
-прегнан-20-она (69 мг) в виде твердого продукта; Разл.>120oС.
Пример 32
Натриеваясоль3β-этинил-3α-гидрокси-21-тиопропансульфонат-5β
-прегнан-20-она
Раствор 3β-этинил-3α-гидрокси-21-гидроксипропилтио-5β
-прегнан-20-она (50 мг, 0,115 ммоль) и комплекс триоксида серы с триметиламином (19 мг, 0,139 ммоль)
в 0,5 мл пиридина перемешивают при комнатной температуре в течение ночи. Смесь разводят хлороформом
и промывают 2N HCl, насыщенным водным NaCl, высушивают с Na2SO4 и
концентрируют под вакуумом до образования сырца. Остаток подвергают хроматографии на испарительной колонне.
Элюция хлороформ:метанол 85: 15 приводит к получению натриевой соли 3β
-этинил-3α-гидрокси-21-тиопропансульфонат-5β-прегнан-20-она (20 мг) в виде твердого продукта; TCX-Rf (хлороформ:метанол 85:15)=0,12.
Аналогично получают натриевую соль 3α-гидрокси-2β-пропокси-21-сульфонилпропансульфат-5α-прегнан-20-она; TCX-Rf (хлороформ:метанол 85:15)=0,15.
Пример 33
3β
-этинил-3α-гидрокси-21-гидроксипропилсульфинил-5β-прегнан-20-он
Суспензию 3β-этинил-3α
-гидрокси-21-гидроксипропилтио-5β-прегнан-20-она (90 мг, 0,208 ммоль)
и периодат натрия (~200 мг в 0,5 мл воды) в метанол:ТГФ 3: 1 перемешивают при температуре от 0oС до комнатной в
течение ночи. Смесь концентрируют до малого объема, и она распределяется в
EtOAc и воде. Органический слой промывают насыщенным водным NaCl, высушивают с Na2SO4 и концентрируют
под вакуумом, что приводит к получению 3β-этинил-3α
-гидрокси-21-гидроксипропилсульфинил-5β-прегнан-20-она (83 мг) в виде пены; TCX-Rf (гексан:ацетон 2:1)=0,035.
Аналогично получают натриевую соль 3α -гидрокси-2β-пропокси-21-сульфинилпропансульфонат-5α-прегнан-20-она.
Пример 34
3β-этинил-3α
-гидрокси-21-гидроксипропилсульфонил-5β
-прегнан-20-он
К раствору 3β-этинил-3α-гидрокси-21-гидроксипропилсульфинил-5β-прегнан-20-она (65 мг, 0,145 ммоль), mСРВА
57-86% (42 мг) добавляют и раствор бикарбоната
натрия (на кончике шпателя) в 5 мл CH2Cl2, полученную смесь перемешивают при температуре от 0oС до комнатной в течение
ночи. Смесь распределяют между CH2
Cl2 и водным бикарбонатом натрия. Органический слой промывают насыщенным водным NaCl, высушивают с
Na2SO4 и
концентрируют под вакуумом до высыхания, что
приводит к получению 3β-этинил-3α-гидрокси-21-гидроксипропилсульфонил-5β-прегнан-20-она (66 мг) в виде белого твердого продукта;
TCX-Rf (СН2Сl2
:ацетон 1:1)=0,061.
Аналогично получают 3α-гидрокси-21-(3'-гидроксипропилсульфонил)-2β-пропокси-5α-прегнан-20-он; TCX-Rf (гексан:ацетон 2:1)=0,026.
Пример 35
3α-гидрокси-21-(пирид-3-ил)окси-5β-прегнан-20-он
К раствору 3α-гидрокси-21-бромо-5β
-прегнан-20-она (300 мг, 0,76 ммоль) в ДМФ (5
мл) добавляют 3-гидроксипиридин (215 мг, 2,27 ммоль) и К2СО3 (313 мг, 2,27 ммоль) и полученную смесь перемешивают при 25o
С в течение 0,5 ч. Реакционную смесь затем
наливают в делительную воронку, содержащую воду (30 мл), и смесь экстрагируют EtOAc (3•35 мл). Объединенные экстракты промывают водой (2•25 мл)
и затем высушивают с Na2SO4. Удаление растворителя под вакуумом приводит к образованию сырца, который очищают хроматографией на испарительной колонне на силикагеле, в результате
получают чистый 3α
-гидрокси-21-(пирид-3-ил)окси-5β-прегнан-20-он (50 мг); Т. пл. 63-66oС; TCX-Rf (MeOH: CH2Cl2 5:95)=0,15.
Пример 36
2β-изопропокси-3α-гидрокси-5α-андростан
а. 2β-изопропокси-3α-гидрокси-5α-андростан-17-он-тозилгидразон
К смеси 2β
-изопропокси-3α-гидрокси-5α-андростан-17-она (700 мг, 2,0 ммоль) и п-толуолсульфонгидразида (450 мг, 2,4 ммоль) добавляют этанол (2 мл) и полученную смесь нагревают с обратным
холодильником в течение 12 ч. Затем реакционную смесь растворяют в CH2Cl2 (150 мл) и промывают водой (4•45 мл). Затем ее высушивают с Na2SO4, и
удаление растворителя под вакуумом приводит к образованию сырца 2β-изопропокси-3α-гидрокси-5α-андростан-17-он-тозилгидразона (1,113 г), который используют без дальнейшей очистки
для следующей стадии.
b. 2β-изопропокси-3α-гидрокси-5α-андростан
К смеси 2β-изопропокси-3α-гидрокси-5α
-андростан-17-он-тозилгидразона (300 мг), NaBH3CN (144 мг) и п-толуолсульфокислоты (30 мг) добавляют ДМФ и сульфолан (1: 1,3 мл) и полученную смесь нагревают до 110oС в течение
3
ч. Затем добавляют дополнительное количество NaBH3CN (144 мг) и п-толуолсульфокислоты (30 мг) и нагревают еще в течение 1 ч. Затем добавляют воду и смесь экстрагируют EtOAc (2•45
мл). Объединенные экстракты высушивают с Na2SO4 и сырец, полученный удалением растворителя, очищают хроматографией на испарительной колонне на силикагеле, в результате чего
получают чистый 2β-изопропокси-3α-гидрокси-5α-андростан (37 мг); TCX-Rf (EtOAc:гексан 1:9)= 0,17.
Пример 37
3α-гидрокси-5β
-19-норандростан
а. 3α-гидрокси-5β-19-норандростан-17-он
К раствору 5β-19-норандростан-3,17-диона (0,76 г, 2,77 ммоль) в ТГФ (30 мл) при -78oС
добавляют раствор гидрида литийтри(трет-бутокси)алюминия. Реакционную смесь затем наливают в делительную воронку, содержащую раствор NH4Cl (50 мл), и экстрагируют продукт EtOAc (3•
50
мл). Объединенные экстракты высушивают с Na2SO4, и удаление растворителя под вакуумом приводит к образованию сырца, который очищают хроматографией на испарительной колонне на
силикагеле для получения чистого 3α-гидрокси-5β-19-норандростан-17-она (605 мг); Т.пл. 159-161oС; TCX-Rf (гексан:ацетон 7:3)=0,30.
b. 3α
-гидрокси-5β-19-норандростан
К смеси 3α-гидрокси-5β-19-норандростан-17-она (0,59 г, 2,13 ммоль) и п-толуолсульфонилгидразида (480 мг, 2,6 ммоль) добавляют этанол (2 мл)
и
полученную смесь нагревают с обратным холодильником в течение 5 ч. Затем реакционную смесь растворяют в CH2Cl2 (100 мл) и промывают водой (2•30 мл). Затем ее высушивают
с
Nа2SO4, и удаление растворителя под вакуумом приводит к образованию сырца (1,0 г). Этот сырец смешивают с NaBH3CN (555 мг) и п-толуолсульфокислоты (68 мг) и смесью
ДМФА и сульфолана (1:1, 10 мл) и полученную смесь нагревают до 130oС в течение 2 ч. Затем добавляют дополнительное количество NaBH3CN (200 мг) и паратолуолсульфоновой кислоты
(30
мг) и нагревают еще в течение 1 ч. Затем добавляют воду (80 мл) и смесь экстрагируют EtOAc (3•50 мл). Объединенные экстракты высушивают с Na2SO4 и сырец, полученный
удалением растворителя, очищают хроматографией на испарительной колонне на силикагеле, в результате чего получают чистый 3α-гидрокси-5β-19-норандростан (217 мг); Т.пл. 129-132o
С; TCX-Rf (EtOAc:гексан 1:9)=0,30.
Пример 38
3α-гидрокси-3β-этинил-5β-19-норандростан
а. 5β-19-норандростан-3-он
К
раствору 3α-гидрокси-5β-19-норандростана (210 мг, 0,8 ммоль) в CH2Cl2 (25 мл) добавляют NaOAc (100 мг, 1,2 ммоль) и РСС (520 мг, 2,4 ммоль) и полученную
смесь
перемешивают при 25oС в течение 1 ч. Затем реакционную смесь фильтруют через лепешку Флорисила (15 г) в воронке Бюхнера, наполненной смесью растворителей: эфир и CH2Cl2
(1:1, 70 мл). Растворитель затем удаляют под вакуумом и сырец, полученный таким образом, очищают хроматографией на испарительной колонне на силикагеле для получения чистого 5β
-19-норандростан-3-она (190 мг); TCX-Rf (EtOAc:гексан 5:95)=0,20.
b. 3α-гидрокси-3β-этинил-5β-19-норандростан
К раствору 1,2-дибромэтилена
(410 мг, 2,2 ммоль) добавляют n-BuLi (2,5М, 1,8 мл, 4,4 ммоль) при -78oС и реакционную смесь перемешивают при этой температуре в течение 45 мин. Затем по каплям добавляют раствор 5β
-19-норандростан-3-она (190 мг, 0,73 ммоль) в ТГФ (10 мл) к образующемуся литиевому реагенту. Реакционную смесь затем наливают в делительную воронку, содержащую раствор NH4Cl (50 мл), и
экстрагируют продукт EtOAc (3•40 мл). Объединенные экстракты высушивают с Na2SO4 и сырец, полученный удалением растворителя, очищают хроматографией на испарительной
колонне на силикагеле для получения чистого 3α-гидрокси-3β-этинил-5β-19-норандростана (120 мг); Т.пл. 152-154oС; TCX-Rf (EtOAc:гексан 1:9)=0,19.
Пример 39
3α-гидрокси-3β-(4'-ацетилфенил)этинил-5β-19-норандростан
К смеси 3α-гидрокси-3β-этинил-5β-19-норандростана (120 мг, 0,
42 ммоль), 4-иодацетофенона (115 мг, 0,46 ммоль), хлорида
бис(трифенилфосфин)палладия (II) (каталитическое количество) и иодида меди (I) (каталитическое количество) добавляют триэтиламин (1,
5
мл) и полученную смесь перемешивают под аргоном в течение 45 мин в колбе, завернутой в алюминиевую фольгу. Затем добавляют CH2Cl2 (5 мл) и реакционную смесь перемешивают в
течение 3 ч. Затем растворитель удаляют под вакуумом и остаток очищают хроматографией на испарительной колонне на силикагеле для получения α-гидрокси-3β- (4'-ацетилфенил)этинил-5β
-19- норандростана (37 мг); TCX-Rf (EtOAc:гексан 15:85)=0,2.
Пример 40
3α-изобутирилокси-17β-метокси-5β-андростан
Раствор 3α
-гидрокси-17β-метокси-5β-андростана (250 мг, 0,82 ммоль) в сухом пиридине (2 мл) обрабатывают изобутирилхлоридом (0,12 мл, 1,15 ммоль) и N, N-диметиламинопиридином (5 мг) при 5oС. После перемешивания смеси при 5-10oС в течение 1 ч смесь гасят раствором HCl (0,5N, 25 мл). Смесь экстрагируют EtOAc. Органический слой промывают разбавленной HCl, водой и
солевым
раствором. После высушивания над безводным MgSO4 раствор фильтруют и упаривают, получая сырец. Этот сырец затем растворяют в небольшом количестве CH2Cl2 и
наносят на
колонку с силикагелем. Элюция смесью гексан:ацетон (9:1) дает 3α-изобутирилокси-17β-метокси-5β-андростан (266 мг); Т.пл. 82-87oС; TCX-Rf
(гексан:ацетон
9:1)=0,6.
Пример 41
3α-гидрокси-21-(пирид-4-илокси)-5β-прегнан-20-он
Раствор 21-бром-3α-гидрокси-5β-прегнан-20-она (500
мг, 1,26 ммоль),
4-гидроксипиридина (144 мг, 1,51 ммоль) и триэтиламина (200 мкл) в 10 мл ТГФ нагревают с обратным холодильником в течение 4 ч. Смесь охлаждают до комнатной температуры, и она
распределяется между
EtOAc и водой. Органический слой промывают водным насыщенным NaCl, высушивают с МgSO4 и концентрируют под вакуумом. Сырец подвергают хроматографии на испарительной
колонне. Элюция 50%
ацетоном в СН2Сl2 дает 3α-гидрокси-21-(пирид-4-илокси)-5β-прегнан-20-он (40 мг) в виде маслянистого твердого продукта; TCX-Rf
(ацетон:СН2
Сl2 1: 1)=0,28.
Пример 42
3α-гидрокси-3β-метил-21-(4'-нитрофенокси)-5α-прегнан-20-он
Раствор 21-бром-3α
-гидрокси-3β
-метил-5α-прегнан-20-она (250 мг, 0,61 ммоль), 4-нитрофенола (127 мг, 0,912 ммоль), триэтиламина (127 мкл, 0,912 ммоль) и небольшое количество иодида натрия в смеси
ацетонитрил:ДМФ (2:1)
перемешивают с нагреванием до ~ 60oС в течение 6 ч. Смесь распределяется между EtOAc и вода:насыщенный водный бикарбонат натрия (1:1). Органический слой промывают 2N
HCl, водой и водным
насыщеным NaCl, высушивают с Na2SO4 и концентрируют под вакуумом. Сырец подвергают хроматографии на испарительной колонне. Элюция 50% ацетоном в гексане дает
3α
-гидрокси-3β-метил-21-(4'-нитрофенокси)-5α-прегнан-20-он (147 мг) в виде твердого продукта; Т.пл. 169-172oС; TCX-Rf (гексан:ацетон 4:1)=0,35.
Аналогично получают 3α-гидрокси-3β-метил-21-(хинолин-6-илокси)-5α-прегнан-20-он; TCX-Rf (гексан:ацетон 3:1)=0,22.
Пример 43
21-(4'-диметиламинофенокси)-3α-гидрокси-3β-метил-5α-прегнан-20-он
Раствор 3α-гидрокси-3β-метил-21-(4'-нитрофенокси)-5α-прегнан-20-она (100 мг, 0,213
ммоль), формальдегида (37% раствор в воде, 800 мл) и 5% Pd/C (30 мг, каталитическое количество) в этаноле помещают в атмосферу H2 при 53 ф/дюйм2 на вибратор Парра в течение
ночи.
Катализатор отфильтровывают промыванием EtOAc и фильтрат промывают в делительной воронке с водой и насыщенным водным NaCl. Органический слой высушивают с Na2SO4 и
концентрируют
под вакуумом. Сырец подвергают хроматографии на испарительной колонне. Элюция 20% ацетоном в гексане дает 21-(4'-диметиламинофенокси)-3α-гидрокси-3β-метил-5α
-прегнан-20-он (64 мг)
в виде пенистого продукта; TCX-Rf (гексан:ацетон 2: 1)=0,55.
Аналогично получают 21-(4'-диметиламинофенилтио)-3α-гидрокси-3β -метоксиметил-5α -прегнан-20-он; TCX-Rf (гексан:ацетон 3:1)=0,35.
Пример 44
3α-гидрокси-3β
-метоксиметил-21-(R)-(4'-нитрофенилсульфинил)-5α-прегнан-20-он;
3α-гидрокси-3β-метоксиметил-21-(S)-(4'-нитрофенилсульфинил)-5α-прегнан-20-он и
3α
-гидрокси-3β-метоксиметил-21-(4'-нитрофенилсульфонил)-5α
-прегнан-20-он
Раствор3α-гидрокси-3β-метоксиметил-21-(4'-нитрофенилтио)-5α-прегнан-20-она (120 мг,
0,23 ммоль), mСРВА 57-86% (111 мг) и NаНСО3 (80 мг, 4 экв.)
в CH2Cl2 перемешивают при комнатной температуре в течение 2 ч. Реакционную смесь распределяют между CH2Cl2 и водным NaHCO3. Органический слой
промывают насыщенным водным NaCl, затем высушивают с Na2SO4 и концентрируют под вакуумом. Сырец подвергают
хроматографии на испарительной колонне. Элюция 40-50% EtOAc в гексане
дает 3α-гидрокси-3β-метоксиметил-21-(4'-нитрофенилсульфонил)-5α-прегнан-20-он (65 мг) в виде твердого
продукта, TCX-Rf (гексан: EtOAc 1: 1)= 0,38, затем 3α
-гидрокси-3β-метоксиметил-21-(R)-(4'-нитрофенилсульфинил)-5α-прегнан-20-он и 3α-гидрокси-3β
-метоксиметил-21-(S)-(4'-нитpoфeнилcyльфинил)-5α-прегнан-20-он в
неопределяемом количестве.
Аналогично получают 21-(4'-фторфенил)сульфонил-3α-гидрокси-3β -метоксиметил-5α-прегнан-20-он.
Пример 45
3α-гидрокси-3β-метоксиметил-21-(4'-пирролидинфенил)сульфонил-5α-прегнан-20-он
Раствор21-(4'-фторфенил)сульфонил-3α-гидрокси-3β-метоксиметил-5α
-прегнан-20-она (100 мг, 0,192 ммоль) и пирролидин (21 мкл, 0,25 ммоль) в 5 мл ДМСО нагревают на масляной бане при
100oС в течение 5 ч, затем перемешивают при комнатной температуре в
течение ночи. Добавляют воду и смесь экстрагируют CH2Cl2. Органическую фазу высушивают с Na2SO4 и концентрируют под вакуумом. Сырец подвергают хроматографии
на испарительной колонне, элюируя смесью гексан:EtOAc для получения вещества, обозначенного в заглавии (62 мг) в
виде твердого продукта желтого цвета.
Пример 46
3α
-гидрокси-21-(4-пиридилметилен)-5β-прегнан-20-он
Раствор этоксида натрия, приготовленный из 300 мг
натрия и 10 мл этанола, пипеткой добавляют к раствору 3α-гидрокси-5β
-прегнан-20-она (500 мг, 1,57 ммоль) и пиридин-4-карбоксальдегида (165 мкл, 1,73 ммоль) в 10 мл этанола. Смесь
энергично перемешивают при комнатной температуре в течение 30 ч. Твердый продукт осаждают,
отфильтровывают и промывают этанолом, затем высушивают под вакуумом, что приводит к получению вещества,
обозначенного в заглавии (260 мг).
Пример 47
3α
-гидрокси-21-(4-пиридилметил)-5β-прегнан-20-он
Раствор 3α
-гидрокси-21-(4-пиридилметилен)-5β-прегнан-20-она (100 мг, 0,245 ммоль) в 4 мл этанола и 4 мл ТГФ, содержащий 20
мг 5% Pd/C, выдерживают в атмосфере водорода из баллона и перемешивают в
течение 5 ч. Катализатор затем отфильтровывают и раствор концентрируют под вакуумом. Остаток подвергают хроматографии на
испарительной колонне, элюируя смесью гексан:ацетон, что приводит к получению
вещества, обозначенного в заглавии (38 мг), в виде твердого продукта; TCX-Rf (гексан:ацетон 2:1)=0,28.
Пример 48
Дикалиевая соль 20,20-[2',
3'-бис(карбокси)этилендиокси]-3α-гидрокси-3β-трифторметил-5β-19-норпрегнана
Смесь 3α-гидрокси-3β
-трифторметил-5β-19-норпрегнан-20-она (1,0 г, 2,68
ммоль), диметил-L-тартрата (1,0 г, 5,61 ммоль), моногидрата паратолуолсульфоновой кислоты (13 мг, 0,068 ммоль) и триметилортоформиата (10,35
мл) в 15 мл толуола нагревают с обратным холодильником с
азеотропным удалением воды. Через 1 ч реакции охлаждают до комнатной температуры и добавляют твердый NаНСО3 (130 мг). Окончательная
смесь распределяется между насыщенным водным раствором
NaHCO3 и этилацетатом. Водный слой отделяют и дважды промывают этилацетатом (2•20 мл). Объединенные слои этилацетата промывают
насыщенным раствором NaCl, высушивают (Na2
SO4) и концентрируют под вакуумом. Остаток хроматографируют (17,5% ацетон/гексан), получая белый пенистый продукт, который растирают в
порошок с гексаном, получая сложный диметиловый эфир
в качестве белого твердого продукта. Раствор диэфира в метаноле (2 мл) и воде (1 мл) обрабатывают твердым КОН (78 мг). После перемешивания в
течение ночи реакционную смесь концентрируют до
высушивания, получая вещество, обозначенное в заглавии, в виде твердого продукта светло-желтого цвета.
Пример 49
Фармакологическая активность
Активность и
эффективность сайта GRC
Полученные in vitro и in vivo экспериментальные данные показывают, что существующие в естественных условиях
метаболиты прогестерона/дезоксикортикостерона и их
производные взаимодействуют с высоким сродством с новым и специфическим сайтом узнавания на GRC для облегчения проводимости ионов хлорида через
нейронные мембраны, чувствительные к ГАМК (Gee K.W. et
al., European Journal of Pharmacology, 136:419-423 (1987); Harrison N.L. et al., J. Pharmacol. Exp. Ther. 241:346-353 (1987)).
Специалистам известно, что модуляция связывания [35S]t-бyтилбициклoфocфopoтиoнaт([35S]TBPS)a является мерой активности и эффективности лекарственных средств, действующих на GRC, эти лекарственные средства могут обладать потенциальной терапевтической ценностью при лечении стресса, состояния тревоги и эпилептических нарушений (Squires R.F., et al., Mol. Pharmacol., 23: 326 (1983); Lawrence L. J., et al., Biochem. Biophys. Res. Comm. 123: 1130-1137 (1984); Wood et al., Pharmacol. Exp. Ther., 231:572-576, (1984)). Ранее был проведен ряд экспериментов для установления природы модуляции [35S] TBPS при воздействии нейроактивных стероидов. Было показано, что эти соединения взаимодействуют с новым сайтом на GRC, который не перекрывается с барбитуратным, бензодиазепиновым или любыми другими ранее известными сайтами. Более того, эти соединения обладают высокой активностью и эффективностью в отношении комплекса GR при строгих структурных требованиях для такой активности.
Процедуры проведения этого анализа полно обсуждены в (1) Gee K.W. et al. , European Journal of Pharmacology, 136:419-423 (1987); и (2) Gee et al., Molecular
Pharmacology, 30:218 (1986). Эти процедуры
выполняют, как описано ниже:
Головной мозг самцов крыс Spague-Dawley удаляют сразу после умерщвления и кору головного мозга иссекают на льду.
Гомогенат Р2 готовят, как описано
ранее (Gee et al., Molecular Pharmacology, 30:218 (1986). Вкратце, кору головного мозга осторожно гомогенизируют в 0,32 М сахарозе с последующим
центрифугированием при 1000•g в течение 10 мин.
Супернатант собирают и центрифугируют при 9000•g в течение 20 минут. Полученный осадок P2 суспендируют до получения 10%
(исходная сырая масса/объем) суспензии в 50 Мм Na/K фосфатном
буфере (рН 7,4) с 200 Мм NaCl для получения гомогената.
Аликвоты по сто микролитров (мкл) гомогената Pg (0,5 миллиграммов (мг) белка) инкубируют с 2 наномолярным (Нм) [35 S]TBPS (TBPS - т-бутилбициклофосфоротионат) (70-110 Ки/миллимоль; New England Nuclear, Boston, MA) в присутствии или при отсутствии тестируемых природных стероидов или их синтетических производных. Тестируемые соединения растворяют в диметилсульфоксиде (Baker Chem. Co., Phillpsbury, NJ) и добавляют в инкубационную смесь в аликвотах по 5 мкл. Инкубационную смесь доводят буфером до конечного объема 1 мл. Неспецифическое связывание отмечают как связывание в присутствии 2 Мм TBPS. Эффект и специфичность ГАМК (Sigma Chem. Co., St. Louis, МО) оценивают, проводя все анализы в присутствии ГАМК + бикукуллин (Sigma Chem. Co.). Инкубирования, проводимые при 25oС в течение 90 минут (в постоянных условиях), заканчивают быстрой фильтрацией через стекловолоконные фильтры (No 32, Schleicher and Schuell, Keene, NH). Связанную с фильтром радиоактивность количественно определяют жидкостной сцинтилляционной спектрофотометрией. Данные по кинетике и кривые зависимости доза-ответ для coeдинeния [35S]TBPS анализируют способом нелинейной регрессии с использованием компьютеризированной повторяющейся процедуры для получения значений констант скорости и IC50 (концентрации соединения, при которой происходит половина от максимального ингибирования основного связывания [35 S]TBPS).
Проводят скрининг различных соединений с целью установления их активности как модуляторов связывания [35S]TBPS in vitro. Эти анализы проводят в соответствии с описанными выше процедурами. На основе этих анализов устанавливают требования структура-активность для специфичного взаимодействия на GRC и порядка их активности и эффективности. Экспериментальные данные, полученные с помощью этого анализа для ряда производных 3α-гидроксипрегнан-20-она, обсуждают Gee K.W. et al., European Journal of Pharmacology, 136:419-423 (1987) и в Патенте США 5232917. В табл. 1 представлены значения IC50 и максимума ингибирования (Imax) для множества соединений, в том числе примеров соединений, описанных и заявленных здесь. IC50 определяют как концентрацию соединений, ингибирующую 50% контрольного связывания [35S]TBPS. Это является показателем активности соединения in vitro. Максимум ингибирования является показателем эффективности соединения in vitro.
Как видно из табл.1, 3α-гидрокси-5α-прегнан-20-он, 3α,21-дигидрокси-5α-прегнан-20-он и соединения, представленные в настоящем изобретении, имеют низкое значение IC50, которое является концентрацией, необходимой для достижения 50% от максимума ингибирования связывания [35S]TBPS, в то время, как соединения такие, как половые стероиды (R5020, эстрадиол и прогестерон), глюкокортикоиды (кортикостерон) и холестерин, имеющие высокое значение IC50, являются в основном неактивными. Таким образом, принимают, что гормональные стероиды и холестерин per se не будут иметь никакой терапевтической ценности для описанных здесь случаев. Для того чтобы разграничить этот уникальный класс стероидов и гормональные стероиды, их теперь называют "нейроактивные стероиды". Однако половые стероиды, такие как прогестерон, могут метаболизироваться в теле в стероиды, подобные 3α-гидрокси-5α-прегнан-20-ону. Таким образом, прогестерон может рассматриваться как "нейроактивное стероидное" пролекарство. Данные по TBPS хорошо коррелируют с данными по поглощению иона36Cl, потенцированному различными 3α -гидроксилированными стероидами, описанными Purdy R.H. et al., J. Med. Chem 33:1572-1581 (1990). Эти данные также хорошо коррелируют с электрофизиологическими данными, полученными измерением активности стероидов при потенцировании ГАМК-индуцируемого тока в яйцеклетках, инъецированных рецепторами ГАМК человека, как описывает Hawkinson J.E. et al. , Vol. Pharmacol. 46:977-985 (1995). Это указывает на то, что анализ TBPS является подходящим способом измерения способности стероидов к аллостерической модуляции активности канала Cl-.
Соединения с ограниченной
активностью
В той мере, в какой желательная терапевтическая активность предоставлялась бы пациенту при минимуме нежелательных побочных
эффектов, это изобретение также включает открытие новых
агонистов с частичной активностью. (табл. 1, соединения с Imax<110%). Для пациентов, которые желают облегчить состояние
тревоги или судороги, снотворный эффект нежелателен. Для
пациентов, которые желают облегчения бессонницы, нежелательны эффекты анестезии. Ожидается, что соединения, описанные как агонисты с частичной
активностью, обладают желательным эффектом при
минимальных нежелательных побочных эффектах.
Преимущества перед прогестероном
Корреляции между пониженными уровнями
прогестерона и симптомами, ассоциированными в PMS, PND и
менструальной эпилепсией (Backstrom et al., J. Psychosom. Obstet. Gynaecol. 2:8-20 (1983); Dalton К., Premenstual Syndrome and Progesterone
Therapy, 2nd edition, Chicago Yaerbook, Chicago (1984)),
привели к использованию прогестерона в их лечении (Mattson et al., "Medroxyprogesterone therapy of canamenial epilepsy" в Advances in
epileptology: XV th Epilepsy International Symposium, Raven Press,
New York (1984) pp. 279-282; Dalton, K., Premenstual Syndrome and Progesterone Therapy, 2nd edition, Chicago Yaerbook, Chicago (1984)
1984). Однако прогестерон не является последовательно
эффективным при лечении вышеупомянутых синдромов. Например, для прогестерона не существует связи доза-ответ при лечении PMS (Maddocks et al.,
1986). Эти результаты являются предсказуемыми в свете
результатов наших исследований in vitro, которые демонстрируют, что прогестерон имеет очень низкую активность в отношении GRC, как видно из табл.
1, по сравнению с нейроактивными стероидами,
описанными в этом изобретении.
Благоприятный эффект прогестерона, возможно, связан с различными превращениями прогестерона в активные метаболиты прогестерона, которые действуют на рецептор ГАМКA. Применение специфических нейроактивных стероидов в лечении вышеупомянутых синдромов четко превосходит применение прогестерона ввиду высокой активности и эффективности этих соединений (См. Gee et al., European Journal of Pharmacology, 136:419-423 (1987) и табл. 1).
Отсутствие гормональных побочных эффектов
Продемонстрировано также, что у
нейроактивных стероидов отсутствуют гормональные побочные эффекты ввиду отсутствия сродства к прогестероновому и иным рецепторам стероидных гормонов (табл. 2-5).
Представленные данные получают,
проводя анализы в соответствии с процедурами, описанными ранее для установления эффекта метаболитов прогестерона и их производных и прогестина R5020 на связывание [3H]R5020 с
прогестероновым рецептором в матке крыс (Gee et al. , Journal of Pharmacology and Experimental Therapeutics 246:803-812 (1988).
3H-прогестерон (0,15 нМ) инкубируют с цитозолем матки крыс в присутствии тестируемых соединений. Специфическое связывание устанавливают после инкубирования и сравнивают с контрольным инкубированием без соединений. Результаты выражают в процентах ингибирования связывания. Если соединения связывают прогестероновый рецептор с высокой аффинностью, следовало бы ожидать 100% ингибирование связывания при тестируемой концентрации.
Различные гормональные активности представителей нейроактивных стероидов далее изучают тестированием их потенциальной эстрогенной, минералокортикоидной и глюкокортикоидной активностей. Эти активности анализируют мониторингом способности соединений ингибировать связывание стероидных гормонов с их соответствующими гормональными рецепторами. Результаты представлены в табл. 3-5. Их выражают, как процент ингибирования связывания3H-лиганда с различными рецепторами стероидных гормонов для соединений в концентрации 10-6 М. Контрольные значения представляют связывание при отсутствии тестируемых соединений.
В табл. 4 крысам делают резекцию надпочечников за 3 суток до умерщвления. Для выделения минералокортикоидного рецептора готовят фракции цитозоля головного мозга, как описано Gee et al., Journal of Pharmacology and Experimental Therapeutics 246:803-812 (1988). Лекарственные средства инкубируют с 3 нМ3 H-альдостероном (специфичный лиганд минералокортикоидного рецептора) в присутствии селективного агониста типа II RU28362 (0,5 мкМ), который блокирует связывание3H-альдостерона с (глюкоротикоидными) рецепторами типа II.
Для табл. 4 фракции цитозоля головного мозга получают, как для табл. 3, и соединения инкубируют с 3 нМ3 H-дексаметазона (специфичный лиганд глюкокортикоидного рецептора).
В табл. 5 представляют ингибирование связывания3H-эстрадиола (специфичного лиганда рецептора эстрогена) с цитозолем матки коровы, приготовленным, как описано ранее Gee et al., Journal of Pharmacology and Experimental Therapeutics 246:803-812 (1988).3H-эстрадиол (0,15 нМ) инкубируют с цитозолем в присутствии соединений.
Результаты этих экспериментов ясно показывают, что нейроактивные стероиды не имеют сильного сродства ни к одному из вышеупомянутых стероидных рецепторов. Таким образом, они не будут давать гормональные побочные эффекты, которые были бы ассоциированы с такими стероидными рецепторами. Нейроактивный стероид 3α-гидрокси-3β -метил-5α -прегнан-20-он далее тестируют in vivo и показывают, что он также не обладает никакой гормональной активностью при введении животным in vivo.
Противосудорожная
активность
Проводят также эксперименты для установления физиологического соответствия взаимодействий нейроактивного стероида и рецептора ГАМК по оценке способности соединений, представленных
в изобретении,
предотвращать индуцированные метразолом судороги у мышей. Мышам инъецируют различные дозы тестируемых соединений, представленных в изобретении, за 10 минут до инъекции метразола. Время
начала
миоклонии (наличие клонической активности передних конечностей), индуцированной метразолом, определяют, наблюдая за каждой мышью в течение 30 минут. У контрольных мышей метразол (85 мг/кг)
будет
индуцировать судороги у 95% животных. Способность некоторых соединений изобретения и используемых в нем защищать мышей от судорог показана в табл. 6.
Способность синтетических нейроактивных стероидов защищать животных от других химических агентов, вызывающих судороги, далее продемонстрирована для нескольких соединений, представленных в настоящем изобретении. Тесты на противосудорожную активность близки вышеописанным. Используют следующие химические агенты, вызывающие судороги: метразол (85 мг/кг); сикуллин (2,7 мг/кг); пикротоксин (3,15 мг/кг); стрихнин (1,25 мг/кг) или носитель (0,9% солевой раствор). Сразу после инъекции агента, вызывающего судороги, или носителя за мышами наблюдают в течение от 30 до 45 минут. Записывают число животных с тоническими и/или клоническими судорогами. В тесте с использованием максимального электрошока ток 50 мА, 60 Гц подводят через корнеальные электроды в течение 200 мс с целью индукции тонического припадка. Способность соединений устранять тонический компонент определяют как конечную точку. Общий потенциал депрессии центральной нервной системы (ЦНС) устанавливают тестом вращающегося стержня через 10 минут после инъекции соединений, в котором определяют число мышей, остающихся на вращающемся стрежне (6 об/мин) через 1 минуту в одном из трех опытов. ED50 (доза, при которой наблюдается половинный от максимума эффект) устанавливают для каждого испытания и представляют в табл. 7 infra. Результаты демонстрируют, что нейроактивные стероиды в сравнении с другими используемыми в клинике противосудорожными агентами являются высоко эффективными и имеют профили, близкие к таковым клоназепама из группы бензодиазепинов. Эти наблюдения показывают терапевтическую пригодность этих соединений как модуляторов возбудимости головного мозга, что согласуется с их высоко аффинным взаимодействием с комплексом GRC in vitro.
Успокаивающее действие
Следующие
эксперименты
демонстрируют, что соединения, представленные в настоящем изобретении, являются эффективными успокаивающими агентами для человека на двух моделях на животных. Результаты этих определений
относительно
других соединений, представленных в настоящем изобретении, представлены в табл. 8 и 9. Двумя моделями на животных, используемыми для измерения поведенческих эффектов соединений против
состояния
тревоги, являются приподнятый крестообразный лабиринт и конфликтный тест Geller-Seifter.
А. Приподнятый крестообразный лабиринт
Теоретическая основа для теста с
приподнятым
крестообразным лабиринтом близка к таковой теста перемещений из света в темноту. Как описано Pellow et al. , J. Neurosci. Meth. 14:149-167 (1985), устройство приподнятого крестообразного
лабиринта
разработано для использования природного избегания мышами открытых пространств. Устройство состоит из двух открытых коридоров и двух закрытых коридоров. Тест с использованием приподнятого
крестообразного лабиринта позволяет делать два измерения состояния тревоги - определение числа выходов в открытые коридоры и времени, проведенного в открытых коридорах, которые выражают в процентах
от
общего числа выходов и проведенного времени в/на открытых и закрытых коридорах.
Самцов мышей N. I. H. Swiss-Webster (Harlan, Indianapolis, IN) массой 15-20 г помещают по четыре/клетку в полиэтиленовые клетки с покрытием опилками. В комнате, где содержат животных, контролируют условия среды (22oС) при 12-часовом цикле свет/темнота (0600-1800 ч). Корм и воду дают ad libitum за исключением периода тестирования. Эксперименты проводят в течение 0700-1500 ч, и группы уравновешивают по времени дневных эффектов. Мышам только вводят однократно лекарство или носитель.
Используемый способ описан ранее (Lister, Psychoparmacol. 92:180-185 (1987)). Устройство включает два открытых коридора, перпендикулярных двум закрытым коридорам, которые приподняты от пола на 50 см. Каждый коридор имеет длину 50 см и стенки у закрытых коридоров высотой 40 см. Лабиринт полностью сделан из черного плексигласа. Над каждым из открытых коридоров помещают лампы накаливания по 200 Вт, чтобы создать сильный контраст между открытыми и закрытыми коридорами.
Через 10 минут после инъекции мышей N.I.H. Swiss-Webster помещают в центр крестообразного лабиринта мордой к открытому коридору. В течение 5-минутного тест-периода измеряют число выходов в открытые коридоры и закрытые коридоры, а также время, проведенное в открытых коридорах и закрытых коридорах. Все четыре лапы должны находиться в коридоре, чтобы зависимая вариация была отмечена. Вследствие этого, время пребывания в центре лабиринта не считают, при этом общее время, проведенное в открытых коридорах и закрытых коридорах, может не быть равным 5 мин.
В табл. 8 приводят суммарные данные успокаивающих активностей соединений, представленных в настоящем изобретении, используя приподнятый крестообразный лабиринт в тех же условиях, что описано выше.
В. Конфликтный тест Geller-Seifter
В этой модели на животных,
имитирующей состояние тревоги
человека, используют условное состояние конфликта у крыс для установления свойств лекарств против состояния тревоги. Крыс приучают нажимать пластинку для положительного
подкрепления при двух режимах
поведения (Geller and Seifter, Psychopharmacologia 1:482-492 (1960)). Первый предусматривает нажимание на пластинку при режиме с изменяющейся скоростью без наказания.
Второй компонент является режимом
с фиксированным соотношением, при котором каждое нажатие на пластинку приводит к положительному подкреплению и наказанию. Компонент наказания образует состояние
конфликта у животного. Компонент без
наказания позволяет наблюдать любые ответы на эффекты депрессанта, которыми может обладать лекарственное средство. Ответ против состояния тревоги повышал бы ответ
с наказанием без влияния на ответ без
наказания.
В конфликтных экспериментах используют самцов белых крыс Sprague-Dawley (Charles River Labs, Wilmington, MA) массой 250-300 г, их держат на ограниченном питании гранулированным кормом Purina Lab Chow при доступности воды в любое время для поддержания массы тела на 85% уровне от уровня свободно питающихся молодых зрелых животных. Крыс помещают отдельно при 12-часовом цикле свет-темнота с освещением в период 0700-1900.
Эффекты против состояния тревоги (наказание-уменьшение наказания) и против депрессии соединений, представленных в настоящем изобретении, измеряют у крыс конфликтным тестом Geller и Seifter (1960). В этом 63-минутном тесте голодные крысы в ответ на нажатие рычага получают как поощрение подслащенное молоко. Режим подкрепления состоит из компонентов наказания и отсутствия наказания, меняющихся каждые 15 минут. Крыс обучают в тест-камерах (Coulbourn instruments) с рычагом, повешенным на одну стенку, маленьким поильником, который выдает как поощрение 0,1 мл молока (1 часть концентрированного молока Eagle:2 части воды), и полом из металлической сетки, через который производят наказание в виде удара тока по лапам. Для программирования и записи используют управляемый SKED (State Systems) миникомпьютер DEC PDP 11/73.
Сначала крысы обучаются отвечать на режим непрерывного подкрепления и быстро усваивают режимы с изменяющимися 30-секундным, 1-минутным и 2-минутным интервалами (VI). При режиме непрерывного подкрепления крысы получают как поощрение молоко после каждого нажатия на рычаг; при режиме VI поощрение в виде молока доступно через нечастые и изменяющиеся интервалы, случающиеся в среднем один раз каждые 2 мин. Затем в основной режим VI без наказания вводят 3-минутные "конфликтные" периоды; первый начинается через 3 мин проведения VI, а другие изменяются между 12-минутными периодами ответа VI. Во время конфликтных периодов, которые сопровождаются сигналом в виде света и звука, режим непрерывного подкрепления снова появляется, и каждое нажатие на рычаг дает как поощрение в виде молока, так и наказание в виде короткого (0,25 мс) удара тока по лапам. Интенсивность удара вначале составляет 0,2 мА и повышается ежедневно на 0.02 мА для постепенного подавления нажимания на рычаг до 5 или менее ответов за конфликтный период. Это обучение занимает 4-6 недель, после чего отмечают стабильно низкое количество ответов во время конфликтных периодов и стабильно высокое количество в периоды отсутствия наказаний. Индуцированное лекарствами повышение количества наказанных ответов принимают за показатель активности против состояния тревоги, тогда как снижение количества ненаказанных ответов принимают за показатель ответной депрессии или седативного эффекта.
В табл. 9 представляют суммарные данные активности против состояния тревоги соединения, представленного в настоящем изобретении, в тесте Geller-Seifer в условиях эксперимента, описанных выше. Вероятно, ожидают, что оставшиеся соединения, представленные в настоящем изобретении, приводят к повышению уровня наказанных ответов в тесте Geller-Seifer и ожидают, что они обладают активностью против состояния тревоги.
Пролекарства
Противосудорожная активность пролекарственных форм
(эфир 3α-изобутирата) базовых соединений 3α
-гидрокси-17β-метокси-5α-андростана представлена на чертеже.
Процент защиты этой пролекарственной формой 3α-гидрокси-17β-метокси-5α-андростана от индуцированных метразолом припадков рассчитывают относительно времени после введения соединений (см. чертеж). Понятно, что это соединение используют как экспериментальный образец для иллюстрации применения пролекарств. В противоположность бензодиазепинам, нейроактивные стероиды могут также индуцировать анестезию. Их способность индуцировать анестезию, как считают, обусловлена их способностью открывать канал ионов хлорида в отсутствие ГАМК, это свойство, которым не обладают бензодиазепины. Поэтому нейростероиды могут действовать прямо на рецептор при отсутствии ГАМК, а также "косвенно" в присутствии ГАМК. Это "косвенное" действие называют "модуляцией" рецептора. Lambert et al., Trends Pharmacology Science 8:224-227 (1987).
Соединения, представленные в изобретении и применяемые в нем, могут быть также использованы при показаниях для анестезии в высоких дозах. Однако предпочтительным способом введения для индукции анестезии является внутривенное (i.v.) введение. У животных анестезирующие свойства лекарственных средств измеряют по способности лекарственных средств приводить к потере установочного рефлекса. Потерю установочного рефлекса определяют как неспособность животного встать в течение 30 с после того, как его кладут на спину. Мышам вводят лекарственное средство внутривенно в латеральную хвостовую вену. После введения мышей кладут на спину и наблюдают за потерей установочного рефлекса. Иллюстрирующие результаты приведены в табл. 10.
Принимают, что пролекарства с подобными модификациями, как описано выше, соединений, представленных и использованных в изобретении, будут иметь активность в качестве пролекарств.
Реферат
Изобретение описывает новые нейроактивные стероиды ряда андростана или прегнана общей формулы I, или их физиологически приемлемые сложные 3-эфиры, где R - Н или низшая алкоксигруппа, R1 - Н, С1-10 алкил, С2-10 алкенил, С2-10 алкинил, галоген С1-10 алкил, тригалоген-С1-10 алкил, гидрокси-С2-10 алкинил, алкокси-С1-10 алкил, необязательно замещенный фенилалкинил, сложный гемиэфир гидроксиалкинилдикарбоновой кислоты; R2 - Н или кетогруппа, R3 - необязательно замещенная алкокси-, алкинилокси-, необязательно замещенная финилалкинилоксигруппа, -С(O)-СН2-Y-G, C(O)-CH2-O-D, -C(O)-CH2-O-E, -C(O)-CH2-Z-G или -C(O)-CH2-Y-Z-A, где Y - O, S, SO или SO2; Z - С1-10 алкил, G - пиридил или необязательно замещенный фенил, D - хинолин, присоединенный к атому углерода; Е - необязательно замещенный фенил, А-ОН, карбоксил или сульфонат; R4 - Н или метил; R5 - Н; R6 - Н; R7 - Н или ОН; R8 - Н; R9 - Н; R10 - Н при условии, что когда R3 - С1-3 алкоксигруппа и R - Н, то R1 отличен от Н; когда R3 - С1-4 алкокси (С1-4) алкоксигруппа, то R1 - от Н или 1-пропенила; когда R3 - -С(О)-СН2-Y-G и G - пиридил, присоединенный к атому углерода, то R1 отличен от Н или С1-10 алкила; или когда R3 - -С(О)-СН2-Z-G, то R1 отличен от Н. Соединения I способны воздействовать на возбудимость мозга таким образом, чтобы облегчить стресс, состояние тревоги, бессонницу, нарушения настроения, обусловленные активными в отношении GRC агентами. 10 с. и 29 з.п. ф-лы, 1 ил., 10 табл.


Формула

или их физиологически приемлемые сложные 3-эфиры,
где R означает водород или низшую алкоксигруппу;
R1 означает водород, С1-10алкил, С2-10алкенил, С2-10алкинил, галогенС1-10алкил, тригалогенС1-10алкил, гидроксиС2-10алкинил, алкоксиС1-10алкил, необязательно замещенный фенил, алкоксиС2-10алкинил, оксоалкинил или его кеталь, необязательно замещенный фенилалкинил, сложный гемиэфир гидроксиалкинилдикарбоновой кислоты;
R2 означает водород или кетогруппу;
R3 означает необязательно замещенную алкокси-, алкинилокси-, необязательно замещенную фенилалкинилоксигруппу, -C(O)-CH2-Y-G, -С(O)-CH2-O-D, -C(O)-CH2-O-E, -C(O)-CH2-Z-G или -C(O)-CH2-Y-Z-A, где
Y обозначает О, S, SO или SO2;
Z обозначает С1-10алкил;
G обозначает пиридил или необязательно замещенный фенил;
D обозначает хинолин, присоединенный к атому углерода;
Е - необязательно замещенный фенил;
А обозначает гидроксил, карбоксил или сульфонат;
R4 обозначает водород или метил;
R5 - водород;
R6 - водород;
R7 - водород или гидроксил;
R8 - водород;
R9 - водород;
R10 - водород;
при условии, что когда R3 - С1-3 алкоксигруппа и R - водород, то R1 - отличен от водорода; когда R3 - С1-4алкокси(С1-4)алкоксигруппа, то R1 - отличен от водорода или 1-пропенила; когда R3 - -C(O)-CH2-Y-G и G - пиридил, присоединенный к атому углерода, то R1 - отличен от водорода или С1-10алкила; или когда R3 - -C(O)-CH2-Z-G, то R1 - отличен от водорода.
гидрокси-3β -[2-(3', 4'-диметоксифенил)этинил] -17β-метокси-5β-андростан; 3α -гидрокси-3β-(4'-метилфенил)этинил-17β-метокси-5β-андростан; 3β -(4'-трифторметилфенил)этинил-3α-гидрокси-17β-метокси-5β-андростан; 3α -гидрокси-3β-(2'-метоксифенил)этинил-17β-метокси-5β-андростан; 3β -(4'-диметиламинофенил)этинил-3α-гидрокси-17β-метокси-5β-андростан; 3β -(4'-ацетилфенил)этинил-3α-гидрокси-17β-метокси-5β-андростан; 3β -(4'-хлорфенил)этинил-3α-гидрокси-17β-метокси-5β-андростан; 3β -(4'-aцeтилфeнил)этинил-3α-гидpoкcи-17β-мeтoкcи-5α-aндpocтaн; этилoвый эфиp 3β -(4'-карбоксифенилэтинил)-3α-гидрокси-17β-метокси-5β-андростана; 3α -гидрокси-3β-(4'-ацетоксиацетилфенил)этинил-17β-метокси-5β-андростан или 3β -(4'-цианофенил)этинил-3α-гидрокси-17β-метокси-5β-андростан.
этиловый эфир 3β-(4'-карбоксифенилэтинил)-3α-гидрокси-19-нор-17β -метокси-5β-андростана; этиловый эфир 3β-(4'-карбоксифенилэтинил)-3α-гидрокси-17β -метокси-5α-андростана; 3β-[4'-(N, N-диэтилкарбоксиамидо)фенил] этинил-3α-гидрокси-17β-метокси-5β-андростан или 3β-(4'-ацетоксифенилэтинил)-3α -гидрокси-17β-метокси-5β-андростан.
метокси-5β-андростан; 3α-гидрокси-3β -[2-(3', 4'-диметоксифенил)этил] -17β -метокси-5β-андростан или 3α -гидрокси-3β-фенил-17β-метокси-5β-андростан.
бутинил)-3α-гидрокси-17β-метокси-5α-андростан-4'-гемисукцинат; 3β-(4'-гидрокси-1'-бутинил)-3α-гидрокси-17β-метокси-5β -19-норандростан; натриевая соль 3β-(4'-гидрокси-1'-бутинил)-3α-гидрокси-17β-метокси-5β-19-норандростан-4'-гемисукцинат; 3β-[3'(R/S)-гидрокси-1'-бутинил)] -3α -гидрокси-17β-метокси-5α-андростан или 3β-(3'-гидрокси-1'-пропинил)-3α-гидрокси-17β-метокси-5β-андростан.
3β-пентинил-3α-гидрокси-17β-метокси-5β-андростан; 3β-циклопропилэтинил-3α -гидрокси-17β-метокси-5β-андростан; 3β-(бут-3'-ен-1'-инил)-3α-гидрокси-17β-метокси-5β-андростан; 3β-(3'-метилбут-2'-ен-1'-инил)-3α -гидрокси-17β-метокси-5β-андростан или 3β-гексинил-3α-гидрокси-17β-метокси-5β-андростан.
3β-бутил-3α-гидрокси-17β-метокси-5β-андростан; 3β -метил-3α-гидрокси-17β-метокси-5α-андростан; 3β-пентил-3α-гидрокси-17β-метокси-5β-андростан;
3β-гексил-3α-гидрокси-17β -метокси-5β-андростан; 3β-трифторметил-3α-гидрокси-17β-метокси-5α-андростан; 3β-трифторметил-3α-гидрокси-17β-метокси-5β-андростан; 3β-фторметил-3α-гидрокси-17β-метокси-5α-андростан; 3β-бромметил-3α-гидрокси-17β-метокси-5α-андростан; 3β-иодметил-3α-
гидрокси-17β-метокси-5α-андростан; 3β-хлорметил-3α-гидрокси-17β-метокси-5α-андростан; 3β-метоксиметил-3α-гидрокси-17β-метокси-5α -андростан; 3β-этоксиметил-3α-гидрокси-17β-метокси-5α-андростан; 3β-пропоксиметил-3α-гидрокси-17β-метокси-5α-андростан; 3β -изопропоксиметил-3α-гидрокси-17β-метокси-5α-андростан; 3β-цианометил-3α-гидрокси-17β-метокси-5α-андростан.
G обозначает пиридил; R4 - водород или метил; и R5, R6, R7, R8, R9 и R10 - каждый означает водород, при условии, что когда R3 означает -C(O)-CH2-Y-G и G обозначает пиридил, то R1 - отличен от водорода или С1-10алкила.
3α-гидрокси-3β -метоксиметил-21-(4'-нитрофенилтио)-5α-прегнан-20-он; 3α-гидрокси-3β-метоксиметил-21-(4'-нитрофенилсульфинил)-5α-прегнан-20-
он; 3α-гидрокси-3β -метоксиметил-21-(4'-нитрофенилсульфонил)-5α-прегнан-20-он; 21-(4'-фторфенилтио)-3α-гидрокси-3β-метоксиметил-5α-прегнан-20-он; 21-(4'-фторфенил)сульфонил-3α -гидрокси-3β-метоксиметил-5α-прегнан-20-он;
3α-гидрокси-3β-метоксиметил-21-(4'-пирролидинофенил)сульфонил-5α-прегнан-20-онил и 21-(4'-аминофенилтио)-3α-гидрокси-3β-метоксиметил-5α-прегнан-20-он. 26. Соединение по п. 1, отличающееся тем, что оно представляет собой 3α -гидрокси-21-(пирид-4-илтио)-5β-прегнан-20-он; 3α-гидрокси-21-(пирид-3-илокси)-5β-прегнан-20-он; 21-(4'-диметиламинофенокси)-3α-гидрокси-3β-метил-5α -прегнан-20-он; 3α-гидрокси-3β-метил-21-(4'-нитрофенокси)-5α-прегнан-20-он; иодид 3α-гидрокси-3β-метил-21-(4'-триметиламмонийфенокси)-5α-прегнан-20-он; иодид 3α-гидрокси-2β-пропокси-21-(4'-N, N, N-триметиламмонийфенокси)-5α-прегнан-20-он; 3α-гидрокси-3β-метил-21-(хинолин-6-илокси)-5α-прегнан-20-он N-метилиодид; 3α-гидрокси-3β-метил-21-(хинолин-6-илокси)-5α-прегнан-20-он.
натриевую соль 3α-гидрокси-2β-пропокси-21-сульфонилпропансульфат-5α-прегнан-20-она или 3α-гидрокси-21-(2'-гидроксиэтилтио)-5β-прегнан-20-он.

Комментарии