Новые аминоалкилбензотиазепиновые производные и их применение - RU2679891C2
Код документа: RU2679891C2
Описание
Область техники
Настоящее изобретение относится к новому аминоалкилбензотиазепиновому производному или его фармацевтически приемлемой соли и к фармацевтической композиции для предупреждения или лечения запора, содержащей их в качестве активного ингредиента.
Предшествующий уровень техники
Запор представляет собой общее заболевание пищеварительного тракта, имеющее коэффициент распространенности в Корее примерно 16%. Оно встречается чаще у женщин, чем у мужчин, и коэффициент распространенности выше у пожилых людей, что составляет примерно от 30% до 40%. Из-за дискомфорта и серьезных последствий для повседневной жизни запор был определен в качестве второй наиболее важной причины, ассоциированной с отсутствием, для рабочих в западных странах, и сообщается, что некоторые пациенты с запором испытывают серьезное ухудшение качества их жизни.
В настоящее время для лечения запора широко используют стимулирующие слабительные средства и размягчители стула. Стимулирующие слабительные средства препятствуют абсорбции воды в толстой кишке и стимулируют перистальтику толстой кишки, и широко используют Senna™ и Bisacodyl™. Кроме того, размягчители стула увеличивают абсорбцию воды фекалиями в результате снижения поверхностного натяжения фекалий, и типичный пример представляет собой Docusate™. Однако эти стимулирующие слабительные средства и размягчители стула могут давать только временные эффекты и могут развивать устойчивость и, таким образом, не рекомендуются для длительного применения.
В то же время, в печени из холестерина образуются желчные кислоты, хранятся в желчном пузыре и выделяются в тонкий кишечник для облегчения переваривания питательных веществ, таких как липиды и витамины, после еды. Примерно 90% желчных кислот резорбируется в печени, но и транспортируется в нижний отдел тонкого кишечника. Подавление резорбции желчных кислот лекарственным средством приводит к перемещению желчных кислот в толстую кишку и индуцирует стимулирование выделения воды в толстой кишке и кишечную перистальтику в этом месте, и является, таким образом, полезным для предупреждения и лечения запора (American Journal of Gastroenterology, 2011, 106: 2154-2163).
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Техническая проблема
Авторы настоящего изобретения, предпринимая усилия по разработке нового соединения для применения для предупреждения и лечения запора, обнаружили, что ряд аминоалкилбензотиазепиновых производных может эффективно подавлять резорбцию желчных кислот и является, таким образом, полезным для предупреждения и лечения запора, тем самым завершая настоящее изобретение.
Техническое решение
В одном аспекте настоящего изобретения предложено соединение, представленное Формулой 1 ниже, или его фармацевтически приемлемая соль:
Формула 1

где
R1 представляет собой гидрокси, карбокси или гидроксисульфонил(C1-4алкил);
R2 и R3, каждый, независимо представляют собой водород, C1-4алкил, гидрокси(C1-4алкил), карбамоил(C1-4алкил), карбокси, карбокси(C1-4алкил), (С5-10гетероарил)(C1-4алкил) или (С5-10арил)(C1-4алкил), или R2 и R3) взятые вместе с соответствующим атомом углерода, к которому они присоединены, образуют С3-7циклоалкилен;
R4 представляет собой водород или карбокси(C1-4алкил);
R5 представляет собой водород, галоген, (C1-4алкил)тио, (C1-4алкил)амино или ди(C1-4алкил)амино;
R6 и R7, каждый, независимо представляют собой С1-6алкил;
R8 и R9, каждый, независимо представляют собой водород, гидрокси, C1-4алкокси, C1-4алкил, галоген, нитро, циано, амино, (C1-4алкил)амино, ди(C1-4алкил)амино, ацетамидо, формил, C1-4алканоил, карбокси, карбамоил, (C1-4алкил)карбамоил, ди(C1-4алкил)карбамоил, карбамоилокси, (C1-4алкил)карбамоилокси, ди(C1-4алкил)карбамоилокси, (C1-4алкил)сульфонилокси, сульфамоилокси, (C1-4алкил)сульфамоилокси или ди(C1-4алкил)сульфамоилокси;
Q представляет собой С5-10арил или С5-10гетероарил; и
n представляет собой целое число от 0 до 3.
Предпочтительно в Формуле 1 выше,
R1 представляет собой гидрокси, карбокси или гидроксисульфонил(C1-4алкил);
R2 и R3, каждый, независимо представляют собой водород, С1-4алкил, гидрокси(C1-4алкил), карбамоил(C1-4алкил), карбокси, карбокси(C1-4алкил) или (С5-10гетероарил)(C1-4алкил), или R2 и R3, взятые вместе с соответствующим атомом углерода, к которому они присоединены, образуют С3-7циклоалкилен;
R4 представляет собой водород или карбокси(C1-4алкил);
R5 представляет собой (C1-4алкил)тио;
R6 и R7, каждый, независимо представляют собой С1-6алкил;
R8 и R9, каждый, независимо представляют собой водород, гидрокси, галоген или С1-4алкокси;
Q представляет собой С5-10арил; и
n представляет собой целое число от 0 до 3.
Предпочтительно, в Формуле 1 выше R1 может представлять собой гидрокси, карбокси или гидроксисульфонилметил.
Предпочтительно, в Формуле 1 выше R2 и R3, каждый, независимо может представлять собой водород, карбокси, метил, изобутил, карбамоилметил, карбоксиметил, карбоксиэтил, гидрокси метил, имидазолилметил, индолилметил или этил, или R2 и R3, взятые вместе с соответствующим атомом углерода, к которому они присоединены, могут образовывать циклопропилен.
Предпочтительно, в Формуле 1 выше R4 может представлять собой водород, карбоксиметил или карбоксиэтил.
Предпочтительно, в Формуле 1 выше R5 может представлять собой метилтио, этилтио или диметиламино.
Предпочтительно, в Формуле 1 выше R6 и R7 оба могут представлять собой бутил или этил.
Предпочтительно, в Формуле 1 выше R8 и R9, каждый, независимо может представлять собой водород, гидрокси, метокси, метил, этил, фтор, хлор, нитро, циано, амино, метиламино, этиламино, диметиламино, ацетил, карбокси, карбамоил, метилкарбамоил, диметилкарбамоил, карбамоилокси, метилкарбамоилокси, диметилкарбамоилокси, метилсульфонилокси, сульфамоилокси, метилсульфамоилокси или диметилсульфамоилокси.
Предпочтительно, в Формуле 1 выше Q может представлять собой фенил, пиридинил, пиримидинил или тиофенил. Согласно Формуле 1 выше Q может представлять собой фенил, пиридинил, пиримидинил или тиофенил, которые замещены R8 и R9. В Q выше положения заместителей, R8 и R9, не определены, но они могут быть расположены на отличающихся друг от друга атомах, и водород может быть связан в положениях, отличных от этих положений. Таким образом, когда и R8, и R9 представляют собой водород, Q может относиться к фенилу, пиридинилу, пиримидинилу или тиофенилу, которые не замещены.
Более предпочтительно, соединение может представлять собой:
1) 2-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)уксусную кислоту;
2) 3-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)пропионовую кислоту;
3) 2-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)янтарную кислоту;
4) (S)-2-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)пропионовую кислоту;
5) 2-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)пентандиовую кислоту;
6) 4-амино-2-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)-4-оксобутановую кислоту;
7) (R)-2-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)пропионовую кислоту;
8) 2-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)-2-метилпропионовую кислоту;
9) (R)-2-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)-3-(1Н-имидазол-4-ил)пропионовую кислоту;
10) (R)-2-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)-3-(1Н-индол-2-ил)пропионовую кислоту;
11) (S)-2-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)-4-метилпентановую кислоту;
12) (S)-2-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)пентандиовую кислоту;
13) (S)-2-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)-3-гидроксипропионовую кислоту;
14) 3-((карбоксиметил)((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)пропионовую кислоту;
15) 3-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)пентандиовую кислоту;
16) 2-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)-2-оксоуксусную кислоту;
17) 1-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)циклопропанкарбоновую кислоту;
18) 2-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)-2-оксоэтансульфоновую кислоту;
19) 2-(((3,3-дибутил-5-(4-метоксифенил)-7-метилтио-1,1-диоксидо-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)уксусную кислоту;
20) 2-(((3,3-дибутил-5-(4-гидроксифенил)-7-метилтио-1,1-диоксидо-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)уксусную кислоту;
21) 2-(((3,3-дибутил-5-(3-метоксифенил)-7-метилтио-1,1-диоксидо-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)уксусную кислоту;
22) 2-(((3,3-дибутил-5-(4-фторфенил)-7-метилтио-1,1-диоксидо-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)уксусную кислоту;
23) 2-(((3,3-дибутил-5-(3-фторфенил)-7-метилтио-1,1-диоксидо-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)уксусную кислоту;
24) 2-(((3,3-дибутил-5-(3-фтор-4-метоксифенил)-7-метилтио-1,1-диоксидо-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)уксусную кислоту;
25) 2-(((3,3-дибутил-5-(4-метоксифенил)-7-метилтио-1,1-диоксидо-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)-2-оксоэтансульфоновую кислоту;
26) 1-(((3,3-дибутил-5-(3-фтор-4-метоксифенил)-7-метилтио-1,1-диоксидо-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)циклопропанкарбоновую кислоту;
27) 2-(((3,3-дибутил-5-(4-фторфенил)-7-метилтио-1,1-диоксидо-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)-2-оксоуксусную кислоту;
28) (3)-2-(((3,3-дибутил-5-(4-фторфенил)-7-метилтио-1,1-диоксидо-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)пропионовую кислоту;
29) (5)-2-(((3,3-дибутил-5-(4-фторфенил)-7-метилтио-1,1-диоксидо-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)-3-гидроксипропионовую кислоту; и
30) 1-(((3,3-дибутил-5-(4-фторфенил)-7-метилтио-1,1-диоксидо-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)циклопропанкарбоновую кислоту.
Кроме того, соединение по настоящему изобретению может присутствовать в форме фармацевтически приемлемой соли. Что касается соли, то полезными могут быть соли присоединения кислот, образованные фармацевтически приемлемыми свободными кислотами. При использовании в данном описании изобретения, термин "фармацевтически приемлемая соль" относится к любой органической или неорганической соли присоединения указанных выше соединений, которая имеет концентрацию для проявления эффективного действия, являясь относительно нетоксичной и неопасной для пациентов, и неблагоприятные эффекты, возникающие от соли, не ухудшают полезные эффекты соединений, представленных Формулой 1.
Соли присоединения кислот могут быть получены традиционным способом, например, путем растворения соединений в избыточном количестве водного раствора кислоты с последующим осаждением соли в смешивающемся с водой органическом растворителе, например метаноле, этаноле, ацетоне или ацетонитриле. Эквимолярное количество соединения и кислоты или спирта (например гликольмонометилового эфира) в воде нагревают и затем смесь сушат путем упаривания, или осажденную соль можно подвергать фильтрованию с отсасыванием.
Кроме того, фармацевтически приемлемая соль металла может быть получена с использованием основания. Соли щелочных металлов или соли щелочноземельных металлов могут быть получены, например, путем растворения соединения в избыточном количестве раствора гидроксида щелочного металла или гидроксида щелочноземельного металла, фильтрования нерастворяющихся солей соединения, упаривания и сушки фильтрата.
Фармацевтически приемлемая соль по настоящему изобретению, если не указано иначе, может включать соль кислотной или основной группы, которая может присутствовать в соединении Формулы 1, и может быть получена способом получения солей, известным в данной области техники.
Кроме того, соединения по настоящему изобретению имеют центр, асимметрический атом углерода, в исходной структуре и ее группе-заместителе, и, таким образом, они могут присутствовать в виде R или S изомеров, рацематов, смесей стереоизомеров и индивидуальных стереоизомеров, и все эти изомеры и их смеси входят в объем настоящего изобретения.
Например, соединения по настоящему изобретению могут быть синтезированы из амино-алкоксибензолтиола и 3-бром-2-(моно или ди)алкилпропионовой кислоты путем последовательности взаимодействий, показанных на реакционной схеме 1 ниже. Однако реакционная схема, показанная ниже, представляет собой только способ для иллюстративных целей, а способ получения соединений по настоящему изобретению не ограничивается этой схемой, и можно использовать любой способ, известный в данной области техники или скорректированный соответствующим образом для применения.
Реакционная схема 1

Заместители в реакционной схеме выше представляют собой заместители, которые определены выше.
Конкретно, стадия 1 относится к получению соединения, представленного Формулой 4, посредством взаимодействия амино-алкоксибензолтиола (например амино-метоксибензолтиола), который является соединением, представленным Формулой 2, и производного 3-бром-2-(моно или ди)алкилпропионовой кислоты (например 3-бром-2,2-дибутилпропионовой кислоты, также известной как 2-бромметил-2-бутилгексаноата), которое является соединением, представленным Формулой 3. Предпочтительно, но без ограничения, взаимодействие на стадии 1 могут быть выполнено в присутствии гидроксида калия, и воду можно использовать в качестве растворителя.
Стадия 2 относится к циклизации для образования бензотиазепина, в ходе которой производное 3,3-диалкил-8-алкокси-2,3-дигидробензо[b][1,4]тиазепин-4(5Н)-она, представленное Формулой 5, получают посредством взаимодействия представленного Формулой 4 соединения, полученного на стадии 1, с HATU (гексафторфосфатом 1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиний-3-оксида). Предпочтительно, но без ограничения, дихлорметан можно использовать в качестве растворителя для стадии 2.
Стадия 3 относится к введению бром-группы в качестве реакционноспособной группы-заместителя, в ходе которого производное 7-бром-3,3-диалкил-8-алкокси-2,3-дигидробензо[b][1,4]тиазепин-4(5Н)-она, представленное Формулой 6, получают посредством взаимодействия соединения, представленного Формулой 5, полученного на стадии 2, с N-бромсукцинимидом. Предпочтительно, но без ограничения, дихлорметан можно использовать в качестве растворителя для стадии 3. N-галогенсукцинимид, включающий атомы другого галогена, можно использовать вместо N-бромсукцинимида. Что касается атома галогена, то можно использовать без ограничения любой галоген, который может давать заместитель, способный к проявлению достаточной реакционной способности в последующей реакции замещения.
Стадия 4 относится к введению группы-заместителя на атоме азота тиазепинового кольца, которое может быть достигнуто посредством взаимодействия соединения, представленного Формулой 6, полученного на стадии 3, с йодированным соединением, представленным Формулой 7. Предпочтительно, реакцию на стадии 4 можно выполнить в присутствии CuI и в качестве растворителя можно использовать ксилол, но без ограничения.
Стадия 5 относится к удалению кетоновой группы на тиазепиновом кольце путем реакции восстановления, и можно использовать LiAlH4 в качестве восстановителя, но без ограничения, и можно использовать любой, без ограничения, восстановитель, способный превращать -(С=O)- в -СН2- путем избирательного восстановления кетоновой группы в тиазепиновом кольце. Предпочтительно, в качестве растворителя для стадии 5 можно использовать диэтиловый эфир, но без ограничения.
Стадия 6 относится к получению диоксидного производного тиазепина посредством окисления с использованием тетраоксида осмия, и в качестве растворителя для стадии 6 можно использовать, предпочтительно, смешанный растворитель из тетрагидрофурана и трет-бутанола, но без ограничения.
Стадия 7 относится к превращению алкоксигруппы на бензольном кольце в гидроксильную группу, с введением при этом группы-заместителя R5 в положение, в котором реакционноспособный галоген замещается в результате реакции замещения, и в качестве реагента для реакции замещения можно использовать соль металла, например соль щелочного металла (M-R5; М представляет собой щелочной металл) группы-заместителя, которую вводят. Предпочтительно, в качестве растворителя для стадии 7 можно использовать диметилформамид (DMF), но без ограничения.
Стадия 8 относится к превращению гидроксигруппы на бензольном кольце в трифторметансульфонат (трифлат; OTf), который является хорошей уходящей группой, и в качестве реагента для введения OTf можно использовать трифторметансульфоновый ангидрид (TfO2). Предпочтительно, в качестве растворителя для стадии 8 можно использовать дихлорметан, но без ограничения.
Стадия 9 относится к введению цианогруппы в качестве предшественника аминометильной группы, в котором группу OTf замещают группой CN путем взаимодействия соединения, представленного Формулой 13, которое вводят с группой OTf и получают на стадии 8, с цианидом цинка. Предпочтительно, взаимодействие на стадии 9 может быть выполнено в присутствии палладия, и в качестве растворителя можно использовать диметилформамид, но без ограничения.
Стадия 10 относится к превращению цианогруппы в формильную группу посредством взаимодействия соединения, в которое вводят цианогруппу на стадии 9, с гидридом диизобутилалюминия (DIBAL-H). Предпочтительно, в качестве растворителя для стадии 10 можно использовать дихлорметан, но без ограничения.
Стадия 11 относится к получению указанного в заголовке соединения посредством реакции конденсации между соединением, представленным Формулой 15, полученным на стадии 10, и аминным производным. Предпочтительно, взаимодействие на стадии 11 может быть выполнено в присутствии триацетоксиборогидрида натрия (NaB(ОАс)3Н), и в качестве растворителя можно использовать дихлорэтан, но без ограничения.
В другом аспекте настоящего изобретения предложена фармацевтическая композиция для предупреждения или лечения запора, содержащая соединение, представленное Формулой 1, или его фармацевтически приемлемую соль в качестве активного ингредиента.
При использовании в данном описании изобретения термин "предупреждение" относится к любому действию, приводящему к подавлению или задержке наступления, распространения и рецидива запора вследствие введения фармацевтической композиции по настоящему изобретению, и термин "лечение" относится к любому действию, приводящему к облегчению симптомов заболевания(й) или благоприятному изменению от введения композиции по настоящему изобретению.
Фармацевтическая композиция по настоящему изобретению может содержать соединение, представленное Формулой 1, или его фармацевтически приемлемую соль в качестве активного ингредиента, и также может дополнительно содержать фармацевтически приемлемый носитель, разбавитель или эксципиент.
Композицию по настоящему изобретению вводят в фармацевтически эффективном количестве. При использовании в данном описании изобретения термин "фармацевтически эффективное количество" относится к количеству, достаточному для лечения заболеваний с обоснованным соотношением польза/риск, применимым к лекарственному лечению, не вызывающему каких-либо неблагоприятных эффектов, и термин "введение" относится к введению пациенту предварительно определенного вещества конкретным подходящим способом.
При использовании в данном описании изобретения термин "терапевтически эффективное количество", который использовали совместно с активными ингредиентами, относится к количеству аминоалкилбензотиазепиновых производных или их фармацевтически приемлемых солей, которое является эффективным для предупреждения или лечения заболевания(й) субъекта.
Фармацевтическая композиция по настоящему изобретению может дополнительно содержать другое(ие) известное(ые) лекарственное(ые) средство(а), традиционно используемое(ые) для предупреждения или лечения заболевания(ий), в дополнение к аминоалкилбензотиазепиновым производным или их фармацевтически приемлемым солям в качестве активного(ых) ингредиента(ов), в зависимости от заболевания(ий), подлежащего(их) предупреждению или лечению.
Полезные эффекты
Новые аминоалкилбензотиазепиновые производные по настоящему изобретению могут подавлять резорбцию желчных кислот и, таким образом, давать возможность желчным кислотам перемещаться в толстую кишку, индуцируя тем самым выделение воды в толстой кишке и стимулируя перистальтику толстой кишки. Эти результаты показывают, что соединения по настоящему изобретению можно эффективно применять в лечении и предупреждении запора.
Лучший вариант
Ниже настоящее изобретение будет описано более подробно со ссылкой на следующие примеры. Однако эти примеры предназначены только для иллюстративных целей, и не имеется в виду ограничение изобретения посредством этих примеров.
Известны различные способы синтеза исходных веществ для синтеза соединений по настоящему изобретению, и при наличии в продаже, исходные вещества могут быть закуплены у поставщиков. Примеры поставщиков реагентов включают Sigma-Aldrich, TCI, Wako, Kanto, Fluorchem, Acros, Alfa, Fluka и Dae-Jung, но без ограничения ими. Кроме того, все вещества на коммерческом рынке использовали без дополнительной очистки, если не указано иначе.
Предпочтительно, соединения, используемые для синтеза в примерах, получали, как описано в примерах получения. Примеры получения представляют собой типичные воплощения реакционной схемы 1 и могут быть надлежащим образом скорректированы в соответствии со структурами соединений в примерах.
Пример получения 1: Получение 3,3-дибутил-7-метилтио-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-карбальдегид-1,1-диоксида
Стадия 1) Получение 2-(((2-амино-5-метоксифенил)тио)метил)-2-бутилгексановой кислоты
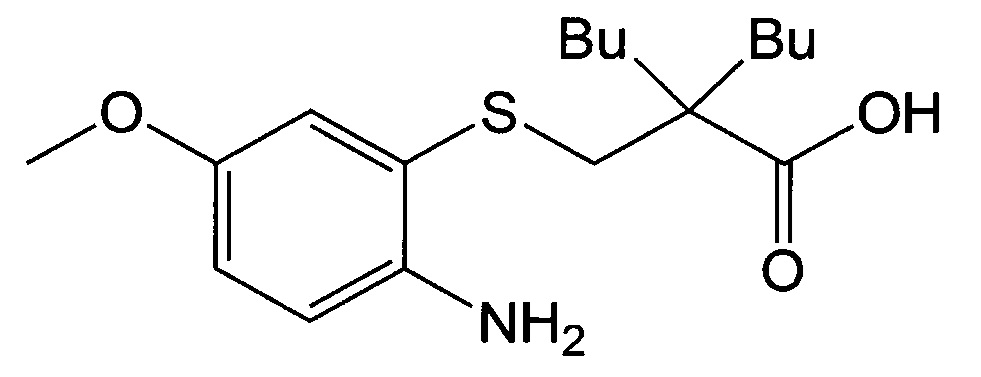
6-Метоксибензо[d]тиазол-2-амин (25 г, 139,7 ммоль) добавляли к 250 мл 30% гидроксида калия и перемешивали при 140°С в течение 18 часов. Реакционную смесь проверяли с помощью тонкослойной хроматографии (ТСХ) для подтверждения образования 2-амино-5-метоксибензолтиола и охлаждали до комнатной температуры. Затем добавляли к ней 2-бромметил-2-бутилгексаноат (44,6 г, 167,7 ммоль) и перемешивали при комнатной температуре в течение примерно 17 часов. Добавляли к ней насыщенный раствор хлорида аммония и дихлорметан, перемешивали в течение 10 минут и дихлорметановый слой экстрагировали, и весь этот процесс повторяли три раза. Дихлорметановый слой сушили над безводным сульфатом магния, фильтровали и затем концентрировали. Полученное таким образом концентрированное соединение заливали метил-трет-бутиловым эфиром и раствором 6 н HCl для экстракции эфирного слоя и затем еще раз концентрировали. Концентрированное соединение представляло собой твердое вещество коричневого цвета и к нему добавляли гексан, перемешивали и фильтровали с получением 25 г твердого вещества цвета слоновой кости с выходом 51%.
Стадия 2) Получение 7-бром-3,3-дибутил-8-метокси-2,3-дигидробензо[b][1,4]тиазепин-4(5Н)-она
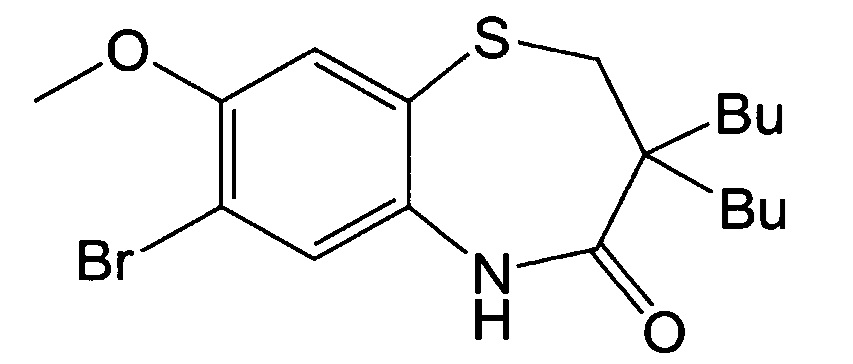
2-(((2-Амино-5-метоксифенил)тио)метил)-2-бутилгексановую кислоту (25 г, 71,78 ммоль), полученную на стадии 1), добавляли к 900 мл дихлорметана и охлаждали до -40°С. Когда температура достигала -40°С, медленно добавляли к ним гексафторфосфат 1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиний-3-оксида (41 г, 107,68 ммоль; HATU) и перемешивали в течение примерно 10 минут. Затем к ним медленно по каплям добавляли диизопропиламин (58,15 мл, 358,9 ммоль). После завершения добавления диизопропиламина смесь перемешивали в течение примерно 5 часов. К ним добавляли насыщенный раствор хлорид аммония и экстрагировали дихлорметановый слой и весь этот процесс повторяли три раза. Экстрагированный дихлорметановый слой сушили над безводным сульфатом магния, фильтровали и затем концентрировали с получением 23 г 3,3-дибутил-8-метокси-2,3-дигидробензо[b][1,4]тиазепин-4(5Н)-она. Полученное таким образом соединение заливали 480 мл дихлорметана и охлаждали до 0°С. После охлаждения медленно добавляли к нему N-бромсукцинимид (14,51 г, 81,54 ммоль) и перемешивали в течение примерно 4 часов. Затем к ним добавляли насыщенный раствор хлорида аммония и экстрагировали дихлорметановый слой. Экстрагированный дихлорметановый слой сушили над безводным сульфатом магния, фильтровали и концентрировали. Концентрированное соединение заливали 200 мл смеси гексана и этилацетата (гексан : этилацетат = 30:1) и дополнительно заливали 200 мл гексана при перемешивании и полученное твердое вещество фильтровали с получением 14 г 7-бром-3,3-дибутил-8-метокси-2,3-дигидробензо[b][1,4]тиазепин-4(5Н)-она в виде указанного в заголовке соединения с выходом 50%.
1Н ЯМР (400 МГц, CDCl3) δ 7.58 (s, 1Н), 6.99 (d, J=2,8 Гц, 1Н), 6.87 (d, J=8,8 Гц, 1Н), 6.77 (dd, J=8,8 Гц, 2,8 Гц, 1Н), 3.78 (s, 3Н), 2.97 (s, 2Н), 1.78-1.85 (m, 2Н), 1.55-1.62 (m, 2Н), 1.18-1.30 (m, 8Н), 0.87 (t, J=6,8 Гц, 6Н).
Стадия 3) Получение диоксида 3,3-дибутил-8-гидрокси-7-метилтио-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепина

7-Бром-3,3-дибутил-8-метокси-2,3-дигидробензо[b][1,4]тиазепин-4(5Н)-он (5,77 г, 14,44 ммоль), полученный на стадии 2, заливали йодбензолом (50 мл), йодидом меди (0,55 г, 2,89 ммоль), карбонатом калия (4 г, 28,9 ммоль) и трис[2-(2-метоксиэтокси)этил]амином (0,5 мл, 1,44 ммоль), перемешивали при комнатной температуре в течение примерно 5 минут и нагревали с обратным холодильником при 190°С в течение 17 часов. Продукт реакции охлаждали до комнатной температуры, фильтровали с использованием диоксида кремния и промывали гексаном для удаления йодбензола. Захваченное диоксидом кремния соединение элюировали этилацетатом и дихлорметаном и восстановленный раствор концентрировали с получением 5,8 г 7-бром-3,3-дибутил-8-метокси-5-фенил-2,3-дигидробензо[b][1,4]тиазепин-4(5Н)-она. Алюмогидрид лития (1,4 г, 36,88 ммоль) добавляли в 500 мл круглодонную колбу и сушили в вакууме. Добавляли в нее диэтиловый эфир (150 мл), охлаждали до -10°С и затем медленно по каплям добавляли в нее безводный сульфат (1 мл, 18,44 ммоль). Полученный таким образом 7-бром-3,3-дибутил-8-метокси-5-фенил-2,3-дигидробензо[b][1,4]тиазепин-4(5Н)-он растворяли в диэтиловом эфире и добавляли по каплям в реакционную колбу. Продукт реакции перемешивали при комнатной температуре в течение 2 часов и заливали насыщенным раствором хлорида аммония для экстракции слоя диэтилового эфира. Экстракт сушили над безводным сульфатом магния, фильтровали и концентрировали с получением 5 г 7-бром-3,3-дибутил-8-метокси-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепина. Полученное таким образом соединение (5 г, 10,98 ммоль) заливали 75 мл смешанного растворителя (тетрагидрофуран : трет-бутанол = 1:1), тетраоксидом осмия (0,07 г, 0,27 ммоль) и N-метилморфолин-N-оксидом (3,96 г, 32,94 ммоль) и перемешивали при комнатной температуре в течение 12 часов. Добавляли к ним насыщенный раствор хлорида аммония и дихлорметан для экстракции дихлорметанового слоя и экстракт концентрировали с получением 3,55 г диоксида 7-бром-3,3-дибутил-8-метокси-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепина в виде твердого вещества цвета слоновой кости. Полученное таким образом соединение (3,55 г, 7,18 ммоль) заливали диметилформамидом (100 мл), тиометоксидом натрия (5,032 г, 71,79 ммоль) и борогидридом натрия (5,43 г, 143,6 ммоль) и перемешивали при 60°С в течение 15 часов. Добавляли к этому насыщенный раствор хлорида аммония и метил-трет-бутиловый эфир для экстракции эфирного слоя и концентрировали его. Концентрированное соединение заливали гексаном и твердое вещество фильтровали с получением 2,7 г диоксида 3,3-дибутил-8-гидрокси-7-метилтио-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепина с выходом 84%.
1Н ЯМР (400 МГц, CDCl3) δ 7.31 (s, 1Н), 7.16 (t, J=8 Гц, 2Н), 6.92 (d, J=8 Гц, 2Н), 6.84 (t, J=6,8 Гц, 1Н), 6.67 (s, 1Н), 3.61 (s, 2Н), 3.07 (s, 2Н), 2.15 (s, 3Н), 1.28-1.44 (m, 4Н), 1.97-1.19 (m, 8Н), 0.74 (t, J=6,8 Гц).
Стадия 4) Получение 3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b]]1,4]тиазепин-8-ил-трифторметансульфоната

Диоксид 3,3-дибутил-8-гидрокси-7-метилтио-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепина (2,7 г, 5,98 ммоль), полученный на стадии 3, заливали дихлорметаном (30 мл) и пиридином (0,63 мл, 7,77 ммоль) и охлаждали до 0°С. Медленно по каплям к ним добавляли трифторметансульфоновый ангидрид (1,3 мл, 7,77 ммоль) и перемешивали при комнатной температуре в течение 5 часов. Добавляли к ним насыщенный раствор хлорида аммония для экстракции дихлорметанового слоя и затем сушили над безводным сульфатом магния, фильтровали и концентрировали. Продукт реакции очищали посредством хроматографии на колонке с диоксидом кремния, используя смешанный растворитель (гексан : этилацетат = 8:1). В результате получали 2,96 г 3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил-трифторметансульфоната с выходом 86%.
1Н ЯМР (400 МГц, CDCl3) δ 7.81 (s, 1Н), 7.39 (t, J=7,6 Гц, 2Н), 7.21 (d, J=7,6 Гц, 2Н), 7.18 (d, J=7,2 Гц, 1Н), 6.46 (s, 1Н), 3.89 (s, 2Н), 3.26 (s, 2Н), 2.13 (s, 3Н), 1.48-1.85 (m, 2Н), 1.35-1.42 (m, 2Н), 1.01-1.20 (m, 8Н), 0.74 (t, J=6,8 Гц).
Стадия 5) Получение 3,3-дибутил-7-метилтио-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-кар6онитрил-диоксида
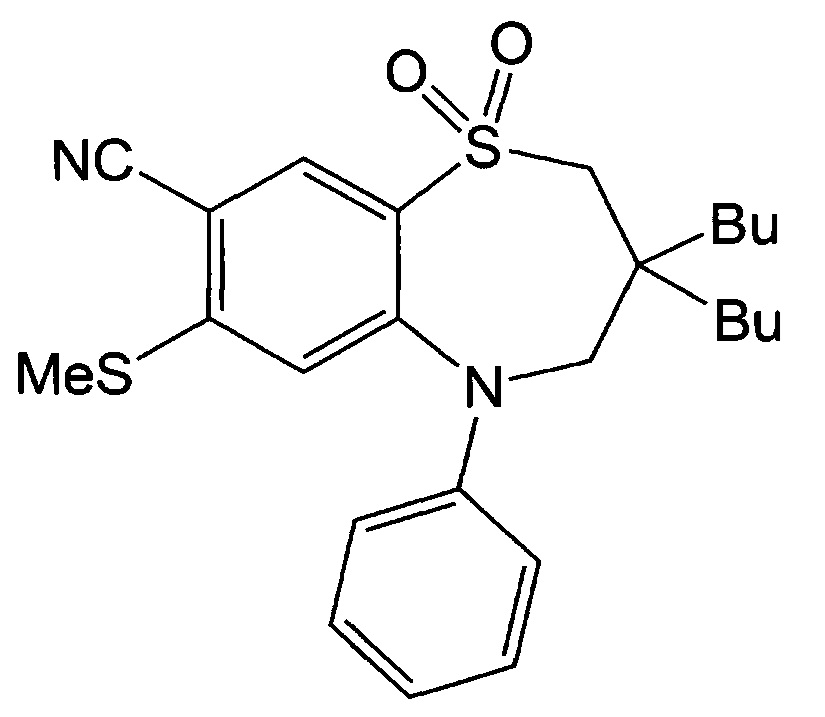
3,3-Дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил-трифторметансульфонат (2,96 г, 5,12 ммоль), полученный на стадии 4, заливали диметилформамидом (60 мл), засыпали порошком цинка (0,034 г, 0,512 ммоль), цианидом цинка (0,66 г, 5,632 ммоль), трис(дибензилиденацетон)дипалладием (0,47 г, 0,51 ммоль) и 1,1-бис(дифенилфосфино)ферроценом (0,34 г, 0,614 ммоль) и перемешивали при 80°С в течение 20 часов. Продукт реакции охлаждали до комнатной температуры и добавляли насыщенный раствор хлорида аммония и этилацетат для экстракции этилацетатного слоя. Экстрагированный этилацетатный слой сушили над безводным сульфатом магния, фильтровали и концентрировали. Концентрированное соединение очищали посредством хроматографии на колонке с диоксидом кремния, используя смешанный растворитель (гексан : этилацетат = 6:1), с получением 1 г указанного в заголовке соединения с выходом 50%.
1Н ЯМР (400 МГц, CDCl3) δ 8.19 (s, 1Н), 7.45 (t, J=7,6 Гц, 2Н), 7.24-7.31 (m, 3Н), 6.26 (s, 1Н), 4.02 (s, 2Н), 3.30 (s, 2Н), 2.11 (s, 3Н), 1.26-1.58 (m, 4Н), 0.83-1.19 (m, 8Н), 0.74 (t, J=6,8 Гц).
Стадия 6) Получение диоксида 3,3-дибутил-7-метилтио-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-карбальдегида

3,3-Дибутил-7-метилтио-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-карбонитрил-диоксид (1 г, 2,1 ммоль), полученный на стадии 5, заливали дихлорметаном, охлаждали до 0°С и медленно по каплям добавляли к нему 5 мл гидрида диизобутилалюминия (DIBAL-H). Продукт реакции нагревали до комнатной температуры и перемешивали в течение 1 часа. Затем продукт реакции вновь охлаждали до 0°С, заливали дистиллированной водой, этилацетатом и тартратом натрия-калия и перемешивали в течение 30 минут. После экстрагирования этилацетатного слоя его сушили над безводным сульфатом магния, фильтровали и концентрировали. Концентрированное соединение очищали посредством хроматографии на колонке с диоксидом кремния, используя смешанный растворитель (гексан : этилацетат = 4:1), с получением 600 мг указанного в заголовке соединения с выходом 63%.
1Н ЯМР (400 МГц, CDCl3) δ 9.91 (s, 1Н), 8.37 (s, 1Н), 7.46 (t, J=7,6 Гц, 2Н), 7.26-7.30 (m, 3Н), 6.27 (s, 1Н), 4.08 (s, 2Н), 3.34 (s, 2Н), 0.88-1.40 (m, 12Н), 0.77 (t, J=6,8 Гц).
Пример 1: Получение 2-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)уксусной кислоты
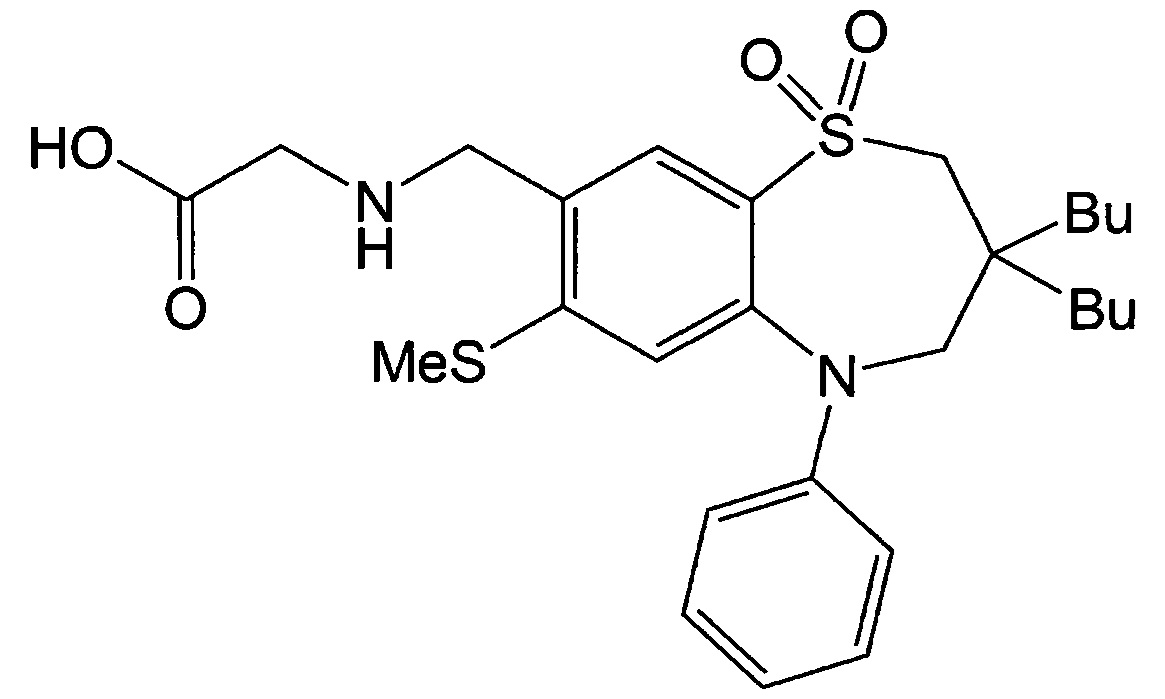
Диоксид 3,3-дибутил-7-метилтио-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-карбальдегида (31 мг, 0,067 ммоль), полученный в примере получения 1, добавляли к 2 мл дихлорэтана и добавляли к ним гидрохлорид метилового эфира этил глицина (11 мг, 0,088 ммоль) и перемешивали при комнатной температуре в течение 20 минут. Затем добавляли к ним триацетоксиборогидрид натрия (28 мг, 0,131 ммоль) и перемешивали при комнатной температуре в течение 17 часов. После завершения взаимодействия выполняли экстракцию путем добавления дихлорметана и дистиллированной воды, сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Фильтрат очищали посредством препаративной ТСХ (PTLC) (дихлорметан : метанол = 50:1) с получением 20,5 мг этил-2-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)ацетата с выходом 57%.
Полученное таким образом соединение (20,5 мг, 0,038 ммоль) добавляли к 3 мл смешанного раствора (тетрагидрофуран : метанол : дистиллированная вода = 1:1:1), заливали гидроксидом лития (16 мг, 0,40 ммоль) и перемешивали при комнатной температуре в течение 12 часов. После завершения взаимодействия добавляли к этому этилацетат и 1 н HCl для экстракции и экстракт сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Фильтрат очищали посредством PTLC (дихлорметан : метанол = 20:1) с получением 10 мг 2-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)уксусной кислоты в качестве указанного в заголовке соединения (выход: 44%).
1Н ЯМР (400 МГц, CDCl3) δ 8.22 (s, 1Н), 7.34 (t, J=7,6 Гц, 2Н), 7.24 (t, J=7,6 Гц, 2Н), 7.12 (t, J=7,6 Гц, 1Н), 6.47 (s, 1Н), 4.46 (s, 2Н), 3.73-3.93 (m, 4Н), 3.33 (s, 2Н), 2.15 (s, 3Н), 1.47-1.52 (m, 2Н), 1.33-1.39 (m, 2Н), 1.08-1.15 (m, 4Н), 1.00-1.03 (m, 4Н), 0.78 (t, J=6,8 Гц, 6Н).
Пример 2: Получение 3-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)пропионовой кислоты
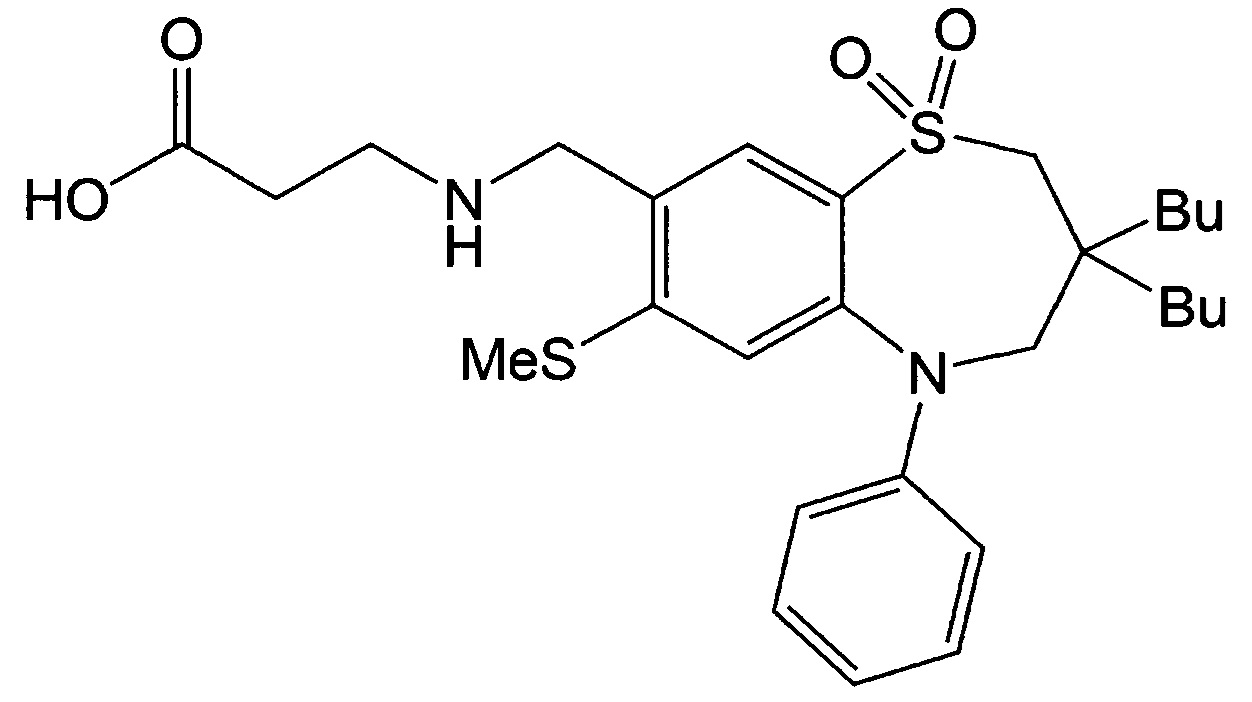
Указанное в заголовке соединение синтезировали способом, аналогичным способу Примера 1, за исключением того, что в качестве реагента вместо гидрохлорида метилового эфира этилглицина использовали этил-3-аминопропаноат (выход: 65%).
1Н ЯМР (400 МГц, CDCl3) δ 8.14 (s, 1Н), 7.38-7.34 (m, 2Н), 7.26-7.22 (m, 2Н), 7.17-6.97 (m, 1Н), 6.46 (s, 1Н), 4.35 (s, 2Н), 3.88 (s, 2Н), 3.26 (s, 4Н), 2.93 (s, 2Н), 2.15 (s, 3Н), 1.60-1.46 (m, 2Н), 1.40-1.29 (m, 2Н), 1.14-0.99 (m, 8Н), 0.81-0.74 (m, 6Н).
Пример 3: Получение 2-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)янтарной кислоты
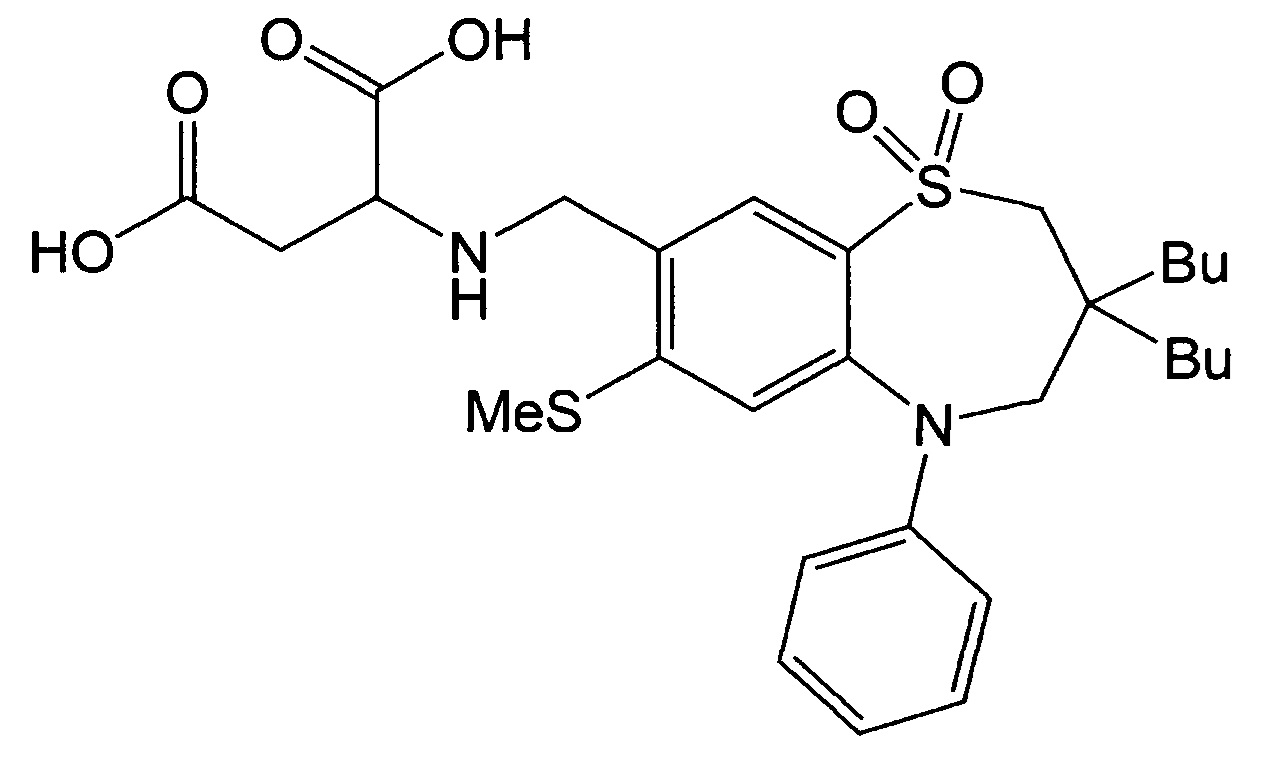
Указанное в заголовке соединение синтезировали способом, аналогичным способу Примера 1, за исключением того, что в качестве реагента вместо гидрохлорида метилового эфира этилглицина использовали диэтиласпартат (выход: 52%).
1Н ЯМР (400 МГц, CDCl3) δ 8.21 (s, 1Н), 7.34 (s, 3Н), 7.24 (s, 1Н), 7.12 (s, 1Н), 6.46 (s, 1Н), 4.62-4.35 (m, 2Н), 4.02-3.88 (m, 2Н), 3.50-3.10 (m, 5Н), 2.17 (s, 3Н), 1.66-1.35 (m, 4Н), 1.22-0.89 (m, 8Н), 0.75 (s, 6Н).
Пример 4: Получение (S)-2-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)пропионовой кислоты

Указанное в заголовке соединение синтезировали способом, аналогичным способу Примера 1, за исключением того, что диэтиловый эфир аланина использовали в качестве реагента вместо гидрохлорида метилового эфира этилглицина (выход: 61%).
1Н ЯМР (400 МГц, CDCl3) δ 8.16 (s, 1Н), 7.32 (s, 2Н), 7.16-7.12 (m, 3Н), 6.45 (s, 1Н), 4.24-4.19 (m, 2Н), 3.81 (s, 2Н), 3.52 (s, 1Н), 3.27 (s, 2Н), 2.09 (s, 3Н), 1.52-1.42 (m, 5H), 1.41-1.25 (m, 2H), 1.24-0.92 (m, 8H), 0.88-0.65 (m, 6H).
Пример 5: Получение 2-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)пентандиовой кислоты

Указанное в заголовке соединение синтезировали способом, аналогичным способу Примера 1, за исключением того, что использовали диэтиловый эфир глутамина в качестве реагента вместо гидрохлорида метилового эфира этилглицина (выход: 36%).
1Н ЯМР (400 МГц, CDCl3) δ 7.74 (s, 1Н), 7.35-7.33 (m, 2Н), 7.19-7.18 (m, 2Н), 7.12-7.09 (m, 1Н), 6.43 (s, 1Н), 4.97 (d, J=14 Гц, 1Н), 4.17 (d, J=15,2 Гц, 1Н), 3.85 (s, 3Н), 3.26 (s, 2Н), 1.21 -0.96 (m, 8Н), 0.82-0.76 (m, 6Н).
Пример 6: Получение 4-амино-2-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)-4-оксобутановой кислоты

Указанное в заголовке соединение синтезировали способом, аналогичным способу Примера 1, за исключением того, что диэтиловый эфир аргинина использовали в качестве реагента вместо гидрохлорида метилового эфира этилглицина (выход: 23%).
Масс-спектр (MS): 576,25 [М+Н]+.
Пример 7: Получение (R)-2-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)пропионовой кислоты
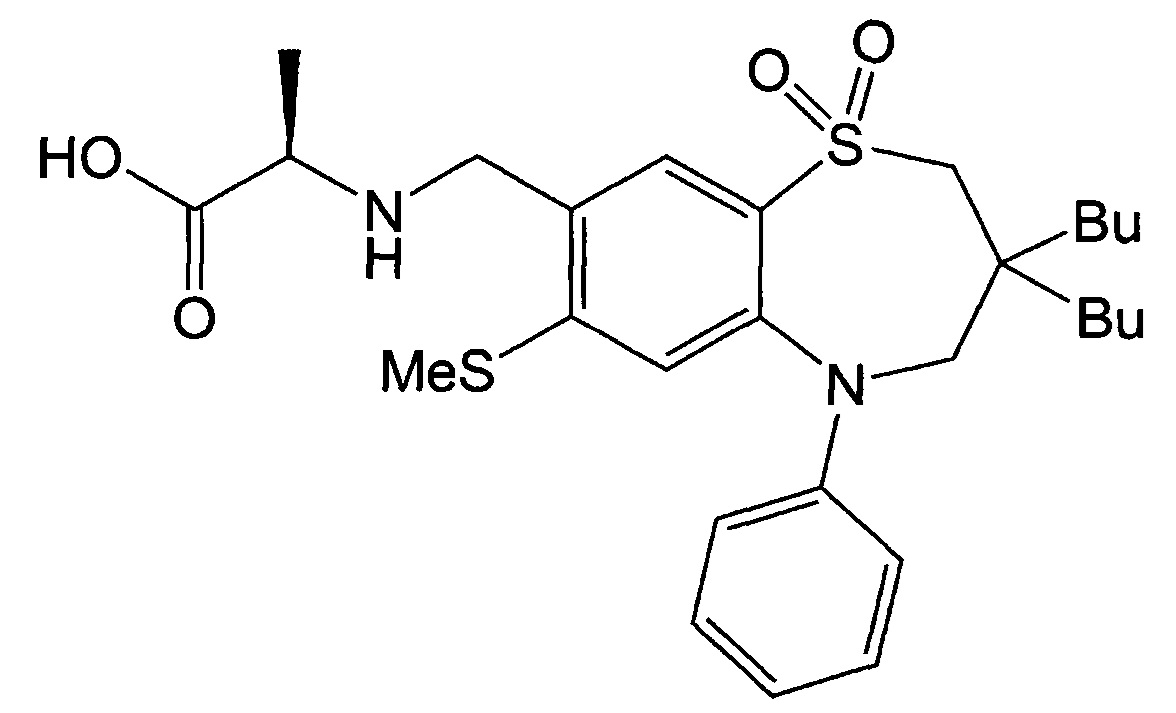
Указанное в заголовке соединение синтезировали способом, аналогичным способу Примера 1, за исключением того, что диэтиловый эфир аланина использовали в качестве реагента вместо гидрохлорида метилового эфира этилглицина (выход: 56%).
1Н ЯМР (400 МГц, CDCl3) δ 8.00 (s, 1Н), 7.19-7.26 (m, 2Н), 7.08-7.10 (m, 3Н), 6.38 (s, 1Н), 4.03-7.09 (m, 2Н), 3.76 (s, 2Н), 3.41 (s, 1Н), 3.20 (s, 2Н), 2.89-2.99 (m, 1Н), 2.02 (s, 3Н), 1.43 (s, 3Н), 1.29-1.36 (m, 2Н), 1.18-1.23 (m, 2Н), 0.81-1.08 (m, 8Н), 0.69-0.7 (m, 6Н).
Пример 8: Получение 2-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)-2-метилпропионовой кислоты

Указанное в заголовке соединение синтезировали способом, аналогичным способу Примера 1, за исключением того, что этил-2-амино-2-метилпропаноат использовали в качестве реагента вместо гидрохлорида метилового эфира этилглицина (выход: 57%).
1Н ЯМР (400 МГц, CDCl3) δ 7.99 (s, 1Н), 7.33 (t, J=7,6 Гц, 2Н), 7.17-7.18 (m, 2Н), 7.11-7.12 (m, 1Н), 6.48 (s, 1Н), 3.96 (s, 2Н), 3.81 (s, 2Н), 3.21 (s, 2Н), 2.14 (s, 3Н), 1.53 (s, 6Н), 1.25-1.34 (m, 4Н), 0.85-1.14 (m, 8Н), 0.76 (t, J=6,8 Гц, 6Н).
Пример 9: Получение (R)-2-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)-3-(1Н-имидазол-4-ил)пропионовой кислоты

Указанное в заголовке соединение синтезировали способом, аналогичным способу Примера 1, за исключением того, что этиловый эфир гистидина использовали в качестве реагента вместо гидрохлорида метилового эфира этилглицина (выход: 43%).
1Н ЯМР (400 МГц, CDCl3) δ 7.77 (s, 1Н), 7.54 (s, 1Н), 7.28-7.30 (m, 2Н), 7.04-7.11 (m, 3Н), 6.78 (s, 1H), 6.38 (s, 1H), 3.78 (s, 4H), 3.41-4.11 (m, 2H), 3.18 (s, 2H), 2.94-2.98 (m, 1H), 1.86 (s, 3H), 1.27-1.43 (m, 4H), 0.82-1.10 (m, 8H), 0.71 (t, J=6,8 Гц, 6H).
Пример 10: Получение (R)-2-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)-3-(1Н-индол-2-ил)пропионовой кислоты

Указанное в заголовке соединение синтезировали способом, аналогичным способу Примера 1, за исключением того, что этиловый эфир триптофана использовали в качестве реагента вместо гидрохлорида метилового эфира этилглицина (выход: 37%).
MS: 648.29 [М+Н]+.
Пример 11: Получение (S)-2-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)-4-метилпентановой кислоты

Указанное в заголовке соединение синтезировали способом, аналогичным способу Примера 1, за исключением того, что этиловый эфир лейцина использовали в качестве реагента вместо гидрохлорида метилового эфира этилглицина (выход: 58%).
MS: 575,29 [М+Н]+.
Пример 12: Получение (S)-2-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)пентандиовой кислоты

Указанное в заголовке соединение синтезировали способом, аналогичным способу Примера 1, за исключением того, что диэтиловый эфир глутамина использовали в качестве реагента вместо гидрохлорида метилового эфира этилглицина (выход: 25%).
MS: 591.27 [М+Н]+.
Пример 13: Получение (S)-2-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)-3-гидроксипропионовой кислоты
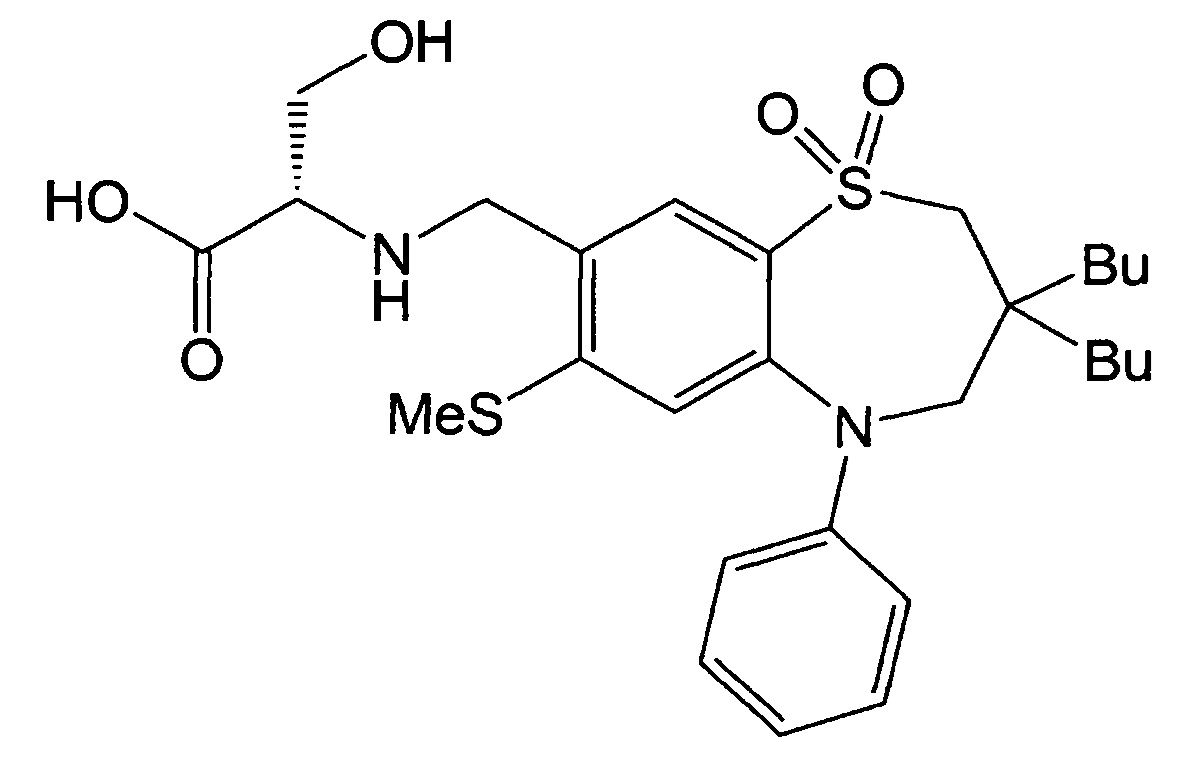
Указанное в заголовке соединение синтезировали способом, аналогичным способу Примера 1, за исключением того, что диэтиловый эфир серина использовали в качестве реагента вместо гидрохлорида метилового эфира этилглицина (выход: 45%).
MS: 549,25 [М+Н]+.
Пример 14: Получение 3-((карбоксиметил)((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)пропионовой кислоты

Указанное в заголовке соединение синтезировали способом, аналогичным способу Примера 1, за исключением того, что 3-((2-этокси-2-оксоэтил)амино)пропаноат использовали в качестве реагента вместо гидрохлорида метилового эфира этилглицина (выход: 49%).
1Н ЯМР (400 МГц, CDCl3) δ 8.16 (s, 1Н), 7.34-7.43 (m, 2Н), 7.27 (s, 2Н), 7.12-7.16 (m, 1H), 6.45 (s, 1H), 4.60-4.72 (m, 2H), 4.48-4.59 (m, 2H), 4.00-4.13 (m, 2H), 3.34 (s, 2H), 3.12-3.23 (m, 2H), 2.14 (s, 3Н), 1.36-1.60 (m, 4H), 1.24-1.30 (m, 8H), 0.71 (t, J=6,8 Гц, 6H).
Пример 15: Получение 3-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)пентандиовой кислоты
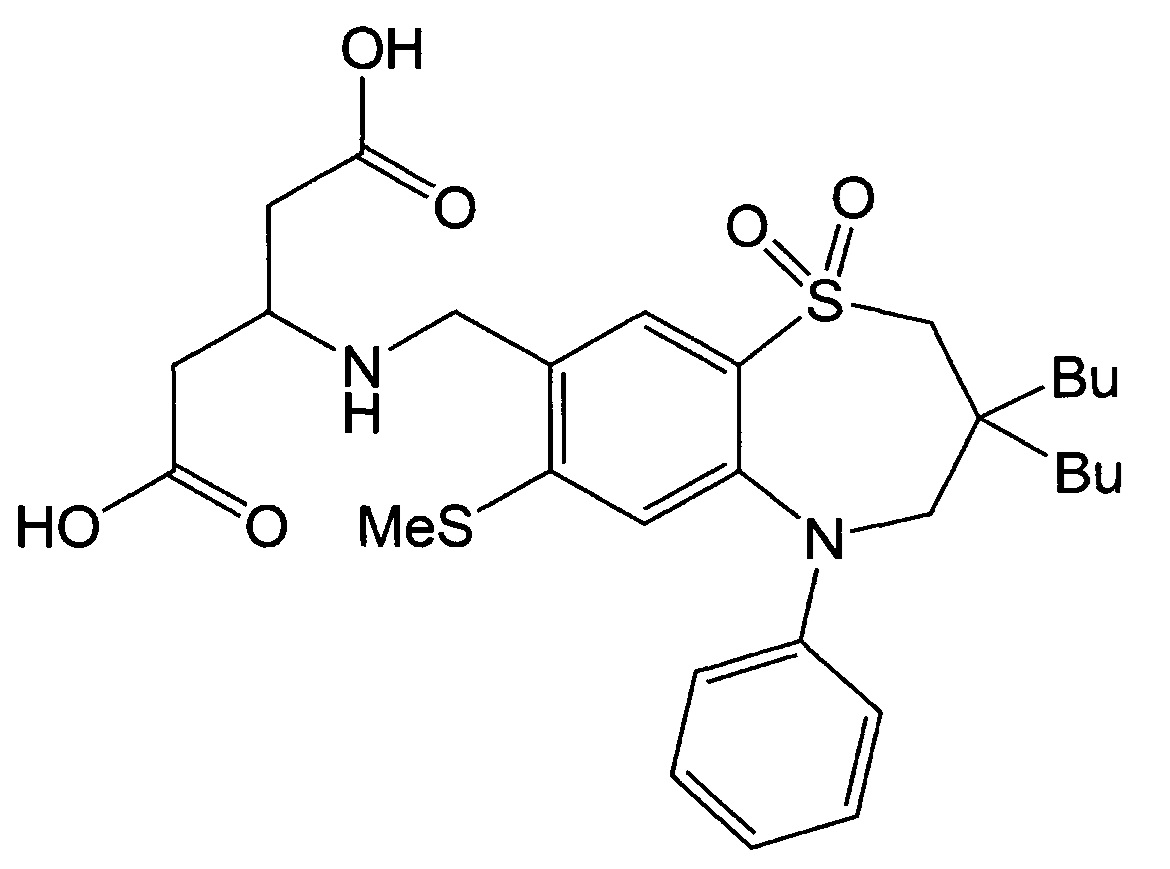
Указанное в заголовке соединение синтезировали способом, аналогичным способу Примера 1, за исключением того, что диэтил-2,2'-азандиилдиацетат использовали в качестве реагента вместо гидрохлорида метилового эфира этилглицина (выход: 41%).
1Н ЯМР (400 МГц, CDCl3) δ 8.02 (s, 1Н), 7.32 (t, J=7,6 Гц, 2Н), 7.21 (d, J=7,2 Гц, 2Н), 7.10 (t, J=6,8 Гц, 1Н), 6.48 (s, 1Н), 4.47 (s, 2Н), 4.03 (s, 1Н), 3.85 (m, 2Н), 3.29 (s, 2Н), 3.06-3.17 (m, 4Н), 2.16 (s, 3Н), 1.35-1.46 (m, 4Н), 1.23-1.32 (m, 8Н), 0.71 (t, J=6,8 Гц, 6Н).
Пример 16: Получение 2-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)-2-оксоуксусной кислоты

3,3-Дибутил-7-метилтио-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-карбонитрилдиоксид (160 мг, 0,350 ммоль), полученный на стадии 5 Примера получения 1, растворяли в 5 мл смешанного раствора (дихлорметан : диэтиловый эфир = 3:2). Продукт реакции охлаждали до 0°С и добавляли алюмогидрид лития (66 мг, 1,752 ммоль) порциями и перемешивали при комнатной температуре в течение 12 часов. После завершения взаимодействия к ним добавляли диэтиловый эфир и дистиллированную воду для экстракции и экстракт сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Фильтрат очищали посредством PTLC (дихлорметан : метанол = 50:1) с получением 40 мг диоксида 8-аминометил-3,3-дибутил-7-метилтио-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепина (выход: 25%).
Полученное таким образом соединение (0,023 г, 0,05 ммоль) добавляли к 5 мл дихлорметана и добавляли к ним триэтиламин (0,01 мл, 0,1 ммоль) и 4-диметиламинопиридин (0,003 г) и перемешивали при комнатной температуре в течение 10 минут. Реакционный раствор охлаждали до 0°С, медленно заливали этил-2-хлор-2-оксоацетат и перемешивали при комнатной температуре в течение 18 часов. Добавляли к нему раствор хлорида аммония и дихлорметан для экстракции дихлорметанового слоя. Экстрагированный дихлорметановый слой сушили над безводным сульфатом магния, фильтровали и концентрировали. Концентрированное соединение (0,02 г) заливали тетрагидрофураном (1 мл), метанолом (1 мл), дистиллированной водой (1 мл) и добавляли гидроксид лития (0,03 г) и перемешивали при комнатной температуре в течение 12 часов. Затем добавляли к нему 6 н HCl и дихлорметан для экстракции с последующим концентрированием и концентрированное соединение очищали посредством PTLC (дихлорметан : метанол = 13:1) с получением 0,015 г 2-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)-2-оксоуксусной кислоты в качестве указанного в заголовке соединения (выход: 78%).
1Н ЯМР (400 МГц, CDCl3) δ 7.76 (s, 1Н), 7.25-7.33 (m, 2Н), 6.97-7.11 (m, 3Н), 6.50 (s, 1Н), 3.72-4.40 (m, 2Н), 3.19 (s, 2Н), 2.50-2.68 (m, 2Н), 2.06 (s, 3Н), 1.27-1.43 (m, 4Н), 0.93-1.20 (m, 8Н), 0.71 (t, J=6,8 Гц, 6Н).
Пример 17: Получение 1-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)циклопропанкарбоновой кислоты
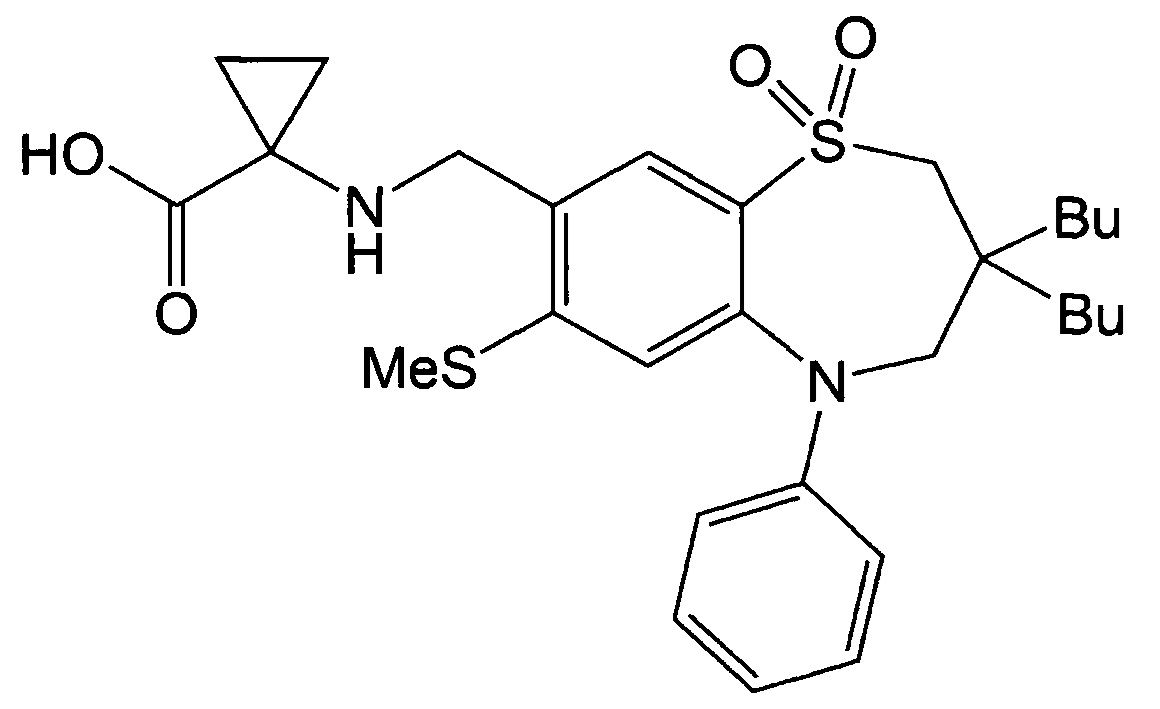
Указанное в заголовке соединение синтезировали способом, аналогичным способу Примера 1, за исключением того, что в качестве реагента вместо гидрохлорида метилового эфира этилглицина использовали этил-1-аминоциклопропан-карбоксилат (выход: 52%).
1Н ЯМР (400 МГц, CDCl3) δ 8.11 (s, 1Н), 7.42-7.35 (m, 2Н), 7.21-7.15 (m, 2Н), 7.13-7.12 (m, 1Н), 6.49 (s, 1Н), 4.53 (s, 2Н), 3.88 (s, 2Н), 3.24 (s, 2Н), 2.04 (s, 3Н), 1.68-1.61 (m, 2Н), 1.55-1.48 (m, 2Н), 1.21-0.92 (m, 12Н), 0.78-0.71 (m, 6Н).
Пример 18: Получение 2-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)-2-оксоэтансульфоновой кислоты

Диоксид 8-аминометил-3,3-дибутил-7-метилтио-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепина получали таким же способом, как в Примере 16. Соединение (40 мг, 0,087 ммоль) растворяли в 4 мл дихлорметана. Продукт реакции охлаждали до 0°С, к нему добавляли медленно по каплям триэтиламин (36 мкл, 0,260 ммоль) и перемешивали в течение 10 минут. К ним добавляли медленно по каплям бромацетилхлорид (15 мкл, 0,174 ммоль) и перемешивали при комнатной температуре в течение 16 часов. После завершения взаимодействия к ним добавляли дихлорметан и раствор хлорида аммония для экстракции и экстракт сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Фильтрат очищали посредством PTLC (дихлорметан : метанол = 30:1) с получением 25 мг 2-бром-N-((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)ацетамида (выход: 50%).
Полученное таким образом соединение (25 мг, 0,043 ммоль) растворяли в 3 мл смешанного раствора (этанол : дистиллированная вода = 1:1). К нему добавляли сульфит натрия (271 мг, 2,149 ммоль) и перемешивали при 80°С в течение 17 часов. После завершения взаимодействия продукт реакции охлаждали до комнатной температуры. К нему добавляли этилацетат и дистиллированную воду для экстракции и экстракт сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Фильтрат очищали посредством PTLC (дихлорметан : метанол = 10:1) с получением 12,5 мг 2-(((3,3-дибутил-7-метилтио-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)-2-оксоэтансульфоновой кислоты (выход: 50%).
MS: 583,20 [М+Н]+.
Пример 19: Получение 2-(((3,3-дибутил-5-(4-метоксифенил)-7-метилтио-1,1-диоксидо-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)уксусной кислоты

Указанное в заголовке соединение синтезировали способом, аналогичным способу Примера 1, за исключением того, что на стадии 3 Примера получения 1 вместо йодбензола использовали 1-йод-4-метоксибензол (выход: 64%).
1Н ЯМР (400 МГц, CDCl3) δ 8.01 (s, 1Н), 7.13-7.15 (m, 2Н), 6.80-6.89 (m, 2Н), 6.31 (s, 1Н), 4.22 (s, 2Н), 3.70-3.81 (m, 5Н), 3.42 (s, 2Н), 3.21 (s, 2Н), 2.08 (s, 3Н), 1.30-1.55 (m, 4Н), 0.86-1.06 (m, 8Н), 0.71-0.76 (m, 6Н).
Пример 20: Получение 2-(((3,3-дибутил-5-(4-гидроксифенил)-7-метилтио-1,1-диоксидо-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)уксусной кислоты

Указанное в заголовке соединение синтезировали способом, аналогичным способу Примера 1, за исключением того, что на стадии 3 Примера получения 1 вместо йодбензола использовали 4-йодфенол (выход: 37%).
1Н ЯМР (400 МГц, CDCl3) δ 7.94 (s, 1Н), 7.20 (d, J=8,8 Гц, 2Н), 6.89 (d, J=8 Гц, 2Н), 6.43 (s, 1Н), 4.30 (s, 2Н), 3.89-3.93 (m, 4Н), 3.30-3.36 (m, 2Н), 2.21 (s, 3Н), 1.40-1.61 (m, 4Н), 1.20-1.29 (m, 8Н), 0.81 (t, J=6,8 Гц, 6Н).
Пример 21: Получение 2-(((3,3-дибутил-5-(3-метоксифенил)-7-метилтио-1,1-диоксидо-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)уксусной кислоты

Указанное в заголовке соединение синтезировали способом, аналогичным способу Примера 1, за исключением того, что на стадии 3 Примера получения 1 вместо йодбензола использовали 1-йод-3-метоксибензол (выход: 47%).
1Н ЯМР (400 МГц, CDCl3) δ 8.05 (s, 1Н), 7.27-7.23 (m, 1Н), 6.78-6.67 (m, 2Н), 6.66-6.57 (m, 1Н), 6.54 (s, 1Н), 4.20 (s, 2Н), 3.82 (s, 2Н), 3.79 (s, 3Н), 3.42 (s, 2Н), 3.29 (s, 2Н), 1.53-1.47 (m, 2Н), 1.43-1.32 (m, 2Н), 1.24-1.04 (m, 8Н), 0.88-0.78 (m, 6Н).
Пример 22: Получение 2-(((3,3-дибутил-5-(4-фторфенил)-7-метилтио-1,1-диоксидо-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)уксусной кислоты
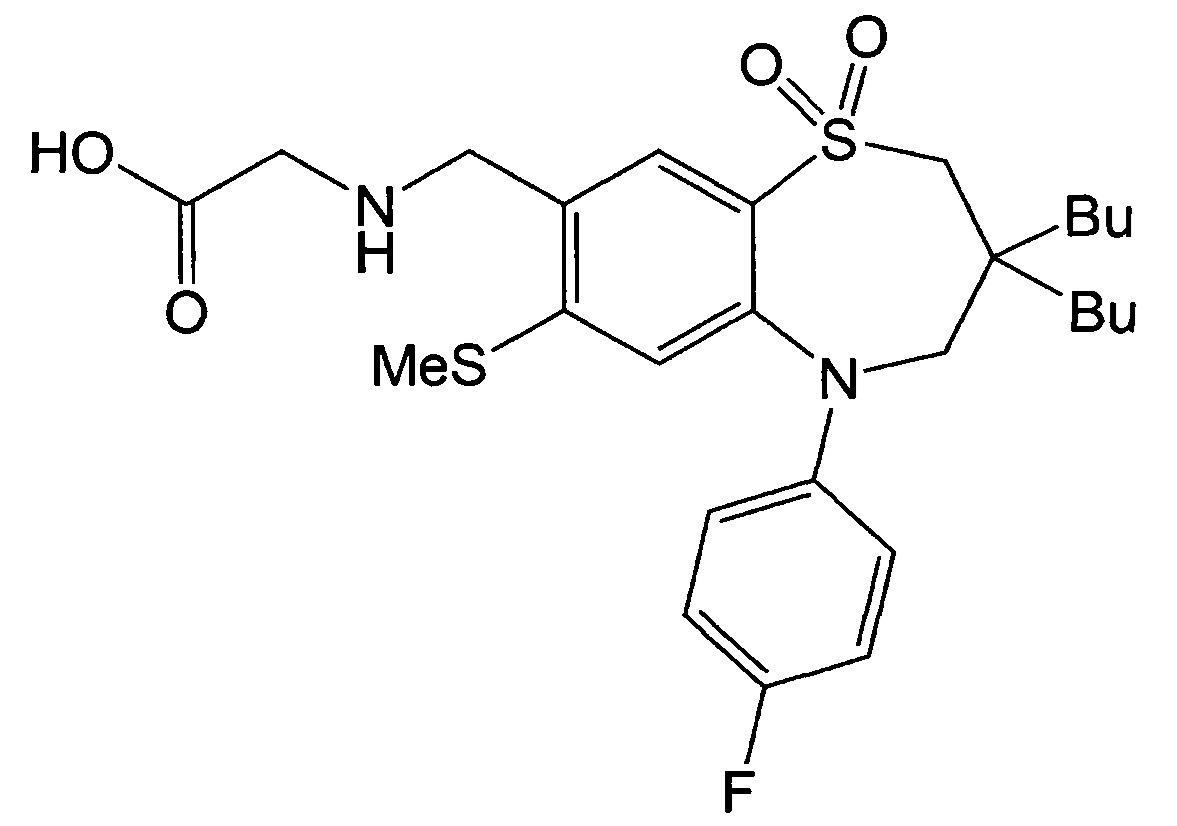
Указанное в заголовке соединение синтезировали способом, аналогичным способу Примера 1, за исключением того, что на стадии 3 Примера получения 1 вместо йодбензола использовали 1-фтор-4-йодбензол.
1Н ЯМР (400 МГц, CDCl3) δ 8.12 (s, 1Н), 7.17-7.20 (m, 2Н), 7.03 (t, J=8,4 Гц, 2Н), 6.40 (s, 1Н), 4.16 (s, 2Н), 3.70 (s, 2Н), 3.33 (s, 2Н), 3.21 (s, 2Н), 2.08 (s, 3Н), 1.37-1.46 (m, 4Н), 0.82-1.06 (m, 8Н), 0.77 (t, J=6,8 Гц, 6Н).
Пример 23: Получение 2-(((3,3-дибутил-5-(3-фторфенил)-7-метилтио-1,1-диоксидо-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)уксусной кислоты

Указанное в заголовке соединение синтезировали способом, аналогичным способу Примера 1, за исключением того, что на стадии 3 Примера получения 1 вместо йодбензола использовали 1-фтор-3-йодбензол.
1Н ЯМР (400 МГц, CDCl3) δ 8.15 (s, 1Н), 7.23-7.13 (m, 1Н), 6.89-6.83 (m, 2Н), 6.75-6.71 (m, 1Н), 6.65 (s, 1Н), 4.27 (s, 2Н), 3.73 (s, 2Н), 3.52 (s, 2Н), 3.26 (s, 2Н), 2.20 (s, 3Н), 1.57-1.46 (m, 2Н), 1.43-1.33 (m, 2Н), 1.26-1.07 (m, 8Н), 0.86-0.78 (m, 6H).
Пример 24: Получение 2-(((3,3-дибутил-5-(3-фтор-4-метоксифенил)-7-метилтио-1,1-диоксидо-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)уксусной кислоты

Указанное в заголовке соединение синтезировали способом, аналогичным способу Примера 1, за исключением того, что на стадии 3 Примера получения 1 вместо йодбензола использовали 2-фтор-4-йод-1-метоксибензол.
1Н ЯМР (400 МГц, CDCl3) δ 8.10 (уширенный s, 1Н), 6.70-6.90 (уширенный s, 3Н), 6.30-6.50 (уширенный s, 1Н), 3.90-4.20 (уширенный s, 2Н), 3.30-3.89 (уширенный s, 3Н), 3.55-3.29 (уширенный s, 2Н), 3.45-2.95 (m, 4Н), 1.98-2.22 (уширенный s, 3Н), 1.23-1.49 (m, 4Н), 0.73-1.24 (8Н), 0.73 (уширенный s, 6Н).
Пример 25: Получение 2-(((3,3-дибутил-5-(4-метоксифенил)-7-метилтио-1,1-диоксидо-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)-2-оксоэтансульфоновой кислоты

Указанное в заголовке соединение синтезировали способом, аналогичным способу Примера 18, за исключением того, что на стадии 3 Примера получения 1 вместо йодбензола использовали 1-йод-4-метоксибензол.
1Н ЯМР (400 МГц, CDCl3) δ 7.70 (s, 1Н), 7.09-6.94 (m, 2Н), 6.82-6.64 (m, 2Н), 6.27 (s, 1Н), 3.80-3.63 (m, 7Н), 3.12 (s, 2Н), 2.43 (s, 2Н), 1.97 (s, 3Н), 1.52-1.27 (m, 4Н), 1.07-0.88 (m, 8Н), 0.82-0.78 (m, 6Н).
Пример 26: Получение 1-(((3,3-дибутил-5-(3-фтор-4-метоксифенил)-7-метилтио-1,1-диоксидо-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)циклопропанкарбоновой кислоты
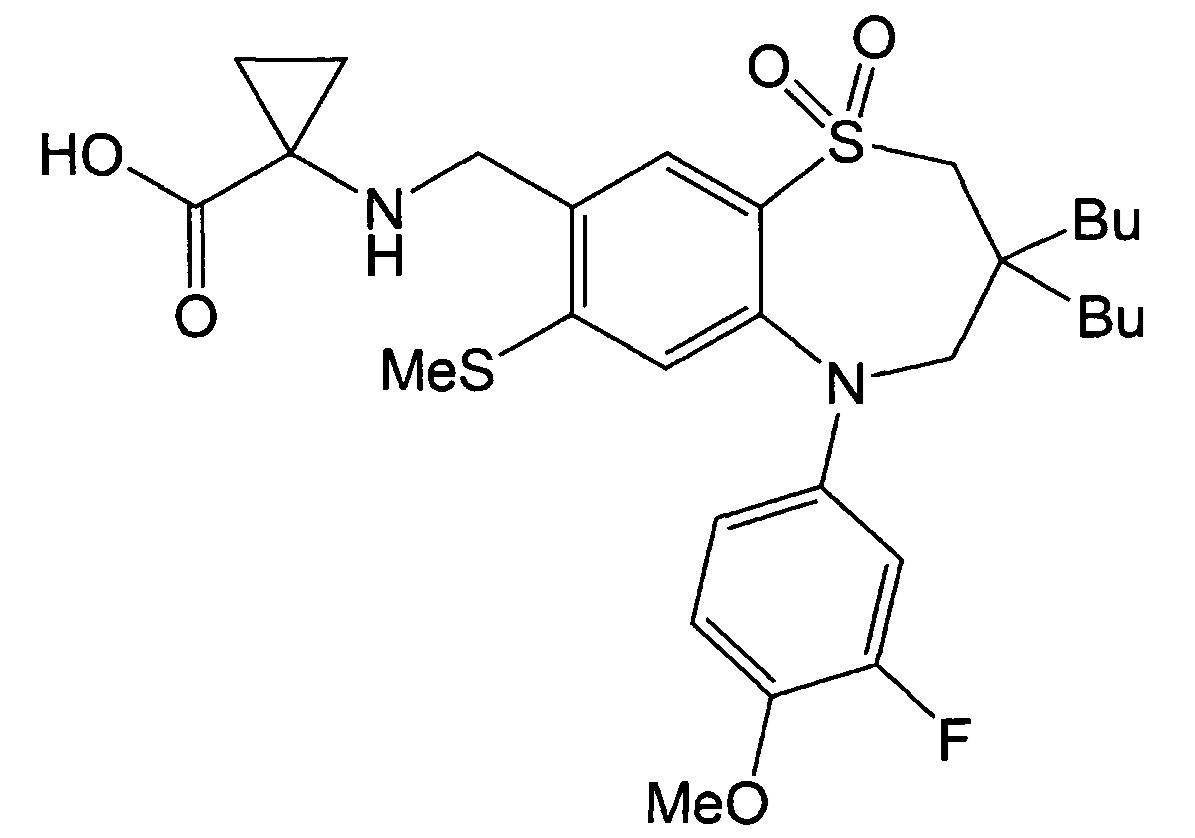
Указанное в заголовке соединение синтезировали способом, аналогичным способу Примера 17, за исключением того, на стадии 3 Примера получения 1 вместо йодбензола использовали 2-фтор-4-йод-1-метоксибензол.
1Н ЯМР (400 МГц, CDCl3) δ 7.89 (s, 1Н), 6.98-6.82 (m, 3Н), 6.48 (s, 1Н), 3.97 (s, 2Н), 3.88 (s, 3Н), 3.70 (s, 2Н), 3.19 (s, 2Н), 2.17 (s, 3Н), 1.51-1.32 (m, 4Н), 1.20-0.94 (m, 8H), 0.81-0.78 (m, 6H).
Пример 27: Получение 2-(((3,3-дибутил-5-(4-фторфенил)-7-метилтио-1,1-диоксидо-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)-2-оксоуксусной кислоты
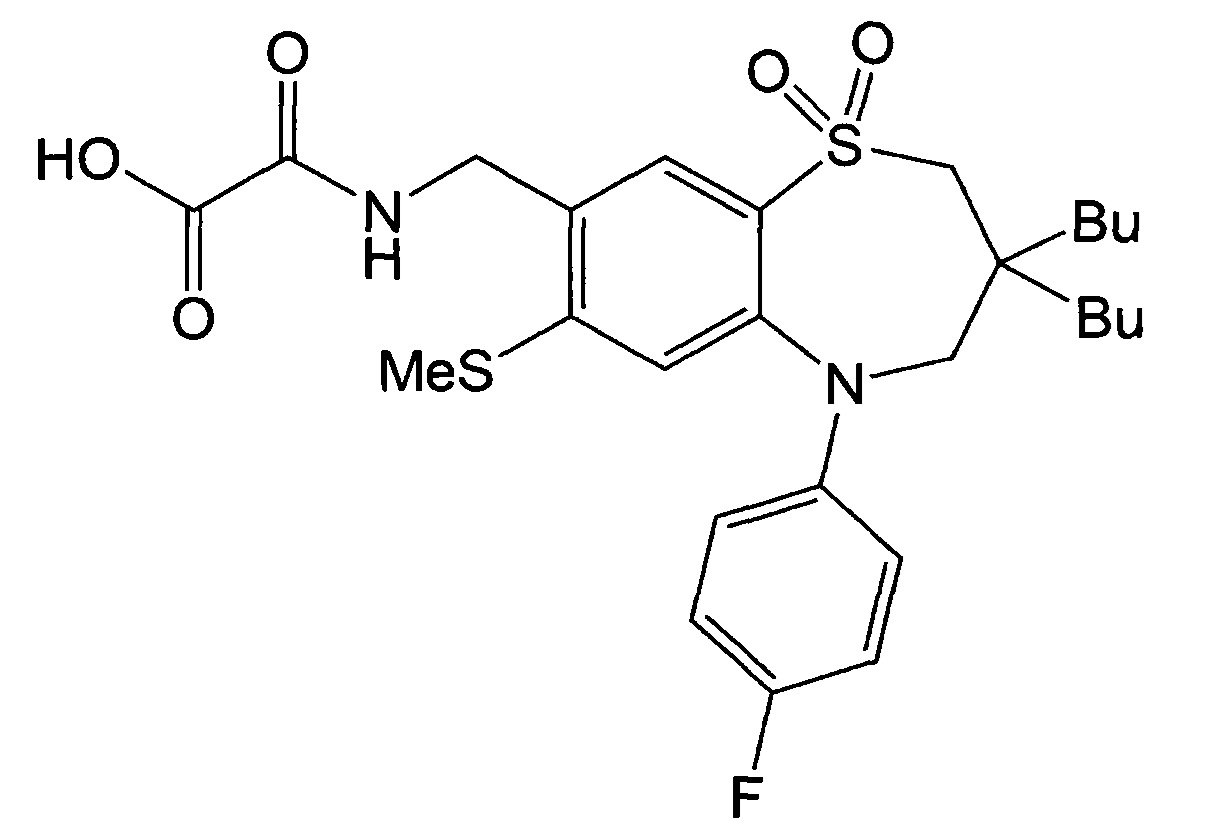
Указанное в заголовке соединение синтезировали способом, аналогичным способу Примера 16, за исключением того, что на стадии 3 Примера получения 1 вместо йодбензола использовали 1-фтор-4-йодбензол.
1Н ЯМР (400 МГц, CDCl3) δ 7.72 (s, 1Н), 7.10 (уширенный s, 2Н), 6.95 (уширенный s, 2Н), 6.42 (s, 1Н), 4.22-4.36 (m, 2Н), 3.66-3.97 (m, 2Н), 3.19-3.47 (m, 2Н), 2.07 (s, 3Н), 1.30-1.33 (m, 4Н), 0.88-1.12 (m, 8Н), 0.75-0.83 (m, 3Н).
Пример 28: Получение (S)-2-(((3,3-дибутил-5-(4-фторфенил)-7-метилтио-1,1-диоксидо-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)пропионовой кислоты
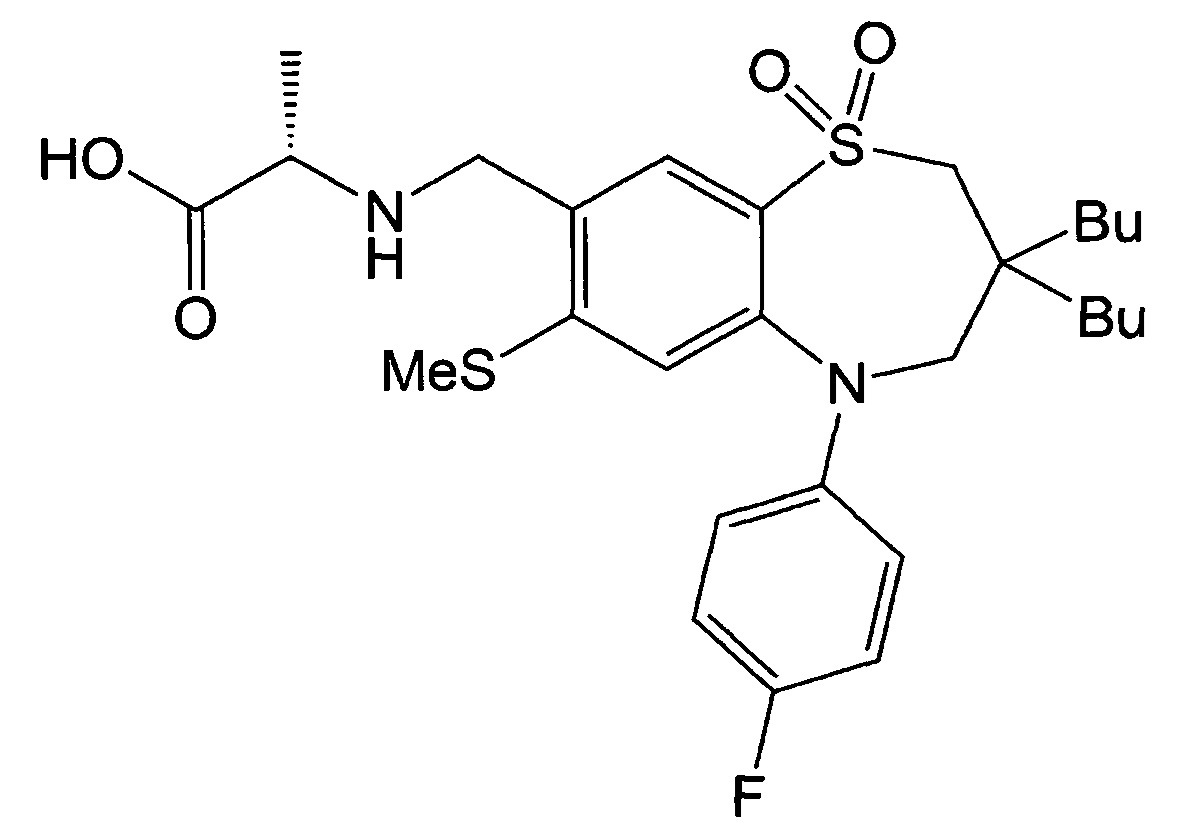
Указанное в заголовке соединение синтезировали способом, аналогичным способу Примера 4, за исключением того, что на стадии 3 Примера получения 1 вместо йодбензола использовали 1-фтор-4-йодбензол.
1Н ЯМР (400 МГц, CDCl3) δ 7.72 (s, 1Н), 7.10 (уширенный s, 2Н), 6.95 (уширенный s, 2Н), 6.42 (s, 1Н), 4.22-4.36 (m, 2Н), 3.66-3.97 (m, 2Н), 3.19-3.47 (m, 2Н), 2.07 (s, 3Н), 1.30-1.33 (m, 4Н), 0.88-1.12 (m, 8Н), 0.75-0.83 (m, 3Н).
Пример 29: Получение (S)-2-(((3,3-дибутил-5-(4-фторфенил)-7-метилтио-1,1-диоксидо-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)-3-гидроксипропионовой кислоты
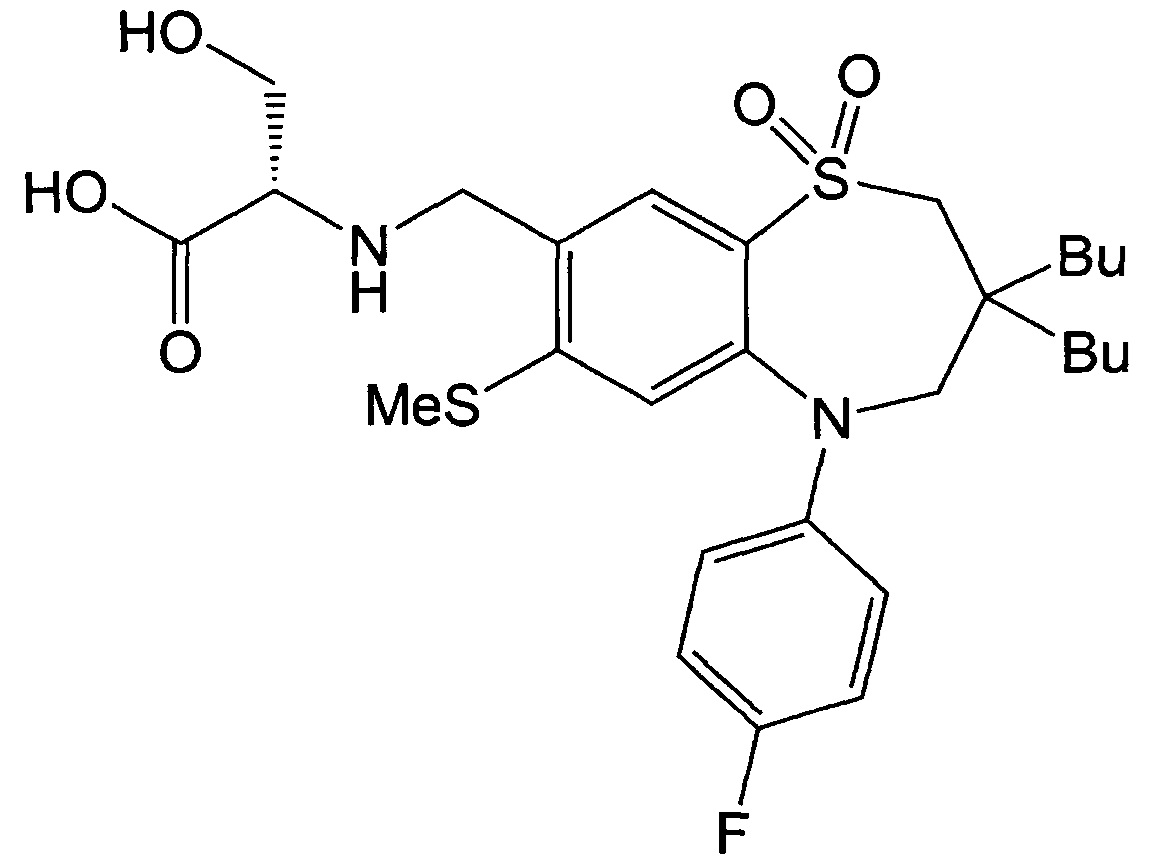
Указанное в заголовке соединение синтезировали способом, аналогичным способу Примера 13, за исключением того, что на стадии 3 Примера получения 1 вместо йодбензола использовали 1-фтор-4-йодбензол.
1Н ЯМР (400 МГц, CDCl3) δ 8.15 (s, 1Н), 7.17 (уширенный s, 2Н), 6.95 (уширенный s, 2Н), 6.51 (s, 1Н), 4.36 (уширенный s, 2Н), 3.95 (уширенный s, 2Н), 6.63 (уширенный s, 2Н), 3.46 (s, 1Н), 3.26 (уширенный s, 2Н), 2.01 (s, 3Н), 1.25-1.43 (m, 4Н), 0.70-0.87 (m, 8Н), 0.59-0.67 (m, 3Н).
Пример 30: Получение 1-(((3,3-дибутил-5-(4-фторфенил)-7-метилтио-1,1-диоксидо-2,3,4,5-тетрагидробензо[b][1,4]тиазепин-8-ил)метил)амино)циклопропанкарбоновой кислоты

Указанное в заголовке соединение синтезировали способом, аналогичным способу Примера 17, за исключением того, что на стадии 3 Примера получения 1 вместо йодбензола использовали 1-фтор-4-йодбензол.
1Н ЯМР (400 МГц, CDCl3) δ 7.92 (s, 1Н), 7.17-7.14 (m, 2Н), 7.09-7.02 (m, 2Н), 6.42 (s, 1Н), 4.11 (s, 2Н), 3.77 (s, 2Н), 3.22 (s, 2Н), 2.15 (s, 3Н), 1.68-1.46 (m, 4Н), 1.40-1.30 (m, 4Н), 1.21-0.92 (m, 8Н), 0.88-0.76 (m, 6Н).
Экспериментальный Пример 1: Время экскреции фекалий и оценка эффективности
Приобретали восьминедельных крыс SD и давали им возможность адаптироваться к условиям выращивания при 12-часовом освещении при 24°С в течение 7 суток. Крыс вынуждали воздерживаться от приема пищи в течение 16 часов перед днем эксперимента и в день эксперимента вводили перорально носитель (0,5% метилцеллюлозу) и тестируемое вещество, которые готовили в концентрации 0,2 мг/мл и в дозе 5 мг/кг, соответственно. Через тридцать минут после введения крыс, съевших по 3 г содержащего барий корма, помещали в клетку для исследования метаболизма и наблюдали для регистрации времени, требующегося для экскреции бария в виде фекалий у каждой крысы после прохождения через кишечник, в течение 10 часов. Кроме того, вычисляли процент крыс, которые экскретировали содержащие барий фекалии в течение 10 часов, и результаты показаны в Таблице 1 ниже.
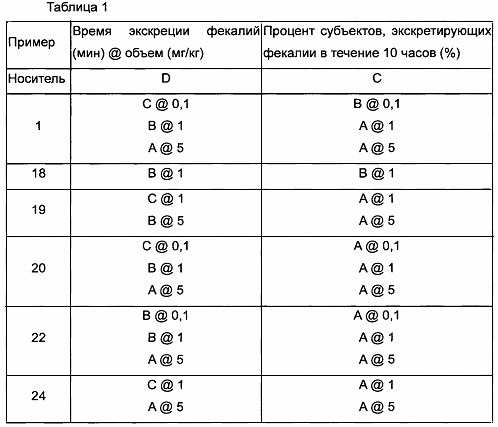
* Время экскреции фекалий
А: 301-400 мин, В: 401-500 мин, С: 501-590 мин, D: 591-600 мин
* Процент субъектов, экскретирующих фекалии в течение 10 часов (%)
А: 76-100%, В: 50-75%, С: <50%
Уменьшение времени экскреции фекалий и увеличение процента крыс, экскретирующих фекалии в течение 10 часов, тесно связаны с освобождением от симптомов запора. Как показано в Таблице 1, экспериментальные крысы, которым вводили соединения по настоящему изобретению, экскретировали фекалии в течение сокращенного времени, и также значительно более высокий процент числа крыс показывал экскрецию фекалий в течение 10 часов, по сравнению с контрольными крысами, которым вводили носитель метилцеллюлозу, которая, как известно, предупреждает запор путем регулирования функций кишечника. Кроме того, было показано, что когда вводимую дозу соединений по настоящему изобретению снижали до уровня от 1/5 до 1/50, полученные эффекты были идентичны или лучше, чем эффекты при введении носителя. Это подтверждает, что соединения по настоящему изобретению могут эффективно предупреждать или лечить запор.
Реферат
Изобретение относится к новым аминоалкилбензотиазепиновым производным формулы 1 или их фармацевтически приемлемым солям и к фармацевтической композиции на их основе для предупреждения или лечения запора. Технический результат: получены новые соединения формулы 1, которые могут применяться для предупреждения или лечения запора. 2 н. и 9 з.п. ф-лы, 1 табл., 31 пр.Формула 1
Формула

Документы, цитированные в отчёте о поиске
Комбинация ингибитора транспорта желчных кислот вподвздошной кишке (ibat) и соли металла для лечения диареи

Комментарии