Бензотиа(ди)азепины и их применение в качестве модуляторов желчных кислот - RU2785867C2
Код документа: RU2785867C2
Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет по заявке Индии № 201811021016, поданной 5 июня 2018 г.; по заявке Швеции № 1850915-8, поданной 18 июля 2018 г.; и по заявке Индии № 201911000892, поданной 8 января 2019 г., раскрытия которых во всей своей полноте включено в настоящее изобретение в качестве ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к производным 1,5-бензотиазепина и 1,2,5-бензотиадиазепина формулы (I). Эти соединения являются модуляторами желчных кислот, обладающими ингибирующей активностью по отношению к апикальному натрий-зависимому переносчику желчных кислот (ASBT) и/или переносчику желчных кислот в печени (LBAT). Настоящее изобретение также относится к фармацевтическим композициям, содержащим эти соединения и к применению этих соединений для лечения сердечно-сосудистых заболеваний, нарушений метаболизма жирных кислот и использования глюкозы, желудочно-кишечных заболеваний и заболеваний печени.
УРОВЕНЬ ТЕХНИКИ
Желчные кислоты являются физиологическими детергентами, которые играют важную роль во всасывании и переносе липидов, питательных веществ и витаминов в кишечнике. Они также являются сигнальными молекулами, которые активируют ядерные рецепторы и сигнальные пути клеток, которые регулируют метаболизм липидов, глюкозы и энергии. Желчные кислоты являются стероидными кислотами, которые синтезируются из холестерина в печени и хранятся в желчном пузыре в виде смешанных мицелл. Во время переваривания двенадцатиперстная кишка запускает высвобождение гормонов, которые вызывают сокращение желчного пузыря и тем самым выделение желчных кислот в тонкий кишечник, где они активируют всасывание жирорастворимых витаминов и холестерина. Когда они попадает в подвздошную кишку, желчные кислоты повторно всасываются из кишечника и секретируются в портальную кровь для возврата в печень с помощью портального венозного кровообращения. Таким образом более 90% желчных кислот рециркулируются и возвращаются в печень. Затем эти желчные кислоты переносятся через синусоидальные мембраны гепатоцитов и повторно секретируются через каналикулярные мембраны в желчь. В этом последнем проходе 75-90% желчных кислот захватываются гепатоцитами, завершая один круг энтерогепатической циркуляции. Оставшаяся доля желчных кислот, очищенная в печени, попадает в системный кровоток, где свободные желчные кислоты фильтруются почечными клубочками, эффективно попадают в проксимальные почечные канальцы и выводятся обратно в системный кровоток. Примечательно, что большинство желчных кислот, секретированных через каналикулярные мембраны в желчь, образованы из пула рециркуляции и менее 10% поступают вследствие нового синтеза в печени. Небольшая доля желчных кислот, которые повторно не всосались в подвздошной кишке, попадает в толстую кишку. В кишечном просвете первичные желчные кислоты превращаются во вторичные желчные кислоты вод действием кишечных бактерий, многие с помощью реакций одинарного или двойного дегидроксилирования стероидного ядра. Желчные кислоты, которые не всосались в кишечнике, затем выводятся в фекалии.
В целом, эффективная система переноса способствует поддержанию больших содержаний постоянного пула желчных кислот, что обеспечивает достаточно высокие содержания сопряженных желчных кислот в кишечнике для стимулирования всасывания липидов, а также уменьшения бактериальной нагрузки тонкого кишечника. Система также сводит к минимуму потерю желчных кислот с фекалиями и мочой и защищает кишечные и гепатобилиарные компартменты путем удаления потенциально цитотоксичных детергентов (описано в обзоре Kosters and Karpen (Xenobiotica 2008, vol. 38, p. 1043-1071); Chiang (J. Lipid Res. 2009, vol. 50, p. 1955-1966); и Dawson (Handb. Exp. Pharmacol. 2011, vol. 201, p. 169-203)).
Установлено, что регуляция размера пула желчных кислот играет ключевую роль в гомеостазе холестерин путем превращения холестерина в желчную кислоту в печени, что является главным путем выведения холестерина из организма. Печень играет важную роль в удалении эндогенных и ксенобиотических соединений из организма. Нормальная гепатобилиарная секреция и энтерогепатическое кровообращение необходимы для выведения из организма эндогенных соединений, таких как холестерин и билирубин и их метаболиты, что поддерживает гомеостаз липидов и желчных кислот. (Kosters and Karpen, Xenobiotica 2008, vol. 38, p. 1043-1071).
Повторное всасывание желчных кислот в подвздошной кишке можно подавить соединениями, ингибирующими апикальный натрий-зависимый переносчик желчных кислот (ASBT). Сообщали, что подавление повторного всасывания желчных кислот применимо для лечения различных заболеваний, включая дислипидемию, диабет, ожирение, констипацию, холестатические заболевания печени, неалкогольный стеатогепатит и другие заболевания печени. За последние десятилетия раскрыт целый ряд соединений-ингибиторов ASBT, см., например, WO 93/16055, WO 94/18183, WO 94/18184, WO 96/05188, WO 96/08484, WO 96/16051, WO 97/33882, WO 98/03818, WO 98/07449, WO 98/40375, WO 99/35135, WO 99/64409, WO 99/64410, WO 00/47568, WO 00/61568, WO 00/38725, WO 00/38726, WO 00/38727, WO 00/38728, WO 00/38729, WO 01/66533, WO 01/68096, WO 02/32428, WO 02/50051, WO 03/020710, WO 03/022286, WO 03/022825, WO 03/022830, WO 03/061663, WO 03/091232, WO 03/106482, WO 2004/006899, WO 2004/076430, WO 2007/009655, WO 2007/009656, WO 2011/137135, DE 19825804, EP 864582, EP 489423, EP 549967, EP 573848, EP 624593, EP 624594, EP 624595, EP 624596, EP 0864582, EP 1173205 и EP 1535913.
Несмотря на целый ряд соединений-ингибиторов ASBT, которые описаны ранее, все еще необходимы модулирующие желчные кислоты соединения, которые обладают оптимизированным профилем активности, селективности и биодоступности.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Установлено, что некоторые производные 1,5-бензотиазепина и 1,2,5-бензотиадиазепина являются активными ингибиторами апикального натрий-зависимого переносчика желчных кислот (ASBT) и/или переносчика желчных кислот в печени (LBAT) и могут быть применимы для лечения заболеваний, при которых желательно ингибирование циркуляции желчных кислот.
Первым объектом настоящего изобретения является соединение формулы (I)

в которой
M выбран из группы, включающей -CH2- и -NR7-;
R1 и R2 все независимо представляют собой C1-4 алкил;
R3 выбран из группы, включающей водород, галоген, гидроксигруппу, C1-4 алкил, C1-4 галогеналкил, C1-4 алкоксигруппу, цианогруппу, нитрогруппу, аминогруппу, N-(C1-4 алкил)аминогруппу, N, N-ди(C1-4 алкил)аминогруппу, N-(арил-C1-4 алкил)аминогруппу, C1-6 алкилкарбониламиногруппу, C3-6 циклоалкилкарбониламиногруппу, N-(C1-4 алкил)аминокарбонил, N, N-ди(C1-4 алкил)аминокарбонил, C1-4 алкилоксикарбониламиногруппу, C3-6 циклоалкилоксикарбониламиногруппу, C1-4 алкилсульфонамидную группу и C3-6 циклоалкилсульфонамидную группу;
n является целым числом, равным 1, 2 или 3;
R4 выбран из группы, включающей водород, галоген, цианогруппу, C1-4 алкил, C3-6 циклоалкил, C1-4 алкоксигруппу, C3-6 циклоалкилоксигруппу, C1-4 алкилтиогруппу, C3-6 циклоалкилтиогруппу, аминогруппу, N-(C1-4 алкил)аминогруппу и N, N-ди(C1-4 алкил)аминогруппу;
один из R5 и R6 представляет собой карбоксигруппу и другой из R5 и R6 выбран из группы, включающей водород, фтор, C1-4 алкил и C1-4 галогеналкил;
R7 выбран из группы, включающей водород и C1-4 алкил; и
R8 выбран из группы, включающей водород и C1-4 алкил;
или его фармацевтически приемлемая соль.
В некоторых вариантах осуществления R1 и R2 все независимо представляют собой C2-4 алкил. В других вариантах осуществления R1 представляет собой н-бутил и R2 представляет собой C2-4 алкил. В предпочтительном варианте осуществления оба R1 и R2 представляют собой н-бутил. В другом предпочтительном варианте осуществления R1 представляет собой н-бутил и R2 представляет собой этил. В еще одном предпочтительном варианте осуществления оба R1 и R2 представляют собой этил.
В некоторых вариантах осуществления R3 выбран из группы, включающей водород, бром, гидроксигруппу, метоксигруппу, аминогруппу, трет-бутоксикарбониламиногруппу, метилсульфонамидную группу и циклопропилсульфонамидную группу. В предпочтительном варианте осуществления n равно 1, т. е. фенильное кольцо замещено только одним заместителем R3. В другом предпочтительном варианте осуществления R3 находится в пара-положении.
В некоторых вариантах осуществления R4 выбран из группы, включающей водород, бром, этил, циклопропил, метоксигруппу, метилтиогруппу и диметиламиногруппу.
В некоторых вариантах осуществления R5 выбран из группы, включающей водород и фтор.
В некоторых вариантах осуществления R6 представляет собой карбоксигруппу.
В некоторых вариантах осуществления R7 представляет собой водород или метил.
В некоторых вариантах осуществления R8 представляет собой водород.
В предпочтительном варианте осуществления соединением формулы (I) является соединение формулы (I-a):

в которой
R1 и R2 все независимо представляют собой этил или н-бутил;
R4 представляет собой фтор, хлор, бром, метилтиогруппу или этилтиогруппу; и
R5 представляет собой водород или фтор;
или его фармацевтически приемлемая соль.
В другом предпочтительном варианте осуществления соединением формулы (I) является соединение формулы (I-b):

в которой
R1 и R2 все независимо представляют собой этил или н-бутил;
R4 представляет собой хлор или метилтиогруппу; и
R5 представляет собой водород или фтор;
или его фармацевтически приемлемая соль.
В другом предпочтительном варианте осуществления соединением формулы (I) является соединение формулы (I-c):

в которой
R4 представляет собой хлор или метилтиогруппу;
или его фармацевтически приемлемая соль.
В другом предпочтительном варианте осуществления соединением формулы (I) является соединение формулы (I-d):
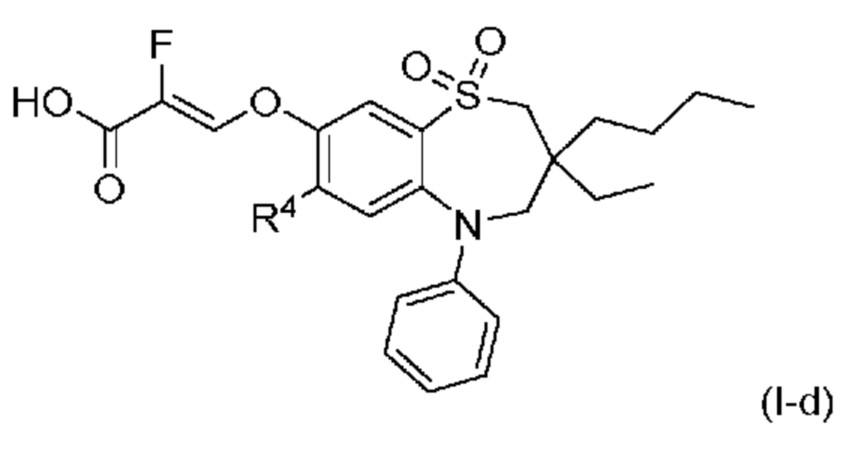
в которой
R4 представляет собой хлор, метилтиогруппу, этилтиогруппу или диметиламиногруппу;
или его фармацевтически приемлемая соль.
В другом предпочтительном варианте осуществления соединением формулы (I) является соединение формулы (I-d), в которой R4 представляет собой хлор или метилтиогруппу;
или его фармацевтически приемлемая соль
В другом предпочтительном варианте осуществления соединением формулы (I) является соединение формулы (I-e):

в которой
R4 представляет собой хлор или метилтиогруппу; и
R5 представляет собой водород или фтор;
или его фармацевтически приемлемая соль.
В другом предпочтительном варианте осуществления соединением формулы (I) является соединение формулы (I-f):
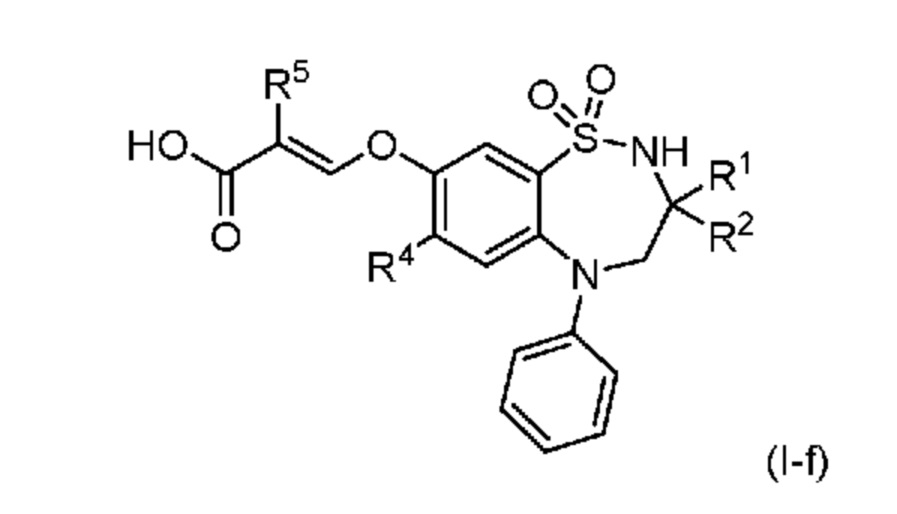
в которой
R1 и R2 все независимо представляют собой этил или н-бутил;
R4 представляет собой хлор или метилтиогруппу; и
R5 представляет собой водород или фтор;
или его фармацевтически приемлемая соль.
В другом предпочтительном варианте осуществления соединением формулы (I) является соединение формулы (I-g):

в которой
R1 и R2 все независимо представляют собой этил или н-бутил;
R4 представляет собой хлор или метилтиогруппу; и
R5 представляет собой водород или фтор;
или его фармацевтически приемлемая соль.
В другом предпочтительном варианте осуществления соединением формулы (I) является соединение формулы (I-h):
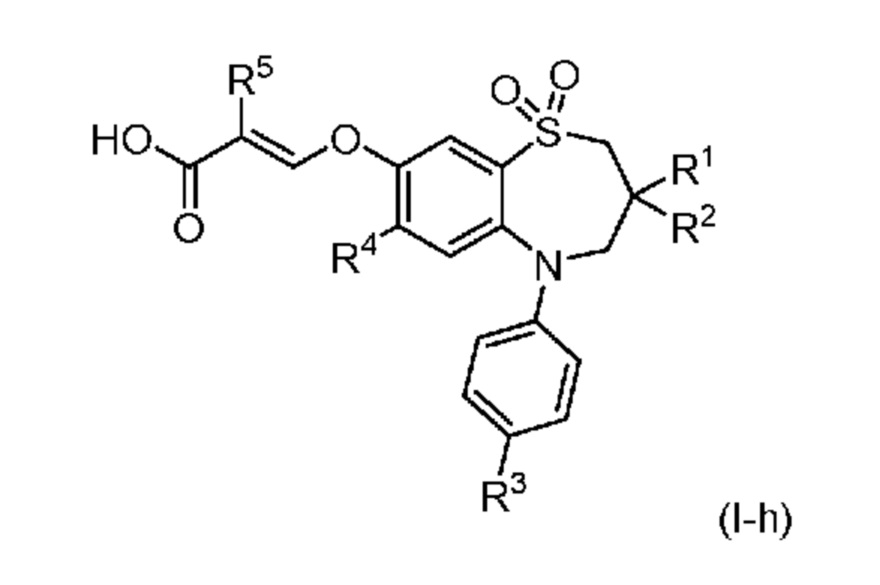
в которой
R1 представляет собой н-бутил;
R2 представляет собой этил или н-бутил;
R3 выбран из группы, включающей N-(C1-4 алкил)аминогруппу, N, N-ди(C1-4 алкил)аминогруппу, N-(арил-C1-4 алкил)аминогруппу, C1-6 алкилкарбониламиногруппу, C1-4 алкилоксикарбониламиногруппу, C1-4 алкилсульфонамидную группу и C3-6 циклоалкилсульфонамидную группу;
R4 представляет собой галоген или C1-4 алкилтиогруппу; и
R5 представляет собой водород или фтор;
или его фармацевтически приемлемая соль.
В другом предпочтительном варианте осуществления соединением формулы (I) является соединение формулы (I-i):
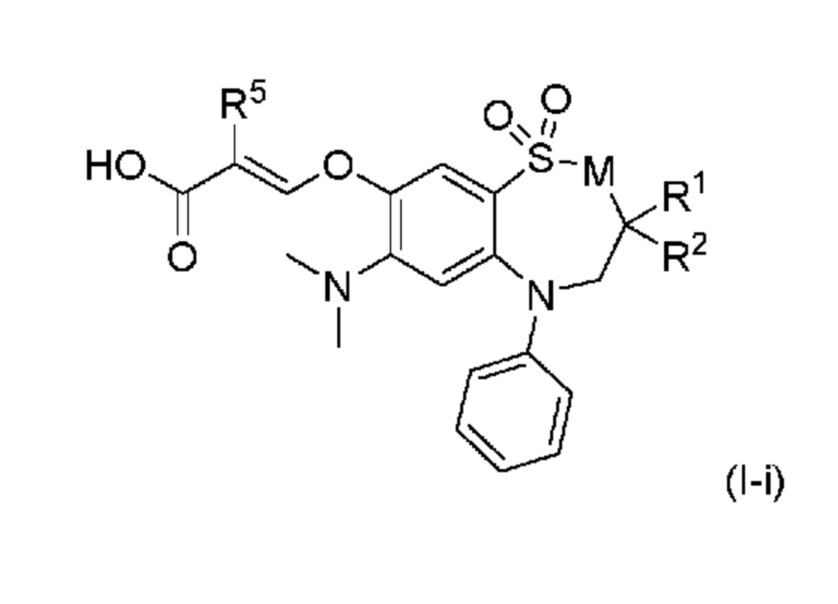
в которой
M представляет собой CH2 или NH;
R1 представляет собой н-бутил;
R2 представляет собой этил или н-бутил;
R5 представляет собой водород или фтор;
или его фармацевтически приемлемая соль.
В предпочтительном варианте осуществления соединение формулы (I) выбран из группы, включающей:
(E)-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((5-(4-аминофенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((5-(4-((трет-бутоксикарбонил)амино)фенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((7-бром-3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(R)-(E)-3-((7-бром-3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(S)-(E)-3-((7-бром-3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((3,3-дибутил-7-циклопропил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((3,3-дибутил-7-(диметиламино)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((3,3-дибутил-5-(4-(циклопропансульфонамидо)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((3,3-дибутил-5-(4-(метилсульфонамидо)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(Z)-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту;
(E)-3-((3,3-дибутил-7-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((3-бутил-3-этил-7-метокси-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((3,3-дибутил-7-метокси-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((5-(4-бромфенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(R)-(E)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(S)-(E)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((3,3-дибутил-5-(4-метоксифенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((3,3-дибутил-5-(4-гидроксифенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((5-(4-(бензиламино)фенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((7-бром-5-(4-((трет-бутоксикарбонил)амино)фенил)-3-бутил-3-этил-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((3,3-дибутил-5-(4-((метоксикарбонил)амино)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((3,3-дибутил-5-(4-(диметиламино)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(Z)-3-((5-(4-((трет-бутоксикарбонил)амино)фенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту;
(E)-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-(4-пиваламидофенил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(Z)-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-(4-пиваламидофенил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту;
(E)-3-((5-(4-((бутоксикарбонил)амино)фенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((3,3-дибутил-5-(4-(3,3-диметилбутанамидо)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(Z)-3-((3,3-дибутил-5-(4-изобутирамидофенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту;
(E)-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-(4-(трифторметил)фенил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((3,3-дибутил-5-(4-изобутирамидофенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-(4-пиваламидофенил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(Z)-3-((3,3-дибутил-5-(4-(циклопентанкарбоксамидо)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту;
(Z)-3-((3,3-дибутил-5-(4-(циклопропанкарбоксамидо)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту;
(E)-3-((3,3-дибутил-5-(4-(циклопентанкарбоксамидо)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-tetrahydrobenzo1-,5-тиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((3-бутил-5-(4-(циклопентанкарбоксамидо)фенил)-3-этил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((3,3-диэтил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((3,3-дибутил-5-(4-бутирамидофенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(Z)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту;
(R)-(Z)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту;
(S)-(Z)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту;
(Z)-3-((3,3-диэтил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту;
(Z)-3-((3,3-дибутил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту;
(Z)-3-((3-бутил-7-хлор-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту;
(R)-(Z)-3-((3-бутил-7-хлор-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту;
(S)-(Z)-3-((3-бутил-7-хлор-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту;
(E)-3-((3-бутил-7-хлор-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(R)-(E)-3-((3-бутил-7-хлор-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(S)-(E)-3-((3-бутил-7-хлор-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(Z)-3-((3,3-диэтил-7-(метилтио)-1,1-диоксидо-5-(4-пиваламидофенил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту;
(Z)-3-((3,3-дибутил-7-хлор-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту;
(E)-3-((3,3-диэтил-7-йод-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((7-бром-3,3-диэтил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(Z)-3-((7-бром-3,3-диэтил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту;
(S)-(Z)-3-((3-бутил-3-этил-7-йод-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(R)-(Z)-3-((3-бутил-3-этил-7-йод-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(Z)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(S)-(Z)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(R)-(Z)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((3-бутил-5-(4-(трет-бутилкарбамоил)фенил)-3-этил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(Z)-3-((7-бром-3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту;
(R)-(Z)-3-((7-бром-3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту;
(S)-(Z)-3-((7-бром-3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту;
(Z)-3-((5-(4-(бензиламино)фенил)-3,3-диэтил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту;
(E)-3-((3,3-дибутил-7-(этилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((3,3-дибутил-5-(4-(трет-бутилкарбамоил)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((3,3-дибутил-5-(4-(изопропилкарбамоил)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(Z)-3-((3,3-дибутил-7-(этилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту;
(Z)-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-(4-пропионамидофенил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту;
(Z)-3-((3-бутил-3-этил-7-(этилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту;
(E)-3-((3-бутил-3-этил-7-(этилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-метакриловую кислоту;
(E)-3-((7-бром-3,3-дибутил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)акриловую кислоту;
(S)-(E)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)акриловую кислоту;
(R)-(E)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)акриловую кислоту;
(Z)-3-((3,3-дибутил-5-(4-(трет-бутилкарбамоил)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту;
(E)-3-((3-бутил-7-(диметиламино)-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((3,3-дибутил-7-фтор-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((3,3-дибутил-7-циано-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)бут-2-еновую кислоту;
(Z)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакриловую кислоту;
(S)-(Z)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакриловую кислоту;
(R)-(Z)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакриловую кислоту;
(E)-3-((7-бром-3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((3-бутил-3-этил-2-метил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)акриловую кислоту;
(S)-(E)-3-((3-бутил-3-этил-2-метил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)акриловую кислоту;
(R)-(E)-3-((3-бутил-3-этил-2-метил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-tetrahydro1,2,5-бензотиадиазепин-8-ил)окси)акриловую кислоту;
(E)-3-((3-бутил-3-этил-7-(метиламино)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(S)-(E)-3-((3-бутил-3-этил-7-(метиламино)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(R)-(E)-3-((3-бутил-3-этил-7-(метиламино)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(Z)-3-((5-(4-бромфенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту;
(Z)-3-((3,3-дибутил-5-(4-гидроксифенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту;
(Z)-3-((3-бутил-3-этил-7-фтор-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту;
(Z)-3-((3,3-дибутил-7-(диметиламино)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакриловую кислоту;
(Z)-3-((3-бутил-3-этил-2-метил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакриловую кислоту;
(S)-(Z)-3-((3-бутил-3-этил-2-метил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакриловую кислоту;
(R)-(Z)-3-((3-бутил-3-этил-2-метил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакриловую кислоту;
(E)-3-((3-бутил-3-этил-7-фтор-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(R)-(E)-3-((3-бутил-3-этил-7-фтор-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(S)-(E)-3-((3-бутил-3-этил-7-фтор-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловую кислоту;
(Z)-3-((3,3-дибутил-5-(4-(диметилкарбамоил)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту;
(Z)-3-((3,3-дибутил-2-метил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакриловую кислоту;
(Z)-3-((7-бром-3-бутил-3-этил-2-метил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакриловую кислоту;
(Z)-3-((3,3-дибутил-5-(3,4-дифторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту;
(Z)-3-((3-бутил-7-(диметиламино)-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту;
(S)-(Z)-3-((3-бутил-7-(диметиламино)-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту; и
(R)-(Z)-3-((3-бутил-7-(диметиламино)-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловую кислоту;
или его фармацевтически приемлемую соль.
При использовании в настоящем изобретении термин "галоген" представляет собой фтор, хлор, бром и йод.
При использовании в настоящем изобретении термин "C1-6 алкил" представляет собой линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода, и термин "C1-4 алкил" представляет собой линейную или разветвленную алкильную группу, содержащую от 1 до 4 атомов углерода. Примеры C1-4 алкила включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил.
При использовании в настоящем изобретении термин "C1-4 галогеналкил" представляет собой линейную или разветвленную C1-4 алкильную группу, определенную в настоящем изобретении, где один или большее количество атомов водорода заменены галогеном. Примеры C1-4 галогеналкила включают хлорметил, фторэтил и трифторметил.
При использовании в настоящем изобретении термины "C1-4 алкоксигруппа" и "C1-4 алкилтиогруппа" представляют собой линейную или разветвленную C1-4 алкильную группу, присоединенную к остальной части молекулы через атом кислорода или серы соответственно.
При использовании в настоящем изобретении термин "C3-6 циклоалкил" представляет собой моноциклическое насыщенное углеводородное кольцо, содержащее от 3 до 6 атомов углерода. Примеры C3-6 циклоалкила включают циклопропил, циклобутил, циклопентил и циклогексил.
Термин "арил" представляет собой ароматическое моноциклическое кольцо, состоящее из 6 атомов углерода или ароматическую бициклическую кольцевую систему, состоящую из 10 атомов углерода. Примеры арила включают фенил, нафтил и азуленил.
Термин "аминогруппа" представляет собой группу -NH2. При использовании в настоящем изобретении термины "N-(C1-4 алкил)аминогруппа" и "N, N-ди(C1-4 алкил)аминогруппа" представляют собой аминогруппу, в которой один или оба атома водорода заменены, соответственно линейной или разветвленной C1-4 алкильной группой. Примеры N-(C1-4 алкил)аминогруппы включают метиламиногруппу, этиламиногруппу и трет-бутиламиногруппу и примеры N, N-ди-(C1-4 алкил)аминогруппы включают диметиламиногруппу и диэтиламиногруппу.
При использовании в настоящем изобретении термин "N-(арил-C1-4 алкил)аминогруппа" представляет собой аминогруппу, в которой атом водорода заменен арил-C1-4 алкильной группой. Примеры N-(арил-C1-4 алкил)аминогруппы включают бензиламиногруппу и фенилэтиламиногруппу. Термин "C1-6 алкилкарбониламиногруппа" представляет собой аминогруппу, в которой атом водорода заменен C1-6 алкилкарбонильной группой. Примеры C1-6 алканоиламиногруппы включают ацетиламиногруппу и трет-бутилкарбониламиногруппу. Термин "C1-4 алкилоксикарбониламиногруппа" представляет собой аминогруппу, в которой атом водорода заменен C1-4 алкилоксикарбонильной группой. Примером C1-4 алкилоксикарбониламиногруппы является трет-бутоксикарбониламиногруппа. Термины "C1-4 алкилсульфонамидная группа" и "C3-6 циклоалкилсульфонамидная группа" представляют собой аминогруппу, в которой атом водорода заменен C1-4 алкилсульфонильной или C3-6 циклоалкилсульфонильной группой соответственно.
При использовании в настоящем изобретении термин "фармацевтически приемлемые" представляет собой соединения, материалы, композиции и/или дозированные формы, которые являются подходящими для применение в фармацевтике для любой и которые обычно являются безопасными, нетоксичными и не являются биологически или в другом отношении нежелательными.
При использовании в настоящем изобретении термин "примерно" в настоящем изобретении представляет собой значение или параметр, который включает (и описывает) варианты, которые относятся к этому значению или параметру. Например, описание с указанием "примерно 20" включает указание "20". Числовые диапазоны включают граничные значения. Обычно термин "примерно" представляет собой указанное значение переменной и все значения переменной, которые отклоняются от значения на значение экспериментальной погрешности для указанного значения (например, в пределах составляющего 95% доверительного интервала среднего значения) или в пределах 10% указанного значения, в зависимости от того, что больше.
1,5-Бензотиазепины и 1,2,5-бензотиадиазепины формулы (I) или их фармацевтически приемлемые соли, являются ингибиторами апикального натрий-зависимого переносчика желчных кислот (ингибиторы ASBT), переносчика желчных кислот в печени (ингибиторы LBAT) или апикального натрий-зависимого переносчика желчных кислот и переносчика желчных кислот в печени (двойные ингибиторы ASBT/LBAT). Поэтому они применимы для лечения или предупреждения патологических состояний, нарушений и заболеваний, при которых желательно ингибирование циркуляции желчных кислот, таких как сердечно-сосудистые заболевания, нарушения метаболизма жирных кислот и использования глюкозы, желудочно-кишечные заболевания и заболевания печени.
Сердечно-сосудистые заболевания и нарушения метаболизма жирных кислот и использования глюкозы включают, но не ограничиваются только ими, гиперхолестеринемию; нарушения метаболизма жирных кислот; сахарный диабет типа 1 и типа 2; осложнения диабета, включая катаракты, заболевания микро- и макрососудов, ретинопатию, невропатию, нефропатию и медленное заживление раны, ишемию тканей, диабетическую стопу, артериосклероз, инфаркт миокарда, острый коронарный синдром, нестабильную стенокардию, стабильную стенокардию, удар, окклюзионное заболевание периферической артерии, кардиомиопатию, сердечную недостаточность, нарушения частоты сердечных сокращений и рестеноз сосудов; связанные с диабетом заболевания, такие как резистентность к инсулину (нарушенный гомеостаз глюкозы), гипергликемия, гиперинсулинемия, повышенное содержание жирных кислот или глицерина в крови, ожирение, дислипидемия, гиперлипидемия, включая гипертриглицеридемию, метаболический синдром (синдром X), атеросклероз и гипертензию; и увеличения содержания липопротеинов высокой плотности.
Желудочно-кишечные заболевания и нарушения включают констипацию (включая хроническую констипацию, функциональную констипацию, хроническую идиопатическую констипацию (CIC), периодическую/спорадическую констипацию, вторичную по отношению к сахарному диабету констипацию, вторичную по отношению к удару констипацию, вторичную по отношению к хроническому заболеванию почек констипацию, вторичную по отношению к рассеянному склерозу констипацию, вторичную по отношению к болезни Паркинсона констипацию, вторичную по отношению к системному склерозу констипацию, вызванную лекарственным средством констипацию, синдром раздраженной толстой кишки с констипацией (IBS-C), смешанный синдром раздраженной толстой кишки (IBS-M), функциональную констипацию у детей и вызванную опиоидом констипацию); болезнь Крона; первичную мальадсорбцию желчных кислот; синдром раздраженной толстой кишки (IBS); воспалительная болезнь кишечника (IBD); воспаление подвздошной кишки; и рефлюксную болезнь и ее осложнения, такие как пищевод Баррета, желчный рефлюксный эзофагит и желчный рефлюксный гастрит.
Заболевание печени, определенное в настоящем изобретении, представляет собой любое заболевание печени и связанных с ней органов, таких как поджелудочная железа, воротная вена, паренхима печени, внутрипеченочное желчное дерево, внепеченочное желчное дерево и желчный пузырь. В некоторых случаях заболевание печени представляет собой зависимое от желчных кислот заболевание печени. Заболевания и нарушения печени включают, но не ограничиваются только ими наследственное метаболическое нарушение в печени; врожденные дефекты синтеза желчных кислот; врожденные аномалии желчных протоков; атрезию желчных протоков; атрезию желчных протоков после операции Касаи; атрезию желчных протоков после трансплантация печени; врожденный гигантоклеточный гепатит; холестаз новорожденных; наследственные формы холестаза; церебросухожильный ксантоматоз; вторичный дефект синтеза BA (желчные кислоты); синдром Цельвегера; связанное с муковисцидозом заболевание печени; дефицит альфа-1-антитрипсина; синдром Алажиля (ALGS); синдром Байлера; первичный дефект синтеза желчных кислот (BA); прогрессирующий семейный внутрипеченочный холестаз (PFIC), включая PFIC-1, PFIC-2, PFIC-3 и неспецифический PFIC, PFIC после отведения желчи и PFIC после трансплантации печени; доброкачественный возвратный внутрипеченочный холестаз (BRIC), включая BRIC1, BRIC2 и неспецифический BRIC, BRIC после отведения желчи и BRIC после трансплантации печени; аутоиммунный гепатит; первичный билиарный цирроз (PBC); фиброз печени; неалкогольную жировую инфильтрацию печени (NAFLD); неалкогольный стеатогепатит (NASH); портальную гипертензию; холестаз; холестаз при синдроме Дауна; вызванный лекарственным средством холестаз; внутрипеченочный холестаз беременных (желтуха во время беременности); внутрипеченочный холестаз; внепеченочный холестаз; связанный с парентеральным питанием холестаз (PNAC); связанный с низким содержанием фосфолипидов холестаз; синдром Аагенеса 1 (LSC1); первичный склерозирующий холангит (PSC); связанный с иммуноглобулином G4 холангит; первичный билиарный холангит; холелитиаз (желчные камни); билиарный литиаз; холедохолитиаз; желчнокаменный панкреатит; болезнь Кароли; злокачественную опухоль желчных протоков; злокачественную опухоль, вызывающую обструкцию желчного дерева; стриктуры желчных протоков; AIDS-ассоциированную холангиопатию; ишемическую холангиопатию; прурит вследствие холестаза или желтухи; панкреатит; хроническое аутоиммунное заболевание печени, приводящее к прогрессирующему холестазу; жировой гепатоз; алкогольный гепатит; острую жировую инфильтрацию печени; жировую инфильтрацию печени беременных; лекарственный гепатит; вызванные перегрузкой железом нарушения; врожденный дефект синтеза желчных кислот типа 1 (BAS типа 1); вызванное лекарственным средством поражение печени (DILI); фиброз печени; врожденный фиброз печени; цирроз печени; гистиоцитоз клеток Лангерганса (LCH); ихтиоз новорожденных - склерозирующий холангит (NISCH); эритропоэтическую протопорфирию (EPP); идиопатическую дуктопению взрослых (IAD); идиопатический врожденный гигантоклеточный гепатит (INH); несиндромальную недостаточность междольковых желчных протоков (NS PILBD); северо-американский индейский детский цирроз (NAIC); саркоидоз печени; амилоидоз; некротизирующий энтероколит; токсичности, вызванные желчными кислотами в сыворотке, включая нарушения сердечного ритма (например, фибрилляция предсердий) в случаях аномального профиля желчных кислот в сыворотке, кардиомиопатию, связанную с циррозом печени ("холекардия"), и слабость скелетных мышц, связанную с холестатическим заболеванием печени; вирусный гепатит (включая гепатит A, гепатит B, гепатит C, гепатит D и гепатит E); печеночно-клеточную карциному (гепатома); холангиокарциному; связанные с желчными кислотами желудочно-кишечные раковые заболевания; и холестаз, вызванный опухолями и новообразованиями в печени, желчных путях и поджелудочной железе.
Другие заболевания, которые можно лечить или предупреждать соединениями формулы (I) или их фармацевтически приемлемыми солями, включают синдромы гиперабсорбции (включая абеталипопротеинемию, семейную гипобеталипопротеинемию (FHBL), болезнь задержки хиломикронов (CRD) и ситостеринемию); гипервитаминоз и остеопетроз; гипертензию; клубочковую гиперфильтрации; и прурит при почечной недостаточности.
Перенос желчных кислот в организме человека регулируется действием представителей семейства SLC10 белков-переносчиков растворенных веществ, в частности, полипептидом-сопереносчиком Na+-таурохолата (NTCP, также называющимся переносчиком желчных кислот в печени (LBAT); символ гена SLC10A1), который экспрессируется в синусоидальной мембране гепатоцитов, и апикальным натрий-зависимым переносчиком желчных кислот (ASBT, также называющимся подвздошнокишечным переносчиком желчных кислот (IBAT), ISBT, ABAT или NTCP2; символ гена SLC10A2), который экспрессируется в апикальной мембране энтероцитов подвздошной кишки, клетках проксимальных почечных канальцев, эпителии печени, крупных холангиоцитов и клетках эпителия желчного пузыря. В печени желчные кислоты эффективно извлекаются из портальной крови переносчиком желчных кислот в печени (LBAT) и потворно секретируются через каналикулярные мембраны насосом выведения солей желчных кислот (BSEP; символ гена ABCB11). Повторное всасывание желчных кислот в подвздошной кишке проводится апикальным натрий-зависимым переносчиком желчных кислот (ASBT), где он обычно называется подвздошнокишечным переносчиком желчных кислот (IBAT). Оба LBAT и ASBT дкйствуют в качестве электрогенных сопереносчиков натрия-растворенного вещества, которые перемещают два или большее количество ионов Na+ в пересчете на одну молекулу растворенного вещества.
Ксенобиотики и эндобиотики, включая желчные кислоты, попадают в печень из портальной крови и секретируются в желчь с помощью особых белков-переносчиков с индивидуализированными специфичностями по отношению к субстрату. Сопряженные с глицином и таурином желчные кислоты существуют в анионной форме и не способны пересекать мембраны путем диффузии, и поэтому для введения в гепатоциты или выведения из них полностью зависят от мембранных белков-переносчиков (Kosters and Karpen, Xenobiotica 2008, vol. 38, p. 1043-1071). Для ASBT и LBAT соли сопряженных с глицином и таурином желчных кислот предпочтительнее их несопряженных аналогов и они обладают более значительным сродством к солям тригидроксипроизводных желчных кислот. Для ASBT пока не обнаружены не являющиеся желчными кислотами субстраты, однако установлено, что LBAT также переносит разные сульфаты стероидов, гормоны и ксенобиотики.
С точки зрения требований по ингибированию, предъявляемых к лекарственному средству, LBAT не столь тщательно охарактеризован, как ASBT. Dong et al. определили утвержденные FDA лекарственные средства, которые ингибируют LBAT человека, и сопоставили LBAT и ASBT с точки зрения требований по ингибированию. Провели серию исследований ингибирования LBAT с использованием утвержденных FDA лекарственных средств совместно с итеративной компьютерной моделью. Скрининг выявил 27 лекарственных средств в качестве новых ингибиторов LBAT, включая ирбесартан (Ki =11,9 мкМ) и эзетимиб (Ki=25,0 мкМ). Установлено, что общим фармакофорным признаком является то, что два гидрофоба и один акцептор водородной связи важны для ингибирования LBAT. Из 72 исследованных in vitro лекарственных средств всего 31 лекарственное средство ингибировало LBAT, а 51 лекарственных средств (т. е. более половины) ингибировали ASBT. Следовательно, поскольку наблюдалось перекрывание ингибиторов, ASBT неожиданно являлся более склонным к ингибированию лекарственным средством, чем LBAT, и это может быть связано с тем, что LBAT обладает меньшим количеством фармакофорных признаков (Dong et al., Mol. Pharm. 2013, vol. 10, p. 1008-1019).
Vaz et al. сообщили о выявлении дефицита LBAT в качестве нового нарушения метаболизма новорожденных с относительно "мягким" клиническим фенотипом. Выявление дефицита LBAT подтвердило, что этот переносчик является основной системой передачи солей сопряженные желчных кислот в печень, но также показало, что вспомогательные переносчики также способны поддерживать энтерогепатический цикл при его отсутствии (Vaz et al., Hepatology 2015, vol. 61, p. 260-267). Эти данные свидетельствуют в пользу гипотезы о том, что ингибирование LBAT является безопасным механизмом воздействия, поскольку гепатоциты все же обладают возможностью поглощать необходимое количество желчных кислот.
Liu et al. описали выявление нового типа гиперхоланемии, которая связана с гомозиготностью мутации p.Ser267Phe в SLC10A1 (LBAT). частота аллеля этой мутации в гене SLC10A1 разная для разных популяций, причем наибольшая частота наблюдается в Южном Китае (8% и 12% в китайских городах Han и Dai соответственно) и во Вьетнаме (11%). Предполагается, что эта "латентная" гиперхоланемия поражает 0,64% популяции в южном Han, 1,44% популяции в китайском городе Dai и 1,21% популяции во Вьетнаме. Также наблюдалось увеличение содержания сопряженных и несопряженных BA в сыворотке гомозиготных индивидуумов. Liu et al. предположили, что эти данные, вероятнее всего, обусловлены уменьшенным переносом BA из портального кровообращения в гепатоциты. Эти данные свидетельствуют в пользу гипотезы о том, что физиологическая функция энтерогепатического кровообращения состоит не только в рециркулировании желчных кислот, но и в выведении желчных кислот из кровообращения для обеспечения гомеостаза (Karpen and Dawson, Hepatology 2015, vol. 61, p. 24-27). Альтернативно, печень может синтезировать увеличенные количества желчных кислот для компенсации ослабления энтерогепатического кровообращения у гомозиготных носителей. Поскольку LBAT также переносит несопряженные желчные кислоты, повышение содержания несопряженных желчных кислот в этом исследовании не было неожиданным (Liu et al., Scientific Reports 2017, 7: 9214, p. 1-7).
Установлено, что LBAT инактивирован при некоторых формах холестатического поражения печени и холестаза, тогда как установлено, что ASBT инактивирован при разных желудочно-кишечных нарушениях, таких как болезнь Крона, первичная мальадсорбция желчных кислот, воспалительная болезнь кишечника и воспаление подвздошной кишки, но активирован при холестазе. LBAT также действует в качестве клеточного рецептора для проникновения вируса гепатита B (HBV) и вируса гепатита D (HDV), которые являются основной причиной заболевания печени и печеночно-клеточной карциномы.
Исследовано влияние ингибирования ASBT на снижение содержания холестерина в плазме и усиление резистентности к инсулину, а также на уменьшение нагрузки печени желчными кислотами при холестатическом заболевание печени. Кроме того, установлено, что ингибирование ASBT восстанавливает содержание инсулина и нормогликемию и это показано, что ингибирование ASBT является перспективным средством лечения сахарного диабета типа 2. Ингибиторы ASBT также использовали для лечения функциональной констипации.
Поскольку ASBT экспрессируется в основном в подвздошной кишке (где его часто обпредставляют собой, как IBAT), не требуется, чтобы ингибиторы ASBT были доступны системно. С другой стороны, ASBT также экспрессируется в клетках проксимальных канальцев почек. Поэтому системно доступные ингибиторы ASBT также могут ингибировать обратный захват желчных кислот в почках. Предполагается, что это приводит к повышенному содержанию желчных кислот в моче и увеличенному выведению желчных кислот из организма с мочой. Поэтому предполагается, что системно доступные ингибиторы ASBT, которые действуют не только в подвздошной кишке, но и в почках, приводят к большему снижению содержания желчных кислот, чем системно недоступные ингибиторы ASBT, которые действуют только в подвздошной кишке.
Соединения, обладающие высокой активностью при ингибировании ASBT, являются особенно подходящими для лечения заболеваний печени, которые вызывают холестаз, таких как прогрессирующий семейный внутрипеченочный холестаз (PFIC), синдром Алажиля, атрезия желчных протоков и неалкогольный стеатогепатит (NASH).
Атрезия желчных протоков является редким заболеванием печени у детей, которое включает полную или частичную блокаду (или даже отсутствие) крупных желчных протоков. Эта блокада или отсутствие вызывают холестаз, который приводит к накоплению желчных кислот, которое поражает печень. В некоторых вариантах осуществления накопление желчных кислот происходит во внепеченочном желчном дереве. В некоторых вариантах осуществления накопление желчных кислот происходит во внутрипеченочном желчном дереве. Современным стандартом лечения является операция Касаи, которая является операцией, с помощью которой удаляют блокированные желчные протоки и непосредственно соединяют часто тонкой кишки с печенью. В настоящее время отсутствуют утвержденные лекарственные средства для этого нарушения.
Настоящее изобретение относится к способам лечения атрезии желчных протоков у нуждающегося в нем субъекта, способы включают введение терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых вариантах осуществления субъекту проводят операцию Касаи до введения соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых вариантах осуществления субъекту вводят соединение формулы (I) или его фармацевтически приемлемую соль, до проведения операции Касаи. В некоторых вариантах осуществления лечение атрезии желчных протоков приводит к снижению содержания желчных кислот в сыворотке у субъекта. В некоторых вариантах осуществления содержание желчных кислот в сыворотке определяют, например, с помощью ферментативного анализа ELISA или анализов по измерению полного содержания желчных кислот, описанных в публикации Danese et al., PLoS One. 2017, vol. 12(6): e0179200, которая во всей своей полноте включена в настоящее изобретение в качестве ссылки. В некоторых вариантах осуществления содержание желчных кислот в сыворотке может снизиться, например, на 10% - 40%, на 20% - 50%, на 30% - 60%, на 40% - 70%, на 50% - 80% или более, чем на 90% по сравнению с содержанием желчных кислот в сыворотке до введения соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых вариантах осуществления лечение атрезии желчных протоков включает лечение прурита.
PFIC является редким генетическим нарушением, которое по оценкам поражает одного из каждых рожденных 50000-100000 детей во всем мире и вызывает прогрессирующее, опасное для жизни заболевание печени.
Одним проявлением PFIC является прурит, который часто приводит к серьезному ухудшению качества жизни. В некоторых случаях PFIC приводит к циррозу и печеночной недостаточности. Современные средства лечения включают частичное отведение желчи наружу (PEBD) и трансплантацию печени, однако эти варианты могут привести к существенному риску послеоперационных, а также к психологическим и социальным проблемам.
Выявлены три альтернативных дефекта генов, которые коррелируют с тремя отдельными подтипами PFIC, известными, как типы 1, 2 и 3.
PFIC типа 1, который часто называют "болезнью Байлера", вызван нарушением секреции желчи вследствие мутаций в гене ATP8B1, который кодирует белок, который способствует поддержанию надлежащего баланса жиров, известных, как фосфолипиды, в клеточных мембранах в желчных протоках. Нарушение баланса этих фосфолипидов связано с холестазом и повышенным содержанием желчных кислот в печени. У субъектов с PFIC типа 1 обычно развивается холестаз в первые месяцы жизни, при отсутствии хирургического лечения развивается в цирроз и терминальную стадию заболевания печени до конца первого десятилетия жизни.
PFIC типа 2, который иногда называют "синдромом Байлера", вызван нарушением секреции солей желчных кислот вследствие мутаций в гене ABCB11, который кодирует белок, известный, как насос выведения солей желчных кислот, который выводит желчные кислоты из печени. У субъектов с PFIC типа 2 часто развивается печеночная недостаточность в первые годы жизни и у них повышенный риск развития типа рака печени, известного, как печеночно-клеточная карцинома.
PFIC типа 3, который обычно наблюдается в первые годы детства с прогрессирующим холестазом, вызван мутациями в гене ABCB4, который кодирует переносчик, который перемещает фосфолипиды через клеточные мембраны.
Кроме того, предположено, что мутации в гене TJP2, гене NR1H4 или гене Myo5b являются причиной PFIC. Кроме того, у некоторых субъектов с PFIC не имеется мутации в любом из генов ATP8B1, ABCB11, ABCB4, TJP2, NR1H4 или Myo5b. В этих случаях причина патологического состояния неизвестна.
Типичные мутации гена ATP8B1 или образовавшегося белка приведены в таблицах 1 и 2, где нумерация основана на белке дикого типа ATP8B1 человека (например, SEQ ID NO: 1) или гене (например, SEQ ID NO: 2). Типичные мутации гена ABCB11 или образовавшегося белка приведены в таблицах 4 и 5, где нумерация основана на белке дикого типа ABCB11 человека (например, SEQ ID NO: 3) или гена (например, SEQ ID NO: 4).
Как может быть известно специалистам в данной области техники, положение аминокислоты в эталонной последовательности белка, которое соответствует положению конкретной аминокислоты в SEQ ID NO: 1 или 3 можно определить путем выравнивания эталонной последовательности белка с SEQ ID NO: 1 или 3 (например, с использованием программного обеспечения, такого как ClustalW2). Изменения в этих остатках (называющиеся в настоящем изобретении, как "мутации") могут включать замены одной или нескольких аминокислот, вставки в последовательности или их фланкирование, и делеции из последовательностей или их фланкирование. Как может быть известно специалистам в данной области техники, положение нуклеотида в эталонной последовательности гена, которое соответствует положению конкретного нуклеотида в SEQ ID NO: 2 или 4 можно определить путем выравнивания эталонной последовательности гена с SEQ ID NO: 2 или 4 (например, с использованием программного обеспечения, такого как ClustalW2). Изменения в этих остатках (называющиеся в настоящем изобретении, как "мутации") замены одного или нескольких нуклеотидов, вставки в последовательности или их фланкирование, и делеции из последовательностей или их фланкирование. См. также публикацию Kooistra, et al., "KLIFS: A structural kinase-ligand interaction database", Nucleic Acids Res. 2016, vol. 44, no. D1, pp. D365-D371, которая во всей своей полноте включена в настоящее изобретение в качестве ссылки.
Каноническая последовательность белков ATP8B1 (SEQ ID NO: 1) - Uniprot ID O43520
MSTERDSETT FDEDSQPNDE VVPYSDDETE DELDDQGSAV EPEQNRVNRE AEENREPFRK ECTWQVKAND RKYHEQPHFM NTKFLCIKES KYANNAIKTY KYNAFTFIPM NLFEQFKRAA NLYFLALLIL QAVPQISTLA WYTTLVPLLV VLGVTAIKDL VDDVARHKMD KEINNRTCEV IKDGRFKVAK WKEIQVGDVI RLKKNDFVPA DILLLSSSEP NSLCYVETAE LDGETNLKFK MSLEITDQYL QREDTLATFD GFIECEEPNN RLDKFTGTLF WRNTSFPLDA DKILLRGCVI RNTDFCHGLV IFAGADTKIM KNSGKTRFKR TKIDYLMNYM VYTIFVVLIL LSAGLAIGHA YWEAQVGNSS WYLYDGEDDT PSYRGFLIFW GYIIVLNTMV PISLYVSVEV IRLGQSHFIN WDLQMYYAEK DTPAKARTTT LNEQLGQIHY IFSDKTGTLT QNIMTFKKCC INGQIYGDHR DASQHNHNKI EQVDFSWNTY ADGKLAFYDH YLIEQIQSGK EPEVRQFFFL LAVCHTVMVD RTDGQLNYQA ASPDEGALVN AARNFGFAFL ARTQNTITIS ELGTERTYNV LAILDFNSDR KRMSIIVRTP EGNIKLYCKG ADTVIYERLH RMNPTKQETQ DALDIFANET LRTLCLCYKE IEEKEFTEWN KKFMAASVAS TNRDEALDKV YEEIEKDLIL LGATAIEDKL QDGVPETISK LAKADIKIWV LTGDKKETAE NIGFACELLT EDTTICYGED INSLLHARME NQRNRGGVYA KFAPPVQESF FPPGGNRALI ITGSWLNEIL LEKKTKRNKI LKLKFPRTEE ERRMRTQSKR RLEAKKEQRQ KNFVDLACEC SAVICCRVTP KQKAMVVDLV KRYKKAITLA IGDGANDVNM IKTAHIGVGI SGQEGMQAVM SSDYSFAQFR YLQRLLLVHG RWSYIRMCKF LRYFFYKNFA FTLVHFWYSF FNGYSAQTAY EDWFITLYNV LYTSLPVLLM GLLDQDVSDK LSLRFPGLYI VGQRDLLFNY KRFFVSLLHG VLTSMILFFI PLGAYLQTVG QDGEAPSDYQ SFAVTIASAL VITVNFQIGL DTSYWTFVNA FSIFGSIALY FGIMFDFHSA GIHVLFPSAF QFTGTASNAL RQPYIWLTII LAVAVCLLPV VAIRFLSMTI WPSESDKIQK HRKRLKAEEQ WQRRQQVFRR GVSTRRSAYA FSHQRGYADL ISSGRSIRKK RSPLDAIVAD GTAEYRRTGD S
Каноническая последовательность DNA для ATP8B1 (SEQ ID NO: 2)
ATG AGT ACA GAA AGA GAC TCA GAA ACG ACA TTT GAC GAG GAT TCT CAG CCT AAT GAC GAA GTG GTT CCC TAC AGT GAT GAT GAA ACA GAA GAT GAA CTT GAT GAC CAG GGG TCT GCT GTT GAA CCA GAA CAA AAC CGA GTC AAC AGG GAA GCA GAG GAG AAC CGG GAG CCA TTC AGA AAA GAA TGT ACA TGG CAA GTC AAA GCA AAC GAT CGC AAG TAC CAC GAA CAA CCT CAC TTT ATG AAC ACA AAA TTC TTG TGT ATT AAG GAG AGT AAA TAT GCG AAT AAT GCA ATT AAA ACA TAC AAG TAC AAC GCA TTT ACC TTT ATA CCA ATG AAT CTG TTT GAG CAG TTT AAG AGA GCA GCC AAT TTA TAT TTC CTG GCT CTT CTT ATC TTA CAG GCA GTT CCT CAA ATC TCT ACC CTG GCT TGG TAC ACC ACA CTA GTG CCC CTG CTT GTG GTG CTG GGC GTC ACT GCA ATC AAA GAC CTG GTG GAC GAT GTG GCT CGC CAT AAA ATG GAT AAG GAA ATC AAC AAT AGG ACG TGT GAA GTC ATT AAG GAT GGC AGG TTC AAA GTT GCT AAG TGG AAA GAA ATT CAA GTT GGA GAC GTC ATT CGT CTG AAA AAA AAT GAT TTT GTT CCA GCT GAC ATT CTC CTG CTG TCT AGC TCT GAG CCT AAC AGC CTC TGC TAT GTG GAA ACA GCA GAA CTG GAT GGA GAA ACC AAT TTA AAA TTT AAG ATG TCA CTT GAA ATC ACA GAC CAG TAC CTC CAA AGA GAA GAT ACA TTG GCT ACA TTT GAT GGT TTT ATT GAA TGT GAA GAA CCC AAT AAC AGA CTA GAT AAG TTT ACA GGA ACA CTA TTT TGG AGA AAC ACA AGT TTT CCT TTG GAT GCT GAT AAA ATT TTG TTA CGT GGC TGT GTA ATT AGG AAC ACC GAT TTC TGC CAC GGC TTA GTC ATT TTT GCA GGT GCT GAC ACT AAA ATA ATG AAG AAT AGT GGG AAA ACC AGA TTT AAA AGA ACT AAA ATT GAT TAC TTG ATG AAC TAC ATG GTT TAC ACG ATC TTT GTT GTT CTT ATT CTG CTT TCT GCT GGT CTT GCC ATC GGC CAT GCT TAT TGG GAA GCA CAG GTG GGC AAT TCC TCT TGG TAC CTC TAT GAT GGA GAA GAC GAT ACA CCC TCC TAC CGT GGA TTC CTC ATT TTC TGG GGC TAT ATC ATT GTT CTC AAC ACC ATG GTA CCC ATC TCT CTC TAT GTC AGC GTG GAA GTG ATT CGT CTT GGA CAG AGT CAC TTC ATC AAC TGG GAC CTG CAA ATG TAC TAT GCT GAG AAG GAC ACA CCC GCA AAA GCT AGA ACC ACC ACA CTC AAT GAA CAG CTC GGG CAG ATC CAT TAT ATC TTC TCT GAT AAG ACG GGG ACA CTC ACA CAA AAT ATC ATG ACC TTT AAA AAG TGC TGT ATC AAC GGG CAG ATA TAT GGG GAC CAT CGG GAT GCC TCT CAA CAC AAC CAC AAC AAA ATA GAG CAA GTT GAT TTT AGC TGG AAT ACA TAT GCT GAT GGG AAG CTT GCA TTT TAT GAC CAC TAT CTT ATT GAG CAA ATC CAG TCA GGG AAA GAG CCA GAA GTA CGA CAG TTC TTC TTC TTG CTC GCA GTT TGC CAC ACA GTC ATG GTG GAT AGG ACT GAT GGT CAG CTC AAC TAC CAG GCA GCC TCT CCC GAT GAA GGT GCC CTG GTA AAC GCT GCC AGG AAC TTT GGC TTT GCC TTC CTC GCC AGG ACC CAG AAC ACC ATC ACC ATC AGT GAA CTG GGC ACT GAA AGG ACT TAC AAT GTT CTT GCC ATT TTG GAC TTC AAC AGT GAC CGG AAG CGA ATG TCT ATC ATT GTA AGA ACC CCA GAA GGC AAT ATC AAG CTT TAC TGT AAA GGT GCT GAC ACT GTT ATT TAT GAA CGG TTA CAT CGA ATG AAT CCT ACT AAG CAA GAA ACA CAG GAT GCC CTG GAT ATC TTT GCA AAT GAA ACT CTT AGA ACC CTA TGC CTT TGC TAC AAG GAA ATT GAA GAA AAA GAA TTT ACA GAA TGG AAT AAA AAG TTT ATG GCT GCC AGT GTG GCC TCC ACC AAC CGG GAC GAA GCT CTG GAT AAA GTA TAT GAG GAG ATT GAA AAA GAC TTA ATT CTC CTG GGA GCT ACA GCT ATT GAA GAC AAG CTA CAG GAT GGA GTT CCA GAA ACC ATT TCA AAA CTT GCA AAA GCT GAC ATT AAG ATC TGG GTG CTT ACT GGA GAC AAA AAG GAA ACT GCT GAA AAT ATA GGA TTT GCT TGT GAA CTT CTG ACT GAA GAC ACC ACC ATC TGC TAT GGG GAG GAT ATT AAT TCT CTT CTT CAT GCA AGG ATG GAA AAC CAG AGG AAT AGA GGT GGC GTC TAC GCA AAG TTT GCA CCT CCT GTG CAG GAA TCT TTT TTT CCA CCC GGT GGA AAC CGT GCC TTA ATC ATC ACT GGT TCT TGG TTG AAT GAA ATT CTT CTC GAG AAA AAG ACC AAG AGA AAT AAG ATT CTG AAG CTG AAG TTC CCA AGA ACA GAA GAA GAA AGA CGG ATG CGG ACC CAA AGT AAA AGG AGG CTA GAA GCT AAG AAA GAG CAG CGG CAG AAA AAC TTT GTG GAC CTG GCC TGC GAG TGC AGC GCA GTC ATC TGC TGC CGC GTC ACC CCC AAG CAG AAG GCC ATG GTG GTG GAC CTG GTG AAG AGG TAC AAG AAA GCC ATC ACG CTG GCC ATC GGA GAT GGG GCC AAT GAC GTG AAC ATG ATC AAA ACT GCC CAC ATT GGC GTT GGA ATA AGT GGA CAA GAA GGA ATG CAA GCT GTC ATG TCG AGT GAC TAT TCC TTT GCT CAG TTC CGA TAT CTG CAG AGG CTA CTG CTG GTG CAT GGC CGA TGG TCT TAC ATA AGG ATG TGC AAG TTC CTA CGA TAC TTC TTT TAC AAA AAC TTT GCC TTT ACT TTG GTT CAT TTC TGG TAC TCC TTC TTC AAT GGC TAC TCT GCG CAG ACT GCA TAC GAG GAT TGG TTC ATC ACC CTC TAC AAC GTG CTG TAC ACC AGC CTG CCC GTG CTC CTC ATG GGG CTG CTC GAC CAG GAT GTG AGT GAC AAA CTG AGC CTC CGA TTC CCT GGG TTA TAC ATA GTG GGA CAA AGA GAC TTA CTA TTC AAC TAT AAG AGA TTC TTT GTA AGC TTG TTG CAT GGG GTC CTA ACA TCG ATG ATC CTC TTC TTC ATA CCT CTT GGA GCT TAT CTG CAA ACC GTA GGG CAG GAT GGA GAG GCA CCT TCC GAC TAC CAG TCT TTT GCC GTC ACC ATT GCC TCT GCT CTT GTA ATA ACA GTC AAT TTC CAG ATT GGC TTG GAT ACT TCT TAT TGG ACT TTT GTG AAT GCT TTT TCA ATT TTT GGA AGC ATT GCA CTT TAT TTT GGC ATC ATG TTT GAC TTT CAT AGT GCT GGA ATA CAT GTT CTC TTT CCA TCT GCA TTT CAA TTT ACA GGC ACA GCT TCA AAC GCT CTG AGA CAG CCA TAC ATT TGG TTA ACT ATC ATC CTG GCT GTT GCT GTG TGC TTA CTA CCC GTC GTT GCC ATT CGA TTC CTG TCA ATG ACC ATC TGG CCA TCA GAA AGT GAT AAG ATC CAG AAG CAT CGC AAG CGG TTG AAG GCG GAG GAG CAG TGG CAG CGA CGG CAG CAG GTG TTC CGC CGG GGC GTG TCA ACG CGG CGC TCG GCC TAC GCC TTC TCG CAC CAG CGG GGC TAC GCG GAC CTC ATC TCC TCC GGG CGC AGC ATC CGC AAG AAG CGC TCG CCG CTT GAT GCC ATC GTG GCG GAT GGC ACC GCG GAG TAC AGG CGC ACC GGG GAC AGC TGA
Таблица 1. Типичные мутации ATP8B1
Таблица 2. Выбранные мутации ATP8B1, связанные с PFIC-1
A Мутация в ‘X’ обпредставляет собой ранний стоп-кодон
Литература для таблиц 1 и 2
1 Folmer et al., Hepatology. 2009, vol. 50(5), p. 1597-1605.
2 Hsu et al., Hepatol Res. 2009, vol. 39(6), p. 625-631.
3 Alvarez et al., Hum Mol Genet. 2004, vol. 13(20), p. 2451-2460.
4 Davit-Spraul et al., Hepatology 2010, vol. 51(5), p. 1645-1655.
5 Vitale et al., J Gastroenterol. 2018, vol. 53(8), p. 945-958.
6Klomp et al., Hepatology 2004, vol. 40(1), p. 27-38.
7 Zarenezhad et al., Hepatitis Monthly: 2017, vol. 17(2); e43500.
8 Dixon et al., Scientific Reports 2017, vol. 7, 11823.
9 Painter et al., Eur J Hum Genet. 2005, vol. 13(4), p. 435-439.
10 Deng et al., World J Gastroenterol. 2012, vol. 18(44), p. 6504-6509.
11 Giovannoni et al., PLoS One. 2015, vol. 10(12): e0145021.
12 Li et al., Hepatology International 2017, vol. 11, No. 1, Supp. Supplement 1, pp. S180. Abstract Number: OP284.
13 Togawa et al., Journal of Pediatric Gastroenterology and Nutrition 2018, vol. 67, Supp. Supplement 1, pp. S363. Abstract Number: 615.
14 Miloh et al., Gastroenterology 2006, vol. 130, No. 4, Suppl. 2, pp. A759-A760. Meeting Info.: Digestive Disease Week Meeting/107th Annual Meeting of the American-Gastroenterological-Association. Los Angeles, CA, USA. May 19.
15 Dröge et al., Zeitschrift fur Gastroenterologie 2015, vol. 53, No. 12. Abstract Number: A3-27. Meeting Info: 32. Jahrestagung der Deutschen Arbeitsgemeinschaft zum Studium der Leber. Dusseldorf, Germany. 22 Jan 2016-23 Jan 2016
16 Mizuochi et al., Clin Chim Acta. 2012, vol. 413(15-16), p. 1301-1304.
17 Liu et al., Hepatology International 2009, vol. 3, No. 1, p. 184-185. Abstract Number: PE405. Meeting Info: 19th Conference of the Asian Pacific Association for the Study of the Liver. Hong Kong, China. 13 Feb 2009-16 Feb 2009
18 McKay et al., Version 2. F1000Res. 2013; 2: 32. DOI: 10.12688/f1000research.2-32.v2
19 Hasegawa et al., Orphanet J Rare Dis. 2014, vol. 9:89.
20Stone et al., J Biol Chem. 2012, vol. 287(49), p. 41139-51.
21 Kang et al., J Pathol Transl Med. 2019 May 16. doi: 10.4132/jptm.2019.05.03. [Epub ahead of print]
22 Sharma et al., BMC Gastroenterol. 2018, vol. 18(1), p. 107.
23 Uegaki et al., Intern Med. 2008, vol. 47(7), p. 599-602.
24 Goldschmidt et al., Hepatol Res. 2016, vol. 46(4), p. 306-311.
25 Liu et al., J Pediatr Gastroenterol Nutr. 2010, vol. 50(2), p. 179-183.
26 Jung et al., J Pediatr Gastroenterol Nutr. 2007, vol. 44(4), p. 453-458.
27Bounford. University of Birmingham. Dissertation Abstracts International, (2016) Vol. 75, No. 1C. Order No.: AAI10588329. ProQuest Dissertations & Theses.
28 Stolz et al., Aliment Pharmacol Ther. 2019, vol. 49(9), p. 1195-1204.
29 Ivashkin et al., Hepatology International 2016, vol. 10, No. 1, Supp. SUPPL. 1, pp. S461. Abstract Number: LBO-38. Meeting Info: 25th Annual Conference of the Asian Pacific Association for the Study of the Liver, APASL 2016. Tokyo, Japan. 20 Feb 2016-24 Feb 2016
30 Blackmore et al., J Clin Exp Hepatol. 2013, vol. 3(2), p. 159-161.
31 Matte et al., J Pediatr Gastroenterol Nutr. 2010, vol. 51(4), p. 488-493.
32 Squires et al., J Pediatr Gastroenterol Nutr. 2017, vol. 64(3), p. 425-430.
33 Hayshi et al., EBioMedicine. 2018, vol. 27, p. 187-199.
34 Nagasaka et al., J Pediatr Gastroenterol Nutr. 2007, vol. 45(1), p. 96-105.
35 Wang et al., PLoS One. 2016; vol. 11(4): e0153114.
36 Narchi et al., Saudi J Gastroenterol. 2017, vol. 23(5), p. 303-305.
37 Alashkar et al., Blood 2015, vol. 126, No. 23. Meeting Info.: 57th Annual Meeting of the American-Society-of-Hematology. Orlando, FL, USA. December 05 -08, 2015. Amer Soc Hematol.
38 Ferreira et al., Pediatric Transplantation 2013, vol. 17, Supp. SUPPL. 1, pp. 99. Abstract Number: 239. Meeting Info: IPTA 7th Congress on Pediatric Transplantation. Warsaw, Poland. 13 Jul 2013-16 Jul 2013.
39 Pauli-Magnus et al., J Hepatol. 2005, vol. 43(2), p. 342-357.
40 Jericho et al., Journal of Pediatric Gastroenterology and Nutrition 2015, vol. 60(3), p. 368-374.
41 van der Woerd et al., PLoS One. 2013, vol. 8(11): e80553.
42 Copeland et al., J Gastroenterol Hepatol. 2013, vol. 28(3), p. 560-564.
43 Dröge et al., J Hepatol. 2017, vol. 67(6), p. 1253-1264.
44 Chen et al., Journal of Pediatrics 2002, vol. 140(1), p. 119-124.
45 Jirsa et al., Hepatol Res. 2004, vol. 30(1), p. 1-3.
46 van der Woerd et al., Hepatology 2015, vol. 61(4), p. 1382-1391.
В некоторых вариантах осуществления мутация в ATP8B1 выбрана из группы, включающей L127P, G308V, T456M, D554N, F529del, I661T, E665X, R930X, R952X, R1014X и G1040R.
Каноническая последовательность белков ABCB11 (SEQ ID NO: 3) - Uniprot ID O95342
MSDSVILRSI KKFGEENDGF ESDKSYNNDK KSRLQDEKKG DGVRVGFFQL FRFSSSTDIW LMFVGSLCAF LHGIAQPGVL LIFGTMTDVF IDYDVELQEL QIPGKACVNN TIVWTNSSLN QNMTNGTRCG LLNIESEMIK FASYYAGIAV AVLITGYIQI CFWVIAAARQ IQKMRKFYFR RIMRMEIGWF DCNSVGELNT RFSDDINKIN DAIADQMALF IQRMTSTICG FLLGFFRGWK LTLVIISVSP LIGIGAATIG LSVSKFTDYE LKAYAKAGVV ADEVISSMRT VAAFGGEKRE VERYEKNLVF AQRWGIRKGI VMGFFTGFVW CLIFLCYALA FWYGSTLVLD EGEYTPGTLV QIFLSVIVGA LNLGNASPCL EAFATGRAAA TSIFETIDRK PIIDCMSEDG YKLDRIKGEI EFHNVTFHYP SRPEVKILND LNMVIKPGEM TALVGPSGAG KSTALQLIQR FYDPCEGMVT VDGHDIRSLN IQWLRDQIGI VEQEPVLFST TIAENIRYGR EDATMEDIVQ AAKEANAYNF IMDLPQQFDT LVGEGGGQMS GGQKQRVAIA RALIRNPKIL LLDMATSALD NESEAMVQEV LSKIQHGHTI ISVAHRLSTV RAADTIIGFE HGTAVERGTH EELLERKGVY FTLVTLQSQG NQALNEEDIK DATEDDMLAR TFSRGSYQDS LRASIRQRSK SQLSYLVHEP PLAVVDHKST YEEDRKDKDI PVQEEVEPAP VRRILKFSAP EWPYMLVGSV GAAVNGTVTP LYAFLFSQIL GTFSIPDKEE QRSQINGVCL LFVAMGCVSL FTQFLQGYAF AKSGELLTKR LRKFGFRAML GQDIAWFDDL RNSPGALTTR LATDASQVQG AAGSQIGMIV NSFTNVTVAM IIAFSFSWKL SLVILCFFPF LALSGATQTR MLTGFASRDK QALEMVGQIT NEALSNIRTV AGIGKERRFI EALETELEKP FKTAIQKANI YGFCFAFAQC IMFIANSASY RYGGYLISNE GLHFSYVFRV ISAVVLSATA LGRAFSYTPS YAKAKISAAR FFQLLDRQPP ISVYNTAGEK WDNFQGKIDF VDCKFTYPSR PDSQVLNGLS VSISPGQTLA FVGSSGCGKS TSIQLLERFY DPDQGKVMID GHDSKKVNVQ FLRSNIGIVS QEPVLFACSI MDNIKYGDNT KEIPMERVIA AAKQAQLHDF VMSLPEKYET NVGSQGSQLS RGEKQRIAIA RAIVRDPKIL LLDEATSALD TESEKTVQVA LDKAREGRTC IVIAHRLSTI QNADIIAVMA QGVVIEKGTH EELMAQKGAY YKLVTTGSPI S
Каноническая последовательность DNA для ABCB11 (SEQ ID NO: 4)
ATG TCT GAC TCA GTA ATT CTT CGA AGT ATA AAG AAA TTT GGA GAG GAG AAT GAT GGT TTT GAG TCA GAT AAA TCA TAT AAT AAT GAT AAG AAA TCA AGG TTA CAA GAT GAG AAG AAA GGT GAT GGC GTT AGA GTT GGC TTC TTT CAA TTG TTT CGG TTT TCT TCA TCA ACT GAC ATT TGG CTG ATG TTT GTG GGA AGT TTG TGT GCA TTT CTC CAT GGA ATA GCC CAG CCA GGC GTG CTA CTC ATT TTT GGC ACA ATG ACA GAT GTT TTT ATT GAC TAC GAC GTT GAG TTA CAA GAA CTC CAG ATT CCA GGA AAA GCA TGT GTG AAT AAC ACC ATT GTA TGG ACT AAC AGT TCC CTC AAC CAG AAC ATG ACA AAT GGA ACA CGT TGT GGG TTG CTG AAC ATC GAG AGC GAA ATG ATC AAA TTT GCC AGT TAC TAT GCT GGA ATT GCT GTC GCA GTA CTT ATC ACA GGA TAT ATT CAA ATA TGC TTT TGG GTC ATT GCC GCA GCT CGT CAG ATA CAG AAA ATG AGA AAA TTT TAC TTT AGG AGA ATA ATG AGA ATG GAA ATA GGG TGG TTT GAC TGC AAT TCA GTG GGG GAG CTG AAT ACA AGA TTC TCT GAT GAT ATT AAT AAA ATC AAT GAT GCC ATA GCT GAC CAA ATG GCC CTT TTC ATT CAG CGC ATG ACC TCG ACC ATC TGT GGT TTC CTG TTG GGA TTT TTC AGG GGT TGG AAA CTG ACC TTG GTT ATT ATT TCT GTC AGC CCT CTC ATT GGG ATT GGA GCA GCC ACC ATT GGT CTG AGT GTG TCC AAG TTT ACG GAC TAT GAG CTG AAG GCC TAT GCC AAA GCA GGG GTG GTG GCT GAT GAA GTC ATT TCA TCA ATG AGA ACA GTG GCT GCT TTT GGT GGT GAG AAA AGA GAG GTT GAA AGG TAT GAG AAA AAT CTT GTG TTC GCC CAG CGT TGG GGA ATT AGA AAA GGA ATA GTG ATG GGA TTC TTT ACT GGA TTC GTG TGG TGT CTC ATC TTT TTG TGT TAT GCA CTG GCC TTC TGG TAC GGC TCC ACA CTT GTC CTG GAT GAA GGA GAA TAT ACA CCA GGA ACC CTT GTC CAG ATT TTC CTC AGT GTC ATA GTA GGA GCT TTA AAT CTT GGC AAT GCC TCT CCT TGT TTG GAA GCC TTT GCA ACT GGA CGT GCA GCA GCC ACC AGC ATT TTT GAG ACA ATA GAC AGG AAA CCC ATC ATT GAC TGC ATG TCA GAA GAT GGT TAC AAG TTG GAT CGA ATC AAG GGT GAA ATT GAA TTC CAT AAT GTG ACC TTC CAT TAT CCT TCC AGA CCA GAG GTG AAG ATT CTA AAT GAC CTC AAC ATG GTC ATT AAA CCA GGG GAA ATG ACA GCT CTG GTA GGA CCC AGT GGA GCT GGA AAA AGT ACA GCA CTG CAA CTC ATT CAG CGA TTC TAT GAC CCC TGT GAA GGA ATG GTG ACC GTG GAT GGC CAT GAC ATT CGC TCT CTT AAC ATT CAG TGG CTT AGA GAT CAG ATT GGG ATA GTG GAG CAA GAG CCA GTT CTG TTC TCT ACC ACC ATT GCA GAA AAT ATT CGC TAT GGC AGA GAA GAT GCA ACA ATG GAA GAC ATA GTC CAA GCT GCC AAG GAG GCC AAT GCC TAC AAC TTC ATC ATG GAC CTG CCA CAG CAA TTT GAC ACC CTT GTT GGA GAA GGA GGA GGC CAG ATG AGT GGT GGC CAG AAA CAA AGG GTA GCT ATC GCC AGA GCC CTC ATC CGA AAT CCC AAG ATT CTG CTT TTG GAC ATG GCC ACC TCA GCT CTG GAC AAT GAG AGT GAA GCC ATG GTG CAA GAA GTG CTG AGT AAG ATT CAG CAT GGG CAC ACA ATC ATT TCA GTT GCT CAT CGC TTG TCT ACG GTC AGA GCT GCA GAT ACC ATC ATT GGT TTT GAA CAT GGC ACT GCA GTG GAA AGA GGG ACC CAT GAA GAA TTA CTG GAA AGG AAA GGT GTT TAC TTC ACT CTA GTG ACT TTG CAA AGC CAG GGA AAT CAA GCT CTT AAT GAA GAG GAC ATA AAG GAT GCA ACT GAA GAT GAC ATG CTT GCG AGG ACC TTT AGC AGA GGG AGC TAC CAG GAT AGT TTA AGG GCT TCC ATC CGG CAA CGC TCC AAG TCT CAG CTT TCT TAC CTG GTG CAC GAA CCT CCA TTA GCT GTT GTA GAT CAT AAG TCT ACC TAT GAA GAA GAT AGA AAG GAC AAG GAC ATT CCT GTG CAG GAA GAA GTT GAA CCT GCC CCA GTT AGG AGG ATT CTG AAA TTC AGT GCT CCA GAA TGG CCC TAC ATG CTG GTA GGG TCT GTG GGT GCA GCT GTG AAC GGG ACA GTC ACA CCC TTG TAT GCC TTT TTA TTC AGC CAG ATT CTT GGG ACT TTT TCA ATT CCT GAT AAA GAG GAA CAA AGG TCA CAG ATC AAT GGT GTG TGC CTA CTT TTT GTA GCA ATG GGC TGT GTA TCT CTT TTC ACC CAA TTT CTA CAG GGA TAT GCC TTT GCT AAA TCT GGG GAG CTC CTA ACA AAA AGG CTA CGT AAA TTT GGT TTC AGG GCA ATG CTG GGG CAA GAT ATT GCC TGG TTT GAT GAC CTC AGA AAT AGC CCT GGA GCA TTG ACA ACA AGA CTT GCT ACA GAT GCT TCC CAA GTT CAA GGG GCT GCC GGC TCT CAG ATC GGG ATG ATA GTC AAT TCC TTC ACT AAC GTC ACT GTG GCC ATG ATC ATT GCC TTC TCC TTT AGC TGG AAG CTG AGC CTG GTC ATC TTG TGC TTC TTC CCC TTC TTG GCT TTA TCA GGA GCC ACA CAG ACC AGG ATG TTG ACA GGA TTT GCC TCT CGA GAT AAG CAG GCC CTG GAG ATG GTG GGA CAG ATT ACA AAT GAA GCC CTC AGT AAC ATC CGC ACT GTT GCT GGA ATT GGA AAG GAG AGG CGG TTC ATT GAA GCA CTT GAG ACT GAG CTG GAG AAG CCC TTC AAG ACA GCC ATT CAG AAA GCC AAT ATT TAC GGA TTC TGC TTT GCC TTT GCC CAG TGC ATC ATG TTT ATT GCG AAT TCT GCT TCC TAC AGA TAT GGA GGT TAC TTA ATC TCC AAT GAG GGG CTC CAT TTC AGC TAT GTG TTC AGG GTG ATC TCT GCA GTT GTA CTG AGT GCA ACA GCT CTT GGA AGA GCC TTC TCT TAC ACC CCA AGT TAT GCA AAA GCT AAA ATA TCA GCT GCA CGC TTT TTT CAA CTG CTG GAC CGA CAA CCC CCA ATC AGT GTA TAC AAT ACT GCA GGT GAA AAA TGG GAC AAC TTC CAG GGG AAG ATT GAT TTT GTT GAT TGT AAA TTT ACA TAT CCT TCT CGA CCT GAC TCG CAA GTT CTG AAT GGT CTC TCA GTG TCG ATT AGT CCA GGG CAG ACA CTG GCG TTT GTT GGG AGC AGT GGA TGT GGC AAA AGC ACT AGC ATT CAG CTG TTG GAA CGT TTC TAT GAT CCT GAT CAA GGG AAG GTG ATG ATA GAT GGT CAT GAC AGC AAA AAA GTA AAT GTC CAG TTC CTC CGC TCA AAC ATT GGA ATT GTT TCC CAG GAA CCA GTG TTG TTT GCC TGT AGC ATA ATG GAC AAT ATC AAG TAT GGA GAC AAC ACC AAA GAA ATT CCC ATG GAA AGA GTC ATA GCA GCT GCA AAA CAG GCT CAG CTG CAT GAT TTT GTC ATG TCA CTC CCA GAG AAA TAT GAA ACT AAC GTT GGG TCC CAG GGG TCT CAA CTC TCT AGA GGG GAG AAA CAA CGC ATT GCT ATT GCT CGG GCC ATT GTA CGA GAT CCT AAA ATC TTG CTA CTA GAT GAA GCC ACT TCT GCC TTA GAC ACA GAA AGT GAA AAG ACG GTG CAG GTT GCT CTA GAC AAA GCC AGA GAG GGT CGG ACC TGC ATT GTC ATT GCC CAT CGC TTG TCC ACC ATC CAG AAC GCG GAT ATC ATT GCT GTC ATG GCA CAG GGG GTG GTG ATT GAA AAG GGG ACC CAT GAA GAA CTG ATG GCC CAA AAA GGA GCC TAC TAC AAA CTA GTC ACC ACT GGA TCC CCC ATC AGT TGA
Таблица 3. Типичные мутации ABCB11
Таблица 4. Выбранные мутации ABCB11, связанные с PFIC-2
A Мутация в ‘X’ обпредставляет собой ранний стоп-кодон
Литература для таблиц 3 и 4
1 Noe et al., J Hepatol. 2005, vol. 43(3), p. 536-543.
2 Lam et al., Am J Physiol Cell Physiol. 2007, vol. 293(5), p. C1709-16.
3 Stindt et al., Liver Int. 2013, vol. 33(10), p. 1527-1735.
4 Gao et al., Shandong Yiyao 2012, vol. 52(10), p. 14-16.
5Strautnieks et al., Gastroenterology. 2008, vol. 134(4), p. 1203-1214.
6Kagawa et al., Am J Physiol Gastrointest Liver Physiol. 2008, vol. 294(1), p. G58-67.
7Byrne et al., Hepatology. 2009, vol. 49(2), p. 553-567.
8 Chen et al., J Pediatr. 2008, vol. 153(6), p. 825-832.
9 Davit-Spraul et al., Hepatology 2010, vol. 51(5), p. 1645-1655.
10 Dröge et al., Sci Rep. 2016, vol. 6: 24827.
11 Lang et al., Pharmacogenet Genomics. 2007, vol. 17(1), p. 47-60.
12 Ellinger et al., World J Gastroenterol. 2017, vol. 23(29), p. :5295-5303.
13 Vitale et al., J Gastroenterol. 2018, vol. 53(8), p. 945-958.
14 Knisely et al., Hepatology. 2006, vol. 44(2), p. 478-86.
15 Ellis et al., Hepatology. 2018, vol. 67(4), p. 1531-1545.
16Lam et al., J Hepatol. 2006, vol. 44(1), p. 240-242.
17 Varma et al., Hepatology 2015, vol. 62(1), p. 198-206.
18 Treepongkaruna et al., World J Gastroenterol. 2009, vol. 15(34), p. 4339-4342.
19Zarenezhad et al., Hepatitis Monthly: 2017, vol. 17(2); e43500.
20 Hayashi et al., Hepatol Res. 2016, vol. 46(2), p. 192-200.
21 Guorui et al., Linchuang Erke Zazhi 2013, vol. 31(10), 905-909.
22 van Mil et al., Gastroenterology. 2004, vol. 127(2), p. 379-384.
23 Anzivino et al., Dig Liver Dis. 2013, vol. 45(3), p. 226-232.
24 Park et al., World J Gastroenterol. 2016, vol. 22(20), p. 4901-4907.
25 Imagawa et al., J Hum Genet. 2018, vol. 63(5), p. 569-577.
26 Giovannoni et al., PLoS One. 2015, vol. 10(12): e0145021.
27 Hu et al., Mol Med Rep. 2014, vol. 10(3), p. 1264-1274.
28 Lang et al,. Drug Metab Dispos. 2006, vol. 34(9), p. 1582-1599.
29 Masahata et al., Transplant Proc. 2016, vol. 48(9), p. 3156-3162.
30 Holz et al., Hepatol Commun. 2018, vol. 2(2), p. 152-154.
31 Li et al., Hepatology International 2017, vol. 11, No. 1, Supp. Supplement 1, pp. S180. Abstract Number: OP284.
32 Francalanci et al., Laboratory Investigation 2011, vol. 91, Supp. SUPPL. 1, pp. 360A. Abstract Number: 1526.
33 Francalanci et al., Digestive and Liver Disease 2010, vol. 42, Supp. SUPPL. 1, pp. S16. Abstract Number: T.N.5.
34 Shah et al., J Pediatr Genet. 2017, vol. 6(2), p. 126-127.
35 Gao et al., Hepatitis Monthly 2017, vol. 17(10), e55087/1-e55087/6.
36 Evason et al., Am J Surg Pathol. 2011, vol. 35(5), p. 687-696.
37 Davit-Spraul et al., Mol Genet Metab. 2014, vol. 113(3), p. 225-229.
38 Maggiore et al., J Hepatol. 2010, vol. 53(5), p. 981-6.
39 McKay et al., Version 2. F1000Res. 2013; 2: 32. DOI: 10.12688/f1000research.2-32.v2
40 Liu et al., Pediatr Int. 2013, vol. 55(2), p. 138-144.
41 Waisbourd-Zinman et al., Ann Hepatol. 2017, vol. 16(3), p. 465-468.
42 Griffin, et al., Canadian Journal of Gastroenterology and Hepatology 2016, vol. 2016. Abstract Number: A200. Meeting Info: 2016 Canadian Digestive Diseases Week, CDDW 2016. Montreal, QC, United States. 26 Feb 2016-29 Feb 2016
43 Qiu et al., Hepatology 2017, vol. 65(5), p. 1655-1669.
44 Imagawa et al., Sci Rep. 2017, 7:41806.
45 Kang et al., J Pathol Transl Med. 2019 May 16. doi: 10.4132/jptm.2019.05.03. [Epub ahead of print]
46 Takahashi et al., Eur J Gastroenterol Hepatol. 2007, vol. 19(11), p. 942-6.
47 Shimizu et al., Am J Transplant. 2011, vol. 11(2), p. 394-398.
48 Krawczyk et al., Ann Hepatol. 2012, vol. 11(5), p. 710-744.
49 Sharma et al., BMC Gastroenterol. 2018, vol. 18(1), p. 107.
50 Sattler et al., Journal of Hepatology 2017, vol. 66, No. 1, Suppl. S, pp. S177. Meeting Info.: International Liver Congress/52nd Annual Meeting of the European-Association-for-the-Study-of-the-Liver. Amsterdam, NETHERLANDS. April 19 -23, 2017. European Assoc Study Liver.
51 Jung et al., J Pediatr Gastroenterol Nutr. 2007, vol. 44(4), p. 453-458.
52 Sciveres. Digestive and Liver Disease 2010, vol. 42, Supp. SUPPL. 5, pp. S329. Abstract Number: CO18. Meeting Info: 17th National Congress SIGENP. Pescara, Italy. 07 Oct 2010-09 Oct 2010
53 Sohn et al., Pediatr Gastroenterol Hepatol Nutr. 2019, vol. 22(2), p. 201-206.
54 Ho et al., Pharmacogenet Genomics. 2010, vol. 20(1), p. 45-57.
55 Wang et al., Hepatol Res. 2018, vol. 48(7), p. 574-584.
56 Shaprio et al., J Hum Genet. 2010, vol. 55(5), p. 308-313.
57 Bounford. University of Birmingham. Dissertation Abstracts International, (2016) Vol. 75, No. 1C. Order No.: AAI10588329. ProQuest Dissertations & Theses.
58 Stolz et al., Aliment Pharmacol Ther. 2019, vol. 49(9), p. 1195-1204.
59 Jankowska et al., J Pediatr Gastroenterol Nutr. 2014, vol. 58(1), p. 92-95.
60 Kim. Journal of Pediatric Gastroenterology and Nutrition 2016, vol. 62, Supp. SUPPL. 1, pp. 620. Abstract Number: H-P-045. Meeting Info: 49th Annual Meeting of the European Society for Paediatric Gastroenterology, Hepatology and Nutrition, ESPGHAN 2016. Athens, Greece. 25 May 2016-28 May 2016.
61 Pauli-Magnus et al., Hepatology 2003, vol. 38, No. 4 Suppl. 1, pp. 518A. print. Meeting Info.: 54th Annual Meeting of the American Association for the Study of Liver Diseases. Boston, MA, USA. October 24-28, 2003. American Association for the Study of Liver Diseases.
62 Li et al., Hepatology International 2017, vol. 11, No. 1, Supp. Supplement 1, pp. S362. Abstract Number: PP0347. Meeting Info: 26th Annual Conference of the Asian Pacific Association for the Study of the Liver, APASL 2017. Shanghai, China. 15 Feb 2017-19 Feb 2017.
63 Rumbo et al., Transplantation 2018, vol. 102, No. 7, Supp. Supplement 1, pp. S848. Abstract Number: P.752. Meeting Info: 27th International Congress of The Transplantation Society, TTS 2018. Madrid, Spain. 30 Jun 2018-05 Jul 2018.
64 Lee et al., Pediatr Gastroenterol Hepatol Nutr. 2017, vol. 20(2), p. 114-123.
65 Sherrif et al., Liver international: official journal of the International Association for the Study of the Liver 2013, vol. 33, No. 8, pp. 1266-1270.
66Blackmore et al., J Clin Exp Hepatol. 2013, vol. 3(2), p. 159-161.
67 Matte et al., J Pediatr Gastroenterol Nutr. 2010, vol. 51(4), p. 488-493.
68 Lin et al., Zhongguo Dang Dai Er Ke Za Zhi. 2018, vol. 20(9), p. 758-764.
69 Harmanci et al., Experimental and Clinical Transplantation 2015, vol. 13, Supp. SUPPL. 2, pp. 76. Abstract Number: P62. Meeting Info: 1st Congress of the Turkic World Transplantation Society. Astana, Kazakhstan. 20 May 2015-22 May 2015.
70 Herbst et al., Mol Cell Probes. 2015, vol. 29(5), p. 291-298.
71Moghadamrad et al., Hepatology. 2013, vol. 57(6), p. 2539-2541.
72 Holz et al., Zeitschrift fur Gastroenterologie 2016, vol. 54, No. 8. Abstract Number: KV275. Meeting Info: Viszeralmedizin 2016, 71. Jahrestagung der Deutschen Gesellschaft fur Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten mit Sektion Endoskopie - 10. Herbsttagung der Deutschen Gesellschaft fur Allgemein- und Viszeralchirurgie. Hamburg, Germany. 21 Sep 2016-24 Sep 2016.
73 Wang et al., PLoS One. 2016; vol. 11(4): e0153114.
74 Hao et al., International Journal of Clinical and Experimental Pathology 2017, vol. 10(3), p. 3480-3487.
75 Arnell et al., J Pediatr Gastroenterol Nutr. 2010, vol. 51(4), p. 494-499.
76 Sharma et al., Indian Journal of Gastroenterology 2017, vol. 36, No. 1, Supp. Supplement 1, pp. A99. Abstract Number: M-20. Meeting Info: 58th Annual Conference of the Indian Society of Gastroenterology, ISGCON 2017. Bhubaneswar, India. 14 Dec 2017-17 Dec 2017.
77 Beauséjour et al., Can J Gastroenterol. 2011, vol. 25(6), p. 311-314.
78 Imagawa et al., Journal of Pediatric Gastroenterology and Nutrition 2016, vol. 63, Supp. Supplement 2, pp. S51. Abstract Number: 166. Meeting Info: World Congress of Pediatric Gastroenterology, Hepatology and Nutrition 2016. Montreal, QC, Canada. 05 Oct 2016-08 Oct 2016.
79 Peng et al., Zhonghua er ke za zhi (Chinese journal of pediatrics) 2018, vol. 56, No. 6, pp. 440-444.
80 Tibesar et al., Case Rep Pediatr. 2014, vol. 2014: 185923.
81Ng et al., Journal of Pediatric Gastroenterology and Nutrition 2018, vol. 66, Supp. Supplement 2, pp. 860. Abstract Number: H-P-127. Meeting Info: 51st Annual Meeting European Society for Paediatric Gastroenterology, Hepatology and Nutrition, ESPGHAN 2018. Geneva, Switzerland. 09 May 2018-12 May 2018.
82 Wong et al., Clin Chem. 2008, vol. 54(7), p. 1141-1148.
83 Pauli-Magnus et al., J Hepatol. 2005, vol. 43(2), p. 342-357.
84 Jericho et al., Journal of Pediatric Gastroenterology and Nutrition. 60, vol. 3, p. 368-374.
85 Scheimann et al., Gastroenterology 2007, vol. 132, No. 4, Suppl. 2, pp. A452. Meeting Info.: Digestive Disease Week Meeting/108th Annual Meeting of the American-Gastroenterological-Association. Washington, DC, USA. May 19 -24, 2007. Amer Gastroenterol Assoc; Amer Assoc Study Liver Dis; Amer Soc Gastrointestinal Endoscopy; Soc Surg Alimentary Tract.
86 Jaquotot-Haerranz et al., Rev Esp Enferm Dig. 2013, vol. 105(1), p. 52-54.
87 Khosla et al., American Journal of Gastroenterology 2015, vol. 110, No. Suppl. 1, pp. S397. Meeting Info.: 80th Annual Scientific Meeting of the American-College-of-Gastroenterology. Honolulu, HI, USA. October 16 -21, 2015.
88 Dröge et al., J Hepatol. 2017, vol. 67(6), p. 1253-1264.
89 Liu et al., Liver International 2010, vol. 30(6), p. 809-815.
90Chen et al., Journal of Pediatrics 2002, vol. 140(1), p. 119-124.
91 U.S. Patent No. 9,295,677
В некоторых вариантах осуществления мутация в ABCB11 выбрана из группы, включающей A167T, G238V, V284L, E297G, R470Q, R470X, D482G, R487H, A570T, N591S, A865V, G982R, R1153C и R1268Q.
Предложены способы лечения PFIC (например, PFIC-1 и PFIC-2) у субъекта, которые включают проведение анализа образца, взятого у субъекта, для определения того, имеется ли у субъекта мутация, связанная с PFIC (например, мутация ATP8B1, ABCB11, ABCB4, TJP2, NR1H4 или Myo5b) и введение (например, специфическое или селективное введение) терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, субъекту, у которого выявлена мутация, связанная с PFIC. В некоторых вариантах осуществления мутацией является ATP8B1 или ABCB11. Например, мутация, приведенная в любой из таблиц 1-4. В некоторых вариантах осуществления мутация в ATP8B1 выбрана из группы, включающей L127P, G308V, T456M, D554N, F529del, I661T, E665X, R930X, R952X, R1014X и G1040R. В некоторых вариантах осуществления мутация в ABCB11 выбрана из группы, включающей A167T, G238V, V284L, E297G, R470Q, R470X, D482G, R487H, A570T, N591S, A865V, G982R, R1153C и R1268Q.
Также предложены способы лечения PFIC (например, PFIC-1 и PFIC-2) у нуждающегося в нем субъекта, способ включает: (a) выявление мутации, связанной с PFIC (например, мутации ATP8B1, ABCB11, ABCB4, TJP2, NR1H4 или Myo5b), у субъекта; и (b) введение субъекту терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых вариантах осуществления способы лечения PFIC могут включать введение терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли субъекту, у которого имеется мутация, связанная с PFIC (например, мутация ATP8B1, ABCB11, ABCB4, TJP2, NR1H4 или Myo5b). В некоторых вариантах осуществления мутацией является ATP8B1 или ABCB11. Например, мутация, приведенная в любой из таблиц 1-4. В некоторых вариантах осуществления мутация в ATP8B1 выбрана из группы, включающей L127P, G308V, T456M, D554N, F529del, I661T, E665X, R930X, R952X, R1014X и G1040R. В некоторых вариантах осуществления мутация в ABCB11 выбрана из группы, включающей A167T, G238V, V284L, E297G, R470Q, R470X, D482G, R487H, A570T, N591S, A865V, G982R, R1153C и R1268Q.
В некоторых вариантах осуществления установлено, что у субъекта имеется мутация, связанная с PFIC у субъекта, или по данным взятого у субъекта для биопсии образца путем использования любого из известных в данной области техники тестов, включая секвенирования следующего поколения (NGS). В некоторых вариантах осуществления установлено, что у субъекта имеется мутация, связанная с PFIC, с использованием утвержденного регулятивным органом, например, утвержденного FDA теста или анализа для выявления мутации, связанной с PFIC у субъекта, или взятого у субъекта для биопсии образца или путем проведения любого из неограничивающих примеров анализов, описанных в настоящем изобретении. Дополнительные методики диагностики PFIC описаны в публикации Gunaydin, M. et al., Hepat Med. 2018, vol. 10, p. 95-104, которая во всей своей полноте включена в настоящее изобретение в качестве ссылки.
В некоторых вариантах осуществления лечение PFIC (например, PFIC-1 или PFIC-2) уменьшает содержание желчных кислот в сыворотке у субъекта. В некоторых вариантах осуществления содержание желчных кислот в сыворотке определяют, например, с помощью ферментативного анализа ELISA или анализов для определения полного содержания желчных кислот, описанного в публикации Danese et al., PLoS One. 2017, vol. 12(6): e0179200, которая во всей своей полноте включена в настоящее изобретение в качестве ссылки. В некоторых вариантах осуществления содержание желчных кислот в сыворотке может снизиться, например, на 10% - 40%, 20% - 50%, 30% - 60%, 40% - 70%, 50% - 80% или более, чем на 90% по сравнению с содержанием желчных кислот в сыворотке до введения соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых вариантах осуществления лечение PFIC включает лечение прурита.
Поскольку LBAT экспрессируется в гепатоцитах, LBAT и двойные ингибирующие ASBT/LBAT вещества должны обладать по меньшей мере некоторой биодоступностью и свободной фракцией в крови. Поскольку ингибирующие LBAT соединения должны быть устойчивы только при переходе из кишечника в печень, предполагается, что достаточно относительно небольшое системное воздействие таких соединений, что сводит к минимуму возможную опасность каких-либо побочных эффектов в остальной части организма. Предполагается, что ингибирование LBAT и ASBT обладает по меньшей мере аддитивными воздействиями на снижение концентрации внутрипеченочных желчных кислот. Также предполагается, что двойной ингибитор ASBT/LBAT может быть способен снижать содержания желчных кислот, не вызывая диарею, как это иногда наблюдается при использовании ингибиторов ASBT.
Соединения, обладающие высокой активностью ингибирования LBAT и достаточной биодоступностью, предположительно являются особенно походящими для лечения гепатита. Соединения, обладающие способностью двойного ингибирования ASBT/LBAT и достаточной биодоступностью, предположительно являются особенно походящими неалкогольного стеатогепатита (NASH).
NASH является распространенным и тяжелым хроническим заболеванием печени, которое напоминает алкогольное заболевание печени, но проявляется у людей, которые употребляют мало алкоголя или не употребляют алкоголь. У пациентов с NASH накопление жира в печени, известное, как неалкогольная жировая инфильтрация печени (NAFLD) или стеатоз, и другие факторы, такие как большое содержание LDL холестерина и резистентность к инсулину, вызывают хроническое воспаление печени и могут привести к прогрессирующему рубцеванию ткани, известному, как фиброз и цирроз, в конечном счете приводящему к печеночной недостаточности и смерти. Установлено, что у пациентов с NASH имеется значительно более высокая полная концентрация желчных кислот в сыворотке натощак, чем у здоровых субъектов ((усиление NASH в 2,2-2,4 раза) и во все время после еды (усиление NASH в 1,7-2,2 раза). Это вызвано увеличением содержания сопряженных с глицином и таурином первичных и вторичных желчных кислот. У пациентов с NASH наблюдается более значительная изменчивость профиля желчных кислот натощак и после еды. Эти результаты показывают, что у пациентов с NASH происходить более значительное воздействие желчных кислот натощак и после еды, включая боле гидрофобные и цитотоксичные вторичные соединения. Усиление воздействия желчных кислот может участвовать в поражении печени и патогенезе NAFLD и NASH (Ferslew et al., Dig Dis Sci. 2015, vol. 60, p. 3318-3328). Поэтому вероятно, что ингибирование ASBT и/или LBAT будет благоприятно для лечения NASH.
NAFLD характеризуется жировым гепатозом при отсутствии вторичных причин жирового гепатоза, включая избыточное потребление алкоголя, другие известные заболеваний печени или длительное проведение стеатогенного лечения (Chalasani et al., Hepatology 2018, vol. 67(1), p. 328-357). NAFLD можно подразделить на неалкогольную жировую инфильтрацию печени (NAFL) и неалкогольный стеатогепатит (NASH). Согласно Chalasani et al. NAFL определяется, как присутствие ≥ 5% жирового гепатоза без свидетельств печеночноклеточного поражения в форме разбухания гепатоцитов. NASH определяется, как присутствие ≥ 5% жирового гепатоза и воспаление с поражением гепатоцитов (например, разбухания) с наличием или без наличия любого фиброза печени. NASH также обычно связывают с воспалением печени и фиброзом печени, которые могут развиваться в цирроз, терминальную стадию заболевания печени и печеночно-клеточную карциному. Хотя фиброз печени не всегда наблюдается при NASH, тяжесть фиброза, если он имеется, можно связать с долговременными последствиями.
Множество подходов используют для оценки и определения того, имеется ли у субъекта NAFLD, и если имеется, тяжести заболевания, включая установление дог, представляет ли NAFLD собой NAFL или NASH. В некоторых вариантах осуществления тяжесть NAFLD можно оценить с помощью NAS. В некоторых вариантах осуществления лечение NAFLD можно оценить с помощью NAS. В некоторых вариантах осуществления NAS можно определить, как описано в публикации Kleiner et al., Hepatology. 2005, 41(6):1313-1321, которая во всей своей полноте включена в настоящее изобретение в качестве ссылки. См., например, таблицу 5, в которой приведена упрощенная схема NAS, адаптированная из публикации Kleiner.
Таблица 5. Пример показателей активности NAFLD (NAS) на стадии фиброза
В некоторых вариантах осуществления NAS определяют неизвазивно, например, как описано в публикации U.S. Application Publication No. 2018/0140219, которая во всей своей полноте включена в настоящее изобретение в качестве ссылки. В некоторых вариантах осуществления NAS определяют для взятого у субъекта образца до введения соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых вариантах осуществления NAS определяют во время периода времени или после периода времени введения соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых вариантах осуществления показатель NAS меньше во время периода времени или после периода времени введения соединения формулы (I) или его фармацевтически приемлемой соли, чем до введения соединения формулы (I) или его фармацевтически приемлемой соли указывает на лечение NAFLD (например, NASH). Например, уменьшение NAS на 1, на 2, на 3, на 4, на 5, на 6 или на 7 указывает на лечение NAFLD (например, NASH). В некоторых вариантах осуществления NAS после введения соединения формулы (I) или его фармацевтически приемлемой соли равен 7 или менее. В некоторых вариантах осуществления NAS во время периода времени введения соединения формулы (I) или его фармацевтически приемлемой соли, равен 5 или менее, 4 или менее, 3 или менее, или 2 или менее. В некоторых вариантах осуществления NAS во время периода времени введения соединения формулы (I) или его фармацевтически приемлемой соли равен 7 или менее. В некоторых вариантах осуществления NAS во время периода времени введения соединения формулы (I) или его фармацевтически приемлемой соли равен 5 или менее, 4 или менее, 3 или менее, или 2 или менее. В некоторых вариантах осуществления NAS после периода времени введения соединения формулы (I) или его фармацевтически приемлемой соли равен 7 или менее. В некоторых вариантах осуществления NAS после периода времени введения соединения формулы (I) или его фармацевтически приемлемой соли равен 5 или менее, 4 или менее, 3 или менее, или 2 или менее.
Дополнительные методики оценки и расчета NASH у субъекта включают определение одного или большего количества следующих: жировой гепатоз (например, накопление жира в печени); воспаление печени; биомаркеры, указывающие на один или большее количество следующих: поражение печени, воспаление печени, фиброз печени и/или цирроз печени (например, маркеры и группы маркеров для сыворотки). Другие примеры физиологических индикаторов NASH могут включать морфологию печени, жесткость печени и размер или массу печени субъекта.
В некоторых вариантах осуществления о NASH у субъекта свидетельствует накопление печеночного жира и обнаружение биомаркера, указывающего на поражение печени. Например, повышенное содержание ферритина в сыворотке и низкие титры сывороточных антител могут быть обычными признаками NASH.
В некоторых вариантах осуществления методики оценки NASH включают магнитно-резонансную визуализацию, количественное исследование стеатоза с помощью спектроскопии или протонной плотности жировой фракции (MRI-PDFF), транзиентную эластографию (FIBROSCAN®), определение градиента давления в венозной системе печени (HPVG), измерение жесткости печени с помощью MRE для диагностики значительного фиброза и/или цирроза печени и оценки гистологических характеристик биопсии печени. В некоторых вариантах осуществления магнитно-резонансную визуализацию используют для обнаружения одного или большего количества следующих: стеатогепатит (NASH-MRI), фиброз печени (Fibro-MRI) и стеатоз. См., например, U.S. Application Publication Nos. 2016/146715 и 2005/0215882, которые во всей своей полноте включены в настоящее изобретение в качестве ссылки.
В некоторых вариантах осуществления лечение NASH может включать ослабление одного или большего количества симптомов, связанных с NASH; уменьшение степени жирового гепатоза; уменьшение NAS; уменьшение воспаления печени; уменьшение содержания биомаркеров, указывающих на один или большее количество следующих: поражение, воспаление печени, фиброз печени и/или цирроз печени; и ослабление фиброза и/или цирроза, отсутствие дальнейшего прогрессирования фиброза и/или цирроза или замедление прогрессирования фиброза и/или цирроза у субъекта после введения одной или большего количества доз соединения формулы (I) или его фармацевтически приемлемой соли.
В некоторых вариантах осуществления лечение NASH включает ослабление одного или большего количества симптомов, связанных с NASH у субъекта. Типичные симптомы могут включать один или большее количество следующих: увеличенная печень, усталость, боль в правой верхней части брюшной полости, вздутие живота, увеличение кровеносных сосудов непосредственно под поверхностью кожи, увеличение молочных желез у мужчин, увеличение селезенки, покраснение ладоней, желтуха и прурит. В некоторых вариантах осуществления субъект является бессимптомным. В некоторых вариантах осуществления полная масса тела субъекта не увеличивается. В некоторых вариантах осуществления полная масса тела субъекта уменьшается. В некоторых вариантах осуществления индекс массы тела (BMI) субъекта не увеличивается. В некоторых вариантах осуществления индекс массы тела (BMI) субъекта уменьшается. В некоторых вариантах осуществления отношение объема талии к объему бедер (WTH) у субъекта не увеличивается. В некоторых вариантах осуществления отношение объема талии к объему бедер (WTH) у субъекта уменьшается.
В некоторых вариантах осуществления лечение NASH можно оценить путем определения жирового гепатоза. В некоторых вариантах осуществления лечение NASH включает уменьшение жирового гепатоза после введения соединения формулы (I) или его фармацевтически приемлемой соли, описанной в настоящем изобретении. В некоторых вариантах осуществления жировой гепатоз определяют с помощью одной или большего количества методик, выбранных из группы, включающей ультразвуковую эхографию, компьютерную томографию (CT), магнитно-резонансную визуализацию, магнитно-резонансную спектроскопию (MRS), магнитно-резонансную эластографию (MRE), транзиентную эластографию (TE) (например, FIBROSCAN®), измерение размера или массы печени, или биопсию печени (см., например, Di Lascio et al., Ultrasound Med Biol. 2018, vol. 44(8), p. 1585-1596; Lv et al., J Clin Transl Hepatol. 2018, vol. 6(2), p. 217-221; Reeder et al., J Magn Reson Imaging. 2011, vol. 34(4), spcone; и de Lédinghen V, et al., J Gastroenterol Hepatol. 2016, vol. 31(4), p. 848-855, которые во всей своей полноте включены в настоящее изобретение в качестве ссылки). У субъекта с диагностированным NASH может наблюдаться более примерно 5% жирового гепатоза, например, от более примерно 5% до примерно 25%, от примерно 25% до примерно 45%, от примерно 45% до примерно 65% или более примерно 65% жирового гепатоза. В некоторых вариантах осуществления у субъекта с от более примерно 5% до примерно 33% жирового гепатоза имеется стадия 1 жирового гепатоза, у субъекта с от примерно 33% до примерно 66% жирового гепатоза имеется стадия 2 жирового гепатоза и у субъекта с более примерно 66% жирового гепатоза имеется стадия 3 жирового гепатоза.
В некоторых вариантах осуществления степень жирового гепатоза определяют до введения соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых вариантах осуществления степень жирового гепатоза определяют во время периода времени или после периода времени введения соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых вариантах осуществления уменьшение степени жирового гепатоза во время периода времени или после периода времени введения соединения формулы (I) или его фармацевтически приемлемой соли по сравнению со степенью до введения соединения формулы (I) или его фармацевтически приемлемой соли указывает на лечение NASH. Например, уменьшение степени жирового гепатоза, составляющее от примерно 1% до примерно 50%, от примерно 25% до примерно 75% или от примерно 50% до примерно 100% указывает на лечение NASH. В некоторых вариантах осуществления уменьшение степени жирового гепатоза, составляющее примерно 5%, примерно 10%, примерно 15%, примерно 20%, примерно 25%, примерно 30%, примерно 35%, примерно 40%, примерно 45%, примерно 50%, примерно 55%, примерно 60%, примерно 65%, примерно 70%, примерно 75%, примерно 80%, примерно 85%, примерно 90% или примерно 95% указывает на лечение NASH.
В некоторых вариантах осуществления наличие воспаления печени определяют с помощью одной или большего количества методик, выбранных из группы, включающей биомаркеры, указывающие воспаления печени, и биопсию образца (образцов) печени субъекта. В некоторых вариантах осуществления тяжесть воспаления печени определяют по биопсии образца (образцов) печени субъекта. Например, воспаление печени можно оценить по биопсии образца печени, как описано в публикации Kleiner et al., Hepatology 2005, vol. 41(6), p. 1313-1321 и Brunt et al., Am J Gastroenterol 1999, vol. 94, p. 2467-2474, которые во всей своей полноте включены в настоящее изобретение в качестве ссылки. В некоторых вариантах осуществления тяжесть воспаления печени определяют до введения соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых вариантах осуществления тяжесть воспаления печени определяют во время периода времени или после периода времени введения соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых вариантах осуществления уменьшение тяжести воспаления печени во время периода времени или после периода времени введения соединения формулы (I) или его фармацевтически приемлемой соли по сравнению со степенью до введения соединения формулы (I) или его фармацевтически приемлемой соли указывает на лечение NASH. Например, уменьшение тяжести воспаления печени, составляющее от примерно 1% до примерно 50%, от примерно 25% до примерно 75% или от примерно 50% до примерно 100% указывает на лечение NASH. В некоторых вариантах осуществления уменьшение тяжести воспаления печени, составляющее примерно 5%, примерно 10%, примерно 15%, примерно 20%, примерно 25%, примерно 30%, примерно 35%, примерно 40%, примерно 45%, примерно 50%, примерно 55%, примерно 60%, примерно 65%, примерно 70%, примерно 75%, примерно 80%, примерно 85%, примерно 90% или примерно 95% указывает на лечение NASH.
В некоторых вариантах осуществления лечение NASH включает лечение фиброза и/или цирроза, например, уменьшение тяжести фиброза, отсутствие дальнейшего прогрессирования фиброза и/или цирроза или замедление прогрессирования фиброза и/или цирроза. В некоторых вариантах осуществления наличие фиброза и/или цирроза определяют с помощью одной или большего количества методик, выбранных из группы, включающей транзиентную эластографию (например, FIBROSCAN®), неинвазивные маркеры фиброза печени и гистологические особенности биопсии печени. В некоторых вариантах осуществления тяжесть (например, стадию) фиброза определяют с помощью одной или большего количества методик, выбранных из группы, включающей транзиентную эластографию (например, FIBROSCAN®), систему количественных показателей фиброза, биомаркеры фиброза печени (например, неинвазивные биомаркеры) и определение градиента давления в венозной системе печени (HVPG). Неограничивающие примеры систем количественных показателей фиброза включают систему количественных показателей фиброза NAFLD (см., например, Angulo et al., Hepatology 2007, vol. 45(4), p. 846-54), систему количественных показателей фиброза, описанную в публикации Brunt et al., Am. J. Gastroenterol. 1999, vol. 94, p. 2467-2474, систему количественных показателей фиброза, описанную в публикации Kleiner et al., Hepatology 2005, vol. 41(6), p. 1313-1321, и систему количественных показателей фиброза ISHAK (см. Ishak et al., J. Hepatol. 1995, vol. 22, p. 696-699), содержания которых во всей их полноте включены в настоящее изобретение в качестве ссылки.
В некоторых вариантах осуществления тяжесть фиброза определяют до введения соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых вариантах осуществления тяжесть фиброза определяют во время периода времени или после периода времени введения соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых вариантах осуществления уменьшение тяжести фиброза во время периода времени или после периода времени введения соединения формулы (I) или его фармацевтически приемлемой соли по сравнению со степенью до введения соединения формулы (I) или его фармацевтически приемлемой соли указывает на лечение NASH. В некоторых вариантах осуществления уменьшение тяжести фиброза, отсутствие дальнейшего прогрессирования фиброза и/или цирроза или замедление прогрессирования фиброза и/или цирроза указывает на лечение NASH. В некоторых вариантах осуществления тяжесть фиброза определяют с помощью системы количественных показателей, такой как любая из систем количественных показателей фиброза, описанных в настоящем изобретении, например, показатель может указывать на стадию фиброза, например, стадию 0 (отсутствие фиброза), стадию 1, стадию 2, стадию 3 и стадию 4 (цирроз) (см., например, Kleiner et al). В некоторых вариантах осуществления снижение стадии фиброза представляет собой уменьшение тяжести фиброза. Например, снижение на 1, 2, 3 или 4 стадии представляет собой уменьшение тяжести фиброза. В некоторых вариантах осуществления снижение стадии, например, от стадии 4 до стадии 3, от стадии 4 до стадии 2, от стадии 4 до стадии 1, от стадии 4 до стадии 0, от стадии 3 до стадии 2, от стадии 3 до стадии 1, от стадии 3 до стадии 0, от стадии 2 до стадии 1, от стадии 2 до стадии 0 или от стадии 1 до стадии 0 указывает на лечение NASH. В некоторых вариантах осуществления стадия фиброза снижается от стадии 4 до стадии 3, от стадии 4 до стадии 2, от стадии 4 до стадии 1, от стадии 4 до стадии 0, от стадии 3 до стадии 2, от стадии 3 до стадии 1, от стадии 3 до стадии 0, от стадии 2 до стадии 1, от стадии 2 до стадии 0 или от стадии 1 до стадии 0 после введения соединения формулы (I) или его фармацевтически приемлемой соли по сравнению со стадией до введения соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых вариантах осуществления стадия фиброза снижается от стадии 4 до стадии 3, от стадии 4 до стадии 2, от стадии 4 до стадии 1, от стадии 4 до стадии 0, от стадии 3 до стадии 2, от стадии 3 до стадии 1, от стадии 3 до стадии 0, от стадии 2 до стадии 1, от стадии 2 до стадии 0 или от стадии 1 до стадии 0 во время периода времени введения соединения формулы (I) или его фармацевтически приемлемой соли по сравнению со стадией до введения соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых вариантах осуществления стадия фиброза снижается от стадии 4 до стадии 3, от стадии 4 до стадии 2, от стадии 4 до стадии 1, от стадии 4 до стадии 0, от стадии 3 до стадии 2, от стадии 3 до стадии 1, от стадии 3 до стадии 0, от стадии 2 до стадии 1, от стадии 2 до стадии 0 или от стадии 1 до стадии 0 после периода времени введения соединения формулы (I) или его фармацевтически приемлемой соли по сравнению со стадией до введения соединения формулы (I) или его фармацевтически приемлемой соли.
В некоторых вариантах осуществления наличие NASH определяют с помощью одного или большего количества биомаркеров, указывающих на один или большее количество следующих: поражение, воспаление печени, фиброз печени и/или цирроз печени или с помощью систем его количественных показателей. В некоторых вариантах осуществления тяжесть NASH определяют с помощью одного или большего количества биомаркеров, указывающих на один или большее количество следующих: поражение, воспаление печени, фиброз печени и/или цирроз печени или с помощью систем его количественных показателей. Содержание биомаркера можно определить путем, например, измерения, количественного определения и мониторинга степени экспрессии гена или mRNA, кодирующего биомаркер, и/или биомаркера пептида или белка. Неограничивающие примеры биомаркеров, указывающих на один или большее количество следующих: поражение, воспаление печени, фиброз печени и/или цирроз печени и/или систем его количественных показателей включают показатель отношения количества аспартатаминотрансферазы (AST) к количеству тромбоцитов (APRI); отношение количества аспартатаминотрансферазы (AST) к количеству аланинаминотрансферазы (ALT) (AAR); показатель FIB-4, который основан на APRI, содержаниях аланинаминотрансферазы (ALT) и возрасте субъекта (см., например, публикацию McPherson et al., Gut 2010, vol. 59(9), p. 1265-9, которая во всей своей полноте включена в настоящее изобретение в качестве ссылки); гиалуроновую кислоту; провоспалительные цитокины; группы биомаркеров, включающие α2-макроглобулин, гаптоглобин, аполипопротеин A1, билирубин, гамма-глутамилтранспептидазу (GGT) совместно с возрастом и полом субъекта для образования меры степени фиброза и некровоспалительной активности в печени (например, FIBROTEST®, FIBROSURE®), группы биомаркеров, включающие билирубин, гамма-глутамилтрансферазу, гиалуроновую кислоту, α2-макроглобулин совместно с возрастом и полом субъекта (например, HEPASCORE®; см., например, Adams et al., Clin. Chem. 2005, vol. 51(10), p. 1867-1873) и группы биомаркеров, включающие тканевый ингибитор металлопротеазы-1, гиалуроновую кислоту и α2-макроглобулин (например, FIBROSPECT®); группы биомаркеров, включающие тканевый ингибитор металлопротеазы 1 (TIMP-1), полипептид типа III с концевой аминогруппой, проколлаген (PIIINP) и гиалуроновую кислоту (HA) (например, показатель усиленного фиброза печени (ELF), см., например, публикацию Lichtinghagen R, et al., J Hepatol. 2013 Aug;59(2):236-42, которая во всей своей полноте включена в настоящее изобретение в качестве ссылки). В некоторых вариантах осуществления наличие фиброза определяют с помощью одного или большего количества следующих: показатель FIB-4, группы биомаркеров, включающие α2-макроглобулин, гаптоглобин, аполипопротеин A1, билирубин, гамма-глутамилтранспептидазу (GGT) совместно с возрастом и полом субъекта для образования меры степени фиброза и некровоспалительной активности в печени (например, FIBROTEST®, FIBROSURE®), группы биомаркеров, включающие билирубин, гамма-глутамилтрансферазу, гиалуроновую кислоту, α2-макроглобулин совместно с возрастом и полом субъекта (например, HEPASCORE®; см., например, Adams et al., Clin. Chem. 2005, vol. 51(10), p. 1867-1873) и группы биомаркеров, включающие тканевый ингибитор металлопротеазы-1, гиалуроновую кислоту и α2-макроглобулин (например, FIBROSPECT®); и группы биомаркеров, включающие тканевый ингибитор металлопротеаз 1 (TIMP-1), полипептид типа III с концевой аминогруппой, проколлаген (PIIINP) и гиалуроновую кислоту (HA) (например, показатель усиленного фиброза печени (ELF)).
В некоторых вариантах осуществления содержание аспартатаминотрансферазы (AST) не увеличивается. В некоторых вариантах осуществления содержание аспартатаминотрансферазы (AST) уменьшается. В некоторых вариантах осуществления содержание аланинаминотрансферазы (ALT) не увеличивается. В некоторых вариантах осуществления содержание аланинаминотрансферазы (ALT) уменьшается. В некоторых вариантах осуществления "содержание" фермента представляет собой концентрацию фермента, например, в крови. Например, содержание AST или ALT можно представить в виде Ед/л.
В некоторых вариантах осуществления тяжесть фиброза определяют с помощью одного или большего количества следующих: показатель FIB-4, группы биомаркеров, включающие α2-макроглобулин, гаптоглобин, аполипопротеин A1, билирубин, гамма-глутамилтранспептидазу (GGT) совместно с возрастом и полом субъекта для образования меры степени фиброза и некровоспалительной активности в печени (например, FIBROTEST®, FIBROSURE®), группы биомаркеров, включающие билирубин, гамма-глутамилтрансферазу, гиалуроновую кислоту, α2-макроглобулин совместно с возрастом и полом субъекта (например, HEPASCORE®; см., например, Adams et al., Clin. Chem. 2005, vol. 51(10), p. 1867-1873, которая во всей своей полноте включена в настоящее изобретение в качестве ссылки) и группы биомаркеров, включающие тканевый ингибитор металлопротеазы-1, гиалуроновую кислоту и α2-макроглобулин (например, FIBROSPECT®); и группы биомаркеров, включающие тканевый ингибитор металлопротеазы 1 (TIMP-1), полипептид типа III с концевой аминогруппой, проколлаген (PIIINP) и гиалуроновую кислоту (HA) (например, показатель усиленного фиброза печени (ELF)).
В некоторых вариантах осуществления воспаление печени определяют по содержанию биомаркеров воспаления печени, например, провоспалительных цитокинов. Неограничивающие примеры биомаркеров, указывающих на воспаление печени, включают интерлейкин-(IL) 6, интерлейкин-(IL) 1β, фактор некроза опухоли (TNF)-α, трансформирующий фактор роста (TGF)-β, моноцитарный хемотаксический белок (MCP)-1, C-реактивный белок (CRP), PAI-1 и изоформы коллагена, такие как Col1a1, Col1a2 и Col4a1 (см., например, публикации Neuman, et al., Can. J. Gastroenterol. Hepatol. 2014, vol. 28(11), p. 607-618 и U.S. Patent No. 9872844, которые во всей своей полноте включены в настоящее изобретение в качестве ссылки). Воспаление печени также можно оценить по изменению инфильтрации макрофагов, например, путем измерения изменения степени экспрессии CD68. В некоторых вариантах осуществления воспаление печени можно определить путем измерения или мониторинга содержания в сыворотке или содержания в кровотоке одного или большего количества следующих: интерлейкин-(IL) 6, интерлейкин-(IL) 1β, фактор некроза опухоли (TNF)-α, трансформирующий фактор роста (TGF)-β, моноцитарный хемотаксический белок (MCP)-1 и C-реактивный белок (CRP).
В некоторых вариантах осуществления содержание одного или большего количества биомаркеров, указывающих на один или большее количество следующих: поражение, воспаление печени, фиброз печени и/или цирроз печени определяют с помощью взятого у субъекта образца до введения соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых вариантах осуществления содержание одного или большего количества биомаркеров, указывающих на один или большее количество следующих: поражение, воспаление печени, фиброз печени и/или цирроз печени определяют во время периода времени или после периода времени введения соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых вариантах осуществления уменьшение содержания одного или большего количества биомаркеров, указывающих на один или большее количество следующих: поражение, воспаление печени, фиброз печени и/или цирроз печени во время периода времени или после периода времени введения соединения формулы (I) или его фармацевтически приемлемой соли по сравнению со степенью до введения соединения формулы (I) или его фармацевтически приемлемой соли указывает на лечение NASH. Например, уменьшение содержания одного или большего количества биомаркеров, указывающих на один или большее количество следующих: поражение, воспаление печени, фиброз печени и/или цирроз печени составляет по меньшей мере примерно 5%, по меньшей мере примерно 10%, по меньшей мере примерно 15%, по меньшей мере примерно 20%, по меньшей мере примерно 25%, по меньшей мере примерно 30%, по меньшей мере примерно 35%, по меньшей мере примерно 40%, по меньшей мере примерно 45%, по меньшей мере примерно 50%, по меньшей мере примерно 55%, по меньшей мере примерно 60%, по меньшей мере примерно 65%, по меньшей мере примерно 70%, по меньшей мере примерно 75%, по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, по меньшей мере примерно 95%, или по меньшей мере примерно 99% указывает на лечение NASH. В некоторых вариантах осуществления уменьшение содержания одного или большего количества биомаркеров, указывающих на один или большее количество следующих: поражение, воспаление печени, фиброз печени и/или цирроз печени после введения соединения формулы (I) или его фармацевтически приемлемой соли, составляет по меньшей мере примерно 5%, по меньшей мере примерно 10%, по меньшей мере примерно 15%, по меньшей мере примерно 20%, по меньшей мере примерно 25%, по меньшей мере примерно 30%, по меньшей мере примерно 35%, по меньшей мере примерно 40%, по меньшей мере примерно 45%, по меньшей мере примерно 50%, по меньшей мере примерно 55%, по меньшей мере примерно 60%, по меньшей мере примерно 65%, по меньшей мере примерно 70%, по меньшей мере примерно 75%, по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, по меньшей мере примерно 95%, или по меньшей мере примерно 99%. В некоторых вариантах осуществления содержание одного или большего количества биомаркеров, указывающих на один или большее количество следующих: поражение, воспаление печени, фиброз печени и/или цирроз печени во время периода времени введения соединения формулы (I) или его фармацевтически приемлемой соли, составляет по меньшей мере примерно 5%, по меньшей мере примерно 10%, по меньшей мере примерно 15%, по меньшей мере примерно 20%, по меньшей мере примерно 25%, по меньшей мере примерно 30%, по меньшей мере примерно 35%, по меньшей мере примерно 40%, по меньшей мере примерно 45%, по меньшей мере примерно 50%, по меньшей мере примерно 55%, по меньшей мере примерно 60%, по меньшей мере примерно 65%, по меньшей мере примерно 70%, по меньшей мере примерно 75%, по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, по меньшей мере примерно 95%, или по меньшей мере примерно 99%. В некоторых вариантах осуществления содержание одного или большего количества биомаркеров, указывающих на один или большее количество следующих: поражение, воспаление печени, фиброз печени и/или цирроз печени после периода времени введения соединения формулы (I) или его фармацевтически приемлемой соли, составляет по меньшей мере примерно 5%, по меньшей мере примерно 10%, по меньшей мере примерно 15%, по меньшей мере примерно 20%, по меньшей мере примерно 25%, по меньшей мере примерно 30%, по меньшей мере примерно 35%, по меньшей мере примерно 40%, по меньшей мере примерно 45%, по меньшей мере примерно 50%, по меньшей мере примерно 55%, по меньшей мере примерно 60%, по меньшей мере примерно 65%, по меньшей мере примерно 70%, по меньшей мере примерно 75%, по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, по меньшей мере примерно 95% или по меньшей мере примерно 99%.
В некоторых вариантах осуществления лечение NASH уменьшает содержание желчных кислот в сыворотке у субъекта. В некоторых вариантах осуществления содержание желчных кислот в сыворотке определяют, например, с помощью ферментативного анализа ELISA или анализов для определения полного содержания желчных кислот, описанного в публикации Danese et al., PLoS One. 2017, vol. 12(6): e0179200, которая во всей своей полноте включена в настоящее изобретение в качестве ссылки. В некоторых вариантах осуществления содержание желчных кислот в сыворотке может снизиться, например, на 10% - 40%, 20% - 50%, 30% - 60%, 40% - 70%, 50% - 80% или более, чем на 90% по сравнению с содержанием желчных кислот в сыворотке до введения соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых вариантах осуществления NASH представляет собой NASH с сопутствующим холестазом. При холестазе блокируется выделение из печени желчи, включая желчные кислоты. Желчные кислоты могут вызвать повреждение гепатоцитов (см., например, Perez MJ, Briz O. World J. Gastroenterol. 2009, vol. 15(14), p. 1677-1689), вероятно, приводящее к фиброзу или к усилению прогрессирования фиброза (например, цирроза) и повышение риска печеночно-клеточной карциномы (см., например, публикации Sorrentino P et al., Dig. Dis. Sci. 2005, vol. 50(6), p. 1130-1135 и Satapathy SK and Sanyal AJ. Semin. Liver Dis. 2015, vol. 35(3), p. 221-235, которые во всей своей полноте включены в настоящее изобретение в качестве ссылки). В некоторых вариантах осуществления лечение NASH включает лечение прурита. В некоторых вариантах осуществления лечение NASH с сопутствующим холестазом включает лечение прурита. В некоторых вариантах осуществления у субъекта с NASH с сопутствующим холестазом имеется прурит.
Типичные биомаркеры для NASH приведены в таблице 6.
Таблица 6. Типичные биомаркеры NASH
Литература для таблицы 6
1 McPherson et al., Gut. 2010, vol. 59(9), p. 1265-1269.
2 Adams, et al. Clin Chem. 2005, vol. 51(10), p. 1867-1873.
3 Lichtinghagen, et al. J Hepatol. 2013, vol. 59(2), p. 236-242.
4Neuman, et al. Can J Gastroenterol Hepatol. 2014, vol. 28(11), p. 607-618.
5 U.S. Patent No. 9,872,844
При использовании в настоящем изобретении термины "лечение", "лечить" представляют собой обращение, облегчение, задержку начала или подавление прогрессирования заболевания или нарушения, или одного или большего количества его симптомов, описанных в настоящем изобретении. В некоторых вариантах осуществления лечение можно проводить после развития одного или большего количества симптомов. В других вариантах осуществления лечение можно проводить при отсутствии симптомов. Например, лечение можно проводить для восприимчивого индивидуума до начала проявления симптомов (например, с учетом симптомов в анамнезе и/или с учетом генетических или других факторов восприимчивости). Лечение также можно продолжать после устранения симптомов, например, для предупреждения или задержки их рецидива.
Походящая фармацевтически приемлемая соль соединения, предлагаемого в настоящем изобретении, представляет собой, например, соль присоединения с основанием соединения, предлагаемого в настоящем изобретении, которое является достаточно кислым, такая как соль щелочного металла (например, соль натрия или калия), соль щелочноземельного металла (например, соль кальция или магния), соль аммония или соль с органическим основанием, которое содержит физиологически приемлемый катион, например, соль с метиламином, диметиламином, триметиламином, пиперидином, морфолином или трис-(2-гидроксиэтил)амином.
Некоторые соединения формулы (I) или их фармацевтически приемлемые соли могут содержать хиральные центры и/или центры геометрической изомерии (E- и Z-изомеры). Следует понимать, что настоящее изобретение включает все такие оптические изомеры, диастереоизомеры и геометрические изомеры, которые обладают ингибирующей активностью по отношению к ASBT и/или LBAT. Настоящее изобретение также относится к любой и всем таутомерным формам соединений формулы (I) или их фармацевтически приемлемых солей, которые обладают ингибирующей активностью по отношению к ASBT и/или LBAT. Некоторые соединения формулы (I) или их фармацевтически приемлемые соли, могут существовать в несольватированных, а также сольватированных формах, таких как, например, гидратированные формы. Следует понимать, что настоящее изобретение включает все такие сольватированные формы, которые обладают ингибирующей активностью по отношению к ASBT и/или LBAT.
Другим объектом настоящего изобретения является фармацевтическая композиция, содержащая терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли и один или большее количество фармацевтически приемлемых инертных наполнителей. Инертные наполнители могут, например, включать наполнители, связующие, разрыхлители, агенты, придающие скользкость и смазывающие вещества. Обычно фармацевтические композиции можно получить обычным образом с использованием обычных инертных наполнителей.
Примеры походящих наполнителей включают, но не ограничиваются только ими, дигидрат дикальцийфосфата, сульфат кальция, лактозу (такую как моногидрат лактозы), сахарозу, маннит, сорбит, целлюлозу, микрокристаллическую целлюлозу, сухой крахмал, гидролизованные крахмалы и предварительно желатинизированный крахмал. В некоторых вариантах осуществления наполнителем является маннит и/или микрокристаллическая целлюлоза.
Примеры походящих связующих включают, но не ограничиваются только ими, крахмал, предварительно желатинизированный крахмал, желатин, сахара (такие как сахароза, глюкоза, декстроза, лактоза и сорбит), полиэтиленгликоль, воска, природные и синтетические камеди (такие как камедь акации и трагакантовая камедь), альгинат натрия, производные целлюлозы (такие как гидроксипропилметилцеллюлоза (или гипромеллоза), гидроксипропилцеллюлоза и этилцеллюлоза) и синтетические полимеры (такие сополимеры как акриловой кислоты и метакриловой кислоты, сополимеры метакриловой кислоты, сополимеры метилметакрилата, сополимеры аминоалкилметакрилата, сополимеры акриловой кислоты/метакриловой кислоты и поливинилпирролидон (повидон)). В некоторых вариантах осуществления связующим является гидроксипропилметилцеллюлоза (гипромеллоза).
Примеры походящих разрыхлителей включают, но не ограничиваются только ими, сухой крахмал, модифицированный крахмал (такой как (частично) предварительно желатинизированный крахмал, натриевая соль гликолята крахмала и натриевая соль карбоксиметилкрахмала), альгиновая кислота, производные целлюлозы (такие как натриевая соль карбоксиметилцеллюлозы, гидроксипропилцеллюлоза и гидроксипропилцеллюлоза низкой степени замещения (L-HPC)) и сшитые полимеры (такие как кармеллоза, натриевая соль кроскармеллозы, кальциевая соль кармеллозы и сшитый PVP (кросповидон)). В некоторых вариантах осуществления разрыхлителем является натриевая соль кроскармеллозы.
Примеры походящих агентов, придающих скользкость, и смазывающих веществ включают, но не ограничиваются только ими, тальк, стеарат магния, стеарат кальция, стеарировую кислоту, глицерилбегенат, коллоидный диоксид кремния, водный диоксид кремния, синтетический силикат магния, мелкодисперсный гранулированный оксид кремния, крахмал, лаурилсульфат натрия, дорную кислоту, оксид магния, воска (такие как карнаубский воск), гидрированное масло, полиэтиленгликоль, бензоат натрия, полиэтиленгликоль и минеральное масло. В некоторых вариантах осуществления агентом, придающим скользкость, или смазывающим веществом является стеарат магния или коллоидный диоксид кремния.
На фармацевтическую композицию обычно можно нанести один или большее количество слоев покрытия. Также включены энтеросолюбильные покрытия или слои покрытия для задержанного или направленного высвобождения соединений формулы (I) или их фармацевтически приемлемых солей. Слои покрытия могут содержать один или большее количество агентов для нанесения покрытия и необязательно могут содержать пластификаторы и/или пигменты (или окрашивающие вещества).
Примеры походящих агенты для нанесения покрытия включают, но не ограничиваются только ими, полимеры на основе целлюлозы (такие как этилцеллюлоза, гидроксипропилметилцеллюлоза (или гипромеллоза), гидроксипропилцеллюлоза, ацетат-фталат целлюлозы, ацетат-сукцинат целлюлозы, гидроксипропилметилацетат-сукцинат целлюлозы и фталат гидроксипропилметилцеллюлозы), полимеры на виниловой основе (такие как поливиниловый спирт) и полимеры на основе акриловой кислоты и их производных (такие как сополимеры акриловой кислоты и метакриловой кислоты, сополимеры метакриловой кислоты, сополимеры метилметакрилата, сополимеры аминоалкилметакрилата, сополимеры акриловой кислоты/метакриловой кислоты). В некоторых вариантах осуществления агентом для нанесения покрытия является гидроксипропилметилцеллюлоза. В других вариантах осуществления агентом для нанесения покрытия является поливиниловый спирт.
Примеры походящих пластификаторов включают, но не ограничиваются только ими, триэтилцитрат, глицерилтриацетат, трибутилцитрат, диэтилфталат, ацетилтрибутилцитрат, дибутилфталат, дибутилсебацинат и полиэтиленгликоль. В некоторых вариантах осуществления пластификатором является полиэтиленгликоль.
Примеры походящих пигментов включают, но не ограничиваются только ими, диоксид титана, оксиды железа (такие как желтый, коричневый, красный или черный оксиды железа) и сульфат бария.
Фармацевтическая композиция может находиться в форме, которая является походящей для перорального введения, для парентеральной инъекции (включая внутривенную, подкожную, внутримышечную и внутрисосудистую инъекцию), для местного введения или для ректального введения. В предпочтительном варианте осуществления фармацевтическая композиция находится в форме, которая является походящей для перорального введения, такой как таблетка или капсула.
Доза, необходимая для терапевтического или профилактического лечения, зависит от пути введения, тяжести заболевания, возраста и массы тела пациента и других факторов, обычно учитывающихся лечащим врачом при определении подходящего режима и дозы для конкретного пациента.
Количество вводимого соединения меняется для пациента, подвергающегося лечению, и может меняться от примерно 1 мкг/кг массы тела до примерно 50 мг/кг массы тела в сутки. Разовая дозированная форма, такая как таблетка или капсула, обычно содержит от примерно 1 до примерно 250 мг активного ингредиента, например, от примерно 1 до примерно 100 мг или, например, от примерно 1 до примерно 50 мг или, например, от примерно 1 до примерно 20 мг, например, примерно 2,5 мг или примерно 5 мг, или примерно 10 мг, или примерно 15 мг. Суточную дозу можно вводить в виде одной дозы или разделить на две, три или большее количество разовых доз. Перорально вводимая суточная доза модулятора желчных кислот предпочтительно равна от примерно 0,1 до примерно 250 мг, более предпочтительно от примерно 1 до примерно 100 мг, например, от примерно 1 до примерно 5 мг, например, от примерно 1 до примерно 10 мг, например, от примерно 1 до примерно 15 мг, или, например, от примерно 1 до примерно 20 мг.
Другим объектом настоящего изобретения является соединение формулы (I) или его фармацевтически приемлемая соль для применения в качестве лекарственного средства. Настоящее изобретение также относится к применению соединения формулы (I) или его фармацевтически приемлемой соли в качестве лекарственного средства.
Другим объектом настоящего изобретения является соединение формулы (I) или его фармацевтически приемлемая соль для применения для лечения или предупреждения любого из заболеваний, указанных в настоящем изобретении. Настоящее изобретение также относится к применению соединения формулы (I) или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения или предупреждения любого из заболеваний, указанных в настоящем изобретении. Настоящее изобретение также относится к способу лечения или предупреждения любого из заболеваний, указанных в настоящем изобретении, у субъекта, такого как человек, включающему введение субъекту, нуждающемуся в таком лечении или предупреждении, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли.
Комбинированная терапия
В одном объекте настоящего изобретения соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации по меньшей мере с одним другим терапевтически активным средством, например, с одним, двумя, тремя или большим количеством других терапевтически активных средств. Соединение формулы (I) или его фармацевтически приемлемая соль и по меньшей мере одно другое терапевтически активное средство можно вводить одновременно, последовательно или по отдельности. Терапевтически активные средства, которые являются подходящими для комбинации с соединениями формулы (I) включают, но не ограничиваются только ими, известные активные средства, которые применимы для лечения любых из указанных выше патологических состояний, нарушений и заболеваний.
В одном варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с другим ингибитором ASBT. Походящие ингибиторы ASBT раскрыты в WO 93/16055, WO 94/18183, WO 94/18184, WO 96/05188, WO 96/08484, WO 96/16051, WO 97/33882, WO 98/03818, WO 98/07449, WO 98/40375, WO 99/35135, WO 99/64409, WO 99/64410, WO 00/47568, WO 00/61568, WO 00/38725, WO 00/38726, WO 00/38727, WO 00/38728, WO 00/38729, WO 01/66533, WO 01/68096, WO 02/32428, WO 02/50051, WO 03/020710, WO 03/022286, WO 03/022825, WO 03/022830, WO 03/061663, WO 03/091232, WO 03/106482, WO 2004/006899, WO 2004/076430, WO 2007/009655, WO 2007/009656, WO 2011/137135, DE 19825804, EP 864582, EP 489423, EP 549967, EP 573848, EP 624593, EP 624594, EP 624595, EP 624596, EP 0864582, EP 1173205 и EP 1535913, которые все во всей своей полноте включены в настоящее изобретение в качестве ссылки.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации со связующим для желчных кислот (также называющимся секвестрантом желчных кислот или смолой), таким как колесевелам, холестирамин или холестипол. В предпочтительном варианте осуществления такой комбинации связующее для желчных кислот готовят для высвобождения в толстой кишке. Примеры таких препаратов раскрыты в например, WO 2017/138877, WO 2017/138878, WO 2019/032026 и WO 2019/032027, которые все во всей своей полноте включены в настоящее изобретение в качестве ссылки.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором DPP-IV, включая глиптины, такие как ситаглиптин, вилдаглиптин, саксаглиптин, линаглиптин, гемиглиптин, анаглиптин, тенелиглиптин, алоглиптин, трелаглиптин, омариглиптин, эвоглиптин, гозоглиптин и дутоглиптин или его фармацевтически приемлемой солью.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором HMG CoA редуктазы, таким как флувастатин, ловастатин, правастатин, симвастатин, аторвастатин, питавастатин церивастатин, мевастатин, розувастатин, бервастатин или далвастатин, или его фармацевтически приемлемой солью.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором всасывания холестерина, таким как эзетимиб, или его фармацевтически приемлемой солью.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с агонистом PPAR альфа, включая фибраты, такие как клофибрат, безафибрат, ципрофибрат, clinofribrate, клофибрид, фенофибрат, гемфиброзил, ронифибрат и симфибрат, или его фармацевтически приемлемая соль.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с агонистом PPAR гамма, включая тиазолидиндионы, такие как пиоглитазон, росиглитазон и лобеглитазон, или его фармацевтически приемлемую соль.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с двойным агонистом PPAR альфа/гамма, включая глитазары, такие как сароглитазар, алеглитазар, мураглитазар или тезаглитазар, или его фармацевтически приемлемую соль.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с двойным агонистом PPAR альфа/дельта, таким как элафибранор.
В еще одном варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с агонистом pan PPAR (т. е. агонистом PPAR, который обладает активностью по отношению ко всем подтипам: α, γ и δ), таким как IVA337.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с модуляторами фарнезоидного рецептора X (FXR), включая агонисты FXR, такие как кафестол, хенодезоксихолевая кислота, 6α-этилхенодезоксихолевая кислота (обетихолевая кислота; INT-747), фексарамин, тропифексор, цилофексор и MET409.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с модулятором рецептора TGR5, включая агонисты TGR5, такие как 6α-этил-23(S)-метилхолевая кислота (INT-777).
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с двойным агонистом FXR/TGR5, таким как INT-767.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с урсодезоксихолевой кислотой (UDCA). В еще одном варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с норурсодезоксихолевой кислотой (nor-UDCA).
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с FGF19 модулятором, таким как NGM282.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с агонистом FGF21, таким как BMS-986036.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором интегрина, таким как PLN-74809 и PLN-1474.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором CCR2/CCR5, таким как ценикривирок.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором каспазы-протеазы, таким как эмриказан.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором галектина-3, таким как GR-MD-02.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором стеароил-CoA десатуразы (SCD), таким как арамхол (арахидиламидхолановая кислота).
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором регулирующей сигнал апоптоза киназы 1 (ASK1), таким как селонсертиб.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором LOXL2, таким как симтузумаб.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором ACC, таким как GS-0976.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с агонистом рецептора-β тиреоидного гормона, таким как MGL3196.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с агонистом GLP-1, таким как лираглутид.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с двойными агонистами глюкагоноподобного пептида и глюкагонового рецептора, такими как SAR425899.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором носителя митохондриального пирувата, таким как MSDC-0602K.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с антиоксидантом, таким как витамин E.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором SGLT1, ингибитором SGLT2 или двойным ингибитором SGLT1 и SGLT2. Примерами таких соединений являюися дапаглифлозин, сотаглифлозин, канаглифлозин, эмпаглифлозин, LIK066 и SGL5213.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором диацилглицерин-O-ацилтрансферазы 2 (DGAT2), таким как DGAT2RX и PF-06865571.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором синтазы жирной кислоты (FASN), таким как TVB-2640.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с активатором AMP-активированной протеинкиназы (AMPK), таким как PXL-770.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с антагонистом глюкокортикоидного рецептора (GR), антагонистом минералокортикоидного рецептора (MR) или двойным антагонистом GR/MR. Примерами таких соединений are MT-3995 и CORT-118335.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с антагонистом каннабиноидного рецептора 1 (CB1), таким как IM102.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с Klothoβ (KLB) и активатором рецептора фибробластного фактора роста (FGFR), таким как MK-3655 (ранее известный, как NGM-313).
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором хемокинового (мотив c-c) лиганда 24 (CCL24), таким как CM101.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с антагонистом A3, таким как PBF-1650.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с антагонистом рецептора P2×7, таким как SGM 1019.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с агонистами рецептора P2Y13, такими как CER-209.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с сульфированным оксистеролом, таким как Дур-928.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с антагонистом лейкотриенового рецептора D4 (LTD4), таким как MN-001.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибиторомприродного киллера типа 1 T-клеток (NKT1), таким как GRI-0621.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с антилипополисахаридом (LPS), таким как IMM-124E.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором VAP1, таким как BI1467335.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с агонистом A3 аденозинового рецептора, таким как CF-102.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с активатором SIRT-1, таким как NS-20.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с агонистом рецептора никотиновой кислоты 1, таким как ARI-3037MO.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с антагонистом TLR4, таким как JKB-121.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором кетогексокиназы, таким как PF-06835919.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с агонистом адипонектинового рецептора, таким как ADP-335.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором аутотоксина, таким как PAT-505 и PF8380.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с антагонистом хемокинового (мотив c-c) рецептора 3 (CCR3), таким как бертилимумаб.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации со стимулятором хлоридных каналов, таким как кобипростон и лубипростон.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором белка теплового шока 47 (HSP47), таким как ND-L02-s0201.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором фактора транскрипции стеринового регуляторного элемента-связывающего белка (SREBP), таким как CAT-2003 и MDV-4463.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с бигуанидином, таким как метформин.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с инсулином.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором гликогенфосфорилазы и/или ингибитором глюкоза-6-фосфатазы.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с сульфонилмочевиной, такой как глипизид, глибенкламид и глимепирид.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с меглитинидом, таким как репаглинид, натеглинид и ормиглитинид.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором глюкозидазы, таким как акарбоза или миглитол.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором скваленсинтазы, таким как TAK-475.
В другом варианте осуществления соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором PTPB1, таким как тродусквемин, эртипротафиб, JTT-551 и кларамин.
Получение соединений
Соединения формулы (I) можно получить в виде свободной кислоты или ее фармацевтически приемлемой соли по методикам, описанным ниже. Применительно к последующему описанию таких методик следует понимать, что, если это целесообразно, походящие защитные группы можно вводить и затем удалять из разных реагентов и промежуточных продуктов таким образом, как известно специалисту в области органического синтеза. Обычные методики использования таких защитных групп, а также примеры походящих защитных групп описаны, например, в Greene’s Protective Groups in Organic Synthesis by P.G.M Wutz и T.W. Greene, 4th Edition, John Wiley & Sons, Hoboken, 2006.
Общие методики
Все использованные растворители были чистыми для анализа. Для проведения реакций обычно использовали имеющиеся в продаже безводные растворители. Исходные вещества приобретали в коммерческих источниках или получали в соответствии с описанными в литературе методиками. 7-Бром-3,3-дибутил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид и 3,3-дибутил-8-гидрокси-7-(метилтио)-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид получали, как описано в WO 02/50051 (методика 26). 7-Бром-3-бутил-3-этил-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид можно получить, как описано в WO 96/16051 (пример 21). 3,3-Дибутил-7-хлор-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид можно получить, как описано в WO 02/08211 (пример 35). 7-Бром-3,3-дибутил-8-метокси-2-(4-метоксибензил)-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1,1-диоксид и 3,3-дибутил-8-гидрокси-2-(4-метоксибензил)-7-(метилтио)-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1,1-диоксид можно получить, как описано в WO 03/022286 (методики 23 и 24 соответственно). Комнатная температура представляет собой 20-25°C. Составы смесей растворителей приведены в процентах по объему или в объемных отношениях.
LCMS:
Название прибора: Agilent 1290 infinity II.
Методика A: Подвижная фаза: A: 0,1% HCOOH в воде: ACN (95:5), B: ACN; скорость потока: 1,5 мл/мин; колонка: ZORBAX XDB C-18 (50×4,6 мм) 3,5 мкМ.
Методика B: Подвижная фаза: A: 10 мМ NH4HCO3 в воде, B: ACN; скорость потока: 1,2 мл/мин; колонка: XBridge C8 (50×4,6 мм), 3,5 мкМ.
Методика C: Подвижная фаза: A: 0,1% HCOOH в воде: ACN (95:5), B: ACN; скорость потока: 1,5 мл/мин; колонка: ATLANTIS dC18 (50×4,6 мм), 5 мкМ.
Методика D: Подвижная фаза: A: 10 мМ NH4OAc в воде, B: ACN; скорость потока: 1,2 мл/мин; колонка: Zorbax Extend C18 (50×4,6 мм) 5 мкМ.
Методика E: Подвижная фаза: A: 0,1% TFA в воде: ACN (95:5), B: 0,1% TFA в ACN; скорость потока: 1,5 мл/мин; колонка: XBridge C8 (50×4,6 мм), 3,5 мкМ.
UPLC:
Название прибора: waters Acquity I Class
Методика A: Подвижная фаза: A: 0,1% HCOOH в воде, B: 0,1% HCOOH в ACN; Скорость потока: 0,8 мл/мин; колонка: Acquity UPLC HSS T3 (2,1×50) мм; 1,8 мкм.
HPLC:
Название прибора: Приборы серии Agilent 1260 Infinity II, указанные ниже, с определение содержания в% путем УФ детектирования (maxplot).
Методика A: Подвижная фаза: A: 10 мМ NH4HCO3 в воде, B: ACN; скорость потока: 1,0 мл/мин; колонка: XBridge C8 (50×4,6 мм, 3,5 мкм).
Методика B: Подвижная фаза: A: 0,1% TFA в воде, B: 0,1% TFA в ACN; скорость потока: 2,0 мл/мин; колонка: XBridge C8 (50×4,6 мм, 3,5 мкм).
Методика C: Подвижная фаза: A: 10 мМ NH4OAc в воде Milli-q, B: ACN; скорость потока:1,0 мл/мин; колонка: Phenomenex Gemini C18 (150×4,6 мм, 3,0 мкм).
Хиральная SFC:
Название прибора: THAR-SFC 80 и THAR-SFC 200 (аналитический)
Отношение количества CO2 к количеству сорастворителя в диапазоне от 60:40 до 80:20
Методика A: Подвижная фаза: 0,5% изопропиламина в IPA; скорость потока: 3 мл/мин; колонка: YMC Amylose-SA (250×4,6 мм, 5 мкм).
Методика B: Подвижная фаза: 0,5% изопропиламина в IPA; скорость потока: 3 мл/мин; колонка: Chiralpak AD-H (250×4,6 мм, 5 мкм).
Методика C: Подвижная фаза: 20 мМ аммиак в метаноле; скорость потока: 3 мл/мин; колонка: YMC Cellulose-SC (250×4,6 мм, 5 мкм).
Методика D: Подвижная фаза: метанол; скорость потока: 3 мл/мин; колонка: Lux A1 (250×4,6 мм, 5 мкм).
Методика E: Подвижная фаза: 0,5% изопропиламина в метаноле; скорость потока: 5 мл/мин; колонка: Lux C4.
Методика F: Подвижная фаза: 0,5% изопропиламина в метаноле; скорость потока: 3 мл/мин; колонка: YMC Cellulose-SC (250×4,6 мм, 5 мкм).
Методика G: Подвижная фаза: 0,5% изопропиламина в метаноле; скорость потока: 3 мл/мин; колонка: Lux A1 (250×4,6 мм, 5 мкм).
Методика H: Подвижная фаза: 0,5% изопропиламина в IPA; скорость потока: 3 мл/мин; колонка: Lux A1 (250×4,6 мм, 5 мкм).
Методика I: Подвижная фаза: 0,5% изопропиламина в метаноле; скорость потока: 3 мл/мин; колонка: Chiral CCS (250×4,6 мм, 5 мкм).
Prep-HPLC:
Название прибора: Agilent 1290 Infinity II
Методика A: Подвижная фаза: A: 0,1% TFA в воде; Подвижная фаза; B: 0,1% TFA в CAN; скорость потока: 2,0 мл/мин; колонка: X-Bridge C8 (50×4,6 мм, 3,5 мкМ).
Методика B: Подвижная фаза: A: 10 мМ NH4OAc в воде; B: ACN; скорость потока: 35 мл/мин; колонка: X select C18 (30×150 мм, 5 мкм).
Методика C: Подвижная фаза: A: 10 мМ NH4HCO3 в воде; B: ACN; скорость потока: 1,0 мл/мин; колонка: XBridge C8 (50×4,6 мм, 3,5 мкм).
Методика D: Подвижная фаза: A: 0,1% HCOOH в воде; B: ACN; скорость потока: 1,0 мл/мин; колонка: X-select C18 (30×150 мм, 5 мкм).
Хиральная препаративная SFC:
Название прибора: PIC SFC 100/PIC SFC 400
Отношение количества CO2 к количеству сорастворителя в диапазоне от 60:40 до 80:20
Методика A: Подвижная фаза: 0,5% изопропиламина в IPA; скорость потока: 3 мл/мин; колонка: YMC Amylose-SA (250×30 мм, 5 мкм).
Методика B: Подвижная фаза: 0,5% изопропиламина в IPA; скорость потока: 3 мл/мин; колонка: Chiralpak AD-H (250×30 мм, 5 мкм).
Методика C: Подвижная фаза: 20 мМ аммиак в метаноле; скорость потока: 3 мл/мин; колонка: YMC Cellulose-SC (250×30 мм, 5 мкм).
Методика D: Подвижная фаза: метанол; скорость потока: 3 мл/мин; колонка: Chiral CCS (250×30 мм, 5мкм).
Методика E: Подвижная фаза: метанол; скорость потока: 3 мл/мин; колонка: Lux A1 (250×30 мм, 5мкм).
Методика F: Подвижная фаза: 0,5% изопропиламина в IPA; скорость потока: 3 мл/мин; колонка: Lux A1 (250×30 мм, 5мкм).
Методика G: Подвижная фаза: 0,5% изопропиламина в метаноле; скорость потока: 3 мл/мин; колонка: Chiral CCS (250×30 мм, 5 мкм).
Аббревиатуры
Ниже настоящее изобретение описано с помощью представленных примеров, которые никоим образом не ограничивают настоящее изобретение. Все цитированные документы и литература, указанные в настоящем изобретении, во всей своей полноте включены в настоящее изобретение в качестве ссылки.
ПРИМЕРЫ
Промежуточный продукт 1
Этил-(E)-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат и этил-(Z)-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат

При перемешивании к раствору 3,3-дибутил-8-гидрокси-7-(метилтио)-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (4 г, 8,93 ммоля) в сухом DMF (50 мл) добавляли этил-(E)-3-бромакрилат (2,4 г, 13,4 ммоля), карбонат калия (2,46 г, 17,87 ммоля) и тетра-бутилбромид аммония (0,287 г, 0,89 ммоля) при комнатной температуре и реакционную смесь нагревали при 90°C в течение 12 ч. После завершения реакции (следили с помощью TLC) реакционную смесь выливали в охлажденную льдом воду и экстрагировали с помощью EtOAc (3×25 мл). Объединенный органический слой промывали рассолом (50 мл), сушили над безводным Na2SO4 и концентрировали в вакууме и получали искомое соединение в виде смеси (E)- и (Z)-изомеров (отношение 1,7:1). Эту смесь разделяли с помощью препаративной HPLC (методика A) и получали первую элюирующуюся фракцию, соответствующую (Z)-изомеру и вторую элюирующуюся фракцию, соответствующую (E)-изомеру, с общим выходом 73%.
(E)-изомер: Выход: 39% (1,9 г, белое твердое вещество).1H NMR (400 MHz, DMSO-d6): δ 7,72 (d, J=16,0 Hz, 1H), 7,48 (s, 1H), 7,32-7,27 (m, 2H), 7,19-7,16 (m, 2H), 7,02-6,97 (m, 1H), 6,63 (s, 1H), 5,48 (d, J=16,0 Hz, 1H), 4,14-4,07 (m, 2H), 3,75 (bs, 2H), 3,36 (s, 2H), 2,14 (s, 3H), 1,40-1,31 (m, 4H), 1,27-1,08 (m, 11H), 0,75-0,73 (m, 6H). LCMS: (методика C) 546,1 (M+H), Rt. 3,47 мин, 97,89% (максимально)
(Z)-изомер: Выход: 34% (1,65 г, белое твердое вещество).1H NMR (400 MHz, DMSO-d6): δ 7,47 (s, 1H), 7,32-7,28 (m, 2H), 7,20-7,19 (m, 2H), 7,16-7,14 (m, 1H), 7,01-6,97 (m, 1H), 6,66 (s, 1H), 5,26 (d, J=8,0 Hz, 1H), 4,13-4,08 (m, 2H), 3,75 (bs, 2H), 3,33 (s, 2H), 2,18 (s, 3H), 1,43-1,36 (m, 2H), 1,33-1,30 (m, 2H), 1,22 (m, 3H), 1,10-0,98 (m, 8H), 0,76-0,73 (m, 6H). LCMS: (методика C) 546,1 (M+H), Rt. 3,34 мин, 98,32% (максимально).
Промежуточный продукт 2
(E)-3-((3,3-дибутил-7-(метилтио)-5-(4-нитрофенил)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота

При перемешивании к раствору (E)-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловой кислоты (пример 1; 1,0 г, 1,93 ммоля) в смеси 1:1 DCM и AcOH (10 мл) при 0°C по каплям добавляли HNO3 (65%, 0,183 г, 2,90 ммоля) в смеси DCM и AcOH (5 мл). После завершения реакции (следили с помощью TLC) реакционную смесь разбавляли с помощью DCM и органический слой промывали водой (30 мл) и насыщенным раствором NaHCO3 (30 мл). Органический слой сушили над безводным Na2SO4 и концентрировали в вакууме и получали искомое соединение. Неочищенное соединение направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 92% (1 г, неочищенное коричневое твердое вещество).
1H NMR (400 MHz, CDCl3): δ 8,14 (d, J=9,2 Hz, 2H), 7,82 (d, J=12,0 Hz, 1H), 7,75 (s, 1H), 6,94 (s, 1H), 6,91 (d, J=8,4 Hz, 2H), 5,69 (d, J=12,0 Hz, 1H), 3,78 (s, 2H), 3,20 (s, 2H), 2,35 (s, 3H), 1,38-1,24 (m, 12H), 0,89 (t, J=6,4 Hz, 6H). LCMS: (методика A) 562,0 (M+H), Rt. 2,73 мин, 98,4% (максимально). HPLC: (методика A) Rt. 5,67 мин, 99,3% (максимально).
Промежуточный продукт 3
Этил-(E)-3-((7-бром-3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат и этил-(Z)-3-((7-бром-3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат
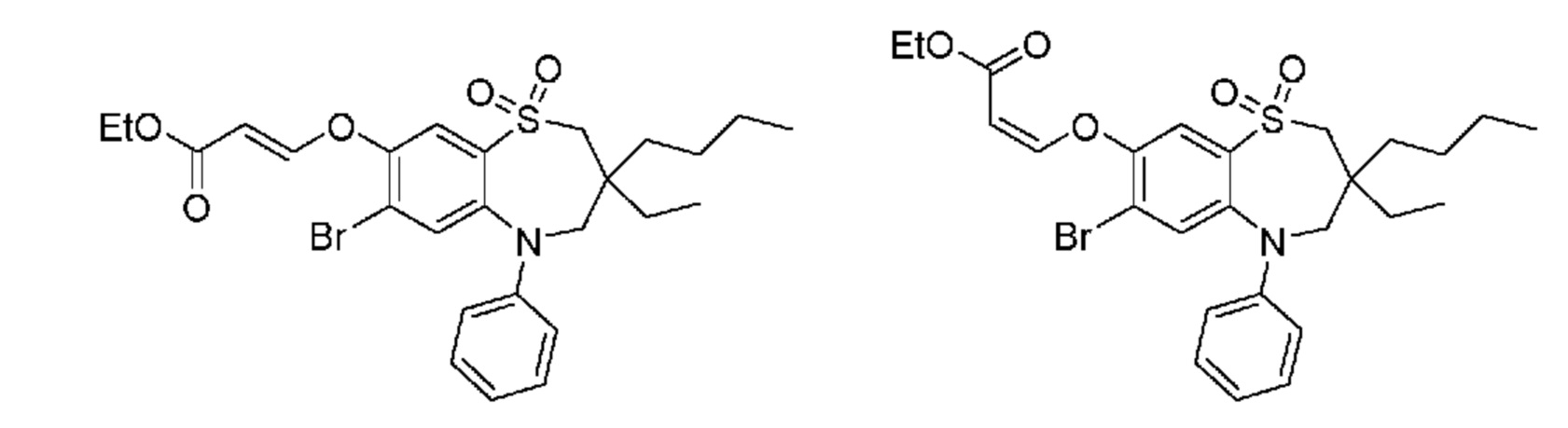
При перемешивании к раствору 7-бром-3-бутил-3-этил-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (0,5 г, 1,1 ммоля) в сухом DMF (20 мл) добавляли этил-(E)-3-бромакрилат (0,59 г, 3,3 ммоля), карбонат натрия (0,35 г, 3,3 ммоля) и тетра-бутилбромид аммония (0,035 г, 0,1 ммоля) при комнатной температуре и реакционную смесь нагревали при 85-90°C в течение 5 ч. После завершения реакции (следили с помощью TLC) реакционную смесь выливали в охлажденную льдом воду и экстрагировали с помощью EtOAc (3×15 мл). Объединенный органический слой промывали рассолом (20 мл), сушили над безводным Na2SO4 и концентрировали в вакууме и получали неочищенное искомое соединение в виде смеси (E)- и (Z)-изомеров (отношение 1:1). Смесь очищали с помощью колоночной хроматографии Isolera (элюент: 8-9% EtOAc/PE; Силикагель: 230-400 меш) и получали первую элюирующуюся фракцию, соответствующую (E)-изомеру, и вторую элюирующуюся фракцию, соответствующую (Z)-изомеру.
(E)-изомер: Выход: 32% (0,28 г, почти белое твердое вещество).1H NMR (400 MHz, DMSO-d6): δ 7,80 (d, J=12,2 Hz, 1H), 7,66 (s, 1H), 7,38-7,25 (m, 4H), 7,10-7,04 (m, 2H), 5,47 (d, J=12,3 Hz, 1H), 4,13 (q, J=7,1 Hz, 2H), 3,81-3,78 (m, 2H), 3,46 (s, 2H), 1,54-1,50 (m, 1H), 1,43-1,30 (m, 3H), 1,21 (t, J=7,08 Hz, 3H), 1,12-0,98 (m, 4H), 0,74-0,71 (m, 6H). LCMS: (методика A) 552,1 (M+ 2), Rt. 3,33 мин, 97,8% (максимально).
(Z)-изомер: Выход: 41% (0,23 г, почти белое твердое вещество).1H NMR (400 MHz, DMSO- d6): δ 7,60 (s, 1H), 7,37-7,31 (m, 2H), 7,21-7,19 (m, 3H), 7,07-7,03 (m, 2H), 5,32 (d, J=6,9 Hz, 1H), 4,11 (q, J=6,9 Hz, 2H), 3,78-3,74 (m, 2H), 3,42-3,38 (m, 2H), 1,51-1,29 (m, 4H), 1,22 (t, J=7,2 Hz, 3H), 1,08-1,01 (m, 4H), 0,73-0,71 (m, 6H). LCMS: (методика A) 552,1(M+ 2), Rt. 3,18 мин, 98,2% (максимально).
Промежуточный продукт 4
3,3-Дибутил-7-циклопропил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид
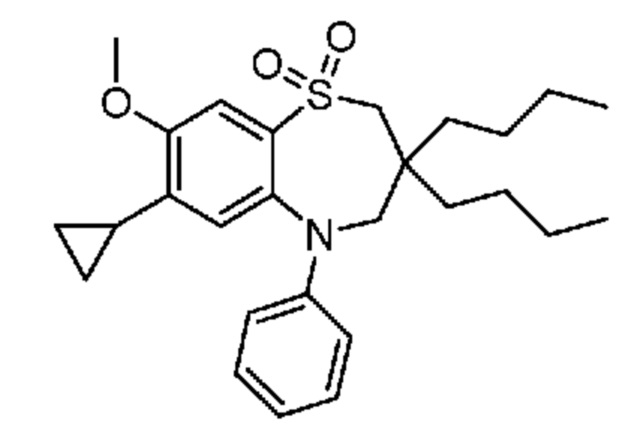
При перемешивании к раствору 7-бром-3,3-дибутил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (3 г, 6,1 ммоля) в смеси толуола и воды (30 мл, 9:1) добавляли 2-циклопропил-4,4,5,5-тетраметил-1,3,2-диоксаборолан (2,04 г, 12,1 ммоля) и K3PO4 (3,86 г, 18,0 ммоля) и реакционную смесь дегазировали с помощью N2 в течение 10 мин. Затем добавляли Pd(dppf)Cl2 DCM (0,25 г, 0,3 ммоля) и реакционную смесь нагревали при 85°C в течение ночи. После завершения реакции (следили с помощью TLC) реакционную массу фильтровали через целит, промывали с помощью EtOAc и объединенную органическую часть концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (5-8% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 99% (3 г, неочищенное желтое смолообразное вещество).
LCMS: (методика A) 456,2 (M+H), Rt. 3,58 мин, 92,56% (максимально).
Промежуточный продукт 5
3,3-Дибутил-7-циклопропил-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид

При перемешивании к раствору 3,3-дибутил-7-циклопропил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида(промежуточный продукт 4; 3 г, 6,6 ммоля) в DCM (30 мл) при 0°C по каплям добавляли BBr3 (3,2 мл, 33,0 ммоля) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. После завершения реакции (следили с помощью TLC) реакционную смесь охлаждали до 0°C. По каплям добавляли EtOAc (10 мл) и охлажденную льдом воду (5 мл) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Затем реакционную смесь подвергали распределению между водой (15 мл) и DCM (15 мл) и водный слой экстрагировали с помощью DCM (3×15 мл). Объединенную органическую часть промывали рассолом (15 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 20-23% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 69% (2 г, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 10,04 (s, 1H), 7,34 (s, 1H), 7,18-7,14 (m, 2H), 6,88-6,86 (m, 2H), 6,80-6,78 (m, 1H), 6,40 (s, 1H), 3,61 (s, 2H), 3,18 (s, 2H), 2,08-2,04 (m, 1H), 1,41-1,31 (m, 4H), 1,20-1,06 (m, 8H), 0,88-0,86 (m, 2H), 0,79-0,77 (m, 6H), 0,44-0,43 (m, 2H). LCMS: (методика A) 442,1 (M+H), Rt. 3,22 мин, 92,53% (максимально).
Промежуточный продукт 6
Этил-(E)-3-((3,3-дибутил-7-циклопропил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат и этил-(Z)-3-((3,3-дибутил-7-циклопропил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат

При перемешивании к раствору 3,3-дибутил-7-циклопропил-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 5; 2 г, 4,5 ммоля) в сухом толуоле (20 мл) добавляли этил-(E)-3-бромакрилат (1,22 г, 6,8 ммоля), Na2CO3 (0,96 г, 9,0 ммоля) и тетра-бутилбромид аммония (0,13 г, 0,4 ммоля) при комнатной температуре и реакционную смесь нагревали при 85°C в течение ночи. После завершения реакции (следили с помощью TLC) реакционную смесь выливали в охлажденную льдом воду и экстрагировали с помощью EtOAc (3×15 мл). Объединенный органический слой промывали рассолом (20 мл), сушили над безводным Na2SO4 и концентрировали в вакууме и получали неочищенное вещество. Полученный материал, который содержал (E)- и (Z)-изомеры в отношении 1:1, очищали с помощью колоночной хроматографии Isolera (элюент: 10-12% EtOAc/PE; силикагель: 230-400 меш). Полученную смесь дополнительно очищали с помощью препаративной HPLC (методика A) и получали первую элюирующуюся фракцию, соответствующую (Z)-изомеру, и вторую элюирующуюся фракцию, соответствующую (E)-изомеру.
(Z)-изомер: Выход: 26% (0,65 г, почти белое смолообразное вещество).1H NMR (400 MHz, DMSO-d6): δ 7,47 (s, 1H), 7,28-7,24 (m, 3H), 7,07-7,06 (m, 2H), 6,96-6,93 (m, 1H), 6,42 (s, 1H), 5,24 (d, J=6,8 Hz, 1H), 3,70 (s, 2H), 3,26 (s, 2H), 2,12-2,11 (m, 1H), 1,41-1,39 (m, 2H), 1,33-1,30 (m, 2H), 1,10-1,07 (m, 5H), 1,00-0,95 (m, 4H), 0,76-0,72 (m, 6H), 0,51-0,50 (m, 2H). LCMS: (методика A) 540,3 (M+H), Rt. 3,51 мин, 98,18% (максимально).
(E)-изомер: Выход: 12% (0,29 г, почти белое смолообразное вещество).1H NMR (400 MHz, DMSO-d6): δ 7,81 (d, J=12,3 Hz, 1H), 7,47 (s, 1H), 7,29-7,26 (m, 2H), 7,13-7,10 (m, 2H), 6,99-6,95 (m, 1H), 6,39 (s, 1H), 5,44 (d, J=12,2 Hz, 1H), 4,14-4,10 (m, 2H), 3,72 (s, 2H), 3,16 (s, 2H), 1,94-1,91 (m, 1H), 1,41-1,31 (m, 4H), 1,22-1,18 (m, 4H), 1,09-1,07 (m, 6H), 1,01-0,89 (m, 3H), 0,75-0,74 (m, 6H), 0,43-0,41 (m, 2H). LCMS: (методика A) 540,3 (M+H), Rt. 3,65 мин, 97,68% (максимально).
Промежуточный продукт 7
3,3-Дибутил-7-(диметиламино)-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид

При перемешивании к раствору 7-бром-3,3-дибутил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (0,8 г, 1,6 ммоля) в толуоле (8 мл), диметиламин (2M в THF; 2,4 мл, 4,8 ммоля) добавляли Cs2CO3 (1,31 г, 4,0 ммоля) и реакционную смесь дегазировали с помощью N2 в течение 10 мин. Затем добавляли Pd(OAc)2 (0,036 г, 0,16 ммоля) и XPhos (0,077 г, 0,16 ммоля) и реакционную смесь нагревали при 90°C в течение ночи. После завершения реакции (следили с помощью TLC) реакционную смесь фильтровали через целит и промывали с помощью EtOAc. Объединенную органическую часть концентрировали в вакууме и получали неочищенное вещество, которое очищали с помощью колоночной хроматографии Isolera (элюент: 13-15% EtOAc/PE, силикагель: 230-400 меш) и получали искомое соединение. Выход: 54% (0,4 г, желтое смолообразное вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,27 (s, 1H), 7,23-7,19 (m, 2H), 7,00-6,98 (m, 2H), 6,86-6,82 (m, 1H), 6,32 (s, 1H), 3,85 (s, 3H), 3,65 (s, 2H), 3,20 (s, 2H), 2,66 (s, 6H), 1,40-1,32 (m, 4H), 1,20-1,12 (m, 8H), 0,79-0,72 (m, 6H). LCMS: (методика A) 459,3 (M+H), Rt. 3,40 мин, 92,77% (максимально).
Промежуточный продукт 8
3,3-Дибутил-7-(диметиламино)-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид

При перемешивании к раствору 3,3-дибутил-7-(диметиламино)-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 7; 0,4 г, 0,87 ммоля) в DCM (4 мл) при 0°C по каплям добавляли BBr3 (0,42 мл, 4,3 ммоля) и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. После завершения реакции (следили с помощью TLC) реакционную массу охлаждали до 0°C. Реакцию останавливали путем проводимого по каплям добавления метанола (5 мл) и затем добавляли охлажденную льдом воду (10 мл). Водный слой экстрагировали с помощью DCM (2×15 мл), промывали рассолом (10 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и получали неочищенное вещество, которое очищали с помощью колоночной хроматографии Isolera (элюент: 15-18% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 66% (0,33 г, желтое смолообразное вещество).
1H NMR (400 MHz, DMSO-d6): δ 9,83 (s, 1H), 7,28 (s, 1H), 7,20-7,16 (m, 2H), 6,94-6,92 (m, 2H), 6,81-6,79 (m, 1H), 6,31 (s, 1H), 3,62 (s, 2H), 3,14 (s, 2H), 2,66 (s, 6H), 1,34-1,24 (m, 4H), 1,16-1,06 (m, 8H), 0,85-0,77 (m, 6H). LCMS: (методика A) 445,2 (M+H), Rt. 3,10 мин, 81,86% (максимально)
Промежуточный продукт 9
Этил-(E)-3-((3,3-дибутил-7-(диметиламино)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат и этил-(Z)-3-((3,3-дибутил-7-(диметиламино)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат

При перемешивании к раствору 3,3-дибутил-7-(диметиламино)-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 8; 2 г, 4,5 ммоля) в толуоле (20 мл) добавляли этил-(E)-3-бромакрилат (1,22 г, 6,8 ммоля), карбонат натрия (0,96 г, 9,0 ммоля) и тетра-бутилбромид аммония (0,13 г, 0,4 ммоля) и полученную смесь нагревали при 85°C в течение 14 ч. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и полученный остаток растворяли в EtOAc (25 мл). Органический слой промывали водой (15 мл), рассолом (15 мл), сушили над безводным Na2SO4, фильтровали и затем концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 30% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение в виде смеси (E)- и (Z)-изомеров. Полученную смесь дополнительно очищали с помощью препаративной HPLC (методика B) и получали первую элюирующуюся фракцию, соответствующую (Z)-изомеру и вторую элюирующуюся фракцию, соответствующую (E)-изомеру.
(Z)-изомер: Выход: 13% (0,05 г, белое смолообразное твердое вещество).1H NMR (300 MHz, DMSO-d6): δ 7,36 (s, 1H), 7,30-7,25 (m, 2H), 7,14-7,12 (m, 2H), 7,02 (d, J=6,9 Hz, 1H), 6,98-6,95 (m, 1H), 6,25 (s, 1H), 5,20 (d, J=6,9 Hz, 1H), 4,13-4,06 (m, 2H), 3,71 (s, 2H), 3,26 (s, 2H), 2,71 (s, 6H), 1,41-1,32 (m, 4H), 1,20 (t, J=7,20 Hz, 3H), 1,10-1,01 (m, 8H), 0,76-0,72 (m, 6H). LCMS: (методика A) 543,3 (M+H), Rt. 3,52 мин, 87,35% (максимально).
(E)-изомер: Выход: 20% (0,08 г, белое смолообразное твердое вещество). LCMS: (методика A) 543,3 (M+H), Rt. 3,65 мин, 95,73% (максимально).
Промежуточный продукт 10
Метил-(Z)-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилат

При перемешивании к раствору 3,3-дибутил-8-гидрокси-7-(метилтио)-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (12,0 г, 26,80 ммоля) в DMF (120 мл) при 0°C порциями добавляли 60% NaH (2,6 г, 53,60 ммоля) и реакционную смесь перемешивали в течение 15 мин. Затем по каплям добавляли метил-3-бром-2,2-дифторпропаноат (10,88 г, 53,60 ммоля) и реакционную смесь нагревали при 85°C в течение 16 ч. После завершения реакции (следили с помощью TLC) реакционную массу охлаждали до 0°C, реакцию останавливали с помощью 1,5 н. HCl (pH ~4) и разбавляли охлажденной льдом водой (150 мл). Водную часть экстрагировали с помощью EtOAc (200 мл). Затем органический слой промывали рассолом (150 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и получали неочищенное вещество, которое очищали с помощью колоночной хроматографии Isolera (элюент: 12-13% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 72% (8,2 г, белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,67 (d, J=18,8 Hz, 1H), 7,59 (s, 1H), 7,32-7,30 (m, 2H), 7,16 (d, J=7,6 Hz, 2H), 7,00 (t, J=7,2 Hz, 1H), 6,66 (s, 1H), 3,79 (s, 3H), 3,75 (s, 2H), 3,36 (s, 2H), 2,18 (s, 3H), 1,44-1,30 (m, 4H), 1,11-0,99 (m, 8H), 0,76 (t, J=6,80 Hz, 6H). LCMS: (методика C) 550,1 (M++H), Rt. 3,30 мин, 98,40% (максимально).
Промежуточный продукт 11
3,3-дибутил-8-метокси-5-фенил-7-винил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид
При перемешивании к раствору 7-бром-3,3-дибутил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (1,2 г, 24,2 ммоля) в смеси 1,4-диоксана и воды (13 мл; 12:1) добавляли пинаколиновый эфир винилбороновой кислоты (0,56 г, 36,3 ммоля) и карбонат калия (1,0 г, 72,6 ммоля) и реакционную смесь дегазировали с помощью N2 в течение 10 мин. Затем добавляли Pd(dppf)2Cl2 (0,09 г, 0,12 ммоля) и полученную смесь нагревали при 85°C в течение 16 ч. После завершения реакции (следили с помощью LCMS) реакционную смесь фильтровали через целит. Полученный фильтрат концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 19% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 85% (0,91 г, коричневое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,28 (s, 1H), 7,20-7,13 (m, 2H), 7,09 (s, 1H), 7,00-6,90 (m, 2H), 6,87-6,83 (m, 2H), 5,68 (d, J=17,7 Hz, 1H), 5,34 (d, J=11,3 Hz, 1H), 3,90 (s, 3H), 3,66-3,80 (m, 2H), 3,30 (s, 2H), 2,00-1,31 (m, 4H), 1,18-1,04 (m, 8H), 0,79-0,74 (m, 6H). LCMS: (методика C) 442,1 (M+H), Rt. 3,47 мин, 91,5% (максимально).
Промежуточный продукт 12
3,3-Дибутил-7-этил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид

К дегазированному раствору 3,3-дибутил-8-метокси-5-фенил-7-винил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 11; 0,6 г, 1,35 ммоля) в этаноле (10 мл) добавляли Pd/C (60 мг, 10%) и полученную смесь перемешивали в течение 4 ч. После завершения реакции (следили с помощью LCMS) реакционную смесь фильтровали через целит и промывали этанолом. Полученный фильтрат концентрировали в вакууме и получали искомое соединение. Выход: 91,3% (0,55 г, белое смолообразное твердое вещество).
LCMS: (методика A) 444,2 (M+H), Rt. 3,63 мин, 67,11% (максимально).
Промежуточный продукт 13
3,3-Дибутил-7-этил-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид
При перемешивании к раствору 3,3-дибутил-7-этил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 12; 0,55 г, 1,23 ммоля) в DCM (10 мл) при 0°C по каплям добавляли BBr3 (0,59 мл, 6,19 ммоля) и полученную смесь перемешивали в течение 1 ч. После завершения реакции (следили с помощью TLC) реакцию останавливали метанолом (0,5 мл) и затем добавляли воду (15 мл). Водный слой отделяли, экстрагировали с помощью DCM (2×15 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и получали неочищенное вещество, которое очищали с помощью колоночной хроматографии Isolera (элюент: 40% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 76% (0,4 г, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 9,96 (s, 1H), 7,35-7,32 (m, 1H), 7,30-7,16 (m, 2H), 6,93-6,87 (m, 2H), 6,81-6,77 (m, 2H), 5,79-3,55 (m, 2H), 3,20 (s, 2H), 1,40-1,24 (m, 4H), 1,18-1,14 (m, 10H), 1,10-1,00 (m, 9H). LCMS: (методика A) 430,1 (M+H), Rt. 3,22 мин, 53,5% (максимально).
Промежуточный продукт 14
Этил-(Z)-3-((3,3-дибутил-7-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат и этил-(E)-3-((3,3-дибутил-7-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат

При перемешивании к раствору 3,3-дибутил-7-этил-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 13; 0,4 г, 0,92 ммоля) в смеси толуола (5 мл) и DMF (2 мл) добавляли этил-(E)-3-бромакрилат (0,33 г, 1,86 ммоля), карбонат натрия (0,25 г, 2,32 ммоля) и тетра-бутилбромид аммония (0,03 г, 0,09 ммоля) и полученную смесь нагревали при 85°C в течение 14 ч. После завершения реакции (следили с помощью LCMS) реакционную смесь концентрировали в вакууме и полученный остаток растворяли в EtOAc (25 мл). Органический слой промывали водой (15 мл), рассолом (15 мл), сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 30% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение в виде смеси (E)- и (Z)-изомеров.
(Z)-изомер: Выход: 19,5% (96 мг, почти белое твердое вещество).1H NMR (400 MHz, DMSO-d6): δ 7,51 (s, 1H), 7,34-7,26 (m, 3H), 7,11-7,13 (m, 2H), 7,00-6,94 (m, 1H), 6,85 (s, 1H), 5,25 (d, J=6,8 Hz, 1H), 4,11 (q, J=6,8 Hz, 2H), 3,81-3,61 (m, 2H), 3,37 (s, 2H), 1,51-1,32 (m, 5H), 1,24-1,20 (m, 5H), 1,07-1,03 (m, 8H), 0,77-0,73 (m, 8H). LCMS: (методика D) 528,2 (M+H), Rt. 3,44 мин, 79,78% (максимально).
(E)-изомер: Выход: 24,5% (120 мг, почти белое твердое вещество).1H NMR(400 MHz, DMSO-d6): δ 7,80 (d, J=12,0 Hz, 1H), 7,49 (s, 1H), 7,32-7,28 (m, 2H), 7,17-7,16 (m, 1H), 7,91-6,99 (m, 2H), 6,85 (s, 1H), 5,48 (d, J=12,0 Hz, 1H), 4,15-4,10 (m, 2H), 3,82-3,71 (m, 2H), 3,37 (s, 2H), 1,49-1,31 (m, 4H), 1,27-1,20 (m, 6H), 1,09-1,02 (m, 8H), 1,01-0,99 (m, 8H). LCMS: (методика A) 528,2 (M+H), Rt. 3,7 мин, 74,4% (максимально).
Промежуточный продукт 15
3-бутил-3-этил-8-гидрокси-7-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид
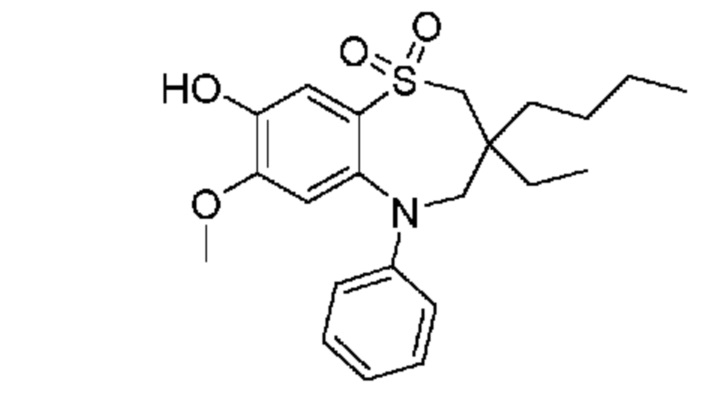
При перемешивании к раствору 7-бром-3-бутил-3-этил-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (1 г, 2,21 ммоля) в метоксиде натрия (21%, 4,42 мл, 4,42 ммоля) добавляли CuBr (0,1 г, 0,31 ммоля) при комнатной температуре и полученную смесь нагревали 6 ч при 85°C. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и полученную неочищенную массу подвергали распределению между EtOAc (25 мл) и водой (25 мл). Водный слой экстрагировали с помощью EtOAc (2×25 мл), объединенный органический слой промывали рассолом (25 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 5% MeOH/DCM; силикагель: 230-400 меш) и получали искомое соединение. Выход: 41% (0,36 г, бледно-розовое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 9,71 (s, 1H), 7,29 (s, 1H), 7,19 (t, J=7,6 Hz, 2H), 6,92 (d, J=8,0 Hz, 2H), 6,80 (t, J=7,6 Hz, 1H), 6,54 (s, 1H), 3,63 (s, 3H), 3,16 (s, 2H), 2,45 (s, 2H), 1,62-1,51 (m, 2H), 1,40-1,31 (m, 2H), 1,28-1,18 (m, 4H), 0,78-0,74 (m, 6H). LCMS: (методика A) 404,2 (M+H), Rt. 2,64 мин, 94,56% (максимально).
Промежуточный продукт 16
Этил-(E)-3-((3-бутил-3-этил-7-метокси-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат и этил-(Z)-3-((3-бутил-3-этил-7-метокси-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат
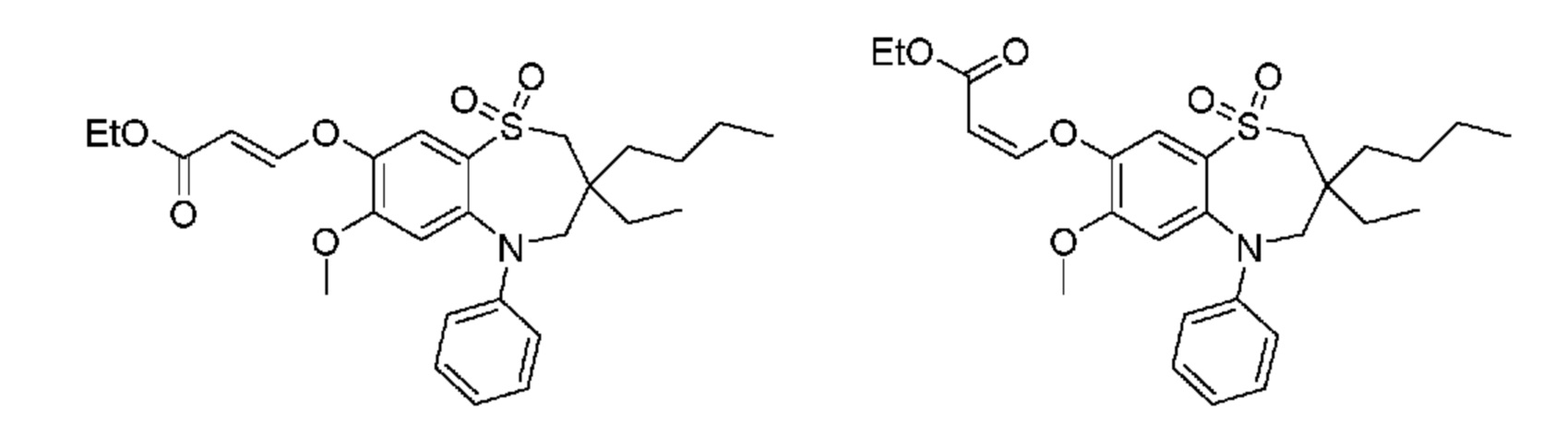
При перемешивании к раствору 3-бутил-3-этил-8-гидрокси-7-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 15; 0,36 г, 0,89 ммоля) в DMF (10 мл) добавляли этил-(E)-3-бромакрилат (0,32 г, 1,78 ммоля), карбонат калия (0,25 г, 1,78 ммоля) и тетра-бутилбромид аммония (5 мг, 0,016 ммоля) и полученную смесь нагревали при 90°C в течение 24 ч. После завершения реакции (следили с помощью TLC) реакцию останавливали водой (5 мл) и водный слой экстрагировали с помощью EtOAc (2×15 мл). Объединенный органический слой промывали водой (15 мл), рассолом (15 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество (1:1 для обоих диастереоизомеров) дополнительно очищали с помощью препаративной HPLC (методика B) и получали первую элюирующуюся фракцию, соответствующую (Z)-изомеру, и вторую элюирующуюся фракцию, соответствующую (E)-изомеру, с суммарным выходом 53%.
(Z)-изомер:: Выход: 0,13 г (почти белое твердое вещество).1H NMR (400 MHz, DMSO-d6): δ 7,49 (s, 1H), 7,29 (t, J=7,6 Hz, 2H), 7,14 (d, J=8,4 Hz, 2H), 7,03-6,91 (m, 2H), 6,55 (s, 1H), 5,16 (d, J=6,8 Hz, 1H), 4,10 (q, J=7,2 Hz, 2H), 3,90-3,72 (m, 2H), 3,63 (s, 3H), 3,31 (s, 2H), 1,42-1,33 (m, 3H), 1,32-1,29 (m, 4H), 1,19-1,02 (m, 4H), 0,76-0,71 (m, 6H). LCMS: (методика C) 502,1 (M+H), Rt. 3,03 мин, 99,13% (максимально).
(E)-изомер: Выход: 0,12 г (почти белое твердое вещество).1H NMR (400 MHz, DMSO-d6): δ 7,72 (d, J=12,2 Hz, 1H), 7,54 (s, 1H), 7,32-7,28 (m, 2H), 7,18-7,16 (m, 2H), 7,01-6,97 (m, 1H), 6,55 (s, 1H), 5,40 (d, J=12,2 Hz, 1H), 4,11 (q, J=7,0 Hz, 2H), 3,92-3,75 (m, 2H), 3,62 (s, 3H), 3,31 (m, 2H), 1,36-1,31 (m, 3H), 1,24-1,20 (m, 4H), 1,21-0,95 (m, 4H), 0,76-0,71 (m, 6H). LCMS: (методика C) 502,1 (M+H), Rt. 3,12 мин, 99,23% (максимально).
Промежуточный продукт 17
7-бром-3,3-дибутил-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид

При перемешивании к раствору 7-бром-3,3-дибутил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (0,8 г, 1,62 ммоля) в DCM (20 мл) при 0°C по каплям добавляли BBr3 (0,78 мл, 8,1 ммоля) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. После завершения реакции (следили с помощью TLC) реакционную смесь охлаждали до 0°C. По каплям добавляли EtOAc (10 мл) и охлажденную льдом воду (5 мл) и смесь перемешивали при комнатной температуре в течение 1 ч. Затем реакционную смесь подвергали распределению между водой (15 мл) и DCM (15 мл) и водный слой экстрагировали с помощью DCM (3×15 мл). Объединенную органическую часть промывали рассолом (15 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 90% (700 мг, неочищенное почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 10,83 (s, 1H), 7,46 (s, 1H), 7,23 (t, J=8,0 Hz, 2H), 7,07 (s, 1H), 6,99 (d, J=7,6 Hz, 2H), 6,88 (t, J=7,2 Hz, 1H), 3,80-3,72 (m, 2H), 3,27 (s, 2H), 1,34-1,31 (m, 4H), 1,13-0,99 (m, 8H), 0,75-0,72 (m, 6H). LCMS: (методика A) 480,1 (M+), Rt. 3,19 мин, 89,95% (максимально).
Промежуточный продукт 18
3,3-дибутил-8-гидрокси-7-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид
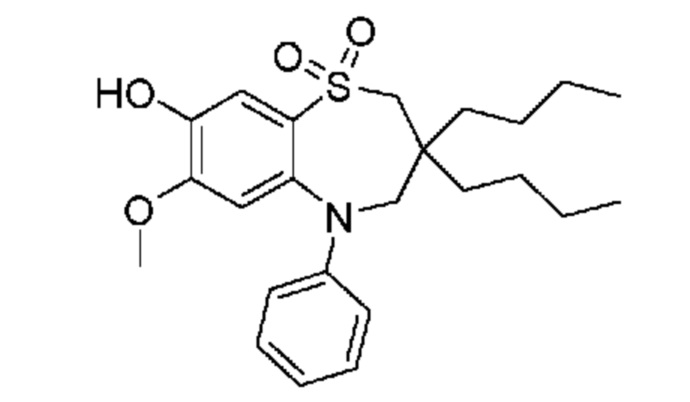
При перемешивании к раствору 7-бром-3,3-дибутил-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 17; 0,9 г, 1,87 ммоля) в метоксиде натрия (21%, 10 мл, 10,2 ммоля) добавляли CuBr (0,15 г, 1,05 ммоля) при комнатной температуре и полученную смесь нагревали при 85°C в течение 6 ч. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и полученную неочищенную массу подвергали распределению между EtOAc (25 мл) и водой (25 мл). Водный слой экстрагировали с помощью EtOAc (2×25 мл) и объединенный органический слой промывали рассолом (25 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 5% MeOH/DCM; силикагель: 230-400 меш) и получали искомое соединение. Выход: 78% (0,63 г, светло-розовое смолообразное вещество).
UPLC: (методика A) 432,5 (M+H), Rt. 1,93 мин, 90,07% (максимально).
Промежуточный продукт 19
Этил-(E)-3-((3,3-дибутил-7-метокси-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат и этил-(Z)-3-((3,3-дибутил-7-метокси-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат
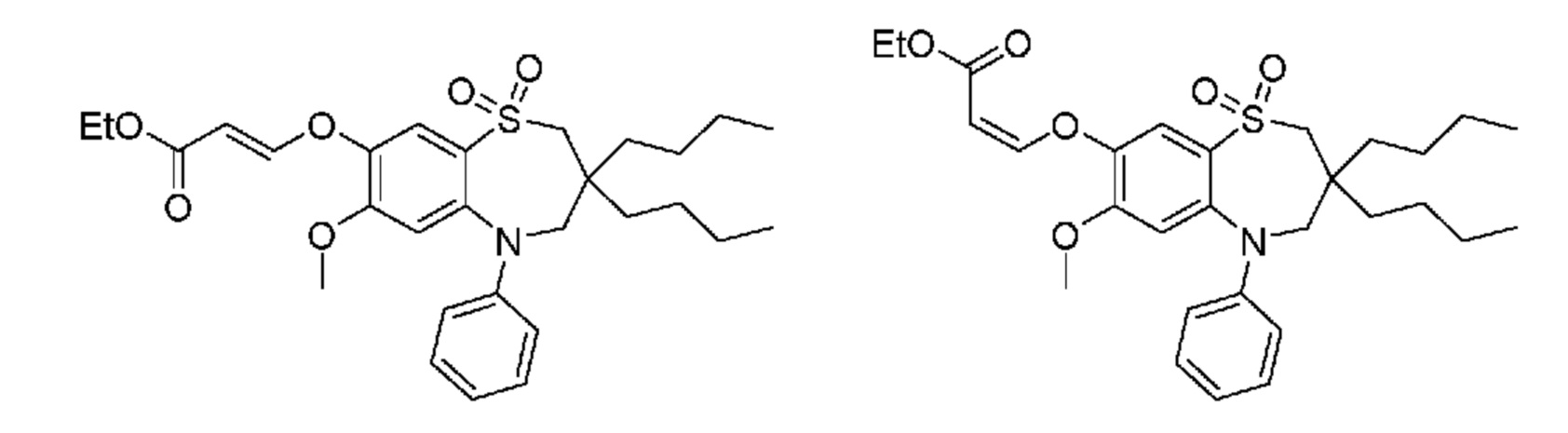
При перемешивании к раствору 3,3-дибутил-8-гидрокси-7-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 18; 0,63 г, 1,45 ммоля) в DMF (10 мл), этил-(E)-3-бромакрилат(0,52 г, 2,90 ммоля) добавляли карбонат натрия (0,39 г, 3,62 ммоля) и тетра-бутилбромид аммония (0,05 г, 0,14 ммоля) и полученную смесь нагревали при 90°C в течение 24 ч. После завершения реакции (следили с помощью TLC) реакцию останавливали водой (5 мл) и водный слой экстрагировали с помощью EtOAc (2×15 мл). Объединенный органический слой промывали водой (15 мл), рассолом (15 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество, которое содержало (E)- и (Z)-изомеры в отношении 1:1, дополнительно очищали с помощью препаративной HPLC (методика B) и получали первую элюирующуюся фракцию, соответствующую (Z)-изомеру, и вторую элюирующуюся фракцию, соответствующую (E)-изомеру с суммарным выходом 60%.
(Z)-изомер: Выход: 0,23 г (почти белое твердое вещество);1H NMR (400 MHz, DMSO-d6): δ 7,46 (s, 1H), 7,28-7,27 (m, 2H), 7,16-7,14 (m, 2H), 7,01-7,00 (m, 2H), 6,50 (s, 1H), 5,14 (d, J=6,8 Hz, 1H), 4,09 (q, J=7 Hz, 2H), 3,75-3,65 (m, 2H), 3,60 (s, 3H), 3,32-3,30 (m, 2H), 1,21-1,19 (m, 4H), 1,18-1,07 (m, 11H), 0,75-0,73 (m, 6H).
(E)-изомер: Выход: 0,23 г (почти белое твердое вещество);1H NMR (400 MHz, DMSO-d6): δ 7,69 (d, J=12,2 Hz, 1H), 7,51 (s, 1H), 7,32-7,28 (m, 2H), 7,18-7,16 (m, 2H), 7,01-6,99 (m, 1H), 6,51 (s, 1H), 5,37 (d, J=12,2 Hz, 1H), 4,09 (q, J=7,0 Hz, 2H), 3,85 (bs, 2H), 3,59 (s, 3H), 3,32 (s, 2H), 1,40-1,31 (m, 4H), 1,21-1,09 (m, 11H), 1,07-1,00 (m, 6H).
Промежуточный продукт 20
5-(4-бромфенил)-3,3-дибутил-8-гидрокси-7-(метилтио)-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид

При перемешивании к раствору 3,3-дибутил-8-гидрокси-7-(метилтио)-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (2 г, 4,47 моля) в сухом DMF (20 мл) по каплям при 0°C добавляли N-бромсукцинимид (0,875 г, 4,92 ммоля), растворенный в сухом DMF (20 мл) и реакционную смесь перемешивали при 0°C в течение 1 ч. После завершения реакции (следили с помощью LCMS) реакционную смесь выливали в измельченный лед. Полученное твердое вещество отфильтровывали, промывали водой (2×20 мл) и сушили в вакууме и получали искомое соединение. Выход: 89% (2,1 г, коричневое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 10,65 (bs, 1H), 7,32-7,30 (m, 3H), 6,82-6,81 (m, 2H), 6,75 (s, 1H), 3,80-3,50 (m, 2H), 3,25-3,15 (m, 2H), 2,23 (s, 3H), 1,46-1,26 (m, 4H), 1,16-1,08 (m, 8H), 0,82-0,80 (m, 6H). UPLC: (методика A) 526,4 (M+H), Rt. 1,42 мин, 94,32%.
Промежуточный продукт 21
Этил-(E)-3-((5-(4-бромфенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат и этил-(Z)-3-((5-(4-бромфенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат

При перемешивании к раствору 5-(4-бромфенил)-3,3-дибутил-8-гидрокси-7-(метилтио)-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 20; 0,49 г, 0,93 ммоля) в DMF (5 мл) добавляли этил-(E)-3-бромакрилат (0,25 г, 4,92 ммоля) и карбонат калия (0,26 г, 1,86 ммоля) при комнатной температуре и полученную смесь нагревали при 100°C в течение 4 ч. После завершения реакции (следили с помощью TLC) реакцию останавливали водой (20 мл) и водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенный органический слой промывали водой (15 мл), рассолом (15 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество, которое содержало (E)- и (Z)-изомеры в отношении 1:1, очищали с помощью препаративной HPLC (методика D) и получали первую элюирующуюся фракцию, соответствующую (Z)-изомеру и вторую элюирующуюся фракцию, соответствующую (E)-изомеру, с суммарным выходом 50%.
(Z)-изомер: Выход: 0,12 г (почти белое твердое вещество);1H NMR (400 MHz, DMSO-d6): δ 7,49 (s, 1H), 7,40 (d, J=8,8 Hz, 2H), 7,24 (d, J=6,8 Hz, 2H), 7,01-6,99 (m, 2H), 6,84 (s, 1H), 5,29 (d, J=6,8 Hz, 1H), 4,11 (q, J=7,2 Hz, 2H), 3,92-3,55 (m, 2H), 3,33 (s, 2H), 2,28 (s, 3H), 1,45-1,05 (m, 14H), 0,80-0,77 (m, 6H). LCMS: (методика C) 624,0 (M+), Rt. 3,43 мин, 96,50% (максимально).
(E)-изомер: Выход: 0,13 г (белое твердое вещество);1H NMR (400 MHz, DMSO-d6): δ 7,77 (d, J=12,0 Hz, 1H), 7,52 (s, 2H), 7,42 (d, J=8,8 Hz, 2H), 7,06-7,04 (m, 2H), 6,84 (s, 1H), 5,55 (d, J=12,0 Hz, 1H), 4,13 (q, J=7,2 Hz, 2H), 3,92-3,55 (m, 2H), 3,36 (s, 2H), 2,27 (s, 3H), 1,45-1,04 (m, 14H), 0,80-0,77 (m, 6H). LCMS: (методика C) 624,0 (M+), Rt. 3,54 мин, 97,99% (максимально).
Промежуточный продукт 22
7-бром-3-бутил-3-этил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид
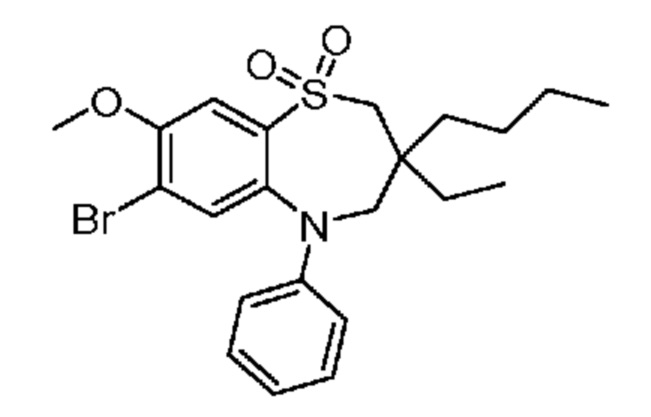
При перемешивании к раствору 7-бром-3-бутил-3-этил-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (1,0 г, 2 ммоля) в сухом DMF (15 мл) при 0°C добавляли гидрид натрия (60% в минеральном масле) (0,09 мг, 2,40 ммоля) и реакционную смесь перемешивали в течение 10 мин. Затем к реакционной смеси добавляли метилйодид (0,4 мл, 6 ммоля) и смесь перемешивали при комнатной температуре в течение 30 мин. После завершения реакции (следили с помощью TLC) реакцию останавливали охлажденной льдом водой (2 мл) и водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенный органический слой промывали водой (15 мл), рассолом (15 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 96% (900 мг, неочищенное коричневое смолообразное твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,45 (s, 1H), 7,26 (t, J=8,0 Hz, 2H), 7,18-7,16 (m, 1H), 7,06-7,04 (m, 2H), 6,93 (t, J=7,2 Hz, 1H), 3,93 (s, 3H), 3,70-3,61 (m, 2H), 3,10 (s, 2H), 1,51-0,90 (m, 8H), 0,80-0,72 (m, 6H). LCMS: (методика A) 468,1 (M+2), Rt. 3,21 мин, 96,82% (максимально).
Промежуточный продукт 23
3-бутил-3-этил-8-гидрокси-7-(метилтио)-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид

При перемешивании к раствору 7-бром-3-бутил-3-этил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 22; 0,9 г, 1,90 ммоля) в сухом DMF (15 мл) добавляли тиометоксид натрия (687 мг, 9,5 ммоля) при комнатной температуре и реакционную смесь перемешивали при 60°C в течение 16 ч. После завершения реакции (следили с помощью LCMS), реакцию останавливали охлажденной льдом водой (2 мл) и водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенный органический слой промывали водой (15 мл), рассолом (15 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 10-15% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 93% (750 мг, бледно-коричневое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,16-7,12 (m, 3H), 6,85-6,83 (m, 2H), 6,71 (t, J=7,2 Hz, 1H), 6,60 (s, 1H), 3,74-3,61 (m, 2H), 3,12 (s, 2H), 2,13 (s, 3H), 1,70-1,08 (m, 8H), 0,80-0,74 (m, 6H). UPLC: (методика A) 420,5 (M+H), Rt. 1,86 мин, 91,84% (максимально).
Промежуточный продукт 24
Этил-(E)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат и этил-(Z)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат

При перемешивании к раствору 3-бутил-3-этил-8-гидрокси-7-(метилтио)-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 23; 0,75 г, 1,79 ммоля) в сухом DMF (20 мл) добавляли этил-(E)-3-бромакрилат (480 мг, 2,68 ммоля) и карбонат калия (494 мг, 3,57 ммоля) и реакционную смесь нагревали при 90°C в течение 4 ч. После завершения реакции (следили с помощью TLC) реакцию останавливали водой (5 мл) и водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенный органический слой промывали водой (15 мл), рассолом (15 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество, которое содержало (E)- и (Z)-изомеры в отношении 1:1, очищали с помощью препаративной HPLC (методика D) и получали первую элюирующуюся фракцию, соответствующую (Z)-изомеру, и вторую элюирующуюся фракцию, соответствующую (E)-изомеру, с суммарным выходом 55%.
(Z)-изомер: Выход: 29% (0,21 г, белое твердое вещество).1H NMR (400 MHz, DMSO-d6): δ 7,75 (d, J=12,4 Hz, 1H), 7,51 (s, 1H), 7,31 (t, J=8,0 Hz, 2H), 7,17 (d, J=8,0 Hz, 2H), 7,00 (t, J=7,2 Hz, 1H), 6,68 (s, 1H), 5,51 (d, J=12,4 Hz, 1H), 4,12 (q, J=7,2 Hz, 2H), 3,85-3,62 (m, 2H), 3,38 (s, 2H), 2,17 (s, 3H), 1,43-1,00 (m, 11H), 0,76-0,73 (m, 6H). LCMS: (методика C) 518,1 (M+H), Rt. 3,25 мин, 99,38% (максимально).
(E)-изомер: Выход: 26% (0,22 г, белое твердое вещество).1H NMR (400 MHz, DMSO-d6): δ 7,48 (s, 1H), 7,29 (t, J=8,0 Hz, 2H), 7,20 (d, J=6,8 Hz, 1H), 7,13 (d, J=7,6 Hz, 2H), 6,98 (t, J=7,2 Hz, 1H), 6,69 (s, 1H), 5,27 (d, J=7,2 Hz, 1H), 4,11 (q, J=7,2 Hz, 2H), 3,75-3,74 (m, 2H), 3,34 (s, 2H), 2,19 (s, 3H), 1,55-0,98 (m, 11H), 0,76-0,75 (m, 6H). LCMS: (методика C) 518,1 (M+H), Rt. 3,15 мин, 98,88% (максимально).
Промежуточный продукт 25
3,3-дибутил-8-гидрокси-5-(4-метоксифенил)-7-(метилтио)-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид

При перемешивании к раствору 5-(4-бромфенил)-3,3-дибутил-8-гидрокси-7-(метилтио)-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 20; 1,5 г, 2,84 ммоля) в сухом DMF (5 мл) добавляли метоксид натрия (5 мл, 20% в метаноле) и CuBr (0,06 г, 0,284 ммоля) при комнатной температуре и реакционную смесь нагревали при 100°C в течение 24 ч. После завершения реакции (следили с помощью LCMS) реакционную смесь фильтровали через целит и промывали с помощью EtOAc (15 мл). Органическую часть концентрировали в вакууме и полученное неочищенное вещество направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 44% (0,600 г, коричневое смолообразное твердое вещество).
LCMS: (методика C) 477,68 (M+H), Rt. 3,51 мин, 76,40% (максимально).
Промежуточный продукт 26
Этил-(E)-3-((3,3-дибутил-5-(4-метоксифенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат и этил-(Z)-3-((3,3-дибутил-5-(4-метоксифенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат
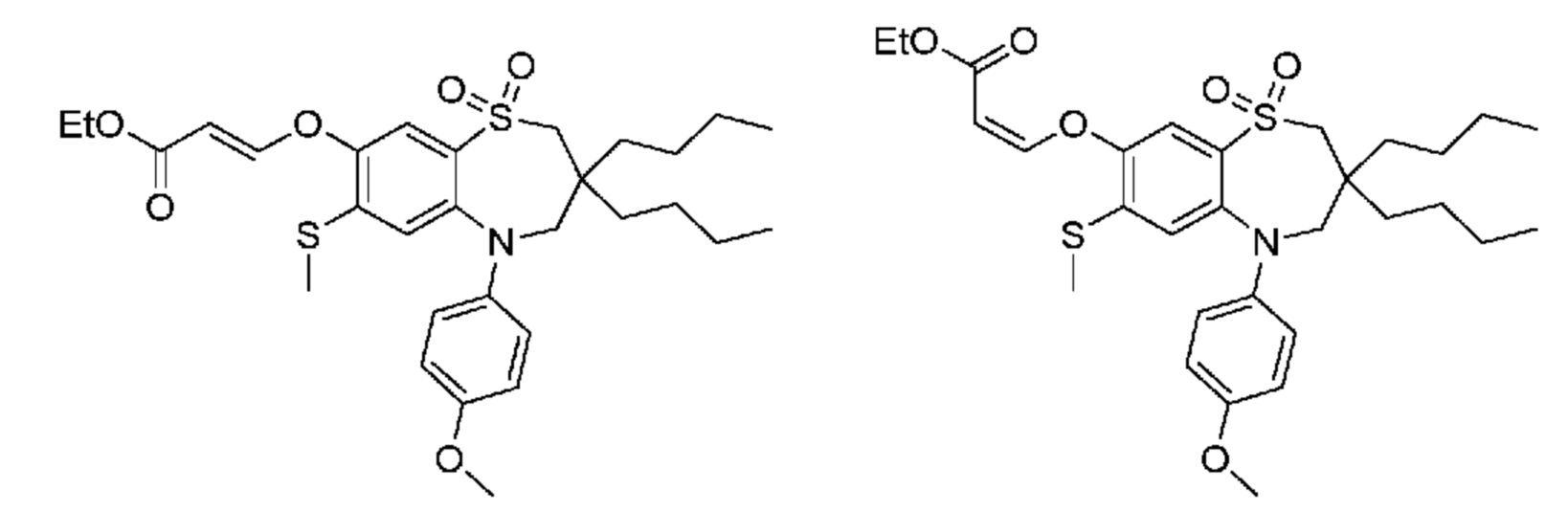
При перемешивании к раствору 3,3-дибутил-8-гидрокси-5-(4-метоксифенил)-7-(метилтио)-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 25; 0,65 г, 1,36 ммоля) в сухом DMF (10 мл) добавляли этил-(E)-3-бромакрилат (0,88 г, 4,92 ммоля) и карбонат калия (0,56 г, 4,08 ммоля) при комнатной температуре и реакционную смесь нагревали при 100°C в течение 4 ч. После завершения реакции (следили с помощью TLC) реакцию останавливали водой (5 мл) и водный слой экстрагировали этилацетатом (2×10 мл). Объединенный органический слой промывали водой (15 мл), рассолом (15 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество, которое содержало (E)- и (Z)-изомеры в отношении 1:1, очищали с помощью препаративной HPLC (методика D) и получали первую элюирующуюся фракцию, соответствующую (Z)-изомеру, и вторую элюирующуюся фракцию, соответствующую (E)-изомеру, с суммарным выходом 51%.
(Z)-изомер: Выход: 25% (0,20 г, почти белое твердое вещество).1H NMR (400 MHz, DMSO-d6): δ 7,42 (s, 1H), 7,25 (d, J=8,6 Hz, 2H), 7,12 (d, J=6,8 Hz, 1H), 6,94 (d, J=9,0 Hz, 2H), 6,43 (s, 1H), 5,22 (d, J=6,8 Hz, 1H), 4,10 (q, J=7,0 Hz, 2H), 3,82-3,65 (m, 5H), 3,40 (s, 2H), 2,13 (s, 3H), 1,42-0,99 (m, 15H), 0,76-0,73 (m, 6H).
(E)-изомер: Выход: 26% (0,21 г, почти белое твердое вещество),1H NMR (400 MHz, DMSO-d6): δ 7,69 (d, J=12,4 Hz, 1H), 7,45 (s, 1H), 7,27 (d, J=9,2 Hz, 2H), 6,95 (d, J=8,8 Hz, 2H), 6,41 (s, 1H), 5,42 (d, J=12,4 Hz, 1H), 4,09 (q, J=6,8 Hz, 2H), 3,82-3,65 (m, 5H), 3,42 (s, 2H), 2,10 (s, 3H), 1,42-0,97 (m, 15H), 0,79-0,75 (m, 6H).
Промежуточный продукт 27
Этил-(E)-3-((3,3-дибутил-5-(4-гидроксифенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат
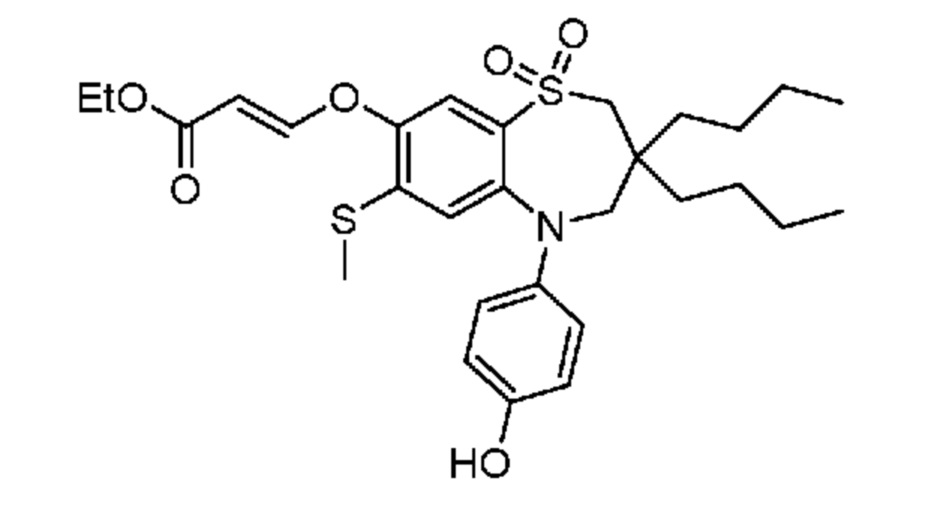
При перемешивании к раствору этил-(E)-3-((3,3-дибутил-5-(4-метоксифенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилату (промежуточный продукт 26; 0,10 г, 0,17 ммоля) в DCM (5 мл) при -78°C по каплям добавляли BBr3 (1M в DCM, 0,3 мл, 0,26 ммоля) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. После завершения реакции (следили с помощью LCMS) реакционную смесь охлаждали до 0°C, по каплям добавляли EtOAc (10 мл) и охлажденную льдом воду (5 мл) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Затем реакционную смесь подвергали распределению между водой (15 мл) и DCM (15 мл) и водный слой экстрагировали с помощью DCM (3×15 мл). Объединенную органическую часть промывали рассолом (15 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 100 мг (неочищенное коричневое смолообразное твердое вещество).
LCMS: (методика C) 562,2 (M+H), Rt. 3,09 мин, 73,17% (максимально).
Промежуточный продукт 28
Этил-(E)-3-((3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат
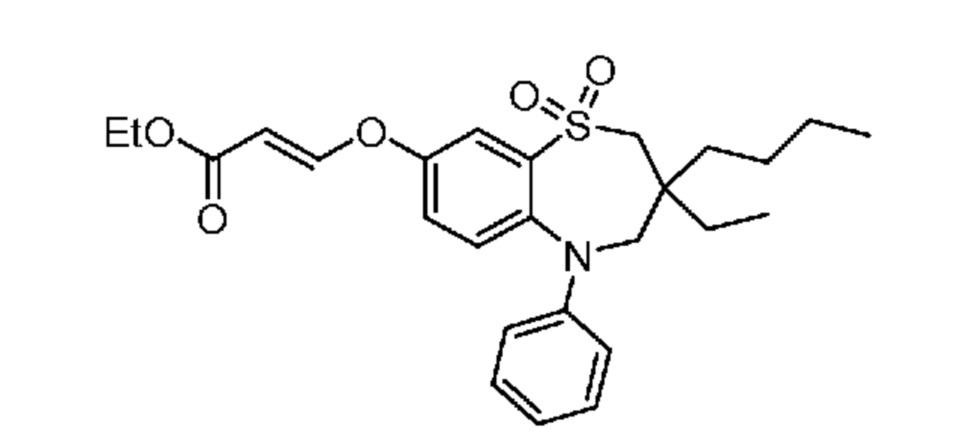
При перемешивании к раствору этил-(E)-3-((7-бром-3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 3; 0,35 г, 0,64 ммоля) в смеси MeOH и воды (10 мл, 4:1 отношение) добавляли NH4Cl (0,03 г, 5,08 ммоля) и порошкообразный Zn (0,21 г, 3,18 ммоля) и реакционную смесь нагревали при 65°C в течение 2 ч. После завершения реакции (следили с помощью TLC) реакцию останавливали водой (15 мл) и водный слой экстрагировали с помощью EtOAc (2×25 мл). Объединенный органический слой промывали рассолом (15 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 15% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 52% (0,150 г, белое смолообразное твердое вещество).
LCMS: (методика A) 472,1 (M+H), Rt. 3,12 мин, 98,24% (максимально).
Промежуточный продукт 29
(E)-3-((7-бром-3-бутил-3-этил-5-(4-нитрофенил)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота

При перемешивании к раствору (E)-3-((7-бром-3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловой кислоты (пример 4; 0,56 г, 1,07 моля) в смеси 1:1 DCM и AcOH (10 мл) по каплям добавляли HNO3 (65%; 0,101 г 1,6 ммоля) в смеси DCM и AcOH (5 мл) при 0°C. После завершения реакции (следили с помощью TLC) реакционную смесь разбавляли с помощью DCM (15 мл) и органический слой промывали водой (15 мл) и насыщенным раствором NaHCO3 (15 мл). Органический слой сушили над безводным Na2SO4 и концентрировали в вакууме и получали искомое соединение. Неочищенное вещество направляли на следующую стадию без дополнительной очистки. Выход: 500 мг (неочищенное коричневое твердое вещество).
LCMS: (методика A) 565,0 (M+-H), Rt,2,53 мин, 70,98% (максимально).
Промежуточный продукт 30
(E)-3-((5-(4-аминофенил)-7-бром-3-бутил-3-этил-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота

При перемешивании к раствору (E)-3-((7-бром-3-бутил-3-этил-5-(4-нитрофенил)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловой кислоты (промежуточный продукт 29; 0,225 г, 0,39 моля) в THF (10 мл) добавляли концентрированную HCl (0,1 мл) и SnCl2 (0,225 г 1,19 ммоля) при комнатной температуре и реакционную смесь перемешивали в течение 12 ч при 70°C. После завершения реакции (следили с помощью TLC) реакцию останавливали насыщенным раствором NaHCO3 (15 мл), фильтровали через слой целита и промывали с помощью EtOAc (2×15 мл). Полученный фильтрат промывали водой (20 мл) и сушили над безводным Na2SO4. Органический слой концентрировали в вакууме и получали неочищенное искомое соединение, которое направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 160 мг (неочищенное коричневое твердое вещество).
LCMS: (методика A) 537,8 (M++H), Rt. 2,17 мин, 90,93% (максимально).
Промежуточный продукт 31
Этил-(E)-3-((3,3-дибутил-7-(метилтио)-5-(4-нитрофенил)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат

При перемешивании к раствору этил-(E)-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 1; 0,33 г, 0,59 ммоля) в смеси 1:1 DCM и AcOH (3 мл) добавляли HNO3 (65%, 0,056 г, 0,89 ммоля) в смеси DCM и AcOH (1 мл) при 0°C. После завершения реакции (следили с помощью TLC) реакционную смесь разбавляли с помощью DCM (15 мл) и органический слой промывали водой (15 мл) и насыщенным раствором NaHCO3 (15 мл). Органический слой сушили над безводным Na2SO4 и концентрировали в вакууме и получали искомое соединение. Неочищенное вещество направляли на следующую стадию без дополнительной очистки. Выход: 300 мг (неочищенное коричневое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 8,04 (d, J=12,4 Hz, 2H), 7,82 (d, J=16,4 Hz, 1H), 7,57 (s, 1H), 7,17 (s, 1H), 6,98 (s, 2H), 5,65 (d, J=16,4 Hz, 1H), 4,13 (q, J=9,6 Hz, 2H), 3,74 (s, 2H), 3,37 (s, 2H), 2,49 (s, 3H), 1,31-1,25 (m, 2H), 1,23-1,14 (m, 10H), 0,83-0,81 (m, 6H). LCMS: (методика D) 591,2 (M++H), Rt. 4,04 мин, 93,4% (максимально).
Промежуточный продукт 32
Метил-(E)-3-((3,3-дибутил-7-(метилтио)-5-(4-нитрофенил)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат

При перемешивании к раствору этил-(E)-3-((3,3-дибутил-7-(метилтио)-5-(4-нитрофенил)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловой кислоты (промежуточный продукт 31; 0,8 г, 1,42 моля) в DCM добавляли оксалилхлорид (0,24 мл, 2,84 ммоля) при 0°C. Затем при этой температуре добавляли DMF (0,05 мл) и реакционную смесь перемешивали в течение 1 ч при 0°C. После завершения реакции (следили с помощью TLC) реакцию останавливали с помощью MeOH (10 мл) и разбавляли с помощью DCM (15 мл). Органический слой промывали водой (15 мл) и насыщенным раствором NaHCO3 (15 мл). Затем органический слой сушили над безводным Na2SO4 и концентрировали в вакууме и получали искомое соединение. Неочищенное вещество направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 775 мг (неочищенное коричневое твердое вещество).
LCMS: (методика C) 577,1 (M++H), Rt. 3,07 мин, 78,21% (максимально).
Промежуточный продукт 33
Метил-(E)-3-((5-(4-аминофенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат

При перемешивании к раствору метил-(E)-3-((3,3-дибутил-7-(метилтио)-5-(4-нитрофенил)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 32; 0,775 г, 1,34 моля) в THF (10 мл) добавляли концентрированную HCl (1 мл) и SnCl2 (1,01 г, 5,37 ммоля) при комнатной температуре и реакционную смесь перемешивали в течение 12 ч при 70°C. После завершения реакции (следили с помощью TLC) реакцию останавливали насыщенным раствором NaHCO3 (25 мл), фильтровали через слой целита и промывали с помощью EtOAc (15 мл). Полученный фильтрат промывали водой (2×15 мл). Объединенный органический слой сушили над безводным Na2SO4 и концентрировали в вакууме и получали неочищенное искомое соединение, которое направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 0,7 г (неочищенное коричневое твердое вещество).
LCMS: (методика C) 547,1 (M++H), Rt. 2,87 мин, 79,4% (максимально).
Промежуточный продукт 34
Метил-(E)-3-((3,3-дибутил-5-(4-((метоксикарбонил)амино)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат

При перемешивании к раствору метил-(E)-3-((5-(4-аминофенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 33, 0,06 г, 0,1 моля) в DCM (5 мл) добавляли триэтиламин (0,03 г, 0,3 ммоля) при 0°C. Затем к реакционной смеси добавляли метилхлорформиат (0,014 г, 0,15 ммоля) и перемешивали 3 ч при КТ. После завершения реакции (следили с помощью TLC) реакционную смесь разбавляли с помощью DCM (10 мл) и органический слой промывали насыщенным раствором NaHCO3 (15 мл). Органический слой сушили над безводным Na2SO4 и концентрировали в вакууме и получали искомое соединение. Неочищенное вещество направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 60 мг (неочищенное почти белое твердое вещество).
LCMS: (методика A) 605,2 (M++H), Rt. 2,97 мин, 66,2% (максимально).
Промежуточный продукт 35
Этил-(E)-3-((5-(4-аминофенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат
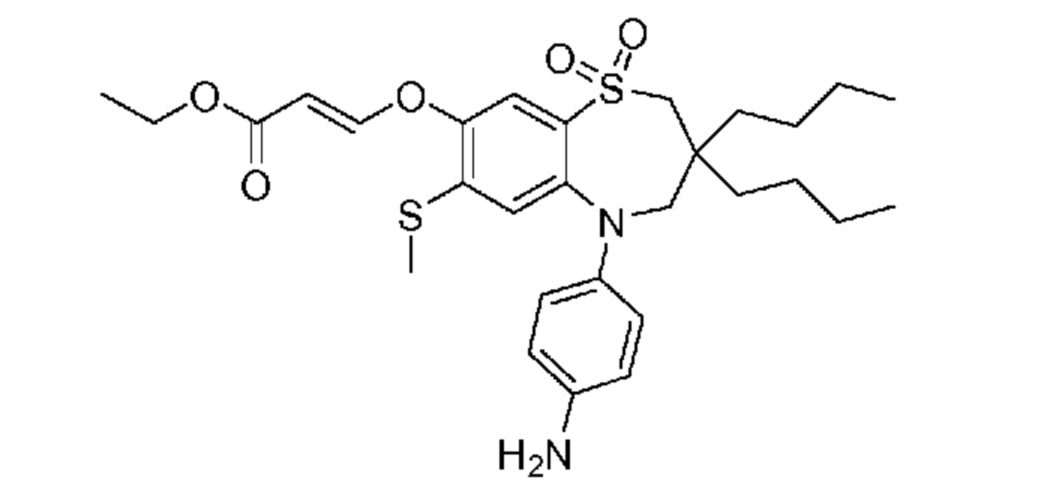
При перемешивании к раствору этил-(E)-3-((3,3-дибутил-7-(метилтио)-5-(4-нитрофенил)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 31; 0,4 г, 0,67 ммоля) в THF (5 мл) добавляли концентрированную HCl (0,1 мл) и SnCl2 (0,512 г, 2,71 ммоля) при комнатной температуре и реакционную смесь перемешивали в течение 12 ч при 70°C. После завершения реакции (следили с помощью TLC) реакцию останавливали насыщенным раствором NaHCO3 (15 мл), фильтровали через слой целита и промывали с помощью EtOAc (2×15 мл). Полученный фильтрат промывали водой (20 мл) и сушили над безводным Na2SO4. Органический слой концентрировали в вакууме и получали неочищенное искомое соединение, которое направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 0. 38 г (неочищенное коричневое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,66 (d, J=16,4 Hz, 1H), 7,39 (s, 1H), 7,04 (d, J=11,6 Hz, 2H), 6,59 (d, J=11,2 Hz, 2H), 6,31 (s, 1H), 5,37 (d, J=16,4 Hz, 1H), 5,09 (s, 2H), 4,10 (q, J=9,2 Hz, 2H), 3,73 (s, 2H), 3,41 (s, 2H), 2,07 (s, 3H), 1,45-1,36 (m, 4H), 1,19-1,01 (m, 8H), 0,91 (t, J=14,4 Hz, 6H). LCMS: (методика C) 561,2 (M++H), Rt. 2,99 мин, 89,73% (максимально).
Промежуточный продукт 36
Метил-(E)-3-((3,3-дибутил-5-(4-(диметиламино)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат
К раствору этил-(E)-3-((5-(4-аминофенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 35; 100 мг, 0,18 ммоля) в метаноле (3 мл) и AcOH (0,5 мл) добавляли формальдегид (37%, 9,2 мг, 0,18 ммоля) и реакционную смесь перемешивали в течение 3 ч при температуре окружающей среды. Затем добавляли NaCNBH3 (23 мг, 0,366 ммоля) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме. Полученный остаток подвергали распределению между водой (10 мл) и EtOAc (15 мл) и водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенный органический слой промывали рассолом (25 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 70% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение (продукт переэтерификации в присутствии метанола). Выход: 43% (46 мг, желтое твердое вещество).
1H-NMR (400 MHz, DMSO-d6): δ 7,70 (d, J=12,4 Hz, 1H), 7,43 (s, 1H), 7,20 (d, J=9,2 Hz, 2H), 6,76 (d, J=8,4 Hz, 2H), 6,38 (s, 1H), 5,45 (d, J=12,0 Hz, 1H), 3,76 (s, 2H), 3,64 (s, 3H), 3,43 (s, 2H), 2,89 (s, 6H), 2,08 (s, 3H), 1,48-1,31 (m, 4H), 1,24-0,84 (m, 8H), 0,74 (t, J=6,8 Hz, 6H). LCMS: (методика A) 575,3 (M+-H), Rt. 3,39 мин, 96,49% (максимально).
Промежуточный продукт 37
(Z)-3-((3,3-дибутил-7-(метилтио)-5-(4-нитрофенил)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота
При перемешивании к раствору (Z)-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловой кислоты (пример 11; 2,4 г, 4,48 ммоля) в смеси 1:1 DCM и AcOH (24 мл) по каплям добавляли HNO3 (65%, 0,42 г, 6,70 ммоля) в смеси DCM и AcOH (12 мл) при 0°C. Затем реакционную смесь перемешивали в течение 1 ч. После завершения реакции (следили с помощью TLC) реакционную смесь разбавляли с помощью DCM (25 мл) и органический слой промывали водой (3×20 мл). Объединенный органический слой промывали рассолом (2×20 мл) и сушили над безводным Na2SO4. Растворитель выпаривали в вакууме и получали неочищенное искомое соединение, которое направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 2,53 г (неочищенное коричневое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 13,71 (s, 1H), 8,05 (d, J=8,8 Hz, 2H), 7,70-7,65 (m, 2H), 7,16 (s, 1H), 7,01-6,86 (m, 2H), 3,86 (s, 2H), 2,67 (s, 2H), 2,38 (s, 3H), 1,59-1,55 (m, 2H), 1,31-1,14 (m, 10H), 0,84-0,80 (m, 6H). LCMS: (методика E) 579,2 (M+-H), Rt. 3,26 мин, 93,55% (максимально).
Промежуточный продукт 38
(Z)-3-((5-(4-аминофенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота
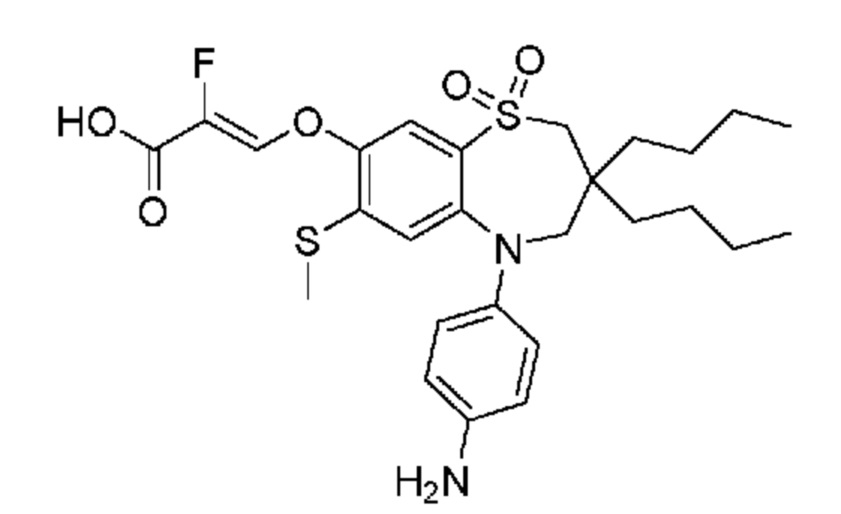
При перемешивании к раствору (Z)-3-((3,3-дибутил-7-(метилтио)-5-(4-нитрофенил)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловой кислоты (промежуточный продукт 37; 2,53 г, 4,30 ммоля) в THF (25,3 мл) добавляли концентрированную HCl (2,53 мл) и SnCl2 (3,29 г, 17,40 ммоля) при комнатной температуре и реакционную смесь нагревали при 80°C в течение ночи. После завершения реакции (следили с помощью TLC) воду (20 мл) к реакционной смеси добавляли и полученное твердое вещество отфильтровывали через слой целита, который промывали с помощью EtOAc (50 мл). Органическую часть промывали рассолом (20 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 6-7% MeOH в DCM; силикагель: 230-400 меш) и получали искомое соединение. Выход: 89% (2,14 г, почти белое твердое вещество).
LCMS: (методика C) 548,9 (M-H), Rt. 2,47 мин, 95,69% (максимально).
Промежуточный продукт 39
Этил-(E)-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-(4-пиваламидофенил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат
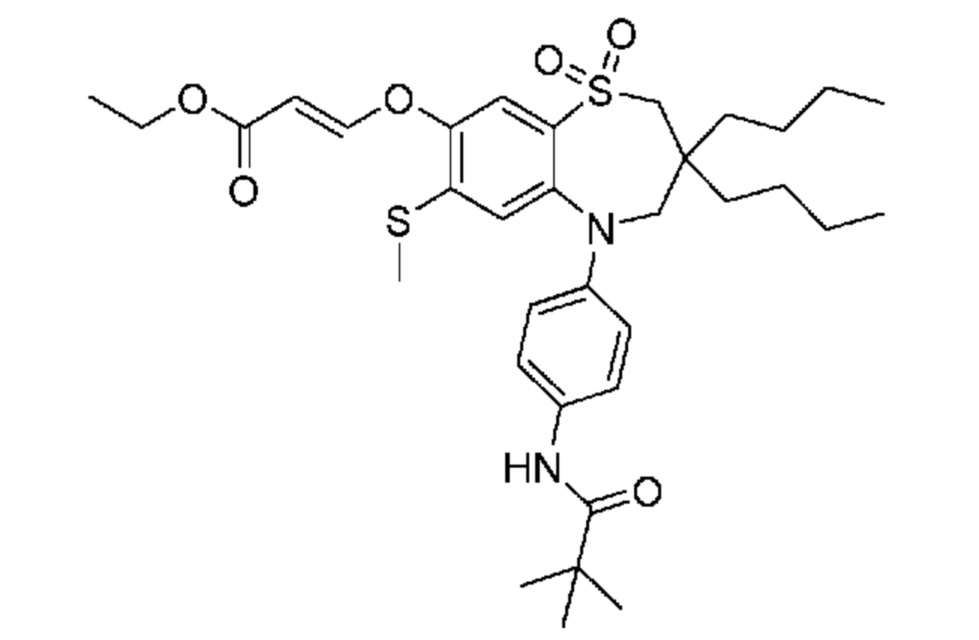
При перемешивании к раствору этил-(E)-3-((5-(4-аминофенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 35; 0,06 г, 0,1 моля) в DCM (5 мл) добавляли триэтиламин (0,03 мл, 0,21 ммоля) при 0°C. Затем добавляли пивалоилхлорид (0,016 г, 0,12 ммоля) и реакционную смесь перемешивали в течение 2 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь разбавляли с помощью DCM (15 мл) и органическую часть промывали насыщенным раствором NaHCO3 (2×10 мл). Объединенный органический слой сушили над безводным Na2SO4 и концентрировали в вакууме и получали неочищенное искомое соединение, которое направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 65 мг (неочищенное почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 9,16 (s, 1H), 7,72 (d, J=16,4 Hz, 1H), 7,60 (d, J=11,6 Hz, 2H), 7,47 (s, 1H), 7,16 (d, J=12,0 Hz, 2H), 6,60 (s, 1H), 5,48 (d, J=16,4 Hz, 1H), 4,12 (d, J=9,6 Hz, 2H), 3,74 (bs, 2H), 3,38 (s, 2H), 2,27 (s, 3H), 1,42 (s, 9H), 1,32-1,22 (m, 6H), 1,20-1,18 (m, 6H), 1,11 (t, J=18,4 Hz, 6H). LCMS: (методика A) 645,3 (M++H), Rt. 3,21 мин, 91,1% (максимально).
Промежуточный продукт 40
Этил-(E)-3-((5-(4-((бутоксикарбонил)амино)фенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат
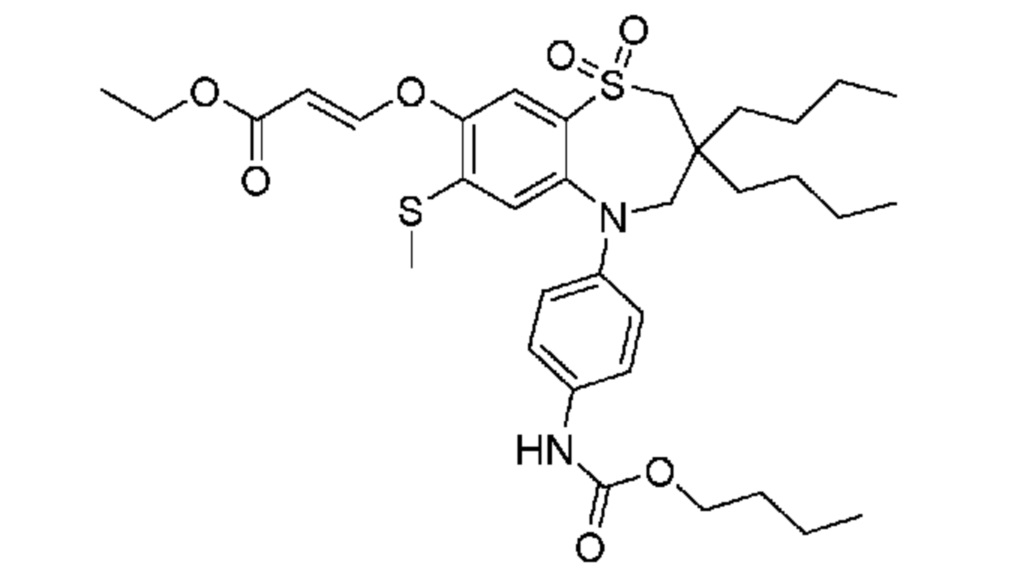
При перемешивании к раствору этил-(E)-3-((5-(4-аминофенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 35; 0,035 г, 0,06 ммоля) в DCM (3 мл) по каплям добавляли триэтиламин (0,012 г, 0,12 ммоля) при 0°C. Затем к реакционной смеси добавляли бутилхлорформиат (0,011 г 0,08 ммоля) и перемешивание продолжали 2 ч при КТ. После завершения реакции (следили с помощью TLC) реакционную смесь разбавляли с помощью DCM (5 мл) и слой DCM промывали насыщенным раствором NaHCO3 (20 мл). Органический слой сушили над безводным Na2SO4 и концентрировали в вакууме и получали неочищенное искомое соединение которое направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 41 мг (неочищенное почти белое твердое вещество). LCMS: (методика A) 660,9 (M++H), Rt. 3,32 мин, 85,01% (максимально).
Промежуточный продукт 41
Этил-(E)-3-((3,3-дибутил-5-(4-(3,3-диметилбутанамидо)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат

При перемешивании к раствору этил-(E)-3-((5-(4-аминофенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 35; 0,150 г, 0,26 ммоля) в DCM (5 мл) по каплям добавляли триэтиламин (0,074 г, 0,53 ммоля) при 0°C. Затем к реакционной смеси добавляли 3,3-диметилбутаноилхлорид (0,054 г 0,4 ммоля) и перемешивание продолжали в течение 2 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь разбавляли с помощью DCM (5 мл) и органический слой промывали насыщенным раствором NaHCO3 (15 мл). Органический слой сушили над безводным Na2SO4 и концентрировали в вакууме и получали неочищенное искомое соединение, которое направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 150 мг (неочищенное почти белое твердое вещество).
1H-NMR (400 MHz, DMSO-d6): δ 9,74 (s, 1H), 7,72 (d, J=16,4 Hz, 1H), 7,56 (d, J=10,8 Hz, 2H), 7,47 (s, 1H), 7,18 (d, J=11,6 Hz, 2H), 6,58 (s, 1H), 5,47 (d, J=16,4 Hz, 1H), 4,12 (q, J=10,0 Hz, 2H), 3,75 (bs, 2H), 3,39 (s, 2H), 2,17 (s, 3H), 2,15 (s, 2H), 1,42-1,32 (m, 3H), 1,27-1,08 (m, 6H), 1,02 (s, 9H), 0,98-0,91 (m, 6H), 0,7 (t, J=8,4 Hz, 6H). LCMS: (методика C) 659,3 (M++H), Rt. 3,30 мин, 93,37% (максимально).
Промежуточный продукт 42
7-бром-3,3-дибутил-8-метокси-5-(4-(трифторметил)фенил)-2,3-дигидро-1,5-бензотиазепин-4(5H)-он
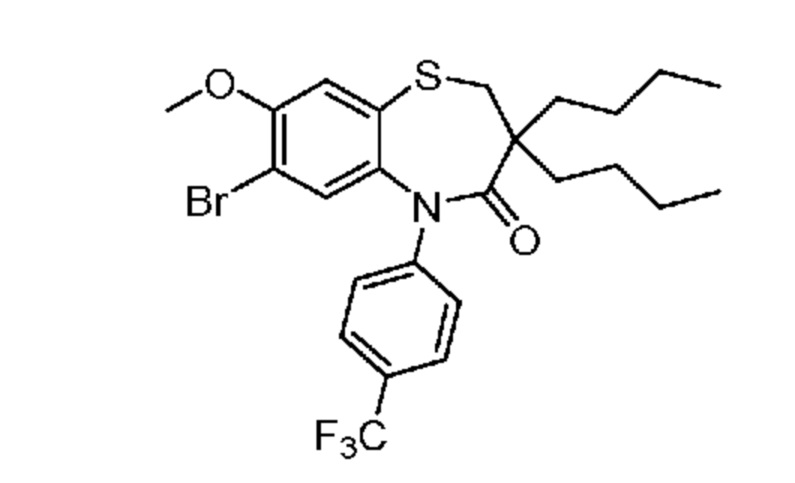
К непродолжительно дегазированному раствору 7-бром-3,3-дибутил-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5H)-он (2 г, 5,01 ммоля) в 4-бромбензотрифториде (6 мл) добавляли трис[2-(2-метоксиэтокси)этил]амин (0,16 г, 0,5 ммоля), CuI (0,19 г, 1,0 ммоля) и сухой K2CO3 (1,38 г, 10,02 ммоля) и реакционную смесь нагревали в течение 24 ч при 130°C. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и полученный остаток переносили в воду (15 мл). Водный слой экстрагировали с помощью EtOAc (2×25 мл) и объединенный органический слой промывали рассолом (50 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 19% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 73% (2,2 г, желтое смолообразное вещество).
LCMS: (методика C) 544,1 (M+H), Rt. 3,54 мин, 89,96% (максимально).
Промежуточный продукт 43
7-бром-3,3-дибутил-8-метокси-5-(4-(трифторметил)фенил)-2,3,4,5-тетрагидро-1,5-бензотиазепин
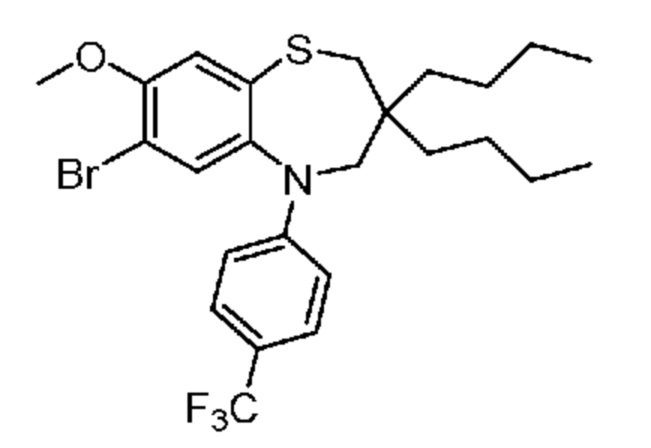
При перемешивании к раствору 7-бром-3,3-дибутил-8-метокси-5-(4-(трифторметил)фенил)-2,3-дигидро-1,5-бензотиазепин-4(5H)-она (промежуточный продукт 42; 2 г, 3,68 ммоля) в сухом THF (20 мл) при 0°C по каплям добавляли диметилсульфид борана (1M в THF; 7,5 мл, 7,37 ммоля) и реакционную смесь нагревали в течение 16 ч при 80°C. После завершения реакции (следили с помощью TLC) реакцию останавливали метанолом (15 мл) при 0°C и нагревали в течение 1 ч при 80°C. Затем реакционную смесь концентрировали в вакууме. Полученный остаток переносили в воду (15 мл) и экстрагировали с помощью EtOAc (2×50 мл). Объединенный органический слой промывали рассолом (50 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 4% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 62% (1,21 г, почти белое твердое вещество).
LCMS: (методика D) 532,1 (M+H), Rt. 3,26 мин, 81,24% (максимально).
Промежуточный продукт 44
7-бром-3,3-дибутил-8-метокси-5-(4-(трифторметил)фенил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид

При перемешивании к раствору 7-бром-3,3-дибутил-8-метокси-5-(4-(трифторметил)фенил)-2,3,4,5-тетрагидро-1,5-бензотиазепина (промежуточный продукт 43; 1,21 г, 2,26 ммоля) ) в смеси ацетона и воды (12 мл, 3:1) добавляли оксон (7 г, 2,27 ммоля) и реакционную смесь перемешивали в течение 48 ч при комнатной температуре. За протеканием реакции следили с помощью TLC и LCMS, которые указывали на образование сульфоксида и сульфона. Затем реакционную смесь фильтровали через целит для удаления избытка оксона и фильтрат разбавляли водой (30 мл). Водный слой экстрагировали с помощью EtOAc (2×40 мл) и объединенный органический слой промывали рассолом (40 мл). Органическую часть сушили над безводным Na2SO4 и концентрировали в вакууме и получали неочищенное вещество, которое очищали с помощью колоночной хроматографии Isolera (элюент: 3% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 68% (0,87 г, бледно-желтое твердое вещество).
LCMS: (методика D) 562,1 (M++H), Rt. 4,39 мин, 95,43% (максимально).
Промежуточный продукт 45
3,3-дибутил-8-гидрокси-7-(метилтио)-5-(4-(трифторметил)фенил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид
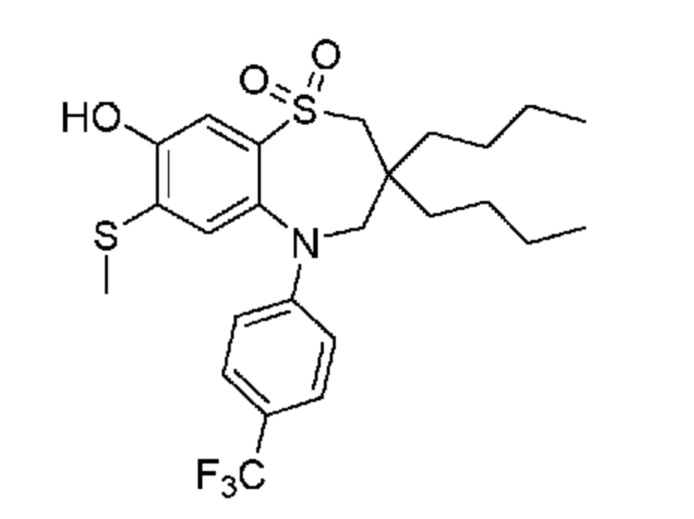
При перемешивании к раствору 7-бром-3,3-дибутил-8-метокси-5-(4-(трифторметил)фенил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 44; 0,87 г, 1,54 ммоля) в DMF (5 мл) добавляли NaSMe (0,57 г, 7,73 ммоля) и раствор нагревали в течение 4 ч при 60°C. После завершения реакции (следили с помощью TLC) реакционную смесь выливали в охлажденную льдом воду (15 мл) и перемешивали в течение 5 мин. Водный слой экстрагировали с помощью EtOAc (2×15 мл) и объединенный органический слой промывали рассолом (15 мл). Органическую часть сушили над безводным Na2SO4 и концентрировали в вакууме и получали неочищенное искомое соединение, которое направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 71% (0,57 г, Желтое смолообразное вещество).
1H-NMR (400 MHz, DMSO-d6): δ 7,95 (s, 1H), 7,45 (d, J=8,0 Hz, 2H), 7,32 (s, 1H), 6,92-6,85 (m, 2H), 6,84 (s, 1H), 3,85 (s, 2H), 3,21 (s, 2H), 2,25 (s, 3H), 1,52-1,39 (m, 2H), 1,26-1,13 (m, 10H), 0,82-0,79 (m, 6H). LCMS: (методика C) 516,1 (M+H), Rt. 3,09 мин, 81,04% (максимально).
Промежуточный продукт 46
Этил-(E)-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-(4-(трифторметил)фенил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат

При перемешивании к раствору 3,3-дибутил-8-гидрокси-7-(метилтио)-5-(4-(трифторметил)фенил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 45; 0,15 г, 0,29 ммоля) в THF (3 мл) добавляли DABCO (0,003 г, 0,029 ммоля) и этилпропиолат (0,043 г, 0,43 ммоля) и реакционную смесь перемешивали в течение 30 мин при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали и остаток подвергали распределению между водой со льдом (10 мл) и EtOAc (10 мл). Водный слой экстрагировали с помощью EtOAc (2×8 мл) и объединенный органический слой промывали рассолом (8 мл). Органическую часть сушили над безводным Na2SO4 и концентрировали в вакууме и получали неочищенное вещество, которое очищали с помощью колоночной хроматографии Isolera (элюент: 40% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 50% (0,09 г, почти белое твердое вещество).
1H-NMR (400 MHz, DMSO-d6): δ 7,81 (d, J=12,0 Hz, 1H), 7,56 (s, 1H), 7,52 (d, J=8,8 Hz, 2H), 7,08-7,04 (m, 3H), 5,61 (d, J=12,0 Hz, 1H), 4,13 (q, J=7,2 Hz, 2H), 3,82 (s, 2H), 3,34 (s, 2H), 2,32 (s, 3H), 1,53-1,41 (m, 2H), 1,33-1,31 (m, 1H), 1,27-1,20 (m, 12H), 0,81-0,77 (m, 6H). LCMS: (методика D) 614,2 (M+H), Rt. 4,35 мин, 91,98% (максимально).
Промежуточный продукт 47
Этил-(E)-3-((3,3-дибутил-5-(4-изобутирамидофенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат
При перемешивании к раствору этил-(E)-3-((5-(4-аминофенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 35, 0,125 г, 0,22 ммоля) в DMF (5 мл) добавляли DIPEA (0,11 мл, 0,66 ммоля), изомасляную кислоту (0,023 г, 0,26 ммоля) и HATU (0,17 г, 0,44 ммоля) при 0°C и затем реакционную смесь перемешивали в течение 1 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь выливали в охлажденную льдом воду (10 мл) и полученное твердое вещество собирали фильтрованием и получали искомое соединение. Соединение направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 130 мг (неочищенное почти белое твердое вещество).
1H-NMR (400 MHz, DMSO-d6): δ 9,78 (s, 1H), 7,72 (d, J=16,4 Hz, 1H), 7,57 (d, J=11,2 Hz, 2H), 7,47 (s, 1H), 7,18 (d, J=10,8 Hz, 2H), 6,58 (s, 1H), 5,47 (d, J=16,4 Hz, 1H), 4,12 (q, J=9,2 Hz, 2H), 3,75 (bs, 2H), 3,35-3,34 (m, 1H), 3,39 (s, 2H), 2,16 (s, 3H), 1,44-1,33 (m, 4H), 1,28-1,19 (m, 6H), 1,11-1,05 (m, 11H), 0,77 (t, J=8,00 Hz, 6H). LCMS: (методика C) 630,9 (M++H), Rt. 3,15 мин, 82,1% (максимально).
Промежуточный продукт 48
Этил-(E)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат

При перемешивании к раствору 3-бутил-3-этил-8-гидрокси-7-(метилтио)-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 23; 1,5 г, 3,57 ммоля) в THF (15 мл) добавляли DABCO (0,04 г, 0,35 ммоля) и этилпропиолат (0,42 г, 4,28 ммоля) при 0°C и реакционную смесь перемешивали в течение 1 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь разбавляли с помощью EtOAc (25 мл). Органический слой промывали водой (2×15 мл), сушили над безводным Na2SO4 и концентрировали в вакууме и получали неочищенное искомое соединение, которое очищали с помощью колоночной хроматографии Isolera (элюент: 10% EtOAc в гексане; силикагель: 230-400 меш) и получали искомое соединение. Выход: 81% (1,5 г, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,74 (d, J=12,4 Hz, 1H), 7,50 (s, 1H), 7,31 (d, J=8,0 Hz, 1H), 7,28 (s, 1H), 7,16 (d, J=7,6 Hz, 2H), 6,99 (t, J=7,2 Hz, 1H), 6,67 (s, 1H), 5,50 (d, J=12,4 Hz, 1H), 4,12 (q, J=7,2 Hz, 2H), 3,74 (s, 2H), 3,37 (s, 2H), 2,16 (s, 3H), 1,53-1,44 (m, 1H), 1,42-1,22 (m, 3H), 1,17 (t, J=6,80 Hz, 3H), 1,09-0,99 (m, 4H), 0,7 (t, J=6,0 Hz, 6H). LCMS: (методика C) 518,1 (M++H), Rt. 3,21 мин, 98,39% (максимально).
Промежуточный продукт 49
Этил-(E)-3-((3-бутил-3-этил-7-(метилтио)-5-(4-нитрофенил)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат

При перемешивании к раствору этил-(E)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 48; 1,3 г, 2,51 ммоля) в смеси 1:1 DCM и AcOH (15 мл) при 0°C добавляли HNO3 (65%, 0,238 г, 3,77 ммоля) в смеси DCM и AcOH (5 мл). После завершения реакции (следили с помощью TLC) реакционную смесь разбавляли с помощью DCM (15 мл) и органический слой промывали водой (15 мл) и насыщенным раствором NaHCO3 (15 мл). Органический слой сушили над безводным Na2SO4 и концентрировали в вакууме и получали неочищенное искомое соединение, которое направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 1,4 г (неочищенное коричневое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 8,05 (d, J=9,2 Hz, 2H), 7,84 (d, J=12,4 Hz, 1H), 7,59 (s, 1H), 7,20 (s, 1H), 6,99 (bs, 2H), 5,67 (d, J=12,4 Hz, 1H), 4,14 (q, J=6,8 Hz, 2H), 3,84 (bs, 2H), 3,40 (s, 2H), 2,38 (s, 3H), 1,66-1,40 (m, 2H), 1,38-1,31 (m, 4H), 1,28-1,19 (m, 5H), 0,82 (t, J=6,40 Hz, 6H). LCMS: (методика C) 562,8 (M++H), Rt,3,01 мин, 97,69% (максимально).
Промежуточный продукт 50
Этил-(E)-3-((5-(4-аминофенил)-3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат

При перемешивании к раствору этил-(E)-3-((3-бутил-3-этил-7-(метилтио)-5-(4-нитрофенил)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 49; 1,4 г, 2,49 ммоля) в THF (20 мл) при комнатной температуре добавляли концентрированную HCl (1 мл) и SnCl2 (1,88 г, 9,96 ммоля) и реакционную смесь перемешивали в течение 12 ч при 70°C. После завершения реакции (следили с помощью TLC) реакцию останавливали насыщенным раствором NaHCO3 (15 мл) и фильтровали через слой целита. Слой целита промывали с помощью EtOAc (2×15 мл) и полученный фильтрат промывали водой (2×25 мл). Объединенный органический слой сушили над безводным Na2SO4 и концентрировали в вакууме и получали неочищенное искомое соединение, которое направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 1,3 г (неочищенное коричневое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,67 (dd, J=12,2, 1,52 Hz, 1H), 7,41 (d, J=1,4 Hz, 1H), 7,04 (d, J=7,3 Hz, 2H), 6,60 (d, J=7,3 Hz, 2H), 6,31 (s, 1H), 5,38 (dd, J=12,3, 1,5 Hz, 1H), 5,10 (s, 2H), 4,13-4,08 (m, 2H), 3,73 (bs, 2H), 3,42 (s, 2H), 2,08 (s, 3H), 1,52-1,38 (m, 4H), 1,36-1,22 (m, 4H), 1,20 (t, J=5,52 Hz, 3H), 0,76 (t, J=5,48 Hz, 6H). LCMS: (методика C) 532,8 (M++H), Rt. 2,73 мин, 91,68% (максимально).
Промежуточный продукт 51
Этил-(E)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-(4-пиваламидофенил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат

При перемешивании к раствору этил-(E)-3-((5-(4-аминофенил)-3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 50; 0,12 г, 0,22 ммоля) в DCM (5 мл) добавляли триэтиламин (0,045 г, 0,45 ммоля) при 0°C. Затем добавляли пивалоилхлорид (0,032 г, 0,27 ммоля) и реакционную смесь перемешивали в течение 2 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь разбавляли с помощью DCM (15 мл) и органический слой промывали насыщенным раствором NaHCO3 (15 мл). Органический слой сушили над безводным Na2SO4 и концентрировали в вакууме и получали неочищенное искомое соединение, которое направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 135 мг (неочищенное почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 9,17 (s, 1H), 7,73 (d, J=12,2 Hz, 1H), 7,60 (d, J=8,6 Hz, 2H), 7,49 (s, 1H), 7,16 (d, J=8,0 Hz, 2H), 6,62 (s, 1H), 5,49 (d, J=12,3 Hz, 1H), 4,12 (q, J=7,0 Hz, 2H), 3,74 (bs, 2H), 3,38 (s, 2H), 2,17 (s, 3H), 1,54-1,42 (m, 4H), 1,36 (s, 9H), 1,35-1,08 (m, 4H), 0,79-0,76 (m, 3H), 0,7 (t, J=7,2 Hz, 6H). LCMS: (методика A) 616,9 (M++H), Rt. 3,08 мин, 94,2% (максимально).
Промежуточный продукт 52
Этил-(E)-3-((3,3-дибутил-5-(4-(циклопентанкарбоксамидо)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат

При перемешивании к раствору этил-(E)-3-((5-(4-аминофенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 35; 0,125 г, 0,22 ммоля) в DMF (3 мл) при 0°C добавляли DIPEA (0,12 мл, 0,66 ммоля), циклопентанкарбоновую кислоту (0,038 г, 0,33 ммоля) и HATU (0,17 г, 0,44 ммоля) и реакционную смесь перемешивали в течение 1 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь выливали в охлажденную льдом воду (15 мл) и водный слой экстрагировали с помощью EtOAc (2×15 мл). Объединенный органический слой промывали рассолом (15 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 140 мг (неочищенное почти белое твердое вещество).
1H-NMR (400 MHz, DMSO-d6): δ 9,83 (s, 1H), 7,72 (d, J=16,4 Hz, 1H), 7,58 (d, J=12,0 Hz, 2H), 7,47 (s, 1H), 7,18 (d, J=11,6 Hz, 2H), 6,57 (s, 1H), 5,47 (d, J=16,0 Hz, 1H), 4,12 (q, J=9,6 Hz, 2H), 3,75 (bs, 2H), 3,36 (s, 2H), 2,55-2,52 (m, 1H), 2,15 (s, 3H), 1,91-1,83 (m, 4H), 1,81-1,72 (m, 4H), 1,69-1,64 (m, 6H), 1,63-1,41 (m, 6H), 1,36-1,08 (m, 3H), 0,8 (t, J=8,8 Hz, 6H). LCMS: (методика A) 657,2 (M++H), Rt. 3,74 мин, 93,37% (максимально).
Промежуточный продукт 53
Этил-(E)-3-((3-бутил-5-(4-(циклопентанкарбоксамидо)фенил)-3-этил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат

При перемешивании к раствору этил-(E)-3-((5-(4-аминофенил)-3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 50; 0,125 г, 0,23 ммоля) в DMF (3 мл) при 0°C добавляли DIPEA (0,12 мл, 0,7 ммоля), циклопентанкарбоновую кислоту (0,040 г, 0,35 ммоля) и HATU (0,178 г, 0,46 ммоля) и реакционную смесь перемешивали в течение 1 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь выливали в охлажденную льдом воду (10 мл) и водный слой экстрагировали с помощью EtOAc (2×15 мл). Объединенный органический слой промывали водой (15 мл), сушили над безводным Na2SO4 и концентрировали в вакууме и получали неочищенное искомое соединение, которое направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 140 мг (неочищенное почти белое твердое вещество).
1H-NMR (400 MHz, DMSO-d6): δ 9,83 (s, 1H), 7,73 (d, J=12,2 Hz, 1H), 7,57 (d, J=8,7 Hz, 2H), 7,48 (s, 1H), 7,17 (d, J=7,6 Hz, 2H), 6,58 (s, 1H), 5,48 (d, J=12,3 Hz, 1H), 4,12 (q, J=7,0 Hz, 2H), 3,74 (bs, 2H), 3,33 (s, 2H), 2,77-2,74 (m, 1H), 2,16 (s, 3H), 1,85-1,83 (m, 2H), 1,74-1,72 (m, 4H), 1,69-1,55 (m, 3H), 1,54-1,44 (m, 3H), 1,38-1,35 (m, 3H), 1,31-1,21 (m, 4H), 0,8 (t, J=6,3 Hz, 6H). LCMS: (методика A) 629,2 (M++H), Rt. 3,57 мин, 90,68% (максимально).
Промежуточный продукт 54
2-(((2-Амино-5-метоксифенил)тио)метил)-2-этилбутановая кислота
При перемешивании к раствору 6-метоксибензо[d]тиазол-2-амина (339 г, 1,88 моля) в воде (3390 мл) добавляли KOH (1688 г, 30,09 моля) и реакционную смесь перемешивали в течение 16 ч при 120°C. После завершения реакции (следили с помощью LCMS), смесь охлаждали до комнатной температуры. Затем по каплям добавляли 2-(бромметил)-2-этилбутановую кислоту (590 г, 2,82 моля; раствор в 1500 мл THF) и смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью LCMS) реакционную смесь охлаждали до 0°C и подкисляли концентрированной HCl (pH ~2). Реакционную смесь экстрагировали с помощью EtOAc (2×4000 мл) и объединенный органический слой промывали водой (1000 мл) и рассолом (500 мл). Органическую часть сушили над безводным Na2SO4 и концентрировали в вакууме и получали неочищенное искомое соединение, которое направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 650 г (неочищенное коричневое смолообразное вещество).
LCMS: (методика A) 284 (M++H), Rt. 1,82 мин, 88,77% (максимально).
Промежуточный продукт 55
3,3-Диэтил-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5H)-он

При перемешивании к раствору 2-(((2-амино-5-метоксифенил)тио)метил)-2-этилбутановой кислоты (промежуточный продукт 54; 650 г, 2,29 моля) в EtOAc (2500 мл) при 0°C по каплям добавляли триэтиламин (463 г, 4,586 моля) и раствор 1-пропанфосфорного ангидрида (50% в EtOAc; 1021 г, 3,211 моля) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью LCMS) к реакционной смеси добавляли воду (2000 мл) и водный слой экстрагировали с помощью EtOAc (2×2000 мл). Объединенный органический слой промывали рассолом (50 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали путем промывки метанолом и получали искомое соединение. Выход: 65% (295 г, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6) δ 9,56 (s, 1H), 7,06-7,03 (m, 1H), 6,97 (s, 1H), 6,87-6,86 (m, 1H), 3,73 (s, 3H), 2,96 (s, 2H), 1,67-1,66 (m, 2H), 1,56-1,54 (m, 2H), 0,79-0,77 (m, 6H). LCMS: (методика A) 266,1 (M++H), Rt. 2,30 мин, 99,45% (максимально).
Промежуточный продукт 56
7-Бром-3,3-диэтил-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5H)-он

При перемешивании к раствору 3,3-диэтил-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5H)-она (промежуточный продукт 55; 100 г, 0,376 моля) в смеси 1:1 DCM и ацетонитрил (1000 мл) порциями добавляли N-бромсукцинимид (80 г, 0,452 моля) и раствор перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали и полученное неочищенное вещество обрабатывали холодным ацетонитрилом и перемешивали в течение 30 мин. Полученный осадок отфильтровывали и промывали холодным ацетонитрилом (2×80 мл) и сушили в вакууме и получали искомое соединение. Выход: 180 г (неочищенное коричневое твердое вещество).
1H NMR (400 MHz, DMSO-d6) δ 9,63 (s, 1H), 7,34 (s, 1H), 7,11 (s, 1H), 3,83 (s, 3H), 2,98 (s, 2H), 1,64-1,66 (m, 2H), 1,50-1,52 (m, 2H), 0,76-0,78 (m, 6H). LCMS: (методика A) 344,1 (M++H), Rt. 2,47 мин, 96,70% (максимально).
Промежуточный продукт 57
7-Бром-3,3-диэтил-8-метокси-5-фенил-2,3-дигидро-1,5-бензотиазепин-4(5H)-он и 3,3-диэтил-7-йод-8-метокси-5-фенил-2,3-дигидро-1,5-бензотиазепин-4(5H)-он
При перемешивании к раствору 7-бром-3,3-диэтил-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5H)-она (промежуточный продукт 56; 180 г, 0,522 моля) в йодбензоле (1400 мл) добавляли йодид меди(I) (20 г, 0,104 моля) и K2CO3(144 г, 1,044 моля) и раствор продували азотом в течение 20 мин для дегазации. Затем добавляли трис[2-(2-метоксиэтокси)этил]амин (16,8 г, 0,052 моля) в атмосфере азота и полученную реакционную смесь нагревали в течение 40 ч при 135°C. После завершения реакции (следили с помощью UPLC) реакционную смесь фильтровали через целит и слой целита промывали с помощью EtOAc (2000 мл). Фильтрат концентрировали в вакууме и получали неочищенное вещество, которое кристаллизовали из холодного петролейного эфира. Полученный осадок отфильтровывали и промывали холодным петролейным эфиром и получали смесь искомых соединений. Выход: 200 г (неочищенное светло-желтое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,37-7,37 (m, 2H), 7,23-7,28 (m, 2H), 7,08-7,09 (m, 2H), 3,89 (s, 2H), 3,48-3,48 (m, 1H), 3,42-3,42 (m, 3H), 3,24 (s, 2H), 3,15 (d, J=3,28 Hz, 2H), 2,64-2,65 (m, 1H), 1,46-1,48 (m, 4H), 0,77-0,77 (m, 6H). LCMS: (методика A) 420,1 (M++H) 30,8%; 468,1 (M++H) 51,8%; Rt. 2,97 и 2,98 мин, 82,6% (максимально).
Промежуточный продукт 58
7-Бром-3,3-диэтил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин и 3,3-диэтил-7-йод-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин
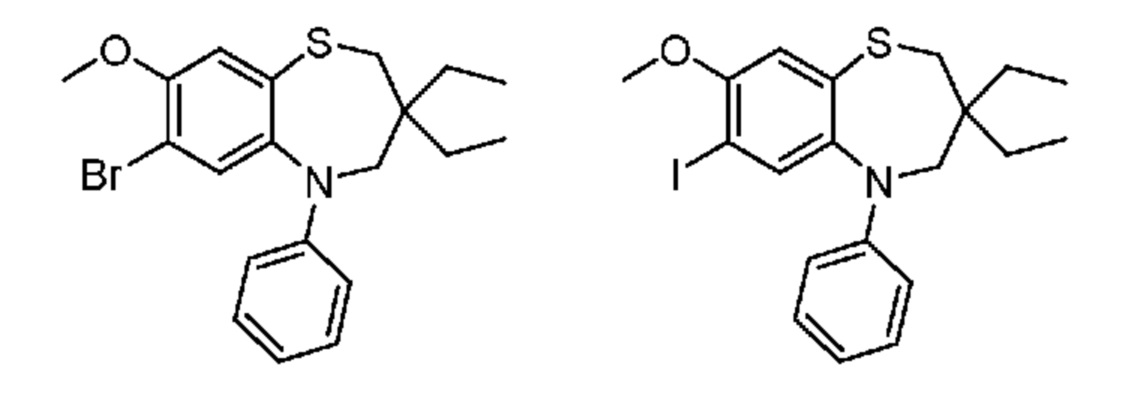
При перемешивании к раствору смеси 7-бром-3,3-диэтил-8-метокси-5-фенил-2,3-дигидро-1,5-бензотиазепин-4(5H)-она и 3,3-диэтил-7-йод-8-метокси-5-фенил-2,3-дигидро-1,5-бензотиазепин-4(5H)-она (промежуточный продукт 57; 100 г, 0,2378 моля) в THF (1000 мл) при 0°C по каплям добавляли диметилсульфид борана (2M в THF; 356 мл, 0,713 моля) и реакционную смесь кипятили с обратным холодильником 40 ч при 75°C. После завершения реакции (следили с помощью TLC) реакционную смесь охлаждали до 0°C и реакцию останавливали метанолом (200 мл). Полученный раствор нагревали в течение 2 ч при 65°C, затем охлаждали до комнатной температуры и концентрировали в вакууме и получали смесь искомых соединений. Полученное неочищенное вещество направляли на следующую стадию без какой-либо дополнительной очистки Выход: 120 г (неочищенная темно-коричневая жидкость).
LCMS: (методика A) 407,0 (M++H), 41,3% и 454,0 (M++H) 53,1%; Rt. 3,81и 3,95 мин, 94,4% (максимально).
Промежуточный продукт 59
7-Бром-3,3-диэтил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид и 3,3-диэтил-7-йод-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид

При перемешивании к раствору смеси 7-бром-3,3-диэтил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепина и 3,3-диэтил-7-йод-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепина (промежуточный продукт 58; 120 г, 0,295 моля) в THF (600 мл) при комнатной температуре добавляли воду (600 мл) и оксон (907 г, 2,95 моля) и реакционную смесь перемешивали в течение 24 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь фильтровали через воронку Бюхнера и фильтрат экстрагировали с помощью EtOAc (2×2500 мл). Объединенный органический слой промывали водой (1000 мл) и рассолом (500 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали с помощью колоночной хроматографии (элюент: 8 -10% EtOAc/PE; силикагель: 230-400 меш) и получали смесь искомых соединений. Выход: 73% (95 г, желтоватое твердое вещество).
1H NMR (400 MHz, DMSO-d6) δ 7,33-7,34 (m, 2H), 7,19-7,22 (m, 2H), 6,87-6,89 (m, 2H), 4,26 (t, J=7,04 Hz, 1H), 3,90-3,92 (m, 3H), 3,67-3,69 (m, 2H), 2,41-2,43 (m, 1H), 2,11-2,13 (m, 2H), 1,50-1,52 (m, 2H), 1,30-1,31 (m, 2H), 0,71-0,73 (m, 6H). LCMS: (методика A) 440,0 (M++H), 486,0 (M++H), Rt. 2,98 мин и 2,99 мин, 80,7% (максимально).
Промежуточный продукт 60
3,3-Диэтил-8-гидрокси-7-(метилтио)-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид
При перемешивании к раствору смеси 7-бром-3,3-диэтил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида и 3,3-диэтил-7-йод-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 59; 95 г, 0,216 ммоля) в DMF (950 мл) добавляли тиометоксид натрия (45,6 г, 0,650 ммоля) и полученную реакционную смесь нагревали в течение 16 ч при 60°C. После завершения реакции (следили с помощью TLC) к реакционной смеси добавляли воду (500 мл) и водный слой экстрагировали с помощью EtOAc (2×1000 мл). Объединенный органический слой промывали рассолом (50 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали с помощью колоночной хроматографии (элюент: 15 -20% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 59% (50 г, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 10,57 (s, 2H), 7,31 (s, 2H), 7,16-7,18 (m, 2H), 6,89 (d, J=7,68 Hz, 2H), 6,76-6,78 (m, 2H), 6,66 (s, 2H), 3,64 (s, 1H), 3,20 (s, 2H), 2,18 (s, 3H), 1,53-1,55 (m, 2H), 1,38-1,30 (m, 2H), 0,74-0,76 (m, 6H). LCMS: (методика A) 392,1 (M++H), Rt. 2,54 мин, 74,77% (максимально).
Промежуточный продукт 61
Этил-(E)-3-((3,3-диэтил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат

При перемешивании к раствору 3,3-диэтил-8-гидрокси-7-(метилтио)-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 60; 0,3 г, 0,76 ммоля) в сухом THF (6 мл) добавляли этилпропиолат (0,11 г, 1,14 ммоля) и DABCO (8,6 мг, 0,076 ммоля) и раствор перемешивали в течение 30 мин. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали. Полученный остаток подвергали распределению между водой (10 мл) и EtOAc (15 мл) и водный слой экстрагировали с помощью EtOAc (2×15 мл). Объединенную органическую часть затем промывали рассолом (10 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 25% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 45% (0,17 г, белое твердое вещество).
1H-NMR (400 MHz, DMSO-d6): δ1H-NMR (400 MHz, DMSO-d6): δ 7,76 (dd, J=12,2, 0,8 Hz, 1H), 7,52 (d, J=0,80 Hz, 1H), 7,32-7,28 (m, 2H), 7,14 (d, J=7,6 Hz, 2H), 6,98 (t, J=7,2 Hz, 1H), 6,72 (s, 1H), 5,53 (dd, J=12,0, 1,2 Hz, 1H), 4,13 (q, J=0,8 Hz, 2H), 3,76 (s, 2H), 3,37 (s, 2H), 2,19 (s, 3H), 1,54-1,52 (m, 2H), 1,39-1,34 (m, 2H), 1,24-1,20 (m, 6H).
Промежуточный продукт 62
Этил-(E)-3-((3,3-дибутил-5-(4-бутирамидофенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат

При перемешивании к раствору этил-(E)-3-((5-(4-аминофенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 35; 0,125 г, 0,22 ммоля) в DCM (3 мл) при 0°C добавляли триэтиламин (0,045 г 0,45 ммоля) и затем бутирилхлорид (0,029 г 0,27 ммоля) и реакционную смесь перемешивали в течение 2 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь разбавляли с помощью DCM (10 мл) и органический слой промывали насыщенным раствором NaHCO3 (15 мл). Органический слой сушили над безводным Na2SO4 и концентрировали в вакууме и получали неочищенное искомое соединение, которое направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 145 мг (неочищенное почти белое твердое вещество).
1H-NMR (400 MHz, CDCl3): δ 7,69 (d, J=Hz, 1H), 7,64 (d, J=9,6 Hz, 1H), 7,52 (d, J=10,8 Hz, 2H), 7,17-7,11 (m, 3H), 6,56 (s, 1H), 5,54 (d, J=16,4 Hz, 1H), 4,21 (q, J=9,2 Hz, 2H), 3,77 (bs, 2H), 3,22 (s, 2H), 2,45 (t, J=9,60 Hz, 2H), 2,16 (s, 3H), 1,84-1,79 (m, 2H), 1,76-1,68 (m, 3H), 1,53-1,44 (m, 6H), 1,41-1,20 (m, 9H), 0,99-0,93 (m, 6H). LCMS: (методика A) 631,3 (M++H), Rt. 2,86 мин, 92,69% (максимально).
Промежуточный продукт 63
Метил-(Z)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилат
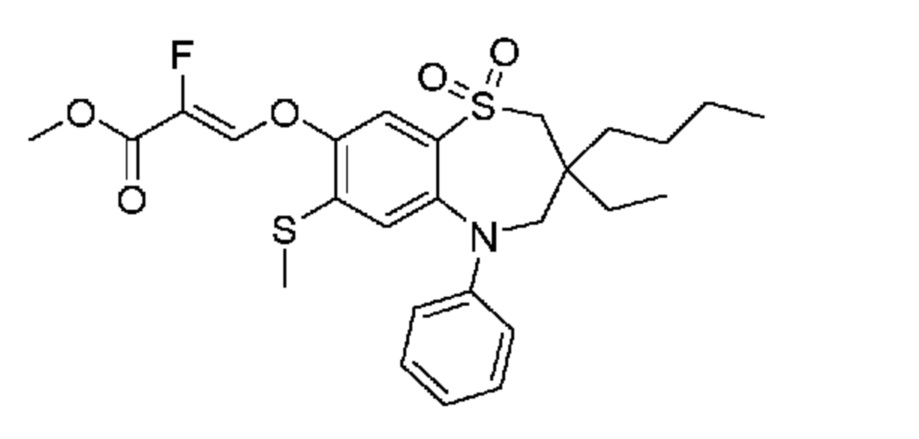
К раствору 3-бутил-3-этил-8-гидрокси-7-(метилтио)-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 23; 0,2 г, 0,5 ммоля) в DMF (2 мл) при 0°C порциями добавляли 60% NaH (0,024 г, 1,02 ммоля) и раствор перемешивали в течение 15 мин. Добавляли метил-3-бром-2,2-дифторпропаноат (0,21 г, 1,02 ммоля) и реакционную смесь нагревали при 85°C в течение ночи. После завершения реакции (следили с помощью TLC) реакционную массу охлаждали до 0°C и реакцию останавливали с помощью 1,5 н. HCl (pH ~4) и разбавляли водой (5 мл). Водный слой экстрагировали с помощью EtOAc (2×10 мл) и объединенный органический слой промывали рассолом (10 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и получали неочищенное искомое соединение, которое дополнительно растирали c диэтиловым эфиром. Полученное соединение сушили в вакууме и направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 46% (0,11 г, коричневое смолообразное вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,70-7,65 (m, 1H), 7,60 (s, 1H), 7,32-7,30 (m, 2H), 7,15-7,13 (m, 2H), 7,00-6,98 (m, 1H), 6,69 (s, 1H), 3,80 (s, 3H), 3,75 (s, 2H), 3,36 (s, 2H), 2,20 (s, 3H), 1,43-1,41 (m, 4H), 1,18-1,10 (m, 4H), 0,74 (t, J=4,80 Hz, 6H). LCMS: (методика A) 522,3 (M++H), Rt. 3,01 мин, 89,38% (максимально).
Промежуточный продукт 64
Метил-(Z)-3-((3,3-диэтил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилат
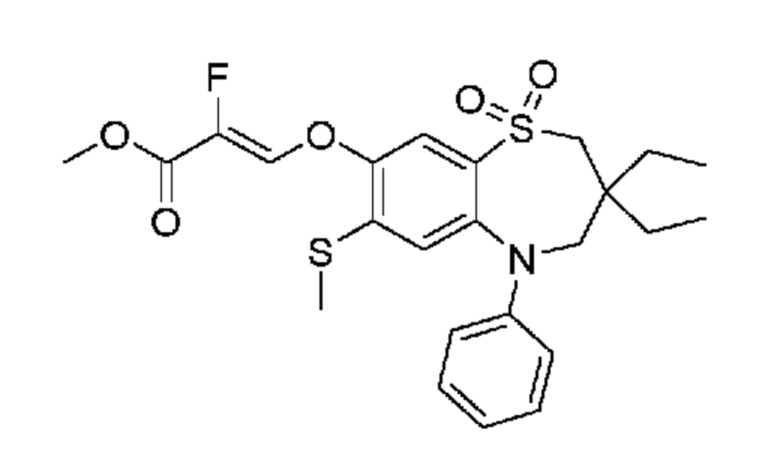
При перемешивании к раствору 3,3-диэтил-8-гидрокси-7-(метилтио)-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 60; 0,2 г, 0,5 ммоля) в DMF (2 мл) при 0°C порциями добавляли 60% NaH (0,024 г, 1,02 ммоля) и смесь перемешивали в течение 15 мин. Добавляли метил-3-бром-2,2-дифторпропаноат (0,21 г, 1,02 ммоля) и реакционную смесь нагревали при 85°C в течение ночи. После завершения реакции (следили с помощью TLC) реакционную массу охлаждали до 0°C и реакцию останавливали с помощью 1,5 н. HCl (pH ~4) и разбавляли водой (5 мл). Водный слой экстрагировали с помощью EtOAc (2×10 мл) и объединенный органический слой промывали рассолом (10 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и получали неочищенное искомое соединение, которое дополнительно растирали c диэтиловым эфиром. Полученное соединение сушили в вакууме и направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 25% (0,06 г, почти белое твердое вещество).
1H NMR (300 MHz, DMSO-d6): δ 7,71-7,65 (m, 1H), 7,61 (s, 1H), 7,31-7,29 (m, 2H), 7,12-7,09 (m, 2H), 6,99-6,94 (m, 1H), 6,72 (s, 1H), 3,79 (s, 3H), 3,83 (s, 2H), 3,35 (s, 2H), 2,21 (s, 3H), 1,56-1,54 (m, 2H), 1,40-1,37 (m, 2H), 0,73 (t, J=6,90 Hz, 6H). LCMS: (методика A) 550,2 (M++H), Rt. 2,87 мин, 93,92% (максимально).
Промежуточный продукт 65
3,3-Дибутил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид

При перемешивании к раствору 7-бром-3,3-дибутил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (0,5 г, 1,01 ммоля) в смеси MeOH и воды (10 мл, 4:1) добавляли NH4Cl (0,86 г, 8,08 ммоля) и порошкообразный Zn (0,32 г, 5,06 ммоля) и реакционную смесь нагревали в течение 3 ч при 65°C. После завершения реакции (следили с помощью TLC) реакцию останавливали водой (15 мл) и водный слой экстрагировали с помощью EtOAc (2×25 мл). Объединенный органический слой промывали рассолом (15 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 15% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 66% (0,28 г, белое твердое вещество).
1H-NMR (400 MHz, DMSO-d6): δ 7,52 (d, J=2,8 Hz, 1H), 7,30-7,24 (m, 2H), 7,05-7,03 (m, 2H), 6,99-6,93 (m, 3H), 3,84 (s, 3H), 3,72 (s, 2H), 3,20 (s, 2H), 1,53-1,41 (m, 4H), 1,28-1,12 (m, 8H), 1,00-0,91 (m, 6H). LCMS: (методика A) 416,2 (M+H), Rt. 3,29 мин, 88,66% (максимально).
Промежуточный продукт 66
3,3-Дибутил-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид
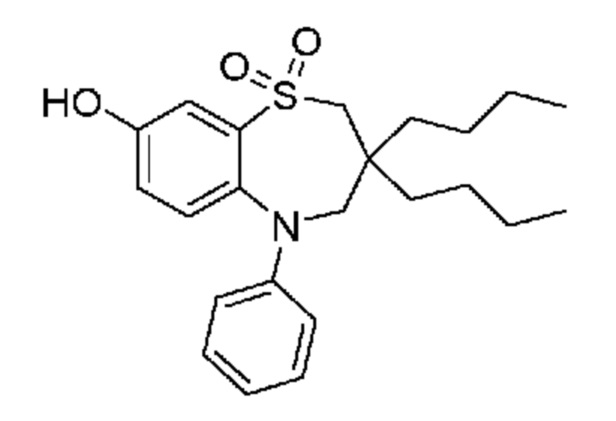
При перемешивании к раствору 3,3-дибутил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 65; 0,28 г, 0,67 ммоля) в сухом DCM (6 мл) при 0°C добавляли BBr3 (1M, 1,4 мл, 1,34 ммоля) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь охлаждали и реакцию останавливали насыщенным раствором Na2CO3 (6 мл). Органический слой отделяли, промывали рассолом (6 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и получали неочищенное искомое соединение, которое направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 74% (200 мг, коричневое смолообразное вещество).
1H-NMR (400 MHz, DMSO-d6): δ 9,99 (s, 1H), 7,29 (d, J=2,7 Hz, 1H), 7,18 (t, J=7,6 Hz, 2H), 6,97-6,89 (m, 4H), 6,81 (t, J=7,2 Hz, 1H), 3,64 (s, 2H), 3,24 (s, 2H), 1,42-1,39 (m, 4H), 1,35-1,24 (m, 8H), 1,17-1,14 (m, 6H). LCMS: (методика A) 402,2 (M+H), Rt. 2,98 мин, 83,09% (максимально).
Промежуточный продукт 67
Метил-(Z)-3-((3,3-дибутил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилат

При перемешивании к раствору 3,3-дибутил-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 66; 0,2 г, 0,49 ммоля) в DMF (2 мл) при 0°C добавляли NaH (60% в минеральном масле; 0,03 г, 0,75 ммоля) и реакционную смесь перемешивали в течение 15 мин. Затем по каплям добавляли метил-3-бром-2,2-дифторпропаноат (0,15 г, 0,74 ммоля) и смесь нагревали в течение 16 ч при 85°C. После завершения реакции (следили с помощью TLC) реакцию останавливали разбавленной HCl (3 мл, 1,5 н.) и водный слой экстрагировали с помощью EtOAc (2×15 мл). Объединенную органическую часть промывали рассолом (10 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 35% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 32% (0,08 г, коричневое твердое вещество).
LCMS: (методика E) 504,2 (M+H), Rt. 2,98 мин, 24,81% (максимально).
Промежуточный продукт 68
5-Хлор-6-метоксибензо[d]тиазол-2-амин
При перемешивании к раствору 3-хлор-4-метоксианилина (10 г, 63,4 ммоля) в уксусной кислоте (100 мл) при комнатной температуре добавляли тиоцианат аммония (5,3 г, 69,8 ммоля) и затем смесь перемешивали в течение 30 мин. К реакционной смеси по каплям добавляли бром (3,2 мл, 63,4 ммоля), растворенный в уксусной кислоте (20 мл), при 15°C и полученную смесь перемешивали в течение 3 ч при комнатной температуре. После завершения реакции полученное твердое вещество отфильтровывали, промывали уксусной кислотой (20 мл) и затем сушили в вакууме. Затем твердое вещество суспендировали в воде (20 мл) и подщелачивали 10% раствором NaOH примерно до pH 10. Твердое вещество отфильтровывали, промывали водой (3×25 мл) и затем сушили в вакууме и получали искомое соединение. Выход: 80% (11 г, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,53 (s, 1H), 7,41 (bs, 2H), 7,36 (s, 1H), 3,82 (s, 3H). LCMS: (методика A) 215,0 (M++H), Rt. 1,39 мин, 97,22% (максимально).
Промежуточный продукт 69
2-(((2-Амино-4-хлор-5-метоксифенил)тио)метил)-2-этилгексановая кислота
При перемешивании к раствору 5-хлор-6-метоксибензо[d]тиазол-2-амина (промежуточный продукт 68; 8 г, 0,037 моля) в воде (120 мл) добавляли KOH (34 г, 0,596 моля) и реакционную смесь перемешивали в течение 16 ч при 120°C. После завершения реакции (следили с помощью LCMS) реакционную смесь охлаждали до комнатной температуры. По каплям добавляли 2-(бромметил)-2-этилгексановую кислоту (13,29 г, 0,0558 моля; раствор в 40 мл THF) и затем смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью LCMS) реакционную смесь охлаждали до 0°C и подкисляли концентрированной HCl (pH ~2). Реакционную смесь экстрагировали с помощью EtOAc (2×25 мл). Затем объединенный органический слой промывали водой (30 мл) и рассолом (30 мл), сушили над безводным Na2SO4 и концентрировали в вакууме и получали неочищенное вещество. Полученное неочищенное вещество направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 21 г (неочищенное коричневое смолообразное вещество).
UPLC: (методика A) 345,8 (M++H), Rt. 1,58 мин, 90,21% (максимально).
Промежуточный продукт 70
3-Бутил-7-хлор-3-этил-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5H)-он

При перемешивании к раствору 2-(((2-амино-4-хлор-5-метоксифенил)тио)метил)-2-этилгексановой кислоты (промежуточный продукт 69; 21 г, 0,0607 моля) в EtOAc (130 мл) при 0°C по каплям добавляли триэтиламин ( 12,26 г, 0,1214 моля) и раствор 1-пропанфосфорного ангидрида (50% EtOAc; 23,16 г, 0,073 моля) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью UPLC) к реакционной смеси добавляли воду (25 мл) и водный слой экстрагировали с помощью EtOAc (2×25 мл). Объединенный органический слой промывали рассолом (25 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 10-12% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 55% (11 г, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 9,61 (s, 1H), 7,16 (d, J=14,8 Hz, 2H), 3,82 (s, 3H), 2,98 (s, 2H), 1,51-1,53 (m, 4H), 1,32-1,26 (m, 4H), 0,92-0,91 (m, 6H). LCMS: (методика A) 328,1 (M++H), Rt. 2,60 мин, 95,79% (максимально). HPLC: (методика B) Rt. 5,51 мин, 97,62% (максимально).
Промежуточный продукт 71
3-Бутил-7-хлор-3-этил-8-метокси-5-фенил-2,3-дигидро-1,5-бензотиазепин-4(5H)-он

При перемешивании к раствору 3-бутил-7-хлор-3-этил-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5H)-она (промежуточный продукт 70; 11 г, 0,034 моля) в йодбензоле (110 мл) добавляли йодид меди(I) (0,640 г, 0,0034 моля) и K2CO3(9,25 г, 0,067 моля) и раствор продували азотом в течение 20 мин для дегазации. Затем добавляли трис[2-(2-метоксиэтокси)этил]амин (2,16 г, 0,0067 моля) в атмосфере азота и полученную реакционную смесь нагревали в течение 40 ч при 135°C. После завершения реакции (следили с помощью UPLC) реакционную смесь фильтровали через целит и слой целита промывали с помощью EtOAc (25 мл). Фильтрат концентрировали в вакууме и получали неочищенное вещество, которое очищали с помощью колоночной хроматографии Isolera (элюент: 3-5% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 86% (11,7 г, бледно-коричневое твердое вещество).
1H NMR (300 MHz, DMSO-d6): δ 7,40-7,39 (m, 3H), 7,29 (d, J=7,2 Hz, 1H), 7,09 (d, J=6,9 Hz, 2H), 6,96 (s, 1H), 3,91 (s, 3H), 3,16 (s, 2H), 1,57-1,55 (m, 4H), 1,19 (d, J=6,9 Hz, 5H), 0,79 (t, J=6,3 Hz, 7H). LCMS: (методика A) 404,1 (M++H), Rt. 3,19 мин, 98,20% (максимально).
Промежуточный продукт 72
3-Бутил-7-хлор-3-этил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин
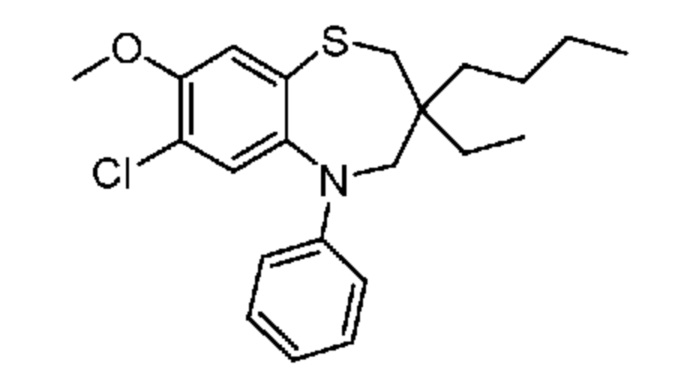
При перемешивании к раствору 3-бутил-7-хлор-3-этил-8-метокси-5-фенил-2,3-дигидро-1,5-бензотиазепин-4(5H)-она (промежуточный продукт 71; 11,7 г, 0,029 моля) в THF (110 мл) при 0°C по каплям добавляли диметилсульфид борана (2M в THF; 73 мл, 0,144 моля) и реакционную смесь кипятили с обратным холодильником в течение 40 ч при 75°C. После завершения реакции (следили с помощью UPLC) реакционную смесь охлаждали до 0°C и реакцию останавливали метанолом (50 мл). Полученный раствор нагревали в течение 2 ч при 65°C, затем охлаждали до RT и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 8-10% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 90% (10,2 г, бесцветная жидкость).
1H NMR (400 MHz, DMSO-d6): δ 7,19 (t, J=7,2 Hz, 2H), 7,08 (s, 1H), 6,93 (s, 2H), 6,79 (d, J=4,0 Hz, 2H), 3,82 (s, 3H), 2,76 (s, 2H), 1,26-1,24 (m, 9H), 0,76-0,71 (m, 6H). LCMS: (методика A) 390,2 (M++H), Rt. 3,01 мин, 99,61% (максимально).
Промежуточный продукт 73
3-Бутил-7-хлор-3-этил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид

При перемешивании к раствору 3-бутил-7-хлор-3-этил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепина (промежуточный продукт 72; 10,2 г, 0,0261mol) в 1,4-диоксане (100 мл) при комнатной температуре добавляли воду (100 мл) и оксон (81 г, 0,2615 моля) и реакционную смесь перемешивали в течение 24 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь фильтровали через воронку Бюхнера и фильтрат экстрагировали с помощью EtOAc (2×25 мл). Объединенный органический слой промывали водой (25 мл) и рассолом (25 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 10-12% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 56% (6,2 г, желтоватое твердое вещество).
1H NMR (300 MHz, DMSO-d6): δ 7,50 (s, 1H), 7,27 (t, J=7,8 Hz, 2H), 7,07-7,04 (m, 4H), 3,94 (s, 3H), 3,69 (s, 2H), 3,33 (s, 2H), 1,52-1,37 (m, 8H), 0,77-0,74 (m, 6H). LCMS: (методика A) 422,1 (M++H), Rt. 3,18 мин, 98,51% (максимально).
Промежуточный продукт 74
3-Бутил-7-хлор-3-этил-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид

При перемешивании к раствору 3-бутил-7-хлор-3-этил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 73; 1,1 г, 2,60 ммоля) в DCM (11 мл) при 0°C добавляли BBr3 (1M раствор в DCM, 13,03 мл, 13,03 ммоля) и раствор перемешивали в течение 1 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) по каплям добавляли при метанол 0°C до прекращения выделения газа. Реакционную смесь разбавляли с помощью DCM (20 мл) и промывали водой (2×20 мл) и рассолом (20 мл). Органическую часть сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 30-32% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 94% (1,0 г, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 10,83 (s, 1H), 7,50 (s, 1H), 7,23 (t, J=8,0 Hz, 2H), 6,99 (d, J=7,6 Hz, 2H), 6,97 (s, 1H), 6,88 (t, J=7,2 Hz, 1H), 3,64 (s, 2H), 3,28 (s, 2H), 1,51-1,34 (m, 4H), 1,12-1,02 (m, 4H), 0,77-0,72 (m, 6H). LCMS: (методика A) 408,2 (M++H), Rt. 2,87 мин, 93,25% (максимально).
Промежуточный продукт 75
Метил-(Z)-3-((3-бутил-7-хлор-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилат

При перемешивании к раствору 3-бутил-7-хлор-3-этил-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 74; 1,0 г, 2,45 ммоля) в DMF (10 мл) при 0°C порциями добавляли 60% NaH (0,18 г, 7,35 ммоля) и реакционную смесь перемешивали в течение 15 мин. Затем добавляли метил-3-бром-2,2-дифторпропаноат (0,99 г, 4,90 ммоля) и реакционную смесь нагревали при 70°C в течение ночи. После завершения реакции (следили с помощью TLC) реакционную массу охлаждали до 0°C и реакцию останавливали с помощью 1,5 н. HCl (pH ~4) и разбавляли водой (10 мл). Водный слой экстрагировали с помощью EtOAc (2×15 мл). Объединенный органический слой промывали рассолом (10 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и получали неочищенное искомое соединение, которое дополнительно растирали c диэтиловым эфиром. Полученное соединение сушили в вакууме и направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 59% (0,74 г, бледно-желтое смолообразное вещество).
LCMS: (методика A) 510,1 (M+H), Rt. 3,13 мин, 94,43% (максимально).
Промежуточный продукт 76
Этил-(E)-3-((3-бутил-7-хлор-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат
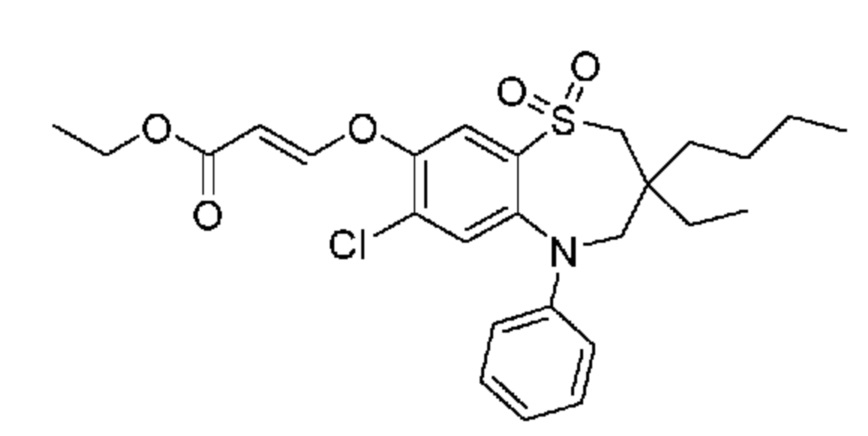
При перемешивании к раствору 3-бутил-7-хлор-3-этил-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 74; 0,95 г, 2,33 ммоля) в THF (10 мл) добавляли DABCO (0,026 г, 0,23 ммоля) и этилпропиолат (0,28 мл, 2,8 ммоля) при 0°C. Затем реакционную смесь перемешивали в течение 1 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь выливали в охлажденную льдом воду (15 мл) и водный слой экстрагировали с помощью EtOAc (3×15 мл). Объединенный органический слой промывали рассолом (20 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 8-9% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 84,7% (1,0 г, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,81 (d, J=16,4 Hz, 1H), 7,70 (s, 1H), 7,39-7,34 (m, 2H), 7,28-7,26 (m, 2H), 7,09 (t, J=9,6 Hz, 1H), 6,90 (s, 1H), 5,48 (d, J=16,4 Hz, 1H), 4,13 (q, J=9,2 Hz, 2H), 3,81 (bs, 2H), 3,46 (s, 2H), 1,55-1,50 (m, 4H), 1,34 (t, J=10,00 Hz, 3H), 1,30-1,15 (m, 4H), 0,92 (t, J=4,40 Hz, 6H). LCMS: (методика A) 506,1(M+), Rt. 3,28 мин, 97,07% (максимально).
Промежуточный продукт 77
Метил-(Z)-3-((3,3-диэтил-7-(метилтио)-5-(4-нитрофенил)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилат

При перемешивании к раствору метил-(Z)-3-((3,3-диэтил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилата (промежуточный продукт 64; 1,0 г, 1,97 ммоля) в смеси 1:1 DCM и AcOH (15 мл) при 0°C добавляли HNO3 (65%; 0,186 г, 2,95 ммоля) в смеси DCM и AcOH (5 мл). После завершения реакции (следили с помощью TLC) реакционную смесь разбавляли с помощью DCM (15 мл). Органический слой промывали водой (15 мл) и насыщенным раствором NaHCO3 (15 мл). Органический слой сушили над безводным Na2SO4 и концентрировали в вакууме и получали неочищенный искомый продукт, который направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 900 мг (неочищенное коричневое твердое вещество).
LCMS: (методика A), Rt,2,62 мин, 88% (максимально).
Промежуточный продукт 78
Метил-(Z)-3-((5-(4-аминофенил)-3,3-диэтил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилат
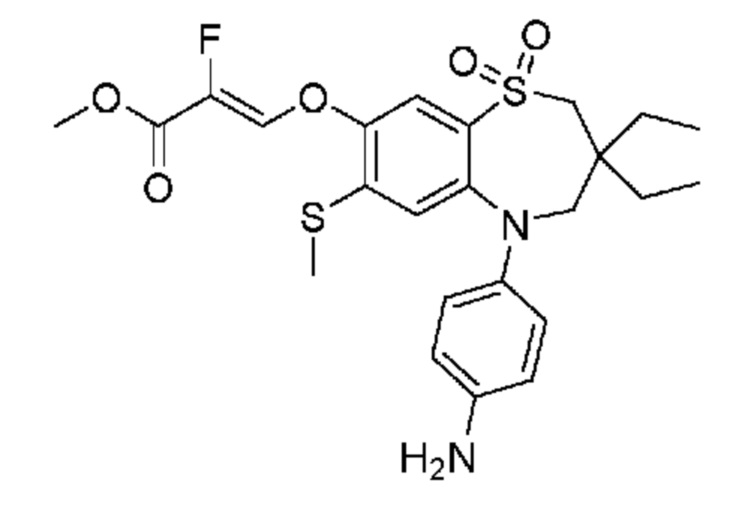
При перемешивании к раствору метил-(Z)-3-((3,3-диэтил-7-(метилтио)-5-(4-нитрофенил)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилата (промежуточный продукт 77; 0,9 г, 1,67 ммоля) в THF (15 мл) при комнатной температуре добавляли концентрированную HCl (1 мл) и SnCl2 (1,26 г, 6,69 ммоля) и реакционную смесь перемешивали в течение 12 ч при 70°C. После завершения реакции (следили с помощью TLC) реакцию останавливали насыщенным раствором NaHCO3 (15 мл) и фильтровали через целит. Слой целита промывали с помощью EtOAc (2×15 мл) и полученный фильтрат промывали водой (2×25 мл). Объединенный органический слой сушили над безводным Na2SO4 и концентрировали в вакууме и получали неочищенное искомое соединение, которое направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 650 мг (неочищенное желтое твердое вещество).
Промежуточный продукт 79
Метил-(Z)-3-((3,3-диэтил-7-(метилтио)-1,1-диоксидо-5-(4-пиваламидофенил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилат
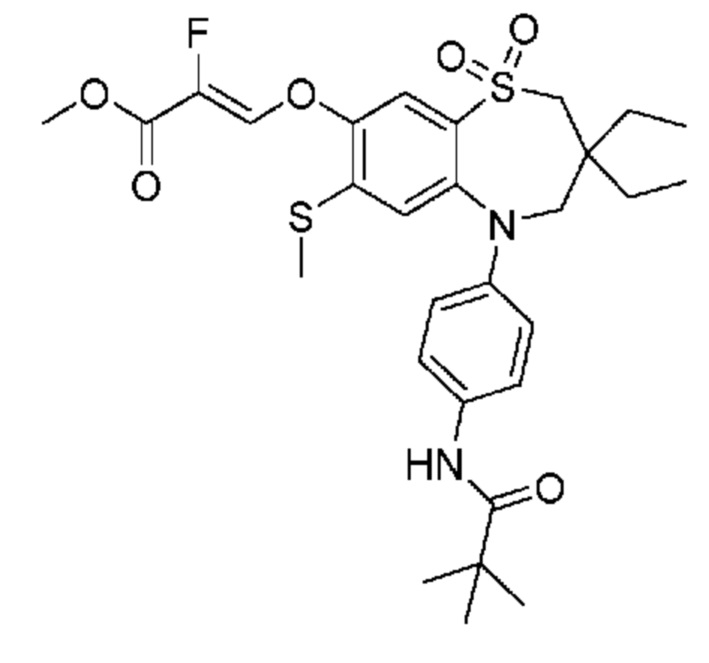
При перемешивании к раствору метил-(Z)-3-((5-(4-аминофенил)-3,3-диэтил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилата (промежуточный продукт 78; 0,15 г, 0,29 ммоля) в DCM (5 мл) добавляли TEA (0,082 мл, 0,59 ммоля) и пивалоилхлорид (0,038 мл, 0,44 ммоля) при 0°C и реакционную смесь перемешивали в течение 2 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь разбавляли с помощью DCM (15 мл) и промывали насыщенным раствором NaHCO3 (15 мл). Органический слой сушили над безводным Na2SO4 и концентрировали в вакууме и получали неочищенное искомое соединение, которое направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 180 мг (неочищенное белое смолообразное вещество).
Промежуточный продукт 80
Метил-(Z)-3-((3,3-дибутил-7-хлор-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилат

При перемешивании к раствору 3,3-дибутил-7-хлор-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (300 мг, 0,688 ммоля) в DMF (3 мл) при 0°C порциями добавляли NaH (60%; 138 мг, 3,44 ммоля) и смесь перемешивали в течение 15 мин. Затем добавляли метил-3-бром-2,2-дифторпропаноат (419 мг, 2,06 ммоля) и реакционную смесь нагревали в течение 16 ч при 85°C. После завершения реакции (следили с помощью TLC) реакционную массу охлаждали до 0°C, реакцию останавливали с помощью 1,5 н. HCl (pH ~4) и разбавляли водой (5 мл). Водный слой экстрагировали с помощью EtOAc (2×10 мл) и объединенный органический слой промывали рассолом (10 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и получали неочищенное искомое соединение, которое направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 617 мг (неочищенная розовая жидкость).
Промежуточный продукт 81
3,3-Диэтил-8-гидрокси-7-йод-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид
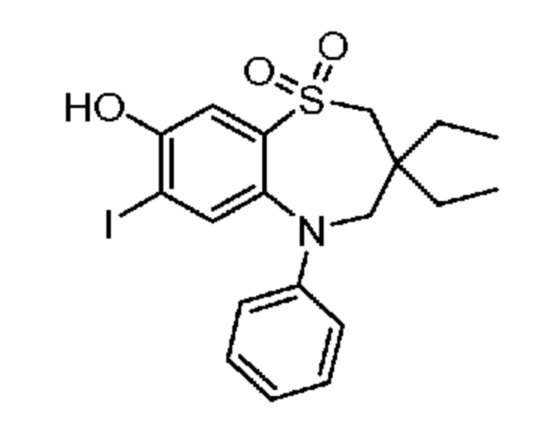
При перемешивании к раствору 3,3-диэтил-7-йод-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (получен путем очистки с помощью препаративной HPLC (методика B) смеси 7-бромированного и 7-йодированного промежуточного продукта 59; 250 мг, 0,52 ммоля) в DCM (5 мл) по каплям добавляли BBr3 (1M раствор в DCM, 0,80 мл, 0,77 ммоля) при -40°C и полученную реакционную смесь перемешивали в течение 4 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь охлаждали до 0°C и по каплям добавляли MeOH до прекращения выделения газа. Реакционную смесь разбавляли с помощью DCM (20 мл) и органический слой промывали водой (2×15 мл), рассолом (20 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и получали неочищенное вещество, которое очищали с помощью колоночной хроматографии Isolera (элюент: 45-50% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 82% (200 мг, бледно-желтое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 10,92 (s, 1H), 7,38 (s, 1H), 7,33 (s, 1H), 7,23-7,19 (m, 2H), 6,94-6,81 (m, 3H), 3,63 (m, 1H), 3,25 (s, 2H), 1,55-1,48 (m, 2H), 1,36-1,23 (m, 2H), 0,73 (t, J=9,6 Hz, 6H). LCMS: (методика A) 472,1 (M++H), Rt. 2,49 мин, 93,10%.
Промежуточный продукт 82
Трет-бутил-(E)-3-((3,3-диэтил-7-йод-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат
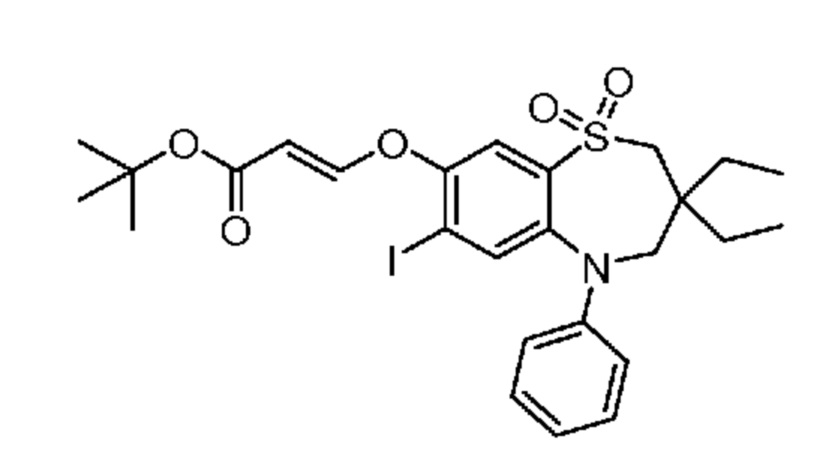
При перемешивании к раствору 3,3-диэтил-8-гидрокси-7-йод-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 81; 100 мг, 0,212 ммоля) в THF (3 мл) при 0°C добавляли DABCO (3 мг, 0,021 ммоля) и трет-бутилпропиолат (32 мг, 0,2545 ммоля) и реакционную смесь перемешивали в течение 1 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь выливали в охлажденную льдом воду (15 мл) и водный слой экстрагировали с помощью EtOAc (3×15 мл). Объединенный органический слой промывали рассолом (20 мл), сушили над безводным Na2SO4 и концентрировали в вакууме и получали неочищенное искомое соединение, которое направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 130 мг (неочищенное почти белое твердое вещество).
LCMS: (методика A) 542,1 (M+-tBu+H), Rt. 3,03 мин, 76,11% (максимально).
Промежуточный продукт 83
7-Бром-3,3-диэтил-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид

При перемешивании к раствору 7-бром-3,3-диэтил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (получен путем очистки с помощью препаративной HPLC (методика B) смеси 7-бромированного и 7-йодированного промежуточного продукта 59; 750 мг, 1,71 ммоля) в DCM (10 мл) по каплям добавляли BBr3 (1M раствор в DCM, 2,60 мл, 2,57 ммоля) при -40°C и полученную реакционную смесь перемешивали в течение 1 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь охлаждали до 0°C и по каплям добавляли MeOH до прекращения выделения газа. Реакционную смесь разбавляли с помощью DCM (25 мл) и органический слой промывали водой (2×15 мл), рассолом (20 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и получали неочищенное вещество, которое очищали с помощью колоночной хроматографии Isolera (элюент: 45-50% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 80% (580 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 10,89 (s, 1H), 7,48 (s, 1H), 7,24-7,13 (m, 3H), 6,96-6,83 (m, 3H), 3,64 (m, 1H), 3,32 (s, 2H), 1,53-1,48 (m, 2H), 1,37-1,30 (m, 2H), 0,73 (t, J=9,6 Hz, 6H). LCMS: (методика A) 424,0 (M+), Rt. 2,44 мин, 98,18%.
Промежуточный продукт 84
Этил-(E)-3-((7-бром-3,3-диэтил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат

При перемешивании к раствору 7-бром-3,3-диэтил-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 83; 200 мг, 0,471 ммоля) в THF (6 мл) добавляли DABCO (5,3 мг, 0,047 ммоля) и этилпропиолат (56 мг, 0,566 ммоля) при 0°C, затем реакционную смесь перемешивали 1 ч при КТ. После завершения реакции (следили с помощью TLC) реакционную смесь выливали в охлажденную льдом воду (15 мл) и водный слой экстрагировали с помощью EtOAc (3×15 мл). Объединенный органический слой промывали рассолом (20 мл), сушили над безводным Na2SO4 и концентрировали в вакууме и получали неочищенное вещество. Полученное неочищенное вещество направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 250 мг (неочищенное коричневое твердое вещество).
LCMS: (методика A) 522,2 (M++H), Rt. 2,40 мин, 86,64% (максимально).
Промежуточный продукт 85
Метил-(Z)-3-((7-бром-3,3-диэтил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилат

При перемешивании к раствору 7-бром-3,3-диэтил-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 83; 200 мг, 0,4713 ммоля) в DMF (5 мл) при 0°C добавляли NaH (60%; 95 мг, 2,356 ммоля) порциями и смесь перемешивали в течение 15 мин. Затем добавляли метил-3-бром-2,2-дифторпропаноат (290 мг, 1,414 ммоля) и реакционную смесь нагревали при 80°C в течение ночи. После завершения реакции (следили с помощью TLC) реакционную смесь охлаждали до 0°C, реакцию останавливали с помощью 1,5 н. HCl (pH ~4) и разбавляли водой (10 мл). Водный слой экстрагировали с помощью EtOAc (2×15 мл) и объединенный органический слой промывали рассолом (15 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и получали неочищенное искомое соединение, которое дополнительно растирали c диэтиловым эфиром. Полученное соединение сушили в вакууме и направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 250 мг (неочищенное коричневое смолообразное вещество). UPLC: (методика A) 528,5 (M++2), Rt. 1,88 мин, 39,34% (максимально).
Промежуточный продукт 86
2-(((2-Амино-5-метоксифенил)тио)метил)-2-этилгексановая кислота
При перемешивании к раствору 6-метоксибензо[d]тиазол-2-амина (270 г, 1,498 моля) в воде (2700 мл) добавляли KOH (1345 г, 23,96 моля) и реакционную смесь перемешивали в течение 16 ч при 120°C. После завершения реакции (следили с помощью LCMS) реакционную смесь охлаждали до комнатной температуры. Затем по каплям добавляли раствор 2-(бромметил)-2-этилгексановой кислоты (533 г, 2,25 моля) в THF (1000 мл) и полученную реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью LCMS) реакционную смесь охлаждали до 0°C и подкисляли концентрированной HCl (pH ~2). Реакционную смесь экстрагировали с помощью EtOAc (2×4000 мл) и объединенный органический слой промывали водой (1000 мл) и рассолом (1000 мл). Органическую часть затем сушили над безводным Na2SO4 и концентрировали в вакууме и получали неочищенное вещество, которое направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 590 г (неочищенное коричневое смолообразное вещество).
LCMS: (методика A) 312,1 (M++H), Rt. 2,24 мин, 97,34% (максимально).
Промежуточный продукт 87
3-Бутил-3-этил-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5H)-он
При перемешивании к раствору 2-(((2-амино-5-метоксифенил)тио)метил)-2-этилгексановой кислоты (промежуточный продукт 86; 590 г, 1,89 моля) в EtOAc (2500 мл) при 0°C по каплям добавляли триэтиламин (530 мл, 3,78 моля) и раствор 1-пропанфосфорного ангидрида (50% в EtOAc; 785 г, 2,46 моля) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью LCMS) к реакционной смеси добавляли воду (2000 мл) и водный слой экстрагировали с помощью EtOAc (2×2000 мл). Объединенный органический слой промывали рассолом (800 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали путем промывки метанолом и получали искомое соединение. Выход: 48% (265 г, почти белое твердое вещество).
1H NMR (300 MHz, DMSO-d6): δ 9,53 (s, 1H), 7,04-7,01 (m, 2H), 6,87-6,86 (m, 1H), 3,72 (s, 3H), 2,50 (s, 2H), 1,68-1,66 (m, 4H), 1,50-1,48 (m, 4H), 0,79-0,72 (m, 6H). LCMS: (методика A) 294,3 (M++H), Rt. 2,68 мин, 99,47% (максимально).
Промежуточный продукт 88
7-Бром-3-бутил-3-этил-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5H)-он

При перемешивании к раствору 3-бутил-3-этил-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5H)-она (промежуточный продукт 87; 265 г, 0,903 моля) в смеси 1:1 DCM и ацетонитрила (2650 мл) порциями добавляли N-бромсукцинимид (209 г, 1,17 моля) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали. Полученное неочищенное вещество обрабатывали холодным ацетонитрилом и перемешивали в течение 30 мин. Полученный осадок отфильтровывали и промывали холодным ацетонитрилом (2×100 мл) и сушили в вакууме и получали искомое соединение. Выход: 179 г (79%, неочищенное коричневое твердое вещество).
1H NMR (300 MHz, DMSO-d6): δ 9,61 (s, 1H), 7,33 (s, 1H), 7,10 (s, 1H), 3,82 (s, 3H), 2,98 (s, 2H), 1,70-1,68 (m, 4H), 1,48-1,45 (m, 4H), 0,84-0,82 (m, 6H). LCMS: (методика A) 372,0 (M++H), Rt. 2,83 мин, 99,20% (максимально).
Промежуточный продукт 89
7-Бром-3-бутил-3-этил-8-метокси-5-фенил-2,3-дигидро-1,5-бензотиазепин-4(5H)-он и 3-бутил-3-этил-7-йод-8-метокси-5-фенил-2,3-дигидро-1,5-бензотиазепин-4(5H)-он

При перемешивании к раствору 7-бром-3-бутил-3-этил-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5H)-она (промежуточный продукт 88; 179 г, 0,483 моля) в йодбензоле (1800 мл) добавляли йодид меди(I) (18,5 г, 0,096 моля) и K2CO3(134 г, 0,967 моля) и раствор продували азотом в течение 20 мин для дегазации. Затем добавляли трис[2-(2-метоксиэтокси)этил]амин (15,6 г, 0,04834 моля) в атмосфере азота и полученную реакционную смесь нагревали в течение 40 ч при 135°C. После завершения реакции (следили с помощью UPLC) реакционную смесь фильтровали через целит и слой целита промывали с помощью EtOAc (2000 мл). Фильтрат концентрировали в вакууме и получали неочищенное вещество, которое кристаллизовали из холодного петролейного эфира. Полученный осадок отфильтровывали и промывали холодным петролейным эфиром и получали смесь искомых соединений. Выход: 180 г (83%, неочищенное светло-желтое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,42-7,40 (m, 2H), 7,30-7,28 (m, 2H), 7,10-7,09 (m, 2H), 3,90 (s, 3H), 3,15 (s, 2H), 1,58-1,52 (m, 8H), 0,83-0,81 (m, 6H). LCMS: (методика A) 448,0 (M++H) 40,8%; 496,0 (M++H) 53,98%; Rt. 3,27 и 3,28 мин, 94,7% (максимально).
Промежуточный продукт 90
7-Бром-3-бутил-3-этил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин и 3-бутил-3-этил-7-йод-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин

При перемешивании к раствору смеси 7-бром-3-бутил-3-этил-8-метокси-5-фенил-2,3-дигидро-1,5-бензотиазепин-4(5H)-она и 3-бутил-3-этил-7-йод-8-метокси-5-фенил-2,3-дигидро-1,5-бензотиазепин-4(5H)-она (промежуточный продукт 89; 180 г, 0,40178 моля) в THF (1800 мл) при 0°C по каплям добавляли диметилсульфид борана (2M в THF; 602 мл, 1,2053 моля) и реакционную смесь кипятили с обратным холодильником в течение 40 ч при 75°C. После завершения реакции (следили с помощью TLC) реакционную смесь охлаждали до 0°C и реакцию останавливали метанолом (400 мл). Полученный раствор нагревали при 65°C в течение 2 ч, затем охлаждали до комнатной температуры и концентрировали в вакууме и получали смесь искомых соединений. Полученное неочищенное вещество направляли на следующую стадию без какой-либо дополнительной очистки Выход: 195 г (неочищенная темно-коричневая жидкость).
1H NMR (400 MHz, DMSO-d6): δ 7,22-7,20 (m, 2H), 7,04-6,93 (m, 1H), 6,88-6,83 (m, 3H), 6,81-6,79 (m, 1H), 3,82 (s, 3H), 3,63 (s, 2H), 2,76 (s, 2H), 1,41-1,40 (m, 8H), 0,80-0,78 (m, 6H). LCMS: (методика A) 448,1 (M++H), 89,8% и 482,2 (M++H) 8,18%; Rt. 3,02 и 3,19 мин, 97,98% (максимально).
Промежуточный продукт 91
7-Бром-3-бутил-3-этил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид и 3-бутил-3-этил-7-йод-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид
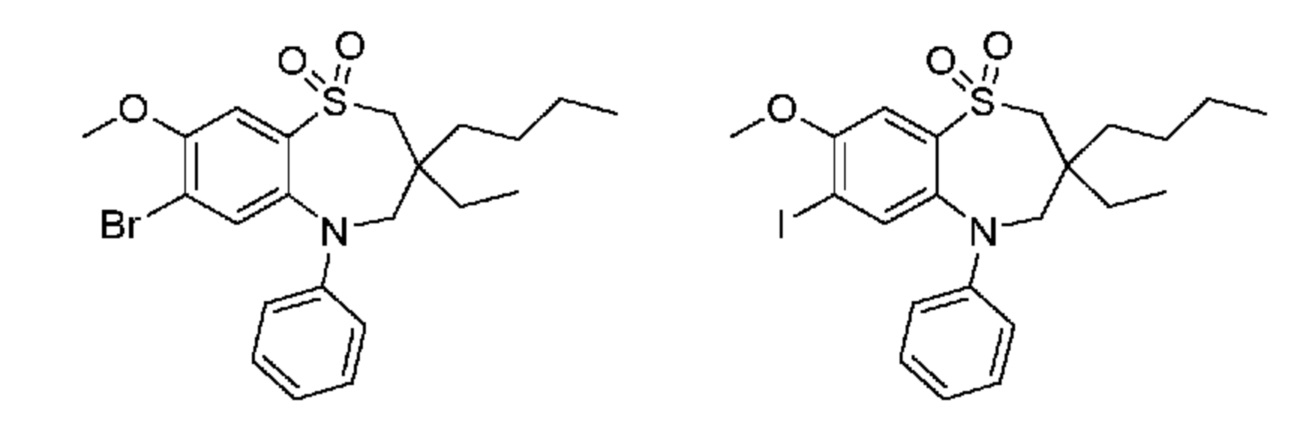
При перемешивании к раствору смеси 7-бром-3-бутил-3-этил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепина и 3-бутил-3-этил-7-йод-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепина (промежуточный продукт 90; 195 г, 0,4488 моля) в THF (1950 мл) добавляли воду (1950 мл) и оксон (1380 г, 4,488 моля) и реакционную смесь перемешивали в течение 24 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь фильтровали через воронку Бюхнера и фильтрат экстрагировали с помощью EtOAc (2×2000 мл). Объединенный органический слой промывали водой (1000 мл) и рассолом (1000 мл), сушили над безводным Na2SO4 и затем концентрировали в вакууме. Неочищенное вещество очищали с помощью колоночной хроматографии (элюент: 10-12% EtOAc/PE; силикагель: 230-400 меш) и получали смесь искомых соединений. Выход: 60% (126 г, почти белое твердое вещество ).
1H NMR (400 MHz, DMSO-d6): δ 7,45 (s, 1H), 7,36-7,32 (m, 2H), 7,25 (s, 1H), 7,16-7,06 (m, 2H), 6,93 (t, J=7,20 Hz, 1H), 3,90 (s, 3H), 3,78 (s, 2H), 1,52-1,41 (m, 2H), 1,36-1,34 (m, 4H), 1,27-1,24 (m, 4H), 1,00-0,80 (m, 6H). LCMS: (методика B) 468,1 (M++H) 91,72%, 514,2 (M++H) 5,70%, Rt. 1,76 мин и 1,88 мин, 97,42% (максимально).
Промежуточный продукт 92
7-Бром-3-бутил-3-этил-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид и 3-бутил-3-этил-8-гидрокси-7-йод-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид

При перемешивании к раствору смеси 7-бром-3-бутил-3-этил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида и 3-бутил-3-этил-7-йод-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 91; 6,5 г, 13,93 ммоля) в DCM (65 мл) при 0°C по каплям добавляли BBr3 (1M раствор в DCM; 69,67 мл, 69,67 ммоля) и раствор перемешивали в течение 1 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь охлаждали до 0°C и по каплям добавляли MeOH до прекращения выделения газа. Реакционную смесь разбавляли с помощью DCM (100 мл) и органический слой промывали водой (2×50 мл) и рассолом (100 мл) и сушили над безводным Na2SO4. Органическую часть затем концентрировали в вакууме и получали неочищенное вещество, которое очищали с помощью колоночной хроматографии Isolera (элюент: 30-32% EtOAc/PE; силикагель: 230-400 меш) и получали смесь искомых соединений. Выход: 95% (6,0 г, почти белое твердое вещество).
LCMS: (методика A) 452,1(M+) и 498,0 (M+-H), Rt. 3,00 и 3,02 мин, 92,15% (полное максимальное).
Промежуточный продукт 93
Этил-(E)-3-((7-бром-3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат и этил-(E)-3-((3-бутил-3-этил-7-йод-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат
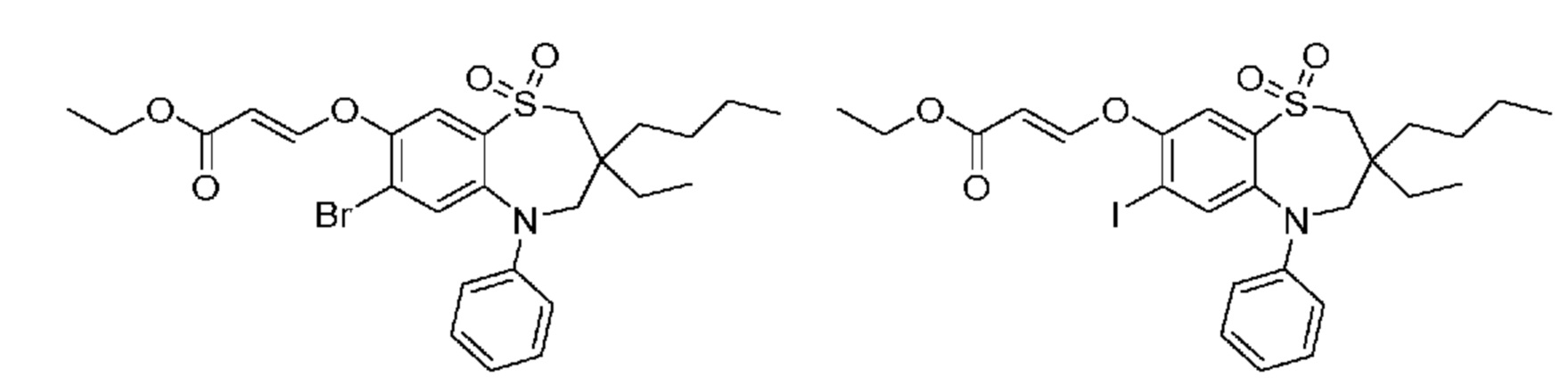
При перемешивании к раствору смеси 7-бром-3-бутил-3-этил-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида и 3-бутил-3-этил-8-гидрокси-7-йод-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 92; 6 г, 13,26 ммоля) в THF (60 мл) при 0°C добавляли DABCO (0,15 г, 1,32 ммоля) и затем этилпропиолат (1,61 мл, 15,91 ммоля) и смесь перемешивали при комнатной температуре в течение 1 ч. После завершения реакции (следили с помощью TLC) реакционную смесь разбавляли водой (100 мл) и экстрагировали с помощью EtOAc (2×50 мл). Объединенный органический слой промывали рассолом (50 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 17-18% EtOAc/PE; силикагель: 230-400 меш) и получали смесь искомых соединений.Выход: 90% (6,6 г, бесцветная смола).
LCMS: (методика C) 598,1 (M++H) и 550,1 (M+), Rt. 3,03 мин, 93,95% (максимально).
Промежуточный продукт 94
(E)-3-((7-бром-3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота и (E)-3-((3-бутил-3-этил-7-йод-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота

При перемешивании к раствору смеси этил-(E)-3-((7-бром-3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата и этил-(E)-3-((3-бутил-3-этил-7-йод-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 93; 6,6 г, 11,98 ммоля) в смеси 1,4-диоксана и воды (60 мл, 4:1) добавляли гидроксид лития (1,01 г, 23,97 ммоля) и реакционную смесь перемешивали при комнатной температуре в течение ночи. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1,5 н., 15 мл) и водный слой экстрагировали с помощью EtOAc (2×100 мл). Объединенную органическую часть промывали водой (50 мл) и рассолом (50 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 3% MeOH/DCM, силикагель: 230-400 меш) и получали смесь искомых соединений. Выход: 54% (3,38 г, белое твердое вещество).
LCMS: (методика A) 520,9 (бром, йод M-H), Rt. 2,90 мин, 97,86% (максимально).
Промежуточный продукт 95
5-(4-бромфенил)-3-бутил-3-этил-8-гидрокси-7-(метилтио)-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид
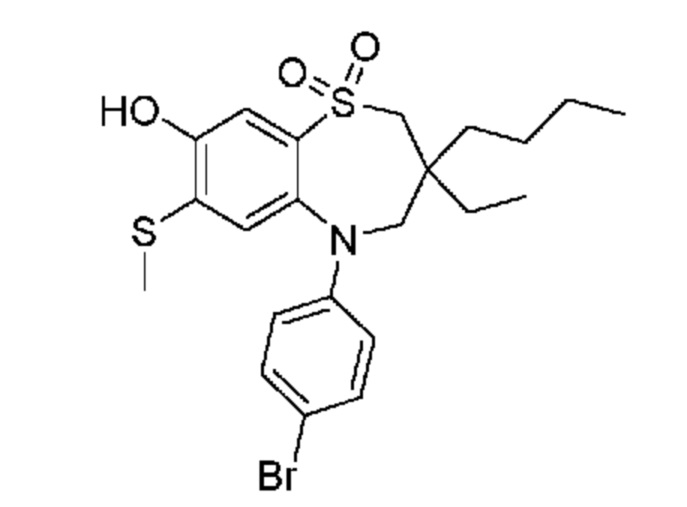
При перемешивании к раствору 3-бутил-3-этил-8-гидрокси-7-(метилтио)-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 23; 2 г, 4,76 ммоля) в DMF (15 мл) при -10°C по каплям добавляли N-бромсукцинимид (0,93 г, 5,24 ммоля) в DMF (5 мл) и реакционную смесь перемешивали в течение 1 ч при температуре ниже 0°C. После завершения реакции (следили с помощью TLC) реакционную смесь выливали в измельченный лед и энергично перемешивали в течение 5 мин. Твердое вещество, которое осаждалось, отфильтровывали, промывали охлажденной льдом водой и сушили в вакууме и получали искомое соединение. Выход: 98% (2,37 г, почти белое твердое вещество).
LCMS: (методика A) 496,1 (M+-2H), Rt. 2,97 мин, 90,53% (максимально).
Промежуточный продукт 96
4-(3-бутил-3-этил-8-гидрокси-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-5(2H)-ил)бензонитрил
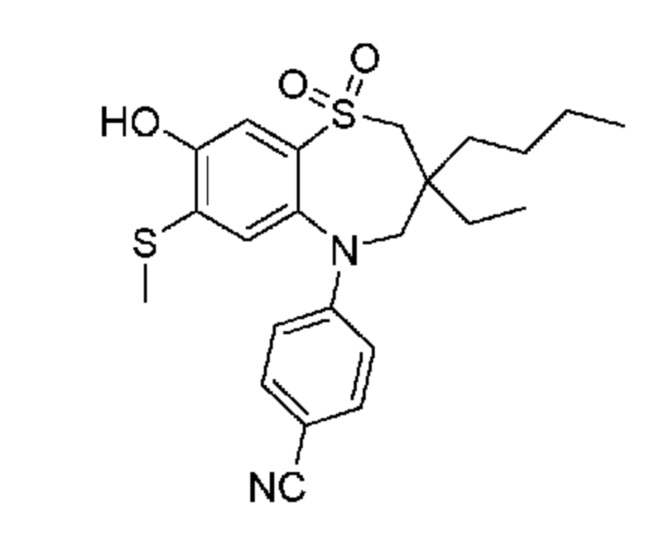
При перемешивании к раствору 5-(4-бромфенил)-3-бутил-3-этил-8-гидрокси-7-(метилтио)-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 95; 2,37 г, 4,75 ммоля) в DMF (24 мл) добавляли цианид цинка (2,23 г, 19 ммоля) и раствор дегазировали с помощью N2 в течение 30 мин. Затем добавляли тетракис(трифенилфосфин)палладий(0) (0,54 г, 0,47 ммоля) и раствор нагревали в течение 24 ч при 100°C. После завершения реакции (следили с помощью TLC) реакционную смесь выливали в охлажденную льдом воду и водный слой экстрагировали с помощью EtOAc (2×50 мл). Объединенный органический слой промывали охлажденной льдом водой (50 мл), рассолом (50 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 15% EtOAc/ PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 52% (1,1 г, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 10,84 (s, 1H), 7,54 (d, J=11,6 Hz, 2H), 7,34 (s, 1H), 6,87-6,85 (m, 2H), 3,51 (bs, 2H), 3,65 (s, 3H), 2,28 (s, 3H), 1,65-1,41 (m, 2H), 1,42-1,22 (m, 6H), 0,84-0,65 (m, 6H). LCMS: (методика A) 445,1 (M++H), Rt. 2,53 мин, 96,66% (максимально).
Промежуточный продукт 97
4-(3-бутил-3-этил-8-гидрокси-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-5(2H)-ил)бензойная кислота

При перемешивании к раствору 4-(3-бутил-3-этил-8-гидрокси-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-5(2H)-ил)бензонитрила (промежуточный продукт 96; 0,5 г, 1,12 ммоля) в смеси этанола и воды (4:1, 20 мл) добавляли NaOH (0,45 г, 11,2 ммоля) и раствор нагревали в течение 4 дней при 100°C. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и подкисляли концентрированной HCl (pH ~2). Водный слой экстрагировали с помощью EtOAc (2×50 мл) и объединенный органический слой промывали охлажденной льдом водой (50 мл), рассолом (50 мл) и затем сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 9% MeOH/DCM; силикагель: 230-400 меш) и получали искомое соединение. Выход: 50% (0,16 г, почти белое твердое вещество).
LCMS: (методика A) 464,1 (M++H), Rt. 2,19 мин, 95,59% (максимально).
Промежуточный продукт 98
N-(трет-бутил)-4-(3-бутил-3-этил-8-гидрокси-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-5(2H)-ил)бензамид

При перемешивании к раствору 4-(3-бутил-3-этил-8-гидрокси-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-5(2H)-ил)бензойной кислоты (промежуточный продукт 97; 160 мг, 0,34 ммоля) в DMF (3 мл) добавляли триэтиламин (0,1 мл, 0,41 ммоля), трет-бутиламин (104 мг, 1,03 ммоля) и HATU (230 мг, 0,64 ммоля) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и полученный остаток растворяли в охлажденной льдом воде (5 мл). Водный слой экстрагировали с помощью EtOAc (2×10 мл) и объединенный органический слой промывали охлажденной льдом водой (10 мл), рассолом (10 мл) и затем сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 35-40 EtOAc/ PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 28% (50 мг, почти белое твердое вещество).
LCMS: (методика A) 517,3 (M+-H), Rt. 2,56 мин, 95,71% (максимально).
Промежуточный продукт 99
Этил-(E)-3-((3-бутил-5-(4-(трет-бутилкарбамоил)фенил)-3-этил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат
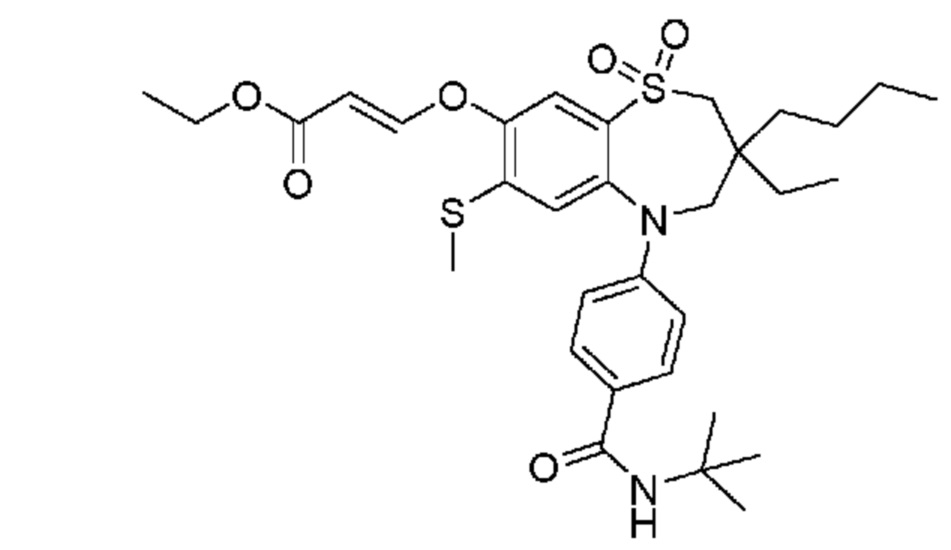
При перемешивании к раствору N-(трет-бутил)-4-(3-бутил-3-этил-8-гидрокси-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-5(2H)-ил)бензамида (промежуточный продукт 98; 50 мг, 0,096 ммоля) в THF (2 мл) добавляли DABCO (1 мг, 0,0096 ммоля) и этилпропиолат (14,18 мг, 0,14 ммоля). Затем реакционную смесь перемешивали в течение 30 мин при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и полученный остаток растворяли в охлажденной льдом воде (5 мл). Водный слой экстрагировали с помощью EtOAc (2×5 мл), объединенный органический слой промывали охлажденной льдом водой (5 мл) и рассолом (5 мл) и затем сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и получали неочищенное вещество, которое направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 50 мг (неочищенное коричневое смолообразное вещество).
LCMS: (методика A) 617,3 (M++H), Rt. 2,74 мин, 12,07% (максимально).
Промежуточный продукт 100
Метил-(Z)-3-((7-бром-3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилат
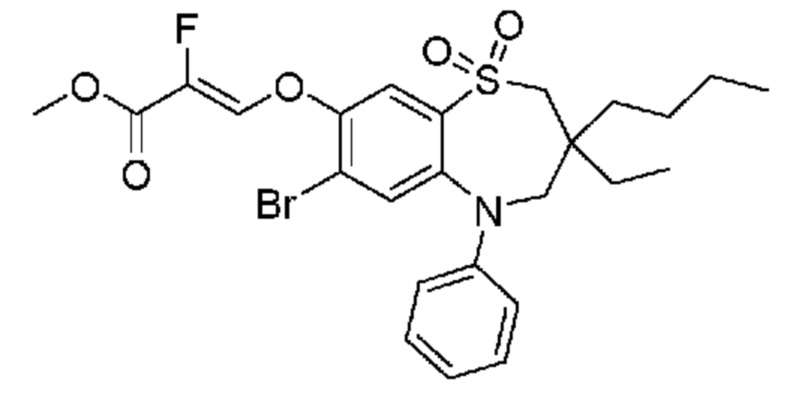
При перемешивании к раствору 7-бром-3-бутил-3-этил-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (0,5 г, 1,11 ммоля) в DMF (5 мл) при 0°C порциями добавляли NaH (60%, 0,08 г, 3,31 ммоля) и смесь перемешивали в течение 15 мин при 0°C. Добавляли метил-3-бром-2,2-дифторпропаноат (0,45 г, 2,2 ммоля) и реакционную смесь нагревали в течение 16 ч при 85°C. После завершения реакции (следили с помощью TLC) реакционную массу охлаждали до 0°C, реакцию останавливали с помощью 1,5 н. HCl (pH ~4) и разбавляли водой (5 мл). Водный слой экстрагировали с помощью EtOAc (2×10 мл) и объединенный органический слой промывали рассолом (10 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и получали неочищенное искомое соединение, которое дополнительно растирали с Et2O. Полученное соединение сушили в вакууме и направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 90% (0,55 г, бесцветная смола).
LCMS: (методика A) 556,1 (M++2), Rt. 3,09 мин, 85,5% (максимально).
Промежуточный продукт 101
3,3-дибутил-7-(этилтио)-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид

При перемешивании к раствору 7-бром-3,3-дибутил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид (2,0 г, 4,04 ммоля) в сухом DMF (20 мл) добавляли тиоэтоксид натрия (1,7 г, 20,24 ммоля) при комнатной температуре и реакционную смесь перемешивали в течение 16 ч при 60°C. После завершения реакции (следили с помощью LCMS) реакцию останавливали охлажденной льдом водой (10 мл) и водный слой экстрагировали с помощью EtOAc (2×20 мл). Объединенный органический слой промывали водой (15 мл) и рассолом (15 мл) и затем сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 10-15% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 65% (1,2 г, почти белое твердое вещество).
1H NMR (400 MHz, DMSO- d6): δ 10,44 (s, 1H), 7,30 (s, 1H), 7,20 (t, J=10,8 Hz, 2H), 6,94 (d, J=10,8 Hz, 2H), 6,82 (t, J=9,6 Hz, 1H), 6,69 (s, 1H), 3,65 (bs, 2H), 3,22 (s, 2H), 2,69 (q, J=9,6 Hz, 2H), 1,40-1,35 (m, 4H), 1,14-1,05 (m, 11H), 0,59-0,81 (m, 6H). LCMS: (методика A) 462,1 (M++H), Rt. 3,18 мин, 94,69% (максимально).
Промежуточный продукт 102
Этил-(E)-3-((3,3-дибутил-7-(этилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат

При перемешивании к раствору 3,3-дибутил-7-(этилтио)-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 101; 0,2 г, 0,43 ммоля) в сухом THF (3 мл) добавляли этилпропиолат (0,043 г, 0,52 ммоля) и DABCO (5 мг, 0,04 ммоля) и затем раствор перемешивали в течение 30 мин при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали и полученный остаток подвергали распределению между водой (10 мл) и EtOAc (15 мл). Водный слой экстрагировали с помощью EtOAc (2×15 мл) и объединенную органическую часть промывали рассолом (10 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 25% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 93% (0,23 г, белое твердое вещество).
1H-NMR (400 MHz, DMSO-d6): δ 7,86 (d, J=10,8 Hz, 1H), 7,49 (s, 1H), 7,35-7,32 (m, 2H), 7,20-7,14 (m, 2H), 7,02 (t, J=9,6 Hz, 1H), 6,65 (s, 1H), 5,47 (d, J=16,0 Hz, 1H), 4,12 (q, J=9,2 Hz, 2H), 3,78 (bs, 2H), 3,47 (s, 2H), 2,76 (q, J=10,8 Hz, 2H), 1,40-1,33 (m, 3H), 1,28 (t, J=7,60 Hz, 4H), 1,23-1,18 (m, 11H), 0,87-0,62 (m, 6H).
Промежуточный продукт 103
4-(3,3-дибутил-8-гидрокси-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-5(2H)-ил)бензонитрил
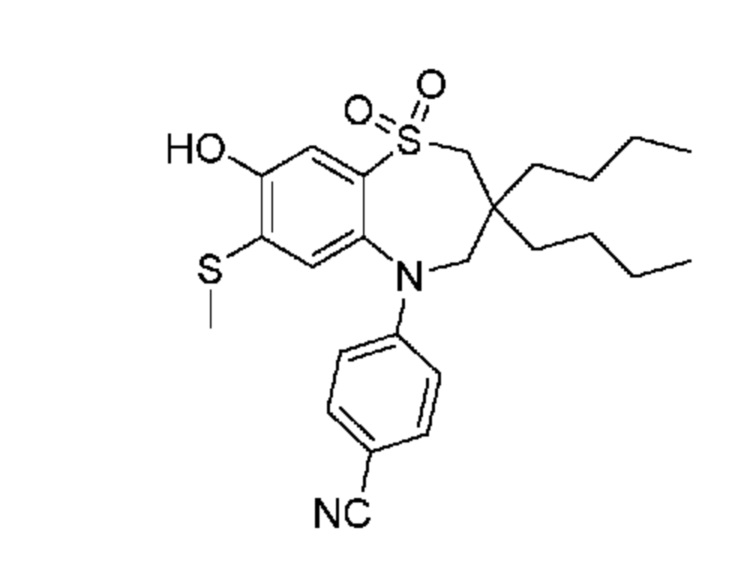
При перемешивании к раствору 5-(4-бромфенил)-3,3-дибутил-8-гидрокси-7-(метилтио)-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 20; 4,4 г, 8,36 ммоля) в DMF (40 мл) при комнатной температуре добавляли цианид цинка (4,9 г, 41,01 ммоля) и затем смесь дегазировали с помощью N2 в течение 30 мин. Затем добавляли тетракис(трифенилфосфин)палладий(0) (0,96 г, 0,83 ммоля) и смесь нагревали в течение 24 ч при 100°C. После завершения реакции (следили с помощью TLC) реакционную смесь выливали в охлажденную льдом воду (25 мл) и водный слой экстрагировали с помощью EtOAc (2×50 мл). Объединенный органический слой промывали охлажденной льдом водой (30 мл), рассолом (30 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 90-100% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 48% (1,9 г, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 10,83 (s, 1H), 7,54 (d, J=11,6 Hz, 2H), 7,34 (s, 1H), 6,92-6,71 (m, 3H), 3,62 (bs, 2H), 3,21 (s, 2H), 2,27 (s, 3H), 1,65-1,35 (m, 3H), 1,29-1,14 (m, 9H), 0,82 (t, J=8,8 Hz, 6H). LCMS: (методика A) 473,2 (M++H), Rt,2,67 мин, 87,18% (максимально).
Промежуточный продукт 104
4-(3,3-дибутил-8-гидрокси-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-5(2H)-ил)бензойная кислота
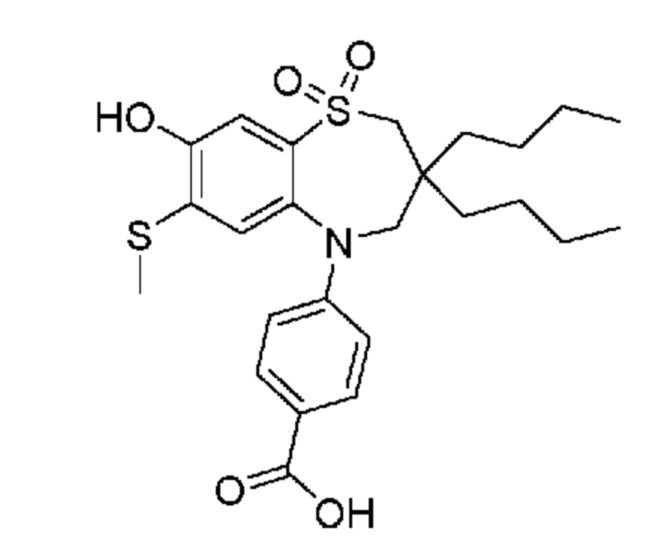
При перемешивании к раствору 4-(3,3-дибутил-8-гидрокси-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-5(2H)-ил)бензонитрила (промежуточный продукт 103; 1,5 г, 3,17 ммоля) в смеси этанола и воды (4:1, 20 мл) добавляли NaOH (1,9 г, 47,67 ммоля) и реакционную смесь нагревали в течение 72 ч при 100°C. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и подкисляли концентрированной HCl при 0°C до pH ~2. Водный слой экстрагировали с помощью EtOAc (2×50 мл) и объединенный органический слой промывали охлажденной льдом водой (50 мл) и рассолом (50 мл) и затем сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 9% MeOH/DCM; силикагель: 230-400 меш) и получали искомое соединение. Выход: 58% (0,76 г, почти белое твердое вещество).
LCMS: (методика A) 492,1 (M++H), Rt. 2,37 мин, 38,32% (максимально).
Промежуточный продукт 105
N-(трет-бутил)-4-(3,3-дибутил-8-гидрокси-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-5(2H)-ил)бензамид

При перемешивании к раствору 4-(3,3-дибутил-8-гидрокси-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-5(2H)-ил)бензойной кислоты (промежуточный продукт 104, 150 мг, 0,3 ммоля) в DMF (3 мл) при комнатной температуре добавляли триэтиламин (92,4 мг, 0,91 ммоля), трет-бутиламин (44,6 мг, 0,61 ммоля) и HATU (232 мг, 0,61 ммоля) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и полученный остаток подвергали распределению между холодной водой (5 мл) и EtOAc (5 мл). Водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенный органический слой промывали охлажденной льдом водой (10 мл) и рассолом (10 мл) и затем сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 35-40% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 42% (70 мг, бледно-желтое твердое вещество).
LCMS: (методика A) 547,2 (M++H), Rt. 2,78 мин, 87,33% (максимально).
Промежуточный продукт 106
Этил-(E)-3-((3,3-дибутил-5-(4-(трет-бутилкарбамоил)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат

При перемешивании к раствору N-(трет-бутил)-4-(3,3-дибутил-8-гидрокси-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-5(2H)-ил)бензамида (промежуточный продукт 105; 70 мг, 0,12 ммоля) в THF (2 мл) при комнатной температуре добавляли DABCO (1,4 мг, 0,012 ммоля) и этилпропиолат (18,9 мг, 0,19 ммоля). Затем реакционную смесь перемешивали в течение 30 мин при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и полученный остаток подвергали распределению между охлажденной льдом водой (2 мл) и EtOAc (2 мл). Водный слой экстрагировали с помощью EtOAc (2×3 мл). Объединенный органический слой промывали охлажденной льдом водой (3 мл) и рассолом (3 мл) и затем сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 30% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 66% (55 мг, бледно-желтое смолообразное вещество).
LCMS: (методика A) 645,3 (M++H), Rt. 3,14 мин, 94,44% (максимально).
Промежуточный продукт 107
4-(3,3-дибутил-8-гидрокси-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-5(2H)-ил)-N-изопропилбензамид
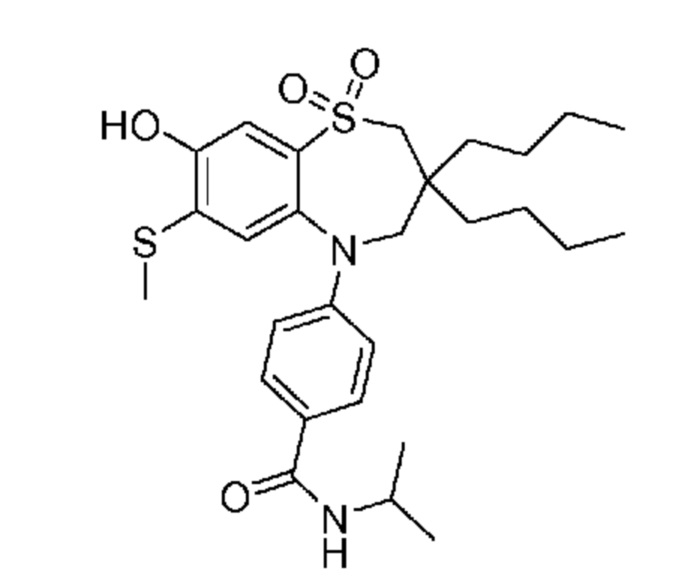
При перемешивании к раствору 4-(3,3-дибутил-8-гидрокси-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-5(2H)-ил)бензойной кислоты (промежуточный продукт 104; 0,23 г, 0,46 ммоля) в DMF (3 мл) добавляли триэтиламин (0,19 мл, 1,4 ммоля), изопропиламин (0,55 г, 0,93 ммоля) и HATU (0,36 г, 0,93 ммоля) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и полученный остаток подвергали распределению между охлажденной льдом водой (5 мл) и EtOAc (5 мл). Водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенный органический слой промывали охлажденной льдом водой (10 мл) и рассолом (10 мл) и затем сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 50% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 28% (70 мг, бледно-коричневое твердое вещество).
1H NMR (400 MHz, CDCl3): δ 7,65-7,63 (m, 2H), 7,15 (s, 1H), 6,92 (d, J=8,4 Hz, 2H), 6,47 (s, 1H), 5,81 (d, J=10,4 Hz, 1H), 4,32-4,28 (m, 1H), 3,65 (bs, 2H), 3,15 (s, 2H), 2,33 (s, 3H), 1,41-1,21 (m, 18H), 0,87-0,74 (m, 6H). LCMS: (методика A) 533,3 (M++H), Rt. 2,58 мин, 84,35% (максимально).
Промежуточный продукт 108
Этил-(E)-3-((3,3-дибутил-5-(4-(изопропилкарбамоил)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат
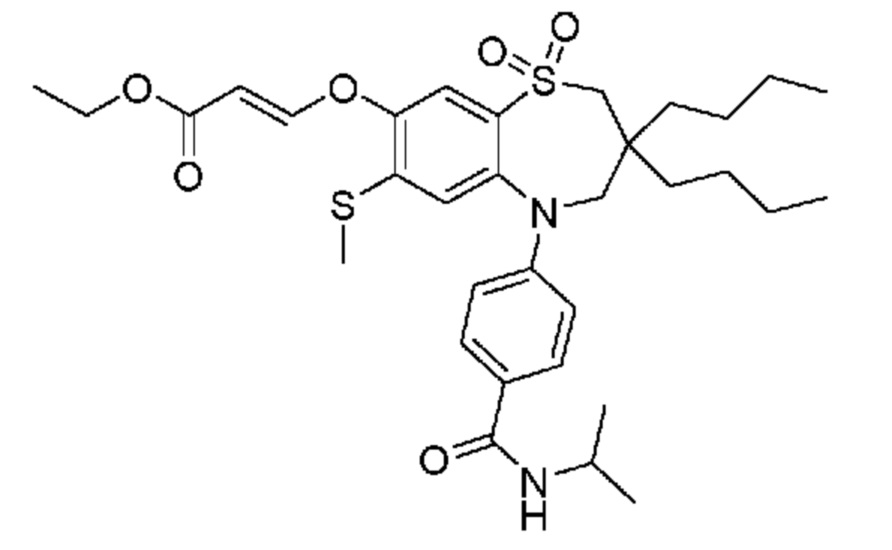
При перемешивании к раствору 4-(3,3-дибутил-8-гидрокси-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-5(2H)-ил)-N-изопропилбензамида (промежуточный продукт 107; 70 мг, 0,12 ммоля) в THF (5 мл) добавляли DABCO (1,5 мг, 0,013 ммоля) и этилпропиолат (19,3 мг, 0,19 ммоля) и реакционную смесь перемешивали в течение 30 мин при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и полученный остаток подвергали распределению между охлажденной льдом водой (2 мл) и EtOAc (2 мл). Водный слой экстрагировали с помощью EtOAc (2×5 мл). Объединенный органический слой промывали охлажденной льдом водой (5 мл и рассолом (5 мл) и затем сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 70% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 50% (50 мг, почти белое твердое вещество).
LCMS: (методика A) 631,3 (M++H), Rt. 2,96 мин, 70,99% (максимально).
Промежуточный продукт 109
Метил-(Z)-3-((3,3-дибутил-7-(этилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилат

При перемешивании к раствору 3,3-дибутил-7-(этилтио)-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 101; 0,4 г, 0,86 ммоля) в DMF (5 мл) при 0°C порциями добавляли NaH (60%, 0,06 г, 2,6 ммоля) и смесь перемешивали в течение 15 мин. Метил-3-бром-2,2-дифторпропаноат (0,35 г, 1,7 ммоля) затем добавляли и реакционную смесь нагревали в течение 16 ч при 85°C. После завершения реакции (следили с помощью TLC) реакционную массу охлаждали до 0°C, реакцию останавливали с помощью 1,5 н. HCl (pH ~4) и разбавляли водой (5 мл). Водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенный органический слой промывали рассолом (10 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество растирали с Et2O. Полученное соединение сушили в вакууме и направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 73% (0,36 г, почти белое твердое вещество).
LCMS: (методика A) 564,1 (M++H), Rt. 3,47 мин, 54,37% (максимально).
Промежуточный продукт 110
3-бутил-3-этил-7-(этилтио)-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид
При перемешивании к раствору смеси 7-бром-3-бутил-3-этил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида и 3-бутил-3-этил-7-йод-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 91; 1,2 г, 2,3 ммоля) в сухом DMF (12 мл) добавляли тиоэтоксид натрия (0,98 г, 11,6 ммоля) при комнатной температуре и реакционную смесь перемешивали в течение 16 ч при 100°C. После завершения реакции (следили с помощью LCMS), реакцию останавливали охлажденной льдом водой (10 мл) и водный слой экстрагировали с помощью EtOAc (2×20 мл). Объединенный органический слой промывали водой (15 мл) и рассолом (15 мл) и затем сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 10-15% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 72% (0,72 г, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 10,48 (s, 1H), 7,38 (s, 1H), 7,31 (d, J=3,2 Hz, 2H), 7,22-7,17 (m, 2H), 6,96-6,91 (m, 1H), 6,79-6,72 (m, 1H), 3,65 (bs, 2H), 3,26 (s, 2H), 2,70 (q, J=7,2 Hz, 2H), 1,34-1,30 (m, 4H), 1,15-1,07 (m, 7H), 0,79 (t, J=7,20 Hz, 6H). LCMS: (методика A) 434,2 (M++H), Rt. 2,92 мин, 98,63% (максимально).
Промежуточный продукт 111
Метил-(Z)-3-((3-бутил-3-этил-7-(этилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилат

При перемешивании к раствору 3-бутил-3-этил-7-(этилтио)-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 110; 0,4 г, 0,92 ммоля) в DMF (4 мл) при 0°C порциями добавляли NaH (60%, 0,07 г, 2,7 ммоля) и смесь перемешивали при этой температуре в течение 15 мин. Затем добавляли метил-3-бром-2,2-дифторпропаноат (0,37 г, 1,8 ммоля) и реакционную смесь нагревали в течение 16 ч при 60°C. После завершения реакции (следили с помощью TLC) реакционную массу охлаждали до 0°C, реакцию останавливали с помощью 1,5 н. HCl (pH ~4) и разбавляли водой (5 мл). Водный слой экстрагировали с помощью EtOAc (2×10 мл) и объединенный органический слой промывали рассолом (10 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 15-20% EtOAc/ PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 47% (0,23 г, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,68 (s, 1H), 7,63-7,62 (m, 1H), 7,30 (t, J=8,0 Hz, 2H), 7,18-7,15 (m, 2H), 6,99 (t, J=7,6 Hz, 1H), 6,69 (s, 1H), 3,88 (s, 3H), 3,78 (s, 2H), 3,38 (s, 2H), 2,71 (q, J=7,2 Hz, 2H), 1,43-1,31 (m, 4H), 1,17-1,03 (m, 7H), 0,72 (t, J=4,40 Hz, 6H). LCMS: (методика A) 536,2 (M++H), Rt. 3,17 мин, 89,63% (максимально).
Промежуточный продукт 112
Этил-(E)-3-((3-бутил-3-этил-7-(этилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат

При перемешивании к раствору 3-бутил-3-этил-7-(этилтио)-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 110; 0,3 г, 0,69 ммоля) в сухом THF (3 мл) добавляли этилпропиолат (0,081 г, 0,83 ммоля) и DABCO (8 мг, 0,06 ммоля) и реакционную смесь перемешивали в течение 30 мин при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и полученный остаток подвергали распределению между водой (10 мл) и EtOAc (10 мл). Водный слой экстрагировали с помощью EtOAc (2×15 мл) и объединенную органическую часть затем промывали рассолом (10 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 15-20% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 95% (0,36 г, бесцветная смола).
LCMS: (методика A) 532,3 (M++H), Rt. 3,34 мин, 95,17% (максимально).
Промежуточный продукт 113
Метил-(E)-3-((3,3-дибутил-2-(4-метоксибензил)-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-метилакрилат
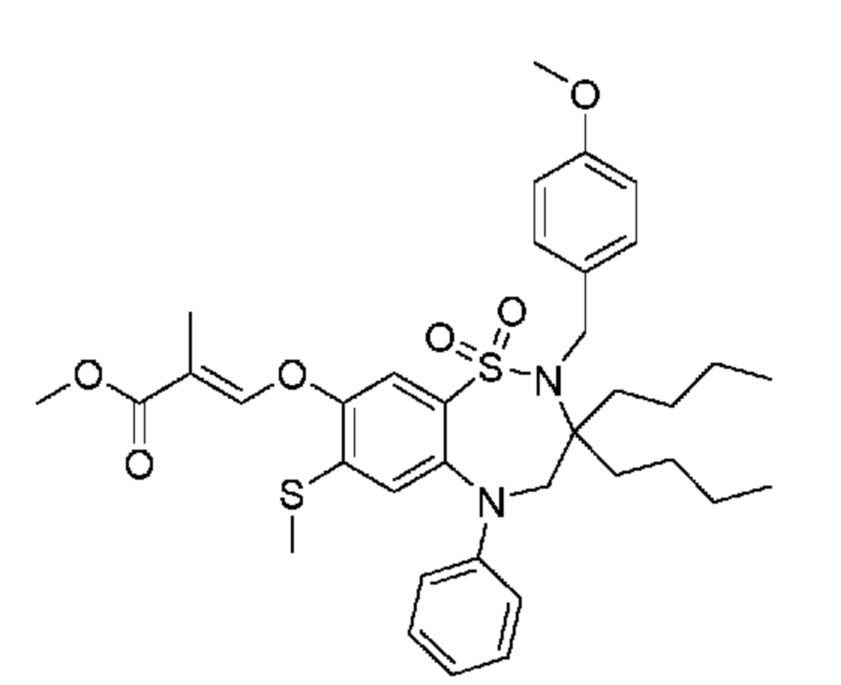
При перемешивании к раствору 3,3-дибутил-8-гидрокси-2-(4-метоксибензил)-7-(метилтио)-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1,1-диоксида (0,5 г, 0,88 ммоля) в сухом DMF (4 мл) добавляли метил-(E)-3-бром-2-метилакрилат (0,32 г, 1,76 ммоля) и карбонат калия (0,37 г, 2,64 ммоля) и реакционную смесь нагревали в течение 16 ч при 50°C. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 12% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 68% (0,4 г, коричневое твердое вещество).
Промежуточный продукт 114
(E)-3-((3,3-дибутил-2-(4-метоксибензил)-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-метакриловая кислота
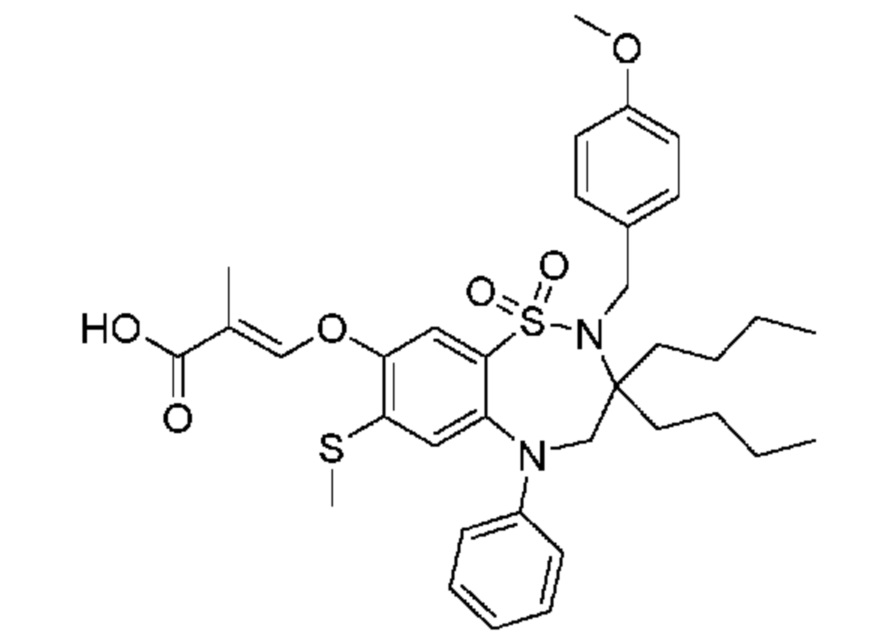
При перемешивании к раствору метил-(E)-3-((3,3-дибутил-2-(4-метоксибензил)-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-метилакрилата (промежуточный продукт 113; 0,2 г, 0,29 моля) ) в смеси 1,4-диоксана и воды (2:1, 6 мл) добавляли гидроксид лития (0,03 г, 0,59 ммоля) при 0°C и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1 мл, 1,5 н.) и водный слой экстрагировали с помощью EtOAc (2×20 мл). Объединенный органический слой промывали водой (8 мл) и рассолом (8 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 0,2 г (неочищенное почти белое смолообразное вещество).
LCMS: (методика E) 653,2 (M++H), Rt. 3,02 мин, 89,63% (максимально)
Промежуточный продукт 115
7-Бром-3,3-дибутил-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1,1-диоксид

При перемешивании к раствору смеси 7-бром-3,3-дибутил-8-метокси-2-(4-метоксибензил)-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1,1-диоксида (1,0 г, 1,62 ммоля) с DCM (20 мл) по каплям добавляли BBr3 (1M раствор в DCM; 1,94 мл, 1,94 ммоля) при 0°C и реакционную смесь перемешивали в течение 15 мин. За протеканием реакции следили с помощью UPLC, которая указывала на образование продукта с удаленной защитной группой PMB. Повторно добавляли BBr3 (1M раствор в DCM; 3,89 мл, 3,89 ммоля) при 0°C и реакционную смесь перемешивали в течение 48 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь охлаждали до 0°C и реакцию останавливали с помощью MeOH (10 мл). Затем реакционную смесь концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 25% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 16% (130 мг, коричневое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 10,54 (s, 1H), 7,38-7,26 (m, 4H), 7,09 (d, J=4,0 Hz, 2H), 6,95 (t, J=8,0 Hz, 2H), 4,00 (s, 2H), 1,49-1,45 (m, 2H), 1,39-1,31 (m, 2H), 1,23-1,14 (m, 3H), 1,09-0,94 (m, 5H), 0,73 (t, J=8,0 Hz, 6H).
Промежуточный продукт 116
трет-Бутил-(E)-3-((7-бром-3,3-дибутил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)акрилат

При перемешивании к раствору 7-бром-3,3-дибутил-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1,1-диоксида (промежуточный продукт 115; 0,1 г, 0,20 ммоля) в THF (5 мл) добавляли DABCO (0,002 г, 0,02 ммоля) и трет-бутилпропиолат (0,04 г, 0,31 ммоля) и реакционную смесь перемешивали в течение 15 мин при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь разбавляли с помощью EtOAc (20 мл). Органический слой промывали водой (2×10 мл) и затем сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и получали неочищенное вещество, которое очищали с помощью колоночной хроматографии Isolera (элюент: 15% EtOAc в гексане; силикагель: 230-400 меш) и получали искомое соединение. Выход: 87% (0,11 г, коричневое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,78 (bs, 1H), 7,65 (d, J=12,0 Hz, 1H), 7,51 (s, 1H), 7,43 (t, J=8,0 Hz, 2H), 7,33 (d, J=6,8 Hz, 2H), 7,18 (t, J=8,0 Hz, 1H), 6,84 (s, 1H), 5,18 (d, J=12,0 Hz, 1H), 4,02 (bs, 2H), 1,51-1,35 (m, 13H), 1,26-1,01 (m, 4H), 0,90-0,80 (m, 4H), 0,80-0,60 (m, 6H). LCMS: (методика A) 605,2 (M+-2H), Rt. 3,78 мин, 90,48% (максимально).
Промежуточный продукт 117
Этил-2-аминобутаноатгидрохлорид

При перемешивании к раствору 2-аминобутановой кислоты (100 г, 0,97 моля) в этаноле (750 мл) добавляли тионилхлорид (78 мл, 1,07 моля) при 0°C. Затем реакционную смесь нагревали в течение 16 ч при 80°C. После завершения реакции реакционную смесь концентрировали в вакууме и получали неочищенное искомое соединение, которое использовали на следующей стадии без какой-либо дополнительной очистки. Выход: 93% (152 г, белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 8,66 (bs, 3H), 4,25-4,16 (m, 2H), 3,98-3,85 (m, 1H), 1,84 (t, J=7,2 Hz, 2H), 1,23 (t, J=6,8 Hz, 3H), 0,92 (t, J=7,6 Hz, 3H).
Промежуточный продукт 118
Этил-(E)-2-(бензилиденамино)бутаноат
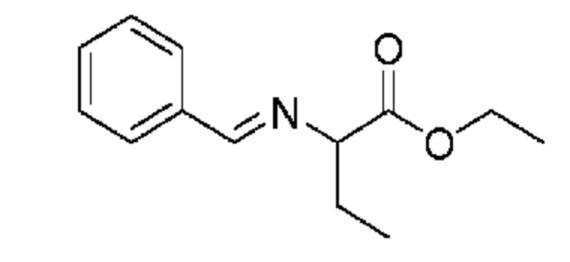
При перемешивании к раствору этил-2-аминобутаноатгидрохлорида (промежуточный продукт 117; 152 г, 0,91 моля) в DCM (900 мл) добавляли триэтиламин (152 мл, 1,09 моля) при 0°C в течение 30 мин. К реакционной смеси порциями добавляли сульфат магния (98 г, 0,82 моля) при 0°C. Затем реакционной смеси добавляли бензальдегид (84 мл, 0,82 моля) при 0°C в течение 20 мин и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь фильтровали через целит и фильтрат концентрировали в вакууме. Полученное неочищенное вещество растворяли в петролейном эфире (1000 мл) и повторно фильтровали через целит. Затем фильтрат концентрировали в вакууме и получали искомое соединение. Это неочищенное вещество направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 90% (180 г, бледно-коричневая жидкость).
1H NMR (400 MHz, DMSO-d6): δ 8,40 (s, 1H), 7,79-7,76 (m, 2H), 7,49-7,47 (m, 3H), 4,16-4,10 (m, 2H), 3,98-3,95 (m, 1H), 1,92-1,89 (m, 1H), 1,79-1,74 (m, 1H), 1,19 (t, J=7,2 Hz, 3H), 0,85 (t, J=7,2 Hz, 3H).
Промежуточный продукт 119
Этил-(E)-2-(бензилиденамино)-2-этилгексаноат

При перемешивании к раствору NaH (60%, 32,8 г, 0,82 моля) в DMF (100 мл) при 0°C в течение 30 мин медленно добавляли этил-(E)-2-(бензилиденамино)бутаноат (промежуточный продукт 118; 180 г, 0,82 моля) в DMF (800 мл). Затем реакционную смесь перемешивали в течение 1,5 ч при комнатной температуре. К реакционной смеси добавляли н-бутилйодид (93 мл, 0,82 моля) при 0°C и смесь перемешивали в течение 1 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакцию останавливали 2-пропанолом (100 мл) при 0°C и затем разбавляли водой (1000 мл). Водный слой экстрагировали петролейным эфиром (1000 мл). Органический слой промывали рассолом (200 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 88% (200 г, желтая жидкость).
1H NMR (400 MHz, DMSO-d6): δ 8,34 (s, 1H), 7,80-7,77 (m, 2H), 7,47-7,44 (m, 3H), 4,16 (q, J=7,0 Hz, 2H), 2,51-1,79 (m, 4H), 1,31-1,18 (m, 7H), 0,88-0,84 (m, 6H).
Промежуточный продукт 120
Этил-2-амино-2-этилгексаноат

При перемешивании к раствору этил-(E)-2-(бензилиденамино)-2-этилгексаноата (промежуточный продукт 119; 200 г, 0,73 моля) в петролейном эфире (500 мл) добавляли разбавленную HCl (1000 мл, 1,5 н.) при 0°C и реакционную смесь энергично перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) органический слой отделяли и водный слой промывали с помощью EtOAc (2×100 мл). Затем водный слой подщелачивали (pH ~8,5) твердым бикарбонатом натрия (200 г) и экстрагировали с помощью EtOAc (2×200 мл). Органический слой промывали водой (2×15 мл). Объединенную органическую часть сушили над безводным Na2SO4 и концентрировали в вакууме и получали искомое соединение. Неочищенное вещество направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 80% (110 г, бледно-желтая жидкость).
1H NMR (400 MHz, DMSO-d6): δ 4,08 (q, J=7,1 Hz, 2H), 1,68-1,00 (m, 13H), 0,85 (t, J=7,2 Hz, 3H), 0,77 (t, J=7,4 Hz, 3H).
Промежуточный продукт 121
2-Амино-2-этил-N-фенилгексанамид
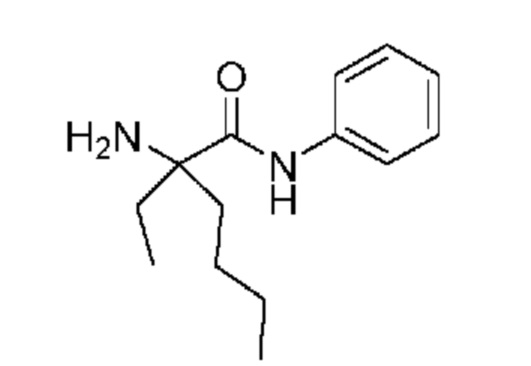
При перемешивании к раствору анилина (48,3 мл, 534 ммоля) в THF (250 мл) при -78°C по каплям добавляли n-BuLi (2,6M в гексанах; 205 мл, 534 ммоля) в течение 30 мин и реакционную смесь перемешивали в течение 45 мин при температуре от -25°C до -30°C. Затем к реакционной смеси добавляли этил-2-амино-2-этилгексаноат (промежуточный продукт 120; 50 г, 267 ммоля) в THF (250 мл) при -78°C и реакционную смесь перемешивали в течение 2 ч при -78°C. После завершения реакции (следили с помощью TLC) реакцию останавливали водой (500 мл) при -78°C. Реакционную смесь экстрагировали с помощью EtOAc (2×250 мл) и органический слой промывали водой (2×15 мл). Органическую часть сушили над безводным Na2SO4 и концентрировали в вакууме и получали неочищенное искомое соединение. Неочищенный продукт растворяли в петролейном эфире (1000 мл). Органическую часть промывали с помощью 30% метанол в воде (2×250 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 66 г (неочищенная коричневая жидкость).
1H NMR (400 MHz, DMSO-d6): δ 7,64 (d, J=8,4 Hz, 2H), 7,30 (t, J=7,4 Hz, 2H), 7,05 (t, J=7,4 Hz, 1H), 6,55 (d, J=8,5 Hz, 1H), 1,76-1,07 (m, 10H), 0,86-0,77 (m, 6H).
Промежуточный продукт 122
2-Этил-N1-фенилгексан-1,2-диамин
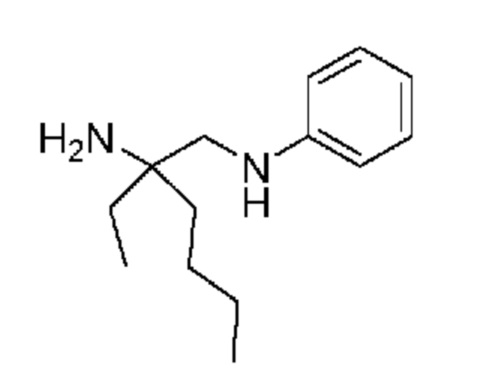
При перемешивании к раствору 2-амино-2-этил-N-фенилгексанамида (промежуточный продукт 121; 66 г, 0,28 моля) в THF (600 мл) добавляли диметилсульфид борана (2M в THF, 253 мл, 0,51 моля) при 0°C и реакционную смесь нагревали в течение 16 ч при 70°C. После завершения реакции (следили с помощью TLC) реакцию останавливали метанолом (300 мл) при 0°C. Затем реакционную смесь нагревали в течение 2 ч при 70°C. Реакционную смесь концентрировали в вакууме и полученный остаток растворяли в EtOAc (1000 мл). Органический слой промывали водой (2×150 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 40% EtOAc в гексане; силикагель: 230-400 меш) и получали искомое соединение. Выход: 82% (50 г, коричневая жидкость).
1H NMR (400 MHz, DMSO-d6): δ 7,04 (t, J=7,2 Hz, 2H), 6,61 (d, J=8,4 Hz, 2H), 6,49 (t, J=7,2 Hz, 1H), 5,15 (t, J=4,8 Hz, 1H), 2,79 (d, J=5,6 Hz, 2H), 1,39-1,17 (m, 10H), 0,88-0,79 (m, 6H).
Промежуточный продукт 123
1,2-бис(2,4-дибром-5-метоксифенил)дисульфан

При перемешивании к раствору 3-метоксибензолтиола (100 г, 0,7 моля) в метаноле (1000 мл) по каплям добавляли бром (73 мл, 1,4 моля) при 0°C и реакционную смесь перемешивали в течение 24 ч при комнатной температуре. Реакционную смесь выпаривали в вакууме и полученное неочищенное вещество разбавляли с помощью EtOAc (2000 мл) и промывали водой (2×500 мл). Органический слой сушили над безводным Na2SO4и концентрировали в вакууме. Полученное неочищенное вещество растворяли в ледяной уксусной кислоте (600 мл), по каплям добавляли бром (20 мл) при комнатной температуре и реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Полученное твердое вещество отфильтровывали, растирали с DCM и сушили в вакууме и получали чистое искомое соединение. Выход: 37% (78 г, белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,69 (s, 2H), 7,17 (s, 2H), 3,84 (s, 6H).
Промежуточный продукт 124
2,4-Дибром-5-метоксибензолсульфонилхлорид

При перемешивании к суспензии 1,2-бис(2,4-дибром-5-метоксифенил)дисульфана (промежуточный продукт 123; 20,0 г, 33,67 ммоля) и нитрата калия (17,02 г, 168,35 ммоля) в ацетонитриле (200 мл) по каплям добавляли сульфурилхлорид (13,6 мл, 168,35 ммоля) при 0°C и реакционную смесь перемешивали в течение 24 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь выливали в измельченный лед и полученное твердое вещество отфильтровывали. Твердое вещество промывали водой и сушили в вакууме и получали чистое искомое соединение. Выход: 91% (22,5 г, белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 8,05 (s, 1H), 7,66 (s, 1H), 4,01 (s, 3H).
Промежуточный продукт 125
2,4-Дибром-5-метокси-N-(3-((фениламино)метил)гептан-3-ил)бензолсульфонамид
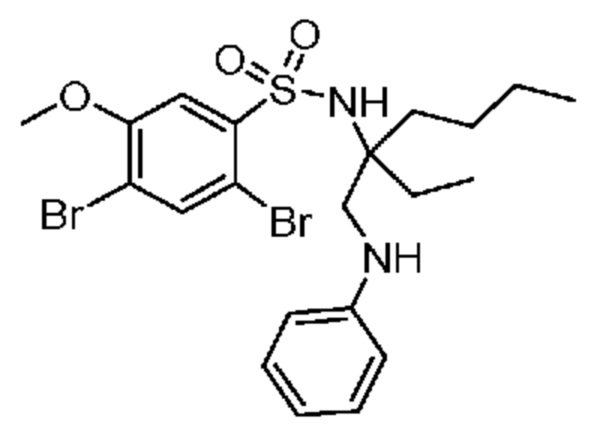
При перемешивании к раствору 2-этил-N1-фенилгексан-1,2-диамина (промежуточный продукт 122; 4,9 г, 22,34 ммоля) в THF (10 мл) добавляли 2,4-дибром-5-метоксибензолсульфонилхлорид (промежуточный продукт 124; 10,5 г, 28,91 ммоля) и триэтиламин (9,3 мл, 67,02 ммоля) при 0°C и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь разбавляли с помощью EtOAc (50 мл). Органический слой промывали водой (2×15 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 10% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 59% (7,2 г, белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 8,01 (s, 1H), 7,60 (s, 1H), 7,50 (s, 1H), 7,03 (t, J=8,1 Hz, 2H), 6,54-6,46 (m, 3H), 4,80 (t, J=5,1 Hz, 1H), 3,86 (s, 3H), 3,07-2,96 (m, 2H), 1,66-1,41 (m, 4H), 1,15-0,95 (m, 4H), 0,78-0,69 (m, 6H).
Промежуточный продукт 126
7-Бром-3-бутил-3-этил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1,1-диоксид
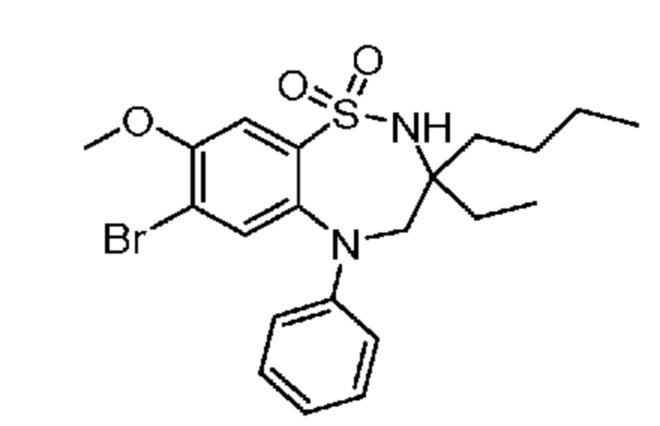
При перемешивании к раствору 2,4-дибром-5-метокси-N-(3-((фениламино)метил)гептан-3-ил)бензолсульфонамида (промежуточный продукт 125; 7,2 г, 13,1 ммоля) в DMF (50 мл) добавляли карбонат калия (3,62 г, 26,2 ммоля) и порошкообразную медь (834 мг, 13,1 ммоля) и реакционную смесь нагревали в течение 24 ч при 150°C. После завершения реакции (следили с помощью TLC) реакционную смесь фильтровали через целит и промывали с помощью EtOAc (25 мл). Фильтрат концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 20% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 83% (5,1 г, белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,43-7,30 (m, 4H), 7,15-7,13 (m, 2H), 7,03-7,01 (m, 2H), 4,00-3,60 (m, 5H), 1,62-1,34 (m, 4H), 1,08-0,95 (m, 4H), 0,74-0,71 (m, 6H). LCMS: (методика A) 467,0 (M+), Rt. 3,06 мин, 95,31% (максимально).
Промежуточный продукт 127
7-Бром-3-бутил-3-этил-8-метокси-2-(4-метоксибензил)-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1,1-диоксид

При перемешивании к раствору 7-бром-3-бутил-3-этил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1,1-диоксида (промежуточный продукт 126; 20,0 г, 42,7 ммоля) в N-метил-2-пирролидоне (100 мл) добавляли Cs2CO3 (27,8 г, 85,5 ммоля) и п-метоксибензилбромид (7,98 мл, 39,5 ммоля) при 0°C и реакционную смесь перемешивали в течение 1 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь разбавляли с помощью EtOAc (200 мл) и органический слой промывали водой (2×50 мл). Органическую часть сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 10% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 64% (16 г, белое твердое вещество).
LCMS: (методика A) 587,2 (M+), Rt. 3,51 мин, 92,94% (максимально).
Промежуточный продукт 128
3-Бутил-3-этил-8-гидрокси-2-(4-метоксибензил)-7-(метилтио)-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1,1-диоксид
При перемешивании к раствору 7-бром-3-бутил-3-этил-8-метокси-2-(4-метоксибензил)-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1,1-диоксида (промежуточный продукт 127; 16,0 г, 27,2 ммоля) в DMF (120 мл) добавляли тиометоксид натрия (9,5 г, 136,1 ммоля) и реакционную смесь нагревали в течение 16 ч при 60°C. После завершения реакции (следили с помощью LCMS) реакционную смесь разбавляли с помощью EtOAc (200 мл) и органический слой промывали водой (2×50 мл). Органическую часть сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 10% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 65% (9,2 г, белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 10,37 (bs, 1H), 7,31-7,22 (m, 5H), 7,01-6,65 (m, 6H), 4,32-4,13 (m, 2H), 4,10-3,90 (m, 2H), 3,74 (s, 3H), 2,15 (s, 3H), 1,62-1,34 (m, 4H), 1,08-0,98 (m, 4H), 0,74-0,65 (m, 6H). LCMS: (методика E) 541,2 (M++H), Rt. 2,86 мин, 93,67% (максимально).
Промежуточный продукт 129
трет-Бутил-(E)-3-((3-бутил-3-этил-2-(4-метоксибензил)-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)акрилат

При перемешивании к раствору 3-бутил-3-этил-8-гидрокси-2-(4-метоксибензил)-7-(метилтио)-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1,1-диоксида (промежуточный продукт 128, 1,0 г, 1,85 ммоля) в THF (10 мл) добавляли DABCO (0,02 г, 0,18 ммоля) и трет-бутилпропиолат (0,28 г, 2,22 ммоля) при 0°C и реакционную смесь перемешивали в течение 1 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь разбавляли с помощью EtOAc (20 мл). Органический слой промывали водой (2×15 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 15% EtOAc в гексане; силикагель: 230-400 меш) и получали искомое соединение. Выход: 49% (0,6 г, белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,66 (d, J=12,3 Hz, 1H), 7,43 (s, 1H), 7,37 (t, J=7,6 Hz, 2H), 7,26 (d, J=8,6 Hz, 2H), 7,20-7,14 (m, 3H), 6,87 (d, J=8,6 Hz, 2H), 6,48-6,25 (m, 1H), 5,27 (d, J=12,1 Hz, 1H), 4,51 (s, 2H), 4,30-4,10 (m, 2H), 3,73 (s, 3H), 2,08 (s, 3H), 1,50-1,36 (m, 13H), 1,18-0,84 (m, 4H), 0,72-0,48 (m, 6H). LCMS: (методика A) 611,2 (M+-tBu+H), Rt. 3,94 мин, 98,16% (максимально).
Промежуточный продукт 130
Метил-(Z)-3-((3,3-дибутил-5-(4-(трет-бутилкарбамоил)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилат

К суспензии NaH (60%, 29 мг, 1,21 ммоля) в DMF (1 мл) при 0°C добавляли N-(трет-бутил)-4-(3,3-дибутил-8-гидрокси-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-5(2H)-ил)бензамид (промежуточный продукт 105; 550 мг, 1,0 ммоля) в DMF (2 мл) и смесь перемешивали в течение 30 мин при комнатной температуре. Затем добавляли метил-3-бром-2,2-дифторпропионат (164 мг, 0,8 ммоля) при 0°C и реакционную смесь нагревали в течение 8 ч при 65°C. После завершения реакции (следили с помощью TLC) реакционную смесь охлаждали до 0°C, реакцию останавливали с помощью разбавляли HCl (1,5 н., 2 мл) и реакционную смесь концентрировали в вакууме. Полученное неочищенное вещество подвергали распределению между охлажденной льдом водой (15 мл) и EtOAc (15 мл) и водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенный органический слой промывали охлажденной льдом водой (10 мл), рассолом (10 мл) и затем сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 40% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 14% (90 мг, бледно-коричневое твердое вещество).
LCMS: (методика E) 649,3 (M++H), Rt. 2,76 мин, 73,56% (максимально).
Промежуточный продукт 131
3-Бутил-7-(диметиламино)-3-этил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид
При перемешивании к раствору 7-бром-3,3-дибутил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (3 г, 6,43 ммоля) в толуоле (10 мл) добавляли Cs2CO3 (5,2 г, 16,1 ммоля) и реакционную смесь дегазировали с помощью N2 в течение 10 мин. Затем добавляли диметиламин (2M в THF; 6,4 мл, 12,8 ммоля), Pd(OAc)2 (0,04 г, 0,16 ммоля), затем X-Phos (0,08 г, 0,16 ммоля) и реакционную смесь нагревали в течение16 ч при 90°C. После завершения реакции (следили с помощью TLC) реакционную смесь фильтровали через целит и промывали с помощью EtOAc (100 мл). Объединенную органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 13-15% EtOAc/PE, силикагель: 230-400 меш) и получали искомое соединение. Выход: 26% (0,7 г, желтое смолообразное вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,28 (s, 1H), 7,22-7,18 (m, 2H), 6,97 (d, J=8,0 Hz, 2H), 6,83 (t, J=7,2 Hz, 1H), 6,34 (s, 1H), 3,85 (s, 3H), 3,70 (bs, 2H), 3,29 (s, 2H), 2,66 (s, 6H), 1,54-1,41 (m, 2H), 1,35-1,24 (m, 2H), 1,20-1,12 (m, 4H), 0,85-0,75 (m, 6H). LCMS: (методика A) 431,2 (M++H), Rt. 3,19 мин, 83,34% (максимально).
Промежуточный продукт 132
3-Бутил-7-(диметиламино)-3-этил-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид
При перемешивании к раствору 3-бутил-7-(диметиламино)-3-этил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 131; 1,9 г, 4,41 ммоля) в DMF (15 мл) при комнатной температуре добавляли тиометоксид натрия (1,54 г, 22,06 ммоля) и реакционную смесь перемешивали в течение 12 ч при 80°C. После завершения реакции (следили с помощью TLC) реакционную массу охлаждали до комнатной температуры и реакцию останавливали водой (15 мл). Водный слой экстрагировали с помощью EtOAc (2×15 мл). Объединенный органический слой промывали водой (20 мл) и рассолом (20 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и получали неочищенное соединение, которое направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 1,8 г (неочищенное коричневое смолообразное вещество).
LCMS: (методика E) 417,2 (M++H), Rt. 2,11 мин, 55,04% (максимально).
Промежуточный продукт 133
трет-Бутил-(E)-3-((3-бутил-7-(диметиламино)-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат

При перемешивании к раствору 3,3-бутил-7-(диметиламино)-3-этил-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 132; 0,1 г, 0,24 ммоля) в сухом THF (3 мл) добавляли трет-бутилпропиолат (0,046 г, 0,36 ммоля) и DABCO (2,7 мг, 0,024 ммоля) и затем реакционную смесь перемешивали в течение 30 мин при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и полученный остаток подвергали распределению между водой (5 мл) и EtOAc (5 мл). Водный слой экстрагировали с помощью EtOAc (2×5 мл). Объединенную органическую часть промывали рассолом (10 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 25% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 85% (0,11 г, белое твердое вещество).
1H-NMR (400 MHz, DMSO-d6): δ 7,56 (d, J=12,2 Hz, 1H), 7,38 (s, 1H), 7,29 (t, J=7,9 Hz, 2H), 7,15 (d, J=7,3 Hz, 2H), 6,97 (t, J=7,4 Hz, 1H), 6,26 (s, 1H), 5,38 (d, J=12,2 Hz, 1H), 3,72 (bs, 2H), 3,29 (s, 2H), 2,67 (s, 6H), 1,44 (s, 9H), 1,37-1,30 (m, 4H), 1,17-0,95 (m, 4H), 0,75-0,70 (m, 6H). LCMS: (методика A) 543,3 (M++H), Rt. 3,5 мин, 97,69% (максимально).
Промежуточный продукт 134
5-Фтор-6-метоксибензо[d]тиазол-2-амин
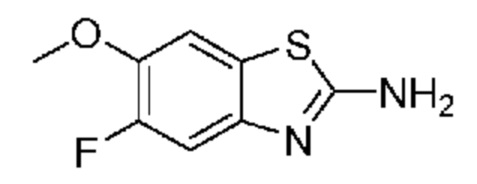
При перемешивании к раствору 3-фтор-4-метоксианилина (5 г, 0,04 ммоля) в уксусной кислоте (50 мл) добавляли тиоцианат аммония (2,96 г, 0,04 ммоля) и реакционную смесь перемешивали в течение 45 мин при комнатной температуре. Затем бром (5,7 г, 0,04 ммоля), растворенный в уксусной кислоте (10 мл), по каплям добавляли к реакционной смеси при 15°C и полученную реакционную смесь перемешивали в течение 3 ч при комнатной температуре. После завершения реакции полученное твердое вещество отфильтровывали и твердое вещество промывали уксусной кислотой (10 мл) и затем сушили в вакууме. Полученное твердое вещество суспендировали в воде (20 мл), подщелачивали 10% раствором NaOH (pH ~10) и отфильтровывали. Полученное твердое вещество промывали водой (3×20 мл) и сушили в вакууме и получали искомое соединение. Выход: 84% (5,9 г, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,52 (d, J=8,6 Hz, 1H), 7,39 (s, 2H), 7,18 (d, J=12,4 Hz, 1H), 3,81 (s, 3H). LCMS: (методика A) 199,04 (M++H), Rt. 1,08 мин, 98,24% (максимально).
Промежуточный продукт 135
2-(((2-Амино-4-фтор-5-метоксифенил)тио)метил)-2-бутилгексановая кислота

При перемешивании к раствору 5-фтор-6-метоксибензо[d]тиазол-2-амина (промежуточный продукт 134; 5,9 г, 0,03 ммоля) в воде (60 мл) добавляли KOH (27 г, 0,47 ммоля) и реакционную смесь перемешивали в течение 16 ч при 120°C. После завершения реакции (следили с помощью LCMS) реакционную смесь охлаждали до комнатной температуры. Затем по каплям добавляли 2-(бромметил)-2-бутилгексановую кислоту (4,5 г, 0,04 ммоля) (растворяли в 20 мл THF) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После израсходования исходного вещества (следили с помощью LCMS) реакционную смесь охлаждали до 0°C и подкисляли концентрированной HCl (pH ~2). Водный слой экстрагировали с помощью EtOAc (2×20 мл). Объединенный органический слой промывали водой (20 мл) и рассолом (20 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 12,5 г (неочищенное коричневое смолообразное вещество).
LCMS: (методика A) 358,2 (M++H), Rt. 2,67 мин, 61,03% (максимально).
Промежуточный продукт 136
3,3-Дибутил-7-фтор-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5H)-он

При перемешивании к раствору 2-(((2-амино-4-фтор-5-метоксифенил)тио)метил)-2-бутилгексановой кислоты (промежуточный продукт 135; 12,5 г, 0,04 ммоля) в EtOAc (80 мл) при 0°C по каплям добавляли триэтиламин ( 9,04 г, 0,07 ммоля) и раствор 1-пропанфосфорного ангидрида (50% в EtOAc; 16,7 г, 0,05 ммоля) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью UPLC) реакцию останавливали водой (100 мл) и водный слой экстрагировали с помощью EtOAc (2×50 мл). Объединенный органический слой промывали рассолом (25 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 10-12% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 48% (5,7 г, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 9,60 (s, 1H), 7,18 (d, J=9,2 Hz, 1H), 6,99 (d, J=12,7 Hz, 1H), 3,82 (s, 3H), 2,98 (s, 2H), 1,64-1,50 (m, 2H), 1,49-1,45 (m, 2H), 1,22-1,17 (m, 8H), 0,83 (t, J=6,7 Hz, 6H). LCMS: (методика A) 340,2 (M++H), Rt. 2,96 мин, 99,47% (максимально).
Промежуточный продукт 137
3,3-Дибутил-7-фтор-8-метокси-5-фенил-2,3-дигидро-1,5-бензотиазепин-4(5H)-он

При перемешивании к раствору 3,3-дибутил-7-фтор-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5H)-она (промежуточный продукт 136; 5,7 г, 0,02 моля) в йодбензоле (30 мл) добавляли йодид меди(I) (0,67 г, 0,003 моля) и K2CO3(4,84 г, 0,035 моля) и раствор продували азотом в течение 20 мин для дегазации. Затем добавляли трис[2-(2-метоксиэтокси)этил]амин (0,56 мл, 0,017 моля) в атмосфере азота и полученную реакционную смесь нагревали в течение 40 ч при 135°C. После завершения реакции (следили с помощью UPLC) реакционную смесь фильтровали через целит и слой целита промывали с помощью EtOAc (100 мл). Фильтрат промывали водой (50 мл) и рассолом (50 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и получали неочищенное вещество, которое очищали с помощью колоночной хроматографии Isolera (элюент: 3-5% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 63% (4,6 г, бледно-коричневое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,44-7,38 (m, 3H), 7,29-7,26 (t, J=7,6 Hz, 1H), 7,07 (d, J=7,6 Hz, 2H), 6,79 (d, J=11,96 Hz, 1H), 3,89 (s, 3H), 3,46 (s, 2H), 1,37-1,38 (m, 4H), 1,18-1,37 (m, 8H), 0,79-0,81 (m, 6H). LCMS: (методика A) 416,3 (M++H), Rt. 3,32 мин, 99,63% (максимально).
Промежуточный продукт 138
3,3-Дибутил-7-фтор-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин
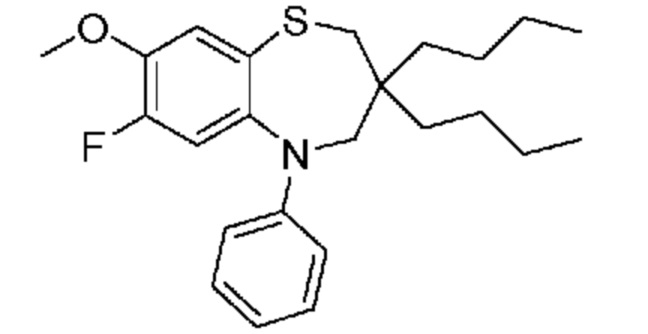
При перемешивании к раствору 3,3-дибутил-7-фтор-8-метокси-5-фенил-2,3-дигидро-1,5-бензотиазепин-4(5H)-она (промежуточный продукт 137; 4,6 г, 11,07 ммоля) в THF (45 мл) при 0°C по каплям добавляли диметилсульфид борана (2M в THF; 17,2 мл, 33,2 ммоля) и реакционную смесь кипятили с обратным холодильником в течение 40 ч при 75°C. После завершения реакции (следили с помощью UPLC) реакционную смесь охлаждали до 0°C, реакцию останавливали метанолом (10 мл) и нагревали в течение 2 ч при 65°C. Затем полученную реакционную смесь охлаждали до комнатной температуры и концентрировали в вакууме и получали неочищенное вещество, которое направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 5 г (неочищенная бесцветная жидкость).
1H NMR (400 MHz, DMSO-d6): δ 7,20 (t, J=7,5 Hz, 2H), 7,10 (d, J=9,5 Hz, 1H), 6,93 (d, J=6,0 Hz, 2H), 6,81 (t, J=7,1 Hz, 1H), 6,62 (d, J=12,6 Hz, 1H), 3,81 (s, 3H), 3,33 (s, 2H), 2,73 (s, 2H), 1,18-1,11 (m, 12H), 0,79-0,78 (m, 6H). LCMS: (методика D) 402,4 (M++H), Rt. 3,9 мин, 99,4% (максимально).
Промежуточный продукт 139
3,3-Дибутил-7-фтор-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид

При перемешивании к раствору 3,3-дибутил-7-фтор-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепина (промежуточный продукт 138; 5 г, 0,01 ммоля) в THF (75 мл) и воде (7,5 мл) добавляли оксон (38,3 г, 0,13 ммоля) при комнатной температуре и реакционную смесь перемешивали в течение в течение 24 ч при этой температуре. После завершения реакции (следили с помощью TLC) реакционную смесь фильтровали через воронку Бюхнера и фильтрат экстрагировали с помощью EtOAc (2×25 мл). Объединенный органический слой промывали водой (25 мл) и рассолом (25 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 10-12% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 59% (3,2 г, почти белое твердое вещество).
LCMS: (методика D) 434,2 (M++H), Rt. 3,21 мин, 92,6% (максимально).
Промежуточный продукт 140
3,3-Дибутил-7-фтор-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид

При перемешивании к раствору 3,3-дибутил-7-фтор-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 139; 1,0 г, 2,3 ммоля) в DCM (10 мл) добавляли BBr3 (1M в DCM; 7 мл, 6,92 ммоля) при 0°C и реакционную смесь перемешивали в течение 1 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) по каплям добавляли метанол (10 мл) при 0°C до прекращения выделения газа. Затем реакционную смесь разбавляли с помощью DCM (20 мл). Слой DCM промывали водой (2×20 мл) и рассолом (10 мл). Органическую часть сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 25-30% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 93% (0,9 г, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 10,45 (s, 1H), 7,48 (d, J=9,4 Hz, 1H), 7,24 (t, J=8,3 Hz, 2H), 7,02 (d, J=7,6 Hz, 2H), 6,90 (t, J=7,3 Hz, 1H), 6,74 (d, J=12,1 Hz, 1H), 3,68 (s, 2H), 3,27 (s, 2H), 1,40-1,32 (m, 4H), 1,18-1,01 (m, 8H), 0,75 (t, J=6,80 Hz, 6H). LCMS: (методика A) 420,3 (M++H), Rt. 2,99 мин, 95,69% (максимально).
Промежуточный продукт 141
трет-бутил-(E)-3-((3,3-дибутил-7-фтор-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат
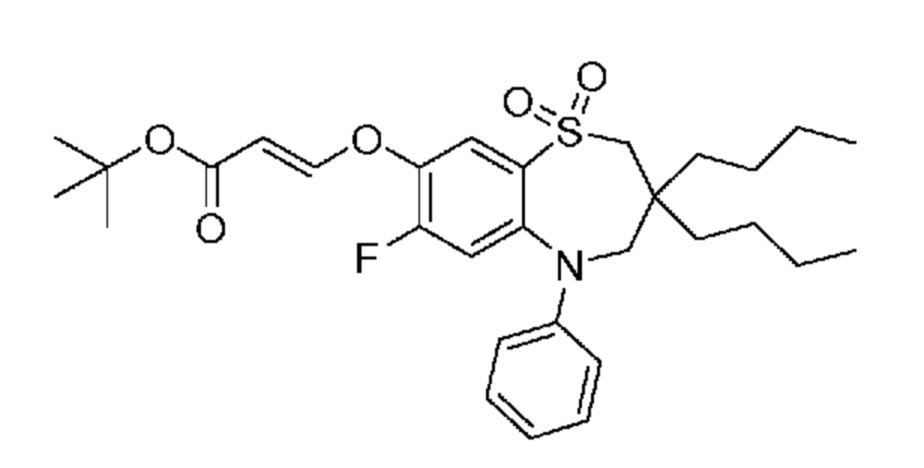
При перемешивании к раствору 3,3-дибутил-7-фтор-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 140; 0,15 г, 0,35 ммоля) в сухом THF (5 мл) добавляли этилпропиолат (0,067 г, 0,53 ммоля) и DABCO (4,0 мг, 0,035 ммоля) и реакционную смесь перемешивали в течение 1 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и полученный остаток подвергали распределению между водой (10 мл) и EtOAc (15 мл). Водный слой экстрагировали с помощью EtOAc (2×15 мл). Объединенную органическую часть промывали рассолом (10 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 25% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 82% (0,16 г, белое твердое вещество).
1H-NMR (400 MHz, DMSO-d6): δ 7,73 (s, 1H), 7,71 (d, J=3,6 Hz, 1H), 7,37 (t, J=8,0 Hz, 2H), 7,31 (d, J=7,6 Hz, 2H), 7,11 (t, J=7,2 Hz, 1H), 6,68 (d, J=11,2 Hz, 1H), 5,36 (d, J=12,0 Hz, 1H), 3,83 (bs, 2H), 3,47 (s, 2H), 1,42 (m, 11H), 1,35-1,28 (m, 2H), 1,27-1,08 (m, 4H), 1,05-1,01 (m, 4H), 0,73 (t, J=8,00 Hz, 6H). LCMS: (методика A) 490,2 (M-tBu+H), Rt. 3,78 мин, 95,03% (максимально).
Промежуточный продукт 142
3,3-Дибутил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбонитрил-1,1-диоксид

К дегазированному раствору 7-бром-3,3-дибутил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (2 г, 4,03 ммоля) в DMA (10 мл) добавляли карбонат натрия (0,42 г, 4,03 ммоля) и K4[Fe(CN)]6 (1,7 г, 4,03 ммоля) при комнатной температуре и реакционную смесь дегазировали с помощью N2 в течение 15 мин. Затем добавляли Pd(OAc)2 (90 мг, 0,4 ммоля) и реакционную смесь нагревали в течение 24 ч при 120°C. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме. Полученную массу подвергали распределению между водой (10 мл) и EtOAc (10 мл) и водный слой экстрагировали с помощью EtOAc (2×25 мл). Объединенный органический слой промывали охлажденной льдом водой (50 мл) и рассолом (50 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 90-100% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 44% (1,2 г, светло-желтое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,56 (s, 1H), 7,36 (s, 1H), 7,28 (t, J=7,6 Hz, 2H), 7,09 (d, J=7,6 Hz, 2H), 6,96 (t, J=7,0 Hz, 1H), 3,99 (s, 3H), 3,43 (s, 2H), 3,34 (s, 2H), 1,40-1,30 (m, 4H), 1,20-1,00 (m, 8H), 0,75 (t, J=6,1 Hz, 6H). LCMS: (методика A) 441,3 (M++H), Rt. 3,15 мин, 87,84% (максимально).
Промежуточный продукт 143
3,3-Дибутил-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбонитрил-1,1-диоксид

К раствору 3,3-дибутил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбонитрил-1,1-диоксида (промежуточный продукт 142; 0,76 г, 1,72 ммоля) в DCM (10 мл) при -10°C добавляли BBr3 (1M в DCM, 3,4 мл, 3,45 ммоля) и реакционную смесь перемешивали в течение 12 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь охлаждали до 0°C и реакцию останавливали охлажденной льдом водой (5 мл). Водный слой экстрагировали с помощью DCM (2×10 мл). Объединенный органический слой промывали охлажденной льдом водой (10 мл) и рассолом (10 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 30% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 28% (0,21 г, желтое твердое вещество).
1H NMR (400 MHz, CDCl3): δ 7,68 (s, 1H), 7,34 (t, J=8,0 Hz, 2H), 7,11-7,05 (m, 4H), 3,75 (s, 2H), 3,26 (s, 2H), 1,42-1,27 (m, 4H), 1,18-1,04 (m, 8H), 0,80 (t, J=6,8 Hz, 6H). LCMS: (методика E) 427,2 (M++H), Rt. 2,76 мин, 68,44% (максимально).
Промежуточный продукт 144
трет-Бутил-(E)-3-((3,3-дибутил-7-циано-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат
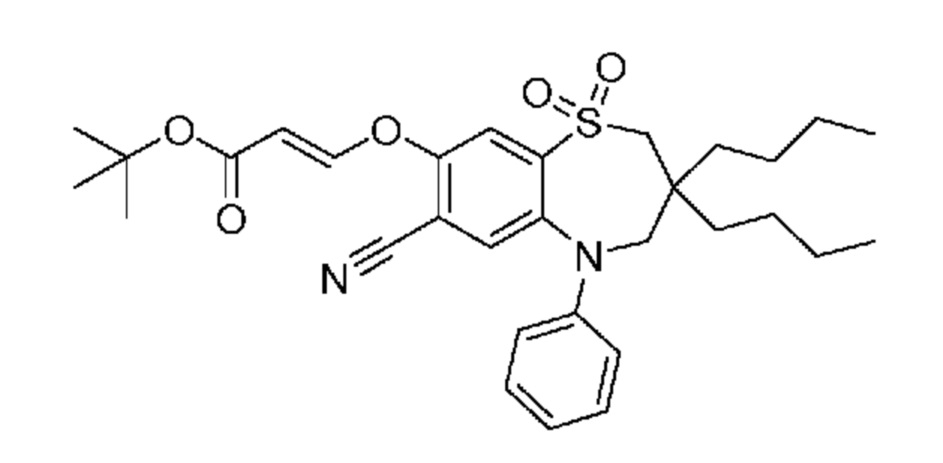
При перемешивании к раствору 3,3-дибутил-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбонитрил-1,1-диоксида (промежуточный продукт 143; 0,21 г, 0,49 ммоля) в THF (2 мл) добавляли DABCO (5,50 мг, 0,05 ммоля) и трет-бутилпропиолат (81 мг, 0,69 ммоля) и реакционную смесь перемешивали в течение 30 мин при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и полученный остаток подвергали распределению между водой (5 мл) и EtOAc (5 мл). Водный слой экстрагировали с помощью EtOAc (2×5 мл). Объединенный органический слой промывали охлажденной льдом водой (5 мл) и рассолом (5 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 25% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 81% (220 мг, желтое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,80 (d, J=12,0 Hz, 1H), 7,75 (s, 1H), 7,37 (t, J=7,6 Hz, 3H), 7,29 (d, J=6,8 Hz, 2H), 7,11 (t, J=7,6 Hz, 1H), 5,57 (d, J=12,0 Hz, 1H), 3,82 (s, 2H), 3,53 (s, 2H), 1,46-1,27 (m, 13H), 1,21-0,85 (m, 8H), 0,74 (t, J=6,4 Hz, 6H). LCMS: (методика E) 497,2 (M+-tBu+H), Rt,3,09 мин, 80,74% (максимально).
Промежуточный продукт 145
Метил-(E)-3-((3,3-дибутил-2-(4-метоксибензил)-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)бут-2-еноат

При перемешивании к раствору 3,3-дибутил-8-гидрокси-2-(4-метоксибензил)-7-(метилтио)-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1,1-диоксида (0,5 г, 0,88 ммоля) в THF (10 мл) добавляли DABCO (0,09 г, 0,88 ммоля) и метил-2-бутиноат (0,13 г, 1,32 ммоля) при комнатной температуре и реакционную смесь перемешивали в течение 16 ч при 50°C. После завершения реакции (следили с помощью TLC) реакционную смесь разбавляли с помощью EtOAc (30 мл) и органический слой промывали водой (2×15 мл). Объединенный органический слой сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 7% EtOAc в гексане; силикагель: 230-400 меш) и получали искомое соединение. Выход: 64% (0,38 г, белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,41-7,34 (m, 3H), 7,23 (d, J=8,0 Hz, 2H), 7,16-7,13 (m, 3H), 6,84 (d, J=8,0 Hz, 2H), 6,34 (s, 1H), 4,76 (s, 1H), 4,58 (s, 2H), 4,28 (s, 2H), 3,73 (s, 3H), 3,56 (d, J=8,0 Hz, 3H), 2,42 (s, 3H), 1,99 (s, 3H), 2,00-1,75 (m, 2H), 1,50-1,32 (m, 2H), 1,20-0,75 (m, 8H), 0,75-0,50 (m, 6H). LCMS: (методика A) 667,3 (M++H), Rt. 3,84 мин, 99,29% (максимально).
Промежуточный продукт 146
(E)-3-((3,3-дибутил-2-(4-метоксибензил)-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)бут-2-еновая кислота

При перемешивании к раствору метил-(E)-3-((3,3-дибутил-2-(4-метоксибензил)-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)бут-2-еноата (промежуточный продукт 145; 0,38 г, 0,56 ммоля) в смеси 1,4-диоксана и воды (10 мл, 4:1) добавляли гидроксид лития (0,047 г, 1,13 ммоля) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1 мл, 1,5 н.). Водный слой экстрагировали с помощью EtOAc (2×20 мл) и объединенный органический слой сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 20% EtOAc в гексане; силикагель: 230-400 меш) и получали искомое соединение. Выход: 40% (150 мг, белое твердое вещество). LCMS: (методика E) 653,2 (M++H), Rt. 3,01 мин, 98,64% (максимально)
Промежуточный продукт 147
Этил-(Z)-3-((3-бутил-3-этил-2-(4-метоксибензил)-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакрилат

При перемешивании к раствору 3-бутил-3-этил-8-гидрокси-2-(4-метоксибензил)-7-(метилтио)-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1,1-диоксида (промежуточный продукт 128; 1 г, 1,85 ммоля) в DMF (10 мл) при 0°C порциями добавляли NaH (60%, 0,037 г, 9,25 ммоля) и реакционную смесь перемешивали в течение 15 мин при 0°C. Затем добавляли метил-3-бром-2,2-дифторпропаноат (1,1 г, 5,55 ммоля) и реакционную смесь нагревали в течение 16 ч при 80°C. После завершения реакции (следили с помощью LCMS) реакционную смесь охлаждали до 0°C, реакцию останавливали с помощью разбавляли HCl (1,5 н., pH ~4) и разбавляли водой (5 мл). Водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенный органический слой промывали рассолом (5 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 30% EtOAc в гексане; силикагель: 230-400 меш) и получали искомое соединение. Выход: 33% (0,04 г, коричневое смолообразное вещество).
LCMS: (методика A) 643,2 (M++H), Rt. 3,35 мин, 90,58% (максимально).
Промежуточный продукт 148
(Z)-3-((3-бутил-3-этил-2-(4-метоксибензил)-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакриловая кислота
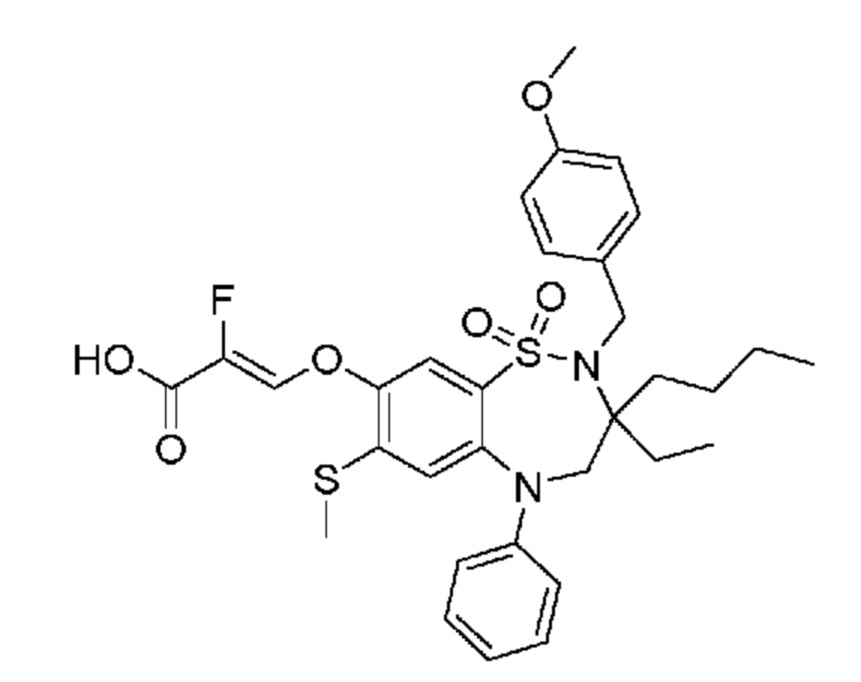
При перемешивании к раствору этил-(Z)-3-((3-бутил-3-этил-2-(4-метоксибензил)-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакрилата (промежуточный продукт 147; 0,04 г, 0,62 ммоля) в смеси 1, 4-диоксана и воды (10 мл, 4:1) добавляли гидроксид лития (0,13 г, 3,11 ммоля) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью LCMS) реакционную смесь подкисляли разбавленной HCl (1,5 н., 3 мл, pH~4) и затем разбавляли водой (5 мл). Водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенный органический слой промывали водой (8 мл) и рассолом (10 мл) и сушили над безводным Na2SO4. Органическую часть выпаривали в вакууме и полученное неочищенное вещество направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 89,9% (350 мг, бледно-коричневое смолообразное вещество).
LCMS: (методика A) 629,1 (M++H), Rt. 3,08 мин, 87,52% (максимально).
Промежуточный продукт 149
7-Бром-3-бутил-3-этил-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1,1-диоксид

При перемешивании к раствору 7-бром-3-бутил-3-этил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1,1-диоксида (промежуточный продукт 126; 1,0 г, 2,13 ммоля) в DCM (10 мл) добавляли BBr3 (0,32 мл, 3,37 ммоля) при -78°C и затем реакционную смесь перемешивали в течение 2 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакцию останавливали метанолом (10 мл) и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 24% EtOAc в гексане; силикагель: 230-400 меш) и получали искомое соединение. Выход: 51% (0,5 г, бесцветная смола).
1H NMR (400 MHz, DMSO-d6): δ 10,58 (s, 1H), 7,37-7,35 (m, 2H), 7,27 (t, J=7,6 Hz, 2H), 7,06-7,04 (m, 2H), 6,97-6,94 (m, 2H), 3,83 (bs, 2H), 1,61-1,58 (m, 2H), 1,50-1,41 (m, 2H), 1,37-1,33 (m, 4H), 0,73 (t, J=6,80 Hz, 6H). LCMS: (методика A) 455,1 (M++2H), Rt 2,81 мин, 94,49% (максимально).
Промежуточный продукт 150
трет-Бутил-(E)-3-((7-бром-3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)акрилат
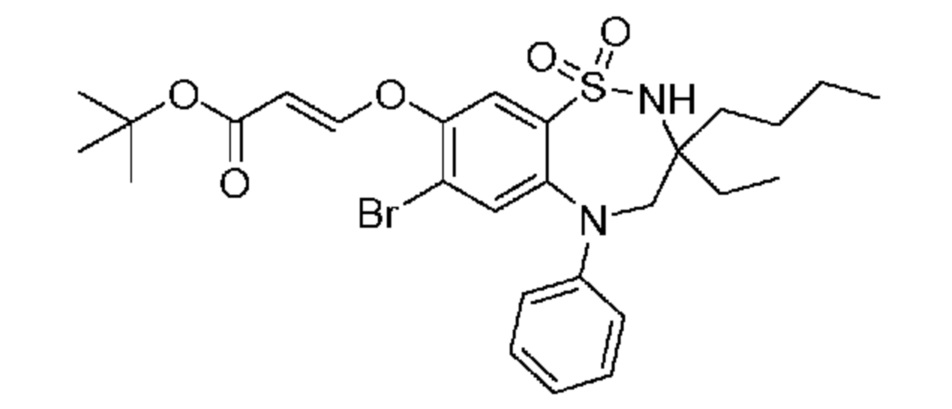
При перемешивании к раствору 7-бром-3-бутил-3-этил-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1,1-диоксида (промежуточный продукт 149; 0,5 г, 1,10 ммоля) ) в THF (5 мл) добавляли DABCO (12,3 мг, 0,1 ммоля) и трет-бутилпропиолат (0,22 мл, 1,60 ммоля) и реакционную смесь перемешивали в течение 1 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь разбавляли с помощью EtOAc (25 мл). Органический слой промывали водой (2×15 мл). Органическую часть сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 8% EtOAc в гексане; силикагель: 230-400 меш) и получали искомое соединение. Выход: 73% (0,46 г, белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,75 (bs, 1H), 7,65 (d, J=16,4 Hz, 1H), 7,54 (s, 1H), 7,45-7,42 (m, 2H), 7,33-7,31 (m, 2H), 7,19-7,15 (m, 1H), 6,84 (s, 1H), 5,19 (d, J=16,4 Hz, 1H), 4,02 (bs, 2H), 1,60-1,51 (m, 2H), 1,42 (s, 9H), 1,28-0,75 (m, 6H), 0,72-0,47 (m, 6H). LCMS: (методика A) 577,2 (M+-2H), Rt. 3,41 мин, 94,96%.
Промежуточный продукт 151
7-Бром-3-бутил-3-этил-8-метокси-2-метил-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1,1-диоксид
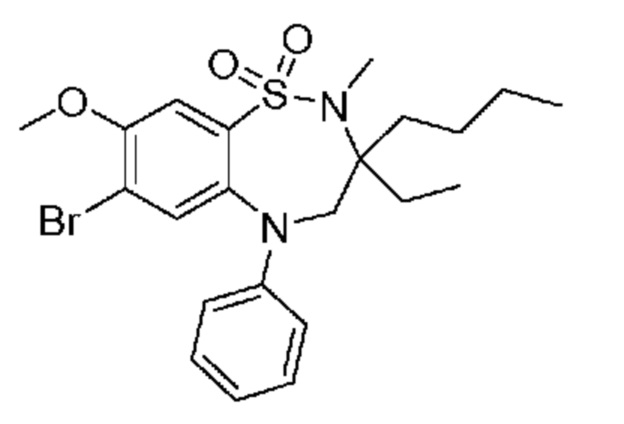
При перемешивании к раствору 7-бром-3-бутил-3-этил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1,1-диоксида (промежуточный продукт 126; 2 г, 4,27 ммоля) в N-метил-2-пирролидоне (10 мл) добавляли Cs2CO3(2,78 г, 8,53 ммоля) и метилйодид (1,33 мл, 21,36 ммоля) при комнатной температуре и затем реакционную смесь перемешивали в течение 8 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь разбавляли с помощью EtOAc (25 мл) и органический слой промывали водой (2×15 мл). Объединенную органическую часть сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 8% EtOAc в гексане; силикагель: 230-400 меш) и получали искомое соединение. Выход: 65% (1,3 г, белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,37-7,32 (m, 3H), 7,22-7,11 (m, 2H), 7,05-7,01 (m, 2H), 4,02-3,93 (m, 2H), 3,89 (s, 3H), 2,82 (s, 3H), 1,85-1,73 (m, 2H), 1,55-1,46 (m, 2H), 1,20-0,91 (m, 4H), 0,78-0,72 (m, 6H). LCMS: (методика E) 483,2 (M++2H), Rt. 2,95 мин, 96,64% (максимально).
Промежуточный продукт 152
3-Бутил-3-этил-8-гидрокси-2-метил-7-(метилтио)-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1,1-диоксид

При перемешивании к раствору 7-бром-3-бутил-3-этил-8-метокси-2-метил-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1,1-диоксида (промежуточный продукт 151; 1,3 г, 2,7 ммоля) в DMF (10 мл) добавляли тиометоксид натрия (0,72 г, 13,50 ммоля) при комнатной температуре и реакционную смесь перемешивали в течение 16 ч при 60°C. После завершения реакции (следили с помощью TLC) реакционную смесь разбавляли с помощью EtOAc (25 мл) и органический слой промывали водой (2×15 мл). Органическую часть сушили над безводным Na2SO4, концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 7% EtOAc в гексане; силикагель: 230-400 меш) и получали искомое соединение. Выход: 72% (0,87 г, белое твердое вещество).
1H NMR (400 MHz, DMSO- d6): δ 10,35 (s, 1H), 7,25-7,18 (m, 3H), 7,01-6,99 (m, 2H), 6,87 (t, J=7,2 Hz, 1H), 6,61 (s, 1H), 3,82 (bs, 2H), 2,68 (s, 3H), 2,13 (s, 3H), 1,84-1,71 (m, 2H), 1,54-1,47 (m, 2H), 1,24-0,95 (m, 4H), 0,86-0,68 (m, 6H). LCMS: (методика E) 435,2 (M++H), Rt. 2,69 мин, 97,42% (максимально).
Промежуточный продукт 153
трет-Бутил-(E)-3-((3-бутил-3-этил-2-метил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)акрилат
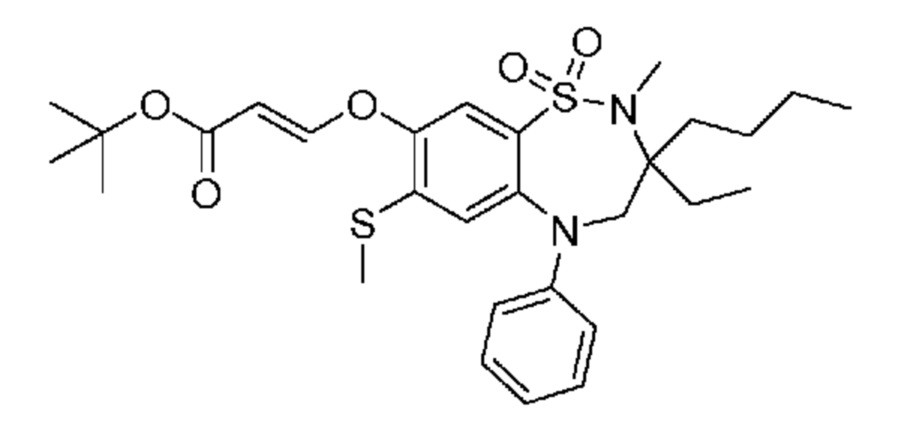
При перемешивании к раствору 3-бутил-3-этил-8-гидрокси-2-метил-7-(метилтио)-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1,1-диоксида (промежуточный продукт 152; 200 мг, 0,46 ммоля) в сухом THF (3 мл) добавляли DABCO (5,10 мг, 0,05 ммоля) и трет-бутилпропиолат (0,1 мл, 0,7 ммоля) при комнатной температуре и реакционную смесь перемешивали в течение 1 ч при комнатной температуре. После завершения реакции (следили с помощью LCMS) реакционную смесь разбавляли охлажденной льдом водой (10 мл). Водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенный органический слой сушили над безводным Na2SO4 и выпаривали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 6% EtOAc в гексане; силикагель: 230-400 меш) и получали искомое соединение. Выход: 75% (190 мг, белое твердое вещество).
H NMR (400 MHz, DMSO- d6): δ 7,61 (d, J=12,4 Hz, 1H), 7,38 (t, J=8,0 Hz, 3H), 7,30 (d, J=7,6 Hz, 2H), 7,12 (t, J=7,2 Hz, 1H), 6,46 (s, 1H), 5,31 (d, J=12,4 Hz, 1H), 4,12 (s, 2H), 2,88 (s, 3H), 2,08 (s, 3H), 1,92-1,86 (m, 1H), 1,82-1,76 (m, 1H), 1,55-1,43 (m, 10H), 1,19-1,08 (m, 5H), 0,83-0,62 (m, 6H). LCMS: (методика A) 505,2 (M+-tBu+H), Rt. 3,65 мин, 97,40%.
Промежуточный продукт 154
3-Бутил-3-этил-8-метокси-7-(метиламино)-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид

При перемешивании к раствору смеси 7-бром-3-бутил-3-этил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида и 3-бутил-3-этил-7-йод-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 91; 1,0 г, 2,1 ммоля) в толуоле (10 мл) добавляли Cs2CO3 (1,74 г, 5,3 ммоля) и реакционную смесь дегазировали в течение 10 мин с помощью N2. Затем Pd(OAc)2 (0,048 г, 0,2 ммоля), затем добавляли X-Phos (0,102 г, 0,2 ммоля) и метиламин (2M THF раствор; 2,14 мл, 4,3 ммоля) и реакционную смесь нагревали в течение 16 ч при 90°C. После завершения реакции (следили с помощью TLC) реакционную смесь фильтровали через целит и промывали с помощью EtOAc (15 мл). Объединенную органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 13-15% EtOAc/PE, силикагель: 230-400 меш) и получали искомое соединение. Выход: 62% (0,55 г, бесцветная смола).
1H NMR (400 MHz, DMSO-d6): δ 7,19 (d, J=11,2 Hz, 1H), 7,15 (s, 2H), 6,93 (s, 2H), 6,79 (t, J=9,6 Hz, 1H), 5,97 (s, 2H), 3,85 (s, 3H), 3,62 (bs, 2H), 3,11 (s, 2H), 2,57 (d, J=2,8 Hz, 3H), 1,36-1,29 (m, 4H), 1,18-1,08 (m, 4H), 0,75 (t, J=9,20 Hz, 6H). LCMS: (методика A) 417,1 (M++H), Rt. 2,78 мин, 98,76% (максимально).
Промежуточный продукт 155
3-Бутил-3-этил-8-гидрокси-7-(метиламино)-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид
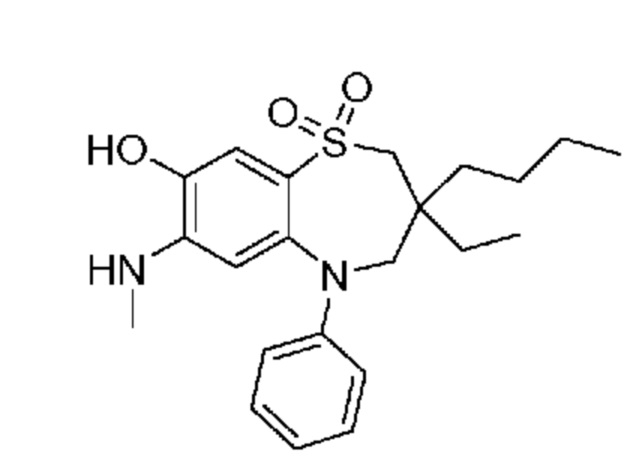
При перемешивании к раствору 3-бутил-3-этил-8-метокси-7-(метиламино)-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 154; 1,0 г, 2,4 ммоля) в DMF (10 мл) при комнатной температуре добавляли тиометоксид натрия (0,84 г, 12,01 ммоля) и реакционную смесь перемешивали в течение 12 ч при 80°C. После завершения реакции (следили с помощью TLC) реакционную смесь охлаждали до комнатной температуры и реакцию останавливали водой (15 мл). Водный слой экстрагировали с помощью EtOAc (2×15 мл). Объединенный органический слой промывали водой (20 мл) и рассолом (20 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и получали неочищенное вещество, которое направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 0,6 г (неочищенное коричневое смолообразное вещество).
LCMS: (методика A) 403,1 (M+H), Rt. 2,76 мин, 78,51% (максимально).
Промежуточный продукт 156
трет-Бутил-(E)-3-((3-бутил-3-этил-7-(метиламино)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат

При перемешивании к раствору 3-бутил-3-этил-8-гидрокси-7-(метиламино)-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 155; 0,15 г, 0,37 ммоля) в сухом THF (5 мл) добавляли трет-бутилпропиолат (0,07 г, 5,59 ммоля) и DABCO (4 мг, 0,037 ммоля) и реакционную смесь перемешивали в течение 1 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и полученный остаток подвергали распределению между водой (10 мл) и EtOAc (15 мл). Водный слой экстрагировали с помощью EtOAc (2×15 мл). Объединенный органический слой промывали рассолом (10 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 25% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 89% (0,18 г, белое твердое вещество).
1H-NMR (400 MHz, DMSO-d6): δ 7,64 (d, J=12,4 Hz, 1H), 7,59 (s, 1H), 7,32 (t, J=8,0 Hz, 2H), 7,27 (s, 1H), 7,23-7,20 (m, 2H), 7,02 (t, J=7,2 Hz, 1H), 6,65 (s, 1H), 5,44 (d, J=12,0 Hz, 1H), 3,81 (bs, 2H), 3,41 (s, 2H), 2,97 (s, 3H), 1,48-1,25 (m, 13H), 1,09-1,05 (m, 4H), 0,74 (t, J=6,80 Hz, 6H). LCMS: (методика A) 527,0 (M++H), Rt. 3,65 мин, 97,28% (максимально).
Промежуточный продукт 157
3,3-Дибутил-8-гидрокси-5-(4-метоксифенил)-7-(метилтио)-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид

При перемешивании к раствору 5-(4-бромфенил)-3,3-дибутил-8-гидрокси-7-(метилтио)-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 20; 5 г, 4,74 ммоля) в DMF (30 мл) при комнатной температуре добавляли NaOMe (30%, 2 мл, 9,50 ммоля) и реакционную смесь дегазировали в течение 15 мин с помощью N2. Затем добавляли Cu(I)Br (68 мг, 0,47 ммоля) и реакционную смесь нагревали в течение 48 ч при 120°C. После завершения реакции (следили с помощью TLC) реакционную смесь выливали в охлажденную льдом воду (5 мл) и водный слой экстрагировали с помощью EtOAc (2×100 мл). Объединенный органический слой промывали охлажденной льдом водой (100 мл) и рассолом (100 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 30-40% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 69% (3,1 г, коричневое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 10,29 (s, 1H), 7,25 (s, 1H), 7,04 (d, J=8,4 Hz, 2H), 6,85 (d, J=8,8 Hz, 2H), 6,47 (s, 1H), 3,71 (s, 3H), 3,66 (bs, 2H), 3,23 (s, 2H), 2,11 (s, 3H), 1,46-1,26 (m, 4H), 1,11-1,02 (m, 8H), 0,76 (t, J=6,4 Hz, 6H). LCMS: (методика E) 478,1 (M++H), Rt. 2,80 мин, 80,65% (максимально).
Промежуточный продукт 158
Этил-(Z)-3-((3,3-дибутил-5-(4-метоксифенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилат
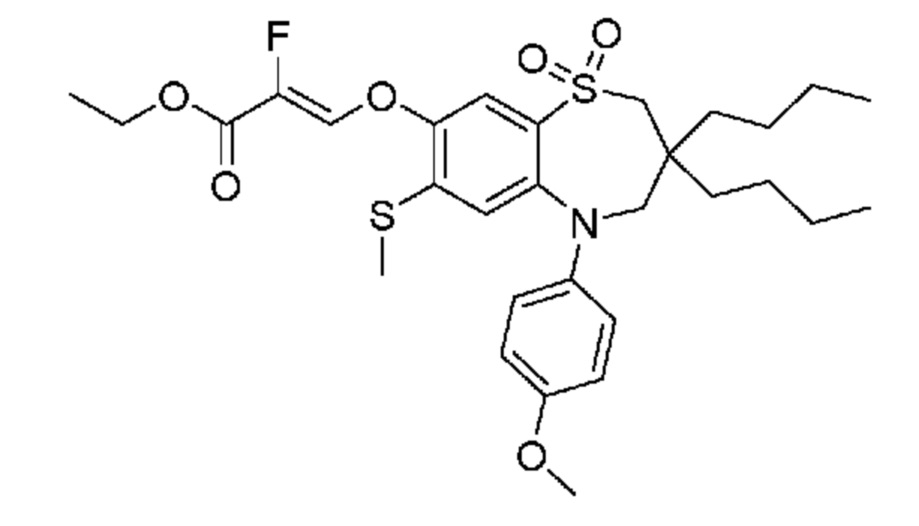
К суспензии NaH (60%, 0,85 г, 21,2 ммоля) в DMF (15 мл) при 0°C по каплям добавляли 3,3-дибутил-8-гидрокси-5-(4-метоксифенил)-7-(метилтио)-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид (промежуточный продукт 157; 3,1 г, 6,5 ммоля) в DMF (7,5 мл) и реакционную смесь перемешивали в течение 30 мин при комнатной температуре. Затем добавляли этил-3-бром-2,2-дифторпропионат (3,5 г, 16,2 ммоля) в DMF (7,5 мл) при 0°C и реакционную смесь нагревали в течение 8 ч при 65°C. После завершения реакции (следили с помощью TLC) реакционную смесь охлаждали до 0°C, реакцию останавливали с помощью разбавляли HCl (1,5 н., 20 мл) и концентрировали в вакууме. Полученный остаток растворяли в охлажденной льдом воде (100 мл) и водный слой экстрагировали с помощью EtOAc (2×100 мл). Объединенный органический слой промывали охлажденной льдом водой (100 мл) и рассолом (100 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 25% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 40% (1,5 г, желтое смолообразное вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,56-7,52 (m, 2H), 7,25 (d, J=8,4 Hz, 2H), 6,95 (d, J=8,0 Hz, 2H), 6,42 (s, 1H), 4,27-4,24 (m, 2H), 3,78-3,73 (m, 5H), 3,40 (s, 2H), 2,12 (s, 3H), 1,42-1,34 (m, 7H), 1,27-0,99 (m, 8H), 0,75-0,73 (m, 6H). LCMS: (методика A) 594,2 (M++H), Rt. 3,36 мин, 93,27% (максимально).
Промежуточный продукт 159
Этил-(Z)-3-((3,3-дибутил-5-(4-гидроксифенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилат
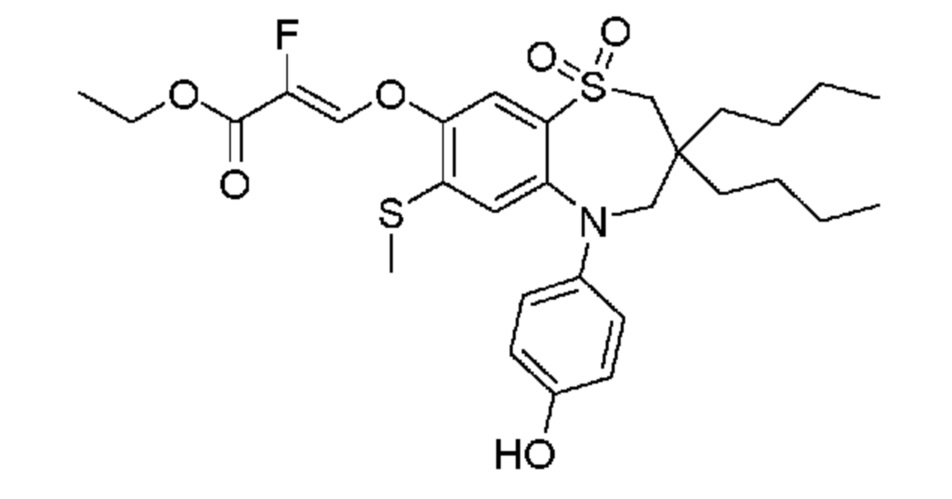
При перемешивании к раствору этил-(Z)-3-((3,3-дибутил-5-(4-метоксифенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилата (1,5 г, 2,52 ммоля) в DCM (20 мл) при -78°C добавляли BBr3 (1M в DCM, 5,1 мл, 5,0 ммоля) и реакционную смесь перемешивали в течение 6 ч при -10°C. После завершения реакции (следили с помощью TLC) реакционную смесь выливали в охлажденную льдом воду (5 мл) и водный слой экстрагировали с помощью DCM (2×50 мл). Объединенный органический слой промывали охлажденной льдом водой (50 мл) и рассолом (50 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 31% EtOAc PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 36% (0,52 г, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 9,39 (s, 1H), 7,53-7,49 (m, 2H), 7,16 (d, J=8,4 Hz, 2H), 6,78 (d, J=8,8 Hz, 2H), 6,34 (s, 1H), 4,24 (q, J=7,2 Hz, 2H), 3,73 (s, 2H), 3,40 (s, 2H), 2,10 (s, 3H), 1,43-1,24 (m, 4H), 1,16-1,11 (m, 3H), 1,09-0,98 (m, 8H), 0,75 (t, J=7,2 Hz, 6H). LCMS: (методика A) 580,2 (M++H), Rt. 2,99 мин, 98,42% (максимально).
Промежуточный продукт 160
5-фтор-6-метоксибензо[d]тиазол-2-амин
При перемешивании к раствору 3-фтор-4-метоксианилин (50 г, 0,354 моля) в уксусной кислоте (300 мл) добавляли тиоцианат аммония (29,69 г, 0,39 моля) при комнатной температуре и затем реакционную смесь перемешивали в течение 45 мин при комнатной температуре. Затем реакционной смеси по каплям добавляли бром (57 г, 0,354 моля), растворенный в уксусной кислоте (100 мл) при 15°C и полученную реакционную смесь перемешивали в течение 3 ч при комнатной температуре. После завершения реакции полученное твердое вещество отфильтровывали, промывали уксусной кислотой (50 мл) и затем сушили в вакууме. Полученное твердое вещество суспендировали в воде (200 мл) и подщелачивали 10% раствором NaOH (pH~10). Полученное твердое вещество отфильтровывали, промывали водой (3×200 мл) и сушили в вакууме и получали искомое соединение. Выход: 86% (60 г, почти белое твердое вещество).
LCMS: (методика A) 199,0 (M++H), Rt. 1,12 мин, 90,09% (максимально).
Промежуточный продукт 161
2-(((2-амино-4-фтор-5-метоксифенил)тио)метил)-2-этилгексановая кислота
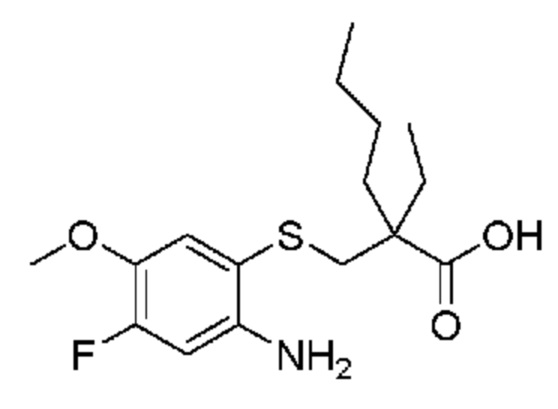
При перемешивании к раствору 5-фтор-6-метоксибензо[d]тиазол-2-амина (промежуточный продукт 160; 30 г, 0,151 моля) в воде (300 мл) добавляли KOH (135 г, 2,42 моля) и реакционную смесь перемешивали в течение 16 ч при 120°C. После завершения реакции (следили с помощью LCMS) реакционную смесь охлаждали до комнатной температуры. Затем по каплям добавляли 2-(бромметил)-2-этилгексановую кислоту (43,05 г, 0,18 моля) (растворяли в 100 мл THF) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью LCMS) реакционную смесь охлаждали до 0°C и подкисляли концентрированной HCl (pH ~2). Водную часть экстрагировали с помощью EtOAc (2×25 мл). Объединенный органический слой промывали водой (30 мл) и рассолом (30 мл). Органическую часть сушили над безводным Na2SO4 и концентрировали в вакууме и получали неочищенное вещество, которое направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 60 г (неочищенное коричневое смолообразное вещество).
Промежуточный продукт 162
3-Бутил-3-этил-7-фтор-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5H)-он
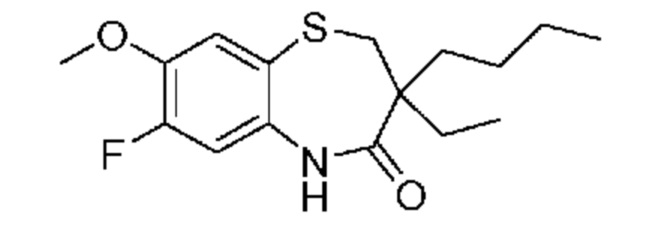
При перемешивании к раствору 2-(((2-амино-4-fluro-5-метоксифенил)тио)метил)-2-этилгексановой кислоты (промежуточный продукт 161; 60 г, 0,18 моля) в EtOAc (600 мл) при 0°C по каплям добавляли триэтиламин ( 36,7 г, 0,3642 моля) и раствор 1-пропанфосфорного ангидрида (50% в EtOAc; 69,5 г, 0,2185 моля) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью UPLC) к реакционной смеси добавляли воду (500 мл) и водный слой экстрагировали с помощью EtOAc (2×500 мл). Объединенный органический слой промывали рассолом (250 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 10-12% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 30% (17 г, почти белое твердое вещество).
LCMS: (методика A) 312,3 (M++H), Rt. 2,64 мин, 99,63% (максимально).
Промежуточный продукт 163
3-Бутил-3-этил-7-фтор-8-метокси-5-фенил-2,3-дигидро-1,5-бензотиазепин-4(5H)-он

При перемешивании к раствору 3-бутил-3-этил-7-фтор-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5H)-она (промежуточный продукт 162; 17 г, 0,05 моля) в йодбензоле (170 мл) добавляли йодид меди(I) (1,03 г, 0,01 моля) и K2CO3(15,08 г, 0,11 моля) и реакционную смесь продували азотом в течение 20 мин для дегазации. Затем добавляли трис[2-(2-метоксиэтокси)этил]амин (3,52 г, 0,01 моля) в атмосфере азота и полученную реакционную смесь нагревали в течение 40 ч при 135°C. После завершения реакции (следили с помощью UPLC) реакционную смесь фильтровали через целит и промывали с помощью EtOAc (250 мл). Фильтрат концентрировали в вакууме и получали неочищенное вещество, которое очищали с помощью колоночной хроматографии Isolera (элюент: 3-5% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 86% (16 г, бледно-коричневое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,37-7,39 (m, 2H), 7,29 (d, J=6,80 Hz, 1H), 7,08 (d, J=6,80 Hz, 2H), 6,82 (d, J=12,00 Hz, 2H), 3,89 (s, 3H), 3,46 (s, 2H), 1,37-1,38 (m, 4H), 1,18-1,37 (m, 4H), 0,79-0,81 (m, 6H). LCMS: (методика A) 387,9 (M+), Rt. 3,09 мин, 99,25% (максимально).
Промежуточный продукт 164
3-Бутил-3-этил-7-фтор-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин
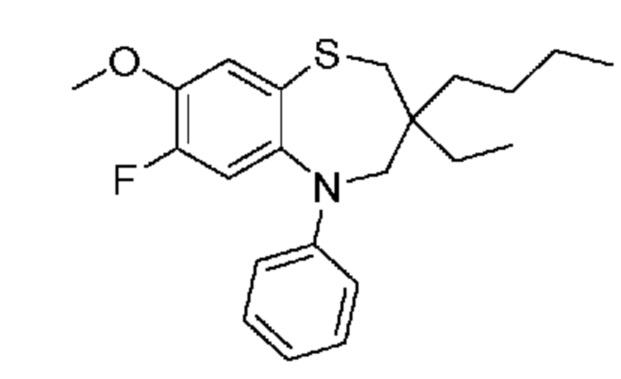
При перемешивании к раствору 3-бутил-3-этил-7-фтор-8-метокси-5-фенил-2,3-дигидро-1,5-бензотиазепин-4(5H)-она (промежуточный продукт 163; 16 г, 0,04 моля) в THF (160 мл) при 0°C по каплям добавляли BH3.DMS (2M в THF, 62 мл, 0,12 моля) и реакционную смесь кипятили с обратным холодильником в течение 40 ч при 75°C. После завершения реакции (следили с помощью UPLC) реакционную смесь охлаждали до 0°C и реакцию останавливали метанолом (100 мл). Полученный раствор нагревали в течение 2 ч при 65°C и затем охлаждали до комнатной температуры и концентрировали в вакууме. Полученную неочищенную смесь направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 100% (15 г, бесцветная жидкость).
LCMS: (методика A) 374,3 (M++H), Rt. 2,72 мин, 92,66% (максимально).
Промежуточный продукт 165
3-Бутил-3-этил-7-фтор-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид

При перемешивании к раствору 3-бутил-3-этил-7-фтор-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепина (промежуточный продукт 164; 15 г, 0,04 моля) в THF (100 мл) добавляли воду (45 мл) и оксон (125 г, 0,40 моля) при комнатной температуре и затем реакционную смесь перемешивали в течение 24 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь фильтровали через воронку Бюхнера и фильтрат экстрагировали с помощью EtOAc (2×250 мл). Объединенный органический слой промывали водой (250 мл) и рассолом (250 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 10-12% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 92% (15 г, желтоватое твердое вещество).
1H NMR (300 MHz, DMSO-d6): δ 7,52 (d, J=8,70 Hz, 1H), 7,23-7,25 (m, 2H), 7,04-7,07 (m, 2H), 6,93-6,95 (m, 1H), 6,80 (d, J=12,60 Hz, 1H), 3,90 (s, 3H), 3,28 (s, 2H), 3,31 (m, 2H), 1,17-1,24 (m, 4H), 0,93-0,95 (m, 4H), 0,73-0,83 (m, 6H). LCMS: (методика A) 406,2 (M++H), Rt. 3,04 мин, 95,49% (максимально).
Промежуточный продукт 166
3-Бутил-3-этил-7-фтор-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид

При перемешивании к раствору 3-бутил-3-этил-7-фтор-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 165; 15 г, 0,036 моля) в DCM (200 мл) добавляли BBr3 (1M в DCM; 74 мл, 0,074 ммоля) при 0°C и реакционную смесь перемешивали в течение 1 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) по каплям добавляли метанол (100 мл) при 0°C до прекращения выделения газа. Реакционную смесь разбавляли с помощью DCM (100 мл) и слой DCM промывали водой (2×200 мл) и рассолом (200 мл). Органическую часть сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 30-32% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 94% (7 г, почти белое твердое вещество).
1H NMR (300 MHz, DMSO-d6): δ 7,48 (d, J=9,60 Hz, 2H), 7,22 (t, J=7,50 Hz, 2H), 6,99 (d, J=7,80 Hz, 2H), 6,74-6,79 (m, 2H), 3,66 (s, 2H), 3,18 (s, 2H), 1,36-1,47 (m, 4H), 1,01-1,10 (m, 4H), 0,73-0,75 (m, 6H). LCMS: (методика A) 392,2 (M++H), Rt. 2,08 мин, 96,59% (максимально).
Промежуточный продукт 167
Метил-(Z)-3-((3-бутил-3-этил-7-фтор-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилат
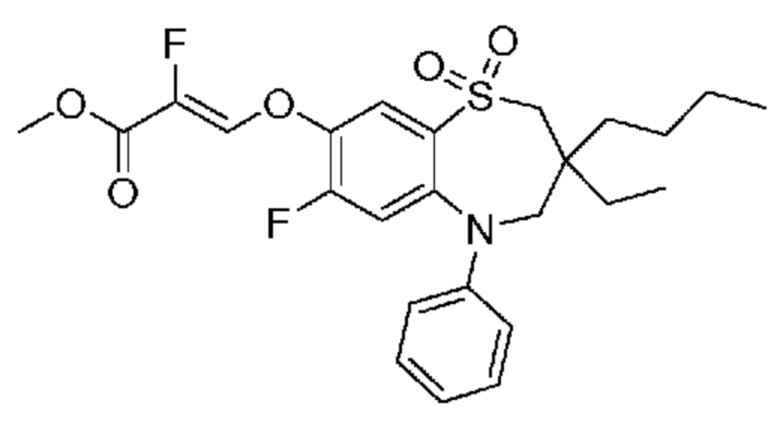
При перемешивании к раствору 3-бутил-3-этил-7-фтор-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 166; 0,5 г, 0,2 моля) в DMF (5 мл) при 0°C порциями добавляли NaH (60%, 0,10 г, 0,02 ммоля) и реакционную смесь перемешивали в течение 15 мин. Затем добавляли метил-3-бром-2,2-дифторпропаноат (0,29 г, 0,02 моля) и реакционную смесь нагревали в течение 16 ч при 85°C. После завершения реакции (следили с помощью TLC) реакционную смесь охлаждали до 0°C, реакцию останавливали разбавленной HCl (1,5 н., pH ~4) и затем разбавляли водой (5 мл). Водный слой экстрагировали с помощью EtOAc (2×5 мл). Объединенный органический слой промывали рассолом (5 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 15-18% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 25% (0,12 г, почти белое твердое вещество).
LCMS: (методика A) 494,2 (M++H), Rt. 3,04 мин, 85% (максимально).
Промежуточный продукт 168
3,3-Дибутил-7-(диметиламино)-8-метокси-2-(4-метоксибензил)-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1-оксид
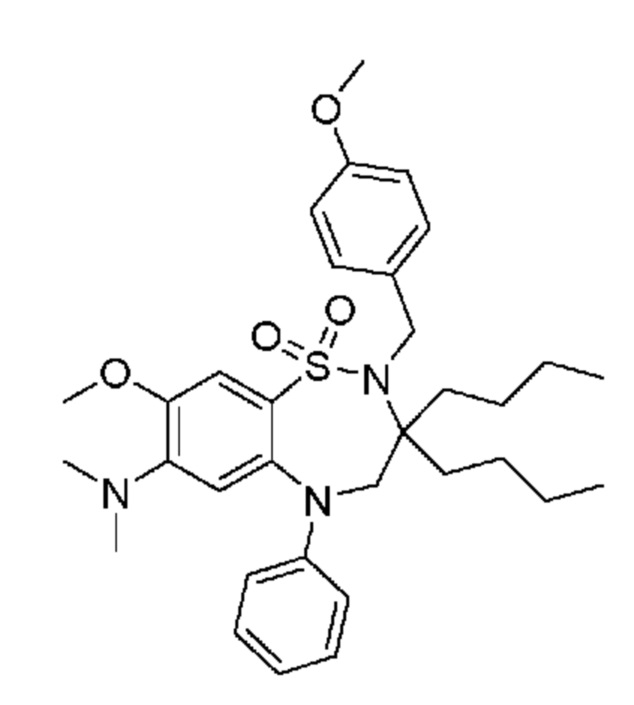
При перемешивании к раствору 7-бром-3,3-дибутил-8-метокси-2-(4-метоксибензил)-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1,1-диоксида (1,0 г, 1,81 ммоля) в толуоле (10 мл) добавляли диметиламин (2M в THF; 2,7 мл, 5,44 ммоля) и Cs2CO3 (1,31 г, 4,0 ммоля) и реакционную смесь дегазировали с помощью N2 в течение 10 мин. Затем Pd(OAc)2 (0,036 г, 0,16 ммоля) и X-Phos (0,077 г, 0,16 ммоля) добавляли и реакционную смесь нагревали в течение 16 ч при 90°C. После завершения реакции (следили с помощью TLC) реакционную смесь фильтровали через целит и промывали с помощью EtOAc (15 мл). Объединенную органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 13-15% EtOAc/PE, силикагель: 230-400 меш) и получали искомое соединение. Выход: 50% (0,53 г, желтое смолообразное вещество).
LCMS: (методика A) 580,3 (M++H), Rt. 2,63 мин, 85,42% (максимально).
Промежуточный продукт 169
3,3-Дибутил-7-(диметиламино)-8-гидрокси-2-(4-метоксибензил)-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1,1-диоксид

При перемешивании к раствору 3,3-дибутил-7-(диметиламино)-8-метокси-2-(4-метоксибензил)-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1-оксида (промежуточный продукт 168; 0,53 г, 0,91 ммоля) в сухом DMF (5 мл) добавляли тиометоксид натрия (320 мг, 4,57 ммоля) при комнатной температуре и реакционную смесь перемешивали в течение 16 ч при 60°C. После завершения реакции (следили с помощью LCMS) реакцию останавливали охлажденной льдом водой (2 мл) и водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенный органический слой промывали водой (15 мл) и рассолом (15 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 10-15% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 87% (450 мг, почти белое твердое вещество).
LCMS: (методика A) 566,3 (M++H), Rt. 3,31 мин, 70,45% (максимально).
Промежуточный продукт 170
Этил-(Z)-3-((3,3-дибутил-7-(диметиламино)-2-(4-метоксибензил)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакрилат

При перемешивании к раствору 3,3-дибутил-7-(диметиламино)-8-гидрокси-2-(4-метоксибензил)-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1,1-диоксида (промежуточный продукт 169; 0,25 г, 0,44 ммоля) в DMF (5 мл) при 0°C порциями добавляли NaH (60%, 0,058 г, 1,43 ммоля) и реакционную смесь перемешивали в течение 15 мин. Затем добавляли этил-3-бром-2,2-дифторпропаноат (0,24 г, 1,1 ммоля) и реакционную смесь нагревали в течение 16 ч при 65°C. После завершения реакции (следили с помощью TLC) реакционную массу охлаждали до 0°C, реакцию останавливали разбавленной HCl (1,5 н., pH ~4) и затем разбавляли водой (5 мл). Водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенный органический слой промывали рассолом (10 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме. Полученное неочищенное вещество затем растирали с Et2O и сушили в вакууме. Полученное соединение повторно очищали с помощью колоночной хроматографии Isolera (элюент: 20% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 64% (0,02 г, почти белое твердое вещество).
LCMS: (методика E) 682,3 (M++H), Rt. 3,18 мин, 80,56% (максимально).
Промежуточный продукт 171
(Z)-3-((3,3-дибутил-7-(диметиламино)-2-(4-метоксибензил)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакриловая кислота
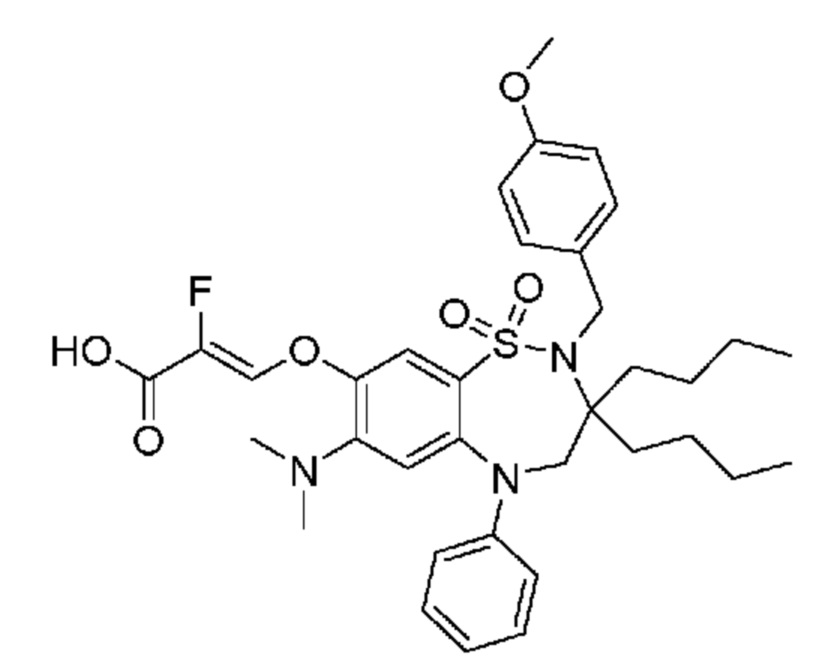
При перемешивании к раствору этил-(Z)-3-((3,3-дибутил-7-(диметиламино)-2-(4-метоксибензил)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакрилата (промежуточный продукт 170; 0,02 г, 0,28 ммоля) в смеси 1,4-диоксана и воды (5 мл, 4:1) добавляли гидроксид лития (0,04 г, 0,84 ммоля) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1,5 н., 3 мл, pH~4) и разбавляли водой (5 мл). Затем водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенный органический слой промывали водой (8 мл) и рассолом (10 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 2-3% MeOH/DCM; силикагель: 230-400 меш) и получали искомое соединение. Выход: 98% (0,18 г, почти белое твердое вещество).
LCMS: (методика E) 654,3 (M++H), Rt. 3,00 мин, 78,1% (максимально).
Промежуточный продукт 172
Этил-(Z)-3-((3-бутил-3-этил-2-метил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакрилат

К суспензии NaH (60%, 118 мг, 4,91 ммоля) в DMA (3 мл) при 0°C добавляли раствор 3-бутил-3-этил-8-гидрокси-2-метил-7-(метилтио)-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1,1-диоксида (промежуточный продукт 152; 0,4 г, 0,92 ммоля) в DMA (3 мл) и реакционную смесь перемешивали в течение 30 мин при комнатной температуре. Затем по каплям добавляли этил-3-бром-2,2-дифторпропионат (0,26 мл, 2,00 ммоля) в DMA (3 мл) при 0°C и реакционную смесь нагревали в течение 3 ч при 60°C. После завершения реакции (следили с помощью TLC) реакционную смесь охлаждали до 0°C, реакцию останавливали разбавленной HCl (1,5 н., 3 мл, pH~4) и концентрировали в вакууме. Полученный остаток подвергали распределению между охлажденной льдом водой (10 мл) и EtOAc (10 мл) и водный слой экстрагировали с помощью EtOAc (2×20 мл). Объединенный органический слой промывали охлажденной льдом водой (15 мл) и рассолом (15 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 10% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 78% (390 мг, бесцветная смола).
Промежуточный продукт 173
трет-Бутил-(E)-3-((3-бутил-3-этил-7-фтор-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилат

При перемешивании к раствору 3-бутил-3-этил-7-фтор-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 166; 500 мг, 1,28 ммоля) в THF (5 мл) при комнатной температуре добавляли DABCO (14 мг, 0,13 ммоля) и трет-бутилпропиолат (161 мг, 1,28 ммоля) и реакционную смесь перемешивали в течение 2 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и полученный остаток подвергали распределению между охлажденной льдом водой (5 мл) и EtOAc (5 мл). Водный слой экстрагировали с помощью EtOAc (2×20 мл). Объединенный органический слой промывали охлажденной льдом водой (10 мл) и рассолом (10 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 5% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 76% (500 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,70-7,72 (m, 2H), 7,27-7,29 (m, 4H), 7,10 (t, J=7,16 Hz, 1H), 6,69 (d, J=12,16 Hz, 1H), 5,37 (d, J=12,20 Hz, 1H), 3,83 (s, 2H), 3,45 (s, 2H), 1,53-1,54 (m, 2H), 1,43 (s, 9H), 1,27-1,30 (m, 2H), 0,96-0,98 (m, 4H), 0,69-0,70 (m, 6H). LCMS: (методика E) 462,1 (M+-tBu+H), Rt. 3,04 мин, 98,65% (максимально).
Промежуточный продукт 174
4-(3,3-Дибутил-8-гидрокси-7-(метилтио)-1,1-диоксидо-2,3,4,5-дигидро-1,5-бензотиазепин-5(2H)-ил)-N, N-диметилбензамид
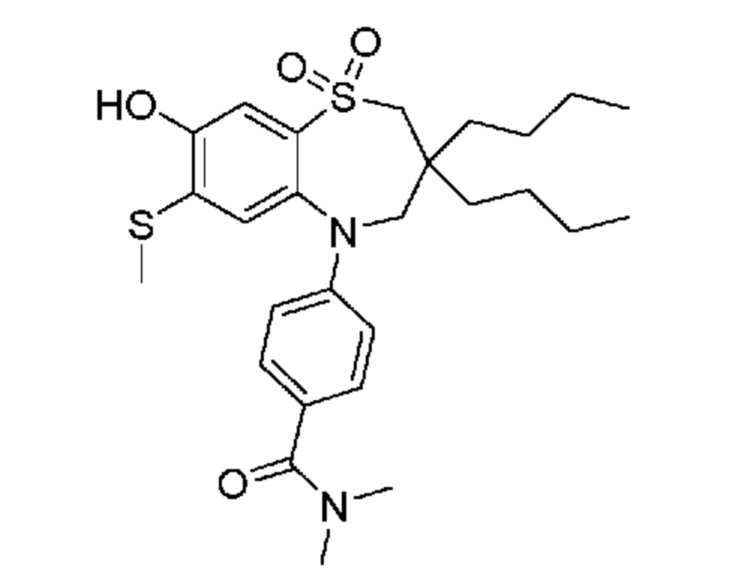
При перемешивании к раствору 4-(3-бутил-3-этил-8-гидрокси-7-(метилтио)-1,1-диоксидо-2,3,4,5-дигидро-1,5-бензотиазепин-5(2H)-ил)бензойной кислоты (промежуточный продукт 104; 500 мг, 1,01 ммоля) в DMF (5 мл) добавляли триэтиламин (0,4 г, 4,04 ммоля), N, N-диметиламин (165 мг, 2,03 ммоля) и HATU (772 мг, 2,03 ммоля) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и полученный остаток подвергали распределению между охлажденной льдом водой (5 мл) и EtOAc (5 мл). Водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенный органический слой промывали охлажденной льдом водой (10 мл) и рассолом (10 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 7% MeOH/DCM; силикагель: 230-400 меш) и получали искомое соединение. Выход: 99% (0,6 г, желтое твердое вещество).
LCMS: (методика A) 519,3 (M++H), Rt. 2,53 мин, 91,00% (максимально).
Промежуточный продукт 175
Этил-(Z)-3-((3,3-дибутил-5-(4-(диметилкарбамоил)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилат

К суспензии NaH (60%, 90 мг, 3,75 ммоля) в DMF (5 мл) при 0°C по каплям добавляли раствор 4-(3,3-дибутил-8-гидрокси-7-(метилтио)-1,1-диоксидо-3,4-дигидро-1,5-бензотиазепин-5(2H)-ил)-N, N-диметилбензамида (промежуточный продукт 175; 600 мг, 1,15 ммоля) в DMF (3 мл) и реакционную смесь перемешивали в течение 30 мин. Затем по каплям добавляли этил-3-бром-2,2-дифторпропионат (627 мг, 2,89 ммоля) в DMF (3 мл) при 0°C и реакционную смесь нагревали в течение 8 ч при 65°C. После завершения реакции (следили с помощью TLC) реакционную смесь охлаждали до 0°C, реакцию останавливали разбавленной HCl (1,5 н., 3 мл) и концентрировали в вакууме. Полученный остаток подвергали распределению между охлажденной льдом водой (10 мл) и EtOAc (10 мл) и водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенный органический слой промывали охлажденной льдом водой (15 мл) и рассолом (15 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 50% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 61% (450 мг, желтое смолообразное вещество).
1H NMR (400 MHz, CDCl3): δ 7,68 (s, 1H), 7,40-7,30 (m, 3H), 7,05 (d, J=8,2 Hz, 2H), 6,79 (s, 1H), 4,57-4,51 (m, 2H), 3,19 (s, 2H), 3,16 (s, 6H), 3,07 (s, 2H), 2,26 (s, 3H), 1,62-1,33 (m, 7H), 1,32-1,15 (m, 8H), 0,91-0,69 (m, 6H). LCMS: (методика E) 635,3 (M++H), Rt. 2,69 мин, 94,79% (максимально).
Промежуточный продукт 176
Этил-(Z)-3-((3,3-дибутил-2-(4-метоксибензил)-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакрилат
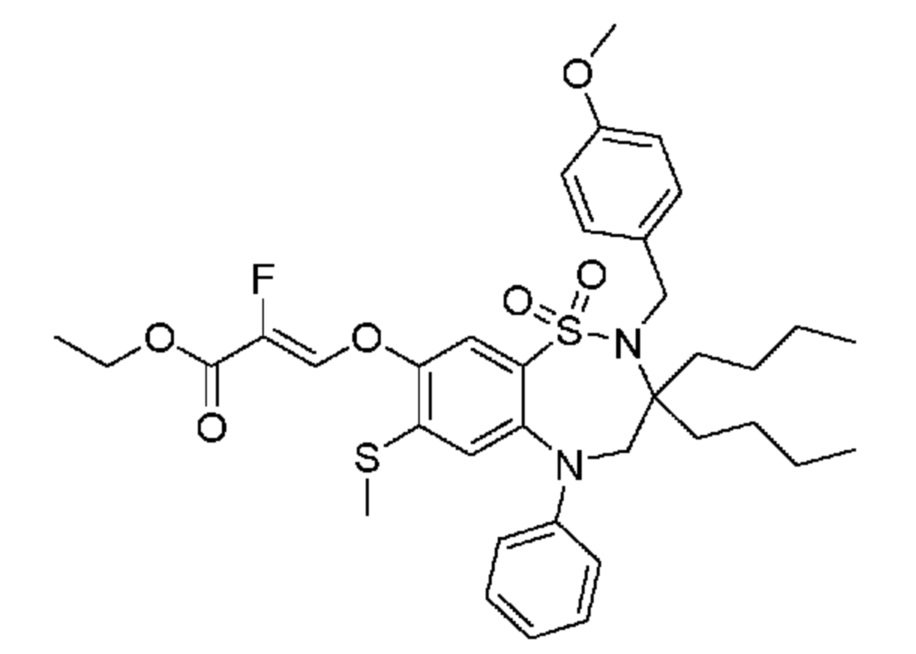
К суспензии NaH (60%, 183 мг, 4,5 ммоля ) в сухом DMA (3 мл) при 0°C добавляли раствор 3,3-дибутил-8-гидрокси-2-(4-метоксибензил)-7-(метилтио)-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1,1-диоксид (0,8 г, 1,40 ммоля) в DMA (3 мл) и реакционную смесь перемешивали в течение 10 мин при комнатной температуре. Затем по каплям добавляли этил-3-бром-2,2-дифторпропионат (0,41 мл, 3,10 ммоля) в DMA (3 мл) при 0°C и реакционную смесь нагревали в течение 3 ч при 60°C. После завершения реакции (следили с помощью TLC) реакционную смесь охлаждали до 0°C, реакцию останавливали разбавленной HCl (1,5 н., 3 мл, pH~4) и концентрировали в вакууме. Полученный остаток подвергали распределению между охлажденной льдом водой (10 мл) и EtOAc (10 мл) и водный слой экстрагировали с помощью EtOAc (2×30 мл). Объединенный органический слой промывали охлажденной льдом водой (15 мл) и рассолом (15 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 15% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 83% (800 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,63 (s, 2H), 7,37 (s, 2H), 7,28-7,14 (m, 6H), 6,87 (d, J=7,6 Hz, 2H), 4,49 (bs, 2H), 4,33-4,22 (m, 3H), 3,73 (s, 3H), 2,11 (s, 3H), 1,40 (bs, 2H), 1,27-1,24 (m, 6H), 1,01-0,98 (m, 8H), 0,86-0,65 (m, 6H). LCMS: (методика E) 685,2 (M++H), Rt. 3,18 мин, 92,22% (максимально). HPLC: (методика B) Rt. 7,46 мин, 96,07% (максимально).
Промежуточный продукт 177
Этил-(Z)-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакрилат

При перемешивании к раствору этил-(Z)-3-((3,3-дибутил-2-(4-метоксибензил)-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакрилата (промежуточный продукт 176; 0,8 г, 1,10 ммоля) в сухом DCM (3 мл) добавляли TFA (3 мл) и триэтилсилан при 0°C и реакционную смесь перемешивали в течение 3 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 5% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 76% (500 мг, почти белое твердое вещество).
LCMS: (методика A) 565,2 (M++H), Rt. 3,28 мин, 97,21% (максимально).
Промежуточный продукт 178
Этил-(Z)-3-((3,3-дибутил-2-метил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакрилат
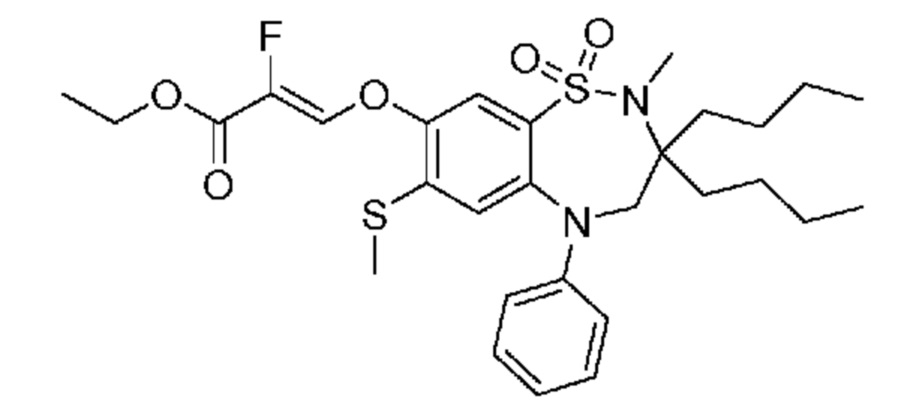
При перемешивании к раствору этил-(Z)-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакрилата (промежуточный продукт 177; 0,5 г, 0,88 ммоля) в N-метил-2-пирролидоне (5 мл) добавляли Cs2CO3 (0,57 г, 1,75 ммоля) и метилйодид (0,28 мл, 4,49 ммоля) при комнатной температуре и реакционную смесь перемешивали в течение 2 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь разбавляли с помощью EtOAc (25 мл) и органический слой промывали водой (2×15 мл). Органическую часть сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 98% (0,5 г, коричневое смолообразное вещество).
Промежуточный продукт 179
7-Бром-3-бутил-3-этил-8-метокси-2-метил-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1,1-диоксид

При перемешивании к раствору 7-бром-3-бутил-3-этил-8-метокси-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1,1-диоксида (промежуточный продукт 126; 1 г, 2,10 ммоля) в N-метил-2-пирролидоне (10 мл) добавляли Cs2CO3(1,39 г, 4,20 ммоля) и метилйодид (0,66 мл, 10,6 ммоля) при комнатной температуре и реакционную смесь перемешивали в течение 3 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь разбавляли с помощью EtOAc (25 мл) и органический слой промывали водой (2×15 мл). Объединенную органическую часть сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 88% (900 мг, почти белое твердое вещество).
LCMS: (методика E) 481,1 (M+), Rt. 2,97 мин, 61,59% (максимально).
Промежуточный продукт 180
7-Бром-3-бутил-3-этил-8-гидрокси-2-метил-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1,1-диоксид

При перемешивании к раствору 7-бром-3-бутил-3-этил-8-метокси-2-метил-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1,1-диоксида (промежуточный продукт 179; 0,75 г, 1,50 ммоля) в DCM (10 мл) добавляли BBr3 (1M в DCM, 2,33 мл, 2,30 ммоля) при -78°C и затем реакционную смесь перемешивали в течение 3 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакцию останавливали метанолом (10 мл) и концентрировали в вакууме. Полученный остаток растворяли в DCM (20 мл) и органическую часть промывали рассолом (20 мл). Органическую часть сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 23% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 27% (0,27 г, почти белое твердое вещество).
LCMS: (методика E) 469,0 (M++2), Rt. 2,74 мин, 86,35% (максимально).
Промежуточный продукт 181
Этил-(Z)-3-((7-бром-3-бутил-3-этил-2-метил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакрилат

К суспензии NaH (0,05 г, 1,39 ммоля) в сухом DMA (2 мл) при 0°C добавляли раствор 7-бром-3-бутил-3-этил-8-гидрокси-2-метил-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-1,1-диоксида (промежуточный продукт 180; 0,2 г, 0,43 ммоля) в DMA (2 мл) и реакционную смесь перемешивали в течение 10 мин при комнатной температуре. Затем по каплям добавляли этил-3-бром-2,2-дифторпропионат (0,12 мл, 0,96 ммоля) в DMA (3 мл) при 0°C и реакционную смесь нагревали в течение 3 ч при 60°C. После завершения реакции (следили с помощью TLC) реакционную смесь охлаждали до 0°C, реакцию останавливали разбавленной HCl (1,5 н., 2 мл, pH~4) и концентрировали в вакууме. Полученный остаток подвергали распределению между охлажденной льдом водой (10 мл) и EtOAc (20 мл) и водный слой экстрагировали с помощью EtOAc (2×30 мл). Объединенный органический слой промывали охлажденной льдом водой (15 мл) и рассолом (15 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 8% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 60% (150 мг, почти белое твердое вещество).
LCMS: (методика E) 585,1 (M++2) Rt. 3,01 мин, 88,73%
Промежуточный продукт 182
7-Бром-3,3-дибутил-5-(3,4-дифторфенил)-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5H)-он

При перемешивании к раствору 7-бром-3,3-дибутил-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5H)-она (3,0 г, 0,007 моля) в 3,4-дифторбромбензоле (5 мл) добавляли йодид меди(I) (0,286 мг, 0,0015 моля) и K2CO3(2,07 г, 0,015 моля) и реакционную смесь продували азотом в течение 20 мин для дегазации. Затем добавляли трис[2-(2-метоксиэтокси)этил]амин (0,242 мл, 0,00075 моля) в атмосфере азота и полученную реакционную смесь нагревали в течение 16 ч при 130°C. После завершения реакции (следили с помощью UPLC) реакционную смесь фильтровали через целит и слой целита промывали с помощью EtOAc (50 мл). Фильтрат промывали водой (50 мл) и рассолом (50 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 8-10% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 74% (2,8 г, бледно-коричневое твердое вещество).
LCMS: (методика E) 512,1 (M+), Rt. 3,07 мин, 85% (максимально).
Промежуточный продукт 183
7-Бром-3,3-дибутил-5-(3,4-дифторфенил)-8-метокси-2,3,4,5-тетрагидро-1,5-бензотиазепин

При перемешивании к раствору 7-бром-3,3-дибутил-5-(3,4-дифторфенил)-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5H)-она (промежуточный продукт 182; 2,8 г, 0,0054 ммоля) в THF (15 мл) при 0°C по каплям добавляли диметилсульфид борана (2M в THF, 8 мл, 0,016 ммоля) и реакционную смесь кипятили с обратным холодильником в течение 3 ч при 60°C. После завершения реакции (следили с помощью UPLC) реакционную смесь охлаждали до 0°C, реакцию останавливали метанолом (10 мл) и затем нагревали в течение 2 ч при 60°C. Полученную реакционную смесь охлаждали до комнатной температуры и концентрировали в вакууме и получали неочищенный продукт, который направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 1,49 г (неочищенная бесцветная жидкость).
Промежуточный продукт 184
7-Бром-3,3-дибутил-5-(3,4-дифторфенил)-8-метокси-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид
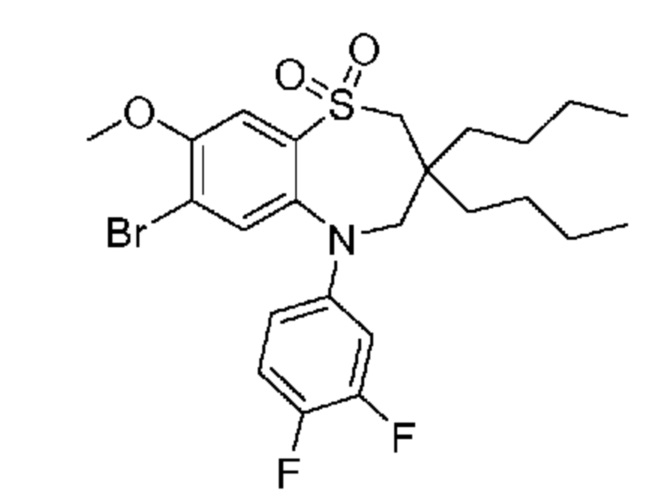
При перемешивании к раствору 7-бром-3,3-дибутил-5-(3,4-дифторфенил)-8-метокси-2,3,4,5-тетрагидро-1,5-бензотиазепина (промежуточный продукт 183; 1,49 г, 0,01 ммоля) в THF (75 мл) и воде (7,5 мл) при комнатной температуре добавляли оксон (38,3 г, 0,13 ммоля) и реакционную смесь перемешивали в течение 24 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь фильтровали через воронку Бюхнера и фильтрат экстрагировали с помощью EtOAc (2×25 мл). Объединенный органический слой промывали водой (25 мл) и рассолом (25 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 10-12% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 62% (1 г, почти белое твердое вещество).
LCMS: (методика A) 532,0 (M++2), Rt. 3,31 мин, 93,84% (максимально).
Промежуточный продукт 185
3,3-Дибутил-5-(3,4-дифторфенил)-8-метокси-7-(метилтио)-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид
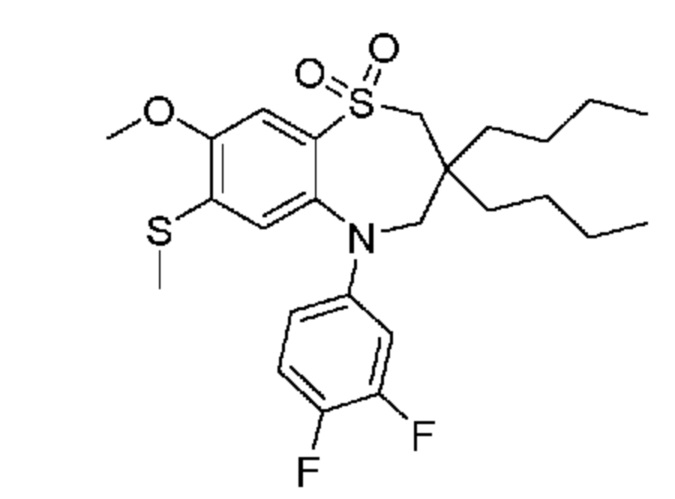
При перемешивании к раствору 7-бром-3,3-дибутил-5-(3,4-дифторфенил)-8-метокси-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 184; 500 мг, 0,9757 ммоля) в DMF (5 мл) добавляли тиометоксид натрия (102 мг, 1,46 ммоля) и полученную реакционную смесь нагревали в течение 2 ч при 60°C. После завершения реакции (следили с помощью TLC) воду (10 мл) к реакционной смеси добавляли и водный слой экстрагировали с помощью EtOAc (2×20 мл). Объединенный органический слой промывали рассолом (500 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 18 -20% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 82% (0,45 г, почти белое твердое вещество).
LCMS: (методика E) 498,2 (M++H), Rt. 3,57 мин, 90,72% (максимально).
Промежуточный продукт 186
3,3-дибутил-5-(3,4-дифторфенил)-8-гидрокси-7-(метилтио)-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксид

При перемешивании к раствору 3,3-дибутил-5-(3,4-дифторфенил)-8-метокси-7-(метилтио)-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 185; 450 мг, 0,9042 ммоля) в DCM ( 5 мл) добавляли BBr3 (1M в DCM; 3 мл, 2,712 ммоля) при 0°C и реакционную смесь перемешивали в течение 1 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) по каплям добавляли метанол (10 мл) при 0°C до прекращения выделения газа. Затем реакционную смесь разбавляли с помощью DCM (10 мл) и органический слой промывали водой (2×10 мл) и рассолом (10 мл). Органическую часть сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 100% EtOAc; силикагель: 230-400 меш) и получали искомое соединение. Выход: 91% (0,4 г, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 10,63 (s, 1H), 7,29 (s, 1H), 7,28-7,19 (m, 1H), 7,03-6,98 (m, 1H), 6,72 (s, 1H), 6,64-6,59 (m, 1H), 3,62 (bs, 2H), 3,22 (s, 2H), 2,22 (s, 3H), 1,40-1,34 (m, 4H), 1,15-1,05 (m, 8H), 0,79 (t, J=6,80 Hz, 6H). LCMS: (методика A) 484,2 (M++H), Rt. 2,97 мин, 94% (максимально).
Промежуточный продукт 187
Этил-(Z)-3-((3,3-дибутил-5-(3,4-дифторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилат

При перемешивании к раствору 3,3-дибутил-5-(3,4-дифторфенил)-8-гидрокси-7-(метилтио)-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 186; 0,1 г, 0,021 ммоля) в DMA (5 мл) при 0°C порциями добавляли NaH (60%, 0,03 г, 0,67 ммоля) и реакционную смесь перемешивали в течение 15 мин при 0°C. Затем добавляли этил-3-бром-2,2-дифторпропаноат (0,112 г, 0,052 ммоля) и реакционную смесь нагревали в течение 5 ч при 60°C. После завершения реакции (следили с помощью TLC) реакционную массу охлаждали до 0°C, реакцию останавливали с помощью 1,5 н. HCl (pH ~4) и разбавляли водой (5 мл). Водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенный органический слой промывали рассолом (10 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество растирали с Et2O. Полученное соединение сушили в вакууме и направляли на следующую стадию без какой-либо дополнительной очистки. Выход: 56% (0,07 г, бесцветная смола).
Промежуточный продукт 188
Этил-(Z)-3-((3-бутил-7-(диметиламино)-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилат
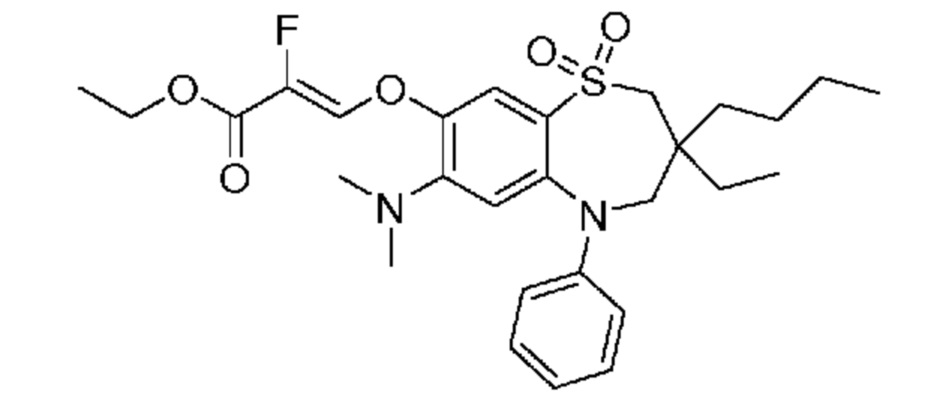
При перемешивании к раствору 3-бутил-7-(диметиламино)-3-этил-8-гидрокси-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-1,1-диоксида (промежуточный продукт 132;0,2 г, 0,48 ммоля) в DMA (5 мл) при 0°C порциями добавляли NaH (60%, 0,04 г, 1,56 ммоля) и реакционную смесь перемешивали 15 мин при 0°C. Затем добавляли этил-3-бром-2,2-дифторпропаноат (0,26 г, 1,20 ммоля) и реакционную смесь нагревали в течение 3 ч при 70°C. После завершения реакции (следили с помощью TLC) реакционную массу охлаждали до 0°C, реакцию останавливали с помощью 1,5 н. HCl (pH ~4) и разбавляли водой (15 мл). Водный слой экстрагировали с помощью EtOAc (2×15 мл), объединенный органический слой промывали рассолом (10 мл) и затем сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 15-20% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 27% (0,07 г, бесцветная смола).
LCMS: (методика A) 533,2 (M++H), Rt. 3,37 мин, 80,27% (максимально).
Промежуточный продукт 189
Этил-(S)-(Z)-3-((3-бутил-7-(диметиламино)-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилат и этил-(R)-(Z)-3-((3-бутил-7-(диметиламино)-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилат
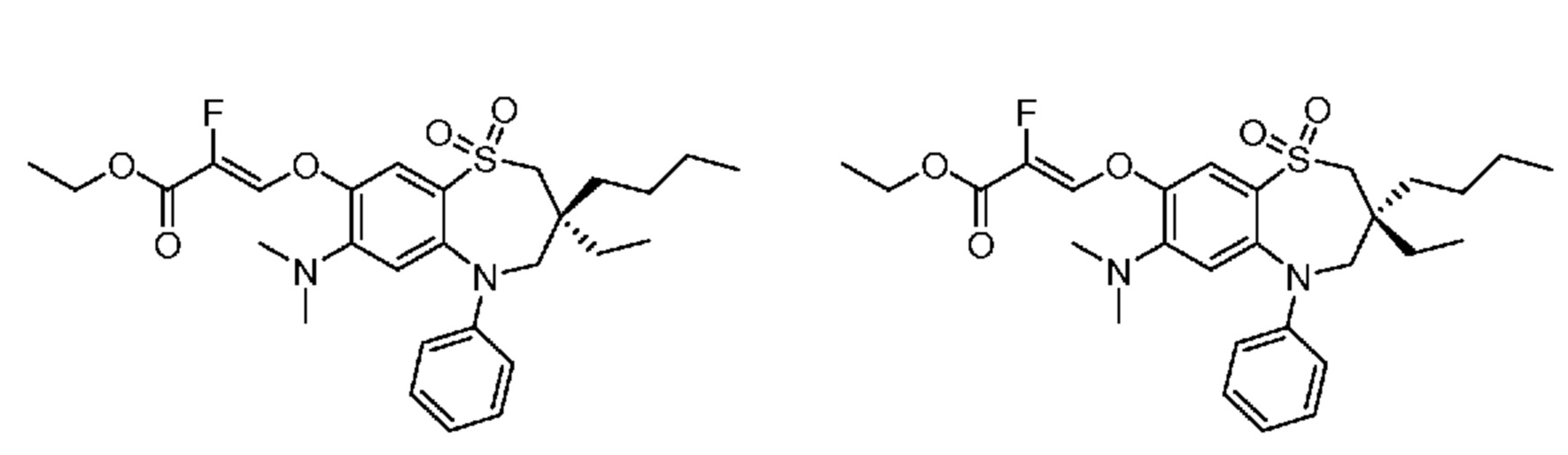
Два энантиомера рацемического (Z)-3-((3-бутил-7-(диметиламино)-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилата (0,340 г, 0,64 ммоля) разделяли с помощью хиральной препаративной SFC (методика G); длина волны: 280 нм; длительность цикла: 5 мин; противодавление: 100 бар. Вещество концентрировали в вакууме при 40°C. Первая элюирующаяся фракция соответствовала энантиомеру 1 и вторая элюирующаяся фракция соответствовала энантиомеру 2. Абсолютная конфигурация этих двух энантиомеров неизвестна.
Энантиомер 1: Выход: 38% (130 мг, почти белое твердое вещество). LCMS: (методика E) 533,1 (M++H), Rt. 3,35 мин, 95,24% (максимально). HPLC: (методика B) Rt. 6,63 мин, 96,05% (максимально). SFC: (методика I) Rt. 2,35 мин, 100% (максимально).
Энантиомер 2: Выход: 44% (150 мг, почти белое твердое вещество). LCMS: (методика E) 533,1 (M++H), Rt. 3,35 мин, 93,83% (максимально). HPLC: (методика B) Rt. 6,63 мин, 97,12% (максимально). SFC: (методика I) Rt. 2,97 мин, 99,54% (максимально).
Пример 1
(E)-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота
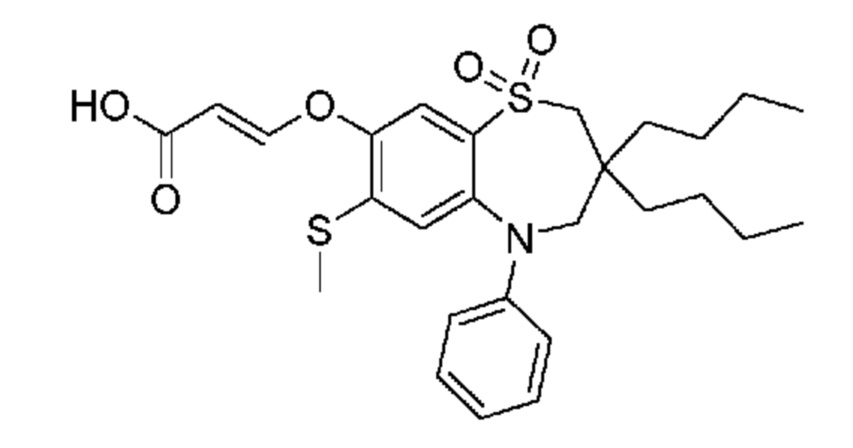
При перемешивании к раствору этил-(E)-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 1; 0,32 г, 0,58 ммоля) в смеси 1,4-диоксана и воды (6 мл, 2:1) добавляли гидроксид лития (0,037 г, 0,88 ммоля) и полученную смесь перемешивали при комнатной температуре в течение 12 ч. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме. Полученный остаток подкисляли разбавленной HCl (1,5 н., 2 мл) и водную часть экстрагировали с помощью EtOAc (2×15 мл). Объединенный органический слой промывали водой (15 мл), рассолом (15 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и неочищенное вещество очищали с помощью препаративной HPLC (методика B) и получали искомое соединение. Выход: 86% (300 мг, белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 12,28 (bs, 1H), 7,66 (d, J=12,0 Hz, 1H), 7,47 (d, J=4,8 Hz, 1H), 7,33-7,29 (m, 2H), 7,18 (bs, 2H), 7,01 (t, J=6,8 Hz, 1H), 6,66 (d, J=4,0 Hz, 1H), 5,42 (dd, J=12,0, 4,4 Hz, 1H), 3,76 (bs, 2H), 3,38 (d, J=4,8 Hz, 2H), 2,16 (d, J=4,40 Hz, 3H), 1,41-1,33 (m, 4H), 1,08-1,01 (m, 8H), 0,75 (t, J=5,60 Hz, 6H). LCMS: (методика D) 518,3 (M+H), Rt. 3,04 мин, 98,5% (максимально). HPLC: (методика A) Rt. 5,75 мин, 99,10% (максимально).
Пример 2
(E)-3-((5-(4-аминофенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота
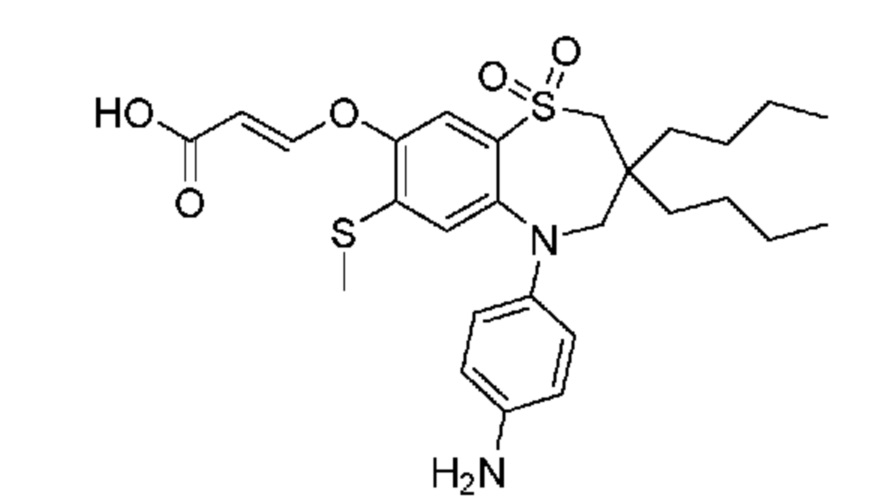
При перемешивании к раствору (E)-3-((3,3-дибутил-7-(метилтио)-5-(4-нитрофенил)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловой кислоты (промежуточный продукт 2; 0,9 г, 1,60 ммоля) в THF (20 мл) добавляли концентрированную HCl (1 мл) и SnCl2 (1,2 г, 6,40 ммоля) при комнатной температуре и реакционную смесь перемешивали в течение 12 ч при 70°C. После завершения реакции (следили с помощью TLC) реакцию останавливали насыщенным раствором NaHCO3, фильтровали через слой целита и затем промывали с помощью EtOAc. Органическую часть промывали водой (25 мл), сушили над безводным Na2SO4 и концентрировали в вакууме и получали искомое соединение. Выход: 94% (800 мг, неочищенное коричневое твердое вещество).
LCMS: (методика A) 533,9 (M+H), Rt. 2,32 мин, 81,07% (максимально).
Пример 3
(E)-3-((5-(4-((трет-бутоксикарбонил)амино)фенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота

При перемешивании к раствору (E)-3-((5-(4-аминофенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловой кислоты (пример 2; 0,2 г, 0,37 моля) в 1,4-диоксане (5 мл) при 0°C добавляли раствор NaOH (0,03 г, 0,56 ммоля) в воде (1 мл), затем Boc-ангидрид (0,16 г, 0,75 ммоля). Перемешивание продолжали в течение 12 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли лимонной кислотой (pH ~3-4) и водный слой экстрагировали с помощью EtOAc (2×25 мл). Объединенный органический слой сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью препаративной HPLC (методика C) и получали искомое соединение. Выход: 30% (70 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 12,24 (s, 1H), 9,32 (s, 1H), 7,64 (d, J=12,2 Hz, 1H), 7,44 (s, 1H), 7,41 (d, J=9,2 Hz, 2H), 7,18 (d, J=8,4 Hz, 2H), 6,50 (s, 1H), 5,38 (d, J=12,2 Hz, 1H), 3,74 (s, 2H), 3,40 (s, 2H), 2,13 (s, 3H), 1,47 (s, 9H), 1,43-1,40 (m, 2H), 1,35-1,29 (m, 2H), 1,13-1,02 (m, 8H), 0,77-0,75 (m, 6H); LCMS: (методика B) 577,3 (M-tBu), Rt. 3,14 мин, 97,7% (максимально). HPLC: (методика A) Rt. 5,95 мин, 99,6% (максимально).
Пример 4
(E)-3-((7-бром-3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота
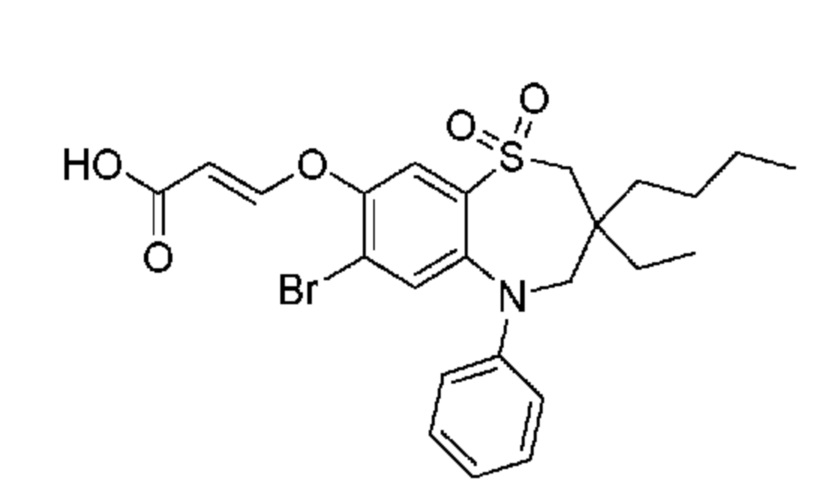
При перемешивании к раствору этил-(E)-3-((7-бром-3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 3; 0,28 г, 0,48 ммоля) в смеси 1,4-диоксана и воды (3 мл; 5:1) добавляли гидроксид лития (0,04 г, 0,96 ммоля) и полученную смесь перемешивали в течение при комнатной температуре в течение 12 ч. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме. Полученный остаток подкисляли разбавленной HCl (1,5 н., 2 мл) и водную часть экстрагировали с помощью EtOAc (2×15 мл). Объединенный органический слой промывали водой (15 мл), рассолом (15 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 2-3% MeOH/DCM; силикагель: 230-400 меш) и получали искомое соединение. Выход: 60% (150 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 12,29 (s, 1H), 7,73 (d, J=12,0 Hz, 1H), 7,65-7,64 (m, 1H), 7,37-7,34 (m, 2H), 7,28-7,25 (m, 2H), 7,09-7,05 (m, 2H), 5,39 (d, J=12,0 Hz, 1H), 3,88-3,73 (m, 2H), 3,46 (s, 2H), 1,52-1,34 (m, 4H), 1,08-0,98 (m, 4H), 0,72-0,69 (m, 6H). LCMS: (методика A) 296,0 (M+H), Rt. 2,86 мин, 95,59% (максимально). HPLC: (методика B) Rt. 6,03 мин, 97,02% (максимально).
Примеры 5 и 6
(R)-(E)-3-((7-бром-3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота и (S)-(E)-3-((7-бром-3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота

Два энантиомера рацемической (E)-3-((7-бром-3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловой кислоты ((пример 4; 150 мг, 0,29 ммоля) разделяли с помощью хиральной препаративной SFC (методика A); подвижная фаза: CO2: IPA (70:30); длина волны: 220 нм; длительность цикла: 5 мин; противодавление: 100 бар. Вещество концентрировали в вакууме при 40°C. Первая элюирующаяся фракция соответствовала энантиомеру 1 и вторая элюирующаяся фракция соответствовала энантиомеру 2. Абсолютная конфигурация этих двух энантиомеров неизвестна.
Энантиомер 1: Выход: 17% (25 мг, почти белое твердое вещество).1H NMR (400 MHz, DMSO-d6): δ 12,29 (s, 1H), 7,73 (d, J=11,6 Hz, 1H), 7,64 (s, 1H), 7,38-7,34 (m, 2H), 7,27-7,26 (m, 2H), 7,10-7,05 (m, 2H), 5,39 (d, J=12,4 Hz, 1H), 3,80-3,78 (m, 2H), 3,46 (s, 2H), 1,52-1,34 (m, 4H), 1,08-0,98 (m, 4H), 0,72-0,69 (m, 6H). LCMS: (методика A) 521,8 (M+), Rt. 2,86 мин, 99,14% (максимально). HPLC: (методика B) Rt. 5,99 мин, 96,82% (максимально). SFC: (методика A) Rt. 4,88 мин, 99,31%.
Энантиомер 2: Выход: 20% (30 мг, почти белое твердое вещество).1H NMR (400 MHz, DMSO): δ 12,28 (s, 1H), 7,73 (d, J=12,4 Hz, 1H), 7,64 (s, 1H), 7,38-7,34 (m, 2H), 7,26-7,24 (m, 2H), 7,10-7,05 (m, 2H), 5,39 (d, J=12,0 Hz, 1H), 3,80-3,75 (m, 2H), 3,46 (s, 2H), 1,51-1,30 (m, 4H), 1,17-0,98 (m, 4H), 0,76-0,68 (m, 6H). LCMS: (методика A) 524,0 (M+ 2), Rt. 2,96 мин, 98,77% (максимально). HPLC: (методика B) Rt. 5,99 мин, 97,71% (максимально). SFC: (методика A) Rt. 5,95 мин, 98,99%.
Пример 7
(E)-3-((3,3-дибутил-7-циклопропил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота

При перемешивании к раствору этил-(E)-3-((3,3-дибутил-7-циклопропил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 6; 0,150 г, 0,28 ммоля) в смеси 1,4-диоксана и воды (6 мл, 5:1) добавлялигидроксид лития (24 мг, 0,06 ммоля) и полученную смесь перемешивали при комнатной температуре в течение 12 ч. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и получали неочищенный остаток, который подкисляли разбавленной HCl (1,5 н., 2 мл) и водный слой экстрагировали с помощью EtOAc (2×15 мл). Органическую часть промывали водой (15 мл), рассолом (15 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 50% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 34% (48 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 12,19 (bs, 1H), 7,76 (d, J=12,0 Hz, 1H), 7,47 (s, 1H), 7,28 (t, J=8,0 Hz, 2H), 7,11 (d, J=7,6 Hz, 2H), 6,98 (t, J=7,2 Hz, 1H), 6,41 (s, 1H), 5,37 (d, J=12,4 Hz, 1H), 3,73 (bs, 2H), 3,36 (s, 2H), 1,97-1,90 (m, 1H), 1,42-1,34 (m, 2H), 1,31-1,24 (m, 2H), 1,10-1,03 (m, 8H), 1,00-0,98 (m, 2H), 0,9 (t, J=4,4 Hz, 6H),0,42-0,41 (m, 2H). LCMS: (методика A) 512,2 (M+H), Rt. 3,13 мин, 99,21% (максимально). HPLC: (методика A) Rt. 6,05 мин, 98,83% (максимально).
Пример 8
(E)-3-((3,3-дибутил-7-(диметиламино)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота

При перемешивании к раствору этил-(E)-3-((3,3-дибутил-7-(диметиламино)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 9; 0,08 г, 0,15 ммоля) в смеси 1,4-диоксана и воды (6 мл, 5:1) добавляли гидроксид лития (0,012 г, 0,29 ммоля) и полученную смесь перемешивали при комнатной температуре в течение ночи. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и получали неочищенный остаток, который подкисляли разбавленной HCl (1,5 н., 2 мл) и водный слой экстрагировали с помощью EtOAc (2×15 мл). Органическую часть промывали водой (15 мл), рассолом (15 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 4-5% MeOH/DCM; силикагель: 230-400 меш) и получали искомое соединение. Полученный материал дополнительно очищали с помощью препаративной HPLC (методика A) и получали искомое соединение. Выход: 9% (7 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 12,16 (s, 1H), 7,58 (d, J=12,4 Hz, 1H), 7,38 (s, 1H), 7,31-7,29 (m, 2H), 7,17-7,15 (m, 2H), 6,99-6,96 (m, 2H), 6,26 (s, 1H), 5,40 (d, J=12,0 Hz, 2H), 3,73 (s, 2H), 3,29 (s, 2H), 2,68 (s, 6H), 1,41-1,32 (m, 4H), 1,15-1,00 (m, 8H), 0,77-0,73 (m, 6H). LCMS: (методика C) 515,2 (M+ 2H), Rt. 3,13 мин, 97,01% (максимально). HPLC: (методика B) Rt. 5,80 мин, 94,38% (максимально).
Пример 9
(E)-3-((3,3-дибутил-5-(4-(циклопропансульфонамидо)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота

При перемешивании к раствору (E)-3-((5-(4-аминофенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловой кислоты (пример 2; 0,12 г, 0,22 ммоля) в пиридине (3 мл) добавляли DMAP (0,03 мг, 0,02 ммоля) и циклопропансульфонилхлорид (0,063 мг 0,45 ммоля) при 0°C и реакционную смесь перемешивали в течение 12 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь разбавляли с помощью EtOAc (25 мл). Затем органический слой промывали насыщенным раствором NaHCO3 (15 мл) и водой (15 мл). Органическую часть сушили над безводным Na2SO4, концентрировали в вакууме и полученное неочищенное вещество очищали с помощью препаративной HPLC (методика C) и получали искомое соединение. Выход: 14% (20 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,45-7,40 (m, 2H), 7,17 (m, 4H), 6,60 (s, 1H), 5,41 (d, J=12,0 Hz, 1H), 3,73 (m, 2H), 3,54 (m, 2H), 2,16 (s, 3H), 1,89 (s, 1H), 1,42-1,30 (m, 4H), 1,12-1,08 (m, 8H), 1,04-1,03 (m, 4H), 0,88-0,85 (m, 6H). LCMS: (методика B) 635,2 (M+-H), Rt. 3,14 мин, 94,6% (максимально). HPLC: (методика A) Rt. 5,28 мин, 99,49% (максимально).
Пример 10
(E)-3-((3,3-дибутил-5-(4-(метилсульфонамидо)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота

При перемешивании к раствору (E)-3-((5-(4-аминофенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловой кислоты (пример 2; 0,11 г, 0,18 ммоля) в пиридине (3 мл) добавляли DMAP (0,03 мг, 0,02 ммоля) и метансульфонилхлорид (0,03 мл, 0,28 ммоля) при 0°C и реакционную смесь перемешивали в течение 12 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь разбавляли с помощью EtOAc (25 мл). Затем органический слой промывали насыщенным раствором NaHCO3 (15 мл) и водой (15 мл). Органическую часть сушили над безводным Na2SO4, концентрировали в вакууме и полученное неочищенное вещество очищали с помощью препаративной HPLC (методика B) и получали искомое соединение. Выход: 5% (7 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): 7,79 (d, J=1,2 Hz, 1H), 7,68 (s, 1H), 7,28 (s, 1H), 7,23 (d, J=8,8 Hz, 1H), 7,13 (d, J=8,8 Hz, 2H), 6,66 (s, 1H), 6,62 (s, 1H), 5,56 (d, J=12,0 Hz, 1H), 3,75 (bs, 2H), 3,22 (s, 2H), 3,02 (d, J=5,60 Hz, 3H), 2,22 (s, 3H), 1,57-1,52 (m, 2H), 1,48-1,41 (m, 6H), 1,28-1,21 (m, 2H), 1,19-1,08 (m, 2H), 0,8 (t, J=6,8 Hz, 6H). LCMS: (методика D) 609,2 (M+-H), Rt. 2,42 мин, 91,68% (максимально). HPLC: (методика C) Rt. 9,87 мин, 96,13% (максимально).
Пример 11
(Z)-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота

При перемешивании к раствору метил-(Z)-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилата (промежуточный продукт 10; 8,2 г, 15,0 ммоля) в смеси 1,4-диоксана и воды (82 мл, 4:1) добавляли LiOH.H2O (1,25 г, 30,0 ммоля) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли с помощью 1,5 н. HCl (pH~4) и разбавляли водой (100 мл). Водную часть экстрагировали с помощью EtOAc (150 мл) и затем органический слой промывали рассолом (100 мл) и сушили над безводным Na2SO4. Органический слой концентрировали в вакууме и получали неочищенное вещество, которое очищали с помощью колоночной хроматографии Isolera (элюент: 3-4% MeOH/DCM; силикагель: 230-400 меш) и получали искомое соединение. Выход: 52% (6,73 г, белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 13,59 (s, 1H), 7,56 (d, J=18,4 Hz, 1H), 7,56 (s, 1H), 7,30 (t, J=7,6 Hz, 2H), 7,16 (d, J=7,6 Hz, 2H), 6,99 (t, J=7,2 Hz, 1H), 6,67 (s, 1H), 3,75 (s, 2H), 3,36 (s, 2H), 2,18 (s, 3H), 1,43-1,41 (m, 2H), 1,36-1,30 (m, 2H), 1,18-1,01 (m, 8H), 0,77-0,72 (m, 6H). LCMS: (методика A) 536,1 (M++H), Rt. 3,19 мин, 97,92% (максимально). HPLC: (методика B) Rt. 6,45 мин, 99,04% (максимально).
Пример 12
(E)-3-((3,3-дибутил-7-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота

При перемешивании к раствору этил-(E)-3-((3,3-дибутил-7-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 14; 0,055 г, 0,1 ммоля) в смеси 1,4-диоксана и воды (6 мл, 5:1) добавляли гидроксид лития (8 мг, 0,2 ммоля) и полученную смесь перемешивали при комнатной температуре в течение 4 ч. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и получали неочищенный остаток, который подкисляли разбавленной HCl (1,5 н., 2 мл) и водный слой экстрагировали с помощью EtOAc (2×15 мл). Органический слой промывали водой (15 мл), рассолом (15 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 80% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 14,4% (7,5 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,74 (d, J=12,1 Hz, 1H), 7,48 (s, 1H), 7,29 (t, J=7,5 Hz, 2H), 7,17-7,15 (m, 2H), 6,98 (t, J=7,3 Hz, 1H), 6,84 (s, 1H), 5,40 (d, J=12,1 Hz, 1H), 3,88-3,65 (m, 2H), 3,37 (s, 2H), 2,49-2,48 (m, 2H), 1,41-1,24 (m, 6H), 1,09-1,04 (m, 6H), 1,01-0,97 (m, 4H), 0,80-0,75 (m, 6H), LCMS: (методика A) 500,3 (M+H), Rt. 3,16 мин, 98,8% (максимально). HPLC: (методика B) Rt. 6,58 мин, 97,03% (максимально).
Пример 13
(E)-3-((3-бутил-3-этил-7-метокси-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота
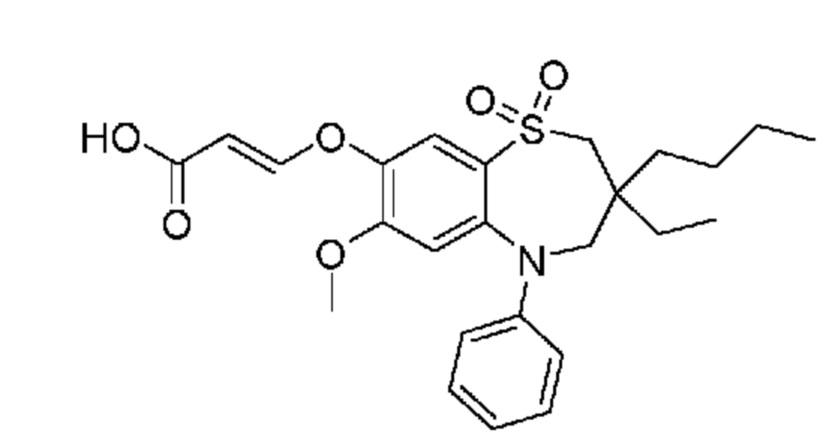
При перемешивании к раствору этил-(E)-3-((3-бутил-3-этил-7-метокси-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 16; 0,125 г, 0,24 ммоля) в смеси 1,4-диоксана и воды (3,5 мл; 6:1) добавляли гидроксид лития (32 мг, 0,74 ммоля) и полученную смесь перемешивали при комнатной температуре в течение 4 ч. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и получали неочищенный остаток, который подкисляли разбавленной HCl (1,5 н., 2 мл). Затем водный слой экстрагировали с помощью EtOAc (2×15 мл). Органический слой промывали водой (15 мл), рассолом (15 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 80% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 21% (23 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 12,12 (s, 1H), 7,65 (d, J=12,0 Hz, 1H), 7,53 (s, 1H), 7,30 (t, J=7,6 Hz, 2H), 7,17-7,15 (m, 2H), 6,98 (t, J=6,8 Hz, 1H), 6,56 (s, 1H), 5,31 (d, J=12,0 Hz, 1H), 3,85-3,65 (m, 2H), 3,61 (s, 3H), 3,31 (s, 2H), 1,53-1,31 (m, 2H), 1,28-1,25 (m, 2H), 1,24-1,09 (m, 4H), 0,75-0,71 (m, 6H). LCMS: (методика D) 474,2 (M+H), Rt. 2,55 мин, 99,31% (максимально). HPLC: (методика B) Rt. 5,59 мин, 98,87% (максимально).
Пример 14
(E)-3-((3,3-дибутил-7-метокси-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота
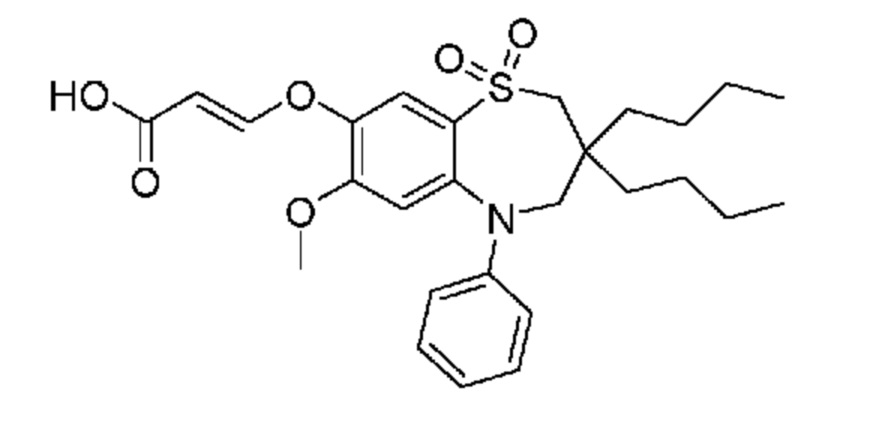
При перемешивании к раствору этил-(E)-3-((3,3-дибутил-7-метокси-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 19; 0,23 г, 0,43 ммоля) в смеси 1,4-диоксана и воды (7 мл, 6:1) добавляли гидроксид лития (0,13 г, 3,03 ммоля) и полученную смесь перемешивали при комнатной температуре в течение 12 ч. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и получали неочищенный остаток, который подкисляли разбавленной HCl (1,5 н., 2 мл). Затем водный слой экстрагировали с помощью EtOAc (2×15 мл). Органический слой промывали водой (15 мл), рассолом (15 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 80% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 75% (160 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,64 (d, J=12,4 Hz, 1H), 7,52 (s, 1H), 7,30 (t, J=8,0 Hz, 2H), 7,19 (d, J=7,2 Hz, 2H), 7,00 (t, J=7,2 Hz, 1H), 6,52 (s, 1H), 5,30 (d, J=12,4 Hz, 1H), 3,76 (bs, 2H), 3,61 (s, 3H), 3,31 (s, 2H), 1,42-1,33 (m, 2H), 1,29-1,20 (m, 2H), 1,10-0,98 (m, 8H), 0,86-0,84 (m, 6H). LCMS: (методика C) 502,1 (M+H), Rt. 2,99 мин, 96,68% (максимально). HPLC: (методика B) Rt. 6,12 мин, 96,05% (максимально).
Пример 15
(E)-3-((5-(4-бромфенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота

При перемешивании к раствору этил-(E)-3-((5-(4-бромфенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 21; 0,10 г, 0,16 ммоля) в смеси 1,4-диоксана и воды (4 мл, 3:1) добавляли гидроксид лития (33 мг, 0,80 ммоля) и полученную смесь перемешивали при комнатной температуре в течение 16 ч. После завершения реакции (следили с помощью LCMS) реакционную смесь концентрировали в вакууме и получали неочищенный остаток, который подкисляли разбавленной HCl (1,5 н., 2 мл). Водный слой экстрагировали с помощью EtOAc (2×10 мл). Органический слой промывали водой (15 мл), рассолом (15 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали с помощью препаративной HPLC (методика D) и получали искомое соединение. Выход: 89% (35 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 12,26 (bs, 1H), 7,71 (d, J=12,4 Hz, 1H), 7,50-7,40 (m, 3H), 7,12-6,91 (m, 2H), 6,84 (s, 1H), 5,48-5,44 (m, 1H), 3,85-3,62 (m, 2H), 3,33 (s, 2H), 2,26 (s, 3H), 1,44-1,05 (m, 12H), 0,85-0,75 (m, 6H). LCMS: (методика D) 596,1 (M+H), Rt. 3,23 мин, 97,39% (максимально). HPLC: (методика B) Rt. 6,63 мин, 97,05% (максимально).
Пример 16
(E)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота
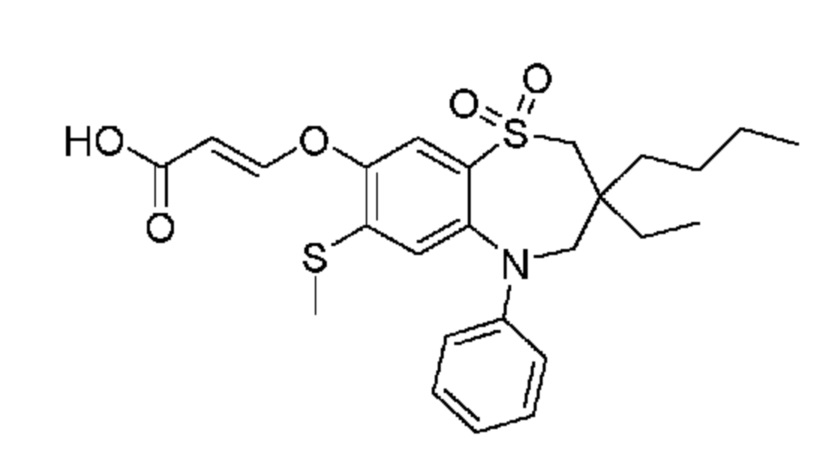
При перемешивании к раствору этил-(E)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 24; 0,3 г, 0,58 ммоля) ) в смеси 1,4-диоксана (10 мл) и воды (3 мл) добавляли гидроксид лития (0,12 г, 2,89 ммоля) и полученную смесь перемешивали при комнатной температуре в течение 16 ч. После завершения реакции (следили с помощью LCMS) реакционную смесь концентрировали в вакууме и получали неочищенный остаток, который подкисляли разбавленной HCl (1,5 н., 2 мл). Водный слой экстрагировали с помощью EtOAc (2×10 мл). Органический слой промывали водой (15 мл), рассолом (15 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью препаративной HPLC (методика D) и получали искомое соединение. Выход: 42% (120 мг, бледно-коричневое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 12,28 (bs, 1H), 7,67 (d, J=12,4 Hz, 1H), 7,49 (s, 1H), 7,30 (t, J=8,0 Hz, 2H), 7,16 (d, J=7,6 Hz, 2H), 6,99 (t, J=7,2 Hz, 1H), 6,69 (s, 1H), 5,43 (d, J=12,0 Hz, 1H), 3,82-3,62 (m, 2H), 3,38 (s, 2H), 2,18 (s, 3H), 1,56-1,32 (m, 4H), 1,20-1,02 (m, 4H), 0,75-0,69 (m, 6H). LCMS: (методика C) 490,0 (M+H), Rt. 2,89 мин, 97,98% (максимально). HPLC: (методика B) Rt. 5,84 мин, 96,52% (максимально).
Примеры 17 и 18
(R)-(E)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота и (S)-(E)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота
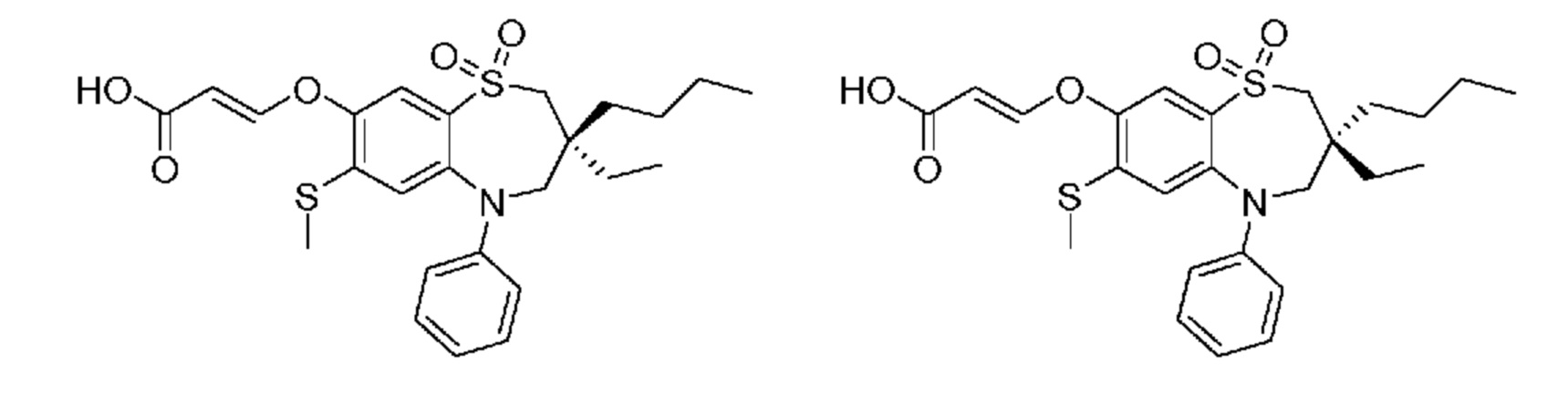
Энантиомеры рацемической (E)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловой кислоты (пример 16; 100 мг, 0,20 ммоля) разделяли с помощью хиральной препаративной SFC (методика B); подвижная фаза: CO2: IPA (70:30); длина волны: 220 нм; длительность цикла: 5 мин; противодавление: 100 бар. Вещество концентрировали в вакууме при 40°C. Первая элюирующаяся фракция давала энантиомер 1 хиральной чистоты 98,01% и вторая фракция давала второй энантиомер в виде смеси. Эту смесь разделяли с помощью хиральной препаративной SFC (методика C); подвижная фаза: CO2: аммиак в метаноле (70:30); длина волны: 220 нм; длительность цикла: 5 мин; противодавление: 100 бар. Первую элюирующуюяся фракцию концентрировали в вакууме при 40°C и получали второй энантиомер с хиральной чистотой 100%. Абсолютная конфигурация этих двух энантиомеров неизвестна.
Энантиомер 1: Выход: 20% (20 мг, почти белое твердое вещество).1H NMR (400 MHz, DMSO-d6): δ 7,58-7,57 (m, 1H), 7,46 (s, 1H), 7,29 (t, J=8,0 Hz, 2H), 7,14 (d, J=7,6 Hz, 2H), 6,98 (t, J=7,2 Hz, 1H), 6,69 (s, 1H), 5,43 (d, J=12,4 Hz, 1H), 3,82-3,62 (m, 2H), 3,37 (s, 2H), 2,18 (s, 3H), 1,54-0,98 (m, 8H), 0,76-0,72 (m, 6H). LCMS: (методика C) 490,1 (M+H), Rt. 2,87 мин, 95,62% (максимально). HPLC: (методика B) Rt. 5,86 мин, 97,74% (максимально). Хиральная чистота: (методика B, хиральная SFC) Rt. 4,69 мин, 98,01% (максимально).
Энантиомер 2: Выход: 13% (15 мг, белое твердое вещество).1H NMR (400 MHz, DMSO-d6): δ 7,66-7,63 (m, 1H), 7,47 (s, 1H), 7,29 (t, J=7,6 Hz, 2H), 7,15 (d, J=8,0 Hz, 2H), 6,98 (t, J=7,2 Hz, 1H), 6,68 (s, 1H), 5,42 (d, J=12,4 Hz, 1H), 3,82-3,62 (m, 2H), 3,36 (s, 2H), 2,17 (s, 3H), 1,53-0,98 (m, 8H), 0,76-0,72 (m, 6H). LCMS: (методика C) 490,1 (M+H), Rt. 2,87 мин, 98,68% (максимально). HPLC: (методика B) Rt. 5,86 мин, 98,65% (максимально). Хиральная чистота: (методика B, хиральная SFC) Rt. 5,28 мин, 100% (максимально).
Пример 19
(E)-3-((3,3-дибутил-5-(4-метоксифенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота

При перемешивании к раствору этил-(E)-3-((3,3-дибутил-5-(4-метоксифенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 26; 0,10 г, 0,17 ммоля) в смеси 1,4-диоксана (10 мл) и воды (3 мл) добавляли гидроксид лития (0,04 г, 0,85 ммоля) и полученную смесь перемешивали при комнатной температуре в течение 16 ч. После завершения реакции (следили с помощью LCMS) реакционную смесь концентрировали в вакууме и получали неочищенный остаток, который подкисляли разбавленной HCl (1,5 н., 2 мл). Водный слой экстрагировали с помощью EtOAc (2×10 мл). Органический слой промывали водой (15 мл), рассолом (15 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью препаративной HPLC (методика D) и получали искомое соединение. Выход: 89% (35 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,35-7,33 (m, 2H), 7,23 (d, J=8,0 Hz, 2H), 6,94-6,91 (m, 2H), 6,42 (s, 1H), 5,35 (d, J=11,6 Hz, 1H), 3,82-3,68 (m, 5H), 3,39 (s, 2H), 2,09 (s, 3H), 1,41-0,95 (m, 12H), 0,75-0,72 (m, 6H). LCMS: (методика B) 548,2 (M+H), Rt. 2,97 мин, 98,03% (максимально). HPLC: (методика B) Rt. 6,28 мин, 99,26% (максимально).
Пример 20
(E)-3-((3,3-дибутил-5-(4-гидроксифенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота
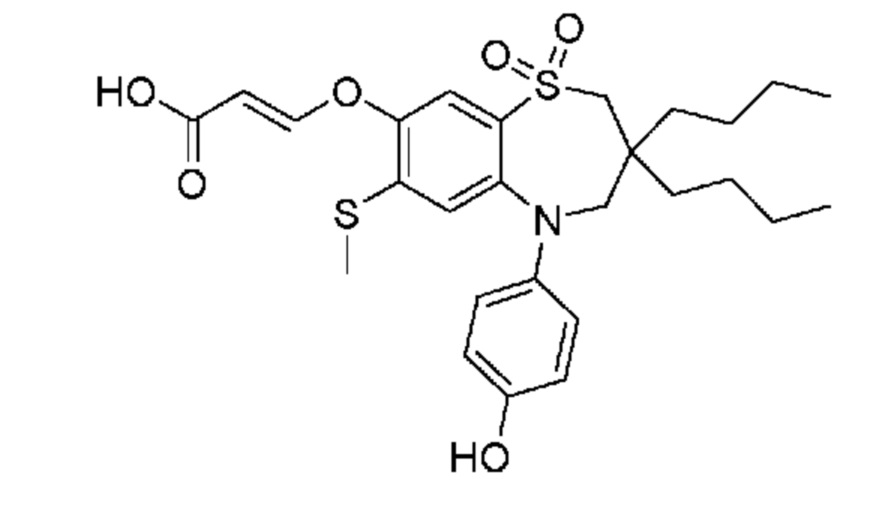
При перемешивании к раствору этил-(E)-3-((3,3-дибутил-5-(4-гидроксифенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 27; 0,09 г, 0,17 ммоля) ) в смеси 1,4-диоксана (10 мл) и воды (3 мл) добавляли гидроксид лития (0,04 г, 0,85 ммоля) и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. После завершения реакции (следили с помощью LCMS) реакционную смесь концентрировали в вакууме и получали неочищенный остаток, который подкисляли разбавленной HCl (1,5 н., 2 мл). Водный слой экстрагировали с помощью EtOAc (2×10 мл). Органический слой промывали водой (15 мл), рассолом (15 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью препаративной HPLC (методика D) и получали искомое соединение. Выход: 21% (20 мг, коричневое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,61 (d, J=12,4 Hz, 1H), 7,41 (s, 1H), 7,18 (d, J=8,4 Hz, 2H), 6,78 (d, J=8,4 Hz, 2H), 6,35 (s, 1H), 5,33 (d, J=12,4 Hz, 1H), 3,78-3,63 (m, 2H), 3,45-3,39 (m, 2H), 2,09 (s, 3H), 1,43-0,98 (m, 12H), 0,77-0,73 (m, 6H). LCMS: (методика B) 534,2 (M+H), Rt. 2,71 мин, 95,25% (максимально). HPLC: (методика B) Rt. 5,51 мин, 95,27% (максимально).
Пример 21
(E)-3-((3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота
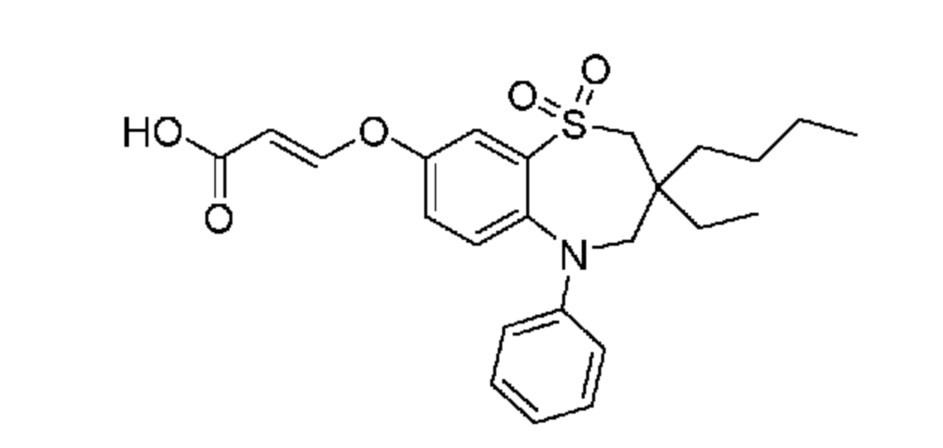
При перемешивании к раствору этил-(E)-3-((3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 28; 0,156 г, 0,33 ммоля) ) в смеси 1,4-диоксана (10 мл) и воды (3 мл) добавляли гидроксид лития (0,03 г, 0,85 ммоля) и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. После завершения реакции (следили с помощью LCMS) реакционную смесь концентрировали в вакууме и получали неочищенный остаток, который подкисляли разбавленной HCl (1,5 н., 2 мл). Водный слой экстрагировали с помощью EtOAc (2×10 мл). Органический слой промывали водой (15 мл), рассолом (15 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 2-3% MeOH/DCM; силикагель: 230-400 меш) и получали искомое соединение. Выход: 21% (25 мг, почти белое твердое вещество).
1H-NMR (400 MHz, DMSO-d6): δ 7,64 (d, J=12,2 Hz, 1H), 7,52 (d, J=2,7 Hz, 1H), 7,35-7,26 (m, 3H), 7,13 (d, J=7,4 Hz, 2H), 6,96 (t, J=7,7 Hz, 2H), 5,49 (d, J=12,1 Hz, 1H), 3,77-3,74 (bs, 2H), 3,38-3,33 (bs, 2H), 1,52-1,35 (m, 4H), 1,33-1,15 (m, 4H), 1,01-0,96 (m, 6H). LCMS: (методика A) 441,9 (M-H), Rt. 2,69 мин, 96,87% (максимально). HPLC: (методика A) Rt. 5,25 мин, 99,10% (максимально).
Пример 22
(E)-3-((5-(4-(бензиламино)фенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота

При перемешивании к раствору (E)-3-((5-(4-аминофенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловой кислоты (пример 2; 0,1 г, 0,18 моля) в MeOH (6 мл) при 0°C по каплям добавляли бензальдегид (0,04 г, 0,37 ммоля) и уксусную кислоту (0,05 мл). Перемешивание продолжали в течение 1 ч при комнатной температуре. Затем добавляли NaCNBH3 (0,03 г, 0,37 ммоля) и реакционную смесь перемешивали в течение 12 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подщелачивали насыщенным раствором NaHCO3 (15 мл) и водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенный органический слой промывали водой (15 мл), рассолом (15 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью препаративной HPLC (методика C) и получали искомое соединение. Выход: 16% (17,79 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,45 (d, J=12,0 Hz, 1H), 7,35-7,28 (m, 5H), 7,23-7,19 (m, 1H), 7,07 (d, J=8,4 Hz, 2H), 6,61 (d, J=8,8 Hz, 2H), 6,31 (t, J=6,0 Hz, 1H), 6,26 (s, 1H), 5,30 (d, J=12,0 Hz, 1H), 4,30 (d, J=6,0 Hz, 2H), 3,71 (bs, 2H), 3,40 (s, 2H), 2,08 (s, 3H), 1,45-1,37 (m, 4H), 1,11-1,07 (m, 8H), 1,04 (t, J=7,20 Hz, 6H); LCMS: (методика C) 623,2 (M++H), Rt. 3,18 мин, 97,02% (максимально). HPLC: (методика A) Rt. 6,08 мин, 97,17% (максимально).
Пример 23
(E)-3-((7-бром-5-(4-((трет-бутоксикарбонил)амино)фенил)-3-бутил-3-этил-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота

При перемешивании к раствору (E)-3-((5-(4-аминофенил)-7-бром-3-бутил-3-этил-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловой кислоты (промежуточный продукт 30; 0,12 г, 0,22 моля) в 1,4-диоксане (5 мл) при 0°C добавляли раствор NaOH (0,013 г, 0,33 ммоля) в воде (1 мл), затем Boc-ангидрид (0,097 г, 0,44 ммоля). Перемешивание продолжали в течение 12 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли лимонной кислотой (~pH 3-4) и водный слой экстрагировали с помощью EtOAc (2×25 мл). Объединенный органический слой сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью препаративной HPLC (методика C) и получали искомое соединение. Выход: 10% (16 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 12,15 (s, 1H), 9,39 (s, 1H), 7,66 (d, J=12,0 Hz, 1H), 7,59 (s, 1H), 7,46 (d, J=8,8 Hz, 2H), 7,24 (d, J=8,4 Hz, 2H), 6,85 (s, 1H), 5,33 (d, J=12,0 Hz, 1H), 3,76 (bs, 2H), 3,48 (s, 2H), 1,48 (s, 9H), 1,33-1,31 (m, 4H), 1,11-1,07 (m, 2H), 1,01-0,97 (m, 2H), 0,73 (t, J=6,80 Hz, 6H); LCMS: (методика B) 635,1 (M+-H), Rt. 2,96 мин, 97,27% (максимально). HPLC: (методика A) Rt. 5,19 мин, 97,97% (максимально).
Пример 24
(E)-3-((3,3-дибутил-5-(4-((метоксикарбонил)амино)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота
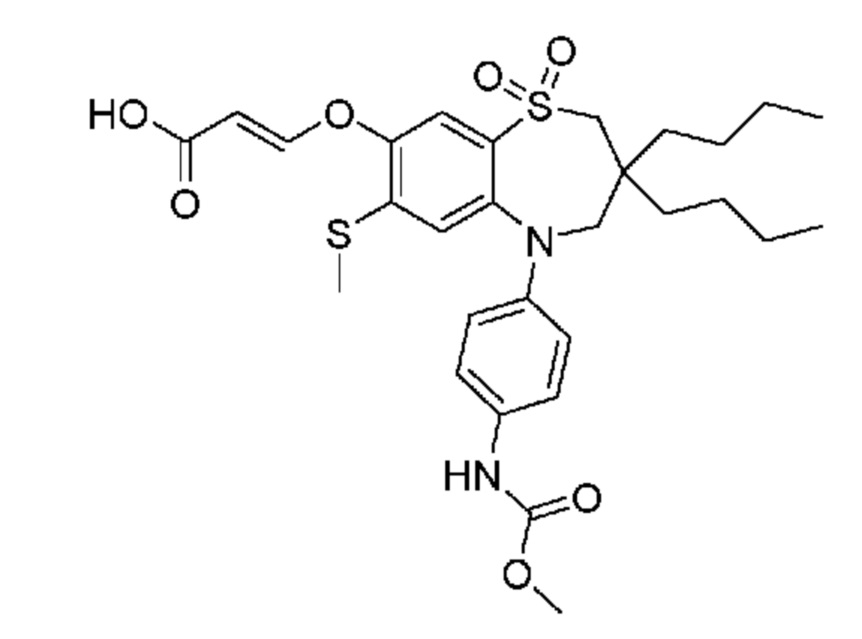
При перемешивании к раствору метил-(E)-3-((3,3-дибутил-5-(4-((метоксикарбонил)амино)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 34; 0,06 г, 0,09 моля) в смеси 1,4-диоксана и воды (5 мл, 4:1) добавляли гидроксид лития (6 мг, 0,14 ммоля) и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1 мл, 1,5 н.) и водный слой экстрагировали с помощью EtOAc (2×10 мл). Органическую часть промывали водой (8 мл) и рассолом (8 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали с помощью препаративной HPLC (методика C) и получали искомое соединение. Выход: 29% (17 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 9,62 (s, 1H), 7,65 (d, J=12,0 Hz, 1H), 7,44 (d, J=3,6 Hz, 2H), 7,42 (s, 1H), 7,20 (d, J=8,4 Hz, 2H), 7,13 (s, 1H), 6,52 (s, 1H), 5,38 (d, J=12,4 Hz, 1H), 3,74 (bs, 2H), 3,66 (s, 3H), 3,40 (s, 2H), 2,13 (s, 3H), 1,24-1,13 (m, 2H), 1,11-1,10 (m, 2H), 1,02-1,00 (m, 8H), 0,7 (t, J=6,4 Hz, 6H). LCMS: (методика B) 591,2 (M++H), Rt. 2,78 мин, 98,32% (максимально). HPLC: (методика A) Rt. 5,18 мин, 98,08% (максимально).
Пример 25
(E)-3-((3,3-дибутил-5-(4-(диметиламино)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота

При перемешивании к раствору метил-(E)-3-((3,3-дибутил-5-(4-(диметиламино)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 36; 46 мг, 0,08 ммоля) в смеси 1,4-диоксана и воды (5 мл, 4:1) добавляли гидроксид лития (6,7 мг, 0,16 ммоля) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1,5 н., 1 мл) и водный слой экстрагировали с помощью EtOAc (2×10 мл). Органическую часть промывали водой (10 мл), рассолом (10 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество растирали с холодным метанолом и получали искомое соединение. Выход: 29% (13 мг, бледно-желтое твердое вещество).
1H-NMR (400 MHz, DMSO-d6): 12,19 (s, 1H), 7,62 (d, J=9,6 Hz, 1H), 7,41 (s, 1H), 7,20 (d, J=6,4 Hz, 2H), 6,76 (d, J=6,0 Hz, 2H), 6,38 (s, 1H), 5,33 (d, J=11,2 Hz, 1H), 3,76 (s, 2H), 3,43 (s, 2H), 2,89 (s, 6H), 2,09 (s, 3H), 1,44-1,39 (m, 4H), 1,34-0,99 (m, 8H), 0,76-0,73 (m, 6H). LCMS: (методика C) 561,2 (M+H), Rt. 2,85 мин, 96,89% (максимально), HPLC: (методика B) Rt. 4,45 мин, 97,85% (максимально).
Пример 26
(Z)-3-((5-(4-((трет-бутоксикарбонил)амино)фенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота

При перемешивании к раствору (Z)-3-((5-(4-аминофенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловой кислоты (промежуточный продукт 38; 0,24 г, 0,43 моля) в 1,4-диоксане (2,4 мл) при 0°C добавляли NaOH (0,026 г, 0,65 ммоля) в воде (0,48 мл) и, затем Boc-ангидрид (0,19 г, 0,87 ммоля) и перемешивание продолжали 16 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли лимонной кислотой (~pH 3-4) и водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенный органический слой сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью препаративной HPLC (методика D) и получали искомое соединение. Выход: 5% (15 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 13,57 (s, 1H), 9,30 (s, 1H), 7,50-7,47 (m, 2H), 7,42 (d, J=8,4 Hz, 2H), 7,14 (d, J=8,4 Hz, 2H), 6,52 (s, 1H), 3,72 (s, 2H), 3,37 (s, 2H), 2,15 (s, 3H), 1,48 (s, 9H), 1,40-1,35 (m, 4H), 1,16-1,03 (m, 8H), 0,77-0,74 (m, 6H); LCMS: (методика A) 651,3 (M+H), Rt. 3,01 мин, 95,75% (максимально). HPLC: (методика B) Rt. 6,46 мин, 95,23% (максимально).
Пример 27
(E)-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-(4-пиваламидофенил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота

При перемешивании к раствору этил-(E)-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-(4-пиваламидофенил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 39; 0,065 г, 0,1 ммоля) в смеси 1,4-диоксана и воды (3 мл, 4:1) добавляли гидроксид лития (0,013 г, 0,31 ммоля) и реакционную смесь перемешивали при комнатной температуре в течение ночи. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1 мл, 1,5 н.) и водный слой экстрагировали с помощью EtOAc (2×10 мл). Органическую часть промывали водой (8 мл) и рассолом (8 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали с помощью препаративной HPLC (методика C) и получали искомое соединение. Выход: 48% (30 мг, почти белое твердое вещество).
1H-NMR (400 MHz, DMSO-d6): δ 12,24 (s, 1H), 9,16 (s, 1H), 7,66 (d, J=12,0 Hz, 2H), 7,60 (d, J=8,4 Hz, 1H), 7,46 (s, 1H), 7,16 (d, J=8,4 Hz, 2H), 6,61 (s, 1H), 5,41 (d, J=12,4 Hz, 1H), 3,74 (bs, 2H), 3,38 (s, 2H), 2,17 (s, 3H), 1,22-1,14 (m, 2H), 1,13-1,11 (m, 2H), 1,09 (s, 9H), 1,06-1,05 (m, 8H), 0,8 (t, J=6,8 Hz, 6H). LCMS: (методика B) 617,2 (M++H), Rt. 2,92 мин, 97,89% (максимально). HPLC: (методика C) Rt. 6,04 мин, 95,46% (максимально).
Пример 28
(Z)-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-(4-пиваламидофенил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота
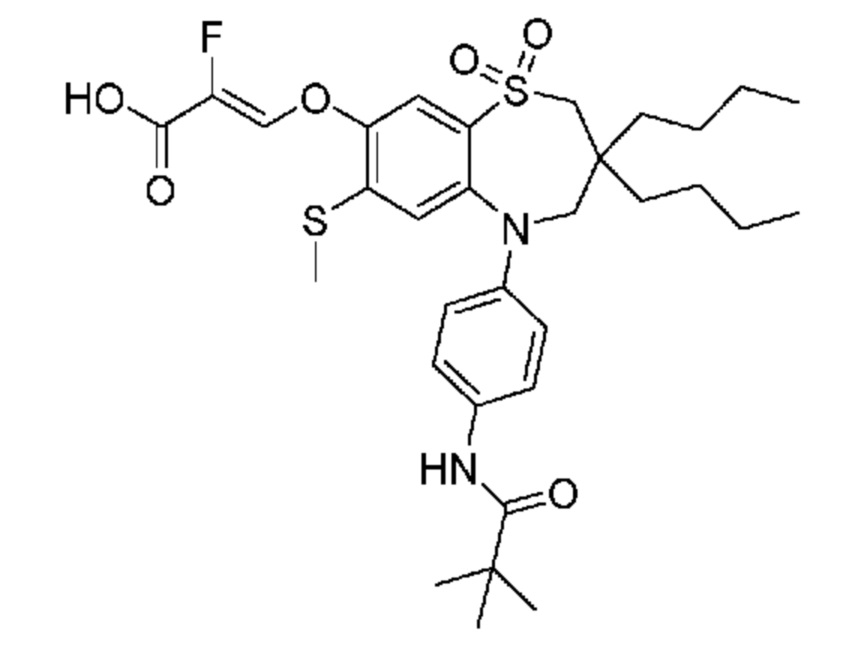
При перемешивании к раствору (Z)-3-((5-(4-аминофенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловой кислоты (промежуточный продукт 38; 0,81 г, 1,40 моля) в DCM (8,1 мл) при 0°C добавляли триэтиламин (0,61 мл, 4,40 ммоля). Затем добавляли пивалоилхлорид (0,22 мл, 1,76 ммоля) и перемешивание продолжали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь разбавляли с помощью DCM (15 мл) и органический слой промывали холодной водой (15 мл) и рассолом (15 мл). Органический слой сушили над безводным Na2SO4 и концентрировали в вакууме и получали неочищенное вещество. Полученное неочищенное вещество очищали с помощью препаративной HPLC (методика B) и получали искомое соединение. Выход: 21% (0,2 г, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6)B362441: δ 13,58 (s, 1H), 9,15 (s, 1H), 7,59-7,49 (m, 4H), 7,12 (d, J=8,4 Hz, 2H), 6,62 (s, 1H), 3,71 (s, 2H), 3,36 (s, 2H), 2,19 (s, 3H), 1,46-1,43 (m, 2H), 1,36-1,30 (m, 2H), 1,22 (s, 9H), 1,13-1,07 (m, 8H), 0,78-0,75 (m, 6H); LCMS (B361751): (методика A) 635,2 (M++H), Rt. 2,88 мин, 96,98% (максимально). HPLC: (методика B) Rt. 6,12 мин, 97,61% (максимально).
Пример 29
(E)-3-((5-(4-((бутоксикарбонил)амино)фенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота

При перемешивании к раствору этил-(E)-3-((5-(4-((бутоксикарбонил)амино)фенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 40; 0,041 г, 0,06 ммоля) в смеси 1,4-диоксана и воды (3 мл, 4:1) добавляли гидроксид лития (0,008 г 0,19 ммоля) и реакционную смесь перемешивали при комнатной температуре в течение ночи. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1 мл, 1,5 н.) и водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенную органическую часть промывали водой (10 мл) и рассолом (10 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали с помощью препаративной HPLC (методика C) и получали искомое соединение. Выход: 20% (6,1 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 12,23 (bs, 1H), 9,58 (s, 1H), 7,65 (d, J=12,0 Hz, 1H), 7,44-7,42 (m, 3H), 7,19 (d, J=8,8 Hz, 2H), 6,52 (s, 1H), 5,38 (d, J=12,0 Hz, 1H), 4,07 (t, J=6,4 Hz, 2H), 3,75 (bs, 2H), 3,40 (s, 2H), 2,13 (s, 3H), 1,62-1,58 (m, 2H), 1,43-1,39 (m, 5H), 1,37-1,33 (m, 5H), 1,24-1,10 (m, 4H), 0,9 (t, J=7,6 Hz, 3H), 0,7 (t, J=6,4 Hz, 6H). LCMS: (методика C) 633,2 (M++1), Rt. 3,06 мин, 98,93% (максимально). HPLC: (методика B) Rt. 6,41 мин, 97,46% (максимально).
Пример 30
(E)-3-((3,3-дибутил-5-(4-(3,3-диметилбутанамидо)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота
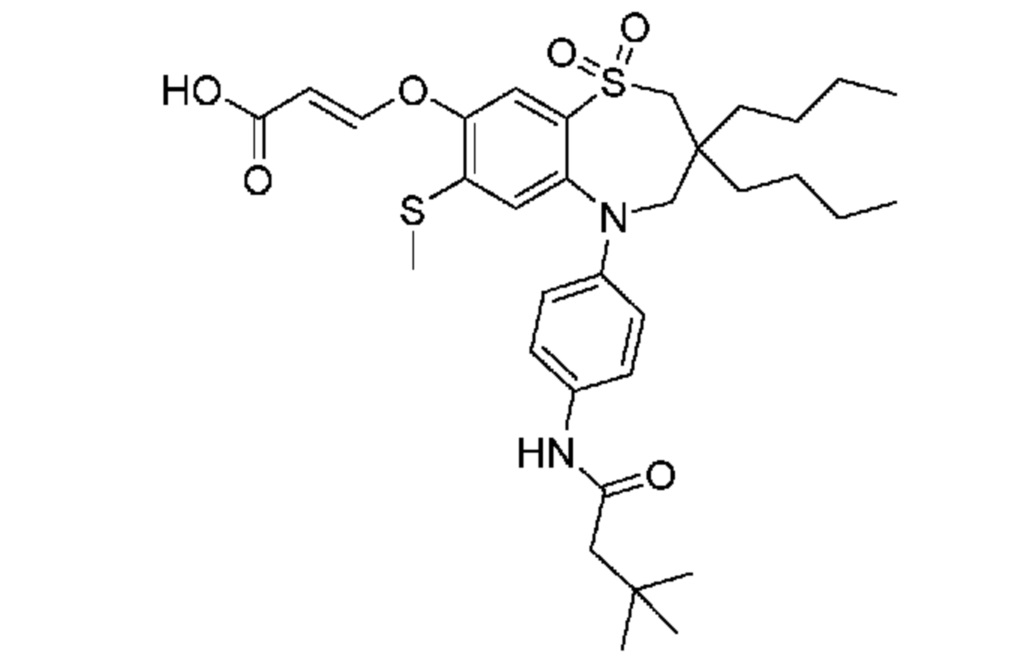
При перемешивании к раствору этил-(E)-3-((3,3-дибутил-5-(4-(3,3-диметилбутанамидо)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 41; 0,15 г, 0,22 ммоля) в смеси 1,4-диоксана и воды (3 мл, 4:1) добавляли гидроксид лития (0,038 г, 0,91 ммоля) при 0°C и затем реакционную смесь перемешивали при комнатной температуре в течение ночи. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1 мл, 1,5 н.) и водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенную органическую часть промывали водой (10 мл) и рассолом (10 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное соединение очищали с помощью фракционной кристаллизации с использованием комбинации DCM/метанол и гексана. Выход: 59% (84,5 мг, почти белое твердое вещество).
1H-NMR (400 MHz, DMSO-d6): δ 12,22 (s, 1H), 9,75 (s, 1H), 7,66 (d, J=12,0 Hz, 1H), 7,56 (d, J=8,8 Hz, 2H), 7,46 (s, 1H), 7,18 (d, J=8,0 Hz, 2H), 6,59 (s, 1H), 5,39 (d, J=12,4 Hz, 1H), 3,75 (bs, 2H), 3,39 (s, 2H), 2,17 (s, 3H), 2,16 (s, 2H), 1,43-1,32 (m, 4H), 1,13-1,07 (m, 8H), 1,02 (s, 9H), 0,8 (t, J=6,8 Hz, 6H). LCMS: (методика C) 631,2 (M++H), Rt. 2,97 мин, 96,38% (максимально). HPLC: (методика B) Rt. 6,14 мин, 97,17% (максимально).
Пример 31
(Z)-3-((3,3-дибутил-5-(4-изобутирамидофенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота
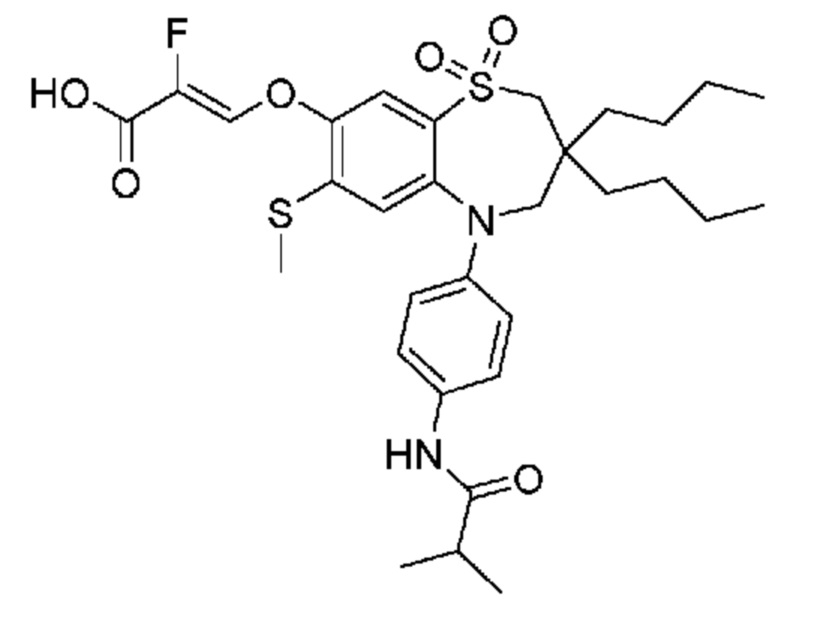
При перемешивании к раствору (Z)-3-((5-(4-аминофенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловой кислоты (промежуточный продукт 38; 0,2 г, 0,36 ммоля) в DMF (2 мл) добавляли изомасляную кислоту (0,041 г, 0,47 ммоля), HATU (0,27 г, 0,73 ммоля) и N-метилморфолин (0,12 мл, 1,10 ммоля) и полученную смесь перемешивали в течение ночи при комнатной температуре. После завершения реакции (следили с помощью TLC) добавляли воду (5 мл) и реакционную смесь экстрагировали с помощью EtOAc (2×10 мл). Объединенный органический слой промывали рассолом (10 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью препаративной HPLC (методика B) и получали искомое соединение. Выход: 10% (10 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 9,77 (s, 1H), 7,57-7,51 (m, 4H), 7,13 (d, J=8,0 Hz, 2H), 6,60 (s, 1H), 3,71 (s, 2H), 3,36 (s, 2H), 2,59-2,57 (m, 1H), 2,18 (s, 3H), 1,44-1,42 (m, 2H), 1,36-1,30 (m, 2H), 1,11-1,09 (m, 14H), 0,78-0,76 (m, 6H). LCMS: (методика A) 621,2 (M+H), Rt. 2,71 мин, 93,97% (максимально). HPLC: (методика B) Rt. 5,75 мин, 93,01% (максимально).
Пример 32
(E)-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-(4-(трифторметил)фенил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота

При перемешивании к раствору этил-(E)-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-(4-(трифторметил)фенил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 46; 0,09 г, 0,14 ммоля) в смеси 1,4-диоксана и воды (5 мл, 4:1) добавляли гидроксид лития (0,012 г, 0,29 ммоля) и реакционную смесь перемешивали в течение 3 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1,5 н., 3 мл) и водный слой экстрагировали с помощью EtOAc (2×8 мл). Объединенный органический слой промывали водой (8 мл) и рассолом (8 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 5% MeOH DCM; силикагель: 230-400 меш) и получали искомое соединение. Выход: 16% (0,014 г, белое твердое вещество).
1H-NMR (400 MHz, DMSO-d6): δ 12,31 (s, 1H), 7,75 (d, J=12,1 Hz, 1H), 7,54-7,51 (m, 3H), 7,07-7,05 (m, 3H), 5,53 (d, J=12,2 Hz, 1H), 3,80 (s, 2H), 3,37 (s, 2H), 2,33 (s, 3H), 1,51-1,48 (m, 2H), 1,33-1,11 (m, 10H), 0,82-0,75 (m, 6H). LCMS: (методика C) 585,8 (M++H), Rt. 3,07 мин, 99,24% (максимально). HPLC: (методика A) Rt. 6,50 мин, 93,77% (максимально).
Пример 33
(E)-3-((3,3-дибутил-5-(4-изобутирамидофенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота
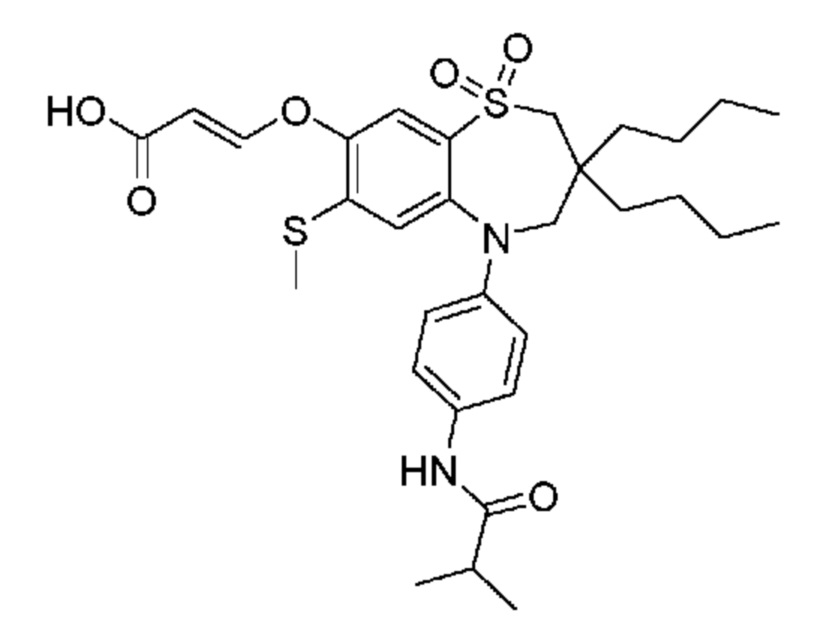
При перемешивании к раствору этил-(E)-3-((3,3-дибутил-5-(4-изобутирамидофенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 47; 0,13 г, 0,206 ммоля) в смеси 1,4-диоксана и воды (3 мл, 4:1) добавляли гидроксид лития (0,035 г, 0,82 ммоля) при 0°C и реакционную смесь перемешивали в течение 3 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1,5 н., 4 мл) и водный слой экстрагировали с помощью EtOAc (2×10 мл). Органическую часть промывали водой (10 мл) и рассолом (10 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали с помощью препаративной HPLC (методика C). Выход: 29% (36 мг, почти белое твердое вещество).
1H-NMR (400 MHz, DMSO-d6): δ 12,23 (s, 1H), 9,79 (s, 1H), 7,66 (d, J=12,4 Hz, 1H), 7,57 (d, J=8,8 Hz, 2H), 7,46 (s, 1H), 7,17 (d, J=8,4 Hz, 2H), 6,58 (s, 1H), 5,40 (d, J=12,0 Hz, 1H), 3,73 (bs, 2H), 3,39 (s, 2H), 3,35-3,34 (m, 1H), 2,16 (s, 3H), 1,44-1,33 (m, 4H), 1,25-1,20 (m, 6H), 1,11-1,01 (m, 8H), 0,8 (t, J=5,6 Hz, 6H). LCMS: (методика C) 603,2 (M++H), Rt. 2,81 мин, 95,01% (максимально). HPLC: (методика B) Rt. 5,7 мин, 95,73% (максимально).
Пример 34
(E)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-(4-пиваламидофенил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота
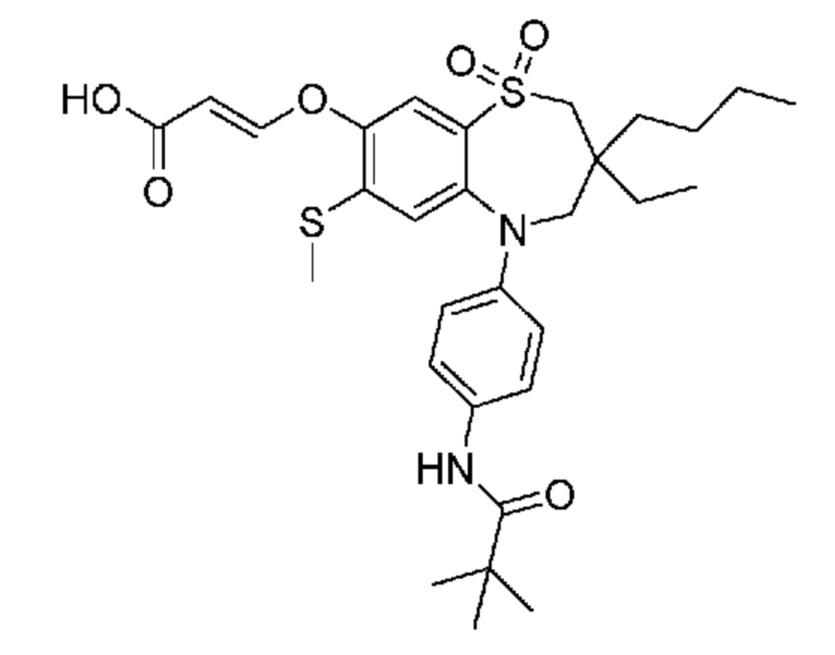
При перемешивании к раствору этил-(E)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-(4-пиваламидофенил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 51; 0,135 г, 0,21 ммоля) в смеси 1,4-диоксана и воды (5 мл, 4:1) при 0°C добавляли гидроксид лития (0,027 г, 0,65 ммоля) и затем реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1,5 н., 4 мл) и водный слой экстрагировали с помощью EtOAc (2×10 мл). Органическую часть промывали водой (10 мл) и рассолом (10 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали с помощью препаративной HPLC (методика C). Выход: 46% (58 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 12,22 (bs, 1H), 9,15 (s, 1H), 7,65 (d, J=12,4 Hz, 1H), 7,58 (d, J=8,8 Hz, 2H), 7,46 (s, 1H), 7,14 (d, J=8,0 Hz, 2H), 6,61 (s, 1H), 5,40 (d, J=12,4 Hz, 1H), 3,73 (bs, 2H), 3,37 (s, 2H), 2,16 (s, 3H), 1,51-1,41 (m, 4H), 1,21 (s, 9H), 1,14-1,07 (m, 4H), 0,77 (t, J=6,80 Hz, 6H). LCMS: (методика B) 587,2 (M+-H), Rt. 2,69 мин, 98,5% (максимально). HPLC: (методика B) Rt. 5,57 мин, 99,14% (максимально).
Пример 35
(Z)-3-((3,3-дибутил-5-(4-(циклопентанкарбоксамидо)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота

При перемешивании к раствору (Z)-3-((5-(4-аминофенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловой кислоты (промежуточный продукт 38; 0,05 г, 0,091 ммоля) в DMF (0,5 мл) добавляли циклопентанкарбоновую кислоту (0,016 г, 0,13 ммоля), HATU (0,069 г, 0,18 ммоля) и N-метилморфолин (0,03 мл, 0,27 ммоля). Реакционную смесь перемешивали в течение ночи при комнатной температуре. После завершения реакции (следили с помощью TLC) к реакционной смеси добавляли воду (5 мл) и полученное твердое вещество отфильтровывали и сушили в вакууме. Неочищенное вещество очищали с помощью препаративной HPLC (методика A) и получали искомое соединение. Выход: 16% (10 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 13,56 (s, 1H), 9,82 (s, 1H), 7,57-7,52 (m, 4H), 7,14 (d, J=8,4 Hz, 2H), 6,58 (s, 1H), 3,73 (s, 2H), 3,36 (s, 2H), 2,77-2,73 (m, 1H), 2,17 (s, 3H), 1,85-1,83 (m, 2H), 1,73-1,69 (m, 4H), 1,56-1,54 (m, 2H), 1,44-1,42 (m, 2H), 1,36-1,30 (m, 2H), 1,12-1,06 (m, 8H), 0,77-0,76 (m, 6H). LCMS: (методика C) 647,2 (M+H), Rt. 3,07 мин, 94,09% (максимально). HPLC: (методика B) Rt. 6,08 мин, 95,76% (максимально).
Пример 36
(Z)-3-((3,3-дибутил-5-(4-(циклопропанкарбоксамидо)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота

При перемешивании к раствору (Z)-3-((5-(4-аминофенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловой кислоты (промежуточный продукт 38; 0,2 г, 0,36 ммоля) в DMF (2 мл) добавляли циклопропанкарбоновую кислоту (0,041 г, 0,47 ммоля), HATU (0,27 г, 0,73 ммоля) и N-метилморфолин (0,12 мл, 1,10 ммоля). Реакционную смесь перемешивали в течение ночи при комнатной температуре. После завершения реакции (следили с помощью TLC) к реакционной смеси добавляли воду (5 мл) и полученное твердое вещество отфильтровывали и сушили в вакууме. Неочищенное вещество очищали с помощью препаративной HPLC (методика B) и получали искомое соединение. Выход: 20% (45 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 10,14 (s, 1H), 7,55-7,48 (m, 3H), 7,37-7,33 (m, 1H), 7,14 (d, J=8,0 Hz, 2H), 6,57 (s, 1H), 3,72 (s, 2H), 3,36 (s, 2H), 2,17 (s, 3H), 1,77-1,75 (m, 1H), 1,43-1,40 (m, 2H), 1,37-1,31 (m, 2H), 1,12-1,08 (m, 8H), 0,78-0,74 (m, 10H). LCMS: (методика C) 619,0 (M++H), Rt. 2,80 мин, 99,01% (максимально). HPLC: (методика B) Rt. 5,71 мин, 97,39% (максимально).
Пример 37
(E)-3-((3,3-дибутил-5-(4-(циклопентанкарбоксамидо)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота
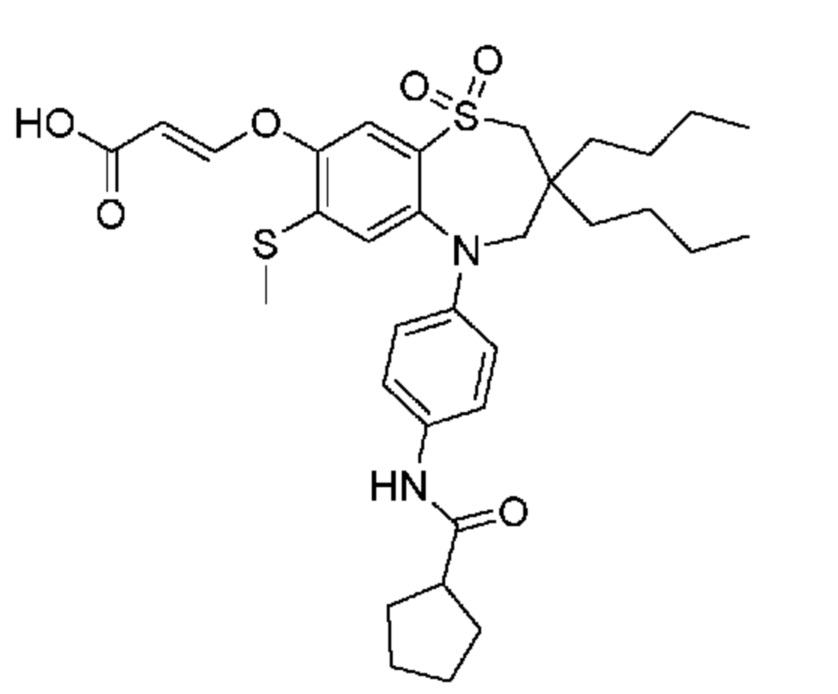
При перемешивании к раствору этил-(E)-3-((3,3-дибутил-5-(4-(циклопентанкарбоксамидо)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 52; 0,14 г, 0,21 ммоля) в смеси 1,4-диоксана и воды (3 мл, 4:1) при 0°C добавляли гидроксид лития (0,036 г, 0,85 ммоля) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1,5 н., 4 мл) и водный слой экстрагировали с помощью EtOAc (2×10 мл). Органическую часть промывали водой (10 мл) и рассолом (10 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали с помощью препаративной HPLC (методика C). Выход: 11% (14,8 мг, почти белое твердое вещество).
1H-NMR (400 MHz, DMSO-d6): δ 12,35 (s, 1H), 9,83 (s, 1H), 7,63 (d, J=12,1 Hz, 1H), 7,57 (d, J=7,8 Hz, 2H), 7,45 (s, 1H), 7,17 (d, J=7,6 Hz, 2H), 6,58 (s, 1H), 5,40 (d, J=11,3 Hz, 1H), 3,74 (bs, 2H), 3,38 (s, 2H), 2,77-2,74 (m, 1H), 2,16 (s, 3H), 1,85-1,84 (m, 2H), 1,71-1,69 (m, 4H), 1,56-1,44 (m, 2H), 1,41-1,33 (m, 4H), 1,12-1,04 (m, 8H), 0,8 (t, J=6,0 Hz, 6H). LCMS: (методика A) 629,2 (M++H), Rt. 2,89 мин, 97,32% (максимально). HPLC: (методика B) Rt. 6,08 мин, 96,14% (максимально).
Пример 38
(E)-3-((3-бутил-5-(4-(циклопентанкарбоксамидо)фенил)-3-этил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота
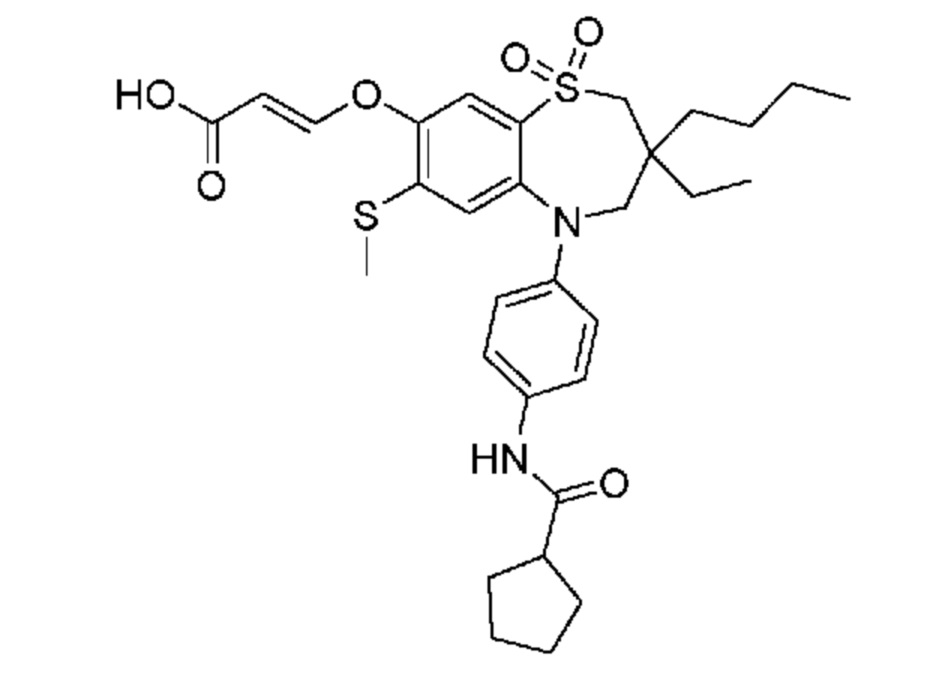
При перемешивании к раствору этил-(E)-3-((3-бутил-5-(4-(циклопентанкарбоксамидо)фенил)-3-этил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 53; 0,14 г, 0,22 ммоля) в смеси 1,4-диоксана и воды (3 мл, 4:1) при 0°C добавляли гидроксид лития (0,037 г, 0,89 ммоля) и реакционную смесь перемешивали в течение 12 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1 мл, 1,5 н.) и водный слой экстрагировали с помощью EtOAc (2×15 мл). Органический слой сушили над Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали с помощью препаративной HPLC (методика C) и получали искомое соединение. Выход: 25% (33 мг, почти белое твердое вещество).
1H-NMR (400 MHz, DMSO-d6): δ 9,83 (s, 1H), 7,62 (d, J=12,2 Hz, 1H), 7,57 (d, J=8,9 Hz, 2H), 7,45 (s, 1H), 7,16 (d, J=8,4 Hz, 2H), 6,59 (s, 1H), 5,41 (d, J=12,2 Hz, 1H), 3,38 (bs, 2H), 3,33 (s, 2H), 2,75-2,74 (m, 1H), 2,16 (s, 3H), 1,85-1,83 (m, 2H), 1,74-1,70 (m, 4H), 1,70-1,56 (m, 3H), 1,55-1,54 (m, 3H), 1,38-1,11 (m, 4H), 0,70 (t, J=7,2 Hz, 6H). LCMS: (методика A) 601,2 (M++H), Rt. 2,67 мин, 99,09% (максимально). HPLC: (методика B) Rt. 5,61 мин, 98,96% (максимально).
Пример 39
(E)-3-((3,3-диэтил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота

При перемешивании к раствору этил-(E)-3-((3,3-диэтил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 61; 0,17 г, 0,34 ммоля) в смеси 1,4-диоксана и воды (4 мл, 4:1) добавляли гидроксид лития (0,03 г, 0,70 ммоля) и реакционную смесь перемешивали при комнатной температуре в течение ночи. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1,5 н., 2 мл) и водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенную органическую часть промывали водой (10 мл) и рассолом (10 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали с помощью препаративной HPLC (методика A) и получали искомое соединение. Выход: 42% (68 мг, почти белое твердое вещество).
1H-NMR (400 MHz, DMSO-d6): δ 12,25 (s, 1H), 7,70 (dd, J=12,2, 2,0 Hz, 1H), 7,50 (d, J=2,4 Hz, 1H), 7,29 (t, J=7,2 Hz, 2H), 7,13 (d, J=6,4 Hz, 2H), 6,97 (t, J=6,8 Hz, 1H), 6,72 (s, 1H), 5,44 (dd, J=12,0, 2,4 Hz, 1H), 3,76 (s, 2H), 3,37 (s, 2H), 2,19 (s, 3H), 1,55-1,53 (m, 2H), 1,39-1,34 (m, 2H), 0,73 (t, J=6,4 Hz, 6H). LCMS: (методика A) 462,1 (M+H), Rt. 2,33 мин, 97,56% (максимально), HPLC: (методика B) Rt. 5,29 мин, 97,10% (максимально).
Пример 40
(E)-3-((3,3-дибутил-5-(4-бутирамидофенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота

При перемешивании к раствору этил-(E)-3-((3,3-дибутил-5-(4-бутирамидофенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 62; 0,145 г, 0,22 ммоля) в смеси 1,4-диоксана и воды (4 мл, 4:1) добавляли гидроксид лития (0,038 г 0,91 ммоля) и реакционную смесь перемешивали при комнатной температуре в течение ночи. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1,5 н., 2 мл) и водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенную органическую часть промывали водой (10 мл) и рассолом (10 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенное соединение очищали с помощью препаративной HPLC (методика C). Выход: 28,2% (39,3 мг, почти белое твердое вещество).
1H-NMR (400 MHz, DMSO-d6): δ 12,22 (s, 1H), 9,83 (s, 1H), 7,66 (d, J=12,4 Hz, 1H), 7,56 (d, J=8,4 Hz, 2H), 7,46 (s, 1H), 7,18 (d, J=8,4 Hz, 2H), 6,57 (s, 1H), 5,39 (d, J=12,4 Hz, 1H), 3,75 (bs, 2H), 3,39 (s, 2H), 2,27 (t, J=7,20 Hz, 2H), 2,15 (s, 3H), 1,64-1,60 (m, 2H), 1,58-1,36 (m, 4H), 1,33-1,08 (m, 4H),1,04-1,02 (m, 4H), 0,9 (t, J=4,0 Hz, 3H), 0,7 (t, J=8,0 Hz, 6H). LCMS: (методика A) 603,3 (M++H), Rt. 2,49 мин, 97,34% (максимально). HPLC: (методика B) Rt. 5,71 мин, 98,16% (максимально).
Пример 41
(Z)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота

При перемешивании к раствору метил-(Z)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилата (промежуточный продукт 63; 0,11 г, 0,21 ммоля) в смеси 1,4-диоксана и воды (3 мл, 4:1) добавляли гидроксид лития (0,018 г, 0,42 ммоля) и реакционную смесь перемешивали в течение ночи при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1,5 н., 3 мл) и добавляли воду (5 мл). Затем водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенный органический слой промывали водой (8 мл) и рассолом (10 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 42-44% EtOAc/PE, силикагель: 230-400 меш) и получали искомое соединение. Выход: 62% (68 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 13,57 (s, 1H), 7,59-7,56 (m, 2H), 7,31-7,29 (m, 2H), 7,14-7,12 (m, 1H), 6,70 (s, 1H), 3,76-3,75 (m, 2H), 3,36 (s, 2H), 2,19 (s, 3H), 1,54-1,43 (m, 4H), 1,18-1,11 (m, 4H), 0,74 (t, J=5,60 Hz, 6H). LCMS: (методика A) 506,2 (M+-H), Rt. 2,85 мин, 97,26% (максимально). HPLC: (методика B) Rt. 5,96 мин, 96,72% (максимально).
Примеры 42 и 43
(R)-(Z)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота и (S)-(Z)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота
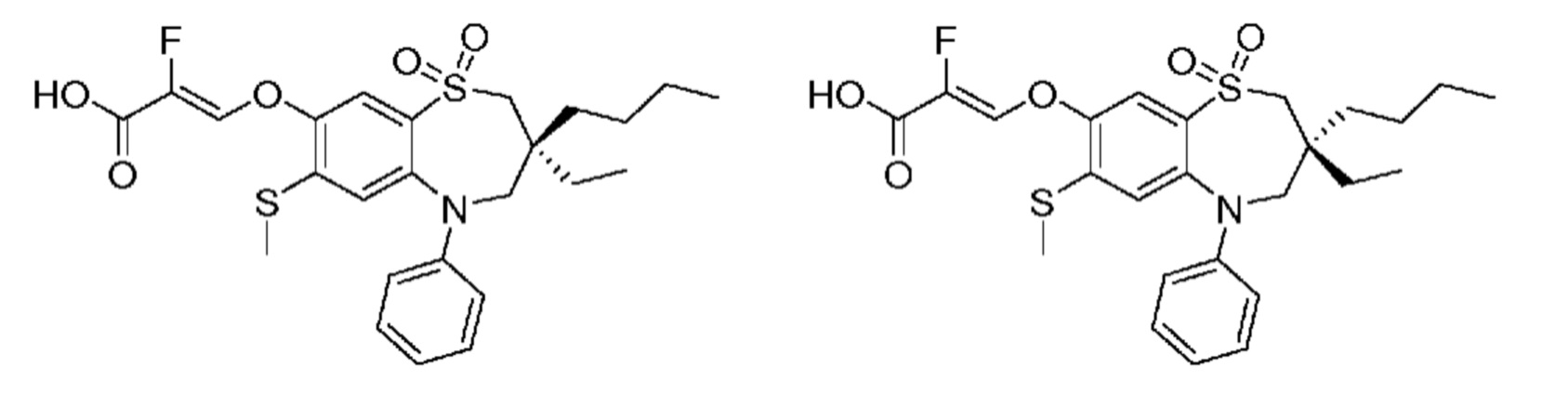
Два энантиомера рацемической (Z)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловой кислоты (пример 41; 50 мг, 0,098 ммоля) разделяли с помощью хиральной препаративной SFC (методика A); подвижная фаза: CO2: IPA (70:30); длина волны: 280 нм; длительность цикла: 5 мин; противодавление: 100 бар. Вещество концентрировали в вакууме при 40°C. Первая элюирующаяся фракция соответствовала энантиомеру 1 и вторая элюирующаяся фракция соответствовала энантиомеру 2. Абсолютная конфигурация этих двух энантиомеров неизвестна.
Энантиомер 1: Выход: 40% (20 мг, почти белое твердое вещество).1H NMR (400 MHz, DMSO-d6): δ 7,57-7,56 (m, 2H), 7,31-7,29 (m, 2H), 7,14-7,12 (m, 2H), 6,99-6,97 (m, 1H), 6,70 (s, 1H), 3,74 (s, 2H), 3,35 (s, 2H), 2,20 (s, 3H), 1 1,42-1,35 (m, 4H), 1,11-1,03 (m, 4H), 0,75-0,74 (m, 6H). LCMS: (методика E) 508,2 (M+H), Rt. 2,68 мин, 96,09% (максимально). HPLC: (методика B) Rt. 5,96 мин, 97,80% (максимально). SFC: (методика A) Rt. 6,23 мин, 100% (максимально).
Энантиомер 2: Выход: 16% (8 мг, почти белое твердое вещество).1H NMR (400 MHz, DMSO-d6): δ 7,54-7,46 (m, 2H), 7,30-7,27 (m, 2H), 7,13-7,12 (m, 2H), 6,98-6,96 (m, 1H), 6,70 (s, 1H), 3,73 (s, 2H), 3,34 (s, 2H), 2,19 (s, 3H), 1,54 (s, 1H), 1,43-1,32 (m, 3H), 1,11-1,01 (m, 4H), 0,75-0,74 (m, 6H). LCMS: (методика A) 508,2 (M++H), Rt. 2,85 мин, 99,63% (максимально). HPLC: (методика A) Rt. 5,99 мин, 98,89% (максимально). SFC: (методика A) Rt. 7,38 мин, 97,68% (максимально).
Пример 44
(Z)-3-((3,3-диэтил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота
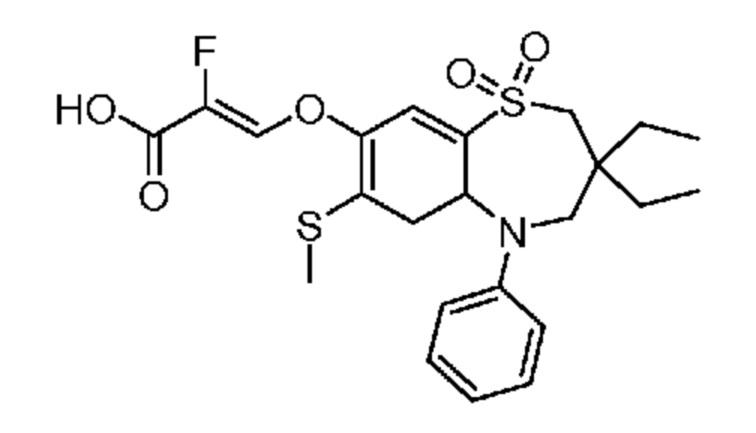
При перемешивании к раствору метил-(Z)-3-((3,3-диэтил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилата (промежуточный продукт 64; 0,06 г, 0,12 ммоля) в смеси 1,4-диоксана и воды (3 мл, 4:1) добавляли гидроксид лития (0,01 г, 0,24 ммоля) и реакционную смесь перемешивали в течение ночи при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1,5 н., 3 мл) и добавляли воду (5 мл). Затем водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенный органический слой промывали водой (8 мл) и рассолом (10 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью препаративной HPLC (методика A) и получали искомое соединение. Выход: 24% (37 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 13,55 (s, 1H), 7,57-7,56 (m, 2H), 7,29-7,27 (m, 2H), 7,10-7,08 (m, 2H), 6,96-6,94 (m, 1H), 6,72 (s, 1H), 3,73 (s, 2H), 3,35 (s, 2H), 2,20 (s, 3H), 1,57-1,55 (m, 2H), 1,38-1,36 (m, 2H), 0,72 (t, J=7,60 Hz, 6H). LCMS: (методика A) 480,1 (M+H), Rt. 2,63 мин, 99,01% (максимально). HPLC: (методика B) Rt. 5,42 мин, 99,46% (максимально).
Пример 45
(Z)-3-((3,3-дибутил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота

При перемешивании к раствору метил-(Z)-3-((3,3-дибутил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилата (промежуточный продукт 67; 0,08 г, 0,15 ммоля) в смеси 1,4-диоксана и воды (3 мл, 4:1) добавляли гидроксид лития (0,013 г, 0,31 ммоля) и реакционную смесь перемешивали при комнатной температуре в течение ночи. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1 мл, 1,5 н.) и водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенную органическую часть промывали водой (8 мл) и рассолом (8 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали с помощью препаративной HPLC (методика A) и получали искомое соединение. Выход: 45% (35 мг, почти белое твердое вещество).
1H-NMR (400 MHz, DMSO-d6): δ 7,44 (d, J=2,8 Hz, 1H), 7,30-7,24 (m, 3H), 7,10-7,08 (m, 2H), 6,98-6,91 (m, 3H), 3,73 (s, 2H), 3,37 (s, 2H), 1,37-1,31 (m, 4H), 1,14-1,00 (m, 8H), 0,85-0,69 (m, 6H). LCMS: (методика C) 490,1 (M+H), Rt. 3,22 мин, 98,94% (максимально), HPLC: (методика B) Rt. 6,27 мин, 99,58% (максимально).
Пример 46
(Z)-3-((3-бутил-7-хлор-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота

При перемешивании к раствору метил-(Z)-3-((3-бутил-7-хлор-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилата (промежуточный продукт 75; 0,74 г, 1,45 ммоля) в смеси 1,4-диоксана и воды (8 мл, 4:1) добавляли гидроксид лития (0,12 г, 2,90 ммоля) и реакционную смесь перемешивали в течение ночи при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1,5 н., 3 мл) и добавляли воду (10 мл). Затем водный слой экстрагировали с помощью EtOAc (2×15 мл). Объединенный органический слой промывали водой (10 мл) и рассолом (10 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 3-4% MeOH/DCM, силикагель: 230-400 меш) и получали искомое соединение. Выход: 72% (0,52 г, белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 13,57 (s, 1H), 7,59-7,56 (m, 2H), 7,31-7,29 (m, 2H), 7,14-7,12 (m, 1H), 6,70 (s, 1H), 3,76-3,75 (m, 2H), 3,36 (s, 2H), 2,19 (s, 3H), 1,54-1,43 (m, 4H), 1,18-1,11 (m, 4H), 0,74 (t, J=5,60 Hz, 6H). LCMS: (методика A) 497,2 (M++H), Rt. 2,86 мин, 97,24% (максимально). HPLC: (методика B) Rt. 6,06 мин, 95,11% (максимально).
Примеры 47 и 48
(R)-(Z)-3-((3-бутил-7-хлор-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота и (S)-(Z)-3-((3-бутил-7-хлор-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота
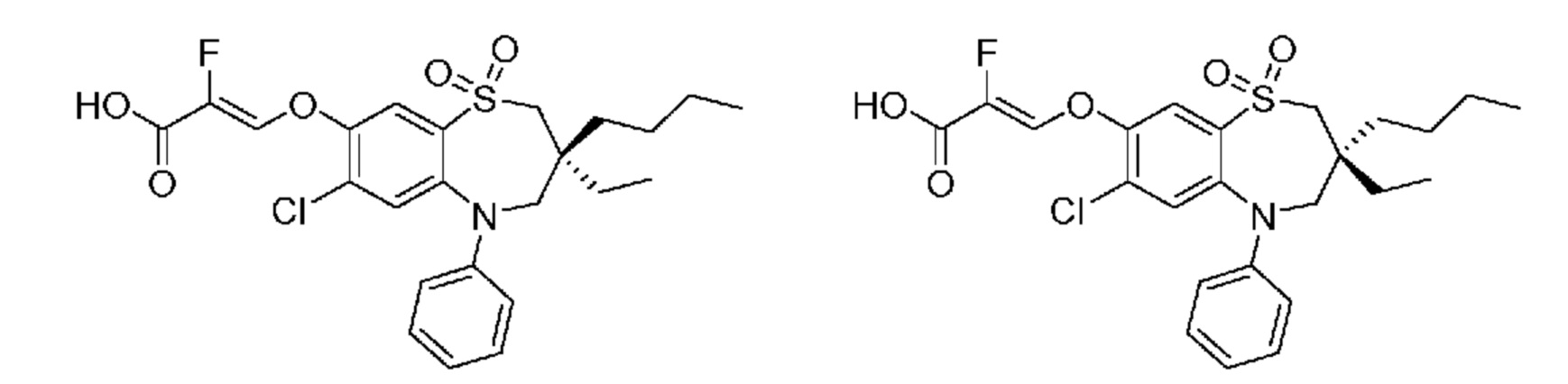
Два энантиомера рацемической (Z)-3-((3-бутил-7-хлор-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловой кислоты (пример 46; 0,52 г, 1,05 ммоля) разделяли с помощью хиральной препаративной SFC (методика A); подвижная фаза: CO2: IPA (70:30); длина волны: 280 нм; длительность цикла: 5 мин; противодавление: 100 бар. Вещество концентрировали в вакууме при 40°C. Первая элюирующаяся фракция соответствовала энантиомеру 1 и вторая элюирующаяся фракция соответствовала энантиомеру 2. Абсолютная конфигурация этих двух энантиомеров неизвестна.
Энантиомер 1: Выход: 26% (140 мг, почти белое твердое вещество).1H NMR (400 MHz, DMSO-d6): δ 13,62 (s, 1H), 7,74 (s, 1H), 7,60 (d, J=18,4 Hz, 1H), 7,34 (t, J=7,2 Hz, 2H), 7,22 (d, J=6,8 Hz, 2H), 7,06 (t, J=7,2 Hz, 1H), 6,94 (s, 1H), 3,78 (s, 2H), 3,44 (s, 2H), 1,53-1,32 (m, 4H), 1,10-1,05 (m, 4H), 0,72-0,72 (m, 6H). LCMS: (методика C) 494,0 (M+-H), Rt. 3,03 мин, 98,39% (максимально). HPLC: (методика B) Rt. 6,05 мин, 97,65% (максимально). SFC: (методика A) Rt. 2,82 мин, 99,06% (максимально).
Энантиомер 2: Выход: 30% (160 мг, почти белое твердое вещество).1H NMR (400 MHz, DMSO-d6): δ 13,61 (s, 1H), 7,74 (s, 1H), 7,59 (d, J=18,4 Hz, 1H), 7,34 (t, J=7,2 Hz, 2H), 7,22 (d, J=7,6 Hz, 2H), 7,06 (t, J=7,2 Hz, 1H), 6,94 (s, 1H), 3,78 (s, 2H), 3,44 (s, 2H), 1,53-1,32 (m, 4H), 1,12-1,07 (m, 4H), 0,73-0,70 (m, 6H). LCMS: (методика C) 494,1 (M+-H), Rt. 3,03 мин, 97,42% (максимально). HPLC: (методика B) Rt. 6,04 мин, 96,90% (максимально). SFC: (методика A) Rt. 3,35 мин, 98,76% (максимально).
Пример 49
(E)-3-((3-бутил-7-хлор-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота
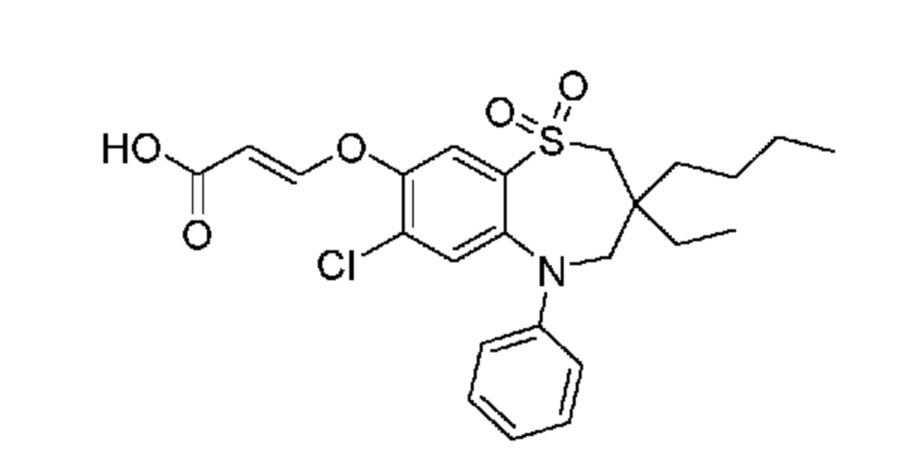
При перемешивании к раствору этил-(E)-3-((3-бутил-7-хлор-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 76; 1,0 г, 1,97 ммоля) в смеси 1,4-диоксана и воды (10 мл; 5:1) добавляли гидроксид лития (0,25 г, 5,92 ммоля) и полученную смесь перемешивали в течение 12 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме. Полученный остаток подкисляли разбавленной HCl (1,5 н., 2 мл) и водную часть экстрагировали с помощью EtOAc (2×15 мл). Объединенный органический слой промывали водой (15 мл) и рассолом (15 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 2-3% MeOH/DCM; силикагель: 230-400 меш) и получали искомое соединение. Выход: 64% (600 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 12,29 (s, 1H), 7,75 (d, J=12,0 Hz, 1H), 7,69 (s, 1H), 7,38-7,36 (m, 1H), 7,34 (s, 1H), 7,27-7,25 (m, 2H), 7,09 (t, J=7,2 Hz, 1H), 6,91 (s, 1H), 5,40 (d, J=12,4 Hz, 1H), 3,81 (bs, 2H), 3,47 (s, 2H), 1,54-1,51 (m, 1H), 1,45-1,34 (m, 3H), 1,11-0,98 (m, 4H), 0,74 (t, J=4,40 Hz, 6H). LCMS: (методика A) 522,0 (M+), Rt. 2,78 мин, 98,84% (максимально). HPLC: (методика B) Rt. 5,95 мин, 98,16% (максимально).
Примеры 50 и 51
(R)-(E)-3-((3-бутил-7-хлор-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота и (S)-(E)-3-((3-бутил-7-хлор-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота

Два энантиомера рацемической (E)-3-((3-бутил-7-хлор-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловой кислоты (пример 49; 600 мг, 1,25 ммоля) разделяли с помощью хиральной препаративной SFC (прибор: Pic SFC 10-150); подвижная фаза: CO2: метанол; колонка: Lux A1; Скорость потока: 3 мл/мин; длина волны: 220 нм; длительность цикла: 5 мин; противодавление: 100 бар. Вещество концентрировали в вакууме при 40°C. Первая элюирующаяся фракция соответствовала энантиомеру 1 и вторая элюирующаяся фракция соответствовала энантиомеру 2. Абсолютная конфигурация этих двух энантиомеров неизвестна.
Энантиомер 1: Выход: 37% (222 мг, почти белое твердое вещество).1H NMR (400 MHz, DMSO-d6): δ 12,32 (bs, 1H), 7,74 (d, J=12,0 Hz, 1H), 7,69 (s, 1H), 7,38-7,34 (m, 2H), 7,27-7,25 (m, 2H), 7,08 (t, J=7,2 Hz, 1H), 6,91 (s, 1H), 5,40 (d, J=12,0 Hz, 1H), 3,81 (bs, 2H), 3,47 (s, 2H), 1,54-1,36 (m, 4H), 1,34-1,04 (m, 4H), 0,73 (t, J=6,80 Hz, 6H). LCMS: (методика C) 480,0 (M++2), Rt. 2,91 мин, 99,26% (максимально). HPLC: (методика B) Rt. 5,95 мин, 98,81% (максимально). SFC: (методика D) Rt. 3,2 мин, 100% (максимально).
Энантиомер 2: Выход: 32% (195 мг, почти белое твердое вещество).1H NMR (400 MHz, DMSO-d6): δ 12,37 (bs, 1H), 7,75 (d, J=12,4 Hz, 1H), 7,68 (d, J=4,8 Hz, 1H), 7,38-7,35 (m, 2H), 7,27 (d, J=6,4 Hz, 2H), 7,11-7,09 (m, 1H), 6,91 (s, 1H), 5,41 (d, J=12,4 Hz, 1H), 3,80 (bs, 2H), 3,40 (s, 2H), 1,53-1,38 (m, 2H), 1,36-1,33 (m, 2H), 1,09-1,07 (m, 2H), 1,04-1,01 (m, 2H), 0,72 (t, J=4,8 Hz, 6H). LCMS: (методика C) 479,1,0 (M++H), Rt. 2,91 мин, 97,56% (максимально). HPLC: (методика B) Rt. 5,95 мин, 95,56% (максимально). SFC: (методика D) Rt. 4,51 мин, 99,16% (максимально).
Пример 52
(Z)-3-((3,3-диэтил-7-(метилтио)-1,1-диоксидо-5-(4-пиваламидофенил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота

При перемешивании к раствору метил-(Z)-3-((3,3-диэтил-7-(метилтио)-1,1-диоксидо-5-(4-пиваламидофенил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилата (промежуточный продукт 79; 0,18 г, 0,3 ммоля) в смеси 1,4-диоксана и воды (10 мл; 5:1) добавляли гидроксид лития (0,038 г, 0,91 ммоля) и полученную смесь перемешивали в течение 12 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме. Полученный остаток подкисляли разбавленной HCl (1,5 н., 2 мл) и водную часть экстрагировали с помощью EtOAc (2×15 мл). Объединенный органический слой промывали водой (15 мл) и рассолом (15 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и получали неочищенное вещество, которое очищали с помощью препаративной HPLC (методика A). Выход: 25% (42 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 9,14 (s, 1H), 7,57 (d, J=8,8 Hz, 2H), 7,52 (s, 1H), 7,48-7,43 (m, 1H), 7,10 (d, J=8,0 Hz, 2H), 6,65 (s, 1H), 3,72 (bs, 2H), 3,35 (s, 2H), 2,20 (s, 3H), 1,55-1,50 (m, 2H), 1,42-1,34 (m, 2H), 1,22 (s, 9H), 0,71 (t, J=7,20 Hz, 6H). LCMS: (методика A) 579,2 (M++H), Rt. 2,42 мин, 99,24% (максимально). HPLC: (методика B) Rt. 5,17 мин, 99,04% (максимально).
Пример 53
(Z)-3-((3,3-дибутил-7-хлор-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота
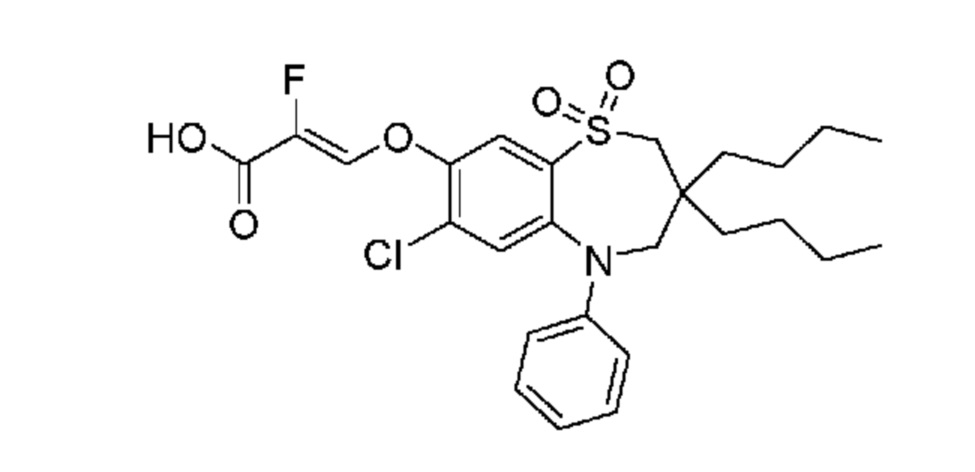
При перемешивании к раствору метил-(Z)-3-((3,3-дибутил-7-хлор-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилата (промежуточный продукт 80; 617 мг, 1,14 ммоля) в смеси 1,4-диоксана и воды (10 мл, 5:1) добавляли гидроксид лития (241 мг, 41,96 ммоля) и реакционную смесь перемешивали в течение ночи при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1,5 н., 3 мл) и добавляли воду (5 мл). Затем водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенный органический слой промывали водой (8 мл) и рассолом (10 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью препаративной HPLC (методика C). Выход: 20% (70 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,61 (s, 1H), 7,33 (t, J=7,6 Hz, 2H), 7,26-7,20 (m, 3H), 7,04 (t, J=7,2 Hz, 1H), 6,93 (s, 1H), 3,75 (s, 2H), 3,38 (d, J=35,8 Hz, 3H), 1,42-1,32 (m, 4H), 1,14-1,08 (m, 8H), 0,75 (s, 6H). LCMS: (методика B) 522,2 (M+-2H), Rt. 2,46 мин, 99,75% (максимально). HPLC: (методика A) Rt. 6,12 мин, 99,28% (максимально).
Пример 54
(E)-3-((3,3-диэтил-7-йод-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота
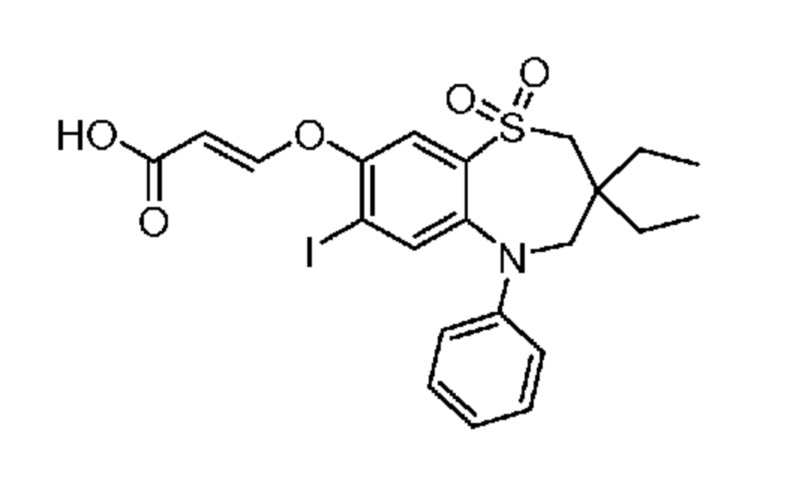
При перемешивании к раствору трет-бутил-(E)-3-((3,3-диэтил-7-йод-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 82; 130 мг, 0,2175 ммоля) в DCM (2 мл) при 0°C добавляли TFA (2 мл) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь выливали в охлажденную льдом воду (15 мл) и водный слой экстрагировали с помощью DCM (3×10 мл). Объединенный органический слой промывали водой (10 мл) и рассолом (10 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью препаративной HPLC (методика B) и получали искомое соединение. Выход: 21% (25 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 12,28 (s, 1H), 7,70 (d, J=12,0 Hz, 1H), 7,53 (s, 1H), 7,35-7,17 (m, 5H), 7,03 (t, J=15,2 Hz, 1H), 5,39 (d, J=12,4 Hz, 1H), 3,74 (s, 2H), 3,41 (s, 2H), 1,53-1,48 (m, 2H), 1,37-1,32 (m, 2H), 0,69 (t, J=14,4 Hz, 6H). LCMS: (методика B) 542,0 (M++H), Rt. 2,09 мин, 95,08% (максимально). HPLC: (методика B) Rt. 5,47 мин, 93,13% (максимально).
Пример 55
(E)-3-((7-бром-3,3-диэтил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота
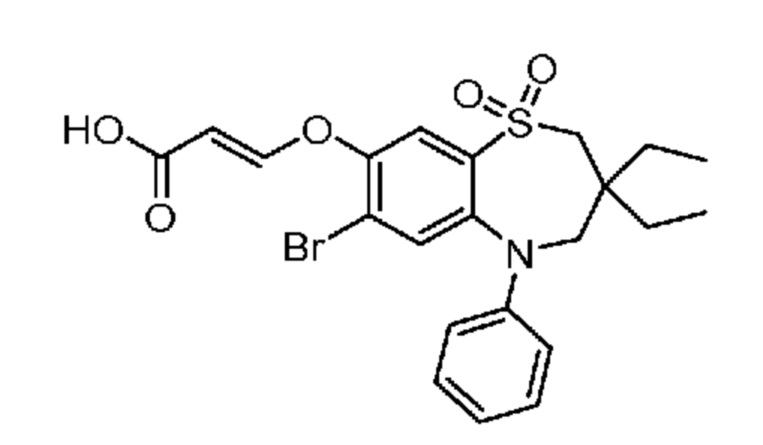
При перемешивании к раствору этил-(E)-3-((7-бром-3,3-диэтил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 84; 250 мг, 0,478 ммоля) в смеси 1,4-диоксана и воды (5 мл, 4:1) добавляли гидроксид лития (100 мг, 2,3925 ммоля) и реакционную смесь перемешивали в течение ночи при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1,5 н., 3 мл) и добавляли воду (10 мл). Водный слой экстрагировали с помощью EtOAc (2×20 мл). Объединенный органический слой промывали водой (15 мл) и рассолом (15 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью препаративной HPLC (методика C) и полученную фракцию концентрировали при пониженном давлении и получали искомое соединение. Выход: 10% (15 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 12,28 (s, 1H), 7,72 (d, J=12,4 Hz, 1H), 7,64 (s, 1H), 7,34 (t, J=15,6 Hz, 2H), 7,21 (d, J=7,6 Hz, 2H), 7,05 (t, J=15,6 Hz, 2H), 5,40 (d, J=12,0 Hz, 1H), 3,77 (s, 2H), 3,43 (d, J=8,0 Hz, 2H), 1,52-1,49 (m, 2H), 1,38-1,34 (m, 2H), 0,69 (t, J=14,4 Hz, 6H). LCMS: (методика E) 494,0 (M++H), Rt. 2,48 мин, 98,56% (максимально). HPLC: (методика B) Rt. 5,43 мин, 98,18% (максимально).
Пример 56
(Z)-3-((7-бром-3,3-диэтил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота

При перемешивании к раствору метил-(Z)-3-((7-бром-3,3-диэтил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилата (промежуточный продукт 85; 250 мг, 0,475 ммоля) в смеси 1,4-диоксана и воды (5 мл, 4:1) добавляли гидроксид лития (100 мг, 2,376 ммоля) и реакционную смесь перемешивали в течение ночи при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1,5 н., 3 мл) и добавляли воду (10 мл). Водный слой экстрагировали с помощью EtOAc (2×15 мл). Объединенный органический слой промывали водой (10 мл) и рассолом (10 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью препаративной HPLC (методика C) и полученную фракцию концентрировали в вакууме и получали искомое соединение. Выход: 10% (15 мг, белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,69 (s, 1H), 7,58 (d, J=18,4 Hz, 1H), 7,32 (t, J=15,6 Hz, 2H), 7,17 (d, J=7,6 Hz, 2H), 7,10 (s, 1H), 7,03 (t, J=14,4 Hz, 1H), 3,73 (d, J=11,2 Hz, 2H), 3,41 (s, 2H), 1,54-1,49 (m, 2H), 1,37-1,32 (m, 2H), 0,69 (t, J=14,8 Hz, 6H). LCMS: (методика A) 512,0 (M++H), Rt. 2,63 мин, 99,15% (максимально). HPLC: (методика B) Rt. 5,56 мин, 95,79% (максимально).
Примеры 57 и 58
(S)-(Z)-3-((3-бутил-3-этил-7-йод-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота и (R)-(Z)-3-((3-бутил-3-этил-7-йод-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота

Энантиомеры рацемической (E)-3-((7-бром-3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловой кислоты и (E)-3-((3-бутил-3-этил-7-йод-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловой кислоты (промежуточный продукт 94; 3,38 г, 5,93 ммоля) разделяли с помощью хиральной препаративной SFC (прибор: Pic SFC 10-150); подвижная фаза: CO2: 0,5% изопропиламина в IPA (70:30); колонка: Lux A1; скорость потока: 3 мл/мин; длина волны: 220 нм; длительность цикла: 5 мин; противодавление: 100 бар. Вещество концентрировали в вакууме при 40°C. Первая элюирующаяся фракция соответствовала энантиомеру 1 примера 5 и 6; вторая элюирующаяся фракция соответствовала смеси энантиомера 2 примера 5 и 6 и энантиомера 1 искомого соединения; и третья фракция соответствовала энантиомеру 2 искомого соединения.
Смесь энантиомера 2 примера 5 и 6 и энантиомера 1 искомого соединения повторно разделяли с помощью хиральной препаративной SFC (прибор: Pic SFC 10-150); подвижная фаза: CO2: 0,5% изопропиламина в IPA (70:30); колонка: YMC Cellulose-SB; Скорость потока: 3 мл/мин; длина волны: 220 нм; длительность цикла: 5 мин; противодавление: 100 бар. Вещество концентрировали в вакууме при 40°C. Первая элюирующаяся фракция соответствовала энантиомеру 2 примера 5 и 6 и вторая элюирующаяся фракция соответствовала энантиомеру 1 искомого соединения. Абсолютная конфигурация этих двух энантиомеров искомого соединения неизвестна.
Энантиомер 1: Выход: 9% (0,305 г, почти белое твердое вещество).1H NMR (400 MHz, DMSO-d6): δ 12,27 (s, 1H), 7,71 (d, J=12,4 Hz, 1H), 7,53 (s, 1H), 7,37-7,33 (m, 2H), 7,27-7,21 (m, 3H), 7,09-7,07 (m, 1H), 5,38 (d, J=12,4 Hz, 1H), 3,66 (s, 2H), 3,43 (s, 2H), 1,53-1,51 (m, 1H), 1,35-1,32 (m, 3H), 1,14-0,99 (m, 4H), 0,74-0,73 (m, 6H). LCMS: (методика A) 568,1 (M+-H), Rt. 2,92 мин, 97,41% (максимально). HPLC: (методика B) Rt. 6,03 мин, 95,00% (максимально). SFC: (методика A) Rt. 3,55 мин, 99,53% (максимально).
Энантиомер 2: Выход: 3,5% (0,12 г, почти белое твердое вещество).1H NMR (400 MHz, DMSO-d6): δ 12,27 (s, 1H), 7,71 (d, J=12,0 Hz, 1H), 7,53 (s, 1H), 7,37-7,33 (m, 2H), 7,27-7,21 (m, 3H), 7,09-7,07 (m, 1H), 5,38 (d, J=12,4 Hz, 1H), 3,68 (s, 2H), 3,43 (s, 2H), 1,51-1,50 (m, 1H), 1,37-1,30 (m, 3H), 1,14-0,98 (m, 4H), 0,75-0,74 (m, 6H. LCMS: (методика A) 568,1 (M+-H), Rt. 2,92 мин, 96,49% (максимально). HPLC: (методика B) Rt. 6,03 мин, 96,77% (максимально). SFC: (методика A) Rt. 6,78 мин, 94,72% (максимально).
Пример 59
(Z)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота
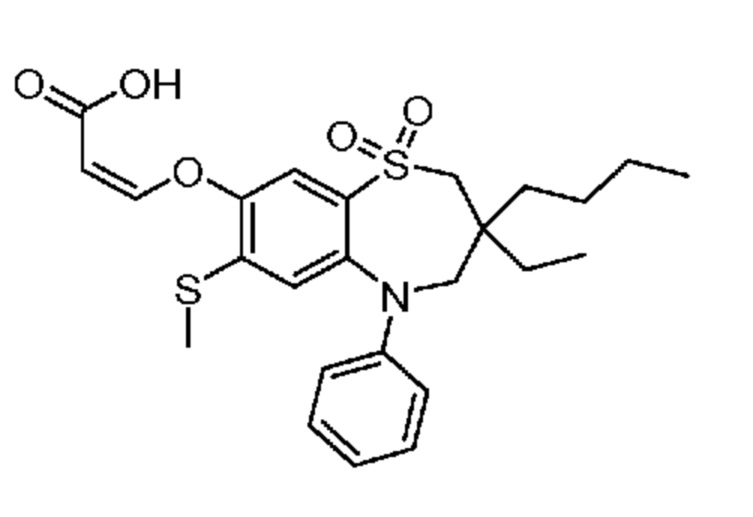
При перемешивании к раствору этил-(Z)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 24; 0,3 г, 0,58 ммоля) в смеси 1,4-диоксана и воды (13 мл, 10:3) добавляли гидроксид лития (0,12 г, 2,89 ммоля) и полученную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью LCMS) реакционную смесь концентрировали в вакууме. Неочищенный остаток подкисляли разбавленной HCl (1,5 н., 2 мл) и водный слой экстрагировали с помощью EtOAc (2×10 мл). Органический слой промывали водой (15 мл) и рассолом (15 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью препаративной HPLC (методика D) и получали искомое соединение. Выход: 56% (160 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 12,13 (bs, 1H), 7,44 (s, 1H), 7,29 (t, J=8,0 Hz, 2H), 7,13 (d, J=7,6 Hz, 2H), 7,09 (d, J=7,2 Hz, 1H), 6,97 (t, J=7,2 Hz, 1H), 6,69 (s, 1H), 5,20 (d, J=6,8 Hz, 1H), 3,74-3,71 (m, 2H), 3,38 (s, 2H), 2,19 (s, 3H), 1,55-1,31 (m, 4H), 1,10-0,98 (m, 4H), 0,75-0,72 (m, 6H). LCMS: (методика A) 490,2 (M+H), Rt. 2,70 мин, 99,89% (максимально). HPLC: (методика B) Rt. 5,69 мин, 99% (максимально).
Примеры 60 и 61
(S)-(Z)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота и (R)-(Z)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота

Два энантиомера рацемической (Z)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловой кислоты (пример 59; 97 мг, 0,20 ммоля) разделяли с помощью хиральной препаративной SFC (методика B); подвижная фаза: CO2: IPA (70:30); длина волны: 220 нм; длительность цикла: 5 мин; противодавление: 100 бар. Вещество концентрировали в вакууме при 40°C. Первая элюирующаяся фракция соответствовала энантиомеру 1 и вторая элюирующаяся фракция соответствовала энантиомеру 2. Абсолютная конфигурация этих двух энантиомеров неизвестна.
Энантиомер 1: Выход: 20% (20 мг, белое твердое вещество).1H NMR (400 MHz, DMSO-d6): δ 12,07 (bs, 1H), 7,43 (s, 1H), 7,29 (t, J=8,4 Hz, 2H), 7,12 (d, J=8,4 Hz, 2H), 6,99 (d, J=7,2 Hz, 1H), 6,97 (t, J=7,2 Hz, 1H), 6,69 (s, 1H), 5,21 (d, J=6,8 Hz, 1H), 3,74-3,71 (m, 2H), 3,38 (s, 2H), 2,19 (s, 3H), 1,54-1,31 (m, 4H), 1,16-0,89 (m, 4H), 0,75-0,72 (m, 6H). LCMS: (методика C) 490,1 (M++H), Rt. 2,78 мин, 98,11% (максимально). HPLC: (методика B) Rt. 5,69 мин, 97,25% (максимально). Хиральная SFC: (методика B) Rt. 8,86 мин, 100% (максимально).
Энантиомер 2: Выход: 18% (18 мг, белое твердое вещество).1H NMR (400 MHz, DMSO-d6): δ 11,92 (bs, 1H), 7,44 (s, 1H), 7,29 (t, J=7,6 Hz, 2H), 7,12 (d, J=7,6 Hz, 2H), 7,05 (d, J=7,2 Hz, 1H), 6,97 (t, J=7,2 Hz, 1H), 6,69 (s, 1H), 5,21 (d, J=6,8 Hz, 1H), 3,74-3,71 (m, 2H), 3,38 (s, 2H), 2,19 (s, 3H), 1,54-1,31 (m, 4H), 1,16-0,89 (m, 4H), 0,75-0,72 (m, 6H). LCMS: (методика C) 490,0 (M++H), Rt. 2,78 мин, 98,21% (максимально). HPLC: (методика B) Rt. 5,69 мин, 96,69% (максимально). Хиральная чистота: (методика B) Rt. 9,84 мин, 98,07% (максимально).
Пример 62
(E)-3-((3-бутил-5-(4-(трет-бутилкарбамоил)фенил)-3-этил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота
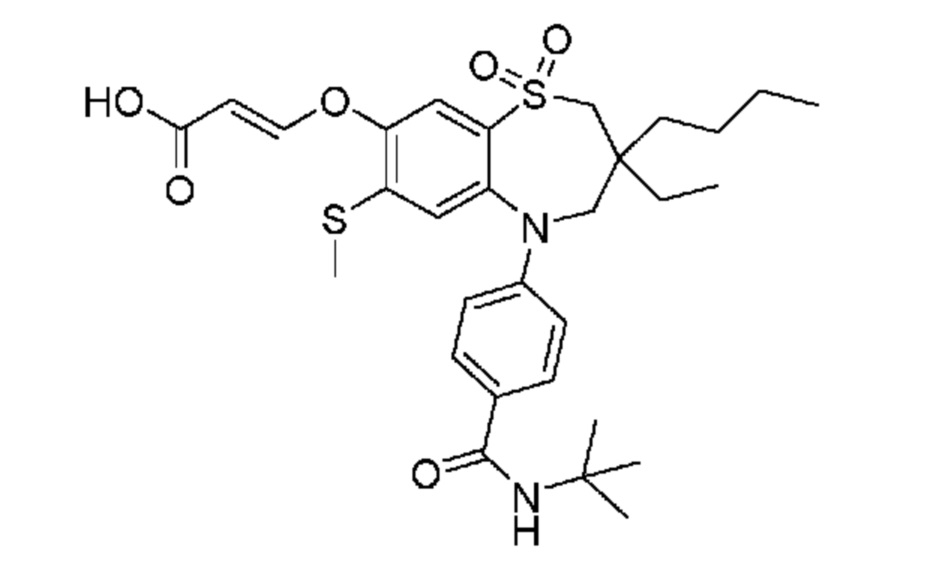
При перемешивании к раствору этил-(E)-3-((3-бутил-5-(4-(трет-бутилкарбамоил)фенил)-3-этил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 99; 50 мг, 0,08 ммоля) в смеси 1,4-диоксана и воды (4:1, 5 мл) добавляли гидроксид лития (6,8 мг, 0,16 ммоля) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и полученный остаток растворяли в охлажденной льдом воде (2 мл). Водный слой экстрагировали с помощью EtOAc (2×5 мл). Объединенный органический слой промывали охлажденной льдом водой (5 мл), рассолом (5 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 10% MeOH/ DCM; силикагель: 230-400 меш) и получали искомое соединение. Выход: 12% (5,9 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,72-7,67 (m, 3H), 7,53 (s, 2H), 6,98-6,94 (m, 3H), 5,51 (d, J=12,0 Hz, 1H), 3,85-3,65 (m, 2H), 3,41 (s, 2H), 2,29 (s, 3H), 1,59-1,49 (m, 2H), 1,36 (s, 9H), 1,33-1,29 (m, 2H), 1,24-1,13 (m, 4H), 0,83-0,79 (m, 6H). LCMS: (методика B) 589,3 (M++H), Rt. 2,11 мин, 95,20% (максимально). HPLC: (методика A) Rt. 5,21 мин, 96,87% (максимально).
Пример 63:
(Z)-3-((7-бром-3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота

При перемешивании к раствору метил-(Z)-3-((7-бром-3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилата (промежуточный продукт 100; 0,55 г, 0,99 ммоля) в смеси 1,4-диоксана и воды (4:1, 5 мл) добавляли гидроксид лития (0,08 г, 1,98 ммоля) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1,5 н., 3 мл, pH~4) и затем разбавляли охлажденной льдом водой (5 мл). Водный слой экстрагировали с помощью EtOAc (2×10 мл) и объединенный органический слой затем промывали водой (8 мл), рассолом (10 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 40-45% EtOAc/ PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 49% (0,26 г, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 13,62 (s, 1H), 7,71 (s, 1H), 7,59 (s, 1H), 7,37-7,33 (m, 2H), 7,31-7,29 (m, 2H), 7,22-7,08 (m, 2H), 3,78 (bs, 2H), 3,43 (s, 2H), 1,38-1,30 (m, 4H), 1,11-1,03 (m, 4H), 0,73 (t, J=6,40 Hz, 6H). LCMS: (методика A) 538,0 (M+- 2H), Rt. 2,84 мин, 98,53% (максимально). HPLC: (методика B) Rt. 6,09 мин, 99,67% (максимально).
Примеры 64 и 65
(R)-(Z)-3-((7-бром-3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота и (S)-(Z)-3-((7-бром-3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота
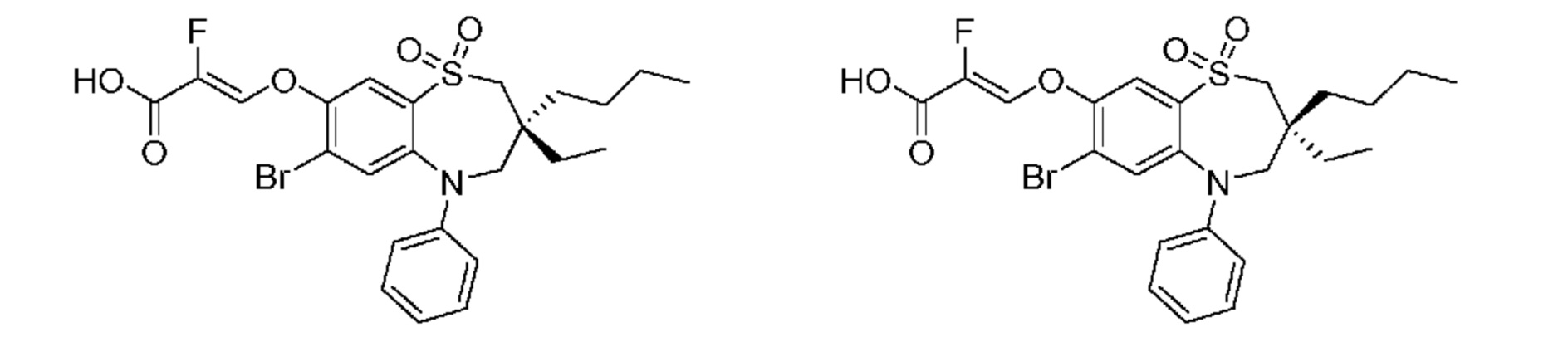
Два энантиомера рацемической (Z)-3-((7-бром-3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловой кислоты (пример 63; 0,24 г, 4,44 ммоля) разделяли с помощью хиральной препаративной SFC (методика F); подвижная фаза: CO2: 0,5% изопропиламина в IPA (70:30); длина волны: 280 нм; длительность цикла: 5 мин; противодавление: 100 бар. Вещество концентрировали в вакууме при 40°C. Первая элюирующаяся фракция соответствовала энантиомеру 1 и вторая элюирующаяся фракция соответствовала энантиомеру 2. Абсолютная конфигурация этих двух энантиомеров неизвестна.
Энантиомер 1: Выход: 14% (34 мг, почти белое твердое вещество).1H NMR (400 MHz, DMSO-d6): δ 13,68 (bs, 1H), 7,69 (s, 1H), 7,56 (d, J=18,8 Hz, 1H), 7,34 (t, J=8,0 Hz, 2H), 7,21 (d, J=7,2 Hz, 2H), 7,08-7,06 (m, 2H), 3,75 (bs, 2H), 3,43 (s, 2H), 1,54-1,45 (m, 1H), 1,41-1,28 (m, 3H), 1,17-0,80 (m, 4H), 0,76-0,64 (m, 6H). LCMS: (методика A) 540,1 (M+), Rt. 2,93 мин, 98,05% (максимально). HPLC: (методика B) Rt. 6,09 мин, 95,88% (максимально). SFC: (методика F) Rt. 6,98 мин, 99,57% (максимально).
Энантиомер 2: Выход: 14% (35 мг, почти белое твердое вещество).1H NMR (400 MHz, DMSO-d6): δ 13,59 (bs, 1H), 7,70 (s, 1H), 7,60 (d, J=18,4 Hz, 1H), 7,37-7,35 (m, 2H), 7,21 (d, J=7,2 Hz, 2H), 7,08-7,04 (m, 2H), 3,76 (bs, 2H), 3,43 (s, 2H), 1,55 -1,53 (m, 1H), 1,42-1,30 (m, 3H), 1,18-0,90 (m, 4H), 0,68-0,78 (m, 6H). LCMS: (методика A) 540,2 (M+), Rt. 2,92 мин, 97,84% (максимально). HPLC: (методика B) Rt. 6,09 мин, 93,15% (максимально). SFC: (методика F) Rt. 8,38 мин, 97,28% (максимально).
Пример 66
(Z)-3-((5-(4-(бензиламино)фенил)-3,3-диэтил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота
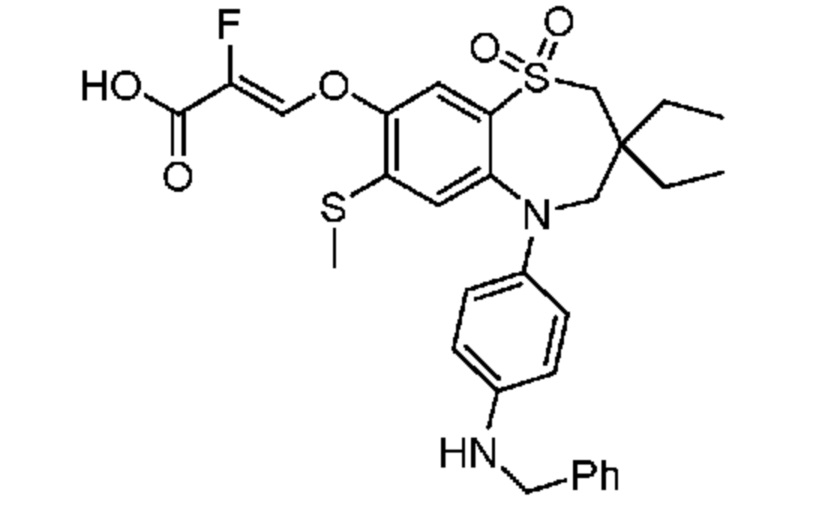
При перемешивании к раствору метил-(Z)-3-((5-(4-аминофенил)-3,3-диэтил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилата (промежуточный продукт 78; 0,02 г, 0,03 ммоля) в смеси 1,4-диоксана и воды (4:1, 5 мл) при комнатной температуре добавляли гидроксид лития (0,01 г, 0,07 ммоля) и смесь перемешивали в течение 1 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли 1,5 н. раствором HCl (3 мл) и разбавляли водой (5 мл). Водный слой экстрагировали с помощью EtOAc (2×10 мл) и объединенный органический слой промывали водой (10 мл), рассолом (10 мл) и затем сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью препаративной HPLC (методика A) и получали искомое соединение. Выход: 17% (3,5 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,43 (s, 1H), 7,37-7,30 (m, 5H), 7,24 (d, J=6,8 Hz, 1H), 7,05 (d, J=8,4 Hz, 2H), 6,63 (d, J=8,4 Hz, 2H), 6,24 (s, 2H), 4,28 (s, 2H), 3,69 (s, 2H), 3,39 (s, 2H), 2,05 (s, 3H), 1,52 (q, J=7,20 Hz, 2H), 1,40 (q, J=7,20 Hz, 2H), 0,64 (t, J=7,20 Hz, 6H). LCMS: (методика A) 585,1 (M++H), Rt. 2,63 мин, 90,29% (максимально). HPLC: (методика B) Rt. 4,33 мин, 93,44% (максимально).
Пример 67
(E)-3-((3,3-дибутил-7-(этилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота
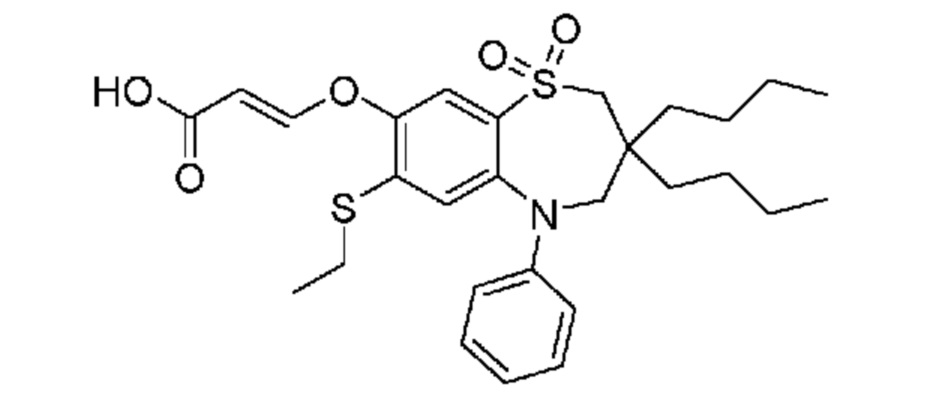
При перемешивании к раствору этил-(E)-3-((3,3-дибутил-7-(этилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 102; 0,23 г, 0,41 ммоля) в смеси 1,4-диоксана и воды (4:1, 5 мл) добавляли гидроксид лития (0,07 г, 1,64 ммоля) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1,5 н., 2 мл) и водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенный органический слой промывали водой (10 мл) и рассолом (10 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью препаративной HPLC (методика A) и получали искомое соединение. Выход: 42% (68 мг, почти белое твердое вещество).
1H-NMR (400 MHz, DMSO-d6): δ 12,24 (s, 1H), 7,68 (d, J=12,2 Hz, 1H), 7,49 (s, 1H), 7,32 (t, J=7,7 Hz, 2H), 7,21 (d, J=7,4 Hz, 2H), 7,03 (t, J=7,2 Hz, 1H), 6,67 (s, 1H), 5,40 (d, J=12,2 Hz, 1H), 3,78 (bs, 2H), 3,40 (s, 2H), 2,69 (q, J=6,92 Hz, 2H), 1,43-1,39 (m, 3H), 1,36-1,13 (m, 12H), 0,86-0,67 (m, 6H). LCMS: (методика A) 532,2 (M++H), Rt. 3,13 мин, 97,39% (максимально). HPLC: (методика A) Rt. 6,07 мин, 96,57% (максимально).
Пример 68
(E)-3-((3,3-дибутил-5-(4-(трет-бутилкарбамоил)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота

При перемешивании к раствору этил-(E)-3-((3,3-дибутил-5-(4-(трет-бутилкарбамоил)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 106; 55 мг, 0,08 ммоля) в смеси 1,4-диоксана и воды (4:1, 5 мл) при комнатной температуре добавляли гидроксид лития (7,17 мг, 0,17 ммоля) и реакционную смесь перемешивали в течение 6 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и полученный остаток подвергали распределению между охлажденной льдом водой (5 мл) и EtOAc (5 мл). Водный слой экстрагировали с помощью EtOAc (2×5 мл). Объединенный органический слой промывали охлажденной льдом водой (5 мл) и рассолом (5 мл) и затем сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 55% EtOAc/PE; силикагель: 230-400 меш). Полученное соединение повторно очищали с помощью препаративной HPLC (методика A) и получали чистое искомое соединение. Выход: 4% (2,1 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,75-7,68 (m, 3H), 7,52 (s, 2H), 6,99-6,92 (m, 3H), 5,51 (d, J=12,4 Hz, 1H), 3,75 (bs, 2H), 3,42 (s, 2H), 2,39 (s, 3H), 1,46-1,57 (m, 2H), 1,36 (s, 9H), 1,22-1,11 (m, 10H), 0,80 (t, J=6,8 Hz, 6H). LCMS: (методика A) 617,3 (M++H), Rt. 2,74 мин, 96,23% (максимально). HPLC: (методика B) Rt. 5,91 мин, 93,46% (максимально).
Пример 69
(E)-3-((3,3-дибутил-5-(4-(изопропилкарбамоил)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота

При перемешивании к раствору этил-(E)-3-((3,3-дибутил-5-(4-(изопропилкарбамоил)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 108; 50 мг, 0,08 ммоля) в смеси 1,4-диоксана и воды (4:1, 5 мл) добавляли гидроксид лития (6,6 мг, 0,16 ммоля) и реакционную смесь перемешивали в течение 2 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и полученный остаток подвергали распределению между охлажденной льдом водой (2 мл) и EtOAc (2 мл). Водный слой экстрагировали с помощью EtOAc (2×5 мл). Объединенный органический слой промывали охлажденной льдом водой (5 мл) и рассолом (5 мл) и затем сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 9% MeOH/DCM; силикагель: 230-400 меш) и получали искомое соединение. Выход: 10% (5 мг, белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 12,28 (bs, 1H), 8,00 (d, J=8,0 Hz, 1H), 7,75-7,72 (m, 3H), 7,53 (s, 1H), 7,03-7,01 (m, 2H), 6,92 (s, 1H), 5,51 (d, J=12,0 Hz, 1H), 4,11-4,06 (m, 1H), 3,78 (bs, 2H), 3,29 (s, 2H), 2,28 (s, 3H), 1,58-1,45 (m, 2H), 1,38-1,25 (m, 2H), 1,18-1,10 (m, 14H), 0,80 (t, J=6,8 Hz, 6H). LCMS: (методика A) 603,2 (M++H), Rt. 2,52 мин, 91,99% (максимально). HPLC: (методика B) Rt. 5,51 мин, 85,91% (максимально).
Пример 70
(Z)-3-((3,3-дибутил-7-(этилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота
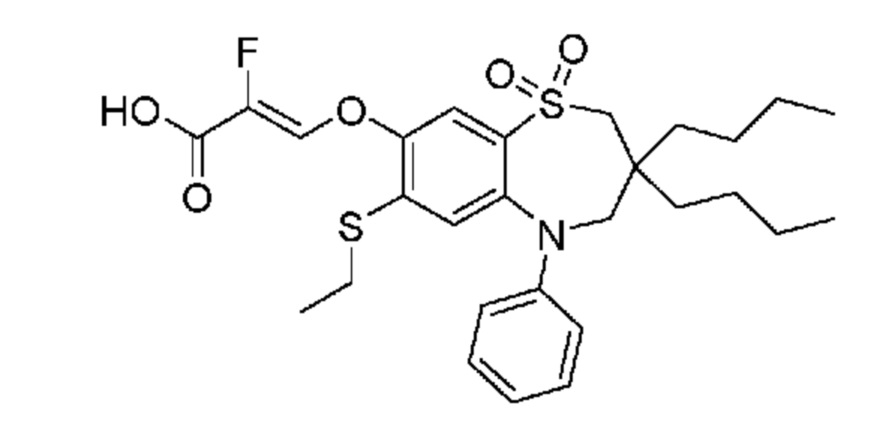
При перемешивании к раствору метил-(Z)-3-((3,3-дибутил-7-(этилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилата (промежуточный продукт 109; 0,36 г, 0,64 ммоля) в смеси 1,4-диоксана и воды (5 мл, 4:1) добавляли гидроксид лития (0,05 г, 1,3 ммоля) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1,5 н., 3 мл) до pH~4 и разбавляли водой (5 мл). Водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенный органический слой промывали водой (8 мл) и рассолом (10 мл) и затем сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 40-45% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 18% (70 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 13,55 (s, 1H), 7,56 (d, J=4,8 Hz, 1H), 7,52 (s, 1H), 7,31 (t, J=8,0 Hz, 2H), 7,18 (d, J=7,6 Hz, 2H), 7,02 (d, J=6,8 Hz, 1H), 6,75 (s, 1H), 3,76 (bs, 2H), 3,37 (s, 2H), 2,71 (q, J=7,2 Hz, 2H), 1,44-1,42 (m, 2H), 1,36-1,30 (m, 2H), 1,18-1,10 (m, 3H), 1,07-1,04 (m, 8H), 0,75 (t, J=6,80 Hz, 6H). LCMS: (методика A) 550,2 (M++1), Rt. 3,19 мин, 97,86% (максимально). HPLC: (методика A) Rt. 6,2 мин, 98,44% (максимально).
Пример 71
(Z)-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-(4-пропионамидофенил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота

При перемешивании к раствору (Z)-3-((5-(4-аминофенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловой кислоты (промежуточный продукт 38; 0,15 г, 0,27 моля) в DCM (5 мл) при 0°C добавляли триэтиламин (0,06 г, 0,54 ммоля), затем пропионилхлорид (0,03 г, 0,32 ммоля) и перемешивание продолжали в течение 1 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь разбавляли с помощью DCM (15 мл) и промывали насыщенным раствором NaHCO3 (10 мл) и рассолом (10 мл). Затем органический слой сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 5% MeOH в DCM; силикагель: 230-400 меш) и получали искомое соединение. Выход: 37% (60 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 9,81 (s, 1H), 7,54 (d, J=8,4 Hz, 2H), 7,42 (s, 1H), 7,30 (d, J=12,0 Hz, 1H),7,13 (d, J=7,6 Hz, 2H), 6,58 (s, 1H), 3,72 (bs, 2H), 3,18 (s, 2H), 2,30 (q, J=7,6 Hz, 2H), 2,16 (s, 3H), 1,43-1,36 (m, 4H), 1,24-1,06 (m, 11H), 0,88-0,65 (m, 6H). LCMS: (методика C) 604,6 (M+-2H), Rt. 2,90 мин, 91,45% (максимально). HPLC: (методика B) Rt. 5,57 мин, 93,38% (максимально).
Пример 72
(Z)-3-((3-бутил-3-этил-7-(этилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота
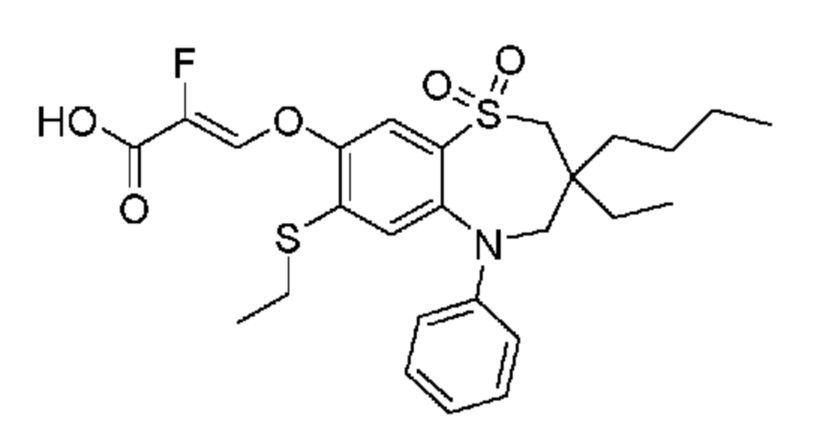
При перемешивании к раствору метил-(Z)-3-((3-бутил-3-этил-7-(этилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилата (промежуточный продукт 111; 0,23 г, 0,42 ммоля) в смеси 1,4-диоксана и воды (4:1, 5 мл) добавляли гидроксид лития (0,04 г, 0,85 ммоля) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1,5 н., 3 мл, pH~4) и разбавляли водой (5 мл). Водный слой экстрагировали с помощью EtOAc (2×10 мл) и объединенный органический слой промывали водой (8 мл) и рассолом (10 мл) и затем сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 35-40% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 30% (0,07 г, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 13,58 (s, 1H), 7,57 (d, J=8,4 Hz, 1H), 7,52 (s, 1H), 7,30 (t, J=8,0 Hz, 2H), 7,15 (d, J=7,6 Hz, 2H), 6,99 (t, J=7,2 Hz, 1H), 6,71 (s, 1H), 3,74 (bs, 2H), 3,37 (s, 2H), 2,75-2,68 (m, 2H), 1,53-1,32 (m, 4H), 1,08-1,01 (m, 7H), 0,74 (t, J=4,80 Hz, 6H). LCMS: (методика A) 522,1 (M++H), Rt. 2,94 мин, 99,01% (максимально). HPLC: (методика A) Rt. 5,74 мин, 95,24% (максимально).
Пример 73
(E)-3-((3-бутил-3-этил-7-(этилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота

При перемешивании к раствору этил-(E)-3-((3-бутил-3-этил-7-(этилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 112; 0,36 г, 0,67 ммоля) в смеси 1,4-диоксана и воды (4:1, 5 мл) добавляли гидроксид лития (0,6 г, 1,35 ммоля) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1,5 н., 2 мл) и водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенный органический слой промывали водой (10 мл) и рассолом (10 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью препаративной HPLC (методика B) и получали искомое соединение. Выход: 54% (180 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 12,25 (s, 1H), 7,68 (d, J=12,0 Hz, 1H), 7,49 (s, 1H), 7,31 (t, J=7,6 Hz, 2H), 7,18 (d, J=7,6 Hz, 2H), 7,01 (t, J=7,2 Hz, 1H), 6,70 (s, 1H), 5,41 (d, J=12,0 Hz, 1H), 3,77 (bs, 2H), 3,39 (s, 2H), 2,70 (q, J=7,20 Hz, 2H), 1,56-1,32 (m, 4H), 1,18-1,03 (m, 7H), 0,73 (t, J=5,20 Hz, 6H). LCMS: (методика A) 504,1 (M++H), Rt. 2,88 мин, 99,31% (максимально). HPLC: (методика B) Rt. 6,02 мин, 96,02% (максимально).
Пример 74
(E)-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-метакриловая кислота

При перемешивании к раствору (E)-3-((3,3-дибутил-2-(4-метоксибензил)-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-метакриловой кислоты (промежуточный продукт 114; 0,2 г, 0,30 ммоля) в сухом DCM (2 мл) добавляли TFA (0,6 мл) и триэтилсилан (0,6 мл) при 0°C и реакционную смесь перемешивали в течение 1 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь разбавляли охлажденной льдом водой (5 мл). Водный слой экстрагировали с помощью EtOAc (2×20 мл). Объединенный органический слой сушили над безводным Na2SO4 и выпаривали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 20% EtOAc/PE; силикагель: 230-400 меш) и полученный продукт дополнительно растирали c диэтиловым эфиром и получали искомое соединение. Выход: 46% (75 мг, белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 12,31 (s, 1H), 7,50 (s, 2H), 7,38-7,32 (m, 3H), 7,29-7,23 (m, 2H), 7,16-7,02 (m, 1H), 6,52 (s, 1H), 4,18-3,71 (bs, 2H), 2,11 (s, 3H), 1,80 (s, 3H), 1,58-1,46 (m, 2H), 1,41-1,35 (m, 2H), 1,29-1,18 (m, 3H), 1,17-1,04 (m, 2H), 1,03-0,92 (m, 3H), 0,74-0,72 (m, 6H). LCMS: (методика E) 533,2 (M++H), Rt. 2,81 мин, 95,34% (максимально). HPLC: (методика B) Rt. 6,39 мин, 95,95% (максимально).
Пример 75
(E)-3-((7-бром-3,3-дибутил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)акриловая кислота
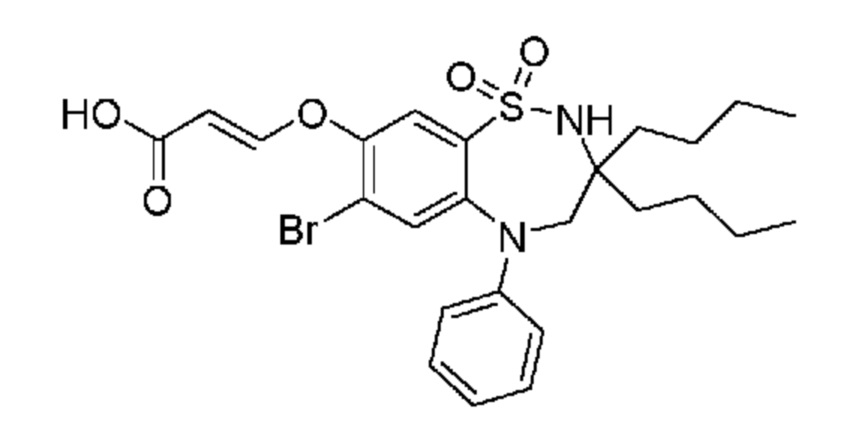
При перемешивании к раствору трет-бутил-(E)-3-((7-бром-3,3-дибутил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)акрилата (промежуточный продукт 116; 0,11 г, 0,18 ммоля) в DCM (5 мл) при 0°C добавляли TFA (2 мл) и реакционную смесь перемешивали в течение 2 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь выливали в охлажденную льдом воду (15 мл) и водный слой экстрагировали с помощью DCM (2×10 мл). Объединенный органический слой промывали водой (10 мл) и рассолом (10 мл) и затем сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 25% EtOAc в гексане; силикагель: 230-400 меш) и получали искомое соединение. Выход: 25% (28 мг, светло-коричневое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 12,23 (s, 1H), 7,76 (s, 1H), 7,68 (d, J=12,0 Hz, 1H), 7,51 (s, 1H), 7,42 (t, J=8,0 Hz, 2H), 7,38-7,29 (m, 2H), 7,17 (t, J=8,0 Hz, 1H), 6,86 (s, 1H), 5,27 (d, J=12,0 Hz, 1H), 4,01 (bs, 2H), 1,60-1,42 (m, 2H), 1,42-1,35 (m, 2H), 1,30-1,11 (m, 2H), 1,00-1,12 (m, 2H), 1,00-0,80 (m, 4H), 0,80-0,60 (m, 6H). LCMS: (методика A) 553,1 (M++2H), Rt. 2,98 мин, 96,92% (максимально). HPLC: (методика B) Rt. 6,28 мин, 98,09% (максимально).
Пример 76
(E)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)акриловая кислота

При перемешивании к раствору трет-бутил-(E)-3-((3-бутил-3-этил-2-(4-метоксибензил)-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)акрилата (промежуточный продукт 129; 0,6 г, 0,9 ммоля) в сухом DCM (5 мл) добавляли TFA (2,5 мл) и триэтилсилан (2,5 мл) при 0°C и реакционную смесь перемешивали в течение 3 ч при комнатной температуре. После завершения реакции (следили с помощью LCMS) реакционную смесь разбавляли охлажденной льдом водой (5 мл) и водный слой экстрагировали с помощью DCM (2×10 мл). Объединенный органический слой сушили над безводным Na2SO4 и выпаривали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 60% EtOAc в гексане; силикагель: 230-400 меш) и получали искомое соединение. Выход: 68% (0,3 г, белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 12,20 (bs, 1H), 7,64 (d, J=12,2 Hz, 1H), 7,54-7,51 (m, 1H), 7,39-7,32 (m, 3H), 7,27-7,21 (m, 2H), 7,11-7,08 (m, 1H), 6,51 (s, 1H), 5,32 (d, J=12,2 Hz, 1H), 4,11-3,97 (m, 2H), 2,10 (s, 3H), 1,63-1,62 (m, 1H), 1,50-1,36 (m, 3H), 1,24-0,93 (m, 4H), 0,86-0,70 (m, 6H). LCMS: (методика A) 491,1 (M++H), Rt. 2,73 мин, 95,09% (максимально). HPLC: (методика B) Rt. 5,66 мин, 94,36% (максимально).
Примеры 77 и 78
(S)-(E)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)акриловая кислота и (R)-(E)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)акриловая кислота

Два энантиомера рацемической (E)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)акриловой кислоты (пример 77; 0,3 г, 0,61 ммоля) разделяли с помощью хиральной препаративной SFC (методика E); подвижная фаза: CO2: 0,5% изопропиламина в метаноле (50:50); длина волны: 210 нм; длительность цикла: 5 мин; противодавление: 100 бар. Вещество концентрировали в вакууме при 40°C. Первая элюирующаяся фракция соответствовала энантиомеру 1 и вторая элюирующаяся фракция соответствовала энантиомеру 2. Абсолютная конфигурация этих двух энантиомеров неизвестна.
Энантиомер 1: Выход: 33,3% (100 мг, почти белое твердое вещество).1H NMR (400 MHz, DMSO-d6): δ 12,21 (bs, 1H), 7,64 (d, J=12,0 Hz, 1H), 7,54-7,51 (m, 1H), 7,36-7,10 (m, 6H), 6,51 (s, 1H), 5,32 (d, J=12,4 Hz, 1H), 4,02-3,87 (m, 2H), 2,10 (s, 3H), 1,63-1,39 (m, 4H), 1,24-0,93 (m, 4H), 0,86-0,70 (m, 6H). LCMS: (методика A) 491,1 (M++H), Rt. 2,71 мин, 96,91% (максимально). HPLC: (методика B) Rt. 5,70 мин, 95,47% (максимально). SFC: (методика E) Rt. 2,03 мин, 96,17% (максимально).
Энантиомер 2: Выход: 34% (110 мг, белое твердое вещество).1H NMR (400 MHz, DMSO-d6): δ 12,21 (bs, 1H), 7,64 (d, J=12,4 Hz, 1H), 7,55-7,51 (m, 1H), 7,39-7,36 (m, 3H), 7,27-7,21 (m, 2H), 7,11-7,08 (m, 1H), 6,51 (s, 1H), 5,32 (d, J=12,4 Hz, 1H), 4,02-3,87 (m, 2H), 2,10 (s, 3H), 1,62-1,38 (m, 4H), 1,24-0,91 (m, 4H), 0,89-0,71 (m, 6H). LCMS: (методика A) 491,2 (M++H), Rt. 2,71 мин, 97,88% (максимально). HPLC: (методика B) Rt. 5,70 мин, 98,57% (максимально). SFC: (методика E) Rt. 2,31 мин, 97,27% (максимально).
Пример 79
(Z)-3-((3,3-дибутил-5-(4-(трет-бутилкарбамоил)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота
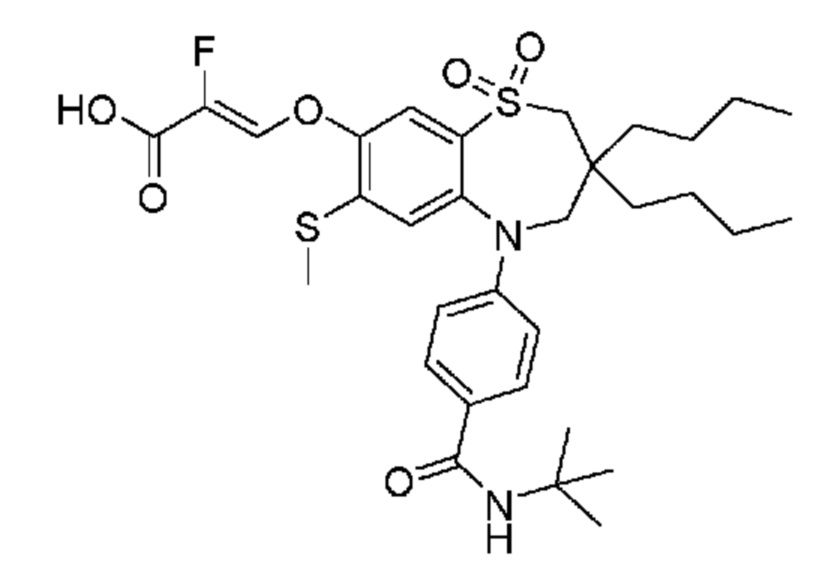
При перемешивании к раствору метил-(Z)-3-((3,3-дибутил-5-(4-(трет-бутилкарбамоил)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилата (промежуточный продукт 130; 90 мг, 0,14 ммоля) в смеси 1,4-диоксана и воды (4:1, 5 мл) добавляли гидроксид лития (11,7 мг, 0,27 ммоля) и смесь перемешивали в течение 2 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и остаток подвергали распределению между охлажденной льдом водой (5 мл) и EtOAc (5 мл). Водный слой экстрагировали с помощью EtOAc (2×5 мл). Объединенный органический слой промывали охлажденной льдом водой (5 мл) и рассолом (5 мл) и затем сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью препаративной HPLC (методика A) и получали искомое соединение. Выход: 13% (11,3 мг, белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,67 (d, J=8,8 Hz, 2H), 7,51-7,47(m, 2H), 7,27-7,23 (m, 1H), 6,94-6,90 (m, 3H), 3,71 (bs, 2H), 3,42 (s, 2H), 2,28 (s, 3H), 1,61-1,58 (m, 2H), 1,36 (s, 9H), 1,31-1,07 (m, 10H), 0,80 (t, J=6,8 Hz, 6H). LCMS: (методика A) 635,2 (M++H), Rt. 2,83 мин, 97,38% (максимально). HPLC: (методика B) Rt. 5,96 мин, 96,71% (максимально).
Пример 80
(E)-3-((3-бутил-7-(диметиламино)-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота

При перемешивании к раствору трет-бутил-(E)-3-((3-бутил-7-(диметиламино)-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 133; 0,11 г, 0,20 ммоля) в DCM (3 мл) добавляли TFA (0,02 г, 2,02 ммоля) при 0°C и реакционную смесь перемешивали в течение 1 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и полученный остаток подвергали распределению между водой (5 мл) и EtOAc (5 мл). Органический слой промывали водой (5 мл) и рассолом (5 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 2-3% MeOH в DCM, силикагель: 230-400 меш) и получали искомое соединение. Выход: 51% (50 мг, почти белое твердое вещество).
1H-NMR (400 MHz, DMSO-d6): δ 7,59 (d, J=12,0 Hz, 1H), 7,39 (s, 1H), 7,28 (t, J=8,0 Hz, 2H), 7,14 (d, J=8,0 Hz, 2H), 6,96 (t, J=7,2 Hz, 1H), 6,29 (s, 1H), 5,41 (d, J=12,4 Hz, 1H), 3,76 (bs, 2H), 3,28 (s, 2H), 2,72 (s, 6H), 1,37-1,30 (m, 4H), 1,24-1,07 (m, 4H), 0,74 (t, J=8,00 Hz, 6H). LCMS: (методика A) 487,2 (M++H), Rt. 2,81 мин, 95,8% (максимально), HPLC: (методика B) Rt. 5,75 мин, 95,33% (максимально).
Пример 81
(E)-3-((3,3-дибутил-7-фтор-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота

При перемешивании к раствору трет-бутил-(E)-3-((3,3-дибутил-7-фтор-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 141; 0,16 г, 0,29 ммоля) в DCM (5 мл) добавляли TFA (0,2 мл, 2,93 ммоля) при 0°C и реакционную смесь перемешивали в течение 3 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и полученный остаток подвергали распределению между EtOAc (10 мл) и водой (10 мл). Органический слой промывали водой (10 мл) и рассолом (10 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью Isolera (элюент: 20% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 55% (78 мг, почти белое твердое вещество).
1H-NMR (400 MHz, DMSO-d6): δ 12,26 (s, 1H), 7,77 (s, 1H), 7,73-7,70 (m, 1H), 7,36 (t, J=8,4 Hz, 2H), 7,29 (d, J=7,6 Hz, 2H), 7,10 (t, J=7,2 Hz, 1H), 6,69 (d, J=12,0 Hz, 1H), 5,41 (d, J=12,0 Hz, 1H), 3,82 (bs, 2H), 3,45 (s, 2H), 1,43-1,28 (m, 4H), 1,13-0,99 (m, 8H), 0,73 (t, J=8,00 Hz, 6H). LCMS: (методика A) 490,2 (M++H), Rt. 3,0 мин, 97,39% (максимально), HPLC: (методика B) Rt. 6,28 мин, 97,94% (максимально).
Пример 82
(E)-3-((3,3-дибутил-7-циано-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота
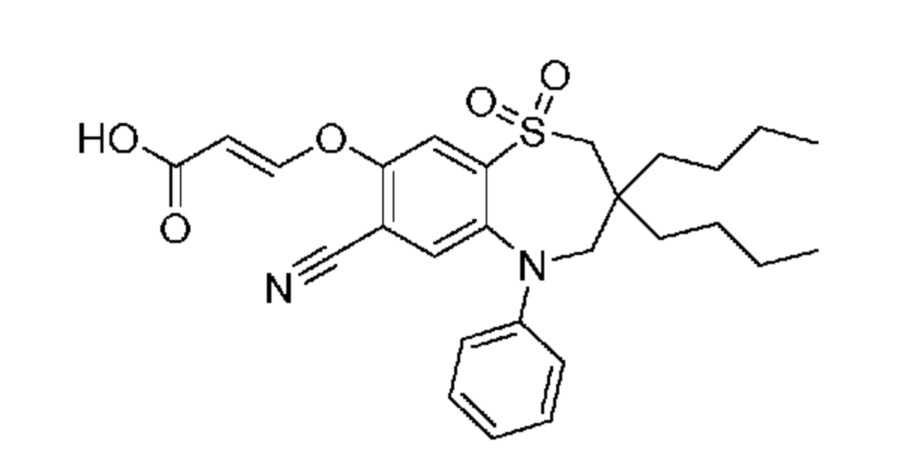
При перемешивании к раствору трет-бутил-(E)-3-((3,3-дибутил-7-циано-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 144; 220 мг, 0,39 ммоля) в DCM (2 мл) при 0°C по каплям добавляли TFA (0,15 мл, 2,0 ммоля) и затем реакционную смесь перемешивали в течение 6 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и остаток подвергали распределению между охлажденной льдом водой (5 мл) и EtOAc (5 мл). Водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенный органический слой промывали охлажденной льдом водой (5 мл) и рассолом (5 мл) и затем сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 35% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 24% (49 мг, желтое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,85 (d, J=12,0 Hz, 1H), 7,75 (s, 1H), 7,36 (t, J=7,2 Hz, 2H), 7,28 (t, J=7,6 Hz, 3H), 7,10 (t, J=7,6 Hz, 1H), 5,62 (d, J=12,4 Hz, 1H), 3,81 (s, 2H), 3,53 (s, 2H), 1,42-1,24 (m, 4H), 1,17-0,99 (m, 8H), 0,74 (t, J=6,4 Hz, 6H). LCMS: (методика A) 497,2 (M++H), Rt. 2,91 мин, 98,47% (максимально). HPLC: (методика B) Rt. 6,17 мин, 98,03% (максимально).
Пример 83
(E)-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)бут-2-еновая кислота

При перемешивании к раствору (E)-3-((3,3-дибутил-2-(4-метоксибензил)-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)бут-2-еновой кислоты (промежуточный продукт 146; 0,15 г, 0,22 ммоля) в сухом DCM (10 мл) при 0°C добавляли TFA (0,4 мл) и триэтилсилан (0,4 мл). Затем реакционную смесь перемешивали в течение 30 мин при комнатной температуре. После завершения реакции (следили с помощью LCMS) реакционную смесь разбавляли охлажденной льдом водой (5 мл) и водный слой экстрагировали с помощью EtOAc (2×20 мл). Объединенный органический слой сушили над безводным Na2SO4и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 14% EtOAc в гексане; силикагель: 230-400 меш) и получали искомое соединение. Выход: 40% (50 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 11,88 (s, 1H), 7,61 (s, 1H), 7,41-7,32 (m, 5H), 7,15-7,13 (m, 1H), 6,48 (s, 1H), 4,65 (s, 1H), 4,01 (s, 2H), 2,38 (s, 3H), 2,05 (s, 3H), 1,60-1,30 (m, 4H), 1,30-1,15 (m, 2H), 1,15-1,05 (m, 2H), 1,05-0,85 (m, 4H), 0,72 (s, 6H). LCMS: (методика A) 533,3 (M++H), Rt. 2,99 мин, 98,60% (максимально). HPLC: (методика B) Rt. 6,36 мин, 98,35% (максимально).
Пример 84
(Z)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакриловая кислота
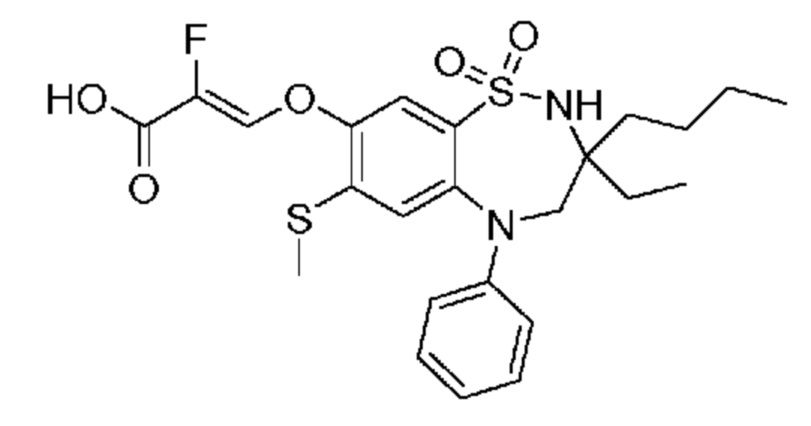
При перемешивании к раствору (Z)-3-((3-бутил-3-этил-2-(4-метоксибензил)-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакриловой кислоты (промежуточный продукт 148; 0,35 г, 0,55 ммоля) в сухом DCM (5 мл) при 0°C добавляли TFA (2,5 мл) и триэтилсилан (2,5 мл). Затем реакционную смесь перемешивали в течение 3 ч при комнатной температуре. После завершения реакции (следили с помощью LCMS) реакционную смесь разбавляли охлажденной льдом водой (10 мл) и водный слой экстрагировали с помощью DCM (2×10 мл). Объединенный органический слой сушили над безводным Na2SO4 и выпаривали в вакууме. Полученное неочищенное вещество очищали с помощью препаративной HPLC (методика D) и получали искомое соединение. Выход: 35% (100 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 13,49 (bs, 1H), 7,52-7,34 (m, 5H), 7,32-7,22 (m, 2H), 7,09-7,08 (m, 1H), 6,52 (s, 1H), 4,15-3,62 (m, 2H), 2,12 (s, 3H), 1,63-1,36 (m, 4H), 1,24-1,06 (m, 4H), 0,93-0,71 (m, 6H). LCMS: (методика A) 509,2 (M++H), Rt. 2,72 мин, 98,96% (максимально). HPLC: (методика B) Rt. 5,77 мин, 99,77% (максимально).
Примеры 85 и 86
(S)-(Z)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакриловая кислота и (R)-(Z)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакриловая кислота
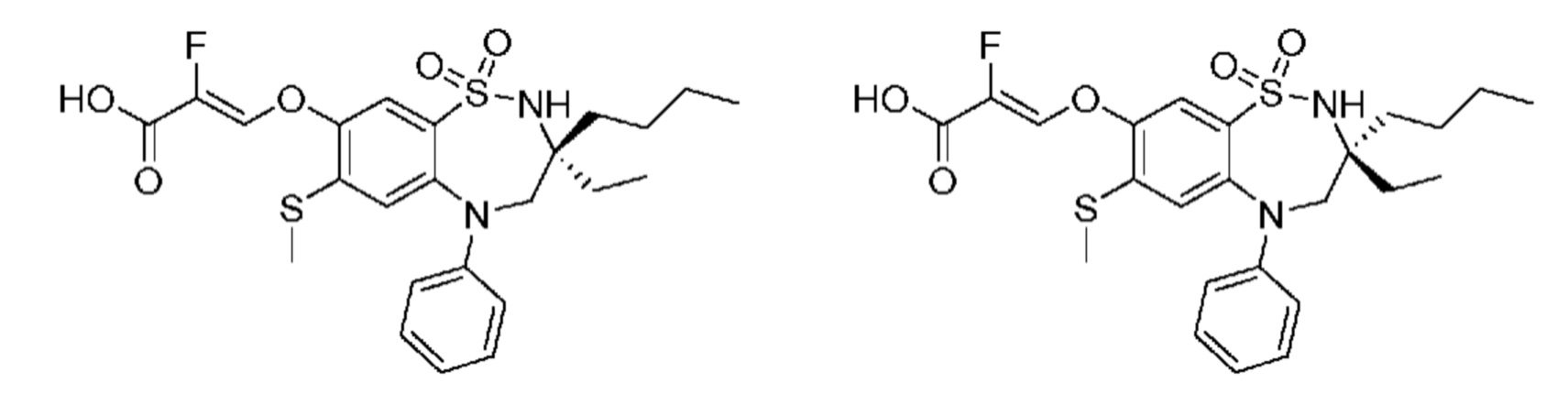
Два энантиомера рацемической (Z)-3-((3-бутил-3-этил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакриловой кислоты (пример 84; 0,08 г, 0,16 ммоля) разделяли с помощью хиральной препаративной SFC; подвижная фаза: CO2: 0,5% изопропиламина в метаноле (70:30); колонка: YMC Cellulose-SC; Скорость потока: 3 мл/мин; длина волны: 210 нм; длительность цикла: 7 мин; противодавление: 100 бар. Вещество концентрировали в вакууме при 40°C. Первая элюирующаяся фракция соответствовала энантиомеру 1 и вторая элюирующаяся фракция соответствовала энантиомеру 2. Абсолютная конфигурация этих двух энантиомеров неизвестна.
Энантиомер 1: Выход: 25% (20 мг, почти белое твердое вещество).1H NMR (400 MHz, DMSO-d6): δ 13,58 (bs, 1H), 7,57-7,31 (m, 5H), 7,32-7,22 (m, 2H), 7,15-7,14 (m, 1H), 6,58 (s, 1H), 4,04-3,82 (m, 2H), 2,18 (s, 3H), 1,69-1,42 (m, 4H), 1,30-1,13 (m, 4H), 0,94-0,71 (m, 6H). LCMS: (методика A) 509,1 (M++H), Rt. 2,74 мин, 98,86% (максимально). HPLC: (методика B) Rt. 5,77 мин, 98,84% (максимально). SFC: (методика F) Rt. 5,25 мин, 100% (максимально).
Энантиомер 2: Выход: 25% (20 мг, бледно-коричневое твердое вещество).1H NMR (400 MHz, DMSO-d6): δ 13,50 (bs, 1H), 7,57-7,43 (m, 3H), 7,36 (t, J=7,2 Hz, 2H), 7,39-7,18 (m, 2H), 7,09-7,07 (m, 1H), 6,52 (s, 1H), 4,04-3,82 (m, 2H), 2,11 (s, 3H), 1,62-1,36 (m, 4H), 1,24-1,06 (m, 4H), 0,94-0,71 (m, 6H). LCMS: (методика A) 509,2 (M++H), Rt. 2,72 мин, 98,97% (максимально). HPLC: (методика B) Rt. 5,77 мин, 99,50% (максимально). SFC: (методика F) Rt. 5,93 мин, 95,00% (максимально).
Пример 87
(E)-3-((7-бром-3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)акриловая кислота

При перемешивании к раствору трет-бутил-(E)-3-((7-бром-3-бутил-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)акрилата (промежуточный продукт 150; 0,2 г, 0,34 ммоля) в сухом DCM (5 мл) добавляли TFA (2 мл) при 0°C и реакционную смесь перемешивали в течение 2 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 28% EtOAc в гексане; силикагель: 230-400 меш) и получали искомое соединение. Выход: 81% (148 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 12,23 (s, 1H), 7,74 (bs, 1H), 7,68 (d, J=6,80 Hz, 1H), 7,51 (s, 1H), 7,41 (t, J=7,6 Hz, 2H), 7,31 (d, J=7,2 Hz, 2H), 7,16 (t, J=7,2 Hz, 1H), 6,85 (bs, 1H), 5,26 (d, J=12,4 Hz, 1H), 4,03 (bs, 2H), 1,60-1,55 (m, 1H), 1,54-1,35 (m, 3H), 1,29-0,98 (m, 2H), 0,95-0,81 (m, 2H), 0,75-0,61(m, 6H). LCMS: (методика A) 525,2 (M++2H), Rt. 2,76 мин, 90,66% (максимально). HPLC: (методика B) Rt. 5,77 мин, 90,61% (максимально).
Пример 88
(E)-3-((3-бутил-3-этил-2-метил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)акриловая кислота
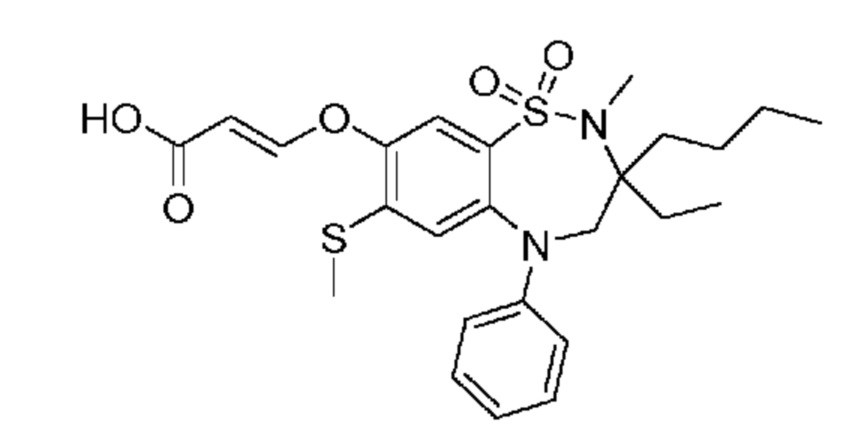
При перемешивании к раствору трет-бутил-(E)-3-((3-бутил-3-этил-2-метил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)акрилата (промежуточный продукт 153; 190 мг, 0,33 ммоля) в сухом DCM (3 мл) добавляли TFA (2 мл) при 0°C и реакционную смесь перемешивали в течение 2 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и разбавляли охлажденной льдом водой (10 мл). Водный слой экстрагировали с помощью EtOAc (2×10 мл) и объединенный органический слой сушили над безводным Na2SO4. Органическую часть выпаривали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 20% EtOAc в гексане; силикагель: 230-400 меш) и получали искомое соединение. Выход: 80% (148 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO- d6): δ 12,22 (s, 1H), 7,66 (d, J=12,2 Hz, 1H), 7,40-7,36 (m, 3H), 7,30 (d, J=7,4 Hz, 2H), 7,12 (t, J=7,2 Hz, 1H), 6,49 (s, 1H), 5,39 (d, J=12,2 Hz, 1H), 4,12 (bs, 2H), 2,88 (s, 3H), 2,10 (s, 3H), 1,90-1,87 (m, 2H), 1,52-1,49 (m, 2H), 1,16-0,90 (m, 4H), 0,82-0,61 (m, 6H). LCMS: (методика A) 504,9 (M+), Rt. 2,91 мин, 97,98% (максимально). HPLC: (методика B) Rt. 6,01 мин, 97,03% (максимально).
Примеры 89 и 90
(S)-(E)-3-((3-бутил-3-этил-2-метил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)акриловая кислота и (R)-(E)-3-((3-бутил-3-этил-2-метил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-tetrahydro1,2,5-бензотиадиазепин-8-ил)окси)акриловая кислота

Два энантиомера рацемической (E)-3-((3-бутил-3-этил-2-метил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)акриловой кислоты (пример 88; 0,14 г, 0,27 ммоля) разделяли с помощью хиральной препаративной SFC (методика F); подвижная фаза: CO2: 0,5% изопропиламина в метаноле; длина волны: 280 нм; длительность цикла: 5 мин; противодавление: 100 бар. Вещество концентрировали в вакууме при 40°C. Первая элюирующаяся фракция соответствовала энантиомеру 1 и вторая элюирующаяся фракция соответствовала энантиомеру 2. Абсолютная конфигурация этих двух энантиомеров неизвестна.
Энантиомер 1: Выход: 28% (40 мг, белое твердое вещество).1H NMR (400 MHz, DMSO- d6): δ 12,20 (bs, 1H), 7,66 (d, J=12,4 Hz, 1H), 7,40-7,36 (m, 5H), 7,12 (t, J=7,2 Hz, 1H), 6,49 (s, 1H), 5,39 (d, J=12,0 Hz, 1H), 4,12 (bs, 2H), 2,88 (s, 3H), 2,09 (s, 3H), 1,91-1,87 (m, 1H), 1,79-1,72 (m, 1H), 1,56-1,50 (m, 2H), 1,24-1,05 (m, 4H), 0,76-0,70 (m, 6H). LCMS: (методика A) 505,2 (M++H), Rt. 2,89 мин, 97,38% (максимально). HPLC: (методика B) Rt. 5,99 мин, 98,97% (максимально). SFC: (методика E) Rt. 2,77 мин, 100% (максимально).
Энантиомер 2: Выход: 28% (40 мг, белое твердое вещество).1H NMR (400 MHz, DMSO- d6): δ 12,19 (bs, 1H), 7,65 (d, J=12,0 Hz, 1H), 7,38 (t, J=8,0 Hz, 3H), 7,29 (d, J=7,6 Hz, 2H), 7,11 (t, J=7,2 Hz, 1H), 6,48 (s, 1H), 5,38 (d, J=12,4 Hz, 1H), 4,06 (s, 2H), 2,87 (s, 3H), 2,09 (s, 3H), 1,91-1,86 (m, 1H), 1,78-1,76 (m, 1H), 1,55-1,52 (m, 2H), 1,46-0,90 (m, 4H), 0,81-0,62 (m, 6H), LCMS: (методика E) 505,1 (M++H), Rt. 2,69 мин, 97,32% (максимально). HPLC: (методика B) Rt. 5,99 мин, 97,57% (максимально). SFC: (методика E) Rt. 3,06 мин, 93,78% (максимально).
Пример 91
(E)-3-((3-бутил-3-этил-7-(метиламино)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота

При перемешивании к раствору трет-бутил-(E)-3-((3-бутил-3-этил-7-(метиламино)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 156; 0,18 г, 0,33 ммоля) в DCM (5 мл) добавляли TFA (0,04 г, 3,31 ммоля) при 0°C и реакционную смесь перемешивали в течение 1 ч при комнатной температуре. После завершения реакции (следили с помощью TLC)реакционную смесь концентрировали в вакууме и остаток подвергали распределению между EtOAc (5 мл) и водой (5 мл). Органический слой промывали водой (10 мл) и рассолом (10 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 2-3% MeOH в DCM; силикагель: 230-400 меш) и получали искомое соединение. Выход: 58% (90 мг, почти белое твердое вещество).
1H-NMR (400 MHz, DMSO-d6): δ 12,15 (s, 1H), 7,64 (d, J=12,0 Hz, 1H), 7,32 (s, 1H), 7,25 (t, J=8,0 Hz, 2H), 7,08 (d, J=7,6 Hz, 2H), 6,90 (t, J=7,2 Hz, 1H), 6,30 (d, J=4,8 Hz, 1H), 6,01 (s, 1H), 5,34 (d, J=12,4 Hz, 1H), 3,69 (bs, 2H), 3,18 (s, 2H), 2,67 (s, 3H), 1,54-1,41 (m, 2H), 1,37-1,30 (m, 2H), 1,11-1,00 (m, 4H), 0,75 (t, J=8,00 Hz, 6H). LCMS: (методика A) 473,3 (M++H), Rt. 2,67 мин, 98,1% (максимально). HPLC: (методика B) Rt. 5,59 мин, 97,1% (максимально).
Примеры 92 и 93
(S)-(E)-3-((3-бутил-3-этил-7-(метиламино)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота и (R)-(E)-3-((3-бутил-3-этил-7-(метиламино)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота
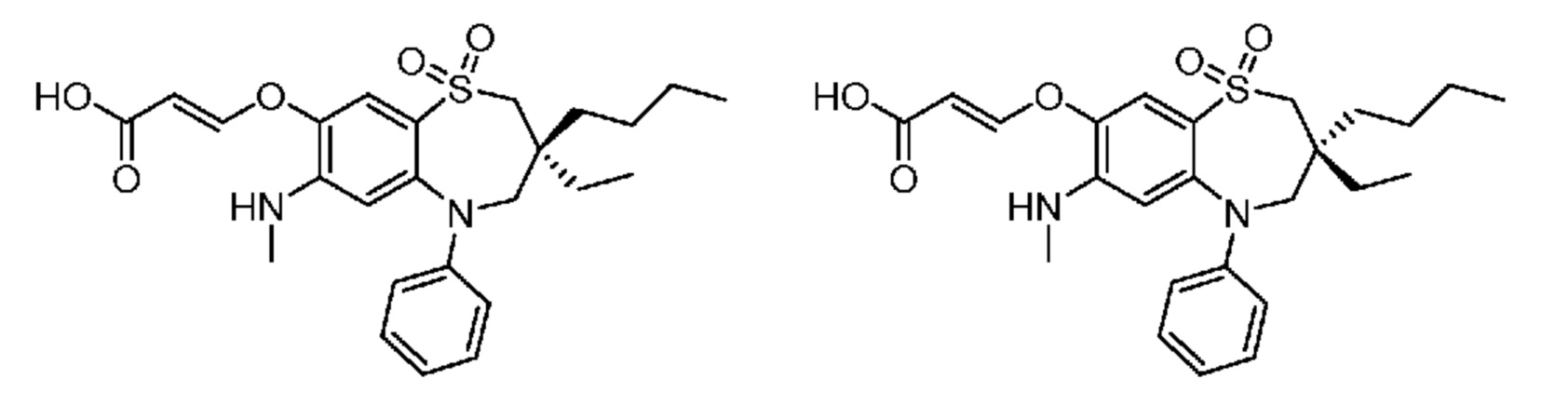
Два энантиомера рацемической (E)-3-((3-бутил-3-этил-7-(метиламино)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловой кислоты (пример 91; 80 мг, 0,16 ммоля) разделяли с помощью хиральной препаративной SFC (методика E); длина волны: 220 нм; длительность цикла: 5 мин; противодавление: 100 бар. Вещество концентрировали в вакууме при 40°C. Первая элюирующаяся фракция соответствовала энантиомеру 1 и вторая элюирующаяся фракция соответствовала энантиомеру 2. Абсолютная конфигурация этих двух энантиомеров неизвестна.
Энантиомер 1: Выход: 11% (10 мг, белое твердое вещество).1H NMR (400 MHz, DMSO-d6): δ 7,38 (d, J=12,0 Hz, 1H), 7,26 (s, 1H), 7,23 (t, J=8,4 Hz, 2H), 7,05 (d, J=7,2 Hz, 2H), 6,88 (t, J=7,2 Hz, 1H), 6,23 (d, J=4,8 Hz, 1H), 6,01 (s, 1H), 5,37 (d, J=12,0 Hz, 1H), 3,67 (bs, 2H), 3,19 (s, 2H), 2,51 (s, 3H), 1,52-1,32 (m, 2H), 1,30-1,01 (m, 6H), 0,73 (t, J=8,00 Hz, 6H). LCMS: (методика A) 473,3 (M++H), Rt. 2,67 мин, 95,41% (максимально). HPLC: (методика B) Rt. 5,60 мин, 97,83% (максимально). Хиральная SFC: (методика D) Rt. 2,95 мин, 95,67% (максимально).
Энантиомер 2: Выход: 18% (15 мг, белое твердое вещество).1H NMR (400 MHz, DMSO-d6): δ 7,39 (d, J=12,0 Hz, 1H), 7,26 (s, 1H), 7,23 (t, J=8,4 Hz, 2H), 7,05 (d, J=7,6 Hz, 2H), 6,88 (t, J=7,2 Hz, 1H), 6,23 (d, J=4,8 Hz, 1H), 6,01 (s, 1H), 5,37 (d, J=12,0 Hz, 1H), 3,71 (bs, 2H), 3,18 (s, 2H), 2,67 (s, 3H), 1,52-1,35 (m, 2H), 1,30-1,08 (m, 6H), 0,73 (t, J=8,00 Hz, 6H). LCMS: (методика A) 473,2 (M++H), Rt. 2,69 мин, 91,43% (максимально). HPLC: (методика B) Rt. 5,6 мин, 96,86% (максимально). Хиральная SFC: (методика D) Rt. 3,77 мин, 95,82% (максимально).
Пример 94
(Z)-3-((5-(4-бромфенил)-3,3-дибутил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота

При перемешивании к раствору (Z)-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловой кислоты (пример 11; 100 мг, 0,18 ммоля) в DMF (5 мл) при 0°C добавляли N-бромсукцинимид (35,5 мг, 0,2 ммоля) и реакционную смесь перемешивали в течение 1 ч при 0°C. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и полученный остаток подвергали распределению между охлажденной льдом водой (5 мл) и EtOAc (5 мл). Водный слой экстрагировали с помощью EtOAc (2×5 мл). Объединенный органический слой промывали охлажденной льдом водой (5 мл) и рассолом (5 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 60% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 52% (60 мг, коричневое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 13,47 (bs, 1H), 7,62 (s, 1H), 7,57 (s, 1H), 7,40 (d, J=9,2 Hz, 2H), 7,01-6,99 (m, 2H), 6,84 (s, 1H), 3,48 (bs, 2H), 3,32 (s, 2H), 2,28 (s, 3H), 1,55-1,39 (m, 2H), 1,47-1,21 (m, 2H), 1,20-1,04 (m, 8H), 0,79 (t, J=6,8 Hz, 6H). LCMS: (методика E) 616,0 (M++2H), Rt,2,92 мин, 96,99% (максимально). HPLC: (методика B) Rt. 6,61 мин, 97,49% (максимально).
Пример 95
(Z)-3-((3,3-дибутил-5-(4-гидроксифенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота
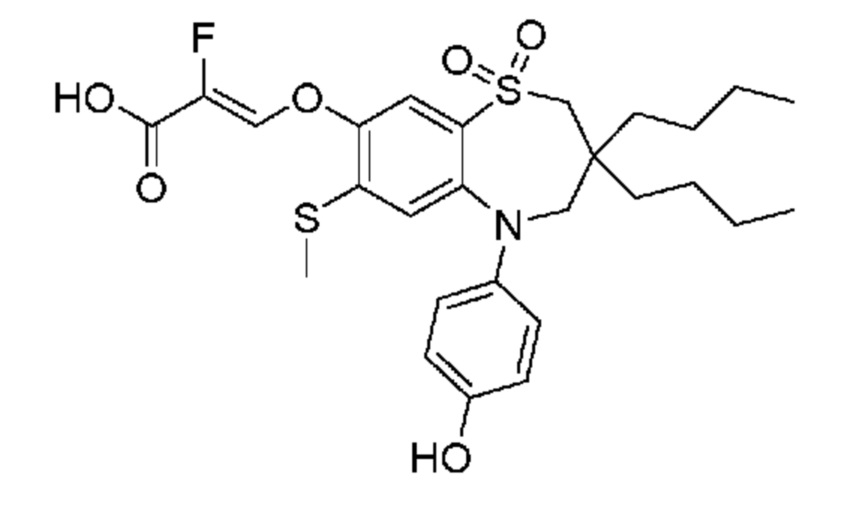
При перемешивании к раствору этил-(Z)-3-((3,3-дибутил-5-(4-гидроксифенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилата (промежуточный продукт 159; 0,51 г, 0,88 ммоля) в смеси 1,4-диоксана и воды (4:1, 10 мл) при комнатной температуре добавляли гидроксид лития (74 мг, 1,75 ммоля) и реакционную смесь перемешивали в течение 30 мин при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и полученный остаток подвергали распределению между охлажденной льдом водой (10 мл) и EtOAc (10 мл). Водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенный органический слой промывали охлажденной льдом водой (10 мл) и рассолом (10 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 8% MeOH/DCM; силикагель: 230-400 меш) и получали искомое соединение. Выход: 42% (235 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 9,37 (s, 1H), 7,47 (s, 1H), 7,42 (d, J=18,8 Hz, 1H), 7,14 (d, J=8,0 Hz, 2H), 6,77 (d, J=8,8 Hz, 2H), 6,34 (s, 1H), 3,71 (s, 2H), 3,39 (s, 2H), 2,09 (s, 3H), 1,42-1,35 (m, 4H), 1,11-1,07 (m, 4H), 1,04-0,97 (m, 4H), 0,76-0,74 (m, 6H). LCMS: (методика A) 552,1 (M++H), Rt. 2,58 мин, 97,48% (максимально). HPLC: (методика B) Rt. 5,52 мин, 97,70% (максимально).
Пример 96
(Z)-3-((3-бутил-3-этил-7-фтор-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота
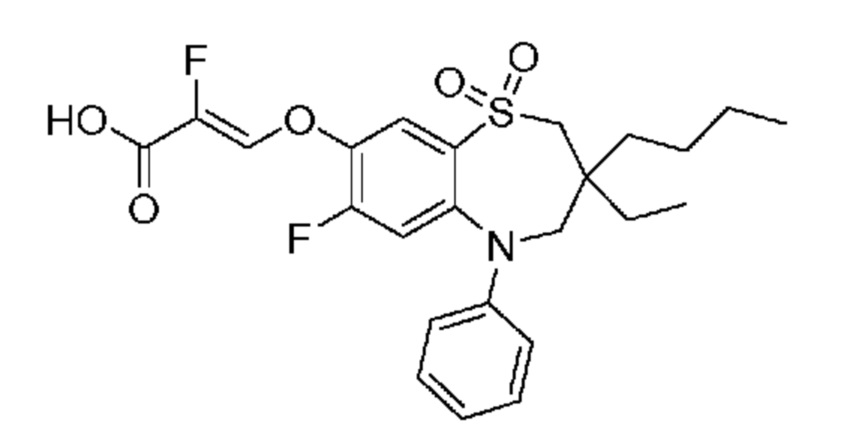
При перемешивании к раствору метил-(Z)-3-((3-бутил-3-этил-7-фтор-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилата (промежуточный продукт 167; 0,12 г, 0,24 ммоля) в смеси 1,4-диоксана и воды (4:1, 5 мл) добавляли гидроксид лития (0,05 г, 1,22 ммоля) и реакционную смесь перемешивали в течение 4 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1,5 н., 3 мл, pH~4) и разбавляли охлажденной льдом водой (5 мл). Водный слой экстрагировали с помощью EtOAc (2×10 мл). Объединенный органический слой промывали водой (5 мл) и рассолом (5 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 18-20% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 43% (50 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,78 (d, J=8,80 Hz, 1H), 7,57 (d, J=18,00 Hz, 1H), 7,32-7,30 (m, 2H), 7,18-7,16 (m, 2H), 7,07 (t, J=7,20 Hz, 1H), 6,75 (d, J=12,00 Hz, 1H), 3,78 (d, J=6,40 Hz, 2H), 3,38 (m, 2H), 1,24-1,20 (m, 4H), 1,06-1,05 (m, 4H), 0,84-0,60 (m, 6H). LCMS: (методика E) 480,1 (M++H), Rt. 2,61 мин, 99,74% (максимально). HPLC: (методика B) Rt. 5,84 мин, 98,24% (максимально).
Пример 97
(Z)-3-((3,3-дибутил-7-(диметиламино)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакриловая кислота

При перемешивании к раствору (Z)-3-((3,3-дибутил-7-(диметиламино)-2-(4-метоксибензил)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакриловой кислоты (промежуточный продукт 171; 0,02 г, 0,27 ммоля) в сухом DCM (2 мл) добавляли трифторуксусную кислоту (1 мл) и триэтилсилан (1 мл) при 0°C и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и полученный остаток подвергали распределению между EtOAc (5 мл) и водой (5 мл). Водный слой экстрагировали с помощью EtOAc (2×10 мл) и объединенный органический слой сушили над безводным Na2SO4 и выпаривали в вакууме. Полученное неочищенное вещество очищали с помощью препаративной HPLC (методика A) и получали искомое соединение. Выход: 11% (17 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 13,42 (s, 1H), 7,37-7,35 (m, 3H), 7,33-7,30 (m, 2H), 7,26 (d, J=9,6 Hz, 2H), 7,07 (s, 1H), 6,15 (s, 1H), 4,05 (bs, 2H), 2,59 (s, 6H), 1,51-1,36 (m, 4H), 1,33-1,19 (m, 4H), 1,09-0,95 (m, 4H), 0,72 (t, J=8,00 Hz, 6H). LCMS: (методика E) 534,2 (M++H), Rt. 2,75 мин, 99,62% (максимально). HPLC: (методика B) Rt. 6,12 мин, 98,21% (максимально).
Пример 98
(Z)-3-((3-бутил-3-этил-2-метил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакриловая кислота

При перемешивании к раствору этил-(Z)-3-((3-бутил-3-этил-2-метил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакрилата (промежуточный продукт 172; 0,39 г, 0,70 ммоля) в смеси THF и воды (10 мл, 4:1) добавляли гидроксид лития (89 мг, 2,12 ммоля) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1,5 н., 3 мл, pH~4) и разбавляли водой (10 мл). Водный слой экстрагировали с помощью EtOAc (2×20 мл). Объединенный органический слой промывали водой (10 мл) и рассолом (10 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью препаративной HPLC (методика D) и получали искомое соединение. Выход: 35% (130 мг, белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,50 (d, J=18,4 Hz, 1H), 7,43 (s, 1H), 7,36 (t, J=7,6 Hz, 2H), 7,25 (d, J=6,8 Hz, 2H), 7,09 (s, 1H), 6,51 (s, 1H), 4,08 (bs, 2H), 2,85 (s, 3H), 2,12 (s, 3H), 1,91-1,76 (m, 2H), 1,55-1,47 (m, 2H), 1,24-0,90 (m, 4H), 0,77-0,71 (m, 6H). LCMS: (методика A) 523,2 (M++H), Rt. 2,90 мин, 99,26% (максимально). HPLC: (методика B) Rt. 6,07 мин, 99,61% (максимально)
Примеры 99 и 100
(S)-(Z)-3-((3-бутил-3-этил-2-метил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакриловая кислота и (R)-(Z)-3-((3-бутил-3-этил-2-метил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакриловая кислота
Два энантиомера рацемической (Z)-3-((3-бутил-3-этил-2-метил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакриловой кислоты (пример 98; 0,13 г, 0,25 ммоля) разделяли с помощью хиральной препаративной SFC (методика F); длина волны: 280 нм; длительность цикла: 5 мин; противодавление: 100 бар. Вещество концентрировали в вакууме при 40°C. Первая элюирующаяся фракция соответствовала энантиомеру 1 и вторая элюирующаяся фракция соответствовала энантиомеру 2. Абсолютная конфигурация этих двух энантиомеров неизвестна.
Энантиомер 1: Выход: 38% (50 мг, почти белое твердое вещество).1H NMR (400 MHz, DMSO-d6): δ 13,5 (bs, 1H), 7,53 (d, J=18,4 Hz, 1H), 7,49 (s, 1H), 7,36 (t, J=7,6 Hz, 2H), 7,25 (d, J=7,6 Hz, 2H), 7,09 (t, J=7,2 Hz, 1H), 6,51 (s, 1H), 4,08 (bs, 2H), 2,85 (s, 3H), 2,15 (s, 3H), 1,90-1,78 (m, 2H), 1,56-1,47 (m, 2H), 1,25-0,90 (m, 4H), 0,77-0,71 (m, 6H). LCMS: (методика E) 523,1 (M++H), Rt. 2,72 мин, 98,30% (максимально). HPLC: (методика B) Rt. 6,07 мин, 97,89% (максимально). SFC: (методика H) Rt. 5,71 мин, 99,46% (максимально).
Энантиомер 2: Выход: 40% (52 мг, почти белое твердое вещество).1HNMR (400 MHz, DMSO-d6): δ 7,50-7,35 (m, 4H), 7,25 (d, J=6,8 Hz, 2H), 7,09 (t, J=6,8 Hz, 1H), 6,51 (s, 1H), 4,08 (s, 2H), 2,85 (s, 3H), 2,12 (s, 3H), 1,91-1,76 (m, 2H), 1,55-1,49 (m, 2H), 1,26-1,23 (m, 1H), 1,18-1,07 (m, 2H), 0,96-0,81 (m, 1H), 0,77-0,73 (m, 6H). LCMS: (методика E) 523,1 (M++H), Rt. 2,72 мин, 98,06% (максимально). HPLC: (методика B) Rt. 6,07 мин, 97,19% (максимально). SFC: (методика H) Rt. 6,7 мин, 98,20% (максимально).
Пример 101
(E)-3-((3-бутил-3-этил-7-фтор-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота

При перемешивании к раствору трет-бутил-(E)-3-((3-бутил-3-этил-7-фтор-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акрилата (промежуточный продукт 173; 0,5 г, 0,97 ммоля) в DCM (3 мл) при 0°C по каплям добавляли TFA (3 мл ) и перемешивали в течение 5 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 14-15% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 90% (400 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 12,26 (s, 1H), 7,74 (t, J=9,20 Hz, 2H), 7,36 (t, J=7,20 Hz, 2H), 7,27 (d, J=6,80 Hz, 2H), 7,09 (t, J=7,20 Hz, 1H), 5,43 (d, J=12,40 Hz, 1H), 6,72 (d, J=12,80 Hz, 1H), 3,80 (d, J=14,80 Hz, 2H), 3,45 (s, 2H), 1,29-1,32 (m, 4H), 0,95-0,97 (m, 4H), 0,69-0,71 (m, 6H). LCMS: (методика E) 462,1 (M++H), Rt. 2,59 мин, 96,24% (максимально). HPLC: (методика B) Rt. 5,73 мин, 97,13% (максимально).
Примеры 102 и 103
(R)-(E)-3-((3-бутил-3-этил-7-фтор-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота и (S)-(E)-3-((3-бутил-3-этил-7-фтор-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловая кислота
Два энантиомера рацемической (E)-3-((3-бутил-3-этил-7-фтор-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)акриловой кислоты (пример 101; 0,40 г, 0,87 ммоля разделяли с помощью хиральной препаративной SFC (методика E); длина волны: 280 нм; длительность цикла: 5 мин; противодавление: 100 бар. Вещество концентрировали в вакууме при 40°C. Первая элюирующаяся фракция соответствовала энантиомеру 1 и вторая элюирующаяся фракция соответствовала энантиомеру 2. Абсолютная конфигурация этих двух энантиомеров неизвестна.
Энантиомер 1: Выход: 26% (85 мг, почти белое твердое вещество).1H NMR (400 MHz, DMSO-d6): δ 7,69 (d, J=8,80 Hz, 1H), 7,63 (d, J=12,40 Hz, 1H), 7,35 (t, J=7,20 Hz, 2H), 7,25-7,27 (m, 2H), 7,08 (t, J=7,20 Hz, 1H), 6,73 (d, J=12,80 Hz, 1H), 5,43 (d, J=12,40 Hz, 1H), 3,44 (s, 2H), 3,35 (s, 2H), 1,36-1,38 (m, 1H), 1,31-1,32 (m, 3H), 1,10-1,11 (m, 4H), 0,69-0,71 (m, 6H). LCMS: (методика E) 462,1 (M++H), Rt. 2,61 мин, 95,03% (максимально). HPLC: (методика B) Rt. 5,73 мин, 97,89% (максимально). SFC: (методика D) Rt. 3,47 мин, 99,44% (максимально).
Энантиомер 2: Выход: 30% (160 мг, почти белое твердое вещество).1HNMR (400 MHz, DMSO-d6): δ 7,64 (d, J=8,80 Hz, 1H), 7,46 (d, J=12,40 Hz, 1H), 7,34 (t, J=7,60 Hz, 2H), 7,24 (d, J=7,60 Hz, 2H), 7,06 (t, J=7,20 Hz, 1H), 6,74 (d, J=12,00 Hz, 1H), 5,41 (d, J=12,00 Hz, 1H), 3,79 (s, 2H), 3,34 (s, 2H), 1,41-1,53 (m, 1H), 1,31-1,32 (m, 3H), 0,99-1,02 (m, 4H), 0,71-0,73 (m, 6H). LCMS: (методика E) 462,1 (M++H), Rt. 2,61 мин, 95,27% (максимально). HPLC: (методика B) Rt. 5,73 мин, 96,74% (максимально). SFC: (методика D) Rt. 4,04 мин, 95,44% (максимально).
Пример 104
(Z)-3-((3,3-дибутил-5-(4-(диметилкарбамоил)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота
При перемешивании к раствору этил-(Z)-3-((3,3-дибутил-5-(4-(диметилкарбамоил)фенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилата (промежуточный продукт 175; 450 мг, 0,7 ммоля) в смеси 1,4-диоксана и воды (4:1, 5 мл) добавляли гидроксид лития (59,5 мг, 0,16 ммоля) и реакционную смесь перемешивали в течение 3 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь концентрировали в вакууме и полученный остаток подвергали распределению между охлажденной льдом водой (10 мл) и EtOAc (10 мл). Водный слой экстрагировали с помощью EtOAc (2×15 мл). Объединенный органический слой промывали охлажденной льдом водой (15 мл) и рассолом (15 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 18% MeOH/DCM; силикагель: 230-400 меш). Полученное соединение повторно очищали с помощью препаративной HPLC (методика A) и получали искомое соединение. Выход: 3% (7 мг, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,50 (s, 1H), 7,43-7,33 (m, 1H), 7,30 (d, J=8,4 Hz, 2H), 7,03-7,01 (m, 2H), 6,87 (s, 1H), 3,92 (bs, 2H), 3,35 (s, 2H), 2,94 (s, 6H), 2,27 (s, 3H), 1,44-1,29 (m, 4H), 1,23-1,03 (m, 8H), 0,77 (t, J=6,4 Hz, 6H). LCMS: (методика A) 607,3 (M++H), Rt. 2,50 мин, 95,26% (максимально). HPLC: (методика E) Rt. 5,38 мин, 97,77% (максимально).
Пример 105
(Z)-3-((3,3-дибутил-2-метил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакриловая кислота
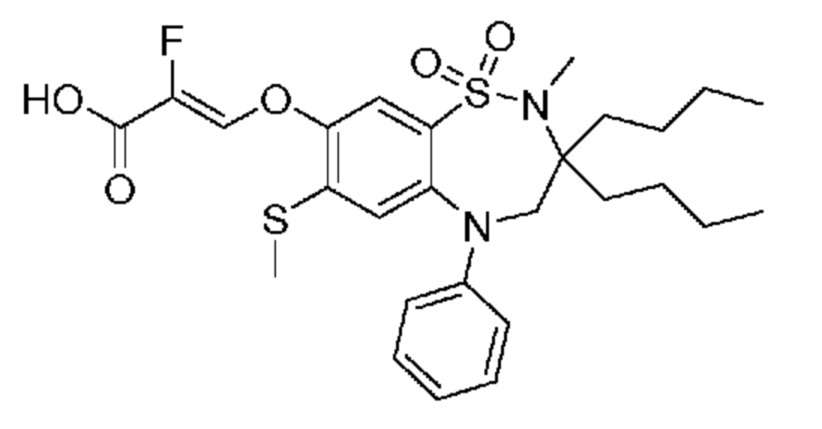
При перемешивании к раствору этил-(Z)-3-((3,3-дибутил-2-метил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакрилата (промежуточный продукт 178; 0,5 г, 0,86 ммоля) в смеси THF и воды (10 мл, 4:1) добавляли гидроксид лития (108 мг, 2,57 ммоля) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1,5 н., 3 мл, pH~4) и разбавляли водой (10 мл). Водный слой экстрагировали с помощью EtOAc (2×20 мл) и объединенный органический слой промывали водой (10 мл) и рассолом (10 мл). Органическую часть сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью колоночной хроматографии Isolera (элюент: 55% EtOAc/PE; силикагель: 230-400 меш) и получали искомое соединение. Выход: 36% (0,17 г, белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 13,46 (bs, 1H), 7,53 (d, J=18,8 Hz, 1H), 7,44 (s, 1H), 7,39-7,35 (m, 2H), 7,28 (d, J=7,6 Hz, 2H), 7,11 (t, J=7,2 Hz, 1H), 6,49 (s, 1H), 4,12 (bs, 2H), 2,87 (s, 3H), 2,11 (s, 3H), 1,82-1,77 (m, 2H), 1,51-1,45 (m, 2H), 1,24-0,95 (m, 8H), 0,76-0,74 (m, 6H). LCMS: (методика E) 551,2 (M++H), Rt. 2,88 мин, 97,46% (максимально). HPLC: (методика B) Rt. 6,55 мин, 97,54% (максимально).
Пример 106
(Z)-3-((7-бром-3-бутил-3-этил-2-метил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакриловая кислота

При перемешивании к раствору этил-(Z)-3-((7-бром-3-бутил-3-этил-2-метил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-8-ил)окси)-2-фторакрилата (промежуточный продукт 181; 0,15 г, 0,25 ммоля) в смеси 1,4-диоксана и воды (5 мл, 4:1) добавляли гидроксид лития (32 мг, 0,77 ммоля) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1,5 н.,1,5 мл, pH~4) и разбавляли водой (15 мл). Водный слой экстрагировали с помощью EtOAc (2×15 мл) и объединенный органический слой промывали водой (10 мл) и рассолом (10 мл). Органическую часть сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью препаративной HPLC (методика D) и получали искомое соединение. Выход: 42% (60 мг, белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,57 (s, 1H), 7,46-7,29 (m, 5H), 7,16 (d, J=6,4 Hz, 1H), 6,88 (s, 1H), 4,12 (bs, 2H), 2,89 (s, 3H), 1,88-1,75 (m, 2H), 1,54-1,48 (m, 2H), 1,17-1,13 (m, 2H), 1,07-0,96 (m, 2H), 0,87-0,85 (m, 6H). LCMS: (методика E) 555,0 (M+), Rt. 2,73 мин, 98,87% (максимально). HPLC: (методика B) Rt. 6,67 мин, 99,69% (максимально)
Пример 107
(Z)-3-((3,3-дибутил-5-(3,4-дифторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота
При перемешивании к раствору этил-(Z)-3-((3,3-дибутил-5-(3,4-дифторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилата (промежуточный продукт 187; 0,05 г, 0,083 ммоля) в смеси 1,4-диоксана и воды (4:1, 5 мл) добавляли гидроксид лития (0,01 г, 0,25 ммоля) и реакционную смесь перемешивали в течение 4 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1,5 н., 3 мл, pH~4) и разбавляли охлажденной льдом водой (5 мл). Водный слой экстрагировали с помощью EtOAc (2×5 мл) и объединенный органический слой промывали водой (5 мл) и рассолом (5 мл). Органическую часть сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью препаративной HPLC и получали чистое искомое соединение. Выход: 32% (0,015 г, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 13,63 (bs, 1H), 7,59-7,54 (m, 2H), 7,34-7,24 (m, 2H), 6,81-6,78 (m, 2H), 3,76 (s, 2H), 3,35 (s, 2H), 2,28 (s, 3H), 1,35-1,33 (m, 4H), 1,23-1,13 (m, 8H), 0,79-0,76 (m, 6H). LCMS: (методика A) 572,1 (M++H), Rt. 2,98 мин, 95,80% (максимально). HPLC: (методика B) Rt. 6,36 мин, 98,43% (максимально).
Пример 108
(Z)-3-((3-бутил-7-(диметиламино)-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота

При перемешивании к раствору этил-(Z)-3-((3-бутил-7-(диметиламино)-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакрилата (промежуточный продукт 188; 0,07 г, 0,13 ммоля) в смеси 1,4-диоксана и воды (4:1, 5 мл) добавляли гидроксид лития (0,02 г, 0,39 ммоля) и реакционную смесь перемешивали в течение 2 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1,5 н., 3 мл, pH~4) и разбавляли охлажденной льдом водой (5 мл). Водный слой экстрагировали с помощью EtOAc (2×10 мл) и объединенный органический слой промывали водой (8 мл) и рассолом (10 мл). Органическую часть сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали с помощью препаративной HPLC (методика A). Выход: 39% (0,026 г, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,39 (s, 1H), 7,26 (t, J=7,2 Hz, 2H), 7,09 (d, J=7,6 Hz, 2H), 7,03 (s, 1H), 6,92 (t, J=7,2 Hz, 1H), 6,31 (s, 1H), 3,70 (bs, 2H), 3,26 (s, 2H), 2,70 (s, 6H), 1,54-1,51 (m, 1H), 1,42-1,30 (m, 3H), 1,24-1,01 (m, 4H), 0,77-0,75 (m, 6H). LCMS: (методика A) 505,1 (M++ H), Rt. 2,88 мин, 99,93% (максимально). HPLC: (методика B) Rt. 5,88 мин, 98,74% (максимально).
Примеры 109 и 110
(S)-(Z)-3-((3-бутил-7-(диметиламино)-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота и (R)-(Z)-3-((3-бутил-7-(диметиламино)-3-этил-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фторакриловая кислота

При перемешивании к раствору энантиомера 1 промежуточного продукта 189 (0,13 г, 0,24 ммоля) в смеси 1,4-диоксана и воды (4:1, 5 мл) добавляли гидроксид лития (0,021 г, 0,48 ммоля) и реакционную смесь перемешивали в течение 1 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1,5 н., 3 мл, pH~4) и разбавляли охлажденной льдом водой (10 мл). Водный слой экстрагировали с помощью EtOAc (2×15 мл) и объединенный органический слой промывали водой (8 мл) и рассолом (10 мл). Органическую часть сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное вещество растирали с Et2O и концентрировали в вакууме и получали искомое соединение. Абсолютная конфигурация энантиомера неизвестна. Выход: 39% (0,026 г, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,39 (s, 1H), 7,25 (t, J=7,6 Hz, 2H), 7,09 (d, J=7,6 Hz, 3H), 6,91 (t, J=6,8 Hz, 1H), 6,31 (s, 1H), 3,69 (bs, 2H), 3,26 (s, 2H), 2,70 (s, 6H), 1,52-1,41 (m, 1H), 1,40-1,30 (m, 3H), 1,24-1,02 (m, 4H), 0,75 (t, J=6,40 Hz, 6H). LCMS: (методика A) 505,2 (M++ H), Rt. 2,84 мин, 99,51% (максимально). HPLC: (методика B) Rt. 5,87 мин, 98,75% (максимально). SFC: (методика F) Rt. 8,93 мин, 100% (максимально).
При перемешивании к раствору энантиомера 2 промежуточного продукта 189 (0,15 г, 0,28 ммоля) в смеси 1,4-диоксана и воды (4:1, 5 мл) добавляли гидроксид лития (0,024 г, 0,56 ммоля) и реакционную смесь перемешивали в течение 2 ч при комнатной температуре. После завершения реакции (следили с помощью TLC) реакционную смесь подкисляли разбавленной HCl (1,5 н., 3 мл, pH~4) и разбавляли охлажденной льдом водой (10 мл). Водный слой экстрагировали с помощью EtOAc (2×15 мл). Объединенный органический слой промывали водой (8 мл) и рассолом (10 мл) и затем сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное вещество растирали с Et2O и получали искомое соединение. Абсолютная конфигурация энантиомера неизвестна. Выход: 39% (0,026 г, почти белое твердое вещество).
1H NMR (400 MHz, DMSO-d6): δ 7,40 (s, 1H), 7,26 (t, J=7,6 Hz, 2H), 7,15 (s, 1H), 7,09 (d, J=7,6 Hz, 2H), 6,92 (t, J=6,8 Hz, 1H), 6,31 (s, 1H), 3,69 (bs, 2H), 3,26 (s, 2H), 2,69 (s, 6H), 1,51-1,49 (m, 1H), 1,35-1,32 (m, 3H), 1,21-1,11 (m, 4H), 0,73 (t, J=7,20 Hz, 6H). LCMS: (методика A) 505,2 (M++ H), Rt. 2,85 мин, 96,20% (максимально). HPLC: (методика B) Rt. 5,87 мин, 99,29% (максимально). SFC: (методика F) Rt. 9,62 мин, 98,93% (максимально).
БИОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ
Протокол анализа ASBT (h/m)
10000 клеток (клеток человека или мыши, сверхэкспрессирующих ASBT) высевали в 96-луночный планшет (Corning CLS3809) в 200 мкл среды MEM-alpha (Gibco 12571-063) с добавлением 10% FBS (Gibco 10438026), содержащей пуромицин (Gibco A1113803) (10 мкг/мл) и инкубировали при 37°C в 5% CO2 в течение 48 ч. После инкубации среды декантировали из лунок и клетки дважды промывали с помощью 300 мкл основной среды MEM-alpha (не содержащей FBS). Каждый раз после декантации основной среды MEM-alpha планшеты постукивали по бумажному полотенцу для обеспечения максимального удаления оставшихся сред.
Разведения исследуемых ингибиторов (в исследовании наибольшая концентрация равнялась 10 мкМ, 3-кратное серийное разведение, 10 образцов), приготовленные в DMSO (Sigma D2650), добавляли в смесь для инкубации (поддерживая равную 0,2% конечную концентрацию DMSO), содержащую 0,25 мкМ 3H-таурохолиновой кислоты (ARC ART-1368) и 5 мкМ холодной таурохолиновой кислоты (Sigma T4009). Затем в лунки добавляли 50 мкл смеси для инкубации, содержащей исследуемые ингибиторы (повторяли дважды), и планшеты инкубировали в течение 20 мин в инкубаторе с CO2 при 37°C. После инкубации реакцию останавливали, помещая планшеты в смесь воды со льдом на 2-3 мин, и затем смесь для инкубации полностью отсасывали из лунок. Лунки дважды промывали с помощью 250 мкл холодной немеченой 1 мМ таурохолиновой кислоты, растворенной в забуференной посредством HEPES (Gibco 15630080) (10 мМ) HBSS (Gibco 14175079) (pH 7,4). Планшеты постукивали по бумажному полотенцу после каждой промывки для обеспечения максимального удаления блокирующего буфера.
100 мкл MicroScint-20 (PerkinElmer 6013621) добавляли в лунки и выдерживали в течение ночи при комнатной температуре и затем считывали на счетчике сцинтилляции и люминесценции для микропланшетов фирмы PerkinElmer по протоколу исследования 3H (при установке на считывание в течение 120 с на лунку).
Протокол анализа LBAT (h/m)
20000 клеток (клеток человека или мыши, сверхэкспрессирующих LBAT) высевали в 96-луночный планшет (Corning CLS3809) в 100 мкл среды MEM-alpha (Gibco 12571-063) с добавлением 10% FBS (Gibco 10438026), содержащей генетицин (Gibco 10131-027) (1 мг/мл), и инкубировали при 37°C в 5% CO2 в течение 24 ч. После инкубации среды декантировали из лунок и клетки дважды промывали с помощью 300 мкл основной среды MEM-alpha (не содержащей FBS). Каждый раз после декантации основной среды MEM-alpha планшеты постукивали по бумажному полотенцу для обеспечения максимального удаления оставшихся сред.
Для LBAT человека смесь для инкубации готовили путем добавления разведений исследуемых ингибиторов (3-кратное серийное разведение в DMSO (Sigma D2650), 10 образцов) в MEM-alpha (без FBS), содержащей 0,3 мкМ 3H-таурохолиновой кислоты (ARC ART-1368) и 7,5 мкМ холодной таурохолиновой кислоты (Sigma T4009) (поддерживая равную 0,2% конечную концентрацию DMSO). Для LBAT мыши смесь для инкубации готовили путем добавления разведений исследуемых ингибиторов (3-кратное серийное разведение в DMSO, 10 образцов) в MEM-alpha (без FBS), содержащей 0,3 мкМ 3H-таурохолиновой кислоты и 25 мкМ холодной таурохолиновой кислоты (поддерживая равную 0,2% конечную концентрацию DMSO).
Затем в лунки добавляли 50 мкл смеси для инкубации, содержащей исследуемые ингибиторы (повторяли дважды), и планшеты инкубировали в течение 20 мин в инкубаторе с CO2 при 37°C. После инкубации реакцию останавливали, помещая планшеты в смесь воды со льдом на 2-3 мин, и затем смесь для инкубации полностью отсасывали из лунок. Лунки дважды промывали с помощью 250 мкл холодной немеченой 1 мМ таурохолиновой кислоты, растворенной в забуференной посредством HEPES (Gibco 15630080) (10 мМ) HBSS (Gibco 14175079) (pH 7,4). Планшеты постукивали по бумажному полотенцу после каждой промывки для обеспечения максимального удаления блокирующего буфера.
100 мкл MicroScint-20 (PerkinElmer 6013621) добавляли в лунки и выдерживали в течение ночи при комнатной температуре и затем считывали на счетчике сцинтилляции и люминесценции для микропланшетов фирмы PerkinElmer по протоколу исследования 3H (при установке на считывание в течение 120 с на лунку при нормальной ориентации планшета).
Протокол анализа на основе HepaRG
Замороженный сосуд с дифференцированными клетками HepaRG (Biopredic International HPR116080) размораживали в среде HepaRG Thawing/Plating/General Purpose (Biopredic International ADD670C) с добавлением 200 мМ Glutamax (Gibco 35050061) по протоколу, предоставленному фирмой Biopredic International. 70000 Клеток на лунку высевали в 96-луночный планшет (Corning CLS3809) в 100 мкл среды HepaRG Thawing/Plating/General Purpose с добавлением 200 мМ Glutamax и инкубировали при 37°C в 5% CO2 в течение 24 ч. После инкубации среду для высевания заменяли на среду HepaRG Maintenance/Metabolism (Biopredic International ADD620C) и инкубировали в течение 6 дней, пополняя свежей средой HepaRG Maintenance/Metabolism каждые 48 ч. После 7 дней инкубации после высевания среду для инкубации декантировали из клеток и клетки дважды промывали с помощью 250 мкл основной среды Вильямса E (Gibco 12551032). После каждого декантирования основной среды Вильямса E планшеты постукивали по бумажному полотенцу для обеспечения максимального удаления оставшихся сред.
Смесь для инкубации готовили путем добавления разведений исследуемых ингибиторов (3-кратное серийное разведение в DMSO (Sigma D2650)) в среде Вильямса E William's E (основной), содержащей 0,3 мкМ 3H-таурохолиновой кислоты (ARC ART-1368) и 7,5 мкМ холодной таурохолиновой кислоты (Sigma T4009) (поддерживая равную 0,2% конечную концентрацию DMSO). Затем в лунки добавляли 50 мкл смеси для инкубации, содержащей исследуемые ингибиторы (повторяли дважды), и планшеты инкубировали в течение 30 мин в инкубаторе с 5% CO2 при 37°C. После инкубации реакцию останавливали, помещая планшеты в смесь воды со льдом на 2-3 мин, и затем смесь для инкубации полностью отсасывали из лунок. Лунки дважды промывали с помощью 250 мкл холодной немеченой 1 мМ таурохолиновой кислоты, растворенной в забуференной посредством HEPES (Gibco 15630080) (10mM) HBSS (Gibco 14175079) (pH 7,4). Планшеты постукивали по бумажному полотенцу после каждой промывки для обеспечения максимального удаления блокирующего буфера.
100 мкл MicroScint-20 (PerkinElmer 6013621) добавляли в лунки и выдерживали в течение ночи при комнатной температуре и затем считывали на счетчике сцинтилляции и люминесценции для микропланшетов фирмы PerkinElmer по протоколу исследования 3H (при установке на считывание в течение 120 с на лунку при нормальной ориентации планшета).
Приготовление разведений исследуемого соединения
Все исследуемые соединения предоставляли в порошкообразной форме при комнатной температуре. Готовили исходные растворы исследуемых соединений в 10 мМ DMSO, отбирали аликвоты и хранили при -20°C. Из исходных растворов соединений в 10 мМ DMSO готовили 3-кратное серийное разведение в DMSO и получали всего 10 разведений исследуемых соединений. Для приготовления смеси для инкубации 0,5 мкл этого разведения в DMSO добавляли к 250 мкл не содержащей FBS базовой среды, содержащей 3H-таурохолиновую кислоту и холодную таурохолиновую кислоту.
Исследования биодоступности
Использовали мышей C57BL/6 в возрасте 8-9 недель. Для каждого исследуемого соединения использовали две группы по 3 животных. Животным одной группы внутривенно вводили одну дозу в 1 мг/кг (разбавитель 100% DMSO) через хвостовую вену и животным второй группы перорально вводили одну дозу в 10 мг/кг с помощью иглы для искусственного питания. Животные группы, которым дозу вводили перорально, голодали в течение ночи. Пробы крови брали через 0,083, 0,25, 0,5, 1, 2, 4, 6, 8 и 24 ч после внутривенного введения и через 0,25, 0,5, 1, 2, 4, 6, 8 и 24 ч после перорального введения. Пробы крови брали из подкожной вены папы. 0,2% EDTA использовали в качестве антикоагулянта. Пробы анализировали по биоаналитическим методикам для научных исследований, разработанным для определения исследуемого соединения в плазме с использованием системы LC-MS/MS.
Результаты
Биологические данные для соединений примеров приведены ниже в таблице 7.
Таблица 7
Модель PD: Исследование влияния исследуемого соединения на полное содержание желчных кислот у самцов мышей C57BL6.
Мышей C57BL/6N Tac в возрасте 8-9 недель использовали для исследования влияния модуляторов желчных кислот на содержание желчных кислот. После завершения карантина и периода акклиматизации животных рандомизировали на x экспериментальных групп на основании массы тела: (i) с введением разбавителя в качестве контроля и (ii) с пероральным введением исследуемого соединения по y мг/кг один раз в сутки. Животных лечили исследуемым соединением в течение 7 дней. В день 5 исследования животных по отдельности помещали в чистые клетки. В день 7 из каждой клетки собирали фекалии, затем у каждого животного ретробульбарным путем брали кровь. Животных умерщвляли для отбора у каждого животного печени и терминального отдела подвздошной кишки для анализа. Два раза в неделю определяли массу тела и потребление корма. Профили липидов сыворотки анализировали в образцах сыворотки в день 7. Полное содержание желчных кислот в сыворотке определяли в образцах сыворотки в день 7. Выведение желчи с фекалиями определяли в образцах фекалий в день 7. Экспрессию CYP7A1 и SHP в печени количественно определяли в образцах печени в день 7. Содержание триглицеридов и общего холестерина определяли в образцах печени в день 7.
Модель желчных кислот в моче: Исследование влияния исследуемых соединений на содержание желчных кислот в моче самцов мышей C57BL/6N.
Мышей C57BL/6N Tac в возрасте 8-9 недель использовали для исследования влияния модуляторов желчных кислот на содержание желчных кислот. После завершения карантина и периода акклиматизации животных рандомизировали на x экспериментальных групп на основании массы тела: (i) с введением разбавителя в качестве контроля и (ii) с пероральным введением исследуемого соединения по y мг/кг один раз в сутки. Животных лечили исследуемым соединением в течение 7 дней. В день 6 исследования животных переводили в клетку для исследования метаболизма. В день 7 из каждой клетки исследования метаболизма собирали фекалии и мочу, затем у каждого животного ретробульбарным путем брали кровь. Животных умерщвляли для отбора у каждого животного почек для анализа. Два раза в неделю определяли массу тела. Полное содержание желчных кислот в сыворотке определяли в образцах сыворотки в день 7. Выведение желчи с фекалиями определяли в образцах фекалий в день 7. Выведение желчных кислот с мочой определяли в образцах в день 7. Экспрессию ASBT, OSTa, OSTAb и MRP2 в почках количественно определяли в образцах в день 7.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ALBIREO AB
<120> БЕНЗОТИА(ДИ)АЗЕПИНЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ ЖЕЛЧНЫХ КИСЛОТ
<130> NP0376WO
<150> IN201811021016
<151> 2018-06-05
<150> SE 1850915-8
<151> 2018-07-18
<150> IN201911000892
<151> 2019-01-08
<160> 4
<170> PatentIn version 3.5
<210> 1
<211> 1251
<212> PRT
<213> Homo sapiens
<400> 1
Met Ser Thr Glu Arg Asp Ser Glu Thr Thr Phe Asp Glu Asp Ser Gln
1 5 10 15
Pro Asn Asp Glu Val Val Pro Tyr Ser Asp Asp Glu Thr Glu Asp Glu
20 25 30
Leu Asp Asp Gln Gly Ser Ala Val Glu Pro Glu Gln Asn Arg Val Asn
35 40 45
Arg Glu Ala Glu Glu Asn Arg Glu Pro Phe Arg Lys Glu Cys Thr Trp
50 55 60
Gln Val Lys Ala Asn Asp Arg Lys Tyr His Glu Gln Pro His Phe Met
65 70 75 80
Asn Thr Lys Phe Leu Cys Ile Lys Glu Ser Lys Tyr Ala Asn Asn Ala
85 90 95
Ile Lys Thr Tyr Lys Tyr Asn Ala Phe Thr Phe Ile Pro Met Asn Leu
100 105 110
Phe Glu Gln Phe Lys Arg Ala Ala Asn Leu Tyr Phe Leu Ala Leu Leu
115 120 125
Ile Leu Gln Ala Val Pro Gln Ile Ser Thr Leu Ala Trp Tyr Thr Thr
130 135 140
Leu Val Pro Leu Leu Val Val Leu Gly Val Thr Ala Ile Lys Asp Leu
145 150 155 160
Val Asp Asp Val Ala Arg His Lys Met Asp Lys Glu Ile Asn Asn Arg
165 170 175
Thr Cys Glu Val Ile Lys Asp Gly Arg Phe Lys Val Ala Lys Trp Lys
180 185 190
Glu Ile Gln Val Gly Asp Val Ile Arg Leu Lys Lys Asn Asp Phe Val
195 200 205
Pro Ala Asp Ile Leu Leu Leu Ser Ser Ser Glu Pro Asn Ser Leu Cys
210 215 220
Tyr Val Glu Thr Ala Glu Leu Asp Gly Glu Thr Asn Leu Lys Phe Lys
225 230 235 240
Met Ser Leu Glu Ile Thr Asp Gln Tyr Leu Gln Arg Glu Asp Thr Leu
245 250 255
Ala Thr Phe Asp Gly Phe Ile Glu Cys Glu Glu Pro Asn Asn Arg Leu
260 265 270
Asp Lys Phe Thr Gly Thr Leu Phe Trp Arg Asn Thr Ser Phe Pro Leu
275 280 285
Asp Ala Asp Lys Ile Leu Leu Arg Gly Cys Val Ile Arg Asn Thr Asp
290 295 300
Phe Cys His Gly Leu Val Ile Phe Ala Gly Ala Asp Thr Lys Ile Met
305 310 315 320
Lys Asn Ser Gly Lys Thr Arg Phe Lys Arg Thr Lys Ile Asp Tyr Leu
325 330 335
Met Asn Tyr Met Val Tyr Thr Ile Phe Val Val Leu Ile Leu Leu Ser
340 345 350
Ala Gly Leu Ala Ile Gly His Ala Tyr Trp Glu Ala Gln Val Gly Asn
355 360 365
Ser Ser Trp Tyr Leu Tyr Asp Gly Glu Asp Asp Thr Pro Ser Tyr Arg
370 375 380
Gly Phe Leu Ile Phe Trp Gly Tyr Ile Ile Val Leu Asn Thr Met Val
385 390 395 400
Pro Ile Ser Leu Tyr Val Ser Val Glu Val Ile Arg Leu Gly Gln Ser
405 410 415
His Phe Ile Asn Trp Asp Leu Gln Met Tyr Tyr Ala Glu Lys Asp Thr
420 425 430
Pro Ala Lys Ala Arg Thr Thr Thr Leu Asn Glu Gln Leu Gly Gln Ile
435 440 445
His Tyr Ile Phe Ser Asp Lys Thr Gly Thr Leu Thr Gln Asn Ile Met
450 455 460
Thr Phe Lys Lys Cys Cys Ile Asn Gly Gln Ile Tyr Gly Asp His Arg
465 470 475 480
Asp Ala Ser Gln His Asn His Asn Lys Ile Glu Gln Val Asp Phe Ser
485 490 495
Trp Asn Thr Tyr Ala Asp Gly Lys Leu Ala Phe Tyr Asp His Tyr Leu
500 505 510
Ile Glu Gln Ile Gln Ser Gly Lys Glu Pro Glu Val Arg Gln Phe Phe
515 520 525
Phe Leu Leu Ala Val Cys His Thr Val Met Val Asp Arg Thr Asp Gly
530 535 540
Gln Leu Asn Tyr Gln Ala Ala Ser Pro Asp Glu Gly Ala Leu Val Asn
545 550 555 560
Ala Ala Arg Asn Phe Gly Phe Ala Phe Leu Ala Arg Thr Gln Asn Thr
565 570 575
Ile Thr Ile Ser Glu Leu Gly Thr Glu Arg Thr Tyr Asn Val Leu Ala
580 585 590
Ile Leu Asp Phe Asn Ser Asp Arg Lys Arg Met Ser Ile Ile Val Arg
595 600 605
Thr Pro Glu Gly Asn Ile Lys Leu Tyr Cys Lys Gly Ala Asp Thr Val
610 615 620
Ile Tyr Glu Arg Leu His Arg Met Asn Pro Thr Lys Gln Glu Thr Gln
625 630 635 640
Asp Ala Leu Asp Ile Phe Ala Asn Glu Thr Leu Arg Thr Leu Cys Leu
645 650 655
Cys Tyr Lys Glu Ile Glu Glu Lys Glu Phe Thr Glu Trp Asn Lys Lys
660 665 670
Phe Met Ala Ala Ser Val Ala Ser Thr Asn Arg Asp Glu Ala Leu Asp
675 680 685
Lys Val Tyr Glu Glu Ile Glu Lys Asp Leu Ile Leu Leu Gly Ala Thr
690 695 700
Ala Ile Glu Asp Lys Leu Gln Asp Gly Val Pro Glu Thr Ile Ser Lys
705 710 715 720
Leu Ala Lys Ala Asp Ile Lys Ile Trp Val Leu Thr Gly Asp Lys Lys
725 730 735
Glu Thr Ala Glu Asn Ile Gly Phe Ala Cys Glu Leu Leu Thr Glu Asp
740 745 750
Thr Thr Ile Cys Tyr Gly Glu Asp Ile Asn Ser Leu Leu His Ala Arg
755 760 765
Met Glu Asn Gln Arg Asn Arg Gly Gly Val Tyr Ala Lys Phe Ala Pro
770 775 780
Pro Val Gln Glu Ser Phe Phe Pro Pro Gly Gly Asn Arg Ala Leu Ile
785 790 795 800
Ile Thr Gly Ser Trp Leu Asn Glu Ile Leu Leu Glu Lys Lys Thr Lys
805 810 815
Arg Asn Lys Ile Leu Lys Leu Lys Phe Pro Arg Thr Glu Glu Glu Arg
820 825 830
Arg Met Arg Thr Gln Ser Lys Arg Arg Leu Glu Ala Lys Lys Glu Gln
835 840 845
Arg Gln Lys Asn Phe Val Asp Leu Ala Cys Glu Cys Ser Ala Val Ile
850 855 860
Cys Cys Arg Val Thr Pro Lys Gln Lys Ala Met Val Val Asp Leu Val
865 870 875 880
Lys Arg Tyr Lys Lys Ala Ile Thr Leu Ala Ile Gly Asp Gly Ala Asn
885 890 895
Asp Val Asn Met Ile Lys Thr Ala His Ile Gly Val Gly Ile Ser Gly
900 905 910
Gln Glu Gly Met Gln Ala Val Met Ser Ser Asp Tyr Ser Phe Ala Gln
915 920 925
Phe Arg Tyr Leu Gln Arg Leu Leu Leu Val His Gly Arg Trp Ser Tyr
930 935 940
Ile Arg Met Cys Lys Phe Leu Arg Tyr Phe Phe Tyr Lys Asn Phe Ala
945 950 955 960
Phe Thr Leu Val His Phe Trp Tyr Ser Phe Phe Asn Gly Tyr Ser Ala
965 970 975
Gln Thr Ala Tyr Glu Asp Trp Phe Ile Thr Leu Tyr Asn Val Leu Tyr
980 985 990
Thr Ser Leu Pro Val Leu Leu Met Gly Leu Leu Asp Gln Asp Val Ser
995 1000 1005
Asp Lys Leu Ser Leu Arg Phe Pro Gly Leu Tyr Ile Val Gly Gln
1010 1015 1020
Arg Asp Leu Leu Phe Asn Tyr Lys Arg Phe Phe Val Ser Leu Leu
1025 1030 1035
His Gly Val Leu Thr Ser Met Ile Leu Phe Phe Ile Pro Leu Gly
1040 1045 1050
Ala Tyr Leu Gln Thr Val Gly Gln Asp Gly Glu Ala Pro Ser Asp
1055 1060 1065
Tyr Gln Ser Phe Ala Val Thr Ile Ala Ser Ala Leu Val Ile Thr
1070 1075 1080
Val Asn Phe Gln Ile Gly Leu Asp Thr Ser Tyr Trp Thr Phe Val
1085 1090 1095
Asn Ala Phe Ser Ile Phe Gly Ser Ile Ala Leu Tyr Phe Gly Ile
1100 1105 1110
Met Phe Asp Phe His Ser Ala Gly Ile His Val Leu Phe Pro Ser
1115 1120 1125
Ala Phe Gln Phe Thr Gly Thr Ala Ser Asn Ala Leu Arg Gln Pro
1130 1135 1140
Tyr Ile Trp Leu Thr Ile Ile Leu Ala Val Ala Val Cys Leu Leu
1145 1150 1155
Pro Val Val Ala Ile Arg Phe Leu Ser Met Thr Ile Trp Pro Ser
1160 1165 1170
Glu Ser Asp Lys Ile Gln Lys His Arg Lys Arg Leu Lys Ala Glu
1175 1180 1185
Glu Gln Trp Gln Arg Arg Gln Gln Val Phe Arg Arg Gly Val Ser
1190 1195 1200
Thr Arg Arg Ser Ala Tyr Ala Phe Ser His Gln Arg Gly Tyr Ala
1205 1210 1215
Asp Leu Ile Ser Ser Gly Arg Ser Ile Arg Lys Lys Arg Ser Pro
1220 1225 1230
Leu Asp Ala Ile Val Ala Asp Gly Thr Ala Glu Tyr Arg Arg Thr
1235 1240 1245
Gly Asp Ser
1250
<210> 2
<211> 3756
<212> DNA
<213> Homo sapiens
<400> 2
atgagtacag aaagagactc agaaacgaca tttgacgagg attctcagcc taatgacgaa 60
gtggttccct acagtgatga tgaaacagaa gatgaacttg atgaccaggg gtctgctgtt 120
gaaccagaac aaaaccgagt caacagggaa gcagaggaga accgggagcc attcagaaaa 180
gaatgtacat ggcaagtcaa agcaaacgat cgcaagtacc acgaacaacc tcactttatg 240
aacacaaaat tcttgtgtat taaggagagt aaatatgcga ataatgcaat taaaacatac 300
aagtacaacg catttacctt tataccaatg aatctgtttg agcagtttaa gagagcagcc 360
aatttatatt tcctggctct tcttatctta caggcagttc ctcaaatctc taccctggct 420
tggtacacca cactagtgcc cctgcttgtg gtgctgggcg tcactgcaat caaagacctg 480
gtggacgatg tggctcgcca taaaatggat aaggaaatca acaataggac gtgtgaagtc 540
attaaggatg gcaggttcaa agttgctaag tggaaagaaa ttcaagttgg agacgtcatt 600
cgtctgaaaa aaaatgattt tgttccagct gacattctcc tgctgtctag ctctgagcct 660
aacagcctct gctatgtgga aacagcagaa ctggatggag aaaccaattt aaaatttaag 720
atgtcacttg aaatcacaga ccagtacctc caaagagaag atacattggc tacatttgat 780
ggttttattg aatgtgaaga acccaataac agactagata agtttacagg aacactattt 840
tggagaaaca caagttttcc tttggatgct gataaaattt tgttacgtgg ctgtgtaatt 900
aggaacaccg atttctgcca cggcttagtc atttttgcag gtgctgacac taaaataatg 960
aagaatagtg ggaaaaccag atttaaaaga actaaaattg attacttgat gaactacatg 1020
gtttacacga tctttgttgt tcttattctg ctttctgctg gtcttgccat cggccatgct 1080
tattgggaag cacaggtggg caattcctct tggtacctct atgatggaga agacgataca 1140
ccctcctacc gtggattcct cattttctgg ggctatatca ttgttctcaa caccatggta 1200
cccatctctc tctatgtcag cgtggaagtg attcgtcttg gacagagtca cttcatcaac 1260
tgggacctgc aaatgtacta tgctgagaag gacacacccg caaaagctag aaccaccaca 1320
ctcaatgaac agctcgggca gatccattat atcttctctg ataagacggg gacactcaca 1380
caaaatatca tgacctttaa aaagtgctgt atcaacgggc agatatatgg ggaccatcgg 1440
gatgcctctc aacacaacca caacaaaata gagcaagttg attttagctg gaatacatat 1500
gctgatggga agcttgcatt ttatgaccac tatcttattg agcaaatcca gtcagggaaa 1560
gagccagaag tacgacagtt cttcttcttg ctcgcagttt gccacacagt catggtggat 1620
aggactgatg gtcagctcaa ctaccaggca gcctctcccg atgaaggtgc cctggtaaac 1680
gctgccagga actttggctt tgccttcctc gccaggaccc agaacaccat caccatcagt 1740
gaactgggca ctgaaaggac ttacaatgtt cttgccattt tggacttcaa cagtgaccgg 1800
aagcgaatgt ctatcattgt aagaacccca gaaggcaata tcaagcttta ctgtaaaggt 1860
gctgacactg ttatttatga acggttacat cgaatgaatc ctactaagca agaaacacag 1920
gatgccctgg atatctttgc aaatgaaact cttagaaccc tatgcctttg ctacaaggaa 1980
attgaagaaa aagaatttac agaatggaat aaaaagttta tggctgccag tgtggcctcc 2040
accaaccggg acgaagctct ggataaagta tatgaggaga ttgaaaaaga cttaattctc 2100
ctgggagcta cagctattga agacaagcta caggatggag ttccagaaac catttcaaaa 2160
cttgcaaaag ctgacattaa gatctgggtg cttactggag acaaaaagga aactgctgaa 2220
aatataggat ttgcttgtga acttctgact gaagacacca ccatctgcta tggggaggat 2280
attaattctc ttcttcatgc aaggatggaa aaccagagga atagaggtgg cgtctacgca 2340
aagtttgcac ctcctgtgca ggaatctttt tttccacccg gtggaaaccg tgccttaatc 2400
atcactggtt cttggttgaa tgaaattctt ctcgagaaaa agaccaagag aaataagatt 2460
ctgaagctga agttcccaag aacagaagaa gaaagacgga tgcggaccca aagtaaaagg 2520
aggctagaag ctaagaaaga gcagcggcag aaaaactttg tggacctggc ctgcgagtgc 2580
agcgcagtca tctgctgccg cgtcaccccc aagcagaagg ccatggtggt ggacctggtg 2640
aagaggtaca agaaagccat cacgctggcc atcggagatg gggccaatga cgtgaacatg 2700
atcaaaactg cccacattgg cgttggaata agtggacaag aaggaatgca agctgtcatg 2760
tcgagtgact attcctttgc tcagttccga tatctgcaga ggctactgct ggtgcatggc 2820
cgatggtctt acataaggat gtgcaagttc ctacgatact tcttttacaa aaactttgcc 2880
tttactttgg ttcatttctg gtactccttc ttcaatggct actctgcgca gactgcatac 2940
gaggattggt tcatcaccct ctacaacgtg ctgtacacca gcctgcccgt gctcctcatg 3000
gggctgctcg accaggatgt gagtgacaaa ctgagcctcc gattccctgg gttatacata 3060
gtgggacaaa gagacttact attcaactat aagagattct ttgtaagctt gttgcatggg 3120
gtcctaacat cgatgatcct cttcttcata cctcttggag cttatctgca aaccgtaggg 3180
caggatggag aggcaccttc cgactaccag tcttttgccg tcaccattgc ctctgctctt 3240
gtaataacag tcaatttcca gattggcttg gatacttctt attggacttt tgtgaatgct 3300
ttttcaattt ttggaagcat tgcactttat tttggcatca tgtttgactt tcatagtgct 3360
ggaatacatg ttctctttcc atctgcattt caatttacag gcacagcttc aaacgctctg 3420
agacagccat acatttggtt aactatcatc ctggctgttg ctgtgtgctt actacccgtc 3480
gttgccattc gattcctgtc aatgaccatc tggccatcag aaagtgataa gatccagaag 3540
catcgcaagc ggttgaaggc ggaggagcag tggcagcgac ggcagcaggt gttccgccgg 3600
ggcgtgtcaa cgcggcgctc ggcctacgcc ttctcgcacc agcggggcta cgcggacctc 3660
atctcctccg ggcgcagcat ccgcaagaag cgctcgccgc ttgatgccat cgtggcggat 3720
ggcaccgcgg agtacaggcg caccggggac agctga 3756
<210> 3
<211> 1321
<212> PRT
<213> Homo sapiens
<400> 3
Met Ser Asp Ser Val Ile Leu Arg Ser Ile Lys Lys Phe Gly Glu Glu
1 5 10 15
Asn Asp Gly Phe Glu Ser Asp Lys Ser Tyr Asn Asn Asp Lys Lys Ser
20 25 30
Arg Leu Gln Asp Glu Lys Lys Gly Asp Gly Val Arg Val Gly Phe Phe
35 40 45
Gln Leu Phe Arg Phe Ser Ser Ser Thr Asp Ile Trp Leu Met Phe Val
50 55 60
Gly Ser Leu Cys Ala Phe Leu His Gly Ile Ala Gln Pro Gly Val Leu
65 70 75 80
Leu Ile Phe Gly Thr Met Thr Asp Val Phe Ile Asp Tyr Asp Val Glu
85 90 95
Leu Gln Glu Leu Gln Ile Pro Gly Lys Ala Cys Val Asn Asn Thr Ile
100 105 110
Val Trp Thr Asn Ser Ser Leu Asn Gln Asn Met Thr Asn Gly Thr Arg
115 120 125
Cys Gly Leu Leu Asn Ile Glu Ser Glu Met Ile Lys Phe Ala Ser Tyr
130 135 140
Tyr Ala Gly Ile Ala Val Ala Val Leu Ile Thr Gly Tyr Ile Gln Ile
145 150 155 160
Cys Phe Trp Val Ile Ala Ala Ala Arg Gln Ile Gln Lys Met Arg Lys
165 170 175
Phe Tyr Phe Arg Arg Ile Met Arg Met Glu Ile Gly Trp Phe Asp Cys
180 185 190
Asn Ser Val Gly Glu Leu Asn Thr Arg Phe Ser Asp Asp Ile Asn Lys
195 200 205
Ile Asn Asp Ala Ile Ala Asp Gln Met Ala Leu Phe Ile Gln Arg Met
210 215 220
Thr Ser Thr Ile Cys Gly Phe Leu Leu Gly Phe Phe Arg Gly Trp Lys
225 230 235 240
Leu Thr Leu Val Ile Ile Ser Val Ser Pro Leu Ile Gly Ile Gly Ala
245 250 255
Ala Thr Ile Gly Leu Ser Val Ser Lys Phe Thr Asp Tyr Glu Leu Lys
260 265 270
Ala Tyr Ala Lys Ala Gly Val Val Ala Asp Glu Val Ile Ser Ser Met
275 280 285
Arg Thr Val Ala Ala Phe Gly Gly Glu Lys Arg Glu Val Glu Arg Tyr
290 295 300
Glu Lys Asn Leu Val Phe Ala Gln Arg Trp Gly Ile Arg Lys Gly Ile
305 310 315 320
Val Met Gly Phe Phe Thr Gly Phe Val Trp Cys Leu Ile Phe Leu Cys
325 330 335
Tyr Ala Leu Ala Phe Trp Tyr Gly Ser Thr Leu Val Leu Asp Glu Gly
340 345 350
Glu Tyr Thr Pro Gly Thr Leu Val Gln Ile Phe Leu Ser Val Ile Val
355 360 365
Gly Ala Leu Asn Leu Gly Asn Ala Ser Pro Cys Leu Glu Ala Phe Ala
370 375 380
Thr Gly Arg Ala Ala Ala Thr Ser Ile Phe Glu Thr Ile Asp Arg Lys
385 390 395 400
Pro Ile Ile Asp Cys Met Ser Glu Asp Gly Tyr Lys Leu Asp Arg Ile
405 410 415
Lys Gly Glu Ile Glu Phe His Asn Val Thr Phe His Tyr Pro Ser Arg
420 425 430
Pro Glu Val Lys Ile Leu Asn Asp Leu Asn Met Val Ile Lys Pro Gly
435 440 445
Glu Met Thr Ala Leu Val Gly Pro Ser Gly Ala Gly Lys Ser Thr Ala
450 455 460
Leu Gln Leu Ile Gln Arg Phe Tyr Asp Pro Cys Glu Gly Met Val Thr
465 470 475 480
Val Asp Gly His Asp Ile Arg Ser Leu Asn Ile Gln Trp Leu Arg Asp
485 490 495
Gln Ile Gly Ile Val Glu Gln Glu Pro Val Leu Phe Ser Thr Thr Ile
500 505 510
Ala Glu Asn Ile Arg Tyr Gly Arg Glu Asp Ala Thr Met Glu Asp Ile
515 520 525
Val Gln Ala Ala Lys Glu Ala Asn Ala Tyr Asn Phe Ile Met Asp Leu
530 535 540
Pro Gln Gln Phe Asp Thr Leu Val Gly Glu Gly Gly Gly Gln Met Ser
545 550 555 560
Gly Gly Gln Lys Gln Arg Val Ala Ile Ala Arg Ala Leu Ile Arg Asn
565 570 575
Pro Lys Ile Leu Leu Leu Asp Met Ala Thr Ser Ala Leu Asp Asn Glu
580 585 590
Ser Glu Ala Met Val Gln Glu Val Leu Ser Lys Ile Gln His Gly His
595 600 605
Thr Ile Ile Ser Val Ala His Arg Leu Ser Thr Val Arg Ala Ala Asp
610 615 620
Thr Ile Ile Gly Phe Glu His Gly Thr Ala Val Glu Arg Gly Thr His
625 630 635 640
Glu Glu Leu Leu Glu Arg Lys Gly Val Tyr Phe Thr Leu Val Thr Leu
645 650 655
Gln Ser Gln Gly Asn Gln Ala Leu Asn Glu Glu Asp Ile Lys Asp Ala
660 665 670
Thr Glu Asp Asp Met Leu Ala Arg Thr Phe Ser Arg Gly Ser Tyr Gln
675 680 685
Asp Ser Leu Arg Ala Ser Ile Arg Gln Arg Ser Lys Ser Gln Leu Ser
690 695 700
Tyr Leu Val His Glu Pro Pro Leu Ala Val Val Asp His Lys Ser Thr
705 710 715 720
Tyr Glu Glu Asp Arg Lys Asp Lys Asp Ile Pro Val Gln Glu Glu Val
725 730 735
Glu Pro Ala Pro Val Arg Arg Ile Leu Lys Phe Ser Ala Pro Glu Trp
740 745 750
Pro Tyr Met Leu Val Gly Ser Val Gly Ala Ala Val Asn Gly Thr Val
755 760 765
Thr Pro Leu Tyr Ala Phe Leu Phe Ser Gln Ile Leu Gly Thr Phe Ser
770 775 780
Ile Pro Asp Lys Glu Glu Gln Arg Ser Gln Ile Asn Gly Val Cys Leu
785 790 795 800
Leu Phe Val Ala Met Gly Cys Val Ser Leu Phe Thr Gln Phe Leu Gln
805 810 815
Gly Tyr Ala Phe Ala Lys Ser Gly Glu Leu Leu Thr Lys Arg Leu Arg
820 825 830
Lys Phe Gly Phe Arg Ala Met Leu Gly Gln Asp Ile Ala Trp Phe Asp
835 840 845
Asp Leu Arg Asn Ser Pro Gly Ala Leu Thr Thr Arg Leu Ala Thr Asp
850 855 860
Ala Ser Gln Val Gln Gly Ala Ala Gly Ser Gln Ile Gly Met Ile Val
865 870 875 880
Asn Ser Phe Thr Asn Val Thr Val Ala Met Ile Ile Ala Phe Ser Phe
885 890 895
Ser Trp Lys Leu Ser Leu Val Ile Leu Cys Phe Phe Pro Phe Leu Ala
900 905 910
Leu Ser Gly Ala Thr Gln Thr Arg Met Leu Thr Gly Phe Ala Ser Arg
915 920 925
Asp Lys Gln Ala Leu Glu Met Val Gly Gln Ile Thr Asn Glu Ala Leu
930 935 940
Ser Asn Ile Arg Thr Val Ala Gly Ile Gly Lys Glu Arg Arg Phe Ile
945 950 955 960
Glu Ala Leu Glu Thr Glu Leu Glu Lys Pro Phe Lys Thr Ala Ile Gln
965 970 975
Lys Ala Asn Ile Tyr Gly Phe Cys Phe Ala Phe Ala Gln Cys Ile Met
980 985 990
Phe Ile Ala Asn Ser Ala Ser Tyr Arg Tyr Gly Gly Tyr Leu Ile Ser
995 1000 1005
Asn Glu Gly Leu His Phe Ser Tyr Val Phe Arg Val Ile Ser Ala
1010 1015 1020
Val Val Leu Ser Ala Thr Ala Leu Gly Arg Ala Phe Ser Tyr Thr
1025 1030 1035
Pro Ser Tyr Ala Lys Ala Lys Ile Ser Ala Ala Arg Phe Phe Gln
1040 1045 1050
Leu Leu Asp Arg Gln Pro Pro Ile Ser Val Tyr Asn Thr Ala Gly
1055 1060 1065
Glu Lys Trp Asp Asn Phe Gln Gly Lys Ile Asp Phe Val Asp Cys
1070 1075 1080
Lys Phe Thr Tyr Pro Ser Arg Pro Asp Ser Gln Val Leu Asn Gly
1085 1090 1095
Leu Ser Val Ser Ile Ser Pro Gly Gln Thr Leu Ala Phe Val Gly
1100 1105 1110
Ser Ser Gly Cys Gly Lys Ser Thr Ser Ile Gln Leu Leu Glu Arg
1115 1120 1125
Phe Tyr Asp Pro Asp Gln Gly Lys Val Met Ile Asp Gly His Asp
1130 1135 1140
Ser Lys Lys Val Asn Val Gln Phe Leu Arg Ser Asn Ile Gly Ile
1145 1150 1155
Val Ser Gln Glu Pro Val Leu Phe Ala Cys Ser Ile Met Asp Asn
1160 1165 1170
Ile Lys Tyr Gly Asp Asn Thr Lys Glu Ile Pro Met Glu Arg Val
1175 1180 1185
Ile Ala Ala Ala Lys Gln Ala Gln Leu His Asp Phe Val Met Ser
1190 1195 1200
Leu Pro Glu Lys Tyr Glu Thr Asn Val Gly Ser Gln Gly Ser Gln
1205 1210 1215
Leu Ser Arg Gly Glu Lys Gln Arg Ile Ala Ile Ala Arg Ala Ile
1220 1225 1230
Val Arg Asp Pro Lys Ile Leu Leu Leu Asp Glu Ala Thr Ser Ala
1235 1240 1245
Leu Asp Thr Glu Ser Glu Lys Thr Val Gln Val Ala Leu Asp Lys
1250 1255 1260
Ala Arg Glu Gly Arg Thr Cys Ile Val Ile Ala His Arg Leu Ser
1265 1270 1275
Thr Ile Gln Asn Ala Asp Ile Ile Ala Val Met Ala Gln Gly Val
1280 1285 1290
Val Ile Glu Lys Gly Thr His Glu Glu Leu Met Ala Gln Lys Gly
1295 1300 1305
Ala Tyr Tyr Lys Leu Val Thr Thr Gly Ser Pro Ile Ser
1310 1315 1320
<210> 4
<211> 3966
<212> DNA
<213> Homo sapiens
<400> 4
atgtctgact cagtaattct tcgaagtata aagaaatttg gagaggagaa tgatggtttt 60
gagtcagata aatcatataa taatgataag aaatcaaggt tacaagatga gaagaaaggt 120
gatggcgtta gagttggctt ctttcaattg tttcggtttt cttcatcaac tgacatttgg 180
ctgatgtttg tgggaagttt gtgtgcattt ctccatggaa tagcccagcc aggcgtgcta 240
ctcatttttg gcacaatgac agatgttttt attgactacg acgttgagtt acaagaactc 300
cagattccag gaaaagcatg tgtgaataac accattgtat ggactaacag ttccctcaac 360
cagaacatga caaatggaac acgttgtggg ttgctgaaca tcgagagcga aatgatcaaa 420
tttgccagtt actatgctgg aattgctgtc gcagtactta tcacaggata tattcaaata 480
tgcttttggg tcattgccgc agctcgtcag atacagaaaa tgagaaaatt ttactttagg 540
agaataatga gaatggaaat agggtggttt gactgcaatt cagtggggga gctgaataca 600
agattctctg atgatattaa taaaatcaat gatgccatag ctgaccaaat ggcccttttc 660
attcagcgca tgacctcgac catctgtggt ttcctgttgg gatttttcag gggttggaaa 720
ctgaccttgg ttattatttc tgtcagccct ctcattggga ttggagcagc caccattggt 780
ctgagtgtgt ccaagtttac ggactatgag ctgaaggcct atgccaaagc aggggtggtg 840
gctgatgaag tcatttcatc aatgagaaca gtggctgctt ttggtggtga gaaaagagag 900
gttgaaaggt atgagaaaaa tcttgtgttc gcccagcgtt ggggaattag aaaaggaata 960
gtgatgggat tctttactgg attcgtgtgg tgtctcatct ttttgtgtta tgcactggcc 1020
ttctggtacg gctccacact tgtcctggat gaaggagaat atacaccagg aacccttgtc 1080
cagattttcc tcagtgtcat agtaggagct ttaaatcttg gcaatgcctc tccttgtttg 1140
gaagcctttg caactggacg tgcagcagcc accagcattt ttgagacaat agacaggaaa 1200
cccatcattg actgcatgtc agaagatggt tacaagttgg atcgaatcaa gggtgaaatt 1260
gaattccata atgtgacctt ccattatcct tccagaccag aggtgaagat tctaaatgac 1320
ctcaacatgg tcattaaacc aggggaaatg acagctctgg taggacccag tggagctgga 1380
aaaagtacag cactgcaact cattcagcga ttctatgacc cctgtgaagg aatggtgacc 1440
gtggatggcc atgacattcg ctctcttaac attcagtggc ttagagatca gattgggata 1500
gtggagcaag agccagttct gttctctacc accattgcag aaaatattcg ctatggcaga 1560
gaagatgcaa caatggaaga catagtccaa gctgccaagg aggccaatgc ctacaacttc 1620
atcatggacc tgccacagca atttgacacc cttgttggag aaggaggagg ccagatgagt 1680
ggtggccaga aacaaagggt agctatcgcc agagccctca tccgaaatcc caagattctg 1740
cttttggaca tggccacctc agctctggac aatgagagtg aagccatggt gcaagaagtg 1800
ctgagtaaga ttcagcatgg gcacacaatc atttcagttg ctcatcgctt gtctacggtc 1860
agagctgcag ataccatcat tggttttgaa catggcactg cagtggaaag agggacccat 1920
gaagaattac tggaaaggaa aggtgtttac ttcactctag tgactttgca aagccaggga 1980
aatcaagctc ttaatgaaga ggacataaag gatgcaactg aagatgacat gcttgcgagg 2040
acctttagca gagggagcta ccaggatagt ttaagggctt ccatccggca acgctccaag 2100
tctcagcttt cttacctggt gcacgaacct ccattagctg ttgtagatca taagtctacc 2160
tatgaagaag atagaaagga caaggacatt cctgtgcagg aagaagttga acctgcccca 2220
gttaggagga ttctgaaatt cagtgctcca gaatggccct acatgctggt agggtctgtg 2280
ggtgcagctg tgaacgggac agtcacaccc ttgtatgcct ttttattcag ccagattctt 2340
gggacttttt caattcctga taaagaggaa caaaggtcac agatcaatgg tgtgtgccta 2400
ctttttgtag caatgggctg tgtatctctt ttcacccaat ttctacaggg atatgccttt 2460
gctaaatctg gggagctcct aacaaaaagg ctacgtaaat ttggtttcag ggcaatgctg 2520
gggcaagata ttgcctggtt tgatgacctc agaaatagcc ctggagcatt gacaacaaga 2580
cttgctacag atgcttccca agttcaaggg gctgccggct ctcagatcgg gatgatagtc 2640
aattccttca ctaacgtcac tgtggccatg atcattgcct tctcctttag ctggaagctg 2700
agcctggtca tcttgtgctt cttccccttc ttggctttat caggagccac acagaccagg 2760
atgttgacag gatttgcctc tcgagataag caggccctgg agatggtggg acagattaca 2820
aatgaagccc tcagtaacat ccgcactgtt gctggaattg gaaaggagag gcggttcatt 2880
gaagcacttg agactgagct ggagaagccc ttcaagacag ccattcagaa agccaatatt 2940
tacggattct gctttgcctt tgcccagtgc atcatgttta ttgcgaattc tgcttcctac 3000
agatatggag gttacttaat ctccaatgag gggctccatt tcagctatgt gttcagggtg 3060
atctctgcag ttgtactgag tgcaacagct cttggaagag ccttctctta caccccaagt 3120
tatgcaaaag ctaaaatatc agctgcacgc ttttttcaac tgctggaccg acaaccccca 3180
atcagtgtat acaatactgc aggtgaaaaa tgggacaact tccaggggaa gattgatttt 3240
gttgattgta aatttacata tccttctcga cctgactcgc aagttctgaa tggtctctca 3300
gtgtcgatta gtccagggca gacactggcg tttgttggga gcagtggatg tggcaaaagc 3360
actagcattc agctgttgga acgtttctat gatcctgatc aagggaaggt gatgatagat 3420
ggtcatgaca gcaaaaaagt aaatgtccag ttcctccgct caaacattgg aattgtttcc 3480
caggaaccag tgttgtttgc ctgtagcata atggacaata tcaagtatgg agacaacacc 3540
aaagaaattc ccatggaaag agtcatagca gctgcaaaac aggctcagct gcatgatttt 3600
gtcatgtcac tcccagagaa atatgaaact aacgttgggt cccaggggtc tcaactctct 3660
agaggggaga aacaacgcat tgctattgct cgggccattg tacgagatcc taaaatcttg 3720
ctactagatg aagccacttc tgccttagac acagaaagtg aaaagacggt gcaggttgct 3780
ctagacaaag ccagagaggg tcggacctgc attgtcattg cccatcgctt gtccaccatc 3840
cagaacgcgg atatcattgc tgtcatggca cagggggtgg tgattgaaaa ggggacccat 3900
gaagaactga tggcccaaaa aggagcctac tacaaactag tcaccactgg atcccccatc 3960
agttga 3966
<---
Реферат
Группа изобретений относится к области медицины, а именно к терапии, и предназначена для лечения сердечно-сосудистых заболеваний, нарушений метаболизма жирных кислот и использования глюкозы, желудочно-кишечных заболеваний и заболеваний печени. Представлены производные 1,5-бензотиазепина и 1,2,5-бензотиадиазепина формулы (I). В другом воплощении обеспечивается фармацевтическая композиция, содержащая данные соединения. Группа изобретений обеспечивает новые производные 1,5-бензотиазепина и 1,2,5-бензотиадиазепина формулы (I), а также фармацевтическую композицию, содержащую данные соединения, которые являются модуляторами желчных кислот, обладающими ингибирующей активностью по отношению к апикальному натрийзависимому переносчику желчных кислот (ASBT) и/или переносчику желчных кислот в печени (LBAT). 2 н. и 13 з.п. ф-лы, 7 табл., 110 пр.
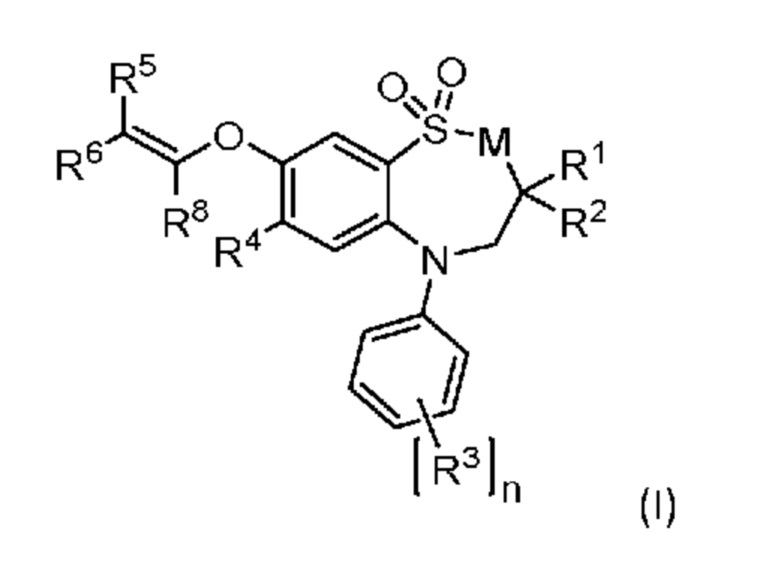
Формула

Документы, цитированные в отчёте о поиске
1,5-бензотиазепины и их применение в качестве антигиперлипидемических средств

Комментарии