Замещенные оксазолидиноны, способы их получения, лекарственное средство на их основе и применение замещенных оксазолидинонов - RU2297415C2
Код документа: RU2297415C2
Описание
Описание
Настоящее изобретение относится к новым пятичленным гетероциклическим соединениям, обладающим биологической активностью, в частности антитромботической активностью, более конкретно к замещенным оксазолидинонам, способам их получения, лекарственному средству на их основе и применению замещенных оксазолидинонов.
Свертывание крови представляет собой защитный механизм организма, с помощью которого могут быть быстро и надежно "герметизированы" дефекты в стенке сосуда. Так можно исключить или, соответственно, свести к минимуму потерю крови. Остановка кровотечения после повреждения сосуда происходит преимущественно благодаря системе свертывания крови, в которой запускается ферментативный каскад сложных реакций протеинов плазмы. В этом участвуют многочисленные факторы свертывания крови, каждый из которых, будучи активированным, переводит в активную форму следующую неактивную ступень каскада. В конце каскада стоит превращение растворимого фибриногена в нерастворимый фибрин, что и приводит к образованию сгустка крови. При свертывании крови традиционно различают внутреннюю и внешнюю системы, которые сходятся в общем завершающем реакционном пути. Ключевая роль при этом принадлежит объединяющему оба пути свертывания фактору Ха, который образуется из проферментного фактора X. Активированная сериновая протеаза Ха расщепляет протромбин до тромбина. Образовавшийся тромбин в свою очередь снова расщепляет фибриноген до фибрина - волокнистого желеобразного вещества свертывания. Кроме того, тромбин является мощным спусковым механизмом агрегации тромбоцитов, которые также вносят значительный вклад в гемостаз.
Поддержание нормального гемостаза - между кровотечением и тромбозом - подчиняется сложному механизму регуляции. Неконтролируемая активация системы свертывания или дефектная блокировка процесса активирования могут вызвать образование локальных тромбов или эмболии в сосудах (артериях, венах, лимфатических сосудах) или в объемах сердца. Результатом этого могут быть такие заболевания с тяжелыми исходами, как инфаркт миокарда, стенокардия (включая приступы стенокардии), реокклюзии и рестенозы после ангиопластических операций или аортокоронарного шунтирования, инсульт, перемежающиеся ишемические приступы, заболевания, связанные с закупоркой периферических артерий, эмболии легких или глубокие венозные тромбозы; эти заболевание далее будут в общем обозначаться как тромбоэмболические заболевания. Кроме того, повышенная свертываемость крови в системном отношении при коагулопатии потребления может приводить к рассеянному внутривазальному свертыванию.
Эти тромбоэмболические заболевания представляют собой самую распространенную причину патологии и смертности в основных индустриальных странах (Pschyrembel, Klynisches Wörterbuch, 257-е издание, 1994, издательство Вальтер де Грюйтер, с.199 и сл., ключевое слово "Blutgerinnung"; Römpp Lexikon Chemie, версия 1.5, 1998, издательство Георг Тиме, Штуттгарт, ключевое слово "Blutgerinnung"; Lubert Stryer, Biochemie, Spectrum der Wissenschaft, Ферлагсгезельшафт мбХ Гейдельберг, 1990, с.259 и сл.).
У известных из уровня техники антикоагулянтов, то есть препятствующих свертыванию крови или блокирующих свертывание веществ, проявляются различные недостатки, которые часто осложняют их применение. Поэтому на практике эффективный способ лечения или, соответственно, профилактики тромбоэмболических заболеваний оказывается очень сложным и неудовлетворительным.
Для терапии и профилактики тромбоэмболических заболеваний находит применение гепарин, который используется для парентерального или подкожного введения. В настоящее время все чаще и чаще предпочтение отдается низкомолекулярному гепарину благодаря его хорошим фармакокинетическим свойствам; правда, и с его помощью не удается устранить описываемые далее известные недостатки, которые проявляются при лечении гепарином. Так, например, гепарин не активен при приеме через рот и характеризуется сравнительно небольшим временем полупревращения. Поскольку гепарин одновременно блокирует многие факторы каскада свертывания крови, он действует неселективно. Кроме того, существует высокий риск кровотечений, и прежде всего могут проявиться кровотечения в мозге и кровотечения в желудочно-кишечном тракте, могут возникнуть тромбопения, медикаментозное облысение или остеопороз (Pschyrembel, Klynisches Wö rterbuch, 257-е издание, 1994, издательство Вальтер де Грюйтер, с.610, ключевое слово "Heparin"; Römpp Lexikon Chemie, версия 1.5, 1998, издательство Георг Тиме, Штуттгарт, ключевое слово "Heparin").
Второй класс антикоагулянтов представлен антагонистами витамина К. К ним относятся, например, 1,3-индандионы, но прежде всего такие соединения, как варфарин, фенпрокумон, дикумарол и другие производные кумарина, которые неселективно блокируют в печени синтез различных продуктов определенных факторов свертывания, образование которых зависит от витамина К. Будучи обусловленным механизмом действия, их эффект начинает проявляться только очень медленно (скрытый период до проявления эффекта от 36 до 48 часов). Эти соединения могут, конечно, приниматься через рот, но из-за высокого риска кровотечений и узкого терапевтического индекса они нуждаются в тщательном подборе индивидуальных установок и контроле состояния пациента. Кроме того, для них описаны другие побочные эффекты, например желудочно-кишечные нарушения, выпадение волос и некрозы кожи (Pschyrembel, Klynisches Wörterbuch, 257-е издание, 1994, издательство Вальтер де Грюйтер, с.292 и сл., ключевое слово "Cumarinderivate"; Ullmann's Encyclopedia of Industrial Chemistry, 5-е издание, VCH Ферлагсгезельшафт, Вейнгейм, 1985-1996, ключевое слово "Vitamin К").
В последнее время описано новое терапевтическое направление в лечении и профилактике тромбоэмболических заболеваний. Целью этого нового терапевтического направления является ингибирование фактора Ха (заявки на международный патент №99/373054 и №99/06371; J.Hauptmann, J.Stürzebecher, Thrombosis Research 1999, 93, 203; F. Al-Obeidi, J.A.Ostrem, Factor Ха inhibitors by classical and combinatorial chemistry, DDT 1998, 3, 223; F. Al-Obeidi, J.A.Ostrem, Factor Ха inhibitors, Exp. Opin. Ther. Patents 1999, 9, 931; B.Kaiser, Thrombin and factor Ха inhibitors, Drugs of the Future 1998, 23, 423; A.Uzan, Antithrombotic agents, Emerging Drugs 1998, 3, 189; B.-Y. Zhu, R.M.Scarborough, Curr. Opin. Card. Pulm. Ren. Inv. Drugs 1999, 1 (1), 63). При этом было показано, что различные как пептидные, так и непептидные соединения в опытах на животных проявляют свойства ингибиторов фактора Ха.
В соответствии с этим задача настоящего изобретения состояла в разработке новых веществ для борьбы с заболеваниями, проявляющих большую терапевтическую широту.
В первую очередь они должны быть пригодны для более эффективной профилактики и/или терапии тромбоэмболических заболеваний и при этом они должны быть лишены, по крайней мере частично, описанных выше недостатков уровня техники, причем понятие "тромбоэмболические заболевания" в смысле настоящего изобретения относится в первую очередь к таким тяжелым заболеваниям, как инфаркт миокарда, стенокардия (включая приступы стенокардии), реокклюзии и рестенозы после ангиопластических операций или аортокоронарного шунтирования, инсульт, перемежающиеся ишемические приступы, заболевания, связанные с закупоркой периферических артерий, эмболии легких или глубокие венозные тромбозы.
Другая задача настоящего изобретения состояла в разработке новых антикоагулянтов, которые с повышенной селективностью ингибируют фактор свертывания крови Ха и с помощью которых должны быть исключены, по крайней мере частично, проблемы, характерные для известных из уровня техники способов лечения тромбоэмболических заболеваний.
В соответствии с этим объектом настоящего изобретения являются замещенные оксазолидиноны общей формулы (I)

где
R1 означает тиофен (тиенил), который может быть сконденсирован с бензолом и который может быть от одного до нескольких раз замещен остатком из группы: атом галогена и алкильная группа с числом атомов углерода от одного до восьми, незамещенная или от одного до нескольких раз замещенная атомами галогенов,
R2 означает одну из следующих групп:
А-,
D-M-A-,
В-М-А-,
В-,
В-М-В-,
D-M-B-,
причем
остаток "А" означает арильную группу с числом атомов углерода от шести до четырнадцати, предпочтительно арильную группу с числом атомов углерода от шести до десяти, в частности фенильную группу,
остаток "В" означает пяти- или шестичленный ароматический гетероцикл, содержащий до трех гетероатомов и/или звеньев цепи на основе гетероатомов, в частности он содержит до двух гетероатомов и/или звеньев в цепи на основе гетероатомов из ряда: атом серы, атом азота и атом кислорода,
остаток "D" означает остаток насыщенного моно- или бициклического гетероцикла с числом членов в цикле от четырех до девяти, который может быть сконденсирован с бензолом и который содержит до трех гетероатомов и/или звеньев в цепи на основе гетероатомов из ряда: атом серы, сульфинильная, сульфонильная группа, атом азота и атом кислорода,
остаток "М" означает группу -NH-, -CH2-, -СН2CH2-, -CONH-, -NHCO-, -SO2- или же означает ковалентную связь,
при этом обозначенные выше группы "А", "В" и "D" в каждом отдельном случае могут быть от одного до нескольких раз замещены остатком из группы: атомы галогенов, трифторметильная группа, оксогруппа, цианогруппа, нитрогруппа, карбамоильная группа, алканоильная группа с числом атомов углерода в алкильном остатке от одного до шести, гидроксиалкилкарбонильная группа с числом атомов углерода в гидроксиалкильном остатке от одного до четырех, группа -COOR27, -C(NR27R28)=NR29, -CONR28R29, -SO2NR28R29, -OR30, -NR30R31, алкильная группа с числом атомов углерода от одного до шести и циклоалкильная группа с числом атомов углерода от трех до семи,
R27, R28 и R29, одинаковые или разные, независимо друг от друга означают атом водорода или алкильную группу с числом атомов углерода от одного до четырех,
и/или
R28 и R29 вместе с соединяющим их атомом азота образуют насыщенный или частично ненасыщенный шестичленный гетероцикл, включающий до трех, предпочтительно до двух, атомов азота, и
R30 и R31, одинаковые или разные, независимо друг от друга означают алкильную группу с числом атомов углерода от одного до четырех,
R3, R4, R5, R6, R7 и R8 означают атом водорода,
а также их фармацевтически приемлемые соли, гидраты, гидраты солей, за исключением соединений общей формулы (I), у которых остаток R1 означает незамещенный 2-тиофеновый остаток и одновременно остаток R2 означает от одного до нескольких раз замещенный фенильный остаток и одновременно каждый из остатков R3, R4, R5, R6, R7 и R8 означают атом водорода.
В первую группу предпочтительных замещенных оксазолидинонов общей формулы (I) входят соединения, у которых
R1 означает 2-тиофен, который может быть от одного до нескольких раз замещен атомами галогенов, предпочтительно хлором или бромом, или алкильной группой с числом атомов углерода от одного до восьми, предпочтительно метильной группой, причем алкильный остаток с числом атомов углерода от одного до восьми может быть в свою очередь от одного до нескольких раз замещен атомами галогенов, предпочтительно фтором,
R2 означает одну из следующих групп:
А-,
D-M-A-,
В-М-А-,
В-,
В-М-В-,
D-M-B-,
причем
остаток "А" означает арильную группу с числом атомов углерода от шести до четырнадцати, предпочтительно арильную группу с числом атомов углерода от шести до десяти, в частности фенильную группу,
остаток "В" означает пяти- или шестичленный ароматический гетероцикл, содержащий до трех гетероатомов и/или звеньев цепи на основе гетероатомов, в частности он содержит до двух гетероатомов и/или звеньев в цепи на основе гетероатомов из ряда: атом серы, атом азота и атом кислорода,
остаток "D" означает остаток насыщенного гетероцикла с числом членов в цикле от четырех до семи, содержащий до трех гетероатомов и/или звеньев в цепи на основе гетероатомов из ряда: атом серы, сульфинильная, сульфонильная группа, атом азота и атом кислорода,
остаток "М" означает группу -NH-, -CH2-, -СН2 СН2, -CONH-, -NHCO- или же означает ковалентную связь,
при этом обозначенные выше группы "А", "В" и "D" в каждом отдельном случае могут быть от одного до нескольких раз замещены остатком из группы: атомы галогенов, трифторметильная группа, оксогруппа, цианогруппа, нитрогруппа, карбамоильная группа, алканоильная группа с числом атомов углерода в алкильном остатке от одного до шести, -COOR27, -C(NR27R28)=NR29, -CONR28R29, -SO2NR28R29, -OR30, -NR30R31, алкильная группа с числом атомов углерода от одного до шести и циклоалкильная группа с числом атомов углерода от трех до семи,
R27, R28 и R29, одинаковые или разные, независимо друг от друга означают атом водорода, алкильную группу с числом атомов углерода от одного до четырех
и/или
R28 и R29 вместе с соединяющим их атомом азота образуют насыщенный или частично ненасыщенный шестичленный гетероцикл, включающий до трех, предпочтительно до двух, атомов азота,
R30 и R31, одинаковые или разные, независимо друг от друга означают алкильную группу с числом атомов углерода от одного до четырех,
R3, R4, R5, R6, R7 и R8 означают атом водорода,
а также их фармацевтически приемлемые соли, гидраты и гидраты солей, за исключением соединений общей формулы (I), у которых остаток R1 означает незамещенный 2-тиофеновый остаток и одновременно остаток R2 означает от одного до нескольких раз замещенный фенильный остаток и одновременно каждый из остатков R3, R4, R5, R6, R7 и R8 означают атом водорода.
Во вторую группу предпочтительных оксазолидинонов общей формулы (I) входят соединения, у которых
R1 означает 2-тиофен, который может быть от одного до нескольких раз замещен атомами галогенов, предпочтительно хлором или бромом, или алкильной группой с числом атомов углерода от одного до восьми, предпочтительно метильной группой, причем алкильный остаток с числом атомов углерода от одного до восьми может быть в свою очередь от одного до нескольких раз замещен атомами галогенов, предпочтительно фтором,
R2 означает одну из следующих групп:
А-,
D-M-A-,
В-М-А-,
В-,
В-М-В-,
D-M-B-,
причем
остаток "А" означает фенильну группу,
остаток "В" означает пяти- или шестичленный ароматический гетероцикл, содержащий до двух гетероатомов из ряда: атом серы, атом азота и атом кислорода,
остаток "D" означает остаток насыщенного пяти- или шестичленного гетероцикла, содержащего до двух гетероатомов и/или звеньев в цепи на основе гетероатомов из ряда: атом серы, сульфинильная, сульфонильная группа, атом азота и атом кислорода,
остаток "М" означает группу -NH-, -CONH-, -NHCO- или же означает ковалентную связь,
при этом обозначенные выше группы "А", "В" и "D" в каждом отдельном случае могут быть от одного до нескольких раз замещены остатком из группы: атомы галогенов, трифторметильная группа, оксогруппа, цианогруппа, алканоильная группа с числом атомов углерода в алкильном остатке от одного до трех, группа -C(NR27R28)=NR29, -CONR28R29, -SO2NR28R29, группа -NR30R31, алкильная группа с числом атомов углерода от одного до четырех, циклопропильная, циклопентильная или циклогексильная группа,
R27, R28 и R29, одинаковые или разные, независимо друг от друга означают атом водорода, алкильную группу с числом атомов углерода от одного до четырех,
и/или
R28 и R29 вместе с соединяющим их атомом азота образуют насыщенный или частично ненасыщенный шестичленный гетероцикл, включающий до двух атомов азота,
R30 и R31, одинаковые или разные, независимо друг от друга означают алкильную группу с числом атомов углерода от одного до четырех,
R3, R4, R5, R6, R7 и R8 означают атом водорода,
а также их фармацевтически приемлемые соли, гидраты и гидраты солей, за исключением соединений общей формулы (I), у которых остаток R1 означает незамещенный 2-тиофеновый остаток и одновременно остаток R2 означает от одного до нескольких раз замещенный фенильный остаток и одновременно каждый из остатков R3, R4, R5, R6, R7 и R8 означают атом водорода.
В третью группу предпочтительных оксазолидинов общей формулы (I) входят соединения, у которых
R1 означает 2-тиофен, который может быть замещен в 5-положении остатком из группы: хлор, бром, метальная или трифторметильная группа,
R2 означает одну из следующих групп:
А-,
D-M-A-,
В-М-А-,
В-,
В-М-В-,
D-M-B-,
причем
остаток "А" означает фенильную группу,
остаток "В" означает пяти- или шестичленный ароматический гетероцикл, содержащий до двух гетероатомов из ряда: атом серы, атом азота, и атом кислорода,
остаток "D" означает остаток насыщенного пяти- или шестичленного гетероцикла, который включает атом азота и может содержать еще один гетероатом и/или звено в цепи на основе гетероатомов из ряда: атом серы, сульфинильная, сульфонильная группа и атом кислорода,
остаток "М" означает группу -NH-, -CONH-, -NHCO- или же означает ковалентную связь,
при этом обозначенные выше группы "А", "В" и "D" в каждом отдельном случае могут быть от одного до нескольких раз замещены остатком из группы: атомы галогенов, трифторметильная группа, оксогруппа, цианогруппа, алканоильная группа с числом атомов углерода в алкильном остатке от одного до трех, группа -CONR28R29, -SO2NR28R29, группа -NR30R31, алкильная группа с числом атомов углерода от одного до четырех, циклопропильная, циклопентильная или циклогексильная группа,
R28 и R29, одинаковые или разные, независимо друг от друга означают атом водорода или алкильную группу с числом атомов углерода от одного до четырех,
и/или
R28 и R29 вместе с соединяющим их атомом азота образуют насыщенный или частично ненасыщенный шестичленный гетероцикл, включающий до двух атомов азота,
R30 и R31, одинаковые или разные, независимо друг от друга означают алкильную группу с числом атомов углерода от одного до четырех,
R3, R4, R5, R6, R7 и R8 означают атом водорода,
а также их фармацевтически приемлемые соли, гидраты и гидраты солей, за исключением соединений общей формулы (I), у которых остаток R1 означает незамещенный 2-тиофеновый остаток и одновременно остаток R2 означает от одного до нескольких раз замещенный фенильный остаток и одновременно каждый из остатков R3, R4, R5, R6, R7 и R8 означают атом водорода.
Наиболее предпочтительным является соединение следующей формулы

и его фармацевтически приемлемые соли, гидраты и гидраты солей.
До настоящего времени оксазолидиноны описывались главным образом лишь в качестве антибиотиков, а в некоторых случаях и в качестве блокаторов моноаминоксидаз и антагонистов фибриногена (обзор по этой теме: B.Riedl, R.Endermann, Exp. Opin. Ther. Patents, 1999, 9 (5), 625), причем для проявления антибактериальных свойств судя по всему оказывается обязательным присутствие небольшой 5-[ацил-аминометильной] группы (предпочтительно 5-[ацетил-аминометильной] группы).
Замещенные арил- и гетероарилфенилоксазолидиноны, у которых атом азота оксазолидинонового кольца может быть связан с замещенным от одного до нескольких раз фенильным остатком и которые могут содержать в 5-положении оксазолидинонового кольца незамещенный N-метил-2-тиофенкарбоксамидный остаток, в частности замещенные оксазолидиноны общей формулы (А)

в которой
R9 означает незамещенный 2-тиофеновый остаток,
R10 означает фенил, незамещенный или замещенный 1-3 остатками из группы, включающей хлор, фтор, метокси, трифторметил,
или их фармацевтически приемлемые соли, гидраты и гидраты солей, а также их применение в качестве веществ с антибактериальным действием известны из патентов США №5929248, №5801246, №5756732, №5654435. №5654428 и №5565571.
Поэтому вторым объектом изобретения является применение известных соединений формулы (А) или их фармацевтически приемлемых солей, гидратов, гидратов солей в качестве средства, селективно ингибирующего фактор Ха и имеющего антитромботическое действие.
Соответствующие изобретению соединения общей формулы (I) в зависимости от набора заместителей могут существовать в стереоизомерных формах, которые отличаются как изображение и его зеркальное отражение (энантиомеры) или же не так, как изображение и его зеркальное отражение (диастереомеры). Изобретение относится как к энантиомерам или диастереомерам, так и к любым их смесям. Рацемические формы точно так же, как и диастереомеры, могут быть разделены известными способами на стереоизомерно однородные составляющие.
Кроме того, определенные соединения общей формулы (I) могут находиться в таутомерных формах. Это явление известно специалисту, и такие соединения также входят в объем притязаний изобретения.
Не вызывающие опасений с физиологической точки зрения соли, то есть приемлемые с фармацевтической точки зрения соли, могут быть представлены солями соответствующих изобретению соединений с неорганическими или с органическими кислотами. Предпочтение отдается солям с неорганическими кислотами, например с хлористоводородной кислотой, бромистоводородной кислотой, фосфорной кислотой или с серной кислотой, или же солям с органическими карбоновыми кислотами или сульфокислотами, например с уксусной кислотой, трифторуксусной кислотой, пропионовой кислотой, малеиновой кислотой, фумаровой кислотой, яблочной кислотой, лимонной кислотой, винной кислотой, молочной кислотой, бензойной кислотой или же с метансульфокислотой, этансульфокислотой, бензолсульфокислотой, толуолсульфокислотой или с нафталиндисульфокислотой.
В качестве фармацевтически приемлемых солей могут быть названы и соли с обычными основаниями, например соли щелочных металлов (например, натриевые или калиевые соли), соли с щелочноземельными металлами (например, кальциевые или магниевые соли) или же соли аммония, являющиеся производными аммиака или таких органических аминов, как, например, диэтиламин, триэтиламин, диизопропилэтиламин, прокаин, дибензиламин, N-метилморфолин, дигидроабиетиламин или метилпиперидин.
В соответствии с изобретением понятие "гидраты" относится к таким формам соединений приведенной выше общей формулы (I), которые в твердом или в жидком состоянии в результате гидратации образуют молекулярное соединение с водой (сольват). В гидратах молекулы воды присоединены без участия валентных связей межмолекулярными силами, в частности за счет образования мостиковых водородных связей. Твердые гидраты содержат воду в виде так называемой кристаллизационной воды в стехиометрических отношениях, причем молекулы воды по состоянию связанности не обязательно должны быть равноценными. Примерами гидратов являются полуторные гидраты, моногидраты, дигидраты или тригидраты. Точно также это относится и к гидратам солей соответствующих изобретению соединений.
Понятие "галоген" относится к атомам фтора, хлора, брома и йода. Предпочтение отдается атомам хлора или фтора.
Понятие алкильной группы с числом атомов углерода от одного до восьми относится к линейному или разветвленному алкильному остатку с числом атомов углерода от одного до восьми. В качестве примера можно назвать метальную, этильную, н-пропильную, изопропильную, н-бутильную, изобутильную, трет.-бутильную, н-пентильную и н-гексильную группу. Производными от этого определения аналогичным образом являются соответствующие алкильные группы с меньшим числом атомов углерода, например алкильные группы с числом атомов углерода от одного до шести и алкильные группы с числом атомов углерода от одного до четырех. В общем случае предпочтение отдается алкильной группе с числом атомов углерода от одного до четырех.
Понятие циклоалкильной группы с числом атомов углерода от трех до семи относится к циклическому алкильному остатку, включающему от трех до семи атомов углерода. В качестве примера можно назвать циклопропильную, циклобутильную, циклопентильную, циклогексильную или циклогептильную группу. Производными от этого понятия аналогичным образом являются соответствующие циклоалкильные группы с меньшим числом атомов углерода, например циклоалкильные группы с числом атомов углерода от трех до пяти. Предпочтение отдается циклопропильной, циклопентильной и циклогексильной группам.
Понятие алканоильной группы с числом атомов углерода от одного до шести относится к линейному или разветвленному алкильному остатку с числом атомов углерода от одного до шести, который в 1-положении несет соединенный двойной связью атом кислорода и присоединен по 1-положению. В качестве примеров следует назвать формильную, ацетильную, пропионильную, н-бутирильную, изобутирильную, пивалоильную, н-гексаноильную группу. Производными от этого понятия аналогичным образом являются соответствующие алканоильные группы с меньшим числом атомов углерода, например алканоильные группы с числом атомов углерода от одного до пяти, алканоильные группы с числом атомов углерода от одного до четырех и алканоильные группы с числом атомов углерода от одного до трех. В общем случае предпочтение отдается алканоильным группам с числом атомов углерода от одного до трех.
Понятие арильной группы с числом атомов углерода от шести до четырнадцати относится к ароматическому остатку с числом атомов углерода от шести до четырнадцати. В качестве примера следует назвать фенильную, нафтильную, фенантренильную и антраценильную группу. Производными от этого понятия аналогичным образом являются соответствующие арильные группы с меньшим числом атомов углерода, например арильные группы с числом атомов углерода от шести до десяти. В общем случае предпочтение отдается арильным группам с числом атомов углерода от шести до десяти.
Понятие пяти- или шестичленный ароматический гетероцикл, содержащий до трех гетероатомов и/или звеньев в цепи на основе гетероатомов из ряда: атом серы, кислорода, азота относится к моноциклическому гетероароматическому соединению, в качестве которого можно назвать пиридил, пиримидил, пиридазинил, фурил и тиенил.
В качестве насыщенного моно- или бициклического гетероцикла с числом членов от четырех до девяти, который может быть сконденсирован с бензолом и который содержит до трех гетероатомов и/или звеньев в цепи на основе гетероатомов из ряда: атом серы, сульфинильная группа, сульфонильная группа, атом азота, и атом кислорода, можно назвать тетрагидрофурил, пирролидинил, пирролинил, пиперидинил, 1,2-дигидропиридинил, 1,4-дигидропиридинил, пипепразинил, морфолинил, тиоморфолинил, азепинил и 1,4-диазепинил. Предпочтение отдается пиперидинильной, морфолинильной и пирролидинильной группам.
Замещенные оксазолидиноны вышеприведенной общей формулы (I) можно получать за счет того, что соединение общей формулы (II)

в которой
остатки R2, R3, R4, R5, R6, R7 и R8 имеют приведенные в п.1 значения,
подвергают взаимодействию с карбоновой кислотой общей формулы (III)
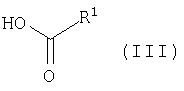
в которой
остаток R1 имеет приведенное в п.1 значение,
или же с соответствующим галогенангидридом карбоновой кислоты, предпочтительно с хлорангидридом карбоновой кислоты, или же с соответствующим симметричным или смешанным ангидридом карбоновой кислоты, представляющим собой производные представленных выше карбоновых кислот общей формулы (III),
в среде инертного растворителя в присутствии, если это необходимо, активирующего агента или конденсирующего средства и/или основания,
причем в тех случаях, когда R2 означает насыщенный циклический углеводородный остаток с числом членов в цикле от трех до семи, включающий один или несколько одинаковых или разных гетероатомов из группы: азот или сера, полученное соединение подвергают окислению с помощью селективного окислителя до соответствующего сульфинила, сульфона или N-оксида,
и/или
в тех случаях, когда молекула полученного соединения формулы (I) включает цианогруппу, в молекуле, данную цианогруппу можно превращать в амидиновую группу,
и/или
в тех случаях, когда молекула полученного соединения формулы (I) включает аминогруппу с трет.-бутоксикарбонильной защитой, данную защитную группу можно отщеплять обычными способами,
и/или
в тех случаях, когда молекула полученного соединения формулы (I) включает анилиновый или бензиламинный остаток, данную аминогруппу можно подвергать взаимодействию с различными реагентами, например с карбоновыми кислотами, ангидридами карбоновых кислот, хлорангидридами карбоновых кислот, изоцианатами, хлоридами судьфокислот или с алкилгалогенидами с образованием соответствующих производных,
и/или
в тех случаях, когда молекула полученного соединения формулы (I) включает фенильный остаток, данный остаок можно подвергать взаимодействию с хлорсульфоновой кислотой и затем с аминами с образованием соответствующих сульфамидов (далее: способ [А]).
Кроме того, замещенные оксазолидиноны вышеприведенной общей формулы (I) можно еще получать за счет того, что соединение общей формулы (IV)

где
остатки R1, R3, R4, R5, R6, R7 и R8 имеют приведенные в п.1 значения,
под действием подходящего селективного окислителя в среде инертного растворителя переводят в соответствующий эпоксид общей формулы (V)

где
остатки R1, R3, R4, R5, R6, R7 и R8 имеют приведенные в п.1 значения,
который затем подвергают взаимодействию с амином общей формулы (VI)

где
остаток R2 имеет приведенное в п.1 значение,
в среде инертного растворителя в присутствии, если это необходимо, катализатора, и сначала получают соединение общей формулы (VII)

где
остатки R1, R2, R3, R4, R5, R6, R7 и R8 имеют приведенные в п.1 значения,
которое затем подвергают циклизации в среде инертного растворителя в присутствии фосгена или эквивалентного фосгену вещества, например карбонилдиимидазола, с образованием соединения общей формулы (I),
причем в тех случаях, когда R2 означает насыщенный циклический углеводородный остаток с числом членов в цикле от трех до семи, включающий один или несколько одинаковых или разных гетероатомов из группы: азот или сера, полученное соединение формулы (I) подвергают окислению с помощью селективного окислителя до соответствующего сульфинила, сульфона или N-оксида,
и/или
в тех случаях, когда молекула полученного соединения формулы (I) включает цианогруппу, данную цианогруппу можно превращать в амидиновую группу,
и/или
в тех случаях, когда молекула полученного соединения формулы (I) включает аминогруппу с трет.-бутоксикарбонильной защитой, данную защитную группу можно отщеплять обычными способами,
и/или
в тех случаях, когда молекула полученного соединения включает анилиновый или бензиламинный остаток, данную аминогруппу можно подвергать взаимодействию с различными реагентами, например с карбоновыми кислотами, ангидридами карбоновых кислот, хлорангидридами карбоновых кислот, изоцианатами, хлоридами судьфокислот или с алкилгалогенидами с образованием соответствующих производных,
и/или
в тех случаях, когда молекула полученного соединения включает фенильный остаток, данный остаток можно подвергать взаимодействию с хлорсульфоновой кислотой и затем с аминами с образованием соответствующих сульфамидов (далее "способ [Б]").
Способы [А] и [Б], которые являются дополнительным объектом изобретения, поясняются следующими реакционными схемами:
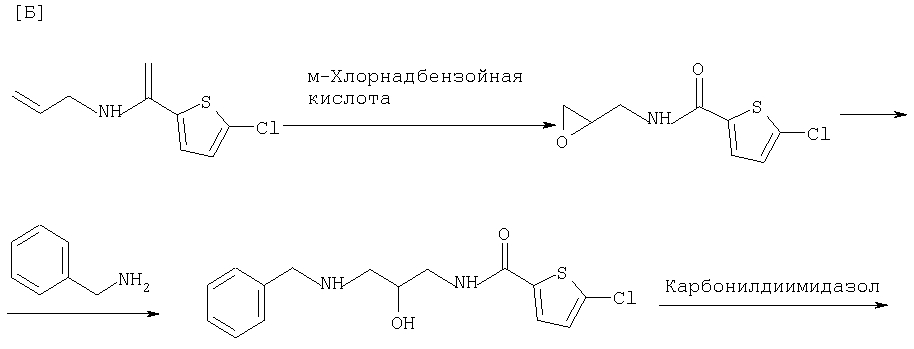

Описанный ранее процесс окисления, который может следовать за этими превращениями, может быть иллюстрирован следующей далее схемой реакций:

В качестве растворителей для реализации описанных выше способов подходят органические растворители, которые инертны в условиях реакций. К ним относятся такие галогензамещенные углеводороды, как дихлорметан, хлороформ, четыреххлористый углерод, 1,2-дихлорэтан, трихлорэтан, тетрахлорэтан, 1,2-дихлорэтилен или трихлорэтилен, такие простые эфиры, как диэтиловый эфир, диоксан, тетрагидрофуран, диметиловый эфир гликоля или диметиловый эфир диэтиленгликоля, такие спирты, как метанол, этанол, н-пропанол, изопропанол, н-бутанол или трет.-бутанол, такие углеводороды, как бензол, ксилол, толуол, гексан или циклогексан, а также диметилформамид, диметилсульфоксид, ацетонитрил, пиридин, гексаметилтриамид фосфорной кислоты или вода.
Можно также использовать смеси растворителей, состоящие из вышеназванных растворителей.
При этом в качестве активирующих реагентов или конденсирующих средств для представленных выше способов подходят используемые обычно для этого реагенты, например гидрохлорид N'-(3-диметиламинопропил)-N-этилкарбодиимида, N,N'-дициклогексилкарбодиимид, гидрат 1-гидрокси-1H-бензтриазола и подобные им соединения. В качестве оснований подходят обычные неорганические и органические основания. К ним предпочтительно относятся такие гидроксиды щелочных металлов, как, например, гидроксид натрия или гидроксид калия, или такие карбонаты щелочных металлов, как карбонат натрия или карбонат калия, а также метилат натрия или калия или же этилат натрия или калия, или трет.-бутилат калия, такие амиды, как амид натрия, бис-(триметилсилил)амид лития или диизопропиламид лития, или же такие амины, как триэтиламин, диизопропилэтиламин, диизопропиламин, 4-N,N-диметиламинопиридин или пиридин.
При этом основание может быть использовано в количестве от 1 до 5 молей, предпочтительно от 1 до 2 молей, из расчета на 1 моль соединения общей формулы (II).
В общем случае реакции протекают в температурном интервале от -78°С до температуры кипения реакционной массы, предпочтительно в интервале от 0°С до температуры кипения реакционной массы.
Взаимодействия могут проводиться при нормальном, при повышенном или при пониженном давлении (например в интервале от 0,5 до 5 бар). В общем случае работы проводят при нормальном давлении.
В качестве подходящих селективных окислителей как при получении эпоксидов, так и для возможного случая проведения реакции окисления с образованием сульфона, сульфоксида или N-оксида, могут рассматриваться, например, м-хлорнадбензойная кислота, метаперйодат натрия, N-метилморфолин-N-оксид, монопероксифталевая кислота или тетраоксид осмия.
Что касается получения эпоксидов, то для этого используются обычные условия проведения реакций.
Что касается более точных указаний на условия проведения реакций для окисления в сульфон, сульфоксид или N-оксид, если они проводятся, то здесь можно сослаться на следующую литературу: M.R.Barbachyn и др., J. Med. Chem. 1996, 39, 680, а также заявка на международный патент №97/10223.
Кроме того, можно сослаться на приведенные в экспериментальной части примеры от 14 до 16.
Амидинирование, если оно проводится, протекает в обычных условиях. Другие подробности процесса можно найти в примерах от 31 до 35 и от 140 до 147.
Соединения общих формул (II), (III), (IV) и (VI) в общем известны специалисту или же они могут быть получены обычными способами. Получение оксазолидинонов, в частности требуемых 5-(аминометил)-2-оксооксазолидинов, представлено в международных заявках на патент №98/01446, №93/23384, №97/03072, J.A.Tucker и др.; J. Med. Chem. 1998, 41, 3727; S.J.Brickner и др., J. Med. Chem. 1996, 39, 673; W.A.Gregory и др., J. Med. Chem. 1989, 32, 1673.
Соответствующие изобретению соединения общей формулы (I) показывают ценный спектр фармакологической активности, который нельзя было предвидеть заранее, поэтому они в частности могут найти применение для профилактики и/или для лечения заболеваний.
Соответствующие изобретению соединения общей формулы (I), в том числе и соединения, которые не могут быть защищены в качестве веществ как объекта изобретения, действуют, в частности, как антикоагулянты и поэтому они предпочтительно могут найти применение в лекарственных средствах для профилактики и/или для лечения тромбоэмболических заболеваний. В смысле настоящего изобретения к "тромбоэмбо-лическим заболеваниям" относятся, в частности, такие серьезные заболевания, как инфаркт миокарда, стенокардия (включая приступы стенокардии), реокклюзии и рестенозы после ангиопластических операций или аортокоронарного шунтирования, инсульт, перемежающиеся ишемические приступы, заболевания, связанные с закупоркой периферических артерий, эмболии легких или глубокие венозные тромбозы.
Кроме того, соответствующие изобретению соединения общей формулы (I), в том числе и соединения, которые не могут быть защищены в качестве веществ как объекта изобретения, пригодны в равной мере для лечения рассеянного интравазального свертывания крови.
И, наконец, соответствующие изобретению соединения общей формулы (I), в том числе и соединения, которые не могут быть защищены в качестве веществ как объекта изобретения, могут также рассматриваться в качестве средств для профилактики и/или для лечения атеросклероза и артрита, а кроме того, и для профилактики и/или лечения болезни Альцгеймера и рака.
Соответствующие изобретению соединения общей формулы (I), в том числе и соединения, которые не могут быть защищены в качестве веществ как объекта изобретения, действуют, в частности, как селективные ингибиторы фактора свертывания крови Ха и они не блокируют, или блокируют только при значительно более высоких концентрациях, другие сериновые протеазы, например тромбин, плазмин или трипсин.
В рамках настоящего изобретения понятие "селективные" относится к таким ингибиторам фактора свертывания крови Ха, у которых значения IC50 для ингибирования фактора Ха в 100 раз, предпочтительно в 500 раз, в частности в 1000 раз, меньше, чем значения IC50 для ингибирования других сериновых протеаз, в частности тромбина, плазмина и трипсина, а что касается способов экспериментальной проверки селективности, то они представлены далее в описываемых методиках тестирования по примерам А-1) а.1) и а.2).
Кроме того, соответствующие изобретению соединения общей формулы (I), в том числе и соединения, которые не могут быть защищены в качестве веществ как объекта изобретения, могут быть использованы также для предотвращения коагуляции ex vivo, например, при консервировании крови или для биологических проб, содержащих фактор Ха.
В соответствии с изложенным объектом настоящего изобретения являются оксазолидиноны формулы (I), которые в частности неожиданно оказывают сильное и селективное блокирующее действие на фактор Ха, причем это относится и к соединениям, которые не могут быть защищены в качестве веществ как объекта изобретения.
Вместе с этим, другим объектом изобретения является лекарственное средство, селективно ингибирующее фактор Ха и имеющее антитромботическое действие, содержащее по крайней мере одно соединение вышеприведенной общей формулы (I) наряду с одним или с несколькими фармакологически допустимыми вспомогательными веществами или носителями.
При рассмотрении способов введения в организм соответствующих изобретению соединений во внимание могут быть приняты все обычные лекарственные формы. Предпочтительно, когда введение осуществляется орально, лингвально, сублингвально, буккально, ректально или парентерально (это значит без участия желудочно-кишечного тракта, то есть внутривенно, внутриартериально, внутрисердечно, в кожу, подкожно, через кожу, внутрибрюшинно или внутримышечно). В частности для этого подходят оральный и внутривенный способ введения. Особое предпочтение отдается оральному способу введения, что представляет собой еще одно преимущество по сравнению с известной из уровня техники терапией тромбоэмболических заболеваний.
Новые активные вещества общей формулы (I) могут быть известным способом переведены в такие обычные лекарственные формы, как таблетки, драже, пилюли, грануляты, аэрозоли, сиропы, эмульсии, суспензии и растворы, с использованием инертных нетоксичных, подходящих в фармацевтическом отношении носителей или растворителей. При этом терапевтически активное соединение в каждом отдельном случае должно присутствовать в концентрации от примерно 0,1 до 95 масс.%, предпочтительно от 0,5 до 90 масс.%, в частности от 1 до 85 масс.%, от всей смеси, то есть в количествах, которые достаточны для достижения предписанного интервала дозировок.
Тем не менее в отдельных случаях может появиться необходимость в отклонении от указанных выше количеств, а именно в зависимости от массы тела или, соответственно, от способа введения, в зависимости от индивидуального отношения к лекарству, от вида лекарственной формы и от момента времени или, соответственно, интервала, в который происходит его прием. Так, в некоторых случаях может оказаться достаточным меньшее чем указанное выше минимальное количество, тогда как в других случаях появляется необходимость в превышении указанной верхней границы. В случае введения в организм повышенных количеств можно рекомендовать их распределение в течение дня на несколько отдельных доз.
Лекарственные формы получают, например, путем разбавления активных веществ растворителями и/или веществами носителями с использованием, если это необходимо, эмульгирующих средств и/или диспергирующих средств, причем, например, в случае использования в качестве разбавителя воды при необходимости могут быть использованы и органические растворители в качестве солюбилизаторов.
В общем случае определенные преимущества получаются, когда при внутривенном способе введения для достижения действенных результатов прописывают количества от примерно 0,001 до 10 мг/кг, предпочтительно от примерно 0,01 до 10 мг/кг, в частности от примерно 0, 1 до 8 мг на кг массы тела.
В общем случае определенные преимущества получаются, когда при оральном способе введения для достижения действенных результатов прописывают количества от примерно 0,01 до 50 мг/кг, предпочтительно от примерно 0,1 до 10 мг/кг, в частности от примерно 0,5 до 8 мг на кг массы тела.
Тем не менее в отдельных случаях может появиться необходимость в отклонении от указанных выше количеств при внутривенном или, соответственно, при оральном введении, а именно в зависимости от массы тела или, соответственно, от способа введения, в зависимости от индивидуального отношения к лекарству, от вида лекарственной формы и от момента времени или, соответственно, интервала, в который происходит его прием. Так, в некоторых случаях может оказаться достаточным меньшее чем указанное выше минимальное количество, тогда как в других случаях появляется необходимость в превышении указанной верхней границы. В случае введения в организм повышенных количеств можно рекомендовать их распределение в течение дня, с приемом нескольких отдельных доз или с использованием замедленного вливания.
Соответствующие изобретению соединения общей формулы (I) отличаются от обычных препаратов для лечения тромбоэмболических заболеваний в частности тем, что благодаря селективной блокировке фактора Ха достигается большая терапевтическая широта. Для пациента это означает меньший риск кровотечения, а для лечащего врача лучшую установку пациента на выздоровление. Кроме того, будучи обусловленным механизмом действия, эффект проявляется быстро. Однако прежде всего соответствующие изобретению соединения позволяют принимать их через рот, что составляет еще одно преимущество при лечении соответствующими изобретению соединениями.
Настоящее изобретение иллюстрируется следующими далее примерами, которые никак не могут ограничивать объем его притязаний.
Примеры
А. Оценка физиологической активности
1. Общие методики испытаний
Особое преимущество биологических свойств соответствующих изобретению соединений может быть установлено следующими далее способами.
а) Описание экспериментов (in vitro)
а.1) Измерение блокирования фактора Ха
Ферментативная активность фактора Ха (FXa) человека измерялась по результатам взаимодействия специфичного по отношению к FXa хромогенного субстрата. При этом фактор Ха отщепляет от хромогенного субстрата n-нитроанилин. Измерения проводились по приведенной далее методике на пластинках для микротитрования.
Исследуемые вещества растворяют в диметилсульфоксиде в различных концентрациях и инкубируют их при температуре 25°С в течение 10 минут с FXa человека (0,5 нмоль/л в виде раствора в ТРИС-буфере с концентрацией 50 ммоль/л С,С,С-трис-(гидроксиметил)аминометана, 150 ммоль/л хлорида натрия, 0,1% альбумина бычьей сыворотки, рН 8,3). В контрольном опыте берут чистый диметилсульфоксид. После этого прибавляют хромогенный субстрат (150 мкмоль/л Pefachrome® FXa производства Пентафарм). После инкубирования в течение 20 минут при 25°С определяют экстинкцию при 405 нм. Экстинкции в опытных загрузках с исследуемыми веществами сравнивают с контрольными загрузками без исследуемого вещества и исходя из этого рассчитывают значение IC50.
Результаты испытаний сведены в таблице 1.
а.2) Определение селективности
Для доказательства селективного ингибирования фактора Ха исследуемые вещества исследовались на ингибирование других сериновых протеаз человека, таких как тромбин, трипсин, плазмин. Для определения ферментативной активности тромбина (75 мУ/мл), трипсина (500 мУ/мл) и плазмина (3, 2 нмоль/л) эти ферменты растворяют в ТРИС-буфере (100 ммоль/л, 20 ммоль/л хлорида кальция, рН 8,0) и в течение 10 минут инкубируют с исследуемым веществом или с растворителем. После этого прибавлением соответствующих специфичных хромогенных субстратов (Chromozym Thrombin® производства Берингер Маннгейм, Chromozym Trypsin® производства Берингер Маннгейм, Chromozym Plasmin® производства Берингер Маннгейм) запускают ферментативную реакцию и через 20 минут определяют экстинкцию при 405 нм. Все определения проводят при 37°С. Экстинкции в опытных загрузках с исследуемыми веществами сравнивают с контрольными пробами без исследуемого вещества и исходя из этого рассчитывают значение IC50.
а.3) Определение антикоагуляционного действия
Антикоагуляционное действие исследуемых веществ определяют in vitro в плазме крови человека. Для этого человеческую кровь собирают в приемник с использованием 0,11 молярного раствора цитрата натрия при соотношении в смеси цитрат натрия/кровь, равном 1/9. Непосредственно после отбора кровь хорошо перемешивают и в течение 10 минут центрифугируют при примерно 2000g. Жидкость над осадком отбирают пипеткой. Протромбиновое время (синонимы: тромбопластиновое время, экспресс-анализ) определяют в присутствии варьируемых концентраций исследуемого вещества или соответствующего растворителя с помощью поступающего в продажу тест-набора (Neoplastin® производства Берингер Маннгейм). Исследуемые соединения в течение 10 минут инкубируют с плазмой при температуре 37°С. После этого прибавлением тромбопластина вызывают свертывание и фиксируют время начала свертывания. Определяют концентрацию исследуемого вещества, которая вызывает двукратное увеличение протромбинового времени.
б) Определение антитромботического действия (in vivo)
б.1) Модель артериовенозного шунтирования (на крысах)
Голодных крыс самцов (штамм HSD CPB:WU) весом от 200 до 250 г наркотизируют раствором Rompun/Ketavet (12 мг/кг/50 мг/кг). Образование тромба вызывают на артериовенозном шунте по аналогии с описанной Christopher N. Berry и др., Br. J. Pharmacol. (1994), 113, 1209-1214, методикой. Для этого препарируют левую яремную вену и правую сонную артерию. Между обоими сосудами устанавливают экстракорпоральный шунт с помощью полиэтиленового (РЕ 60) шланга длиной 10 см. В середине этого полиэтиленового шланга вставлен еще один полиэтиленовый (РЕ 160) шланг длиной 3 см, в который в качестве тромбогенной поверхности помещена петля из разлохмаченной нейлоновой нити. Экстракорпоральное кровообращение поддерживают в течение 15 минут. После этого удаляют шунт и сразу взвешивают нейлоновую нить с тромбом. Исходную массу нейлоновой нити определяют до начала опыта. Исследуемые вещества дают бодрствующим животным перед наложением экстракорпорального кровообращения внутривенно через вену хвоста или орально через глоточный зонд.
Результаты приведены в таблице 2.
6.2) Модель артериального тромбоза (на крысах)
Голодных крыс самцов (штамм HSD CPB:WU) наркотизируют так, как описано выше. Вес крыс в среднем около 200 г. Левую сонную артерию препарируют на длину около 2 см. Образование артериального тромба индуцируют путем механического повреждения сосуда по аналогии с описанной в работе K.Meng и др., Naunyn Schmiedeberg's Arch. Pharmacol. (1977), 301, 115-119, методикой. Для этого препарированную сонную артерию отключают от кровообращения зажимами, на две минуты охлаждают в металлическом желобке до -12°С и для стандартизации размера тромба одновременно сжимают грузом в 200 г. После этого дополнительно снижают ток крови охватывающим сонную артерию пружинным зажимом, установленным на некотором удалении от поврежденного участка сосуда. Ближний зажим снимают, закрывают рану и снова вскрывают ее через 4 часа для извлечения поврежденного отрезка сосуда. Отрезок сосуда вскрывают в продольном направлении и удаляют тромб из поврежденного участка сосуда. Сразу определяют массу тромбов во влажном состоянии. Исследуемые вещества дают бодрствующим животным внутривенно через вену хвоста или орально через глоточный зонд.
б.3) Модель венозного тромбоза (на крысах)
Голодных крыс самцов (штамм HSD CPB:WU) наркотизируют так, как описано выше, Вес крыс в среднем около 200 г. Левую яремную вену препарируют на длину около 2 см. Образование венозного тромба индуцируют путем механического повреждения сосуда по аналогии с описанной в работе K.Meng и др., Naunyn Schmiedeberg's Arch. Pharmacol. (1977), 301, 115-119, методикой. Для этого яремную вену отключают от кровообращения зажимами, на две минуты охлаждают в металлическом желобке до -12°С и для стандартизации размера тромба одновременно сжимают грузом в 200 г. Снова открывают кровообращение и закрывают рану. Через 4 часа снова вскрывают рану для извлечения тромба из поврежденного отрезка сосуда. Сразу определяют массу тромбов во влажном состоянии. Исследуемые вещества дают бодрствующим животным внутривенно через вену хвоста или орально через глоточный зонд.
Б. Примеры получения
Исходные соединения
Получение 3-морфолинона описано в патенте США № 5349045.
Получение N-(2,3-эпоксипропил)фталимида описано у J.-W. Chem. и др. Tetrahedron Lett. 1998, 39, 8483.
Замещенные анилины могут быть получены в результате взаимодействия, например, 4-фторнитробензола, 2,4-дифторнитробензола или 4-хлорнитробензола с соответствующими аминами или амидами в присутствии основания. Эта реакция может также проводиться в присутствии таких палладиевых катализаторов, как диацетат палладия/DPPF/трет.-бутилат натрия (Tetrahedron Lett. 1999, 40, 2035) или медь (Renger, Synthesis 1985, 856; Aebischer и др., Heterocycles 1998, 48, 2225). Галогензамещенные ароматические соединения без нитрогруппы могут быть также сначала превращены в соответствующие амиды для того, чтобы затем провести нитрование в 4-положение (патент США №3279880).
I. 4-(4-Морфолин-3-онил)нитробензол

В 2 л N-метилпирролидона растворяют 2 моля (202 г) морфолин-3-она (E.Pfeil, U.Harder, Angew. Chem. 79, 1967, 188). В течение двух часов отдельными порциями прибавляют 88 г (2,2 моля) гидрида натрия (60% в парафине). После окончания выделения водорода при охлаждении, поддерживая комнатную температуру, в течение 1 часа прибавляют по каплям 282 г (2 моля) 4-фторнитробензола и оставляют реакционную смесь на ночь при перемешивании. После этого в вакууме 12 мбар при температуре 76°С отгоняют 1,7 л объема жидкости, остаток выливают в 2 л воды и экстрагируют эту смесь дважды по 1 л этилацетата. После промывки объединенных органических фаз водой сушат сульфатом натрия и отгоняют в вакууме растворитель. Очистку проводят хроматографированием на силикагеле смесью гексан/этилацетат (1:1) с последующей кристаллизацией из этилацетата. Продукт получают в виде бесцветного или коричневатого твердого вещества с выходом 78 г (17,6% от теории).
Спектр 1Н-ЯМР (300 МГц, дейтерохлороформ): 3, 86 (м., 2Н, CH2CH2), 4,08 (м., 2Н, CH2 CH2), 4,49 (с, 2Н, CH2СО), 7,61 (д., 2Н,3J=8,95 Гц, CHCH), 8,28 (д., 2Н,3J=8,95 Гц, CHCH).
Масс-спектр (относительная интенсивность в %): 222 (74, М+), 193 (100), 164 (28), 150 (21), 136 (61), 117 (22), 106 (24), 90 (37), 76 (38), 63 (32), 50 (25).
Аналогично синтезированы следующие соединения:
3-фтор-4-(4-морфолин-3-онил)нитробензол,
4-(N-пиперидонил)нитробензол,
3-фтор-4-(N-пиперидонил)нитробензол,
4-(N-пирролидонил)нитробензол,
3-фтор-4-(N-пирролидонил)нитробензол.
II. 4-(4-Морфолин-3-онил)анилин

В автоклаве в 200 мл тетрагидрофурана растворяют 63 г (0,275 моля) 4-(4-Морфолин-3-онил)нитробензола, прибавляют 3,1 г 5%-ного палладия на угле и 8 часов гидрируют при температуре 70°С и при давлении водорода 50 бар. После отделения катализатора фильтрованием отгоняют в вакууме растворитель и очищают продукт кристаллизацией из этилацетата. Получают продукт в виде бесцветного или голубоватого твердого вещества с выходом 20 г (37,6% от теории).
Очистка также может быть проведена хроматографированием на силикагеле смесью гексана и этилацетата (1:1).
Спектр 1Н-ЯМР (300 МГц, дейтерохлороформ): 3,67 (м., 2Н, CH2СН2), 3,99 (м., 2Н, СН2CH2), 4,27 (с., 2Н, CH2СО), 6,68 (д., 2Н,3J=8,71 Гц, CHCH), 7,03 (д., 2Н,3J=8,71 Гц, CHCH).
Масс-спектр (относительная интенсивность в %): 192 (100, М+), 163 (48), 133 (26), 119 (76), 106 (49), 92 (38), 67 (27), 65 (45), 52 (22), 28 (22).
Аналогично синтезированы следующие соединения:
3-фтор-4-(4-морфолин-3-онил)анилин,
4-(N-пиперидонил)анилин,
3-фтор-4-(N-пиперидонил)анилин,
4-(N-пирролидонил)анилин,
3-фтор-4-(N-пирролидонил)анилин.
Общий способ получения 4-замещенных анилинов взаимодействием 1-фтор-4-нитробензолов и 1-хлор-4-нитробензолов с первичными и вторичными аминами с последующим восстановлением

Эквимолярные количества фторнитробензола или, соответственно, хлорнитробензола и анилина растворяют в диметилсульфоксиде или в ацетонитриле (концентрация раствора от 0,1 М до 1,0 М) и оставляют при перемешивании на ночь при температуре 100°С. После охлаждения до комнатной температуры реакционную смесь разбавляют эфиром и промывают водой. Органическую фазу сушат над сульфатом магния, фильтруют и упаривают. Если в реакционной смеси выпадает осадок, то его отфильтровывают и промывают эфиром или ацетонитрилом. Если и в маточном растворе обнаруживается продукт, то его обрабатывают эфиром и водой, как это описано выше. Сырые продукты могут быть очищены хроматографированием на силикагеле (смесями дихлорметан/циклогексан и дихлорметан/этанол).
Для завершающего восстановления нитросоединение растворяют в метаноле, в этаноле или в смесях этанола с дихлорметаном (концентрации в растворах от 0,01 М до 0,5 М), прибавляют 10%-ный палладий на угле и оставляют на ночь при перемешивании в атмосфере водорода при нормальном давлении. Затем фильтруют и упаривают. Сырой продукт может быть очищен хроматографированием на силикагеле (смесями дихлорметана с этанолом) или методом препаративной ВЭЖХ с обращением фаз (смесями ацетонитрила с водой).
В качестве альтернативного восстановителя может быть также использован порошок железа. Для этого нитросоединение растворяют в уксусной кислоте (концентрация в растворе от 0, 1 М до 0,5 М) и при 90°С отдельными порциями прибавляют в течение 10-15 минут шесть эквивалентов порошка железа и воду (от 0,3 до 0,5 от объема уксусной кислоты). Через 30 минут при температуре 90°С фильтруют и упаривают фильтрат. Остаток экстрагируют этилацетатом с добавлением 2 н. раствора гидроксида натрия. Органическую фазу сушат над сульфатом магния, фильтруют и упаривают. Сырой продукт может быть очищен хроматографированием на силикагеле (смесями дихлорметана с этанолом) или методом препаративной ВЭЖХ с обращением фаз (смесями ацетонитрила с водой).
Аналогичным способом получены следующие далее исходные соединения.
III-1. Трет.-бутил-1(4-аминофенил)-L-пролинат
Масс-спектр (ионизация электрораспылением): m/z (%)=304(M+H+CH3CN, 100), 263 (M+H, 20).
ВЭЖХ (метод 4): время удерживания 2,79 мин.
III-2. 1-(4-Аминофенил)-3-пиперидинкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=220 (M+H, 100).
ВЭЖХ (метод 4): время удерживания 0,59 мин.
III-3. 1-(4-Аминофенил)-4-пиперидинкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=220 (M+H, 100).
ВЭЖХ (метод 4): время удерживания 0,57 мин.
III-4. 1-(4-Аминофенил)-4-пиперидинон
Масс-спектр (ионизация электрораспылением): m/z (%)=191 (M+H, 100).
ВЭЖХ (метод 4): время удерживания 0,64 мин.
III-5. 1-(4-Аминофенил)-L-пролинамид
Масс-спектр (ионизация электрораспылением): m/z (%)=206 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 0,72 мин.
III-6. [1-(4-Аминофенил)-3-пиперидинил]метанол
Масс-спектр (ионизация электрораспылением): m/z (%)=207 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 0,60 мин.
III-7. [1-(4-Аминофенил)-2-пиперидинил]метанол
Масс-спектр (ионизация электрораспылением): m/z (%)=207 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 0,59 мин.
III-8. Этиловый эфир 1-(4-аминофенил)-2-пиперидинкарбоновой кислоты
Масс-спектр (ионизация электрораспылением): m/z (%)=249 (М+Н, 35), 175 (100).
ВЭЖХ (метод 4): время удерживания 2,43 мин.
III-9. [1-(4-Аминофенил)-2-пирролидинил]метанол
Масс-спектр (ионизация электрораспылением): m/z (%)=193 (М+Н, 45).
ВЭЖХ (метод 4): время удерживания 0,79 мин.
III-10. 4-(2-Метилгексагидро-5Н-пирроло[3, 4-d]изоксазол-5-ил)фениламин
Получают из 2-метилгексагидро-2Н-пирроло[3,4-d]изоксазола (Ziegler, Carl В., и др., J. Heterocycl. Chem., 25, 2,1988, 719-723).
Масс-спектр (ионизация электрораспылением): m/z (%)=220 (М+Н, 50), 171 (100).
ВЭЖХ (метод 4): время удерживания 0,54 мин.
III-11. 4-(1-Пирролидинил)-3-(трифторметил)анилин
Масс-спектр (ионизация электрораспылением): m/z (%)=231 (М+Н, 100).
ВЭЖХ (метод 7): время удерживания 3,40 мин.
III-12. 3-Хлор-4-(1-пирролидинил)анилин
Масс-спектр (ионизация электрораспылением): m/z (%)=197 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 0,78 мин.
III-13. 5-Амино-2-(4-морфолинил)бензамид
Масс-спектр (ионизация электрораспылением): m/z (%)=222 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 0,77 мин.
III-14. 3-Метокси-4-(4-морфолинил)анилин
Масс-спектр (ионизация электрораспылением): m/z (%)=209 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 0,67 мин.
III-15. 1-[5-Амино-2-(4-морфолинил)фенил]этанон
Масс-спектр (ионизация электрораспылением): m/z (%)=221 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 0,77 мин.
Общий способ получения 4-замещенных анилинов взаимодействием 1-фтор-4-нитробензолов с амидами с последующим восстановлением

В диметилформамиде растворяют амид и прибавляют 1,5 эквивалента трет.-бутилата калия. Смесь 1 час перемешивают при комнатной температуре, затем отдельными порциями прибавляют 1, 2 эквивалента 1-фтор-4-нитробензола. Реакционную смесь оставляют при перемешивании на ночь при комнатной температуре, разбавляют эфиром и этилацетатом и промывают насыщенным раствором бикарбоната натрия в воде. Органическую фазу сушат над сульфатом магния, фильтруют и упаривают. Сырой продукт может быть очищен хроматографированием на силикагеле (смесями дихлорметана с этанолом).
Для завершающего восстановления нитросоединение растворяют в этаноле (концентрации в растворах от 0,01 М до 0,5 М), прибавляют 10%-ный палладий на угле и оставляют на ночь при перемешивании в атмосфере водорода при нормальном давлении. Затем фильтруют и упаривают. Сырой продукт может быть очищен хроматографированием на силикагеле (смесями дихлорметана с этанолом) или методом препаративной ВЭЖХ с обращением фаз (смесями ацетонитрила с водой).
В качестве альтернативного восстановителя может быть также использован порошок железа. Для этого нитросоединение растворяют в уксусной кислоте (концентрация в растворе от 0,1 М до 0,5 М) и при 90°С отдельными порциями прибавляют в течение 10-15 минут шесть эквивалентов порошка железа и воду (от 0,3 до 0,5 от объема уксусной кислоты). Через 30 минут при температуре 90°С фильтруют и упаривают фильтрат. Остаток экстрагируют этилацетатом с добавлением 2 н. раствора гидроксида натрия. Органическую фазу сушат над сульфатом магния, фильтруют и упаривают. Сырой продукт может быть очищен хроматографированием на силикагеле (смесями дихлорметана с этанолом) или методом препаративной ВЭЖХ с обращением фаз (смесями ацетонитрила с водой).
Аналогичным способом получены следующие далее исходные соединения.
IV-1. 1-[4-Амино-2-(трифторметил)фенил)]-2-пирролидинон
Масс-спектр (ионизация электрораспылением): m/z (%)=245 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,98 мин.
IV-2. 4-[4-Амино-2-(трифторметил)фенил)]-3-морфолинон
Масс-спектр (ионизация электрораспылением): m/z (%)=261 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2, 54 мин.
IV-3. 4-(4-Амино-2-хлорфенил)-3-морфолинон
Масс-спектр (ионизация электрораспылением): m/z (%)=227 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 1,96 мин.
IV-4. 4-(4-Амино-2-метилфенил)-3-морфолинон
Масс-спектр (ионизация электрораспылением): m/z (%)=207 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 0,71 мин.
IV-5. 5-Амино-2-(3-оксо-4-морфолинил)бензонитрил
Масс-спектр (ионизация электрораспылением): m/z (%)=218 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 1,85 мин.
IV-6. 1-(4-Амино-2-хлорфенил)-2-пирролидинон
Масс-спектр (ионизация электрораспылением): m/z (%)=211 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,27 мин.
IV-7. 4-(4-Амино-2,6-диметилфенил)-3-морфолинон
Получают из 2-фтор-1,3-диметил-5-нитрбензола (Bartoli и др., J. Org. Chem. 1975, 40, 872)
Масс-спектр (ионизация электрораспылением): m/z(%)=221 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 0,77 мин.
IV-8. 4-(2, 4-Диаминофенил)-3-морфолинон
Получают из 1-фтор-2,4-динитробензола.
Масс-спектр (ионизация электрораспылением): m/z (%)=208 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 0,60 мин.
IV-9. 4-(4-Амино-2-хлорфенил)-2-метил-3-морфолинон
Получают из 2-метил-3-морфолинона (E.Pfeil, U.Harder, Angew. Chem. 1967, 79, 188).
Масс-спектр (ионизация электрораспылением): m/z (%)=241 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,27 мин.
IV-10. 4-(4-Амино-2-хлорфенил)-6-метил-3-морфолинон
Получают из 6-метил-3-морфолинона (европейский патент №350002).
Масс-спектр (ионизация электрораспылением): m/z (%)=241 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,43 мин.
Получение соединений формулы (I)
Следующие далее примеры от 1 до 13, от 17 до 19 и от 36 до 57 относятся к способа [А].
Пример 1
Получение N-{[(5S)-3-(3-Фтор-4-морфолинофенил)-2-оксо-1, 3-оксазолидин-5-ил]метил}-5-хлор-2-тиофенкарбоксамида

В 9,9 мл диметилформамида растворяют 0,45 г (1,52 ммоля) (5S)-5-(аминометил)-3-(3-фтор-4-морфолинофенил)-1,3-оксазолидин-2-она (получен по методике S.J.Brickner и др., J. Med. Chem. 1996, 39, 673), 0,25 г (1, 52 ммоля) 5-хлортиофен-2-карбоновой кислоты и 0,3 г (1,3 эквивалента) гидрата 1-гидрокси-1Н-бензтриазола. К этой смеси прибавляют 0,31 г (1,98 ммоля, 1,3 эквивалента) N'-(3-диметиламинопропил)-N-этилкарбодиимида и при комнатной температуре прибавляют по каплям 0,39 г (0,53 мл, 3,05 ммоля, 2 эквивалента) диизопропилэтиламина. Оставляют на ночь при перемешивании при комнатной температуре. Прибавляют 2 г силикагеля и упаривают смесь в вакууме досуха. Остаток хроматографируют на силикагеле градиентом концентраций толуола/этилацетата. Получают 0,412 г (61,5% от теории) целевого соединения с т.пл. 197°С.
Rf(на силикагеле, толуол/этилацетат 1:1)=0,29 (у исходного продукта Rf=0,0).
Масс-спектр (десорбционно-химическая ионизация): 440,2 (М+Н), Cl-матрица.
Спектр1Н-ЯМР (d6-диметилсульфоксид, 300 МГц): 2,95 (м., 4Н), 3,6 (т., 2Н), 3,72 (м., 4Н), 3,8 (д.д., 1Н), 4,12 (т., 1Н), 4,75-4,85 (м., 1Н), 7,05 (т., 1Н), 7,15-7,2 (м., 3Н), 7,45 (д.д., 1Н), 7,68 (д., 1Н), 8,95 (т., 1Н).
Пример 2
N-{[(5S)-3-(4-Морфолинофенил)-2-оксо-1,3-оксазолидин-5-ил]метил}-5-хлор-2-тиофенкарбоксамид

Получают по аналогии с примером 1 из бензил-4-морфолинофенилкарбамата через стадию образования (5S)-5-(аминометил)-3-(3-фтор-4-морфолинофенил)-1,3-оксазолидин-2-она.
Т.пл.198°С.
Значение IC50=43 нМ.
Rf (на силикагеле, толуол/этилацетат 1:1)=0,24.
Пример 3
N-({(5S)-3-[3-Фтор-4-(1,4-тиазинан-4-ил)фенил]-2-оксо-1,3-оксазолидин-5-ил} метил)-5-хлор-2-тиофенкарбоксамид
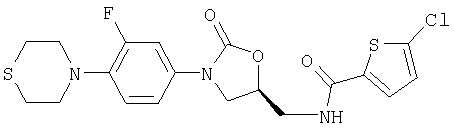
Получают аналогично из (5S)-5-(аминометил)-3-[3-фтор-4-1,4-тиазинан-4-ил)фенил]-1, 3-оксазолидин-2-она (его получение описано в M.R.Barbachyn и др., J. Med. Chem. 1996, 39, 680).
Т.пл. 193°С.
Выход 82%.
Rf (на силикагеле, толуол/этилацетат 1:1)=0,47 (у исходного продукта Rf =0,0).
Пример 4
5-Бром-N-({(5S)-3-[3-фтор-4-(1,4-тиазинан-4-ил)фенил]-2-оксо-1, 3-оксазолидин-5-ил}метил)-2-тиофенкарбоксамид
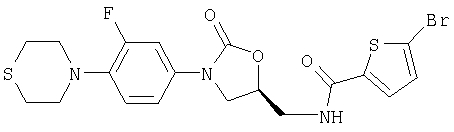
Получают аналогично из 5-бромтиофен-2-карбоновой кислоты.
Т.пл. 200°С.
Пример 5
5-Метил-N-({(5S)-3-[3-фтор-4-(1,4-тиазинан-4-ил)фенил]-2-оксо-1,3-оксазолидин-5-ил} метил)-2-тиофенкарбоксамид

Получают аналогично из 5-метилтиофен-2-карбоновой кислоты.
Т.пл. 167°С.
Пример 6
Н-{[(5S)-3-(6-Метилтиено[2,3-b]пиридин-2-ил)-2-оксо-1,3-оксазолидин-5-ил]метил}-5-хлор-2-тиофенкарбоксамид
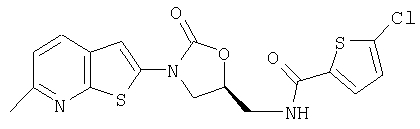
Получают аналогично из (5S)-5-(аминометил)-3-(6-метилтиено[2,3-b]пиридин-2-ил)-1, 3-оксазолидин-2-она (его получение описано в заявке на европейский патент №785200).
Т.пл. 247°С.
Пример 7
N-{[(5S)-3-(3-Метил-2-оксо-2, 3-дигидро-1,3-бензотиазол-6-ил)-2-оксо-1, 3-оксазолидин-5-ил]метил}-5-хлор-2-тиофенкарбоксамид

Получают аналогично из 6-[(5S)-5-(аминометил)-2-оксо-1,3-оксазолидин-3-ил]-3-метил-1,3-бензотиазол-2(3Н)-она (его получение описано в заявке на европейский патент №738726).
Т.пл. 217°С.
Пример 8
N-[((5S)-3-{3-Фтор-4-[4-(4-пиридинил)пиперазино]фенил}-2-оксо-1,3-оксазолидин-5-ил)метил]-5-хлор-2-тиофенкарбоксамид

Получают аналогично из (5S)-5-(аминометил)-3-{3-фтор-4-[4-(4-пиридинил)пиперазино]фенил}-1,3-оксазолидин-2-она (его получают аналогично J.A.Tucker и др., J. Med. Chem. 1998, 41, 3727). Масс-спектр (ионизация электрораспылением): 516 (М+Н), Cl-матрица.
Пример 9
N-({(5S)-3-[3-Фтор-4-(4-метилилпиперазино)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамид

Получают аналогично из (5S)-5-(аминометил)-3-[3-фтор-4-(4-метилпиперазино)фенил]-1,3-оксазолидин-2-она.
Пример 10
N-({(5S)-3-[3-Фтор-4-(4-трет.-бутоксикарбонилпиперазин-1-ил)фенил]-2-оксо-1, 3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамид

Получают аналогично из (5S)-5-(аминометил)-3-[3-фтор-4-(4-трет.-бутоксикарбонил-пиперазин-1-ил)фенил]-1,3-оксазолидин-2-она (его получение приведено в уже цитированной заявке на международный патент №93/23384.
Т.пл. 184°С.
Rf (на диоксиде кремния, толуол/этилацетат 1:1)=0,42.
Пример 11
N-({(5S)-3-[3-Фтор-4-(4-пиперазин-1-ил)фенил]-2-оксо-1,3-оксазолидин-5-ил}-метил)-5-хлор-2-тиофенкарбоксамид

Получают действием трифторуксусной кислоты в метиленхлориде на соединение по примеру 10.
Значение IC50=140 нМ.
Спектр1Н-ЯМР (d6-диметилсульфоксид): 3,01-3,25 (м., 8Н), 3,5-3,65 (м., 2Н), 3,7-3,9 (м., 1Н), 4,05-4,2 (м., 1Н), 4,75-4,9 (м., 1Н), 7,05-7,25 (м., 3Н), 7,5 (д.д., 1Н), 7,7 (д., 1Н), 8,4 (ш.с., 1Н), 9,0 (т., 1Н).
Пример 12
N-[((5S)-3-(2,4'-Бипиридинил-5-ил)-2-оксо-1, 3-оксазолидин-5-ил)метил]-5-хлор-2-тио-фенкарбоксамид

Получают аналогично из (5S)-5-(аминометил)-3-(2,4'-бипиридинил-5-ил)-1,3-оксазоли-дин-2-она (его получение приведено в заявке на европейский патент №789026).
Rf (на диоксиде кремния, толуол/этилацетат 1:2)=0,6.
Масс-спектр (ионизация электрораспылением): 515 (М+Н), Cl-матрица.
Пример 13
N-{[(5S)-2-Оксо-3-(4-пиперидинофенил)-1, 3-оксазолидин-5-ил]метил}-5-хлор-2-тиофенкарбоксамид

Получают из 5-(гидроксиметил)-3-(4-пиперидинофенил)-1,3-оксазолидин-2-она (его получение приведено в патенте ФРГ №2708236) после его превращения в мезилат, взаимодействия с фталимидом калия, гидразинолиза и реакции с 5-хлортиофен-2-карбоновой кислотой.
Rf (на диоксиде кремния, толуол/этилацетат 1:1)=0,31.
Т.пл. 205°С.
Пример 17
N-({(5S)-2-Оксо-3-[4-(2-оксо-1-пирролидинил)фенил]-1, 3-оксазолидин-5-ил}-метил)-5-хлор-2-тиофенкарбоксамид

Из 1-(4-аминофенил)пирролидин-2-она (его получение приведено в работе Reppe и др., Justus Liebigs Arm. Chem., 596, 1955, 209) по аналогии с известной схемой синтеза (S.J.Brickner и др., J. Med. Chem. 1996, 39, 673) после взаимодействия с бензилоксикарбонилхлоридом, последующей реакции с R-глицидилбутиратом, превращения в мезитилат, взаимодействия с фталимидом калия, гидразинолиза в метаноле и реакции с 5-хлортиофен-2-карбоновой кислотой получают в конце концов N-({(5S)-2-Оксо-3-[4-(2-оксо-1-пирролидинил)фенил]-1, 3-оксазолидин-5-ил}-метил)-5-хлор-2-тиофенкарбоксамид. Полученный таким образом N-({(5S)-2-оксо-3-[4-(2-оксо-1-пирролидинил)фенил]-1,3-оксазолидин-5-ил}-метил)-5-хлор-2-тиофенкарбоксамид характеризуется значением IC50=4 нМ (определение значения IC50 проведено в соответствии с описанным выше примером A-1.a.1) "Измерение блокирования фактора Ха").
Т.пл. 229°С.
Значение Rf (на диоксиде кремния, толуол/этилацетат 1:1)=0,05 (у исходного продукта Rf=0,0).
Масс-спектр (ионизация электрораспылением): 442,0 (21%, M+Na, Cl-матрица) 420,0 (72%, M+H, Cl-матрица), 302,3 (12%), 215 (52%), 145 (100%).
Спектр1Н-ЯМР (d6-диметилсульфоксид, 300 МГц): 2,05 (м., 2Н), 2,45 (м., 2Н), 3,6 (т., 2Н). 3,77-3,85 (м., 3Н), 4,15 (т., 1Н), 4, 75-4.85 (м., 1Н), 7,2 (д., 1Н), 7.5 (д., 2Н), 7,65 (д., 2Н), 7,69 (д., 1Н). 8,96 (т., 1Н).
Далее приводятся отдельные стадии описанного выше синтеза по примеру 17 с соответствующими подготовительными операциями.
К 4 г (22,7 ммоля) 1-(4-аминофенил)пирролидин-2-она и 3,6 мл (28,4 ммоля) N,N-диметиланилина в 107 мл тетрагидрофурана при температуре -20°С медленно прибавляют 4,27 г (25,03 ммоля) бензилового эфира хлормуравьиной кислоты. Перемешивают 30 минут при -20°С и после этого дают реакционной смеси нагреться до комнатной температуры. Прибавляют 0,5 л этилацетата и промывают органическую фазу 0,5 л насыщенного раствора хлорида натрия. Отделенную органическую фазу сушат сульфатом магния и упаривают растворитель в вакууме. Остаток растирают с диэтиловым эфиром и отсасывают. Получают 5,2 г (73,8% от теории) бензил-4-(2-оксо-1-пирролидинил)-фенилкарбамата в виде светло-бежевых кристаллов с температурой плавления 174°С.
В атмосфере аргона к 1,47 г (16,66 ммоля) изоамилового спирта в 200 мл тетрагидрофурана при температуре -10°С прибавляют по каплям 7,27 мл 2,5 молярного раствора н-бутиллития в гексане, причем для изменения цвета добавленного в качестве индикатора N-бензилиденбензиламина потребовалось добавление еще 8 мл бутиллития. Перемешивают 10 минут при -10°С, охлаждают до -78°С и медленно прибавляют раствор 4,7 г (15,14 ммоля) бензил-4-(2-оксо-1-пирролидинил)фенилкарбамата. После еще раз прибавляют до изменения цвета индикатора на розовый 4 мл раствора бутиллития. Перемешивают 10 минут при -78°С, прибавляют 2,62 г (18,17 ммоля) R-глицидилбутирата и продолжают перемешивание в течение 30 минут при -78°С.
Реакционной массе дают нагреться до комнатной температуры и оставляют ее на ночь, к смеси прибавляют 200 мл воды и отгоняют тетрагидрофурановую составляющую в вакууме. Водный остаток экстрагируют этилацетатом, органическую фазу сушат сульфатом магния и упаривают ее в вакууме. Остаток растирают с 500 мл диэтилового эфира и отсасывают выпадающие кристаллы в вакууме.
Получают 3,76 г (90% от теории) (5R)-5-(гидроксиметил)-3-[4-(2-оксо-1-пирролидинил)фенил]-1, 3-оксазолидин-2-она с температурой плавления 148°С и значением Rf (на диоксиде кремния, толуол/этилацетат 1:1)=0, 04 (у исходного продукта Rf=0,3).
В 160 мл дихлорметана при 0°С перемешивают 3,6 г (13,03 моля) (5R)-5-(гидроксиметил)-3-[4-(2-оксо-1-пирролидинил)фенил]-1, 3-оксазолидин-2-она и 2,9 г (28,67 ммоля) триэтиламина. При перемешивании прибавляют 1,79 г (15,64 ммоля) хлорангидрида метансульфокислоты и 1,5 часа перемешивают при 0°С и еще 3 часа при комнатной температуре.
Реакционную смесь промывают водой и экстрагируют водную фазу еще раз метилен-хлоридом. Объединенные органические экстракты сушат сульфатом магния и упаривают. После этого остаток (1,67 г) растворяют в 70 мл ацетонитрила, прибавляют 2, 62 г (14,16 ммоля) фталимида калия и 45 минут перемешивают в закрытом сосуде при нагревании в микроволновой печи при температуре 180°С.
Смесь отделяют фильтрованием от нерастворимого остатка, фильтрат упаривают в вакууме, остаток (1,9 г) растворяют в метаноле и прибавляют 0,47 г (9,37 ммоля) гидразингидрата. Нагревают при кипении 2 часа, охлаждают, прибавляют насыщенный раствор бикарбоната натрия и шесть раз экстрагируют общим объемом 2 л метиленхлорида. Объединенные органические экстракты сырого (5S)-5-(аминометил)-3-[4-(2-оксо-1-пирролидинил)фенил]-1, 3-оксазолидин-2-она сушат сульфатом магния и упаривают в вакууме.
На конечной стадии для получения N-({(5S)-2-оксо-3-[4-(2-оксо-1-пирролидинил)фенил]-1, 3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамида в 7,6 мл диметилформамида растворяют 0,32 г (1,16 ммоля) полученного на предыдущей стадии (5S)-5-(аминометил)-3-[4-(2-оксо-1-пирролидинил)фенил]-1,3-оксазолидин-2-она, 0,19 г (1,16 ммоля) 5-хлортиофен-2-карбоновой кислоты и 0,23 г (1,51 ммоля) гидрата 1-гидрокси-1H-бензтриазола. Прибавляют 0,29 г (1,51 ммоля) N'-(3-диметиламинопропил)-N-этилкарбодиимида и при комнатной температуре прибавляют по каплям 0,3 г (0,4 мл, 2,32 ммоля, 2 эквивалента) диизопропилэтиламина. Оставляют на ночь при перемешивании при комнатной температуре.
Смесь упаривают в вакууме досуха, растворяют остаток в 3 мл диметилсульфоксида и хроматографируют методом ВЭЖХ с обращением фаз градиентом смеси ацетонитрил/вода/0,5% трифторуксусной кислоты. Прошедшие хроматограф фракции упаривают для отделения ацетонитрила и отсасывают выпадающее соединение. Получают 0,19 г (39% от теории) целевого соединения. Аналогично получены приведенные далее соединения.
Пример 18
N-({(5S)-2-Оксо-3-[4-(1-пирролидинил)фенил]-1, 3-оксазолидин-5-ил}-метил)-5-хлор-2-тиофенкарбоксамид
По аналогии с примером 17 из 4-пирролидин-1-ил-анилина (Reppe и др., Justus Liebigs Ann. Chem., 596, 1955, 151) получают соединение N-({(5S)-2-оксо-3-[4-(1-пирролидинил)фенил]-1,3-оксазолидин-5-ил}-метил)-5-хлор-2-тиофенкарбоксамид.
IC50=40 нМ.
Т.пл. 216°С.
Значение Rf (на диоксиде кремния, толуол/этилацетат 1:1)=0,31 (у исходного продукта Rf=0,0).
Пример 19
N-({(5S)-2-Оксо-3-[4-(диэтиламино)фенил]-1,3-оксазолидин-5-ил} -метил)-5-хлор-2-тиофенкарбоксамид
Аналогично из N,N-диэтилфенил-1,4-диамина (патент США №2811555, 1955) получают соединение N-({(5S)-2-оксо-3-[4-(диэтиламино)фенил]-1,3-оксазолидин-5-ил}-метил)-5-хлор-2-тиофенкарбоксамид.
IC50=270 нМ.
Т.пл. 181°С.
Значение Rf (на диоксиде кремния, толуол/этилацетат 1:1)=0,25 (у исходного продукта Rf=0,0).
Пример 36
N-({(5S)-3-[2-Метил-4-(4-морфолинил)фенил]-2-оксо-1,3-оксазолидин-5-ил}-метил)-5-хлор-2-тиофенкарбоксамид
Получают из 2-метил-4-(4-морфолинил)анилина (J.E.LuValle и др., J. Am. Chem. Soc. 1948, 70, 2223).
Масс-спектр (ионизация электрораспылением): m/z (%)=436 ([M+H]+, 100), Cl-матрица.
ВЭЖХ (метод 1): время удерживания (%)=3,77 (98).
IC50=1,26 мкМ.
Пример 37
N-{[(5S)-3-(3-Хлор-4-морфолинофенил)-2-оксо-1,3-оксазолидин-5-ил]-метил}-5-хлор-2-тиофенкарбоксамид
Получают из 3-хлор-4-(4-морфолинил)анилина (H.R.Snyder и др., J. Pharm. Sci. 1977, 66, 1204).
Масс-спектр (ионизация электрораспылением): m/z (%)=456 ([M+H]+, 100), Cl2-матрица.
ВЭЖХ (метод 2): время удерживания (%)=4,31 (100).
IC50=33 нМ.
Пример 38
N-({(5S)-3-[4-(4-Морфолинилсульфонил)фенил]-2-оксо-1,3-оксазолидин-5-ил}-метил)-5-хлор-2-тиофенкарбоксамид
Получают из 4-(4-морфолинилсульфонил)анилина (Adams и др., J. Am. Chem. Soc. 1939, 61, 2342).
Масс-спектр (ионизация электрораспылением): m/z (%)=486 ([М+Н]+, 100), Cl-матрица.
ВЭЖХ (метод 3): время удерживания (%)=4,07 (100).
IC50=2 мкМ.
Пример 39
N-({(5S)-3-[4-(1-Азетидинилсульфонил)фенил]-2-оксо-1,3-оксазолидин-5-ил}-метил)-5-хлор-2-тиофенкарбоксамид
Получают из 4-(1-азетидинилсульфонил)анилина.
Масс-спектр (десорбционно-химическая ионизация, аммиак): m/z (%)=473 ([M+NH4]+, 100), Cl-матрица.
ВЭЖХ (метод 3): время удерживания (%)=4,10 (100).
IC50=0,84 мкМ.
Пример 40
N-[((5S)-3-{4-[(Диметиламино)сульфонил]фенил}-2-оксо-1, 3-оксазолидин-5-ил)-метил]-5-хлор-2-тиофенкарбоксамид
Получают из 4-амино-N,N-диметилбензолсульфонамида (I.K.Khanna и др., J. Med. Chem. 1997, 40, 1619).
Масс-спектр (ионизация электрораспылением): m/z (%)=444 ([М+Н]+, 100), Cl-матрица.
ВЭЖХ (метод 3): время удерживания (%)=4,22 (100).
IC50=90 нМ.
Общий способ ацилирования 5-(аминометил)-3-[4-(2-оксо-1-пирролидинил)-фенил]-1,3-оксазолидин-2-она хлорангидридами карбоновых кислот.

К соответствующему хлорангидриду кислоты (2,5 эквивалента) при комнатной температуре в атмосфере аргона прибавляют по каплям примерно децимолярный раствор 5-(аминометил)-3-[4-(2-оксо-1-пирролидинил)фенил]-1,3-оксазолидин-2-она (по примеру 45) (1,0 эквивалента) и абсолютного пиридина (около 6 эквивалентов) в абсолютном дихлорметане. Смесь около 4 часов перемешивают при комнатной температуре, затем прибавляют около 5,5 эквивалентов PS-Trisamine (производства Аргоноут Текнолоджиз). Суспензию слабо перемешивают в течение двух часов, после разбавления смесью дихлорметан/диметилформамид (3:1) фильтруют (смолу промывают смесью дихлорметан/диметилформамид) и упаривают фильтрат. Полученный продукт, если это необходимо, очищают методом препаративной ВЭЖХ с обращением фаз. По аналогичной схеме получают следующее далее соединение.
Пример 41
N-({2-Оксо-3-[4-(2-оксо-1-пирролидинил)фенил]-1,3-оксазолидин-5-ил}метил)-2-тиофенкарбоксамид
Жидкостная хроматомасс-спектрометрия (метод 6): m/z (%)=386 (М+Н, 100).
Жидкостная хроматомасс-спектрометрия: время удерживания (%)=3,04 (100).
IC50=1,3 мкМ.
Общий способ получения ацильных производных на основе 5-(аминометил)-3-[4-(2-оксо-1-пирролидинил)фенил]-1,3-оксазолидин-2-она и карбоновых кислот

К 2,9 эквивалента связанного со смолой карбодиимида (PS-Carbodiimid производства Аргоноут Текнолоджиз) прибавляют соответствующую карбоновую кислоту (около 2 эквивалентов) и смесь из абсолютного дихлорметана и диметилформамида (примерно 9:1). После легкого встряхивания в течение примерно 15 минут при комнатной температуре прибавляют 5-(аминометил)-3-[4-(2-оксо-1-пирролидинил)фенил]-1,3-оксазолидин-2-он (по примеру 45) (1,0 эквивалента) и оставляют смесь при встряхивании на ночь. После этого смолу отфильтровывают (промывают дихлорметаном) и упаривают фильтрат. Полученный продукт, если это необходимо, очищают методом препаративной ВЭЖХ с обращением фаз. По аналогичной схеме получают следующие далее соединения.
Пример 42
5-Метил-N-({2-оксо-3-[4-(2-оксо-1-пирролидинил)фенил]-1,3-оксазолидин-5-ил}-метил)-2-тиофенкарбоксамид
Жидкостная хроматомасс-спектрометрия: m/z (%)=400 (М+Н, 100).
Жидкостная хроматомасс-спектрометрия (метод 6): время удерживания (%)=3,23 (100).
IC50=0,16 мкМ.
Пример 43
5-Бром-N-({2-оксо-3-[4-(2-оксо-1-пирролидинил)фенил]-1,3-оксазолидин-5-ил}метил)-2-тиофенкарбоксамид
Жидкостная хроматомасс-спектрометрия: m/z (%)=466 (М+Н, 100).
Жидкостная хроматомасс-спектрометрия (метод 5): время удерживания (%)=3,48 (78).
IC50=0,014 мкМ.
Пример 44
N-({(5S)-2-Оксо-3-[4-(3-оксо-4-морфолинил)фенил]-1,3-оксазолидин-5-ил}-метил)-5-хлор-2-тиофенкарбоксамид

а) 2-((2R)-2-Гидрокси-3-{[4-(3-оксо-4-морфолинил)фенил]амино}пропил)-1Н-изоиндол-1,3(2Н)-дион
Суспензию 2-[(2S)-2-оксиранилметил]-1Н-изоиндол-1,3(2Н)-диона (A.Gutcait и др., Tetrahedron Asym. 1996, 7, 1641) (5,68 г, 27,9 ммоля) и 4-(4-аминофенил)-3-морфоли-нона (5,37 г, 27,9 ммоля) в смеси этанола с водой (9:1, 140 мл) 14 часов кипятят с обратным холодильником (осадок переходит в раствор, через некоторое время снова образуется осадок). Осадок (целевой продукт) отфильтровывают, трижды промывают диэтиловым эфиром и сушат. Объединенные маточные растворы упаривают в вакууме и после добавления второй порции 2-[(2S)-2-оксиранилметил]-1Н-изоиндол-1,3(2Н)-диона (2,84 г, 14,0 ммоля) суспендируют в смеси этанола с водой (9:1, 70 мл) и 13 часов кипятят с обратным холодильником (осадок переходит в раствор, через некоторое время снова образуется осадок). Осадок (целевой продукт) отфильтровывают, трижды промывают диэтиловым эфиром и сушат. Общий выход 10,14 г, 92% от теории.
Масс-спектр (ионизация электрораспылением): m/z (%)=418 ([M+Na]+, 84), 396([М+Н]+, 93).
ВЭЖХ (метод 3): время удерживания (%)=3,34 (100).
б) 2-({(5S)-2-Оксо-3-[4-(3-оксо-4-морфолинил)фенил]-1,3-оксазолидин-5-ил}метил)-1Н-изоиндол-1,3(2Н)-дион
К суспензии аминоспирта (3,58 г, 9,05 ммоля) в 90 мл тетрагидрофурана в атмосфере аргона при комнатной температуре прибавляют N,N'-карбонилдиимидазол (2,94 г, 18,1 ммоля) и диметиламинопиридин (каталитическое количество). Реакционную суспензию 12 часов перемешивают при 60°С (осадок переходит в раствор, через некоторое время осадок снова образуется), добавляют вторую порцию N,N'-карбонилдиимидазола (2,94 г, 18,1 ммоля) и перемешивают при 60°С еще 12 часов. Осадок (целевой продукт) отфильтровывают, промывают тетрагидрофураном и сушат. Фильтрат упаривают в вакууме и очищают дополнительную порцию продукта с помощью флэш-хроматографии (смеси дихлорметана с метанолом). Общий выход 3,32 г, 87% от теории.
Масс-спектр (ионизация электрораспылением): m/z(%)=422 ([М+Н]+, 100).
ВЭЖХ (метод 4): время удерживания (%)=3,37 (100).
в) N-({(5S)-2-Оксо-3-[4-(3-оксо-4-морфолинил)фенил]-1, 3-оксазолидин-5-ил}-метил)-5-хлор-2-тиофенкарбоксамид
К суспензии оксазолидинона (4,45 г, 10,6 ммоля) в 102 мл этанола при комнатной температуре прибавляют по каплям метиламин (40%-ный раствор в воде, 10,2 мл, 0,142 моля). Реакционную смесь 1 час кипятят с обратным холодильником и упаривают в вакууме. Сырой продукт без дополнительной очистки используют в следующей реакции.
К раствору амина в 90 мл пиридина в атмосфере аргона при 0°С прибавляют по каплям хлорангидрид 5-хлортиофен-2-карбоновой кислоты (2,29 г, 12,7 ммоля). Охлаждение льдом прекращают, перемешивают реакционную смесь 1 час при комнатной температуре и прибавляют воду. После прибавления дихлорметана и разделения фаз экстрагируют водную фазу дихлорметаном. Объединенные органические фазы сушат сульфатом натрия, фильтруют и упаривают в вакууме. Целевой продукт очищают с помощью флэш-хроматографии (смеси дихлорметана с метанолом). Общий выход 3,92 г, 86% от теории.
Т.пл. 232-233С.
Спектр1Н-ЯМР (d6-диметилсульфоксид, 200 МГц): 9,05-8,90 (т., J=5,8 Гц, 1Н), 7,70 (д., J=4,1 Гц, 1H), 7,56 (д., J=9,0 Гц, 2H), 7,41 (д., J=9,0 Гц, 2H), 7,20 (д., J=4,1 Гц, 1Н), 4,93-4,75 (м., 1Н), 4,27-4,12 (м., 3Н), 4,02-3,91 (м., 2Н), 3,91-3,79 (д.д., J=6,1 Гц, 9,2 Гц, 1Н), 3,76-3,66 (м, 2Н), 3,66-3,54 (м., 2Н).
Масс-спектр (ионизация электрораспылением): m/z (%)=436 ([М+Н]+, 100, Cl-матрица).
ВЭЖХ (метод 2): время удерживания (%)=3,60 (100).

IC50=0,7 нМ
Аналогично получены приведенные далее соединения.
Пример 45
5-Метил-N-({(5S)-2-оксо-3-[4-(3-оксо-4-морфолинил)фенил]-1,3-оксазолидин-5-ил}-метил)-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=831 ([2М+Н]+, 100), 416 ([М+Н]+, 66).
ВЭЖХ (метод 3): время удерживания (%)=3,65 (100).
IC50=4,2 нМ
Пример 46
5-Бром-N-({(5S)-2-оксо-3-[4-(3-оксо-4-морфолинил)фенил]-1,3-оксазолидин-5-ил}-метил)-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=480 ([М+Н]+, 100, Br-матрица).
ВЭЖХ (метод 3): время удерживания (%)=3,87 (100).
IC50=0,3 нМ
Пример 47
N-{[(5S)-3-(3-Изопропил-2-оксо-2,3-дигидро-1,3-бензоксазол-6-ил)-2-оксо-1,3-оксазолидин-5-ил]метил)-5-хлор-2-тиофенкарбоксамид
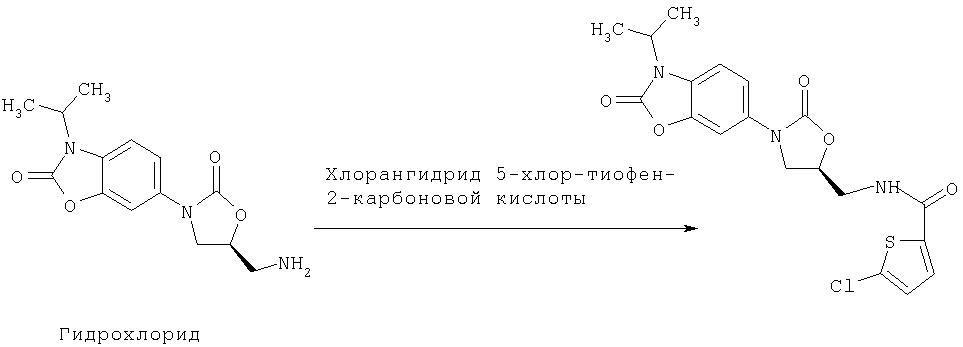
В 5 мл тетрагидрофурана суспендируют 200 мг (0,61 ммоля) гидрохлорида 6-[(5S)-5-(аминометил)-2-оксо-1,3-оксазолидин-3-ил]-3-изопропил-1, 3-бензоксазол-2(3Н)-она (европейский патент №738726) и прибавляют 0,26 мл (1,83 ммоля) триэтиламина и 132 мг (0,73 ммоля) хлорангидрида 5-хлортиофен-2-карбоновой кислоты. Реакционную смесь оставляют на ночь при перемешивании при комнатной температуре и после этого упаривают. Продукт выделяют хроматографированием на колонке (силикагель, метиленхлорид/этанол: от 50:1 до 20/1). Получают 115 мг (43% от теории) целевого соединения.
Масс-спектр (ионизация электрораспылением): m/z (%)=436 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания=3,78 (100).
Аналогично получены приведенные далее соединения.


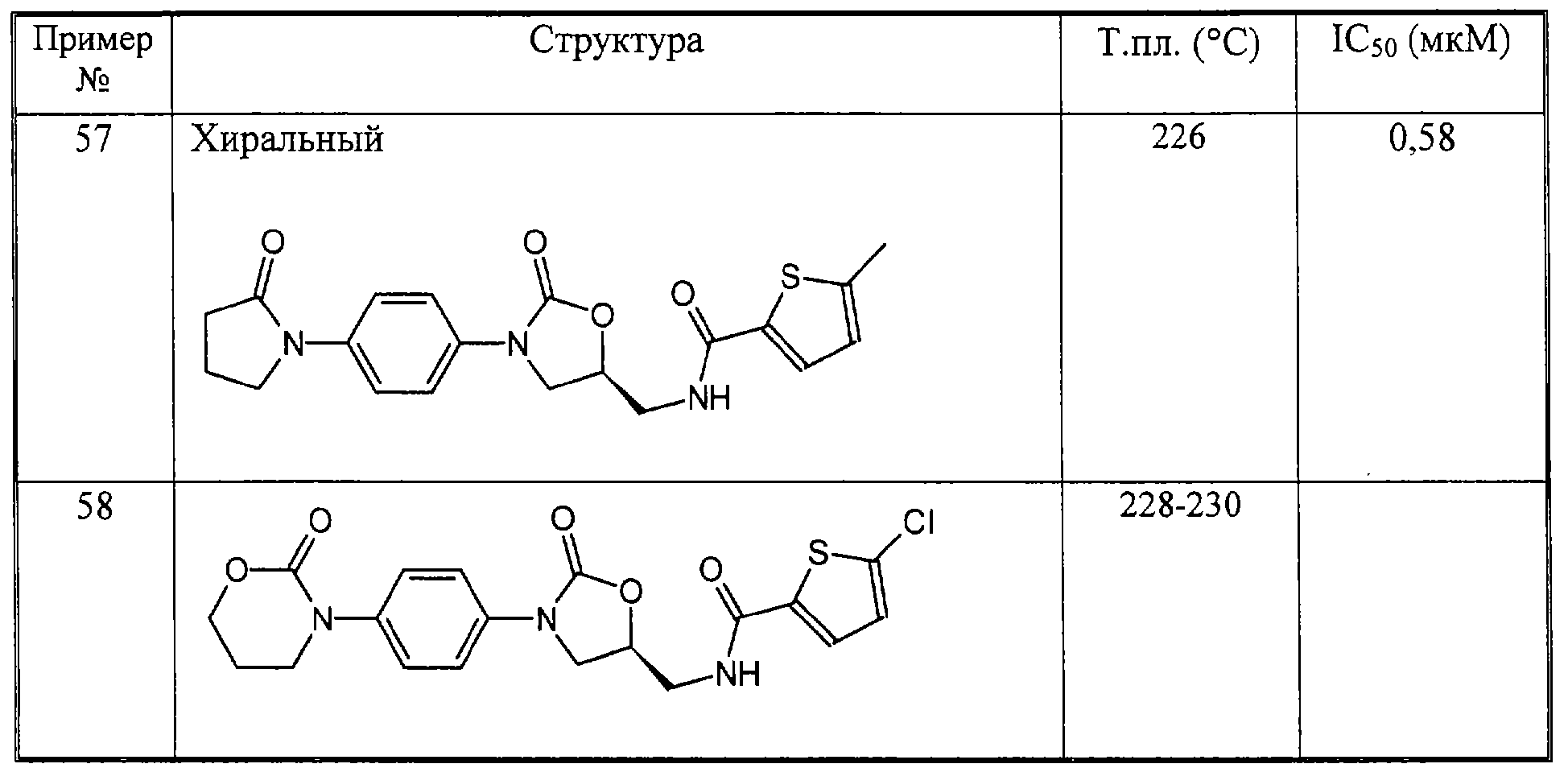
Следующие далее примеры от 20 до 30 и от 58 до 139 относятся к варианту [Б] способа получения, причем примеры 20 и 21 представляют получение исходных соединений.
Пример 20 Получение N-аллил-5-хлор-2-тиофенкарбоксамида

К охлаждаемому льдом раствору 2,63 мл (35 ммолей) аллиламина в 14,2 мл абсолютного пиридина и 14,2 мл абсолютного тетрагидрофурана прибавляют 7,61 г (42 ммоля) хлорангидрида 5-хлортиофен-2-карбоновой кислоты. Охлаждение льдом прекращают и 3 часа перемешивают смесь при комнатной температуре перед тем, как упарить ее в вакууме. К остатку прибавляют воду и отфильтровывают твердое вещество. Сырой продукт очищают с помощью флэш-хроматографии на силикагеле (дихлорметаном). Выход 7, 20 г (99% от теории).
Масс-спектр (десорбционно-химическая ионизация, NH4): m/z (%)=219 (M+NH4, 100), 202 (М+Н, 32).
ВЭЖХ (метод 1): время удерживания (%)=3,96 минут (98,9).
Пример 21
Получение N-(2-оксиранилметил)-5-хлор-2-тиофенкарбоксамида

К охлаждаемому льдом раствору 2,0 г (9,92 ммоля) N-аллил-5-хлор-2-тиофенкарбоксамида в 10 мл дихлорметана прибавляют 3,83 г м-хлорнадбензойной кислоты (содержание около 60%). Смесь оставляют при перемешивании на ночь, она при этом нагревается до комнатной температуры, и после этого три раза промывают ее 10%-ным раствором бисульфата натрия. Органическую фазу два раза промывают насыщенным раствором бикарбоната натрия и насыщенным раствором хлорида натрия, сушат сульфатом магния и упаривают. Продукт очищают хроматографированием на силикагеле (циклогексан/этилацетат 1:1).
Выход 837 мг (39% от теории)
Масс-спектр (десорбционно-химическая ионизация, NH4): m/z (%)=253 (M+NH4, 100), 218 (М+Н, 80).
ВЭЖХ (метод 1): время удерживания (%)=3,69 минут (около 80).
Общий способ получения замещенных производных N-(3-амино-2-гидроксипропил)-5-хлор-2-тиофенкарбоксамида из N-(2-оксиранилметил)-5-хлор-2-тиофенкарбоксамида

К раствору производного первичного амина или анилина (от 1,5 до 2,5 эквивалентов) в 1,4-диоксане, в смесях 1,4-диоксана с водой или в этаноле или же в смесях этанола с водой (концентрация от примерно 0,3 до 1,0 моль/л) при комнатной температуре или при температурах до 80°С прибавляют отдельными порциями N-(2-оксиранилметил)-5-хлор-2-тиофенкарбоксамид (1 эквивалент). Перед упариванием смесь перемешивают от 2 до 6 часов. Из реакционной смеси продукт может быть выделен с помощью хроматографии на силикагеле (смеси циклогексана с этилацетатом, дихлорметана с метанолом или смеси дихлорметана, метанола и триэтиламина). Аналогичным способом получают следующие далее соединения.
Пример 22
N-[3-(Бензиламино)-2-гидроксипропил]-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=325 (М+Н, 100).
ВЭЖХ (метод 1): время удерживания 3,87 минут (97,9).
Пример 23
5-Хлор-N-[3-(3-цианоанилино)-2-гидроксипропил]-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=336 (М+Н, 100).
ВЭЖХ (метод 2): время удерживания 4,04 минут (100).
Пример 24
5-Хлор-N-[3-(4-цианоанилино)-2-гидроксипропил]-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=336 (М+Н, 100).
ВЭЖХ (метод 1): время удерживания 4,12 минут (100).
Пример 25
5-Хлор-N-{3-[4-(цианометил)анилино]-2-гидроксипропил}-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=350 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 3,60 минут (95,4).
Пример 26
5-Хлор-N-{3-[3-(цианометил)анилино]-2-гидроксипропил}-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=350 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 3,76 минут (94,2).
Пример 58а
трет.-Бутил-4-[(3-{[(5-хлор-2-тиенил)карбонил]амино}-2-гидроксипропил)амино]-бензилкарбамат
Получают из трет.-бутил-4-аминобензилкарбамата (Bioorg. Med. Chem. Lett., 1997, 1921-1926).
Масс-спектр (ионизация электрораспылением, катионы): m/z (%)=440 (М+Н, 100); (ионизация электрораспылением, анионы): m/z (%)=438 (М-Н, 100).
ВЭЖХ (метод 1): время удерживания 4,08 минут (100).
Пример 59
трет.-Бутил-4-[(3-{[(5-хлор-2-тиенил)карбонил]амино}-2-гидроксипропил)амино]-фенилкарбамат
Получают из N-трет.-бутоксикарбонил-1,4-фенилендиамина.
Масс-спектр (ионизация электрораспылением): m/z (%)=426 (М+Н, 45), 370 (100).
ВЭЖХ (метод 1): время удерживания 4,06 (100).
Пример 60
трет.-Бутил-2-гидрокси-3-{[4-(2-оксо-1-пирролидинил)фенил]амино} пропил-карбамат
Получают из 1-(4-аминофенил)-2-пирролидинона (Justus Liebigs Ann. Chem. 1955, 596, 204).
Масс-спектр (десорбционно-химическая ионизация, NH3): m/z (%)=350 (М+Н, 100).
ВЭЖХ (метод 1): время удерживания 3,57 (97).
Пример 61
N-(3-{[3-Фтор-4-(3-оксо-4-морфолинил)фенил]амино}-2-гидроксипропил)-5-хлор-2-тиофенкарбоксамид
В 15 мл этанола и 1 мл воды в течение 6 часов кипятят с обратным холодильником 800 мг (3,8 ммоля) 4-(4-амино-2-фторфенил)-3-морфолинона и 700 мг (3,22 ммоля) N-(2-оксиранилметил)-5-хлор-2-тиофенкарбоксамида. Упаривают в вакууме, после обработки этилацетатом отсасывают от выпавших кристаллов и хроматографированием маточного раствора получают 276 мг (17% от теории) целевого соединения. Rf(этилацетат)=0,25.
Пример 62
N-(3-Анилино-2-гидроксипропил)-5-хлор-2-тиофенкарбоксамид
Получают из анилина.
Масс-спектр (десорбционно-химическая ионизация, NH3): m/z (%)=311 (М+Н, 100),
Cl-матрица.
ВЭЖХ (метод 3): время удерживания 3,79 (100).
Пример 63
N-(2-Гидрокси-3-{[4-(3-оксо-4-морфолинил)фенил]амино}-пропил)-5-хлор-2-тиофенкарбоксамид
Получают из 4-(4-аминофенил)-3-морфолинона.
Масс-спектр (ионизация электрораспылением): m/z (%)=410 ([М+Н]+, 50), Cl-матрица.
ВЭЖХ (метод 3): время удерживания 3,58 (100).
Пример 64
N-[3-({4-[Ацетил(циклопропил)амино]фенил}амино)-2-гидроксипропил]-5-хлор-2-тиофенкарбоксамид
Получают из N-(4-аминофенил)-N-циклопропилацетамида.
Масс-спектр (ионизация электрораспылением): m/z (%)=408 ([М+H]+, 100), Cl-матрица.
ВЭЖХ (метод 3): время удерживания 3,77 (100).
Пример 65
N-[3-({4-[Ацетил(метил)амино]фенил}амино)-2-гидроксипропил]-5-хлор-2-тиофенкарбоксамид
Получают из 5(S)-5-(аминометил)-3-(4-морфолинофенил)-1,3-оксазолидин-2-она.
Масс-спектр (ионизация электрораспылением): m/z (%)=382 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 3,31 мин.
Пример 66
N-(2-Гидрокси-3-{[4-(1H-1,2, 3-триазол-1-ил)фенил]амино}пропил)-5-хлор-2-тиофенкарбоксамид
Получают из 4-(1Н-1,2,3-триазол-1-ил)анилина (Bouchet и др., J. Chem. Soc. Perkin Trans. 2, 1974, 449).
Масс-спектр (ионизация электрораспылением): m/z (%)=378 ([М+Н]+, 100).
ВЭЖХ (метод 4): время удерживания 3,55 мин.
Пример 67
трет.-Бутил-1-{4-[(3-{[(5-хлор-2-тиенил)карбонил]амино}-2-гидроксипропил)-амино]-фенил}-L-пролинат
Масс-спектр (ионизация электрораспылением): m/z (%)=480 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 3,40 мин.
Пример 68
1-{4-[(3-{[(5-Хлор-2-тиенил)карбонил]амино}-2-гидроксипропил)амино]фенил}-4-пиперидинкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=437 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,39 мин.
Пример 69
1-{4-[(3-{[(5-Хлор-2-тиенил)карбонил]амино}-2-гидроксипропил)амино]фенил}-3-пиперидинкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=437 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,43 мин.
Пример 70
N-(2-Гидрокси-3-{[4-(4-оксо-1-пиперидинил)фенил]амино}пропил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=408 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,43 мин.
Пример 71
1-{4-[(3-{[(5-Хлор-2-тиенил)карбонил] амино}-2-гидроксипропил)-амино]-фенил}-L-пролинамид
Масс-спектр (ионизация электрораспылением): m/z (%)=423 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,51 мин.
Пример 72
N-[2-Гидрокси-3-({4-[3-(гидроксиметил)-1-пиперидинил]фенил}амино)пропил]-5-хлор-
2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=424 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,43 мин.
Пример 73
N-[2-Гидрокси-3-({4-[2-(гидроксиметил)-1-пиперидинил] фенил}амино)пропил]-5-хлор-
2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=424 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,49 мин.
Пример 74
Этиловый эфир 1-{4-[(3-{[(5-хлор-2-тиенил)карбонил]амино}-2-гидроксипропил)-амино]фенил}-2-пиперидинкарбоновой кислоты
Масс-спектр (ионизация электрораспылением): m/z (%) = 466 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 3,02 мин.
Пример 75
N-[2-Гидрокси-3-({4-[2-(гидроксиметил)-1-пирролидинил]фенил}амино)пропил]-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%) = 410 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,48 мин.
Пример 76
N-(2-Гидрокси-3-{[4-(2-метилгексагидро-5-Н-пирроло[3,4-d]изоксазол-5-ил)фенил]-амино}пропил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=437 (М+Н, 100).
ВЭЖХ (метод 5): время удерживания 1,74 мин.
Пример 77
N-(2-Гидрокси-3-{[4-(1-пирролидинил)-3-(трифторметил)фенил]амино}пропил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=448 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 3,30 мин.
Пример 78
N-(2-Гидрокси-3-{[4-(2-оксо-1-пирролидинил)-3-(трифторметил)фенил]амино}пропил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=462 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 3,50 мин.
Пример 79
N-(3-{[4-(3-Оксо-4-морфолинил)-3-хлорфенил]амино}-2-гидроксипропил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=444 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 3,26 мин.
Пример 80
N-(2-Гидрокси-3-{[4-(3-оксо-4-морфолинил)-3-(трифторметил)фенил]амино}пропил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=478 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 3,37 мин.
Пример 81
N-(2-Гидрокси-3-{[3-метил-4-(3-оксо-4-морфолинил)фенил]амино}пропил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=424 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,86 мин.
Пример 82
N-(3-{[4-(3-Оксо-4-морфолинил)-3-цианофенил]амино}-2-гидроксипропил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=435 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 3,10 мин.
Пример 83
5-Хлор-N-(3-{[3-хлор-4-(1-пирролидинил)фенил]амино}-2-гидроксипропил)-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=414 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,49 мин.
Пример 84
5-Хлор-N-(3-{[3-хлор-4-(2-оксо-1-пирролидинил)фенил]амино}-2-гидроксипропил)-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=428 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 3,39 мин.
Пример 85
N-(3-{[3, 5-Диметил-4-(3-оксо-4-морфолинил)фенил]амино}-2-гидроксипропил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=438 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,84 мин.
Пример 86
N-(3-{[3-(Аминокарбонил)-4-(4-морфолинил)фенил]амино}-2-гидроксипропил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=439 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,32 мин.
Пример 87
N-Гидрокси-3-{[3-метокси-4-(4-морфолинил)фенил]амино}пропил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=426 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,32 мин.
Пример 88
N-(3-{[3-Ацетил-4-(4-морфолинил)фенил]амино}-2-гидроксипропил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=438 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,46 мин.
Пример 89
N-(3-{[3-Амино-4-(3-оксо-4-морфолинил)фенил]амино}-2-гидроксипропил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=425 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,45 мин.
Пример 90
5-Хлор-N-(3-{[3-хлор-4-(2-метил-3-оксо-4-морфолинил)фенил]амино}-2-гидроксипропил)-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=458 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 3,44 мин.
Пример 91
5-Хлор-N-(3-{[3-хлор-4-(2-метил-5-оксо-4-морфолинил)фенил] амино}-2-гидроксипропил)-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=458 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 3,48 мин.
Пример 91а
N-[2-Гидрокси-3-({4-[(3-оксо-4-морфолинил)метил]фенил}амино)пропил]-5-хлор-2-тиофенкарбоксамид
Получают из 4-(4-аминобензил)-3-морфолинона (Surrey и др., J. Am. Chem. Soc. 77,
1955, 633).
Масс-спектр (ионизация электрораспылением): m/z (%)=424 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,66 мин.
Общий способ получения 3-замещенных производных 5-хлор-N-[(2-оксо-1,3-оксазолидин-5-ил)метил]-2-тиофенкарбоксамида из замещенных производных N-(3-амино-2-гидроксипропил)-5-хлор-2-тиофенкарбоксамидов
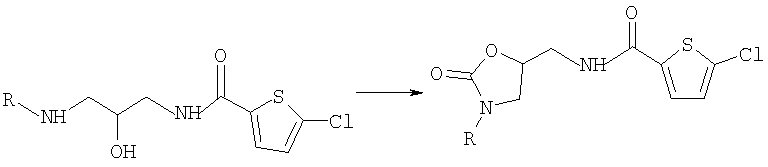
К раствору замещенного производного N-(3-амино-2-гидроксипропил)-5-хлор-2-тиофенкарбоксамида (1,0 эквивалент) в абсолютном тетрагидрофуране (концентрация около 0,1 моль/л) при комнатной температуре прибавляют карбонилдиимидазол (от 1,2 до 1,8 эквивалента) или сравнимый с ним по свойствам эквивалент фосгена. При комнатной температуре или, если это необходимо, при повышенной температуре (до 70°С) смесь перемешивают от 2 до 18 часов и упаривают в вакууме. Продукт может быть очищен с помощью хроматографии на силикагеле (смесями дихлорметана и метанола или циклогексана и этилацетата).
Аналогичным способом получают следующие далее соединения.
Пример 27
N-[(3-Бензил-2-оксо-1, 3-оксазолидин-5-ил)метил]-5-хлор-2-тиофенкарбоксамид
Масс-спектр (десорбционно-химическая ионизация, NH4): m/z (%)=372 (M+Na, 100), 351(М+Н,45).
ВЭЖХ (метод 1): время удерживания 4,33 минуты (100).
Пример 28
5-Хлор-N-{[3-(цианофенил)-2-оксо-1,3-оксазолидин-5-ил]метил}-2-тиофенкарбоксамид
Масс-спектр (десорбционно-химическая ионизация, NH4): m/z (%)=362 (М+Н, 42), 145 (100).
ВЭЖХ (метод 2): время удерживания 4,13 минуты (100).
Пример 29
5-Хлор-N-({3-[4-(цианометил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспьшением): m/z (%)=376 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 4,12 мин.
Пример 30
5-Хлор-N-({3-[3-(цианометил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=376 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 4,17 мин.
Пример 92
трет.-Бутил-4-[5-({[(5-хлор-2-тиенил)карбонил]амино}метил)-2-оксо-1,3-оксазолидин-3-ил]бензилкарбамат
Получают из соединения по примеру 58.
Масс-спектр (ионизация электрораспылением): m/z (%)=488 (M+Na, 23), 349 (100).
ВЭЖХ (метод 1): время удерживания 4,51 (98,5).
Пример 93
трет.-Бутил-4-[5-({[(5-хлор-2-тиенил)карбонил]амино}метил)-2-оксо-1,3-оксазолидин-3-ил]фенилкарбамат
Получают из соединения по примеру 59.
Масс-спектр (ионизация электрораспылением): m/z (%)=493 (M+Na, 70), 452 (М+Н, 10), 395 (100).
ВЭЖХ (метод 1): время удерживания 4,41 (100).
Пример 94
трет.-Бутил-2-оксо-3-[4-(2-оксо-1-пирролидинил)фенил]-1,3-оксазолидин-5-ил}метилкарбамат
Получают из соединения по примеру 60.
Масс-спектр (десорбционно-химическая ионизация, NH3): m/z (%)=393 (M+NH4, 100).
ВЭЖХ (метод 3): время удерживания (%)=3,97 (100).
Пример 95
N-({3-[3-Фтор-4-(3-оксо-4-морфолинил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамид

В 20 мл диоксана в течение двух часов кипятят с обратным холодильником 260 мг (0,608 ммоля) N-(3-{[3-фтор-4-(3-оксо-4-морфолинил)фенил]амино}-2-гидроксипропил)-5-хлор-2-тиофенкарбоксамида (получен по примеру 61), 197 мг (1,22 ммоля) карбонилдиимидазола и 7 мг диметиламинопиридина. Затем прибавляют 20 мл ацетонитрила и перемешивают в течение 30 минут в микроволновой печи в закрытой емкости при температуре 180°С. Раствор упаривают на роторном испарителе и хроматографируют методом ВЭЖХ на колонке с обращением фаз. Получают 53 мг (19% от теории) целевого соединения.
Спектр ЯМР (300 МГц, d6-диметилсульфоксид): δ 3,6-3,7 (м., 4H), 3,85 (д.д., 1H), 3,95 (м., 2H), 4,2 (м., 1H), 4,21 (с., 2Н), 4,85 (м., 1H), 4,18 (с., 2Н), 7,19 (д., 1Н, тиофен), 7,35 (д.д., 1Н), 7,45 (т., 1H), 7,55 (д.д., 1H), 7,67 (д., 1H, тиофен), 8,95 (т., 1H, CONH).
Пример 96
N-[(2-Оксо-3-фенил-1,3-оксазолидин-5-ил)метил]-5-хлор-2-тиофенкарбоксамид
Получают из соединения по примеру 62.
Масс-спектр (ионизация электрораспылением): m/z (%)=359 ([M+Na]+, 71), 337 ([М+Н]+, 100), Cl-матрица.
ВЭЖХ (метод 3): время удерживания 4,39 (100).
IC50=2 мкМ.
Пример 97
N-({2-Оксо-3-[4-(3-оксо-4-морфолинил)фенил]-1,3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамид
Получают из соединения по примеру 63.
Масс-спектр (ионизация электрораспылением): m/z (%)=458 ([M+Na]+, 66), 436 ([М+Н]+, 100), Cl-матрица.
ВЭЖХ (метод 3): время удерживания 3,89 (100).
IC50=1,4 нМ.
Пример 98
N-[(3-{4-[Ацетил(циклопропил)амино]фенил}-2-оксо-1, 3-оксазолидин-5-ил)метил]-5-хлор-2-тиофенкарбоксамид
Получают из соединения по примеру 64.
Масс-спектр (ионизация электрораспылением): m/z (%)=456 ([M+Na]+, 55), 434 ([М+Н]+, 100), Cl-матрица.
ВЭЖХ (метод 3): время удерживания 4,05 (100).
IC50=50 нМ.
Пример 99
N-[(3-{4-[Ацетил(метил)амино]фенил}-2-оксо-1,3-оксазолидин-5-ил)метил]-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=408 (М+Н, 30), 449 (M+H+CH3CN, 100).
ВЭЖХ (метод 4): время удерживания 3,66 мин.
Пример 100
N-({2-Оксо-3-[4-(1H-1,2,3-триазол-1-ил)фенил]-1, 3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=404 (М+Н, 45), 445 (M+H+CH3CN, 100).
ВЭЖХ (метод 4): время удерживания 3,77 мин.
Пример 101
трет.-Бутил-1-{4-[5-({[(5-хлор-2-тиенил)карбонил]амино}метил)-2-оксо-1,3-оксазолидин-3-ил] фенил}-L-пролинат
Масс-спектр (ионизация электрораспылением): m/z (%)=450 (М+Н-56, 25), 506 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 5,13 мин.
Пример 102
1-{4-[5-({[(5-Хлор-2-тиенил)карбонил]амино}метил)-2-оксо-1,3-оксазолидин-3-ил]фенил}-4-пиперидинкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=463 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,51 мин.
Пример 103
1-{4-[5-({[(5-Хлор-2-тиенил)карбонил]амино}метил)-2-оксо-1, 3-оксазолидин-3-ил]фенил}-3-пиперидинкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=463 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,67 мин.
Пример 104
N-{2-Оксо-3-[4-(4-оксо-1-пиперидинил)фенил]-1,3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%) = 434 (М+Н, 40), 452 (М+Н+Н2O,100), 475 (M+H+CH3CN, 60).
ВЭЖХ (метод 4): время удерживания 3,44 мин.
Пример 105
1-{4-[5-({[(5-Хлор-2-тиенил)карбонил] амино}метил)-2-оксо-1,3-оксазолидин-3-ил] фенил}-L-пролинамид
Масс-спектр (ионизация электрораспылением): m/z (%)=449 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 3,54 мин.
Пример 106
N-[(3-{4-[3-(Гидроксиметил)-1-пиперидинил] фенил}-2-оксо-1, 3-оксазолидин-5-ил)метил]-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=450 (М+Н, 100).
ВЭЖХ (метод 5): время удерживания 2,53 мин.
Пример 107
N-[(3-{4-[2-(Гидроксиметил)-1-пиперидинил]фенил}-2-оксо-1,3-оксазолидин-5-ил)метил]-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=450 (М+Н, 100).
ВЭЖХ (метод 5): время удерживания 2,32 мин.
Пример 108
Этиловый эфир 1-{4-[5-({[(5-Хлор-2-тиенил)карбонил]амино}метил)-2-оксо-1,3-оксазолидин-3-ил]фенил}-2-пиперидинкарбоновой кислоты
Масс-спектр (ионизация электрораспылением): m/z (%)=492 (М+Н, 100).
ВЭЖХ (метод 5): время удерживания 4,35 мин.
Пример 109
N-[(3-{4-[2-(Гидроксиметил)-1-пирролидинил]фенил}-2-оксо-1, 3-оксазолидин-5-ил)метил]-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=436 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,98 мин.
Пример 110
N-({2-Оксо-3-[4-(1-пирролидинил)-3-(трифторметил)фенил]-1,3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=474 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 4,63 мин.
Пример 111
N-({3-[4-(2-Метилгексагидро-5Н-пирроло[3, 4-d]изоксазол-5-ил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=463 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,56 мин.
Пример 112
N-({2-Оксо-3-[4-(2-оксо-1-пирролидинил)-3-(трифторметил)фенил]-1,3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=488 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 3,64 мин.
Пример 113
N-({3-[3-Хлор-4-(3-оксо-4-морфолинил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=470 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 3,41 мин.
Пример 114
N-({2-Оксо-3-[4-(3-оксо-4-морфолинил)-3-(трифторметил)фенил]-1, 3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=504 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 3,55 мин.
Пример 115
N-({3-[3-Метил-4-(3-оксо-4-морфолинил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=450 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 3,23 мин.
Пример 116
5-Хлор-N-({3-[3-циано-4-(3-оксо-4-морфолинил)фенил] -2-оксо-1,3-оксазолидин-5-ил}метил)-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=461 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 3,27 мин.
Пример 117
N-({3-[3-Хлор-4-(1-пирролидинил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=440 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 3,72 мин.
Пример 118
N-({3-[3-Хлор-4-(2-оксо-1-пирролидинил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=454 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 3,49 мин.
Пример 119
N-({3-[3,5-Диметил-4-(3-оксо-4-морфолинил)фенил]-2-оксо-1, 3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=464 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 3,39 мин.
Пример 120
N-({3-[3-(Аминокарбонил)-4-(морфолинил)фенил]-2-оксо-1,3-оксазолидин-5-ил}-метил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=465 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 3,07 мин.
Пример 121
N-({3-[3-Метокси-4-(4-морфолинил)фенил]-2-оксо-1, 3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=452 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,86 мин.
Пример 122
N-({3-[3-Ацетил-4-(4-морфолинил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=464 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 3,52 мин.
Пример 123
N-({3-[3-Амино-4-(3-оксо-4-морфолинил)фенил]-2-оксо-1, 3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=451 (М+Н, 100).
ВЭЖХ (метод 6): время удерживания 3,16 мин.
Пример 124
N-({3-[3-Хлор-4-(2-метил-3-оксо-4-морфолинил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=484 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 3,59 мин.
Пример 125
N-({3-[3-Хлор-4-(2-метил-5-оксо-4-морфолинил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=484 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 3,63 мин.
Пример 125а
N-[(2-Оксо-3-{4-[(3-оксо-4-морфолинил)метил]фенил}-1, 3-оксазолидин-5-ил)метил]-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=450 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 3,25 мин.
В результате раскрытия эпоксидной связи амином с последующей циклизацией в соответствующий оксазолидинон получены также приведенные далее соединения.



В следующих далее примерах от 14 до 16 приведены примеры реализации изобретения с факультативной стадией окисления, то есть с реакцией, которая представляет собой возможную стадию способа получения.
Пример 14
N-({(5S)-3-[3-Фтор-4-(1-оксо-1[лямбда]4, 4-тиазинан-4-ил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамид

К раствору перйодата натрия (0,05 г, 0,23 ммоля) в 0,54 мл воды прибавляют при температуре 0°С 0,1 г (0,22 ммоля) N-({(5S)-3-[3-фтор-4-(1,4-тиазинан-4-ил)фенил]-2-оксо-1, 3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамида, полученного по примеру 3, в 0,77 мл метанола. После этого прибавляют 1 мл диметилформамида и 8 часов перемешивают при комнатной температуре. После добавления еще 50 мг перйодата натрия снова оставляют на ночь при перемешивании при комнатной температуре. В заключение к реакционной смеси прибавляют 50 мл воды и отсасывают нерастворимый продукт. После промывки водой и сушки получают 60 мг (58% от теории) кристаллов. Т.пл. 257°С.
Rf (силикагель, толуол/этилацетат 1:1)=0,54 (у исходного продукта Rf=0,46).
Значение IC50=1,1 мкМ.
Масс-спектр (десорбционно-химическая ионизация): 489 (M+NH4), Cl-матрица.
Пример 15
Получение N-({(5S)-3-[4-(1,1-диоксо-1[лямбда]6,4-тиазинан-4-ил)-3-фторфенил]-2-оксо-
1,3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамида
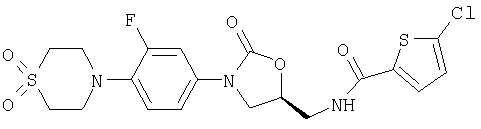
К полученному по примеру 3 N-({(5S)-3-[3-фтор-4-(1,4-тиазинан-4-ил)фенил]-2-оксо-1, 3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамиду (0,1 г, 0,22 ммоля) в 3,32 мл смеси из 1 части воды и 3 частей ацетона прибавляют 80 мг (0,66 ммоля) N-метил-морфолин-N-оксида и 0,1 мл 2,5%-ного раствора тетраоксида осмия в 2-метил-2-пропаноле. Оставляют на ночь при перемешивании при комнатной температуре и снова прибавляют 40 мг N-метилморфолин-N-оксида. Снова оставляют на ночь при перемешивании при комнатной температуре, выливают реакционную смесь в 50 мл воды и три раза экстрагируют этилацетатом. Из органической фазы после сушки и упаривания получают 23 мг, а из водной фазы после отсасывания нерастворимого твердого вещества получают 19 мг (общий выход 39% от теории) целевого соединения.
Т.пл. 238°С.
Rf (толуол/этилацетат 1:1)=0,14 (у исходного продукта Rf=0,46).
Значение IC50=210 нМ.
Масс-спектр (десорбционно-химическая ионизация): 505 (M+NH4), Cl-матрица.
Пример 16
N-Оксид N-{[(5S)-3-(3-фтор-4-морфолинофенил)-2-оксо-1,3-оксазолидин-5-ил]метил}-5-хлор-2-тиофенкарбоксамида
Это вещество получают действием магниевой соли монопероксифталевой кислоты на N-{[(5S)-3-(3-фтор-4-морфолинофенил)-2-оксо-1,3-оксазолидин-5-ил]метил}-5-хлор-2-тиофенкарбоксамид, полученный по примеру 1.
Масс-спектр (ионизация электрораспылением): 456 (М+Н, 21%, Cl-матрица), 439 (100%).
Следующие далее примеры от 31 до 35 и от 140 до 147 относятся к реализации изобретения с факультативной стадией амидинирования, то есть с реакцией, которая представляет собой возможную стадию способа получения.
Общий способ получения амидинов и производных амидинов из цианометилфенилзамещенных производных N-[2-оксо-1,3-оксазолидин-5-ил)-метил]-5-хлор-2-тиофенкарбоксамида
Соответствующее цианометилфенилзамещенное производное N-[(2-оксо-1, 3-оксазоли-дин-5-ил)-метил]-5-хлор-2-тиофенкарбоксамида (1,0 эквивалент) вместе с триэтиламином (8,0 эквивалентов) перемешивают от одного до двух дней при комнатной температуре в насыщенном сероводородом пиридине (концентрация около 0,05-0,1 моль/л). Реакционную смесь разбавляют этилацетатом и промывают двунормальной соляной кислотой. Органическую фазу сушат сульфатом магния, фильтруют и упаривают в вакууме.
Сырой продукт растворяют в ацетоне (0,01-0,1 моль/л) и прибавляют метилйодид (40 эквивалентов). Реакционную смесь перемешивают при комнатной температуре от двух до пяти часов и после этого упаривают в вакууме.
Остаток растворяют в метаноле (0,01-0,1 моль/л) и для получения незамещенных амидинов прибавляют ацетат аммония (3 эквивалента) и хлорид аммония (2 эквивалента). Для получения замещенных амидиновых производных к раствору в метаноле прибавляют первичные или вторичные амины (1,5 эквивалента) и уксусную кислоту (2 эквивалента). Через 5-30 часов удаляют растворитель в вакууме и очищают остаток с помощью хроматографии на RР8-колонке с силикагелем (вода/ацетонитрил от 9/1 до 1/1+0,1% трифторуксусной кислоты). Аналогичным способом получают следующие далее соединения.
Пример 31
N-({3-[4-(2-Амино-2-иминоэтил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=393 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,63 мин.
Пример 32
N-({3-[3-(4, 5-Дигидро-1Н-имидазол-2-илметил)фенил]-2-оксо-1,3-оксазолидин-5-ил}-метил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=419 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,61 мин.
Пример 33
N-[(3-{3-[2-Имино-2-(4-морфолинил)этил]фенил}-2-оксо-1, 3-оксазолидин-5-ил)метил]-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)= 63 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,70 мин.
Пример 34
N-[(3-{3-[2-Имино-2-(1-пирролидинил)этил]фенил}-2-оксо-1,3-оксазолидин-5-ил)метил]-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=447 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,82 мин.
Пример 35
N-({3-[3-(2-Амино-2-иминоэтил)фенил]-2-оксо-1, 3-оксазолидин-5-ил}-метил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=393 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,60 мин.
Пример 140
N-({3-[4-(4,5-Дигидро-1Н-имидазол-2-илметил)фенил]-2-оксо-1,3-оксазолидин-5-ил}-метил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=419 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,65 мин.
Пример 141
N-[(3-{4-[2-Имино-2-(4-морфолинил)этил]фенил}-2-оксо-1,3-оксазолидин-5-ил)метил]-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=463 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,65 мин.
Пример 142
N-[(3-{4-[2-Имино-2-(1-пиперидинил)этил]фенил}-2-оксо-1, 3-оксазолидин-5-ил)-метил]-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=461 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,83 мин.
Пример 143
N-[(3-{4-[2-Имино-2-(1-пирролидинил)этил] фенил}-2-оксо-1,3-оксазолидин-5-ил)метил]-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=447 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,76 мин.
Пример 144
5-Хлор-N-[(3-{4-[2-(циклопентиламино)-2-иминоэтил]фенил}-2-оксо-1,3-оксазолидин-5-ил)-метил]-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=461 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,89 мин.
Пример 145
N-[-{[3-(4-{2-Имино-2-[(2,2,2-трифторэтил)амино]этил}фенил)-2-оксо-1, 3-оксазолидин-5-ил]метил}-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=475 (М+Н, 100). ВЭЖХ (метод 4): время удерживания 2,79 мин.
Пример 146
N-({3-[4-(2-Анилино-2-иминоэтил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=469 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,83 мин.
Пример 147
N-[(3-{4-[2-Имино-2-(2-пиридиниламино)этил]фенил}-2-оксо-1, 3-оксазолидин-5-ил)метил]-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=470 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания 2,84 мин.
Следующие далее примеры от 148 до 151 относятся к отщеплению с аминогруппы защитной трет.-бутоксикарбонильной группы.
Общий способ отщепления трет.-бутоксикарбонильных защитных групп
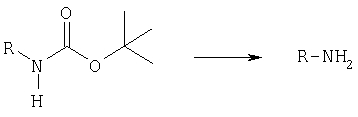
К охлаждаемому льдом раствору соединения с трет.-бутоксикарбонильной защитной группой в хлороформе или в дихлорметане (концентрация примерно от 0,1 до 0,3 моль/л) прибавляют по каплям водную трифторуксусную кислоту (около 90%). Примерно через 15 минут охлаждение льдом удаляют и перемешивают смесь около 2-3 часов при комнатной температуре, затем упаривают раствор и высушивают в высоком вакууме. Остаток растворяют в дихлорметане или в смеси дихлорметана и метанола и промывают насыщенным раствором бикарбоната натрия или однонормальным раствором гидроксида натрия. Органическую фазу промывают насыщенным раствором хлорида натрия, сушат над небольшим количеством сульфатом магния и концентрируют ее. Очистку, если она необходима, проводят путем кристаллизации из диэтилового эфира или смесей диэтилового эфира с дихлорметаном.
По аналогии с этим из предшественников с трет.-бутоксикарбонильными защитными группами получают следующие далее соединения.
Пример 148
N-({3-[4-(Аминометил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамид
Получают из соединения по примеру 92.
Масс-спектр (ионизация электрораспылением): m/z (%)=349 (M-NH2, 25), 305 (100).
ВЭЖХ (метод 1): время удерживания 3,68 (98).
IC50: 2,2 мкМ.
Пример 149
N-{[3-(4-Аминофенил)-2-оксо-1,3-оксазолидин-5-ил]метил}-5-хлор-2-тиофенкарбоксамид
Получают из соединения по примеру 93.
Масс-спектр (ионизация электрораспылением): m/z (%)=352 (М+Н, 25).
ВЭЖХ (метод 1): время удерживания 3,50 (100).
IC50:2 мкМ.
Альтернативный синтез этого соединения с получением чистых энантиомеров представлен следующей далее схемой превращений (см. также S.A.Delalande, патент ФРГ №2836305, 1979; Chem. Abstr. 90, 186926):

Пример 150
N-({3-[4-(Глициламино)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)-5-хлор-2-
тиофенкарбоксамид
Получают из соединения по примеру 152.
Масс-спектр (ионизация электрораспылением, катионы): m/z (%)=408 (100).
ВЭЖХ (метод 3): время удерживания 3,56 (97). IC50: 2 мкМ.
Пример 151
5-(Аминометил)-3-[4-(2-оксо-1-пирролидинил)фенил]-1,3-оксазолидин-2-он
Получают из соединения по примеру 60.
Масс-спектр (ионизация электрораспылением): m/z (%)=276 (М+Н, 100). ВЭЖХ (метод 3): время удерживания 2,99 (100). IC50:2 мкМ.
Следующие далее примеры от 152 до 166 относятся к превращениям по аминогруппе анилинозамещенных или бензиламинозамещенных оксазолидинонов при действии различных реагентов.
Пример 152
N-({3-[4-(N-трет.-Бутилоксикарбонил-глициламино)фенил] -2-оксо-1,3-оксазолидин-5-
ил}метил)-5-хлор-2-тиофенкарбоксамид

К раствору 751 мг (4,3 ммоля) трет.-бутилоксикарбонилглицина, 870 мг (6,4 ммоля) гидрата 1-гидрокси-1Н-бензтриазола, 1790 мг (4,7 ммоля) гексафторфосфата О-бенз-триазол-1-ил-N,N,N',N'-тетраметилурония и 1,41 мл (12,9 ммоля) N-метилморфолина в 15 мл смеси диметилформамида и дихлорметана (1:1) при температуре 0° С прибавляют 754 мг (2,1 ммоля) N-{[3-(4-аминофенил)-2-оксо-1,3-оксазолидин-5-ил]метил}-5-хлор-2-тиофенкарбоксамида (получен по примеру 149). Смесь оставляют на ночь при перемешивании при комнатной температуре, после этого разбавляют водой. Выпавшее твердое вещество отфильтровывают и сушат. Выход 894 мг (79,7% от теории). Масс-спектр (десорбционно-химическая ионизация, NH3): m/z (%)=526 (M+NH4, 100). ВЭЖХ (метод 3): время удерживания 4,17 (97).
Пример 153
N-[(3-{4-[(Ацетиламино)метил] фенил}-2-оксо-1, 3-оксазолидин-5-ил)метил]-5-хлор-2-тиофенкарбоксамид

К смеси 30 мг (0,082 ммоля) N-({3-[4-(аминометил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамида (получен по примеру 148) в 1,5 мл абсолютного тетрагидрофурана, 1,0 мл абсолютного дихлорметана и 0, 02 мл абсолютного пиридина при температуре 0°С прибавляют 0,015 мл (0,164 ммоля) уксусного ангидрида. Смесь оставляют на ночь при перемешивании при комнатной температуре. После прибавления эфира и кристаллизации получают продукт. Выход 30 мг (87% от теории)
Масс-спектр (ионизация электрораспылением): m/z (%)=408 (М+Н, 18), 305 (85).
ВЭЖХ (метод 1): время удерживания 3,78 (97). IC50: 0,6 мкМ.
Пример 154
N-{[3-(4-{[(Аминокарбонил)амино]метил}фенил)-2-оксо-1, 3-оксазолидин-5-ил]метил}-5-хлор-2-тиофенкарбоксамид
К смеси 30 мг (0,082 ммоля) N-({3-[4-(аминометил)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамида (получен по примеру 148) и 1,0 мл дихлорметана при комнатной температуре прибавляют по каплям 0,19 мл (0,82 ммоля) триметилсилилизоцианата. Оставляют при перемешивании на ночь и после прибавления эфира выделяют продукт фильтрованием. Выход 21,1 мг (52% от теории).
Масс-спектр (ионизация электрораспылением): m/z (%)=409 (М+Н, 5), 305 (72).
ВЭЖХ (метод 1): время удерживания 3,67 (83).
IC50: 1,3 мкМ.
Общий способ ацилирования N-{[3-(4-аминофенил)-2-оксо-1,3-оксазолидин-5-ил]метил]-5-хлор-2-тиофенкарбоксамида хлорангидридами карбоновых кислот

В атмосфере аргона к соответствующему хлорангидриду кислоты (2,5 эквивалента) прибавляют по каплям примерно децимолярный раствор N-{[3-(4-аминофенил)-2-оксо-1,3-оксазолидин-5-ил]метил}-5-хлор-2-тиофенкарбоксамида (получен по примеру 149) (1,0 эквивалента) в смеси абсолютных дихлорметана и пиридина (19:1). Смесь оставляют при перемешивании на ночь, прибавляют примерно 5 эквивалентов PS-Trisamine (производства Аргоноут Текнолоджиз) и 2 мл абсолютного дихлорметана. После слабого перемешивания в течение 1 часа отфильтровывают и концентрируют фильтрат. При необходимости продукт очищают методом препаративной ВЭЖХ с обращением фаз. По аналогичной методике получают следующие далее соединения.
Пример 155
N-({3-[4-(Ацетиламино)фенил]-2-оксо-1,3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамид
Жидкостная хроматомасс-спектрометрия: m/z (%)=394 (М+Н, 100).
Жидкостная хроматомасс-спектрометрия (метод 6): время удерживания (%)=3,25 (100).
IC50: 1,2 мкМ.
Пример 156
N-[(2-Оксо-3-{4-[(2-тиенилкарбонил)амино]фенил}-1,3-оксазолидин-5-ил)метил]-5-хлор-2-тиофенкарбоксамид
Жидкостная хроматомасс-спектрометрия: m/z (%)=462 (М+Н, 100).
Жидкостная хроматомасс-спектрометрия (метод 6): время удерживания (%)=3,87 (100).
IC50: 1,3 мкМ.
Пример 157
N-[(3-{4-[(Метоксиацетил)амино]фенил}-2-оксо-1,3-оксазолидин-5-ил)метил] -5-хлор-2-тиофенкарбоксамид
Жидкостная хроматомасс-спектрометрия: m/z (%)=424 (М+Н, 100).
Жидкостная хроматомасс-спектрометрия (метод 6): время удерживания (%)=3,39 (100).
IC50: 0,73 мкМ.
Пример 158
N-{4-[5-({[(5-Хлор-2-тиенил)карбонил]амино}метил)-2-оксо-1,3-оксазолидин-3-ил]-фенил}-3,5-диметил-4-изоксазолкарбоксамид
Жидкостная хроматомасс-спектрометрия: m/z (%)=475 (М+Н, 100).
IC50: 0,46 мкМ.
Пример 159
N-{[3-(4-{[(3-Хлорпропил)сульфонил]амино}фенил)-2-оксо-1, 3-оксазолидин-5-ил]-метил}-5-хлор-2-тиофенкарбоксамид

К охлаждаемому льдом раствору 26,4 мг (0,15 ммоля) 3-хлор-1-пропансульфохлорида и 0,03 мл (0,2 ммоля) триэтиламина в 3,5 мл абсолютного дихлорметана прибавляют 35 мг (0,1 ммоля) N-{[3-(4-аминофенил)-2-оксо-1, 3-оксазолидин-5-ил]метил}-5-хлор-2-тиофенкарбоксамида (получен по примеру 149). Через 30 минут снимают охлаждение льдом и оставляют смесь на ночь при перемешивании при комнатной температуре, затем прибавляют 150 мг (около 5,5 эквивалентов) PS-Trisamine (производства Аргоноут Текнолоджиз) и 0,5 мл дихлорметана. Суспензию слабо перемешивают в течение двух часов, фильтруют (смолу промывают смесью дихлорметана с метанолом) и упаривают фильтрат. Продукт очищают методом препаративной ВЭЖХ с обращением фаз. Выход 19,6 мг (40% от теории).
Жидкостная хроматомасс-спектрометрия: m/z (%)=492 (М+Н, 100).
Жидкостная хроматомасс-спектрометрия (метод 5): время удерживания (%)=3,82 (91).
IC50: 1,7 мкМ.
Пример 160
N-({3-[4-(1,1-Диоксидо-2-изотиазолидинил)фенил]-2-оксо-1,3-оксазолидин-5-ил}-метил)-5-хлор-2-тиофенкарбоксамид

Смесь из 13,5 мг (0,027 ммоля) N-{[3-(4-{[(3-хлорпропил)сульфонил]амино}фенил)-2-оксо-1,3-оксазолидин-5-ил]метил}-5-хлор-2-тиофенкарбоксамида (получен по примеру 159) и 7,6 мг (0,055 ммоля) карбоната калия в 0,2 мл диметилформамида 2 часа нагревают при температуре 100°С. После охлаждения разбавляют дихлорметаном и промывают водой. Органическую фазу сушат и упаривают. Остаток очищают методом препаративной тонкослойной хроматографии (силикагель, дихлорметан/метанол, 95:5).
Выход 1,8 мг (14,4% от теории).
Масс-спектр (ионизация электрораспылением): m/z (%)=456 (М+Н, 15), 412 (100). Жидкостная хроматомасс-спектрометрия (метод 4): время удерживания (%)=3,81 (90).
IC50: 0,14 мкМ.
Пример 161
N-[((5S)-3-{4-[(5-Хлорпентаноил)амино]фенил}-2-оксо-1,3-оксазолидин-5-ил)-метил]-5-хлор-2-тиофенкарбоксамид
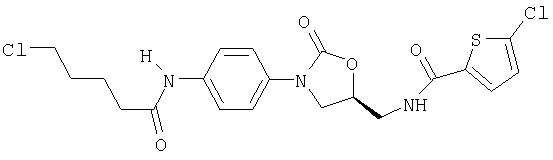
В 27 мл тетрагидрофурана растворяют 0,5 г (1,29 ммоля) N-{[(5S)-3-(4-аминофенил)-2-оксо-1, 3-оксазолидин-5-ил]метил}-5-хлор-2-тиофенкарбоксамида (получен по примеру 149) и прибавляют 0,2 г (1,29 ммоля) хлорангидрида 5-хлорвалериановой кислоты, а также 0,395 мл (2,83 ммоля) триэтиламина. Реакционную смесь упаривают в вакууме и хроматографируют на силикагеле градиентом растворителей от смеси толуол/этилацетат (1:1) до чистого этилацетата. Получают 315 мг (52% от теории) твердого вещества.
Т.пл. 211°С.
Пример 162
N-({(5S)-2-Оксо-3-[4-(2-оксо-1-пиперидинил)фенил]-1, 3-оксазолидин-5-ил}-метил)-5-хлор-2-тиофенкарбоксамид
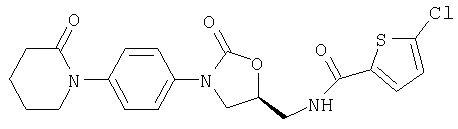
В инертной атмосфере к 5 мл диметилсульфоксида прибавляют 30 мг 60%-ного гидрида натрия в парафиновом масле и в течение 30 минут нагревают при 75°С до окончания вьщеления газа. После этого прибавляют по каплям раствор 290 мг (0,617 ммоля) N-[((5S)-3-{4-[(5-хлорпентаноил)амино]фенил}-2-оксо-1,3-оксазолидин-5-ил)-метил]-5-хлор-2-тиофенкарбоксамида (получен по примеру 161) в 5 мл метиленхлорида и оставляют на ночь при перемешивании при комнатной температуре. Реакцию останавливают и выливают смесь в 100 мл воды, экстрагируют этилацетатом. Упаренную органическую фазу хроматографируют на колонке RP-8, элюируя смесью ацетонитрил/вода. Получают 20 мг (7,5% от теории) целевого соединения.
Т.пл. 205°С.
Спектр ЯМР (300 МГц, d6-диметилсульфоксид): δ=1,85 (м., 4H), 2,35 (м., 2H), 3,58 (м., 4Н), 3,85 (м., 1H), 4,2 (т., 1H), 4,82 (м., 1H), 7,18 (д., 1H, тиофен), 7,26 (д., 2Н), 7,50 (д., 2Н), 2,68 (д., 1H, тиофен), 9,0 (т., 1H, CONH).
IC50: 2,8 нМ.
Пример 163
N-[((5S)-3-{4-[(3-Бромпропионил)амино]фенил}-2-оксо-1,3-оксазолидин-5-ил)-метил]-5-хлор-2-тиофенкарбоксамид

Это вещество получают по аналогии с примером 149.
Пример 164
N-({(5S)-2-Оксо-3-[4-(2-оксо-1-азетидинил)фенил]-1,3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамид

Получают аналогичным способом путем циклизации полученного по примеру 163 бромпропионильного соединения с открытой цепью действием гидрида натрия в диметилсульфоксиде.
Масс-спектр (ионизация электрораспылением): m/z (%)=406 (М+Н, 100), Cl-матрица.
IC50: 380 нМ.
Пример 165
трет.-Бутиловый эфир 4-{4-[5-({[(5-хлор-2-тиенил)карбонил]амино}метил)-2-оксо-1,3-оксазолидин-3-ил]фенил}-3,5-диоксо-1-пиперазинкарбоновой кислоты

К раствору 199 мг (0,85 ммоля) трет.-бутоксикарбонилиминодиуксусной кислоты, 300 мг (2,2 ммоля) гидроксибензтриазола, 0,66 мл (6 ммолей) N-метилморфолина и 647 мг (1,7 ммоля) HBTU прибавляют 300 мг (0,85 ммоля) N-{[3-(4-аминофенил)-2-оксо-1,3-оксазолидин-5-ил]метил}-5-хлор-2-тиофенкарбоксамида в 6 мл смеси из диметилформамида и дихлорметана (1:1). Смесь оставляют при перемешивании на ночь, затем разбавляют дихлорметаном и промывают водой, насыщенным раствором хлорида аммония, насыщенным раствором бикарбоната натрия, водой и насыщенным раствором хлорида натрия. Органическую фазу сушат над сульфатом магния и упаривают. Сырой продукт очищают с помощью хроматографии на силикагеле (смесь дихлорметана и метанола 98:2). Выход 134 мг (29% от теории).
Масс-спектр (ионизация электрораспылением): m/z (%)=571 (M+Na, 82), 493 (100).
ВЭЖХ (метод 3): время удерживания (%)=4,39 (90).
IC50: 2 мкМ.
Пример 166
Трифторацетат N-[((5S)-3-{4-[(3R)-3-амино-2-оксо-1-пирролидинил]фенил}-2-оксо-1, 3-оксазолидин-5-ил)метил]-5-хлор-2-тиофенкарбоксамида

N2-(трет.-Бутоксикарбонил)-N1-{4-[(5S)-5-({[(5-хлор-2-тиенил)карбонил]амино}-метил)-2-оксо-1,3-оксазолидин-3-ил]фенил}-D-метионинамид
В 35 мл диметилформамида растворяют 429 мг (1,72 ммоля) N-трет.-бутоксикарбонил-D-метионина, 605 мг (1,72 ммоля) N-{[(5S)-3-(4-аминофенил)-2-оксо-1,3-оксазолидин-5-ил]метил}-5-хлор-2-тиофенкарбоксамида и 527 мг (3,44 ммоля) гидрата 1-гидрокси-1Н-бензтриазола, прибавляют 660 мг (3,441 ммоля) гидрохлорида N'-(3-диметиламинопропил)-N-этилкарбодиимида и затем прибавляют по каплям 689 мг (5,334 ммоля) N-этилдиизопропиламина. Оставляют на два дня при перемешивании при комнатной температуре. Полученную суспензию отсасывают и промывают остаток диметилформамидом. К объединенным фильтратам прибавляют немного силикагеля, упаривают в вакууме и хроматографируют на силикагеле градиентом концентраций от толуола до смеси 10 частей толуола и 7 частей этилацетата. Получают 170 мг (17% от теории) целевого соединения с т.пл. 183°С.
Rf (на диоксиде кремния, толуол/этилацетат 1:1)=0,2.
Спектр1Н-ЯМР (300 МГц, d6-диметилсульфоксид): δ=1,4 (с., 1H, трет.-бутоксикарбонил), 1,88-1,95 (м., 2H), 2,08 (с., 3Н, SCH3), 2,4-2,5 (м., 2Н, частично перекрывается сигналом от диметилсульфоксида), 3,6 (м., 2H), 3,8 (м., 1Н), 4,15 (м., 2Н), 4,8 (м., 1Н), 7,2 (1Н, тиофен), 7,42 (д., часть АВ-системы, 2Н), 7,6 (д., часть АВ-системы, 2Н), 7,7 (д., 1Н, тиофен), 8,95 (т., 1H, CH2NHCO), 9,93 (с.ш., 1Н, NH).
трет.-Бутил-(3R)-1-{4-[(5S)-5-({[(5-хлор-2-тиенил)карбонил]амино}-метил)-2-оксо-1,3-оксазолидин-3-ил]фенил}-2-оксо-3-пирролидинилкарбамат
В 2 мл диметилсульфоксида растворяют 170 мг (0,292 ммоля) N2-(трет.-бутокси-карбонил)-N1-{4-[(5S)-5-({[(5-хлор-2-тиенил)карбонил]амино}-метил)-2-оксо-1,3-оксазолидин-3-ил]фенил}-D-метионинамида и прибавляют 178,5 мг (0,875 ммоля)йодида триметилсульфония и 60,4 мг (0,437 ммоля) карбоната калия и 3,5 часа перемешивают при температуре 80°С. После этого упаривают в высоком вакууме и промывают остаток этанолом. В остатке получают 99 мг целевого соединения.
Спектр1Н-ЯМР (300 МГц, d6-диметилсульфоксид): δ=1,4 (с., 1H, трет.-бутоксикарбонил), 1,88-2,05 (м., 1H), 2,3-2,4 (м., 1H), 3, 7-3,8 (м., 3Н), 3,8-3,9 (м., 1H), 4,1-4,25 (м., 1H), 4,25-4,45 (м., 1H), 4,75-4,95 (м., 1H), 7,15 (1H, тиофен), 7,25 (д., 1H), 7,52 (д., часть АВ-системы, 2H), 7,65 (д., часть АВ-системы, 2H), 7,65 (д., 1Н, тиофен), 9,0 (с.ш., 1Н).
Трифторацетат N-[((5S)-3-{4-[(3R)-3-амино-2-оксо-1-пирролидинил]фенил}-2-оксо-1,3-оксазолидин-5-ил)метил]-5-хлор-2-тиофенкарбоксамида
В 4 мл метиленхлорида суспендируют 97 мг (0,181 ммоля) трет.-бутил-(3R)-1-{4-[(5S)-5-({[(5-хлор-2-тиенил)карбонил]амино}-метил)-2-оксо-1, 3-оксазолидин-3-ил]фенил}-2-оксо-3-пирролидинилкарбамата. Прибавляют 1,5 мл трифторуксусной кислоты и 1 час перемешивают при комнатной температуре. После этого упаривают в вакууме и очищают с помощью ВЭЖХ с обращением фаз (градиент ацетонитрил/вода /0,1% трифторуксусная кислота). После упаривания соответствующей фракции получают 29 мг (37% от теории) целевого соединения с т.пл. 241°С (разл.).
Rf (на диоксиде кремния, этанол/триэтиламин 17:1)=0,19.
Спектр1Н-ЯМР (300 МГц, d6-диметилсульфоксид): δ=1,92-2,2 (м., 1Н), 2,4-2,55 (м., 1Н, частично перекрывается сигналом от диметилсульфоксида), 3,55-3,65 (м., 2Н), 3,75-3,95 (м., 3Н), 4,1-4,3 (м., 2Н), 4,75-4,9 (м., 1Н), 7,2 (1H, тиофен), 7,58 (д., часть АВ-системы, 2Н), 7,7 (д., часть АВ-системы, 2Н), 7,68 (д., 1Н, тиофен), 8,4 (с.ш., 3Н, NH3), 8,9 (т., 1H, NHCO).
Следующие далее примеры от 167 до 170 относятся к введению сульфонамидных групп в фенилзамещенные оксазолидиноны.
Общий способ получения замещенных сульфонамидов из N-[(2-оксо-3-фенил-1,3-оксазолидин-5-ил)метил]5-хлор-2-тиофенкарбоксамида

В атмосфере аргона к хлорсульфоновой кислоте (12 эквивалентов) при температуре 5°С прибавляют N-[(2-оксо-3-фенил-1,3-оксазолидин-5-ил)метил]5-хлор-2-тиофенкарбоксамид (получен по примеру 96). Реакционную смесь 2 часа перемешивают при комнатной температуре и после этого выливают в воду со льдом. Выпавший осадок отфильтровывают, промывают водой и сушат.
Затем в атмосфере аргона при комнатной температуре растворяют в тетрагидрофуране (концентрация 0,1 моль/л) и прибавляют соответствующий амин (3 эквивалента), три-этиламин (1,1 эквивалента) и диметиламинопиридин (0,1 эквивалент). Реакционную смесь перемешивают в течение 1-2 часов и после этого упаривают в вакууме. Целевой продукт очищают с помощью флэш-хроматографии (смеси дихлорметана с метанолом).
По аналогии с этим получают следующие далее соединения.
Пример 167
N-({2-Оксо-3-[4-(1-пирролидинилсульфонил)фенил]-1,3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=492 ([M+Na]+, 100), 470 ([М+Н]+, 68), Cl-матрица.
ВЭЖХ (метод 3): время удерживания (%)=4,34 (100).
IC50=0,5 мкМ.
Пример 168
N-[(3-{4-[(4-Метил-1-пиперазинил)сульфонил]фенил}-2-оксо-1,3-оксазолидин-5-ил)-метил]-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=499 ([М+Н]+, 100), Cl-матрица.
ВЭЖХ (метод 2): время удерживания (%)=3,3 (100).
Пример 169
N-({2-Оксо-3-[4-(1-пиперидинилсульфонил)фенил]-1,3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=484 ([М+Н]+, 100), Cl-матрица.
ВЭЖХ (метод 2): время удерживания (%)=4,4 (100).
Пример 170
N-[(3-(4-[(4-Гидрокси-1-пиперидинил)сульфонил] фенил}-2-оксо-1, 3-оксазолидин-5-ил)метил]-5-хлор-2-тиофенкарбоксамид
Масс-спектр (ионизация электрораспылением): m/z (%)=500 ([М+Н]+, 100), Cl-матрица.
ВЭЖХ (метод 3): время удерживания (%)=3,9 (100).
Пример 171
N-({2-Оксо-3-[4-(1-пирролидинил)фенил]-1,3-оксазолидин-5-ил}метил)-5-хлор-2-тиофенкарбоксамид

В 6 мл дихлорметана и 9 мл трифторуксусной кислоты растворяют 780 мг (1,54 ммоля) трет.-бутил-1-{4-[5-({[(5-хлор-2-тиенил)карбонил]амино}метил)-2-оксо-1,3-оксазолидин-3-ил]фенил}-пролината и перемешивают смесь в течение двух дней при температуре 40°С. Затем реакционную смесь упаривают и перемешивают с эфиром и 2 н. раствором гидроксида натрия. Водную фазу упаривают и перемешивают с эфиром и 2 н. соляной кислотой. Полученную при этой экстракции органическую фазу сушат над сульфатом магния, фильтруют и упаривают. Сырой продукт хроматографируют на силикагеле (дихлорметан/этанол/концентрированный водный раствор аммиака в соотношении от 100/1/0,1 до 20/1/0,1). Получают 280 мг (40% от теории) продукта.
Масс-спектр (ионизация электрораспылением): m/z (%)=406 (М+Н, 100).
ВЭЖХ (метод 4): время удерживания (%)=3,81 мин.
Параметры ВЭЖХ и параметры жидкостной хроматомасс-спектрометрии в приведенных выше данных ВЭЖХ и жидкостной хроматомасс-спектрометрии в представленных выше примерах (время удерживания указано в минутах):
[1] колонка Kromasil С18, L-R температура 30°С, скорость протекания 0,75 мл/мин, элюент А=0,01 М HClO4, Б=ацетонитрил, градиент → 0,5 мин. 98% А → 4,5 мин. 10% А → 6,5 мин. 10% А;
[2] колонка Kromasil C18 60*2, L-R температура 30°С, скорость протекания 0,75 мл/мин, элюент А = 0,01 М Н3РО4, Б = ацетонитрил, градиент → 0,5 мин. 90% А → 4,5 мин. 10% А → 6,5 мин. 10% А;
[3] колонка Kromasil C18 60*2, L-R температура 30°С, скорость протекания 0,75 мл/мин, элюент А=0,005 М HClO4, Б=ацетонитрил, градиент → 0,5 мин. 98% А → 4,5 мин. 10% А → 6,5 мин. 10% А;
[4] колонка Symmetry C18 2, 1×150 мм, обогреватель колонки 50°С, скорость протекания 0,6 мл/мин, элюент А=0,6 г 30%-ной соляной кислоты на 1 л воды, Б=ацетонитрил, градиент 0,0 мин. 90% А → 4, 0 мин. 10% А → 9 мин. 10% А;
[5] MHZ-2Q, прибор Micromass Quattro LCZ колонка Symmetry C18 50 мм × 2,1 мм, 3,5 мкм, температура 40°С, скорость протекания 0,5 мл/мин, элюент А=ацетонитрил+0,1% муравьиной кислоты, Б=вода+0,1% муравьиной кислоты, градиент 0,0 мин. 10% А → 4 мин. 90% А → 6 мин. 90% А;
[6] MHZ-2P, прибор Micromass Platform LCZ колонка Symmetry C18 50 мм × 2,1 мм, 3,5 мкм, температура 40°С, скорость протекания 0,5 мл/мин, элюент А=ацетонитрил+0,1% муравьиной кислоты, Б=вода+0,1% муравьиной кислоты, градиент 0,0 мин. 10% А → 4 мин. 90% А → 6 мин. 90% А;
[7] MHZ-7Q, прибор Micromass Quattro LCZ колонка Symmetry C18 50 мм × 2,1 мм, 3,5 мкм, температура 40°С, скорость протекания 0,5 мл/мин, элюент А=ацетонитрил+0,1% муравьиной кислоты, Б=вода+0,1% муравьиной кислоты, градиент 0,0 мин. 5% А → 1 мин. 5% А → 5 мин. 90% А → 6 мин. 90% А.
Общий способ получения оксазолидинонов общей формулы Б твердофазным синтезом Взаимодействия различных связанных со смолой продуктов протекали без постадийного выделения в раздельных реакционных сосудах.
В 70 мл диметилсульфоксида растворяют 1,2 г (3,75 ммоля) 5-(бромметил)-3-(4-фтор-3-нитрофенил)-1,3-оксазолидин-2-она А (получен из эпибромгидрина и 4-фтор-3-нитрофенилизоцианата с бромидом лития и трибутилфосфиноксидом в ксилоле по аналогии с патентом США № 4128654, пример 2) и 1,91 мл (4,13 ммоля) диизопропилэтиламина, прибавляют вторичный амин (1,1 эквивалента, аминная компонента 1) и проводят взаимодействие в течение 5 часов при температуре 55°С. К этому раствору прибавляют смолу TentaGel Sam (5,00 г, 0,25 ммоль/г) и для протекания реакции выдерживают 48 часов при 75°С. Смолу отфильтровывают и многократно промывают метанолом, диметилформамидом, метанолом, дихлорметаном и диэтиловым эфиром и сушат. Смолу (5,00 г) суспендируют в дихлорметане (80 мл), прибавляют диизопропилэтиламин (10 эквивалентов) и хлорангидрид 5-хлортиофен-2-карбоновой кислоты [получен в результате реакции 5-хлортиофен-2-карбоновой кислоты (5 эквивалентов) с 1-хлор-1-диметиламино-2-метилпропеном (5 эквивалентов) в дихлорметане (20 мл) при комнатной температуре в течение 15 минут] и оставляют на 5 часов при комнатной температуре для протекания реакции. Полученную смолу отфильтровывают и многократно промывают метанолом, дихлорметаном и диэтиловым эфиром и сушат. После этого смолу суспендируют в смеси диметилформамида и воды (объемное отношение 9:2, 80 мл), прибавляют дигидрат дихлорида олова (5 эквивалентов) и проводят взаимодействие в течение 18 часов при комнатной температуре. Смолу снова многократно промывают метанолом, диметилформамидом, водой, метанолом, дихлорметаном и диэтиловым эфиром и сушат. Эту смолу суспендируют в дихлорметане, прибавляют диизопропилэтиламин (10 эквивалентов) и при 0°С прибавляют хлорангидрид кислоты (5 эквивалентов производного кислоты 1) и для протекания реакции оставляют на ночь при комнатной температуре. Карбоновые кислоты перед проведением взаимодействия переводят в соответствующие хлорангидриды действием 1-диметиламино-1-хлор-2-метилпропена (1 эквивалент из расчета на карбоновую кислоту) в дихлорметане при комнатной температуре в течение 15 минут. Смолу многократно промывают диметилформамидом, водой, диметилформамидом, метанолом, дихлорметаном и диэтиловым эфиром и сушат. В случае использования в качестве производного кислоты 1 аминокислот с 9-флуоренилметилоксикарбонильной защитной группой эту защитную группу на последней стадии реакции снимают действием пиперидина в диметилформамиде (объемное соотношение 1/4) при комнатной температуре в течение 15 минут, а смолу промывают диметилформамидом, метанолом, дихлорметаном и диэтиловым эфиром и сушат. После этого продукт отщепляют от твердой фазы трифторуксусной кислотой в дихлорметане (объемное соотношение 1:1), смолу отфильтровывают и упаривают реакционные растворы. Сырые продукты фильтруют через силикагель (дихлорметан и метанол в соотношении 9:1) и упаривают для получения порции продуктов Б.
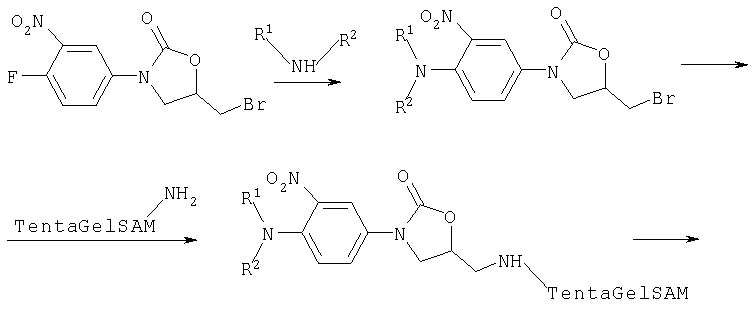

Способом твердофазного синтеза получают следующие далее соединения.
Пример 172
N[(3-{3-(β -Аланиламино)-4-[(3-гидроксипропил)амино]фенил}-2-оксо-1,3-оксазолидин-5-ил)метил]-5-хлор-2-тиофенкарбоксамид

По аналогии с общей методикой получения производных Б проводят взаимодействие 5 г (1,25 ммоля) смолы TentaGel SAM с азетидином в качестве аминного производного 1 и с защищенным флуоренилметилоксикарбонильной группой β-аланином в качестве производного кислоты 1. Полученный после отщепления сырой продукт 48 часов перемешивают в метаноле при комнатной температуре и упаривают досуха. Этот сырой продукт очищают с помощью ВЭЖХ с обращением фаз, используя градиент смеси воды, трифторуксусной кислоты и ацетонитрила.
Спектр1H-ЯМР (400 МГц, дейтерометанол): 2,31 (т.т., 2Н), 3,36 (т., 2Н), 3,54 (т., 2Н), 3,62 (т., 2Н), 3,72 (д.д., 1H), 3,79 (д.д., 1H), 4,01 (д.д., 1H), 4, 29 (д.д., 2H), 4,43 (т., 2Н), 4,85-4,95 (м., 1H), 7,01 (д., 1Н), 4,48-7,55 (м., 2H), 7,61 (д., 1H), 7,84 (д., 1H).
Пример 173
N-({3-[4-(3-Амино-1-пирролидинил)-3-нитрофенил]-2-оксо-1, 3-оксазолидин-5-ил}-метил)-5-хлор-2-тиофенкарбоксамид
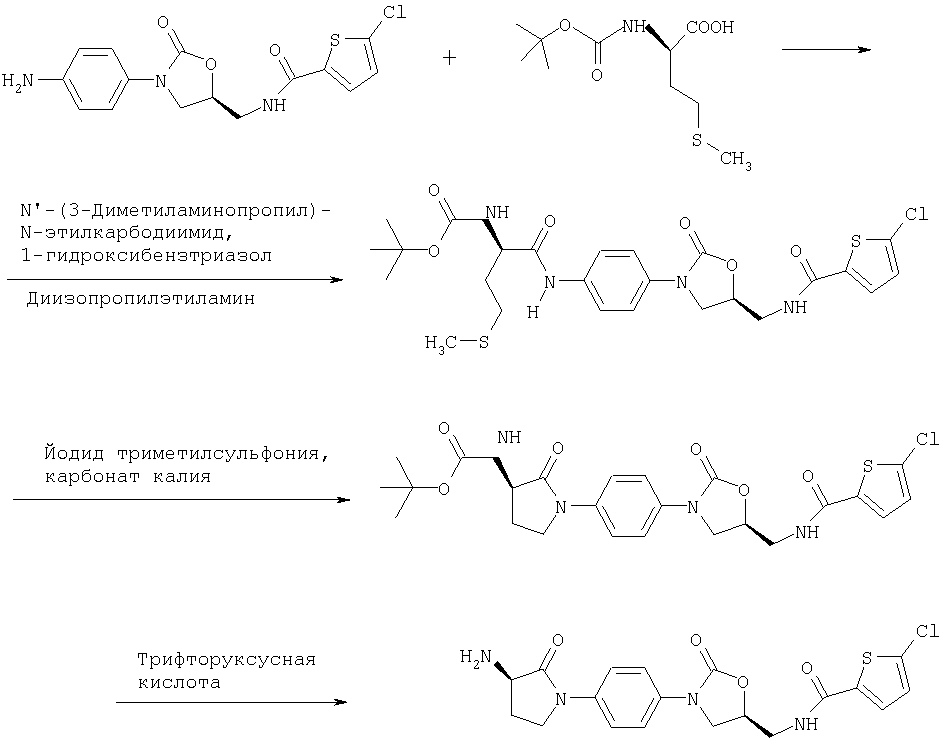
По аналогии с общей методикой получения производных Б проводят взаимодействие 130 мг (32,5 мкмоля) смолы TentaGel SAM с трет.-бутил-3-пирролидинилкарбаматом в качестве аминного производного 1. Полученное после ацилирования 5-хлортиофенкарбоновой кислотой производное нитробензола отщепляют от твердой фазы и упаривают. Этот сырой продукт очищают с помощью ВЭЖХ с обращением фаз, используя градиент смеси воды, трифторуксусной кислоты и ацетонитрила.
Спектр1Н-ЯМР (400 МГц, дейтерометанол): 2,07-2,17 (м., 1Н), 2,39-2,49 (м., 1H), 3,21-3,40 (м., 2Н), 3,45 (д.д., 1Н), 3,50-3,60 (м., 1Н), 3,67 (д.д., 1Н), 3,76 (д.д., 1Н), 3,88-4,00 (м., 2Н), 4,14-4,21 (т., 1H), 4,85-4,95 (м., 1H), 7,01 (д., 1H), 7,11 (д., 1Н), 7,52 (д., 1H), 7,66 (д.д., 1Н), 7,93 (д., 1H).
Пример 174
H-({3-[3-(Ацетиламино)-4-(1-пирролидинил)фенил]-2-оксо-1, 3-оксазолидин-5-ил}-метил)-5-хлор-2-тиофенкарбоксамид
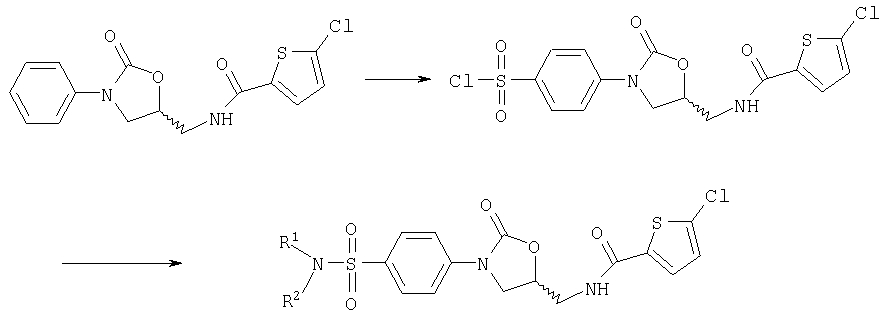
По аналогии с общей методикой получения производных Б проводят взаимодействие 130 мг (32,5 мкмоля) смолы TentaGel SAM с пирролидином в качестве аминного производного 1 и с ацетилхлоридом в качестве производного кислоты 1. Сырой продукт перемешивают с этилацетатом и с раствором бикарбоната натрия, органическую фазу высаливают хлоридом натрия, декантируют и упаривают досуха. Этот сырой продукт очищают методом вакуумной флэш-хроматографии на силикагеле (смесь дихлорметана и этилацетата в соотношениях от 1:1 до 0:1).
Спектр1Н-ЯМР (400 МГц, дейтерометанол): 1,93-2,03 (широкая полоса, 4Н), 2,16 (с, 3Н), 3,20-3,30 (широкая полоса, 4Н), 3,70 (д., 2Н), 3,86 (д.д., 1H), 4,10 (д.д., 1Н), 4,14 (д.д., 1H), 4, 80-4,90 (м., 1H), 7,00 (д., 1H), 7,07 (д., 1H), 7,31 (д.д., 1H), 7,51 (д., 1H), 7,60 (д., 1H).
По аналогии с общей методикой получения синтезируют следующие далее соединения.



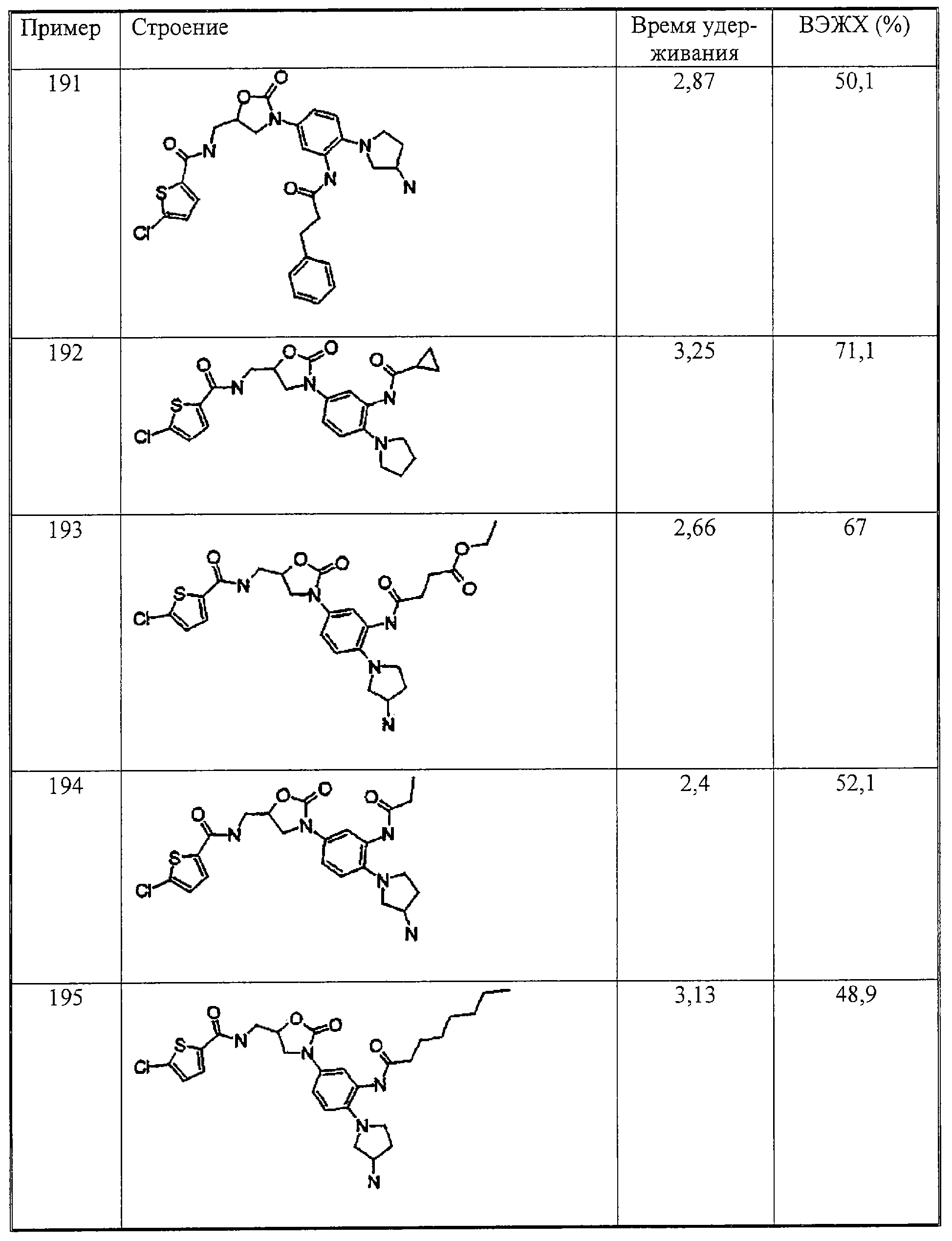


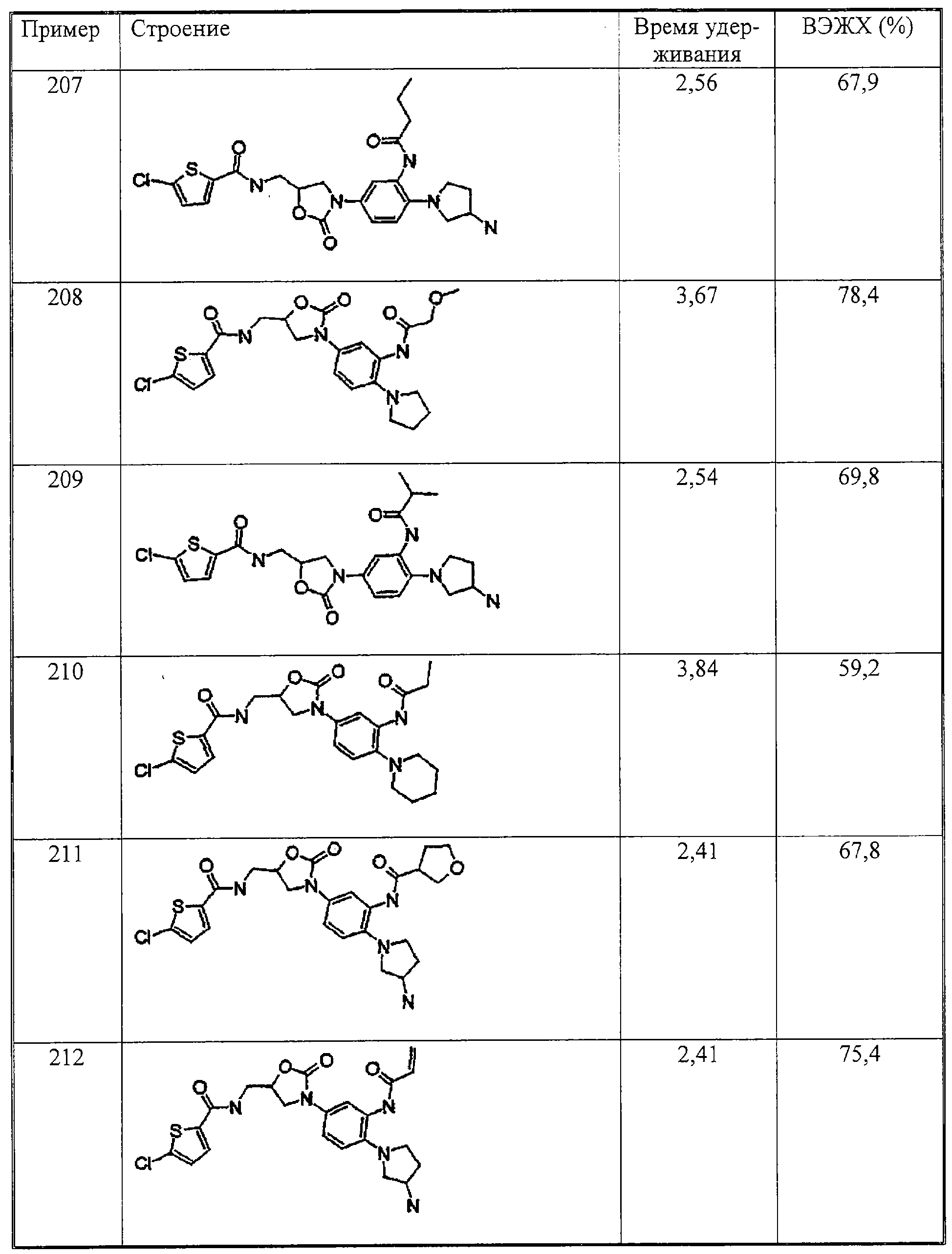

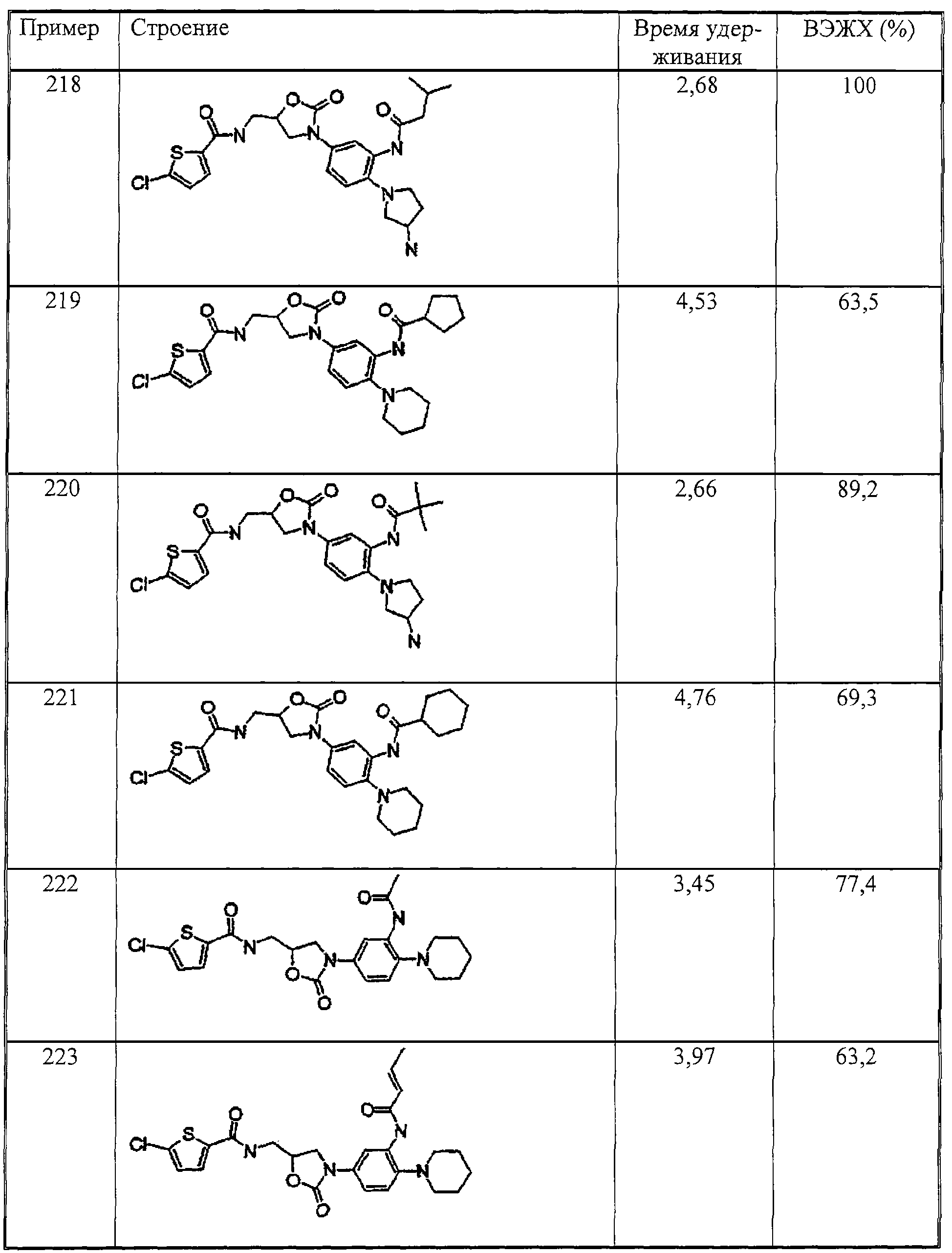



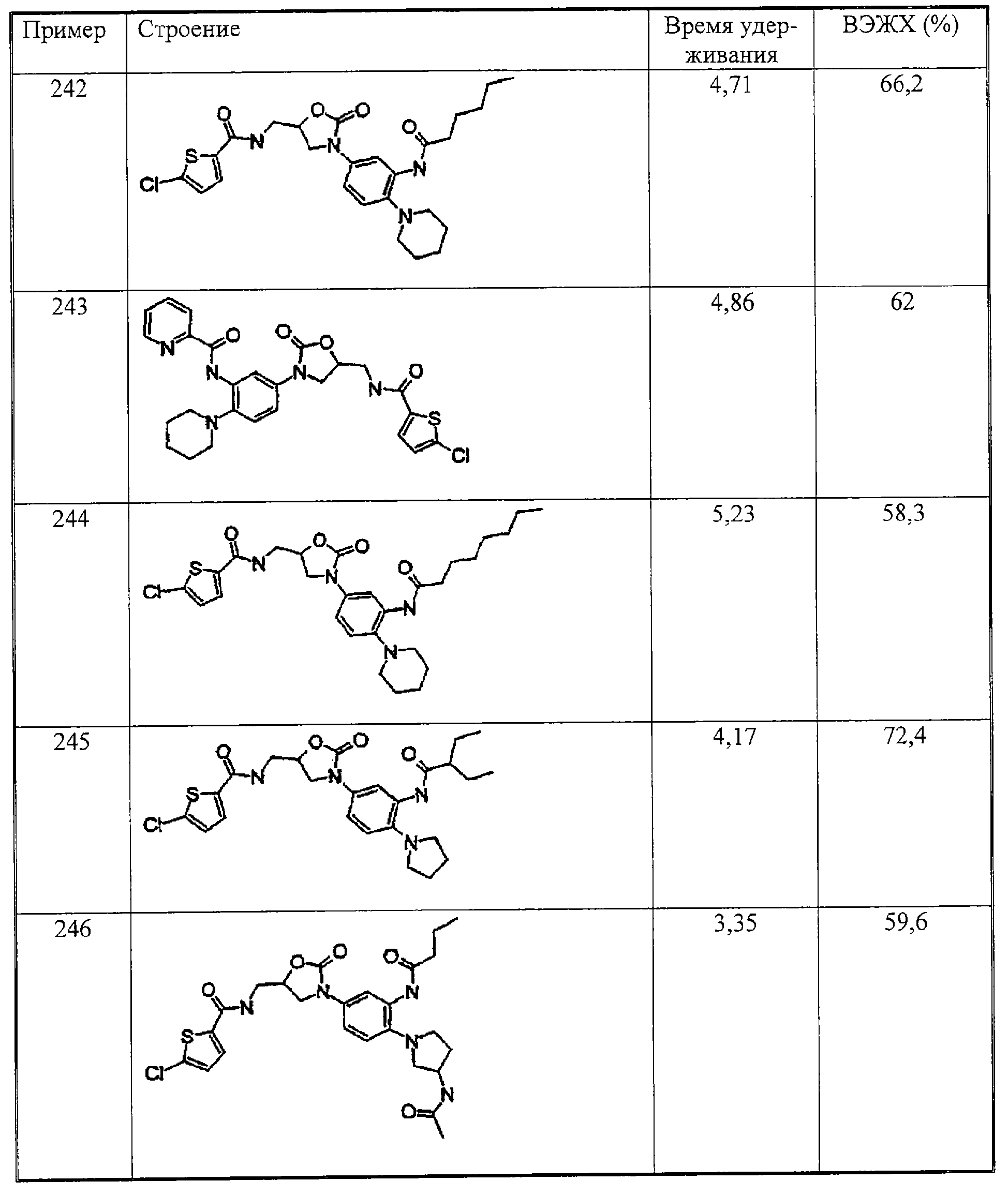


Все продукты твердофазного синтеза были охарактеризованы с помощью жидкостной хроматомасс-спектрометрии. Для этого в соответствии со стандартом использовалась следующая система разделения: прибор HP 1100 с УФ-детектором (208-400 нм), температура обогревателя 40°С, колонка Waters-Symmetry C18 (50 мм × 2,1 мм, 3,5 мкм), подвижная фаза А: 99,9% ацетонитрила/0,1% муравьиной кислоты, подвижная фаза Б: 99,9% воды/0,1% муравьиной кислоты, градиент:
Анализ веществ проводился с помощью прибора Micromass Quattro LCZ MS, ионизация электрораспылением (катионы/анионы).
В приведенных структурах, которые содержат остатки


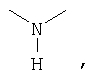
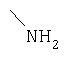
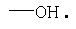
Получение таблеток
Гидроксипропилметилцеллюлозу и лаурилсульфат натрия растворяют в воде. В полученном растворе суспендируют соединение формулы (I) в качестве активного вещества. Полученную таким образом суспензию набрызгивают методом гранулирования в кипящем слое на смесь, состоящую из микрокристаллической целлюлозы, моногидрата лактозы и кроскармелозы.
После сушки и просеивания (через сито с размером отверстий 0,8 мм) полученного гранулята добавляют стеарат магния и перемешивают. Полученную таким образом смесь прессуют в таблетки диаметром 6 мм. Последующее лакирование таблеток осуществляют с помощью двуокиси титана, которая суспендирована в водном растворе гидроксипропилметилцеллюлозы и полиэтиленгликоля.
Получение гранулятов
Гидроксипропилметилцеллюлозу и лаурилсульфат натрия растворяют в воде. В полученном растворе суспендируют соединение формулы (I) в качестве активного вещества. Полученную таким образом суспензию набрызгивают методом гранулирования в кипящем слое на смесь, состоящую из микрокристаллической целлюлозы, моногидрата лактозы и кукурузного крахмала.
После сушки и просеивания (через сито с размером отверстий 0,8 мм) полученного гранулята добавляют высокодисперсную двуокись кремния и перемешивают. Полученную смесь в количестве 160 мг наполняют в капсулы из твердого желатина величиной 2.
Реферат
Изобретение относится к новым оксазолидинонам общей формулы (I), их фармацевтически приемлемым солям, гидратам и гидратам солей, селективно ингибирующим фактор Ха и имеющим антитромботическое действие, к способу их получения (варианты), к применению известных замещенных оксазолидинонов общей формулы (А) в качестве средства, селективно ингибирующего фактор Ха и имеющего антитромботическое действие, и лекарственному средству на основе, по крайней мере, одного соединения общей формулы (I) или, по крайней мере, одного соединения общей формулы (А)

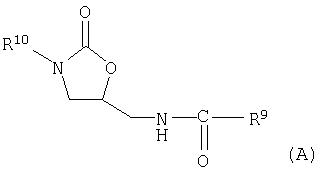
Значения заместителей R1, R2, R3, R4, R5, R6, R7, R8, R9 и R10 указаны в формуле изобретения. 5 н. и 5 з.п-в ф-лы, 2 табл.
Формула






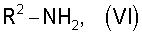


Документы, цитированные в отчёте о поиске
Способ получения 3-(замещенный фенил)-5-ациламидометилоксазолидинонов-2 в виде @ - или смеси @ - и @ -стереоизомеров

Комментарии