: Изобретение относится к способу I получения новых химических соедине-
|Ний, а именно 3-(замещенный фенил)- 15-ациламидомет1-шоксазолидинонов-2 в
виде 1- или смеси d- и 1-стереоизо- ;меров, которые обладают антибактери-
;альным действием и могут найти приме- :нение в медицине.
I Целью изобретения является создание способа полухгения новых производных
оксазолидинона, обладающих анти- Зактериальной активностью с увеличен-
:1Ой продолжительностью действия ин :зиво и ослабленными побочными эффектами .
Структура и физико-химические ха- |5актеристики оксизолидинонов-2,получа-
емых по предлагаемому способу, приведены в табл.1..
Пример 1. Получение (1)-N-
{3- 4-(метилтио)-фенил -2-оксоокса- : олидин-5-илметил ацетамида (соединение 5). -
А. Получение (1)-5-аминометил-3- |4-(метилтио)-фенил -2-оксазолидино- на.
Раствор 200 г (0,78 моль)(а1)-5- бромметил-3- f4-(метилтио)-фенил -2-
оксазолидинона в 300 мл этанола под Давлением обрабатьтают 300 г аммиака
При I00 С в течение 8 ч. Реакционную массу затем взвевхивают в воде, охлаж-
д}ают на ледяной бане, подщелачивают 1р%-ной гидроокисью натрия и затем
э страгируют этилацетатом. Собранные
O
5
экстракты промывают рассолом,высусш- вают и концентрируют под пониженным
давлением. Полученный продукт растирают с диэтиловым эфиром, фильтруют
5 и промывают диэтиловым эфиром с получением 129,7 г продукта. Перерастворение
осуществляют путем взвешивания продукта в 100 мл метоксиэтанола с
50 г (1)-миндальной кислоты, после . чего взвесь подогревают до получения
однородного раствора. Раствор охлаждают медленно до комнатной температуры
, фильтруют, промывают этанолом и высушива:ют.. Твердый продукт затем
кристаллизуют 3 раза из метоксиэтанола , содержащего 1 г (1)-миндальной
кислоты с получением (1)-миндальной соли. Порцию миндальной соли (10,0 г)
взвешивают в 100 мл воды и свободный амин получают путем добавления 10%-ной водной гидроокиси натрия.
Смесь экстрагируют зтилацетатом, про- мьшают рассолом, высушивают и концентрируют
под пониженным давлением. Свободный амин растирают с диэтиловым эфиром с получением 5,73 г продукта
с т.пл.95-9б с ( Л1 - 72,3 i 0,4 (С 1 в ацетонитриле).
Б. В раствор 5,73 г (24, 1 ммоль) (1)- 5-аминометил-З f-4- (метил тио) -фенил}-2- в 40 мл пиридина
2,3 мл ангидрида уксусн ой кислоты (по каплям) с
интенсивным перемешиванием.Реакционную массу нагревают до комнатной температуры
и перемешивают под атмосфе0
5
0
5
оксазолидинона при О С добавляют
рой азота в течение ночи, затем концентрируют под пониженным давлением
и остаток растирают с 10%-ным водным раствором соляной кислоты, фильтруют
и промывают водой. Выход продукта составляет 6,0 г (89%). Т.п. 166,7 -г 167,.
Пример 2. Получение (dl)-N- (3-фенил-2.-оксоосазолидин-5-илметил)- Q ацетамида.
Раствор 50,0 г (196,1 MMonb)(dl)- 5-бромметил-3-феншт-2-оксазолидинона в диметилацетамиде обрабатывают ПOJД
давлением.100 г аммиака при 100 С в 15 течение 14 ч. Реакционную массу разбавляют
водой и экстрагируют этилаце- татом. .Органический слой промьшают водой и рассолом, высушивают и упариние
продолжают еще 1 ч. Реакционную массу затем выливают на лед, твердое
вещество отфильтравьгеают и хорошо про мьгоают водой. Твердое вещество затем
добавляют в,смесь концентрированного гидроксида аммония и тетрагидрофура-
на (ТГФ), который удаляют путем концентрирования массы под пониженным
давлением. Остаток перемешивают с во дой и отфильтровьшают, выход cocTg -
ляет 7,71 г продукта.с т.пл. 230,0- 230,.Его перекристаллизовьшают и
смеси 70%-ного этанола с водой и получают 7,32 г продукта с т.пл. 228,5
229,0 С. Его еще раз перекристаллизо вьшают из ацетонитрила с получением
6,85 г продукта с т.пл. 236,4-236, Пример 4. Получение (1)-Nвают под пониженным давлением с полу-2о з-(4-азидосульфонилфенил)-2-оксоокчением 24,6 г.
PdcTBOp 10,0 г (52,1 ммоль) (dl) 5-аминометил-3-фенш1-2-оксазолидинот на в 60 мл пиридина перемешивают с
добавлением по каплям 5 мл ангидрида уксусной кислоты. Смесь перемешивают
в течение ночи. В результате получают
сазолидин-5-илметилТ-ацетамида (соеди
нение 37). 5,0 г (21,3 ммоль)(1)-N- (3-фенил-2-оксооксазолидин-5-илме-
тил)-ацетамида добавляют в 25 мл хлор 25 сульфокислоты, перемешивают смесь в
течение 2 ч, выливают на лед, фильтруют и тщательно промьшают. После от-
сасьшания из продукта жидкости на фильтре до сухого состояния его добавляют
в раствор, приготовленный ра створением 2,0 г азида натрия в 5 мл
воды, и разбавляют раствор 50 мл ацетона . Смесь перемешивают в течение
2 ч и под пониженным давлением вьта- ривают ацетон. Остаток разбавляют водой
и смесь фильтруют, получая 5,81 г продукта с т.пл. 102-104 С (с разл.)
Последний церекристаллизовьшают из
7,2 г продукта с т.пл. 130-130,7 С
(выход 59%).
Пример 3. Получение (1)-N- З- 4-(аминосульфонил)-фенил -2-оксо-
оксазолидин-5-илметил1ацетамида (соединение 36).
А. Получение (1)-Н-.(3-фенил-2- оксазолидин-5-илметш1)-ацетамида.
Раствор 12,5 г (65,0 ммоль) (1)- 5-аминометил-3-фенил-2-оксазолидино-
на в 50 мл сухого пиридина перемешивают с добавлением 7 мл ангидрида уксусной
кислоты. Смесь оставляют стоять в течение ночи, затем ее концентрируют . Полученный остаток перемешивают
с водой и твердый остаток фильтруют и высушивают; выход составляет
10,2 г продукта с т.пл. 122,4-124,5°С . Его перекристаллизовьшают из этанола
с получением 5,02 г продукта с т.пл. 126,8-127,3°С. Получают вторую порцию
и перекристаллизовьшают из этанола с получением 3,08 г материала с т.пл. 127,3-127,.
Н. 15-миллилитровую порцию хлорсульфокислоты перемешивают и в атмосфере
азота вьщерживают при комнатной температуре .с одновременным добавлением 7,91 г (33,8 ммоль)
(l)-N-(3-фeнил-2-oкcaзoлйд ш-5-илмe- тил)-ацетамида. После полного растворения
твердого вещества., перемешива
ние продолжают еще 1 ч. Реакционную
массу затем выливают на лед, твердое вещество отфильтравьгеают и хорошо про-
мьгоают водой. Твердое вещество затем добавляют в,смесь концентрированного
гидроксида аммония и тетрагидрофура- на (ТГФ), который удаляют путем концентрирования
массы под пониженным давлением. Остаток перемешивают с водой и отфильтровьшают, выход cocTg -
ляет 7,71 г продукта.с т.пл. 230,0- 230,.Его перекристаллизовьшают из
смеси 70%-ного этанола с водой и получают 7,32 г продукта с т.пл. 228,5-
229,0 С. Его еще раз перекристаллизовьшают из ацетонитрила с получением
6,85 г продукта с т.пл. 236,4-236,, Пример 4. Получение (1) (4-азидосульфонилфенил)-2-оксоок з-
(4-азидосульфонилфенил)-2-оксоок
сазолидин-5-илметилТ-ацетамида (соединение
37). 5,0 г (21,3 ммоль)(1)-N- (3-фенил-2-оксооксазолидин-5-илме-
тил)-ацетамида добавляют в 25 мл хлор- сульфокислоты, перемешивают смесь в
течение 2 ч, выливают на лед, фильтруют и тщательно промьшают. После от-
сасьшания из продукта жидкости на фильтре до сухого состояния его добавляют
в раствор, приготовленный растворением 2,0 г азида натрия в 5 мл
воды, и разбавляют раствор 50 мл ацетона . Смесь перемешивают в течение
2 ч и под пониженным давлением вьта- ривают ацетон. Остаток разбавляют водой
и смесь фильтруют, получая 5,81 г продукта с т.пл. 102-104 С (с разл.).
Последний церекристаллизовьшают из
0
5
0
5
этанола, получая 5,0 г продукта с
т.пл. 122,5-123,4 С (с разл.).
Пример 5. С применением хлор-
сульфирования, описанного в примере 3, получают соединения 38-40.
Пример 6. Получение (1)-N- (метилсульфинил)-фенил -2-оксо-
оксазолидин-5- илметш1| ацетамида (соединение 41).
Порцию из 5,61 г (20 ммоль)(1)-N- (метилтио)-фенил -2-оксооксазо- лидин-5-илметил|ацетамида в 200 мл
метанола перемешивают при температуре 0°С, одновременно добавляя в нее
постепенно раствор 12,3 г продукта Оксон (2KHS05- KHSO;, ) в 50мл
воды. После завершения операции добавления сульфид полностью израсходуется
, как это определяется тонкослойной хроматографией, в результате чего
продукт представляет собой смесь
10
сульфоксида с сульфоном. Этот раствор нагревают совместно с 12 мл метил- сульфида с целью уменьшить избыток
продукта Оксон , концентрируют под пониженным давлением, получая 2,0 г продукта с т.пл. 188,6-189,. Этот,
последний перекристаллизовьшают из смеси 70%-ного этанола с водой, получая 1,5 г сульфоксида с т.пл.193,7-
197.С.
Пример 7. Получение метилового эфира (1)-N- з-С4-(метш1сульфи-
нил -2-оксооксазолидин-5-илметш1| - карбаминовой кислоты (соединение 42). В соответствии с процедурой, опи-
санной в примере 6, указанное в заготовке соединение (т.пл.150,5 - 159,5 С) получают с использованием
в качестве исходного продукта соединения 6.
Пример 8. Получение (1)-N-
3-(4-нитрофенш1)-2-оксооксазолидин- 5-ш1метш1 ацетамида (соединение 47).
30-миллилитровую порцию концентри- рованной серной кислоты в токе азота
15
20
: переменитают с сяспаждением до темпе- ;ратуры - 10°С, после чего в нее до-
бавляют 5 г (21,3 ммоль) (l)-N-(3- 1фенил-2-оксазолидин-5-илметш1)гацета
|мида. После полного растворения твер |дого материала при Температуре от
|-}0 до О С добавляют 2,2 г нитрата |калия. Затем смеси дают нагреться до
|комнатной температуры в течение 2 ч. Далее смесь выливают на лед, выпавший
в осадок продукт отфильт.ровьшают тщательно промывают водой и сушат, получая 3,47 г вещества. Тонкослой-
|ная хроматография на пластинке с си- . ликагелем при элюировании смесью хлороформа
с метанолом в соотношении 9:1 показывает наличие пятна R/-0,37 для п-нитро- и пятно ,28 для о
Нитросоединения. Продукт перекристал
лизовывают из ацетонитрила, получая
2,15 г с т.пл.; 194,5 - 195,, который характеризуется одним пятном на тонкослойной хромато-
грамме, что указывает на наличие па- ранитропродукта.
Пример 9. Получение (1)-N- |,3-(2-нитрофенил)-2-оксооксазолидин- 5-илметил ацетамида (соединение 48),
90-миллилитровую порцию концентрированной серной кислоты перемепш-
нают в токе сухого азота, добавляя в нее II г нитрата калия. Смесь нагревают
, ее охлаждают на бане со льдо
5
до температуры 0-10 С, добавляя в нее постепенно 23,4 г (0,10 моль) .()-
К-(3-фенил-2-оксазолидин-5-илметил)- ацетамида. После перемешивания в течение
1 ч тонкослойная хроматограмма показывает, что в смеси содержится
остаток ИСХОДНОГО соединения. Добавляют дополнительно 3 г нитрата калия
и перемешивание продолжают в течение еще 2ч. Реакционную смесь вьшивают
в смесь воды со льдом и продукт экстрагируют хлороформом. Экстракт концентрируют
и остаток (20 г) разделяют препаративной хроматографией с использованием Уотерс Преп 500. В виде
первой фракции t получаиот 2,8 г продукта с т.пл.130-13б С.
Пример 10. Получение (1)-N0 3-(4-аминофенил)-2-оксооксазолидин- 5-ш1метш1 -ацетамида (соединение 49).
Смесь 5,00 г (17,9 ммоль) (1)-N- 3-(4-нитрофенил)-2-оксооксазолидин-
5-илмeтшIJ-aцeтaмидa, 50 мл абсолютированного этанола и 3 г никеля Ренея
в качестве катализатора перемешивают, выдерживая при температуре , одновременно
постепенно добавляя в нее раствор 5 мл 95%-ного гидразина, раз0 бавленного 20 мл абсолютированного
этанола. Температуру повьш1ают до точки кипения с обратным холодильником и
удаляют газ. После кипячения с обратным холодильником в течение 30 мин
5 раствор профильтровывают и концентрируют до образования стеклопрдобной
массы, которую кристаллизуют. Кристаллы перемешивают с ацетонитрнлом и.
отфильтровьюают, в результате чего
0 получают 3,42 г продукта с т.пл.147,5-
148,3- С.
Пример 11. Получение (1)-N- (ацетиламино)-фенил}-2-оксоок-
сазолидин-5-илметил)-ацетамида (соёПорцию весом 0,95 г соединения
примера 10 в 5 мл тетрагидрофурана и 5 мл триэтиламина, 2 мл уксусного ангидрида
, 0,01 г 4-диметиламинопиридина (ДМАП) и 10 мл диметилацетамида нагревают, а затем.концентрируют под
пониженным давлением, добавляют воду, белый твердый материал отфильтровьша-
ют и промывают водой, получая 0,56 г
продукта с т.пл. 224,1-224,9 с (с
разл,). Его перекристаллизовьша1С)т из 50 мл ацетонитрила, получая 0,44 г
продукта с т.пл. 225,5-225,8 с (с разл.).
|з
1
Пример 12. Получение (1)-N-
3-С4-(метилсульфониламино)-фенил - 2-оксооксазолидин-5-илметил}ацетами- да (соединение 5).
Раствор 1,24 г (5 ммоль) соединения примера 10 в 5 мл пиридина перемешивают
на бане из льда с ацетоном в токе азота, одновременно добавив 0,4 мл метансульфонилхлоркда. Появляется
интенсивная красная окраска и отделяется твердый материал. Смесь перемешивают в течение 1 ч, разбавляют
водой и подкисляют соляной кислсг- той. Затем смесь концентрируют под
пониженным давлением, остаток перемешивают с ацетонитрилом и отфильтровывают
, получая 0,50 г продукта с т.пл 223,5-224,. Этот твердьй продукт обладает достаточной водорастворимо-
стью.
, Пример 13. Получение (1)-N- (метиламинесульфонил) -фенил -2
оксооксазолидин-5-илметил1-ацетамида (соединение 19).
Порцию 5,0 г (21,3 ммоль) (1)-N- (3-фенил-2-оксооксазолидин-5-илме- тил)-ацетамида добавляют в 25 мл
хлорсульфоновой кислоты. Смесь перемешивают в течение 2 ч, выливают в лед, фильтруют и промьтают водой.
Твердый материал затем сушат в вакууме , после чего его добавляют в раст
в.ор 20 мл ТГФ и метиламина (40% в воде, 2 мл, 25,6 ммоль). По истечении
30 мин смесь концентрируют в вакууме и разбавляют водой. Вьщеливший ся твердый продукт отфильтровьшают и
промывают теплым этанолом с получением 5 г (72%) продукта с т.пл.181,5- 182 с.
Пример 14. Получение метилового эфира (1)-N-Гз- 4-(N,0-димe- тилгидpoкcилaминocyльфoнил)-фeнилj-
2-oкcooкcaзoлидин-5-илмeтилlкapбaмo-
вой кислоты (соединение 39).
В суспензию 2,0 г (20 ммоль) гидрохлорида N,0-димeтилгидpoкcилaминa в 35 мл ТГФ добавили 2,0 г (18 ммоль
трет.бутилата калия при О С. Затем. добавили 2,67 г (10 ммоль) метилового
эфира (1)-N-Гз- 4-(xлopcyльфoншl) фeнил -2-oкcooкcaзoлидин-5-илмeтил j
карбамовой кислоты в течение 5 мин. Смесь перемешивали при комнатной тем
пературе в течение I ч. Затем растворитель концентрировали и остаток
экстрагировали этилацетатом. Отделенный слой этилацетата сушили над суль
0
5 0
45
5
0
35
0
g
g
фатом натрия. После фильтрации растворитель удалили в вакууме. После добавки
этанола к остатку получили 1,15 г (32%) кристаллического продукта с т.пл.128,1-129,1°С.
Дозировочные формы.
Антибактериальные соединения, полученные
по предлагаемому способу, можно вводить в организм с помощью любых средств, которые обеспечиваю-
введение активнодействующего вещества в контакт с местом действия этого
вещества в организме млекопитающего. Их можно вводить в организм с помощью
любого из средств, которые предназна- .чены для такого применения,в сочетании
с фармацевтическими средствами либо в виде индивидуальных терапевтических
агентов, либо в сочетании терапевтических агентов. Их можно вводить индивидуально
, однако, обычно вводят в организм в сочетании с фармацевтическим носителем, выбираемым с учетом
выбранного пути введения в организм и сложившейся фармацевтической практики .
Вводимые в организм дозировки изменяются в зависимости от таких факторов
, как фармакодинамические харак- теристики конкретно используемого
агента, метод и путь его введения в организм; возраст, состояние здоровья
и вес пациента; природа и степень проявления симптомов заболевания, вида
параллельного лечения, частоты лечения и целевого эффекта. Обычно ежедневная
дозировка активнодействующего вещества составляет приблизительно
5-20 мг/кг живого веса. Обычно, когда применяют более сильнодействующее
соединение по предлагаемому способу, желаемый эффект достигается при введении
5-15, предпочтительно 5 - 7,5 мг/кг живого веса в день, причем эти дозы делят на дробные дозировки
для ежедневного приема 2-4 раза или же употребляют в такой форме, которая
обеспечивает постоянное выделение активнодействующего вещества. Такие лекарства можно также вводить в
организм парентерально.
Дозировочные формы (композиции),
приемлемые для введения внутрь, содержат приблизительно 1,0-500 мг активнодействующего
вещества на единицу (дозировку). В этих фармацевтических композициях активнодействующий
компонент обычно присутствует в количестве приблизительно 0,5-95 мае Л в
пересчете на общее весовое количество композиции.
Активнодействующее вещество можно вводить в организм через рот в твердых дозировочных формах, например в
виде капсул, таблеток и порошков, или в жидких дозировочных формах, например в виде эликсиров, сиропов и
суспенэи, причем это активнодейству- ющее вещество можно также вводить в
организм парентерально в виде сте-. рильных жидких дозировочных форм.
Желатиновые капсулы содержат ак- тивнодействующёе вещество и порошкообразные
носители (наполнители), например лактозу, сахарозу, маннит, ; крахмал, производные целлюлозы, стеа-
i рат магния или стеариновузо кислоту. I Аналогичные разбавители могут быть
использованы в производстве прессованных таблеток. Как таблетки, так и
I капсулы, могут быть изготовлены в ви- де препаратов, постоянно вьщеляющих
активнодействующее вещество, обеспечивающих непрерьшное выделение лекарственного
вещества в течение периода в несколько часов. Прессованные таблетки могут быть снабжены сахарным
Покрытием или покрыты пленкой, позволяющей маскировать любой неприятный
привкус и зап1ищать таблетку от воздействия на нее атмосферных факторов,
или же так назьшаемым внутрикшпечным Покрытием для селективного усвоения
На определенном участке желудочно-кишечного тракта.
Жидкие дозированные формы для вве- ;цения в организм через рот могут со-
держать красители и ароматизирующие Добавки с целью приобретения более
приятного .для пациента внешнего вида.
Обычно в качестве носителей (на
Полнителей) для приготовления парёнтё- лс готовят смешением 1,5 Ью.с.% активноральных раствороа -могут служить вода,
приемлемые масла, соль, водная дест- роза. (глюкоза ) и аналогичные сахарные
растворы и гликоли, например пропи- ленгликоль или полиэтиленгликоли. Растворы
для парентерального введения в организм по предпочтительному варианту должны содержать водораствори-
м:)7Ю соль активнодействующего вещества , приемлемые стабшшзируюшие агенты
и, если необходимо, буферные вещества . Подходяпр ми стабилизирующими
агентами могут служить антиоксиданты, шшример бисульфат натрия, сульфит
0 5 О
0
5
натрия и аскорбиновая кислота, используемые
индивидуально или в сочетании . Кроме того, применяют лимонную кислоту и ее соли и натриевую соль
ЭДТА. Парентеральные растворы могут также содержать консерванты, например бензальконийхлорид, метил- или
пропилпарабен и хлорбутанол.
Фармацевтические дозировочные формы
, предназначенные для введения соединений по предложенному способу в
организм, могут быть проиллюстрированы следующими примерами.
Капсулы. Целый ряд единичных капсул готовят наполнением стандартных двухкомпонентных твердых желатиновых
капсул, в каждую из которых вводят до 75 мг порошкообразного активнодей-
ствующего вещества, 150 мг лактозы, 24 мг талька и 6 мг стеарата магния.
Мягкие желатиновые капсулы. Готовят смесь активнодействующего вещества
с соевым маслом, после чего эту смесь с помощью нагнетательного поршневого
насоса вводят в желатиновый контейнер с получением мягких желатиновых
капсул, содержащих по 75 мг активнодействующего вещества. Далее такие капсуда промывают и сушат.
Таблетки. Цел ый ряд таблеток готовят таким образом, что дозировочная
единица включает по 75 мг активнодей-, ствующего вещества, 0,2 мг коллоидной
двуокиси кремния, 5 мг стеарата магния , 250 мг микрокристаллической целлюлозы
, 11 мг кукурузного крахмала и 98,8 мг лактозы. Для повьшгения аппетитности
или отсрочки момента усвоения можно наносить соответствующие покрытия.
Препараты Для инъекций. Парентеральную композицию, приемлемую для
введения в организм путем инъекции.
0
5
действующего компонента с 10 об.% пропиленгликоля и водой, добавлением
хлористого натрия раствор делают изотоническим и стерилизуют.
Суспензия. Водную суспензию готовят для введения в организм через рот
таким образом, что каждые ее 5 мл содержат по 75 мг тонкодиспергированно-
го активнодействующего вещества, . 200 мг карбоксиметилцеллюлозы натрия,
5 мг бензоата натрия, 1,0 г раствора сорбита, U.S.P и 0,025 мл ванилина.
Полезность. Результаты испытаний показывают, что новые соединения, полу
чаемые по предлагаемому способу, явля- ются биологически активными против грам
положительных и грамотрицательных б актерий, включая культуры Staphylo- COCCUS aureus, продуцирующие бета-
лактамазу. Эти агенты потенциально полезны при лечении заразных заболеваний
как у человека, так и у животных , включая заболевания дыхательных путей, желудочнокищечные заболевания,
мочеполовые заболевания и болезни центральной нервной системы, крови, интерстициальных жидкостей, мягкик
тканей и костей.
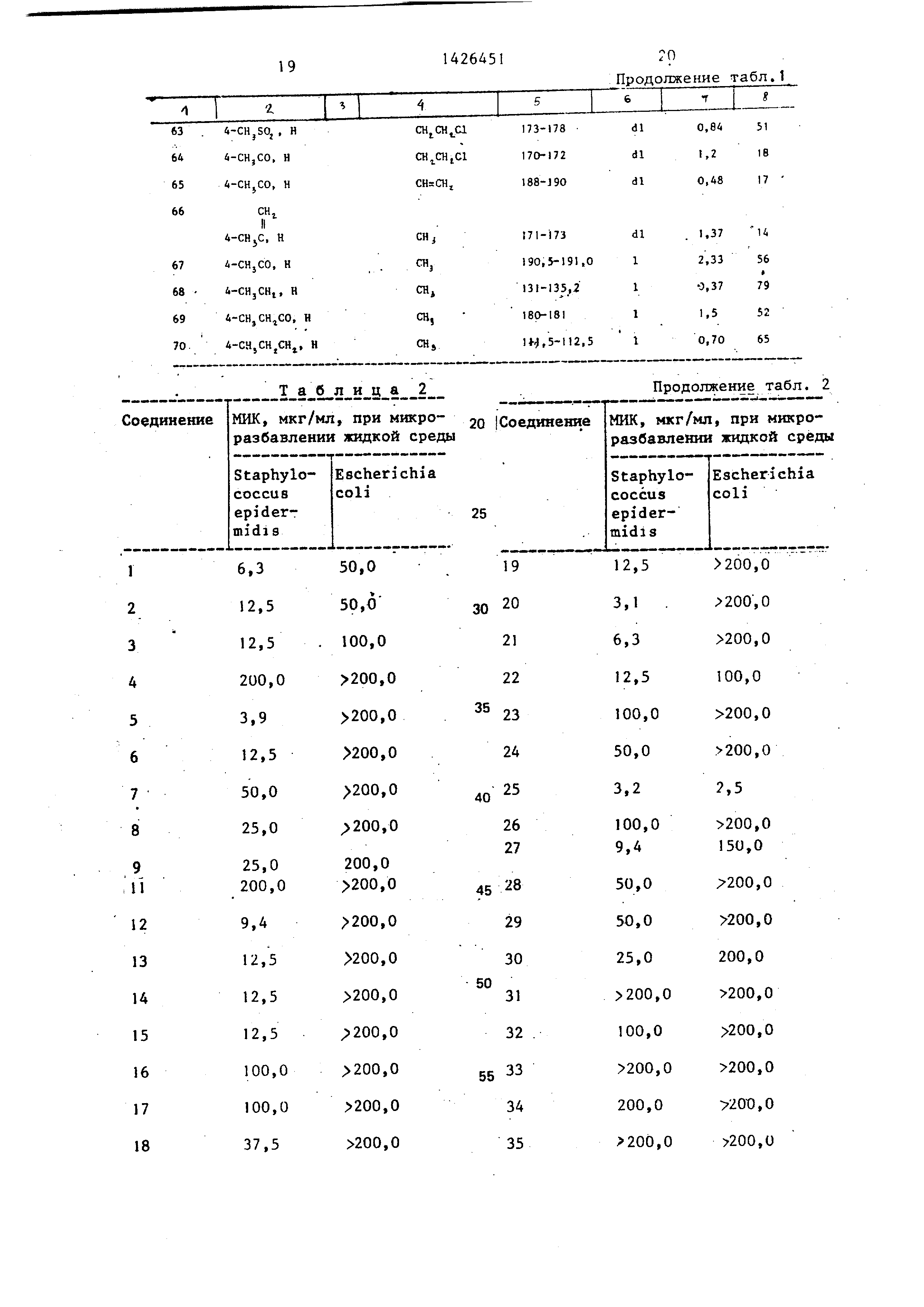
Как показано в табл.2, соединения
формулы I проявляют антибактериальное действие ин витро. Для определения
24-часов|,Х минимальных ингибирующих концентраций (МИК) в отношении под-
опытных штаммов микроорганизмов Stap- hylococcus epidermidis и Esch erichia
coli используют жидкую среду Мюллера- Хинтона в соответствии с методикой микроразбавления.
В ходе проведения испытаний ин витро с использованием соединения
примера 4 в соответствии с описанными процедурами, не было установлено
никакой эффективности против микроор- ганизмов Staphylococcua aureus или
Escherichia coli. Предполагается, что соединение примера 4 могло бы обеспечить
эффект при более высоких концентрациях или при других условиях испы-
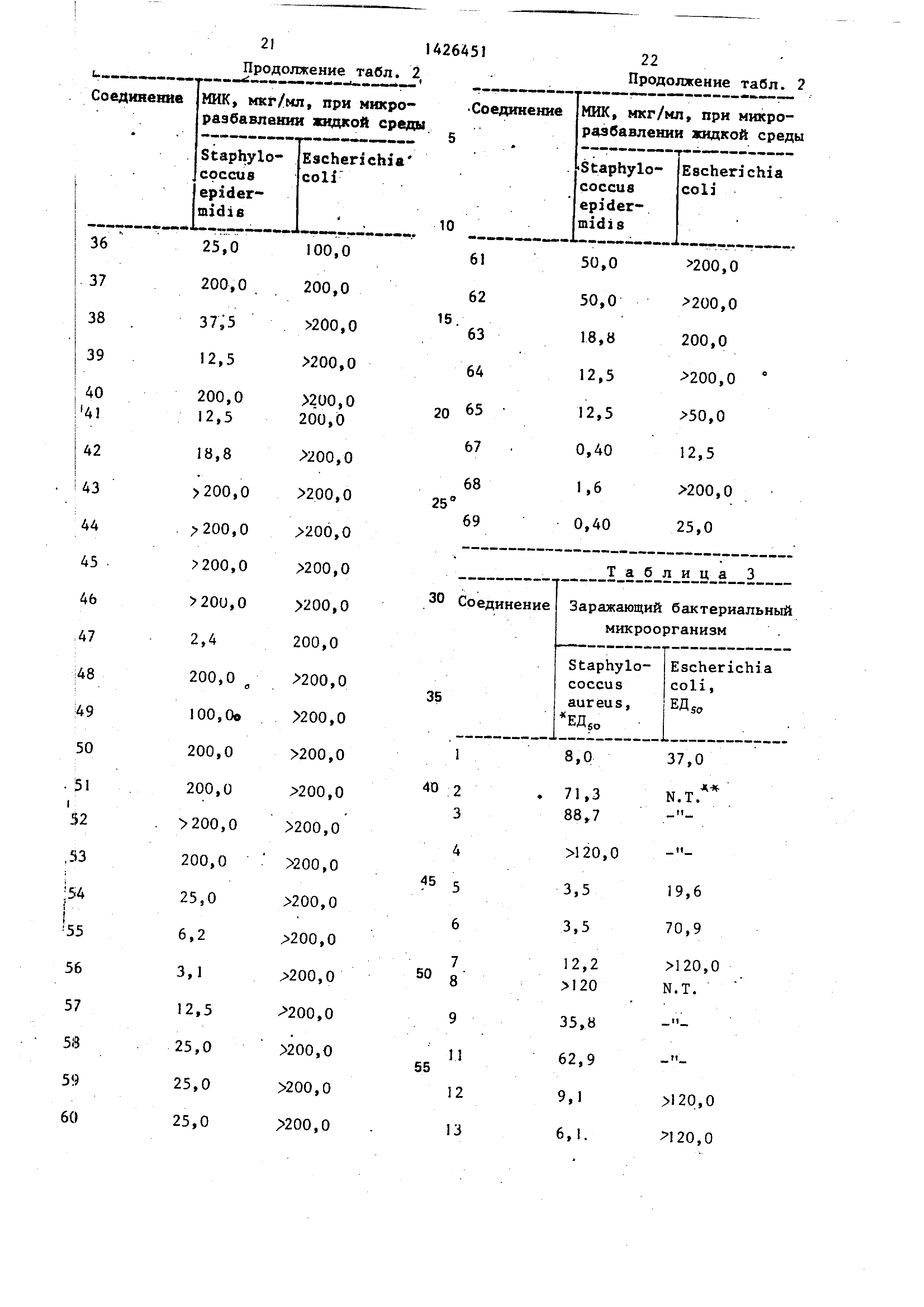
таний. Установлено, что оно проявляет антибактериальное действие ин виво (табл.3 и 4).
Потенция этих соединений ин виво подтверждается данными, которые сведены
в табл.3 и 4. Определение эффективности ин виво проводят интрапери-
тонеальным введением в организм мьшей культур заражающих микроорганизмов,
разбавленных с учетом достижения 90- 100%-ной смертности у контрольных животных
в течение семи дней. В качестве разбавителей использовали трипти-.
казную соевую жидкую среду для микроорганизмов E.coli и 5%-ный водный раствор муцина желудка свиньи для
микроорганизмов Staphylococcus аи- : reus. Испытьшаемые соединения растворяли
или суспендировали в 0,25%-ном водном растворе продукта Метосел (Метосел гоксипропилметилцеллкшоза
Е15 Премиум, фирма Дау кемикал ком- пани) для введения через рот или в
стерильной дистиллированной воде, со
.5
0
15
20
державший 5% диметилсульфоксида (фирма Фишер сайентифик компани, Фейр-
лон, штат Нью-Джерси) для подкожного введения. Эти соединения в определенных
дозировках вводили мышам во время их заражения и вновь по истечении
4 ч после заражения. Смертность фиксировали ежедневно до завершения испытаний
, а 50%-ную эффективную дозировку , ЕДу, рассчитьдаали по методике Рида-Мьюнха.
Предполагаемые терапевтические уровни для человека должны быть достигнуты
при введении через рот в количестве 5-20 мг/кг живого веса в виде дробных дозировок, принимаемьк .
ежедневно 2-4 раза. При серьезных или угрожающих жизни заражениях указанные
дозировки могут быть увеличены .
Результаты всех испытаний приведены
в табл.2-4.
Формула изобретения
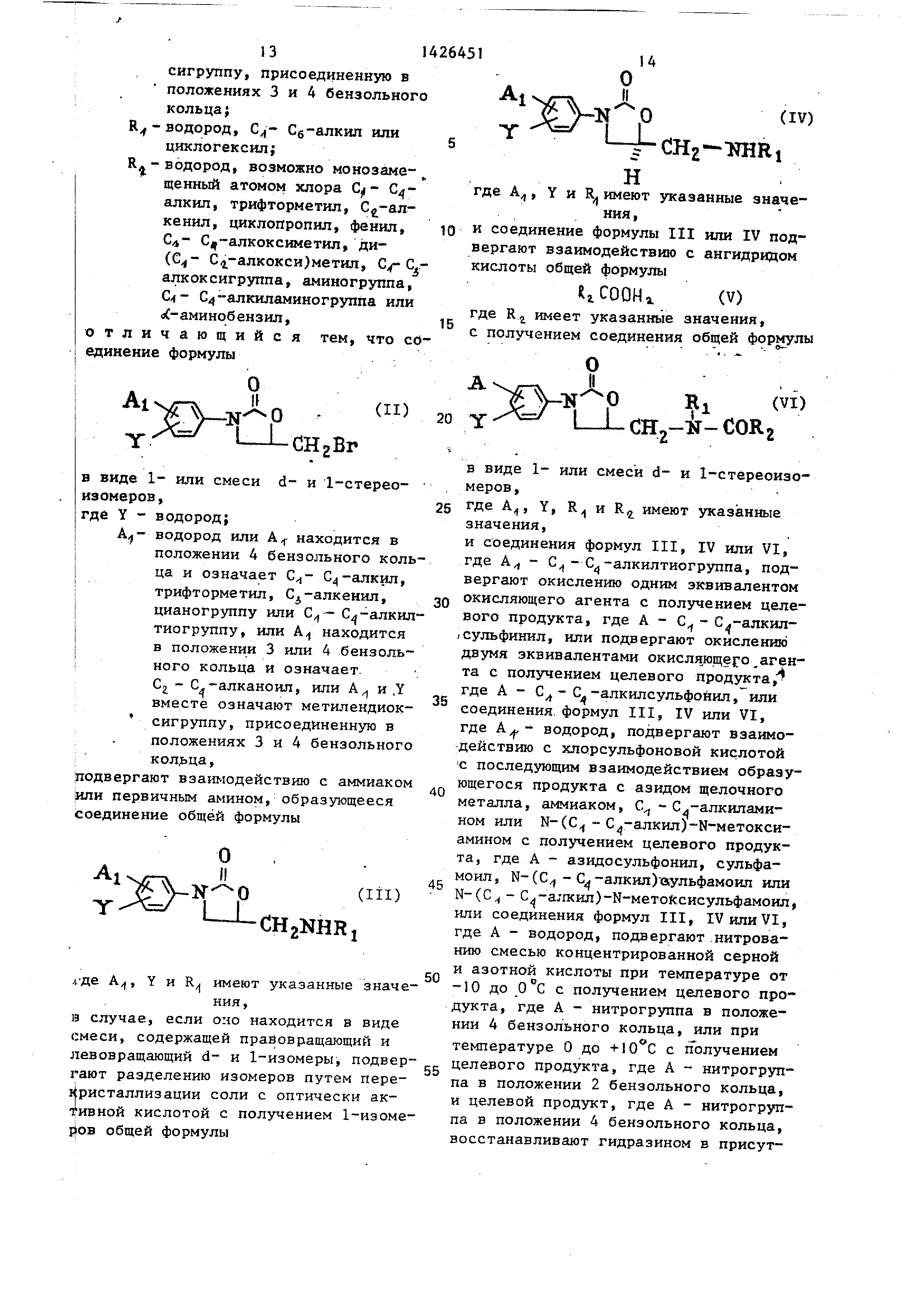
Способ получения 3- (замещенный фе- нил 1-5-ациламидометилоксазолидинонов-
2 общей формулы
в вида 1- или смеси d- и 1-стереонзомеров , ,
где Y - водород;
А находится в положении 4 бензольного кольца и означает С -алкил, трифторметил,
Сз-алкенил, аминогруппу, ци- аногруппу, С -алкилтио- группу, Сц-алкилсульфи-
нил, Сл-алкилсуЛьфонил, азидосульфонил, сульфамоил, N-( С -алкил)сульфамоил,
N-( С4-алкил)-Ы-метокси- сульфамоил, С -алканоил- аминогруппу или С -алкил-
сульфониламиногруппу, или А находится в положении 3 или 4 бензольного кольца и означает
Сг - С |-алканоил, или А находится в положении 2 или 4 бензольного кольца и означает
нитрогруппу, или А,и Y вместо означают метилендиоксигруппу , присоединенную в положениях 3 и 4 бензольного
кольца;
R - водород, Сб-алкил или
циклогексил;
Кд-водород, возможно монозаме- щенный атомом хлора Cf- C/f алккп, трифторметил,
кенил, циклопропил, фенил, СА Cj -алкоксиметшт, ди- ( С4 алкокси)метил, С/-С,-
алкоксигруппа, аминогруппа, Q- С4 алкнпг1миногруппа или о(-аминобензил,
тличающийся тем, что содинение формулы
(II)
CHgBr
в виде 1- или смеси d- и 1-стереоизомеров
,
где Y - водород;
водород или А находится в
положении 4 бензольного кольца и означает С -алкил, трифторметил, С -алкеиш1,
цианогруппу или С -алкил- тиогруппу, или А находится
; в положении 3 или 4 бензоль; ного кольца и означает
С - С,-алканоил, или А и ,Y вместе означают метилендиок- сигруппу, присоединенную в
. положениях 3 и 4 бензольного
; кольца,
утодвергают взаимодействию с аммиаком
или первичным амином, образующееся
соединение общей формулы
(lii)
CHjNHRi
.где А, Y и R имеют указанные значения ,
в случае, если оно находится в виде смеси, содержащей прайсаращающир и
левовращающий d- и 1-изомвры, подвергают разделению изомеров путем пере-
1|ристаллизации соли с оптически активной кислотой с получением 1-изоме- Дов общей формулы
N р (IV) J-CHg-1ШК1 Н
где А, Y и R имеют указанные значения ,
и соединение формулы III или IV подвергают взаимодействию с ангидридом кислоты общей формулы
КгСООНг (V) где RJ имеет указаннью значения,
с получением соединения общей формулы
(VI)
СЩ-Н-СОКз
5
0
5
0
0
5
в виде 1- или смеси d- и 1-стереоизо- меров,
где А, Y, R и R имеют указанные
значения,
и соединения формул III, IV или VI,
где А - С - С -алкилтиогруппа, подвергают окислению одиим зквивалентом
окисляющего агента с получением целевого продукта, где А - С - С -алкил-
сульфинил, или подвергают окислению двумя эквивалентами окисляющего агента
с получением целевого продукта, где А - С - С -алкилсульфонил, или соединения, формул III, IV или VI,
где водород, подвергают взаимодействию с хлорсульфоновой кислотой
С последующим взаимодействием образующегося продукта с азидом щелочного
металла, аммиаком, С - С.-алкилами- ном или N-(C - С -алкил)-Ы-метокси-
амином с получением целевого продукта , где А - азидосульфонил, сульфа-
моил, N-(C - С -алкил) вульфамоил или N-(С - )-Н-метоЛсисульфамоил,
или соединения формул III, IV или VI, где А - водород, подвергают .нитрованию
смесью концентрированной серной и азотной кислоты при температуре от
-10 до О с с получением целевого продукта , где А - нитрогруппа в положении
4 бензольного кольца, или при температуре О до с получением целевого продукта, где А - нитрогруппа
в положении 2 бензольного кольца, и целевой продукт, где А - нитрогруппа
в положении 4 бензольного кольца, восстанавливают гидразином в присут14 .02.84 при Y - водород и А находится в положении 4 бензольного кольца
и означает С - С -алкил, трифторствии никеля Ренея в качестве катализатора
с получением целевого продукта , где А - аминогруппа, и целевой продукт/ где А - аминогруппа, подвергают
взаимодействию с ангидридом С -С -алкановой кислоты с получением .целевого продукта, где А - ,-ал-
каноиламиногруппа, или с хлоридом С - Сд-алкансульфоновой кислоты с по- ю сульфониламиногруппу, или А находится
лучением целевого продукта, где А - в положении 3 или 4 бензольного коль- С - Сд-алкилсульфониламиногруппа. ца и означает Cj - С -алканоил, или
Приоритет по признакамА находи,тся в положении 2 или 4 бе н07 .06.83 при Y - водород и А нахо- зольного кольца и означает нитрогруп-
дится в положении 4 бензольного коль- is У А и Y вместе означают мети- ца и означает С - С -алкилтиогруппу, лендй оксигруппу, присоединенную в пометил
, Cj-алкенил, аминогруппу, циа- ногруппу, азидосульфонил, сульфамоил,
N-(C - С -алкип)сульфамоил, N-(C - С4-алкш1)-К-метоксисульфамоил, алканоиламиногруппу или С - С -алкилС
,, - С -алкилсульфинил или С, - килсульфонил, R и Rrt имеют указанные
в формуле изобретения значения;
ложениях 3 и 4 бензольного кольца, R
и R имеют указанные в формуле изобретения значения.
14.02.84 при Y - водород и А находится в положении 4 бензольного кольца
и означает С - С -алкил, трифторсульфониламиногруппу , или А находится
в положении 3 или 4 бензольного коль- ца и означает Cj - С -алканоил, или
А находи,тся в положении 2 или 4 бе нсульфониламиногруппу , или А находится
в положении 3 или 4 бензольного коль- ца и означает Cj - С -алканоил, или
А находи,тся в положении 2 или 4 бе нметил , Cj-алкенил, аминогруппу, циа-
ногруппу, азидосульфонил, сульфамоил, N-(C - С -алкип)сульфамоил, N-(C - С4-алкш1)-К-метоксисульфамоил,
алканоиламиногруппу или С - С -алкилложениях 3 и 4 бензольного кольца, R
и R имеют указанные в формуле изобретения значения.
Таблица 1
67 68 69 70.
25,0
200,0
9,4
12,5
12,5
12,5
100,0
100,0
37,5
200,0
200,0
200,0 200,0 200,0
200,0 200,0 200.0 200,0
14
56
79
52 65
27
5 28 29
30
0 31
32
5 33
34 35
9,4
50,0
50,0
25,0
200,0
100,0
200,0
200,0
200,0
150,0
; 200,0
200,0
200,0
200,0
200,0
200,0
20-0,0
200,0
231426451
Продолжение табл. 3
Соединение
12,0 51,7
120,0
120,0
59,5
96,6.
130,9
17,2
15,3
120,0
25,9
16.,1
65 ,,7 N.T.
||
-
|1
- -
29,7
10,5
N.T.
.
.120,0
2. Продолжение табл. 3
0
5
5
54 55 56 57 58
59 60
61 62 63 64 65
64,0
47,9
2,7
9,6
11,0
11,3
50,7
31,0 ,0 30,2
10,9 7,9
120,0 65,9 120,0 138,0
98,4 N.T.
«. -ш
П
76,8
V20,0
83,2
25
Продолжение табл. 3
1426451














Комментарии