Пиримидин-замещенные пуриновые соединения в качестве ингибиторов киназы (или киназ) - RU2506264C2
Код документа: RU2506264C2
Описание
Настоящее изобретение относится к 5-(9-изопропил-8-метил-2-морфолин-4-ил-9-гидро-пурин-6-ил)-пиримидин-2-иламину, способам его получения, фармацевтическим композициям, содержащим данное соединение, а также к применению этого соединения для лечения некоторых нарушений или состояний, связанных с киназами.
Поиск ингибиторов киназ представляет собой плодотворную почву для создания веществ, применяемых в фармацевтике. Киназы, также известные как фосфотрансферазы, являются ферментами, переносящими фосфатные группы от молекул-макроэргов (например, АТФ) к специфическим молекулам-мишеням (обычно называемыми субстратами) в ходе процесса, называемого фосфорилированием. Одной из наиболее многочисленных групп киназ являются киназы, которые оказывают воздействие и модифицируют активность специфических белков.
Ввиду способности ингибиторов киназ действовать в качестве фармацевтически активных соединений было проведено существенное количество исследований по выявлению соединений, обладающих наибольшей активностью в отношении этих мишеней. В области онкологии двумя наиболее важными мишенями для терапевтических соединений являются киназы mTOR и PI3. В качестве примера исследования в этой области можно привести заявку PCT/SG 2008/000379, в которой раскрыты соединения, обладающие активностью в отношении киназ обоих типов: mTOR и PI3.
Соединения, ингибирующие одновременно оба типа киназ (mTOR и PI3), могут обладать сильной анти-пролиферативной, анти-ангиогенной и противораковой активностью, поскольку воздействуют на путь PDK/Akt/mTOR в нескольких местах. В настоящее время впервые проводят исследования ряда ингибиторов данного типа в клинических условиях (например, BEZ235, XL765, GDC0941, РХ866, SF1126).
В процессе поиска наиболее подходящего в качестве потенциального лекарственного средства для того, чтобы сделать окончательный вывод о том, является ли соединение подходящим потенциальным лекарственным средством, учитывают несколько факторов. Соответственно, при исследовании потенциального соединения для дальнейшей разработки помимо его ингибиторной активности учитывают ряд свойств самого соединения. При оценке специалист в области медицинской химии рассматривает фармакологические («лекарствоподобные») свойства молекул и включает в рассмотрение такие факторы, как, например, активность соединения в отношении мишени, растворимость соединений (если они не растворимы, то обычно такие соединения являются плохими потенциальными лекарственными средствами), метаболическую активность соединения in vitro и in vivo, а также возможные побочные эффекты, которые это соединение может вызвать в организме, и пр.. Авторы настоящего изобретения идентифицировали соединение, обладающее существенно улучшенными фармакологическими свойствами в сравнении с другими соединениями в данной области.
КРАТКОЕ ОПИСАНИЕ
Согласно настоящему изобретению предложено соединение формулы I

или фармацевтически приемлемая соль указанного соединения.
В дополнение к соединению формулы I описаны также варианты реализации, относящиеся к фармацевтически приемлемым солям указанного соединения, фармацевтически приемлемым N-оксидам, фармацевтически приемлемым пролекарствам, фармацевтически приемлемым метаболитам указанного соединения и фармацевтически приемлемым солям этих метаболитов.
Настоящее изобретение также относится к фармацевтическим композициям, включающим соединение согласно настоящему изобретению с фармацевтически приемлемым носителем, разбавителем или вспомогательным веществом.
Следующий аспект настоящего изобретения относится к способу ингибирования протеинкиназы, выбранной из группы, состоящей из серин/треонин-протеинкиназы, фрагмента или комплекса, функционального эквивалента серин/треонин-протеинкиназы, а также киназы PI3, фрагмента, комплекса или функционального эквивалента киназы PI3, включающему воздействие на протеинкиназу или фрагмента, комплекс или функциональный эквивалент или ко-фактор протеинкиназы эффективным количеством соединения согласно настоящему изобретению.
Предложенное соединение может воздействовать непосредственно и исключительно на молекулу киназы, комплекс или фрагмент киназы и ингибировать их биологическую активность. Однако известно, что данное соединение может, по меньшей мере, частично воздействовать и на ко-факторы, участвующие в процессе фосфорилирования. Известные ко-факторы киназ включают ионные группы (такие как цинк и кальций), жиры (такие как фосфатидилсерин) и диацилглицеролы.
В некоторых вариантах реализации протеинкиназа представляет собой серин/треонин-протеинкиназу или фрагмент, комплекс или функциональный эквивалент серин/треонин-протеинкиназы. В некоторых вариантах реализации серин/треонин-протеинкиназа, фрагмент или комплекс серин/треонин-протеинкиназа представляет собой протеинкиназа mTOR или фрагмент, комплекс или функциональный эквивалент протеинкиназы mTOR. В некоторых вариантах реализации серин/треонин-протеинкиназа, фрагмент или комплекс серин/треонин-протеинкинаы представляет собой протеинкиназу mTORC1, фрагмент, комплекс или функциональный эквивалент протеинкиназы mTORC1. В некоторых вариантах реализации серин/треонин-протеинкиназа, фрагмент или комплекс серин/треонин-протеинкиназы представляет собой протеинкиназу mTORC2 или фрагмент, комплекс или функциональный эквивалент протеинкиназы mTORC2.
В некоторых вариантах реализации протеинкиназа представляет собой киназу PI3, или фрагмент, комплекс, или функциональный эквивалент киназы PI3. В некоторых вариантах реализации киназа PI3, фрагмент, комплекс или функциональный эквивалент киназы PI3 представляет собой PI3 класса 1 или фрагмент, комплекс или функциональный компонент PI3 класса 1.
В одном варианте реализации способа обработки одной или более протеинкиназ соединением включает введение указанного соединения животному, в организме которого содержатся указанные одна или более протеинкиназ.
В следующем аспекте настоящего изобретения предложено применение указанного соединения для ингибирования одной или более киназ, выбранных из группы, состоящей из серин/треонин-протеинкиназы, фрагмента, комплекса или функционального эквивалента серин/треонин-протеинкиназы, киназы PI3, фрагмента, комплекса или функционального эквивалента киназы PI3.
В некоторых вариантах реализации протеинкиназа представляет собой серин/треонин-протеинкиназу или фрагмент, комплекс или функциональный эквивалент серин/треонин-протеинкиназы. В некоторых вариантах реализации серин/треонин-протеинкиназа, фрагмент или комплекс представляет собой протеинкиназу mTOR, фрагмент, или функциональный эквивалент протеинкиназы mTOR. В некоторых вариантах реализации серин/треонин-протеинкиназа, фрагмент или комплекс серин/треонин-протеинкиназы представляет собой протеинкиназу mTORC1 или фрагмент, комплекс или функциональный эквивалент протеинкиназы mTORC1. В некоторых вариантах реализации серин/треонин-протеинкиназа, фрагментом или комплекс серин/треонин-протеинкиназа представляет собой протеинкиназу mTORC2, фрагмент комплекс или функциональный эквивалент протеинкиназы mTORC2.
В некоторых вариантах реализации протеинкиназа представляет собой киназу PI3, или фрагмент, комплекс, или функциональный эквивалент киназы PI3. В некоторых вариантах реализации киназа PI3, фрагмент, комплекс или функциональный эквивалент киназы PI3 представляет собой PI3 класса 1 или фрагмент, комплекс или функциональный компонент PI3 класса 1.
В следующем аспекте настоящего изобретения предложен способ лечения или предотвращения у млекопитающего состояния, при котором ингибирование одной или более протеинкиназ, выбранных из группы, состоящей из серин/треонин-протеинкиназы, фрагмента, комплекса или функционального эквивалента серин/треонин-протеинкиназы, киназы PI3, фрагмента, комплекса или функционального эквивалента киназы PI3 предотвращает, снижает или облегчает патологию или состояние, причем указанный способ включает введение терапевтически эффективного количества соединения согласно настоящему изобретению.
В некоторых вариантах реализации протеинкиназа представляет собой серин/треонин-протеинкиназу или фрагмент, комплекс или функциональный эквивалент серин/треонин-протеинкиназы. В некоторых вариантах реализации серин/треонин-протеинкиназа, фрагмент или комплекс представляет собой протеинкиназу mTOR, фрагмент, или функциональный эквивалент протеинкиназы mTOR. В некоторых вариантах реализации серин/треонин-протеинкиназа, фрагмент или комплекс серин/треонин-протеинкиназы представляет собой протеинкиназу mTORC1 или фрагмент, комплекс или функциональный эквивалент протеинкиназы mTORC1. В некоторых вариантах реализации серин/треонин-протеинкиназа, фрагментом или комплекс серин/треонин-протеинкиназа представляет собой протеинкиназу mTORC2, фрагмент комплекс или функциональный эквивалент протеинкиназы mTORC2.
В некоторых вариантах реализации протеинкиназа представляет собой киназу PI3, или фрагмент, комплекс, или функциональный эквивалент киназы PI3. В некоторых вариантах реализации киназа PI3, фрагмент, комплекс или функциональный эквивалент киназы PI3 представляет собой PI3 класса 1 или фрагмент, комплекс или функциональный компонент PI3 класса 1.
В некоторых вариантах реализации состояние представляет собой рак. В некоторых вариантах реализации рак выбран из группы, состоящей из рака крови, такого как миелопролиферативные нарушения (идиопатический миелофиброз, истинная полицитемия, эссенциальный тромбоцитоз, хронический миелоидный лейкоз), миелоидная метаплазия, миеломоноцитарный лейкоз, острый лимфотический лейкоз, острый эритробластический лейкоз, болезнь Ходжкина и не-Ходжкинская лимфома, острый Т-клеточный лейкоз, миелодипластические синдромы, заболевания плазматических клеток, волосато-клеточный лейкоз, саркома Капоши, лимфома; гинекологических видов рака, таких как карцинома груди, рак яичников, рак шейки матки, рак влагалища и половых губ, гиперплазия эндометрия; раковых заболеваний желудочно-кишечного тракта, таких как карцинома толстого кишечника и прямой кишки, полипы, рак печени, желудка, рак поджелудочной железы, рак желчного пузыря; рака мочевыводящих путей, такого как рак простаты, почек, мочевого пузыря, рак уретры, рак полового члена; рака кожи, такого как меланома; опухолей мозга, таких как глиобластома, нейробластома, астроцитома, олигодендроглиома, эпендиома, глиома ствола мозга, медуллобластома, менингиома; рака головы и шеи, такого как карцинома носоглотки, карцинома гортани; рака дыхательных путей, такого как карцинома легких (немелкоклеточный рак легкого и мелкоклеточный рак легкого), мезотелиома; заболеваний глаз, таких как ретинобластома; заболеваний опорно-двигательного аппарата, таких как остеосаркома, неоплазмии опорно-двигательного аппарата, плоскоклеточная карцинома и фиброма. В других вариантах реализации соединение согласно настоящему изобретению может быть применено для лечения предраковых состояний или гиперплазии, включая семейный аденоматозный полипоз, аденоматозный полипоа толстой кишки, миелоидную дисплазию, дисплазию эндометрия, атипическую гиперплазию эндометрия, дисплазию шейки матки, интраэпителиальную неоплазию влагалища, доброкачественную гиперплазию простаты, папилломы гортани, старческий и солнечный кератоз, себорейный кератоз и кератоакантому.
В некоторых вариантах реализации состояние представляет собой аутоиммунное или воспалительное заболевание или заболевание, поддерживаемое повышенной неоваскуляризацией. Заболевания, которые в некоторой степени относят к заболеваниям аутоиммуннной этиологии, включают следующие: острый рассеянный энцефаломиелит, болезнь Аддисона, агаммаглобулиниемия, агранулоцитоз, аллергическая астма, аллергический энцефаломиелит, аллергический ринит, очаговая алопеция, старческая алопеция, преждевременное старение, анеритроплазия, анкилозирующий спондилит, синдром антифосфолипидных антител, аортрит, апластическая анемия, атипичный дерматит, аутоиммунная гемолитическая анемия, аутоиммунный гепатит, аутоиммунный оофорит, болезнь Бало, Базедова болезнь, болезнь Бехчета, бронхиальная астма, синдром Кастлмана, целиакия, болезнь Шагаса, хроническая воспалительная демиелинизирующая полинейропатия, синдром Чарг-Штрауса, синдром Когана, миокардит Коксаки, болезнь Крона, кожная эозинофилия, кожная Т-клеточная лимфома, полиформная дерматическая эритема, дерматомиозит, диабетическая ретинопатия, синдром Дресслера, эпителиальная дистрофия роговицы, экземный дерматит, эндометриоз, эозинофильный фасцит, эозинофильный гастроэнтерит, буллезный эпидермолиз, гестационный пемфигоид, синдром Эванса, фиброзирующий альвеолит, гестационный пемфигоид, гломерулонефрит, синдром Гудпасчера, болезнь «трансплантат против хозяина», болезнь Грейвза, синдром Гиллаин-Барре, болезнь Хашимото, гемолитический-уретический синдром, герпетический кератит, ихтиоз обыкновенный, идиопатическая интерстинальная пневмония, идиопатическия тромбоцитопеническая пупрура, воспалительные заболевания кишечника, болезнь Кавасаки, кератит, кератоконъюктивит, синдром Ламберта-Итона, вульгарная лейкодерма, плоский лишай, лишайные уплотнения, болезнь Лайма, линеарные IgA-заболевания, дегенерация желтого пятна, мегалобластическая анемия, болезнь Меньера, язва Мурена, болезнь Муха- Габермана, рассеянный миозит, рассеянный склероз, злокачественная миастения, некрозирующий энтероколит, нейромиелит зрительного нерва, пемфигус глаз, опсоклонус-миоклонус синдром, тироидит Орда, пароксизмальная ночная гемоглобинурия, синдром Парсонейджа-Тернера, пемфигус, периодонтит, пернициозная анемия, аллергия на пыльцу, аутоиммунный полигландулярный синдром, задний увеит, первичный биллиарный цирроз, проктит, псевдомембранный колит, псориаз, эмфизема легкого, пиодермия, синдром Рейтера, обратимые обструктивные заболевания дыхательных путей, ревматический полиартрит, ревматоидный артрит, саркоидоз, склерит, синдром Сезари, синдром Шегрена, системный бактериальный эндокардит, системная красная волчанка, синдром Такаясу, темпоральный артериит, синдром Толоса-Хунта, сахарный диабет первого типа, неспецифический язвенный колит, весенний катар глаз, витилиго, синдром Фогта-Койанаги-Харада и грануломатоз Вегнера. В некоторых вариантах реализации состояние представляет собой эндометриоз.
В следующем аспекте изобретения предложено применение соединения согласно изобретению для изготовления лекарственного средства для лечения у животного состояния, при котором ингибирование одной или более киназ, выбранных из группы, состоящей из серин/треонин-протеинкиназы, фрагмента, комплекса или функционального эквивалента серин/треонин-протеинкиназы, киназы PI3 или фрагмента, комплекса или функционального эквивалента киназы PI3, предотвращает, подавляет или облегчает патологию и симптоматику указанного состояния.
В другом аспекте настоящего изобретения предложено применение соединения согласно настоящему изобретению или фармацевтически приемлемой соли, N-оксида или пролекарства указанного соединения в лечении состояния при котором одной или более киназ, выбранных из группы, состоящей из серин/треонин-протеинкиназы, фрагмента, комплекса или функционального эквивалента серин/треонин-протеинкиназы, киназы PI3 или фрагмента, комплекса или функционального эквивалента киназы PI3, предотвращает, подавляет или облегчает патологию и симптоматику указанного состояния.
В некоторых вариантах реализации протеинкиназа представляет собой серин/треонин-протеинкиназу или фрагмент, комплекс или функциональный эквивалент серин/треонин-протеинкиназы. В некоторых вариантах реализации серин/треонин-протеинкиназа, фрагмент или комплекс представляет собой протеинкиназу mTOR, фрагмент, или функциональный эквивалент протеинкиназы mTOR. В некоторых вариантах реализации серин/треонин-протеинкиназа, фрагмент или комплекс серин/треонин-протеинкиназы представляет собой протеинкиназу mTORC1 или фрагмент, комплекс или функциональный эквивалент протеинкиназы mTORC1. В некоторых вариантах реализации серин/треонин-протеинкиназа, фрагментом или комплекс серин/треонин-протеинкиназа представляет собой протеинкиназу mTORC2, фрагмент комплекс или функциональный эквивалент протеинкиназы mTORC2.
В некоторых вариантах реализации протеинкиназа представляет собой киназу PI3, или фрагмент, комплекс, или функциональный эквивалент киназы PI3. В некоторых вариантах реализации киназа PI3, фрагмент, комплекс или функциональный эквивалент киназы PI3 представляет собой PI3 класса 1 или фрагмент, комплекс или функциональный компонент PI3 класса 1.
В другом аспекте настоящего изобретения предложен способ предотвращения или лечения пролиферативных патологий в общем.
В некоторых вариантах реализации состояние представляет собой рак. В некоторых вариантах реализации рак выбран из группы, состоящей из рака крови, такого как миелопролиферативные нарушения (идиопатический миелофиброз, истинная полицитемия, эссенциальный тромбоцитоз, хронический миелоидный лейкоз), миелоидная метаплазия, миеломоноцитарный лейкоз, острый лимфотический лейкоз, острый эритробластический лейкоз, болезнь Ходжкина и не-Ходжкинская лимфома, острый Т-клеточный лейкоз, миелодипластические синдромы, заболевания плазматических клеток, волосато-клеточный лейкоз, саркома Капоши, лимфома; гинекологических видов рака, таких как карцинома груди, рак яичников, рак шейки матки, рак влагалища и половых губ, гиперплазия эндометрия; раковых заболеваний желудочно-кишечного тракта, таких как карцинома толстого кишечника и прямой кишки, полипы, рак печени, желудка, рак поджелудочной железы, рак желчного пузыря; рака мочевыводящих путей, такого как рак простаты, почек, мочевого пузыря, рак уретры, рак полового члена; рака кожи, такого как меланома; опухолей мозга, таких как глиобластома, нейробластома, астроцитома, олигодендроглиома, эпендиома, глиома ствола мозга, медуллобластома, менингиома; рака головы и шеи, такого как карцинома носоглотки, карцинома гортани; рака дыхательных путей, такого как карцинома легких (немелкоклеточный рак легкого и мелкоклеточный рак легкого), мезотелиома; заболеваний глаз, таких как ретинобластома; заболеваний опорно-двигательного аппарата, таких как остеосаркома, неоплазмии опорно-двигательного аппарата, плоскоклеточная карцинома и фиброма. В некоторых вариантах реализации состояние представляет собой эндометриоз.
Дополнительно предполагается, что формула (I) охватывает растворимые и нерастворимые формы соединения, где это применимо. Таким образом, каждая формула включает соединения с указанной структурой, включая гидратированные и негидратированные формы.
Эти и другие разделы настоящего изобретения представлены далее.
ПОДРОБНОЕ ОПИСАНИЕ
В данном описании используется ряд терминов, хорошо известных специалисту. При этом для внесения ясности будет определен ряд терминов.
Термин «фармацевтически приемлемая соль» относится к солям, которые сохраняют необходимую биологическую активность определенного выше соединения, и включают фармацевтически приемлемые соли присоединения кислоты и соли присоединения основания. Пригодные фармацевтически приемлемые соли присоединения кислоты соединения формулы I могут быть получены как из неорганической, так и из органической кислоты. Примерами таких неорганических кислот являются соляная, серная, фосфорная кислоты. Предпочтительными органическими кислотами являются алифатические, циклоалифатические, ароматические, гетероциклические карбоновые и сульфоновые классы органических кислот, например, такие как муравьиная, уксусная, пропионовая, янтарная, гликолевая, глюконовая, молочная, яблочная, винная, лимонная, фумаровая, малеиновая, алкилсульфокислота и арилсульфокислота. Дополнительная информация о фармацевтически приемлемых солях может быть найдена в Remington Pharmaceutical Sciences, 19th Edition, Mack Publishing Co., Easton, PA 1995. В том случае, если агенты представляют собой твердые вещества для специалиста будет понятно, соединение изобретения, агенты, соли могут быть представлены в различных кристаллических или полиморфных формах, каждую из которых можно применять в рамках настоящего изобретения, и которые охватываются приведенными формулами.
Термин «терапевтически эффективное количество» или «эффективное количество» означает количество, достаточное для обеспечения благоприятных или требуемых клинических результатов. Эффективное количество можно вводить однократно или многократно. Эффективного количества обычно достаточно для смягчения, улучшения, стабилизации, обращения, замедления или устранения прогрессирования болезненного состояния.
Предполагается, что термин «функциональный эквивалент» включает варианты описанных здесь конкретных протеинкиназ. Понятно, что киназы могут иметь изоформы, причем первичные, вторичные, третичные и четвертичные структуры отдельных изоформ киназы будут отличаться от исходной киназы, однако обладают такой же биологической активность, что и протеинкиназы. Изоформы могут возникать как результат нормальных аллельных различий в популяцией и содержать мутации, такие как замена, делеция, присоединение, отрезания, удвоение аминокислот. Также в понятие «функциональный эквивалент» включены варианты, полученные на уровне транскрипции. Другие функциональные эквиваленты включают киназы, имеющие альтернативные посттрансляционные модификации, такие как гликолизирование.
Соединение согласно настоящему изобретению демонстрирует улучшенные фармакологические свойства, подробно описанные ниже, по сравнению со структурно близцими соединениями в этой области.
Такого рода улучшенные свойства предполагают, что соединение согласно настоящему изобретению сможет стать подходящим выбором для фармацевтических разработок в этой области. Во-первых, изучаемое соединение согласно настоящему изобретению проявляет сравнимую, если не превосходящую, активность в ингибировании двух представляющих интерес киназ-mTOR и PI3. Активность соединения согласно настоящему изобретению в отношении PI3 выше, чем активность других исследованных соединений, и демонстрирует активность в отношении mTOR которая сравнима с активностью других исследованных соединений, а также характеризуется пригодным для терапевтического применения уровнем.
Несмотря на то, что тесты по определению ферментативной активности показывают, что практически все соединения, взятые для, обладали приемлемым уровнем активности, в дальнейших тестах выявили ряд соединений, которые были исключены как непригодные для дальнейших фармацевтических разработок или по иным причинам. Так, например, соединение согласно настоящему изобретению имело умеренную растворимость в воде (178 мкМ), определяющей то, что из соединения согласно настоящему изобретению может быть приготовлен фармацевтический состав, усваивающийся при пероральном введении, тогда как ряд взятых для сравнения соединений не продемонстрировали приемлемой растворимости. Таким образом, соединение согласно настоящему изобретению демонстрирует сочетание высокой активности и хороших характеристик растворимости.
Из соединений, которые продемонстрировали сочетание активности и растворимости, соединение согласно настоящему изобретению было лучшим по показателям метаболической стабильности. Соединение продемонстрировало высокую стабильность исследованиях с микросомами печени человека, его указывает на достаточную устойчивость к разрушению в физиологической среде. Напротив, другие соединения, обладающий активностью и растворимостью, не продемонстрировали даже близкой стабильности. Поскольку соединение согласно настоящему изобретению демонстрирует уникальное сочетание активности, растворимости и стабильности, это делает его превосходным кандидатным лекарственным средством по сравнению с другими взятыми для сравнения известными соединениями несмотря на видимую структурную схожесть этих соединений.
Соединение согласно настоящему изобретению обладает способностью ингибировать активность некоторых протеинкиназ. Способность ингибировать активность киназ может быть результатом того, что соединение согласно настоящему изобретению действует непосредственно и направленно на молекулу киназы и ингибирует ее активность. Однако следует понимать, что соединение может также действовать частично на ко-факторы киназ в процессе их участия в фосфорилировании. Соединение возможно обладает активностью в отношении протеинкиназ PI3 или фрагментов, комплексов или функциональных эквивалентов протеинкиназ PI3. Данное соединение возможно обладает активностью в отношении серин/треонин-протеинкиназ, таких как mTOR или их фрагментов, комплексов или функциональных эквивалентов.
Ингибирование протеинкиназ может быть осуществлено любыми известными в этой области способами. Например, если нужно осуществить ингибирование протеинкиназы in vitro, то в раствор, содержащий очищенный фермент-киназу, добавляют подходящее количество соединения согласно настоящему изобретению. В условиях, когда необходимо осуществить ингибирование активности протеинкиназ у млекопитающего, ингибирование киназ обычно включает введение соединения согласно настоящему изобретению млекопитающему, имеющему эту киназу.
Соответственно соединение согласно настоящему изобретению может найти широкий спектр применений, в котором может быть использована его способность ингибировать протеинкиназы указанных выше типов. Например, соединения можно применять для ингибирования серин/треонин протеинкиназ. Соединения можно применять для лечения или предотвращения у млекопитающих состояний, при которых ингибирование протеинкиназ и/или их ко-факторов предотвращает, уменьшает или облегчает патологию или симптоматику патологий.
Предложенное соединение может можно применять для лечения пролиферативных заболеваний. Примером таких заболеваний является рак. Ожидается, что соединение будет обладать способностью лечить как твердые, так и жидкие опухоли. В некоторых вариантах реализации виды рака, которые можно лечить соединением согласно настоящему изобретению, представляют собой солидные опухоли и рак крови.
В настоящем описании, термин «рак» является общим термином, который охватывает огромное число состояний, характеризующихся неконтролируемым анормальным ростом клеток. Ожидается, что соединение согласно настоящему изобретению можно будет применять для лечения различных видов рака, включающя, в качестве неограничивающих примеров, рак костей, опухоли мозга и ЦНС, рак груди, рак толстой кишки, рак эндокринной железы, включающий адренокортикальную карциному, рак поджелудочной железы, рак гипофиза, рак щитовидной железы, рак паращитовидной железы, рак тимуса, рак желудочно-кишечного тракта, рак печени, рак общего печеночного протока, карциноидная опухоль желудочно-кишечного тракта, рак желчного пузыря, рак мочеполовой системы, рак половой системы, рак головы и шеи, лейкемии, миеломы, болезни крови, рак легких, лимфомы, рак глаз, рак кожи, саркомы мягких тканей, зрелые саркомы мягких тканей, саркома Капоши, рак мочевой системы.
Примеры рака, который можно лечить соединением согласно настоящему изобретению, включает рак крови, такой как миелопролиферативные нарушения (идиопатический миелофиброз, истинная полицитемия, эссенциальный тромбоцитоз, хронический миелоидный лейкоз), миелоидная метаплазия, миеломоноцитарный лейкоз, острый лимфотический лейкоз, острый эритробластический лейкоз, болезнь Ходжкина и не-Ходжкинская лимфома, острый Т-клеточный лейкоз, миелодипластические синдромы, заболевания плазматических клеток, волосато-клеточный лейкоз, саркома Капоши, лимфома; гинекологических видов рака, таких как карцинома груди, рак яичников, рак шейки матки, рак влагалища и половых губ, гиперплазия эндометрия; раковых заболеваний желудочно-кишечного тракта, таких как карцинома толстого кишечника и прямой кишки, полипы, рак печени, желудка, рак поджелудочной железы, рак желчного пузыря; рака мочевыводящих путей, такого как рак простаты, почек, мочевого пузыря, рак уретры, рак полового члена; рака кожи, такого как меланома; опухолей мозга, таких как глиобластома, нейробластома, астроцитома, олигодендроглиома, эпендиома, глиома ствола мозга, медуллобластома, менингиома; рака головы и шеи, такого как карцинома носоглотки, карцинома гортани; рака дыхательных путей, такого как карцинома легких (немелкоклеточный рак легкого и мелкоклеточный рак легкого), мезотелиома; заболеваний глаз, таких как ретинобластома; заболеваний опорно-двигательного аппарата, таких как остеосаркома, неоплазмии опорно-двигательного аппарата, плоскоклеточная карцинома и фиброма. Соединение согласно настоящему изобретению можно также применять для лечения предраковых состояний или гиперплазии, включая семейный аденоматозный полипоз, аденоматозный полипоз толстой кишки, миелоидную дисплазию, дисплазию эндометрия, атипическую гиперплазию эндометрия, дисплазии шейки матки, интраэпителиальную неоплазию влагалища, доброкачественную гиперплазию простаты, папилломы гортани, старческий и солнечный кератоз, себорейный кератоз и кератоакантомы.
Также ожидается, что соединение согласно настоящему изобретению будет применимо в лечении аутоиммунных или воспалительных заболеваний, а заболеваний, поддерживаемых повышенной неоваскуляризацией. Заболевания, которые в некоторой степени относят к заболеваниям аутоиммуннной этиологии, включают следующие: острый рассеянный энцефаломиелит, болезнь Аддисона, агаммаглобулиниемия, агранулоцитоз, аллергическая астма, аллергический энцефаломиелит, аллергический ринит, очаговая алопеция, старческая алопеция, преждевременное старение, анеритроплазия, анкилозирующий спондилит, синдром антифосфолипидных антител, аортрит, апластическая анемия, атипичный дерматит, аутоиммунная гемолитическая анемия, аутоиммунный гепатит, аутоиммунный оофорит, болезнь Бало, Базедова болезнь, болезнь Бехчета, бронхиальная астма, синдром Кастлмана, целиакия, болезнь Шагаса, хроническая воспалительная демиелинизирующая полинейропатия, синдром Чарг-Штрауса, синдром Когана, миокардит Коксаки, болезнь Крона, кожная эозинофилия, кожная Т-клеточная лимфома, полиформная дерматическая эритема, дерматомиозит, диабетическая ретинопатия, синдром Дресслера, эпителиальная дистрофия роговицы, экземный дерматит, эндометриоз, эозинофильный фасцит, эозинофильный гастроэнтерит, буллезный эпидермолиз, гестационный пемфигоид, синдром Эванса, фиброзирующий альвеолит, гестационный пемфигоид, гломерулонефрит, синдром Гудпасчера, болезнь «трансплантат против хозяина», болезнь Грейвза, синдром Гиллаин-Барре, болезнь Хашимото, гемолитический-уретический синдром, герпетический кератит, ихтиоз обыкновенный, идиопатическая интерстинальная пневмония, идиопатическия тромбоцитопеническая пупрура, воспалительные заболевания кишечника, болезнь Кавасаки, кератит, кератоконъюктивит, синдром Ламберта-Итона, вульгарная лейкодерма, плоский лишай, лишайные уплотнения, болезнь Лайма, линеарные IgA-заболевания, дегенерация желтого пятна, мегалобластическая анемия, болезнь Меньера, язва Мурена, болезнь Муха-Габермана, рассеянный миозит, рассеянный склероз, злокачественная миастения, некрозирующий энтероколит, нейромиелит зрительного нерва, пемфигус глаз, опсоклонус-миоклонус синдром, тироидит Орда, пароксизмальная ночная гемоглобинурия, синдром Парсонейджа-Тернера, пемфигус, периодонтит, пернициозная анемия, аллергия на пыльцу, аутоиммунный полигландулярный синдром, задний увеит, первичный биллиарный цирроз, проктит, псевдомембранный колит, псориаз, эмфизема легкого, пиодермия, синдром Рейтера, обратимые обструктивные заболевания дыхательных путей, ревматический полиартрит, ревматоидный артрит, саркоидоз, склерит, синдром Сезари, синдром Шегрена, системный бактериальный эндокардит, системная красная волчанка, синдром Такаясу, темпоральный артериит, синдром Толоса-Хунта, сахарный диабет первого типа, неспецифический язвенный колит, весенний катар глаз, витилиго, синдром Фогта-Койанаги-Харада и грануломатоз Вегнера. В некоторых вариантах реализации патологией является эндометриоз.
Соединение согласно настоящему изобретению можно также применять для изготовления лекарственных средств для лечения у млекопитающего состояния, при этом ингибирование протеинкиназ может предотвращать, снижать или облегчать патологию и симптоматику состояния. Соединение согласно настоящему изобретению можно также применять для изготовления лекарственных средств для лечения или предотвращения заболеваний, связанных с киназами.
Введение соединения формулы I согласно настоящему изобретению можно осуществлять с использованием любого приемлемого энтерального пути введения, такого как пероральное или ректальное, или парентерального введения, такого как подкожное, внутримышечное, внутривенное и внутрикожное. Инъекция может быть болюсной или посредством постоянной или дискретной инфузии. Как правило, активное соединение включают в фармацевтически приемлемый носитель или растворитель в количестве, необходимом для получения пациентом эффективного терапевтического количества. В различных вариантах реализации ингибирующее соединение может быть избирательно токсично или более токсично для быстро пролиферирующих клеток, например по сравнению с нормальными клетками.
При применении соединения согласно настоящему изобретению его можно вводить в любых формах и видах, обеспечивающих биодоступность соединения. Специалист в области получения составов может легко выбрать подходящую форму и вид введения, в зависимости от определенных характеристик выбранного соединения, патогенеза, стадии патогенеза и других значимых обстоятельств. Дополнительную информацию можно найти в «Remingtons Pharmaceutical Sciences, 19th edition, Mack Publishing Co. (1995).
Соединение согласно настоящему изобретению можно вводить отдельно или в форме фармацевтической композиции в сочетании с фармацевтически приемлемым носителем, растворителем или вспомогательным веществом. Соединение согласно настоящему изобретению, эффективное само по себе, обычно назначают в форме фармацевтически приемлемых солей, поскольку эти формы обычно более стабильны, легче кристаллизуются и имеют повышенную растворимость.
Однако, настоящее соединение обычно используют в форме фармацевтических композиций, которые составляют в зависимости от способа введения. Поэтому в некоторых вариантах реализации настоящего изобретения предложена фармацевтическая композиция, включающая соединение согласно настоящему изобретению и фармацевтически приемлемый носитель, растворитель или вспомогательное вещество. Композиции составляют в соответствии способами, известными в этой области.
В других вариантах реализации изобретения предложена фармацевтическая упаковка или набор, содержащая одну или более емкостей, содержащих один или более компонентов фармацевтической композиции согласно настоящему изобретению. В такой упаковке или наборе возможно находится емкость, содержащая единичную дозу вещества (веществ). Набор может содержать композицию, состоящую действующее вещество, либо виде концентрата (включая лиофилизированные концентраты), которые можно разбавлять перед применением, а также готовые к применению концентраты, при этом емкость включают одну или более доз. Для удобства в наборе единичная доза может быть помещена в стерильные виалы для непосредственного использования врачом, при этом виалы содержат необходимое количество вещества (веществ). К такому контейнеру (контейнерам) могут быть предложены различные письменные материалы, такие как инструкция по медицинскому применению или информация об использовании и реализации фармацевтических и биологических продуктов для применения у человека.
Соединение согласно настоящему изобретению можно применять или вводить назначено в комбинации с одним или более лекарственными средствами для лечения нарушений/заболеваний, описанных выше. Компоненты можно вводить в одном составе или в разных составах. В случае введения в разных составах соединения согласно настоящему изобретению можно вводить последовательно или одновременно с другим препаратом (препаратами).
В связи с возможностью введения соединения с одним или более лекарственных средств, соединение согласно настоящему изобретению можно применять в комбинированной терапии. При этом обычно соединения вводят в сочетании друг с другом. Таким образом, соединение согласно настоящему изобретению можно вводить как одновременно (как комбинированный препарат), так и последовательно в таком порядке, чтобы обеспечить улучшенный терапевтический эффект.
Фармацевтические композиции согласно настоящему изобретению для парентерального введения можно вводить в виде фармацевтически приемлемых стерильных водных или неводных растворов, дисперсий, суспензий или эмульсий, а также в виде стерильных порошков, которые перед введением разбавляют стерильными растворами или дисперсиями для инъекций. Примерами подходящих водных и неводных носителей, растворителей, растворимых веществ или сред являются вода, этанол, полиолы (такие как глицерол, пропиленгликоль, полиэтиленгликоль и им подобные), а так же их подходящие смеси, растительные масла (такие как оливковое масло) и пригодные для введения органические сложные эфиры, такие как этилолеат. Соответствующую текучесть можно обеспечить при помощи материалов покрытия, таких как лецитин, путем обеспечения нужного размера частиц в случае с дисперсиями, и путем использования ПАВ.
Такие композиции могут содержать вспомогательные вещества, такие как консервант, увлажняющий реагент, эмульгаторы, дисперсионные реагенты. Для предотвращения заражения микроорганизмами могут быть использованы антибактериальные и противогрибковые реагенты, например, парабен, хлорбутанол, феноловая карбоновая кислота и подобные им. Может быть возможным и включение необходимых изотонических реагентов, таких как сахара, натрия хлорид или подобных. Пролонгированное действие фармацевтической формы можно обеспечить путем включения реагентов, которые задерживают всасывание, таких как моностеарат алюминия или желатин.
Для более эффективного распределения соединения могут быть включены в медленно освобождающиеся системы или системы доставки такие, как полимеры матрикса, липосомы, микросферы.
Стерильность форму для инъекций можно обеспечить путем, например, фильтрации через задерживающий бактерии фильтр, или путем включения стерилизующих агентов в твердую стерильную композицию, которую перед применением можно растворить или диспергировать в стерильной воде или других стерильных средах.
Твердые дозированные формы для перорального введения включают капсулы, таблетки, пилюли, порошки, гранулы. В таких твердых формах активное вещество смешано с инертными фармацевтически приемлемыми вспомогательными веществами или носителями, такими как натрия цитрат или кальциядифосфат и/или а) наполнителями и разбавителями, такими как крахмал, лактоза, сахароза, глюкоза, маннит, кремневая кислота, б) связывающими веществами, такими как карбоксиметилцеллюлоза, альгинат, желатин, поливинилпирролидон, сахароза, камедь, с) увлажнителями, такими как глицерин, д) дезинтегрирующими веществами, такими как агар-агар, карбонат кальция, картофельный или маниока крахмал, альгиновая кислота, отдельные силикаты, натрия карбонат, е) задерживающими растворение реагентами, такими как парафин, ж) ускорителями абсорбции, такими как соединения четвертичного аммония, з) увлажняющими реагентами, такими какцетиловый спирт и глицеролмоностеарат, и) абсорбентами, такими как каолин и бентонит, к) лубрикантами, такими как тальк, стеарат кальция, магния стеарат, твердый полиэтиленгликоль, лаурилсульфат натрия и их смеси. В капсулы, таблетки и пилюли могут быть включены и буферные реагенты.
Твердые композиции подобного типа также могут быть использованы в качестве наполнителей мягких и твердых желатиновых капсулах, вспомогательными веществами в которых могут быть лактоза или молочный сахар и высокомолекулярные полиэтиленгликоли или подобные вещества.
Твердые дозированные формы таблеток, капсул, пилюлей и гранул могут быть изготовлены с покрытиями и оболочками, например, покрытиями для энтерального введения, а также другими покрытиями, хорошо известными в производстве фармацевтических препаратов. Формы могут содержать реагент, делающий их непрозрачными, или могут быть с таким составом, при котором высвобождается только активное вещество (вещества), или, что предпочтительно, оно задерживается для высвобождения в определенной части желудочно-кишечного тракта. Примерами таких включенных композиций могут быть включенные полимерные вещества и воска.
Активное соединение может быть в форме микрокапсул, предпочтительно с одним или более вспомогательным веществом, упомянутым ранее.
Жидкими формами для перорального применения являются фармацевтически приемлемые эмульсии, суспензии, сиропы и настойки. Кроме активных веществ жидкие формы могут содержать растворители, обычно использующиеся в данной области, например, воду или другие растворители, растворяющие реагенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, хлопковое масло, арахисовое, кукурузное, масло зародышей, оливковое, касторовое, кунжутное) глицерол, тетрагексафурфуриловый спирт, полиэтиленгликоль, эфиры жирных кислот сорбитанови их смеси.
Кроме инертных растворителей, пероральные композиции могут включать вспомогательные вещества, такие как увлажняющие реагенты, эмульгаторы и суспензирующие реагенты, подсластители, ароматизаторы и отдушки.
В суспензиях кроме активных веществ могут содержаться суспендирующие реагенты, такие как, например, этоксилированныеизостеариловые спирты, полиэтоксилен сорбитол и эфиры сорбитана, микрокристаллическая целлюлоза, бентонит, агар-агар, трагакант, или их смеси.
Композициями для ректального или вагинального применения преимущественно являются суппозитории, которые могут быть получены путем смешивания веществ изобретения с подходящими не вызывающими раздражения вспомогательными веществами или носителями, такими как кокосовое масло, полиэтиленгликоль, или же суппозитории из воска, твердые при комнатной температуре, но жидкие при температуре тела, таким образом при растворении в ректальном или вагинальном каналах выделяется активное вещество.
Дозированными формами для местного применения соединения согласно настоящему изобретению являются порошки, пластыри, спреи, мази и ингаляторы. Активное вещество смешивают в стерильных условиях с фармацевтически приемлемым носителем или необходимыми консервантами, буферами или требующимися распыляющими веществами.
Вводимое количество соединения в предпочтительном случае обеспечивает лечение, смягчения или облегчение патологии действием. Терапевтически эффективное количество может быть определено диагностом путем использования типового оборудования и исследования результатов, полученных при аналогичных обстоятельствах. При определении терапевтически эффективного количества существует ряд факторов, включающих, но не ограничивающихся следующими факторами: вид животного, размер, возраст, общее состояние здоровья, особенность заболевания, степень заболевания, чувствительность пациента к лечению, особенность назначенного вещества, способ назначения, биодоступность назначенного препарата, выбранный режим дозирования, использование других препаратов и другие важные обстоятельства.
Предпочтительная дозировка будет лежать в диапазоне от 0,01 до 300 мг на килограмм массы тела. Более предпочтительной дозой будет суточная доза 0,1-100 мг на килограмм массы тела, так же суточная доза 0,2-80 мг на килограмм массы тела, и еще более предпочтительной - суточная доза 0,2-50 мг на килограмм массы тела. Подходящая суточная доза может быть назначена в виде нескольких под-доз.
СИНТЕЗ СОЕДИНЕНИЯ СОГЛАСНО ИЗОБРЕТЕНИЮ
5-(9-изопропил-8-метил-2-морфолин-4-ил-9-гидро-пурин-6-ил)-пиримидин-2-иламин получали из дихлорпурина в 5 стадий, показанных на схеме 1.
Схема 1

ПРИМЕРЫ
В описанных ниже примерах, если не указано иного, все значения температуры приведены в градусах Цельсия, а все части и проценты рассчитаны по массе.
Различные исходные материалы и другие реагенты приобрели у коммерческих поставщиков, таких как Aldrich Chemical Company и Lancaster Synthesis Ltd., и использовали без последующей очистки, если не указано иного. Тетрагидрофуран и N,N-диметилформамидприобрели у Aldrich в герметичных бутылках и использовали в том виде, в котором получали. Все растворители очищали стандартными методами, используемыми в данной области, если не указано иное.
Приведенные ниже реакции проводили при избыточном давлении азота, аргона или с сушильной трубкой, при температуре окружающей среды (если не указано иного), в безводных растворителях в колбах с резиновой септой для введения субстратов и реагентов при помощи шприца. Посуда из стекла предварительно сушили в сушильном шкафу и/или прокаливали. Аналитическую тонкослойную хроматографию осуществили на пластинах Silicagel 60Р254 на стекле (производства Merck толщиной 0,25 мм) и с элюированием подходящим соотношением растворителей (объем/объем). Реакции анализировали методом тонкослойной хроматографии и прекращали при израсходовании исходных материалов.
Пластинки для ТСХ визуализировали по поглощению УФ использованием опрыскивания п-анисовым альдегидом или фосфомолибденовой кислотой (производитель - Aldrich Chemical Company, с 20% содержанием этанола) с активацией нагревом или помещением в йодную камеру.
Выделение продукта реакции осуществили путем удвоения объема реакционной смеси добавлением реакционного растворителя или экстракционного растворителя с последующей промывкой указанными водными растворителями в объеме 25% от экстракционной смеси (если не указано иное). Полученные растворы сушили безводным натрий сульфатом перед фильтрацией, выпаривание растворителей провели при пониженном давлении в роторном испарителе, в описании этот процесс называется удалением растворителей под вакуумом.
Флэш-хроматографию (Stillatal, J. Org. Chem., 43, 2923 (1978)) провели с использованием силикагеля марки EMerck (47-61 мм)при соотношении силикагель: сырой материал от 20:1 до 50:1, если не указано иного. Гидрогенолиз провели при указанном давлении или при атмосферном давлении.
1Н ЯМР-спектры сняли на оборудовании Bruker при 400 МГц,13С-ЯМР спектры сняли при 100 МГц. ЯМР-спектры получили в форме растворов в CdCl3 (в ppm), с использованием хлороформа в качестве эталонного раствора (7,27 ppm и 77,0 ppm), или Cd3OD (3,4 и 4,8 ppm и 49,3 ppm), или внутреннего стандарта тетраметилсилана (ТМС) (0,00 ppm) в случае необходимости. В случае необходимости использовали другие растворители для ЯМР. При выявлении нескольких пиков используют следующие аббревиатуры: s - синглет, d - дуплет, t - триплет, т - мультиплет, br - широкий, d - дублет дублетов, dt - дублет триплетов. Константы взаимодействия, если они есть, приведены в Гц. Масс-спектры получили методом жидкостной хроматографии (ЖХ) - масс-спектрометрии (МС) на детекторах ESI или APCI соответственно. Температуры плавления не корректировали. Все конечные продукты имели чистоту более 90% (согласно методу высокоэффективной хроматографии при длине волн 220-240 нм).
Приведенные ниже примеры синтеза иллюстрируют один из способов получения согласно настоящему изобретению, но их не следует рассматривать как ограничение способов синтеза.
Пример 1 Синтез соединения согласно изобретению
Синтез 2,6-дихлор-9-изопроприл-9-Н-пурина

2,6-дихлорпурин(2 ммоль), изопропанол (8 ммоль) и трифенилфосфин (4 ммоль) разбавили в 40 мл безводного тетрагидрофурана, и к смеси по каплям при комнатной температуре в течение 30 минут добавляли диизопропилазидодикарбоксилат (4 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение суток. Периодически наблюдали за ходом реакции с помощью ТСХ или ЖХ-МС. Реакционную смесь перелили в мерный стакан с ледяной водой. В результате экстракции водного слоя (трижды экстрагировали этилацетатом по 100 мл) получили полупродукт. Полупродукт очистили хроматографией на силикагелевой колонке (10-80% этилацетат в керосиновом эфире, градиентное вымывание), в результате получили 2,6-дихлор-9-изопропил-9-гидро-пурин с выходом 77%.
Синтез 5-(2-хлор-9-изопропил-9-гидро-пурин-6-ил)-пиримидин-2-иламина

К раствору 2,6-дихлор-9-изопропил-9-гидро-пурина (5,21 ммоль), 5-(4,4,5,5-тетраметил-[1,3,2] диоксаборолан-2-иламина (5,21 ммоль) и 1,1-бис-(дифенилфосфино)-ферроцин палладий (II) хлоридом в комплексе с дихлорметаном (0,26 ммоль) в пероксиде свободного диоксана (40 мл) добавили 2 М водный раствор натрия карбоната (15,6 ммоль). Полученную смесь дегазировали и продули азотом. Затем реакционную смесь перемешали при нагревании на масляной бане при температуре 80°C в течение 3 часов. Реакционную смесь проверили с помощью ЖХ-МС на отсутствие исходных пуринов.
Реакционную смесь охладили до комнатной температуры, растворители удалили при пониженном давлении. Осадок добавили к смеси этилацетата и воды. Органическую фазу отделили, водную фазу экстрагировали этилацетатом в пропорции 3:100. После удаления органических веществ вакуумом получили 5-(2-хлор-9-изопропил-9-гидро-пурин-6-ил)-пиримидин-2-иламин с выходом 55%.
Синтез 5-(9-изопропил-2-морфолин-4-ил-9-гидро-пурин-6-ил)-пиримидин-2-иламина

К раствору 5-(2-хлор-9-изопропил-9-гидро-пурин-6-ил)-пиримидин-2-иламина (2,84 ммоль) в диметилацетамиде(18 мл) добавили морфолин (2,84 ммоль). Реакционную смесь перемешивали при нагревании на масляной бане при температуре 94°C в течение 12 часов. Реакцию проверяли на отсутствие исходных материалов с помощью ЖХ-МС. Полупродукт незамедлительно пропустили через ВЭЖХ-колонку и очистили, при этом получили 5-(9-изопропил-2-морфолин-4-ил-9-гидро-пурин-6-ил)-пиримидин-2-иламин с выходом 58%.1Н NMR, DMSO-d6: 9,53 (s, 2Н), 8,32 (s, 1H), 7,30 (bs, 2H), 4,72 (m, 1H), 3,78 (m, 4H), 3,73 (m, 4H), 1,55 (d, 6H). m/z: 341,17 [MH]+.
Синтез 5-(8-бром-9-изопропил-2-морфолин-4-ил-9-гидро-пурин-6-ил)-пиримидин-2-иламина.

К раствору 5-(9-изопропил-2-морфолин-4-ил-9-гидро-пурин-6-ил)-пиримидин-2-иламина (1,03 г, 3,03 ммоль) в 15 мл хлороформа медленно добавили N-бромсукцинимид (594 мг, 3,34 ммоль) при температуре 5°C. При этой температуре проводили реакцию в течение 2 часов. В результате полученный продукт 5-(8-бром-9-изопропил-2-морфолин-4-ил-9-гидро-пурин-6-ил)-пиримидин-2-иламин очистили на флэш-колонке (система растворителей: 50% этилацетат в гексане) и получили 5-(8-бром-9-изопропил-2-морфолин-4-ил-9-гидро-пурин-6-ил)-пиримидин-2-иламин с выходом 52% (660 мг).1Н ЯМР, MeOD: 9,67 (s, 2Н), 4,90 (m, 1H), 3,89 (m, 4H), 3,82 (s, 4H), 1,72 (d, 6H). m/z: 419,31, 421,07 [MH]+.
Синтез 5-(9-изопропил-8-метил-2-морфолин-4-ил-9-гидро-пурин-6-ил)-пиримидин-2-иламина

В закрытом сосуде к раствору 5-(8-бром-9-изопропил-2-морфолин-4-ил-9-гидро-пурин-6-ил)-пиримидин-2-иламина (30 мг, 0,072 ммоль)и Pd(dppf)Cl2 (3 мг, 5% ммоль) в 3 мл безводного диоксана медленно прибавляли диметилцинк (210 мкл, 1,0 М в растворе гептана). Смесь нагрели до 65°C. Капельно добавили метанол, затем растворители удалили вакуумом. К остатку добавили этилацетат, полученный раствор промыли 1М соляной кислотой, водой и солевым раствором, затем осушили Na2SO4 После удаления растворителя полученную смесь пропустили через флэш-колонку на силикагеле и выделили 5-(9-изопропил-8-метил-2-морфолин-4-ил-9-гидро-пурин-6-ил)-пиримидин-2-иламин в количестве 8 г с выходом 47%.1HNMR, MeOD: 9,40 (s, 2Н), 4,81 (m, 1Н), 3,89 (m, 4H), 3,82 (s, 4H), 3,71(s, 3H), 1,73 (d, 6H). m/z: 355,16 [MH]+.
Пример 2 Сравнительные биологические тесты
Соединение согласно настоящему изобретению сравнили с рядом веществ, полученных и описанных в PCT/SG 2008/000379 по некоторым биологическим показателям. Параметрами тестирования были:
- активность в mTOR тесте
- активность в PI3K тесте
- Растворимость
- стабильность в микросомах человека.
Детальная методика каждого из тестов приведена ниже.
mTOR тест
Усеченная mTOR киназа и белоксHis-tag4eBP1 были получены самостоятельно. [γ33P]-ATO была приобретена у Amersham (GEHealthcare). Другие реактивы, если не указано иного, приобретены у Sigma-Aldrich.
Тесты фосфорилирования были изначально проведены в объеме 20 мкл на 384-луночном полипропиленовом планшете (Greiner). Вещества обычно тестировали в диапазоне от 100 мкМ до 0,006 мкМ, с восьмиступенчатым разведением, в двух повторах. 10 мкл/на лунку 2Х раствора (1,5 мкг/мл mTOR, 40 мкг/мл 4еВР1 в 1X тестируемом буфере, состоящим из 10 мл MN-2-гидроэтил-пиперазин-N-2-этансульфоновой кислоты с рН 7,5, 50 мкМ натрия хлорида и 10 мкМ марганца хлорида (II) нанесли на планшет с образцами, содержащим 1 мкл/на лунку исследуемого соединения в чистом ДМСО. Для запуска реакции добавили 10 мкл 20 мкМ раствора АТФ (конечная концентрация 10 мкМ АТФ и 0,4 мкКи/на лунку [γ33Р]-АТФ). По истечении 1 часа инкубации при комнатной температуре реакцию прервали добавлением 40 мкл/на лунку20 мМ ЭДТА/1 мМ раствора АТФ.
50 мкл полученной реакционной смеси перенесли в 384-луночный MultiscreenHTP-РН фильтрующий планшет (Millipore) предварительно заполненным 50 мкл/на лунку 1% раствором фосфорной кислоты. Планшет промыли 4 раза 120 мкл/на лунку 0,5% раствором фосфорной кислоты с помощью вакуумной фильтрации. В конце добавили 10 мкл/на лунку Optiphase™ Supermix жидкая сцинтиллирующая смесь (PerkinElmer). По истечение по меньшей мере 1 часа инкубации провели подсчет на WallacMicrobetaTrilux люминистирующем счетным устройстве, учитывая поправку исчисления. IC50 определили как требуемую концентрацию вещества для 50%-гоот максимально возможного ингибирования активности киназы.
PI3 тест
Рекомбинант PI3 Kp 110α/р85 получили самостоятельно. Фосфотидилиноситол (Ptdlns), фосфотидилсерин (PtdSer) и все остальные неуточненные реагентыприобрели у Sigma-Aldrich. [γ33Р]-АТФ и Optiphasec сцинтиллятор приобрели у PerkinElmer.
Тесты проводили в объеме 25 мкл на 384-луночном планшете Maxisorp. Вещества исследовали в 8 концентрациях в трехкратном серийном разведении, в основном начиная с концентрации 10 мкМ. Планшет Maxisorp покрыли 20 мкл/на лунку смесью Ptdlns и PtdSer в соотношении 1:1 (0,1 мг/мл каждого в смеси хлороформа и этанола в соотношении 3:7) и оставили на ночь в вытяжном шкафу при комнатной температуре для высыхания.
Для протекания реакции с ферментом дозировали соединение по 5 мкл/на лунку (в 2,5% ДМСО), 10 мкл/на лунку с ферментом(0,5 мкг/мл р110α + 1 мг/мл р85) и 10 мкл/на лунку5 мкМ АТФ с мкКи/мл [γ33Р]АТФ в тестируемом буфере (конечные концентрации: 0,2 мкг/мл p110α, 2 мкМ АТФ, 0,05 мкКи/ на лунку [γ33Р]АТФ в 1Х тестируемом буфере: буфер состоит из 100 мМ трис-соляной кислоты с рН 7,0, 200 мМ натрия хлорида, 8 мМ магния хлорида (II)). Реакцию провели при комнатной температуре в течение 1 часа, затем прервали путем добавления 30 мкл/на лунку 50 мМ раствором ЭДТА. Затем планшет дважды промыли в ТБС, высушили, добавили 30 мкл/на лунку сцинциллятора перед подсчетом на MicrobetaTrilux. IC50 определили как требуемую концентрацию вещества для 50%-го от максимально возможного ингибирования активности киназы.
Тест на микросомальную стабильность
Вначале оценивали стабильность вещества in vitro в высокопроизводительном формате на 96-луночном планшете (Whatman). Тест включал инкубацию с микросомами печени человека (МПЧ). В качестве эталонного стандарта использовали верапамил, приобретенный в Sigma-Aldrich. МПЧ приобрели в Xenotech (20 мг/мл в 250 мМ растворе сахарозы). Предварительно приготовили 100 мМ реакционной смеси калий-фосфатного буфера, смешав 80 мл 1М K2HPO4 и 20 мл 1М K2HPO4 в 900 воды (рН довели до 7,4 соляной кислотой), буфер хранили при комнатной температуре. K2HPO4·3Н2О и K2HPO4 были получены в Sigma Aldrich, НАДФ·Н и восстанавливающую систему растворов А и Б приобрели в Gentest. Предварительно приготовили раствор для остановки реакции, состоящий из ацетонитрила и ДМСО (80:20); раствор хранили при температуре 4°C. Все использованные растворители были класса «для ВЭЖХ», воду для приготовления реакционных растворов и для проведения анализов методом ЖХ-МС деионизировали на установке Milli-Q.
2,5 мкл 10 мМ маточного раствора тестируемого соединения в ДМСО разбавляли в 200 раз путем смешивания с 500 мкл 50 мМ калий-фосфатного буфера (pH 7,4, приготовлен путем разведения 100 мМ маточного буферного раствора водой). 8 мкл смеси, содержащей соединение, добавили к 72 мкл предварительно приготовленной инкубационной смеси (2250 мкл воды, 2900 мкл 100 мМ калий-фосфатного буфера, 290 мкл НАДФ·Н восстанавливающая система растворов А и Б и 250 мкл МПЧ). Полученную смесь (с концентрацией соединения 5 мкМ) инкубировали при температуре 37°C в В. инкубаторе Braun Certomat H, после чего в каждую лунку на планшете, содержащую 100 мкл раствора для остановки реакции, добавляли аликвоту объемом 50 мкл. После центрифугирования при 4°C в течение 15 минут при 2000 об/мин. 100 мкл полученной надосадочной жидкости перенесли на планшет для ЖХ-МС для анализа. Каждое тестируемое соединение тестировали многократно и инкубировали в течение нескольких периодов времени (5, 15, 30, 45 и 60 минут). Остаточную концентрацию соединения определяли путем жидкостной хроматографии и масс-спектрометрии (ABIQtrap 3200) и сравнивали с эталонным раствором известной концентрации. Стабильность выражали в форме периода полураспада в минутах (t1/2).
Высокопроизводительный анализ растворимости
Растворимость соединения определяли с использованием высокопроизводительного метода кинетического анализа растворимости с использованием 96-луночного формата. Растворимость соединения определяли с использованием микропланшетного спектрофотометра в УФ-области (Molecula Devices Spectra Max Plus 384). В качестве эталонных стандартов использовали Вориностат (SAHA) и Никардипин (приобрели в Sigma).
Соединения в ДМСО растворяли в фосфатном буфере (Sigma) с конечной концентрацией 250 мкМ (5 мкл 10 мМ маточного раствора в 195 мкл фосфатного буфера с РН 7,0) и тщательно перемешали. Затем смесь перемешивали при 600 об/мин, в течение 1,5 часов, после этого смесь оставляли для отстаивания при комнатной температуре на 2 часа. Затем планшет центрифугировали при 1500 г в течение 15 минут. Полученную надосадочную жидкость (80 мкл) перенесли на планшет для УФ-анализа и разбавили ДМСО (20 мкл). Количественный анализ образцов осуществляли с помощью калибровочных растворов соответствующего соединений, приготовленных в смеси фосфатный буфер/ДМСО (80:20).
Тестируемые соединения показаны ниже:

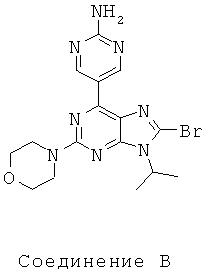



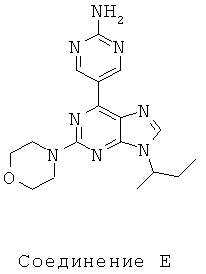
В таблице 1 приведены результаты биологических тестов
Как видно из таблицы, хотя все соединения обладали некоторой активностью, соединение согласно настоящему изобретению обладало активностью в отношении обеих интересующих ферментов, сравнимой со всеми другими соединениями, за исключением соединения Е, которое обладает значительно более низкой активностью в отношении киназы mTOR. Таким образом, соединение Е является несколько менее подходящим для применения в качестве лекарства, чем другие соединения, использовавшиеся в описанном анализе для сравнения, поскольку имеет наиболее низкую активность киназы mTOR.
Не все исследованные соединения продемонстрировал приемлемые характеристики растворимости. Например, низкие результаты по растворимости соединений А, В Е означают, что эти соединения не могут быть хорошими потенциальными лекарственными средствами. Их низкая растворимость препятствует эффективному приготовления составов в физиологически приемлемых носителях, следовательно, уменьшается вероятность того, что они будут иметь хорошие фармакокинетические характеристики для перорального применения.
Что касается метаболической стабильности, результаты значительно отличались. В этих тестах соединения А, В, Е и соединение согласно настоящему изобретению имели приемлемую стабильность в микросомах печени человека. Это указывает на то, что в случае их успешного введения эти соединения будут достаточно стабильны для достижения требуемого физиологического эффекта в организме пациента. Более того, среди соединений, проявляющих хорошую ингибиторную активность в отношении обеих видов киназ mTOR и PI3K и хорошую растворимость, (В, D и соединение согласно настоящему изобретению), только соединение согласно настоящему изобретению обладает приемлемой метаболической стабильностью.
Все соединения А-Е и соединение согласно настоящему изобретению демонстрируют хорошую активность в данных тестах, однако соединение согласно настоящему изобретению является одним из самых эффективных благодаря комбинации высокой ингибиторной активности, хорошей растворимости в воде и хорошей метаболической стабильности.
В целом биологические результаты, которые продемонстрировали исследованные соединения в описанных выше тестах, показали, что, несмотря на схожесть соединений с соединением согласно настоящему изобретению, только соединение согласно настоящему изобретению продемонстрировало требуемую комбинацию активности, хорошей растворимости в воде и метаболической стабильности, что делает это соединение подходящим для использования в качестве лекарственного средства. Эти исследования продемонстрировали превосходство соединения согласно настоящему изобретению в качестве потенциального лекарственного средства.
Пример 3 Тесты на эффективность с использование биомаркеров на клетках (pp70-S6KT389, pAktS473)
Для демонстрирования активности соединения согласно настоящему изобретению провели2 теста с использованием биомаркеров в клетке. Методика описана ниже:
Набор Alphascreen® Surefire p-Akt (Ser 473) 384 (TGP, № по каталогу.: TGRAS500)
Alphascreen® Surefirephospho-p70 S6 киназа (Thr 389) 384 kit (TGR, Cat. No.: TGR70S500) HProxiplate-384 Plus (Perkin Elmer, №по каталогу: 6008280) приобрели в Perkin Elmer. Клетки (PC-3) карциномы простаты человека приобретали в АТСС. Все реагенты, если не указано иного, приобретали в Sigma-Aldrich.
В день 1 200 мкл 2 X 105 клеток/мл клеточного раствора клеток РС3 засевали в каждую лунку 96-луночного планшета. Соединения добавляли по истечении 24 часов после засева и обычно исследовали в концентрациях 10 мкм-4,6 нМ, с 8-ю разведениями, трижды. Конечная концентрация ДМСО после 4-часовой инкубации при 37°C составила 0,1%. После инкубации надосадочный слой удалили, клетки лиофилизировали в 1X лизирующем буфере (набор Alpha Screen) и осторожно перемешивали в течение 10 минут. 4 мкл лизата и 5 мкл смеси Реакционного буфера с Активирующим буфером, содержащей Alpha Screen Акцепторные гранулы, добавляли в каждую из 384 лунок (соотношение Реакционный буфер: Активирующий буфер: Акцепторные гранулы составляло 40:10:1) и осторожно перемешивали в течение 2 часов при комнатной температуре в темноте. 2 мкл разбавляющего буфера, содержащего Донорные гранулы Alpha Screen® (соотношение разбавляющего буфера: Донорные сферы составляет 20:1) добавляли в каждую из лунок 384-луночного планшета, помещали на планшетный шейкер на 1-2 минуты и инкубировали при комнатной температуре в течение ночи.
Для считывания результатов использовали устройство BMG Pherostar со стандартными настройками Alpha Screen (режим влажности: Alpha Screen, режим считывания: Endpoint, оптический режим: Alpha Screen 680 570; время удерживания: 0,30 с, время возбуждения: 0,10 с, начало интеграции: 0,34 с, начало интеграции: 0,30 с, коэффициент усиления: 3000).
IC50 определяли как молярную концентрацию вещества, которая обеспечивает 50% от максимально возможной ингибиторной активности киназы. Измеренная IC50 5-(9-изопропил-8-метил-2-морфолин-4-ил-9-гидро-пурин-6-ил)-пиримидин-2-иламин в отношении ингибирования фосфорилирования p70-S6KT389 и pAktS473 составила 24 нМ и 9 нМ соответственно.
Результаты биомаркерного анализа продемонстрировали активность соединения согласно изобретению в ингибировании ферментативной активности киназы.
Реферат
Настоящее изобретение относится к новому пиримидин-замещенному пуриновому соединению формулы (I) или фармацевтически приемлемой соли указанного соединения, которые обладают ингибирующим действием в отношении mTOR и Р13 киназ и могут быть использованы при лечении рака. Соединение формулы (I) соответствует структурной формуле:.Изобретение также относится к фармацевтической композиции содержащей терапевтически эффективное количество указанного соединения и фармацевтически приемлемый разбавитель, вспомогательное вещество или носитель; к способу ингибирования протеинкиназы, выбранной из mTOR или Р13 киназы, и к способу лечения или предотвращения состояния у млекопитающего, связанного с ингибированием активности mTOR и/или Р13 киназ. 5 н. и 6 з.п. ф-лы, 1 табл., 3 пр.
Формула
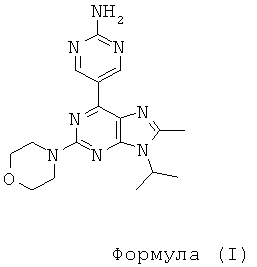
или фармацевтически приемлемая соль указанного соединения.
Документы, цитированные в отчёте о поиске
2,6,9-тризамещенное производное пурина, фармацевтически приемлемая катионная соль, способ ингибирования пролиферации клеток, фармацевтическая композиция

Комментарии