Производные зн-хиназолин-4-она и лекарственное средство, обладающее свойствами специфического ингибитора моноаминооксидазы b - RU2340604C2
Код документа: RU2340604C2
Описание
Настоящее изобретение относится к производным ЗН-хиназолин-4-она, к способу их получения, фармацевтическим композициям, содержащим эти соединения, а также к их применению в качестве селективных ингибиторов моноаминоксидазы В.
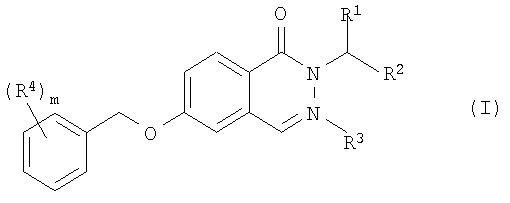
Согласно первому аспекту настоящего изобретения предлагается соединение формулы I:
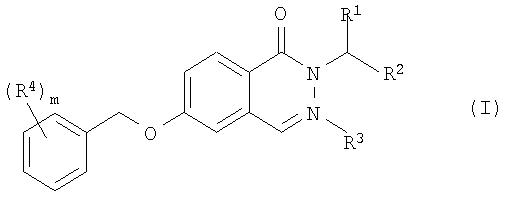
в которой R1 представляет собой -(CH2)n-CO-NR5R6; -(CH2)n-COOR7; -(CH2)n- NR5R6; -(CH2)n-CN; - (CH2)n-OR8 или фенил, который является незамещенным или замещенным заместителями в количестве от одного до трех, выбранными из галогена и фтор(С1-С6)-алкила;
R2 представляет собой водород, галоген или (С1-С6)-алкил;
R3 представляет собой водород, (С1-С6)-алкил, (С3-С6)-циклоалкил или бензил;
R4 представляет собой галоген, фтор(С1-С6)-алкил, циано, (С1-С6)-алкокси или фтор(С1-С6)-алкокси;
R5 и R6независимо друг от друга представляют собой водород или (С1-С6)-алкил;
R7 представляет собой водород или C1-С6-алкил;
R8 представляет собой водород или C1-С6-алкил;
m означает 1, 2 или 3 и
n означает 0, 1 или 2,
а также его фармацевтически приемлемые соли.
Согласно другому аспекту настоящего изобретения предлагается соединение формулы I, в которой
R1 представляет собой -(CH2)n-CO-NR5R6; -(CH2)n-COOR7; -(CH2)nNR5R6; -(CH2)n-CN; -(CH2)n-OR8 или фенил, который является незамещенным или замещенным заместителями в количестве от одного до трех, выбранными из галогена и фтор(С1-С6)-алкила;
R2 представляет собой водород, галоген или (С1-С6)-алкил;
R3 представляет собой водород, (С1-С6)-алкил, (С3-С6)-циклоалкил или бензил;
R4 представляет собой галоген, фтор(С1-С6)-алкил, циано, (С1-С6)-алкокси или фтор(С1-С6)-алкокси;
R5 и R6независимо друг от друга представляют собой водород или (С1-С6)-алкил;
R7 представляет собой водород или C1-С6-алкил;
R8 представляет собой водород или C1-С6-алкил;
m означает 1, 2 или 3 и
n означает 0, 1 или 2,
а также его фармацевтически приемлемые соли.
Было обнаружено, что соединения общей формулы I являются селективными ингибиторами моноаминоксидазы В.
Моноаминоксидаза (МАО, КФ 1, 4, 3, 4) представляет собой флавинсодержащий фермент, который отвечает за окислительное деаминирование эндогенных трансмиттеров - моноаминов, например, таких как допамин, серотонин, адреналин или норадреналин, и аминов, содержащихся в следовых количествах, например, таких как фенилэтиламин, а также ряда аминов - ксенобиотиков. Этот фермент существует в двух формах, МАО-А и МАО-В, кодируемых различными генами [Bach et al., Proc. Natl. Acad. Sci. USA 85:4934-4938 (1988)] и различающихся по распределению в органах организма, структуре и субстратной специфичности. МАО-А обладает высоким сродством к серотонину, октопамину, адреналину и норадреналину; в то время как природными субстратами для МАО-В являются фенилэтиламин и тирамин. Полагают, что в окислении допамина принимают участие обе формы. МАО-В широко распространен в ряде органов, включая мозг [Cesura, Pletscher, Prog. Drug Research 38:171-297 (1992)]. Активность МАО-В в мозге, по-видимому, увеличивается с возрастом. Это увеличение является признаком глиоза, связанного со старением [Fowler et al., J. Neural. Transm. 49:1-20 (1980)]. В дополнение, активность МАО-В является более высокой в мозге пациентов, страдающих болезнью Альцгеймера [Dostert et al., Biochem. Pharmacol. 38:555-561 (1989)], и было обнаружено, что МАО-В в значительной степени экспрессируется в астроцитах вокруг старческих бляшек [Saura et al., Neuroscience 70:755-774 (1994)]. В этой связи, поскольку окислительное деаминирование первичных аминов при воздействии МАО приводит к продуцированию NH3, альдегидов и Н2О2, агентов с установленной или потенциальной токсичностью, полагают, что имеется логическое обоснование для применения селективных ингибиторов МАО-В для лечения слабоумия (деменции) и болезни Паркинсона. Ингибирование активности МАО-В служит причиной снижения ферментативной инактивации допамина и, таким образом, приводит к пролонгированию доступности нейротрансмиттера в допаминовых нейронах. Процессы дегенерации, связанные со старением и заболеваниями Альцгеймера и Паркинсона, также могут быть признаками окислительного стресса вследствие повышения активности МАО и последующего увеличения образования Н2О2 при воздействии МАО-В. Следовательно, ингибиторы МАО-В могут оказывать воздействие как посредством снижения образования кислородных радикалов, так и посредством повышения содержания моноаминов в мозге.
Учитывая взаимосвязь МАО-В с вышеуказанными неврологическими расстройствами, интересно получить потенциальные и селективные ингибиторы, которые могли бы позволить осуществить контроль ферментной активности такого типа. Фармакология некоторых известных ингибиторов МАО-В обсуждается, например, в статье: Bentuù-Ferrer et al., CNS Drugs, 6:217-236 (1996). Поскольку главным ограничением для проявления необратимой и неселективной активности ингибитора МАО является необходимость соблюдать диетологические предписания из-за риска возникновения гипертензионного кризиса в том случае, когда происходит поступление тирамина, а также вследствие возможности взаимодействия с другими лекарственными средствами [Gardner et al., J.Clin. Psychiatry 57:99-104 (1996)], такие нежелательные проявления менее выражены в случае обратимых и селективных ингибиторов МАО, в частности, в случае ингибиторов МАО-В.
Таким образом, существует необходимость в ингибиторах МАО-В, которые обладают высокой селективностью и которым не присущи нежелательные побочные эффекты необратимых ингибиторов МАО с низкой селективностью по отношению к ферменту.
Было обнаружено, что соединения формулы I, являющиеся предметом настоящего изобретения, и их фармацевтически приемлемые соли обладают потенциалом как высокоэффективные ингибиторы МАО-В. Объектом настоящего изобретения также является способ получения соединений формулы I, лекарственные средства на основе соединений согласно настоящему изобретению и их изготовление, а также применение этих соединений для контроля или профилактики заболеваний, медиатором при которых являются ингибиторы моноаминоксидазы В, и, соответственно, способы получения соответствующих лекарственных средств.
Приведенные ниже определения общих терминов, использованные в тексте настоящей патентной заявки, используются вне зависимости от того, приводится ли термин отдельно или в комбинации. Необходимо отметить, что при использовании в описании заявки и в прилагаемой формуле изобретения термины, приведенные в грамматической форме единственного числа, подразумевают также и множественное число, если контекст ясно не указывает на противоположное.
Термин "(С1-С6)-алкил" ("низший алкил"), используемый в тексте настоящей заявки, означает насыщенные углеродные радикалы с линейной или разветвленной цепью, содержащие от 1 до 6 атомов углерода, предпочтительно содержащие от 1 до 4 атомов углерода, например, такие как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил и подобные им.
Термин "галоген" означает фтор, хлор, бром и иод.
Термин "галоген-(С1-С6)-алкил" означает низший алкильный радикал, как определено в тексте настоящей заявки, замещенный в любом положении одним или более атомом галогена, как определено в тексте настоящей заявки. Примеры галогеналкильных радикалов включают, не ограничиваясь указанным, 1,2-дифторпропил, 1,2-дихлорпропил, трифторметил, 2,2,2-трифторэтил, 2,2,2-трихлорэтил, 1,1,1-трифторпропил и подобные радикалы.
"(С1-С6)-алкокси" означает радикал -O-R, в котором R представляет собой низший алкильный радикал, как определено в тексте настоящей заявки. Примеры радикалов алкокси включают, не ограничиваясь указанным, метокси, этокси, изопропокси и подобные радикалы.
Термин "фармацевтически приемлемые соли" соединений означают такие соли, которые являются фармацевтически приемлемыми и которые, как правило, безопасны и не являются неприемлемыми в биологическом и других отношениях и которые обладают необходимой биологической активностью, присущей исходным соединениям. Эти соли являются производными неорганической или органической кислоты или основания. Необходимо понимать, что все указания на фармацевтически приемлемые соли включают аддитивные формы (сольваты) или кристаллические формы (полиморфные модификации - полиморфы) той же самой соли - продукта присоединения кислоты.
В соответствии с одним из вариантов осуществления настоящего изобретения предлагается соединение формулы I, в которой R1 означает -(СН2)nCO-NH2 и n равно 0 или 1.
В соответствии с одним из вариантов осуществления настоящего изобретения предлагается соединение формулы I, в которой R1 означает -(СН2)n-COOR7, где R7 представляет собой водород или (С1-С6)-алкил и n равно 0, 1 или 2. В соответствии с еще одним вариантом осуществления настоящего изобретения предлагается соединение формулы I, в которой R1 представляет собой -(СН2)n-COOR7, где R7 означает (С1-С6)-алкил и n равно 0.
В соответствии с одним из вариантов осуществления настоящего изобретения предлагается соединение формулы I, в которой R1 представляет собой -(CH2)n-NH2 и n означает 1 или 2.
В соответствии с одним из вариантов осуществления настоящего изобретения предлагается соединение формулы I, в которой R1 представляет собой -(CH2)n-CN; n равно 0, 1 или 2. В соответствии с еще одним вариантом осуществления настоящего изобретения предлагается соединение формулы I, в которой R1 представляет собой -CN.
В соответствии с одним из вариантов осуществления настоящего изобретения предлагается соединение формулы I, в которой R1 представляет собой фенил, который является замещенным галогеном.
В соответствии с одним из вариантов осуществления настоящего изобретения предлагается соединение формулы I, в которой R2представляет собой водород или (С1-С6)-алкил. В соответствии с еще одним вариантом осуществления настоящего изобретения предлагается соединение формулы I, в которой R2 представляет собой водород или метил.
В соответствии с одним из вариантов осуществления настоящего изобретения предлагается соединение формулы I, в которой R3 представляет собой (С1-С6)-алкил, (С3-С6)-циклоалкил или бензил. В соответствии с еще одним вариантом осуществления настоящего изобретения предлагается соединение формулы I, в которой R3 означает (С3-С6)-циклоалкил. В соответствии с еще одним вариантом осуществления настоящего изобретения предлагается соединение формулы I, в которой R3 означает бензил.
В соответствии с одним из вариантов осуществления настоящего изобретения предлагается соединение формулы I, в которой R4 означает галоген и m означает 1.
Среди соединений, являющихся предметом настоящего изобретения, соединения формулы I или их фармацевтически приемлемые соли являются предпочтительными.
Предпочтительными соединениями формулы I являются такие, в которых R3 означает водород.
Также предпочтительны соединения формулы I, в которой R3 означает (C1-С6)-алкил. Особенно предпочтительными являются такие соединения, в которых R3 означает метил.
Соединения формулы I, в которой R3 представляет собой (С3-С6)-циклоалкил или бензил, также являются предпочтительными.
Кроме того, предпочтительны соединения формулы I, в которых R1 представляет собой -(CH2)n-CO-NR5R6, где R5 и R6 независимо друг от друга представляют собой водород или (С1-С6)-алкил и n равно 0, 1 или 2. Особенно предпочтительны такие соединения, в которых R5 и R6 представляют собой водород и n равно 0, 1 или 2.
Даже более предпочтительны соединения формулы I, в которой R1 представляет собой -(CH2)n-CO-NR5R6, где R5 и R6 означают водород и n равно 0.
Следующие соединения являются примерами таких соединений:
2-[7-(3-фторбензилокси)-4-оксо-4Н-хиназолин-3-ил]ацетамид,
2-[7-(3-фторбензилокси)-4-оксо-4Н-хиназолин-3-ил]пропионамид,
2-[7-(4-фторбензилокси)-4-оксо-4Н-хиназолин-3-ил]ацетамид,
2-[7-(4-фторбензилокси)-4-оксо-4Н-хиназолин-3-ил]пропионамид,
2-[7-(3-фторбензилокси)-2-метил-4-оксо-4Н-хиназолин-3-ил]ацетамид и
2-[2-циклопропил-7-(3-фторбензилокси)-4-оксо-4Н-хиназолин-3-ил]ацетамид.
Также предпочтительными являются соединения формулы I, в которой R1представляет собой -(CH2)n-OR8, где R8 означает водород или (С1-С6)-алкил и n равно 0, 1 или 2. Особенно предпочтительны такие соединения, в которых R8означает метил и n равно 1.
Примерами таких соединений являются следующие соединения:
7-(3-фторбензилокси)-3-(2-метоксиэтил)-3Н-хиназолин-4-он,
7-(4-фторбензилокси)-3-(2-метоксиэтил)-3Н-хиназолин-4-он и
7-(3-фторбензилокси)-3-(2-метоксиэтил)-2-метил-3Н-хиназолин-4-он.
Кроме того, предпочтительны соединения формулы I, в которой R1 означает -(CH2)n-NR5R6, где R5 и R6 независимо друг от друга представляют собой водород или C1-С6-алкил и n равно 0, 1 или 2. Особенно предпочтительными в этой группе являются такие соединения, в которых R5 и R6 представляют собой водород и n равно 0, 1 или 2.
Примерами таких соединений являются следующие соединения:
3-(2-аминоэтил)-7-(3-фторбензилокси)-3Н-хиназолин-4-он, 1:2 гидрохлорид,
3-(3-аминопропил)-7-(3-фторбензилокси)-3Н-хиназолин-4-он, 1:2 гидрохлорид,
3-(2-аминоэтил)-7-(4-фторбензилокси)-3Н-хиназолин-4-он, 1:1 гидрохлорид и
2-[7-(3-фторбензилокси)-2-метил-4-оксо-4Н-хиназолин-3-ил]этиламмонийхлорид.
Особенно предпочтительными соединениями формулы I являются такие соединения, в которых R4 представляет собой галоген или фтор(С1-С6)-алкил. Наиболее предпочтительно, если R4 означает фтор.
В соответствии с еще одним вариантом осуществления настоящего изобретения предлагается соединение формулы I, выбранное из следующих соединений:
2-[7-(3-фторбензилокси)-4-оксо-4Н-хиназолин-3-ил]ацетамид,
2-[7-(3-фторбензилокси)-4-оксо-4Н-хиназолин-3-ил]пропионамид,
2-[7-(4-фторбензилокси)-4-оксо-4Н-хиназолин-3-ил]ацетамид,
2-[7-(4-фторбензилокси)-4-оксо-4Н-хиназолин-3-ил]пропионамид,
2-[7-(3-фторбензилокси)-2-метил-4-оксо-4Н-хиназолин-3- ил]ацетамид,
2-[2-циклопропил-7-(3-фторбензилокси)-4-оксо-4Н-хиназолин-3-ил]ацетамид,
7-(3-фторбензилокси)-3-(2-метоксиэтил)-3Н-хиназолин-4-он,
7-(4-фторбензилокси)-3-(2-метоксиэтил)-3Н-хиназолин-4-он,
7-(3-фторбензилокси)-3-(2-метоксиэтил)-2-метил-3Н-хиназолин-4-он,
3-(2-аминоэтил)-7-(3-фторбензилокси)-3Н-хиназолин-4-он, 1:2 гидрохлорид,
3-(3-аминопропил)-7-(3-фторбензилокси)-3Н-хиназолин-4-он, 1:2 гидрохлорид,
3-(2-аминоэтил)-7-(4-фторбензилокси)-3Н-хиназолин-4-он, 1:1 гидрохлорид, и
2-[7-(3-фторбензилокси)-2-метил-4-оксо-4Н-хиназолин-3-ил]этиламмонийхлорид.
Согласно дополнительному аспекту настоящего изобретения предлагается способ получения соединения формулы I и его фармацевтически приемлемых солей, включающий взаимодействие соединения формулы IV:
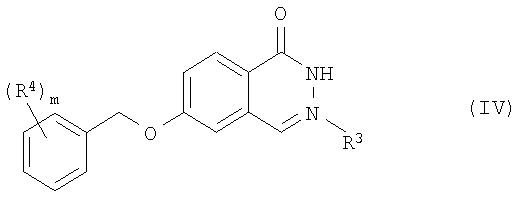
в которой R3 представляет собой водород, (С1-С6)-алкил, (С3-С6)-циклоалкил или бензил;
R4 представляет собой галоген, фтор(С1-С6)-алкил, циано, (С1-С6)-алкокси или фтор(С1-С6)-алкокси и
m означает 1, 2 или 3,
с соединением формулы V:
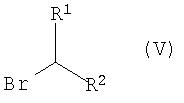
в которой R1 представляет собой -(CH2)n-CO-NR5R6; -(CH2)n-COOR7; (СН2)n-NR5R6; -(CH2)n-CN; -(CH2)n-OR8 или фенил, который является незамещенным или замещенным заместителями в количестве от одного до трех, выбранными из галогена и фтор(С1-С6)-алкила;
R2 представляет собой водород, галоген или (С1-С6)-алкил;
R5 и R6независимо друг от друга представляют собой водород или (С1-С6)-алкил;
R7 представляет собой водород или (C1-С6)-алкил;
R8 представляет собой водород или (C1-С6)-алкил;
n означает 0, 1 или 2,
и необязательно превращение полученного соединения формулы I в фармацевтически приемлемую соль.
В соответствии с одним из вариантов соединения общей формулы I и их фармацевтически приемлемые соли могут быть получены взаимодействием соединения формулы II:
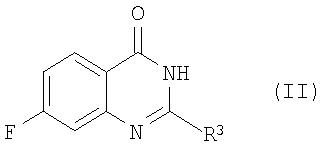
в которой R3 представляет собой водород,
с соединением формулы III:
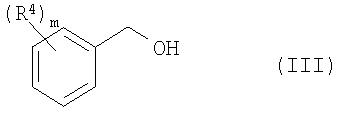
с получением при этом соединения формулы IV:

в которой R3 представляет собой водород,
это соединение в свою очередь взаимодействует с соединением формулы V:

с получением при этом соединения формулы I,
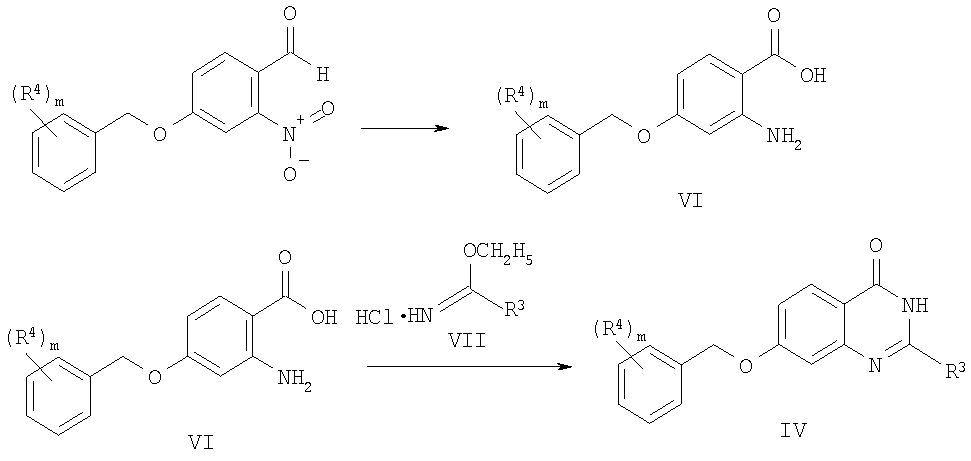
и, если необходимо, превращением соединения формулы I в фармацевтически приемлемую соль, или, в качестве альтернативы, взаимодействием соединения формулы VI:
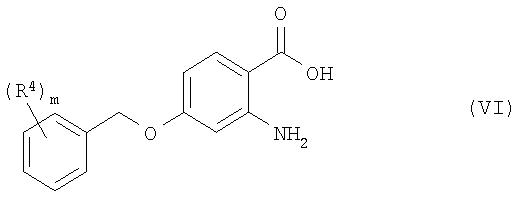
с соединением формулы VII:
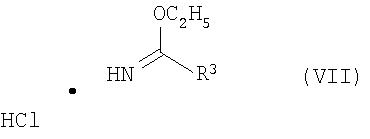
с получением при этом соединения формулы IV, которое, в свою очередь, взаимодействует с соединением формулы V с образованием при этом соединения формулы I, и, если необходимо, с превращением соединения формулы I в фармацевтически приемлемую соль.
Согласно настоящему изобретению соединения общей формулы I могут быть получены в соответствии со следующей схемой 1: 2-амино-4-фторбензойную кислоту VIII нагревают в присутствии формамидина ацетата IX, что после подщелачивания реакционной среды приводит к получению соединений типа IIа. Последующее взаимодействие с натриевыми солями бензиловых спиртов типа Х позволяет получить соединения типа IVa, которые затем растворяют в 1 -метил-2-пирролидоне (N-МП) и обрабатывают гидридом натрия и электрофилом формулы V, получая при этом соединения формулы I, в которой R3 означает водород.
Схема 1
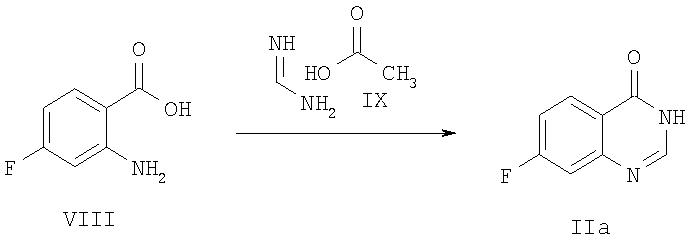

В качестве альтернативы соединения общей формулы I могут быть получены в соответствии со следующей схемой 2: 4-фтор-2-нитробензонитрил XI нагревают в присутствии HBr и затем полученную кислоту XII этерифицируют метанолом в кислой среде, получая при этом соединение формулы XIII. Последующее взаимодействие натриевых солей с бензиловыми спиртами типа Х позволяет получить соединения типа XIV, которые затем гидрируют до анилинов формулы VI. Обработка с использованием ацетамидата гидрохлорида типа VII в основании (обычно метоксид натрия) приводит к получению хиназолинонов IV, которые затем алкилируют соединениями типа V с получением при этом целевых соединений формулы I.
Схема 2

Фармацевтически приемлемые соли соединений формулы I могут быть легко получены с использованием методик, которые сами по себе известны, учитывая химическую природу соединения, которое необходимо перевести в солевую форму. Подходящими для получения фармацевтически приемлемых солей основных соединений формулы I являются неорганические или органические кислоты, например, такие как хлороводородная кислота, бромоводородная кислота, серная кислота, азотная кислота, фосфорная кислота или лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, виннокаменная кислота, метансульфоновая кислота, n-толуолсульфоновая кислота и подобные им кислоты. Соединения, которые содержат атомы щелочных металлов или щелочноземельных металлов, например, таких как натрий, калий, кальций, магний и подобные металлы, основные амины или основные аминокислоты являются подходящими для получения фармацевтически приемлемых солей кислотных соединений.
Соединения формулы I и их фармацевтически приемлемые соли являются, как уже указывалось выше, ингибиторами моноаминоксидазы В (МАО-В) и могут быть использованы для лечения или профилактики заболеваний, при которых использование ингибиторов МАО-В может быть полезным. Такие заболевания включают острые и хронические неврологические нарушения или расстройства, когнитивные расстройства и недостаточность памяти. Подходящими для лечения неврологическими нарушениями или расстройствами являются, например, травматические или хронические процессы в нервной системе, такие как болезнь Альцгеймера, другие типы слабоумия (деменции), небольшое снижение когнитивных способностей или болезнь Паркинсона. Другие показания включают психиатрические заболевания, например, такие как депрессия, беспокойство, острое тревожное состояние с реакцией паники, социальная фобия, шизофрения, нарушения и расстройства аппетита и метаболические нарушения или расстройства, например, такие как ожирение, а также показания включают профилактику и лечение синдрома отмены, включая злоупотребление алкоголем, никотином и другими вызывающими привыкание лекарственными и наркотическими средствами. Другие подлежащие лечению показания могут представлять собой синдром дефицита (WO 01/34172), периферическую нейропатию, вызванную химиотерапией опухолей (WO 97/33572), или лечение рассеянного склероза (WO 96/40095) и другие нейровоспалительные заболевания.
Фармакологическую активность соединений тестировали с использованием следующего метода.
Кодируемые цДНК' МАО-А и МАО-В человека транзиентно трансфектировали в клетках EBNA, используя методику, описанную в статье: Schlaeger, Christensen, Cytotechnology, 15:1-13 (1998). После транфекции клетки гомогенизировали, используя гомогенизатор "Polytron homogeneiser", в 20 мМ Трис HCl буфера, рН 8,0, содержащего 0,5 мМ ЭГТК (EGTA) и 0,5 мМ фенилметансульфонилфторида. Клеточные мембраны получают посредством центрифугирования при 45000×g и, после двух стадий промывки с использованием 20 мМ Трис HCl буфера, рН 8,0, содержащего 0,5 мМ ЭГТК, мембраны в заключение ресуспендируют в вышеуказанном буфере и хранят аликвоты при -80°С до начала использования.
Ферментативную активность МАО-А и МАО-В анализируют, проводя фотометрический анализ в 96-луночных планшетах, с использованием модификации методики, описанной в статье: Zhou, Panchuk-Voloshina, Analytical Biochemistry 253:169-174 (1997). Вкратце, аликвоты мембран инкубируют в 0,1 М фосфатно-калиевом буфере, рН 7,4, в течение 30 мин при 37°С в присутствии соединений в различных концентрациях или без добавления соединения. После этого ферментативную реакцию инициируют добавлением тирамина - МАО субстрата - вместе с 1 Ед/мл пероксидазы хрена ("Roche Biochemicals") и 80 мкМ N-ацетил-3,7-дигидроксифеноксазина ("Amplex Red", "Molecular Probes"). Образцы дополнительно инкубируют в течение 30 мин при 37°С в конечном объеме, составляющем 200 мкл, и затем определяют поглощение при длине волны 570 нм, используя устройство для прочтения планшетов "SpectraMax plate reader" (фирма "Molecular Devices"). Фоновое (неспецифическое) поглощение определяют в присутствии 10 мкМ хлоргилина для МАО-А или 10 мкМ L-депренила для МАО-В. Значения IC50 определяют по кривым ингибирования, полученным с использованием ингибитора в девяти концентрациях, в сериях по два образца, вычисляя по экспериментальным данным параметры четырехпараметрического логистического уравнения с использованием компьютерной программы.
Соединения согласно настоящему изобретению являются специфическими ингибиторами МАО-В. Активность соединений формулы I, измеренная при проведении вышеуказанного анализа, находится в пределах до 10 мкМ или менее, обычно 1 мкМ или менее и идеально 0,3 мкМ или менее.
Соединения формулы I и их фармацевтически приемлемые соли могут быть использованы в качестве лекарственных средств, например, в виде фармацевтических препаратов. Фармацевтические препараты могут быть введены перорально, например, в виде таблеток, таблеток с покрытием, драже, твердых или мягких желатиновых капсул, растворов, эмульсий или суспензий. Кроме того, введение может быть эффективно осуществлено ректально, например, в виде суппозиториев или парентерально, например, в виде растворов для инъекций.
Соединения формулы I и их фармацевтически приемлемые соли для изготовления фармацевтических препаратов могут быть использованы вместе с фармацевтически инертными, неорганическими или органическими носителями. В качестве таких носителей для таблеток, таблеток с покрытием, драже, твердых желатиновых капсул могут быть использованы, например, лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли и подобные носители. Подходящие носители для мягких желатиновых капсул представляют собой, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и подобные им носители; однако, с учетом природы активного вещества, для изготовления мягких желатиновых капсул носитель обычно не требуется. Подходящие носители для изготовления растворов или сиропов представляют собой, например, воду, полиолы, сахарозу, инвертный сахар, глюкозу и подобные носители. Вспомогательные вещества, такие как спирты, полиолы, глицерин, растительные масла и тому подобное, могут быть использованы для получения водных растворов для инъекций водорастворимых солей соединений формулы I, но, как правило, в этом нет необходимости. Подходящие носители для суппозиториев представляют собой, например, природные или отвержденные масла, воски, жиры, полутвердые и жидкие полиолы и подобные им носители.
В дополнение, фармацевтические препараты могут содержать консерванты, солюбилизирующие вещества, стабилизаторы, агенты, улучшающие смачиваемость, подсластители, подкрашивающие вещества, вещества, улучшающие вкус и запах, соли для регулирования осмотического давления, буферные вещества, маскирующие агенты или антиоксиданты. Эти препараты также могут содержать другие терапевтически значимые вещества.
Как указывалось выше, лекарственные средства, содержащие соединение формулы I или его фармацевтически приемлемые соли и терапевтически инертный наполнитель, также являются объектом настоящего изобретения, также как и способ получения таких лекарственных средств, который включает объединение одного или более соединения формулы I или его фармацевтически приемлемых солей и, если необходимо, одного или более другого терапевтически значимого вещества с получением при этом фармацевтической дозированной формы, вместе с одним или более терапевтически инертным носителем.
Дозировка может варьироваться в широких пределах и, безусловно, будет зависеть от индивидуальных требований в каждом конкретном случае. Как правило, эффективная дозировка для перорального или парентерального введения составляет 0,01-20 мг/кг/день, причем дозировка, составляющая 0,1-10 мг/ кг/день является предпочтительной для всех указанных показаний. Дневная дозировка для взрослых людей массой 70 кг, соответственно, составляет 0,7-1400 мг в день, предпочтительно от 7 до 700 мг в день.
Следующие примеры приведены только в целях иллюстрации изобретения. Эти примеры не следует рассматривать как ограничивающие объем изобретения, но, главным образом, как типичные для осуществления изобретения. Для термина "комнатная температура" используется сокращение "rt".
Пример 1:2-[7-(3-фторбензилокси)-4-оксо-4Н-хиназолин-3-ил]ацетамид
а) 7-Фтор-3Н-хиназолин-4-он
Смесь 2-амино-4-фторбензойной кислоты (14,6 г, 94 ммоль) и форамидина ацетата (19,6 г, 18,8 ммоль) в 2-метоксиэтаноле (110 мл) нагревают при 130°С в течение 18 час. После охлаждения смесь наполовину упаривают и при этом образуется осадок твердого вещества не совсем белого цвета. Полученную смесь разбавляют аммиаком (25%, 10 мл в 90 мл воды) и затем полученное твердое вещество отфильтровывают и промывают водой. После этого твердое вещество промывают гексаном и высушивают под высоким вакуумом, получая при этом указанное в заголовке соединение (12,5 г, выход 81%) в виде не совсем белого твердого вещества. Масс-спектр: m/е=165,2 (М+Н+).
б) 7-(3-Фторбензилокси)-3Н-хиназолин-4-он
Натрий (1,8 г, 78,6 ммоль) добавляют частями к 3-фторбензиловому спирту и нагревают смесь при 80-90°С в течение 4 час в атмосфере аргона. Полученную суспензию охлаждают до комнатной температуры и затем добавляют 7-фтор-3Н-хиназолин-4-он (3,2 г, 19,5 ммоль), после чего смесь нагревают при 130-140°С в течение 14 час. Полученный твердый продукт разбавляют водой (400 мл) и затем смесь подкисляют до рН 3-4, используя HCl (4 н.). Полученный осадок затем отфильтровывают, промывают водой (100 мл) и диэтиловым эфиром (100 мл). После перекристаллизации из смеси тетрагидрофуран : этилацетат (в соотношении 1:1) получают указанное в заголовке соединение (3,2 г, выход 61%) в виде белых кристаллов. Масс-спектр: m/е=271,3 (М+Н+).
в) 2-[7-(3-Фторбензилокси)-4-оксо-4Н-хиназолин-3-ил]ацетамид
7-(3-Фторбензилокси)-3Н-хиназолин-4-он (200 мг, 0,74 ммоль) и гидрид натрия (55%, 36 мг, 0,81 ммоль) в N-метилпирролидоне (5 мл) нагревают при 60°С в течение 1 час. Затем добавляют бромацетамид (117 мг, 0,85 ммоль) и полученную смесь нагревают при 80°С в течение 1 час. После охлаждения до комнатной температуры добавляют воду (50 мл), после чего полученный осадок промывают метанолом и диэтиловым эфиром и затем высушивают под высоким вакуумом, получая при этом указанное в заголовке соединение (200 мг, выход 83%) в виде не совсем белого твердого вещества. Масс-спектр: m/е=328,3 (М+Н+).
Пример 2: 2-[7-(3-фторбензилокси)-4-оксо-4Н-хиназолин-3-ил]пропионамид
Как описано в примере 1в, 7-(3-фторбензилокси)-3Н-хиназолин-4-он (200 мг, 0,74 ммоль) превращают в указанное в заголовке соединение (190 мг, выход 75%) (используя 2-бромпропионамид вместо бромацетамида), которое получают в виде белого твердого вещества. Масс-спектр: m/е=342,3 (М+Н+).
Пример 3: 7-(3-фторбензилокси)-3-(2-метоксиэтил)-3Н-хиназолин-4-он
Как описано в примере 1в, 7-(3-фторбензилокси)-3Н-хиназолин-4-он (200 мг, 0,74 ммоль) превращают в указанное в заголовке соединение (165 мг, выход 68%) [используя простой (2-бромметил)метиловый эфир вместо бромацетамида], которое получают в виде белого твердого вещества после кристаллизации из смеси диэтиловый эфир : гептан. Масс-спектр: m/е=342,3 (М+Н+).
Пример 4: 3-(2-аминоэтил)-7-(3-фторбензилокси)-3Н-хиназолин-4-он, 1:2 гидрохлорид
а) трет-Бутиловый эфир {2-[7-(3-фторбензилокси)-4-оксо-4Н-хиназолин-3-ил]этил}карбаминовой кислоты
Как описано в примере 1в, 7-(3-фторбензилокси)-3Н-хиназолин-4-он (200 мг, 0,74 ммоль) превращают в указанное в заголовке соединение (175 мг, выход 57%) [используя 2-(Вос-амино)этилбромид вместо бромацетамида], которое получают в виде белого твердого вещества после кристаллизации из смеси диэтиловый эфир : гептан. Масс-спектр: m/е=342,3 (М+Н+).
б) 3-(2-Аминоэтил)-7-(3-фторбензилокси)-3Н-хиназолин-4-он, 1:2 гидрохлорид
Смесь трет-бутилового эфира {2-[7-(3-фторбензилокси)-4-оксо-4Н- хиназолин-3-ил]этил}карбаминовой кислоты (150 мг, 0,36 ммоль) и HCl в диоксане (4 н., 3 мл) перемешивают при комнатной температуре в течение 72 часов. Полученный осадок отфильтровывают и промывают диэтиловым эфиром, получая при этом указанное в заголовке соединение (120 мг, выход 86%) в виде белого твердого вещества. Масс-спектр: m/е=314,3 (М+Н+).
Пример 5: этиловый эфир [7-(3-фторбензилокси)-4-оксо-4Н-хиназолин-3-ил] уксусной кислоты
Как описано в примере 1в, 7-(3-фторбензилокси)-3Н-хиназолин-4-он (200 мг, 0,74 ммоль) превращают в указанное в заголовке соединение (170 мг, выход 65%) [используя этилбромацетат вместо бромацетамида], которое получают в виде белого твердого вещества. Масс-спектр: m/е=357,3 (М+Н+).
Пример 6: этиловый эфир фтор-[7-(3-фторбензилокси)-4-оксо-4Н-хиназолин-3-ил]уксусной кислоты
Как описано в примере 1в, 7-(3-фторбензилокси)-3Н-хиназолин-4-он (200 мг, 0,74 ммоль) превращают в указанное в заголовке соединение (100 мг, выход 36%) [используя этилбромфторацетат вместо бромацетамида], которое после очистки хроматографией (SiO2, смесь CH2Cl2: 2 н. NH3/МеОН в соотношении от 99:1 до 9:1) и перекристаллизации из смеси диэтиловый эфир : гептан получают в виде белого твердого вещества. Масс-спектр: m/е=375,4 (М+Н+).
Пример 7: этиловый эфир 2-[7-(3-фторбензилокси)-4-оксо-4Н-хиназолин-3-ил]пропионовой кислоты
Как описано в примере 1в, 7-(3-фторбензилокси)-3Н-хиназолин-4-он (200 мг, 0,74 ммоль) превращают в указанное в заголовке соединение (240 мг, выход 88%) [используя этил-2-бромпропионат вместо бромацетамида], которое после очистки хроматографией (SiO2, смесь СН2Cl2: 2 н. NH3/МеОН в соотношении от 99:1 до 9:1) получают в виде бесцветного маслянистого вещества. Масс-спектр: m/е=371,3 (М+Н+).
Пример 8: трет-бутиловый эфир [7-(3-фторбензилокси)-4-оксо-4Н-хиназолин-3-ил]уксусной кислоты
Как описано в примере 1в, 7-(3-фторбензилокси)-3Н-хиназолин-4-он (200 мг, 0,74 ммоль) превращают в указанное в заголовке соединение (277 мг, выход 97%) [используя трет-бутилбромацетат вместо бромацетамида], которое после очистки хроматографией (SiO2, смесь CH2Cl2: 2 н. NH3/МеОН в соотношении от 99:1 до 9:1) получают в виде белого твердого вещества. Масс-спектр: m/е=385,3 (М+Н+).
Пример 9: трет-бутиловый эфир 2-[7-(3-фторбензилокси)-4-оксо-4Н-хиназолин-3-ил]пропионовой кислоты
Как описано в примере 1в, 7-(3-фторбензилокси)-3Н-хиназолин-4-он (200 мг, 0,74 ммоль) превращают в указанное в заголовке соединение (245 мг, выход 83%) [используя трет-бутиловыи эфир 2-бромпропионовой кислоты вместо бромацетамида], которое получают в виде белого твердого вещества после очистки хроматографией (SiO2, смесь CH2Cl2: 2 н. NH3/МеОН в соотношении от 99:1 до 9:1). Масс-спектр: m/е=385,3 (М+Н+).
Пример 10: 3-(3-аминопропил)-7-(3-фторбензилокси)-3Н-хиназолин-4-он, гидрохлорид 1:2
а) трет-Бутиловыи эфир {3-[7-(3-фторбензилокси)-4-оксо-4Н-хиназолин-3-ил] пропил}карбаминовой кислоты
Как описано в примере 1в, 7-(3-фторбензилокси)-3Н-хиназолин-4-он (200 мг, 0,74 ммоль) превращают в указанное в заголовке соединение (312 мг, выход 99%) [используя 3-(Вос-амино)пропилбромид вместо бромацетамида], которое после очистки хроматографией (SiO2, смесь СН2Cl2: 2 н. NH3/МеОН в соотношении от 99:1 до 9:1) получают в виде белого твердого вещества. Масс-спектр: m/е=428,5 (М+Н+).
б) 3-(3-Аминопропил)-7-(3-фторбензилокси)-3Н-хиназолин-4-он, 1:2 гидрохлорид
Смесь трет-бутилового эфира {3-[7-(3-фторбензилокси)-4-оксо-4Н-хиназолин-3-ил]пропил}карбаминовой кислоты (275 мг, 0,64 ммоль) и HCl в диоксане (4 н., 8 мл) перемешивают при комнатной температуре в течение 16 час. Полученный осадок отфильтровывают и перекристаллизовывают из смеси EtOH : эфир, получая при этом указанное в заголовке соединение (120 мг, выход 47%) в виде белого твердого вещества. Масс-спектр: m/е=328,3 (М+Н+).
Пример 11: 3-(3-фторбензил)-7-(3-фторбензилокси)-3Н-хиназолин-4-он
Как описано в примере 1в, 7-(3-фторбензилокси)-3Н-хиназолин-4-он (200 мг, 0,74 ммоль) превращают в указанное в заголовке соединение (253 мг, 90%) [используя 3-фторбензилбромид вместо бромацетамида], которое после очистки хроматографией получают в виде белого твердого вещества (SiO2, смесь СН2Cl2: 2 н. NH3/МеОН в соотношении от 99:1 до 9:1). Масс-спектр: m/е=379,3 (М+Н+).
Пример 12: 2-[7-(4-фторбензилокси)-4-оксо-4Н-хиназолин-3-ил]ацетамид
а) 7-(4-Фторбензилокси)-3Н-хиназолин-4-он
Смесь гидрида натрия (55%, 3,2 г, 73 ммоль), 4-фторбензилового спирта и (9,2 г, 73 ммоль) и 7-фтор-3Н-хиназолин-4-она (3,0 г, 18 ммоль) в ДМФ (75 мл) нагревают при 140°С в течение 2 час. Полученную суспензию охлаждают до комнатной температуры и подкисляют смесь до рН 3, используя HCl (конц.). Полученный осадок затем отфильтровывают, промывают водой и диэтиловым эфиром. После частичной очистки хроматографией на силикагеле с элюированием смесью этилацетат : гексан (в соотношении 2:1) получают указанное в заголовке соединение (3,2 г, выход 66%) в виде не совсем белого твердого вещества. Масс-спектр: m/е=271,3 (М+Н+).
б) 2-[7-(4-Фторбензилокси)-4-оксо-4Н-хиназолин-3-ил]ацетамид
Как описано в примере 1в, 7-(4-фторбензилокси)-3Н-хиназолин-4-он (пример 12а, 200 мг, 0,74 ммоль) превращают в указанное в заголовке соединение (20 мг, выход 8%), которое получают в виде белого твердого вещества после очистки с использованием жидкостной хроматографии высокого разрешения (ЖХВР) ("Waters Xterra RP18" (5 мкм ×50×19 мм), элюирование смесью AcCN / 0,1% ТФУ / вода. Масс-спектр: m/е=328,3 (М+Н+).
Пример 13: 2-[7-(4-фторбензилокси)-4-оксо-4Н-хиназолин-3-ил]пропионамид
Как описано в примере 1в, 7-(4-фторбензилокси)-3Н-хиназолин-4-он (400 мг, 1,5 ммоль) превращают в указанное в заголовке соединение (37 мг, выход 7%) (используя 2-бромпропионамид вместо бромацетамида), которое получают в виде белого твердого вещества после очистки с использованием ЖХВР ("Waters Xterra RP18" (5 мкм × 50 × 19 мм), элюирование смесью AcCN / 0,1% ТФУ / вода. Масс-спектр: m/е=340,2 (М+Н+).
Пример 14: этиловый эфир [7-(4-фторбензилокси)-4-оксо-4Н-хиназолин-3-ил]уксусной кислоты
Как описано в примере 1в, 7-(4-фторбензилокси)-ЗН-хиназолин-4-он (400 мг, 1,5 ммоль) превращают в указанное в заголовке соединение (83 мг, 16%) (используя этилбромацетат вместо бромацетамида), которое получают в виде белого твердого вещества после очистки с использованием ЖХВР ("Waters Xterra RP18" (5 мкм ×50×19 мм), элюирование смесью AcCN / 0,1% ТФУ / вода. Масс-спектр: m/е=357,3 (М+Н+).
Пример 15: этиловый эфир 2-[7-(4-фторбензилокси)-4-оксо-4Н-хиназолин-3-ил]пропионовой кислоты
Как описано в примере 1в, 7-(4-фторбензилокси)-3Н-хиназолин-4-он (400 мг, 1,5 ммоль) превращают (используя этил-2-бромпропионат вместо бромацетамида) в указанное в заголовке соединение (32 мг, выход 6%), которое получают в виде белого твердого вещества после очистки с использованием ЖХВР ("Waters Xterra RP18" (5 мкм × 50 × 19 мм), элюирование с использованием смеси AcCN / 0,1% ТФУ / вода. Масс-спектр: m/е=371,3 (М+Н+).
Пример 16: 7-(4-фторбензилокси)-3-(2-метоксиэтил)-3Н-хиназолин-4-он
Как описано в примере 3, 7-(4-фторбензилокси)-3Н-хиназолин-4-он (400 мг, 1,5 ммоль) превращают в указанное в заголовке соединение (115 мг, выход 24%), которое получают в виде белого твердого вещества после очистки с использованием ЖХВР ("Waters Xterra RP18" (5 мкм ×50×19 мм), элюирование смесью AcCN / 0,1% ТФУ / вода. Масс-спектр: m/е=329,1 (М+Н+).
Пример 17: 3-(2-аминоэтил)-7-(4-фторбензилокси)-3Н-хиназолин-4-он, 1:1 гидрохлорид
а) трет-Бутиловый эфир {2-[7-(4-фторбензилокси)-4-оксо-4Н-хиназолин-3-ил]этил}карбаминовой кислоты
Как описано в примере 10а, 7-(4-фторбензилокси)-3Н-хиназолин-4-он (300 мг, 1,1 ммоль) превращают в указанное в заголовке соединение (105 мг, выход 23%), которое получают в виде белого твердого вещества после очистки с использованием ЖХВР ("Waters Xterra RP18" (5 мкм ×50×19 мм), элюирование смесью AcCN / 0,1% ТФУ/ вода. Масс-спектр: m/е=414,5 (М+Н+).
б) 3-(2-Аминоэтил)-7-(4-фторбензилокси)-3Н-хиназолин-4-он, 1:1 гидрохлорид
Как описано в примере 10б, трет-бутиловый эфир {2-[7-(4-фторбензилокси)-4-оксо-4Н-хиназолин-3-ил]этил}карбаминовой кислоты (102 мг, 0,25 ммоль) превращают в указанное в заголовке соединение (84 мг, выход 97%), которое получают в виде белого твердого вещества. Масс-спектр: m/е=314,2 (М+Н+).
Пример 18: 3-[7-(4-фторбензилокси)-4-оксо-4Н-хиназолин-3-ил]пропионамид
Как описано в примере 1в, 7-(4-фторбензилокси)-3Н-хиназолин-4-он (300 мг, 1,1 ммоль) превращают в указанное в заголовке соединение (72 мг, выход 19%) (используя 3-бромпропионамид вместо бромацетамида), которое получают в виде белого твердого вещества после очистки с использованием ЖХВР ("Waters Xterra RP18" (5 мкм ×50×19 мм), элюирование смесью AcCN / 0,1%ТФУ / вода. Масс-спектр: m/е=342,1 (М+Н+).
Пример 19: 2-[7-(3-фторбензилокси)-2-метил-4-оксо-4Н-хиназолин-3-ил]ацетамид
а) 4-Фтор-2-нитробензойная кислота
Смесь 4-фтор-2-нитробензонитрила (12,2 г, 73,7 ммоль), суспендированного в HBr (48%, 74,5 мл, 664 ммоль) нагревают при 130°С в течение 6,5 час. После охлаждения до комнатной температуры добавляют воду (1 л) и полученный осадок промывают водой и гексаном, получая при этом указанное в заголовке соединение (11,0 г, выход 81%) в виде светло-коричневого твердого вещества. Масс-спектр: m/е=183,9 (М-Н).
б) Метиловый эфир 4-фтор-2-нитробензойной кислоты
Смесь 4-фтор-2-нитробензойной кислоты (10,9 г, 58,8 ммоль) в метаноле (120 мл), содержащую серную кислоту (1,8 г, 18,7 ммоль), кипятят с обратным холодильником в течение 41 час. После охлаждения до комнатной температуры полученную смесь выливают в раствор гидрокарбоната натрия (насыщенный, 250 мл) и экстрагируют этилацетатом (3×100 мл). Объединенные экстракты промывают насыщенным раствором соли (100 мл), высушивают и упаривают, получая при этом указанное в заголовке соединение (10,7 г, выход 91%) в виде светло-коричневого жидкого вещества. Масс-спектр: m/е=199,0 (М-Н).
в) 3-Фторбензиловый эфир 4-(3-фторбензилокси)-2-нитробензойной кислоты и метиловый эфир 4-(3-фторбензилокси)-2-нитробензойной кислоты
Смесь метилового эфира 4-фтор-2-нитробензойной кислоты (9,2 г, 46,3 моль), 3-фторбензилового спирта (16,7 г, 132,4 ммоль) и карбоната калия (12,8 г, 92,6 ммоль) в ДМФ (210 мл) нагревают при 65°С в течение 48 час. После охлаждения до комнатной температуры полученную смесь выливают в воду (400 мл) и экстрагируют диэтиловым эфиром (3×100 мл). Объединенные экстракты промывают насыщенным раствором соли (100 мл), высушивают и упаривают. После очистки хроматографией на силикагеле с элюированием смесью этилацетат : гексан (в соотношении 1:1) получают указанное в заголовке соединение (14,0 г, выход 76%) в виде светло-желтой жидкости.
г) 4-(3-Фторбензилокси)-2-нитробензойная кислота
Смесь 3-фторбензилового эфира 4-(3-фторбензилокси)-2-нитробензойной кислоты и метилового эфира 4-(3-фторбензилокси)-2-нитробензойной кислоты (14,0 г, 35,0 ммоль) в ТГФ (120 мл) и воде (120 мл), содержащей моногидрат гидроксида лития (2,94 г, 70,1 ммоль), перемешивают при комнатной температуре в течение 48 час. Затем полученную смесь выливают в гидроксид натрия (2 н., 50 мл), после чего смесь экстрагируют диэтиловым эфиром (3×150 мл). Водную фазу затем доводят до рН 2, используя HCl. Затем полученную смесь выливают в гидроксид натрия (2 н., 50 мл) и водную фазу доводят до рН 5,2, используя HCl, после чего смесь экстрагируют диэтиловым эфиром (3×100 мл). Объединенные экстракты затем промывают насыщенным раствором соли (100 мл), высушивают и упаривают, получая при этом указанное в заголовке соединение (6,6 г, выход 65%) в виде светло-желтого твердого вещества. Масс-спектр: m/е=290,0 (М-Н).
д) 2-Амино-4-(3-фторбензилокси)бензойная кислота
Смесь 4-(3-фторбензилокси)-2-нитробензойной кислоты (7,2 г, 24,8 ммоль) в этилацетате (150 мл) в присутствии Pt/C (5%, 1,0 г) гидрируют при комнатной температуре и давлении в течение 3,5 час. Смесь затем фильтруют и упаривают фильтрат. Полученное светло-коричневое твердое вещество растирают с дихлорметаном (ДХМ), получая при этом указанное в заголовке соединение (5,2 г, выход 80%) в виде не совсем белого твердого вещества. Масс-спектр: m/е=260,1 (М-Н).
В качестве альтернативы смесь 4-(3-фторбензилокси)-2-нитробензойной кислоты (6,6 г, 22,8 ммоль) в этилацетате (140 мл) в присутствии Pd/C (5%, 1,0 г) гидрируют при комнатной температуре и давлении в течение 3,5 час. Затем смесь фильтруют и упаривают фильтрат. Полученное светло-коричневое твердое вещество растирают с ДХМ, получая при этом указанное в заголовке соединение (5,1 г, выход 87%) в виде не совсем белого твердого вещества.
е) 7-(3-Фторбензилокси)-2-метил-ЗН-хиназолин-4-он
К смеси 2-амино-4-(3-фторбензилокси)бензойной кислоты (2,0 г, 7,7 ммоль) и этилацетамидата HCl (1,9 г, 15,3 ммоль) в метаноле (30 мл) добавляют метоксид натрия (5,4 М, 0,83 г, 15,3 ммоль) и полученную смесь кипятят с обратным холодильником в течение 19 час. По истечении этого времени добавляют этилацетамидат HCl (1,9 г, 15,3 ммоль) и метоксид натрия (5,4 М, 0,83 г, 15,3 ммоль) и полученную смесь нагревают дополнительно в течение 1 час. После охлаждения до комнатной температуры смесь выливают в воду (40 мл) и затем полученный осадок перемешивают в течение 2 час, после чего отфильтровывают, получая при этом указанное в заголовке соединение (2,1 г, выход 97%) в виде не совсем белого твердого вещества. Масс-спектр: m/е=283,1 (М-Н).
ж) 2-[7-(3-Фторбензилокси)-2-метил-4-оксо-4Н-хиназолин-3-ил]ацетамид
Как описано в примере 1в, 7-(3-фторбензилокси)-2-метил-3Н-хиназолин-4-он (250 мг, 0,88 ммоль) превращают в указанное в заголовке соединение (218 мг, выход 73%), которое получают в виде белого твердого вещества после растирания с дихлорметаном (ДХМ). Масс-спектр: m/е=342,1 (М+Н+).
Пример 20: 7-(3-фторбензилокси)-3-(2-метоксиэтил)-2-метил-3Н-хиназолин-4-он
Как описано в примере 3, 7-(3-фторбензилокси)-2-метил-3Н-хиназолин-4-он (250 мг, 0,88 ммоль) превращают в указанное в заголовке соединение (150 мг, выход 45%), которое после очистки хроматографией (SiO2, смесь EtOAc : гептан в соотношении от 1:3 до 2:1) получают в виде белого твердого вещества. Масс-спектр: m/е=343,1 (М+Н+).
Пример 21: 2-[7-(3-фторбензилокси)-2-метил-4-оксо-4Н-хиназолин-3-ил]этиламмонийхлорид
а) трет-Бутиловый эфир {2-[7-(3-фторбензилокси)-2-метил-4-оксо-4Н-хиназолин-3-ил]этил}карбаминовой кислоты
Как описано в примере 4а, 7-(3-фторбензилокси)-2-метил-ЗН-хиназолин-4-он (250 мг, 0,88 ммоль) превращают в указанное в заголовке соединение (72 мг, выход 18%), которое получают в виде белого твердого вещества после очистки хроматографией (SiO2, смесь EtOAc : гептан в соотношении от 1:4 до 2:1). Масс-спектр: m/е=428,3 (М+Н+).
б) 2-[7-(3-Фторбензилокси)-2-метил-4-оксо-4Н-хиназолин-3-ил]этиламмонийхлорид
Как описано в примере 4б, трет-бутиловый эфир {2-[7-(3-фторбензилокси)-2-метил-4-оксо-4Н-хиназолин-3-ил]этил}карбаминовой кислоты (50 мг, 0,12 ммоль) превращают в указанное в заголовке соединение (45 мг, выход 85%), которое после очистки хроматографией (SiO2, смесь EtOAc : гептан в соотношении от 1:4 до 2:1) получают в виде белого твердого вещества. Масс-спектр: m/е=328,2 (М+Н+).
Пример 22: 2-[7-(3-фторбензилокси)-2-изопропил-4-оксо-4Н-хиназолин-3-ил]ацетамид
а) 7-(3-Фторбензилокси)-2-изопропил-3Н-хиназолин-4-он
Как описано в примере 19е, 2-амино-4-(3-фторбензилокси)бензойную кислоту (1 г, 3,8 ммоль) превращают [используя этилизопропиламидат HCl вместо этилацетамидата HCl] в указанное в заголовке соединение (196 мг, выход 16%), которое получают в виде белого твердого вещества после очистки хроматографией (SiO2, смесь дихлорметан: МеОН в соотношении от 95:5 до 85:15). Масс-спектр: m/е=330,1 (M+NH4+).
б) 2-[7-(3-Фторбензилокси)-2-изопропил-4-оксо-4Н-хиназолин-3-ил]ацетамид
Как описано в примере 1в, 7-(3-фторбензилокси)-2-изопропил-3Н-хиназолин-4-он (80 мг, 0,26 ммоль) превращают в указанное в заголовке соединение (84 мг, выход 89%), которое получают в виде белого твердого вещества после растирания с дихлорметаном. Масс-спектр: m/е=370,2 (М+Н+).
Пример 23: [7-(3-фторбензилокси)-2-изопропил-4-оксо-4Н-хиназолин-3-ил]ацетонитрил
К смеси 2-[7-(3-фторбензилокси)-2-изопропил-4-оксо-4Н-хиназолин-3-ил]ацетамида (50 мг, 0,14 ммоль) в диметилформамиде (0,5 мл), дихлорметане (2 мл) добавляют N-этил-N,N-диизопропиламин (26,2 мг, 0,2 ммоль) и полученную смесь охлаждают до -78°С. Затем добавляют ангидрид трифторсульфоновой кислоты (49,6 мг, 0,18 ммоль) и реакционной смеси дают нагреться до комнатной температуры в течение 30 мин. После этого полученную смесь выливают в раствор гидрокарбоната натрия (насыщенный, 5 мл) и экстрагируют смесь диэтиловым эфиром (3×5 мл). Объединенные экстракты затем промывают насыщенным раствором соли, высушивают и упаривают, получая при этом светло-желтое твердое вещество. После очистки хроматографией (SiO2, смесь EtOAc : гептан в соотношении от 1:1 до 85:15) получают указанное в заголовке соединение (26 мг, выход 55%) в виде белого твердого вещества. Масс-спектр: m/е=352,2 (М+Н+).
Пример 24: 2-[2-циклопропил-7-(3-фторбензилокси)-4-оксо-4Н-хиназолин-3-ил]ацетамид
а) 2-Циклопропил-7-(3-фторбензилокси)-ЗН-хиназолин-4-он
Как описано в примере 19е, 2-амино-4-(3-фторбензилокси)бензойную кислоту (1,0 г, 3,8 ммоль) превращают [используя этилциклопропиламидат HCl вместо этилацетамидата HCl] в указанное в заголовке соединение (607 мг, выход 49%), которое получают после растирания с диэтиловым эфиром в виде белого твердого вещества. Масс-спектр: m/е=311,2 (М+Н+).
б) 2-[2-Циклопропил-7-(3-фторбензилокси)-4-оксо-4Н-хиназолин-3-ил]ацетамид
Как описано в примере 1в, 2-циклопропил-7-(3-фторбензилокси)-3Н-хиназолин-4-он (80 мг, 0,26 ммоль) превращают в указанное в заголовке соединение (98 мг, выход 65%), которое получают в виде белого твердого вещества после очистки хроматографией (SiO2, смесь дихлорметан : МеОН в соотношении от 98:2 до 9:1). Масс-спектр: m/е=368,1 (М+Н+).
Пример 25: 2-циклопропил-7-(3-фторбензилокси)-3-(2-метоксиэтил)-3Н-хиназолин-4-он
Как описано в примере 3, 2-циклопропил-7-(3-фторбензилокси)-3Н-хиназолин-4-он (150 мг, 0,48 ммоль) превращают в указанное в заголовке соединение (15 мг, выход 8%), которое после очистки хроматографией (SiO2, смесь дихлорметан : МеОН в соотношении 95:5) получают в виде белого твердого вещества. Масс-спектр: m/е=369,2 (М+Н+).
Пример 26: метиловый эфир [2-циклопропил-7-(3-фторбензилокси)-4-оксо-4Н-хиназолин-3-ил] уксусной кислоты
Как описано в примере 1в, 2-циклопропил-7-(3-фторбензилокси)-3Н-хиназолин-4-он (100 мг, 0,3 ммоль) превращают [используя метилбромацетат вместо бромацетамида] в указанное в заголовке соединение (33 мг, выход 27%), которое получают в виде белого твердого вещества после очистки хроматографией (SiO2, смесь EtOAc : гептан в соотношении от 1:9 до 1:1). Масс-спектр: m/е=383,3 (М+Н+).
Пример 27: 2-[2-бензил-7-(3-фторбензилокси)-4-оксо-4Н-хиназолин-3-ил]ацетамид
а) 2-Бензил-7-(3-фторбензилокси)-3Н-хиназолин-4-он
Как описано в примере 19е, 2-амино-4-(3-фторбензилокси)бензойную кислоту (1,0 г, 3,8 ммоль) превращают [используя этилбензиламидат HCl вместо этилацетамидата HCl] в указанное в заголовке соединение (731 мг, выход 53%), которое получают в виде белого твердого вещества после растирания с диэтиловым эфиром. Масс-спектр: m/е=361,2 (М+Н+).
б) 2-[2-Бензил-7-(3-фторбензилокси)-4-оксо-4Н-хиназолин-3-ил]ацетамид
Как описано в примере 1в, 2-бензил-7-(3-фторбензилокси)-3Н-хиназолин-4-он (150 мг, 0,42 ммоль) превращают в указанное в заголовке соединение (94 мг, выход 54%), которое получают в виде белого твердого вещества после очистки хроматографией (SiO2, смесь дихлорметан : МеОН в соотношении от 99:1 до 9:1). Масс-спектр: m/е=418,2 (М+Н+).
Пример А: таблетки
Таблетки указанного ниже состава получают по общепринятой методике:
Пример Б: таблетки
Таблетки указанного ниже состава получают по общепринятой методике:
Пример В: капсулы
Получают капсулы следующего состава:
Активный ингредиент с подходящим размером частиц, кристаллическую лактозу и микрокристаллическую целлюлозу гомогенно смешивают друг с другом, просеивают и после этого добавляют при смешении тальк и стеарат магния. Полученную в итоге смесь помещают в желатиновые капсулы подходящего размера.
Пример Г: раствор для инъекций
Раствор для инъекций может иметь следующий состав, его приготавливают обычным образом:
Реферат
Изобретение относится к новым производным 3Н-хиназолин-4-она формулы I и к их фармацевтически приемлемым солям, обладающим свойствами специфического ингибитора моноаминооксидазы В (МАО В). Соединения могут найти применение для лечения и профилактики болезни Альцгеймера и старческого слабоумия (деменции). В соединении формулы I
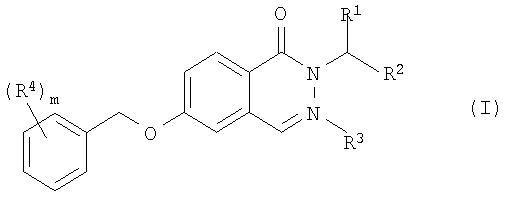
R1 представляет собой -(CH2)n-CO-NR5R6; -(CH2)n-COOR7; -(CH2)n- NR5R6; -(CH2)n-CN; -(CH2)n-OR8 или фенил, который является незамещенным или замещенным заместителями в количестве от одного до трех, выбранными из галогена; R2 представляет собой водород; R3 представляет собой водород, (С1-С6)-алкил, (С3-С6)-циклоалкил или бензил; R4представляет собой галоген; R5 и R6 представляют собой водород; R7 представляет собой водород или С1-С6-алкил; R8 представляет собой С1-С6-алкил; m означает 1, 2 или 3 и n означает 0, 1 или 2. Изобретение также относится к лекарственному средству на основе новых соединений. 2 н. и 3 з.п. ф-лы.
Формула
Документы, цитированные в отчёте о поиске
Трехзамещенные фенильные производные и фармацевтическая композиция

Комментарии