Способ ингибирования опухолевых клеток новыми производными 3-трифторметилхиноксалин 1,4-диоксида - RU2746395C1
Код документа: RU2746395C1
Описание
Область техники
Изобретение относится к фармацевтической промышленности, а именно к медицинскому применению производных 3-трифторметилхиноксалин 1,4-диоксида для ингибирования роста опухолевых клеток, а также их структуре и методам получения.
Уровень техники
Хиноксалин 1,4-диоксиды имеют высокий потенциал практического применения в медицине. Соединения этого ряда имеют широкий спектр фармакологической активности, в частности, они обладают антибактериальной [Vieira Μ. et al. Microbiol Res., 2014, 169, 287-293], противотуберкулезной [Jaso A. et al. J. Med. Chem., 2005, 48, 2019-2025], противоопухолевой [Das U. et al. Bioorg.Med. Chem., 2009,17, 3909-3915], противогрибковой [Carta A. et al. Eur. J. Med. Chem., 2002, 37, 355-66], противопаразитарной [Marin A. et al. Exp.Parasitol, 2008, 118, 25-31], антиоксидантной [Burguete A. et al. Chem. Biol. Drug Des., 2011, 77, 255-267] активностями. Более того, производные хиноксалин 1,4-диоксида способны селективно подавлять рост опухолевых клеток, находящихся в условиях гипоксии [Cheng G. et al. Front. Pharmacol, 2016, 7, 1-21].
В работах последних лет установлено, что гипоксические условия способствуют формированию агрессивного фенотипа опухолевых клеток, развитию в них множественной лекарственной устойчивости, что ассоциировано с плохим прогнозом выживаемости пациентов. Клеточный ответ на гипоксию, главным образом, опосредован индукцией транскрипционного фактора HIF-1α (гипоксия-индуцируемый фактор-1α), который регулирует экспрессию различных генов, ответственных за адаптацию и прогрессию опухолевых клеток [Bertou J.A. et al. Proc. Natl. Acad. Sci, 2009, 106, 14391-14396; Martin, B. et al. Nat. Rev. Cancer, 2004, 4, 437-447]. Существует несколько классов органических соединений, активных в отношении гипоксических опухолевых клеток, в том числе и производные хиноксалин 1,4-диоксида [Wigerup С.et al. Pharmacology & Therapeutics, 2016, 164, 152-169; Wilson, W.R. et al. Nat. Rev. Cancer, 2011, 11, 393-410]. Например, цитотоксические производные хиноксалин-2-карбонитрил 1,4-диоксида (например, производное формулы 1) [Scherbakov А. М. et al. Cancer Invest., 2018, 3, 199-209; Hu Y. et al. Molecules, 2012, 17, 9683-9696], а также 3-аминохиноксалин 1,4-диоксида (например, соединения 2 и 3) [Monge A. et al. J. Med. Chem., 1995, 38, 1786; GB 2297089, 1996; Ortega M. et al. Eur. J. Med. Chem., 2000, 35, 21-30; Ismail M.M.F. et al. Eur. J. Med. Chem., 2010, 45, 2733.] превосходят по цитотоксичности и гипоксической селективности, препарат сравнения тирапазамин.

Кроме того, описаны водорастворимые хиноксалин-2-карбонитрил 1,4-диоксиды, содержащие остатки циклических диаминов (например, соединение 4), способные блокировать рост опухолевых клеток, находящихся в условиях гипоксии [RU 2640304]. Также известно, что хиноксалин-2-карбонитрил 1,4-диоксиды обладают высокой антипролиферативной активностью в отношении опухолевых клеток с множественной лекарственной устойчивостью [РСТ Int. Appl. WO 2015167350, RU 2640304]. Известно, что некоторые 2-ацил- и 3-трифторметильные производные способны подавлять деление опухолевых клеток (например, производные формул 5 и 6), однако практическое применение затруднено низкой растворимостью этих соединений в водных средах [Zarranz В. et al. Bioorg. Med. Chem., 2004, 12, 3711-3721; Solano B. et al. J. Med. Chem., 2007, 50, 5485-5492; Das U. et al. Bioorg. Med. Chem., 2009, 17, 3909-3915].

Целью настоящего изобретения ставилось получение новых производных 2-ацил-3-трифторметилхиноксалин 1,4-диоксидов, обладающих растворимостью в водных средах, способных индуцировать гибель опухолевых клеток и обладающих селективностью в условиях гипоксии.
Раскрытие изобретения
Настоящее изобретение призвано получить более активные противоопухолевые производные 3-трифторметилхиноксалин 1,4-диоксида, содержащие фрагменты циклических диаминов, повышающих растворимость соединений в водных средах, обладающие высокой активностью в отношении опухолевых клеток.
Настоящее изобретение включает производные 3-трифторметилхиноксалин 1,4-диоксида, соответствующие формуле 7, содержащее в положении 2 ацильный или алкоксикарбонильный радикал и остаток циклического диамина, связанный одним из атомов азота с бензольным фрагментом хиноксалинового цикла, их водорастворимые соли и сольваты или гидраты на их основе, пригодные для использования в медицине в качестве терапевтически активных веществ для лечения заболеваний, связанных с неконтролируемым делением клеток, прежде всего, различных солидных опухолей.

где X - независимо означает C1-6алкил, С1-6алкокси, арильный или гетероарильный фрагмент, с одним гетероатомом, выбранным из N, О и S, содержащие в своем составе 1, 2, 5 или 6 атомов, необязательно замещенные одним или несколькими заместителями, выбранным из C1-6алкила, С1-6алкокси, С1-6алкилтио или галогена;
Υ - независимо означает необязательно замещенный остаток диамина, непосредственно связанный одним из атомов азота с бензольным фрагментом хиноксалинового цикла. Примеры диаминов, пригодных для формирования структуры 7, включают без ограничения перечисленным циклические диамины (например, пиперазин, 1,4-диазепин), аминопроизводные циклических аминов (например, 3-аминопирролидин, 3-аминопиперидин, 4-аминопиперидин), необязательно замещенные по атомам азота или углерода одним или несколькими заместителями, выбранным из алкила, гидроксиалкила;
Ζ - независимо означает атом водорода или галогена.
Настоящее изобретение относится также к применению таких соединений в качестве терапевтически активных для лечения заболеваний человека связанных с повышенной скоростью роста клеток (т.е. гиперпролиферацией), прежде всего онкологических заболеваний различного генеза, включая без ограничения перечисленным, карциномы, саркомы, лейкемиии т.п.
Соединения по настоящему изобретению могут быть получены различными способами. Описанные ниже схемы лишь иллюстрируют возможность синтеза заявленных структур. Исходные материалы и реагенты, которые используются при получении соединений формулы 7, являются коммерческими химическими соединениями, поставляемыми фирмами, такими, как «Merck», «Acros», «Aldrich» или их можно получить методами, известными специалисту в данной области или описанными в литературе.
Если не указано иное, реакции, приведенные в описании заявки, предпочтительно проводят при атмосферном давлении от приблизительно -78°С до 180°С, более предпочтительно от 0°С до 120°С в инертном растворителе или без него.
Одним из способов получения, заявленных в изобретении 2-ацил-3-трифторметилхиноксалин-1,4-диоксидов, соответствующих формуле 7, является метод, основанный на замещении уходящих групп (LG) в положениях 6 или 7 3-трифторметилхиноксалин-1,4-диоксида на остатки диаминов (Y) (схема А). При необходимости для достижения более полной конверсии исходных и/или более высокого выхода целевых продуктов при проведении реакции могут быть использованы дополнительные органические или неорганические основания (В), а для обеспечения селективности замещения, функциональные группы, содержащиеся в остатке диамина (Y/Z) могут быть блокированы с помощью защитных групп с их последующим удалением.

Исходные 3-трифторметилхиноксалин 1,4-диоксиды 8 могут быть получены различными методами, например, по методикам, описанным в литературе [Solano В. et al. J. Med. Chem., 2007, 50, 5485-5492; Zarranz B. et al. Bioorg. Med. Chem., 2004, 12, 3711-3721; Perez-Silanes S. et al. Bioorg. Med. Chem. Lett., 2016, 26, 903-906; Benitez D. et al. J. Med. Chem., 2011, 54, 3624-3636; Vicente E. et al. Molecules, 2008, 13, 69-77; Torres E. et al. Eur. J. Med. Chem., 2013, 66, 324-334].
Другой возможный способ получения заявляемых соединений формулы 7, основан на реакции Бейрута бензофуроксанов 9, содержащих остаток диамина Υ и трифторметилзамещенными 1,3-дикарбонильными соединениями в присутствии оснований В (схема Б). При необходимости для обеспечения селективности замещения, функциональные группы, содержащиеся в остатке диамина (Υ) также могут быть блокированы с помощью защитных групп с их последующим удалением.

Исходные бензофуроксаны 9 и трифторпроизводные 1,3-дикарбонильных соединений могут быть получены различными методами, описанным в литературе [Пат. РФ №2640304; Kotovskaya S.K. J. Fluorine Chem., 2004,125, 421-428; Wang N.Y. et al. Bioorg. & Med. Chem. Let., 2014, 24, 1581-1588; Stevenson R. et al. Bioorg. Med. Chem., 2018, 26, 3406-3413; Zhou Y. et al. Tetrahedron, 2014, 70,4668-4674].
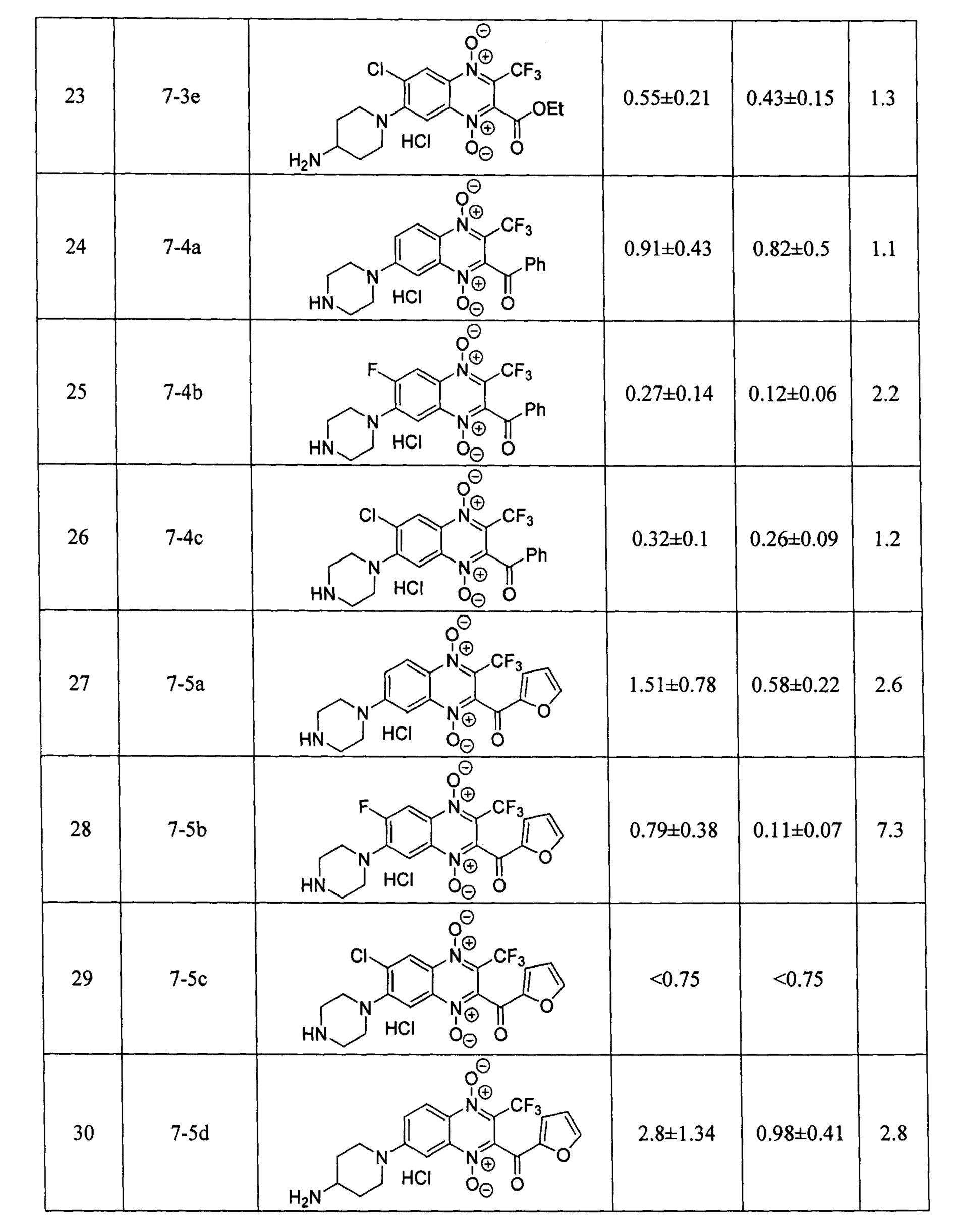
В настоящем изобретении авторами показано, что соединения формулы 7 в субмикромолярных и микромолярных концентрациях ингибируют пролиферацию всех типов исследованных опухолевых клеток, находящихся в условиях нормоксии. Кроме того, большинство из описанных производных формулы 7 обладают большой антипролиферативной активностью в отношении опухолевых клеток, находящихся в условиях гипоксии.
Если не указано иное, термины, используемые в описании заявки и пунктах формулы изобретения, имеют значения, указанные ниже. Следует отметить, что, если не указано иное, используемые в описании и пунктах формулы формы единственного числа включают также формы множественного числа.
"Алкил" означает, если не указано иное, одновалентный насыщенный углеводородный радикал с прямой или разветвленной цепью или циклический радикал, включающий только атомы углерода и водорода и содержащий от 1 до включительно 6 атомов углерода. Примеры алкильных радикалов включают, без ограничения перечисленным, метил, этил, пропил, изопропил, изобутил, втор-бутил, трет-бутил, пентил, н-гексил и т.п.
"Алкокси" означает радикал -OR, где R означает указанный выше алкильный радикал. Примеры алкокси-радикалов включают, без ограничения перечисленным, метокси, этокси, изопропокси, изобутокси и т.п.
"Амино" означает группы -NH2, -NHR1, -NR1R2, где R1 и R2 каждый независимо означает алкильные радикалы, указанные выше. Примеры аминорадикалов включают, без ограничения перечисленным, амино, метиламино, этиламино, диметиламино, метилэтиламино, диэтиламино и т.п.
"Арил" означает, если не указано иное, одновалентный циклический ароматический углеводородный радикал, содержащий один или более конденсированных циклов, из которых по меньшей мере один цикл является ароматическим, который необязательно замещен одним или несколькими заместителями, выбранным из группы, включающей алкил, алкилтио, алкокси, галоген. Примеры арильных радикалов включают, без ограничения перечисленным, фенил, бифенил, нафтил, инданил, антрахинонил и т.п.
"Галоген" означает радикал фтора, хлора, брома, иода.
Тетероарил" означает, если не указано иное, одновалентный ароматический карбоциклический радикал, содержащий один или более циклов, включающих в цикле один, два или три гетероатома (выбранных из N, О или S), и необязательно замещенный заместителем, выбранным из группы, включающей алкил, алкокси, алкилтио, галоген. Примеры гетероарильных радикалов включают, без ограничения перечисленным, пирролил, фурил, тиофенил, пиридинил и т.п.
"Гидроксиалкил" означает алкильный радикал, указанный выше, замещенный одной или более, предпочтительно одной, двумя или тремя гидроксигруппами при условии, что к одному углеродному атому присоединено не более одной гидроксигруппы. Примеры гидроксиалкильных радикалов включают, без ограничения перечисленным, гидроксиметил, 2-гидроксиэтил, 2-гидроксипропил, 3-гидроксипропил, 2,3-дигидроксипропил и т.п.
Термином "защитная группа" обозначается группа, подходящая для блокирования функциональной группы в условиях проведения реакции, как описано в литературе [Wuts P.G.M. Greene’s Protective Groups in Organic Synthesis. J. Wiley & Sons, N.-J., 2014, 1360]. Пример таких групп для блокирования аминогруппы включают, без ограничения перечисленным mpem-бутоксикарбонил (Boc), адамантилоксикарбонильную (Adoc), флуоренилметилоксикарбонильную (Fmoc).
Термин "изомеры" означает соединения с одинаковой молекулярной формулой, но отличающиеся природой или последовательностью химических связей или пространственным расположением атомов. Изомеры, которые различаются пространственным расположением атомов, называются "стереоизомерами". Атом углерода, связанный с четырьмя разными заместителями, называется "хиральным центром".
"Инертный органический растворитель" означает растворитель, инертный в условиях описываемой в тексте реакции, включающий, например, бензол, толуол, ацетонитрил, тетрагидрофуран, N,N-диметилформамид, N,N-диметилацетамид, N-метилпирролидон, диметилсульфоксид, сульфолан, хлороформ, дихлорметан, дихлорэтан, этилацетат, ацетон, метилэтилкетон, метанол, этанол, пропадал, изопропанол, трет-бутанол, диоксан, пиридин и т.п. Если не указано иное, растворители, использованные в реакциях по настоящему изобретению, являются инертными растворителями.
"Необязательный" или "необязательно" означает, что последующее событие или обстоятельство может произойти, но необязательно произойдет, и, что описание включает случаи, когда это событие или обстоятельство произойдет, и случаи, когда оно не произойдет. Например, термин "необязательно замещенный" при использовании в связи с термином "арил", "фенил" или "гетероарил" означает арил, фенил или гетероарил, который необязательно и независимо содержит от одного до четырех заместителей, предпочтительно один или два заместителя, выбранных из группы, включающей алкил, алкилтио, алкокси, галоген и т.п.
"Сольваты" означает сольватированные формы, содержащие стехиометрическое или нестехиометрическое количество растворителя. Некоторые соединения способны удерживать в кристаллической решетке фиксированное количество молекул растворителя, образуя сольват.Гидраты образуются в том случае, если в качестве растворителя используется вода, а алкоголяты образуются в том случае, если растворителем является спирт.
"Таутомеры" означает соединения, структуры которых отличаются пространственным расположением атомов, но находятся в равновесном состоянии. Соединения формулы 7 могут содержать группы, которые могут находиться в таутомерном равновесии. Подразумевается, что, если соединения формулы 7 могут существовать в таутомерных формах, то настоящее изобретение включает все таутомерные формы, а названия соединений не исключают любую таутомерную форму.
"Уходящая группа" означает группу, название которой обычно ассоциируется с ее использованием в синтетической органической химии, т.е. означает атом или группу, которая замещается в условиях реакции. Примеры уходящей группы включают, без ограничения перечисленным, галоген, алкан- или аренсульфонилокси, (такие, как метансульфонилокси, этансульфонилокси, бензолсульфонилокси, тозилокси и тиенилокси), алкокси, алкилтио, гидрокси и т.п.
"Фармакологическое действие" означает термин, используемый в описании заявки, включает результаты воздействия на субъект, при которых достигается предполагаемая цель терапии. Например, фармакологическое действие означает такие результаты воздействия, которые приводят к излечению или замедлению развития, предупреждению рецидива заболевания.
"Фармацевтически приемлемый" означает используемое как в ветеринарии, так и в фармацевтике вещество или материал, которые обычно являются нетоксичными, безопасными в биологическом или ином отношении.
"Фармацевтически приемлемые соли" соединения означают соли, которые являются фармацевтически приемлемыми и обладают необходимой фармакологической активностью исходного соединения. Такие соли включают кислотно-аддитивные соли неорганических кислот, таких, как хлористоводородная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота и т.п., или органических кислот, таких, как уксусная кислота, бензойная кислота, лимонная кислота, фумаровая кислота, глутаминовая кислота, гликолевая кислота, молочная кислота, малеиновая кислота, яблочная кислота, метансульфоновая кислота, пропионовая кислота, салициловая кислота, янтарная кислота, винная кислота, толуолсульфоновая кислота и т.п. Подразумевается, что фармацевтически приемлемые соли включают сольваты или кристаллические формы (полиморфные образования) указанной кислотно-аддитивной соли. Предпочтительными фармацевтически приемлемыми солями являются соли соляной кислоты, серной кислоты, фосфорной кислоты, метансульфоновой кислоты, уксусной кислоты, малеиновой кислоты, винной кислоты, лимонной кислоты, соли натрия, калия, кальция, цинка и магния.
"Хиральное соединение" означает соединение с одним или более хиральными центрами. Это соединение имеет две энантиомерные формы с противоположной хиральностью и может существовать как в виде отдельных энантиомеров, так и в виде смеси энантиомеров. Смесь, содержащая равные количества отдельных энантиомеров, называется "рацемической смесью". Соединения, содержащие более одного хирального центра, могут существовать в виде индивидуального диастереомера или в виде смеси диастереомеров, которая называется "диастереомерной смесью". При наличии хирального центра, стереизомеры можно охарактеризовать абсолютной конфигурацией (R или S) этого хирального центра. Абсолютная конфигурация означает пространственное расположение заместителей у хирального центра. Указанные заместители, связанные с хиральным центром, классифицируются по правилу Кана, Ингольда и Прелога [Cahn et al., Angew. Chem., 1966, 78, 413].
"Циклический амин" означает циклическое, преимущественно насыщенное, соединение, в котором в образовании циклической системы участвует один атома азота. Примеры циклических аминов включают, без ограничения перечисленным, пирролидин, пиперидин, азепин и т.п.
"Циклический диамин" означает циклическое, преимущественно насыщенное, соединение, в котором в образовании циклической системы участвуют два атома азота. Примеры циклических диаминов включают, без ограничения перечисленным, пиперазин, 1,4-диазепан и т.п.
Типичные соединения по изобретению, способы их синтеза и биологическая активность приводятся в ряде примеров, описанных ниже.
Примеры, показывающие возможность получения новых производных хиноксалин 1,4-диоксида, являющихся предметом настоящего изобретения, а также их физико-химические свойства и способность ингибировать опухолевый рост, описанные ниже, приводятся лишь для иллюстрации настоящего изобретения, а не для ограничения объема притязаний.
Пример 1
2-Ацетил-7-(пиперазин-1-ил)-3-трифторметилхиноксалин 1,4-диоксида гидрохлорид
(7-1а)
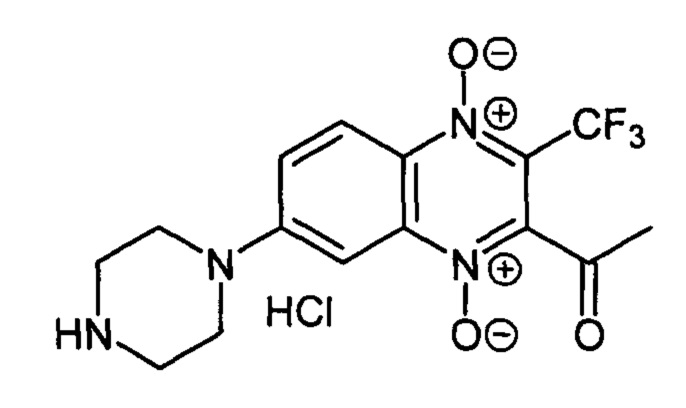
К раствору 140 мг (0.48 ммоль) 3-ацетил-7-фтор-3-трифторметилхиноксалин 1,4-диоксида (8, X=СН3, LG=F, Ζ=Η, схема А), полученного по методу [Zarranz В. et al. Bioorg. Med. Chem., 2004, 12, 3711-3721], в тетрагидрофуране (10 мл) прибавляют пиперазин (210 мг, 2.41 ммоль) и перемешивают смесь при комнатной температуре 3 ч. После завершения реакции реакционную массу упаривают, остаток очищают колоночной хроматографией (хлороформ-метанол, 6:1). Свободное основание производного 7-1а растворяют в тетрагидрофуране (3 мл), прибавляют насыщенный раствор HCl в диэтиловом эфире (2 мл). Смесь упаривают, а остаток растворяют в дистиллированной воде (1 мл), раствор фильтруют, прибавляют метанол (4 мл) и диэтиловый эфир (10 мл) для осаждения продукта. Образовавшийся осадок отфильтровывают и промывают смесью метанол-диэтиловый эфир (1:5, 10 мл), диэтиловым эфиром (2×10 мл) и гексаном (10 мл). Выход 140 мг (83%) 7-1а в виде желто-оранжевого порошка. Т. пл. 215-217°С (с разл.). ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=336 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 10 → 90% (45 мин): Rt=12.3 мин, чистота 94.6%. УФ-спектр, нм (EtOH): 216, 271, 301, 336, 381. Спектр ЯМР1Н (400 МГц, ДМСО-d6, δ, м.д. (J, Гц): 9.73 (уш.с, 2Н, NH2+); 8.30 (д, J=9.6, 1Н, Н-5); 7.86 (д, J=9.6, 1Н, Н-6); 7.51 (с, 1Н, Н-8); 3.83 (уш.м, 4Н, СН2); 3.24 (уш.м, 4Н, СН2); 2.58 (с, 3Н, СН3). Найдено: m/z (ESI), 357.1197. [М+Н]+C15H16F3N4O3+. Вычислено: 357.1169.
Пример 2
2-Ацетил-7-(пиперазин-1 -ил)-6-фтор-3-трифторметилхиноксалин 1,4-диоксида
гидрохлорид (7-1b)

Получают по методике, аналогичной приведенной в примере 1, из 2-ацетил-6,7-дифтор-3-трифторметилхиноксалин 1,4-диоксида (8, X=СН3, LG=F, Ζ=F, схема А) и пиперазина. Выход 63%. Т. пл. 165-167°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=330 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 → 80% (45 мин): Rt=10.2 мин, чистота 95.1%. Спектр ЯМР1Н (400 МГц, ДМСО-d6), δ, м.д., (J, Гц): 9.79 (с, 2Н, NH2+); 8.24 (д, J=12.9, 1H, Н-5); 7.74 (д, J=7.8, 1H, Н-8); 3.65 (уш.м, 4Н, СН2); 3.29 (уш.м, 4Н, СН2); 2.59 (с, 3Н, СН3). Найдено: m/z (ESI), 375.1091. [М+Н]+ C15H15F4N4O3+. Вычислено: 375.1075.
Пример 3
2-Ацетил-6-(пиперазин-1 -ил)-7-фтор-3-трифторметилхиноксалин 1,4-диоксида
гидрохлорид (7-1с)

Получают в качестве минорного компонента в синтезе производного 7-1b, описанного в примере 2. Выход 26%. Т. пл. 158-160°С (с разл.). ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=335 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 → 80% (45 мин): Rt=9.6 мин, чистота 95.9%. УФ-спектр, нм (EtOH): 216, 274, 334, 381, 423. Спектр ЯМР1Н (400 МГц, ДМСО-d6), δ, м.д., (J, Гц): 9.79 (с, 2Н, NH2+); 8.24 (д, J=12.9, 1H, Н-5); 7.74 (д, J=7.8, 1H, Н-8); 3.65 (уш.м, 4Н, СН2); 3.29 (уш.м, 4Н, СН2); 2.59 (с, 3Н, СН3). Найдено: m/z (ESI), 375.1167. [М+Н]+C15H15F4N4O3+. Вычислено: 375.1075.
Пример 4
2-Ацетил-7-(пиперазин-1 -ил)-3-трифторметил-6-хлорхиноксалин 1,4-диоксида
гидрохлорид (7-1d)

Получают по методике, аналогичной приведенной в примере 1, из 2-ацетил-3-трифторметил-6,7-дихлорхиноксалин 1,4-диоксида (8, X=СН3, LG=Cl, Ζ=Cl, схема А) и пиперазина. Выход 78%. Т. пл. >250°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=340 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 10 → 90% (45 мин): Rt=14.0 мин, чистота 95.2%. УФ-спектр, нм (EtOH): 222, 244, 282, 342, 391. Спектр ЯМР1Н (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 9.82 (уш.с, 2Н, NH2+); 8.52 (с, 1Н, Н-5); 7.86 (с, 1Н, Н-8); 3.53-3.51 (м, 4Н, СН2); 3.31-3.30 (м, 4Н, СН2); 2.60 (с, 3Н, СН3). Найдено: m/z (ESI), 391.0797. [М+Н]+C15H15ClF3N4O3+. Вычислено: 391.0779.
Пример 5
2-Ацетил-7-(2-гидроксиэтилпиперазин-1 -ил)-3 -трифторметилхиноксалин 1,4-диоксида гидрохлорид (7-1е)
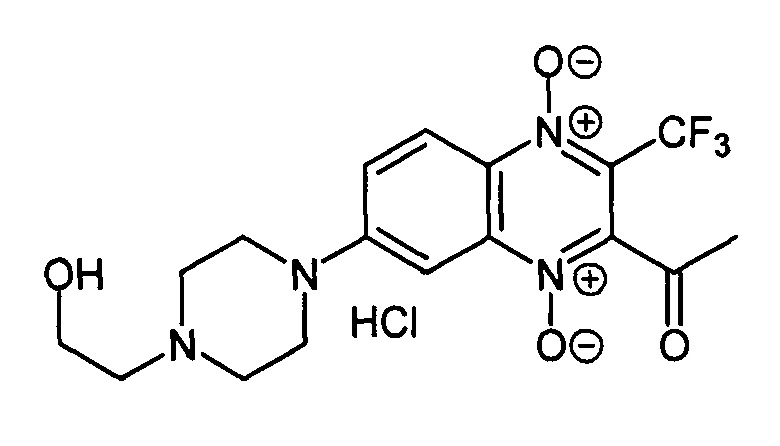
К раствору 150 мг (0.52 ммоль) 3-ацетил-7-фтор-3-трифторметилхиноксалин 1,4-диоксида (8, X=СН3, LG=F, Ζ=Н, схема А) в N,N-диметилформамиде (5 мл) прибавляют N-(2-гидроксиэтил)пиперазин (170 мг, 1.3 ммоль) и перемешивают смесь при комнатной температуре 5 ч. В реакционную смесь прибавляют ледяную воду (10 мл), выпавший осадок фильтруют и сушат на воздухе. Продукт очищают колоночной хроматографией (хлороформ-метанол, 5:1). Получают 152 мг (73%) свободного основания 7-1е. Свободное основание производного 7-1е растворяют в тетрагидрофуране (3 мл), прибавляют насыщенный раствор HCl в диэтиловом эфире (2 мл). Смесь упаривают, остаток растворяют дистиллированной воде (2 мл), раствор фильтруют, прибавляют метанол (2 мл) и диэтиловый эфир (10 мл) для осаждения продукта. Образовавшийся осадок отфильтровывают и промывают смесью метанол-диэтиловый эфир (1:5, 10 мл), диэтиловым эфиром (2×10 мл) и гексаном (10 мл). Получают 140 мг (67%) 7-1е в виде оранжевого порошка. Т. пл. 227-229°С (с разл.). ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=335 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 -» 80% (35 мин): Rt=8.3 мин, чистота 94.9%. УФ-спектр, нм (ЕЮ*Н): 217,270, 299, 336, 380. Спектр ЯМР1H (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 11.38 (уш.с, 1Н, NH+); 8.31 (д, J=9.8, 1Н, Н-5); 7.89 (д, J=9.8, 1H, Н-6); 7.53 (с, 1Н, Н-8); 5.44 (уш.с, 1H, ОН); 4.28 (уш.м, 2Н, СН2); 3.84 (уш.м, 2Н, СН2); 3.64-3.59 (м, 4Н, СН2); 3.26-3.25 (м, 4Н, СН2); 2.59 (с, 3Н, СН3). Найдено: m/z (ESI), 401.1460. [М+Н]+ C17H20F3N4O4+. Вычислено: 401.1431.
Пример 6
2-Ацетил-7-(2-гидроксиэтилпиперазин-1-ил)-3-трифторметил-6-хлорхиноксалин 1,4-диоксида гидрохлорид (7-If)

Получают по методике, аналогичной приведенной в примере 5, из 2-ацетил-3-трифторметил-6,7-дихлорхиноксалин 1,4-диоксида (8, X=СН3, LG=Cl, Ζ=Cl, схема А) и N-2-гидроксиэтилпиперазина. Выход 70%. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4,6×250 мм, LW=250 нм, элюент: А - H3PO4 (0.01 М) рН=2,6, В - MeCN; градиент В 20 → 80% (45 мин): Rt=9.5 мин, чистота 95.4%. Спектр ЯМР1Н (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 8.55 (с, 1Н, Н-8); 7.87 (с, 1H, Н-5); 5.42 (уш.с, 1Н, ОН); 3.81 (уш.м, 2Н, СН2ОН); 3.78-3.68 (м, 4Н, СН2); 3.32-3.25 (уш.м, 6Н, СН2); 2.60 (с, 3Н, СН3). Найдено: m/z (ESI), 435.1019. [М+Н]+ C17H19ClF3N4O4+. Вычислено: 435.1041.
Пример 7
2-Ацетил-6-(2-гидроксиэтилпиперазин-1-ил)-3-трифторметил-7-хлорхиноксалин 1,4-диоксида гидрохлорид (7-1g)

Получают в качестве минорного компонента в синтезе производного 7-1f, описанного в примере 6. Выход 21%. Т. пл. 181-182°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=250 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 → 80% (45 мин): Rt=9.7 мин, чистота 97.1%. Спектр ЯМР1Н (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 8.55 (с, 1Н, Н-8); 7.87 (с, 1Н, Н-5); 5.42 (уш.с, 1H, ОН); 3.81 (уш.м, 2Н, СН2ОН); 3.78-3.68 (м, 4Н, СН2); 3.32-3.25 (уш.м, 6Н, СН2); 2.60 (с, 3Н, СН3). Найдено: m/z (ESI), 435.1031. [М+Н]+C17H19ClF3N4O4+. Вычислено: 435.1041.
Пример 8
2-Ацетил-7-(гомопиперазин-1 -ил)-3-трифторметилхиноксалин 1,4-диоксида
гидрохлорид (7-1h)

Получают по методике, аналогичной приведенной в примере 1, из 2-ацетил-7-фтор-3-трифторметилхиноксалин 1,4-диоксида (8, X=СН3, LG=F, Ζ=Η, схема А) и гомопиперазина. Выход 41%. Т. пл. 254-257°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=300 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 → 80% (45 мин): Rt=10.1 мин, чистота 96.7%. Спектр ЯМР1Н (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 9.58 (уш. с, 2Н, ΝΗ2+; 8.27 (д, J=9.8, 1H, Н-5); 7.74 (дд, J1=9.8, J2=2.7, 1Н, Н-5); 7.30 (д, J=2.7, 1Н, Н-8); 3.99 (уш.м, 2Н, СН2); 3.76 (т, J=5.9, 2Н, СН2); 3.30 (уш.м, 2Н, СН2); 3.14 (уш.м, 2Н, СН2); 2.59 (с, 3Н, СН3); 2.19 (уш.м, 2Н, СН2). Найдено: m/z (ESI), 371.1334. [М+Н]+C16H18F3N4O3+. Вычислено: 371.1326.
Пример 9
2-Ацетил-7-(метилгомопиперазин-1 -ил)-3-трифторметилхиноксалин 1,4-диоксида
гидрохлорид (7-1j)

Получают по методике, аналогичной приведенной в примере 5, из 3-ацетил-7-фтор-3-трифторметилхиноксалин 1,4-диоксида (8, X=СН3, LG=F, Ζ=Н, схема А) и Ν-метилгомопиперазина. Выход 47%. Т. пл. 245-246°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=335 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 → 80% (45 мин): Rt=8.6 мин, чистота 95.6%. УФ-спектр, нм (EtOH): 218, 267, 337, 381, 484. Спектр ЯМР1H (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 11.40 (уш.с, 1H, NH+); 8.27 (дд, J=9.4, J=5.1, 1Н, Н-5); 7.74 (д, J=9.4, 1Н, Н-6); 7.27 (с, 1Н, Н-8); 4.05 (уш.м, 2Н, СН2); 3.68 (уш.м, 2Н, СН2); 3.40 (уш.м, 4Н, СН2); 3.30-3.14 (м, 2Н, СН2); 2.79 (с, 3Н, NCH3); 2.59 (с, 3Н, СОСН3). Найдено: m/z (ESI), 385.1535. [М+Н]+ C17H20F3N4O3+. Вычислено: 385.1482.
Пример 10
7-(4-Аминопиперидин-1 -ил)-2-ацетил-3-трифторметилхиноксалин 1,4-диоксида
гидрохлорид (7-1k)

К раствору 150 мг (0.51 ммоль) 2-ацетил-7-фтор-3-трифторметилхиноксалин 1,4-диоксида (8, X=СН3, LG=F, Ζ=Н, схема А) в тетрагидрофуране (4 мл) прибавляют 4-N-Вос-аминопиперидин (258 мг, 1.3 ммоль) и перемешивают реакционную смесь при комнатной температуре 12 ч. После завершения реакции (контроль по ТСХ) реакционную смесь упаривают, остаток очищают колоночной хроматографией (хлороформ-этилацетат, 30:1). Получают 168 мг (89%) Вос-производного 7-1k. Полупродукт растворяют в тетрагидрофуране (2 мл), прибавляют насыщенный раствор HCl в диэтиловом эфире (2 мл) и перемешивают 2 ч. Реакционную смесь упаривают, а остаток растворяют в дистиллированной воде (2 мл), раствор фильтруют, прибавляют метанол (2 мл) и диэтиловый эфир (10 мл) для осаждения продукта. Образовавшийся осадок отфильтровывают и промывают смесью метанол-диэтиловый эфир (1:10, 10 мл), диэтиловым эфиром (2×10 мл) и гексаном (10 мл). Получают 151 мг (80%) 7-1k в виде оранжевого порошка. Т. пл. 240-242°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=490 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 → 80% (45 мин): Rt=9.0 мин, чистота 96.9%. УФ-спектр, нм (EtOH): 218, 268, 338, 382, 489. Спектр ЯМР1Н (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 8.47 (уш.с, 3Н, NH3+); 8.25 (д, J=9.8, 1H, Н-5); 7.85 (дд, J=9.8, J=1.9,1Н, Н-6); 7.42 (с, 1H, Н-8); 4.18 (д, J=12.9, 2Н, СН2); 3.37-3.34 (м, 1Н, СН); 3.17 (т, J=9.8, 2Н, СН2); 2.58 (с, 3Н, СН3); 2.08 (д, J=10.9, 2Н, СН2); 1.64 (кв, J=10.9, 2Н, СН2). Найдено: m/z (ESI), 371.1343. [М+Н]+ C16H18F3N4O3+. Вычислено: 371.1326.
Пример 11
7-(4-Аминопиперидин- -ил)-2-ацетил-6-фтор-3-трифторметилхиноксалин 1,4-диоксида гидрохлорид (7-11)

Получают по методике, аналогичной приведенной в примере 10, из 2-ацетил-6,7-дифтор-3-трифторметилхиноксалин 1,4-диоксида (8, X=СН3, LG=F, Ζ=F, схема А) и 4-Вос-аминопиперидина. Выход 64%. Т. пл. 221-223°С (с разл.). ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=335 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 80% (45 мин): Rt=10.3 мин, чистота 97.6%. УФ-спектр, нм (EtOH): 219, 275, 336, 388, 448. Спектр ЯМР1H (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 8.48 (уш.с, 3Н, NH3+); 8.21 (д, J=12.9, 1Н, Н-5); 7.67 (д, J=8.2, 1H, Н-8); 3.79 (д, J=12.9, 2Н, СН2); 3.30 (уш.м, 1Н, СН); 3.10 (т, J=12.9,2Н, СН2); 2.58 (с, 3Н, СН3); 2.12 (д, J=10.9, 2Н, СН2); 1.76 (кв, J=10.9,2Н, СН2). Найдено: m/z (ESI), 389.1261. [М+Н]+ C16H17F4N4O3+. Вычислено: 389.1231.
Пример 12
6-(4-Аминопиперидин-1-ил)-2-ацетил-7-фтор-3-трифторметилхиноксалин 1,4-диоксида гидрохлорид (7-1m)

Получают в качестве минорного компонента в синтезе производного 7-11, описанного в примере 11. Выход 17%. Т. пл. 230-231°С (с разл.). ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=345 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 → 80% (45 мин): Rt=9.8 мин, чистота 95.3%. УФ-спектр, нм (EtOH): 217, 272, 343, 382. Спектр ЯМР1H (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 8.48 (уш.с, 3Н, NH3+); 8.21 (д, J=12.9, 1Н, Н-5); 7.67 (д,. J=8.2, 1H, Н-8); 3.79 (д, J=12.9, 2Н, СН2); 3.30 (уш.м, 1Н, СН); 3.10 (т, J=12.9, 2Н, СН2); 2.58 (с, 3Н, СОСН3); 2.12 (д, J=10.9, 2Н, СН2); 1.76 (кв, J=10.9, 2Н, СН2). Найдено: m/z (ESI), 389.1250. [М+Н]+ C16H17F4N4O3+. Вычислено: 389.1231.
Пример 13
7-(Пиперазин-1-ил)-2-пропионил-3-трифторметилхиноксалин 1,4-диоксида
метансульфонат (7-2а)

К раствору 150 мг (0.49 ммоль) 2-пропионил-7-фтор-3-трифторметилхиноксалин 1,4-диоксида (8, X=СН2СН3, LG=F, Ζ=Н, схема А), полученного по методу [Zarranz В. et al. Bioorg. & Med. Chem., 2004, 12, 3711-3721], в тетрагидрофуране (10 мл) прибавляют пиперазин (210 мг, 2.41 ммоль) и перемешивают реакционную смесь при комнатной температуре. После завершения реакции (контроль по ТСХ) реакционную смесь упаривают, остаток очищают колоночной хроматографией (хлороформ-метанол, 6:1). Свободное основание производного 7-2а растворяют в хлороформе (3 мл), прибавляют раствор метансульфокислоты (58 мг, 0.61 ммоль) в хлороформе (1 мл) и перемешивают 3 ч. Реакционную смесь упаривают, а остаток растворяют в дистиллированной воде (1 мл), раствор фильтруют, прибавляют метанол (2 мл) и диэтиловый эфир (10 мл) для осаждения продукта. Образовавшийся осадок отфильтровывают и промывают смесью метанол-диэтиловый эфир (1:5, 10 мл), диэтиловым эфиром (2×10 мл) и гексаном (10 мл). Получают 138 мг (76%) 7-2а в виде желто-оранжевого порошка. Т. пл. 200-201°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=300 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 → 80% (45 мин): Rt=16.2 мин, чистота 95.5%. Спектр ЯМР1Н (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 8.99 (уш.с, 2Н, NH2+); 8.31 (д, J=8.0, 1Н, Н-5); 7.86 (д, J=8.0, 1H, Н-6); 7.52 (с, 1Н, Н-8); 3.79 (уш.м, 4Н, СН2); 3.45 (уш.м, 4Н, СН2); 2.90 (уш.м, 2Н, СОСН2СН3); 2.41 (с, 3Н, CH3SO3); 1.14 (уш.м, 3Н, СОСН2СН3). Найдено: m/z (ESI), 371.1346. [М+Н]+ C11H4F7N2O3+. Вычислено: 371.1326. Найдено, %: С 43.69, Η 4.86, N 12.17; вычислено для C16H17F3N4O3*MsOH*2H20, %: С, 43.78; Н, 4.54; N, 12.01.
Пример 14
7-(Пиперазин-1 -ил)-2-пропионил-6-фтор-3-трифторметилхиноксалин 1,4-диоксида
гидрохлорид (7-2b)

Получают по методике, аналогичной приведенной в примере 1, из 2-пропионил-6,7-дифтор-3-трифторметилхиноксалин 1,4-диоксида (8, X=СН2СН3, LG=F, Ζ=F, схема А), полученного по методу [Zarranz В. et al. Bioorg. & Med. Chem., 2004, 12, 3711-3721] и пиперазина. Выход 58%. Т. пл. 233-235°С (с разл.). ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=335 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 10 → 90% (45 мин): Rt=14.5 мин, чистота 94.9%. УФ-спектр, нм (EtOH): 216, 274, 335, 388. Спектр ЯМР1H (400 МГц, ДМСО-d6), δ, м.д., (J, Гц): 9.77 (уш.с, 2Н, NH2+); 8.24 (д, J=12.9, 1H, Н-5); 7.74 (д, J=8.2, 1Н, Н-8); 3.64 (уш.м, 4Н, СН2); 3.37-3.35 (м, 4Н, СН2); 2.90 (кв, .J=7.3, 2Н, СОСН2СН3); 1.14 (т, J=7.3, 3Н, СОСН2СН3). Найдено: m/z (ESI), 389.1221. [М+Н]+ C16H17F4N4O3+. Вычислено: 389.1231. Найдено, %: С 43.47, Η 4.29, N 12.66; вычислено для C16H16F4N4O3*HCl*H2O, %: С, 43.40; Н, 4.33; N, 12.65.
Пример 15
7-(Пиперазин-1-ил)-2-пропионил-3-трифторметил-6-хлорхиноксалин 1,4-диоксида
метансульфонат (7-2с)

К раствору 140 мг (0.39 ммоль) 6-(4-Вос-пиперазин-1-ил)-5-хлорбензофуроксана (9, Ζ=Cl, Υ=4-Вос-пиперазин-1-ил, схема Б)), полученного по методу [RU 2640304], и 332 мг (1.97 ммоль) 1,1,1-трифторгексан-2,4-диона (X=СН2СН3, схема Б) в хлороформе (10 мл) прибавляют триэтиламин (7 мг; 0.05 ммоль) и перемешивают реакционную смесь при комнатной температуре 4 ч. Выпавший осадок отфильтровывают, промывают хлороформом (3×1 мл) и переосаждают из смеси хлористый метилен - петролейный эфир. Получают 111 мг (54%) Вос-производного 7-2с.
Полупродукт растворяют в хлороформе (5 мл), прибавляют раствор метансульфокислоты (58 мг, 0.61 ммоль) в хлороформе (1 мл), перемешивают 1 ч и упаривают реакционную смесь. Остаток растворяют в дистиллированной воде (2 мл), раствор фильтруют, прибавляют метанол (2 мл) и диэтиловый эфир (10 мл) для осаждения продукта. Образовавшийся осадок отфильтровывают и промывают смесью метанол-диэтиловый эфир (1:5, 10 мл), диэтиловым эфиром (2×10 мл) и гексаном (10 мл). Получают 51 мг (45%) 7-2с в виде желтого порошка. Т. пл. 243-246°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=300 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 → 80% (45 мин): Rt=15.8 мин, чистота 97.3%. Спектр ЯМР1Н (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 9.03 (уш.с, 2Н, NH2+); 8.51 (с, 1H, Н-8); 7.85 (с, 1Н, Н-5); 3.47 (уш.м, 4Н, СН2); 3.35 (уш.м, 4Н, СН2); 2.90 (кв, J=6.8, 2Н, СОСН2СН3); 2.43 (с, 3Н, CH3SO3-); 1.13 (т, J=6.8, 3Н, СОСН2СН3);. Найдено: m/z (ESI), 405.0947. [М+Н]+ C16H17ClF3N4O3+. Вычислено: 405.0936.
Пример 16
7-(3 -Метилпиперазин-1-ил)-2-пропионил-3-трифторметилхиноксалин 1,4-диоксида
метансульфонат (7-2d)

Получают по методике, аналогичной приведенной в примере 10, из 2-пропионил-7-фтор-3-трифторметилхиноксалин 1,4-диоксида (8, X=СН2СН3, LG=F, Ζ=Η, схема А) и 1-Boc-2-метилпиперазина. Выход 84%. Т. пл. 257-258°С (с разл.). ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=295 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 → 80% (45 мин): Rt=13.5 мин, чистота 98.4%. Спектр ЯМР1H (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 9.29-8.98 (м, 2Н,+NH2); 8.29 (д, J=9.4, 1Н, Н-5); 7.88 (д, J=9.4, 1Н, Н-6); 7.52 (с, 1H, Н-8); 4.28-4.19 (м, 2Н, СН2); 3.46-3.34 (м, 3Н, СН, СН2); 3.20-3.12 (м, 2Н, СН2); 2.89 (кв, J=6.8, 2Н, СОСН2СН3); 2.43 (с, 3Н, CH3S03-); 1.33 (д, J=5.9, 3Н, СН3); 1.13 (т, J=6.8, 3Н, СОСН2СН3). Найдено: m/z (ESI), 385.1476. [М+Н]+ C17H20F3N4O3+. Вычислено: 385.1482.
Пример 17
2-Пропионил-3-трифторметил-7-(этилпиперазин-1-ил)хиноксалин 1,4-диоксида
гидрохлорид (7-2е)

Получают по методике, аналогичной приведенной в примере 5, из 2-пропионил-7-фтор-3-трифторметилхиноксалин 1,4-диоксида (8, X=СН2СН3, LG=F, Ζ=Η, схема А) и Ν-этилпиперазина. Выход 81%. Т. пл. >250°С (с разл.). ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=300 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 → 80% (45 мин): Rt=12.2 мин, чистота 96.9%. Спектр ЯМР1H (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 11.61 (уш.м, 2Н,+NH2); 8.32 (д, J=9.4, 1Н, Н-5); 7.88 (д, J=9.4, 1H, Н-6); 7.54 (д, J=9.4, 1Н, Н-8); 4.30 (кв, J=12.9, 2Н, -NCH2CH3); 3.61-3.48 (м, 4Н, СН2); 3.18-3.10 (м, 4Н, СН2); 2.90 (кв, J=6.6, 2Н, СОСН2СН3); 1.30 (т, J=7.0, 3Н, -NCH2CH3); 1.14 (т, J=7.4, 3Н, СОСН2СН3). Найдено: m/z (ESI), 399.1645. [М+Н]+ C18H22F3N4O3+. Вычислено: 399.1639.
Пример 18
7-(2-Гидроксиэтилпиперазин-1-ил)-2-пропионил-3-трифторметилхиноксалин 1,4-диоксида гидрохлорид (7-2f)

Получают по методике, аналогичной приведенной в примере 5, из 2-пропионил-7-φτορ-3-трифторметилхиноксалин 1,4-диоксида (8, X=СН2СН3, LG=F, Ζ=Η, схема А) и Ν-(2-гидроксиэтил)пиперазина. Выход 51%. Т. пл.>250°С (с разл.). ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=320 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 → 80% (45 мин): Rt=10.6 мин, чистота 97.2%. УФ-спектр, нм (EtOH): 217, 270, 298, 337, 382. Спектр ЯМР Ή (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 11.02 (уш.с, 2Н, NH2+); 8.33 (д, J=9.8, 1Н, Н-5); 7.88 (д, J=9.8, 1Н, Н-8); 7.55 (с, 1Н, Н-8); 5.42 (уш.с, 1Н, ОН); 3.82 (уш.м, 2Н, СН2); 3.65 (уш.м, 2Н, СН2ОН); 3.54 (уш.м, 2Н, СН2СН2ОН); 3.25 (уш.м, 2Н, СН2); 2.90 (кв, J=6.8, 2Н, СОСН2СН3); 1.14 (т, J=6.8, 3Н, СОСН2СН3). Найдено: m/z (ESI), 415.1556. [М+Н]+ C18H22F3N4O4+. Вычислено: 415.1588.
Пример 19
7-(4-Аминопиперидин-1-ил)-2-пропионил-3-трифторметилхиноксалин 1,4-диоксида
гидрохлорид (7-2g)

Получают по методике, аналогичной приведенной в примере 10, из 2-пропионил-7-фтор-3-трифторметилхиноксалин 1,4-диоксида (8, X=СН2СН3, LG=F, Ζ=Н, схема А) и 4-N-Вос-аминопиперидина. Выход 63%. Т. пл. 243-245°С (с разл.). ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=340 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 → 80% (45 мин): Rt=11.2 мин, чистота 98.8%. УФ-спектр, нм (EtOH): 219, 269, 339, 383,486. Спектр ЯМР1Н (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 8.47 (уш.с, 3Н, NH3+; 8.25 (д, J=8.9, 1H, Н-5); 7.84 (д, 7=8.9, 1Н, Н-6); 7.41 (с, 1H, Н-8); 4.18 (д, J=13.3, 2Н, СН2); 3.38 (уш.м, 1Н, СН); 3.17 (т, J=13.3, 2Н, СН2); 2.89 (кв, J=7.0, 2Н, СОСН2СН3); 2.09 (д,.J=10.9, 2Н, СН2); 1.64 (кв, J=10.9, 2Н, СН2); 1.13 (т, J=7.0, 3Н, СОСН2СН3). Найдено: m/z (ESI), 385.1464. [М+Н]+ C17H20F3N4O3+. Вычислено: 385.1482.
Пример 20
7-(4-Аминопиперазин-1-ил)-2-пропионил-6-фтор-3-трифторметилхиноксалин 1,4-диоксида гидрохлорид (7-2h)

Получают по методике, аналогичной приведенной в примере 10, из 2-пропионил-6,7-дифтор-3-трифторметилхиноксалин 1,4-диоксида (8, X=СН2СН3, LG=F, Ζ=F, схема А) и 4-N-Вос-аминопиперидина. Выход 49%. Т. пл. >250°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=300 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 → 80% (45 мин): Rt=14.1 мин, чистота 95.3%. Спектр ЯМР1H (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 8.19 (д, J=12.9, 1Н, Н-5); 8.06 (уш.с, 3Н, NH3+); 7.66 (д, J=7.8, 1Н, Н-8); 3.77 (д, J=12.3, 2Н, СН2); 3.32 (уш.м, 1Н, СН); 3.10 (т, J=12.3, 2Н, СН2); 2.89 (кв, J=6.6, 2Н, СОСН2СН3); 2.08 (д, J=10.7, 2Н, СН2); 1.72 (кв, J=10.7, 2Н, СН2); 1.13 (т, J=6.6, 3Н, СОСН2СН3). Найдено: m/z (ESI), 403.1310. [М+Н]+ C17H19F4N4O3+. Вычислено: 403.1388.
Пример 21
7-(4-Аминопиперазин-1-ил)-2-пропионил-3-трифторметил-6-хлорхиноксалин 1,4-диоксида гидрохлорид (7-2j)
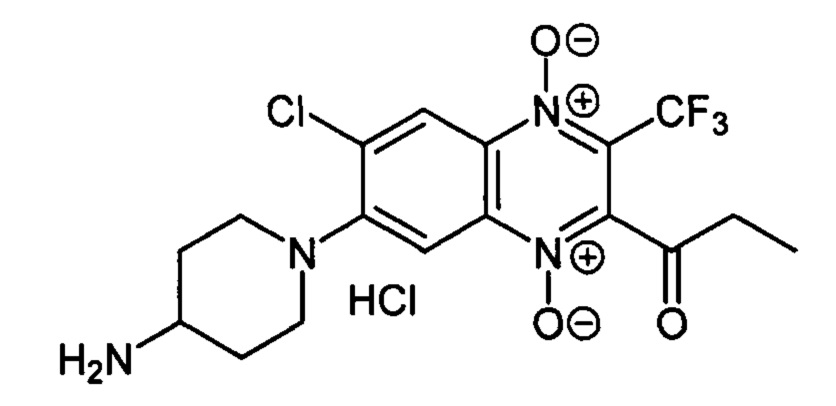
Получают по методике, аналогичной приведенной в примере 10, из 2-пропионил-3-трифторметил-6,7-дихлорхиноксалин 1,4-диоксида (8, X=СН2СН3, LG=Cl, Ζ=Cl, схема А) и 4-N-Вос-аминопиперидина. Выход 60%. Т. пл. >250°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=295 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 → 80% (45 мин): Rt=12.9 мин, чистота 95.2%. УФ-спектр, нм (EtOH): 228, 285,345, 393. Спектр ЯМР1Н (400 МГц, ДМСО-d6), 6, м.д. (J, Гц): 8.41 (уш.с, 3Н, NH3+); 8.46 (с, 1Н, Н-8); 7.79 (с, 1Н, Н-5); 3.61 (д, J=12.1, 2Н, СН2); 3.26 (уш.м, 1H, СН); 2.97 (т, J=11.3, 2Н, СН2); 2.87 (кв, J=7.0,2Н, СОСН2СН3); 2.11 (д, J=11.3,2Н, СН2); 1.79 (кв, J=11.3, 2Н, СН2); 1.12 (т, J=7.0, 3Н, СОСН2СН3). Найдено: m/z (ESI), 419.1053. [М+Н]+ C17H19ClF3N4O3+. Вычислено: 419.1092.
Пример 22
6-(4-Аминопиперазин-1-ил)-2-пропионил-3-трифторметил-7-хлорхиноксалин 1,4-диоксида гидрохлорид (7-2k)

Получают в качестве минорного компонента в синтезе производного 7-2j, описанного в примере 21. Выход 22%. Т. пл. >250°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4,6×250 мм, LW=330 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 → 80% (45 мин): Rt=13.7 мин, чистота 95.0%. УФ-спектр, нм (EtOH): 228, 285, 345, 393. Спектр ЯМР1H (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 8.41 (уш.с, 3Н, NH3+); 8.46 (с, 1H, Н-8); 7.79 (с, 1H, Н-5); 3.61 (д, J=12.1, 2Н, СН2); 3.26 (уш.м, 1Н, СН); 2.97 (т, J=11.3, 2Н, СН2); 2.87 (кв, J=7.0,2Н, СОСН2СН3); 2.11 (д, J=11.3, 2Н, СН2); 1.79 (кв, J=11.3, 2Н, СН2); 1.12 (т, J=7.0, 3Н, СОСН2СН3). Найдено: m/z (ESI), 419.1067. [М+Н]+ C17H19ClF3N4O3+. Вычислено: 419.1092.
Пример 23
7-(Гомопиперазин-1-ил)-2-пропионил-3-трифторметилхиноксалин 1,4-диоксида
гидрохлорид (7-21)

Получают по методике, аналогичной приведенной в примере 1, из 2-пропионил-7-фтор-3-трифторметилхиноксалин 1,4-диоксида (8, X=СН2СН3, LG=F, Ζ=Н, схема А) и гомопиперазина. Выход 35%. Т. пл. 215-216°С. ВЭЖХ (колонка Kromasil- 100-5-мкм С-18 4.6×250 мм, LW=300 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 → 80% (45 мин): Rt=11.7 мин, чистота 90.8%. Спектр ЯМР1Н (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 9.52 (уш.с, 2Н,+NH2); 8.28 (д, J=8.7, 1H, Н-5); 7.73 (д, J=8.7, 1Н, Н-6); 7.30 (с, 1H, Н-8); 3.98 (уш.м, 2Н, СН2); 3.76 (уш.м, 2Н, СН2); 3.30 (уш.м, 2Н, СН2); 2.90 (кв, J=6.3, 3Н, СОСН2СН3); 2.19 (уш.м, 2Н, СН2); 1.13 (т, J=6.3, 3Н, СОСН2СН3). Найдено: m/z (ESI), 385.1471. [М+Н]+ C17H20F3N4O3+. Вычислено: 385.1482.
Пример 24
7-(4-Метилгомопиперазин-1-ил)-2-пропионил-3-трифторметилхиноксалин 1,4-диоксида гидрохлорид (7-2 т)

Получают по методике, аналогичной приведенной в примере 5, из 2-пропионил-7-фтор-3-трифторметилхиноксалин 1,4-диоксида (8, X=СН2СН3, LG=F, Ζ=Η, схема А) и Ν-метилгомопиперазина. Выход 31%. Т. пл. 240-242°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=320 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 → 80% (45 мин): Rt=10.9 мин, чистота 95.1%. УФ-спектр, нм (EtOH): 218, 268, 305, 338, 382. Спектр ЯМР1H (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 11.46 (уш.с, 1Н, NH+); 8.27 (д, J=9.4, 1Н, Н-5); 7.75 (д, J=9.4, 1H, Н-6); 7.26 (с, 1Н, Н-8); 4.13-3.93 (м, 2Н, СН2); 3.67-3.56 (м, 4Н, СН2); 3.27-3.15 (м, 2Н, СН2); 2.89 (кв, J=7.0, 2Н, СОСН2СН3); 2.78 (с, 3Н, NCH3); 2.24-2.21 (м, 2Н, СН2); 1.13 (т, J=7.0, 3Н, СОСН2СН3). Найдено: m/z (ESI), 399.1704. [М+Н]+ C18H22F3N4O3+. Вычислено: 399.1639.
Пример 25
7-(Пиперазин-1-ил)-3-трифторметил-2-этоксикарбонилхиноксалин 1,4-диоксида
гидрохлорид (7-3а)

Получают по методике, аналогичной приведенной в примере 1, из 7-фтор-3-трифторметил-2-этоксикарбонилхиноксалин 1,4-диоксида (8, X=ОСН2СН3, LG=F, Ζ=Η, схема А), полученного по методу [Zarranz В. et al. Bioorg. & Med. Chem., 2004, 12, 3711-3721], и пиперазна. Выход 46%. Т. пл. 185-187°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=335 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 → 60% (45 мин): Rt=12.9 мин, чистота 95.6%. УФ-спектр, нм (EtOH): 272, 302, 337, 382. Спектр ЯМР1H (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 9.64 (уш.с, 2Н, NH2+); 8.27 (д, J=9.0, 1H, Н-5); 7.84 (д, J=9.0, 1Н, Н-6); 7.48 (с, 1H, Н-8); 4.45 (кв, J=7.0, 2Н, ОСН2СН3); 3.82 (м, 4Н, СН2); 3.27 (м, 4Н, СН2); 1.32 (т, J=7.0, 3Н, ОСН2СН3). Найдено: m/z (ESI), 387.1250. [М+Н]+ C16H18F3N4O4+. Вычислено: 387.1275.
Пример 26
7-(Пиперазин-1-ил)-6-фтор-3-трифторметил-2-этоксикарбонилхиноксалин 1,4-диоксида гидрохлорид (7-ЗЬ)

Получают по методике, аналогичной приведенной в примере 1, из 6,7-дифтор-3-трифторметил-2-этоксикарбонилхиноксалин 1,4-диоксида (8, X=ОСН2СН3, LG=F, Ζ=F, схема А) и пиперазина. Выход 42%. Т. пл. 211-213°С (с разл.). ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=335 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN;
градиент В 20 → 80% (45 мин): Rt=11.9 мин, чистота 95.5%. УФ-спектр, нм (EtOH): 215, 275, 337, 388. Спектр ЯМР1H (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 9.69 (с, 2Н, NH2+); 8.24 (д, J=12.9, 1Н, Н-5); 7.73 (д, J=8.2, 1Н, Н-8); 4.47 (кв, J=7.0, 2Н, ОСН2СН3); 3.62 (уш.м, 2Н, СН2); 3.29 (уш.м, 4Н, СН2); 1.32 (т, J=7.0, 3Н, ОСН2СН3). Найдено: m/z (ESI), 405.1233. [М+Н]+ Cl6H17F4N4O4+. Вычислено: 405.1180.
Пример 27
6-(Пиперазин-1-ил)-7-фтор-3-трифторметил-2-этоксикарбонилхиноксалин 1,4-
диоксида гидрохлорид (7-3с)

Получают в качестве минорного компонента продукта в синтезе производного 7-3 с, описанного в примере 26. Выход 34%. Т. пл. 226-228°С (с разл.). ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=340 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 → 80% (45 мин): Rt=11.3 мин, чистота 96.5%. УФ-спектр, нм (EtOH): 213, 272, 342, 382. Спектр ЯМР1Н (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 9.69 (с, 2Н, NH2+); 8.24 (д, J=12.9,1Н, Н-5); 7.73 (д, J=8.2, 1Н, Н-8); 4.47 (кв, J=7.0, 2Н, ОСН2СН3); 3.62 (уш.м, 2Н, СН2); 3.29 (уш.м, 4Н, СН2); 1.32 (т, J=7.0, 3Н, ОСН2СН3). Найдено: m/z (ESI), 405.1221. [М+Н]+ C16H17F4N4O4+. Вычислено: 405.1180.
Пример 28
7-(Пиперазин-1-ил)-3-трифторметил-6-хлор-2-этоксикарбонилхиноксалин 1,4-
диоксида метансульфонат (7-3d)

Получают по методике, аналогичной приведенной в примере 15, из 6-(4-Вос-пиперазин-1-ил)-5-хлоробензофуроксана (9, Ζ=Cl, Υ=4-Вос-пиперазин-1-ил, схема Б), полученного по методу [RU 2640304], и этил 4,4,4-трифторацетоацетата (X=ОСН2СН3, схема Б). Выход 83%. Т. пл. >250°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4,6×250 мм, LW=280 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 → 80% (45 мин): Rt=13.9 мин, чистота 96.6%. УФ-спектр, нм (EtOH): 235, 267, 282, 345, 393. Спектр ЯМР1Н (400 МГц, ДМСО-d6), 6, м.д.: 8.97 (уш.с, 2Н, NH2+); 8.50 (с, 1H, Н-8); 7.86 (с, 1Н, Н-5); 4.47 (кв,.7=7.0, 2Н, ОСН2СН3); 4.31 (уш.м, 4Н, СН2); 3.46 (уш.м, 4Н, СН2); 1.32 (кв, J=7.0, 3Н, ОСН2СН3). Найдено: m/z (ESI), 421.0883. [М+Н]+ C16H17ClF3N4O4+. Вычислено: 421.0885.
Пример 29
7-(4-Аминопиперидин-1-ил)-3-трифторметил-6-хлор-2-этоксикарбонилхиноксалин
1,4-диоксида гидрохлорид (7-Зе)

Получают по методике, аналогичной приведенной в примере 10, из 3-трифторметил-6,7-дихлор-2-этоксикарбонилхиноксалин 1,4-диоксида (8, X=ОСН2СН3, LG=Cl, Ζ=Cl, схема А) и 4-N-Вос-аминопиперидина. Выход 52%. Т. пл. >250°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=254 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 → 60% (30 мин): Rt=14.4 мин, чистота 90.9%. Спектр ЯМР1H (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 8.45 (с, 1H, Н-8); 8.24 (уш.с, 3Н, NH3+); 7.78 (с, 1H, Н-5); 4.45 (кв,.7=6.8, 2Н, ОСН2СН3); 3.61 (д, J=10.6, 2Н, СН2); 3.26 (уш.м, 1Н, СН); 2.96 (д, J=10.6,2Н, СН2); 2.10 (д, J=9.0, 2Н, СН2); 1.76 (кв, J=9.0, 2Н, СН2); 1.30 (т, J=6.8, 3Н, ОСН2СН3). Найдено: m/z (ESI), 435.1038. [М+Н]+ C16H17ClF3N4O4+. Вычислено: 435.1041.
Пример 30
2-Бензоил-7-(пиперазин-1-ил)-3-трифторметилхиноксалин 1,4-диоксида гидрохлорид
(7-4а)

Получают по методике, аналогичной приведенной в примере 1, из 2-бензоил-7-фтор-3-трифторметилхиноксалин 1,4-диоксида (8, X=С6Н5, LG=F, Ζ=Η, схема А), полученного по методу [Zarranz В. et al. Bioorg. & Med. Chem., 2004,12, 3711-3721], и пиперазина. Выход 76%. Т. пл. 258-159°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=340 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 10 90% (45 мин): Rt=16.0 мин, чистота 95.4%. УФ-спектр, нм (EtOH): 206, 275, 340, 383. Спектр ЯМР1Н (400 МГц, ДМСО-d6), 6, м.д. (J, Гц): 9.65 (уш.с, 2Н, NH2+); 8.38 (д, J=9.8, 1H, Н-5); 8.09 (д, J=7.8, 2Н, С6Н5); 7.89 (д, J=9.8, 1H, Н-6); 7.75 (т, J=7.8, 1H, С6Н5); 7.58 (т, J=7.8, 2Н, С6Н5); 7.49 (с, 1Н, Н-8); 3.82 (уш.м, 4Н, СН2); 3.25 (уш.м, 4Н, СН2). Найдено: m/z (ESI), 419.1327. [М+Н]+ C20H18F3N4O3+. Вычислено: 419.1326.
Пример 31
2-Бензоил-7-(пиперазин-1-ил)-6-фтор-3-трифторметилхиноксалин 1,4-диоксида
гидрохлорид (7-4b)

Получают по методике, аналогичной приведенной в примере 1, из 2-бензоил-6,7-дифтор-3-трифторметилхиноксалин 1,4-диоксида (8, X=C6H5, LG=F, Ζ=F, схема А) и пиперазина. Выход 53%. Т. пл. >250°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=270 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 ->80% (45 мин): Rt=14.7 мин, чистота 95.1%. УФ-спектр, нм (EtOH): 271, 338, 391. Спектр ЯМР1Н (400 МГц, ДМСО-d6), δ, м.д., (J, Гц): 9.71 (уш.с, 2Н, NH2+); 8.32 (д, J=12.5, 1H, Н-5); 8.10 (д, J=8.2, 2Н, С6Н5); 7.76 (т, J=7A, 1Н, С6Н5); 7.71 (д, J=8.2, 1H, Н-8); 7.59 (т, J=7.4, 2Н, С6Н5); 3.62 (уш.м, 4Н, СН2); 3.29 (уш.м, 4Н, СН2). Найдено: m/z (ESI), 437.1253. [М+Н]+ C20H17F4N4O3+. Вычислено: 437.1231.
Пример 32
2-Бензоил-7-(пиперазин-1-ил)-3 -трифторметил-6-хлорхиноксалин 1,4-диоксида
гидрохлорид (7-4 с)

Получают по методике, аналогичной приведенной в примере 1, из 2-бензоил-3-трифторметил-6,7-дихлорхиноксалин 1,4-диоксида (8, X=С6Н5, LG=Cl, Ζ=Cl, схема А) и пиперазина. Выход 84%. Т. пл. >250°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=345 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 10 → 90% (45 мин): Rt=17.5 мин, чистота 94.6%. УФ-спектр, нм (EtOH): 258, 284, 345, 394. Спектр ЯМР1H (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 9.88 (уш.с, 2Н, NH2+), 8.57 (с, 1Н, Н-8); 8.10 (д, J=7.8, 2Н, С6Н5); 7.82 (с, 1Н, Н-5); 7.74 (м, 1Н, С6Н5); 7.59 (т, J=7.8, 2Н, С6Н5); 3.51 (уш.м, 4Н, СН2); 3.29 (уш.м, 4Н, СН2). Найдено: m/z (ESI), 453.0918. [М+Н]+ C20H17ClF3N4O3+. Вычислено: 453.0936.
Пример 33
2-(4-Метилбензоил)-7-(пиперазин-1-ил)-3-трифторметилхиноксалин 1,4-диоксида
гидрохлорид (7-4d)

Получают по методике, аналогичной приведенной в примере 1, из 2-(4-метилбензоил)-7-фтор-3-трифторметилхиноксалин 1,4-диоксида (8, X=4-CH3C6H4, LG=F, Ζ=Н, схема А), полученного по методу [Zarranz В. et al. Bioorg. & Med. Chem., 2004, 12, 3711-3721], и пиперазина. Выход 83%. Т. пл. >250°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=300 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 → 80% (45 мин): Rt=15.2 мин, чистота 97.0%. УФ-спектр, нм (EtOH): 206, 275, 342, 386. Найдено: m/z (ESI), 433.1493. [М+Н]+ C21H20F3N4O3+. Вычислено: 433.1482.
Пример 34
7-(Пиперазин-1-ил)-3-трифторметил-2-(4-хлорбензоил)хиноксалин 1,4-диоксида
гидрохлорид (7-4е)

Получают по методике, аналогичной приведенной в примере 1, из 7-фтор-3-трифторметил-2-(4-хлорбензоил)хиноксалин 1,4-диоксида (8, X=4-ClC6H4, LG=F, Ζ=Η, схема А), полученного по методу [Zarranz В. et al. Bioorg. & Med. Chem., 2004, 12, 3711-3721], и пиперазина. Выход 77%. Т. пл. >250°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=300 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 → 80% (45 мин): Rt=15.4 мин, чистота 95.1%. УФ-спектр, нм (EtOH): 210, 270, 344, 385. Найдено: m/z (ESI), 453.0921. [М+Н]+ C20H17ClF3N4O3+. Вычислено: 453.0936.
Пример 35
2-(4-Метилтиобензоил)-7-(пиперазин-1 -ил)-3-трифторметилхиноксалин 1,4-диоксида
гидрохлорид (7-4f)

Получают по методике, аналогичной приведенной в примере 1, из 2-(4-метилтиобензоил)-7-фтор-3-трифторметилхиноксалин 1,4-диоксида (8, X=4-CH3SC6H4, LG=F, Ζ=Н, схема А), полученного по методу [Zarranz В. et al. Bioorg. & Med. Chem., 2004,12, 3711-3721], и пиперазина. Выход 63%. Т. пл. >250°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=300 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 → 60% (30 мин): Rt=17.0 мин, чистота 94.8%. УФ-спектр, нм (EtOH): 210, 279, 346, 390. Найдено: m/z (ESI), 465.1210. [М+Н]+ C21H20F3N4O3S+. Вычислено: 465.1203.
Пример 36
2-(3,4-Диметилбензоил)-7-(пиперазин-1-ил)-3-трифторметилхиноксалин 1,4-диоксида
гидрохлорид (7-4g)

Получают по методике, аналогичной приведенной в примере 1, из 2-(3,4-диметилбензоил)-7-фтор-3-трифторметилхиноксалин 1,4-диоксида (8, X=3,4-(СН3)2С6Н3, LG=F, Ζ=Н, схема А), полученного по методу [Zarranz В. et al. Bioorg. & Med. Chem., 2004, 12, 3711-3721], и пиперазина. Выход 72%. Т. пл. >250°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=300 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 → 80% (45 мин): Rt=16.4 мин, чистота 94.7%. УФ-спектр, нм (EtOH): 211, 267, 341, 385. Найдено: m/z (ESI), 447.1628. [М+Н]+ C22H22F3N4O3+. Вычислено: 447.1639.
Пример 37
7-(Пиперазин-1-ил)-3-трифторметил-2-(3,4-дихлорбензоил)хиноксалин 1,4-диоксида
гидрохлорид (7-4h)

Получают по методике, аналогичной приведенной в примере 1, из 7-фтор-3-трифторметил-2-(3,4-дихлорбензоил)хиноксалин 1,4-диоксида (8, X=3,5-С12С6Н3, LG=F, Ζ=Η, схема А), полученного по методу [Zarranz В. et al. Bioorg. & Med. Chem., 2004,12, 3711-3721], и пиперазина. Выход 69%. Т. пл. >250°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=300 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 → 80% (45 мин): Rt=17.8 мин, чистота 95.5%. УФ-спектр, нм (EtOH): 211, 272, 340, 389. Найдено: m/z (ESI), 487.0554. [М+Н]+ C20Η16Cl2F3Ν4O3+. Вычислено: 487.0546.
Пример 38
2-(3,4,5-Тримеоксибензоил)-7-(пиперазин-1-ил)-3-трифторметилхиноксалин 1,4-диоксида гидрохлорид (7-4j)

Получают по методике, аналогичной приведенной в примере 1, из 2-(3,4,5-триметоксибензоил)-7-фтор-3-трифторметилхиноксалин 1,4-диоксида (8, X=3,4,5-С6Н2(ОСН3)3, LG=F, Ζ=Н, схема А), полученного по методу [Zarranz В. et al. Bioorg. & Med. Chem., 2004,12, 3711-3721], и пиперазина. Выход 48%. Т. пл. >250°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=300 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 → 80% (45 мин): Rt=19.7 мин, чистота 96.2%. УФ-спектр, нм (EtOH): 214, 275, 340, 386. Найдено: m/z (ESI), 509.1633. [М+Н]+ C23H24F3N4O6+ Вычислено: 509.1642.
Пример 39
7-(Пиперазин-1 -ил)-3-трифторметил-2-(2-фуроил)хиноксалин 1,4-диоксида
гидрохлорид (7-5а)

Получают по методике, аналогичной приведенной в примере 1, из 7-фтор-3-трифторметил-2-(2-фуроил)хиноксалин 1,4-диоксида (8, X=2-С4Н3О, LG=F, Ζ=Η, схема А), полученного по методу [Zarranz В. et al. Bioorg. & Med. Chem., 2004, 12, 3711-3721], и пиперазина. Выход 71%. Т. пл. 220-222°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=340 нм, элюент: A - H3PO4 (0.01 Μ) ρΗ=2.6, В - MeCN; градиент В 10 → 90% (45 мин): Rt=11.0 мин, чистота 95.3%. Спектр ЯМР1H (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 9.60 (уш.с, 2Н, NH2+); 8.37 (д, J=8.9,1Н, Н-5); 8.20 (уш.м, 1Н, C4H3O); 7.89 (д, J=8.9, 1Н, Н-6); 7.85 (уш.м, 1Н, C4H3O); 7.50 (с, 1H, Н-8); 6.82 (уш.м, 1Н, C4H3O); 3.81 (уш.м, 4Н, СН2); 3.24 (м, 4Н, СН2). Найдено: m/z (ESI), 409.1078. [М+Н]+ C18H16F3N4O4+. Вычислено: 409.1118.
Пример 40
7-(Пиперазин-1-ил)-6-фтор-3-трифторметил-2-(2-фуроил)хиноксалин 1,4-диоксида
гидрохлорид (7-5b)

Получают по методике, аналогичной приведенной в примере 1, из 6,7-дифтор-3-трифторметил-2-(2-фуроил)хиноксалин 1,4-диоксида (8, X=2-C4H3O, LG=F, Ζ=F, схема А) и пиперазина. Выход 47%. Т. пл. 230-232°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=300 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 → 80% (45 мин): Rt=12.0 мин, чистота 95.8%. Спектр ЯМР1Н (400 МГц, ДМСО-d6, δ, м.д. (J, Гц): 9.58 (уш.с, 2Н, NH2+); 8.33 (д, J=12.9, 1Н, Н-5); 8.23 (уш.м, 1Н, C4H3O); 7.86 (уш.м, 1Н, C4H3O); 7.73 (д, J=8.2, 1Н, Н-8); 6.83-6.82 (м, 1Н, C4H3O); 3.61 (уш.м, 4Н, СН2); 3.29 (уш.м, 4Н, СН2). Найдено: m/z (ESI), 427.1030. [М+Н]+ C18H15F4N4O4+. Вычислено: 427.1024.
Пример 41
7-(Пиперазин-1-ил)-3-трифторметил-2-(2-фуроил)-6-хлорхиноксалин 1,4-диоксида
гидрохлорид (7-5 с)

Получают по методике, аналогичной приведенной в примере 1, из 3-трифторметил-6,7-дихлор-2-(2-фуроил)хиноксалин 1,4-диоксида (8, X=2-C4H3O, LG=Cl, Ζ=Cl, схема А) и пиперазина. Выход 82%. Т. пл. >250°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=300 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 10 → 90% (45 мин): Rt=13.0 мин, чистота 96.4%. УФ-спектр, нм (EtOH): 291, 374, 499. Спектр ЯМР1Н (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 8.53 (с, 1Н, Н-5); 8.14 (уш.м, 1H, C4H3O); 7.83 (с, 1Н, Н-8); 7.76 (уш.м, 1Н, C4H3O); 6.80-6.79 (м, 1Н, C4H3O); 3.45 (уш.м, 4Н, СН2); 3.31 (уш.м, 4Н, СН2). Найдено: m/z (ESI), 443.0734. [М+Н]+ C18H15ClF3N4O4+. Вычислено: 443.0728.
Пример 42
7-(4-Аминопиперидин-1-ил)-3-трифторметил-2-(2-фуроил)хиноксалин 1,4-диоксида
гидрохлорид (7-5d)

Получают по методике, аналогичной приведенной в примере 10, из 7-фтор-3-трифторметил-2-(2-фуроил)хиноксалин 1,4-диоксида (8, X=2-C4H3O, LG=F, Ζ=Η, схема А) и 4-N-Вос-аминопиперидина. Выход 68%. Т. пл. 255-257°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=295 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 → 60% (30 мин): Rt=11.2 мин, чистота 94.9%. УФ-спектр, нм (EtOH): 219, 236, 342, 383,490. Спектр ЯМР1Н (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 8.43 (уш.с, 3Н, NH3+); 8.30 (д, J=8.9, 1Н, Н-5); 8.20 (уш.м, 1Н, C4H3O); 7.88 (д, J=8.9, 1Н, Н-6); 7.85 (уш.м, 1Н, C4H3O); 7.42 (с, 1Н, Н-8); 6.81 (уш.м, 1Н, C4H3O); 4.19 (д, J=7.8, 2Н, СН2); 3.41 (уш.м, 1Н, СН); 3.16 (т, J=9.8, 2Н, СН2); 2.08 (д, J=7.8, 2Н, СН2); 1.63 (д, J=7.8, 2Н, СН2). Найдено: m/z (ESI), 423.1280. [М+Н]+ C19H18F3N4O4+. Вычислено: 423.1275.
Пример 43
7-(3-(R)-Аминопирролидин-1-ил)-6-фтор-3-трифторметил-2-(2-фуроил)хиноксалин
1,4-диоксида гидрохлорид (7-5е)

Получают по методике, аналогичной приведенной в примере 10, из 6,7-дифтор-3-трифторметил-2-(2-фуроил)хиноксалин 1,4-диоксида (8, X=2-С4Н3О, LG=F, Ζ=F, схема А) и 3-(S)-N-Вос-аминопирролидина. Выход 46%. Т. пл. 241-243°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=300 нм, элюент: А - HCOONH4 (0.2%) рН=6.5, В - MeCN; градиент В 20 → 60% (45 мин): Rt=15.2 мин, чистота 95.1%. УФ-спектр, нм (EtOH): 223, 276, 297, 338, 379, 475. Спектр ЯМР1H (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 8.54 (уш.с, 3Н, NH3+); 8.23 (д, J=11.5, 1Н, Н-5); 8.20 (уш.м, 1Н, C4H3O); 7.84 (т, J=3.8, 1Н, C4H3O); 7.17 (д, J=8.2,1Н, Н-8); 6.82 (дд, J1=3.8, J2=1.7,1Н, C4H3O); 3.98 (д, J=5.9, 2Н, СН2); 3.89-3.87 (м, 1Н, СН2); 3.80-3.78 (м, 1Н, СН); 3.74-3.67 (м, 1Н, СН2); 2.40-2.29 (м, 1H, СН2); 2.22-2.18 (м, 1Н, СН2). Найдено: m/z (ESI), 427.1016. [М+Н]+ C18H15F4N4O4+. Вычислено: 427.1024.
Пример 44
7-(3-(S)-Аминопирролидин-1-ил)-6-фтор-3-трифторметил-2-(2-фуроил)хиноксалин
1,4-диоксида гидрохлорид (7-5f)

Получают по методике, аналогичной приведенной в примере 10, из 6,7-дифтор-3-трифторметил-2-(2-фуроил)хиноксалин 1,4-диоксида (8, X=2-C4H3O, LG=F, Ζ=F, схема А) и 3-(S)-N-Вос-аминопирролидина. Выход 43%. Т. пл. 252-254°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=300 нм, элюент: А - HCOONH4 (0.2%) рН=6.5, В - MeCN; градиент В 20 → 60% (45 мин): Rt=15.1 мин, чистота 95.4%. УФ-спектр, нм (EtOH): 220, 277, 297, 338, 379,474. Спектр ЯМР1H (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 8.54 (уш.с, 3Н, NH3+); 8.23 (д, J=11.5, 1Н, Н-5); 8.20 (уш.м, 1Н, C4H3O); 7.84 (т, J=3.8,1Н, C4H3O); 7.17 (д, J=8.2, 1H, Н-8); 6.82 (дд, J1=3.8, J2=1.7, 1H, C4H3O); 3.98 (д, J=5.9, 2Н, СН2); 3.89-3.87 (м, 1Н, СН2); 3.80-3.78 (м, 1Н, СН); 3.74-3.67 (м, 1Н, СН2); 2.40-2.29 (м, 1Н, СН2); 2.22-2.18 (м, 1Н, СН2). Найдено: m/z (ESI), 427.1004. [М+Н]+ C18H15F4N4O4+. Вычислено: 427.1024.
Пример 45
7-(3-Аминопирролидин-1-ил)-3-трифторметил-2-(2-фуроил)-6-хлорхиноксалин 1,4-диоксида гидрохлорид (7-5g)

Получают по методике, аналогичной приведенной в примере 10, из 6,7-дихлор-3-трифторметил-2-(2-фуроил)хиноксалин 1,4-диоксида (8, X=2-C4H3O, LG=CI, Ζ=Cl, схема А) и 3-(R)-N-Вос-аминопирролидина. Выход 77%. Т. пл. 195-196°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=300 нм, элюент: А - HCOONH4 (0.2%) рН=6.5, В - MeCN; градиент В 20 → 60% (45 мин): Rt=18.5 мин, чистота 95.2%. УФ-спектр, нм (EtOH): 225, 300, 353, 389, 483. Спектр ЯМР1Н (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 8.62 (уш.с, 3Н, NH3+); 8.42 (с, 1H, Н-5); 8.22 (уш.м, 1H, C4H3O); 7.85-7.84 (м, 1Н, C4H3O); 7.31 (с, 1Н, Н-8); 6.82-6.81 (м, 1H, C4H3O); 4.09-4.03 (м, 1Н, СН); 3.93-3.91 (м, 2Н, СН2); 3.89-3.61 (м, 2Н, СН2); 2.35-2.18 (м, 2Н, СН2). Найдено: m/z (ESI), 443.0703. [М+Н]+ C18H15ClF3N4O4+. Вычислено: 443.0728.
Пример 46
6-(3-Аминопирролидин-1-ил)-3-трифторметил-2-(2-фуроил)-7-хлорхиноксалин 1,4-диоксида гидрохлорид (7-5h)

Получают в качестве минорного компонента в синтезе производного 7-5g, описанного в примере 45. Выход 15%. Т. пл. 205-207°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=300 нм, элюент: А - HCOONH4 (0.2%) рН=6.5, В - MeCN; градиент В 20 → 60% (45 мин): Rt=18.9 мин, чистота 95.6%. Спектр ЯМР1H (400 МГц, MDCO4rt-d6), δ, м.д. (J, Гц):. 8.62 (уш.с, 3Н, NH3+); 8.42 (с, 1Н, Н-5); 8.22 (уш.м, 1Н, C4H3O); 7.85-7.84 (м, 1H, C4H3O); 7.31 (с, 1Н, Н-8); 6.82-6.81 (м, 1Н, C4H3O); 4.09-4.03 (м, 1Н, СН); 3.93-3.91 (м, 2Н, СН2); 3.89-3.61 (м, 2Н, СН2); 2.35-2.18 (м, 2Н, СН2). Найдено: m/z (ESI), 443.0715. [М+Н]+ C18H15ClF3N4O4+. Вычислено: 443.0728.
Пример 47
7-(Пиперазин-1-ил)-2-((тиен-2-ил)карбонил)-3-трифторметил-6
-хлоркарбонилхиноксалин 1,4-диоксида гидрохлорид (7-6а)
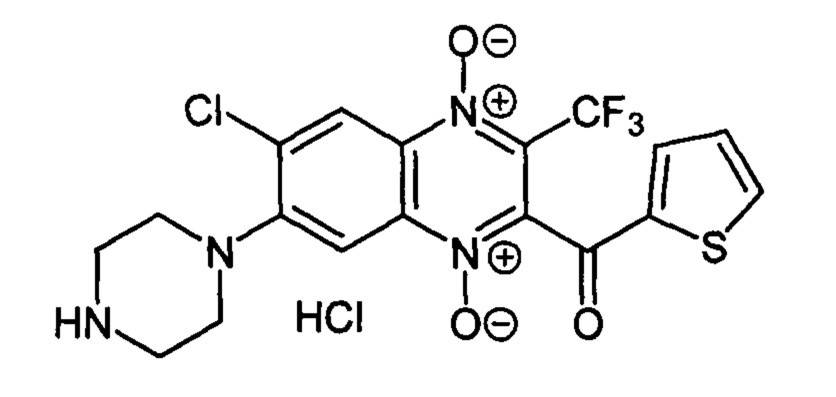
Получают по методике, аналогичной приведенной в примере 1, из 2-((тиен-2-ил)карбонил)-3-трифторметил-6,7-дихлорхиноксалин 1,4-диоксида (8, X=2-C4H3S, LG=Cl, Ζ=Cl, схема А), полученного по методу [Zarranz В. et al. Bioorg. & Med. Chem., 2004, 12, 3711-3721], и пиперазина. Выход 34%. Т. пл. >250°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=300 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 → 80% (45 мин): Rt=13.5 мин, чистота 94.9%. УФ-спектр, нм (EtOH): 220, 245, 380, 495. Найдено: m/z (ESI), 459.0512. [М+Н]+ C18H15ClF3N4O3S+. Вычислено: 459.0500.
Пример 48
2-Изоникотиноил-7-(пиперазин-1 -ил)-3 -трифторметил-6-хлоркарбонилхиноксалин
1,4-диоксида гидрохлорид (7-7а)
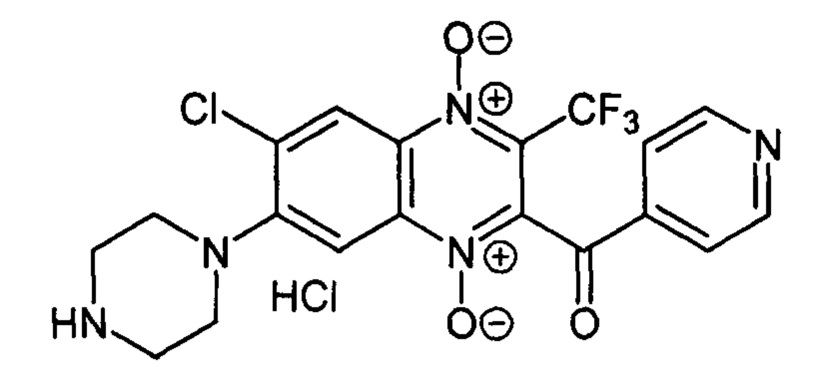
Получают по методике, аналогичной приведенной в примере 1, из 2-(изоникотиноил)-3-трифторметил-6,7-дихлорхиноксалин 1,4-диоксида (8, X=3-C5H4N, LG=Cl, Ζ=Cl, схема А), полученного по методу [Zarranz В. et al. Bioorg. & Med. Chem., 2004, 12, 3711-3721], и пиперазина. Выход 27%. Т. пл. >250°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=300 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20 → 80% (45 мин): Rt=17.9 мин, чистота 95.1%. УФ-спектр, нм (EtOH): 213, 340, 376, 492. Найдено: m/z (ESI), 454.0873. [М+Н]+ C19H16ClF3N5O3+. Вычислено: 454.0888.
Примеры, подтверждающие наличие биологической активности
Пример 49
Ингибирование роста опухолевых клеток в условиях нормоксии и гипоксии 2-ацил-3-трифторметилхиноксалин 1,4-диоксидами
Оценка противоопухолевой активности заявленных соединений 7 проводилась на клеточной линии аденокарциномы молочной железы человека MCF-7 в условия нормоксии и гипоксии, при инкубировании в атмосфере, содержащей 1% кислорода. Данные об антипролиферативной активности (IC50 - концентрация, ингибирующая рост клеток на 50% по сравнению с контролем) в условиях нормоксии и гипоксии; индекс гипоксической цитотоксичности (HCR=IC50(нормоксия) / IC50(гипоксия)), заявленных в изобретении производных формулы 7, включая значения IC50 и HCR для препаратов сравнения - доксорубицина, цисплатина, экспериментального гипоксия-селективного агента тирапазамина и ранее описанного хиноксалин-2-карбонитрил 1,4-диоксида 4 [RU 2640304], приведены в таблице 1. Определение IC50 проводилось с помощью МТТ-теста по стандартной методике, описанной в литературе [Scherbakov А. М. et al. Cancer Invest., 2018, 3, 199-209].
Результаты исследования цитотоксических свойств показывают, что описанные в изобретении соединения, способны в низких микромолярных и субмикромолярных концентрация воздействовать на опухолевые клетки. Полученные данные доказывают, что активность полученных производных, в большинстве случаев, превосходит активность препаратов сравнения цисплатина и доксорубицина как в условиях гипоксии, так и условиях нормоксии, а также имеют более высокий индекс гипоксической цитотоксичности (HCR). Кроме того, большинство производных 3-трифторметилхиноксалин 1,4-диоксида 7 более эффективно ингибируют пролиферацию клеток аденокарциномы молочной железы MCF-7, находящихся как в условии нормоксии, так и в условиях гипоксии, чем препарат сравнения тирапазамин и ранее описанный водорастворимый хиноксалин-2-карбонитрил 1,4-диоксид 4.
Стоит отметить, что в отличие от ранее описанных в литературе 3-трифторметилхиноксалин 1,4-диоксидов (например, соединение 5 [Zarranz В. et al. Bioorg. & Med. Chem., 2004, 12, 3711-3721]), производные формулы 7, являющиеся предметом настоящего изобретения, обладают высокой растворимостью в фармакологически-приемлемых водных средах, что значительно упрощает их практическое применение в медицине.




Пример 50
Способность 2-ацил-3-трифторметилхиноксалин 1,4-диоксидов подавлять рост различных типов опухолевых клеток
Сравнительное исследование цитотоксичности соединений общей формулы 7 и их ранее описанных хиноксалин-2-карбонитрил 1,4-диокидов (производное 4, RU 2640304) проводилось в тестах in vitro на культурах клеток аденокарциномы поджелудочной железы Capan-1, хронической миелоидной лейкемии Нар-1, аденокарциномы толстой кишки НСТ-116, немелкоклеточной карциномы легкого NCI-H460, промиелоцитарного лейкоза человека HL-60 и лимфолейкоза человека K562. Данные об антипролиферативной активности (IC50 - концентрация, ингибирующая рост клеток на 50%) представлены в таблице 2. Определение IC50 проводилось с помощью МТТ-теста по стандартной методике, описанной в литературе [MossmanT. J. Immunol. Methods, 1983, 65, 55].
Из полученных результатов видно, что заявленные 3-трифторметилхиноксалин 1,4-диоксиды формулы 7 ингибируют рост опухолевых клеток в низких микромолярных и субмикромолярных концентрациях. Более того, цитотоксичность полученных соединений формулы 7 (7-2а, 7-2с и 7-3а) в 2-10 раз выше, чем для их водорасторимого аналога формулы 4, антипролиферативные свойства которого описаны ранее [RU 2640304].

Реферат
Изобретение относится к новым производным 3-трифторметилхиноксалин 1,4-диоксида, содержащим остаток диамина в бензольном фрагменте хиноксалинового цикла, а также его фармакологически приемлемые соли, гидраты, соответствующим формуле:. Технический результат: получены новые производные 3-трифторметилхиноксалин 1,4-диоксида, способные ингибировать деление опухолевых клеток. 2 н. и 7 з.п. ф-лы, 2 табл., 50 пр.
Формула

Документы, цитированные в отчёте о поиске
Производные 1,4-диоксида хиноксалин-2-карбонитрила, ингибирующие рост опухолевых клеток

Комментарии