Контролируемое высвобождение фенольных опиатов - RU2469038C2
Код документа: RU2469038C2
Чертежи


Описание
Настоящее изобретение заявляет преимущество предварительной патентной заявки US №60/809082, зарегистрированной 26 мая 2006 г. и предварительной патентной заявки US №60/901795, зарегистрированной 16 февраля 2007 г., содержание которых включено сюда полностью.
Область техники, к которой относится изобретение
Настоящее изобретение относится к контролируемому высвобождению фенольных опиатов. Более конкретно оно относится к способу предоставления пациентам контролируемого высвобождения фенольных опиатов с применением пролекарства, имеющего определенный заместитель фенольного атома водорода, к пролекарствам фенольных опиатов и к фармацевтическим композициям, включающим пролекарства.
Уровень техники
Системы доставки часто являются важными для безопасного введения активных агентов, например лекарств. Часто системы доставки могут оптимизировать биологическую доступность, улучшить воспроизводимость дозировки и улучшить контактность больного (например, путем снижения частоты введения доз). Решения задач доставки лекарства и/или биологической доступности в фармацевтических разработках включают превращение известных лекарств в пролекарства. Обычно в молекуле пролекарства полярную функциональную группу активного агента (например, карбоновую кислоту, аминогруппу, фенольную группу, сульфгидрильную группу и т.д.) маскируют специальной группой (прогруппой), лабильной в физиологических условиях. Соответственно, пролекарства обычно переносятся через гидрофобные биологические барьеры, например мембраны, и могут обладать превосходящими физико-химическими свойствами по сравнению с исходным лекарством. Пролекарства обычно являются нетоксичными и в идеале избирательно расщепляются по месту действия лекарства. Предпочтительно, отщепление прогруппы происходит быстро и количественно с образованием нетоксичных побочных продуктов (например, гидролизованной прогруппы).
Пролекарства, как описано выше, могут предоставлять пациентам безопасное и эффективное лечение, если пациенты следуют инструкциям лечащего врача. К сожалению, пациенты не всегда следуют инструкциям, которые они получают. Они могут случайно принять повышенную дозу пролекарства или намеренно злоупотреблять им, например путем приема повышенной дозы, путем инъецирования или вдыхания его или путем применения легкодоступных химикатов из домашнего хозяйства (например, уксуса или питьевой соды) для получения активного лекарства из пролекарства. Злоупотребление имеет особое значение в случае пролекарств (предшественников) опиатов, которые при правильном употреблении применяют для лечения боли.
Есть потребность в пролекарстве опиата, которое обладало бы встроенным контролем, так чтобы было затруднительно применять пролекарство не с той целью, для которой оно предназначено.
Раскрытие изобретения
Теперь найден способ создания такой конфигурации пролекарства фенольного опиата, которая обеспечивает контролируемое высвобождение лекарства.
Фенольные опиаты образуют подгруппу опиатов и включают часто прописываемые лекарства гидроморфон, оксиморфон и морфин.
В одном аспекте настоящее изобретение предоставляет способ обеспечения пациента фенольным опиатом, активируемым после введения и с контролируемым высвобождением, включающий введение упомянутому пациенту соответствующего соединения, в котором фенольный атом водорода замещен разделительной отходящей группой, несущей нуклеофильный азот, который защищен ферментативно-отщепляемым звеном, где конфигурация разделительной отходящей группы и нуклеофильного азота таковы, что при ферментативном отщеплении отщепляемой части нуклеофильный азот может образовать циклическую мочевину, карбамат или тиокарбамат, освобождая соединение от разделительной отходящей группы, что предоставляет пациенту контролируемое высвобождение фенольного опиата.
В другом аспекте настоящее изобретение предоставляет получение лекарственного средства для предоставления пациенту фенольного опиата, активируемого после введения и с контролируемым высвобождением, где активное вещество является соответствующим соединением, в котором фенольный атом водорода замещен разделительной отходящей группой, несущей нуклеофильный азот, который защищен ферментативно-отщепляемым звеном, где конфигурация разделительной отходящей группы и нуклеофильного азота таковы, что при ферментативном отщеплении отщепляемой части нуклеофильный азот может образовать циклическую мочевину, карбамат или тиокарбамат, освобождая соединение от разделительной отходящей группы, что предоставляет пациенту контролируемое высвобождение фенольного опиата.
Соответствующее соединение (пролекарство согласно настоящему изобретению) предоставляет активируемое после введения контролируемое высвобождение фенольного опиата, поскольку оно нуждается в ферментативном расщеплении для начала высвобождения соединения и поскольку скорость высвобождения опиата зависит как от скорости ферментативного расщепления, так и от скорости реакции циклизации. Соответственно, пролекарство обладает пониженной подверженностью случайной передозировке или злоупотреблению путем ли преднамеренной передозировки, введения ли неподходящим способом, например путем инъекции, или путем химической модификации с применением легкодоступных в домашнем хозяйстве химикатов. Пролекарство устроено так, что оно не приведет к избыточно высоким концентрациям в плазме активного лекарства, если его применяют неправильно, и его непросто подвергать разложению для получения активного вещества другим способом кроме ферментативного расщепления.
Фермент, способный отщеплять ферментативно-отделяемую часть молекулы, может быть пептидазой, когда ферментативно-отщепляемая часть связана с нуклеофильным азотом через амидную связь (например, пептидную связь -NHCO-). В отдельных осуществлениях фермент является пищеварительным ферментом, например пепсином, трипсином, химотрипсином, колипазой, эластазой, аминопептидазой N, аминопептидазой А, дипептидиламинопептидазой IV, трипептидазой или энтеропептидазой. Соответственно, в одном осуществлении способа соответствующее соединение вводят пациенту перорально.
Ферментативно-отщепляемая часть, связанная с нуклеофильным азотом через амидную связь, может быть, например, остатком аминокислоты, или пептидом, или (α)N-ацильным производным аминокислоты или пептида (например, N-ацильным производным фармацевтически приемлемой карбоновой кислоты, например, N-ацетильным производным.). Пептид может содержать, например, до 10 аминокислотных остатков. Например, он может быть дипептидом или трипептидом. Каждая аминокислота может быть преимущественно природной D- или L-аминокислотой (например, L-аминокислотой). Примерами встречающихся в природе аминокислот являются аланин, аргинин, аспарагин, аспарагиновая кислота, цистеин, глицин, глутамин, глутаминовая кислота, гистидин, изолейцин, лейцин, метионин, фенилаланин, пролин, серин, треонин, триптофан, тирозин, лизин и валин. Соответственно, примеры ферментативно-отщепляемых звеньев включают остатки L-аминокислот, перечисленных выше, и их N-ацетильные производные, а также дипептиды или трипептиды, образованные из двух или трех вышеперечисленных L-аминокислот и их N-ацетильных производных.
Циклическая группа, образуемая при высвобождении фенольного опиата, является фармацевтически приемлемой, в частности фармацевтически приемлемой циклической мочевиной, карбаматом или тиокарбаматом. Понятно, что циклические мочевины, в частности, очень стабильны и обладают низкой токсичностью.
В одном конкретном осуществлении изобретения разделительная отходящая группа, несущая нуклеофил, защищенный отщепляемым звеном, является группой формулы -C(O)-N(CH3)-(CH2)2-NH(R4), где R4 является ферментативно-отщепляемым звеном, связанным с группой NH через амидную связь. Когда N-R4 амидная связь расщепляется ферментативно, нуклеиофильный азот (-NH2) освобождается и вступает в реакцию циклизации с карбонильной группой, образуя циклическую мочевину и высвобождая фенольный опиат.
В основном, разделительной группой может быть любая группа, способная образовывать циклическую мочевину, карбамат или тиокарбамат, когда фенольный опиат вытесняется нуклеофильным азотом. Соответственно, разделительной группой может быть, например, группа формулы -C(O)-Y-L-N-(R3)(R4), в которой
Y является -NR5-, -О- или -S-;
L является незамещенным или замещенным алкилом, алкенилом, алкинилом, карбоциклической или гетероциклической группой или комбинацией двух или более таких групп, связанных вместе одинарной связью, спиро-связкой, одинарной или двойной связью или через С=O, О, S, SO, SO2, CONH, NHCO или NH связку;
каждый из R3 и R4 независимо является водородом, алкилом, замещенным алкилом, арилом или замещенным арилом;
R4 является ферментативно-отщепляемым звеном, связанным с азотом группы NR через амидную связь.
В одном осуществлении R4 является группой формулы

где:
каждый R6 независимо является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом, или при необходимости R6 и R7вместе с атомами, к которым они присоединены, образуют циклогетероалкил или замещенный циклогетероалкил;
R7 является водородом, алкилом, замещенным алкилом, ацилом, замещенным ацилом, алкоксикарбонилом, замещенным алкоксикарбонилом, арилом, замещенным арилом, арилалкилом или замещенным арилалкилом;
p является целым числом от 1 до 5;
каждая W независимо является -NR8-, -О- или -S-;
каждый R8 независимо является водородом, алкилом, замещенным алкилом, арилом или замещенным арилом, или при необходимости каждый R6 и R8 независимо вместе с атомами, к которым они присоединены, образуют циклогетероалкил или замещенный циклогетероалкил.
Понятно, что когда W является NH и R7 является Н или ацилом, то R4 является остатком аминокислоты или пептида, или его N-ацильным производным. Когда W является NR8, R7 является Н или ацилом, и R6 и R8 вместе с атомами, к которым они присоединены, образуют кольцо пирролидина, то R4 является остатком пролина или его N-ацильным производным.
Соответственно, в другом осуществлении R4 является остатком D- или L-аминокислоты (например, L-аминокислоты), выбранной из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глицина, глутамина, глутаминовой кислоты, гистидина, изолейцина, лейцина, метионина, фенилаланина, пролина, серина, треонина, триптофана, тирозина, лизина и валина, остатком дипептида или трипептида, состоящего из двух или трех D- или L-аминокислотных остатков (например, L-аминокислотных остатков), независимо выбранных из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глицина, глутамина, глутаминовой кислоты, гистидина, изолейцина, лейцина, метионина, фенилаланина, пролина, серина, треонина, триптофана, тирозина, лизина и валина или остатков их N-ацильных производных, например N-ацетильным производным.
В одном осуществлении L является незамещенной или замещенной 1,2-фениленовой группой. Например, Y-L-NR3 вместе могут образовывать группу 1,2-диаминофенилена, являющуюся незамещенной или замещенной по фениленовому циклу одним или двумя заместителями, выбранными из атомов галогенов, (1-4С)алкила и (1-4С)алкокси.
В другом осуществлении L является двухвалентной группой формулы
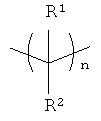
где
n является целым числом от 1 до 10 и
каждый из R1 и R2 независимо является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, или R1 и R2 вместе с углеродом, к которому они присоединены, образуют циклоалкил или замещенным циклоалкил, или две R1 или R2 группы на соседних атомах углерода вместе с атомами углерода, к которым они присоединены, могут образовать циклоалкил или замещенный циклоалкил.
Соответственно, в одном осуществлении разделительная отходящая группа, несущая нуклеофильный атом, защищенный с помощью отщепляемого звена, представлена формулой -C(O)-Y-(C(R1)(R2))n-N(R3)(R4); разделительная отходящая группа соответствует группе -C(O)-Y-(C(R1)(R2))n-, нуклеофильный атом азота, защищенный отщепляемым звеном, соответствует группе -N-H(R3)(R4), и отщепляемое звено, соответствует группе R4, где
Y является -NR5-, -О- или -S-;
n является целым числом от 1 до 10 и
каждый из R1, R2, R3 и R5 независимо является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, или R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют циклоалкил или замещенный циклоалкил, или две R1 или R2 группы на соседних атомах углерода вместе с атомами углерода, к которым они присоединены, могут образовать циклоалкил или замещенный циклоалкил;
R4 является

каждый R6 независимо является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом, или при необходимости R6 и R7вместе с атомами, к которым они присоединены, образуют циклогетероалкил или замещенный циклогетероалкил;
R7 является водородом, алкилом, замещенным алкилом, ацилом, замещенным ацилом, алкоксикарбонилом, замещенным алкоксикарбонилом, арилом, замещенным арилом, арилалкилом или замещенным арилалкилом;
p является целым числом от 1 до 5;
каждая W независимо является -NR8-, -О- или -S-;
каждый R8 независимо является водородом, алкилом, замещенным алкилом, арилом или замещенным арилом, или при необходимости каждый R6 и R8 независимо вместе с атомами, к которым они присоединены, образуют циклогетероалкил или замещенный циклогетероалкил.
Так, если ХН представляет фенольный опиат, который высвобождается, то соответствующее соединение можно представить основной формулой (I)

и циклическую мочевину, карбамат или тиоцианат можно представить формулой
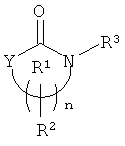
В одном осуществлении каждый из R1, R2, R3 и R5 независимо является водородом, алкилом, замещенным алкилом, арилом или замещенным арилом.
В другом осуществлении R6 является боковым атомом или группой природной аминокислоты, например, Н (у глицина), -CH2(CH2)NH2 (у лейцина), CH2CH2CH2NHC(NH)NH2 (из аргинина), 4-гидроксибензил (у тирозина), CH2COOH (у аспарагиновой кислоты) или CH2CH2COOH (у глютаминовой кислоты).
В другом осуществлении R7 является атомом водорода или незамещенной или замещенной ацильной группой, например (1-6С)алканоилом, например ацетилом или трет-бутаноилом; бензоилом, незамещенным или замещенным метилендиокси или одним или двумя заместителями, выбранными из (1-4С)алкила, (1-4С)алкокси или галогена, например бензоилом или пиперонилом; CONRxRy, в которой Rx и Ry независимо являются водородом или (1-4С)алкилом, например CONH2 или гемикислотой или гемиэфиром, например СН2СН2СООН или CH2CH2COOEt. Незамещенная или замещенная группа предпочтительно является остатком фармацевтически приемлемой карбоновой кислоты.
Примерами конкретных значений являются:
для Y:-NR5-,
для R5: (1-4С)алкил, например -СН3,
для L: -СН2СН2-,
для R1 и R2: водород или (1-4С)алкил, например -СН3, более конкретно водород,
для n: 2 или 3,
для R3: водород или (1-4С)алкил, например -СН3,
для W: NH,
для R6: водород, -СН2(СН2)3NH2, CH2CH2CH2NHC(NH)NH2, 4-гидроксибензил, СН2СООН или CH2CH2COOH,
для R7: водород, (1-6С)алканоил, например ацетил или трет-бутаноил; при необходимости замещенный бензоил, например бензоил, незамещенный или замещенный метилендиокси или одним, или двумя заместителями, выбранными из (1-4С)алкила, (1-4С)алкокси или галогена, например бензоил или пиперонил, в частности водород или ацетил;
для циклогетероалкила или замещенного циклогетероалкила, образованного R6 и R8 вместе с атомами, к которым они присоединены: пирролидинил,
для p: 1 или 2,
для R4: аргинин, N-ацетиларгинин, N-трет-бутаноиларгинин, N-бензоиларгинин, N-пиперониларгинин, N-глициниларгинин, лизин, глутаминовая кислота, аспарагиновая кислота, тирозин, пролин и N-глицинилпролин.
Обычно соответствующее соединение (пролекарство согласно изобретению) вводят орально. Однако в отдельных осуществлениях предусмотрена возможность другого пути введения.
Каждое соответствующее соединение может иметь свой профиль высвобождения, где скорость высвобождения фенольного опиата зависит от скорости отщепления отщепляемого звена и скорости протекания реакции внутримолекулярной циклизации с участием нуклеофильного азота, т.е. реакции высвобождения, таким образом, представляющей фенольный опиат. Соответственно, одно осуществление способа включает введение разнообразных соответствующих соединений пациенту, где у каждого соответствующего соединения имеется своя отличная разделительная отходящая группа и/или свое отличное отщепляемое звено, так чтобы предоставить пациенту отличное от другого контролируемое высвобождение фенольного опиата.
Конкретные примеры фенольных опиатов включают оксиморфон, гидроморфон, морфин и их производные. Следует особо отметить оксиморфон, гидроморфон и морфин. Другими примерами фенольных опиатов являются бупренорфин, дигидроэторфин, дипренорфин, эторфин и леворфанол.
Пролекарство можно вводить само по себе или его можно вводить совместно с одним или более другим активным агентом. В одном осуществлении их можно вводить совместно с периферическим антагонистом опиатов, таким как (R)-N-метилналтрексон (N-MTX) или его пролекарством. Специалисту в данной области понятно, что (R)-N-метилналтрексон является антагонистом действия опиатов, таких как гидроморфон, оксиморфон и морфин, но не может пересекать гематоэнцефалический барьер. Поэтому он является антагонистом только их периферического действия, являющегося нежелательным, но не их действия на центральную нервную систему, как, например, ослабление боли, которое является желательным. В одном осуществлении пролекарство (R)-N-метилналтрексона является соединением формулы (I), где X представляет фенольный остаток (R)-N-метилналтрексона, Y, R1, R2, R3, n имеют любое значение из приведенных выше и R4 является водородом или имеет любое значение из приведенных выше. Такое пролекарство можно вводить орально. Соединения, в которых R4 имеет любое значение из вышеприведенных, предпочтительно высвобождают (R)-N-метилналтрексон таким способом, как пролекарство опиата высвобождает опиат, в качестве антагониста которого их применяют. Такие соединения можно включать в составы для совместного введения с пролекарством опиата согласно настоящему изобретению, например, в фармацевтическую композицию, включающую оба соединения и фармацевтически приемлемый носитель. Понятно, что исходное лекарство, (R)-N-метилналтрексон обладает плохой биологической доступностью при оральном введении и обычно нуждается в парентеральном введении. Так, пролекарства (R)-N-метилналтрексона согласно настоящему изобретению применимы в таком случае, когда необходима терапия с оральным введением (R)-N-метилналтрексона.
В другом аспекте настоящее изобретение предоставляет пролекарство оксиморфона, гидроморфона или морфина, способное предоставлять оксиморфон, гидроморфон или морфин с активированным после введения контролируемым высвобождением. Соответственно, настоящее изобретение предоставляет соединение структурной формулы (I):

или его соль, гидрат или сольват, где
Х является оксиморфоном, гидроморфоном или морфином, где атом водорода гидроксильной группы фенола замещен ковалентной связью с -C(O)-Y-(C(R1)(R2))n-N-(R3)(R4),
Y является -NR5-, -О- или -S-;
n является целым числом от 1 до 4,
каждый из R1, R2, R3 и R5 независимо является водородом, алкилом, замещенным алкилом, арилом или замещенным арилом, или R1 и R2 вместе с углеродом, к которому они присоединены, образуют циклоалкил или замещенный циклоалкил, или две R1 или R2 группы на соседних атомах углерода вместе с атомами углерода, к которым они присоединены, могут образовать циклоалкил или замещенный циклоалкил,
R4 является

каждый R6 независимо является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом, или при необходимости R6 и R7 вместе с атомами, к которым они присоединены, образуют циклогетероалкил или замещенный циклогетероалкил;
R7 является водородом, алкилом, замещенным алкилом, ацилом, замещенным ацилом, алкоксикарбонилом, замещенным алкоксикарбонилом, арилом, замещенным арилом, арилалкилом или замещенным арилалкилом;
p является целым числом от 1 до 10;
каждая W независимо является -NR8-, -О- или -S-;
каждый R8 независимо является водородом, алкилом, замещенным алкилом, арилом или замещенным арилом, или при необходимости каждый R6 и R8 независимо вместе с атомами, с которыми они связаны, образуют циклогетероалкил или замещенный циклогетероалкил.
Например, когда Х является остатком гидроморфона, соединение формулы (I) имеет структуру
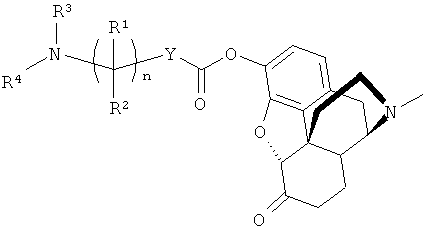
В одном осуществлении Х является гидроморфоном иди оксиморфоном. В другом осуществлении Х является морфином.
В другом аспекте настоящее изобретение предоставляет соединение формулы (I)

или его соль, гидрат или сольват, где
Х является (R)-N-метилналтрексоном, где атом водорода гидроксильной группы фенола замещен ковалентной связью с -C(O)-Y-(C(R1)(R2))n-N-(R3)(R4) и Y, R1, R2 n, R3 и R4 имеют значения, как приведено выше.
В другом аспекте предоставлены фармацевтические композиции, обычно включающие одно или более соединение формулы (I), его соль, гидрат или сольват, и фармацевтически приемлемое средство доставки, например растворитель, носитель, наполнитель или вспомогательное вещество. Выбор растворителя, носителя, наполнителя и вспомогательного вещества зависит помимо других факторов от требуемого способа введения.
В дополнительном аспекте предоставлены способы лечения или предотвращения различных заболеваний или нарушений. Способы обычно включают введение пациенту, которому необходимо лечение или предотвращение, терапевтически эффективного количества соединения формулы (I) и/или включающей его фармацевтической композиции.
Краткое описание фигур
Фигура 1 показывает изменение во времени концентрации в плазме высвобожденного N-MTX после орального введения (РО) дозы у крыс.
Фигура 2 показывает изменение во времени концентрации в плазме высвобожденного гидроморфона и N-MTX после орального введения (РО) дозы пролекарства у крыс.
Осуществление изобретения
Как применяется здесь, термин «алкил» сам по себе или как часть другого заместителя относится к насыщенному разветвленному или неразветвленному одновалентному углеводородному радикалу, полученному путем удаления одного атома водорода от одного углеродного атома в исходном алкане. Типичные алкильные группы включают, не ограничиваясь этим, метил, этил, пропилы, например пропан-1-ил или пропан-2-ил, и бутилы, например бутан-1-ил, бутан-2-ил, 2-метил-пропан-1-ил или 2-метил-пропан-2-ил.
В отдельных осуществлениях алкильная группа включает от 1 до 20 атомов углерода. В других осуществлениях алкильная группа включает от 1 до 10 атомов углерода. В дополнительных осуществлениях алкильная группа включает от 1 до 6 атомов углерода, например от 1 до 4 атомов углерода.
«Алкенил» сам по себе или как часть другого заместителя относится к ненасыщенному разветвленному, неразветвленному или циклическому алкильному радикалу, имеющему по меньшей мере одну двойную связь между атомами углерода, полученному путем удаления одного атома водорода от одного углеродного атома в исходном алкене. Группа может иметь цис- или транс-конформацию относительно двойной связи (связей). Типичные алкенильные группы включают, не ограничиваясь этим, этенил, пропенилы, например проп-1-ен-1-ил, проп-1-ен-2-ил, проп-2-ен-1-ил (аллил), проп-2-ен-2-ил, циклопроп-1-ен-1-ил, циклопроп-2-ен-1-ил, бутенилы, например бут-1-ен-1-ил, бут-1-ен-2-ил, 2-метил-проп-1-ен-1-ил, бут-2-ен-1-ил, бут-2-ен-2-ил, бута-1,3-диен-1-ил, бута-1,3-диен-2-ил, циклобут-1-ен-1-ил, циклобут-1-ен-3-ил, циклобута-1,3-диен-1-ил и т.д., и т.п.
«Алкинил» сам по себе или как часть другого заместителя относится к ненасыщенному разветвленному, неразветвленному или циклическому алкильному радикалу, имеющему по меньшей мере одну тройную связь между атомами углерода, полученному путем удаления одного атома водорода от одного углеродного атома в исходном алкине. Типичные алкинильные группы включают, не ограничиваясь этим, этинил, пропинилы, например проп-1-ин-1-ил, проп-2-ин-1-ил и т.д., бутинилы, например бут-1-ин-1-ил, бут-1-ин-3-ил, бут-3-ин-1-ил и т.д., и т.п.
«Ацил» сам по себе или как часть другого заместителя относится к радикалу - C(O)R30, где R30 является водородом, алкилом, циклоалкилом, циклогетероалкилом, арилом, арилалкилом, гетероалкилом, гетероарилом, гетероарилалкилом, как определено выше. Представительные примеры включают, не ограничиваясь этим, формил, ацетил, трет-бутаноил, циклогексилкарбонил, циклогексилметилкарбонил, бензоил, пиперонил, бензилкарбонил и т.п.
«Алкокси» сам по себе или как часть другого заместителя относится к радикалу -OR31, где R31 представляет алкильную или циклоалкильную группу, как определено выше. Представительные примеры включают, не ограничиваясь этим, метокси, этокси, пропокси, бутокси, циклогексилокси и т.п.
«Алкоксикарбонил» сам по себе или как часть другого заместителя относится к радикалу -C(O)R31, где R31 представляет алкильную или циклоалкильную группу, как определено выше. Представительные примеры включают, не ограничиваясь этим, метоксикарбонил, этоксикарбонил, пропоксикарбонил, бутоксикарбонил, циклогексилоксикарбонил и т.п.
«Арил» сам по себе или как часть другого заместителя относится к одновалентному ароматическому углеводородному радикалу, полученному путем удаления одного атома водорода от одного углеродного атома в исходном ароматическом цикле. Типичные арильные группы включают, не ограничиваясь этим, группы, полученные из ацеантрилена, аценафтилена, ацефенантрилена, атрацена, азулена, бензола, хризена, коронена, фторантрена, фторена, гексацена, гексафена, гексалена, as-индацена, s-индацена, индана, индена, нафталина, октацена, октафена, окталена, овалена, пента-2,4-диена, пентацена, пенталена, пентафена, перилена, феналена, фенантрена, пицена, плейадена, пирена, пирантрена, рубисена, трифенилена, тринафталина и т.п. В отдельных осуществлениях арильная группа включает от 6 до 20 атомов углерода. В других осуществлениях арильная группа включает от 6 до 12 атомов углерода. Примерами арильных групп являются фенил и нафтил.
«Арилалкил» сам по себе или как часть другого заместителя относится к нециклическому алкильному радикалу, в котором один из водородных атомов, связанных с атомом углерода, обычно с концевым или с sp3 атомом углерода, замещен арильной группой. Типичные арилалкильные группы включают, не ограничиваясь этим, бензил, 2-фенилет-1-ил, нафтилметил, 2-нафтилет-1-ил, нафтобензил, 2-нафтофенилет-1-ил и т.п. В отдельных осуществлениях арилалкильная группа является (С7-С30) арилалкилом, например алкильная часть арилалкильной группы является (C1-С10) и арильная часть является (С6-С20). В других осуществлениях арилалкильная группа является (C7-C20) арилалкилом, например алкильная часть арилалкильной труппы является (C1-C8) и арильная часть является (С6-С12).
Соединения можно идентифицировать по их химической структуре и/или по их химическому названию. Соединения, описанные здесь, могут содержать один или более хиральный центр и/или двойную связь и поэтому могут существовать в виде стереоизомеров, например изомеров по двойной связи (например, геометрических изомерорв), энантиомеров или диастереомеров. Соответственно, все возможные энантиомеры и стереоизомеры соединений, включая чистые с точки зрения стереоизомерии формы (например, чистые геометрические изомеры, чистые энантиомеры или чистые диастереомеры) и смеси энантиомеров и стереоизомеров, включены в описание соединений согласно изобретению. Смеси энантиомеров и стереоизомеров можно разделять на отдельные компоненты энантиомеров и стереоизомеров с помощью способов разделения или способов хирального синтеза, хорошо известных специалисту в данной области техники. Соединения могут также находиться в нескольких таутомерных формах, включая енольную форму, кето-форму и их смесь. Соответственно, химические структуры, приведенные здесь, охватывают все возможные таутомерттные формы рассматриваемых соединений. Описанные соединения также включают соединения, помеченные изотопами, где один или более атом имеет атомную массу, отличную от атомной массы, обычно обнаруживаемой в природе. Примеры изотопов, которые можно включать в соединения, раскрытые здесь, включают, не ограничиваясь этим,2Н,3Н,11С,13С,15N,18O,17O и т.д. Соединения могут находиться как в несольватированных формах, так и в сольватированных формах, включая гидратированные формы. Отдельные соединения могут находиться во множественных кристаллических или в аморфной форме. Обычно, все физические формы являются эквивалентными для применения, рассматриваемого здесь, и охвачены областью притязаний настоящего изобретения.
«Циклоалкил» сам по себе или как часть другого заместителя относится к насыщенному циклическому алкильному радикалу. Типичные циклоалкильные группы включают, не ограничиваясь этим, группы, полученные из циклопропана, циклобутана, циклопентана, циклогексана и т.п. В отдельных осуществлениях циклоалкильная группа является (С3-С10) циклоалкилом. В других осуществлениях циклоалкилная группа является (С3-С7) циклоалкилом.
«Циклогетеролкил» сам по себе или как часть другого заместителя относится к насыщенному циклическому алкильному радикалу, в котором один или более углеродный атом (и любой связанный с ним атом водорода) независимо замещены одинаковыми или разными гетероатомами. Типичные гетероатомы, замещающие атомы углерода, включают, не ограничиваясь этим, N, Р, О, S, Si и т.д. Типичные циклогетероалкильные группы включают, не ограничиваясь этим, группы, полученные из эпоксидов, азиринов, тииранов, имидазолидина, морфолина, пиперазина, пиперидина, пиразолидина, пирролидина, хинуклидина и т.п.
«Гетероалкил, гетероалкенил и гетероалкинил» сами по себе или как части другого заместителя относятся к алкильным, алкенильным или алкинильным группам соответственно, в которых один или более атом углерода (и любой связанный с ним водородный атом) независимо замещены одинаковыми или разными гетероатомными группами. Типичные гетероатомные группы, которые можно включать в эти группы, включают, не ограничиваясь этим, -O-, -S-, -O-O-, -S-S-, -O-S-, NR37R38-, =N-N=, -N=N-, -N=N-NR39R40, -PR41-, -P(O)2-, FOR42-, -O-P(O)2-, -SO-, SO2-, SnR43R44- и подобные, где R37, R38, R39, R40, R41, R42, R43 и R44 независимо являются водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, циклоалкилом, замещенным циклоалкилом, циклогетероалкилом, замещенным циклогетероалкилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом или замещенным гетероарилалкилом.
«Гетероарил» сам по себе или как часть другого заместителя относится к одновалентному гетероароматическому радикалу, полученному путем удаления одного атома водорода от одного атома в исходной гетероароматической циклической системе. Типичные гетероарильные группы включают, не ограничиваясь этим, группы, полученные из акридина, арсиндола, карбазола, β-карболина, хромана, хромена, синнолина, фурана, имидазола, индазола, индола, индолина, индолизина, изобензофурана, изохромена, изоиндола, изоиндолина, изохинолина, изотиазола, изоксазола, нафтиридина, оксадиазола, оксазола, перимидина, фенантридина, фенантролина, феназина, фталазина, преридина, пурина, пирана, пиразина, пиразола, пиридазина, пиридина, пиримидина, пиррола, пирролизина, хиназолина, хинолина, хинолизина, хиноксалина, тетразола, тиадиазола, тиазола, тиофена, триазола, ксантина и т.п. В отдельных осуществлениях гетероарильная группа является 5-20-членным гетероарилом. В других осуществлениях гетероарильная группа является 5-10-членным гетероарилом. В дополнительных осуществлениях гетероарильная группа является производным тиофена, пиррола, бензотиофена, бензофурана, индола, пиридина, хинолина, имидазола, оксазола и пиразина.
«Гетероарилалкил» сам по себе или как часть другого заместителя относится к нециклическому алкильному радикалу, в котором один из водородных атомов, связанных с атомом углерода, обычно с концевым или с sp3 атомом углерода, замещен гетероарильной группой. В отдельных осуществлениях гетероарилалкильная группа является 6-30-членным гетероарилалкилом, например алкильная часть гетероарилалкила является 1-10-членной и гетероарильная часть является 5-20-членным гетероарилом. В других осуществлениях гетероарилалкильная группа является 6-20-членным гетероарилалкилом, например алкильная часть гетероарилалкила является 1-8-членной и гетероарильная часть является 5-12-членным гетероарилом.
«Опиат» относится к химическому веществу, проявляющему свое фармакологическое действие путем взаимодействия с опиатными рецепторами, предоставляя пациентам облегчение боли. «Фенольный опиат» относится к подгруппе опиатов, содержащих фенольную группу. Примеры фенольных опиатов включают бупренорфин, дигидроэторфин, дипренорфин, эторфин, гидроморфон, леворфанол, морфин и оксиморфон. «Антагонист опиата» является соединением, проявляющим антагонизм по отношению к фармакологическому действию опиата. Термин включает антагонисты фенольных опиатов. Примеры антагонистов фенольных опиатов включают налтрексон, налоксон и (R)-N-метилналтрексон. «Периферический опиатный антагонист» является соединением, неспособным проникать через гематоэнцефалический барьер и в связи с этим способным проявлять антагонистическое действие только в отношении (нежелательного) действия опиатов вне центральной нервной системы. Примером периферического антагониста опиатов является (R)-N-метилналтрексон.
«Исходная ароматическая циклическая система» сама по себе или как часть другого заместителя относится к ненасыщенной циклической или полициклической системе, обладающей сопряженной системой π-электронов. Конкретно включены в определение «исходной ароматической циклической системы» системы сопряженных колец, в которых одно или более из колец является ароматическим и одно или более из колец является насыщенным или ненасыщенным, например фторен, индан, инден, фенален и т.д. Типичные исходные ароматические циклические системы включают, не ограничиваясь этим, ацеантрилен, аценафтилен, ацефенантрилен, антрацен, азулен, бензол, хризен, коронен, фторантренен, фторен, гексафен, гексален, as-индацен, s-индацен, индан, инден, нафталин, октацен, октафен, октален, овален, пента-2,4-диен, пентацен, пентален, пентафен, перилен, фенален, фенантрен, пицен, плейаден, пирен, пирантрен, рубисен, трифенилен, тринафталин и т.п.
«Исходная гетероароматическая циклическая система» сама по себе или как часть другого заместителя относится к исходной ароматической циклической системе, в которой один или более углеродный атом (и любой связанный с ним атом водорода) независимо замещены одинаковыми или разными гетероатомами. Типичные гетероатомы, замещающие атомы углерода, включают, не ограничиваясь этим, N, Р, О, S, Si и т.д. Конкретно включенными в определение «исходной гетероароматической циклической системы» являются системы сопряженных колец, в которых одно или более из колец является ароматическим и одно или более из колец является насыщенным или ненасыщенным, например арсиндол, бензодиоксан, бензофуран, хроман, хромен, индол, индолин, ксантин и т.д. Типичные исходные гетероароматические циклические системы включают, не ограничиваясь этим, арсиндол, карбазол, β-карболин, хроман, хромен, синнолин, фуран, имидазол, индазол, индол, индолин, индолизин, изобензофуран, изохромен, изоиндол, изоиндолин, изохинолин, изотиазол, изоксазол, нафтиридин, оксадиазол, оксазол, перимидин, фенантридин, фенантролин, феназин, фталазин, преридин, пурин, пиран, пиразин, пиразол, пиридазин, пиридин, пиримидин, пиррол, пирролизин, хиназолин, хинолин, хинолизин, хиноксалин, тетразол, тиодиазол, тиазол, тиофен, триазол, ксантин и т.п.
«Фармацевтическая композиция» относится к по меньшей мере одному соединению и фармацевтически приемлемому средству доставки, с которым соединение вводят пациенту.
«Фармацевтически приемлемый носитель» относится к соли соединения, которая обладает требуемой фармакологической активностью исходного соединения. Такие соли включают: (1) соли дополнительных кислот, образованные с неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и подобные, или образованные с органическими кислотами, такими как уксусная кислота, пропионовая кислота, гексаноевая кислота, циклопентанпропионовая кислота, гликолевая кислота, пировиноградная кислота, молочная кислота, малоновая кислота, янтарная кислота, яблочная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, 3-(4-гидроксибензоил)-бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, 1,2-этандисульфоновая кислота, 2-гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, 4-хлорбензолсульфоновая кислота, 2-нафталинсульфоновая кислота, 4-толуолсульфоновая кислота, камфорасульфоновая кислота, 4-метилбицикло[2.2.2]-окт-2-ене-1-карбоновая кислота, глюкогептоновая кислота, 3-фенилпропионовая кислота, триметилуксусная кислота, третбутилуксусная кислота, лаурилсерная кислота, глюконовая кислота, глутаминовая кислота, гидроксинафтоевая кислота, салициловая кислота, стеариновая кислота, муконовая кислота и т.п.; или (2) соли, образованные при замене кислотного протона в исходном соединении ионом металла, например ионом щелочного металла, ионом щелочноземельного металла или ионом алюминия, или при образовании комплекса с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, N-метилглюкамин и т.п.
«Фармацевтически приемлемое средство доставки» относится к растворителю, вспомогательному веществу, наполнителю или носителю, вместе с которыми соединение вводят.
«Пациент» включает млекопитающих, а именно людей. Термины «человек» и «пациент» применяются здесь взаимозаменяемо.
«Предотвращение» относится к уменьшению риска наступления болезни или нарушения (например, приведение к неразвитию по меньшей мере одного симптома болезни у пациента, который может быть подвержен или предрасположен к болезни, но еще не испытывает или не проявляет симптомов болезни).
«Пролекарство» относится к производному активного агента, которому необходимо подвергнуться превращению в организме для высвобождения активного агента. Пролекарство часто, хотя и необязательно, является фармакологически неактивным до превращения в активный агент.
«Прогруппа» относится к форме защитной группы, которая при применении для маскировки функциональной группы активного агента превращает активный агент в пролекарство. Обычно, прогруппу можно прсоединять к лекарству через связь (связи), расщепляемые ферментативным или неферментативным способом in vivo.
«Защитная группа» относится к группировке атомов, которая при присоединении к реактивной функциональной группе молекулы маскирует, уменьшает или предотвращает реакционную способность функциональной группы. Примеры защитных групп можно найти в Green et al., "Protective Groups in Organic Chemistry," (Wiley, 2
«Замещенный» относится к группе, в которой один или более атом водорода независимо замещены одинаковыми или разными заместителями. Типичные заместители включают, не ограничиваясь этим, алкилендиокси (например, метилендиокси), -М, -R60, -O-, =O, -OR60, -SR60, -S-, =S, -NR60R61, =NR60, -CF3, -CN, -OCN, -SCN, -NO, -NO2, =N2, -N3, -S(O)2O-, -S(O)2OH, -S(O)2R60, -OS(O)2O; -OS(O)2R60, -P(O)(O-)2, -P(O)(OR60)(O-), -OP(O)(OR60)(OR61), -C(O)R60, -C(S)R60, -C(O)OR60, -C(O)NR60R61, -C(O)O-, -C(S)OR60, -NR62C(O)NR60R61, -NR62C(S)NR60R61, -NR62C(NR63)NR60R61 и -C(NR62)NR60R61, где М является галогеном; R60, R61, R62 и R63 независимо являются водородом, алкилом, замещенным алкилом, алкокси, замещенным алкокси, циклоалкилом, замещенным циклоалкилом, циклогетероалкилом, замещенным циклогетероалкилом, арилом, замещенным арилом, гетероарилом или замещенным гетероарилом, или при необходимости R60 и R61 вместе с атомом азота, с которым они связаны, образуют циклогетероалкил или замещенный циклогетероалкил, и R64 и R65 независимо являются водородом, алкилом, замещенным алкилом, арилом, циклоалкилом, замещенным циклоалкилом, циклогетероалкилом, замещенным циклогетероалкилом, арилом, замещенным арилом, гетероарилом или замещенным гетероарилом, или при необходимости R64 и R65 вместе с атомом азота, с которым они связаны, образуют циклогетероалкил или замещенный циклогетероалкил. В отдельных осуществлениях заместители включают -М, -R60, =O, -OR60, -SR60, -S-, =S, -NR60R61, =NR60, -CF3, -CN, -OCN, -SCN, -NO, -NO2, =N2, -N3, -S(O)2R60, -OS(O)2O-, -OS(O)2R60, -P(O)(O-)2, -P(O)(OR60)(O-), -OP(O)(OR60)(OR61), -C(O)R60, -C(S)R60, -C(O)OR60, -C(O)NR60R61, -C(O)O-, -NR62C(O)NR60R61. В других осуществлениях заместители включают -М, -R60, =O, -OR60, -SR60, -NR60R61, -CF3, -CN, -NO2, -S(O)2R60, -P(O)(OR60)(O-), -OP(O)(OR60)(OR61), -C(O)R60, -C(O)OR60, -C(O)NR60R61, -C(O)O-. В дополнительных осуществлениях заместители включают -М, -R60, =O, -OR60, -SR60, -NR60R61, -CF3, -CN, -NO2, -S(O)2R60, -OP(O)(OR60))(OR61), -C(O)R60, -C(O)OR60, -C(O)O-, где R60, R61 и R62, как определено выше. Например, замещенная группа может нести метилендиокси заместитель или один, два или три заместителя, выбранные из атома галогена, (1-4С) алкильной группы и (1-4С)алкокси группы.
«Лечение» болезни или нарушения в отдельных осуществлениях относится к ослаблению болезни или нарушения (например, к остановке или замедлению развития болезни или по меньшей мере одного ее клинического симптома). В других осуществлениях «лечение» относится к ослаблению по меньшей мере одного физического параметра, который может быть незамечен пациентом. В других осуществлениях «лечение» относится к подавлению заболевания или нарушения на физическом уровне (например, стабилизация видимого симптома), на физиологическом уровне (например, стабилизация физического параметра) или на обоих. В других осуществлениях «лечение» относится к замедлению наступления болезни или нарушения.
«Терапевтически эффективное количество» означает количество соединения, которое при введении пациенту для лечения болезни является достаточным для достижения действия такого лечения болезни. «Терапевтически эффективное количество» варьирует в зависимости от соединения, заболевания и его серьезности и возраста, веса и т.д. пациента на лечении.
Далее детально рассмотрены различные осуществления. Следует понимать, что изобретение не ограничено этими осуществлениями. Напротив, оно охватывает альтернативы, модификации и эквиваленты, которые можно включить в область притязаний формулы изобретения.
В настоящем изобретении раскрыты пролекарства фенольных опиатов. Прогруппа пролекарства включает разделительную группу и отщепляемое звено, где разделительная группа inter alia физически отделяет молекулу лекарства от отщепляемого звена. Соответственно, пролекарство, раскрытое здесь, включает фенол, присоединенный через атом кислорода фенола к разделительной группе, которая дополнительно присоединена к отщепляемому звену. Отщепление отщепляемого звена открывает нуклеофильный азот, что приводит к «активации» пролекарства. Контролируемое высвобождение исходного лекарства далее может опосредоваться нуклеофильным азотом, претерпевающим реакцию внутримолекулярной циклизации и высвобождения.
Отщепляемое звено может включать амид. Обычно, отщепляемое звено может отщепляться в физиологических условиях. Отщепляемое звено отщепляется ферментативно.
В отдельных осуществлениях предоставлено соединение структурной формулы (I) или его соли, сольваты или гидраты

где
Х является фенольным опиатом, в котором атом водорода гидроксильной группы замещен ковалентной связью с -C(O)-Y-(C(R1)(R2))n-N-(R3R4),
Y является -NR5-, -О- или -S-;
n является целым числом от 1 до 4,
каждый из R1, R2, R3 и R5 независимо является водородом, алкилом, замещенным алкилом, арилом или замещенным арилом, или R1 и R2 вместе с углеродом, к которому они присоединены, образуют циклоалкил или замещенный циклоалкил,
R4 является

Каждый R6 независимо является водородом, алкилом, замещенным алкилом, арилом, замещенным арилом, арилалкилом, замещенным арилалкилом, гетероалкилом, замещенным гетероалкилом, гетероарилом, замещенным гетероарилом, гетероарилалкилом, замещенным гетероарилалкилом или при необходимости R6 и R7 вместе с атомами, с которыми они связаны, образуют циклогетероалкил или замещенный циклогетероалкил;
R7 является водородом, алкилом, замещенным алкилом, ацилом, замещенным ацилом, алкоксикарбонилом, замещенным алкоксикарбонилом, арилом, замещенным арилом, арилалкилом или замещенным арилалкилом;
p является целым числом от 1 до 10;
каждая W независимо является -NR8-, -О- или -S-;
каждый R8 независимо является водородом, алкилом, замещенным алкилом, арилом или замещенным арилом или при необходимости каждый R6 и R8 независимо вместе с атомами, с которыми они связаны, образуют циклогетероалкил или замещенный циклогетероалкил.
В отдельных осуществлениях каждый из R1, R2, R3 и R5 независимо является водородом, алкилом, замещенным алкилом, арилом или замещенным арилом.
В отдельных осуществлениях Х является гидроморфоном, морфином или оксиморфоном. В других осуществлениях Х является бупренорфином, дигидроэторфином, дипренорфином, эторфином или леворфанолом.
В отдельных осуществлениях R7 является водородом, алкилом, ацилом или алкоксикарбонилом. В других осуществлениях R7 является

где R9 является водородом или алкилом и x является целым числом от 1 до 2000. В других осуществлениях R7 является доступным в продаже производным ПЭГ, например ПЭГ-200, ПЭГ-400, ПЭГ-1550, ПЭГ-3350, ПЭГ-6000, ПЭГ-20000 или ПЭГ-40000.
В отдельных осуществлениях Y является -NR5- и R5 является водородом или алкилом. В других осуществлениях n равно 1. В других осуществлениях R1, R2, R3, R5 и R8 независимо являются водородом или алкилом.
В отдельных осуществлениях каждый R6 независимо является водородом, алкилом, замещенным алкилом, арилом, арилалкилом, циклоалкилом, замещенным циклоалкилом, замещенным арилалкилом или гетероарилалкилом, или при необходимости R6 и R7 вместе с атомами, к которым они присоединены, образуют циклогетероалкил или замещенный циклогетероалкил. В других осуществлениях R6 независимо является водородом, алкилом, замещенным алкилом, арилом, арилалкилом, замещенным арилалкилом, гетероалкилом, гетероарилалкилом, замещенным гетероарилалкилом, или при необходимости R6 и R7 вместе с атомами, к которым они присоединены, образуют циклогетероалкил или замещенный циклогетероалкил. В других осуществлениях каждый R6 независимо является водородом, метилом, изопропилом, изобутилом, втор-бутилом, трет-бутилом, циклопентилом, циклогексилом, -CH2OH, -СН(ОН)СН3, -CH2CO2H, -CH2CH2CO2H, -CH2CONH2, -CH2CH2CONH2, -CH2CH2SCH3, -CH2SH, -CH2(СН2)3NH2, -CH2CH2CH2NHC(NH)NH2, фенилом, бензилом, гомобензилом, 4-гидроксибензилом, 4-бромбензилом, 4-имидазолилметилом, 3-индолилметилом, 3-(5-гидроксииндолил)-метилом, 9-антранилметилом, 3-бензотиенилметилом, циклогексилметилом, дифенилметилом, 2-фурилметилом, йодметилом, 1-нафтилметилом, 2-нафтилметилом, 2-пиридилметилом, 3-пиридилметилом, 4-пиридилметилом, 3-стирилметилом, 2-тиенилметилом, винилметилом, циклогексилом, ацетиленометилом, 2-трифторметилбензилом, 2-хлорбензилом, 2-цианобензилом, 2-фторбензилом, 2-метилбензилом, 3-трифторметилбензилом, 3-хлорбензилом, 3-цианобензилом, 3-фторбензилом, 3-метилбензилом, 4-бензоилбензилом, 3,5-дибром-4-гидроксибензилом, 3-трифторметилбензилом, 4-хлорбензилом, 4-цианобензилом, 4-фторбензилом, 4-йодбензилом, 4-метилбензилом, 4-нитробензилом, 3,4-дигидроксибензилом, 2,4-дихлорбензилом, 3,4-дихлорбензилом, 3,4-дифторбензилом, 3,5-дийод-4-гидроксибензилом, 3-нитро-4-гидроксибензилом, аминометилом,




или при необходимости R6 и R7 вместе с атомами, к которым они присоединены, образуют азетидин, пирролидин или пиперидин.
В отдельных осуществлениях W является -NR8- и каждый R7 независимо является водородом или алкилом, арилом или арилалкилом.
В отдельных осуществлениях R7 является водородом, алкилом, ацилом или алкоксикарбонилом.
В других осуществлениях каждый R6 независимо является -CH2(CH2)3NH2 или -CH2CH2CH2NHC(NH)NH2. В дополнительных осуществлениях p равно 1 и R6 является -СН2(СН2)3NH2 или -CH2CH2CH2NHC(NH)NH2. В других осуществлениях каждый W является -NR8-, каждый R8 является водородом и R7 является водородом, ацилом, замещенным ацилом, алкоксикарбонилом или замещенным алкоксикарбонилом.
В отдельных осуществлениях каждый R6 независимо является фенилом, бензилом, 4-гидроксибензилом, 4-бромбензилом, 4-имидазолилметилом, 3-индолилметилом, изобутилом, -CH2CH2SCH3, -CH2CH2CONH2 -CH2CH2CONH2 или -CH2CO2H. В других осуществлениях каждый R6 независимо является бензилом, 4-гидроксибензилом, 4-бромбензилом или 3-индолилметилом. В других осуществлениях n равно 1 и R6 является фенилом, бензилом, 4-гидроксибензилом, 4-бромбензилом, 4-имидазолилметилом, 3-индолилметилом, изобутилом, -CH2CH2SCH3, -CH2CH2CONH2, -CH2CH2CONH2 или -CH2CO2H. В других осуществлениях n равно 1 и R6 является бензилом, 4-гидроксибензилом, 4-бромбензилом или 3-индолилметилом. В отдельных из любого среди вышеперечисленных осуществлений W является -NR8-, каждый R8 является водородом и R7 является ацилом, замещенным ацилом, алкоксикарбонилом или замещенным алкоксикарбонилом.
В отдельных осуществлениях p больше 1 и R7 является водородом. В любом из вышеприведенных осуществлений каждый W является -NR8-, каждый R8 является водородом и R7 является ацилом, замещенным ацилом, алкоксикарбонилом или замещенным алкоксикарбонилом.
В отдельных осуществлениях p равно 3 и R7 является водородом. В других осуществлениях каждый W является -NR8 - и каждый R8 является водородом.
В отдельных осуществлениях каждый R7 независимо является водородом, метилом, изопропилом, изобутилом, sec-бутилом, -CH2OH или -CH2SH. В других осуществлениях p равно 1 и R6 является водородом, метилом, изопропилом, изобутилом или sec-бутилом, каждый W является -NR8-, каждый R8 является водородом и R7 является ацилом, замещенным ацилом, алкоксикарбонилом или замещенным алкоксикарбонилом.
В отдельных осуществлениях каждый R6 независимо является водородом, метилом, изопропилом, изобутилом, sec-бутилом, трет-бутилом, циклопентилом, циклогексилом, -CH2OH, -CH(OH)CH3, -CH2CONH2, -CH2CH2SCH3, -CH2SH, фенилом, бензилом, 4-гидроксибензилом, 4-бромбензилом или 3-индолилметилом. В других осуществлениях каждый R6 независимо является водородом, метилом, изопропилом, изобутилом, sec-бутилом, трет-бутилом, циклопентилом, циклогексилом, фенилом, бензилом, 4-бромбензилом, 3-индолилметилом, или при необходимости R6 и R7 вместе с атомами, к которым они присоединены, образуют азетидин, пирролидин или пиперидин. В отдельных вышеприведенных осуществлениях каждый W является -NR8, каждый R8 является водородом или при необходимости каждый R6 и R8 независимо вместе с атомами, к которым они присоединены, образуют азетидин, пирролидин или пиперидин и R7 является ацилом, замещенным ацилом, алкоксикарбонилом или замещенным алкоксикарбонилом.
В отдельных осуществлениях каждый R6 независимо является бензилом, 4-гидроксибензилом или изобутилом. В других осуществлениях каждый W является -NR8-, каждый R8 является водородом и R7 является ацилом, замещенным ацилом, алкоксикарбонилом или замещенным алкоксикарбонилом.
В отдельных осуществлениях каждый R6 независимо является -CH2CO2H или -CH2CH2CO2H. В других осуществлениях каждый W является -NR8-, каждый R8 является водородом и R7 является ацилом, замещенным ацилом, алкоксикарбонилом или замещенным алкоксикарбонилом.
В других осуществлениях p равно 2 и R6 группа, смежная с N-концевым атомом азота, независимо является водородом, метилом, изопропилом, изобутилом, sec-бутилом, трет-бутилом, циклопентилом, циклогексилом, -CH2OH, -CH(OH)CH3, -CH2CO2H, -CH2CH2CO2H, -CH2CONH2, -CH2CH2CONH2, -CH2CH2SCH3, -CH2SH, -CH2(CH2)3NH2, -CH2CH2CH2NHC(NH)NH2, фенилом, бензилом, гомобензилом (фенетилом), 4-гидроксибензилом, 4-бромбензилом, 4-имидазолилметилом, 3-индолилметилом, 3-(5-гидроксииндолил)-метилом, 9-антранилметилом, 3-бензотиенилметилом, циклогексилметилом, дифенилметилом, 2-фурилметилом, йодметилом, 1-нафтилметилом, 2-нафтилметилом, 2-пиридилметилом, 3-пиридилметилом, 4-пиридилметилом, 3-стирилметилом, 2-тиенилметилом, винилметилом, циклогексилом, ацетиленометилом, 2-трифторметилбензилом, 2-хлорбензилом, 2-цианобензилом, 2-фторбензилом, 2-метилбензилом, 3-трифторметилбензилом, 3-хлорбензилом, 3-цианобензилом, 3-фторбензилом, 3-метилбензилом, 4-бензоилбензилом, 3,5-дибром-4-гидроксибензилом, 3-трифторметилбензилом, 4-хлорбензилом, 4-цианобензилом, 4-фторбензилом, 4-йодбензилом, 4-метилбензилом, 4-нитробензилом, 3,4-дигидроксибензилом, 2,4-дихлорбензилом, 3,4-дихлорбензилом 3,4-дифторбензилом, 3,5-дийод-4-гидроксибензилом, 3-нитро-4-гидроксибензилом, аминометилом,





или при необходимости каждый R6 и R8 независимо вместе с атомами, к которым они присоединены, образуют азетидин, пирролидин или пиперидин, и другая R6 группа является метилом, или R6 и R8 независимо вместе с атомами, к которым они присоединены, образуют пирролидин. В других осуществлениях каждый W является -NR8-, каждый R8 является водородом или при необходимости каждый R6 и R8 независимо вместе с атомами, к которым они присоединены, образуют пирролидин и R7 является ацилом, замещенным ацилом, алкоксикарбонилом или замещенным алкоксикарбонилом.
В других отдельных вышеперечисленных осуществлениях p равно 1 и R6 является водородом. В отдельных вышеперечисленных осуществлениях p равно 1, R6 является водородом и W является NH. В отдельных вышеперечисленных осуществлениях p равно 1, R6 является водородом, W является NH и R7 является водородом. В других осуществлениях каждый R6 является водородом и W является NH. В других осуществлениях каждый R6 является водородом, W является NH и R7 являтся водородом.
В отдельных осуществлениях Y является NR5, n равно 2 или 3, p равно 1 или 2, R1 R2, R3, R5 и R7 независимо являются водородом или алкилом, каждый R6 независимо является водородом, алкилом, замещенным алкилом, арилом, арилалкилом, замещенным арилалкилом, гетероалкилом, гетероарилалкилом, замещенным гетероарилалкилом, или при необходимости R6 и R7 вместе с атомами, с которыми они связаны, образуют циклогетероалкил или замещенный циклогетероалкил. В других осуществлениях Y является NR5, n равно 2, p равно 1, R1 и R2 являются водородом, R3 и R5 являются метилом или водородом и R6 независимо является водородом, алкилом, замещенным алкилом, арилом, арилалкилом, замещенным арилалкилом, гетероалкилом, гетероарилалкилом, замещенным гетероарилалкилом, или при необходимости R6 и R7 вместе с атомами, к которым они присоединены, образуют циклогетероалкил или замещенный циклогетероалкил, или при необходимости R7 является водородом. В дополнительных осуществлениях Y является NR5, n равно 2, R1 и R2 являются водородом, R3 и R5 являются метилом или водородом, R7 является водородом и R6 является -CH2(CH2)3NH2 или -CH2CH2CH2NHC(NH)NH2. В отдельных вышеперечисленных осуществлениях Х является оксиморфоном или гидроморфоном.
Соединения, описанные здесь, можно получить по способам, в основном проиллюстрированным на схемах 1-4.
Прогруппы, описанные здесь, можно получить и присоединить к лекарствам, содержащим фенолы, по способам, известным специалисту в данной области техники (см., например, Green et al, "Protective Groups in Organic Chemistry" (Wiley, 2

На схеме 1 и в формуле I, supra, где с иллюстративными целями Т является -O-, -S- или NR3, Y является NR5, -О- или -S-, W является NR8, -О- или -S-, n равно 2, R1 и R2являются водородом, p, R3, R5, R6, R7 и R8 - как определено выше, Х является фенольным опиатом, Р является защитной группой и М является отходящей группой, соединение 1 можно ацилировать с помощью подходящей карбоновой кислоты или эквивалента карбоновой кислоты для получения соединения 2, с которого затем можно снять защиту с получением соединения 3. Соединение 3 затем реагирует с активированным эквивалентом угольной кислоты 4 для получения искомого соединения 5.

На схеме 2 и в формуле I, supra, где с иллюстративными целями Т является -O-, -S- или NR3, Y является NCH3, W является NR8, -О- или -S-, n равно 2, R1 и R2 являются водородом, p, R3, R5, R6, R7 и R8 - как определено выше, Х является фенольным опиатом, Р является защитной группой и М является отходящей группой, соединение 6 ацилируют с помощью подходящей карбоновой кислоты или эквивалента карбоновой кислоты для получения соединения 7. С соединения 7 затем снимают защиту и приводят во взаимодействие с активированным эквивалентом угольной кислоты 4 для получения искомого соединения 9.

На схеме 3 и в формуле I, supra, где с иллюстративными целями Т является NCH3, Y является NR5, -О- или -S-, W является NR8, -О- или -S-, n равно 2, R1 и R2 являются водородом, p, R3, R5, R6, R7 и R8 - как определено выше, Х является фенольным опиатом, Р является защитной группой и М является отходящей группой, соединение 10 ацилируют с помощью подходящей карбоновой кислоты или эквивалента карбоновой кислоты для получения соединения 11, которое после снятия защиты и внутренней перестройки функциональной группы при необходимости превращают в соединение 12. Взаимодействие соединения 12 с активированным эквивалентом угольной кислоты 4 дает искомое соединения 13.

На схеме 4 и в формуле I, supra, где с иллюстративными целями Т и Y являются NCH3, W является NR8, -О- или -S-, n равно 2, R1 и R2 являются водородом, p, R3, R5, R6, R7 и R8 - как определено выше, Х является фенольным опиатом, Р является защитной группой и М является отходящей группой, соединение 14 ацилируют с помощью подходящей карбоновой кислоты или эквивалента карбоновой кислоты для получения соединения 15. Взаимодействие соединения 15 с активированным эквивалентом угольной кислоты 4 дает искомое соединения 16.
Соединение формулы (I), полученное по такому способу, в котором R7 представляет атом водорода, можно затем ацилировать для получения соответствующего соединения формулы (I), в котором значение p увеличено или в котором R7 представляет ацильную группу.
Поэтому согласно другому аспекту настоящее изобретение предоставляет способ получения соединения формулы (I) или его фармацевтически приемлемой соли, который включает реакцию соединения формулы (III)

или его производного с введенной защитой с соединением формулы (IV)

где М представляет отходящий атом или группу, например активированную арилоксикарбоновую группу, например p-нитрофеноксикарбонил,
с последующим удалением защитных групп и при необходимости ацилированием соединения формулы (I), в котором R7 (в группе R4 по вышеприведенному определению) представляет атом водорода и/или образование фармацевтически приемлемой соли.
Соединения формулы (I), в которых Х представляет остаток (R)-N-метилналтрексона, можно также получить путем метилирования соответствующего соединения формулы (I), в котором Х является остатком налтрексона или его производным с введенной защитой.
Выбор подходящих защитных групп, реагентов и реакционных условий для любого этапа вышеприведенных схем находится в пределах круга знаний специалиста в данной области техники. Другие способы синтеза пролекарств, описанные здесь, легко понятны специалисту и могут применяться для синтеза вышеописанных соединений. Соответственно, способы, представленные на схемах, являются иллюстративными, а не исчерпывающими.
Изобретение далее представляет все новые интермедиаты, описанные здесь.
В основном, пролекарства, раскрытые здесь, можно применять для лечения и/или предотвращения тех же заболеваний или состояний, что и исходное лекарство, хорошо известное в данной области техники (см., например, Physicians Desk Reference, 2000 54th Edition and the Merck Index, 13th Edition). Фенольные опиаты применяют при лечении боли.
Например, пролекарство фенольного опиата, например гидроморфона, можно применять inter alia, для лечения или предотвращения боли, включая, но не ограничиваясь этим, острую боль, хроническую боль, невропатическую боль, острую травматическую боль, боль при артрите, боль при остеоартрите, боль при ревматоидном артрите, скелетно-мышечную боль, боль после зубной хирургии, зубную боль, мышечно-фаспиальную боль, боль при раке, боль во внутренностях, боль при диабете, мышечную боль, невралгическую боль после герпеса, хроническую тазовую боль, боль при эндометриозе, тазовую воспалительную боль и боль, связанную с родами. Острая боль включает, не ограничиваясь этим, острую травматическую боль и боль после хирургической операции. Хроническая боль включает, не ограничиваясь этим, невропатическую боль, боль при артрите, боль при остеоартрите, боль при ревматоидном артрите, скелетно-мышечную боль, зубную боль, мышечно-фасциальную боль, боль при раке, боль при диабете, боль во внутренностях, мыщечную боль, невралгическую боль после герпеса, хроническую тазовую боль, боль при эндометриозе, тазовую воспалительную боль и боль в спине.
Фармацевтические композиции, раскрытые здесь, включают пролекарство, раскрытое здесь, с подходящим количеством фармацевтически приемлемого средства доставки, так чтобы получилась форма для правильного введения субъекту.
Подходящие фармацевтические средства доставки включают наполнители, например крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, глицеринмоностеарат, тальк, хлористый натрий, сухое снятое молоко, глицерин, пропиленгликоль, воду, этанол и т.п. Фармацевтические композиции по настоящему изобретению при необходимости могут также включать небольшие количества увлажняющих или эмульгирующих агентов, или рН-буферных агентов. Дополнительно, можно применять вспомогательные агенты, загустители, лубриканты и красители.
Фармацевтические композиции можно получать любым способом с помощью общепринятого смешивания, растворения, гранулирования, получения драже, растирания в порошок, эмульгирования, заключения в капсулы, захвата (в оболочку) и лиофилизации. Фармацевтические композиции можно составлять общепринятым способом с применением одного или более физиологически приемлемого носителя, разжижителя, наполнителя или вспомогательного вещества, облегчающих переработку соединений, раскрытых здесь, в лекарственные средства, которые можно применять в фармацевтике. Правильный подбор состава зависит от избранного пути введения.
Фармацевтические композиции согласно настоящему изобретению могут принимать форму растворов, суспензий, эмульсий, таблеток, пилюль, порошков, капсул, содержащих липиды капсул, порошков, составов с задержанным высвобождением, суппозиториев, эмульсий, аэрозолей, спреев, суспензий или любые другие пригодные для применения формы, известные специалисту в данной области. В отдельных осуществлениях фармацевтически приемлемым средством доставки является капсула (см., например, Grosswald et ah, US патент №5698155). Другие примеры подходящих фармацевтических средств доставки описаны в данной области техники (см. Remington's Pharmaceutical Sciences, Philadelphia College of Pharmacy and Science, 19th Edition, 1995).
Фармацевтические композиции для перорального введения могут быть в форме таблеток, пастилок, водных или масляных суспензий, гранул, порошков, эмульсий, капсул, сиропов, вязких сиропов, суспензий или эликсиров, например. Композиции для орального введения могут содержать один или более дополнительный компонент, например подсластитель, например фруктозу, аспартам или сахарин, ароматизатор, например перечную мяту или масло зимолюбки, или вишнеыве красители и консерванты для получения приятного на вкус фармацевтического средства. Дополнительно, при получении таблетки или пилюли композиции можно покрывать оболочкой для замедления дезинтеграции и поглощения в желудочно-кишечном тракте, таким способом предоставляя замедленное действие в течение увеличенного периода времени. Пероральные композиции могут включать стандартные средства, например манит, лактозу, крахмал, стеарат магния, сахарин натрия, целлюлозу, карбонат магния, сахарозу, сорбит, кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, смолу трагаканта, метилцелллюлозу, гидроксипропиметилцеллюлозу, карбоксиметилцеллюлозу натрия и/или поливинилпирролидон (ПВП), гранулирующие агенты, связывающие агенты и дезинтегрирующие агенты, например поперечно-сшитый поливинилпирролидон, агар или алгиновую кислоту или ее соль, например алгинат натрия и т.д.
В отдельных осуществлениях фармацевтические композиции находятся в форме пастилок или леденцов, где растворение и высвобождение активных ингредиентов происходит в ротовой полости, в основном, с участием слизистой оболочки рта. В случае таких осуществлений можно также применять буферные агенты для получения оптимальной среды для доставки агентов или композиций. Дополнительные компоненты могут включать, например, подсластители, связывающие агенты, растворители, дезинтегрирующие агенты, лубриканты и т.д.
В других осуществлениях фармацевтическая композиции находится в растворимой подъязычной таблетке, когда растворение и высвобождение активных ингредиентов происходит под языком и композиции и/или соединения, раскрытые здесь, поглощаются через слизистую оболочку рта. В случае таких осуществлений можно также применять буферные агенты для получения оптимальной среды для доставки каждого агента. Дополнительные компоненты могут включать, например, подсластители, связывающие агенты, растворители, дезинтегрирующие агенты и т.д.
Способы, включающие оральное введение соединений, раскрытых здесь, можно также применять с различными лекарственными формами, предоставляющими замедленное высвобождение.
В отдельных осуществлениях лекарственная форма состоид из шариков, которые при растворении или диффузии высвобождают композиции и/или соединения, раскрытые здесь, в течение растянутого на часы периода времени, предпочтительно, в течение периода по меньшей мере из 6 часов, в течение периода по меньшей мере из 8 часов, более предпочтительно, в течение периода по меньшей мере из 12 часов и, наиболее предпочтительно, в течение периода по меньшей мере из 24 часов. Шарики могут включать композицию, расположенную в центре или в ядре, включающую соединения, раскрытые здесь, и фармацевтически приемлемые средства, включая при необходимости лубриканты, антиоксиданты и буферные агенты. Шарики могут быть лекарственным средством диаметром от примерно 1 до примерно 2 мм. Отдельные шарики могут включать дозы соединений, раскрытых здесь. В отдельных осуществлениях шарики получают из несшитых материалов для усиления их разрушения в желудочно-кишечном тракте. Шарики можно покрывать полимером для контроля скорости высвобождения, который обеспечивает профиль высвобождения во времени.
Шарики для высвобождения во времени (замедленного или пролонгированного высвобождения) можно получать в виде таблеток для терапевтически эффективного введения. Шарики можно включать в матрицу таблеток путем прямого прессования множества шариков, покрытых, например, акриловой пленкой и смешанных с наполнителем, например гидроксипропилметилцеллюллозой. Способы получения шариков раскрыты в данной области техники (Lu, Int. J. Pharm. 1994, 112, 117-124; Pharmaceutical Sciences by Remington, 14th ed, pp 1626-1628 (1970); Fincher, J Pharm. Sci. 1968, 57, 1825-1835; Benedikt, United States Patent No. 4,083,949) так же, как и получение таблеток (Pharmaceutical Sciences, by Remington, 17th Ed, Ch. 90, pp 1603-1625 (1985).
В других осуществлениях можно применять насос для замедленного орального введения (Langer, supra; Sefton, 1987, CRC Crit RefBiomed. Eng. 14: 201; Saudek et al, 1989, JV. Engl. J Med. 321: 574).
В других осуществлениях можно применять полимерные материалы (см. "Medical Applications of Controlled Release", Langer and Wise (eds.), CRC Press., Boca Raton, Florida (1974); "Controlled Drug Bioavailability", Drug Product Design and Performance, Smolen and Ball (eds.), Wiley, New York (1984); Langer et al, 1983, J Macromol. Sci. Rev. Macromol Chem. 23:61; Levy et al., 1985, Science 228:190; During et al, 1989, Ann. Neurol. 25:351; Howard et al, 1989, J Neurosurg. 71:105). В отдельных осуществлениях полимерные материалы можно применять для орального введения с замедленным высвобождением. Такие полимеры включают, например, карбоксиметилцеллюлозу натрия, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу и гидроксиэтилцеллюлозу (наиболее предпочтительно, гидроксипропилметилцеллюлозу). Другие эфиры целлюлозы также описаны (Alderman, Int. J. Pharm. Tech. & Prod. Mfr. 1984, 5(3) 1-9). Факторы, воздействующие на высвобождение лекарств, хорошо известны специалисту и описаны в данной области техники (Bamba et al, Int. J. Pharm. 1979, 2, 307).
В других осуществлениях брюшные препараты в оболочке (enteric-coated) можно применять для орального введения с замедленным высвобождением. Материалы оболочки включают, например, полимеры с рН-зависимой растворимостью (т.е. контролируемое рН высвобождение), полимеры с медленной или рН-зависимой скоростью набухания, растворения или разрушения (т.е. контролируемое временем высвобождение), полимеры, разрушающиеся под действием ферментов (т.е. ферментативно-контролируемое высвобождение), и полимеры, образующие плотные слои, разрушающиеся при повышении давления (контролируемое давлением высвобождение).
В других осуществлениях для орального введения с замедленным высвобождением можно применять липидную матрицу, высвобождающую лекарство. Например, твердые микрочастицы композиций и/или соединений, раскрытых здесь, можно покрывать тонким слоем липида с контролируемым высвобождением (например, глицерилбегената и/или глицерилпальмитостеарата), как раскрыто в Farah et al, патент U.S. №6375987 и Joachim et al, патент U.S. №6379700. Покрытые липидом частицы можно при необходимости спрессовать в таблетку. Другой материал матрикса на липидной основе с контролируемым высвобождением, подходящий для орального введения с замедленным высвобождением, включает полигликозилированные глицериды, как раскрыто в Roussin et al., патент U.S. №6171615.
В других осуществлениях можно применять воски для орального введения с замедленным высвобождением. Примеры восков, подходящих для замедленного высвобождения, раскрыты в Cain et al, патент U.S. №3402240 (карнаубский воск, воск канделилла, воск эспарто и воск урикури), Shtohryn et al, патент U.S. №4820523 (гидрогенированное растительное масло, пчелиный воск, карнаубский воск, парафин, воск канделилла, озокерит и их смесь) и Walters, патент U.S. №4421736 (смесь парафина и касторового масла).
В других осуществлениях применяют осмотические системы доставки для орального ведения с замедленным высвобождением (Verma et al, DrugDev. Ind. Pharm. 2000, 26: 695-708). В отдельных осуществлениях применяют OROS® системы производства Alza Corporation, Mountain View, CA в средствах доставки для орального введения с замедленным высвобождением (Theeuwes et al, патент U.S. №3845770; Theeuwes et al, патент U.S. №3916899).
В других осуществлениях системы для контролируемого высвобождения можно помещать поблизости от мишени композиций и/или соединений, раскрытых здесь, при этом требуется только фракция системной дозы (см., например, Goodson, in "Medical Applications of Controlled Release", supra, vol.2, pp.115-138 (1984)). Другие системы с контролируемым высвобождением, обсуждаемые в Langer, 1990, Science 249:1527-1533, также можно применять.
В других осуществлениях лекарственные формы включают соединения, раскрытые здесь, покрытые полимерным субстратом. Полимер может быть деградируемым или недеградируемым полимером. Покрытый оболочкой субстрат можно завернуть в самого себя с предоставлением двухслойной формы лекарства. Например, соединения, раскрытые здесь, можно нанести на полимерный слой из полипептида, коллагена, желатина, поливинилового спирта, полиортоэфира, полиацетила или полиортокарбоната, и покрытый полимер можно завернуть в самого себя для получения двухслойной лекарственной формы. При употреблении биодеградируемая лекарственная форма разрушается с контролируемой скоростью с высвобождением соединений в течение длительного периода времени. Представительные биодеградируемые полимеры включают выбранные из группы, состоящей из биодеградируемых полиамидов, полиаминокислот, полиэфиров, поли(молочной кислоты), поли(гликолевой кислоты), поли(углеводов), поли(ортоэфиров), поли(ортокарбоната), поли(ацетила), поли(ангидридов), биодеградируемых поли(дигидропиранов) и поли(диоксинов), известных в данной области техники (Rosoff, Controlled Release of Drugs, Chap.2, pp.53-95 (1989); Heller et al, патент U.S. №3811444; Michaels, патент U.S. №3962414; Capozza, патент U.S. №4066747; Schmitt, патент U.S. №4070347; Choi et al, патент U.S. №4079038; Choi et al, патент U.S. №4093709).
В других осуществлениях лекарственная форма включает соединения, раскрытые здесь, помещенные в полимер, который высвобождает лекарства путем диффузии сквозь полимер, или путем протока сквозь поры, или путем разрушения полимерной матрицы. Полимерная форма доставки лекарства включает количество от 10 до 2500 мг, равномерно распределенное на или в полимере. Лекарственная форма включает по меньшей мере одну доступную поверхность в начале доставки дозы. Недоступная поверхность, если такая есть, покрыта фармацевтически приемлемым материалом, непроницаемым для лекарства (лекарств). Лекарственную форму можно получать по способам, известным в данной области техники. Пример получения лекарственной формы включает смешивание фармацевтически приемлемого носителя, такого как полиэтиленгликоль, с известной дозой композиции и/или соединений, раскрытых здесь, при повышенной температуре (например, 37°С) и добавления ее к силиконовому эластомеру медицинского качества со сшивающим агентом, например, к октаноэтану, с последующей заливкой в форму. Этап повторяют при необходимости для каждого последующего слоя. Систему оставляют уравновеситься в течение примерно 1 часа для получения лекарственной формы. Представительные полимеры для получения лекарственной формы включают выбранные из группы, состоящей из олефина, виниловых полимеров, дополнительных полимеров, конденсированных полимеров, углеводных полимеров и силиконовых полимеров, представленных полиэтиленом, полипропиленом, поливинилацетатом, полиметилакрилатом, полиизобутилметилакрилатом, полиалгинатом, полиамидом и полисиликоном. Полимеры и способы их получения описаны в данной области техники (Coleman et al. Polymers 1990, 31, 1187-1231; Roerdink et al. Drug Carrier Systems 1989, 9, 57-10; Leong et al. Adv. Drug Delivery Rev. 1987, 1, 25, 199-233; Roff et al. Handbook of Common Polymers 1971, CRC Press; Chien et al, патент U.S. №3992518).
В других осуществлениях лекарственная форма включает множество мелких пилюль. Мелкие пилюли для замедленного высвобождения предоставляют набор индивидуальных доз для предоставления различных доз по ходу времени для достижения профиля замедленного высвобождения лекарства в течение периода времени до 24 часов. Матрица включает гидрофильный полимер, выбранный из группы, состоящей из полисахарида, агара, агарозы, природной смолы (камеди), щелочного алгината, включая алгинат натрия, каррагена, фукоидана, фурцелларана, ламинарана, гипнея, гуммиарабика, смолы гхати, смолы карайа, смолы трагаканта, смолы семян цератонии, пектина, амилопектина, желатина и гидрофильного коллоида. Гидрофильная матрица включает множество (от 4 до 50) мелких пилюль, каждая мелкая пилюля содержит дозу из популяции от 10 нг, 0,5 мг, 1 мг, 1,2 мг, 1,4 мг, 1,6 мг, 5,0 мг и т.д. Мелкие пилюли включают стенку, контролирующую скорость высвобождения, толщиной от 0,001 мм до 10 мм для предоставления растянутого во времени высвобождения лекарств. Представительные материалы для образования стенки включают триглицеридный эфир, выбранный из группы, состоящей из глицерилтристеарата, глицерилмоностеарата, глицерилдипальмитата, глицериллауреата, глицерилдидеценоата и глицерилтриденоата. Другие материалы для образования стенки включают поливинилацетат, фталат, фталат метилцеллюлозы и микропористые олефины. Способы получения мелких пилюль раскрыты в Urquhart et ah, патент U.S. №4434153; Urquhart et ah, патент U.S. №4721613; Theeuwes, патент U.S. №4853229; Barry, патент U.S. №2996431; Neville, патент U.S. №3139383; Mehta, патент U.S. №4752470.
В других осуществлениях лекарственная форма включает осмотическую лекарственную форму, включающую полупроницаемую стенку, окружающую терапевтическую композицию, включающую соединения, раскрытые здесь. При применении в организме субъекта осмотическая лекарственная форма, включающая однородную композицию, впитывает жидкость через полупроницаемую мембрану внутрь лекарственной формы под действием концентрационного градиента на полупроницаемой мембране. Терапевтическая композиция в лекарственной форме создает разницу осмотических давлений, которая обусловливает введение терапевтической композиции путем выхода из лекарственной формы в течение длительного периода времени вплоть до 24 часов (или в некоторых случаях до 30 часов) для предоставления контролируемого замедленного высвобождения. Этот способ доставки может предоставлять по существу нулевой порядок профиля доставки в противоположность профилю с пиком у составов с немедленным высвобождением.
В других осуществлениях лекарственная форма включает другую осмотическую лекарственную форму, включающую стенку, окружающую отсек, стенка включает полупроницаемую полимерную композицию, проницаемую для прохода жидкости и практически непроницаемую для прохода соединений, раскрытых в настоящем изобретении и находящихся в отсеке, слой композиции, содержащей лекарство в отсеке, слой композиции выталкивающего гидрогеля в отсеке, включающий осмотически активный состав для впитывания и поглощения жидкости, для увеличения в размере и выталкивания композиции лекарства из лекарственной формы, и по меньшей мере одно отверстие в стенке для высвобождения композиции. Согласно такому способу доставка соединений, раскрытых здесь, происходит путем впитывания жидкости через полупроницаемую стенку со скоростью впитывания жидкости, определяемой проницаемостью полупроницаемой стенки и осмотическим давлением на полупроницаемой стенке, что заставляет выталкивающий слой разбухать, осуществляя доставку соединений, раскрытых здесь, из лекарственной формы через выходное отверстие субъекту в течение продолжительного периода времени (до 24 или даже до 30 часов). Композиция слоя гидрогеля может включать от 10 мг до 100 мг гидрогеля, выбранного из группы, состоящей из полиалкиленоксида со средним молекулярным весом в интервале от 1000000 до 8000000, выбранного из группы, состоящей из полиэтиленоксида со средним молекулярным весом 1000000, полиэтиленоксида со средним молекулярным весом 2000000, полиэтиленоксида со средним молекулярным весом 4000000, полиэтиленоксида со средним молекулярным весом 5000000, полиэтиленоксида со средним молекулярным весом 7000000 и полипропиленоксида со средним молекулярным весом от 1000000 до 8000000; или от 10 мг до 1000 мг щелочной карбоксиметилцеллюлозы со средним молекулярным весом от 10000 до 6000000, например карбоксиметилцеллюлозы натрия или карбоксиметилцеллюлозы калия. Расширяющийся слой гидрогеля включает от 0,0 до 350 мг, в настоящем продукте; от 0,1 мг до 250 мг гидроксиалкилцеллюлозы среднего молекулярного веса от 7500 до 450000 (например, гидроксиметилцеллюлозы, гидроксиэтилцеллюлозы, гидроксипропилцеллюлозы, гидроксибутилцеллюлозы или гидроксипентилцеллюлозы) в настоящем продукте; от 1 мг до 50 мг осмотически активного агента, выбранного из группы, состоящей из хлористого натрия, хлористого калия, однозамещенного фосфата калия, винной кислоты, лимонной кислоты, рафинозы, сульфата магния, хлорида магния, мочевины, инозита, сахарозы, глюкозы и сорбита; от 0 до 5 мг красителя, например окиси железа; от 0 до 30 мг в настоящем продукте, от 0,1 до 30 мг гидроксипропилалкилцеллюлозы среднего молекулярного веса от 9000 до 225000, выбранной из группы, состоящей из гидроксипропилэтилцеллюлозы, гидроксипропилпентилцеллюлозы, гидроксипропилметилцеллюлозы и гидроксипропилбутилцеллюлозы; от 0 до 1,5 мг антиоксиданта, выбранного из группы, состоящей из аскорбиновой кислоты, бутилированного гидроксианизола, бутилированного гидроксихинона, бутилгидроксианизола, гидроксикумарина, бутилированного гидрокситолуола, цефальма, этилгаллата, пропилгаллата, октилгаллата, лаурилгаллата, пропилгидроксибензоата, тригидроксибутирофенона, диметилфенола, дибутилфенола, витамина Е, лецитина и этаноламина и от 0 до 7 мг лубриканта, выбранного из группы, состоящей из стеарата кальция, стеарата магния, стеарата цинка, олеата магния, пальмитата кальция, суберата натрия, лаурата калия, солей жирных кислот, солей алициклических кислот, солей ароматических кислот, стеариновой кислоты, олеиновой кислоты, пальмитиновой кислоты, смеси солей жирной, алициклической или ароматической кислоты и жирной, алициклической или ароматической кислоты.
В одной осмоческой лекарственной форме полупроницаемая стенка включает композицию, проницаемую для жидкости и непроницаемую для соединений, раскрытых здесь. Стенка является нетоксичной и включает полимер, выбранный из группы, состоящей из ацилата целлюлозы, диацилата целлюлозы, триацилата целлюлозы, ацетата целлюлозы, диацетата целлюлозы и триацетата целлюлозы. Стенка включает 75-100 вес.% целлюлозного стенкообразующего полимера, или стенка может включать дополнительно 0,01-80 вес.% полиэтиленгликоля или 1-25 вес.% эфира целлюлозы, выбранного из группы, состоящей из гидроксипропилцеллюлозы или гидроксипропилалкилцеллюлозы, например гидроксипропилметилцеллюлозы. Сумма весовых процентов всех компонентов стенки равна 100. Внутренний отсек включает композицию, содержащую лекарство, саму по себе или нанесенную на слой композиции способного к разбуханию гидрогеля. Композиция способного к разбуханию гидрогеля в отсеке увеличивается в размере путем впитывания жидкости через полупроницаемую стенку, что приводит к разбуханию гидрогеля и занятию им пространства отсека, в результате чего композиция с лекарством выталкивается из лекарственной формы. Слой с терапевтической композицией и слой, способный к разбуханию, действуют вместе при функционировании лекарственной формы с высвобождением соединений, раскрытых здесь, в организме субъекта с течением времени. Лекарственная форма включает выходное отверстие в стенке, соединяющее окружающую среду с внутренним отсеком лекарственной формы. Форму дозировки, приводимую в действие осмосом, можно получать для доставки лекарства из лекарственной формы субъекту со скоростью высвобождения нулевого порядка в течение периода времени вплоть до примерно 24 час.
Выражение «выходное отверстие», как применяется здесь, включает способы и подходы, применимые для дозированного высвобождения соединений, раскрытых здесь, из отсека лекарственной формы. Способы выхода включают по меньшей мере один канал, включая отверстие, скважину, щель, пору, пористый элемент, пустотелое волокно, капиллярную трубку, канал, пористую покрышку или пористый элемент, обеспечивающий контролируемое осмосом высвобождение соединений, раскрытых здесь. Выходной канал включает материал, разрушаемый или вымываемый из стенки в жидкой среде при применении с получением по меньшей мере одного размерного выходного отверстия для контролируемого высвобождения. Представительные материалы для образования выходного отверстия или множественных выходных отверстий включают разрушаемые (разъедаемые) полимеры полигликолевой кислоты или полимолочной кислоты в составе стенки, желатиновую нить, поливиноловый спирт, разрушаемые полисахариды, соли и окислы. Выходную пору или много пор можно получить путем разъедания разрушаемого соединения, например сорбита, в стенке. Выходное отверстие обладает размерами для контролируемого высвобождения, например, является круглым, треугольным, квадратным или эллиптическим для дозируемого высвобождения композиции и/или лекарств из лекарственной формы. Лекарственная форма может быть сконструирована с одним или более выходными отверстиями, отстоящими друг от друга на одной поверхности или более чем на одной поверхности стенки. Выражение «жидкая среда» относится к водным биологическим жидкостям у пациента человека, включая желудочно-кишечный тракт. Выходные отверстия и оборудования для их образования описаны в Theeuwes et al, патент U.S. №3845770; Theeuwes et al, патент U.S. №3916899; Saunders et al, патент U.S. №4063064; Theeuwes et al, патент U.S. №4088864 and Ayer et al, патент U.S. №4816263. Выходные отверстия, образуемые путем разрушения (выщелачивания) описаны в Ayer et al, патент U.S. №4200098 и Ayer et al, патент U.S. №4285987.
Для уменьшения частоты введения лекарственных форм и повышения удобства для субъекта и увеличения одобрения субъектом лекарственная форма для орального применения с замедленным высвобождением (независимо от конкретной лекарственной формы с замедленным высвобождением) предпочтительно предоставляет терапевтические концентрации соединений, раскрытых здесь, в кровоток пациента в течение периода по меньшей мере примерно 6 час, более предпочтительно в течение периода времени по меньшей мере примерно 8 час, более предпочтительно в течение периода времени по меньшей мере примерно 12 час, и наиболее предпочтительно в течение периода времени по меньшей мере 24 часа.
В случае оральных жидких препаратов, например суспензий, эликсиров и растворов, подходящие носители, наполнители и растворители включают воду, физиологический раствор, алкиленгликоли (например, пропиленгликоль), полиалкиленгликоли (например, полиэтиленгликоль), масла, спирты, слабокислые буферные растворы с рН от 4 до 6 (например, ацетат, цитрат, аскорбат в концентрации от примерно 5 мМ до примерно 50 мМ) и т.д. Дополнительно можно добавлять ароматические агенты, консерванты, красители, соли желчных кислот, ацилкарнитины и т.п.
Жидкие лекарственные составы, подходящие для применения с небулайзерами и приспособлениями для жидких спреев и приспособлениями для EHD (электрогидродинамических) аэрозолей, обычно включают соединения, раскрытые здесь, вместе с фармацевтически приемлемым носителем, например жидкостью (например, спиртом, водой, полиэтиленгликолем или перфторуглеродом). При необходимости можно добавлять другой материал для изменения аэрозольных свойств раствора или суспензии композиций и/или соединений, раскрытых здесь. В отдельных осуществлениях такой материал является жидкостью, например спиртом, гликолем, полигликолем или жирной кислотой. Другие способы составления жидких растворов или суспензий лекарств для применения с аэрозольными устройствами известны специалисту в данной области техники (Biesalski, патент U.S. №5112598; Biesalski, патент U.S. №5556611).
Для топикального введения соединения, раскрытые здесь, можно включать в состав в виде растворов, гелей, мазей, кремов, суспензий и т.д., как хорошо известно в данной области техники.
Для буккального введения соединения, раскрытые здесь, могут также быть в форме таблеток, пастилок, леденцов и т.п., составленных по известным способам.
Соединения, раскрытые здесь, можно также включать в составы ректальных или вагинальных композиций, например суппозитории или удерживаемые клизмы, например содержащие общепринятые основы суппозиториев, например масло какао или другие глицериды.
Системные составы включают таковые, предназначенные для инъекций, например подкожных, внутривенных, внутримышечных, интратекальных или внутрибрюшинных инъекций, а также таковые, предназаначенные для трансдермального, трансмукозального, орального или пульмонарного введения. Системные составы можно делать в комбинации с дополнительным активным агентом, улучшающим мукоцилиарный клиренс слизистой оболочки дыхательных путей или уменьшающим вязкость мокроты. Такие активные агенты включают, не ограничиваясь этим, блокаторы натриевых каналов, антибиотики, N-ацетилцистеин, гомоцистеин и фосфолипиды.
Для инъекции соединения, раскрытые здесь, можно включать в композиции с водными растворами, например физиологически совместимыми буферами, например раствором Хэнкса, раствором Рингера, физиологическим раствором с буфером или в ассоциации с поверхностно-активным агентом (или увлажняющим агентом, или поверхностно-активным веществом), или получать в форме эмульсии (например, эмульсии типа вода-в-масле или масло-в-воде). Подходящие поверхностно-активные агенты включают, в частности, неионные агенты, например полиоксиэтиленсорбитаны (например, Tween™ 20, 40, 60, 80 или 85) и другие сорбитаны (например, Span™ 20, 40, 60, 80 или 85). Композиции с поверхностно-активным агентом могут включать от 0,05 до 5% поверхностно-активного агента или от 0,1 до 2,5% поверхностно-активного агента. Раствор может содержать, например, суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, соединения, раскрытые здесь, могут находиться в форме порошка для смешивания с подходящим средством перед употреблением, например стерильной водой без пирогенов.
Подходящие эмульсии можно получить с помощью доступных в продаже жировых эмульсий. Комбинации (или отдельные соединения) можно растворять в предварительно сделанной эмульсии или альтернативно их можно растворять в масле (например, соевом масле, масле сафлора красильного, хлопковом масле, кунжутном масле, масле зерновых или миндальном масле) и получить эмульсию путем смешивания с фосфолипидами (например, фосфолипидами яйца, фосфолипидами сои и лецитином из сои) и водой. Понятно, что можно добавлять другие ингредиенты, например глицерин или глюкозу, для доведения тоничности эмульсии. Подходящие эмульсии обычно содержат до 20% масла, например от 5 до 20%. В отдельных осуществлениях добавляют ЭДТА в качестве консерванта.
В дополнение к составам, описанным ранее, соединения, раскрытые здесь, можно также включать в составы депонированных препаратов. Такие составы с пролонгированным действием можно вводить путем имплантации (например, подкожной или внутримышечной) или путем внутримышечной инъекции. Так, например, соединения, раскрытые здесь, можно включать в составы с подходящими полимерными или гидрофобными материалами (например, в качестве эмульсии в приемлемом масле), или с ионообменными смолами, или применять в виде малорастворимых производных, например в виде малорастворимой соли.
При применении для лечения и/или предотвращения заболеваний соединения, раскрытые здесь, и/или включающие их фармацевтические композиции можно вводить сами по себе или в комбинации с другими фармацевтическими агентами, включая соединения, раскрытые здесь и/или включающие их фармацевтические композиции. Соединения, раскрытые здесь, можно вводить или наносить сами по себе или в виде фармацевтических композиций. Конкретная фармацевтическая композиция зависит от необходимого способа введения, как хорошо известно специалисту в данной области техники.
Соединения, раскрытые здесь, и/или включающие их фармацевтические композиции можно вводить субъекту путем внутривенной болюсной инъекции, продолжительного внутривенного вливания, оральной таблетки, оральной капсулы, орального раствора, внутримышечной инъекции, подкожной инъекции, чрескожной абсорбции, буккальной абсорбции, интраназальной абсорбции, ингаляции, сублингвально, интрацеребрально, интравагинально, ректально, топикально, в частности через уши, нос, глаза или кожу, или любым другим подходящим способом, известным специалисту в данной области. В отдельных осуществлениях соединения, раскрытые здесь, и/или их фармацевтические композиции доставляют с помощью форм дозировки с замедленным высвобождением, включая оральные лекарственные формы с замедленным высвобождением. Введение может быть системным или локальным. Известны различные системы доставки (например, инкапсуляция в липосомы, микрочастицы, микрокапсулы, капсулы, системы доставки лекарств «контролируемая пациентом анальгезия» и т.д.), которые можно применять для доставки соединений, раскрытых здесь, и/или включающих их фармацевтических композиций.
Соединения, раскрытые здесь, и/или включающие их фармацевтические композиции можно также вводить прямо в легкие путем ингаляции. Для введения путем ингаляции соединения, раскрытые здесь, и/или включающие их фармацевтические композиции можно вводить в легкие с помощью различных приспособлений. Например, можно применять ингалятор с дозатором (MDI), который применяет емкости, содержащие подходящие легкокипящие пропеллянты, например дихлордифторметан, трихлорфторметан, дихлортетрафторметан, двуокись углерода, или можно применять другие подходящие газы для доставки соединений, раскрытых здесь, и/или включающих их фармацевтических композиций.
Альтернативно, можно применять ингалятор сухих порошков (DPI) для введения соединений, раскрытых здесь, и/или включающих их фармацевтических композиций (см., например, Raleigh et al., Proc. Amer. Assoc. Cancer Research Annual Meeting, 1999, 40, 397). Приспособления DPI обычно применяют такой механизм, как газовый удар, для создания облачка сухого порошка внутри контейнера, которое пациент может вдохнуть. Популярной вариацией является система множественных доз (MDDPI), позволяющая доставку более чем одной терапевтической дозы. Например, желатиновые капсулы и катриджы для применения в ингаляторе или инсуфляторе можно приготовить так, чтобы они содержали порошкообразную смесь композиций и/или соединений, раскрытых здесь, и подходящую порошковую основу для таких систем, например лактозу или крахмал.
Другой тип приспособления, которое можно применять для доставки соединений, раскрытых здесь, и/или включающих их фармацевтических композиций, представляет собой устройство для жидких спреев, которое производится, например, Aradigm Corporation, Hayward, CA. Системы для жидких спреев применяют очень маленькие сопла для превращения жидких лекарственных составов в аэрозоль, который можно прямо вдыхать.
В отдельных осуществлениях применяют небулайзер для доставки соединений, раскрытых здесь, и/или включающих их фармацевтических композиций. Небулайзеры создают аэрозоли жидких лекарственных составов, применяя, например, энергию ультразвука для образования мельчайших частиц, которые можно легко вдыхать (например, Verschoyle et al, British J. Cancer, 1999, 80, Suppl. 2, 96; Armer et al, 15, патент U.S. №5954047; van der Linden et al, патент U.S. №5950619; van der Linden et al., патент U.S. №5970974).
В других осуществлениях применяют электрогидродинамическое аэрозольное устройство ("EHD") для доставки соединений, раскрытых здесь, и/или включающих их фармацевтических композиций. Аэрозольные устройства EHD применяют электрическую энергию для превращения в аэрозоли жидких лекарственных растворов или суспензий (см., например, Noakes et al., патент U.S. №4765539; Coffee, патент U.S. №4962885; Coffee, международная публикация WO №94/12285; Coffee, международная публикация WO №94/14543; Coffee, международная публикация WO №95/26234; Coffee, международная публикация WO №95/26235; Coffee, международная публикация WO №95/32807). Другие способы интрапульмонарной доставки соединений, раскрытых здесь, и/или включающих их фармацевтических композиций известны специалисту в данной области и находятся в рамках притязаний настоящего раскрытия.
Трансдермальные устройства также можно применять для соединений, раскрытых здесь, и/или включающих их фармацевтических композиций. В отдельных осуществлениях устройство для трансдермальной доставки является трансдермальным устройством матричного типа (Miller et al., международная публикация WO №302004/041324). В других осуществлениях устройство для трансдермальной доставки является мультиламинатным трансдермальным устройством (Miller, патентная заявка U.S. 2005/0037059).
Количество соединений согласно изобретению и/или включающих их фармацевтических композиций, которое будет эффективным для лечения или предотвращения заболеваний у пациента, зависит от конкретной природы состояния и может быть определено с помощью стандартных клинических подходов, известных в данной области техники. Количество вводимых соединений согласно изобретению и/или включающих их фармацевтических композиций, конечно, в числе других факторов, зависит от субъекта на лечении, способа введения и суждения лечащего врача.
В конкретных осуществлениях соединения согласно изобретению и/или включающие их фармацевтические композиции можно применять в комбинационной терапии вместе по меньшей мере с одним другим терапевтическим агентом. Соединения согласно изобретению и/или включающие их фармацевтические композиции и терапевтический агент могут действовать аддитивно или, более предпочтительно, синергическим способом. В отдельных осуществлениях соединения согласно изобретению и/или включающие их фармацевтических композиции вводят одновременно с введением другого терапевтического агента. Например, соединения согласно изобретению и/или включающие их фармацевтические композиции можно вводить вместе с другим терапевтическим агентом (например, включая, но не ограничиваясь этим, вместе с периферическим антагонистом опиатов, слабительным, неопиатным анальгетиком и т.п.). В других осуществлениях соединения согласно изобретению и/или включающие их фармацевтические композиции вводят до или после введения других терапевтических агентов.
В одном осуществлении настоящее изобретение представляет фармацевтическую композицию, включающую соединение формулы (I) или его соль, гидрат или сольват, в котором Х является (R)-N-метилналтрексоном, и соединение формулы (I) или его соль, гидрат или сольват, в котором Х является фенольным опиатом, например оксиморфоном, гидроморфоном или морфином, и фармацевтически приемлемый носитель.
Специалисту в данной области техники понятно, что можно применять много модификаций как материалов, так и способов, не выходя за область притязаний настоящего изобретения. Соответственно, настоящие осуществления следует рассматривать как иллюстративные, а не ограничивающие, и изобретение не следует ограничивать деталями, приведенными здесь, но можно модифицировать в пределах области притязаний, заданной приложенной формулой изобретения или ее эквивалентом.
Все публикации и патенты, процитированные здесь, включены полностью посредством ссылки.
Нижеследующие примеры иллюстрируют изобретение.
В примерах применяются следующие сокращения:
HOBt: 1-гидроксибензотриазол; PyBOP: бензотриазол-1-ил-окси-трис-пирролидинфосфоний гексафторфосфат; DIEA: диизопропилэтиламин и BocGlyOSu: N-(N-α-глицинилокси)сукцинимид.
Препарат 1

BocArg(diBoc)OH (Bachem, 0,47 г, 1,0 ммоль) растворяют в диметилформамиде (5 мл) и смешивают с HOBt (0,15 г, 1,15 ммоль) и PyBOP (0,6 г, 1,15 ммоль). Диизопропилэтиламин (0,4 мл, 2,3 ммоль) добавляют к смеси, затем получившийся раствор перемешивают в течение 10 мин и добавляют к раствору H2NCH2CH2N(CH3)CBz (0,28 г, 1,15 ммоль) в диметилформамиде (3 мл). Защелачивают путем добавления DIEA (0,4 мл, 2,3 ммоль). Смесь перемешивают в течение 2 час и затем вливают в 40 мл 5% водной лимонной кислоты. Продукт экстрагируют с помощью 20 мл смеси этилового эфира с этилацетатом (5:1). Органический слой промывают водой, два раза 10 мл 1 М водного раствора карбоната натрия, водой и насыщенным раствором хлористого натрия и затем сушат над сульфатом магния. Растворители удаляют путем выпаривания для получения 0,65 г (98%) изображенного продукта.
Препарат 2

Препарат (продукт) 1 (0,65 г, 0,98 ммоль) растворяют в этаноле (10 мл). Затем добавляют катализатор Перлмана (0,32 г) и смесь подвергают гидрированию (1 атм, 24 часа). Получившуюся смесь отфильтровывают от катализатор и растворитель удаляют путем выпаривания. Остаток затем сушат под вакуумом в течение 2 час с получением 0,525 г (99%) изображенного продукта.
Препарат 3

Гидроморфон (0,21 г, 0,74 ммоль) суспендируют в дихлорметане (3 мл). Затем по каплям добавляют раствор p-нитрофенилхлоркарбоната (0,16 г, 0,79 ммоль) в дихлорметане (3 мл) в течение 5 мин. Реакционную смесь затем озвучивают в течение 2 час для получения маточного раствора изображенного продукта, который применяют на следующем этапе.
Препарат 4

Препарат (продукт) 2 (0,21 г, 0,38 ммоль) добавляют к препарату 3 (маточный раствор, 3 мл, 0,38 ммоль). Затем доводят рН путем добавления триэтиламина (0,056 мл, 0,4 ммоль). Реакционную смесь затем перемешивают в течение 6 час. Растворитель затем выпаривают под вакуумом и остаток растворяют в смеси диэтилового эфира с этилацетатом (3:1, 10 мл) и промывают четыре раза 5 мл 1 М водного раствора карбоната натрия. Органический слой промывают три раза водой (10 мл) и один раз насыщенны раствором хлористого натрия (10 мл), затем сушат над сульфатом магния. Растворител затем удаляют путем выпаривания для получения 0,28 г изображенного продукта (87,5%).
Пример 1
Гидроморфон-3-(N-метил-N-(2-аргиниламино))этилкарбамат
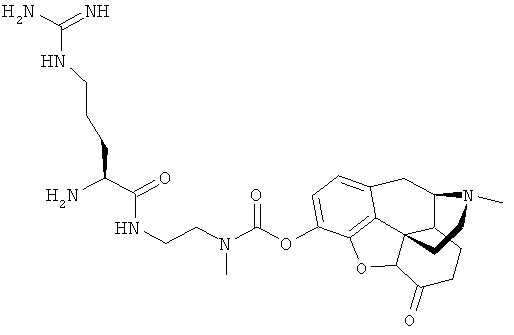
Препарат (продукт) 4 (0,28 г, 0,33 ммоль) растворяют в смеси дихлорметана и трифторуксусной кислоты (1:1) (6 мл). Реакционную смесь затем перемешивают в течение 6 час. Растворитель затем удаляют путем выпаривания под вакуумом и остаток подвергают тритурации этиловьм эфиром (10 мл). Образуется осадок, его отфильтровывают, промывают диэтиловым эфиром (10 мл) четыре раза и сушат в токе сухого азота для получения грубого продукта (0,26 г). Часть грубого продукта (0,14 г) очищают с помощью препаративной хроматографии HPLC (жидкостная хроматография высокого разрешения) с обращенной фазой (с градиентом ацетонитрила) с получением изображенного соединения (0,031 г, 29%). Спектр масс: расчетный 541,3, наблюдаемый 542,4.
Препарат 5

BocGlyOSu (0,037 г, 0,136 ммоль) добавляют при перемешивании к раствору продукта, полученного по примеру 1, (0,12 г, 0,136 ммоль) в диметилформамиде (3 мл). Затем к реакционной смеси добавляют триэтиламин (0,048 мл, 0,272 ммоль) и получившийся раствор перемешивают в течение 2 часов. Растворитель затем удаляют путем выпаривания под высоким вакуумом и остаток подвергают тритурации диэтиловым эфиром (3 мл) с получением изображенного соединения (0,125 г, 100%).
Пример 2
Гидроморфон-3-(N-метил-N-(2-N'-глициниларгиниламино))этилкарбамат

У препарата (родукта) 5 снимают защиту по способу из примера 1 с получением грубого продукта, который очищают с помощью препаративной хроматографии HPLC с обращенной фазой с получением изображенного продукта (0,015 г, 16%). Спектр масс: расчетный 598,3, наблюдаемый 599,1.
Пример 3
Гидроморфон-3-(N-метил-N-(2-N'-ацетиларгиниламино))этилкарбамат
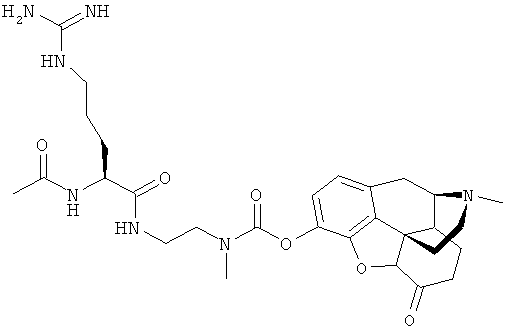
Соединение получают по способу, примененному для получения препарата 5 и в примере 2, но с применением уксусного ангидрида вместо BocGlyOSu. Спектр масс: расчетный 583,3, наблюдаемый 584,4.
Пример 4
Гидроморфон-3-(N-метил-N-(2-N'-трет-бутаноиларгиниламино))этилкарбамат

Соединение получают по способу, примененному для получения препарата 5 и в примере 2, но с применением трет-бутаноилхлорида вместо BocGlyOSu. Спектр масс: расчетный 625,4, наблюдаемый 626,8.
Пример 5
Гидроморфон-3-(N-метил-N-(2-N'-бензоиларгиниламино))этилкарбамат
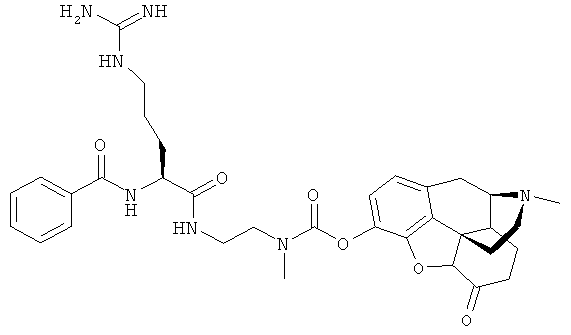
Соединение получают по способу, примененному для получения препарата 5 и в примере 2, но с применением бензоилхлорида вместо BocGlyOSu. Спектр масс: расчетный 645,3, наблюдаемый 646,7.
Пример 6
Гидроморфон-3-(N-метил-N-(N'-пиперонил-2-аргиниламино))этилкарбамат

Соединение получают по способу, примененному для получения препарата 5 и в примере 2, но с применением пиперонилхлорида вместо BocGlyOSu. Спектр масс: расчетный 689,3, наблюдаемый 690,4.
Пример 7
Гидроморфон-3-(N-метил-N-(2-лизиниламино))этилкарбамат

Соединение получают по способу, примененному для получения препаратов 1-4 и в примере 1, но с применением BocLys(Boc)OH вместо BocArg(diBoc)OH.. Спектр масс: расчетный 513,3, наблюдаемый 514,2.
Пример 8
Гидроморфон-3-(N-метил-N-(2-лизинил(метил) амино))этилкарбамат

Соединение получают по способу, примененному в примере 7, но с применением CH3NHCH2CH2N(CH3)CBz вместо H2NCH2CH2N(CH3)CBz. Спектр масс: расчетный 527,3, наблюдаемый 528,2.
Пример 9
Гидроморфон-3-(N-метил-N-(2-N'-аргинил(метил)амино))этилкарбамат

Соединение получают по способу, примененному для получения препаратов 1-4 и в примере 1, но с применением CH3NHCH2CH2N(CH3)CBz вместо H2NCH2CH2N(CH3)CBz. Спектр масс: расчетный 555,3; наблюдаемый 556,3.
Пример 10
Гидроморфон-3-(N-метил-N-(2-глутамиламино))этилкарбамат

Соединение получают по способу, примененному для получения препаратов 1-4 и в примере 1, но с применением BocGlu(OBut)ОН вместо BocArg(diBoc)OH. Спектр масс: расчетный 514,2, наблюдаемый 515,3.
Пример 11
Гидроморфон-3-(N-метил-N-(2-аспартамиламино))этилкарбамат

Соединение получают по способу, примененному для получения препаратов 1-4 и в примере 1, но с применением BocAsp(OtBu)OSu вместо BocArg(diBoc)OH. Спектр масс: расчетный 500,23, наблюдаемый 501,5.
Пример 12
Гидроморфон-3-(N-метил-N-(2-тирозиниламино))этилкарбамат

Соединение получают по способу, примененному для получения препаратов 1-4 и в примере 1, но с применением BocTyr(OtBu)OH вместо BocArg(diBoc)OH. Спектр масс: расчетный 548,26, наблюдаемый 549,3.
Сравнительный пример 1

Соединение получают по способу, примененному для получения препаратов 1-4 и в примере 1, но с применением циклобензенпиперидина вместо H2NCH2CH2N(CH3)CBz. Спектр масс: расчетный 553,3, наблюдаемый 554,5.
Препарат 6

Оксиморфон (0,15 г, 0,5 ммоль) суспендируют в дихлорметане (3 мл). Затем по каплям добавляют р-нитрофенолхлоркарбонат (0,105 г, 0,52 ммоль) в дихлорметане (5 мл) в течение 5 мин. Реакционную смесь затем озвучивают в течение 2 часов с получением маточного раствора изображенного соединения, которое применяют на следующем этапе.
Препарат 7

Препарат (продукт) 2, описанный ранее, (0,265 г, 0,5 ммоль) добавляют к препарату 6 (маточный раствор, 8 мл, 0,5 ммоль). Затем доводят рН путем добавления триэтиламина (0,14 мл, 1,0 ммоль). Реакционную смесь затем перемешивают в течение 4 часов. Растворитель затем выпаривают под вакуумом и остаток растворяют в смеси диэтилового эфира с этилацетатом (3:1, 10 мл) и промывают 4 раза 5 мл 1 М водного раствора карбоната натрия. Органический слой затем промывают три раза водой (10 мл) и один раз насыщенным раствором хлористого натрия (10 мл), затем сушат над сульфатом магния. Растворитель затем удаляют выпариванием под вакуумом с получением 0,39 г изображенного продукта (90%).
Пример 13
Оксиморфон-3-(N-метил-N-(2-аргиниламино))этилкарбамат

Препарат (продукт) 7 (0,39 г, 0,46 ммоль) растворяют в смеси дихлорметана с трифторуксусной кислотой (6 мл). Реакционную смесь затем перемешивают в течение 6 час. Растворитель затем удаляют путем выпаривания под вакуумом и остаток подвергают тритурации этиловым эфиром (10 мл). Образуется осадок, его отфильтровывают, промывают диэтиловым эфиром (10 мл) четыре раза и сушат в токе сухого азота для получения грубого продукта (0,46 г). Часть грубого продукта (0,06 г) очищают с помощью препаративной хроматографии HPLC с обращенной фазой (с градиентом ацетонитрила) с получением изображенного соединения (0,035 г, 90%). Спектр масс: расчетный 557,3, наблюдаемый 558,0.
Препарат 8

BocGlyOSu (0,065 г, 0,24 ммоль) добавляют при перемешивании к раствору грубого продукта по примеру 13 (0,2 г, 0,22 ммоль) в диметилформамиде (3 мл). Затем к реакционной смеси добавляют триэтиламин (0,066 мл, 0,48 ммоль) и получившийся раствор перемешивают в течение 2 часов. Растворитель затем удаляют путем выпаривания под высоким вакуумом и остаток подвергают тритурации диэтиловым эфиром (3 раза по 3 мл) с получением изображенного соединения (0,164 г, 79%).
Пример 14
Оксиморфон-3-(N-метил-N-(2-N'-глициниларгиниламино))этилкарбамат

У препарата (продукта) 8 снимают защиту по способу согласно примеру 13 с получением грубого продукта, который очищают с помощью препаративной хроматографии HPLC с обращенной фазой с получением изображенного продукта (0,055 г, 44%). Спектр масс: расчетный 614,3, наблюдаемый 615,4.
Пример 15
Оксиморфон-3-(N-метил-N-(2-N'-ацетиларгиниламино))этилкарбамат

Соединение получают и очищают по способу, примененному для получения препарата 8 и в примере 14, но с применением уксусного ангидрида вместо BocGlyOSu. Спектр масс: расчетный 599,3, наблюдаемый 600,4.
Препарат 9

Препарат (продукт) 9 синтезируют по способу, приведенному для препарата 7, применяя вместо морфина оксиморфон, с получением маточного раствора изображенного продукта, который применяют далее для получения препарата 10.
Препарат 10
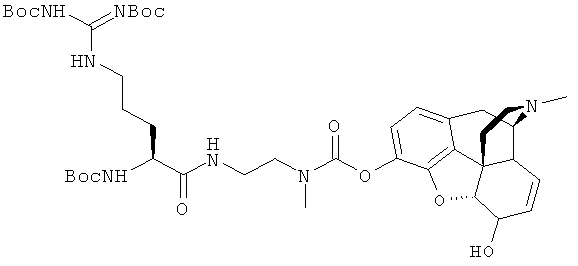
Препарат (продукт) 10 синтезируют по способу, приведенному для препарата 12, с получением изображенного продукта в количестве 0,85 г (92%).
Пример 16
Морфин-3-(N-метил-N-(2-аргиниламино))этилкарбамат

Препарат (продукт) 16 синтезируют по способу, приведенному в примере 13, с получением грубого продукта (0,93 г). Часть грубого продукта (0,08 г) очищают с помощью препаративной хроматографии HPLC с обращенной фазой (с градиентом ацетонитрила) с получением изображенного соединения (0,043 г, 45%). Спектр масс: расчетный 541,6, наблюдаемый 542,6.
Препарат 11

Препарат (продукт) 11 синтезируют по способу, приведенному для препарата 13, с получением изображенного соединения (0,18 г, 84%).
Пример 17
Морфин-3-(N-метил-N-(2-N'-глициниларгиниламино))этилкарбамат

У препарата (продукта) 11 снимают защиту по способу, приведенному в примере 13, с получением грубого продукта, который очищают с помощью препаративной хроматографии HPLC с обращенной фазой с получением изображенного продукта (0,036 г, 40%). Спектр масс: расчетный 598,7, наблюдаемый 599,6.
Пример 18
Морфин-3-(N-метил-N-(2-N'-ацетиларгиниламино))этилкарбамат

Соединение получают и очищают по способу, приведенному для препарата 8 и в примере 14, но с применением уксусного ангидрида вместо BocGlyOSu. Спектр масс: расчетный 583,7, наблюдаемый 584,5.
Препарат 12
Налтрексон в виде свободного основания получают по способу, сходному с описанным в патенте US 4176186.
(R)-N-налтрексон синтезируют по способу, сходному с описанным в патенте WO 2006127899.

Налтрексон (0,34 г, 1,0 ммоль) растворяют в дихлорметане (10 мл). Затем по каплям добавляют p-нитрофенилхлоркарбонат (0,212 г, 1,1 ммоль) в дихлорметане (5 мл) в течение 5 мин. Реакционную смесь затем озвучивают в течение 2 час для получения маточного раствора изображенного продукта, который применяют на следующем этапе.
Препарат 13

Препарат (продукт) 12 (маточный раствор, 15 мл, 1,0 ммоль) добавляют к раствору из 0,265 г (1,05 ммоль) бензил-2-(метиламино)этилкарбамата гидрохлорида в 10 мл диметилформамида. Затем доводят рН путем добавления триэтиламина (0,28 мл, 2,0 ммоль). Реакционную смесь затем перемешивают в течение 2 час. Растворитель затем выпаривают под вакуумом и остаток растворяют в этилацетате (20 мл) и промывают четыре раза 10 мл 1 М водного раствора карбоната натрия. Органический слой затем промывают три раза водой (10 мл) и один раз насыщенным раствором хлористого натрия (10 мл), затем сушат над сульфатом магния. Растворитель затем удаляют путем выпаривания для получения изображенного продукта (0,425 г, 74%). Спектр масс: расчетный 575,26, наблюдаемый 576,4.
Препарат 14

Препарат (продукт) 13 (0,425 г, 0,74 ммоль) растворяют в 5 мл сухого ацетона. Затем добавляют метилйодид (1,42 г, 10 ммоль) и смесь нагревают в пробирке с крышкой при 85°С в течение 3 дней. Растворитель удаляют выпариванием. Остаток затем растворяют в 10 мл метанола и наносят на колонку с 4 г анионообменной смолы в форме хлорида (DOWEX 1×2-200). Хлористую соль элюируют с колонки с применением 50 мл метанола. Раствор затем упаривают до объема 10 мл и смешивают с 2 г силикагеля. Оставшийся растворитель затем выпаривают и остаток в виде сухого порошка наносят на колонку с силикагелем. Оставшийся исходный материал снова элюируют смесью дихлорметана с 1 М раствором аммиака в метаноле (95:5). Затем элюируют продукт смесью дихлорметана с 1 М раствором аммиака в метаноле (70:30) с получением изображенного соединения (0,125 г, 27%).
Пример 19

Препарат (продукт) 14 (0,125 г, 0,2 ммоль) растворяют в трифторуксусной кислоте (3 мл). Добавляют 1 М раствор трибромида бора в дихлорметане (0,4 мл, 0,4 ммоль) при 0-5°С. Смесь перемешивают в течение 2 часов. Растворитель удаляют под вакуумом. С остатком смешивают 10 мл 3 н водного раствора соляной кислоты и смесь перемешивают в течение 16 час. После выпаривания воды под вакуумом грубый продукт очищают с помощью препаративной хроматографии HPLC с обращенной фазой (с градиентом ацетонитрила) с получением изображенного соединения (0,032 г, 30%). Спектр масс: расчетный 456,25, наблюдаемый 456,4.
Препарат 15

Препарат (продукт) 15 получают по способу, приведенному для препарата 1, но с применением BocLys(Boc)OH для получения изображенного продукта с выходом 74%.
Препарат 16
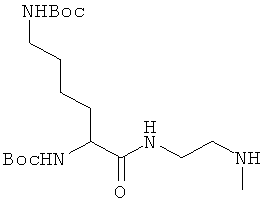
Препарат (продукт) 16 получают по способу, приведенному для препарата 2, но с применением препарата 15 для получения изображенного продукта с выходом 95%.
Препарат 17

Препарат (продукт) 17 получают по способу, приведенному для препарата 12, но с применением препарата 16 для получения изображенного продукта с выходом 66%.
Препарат 18

Соединение получают по способу, приведенному для препарата 14. Выход 16%.
Пример 20

Соединение получают по способу, приведенному в примере 1. Грубый продукт очищают с помощью препаративной хроматографии HPLC с обращенной фазой (с градиентом ацетонитрила) с получением изображенного соединения (33%). Спектр масс: расчетный 584,3, наблюдаемый 584,5.
Протоколы для оценочного тестирования соединений
1а. «Кухонный» тест
Стабильность тестируемого соединения в присутствии легкодоступных химикатов домашнего хозяйства, уксусной кислоты (уксуса) и бикарбоната натрия (питьевой соды) можно продемонстрировать с помощью следующего «кухонного» теста.
Растворяют 0,5 мг тестируемого соединения в 1 мл каждого из следующих растворов, соответствующих возможным химикатам домашнего хозяйства: 30% водного раствора уксусной кислоты, 50% водного раствора этанола и насыщенного водного раствора бикарбоната натрия (питьевой соды). Каждый раствор держат при комнатной температуре в течение 20-24 час и затем нагревают при 85°С в течение 20-24 час. Высвобождение гидроморфона и общую стабильность отслеживают с помощью аналитической HPLC. Соединение считают прошедшим этот тест, если через 20 час концентрация гидроморфона не превосходит 10% исходного материала или другого продукта деградации.
Соединения, приведенные здесь в качестве примеров, прошли этот тест.
1б. Демонстрация контролируемого высвобождения исходного лекарства из «активированного» пролекарства
Демонстрация in vitro
Контролируемое высвобождение исходного лекарства (например, гидроморфона) из пролекарства демонстрируют путем синтеза и тестирования in vitro нескольких соединений, изображенных в таблице 1. Соединения А и С являются примерами «активированных» пролекарств, где ферментативно-отщепляемая активирующая группа отсутствует в целях возможности проведения оценки кинетики, определяемой последовательностью реакций внутримолекулярной циклизации и высвобождения. Как описано выше, последовательность внутримолекулярных реакций циклизации и высвобождения приводит к одновременному образованию циклической мочевины и высвобождению исходного лекарства.
Кинетики высвобождения этих соединений оценивают в водных растворах при повышенном рН. Высвобождение гидроморфона по ходу этих реакций подтверждают с помощью LC-MS (жидкостная хроматография в сочетании с масс-спектрометрией) анализа. Соединение D является интересным примером молекулы, несущей нуклеофильный атом азота, пока еще остающийся неспособным к внутримолекулярной реакции циклизации-высвобождения из-за конформационных ограничений, налагаемых пиперазиновым циклом (т.е. он не может принять конформацию, необходимую для нуклеофильной передачи одиночной пары электронов на азоте на карбонильный углерод карбаматного звена). Дополнительный пример структурных свойств, необходимых для реакции внутримолекулярной циклизации-высвобождения, предоставлен соединением В, представляющим молекулу в «неактивированной» форме (т.е. одиночная пара электров на ацилированом атоме азота является недоступной для нуклеофильной атаки карбамата). Интересно заметить, что такие реакции внутримолекулярой циклизации-высвобождения могут ингибироваться при низком рН в результате дезактивации нуклеофильного атома азота путем протонирования.
Эти данные подтверждают функциональные роли разделительной группы и «активируемого» нуклеофильного азота в реакциях внутримлекуляной циклизации и высвобождения молекулы исходного лекарства.
Демострация in vivo
Для того чтобы исследовать образование исходного лекарства из пролекарства in vivo, соединения, изображенные в таблице 2, синтезируют и внутривенно вводят крысам. Вслед за введением дозы измеряют уровни гидроморфона в плазме, как описано в экспериментальном разделе. Соединения А и В являются примерами «активированных» пролекарств, у которых ферментативно-отщепляемые активирующие группы отсутствуют с целью проведения специфической оценки кинетики за счет последовательности реакций внутримолекулярной циклизации-высвобождения. Как описано выше, последовательность реакций внутримолекулярной циклизации-высвобождения приводит к одновременному образованию циклической мочевины и высвобождению исходного лекарства.
Когда такие лекарства вводят крысам, высвобождается гидроморфон. Соединение С является интересным примером молекулы, несущей нуклеофильный атом азота, пока еще остающийся неспособным к реакции внутримолекулярной циклизации-высвобождения из-за конформационных ограничений, налагаемых пиперазиновьм циклом (т.е. он не может принять конформацию, необходимую для нуклеофильного переноса одиночной пары электронов от азота на карбонильный углерод карбаматного звена). Когда это соединение вводят крысам, гидроморфон не обнаруживается. Соединение D является примером пролекарства, где ферментативно-отщепляемая защитная группа присоединена к азоту пиперазина. Исследуют, допускает ли эта молекула возможность прямого опосредованного ферментом гидролиза карбаматного звена. Данные показывают, что этот процесс не происходит in vivo. Интересно, что когда крысам вводят соединение D, то образуется соединение С и гидроморфон не освобождается, что предоставляет дополнительное доказательство активации рассматриваемых пролекарств in vivo.
2. Анализ связывания человеческого рецептора µ-опиатов in vitro
В данном тесте измеряют сродство тестируемых соединений к рецептору µ-опиатов по сравнению с гидроморфоном.
Основная процедура:
Основную процедуру проводят согласно способу, описанному Wang, J.-B., Johnson, Р.S., Perscio, A.M., Hawkins, A.L., Griffin, CA. and UhI, G.R. (1994). FEBS Lett., 338: 217-222.
Анализ: рецептор µ-опиатов.
Происхождение: человеческий рекомбинантный (клетки НЕК-293).
Контрольное соединение: [d-Ala2, N-Me-Phe4, Gly5-ол]-энкефалин (DAMGO).
Радиоактивный лиганд: [3H]DAMGO (0,5 нМ).
Неспецифический лиганд: налоксон (10 мкМ).
Инкубация: 120 мин при 22°С.
Способ детектирования: сцинтилляционный счетчик.
Анализ и представление результатов. Специфическое связывание с рецептором определяют как разность между общим связыванием и неспецифическим связыванием, определенными в присутствии избытка немеченого лиганда. Результат представляют в процентах от контроля специфического связывания и как наблюдающееся ингибирование контрольного специфического связывания, полученное в присутствии тестируемых соединений. Значения IC50 (концентрация в молях, приводящая к половине максимального ингибирования контрольного специфического связывания) и коэффициенты Хилла (nH) определяют с помощью аппроксимации кривых конкурентного ингибирования по уравнению Хилла с применением нелинейной регрессии.
Результаты:
Вышеприведенные результаты, согласующиеся с данными о взаимосвязи структуры и активности опиатов, известными из литературы, полученные путем скрининга этих представительных молекул, показывают инактивацию опиатов при присоединении прогруппы к фенольному остатку гидроморфона.
3. Фармакокинетические данные
Концентрация гидроморфона в плазме в зависимости от времени после внутривенного введений у крыс
Внутривенное введение: тестируемое соединение растворяют в физиологическом растворе (2 мг/мл) и вводят путем инъекции в хвостовую вену или яремную вену через канюлю самцам крыс Sprague-Dawley. Гидроморфон (НМ) в количестве 1 мг/кг, оксигидроморфон (ОМ) в количестве 0,5 мг/кг, морфин (MR) в количестве 1 мг/кг и N-метилналтрексон (N-MTX) в количестве 2 мг/кг применяют в качестве положительных контролей и тестируемые соединения дозируют по эквивалентной дозе исходного опиата (например, эквивалентно 1 мг/кг, 0,5 мг/кг или 2 мг/кг). В конкретные моменты времени кровь отбирают, погашают метанолом, центрифугируют при 14000 об/мин при 4°С и хранят при -80°С до анализа. Образцы количественно оценивают с помощью LS/MS/MS с применением ABI3000 тройного квадрупольного масс-спектрометра.
Оральное введение. Тестируемое соединение растворяют в физиологическом растворе (20 мг/мл) и вводят орально самцам крыс Sprague-Dawley с канюлей в яремной вене. НМ, ОМ, MR в количестве 10 мг/кг и N-MTX в количестве 20 мг/кг применяют в качестве положительных контролей и тестируемые соединения дозируют приблизительно эквивалентно дозе исходного опиата (например, эквивалентно 10 или 20 мг/кг). В конкретные моменты времени кровь отбирают, погашают метанолом, центрифугируют при 14000 об/мин при 4°С и хранят при -80°С до анализа. Образцы количественно оценивают с помощью LS/MS/MS с применением ABI3000 тройного квадрупольного масс-спектрометра.
Результаты
По сравнению с гидроморфоном, соединения согласно изобретению проявляют меньшие значения Cmax гидроморфона при внутривенном введении, однако проявляют сходные с гидроморфоном значения Cmax при оральном введении.
По сравнению с оксиморфоном, соединения согласно изобретению проявляют меньшие значения Cmax оксиморфона при внутривенном введении, однако проявляют сходные с оксиморфоном значения Cmax при пероральном введении.
По сравнению с морфином, соединения согласно изобретению проявляют меньшие значения Cmax морфина при внутривенном введении, однако проявляют сходные с морфином значения Cmax при оральном введении.
Соединение из примера 19, являющееся вторичным карбаматным пролекарством (R)-N-метилналтрексона, описывает один аспект изобретения, представляющий способ предоставления пациенту активируемого после введения антаготиста фенольного опиата с контролируемым высвобождением, в данном случае антагониста опиатов с периферическим действием. По сравнению с (R)-N-метилналтрексоном соединение проявляет лучшие значения Cmax (R)-N-метилналтрексона при оральном введении.
Фигура 1. Концентрация N-MTX в плазме в зависимости от времени после перорального введения у крыс. Сплошная линия представляет концентрацию N-MTX в плазме после орального введения N-MTX в количестве 20 мг/кг. Пунктирная линия представляет концентрацию N-MTX в плазме после орального введения соединения из примера 19 в количестве 20 мг/кг.
Фигура 2. Концентрация гидроморфона и N-MTX в плазме в зависимости от времени после перорального введения пролекарств у крыс. Сплошная линия представляет концентрацию гидроморфона в плазме после орального введения соединения из примера 3 в количестве 10 мг/кг. Пунктирная линия представляет концентрацию N-MTX в плазме после орального введения соединения из примера 19 в количестве 20 мг/кг.
При рассмотрении кривых изменения концентрации в плазме в зависимости от времени на фигуре 1 ясно, что применение (R)-N-метилналтрексона может быть ограниченным из-за его плохого фармакокинетического профиля (например, биодоступности при оральном введении). Это ограничение можно преодолеть с помощью пролекарства, представленного соединением из примера 19, проявляющим улучшенный фармакокинетический профиль (например, повышенную биодоступность при оральном введении). Дополнительно, фигура 2 демонстрирует, что применение пролекарств, представленных соединениями по примерам 3 и 19, приводит к более высоким и возможно взаимодополняющим (complimentary) уровням агониста и атнагониста опиатов в плазме, которые можно получить при оральном введении соответствующих пролекарств.
Концентрация гидроморфона в плазме в зависимости от времени после внутривенного введения у собак.
Пятнадцать самцов собак породы бигль отбирают из колонии на испытательной станции (Test Facility) животных и разбивают на пять групп по три животных в группе. Животных отбирают для исследования на основе удовлетворительного здоровья, как определяет штатный ветеринар с помощью тестов на состояние здоровья, предшествующих исследованию. Животных подвергают голоданию в течение ночи перед каждым введением дозы и выдают им пищу приблизительно через 4 часа после каждого введения дозы. Все вещества хранят при 22±5°С до введения дозы в сухих условиях.
Внутривенное введение
Тестируемые соединения готовят на 0,9% растворе NaCl в требуемой концентрации 0,4 мг/мл (0,4 мг/кг конечная доза) для внутривенного введения. Гидроморфон готовят на 0,9% растворе NaCl в требуемой концентрации 0,2 и 0,1 мг/мл (0,1 и 0,2 мг/кг конечная доза) для внутривенного введения.
Образец состава, включающего дозу, отбирают из каждого состава для внутривенного введения доз до его введения до и после фильтрации. Все образцы составов доз сохраняют при -20±5°С до анализа.
Тестируемые соединения вводят через временные чрезкожные катетеры, помещенные в периферическую вену, в количестве 0,4 мг/кг и в объеме дозы 1 мл/кг. Животные получают медленный внутривенный болюс, вводимый в течение 1,5 мин. Гидроморфон вводят сходным образом в количестве 0,2 мк/кг и в объеме дозы 1 мл/кг. Животные получают медленный внутривенный болюс, вводимый в течение 2 мин. Сразу после внутривенного введения катетеры промывают 3 мл физиологического раствора перед удалением. Образцы крови (0,5 мл, цельная кровь, антикоагулянт Li-гепарин) отбирают до введения дозы и в определенные моменты времени в течение 24 час после внутривенного введения. Все образцы отбирают путем прямого прокола периферической вены, погашают метанолом, центрифугируют при 14000 об/мин и хранят при -80°С до анализа. Образцы количественно оценивают с помощью LS/MS/MS с применением ABI3000 тройного квадрупольного масс-спектрометра.
Пероральное введение
Тестируемые соединения готовят на 0,9% растворе NaCl в требуемой концентрации 4 мг/мл (4 мг/кг конечная доза) для орального введения. Гидроморфон готовят на 0,9% растворе NaCl в требуемой концентрации 2 мг/мл (2 мг/кг конечная доза) для перорального введения. Составы для перорального введения перемешивают путем взбалтывания и при необходимости озвучивают до полного растворения. Образец состава дозы (0,15 мл) отбирают от каждого состава для перорального введения перед введением дозы. Все образцы составов доз сохраняют при -20±5°С до анализа.
Тестируемые соединения вводят перорально через трубку для кормления в количестве 4 мг/кг и в объеме дозы 1 мл/кг. Гидроморфон вводят перорально через трубку для кормления в количестве 2 мг/кг и в объеме дозы 1 мл/кг. Сразу после перорального введения трубки для кормления промывают 10 мл воды перед их удалением. Образцы крови (0,5 мл, цельная кровь, антикоагулянт Li-гепарин) отбирают до введения дозы и в определенные моменты времени в течение 24 час после орального введения. Все образцы отбирают путем прямого прокола периферической вены, гасят метанолом, центрифугируют при 14000 об/мин и хранят при -80°С до анализа. Образцы количественно оценивают с помощью LS/MS/MS с применением ABI3000 тройного квадрупольного масс-спектрометра.
Результаты
По сравнению с гидроморфоном, соединения согласно изобретению проявляют меньшие значения Cmax гидроморфона при внутривенном введении, однако проявляют сходные с гидроморфоном значения Cmax при пероральном введении.
Вместе взятые эти данные тестирования показывают, что соединения согласно изобретению способны предоставлять пациентам активируемые после введения фенольные опиаты с контролируемым высвобождением. В частности, данные показывают, что пролекарства высвобождают опиаты при пероральном введении, но удерживаются от высвобождения опиатов в условиях, обычно применяемых теми, кто хотел бы злоупотребить лекарством.
Реферат
В настоящем изобретении заявлено соединение структурной формулы (I) или его фармацевтически приемлемая соль, сольват или гидрат, где: Х является фенольным опиатом, в котором атом водорода гидроксильной группы фенола замещен ковалентной связью с -C(O)-Y-(C(R)(R))-N-C(R)(R); Y является -NR-, Rявляется (C) алкилом; n равно 2 или 3, каждый из Rи Rнезависимо является водородом, алкилом или замещенным алкилом; R- является водородом или метилом; Rявляется остатком L-аминокислоты или остатком их N-ацильных производных, а также гидроморфон 3-(N-метил-N-(2-N'-ацетиларгиниламино)этилкарбамат, или его фармацевтически приемлемая соль. Указан также способ получения соединения формулы (I) или его фармацевтически приемлемой соли. Заявлена фармацевтическая композиция, контролирующая высвобождение фенольных опиатов и способ лечения боли у пациента, который нуждается в этом, включающий введение эффективного количества соединения. 5 н. и 14 з.п. ф-лы, 20 пр., 12 табл., 2 ил.
Формула

или его фармацевтически приемлемая соль, сольват или гидрат,
где Х является фенольным опиатом, в котором атом водорода гидроксильной группы фенола замещен ковалентной связью с -C(O)-Y-(C(R1)(R2))n-N-C(R3)(R4);
Y является -NR5-, R5 является (С1-6) алкилом;
n равно 2 или 3,
каждый из R1 и R2 независимо является водородом, алкилом или замещенным алкилом;
R3 - является водородом или метилом;
R4 является остатком L-аминокислоты, выбранной из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глицина, глутамина, глутаминовой кислоты, гистидина, изолейцина, лейцина, метионина, фенилаланина, пролила, серина, треонина, триптофана, тирозина, лизина и валина, остатком дипептида или трипептида, состоящего из двух или трех L-аминокислотных остатков, независимо выбранных из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глицина, глутамина, глутаминовой кислоты, гистидина, изолейцина, лейцина, метионина, фенилаланина, пролина, серина, треонина, триптофана, тирозина, лизина и валина, или остатком их N-ацильных производных.

или его защищенного производного,
в которой Y, R1, R2, n, R3 и R4 как определено для формулы I, с соединением формулы (IV)

где Х как определено для формулы I, M представляет собой уходящий атом или группу,
с последующим удалением любой защитной группы и, при необходимости, ацилированием этого соединения и/или образованием фармацевтически приемлемой соли.
Документы, цитированные в отчёте о поиске
Производные 6-амино-морфина, способ их получения и их применение
Патенты аналоги
Производные 6-амино-морфина, способ их получения и их применение






Комментарии