Способы получения изохинолинонов и твердые формы изохинолинонов - RU2626883C2
Код документа: RU2626883C2
Чертежи






















Описание
ПРИТЯЗАНИЯ НА ПРИОРИТЕТ
Настоящая заявка претендует на приоритет Предварительной Заявки на патент США с порядковым номером 61/431304, поданной 10 Января 2011 года, и Предварительной Заявки на патент США с порядковым номером 61/578655, поданной 21 Декабря 2011 года, причем обе указанные заявки включены в настоящую заявку в полном объеме посредством ссылки.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Активность клетки может регулироваться внешними сигналами, которые стимулируют или ингибируют внутриклеточные процессы. Процесс, посредством которого стимулирующие или ингибирующие сигналы передаются в клетку, вызывая внутриклеточную реакцию, именуется сигнальной трансдукцией (передачей сигнала). В течение последних десятилетий были выявлены каскадные процессы сигнальной трансдукции, и было обнаружено, что они играют ключевую роль в целом ряде биологических реакций. Было обнаружено, что нарушения в различных компонентах путей передачи сигналов несут ответственность за широкий круг заболеваний, включая многочисленные формы рака, воспалительных расстройств, метаболических расстройств, сосудистых и нервных заболеваний (Gaestel et al., Current Medicinal Chemistry (2007) 14:2214-2234).
Киназы представляют собой важный класс сигнальных молекул. Киназы можно в целом разделить на протеин киназы и липид киназы (липидные киназы), причем некоторые киназы демонстрируют двойную специфичность. Протеин киназы представляют собой ферменты, которые фосфорилируют другие белки и/или сами себя (т.е. осуществляют аутофосфорилирование). Протеин киназы можно в целом подразделить на три основные группы, исходя из особенностей фосфорилирования субстратов: тирозин киназы, которые преимущественно фосфорилируют субстраты по остаткам тирозина (например, erb2, рецептор PDGF, рецептор EGF, рецептор VEGF, src, abl), серин/треонин киназы, которые преимущественно фосфорилируют субстраты по остаткам серина и/или треонина (например, mTorC1, mTorC2, ATM, ATR, DNA-PK, Akt) и киназы двойной специфичности, которые фосфорилируют субстраты по остаткам тирозина, серина и/или треонина.
Липид киназы представляют собой ферменты, которые катализируют фосфорилирование липидов. Эти ферменты, и образующиеся фосфорилированные липиды и полученные из этих липидов биологически активные органические молекулы играют важную роль в большом количестве различных физиологических процессов, включая клеточную пролиферацию, миграцию, адгезию и дифференцировку. Некоторые липид киназы ассоциированы с клеточными мембранами и катализируют фосфорилирование липидов, содержащихся в клеточных мембранах или ассоциированных с ними. Примеры таких ферментов включают фосфоинозитид (фосфоинозитиды) киназы (например, PI3-киназы, PI4-киназы), диацилглицерин киназы и сфингозин киназы.
Фосфоинозитид 3-киназы (PI3K) составляют особое и консервативное семейство внутриклеточных липид киназ, которые фосфорилируют 3’-OH группу фосфатидилинозитов или фосфоинозитидов. Семейство PI3K включает 15 киназ, которые различаются по специфичности к субстратам, моделям экспрессии и путям регулирования. PI3K класса I (p110α, p110β, p110δ и p110γ), как правило, активируются тирозин киназами или рецепторами, сопряженными с G-белком, с образованием липидных продуктов, именуемых PIP3, которые вступают во взаимодействие с эффекторами последующих стадий процесса, например, с эффекторами сигнального пути Akt/PDK1, mTOR, киназами семейства Tec и GTPазами семейства Rho. PI3K классов II и III играют ключевую роль во внутриклеточной миграции во время синтеза PI(3)P и PI(3,4)P2.
Сигнальный путь PI3K является одной из систем, которые наиболее часто подвергаются мутациям при раковых заболеваниях человека. Передача сигнала PI3K также представляет собой ключевой фактор при многих других заболеваниях у людей. Передача сигнала PI3K вовлечена во многие болезненные состояния, включая аллергический контактный дерматит, ревматоидный артрит, остеоартрит, воспалительные заболевания кишечника, хроническую обструктивную болезнь легких, псориаз, рассеянный склероз, астму, расстройства, связанные с осложнениями диабета, и воспалительные осложнения заболеваний сердечно-сосудистой системы, например острый коронарный синдром.
Было разработано большое число ингибиторов PI3K. Хотя во многих случаях активность таких соединений первоначально оценивали по их растворам, важную роль играют характеристики твердых форм, например, полиморфизм. Полиморфные формы лекарственного вещества, например, ингибитора PI3K, могут иметь различные химические и физические свойства, в т.ч. степень кристалличности, температуру плавления, химическую реакционную способность, растворимость, скорость растворения, оптические и механические свойства, давление паров и плотность. Эти свойства могут оказывать непосредственное влияние на легкость производства лекарственного вещества и конечного лекарственного продукта. Кроме того, полиморфизм часто является фактором, подпадающим под тестирование лекарственных продуктов различных производителей на «единообразие», осуществляемое регулирующими органами. Например, полиморфизм часто выявляют у таких соединений, как варфарин натрия, фамотидин и ранитидин. Полиморфизм может влиять на качество, безопасность и/или эффективность лекарственного продукта, например, ингибитора киназы. Таким образом, исследования, направленные на полиморфы ингибиторов PI3K и способы получения полиморфов ингибиторов PI3K, представляются очень полезной областью исследований при разработке действующих фармацевтических ингредиентов (API).
Кроме того, ингибиторы PI3K применялись для лечения различных заболеваний и расстройств у людей (например, в клинических испытаниях). Для получения лекарственных веществ, предназначенных для применения в лечении людей, подходит существующая в настоящее время Надлежащая Практика Организации Производства (GMP). Следует применять такие способы производства, которые позволяют регулировать уровни примесей и гарантировать, что производятся такие API, которые стабильно соответствуют установленным спецификациям. Таким образом, существует значительная потребность в способе получения ингибиторов PI3K, подходящих для применения людьми, в частности в промышленном масштабе, который, в том числе, является безопасным, масштабируемым, эффективным, экономически целесообразным и/или имеющим другие желаемые свойства. Среди прочего, в настоящем изобретении раскрыты полиморфные формы ингибиторов PI3K, которые удовлетворяют указанным потребностям, и обеспечивают важные преимущества.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
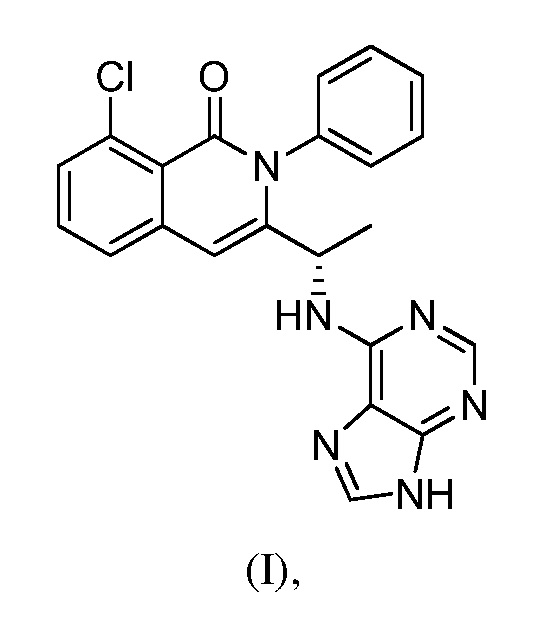
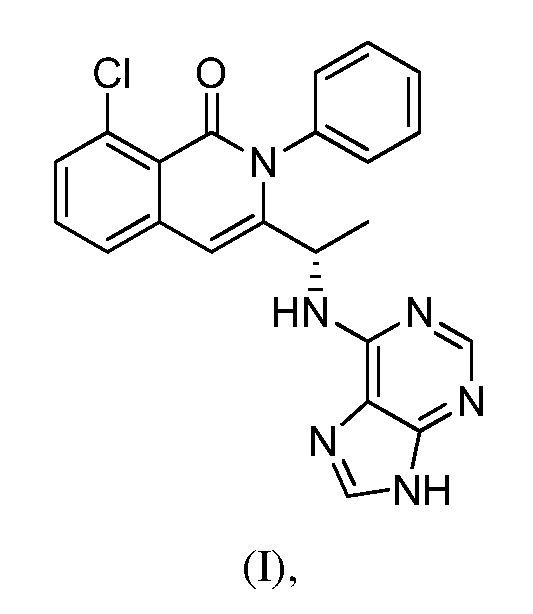
В одном из вариантов осуществления, изобретение относится к полиморфным формам соединения формулы (I)

именуемым в настоящей заявке формой A, формой B, формой C, формой D, формой E, формой F, формой G, формой H, формой I, формой J или аморфной формой соединения формулы (I) или к их солям, сольватам или гидратам; или к смеси двух или нескольких из указанных форм. В одном из вариантов осуществления, полиморфная форма соединения формулы (I) может являться кристаллической формой, частично кристаллической формой, аморфной формой, или смесью кристаллической формы (форм) и/или аморфной формы (форм).
В одном из вариантов осуществления, изобретение относится к способу получения соединения формулы (I):

или его фармацевтически приемлемой соли, сольвата или гидрата. В одном из вариантов осуществления, этот способ включает любые одну, две, три, четыре, пять, шесть, семь или восемь или более из следующих стадий:
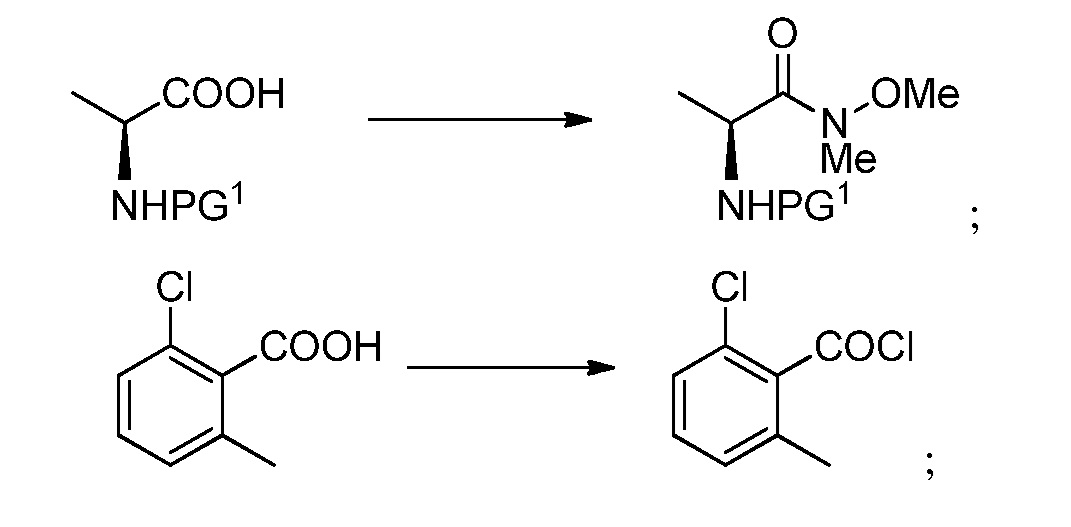


где:
фрагмент X выбран из фтора, хлора, брома, йода, -O-SO2-4-метилфенила и -O-SO2-метила;
фрагмент PG1 выбран из бензила, замещенного бензила, метоксикарбонила, этоксикарбонила, замещенного этоксикарбонила, 9-флуоренилоксикарбонила, замещенного 9-флуоренилоксикарбонила, 2,2,2-трихлорэтоксикарбонила, 2-триметилсилилэтоксикарбонила, (2-фенил-2-триметилсилил)этоксикарбонила, 2-фенилэтоксикарбонила, 1,1-диметил-2,2-дибромэтоксикарбонила, 1,1-диметил-2,2,2-трихлорэтоксикарбонила, т-бутоксикарбонила, 1-адамантилоксикарбонила, 2-адамантилоксикарбонила, триизопропилсилоксикарбонила, винилоксикарбонила, 1-изопропоксикарбонила, 8-хинолилоксикарбонила, 2,4-диметилпент-3-илоксикарбонила, бензилоксикарбонила и замещенного бензилоксикарбонила;
фрагмент PG2 выбран из метилсульфонила, замещенного метилсульфонила, бензолсульфонила, замещенного бензолсульфонила, бензилоксикарбонила, замещенного бензилоксикарбонила, 2,2,2-трихлорэтоксикарбонила, 2-триметилсилилэтоксикарбонила, т-бутоксикарбонила, 1-адамантилоксикарбонила, 2-адамантилоксикарбонила, алкила, замещенного алкила, т-бутилдиметилсилила, триизопропилсилила, аллила, бензила, замещенного бензила, гидроксиметила, метоксиметила, диэтоксиметила, (2-хлорэтокси)метила, т-бутоксиметила, т-бутилдиметилсилоксиметила, пивалоилоксиметила, бензилоксиметила, диметиламинометила, 2-тетрагидропиранила, замещенного алкоксиметила и замещенного арилоксиметила; и
где заместители выбраны из алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклила, арила, арилалкила, гетероарила, гетероарилалкила, алкокси, циклоалкокси, гетероциклилокси, арилокси, гетероарилокси, амидо, амино, ацила, ацилокси, алкоксикарбонила, сложного эфира, простого эфира, тио, сульфинила, сульфонила, сульфонамидо, галогена, циано, гидроксила, нитро, фосфата, мочевины, карбамата и карбоната.
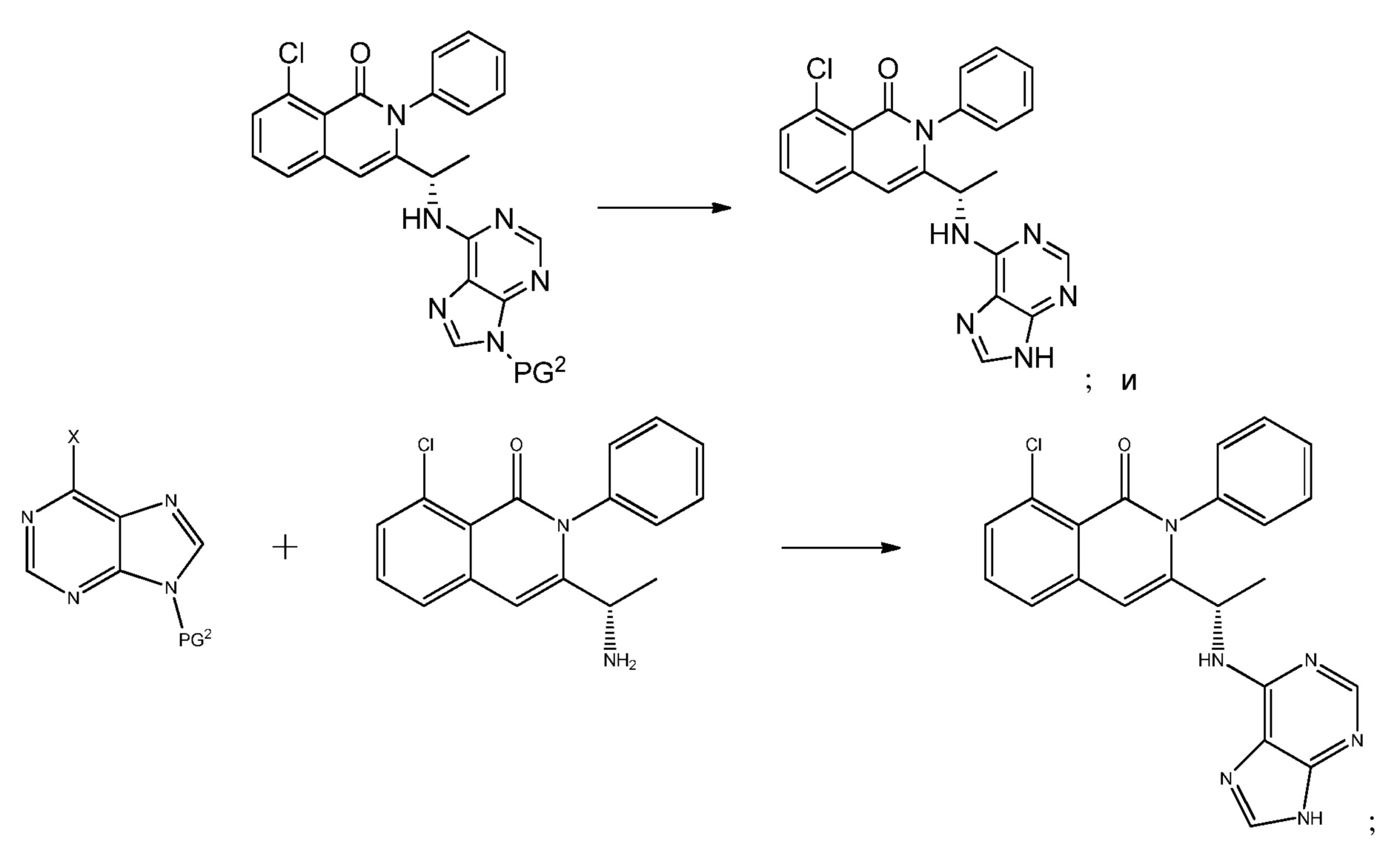
В одном из вариантов осуществления, в изобретении разработан способ получения полиморфной формы C соединения формулы (I)
где указанный способ включает:
(i) воздействие среды, содержащей воду, на композицию, содержащую, по меньшей мере, один полиморф соединения формулы (I), не являющийся формой C, или его соль, сольват или гидрат, в течение периода времени, достаточного для превращения, по меньшей мере, 50% общего количества полиморфа (полиморфов), не являющегося формой C, в форму C соединения формулы (I); и
(ii) выделение указанной полиморфной формы C.
В одном из вариантов осуществления, среда, содержащая воду, включает воду, например, в форме паров воды и/или жидкой воды. В одном из вариантов осуществления, среда, содержащая воду, включает систему растворителей, в которую входит неводный растворитель и жидкая вода. В одном из вариантов осуществления, неводный растворитель представляет собой растворитель, смешивающийся с водой. Например, жидкая вода может присутствовать в количестве примерно 1%, примерно 2%, примерно 3%, примерно 4%, примерно 5%, примерно 6%, примерно 7%, примерно 8%, примерно 9%, примерно 10%, примерно 15%, примерно 20%, примерно 25%, примерно 30%, примерно 35%, примерно 40%, примерно 45%, примерно 50%, примерно 55%, примерно 60%, примерно 65%, примерно 70%, примерно 75%, примерно 80%, примерно 85%, примерно 90%, примерно 95%, примерно 96%, примерно 97%, примерно 98%, примерно 99% или примерно 100% по объему от объема системы растворителей. В одном из вариантов осуществления, жидкая вода присутствует в количестве от примерно 10% до примерно 50% по объему от объема системы растворителей.
В одном из вариантов осуществления, среда, содержащая воду, включает систему растворителей, содержащую воду (например, примерно 90% объем/объем) и изопропиловый спирт (например, примерно 10% объем/объем). В одном из вариантов осуществления, среда, содержащая воду, включает систему растворителей, включающую воду и этанол. В одном из вариантов осуществления, среда, содержащая воду, включает систему растворителей, содержащую воду и смешивающийся с водой растворитель, например, в том числе, спирт C1-C4, ацетон и ацетонитрил. В одном из вариантов осуществления, смешивающийся с водой растворитель представляет собой спирт, в т.ч., например, метанол, этанол, 1-пропанол, 2-пропанол, 1-бутанол, 2-бутанол, т-бутанол, этиленгликоль. В одном из вариантов осуществления соотношение между водой и смешивающимся с водой растворителем в системе растворителей по настоящей заявке составляет примерно 50:1, примерно 40:1, примерно 30:1, примерно 20:1, примерно 10:1, примерно 9:1, примерно 8:1, примерно 7:1, примерно 6:1, примерно 5:1, примерно 4:1, примерно 3:1, примерно 2:1, примерно 1:1, примерно 1:2, примерно 1:3, примерно 1:4, примерно 1:5, примерно 1:6, примерно 1:7, примерно 1:8, примерно 1:9, примерно 1:10, примерно 1:20, примерно 1:30, примерно 1:40 или примерно 1:50 объем/объем. В одном из вариантов осуществления, соотношение между водой и смешивающимся с водой растворителем в системе растворителей по настоящей заявке составляет от примерно 50:1 до примерно 1:1, от примерно 40:1 до примерно 1:1, от примерно 30:1 до примерно 1:1, от примерно 20:1 до примерно 1:1, от примерно 10:1 до примерно 1:1, от примерно 9:1 до примерно 1:1, от примерно 8:1 до примерно 1:1, от примерно 7:1 до примерно 1:1, от примерно 6:1 до примерно 1:1, от примерно 5:1 до примерно 1:1, от примерно 4:1 до примерно 1:1, от примерно 3:1 до примерно 1:1, от примерно 2:1 до примерно 1:2, от примерно 1:1 до примерно 1:4, от примерно 1:1 до примерно 1:5, от примерно 1:1 до примерно 1:6, от примерно 1:1 до примерно 1:7, от примерно 1:1 до примерно 1:8, от примерно 1:1 до примерно 1:9, от примерно 1:1 до примерно 1:10, от примерно 1:1 до примерно 1:20, от примерно 1:1 до примерно 1:30, от примерно 1:1 до примерно 1:40, или от примерно 1:1 до примерно 1:50 объем/объем.
В одном из вариантов осуществления, полиморф, не являющийся формой C, представляет собой твердую форму соединения формулы (I) или его соли, сольвата или гидрата (например, кристаллическую форму, аморфную форму или смесь кристаллической формы (форм) и/или аморфной формы (форм)), которая не является полиморфной формой C соединения формулы (I). В одном из вариантов осуществления, полиморф, не являющийся формой C, представляет собой форму A, форму B, форму D, форму E, форму F, форму G, форму H, форму I, форму J или аморфную форму соединения формулы (I) или их соль, сольват или гидрат; или смесь двух или нескольких из этих форм. В одном из вариантов осуществления, полиморф, не являющийся формой C, может включать, по меньшей мере, примерно 50% по массе полиморфной формы A соединения формулы (I). В одном из вариантов осуществления, полиморф, не являющийся формой C (например, форма A или форма B), может быть получен из композиции, включающей форму C.
В одном из вариантов осуществления, изобретение относится к способу получения полиморфной формы C соединения формулы (I):

где указанный способ включает:
(i) взаимодействие соединения формулы (Ia):

где:
PG2 представляет собой защитную группу, выбранную из метилсульфонила, замещенного метилсульфонила, бензолсульфонила, замещенного бензолсульфонила, бензилоксикарбонила, замещенного бензилоксикарбонила, 2,2,2-трихлорэтоксикарбонила, 2-триметилсилилэтоксикарбонила, т-бутоксикарбонила, 1-адамантилоксикарбонила, 2-адамантилоксикарбонила, алкила, замещенного алкила, т-бутилдиметилсилила, триизопропилсилила, аллила, бензила, замещенного бензила, гидроксиметила, метоксиметила, диэтоксиметила, (2-хлорэтокси)метила, т-бутоксиметила, т-бутилдиметилсилоксиметила, пивалоилоксиметила, бензилоксиметила, диметиламинометила, 2-тетрагидропиранила, замещенного алкоксиметила и замещенного арилоксиметила, и
где заместители выбраны из алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклила, арила, арилалкила, гетероарила, гетероарилалкила, алкокси, циклоалкокси, гетероциклилокси, арилокси, гетероарилокси, амидо, амино, ацила, ацилокси, алкоксикарбонила, сложного эфира, простого эфира, тио, сульфинила, сульфонила, сульфонамидо, галогена, циано, гидроксила, нитро, фосфата, мочевины, карбамата и карбоната;
с одним или несколькими реагентами для удаления защитной группы PG2 с получением соединения формулы (I); и
(ii) выделение полиморфной формы C соединения формулы (I);
где, по меньшей мере, одну из стадий (i) и (ii) проводят в среде, содержащей воду.
В некоторых вариантах осуществления, один или несколько реагентов для удаления защитной группы PG2 включают, не ограничиваясь этим, кислоты, например, HCl, HBr и TFA; основания, представляющие собой карбонаты, например, Na2CO3 и K2CO3; основания, представляющие собой гидроксиды, например, NaOH и KOH; литиевые основания, например, метиллитий, этиллитий, пропиллитий, н-бутиллитий, н-пентиллитий и н-гексиллитий; окислители, например, нитрат церия аммония; гидрирующие реагенты, например, циклогексадиен/Pd чернь и H2/Pd на угле; TBAF и BF3·Et2O. В одном из вариантов осуществления, среда, содержащая воду, включает воду, например, в форме водяных паров и/или жидкой воды. В одном из вариантов осуществления, среда, содержащая воду, включает систему растворителей, включающую неводный растворитель и жидкую воду, как описано в других местах настоящей заявки.
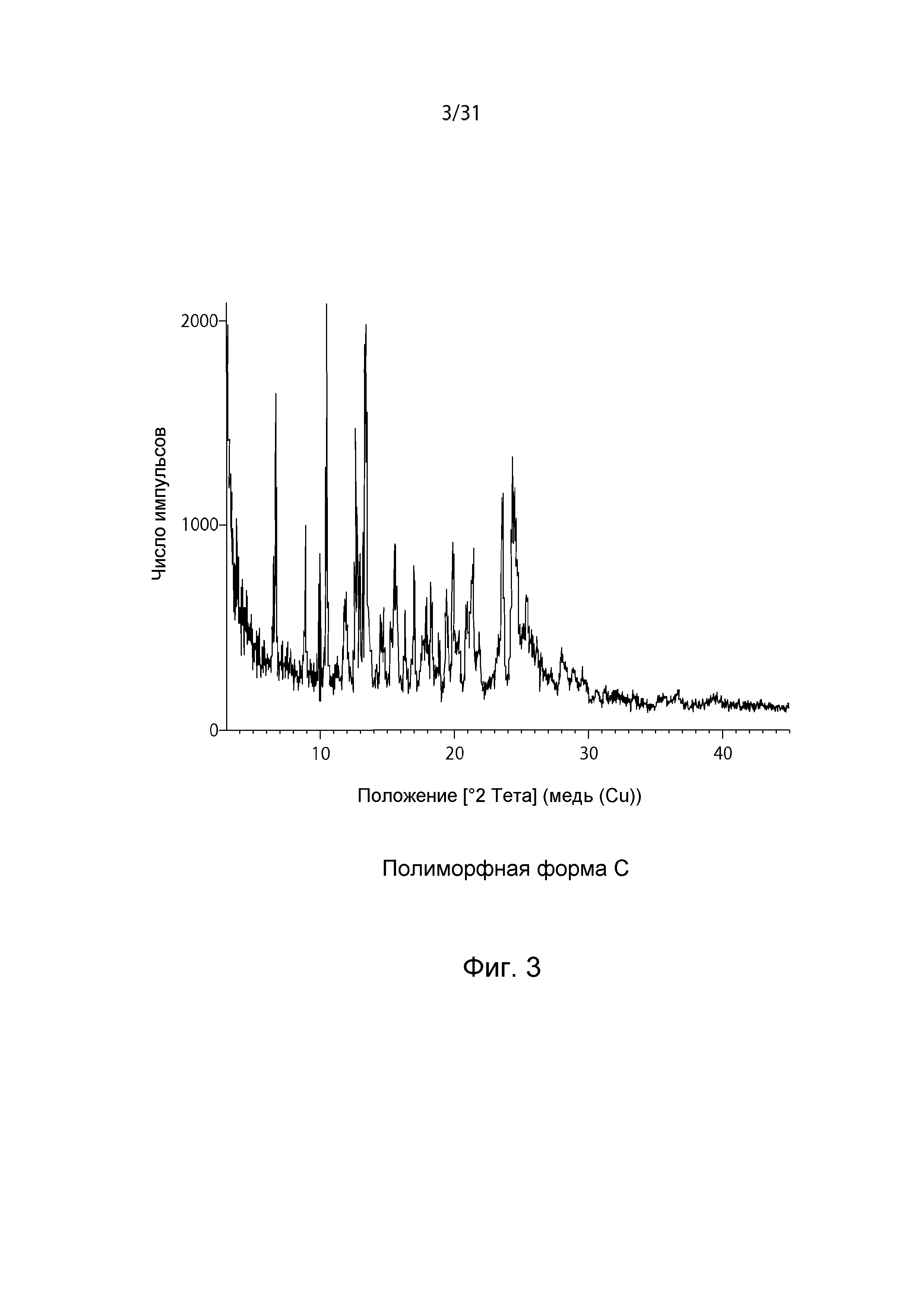
В некоторых вариантах осуществления, полиморф по настоящему изобретению является полиморфной формой C соединения формулы (I). В некоторых вариантах осуществления, изобретение относится к твердой форме соединения формулы (I), включающей форму C соединения формулы (I). В некоторых вариантах осуществления, изобретение относится к твердой форме соединения формулы (I), включающей форму C соединения формулы (I), которая является практически чистой. В одном из вариантов осуществления, форма C может быть охарактеризована, наличием на картине дифракции рентгеновских лучей на порошке (XRPD) пиков при углах 2Θ примерно 10,4, примерно 13,3 и примерно 24,3 градусов. В некоторых вариантах осуществления форма C характеризуется наличием на термограмме дифференциальной сканирующей калориметрии (DSC) эндотермического пика при температуре примерно 208°C. В других вариантах осуществления, форма C характеризуется наличием на термограмме дифференциальной сканирующей калориметрии (DSC) эндотермического пика при температуре примерно 208°C, экзотермического пика при температуре примерно 222°C и эндотермического пика при температуре примерно 280°C. В некоторых вариантах осуществления, форму C можно охарактеризовать термогравиметрическим анализом, где наблюдаемая потеря массы в % составляет примерно 1,7% приблизительно при 80°C и примерно 0,2% приблизительно при 190°C.
В одном из вариантов осуществления, изобретение относится к способу получения полиморфной формы A соединения формулы (I):
где указанный способ включает:
(i) взаимодействие соединения формулы (Ia):

где:
PG2 представляет собой защитную группу, выбранную из метилсульфонила, замещенного метилсульфонила, бензолсульфонила, замещенного бензолсульфонила, бензилоксикарбонила, замещенного бензилоксикарбонила, 2,2,2-трихлорэтоксикарбонила, 2-триметилсилилэтоксикарбонила, т-бутоксикарбонила, 1-адамантилоксикарбонила, 2-адамантилоксикарбонила, алкила, замещенного алкила, т-бутилдиметилсилила, триизопропилсилила, аллила, бензила, замещенного бензила, гидроксиметила, метоксиметила, диэтоксиметила, (2-хлорэтокси)метила, т-бутоксиметила, т-бутилдиметилсилоксиметила, пивалоилоксиметила, бензилоксиметила, диметиламинометила, 2-тетрагидропиранила, замещенного алкоксиметила и замещенного арилоксиметила, и
где заместители выбраны из алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклила, арила, арилалкила, гетероарила, гетероарилалкила, алкокси, циклоалкокси, гетероциклилокси, арилокси, гетероарилокси, амидо, амино, ацила, ацилокси, алкоксикарбонила, сложного эфира, простого эфира, тио, сульфинила, сульфонила, сульфонамидо, галогена, циано, гидроксила, нитро, фосфата, мочевины, карбамата и карбоната;
с одним или несколькими реагентами для удаления защитной группы PG2 с получением соединения формулы (I); и
(ii) выделение полиморфной формы A соединения формулы (I).
В некоторых вариантах осуществления, стадия (ii) может включать перекристаллизацию соединения формулы (I) или его соли, сольвата или гидрата из системы с одним растворителем, или из системы с несколькими растворителями, которые не содержат ни этилацетата, ни гексана. В некоторых вариантах осуществления, этот способ дополнительно включает стадию растворения соединения формулы (I) или его соли, сольвата или гидрата в системе с одним растворителем или в системе с несколькими растворителями, удаление твердого остатка с получением жидкого раствора, охлаждение указанного жидкого раствора со скоростью, которая позволяет осуществить кристаллизацию формы A, и выделение формы A из жидкого раствора.
В некоторых вариантах осуществления, один или несколько реагентов для удаления защитной группы PG2 включают, не ограничиваясь этим, кислоты, например, HCl, HBr и TFA; основания, представляющие собой карбонаты, например, Na2CO3 и K2CO3; основания, представляющие собой гидроксиды, например, NaOH и KOH; литиевые основания, например, метиллитий, этиллитий, пропиллитий, н-бутиллитий, н-пентиллитий и н-гексиллитий; окислители, например, нитрат церия аммония; гидрирующие реагенты, например, циклогексадиен/Pd чернь и H2/Pd на угле; TBAF и BF3·Et2O.
В одном из вариантов осуществления, изобретение относится к композиции, включающей соединение формулы (I):

или его фармацевтически приемлемую соль, сольват или гидрат, а также один или несколько фармацевтически приемлемых эксципиентов.
В одном из вариантов осуществления, композиция включает полиморфную форму C. В одном из вариантов осуществления, композиция включает смесь полиморфной формы C и, по меньшей мере, одного полиморфа соединения формулы (I), не являющегося формой C, или его фармацевтически приемлемой соли, сольвата или гидрата. Например, в некоторых вариантах осуществления, композиция может включать полиморфную форму C и полиморфную форму A. В других вариантах осуществления, композиция может включать полиморфную форму C и полиморфную форму B. В других вариантах осуществления, композиция может включать полиморфную форму C и полиморфную форму D. В других вариантах осуществления, композиция может включать полиморфную форму C и полиморфную форму E. В других вариантах осуществления, композиция может включать полиморфную форму C и полиморфную форму F. В других вариантах осуществления, композиция может включать полиморфную форму C и полиморфную форму G. В других вариантах осуществления, композиция может включать полиморфную форму C и полиморфную форму H. В других вариантах осуществления, композиция может включать полиморфную форму C и полиморфную форму I. В других вариантах осуществления, композиция может включать полиморфную форму C и полиморфную форму J. В других вариантах осуществления, композиция может включать полиморфную форму C и аморфную форму соединения формулы (I) или ее фармацевтически приемлемую соль, сольват или гидрат. В одном из вариантов осуществления соотношение между полиморфной формой C и общим количеством полиморфа(полиморфов), не являющегося формой C, составляет более, чем примерно 1:1, более, чем примерно 2:1, более, чем примерно 3:1, более, чем примерно 4:1, более, чем примерно 5:1, более, чем примерно 6:1, более, чем примерно 7:1, более, чем примерно 8:1 или более, чем примерно 9:1. В одном из вариантов осуществления, композиция, включающая форму C, является фармацевтической композицией. В одном из вариантов осуществления, композиция состоит из, по меньшей мере, 98% по массе соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или гидрата.
В одном из вариантов осуществления, композиция включает смесь полиморфной формы A и, по меньшей мере, одного полиморфа соединения формулы (I), не являющегося формой A, или его фармацевтически приемлемой соли, сольвата или гидрата. Например, в некоторых вариантах осуществления, композиция может включать полиморфную форму A и полиморфную форму B. В других вариантах осуществления, композиция может включать полиморфную форму A и полиморфную форму C. В других вариантах осуществления, композиция может включать полиморфную форму A и полиморфную форму D. В других вариантах осуществления, композиция может включать полиморфную форму A и полиморфную форму E. В других вариантах осуществления, композиция может включать полиморфную форму A и полиморфную форму F. В других вариантах осуществления, композиция может включать полиморфную форму A и полиморфную форму G. В других вариантах осуществления, композиция может включать полиморфную форму A и полиморфную форму H. В других вариантах осуществления, композиция может включать полиморфную форму A и полиморфную форму I. В других вариантах осуществления, композиция может включать полиморфную форму A и полиморфную форму J. В других вариантах осуществления, композиция может включать полиморфную форму A и аморфную форму соединения формулы (I) или их фармацевтически приемлемые соли, сольваты или гидраты. В одном из вариантов осуществления соотношение между полиморфной формой A и общим количеством полиморфа(полиморфов), не являющегося формой A, составляет более, чем примерно 1:1, более, чем примерно 2:1, более, чем примерно 3:1, более, чем примерно 4:1, более, чем примерно 5:1, более, чем примерно 6:1, более, чем примерно 7:1, более, чем примерно 8:1 или более, чем примерно 9:1. В одном из вариантов осуществления соотношение между полиморфной формой A и общим количеством полиморфа(полиморфов), не являющегося формой A, составляет менее, чем примерно 1:1, менее, чем примерно 2:1, менее, чем примерно 3:1, менее, чем примерно 4:1, менее, чем примерно 5:1, менее, чем примерно 6:1, менее, чем примерно 7:1, менее, чем примерно 8:1 или менее, чем примерно 9:1. В одном из вариантов осуществления, композиция, включающая форму A, является фармацевтической композицией. В одном из вариантов осуществления, композиция, по меньшей мере, на 98% по массе состоит из соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или гидрата.
В одном из вариантов осуществления, композиция по настоящему изобретению представляет собой твердую дозированную форму, включающую полиморф соединения формулы (I) или его фармацевтически приемлемую соль, сольват или гидрат, а также один или несколько фармацевтически приемлемых эксципиентов. В одном из вариантов осуществления, композиция по настоящему изобретению представляет собой твердую дозированную форму, включающую полиморф соединения формулы (I) или его фармацевтически приемлемую соль, сольват или гидрат. В одном из вариантов осуществления, композиция по настоящему изобретению является таблеткой или капсулой. В одном из вариантов осуществления, композиция по настоящему изобретению является капсулой.
В одном из вариантов осуществления, композиция по настоящему изобретению включает терапевтически эффективное количество полиморфа соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления, это терапевтически эффективное количество составляет примерно 0,5, примерно 1, примерно 2, примерно 3, примерно 4, примерно 5, примерно 10, примерно 15, примерно 20, примерно 25, примерно 30, примерно 35, примерно 40, примерно 45, примерно 50, примерно 55, примерно 60, примерно 65, примерно 70, примерно 75, примерно 80, примерно 85, примерно 90, примерно 95, примерно 100, примерно 110, примерно 120, примерно 130, примерно 140, примерно 150, примерно 160, примерно 170, примерно 180, примерно 190, примерно 200, примерно 210, примерно 220, примерно 230, примерно 240, примерно 250, примерно 260, примерно 270, примерно 280, примерно 290, примерно 300, примерно 325, примерно 350, примерно 375, примерно 400, примерно 425, примерно 450, примерно 475, примерно 500, примерно 600, примерно 700, примерно 800, примерно 900 или примерно 1000 мг или более. В одном из вариантов осуществления, композиция по настоящему изобретению включает, по меньшей мере, один фармацевтически приемлемый носитель или эксципиент. В некоторых вариантах осуществления, композиция по настоящему изобретению включает один или несколько фармацевтически приемлемых носителей или эксципиентов, в том числе, например, микрокристаллическую целлюлозу, кросповидон и/или стеарат магния. В одном из вариантов осуществления, композиция по настоящему изобретению представляет собой дозированную форму с немедленным высвобождением. В некоторых вариантах осуществления, композиция по настоящему изобретению представляет собой твердую желатиновую капсулу. В некоторых вариантах осуществления, композиция по настоящему изобретению представляет собой мягкую желатиновую капсулу. В некоторых вариантах осуществления, композиция по настоящему изобретению включает форму C соединения формулы (I). В некоторых вариантах осуществления, композиция по настоящему изобретению включает форму A соединения формулы (I). В некоторых вариантах осуществления, композиция по настоящему изобретению включает аморфную форму соединения формулы (I). В некоторых вариантах осуществления, композиция по настоящему изобретению включает смесь двух или нескольких полиморфов соединения формулы (I) или их фармацевтически приемлемую соль, сольват или гидрат, например, описанные в настоящем изобретении полиморфы A, B, C, D, E, F, G, H, I и J.
В другом варианте осуществления, композиция по настоящему изобретению представляет собой суспензию, включающую карбоксиметилцеллюлозу и воду. В одном из вариантов осуществления, композиция по настоящему изобретению может дополнительно включать один или несколько эксципиентов, например, полисорбат, полиэтиленгликоль, циклодекстрин, декстрозу, н-метилпирролидон, pH-буферы, разбавленную хлористоводородную кислоту, сложные эфиры полиоксиэтилена и 12-гидроксистеариновой кислоты или смеси двух или нескольких из перечисленных эксципиентов. Другие эксципиенты, которые могут применяться в типовых составах включают, не ограничиваясь этим, наполнители, такие как лактоза, маннит, крахмал, сорбит, сахароза, дикальцийфосфат и микрокристаллическая целлюлоза; дезинтегрирующие средства, такие как натрий кросскармелоза и натрий крахмал гликолят; средства для скольжения, такие как коллоидный диоксид кремния, диоксид кремния, силикат магния и тальк; смазывающие средства, такие как стеарил фумарат натрия и стеариновая кислота; и поверхностно-активные вещества, такие как лаурил сульфат натрия, додецил сульфат натрия, Tween®80 и Lutrol®.
В одном из вариантов осуществления, композицию по настоящему изобретению применяют для лечения расстройства, связанного с PI3K (например, заболевания или расстройства, описанного в тексте настоящей заявки или известного в технике). В одном из вариантов осуществления, композицию по настоящему изобретению применяют для ингибирования активности PI3K киназы. Эффективность соединения формулы (I) в этих способах, а также других способах, раскрытых в настоящей заявке, была описана, например, в заявке US 2009/0312319.
В одном из вариантов осуществления, изобретение относится к способу лечения расстройства, связанного с PI3K (например, заболевания или расстройства, описанного в тексте настоящей заявки или известного в технике), где указанный способ включает введение полиморфа соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или гидрата, субъекту, у которого имеется такая необходимость. В одном из вариантов осуществления, изобретение относится к способу лечения расстройства, связанного с PI3K, где указанный способ включает введение полиморфа соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или гидрата, субъекту, у которого имеется такая необходимость. В одном из вариантов осуществления, изобретение относится к способу лечения расстройства, связанного с PI3K, где указанный способ включает введение композиции по настоящему изобретению субъекту, у которого имеется такая необходимость. В одном из вариантов осуществления, указанный способ включает введение полиморфа соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или гидрата, или его композиции, субъекту, у которого имеется такая необходимость, перорально, парентерально или местно. В одном из вариантов осуществления, указанный способ включает совместное применение одного или нескольких дополнительных терапевтических агентов или способов лечения субъекта, наряду с одной или несколькими дополнительными лечебными процедурами (например, радиационной терапией, или хирургическим вмешательством).
ОПИСАНИЕ ИЛЛЮСТРАТИВНОГО МАТЕРИАЛА
На Фиг.1 показана картина дифракции рентгеновских лучей на порошке (XRPD) полиморфной формы A.
На Фиг.2 показана рентгенограмма XRPD полиморфной формы B.
На Фиг.3 показана рентгенограмма XRPD полиморфной формы C.
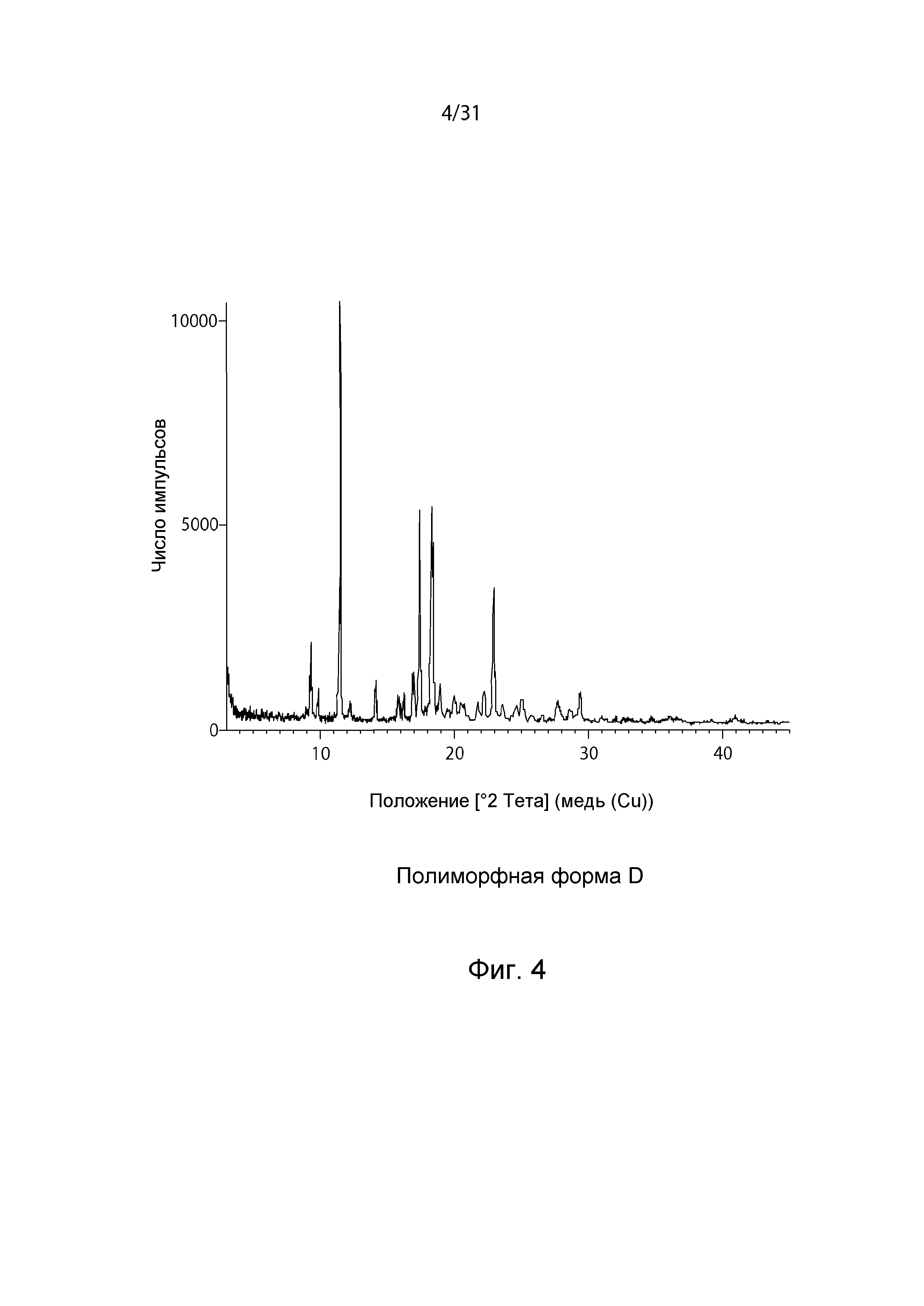
На Фиг.4 показана рентгенограмма XRPD полиморфной формы D.
На Фиг.5 показана рентгенограмма XRPD полиморфной формы E.
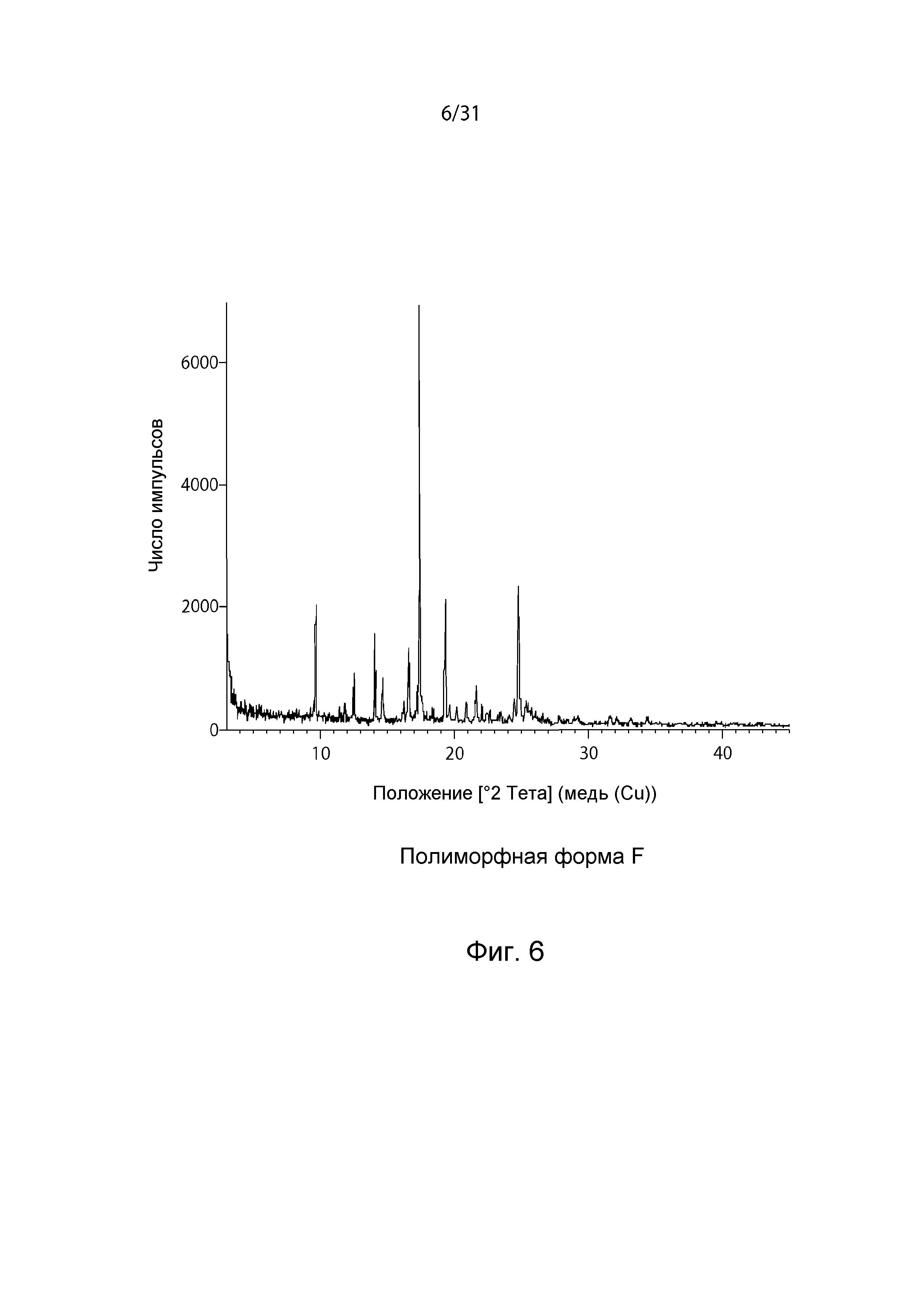
На Фиг.6 показана рентгенограмма XRPD полиморфной формы F.
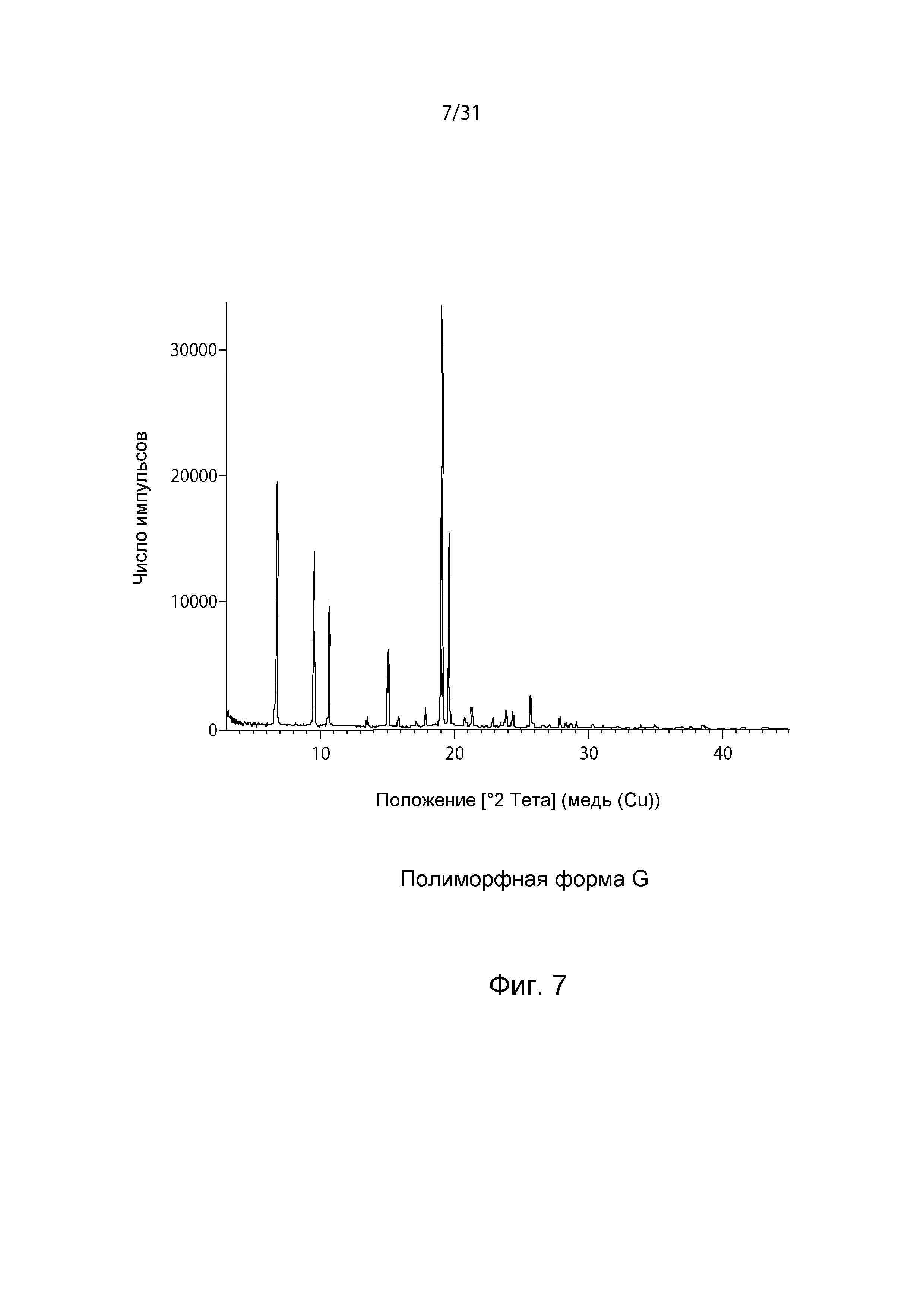
На Фиг.7 показана рентгенограмма XRPD полиморфной формы G.
На Фиг.8 показана рентгенограмма XRPD полиморфной формы H.
На Фиг.9 показана рентгенограмма XRPD полиморфной формы I.
На Фиг.10 показана рентгенограмма XRPD полиморфной формы J.
На Фиг.11 рентгенограмма XRPD аморфной формы соединения формулы (I).
На Фиг.12 показана термограмма дифференциальной сканирующей калориметрии (DSC) полиморфной формы A.
На Фиг.13 показана термограмма DSC полиморфной формы B.
На Фиг.14 показана термограмма DSC полиморфной формы C.
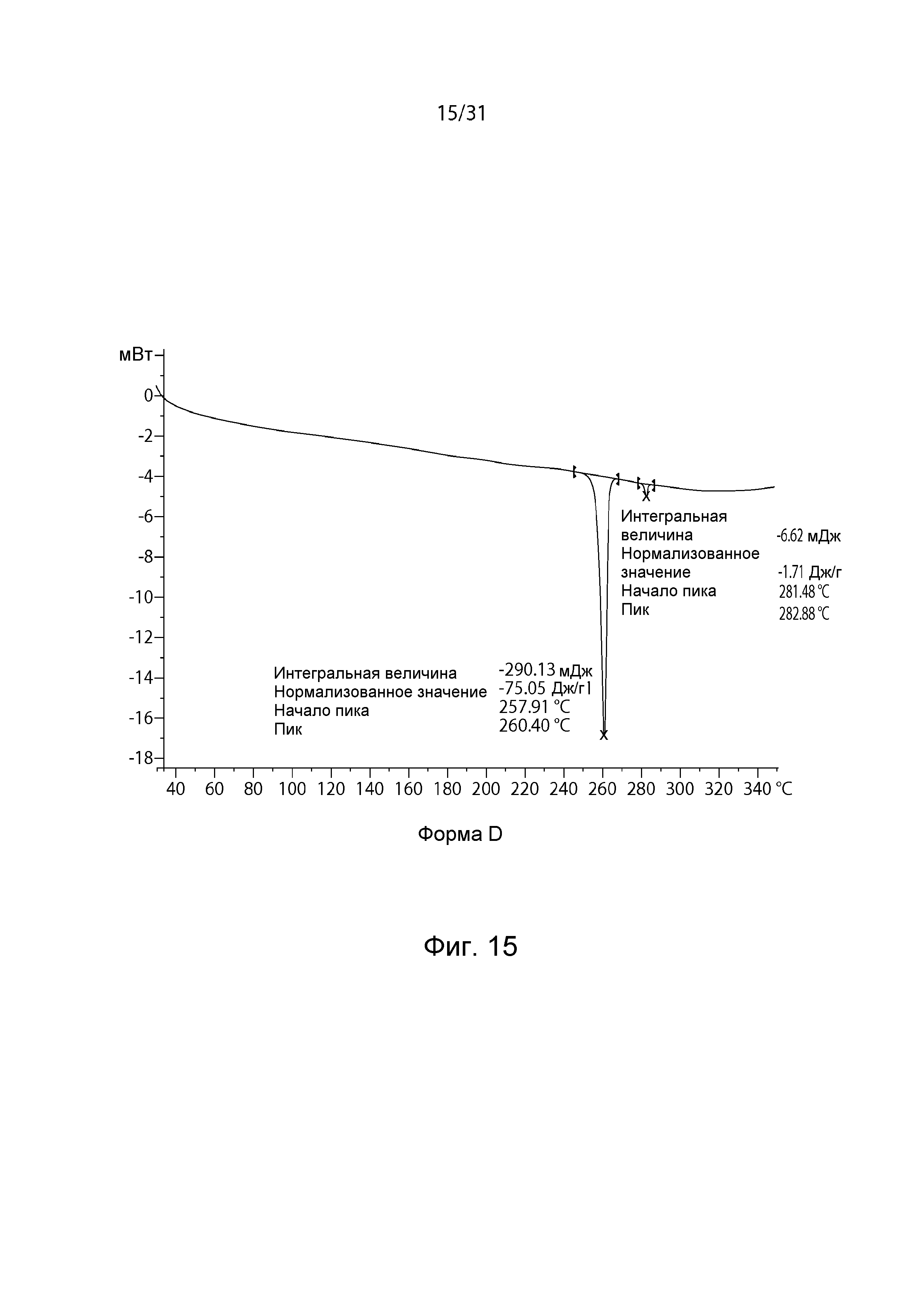
На Фиг.15 показана термограмма DSC полиморфной формы D.
На Фиг.16 показана термограмма DSC полиморфной формы E.
На Фиг.17 показана термограмма DSC полиморфной формы F.
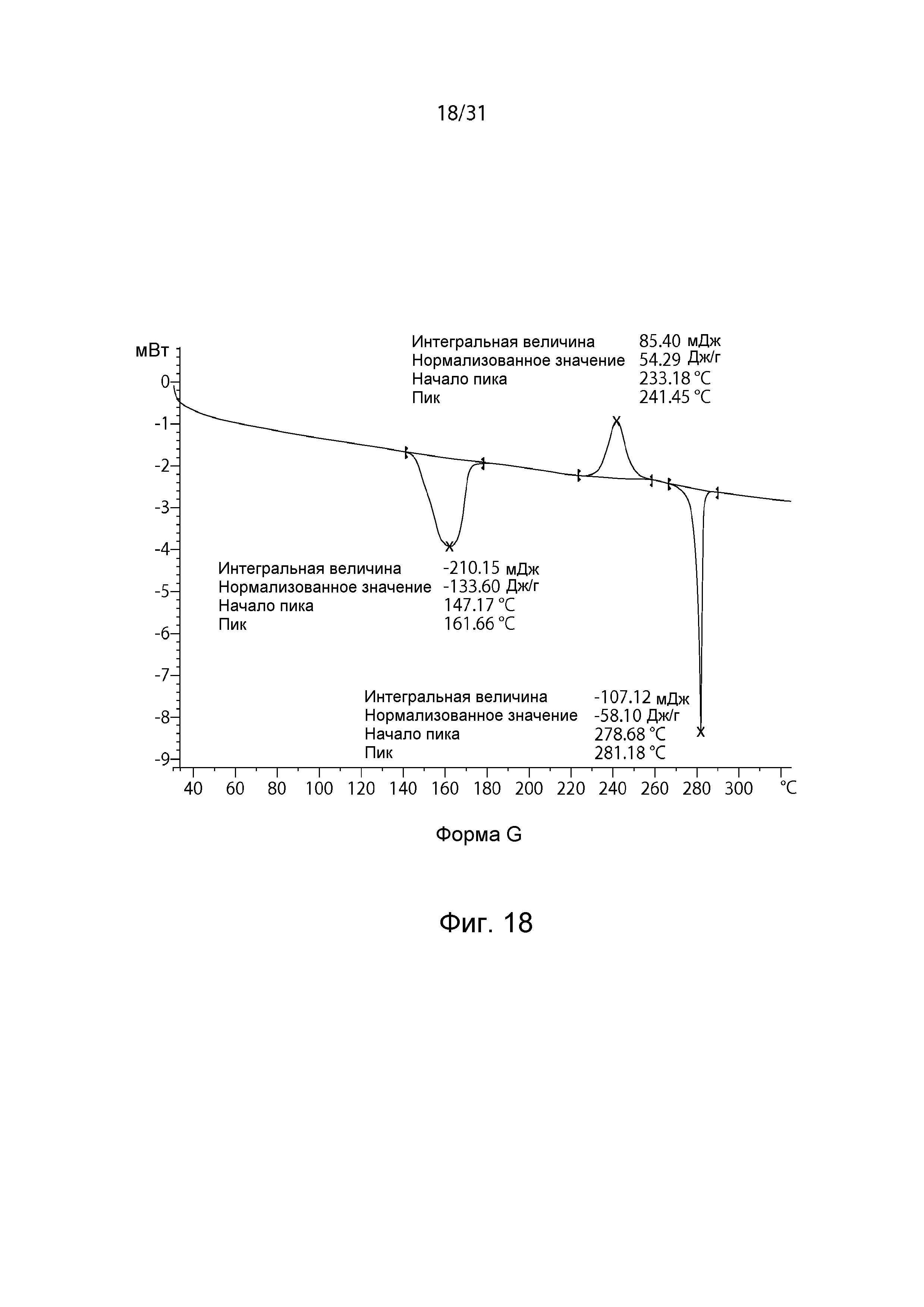
На Фиг.18 показана термограмма DSC полиморфной формы G.
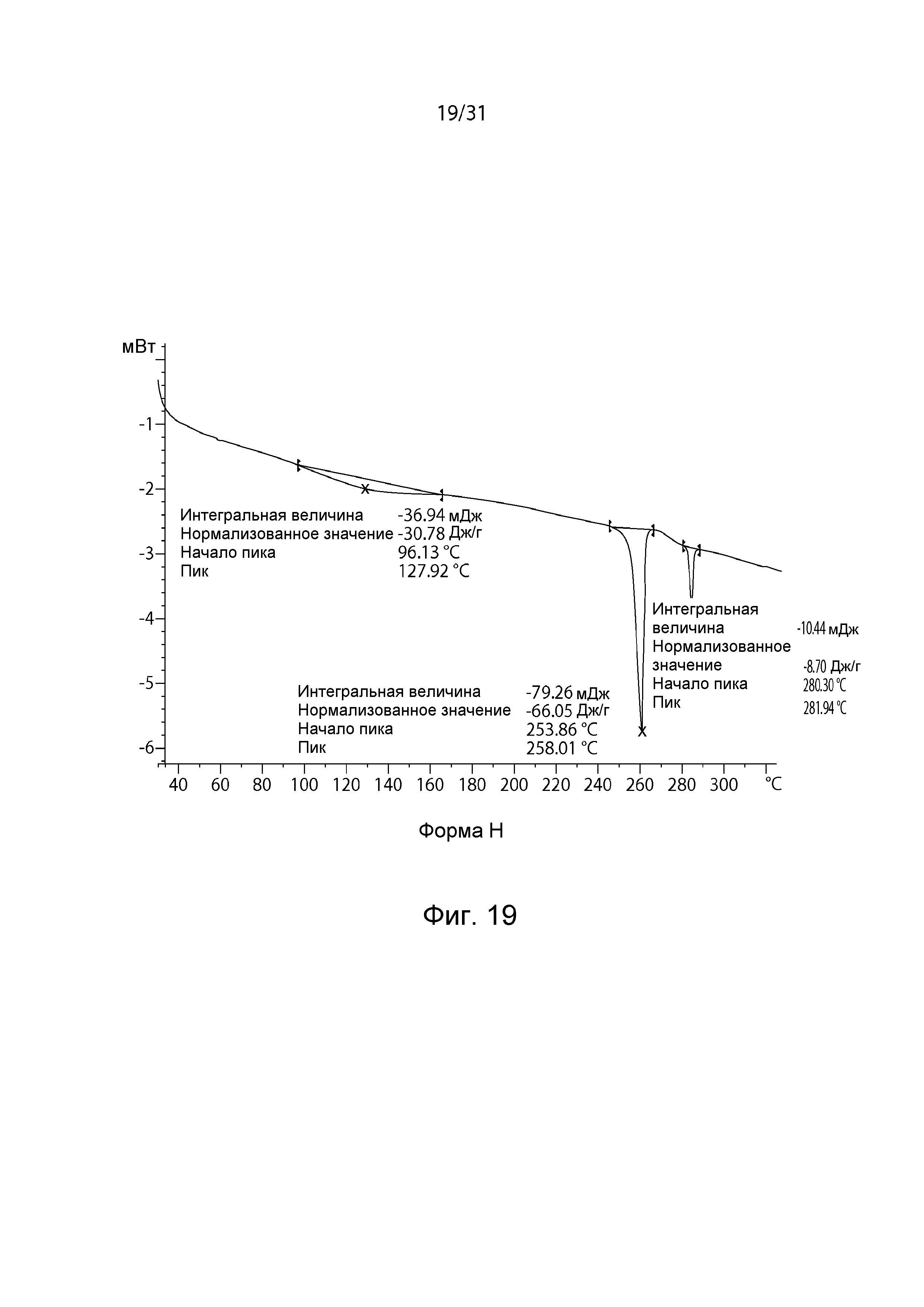
На Фиг.19 показана термограмма DSC полиморфной формы H.
На Фиг.20 показана термограмма DSC полиморфной формы I.
На Фиг.21 показана термограмма DSC полиморфной формы J.
На Фиг.22 показана термограмма DSC и данные термогравиметрического анализа (TGA) полиморфной формы A.
На Фиг.23 показаны две термограммы DSC полиморфной формы C.
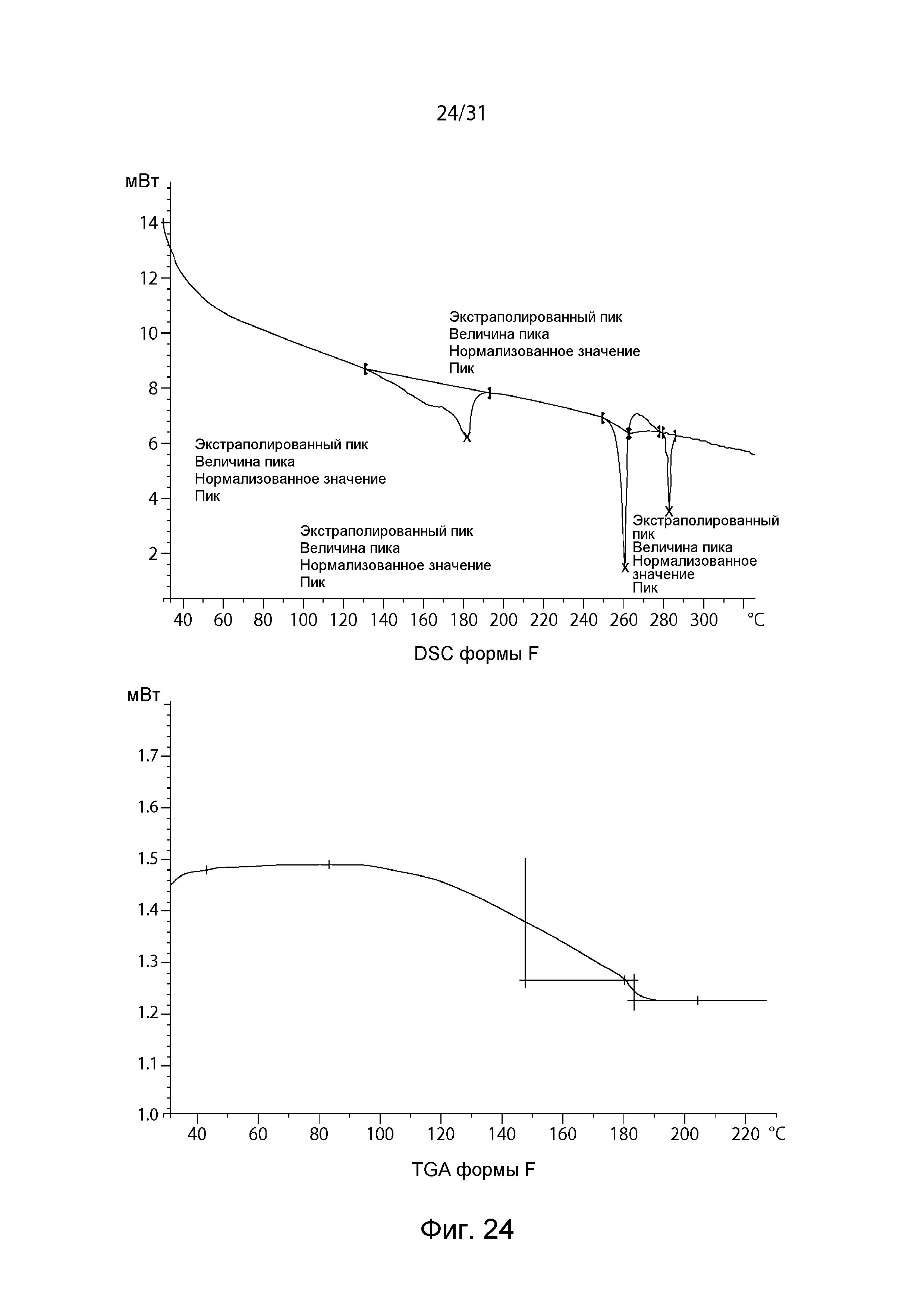
На Фиг.24 показаны DSC и TGA полиморфной формы F.
На Фиг.25 показан набор солей, протестированных на образование кристаллических твердых веществ в различных растворителях.
На Фиг.26 показана структура монокристалла сольвата полиморфной формы G соединения формулы (I) с MTBE (т-бутилметиловым эфиром) по данным рентгеноструктурного анализа.
На Фиг.27 показан FT-IR (ИК-Фурье) спектр полиморфной формы C.
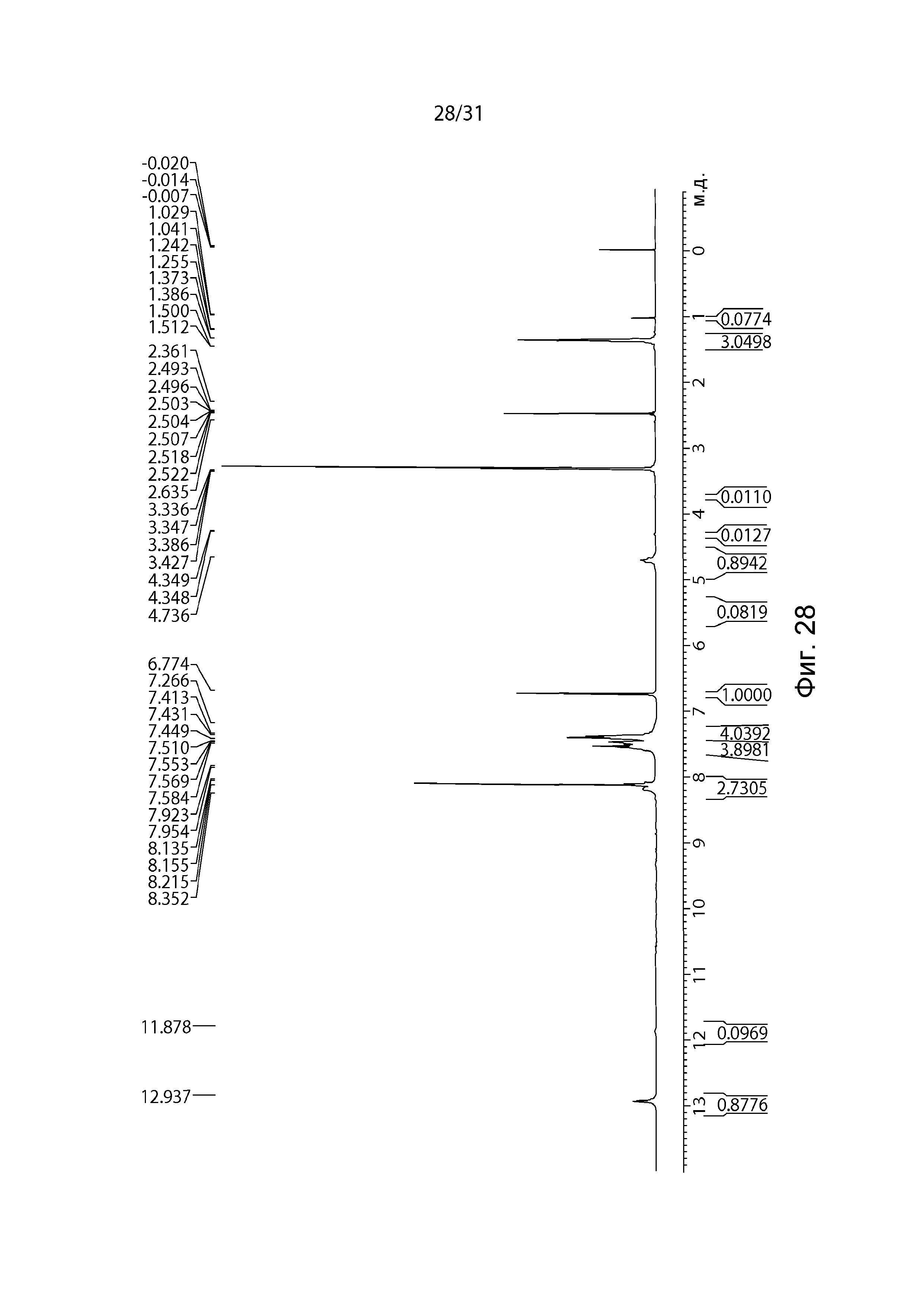
На Фиг.28 показан1H-ЯМР спектр полиморфной формы C.
На Фиг.29 показан13C-ЯМР спектр полиморфной формы C.
На Фиг.30 показаны данные анализа динамической сорбции паров (DVS) полиморфной формы C.
На Фиг.31 показаны типовые профили растворения капсул, содержащих полиморфную форму C.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Некоторые особенности настоящего изобретения обстоятельно изложены в приложенной формуле изобретения. Понимание различных особенностей и/или преимуществ настоящего изобретения может быть достигнуто при ознакомлении с приведенным ниже подробным описанием изобретения, в котором раскрыты иллюстративные варианты его осуществления.
Хотя в настоящей заявке показаны и описаны различные варианты осуществления настоящего изобретения, специалисту в данной области техники должно быть очевидно, что эти варианты осуществления приведены только в качестве примера. Специалисту в данной области придут в голову многочисленные варианты, изменения и замены, которые не выходят за пределы объема настоящего изобретения. Следует понимать, что в рамках настоящего изобретения могут применяться различные альтернативы вариантам осуществления, описанным в настоящей заявке.
I. ОПРЕДЕЛЕНИЯ
Если не приведено иного определения, все технические и научные термины, использованные в тексте заявки, имеют те значения, которые обычно понимают под ними специалисты в данной области техники.
В описании и в формуле изобретения, формы единственного числа “a”, “an” и “the” подразумевают также формы множественного числа, если контекст явно не указывает на противоположное.
Если для описания физических свойств, например, молекулярной массы, или химических свойств, например, коэффициентов в химической формуле, применяются диапазоны значений, считается, что они включают все комбинации и подкомбинации диапазонов, а также конкретные варианты значений. Термин «примерно», относящийся к числу или численному диапазону, означает, что это число или численный диапазон указаны с приближением в рамках разброса экспериментальных данных (или статистической погрешности эксперимента) и поэтому число или численный диапазон могут быть указаны с точностью, например, от 1% до 15%, от 1% до 10%, от 1% до 5%, от 0,5% до 5% и от 0,5% до 1% от приведенного значения числа или численного диапазона. В настоящем описании, в каждом случае, когда число или численный диапазон предваряются термином «примерно», изобретение также включает вариант с точным указанным значением (значениями). Например, фраза «примерно 3°C» охватывает вариант осуществления, в котором температура составляет ровно «3°C». Термины «примерно» и «приблизительно» в настоящем описании являются полностью взаимозаменяемыми. Термины «между» или «от … до …» включают граничные значения на обоих концах диапазона. Например, диапазон, описанный как «от 3 до 5» включает значения «3» и «5».
В настоящем описании, если не дано иного определения, термины «агент», «биологически активный агент» или «второй действующий агент» относятся к биологическим, фармацевтическим или химическим соединениям или другим фрагментам. Не ограничивающие примеры включают простые или сложные органические или неорганические молекулы, пептиды, белки, олигонуклеотиды, антитела, производные антител, фрагменты антител, производные витаминов, углеводы, токсины или химиотерапевтические соединения. Можно синтезировать различные соединения, например, малые молекулы и олигомеры (например, олигопептиды и олигонуклеотиды) и синтетические органические соединения на базе различных типовых биологически активных структур. Кроме того, соединения для скрининга можно получать из различных природных источников, например, растительных или животных экстрактов и т.п. Специалист в данной области легко поймет, что не существует ограничений в отношении структурной природы агентов по настоящему изобретению.
В настоящем описании, если не указано иное, термин «агонист» относится к соединению, имеющему способность инициировать или усиливать биологическое действие целевого белка за счет инициации или усиления как активности, так и экспрессии целевого белка. Соответственно, термин «агонист» определяется в контексте биологической роли целевого белка. Хотя агонисты по настоящему изобретению способны специфично взаимодействовать (например, связываться) с мишенью, соединения, которые инициируют или усиливают биологическую активность целевого белка за счет взаимодействия с другими участниками того пути передачи сигнала, в который включен и целевой белок, также конкретно охвачены этим определением.
В настоящем описании, если не указано иное, термины «антагонист» и «ингибитор» являются взаимозаменяемыми, и относятся к соединению, обладающему способностью ингибировать биологическое действие целевого белка, за счет ингибирования, как активности, так и экспрессии этого целевого белка. Соответственно, термины «антагонист» и «ингибитор» определяются в контексте биологической роли целевого белка. Хотя антагонисты по настоящему изобретению способны специфично взаимодействовать (например, связываться) с мишенью, соединения, которые ингибируют биологическую активность целевого белка за счет взаимодействия с другими участниками того пути передачи сигнала, в который включен и целевой белок, также конкретно охвачены этим определением. В одном из вариантов осуществления, биологическая активность, ингибируемая антагонистом, связана с развитием, ростом или распространением опухоли, или с нежелательным иммунным ответом, например, проявляющимся при аутоиммунных заболеваниях.
В настоящем описании, если не указано иное, термины «противораковый агент», «противоопухолевый агент» или «химиотерапевтический агент» относятся к любому агенту, применимому при лечении непластического состояния. Один из классов противораковых агентов включает химиотерапевтические агенты. В настоящем описании, если не указано иное, «химиотерапия» означает введение одного или нескольких химиотерапевтических препаратов и/или других агентов раковому больному различными путями, включая внутривенное, пероральное, внутримышечное, интраперитонеальное, интравезикальное (внутрипузырное), подкожное, трансдермальное, буккальное введение, введение с помощью ингаляции или в форме суппозитория.
В настоящем описании, если не указано иное, термин «клеточная пролиферация» относится к явлению, при котором число клеток изменилось в результате деления. В одном из вариантов, этот термин охватывает рост клеток, при котором подвергается изменению их морфология (например, увеличиваются размеры), что указывает на пролиферативный сигнал.
В настоящем описании, если не указано иное, термины «совместное введение», «вводимый в комбинации с» и их грамматические эквиваленты охватывают введение животному двух или нескольких агентов либо одновременно, либо последовательно. В одном из вариантов осуществления, оба агента и/или их метаболиты присутствуют в организме животного одновременно. В одном из вариантов осуществления, совместное введение включает одновременное введение в составе отдельных композиций, введение в разное время в составе отдельных композиций или введение в составе одной композиции, в которой присутствуют оба агента.
В настоящем описании, если не указано иное, термины «эффективное количество» или «терапевтически эффективное количество» относятся к количеству соединения, описанного в настоящей заявке, которого достаточно, чтобы вызвать намеченный результат или эффект, включая, но не ограничиваясь этим, лечение болезни, указанной в настоящем описании. Терапевтически эффективное количество может меняться в зависимости от намеченного применения (in vitro или in vivo), субъекта и болезненного состояния, которое подвергается лечению, например, от массы и возраста субъекта, тяжести болезненного состояния, способа введения и подобных особенностей, которые может определить рядовой специалист в данной области техники. Этот термин можно также применять к дозе, которая должна вызвать конкретную реакцию в целевых клетках, например, уменьшение адгезии тромбоцитов и/или миграции клеток. Конкретная доза будет меняться в зависимости от конкретных выбранных соединений, предписанной схемы введения, введения в комбинации с другими соединениями, расписания введения, ткани, в которую вводят препарат и физической системы доставки, переносящей препарат.
В настоящем описании, если не указано иное, термины «лечение», «облегчение» или «улучшение» являются взаимозаменяемыми, и относятся к пути достижения полезных или желаемых результатов, включая, но не ограничиваясь этим, терапевтическую пользу и/или профилактическую пользу. В одном из вариантов осуществления, терапевтическая польза означает ликвидацию или облегчение основного расстройства, подвергаемого лечению. В одном из вариантов осуществления, терапевтическая польза достигается ликвидацией или облегчением одного или нескольких физиологических симптомов, связанных с основным расстройством, так чтобы наблюдалось улучшение состояния здоровья пациента, несмотря на то, что у пациента может по-прежнему иметься основное расстройство. Для достижения профилактической пользы, композицию можно вводить пациенту, у которого имеется опасность развития конкретного заболевания, или пациенту, у которого проявляется один или несколько физиологических симптомов заболевания, независимо от того диагностировано данное заболевание или нет.
В настоящем описании, если не указано иное, термин «терапевтический эффект» охватывает терапевтическую пользу и/или профилактическую пользу, которые описаны в настоящей заявке. Терапевтический эффект включает отсрочку или устранение наступления заболевания или состояния, отсрочку или устранение появления симптомов заболевания или состояния, замедление, остановку или обращение прогрессирования заболевания или состояния, или любую комбинацию перечисленного.
В настоящем описании, если не указано иное, «сигнальная трансдукция» или «передача сигнала» означает процесс, в ходе которого стимулирующие или ингибирующие сигналы передаются в клетку и в пределах клетки, вызывая внутриклеточную реакцию. Термин «модулятор пути сигнальной трансдукции» относится к соединению, которое модулирует активность одного или нескольких клеточных белков, вовлеченных в этот конкретный путь передачи сигнала. Модулятор может увеличивать (агонист) или подавлять (антагонист) активность сигнальных молекул.
В настоящем описании, если не указано иное, термин «селективное ингибирование» или «селективно ингибирует» в применении к биологически активному агенту, относится к способности этого агента селективно уменьшать активность передачи целевого сигнала по сравнению с активностью передачи нецелевого сигнала, за счет прямого или опосредованного взаимодействия с мишенью.
В настоящем описании, если не указано иное, термин «in vivo» относится к явлениям, которые происходят в организме субъекта.
В настоящем описании, если не указано иное, термин «in vitro» относится к явлениям, которые имеют место вне организма субъекта. Например, термин «исследование in vitro» относится к любым исследованиям, проводимым вне организма субъекта. Исследования in vitro включают клеточные исследования, в которых используются живые или мертвые клетки. В одном из вариантов осуществления термин «исследование in vitro» охватывает также исследования без использования клеток, в которых не применяются интактные клетки.
Субъекты, которым предполагается вводить препарат по настоящему изобретению, включают, не ограничиваясь этим, людей (т.е. мужчин или женщин любой возрастной группы, например, субъектов детского возраста (например, младенцев, детей, подростков) или взрослых субъектов (например, молодых людей, людей среднего возраста или людей старшего возраста)) и/или других приматов (например, яванского макака, макака резус); млекопитающих, в т.ч. коммерчески значимых млекопитающих, таких как крупный рогатый скот, свиньи, лошади, овцы, козы, кошки и/или собаки; и/или птиц, включая коммерчески значимых птиц, таких как куры, утки, гуси, куропатки и/или индейки.
В настоящем описании, если не указано иное, термин «радиационная терапия» означает воздействие на пациента, с применением стандартных методик и композиций, известных практикам, источников радиоактивного излучения, например, радионуклидов, излучающих альфа-частицы (например, радиоактивных препаратов актиния и тория), источников излучения с низкой линейной передачей энергии (LET) (например, источников бета излучения), источников конверсионных электронов (например, стронция-89 и самария-153-EDTMP) или источников излучения высокой энергии, в т.ч., но не ограничиваясь этим, рентгеновские лучи, гамма лучи и нейтроны.
Термины «введение в реакцию» или «введение во взаимодействие» относятся к созданию условий для взаимодействия одного или нескольких химических веществ с другими одним или несколькими химическими веществами. Введение во взаимодействие включает процесс добавления одного или нескольких соединений к твердой, жидкой или газообразной смеси одного или нескольких соединений (тех же самых или других веществ), или к жидкому раствору или мультифазной жидкой смеси. Взаимодействие соединений включает процесс или процессы взаимодействия одного или нескольких соединений (например, образования или расщепления химических связей; образования солей, образования сольватов, хелатирование или другое взаимодействие без изменения связей) с одним или несколькими соединениями (теми же самыми или другими химическими веществами). Акт взаимодействия может включать изменение одного или нескольких соединений, например, путем изомеризации (например, таутомеризации, отделения одного изомера от другого, рацемизации).
В настоящем описании термин «выделение» включает, не ограничиваясь этим, действие, направленное на получение одного или нескольких соединений путем сбора во время и/или после завершения стадии способа по настоящему изобретению, а также действие, направленное на получение одного или нескольких соединений путем отделения одного или нескольких соединений от одного или нескольких других химических соединений во время и/или после завершения стадии способа по настоящему изобретению. Термин «сбор» относится к любому действию (действиям) известным в технике для этой цели, включая, но не ограничиваясь перечисленным, декантацию маточного раствора с твердого осадка для получения одного или нескольких соединений, а также выпаривание жидкой среды раствора или другой смеси с получением твердого вещества, масла или другого остатка, который включает одно или несколько соединений. Твердое вещество, среди прочих характеристик, известных в технике, может быть кристаллическим, не кристаллическим, частично кристаллическим, аморфным, содержащим один или несколько полиморфов, порошкообразным, гранулированным, содержащим частицы различных размеров, содержащим частицы одинакового размера. Масло, серди прочих характеристик, известных в технике, может иметь различный цвет и вязкость, и включать одну или несколько твердых форм в виде гетерогенной смеси. Термин «отделение» относится к любому действию (действиям), известным в технике для этой цели, включая, но не ограничиваясь этим, выделение одного или нескольких соединений из их раствора или смеси с использованием, например, кристаллизации с затравками или без них, или другой методики осаждения (например, добавления к раствору антирастворителя для инициирования осаждения соединения; нагревания раствора с последующим охлаждением, для инициирования осаждения соединения; царапания поверхности раствора подходящим инструментом для инициирования осаждения соединения), а также перегонки. Выделение одного или нескольких соединений может включать получение солей, сольватов, гидратов, хелатов или других комплексов этих соединений, с последующим сбором или разделением, как описано выше.
В настоящем описании, «фармацевтически приемлемая форма» раскрытого соединения формулы (I) включает, не ограничиваясь этим, его фармацевтически приемлемые соли, гидраты, сольваты, хелаты, нековалентные комплексы, изомеры, пролекарства и изотопно-меченые производные, а также их смеси. Таким образом, термин «химическое соединение» или «химические соединения» охватывает также фармацевтически приемлемые соли, гидраты, сольваты, хелаты, нековалентные комплексы, изомеры, пролекарства и изотопно-меченые производные этих соединений, а также их смеси. В некоторых вариантах осуществления, фармацевтически приемлемая форма соединения формулы (I), по настоящему изобретению включает его соль, сольват и гидрат.
В некоторых вариантах осуществления, фармацевтически приемлемая форма представляет собой фармацевтически приемлемую соль. В настоящей заявке термин «фармацевтически приемлемая соль» относится к таким солям, которые с медицинской точки зрения подходят для применения в контакте с тканями субъекта, не обладая неприемлемой токсичностью, не вызывая раздражения, аллергической реакции и т.п., и которые соответствуют разумному соотношению польза/риск. Фармацевтически приемлемые соли хорошо известны в технике. Например, Berge и соавторы подробно описывают фармацевтически приемлемые соли в J.Pharmaceutical Sciences (1977) 66:1-19. Фармацевтически приемлемые соли соединений по настоящему изобретению включают соли, полученные из подходящих неорганических и органических кислот и оснований. Неорганические кислоты, из которых можно получить соли, включают, не ограничиваясь перечисленными, хлористоводородную кислоту, бромистоводородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и т.п. Органические кислоты, из которых можно получать соли, включают, не ограничиваясь перечисленными, уксусную кислоту, пропионовую кислоту, гликолевую кислоту, пировиноградную кислоту, щавелевую кислоту, малеиновую кислоту, малоновую кислоту, янтарную кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, п-толуолсульфоновую кислоту, салициловую кислоту и т.п. Примерами фармацевтически приемлемых, нетоксичных кислотно-аддитивных солей являются соли, образованные аминогруппами и неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота и перхлорная кислота, или органическими кислотами, такими как уксусная кислота, щавелевая кислота, малеиновая кислота, винная кислота, лимонная кислота, янтарная кислота или малоновая кислота, или полученные с помощью других методик, применяемых в технике, например, ионного обмена. Другие фармацевтически приемлемые соли включают адипаты, альгинаты, аскорбаты, аспартаты, бензолсульфонаты, бесилаты, бензоаты, бисульфаты, бораты, бутираты, камфораты, камфорсульфонаты, цитраты, циклопентанпропионаты, диглюконаты, додецилсульфаты, этансульфонаты, формиаты, фумараты, глюкогептонаты, глицерофосфаты, глюконаты, гемисульфаты, гептаноаты, гексаноаты, гидройодиды, 2-гидрокси-этансульфонаты, лактобионаты, лактаты, лаураты, лаурилсульфаты, малаты, малеаты, малонаты, метансульфонаты, 2-нафталинсульфонаты, никотинаты, нитраты, олеаты, оксалаты, пальмитаты, памоаты, пектинаты, персульфаты, 3-фенилпропионаты, фосфаты, пикраты, пивалаты, пропионаты, стеараты, сукцинаты, сульфаты, тартраты, тиоцианаты, п-толуолсульфонаты, ундеканоаты, валераты и т.п. В некоторых вариантах осуществления, органические кислоты, из которых можно получить соли, включают, например, уксусную кислоту, пропионовую кислоту, гликолевую кислоту, пировиноградную кислоту, щавелевую кислоту, малеиновую кислоту, малоновую кислоту, янтарную кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, п-толуолсульфоновую кислоту, салициловую кислоту и т.п. Фармацевтически приемлемые соли, полученные из подходящих оснований, включают соли щелочных металлов, щелочноземельных металлов, аммония и катионов N+(C1-4алкил)4. Неорганические основания, из которых можно получить соли, включают, не ограничиваясь перечисленными, ионы натрия, калия, лития, аммония, кальция, магния, железа, цинка, меди, марганца, алюминия и т.п. Органические основания, из которых можно получить слои, включают, не ограничиваясь перечисленными, первичные, вторичные и третичные амины, замещенные амины, включая природные замещенные амины, циклические амины, основные ионообменные смолы и т.п., примеры которых включают, не ограничиваясь перечисленными, изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин и этаноламин. В некоторых вариантах осуществления, фармацевтически приемлемые основно-аддитивные соли являются солями аммония, калия, натрия, кальция или магния. Типовые соли щелочных или щелочноземельных металлов включают соли натрия, лития, калия, кальция, магния, железа, цинка, меди, марганца, алюминия и т.п. Другие фармацевтически приемлемые соли включают, когда это целесообразно, нетоксичные катионы аммония, четвертичного аммония и аминов, с такими противоионами, как галогениды, гидроксиды, карбоксилаты, сульфаты, фосфаты, нитраты, низший алкил сульфонаты и арилсульфонаты. Органические основания, из которых могут быть получены соли, включают, например, первичные, вторичные или третичные амины, замещенные амины, включая природные замещенные амины, циклические амины, основные ионообменные смолы и т.п., например, изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин и этаноламин. В некоторых вариантах осуществления, фармацевтически приемлемая основно-аддитивная соль выбрана из солей аммония, калия, натрия, кальция и магния. В понятие фармацевтически приемлемых солей входят бис-соли (т.е. включающие два противоиона) и высшие соли (т.е. соли, включающие три или более противоионов).
Кроме того, если соединение по настоящему изобретению получено в виде кислотно-аддитивной соли, свободное основание можно получить подщелачиванием раствора этой соли. Наоборот, если продукт является свободным основанием, кислотно-аддитивную соль, в частности фармацевтически приемлемую кислотно-аддитивную соль, можно получить растворением свободного основания в подходящем органическом растворителе, и обработкой этого раствора кислотой по стандартной методике получения кислотно-аддитивных солей из оснований. Специалист в данной области техники должен определить различные методики синтеза, которые могут применяться для получения нетоксичных фармацевтически приемлемых аддитивных солей.
В некоторых вариантах осуществления, фармацевтически приемлемая соль является «сольватом» (например, гидратом). В настоящей заявке термин «сольват» относится к соединениям, которые дополнительно включают стехиометрическое или не стехиометрическое количество растворителя, связанного нековалентными межмолекулярными силами. Сольват может являться сольватом соединения по настоящему изобретению или его фармацевтически приемлемой соли. Если растворитель является водой, сольват именуют «гидратом». Фармацевтически приемлемые сольваты и гидраты представляют собой комплексы, которые, например, могут включать от 1 до примерно 100, или от 1 до примерно 10, или от одной до примерно 2,3 или 4 молекул воды или растворителя. В некоторых вариантах осуществления гидрат может представлять собой канальный гидрат. Следует понимать, что термин «соединение» в настоящей заявке охватывает соединение и сольваты соединения, а также их смеси.
В настоящей заявке, если не указано иное, термин «пролекарство» предназначен для указания на соединение, которое в физиологических условиях или в результате сольволиза может превращаться в биологически активное соединение, описанное в настоящей заявке. Таким образом, термин «пролекарство» относится к предшественнику биологически активного соединения, который является фармацевтически приемлемым. Пролекарство может быть неактивным при введении субъекту, но превращается в активное соединение, например, путем гидролиза. В некоторых вариантах осуществления, пролекарственное соединение часто обеспечивает такие преимущества, как растворимость, совместимость с тканями или замедленное высвобождение в организме млекопитающего (смотрите, например, Bundgard, H., Design of Prodrugs (1985), pp. 7-9, 21-24 (Elsevir, Amsterdam)). Обсуждение пролекарств приведено в Higuchi, T., et al., “Pro-drugs as Novel Delivery Systems”, A.C.S.Symposium Series, Vol.14, и в Bioreversible Carriers in Drug Design, ed. Edward B.Roche, American Pharmaceutical Association and Pergamon Press, 1987, причем обе указанные работы включены в настоящую заявку в полном объеме с помощью ссылки. Кроме того, имеется в виду, что термин «пролекарство» включает любые ковалентно связанные носители, которые высвобождают действующее соединение формулы (I) in vivo, если такое пролекарство вводят субъекту из числа млекопитающих. Пролекарства действующего соединения по настоящей заявке можно получать модификацией функциональных групп, имеющихся в действующем соединении формулы (I), таким образом, чтобы модифицирующие группы отщеплялись, либо при стандартных воздействиях, либо in vivo, образуя исходное действующее соединение. Пролекарства включают соединения, в которых гидрокси, амино или меркапто группа связана с любой группой, которая, при введении пролекарства действующего соединения формулы (I) субъекту из числа млекопитающих, отщепляется, с образованием свободной гидроксигруппы, свободной аминогруппы или свободной меркаптогруппы, соответственно. Примеры пролекарств включают, не ограничиваясь этим, ацетатные, формиатные и бензоатные производные спиртов, ацетамиды, формамиды и бензамиды, полученные из функциональных аминогрупп действующего соединения, и т.п. Другие примеры пролекарств включают соединения, которые содержат фрагменты -NO, -NO2, -ONO или -ONO2. Пролекарства, как правило, можно получать с применением хорошо известных методик, например, описанных в Burger’s Medicinal Chemistry and Drug Discovery, 172-178, 949-982 (Manfred E., Wolff ed., 5th ed., 1995) и Design of Prodrugs (H.Bundgaard ed., Elselvier, New York, 1985).
Например, если раскрытое соединение или фармацевтически приемлемая форма соединения содержит функциональную группу карбоновой кислоты, пролекарства могут включать фармацевтически приемлемый сложный эфир, образованный путем замены атома водорода кислотной группы, такой группой как (C1-C8)алкил, (C2-C12)алканоилоксиметил, 1-(алканоилокси)этил, включающий от 4 до 9 атомов углерода, 1-метил-1-(алканоилокси)этил, включающий от 5 до 10 атомов углерода, алкоксикарбонилоксиметил, включающий от 3 до 6 атомов углерода, 1-(алкоксикарбонилокси)этил, включающий от 4 до 7 атомов углерода, 1-метил-1-(алкоксикарбонилокси)этил, включающий от 5 до 8 атомов углерода, N-(алкоксикарбонил)аминометил, включающий от 3 до 9 атомов углерода, 1-(N-(алкоксикарбонил)амино)этил, включающий от 4 до 10 атомов углерода, 3-фталидил, 4-кротонолактонил, гамма-бутиролактон-4-ил, ди-N,N-(C1-C2)алкиламино(C2-C3)алкил (например, β-диметиламиноэтил), карбамоил-(C1-C2)алкил, N,N-ди(C1-C2)алкилкарбамоил-(C1-C2)алкил, и пиперидино-, пирролидино- или морфолино(C2-C3)алкил.
Аналогично, если раскрытое соединение или фармацевтически приемлемая форма соединения содержит спиртовую функциональную группу, пролекарство может быть образовано заменой атома водорода спиртовой группы такой группой, как (C1-C6)алканоилоксиметил, 1-((C1-C6)алканоилокси)этил, 1-метил-1-((C1-C6)алканоилокси)этил(C1-C6)алкоксикарбонилоксиметил, N-(C1-C6)алкоксикарбониламинометил, сукциноил, (C1-C6)алканоил, α-амино(C1-C4)алканоил, арилацил и α-аминоацил или α-аминоацил-α-аминоацил, где каждая α-аминоацильная группа независимо выбрана из природных L-аминокислот, P(O)(OH)2, -P(O)(O(C1-C6)алкил)2 или гликозила (радикала, который образуется в результате удаления гидроксильной группы полуацетальной формы углевода).
Если раскрытое соединение или фармацевтически приемлемая форма соединения формулы (I) содержит функциональную аминогруппу, пролекарство может быть образовано заменой атома водорода аминогруппы такой группой, как R-карбонил, RO-карбонил, NRR’-карбонил, где каждый из заместителей R и R’ независимо представляет собой (C1-C10)алкил, (С3-С7)циклоалкил, бензил, природный α-аминоацил или природный α-аминоацил-природный α-аминоацил, -C(OH)C(O)OY1, где Y1 означает H, (C1-C6)алкил или бензил, -C(OY2)Y3, где Y2 означает (C1-C4)алкил, и Y3 означает (C1-C6)алкил, карбокси(C1-C6)алкил, амино(C1-C4)алкил, или моно-N- или ди-N,N-(C1-C6)алкиламиноалкил, -C(Y4)Y5, где Y4 означает H или метил, и Y5 представляет собой моно-N- или ди-N,N-(C1-C6)алкиламино, морфолино, пиперидин-1-ил или пирролидин-1-ил.
В некоторых вариантах осуществления, фармацевтически приемлемая форма является изомером. «Изомеры» представляют собой различные соединения, имеющие одну и ту же молекулярную формулу. «Стереоизомеры» («пространственные изомеры») представляют собой изомеры, которые отличаются только расположением атомов в пространстве. В настоящем описании термин «изомер» включает все без исключения геометрические изомеры и пространственные изомеры. Например, «изомеры» включают геометрические цис- и трансизомеры, образующиеся вследствие наличия двойной связи, которые именуются также E- и Z-изомерами; R- и S-энантиомеры; диастереомеры, (d)-изомеры и (l)-изомеры, их рацемические смеси; а также другие смеси изомеров, и все указанные изомеры и их смеси входят в объем настоящего изобретения.
Заместители вокруг двойной углерод-углеродной связи альтернативно могут именоваться «цис» или «транс», где «цис» относится к заместителям, расположенным с одной стороны двойной связи, и «транс» относится к заместителям, расположенным с противоположных сторон двойной связи. Расположение заместителей в карбоциклическом кольце также может именоваться «цис» или «транс». Термин «цис» относится к заместителям, расположенным с одной и той же стороны плоскости кольца, и термин «транс» относится к заместителям, расположенным по разные стороны от плоскости кольца. Смеси соединений, в которых заместители расположены как по одну сторону, так и по разные стороны от плоскости кольца, именуются «цис/транс».
Энантиомеры представляют собой пары стереоизомеров, которые являются несовместимыми зеркальными отображениями друг друга. Смесь пары энантиомеров в любых соотношениях известна как «рацемическая» смесь. Для обозначения рацемической смеси, когда это необходимо, используется символ «(±)». «Диастереоизомеры» («диастереомеры») являются стереоизомерами, которые включают, по меньшей мере, два асимметрических атома, но которые не являются зеркальными отображениями друг друга. Абсолютную конфигурацию определяют согласно R-S системе Кана-Ингольда-Прелога. Если соединение формулы (I) имеет энантиомерные формы, пространственная конфигурация у каждого хирального атома углерода может обозначаться символами R или S. Разделенные соединения, абсолютная конфигурация которых неизвестна, могут обозначаться символами (+) или (-) в зависимости от направления (правовращающее или левовращающее), в котором соединение вращает плоскость поляризованного света для D-линии натрия. Некоторые из соединений, описанных в настоящей заявке, включают один или несколько асимметрических центров и, следовательно, они могут образовывать энантиомеры, диастереомеры и другие стереоизомерные формы, которые можно определить в терминах абсолютной конфигурации при каждом асимметрическом атоме, как (R)- или (S)-формы. Считается, что химические соединения, фармацевтические композиции и способы по настоящему изобретению, включают все такие возможные изомеры, включая рацемические смеси, практически оптически чистые формы и промежуточные смеси. Оптически активные (R)- и (S)- изомеры можно получать, например, используя хиральные синтоны или хиральные реагенты, или разделять, используя стандартные методики.
В настоящем описании, если не указано иное, термин «стереомерно чистый» означает композицию или вещество, которое включает один стереоизомер соединения, и практически не содержит других стереоизомеров этого соединения. Например, стереомерно чистая композиция соединения, имеющего один хиральный центр, должна быть практически свободна от другого энантиомера этого соединения. Стереомерно чистая композиция соединения, имеющего два хиральных центра, должна быть практически свободна от других стереоизомеров (например, диастереоизомеров или энантиомеров или син- или анти-изомеров, или цис- или транс-изомеров) этого соединения. Типовое стереомерно чистое соединение включает более чем примерно 80 процентов по массе одного стереоизомера соединения и менее, чем примерно 20 процентов по массе другого стереоизомера соединения, более чем примерно 90 процентов по массе одного стереоизомера соединения и менее, чем примерно 10 процентов по массе другого стереоизомера соединения, более чем примерно 95 процентов по массе одного стереоизомера соединения и менее, чем примерно 5 процентов по массе другого стереоизомера соединения или более чем примерно 97 процентов по массе одного стереоизомера соединения и менее чем примерно 3 процентов по массе другого стереоизомера соединения.
В настоящем описании, если не указано иное, термин «энантиомерно чистый» означает стереомерно чистую композицию соединения, имеющего один или несколько хиральных центров.
В настоящем описании, если не указано иное, термины «энантиомерный избыток» и «диастереомерный избыток» являются взаимозаменяемыми. В некоторых вариантах осуществления, о соединениях с одним центром пространственной изомерии говорят, как о присутствующих в энантиомерном избытке, и о соединениях с двумя центрами пространственной изомерии говорят, что они присутствуют в «диастереомерном избытке». Например, термин «энантиомерный избыток» хорошо известен в технике и определяется, как:

Таким образом, термин «энантиомерный избыток» связан с термином «оптическая чистота», в том смысле, что оба они служат мерой одного и того же явления. Величина ee должна быть числом от 0 до 100, где 0 соответствует рацемической смеси, и 100 соответствует энантиомерно чистому веществу. Соединение, о котором раньше говорили, что оно имеет оптическую чистоту 98%, в настоящее время более точно характеризуют, как имеющее ee 96%. Ee 90% отражает наличие в рассматриваемом веществе 95% одного энантиомера и 5% другого(других).
Некоторые композиции, описанные в настоящей заявке, имеют энантиомерный избыток S-энантиомера, по меньшей мере, примерно 50%, 75%, 90%, 95% или 99%. Другими словами, в композициях имеется избыточное количество S-энантиомера по отношению к R-энантиомеру. В других вариантах осуществления, некоторые композиции, описанные в настоящей заявке, имеют энантиомерный избыток R-энантиомера, по меньшей мере, примерно 50%, 75%, 90%, 95% или 99%. Другими словами, в композициях имеется избыточное количество R-энантиомера по отношению к S-энантиомеру.
Например, в некоторых вариантах осуществления, изомер/энантиомер может быть получен практически свободным от другого энантиомера и может именоваться «оптически обогащенным», «энантиомерно обогащенным», «энантиомерно чистым» и «не рацемическим», где все указанные понятия в настоящей заявке являются взаимозаменяемыми. Эти термины относятся к композициям, в которых процентное содержание по массе одного энантиомера превосходит количество этого энантиомера в контрольной смеси рацемической композиции (т.е. превышает примерно 1:1 по массе). Например, энантиомерно обогащенный препарат S-энантиомера означает препарат соединения, имеющий более примерно 50% по массе S-энантиомера по отношению к R-энантиомеру, например, не менее примерно 75% по массе или не менее примерно 80% по массе. В некоторых вариантах осуществления, обогащение может быть существенно больше, чем примерно 80% по массе, что обозначается терминами «значительно энантиомерно обогащенный», «имеющий значительную энантиомерную чистоту» или «практически не рацемический» препарат, которые относятся к препаратам композиций, которые содержат не менее примерно 85% по массе одного энантиомера по отношению к другому энантиомеру, например, не менее примерно 90% по массе или не менее примерно 95% по массе. В некоторых вариантах осуществления, соединение по настоящему изобретению состоит из не менее, чем примерно 90% по массе одного энантиомера. В других вариантах осуществления, соединения формулы (I) состоят из не менее, чем примерно 95%, 98% или 99% по массе одного энантиомера.
В некоторых вариантах осуществления, соединение формулы (I) является рацемической смесью (S)- и (R)-изомеров. В других вариантах осуществления, изобретение относится к смеси соединений, в которой индивидуальные соединения, входящие в смесь, существуют преимущественно в (S)- или (R)-изомерной конфигурации. Например, смесь соединений имеет избыток (S)-энантиомера более чем примерно 55%, примерно 60%, примерно 65%, примерно 70%, примерно 75%, примерно 80%, примерно 85%, примерно 90%, примерно 95%, примерно 96%, примерно 97%, примерно 98%, примерно 99%, примерно 99,5% или более. В других вариантах осуществления, смесь соединений имеет избыток (S)-энантиомера от более, чем примерно 55% до примерно 99,5%, от более, чем примерно 60% до примерно 99,5%, от более, чем примерно 65% до примерно 99,5%, от более, чем примерно 70% до примерно 99,5%, от более, чем примерно 75% до примерно 99,5%, от более, чем примерно 80% до примерно 99,5%, от более, чем примерно 85% до примерно 99,5%, от более, чем примерно 90% до примерно 99,5%, от более, чем примерно 95% до примерно 99,5%, от более, чем примерно 96% до примерно 99,5%, от более, чем примерно 97% до примерно 99,5%, от более, чем примерно 98% до более чем примерно 99,5%, от более, чем примерно 99% до примерно 99,5%, или более.
В других вариантах осуществления, смесь соединений имеет избыток (R)-энантиомера более, чем примерно 55%, примерно 60%, примерно 65%, примерно 70%, примерно 75%, примерно 80%, примерно 85%, примерно 90%, примерно 95%, примерно 96%, примерно 97%, примерно 98%, примерно 99%, примерно 99,5% или более. В других вариантах осуществления, смесь соединений имеет избыток (R)-энантиомера от более, чем примерно 55% до примерно 99,5%, от более, чем примерно 60% до примерно 99,5%, от более, чем примерно 65% до примерно 99,5%, от более, чем примерно 70% до примерно 99,5%, от более, чем примерно 75% до примерно 99,5%, от более, чем примерно 80% до примерно 99,5%, от более, чем примерно 85% до примерно 99,5%, от более, чем примерно 90% до примерно 99,5%, от более, чем примерно 95% до примерно 99,5%, от более, чем примерно 96% до примерно 99,5%, от более, чем примерно 97% до примерно 99,5%, от более, чем примерно 98% до более чем примерно 99,5%, от более, чем примерно 99% до примерно 99,5%, или более.
В других вариантах осуществления, смесь соединений содержит идентичные химические соединения, за исключением их стереохимической конфигурации, а именно (S)- или (R-)-изомеров. Например, если соединение по настоящему изобретению содержит фрагмент -CH(R)-, и R не является водородом, в этом случае фрагмент -CH(R)- имеет (S)- или (R-)-стереохимическую конфигурацию, для каждого из идентичных химических соединений. В некоторых вариантах осуществления, смесь идентичных химических соединений является рацемической смесью (S)- и (R-)-изомеров. В другом варианте осуществления, смесь идентичных химических соединений (за исключением стереохимической конфигурации), содержит преимущественно (S)-изомеры или преимущественно (R)-изомеры. Например, (S)-изомеры в смеси идентичных химических соединений присутствуют в количестве примерно 55%, примерно 60%, примерно 65%, примерно 70%, примерно 75%, примерно 80%, примерно 85%, примерно 90%, примерно 95%, примерно 96%, примерно 97%, примерно 98%, примерно 99%, примерно 99,5% или более относительно (R)-изомеров. В некоторых вариантах осуществления, (S)-изомеры в смеси идентичных химических соединений присутствуют в (S)-энантиомерном избытке от более, чем примерно 55% до примерно 99,5%, от более, чем примерно 60% до примерно 99,5%, от более, чем примерно 65% до примерно 99,5%, от более, чем примерно 70% до примерно 99,5%, от более, чем примерно 75% до примерно 99,5%, от более, чем примерно 80% до примерно 99,5%, от более, чем примерно 85% до примерно 99,5%, от более, чем примерно 90% до примерно 99,5%, от более, чем примерно 95% до примерно 99,5%, от более, чем примерно 96% до примерно 99,5%, от более, чем примерно 97% до примерно 99,5%, от более, чем примерно 98% до более чем примерно 99,5%, от более, чем примерно 99% до примерно 99,5%, или более.
В другом варианте осуществления, (R)-изомеры в смеси идентичных химических соединений (за исключением их стереохимической конфигурации) присутствуют в количестве примерно 55%, примерно 60%, примерно 65%, примерно 70%, примерно 75%, примерно 80%, примерно 85%, примерно 90%, примерно 95%, примерно 96%, примерно 97%, примерно 98%, примерно 99%, примерно 99,5% или более относительно (S)-изомеров. В некоторых вариантах осуществления, (R)-изомеры в смеси идентичных химических соединений (за исключением их стереохимической конфигурации) присутствуют в (R)-энантиомерном избытке от более, чем примерно 55% до примерно 99,5%, от более, чем примерно 60% до примерно 99,5%, от более, чем примерно 65% до примерно 99,5%, от более, чем примерно 70% до примерно 99,5%, от более, чем примерно 75% до примерно 99,5%, от более, чем примерно 80% до примерно 99,5%, от более, чем примерно 85% до примерно 99,5%, от более, чем примерно 90% до примерно 99,5%, от более, чем примерно 95% до примерно 99,5%, от более, чем примерно 96% до примерно 99,5%, от более, чем примерно 97% до примерно 99,5%, от более, чем примерно 98% до более чем примерно 99,5%, от более, чем примерно 99% до примерно 99,5%, или более.
Энантиомеры можно выделять из рацемических смесей с помощью любого способа, известного специалисту в данной области техники, включая хиральную жидкостную хроматографию высокого давления (HPLC, ВЭЖХ), получение и кристаллизацию хиральных солей или получать асимметрическим синтезом. Смотрите, например, Enantiomers, Racemates and Resolutions (Jacques, Ed., Wiley Interscience, New York, 1981); Wilen et al., Tetrahedron 33:2725 (1977); Stereochemistry of Carbon Compounds (E.L. Eliel, Ed., McGraw-Hill, NY, 1962); and Tables of Resolving Agents and Optical Resolutions p. 268 (E.L. Eliel, Ed., Univ. of Notre Dame Press, Notre Dame, IN 1972).
В некоторых вариантах осуществления, фармацевтически приемлемая форма представляет собой таутомер. В настоящей заявке термин «таутомер» относится к типу изомеров, который включает два или несколько превращающихся друг в друга соединений, причем это превращение происходит в результате, по меньшей мере, одной формальной миграции атома водорода и, по меньшей мере, одного изменения кратности связи (например, одинарная связь превращается в двойную связь, тройная связь - в одинарную связь или наоборот). «Таутомеризация» включает прототропную таутомеризацию или таутомеризацию со сдвигом протона, которые считаются частным случаем кислотно-основных взаимодействий. «Прототропная таутомеризация» или «таутомеризация со сдвигом протона» включает миграцию протона, сопровождающуюся изменением кратности связей. Точное соотношение таутомеров зависит от нескольких факторов, в т.ч. температуры, растворителя и pH. Если таутомеризация становится возможной (например, в растворе), может достигаться химическое равновесие между таутомерами. Таутомеризация (т.е. реакция, приводящая к получению таутомерной пары) может катализироваться кислотами или основаниями, или может происходить без действия или присутствия внешнего агента. Типовые примеры таутомеризации включают, не ограничиваясь этим, кетон-енол; амид-имид; лактам-лактим; енамин-имин; и енамин-(другой)енамин таутомеризацию. Примером кето-енольной таутомеризации является взаимное превращение таутомеров пентан-2,4-диона и 4-гидроксипент-3-ен-2-она. Другим примером таутомеризации является фенол-кетон таутомеризация. Другим примером таутомеризации фенол-кетон является взаимное превращение таутомеров пиридин-4-ола и пиридин-4(1H)-она.
В настоящей заявке, термин «Формула (I)» включает (S)-3-(1-(9H-пурин-6-иламино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он в виде его имидного таутомера, показанного приведенной ниже формулой (I-1) и его лактимного таутомера, показанного приведенной ниже формулой (I-2):

В настоящей заявке, термин «Формула (I)» включает (S)-3-(1-(9H-пурин-6-иламино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он в виде его имидного таутомера, показанного приведенной ниже формулой (I-1) и его лактимного таутомера, показанного приведенной ниже формулой (I-2):

В настоящей заявке, если не указано иное, имеется в виду, что изображенные в тексте структуры включают соединения, которые различаются только наличием одного или нескольких изотопно-обогащенных атомов. Например, в объем настоящего изобретения входят соединения, имеющие представленные структуры, за исключением замены водорода дейтерием или тритием, или замены углерода13C- или14C-обогащенным углеродом, или замены азота13N- или14N-обогащенным азотом, или замены кислорода14O-,15O-,17O- или18O-обогащенным кислородом, или замены хлора35Cl-,36Cl- или37Cl-обогащенным хлором.
В одном из вариантов осуществления, соединения по настоящему изобретению, могут также содержать доли изотопов одного или нескольких атомов, составляющих эти соединения, которые отличаются от природного содержания аналогичных изотопов. Например, соединения могут быть мечены радиоактивными изотопами, например, тритием (3H), йодом-125 (125I) или углеродом-14 (14C). Некоторые из изотопно-меченых соединений по настоящему изобретению (например, меченых3H и14C) применимы в качестве соединений и/или субстратов при исследовании распределения в тканях. Меченые тритием (т.е.3H) и углеродом-14 (т.е.14C) соединения могут обеспечить легкость проникновения и возможность детектирования. Далее, замещение более тяжелыми изотопами, например, дейтерием (2H) может обеспечить некоторые терапевтические преимущества, вследствие большей метаболической устойчивости образующихся при этом соединений (т.е. увеличенного времени полужизни in vivo или необходимости более низких дозировок). Изотопно-меченые соединения по настоящему изобретению, как правило, можно получать, применяя изотопно-меченые реагенты вместо аналогичных реагентов с нормальным изотопным составом. В некоторых вариантах осуществления, изобретение относится к соединениям, которые могут также содержать отличные от природных соотношения атомных изотопов для одного или нескольких атомов, составляющих эти соединения. Все вариации изотопного состава, касающиеся как радиоактивных, так и стабильных атомов, входят в объем настоящего изобретения.
В настоящем изобретении, если не указано иное, каждый из терминов «растворитель», «органический растворитель» или «инертный растворитель» означает растворитель, который является инертным в условиях проведения реакции, описанной в связи с этим растворителем, и в число таких растворителей входят, не ограничиваясь перечисленными, бензол, толуол, ацетонитрил, этилацетат, изопропилацетат, гексан, гептан, диоксан, тетрагидрофуран (THF, ТГФ), диметилформамид (DMF, ДМФА), диметилацетамид (DMA), хлороформ, метиленхлорид (дихлорметан), диэтиловый эфир, метанол, бутанол, метил т-бутиловый эфир (MTBE), 2-бутанон (MEK), N-метилпирролидон (NMP), пиридин и т.п. Если не указано иное, растворители, применяемые в реакциях, описанных в настоящей заявке, являются инертными органическими растворителями. Если не указано иное, объемный эквивалент растворителя равняется одному кубическому сантиметру (см3) (или мл) на каждый грамм реагента, введенного в реакцию в минимальном мольном количестве.
В настоящем описании, если не указано иное, термины «фармацевтически приемлемый носитель» или «фармацевтически приемлемый эксципиент» охватывают все без исключения растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые реагенты, изотонические агенты и агенты, замедляющие абсорбцию, и т.п. Применение таких сред и агентов для фармацевтически активных веществ известно в технике. За исключением тех случаев, когда какая-либо стандартная среда или агент не совместимы с действующим ингредиентом, в настоящем изобретении рассматривается его применение в терапевтических композициях. В композиции могут также включаться дополнительные действующие ингредиенты.
В настоящем описании, если не указано иное, термин «полиморф» может применяться для описания кристаллического вещества, например, кристаллической формы. В некоторых вариантах осуществления подразумевается также, что термин «полиморф» включает все кристаллические и аморфные формы соединения или его солей, в т.ч., например, кристаллические формы, полиморфы, псевдополиморфы, сольваты, гидраты, сокристаллы, несольватированные полиморфы (включая безводные формы), конформационные полиморфы, таутомерные формы, разупорядоченные кристаллические формы и аморфные формы, а также их смеси, если не указана конкретная кристаллическая или аморфная форма. Соединения по настоящему изобретению включают кристаллические и аморфные формы этих соединений, в т.ч., например, кристаллические формы, полиморфы, псевдополиморфы, сольваты, гидраты, сокристаллы, несольватированные полиморфы (включая безводные формы), конформационные полиморфы, таутомерные формы, разупорядоченные кристаллические формы и аморфные формы соединений или их солей, а также их смеси.
В настоящем описании, если не указано иное, подразумевается, что конкретная форма соединения формулы (I), описанная в заявке (например, форма A, B, C, D, E, F, G, H, I, J или аморфная форма соединения формулы (I) или их смеси) охватывает, в том числе, твердую форму соединения формулы (I) или его соли, сольвата или гидрата.
В настоящем описании, если не указано иное, термин «твердая форма» и родственные термины, относятся к физической форме, включающей соединение по настоящему изобретению или его соль, сольват или гидрат, которые не находятся в жидком или газообразном состоянии. Твердые формы могут быть кристаллическими, аморфными, разупорядоченными кристаллами, частично кристаллическими и/или частично аморфными.
В настоящем описании, если не указано иное, термин «кристаллический», если он применяется для описания вещества, компонента или продукта, означает, что это вещество, компонент или продукт в основном является кристаллическим, согласно, например, данным по дифракции рентгеновских лучей. Смотрите, например, Remington: The Science and Practice of Pharmacy, Lippincott Williams & Wilkins, 21st ed. (2005).
В настоящем описании, если не указано иное, термин «кристаллическая форма» и родственные термины относятся к кристаллическим материалам, включающим данное вещество, в т.ч. однокомпонентным кристаллическим формам и многокомпонентным кристаллическим формам и охватывают, не ограничиваясь этим, полиморфы, сольваты, гидраты, сокристаллы и другие молекулярные комплексы, а также соли, сольваты солей, гидраты солей, другие молекулярные комплексы солей и их полиморфы. В некоторых вариантах осуществления, кристаллическая форма вещества может быть практически свободна от аморфных форм и/или других кристаллических форм. В других вариантах осуществления, кристаллическая форма вещества может содержать примерно 1%, примерно 2%, примерно 3%, примерно 4%, примерно 5%, примерно 10%, примерно 15%, примерно 20%, примерно 25%, примерно 30%, примерно 35%, примерно 40%, примерно 45% или примерно 50% одной или нескольких аморфных форм и/или других кристаллических форм по массе, и/или по соотношению молей.
Некоторые кристаллические формы вещества можно получать целым рядом способов, например, не ограничиваясь этим, перекристаллизацией из расплава, охлаждением расплава, перекристаллизацией из растворителя, перекристаллизацией в замкнутых пространствах, например, в нанопорах или капиллярах, перекристаллизацией на поверхностях или матрицах, например, на полимерах, перекристаллизацией в присутствии добавок, например, сокристаллизующихся контр-молекул, десольватацией, дегидратацией, быстрым выпариванием, быстрым охлаждением, медленным охлаждением, диффузией пара, возгонкой, растиранием, растиранием с небольшим количеством растворителя, осаждением, вызванным микроволновым излучением, осаждением, вызванным ультразвуком, осаждением, вызванным лазерным излучением и/или осаждением из сверхкритического флюида. В настоящем описании, если не указано иное, термин «выделение» охватывает также очистку.
Методики, которыми можно охарактеризовать кристаллические формы и аморфные формы, могут включать, не ограничиваясь этим, термогравиметрический анализ (TGA), дифференциальную сканирующую калориметрию (DSC), дифрактометрию рентгеновских лучей на порошке (XRPD), дифрактометрию рентгеновских лучей на монокристаллах, колебательную спектроскопию, например, инфракрасную (IR, ИК) и спектроскопию комбинационного рассеяния, твердофазную спектроскопию ядерного магнитного резонанса (NMR, ЯМР), оптическую микроскопию, высокотемпературную оптическую микроскопию, сканирующую электронную микроскопию (SEM), электронную кристаллографию и количественный анализ, анализ размера частиц (PSA), анализ поверхности частиц, исследования растворимости и исследования растворения.
В настоящем описании, если не указано иное, термин «пик», если он применяется в связи со спектрами или данными, представленными в графической форме (например, XRPD, ИК, спектроскопией комбинационного рассеяния и ЯМР), относится к пику или другому особому элементу, который специалист в данной области техники мог бы выделить, как не относящийся к фоновому шуму. Термин «значимый пик» относится к пикам, по меньшей мере, среднего размера (например, высоты) относительно других пиков в спектре или наборе данных, или, по меньшей мере, в 1,5, 2 или 2,5 раза превосходящим уровень фона в спектре или наборе данных.
В настоящем описании, если не указано иное, термины «аморфный», «аморфная форма» и родственные термины означают, что рассматриваемое вещество, компонент или продукт является главным образом не кристаллическим по данным дифракции рентгеновских лучей. В некоторых вариантах осуществления, аморфная форма вещества может быть практически свободна от других аморфных форм и/или кристаллических форм. В некоторых вариантах осуществления, аморфная форма вещества может включать одну или несколько разупорядоченных кристаллических форм. В других вариантах осуществления, аморфная форма вещества может содержать примерно 1%, примерно 2%, примерно 3%, примерно 4%, примерно 5%, примерно 10%, примерно 15%, примерно 20%, примерно 25%, примерно 30%, примерно 35%, примерно 40%, примерно 45% или примерно 50% одной или нескольких других аморфных форм и/или кристаллических форм по массе и/или по соотношению молей. Аморфные формы вещества можно получать целым рядом способов, которые известны в технике. Эти способы включают, не ограничиваясь перечисленными, нагревание, охлаждение расплава, быстрое охлаждение расплава, выпаривание растворителя, быстрое выпаривание растворителя, десольватацию, возгонку, растирание, растирание в замороженном состоянии, высушивание распылением и лиофильную сушку.
В настоящем описании, если не указано иное, фраза «композиция практически свободна» или «композиция практически не содержит» того или иного соединения означает, что композиция содержит менее примерно 20 процентов по массе, менее примерно 10 процентов по массе, менее примерно 5 процентов по массе, менее примерно 3 процентов по массе, или менее примерно 1 процента этого соединения по массе.
В настоящем описании, если не указано иное, термин «практически чистый», если он применяется для описания полиморфа, кристаллической формы или твердой формы соединения или комплекса по настоящему изобретению, означает твердую форму соединения или комплекса, которая включает конкретный полиморф и практически свободна от других полиморфных и/или аморфных форм этого соединения. Типовой практически чистый полиморф включает более, чем примерно 80% по массе одной полиморфной формы соединения и менее, чем примерно 20% по массе других полиморфных и/или аморфных форм этого соединения; более, чем примерно 90% по массе одной полиморфной формы соединения и менее, чем примерно 10% по массе других полиморфных и/или аморфных форм этого соединения; более, чем примерно 95% по массе одной полиморфной формы соединения и менее, чем примерно 5% по массе других полиморфных и/или аморфных форм этого соединения; более, чем примерно 97% по массе одной полиморфной формы соединения и менее, чем примерно 3% по массе других полиморфных и/или аморфных форм этого соединения; или более, чем примерно 99% по массе одной полиморфной формы соединения и менее, чем примерно 1% по массе других полиморфных и/или аморфных форм этого соединения.
В настоящем описании, если не указано иное, кристаллическая форма, которая «практически свободна» от воды и/или растворителя в кристаллической решетке, содержит такое количество воды и/или растворителя в кристаллической решетке, которое в некоторых вариантах осуществления, находится примерно вблизи от предела обнаружения, в других вариантах осуществления находится примерно на пределе обнаружения и, в еще одной группе вариантов осуществления, находится примерно ниже предела обнаружения для растворителя и/или воды в кристаллической решетке при измерении с помощью стандартных методик исследования твердого тела, например, описанных в настоящей заявке. В некоторых вариантах осуществления, методика исследования твердого тела, применяемая для определения количества воды и/или растворителя в кристаллической решетке, представляет собой термогравиметрический анализ. В других вариантах осуществления, методика исследования твердого тела, применяемая для определения количества воды и/или растворителя в кристаллической решетке, представляет собой определение воды по Карлу Фишеру. В других вариантах осуществления, кристаллическая форма, которая «практически свободна» от воды и/или растворителя в кристаллической решетке, включает такое количество воды и/или растворителя, которое менее, чем примерно 5%, менее, чем примерно 4%, менее, чем примерно 3%, менее, чем примерно 2%, менее, чем примерно 1%, менее, чем примерно 0,9%, менее, чем примерно 0,8%, менее, чем примерно 0,7%, менее, чем примерно 0,6%, менее, чем примерно 0,5%, менее, чем примерно 0,4%, менее, чем примерно 0,3%, менее, чем примерно 0,2%, менее, чем примерно 0,1%, менее, чем примерно 0,05% или менее, чем примерно 0,01% от общей массы кристаллической формы.
В настоящей заявке, кристаллическая или аморфная форма, которая является «чистой», т.е. практически свободной от других кристаллических или аморфных форм, содержит менее, чем примерно 10 процентов по массе одной или нескольких других кристаллических или аморфных форм, менее, чем примерно 5 процентов по массе одной или нескольких других кристаллических или аморфных форм, менее, чем примерно 3 процента по массе одной или нескольких других кристаллических или аморфных форм или менее, чем примерно 1 процент по массе одной или нескольких других кристаллических или аморфных форм.
В настоящей заявке, если не указано иное, термин «стабильный» или «устойчивый» относится к соединению или композиции, которые с трудом разлагаются или меняют свой химический состав или физическое состояние. Стабильная композиция или состав по настоящему изобретению не подвергается значительному разрушению в обычных условиях производства или хранения. В некоторых вариантах осуществления, термин «стабильный», относящийся к составу или дозированной форме, означает, что действующий ингредиент этого состава или дозированной формы остается неизменным по своему химическому составу или физическому состоянию в течение указанного периода времени и не подвергается значительному разрушению, агрегации или другим изменениям (по данным, например, ВЭЖХ, Фурье-ИК или XRPD). В некоторых вариантах осуществления, примерно 70 процентов или более, примерно 80 процентов или более, примерно 90 процентов или более, примерно 95 процентов или более, примерно 98 процентов или более или примерно 99 процентов или более соединения остается в неизменном состоянии по истечении указанного периода. В одном из вариантов осуществления, полиморф по настоящему изобретению является стабильным при долговременном хранении (например, полиморфная форма не претерпевает значительных изменений после примерно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 18, 24, 30, 36, 42, 48, 54, 60 или более чем 60 месяцев хранения).
Ниже приведены более подробные описания конкретных функциональных групп и химических терминов. Химические элементы приведены в соответствии с периодической системой химических элементов в версии CAS, Handbook of Chemistry and Physics, 75th ed., на внутренней стороне обложки, и конкретные функциональные группы, как правило, определены, как описано в тексте заявки. Кроме того, общие принципы органической химии, а также конкретные функциональные фрагменты и их реакционная способность описаны Organic Chemistry, Thomas Sorrell, University Science Books, Sausalito, 1999; Smith and March March’s Advanced Organic Chemistry, 5th ed., John Wiley & Sons, Inc., New York, 2001; Larock, Comprehensive Organic Transformations, VCH Publishers, Inc., New York, 1989; and Carruthers, Some Modern Methods of Organic Synthesis, 3rd ed., Cambridge University Press, Cambridge, 1987.
Если в заявке приводится диапазон значений, имеется в виду, что он охватывает каждое значение и поддиапазон в пределах указанного диапазона. Например, имеется в виду, что «C1-6 алкил» охватывает C1, C2, C3, C4, C5, C6, C1-6, C1-5, C1-4, C1-3, C1-2, C2-6, C2-5, C2-4, C2-3, C3-6, C3-5, C3-4, C4-6, C4-5 и C5-6 алкил.
Термин «алкил» относится к радикалу с линейной или разветвленной углеводородной цепью, состоящему только из атомов углерода и водорода, который не включает ненасыщенных фрагментов, и содержит от одного до десяти атомов углерода (например, C1-10 алкил). В любом месте настоящей заявки, численный диапазон, например, «от 1 до 10», относится к каждому целому числу в данном диапазоне, например, фраза «от 1 до 10 атомов углерода» означает, что алкильная группа может содержать 1 атом углерода, 2 атома углерода, 3 атома углерода и т.д. до 10 атомов углерода включительно, хотя данное определение охватывает также «алкилы» для которых не указан численный диапазон. В некоторых вариантах осуществления, термин «алкил» относится к C1-C6 алкильной группе. В некоторых вариантах осуществления, алкильная группа включает от 1 до 10, от 1 до 6 или от 1 до 3 атомов углерода. Типовые насыщенные алкилы с линейной цепью включают, не ограничиваясь этим, -метил, -этил, -н-пропил, -н-бутил, -н-пентил и -н-гексил; при этом насыщенные разветвленные алкилы включают, не ограничиваясь этим, -изопропил, -втор-бутил, -изобутил, -трет-бутил, -изопентил, 2-метилбутил, 3-метилбутил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 2-метилгексил, 3-метилгексил, 4-метилгексил, 5-метилгексил, 2,3-диметилбутил и т.п. Алкил присоединен к остальной части молекулы одинарной связью. Если в описании не указано иное, алкильная группа необязательно замещена одним или несколькими заместителями, которые независимо включают: ацил, алкил, алкенил, алкинил, алкокси, алкиларил, циклоалкил, аралкил, арил, арилокси, амино, амидо, амидино, имино, азид, карбонат, карбамат, карбонил, гетероалкил, гетероарил, гетероарилалкил, гетероциклоалкил, гидрокси, циано, галоген, галогеналкокси, галогеналкил, сложный эфир, простой эфир, меркапто, тио, алкилтио, арилтио, тиокарбонил, нитро, оксо, фосфат, фосфонат, фосфинат, силил, сульфинил, сульфонил, сульфонамидил, сульфоксил, сульфонат, мочевину, фрагменты -Si(Ra)3-, -ORa, -SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -OC(O)N(Ra)2, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, -N(Ra)C(O)N(Ra)2, -N(Ra)C(NRa)N(Ra)2, -N(Ra)S(O)tRa (где t означает 1 или 2), -S(O)tORa (где t означает 1 или 2), -S(O)tN(Ra)2 (где t означает 1 или 2) или -O-P(=O)(ORa)2, где каждый из заместителей Ra независимо представляет собой водород, алкил, галогеналкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероарилалкил, и каждый из этих фрагментов может быть необязательно замещен, как определено в тексте заявки.
Термин «пергалогеналкил» относится к алкильной группе, в которой все атомы водорода замещены атомами галогенов, выбранными из фтора, хлора, брома и йода. В некоторых вариантах осуществления, все без исключения атомы водорода замещены фтором. В некоторых вариантах осуществления, все без исключения атомы водорода замещены атомами хлора. Примеры пергалогеналкильных групп включают -CF3, -CF2CF3, -CF2CF2CF3, -CCl3, -CFCl2, -CF2Cl и т.п.
Термин «алкенил» относится к радикалу с линейной или разветвленной углеводородной цепью, состоящему только из атомов углерода и водорода, содержащему , по меньшей мере, одну двойную связь, и включающему от двух до десяти атомов углерода (т.е. C2-C10 алкенилу). В любом месте текста заявки, численный диапазон, например, «от 2 до 10» относится к каждому целому числу в данном диапазоне; например, фраза «от 2 до 10 атомов углерода» означает, что алкенильная группа может состоять из 2 атомов углерода, 3 атомов углерода и т.д. вплоть до 10 атомов углерода включительно. В некоторых вариантах осуществления, алкенил включает от двух до восьми атомов углерода. В других вариантах осуществления, алкенил включает от двух до пяти атомов углерода (например, C2-C5 алкенил). Алкенил прикреплен к остальной части молекулы одинарной связью, например, этенил (т.е. винил), проп-1-енил (т.е. аллил), бут-1-енил, пент-1-енил, пента-1,4-диенил и т.п. Одна или несколько двойных углерод-углеродных связей могут находиться внутри цепи (как, например, в 2-бутениле) или на ее конце (как, например, в 1-бутениле). Примеры C2-4 алкенильных групп включают этенил (C2), 1-пропенил (C3), 2-пропенил (C3), 1-бутенил (C4), 2-бутенил (C4), бутадиенил (C4) и т.п. Примеры C2-6 алкенильных групп включают приведенные выше C2-4 алкенильные группы, а также пентенил (C5), пентадиенил (C5), гексенил (C6) и т.п. Другие примеры алкенилов включают гептенил (C7), октенил (C8), октатриенил (C8) и т.п. Если в данной заявке не указано иное, алкенильная группа необязательно замещена одним или несколькими заместителями, которые независимо включают: ацил, алкил, алкенил, алкинил, алкокси, алкиларил, циклоалкил, аралкил, арил, арилокси, амино, амидо, амидино, имино, азид, карбонат, карбамат, карбонил, гетероалкил, гетероарил, гетероарилалкил, гетероциклоалкил, гидрокси, циано, галоген, галогеналкокси, галогеналкил, сложный эфир, простой эфир, меркапто, тио, алкилтио, арилтио, тиокарбонил, нитро, оксо, фосфат, фосфонат, фосфинат, силил, сульфинил, сульфонил, сульфонамидил, сульфоксил, сульфонат, мочевину, фрагменты -Si(Ra)3-, -ORa, -SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -OC(O)N(Ra)2, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, -N(Ra)C(O)N(Ra)2, -N(Ra)C(NRa)N(Ra)2, -N(Ra)S(O)tRa (где t означает 1 или 2), -S(O)tORa (где t означает 1 или 2), -S(O)tN(Ra)2 (где t означает 1 или 2) или -O-P(=O)(ORa)2, где каждый из заместителей Ra независимо представляет собой водород, алкил, галогеналкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероарилалкил, и каждый из этих фрагментов может быть необязательно замещен, как определено в тексте заявки.
Термин «алкинил» относится к радикалу с линейной или разветвленной цепью, состоящему только из атомов углерода и водорода, содержащему , по меньшей мере, одну тройную связь и включающему от двух до десяти атомов углерода (т.е. C2-C10 алкинилу). В любом месте текста заявки, численный диапазон, например, «от 2 до 10» относится к каждому целому числу в данном диапазоне; например, фраза «от 2 до 10 атомов углерода» означает, что алкинильная группа может включать 2 атома углерода, 3 атома углерода и т.д. вплоть до 10 атомов углерода включительно. В некоторых вариантах осуществления, алкинил включает от двух до восьми атомов углерода. В других вариантах осуществления, алкинил включает от двух до пяти атомов углерода (например, C2-C5 алкинил). Алкинил присоединен к остальной части молекулы простой связью, как, например, этинил, пропинил, бутинил, пентинил, гексинил и т.п. Если в заявке не указано иное, алкинильная группа необязательно замещена одним или несколькими заместителями, которые независимо включают: ацил, алкил, алкенил, алкинил, алкокси, алкиларил, циклоалкил, аралкил, арил, арилокси, амино, амидо, амидино, имино, азид, карбонат, карбамат, карбонил, гетероалкил, гетероарил, гетероарилалкил, гетероциклоалкил, гидрокси, циано, галоген, галогеналкокси, галогеналкил, сложный эфир, простой эфир, меркапто, тио, алкилтио, арилтио, тиокарбонил, нитро, оксо, фосфат, фосфонат, фосфинат, силил, сульфинил, сульфонил, сульфонамидил, сульфоксил, сульфонат, мочевину, фрагменты -Si(Ra)3-, -ORa, -SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -OC(O)N(Ra)2, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, -N(Ra)C(O)N(Ra)2, -N(Ra)C(NRa)N(Ra)2, -N(Ra)S(O)tRa (где t означает 1 или 2), -S(O)tORa (где t означает 1 или 2), -S(O)tN(Ra)2 (где t означает 1 или 2) или -O-P(=O)(ORa)2, где каждый из заместителей Ra независимо представляет собой водород, алкил, галогеналкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероарилалкил, и каждый из этих фрагментов может быть необязательно замещен, как определено в тексте заявки.
Термин «алкокси» относится к группе -O-алкил, включающей от 1 до 10 атомов углерода, имеющей линейную, разветвленную, циклическую конфигурацию или их комбинацию, присоединенной к остальной части молекулы через атом кислорода. Примеры алкоксигрупп включают метокси, этокси, пропокси, изопропокси, циклопропилокси, циклогексилокси и т.п. Термин «низшая алкоксигруппа» относится к алкоксигруппам, содержащим от одного до шести атомов углерода. В некоторых вариантах осуществления, C1-C4 алкокси представляет собой алкоксигруппу, которая включает алкилы как с линейной, так и с разветвленной цепью, содержащей от 1 до 4 атомов углерода. Если в заявке не указано иное, алкоксигруппа необязательно замещена одним или несколькими заместителями, которые независимо включают: ацил, алкил, алкенил, алкинил, алкокси, алкиларил, циклоалкил, аралкил, арил, арилокси, амино, амидо, амидино, имино, азид, карбонат, карбамат, карбонил, гетероалкил, гетероарил, гетероарилалкил, гетероциклоалкил, гидрокси, циано, галоген, галогеналкокси, галогеналкил, сложный эфир, простой эфир, меркапто, тио, алкилтио, арилтио, тиокарбонил, нитро, оксо, фосфат, фосфонат, фосфинат, силил, сульфинил, сульфонил, сульфонамидил, сульфоксил, сульфонат, мочевину, фрагменты -Si(Ra)3-, -ORa, -SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -OC(O)N(Ra)2, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, -N(Ra)C(O)N(Ra)2, -N(Ra)C(NRa)N(Ra)2, -N(Ra)S(O)tRa (где t означает 1 или 2), -S(O)tORa (где t означает 1 или 2), -S(O)tN(Ra)2 (где t означает 1 или 2) или -O-P(=O)(ORa)2, где каждый из заместителей Ra независимо представляет собой водород, алкил, галогеналкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероарилалкил, и каждый из этих фрагментов может быть необязательно замещен, как определено в тексте заявки. Термины «алкенокси» и «алкинокси» соответствуют приведенному выше описанию «алкокси», в котором приставка «алк» заменена приставками «алкен» или «алкин» соответственно, и исходные термины «алкенил» или «алкинил» соответствуют данному выше описанию.
Термин «алкоксикарбонил» относится к группе формулы (алкокси)(C=O)-, присоединенной к остальной части молекулы через карбонильный атом углерода и включающей от 1 до 10 атомов углерода. Таким образом, C1-C6 алкоксикарбонильная группа представляет собой алкоксигруппу, включающую от 1 до 6 атомов углерода, присоединенную через атом кислорода к карбонильному линкеру. В обозначении C1-C6 в число атомов углерода не включен карбонильный углерод. Термин «низший алкоксикарбонил» относится к алкоксикарбонильной группе, в которой алкильный фрагмент алкоксигруппы является низшей алкильной группой. В некоторых вариантах осуществления, C1-C4 алкокси представляет собой алкоксигруппу, которая включает алкоксигруппы, как с линейными, так и с разветвленными цепями, содержащие от 1 до 4 атомов углерода. Если в описании не указано иное, алкоксикарбонильная группа необязательно замещена одним или несколькими заместителями, которые независимо включают: ацил, алкил, алкенил, алкинил, алкокси, алкиларил, циклоалкил, аралкил, арил, арилокси, амино, амидо, амидино, имино, азид, карбонат, карбамат, карбонил, гетероалкил, гетероарил, гетероарилалкил, гетероциклоалкил, гидрокси, циано, галоген, галогеналкокси, галогеналкил, сложный эфир, простой эфир, меркапто, тио, алкилтио, арилтио, тиокарбонил, нитро, оксо, фосфат, фосфонат, фосфинат, силил, сульфинил, сульфонил, сульфонамидил, сульфоксил, сульфонат, мочевину, фрагменты -Si(Ra)3-, -ORa, -SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -OC(O)N(Ra)2, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, -N(Ra)C(O)N(Ra)2, -N(Ra)C(NRa)N(Ra)2, -N(Ra)S(O)tRa (где t означает 1 или 2), -S(O)tORa (где t означает 1 или 2), -S(O)tN(Ra)2 (где t означает 1 или 2) или -O-P(=O)(ORa)2, где каждый из заместителей Ra независимо представляет собой водород, алкил, галогеналкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероарилалкил, и каждый из этих фрагментов может быть необязательно замещен, как определено в тексте заявки. Термины «алкеноксикарбонил» и «алкиноксикарбонил» соответствуют приведенному выше описанию «алкоксикарбонила», в котором приставка «алк» заменена приставками «алкен» или «алкин», соответственно, и исходные термины «алкенил» или «алкинил» соответствуют данному выше описанию.
Термин «ацил» относится к группам R-C(O)-, например, но не ограничиваясь этим, (алкил)-C(O), (алкенил)-C(O), (алкинил)-C(O), (арил)-C(O), (циклоалкил)-C(O), (гетероарил)-C(O), (гетероалкил)-C(O) и (гетероциклоалкил)-C(O), где ацильная группа присоединена к остальной части молекулы через карбонильную группу. В некоторых вариантах осуществления, ацильный радикал представляет собой C1-C10 ацильный радикал, где указанные числа относятся к сумме общего числа атомов углерода в цепи или цикле, например, алкильного, алкенильного, алкинильного, арильного, циклогексильного, гетероарильного или гетероциклоалкильного фрагмента и карбонильного атома углерода ацила. Например, C4-ацил включает три атома цепи или цикла и один карбонильный атом углерода. Если радикал R представляет собой гетероарил или гетероциклоалкил, гетероатомы цикла или цепи включаются в общее число атомов цикла или цепи. Если в описании не указано иное, фрагмент R ацилоксигруппы может быть необязательно замещен одним или несколькими заместителями, которые независимо включают: ацил, алкил, алкенил, алкинил, алкокси, алкиларил, циклоалкил, аралкил, арил, арилокси, амино, амидо, амидино, имино, азид, карбонат, карбамат, карбонил, гетероалкил, гетероарил, гетероарилалкил, гетероциклоалкил, гидрокси, циано, галоген, галогеналкокси, галогеналкил, сложный эфир, простой эфир, меркапто, тио, алкилтио, арилтио, тиокарбонил, нитро, оксо, фосфат, фосфонат, фосфинат, силил, сульфинил, сульфонил, сульфонамидил, сульфоксил, сульфонат, мочевину, фрагменты -Si(Ra)3-, -ORa, -SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -OC(O)N(Ra)2, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, -N(Ra)C(O)N(Ra)2, -N(Ra)C(NRa)N(Ra)2, -N(Ra)S(O)tRa (где t означает 1 или 2), -S(O)tORa (где t означает 1 или 2), -S(O)tN(Ra)2 (где t означает 1 или 2) или -O-P(=O)(ORa)2, где каждый из заместителей Ra независимо представляет собой водород, алкил, галогеналкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероарилалкил, и каждый из этих фрагментов может быть необязательно замещен, как определено в тексте заявки.
Термин «ацилокси» относится к R(C=O)О-радикалу, где фрагмент R может представлять алкил, алкенил, алкинил, гетероалкил, гетероалкенил, гетероалкинил, арил, циклогексил, гетероарил или гетероциклоалкил, которые соответствуют данному выше описанию. Ацилоксигруппа присоединена к основной части молекулы через кислородную функциональность. В некоторых вариантах осуществления, ацилоксигруппа представляет С1-С4 ацилокси радикал, где указанные числа относятся к общему числу атомов углерода в цепи или цикле алкильного, алкенильного, алкинильного, арильного, циклогексильного, гетероарильного или гетероциклоалкильного фрагмента ацилокси группы и карбонильного атома углерода ацила, например, C4-ацилокси включает три атома цикла или цепи и один карбонильный атом. Если радикал R представляет собой гетероарил или гетероциклоалкил, гетероатомы цикла или цепи включаются в общее число атомов цепи или цикла. Если в описании не указано иное, фрагмент R ацилоксигруппы может быть необязательно замещен одним или несколькими заместителями, которые независимо включают: ацил, алкил, алкенил, алкинил, алкокси, алкиларил, циклоалкил, аралкил, арил, арилокси, амино, амидо, амидино, имино, азид, карбонат, карбамат, карбонил, гетероалкил, гетероарил, гетероарилалкил, гетероциклоалкил, гидрокси, циано, галоген, галогеналкокси, галогеналкил, сложный эфир, простой эфир, меркапто, тио, алкилтио, арилтио, тиокарбонил, нитро, оксо, фосфат, фосфонат, фосфинат, силил, сульфинил, сульфонил, сульфонамидил, сульфоксил, сульфонат, мочевину, фрагменты -Si(Ra)3-, -ORa, -SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -OC(O)N(Ra)2, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, -N(Ra)C(O)N(Ra)2, -N(Ra)C(NRa)N(Ra)2, -N(Ra)S(O)tRa (где t означает 1 или 2), -S(O)tORa (где t означает 1 или 2), -S(O)tN(Ra)2 (где t означает 1 или 2) или -O-P(=O)(ORa)2, где каждый из заместителей Ra независимо представляет собой водород, алкил, галогеналкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероарилалкил, и каждый из этих фрагментов может быть необязательно замещен, как определено в тексте заявки.
Термины «амино» или «амин» относятся к группе радикалов -N(Rb)2, -N(Rb)Rb или -RbN(Rb)Rb, где каждый фрагмент Rb независимо выбран из водорода, алкила, алкенила, алкинила, галогеналкила, гетероалкила (связанного через атом углерода цепи), циклоалкила, циклоалкилалкила, арила, аралкила, гетероциклоалкила (связанного через атом углерода цикла), гетероциклоалкилалкила, гетероарила (связанного через атом углерода цикла) или гетероарилалкила, если иное не указано в описании, причем каждый из этих фрагментов сам может быть необязательно замещен, как указано в описании. Если группа -N(Rb)2 содержит два фрагмента Rb, отличающиеся от водорода, они, совместно с атомом азота, могут образовывать 3-, 4-, 5-, 6- или 7-членный цикл. Например, подразумевается, что фрагмент -N(Rb)2 включает, не ограничиваясь этим, 1-пирролидинил и 4-морфолинил. Если в описании не указано иное, аминогруппа необязательно замещена одним или несколькими заместителями, которые независимо включают: ацил, алкил, алкенил, алкинил, алкокси, алкиларил, циклоалкил, аралкил, арил, арилокси, амино, амидо, амидино, имино, азид, карбонат, карбамат, карбонил, гетероалкил, гетероарил, гетероарилалкил, гетероциклоалкил, гидрокси, циано, галоген, галогеналкокси, галогеналкил, сложный эфир, простой эфир, меркапто, тио, алкилтио, арилтио, тиокарбонил, нитро, оксо, фосфат, фосфонат, фосфинат, силил, сульфинил, сульфонил, сульфонамидил, сульфоксил, сульфонат, мочевину, фрагменты -Si(Ra)3-, -ORa, -SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -OC(O)N(Ra)2, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, -N(Ra)C(O)N(Ra)2, -N(Ra)C(NRa)N(Ra)2, -N(Ra)S(O)tRa (где t означает 1 или 2), -S(O)tORa (где t означает 1 или 2), -S(O)tN(Ra)2 (где t означает 1 или 2) или -O-P(=O)(ORa)2, где каждый из заместителей Ra независимо представляет собой водород, алкил, галогеналкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероарилалкил, и каждый из этих фрагментов может быть необязательно замещен, как определено в тексте заявки.
Термины «амин» и «амино» относятся также к N-оксидам, т.е. группам -N+(H)(Ra)O- и -N+(Ra)(Ra)O-, где Ra соответствует данному выше определению, и где N-оксид связан с остальной частью молекулы через атом N. N-оксиды можно получать обработкой соответствующей аминогруппы, например, пероксидом водорода или м-хлорпероксибензойной кислотой. Специалист в данной области техники хорошо знаком с условиями проведения реакции получения N-оксидов.
Термины «амид» или «амидо» относятся к химическому фрагменту формулы -C(O)N(Rb)2 или -NRbC(O)Rb, где фрагмент Rb независимо выбран из водорода, алкила, алкенила, алкинила, галогеналкила, гетероалкила (связанного через атом углерода цепи), циклоалкила, циклоалкилалкила, арила, аралкила, гетероциклоалкила (связанного через атом углерода цикла), гетероциклоалкилалкила, гетероарила (связанного через атом углерода цикла) или гетероарилалкила, если иное не указано в описании, причем каждый из этих фрагментов сам может быть необязательно замещен, как указано в описании. В некоторых вариантах осуществления, описываемый радикал может представлять собой C1-C4 амидо или амидный радикал, где атом углерода амидного карбонила включен в общее число атомов углерода радикала. Если фрагмент -C(O)N(Rb)2 содержит два заместителя, отличных от водорода, они могут совместно с атомом азота образовывать 3-, 4-, 5-, 6- или 7-членный цикл. Например, имеется в виду, что фрагмент N(Rb)2 радикала -C(O)N(Rb)2 включает, не ограничиваясь этим, 1-пирролидинил и 4-морфолинил. Если в описании не указано иное, фрагмент Rb амидогруппы необязательно замещен одним или несколькими заместителями, которые независимо включают: ацил, алкил, алкенил, алкинил, алкокси, алкиларил, циклоалкил, аралкил, арил, арилокси, амино, амидо, амидино, имино, азид, карбонат, карбамат, карбонил, гетероалкил, гетероарил, гетероарилалкил, гетероциклоалкил, гидрокси, циано, галоген, галогеналкокси, галогеналкил, сложный эфир, простой эфир, меркапто, тио, алкилтио, арилтио, тиокарбонил, нитро, оксо, фосфат, фосфонат, фосфинат, силил, сульфинил, сульфонил, сульфонамидил, сульфоксил, сульфонат, мочевину, фрагменты -Si(Ra)3-, -ORa, -SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -OC(O)N(Ra)2, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, -N(Ra)C(O)N(Ra)2, -N(Ra)C(NRa)N(Ra)2, -N(Ra)S(O)tRa (где t означает 1 или 2), -S(O)tORa (где t означает 1 или 2), -S(O)tN(Ra)2 (где t означает 1 или 2) или -O-P(=O)(ORa)2, где каждый из заместителей Ra независимо представляет собой водород, алкил, галогеналкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероарилалкил, и каждый из этих фрагментов может быть необязательно замещен, как определено в тексте заявки.
Термин «амид» или «амидо» охватывает молекулы аминокислоты или пептида. Любая амино, гидрокси или карбоксильная группа соединений по настоящему изобретению может быть превращена в амидную группу. Методики и конкретные группы для получения таких амидов известны специалисту в данной области техники, и их можно легко найти в справочных руководствах, например, в книге Greene and Wuts, Protective Groups in Organic Synthesis, 3rd Ed., John Wiley & Sons, New York, NY, 1999, которая включена в настоящую заявку посредством ссылки в полном объеме.
Термин «амидино» относится к радикалам -C(=NRb)N(Rb)2 и -N(Rb)-C(=NRb)-, в которых каждая из групп Rb независимо выбрана из водорода, алкила, алкенила, алкинила, галогеналкила, гетероалкила (связанного через атом углерода цепи), циклоалкила, циклоалкилалкила, арила, аралкила, гетероциклоалкила (связанного через атом углерода цикла), гетероциклоалкилалкила, гетероарила (связанного через атом углерода цикла) или гетероарилалкила, если иное не указано в описании, причем каждый из этих фрагментов сам может быть необязательно замещен, как указано в описании.
Термины «ароматический фрагмент» или «арил» относятся к радикалу, содержащему от шести до десяти циклических атомов (например, ароматическому фрагменту C6-C10 или C6-C10 арилу), который включает, по меньшей мере, один цикл, имеющий сопряженную пи-электронную систему, и который является карбоциклическим (например, фенил, флуоренил и нафтил). Например, двухвалентные радикалы, образованные из соответствующих производных бензола и имеющие свободные валентности у циклических атомов, именуются замещенными фениленовыми радикалами. В других вариантах осуществления, наименования двухвалентных радикалов, полученных из одновалентных полициклических углеводородных радикалов, названия которых заканчиваются на «-ил», путем удаления одного атома водорода от атома углерода со свободной валентностью, образуют добавлением окончания «-иден» к названию соответствующего одновалентного радикала, например, нафтильную группу с двумя точками прикрепления остальных фрагментов молекулы именуют нафтилиденом. В любом месте текста заявки, численный диапазон, например во фразе «6-10 арил» относится к каждому целому числу в данном диапазоне; например, фраза «от 6 до 10 циклических атомов» означает, что арильная группа может состоять из 6 циклических атомов, 7 циклических атомов и т.д., вплоть до 10 циклических атомов включительно. Описываемый термин включает моноциклические или конденсированные полициклические (т.е. циклы которых совместно включают пары соседних циклических атомов) группы. Если в описании не указано иное, арильный фрагмент может быть необязательно замещен одним или несколькими заместителями, которые независимо включают: ацил, алкил, алкенил, алкинил, алкокси, алкиларил, циклоалкил, аралкил, арил, арилокси, амино, амидо, амидино, имино, азид, карбонат, карбамат, карбонил, гетероалкил, гетероарил, гетероарилалкил, гетероциклоалкил, гидрокси, циано, галоген, галогеналкокси, галогеналкил, сложный эфир, простой эфир, меркапто, тио, алкилтио, арилтио, тиокарбонил, нитро, оксо, фосфат, фосфонат, фосфинат, силил, сульфинил, сульфонил, сульфонамидил, сульфоксил, сульфонат, мочевину, фрагменты -Si(Ra)3-, -ORa, -SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -OC(O)N(Ra)2, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, -N(Ra)C(O)N(Ra)2, -N(Ra)C(NRa)N(Ra)2, -N(Ra)S(O)tRa (где t означает 1 или 2), -S(O)tORa (где t означает 1 или 2), -S(O)tN(Ra)2 (где t означает 1 или 2) или -O-P(=O)(ORa)2, где каждый из заместителей Ra независимо представляет собой водород, алкил, галогеналкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероарилалкил, и каждый из этих фрагментов может быть необязательно замещен, как определено в тексте заявки.
Термины «аралкил» или «арилалкил» относятся к радикалу (арил)алкил-, где арил и алкил соответствуют данным в тексте определениям, и необязательно замещены одним или несколькими заместителями, которые перечислены в качестве подходящих заместителей для арила и алкила соответственно. «Аралкил/арилалкил» связаны с остальной частью молекулы через алкильную группу. Термины «аралкенил/арилалкенил» и «аралкинил/арилалкинил» аналогичны приведенному выше описанию «аралкила/арилалкила», в котором «алкил» заменен «алкенилом» или «алкинилом» соответственно, причем термины «алкенил» или «алкинил» соответствуют приведенному в тексте заявки описанию.
Термин «азид» относится к радикалу -N3.
Термин «карбамат» относится к одному из следующих радикалов: -O-(C=O)-N(Rb)-, -O-(C=O)-N(Rb)2, -N(Rb)-(C=O)-O- и -N(Rb)-(C=O)-ORb, где каждая из групп Rb независимо выбрана из алкила, алкенила, алкинила, галогеналкила, гетероалкила (связанного через атом углерода цепи), циклоалкила, циклоалкилалкила, арила, аралкила, гетероциклоалкила (связанного через атом углерода цикла), гетероциклоалкилалкила, гетероарила (связанного через атом углерода цикла) или гетероарилалкила, если иное не указано в описании, причем каждый из этих фрагментов сам может быть необязательно замещен, как указано в описании.
Термин «карбонат» относится к радикалу -O-(C=O)-O-.
Термин «карбонил» относится к радикалу -(C=O)-.
Термин «карбоксальдегид» относится к радикалу -(C=O)H.
Термин «карбоксил» относится к радикалу -(C=O)OH.
Термин «циано» относится к радикалу -CN.
Каждый из терминов «циклоалкил» и «карбоциклил» относится к моноциклическому или полициклическому радикалу, который содержит только углерод и водород, и может быть насыщенным или частично ненасыщенным. Частично ненасыщенные циклоалкильные группы могут именоваться «циклоалкенилами», если карбоцикл содержит, по меньшей мере, одну двойную связь, или «циклоалкинилами», если карбоцикл содержит, по меньшей мере, одну тройную связь. Циклоалкильные группы включают группы, содержащие от 3 до 10 циклических атомов (т.е. C3-C10 циклоалкилы). В любом месте текста настоящего описания численный диапазон, например, «от 3 до 10» относится к каждому целому числу в этом диапазоне; например, фраза «от 3 до 10 атомов углерода» означает, что циклоалкильная группа может состоять из 3 атомов углерода, 4 атомов углерода, 5 атомов углерода и т.д. вплоть до 10 атомов углерода включительно. Термин «циклоалкил» включает также мостиковые и спиро циклические структуры, не содержащие гетероатомов. Кроме того, этот термин охватывает моноциклические или конденсированные полициклические (т.е. содержащие циклы, которые совместно включают пары соседних циклических атомов) группы. В некоторых вариантах осуществления, описываемый термин относится к C3-C8 циклоалкильному радикалу. В некоторых вариантах осуществления, описываемый термин относится к C3-C5 циклоалкильному радикалу. Иллюстративные примеры циклоалкильных групп включают, не ограничиваясь этим, следующие фрагменты: C3-6 карбоциклильные группы включают, не ограничиваясь этим, циклопропил (C3), циклобутил (C4), циклопентил (C5), циклопентенил (C5), циклогексил (C6), циклогексенил (C6), циклогексадиенил (C6) и т.п. Примеры C3-8 карбоциклильных групп включают упомянутые выше C3-6 карбоциклильные группы, а также циклогептил (C7), циклогептадиенил (C7), циклогептатриенил (C7), циклооктил (C8), бицикло[2.2.1]гептанил, бицикло[2.2.2]октанил и т.п. Примеры C3-10 карбоциклильных групп включают упомянутые выше C3-8 карбоциклильные группы, а также октагидро-1H-инденил, декагидронафталинил, спиро[4.5]деканил и т.п. Если в описании не указано иное, циклоалкильная группа необязательно замещена одним или несколькими заместителями, которые независимо включают: ацил, алкил, алкенил, алкинил, алкокси, алкиларил, циклоалкил, аралкил, арил, арилокси, амино, амидо, амидино, имино, азид, карбонат, карбамат, карбонил, гетероалкил, гетероарил, гетероарилалкил, гетероциклоалкил, гидрокси, циано, галоген, галогеналкокси, галогеналкил, сложный эфир, простой эфир, меркапто, тио, алкилтио, арилтио, тиокарбонил, нитро, оксо, фосфат, фосфонат, фосфинат, силил, сульфинил, сульфонил, сульфонамидил, сульфоксил, сульфонат, мочевину, фрагменты -Si(Ra)3-, -ORa, -SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -OC(O)N(Ra)2, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, -N(Ra)C(O)N(Ra)2, -N(Ra)C(NRa)N(Ra)2, -N(Ra)S(O)tRa (где t означает 1 или 2), -S(O)tORa (где t означает 1 или 2), -S(O)tN(Ra)2 (где t означает 1 или 2) или -O-P(=O)(ORa)2, где каждый из заместителей Ra независимо представляет собой водород, алкил, галогеналкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероарилалкил, и каждый из этих фрагментов может быть необязательно замещен, как определено в тексте заявки.
Термин «сложный эфир» относится к радикалу формулы -COOR, где фрагмент R выбран из алкила, алкенила, алкинила, галогеналкила, гетероалкила (связанного через атом углерода цепи), циклоалкила, циклоалкилалкила, арила, аралкила, гетероциклоалкила (связанного через атом углерода цикла), гетероциклоалкилалкила, гетероарила (связанного через атом углерода цикла) или гетероарилалкила. Можно этерифицировать любую амино, гидрокси или карбоксильную группу соединений по настоящему изобретению. Методики и конкретные группы, подходящие для получения таких сложных эфиров известны специалисту в данной области техники и их можно легко найти в справочных руководствах, например, в книге Greene and Wuts, Protective Groups in Organic Synthesis, 3rd Ed., John Wiley & Sons, New York, NY, 1999, которая включена в настоящую заявку посредством ссылки в полном объеме. Если в описании не указано иное, сложноэфирная группа может быть необязательно замещена одним или несколькими заместителями, которые независимо включают: ацил, алкил, алкенил, алкинил, алкокси, алкиларил, циклоалкил, аралкил, арил, арилокси, амино, амидо, амидино, имино, азид, карбонат, карбамат, карбонил, гетероалкил, гетероарил, гетероарилалкил, гетероциклоалкил, гидрокси, циано, галоген, галогеналкокси, галогеналкил, сложный эфир, простой эфир, меркапто, тио, алкилтио, арилтио, тиокарбонил, нитро, оксо, фосфат, фосфонат, фосфинат, силил, сульфинил, сульфонил, сульфонамидил, сульфоксил, сульфонат, мочевину, фрагменты -Si(Ra)3-, -ORa, -SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -OC(O)N(Ra)2, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, -N(Ra)C(O)N(Ra)2, -N(Ra)C(NRa)N(Ra)2, -N(Ra)S(O)tRa (где t означает 1 или 2), -S(O)tORa (где t означает 1 или 2), -S(O)tN(Ra)2 (где t означает 1 или 2) или -O-P(=O)(ORa)2, где каждый из заместителей Ra независимо представляет собой водород, алкил, галогеналкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероарилалкил, и каждый из этих фрагментов может быть необязательно замещен, как определено в тексте заявки.
Термин «простой эфир» относится к -Rb-O-Rb-радикалу, где каждая из групп Rb независимо выбрана из водорода, алкила, алкенила, алкинила, галогеналкила, гетероалкила (связанного через атом углерода цепи), циклоалкила, циклоалкилалкила, арила, аралкила, гетероциклоалкила (связанного через атом углерода цикла), гетероциклоалкилалкила, гетероарила (связанного через атом углерода цикла) или гетероарилалкила, если иное не указано в описании, причем каждый из этих фрагментов сам может быть необязательно замещен, как указано в описании.
Термины «гало», «галогенид» или, в качестве альтернативы, «галоген» означает фтор, хлор, бром или йод. Термины «галогеналкил», «галогеналкенил», «галогеналкинил» и «галогеналкокси» относятся к алкилу, алкенилу, алкинилу и алкокси, которые замещены одним или несколькими атомами галогена, или их комбинациями. Например, термины «фторалкил» и «фторалкокси» включают, соответственно, галогеналкил и галогеналкокси, в которых галоген представляет собой фтор, например, но не ограничиваясь указанным, трифторметил, дифторметил, 2,2,2-трифторэтил, 1-фторметил-2-фторэтил и т.п. Каждая из алкильной, алкенильной, алкинильной и алкокси групп соответствует данному в тексте определению и может быть дополнительно замещена, как описано в настоящей заявке.
Термины «гетероалкил», «гетероалкенил» и «гетероалкинил» включают соответственно алкильные, алкенильные и алкинильные радикалы, которые включают один или несколько атомов скелета цепи, выбранных из атомов, отличных от углерода, например, кислорода, азота, серы, фосфора, или их комбинацию. Могут быть указаны численные диапазоны, например, C1-C4 гетероалкил, которые относятся к длине цепи в целом, которая в данном примере имеет длину 4 атома. Например, радикал -CH2OCH2CH3 именуется “C4” гетероалкилом, который включает длину цепи атома с учетом центрального гетероатома. Соединение с остальной частью молекулы может осуществляться либо через гетероатом, либо через атом углерода гетероалкильной цепи. Например, фраза «N-содержащий гетероалкильный фрагмент» относится к группе, в которой, по меньшей мере, один из скелетных атомов является атомом азота. Один или несколько гетероатомов в гетероалкильном радикале могут быть необязательно окислены. Один или несколько атомов азота, если они присутствуют в радикале, также могут быть необязательно кватернизованы. Например, гетероалкил включает также скелетные цепи, замещенные одним или несколькими заместителями оксида азота (-O-). Типовые гетероалкильные группы включают, не ограничиваясь этим, простые эфиры, например, метоксиэтанил (-CH2CH2OCH3), этоксиметанил (-CH2OCH2CH3), (метоксиметокси)этанил (-CH2CH2OCH2OCH3), (метоксиметокси)метанил (-CH2OCH2OCH3) и (метоксиэтокси)метанил (-CH2OCH2CH2OCH3) и т.п.; амины, например, -CH2CH2NHCH3, -CH2CH2N(CH3)2, -CH2NHCH2CH3, -CH2N(CH2CH3)(CH3) и т.п. Каждая из гетероалкильной, гетероалкенильной и гетероалкинильной групп могут быть необязательно замещены одним или несколькими заместителями, которые независимо включают: ацил, алкил, алкенил, алкинил, алкокси, алкиларил, циклоалкил, аралкил, арил, арилокси, амино, амидо, амидино, имино, азид, карбонат, карбамат, карбонил, гетероалкил, гетероарил, гетероарилалкил, гетероциклоалкил, гидрокси, циано, галоген, галогеналкокси, галогеналкил, сложный эфир, простой эфир, меркапто, тио, алкилтио, арилтио, тиокарбонил, нитро, оксо, фосфат, фосфонат, фосфинат, силил, сульфинил, сульфонил, сульфонамидил, сульфоксил, сульфонат, мочевину, фрагменты -Si(Ra)3-, -ORa, -SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -OC(O)N(Ra)2, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, -N(Ra)C(O)N(Ra)2, -N(Ra)C(NRa)N(Ra)2, -N(Ra)S(O)tRa (где t означает 1 или 2), -S(O)tORa (где t означает 1 или 2), -S(O)tN(Ra)2 (где t означает 1 или 2) или -O-P(=O)(ORa)2, где каждый из заместителей Ra независимо представляет собой водород, алкил, галогеналкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероарилалкил, и каждый из этих фрагментов может быть необязательно замещен, как определено в тексте заявки.
«Гетероарил» или, в качестве альтернативы, «гетероароматический фрагмент» относится к радикалу, представляющему собой 5-18-членную моноциклическую или полициклическую (например, бициклическую или трициклическую) ароматическую систему (например, содержащую 6, 10 или 14 ᴨ (пи) электронов, которые делокализованы по циклической структуре), содержащую циклические атомы углерода и 1-6 циклических гетероатомов, включенных в циклическую ароматическую систему, где каждый гетероатом независимо выбран из азота, кислорода, фосфора и серы («5-18-членный гетероарил»). Гетероарильные полициклические системы могут включать один или несколько гетероатомов в одном или в обоих циклах. В любом месте текста настоящей заявки, численный диапазон, например, «от 5 до 18», относится к каждому целому числу внутри данного диапазона; например, фраза «от 5 до 18 циклических атомов» означает, что гетероарильная группа может состоять из 5 циклических атомов, 6 циклических атомов и т.д. вплоть до 18 циклических атомов включительно. Например, двухвалентные радикалы, полученные из одновалентных гетероарильных радикалов, наименования которых заканчиваются на «ил», путем удаления одного атома водорода от атома углерода с незанятой валентностью, именуют добавлением суффикса «-иден» к наименованию соответствующего одновалентного радикала, например, пиридильную группу с двумя точками присоединения остальных фрагментов молекулы именуют пиридилиденом.
Например, термины N-содержащий «гетероароматический» или «гетероарильный» фрагмент относятся к ароматической группе, в которой, по меньшей мере, один из скелетных атомов цикла является атомом азота. Один или несколько гетероатомов в гетероарильном радикале могут быть необязательно окислены. Один или несколько атомов азота, если они присутствуют в данном фрагменте, также могут быть необязательно кватернизованы. Гетероарил также включает циклические системы, замещенные одним или несколькими фрагментами оксида азота (-O-), например, пиридинил N-оксиды. Гетероарил прикреплен к остальной части молекулы через любой атом цикла (циклов).
Термин «гетероарил» охватывает также циклические системы, в которых гетероарильный цикл, который определен выше, конденсирован с одним или несколькими арильными группами, где точка присоединения гетероарила к остальной части молекулы находится либо на арильном, либо на гетероарильном цикле, или в которых гетероарильный цикл, который определен выше, конденсирован с одним или несколькими циклоалкильными или гетероциклическими группами, где точка присоединения гетероарила к остальной части молекулы находится на гетероарильном цикле. Для полициклических гетероарильных групп, в которых один цикл не содержит гетероатома (например, индолила, хинолинила, карбазолила и т.п.), точка прикрепления к остальной части молекулы может находиться на любом цикле, т.е. либо на цикле, включающем гетероатом (например, 2-индолил), либо на цикле, который не содержит гетероатом (например, 5-индолил). В некоторых вариантах осуществления, гетероарильная группа является 5-10-членной ароматической циклической системой, содержащей циклические атомы углерода и 1-4 циклических гетероатома, входящих в ароматическую циклическую систему, где каждый гетероатом независимо выбран из азота, кислорода, фосфора и серы («5-10-членный гетероарил»). В некоторых вариантах осуществления, гетероарильная группа является 5-8-членной ароматической циклической системой, содержащей циклические атомы углерода и 1-4 циклических гетероатома, входящих в ароматическую циклическую систему, где каждый гетероатом независимо выбран из азота, кислорода, фосфора и серы («5-8-членный гетероарил»). В некоторых вариантах осуществления, гетероарильная группа является 5-6-членной ароматической циклической системой, содержащей циклические атомы углерода и 1-4 циклических гетероатома, входящих в ароматическую циклическую систему, где каждый гетероатом независимо выбран из азота, кислорода, фосфора и серы («5-6-членный гетероарил»). В некоторых вариантах осуществления, 5-6-членный гетероарил содержит 1-3 циклических гетероатома, выбранных из азота, кислорода, фосфора и серы. В некоторых вариантах осуществления, 5-6-членный гетероарил содержит 1-2 циклических гетероатома, выбранных из азота, кислорода, фосфора и серы. В некоторых вариантах осуществления, 5-6-членный гетероарил содержит 1 циклический гетероатом, выбранный из азота, кислорода, фосфора и серы.
Примеры гетероарилов включают, не ограничиваясь этим, азепинил, акридинил, бензимидазолил, бензиндолил, 1,3-бензодиоксолил, бензофуранил, бензооксазолил, бензо[d]тиазолил, бензотиадиазолил, бензо[b][1,4]диоксепинил, бензо[b][1,4]оксазинил, 1,4-бензодиоксанил, бензонафтофуранил, бензоксазолил, бензодиоксолил, бензодиоксинил, бензоксазолил, бензопиранил, бензопиранонил, бензофуранил, бензофуранонил, бензофуразанил, бензотиазолил, бензотиенил (бензотиофенил), бензотиено[3,2-d]пиримидинил, бензотриазолил, бензо[4,6]имидазо[1,2-a]пиридинил, карбазолил, циннолинил, циклопента[d]пиримидинил, 6,7-дигидро-5H-циклопента[4,5]тиено[2,3-d]пиримидинил, 5,6-дигидробензо[h]хиназолинил, 5,6-дигидробензо[h]циннолинил, 6,7-дигидро-5H-бензо[6,7]циклогепта[1,2-c]пиридазинил, дибензофуранил, дибензотиофенил, фуранил, фуразанил, фуранонил, фуро[3,2-c]пиридинил, 5,6,7,8,9,10-гексагидроциклоокта[d]пиримидинил, 5,6,7,8,9,10-гексагидроциклоокта[d]пиридазинил, 5,6,7,8,9,10-гексагидроциклоокта[d]пиридинил, изотиазолил, имидазолил, индазолил, индолил, индазолил, изоиндолил, индолинил, изоиндолинил, изохинолинил, индолизинил, изоксазолил, 5,8-метано-5,6,7,8-тетрагидрохиназолинил, нафтиридинил, 1,6-нафтиридинонил, оксадиазолил, 2-оксоазепинил, оксазолил, оксиранил, 5,6,6a,7,8,9,10,10a-октагидробензо[h]хиназолинил, 1-фенил-1H-пирролил, феназинил, фенотиазинил, феноксазинил, фталазинил, птеридинил, пуринил, пиранил, пирролил, пиразолил, пиразоло[3,4-d]пиримидинил, пиридинил, пиридо[3,2-d]пиримидинил, пиридо[3,4-d]пиримидинил, пиразинил, пиримидинил, пиридазинил, пирролил, хиназолинил, хиноксалинил, хинолинил, изохинолинил, тетрагидрохинолинил, 5,6,7,8-тетрагидрохиназолинил, 5,6,7,8-тетрагидробензо[4,5]тиено[2,3-d]пиримидинил, 6,7,8,9-тетрагидро-5H-циклогепта[4,5]тиено[2,3-d]пиримидинил, 5,6,7,8-тетрагидропиридо[4,5-c]пиридазинил, тиазолил, тиадиазолил, тиапиранил, триазолил, тетразолил, триазинил, тиено[2,3-d]пиримидинил, тиено[3,2-d]пиримидинил, тиено[2,3-c]пиридинил и тиофенил (т.е. тиенил). Если в описании не указано иное, гетероарильный фрагмент необязательно замещен одним или несколькими заместителями, которые независимо включают: ацил, алкил, алкенил, алкинил, алкокси, алкиларил, циклоалкил, аралкил, арил, арилокси, амино, амидо, амидино, имино, азид, карбонат, карбамат, карбонил, гетероалкил, гетероарил, гетероарилалкил, гетероциклоалкил, гидрокси, циано, галоген, галогеналкокси, галогеналкил, сложный эфир, простой эфир, меркапто, тио, алкилтио, арилтио, тиокарбонил, нитро, оксо, фосфат, фосфонат, фосфинат, силил, сульфинил, сульфонил, сульфонамидил, сульфоксил, сульфонат, мочевину, фрагменты -Si(Ra)3-, -ORa, -SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -OC(O)N(Ra)2, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, -N(Ra)C(O)N(Ra)2, -N(Ra)C(NRa)N(Ra)2, -N(Ra)S(O)tRa (где t означает 1 или 2), -S(O)tORa (где t означает 1 или 2), -S(O)tN(Ra)2 (где t означает 1 или 2) или -O-P(=O)(ORa)2, где каждый из заместителей Ra независимо представляет собой водород, алкил, галогеналкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероарилалкил, и каждый из этих фрагментов может быть необязательно замещен, как определено в тексте заявки.
Каждый из терминов «гетероциклил», «гетероциклоалкил» или «гетерокарбоциклил» относится к любому 3-18-членному неароматическому радикалу моноциклического или полициклического фрагмента, включающему, по меньшей мере, один гетероатом, выбранный из азота, кислорода, фосфора и серы. Гетероциклильная группа может быть моноциклической, бициклической, трициклической или тетрациклической системой, где эта полициклическая система может быть конденсированной, мостиковой или спиро циклической системой. Гетероциклильные полициклические системы могут включать один или несколько гетероатомов в одном или нескольких циклах. Гетероциклильная группа может быть насыщенной или частично ненасыщенной. Частично ненасыщенные гетероциклоалкильные группы могут именоваться «гетероциклоалкенилами», если гетероциклил содержит, по меньшей мере, одну двойную связь, или «гетероциклоалкинилами», если гетероциклил содержит, по меньшей мере, одну тройную связь. Во всех случаях появления в тексте заявки, численный диапазон, например, «от 5 до 18» относится к каждому целому числу в данном диапазоне; например, фраза «от 5 до 18 циклических атомов» означает, что гетероциклильная группа может состоять из 5 циклических атомов, 6 циклических атомов и т.д., вплоть до 18 циклических атомов включительно. Например, названия двухвалентных радикалов, полученных из одновалентных гетероциклильных радикалов, наименования которых заканчиваются на «ил», путем удаления одного атома водорода от атома углерода с незанятой валентностью, получают добавлением суффикса «-иден» к наименованию соответствующего одновалентного радикала, например, пиперидиновую группу с двумя точками присоединения остальных фрагментов молекулы именуют пиперидилиденом.
Термин «N-содержащий гетероциклильный фрагмент» относится к неароматической группе, в которой, по меньшей мере, один из циклических атомов является атомом азота. Гетероатом (гетероатомы) в гетероциклильном радикале могут быть необязательно окислены. Один или несколько атомов азота, если они присутствуют в данном фрагменте, также могут быть необязательно кватернизованы. Гетероциклил также включает циклические системы, замещенные одним или несколькими фрагментами оксида азота (-O-), например, пиперидинил N-оксиды. Гетероциклил прикреплен к остальной части молекулы через любой атом любого из циклов.
Термин «гетероциклил» охватывает также циклические системы, в которых гетероциклильный фрагмент, который определен выше, конденсирован с одним или несколькими карбоциклильными группами, где точка присоединения остальной части молекулы находится либо на карбоциклильном фрагменте, либо на гетероциклильном фрагменте, или циклические системы, в которых гетероциклильный фрагмент, который определен выше, конденсирован с одним или несколькими арильными или гетероарильными группами, где точка присоединения к остальной части молекулы находится на гетероциклильном фрагменте. В некоторых вариантах осуществления, гетероциклильная группа является 3-10-членной неароматической циклической системой, содержащей циклические атомы углерода и 1-4 циклических гетероатома, где каждый гетероатом независимо выбран из азота, кислорода, фосфора и серы («3-10-членный гетероциклил»). В некоторых вариантах осуществления, гетероциклильная группа является 5-8-членной неароматической циклической системой, содержащей циклические атомы углерода и 1-4 циклических гетероатома, где каждый гетероатом независимо выбран из азота, кислорода, фосфора и серы («5-8-членный гетероциклил»). В некоторых вариантах осуществления, гетероциклильная группа является 5-6-членной неароматической циклической системой, содержащей циклические атомы углерода и 1-4 циклических гетероатома, где каждый гетероатом независимо выбран из азота, кислорода, фосфора и серы («5-6-членный гетероциклил»). В некоторых вариантах осуществления, 5-6-членный гетероциклил содержит 1-3 циклических гетероатома, выбранных из азота, кислорода, фосфора и серы. В некоторых вариантах осуществления, 5-6-членный гетероциклил содержит 1-2 циклических гетероатома, выбранных из азота, кислорода, фосфора и серы. В некоторых вариантах осуществления, 5-6-членный гетероциклил содержит 1 циклический гетероатом, выбранный из азота, кислорода, фосфора и серы.
Примеры 3-членных гетероциклилов, содержащих 1 гетероатом, включают, не ограничиваясь перечисленными, азиридинил, оксиранил, тиоренил. Примеры 4-членных гетероциклилов, содержащих 1 гетероатом, включают, не ограничиваясь перечисленными, азетидинил, оксетанил и тиетанил. Примеры 5-членных гетероциклилов, содержащих 1 гетероатом, включают, не ограничиваясь перечисленными, тетрагидрофуранил, дигидрофуранил, тетрагидротиофенил, дигидротиофенил, пирролидинил, дигидропирролил и пирролил-2,5-дион. Примеры 5-членных гетероциклилов, содержащих 2 гетероатома, включают, не ограничиваясь перечисленными, диоксоланил, оксатиоланил и дитиоланил. Примеры 5-членных гетероциклилов, содержащих 3 гетероатома, включают, не ограничиваясь перечисленными, триазолинил, оксадиазолинил и тиадиазолинил. Примеры 6-членных гетероциклильных групп, содержащих 1 гетероатом, включают, не ограничиваясь перечисленными, пиперидинил, тетрагидропиранил, дигидропиридинил и тианил. Примеры 6-членных гетероциклильных групп, содержащих 2 гетероатома, включают, не ограничиваясь перечисленными, пиперазинил, морфолинил, дитианил, диоксанил и триазинил. Примеры 7-членных гетероциклильных групп, содержащих 1 гетероатом, включают, не ограничиваясь перечисленными, азепанил, оксепанил и тиепанил. Примеры 8-членных гетероциклильных групп, содержащих 1 гетероатом, включают, не ограничиваясь перечисленными, азоканил, оксеканил и тиоканил. Примеры бициклических гетероциклильных групп включают, не ограничиваясь перечисленными, индолинил, изоиндолинил, дигидробензофуранил, дигидробензотиенил, тетрагидробензотиенил, тетрагидробензофуранил, тетрагидроиндолил, тетрагидрохинолинил, тетрагидроизохинолинил, декагидрохинолинил, декагидроизохинолинил, октагидрохроменил, октагидроизохроменил, декагидронафтиридинил, декагидро-1,8-нафтиридинил, октагидропирроло[3,2-b]пиррол, индолинил, фталимидил, нафталимидил, хроманил, хроменил, 1H-бензо[e][1,4]диазепинил, 1,4,5,7-тетрагидропирано[3,4-b]пирролил, 5,6-дигидро-4H-фуро[3,2-b]пирролил, 6,7-дигидро-5H-фуро[3,2-b]пиранил, 5,7-дигидро-4H-тиено[2,3-c]пиранил, 2,3-дигидро-1H-пирроло[2,3-b]пиридинил, 2,3-дигидрофуро[2,3-b]пиридинил, 4,5,6,7-тетрагидро-1H-пирроло[2,3-b]пиридинил, 4,5,6,7-тетра-гидрофуро[3,2-c]пиридинил, 4,5,6,7-тетрагидротиено[3,2-b]пиридинил, 1,2,3,4-тетрагидро-1,6-нафтиридинил и т.п.
Если не указано иное, гетероциклильные фрагменты необязательно замещены одним или несколькими заместителями, которые независимо включают: ацил, алкил, алкенил, алкинил, алкокси, алкиларил, циклоалкил, аралкил, арил, арилокси, амино, амидо, амидино, имино, азид, карбонат, карбамат, карбонил, гетероалкил, гетероарил, гетероарилалкил, гетероциклоалкил, гидрокси, циано, галоген, галогеналкокси, галогеналкил, сложный эфир, простой эфир, меркапто, тио, алкилтио, арилтио, тиокарбонил, нитро, оксо, фосфат, фосфонат, фосфинат, силил, сульфинил, сульфонил, сульфонамидил, сульфоксил, сульфонат, мочевину, фрагменты -Si(Ra)3-, -ORa, -SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -OC(O)N(Ra)2, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, -N(Ra)C(O)N(Ra)2, -N(Ra)C(NRa)N(Ra)2, -N(Ra)S(O)tRa (где t означает 1 или 2), -S(O)tORa (где t означает 1 или 2), -S(O)tN(Ra)2 (где t означает 1 или 2) или -O-P(=O)(ORa)2, где каждый из заместителей Ra независимо представляет собой водород, алкил, галогеналкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероарилалкил, и каждый из этих фрагментов может быть необязательно замещен, как определено в тексте заявки.
Термин «нитро» относится к радикалу -NO2.
Термин «фосфат» относится к радикалу -O-P(=O)(ORb)2, где каждая из групп Rb независимо выбрана из водорода, алкила, алкенила, алкинила, галогеналкила, гетероалкила (связанного через атом углерода цепи), циклоалкила, циклоалкилалкила, арила, аралкила, гетероциклоалкила (связанного через атом углерода цикла), гетероциклоалкилалкила, гетероарила (связанного через атом углерода цикла) или гетероарилалкила, если иное не указано в описании, причем каждый из этих фрагментов сам может быть необязательно замещен, как указано в описании. В некоторых вариантах осуществления, если Rb представляет собой атом водорода и в зависимости от значения pH, этот атом водорода может быть замещен противоионом с соответствующим зарядом.
Термин «имино» относится к радикалу -(C=N)-Rb, где группа Rb выбрана из водорода, алкила, алкенила, алкинила, галогеналкила, гетероалкила (связанного через атом углерода цепи), циклоалкила, циклоалкилалкила, арила, аралкила, гетероциклоалкила (связанного через атом углерода цикла), гетероциклоалкилалкила, гетероарила (связанного через атом углерода цикла) или гетероарилалкила, если иное не указано в описании, причем каждый из этих фрагментов сам может быть необязательно замещен, как указано в описании.
Термин «фосфонат» относится к радикалу -O-P(=O)(Rb)(ORb), где каждая из групп Rb независимо выбрана из водорода, алкила, алкенила, алкинила, галогеналкила, гетероалкила (связанного через атом углерода цепи), циклоалкила, циклоалкилалкила, арила, аралкила, гетероциклоалкила (связанного через атом углерода цикла), гетероциклоалкилалкила, гетероарила (связанного через атом углерода цикла) или гетероарилалкила, если иное не указано в описании, причем каждый из этих фрагментов сам может быть необязательно замещен, как указано в описании. В некоторых вариантах осуществления, если Rb представляет собой атом водорода и в зависимости от значения pH, этот атом водорода может быть замещен противоионом с соответствующим зарядом.
Термин «фосфинат» относится к радикалу -P(=O)(Rb)(ORb), где каждая из групп Rb независимо выбрана из водорода, алкила, алкенила, алкинила, галогеналкила, гетероалкила (связанного через атом углерода цепи), циклоалкила, циклоалкилалкила, арила, аралкила, гетероциклоалкила (связанного через атом углерода цикла), гетероциклоалкилалкила, гетероарила (связанного через атом углерода цикла) или гетероарилалкила, если иное не указано в описании, причем каждый из этих фрагментов сам может быть необязательно замещен, как указано в описании. В некоторых вариантах осуществления, если Rb представляет собой атом водорода и в зависимости от значения pH, этот атом водорода может быть замещен противоионом с соответствующим зарядом.
В настоящем описании термины «замещенный» или «замещение» означают, что, по меньшей мере, один атом водорода, присутствующий у атома той или иной группы (например, у атома углерода или азота) заменен допустимым заместителем, например, заместителем, который в результате замещения атома водорода приводит к стабильному соединению, например, соединению, которое не претерпевает самопроизвольного превращения, например, путем перегруппировки, циклизации, элиминирования или другой реакции. Если не указано иное, «замещенная» группа может иметь заместитель по одному или нескольким подходящим положениям в группе, и если в любой указанной структуре замещено более, чем одно положение, заместители в различных положениях могут быть либо одинаковыми, либо различными. Заместители включают одну или несколько групп, индивидуально и независимо выбранных из ацила, алкила, алкенила, алкинила, алкокси, алкиларила, циклоалкила, аралкила, арила, арилокси, амино, амидо, азида, карбоната, карбонила, гетероалкила, гетероарила, гетероарилалкила, гетероциклоалкила, гидрокси, циано, галогена, галогеналкокси, галогеналкила, сложного эфира, меркапто, тио, алкилтио, арилтио, тиокарбонила, нитро, оксо, фосфата, фосфоната, фосфината, силила, сульфинила, сульфонила, сульфонамидила, сульфоксила, сульфоната, мочевины, фрагментов -Si(Ra)3-, -ORa, -SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -OC(O)N(Ra)2, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, -N(Ra)C(O)N(Ra)2, -N(Ra)C(NRa)N(Ra)2, -N(Ra)S(O)tRa (где t означает 1 или 2), -S(O)tORa (где t означает 1 или 2), -S(O)tN(Ra)2 (где t означает 1 или 2) или -O-P(=O)(ORa)2, где каждый из заместителей Ra независимо представляет собой водород, алкил, галогеналкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероарилалкил, и каждый из этих фрагментов может быть необязательно замещен, как определено в тексте заявки. Например, замещенный циклоалкил может нести замещающие атомы галогена у одного или нескольких циклических атомов углерода и т.п. Защитные группы, которые могут образовывать защищенные производные указанных выше заместителей, известны специалисту в данной области техники и их можно найти в соответствующих руководствах, например, в книге Greene and Wuts, смотрите выше.
Термин «силил» относится к радикалу -Si(Rb)3, в котором каждая из групп Rb независимо выбрана из алкила, алкенила, алкинила, галогеналкила, гетероалкила (связанного через атом углерода цепи), циклоалкила, циклоалкилалкила, арила, аралкила, гетероциклоалкила (связанного через атом углерода цикла), гетероциклоалкилалкила, гетероарила (связанного через атом углерода цикла) или гетероарилалкила, если иное не указано в описании, причем каждый из этих фрагментов сам может быть необязательно замещен, как указано в описании.
Каждый из терминов «сульфанил», «сульфид» и «тио» относится к радикалу -S-Rb, где группа Rb выбрана из алкила, алкенила, алкинила, галогеналкила, гетероалкила (связанного через атом углерода цепи), циклоалкила, циклоалкилалкила, арила, аралкила, гетероциклоалкила (связанного через атом углерода цикла), гетероциклоалкилалкила, гетероарила (связанного через атом углерода цикла) или гетероарилалкила, если иное не указано в описании, причем каждый из этих фрагментов сам может быть необязательно замещен, как указано в описании. Например, термин «алкилтио» относится к радикалу «алкил-S-», и термин «арилтио» относится к радикалу «арил-S-», каждый из которых связан с остальной частью молекулы через атом S. Каждый из терминов «сульфид», «тиол», «меркапто» и «меркаптан» может также относиться к группе -RbSH.
Термины «сульфинил» или «сульфоксид» относятся к радикалу -S(O)-Rb, где для «сульфинила» Rb означает H, и для «сульфоксида» группа Rb выбрана из алкила, алкенила, алкинила, галогеналкила, гетероалкила (связанного через атом углерода цепи), циклоалкила, циклоалкилалкила, арила, аралкила, гетероциклоалкила (связанного через атом углерода цикла), гетероциклоалкилалкила, гетероарила (связанного через атом углерода цикла) или гетероарилалкила, если иное не указано в описании, причем каждый из этих фрагментов сам может быть необязательно замещен, как указано в описании.
Термины «сульфонил» или «сульфон» относятся к радикалу -S(O2)-Rb, где группа Rb выбрана из водорода, алкила, алкенила, алкинила, галогеналкила, гетероалкила (связанного через атом углерода цепи), циклоалкила, циклоалкилалкила, арила, аралкила, гетероциклоалкила (связанного через атом углерода цикла), гетероциклоалкилалкила, гетероарила (связанного через атом углерода цикла) или гетероарилалкила, если иное не указано в описании, причем каждый из этих фрагментов сам может быть необязательно замещен, как указано в описании.
Термины «сульфонамидил» или «сульфонамидо» относятся к следующим радикалам: -S(=O)2-N(Rb)2, -N(Rb)-S(=O)2-Rb, -S(=O)2-N(Rb)- или - N(Rb)-S(=O)2-, в которых каждая из групп Rb независимо выбрана из водорода, алкила, алкенила, алкинила, галогеналкила, гетероалкила (связанного через атом углерода цепи), циклоалкила, циклоалкилалкила, арила, аралкила, гетероциклоалкила (связанного через атом углерода цикла), гетероциклоалкилалкила, гетероарила (связанного через атом углерода цикла) или гетероарилалкила, если иное не указано в описании, причем каждый из этих фрагментов сам может быть необязательно замещен, как указано в описании. Группы Rb во фрагменте -S(=O)2-N(Rb)2 совместно с атомом азота, к которому они присоединены, могут образовывать 4-, 5-, 6- или 7-членный гетероцикл. В некоторых вариантах осуществления, этот термин означает C1-C4 сульфонамидо, где каждая группа Rb во фрагменте сульфонамидо содержит в общей сложности 1 атом углерода, 2 атома углерода, 3 атома углерода или 4 атома углерода.
Термины «сульфоксил» или «сульфоксид» относятся к радикалу -S(=O)2OH.
Термин «сульфонат» относится к радикалу -S(=O)2-ORb, где группа Rb выбрана из алкила, алкенила, алкинила, галогеналкила, гетероалкила (связанного через атом углерода цепи), циклоалкила, циклоалкилалкила, арила, аралкила, гетероциклоалкила (связанного через атом углерода цикла), гетероциклоалкилалкила, гетероарила (связанного через атом углерода цикла) или гетероарилалкила, если иное не указано в описании, причем каждый из этих фрагментов сам может быть необязательно замещен, как указано в описании.
Термин «тиокарбонил» относится к радикалу -(C=S)-.
Термин «мочевина» относится к радикалу -N(Rb)-(C=O)-N(Rb)2 или -N(Rb)-(C=O)-N(Rb)-, где каждая из групп Rb независимо выбрана из алкила, алкенила, алкинила, галогеналкила, гетероалкила (связанного через атом углерода цепи), циклоалкила, циклоалкилалкила, арила, аралкила, гетероциклоалкила (связанного через атом углерода цикла), гетероциклоалкилалкила, гетероарила (связанного через атом углерода цикла) или гетероарилалкила, если иное не указано в описании, причем каждый из этих фрагментов сам может быть необязательно замещен, как указано в описании.
Если замещающие группы показаны с помощью стандартных химических формул, записанных слева направо, они также охватывают химически идентичные заместители, которые могли бы получиться при написании этой структуры справа налево, например, обозначение -CH2O- эквивалентно обозначению -OCH2-.
II. СОЕДИНЕНИЯ, КОМПОЗИЦИИ И СПОСОБЫ ПОЛУЧЕНИЯ
В одном из вариантов осуществления, соединение относится к полиморфным формам соединения формулы (I):

которые в настоящем описании именуются формой A, формой B, формой C, формой D, формой E, формой F, формой G, формой H, формой I, формой J или аморфной формой соединения формулы (I), или к их солям, сольватам или гидратам; или к смеси двух или нескольких из перечисленных форм. В одном из вариантов осуществления, полиморфная форма соединения формулы (I) может являться кристаллической формой, частично кристаллической формой, аморфной формой или смесью кристаллической формы (форм) и/или аморфной формы (форм).
В одном из вариантов осуществления, полиморф по настоящему изобретению представляет собой форму A, форму B, форму C, форму D, форму E, форму F, форму G, форму H, форму I, форму J или аморфную форму соединения формулы (I) или их фармацевтически приемлемую соль, сольват или гидрат, или смесь двух или нескольких из перечисленных форм. В одном из вариантов осуществления, полиморф по настоящему изобретению представляет собой форму B, форму C, форму D, форму E, форму F, форму G, форму H, форму I, форму J или аморфную форму соединения формулы (I) или их фармацевтически приемлемую соль, сольват или гидрат. В одном из вариантов осуществления, полиморф по настоящему изобретению представляет собой форму A, форму B, форму C, форму D, форму E, форму F, форму G, форму H, форму I, форму J или аморфную форму соединения формулы (I) или их фармацевтически приемлемую соль, сольват или гидрат, или смесь двух или нескольких указанных форм, которые являются практически чистыми. В одном из вариантов осуществления, полиморф по настоящему изобретению является термически устойчивым. В одном из вариантов осуществления, полиморф по настоящему изобретению является устойчивым при долговременном хранении (например, не претерпевает существенных изменений полиморфной формы после примерно 1, примерно 2, примерно 3, примерно 4, примерно 5, примерно 6, примерно 7, примерно 8, примерно 9, примерно 10, примерно 11, примерно 12, примерно 18, примерно 24, примерно 30, примерно 36, примерно 42, примерно 48, примерно 54, примерно 60 или более, чем примерно 60 месяцев хранения). В одном из вариантов осуществления, после хранения в течение определенного периода времени, менее, чем примерно 20%, менее, чем примерно 10%, менее, чем примерно 9%, менее, чем примерно 8%, менее, чем примерно 7%, менее, чем примерно 6%, менее, чем примерно 5%, менее, чем примерно 4%, менее, чем примерно 3%, менее, чем примерно 2%, или менее, чем примерно 1% по массе полиморфа по настоящему изобретению превращается в другой полиморф (полиморфы).
В некоторых вариантах осуществления, полиморф по настоящему изобретению представляет собой полиморфную форму C соединения формулы (I). В некоторых вариантах осуществления, изобретение относится к твердой форме соединения формулы (I), включающей форму C соединения формулы (I). В некоторых вариантах осуществления, изобретение относится к твердой форме соединения формулы (I), включающей форму C соединения формулы (I), которая является практически чистой. В одном из вариантов осуществления, форма C может быть охарактеризована наличием пиков в картине дифракции рентгеновских лучей на порошке (XRPD) при углах 2Θ примерно 10,4, примерно 13,3 и примерно 24,3 градусов. В некоторых вариантах осуществления, форма C характеризуется термограммой дифференциальной сканирующей калориметрии (DSC), которая включает эндотермический пик примерно при 208°C. В некоторых вариантах осуществления, форму C можно охарактеризовать термогравиметрическим анализом, в котором наблюдаемая потеря массы составляет примерно 1,7% примерно при 80°C, и примерно 0,2% примерно при 190°C.
В одном из вариантов осуществления, полиморф, не являющийся формой C, представляет собой твердую форму соединения формулы (I) или его соли, сольвата или гидрата (например, кристаллическую форму, аморфную форму или смесь кристаллической формы (форм) и/или аморфной формы (форм)), которая не является полиморфной формой C соединения формулы (I). В одном из вариантов осуществления, полиморф, не являющийся формой C, представляет собой форму A, форму B, форму D, форму E, форму F, форму G, форму H, форму I, форму J или аморфную форму соединения формулы (I) или их соль, сольват или гидрат; или смесь двух или нескольких из перечисленных форм. В одном из вариантов осуществления, полиморф, не являющийся формой C, может включать не менее 50% по массе полиморфной формы A соединения формулы (I). В одном из вариантов осуществления, полиморф, не являющийся формой C (например, форму A или форму B), можно получить из композиции, включающей форму C.
В некоторых вариантах осуществления, соль соединения формулы (I) по настоящему изобретению представляет собой соль, полученную из L-винной кислоты, п-толуолсульфоновой кислоты, D-глюкуроновой кислоты, этан-1,2-дисульфоновой кислоты (EDSA), 2-нафталинсульфоновой кислоты (NSA), хлористоводородной кислоты (HCl), бромистоводородной кислоты (HBr), лимонной кислоты, нафталин-1,5-дисульфоновой кислоты (NDSA), DL-миндальной кислоты, фумаровой кислоты, серной кислоты, малеиновой кислоты, метансульфоновой кислоты (MSA), бензолсульфоновой кислоты (BSA), этансульфоновой кислоты (ESA), L-яблочной кислоты, фосфорной кислоты или аминоэтансульфоновой кислоты (таурина). В некоторых вариантах осуществления, соль соединения формулы (I) по настоящему изобретению представляет собой моно- или бис- кислотную соль. В некоторых вариантах осуществления, соль соединения формулы (I) по настоящему изобретению является солью HCl (например, моно-HCl солью или бис-HCl солью), или ее сольватом или гидратом. В некоторых вариантах осуществления, соль, сольват или гидрат соединения формулы (I) по настоящему изобретению являются кристаллическими веществами, частично кристаллическими веществами или аморфными веществами, или смесью одной или нескольких кристаллических форм и/или аморфных форм.
В одном из вариантов осуществления, изобретение относится к композиции, включающей соединение формулы (I):

или его фармацевтически приемлемую соль, сольват или гидрат, а также один или несколько фармацевтически приемлемых эксципиентов.
В одном из вариантов осуществления, эта композиция включает полиморфную форму C. В одном из вариантов осуществления, эта композиция включает смесь полиморфной формы C и, по меньшей мере, одной полиморфной формы, не являющейся формой C соединения формулы (I) или их фармацевтически приемлемые соли, сольваты или гидраты. Например, в некоторых вариантах осуществления, композиция может включать полиморфную форму C и полиморфную форму A. В других вариантах осуществления, композиция может включать полиморфную форму C и полиморфную форму B. В других вариантах осуществления, композиция может включать полиморфную форму C и полиморфную форму D. В других вариантах осуществления, композиция может включать полиморфную форму C и полиморфную форму E. В других вариантах осуществления, композиция может включать полиморфную форму C и полиморфную форму F. В других вариантах осуществления, композиция может включать полиморфную форму C и полиморфную форму G. В других вариантах осуществления, композиция может включать полиморфную форму C и полиморфную форму H. В других вариантах осуществления, композиция может включать полиморфную форму C и полиморфную форму I. В других вариантах осуществления, композиция может включать полиморфную форму C и полиморфную форму J. В других вариантах осуществления, композиция может включать полиморфную форму C и аморфную форму соединения формулы (I) или их фармацевтически приемлемые соли, сольваты или гидраты. В одном из вариантов осуществления, соотношение между полиморфной формой C и общим количеством полиморфных форм, не являющихся формами C, превышает примерно 1:1, превышает примерно 2:1, превышает примерно 3:1, превышает примерно 4:1, превышает примерно 5:1, превышает примерно 6:1, превышает примерно 7:1, превышает примерно 8:1 или превышает примерно 9:1. В одном из вариантов осуществления, композиция, включающая форму C, является фармацевтической композицией. В одном из вариантов осуществления, эта композиция, по меньшей мере, примерно на 98% по массе состоит из соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или гидрата.
В одном из вариантов осуществления, композиция включает смесь полиморфной формы A и, по меньшей мере, одной полиморфной формы, не являющейся формой A, соединения формулы (I) или их фармацевтически приемлемые соли, сольваты или гидраты. Например, в некоторых вариантах осуществления, композиция может включать полиморфную форму A и полиморфную форму B. В других вариантах осуществления, композиция может включать полиморфную форму A и полиморфную форму C. В других вариантах осуществления, композиция может включать полиморфную форму A и полиморфную форму D. В других вариантах осуществления, композиция может включать полиморфную форму A и полиморфную форму E. В других вариантах осуществления, композиция может включать полиморфную форму A и полиморфную форму F. В других вариантах осуществления, композиция может включать полиморфную форму A и полиморфную форму G. В других вариантах осуществления, композиция может включать полиморфную форму A и полиморфную форму H. В других вариантах осуществления, композиция может включать полиморфную форму A и полиморфную форму I. В других вариантах осуществления, композиция может включать полиморфную форму A и полиморфную форму J. В других вариантах осуществления, композиция может включать полиморфную форму A и аморфную форму соединения формулы (I) или их фармацевтически приемлемые соли, сольваты или гидраты. В одном из вариантов осуществления, соотношение между полиморфной формой A и общим количеством полиморфных форм, не являющихся формами A, превышает примерно 1:1, превышает примерно 2:1, превышает примерно 3:1, превышает примерно 4:1, превышает примерно 5:1, превышает примерно 6:1, превышает примерно 7:1, превышает примерно 8:1 или превышает примерно 9:1. В одном из вариантов осуществления, соотношение между полиморфной формой A и общим количеством полиморфных форм, не являющихся формами A, составляет менее чем, примерно 1:1, менее, чем примерно 2:1, менее, чем примерно 3:1, менее, чем примерно 4:1, менее, чем примерно 5:1, менее, чем примерно 6:1, менее, чем примерно 7:1, менее, чем примерно 8:1 или менее, чем примерно 9:1. В одном из вариантов осуществления, композиция, включающая форму A, является фармацевтической композицией. В одном из вариантов осуществления, эта композиция, по меньшей мере, примерно на 98% по массе состоит из соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или гидрата.
В некоторых вариантах осуществления, изобретение относится к композиции, включающей терапевтически эффективное количество соединения формулы (I):

или его фармацевтически приемлемой соли, сольвата или гидрата; а также один или несколько фармацевтически приемлемых эксципиентов.
В одном из вариантов осуществления, эта композиция включает полиморфную форму C соединения формулы (I). В одном из вариантов осуществления, эта композиция может дополнительно включать один или несколько полиморфов соединения формулы (I), не являющихся полиморфной формой C, или их фармацевтически приемлемых солей, сольватов или гидратов. В некоторых вариантах осуществления, соотношение между полиморфной формой C и общим количеством полиморфных форм, не являющихся формами C, превышает примерно 1:1, превышает примерно 2:1, превышает примерно 3:1, превышает примерно 4:1, превышает примерно 5:1, превышает примерно 6:1, превышает примерно 7:1, превышает примерно 8:1 или превышает примерно 9:1. В одном из вариантов осуществления, эта композиция включает полиморфную форму A соединения формулы (I). В одном из вариантов осуществления, эта композиция может дополнительно включать один или несколько полиморфов соединения формулы (I), не являющихся полиморфной формой A, или их фармацевтически приемлемых солей, сольватов или гидратов. В некоторых вариантах осуществления, соотношение между полиморфной формой A и общим количеством полиморфных форм, не являющихся формой A, превышает примерно 1:1, превышает примерно 2:1, превышает примерно 3:1, превышает примерно 4:1, превышает примерно 5:1, превышает примерно 6:1, превышает примерно 7:1, превышает примерно 8:1 или превышает примерно 9:1. В некоторых вариантах осуществления, соотношение между полиморфной формой A и общим количеством полиморфных форм, не являющихся формой A, составляет менее, чем, примерно 1:1, менее, чем примерно 2:1, менее, чем примерно 3:1, менее, чем примерно 4:1, менее, чем примерно 5:1, менее, чем примерно 6:1, менее, чем примерно 7:1, менее, чем примерно 8:1 или менее, чем примерно 9:1.
В одном из вариантов осуществления, полиморфные формы по настоящему изобретению применимы в производстве медикаментов и их можно получать посредством процесса кристаллизации с получением кристаллических и полукристаллических форм или при затвердевании с получением аморфных форм. В некоторых вариантах осуществления, кристаллизацию проводят либо путем получения соединения формулы (I) в реакционной смеси с последующим выделением полиморфа из реакционной смеси, либо путем растворения соединения формулы (I) в растворителе, необязательно при нагревании, с последующей кристаллизацией/затвердеванием продукта при охлаждении и/или при добавлении антирастворителя в течение определенного периода времени. Кристаллизацию или затвердевание можно проводить путем высушивания в регулируемых условиях до достижения определенного содержания воды в конечной полиморфной форме.
В одном из вариантов осуществления, изобретение относится к способам получения одного или нескольких полиморфов соединения формулы (I):
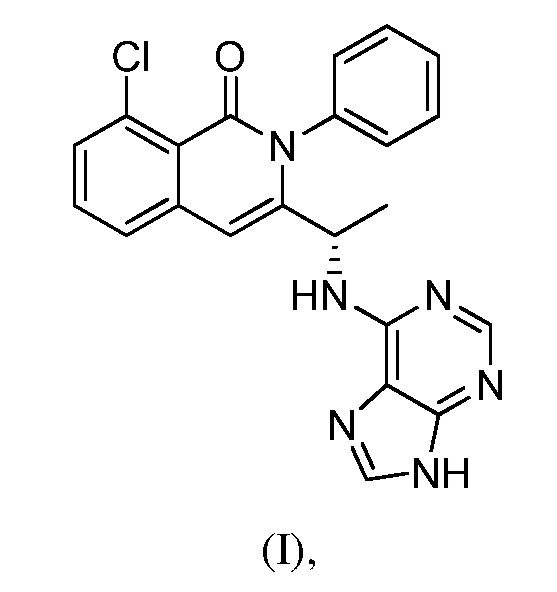
или их фармацевтически приемлемых солей, сольватов или гидратов. Полиморфы, полученные способом по настоящему изобретению, включают форму A, форму B, форму C, форму D, форму E, форму G, форму H, форму I, форму J или аморфную форму соединения формулы (I), или смеси двух или нескольких из перечисленных форм. В одном из вариантов осуществления, полиморф по настоящему изобретению является сольватом или гидратом соединения формулы (I). В одном из вариантов осуществления, полиморф по настоящему изобретению является моно- или бис- кислотно-аддитивной солью, например, моно-HCl солью или бис-HCl солью соединения формулы (I) или ее сольватом или гидратом.
В одном из вариантов осуществления, изобретение относится к способу получения соединения формулы (I):

или его фармацевтически приемлемой соли, сольвата или гидрата.
В одном из вариантов осуществления, этот способ включает любую одну, две, три, четыре, пять, шесть, семь или восемь или более из следующих стадий:



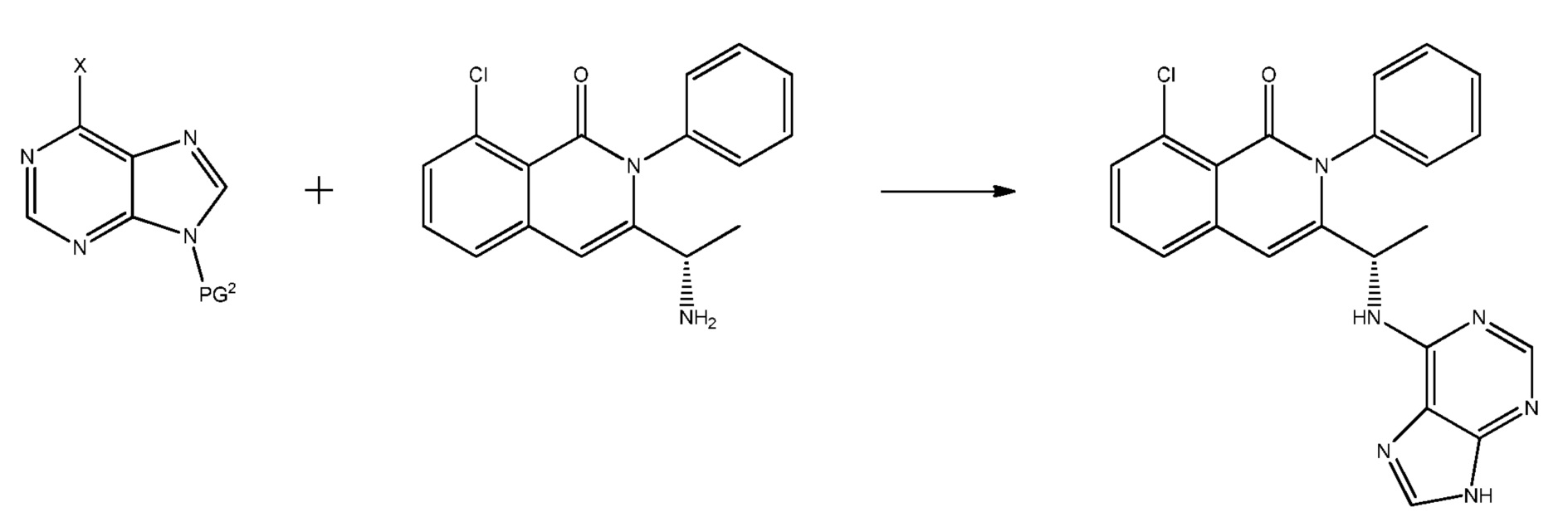
где:
фрагмент X выбран из фтора, хлора, брома, йода, -O-SO2-4-метилфенила и -O-SO2-метила;
фрагмент PG1 выбран из бензила, замещенного бензила, метоксикарбонила, этоксикарбонила, замещенного этоксикарбонила, 9-флуоренилоксикарбонила, замещенного 9-флуоренилоксикарбонила, 2,2,2-трихлорэтоксикарбонила, 2-триметилсилилэтоксикарбонила, (2-фенил-2-триметилсилил)этоксикарбонила, 2-фенилэтоксикарбонила, 1,1-диметил-2,2-дибромэтоксикарбонила, 1,1-диметил-2,2,2-трихлорэтоксикарбонила, т-бутоксикарбонила, 1-адамантилоксикарбонила, 2-адамантилоксикарбонила, триизопропилсилоксикарбонила, винилоксикарбонила, 1-изопропоксикарбонила, 8-хинолилоксикарбонила, 2,4-диметилпент-3-илоксикарбонила, бензилоксикарбонила и замещенного бензилоксикарбонила;
фрагмент PG2 выбран из метилсульфонила, замещенного метилсульфонила, бензолсульфонила, замещенного бензолсульфонила, бензилоксикарбонила, замещенного бензилоксикарбонила, 2,2,2-трихлорэтоксикарбонила, 2-триметилсилилэтоксикарбонила, т-бутоксикарбонила, 1-адамантилоксикарбонила, 2-адамантилоксикарбонила, алкила, замещенного алкила, т-бутилдиметилсилила, триизопропилсилила, аллила, бензила, замещенного бензила, гидроксиметила, метоксиметила, диэтоксиметила, (2-хлорэтокси)метила, т-бутоксиметила, т-бутилдиметилсилоксиметила, пивалоилоксиметила, бензилоксиметила, диметиламинометила, 2-тетрагидропиранила, замещенного алкоксиметила и замещенного арилоксиметила; и
где заместители выбраны из алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклила, арила, арилалкила, гетероарила, гетероарилалкила, алкокси, циклоалкокси, гетероциклилокси, арилокси, гетероарилокси, амидо, амино, ацила, ацилокси, алкоксикарбонила, сложного эфира, простого эфира, тио, сульфинила, сульфонила, сульфонамидо, галогена, циано, гидроксила, нитро, фосфата, мочевины, карбамата и карбоната.
В одном из вариантов осуществления, изобретение относится к способу получения соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или гидрата, включающему следующую стадию:
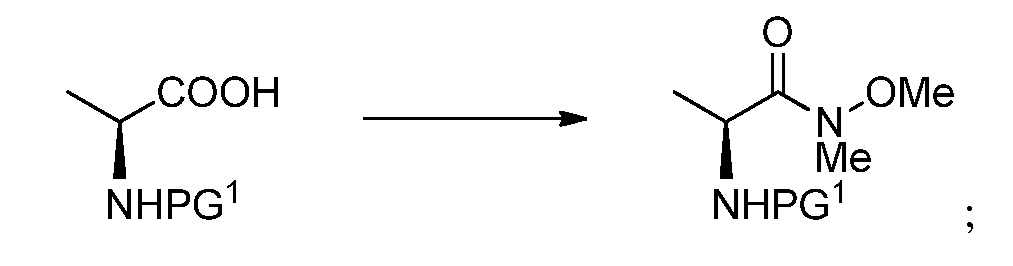
где:
фрагмент PG1 выбран из бензила, замещенного бензила, метоксикарбонила, этоксикарбонила, замещенного этоксикарбонила, 9-флуоренилоксикарбонила, замещенного 9-флуоренилоксикарбонила, 2,2,2-трихлорэтоксикарбонила, 2-триметилсилилэтоксикарбонила, (2-фенил-2-триметилсилил)этоксикарбонила, 2-фенилэтоксикарбонила, 1,1-диметил-2,2-дибромэтоксикарбонила, 1,1-диметил-2,2,2-трихлорэтоксикарбонила, т-бутоксикарбонила, 1-адамантилоксикарбонила, 2-адамантилоксикарбонила, триизопропилсилоксикарбонила, винилоксикарбонила, 1-изопропоксикарбонила, 8-хинолилоксикарбонила, 2,4-диметилпент-3-илоксикарбонила, бензилоксикарбонила и замещенного бензилоксикарбонила; и
где заместители выбраны из алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклила, арила, арилалкила, гетероарила, гетероарилалкила, алкокси, циклоалкокси, гетероциклилокси, арилокси, гетероарилокси, амидо, амино, ацила, ацилокси, алкоксикарбонила, сложного эфира, простого эфира, тио, сульфинила, сульфонила, сульфонамидо, галогена, циано, гидроксила, нитро, фосфата, мочевины, карбамата и карбоната.
В некоторых вариантах осуществления, PG1 представляет собой карбаматную защитную группу, например, алкоксикарбонил или арилоксикарбонил. В одном из вариантов осуществления, группа PG1 выбрана из т-бутоксикарбонила и бензилоксикарбонила. В одном из вариантов осуществления, PG1 представляет собой т-бутоксикарбонил.
В одном из вариантов осуществления, эта стадия включает введение во взаимодействие исходной аминокислоты с защищенной аминогруппой N,O-диметилгидроксиламином (например, в форме свободного основания или в форме соли, например, соли с HCl) в присутствии сшивающего реагента с получением амидного продукта. В некоторых вариантах осуществления, сшивающий реагент может включать, не ограничиваясь этим, EDCI, DCC, DIC, HATU, HBTU, HCTU, TBTU и PyBOP, необязательно в присутствии HOBt, HOAt и/или основания (например, основания амина, такого как Et3N). В одном из вариантов осуществления, реагент для сшивания амида представляет собой EDCI в присутствии HOBt.
В одном из вариантов осуществления, изобретение относится к способу получения соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или гидрата, включающему следующую стадию:

В одном из вариантов осуществления, эта стадия включает взаимодействие 2-хлор-6-метилбензойной кислоты, например, с тионилхлоридом или оксалилхлоридом, необязательно в присутствии каталитического количества ДМФА, с получением 2-хлор-6-метилбензоил хлорида.
В одном из вариантов осуществления, изобретение относится к способу получения соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или гидрата, включающему следующую стадию:
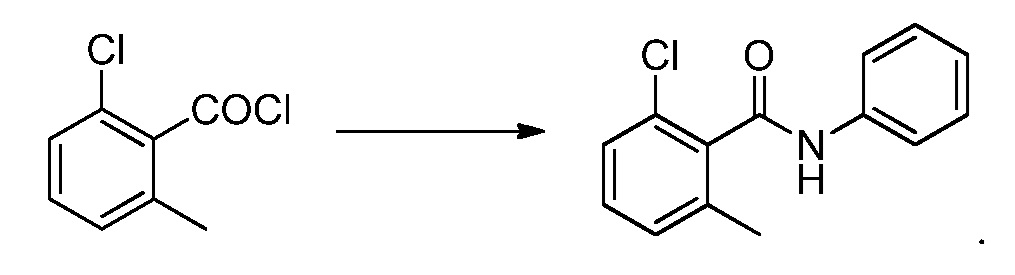
В одном из вариантов осуществления, эта стадия включает взаимодействие 2-хлор-6-метилбензоил хлорида с анилином с получением 2-хлор-6-метил-N-фенилбензамида. В одном из вариантов осуществления, эту стадию необязательно проводят в присутствии основания (например, основания амина, такого как Et3N).
В одном из вариантов осуществления, изобретение относится к способу получения соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или гидрата, включающему следующую стадию:
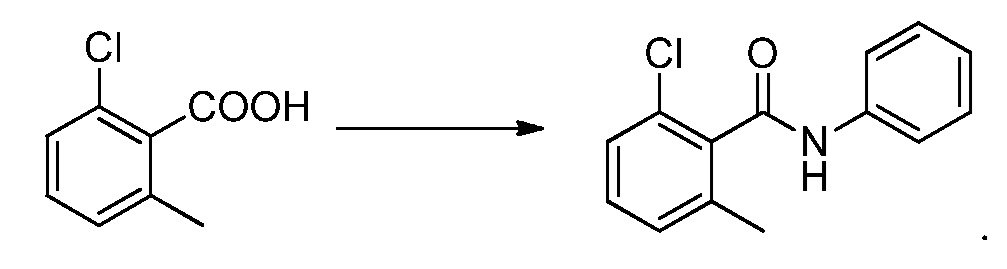
В одном из вариантов осуществления, эта стадия включает взаимодействие 2-хлор-6-метилбензойной кислоты с анилином в присутствии сшивающего реагента с получением 2-хлор-6-метил-N-фенилбензамида. В некоторых вариантах осуществления, сшивающий реагент может включать, не ограничиваясь этим, EDCI, DCC, DIC, HATU, HBTU, HCTU, TBTU и PyBOP, необязательно в присутствии HOBt, HOAt и/или основания (например, основания амина, такого как Et3N). В некоторых вариантах осуществления, 2-хлор-6-метилбензойную кислоту можно вначале превратить в ацилгалогенид (например, используя SOCl2) или ангидрид (например, используя известные в технике методики, например, но не ограничиваясь этим, взаимодействие с одним или несколькими эквивалентами подходящей кислоты, например, алкил-COOH и сшивающего реагента), и затем ввести этот ацилгалогенид или ангидрид в реакцию с анилином, с получением 2-хлор-6-метил-N-фенилбензамида.
В одном из вариантов осуществления, изобретение относится к способу получения соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или гидрата, включающему следующую стадию:

где:
фрагмент PG1 выбран из бензила, замещенного бензила, метоксикарбонила, этоксикарбонила, замещенного этоксикарбонила, 9-флуоренилоксикарбонила, замещенного 9-флуоренилоксикарбонила, 2,2,2-трихлорэтоксикарбонила, 2-триметилсилилэтоксикарбонила, (2-фенил-2-триметилсилил)этоксикарбонила, 2-фенилэтоксикарбонила, 1,1-диметил-2,2-дибромэтоксикарбонила, 1,1-диметил-2,2,2-трихлорэтоксикарбонила, т-бутоксикарбонила, 1-адамантилоксикарбонила, 2-адамантилоксикарбонила, триизопропилсилоксикарбонила, винилоксикарбонила, 1-изопропоксикарбонила, 8-хинолилоксикарбонила, 2,4-диметилпент-3-илоксикарбонила, бензилоксикарбонила и замещенного бензилоксикарбонила; и
где заместители выбраны из алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклила, арила, арилалкила, гетероарила, гетероарилалкила, алкокси, циклоалкокси, гетероциклилокси, арилокси, гетероарилокси, амидо, амино, ацила, ацилокси, алкоксикарбонила, сложного эфира, простого эфира, тио, сульфинила, сульфонила, сульфонамидо, галогена, циано, гидроксила, нитро, фосфата, мочевины, карбамата и карбоната.
В некоторых вариантах осуществления, PG1 представляет собой карбаматную защитную группу, например, алкоксикарбонил или арилоксикарбонил. В одном из вариантов осуществления, группа PG1 выбрана из т-бутоксикарбонила и бензилоксикарбонила. В одном из вариантов осуществления, PG1 представляет собой т-бутоксикарбонил.
В одном из вариантов осуществления, исходное вещество этой стадии, т.е. 2-хлор-6-метил-N-фенилбензамид вводят во взаимодействие с (S)-трет-бутил(1-(метокси(метил)амино)-1-оксопропан-2-ил)карбаматом в присутствии алкиллития, например, н-бутиллития или н-гексиллития с получением защищенного амина. В другом варианте осуществления, 2-хлор-6-метил-N-фенилбензамид вводят во взаимодействие с Boc-Ala-OMe или другими C1-6 алкильными сложными эфирами в аналогичных условиях с получением защищенного амина. В другом варианте осуществления, (S)-трет-бутил(1-(метокси(метил)амино)-1-оксопропан-2-ил)карбамат вводят во взаимодействие с алкилсодержащим реактивом Гриньяра, например, но не ограничиваясь этим, изопропилсодержащим реактивом Гриньяра (например, iPrMgCl), с последующим добавлением к смеси, включающей 2-хлор-6-метил-N-фенилбензамид. Другие подходящие реактивы Гриньяра включают, не ограничиваясь этим, органомагнийгалогениды, например, органомагнийхлориды и органомагнийбромиды. Не ограничивающие примеры реактивов Гриньяра включают метилмагний (хлорид или бромид), замещенные метилмагний (хлориды или бромиды), например, 2-нафтиленилметилмагний (хлорид или бромид), циклогексилметилмагний (хлорид или бромид) и 1,3-диоксанилметилмагний (хлорид или бромид), этилмагний (хлорид или бромид), фенилмагний (хлорид или бромид), замещенные фенилмагний (хлориды или бромиды) и другие подобные соединения, известные в технике.
В одном из вариантов осуществления, изобретение относится к способу получения соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или гидрата, включающему следующую стадию:
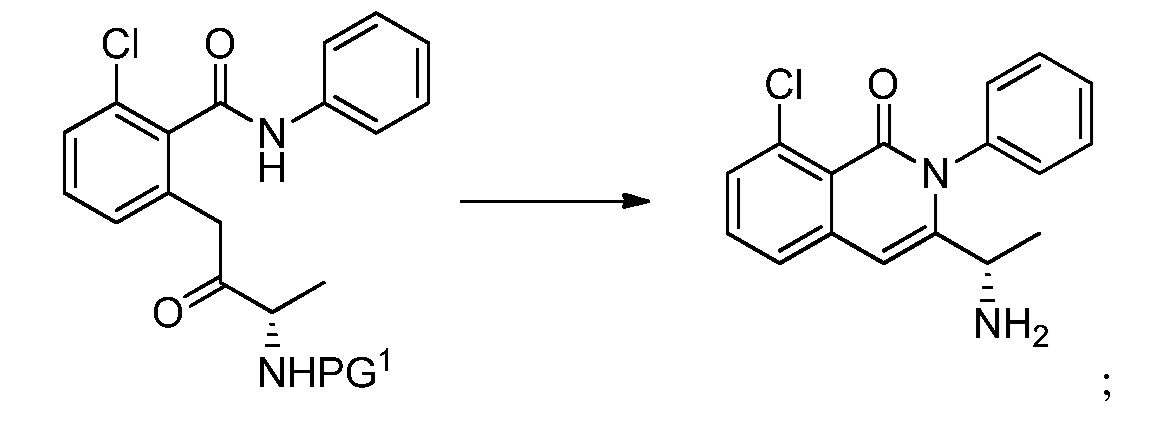
где:
фрагмент PG1 выбран из бензила, замещенного бензила, метоксикарбонила, этоксикарбонила, замещенного этоксикарбонила, 9-флуоренилоксикарбонила, замещенного 9-флуоренилоксикарбонила, 2,2,2-трихлорэтоксикарбонила, 2-триметилсилилэтоксикарбонила, (2-фенил-2-триметилсилил)этоксикарбонила, 2-фенилэтоксикарбонила, 1,1-диметил-2,2-дибромэтоксикарбонила, 1,1-диметил-2,2,2-трихлорэтоксикарбонила, т-бутоксикарбонила, 1-адамантилоксикарбонила, 2-адамантилоксикарбонила, триизопропилсилоксикарбонила, винилоксикарбонила, 1-изопропоксикарбонила, 8-хинолилоксикарбонила, 2,4-диметилпент-3-илоксикарбонила, бензилоксикарбонила и замещенного бензилоксикарбонила; и
где заместители выбраны из алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклила, арила, арилалкила, гетероарила, гетероарилалкила, алкокси, циклоалкокси, гетероциклилокси, арилокси, гетероарилокси, амидо, амино, ацила, ацилокси, алкоксикарбонила, сложного эфира, простого эфира, тио, сульфинила, сульфонила, сульфонамидо, галогена, циано, гидроксила, нитро, фосфата, мочевины, карбамата и карбоната.
В некоторых вариантах осуществления, PG1 представляет собой карбаматную защитную группу, например, алкоксикарбонил или арилоксикарбонил. В одном из вариантов осуществления, группа PG1 выбрана из т-бутоксикарбонила и бензилоксикарбонила. В одном из вариантов осуществления, PG1 представляет собой т-бутоксикарбонил.
В одном из вариантов осуществления, защищенный амин вводят во взаимодействие с неорганической кислотой, например, HCl или трифторуксусной кислотой, с получением изохинолинона. Другие походящие кислоты включают, не ограничиваясь этим, метансульфоновую кислоту, серную кислоту, бромистоводородную кислоту, азотную кислоту, фосфорную кислоту, перхлорную кислоту и камфорсульфоновую кислоту.
В одном из вариантов осуществления, изобретение относится к способу получения соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или гидрата, включающему следующую стадию:

где:
фрагмент X выбран из фтора, хлора, брома, йода, -O-SO2-4-метилфенила и -O-SO2-метила;
фрагмент PG2 выбран из метилсульфонила, замещенного метилсульфонила, бензолсульфонила, замещенного бензолсульфонила, бензилоксикарбонила, замещенного бензилоксикарбонила, 2,2,2-трихлорэтоксикарбонила, 2-триметилсилилэтоксикарбонила, т-бутоксикарбонила, 1-адамантилоксикарбонила, 2-адамантилоксикарбонила, алкила, замещенного алкила, т-бутилдиметилсилила, триизопропилсилила, аллила, бензила, замещенного бензила, гидроксиметила, метоксиметила, диэтоксиметила, (2-хлорэтокси)метила, т-бутоксиметила, т-бутилдиметилсилоксиметила, пивалоилоксиметила, бензилоксиметила, диметиламинометила, 2-тетрагидропиранила, замещенного алкоксиметила и замещенного арилоксиметила; и
где заместители выбраны из алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклила, арила, арилалкила, гетероарила, гетероарилалкила, алкокси, циклоалкокси, гетероциклилокси, арилокси, гетероарилокси, амидо, амино, ацила, ацилокси, алкоксикарбонила, сложного эфира, простого эфира, тио, сульфинила, сульфонила, сульфонамидо, галогена, циано, гидроксила, нитро, фосфата, мочевины, карбамата и карбоната.
В одном из вариантов осуществления, PG2 означает 2-тетрагидропиранил. В некоторых вариантах осуществления, X выбран из фтора, хлора, брома и йода. В одном из вариантов осуществления, X означает хлор. В некоторых вариантах осуществления, данная стадия включает взаимодействие 6-хлор-9H-пурина с 3,4-дигидро-2H-пираном с получением 6-хлор-9-(тетрагидро-2H-пиран-2-ил)-9H-пурина.
В одном из вариантов осуществления, изобретение относится к способу получения соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или гидрата, включающему следующую стадию:

где:
фрагмент X выбран из фтора, хлора, брома, йода, -O-SO2-4-метилфенила и -O-SO2-метила;
фрагмент PG2 выбран из метилсульфонила, замещенного метилсульфонила, бензолсульфонила, замещенного бензолсульфонила, бензилоксикарбонила, замещенного бензилоксикарбонила, 2,2,2-трихлорэтоксикарбонила, 2-триметилсилилэтоксикарбонила, т-бутоксикарбонила, 1-адамантилоксикарбонила, 2-адамантилоксикарбонила, алкила, замещенного алкила, т-бутилдиметилсилила, триизопропилсилила, аллила, бензила, замещенного бензила, гидроксиметила, метоксиметила, диэтоксиметила, (2-хлорэтокси)метила, т-бутоксиметила, т-бутилдиметилсилоксиметила, пивалоилоксиметила, бензилоксиметила, диметиламинометила, 2-тетрагидропиранила, замещенного алкоксиметила и замещенного арилоксиметила; и
где заместители выбраны из алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклила, арила, арилалкила, гетероарила, гетероарилалкила, алкокси, циклоалкокси, гетероциклилокси, арилокси, гетероарилокси, амидо, амино, ацила, ацилокси, алкоксикарбонила, сложного эфира, простого эфира, тио, сульфинила, сульфонила, сульфонамидо, галогена, циано, гидроксила, нитро, фосфата, мочевины, карбамата и карбоната.
В одном из вариантов осуществления, PG2 означает 2-тетрагидропиранил. В некоторых вариантах осуществления, X выбран из фтора, хлора, брома и йода. В одном из вариантов осуществления, X означает хлор. В одном из вариантов осуществления, защищенный хлорпурин вводят во взаимодействие с изохинолиноном в присутствии основания, например, амина (например, Et3N) в спиртовом растворителе (например, MeOH, EtOH, PrOH, iPrOH).
В одном из вариантов осуществления, изобретение относится к способу получения соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или гидрата, включающему следующую стадию:

где:
фрагмент PG2 выбран из метилсульфонила, замещенного метилсульфонила, бензолсульфонила, замещенного бензолсульфонила, бензилоксикарбонила, замещенного бензилоксикарбонила, 2,2,2-трихлорэтоксикарбонила, 2-триметилсилилэтоксикарбонила, т-бутоксикарбонила, 1-адамантилоксикарбонила, 2-адамантилоксикарбонила, алкила, замещенного алкила, т-бутилдиметилсилила, триизопропилсилила, аллила, бензила, замещенного бензила, гидроксиметила, метоксиметила, диэтоксиметила, (2-хлорэтокси)метила, т-бутоксиметила, т-бутилдиметилсилоксиметила, пивалоилоксиметила, бензилоксиметила, диметиламинометила, 2-тетрагидропиранила, замещенного алкоксиметила и замещенного арилоксиметила; и
где заместители выбраны из алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклила, арила, арилалкила, гетероарила, гетероарилалкила, алкокси, циклоалкокси, гетероциклилокси, арилокси, гетероарилокси, амидо, амино, ацила, ацилокси, алкоксикарбонила, сложного эфира, простого эфира, тио, сульфинила, сульфонила, сульфонамидо, галогена, циано, гидроксила, нитро, фосфата, мочевины, карбамата и карбоната.
В одном из вариантов осуществления, PG2 означает 2-тетрагидропиранил. В одном из вариантов осуществления, защищенный пурин вводят во взаимодействие с неорганической кислотой, такой, как, но не ограничиваясь перечисленными, HCl, HBr, перхлорная кислота, серная кислота, азотная кислота и фосфорная кислота, в спиртовом растворителе (например, MeOH, EtOH, PrOH, iPrOH). В одном из вариантов осуществления, неорганическая кислота представляет собой HCl.
В одном из вариантов осуществления, изобретение относится к способу получения соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или гидрата, включающему следующую стадию:

где:
фрагмент X выбран из фтора, хлора, брома, йода, -O-SO2-4-метилфенила и -O-SO2-метила.
В некоторых вариантах осуществления, X выбран из фтора, хлора, брома и йода. В одном из вариантов осуществления, X означает хлор. В одном из вариантов осуществления, исходные вещества вводят во взаимодействие с амином, например, Et3N в спиртовом растворителе, например глицерине, для осуществления реакции сшивания с участием аминогруппы.
В некоторых вариантах осуществления, интермедиаты для синтеза соединения формулы (I) или его соли, сольвата или гидрата получают согласно одной или нескольким из следующих схем.
Схема 1

В одном из вариантов осуществления, превращение соединения 1 в соединение 2 можно осуществить любым способом, известным в технике. В одном из вариантов осуществления, соединение 1 вводят во взаимодействие с MeNHOMe (HCl) в присутствии EDCI и HOBt. В некоторых вариантах осуществления, может присутствовать основание, например, триэтиламин.
Схема 2

В одном из вариантов осуществления, превращение соединения 3 в соединение 4 происходит в присутствии пара-толуолсульфоновой кислоты. В другом варианте осуществления, введение защитной группы THP осуществляют с применением камфорсульфоновой кислоты в 2-метилтетрагидрофуране.
Схема 3

В одном из вариантов осуществления, превращение соединения 5 в соединение 7 можно осуществить по методике, известной в технике. В одном из вариантов осуществления, соединение 5 вводят в реакцию с тионилхлоридом и ДМФА, получая соединение 6, которое, в свою очередь, вводят во взаимодействие с анилином, получая соединение 7.
В одном из вариантов осуществления, соединение 7 превращают в соединение 8, осуществляя взаимодействие соединения 7 с н-гексиллитием и затем, добавляя соединение 2, которое перед этим ввели в реакцию с изопропилсодержащим реактивом Гриньяра (например, iPrMgCl). В одном из вариантов осуществления, соединение 8 превращают в соединение 9 в присутствии кислоты, например, хлористоводородной кислоты, трифторуксусной кислоты или метансульфоновой кислоты, в растворителе, например, метаноле или изопропиловом спирте. В одном из вариантов осуществления, эта кислота может являться трифторуксусной кислотой.
В одном из вариантов осуществления, соединение формулы (I) или его соль, сольват или гидрат, получают взаимодействием соединения 3 и соединения 9 по следующей схеме:
Схема 4

В одном из вариантов осуществления, исходные вещества 3 и 9 вводят в реакцию в присутствии амина, например, Et3N в спиртовом растворителе, например, глицерине, для осуществления сшивания пуринового соединения.
В одном из вариантов осуществления, для получения соединения формулы (I), его соли, сольвата или гидрата, можно следовать приведенной ниже схеме синтеза:
Схема 5

где:
фрагмент PG2 выбран из метилсульфонила, замещенного метилсульфонила, бензолсульфонила, замещенного бензолсульфонила, бензилоксикарбонила, замещенного бензилоксикарбонила, 2,2,2-трихлорэтоксикарбонила, 2-триметилсилилэтоксикарбонила, т-бутоксикарбонила, 1-адамантилоксикарбонила, 2-адамантилоксикарбонила, алкила, замещенного алкила, т-бутилдиметилсилила, триизопропилсилила, аллила, бензила, замещенного бензила, гидроксиметила, метоксиметила, диэтоксиметила, (2-хлорэтокси)метила, т-бутоксиметила, т-бутилдиметилсилоксиметила, пивалоилоксиметила, бензилоксиметила, диметиламинометила, 2-тетрагидропиранила, замещенного алкоксиметила и замещенного арилоксиметила; и
где заместители выбраны из алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклила, арила, арилалкила, гетероарила, гетероарилалкила, алкокси, циклоалкокси, гетероциклилокси, арилокси, гетероарилокси, амидо, амино, ацила, ацилокси, алкоксикарбонила, сложного эфира, простого эфира, тио, сульфинила, сульфонила, сульфонамидо, галогена, циано, гидроксила, нитро, фосфата, мочевины, карбамата и карбоната.
Хотя выше показана двухстадийная схема синтеза, этот синтез можно осуществить в одном сосуде, без выделения промежуточных продуктов. В одном из вариантов осуществления, первую стадию с получением соединения (Ia) можно проводить в присутствии основания (например, амина, такого как, но не ограничиваясь этим, Et3N) в спиртовом растворителе (например, MeOH, EtOH, PrOH, iPrOH). В зависимости от природы защитной группы PG2, для снятия защиты соединения (Ia) с получением соединения (I) могут применяться описанные ниже реагенты. Один или несколько реагентов для удаления защитной группы PG2 включают, не ограничиваясь этим, кислоты, такие как HCl, HBr и TFA; карбонаты, такие как Na2CO3 и K2CO3; гидроксиды, такие как NaOH и KOH; литиевые основания, такие как метиллитий, этиллитий, пропиллитий, н-бутиллитий, н-пентиллитий и н-гексиллитий; окислители, такие как нитрат церия аммония; гидрирующие реагенты, такие как циклогексадиен/Pd чернь и H2/Pd на угле; TBAF и BF3·Et2O.
В одном из вариантов осуществления, для получения соединения формулы (I), его соли, сольвата или гидрата, используется приведенная ниже схема синтеза:

В одном из вариантов осуществления, первую стадию, приводящую к получению соединения 10, можно проводить в присутствии основания (например, амина, такого как, но не ограничиваясь этим, Et3N) в спиртовом растворителе (например, MeOH, EtOH, PrOH, iPrOH). В некоторых вариантах осуществления, соединение формулы (I) или его соль, сольват или гидрат получают в результате обработки защищенного соединения-предшественника (например, соединения 10) хлористоводородной кислотой в этаноле с последующей обработкой дихлорметаном. В некоторых вариантах осуществления, продукт обработки дихлорметаном подвергают воздействию водной среды, содержащей, например, приблизительно 90% воды и приблизительно 10% 2-пропанола.
В одном из вариантов осуществления, выделение и очистку химических соединений и интермедиатов, описанных в настоящей заявке, можно проводить с применением таких способов, как, но не ограничиваясь только ими, фильтрование, экстракция, кристаллизация, осаждение, колоночная хроматография на силикагеле, жидкостная хроматография высокого давления, тонкослойная хроматография или толстослойная хроматография, или комбинацией этих способов. Не ограничивающие примеры типовых методик, подходящих для выделения и очистки соединений приведены в примерах ниже по тексту. Однако могут применяться и другие способы выделения и очистки, известные в технике.
Перед включением в состав лекарственного продукта в качестве действующего фармацевтического ингредиента, соединение формулы (I) или его соль, сольват или гидрат, можно выделить с чистотой, превышающей примерно 90%, превышающей примерно 91%, превышающей примерно 92%, превышающей примерно 93%, превышающей примерно 94%, превышающей примерно 95%, превышающей примерно 96%, превышающей примерно 97%, превышающей примерно 98%, превышающей примерно 99% и с чистотой, доходящей до 100%.
В некоторых вариантах осуществления, (R)- и (S)-изомеры соединения формулы (I), если присутствуют оба этих изомера, можно разделить способами, известными специалисту в данной области, например, получением диастереомерных солей или комплексов, которые можно разделить, например, кристаллизацией; получением диастереомерных производных, которые можно разделить, например, кристаллизацией, газо-жидкостной или жидкостной хроматографией; селективной реакцией одного энантиомера с энантиомер-специфичным реагентом, например, ферментным окислением или восстановлением, с последующим разделением модифицированных и немодифицированных энантиомеров; или газо-жидкостной или жидкостной хроматографией в хиральных условиях, например, на хиральной неподвижной фазе, например, силикагеле с которым связан хиральный лиганд, или в присутствии хирального растворителя. В качестве альтернативы, тот или иной энантиомер можно получить асимметрическим синтезом с использованием оптически активных реагентов, субстратов, катализаторов или растворителей, или путем превращения одного энантиомера в другой путем асимметрической трансформации. В некоторых вариантах осуществления, соединение формулы (I) присутствует в виде рацемической или не рацемической смеси с его энантиомером. В одном из вариантов осуществления, соединение формулы (I) присутствует в энантиомерном избытке (ee), выбранном из более примерно 60%, более примерно 65%, более примерно 70%, более примерно 75%, более примерно 80%, более примерно 85%, более примерно 90%, более примерно 91%, более примерно 92%, более примерно 93%, более примерно 94%, более примерно 95%, более примерно 96%, более примерно 97%, более примерно 98% и более примерно 99%.
В одном из вариантов осуществления, изобретение относится к способу получения полиморфа соединения формулы (I):

или его фармацевтически приемлемой соли, сольвата или гидрата. В одном из вариантов осуществления, этот способ включает выделение полиморфа в качестве первой твердой формы после синтеза соединения формулы (I). В другом варианте осуществления, этот способ включает выделение полиморфа в качестве продукта превращения предыдущей твердой формы соединения формулы (I) (например, на первом этапе выделяют твердую форму первого полиморфа соединения формулы (I) или его соли, сольвата или гидрата, и затем превращают выделенную твердую форму во второй полиморф в подходящих условиях). Превращения одной полиморфной формы в другие входят в объем настоящего изобретения. В одном из вариантов осуществления, такие превращения могут применяться в качестве способа получения полиморфной формы для производства медицинских препаратов.
В одном из вариантов осуществления, изобретение относится к способу получения полиморфной формы C соединения формулы (I):

где указанный способ включает:
(i) введение во взаимодействие соединения формулы (Ia):

где
фрагмент PG2 представляет собой защитную группу, выбранную из метилсульфонила, замещенного метилсульфонила, бензолсульфонила, замещенного бензолсульфонила, бензилоксикарбонила, замещенного бензилоксикарбонила, 2,2,2-трихлорэтоксикарбонила, 2-триметилсилилэтоксикарбонила, т-бутоксикарбонила, 1-адамантилоксикарбонила, 2-адамантилоксикарбонила, алкила, замещенного алкила, т-бутилдиметилсилила, триизопропилсилила, аллила, бензила, замещенного бензила, гидроксиметила, метоксиметила, диэтоксиметила, (2-хлорэтокси)метила, т-бутоксиметила, т-бутилдиметилсилоксиметила, пивалоилоксиметила, бензилоксиметила, диметиламинометила, 2-тетрагидропиранила, замещенного алкоксиметила и замещенного арилоксиметила; и
где заместители выбраны из алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклила, арила, арилалкила, гетероарила, гетероарилалкила, алкокси, циклоалкокси, гетероциклилокси, арилокси, гетероарилокси, амидо, амино, ацила, ацилокси, алкоксикарбонила, сложного эфира, простого эфира, тио, сульфинила, сульфонила, сульфонамидо, галогена, циано, гидроксила, нитро, фосфата, мочевины, карбамата и карбоната;
с одним или несколькими реагентами для удаления защитной группы PG2 с получением соединения формулы (I); и
(ii) выделение полиморфной формы C соединения формулы (I);
где, по меньшей мере, одну из стадий (i) и (ii) проводят в среде, содержащей воду.
В некоторых вариантах осуществления, один или несколько реагентов для удаления защитной группы PG2 включают, не ограничиваясь этим, кислоты, такие как HCl, HBr и TFA; карбонаты, такие как Na2CO3 и K2CO3; гидроксиды, такие как NaOH и KOH; литиевые основания, такие как метиллитий, этиллитий, пропиллитий, н-бутиллитий, н-пентиллитий и н-гексиллитий; окислители, такие как нитрат церия аммония; гидрирующие реагенты, такие как циклогексадиен/Pd чернь и H2/Pd на угле; TBAF и BF3·Et2O. В одном из вариантов осуществления, среда, содержащая воду, включает воду, например, в форме паров воды и/или жидкой воды. В одном из вариантов осуществления, среда, содержащая воду, включает систему растворителей, содержащую неводный растворитель и жидкую воду, как описано в других местах настоящей заявки.
В одном из вариантов осуществления, изобретение относится к способу получения полиморфной формы C соединения формулы (I):

где указанный способ включает:
(i) воздействие на композицию, включающую, по меньшей мере, один полиморф соединения формулы (I), не являющийся формой C, или его соль, сольват или гидрат, среды, содержащей воду, в течение периода времени, достаточного для превращения, по меньшей мере, примерно 50% общего количества полиморфа, не являющегося формой C, в форму C соединения формулы (I); и
(ii) выделение указанной полиморфной формы C.
В некоторых вариантах осуществления, стадия выделения включает перекристаллизацию продукта реакции из системы с одним растворителем. В некоторых вариантах осуществления, стадия выделения включает перекристаллизацию продукта реакции из системы с двумя, тремя или большим количеством растворителей, где системы с двумя, тремя или несколькими растворителями обобщенно именуются системами с несколькими растворителями. В некоторых вариантах осуществления, стадия выделения включает кристаллизацию из системы с одним или несколькими растворителями, где эта кристаллизация включает охлаждение раствора, содержащего соединение формулы (I). В некоторых вариантах осуществления, стадия выделения включает кристаллизацию из системы с одним или несколькими растворителями, где эта кристаллизация включает добавление антирастворителя, в сочетании со стадией охлаждения или без нее, для осаждения формы C. В некоторых вариантах осуществления, кристаллизацию проводят в среде, содержащей воду. Если среда содержит воду, вода может присутствовать в следовых количествах или в количествах менее примерно 1% по объему от объема растворителя, или может находиться в виде паров воды. В некоторых вариантах осуществления, вода может присутствовать в качестве сорастворителя (или антирастворителя), например, в количестве от примерно 1% до примерно 50%. Например, вода может присутствовать в количестве примерно 5%, примерно 10%, примерно 15%, примерно 20%, примерно 25%, примерно 30%, примерно 35%, примерно 40%, примерно 45% и примерно 50% по объему от объема растворителя. В некоторых вариантах осуществления, вода может присутствовать в количествах, равных или превышающих примерно 50% по объему от объема растворителя. Например, вода может присутствовать в количестве примерно 55%, примерно 60%, примерно 65%, примерно 70%, примерно 75%, примерно 80%, примерно 85%, примерно 90%, примерно 95% и до 100% по объему от объема растворителя. В некоторых вариантах осуществления, жидкая вода входит в систему нескольких растворителей, например, в количестве от примерно 10% до примерно 50% по объему от объема системы растворителей. В некоторых вариантах осуществления, жидкая вода входит в систему нескольких растворителей, в количестве равном или превышающем примерно 50% по объему от объема системы растворителей. В некоторых вариантах осуществления, вода может присутствовать в виде паров воды или естественной влажности окружающего воздуха.
В одном из вариантов осуществления, неводный растворитель представляет собой растворитель, смешивающийся с водой. Например, жидкая вода может быть представлена в количестве примерно 1%, примерно 2%, примерно 3%, примерно 4%, примерно 5%, примерно 6%, примерно 7%, примерно 8%, примерно 9%, примерно 10%, примерно 15%, примерно 20%, примерно 25%, примерно 30%, примерно 35%, примерно 40%, примерно 45%, примерно 50%, примерно 55%, примерно 60%, примерно 65%, примерно 70%, примерно 75%, примерно 80%, примерно 85%, примерно 90%, примерно 95%, примерно 96%, примерно 97%, примерно 98%, примерно 99% или примерно 100% по объему от объема системы растворителей. В одном из вариантов осуществления, жидкая вода присутствует в количестве от примерно 10% до примерно 50% по объему от объема системы растворителей.
В одном из вариантов осуществления, среда, содержащая воду, включает систему растворителей, содержащую воду (например, приблизительно 90% объем/объем) и изопропиловый спирт (например, приблизительно 10% объем/объем). В одном из вариантов осуществления, среда, содержащая воду, включает систему растворителей, содержащую воду и этанол. В одном из вариантов осуществления, среда, содержащая воду, включает систему растворителей, содержащую воду и смешивающийся с водой растворитель, например, в числе прочих, C1-C4 спирт, ацетон, ацетонитрил и т.п. В одном из вариантов осуществления, смешивающийся с водой растворитель представляет собой спирт, например, метанол, этанол, 1-пропанол, 2-пропанол, 1-бутанол, 2-бутанол, т-бутанол, этиленгликоль и т.п. В одном из вариантов осуществления, соотношение между водой и смешивающимся с водой растворителем в системе растворителей по настоящему изобретению составляет примерно 50:1, примерно 40:1, примерно 30:1, примерно 20:1, примерно 10:1, примерно 9:1, примерно 8:1, примерно 7:1, примерно 6:1, примерно 5:1, примерно 4:1, примерно 3:1, примерно 2:1, примерно 1:1, примерно 1:2, примерно 1:3, примерно 1:4, примерно 1:5, примерно 1:6, примерно 1:7, примерно 1:8, примерно 1:9, примерно 1:10, примерно 1:20, примерно 1:30, примерно 1:40 или примерно 1:50 объем/объем. В одном из вариантов осуществления, соотношение между водой и смешивающимся с водой растворителем в системе растворителей по настоящему изобретению составляет от примерно 50:1 до примерно 1:1, от примерно 40:1 до примерно 1:1, от примерно 30:1 до примерно 1:1, от примерно 20:1 до примерно 1:1, от примерно 10:1 до примерно 1:1, от примерно 9:1 до примерно 1:1, от примерно 8:1 до примерно 1:1, от примерно 7:1 до примерно 1:1, от примерно 6:1 до примерно 1:1, от примерно 5:1 до примерно 1:1, от примерно 4:1 до примерно 1:1, от примерно 3:1 до примерно 1:1, от примерно 2:1 до примерно 1:2, от примерно 1:1 до примерно 1:4, от примерно 1:1 до примерно 1:5, от примерно 1:1 до примерно 1:6, от примерно 1:1 до примерно 1:7, от примерно 1:1 до примерно 1:8, от примерно 1:1 до примерно 1:9, от примерно 1:1 до примерно 1:10, от примерно 1:1 до примерно 1:20, от примерно 1:1 до примерно 1:30, от примерно 1:1 до примерно 1:40 или от примерно 1:1 до примерно 1:50 объем/объем.
В одном из вариантов осуществления, изобретение относится к способу получения полиморфной формы A соединения формулы (I):
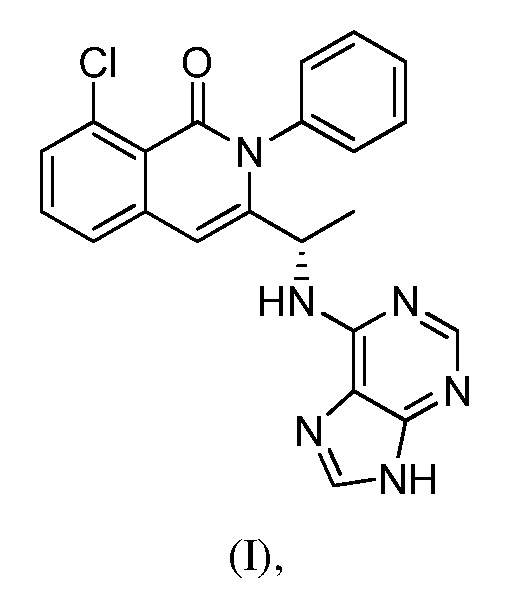
где указанный способ включает:
(i) введение во взаимодействие соединения формулы (Ia):
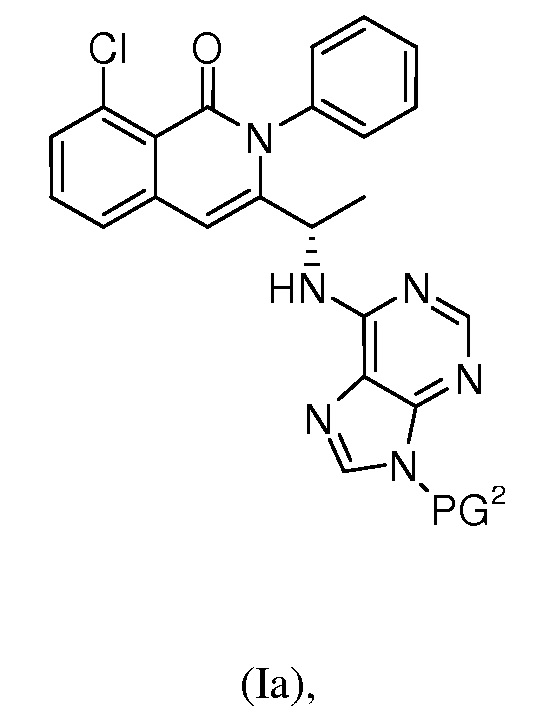
где
фрагмент PG2 представляет собой защитную группу, выбранную из метилсульфонила, замещенного метилсульфонила, бензолсульфонила, замещенного бензолсульфонила, бензилоксикарбонила, замещенного бензилоксикарбонила, 2,2,2-трихлорэтоксикарбонила, 2-триметилсилилэтоксикарбонила, т-бутоксикарбонила, 1-адамантилоксикарбонила, 2-адамантилоксикарбонила, алкила, замещенного алкила, т-бутилдиметилсилила, триизопропилсилила, аллила, бензила, замещенного бензила, гидроксиметила, метоксиметила, диэтоксиметила, (2-хлорэтокси)метила, т-бутоксиметила, т-бутилдиметилсилоксиметила, пивалоилоксиметила, бензилоксиметила, диметиламинометила, 2-тетрагидропиранила, замещенного алкоксиметила и замещенного арилоксиметила; и
где заместители выбраны из алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклила, арила, арилалкила, гетероарила, гетероарилалкила, алкокси, циклоалкокси, гетероциклилокси, арилокси, гетероарилокси, амидо, амино, ацила, ацилокси, алкоксикарбонила, сложного эфира, простого эфира, тио, сульфинила, сульфонила, сульфонамидо, галогена, циано, гидроксила, нитро, фосфата, мочевины, карбамата и карбоната;
с одним или несколькими реагентами для удаления защитной группы PG2 с получением соединения формулы (I); и
(ii) выделение полиморфной формы A соединения формулы (I).
В некоторых вариантах осуществления, один или несколько реагентов для удаления защитной группы PG2 включают, не ограничиваясь этим, кислоты, такие как HCl, HBr и TFA; карбонаты, такие как Na2CO3 и K2CO3; гидроксиды, такие как NaOH и KOH; литиевые основания, такие как метиллитий, этиллитий, пропиллитий, н-бутиллитий, н-пентиллитий и н-гексиллитий; окислители, такие как нитрат церия аммония; гидрирующие реагенты, такие как циклогексадиен/Pd чернь и H2/Pd на угле; TBAF и BF3·Et2O.
В некоторых вариантах осуществления, стадия (ii) может включать перекристаллизацию соединения формулы (I) или его соли, сольвата или гидрата, из системы с одним растворителем или из системы с несколькими растворителями, которая не содержит как этилацетата, так и гексана. В некоторых вариантах осуществления, этот способ дополнительно включает стадию растворения соединения формулы (I) или его соли, сольвата или гидрата в системе с одним растворителем или несколькими растворителями, удаление остатков твердого вещества с получением жидкого раствора, охлаждение указанного жидкого раствора с такой скоростью, которая вызывает кристаллизацию формы A, и выделение формы A из жидкого раствора.
В некоторых вариантах осуществления, выделенный полиморф представляет собой форму A, и стадия выделения включает перекристаллизацию продукта реакции из системы с одним растворителем. В некоторых вариантах осуществления, выделенный полиморф представляет собой форму A, и стадия выделения включает перекристаллизацию продукта реакции из системы с двумя, тремя или большим числом растворителей, где эти системы обобщенно именуются системами с несколькими растворителями, и где эти системы с несколькими растворителями не содержат как этилацетата, так и гексана. В некоторых вариантах осуществления, выделенный полиморф представляет собой форму A, и стадия выделения включает кристаллизацию из системы с одним или несколькими растворителями, где кристаллизация включает охлаждение раствора, содержащего соединение формулы (I). В некоторых вариантах осуществления, выделенный полиморф представляет собой форму A, и стадия выделения включает кристаллизацию из системы с одним или несколькими растворителями, где кристаллизация включает добавление антирастворителя в сочетании со стадией охлаждения, либо без нее, с выделением формы A.
В одном из вариантов осуществления, изобретение относится к способу получения полиморфной формы B соединения формулы (I):

где указанный способ включает термическое превращение полиморфа соединения (I), не являющегося формой B, или его соли, сольвата или гидрата с получением полиморфной формы B.
В некоторых вариантах осуществления, полиморф не являющийся формой B, является твердой формой соединения формулы (I) или его соли, сольвата или гидрата (например, кристаллической формой, аморфной формой или смесью кристаллической формы (форм) и/или аморфной формы (форм)), которая не является полиморфной формой B соединения формулы (I). В одном из вариантов осуществления, полиморф, не являющийся формой B, представляет собой форму A, форму C, форму D, форму E, форму F, форму G, форму H, форму I, форму J или аморфную форму соединения формулы (I) или его соли, сольвата или гидрата, или смесь двух или нескольких упомянутых форм.
В некоторых вариантах осуществления, настоящее изобретение относится к способам получения полиморфа соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или гидрата, где указанный способ включает превращение первого полиморфа или смеси полиморфов соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или гидрата, во второй полиморф соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления, эти способы включают воздействие на композицию, включающую один или несколько полиморфов, условий, достаточных для превращения, по меньшей мере, примерно 50% общего количества исходного полиморфа или первого полиморфа во второй полиморф и, необязательно, выделение второго полиморфа.
В некоторых вариантах осуществления, исходная твердая форма или первая твердая форма соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или гидрата содержит более, чем примерно 50% полиморфа (полиморфов), не являющегося формой A, в качестве первого полиморфа, и вторым полиморфом является форма A.
В некоторых вариантах осуществления, исходная твердая форма или первая твердая форма соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или гидрата, содержит более, чем примерно 50% полиморфа (полиморфов), не являющегося формой C, и второй полиморф является формой C. В одном из вариантов осуществления, превращение в форму C проводят в среде, содержащей воду, в течение периода времени, достаточного для превращения, по меньшей мере, примерно 50% общего количества полиморфа (полиморфов), не являющегося формой C, в форму C соединения формулы (I), при необязательной стадии отделения формы C от любого полиморфа (полиморфов), не являющегося формой C. Среда, содержащая воду, может включать воздействие на исходную твердую форму или композицию паров воды или жидкой воды. Например, среда, содержащая воду, может включать воздействие на исходную твердую форму или композицию определенного количества жидкой воды, либо индивидуально, либо в комбинации с дополнительными жидкостями или другими компонентами, с образованием суспензии. В некоторых вариантах осуществления, исходную твердую форму или композицию можно подвергать действию паров воды или влаги в течение определенного периода времени при температуре, достаточной для осуществления превращения в форму C. В некоторых вариантах осуществления, исходная композиция содержит одну или несколько форм из числа формы A, формы B, формы D, формы E, формы F, формы G, формы H, формы I, формы J или аморфной формы соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или гидрата, или смесь двух или нескольких упомянутых форм. В некоторых вариантах осуществления, исходная композиция содержит более примерно 50% по массе полиморфной формы A.
В некоторых вариантах осуществления, изобретение относится к композициям, включающим полиморф соединения формулы (I). В некоторых вариантах осуществления, полиморф соединения формулы (I) представляет собой фармацевтически приемлемую соль, сольват или гидрат. В некоторых вариантах осуществления, композиция включает смесь первого полиморфа соединения формулы (I) и одной или нескольких дополнительных форм соединения формулы (I), например, аморфной формы соединения формулы (I) и/или одного или нескольких других полиморфов соединения формулы (I). В этой смеси, каждый компонент числа из первого полиморфа, аморфной формы и одного или нескольких других полиморфов, независимо может находиться в форме фармацевтически приемлемой соли, сольвата или гидрата, как описано в настоящей заявке, причем две соли, сольвата или гидрата необязательно аналогичны друг другу или отличаются друг от друга.
В некоторых вариантах осуществления, композиция включает смесь форм соединения формулы (I), раскрытых в настоящем описании, и включает большее количество первого полиморфа соединения формулы (I) по отношению к одному или нескольким дополнительным формам соединения формулы (I) в смеси. В некоторых вариантах осуществления, первый полиморф соединения формулы (I) выбран из формы A, формы B, формы C, формы D, формы E, формы F, формы G, формы H, формы I и формы J. В некоторых вариантах осуществления, одна или несколько дополнительных форм соединения формулы (I) выбраны из одного или нескольких полиморфов соединения формулы (I), которые отличаются от первого полиморфа, и аморфной формы соединения формулы (I). В этой смеси каждый компонент из числа первого полиморфа, аморфной формы и одного или нескольких других полиморфов может независимо находиться в форме фармацевтически приемлемой соли, сольвата или гидрата, которые описаны в настоящей заявке, причем две соли, сольвата или гидрата необязательно аналогичны друг другу или отличаются друг от друга.
В некоторых вариантах осуществления, массовое соотношение между первым полиморфом (например, формой A, формой B, формой C, формой D, формой E, формой F, формой G, формой H, формой I и формой J) и одной или несколькими дополнительными формами соединения формулы (I) превышает примерно 1:1, превышает примерно 2:1, превышает примерно 3:1, превышает примерно 4:1, превышает примерно 5:1, превышает примерно 6:1, превышает примерно 7:1, превышает примерно 8:1, превышает примерно 9:1, превышает примерно 10:1, превышает примерно 20:1, превышает примерно 30:1, превышает примерно 40:1, превышает примерно 50:1, превышает примерно 60:1, превышает примерно 70:1, превышает примерно 80:1, превышает примерно 90:1 или превышает примерно 99:1.
Например, в некоторых вариантах осуществления, композиция включает полиморфную форму C и полиморфную форму (формы), не являющуюся формой C, в массовом отношении, превышающем примерно 1:1, превышающем примерно 2:1, превышающем примерно 3:1, превышающем примерно 4:1, превышающем примерно 5:1, превышающем примерно 6:1, превышающем примерно 7:1, превышающем примерно 8:1, превышающем примерно 9:1, превышающем примерно 10:1, превышающем примерно 20:1, превышающем примерно 30:1, превышающем примерно 40:1, превышающем примерно 50:1, превышающем примерно 60:1, превышающем примерно 70:1, превышающем примерно 80:1, превышающем примерно 90:1 или превышающем примерно 99:1. В некоторых вариантах осуществления, композиция включает первый полиморф соединения формулы (I), например, форму C, и практически не содержит других форм соединений формулы (I). В некоторых вариантах осуществления, композиция включает форму C и форму A. В некоторых вариантах осуществления, композиция включает форму C и форму B. В некоторых вариантах осуществления, композиция включает форму C и форму D. В некоторых вариантах осуществления, композиция включает форму C и форму E. В некоторых вариантах осуществления, композиция включает форму C и форму F. В некоторых вариантах осуществления, композиция включает форму C и форму G. В некоторых вариантах осуществления, композиция включает форму C и форму H. В некоторых вариантах осуществления, композиция включает форму C и форму I. В некоторых вариантах осуществления, композиция включает форму C и форму J. В некоторых вариантах осуществления, композиция включает форму C и аморфную форму соединения формулы (I) или их фармацевтически приемлемые соли, сольваты или гидраты.
В некоторых вариантах осуществления, изобретение относится к композиции, включающей форму A и один или несколько полиморфов соединения формулы (I), не являющихся формой A, или одну или несколько их фармацевтически приемлемых солей, сольватов или гидратов. В некоторых вариантах осуществления, изобретение относится к композиции, включающей форму B и один или несколько полиморфов соединения формулы (I), не являющихся формой B, или одну или несколько их фармацевтически приемлемых солей, сольватов или гидратов. В некоторых вариантах осуществления, изобретение относится к композиции, включающей форму С и один или несколько полиморфов соединения формулы (I), не являющихся формой С, или одну или несколько их фармацевтически приемлемых солей, сольватов или гидратов. В некоторых вариантах осуществления, изобретение относится к композиции, включающей форму D и один или несколько полиморфов соединения формулы (I), не являющихся формой D, или одну или несколько их фармацевтически приемлемых солей, сольватов или гидратов. В некоторых вариантах осуществления, изобретение относится к композиции, включающей форму E и один или несколько полиморфов соединения формулы (I), не являющихся формой E, или одну или несколько их фармацевтически приемлемых солей, сольватов или гидратов. В некоторых вариантах осуществления, изобретение относится к композиции, включающей форму F и один или несколько полиморфов соединения формулы (I), не являющихся формой F, или одну или несколько их фармацевтически приемлемых солей, сольватов или гидратов. В некоторых вариантах осуществления, изобретение относится к композиции, включающей форму G и один или несколько полиморфов соединения формулы (I), не являющихся формой G, или одну или несколько их фармацевтически приемлемых солей, сольватов или гидратов. В некоторых вариантах осуществления, изобретение относится к композиции, включающей форму H и один или несколько полиморфов соединения формулы (I), не являющихся формой H, или одну или несколько их фармацевтически приемлемых солей, сольватов или гидратов. В некоторых вариантах осуществления, изобретение относится к композиции, включающей форму I и один или несколько полиморфов соединения формулы (I), не являющихся формой I, или одну или несколько их фармацевтически приемлемых солей, сольватов или гидратов. В некоторых вариантах осуществления, изобретение относится к композиции, включающей форму J и один или несколько полиморфов соединения формулы (I), не являющихся формой J, или одну или несколько их фармацевтически приемлемых солей, сольватов или гидратов. В некоторых вариантах осуществления, изобретение относится к композиции, включающей аморфную форму соединения формулы (I) или ее фармацевтически приемлемую соль, сольват или гидрат. В некоторых вариантах осуществления, изобретение относится к композиции, включающей аморфную форму соединения формулы (I) и один или несколько полиморфов соединения формулы (I), выбранных из форм A, B, C, D, E, F, G, H, I и J или одну или несколько их фармацевтически приемлемых солей, сольватов или гидратов. В некоторых вариантах осуществления, изобретение относится к композициям, включающим одну или несколько форм из числа форм A, B, C, D, E, F, G, H, I и J, или аморфную форму, или одну, или несколько из их фармацевтически приемлемых солей, сольватов или гидратов.
В некоторых вариантах осуществления, полиморфную форму соединения формулы (I) можно получить растворением исходного соединения формулы (I) (например, другой полиморфной формы, аморфной формы или соли, сольвата, или гидрата любого из этих химических соединений) в растворителе. В некоторых вариантах осуществления, количество растворителя может быть минимальным количеством, необходимым для растворения исходного соединения формулы (I), либо при комнатной, либо при повышенной температуре. Раствор необязательно можно профильтровать. В некоторых случаях, к раствору может быть добавлен антирастворитель (например, растворитель, в котором исходное соединение растворимо в меньшей степени, чем в первом растворителе). В случае повышенной температуры раствора, раствор можно охлаждать относительно быстро (что в настоящей заявке именуется «быстрым охлаждением»), путем, например, выдерживания раствора примерно при +4°C в течение ночи. Другой способ может включать охлаждение раствора до комнатной температуры со скоростью примерно 20°C/час (что именуется в настоящей заявке «медленным охлаждением»), после чего раствору необязательно дают прийти в тепловое равновесие в течение ночи при комнатной температуре (с перемешиванием или без перемешивания). В некоторых вариантах осуществления, поверхность раствора можно скрести устройствами, известными в технике, например, но не ограничиваясь этим, шпателем. В других вариантах осуществления, раствор можно концентрировать способами, известными в технике, например, в вакууме или пропусканием тока газа (инертного газа, например, аргона или азота; воздуха, CO2 и т.д.), и, в некоторых случаях, упаривать досуха. Твердые вещества, полученные с помощью этих способов или их вариантов, можно выделять, например, фильтрованием или декантацией оставшейся жидкости. Идентификация полученной полиморфной формы соединения формулы (I) или его соли, сольвата или гидрата, может быть осуществлена любым способом (например, XRPD, DSC, TGA и т.д.), описанным в настоящей заявке и известным в технике.
Форма A
В одном из вариантов осуществления, полиморф по настоящему изобретению представляет собой форму A соединения формулы (I).
На Фиг.1 показана типовая картина дифракции рентгеновских лучей на порошке (XRPD) для полиморфной формы A.
В одном из вариантов осуществления, полиморфная форма A может быть охарактеризована любыми одним, двумя, тремя, четырьмя, пятью, шестью, семью, восемью, девятью, десятью или большим количеством значимых пиков, изображенных на Фиг.1. В одном из вариантов осуществления, полиморфную форму A можно охарактеризовать наличием, по меньшей мере, одного пика на рентгенограмме XRPD, выбранного из пиков при углах 2Θ =9,6°(±0,2°), 12,2°(±0,2°) и 18,3°(±0,2°). В одном из вариантов осуществления, полиморфную форму A можно охарактеризовать наличием на рентгенограмме XRPD, по меньшей мере, одного пика, выбранного из пиков при углах 2Θ =9,6°(±0,2°), 12,2°(±0,2°) и 18,3°(±0,2°) в комбинации с, по меньшей мере, одним пиком на рентгенограмме XRPD, выбранным из пиков при углах 2Θ =15,6°(±0,2°) и 19,2°(±0,2°). В другом варианте осуществления, полиморфную форму A можно охарактеризовать наличием на рентгенограмме XRPD, по меньшей мере, одного пика, выбранного из пиков при углах 2Θ =9,6°(±0,2°), 12,2°(±0,2°), 15,6°(±0,2°), 18,3°(±0,2°) и 19,2°(±0,2°) в комбинации с, по меньшей мере, одним пиком на рентгенограмме XRPD, выбранным из пиков при углах 2Θ =9,1°(±0,2°), 9,4°(±0,2°), 12,4°(±0,2°), 14,8°(±0,2°), 16,3°(±0,2°), 17,7°(±0,2°), 21,1°(±0,2°), 21,9°(±0,2°), 24,0°(±0,2°) и 26,9°(±0,2°). В одном из вариантов осуществления, полиморфную форму A можно охарактеризовать наличием на рентгенограмме XRPD практически всех пиков, показанных на Фиг.1.
На Фиг.12 и 22 показана термограмма дифференциальной сканирующей калориметрии (DSC) для полиморфной формы A. В некоторых вариантах осуществления, полиморфную форму A можно охарактеризовать наличием эндотермического пика при температуре примерно 238°C или примерно 239°C. В другом варианте осуществления, полиморфную форму A можно охарактеризовать наличием эндотермического пика при температуре примерно 238°C или примерно 239°C, а также эндотермического пика примерно при 280°C.
На Фиг.22 показаны данные термогравиметрического анализа (TGA) для полиморфной формы A. Отсутствие характерных элементов на кривой TGA указывает на отсутствие значительной потери массы при нагревании.
В некоторых вариантах осуществления, форму A можно получать кристаллизацией при быстром или медленном охлаждении из систем с одним растворителем, полученных путем растворения формы C в этом растворителе, в число которых входят, но не ограничиваясь этим, ацетонитрил и н-бутанол. В некоторых вариантах осуществления, форму A можно получить кристаллизацией из системы с двумя растворителями, включающей этилацетат и гексан. В других вариантах осуществления, форму A можно получать при быстром или медленном охлаждении из системы с двумя растворителями, полученной растворением формы C в таком растворителе, как, но не ограничиваясь перечисленными, ацетон, метилэтилкетон, ДМФА, диоксан, с последующим добавлением антирастворителя, например, но не ограничиваясь этим, дихлорметана. В одном из вариантов осуществления, форму A можно также получать из суспензий в дихлорметане, ацетонитриле, этаноле и/или изопропиловом спирте. В одном из вариантов осуществления, форму A можно получать из суспензии формы C, формы D и/или формы E в ацетонитриле.
В одном из вариантов осуществления, форму A получают ресуспендированием одного или нескольких полиморфов, не являющихся формой A, в безводном растворителе. В одном из вариантов осуществления, полиморфы, не являющиеся формой A, включают, не ограничиваясь этим, форму B, форму C, форму D, форму E, форму F, форму G, форму H, форму I, форму J, аморфную форму и их смеси. Например, в одном из вариантов осуществления, форму A можно получать ресуспендированием одного или нескольких полиморфов, не являющихся формой A (например, но не ограничиваясь этим, формы C или аморфной формы), например, в хлороформе, дихлорметане, изопропиловом спирте, этаноле или их смеси. В другом варианте осуществления, форму A можно получать ресуспендированием смеси формы A, формы B и формы C в ацетонитриле. В одном из вариантов осуществления, форму A можно получать ресуспендированием смеси формы A, формы C, формы D и формы E в изопропаноле. В одном из вариантов осуществления, форму A можно получать кристаллизацией из системы нескольких растворителей. В одном из вариантов осуществления, форма A может быть безводной.
Форма B
В одном из вариантов осуществления, полиморф по настоящему изобретению представляет собой форму B соединения формулы (I).
На Фиг.2 показана типовая рентгенограмма XRPD полиморфной формы B.
В одном из вариантов осуществления, полиморфная форма B может быть охарактеризована любыми одним, двумя, тремя, четырьмя, пятью, шестью, семью, восемью, девятью, десятью или большим количеством значимых пиков, изображенных на Фиг.2. В одном из вариантов осуществления, полиморфную форму B можно охарактеризовать наличием на рентгенограмме XRPD, по меньшей мере, одного пика, выбранного из пиков при углах 2Θ =7,9°(±0,2°), 13,4°(±0,2°) и 23,4°(±0,2°). В одном из вариантов осуществления, полиморфную форму B можно охарактеризовать наличием на рентгенограмме XRPD, по меньшей мере, одного пика, выбранного из пиков при углах 2Θ =7,9°(±0,2°), 13,4°(±0,2°) и 23,4°(±0,2°) в комбинации с, по меньшей мере, одним пиком на рентгенограмме XRPD, выбранным из пиков при углах 2Θ =14,0°(±0,2°) и 15,0°(±0,2°). В другом варианте осуществления, полиморфную форму B можно охарактеризовать наличием на рентгенограмме XRPD, по меньшей мере, одного пика, выбранного из пиков при углах 2Θ =7,9°(±0,2°), 13,4°(±0,2°), 14,0°(±0,2°), 15,0°(±0,2°) и 23,4°(±0,2°) в комбинации с, по меньшей мере, одним пиком на рентгенограмме XRPD, выбранным из пиков при углах 2Θ =9,5°(±0,2°), 12,7°(±0,2°), 13,6°(±0,2°), 14,2°(±0,2°), 15,7°(±0,2°), 19,0°(±0,2°), 22,3°(±0,2°), 24,2°(±0,2°), 24,8°(±0,2°) и 26,9°(±0,2°). В одном из вариантов осуществления, полиморфную форму B можно охарактеризовать наличием на рентгенограмме XRPD практически всех пиков, показанных на Фиг.2.
На Фиг.13 показана термограмма дифференциальной сканирующей калориметрии (DSC) полиморфной формы B. В некоторых вариантах осуществления, полиморфную форму B можно охарактеризовать наличием эндотермического пика при температуре примерно 280°C-283°C. В одном из вариантов осуществления, эндотермический пик на термограмме DSC находится примерно при 281°C. В одном из вариантов осуществления, эндотермический пик на термограмме DSC находится примерно при 282°C. В одном из вариантов осуществления, эндотермический пик на термограмме DSC находится примерно при 283°C.
В некоторых вариантах осуществления, форму B можно получить из формы A путем изотермического выдерживания при температуре примерно 250°C с последующим охлаждением до комнатной температуры. В одном из вариантов осуществления, форму B можно получить из формы C по аналогичной методике термической конверсии. В некоторых вариантах осуществления, форму B получают термической конверсией из полиморфа, не являющегося формой B, например, но не ограничиваясь этим, формы A, формы C, формы D, формы E, формы F, формы G, формы H, формы I, формы J, аморфной формы и их смесей. В одном из вариантов осуществления, форма B может быть безводной.
Форма C
В одном из вариантов осуществления, полиморф по настоящему изобретению представляет собой форму C соединения формулы (I).
На Фиг.3 показана типовая рентгенограмма XRPD полиморфной формы C.
В одном из вариантов осуществления, полиморфная форма C может быть охарактеризована любыми одним, двумя, тремя, четырьмя, пятью, шестью, семью, восемью, девятью, десятью или большим количеством значимых пиков, изображенных на Фиг.3. В одном из вариантов осуществления, полиморфную форму C можно охарактеризовать наличием, по меньшей мере, одного пика на рентгенограмме XRPD, выбранного из пиков при углах 2Θ =10,5°(±0,2°), 13,7°(±0,2°) и 24,5°(±0,2°). В другом варианте осуществления, полиморфную форму C можно охарактеризовать наличием на рентгенограмме XRPD, по меньшей мере, одного пика, выбранного из пиков при углах 2Θ =10,4°(±0,2°), 13,3°(±0,2°) и 24,3°(±0,2°). В одном из вариантов осуществления, полиморфную форму C можно охарактеризовать наличием на рентгенограмме XRPD, по меньшей мере, одного пика, выбранного из пиков при углах 2Θ =10,4°(±0,2°), 13,3°(±0,2°) и 24,3°(±0,2°) в комбинации с, по меньшей мере, одним пиком на рентгенограмме XRPD, выбранным из пиков при углах 2Θ =6,6°(±0,2°) и 12,5°(±0,2°). В другом варианте осуществления, полиморфную форму C можно охарактеризовать наличием на рентгенограмме XRPD, по меньшей мере, одного пика, выбранного из пиков при углах 2Θ =6,6°(±0,2°), 10,4°(±0,2°), 12,5°(±0,2°), 13,3°(±0,2°) и 24,3°(±0,2°) в комбинации с, по меньшей мере, одним пиком на рентгенограмме XRPD, выбранным из пиков при углах 2Θ =8,8°(±0,2°), 9,9°(±0,2°), 13,4°(±0,2°), 15,5°(±0,2°), 16,9°(±0,2°), 19,8°(±0,2°), 21,3°(±0,2°), 23,6°(±0,2°), 25,3°(±0,2°) и 27,9°(±0,2°). В одном из вариантов осуществления, полиморфную форму C можно охарактеризовать наличием в рентгенограмме XRPD практически всех пиков, показанных на Фиг.3.
На Фиг.14 и 23 показана типовая термограмма дифференциальной сканирующей калориметрии (DSC) полиморфной формы C. В некоторых вариантах осуществления, полиморфную форму C можно охарактеризовать наличием эндотермического пика при температуре примерно 203°C. В некоторых вариантах осуществления, полиморфную форму C можно охарактеризовать наличием эндотермического пика при температуре примерно 206°C или примерно 208°C. В другом варианте осуществления, полиморфную форму C можно охарактеризовать наличием эндотермического пика в диапазоне от примерно 203°C до примерно 208°C, по меньшей мере, одного пика, выбранного из экзотермического пика в диапазоне от примерно 251°C до примерно 254°C, и эндотермического пика в диапазоне от примерно 281°C до примерно 283°C. В одном из вариантов осуществления, полиморфную форму C можно охарактеризовать наличием эндотермического пика примерно при 208°C, экзотермического пика примерно 254°C и эндотермического пика примерно при 283°C. Изменчивость положения пиков находится в пределах, ожидаемых при использовании данной методики термографического анализа, как показано ниже в разделе примеров. Например, на положение пика, среди прочих факторов, известных в технике, могут влиять методика приготовления образца, скорость роста температуры и применяемый прибор.
В некоторых вариантах осуществления, полиморфную форму C можно охарактеризовать термогравиметрическим анализом (TGA). В одном из вариантов осуществления, можно наблюдать потерю массы примерно 1,7 масс.% приблизительно при 80°C и потерю массы примерно 0,2 масс.% приблизительно при 190°C.
В некоторых вариантах осуществления, форму C получают в смеси с полиморфами, не являющимися формой C, например, но не ограничиваясь этим, с формой A, формой B, формой D, формой E, формой F, формой G, формой H, формой I, формой J, аморфной формой и их смесями. Например, в некоторых вариантах осуществления, форма C является композицией, дополнительно включающей один или несколько полиморфов, не являющихся формой C. Количество полиморфов, не являющихся формой C, в этой композиции может меняться. Например, в некоторых вариантах осуществления, массовое соотношение между полиморфной формой C и общим количеством одной или нескольких полиморфных форм, не являющихся формой C, превышает примерно 7:1, превышает примерно 8:1, превышает примерно 9:1, превышает примерно 9,5:1 или превышает примерно 99:1. Аналогично, при включении в состав фармацевтических композиций, могут присутствовать различные количества полиморфных форм, не являющихся формой C. В некоторых вариантах осуществления, массовое соотношение между полиморфной формой C и общим количеством одной или нескольких полиморфных форм, не являющихся формой C, в фармацевтической композиции превышает примерно 7:1, превышает примерно 8:1, превышает примерно 9:1, превышает примерно 9,5:1 или превышает примерно 99:1.
В некоторых вариантах осуществления, форму C получают в результате непосредственной обработки реакционной смеси, образующейся на стадии получения соединения формулы (I), причем не являющихся формой С не получают, или получают в качестве второстепенных компонентов. В некоторых вариантах осуществления, конечная обработка реакционной смеси включает применение воды для удаления всех растворимых солей, образовавшихся во время реакции. В некоторых вариантах осуществления, можно добавлять кристаллические затравки, чтобы избежать или уменьшить образование соединения формулы (I) в виде масла. Могут применяться кристаллические затравки любой формы. В одном из вариантов осуществления, кристаллическая затравка представляет собой кристаллы полиморфной формы C. В некоторых вариантах осуществления, одну или несколько полиморфных форм, не являющихся формой C, получают с выделением и/или очисткой или без них, и затем превращают одну или несколько форм, не являющихся формой C, в форму C.
В некоторых вариантах осуществления, форму C получают, помещая форму A в воду с образованием суспензии, примерно на 18-24 часа, или до превращения определенного количества формы A в форму C. В некоторых вариантах осуществления, форму C получают, помещая форму A в воду или систему растворителя, содержащую воду. При действии воды или системы растворителя, содержащей воду, комбинация может образовывать суспензию. Комбинацию формы A и воды или системы растворителя, содержащей воду, можно перемешивать, необязательно при нагревании, до тех пор, пока она не превратится в форму C. В некоторых вариантах осуществления, форму A подвергают действию воды, исключая из системы другие растворители. В некоторых вариантах осуществления, форму C можно получать суспендированием формы D и/или формы E в воде. В некоторых вариантах осуществления, форму C можно получать суспендированием смеси формы A, формы C, формы D, и формы E в воде. В одном из вариантов осуществления, форму C можно получать суспендированием смеси формы B и формы C в воде.
В некоторых вариантах осуществления, система растворителя представляет собой смесь спирта C1-C6 с водой. В некоторых вариантах осуществления, система растворителя состоит из смешивающегося с водой спирта и воды. В некоторых вариантах осуществления, система состоит из неспиртового смешивающегося с водой растворителя и воды. В некоторых вариантах осуществления, форму C получают при быстром или медленном охлаждении из системы с двумя растворителями, включающей, не ограничиваясь этим, этанол, изопропиловый спирт, тетрагидрофуран, ацетон, диоксан, NMP, DME и ДМФА в качестве первого растворителя, а также антирастворитель, например, но не ограничиваясь этим, воду. В некоторых вариантах осуществления, система растворителя состоит из этанола или 2-пропанола и воды. В некоторых вариантах осуществления, форму C можно получать суспендированием смеси формы A, формы B и формы C в этаноле и воде.
Если в дополнение к воде применяется растворитель, то соотношение между растворителем и водой может меняться от примерно 100/1 до примерно 1/100. Например, соотношение между растворителем и водой можно выбрать из примерно 100/1, примерно 90/1, примерно 80/1, примерно 70/1, примерно 60/1, примерно 50/1, примерно 40/1, примерно 30/1, примерно 20/1, примерно 10/1, примерно 9/1, примерно 8/1, примерно 7/1, примерно 6/1, примерно 5/1, примерно 4/1, примерно 3/1, примерно 2/1, примерно 1,5/1, примерно 1/1, примерно 1/1,5, примерно 1/2, примерно 1/3, примерно 1/4, примерно 1/5, примерно 1/6, примерно 1/7, примерно 1/8, примерно 1/9, примерно 1/10, примерно 1/20, примерно 1/30, примерно 1/40, примерно 1/50, примерно 1/60, примерно 1/70, примерно 1/80, примерно 1/90 и примерно 1/100. В некоторых вариантах осуществления, отношение этанола или изопропилового спирта к воде может составлять примерно 7/4, примерно 9/7, примерно 7/10 и т.п. Общее количество растворителя или системы растворителей может быть выбрано из примерно 0,1 объема (например, литров/кг), примерно 0,5 объемов, примерно 1 объема, примерно 2 объемов, примерно 3 объемов, примерно 4 объемов, примерно 5 объемов, примерно 6 объемов, примерно 7 объемов, примерно 8 объемов, примерно 9 объемов, примерно 10 объемов, примерно 11 объемов, примерно 12 объемов, примерно 13 объемов, примерно 14 объемов, примерно 15 объемов, примерно 16 объемов, примерно 17 объемов, примерно 18 объемов, примерно 19 объемов, примерно 20 объемов, примерно 30 объемов, примерно 40 объемов, примерно 50 объемов или более. В некоторых вариантах осуществления, система растворителей является смесью этанол/вода. В некоторых вариантах осуществления, система растворителей является смесью изопропиловый спирт/вода.
В некоторых вариантах осуществления, способ получения формы C включает получение суспензии формы C в дихлорметане, что приводит к превращению полиморфной формы C в полиморфную форму A. После выделения твердого вещества фильтрованием, полиморфную форму A можно добавить к воде с образованием суспензии. После перемешивания в течение определенного периода времени (например, примерно 3-12 часов), суспензию можно отфильтровать, и выделить полиморфную форму C.
В некоторых вариантах осуществления, форму C получают перекристаллизацией формы, не являющейся формой C, которая включает полное растворение формы, не являющейся формой C, с последующим фильтрованием для удаления всех нерастворимых частиц, за которым следует кристаллизация с получением формы C. В некоторых вариантах осуществления, не проводят полного растворения и фильтрования, и в этом случае образуется суспензия, которая превращается в форму C без полного растворения одной или нескольких форм, не являющихся формой C. В одном из вариантов осуществления, форму C можно получить кристаллизацией из системы с несколькими растворителями. В некоторых вариантах осуществления, форма C демонстрирует лучшую сыпучесть, чем форма A. В некоторых вариантах осуществления, форма C является канальным гидратом.
Форма D
В одном из вариантов осуществления, полиморф по настоящему изобретению представляет собой форму D соединения формулы (I).
На Фиг.4 показана типовая рентгенограмма XRPD полиморфной формы D.
В одном из вариантов осуществления, полиморфная форма D может быть охарактеризована любыми одним, двумя, тремя, четырьмя, пятью, шестью, семью, восемью, девятью, десятью или большим количеством значимых пиков, изображенных на Фиг.4. В одном из вариантов осуществления, полиморфную форму D можно охарактеризовать наличием на рентгенограмме XRPD, по меньшей мере, одного пика, выбранного из пиков при углах 2Θ =11,4°(±0,2°), 17,4°(±0,2°) и 22,9°(±0,2°). В одном из вариантов осуществления, полиморфную форму D можно охарактеризовать наличием на рентгенограмме XRPD, по меньшей мере, одного пика, выбранного из пиков при углах 2Θ =11,4°(±0,2°), 17,4°(±0,2°) и 22,9°(±0,2°) в комбинации с, по меньшей мере, одним пиком на рентгенограмме XRPD, выбранным из пиков при углах 2Θ =9,2°(±0,2°) и 18,3°(±0,2°). В другом варианте осуществления, полиморфную форму D можно охарактеризовать наличием на рентгенограмме XRPD, по меньшей мере, одного пика, выбранного из пиков при углах 2Θ =9,2°(±0,2°), 11,4°(±0,2°), 17,4°(±0,2°), 18,3°(±0,2°) и 22,9°(±0,2°) в комбинации с, по меньшей мере, одним пиком на рентгенограмме XRPD, выбранным из пиков при углах 2Θ =9,8°(±0,2°), 12,2°(±0,2°), 15,8°(±0,2°), 16,2°(±0,2°), 16,8°(±0,2°), 18,9°(±0,2°), 19,9°(±0,2°), 20,0°(±0,2°), 24,9°(±0,2°) и 29,3°(±0,2°). В одном из вариантов осуществления, полиморфную форму D можно охарактеризовать наличием на рентгенограмме XRPD практически всех пиков, показанных на Фиг.4.
На Фиг.15 показана термограмма дифференциальной сканирующей калориметрии (DSC) полиморфной формы D. В некоторых вариантах осуществления, полиморфную форму D можно охарактеризовать наличием эндотермического пика при температуре примерно 260°С. В другом варианте осуществления, полиморфную форму D можно охарактеризовать наличием эндотермического пика при температуре примерно 260°C, а также эндотермического пика при температуре примерно 283°C.
В некоторых вариантах осуществления, полиморфную форму D можно охарактеризовать термогравиметрическим анализом (TGA). В одном из вариантов осуществления, потеря массы примерно 0,2 масс.% может наблюдаться примерно при 150°C.
В некоторых вариантах осуществления, форму D можно получать кристаллизацией при быстром охлаждении из системы с одним растворителем, включая, но не ограничиваясь этим, тетрагидрофуран, метилэтилкетон, диоксан или диметилформамид. В некоторых вариантах осуществления, форму D можно получать кристаллизацией при медленном охлаждении из системы с одним растворителем, включая, но не ограничиваясь этим, тетрагидрофуран, метилэтилкетон или диоксан. В одном из вариантов осуществления, форму D можно получать суспендированием формы C и/или формы E в метилэтилкетоне. В одном из вариантов осуществления, форму D можно получать суспендированием смеси формы A, формы B и формы C в метилэтилкетоне. В другом варианте осуществления, форму D можно получать суспендированием смеси формы B и формы D в метилэтилкетоне.
В некоторых вариантах осуществления, форму D можно получать кристаллизацией при быстром охлаждении из системы с двумя растворителями, которая включает, например, тетрагидрофуран, диоксан или ДМФА в качестве основного растворителя, а также антирастворитель, например, но не ограничиваясь этим, MTBE. В некоторых вариантах осуществления, форму D можно получать кристаллизацией при быстром охлаждении из системы с двумя растворителями, которая включает, например, тетрагидрофуран, изопропанол или ДМФА в качестве основного растворителя, а также антирастворитель, например, но не ограничиваясь этим, толуол. В некоторых вариантах осуществления, форму D можно получать кристаллизацией при быстром охлаждении из системы с двумя растворителями, которая включает, например, тетрагидрофуран в качестве основного растворителя и дихлорметан в качестве антирастворителя. В некоторых вариантах осуществления, форму D можно получать кристаллизацией при медленном охлаждении из системы с двумя растворителями, которая включает, например, метилэтилкетон или ДМФА в качестве основного растворителя и MTBE в качестве антирастворителя. В некоторых вариантах осуществления, форму D можно получать кристаллизацией при медленном охлаждении из системы с двумя растворителями, которая включает, например, тетрагидрофуран или DME в качестве основного растворителя и дихлорметан в качестве антирастворителя. В некоторых вариантах осуществления, форму D можно получать кристаллизацией при медленном охлаждении из системы с двумя растворителями, которая включает, например, изопропанол, NNP или DME в качестве основного растворителя и толуол в качестве антирастворителя.
В одном из вариантов осуществления, форму D можно получать кристаллизацией из системы с несколькими растворителями. В некоторых вариантах осуществления, форму D можно получать суспендированием в метилэтилкетоне полиморфа, не являющегося формой D, например, но не ограничиваясь этим, форм A, B, C или E. В одном из вариантов осуществления, форма D может быть безводной.
Форма E
В одном из вариантов осуществления, полиморф по настоящему изобретению представляет собой форму E соединения формулы (I).
На Фиг.5 показана типовая рентгенограмма XRPD полиморфной формы E.
В одном из вариантов осуществления, полиморфная форма E может быть охарактеризована любыми одним, двумя, тремя, четырьмя, пятью, шестью, семью, восемью, девятью, десятью или большим количеством значимых пиков, изображенных на Фиг.5. В одном из вариантов осуществления, полиморфную форму E можно охарактеризовать наличием на рентгенограмме XRPD, по меньшей мере, одного пика, выбранного из пиков при углах 2Θ =6,7°(±0,2°), 9,3°(±0,2°) и 24,4°(±0,2°). В одном из вариантов осуществления, полиморфную форму E можно охарактеризовать наличием на рентгенограмме XRPD, по меньшей мере, одного пика, выбранного из пиков при углах 2Θ =6,7°(±0,2°), 9,3°(±0,2°) и 24,4°(±0,2°) в комбинации с, по меньшей мере, одним пиком на рентгенограмме XRPD, выбранным из пиков при углах 2Θ =12,7°(±0,2°) и 13,9°(±0,2°). В другом варианте осуществления, полиморфную форму E можно охарактеризовать наличием на рентгенограмме XRPD, по меньшей мере, одного пика, выбранного из пиков при углах 2Θ =6,7°(±0,2°), 9,3°(±0,2°), 12,7°(±0,2°), 13,9°(±0,2°) и 24,4°(±0,2°) в комбинации с, по меньшей мере, одним пиком на рентгенограмме XRPD, выбранным из пиков при углах 2Θ =12,4°(±0,2°), 13,3°(±0,2°), 14,3°(±0,2°), 15,5°(±0,2°), 17,4°(±0,2°), 18,5°(±0,2°), 22,0°(±0,2°), 23,9°(±0,2°), 24,1°(±0,2°) и 26,4°(±0,2°). В одном из вариантов осуществления, полиморфную форму E можно охарактеризовать наличием на рентгенограмме XRPD практически всех пиков, показанных на Фиг.5.
На Фиг.16 показана термограмма дифференциальной сканирующей калориметрии (DSC) полиморфной формы E. В некоторых вариантах осуществления, полиморфную форму E можно охарактеризовать наличием эндотермического пика при температуре примерно 131°С, эндотермического пика при температуре примерно 263°С, экзотермического пика при температуре примерно 267°С и эндотермического пика при температуре примерно 282°С.
В некоторых вариантах осуществления, полиморфную форму E можно охарактеризовать термогравиметрическим анализом (TGA). В одном из вариантов осуществления, потеря массы примерно 0,7 масс.% может наблюдаться примерно при 80°C, и потеря массы примерно 1,3 масс.% может наблюдаться примерно при 130°C.
В некоторых вариантах осуществления, форму E можно получать из формы A путем кристаллизации при медленном охлаждении из системы с одним растворителем, которым является, например, метанол. В некоторых вариантах осуществления, форму E можно получать кристаллизацией при быстром или медленном охлаждении из системы с двумя растворителями, включающей, например, метанол в качестве основного растворителя и воду в качестве антирастворителя. В одном из вариантов осуществления, форму E можно получать кристаллизацией из системы с несколькими растворителями. В одном из вариантов осуществления, форма E может быть безводной.
Форма F
В одном из вариантов осуществления, полиморф по настоящему изобретению представляет собой форму F соединения формулы (I).
На Фиг.6 показана типовая рентгенограмма XRPD полиморфной формы F.
В одном из вариантов осуществления, полиморфная форма F может быть охарактеризована любыми одним, двумя, тремя, четырьмя, пятью, шестью, семью, восемью, девятью, десятью или большим количеством значимых пиков, изображенных на Фиг.6. В одном из вариантов осуществления, полиморфную форму F можно охарактеризовать наличием на рентгенограмме XRPD, по меньшей мере, одного пика, выбранного из пиков при углах 2Θ =9,6°(±0,2°), 17,3°(±0,2°) и 24,6°(±0,2°). В одном из вариантов осуществления, полиморфную форму F можно охарактеризовать наличием на рентгенограмме XRPD, по меньшей мере, одного пика, выбранного из пиков при углах 2Θ =9,6°(±0,2°), 17,3°(±0,2°) и 24,6°(±0,2°) в комбинации с, по меньшей мере, одним пиком на рентгенограмме XRPD, выбранным из пиков при углах 2Θ =14,0°(±0,2°) и 19,2°(±0,2°). В другом варианте осуществления, полиморфную форму F можно охарактеризовать наличием на рентгенограмме XRPD, по меньшей мере, одного пика, выбранного из пиков при углах 2Θ =9,6°(±0,2°), 14,0°(±0,2°), 17,3°(±0,2°), 19,2°(±0,2°) и 24,6°(±0,2°) в комбинации с, по меньшей мере, одним пиком на рентгенограмме XRPD, выбранным из пиков при углах 2Θ =12,4°(±0,2°), 16,1°(±0,2°), 16,6°(±0,2°), 17,1°(±0,2°), 20,8°(±0,2°), 21,5°(±0,2°), 22,0°(±0,2°), 24,3°(±0,2°), 25,2°(±0,2°) и 25,4°(±0,2°). В одном из вариантов осуществления, полиморфную форму F можно охарактеризовать наличием на рентгенограмме XRPD практически всех пиков, показанных на Фиг.6.
На Фиг.17 и 24 показана типовая термограмма дифференциальной сканирующей калориметрии (DSC) формы F. В некоторых вариантах осуществления, полиморфную форму F можно охарактеризовать наличием эндотермического пика при температуре примерно 181°С, эндотермического пика при температуре примерно 160°С, экзотермического пика при температуре примерно 266°С и эндотермического пика при температуре примерно 282°С.
На Фиг.24 показаны данные термогравиметрического анализа (TGA) для полиморфной формы F. В некоторых вариантах осуществления, полиморфную форму F можно охарактеризовать TGA. В одном из вариантов осуществления, потеря массы примерно 15,8 масс.% может наблюдаться примерно при 150°C, и потеря массы примерно 2,8 масс.% может наблюдаться примерно при 180°C.
В некоторых вариантах осуществления, форму F можно получать кристаллизацией при быстром охлаждении из системы с двумя растворителями, включающей, например, NMP в качестве основного растворителя и MTBE в качестве антирастворителя. В некоторых вариантах осуществления, форму F можно получать кристаллизацией при медленном охлаждении из системы с двумя растворителями, включающей, например, NMP в качестве основного растворителя и MTBE в качестве антирастворителя. В некоторых вариантах осуществления, форма F является NMP сольватом. В некоторых вариантах осуществления, MTBE может присутствовать в качестве антирастворителя. В одном из вариантов осуществления, форму F можно получать кристаллизацией из системы с несколькими растворителями.
Форма G
В одном из вариантов осуществления, полиморф по настоящему изобретению представляет собой форму G соединения формулы (I).
На Фиг.7 показана типовая рентгенограмма XRPD полиморфной формы G.
В одном из вариантов осуществления, полиморфная форма G может быть охарактеризована любыми одним, двумя, тремя, четырьмя, пятью, шестью, семью, восемью, девятью, десятью или большим количеством значимых пиков, изображенных на Фиг.7. В одном из вариантов осуществления, полиморфную форму G можно охарактеризовать наличием на рентгенограмме XRPD, по меньшей мере, одного пика, выбранного из пиков при углах 2Θ =6,7°(±0,2°), 9,5°(±0,2°) и 19,0°(±0,2°). В одном из вариантов осуществления, полиморфную форму G можно охарактеризовать наличием на рентгенограмме XRPD, по меньшей мере, одного пика, выбранного из пиков при углах 2Θ =6,7°(±0,2°), 9,5°(±0,2°) и 19,0°(±0,2°) в комбинации с, по меньшей мере, одним пиком на рентгенограмме XRPD, выбранным из пиков при углах 2 Θ=10,6°(±0,2°) и 19,6°(±0,2°). В другом варианте осуществления, полиморфную форму G можно охарактеризовать наличием на рентгенограмме XRPD, по меньшей мере, одного пика, выбранного из пиков при углах 2Θ =6,7°(±0,2°), 9,5°(±0,2°), 10,6°(±0,2°), 19,0°(±0,2°) и 19,6°(±0,2°) в комбинации с, по меньшей мере, одним пиком на рентгенограмме XRPD, выбранным из пиков при углах 2Θ =13,4°(±0,2°), 15,0°(±0,2°), 15,8°(±0,2°), 17,8°(±0,2°), 20,7°(±0,2°), 21,2°(±0,2°), 22,8°(±0,2°), 23,8°(±0,2°), 24,3°(±0,2°) и 25,6°(±0,2°). В одном из вариантов осуществления, полиморфную форму G можно охарактеризовать наличием на рентгенограмме XRPD практически всех пиков, показанных на Фиг.7.
На Фиг.18 показана термограмма дифференциальной сканирующей калориметрии (DSC) полиморфной формы G. В некоторых вариантах осуществления, полиморфную форму G можно охарактеризовать наличием эндотермического пика при температуре примерно 162°С. В других вариантах осуществления, полиморфную форму G можно охарактеризовать наличием эндотермического пика при температуре примерно 162°С, экзотермического пика при температуре примерно 241°С и эндотермического пика при температуре примерно 281°С.
В некоторых вариантах осуществления, полиморфную форму G можно охарактеризовать с помощью термогравиметрического анализа (TGA). В одном из вариантов осуществления, потеря массы примерно 18,5 масс.% может наблюдаться примерно при 160°C.
В некоторых вариантах осуществления, форму G можно получать кристаллизацией при быстром охлаждении из системы с двумя растворителями, включающей, например, этанол, изопропиловый спирт или метанол в качестве основного растворителя. В некоторых вариантах осуществления, MTBE может присутствовать в качестве антирастворителя. В одном из вариантов осуществления, форма G является MTBE сольватом. В одном из вариантов осуществления, форму G можно получать кристаллизацией из системы с несколькими растворителями.
Форма H
В одном из вариантов осуществления, полиморф по настоящему изобретению представляет собой форму H соединения формулы (I).
На Фиг.8 показана типовая рентгенограмма XRPD полиморфной формы H.
В одном из вариантов осуществления, полиморфная форма H может быть охарактеризована любыми одним, двумя, тремя, четырьмя, пятью, шестью, семью, восемью, девятью, десятью или большим количеством значимых пиков, изображенных на Фиг.8. В одном из вариантов осуществления, полиморфную форму H можно охарактеризовать наличием на рентгенограмме XRPD, по меньшей мере, одного пика, выбранного из пиков при углах 2Θ =8,9°(±0,2°), 9,2°(±0,2°) и 14,1°(±0,2°). В одном из вариантов осуществления, полиморфную форму H можно охарактеризовать наличием на рентгенограмме XRPD, по меньшей мере, одного пика, выбранного из пиков при углах 2Θ =8,9°(±0,2°), 9,2°(±0,2°) и 14,1°(±0,2°) в комбинации с, по меньшей мере, одним пиком на рентгенограмме XRPD, выбранным из пиков при углах 2Θ =17,3°(±0,2°) и 18,5°(±0,2°). В другом варианте осуществления, полиморфную форму H можно охарактеризовать наличием на рентгенограмме XRPD, по меньшей мере, одного пика, выбранного из пиков при углах 2Θ =8,9°(±0,2°), 9,2°(±0,2°), 14,1°(±0,2°), 17,3°(±0,2°) и 18,5°(±0,2°) в комбинации с, по меньшей мере, одним пиком на рентгенограмме XRPD, выбранным из пиков при углах 2Θ =7,1°(±0,2°), 10,6°(±0,2°), 11,3°(±0,2°), 11,6°(±0,2°), 16,2°(±0,2°), 18,3°(±0,2°), 18,8°(±0,2°), 20,3°(±0,2°), 21,7°(±0,2°) и 24,7°(±0,2°). В одном из вариантов осуществления, полиморфную форму H можно охарактеризовать наличием на рентгенограмме XRPD практически всех пиков, показанных на Фиг.8.
На Фиг.19 показана термограмма дифференциальной сканирующей калориметрии (DSC) полиморфной формы H. В некоторых вариантах осуществления, полиморфную форму H можно охарактеризовать наличием эндотермического пика при температуре примерно 128°С и эндотермического пика при температуре примерно 258°С. В других вариантах осуществления, полиморфную форму H можно охарактеризовать наличием эндотермического пика при температуре примерно 128°С, эндотермического пика при температуре примерно 258°С и эндотермического пика при температуре примерно 282°С.
В некоторых вариантах осуществления, полиморфную форму H можно охарактеризовать с помощью термогравиметрического анализа (TGA). В одном из вариантов осуществления, потеря массы примерно 7,5 масс.% может наблюдаться примерно при 130°C.
В некоторых вариантах осуществления, форму H можно получать кристаллизацией при медленном охлаждении из системы с двумя растворителями, включающей, например, диоксан в качестве основного растворителя и антирастворитель, например, но не ограничиваясь этим, MTBE. В одном из вариантов осуществления, форма H является MTBE сольватом. В одном из вариантов осуществления, форму H можно получать кристаллизацией из системы с несколькими растворителями.
Форма I
В одном из вариантов осуществления, полиморф по настоящему изобретению представляет собой форму I соединения формулы (I).
На Фиг.9 показана типовая рентгенограмма XRPD полиморфной формы I.
В одном из вариантов осуществления, полиморфная форма I может быть охарактеризована любыми одним, двумя, тремя, четырьмя, пятью, шестью, семью, восемью, девятью, десятью или большим количеством значимых пиков, изображенных на Фиг.9. В одном из вариантов осуществления, полиморфную форму I можно охарактеризовать наличием на рентгенограмме XRPD, по меньшей мере, одного пика, выбранного из пиков при углах 2Θ =9,7°(±0,2°), 19,3°(±0,2°) и 24,5°(±0,2°). В одном из вариантов осуществления, полиморфную форму I можно охарактеризовать наличием на рентгенограмме XRPD, по меньшей мере, одного пика, выбранного из пиков при углах 2Θ =9,7°(±0,2°), 19,3°(±0,2°) и 24,5°(±0,2°) в комбинации с, по меньшей мере, одним пиком на рентгенограмме XRPD, выбранным из пиков при углах 2Θ =11,4°(±0,2°) и 14,2°(±0,2°). В другом варианте осуществления, полиморфную форму I можно охарактеризовать наличием на рентгенограмме XRPD, по меньшей мере, одного пика, выбранного из пиков при углах 2Θ =9,7°(±0,2°), 11,4°(±0,2°), 14,2°(±0,2°), 19,3°(±0,2°) и 24,5°(±0,2°) в комбинации с, по меньшей мере, одним пиком на рентгенограмме XRPD, выбранным из пиков при углах 2Θ =9,2°(±0,2°), 14,7°(±0,2°), 15,5°(±0,2°), 16,7°(±0,2°), 17,3°(±0,2°), 18,4°(±0,2°), 21,4°(±0,2°), 22,9°(±0,2°), 29,1°(±0,2°) и 34,1°(±0,2°). В одном из вариантов осуществления, полиморфную форму I можно охарактеризовать наличием на рентгенограмме XRPD практически всех пиков, показанных на Фиг.9.
На Фиг.20 показана термограмма дифференциальной сканирующей калориметрии (DSC) полиморфной формы I. В некоторых вариантах осуществления, полиморфную форму I можно охарактеризовать наличием эндотермического пика при температуре примерно 208°С и эндотермического пика при температуре примерно 263°С.
В некоторых вариантах осуществления, полиморфную форму I можно охарактеризовать с помощью термогравиметрического анализа (TGA). В одном из вариантов осуществления, потеря массы примерно 10,5 масс.% может наблюдаться при температуре примерно 130°C и потеря массы примерно 0,8 масс.% может наблюдаться при температуре примерно 200°C.
В некоторых вариантах осуществления, форму I можно получать кристаллизацией при медленном охлаждении из системы с двумя растворителями, включающей, не ограничиваясь этим, ацетон, MEK или диоксан в качестве основного растворителя и антирастворитель, например, но не ограничиваясь этим, толуол. В одном из вариантов осуществления, форма I является гемисольватом-толуолсольватом. В одном из вариантов осуществления, форму I можно получать кристаллизацией из системы с несколькими растворителями.
Форма J
В одном из вариантов осуществления, полиморф по настоящему изобретению представляет собой форму J соединения формулы (I).
На Фиг.10 показана типовая рентгенограмма XRPD полиморфной формы J.
В одном из вариантов осуществления, полиморфная форма J может быть охарактеризована любыми одним, двумя, тремя, четырьмя, пятью, шестью, семью, восемью, девятью, десятью или большим количеством значимых пиков, изображенных на Фиг.10. В одном из вариантов осуществления, полиморфную форму J можно охарактеризовать наличием на рентгенограмме XRPD, по меньшей мере, одного пика, выбранного из пиков при углах 2Θ =9,1°(±0,2°), 17,3°(±0,2°) и 18,3°(±0,2°). В одном из вариантов осуществления, полиморфную форму J можно охарактеризовать наличием на рентгенограмме XRPD, по меньшей мере, одного пика, выбранного из пиков при углах 2Θ =9,1°(±0,2°), 17,3°(±0,2°) и 18,3°(±0,2°) в комбинации с, по меньшей мере, одним пиком на рентгенограмме XRPD, выбранным из пиков при углах 2Θ =16,4°(±0,2°) и 17,9°(±0,2°). В другом варианте осуществления, полиморфную форму J можно охарактеризовать наличием на рентгенограмме XRPD, по меньшей мере, одного пика, выбранного из пиков при углах 2Θ =9,1°(±0,2°), 16,4°(±0,2°), 17,3°(±0,2°), 17,9°(±0,2°) и 18,3°(±0,2°) в комбинации с, по меньшей мере, одним пиком на рентгенограмме XRPD, выбранным из пиков при углах 2Θ =9,4°(±0,2°), 10,1°(±0,2°), 10,7°(±0,2°), 14,0°(±0,2°), 14,3°(±0,2°), 15,5°(±0,2°), 16,9°(±0,2°), 19,9°(±0,2°), 24,0°(±0,2°) и 24,7°(±0,2°). В одном из вариантов осуществления, полиморфную форму J можно охарактеризовать наличием на рентгенограмме XRPD практически всех пиков, показанных на Фиг.10.
На Фиг.21 показана термограмма дифференциальной сканирующей калориметрии (DSC) полиморфной формы J. В некоторых вариантах осуществления, полиморфную форму J можно охарактеризовать наличием эндотермического пика при температуре примерно 259°С. В другом варианте осуществления, полиморфную форму J можно охарактеризовать наличием эндотермического пика при температуре примерно 121°С, эндотермического пика при температуре примерно 185°С, эндотермического пика при температуре примерно 259°С и эндотермического пика при температуре примерно 282°С.
В некоторых вариантах осуществления, полиморфную форму J можно охарактеризовать с помощью термогравиметрического анализа (TGA). В одном из вариантов осуществления, потеря массы примерно 10,8 масс.% может наблюдаться при температуре примерно 100°C.
В некоторых вариантах осуществления, форму J можно получать кристаллизацией при медленном охлаждении из системы с двумя растворителями, включающей, не ограничиваясь этим, ДМФА в качестве основного растворителя и антирастворитель, например, но не ограничиваясь этим, толуол. В одном из вариантов осуществления, форма J является гемисольватом толуола. В одном из вариантов осуществления, форму J можно получать кристаллизацией из системы с несколькими растворителями.
Аморфные формы
В одном из вариантов осуществления, изобретение относится к аморфной форме соединения формулы (I).
На Фиг.11 показана типовая рентгенограмма XRPD аморфной формы. Отсутствие дифракционных пиков указывает на отсутствие кристаллического характера у аморфной формы.
В одном из вариантов осуществления, аморфную форму соединения формулы (I) или ее фармацевтически приемлемые соли сольваты или гидраты, можно получить растворением кристаллической формы с последующим удалением растворителя в условиях, при которых не образуются стабильные кристаллы. Например, получение твердой формы можно осуществить путем быстрого удаления растворителя, путем быстрого добавления антирастворителя (который вызывает осаждение аморфной формы из раствора) или путем физического прекращения процесса кристаллизации. Кроме того, можно применять измельчение. В других вариантах осуществления, аморфную форму соединения формулы (I) или его фармацевтически приемлемых соли, сольвата или гидрата можно получать с применением способа или методики, описанных в любом месте текста настоящей заявки.
В некоторых вариантах осуществления, аморфную форму можно получать быстрым охлаждением из системы с одним растворителем, например, этанолом, изопропиловым спиртом, т-амиловым спиртом, н-бутанолом, метанолом, ацетоном, этилацетатом или уксусной кислотой. В некоторых вариантах осуществления, аморфную форму можно получать медленным охлаждением из системы с одним растворителем, например, этанолом, изопропиловым спиртом, т-амиловым спиртом или этилацетатом.
В некоторых вариантах осуществления, аморфную форму можно получать быстрым охлаждением из системы с двумя растворителями, включающей, например, ацетон или DME в качестве основного растворителя. В некоторых вариантах осуществления, аморфную форму можно получать медленным охлаждением из системы с двумя растворителями, включающей, например, этанол, изопропиловый спирт, ТГФ, ацетон или метанол в качестве основного растворителя. В некоторых вариантах осуществления, аморфную форму можно получать растворением соединения формулы (I) в т-бутаноле и воде при повышенной температуре, с последующим охлаждением для получения твердой аморфной формы.
В некоторых вариантах осуществления, аморфное соединение формулы (I) представляет собой его соль, сольват или гидрат. В некоторых вариантах осуществления, аморфное соединение формулы (I) является его фармацевтически приемлемой солью, сольватом или гидратом. В одном из вариантов осуществления, аморфная форма соединения формулы (I) может содержать определенное количество одной или нескольких частично кристаллических или кристаллических форм соединения формулы (I). Не ограничивающие примеры включают аморфные формы соединения формулы (I), содержащие менее примерно 10% одной или нескольких частично кристаллических или кристаллических форм соединения формулы (I), менее примерно 9% одной или нескольких частично кристаллических или кристаллических форм соединения формулы (I), менее примерно 8% одной или нескольких частично кристаллических или кристаллических форм соединения формулы (I), менее примерно 7% одной или нескольких частично кристаллических или кристаллических форм соединения формулы (I), менее примерно 6% одной или нескольких частично кристаллических или кристаллических форм соединения формулы (I), менее примерно 5% одной или нескольких частично кристаллических или кристаллических форм соединения формулы (I), менее примерно 4% одной или нескольких частично кристаллических или кристаллических форм соединения формулы (I), менее примерно 3% одной или нескольких частично кристаллических или кристаллических форм соединения формулы (I), менее примерно 2% одной или нескольких частично кристаллических или кристаллических форм соединения формулы (I), менее примерно 1% одной или нескольких частично кристаллических или кристаллических форм соединения формулы (I), менее примерно 0,5% одной или нескольких частично кристаллических или кристаллических форм соединения формулы (I), менее примерно 0,1% одной или нескольких частично кристаллических или кристаллических форм соединения формулы (I) и менее примерно 0,01% одной или нескольких частично кристаллических или кристаллических форм соединения формулы (I). В некоторых вариантах осуществления, аморфная форма соединения формулы (I) или его соли сольвата или гидрата, содержит одну или несколько частично кристаллических форм соединения или его соли, сольвата или гидрата. В некоторых вариантах осуществления, аморфная форма соединения формулы (I) или его соли сольвата или гидрата, содержит одну или несколько кристаллических форм соединения формулы (I) или его соли, сольвата или гидрата.
Солевые формы
В некоторых вариантах осуществления, соединение формулы (I) по настоящему изобретению является фармацевтически приемлемой солью, ее сольватом или гидратом. В одном из вариантов осуществления, фармацевтически приемлемая кислотно-аддитивная соль соединения по настоящему изобретению может быть образована неорганическими кислотами и органическими кислотами. Неорганические кислоты, из которых можно получать соли, включают, не ограничиваясь этим, хлористоводородную кислоту, бромистоводородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и т.п. Органические кислоты, из которых можно получать соли, включают, не ограничиваясь этим, уксусную кислоту, пропионовую кислоту, гликолевую кислоту, пировиноградную кислоту, щавелевую кислоту, малеиновую кислоту, малоновую кислоту, янтарную кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, п-толуолсульфоновую кислоту, салициловую кислоту и т.п. В других вариантах осуществления, если это целесообразно, можно получать фармацевтически приемлемые основно-аддитивные соли соединения по настоящему изобретению с неорганическими и органическими основаниями. Неорганические основания, из которых можно получать такие соли, включают, не ограничиваясь этим, основания, содержащие натрий, калий, литий, аммоний, кальций, магний, железо, цинк, медь, марганец, алюминий и т.п. Органические основания, из которых можно получать соли соединения по настоящему изобретению, включают, не ограничиваясь этим, первичные, вторичные и третичные амины, замещенные амины, в т.ч. встречающиеся в природе замещенные амины, циклические амины, основные ионообменные смолы и т.п. Примеры оснований включают, не ограничиваясь этим, изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин и этаноламин. В некоторых вариантах осуществления, фармацевтически приемлемая основно-аддитивная соль является солью аммония, калия, натрия, кальция или магния. В одном из вариантов осуществления, термином фармацевтически приемлемые соли охвачены бис соли (т.е. соли, включающие два противоиона) и высшие соли (т.е., включающие три или большее число противоионов).
В некоторых вариантах осуществления, соли соединения формулы (I) могут быть образованы, например, L-винной кислотой, п-толуолсульфоновой кислотой, D-глюкуроновой кислотой, этан-1,2-дисульфоновой кислотой (EDSA), 2-нафталинсульфоновой кислотой (NSA), хлористоводородной кислотой (HCl) (моно- и бис-), бромистоводородной кислотой (HBr), лимонной кислотой, нафталин-1,5-дисульфоновой кислотой (NDSA), DL-миндальной кислотой, фумаровой кислотой, серной кислотой, малеиновой кислотой, метансульфоновой кислотой (MSA), бензолсульфоновой кислотой (BSA), этансульфоновой кислотой (ESA), L-яблочной кислотой, фосфорной кислотой и аминоэтансульфоновой кислотой (таурином).
III. КОМПОЗЦИИ
Настоящее изобретение относится к композициям, в т.ч. фармацевтическим композициям, включающим одну или несколько полиморфных или аморфных форм соединения формулы (I) или их фармацевтически приемлемых форм (например, фармацевтически приемлемых солей, гидратов, сольватов, хелатов, нековалентных комплексов, изомеров, пролекарств и изотопно-меченых производных), которые указаны в настоящем описании. В некоторых вариантах осуществления, изобретение относится к фармацевтическим композициям, включающим полиморфную форму C или ее фармацевтически приемлемые соли, сольваты или гидраты, а также один или несколько фармацевтически приемлемых эксципиентов. В некоторых вариантах осуществления, изобретение относится к фармацевтическим композициям, включающим полиморфную форму C и полиморфную форму A или их фармацевтически приемлемые соли, сольваты и гидраты, а также один или несколько фармацевтически приемлемых эксципиентов, где соотношение между полиморфной формой C и полиморфной формой A превышает примерно 9:1. В некоторых вариантах осуществления, изобретение относится к фармацевтическим композициям, включающим одну или несколько из полиморфных форм A, B, C, D, E, F, G, H, I и J, или аморфную форму соединения формулы (I), или их фармацевтически приемлемые соли, сольваты и гидраты или их смеси, а также один или несколько фармацевтически приемлемых эксципиентов. В других вариантах осуществления, изобретение относится к фармацевтическим композициям, включающим полиморфную форму C и, по меньшей мере, один полиморф, не являющийся формой C, выбранный из формы A, формы B, формы D, формы E, формы F, формы G, формы H, формы I, формы J или аморфных форм соединения формулы (I) или их солей сольватов, или гидратов, а также один или несколько фармацевтически приемлемых эксципиентов.
В некоторых вариантах осуществления, отношение полиморфа, например, формы C, ко всем другим полиморфам в композиции по настоящему изобретению может превышать, примерно 5:1, примерно 6:1, примерно 7:1, примерно 8:1, примерно 9:1 или более.
В некоторых вариантах осуществления, фармацевтические композиции по настоящему изобретению обычно имеют такой состав, что они включают в качестве действующего ингредиента терапевтически эффективное количество соединения по настоящему изобретению (например, конкретного полиморфа по настоящему изобретению) или его фармацевтически приемлемых солей, гидратов, сольватов, хелатов, сложных эфиров, нековалентных комплексов, изомеров, пролекарств и изотопно-меченых производных. В некоторых вариантах осуществления, фармацевтические композиции содержат одну или несколько фармацевтически приемлемых солей, сольватов, гидратов и/или координационных комплексов соединения по настоящему изобретению, а также один или несколько фармацевтически приемлемых эксципиентов, например, носителей (включая инертные твердые разбавители и наполнители), разбавителей (включая стерильные водные растворы и различные органические растворители), средств для улучшения проницаемости, солюбилизаторов и/или адъювантов.
В некоторых вариантах осуществления, фармацевтические композиции по настоящему изобретению можно вводить самостоятельно или в комбинации с одним или несколькими другими агентами, которые также обычно вводятся в форме фармацевтической композиции. В некоторых вариантах осуществления, полиморф по настоящему изобретению и другой агент (агенты) можно смешивать в одном препарате или оба компонента можно включать в состав отдельных препаратов, для применения их в комбинации, раздельно или одновременно.
В одном из вариантов осуществления, введение полиморфов или фармацевтических композиций по настоящему изобретению, можно осуществлять любым способом, который дает возможность доставить полиморфы или фармацевтические композиции к месту их действия. Эти способы включают, например, пероральную доставку, интрадуоденальную доставку, парентеральные инъекции (включая внутривенную, внутриартериальную, подкожную, внутримышечную, внутрисосудистую, интраперитонеальную или инфузию), местные пути введения (например, трансдермальное нанесение), ректальное введение, введение путем местной доставки с помощью катетера или стента, или с помощью ингаляции. В одном из вариантов осуществления, полиморфы можно также вводить интраадипозально или интратекально.
Фармацевтические композиции можно создавать специально для введения в твердой или жидкой форме, включая композиции, адаптированные для следующих путей введения: перорального введения, например, кисели (водные или неводные растворы или суспензии), таблетки (например, таблетки для буккального введения, сублингвального введения и системной абсорбции), капсулы, болюсы, порошки, гранулы, пасты для нанесения на язык и введения интрадуоденальным путем; парентерального введения, включая внутривенное, внутриартериальное, подкожное, внутримышечное, внутрисосудистое, интраперитонеальное введение или инфузию, как, например, стерильный раствор или суспензия, или состав с продолжительным высвобождением; местного нанесения, например, в виде крема, мази, или пластыря или спрея с регулируемым высвобождением, наносимого на кожу; внутривагинального или интраректального введения, например, в форме пессария, крема, стента или пены; сублингвального введения; глазного введения; легочного введения; местной доставки с помощью катетера или стента; интратекального или назального введения.
Примеры подходящих водных и неводных носителей, которые могут применяться в фармацевтических композициях, включают воду, этанол, полиолы (например, глицерин, пропиленгликоль, полиэтиленгликоль и т.п.) и их подходящие смеси, растительные масла, например, оливковое масло, а также подходящие для инъекций органические сложные эфиры, например, этилолеат. Подходящую текучесть можно поддерживать, например, с помощью покрывающих материалов, например, лецитина, сохраняя требуемый размер частиц в случае дисперсий и применяя поверхностно-активные вещества.
Эти композиции могут также содержать адъюванты, например, консерванты, смачивающие агенты, эмульгирующие агенты, диспергирующие агенты, смазывающие вещества и/или антиоксиданты. Предотвращение действия микроорганизмов на соединение по настоящей заявке можно гарантировать включением в составы различных антибактериальных и противогрибковых агентов, например, парабена, хлорбутанола, фенола, сорбиновой кислоты и т.п. В некоторых вариантах осуществления, композиции по настоящему изобретению включают изотонические агенты, например, сахара, хлорид натрия и т.п. Кроме того, продолжительная абсорбция фармацевтической формы для инъекций может быть достигнута включением агентов, которые замедляют абсорбцию, например, моностеарата алюминия и желатина.
Способы получения этих составов или композиций включают стадию смешивания соединения по настоящему изобретению и/или химиотерапевтического средства с носителем и, необязательно, одним или несколькими вспомогательными ингредиентами. Как правило, составы получают однородным и тесным смешиванием соединения по настоящему изобретению с жидкими носителями или тонкоизмельченными твердыми носителями, или носителями обоих типов и затем, если это необходимо, придание продукту определенной формы.
Получение таких фармацевтических композиций хорошо известно в технике. См., например, Anderson, Philip O.; Knoben, James E.; Troutman, William G, eds., Handbook of Clinical Drug Data, Tenth Edition, McGraw-Hill, 2002; Pratt and Taylor, eds., Principles of Drug Action, Third Edition, Churchill Livingston, New York, 1990; Katzung, ed., Basic and Clinical Pharmacology, Ninth Edition, McGraw Hill, 20037ybg; Goodman and Gilman, eds., The Pharmacological Basis of Therapeutics, Tenth Edition, McGraw Hill, 2001; Remingtons Pharmaceutical Sciences, 20th Ed., Lippincott Williams & Wilkins., 2000; Martindale, The Extra Pharmacopoeia, Thirty-Second Edition (The Pharmaceutical Press, London, 1999); где все перечисленные источники включены в заявку в полном объеме посредством ссылок. За исключением тех случаев, когда какая-либо стандартная эксципиентная среда несовместима с соединениями по настоящему изобретению, например, за счет появления каких-либо нежелательных биологических эффектов или иного вредного взаимодействия с любым другим компонентом (компонентами) фармацевтически приемлемой композиции, применение этого эксципиента считается входящим в объем настоящего изобретения.
В некоторых вариантах осуществления, концентрация одного или нескольких полиморфов по настоящему изобретению в композиции по настоящему изобретению составляет менее примерно 100%, примерно 90%, примерно 80%, примерно 70%, примерно 60%, примерно 50%, примерно 40%, примерно 30%, примерно 20%, примерно 19%, примерно 18%, примерно 17%, примерно 16%, примерно 15%, примерно 14%, примерно 13%, примерно 12%, примерно 11%, примерно 10%, примерно 9%, примерно 8%, примерно 7%, примерно 6%, примерно 5%, примерно 4%, примерно 3%, примерно 2%, примерно 1%, примерно 0,5%, примерно 0,4%, примерно 0,3%, примерно 0,2%, примерно 0,1%, примерно 0,09%, примерно 0,08%, примерно 0,07%, примерно 0,06%, примерно 0,05%, примерно 0,04%, примерно 0,03%, примерно 0,02%, примерно 0,01%, примерно 0,009%, примерно 0,008%, примерно 0,007%, примерно 0,006%, примерно 0,005%, примерно 0,004%, примерно 0,003%, примерно 0,002%, примерно 0,001%, примерно 0,0009%, примерно 0,0008%, примерно 0,0007%, примерно 0,0006%, примерно 0,0005%, примерно 0,0004%, примерно 0,0003%, примерно 0,0002% или примерно 0,0001% масс./масс., масса/объем или объем/объем.
В некоторых вариантах осуществления, концентрация одного или нескольких полиморфов по настоящему изобретению в композиции по настоящему изобретению составляет более примерно 90%, примерно 80%, примерно 70%, примерно 60%, примерно 50%, примерно 40%, примерно 30%, примерно 20%, примерно 19,75%, примерно 19,50%, примерно 19,25%, примерно 19%, примерно 18,75%, примерно 18,50%, примерно 18,25%, примерно 18%, примерно 17,75%, примерно 17,50%, примерно 17,25%, примерно 17%, примерно 16,75%, примерно 16,50%, примерно 16,25%, примерно 16%, примерно 15,75%, примерно 15,50%, примерно 15,25%, примерно 15%, примерно 14,75%, примерно 14,50%, примерно 14,25%, примерно 14%, примерно 13,75%, примерно 13,50%, примерно 13,25%, примерно 13%, примерно 12,75%, примерно 12,50%, примерно 12,25%,примерно 12%, примерно 11,75%, примерно 11,50%, примерно 11,25%, примерно 11%, примерно 10,75%, примерно 10,50%, примерно 10,25%, примерно 10%, примерно 9,75%, примерно 9,50%, примерно 9,25%, примерно 9%, примерно 8,75%, примерно 8,50%, примерно 8,25%, примерно 8%, примерно 7,75%, примерно 7,50%, примерно 7,25%, примерно 7%, примерно 6,75%, примерно 6,50%, примерно 6,25%, примерно 6%, примерно 5,75%, примерно 5,50%, примерно 5,25%, примерно 5%, примерно 4,75%, примерно 4,50%, примерно 4,25%, примерно 4%, примерно 3,75%, примерно 3,50%, примерно 3,25%, примерно 3%, примерно 2,75%, примерно 2,50%, примерно 2,25%, примерно 2%, примерно 1,75%, примерно 1,50%, примерно 1,25%, примерно 1%, примерно 0,5%, примерно 0,4%, примерно 0,3%, примерно 0,2%, примерно 0,1%, примерно 0,09%, примерно 0,08%, примерно 0,07%, примерно 0,06%, примерно 0,05%, примерно 0,04%, примерно 0,03%, примерно 0,02%, примерно 0,01%, примерно 0,009%, примерно 0,008%, примерно 0,007%, примерно 0,006%, примерно 0,005%, примерно 0,004%, примерно 0,003%, примерно 0,002%, примерно 0,001%, примерно 0,0009%, примерно 0,0008%, примерно 0,0007%, примерно 0,0006%, примерно 0,0005%, примерно 0,0004%, примерно 0,0003%, примерно 0,0002% или примерно 0,0001% масс./масс., масса/объем или объем/объем.
В некоторых вариантах осуществления, концентрация одного или нескольких полиморфов по настоящему изобретению в композиции по настоящему изобретению находится в диапазоне от примерно 0,0001% до примерно 50%, от примерно 0,001% до примерно 40%, от примерно 0,01% до примерно 30%, от примерно 0,02% до примерно 29%, от примерно 0,03% до примерно 28%, от примерно 0,04% до примерно 27%, от примерно 0,05% до примерно 26%, от примерно 0,06% до примерно 25%, от примерно 0,07% до примерно 24%, от примерно 0,08% до примерно 23%, от примерно 0,09% до примерно 22%, от примерно 0,1% до примерно 21%, от примерно 0,2% до примерно 20%, от примерно 0,3% до примерно 19%, от примерно 0,4% до примерно 18%, от примерно 0,5% до примерно 17%, от примерно 0,6% до примерно 16%, от примерно 0,7% до примерно 15%, от примерно 0,8% до примерно 14%, от примерно 0,9% до примерно 12%, от примерно 1% до примерно 10% масс./масс., масса/объем или объем/объем.
В некоторых вариантах осуществления, концентрация одного или нескольких полиморфов по настоящему изобретению в композиции по настоящему изобретению находится в диапазоне от примерно 0,001% до примерно 10%, от примерно 0,01% до примерно 5%, от примерно 0,02% до примерно 4,5%, от примерно 0,03% до примерно 4%, от примерно 0,04% до примерно 3,5%, от примерно 0,05% до примерно 3%, от примерно 0,06% до примерно 2,5%, от примерно 0,07% до примерно 2%, от примерно 0,08% до примерно 1,5%, от примерно 0,09% до примерно 1%, от примерно 0,1% до примерно 0,9% масс./масс., масса/объем или объем/объем.
В некоторых вариантах осуществления, количество одного или нескольких полиморфов по настоящему изобретению в композиции по настоящему изобретению равно или меньше, чем примерно 10 г, примерно 9,5 г, примерно 9,0 г, примерно 8,5 г, примерно 8,0 г, примерно 7,5 г, примерно 7,0 г, примерно 6,5 г, примерно 6,0 г, примерно 5,5 г, примерно 5,0 г, примерно 4,5 г, примерно 4,0 г, примерно 3,5 г, примерно 3,0 г, примерно 2,5 г, примерно 2,0 г, примерно 1,5 г, примерно 1,0 г, примерно 0,95 г, примерно 0,9 г, примерно 0,85 г, примерно 0,8 г, примерно 0,75 г, примерно 0,7 г, примерно 0,65 г, примерно 0,6 г, примерно 0,55 г, примерно 0,5 г, примерно 0,45 г, примерно 0,4 г, примерно 0,35 г, примерно 0,3 г, примерно 0,25 г, примерно 0,2 г, примерно 0,15 г, примерно 0,1 г, примерно 0,09 г, примерно 0,08 г, примерно 0,07 г, примерно 0,06 г, примерно 0,05 г, примерно 0,04 г, примерно 0,03 г, примерно 0,02 г, примерно 0,01 г, примерно 0,009 г, примерно 0,008 г, примерно 0,007 г, примерно 0,006 г, примерно 0,005 г, примерно 0,004 г, примерно 0,003 г, примерно 0,002 г, примерно 0,001 г, примерно 0,0009 г, примерно 0,0008 г, примерно 0,0007 г, примерно 0,0006 г, примерно 0,0005 г, примерно 0,0004 г, примерно 0,0003 г, примерно 0,0002 г или примерно 0,0001 г.
В некоторых вариантах осуществления, количество одного или нескольких полиморфов по настоящему изобретению в композиции по настоящему изобретению превышает примерно 0,0001 г, примерно 0,0002 г, примерно 0,0003 г, примерно 0,0004 г, примерно 0,0005 г, примерно 0,0006 г, примерно 0,0007 г, примерно 0,0008 г, примерно 0,0009 г, примерно 0,001 г, примерно 0,0015 г, примерно 0,002 г, примерно 0,0025 г, примерно 0,003 г, примерно 0,0035 г, примерно 0,004 г, примерно 0,0045 г, примерно 0,005 г, примерно 0,0055 г, примерно 0,006 г, примерно 0,0065 г, примерно 0,007 г, примерно 0,0075 г, примерно 0,008 г, примерно 0,0085 г, примерно 0,009 г, примерно 0,0095 г, примерно 0,01 г, примерно 0,015 г, примерно 0,02 г, примерно 0,025 г, примерно 0,03 г, примерно 0,035 г, примерно 0,04 г, примерно 0,045 г, примерно 0,05 г, примерно 0,055 г, примерно 0,06 г, примерно 0,065 г, примерно 0,07 г, примерно 0,075 г, примерно 0,08 г, примерно 0,085 г, примерно 0,09 г, примерно 0,095 г, примерно 0,1 г, примерно 0,15 г, примерно 0,2 г, примерно 0,25 г, примерно 0,3 г, примерно 0,35 г, примерно 0,4 г, примерно 0,45 г, примерно 0,5 г, примерно 0,55 г, примерно 0,6 г, примерно 0,65 г, примерно 0,7 г, примерно 0,75 г, примерно 0,8 г, примерно 0,85 г, примерно 0,9 г, примерно 0,95 г, примерно 1 г, примерно 1,5 г, примерно 2 г, примерно 2,5 г, примерно 3 г, примерно 3,5 г, примерно 4 г, примерно 4,5 г, примерно 5 г, примерно 5,5 г, примерно 6 г, примерно 6,5 г, примерно 7 г, примерно 7,5 г, примерно 8 г, примерно 8,5 г, примерно 9 г, примерно 9,5 г, примерно 10 г или более.
В некоторых вариантах осуществления, количество одного или нескольких полиморфов по настоящему изобретению в композиции по настоящему изобретению находится в диапазоне от примерно 0,0001 до примерно 10 г, от примерно 0,0005 до примерно 9 г, от примерно 0,001 до примерно 8 г, от примерно 0,005 до примерно 7 г, от примерно 0,01 до примерно 6 г, от примерно 0,05 до примерно 5 г, от примерно 0,1 до примерно 4 г, от примерно 0,5 до примерно 4 г или от примерно 1 до примерно 3 г.
В одном из вариантов осуществления, полиморфы по настоящему изобретению эффективны в широком диапазоне дозировок. Например, при лечении взрослых людей дозировки от примерно 0,01 до примерно 1000 мг, от примерно 0,5 до примерно 100 мг, от примерно 1 до примерно 50 мг, и от примерно 5 до примерно 40 мг в день являются примерами применимых дозировок. Примерная дозировка составляет от примерно 10 до примерно 30 мг в день. Точная дозировка должна зависеть от пути введения, формы, в которой вводится полиморф, субъекта, подвергаемого лечению, массы тела субъекта, подвергаемого лечению, а также предпочтений и опыта лечащего врача.
Ниже описаны не ограничивающие примеры фармацевтических композиций и способов их получения.
Фармацевтические композиции для перорального введения
В некоторых вариантах осуществления, в изобретении разработаны фармацевтические композиции для перорального введения, где композиции включают полиморф по настоящему изобретению или его фармацевтически приемлемую форму (например, фармацевтически приемлемые соли, гидраты, сольваты, хелаты, нековалентные комплексы, изомеры, пролекарства и изотопно-меченые производные), а также фармацевтически приемлемый эксципиент (например, эксципиент, подходящий для перорального введения).
В одном из вариантов осуществления, композиция по настоящему изобретению представляет собой твердую дозированную форму, включающую полиморф соединения формулы (I) или его фармацевтически приемлемую соль, сольват или гидрат, а также один или несколько фармацевтически приемлемых эксципиентов. В одном из вариантов осуществления, композиция по настоящему изобретению представляет собой дозированную лекарственную форму, включающую полиморф соединения формулы (I) или его фармацевтически приемлемую соль, сольват или гидрат. В одном из вариантов осуществления, композиция по настоящему изобретению представляет собой таблетку или капсулу. В одном из вариантов осуществления, композиция по настоящему изобретению включает терапевтически эффективное количество полиморфа соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или гидрата.
В одном из вариантов осуществления, композиция по настоящему изобретению включает терапевтически эффективное количество полиморфа соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления, это терапевтически эффективное количество составляет примерно 0,5, примерно 1, примерно 2, примерно 3, примерно 4, примерно 5, примерно 10, примерно 15, примерно 20, примерно 25, примерно 30, примерно 35, примерно 40, примерно 45, примерно 50, примерно 55, примерно 60, примерно 65, примерно 70, примерно 75, примерно 80, примерно 85, примерно 90, примерно 95, примерно 100, примерно 110, примерно 120, примерно 130, примерно 140, примерно 150, примерно 160, примерно 170, примерно 180, примерно 190, примерно 200, примерно 210, примерно 220, примерно 230, примерно 240, примерно 250, примерно 260, примерно 270, примерно 280, примерно 290, примерно 300, примерно 325, примерно 350, примерно 375, примерно 400, примерно 425, примерно 450, примерно 475, примерно 500, примерно 600, примерно 700, примерно 800, примерно 900 или примерно 1000 мг или более. В одном из вариантов осуществления, композиция по настоящему изобретению включает, по меньшей мере, один фармацевтически приемлемый носитель или эксципиент. В некоторых вариантах осуществления, композиция по настоящему изобретению включает один или несколько фармацевтически приемлемых носителей или эксципиентов, в т.ч., например, микрокристаллическую целлюлозу, кросповидон и/или стеарат магния. В одном из вариантов осуществления, композиция по настоящему изобретению представляет собой дозированную форму с немедленным высвобождением. В некоторых вариантах осуществления, композиция по настоящему изобретению представляет собой твердую желатиновую капсулу. В некоторых вариантах осуществления, композиция по настоящему изобретению представляет собой мягкую желатиновую капсулу. В некоторых вариантах осуществления, композиция по настоящему изобретению включает форму C соединения формулы (I). В некоторых вариантах осуществления, композиция по настоящему изобретению включает форму A соединения формулы (I). В некоторых вариантах осуществления, композиция по настоящему изобретению включает аморфную форму соединения формулы (I). В некоторых вариантах осуществления, композиция по настоящему изобретению включает смесь двух или нескольких полиморфов соединения формулы (I) или их фармацевтически приемлемых солей, сольватов или гидратов, например, полиморфных форм, описанных в настоящей заявке.
В других вариантах осуществления, композиция по настоящему изобретению включает одно или несколько соединений формулы (I) и суспензию, включающую карбоксиметилцеллюлозу и воду. В одном из вариантов осуществления, композиция по настоящему изобретению может дополнительно включать один или несколько эксципиентов, например, полисорбат, полиэтиленгликоль, циклодекстрин, декстрозу, н-метилпирролидон, pH буферы, разбавленную хлористоводородную кислоту, сложные эфиры полиоксиэтилена и 12-гидроксистеариновой кислоты, или смесь двух или нескольких из перечисленных эксципиентов. В одном из вариантов осуществления, способ получения суспензии включает, не ограничиваясь этим, смешивание заранее установленного количества соединения формулы (I) в форме порошка с носителем, например, предусмотренной USP коммерчески доступной натрия карбоксиметилцеллюлозой (CMC) средней вязкости в стерильной воде для инъекций (SWFI).
В некоторых вариантах осуществления, изобретение относится к твердой фармацевтической композиции, подходящей для перорального введения, включающей: (i) эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой формы (например, фармацевтически приемлемых солей, гидратов, сольватов, хелатов, нековалентных комплексов, изомеров, пролекарств и изотопно-меченых производных); необязательно (ii) эффективного количества второго агента; и (iii) одного или нескольких фармацевтических эксципиентов, подходящих для перорального введения. В некоторых вариантах осуществления, композиция дополнительно содержит: (iv) эффективное количество третьего агента.
В некоторых вариантах осуществления, изобретение относится к жидкой фармацевтической композиции, подходящей для перорального введения. В некоторых вариантах осуществления, изобретение относится к капсульной дозированной форме, подходящей для перорального введения.
В некоторых вариантах осуществления, фармацевтические композиции по настоящему изобретению, подходящие для перорального введения, могут быть представлены в виде дискретных дозированных форм, например, капсул, пилюль, облаток или таблеток или жидкостей, или аэрозольных спреев, каждая из которых содержит предустановленное количество действующего ингредиента в виде порошка или гранул, раствора или суспензии в водной или неводной жидкости, эмульсии масло-в-воде или жидкой эмульсии вода-в-масле. В случае твердых лекарственных форм, композиции, как правило, получают однородным и тщательным смешиванием действующего ингредиента с жидкими носителями или тонкоизмельченными твердыми носителями или носителями обоих типов, и затем, если необходимо, продукту придают форму, характерную для продуктов данного типа. Например, таблетку можно изготовить прессованием или формованием, необязательно с одним или несколькими вспомогательными ингредиентами. Прессованные таблетки можно изготавливать прессованием в подходящем устройстве действующего ингредиента в сыпучей форме, например, в виде порошка или гранул, необязательно смешанного с эксципиентом, например, но не ограничиваясь этим, связующим веществом, смазывающим средством, инертным разбавителем и/или поверхностно-активным или диспергирующим агентом. Формованные таблетки можно получать формованием в подходящем агрегате смеси порошкообразного соединения, смоченного инертным жидким или полутвердым разбавителем.
Твердые композиции аналогичного типа могут применяться в качестве наполнителей мягких и твердых желатиновых капсул с наполнителем, при использовании таких эксципиентов, как лактоза или молочный сахар, а также полиэтиленгликолей высокой молекулярной массы и т.п. Твердые дозированные формы таблеток, драже, капсул, пилюль и гранул можно снабжать покрытиями и оболочками, например, кишечными покрытиями и другими покрытиями, хорошо известными в технике получения фармацевтических составов. Они могут необязательно включать средства, придающие непрозрачность, и могут иметь состав, который позволяет высвобождать действующий ингредиент (ингредиенты) только или преимущественно в определенных частях желудочно-кишечного тракта, необязательно, в течение продолжительного времени. Примеры композиций, содержащих включения действующих агентов, которые могут применяться в настоящем изобретении, включают полимерные вещества и воски. Твердые композиции аналогичного типа могут применяться в качестве наполнителей в мягких и твердых желатиновых капсулах, с использованием таких эксципиентов, как лактоза или молочный сахар, а также полиэтиленгликолей высокой молекулярной массы и т.п.
Действующие ингредиенты могут находиться в микроинкапсулированной форме и могут необязательно содержать один или несколько из указанных выше эксципиентов. Твердые дозированные формы таблеток, драже, капсул, пилюль и гранул можно снабжать покрытиями и оболочками, например, кишечными покрытиями, покрытиями с регулируемым высвобождением и другими покрытиями, хорошо известными в технике получения фармацевтических составов. В таких твердых дозированных формах действующий ингредиент может быть смешан с, по меньшей мере, одним инертным разбавителем, например, сахарозой, лактозой или крахмалом. Такие дозированные формы обычно могут включать дополнительные вещества помимо инертных разбавителей, например, смазывающие вещества для таблетирования и другие средства для облегчения таблетирования, например, стеарат магния и микрокристаллическую целлюлозу. В случае капсул, таблеток и пилюль, дозированные формы могут включать буферные агенты. Они могут необязательно включать средства, придающие непрозрачность, и могут иметь состав, который позволяет высвобождать действующий ингредиент (ингредиенты) только или преимущественно в определенных частях желудочно-кишечного тракта, необязательно, продолжительным образом. Примеры композиций, которые могут быть использованы в настоящем изобретении, включают полимерные вещества и воски.
Кроме того, настоящее изобретение охватывает безводные фармацевтические композиции и дозированные формы, включающие действующий ингредиент, поскольку вода может облегчать разрушение некоторых соединений. Например, в фармацевтической технике воду можно добавлять (например, 5%) в качестве средства, имитирующего долговременное хранение, для определения таких характеристик, как срок хранения или стабильность составов с течением времени. Безводные фармацевтические композиции и дозированные формы по настоящему изобретению можно получать с применением безводных ингредиентов или ингредиентов с низким содержанием влаги в условиях пониженной влажности или незначительного присутствия воды. Фармацевтические композиции и дозированные формы по настоящему изобретению, которые содержат лактозу, можно сделать безводными, если ожидается значительный контакт с водой и/или влажностью при производстве, упаковке и/или хранении. Безводную фармацевтическую композицию можно получать, и хранить таким образом, чтобы сохранялся ее безводный характер. Соответственно, безводные композиции можно упаковывать, применяя материалы, которые, как известно, предохраняют от действия воды, вследствие чего их можно включать в соответствующие лекарственные наборы. Примеры подходящих упаковок включают, не ограничиваясь этим, герметичные упаковки из фольги, пластмассы или подобных материалов, контейнеры для разовых доз, блистерные упаковки и контурные упаковки.
В некоторых вариантах осуществления, действующий ингредиент может быть тщательно смешан с фармацевтическим носителем по стандартной методике получения фармацевтических смесей. Носитель может принимать широкое разнообразие форм, в зависимости от формы препарата, намеченной для введения. При получении композиций пероральных дозированных форм, в качестве носителя можно применять любую из стандартных фармацевтических сред, например, воду, гликоли, масла, спирты, вкусоароматические агенты, консерванты, красители и т.п. в случае жидких пероральных препаратов (таких как суспензии, растворы и эликсиры) или аэрозолей; или такие носители, как крахмалы, сахара, микрокристаллическая целлюлоза, разбавители, гранулирующие агенты, смазывающие средства, связующие вещества и дезинтегрирующие агенты в случае твердых пероральных препаратов, в некоторых вариантах осуществления, без применения лактозы. Например, подходящие носители включают порошки, капсулы и таблетки в случае твердых пероральных препаратов. В некоторых вариантах осуществления, таблетки можно покрывать по стандартным методикам, в которых применяется или не применяется вода.
В одном из вариантов осуществления, действующий ингредиент может быть необязательно смешан с одним или несколькими инертными фармацевтически приемлемыми эксципиентами или носителями, такими как цитрат натрия или дикальций фосфат и/или a) наполнителями или увеличителями объема, например, крахмалами, лактозой, сахарозой, глюкозой, маннитом и кремниевой кислотой, b) связующими веществами, например, карбоксиметилцеллюлозой, альгинатами, желатином, поливинилпирролидиноном, сахарозой и гуммиарабиком, c) увлажнителями, например, глицерином, d) дезинтергирующими средствами, например, агаром, карбонатом кальция, крахмалом картофеля или маниока, альгиновой кислотой, некоторыми силикатами и карбонатом натрия, e) агентами, замедляющими растворение, например, парафином, f) ускорителями абсорбции, например, соединениями четвертичного аммония, g) смачивающими агентами, например, цетиловым спиртом и моностеаратом глицерина, h) абсорбентами, например, каолином и бентонитовой глиной и i) смазывающими веществами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси. В случае капсул, таблеток и пилюль, дозированная форма может включать буферные агенты.
В некоторых вариантах осуществления, связующие вещества, подходящие для применения в фармацевтических композициях и дозированных формах, включают, не ограничиваясь этим, кукурузный крахмал, картофельный крахмал или другие крахмалы, желатин, природные и синтетические смолы, например, гуммиарабик, альгинат натрия, альгиновую кислоту, другие альгинаты, порошкообразный трагакант, гуаровую камедь, целлюлозу и ее производные (например, этилцеллюлозу, ацетат целлюлозы, кальций карбоксиметилцеллюлозу, натрий карбоксиметилцеллюлозу), поливинилпирролидон, метилцеллюлозу, прежелатинизированный крахмал, гидроксипропилметилцеллюлозу, микрокристаллическую целлюлозу, а также смеси двух или нескольких перечисленных компонентов. В некоторых вариантах осуществления, примеры связующих веществ включают, не ограничиваясь этим, крахмал (например, кукурузный крахмал или крахмальный клей); желатин; сахара (например, сахарозу, глюкозу, декстрозу, декстрин, мелассу, лактозу, лактит, маннит и т.д.); природные и синтетические смолы (например, гуммиарабик, альгинат натрия, экстракт ирландского мха, камедь панвар, камедь гхатти, растительный клей из шелухи, карбоксиметилцеллюлозу, метилцеллюлозу, этилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, микрокристаллическую целлюлозу, ацетат целлюлозы, поли(винилпирролидон), силикат алюминия магния (Veegum) и арабиногалактана лиственницу); альгинаты; полиэтиленоксид; полиэтиленгликоль; неорганические соли кальция; кремниевую кислоту; полиметакрилаты; воски; воду; спирт; и т.д.; а также смеси двух или нескольких из перечисленных связующих веществ.
Примеры подходящих наполнителей для применения в фармацевтических композициях и дозированных формах по настоящему изобретению включают, не ограничиваясь перечисленными, тальк, карбонат кальция (например, гранулы или порошок), микрокристаллическую целлюлозу, порошкообразную целлюлозу, декстраты, каолин, маннит, кремниевую кислоту, сорбит, крахмал, прежелатинизированный крахмал и смеси двух или нескольких подобных наполнителей.
В некоторых вариантах осуществления, в композициях по настоящему изобретению можно применять дезинтегрирующие средства, для получения таблеток, которые разрушаются при действии водной среды. Добавление слишком большого количества дезинтегрирующего средства может привести к получению таблеток, которые разрушаются в таре для хранения. Слишком малого количества может оказаться недостаточно для разрушения таблеток при их целевом применении, что может изменить скорость и степень высвобождения действующего ингредиента (ингредиентов) из дозированной формы. Таким образом, для формирования дозированных форм полиморфов по настоящему изобретению могут применяться достаточные количества дезинтегрирующих средств, которые не являются не слишком маленькими, не слишком большими для нежелательного изменения высвобождения действующего ингредиента (ингредиентов). Количество применяемого дезинтегрирующего средства может меняться в зависимости от типа состава и пути введения. В некоторых вариантах осуществления, в фармацевтических композициях по настоящему изобретению может применяться от примерно 0,5 до примерно 15 массовых процентов дезинтегрирующего средства, или от примерно 1 до 5 массовых процентов дезинтегрирующего средства. Дезинтегрирующие средства, которые могут применяться для получения фармацевтических композиций и дозированных форм по настоящему изобретению, включают, не ограничиваясь этим, агар-агар, альгиновую кислоту, карбонат кальция, микрокристаллическую целлюлозу, натрий кросскармелозу, кросповидон, полакрилин калия, натрий крахмал гликолят, крахмал картофеля или маниока, прежелатинизированный крахмал, другие виды крахмала, глины, другие альгинаты, другие виды целлюлоз, смолы, а также смеси двух или нескольких перечисленных дезинтегрирующих средств.
В некоторых вариантах осуществления, смазывающие средства, которые можно применять для получения фармацевтических композиций и дозированных форм по настоящему изобретению включают, не ограничиваясь этим, стеарат кальция, стеарат магния, минеральное масло, легкое минеральное масло, глицерин, глицерилбегенат, сорбит, маннит, полиэтиленгликоль, другие гликоли, стеариновую кислоту, лаурилсульфат натрия, бензоат натрия, ацетат натрия, хлорид натрия, лейцин, лаурилсульфат магния, тальк, гидрированное растительное масло (например, арахисовое масло, хлопковое масло, подсолнечное масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло), стеарат цинка, этилолеат, этиллаурат, агар, солод и смеси двух или нескольких перечисленных смазывающих средств. Дополнительные смазывающие средства включают, например, силоидный силикагель, коагулированный аэрозоль синтетического оксида кремния или смеси двух или нескольких из этих компонентов. В некоторых вариантах осуществления, смазывающее средство, необязательно, можно добавлять в количестве менее чем примерно 1 массовый процент от массы фармацевтической композиции.
В некоторых вариантах осуществления, фармацевтическая композиция или дозированная форма по настоящему изобретению включает коллоидные частицы. В некоторых случаях коллоидные частицы включают, по меньшей мере, один катионный агент и, по меньшей мере, одно неионное ПАВ, например, полоксамер, тилоксапол, полисорбат, полиоксиэтиленовое производное касторового масла, сложный эфир сорбитана или полиоксил стеарат. В некоторых случаях, упомянутый катионный агент представляет собой алкиламин, третичный алкиламин, соединение четвертичного аммония, катионный липид, аминоспирт, соль бигуанидина, катионное соединение или смесь двух или нескольких перечисленных компонентов. В некоторых случаях, катионный агент представляет собой соль бигуанидина, например, хлоргексидин, полимаминопропил бигуанидин, фенформин, алкилбигуанидин или смесь двух или нескольких из перечисленных компонентов. В некоторых случаях, соединение четвертичного аммония представляет собой галогенид бензалкония, галогенид лауралкония, цетримид, галогенид гексадецилтриметиламмония, галогенид тетрадецилтриметиламмония, галогенид додецилтриметиламмония, галогенид цетримония, галогенид бензетония, галогенид бегеналкония, галогенид цеталкония, галогенид цетилдимония, галогенид цетилпиридиния, галогенид бензододециния, галогенид хлораллил метенамина, галогенид миристилалкония, галогенид стеаралкония или смесь двух или нескольких из перечисленных компонентов. В некоторых случаях, катионный агент представляет собой хлорид бензалкония, хлорид лауралкония, бромид бензододециния, хлорид бензетения, бромид гексадецилтриметиламмония, бромид тетрадецилтриметиламмония, бромид додецилтриметиламмония или смесь двух или нескольких из перечисленных соединений. В некоторых случаях, коллоидные частицы включают масляную фазу. В некоторых случаях, масляная фаза является минеральным маслом, легким минеральным маслом, триглицеридом с цепью средней длины (MCT), кокосовым маслом, гидрированным маслом, в т.ч. гидрированным хлопковым маслом, гидрированным пальмовым маслом, гидрированным касторовым маслом, гидрированным соевым маслом, производным полиэтилена и гидрированного касторового масла, таким как полиоксил-40- гидрированное касторовое масло, полиоксил-60-гидрированное касторовое масло или полиоксил-100-гидрированное касторовое масло.
В одном из вариантов осуществления, если водные суспензии и/или эликсиры предназначены для перорального введения, действующий ингредиент в этих лекарственных формах может быть скомбинирован с различными подсластителями или вкусоароматическим агентами, красящими веществами или пигментами и, в некоторых вариантах осуществления, эмульгирующими и/или суспендирующими агентами, в сочетании с такими разбавителями, как вода, этанол, пропиленгликоль, глицерин и различные комбинации перечисленных разбавителей.
В некоторых вариантах осуществления, таблетки могут не иметь покрытия или могут быть покрыты по известным методикам для замедления разрушения и абсорбции в желудочно-кишечном тракте, что обеспечивает устойчивое действие в течение более продолжительного периода времени. Например, могут применяться материалы, приводящие к увеличению продолжительности действия, например, глицерил моностеарат или глицерил дистеарат. Составы для перорального применения могут также представлять собой твердые желатиновые капсулы, в которых действующий ингредиент смешан с инертным твердым разбавителем, например, карбонатом кальция, фосфатом кальция или каолином; или мягкие желатиновые капсулы, в которых действующий ингредиент смешан с водой или масляной средой, например, арахисовым маслом, жидким парафином или оливковым маслом.
В некоторых вариантах осуществления, поверхностно-активные вещества, которые могут применяться для получения фармацевтических композиций и дозированных форм по настоящему изобретению, включают, не ограничиваясь этим, гидрофильные ПАВ, липофильные ПАВ и смеси двух или нескольких из перечисленных ПАВ. Например, может применяться смесь гидрофильных ПАВ, смесь липофильных ПАВ или смесь, по меньшей мере, одного гидрофильного ПАВ и, по меньшей мере, одного липофильного ПАВ.
В некоторых вариантах осуществления, подходящее гидрофильное ПАВ обычно может иметь значение HLB, равное, по меньшей мере, 10, в то время как подходящие липофильные ПАВ обычно могут иметь значение HLB менее чем примерно 10. Эмпирическим параметром, применяемым для характеристики относительной гидрофильности и гидрофобности неионных амфифильных соединений, является гидрофильно-липофильный баланс (значение «HLB»). ПАВ с более низкими значениями HLB являются более липофильными или гидрофобными и обладают более высокой растворимостью в маслах, в то время как ПАВ с более высокими значениями HLB являются более гидрофильными и имеют более высокую растворимость в водных растворах. Обычно считается, что гидрофильными ПАВ являются соединения, имеющие значения HLB более примерно 10, а также анионные, катионные или цвиттерионные соединения, к которым шкала HLB, как правило, не применяется. Соответственно, липофильными (т.е. гидрофобными) ПАВ являются соединения, имеющие значения HLB, равные или меньшие примерно 10. Однако значение HLB поверхностно-активного вещества является лишь приблизительным ориентиром, часто применяемым при получении промышленных, фармацевтических и косметических эмульсий.
В некоторых вариантах осуществления, гидрофильные ПАВ могут быть ионными или неионными. Подходящие ионные ПАВ включают, не ограничиваясь этим, соли алкиламмония; соли фусидовой кислоты; производные жирных кислот с аминокислотами, олигопептидами и полипептидами; глицериды производных аминокислот, олигопептидов и полипептидов; лецитины и гидрированные лецитины; лизолецитины и гидрированные лизолецитины; фосфолипиды и их производные; лизофосфолипиды и их производные; соли эфиров карнитина и жирных кислот; соли алкилсульфатов; соли жирных кислот; докузат натрия; ацилактилаты; эфиры моно- и диацетилированной винной кислоты и моно- и диглицеридов; сукцинилированные моно- и диглицериды; эфиры лимонной кислоты и моно- и диглицеридов; и смеси двух или нескольких из перечисленных ПАВ.
В составе упомянутой выше группы, ионные ПАВ включают, в качестве примера: лецитины, лизолецитин, фосфолипиды, лизофосфолипиды и их производные; соли эфиров карнитина и жирных кислот; соли алкилсульфатов; соли жирных кислот; докузат натрия; ацилактилаты; эфиры моно- и диацетилированной винной кислоты и моно- и диглицеридов; сукцинилированные моно- и диглицериды; эфиры лимонной кислоты и моно- и диглицеридов; и смеси двух или нескольких из перечисленных ПАВ.
В некоторых вариантах осуществления, ионные ПАВ могут представлять собой ионизированные формы лецитина, лизолецитина, фосфатидилхолина, фосфатидилэтаноламина, фосфатидилглицерина, фосфатидной кислоты, фосфатидилсерина, лизофосфатидилхолина, лизофосфатидилэтаноламина, лизофосфатидилглицерина, лизофосфатидной кислоты, лизофосфатидилсерина, ПЭГ-фосфатидилэтаноламина, PVP-фосфатидилэтаноламина, эфиров жирных кислот и молочной кислоты, стеароил-2-лактилата, стеароил лактилата, сукцинилированных моноглицеридов, эфиров моно/диацетилированной винной кислоты и моно/диглицеридов, эфиров лимонной кислоты и моно/диглицеридов, холилсаркозина, капроата, каприлата, капрата, лаурата, миристата, пальмитата, олеата, рицинолеата, линолеата, линолената, стеарата, лаурилсульфата, тетрацецилсульфата, докузата, лауроил карнитинов, пальмитоил карнитинов, миристоил карнитинов, их солей и смесей двух или нескольких перечисленных соединений.
В некоторых вариантах осуществления, гидрофильные неионные ПАВ могут включать, не ограничиваясь этим, алкилглюкозиды; алкилмальтозиды; алкилтиоглюкозиды; лаурилмакрогол глицериды; полиоксиалкилен алкиловые простые эфиры, например, алкиловые простые эфиры полиэтиленгликоля; полиоксиалкилен алкилфенолы, например, полиэтиленгликоль алкилфенолы; сложные эфиры жирных кислот и полиоксиалкилен алкилфенолы, например, моноэфиры жирных кислот и полиэтиленгликоля, и диэфиры жирных кислот и полиэтиленгликоля; сложные эфиры жирных кислот и полиэтиленгликоль глицерина; сложные эфиры жирных кислот и полиглицерина; сложные эфиры жирных кислот и полиоксиалкилен сорбитана, например, сложные эфиры жирных кислот и полиэтиленгликоль сорбитана; гидрофильные продукты трансэтерификации полиолов с, по меньшей мере, одним соединением из группы, состоящей из глицеридов, растительных масел, гидрированных растительных масел, жирных кислот и стеринов; полиоксиэтиленстерины, их производные и аналоги; полиоксиэтилированные витамины и их производные; блок-сополимеры полиоксиэтилена-полиоксипропилена; и их смеси; сложные эфиры жирных кислот и полиэтиленгликоль сорбитана и гидрофильные продукты трансэтерификации полиолов с, по меньшей мере, одним соединением из группы, состоящей из триглицеридов, растительных масел, гидрированных растительных масел, а также смеси двух или нескольких перечисленных компонентов. Полиол может представлять собой глицерин, этиленгликоль, полиэтиленгликоль, сорбит, пропиленгликоль, пентаэритрит или сахарид.
Другие гидрофильные неионные ПАВ включают, не ограничиваясь этим, ПЭГ-10 лаурат, ПЭГ-12 лаурат, ПЭГ-20 лаурат, ПЭГ-32 лаурат, ПЭГ-32 дилаурат, ПЭГ-12 олеат, ПЭГ-15 олеат, ПЭГ-20 олеат, ПЭГ-20 диолеат, ПЭГ-32 олеат, ПЭГ-200 олеат, ПЭГ-400 олеат, ПЭГ-15 стеарат, ПЭГ-32 дистеарат, ПЭГ-40 стеарат, ПЭГ-100 стеарат, ПЭГ-20 дилаурат, ПЭГ-25 глицерил триолеат, ПЭГ-32 диолеат, ПЭГ-20 глицерил лаурат, ПЭГ-30 глицерил лаурат, ПЭГ-20 глицерил стеарат, ПЭГ-20 глицерил олеат, ПЭГ-30 глицерил олеат, ПЭГ-30 глицерил лаурат, ПЭГ-40 глицерил лаурат, ПЭГ-40 масло пальмовых ядер, ПЭГ-50 гидрированное касторовое масло, ПЭГ-40 касторовое масло, ПЭГ-35 касторовое масло, ПЭГ-60 касторовое масло, ПЭГ-40 гидрированное касторовое масло, ПЭГ-60 гидрированное касторовое масло, ПЭГ-60 кукурузное масло, ПЭГ-6 капрат/каприлат глицериды, ПЭГ-8 капрат/каприлат глицериды, полиглицерил-10 лаурат, ПЭГ-30 холестерин, ПЭГ-25 фитостерин, ПЭГ-30 соевый стерин, ПЭГ-20 триолеат, ПЭГ-40 сорбитанолеат, ПЭГ-80 сорбитанлаурат, полисорбат 20, полисорбат 80, POE-9 лауриловый эфир, POE-23 лауриловый эфир, POE-10 олеиловый эфир, POE-20 олеиловый эфир, POE-20 стеариловый эфир, токоферил ПЭГ-100 сукцинат, ПЭГ-24 холестерин, полиглицерил-10 олеат, Tween® 40, Tween® 60, моностеарат сахарозы, монолаурат сахарозы, монопальмитат сахарозы, ряд ПЭГ 10-100 нонилфенолов, ряд ПЭГ 15-100 октилфенолов, а также полоксамеры и смеси двух или нескольких из перечисленных ПАВ.
В некоторых вариантах осуществления, подходящие липофильные ПАВ включают, только в качестве примера: жирные спирты; сложные эфиры глицерина и жирных кислот; сложные эфиры ацетилированного глицерина и жирных кислот; сложные эфиры низших спиртов и жирных кислот; сложные эфиры пропиленгликоля и жирных кислот; сложные эфиры сорбитана и жирных кислот; сложные эфиры полиэтиленгликольсорбитана и жирных кислот; стерин и производные стерина; полиоксиэтилированные стерины и их производные; полиэтиленгликоль алкиловые простые эфиры; сложные эфиры сахаров; простые эфиры сахаров; производные молочной кислоты и моно- и диглицеридов; гидрофобные продукты трансэтерификации полиолов с, по меньшей мере, одним соединением из группы, состоящей из глицеридов, растительных масел, гидрированных растительных масел, жирных кислот и стеринов; маслорастворимые витамины/производные витаминов; и смеси двух или нескольких из перечисленных соединений. В составе этой группы, липофильные ПАВ включают сложные эфиры глицерина и жирных кислот, сложные эфиры пропиленгликоля и жирных кислот и смеси двух или нескольких из указанных соединений; или липофильные ПАВ включают гидрофобные продукты трансэтерификации полиолов с, по меньшей мере, одним соединением из группы, состоящей из растительных масел, гидрированных растительных масел и триглицеридов.
В одном из вариантов осуществления, фармацевтическая композиция может включать солюбилизатор для обеспечения хорошей солюбилизации и/или растворения соединения по настоящему изобретению и/или минимизации осаждения соединения по настоящему изобретению. Эти агенты могут применяться в композициях для не перорального применения, например, композициях для инъекций. Солюбилизатор можно также добавлять для увеличения растворимости гидрофильного лекарственного средства и/или других компонентов, например, ПАВ, или для того, чтобы композиция оставалась в форме стабильного или гомогенного раствора или дисперсии.
Примеры подходящих солюбилизаторов включают, не ограничиваясь этим, следующие соединения: спирты и полиолы, например, этанол, изопропиловый спирт, бутанол, бензиловый спирт, этиленгликоль, пропиленгликоль, бутандиолы и их изомеры, глицерин, пентаэритрит, сорбит, маннит, транскутол, диметилизосорбид, полиэтиленгликоль, полипропиленгликоль, поливиниловый спирт, гидроксипропил метилцеллюлозу и другие производные целлюлозы, циклодекстрины и производные циклодекстрина; простые эфиры полиэтиленгликолей, имеющих среднюю молекулярную массу от примерно 200 до примерно 6000, например, эфир ПЭГ и тетрагидрофурфурилового спирта (гликофурол) или метокси ПЭГ; амиды или другие азотсодержащие соединения, например, 2-пирролидон, 2-пиперидон, ε-капролактам, N-алкилпирролидон, N-гидроксиалкилпирролидон, N-алкилпиперидон, N-алкилкапролактам, диметилацетамид и поливинилпирролидон; сложные эфиры, например, этилпропионат, трибутилцитрат, ацетил триэтилцитрат, ацетил трибутил цитрат, триэтилцитрат, этилолеат, этил каприлат, этил бутират, триацетин, моноацетат пропиленгликоля, диацетат пропиленгликоля, ε-капролактон и его изомеры, δ-валеролактон и его изомеры, β-бутиролактон и его изомеры; и другие солюбилизаторы, известные в технике, например, диметилацетамид, диметил изосорбид, N-метил пирролидоны, монооктаноин, моноэтиловый эфир диэтиленгликоля, воду, а также смеси двух или нескольких из перечисленных соединений. В некоторых вариантах осуществления, в качестве солюбилизатора в композициях по настоящему изобретению может применяться солюбилизатор, содержащий моно- и дисложные эфиры полигликоля и 12-гидроксистеариновой кислоты и примерно 30% свободного полиэтиленгликоля (который можно приобрести под торговым наименованием Solutol® HS 15).
В некоторых вариантах осуществления, могут применяться смеси солюбилизаторов. Примеры включают, не ограничиваясь этим, смеси двух или нескольких компонентов из числа триацетина, триэтилцитрата, этилолеата, этилкаприлата, диметилацетамида, N-метилпирролидона, N-гидроксиэтилпирролидона, поливинилпирролидона, гидроксипропил метилцеллюлозы, гидроксипропил циклодекстринов, этанола, полиэтиленгликоля 200-100, гликофурола, транскутола, пропиленгликоля или диметилизосорбида. В некоторых вариантах осуществления, солюбилизаторы включают сорбит, глицерин, триацетин, этиловый спирт, ПЭГ-400, гликофурол и пропиленгликоль.
В некоторых вариантах осуществления, на количество солюбилизатора, который можно ввести в состав композиции по настоящему изобретению, не накладывается конкретных ограничений. Количество того или иного стабилизатора может быть ограничено биологически приемлемым количеством, которое может легко определить специалист в данной области техники. В некоторых ситуациях, может оказаться предпочтительным включать количества солюбилизаторов, которые существенно превосходят биологически приемлемые количества, например, для максимального увеличения концентрации лекарственного средства, причем избыток солюбилизатора удаляют перед введением композиции субъекту с помощью стандартных методик, например, отгонки или выпаривания. Таким образом, солюбилизатор, если он присутствует в композиции, может находиться в массовом отношении от примерно 10% до примерно 25%, примерно 50%, примерно 100% или до примерно 200% по массе, относительно суммарной массы действующего средства и других эксципиентов. В некоторых вариантах осуществления, могут также применяться очень малые количества солюбилизаторов, например, приблизительно 5%, приблизительно 2%, приблизительно 1% или даже менее. В некоторых вариантах осуществления, солюбилизатор может присутствовать в количестве от примерно 1% до примерно 100%, или от примерно 5% до примерно 25% по массе.
В одном из вариантов осуществления, композиция по настоящему изобретению может дополнительно включать одну или несколько фармацевтически приемлемых добавок и/или эксципиентов. Эти добавки и эксципиенты включают, не ограничиваясь этим, средства для устранения липкости, пеногасители, буферные агенты, полимеры, антиоксиданты, консерванты, хелатообразующие агенты, модуляторы вязкости, средства для придания тоничности, вкусоароматические добавки, красители, ароматизаторы, средства для придания непрозрачности, суспендирующие агенты, связующие средства, наполнители, пластификаторы, смазывающие средства и смеси двух или нескольких из перечисленных эксципиентов. В другом варианте осуществления, композиция по настоящему изобретению может дополнительно включать одну или несколько фармацевтически приемлемых добавок и/или эксципиентов, например, но не ограничиваясь перечисленными, инертные разбавители, диспергирующие и/или гранулирующие агенты, поверхностно-активные вещества и/или эмульгаторы, дезинтегрирующие агенты, связующие агенты, консерванты, буферные агенты, смазывающие агенты и/или масла. Например, в композиции могут быть представлены такие эксципиенты, как какао-масло и воски для суппозиториев, красящие агенты, покрывающие агенты, подсластители, вкусоароматические добавки и отдушки.
Типовые поверхностно-активные вещества и/или эмульгаторы включают, не ограничиваясь этим, природные эмульгаторы (например, гуммиарабик, агар, альгиновую кислоту, альгинат натрия, трагакант, хондрус, холестерин, ксантан, пектин, желатин, яичный желток, казеин, ланолин, холестерин, воск и лецитин), коллоидные глины (например, бентонит [силикат алюминия] и Veegum [силикат магния алюминия]), производные аминокислот с длинными цепями, спирты высокой молекулярной массы (например, стеариловый спирт, цетиловый спирт, олеиловый спирт, триацетинмоностеарат, этиленгликоль дистеарат, глицерил моностеарат и пропиленгликоль моностеарат, поливиниловый спирт), карбомеры (например, карбоксиполиметилен, полиакриловую кислоту, полимеры акриловой кислоты и карбоксивиниловые полимеры), каррагинан, производные целлюлозы (например, натрий карбоксиметилцеллюлозу, порошкообразную целлюлозу, гидроксиметилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропил метилцеллюлозу, метилцеллюлозу), сложные эфиры сорбитана и жирных кислот (например, полиоксиэтиленсорбитана монолаурат [Tween®20], полиоксиэтиленсорбитан [Tween®60], полиоксиэтиленсорбитана моноолеат [Tween®80], сорбитана монопальмитат [Span 40], сорбитана моностеарат [Span 60], сорбитана тристеарат [Span 65], глицерил моноолеат, сорбитана моноолеат [Span 80]), сложные эфиры полиоксиэтилена (например, полиоксиэтилена моностеарат [Myrj 45], полиоксиэтилен гидрированное касторовое масло, полиэтоксилированное касторовое масло, полиоксиметилен стеарат и Solutol®), сложные эфиры сахарозы и жирных кислот, сложные эфиры полиэтиленгликоля и жирных кислот (например, Cremophor®), простые эфиры полиоксиэтилена (например, лауриловый простой эфир полиоксиэтилена [BriJ 30]), поли(винилпирролидон), монолаурат диэтиленгликоля, олеат триэтаноламина, олеат натрия, олеат калия, этилолеат, олеиновую кислоту, этиллаурат, лаурилсульфат натрия, Pluronic F68, Poloxamer 188, бромид цетримония, хлорид цетилпиридиния, хлорид бензалкония, докузат натрия и т.д. и/или их комбинации.
Примеры консервантов могут включать антиоксиданты, хелатообразующие агенты, противомикробные консерванты, противогрибковые консерванты, спиртовые консерванты, кислотные консерванты и другие консерванты. Примеры антиоксидантов включают, не ограничиваясь этим, альфа токоферол, аскорбиновую кислоту, аскорбилпальмитат, бутилированный гидроксианизол, бутилированный гидрокситолуол, монотиоглицерин, метабисульфит калия, пропионовую кислоту, пропилгаллат, аскорбат натрия, бисульфит натрия, метабисульфит натрия и сульфит натрия. Примеры хелатообразующих агентов включают этилендиаминтетрауксусную кислоту (EDTA), моногидрат лимонной кислоты, динатрий эдетат, дикалий эдетат, этилендиаминтетрауксусную кислоту, фумаровую кислоту, яблочную кислоту, фосфорную кислоту, эдетат натрия, винную кислоту и тринатрий эдетат. Примеры противомикробных консервантов включают, не ограничиваясь этим, хлорид бензалкония, хлорид бензетония, бензиловый спирт, бронопол, цетримид, хлорид цетилпиридиния, хлоргексидин, хлорбутанол, хлоркрезол, хлорксиленол, крезол, этиловый спирт, глицерин, гексетидин, имидмочевину, фенол, феноксиэтанол, фенилэтиловый спирт, нитрат фенилртути, пропиленгликоль и тимеросал. Примеры противогрибковых консервантов включают, не ограничиваясь этим, бутилпарабен, метилпарабен, этилпарабен, пропилпарабен, бензойную кислоту, гидроксибензойную кислоту, бензоат калия, сорбат калия, бензоат натрия, пропионат натрия и сорбиновую кислоту. Примеры спиртовых консервантов включают, не ограничиваясь этим, этанол, полиэтиленгликоль, фенол, фенольные соединения, бисфенол, хлорбутанол, гидроксибензоат и фенилэтиловый спирт. Примеры кислотных консервантов включают, не ограничиваясь этим, витамин A, витамин C, витамин E, бета-каротин, лимонную кислоту, уксусную кислоту, дегидроуксусную кислоту, аскорбиновую кислоту, сорбиновую кислоту и фитиновую кислоту. Другие консерванты включают, не ограничиваясь этим, токоферол, токоферола ацетат, детероксима мезилат, цетримид, бутилированный гидроксианизол (BHA), бутилированный гидрокситолуол (BHT), этилендиамин, лаурилсульфат натрия (SLS), лаурилэфирсульфат натрия (SLES), бисульфит натрия, метабисульфит натрия, сульфит калия, метабисульфит калия, Glydant® Plus, Phenonip, метилпарабен, Germall®115, Germaben® II, NeoloneTM, KathonTM и Euxyl®. В некоторых вариантах осуществления, консервант представляет собой антиоксидант. В других вариантах осуществления, консервант представляет собой хелатообразующий агент.
Примеры масел включают, не ограничиваясь этим, миндальное масло, масло семечек абрикоса, масло авокадо, масло бабассу, масло бергамота, масло семян черной смородины, масло бораго, масло можжевельника, масло ромашки, масло канолы, масло тмина, масло карнаубы, касторовое масло, коричное масло, масло какао, кокосовое масло, масло печени трески, масло кофе, кукурузное масло, масло семян хлопчатника, жир эму, эвкалиптовое масло, масло энотеры, рыбий жир, масло семян льна, гераниол, масло бутылочной тыквы, масло виноградных семян, масло фундука, масло иссопа, изопропилмиристат, масло жожоба, масло лакового дерева, лавандиновое масло, масло лаванды, масло лимона, масло лицеа кубеба, масло ореха макадамия, масло мальвы, масло семян манго, масло семян пенника лугового, жир норки, масло мускатного ореха, оливковое масло, апельсиновое масло, жир атлантического большеголова, пальмовое масло, масло ядер кокосового ореха, масло косточек персика, арахисовое масло, масло макового семени, масло тыквенных семян, масло семян рапса, масло рисовых отрубей, масло розмарина, саффлоровое масло, масло сандалового дерева, масло саскваны, масла душистых трав, масло облепихи крушинной, масло кунжута, масло дерева ши, силикон, соевое масло, подсолнечное масло, масло чайного дерева, масло артишока, масло цубаки (камелии), ветиверовое масло, масло грецкого ореха и масло зародышей пшеницы. Примеры масел включают, не ограничиваясь этим, бутилстеарат, триглицерид каприловой кислоты, триглицерид каприновой кислоты, циклометикон, диэтилсебацинат, диметикон 360, изопропилмиристат, минеральное масло, октилдодеканол, олеиловый спирт, силиконовое масло и их комбинации.
Типовые гранулирующие и/или диспергирующие агенты включают, не ограничиваясь этим, картофельный крахмал, кукурузный крахмал, крахмал маниока, натрий крахмал гликолят, глины, альгиновую кислоту, гуаровую камедь, цитрусовую пульпу, агар, бентонит, целлюлозу и древесные продукты, природную губку, катионнообменные смолы, карбонат кальция, силикаты, карбонат натрия, поперечно-сшитый поли(винилпирролидон)(кросповидон), натрий карбоксиметил крахмал (натрий крахмал гликолят), карбоксиметилцеллюлозу, поперечно-сшитую натрий карбоксиметил целлюлозу (кросскармелозу), метилцеллюлозу, прежелатинизированный крахмал (крахмал 1500), микрокристаллический крахмал, нерастворимый в воде крахмал, кальций карбоксиметил целлюлозу, силикат алюминия магния (Veegum®), лаурилсульфат натрия, соединения четвертичного аммония и т.д., а также комбинации перечисленных компонентов.
Примеры разбавителей включают, не ограничиваясь этим, карбонат кальция, карбонат натрия, фосфат кальция, дикальций фосфат, сульфат кальция, гидрофосфат кальция, фосфат натрия, лактозу, сахарозу, целлюлозу, микрокристаллическую целлюлозу, каолин, маннит, сорбит, инозит, хлорид натрия, сухой крахмал, кукурузный крахмал, порошкообразный сахар и т.д., а также комбинации перечисленных разбавителей.
В другом варианте осуществления, в композицию по настоящему изобретению можно включать кислоту или основание с целью облегчения изготовления, улучшения устойчивости или по другим причинам. Примеры фармацевтически приемлемых оснований включают, не ограничиваясь этим, аминокислоты, сложные эфиры аминокислот, гидроксид аммония, гидроксид калия, гидроксид натрия, гидрокарбонат натрия, гидроксид алюминия, карбонат кальция, гидроксид магния, алюмосиликат магния, синтетический силикат алюминия, синтетический гидрокальцит, гидроксид алюминия магния, диизопропилэтиламин, этаноламин, этилендиамин, триэтаноламин, триэтиламин, триизопропаноламин, триметиламин, трис(гидроксиметил)аминометан (TRIS) и т.п. В некоторых вариантах осуществления, фармацевтически приемлемые основания являются солями фармацевтически приемлемых кислот. Примеры фармацевтически приемлемых кислот включают, не ограничиваясь этим, уксусную кислоту, акриловую кислоту, адипиновую кислоту, альгиновую кислоту, алкансульфоновую кислоту, аминокислоты, аскорбиновую кислоту, бензойную кислоту, борную кислоту, масляную кислоту, угольную кислоту, лимонную кислоту, жирные кислоты, муравьиную кислоту, фумаровую кислоту, глюконовую кислоту, гидрохинонсульфоновую кислоту, изоаскорбиновую кислоту, молочную кислоту, малеиновую кислоту, щавелевую кислоту, пара-бромфенилсульфоновую кислоту, пропионовую кислоту, п-толуолсульфоновую кислоту, салициловую кислоту, стеариновую кислоту, янтарную кислоту, дубильную кислоту, винную кислоту, тиогликолевую кислоту, толуолсульфоновую кислоту, мочевую кислоту и т.п.; а также соли многоосновных кислот, например, фосфат натрия, динатрийгидрофосфат и натрийдигидрофосфат. Если основание представляет собой соль, катион основания может представлять собой любой известный и фармацевтически приемлемый катион, например, аммоний, катион щелочного металла, катион щелочноземельного металла и т.п. Примеры таких катионов могут включать натрий, калий, литий, магний, кальций и аммоний.
В одном из вариантов осуществления, подходящие кислоты представляют собой фармацевтически приемлемые органические или неорганические кислоты. Примеры подходящих неорганических кислот включают, не ограничиваясь этим, хлористоводородную кислоту, бромистоводородную кислоту, йодистоводородную кислоту, серную кислоту, азотную кислоту, борную кислоту, фосфорную кислоту и т.п. Примеры подходящих органических кислот включают, не ограничиваясь этим, уксусную кислоту, акриловую кислоту, адипиновую кислоту, альгиновую кислоту, алкансульфоновую кислоту, аминокислоты, аскорбиновую кислоту, бензойную кислоту, борную кислоту, масляную кислоту, угольную кислоту, лимонную кислоту, жирные кислоты, муравьиную кислоту, фумаровую кислоту, глюконовую кислоту, гидрохинонсульфоновую кислоту, изоаскорбиновую кислоту, молочную кислоту, малеиновую кислоту, метансульфоновую кислоту, щавелевую кислоту, пара-бромфенилсульфоновую кислоту, пропионовую кислоту, п-толуолсульфоновую кислоту, салициловую кислоту, стеариновую кислоту, янтарную кислоту, дубильную кислоту, винную кислоту, тиогликолевую кислоту, толуолсульфоновую кислоту, мочевую кислоту и т.п.
Фармацевтические композиции для парентерального введения
В некоторых вариантах осуществления, изобретение относится к фармацевтическим композициям для парентерального введения, содержащим полиморф по настоящему изобретению или его фармацевтически приемлемую форму (например, фармацевтически приемлемую соль, гидрат, сольват, хелат, нековалентный комплекс, изомер, пролекарство и изотопно-меченое производное), а также фармацевтический эксципиент, подходящий для парентерального введения. В некоторых вариантах осуществления, изобретение относится к фармацевтическим композициям для парентерального введения, содержащим: (i) эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой формы (например, фармацевтически приемлемой соли, гидрата, сольвата, хелата, нековалентного комплекса, изомера, пролекарства и изотопно-меченого производного); необязательно (ii) эффективное количество одного или нескольких вторых агентов; и (iii) один или нескольких фармацевтических эксципиентов, подходящих для парентерального введения. В некоторых вариантах осуществления, фармацевтическая композиция дополнительно содержит: (iv) эффективное количество третьего агента.
В некоторых вариантах осуществления, формы композиций по настоящему изобретению, которые подходят для введения с помощью инъекций, включают водные или масляные суспензии или эмульсии с кунжутным маслом, кукурузным маслом, хлопковым маслом или арахисовым маслом, а также эликсиры манит, декстроза или стерильные водные растворы и аналогичные фармацевтические формы.
Жидкие дозированные формы для перорального или парентерального введения включают, не ограничиваясь этим, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Помимо действующих ингредиентов, жидкие дозированные формы могут включать инертные разбавители, обычно применяемые в технике, например, воду или другие растворители, солюбилизирующие агенты и эмульгаторы, например, этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в т.ч. хлопковое, арахисовое, кукурузное, ростков, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли, и сложные эфиры жирных кислот и сорбитана, а также их смеси. В некоторых вариантах осуществления композиций для парентерального введения, соединения по настоящему изобретению могут быть смешаны с солюбилизирующими агентами, такими как Cremophor®, спирты, масла, модифицированные масла, гликоли, полисорбаты, циклодекстрины, полимеры и их комбинации.
В некоторых вариантах осуществления, для инъекций применяются растворы действующих соединений в водном солевом растворе. В некоторых вариантах осуществления, могут применяться этанол, глицерин, пропиленгликоль, жидкий полиэтиленгликоль или подобные соединения (и их подходящие смеси), производные циклодекстрина или растительные масла. Стерильные препараты для инъекций могут представлять собой стерильные растворы, суспензии или эмульсии для инъекций в нетоксичных разбавителях или растворителях, подходящих для парентерального введения, например, раствор в 1,3-бутандиоле. В число примеров носителей и растворителей, которые могут применяться в парентеральных композициях по настоящему изобретению, входят вода, раствор Рингера, U.S.P. и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды, обычно применяются стерильные нелетучие масла. С этой целью может применяться любое не раздражающее нелетучее масло, включая синтетические моно- и диглицериды. Кроме того, при получении препаратов для инъекций могут применяться жирные кислоты, например, олеиновая кислота. Необходимую подвижность состава можно поддерживать, например, применением покрытий, таких как лецитин, для поддержания определенного размера частиц в случае дисперсий, или применением ПАВ. В некоторых вариантах осуществления, предотвращение действия микроорганизмов может быть достигнуто с помощью различных антибактериальных и противогрибковых агентов, например, парабенов, хлорбутанола, фенола, сорбиновой кислоты, тимеросала и т.п.
В некоторых вариантах осуществления, стерильные растворы для инъекций получают введением соединения по настоящему изобретению в определенное количество подходящего растворителя вместе с прочими ингредиентами, которые перечислены в заявке, с последующей стерилизацией фильтрованием. В некоторых вариантах осуществления, дисперсии получают введением различных стерилизованных действующих ингредиентов в стерильный носитель, который содержит основную дисперсионную среду и прочие ингредиенты, которые перечислены в заявке. В случае стерильных порошков для получения стерильных растворов для инъекций, подходящие методики получения включают, не ограничиваясь этим, способы вакуумного высушивания и лиофилизации, которые позволяют получить порошок действующего ингредиента, скомбинированного с любым другим ингредиентом из предварительно отфильтрованного стерильного раствора.
Составы для инъекций могут подвергаться стерилизации, например, с помощью фильтрования через фильтр, задерживающий бактерии, или путем введения стерилизующих агентов в форме стерильных твердых композиций, которые перед применением могут быть растворены или диспергированы в стерильной воде или других стерильных средах, пригодных для инъекций. Композиции для инъекций могут содержать от примерно 0,1 до примерно 5% масс./масс. соединения по настоящему изобретению.
Фармацевтические композиции для местного введения
В некоторых вариантах осуществления, изобретение относится к фармацевтической композиции для местной (например, трансдермальной) доставки, включающей полиморф по настоящему изобретению или его фармацевтически приемлемую форму (например, фармацевтически приемлемую соль, гидрат, сольват, хелат, нековалентный комплекс, изомер, пролекарство и изотопно-меченое производное), а также фармацевтический эксципиент, подходящий для местной (например, трансдермальной) доставки. В некоторых вариантах осуществления, изобретение относится к фармацевтическим композициям для местного введения, содержащим: (i) эффективное количество соединения по настоящему изобретению; необязательно (ii) эффективное количество одного или нескольких вторых агентов; и (iii) один или нескольких фармацевтических эксципиентов, подходящих для местного введения. В некоторых вариантах осуществления, фармацевтическая композиция дополнительно содержит: (iv) эффективное количество третьего агента.
В некоторых вариантах осуществления, композиции по настоящему изобретению могут входить в состав препаратов в твердой, полутвердой или жидкой форме, подходящих для местного и/или поверхностного введения, например, гелей, водорастворимых желе, кремов, лосьонов, суспензий, пен, порошков, суспензий, мазей, растворов, масел, паст, суппозиториев, спреев, эмульсий, солевых растворов и растворов на основе диметилсульфоксида (ДМСО). В одном из вариантов осуществления, более густые носители способны обеспечить продолжительно действие активного ингредиента на определенном участке. В противоположность этому, состав в форме раствора может обеспечить более быстрое действие активного ингредиента на выбранном участке.
В некоторых вариантах осуществления, фармацевтические композиции могут также включать подходящие твердые или гелевые носители или эксципиенты, которые являются соединениями, позволяющими увеличить проникновение или содействовать доставке терапевтических молекул через роговой слой кожи, который является барьером проницаемости кожи. Существует большое количество молекул, улучшающих проникновение, известных специалисту в области составов для местного применения. Примеры таких носителей и эксципиентов включают, не ограничиваясь этим, увлажнители (например, мочевину), гликоли (например, пропиленгликоль), спирты (например, этанол), жирные кислоты (например, олеиновую кислоту), ПАВ (например, изопропил миристат и лаурилсульфат натрия), пирролидоны, глицерил монолаураты, сульфоксиды, терпены (например, ментол), амины, амиды, алканы, алканолы, воду, карбонат кальция, фосфат кальция, различные сахара, крахмалы, производные целлюлозы, желатин и полимеры, например, полиэтиленгликоли.
В другом варианте осуществления, фармацевтические композиции или дозированные формы, предназначенные для применения в способах по настоящему изобретению, вводят с помощью устройств для трансдермальной доставки («пластырей»). Такие трансдермальные пластыри могут применяться для обеспечения непрерывной или дискретной инфузии соединения по настоящему изобретению в регулируемых количествах, либо вместе с другими агентами, либо без них.
Структура и применение трансдермальных пластырей для доставки фармацевтического агента известны в технике. Смотрите, например, патенты США №№ 5023252, 4992445 и 5001139, включенные в настоящую заявку с помощью ссылки. Можно разработать пластыри, обеспечивающие непрерывную, пульсирующую доставку или доставку по потребности.
Подходящие устройства для применения при доставке интрадермальных фармацевтически приемлемых композиций, описанных в настоящей заявке, включают устройства с короткими иглами, например, описанные в патентах США 4886499; 5190521; 5328483; 5527288; 4270537; 5015235; 5141496 и 5417662. Интрадермальные композиции могут вводиться с помощью устройств, которые ограничивают эффективную длину проникновения иглы в кожу, например, описанные в публикации PCT WO 99/34850 и их функциональные эквиваленты. Подходят устройства для впрыскивания струей, которые доставляют жидкие вакцины в дерму с помощью шприца для впрыскивания струй жидкости и/или иглы, которая протыкает роговой слой кожи и формирует струю, которая попадает в дерму. Устройства для впрыскивания струей описаны, например, в патентах США 5480381; 5599302; 5334144; 5993412; 5649912; 5569189; 5704911; 5383851; 5893397; 5466220; 5339163; 5312335; 5503627; 5064413; 5520639; 4596556; 4790824; 4941880; 4940460; и публикациях PCT WO 97/37705 и WO 97/13537. Подходят устройства для баллистической доставки порошка/частиц, в которых сжатый газ применяется для ускорения проникания частиц лекарственного средства в порошке через внешние слои кожи в дерму. В качестве дополнения или альтернативы, можно применять обычные шприцы в классической методике интрадермального введения Манту.
Составы, подходящие для местного введения, могут, например, включать от примерно 1% до примерно 10% (масса/масса) соединения формулы (I), хотя концентрация соединения формулы (I) может быть ограничена только пределом растворимости соединения формулы (I) в растворителе. В некоторых вариантах осуществления, составы, подходящие для местного введения, могут, например, включать от примерно 1% до примерно 9% (масса/масса) соединения формулы (I), например, от приблизительно 1% до приблизительно 8% (масса/масса), кроме того, например, от приблизительно 1% до приблизительно 7% (масса/масса), кроме того, например, от приблизительно 1% до приблизительно 6% (масса/масса), кроме того, например, от приблизительно 1% до приблизительно 5% (масса/масса), кроме того, например, от приблизительно 1% до приблизительно 4% (масса/масса), кроме того, например, от приблизительно 1% до приблизительно 3% (масса/масса) и кроме того, например, от приблизительно 1% до приблизительно 2% (масса/масса) соединения формулы (I). Составы для местного введения могут дополнительно включать один или несколько дополнительных фармацевтически приемлемых эксципиентов, описанных в настоящей заявке.
Фармацевтические композиции для ингаляционного введения
В некоторых вариантах осуществления, в настоящем изобретении предусмотрены фармацевтические композиции для ингаляционного введения, содержащие полиморф по настоящему изобретению или его фармацевтически приемлемую форму (например, фармацевтически приемлемую соль, гидрат, сольват, хелат, нековалентный комплекс, изомер, пролекарство и изотопно-меченое производное), а также фармацевтический эксципиент, подходящий для инголяционного введения. В некоторых вариантах осуществления, изобретение относится к фармацевтическим композициям для ингаляционного введения, содержащим: (i) эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой формы (например, фармацевтически приемлемой соли, гидрата, сольвата, хелата, нековалентного комплекса, изомера, пролекарства и изотопно-меченого производного); необязательно (ii) эффективное количество одного или нескольких вторых агентов; и (iii) один или нескольких фармацевтических эксципиентов, подходящих для ингаляционного введения. В некоторых вариантах осуществления, фармацевтическая композиция дополнительно содержит: (iv) эффективное количество третьего агента.
В некоторых вариантах осуществления, изобретение относится к композициям для ингаляции или инсуффляции, которые могут включать растворы и суспензии в фармацевтически приемлемых водных или органических растворителях или их смесях; а также подходящие порошки. Эти жидкие или твердые композиции могут содержать подходящие фармацевтически приемлемые эксципиенты, описанные в настоящей заявке. В некоторых вариантах осуществления, композиции вводят пероральным или назальным респираторным путем для достижения местного или системного действия. В некоторых вариантах осуществления, композиции в фармацевтически приемлемых растворителях можно распылять с помощью инертных газов. Распыленные растворы можно вдыхать непосредственно из распыляющего устройства, или распыляющее устройство может быть присоединено к лицевой маске или промежуточному агрегату, создающему повышенное давление вдыхаемых газов. В некоторых вариантах осуществления, композиции в форме растворов суспензий или порошков можно вводить, например, перорально или назально, из устройств, которые подают составы подходящим образом.
Фармацевтические композиции для глазного введения
В некоторых вариантах осуществления, изобретение относится к фармацевтической композиции для лечения глазных расстройств. В одном из вариантов осуществления, композиция имеет состав, подходящий для глазного введения, и она включает эффективное количество полиморфа по настоящему изобретению или его фармацевтически приемлемой формы (например, фармацевтически приемлемой соли, гидрата, сольвата, хелата, нековалентного комплекса, изомера, пролекарства и изотопно-меченого производного) по настоящему изобретению, а также фармацевтический эксципиент, подходящий для глазного введения. В некоторых вариантах осуществления, фармацевтические композиции по настоящему изобретению, подходящие для глазного введения, могут представлять собой дискретные дозированные формы, например, капли или спреи, каждая единица которых содержит заранее определенное количество действующего ингредиента в форме раствора или суспензии в водной или неводной жидкости, эмульсии масло-в-воде или эмульсии вода-в-масле. Другие формы введения включают глазные капли, внутриглазные инъекции, интравитреальные инъекции, местное введение или с применением устройства с лекарственным покрытием, микрокапсулы, имплантаты или микроструйные устройства. В некоторых случаях, соединения по настоящему изобретению вводят с носителем или эксципиентом, который увеличивает проникновение действующего ингредиента внутрь глаза, например, масляной или водной эмульсией с коллоидными частицами, у которых имеется масляное ядро, окруженное тонким межфазной пленкой.
В некоторых случаях, коллоидные частицы включают, по меньшей мере, один катионный агент и, по меньшей мере, одно неионное ПАВ, например, полоксамер, тилоксапол, полисорбат, полиоксиэтиленовое производное касторового масла, сложный эфир сорбитана или полиоксил стеарат. В некоторых случаях, катионный агент представляет собой алкиламин, третичный алкиламин, соединение четвертичного аммония, катионный липид, аминоспирт, соль бигуанидина, катионное соединение или их смесь. В некоторых случаях, катионный агент представляет собой соль бигуанидина, например, хлоргексидин, полиаминопропил бигуанидин, фенформин, алкилбигуанидин или их смесь. В некоторых случаях, соединение четвертичного аммония представляет собой галогенид бензалкония, галогенид лауралкония, цетримид, галогенид гексадецилтриметиламмония, галогенид тетрадецилтриметиламмония, галогенид додецилтриметиламмония, галогенид цетримония, галогенид бензетония, галогенид бегеналкония, галогенид цеталкония, галогенид цетилдимония, галогенид цетилпиридиния, галогенид бензододециния, галогенид хлораллил метенамина, галогенид миристилалкония, галогенид стеаралкония или смесь двух или нескольких из перечисленных компонентов. В некоторых случаях, катионный агент представляет собой хлорид бензалкония, хлорид лауралкония, бромид бензододециния, хлорид бензетения, бромид гексадецилтриметиламмония, бромид тетрадецилтриметиламмония, бромид додецилтриметиламмония или смесь двух или нескольких из перечисленных соединений. В некоторых случаях, масляная фаза является минеральным маслом и легким минеральным маслом, триглицеридом с цепью средней длины (MCT), кокосовым маслом; гидрированным маслом, включающим гидрированное хлопковое масло, гидрированное пальмовое масло, гидрированное касторовое масло или гидрированное соевое масло; производным полиэтилена и гидрированного касторового масла, таким как полиоксил-40-гидрированное касторовое масло, полиоксил-60-гидрированное касторовое масло или полиоксил-100-гидрированное касторовое масло.
В изобретении рассматривается возможность применения всех путей глазного введения, включая поверхностное, субконъюнктивальное, периокулярное, ретробульбарное, субтеноновое, интракамеральное, интравитреальное, интраокулярное, субретинальное, околосклеральное и супрахориоидальное введение. Может быть целесообразным системное или парентеральное введение, включая, но не ограничиваясь этим, внутривенное, подкожное или пероральное введение. Примерами способов введения будут являться интравитреальное или субтеноновая инъекция растворов или суспензий, или интравитреальное или субтеноновое размещение биоразрушаемых или не биоразрушаемых устройств, или введение на поверхность глаза растворов или суспензий, или заднее околосклеральное введение гелевого или кремового состава.
В некоторых вариантах осуществления, глазные капли можно получать растворением действующего ингредиента в стерильном водном растворе, например, физиологическом солевом растворе или буферном растворе; или растворением порошковых композиций перед применением. Могут быть выбраны другие носители, которые известны в технике, включая, но не ограничиваясь этим, сбалансированный солевой раствор, солевой раствор, водорастворимые полиэфиры, такие как полиэтиленгликоль, поливиниловые производные, такие как поливиниловый спирт и повидон, производные целлюлозы, такие как метилцеллюлоза и гидроксипропилметилцеллюлоза, продукты переработки нефти, такие как минеральное масло и белый вазелин, животные жиры, такие как ланолин, полимеры акриловой кислоты, такие как карбоксиполиметиленовый гель, растительные жиры, такие как арахисовое масло, полисахариды, такие как декстраны, гликозаминогликаны, например, гиалуронат натрия; и смеси двух или нескольких перечисленных носителей. В некоторых вариантах осуществления, могут вводиться добавки, традиционно применяемые в глазных каплях. Такие добавки включают ионизирующие агенты (например, хлорид натрия), буферный агент (например, борную кислоту, моногидрофосфат натрия, дигидрофосфат натрия), консерванты (хлорид бензалкония, хлорид бензетония, хлорбутанол), загустители (например, сахариды, в т.ч. лактозу, маннит, мальтозу; например, гиалуроновую кислоту или ее соли, в т.ч. гиалуронат натрия, гиалуронат калия; например, мукополисахариды, в т.ч. хондроитина сульфат; например, полиакрилат натрия, карбоксивиниловый полимер, поперечно-сшитый полиакрилат, поливиниловый спирт, поливинилпирролидон, метилцеллюлозу, гидроксипропилметилцеллюлозу, гидроксиэтилцеллюлозу, карбоксиметилцеллюлозу, гидроксипропилцеллюлозу, или другие агенты, известные специалистам в данной области).
Другие пути введения
В одном из вариантов осуществления, композиции по настоящему изобретению могут также доставляться с применением пропитанного или покрытого устройства, например, стента или помещаемого в артерию цилиндрического полимерного устройства. Такой способ введения может, например, способствовать предотвращению или ослаблению рестеноза после таких процедур, как баллонная ангиопластика. Не ограничиваясь каким-либо конкретным объяснением, соединение по настоящему изобретению может замедлять или ингибировать миграцию или пролиферацию гладкомышечных клеток в артериальной стенке, которые способствуют рестенозу. Соединение по настоящему изобретению можно вводить, например, путем местной доставки из каркаса стента, из стент-графтов, из имплантатов или из оболочки или корпуса стента. В некоторых вариантах осуществления, соединения по настоящему изобретению вводят в состав матрицы. Эта матрица может быть полимерной матрицей, и она может служить для связывания соединения со стентом. Полимерные матрицы, подходящие для такого применения, включают, например, полиэфиры или сополимеры на основе лактонов, например, полилактид, поликапролактонгликолид, сложные полиортоэфиры, полиангидриды, полиаминокислоты, полисахариды, полифосфазены, сополимеры поли(простой эфир-сложный эфир) (например, PEO-PLLA); полидиметилсилоксан, поли(этилен-винилацетат), полимеры или сополимеры на основе акрилатов (например, полигидроксиэтил метилметакрилат, поливинилпирролидон), фторированные полимеры, например, политетрафторэтилен, и сложные эфиры целлюлозы. Подходящие матрицы могут быть не разрушаемыми, или могут разрушаться со временем, высвобождая соединение или соединения. Соединение по настоящему изобретению можно наносить на поверхность стента различными способами, например, погружением/центрифугированием покрытия, распылением покрытия, погружением покрытия и/или с помощью кисти. Соединение по настоящему изобретению можно наносить в растворителе и растворителю можно дать испариться, что приведет к образованию слоя соединения на стенте. В качестве альтернативы, соединение можно наносить на корпус стента или имплантата, например, в микроканальцах или микропорах. После имплантации, соединение диффундирует из корпуса стента, вступая в контакт с артериальной стенкой. Такие стенты можно получать погружением стента, изготовленного таким образом, чтобы он содержал эти микропоры или микроканальцы, в раствор соединения по настоящему изобретению в подходящем растворителе, с последующим выпариванием растворителя. Избыток лекарственного средства с поверхности стента можно удалить дополнительным кратковременным промыванием растворителем. В еще одном варианте осуществления, соединение по настоящему изобретению может быть ковалентно связано со стентом или имплантатом. Может применяться такой линкер, который разрушается in vivo, что приводит к высвобождению соединения по настоящему изобретению. С этой целью может применяться любая биологически лабильная связь, например, сложноэфирная, амидная или ангиридная связь. Кроме того, соединение по настоящему изобретению можно вводить интраваскулярно из баллона, применяемого при ангиопластике. Для уменьшения рестеноза можно также осуществлять экстраваскулярное введение соединения по настоящему изобретению через перикарду или путем адвенцитиального нанесения составов по настоящему изобретению.
Ряд стентовых устройств, которые могут применяться описанным выше способом, раскрыт, например, в перечисленных ниже патентах: патенте США № 5451233; патенте США № 5040548; патенте США № 5061273; патенте США № 5496346; патенте США № 5292331; патенте США № 5674278; патенте США № 3657744; патенте США № 4739762; патенте США № 5195984; патенте США № 5292331; патенте США № 5674278; патенте США № 5879382; и патенте США № 6344053.
Составы для введения с регулируемым высвобождением
В некоторых вариантах осуществления, изобретение относится к фармацевтическим композициям для введения с регулируемым высвобождением, содержащим полиморф по настоящему изобретению или его фармацевтически приемлемую форму (например, фармацевтически приемлемую соль, гидрат, сольват, хелат, нековалентный комплекс, изомер, пролекарство и изотопно-меченое производное), а также фармацевтический эксципиент, подходящий для введения с регулируемым высвобождением. В некоторых вариантах осуществления, изобретение относится к фармацевтическим композициям для введения с регулируемым высвобождением, содержащим: (i) эффективное количество полиморфа по настоящему изобретению или его фармацевтически приемлемой формы (например, фармацевтически приемлемой соли, гидрата, сольвата, хелата, нековалентного комплекса, изомера, пролекарства и изотопно-меченого производного); необязательно (ii) эффективное количество одного или нескольких вторых агентов; и (iii) один или нескольких фармацевтических эксципиентов, подходящих для введения с регулируемым высвобождением. В некоторых вариантах осуществления, фармацевтическая композиция дополнительно содержит: (iv) эффективное количество третьего агента.
Действующие агенты, например, соединения по настоящему изобретению, можно вводить с помощью средств или устройств для доставки с регулируемым высвобождением, которые хорошо известны рядовым специалистам в данной области техники. Примеры включают, не ограничиваясь этим, средства и устройства, описанные в патентах №№: 3845770; 3916899; 3536809; 3598123; и 4008719; 5674533; 5059595; 5591767; 5120548; 5073543; 5639476; 5354556; 5639480; 5733566; 5739108; 5891474; 5922356; 5972891; 5980945; 5993855; 6045830; 6087324; 6113943; 6197350; 6248363; 6264970; 6267981; 6376461; 6419961; 6589548; 6613358; 6699500, каждый из которых включен в настоящую заявку с помощью ссылки. Такие дозированные формы могут использоваться для обеспечения медленного или регулируемого высвобождения одного или нескольких действующих агентов, например, гидроксипропилметилцеллюлоза, другие полимерные матрицы, гели, проницаемые мембраны, осмотические системы, многослойные покрытия, микрочастицы, липосомы, микросферы, или их комбинации в различных пропорциях, для обеспечения необходимого профиля высвобождения. Можно легко подобрать подходящие составы с регулируемым высвобождением, известные рядовому специалисту в данной области техники, включая описанные в настоящей заявке, которые подходят для применения в сочетании с действующими агентами по настоящему изобретению. Так, например, фармацевтические композиции по настоящему изобретению включают дозированные лекарственные формы, подходящие для перорального введения, такие как, но не ограничиваясь этим, таблетки, капсулы, гелевые капсулы и каплеты, которые адаптированы для регулируемого высвобождения.
Все фармацевтические продукты с регулируемым высвобождением имеют общую цель улучшить лекарственную терапию по сравнению с уровнем, который достигается при применении их аналогов с обычным высвобождением. В некоторых вариантах осуществления, применение препарата с регулируемым высвобождением в медицинском лечении характеризуется минимальным количеством лекарственного средства, применяемым для лечения или подавления заболевания, расстройства или состояния, за минимальное количество времени. Преимущества составов с регулируемым высвобождением включают повышение активности лекарственного препарата, уменьшение частоты введения и повышение приверженности субъекта лечению. Кроме того, составы с регулируемым высвобождением могут применяться для влияния на время начала действия или другие характеристики, например, уровни лекарственного средства в крови, и, таким образом, они могут влиять на возникновение побочных (например, нежелательных) эффектов.
В некоторых вариантах осуществления, составы с регулируемым высвобождением разработаны таким образом, чтобы первоначально высвобождать определенное количество соединения (например, полиморфа) по настоящему изобретению или его фармацевтически приемлемой формы (например, фармацевтически приемлемой соли, гидрата, сольвата, хелата, нековалентного комплекса, изомера, пролекарства и изотопно-меченого производного), которое быстро вызывает терапевтическое действие, и затем постепенно и непрерывно высвобождает дополнительные порции соединения, чтобы поддерживать этот уровень терапевтического или профилактического действия в течение продолжительного периода времени. Для поддержания этого постоянного уровня соединения формулы (I) в организме, это соединение должно высвобождаться из дозированной формы со скоростью, которая позволит заместить количество вещества, подвергшегося метаболизму и выведенное из организма. Регулируемое высвобождение действующего агента может быть стимулировано различными условиями, включая, но не ограничиваясь этим, pH, температуру, ферменты, воду или другими физиологическими условиями или соединениями.
В некоторых вариантах осуществления, фармацевтическую композицию можно вводить с помощью внутривенной инфузии, имплантируемого осмотического насоса, трансдермального пластыря, липосом или других способов введения. В одном варианте осуществления, может применяться насос (смотрите, Sefton, CRC Crit. Ref. Biomed. Eng. 14:201 (1987); Buchwald et al., Surgery 88:507 (1980); Saudek et al., N. Engl. J. Med. 321:574 (1989)). В другом варианте осуществления можно применять полимерные материалы. В еще одном варианте осуществления, систему с регулируемым высвобождением можно помещать в необходимый участок организма субъекта, определенный практикующим специалистом, причем при этом требуется только определенная часть системной дозы (смотрите, например, Goodson, Medical Applications of Controlled Release, 115-138 (vol.2, 1984)). Другие системы с регулируемым высвобождением обсуждаются в обзоре Langer, Science 249:1527-1533 (1990). Один или несколько действующих агентов могут быть диспергированы в твердой внутренней матрице, например, из полиметилметакрилата, полибутилметакрилата, пластифицированного или непластифицированного поливинилхлорида, пластифицированного нейлона, пластифицированного полиэтилентерефталата, природного каучука, полиизопрена, полиизобутилена, полибутадиена, полиэтилена, сополимеров этилен-винилацетат, силиконовых каучуков, полидиметиленсилоксанов, сополимеров силикона и карбонатов, гидрофильных полимеров, например, гидрогелей сложных эфиров акриловой и метакриловой кислоты, коллагена, поперечно-сшитого поливинилового спирта и поперечно-сшитого частично гидролизованного поливинилацетата, которая окружена внешней полимерной мембраной, например, из полиэтилена, полипропилена, сополимеров этилен/пропилен, сополимеров этилен/этилакрилат, сополимеров этилен/винилацетат, силиконовых каучуков, полидиметилсилоксанов, неопренового каучука, хлорированного полиэтилена, поливинилхлорида, сополимеров винилхлорида с винилацетатом, винилиденхлорида, этилена и пропилена, иономерного полиэтилентерефталата, бутилкаучука, эпихлоргидринового каучука, сополимера этилен/виниловый спирт, терполимера этилен/винилацетат/виниловый спирт и сополимера этилен/винилоксиэтанол, которые нерастворимы в жидких средах организма. Затем один или несколько действующих агентов диффундируют через внешнюю полимерную мембрану на стадии, определяющей скорость высвобождения. Процентная доля действующего агента в таких парентеральных композициях в значительной степени зависит от их конкретной природы, а также от потребностей субъекта.
Дозировка
Соединение (например, полиморф), описанное в настоящей заявке, или его фармацевтически приемлемая форма (например, фармацевтически приемлемая соль, гидрат, сольват, хелат, нековалентный комплекс, изомер, пролекарство и изотопно-меченое производное) могут доставляться в форме фармацевтически приемлемых композиций, которые включают терапевтически эффективное количество одного или нескольких соединений или их фармацевтически приемлемых форм (например, фармацевтически приемлемых солей, гидратов, сольватов, хелатов, нековалентных комплексов, изомеров, пролекарств и изотопно-меченых производных), описанных в настоящей заявке, и/или один или несколько дополнительных терапевтических агентов, например, химиотерапевтических средств, входящих в состав совместно с одним или несколькими фармацевтически приемлемыми эксципиентами. В некоторых случаях, соединение или фармацевтически приемлемую форму по настоящему изобретению и дополнительный терапевтический агент, вводят в отдельных фармацевтических композициях, и они могут вводиться (например, вследствие различных физических и/или химических характеристик) различными путями (например, одно терапевтическое средство вводят перорально, тогда как другое вводят внутривенно). В других случаях, соединение по настоящему изобретению или его фармацевтически приемлемую форму, и дополнительный терапевтический агент можно вводить раздельно, но одним и тем же путем (например, оба агента перорально или оба внутривенно). В других случаях, соединение по настоящему изобретению или его фармацевтически приемлемую форму, и дополнительный терапевтический агент можно вводить в составе одной и той же фармацевтической композиции.
В одном из вариантов осуществления, полиморфы по настоящему изобретению можно вводить в различных дозировках. В технике известно, что из-за возможных различий между субъектами в фармакокинетике, для оптимального лечения может применяться индивидуальный подбор режима введения. Дозировки для соединений по настоящему изобретению могут быть найдены в результате стандартных экспериментов с учетом настоящего описания.
В одном из вариантов осуществления, количество вводимого соединения будет зависеть от подвергаемого лечению млекопитающего, тяжести расстройства или состояния, пути введения, скорости введения, фармакокинетики соединения, скорости выведения или метаболизма конкретного применяемого соединения, скорости и степени абсорбции, продолжительности лечения, других препаратов, соединений и/или материалов, применяемых в комбинации с конкретным вводимым соединением, возраста, пола, массы, общего состояния здоровья и предыдущей медицинской истории пациента, подвергаемого лечению, усмотрения лечащего врача и подобных факторов, хорошо известных в медицинской технике. В одном из вариантов осуществления, эффективная дозировка находится в диапазоне от примерно 0,001 до примерно 100 мг на кг массы тела в день, или от примерно 1 до примерно 35 мг/кг/день в виде одной или нескольких доз. В одном из вариантов осуществления, для человека массой 70 кг, эффективная дозировка может составлять от примерно 0,05 до 7 г/день или от примерно 0,05 до примерно 2,5 г/день. В некоторых случаях, более адекватными будут дозировки, меньшие нижней границы указанного диапазона, тогда как в других случаях могут применяться еще большие дозировки, которые не вызывают каких-либо вредных побочных эффектов, например, в некоторых вариантах осуществления, за счет деления этих больших доз на несколько меньших доз для введения в течение дня.
Как правило, подходящая дневная дозировка соединения по настоящему изобретению и/или химиотерапевтического средства будет представлять собой такое количество соединения, которое, в некоторых вариантах осуществления, может являться самой низкой дозой, эффективной для достижения терапевтического эффекта. Эта эффективная доза, как правило, будет зависеть от описанных выше факторов. Как правило, дозировки соединения по настоящему изобретению для пациента, при применении с целью достижения указанного эффекта, могут находиться в пределах от примерно 0,0001 мг до примерно 100 мг в день, или от примерно 0,001 мг до примерно 100 мг в день, или от примерно 0,01 мг до примерно 100 мг в день, или от примерно 0,1 мг до примерно 100 мг в день, или от примерно 0,0001 мг до примерно 500 мг в день, или от примерно 0,001 мг до примерно 500 мг в день, или от примерно 0,01 мг до примерно 1000 мг в день, или от примерно 0,01 мг до примерно 500 мг в день, или от примерно 0,1 мг до примерно 500 мг в день, или от примерно 1 мг до 50 мг в день, или от примерно 5 мг до 40 мг. Типовая дозировка составляет от примерно 10 до примерно 30 мг в день. В некоторых вариантах осуществления, для человека массой 70 кг, подходящая дозировка могла бы составлять от примерно 0,05 до примерно 7 г/день, например, от примерно 0,05 до примерно 2,5 г/день. Можно менять реальные уровни дозировок действующих ингредиентов в фармацевтических композициях по настоящему изобретению, с тем, чтобы получать количество действующего ингредиента, которое эффективно для достижения терапевтической реакции, для конкретного пациента, композиции и формы введения, и не является токсичным для пациента. В некоторых случаях, более адекватными будут дозировки, меньшие нижней границы указанного диапазона, тогда как в других случаях могут применяться еще большие дозировки, которые не вызывают каких-либо вредных побочных эффектов, например, в некоторых вариантах осуществления, за счет деления этих больших доз на несколько меньших доз для введения в течение дня.
В некоторых вариантах осуществления, соединение по настоящему изобретению вводят в виде одиночной дозы. В некоторых вариантах осуществления, это введение осуществляют путем инъекции, например, внутривенной инъекции, для быстрого введения агента. В других вариантах осуществления, это введение осуществляют пероральным путем, например, для легкости введения и повышенной приверженности пациента лечению. Если это целесообразно, можно также применять другие пути. В некоторых вариантах осуществления, одиночная доза соединения по настоящему изобретению может применяться для лечения острого состояния.
В некоторых вариантах осуществления, соединение по настоящему изобретению вводят в виде нескольких доз. В одном из вариантов осуществления, введение соединения можно осуществлять примерно один раз, два раза, три раза, четыре раза, пять раз, шесть раз или более шести раз в день. В одном из вариантов осуществления, введение можно осуществлять примерно один раз в месяц, один раз каждые две недели, один раз в неделю или один раз в два дня. В другом варианте осуществления, соединение по настоящему изобретению и другой агент вводят совместно примерно от одного до шести раз в день. В другом варианте осуществления, введение соединения по настоящему изобретению и другого агента продолжается в течение менее примерно 7 дней. В следующем варианте осуществления, введение продолжается в течение более чем примерно 6, 10, 14 или 28 дней, двух месяцев, шести месяцев или одного года. В некоторых вариантах осуществления, достигается непрерывное введение, которое продолжают в течение необходимого времени. В некоторых вариантах осуществления, соединение по настоящему изобретению вводят в циклическом режиме (например, период введения, за которым следует период без введения, и повторение этого цикла в течение необходимого времени).
В некоторых вариантах осуществления, соединение можно вводить ежедневно, через день, три раза в неделю, два раза в неделю, раз в неделю или раз в две недели. Расписание введения может включать «лекарственные каникулы», т.е. лекарство можно вводить по схеме две недели введения, одна неделя перерыва, или три недели введения, одна неделя перерыва, или четыре недели введения, одна неделя перерыва и т.д., или непрерывно, без лекарственных каникул. Соединения можно вводить перорально, внутривенно, интраперитонеально, местно, трансдермально, внутримышечно, подкожно, интраназально, сублингвально или любым другим путем.
В одном из вариантов осуществления, введение агента по настоящему изобретению может продолжаться в течение необходимого времени. В некоторых вариантах осуществления, агент по настоящему изобретению вводят в течение более чем 1, 2, 3, 4, 5, 6, 7, 14 или 28 дней. В некоторых вариантах осуществления, агент по настоящему изобретению вводят в течение менее чем 28, 14, 7, 6, 5, 4, 3, 2 или 1 дня. В некоторых вариантах осуществления, агент по настоящему изобретению вводят на постоянной основе, например, для лечения хронических расстройств.
В одном из вариантов осуществления, эффективное количество соединения по настоящему изобретению можно вводить в виде одной или нескольких доз, любым из приемлемых путей введения агентов, имеющих аналогичные свойства, включая пероральный, парентеральный, подкожный, внутривенный, интраперитонеальный, внутримышечный, внутриартериальный, местный, ректальный, буккальный, интраназальный, трансдермальный пути введения или в виде ингалянта. В одном из вариантов осуществления, соединение вводят перорально, в виде одной дозы раз в день. В других вариантах осуществления, соединение вводят перорально в виде нескольких доз, например, по меньшей мере, двух, трех или более доз в течение дня.
В некоторых вариантах осуществления, соединение вводят, например, перорально, в виде одной дозы примерно 50 мг или менее раз в день, примерно 40 мг или менее, примерно 30 мг или менее, примерно 25 мг или менее, примерно 20 мг или менее, примерно 15 мг или менее, примерно 12,5 мг или менее, примерно 10 мг или менее, примерно 5 мг или менее, примерно 4 мг или менее, примерно 3 мг или менее, примерно 2 мг или менее или примерно 1 мг или менее (например, примерно 0,9 мг, примерно 0,8 мг, примерно 0,7 мг, примерно 0,6 мг, примерно 0,5 мг, примерно 0,4 мг, примерно 0,3 мг, примерно 0,2 мг, примерно 0,1 мг или примерно 0,05 мг или менее). В некоторых вариантах осуществления соединение вводят, например, перорально, один раз в день в виде одной дозы в диапазоне от примерно 0,05 мг до примерно 50 мг, от примерно 0,1 мг до примерно 45 мг, от примерно 0,2 мг до примерно 40 мг, от примерно 0,5 мг до примерно 35 мг, от примерно 0,7 мг до примерно 30 мг, от примерно 1 мг до примерно 30 мг, от примерно 2 мг до примерно 25 мг, от примерно 5 мг до примерно 20 мг, от примерно 7 мг до примерно 15 мг, от примерно 10 мг до примерно 12 мг, от примерно 5 мг до примерно 10 мг, от примерно 1 мг до примерно 5 мг, от примерно 0,01 мг до примерно 1 мг, от примерно 0,01 мг до примерно 0,05 мг или от примерно 0,05 мг до примерно 1 мг.
В некоторых вариантах осуществления, соединение вводят, например, перорально в виде нескольких доз в течение дня (например, дважды в день), где каждая доза составляет примерно 50 мг или менее, примерно 40 мг или менее, примерно 30 мг или менее, примерно 25 мг или менее, примерно 20 мг или менее, примерно 15 мг или менее, примерно 12,5 мг или менее, примерно 10 мг или менее, примерно 5 мг или менее, примерно 4 мг или менее, примерно 3 мг или менее, примерно 2 мг или менее или примерно 1 мг или менее (например, примерно 0,9 мг, примерно 0,8 мг, примерно 0,7 мг, примерно 0,6 мг, примерно 0,5 мг, примерно 0,4 мг, примерно 0,3 мг, примерно 0,2 мг, примерно 0,1 мг или примерно 0,05 мг или менее). В некоторых вариантах осуществления, соединение вводят, например, перорально в виде нескольких доз в течение дня (например, дважды в день), где каждая доза находится в пределах от примерно 0,05 мг до примерно 50 мг, от примерно 0,1 мг до примерно 45 мг, от примерно 0,2 мг до примерно 40 мг, от примерно 0,5 мг до примерно 35 мг, от примерно 0,7 мг до примерно 30 мг, от примерно 1 мг до примерно 30 мг, от примерно 2 мг до примерно 25 мг, от примерно 5 мг до примерно 20 мг, от примерно 7 мг до примерно 15 мг, от примерно 10 мг до примерно 12 мг, от примерно 5 мг до примерно 10 мг, от примерно 1 мг до примерно 5 мг, от примерно 0,01 мг до примерно 1 мг, от примерно 0,01 мг до примерно 0,05 мг или от примерно 0,05 мг до примерно 1 мг.
Поскольку соединения по настоящему изобретению могут применяться в комбинации с другими средствами лечения (например, дополнительными химиотерапевтическими средствами, радиационным или хирургическим лечением), дозировки каждого агента или методики лечения могут быть ниже, чем соответствующие дозировки при лечении с помощью единственного агента. Дозировка при терапии в качестве единственного агента может находиться в пределах от, например, примерно 0,0001 до примерно 200 мг, или от примерно 0,001 до примерно 100 мг, или от примерно 0,01 до примерно 100 мг, или от примерно 0,1 до примерно 100 мг, или от примерно 0,05 мг до примерно 50 мг, или от примерно 1 до примерно 50 мг в день.
Если соединение по настоящему изобретению вводят в форме фармацевтической композиции, которая включает один или несколько агентов, и агент имеет более короткое время полужизни по сравнению с соединением по настоящему изобретению, содержание этого агента и соединения по настоящему изобретению в дозированных формах можно отрегулировать соответственно.
В одном из аспектов, изобретение относится к композиции, которая включает соединение формулы (I) (например, композиции, включающей одну или несколько полиморфных форм соединения формулы (I), например, полиморфную форму C), и при введении в дозировке действующего соединения в диапазоне от 0,05 мг один раз в день (QD) до 50 мг дважды в день (BID), способны обеспечить количество соединения, достаточное для достижения средней площади под кривой зависимости концентрации от времени в стационарном состоянии, т.е. AUC (например, AUC0-24 или AUCtauss), не менее, чем примерно 0,5 нг*ч/мл, не менее, чем примерно 1 нг*ч/мл, не менее, чем примерно 2,5 нг*ч/мл, не менее, чем примерно 5 нг*ч/мл, не менее, чем примерно 10 нг*ч/мл, не менее, чем примерно 25 нг*ч/мл, не менее, чем примерно 50 нг*ч/мл, не менее, чем примерно 100 нг*ч/мл, не менее, чем примерно 150 нг*ч/мл, не менее, чем примерно 200 нг*ч/мл, не менее, чем примерно 250 нг*ч/мл, не менее, чем примерно 300 нг*ч/мл, не менее, чем примерно 500 нг*ч/мл, не менее, чем примерно 750 нг*ч/мл, не менее, чем примерно 850 нг*ч/мл, не менее, чем примерно 950 нг*ч/мл, не менее, чем примерно 1000 нг*ч/мл, не менее, чем примерно 1500 нг*ч/мл, не менее, чем примерно 2000 нг*ч/мл, не менее, чем примерно 3000 нг*ч/мл, не менее, чем примерно 5000 нг*ч/мл, не менее, чем примерно 10000 нг*ч/мл, не менее, чем примерно 12 000 нг*ч/мл, не менее, чем примерно 15000 нг*ч/мл, не менее, чем примерно 20000 нг*ч/мл, не менее, чем примерно 25000 нг*ч/мл, не менее, чем примерно 30000 нг*ч/мл, не менее, чем примерно 50000 нг*ч/мл, не менее, чем примерно 75000 нг*ч/мл, не менее, чем примерно 100000 нг*ч/мл, не менее, чем примерно 200000 нг*ч/мл или не менее, чем примерно 300000 нг*ч/мл. В некоторых вариантах осуществления, AUC (например, AUC0-24 или AUCtauss) композиции при введении в дозировке действующего соединения в диапазоне от примерно 0,05 мг QD до примерно 50 мг BID, составляет не менее, чем примерно 5 нг*ч/мл, не менее, чем примерно 50 нг*ч/мл, не менее, чем примерно 100 нг*ч/мл, не менее, чем примерно 150 нг*ч/мл, не менее, чем примерно 200 нг*ч/мл, не менее, чем примерно 300 нг*ч/мл, не менее, чем примерно 400 нг*ч/мл, не менее, чем примерно 500 нг*ч/мл, не менее, чем примерно 600 нг*ч/мл, не менее, чем примерно 700 нг*ч/мл, не менее, чем примерно 800 нг*ч/мл, не менее, чем примерно 900 нг*ч/мл, не менее, чем примерно 1000 нг*ч/мл, не менее, чем примерно 1500 нг*ч/мл, не менее, чем примерно 2000 нг*ч/мл, не менее, чем примерно 2500 нг*ч/мл, не менее, чем примерно 3000 нг*ч/мл, не менее, чем примерно 5000 нг*ч/мл, не менее, чем примерно 10000 нг*ч/мл, не менее, чем примерно 15000 нг*ч/мл, не менее, чем примерно 20000 нг*ч/мл, не менее, чем примерно 25000 нг*ч/мл или не менее, чем примерно 30000 нг*ч/мл. В других вариантах осуществления, AUC (например, AUC0-24 или AUCtauss) композиции при введении в дозировке действующего соединения в диапазоне от примерно 0,05 мг QD до примерно 50 мг BID, находится в диапазоне от примерно 0,5 нг*ч/мл до примерно 300000 нг*ч/мл, от примерно 1 нг*ч/мл до примерно 200000 нг*ч/мл, от примерно 2,5 нг*ч/мл до примерно 250000 нг*ч/мл, от примерно 5 нг*ч/мл до примерно 30000 нг*ч/мл, от примерно 10 нг*ч/мл до примерно 200000 нг*ч/мл, от примерно 25 нг*ч/мл до примерно 100000 нг*ч/мл, от примерно 50 нг*ч/мл до примерно 75000 нг*ч/мл, от примерно 100 нг*ч/мл до примерно 50000 нг*ч/мл, от примерно 200 нг*ч/мл до примерно 40000 нг*ч/мл, от примерно 500 нг*ч/мл до примерно 30000 нг*ч/мл, от примерно 1000 нг*ч/мл до примерно 25000 нг*ч/мл, от примерно 700 нг*ч/мл до примерно 15000 нг*ч/мл, от примерно 500 нг*ч/мл до примерно 10000 нг*ч/мл, от примерно 1000 нг*ч/мл до примерно 5000 нг*ч/мл, от примерно 10000 нг*ч/мл до примерно 50000 нг*ч/мл, от примерно 20000 нг*ч/мл до примерно 40000 нг*ч/мл или от примерно 25000 нг*ч/мл до примерно 30000 нг*ч/мл. В одном из вариантов осуществления, AUC (например, AUC0-24 или AUCtauss) композиции при введении в дозировке действующего соединения в диапазоне от примерно 0,05 мг QD до примерно 50 мг BID, находится в диапазоне от примерно 5 нг*ч/мл до примерно 30000 нг*ч/мл, от примерно 1000 нг*ч/мл до примерно 15000 нг*ч/мл, от примерно 2500 нг*ч/мл до примерно 10000 нг*ч/мл, от примерно 100 нг*ч/мл до примерно 3500 нг*ч/мл, от примерно 145 нг*ч/мл до примерно 3000 нг*ч/мл, от примерно 250 нг*ч/мл до примерно 2500 нг*ч/мл, от примерно 300 нг*ч/мл до примерно 2500 нг*ч/мл, от примерно 500 нг*ч/мл до примерно 2300 нг*ч/мл, от примерно 800 нг*ч/мл до примерно 2200 нг*ч/мл, от примерно 140 нг*ч/мл до примерно 900 нг*ч/мл, от примерно 500 нг*ч/мл до примерно 10 000 нг*ч/мл, от примерно 1000 нг*ч/мл до примерно 5000 нг*ч/мл, от примерно 10000 нг*ч/мл до примерно 50000 нг*ч/мл, от примерно 20000 нг*ч/мл до примерно 40000 нг*ч/мл или от примерно 25000 нг*ч/мл до примерно 30000 нг*ч/мл.
В одном из вариантов осуществления, композиции, которые включают соединение формулы (I), при введении человеку в диапазоне дозировок действующего вещества от примерно 1 мг до примерно 30 мг в виде одной дозы в день (QD) перорально, способны обеспечить количество соединения, достаточное для достижения AUC, например, AUC0-24, не менее, чем примерно 40 нг*ч/мл, не менее, чем примерно 50 нг*ч/мл, не менее, чем примерно 75 нг*ч/мл, не менее, чем примерно 100 нг*ч/мл, не менее, чем примерно 150 нг*ч/мл, не менее, чем примерно 200 нг*ч/мл, не менее, чем примерно 300 нг*ч/мл, не менее, чем примерно 400 нг*ч/мл, не менее, чем примерно 500 нг*ч/мл, не менее, чем примерно 600 нг*ч/мл, не менее, чем примерно 700 нг*ч/мл, не менее, чем примерно 800 нг*ч/мл, не менее, чем примерно 900 нг*ч/мл, не менее, чем примерно 1000 нг*ч/мл, не менее, чем примерно 1500 нг*ч/мл, не менее, чем примерно 2000 нг*ч/мл, не менее, чем примерно 2500 нг*ч/мл, не менее, чем примерно 3000 нг*ч/мл, не менее, чем примерно 5000 нг*ч/мл, не менее, чем примерно 10000 нг*ч/мл, не менее, чем примерно 15000 нг*ч/мл, не менее, чем примерно 20000 нг*ч/мл, не менее, чем примерно 30000 нг*ч/мл или не менее, чем примерно 50000 нг*ч/мл. В одном из вариантов осуществления, AUC, например AUC0-24 для композиции при введении в диапазоне дозировок действующего вещества от примерно 1 мг до примерно 30 мг в виде одной дозы в день (QD) перорально, находится в диапазоне от примерно 5 нг*ч/мл до примерно 30000 нг*ч/мл, от примерно 100 нг*ч/мл до примерно 3500 нг*ч/мл, от примерно 145 нг*ч/мл до примерно 3300 нг*ч/мл, от примерно 200 нг*ч/мл до примерно 2500 нг*ч/мл, от примерно 300 нг*ч/мл до примерно 2100 нг*ч/мл, от примерно 500 нг*ч/мл до примерно 2000 нг*ч/мл, от примерно 500 нг*ч/мл до примерно 5000 нг*ч/мл, от примерно 1000 нг*ч/мл до примерно 10000 нг*ч/мл, от примерно 10000 нг*ч/мл до примерно 50000 нг*ч/мл, от примерно 20000 нг*ч/мл до примерно 40000 нг*ч/мл или от примерно 25000 нг*ч/мл до примерно 30000 нг*ч/мл.
В другом варианте осуществления, композиции, которые включают соединение формулы (I), при введении в диапазоне дозировок действующего вещества от примерно 1 мг до примерно 10 мг (например, при измерении на 14 день после многократного введения 1, 2, 5 и 10 мг (например, введения в режиме QD в дни 1 и 14, и дважды в день (BID) в дни 2-13)), способны обеспечить количество соединения, достаточное для достижения средней площади под кривой зависимости концентрации от времени в стационарном состоянии (AUCtauss) не менее, чем примерно 100 нг*ч/мл, не менее, чем примерно 200 нг*ч/мл, не менее, чем примерно 500 нг*ч/мл, не менее, чем примерно 700 нг*ч/мл, не менее, чем примерно 1000 нг*ч/мл, не менее, чем примерно 1200 нг*ч/мл, не менее, чем примерно 1500 нг*ч/мл, не менее, чем примерно 2000 нг*ч/мл, не менее, чем примерно 2500 нг*ч/мл, не менее, чем примерно 3000 нг*ч/мл, не менее, чем примерно 5000 нг*ч/мл, не менее, чем примерно 10000 нг*ч/мл, не менее, чем примерно 15000 нг*ч/мл, не менее, чем примерно 20000 нг*ч/мл, не менее, чем примерно 25000 нг*ч/мл или не менее, чем примерно 30000 нг*ч/мл. В одном из вариантов осуществления, AUC, например, AUCtauss композиции при введении в диапазоне дозировок действующего соединения от примерно 1 мг до примерно 10 мг (например, при измерении на 14 день после многократного введения 1, 2, 5 и 10 мг (например, введения в режиме QD в дни 1 и 14, и дважды в день (BID) в дни 2-13)) находится в диапазоне от примерно 5 нг*ч/мл до примерно 30000 нг*ч/мл, от примерно 100 нг*ч/мл до примерно 3500 нг*ч/мл, от примерно 150 нг*ч/мл до примерно 3300 нг*ч/мл, от примерно 200 нг*ч/мл до примерно 2500 нг*ч/мл, от примерно 300 нг*ч/мл до примерно 2500 нг*ч/мл, от примерно 500 нг*ч/мл до примерно 5000 нг*ч/мл, от примерно 1000 нг*ч/мл до примерно 10000 нг*ч/мл, от примерно 10000 нг*ч/мл до примерно 50000 нг*ч/мл, от примерно 20000 нг*ч/мл до примерно 40000 нг*ч/мл или от примерно 25000 нг*ч/мл до примерно 30000 нг*ч/мл. В настоящей заявке термин «AUC0-24» относится к средней площади под кривой зависимости концентрации в плазме от времени в стационарном состоянии до 24 часов после введения препарата. Термин «AUCtauss» относится к AUC0-24 для QD введения и AUC0-12 для BID введения. «AUC» относится к площади под кривой зависимости концентрации в плазме от времени в течение определенного интервала. Значения AUC выражены в нанограммах в час на миллилитр, что сокращенно именуется в тексте заявки нг ч/мл или нг*ч/мл. Значения AUC можно определять с помощью стандартных методик, известных в технике, смотрите, например, Goodman and Gilman’s The Pharmacological Basis Of Therapeutics, 10th ed.; Hardman, J.G., Limbird, L.E., Eds.; McGraw-Hill: New York, 2001.
В другом аспекте, в изобретении раскрыты композиции, которые включают соединение формулы (I) (например, композиции, включающие одну или несколько полиморфных форм соединения формулы (I), например, полиморфную форму C) и при введении в диапазоне дозировок действующего вещества от 0,05 мг один раз в день (QD) до 50 мг два раза в день (BID), способны обеспечить наблюдаемую максимальную концентрацию в плазме (Cmax) не менее, чем примерно 0,05 нг/мл, не менее, чем примерно 0,1 нг/мл, не менее, чем примерно 0,5 нг/мл, не менее, чем примерно 1 нг/мл, не менее, чем примерно 10 нг/мл, не менее, чем примерно 50 нг/мл, не менее, чем примерно 100 нг/мл, не менее, чем примерно 150 нг/мл, не менее, чем примерно 200 нг/мл, не менее, чем примерно 300 нг/мл, не менее, чем примерно 400 нг/мл, не менее, чем примерно 500 нг/мл, не менее, чем примерно 900 нг/мл, не менее, чем примерно 1000 нг/мл, не менее, чем примерно 2000 нг/мл, не менее, чем примерно 3000 нг/мл, не менее, чем примерно 4000 нг/мл, не менее, чем примерно 5000 нг/мл, не менее, чем примерно 10000 нг/мл, не менее, чем примерно 20000 нг/мл, не менее, чем примерно 30000 нг/мл или не менее, чем примерно 40000 нг/мл. В других вариантах осуществления, Cmax композиции при введении в диапазоне дозировок действующего вещества от примерно 0,05 мг QD до примерно 50 мг BID составляет не менее, чем примерно 20 нг/мл, не менее, чем примерно 40 нг/мл, не менее, чем примерно 50 нг/мл, не менее, чем примерно 80 нг/мл, не менее, чем примерно 100 нг/мл, не менее, чем примерно 200 нг/мл, не менее, чем примерно 500 нг/мл, не менее, чем примерно 750 нг/мл, не менее, чем примерно 1000 нг/мл, не менее, чем примерно 1500 нг/мл, не менее, чем примерно 5000 нг/мл, не менее, чем примерно 10000 нг/мл, не менее, чем примерно 15000 нг/мл, не менее, чем примерно 20000 нг/мл, не менее, чем примерно 30000 нг/мл или не менее, чем примерно 40000 нг/мл. В других вариантах осуществления, Cmax композиции при введении в диапазоне дозировок действующего вещества от примерно 0,05 мг QD до примерно 50 мг BID находится в диапазоне от примерно 0,5 нг/мл до примерно 40000 нг/мл, от примерно 0,1 нг/мл до примерно 20000 нг/мл, от примерно 1 нг/мл до примерно 20000 нг/мл, от примерно 0,5 нг/мл до примерно 4000 нг/мл, от примерно 0,5 нг/мл до примерно 10000 нг/мл, от примерно 1 нг/мл до примерно 3000 нг/мл, от примерно 10 нг/мл до примерно 2000 нг/мл, от примерно 40 нг/мл до примерно 1500 нг/мл, от примерно 150 нг/мл до примерно 1000 нг/мл, от примерно 200 нг/мл до примерно 500 нг/мл, от примерно 300 нг/мл до примерно 400 нг/мл, от примерно 500 нг/мл до примерно 1000 нг/мл, от примерно 1000 нг/мл до примерно 5000 нг/мл, от примерно 5000 нг/мл до примерно 10000 нг/мл, от примерно 10000 нг/мл до примерно 20000 нг/мл, от примерно 20000 нг/мл до примерно 30000 нг/мл или от примерно 30000 нг/мл до примерно 40000 нг/мл. В одном из вариантов осуществления, Cmax композиции при введении в диапазоне дозировок действующего вещества от примерно 0,05 мг QD до примерно 50 мг BID находится в диапазоне от примерно 0,5 нг/мл до примерно 4000 нг/мл, от примерно 20 нг/мл до примерно 1500 нг/мл, от примерно 40 нг/мл до примерно 1100 нг/мл, от примерно 50 нг/мл до примерно 1000 нг/мл, от примерно 80 нг/мл до примерно 900 нг/мл, от примерно 100 нг/мл до примерно 500 нг/мл, от примерно 200 нг/мл до примерно 450 нг/мл, от примерно 500 нг/мл до примерно 1000 нг/мл, от примерно 1000 нг/мл до примерно 5000 нг/мл, от примерно 5000 нг/мл до примерно 10000 нг/мл, от примерно 10000 нг/мл до примерно 20000 нг/мл, от примерно 20000 нг/мл до примерно 30000 нг/мл или от примерно 30000 нг/мл до примерно 40000 нг/мл.
В одном из вариантов осуществления, композиции, которые включают соединение формулы (I), при введении человеку в диапазоне дозировок от примерно 1 мг до примерно 30 мг в виде одной дозы один раз в день (QD) перорально, способны обеспечить Cmax не менее, чем примерно 20 нг/мл, не менее, чем примерно 40 нг/мл, не менее, чем примерно 50 нг/мл, не менее, чем примерно 80 нг/мл, не менее, чем примерно 100 нг/мл, не менее, чем примерно 200 нг/мл, не менее, чем примерно 500 нг/мл, не менее, чем примерно 750 нг/мл, не менее, чем примерно 1000 нг/мл или не менее, чем примерно 1500 нг/мл. В других вариантах осуществления, Cmax при введении человеку в диапазоне дозировок от примерно 1 мг до примерно 30 мг в виде одной дозы один раз в день (QD) перорально, композиции способны обеспечить Cmax в диапазоне от примерно 20 нг/мл до примерно 1500 нг/мл, от примерно 40 нг/мл до примерно 1200 нг/мл, от примерно 50 нг/мл до примерно 1000 нг/мл, от примерно 80 нг/мл до примерно 1000 нг/мл, от примерно 100 нг/мл до примерно 500 нг/мл, от примерно 200 нг/мл до примерно 450 нг/мл, от примерно 500 нг/мл до примерно 1000 нг/мл, от примерно 1000 нг/мл до примерно 5000 нг/мл, от примерно 5000 нг/мл до примерно 10000 нг/мл, от примерно 10000 нг/мл до примерно 20000 нг/мл, от примерно 20000 нг/мл до примерно 30000 нг/мл или от примерно 30000 нг/мл до примерно 40000 нг/мл.
В другом варианте осуществления, композиции, которые включают соединение формулы (I), при введении в диапазоне дозировок действующего вещества от примерно 1 мг до примерно 10 мг (например, при измерении на 14 день после многократного введения 1, 2, 5 и 10 мг (например, введения в режиме QD в дни 1 и 14, и дважды в день (BID) в дни 2-13)), способны обеспечить количество соединения, достаточное для достижения Cmax не менее, чем примерно 40 нг/мл, не менее, чем примерно 50 нг/мл, не менее, чем примерно 60 нг/мл, не менее, чем примерно 100 нг/мл, не менее, чем примерно 200 нг/мл, не менее, чем примерно 300 нг/мл, не менее, чем примерно 400 нг/мл, не менее, чем примерно 500 нг/мл, не менее, чем примерно 590 нг/мл, не менее, чем примерно 750 нг/мл, не менее, чем примерно 1000 нг/мл, не менее, чем примерно 1500 нг/мл, не менее, чем примерно 5000 нг/мл, не менее, чем примерно 10000 нг/мл, не менее, чем примерно 15000 нг/мл, не менее, чем примерно 20000 нг/мл, не менее, чем примерно 30000 нг/мл или не менее, чем примерно 40000 нг/мл. В одном из вариантов осуществления, композиции, которые включают соединение формулы (I) (например, полиморфную форму C), при введении в дозировке действующего вещества примерно 1 мг (BID), 2 мг (BID), 5 мг (BID) или 10 мг (QD) в режиме многократного введения (например, при измерении на 14 день после многократного введения 1, 2, 5 и 10 мг (например, введения в режиме QD в дни 1 и 14, и дважды в день (BID) в дни 2-13)), способны обеспечить Cmax в диапазоне от примерно 50 нг/мл до примерно 600 нг/мл, от примерно 60 нг/мл до примерно 400 нг/мл, от примерно 100 нг/мл до примерно 360 нг/мл, от примерно 140 нг/мл до примерно 250 нг/мл, от примерно 250 нг/мл до примерно 1000 нг/мл, от примерно 1000 нг/мл до примерно 5000 нг/мл, от примерно 5000 нг/мл до примерно 10000 нг/мл, от примерно 10000 нг/мл до примерно 20000 нг/мл, от примерно 20000 нг/мл до примерно 30000 нг/мл или от примерно 30000 нг/мл до примерно 40000 нг/мл.
В одном из вариантов осуществления, композиции, которые включают соединение формулы (I), при введении человеку в диапазоне дозировок действующего вещества от 1 мг до 30 мг в виде одной дозы один раз в день (QD) перорально, имеют время полужизни (t1/2) не менее 3 часов, не менее 5 часов, не менее 6 часов, не менее 7 часов, не менее 8 часов или не менее 10 часов. В другом варианте осуществления, композиции, которые включают соединение формулы (I), при введении человеку в диапазоне дозировок действующего вещества от примерно 1 мг до примерно 30 мг в виде одной дозы один раз в день (QD) перорально, имеют время полужизни (t1/2) в диапазоне от примерно 3 часов до примерно 10 часов.
Значения Cmax и времени полужизни (t1/2) можно определять с помощью стандартных методик, известных в технике, смотрите, например, Goodman and Gilman’s The Pharmacological Basis Of Therapeutics, 10th ed.; Hardman, J.G., Limbird, L.E., Eds.; McGraw-Hill: New York, 2001. В одном из вариантов осуществления, время полужизни вычисляют как 0,693/kel (окончательное выведение).
Наборы
В еще одном варианте осуществления, изобретение относится к наборам. В одном из вариантов осуществления, эти наборы включают соединение или полиморфы, описанные в настоящей заявке, или их фармацевтически приемлемую форму (например, фармацевтически приемлемые соли, гидраты, сольваты, хелаты, нековалентные комплексы, изомеры, пролекарства и изотопно-меченые производные) в подходящей упаковке, а также печатный материал, который может включать инструкции по применению, обсуждение клинических исследований, перечень побочных эффектов и т.п. Кроме того, эти наборы могут включать такую информацию, как ссылки на научную литературу, листки-вкладыши, результаты клинических испытаний и/или краткое изложение этих материалов и т.п., в которых показано или обосновано действие и/или преимущество соединения или композиции, и/или в которых описаны дозировка, введение, побочные эффекты, взаимодействие с другими лекарственными препаратами и/или другая информация, полезная для медицинского работника. Эта информация может быть основана на результатах различных исследований, например, исследований с использованием экспериментальных животных, включая модели in vivo, или исследования, основанные на клинических испытаниях на людях.
В некоторых вариантах осуществления, с набором поставляется средство для напоминания, например, в форме цифр, расположенных рядом с таблетками или капсулами, где эти цифры соответствуют дням режима введения, в который следует принимать данную таблетку или капсулу. Другой пример такого средства для напоминания, представляет собой отпечатанный на карточке календарь, например, следующего содержания «Первая неделя, понедельник, вторник … и т.д. … вторая неделя, понедельник, вторник … и т.д. На ум легко могут прийти другие варианты средств для напоминания. «Дневная доза» может представлять собой одну таблетку или капсулу, или несколько таблеток или капсул, которые необходимо принять в данный день.
Фармацевтические упаковки и/или наборы по настоящему изобретению могут включать композицию по настоящему изобретению и контейнер (например, флакон, ампулу, бутылку, шприц и/или дозирующую упаковку, или другой подходящий контейнер). В некоторых вариантах осуществления, наборы по настоящему изобретению могут необязательно дополнительно включать второй контейнер, содержащий подходящий водный носитель для разбавления или суспендирования композиции по настоящему изобретению, с целью получения препарата для введения субъекту. В некоторых вариантах осуществления, содержимое контейнера с составом по настоящему изобретению и контейнера с растворителем объединяют с получением, по меньшей мере, одной порции дозированной формы.
В одном из вариантов осуществления, один контейнер может содержать один или несколько отсеков, предназначенных для композиции по настоящему изобретению и/или подходящего водного носителя для суспендирования или разбавления. В некоторых вариантах осуществления, этот контейнер может быть приспособлен для модификации, с тем, чтобы можно было осуществлять физическую модификацию контейнера, которая позволяет объединять отсеки и/или компоненты из отдельных отсеков. Например, мешок из фольги или пластмассы может иметь два или несколько отсеков, разделенных перфорированной перегородкой, которая может быть разорвана с тем, чтобы позволить смешаться компонентам двух индивидуальных отсеков, после того, как появляется сигнал о разрушении перегородки. Таким образом, фармацевтическая упаковка или набор может включать подобные контейнеры со многими отсеками, содержащими композицию по настоящему изобретению, и подходящий растворитель и/или подходящий водный носитель для суспензии.
В некоторых вариантах осуществления, наборы могут дополнительно включать еще один агент. В некоторых вариантах осуществления, соединение по настоящему изобретению или его фармацевтически приемлемую форму (например, фармацевтически приемлемую соль, гидрат, сольват, хелат, нековалентный комплекс, изомер, пролекарство и изотопно-меченое производное) и второй агент включают в состав отдельных композиций в разных контейнерах в наборе. В некоторых вариантах осуществления, соединение по настоящему изобретению или его фармацевтически приемлемую форму (например, фармацевтически приемлемую соль, гидрат, сольват, хелат, нековалентный комплекс, изомер, пролекарство и изотопно-меченое производное) и второй агент включают в состав единой композиции в контейнере, входящем в набор. Подходящие упаковки и дополнительные компоненты (например, мерные колпачки для жидких препаратов, обертка из фольги для минимизации действия воздуха и т.п.) известны в технике, и их можно включать в набор. Наборы по настоящему изобретению могут поставляться, продаваться и/или продвигаться медицинскими работниками, включая врачей, медсестер, фармацевтов, должностных лиц, имеющих отношение к фармацевтическим составам, и т.п. В некоторых вариантах осуществления, наборы могут также продаваться непосредственно потребителям.
Примером такого набора является, так называемая, блистерная упаковка. Блистерные упаковки хорошо известны в упаковочной индустрии и широко применяются для упаковки фармацевтических дозированных лекарственных форм (таблеток, капсул и т.п.). Блистерные упаковки обычно состоят из листа относительно жесткого материала, покрытого пленкой из предпочтительно прозрачного пластического материала. Во время процесса упаковки, в пластмассовой пленке формируются углубления. Эти углубления имеют размер и форму таблеток или капсул, которые предполагается упаковать. Далее таблетки или капсулы помещают в углубления, и лист относительно жесткого материала напаивают на пластмассовую пленку с той стороны пленки, которая противоположна направлению сформированных углублений. В результате, таблетки или капсулы оказываются запечатанными в углублениях между пластмассовой пленкой и листом. Лист имеет такую прочность, что таблетки или капсулы можно удалять из блистерной упаковки вручную, надавливая на углубления, в результате чего в листе на месте углублений образуются отверстия. Затем таблетки или капсулы можно извлечь через указанные отверстия.
Наборы могут дополнительно включать фармацевтически приемлемые носители, которые могут применяться для введения одного или нескольких действующих соединений. Например, если действующий агент присутствует в наборе в твердой форме, которую необходимо восстановить для парентерального введения, набор может включать герметично закрытый контейнер с подходящим носителем, в котором можно растворить действующий агент с получением гомогенного стерильного раствора, который подходит для парентерального введения. Примеры фармацевтически приемлемых носителей включают, не ограничиваясь этим: воду для инъекций USP; водные носители, например, но не ограничиваясь этим, хлорид натрия для инъекций, раствор Рингера для инъекций, раствор декстрозы для инъекций, раствор декстрозы и хлорида натрия для инъекций и раствор Рингера с лактатом для инъекций; смешивающиеся с водой носители, например, но не ограничиваясь этим, этиловый спирт, полиэтиленгликоль и полипропиленгликоль; и неводные носители, например, но не ограничиваясь этим, кукурузное масло, хлопковое масло, масло арахиса, кунжутное масло, этилолеат, изопропилмиристат и бензилбензоат.
Кроме того, настоящее изобретение охватывает безводные фармацевтические композиции и дозированные формы, включающие действующий ингредиент, поскольку вода может способствовать разрушению некоторых соединений. Например, в фармацевтической технике, можно добавлять воду (например, приблизительно 5%) в качестве средства имитации долговременного хранения, для определения таких характеристик, как срок хранения или стабильность препарата с течением времени. Безводные фармацевтические композиции и дозированные формы можно получать с использованием безводных ингредиентов или ингредиентов с небольшим содержанием воды в условиях низкой влажности. Например, фармацевтические композиции и дозированные формы, которые содержат лактозу, можно получать в безводном состоянии, если ожидается существенный контакт с водой и/или влажностью при производстве, упаковке и/или хранении. Безводную фармацевтическую композицию можно получать, и хранить таким образом, чтобы сохранялся ее безводный характер. Соответственно, безводные фармацевтические композиции можно упаковывать с использованием материалов, о которых известно, что они предотвращают действие воды и их можно включать в подходящие лекарственные наборы. Примеры подходящих упаковок включают, не ограничиваясь этим, герметично закрытые упаковки из фольги, пластмассы или подобных материалов, контейнеры для разовых доз, блистерные упаковки и контурные упаковки.
В одном из вариантов осуществления, полиморфы по настоящему изобретению или их фармацевтически приемлемые формы (например, фармацевтически приемлемые соли, гидраты, сольваты, хелаты, нековалентные комплексы, изомеры, пролекарства и изотопно-меченые производные) могут применяться в комбинации с агентами, раскрытыми в настоящей заявке, или другими подходящими агентами, в зависимости от подвергаемого лечению состояния. Таким образом, в некоторых вариантах осуществления, полиморфы по настоящему изобретению или их фармацевтически приемлемые формы (например, фармацевтически приемлемые соли, гидраты, сольваты, хелаты, нековалентные комплексы, изомеры, пролекарства и изотопно-меченые производные) могут вводиться совместно с другими агентами, которые указаны в тексте заявки. В случае применения в составе комбинированной терапии, полиморфы по настоящему изобретению или их фармацевтически приемлемые формы (например, фармацевтически приемлемые соли, гидраты, сольваты, хелаты, нековалентные комплексы, изомеры, пролекарства и изотопно-меченые производные) могут вводиться в комбинации со вторым агентом одновременно или отдельно. Введение в комбинации может включать одновременное введение двух агентов в одной и той же дозированной форме, одновременное введение в отдельных дозированных формах и отдельное введение. В некоторых вариантах осуществления, полиморф по настоящему изобретению и любой из вторых агентов, упомянутых в заявке, могут быть совместно включены в одну и ту же дозированную форму и вводиться одновременно. В качестве альтернативы, в некоторых вариантах осуществления, полиморф по настоящему изобретению или его фармацевтически приемлемые формы (например, фармацевтически приемлемые соли, гидраты, сольваты, хелаты, нековалентные комплексы, изомеры, пролекарства и изотопно-меченые производные) и любые из вторых агентов, описанных в настоящей заявке, могут вводиться одновременно, причем оба агента вводятся в отдельных составах. В качестве другой альтернативы, полиморф по настоящему изобретению или его фармацевтически приемлемая форма (например, фармацевтически приемлемая соль, гидрат, сольват, хелат, нековалентный комплекс, изомер, пролекарство и изотопно-меченое производное) можно вводить после или до введения любого из вторых агентов, описанных в настоящей заявке. В отдельном протоколе введения полиморф по настоящему изобретению или его фармацевтически приемлемая форма (например, фармацевтически приемлемая соль, гидрат, сольват, хелат, нековалентный комплекс, изомеры, пролекарство и изотопно-меченое производное) и любой из вторых агентов, описанных в настоящей заявке, можно вводить с интервалом в несколько минут, с интервалом в несколько часов или с интервалом в несколько дней.
IV. СПОСОБЫ ЛЕЧЕНИЯ
Фосфоинозитид 3-киназы (PI3K) являются членами консервативного семейств липид киназ, которые регулируют многочисленные функции клеток, включая пролиферацию, дифференцировку, выживание клеток и метаболизм. В клетках млекопитающих имеется несколько классов PI3K, включая, в числе прочих, подгруппы класса IA (например, PI3K-α,β,δ), которые, как правило, активируются рецепторами тирозин киназ (RTK); класса IB (например, PI3K-γ), которые активируются рецепторами, сопряженными с G-белком. PI3K проявляют свою биологическую активность через «PI3K-опосредованный сигнальный путь», который включает несколько компонентов, прямо и/или косвенно передающих сигнал, инициированный PI3K, включая образование вторичного мессенджера фосфатидилинозит, 3,4,5-трифосфата (PIP3) на плазматической мембране, активацию передачи сигнала гетеротримерного G-белка и генерацию дополнительных вторичных мессенджеров, например, cAMP, DAG и IP3, где все перечисленные мессенджеры вызывают обширный каскадный процесс активации протеин киназ (обзор приведен в Vanhaesebroeck, B. et al. (2001) Annu Rev Biochem. 70:535-602). Например, PI3K-δ активируется клеточными рецепторами за счет взаимодействия с регулирующей субъединицей PI3K (p85) доменов SH2, или за счет непосредственного взаимодействия с RAS. PIP3, образовавшийся за счет активности PI3K, активирует эффекторные пути на следующих этапах передачи сигнала за счет взаимодействия с ферментами, содержащими плекстрин-гомологичный домен (PH) (например, PDK-1 и AKT[PKB]). (Fung-Leung WP.(2011) Cell Signal. 23(4):603-8). В отличие от PI3K-δ, PI3K-γ не является PI3K класса 1A, и связана не с регулирующей субъединицей семейства P85, а с регулирующей субъединицей семейства p101. PI3K-γ киназа связана с рецепторами, сопряженными с G-белком (GPCR), способствует очень быстрой индукции PIP3 и также может активироваться под действием RAS.
В некоторых вариантах осуществления, изобретение относится к способам модулирования активности PI3K киназ (например, селективного модулирования) за счет приведения в контакт киназы с эффективным количеством соединения или его фармацевтически приемлемой формы (например, фармацевтически приемлемой соли, гидрата, сольвата, хелата, нековалентного комплекса, изомера, пролекарства и изотопно-меченого производного), или фармацевтической композиции по настоящему изобретению. Модулирование может представлять собой ингибирование или повышение активности киназы. В некоторых вариантах осуществления, изобретение относится к способам ингибирования активности киназы за счет приведения в контакт киназы с эффективным количеством соединения по настоящему изобретению в растворе. В некоторых вариантах осуществления, изобретение относится к способам ингибирования активности киназы за счет приведения в контакт клетки, ткани или органа, в котором экспрессируется представляющая интерес киназа. В некоторых вариантах осуществления, изобретение относится к способам ингибирования активности киназы у субъекта, путем введения в организм субъекта эффективного количества соединения, раскрытого в настоящей заявке.
В некоторых вариантах осуществления, изобретение относится к способам ингибирования активности киназы в растворе, путем приведения в контакт указанного раствора с определенным количеством соединения по настоящему изобретению, которого достаточно для ингибирования активности киназы в указанном растворе. В некоторых вариантах осуществления, изобретение относится к способам ингибирования активности киназы в клетке, путем приведения в контакт упомянутой клетки с определенным количеством соединения по настоящему изобретению, которого достаточно для ингибирования активности киназы в указанной клетке. В некоторых вариантах осуществления, изобретение относится к способам ингибирования активности киназы в ткани, путем приведения в контакт упомянутой ткани с определенным количеством соединения по настоящему изобретению, которого достаточно для ингибирования активности киназы в указанной ткани. В некоторых вариантах осуществления, изобретение относится к способам ингибирования активности киназы в организме, путем приведения в контакт упомянутого организма с определенным количеством соединения по настоящему изобретению, которого достаточно для ингибирования активности киназы в указанном организме. В некоторых вариантах осуществления, изобретение относится к способам ингибирования активности киназы в организме животного, путем приведения в контакт организма упомянутого животного с определенным количеством соединения по настоящему изобретению, которого достаточно для ингибирования активности киназы в указанном организме животного. В некоторых вариантах осуществления, изобретение относится к способам ингибирования активности киназы в организме млекопитающего, путем приведения в контакт организма упомянутого млекопитающего с определенным количеством соединения по настоящему изобретению, которого достаточно для ингибирования активности киназы в организме указанного млекопитающего. В некоторых вариантах осуществления, изобретение относится к способам ингибирования активности киназы в организме человека, путем приведения в контакт организма упомянутого человека с определенным количеством соединения по настоящему изобретению, которого достаточно для ингибирования активности киназы в организме указанного человека.
В некоторых вариантах осуществления, процент активности киназы после контакта киназы с соединением по настоящему изобретению, составляет менее чем примерно 1%, примерно 5%, примерно 10%, примерно 20%, примерно 30%, примерно 40%, примерно 50%, примерно 60%, примерно 70%, примерно 80%, примерно 90%, примерно 95% или примерно 99% от активности киназы в отсутствии указанной стадии приведения в контакт. В некоторых вариантах осуществления, процентная доля ингибирования превышает примерно 25%, примерно 30%, примерно 40%, примерно 50%, примерно 60%, примерно 70%, примерно 80% или примерно 90%. В некоторых вариантах осуществления, изобретение относится к способам ингибирования активности киназы PI3K у субъекта (включая млекопитающих, например, людей), путем приведения в контакт указанного субъекта с определенным количеством соединения по настоящему изобретению, которого достаточно для ингибирования активности PI3 киназы в организме указанного субъекта.
В некоторых вариантах осуществления, киназа представляет собой липид киназу или протеин киназу. В некоторых вариантах осуществления, киназа выбрана из PI3 киназ, в т.ч. различных изоформ, например, PI3 киназы α, PI3 киназы β, PI3 киназы γ, PI3 киназы δ; DNA-PK; mTor; Abl, VEGFR, рецептора эфрина B4 (EphB4); TEK рецептора тирозин киназы (TIE2); FMS-подобной тирозин киназы 3 (FLT-3); рецептора тромбоцитарного фактора роста (PDGFR); RET; ATM; ATR; hSmg-1; Hck; Src; рецептора эпидермального фактора роста (EGFR); KIT; рецептора инсулина (IR) и IGFR.
В одном из вариантов осуществления, изобретение относится также к способам модулирования активности PI3 киназы путем приведения в контакт PI3 киназы с определенным количеством соединения по настоящему изобретению, достаточным для модулирования активности PI3 киназы. Модулирование может представлять собой ингибирование или повышение активности PI3 киназы. В некоторых вариантах осуществления, изобретение относится к способам ингибирования активности киназы PI3 путем приведения PI3 киназы в контакт с определенным количеством соединения по настоящему изобретению, достаточным для модулирования активности PI3 киназы. В некоторых вариантах осуществления, изобретение относится к способам ингибирования активности PI3 киназы. В некоторых вариантах осуществления, такое ингибирование может иметь место в растворе, в клетке, экспрессирующей одну или несколько PI3 киназ, в ткани, включающей клетку, экспрессирующую одну или несколько PI3 киназ, или в организме, экспрессирующем одну или несколько PI3 киназ. В некоторых вариантах осуществления, изобретение относится к способам ингибирования активности PI3 киназы в организме животного (включая млекопитающего, такого как человек) путем приведения в контакт организма указанного животного с определенным количеством соединения по настоящему изобретению, которое является достаточным для ингибирования активности PI3 киназы в организме указанного животного.
В настоящей заявке, термин «PI3K-опосредованное расстройство» относится к заболеванию или состоянию, включающему нарушенный PI3K-опосредованный путь передачи сигнала. В одном из вариантов осуществления, изобретение относится к способу лечения PI3K-опосредованного расстройства у субъекта, где указанный способ включает введение терапевтически эффективного количества соединения или фармацевтической композиции по настоящему изобретению. В некоторых вариантах осуществления, изобретение относится к способу лечения PI3K-δ или PI3K-γ опосредованного расстройства у субъекта, где указанный способ включает введение терапевтически эффективного количества соединения или фармацевтической композиции по настоящему изобретению. В некоторых вариантах осуществления, изобретение относится к способу ингибирования, по меньшей мере, одной киназы PI3K-δ или PI3K-γ, где указанный способ включает приведение в контакт клетки, экспрессирующей PI3K in vitro или in vivo, с эффективным количеством соединения или композиции по настоящему изобретению. Было установлено, что PI3K связаны с широким кругом состояний, включая иммунные заболевания, рак и тромбоз (обзор можно найти в Vanhaesebroeck, B et al. (2010) Current Topics in Microbiology and Immunology, DOI 10.1007/82_2010_65). Например, PI3K класса I, в частности изоформы PI3K-γ и PI3K-δ, в больших количествах экспрессируются в лейкоцитах и связаны с адаптивным и врожденным иммунитетом; таким образом, считается, что эти PI3K являются важными медиаторами воспалительных расстройств и злокачественных гематологических заболеваний (смотрите обзоры в: Harris, SJ et al. (2009) Curr Opin Investig Drugs 10(11):1151-62); Rommel C. et al. (2007) Nat Rev Immunol 7(3):191-201; Durand CA et al. (2009) J Immunol. 183(9):5673-84; Dil N, Marshall AJ. (2009) Mol Immunol. 46(10):1970-8; Al-Alwan MM et al. (2007) J Immunol. 178(4):2328-35; Zhang TT, et al. (2008) J Allergy Clin Immunol. 2008; 122(4):811-819.e2; Srinivasan L, et al. (2009) Cell 139(3):573-86).
Большое число публикаций подтверждает роль PI3K-δ, PI3K-γ и PI3K-β в дифференцировке, сохранении и активации иммунных клеток и опухолевых клеток, что более подробно описано ниже.
Значение PI3K-δ в развитии и деятельности B-клеток подтверждено при исследовании с участием ингибиторов и генетических моделей. PI3K-δ является важным медиатором передачи сигнала рецептора B-клеток (BCR) и предшествует активации AKT, кальциевого потока, PLCγ, MAP киназы, P70S6k и FOXO3a. Киназа PI3K-δ также играет важную роль в передаче сигнала IL4R, S1P и CXCR5 и, как было показано, модулируют реакции на toll-подобные рецепторы 4 и 9. Ингибиторы PI3K-δ показали важность PI3K-δ в развитии B-клеток (краевой зоны и клеток B1), активации B-клеток, хемотаксисе, миграции и хомингу к лимфоидной ткани и в регулировании переключения между классами иммуноглобулинов, ведущему к выработке IgE. Clayton E et al. (2002) J Exp Med. 196(6):753-63; Bilancio A, et al. (2006) Blood 107(2):642-50; Okkenhaug K. et al. (2002) Science 297(5583):1031-4; Al-Alwan MM et al. (2007) J Immunol. 178(4):2328-35; Zhang TT, et al. (2008) J Allergy Clin Immunol. 2008;122(4):811-819.e2; Srinivasan L, et al. (2009) Cell 139(3):573-86).
Было продемонстрировано, что в T-клетках PI3K-δ играет роль рецептора, участвует в передаче сигналов цитокинов и на сигнальном пути предшествует AKT, PLCγ и GSK3b. При удалении PI3K-δ, или у мышей с отключенным синтезом киназы, или в исследованиях с участием ингибиторов, наблюдались дефекты T-клеток, в т.ч. пролиферации, активации и дифференцировки, которые приводили к ослаблению реакции T-хелперных клеток 2 (TH2), специфическим дефектам T-клеток памяти (уменьшению DTH), нарушениям антиген-зависимой миграции клеток и нарушениям в хемотаксисе/миграции к хемокинам (например, S1P, CCR7, CD62L). (Garçon F. et al. (2008) Blood 111(3):1464-71; Okkenhaug K et al. (2006). J Immunol. 177(8):5122-8; Soond DR, et al. (2010) Blood 115(11):2203-13; Reif K, (2004). J Immunol. 2004;173(4):2236-40; Ji H. et al. (2007) Blood 110(8):2940-7; Webb LM, et al. (2005) J Immunol. 175(5):2783-7; Liu D, et al. (2010) J Immunol. 184(6):3098-105; Haylock-Jacobs S, et al. (2011) J Autoimmun. 2011;36(3-4):278-87; Jarmin SJ, et al. (2008) J Clin Invest. 118(3):1154-64).
В нейтрофилах, PI3K-δ, наряду с PI3K-γ и PI3K-β способствуют реакции на иммунные комплексы, передаче сигнала FCgRII, включая миграцию и респираторный всплеск нейтрофилов. В нейтрофилах человека в ответ на формил пептидный рецептор (FMLP) или компонент комплемента C5a(C5a), PI3K-γ-зависимым образом происходит быстрая индукция PIP3, за которой следует продолжительный период выработки PIP3, который зависит от PI3K-δ и играет существенную роль для окислительной вспышки. Реакции на иммунные комплексы способствуют PI3K-δ, PI3K-γ и PI3K-β, и эта реакция является важной промежуточной стадией повреждения тканей в моделях аутоиммунных заболеваний (Randis TM et al. (2008) Eur J Immunol. 38(5):1215-24; Pinho V, (2007) J Immunol. 179(11):7891-8; Sadhu C. et al. (2003) J Immunol. 170(5): 2647-54; Condliffe AM et al. (2005) Blood 106(4):1432-40).
В макрофагах, отобранных у пациентов с хронической обструктивной болезнью легких (COPD), способность реагировать на глюкокортикоиды может быть восстановлена обработкой клеток ингибиторами PI3K-δ. Реакция макрофагов на иммунные комплексы также обусловлена PI3K-δ и PI3K-γ через феномен Артюса (передача сигналов FCgR и C5a) (Randis TM, et al. (2008) Eur J Immunol. 38(5):1215-24 ; Marwick JA et al. (2009) Am J Respir Crit Care Med. 179(7):542-8; Konrad S, et al. (2008) J Biol Chem. 283(48):33296-303).
В мастоцитах, фактор роста стволовых клеток (SCF) и IL3-зависимая пролиферация, дифференцировка и функции, а также хемотаксис, являются PI3K-δ зависимыми. Сшивание FCgR1 аллергеном/IgE, приводящее к высвобождению цитокинов и дегрануляции мастоцитов, в значительной степени ингибируется обработкой ингибиторами PI3K-δ, указывая на роль PI3K-δ в аллергических заболеваниях (Ali K et al. (2004) Nature 431(7011):1007-11; Lee KS, et al. (2006) FASEB J. 20(3):455-65; Kim MS, et al. (2008) Trends Immunol. 29(10):493-501).
Эффективная миграция природных клеток-киллеров (NK) в направлении хемокинов, включая CXCL10, CCL3, S1P и CXCL12, или в качестве реакции на LPS в брюшной полости, зависима от обоих киназ PI3K-δ и PI3K-γ (Guo H, et al. (2008) J Exp Med. 205(10):2419-35; Tassi I, et al. (2007) Immunity 27(2):214-27; Saudemont A, (2009) Proc Natl Acad Sci U S A. 106(14):5795-800; Kim N, et al. (2007) Blood 110(9):3202-8).
Роль PI3K-δ, PI3K-γ и PI3K-β в дифференцировке, сохранении и активации иммунных клеток подтверждает роль этих ферментов в воспалительных расстройствах от аутоиммунных заболеваний (например, ревматоидного артрита, рассеянного склероза) и до аллергических воспалительных расстройств, например, астмы и COPD. Многочисленные подтверждения этого могут быть получены в экспериментальных животных моделях, или изучены с использованием известных в технике животных моделей. В одном из вариантов осуществления, в настоящей заявке описан способ лечения воспалительных расстройств от аутоиммунных заболеваний (например, ревматоидного артрита, рассеянного склероза) и до аллергических воспалительных расстройств, например, астмы и COPD, с применением соединений по настоящему изобретению.
Например, было показано, что ингибиторы PI3K-δ и/или γ обладают противовоспалительной активностью в ряде животных моделей аутоиммунного ревматоидного артрита (Williams, O. et al. (2010) Chem Biol, 17(2):123-34; WO 2009/088986; WO 2009/088880; WO 2011/008302). PI3K-δ экспрессируется в синовиальной ткани при RA (в особенности в синовиальном выстилающем слое, который содержит фибробластоподобные синовиоциты (FLS)), и было показано, что селективные ингибиторы PI3K-δ эффективно ингибируют рост и выживание синовиоцитов (Bartok et al. (2010) Arthritis Rheum 62 Suppl 10:62). Было показано, что ряд ингибиторов PI3K-δ и -γ облегчают симптомы артрита (например, опухание суставов, уменьшение уровней индуцированного сывороткой коллагена, уменьшение патологии суставов и/или воспаление) в известных в технике моделях RA, таких как, коллаген-индуцированный артрит и адъювант-индуцированный артрит (WO 2009/088986; WO 2009/088880; WO 2011/008302).
Роль PI3K-δ была показана также в моделях T-клеточно-зависимого ответа, включая модель DTH. В модели мышиного экспериментального аутоиммунного энцефаломиелита (EAE), имитирующего рассеянный склероз, мыши с двойной мутацией PI3K-γ/δ проявляют устойчивость. Было также показано, что ингибиторы PI3K-δ блокируют появление EAE и развитие клеток TH-17 как in vitro, так и in vivo (Haylock-Jacobs, S. et al. (2011) J.Autoimmunity 36(3-4):278-87).
Системная красная волчанка (SLE) является комплексным заболеванием, для развития которого на разных стадиях необходимы T-клетки памяти, поликлональный рост и дифференцировка B-клеток в клетки плазмы, и врожденный иммунный ответ на эндогенные «молекулы сигналов повреждения» (DAMP) и воспалительные реакции на иммунные комплексы через систему комплемента, а также рецепторы FC. Значение обеих киназ PI3K-δ и PI3K-γ для упомянутых сигнальных путей и типов клеток позволяет предположить, что их блокирование ингибиторами могло бы оказаться эффективным при данном заболевании. Роль PI3K в развитии волчанки можно также предсказать с помощью двух генетических моделей волчанки. Устранение гомолога фосфатазы и тензина (PTEN) приводит к волчаночно-подобному фенотипу, так же как и трансгенная активация PI3K класса 1A, в который входит PI3K-δ. Подавление PI3K-γ в этой модели волчанки с трансгенной активацией класса 1A играет защитную роль, и обработка PI3K-γ селективным ингибитором в мышиной MLR/lpr модели волчанки ослабляет симптомы (Barber, DF et al. (2006) J.Immunol. 176(1):589-93).
При аллергических заболеваниях, с помощью генетических моделей и обработки ингибиторами, было показано, что PI3K-δ играет существенную роль в активации мастоцитов в пробе на пассивную кожную анафилаксию (Ali K et al. (2008) J Immunol. 180(4):2538-44; Ali K, (2004) Nature 431 (7011):1007-11). При легочном измерении реакции на иммунные комплексы (реакция Артюса) PI3K-δ-нокаутированные животные оказываются устойчивыми, демонстрируя нарушение активации макрофагов и выработки C5a. Исследования нокаутированных особей и исследования с использованием ингибиторов для обеих киназ PI3K-δ и PI3K-γ, подтвердили участие этих ферментов в аллергическом воспалении дыхательных путей, вызванном яичным альбумином, и в модели гиперчувствительности (Lee KS et al. (2006) FASEB J. 20(3):455-65). Уменьшение инфильтрации эозинофилов, нейтрофилов и лимфоцитов, а также TH2 цитокинов (IL4, IL5 и IL13) наблюдалось как для PI3K-δ-специфичных ингибиторов, так и для ингибиторов двойной специфичности PI3K-δ и PI3K-γ, в модели астмы, вызванной Ova (Lee KS et al. (2006) J Allergy Clin Immunol 118(2):403-9).
Ингибирование PI3K-δ и PI3K-γ может применяться при лечении COPD. В модели вдыхания мышами дыма, имитирующей COPD, у PI3K-δ-нокаутированных животных не развивалась невосприимчивость к глюкокортикоидам, вызванная вдыханием дыма, в то время, как у особей дикого типа и PI3K-γ-нокаутированных особей, такая невосприимчивость появлялась. Вдыхание состава двойного ингибитора PI3K-δ и PI3K-γ блокировало воспаление в моделях LPS и вдыхания дыма, имитирующих COPD, что определяли по нейтрофилии и невосприимчивости к глюкокортикоидам (Doukas J et al. (2009) J Pharmacol Exp Ther. 328(3):758-65).
Кроме того, PI3K класса I, в частности изоформы PI3K-δ и PI3K-γ, имеют отношение к раковым заболеваниям (обзоры приведены, например, в Vogt, PK et al. (2010) Curr Top Microbiol Immunol. 347:79-104; Fresno Vara, JA et al. (2004) Cancer Treat Rev. 30(2):193-204; Zhao, L and Vogt, PK. (2008) Oncogene 27(41):5486-96). Было показано, что ингибиторы PI3K, например, PI3K-δ и/или -γ обладают противораковой активностью (например, Courtney, KD et al. (2010) J Clin Oncol. 28(6):1075-1083); Markman, B et al. (2010) Ann Oncol. 21(4):683-91; Kong, D and Yamori, T (2009) Curr Med Chem. 16(22):2839-54; Jimeno, A et al. (2009) J Clin Oncol. 27:156s (suppl; abstr 3542); Flinn, IW et al. (2009) J Clin Oncol. 27:156s (suppl; abstr 3543); Shapiro, G et al. (2009) J Clin Oncol. 27:146s (suppl; abstr 3500); Wagner, AJ et al. (2009) J Clin Oncol. 27:146s (suppl; abstr 3501); Vogt, PK et al. (2006) Virology 344(1):131-8; Ward, S et al. (2003) Chem Biol. 10(3):207-13; WO 2011/041399; US 2010/0029693; US 2010/0305096; US 2010/0305084). В одном из вариантов осуществления, изобретение относится к способу лечения рака.
Типы раковых заболеваний, которые можно лечить с применением ингибитора PI3K (в т.ч. PI3K-δ и/или -γ), включают, например, лейкоз (например, хронический лимфоцитарный лейкоз (CLL), острый миелоидный лейкоз (ALL), хронический миелоидный лейкоз (CML) (например, Salmena, L et al. (2008) Cell 133:403-414; Chapuis, N et al. (2010) Clin Cancer Res. 16(22):5424-35; Khwaja, A (2010) Curr Top Microbial Immunol. 347:169-88); лимфому (например, неходжкинскую лимфому или ходжкинскую лимфому) (например, Salmena, L et al. (2008) Cell 133:403-414); рак легких, например, немелкоклеточный рак легких, мелкоклеточный рак легких (например, Herrera, VA et al. (2011) Anticancer Res. 31(3):849-54); меланому (например, Haluska, F et al. (2007) Semin Oncol. 34(6):546-54); рак простаты (например, Sarker, D et al. (2009) Clin Cancer Res. 15(15): 4799-805); глиобластому (например, Chen, JS et al. (2008) Mol Cancer Ther. 7:841-850); рак эндометрия (например, Bansal, N et al. (2009) Cancer Control. 16(1):8-13); рак поджелудочной железы (например, Furukawa, T (2008) J Gastroenterol. 43(12):905-11); почечно-клеточную карциному (например, Porta, C and Figlin, RA (2009) J Urol. 182(6):2569-77); колоректальный рак (например, Saif, MW and Chu, E (2010) Cancer J. 16(3):196-201); рак груди (например, Torbett, NE et al. (2008) Biochem J. 415:97-100); рак щитовидной железы (например, Brzezianska, E and Pastuszak-Lewandoska, D (2011) Front Biosci. 16:422-39); и рак яичников (например, Mazzoletti, M and Broggini, M (2010) Curr Med Chem. 17(36):4433-47).
Многочисленные публикации подтверждают значение PI3K-δ и PI3K-γ при лечении гематологических разновидностей рака. PI3K-δ и PI3K-γ в значительных количествах экспрессируются в компартменте гема и некоторых солидных опухолях, включая рак простаты, груди и глиобластомы (Chen J.S. et al. (2008) Mol Cancer Ther. 7(4):841-50; Ikeda H. et al. (2010) Blood 116(9):1460-8).
При гематологических раковых заболеваниях, включая острый миелоидный лейкоз (AML), множественную миелому (MM) и хронический лимфоцитарный лейкоз (CLL), избыточная экспрессия и конститутивная активация PI3K-δ подтверждает мысль о том, что ингибирование PI3K-δ могло бы иметь терапевтическое значение Billottet C, et al. (2006) Oncogene 25(50):6648-59; Billottet C, et al. (2009) Cancer Res. 69(3):1027-36; Meadows, SA, 52nd Annual ASH Meeting and Exposition; 2010 Dec 4-7; Orlando, FL; Ikeda H, et al. (2010) Blood 116(9):1460-8; Herman SE et al. (2010) Blood 116(12):2078-88; Herman SE et al. (2011). Blood 117(16):4323-7. В одном из вариантов осуществления, изобретение относится к способу лечения гематологических раковых заболеваний, включая, но не ограничиваясь этим, острый миелоидный лейкоз (AML), множественную миелому (MM) и хронический лимфоцитарный лейкоз (CLL).
Эффективность ингибитора PI3K-δ (CAL-101) оценивали в клиническом испытании фазы 1 у пациентов со злокачественными гематологическими заболеваниями, и этот ингибитор продемонстрировал активность при CLL у пациентов с плохими прогнозами. При CLL ингибирование PI3K-δ не только непосредственно поражает опухолевые клетки, но также оказывает влияние на способность опухолевых клеток взаимодействовать с их микросредой. Эта микросреда включает контакт с факторами, выделяемыми стромальными клетками, T-клетками, нурзальными клетками, а также другими опухолевыми клетками. CAL-101 подавляет экспрессию факторов стромальных и T-клеток, в т.ч. CCL3, CCL4 и CXCL13, а также способность опухолевых клеток CLL реагировать на эти факторы. Введение CAL-101 пациентам с CLL вызывает быстрое уменьшение лимфатических узлов и перераспределение лимфоцитов в циркуляцию, а также влияет на тоническую передачу сигналов выживания через BCR, что ведет к понижению жизнеспособности клеток и увеличивает апоптоз. Введение CAL-101 в качестве единственного агента также продемонстрировало эффективность при лимфоме из клеток мантийной зоны и рефракторной не ходжкинской лимфоме (Furman, RR, et al. 52nd Annual ASH Meeting and Exposition; 2010 Dec 4-7; Orlando, FL; Hoellenriegel,J, et al. 52nd Annual ASH Meeting and Exposition; 2010 Dec 4-7; Orlando, FL; Webb, HK, et al. 52nd Annual ASH Meeting and Exposition; 2010 Dec 4-7; Orlando, FL; Meadows, et al. 52nd Annual ASH Meeting and Exposition; 2010 Dec 4-7; Orlando, FL; Kahl, B, et al. 52nd Annual ASH Meeting and Exposition; 2010 Dec 4-7; Orlando, FL; Lannutti BJ, et al. (2011) Blood 117(2):591-4).
Ингибиторы PI3K-δ продемонстрировали активность против PI3K-δ положительных глиом in vitro (Kashishian A, et al. Poster presented at: The American Association of Cancer Research 102nd Annual Meeting; 2011 Apr 2-6; Orlando, FL). PI3K-β представляет собой изоформу PI3K, которая чаще всего активирована в опухолях, в которых мутации подвергся супрессор опухолей PTEN (Ward S, et al. (2003) Chem Biol. 10(3):207-13). В этой подгруппе опухолей, может оказаться эффективным введение ингибитора PI3K-δ либо индивидуально, либо в комбинации с цитотоксическим агентом.
Другой механизм, благодаря которому ингибиторы PI3K-δ оказывают влияние на солидные опухоли, включает взаимодействие опухолевых клеток с их микроокружением. PI3K-δ, PI3K-γ и PI3K-β экспрессируется в иммунных клетках, которые проникают в опухоли, в т.ч. проникающих в опухоли лимфоцитов, макрофагов и нейтрофилов. Ингибиторы PI3K-δ могут модифицировать действие этих ассоциированных с опухолью иммунных клеток и их реакцию на сигналы, поступающие из стромы, опухоли и других иммунных клеток, и, таким образом, влиять на опухолевые клетки и метастазы (Hoellenriegel, J, et al. 52nd Annual ASH Meeting and Exposition; 2010 Dec 4-7; Orlando, FL).
PI3K-δ экспрессируется также в эндотелиальных клетках. Было показано, что опухоли у мышей после обработки PI3K-δ-селективными ингибиторами, легче уничтожались радиационной терапией. В этом же исследовании было установлено, что под действием ингибитора PI3K-δ ослабляется формирование капиллярной сети, и было постулировано, что слабая капиллярная сеть способствует более эффективному действию радиации. Ингибиторы PI3K-δ могут влиять на характер взаимодействия опухолей с их микроокружением, включая стромальные клетки, иммунные клетки и эндотелиальные клетки, и проявлять терапевтическую эффективность либо самостоятельно, либо в сочетании с другими способами лечения (Meadows, SA, et al. Paper presented at: 52nd Annual ASH Meeting and Exposition; 2010 Dec 4-7; Orlando, FL; Geng L, et al. (2004) Cancer Res. 64(14):4893-9).
В других вариантах осуществления, ингибирование PI3K (например, PI3K-δ и/или -γ) может применяться для лечения нейропсихиатрических расстройств, например, аутоиммунных заболеваний мозга. Инфекции и иммунные факторы принимают участие в патогенезе ряда нейропсихиатрических расстройств, включая, но не ограничиваясь этим, хорею Сиденгама (SC) (Garvey, M.A. et al (2005) J.Child Neurol. 20:424-429), синдром Туретта (TS), обсессивно-компульсивное расстройство (OCD) (Asbahr, F.R. et al. (1998) Am.J.Psychiatry 155:1122-1124), синдром дефицита внимания/гиперактивности (AD/HD) (Hirschtritt, M.E. et al. (2008) Child Neuropsychol. 1:1-16; Peterson, B. S. et al. (2000) Arch. Gen. Psychiatry 57:364-372), нервную анорексию (Sokol, M. S. (2000) J. Child Adolesc. Psychopharmacol. 10:133-145; Sokol, M. S. et al. (2002) Am.J. Psychiatry 159: 1430-1432), депрессию (Leslie, D. L., et al. (2008) J. Am. Acad. Child Adolesc. Psychiatry 47:1166-1172) и заболевания аутического спектра (ASD) (Hollander, E. et al. (1999) Am. J. Psychiatry 156:317-320; Margutti, P. et al. (2006) Curr. Neurovasc. Res. 3:149-157). Подгруппа детских обсессивно-компульсивных расстройств и тиковых расстройств была объединена в детские аутоиммунные нейропсихиатрические расстройства, ассоциированные со стрептококковой инфекцией (PANDAS). Расстройства PANDAS являются примером расстройств, при которых началу и обострению нейропсихиатрических симптомов предшествует стрептококковая инфекция (Kurlan, R., Kaplan, E.L. (2004) Pediatrics 113:883-886; Garvey, M. A. et al. (1998) J. Clin. Neurol. 13:413-423). Многие из расстройств PANDAS имеют общий механизм развития, связанный с выработкой антител против эпитопов, ассоциированных со стрептококками, например GlcNAc, что приводит к неврологическим эффектам (Kirvan. C. A. et al. (2006) J. Neuroimmunol. 179:173-179). Аутоантитела, распознающие эпитопы центральной нервной системы (ЦНС), были также обнаружены в сыворотке большинства субъектов с PANDAS (Yaddanapudi, K. et al. (2010) Mol. Psychiatry 15:712-726). Таким образом, ряд нейропсихиатрических расстройств связан с иммунными и аутоиммунными компонентами, которые делают их доступными для терапии, включающей ингибирование PI3K-δ и/или -γ.
В некоторых вариантах осуществления, изобретение относится к способу лечения (например, ослабления или улучшения одного или нескольких симптомов) нейропсихиатрических расстройств (например, аутоиммунных заболеваний мозга), в котором применяется ингибитор PI3K-δ и/или -γ, индивидуально или в составе комбинированной терапии. Например, один или несколько ингибиторов PI3K-δ и/или -γ по настоящему изобретению могут применяться индивидуально или в комбинации с любым подходящим терапевтическим агентом и/или способом лечения, например, пищевыми добавками, для лечения нейропсихиатрических расстройств. Примеры нейропсихиатрических расстройств, которые можно лечить ингибиторами PI3K-δ и/или -γ по настоящему изобретению, включают, не ограничиваясь этим, расстройства PANDAS, хорею Сиденгама, синдром Туретта, обсессивно-компульсивное расстройство, синдром дефицита внимания/гиперактивности, нервную анорексию, депрессию и заболевания аутического спектра. Общее расстройство психологического развития (PDD) является типовым классом заболеваний аутического спектра, который включает аутическое расстройство, синдром Аспергера, детское дезинтегративное расстройство (CDD), синдром Ретта и PDD, не классифицированные другим образом (PDD-NOS). В технике известны животные модели для оценки активности ингибиторов PI3K-δ и/или -γ. Например, мышиная модель PANDAS описана, например, в Yaddanapudi, K. et al. (2010) смотрите выше; и Hoffman, K. I. et al. (2004) J. Neurosci. 24:1780-1791.
Настоящее изобретение относится к способам применения соединений или фармацевтических композиций по настоящему изобретению для лечения болезненных состояний, включая, но не ограничиваясь этим, заболевания, связанные с нарушением функций одного или нескольких типов PI3 киназ. Например, подробное описание состояний и расстройств, опосредованных активностью киназы p110δ, приведено в заявке Sadu et al., WO 01/81346, которая включена в настоящую заявку посредством ссылки в полном объеме для любых целей.
В одном из вариантов осуществления, способы лечения по настоящему изобретению включают введение субъекту терапевтически эффективного количества соединения по настоящему изобретению. В одном из вариантов осуществления, изобретение относится к способу лечения воспалительного расстройства, в т.ч. аутоиммунного заболевания, у млекопитающих. В одном из вариантов осуществления, этот способ включает введение указанному млекопитающему терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли, сложного эфира, пролекарства, сольвата, гидрата или производного. Примеры аутоиммунных заболеваний включают, не ограничиваясь этим, острый рассеянный энцефаломиелит (ADEM), болезнь Адиссона, антифосфолипидный синдром (APS), апластическую анемию, аутоиммунный гепатит, глютеновую болезнь, болезнь Крона, сахарный диабет (I типа), синдром Гудпасчера, болезнь Грейвса, синдром Гийена-Барре (GBS), болезнь Хашимото, красную волчанку, рассеянный склероз, миастению гравис, опсомиоклональный синдром (OMS, синдром пляшущих глаз), неврит зрительного нерва, тиреоидит Орда, пузырчатку, полиартрит, первичный биллиарный цирроз, псориаз, буллезный пемфигоид, ревматоидный артрит, синдром Рейтера, артериит Такаясу, темпоральный артериит (известный также как «гигантоклеточный артериит»), тепловую аутоиммунную гемолитическую анемию, грануломатоз Вегенера, генерализованную аллопецию, болезнь Чагаса, синдром хронической усталости, вегетативную дистонию, эндометриоз, гнойный гидраденит, интерстициальный цистит, нейромиотонию, саркоидоз, склеродермию, язвенный колит, витилиго и вульводинию. В других вариантах осуществления, расстройства и болезненные состояния включают расстройства, связанные с резорбцией костной ткани и тромбоз.
Воспаление принимает разнообразные формы и включает, не ограничиваясь этим, острое, адгезивное(слипчивое), атрофическое, катаральное, хроническое, цирротическое, диффузное, рассеянное, экссудативное, фибринозное, фиброзирующее, очаговое, гранулематозное, гиперпластическое, гипертрофическое, интерстициальное, метастатическое, некротическое, облитерирующее, паренхиматозное, пластическое, продуктивное, пролиферирующее, псевдомембранное, гнойное, склерозирующее, серозно-фибринозное, серозное, простое, специфичное, подострое, гноеродное, токсическое, травматическое и/или язвенное воспаление.
Примеры воспалительных состояний включают, не ограничиваясь этим, воспаление, связанное с акне, анемией (например, анемией Эрлиха, гемолитической аутоиммунной анемией), астмой, артериитом (например, полиартериитом, темпоральным артериитом, узелковым периартериитом, артериитом Такаясу), артритом (например, кристаллическим артритом (подагрой), остеоартритом, псориатическим артритом, подагрическим артритом, реактивным артритом, ревматоидным артритом и артритом Рейтера), анкилозирующим спондилитом, амилозом, боковым амиотрофическим склерозом, аутоиммунными заболеваниями, аллергиями или аллергическими реакциями, атеросклерозом, бронхитом, бурситом, хроническим простатитом, конъюнктивитом, болезнью Чагаса, хронической обструктивной болезнью легких, дерматомиозитом, дивертикулитом, диабетом (например, сахарным диабетом I типа, сахарным диабетом II типа), кожными состояниями (например, псориазом, экземой, ожогами, дерматитом, кожным зудом (чесоткой)), эндометриозом, синдромом Гийена-Барре, инфекцией, ишемической болезнью сердца, болезнью Кавасаки, гломерулонефритом, гингивитом, гиперчувствительностью, головной болью (например, головной болью, вследствие мигрени, тензионной головной болью), кишечной непроходимостью (например, послеоперационной кишечной непроходимостью и кишечной непроходимостью при сепсисе), идиопатической тромбоцитопенической пурпурой, интерстициальным циститом (болевым синдромом мочевого пузыря), желудочно-кишечными расстройствами (например, выбранными из язвы желудка и двенадцатиперстной кишки, регионарного энтерита, дивертикулита, желудочно-кишечного кровотечения, эозинофильных желудочно-кишечных расстройств (например, эозинофильного эзофагита, эозинофильного гастрита, эозинофильного гастроэнтерита, эозинофильного колита), гастрита, диареи, гастроэзофагеального рефлюкса GORD или его симптома GERD), воспалительными заболеваниями кишечника (IBD) (например, болезнью Крона, язвенным колитом, коллагеновым колитом, лимфоцитарным колитом, ишемическим колитом, синдромом Бехчета, неопределенным колитом и воспалительным синдромом кишечника (IBS)), волчанкой, рассеянным склерозом, очаговой склеродермией, миастенией гравис, ишемией миакарда, нефротическим синдромом, обыкновенной пузырчаткой, злокачественной анемией, пептическими язвами, полимиозитом, первичным биллиарным циррозом, нейровоспалением, связанным с расстройствами мозга (например, болезнью Паркинсона, болезнью Хантингтона и болезнью Альцгеймера), простатитом, хроническим воспалением, связанным с радиационным поражением мозга, воспалительными заболеваниями тазовых органов, поражениями при реперфузии, региональным энтеритом, ревматической лихорадкой, системной красной волчанкой, кожной красной волчанкой, склеродермией, фиброзным раком, саркоидозом, спондилоартропатией, синдромом Шегрена, тиреоидитом, отторжением трансплантата, тендинитом, травмой или повреждением (например, обморожением, химическими раздражителями, токсинами, рубцеванием, ожогами, физическими травмами), васкулитом, витилиго и гранулематозом Вегенера. В некоторых вариантах осуществления, воспалительное расстройство выбрано из артрита (например, ревматоидного артрита), воспалительных заболеваний кишечника, воспалительного синдрома кишечника, астмы, псориаза, эндометриоза, интерстинального цистита и простатита. В некоторых вариантах осуществления, воспалительное состояние является острым воспалительным состоянием (например, воспалением, вызванным инфекцией). В некоторых вариантах осуществления, воспалительное состояние является хроническим воспалительным состоянием (например, состоянием, вызванным астмой, артритом и воспалительным заболеванием кишечника). Соединения по настоящему изобретению могут также найти применение при лечении воспаления, связанного с травмой, и невоспалительной миалгией.
Иммунные расстройства, такие как аутоиммунные расстройства, включают, не ограничиваясь этим, артрит (в т.ч. ревматоидный артрит, спондилоартропатии, подагрический артрит, дегенеративные заболевания суставов, такие как остеоартрит, системную красную волчанку, синдром Шегрена, алкилозирующий спондилит, недифференцированный спондилит, болезнь Бехчета, гемолитические аутоиммунные анемии, рассеянный склероз, боковой амиотрофический склероз, амилоз, острый плечекистевой синдром, псориотический и юношеский артрит), астму, артериосклероз, остеопороз, бронхит, тендинит, бурсит, кожные состояния (например, псориаз, экзему, ожоги, дерматит, кожный зуд (чесотку)), энурез, эозинофильные заболевания, желудочно-кишечные расстройства (например, выбранные из язвенных заболеваний желудка и двенадцатиперстной кишки, регионарных энтеритов, дивертикулита, желудочно-кишечного кровотечения, эозинофильных желудочно-кишечных расстройств (например, эозинофильного эзофагита, эозинофильного гастрита, эозинофильного гастроэнтерита, эозинофильного колита), гастрита, диареи, гастроэзофагеального рефлюкса (GORD или его синонима GERD), воспалительных болезней кишечника (IBD) (например, болезни Крона, язвенного колита, коллагенозного колита, лимфоцитарного колита, ишемического колита, колита отключенной кишки, синдрома Бехчета, недифференцированного колита) и воспалительного синдрома кишечника (IBS)), а также расстройств, которые облегчаются гастропрокинетическим агентом (например, кишечной непроходимости, послеоперационной кишечной непроходимости и кишечной непроходимости при сепсисе; гастроэзофагеального рефлюкса (GORD или его синонима GERD); эозинофильного эзофагита, гастропареза, например, диабетического гастропареза; непереносимости пищевых продуктов и пищевых аллергий, а также других функциональных расстройств кишечника, например, неязвенной диспепсии (NUD) и боли в груди, не связанной с сердцем (NCCP, включая хондрит реберно-грудинного сочленения)).
В некоторых вариантах осуществления, способ лечения воспалительных или аутоиммунных заболеваний включает введение субъекту (например, млекопитающему) терапевтически эффективного количества соединения по настоящему изобретению, которое селективно ингибирует PI3K-δ и/или PI3K-γ по сравнению с другими типами киназ PI3. Такое селективное ингибирование PI3K-δ и/или PI3K-γ может быть предпочтительным для лечения любых из заболеваний и состояний, описанных в настоящей заявке. Например, не ограничиваясь какой-либо конкретной теорией, селективное ингибирование PI3K-δ может подавлять воспалительные реакции, связанные с воспалительными заболеваниями, аутоиммунными заболеваниями или заболеваниями, сопровождающимися нежелательными иммунными реакциями, включая, но не ограничиваясь этим, астму, эмфизему, аллергию, дерматит, ревматоидный артрит, псориаз, системную красную волчанку или реакцию трансплантата против хозяина. Не ограничиваясь какой-либо конкретной теорией, селективное ингибирование PI3K-δ может дополнительно обеспечивать уменьшение воспалительной или нежелательной иммунной реакции без сопутствующего ослабления способности подавлять бактериальную, вирусную и/или грибковую инфекцию. Не ограничиваясь какой-либо конкретной теорией, селективное ингибирование как PI3K-δ, так и PI3K-γ может быть предпочтительным для ингибирования воспалительной реакции в организме субъекта в большей степени, чем это могло бы обеспечить селективное ингибирование только PI3K-δ или только PI3K-γ. В одном из вариантов осуществления, один или несколько из способов по настоящему изобретению эффективны для уменьшения выработки антиген-специфичных антител in vivo примерно в 2 раза, примерно в 3 раза, примерно в 4 раза, примерно в 5 раз, примерно в 7,5 раз, примерно в 10 раз, примерно в 25 раз, примерно в 50 раз, примерно в 100 раз, примерно в 250 раз, примерно в 500 раз, примерно в 750 раз или примерно в 1000 раз или более. В другом варианте осуществления, один или несколько способов по настоящему изобретению эффективны для уменьшения выработки антиген-специфичного IgG3 и/или IgGM in vivo примерно в 2 раза, примерно в 3 раза, примерно в 4 раза, примерно в 5 раз, примерно в 7,5 раз, примерно в 10 раз, примерно в 25 раз, примерно в 50 раз, примерно в 100 раз, примерно в 250 раз, примерно в 500 раз, примерно в 750 раз или примерно в 1000 раз или более.
В одном из вариантов осуществления, один или несколько способов по настоящему изобретению эффективны при облегчении симптомов, связанных с ревматоидным артритом, включая, но не ограничиваясь этим, ослабление опухания суставов, уменьшение уровней антител к коллагену в сыворотке и/или уменьшение патологии суставов, например, резорбции костной ткани, повреждения хряща, паннуса и/или воспаления. В другом варианте осуществления, способ по настоящему изобретению эффективен для уменьшения воспаления голеностопного сустава, по меньшей мере, примерно на 2%, примерно на 5%, примерно на 10%, примерно на 15%, примерно на 20%, примерно на 25%, примерно на 30%, примерно на 50%, или примерно на 60%, или от примерно 75% до примерно 90%. В другом варианте осуществления, способы по настоящему изобретению эффективны при уменьшении воспаления коленного сустава, по меньшей мере, примерно на 2%, примерно на 5%, примерно на 10%, примерно на 15%, примерно на 20%, примерно на 25%, примерно на 30%, примерно на 50%, или примерно на 60%, или от примерно 75% до примерно 90% или более. В еще одном варианте осуществления, способы по настоящему изобретению эффективны для уменьшения уровней антител к коллагену II типа в сыворотке, по меньшей мере, примерно на 10%, примерно на 12%, примерно на 15%, примерно на 20%, примерно на 24%, примерно на 25%, примерно на 30%, примерно на 35%, примерно на 50%, примерно на 60%, примерно на 75%, примерно на 80%, примерно на 86%, примерно на 87% или примерно на 90% или более. В следующем варианте осуществления, способы по настоящему изобретению эффективны для уменьшения показателя гистопатологии голеностопного сустава примерно на 5%, примерно на 10%, примерно на 15%, примерно на 20%, примерно на 25%, примерно на 30%, примерно на 40%, примерно на 50%, примерно на 60%, примерно на 75%, примерно на 80% или примерно на 90% или более. В еще одном варианте осуществления, способы по настоящему изобретению эффективны для уменьшения показателя гистопатологии коленного сустава примерно на 5%, примерно на 10%, примерно на 15%, примерно на 20%, примерно на 25%, примерно на 30%, примерно на 40%, примерно на 50%, примерно на 60%, примерно на 75%, примерно на 80% или примерно на 90% или более.
В других вариантах осуществления, изобретение относится к способам применения соединений или фармацевтических композиций по настоящему изобретению для лечения респираторных заболеваний, включая, но не ограничиваясь этим, заболевания, поражающие доли легких, плевральную полость, мелкие бронхи, трахею, верхние дыхательные пути или нервы и мышцы, участвующие в дыхании. Например, изобретение относится к способам лечения обструктивной болезни легких, включая COPD. Хроническая обструктивная болезнь легких (COPD) является обобщающим термином для группы заболеваний дыхательных путей, которые характеризуются наличием препятствий и ограничением потока воздуха. Состояниями, входящими в этот обобщающий термин, являются: хронический бронхит, эмфизема и бронхоэктаз.
В другом варианте осуществления, соединения по настоящему изобретению применяются для лечения астмы. Кроме того, соединение или фармацевтическая композиция по настоящему изобретению может применяться для лечения эндотоксикоза и сепсиса. В одном из вариантов осуществления, соединения или фармацевтические композиции по настоящему изобретению применяются для лечения ревматоидного артрита (RA). В еще одном варианте осуществления, соединения или фармацевтические композиции по настоящему изобретению применяются для лечения контактного или атопического дерматита. Контактный дерматит включает ирритативный дерматит, фототоксический дерматит, аллергический дерматит, фотоаллергический дерматит, контактную аллергическую сыпь, системный дерматит контактного типа и т.п. Ирритативный дерматит может возникать при попадании на кожу слишком большого количества вещества или, если кожа чувствительна к определенному веществу. Атопический дерматит, иногда именуемый экземой, является разновидностью дерматита, т.е. атопическим кожным заболеванием.
Кроме того, изобретение относится к способу лечения гиперпролиферативного расстройства у млекопитающего, включающему введение указанному млекопитающему терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли, сложного эфира, пролекарства, сольвата, гидрата или производного. В некоторых вариантах осуществления, гиперпролиферативное расстройство представляет собой миелоидное заболевание, миелодиспластический синдром (MDS), миелопролиферативную болезнь (MPD) или расстройство, связанное с мастоцитами. В некоторых вариантах осуществления, указанный способ относится к лечению раковый заболеваний, например, острого миелоцитарного лейкоза, ретинобластомы, внутриглазной меланомы или раковых заболеваний тимуса, мозга, легких, плоских клеток, кожи, глаз, полости рта и ротоглоточной области, мочевого пузыря, желудка, поджелудочной железы, груди, шейки матки, головы, шеи, почек, печени, яичников, простаты, ободочной и прямой кишки, пищевода, яичек, гинекологических раковых заболеваний, щитовидной железы, центральной или периферической нервной системы, или раковых заболеваний, связанных со СПИДом (например, лимфомы или саркомы Капоши) или рака, вызванного вирусами. В некоторых вариантах осуществления, указанный способ относится к лечению не раковых гиперпролиферативных расстройств, например, доброкачественной гиперплазии кожи (например, псориаза), рестеноза или простаты (например, доброкачественной гипертрофии простаты (BPH)).
Кроме того, изобретение относится к способу лечения заболеваний, связанных с васкулогенезом или ангиогенезом у млекопитающих, включающему введение указанному млекопитающему терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли, сложного эфира, пролекарства, сольвата, гидрата или производного. В некоторых вариантах осуществления, указанный способ предназначен для лечения заболевания, выбранного из группы, состоящей из опухолевого ангиогенеза, хронических воспалительных заболеваний, таких как ревматоидный артрит, атеросклероз, воспалительное заболевание кишечника, кожных воспалительных заболеваний, таких как псориаз, экзема, а также склеродермии, диабета, диабетической ретинопатии, ретинопатии недоношенных, возрастной макулодистрофии, гемангиомы, глиомы, меланомы, саркомы Капоши и раковых заболеваний яичников, груди, легких, поджелудочной железы, простаты, ободочной кишки и эпидермоида.
В одном из вариантов осуществления, пациенты, которых можно лечить соединениями по настоящему изобретению или фармацевтически приемлемыми солями, сложными эфирами, пролекарствами, сольватами, гидратами или производными указанных соединений согласно способам по настоящему изобретению, включают, например, пациентов, у которых диагностировано наличие псориаза; рестеноза; атеросклероза; BPH; рака груди, например, дуктального рака в ткани протоков молочной железы, медуллярного рака, перстневидно-клеточного рака, тубулярного рака и воспалительного рака груди; рака яичников, включая опухоли эпителия яичников, например, аденокарциному яичников и аденокарциному яичников, мигрировавшую из яичника в брюшную полость; рака матки; рака шейки матки, например, аденокарциномы эпителия шейки матки, включая плоскоклеточный рак и аденокарциномы; рака простаты, например, рака простаты, выбранного из аденокарциномы или аденокарциномы, мигрировавшей в костную ткань; рака поджелудочной железы, например, эпителиального рака в ткани протока поджелудочной железы и аденокарциномы в протоке поджелудочной железы; рака мочевого пузыря, например, переходно-клеточного рака мочевого пузыря, уротелиальных карцином (переходно-клеточных карцином), опухолей уротелиальных клеток, которые выстилают мочевой пузырь, плоскоклеточных карцином, аденокарцином и мелкоклеточных карцином; лейкоза, например, острого миелогенного лейкоза (AML), острого лимфоцитарного лейкоза, хронического лимфоцитарного лейкоза, хронического миелоидного лейкоза, лейкоза ворсистых клеток, миелодисплазии, миелопролиферативных расстройств, острого миелоидного лейкоза (AML), хронического миелоцитарного лейкоза (CML), мастоцитоза, хронического лимфоцитарного лейкоза (CLL), множественной миеломы (MM) и миелодиспластического синдрома (MDS); рака костей; рака легких, например, не мелкоклеточного рака легких (NSCLC), который подразделяется на плоскоклеточный рак, аденокарциному и крупноклеточные не дифференцированные раковые карциномы, и мелкоклеточного рака легких; рака кожи, например, базально-клеточной карциномы, меланомы, плоскоклеточного рака и актинического кератоза, который является состоянием кожи, в некоторых случаях, переходящим в плоскоклеточный рак; ретинобластомы глаза; кожной или внутриглазной (глазной) меланомы; первичного рака печени (рака, который первоначально развивается в печени); рака почек; рака щитовидной железы, например, папиллярного, фолликулярного, медуллярного и анапластического; лимфомы, связанной со СПИДом, например, диффузной крупно B-клеточной лимфомы, B-клеточной иммунобластной лимфомы и мелкоклеточной нерасщепляющейся лимфомы; саркомы Капоши; раковых заболеваний, вызванных вирусами, включая вирус гепатита B (HBV), вирус гепатита C (HCV), вызывающие гепатоклеточную карциному; лимфотропный вирус человека типа 1 (HTLV-1), вызывающий T-клеточный лейкоз/лимфому взрослых; и вирус папилломы человека (HPV), вызывающий рак шейки матки; раковых заболеваний центральной нервной системы (CHS), например, первичных опухолей мозга, которые включают глиомы (астроцитому, анапластическую астроцитому или мультиформную глиобластому), олигодендроглиому, эпендимому, менингиому, лимфому, шванному и медуллобластому; раковых заболеваний периферической нервной системы (PNS), например, нейрому слухового нерва и злокачественные опухоли оболочек периферических нервов (MPNST), в т.ч. нейрофибромы и шванномы, злокачественную фиброцитому, злокачественную фиброгистоцитому, злокачественную менингиому, злокачественную мезотелиому, и злокачественную смешанную опухоль Мюллера; раковых заболеваний полости рта и ротоглоточной области, например, гипофарингеального рака, ларингеального рака, назофарингеального рака и орофарингеального рака; рака желудка, например, лимфомы, стромальных опухолей желудка и карциноидных опухолей; рака яичек, например, гермином (GCT), которые включают семиномы и несеминомы, и опухолей стромы половых желез, которые включают опухоли из клеток Лейдига и опухоли из клеток Сертоли; раковых заболеваний тимуса, например, тимом, карцином тимуса, болезни Ходжкина, неходжкинских лимфом, карциноидов или карциноидных опухолей; ректального рака и/или рака ободочной кишки.
В одном из вариантов осуществления, пациенты, которых можно лечить соединениями по настоящему изобретению, или фармацевтически приемлемыми солями, сложными эфирами, пролекарствами, сольватами, гидратами и производными указанных соединений, в соответствии со способами по настоящему изобретению, включают, например, пациентов, у которых было диагностировано наличие состояний, включающих, но не ограничивающихся этим, нейрому слухового нерва, аденокарциному, рак надпочечника, рак анального канала, ангиосаркому (например, лимфангиосаркому, лимфангиоэндотелиосаркому, гемангиосаркому), доброкачественную моноклональную гаммопатию, рак желчного пузыря (например, холангиосаркому), рак мочевого пузыря, рак груди (например, аденокарциному груди, папиллярную карциному груди, рак молочной железы, медуллярную карциному груди), рак мозга (например, менингиому; глиому, например, астроцитому, олигодендроглиому; медуллобластому), рак бронхов, рак шейки матки (например, аденокарциному шейки матки), хориокарциному, хордому, краниофарингиому, колоректальный рак (например, рак ободочной кишки, рак прямой кишки, колоректальную аденокарциному), эпителиальную карциному, эпендимому, эндотелиосаркому (например, саркому Капоши, множественную идиопатическую геморрагическую саркому), рак эндометрия, рак пищевода (например, аденокарциному пищевода, аденокарциному Барретта), саркому Эвинга, семейную гиперэозинофилию, рак желудка (например, аденокарциному желудка), гастроинтестинальную стромальную опухоль (GIST), раковые заболевания головы и шеи (например, плоскоклеточный рак головы и шеи, рак ротовой полости (например, плоскоклеточный рак ротовой полости (OSCC)), болезни тяжелых цепей (например, болезнь альфа цепей, болезнь гамма цепей, болезнь мю цепей), гемангиобластому, воспалительные миофибробластные опухоли, иммуноцитарный амилоидоз, рак почек (например, нефробластому, также именуемую опухолью Вилмса, почечно-клеточную карциному), рак печени (например, гепатоклеточный рак (HCC), злокачественную гепатому), рак легких (например, бронхогенную карциному, мелкоклеточный рак легких (SCLC), не мелкоклеточный рак легких (NSCLC), аденокарциному легких), лейкоз (например, острый лимфоцитарный лейкоз (ALL), который включает ALL линии B-клеток и ALL линии T-клеток, хронический лимфоцитарный лейкоз (CLL), пролимфоцитарный лейкоз (PLL), лейкоз ворсистых клеток (HLL) и макроглобулинемию Вальденстрема (WM); лимфомы периферических T-клеток (PTCL), T-клеточный лейкоз/лимфому взрослых (ATL), кожную T-клеточную лимфому (CTCL), лейкоз больших гранулярных лимфоцитов (LGF), болезнь Ходжкина и болезнь Рида-Штернберга; острый миелоцитарный лейкоз (AML), хронический миелоцитарный лейкоз (CML)), хронический лимфоцитарный лейкоз (CLL), лимфому (например, лимфому Ходжкина (HL), не ходжкинскую лимфому (NHL), фолликулярную лимфому, диффузную крупно B-клеточную лимфому (DLBCL), лимфому из клеток мантийной зоны (MCL)), лейомиосаркому (LMS), мастоцитоз (например, системный мастоцитоз), множественную миелому (MM), миелодиспластический синдром (MDS), мезотелиому, миелопролиферативные расстройства (MPD) (например, истинную полицитемию (PV), эссенциальный тромбоцитоз (ET), хронический миеломоноцитарный лейкоз (CMML), идеопатическую миелоидную метаплазию (AMM), именуемую также миелофиброзом (MF), хронический идиопатический миелофиброз, хронический миелоцитарный лейкоз (CML), хронический нейтрофильный лейкоз (CNL), гиперэозинофильный синдром (HES)), нейробластому, нейрофиброму (например, нейрофиброматоз (NF) типа 1 или типа 2, шванноматоз), нейроэндокринный рак (например, гастроэнтеропанкреатическую нейроэндокринную опухоль (GEP-NET), карциноидную опухоль), остеосаркому, рак яичников (например, цистаденокарциному, эмбриональную карциному яичников, аденокарциному яичников), болезнь Педжета вульвы, болезнь Педжета пениса, папиллярную аденокарциному, рак поджелудочной железы (например, аденокарциному поджелудочной железы, внутрипротоковую папиллярную муцинозную опухоль (IPMN)), пинеалому, примитивную нейроэктодермальную опухоль (PNT), рак простаты (например, аденокарциному простаты), рабдомиосаркому, ретинобластому, рак слюнной железы, рак кожи (например, плоскоклеточную карциному (SCC), кератоакантому (KA), меланому, базально-клеточный рак (BCC)), рак тонкого кишечника (например, рак аппендикса), саркому мягких тканей (например, злокачественную фиброзную гистоцитому (MFH), липосаркому, злокачественные опухоли оболочки периферических нервов (MPNST), хондросаркому, фибросаркому, миксосаркому), карциному сальной железы, карциному потовой железы, синовиому, рак яичек (например, семиному, эмбриональную карциному яичек), рак щитовидной железы (например, папиллярный рак щитовидной железы, папиллярную тиреоидную карциному (PTC), медуллярный рак щитовидной железы) и макроглобулинемию Вальденстрема.
В некоторых вариантах осуществления, изобретение относится к способам лечения гематологических злокачественных заболеваний у субъекта, включающим введение указанному субъекту терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли, сложного эфира, пролекарства, сольвата, гидрата или производного. В некоторых вариантах осуществления, гематологическое злокачественное заболевание представляет собой миелоидное злокачественное заболевание. Примеры миелоидных злокачественных заболеваний, которые можно лечить с применением соединений по настоящему изобретению, включают: лейкоз (например, острый миелоидный лейкоз (AML) или хронический миелоцитарный лейкоз (CML)); миелодиспластический синдром (MDS) (например, низкодифференцированный MDS или высокодифференцированный MDS); миелопролиферативную болезнь (MPD) (например, эссенциальный тромбоцитоз (ET), миелофиброз (MF), истинную полицитемию (PV) или хроническую миеломоноцитарную лейкемию (CMML)) и расстройства, связанные с мастоцитами.
В некоторых вариантах осуществления, гематологическое злокачественное заболевание представляет собой лимфоидное злокачественное заболевание, например, лимфому. Примеры лимфом, которые можно лечить с применением соединений по настоящему изобретению, включают лимфомы Ходжкина, не ходжкинские лимфомы (например, B-клеточные или T-клеточные), лейкозы (например, острый лимфоцитарный лейкоз (ALL) или хронический лимфоцитарный лейкоз (CLL)), а также посттрансплантационные лимфопролиферативные расстройства (PLD). Примеры B-клеточных лимфом включают: диффузную крупно B-клеточную лимфому (DLBCL), лимфому из клеток мантийной зоны и индолентную не ходжкинскую лимфому (iNHL). Примеры T-клеточных лимфом включают периферическую T-клеточную лимфому (PYCL) и кожную T-клеточную лимфому (CTCL). Примеры острых лимфоцитарных лейкозов (ALL) включают T-клеточные ALL и B-клеточные ALL. Примеры PLD включают множественную миелому, PLD Вальденстрема и амилоидное PLD.
В других вариантах осуществления, соединения и композиции по настоящему изобретению могут применяться для профилактики PI3K-опосредованных раковых заболеваний у субъектов, у которых имеются такие заболевания или есть риск возникновения опосредованных раковых заболеваний. В одном из вариантов осуществления, соединения и композиции по настоящему изобретению могут применяться в качестве химиопрофилактического агента, например, агента, который ингибирует, замедляет или обращает развитие PI3K-опосредованного ракового заболевания. Подобное действие соединений по настоящему изобретению подтверждается, по меньшей мере, частично, обширными исследованиями, демонстрирующими действие противовоспалительных агентов, например, ингибиторов COX-2, в качестве химиопрофилактических агентов, ослабляющих или подавляющих развитие рака, включая, в том числе, рак ободочной кишки. Поскольку как ингибиторы COX-2, так и ингибиторы PI3K обладают широким спектром противовоспалительной активности, ожидается, что ингибирование PI3K будет обладать химиопрофилактическим действием при ослаблении или подавлении развития ряда раковых заболеваний.
В некоторых вариантах осуществления, изобретение относится к способу лечения или профилактики обострения и/или рецидива PI3K-опосредованного рака (например, PI3K-опосредованного рака, описанного в настоящей заявке). Этот способ включает введение субъекту ингибитора PI3K, например, одного или нескольких ингибиторов PI3K, описанных в настоящей заявке, в количествах, достаточных для ослабления или подавления повторного роста или рецидива раковой опухоли у субъекта. В некоторых вариантах осуществления, субъект представляет собой пациента, которому проводится или проводилось противораковая терапия (например, лечение другими противораковыми агентами, хирургическое лечение и/или радиационное лечение). Ингибитор PI3K можно вводить до, одновременно или после другого противоракового лечения; или во время ремиссии ракового заболевания. Подавление обострения или ремиссии необязательно является полным, если лечение или профилактика задерживает (например, на неделю, месяц, год) начало обострения и/или рецидива, или ослабляет или замедляет повторный рост (например, по меньшей мере, примерно на 10%, примерно на 20%, примерно на 30%, примерно на 40%, примерно на 50% или более) PI3K-опосредованной раковой опухоли (например, по сравнению с субъектом, которому не вводили ингибитор PI3K).
Так, например, в одном из вариантов осуществления, в изобретении раскрыт способ увеличения продолжительности жизни без рецидивов у субъекта с раковым заболеванием, который получает или получал противораковое лечение, путем введения субъекту терапевтически эффективного количества ингибитора PI3K. «Продолжительность жизни без рецидивов», как известно специалисту в данной области техники, представляет собой период времени после определенного момента лечения рака, во время которого не наблюдается клинически определяемого рецидива рака. В некоторых вариантах осуществления, ингибитор PI3K вводят одновременно с противораковой терапией. В других вариантах осуществления, ингибитор PI3K вводят последовательно (в любом порядке) с противораковой терапией. В случае одновременного введения, можно продолжать введение ингибитора PI3K, после того, как прекращена противораковая терапия. В других вариантах осуществления, ингибитор PI3K вводят после того, как прекращена противораковая терапия (например, без периода, когда введение ингибитора PI3K и противораковую терапию осуществляют одновременно). Ингибитор PI3K можно вводить сразу же после прекращения противораковой терапии, или может существовать определенный промежуток времени (например, до нескольких часов, примерно день, примерно неделя, примерно месяц, примерно шесть месяцев или год) между завершением противораковой терапии и введением ингибитора PI3K. Лечение ингибитором PI3K можно продолжать, пока продолжается период без рецидивов (например, примерно до одного дня, примерно неделю, примерно месяц, примерно шесть месяцев, примерно год, примерно два года, примерно три года, примерно четыре года, примерно пять лет или более).
Кроме того, настоящее изобретение относится к способу лечения диабета у млекопитающего, включающему введение указанному млекопитающему терапевтически эффективного количества соединения по настоящему изобретению, или его фармацевтически приемлемой соли, сложного эфира, пролекарства, сольвата, гидрата или производного.
Кроме того, соединения по настоящему изобретению могут применяться для лечения акне. В некоторых вариантах осуществления, воспалительное состояние и/или иммунное расстройство является кожным состоянием. В некоторых вариантах осуществления, это кожное состояние представляет собой зуд (чесотку), псориаз, экзему, ожоги или дерматит. В некоторых вариантах осуществления, кожное состояние представляет собой псориаз. В некоторых вариантах осуществления, кожное состояние представляет собой зуд.
Помимо этого, соединения по настоящему изобретению могут применяться в лечении артериосклероза, включая атеросклероз. Артериосклероз является общим термином, описывающим любое уплотнение стенок средних или крупных артерий. Атеросклероз представляет собой уплотнение артерий именно из-за атеросклеротических бляшек.
В некоторых вариантах осуществления, изобретение относится к способу лечения сердечно-сосудистых заболеваний у субъекта, который включает введение указанному субъекту терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой формы (например, фармацевтически приемлемой соли, гидрата, сольвата, хелата, нековалентного комплекса, изомера, пролекарства и изотопно-меченого производного). Примеры сердечно-сосудистых состояний включают, не ограничиваясь этим, атеросклероз, рестеноз, окклюзию сосуда и обструктивную болезнь сонной артерии.
В некоторых вариантах осуществления, воспалительное расстройство и/или иммунное расстройство является желудочно-кишечным расстройством. В некоторых вариантах осуществления, желудочно-кишечное расстройство выбрано (например, из язвенных заболеваний желудка и двенадцатиперстной кишки, регионарного энтерита, дивертикулита, желудочно-кишечного кровотечения, эозинофильных желудочно-кишечных расстройств (например, эозинофильного эзофагита, эозинофильного гастрита, эозинофильного гастроэнтерита, эозинофильного колита), гастрита, диареи, гастроэзофагеального рефлюкса (GORD или синонима GERD), воспалительных болезней кишечника (IBD) (например, болезни Крона, язвенного колита, коллагенозного колита, лимфоцитарного колита, ишемического колита, колита отключенной кишки, синдрома Бехчета, недифференцированного колита) и воспалительного синдрома кишечника (IBS)). В некоторых вариантах осуществления, желудочно-кишечное расстройство является воспалительной болезнью кишечника (IBD).
Далее, соединение по настоящему изобретению или его фармацевтически приемлемая форма (например, фармацевтически приемлемая соль, гидрат, сольват, хелат, нековалентный комплекс, изомер, пролекарство и изотопно-меченое производное), могут применяться для лечения гломерулонефрита. Гломерулонефрит является первичным или вторичным аутоиммунным заболеванием почек, характеризующимся воспалением клубочков. Оно может быть бессимптомным или проявляться гематурией и/или протеинурией. Существует много известных типов гломерулонефрита, которые подразделяются на острые, подострые или хронические. Причины гломерулонефрита могут быть инфекционными (бактериальными, вирусными или паразитическими патогенами), аутоиммунными или паранеопластическими.
В некоторых вариантах осуществления, изобретение относится к соединениям или их фармацевтически приемлемым формам (например, фармацевтически приемлемым солям, гидратам, сольватам, хелатам, нековалентным комплексам, изомерам, пролекарствам и изотопно-меченым производным) или фармацевтическим композициям по настоящему изобретению для лечения полиорганной недостаточности. Кроме того, изобретение относится к соединениям или их фармацевтически приемлемым формам (например, фармацевтически приемлемым солям, гидратам, сольватам, хелатам, нековалентным комплексам, изомерам, пролекарствам и изотопно-меченым производным) или фармацевтическим композициям по настоящему изобретению для лечения заболеваний печени (включая диабет), заболеваний желчного пузыря (включая, камни желчного пузыря), панкреатита или почечных заболеваний (включая, пролиферативный гломерулонефрит и почечные заболевания, вызванные диабетом) или боли у субъекта.
В некоторых вариантах осуществления, изобретение относится к соединениям или их фармацевтически приемлемым формам (например, фармацевтически приемлемым солям, гидратам, сольватам, хелатам, нековалентным комплексам, изомерам, пролекарствам и изотопно-меченым производным) или фармацевтическим композициям по настоящему изобретению для профилактики имплантации бластоциты у субъекта.
В некоторых вариантах осуществления, изобретение относится к соединениям или их фармацевтически приемлемым формам (например, фармацевтически приемлемым солям, гидратам, сольватам, хелатам, нековалентным комплексам, изомерам, пролекарствам и изотопно-меченым производным), или фармацевтическим композициям по настоящему изобретению для лечения расстройств, включающих агрегацию тромбоцитов или адгезию тромбоцитов, включая, но не ограничиваясь этим, идиопатическую тромбоцитопеническую пурпуру, синдром Бернара-Сулье, тромбастению Гланцмана, синдром Скотта, болезнь фон Виллебранда, синдром Германски-Пудлака и синдром серых тромбоцитов.
В некоторых вариантах осуществления, соединения или их фармацевтически приемлемые формы (например, фармацевтически приемлемые соли, гидраты, сольваты, хелаты, нековалентные комплексы, изомеры, пролекарства и изотопно-меченые производные), или фармацевтические композиции по настоящему изобретению предназначены для лечения заболевания, которое представляет собой атрофию скелетных мышц, скелетную или мышечную гипертрофию. В некоторых вариантах осуществления, изобретение относится к соединениям или их фармацевтически приемлемым формам (например, фармацевтически приемлемым солям, гидратам, сольватам, хелатам, нековалентным комплексам, изомерам, пролекарствам и изотопно-меченым производным), или фармацевтическим композициям по настоящему изобретению для лечения расстройств, которые включают не ограничиваясь этим, раковые заболевания, указанные в настоящей заявке, расстройства, связанные с трансплантацией (например, уменьшение частоты отторжения, болезни трансплантат против хозяина и т.д.), мышечный склероз (MS), аллергические расстройства (например, артрит, аллергический энцефаломиелит) и другие расстройства, связанные с подавлением иммунитета, метаболические расстройства (например, диабет), сокращение утолщения интимы, вследствие сосудистого повреждения и болезни, обусловленные неправильно свернутыми белками (например, болезнь Альцгеймера, болезнь Гоше, болезнь Паркинсона, болезнь Хантингтона, кистозный фиброз, макулодистрофию, пигментную дистрофию сетчатки и прионовые расстройства) (поскольку ингибирование mTOR может облегчить действие агрегатов неправильно свернутых белков). Эти расстройства включают также синдромы гамартомы, например, туберозный склероз и болезнь Ковдена (которую также именуют синдромом Ковдена и синдромом полиморфной гамартомы).
В других вариантах осуществления, соединения по настоящему изобретению могут применяться для лечения бурсита, волчанки, острого рассеянного энцефаломиелита (ADEM), болезни Аддисона, антифосфолипидного синдрома (APS), апластической анемии, аутоиммунного гепатита, глютеновой болезни, болезни Крона, сахарного диабета (1 типа), синдрома Гудпасчера, болезни Гревса, синдрома Гийена-Барре (GBS), болезни Хашимото, воспалительной болезни кишечника, системной красной волчанки, миастении гравис, синдрома пляшущих глаз (опсо-миоклонального синдрома, OMS), неврита зрительного нерва, тиреоидита Орда, остеоартрита, увеоретинита, пузырчатки, полиартрита, первичного биллиарного цирроза, синдрома Рейтера, артериита Такаясу, темпорального артериита, тепловой аутоиммунной гемолитической анемии, гранулематоза Вегенера, общей алопеции, болезни Чагаса, синдрома хронической усталости, вегетативной дистонии, эндометриоза, гнойного гидраденита, интерстициального цистита, нейромиотонии, саркоидоза, склеродермии, язвенного колита, витилиго, вульводинии, аппендицита, артериита, артрита, блефарита, бронхиолита, бронхита, цервицита, холангита, холецистита, хориоамнионита, колита, конъюнктивита, цистита, дакриоаденита, дерматомиозита, эндокардита, эндометрита, энтерита, энтероколита, эпикондилита, эпидидимита, фасциита, фиброзита, гастрита, гастроэнтерита, гингивита, гепатита, гидраденита, илеита, ирита, ларингита, мастита, менингита, миелита, миокардита, миозита, нефрита, омфалита, оофорита, орхита, остеита, отита, панкреатита, паротита (свинки), перикардита, перитонита, фарингита, плеврита, флебита, пневмонита, проктита, простатита, пиелонефрита, ринита, сальпингита, синусита, стоматита, синовита, тендинита, тонзиллита, увеита, вагинита, васкулита или вульвита.
В других вариантах осуществления, соединения по настоящему изобретению могут применяться для лечения круглогодичного аллергического ринита, мезентерита, перитонита, акродерматита, ангиодерматита, атопического дерматита, контактного дерматита, экземы, мультиформной эритемы, интертриго, синдрома Стивенса-Джонсона, токсического эпидермального некролиза, кожной аллергии, тяжелой аллергической реакции/анафилаксии, аллергического гранулематоза, гранулематоза Вегенера, аллергического конъюнктивита, хориоретинита, конъюнктивита, инфекционного кератоконъюнктивита, кератоконъюнктивита, офтальмии новорожденных, трахомы, увеита, воспаления глаз, блефароконъюнктивита, мастита, гингивита, перикоронита, фарингита, ринофарингита, сиаладенита, воспаления скелетно-мышечной системы, болезни Стилла у взрослых, болезни Бехчета, бурсита, хондрокальциноза, дактилита, синдрома Фелти, подагры, инфекционного артрита, болезни Лайма, воспалительного остеоартрита, периартрита, синдрома Рейтера, вирусной инфекции реки Росс, синдрома острой дыхательной недостаточности, острого бронхита, острого синусита, аллергического ринита, астмы, тяжелой рефрактерной астмы, фарингита, плеврита, ринофарингита, сезонного аллергического ринита, синусита, астматического состояния, трахеобронхита, ринита, серозита, менингита, оптиконевромиелита, полиовирусной инфекции, синдрома Альпорта, баланита, эпидидимита, эпидидимоорхита, фокально-сегментального гломерулосклероза, гломерулонефрита, нефропатии IgA-типа (болезни Бергера), орхита, параметрита, воспалительных заболеваний органов таза, простатита, пиелита, пиелонефрита, гранулематоза Вегенера, гиперурикемии, аортита, артериита, хилоперикардита, синдрома Дресслера, эндартериита, эндокардита, экстракраниального темпорального артериита, артериитов, связанных с ВИЧ, интракраниального темпорального артериита, болезни Кавасаки, лимфангиофлебита, болезни Мондора, периартериита или перикардита.
В некоторых вариантах осуществления, соединения по настоящему изобретению применяются для лечения аутоиммунного гепатита, еюнита, мезентерита, мукозита, неалкогольного стеатогепатита, невирусного гепатита, аутоиммунного панкреатита, перигепатита, перитонита, воспаления илеоанального резервуара, проктита, псевдомембранозного колита, ректосигмоидита, сальпингоперитонита, сигмоидита, стеатогепатита, язвенного колита, синдрома Черджа-Штрауса, язвенного проктита, синдрома воспаленного кишечника, желудочно-кишечного воспаления, острого энтероколита, анусита, некроза Бальсера, холецистита, колита, болезни Крона, дивертикулита, энтерита, энтероколита, энтерогепатита, эозинофильного эзофагита, эзофагита, гастрита, геморрагического энтерита, гепатита, инфекции вируса гепатита, гепатохолангита, гипертрофического гастрита, илеита, илеоцекита, саркоидоза, воспалительной болезни кишечника, анкилозирующего спондилита, ревматоидного артрита, юношеского ревматоидного артрита, псориаза, псориатического артрита, волчанки (кожной/системной/волчаночного нефрита), СПИДа, агаммаглобулинемии, СПИД-ассоциированного комплекса, болезни Брутона, синдрома Чедиака-Хигаси, вариабельного неклассифицируемого иммунодефицита, синдрома ДиДжорджи, дисгаммаглобулинемии, иммуноглобулиновой недостаточности, синдрома Джоба, синдрома Незелофа, нарушения фагоцитарной и бактерицидной функции, синдрома Вискотта-Олдрича, асплении, элефантиаза (слоновой болезни), гиперспленизма, болезни Кавасаки, лимфаденопатии, лимфедемы, лимфоцеле, синдрома Нонне-Милроя-Мейджа, болезни селезенки, спленомегалии, тимомы, болезни тимуса, периваскулита, флебита, плевроперикардита, узелкового полиартериита, васкулита, артериита Такаясу, темпорального артериита, облитерирующего тромбангиита, тромбоэндокардита, тромбофлебита или COPD.
В некоторых вариантах осуществления, изобретение относится к способам лечения воспалительного или аутоиммунного заболевания у субъекта, включающему введение указанному субъекту терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли, сложного эфира, пролекарства, сольвата, гидрата или производного. В некоторых вариантах осуществления, воспалительное или аутоиммунное заболевание включает астму, ревматоидный артрит, болезнь Крона, волчанку и рассеянный склероз.
В некоторых вариантах осуществления, воспалительное или аутоиммунное заболевание включает: идиопатическую тромбоцитопеническую пурпуру; анемию, например, апластическую анемию; волчанку, например, кожную красную волчанку; и пузырчатку, например, буллезный пемфигоид с образованием пузырей на коже.
Кроме того, настоящее изобретение относится к способу лечения сердечно-сосудистого заболевания у млекопитающего, включающему введение указанному млекопитающему терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли, сложного эфира, пролекарства, сольвата, гидрата или производного. Примеры сердечно-сосудистых состояний включают, не ограничиваясь этим, атеросклероз, рестеноз, окклюзию (закупорку)сосуда и непроходимость сонной артерии.
В следующем варианте осуществления, изобретение относится к способам прекращения деятельности лейкоцитов или прекращения деятельности остеокластов. В одном из вариантов осуществления, способ включает приведение в контакт лейкоцита или остеокласта с соединением по настоящему изобретению в количестве, которое прерывает деятельность указанных клеток.
В еще одном варианте осуществления, изобретение относится к способам лечения глазных заболеваний путем введения соединения по настоящему изобретению или фармацевтической композиции по настоящему изобретению в глаз субъекта.
V. КОМБИНИРОВАННОЕ ЛЕЧЕНИЕ
Кроме того, настоящее изобретение относится к способам комбинированной терапии в которых агент, о котором известно, что он модулирует другие сигнальные пути или другие компоненты того же сигнального пути, или даже перекрывающиеся группы целевых ферментов, применяется в комбинации с соединением по настоящему изобретению или его фармацевтически приемлемой солью, сложным эфиром, пролекарством, сольватом, гидратом или производным. В одном из вариантов осуществления, такая терапия включает, не ограничиваясь этим, комбинацию соединения по настоящему изобретению с химиотерапевтическим агентом, терапевтическими антителами, и радиационным лечением, с целью достижения синергетического или аддитивного эффекта.
В одном из вариантов осуществления, соединения или фармацевтические композиции по настоящему изобретению могут обеспечивать синергетическую или аддитивную эффективность при введении в комбинации с агентами, которые ингибируют выработку или активность IgE. Такие комбинации могут уменьшать нежелательные эффекты от высоких уровней IgE, связанных с применением одного или нескольких ингибиторов PI3K-δ, если эти эффекты имеют место. В некоторых вариантах осуществления, это может быть особенно применимо при лечении аутоиммунных и воспалительных расстройств (AIID), например, ревматоидного артрита. Кроме того, не ограничиваясь какой-либо конкретной теорией, введение ингибиторов PI3K-δ или PI3K-δ/γ по настоящему изобретению в комбинации с ингибиторами mTOR, также может приводить к синергетическому действию за счет улучшения ингибирования сигнального пути PI3K.
В другом варианте осуществления, изобретение относится к комбинированному лечению заболевания, связанного с PI3K-δ, включающему введение субъекту ингибитора PI3K-δ и агента, который ингибирует выработку или активность IgE. Применимы другие типовые ингибиторы PI3K-δ, и они описаны, например, в патенте США № 6800620, включенном в настоящую заявку с помощью ссылки. В некоторых вариантах осуществления, такая комбинированное лечение применимо, в частности, для лечения аутоиммунных и воспалительных заболеваний (AIID), включая, но не ограничиваясь этим, ревматоидный артрит.
Агенты, которые ингибируют выработку IgE известны в технике, и они включают, не ограничиваясь этим, одно или несколько веществ из числа TEI-9874, 2-(4-(6-циклогексилокси-2-нафтилокси)фенилацетамид)бензойной кислоты, рапамицина, аналогов рапамицина (т.е. рапалогов), ингибиторов TORC1, ингибиторов TORC2, и любых других соединений, которые ингибируют mTORC1 и mTORC2. Агенты, которые ингибируют активность IgE, включают, например, антитела против IgE, как, например Омализумаб и TNX-901.
Для лечения аутоиммунных заболеваний, соединения или фармацевтические композиции по настоящему изобретению могут применяться в комбинации с обычно назначаемыми лекарственными средствами, включая, но не ограничиваясь этим, Enbrel®, Remicade®, Humira®, Avonex® и Rebif®. Для лечения респираторных заболеваний, соединения или фармацевтические композиции по настоящему изобретению могут вводиться в комбинации с обычно назначаемыми лекарственными средствами, включая, но не ограничиваясь этим, Xolair®, Advair®, Singulair® и Spiriva®.
В одном из вариантов осуществления, соединения по настоящему изобретению можно включать в один препарат или вводить в сочетании с другими агентами, которые способны облегчить симптомы воспалительных состояний, например, энцефаломиелита, астмы и других заболеваний, описанных в настоящей заявке. Эти агенты включают, не ограничиваясь перечисленными, нестероидные противовоспалительные средства (NSAID), например, ацетилсалициловую кислоту; ибупрофен; напроксен; индометацин; набуметон; и толметин. В некоторых вариантах осуществления, кортикостероиды применяются для уменьшения воспаления и подавления активности иммунной системы. Например, одним из обычно назначаемых препаратов подобного типа является преднизон. Хлорохин (Aralen®) или гидроксихлорохин (Plaquenil®) могут оказаться очень полезными для некоторых индивидуумов с волчанкой. Их очень часто назначают для лечения кожных и суставных симптомов волчанки. Азатиоприн (Imuran) и циклофосфамид (CYTOXANTM) подавляют воспаление, и обычно подавляют иммунную систему. Другие агенты, например, метотрексат и циклоспорин могут применяться для борьбы с симптомами волчанки. Антикоагулянты применяют для предотвращения быстрого свертывания крови. Антикоагулянты включают широкий круг средств, например, от аспирина в очень низких дозах, который препятствует склеиванию тромбоцитов, до гепарина/комадина. Другие соединения, применяемые при лечении волчанки, включают белимумаб (Benlysta®).
В другом варианте осуществления, изобретение относится к фармацевтической композиции, предназначенной для ингибирования аномального роста клеток у млекопитающих, включающей определенное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли, сложного эфира, пролекарства, сольвата, гидрата или производного, в комбинации с подходящим количеством противоракового агента (например, биотерапевтического или химиотерапевтического агента). В настоящее время в технике известно большое количество химиотерапевтических средств, и их можно применять в комбинации с соединениями по настоящему изобретению. Другие способы лечения рака, которые также могут применяться в комбинации с соединениями по настоящему изобретению, включают, не ограничиваясь этим, хирургию, хирургическое вмешательство и радиационное лечение.
В некоторых вариантах осуществления, химиотерапевтический агент выбран из группы, состоящей из ингибиторов митоза, алкилирующих агентов, антиметаболитов, интеркалирующих антибиотиков, ингибиторов фактора роста, ингибиторов клеточного цикла, ферментов, ингибиторов топоизомеразы, модификаторов биологической реакции, антигормонов, ингибиторов ангиогенеза и анти-андрогенов. Не ограничивающие примеры противораковых агентов включают, например, химиотерапевтические агенты, цитотоксичные агенты, непептидные малые молекулы, например, Gleevec® (иматиниба мезилат), Velcade® (бортезомиб), CASODEXTM (бикалютамид), IressaTM (гефитиниб) и адриамицин, а также большое число химиотерапевтических агентов. Не ограничивающие примеры химиотерапевтических агентов включают, например, алкилирующие агенты, такие как тиотепа и циклофосфамид (CYTOXANTM); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метилмеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфаорамид и триметилоломеламин; азотистые иприты, например, хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, меклоретамин, меклоретамина оксида гидрохлорид, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урацил иприт; нитрозмочевины, такие как кармустин, хлорзотоцин, фотемустин, ломустин, нимустин, ранимустин; антибиотики, например, аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, калихеамицин, карабицин, кариномицин, карзинофилин, CASODEXTM, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин, эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, микофеноловую кислоту, ногаламицин, оливомицины, пепломицин, порфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; препараты, угнетающие функцию надпочечников, такие как аминоглутетимид, митотан, трилостан; средства, восполняющие фолиевую кислоту, такие как фролиновая кислота; ацеглатон; альдофосфамида гликозид; аминолевулиновую кислоту; амсакрин; бестрабуцил; бизантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элфомитин; эллиптиния ацетат; этоглюцид; нитрат галлия; гидроксимочевину; лентинан; лонидамин; митогуазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; подофилиновую кислоту; 2-этилгидразид; прокарбазин; PSK.RTM; разоксан; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2’,2”-трихлортриэтиламин; уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид (“Ara-C”); циклофосфамид; тиотепу; таксаны, например, паклитаксел (TAXOLTM, Bristol-Myers Squibb Oncology, Princeton, N.J.) и доцетаксел (TAXOTERE®, Rhone-Poulenc Rorer, Antony, France); ретиноевую кислоту; эсперамицины; а также капецитабин; и фармацевтически приемлемые соли, сольваты или производные любых из перечисленных препаратов. Кроме того, подходящими химиотерапевтическими средствами, нормализующими деятельность клеток, являются антигормональные агенты, которые регулируют или ингибируют действие гормонов на опухоли, например, антиэстрогены, в т.ч. например, тамоксифен (NovaldexTM), ралоксифен, 4(5)-имидазолы, ингибирующие ароматазу, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY 117018, онапристон и торемифен (фарестон); и антиандрогены, такие как флутамид, нилутамид, бикалутамид, леупролид и госерелин; хлорамбуцил; гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; производные платины, такие как цисплатин и карбоплатин; винбластин; платина; этопозид (VP-16); ифосфамид; митомицин C; митоксантрон; винкристин; винорелбин; навелбин; новантрон; тенипозид; дауномицин; аминоптерин; Xeloda®; ибандронат; камптотецин-11 (CPT-11); ингибитор топоизомеразы RFS 2000; и дифторметилорнитин (DMFO). В некоторых вариантах осуществления, соединения или фармацевтические композиции по настоящему изобретению могут применяться в комбинации с обычно назначаемыми противораковыми препаратами, такими как, например, Herceptin®, Avastin®, Erbitux®, Rituxan®, Taxol®, Arimidex®, Taxotere® и Velcade®.
Не ограничивающими примерами являются химиотерапевтические агенты, цитотоксические агенты и непептидные малые молекулы, в том числе ABVD, авицин, абаговомаб, акридина карбоксамид, адекатумумаб, 17-N-аллиламино-17-деметоксигелданамицин, альфарадин, альвоцидиб, 3-аминопиридин-2-карбоксальдегид тиосемикарбазон, амонафид, антрацендион, анти-CD22 иммунотоксины, антинеопластик, антитуморогенные травы, Apaziquone®, атипримод, азатиоприн, белотекан, бендамустин, BIBW 2992, бирикодар, бросталлицин, бриостатин, бутионина сульфоксимин, CBV (химиотерапия), каликулин, кризотиниб, неспецифические антинеопластические агенты клеточного цикла, дихлоруксусная кислота, дискодермолид, элсамитруцин, эноцитабин, эпотилон, эрибулин, эверолимус, экзатекан, экзисулинид, ферругинол, фородезин, фосфестрол, химиотерапевтическая схема лечения ICE, IT-101, имексон, имиквимод, индолокарбазол, ирофульвен, ланиквидар, ларотаксел, леналидомид, лукантон, луртотекан, мафосфамид, митозоломид, нафоксидин, недаплатин, олапариб, ортатаксел, PAC-1, паупау, пиксантрон, ингибитор протеасомы, ребеккамицин, резиквимод, рубитекан, SN-38, салиноспорамид A, сапацитабин, стэнфорд V, сваинсонин, талапорфин, тариквидар, тегафур-урацил, Temodar®, тезетаксел, триплатина тетранитрат, трис(2-хлорэтил)амин, троксацитабин, урамустин, вадимезан, винфлунин, ZD6126 и зосуквидар.
В некоторых вариантах осуществления, химиотерапевтические средства выбраны из ингибиторов сигнального пути «хеджехог» (hedgehog), включая, но не ограничиваясь этим, IPI-926 (смотрите патент США 7812164). Другие подходящие ингибиторы сигнального пути хеджехог включают, например, описанные и раскрытые в патенте США 7230004, опубликованной заявке на патент США № US 2008/0293754, опубликованной заявке на патент США № US 2008/0287420 и опубликованной заявке на патент США № US 2008/0293755, содержание которых включено в настоящую заявку посредством ссылки в полном объеме. Примеры других подходящих ингибиторов сигнального пути хеджехог включают ингибиторы, описанные в опубликованных заявках на патент США №№ US 2002/0006931, US 2007/0021493 и US 2007/0060546, а также в опубликованных международных заявках №№ WO 2001/19800, WO 2001/26644, WO 2001/27135, WO 2001/49279, WO 2001/74344, WO 2003/011219, WO 2003/088970, WO 2004/020599, WO 2005/013800, WO 2005/033288, WO 2005/032343, WO 2005/042700, WO 2006/028958, WO 2006/050351, WO 2006/078283, WO 2007/054623, WO 2007/059157, WO 2007/120827, WO 2007/131201, WO 2008/070357, WO 2008/110611, WO 2008/112913 и WO 2008/131354. Дополнительные примеры ингибиторов сигнального пути хеджехог включают, не ограничиваясь этим, GDC-0449 (известный также как RG3616 или висмодегиб), описанный, например, в Von Hoff D. et al., N. Engl. J. Med. 2009; 361(12):1164-72; Robarge K.D. et al., Bioorg Med Chem Lett. 2009; 19(19):5576-81; Yauch, R. L. et al. (2009) Science 326: 572-574; Sciencexpress: 1-3 (10.1126/science.1179386); Rudin, C. et al. (2009) New England J of Medicine 361-366 (10.1056/nejma0902903); BMS-833923 (известный также, как XL139), описанный, например, в Siu L. et al., J. Clin.Oncol. 2010; 28:15s (suppl; abstr 2501); и National Institute of Health Clinical Trial Identifier No NCT006701891; LDE-225, описанный, например, в Pan S et al., ACS Med. Chem. Lett., 2010; 1(3): 130-134; LEQ-506, описанный, например, в National Institute of Health Clinical Trial Identifier No NCT01106508; PF-04449913, описанный, например, в National Institute of Health Clinical Trial Identifier No NCT00953758; антагонисты сигнального пути хеджехог, раскрытые в опубликованной заявке на патент США № US 2010/0286114; SMOi2-17, описанный, например, в опубликованной заявке на патент США № US 2010/0093625; SANT-1 и SANT-2, описанные, например, в Rominger C. M. et al., J. Pharmacol. Exp. Ther. 2009; 329(3):995-1005; 1-пиперазинил-4-арилфталазины или их аналоги, описанные в Lucas B. S. et al., Bioorg. Med. Chem. Lett. 2010; 20(12):3618-22.
Другие химиотерапевтические агенты включают, не ограничиваясь этим, анти-эстрогены (например, тамоксифен, ралоксифен и мегестрол), агонисты LHRH (например, госкрилин и леупролид), анти-андрогены (например, флутамид и бикалутамид), средства для фотодинамической терапии (например, вертопорфин (BPD-MA), фталоцианин, фотосенсибилизатор Pc4 и деметокси-гипокреллин A (2BA-2-DMHA)), азотистые иприты (например, циклофосфамид, ифосфамид, трофосфамид, хлорамбуцил, эстрамустин и мелфалан), нитрозомочевины (например, кармустин (BCNU) и ломустин (CCNU)), алкилсульфонаты (например, бусульфан и треосульфан), триазены (например, дакарбазин, темозоломид) платиносодержащие соединения (например, цисплатин, карбоплатин, оксалиплатин), алкалоиды барвинка (например, винкристин, винбластин, виндезин и винорелбин), таксоиды (например, паклитаксел или эквивалент паклитаксела, например, паклитаксел, связанный наночастицами альбумина (абраксан), паклитаксел, связанный докозагексаеновой кислотой (DHA-паклитаксел, Taxoprexin®), паклитаксел, связанный полиглутаматом (PG-паклитаксел, паклитаксел полиглумекс, CT-2103, XYOTAXTM), пролекарство, активируемое опухолью (TAP) ANG 1005 (ангиопеп-2, связанный с тремя молекулами паклитаксела), паклитаксел-EC-1 (паклитаксел, связанный с erbB2-распознающим пептидом EC-1) и паклитаксел, конъюгированный с глюкозой, например, 2’-паклитаксел метил 2-глюкопиранозил сукцинат; доцетаксел, таксол), эпиподофиллины (например, этопозид, этопозида фосфат, тенипозид, топотекан, 9-аминокамптотецин, камптоиринотекан, иринотекан, криснатол, митомицин C), антиметаболиты, ингибиторы DHFR (например, метотрексат, дихлорметатрексат, триметрексат, эдатрексат), ингибиторы IMP дегидрогеназы (например, микофеноловую кислоту, тиазофурин, рибавирин и EICAR), ингибиторы рибонуклеотид редуктазы (например, гидроксимочевину и дефероксамин), аналоги урацила (например, 5-фторурацил (5-FU), флоксуридин, доксифлуридин, ратитрексед, тегафур-урацил, капецитабин), аналоги цитозина (например, цитарабин (ara C), цитозина арабинозид и флударабин), аналоги пурина (например, меркаптопурин и тиогуанин), аналоги витамина D3 (например, EB 1089, CB 1093 и KH 1060), ингибиторы изопренилирования (например, ловастатин), дофаминергические нейротоксины (например, ион 1-метил-4-фенилпиридиния), ингибиторы клеточного цикла (например, стауроспорин), актиномицин (например, актиномицин D, дактиномицин), блеомицин (например, блеомицин A2, блеомицин B2, пепломицин), антрациклины (например, даунорубицин, доксорубицин, ПЭГилированный липосомальный доксорубицин, идарубицин, эпирубицин, пирарубицин, зорубицин, митоксантрон), ингибиторы MDR (например, верапамил), ингибиторы Ca2+ ATPазы (например, тапсигаргин), иматиниб, талидомид, леналидомид, ингибиторы тирозинкиназы (например, акситиниб (AG013736), босутиниб (SKI-606), седираниб (RECENTINTM, AZD2171), дасатиниб (SPRYCEL®, BMS-354825), эрлотиниб (TARCEVA®), гефтиниб (IRESSA®), иматиниб (Gleevec®, CGP57148B, STI-571), лапатиниб (TYKERB®, TYVERB®), лестауртиниб (CEP-701), нератиниб (HKI-272), нилотиниб (TASIGNA®), семаксаниб (семаксиниб, SU5416), сунитиниб (SUTENT®, SU11248), тоцераниб (PALLADIA®), вандетаниб (ZACTIMA®, ZD6474), ваталаниб (PTK787, PTK/ZK), трастузумаб (HERCEPTIN®), бевацизумаб (AVASTIN®), ритуксимаб (RITUXAN®), цетуксимаб (ERBITUX®), панитумумаб (VECTIBIX®), ранибизумаб (Lucentis®), нилотиниб (TASIGNA®), сорафениб (NEXAVAR®), эверолимус (AFINITOR®), алемтузумаб (CAMPATH®), гемтузумаб озогамицин (MYLOTARG®), темсиролимус (TORISEL®), ENMD-2076, PCI-32765, AC220, довитиниба лактат (TKI258, CHIR-258), BIBW2992 (TOVOKTM), SGX523, PF-04217903, PF-02341066, PF-299804, BMS-777607, ABT-869, MP470, BIBF 1120 (VARGATEF®), AP24534, JNJ-26483327, MGCD265, DCC-2036, BMS-690154, CEP-11981, тивозаниб (AV-951), OSI-930, MM-121, XL-184, XL-647 и/или XL228), ингибиторы протеасомы (например, бортезомиб (Velcade®), ингибиторы mTOR (например, рапамицин, темсиролимус (CCI-779), эверолимус (RAD-001), ридафоролимус, AP23573 (Ariad), AZD8055 (AstraZeneca), BEZ235 (Novartis), BGT226 (Novartis), XL765 (Sanofi Aventis), PF-4691502 (Pfizer), GDC0980 (Genentech), SF1126 (Semafoe) и OSI-027 (OSI)), облимерсен, гемцитабин, карминомицин, лейковорин, пеметрексед, циклофосфамид, дакарбазин, прокарбазин, преднизолон, дексаметазон, кампатецин, пликамицин, аспарагиназу, аминоптерин, метоптерин, порфиромицин, мелфалан, лейрозидин, лейрозин, хлорамбуцил, трабектидин, прокарбазин, дискодермолид, карминомицин, аминоптерин и гексаметил меламин.
Примеры биотерапевтических агентов включают, не ограничиваясь этим, интерфероны, цитокины (например, факторы некроза опухолей, интерферон α, интерферон γ), вакцины, гематопоэтические факторы роста, средства моноклональной сывороточной терапии, иммуностимуляторы и/или иммуномодулирующие агенты (например, IL-1, 2, 4, 6 или 12), факторы роста иммунных клеток (например, GM-CSF) и антитела (например, Herceptin® (трастузумаб), T-DM1, AVASTIN® (бевацизумаб), ERBITUX® (цетуксимаб), Vectibix® (панитумумаб), Rituxan® (ритуксимаб) и Bexxar® (тоситумомаб)).
В некоторых вариантах осуществления, химиотерапевтическое средство выбрано из ингибиторов HSP90. Ингибитор HSP90 может являться производным гелданамицина, например, бензохинон- или гидрохинонансамициновым ингибитором HSP90 (например, IPI-493 и/или IPI-504). Не ограничивающие примеры ингибиторов HSP90 включают IPI-493, IPI-504, 17-AAG (известный также как танеспимицин или CNF-1010), BIIB-021 (CNF-2024), BIIB-028, AUY-922 (известный также как VER-49009), SNX-5422, STA-9090, AT-13387, XL-888, MPC-3100, CU-0305, 17-DMAG, CNF-1010, макбецин (например, макбецин I, макбецин II), CCT-018159, CCT-129397, PU-H71 или PF-04928473 (SNX-2112).
В некоторых вариантах осуществления, химиотерапевтическое средство выбрано из ингибиторов PI3K (например, включая те ингибиторы PI3K, которые раскрыты в настоящей заявке, и те ингибиторы PI3K, которые не раскрыты в настоящей заявке). В некоторых вариантах осуществления, ингибитор PI3K представляет собой ингибитор дельта и гамма изоформ PI3K. В некоторых вариантах осуществления, ингибитор PI3K представляет собой ингибитор альфа изоформ PI3K. В других вариантах осуществления, ингибитор PI3K представляет собой ингибитор одной или нескольких изоформ из числа альфа, бета, дельта и гамма изоформ PI3K. Примеры ингибиторов PI3K, которые могут применяться в комбинации, описаны, например, в WO 09/088990, WO 09/088086, WO 2011/008302, WO 2010/036380, WO 2010/006086, WO 09/114870, WO 05/113556; US 2009/0312310 и US 2011/0046165. Дополнительные ингибиторы PI3K, которые могут применяться в комбинации с фармацевтическими композициями по настоящему изобретению, включают, не ограничиваясь этим, GSK 2126458, GDC-0980, GDC-0941, Sanofi XL147, XL756, XL147, PF-46915032, BKM 120, CAL-101, CAL 263, SF1126, PX-886 и двойной ингибитор PI3K (например, Novartis BEZ235). В одном из вариантов осуществления, ингибитор PI3K представляет собой изохинолинон.
Кроме того, изобретение относится к способу применения соединений по настоящему изобретению или их фармацевтически приемлемых форм (например, фармацевтически приемлемых солей, гидратов, сольватов, хелатов, нековалентных комплексов, изомеров, пролекарств и изотопно-меченых производных), или фармацевтических композиций по настоящему изобретению в комбинации с радиационной терапией при подавлении аномального роста клеток или лечении гиперпролиферативных расстройств у млекопитающих. Методики проведения радиационной терапии известны в технике и эти методики могут применяться в комбинированной терапии, описанной в настоящей заявке. При осуществлении этой комбинированной терапии, соединения по настоящему изобретению могут вводиться, как описано в заявке.
В одном из вариантов осуществления, радиационную терапию можно осуществлять одним или несколькими способами, или комбинацией способов, включая, но не ограничиваясь этим, радиационную терапию с внешним источником излучения, радиационную терапию с внутренним источником излучения, радиационную терапию с имплантированным источником излучения, стереотаксическую радиационную хирургию, системную радиационную терапию, радиотерапию и постоянную или временную интерстициальную брахитерапию. Термин «брахитерапия» в настоящем описании относится к радиационной терапии, осуществляемой путем помещения в организм, в опухоль или вблизи от нее, или вместо другой пролиферативной болезни ткани, пространственно ограниченного радиоактивного материала. Считается, что указанный термин включает, не ограничиваясь этим, действие радиоактивных изотопов (например, At-211, I-131, I-125, Y-90, Re-186, Re-188, Sm-153, Bi-212, P-32 и радиоактивных изотопов Lu). Подходящие источники радиации для применения в качестве средства приведения клеток в нормальное состояние по настоящему изобретению, включают как твердые, так и жидкие источники. В качестве неограничивающего примера, источником излучения может являться радионуклид, например, I-125, I-131, Yb-169 или Ir-192 в качестве твердых источников, I-125 в качестве твердого источника, или другие радионуклиды, которые испускают протоны, бета-частицы, гамма-излучение или другие радиоактивные лучи. Радиоактивный материал может также являться жидкостью, изготовленной из любого раствора радионуклида (радионуклидов), например, раствора I-125 или I-131, или радиоактивной жидкостью, которую можно получать с использованием суспензии подходящего текучего препарата, содержащего мелкие частицы твердых радионуклидов, например, Au-198 или Y-90. Кроме того, радионуклид (радионуклиды) может быть заключен в гель или радиоактивные микросферы.
Не ограничиваясь какой-либо конкретной теорией, соединения по настоящему изобретению могут делать аномальные клетки более чувствительными к действию радиации, облегчая уничтожение и/или подавление роста таких клеток. Соответственно, настоящее изобретение относится к способу сенсибилизации аномальных клеток у млекопитающих к лечению радиацией, который включает введение млекопитающему подходящего количества соединения по настоящему изобретению или его фармацевтически приемлемой соли, сложного эфира, пролекарства, сольвата, гидрата или производного, где указанное количество эффективно для придания аномальным клеткам чувствительности к лечению радиацией. Количество соединения, соли или сольвата в этом способе можно установить согласно способам определения эффективных количеств таких соединений, описанных в настоящей заявке.
В одном из вариантов осуществления, соединения или фармацевтические композиции по настоящему изобретению могут применяться в комбинации с подходящими количествами одного или нескольких соединений, выбранных их анти-ангиогенных средств, ингибиторов сигнальной трансдукции, антипролиферативных агентов, ингибиторов гликолиза или ингибиторов аутофагии.
В одном из вариантов осуществления, в комбинации с соединениями по настоящему изобретению или описанными в заявке фармацевтическими композициями могут применяться средства против ангиогенеза, например, ингибиторы MMP-2 (матриксной металлопротеиназы 2), ингибиторы MMP-9 (матриксной металлопротеиназы 9) и ингибиторы COX-II (циклооксигеназы II). Примеры подходящих ингибиторов COX-II включают Celebrex® (алекоксиб), вальдекоксиб и рофекоксиб. Примеры подходящих ингибиторов матриксной металлопротеиназы описаны, например, в WO 96/33172, WO 96/27583, европейской патентной заявке №97304971.1, европейской патентной заявке № 99308617.2, WO 98/07697, WO98/03516, WO 98/34918, WO 98/34915, WO 98/33768, WO 98/30566, европейской патентной публикации 606046, европейской патентной публикации 931788, WO 90/05719, WO 99/52910, WO 99/52889, WO 99/29667, международной заявке PCT № PCT/IB98/01113, европейской патентной заявке № 99302232.1, патентной заявке Великобритании № 9912961.1, патенте США № 7030242, патенте США № 5863949, патенте США № 5861510 и европейской патентной публикации 780386, где все указанные источники включены в настоящую заявку посредством ссылок в полном объеме. В одном из вариантов осуществления, ингибиторы MMP-2 и MMP-9 представляют собой такие соединения, которые обладают небольшой или вообще не обладают способностью ингибировать MMP-1, или такие соединения, которые селективно ингибируют MMP-2 и/или MMP-9 по отношению к другим матриксным металлопротеиназам (т.е. MMP-1, MMP-3, MMP-4, MMP-5, MMP-6, MMP-7, MMP-8, MMP-10, MMP-11, MMP-12 и MMP-13). Некоторыми не ограничивающими примерами ингибиторов MMP, применимых в настоящем изобретении, являются AG-3340, RO 32-3555 и RS 13-0830.
Ингибиторы аутофагии включают, не ограничиваясь этим, хлороквин, 3-метиладенин, гидроксихлороквин (PlaquenilTM), бафиломицин A1, 5-амино-4-имидазол карбоксамид рибозид (AICAR), окадиаковую кислоту, токсины водорослей, подавляющие аутофагию, которые ингибируют протеин фосфатазы типа 2A или типа 1, аналоги cAMP и препараты, которые повышают уровни cAMP, такие как аденозин, LY204002, N6-меркаптопурин рибозид и винбластин. Кроме того, может применяться антисмысловая или siRNA, которая ингибирует экспрессию белков, в т.ч. но не ограничиваясь этим, белка ATG5 (которые вовлечены в аутофагию).
Кроме того, настоящее изобретение относится к способу лечения сердечно-сосудистых расстройств у млекопитающего, а также к фармацевтической композиции для такого лечения, включающей подходящее количество соединения по настоящему изобретению или его фармацевтически приемлемой соли, сложного эфира, пролекарства, сольвата, гидрата или производного, а также подходящее количество одного или нескольких вторых терапевтических агентов, применимых для лечения сердечно-сосудистого расстройства.
Примеры вторых терапевтических агентов для лечения сердечно-сосудистых заболеваний включают, не ограничиваясь этим, антитромботические средства, например, простациклин и салицилаты, тромболитические средства, например, стрептокиназу, урокиназу, тканевый активатор плазминогена (TPA) и анизолированный активаторный комплекс плазминоген-стрептокиназа (APSAC), антитромбоцитарные средства, например, ацетилсалициловую кислоту (ASA) и клопидрогел, сосудорасширяющие агенты, например, нитраты, средства, блокирующие кальциевый канал, антипролиферативные агенты, например, колхицин и алкилирующие агенты, интеркалирующие агенты, факторы, модулирующие рост, например, интерлейкины, трансформирующий фактор роста бета и аналоги тромбоцитарного фактора роста, моноклональные антитела, направленные против факторов роста, противовоспалительные агенты, как стероидной, так и нестероидной природы, а также другие агенты, которые могут модулировать тонус сосудов, деятельность сосудов, артериосклероз и улучшать реакцию на поражение сосуда или органа при хирургическом вмешательстве. В одном из вариантов осуществления, для реализации направленной доставки терапевтического средства в стенку сосуда, может применяться покрытие. В одном из вариантов осуществления, в комбинации или покрытия по настоящему изобретению можно также включать антибиотики. В одном из вариантов осуществления, при включении действующего агента в набухающий полимер, действующий агент может высвобождаться при набухании полимера.
В одном из вариантов осуществления, соединения по настоящему изобретению могут быть включены в один состав или вводиться в сочетании с жидкими или твердыми средствами для образования барьеров между тканями, известными также как противоспаечные барьеры. Примеры противоспаечных барьеров включают, не ограничиваясь этим, полисахариды, полигликаны, сепрафильм, интерсид и гиалуроновую кислоту.
В одном из вариантов осуществления, лекарственные средства, которые можно вводить в сочетании с соединениями, описанными в настоящей заявке, включают подходящие лекарственные средства, которые можно доставлять ингаляцией, например, аналгетики, такие как кодеин, дигидроморфин, эрготамин, фентанил или морфин; стенокардические препараты, например, дилтиазем; антиаллергические средства, например, кромогликат, кетотифен или недокромил; антиинфекционные средства, например, цефалоспорины, пенициллины, стрептомицин, сульфонамиды, тетрациклины или пентамидин; антигистаминные средства, например, метапирилен; противовоспалительные средства, например, беклометазон, флунизолид, будесонид, типредан, триамцинолона ацетонид или флутиказон; средства против кашля, например, носкапин; бронхорасширяющие средства, например, эфедрин, адреналин, фенотерол, формотерол, изопреналин, метапротеренол, фенилэприн, фенилпропаноамин, пирбутерол, репротерол, римитерол, сальбутамол, сальметерол, тербуталин, изоэтарин, тулобутерол, орципреналин или (-)-4-амино-3,5-дихлор-α-[[[6-[2-(2-пиридинил)этокси]гексил]амино]метил]бензолметанол; диуретики, например, амилорид; антихолинергические средства, например, ипратропий, атропин или окситропий; гормоны, например, кортизон, гидрокортизон или преднизолон; ксантины, например, аминофилин, холина теофиллинат, лизина теофиллинат или теофиллин; и терапевтические белки и пептиды, например, инсулин или глюкагон. В одном из вариантов осуществления, специалисту в данной области техники должно быть ясно, что, когда это целесообразно, лекарственные средства можно применять в форме солей (например, солей щелочных металлов или солей аминов, или кислотно-аддитивных солей), в форме сложных эфиров (например, сложных эфиров с низшими алкильными заместителями) или в форме сольватов (например, гидратов) для оптимизации активности и/или стабильности лекарственного средства.
Другие примеры терапевтических агентов, применимых для комбинированной терапии, включают, не ограничиваясь этим, агенты, описанные в настоящей заявке, радиационную терапию, антагонисты гормонов, гормоны и их рилизинг-факторы, тиреоидные и антитиреоидные препараты, эстрогены и прогестины, андрогены, адренокортикотропный гормон; стероиды надпочечников и их синтетические аналоги; ингибиторы синтеза и действия гормонов надпочечников, инсулин, пероральные гипогликемические агенты, и эндокринные продукты поджелудочной железы, агенты, влияющие на кальцификацию и ремоделирование костей: кальций, фосфаты, паратиреоидный гормон, витамин D, кальцитонин, витамины, например, водорастворимые витамины, комплекс витаминов B, аскорбиновую кислоту, жирорастворимые витамины, витамин A, K и E, факторы роста, цитокины, хемокины, агонисты и антагонисты мускаринового рецептора; средства против холинэстеразы; средства, действующие в местах нервно-мышечного контакта и/или автономных ганглиях; катехоламины, симпатомиметики и агонисты или антагонисты адренергического рецептора; и агонисты и антагонисты рецептора 5-гидрокситриптамина (5-HT, серотонина).
В одном из вариантов осуществления, терапевтические агенты могут также включать один или несколько агентов для борьбы с болью и воспалением, например, гистамин и антагонисты гистамина, брадикинин и антагонисты брадикинина, 5-гидрокситриптамин (серотонин), липидные соединения, которые образуются при биологическом превращении продуктов селективного гидролиза мембранных фосфолипидов, эйкозаноиды, простагландины, тромбоксаны, лейкотриены, аспирин, нестероидные противовоспалительные агенты, аналгетические и жаропонижающие агенты, агенты, ингибирующие синтез простагландинов и тромбоксанов, селективные ингибиторы индуцибельной циклооксигеназы, селективные ингибиторы индуцибельной циклооксигеназы-2, аутакоиды, паракринные гормоны, соматостатин, гастрин, цитокины, которые опосредуют взаимодействия, вовлеченные в гуморальный и клеточный иммунный ответ, аутакоиды жирового происхождения, эйкозаноиды, β-адренергические агонисты, ипратропий, глюкокортикоиды, метилксантины, блокаторы натриевых каналов, агонисты опиоидного рецептора, блокаторы кальциевого канала, стабилизаторы мембраны и ингибиторы лейкотриена.
В одном из вариантов осуществления, дополнительные терапевтические агенты, применение которых предполагается в настоящем изобретении, включают диуретики, вазопрессин, агенты, влияющие на консервацию воды в почках, реннин, ангиотензин, агенты, применимые для лечения ишемии миокарда, средства против гипертонии, ингибиторы ангиотензин-превращающего фермента, антагонисты β-адренергического рецептора, агенты для лечения гиперхолестеринемии и агенты для лечения дислипидемии.
В одном из вариантов осуществления, другие терапевтические агенты, применение которых предполагается в настоящем изобретении, включают препараты для регулирования кислотности в желудке, агенты для лечения пептических язв, агенты для лечения гастроэзофагеального рефлюкса, прокинетические агенты, противорвотные средства, агенты, применяемые при синдроме раздраженного кишечника, средства, применяемые при диарее, средства, применяемые при запоре, средства, применяемые при воспалительной болезни кишечника, средства, применяемые при болезнях печени и желчного пузыря, средства, применяемые при заболеваниях поджелудочной железы, терапевтические средства, применяемые для лечения протозойных инфекций, препараты, применяемые при лечении малярии, амебиаза, лямблиоза, трихомониаза, трипаносомоза и/или лейшманиоза, и/или лекарственных средств, применяемых в химиотерапии гельминтоза. В одном из вариантов осуществления, другие терапевтические агенты включают антимикробные агенты, сульфонамиды, триметоприм-сульфаметоксазол хинолоны и агенты для лечения инфекций мочевыводящих путей, пенициллины, цефалоспорины, и другие бета-лактамовые антибиотики, агенты, включающие аминогликозид, ингибиторы синтеза протеинов, препараты, применяемые в химиотерапии туберкулеза, заболевания, вызываемого комплексом бактерий Mycobacterium avium, и проказы, противогрибковые агенты и противовирусные агенты, включая агенты против ретровирусов и вирусов, не относящихся к ретровирусам.
В одном из вариантов осуществления, примеры терапевтических антител, которые могут быть скомбинированы с соединением по настоящему изобретению, включают, не ограничиваясь этим, антитела против рецептора тирозин киназы (цетуксимаб, панитумумаб, трастузумаб) и антитела против CD20 (ритуксимаб, тозитумомаб) и другие антитела, например, алемтузумаб, бевацизумаб и гемтузумаб.
В других вариантах осуществления, в способах по настоящему изобретению предусматривается применение терапевтических агентов, предназначенных для модулирования иммунитета, например, иммуномодуляторов, иммунодепрессивных агентов, толерогенов и иммуностимуляторов. В других вариантах осуществления, в способах по настоящему изобретению предусмотрено применение терапевтических агентов, действующих на кровь и кроветворные органы, гематопоэтических агентов, факторов роста, минеральных соединений, витаминов, антикоагулянтов, тромболитических средств и антитромбоцитарных препаратов.
В одном из вариантов осуществления, для лечения рака почек, можно комбинировать соединение по настоящему изобретению или его фармацевтически приемлемую форму (например, фармацевтически приемлемую соль, гидрат, сольват, хелат, нековалентный комплекс, изомер, пролекарство и изотопно-меченое производное), или фармацевтическую композицию по настоящему изобретению с сорафенибом и/или авастином. Для лечения расстройства эндометрия, можно комбинировать соединение по настоящему изобретению с доксорубицином, таксотере (таксолом) и/или цисплатином (карбоплатином). Для лечения рака яичников, можно комбинировать соединение по настоящему изобретению с цисплатином (карбоплатином), таксотере, доксорубицином, топотеканом и/или тамоксифеном. Для лечения рака груди, можно комбинировать соединение по настоящему изобретению с таксотере (Taxol®), гемцитабином (капецитабином), тамоксифеном, летрозолом, Tarceva®, лапатинибом, PD0325901, Avastin®, Herceptin®, OSI-906 и/или OSI-930. Для лечения рака легких, можно комбинировать соединение по настоящему изобретению с таксотере (таксолом), гемцитабином, цисплатином, пеметрекседом, Tarceva®, PD0325901 и/или Avastin®.
В одном из вариантов осуществления, дополнительные терапевтические агенты, которые могут быть скомбинированы с соединением по настоящему изобретению можно найти в одиннадцатом издании Goodman and Gilman’s “The Pharmacological Basis of Therapeutics” или в настольном справочнике врача Physician’s Desk Reference, где оба указанных источника включены в настоящую заявку с помощью ссылки в полном объеме.
В одном из вариантов осуществления, соединения по настоящему изобретению могут применяться в комбинации с агентами, раскрытыми в настоящей заявке, или другими подходящими агентами, в зависимости от состояния, подвергаемого лечению. Следовательно, в некоторых вариантах осуществления, соединения по настоящему изобретению будут вводиться совместно с другими агентами, описанными в настоящей заявке. При применении в комбинированной терапии, соединения по настоящему изобретению могут вводиться одновременно или раздельно со вторыми агентами. Это введение в комбинации может включать одновременное введение двух агентов в составе одной и той же дозированной формы, одновременное введение в разных дозированных формах и раздельное введение. В одном из вариантов осуществления, соединение по настоящему изобретению и любой из дополнительных агентов, описанных в заявке, могут быть вместе включены в одну и ту же дозированную форму и вводиться одновременно. В качестве альтернативы, соединение по настоящему изобретению и любой из дополнительных агентов, описанных в заявке, могут вводиться одновременно, где соединение и дополнительный агент(агенты) находятся в отдельных составах. В другом альтернативном варианте осуществления, соединение по настоящему изобретению можно вводить до или после введения любого из дополнительных агентов, описанных в заявке. В отдельных схемах введения, соединение по настоящему изобретению и любой из дополнительных агентов, описанных в заявке, можно вводить с интервалом в несколько минут, или с интервалом в несколько часов, или с интервалом в несколько дней.
Приведенные ниже примеры и синтезы дополнительно иллюстрируют соединения, полиморфы и композиции по настоящему изобретению, а также способы получения этих соединений, полиморфов и композиций. Следует понимать, что объем настоящего изобретения никоим образом не ограничен приведенными ниже примерами и синтезами. В приведенных ниже примерах, молекулы с единственным хиральным центром, если не указано иное, существуют в форме рацемической смеси. Молекулы с двумя или несколькими хиральными центрами, если не указано иное, существуют в виде рацемической смеси диастереомеров. Отдельные энантиомеры/диастереомеры могут быть получены способами, известными специалистам в данной области техники.
Включение посредством ссылки
Все публикации, патенты и патентные заявки, упомянутые в настоящем описании, включены в заявку посредством ссылки в той же степени, как если бы, о каждой индивидуальной публикации, патенте или патентной заявке было конкретно и индивидуально сказано, что она включена в заявку посредством ссылки. В случае противоречий, настоящая заявка, включая все приведенные определения, будет иметь преимущественное значение.
ПРИМЕРЫ
Химические примеры
Если не указано иное, реакции, описанные в примерах, проводят при атмосферном давлении, как правило, в диапазоне температур от -10°C до 200°C. Далее, за исключением специально оговоренных случаев, имеется в виду, что время и условия проведения реакции указаны приблизительно, например, реакции протекают примерно при атмосферном давлении, в диапазоне температур от -10°C до примерно 110°C, в течение промежутка времени, который составляет, например, от приблизительно 1 до приблизительно 24 часов; реакции, которые оставляют на ночь, в некоторых вариантах осуществления могут в среднем продолжаться примерно 16 часов. В настоящем описании термин «объем» или «объемный» относятся к 1 литру растворителя на килограмм реагента, взятого в минимальном количестве.
Выделение и очистка химических соединений и интермедиатов, описанных в заявке, может проводиться, необязательно, с помощью любой подходящей методики выделения или очистки, как, например, фильтрования, экстракции, кристаллизации, колоночной хроматографии, тонкослойной хроматографии, толстослойной хроматографии или комбинации этих методик. Конкретные иллюстрации подходящих методик разделения и выделения даны с помощью ссылки на приведенные ниже примеры. Однако, могут применяться и другие эквивалентные методики разделения и выделения.
В некоторых вариантах осуществления, (R)- и (S)-изомеры не ограничивающих типовых соединений, если они имеются, можно разделять способами, известными специалисту в данной области техники, например, получением диастереоизомерных солей или комплексов, которые можно разделить, например, кристаллизацией; получением диастереоизомерных производных, которые можно разделить, например, кристаллизацией, газо-жидкостной или жидкостной хроматографией; селективными реакциями одного энантиомера с энантиомер-специфичным реагентом, например, ферментативным окислением или восстановлением, с последующим разделением модифицированного и немодифицированного энантиомеров; или газо-жидкостной или жидкостной хроматографией в хиральном окружении, например, на хиральной неподвижной фазе, например, оксиде кремния, с которой связан хиральный лиганд или в присутствии хирального растворителя. В качестве альтернативы, конкретный энантиомер можно синтезировать асимметрическим синтезом с использованием оптически активных реагентов, субстратов, катализаторов или растворителей, или путем превращения одного энантиомера в другой асимметрической трансформацией.
Соединения по настоящему изобретению необязательно можно вводить во взаимодействие с фармацевтически приемлемой кислотой с получением соответствующих кислотно-аддитивных солей. Кроме того, соединения по настоящему изобретению необязательно можно вводить во взаимодействие с фармацевтически приемлемым основанием, с получением соответствующих основно-аддитивных солей.
В некоторых вариантах осуществления, соединения по настоящему изобретению, как правило, можно синтезировать подходящей комбинацией общеизвестных способов синтеза. Методики, применимые в синтезе этих химических соединений, являются как легко понятными, так и доступными специалисту в соответствующей области техники, на основании настоящего описания. Многие из необязательно замещенных исходных соединений и других реагентов, можно приобрести, например, у Aldrich Chemical Company (Milwaukee, WI), или они могут быть легко получены специалистами в данной области с использованием стандартной методологии синтеза.
Приведенное ниже обсуждение призвано иллюстрировать некоторые из разнообразных способов, подходящих для применения при получении соединений по настоящему изобретению, причем не имеется в виду, что они ограничивают круг реакций или реакционных последовательностей, которые можно применять при получении соединений по настоящему изобретению.
Полиморфы, полученные согласно способам по настоящему изобретению, могут быть охарактеризованы любыми способами, известными в технике. Например, полиморфы, полученные способами по настоящему изобретению, можно охарактеризовать, в том числе, дифракцией рентгеновских лучей на порошке (XRPD), дифференциальной сканирующей калориметрией (DCS), термогравиметрическим анализом (TGA), динамической сорбцией паров (DVS), высокотемпературной микроскопией, оптической микроскопией, анализом Карла Фишера, определением температуры плавления, спектроскопией (например, комбинационного рассеяния, ядерного магнитного резонанса твердого тела (ssNMR), ядерного магнитного резонанса в жидкой фазе (1H и13C-ЯМР) и FT-IR (Фурье-ИК)), определением термической устойчивости, устойчивости к измельчению и растворимости и др.
XRPD
Соединения и полиморфы по настоящему изобретению можно охарактеризовать с помощью картины дифракции рентгеновских лучей на порошке (XRPD). Относительные интенсивности пиков XRPD могут меняться, среди прочих параметров, в зависимости от методики приготовления образца, методики установки образца в прибор и конкретного применяемого прибора. Кроме того, на значения 2Θ пиков могут влиять переход с одного прибора на другой и прочие факторы. Таким образом, в некоторых вариантах осуществления, значения пиков XRPD могут меняться на плюс или минус примерно 0,2 градуса тета или более, что в данном описании отображается в виде «(±0,2°)».
Рентгенограммы XRPD для каждой из форм A-J и аморфной формы соединения формулы (I) регистрировали с помощью дифрактометра PANalytical CubiX XPert PRO MPD, используя падающий пучок излучения CU, испускаемый источником Optix long с тонкой фокусировкой. Эллиптическое градиентное многослойное зеркало применяли для фокусировки рентгеновского излучения Cu Kα через образец на детектор. Образцы помещали на кремниевый ультра-микро держатель для образцов с нулевым возвратом. Исследования проводили с использованием облучаемой полосы 10 мм, используя следующие параметры, которые устанавливали на приборе/с помощью программы:
DSC
Соединения и полиморфы по настоящему изобретению можно охарактеризовать индивидуальной термограммой дифференциальной сканирующей калориметрии (DSC). Что касается DSC, в технике известно, что наблюдаемая температура пиков будет зависеть, в числе прочих параметров, от скорости изменения температуры, методики приготовления образца и конкретного применяемого прибора. Таким образом, приведенные в заявке значения температур пиков на термограмме DSC могут меняться примерно на плюс или минус 2°C, примерно на плюс или минус 3°C, примерно на плюс или минус 4°C, примерно на плюс или минус 5°C, примерно на плюс или минус 6°C, до примерно на плюс или минус 7°C или более. Для некоторых полиморфных форм, анализ DSC выполняли для более, чем одного образца, что иллюстрирует известную изменчивость положения пика, например, из-за упомянутых выше факторов. Наблюдаемые различия в положении пиков согласуются с ожиданиями специалиста в данной области техники для характерной погрешности различных образцов индивидуальной полиморфной формы соединения формулы (I).
Примеси, находящиеся в образце, также могут оказывать влияние на положение пиков на любой конкретной термограмме DSC. В некоторых вариантах осуществления, наличие в образце, анализируемом DSC, одного или несколько химических соединений, которые не являются полиморфами соединения формулы (I), может привести к появлению одного или нескольких пиков при более низкой температуре, чем пик (пики), относящиеся к температуре перехода данного полиморфа по настоящему изобретению.
Анализ DSC проводили с использованием дифференциального сканирующего калориметра Mettler 822e. Образцы отвешивали в алюминиевый поддон, закрытый крышкой с проколотыми отверстиями, и затем обжимали края крышки. Стандартные условия проведения анализа включали температуру от примерно 30°C до примерно 300-350°C при скорости изменения температуры примерно 10°C/мин. Несколько дополнительных скоростей повышения температуры использовали в качестве части исследования высокоплавкой формы B, в т.ч. примерно 2°C/мин, примерно 5°C/мин и примерно 20°C/мин. Образцы исследовали при нескольких скоростях повышения температуры для определения термических и кинетических параметров наблюдаемых переходов.
С помощью DSC проводили также эксперименты по выдерживанию соединений в изотермических условиях. Температуру образцов поднимали со скоростью примерно 10°C/мин (до температуры от примерно 100°C до примерно 250°C) и выдерживали при этой температуре в течение примерно пяти минут, после чего быстро охлаждали до комнатной температуры. В этих экспериментах образцы затем анализировали с помощью XRPD или повторно исследовали с помощью DSC.
TGA
Полиморфные формы по настоящему изобретению могут демонстрировать термические характеристики, отличающиеся от характеристик аморфного материала или другой полиморфной формы. Поведение вещества при повышенной температуре можно определить в лаборатории с помощью термогравиметрического анализа (TGA), который можно применять для того, чтобы различить некоторые полиморфные формы между собой. В одном из вариантов осуществления, полиморф по настоящему изобретению может быть охарактеризован термогравиметрическим анализом.
Термогравиметрические исследования выполняли на приборе для термогравиметрического анализа Mettler 851e SDTA/TGA. Образцы взвешивали в алюминиевом тигле и исследовали при температурах от примерно 30°C до примерно 230°C при скорости повышения температуры примерно 10°C/мин.
DVS
Соединения и полиморфы по настоящему изобретению могут быть охарактеризованы анализом поглощения паров воды. Этот анализ проводили с применением прибора Hiden IGAsorp Moisture Sorption. Эксперименты по сорбции паров воды проводили примерно при 25°C, осуществляя сканирование адсорбции от примерно 40% до примерно 90% относительной влажности (RH), с шагом примерно 10% RH, и сканирование десорбции от примерно 85% до примерно 0% RH с шагом примерно -10% RH. Второе сканирование адсорбции от примерно 10% до примерно 40% RH проводили для определения сорбции влаги, начиная от сухого вещества и до начала поглощения влаги. В каждой исследуемой точке образцам давали прийти в равновесие в течение примерно 4 часов или до достижения практически неизменной массы. После сканирования изотермической сорбции, образцы высушивали в течение примерно одного часа при повышенной температуре (примерно 60°C) для определения массы в сухом состоянии. После исследования сорбции водяных паров проводили XRPD анализ для определения твердой формы.
Оптическая микроскопия
Соединения и полиморфы по настоящему изобретению можно охарактеризовать микроскопическими исследованиями, в частности оптической микроскопией. Микроскопические исследования проводили с помощью поляризационного микроскопа Leica DMRB Polarized Microscope. При исследовании образцов в комбинации с микроскопом поляризованного света применялась цифровая камера (с разрешением 1600×1200). Небольшие количества образцов диспергировали в минеральном масле на предметном стекле, закрывали покровным стеклом, и наблюдали при увеличении 100×.
Анализ Карла Фишера
Соединения и полиморфы по настоящему изобретению можно охарактеризовать анализом Карла Фишера для определения содержания воды. Анализ Карла Фишера проводили с помощью кулонометра Metrohm 756 KF. Для проведения титрования по Карлу Фишеру в автоматический AD кулонометр добавляли количество вещества, достаточное для получения 50 мкг воды, т.е. от примерно 10 до примерно 50 мг образца.
Спектроскопия комбинационного рассеяния (КР)
Соединения и полиморфы по настоящему изобретению можно охарактеризовать спектроскопией комбинационного рассеяния. Спектроскопию комбинационного рассеяния проводили на приборе Kaiser RamanRXN1, помещая образцы в стеклянные кюветы. Спектры КР регистрировали, используя макроскоп PhAT при длине волны излучения 785 нм и размере пятна примерно 1,2 мм. Для получения спектров применялось от 12 до 16 прохождений при времени экспозиции от примерно 0,5 до примерно 12 секунд, при фильтрации от космического излучения. При обработке данных вычитали фоновый сигнал, зарегистрированный в таких же условиях для пустой кюветы. Для получения интерпретируемых данных при необходимости проводили коррекцию на уровень фона и сглаживание.
FT-IR (Фурье-ИК)
Соединения и полиморфы по настоящему изобретению можно охарактеризовать FT-IR спектроскопией. Регистрацию IF-IR спектров проводили с применением инфракрасных спектрометров Nicolet Nexus 470 или Avatar 370 и программы OMNIC. Анализ образцов проводили с применением алмазного устройства для получения нарушенного полного отражения (ATR). Образец вещества наносили на поверхность кристалла алмаза, и поворачивали ручку ATR для достижения необходимого давления. Затем осуществляли регистрацию и анализ спектра с использованием программы OMNIC. Альтернативные виды образцов включали кюветы с раствором, суспензии, тонкие пленки и прессованные диски, например, изготовленные из KBr, как известно в технике.
ЯМР
Соединения и полиморфы по настоящему изобретению можно охарактеризовать с помощью ядерного магнитного резонанса (ЯМР). Спектры ЯМР регистрировали с помощью прибора Bruker AVANCE 500 МГц, снабженного 5-мм датчиком BBO. Образцы (массой от примерно 2 до примерно 10 мг) растворяли в ДМСО-d6, содержащем примерно 0,05% тетраметилсилана (TMS) в качестве внутреннего стандарта. Спектры1H-ЯМР регистрировали на частоте 500 МГц, используя 5 мм (1H-X)Z градиентный датчик с широкополосной регистрацией. При регистрации спектров применяли 30-градусный импульс со спектральной шириной 20 мд, с частотой повторения 1,0 с, при 32-64 прохождениях.
Высокоэффективная жидкостная хроматография
Соединения и полиморфы по настоящему изобретению можно исследовать с помощью высокоэффективной жидкостной хроматографии, с использованием прибора Agilent 1100. Для проведения ахиральной ВЭЖХ использовались следующие параметры работы прибора:
Элюирование градиентом растворителей
Соединения и полиморфы по настоящему изобретению можно исследовать высокоэффективной жидкостной хроматографией, с использованием хиральной ВЭЖХ колонки для определения величины энантиомерного избытка (%ee):
Пример 1: Синтез (S)-3-(1-аминоэтил)-8-хлор-2-фенилизохинолин-1(2Р)-она
Пример 1A

Соединение 1 (6,00 кг) обрабатывали моногидратом 1-гидроксибензотриазола (HOBt·H2O), триэтиламином, гидрохлоридом N,O-диметилгидроксиламина и EDCI в диметилацетамиде (DMA) при 10°C. За ходом реакции наблюдали с помощью протонной спектроскопии ЯМР и установили, что реакция закончилась в течение 2,6 часа, с образованием соединения 2 в виде белого твердого вещества с выходом 95%. R-энантиомер не был обнаружен с помощью протонной спектроскопии ЯМР, при использовании (R)-(-)-альфа-ацетилминдальной кислоты в качестве реагента, позволяющего получить раздельные сигналы хиральных форм в спектре ЯМР.
Пример 1B

Соединение 3 (4,60 кг) обрабатывали моногидратом п-толуолсульфоновой кислоты и 3,4-дигидро-2H-пираном (DHP) в этилацетате при 75°C в течение 2,6 часа. За ходом реакции следили с помощью ВЭЖХ. В результате реакции получали соединение 4 в виде твердого желтого вещества с выходом 80% с чистотой >99% по данным ВЭЖХ (AUC).
Пример 1C
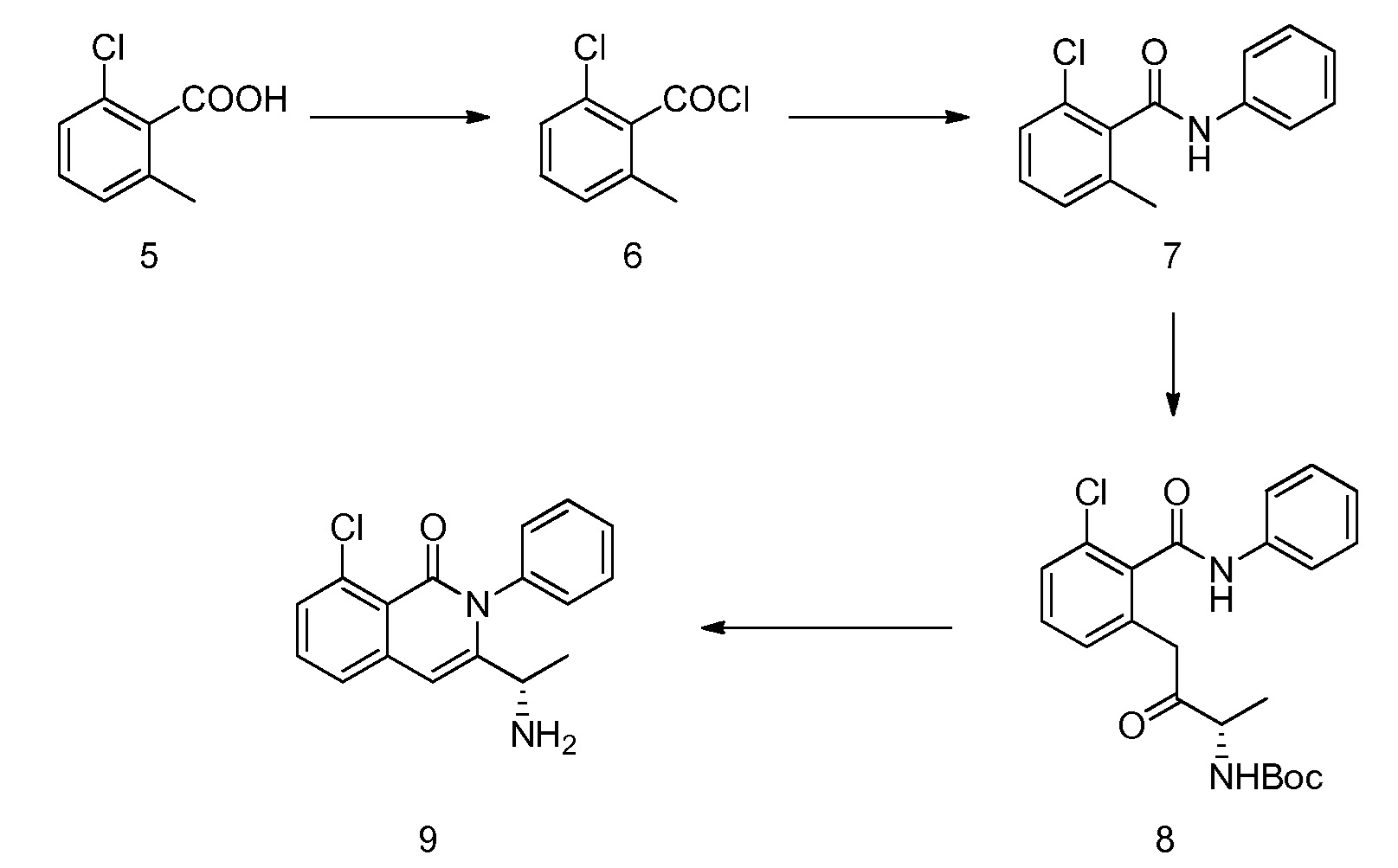
Соединение 5 (3,30 кг) обрабатывали тионилхлоридом и каталитическим количеством ДМФА в хлористом метилене при 25°C в течение пяти часов. За ходом реакции наблюдали с помощью ВЭЖХ, которая показала 97,5% (AUC) превращение в соединение 6. Соединение 6 обрабатывали анилином in situ в хлористом метилене при 25°C в течение 15 часов. За ходом реакции наблюдали с помощью ВЭЖХ, и получали соединение 7 в виде твердого вещества коричневого цвета с выходом 81% и чистотой >99% (AUC) по данным ВЭЖХ анализа.
Соединение 2 обрабатывали 2,0 М изопропилсодержащим реактивом Гриньяра в ТГФ при -20°C. Полученный раствор добавляли к соединению 7 (3,30 кг) предварительно обработанному 2,3М н-гексиллитием в тетрагидрофуране при -15°C. За ходом реакции наблюдали с помощью ВЭЖХ, до фиксации 99% (AUC) превращения в соединение 8. Соединение 8 обрабатывали in situ концентрированным раствором HCl в изопропиловом спирте при 70°C в течение восьми часов. За ходом реакции наблюдали при помощи ВЭЖХ, и выделяли соединение 9 в виде твердого вещества коричневого цвета с выходом 85%, чистотой (AUC) 98% и энантиомерным избытком 84% (AUC) по данным ВЭЖХ исследования.
Пример 1D
Соединение 9 (3,40 кг) обрабатывали D-винной кислотой в метаноле при 55°C в течение 1-2 часов. Полученную реакционную смесь фильтровали, и обрабатывали гидроксидом аммония в деионизированной (DI) воде, получая энантиомерно обогащенное соединение 9 в виде желтовато-коричневого твердого вещества с выходом 71%, чистотой >99% (AUC) и ee 91% (AUC) по данным ВЭЖХ анализа.
Пример 2: Синтез (S)-3-(1-аминоэтил)-8-хлор-2-фенилизохинолин-1(2H)-она
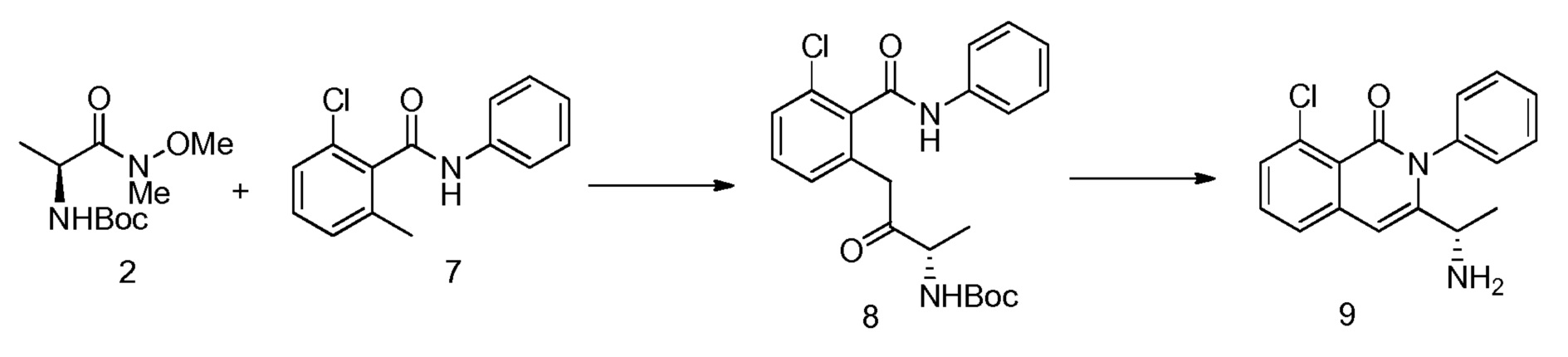
Пример 2A
К соединению 7 (20,1 г) добавляли 100 мл безводного ТГФ. Полученный раствор охлаждали примерно до -10°C и медленно (например, в течение примерно 20 мин) добавляли 80 мл н-гексиллития (2,3М в гексане, 2,26 экв.). Полученный раствор перемешивали примерно при -10°C в течение приблизительно 20 мин.
К соединению 2 (26,5 г, 1,39 экв.) добавляли 120 мл безводного ТГФ. Полученную смесь охлаждали примерно до -10°C и медленно (например, в течение примерно 15-20 мин) добавляли 60 мл изопропилмагнийхлорида (2,0М в ТГФ, 1,47 экв.). Полученную смесь перемешивали примерно при -10°C в течение примерно 20 минут. Смесь, полученную из соединения 2, добавляли к раствору, полученному из соединения 7, поддерживая внутреннюю температуру в пределах от примерно -10 до примерно 0°C. По окончании добавления (примерно 5 мин) удаляли охлаждающую баню и полученную смесь перемешивали при комнатной температуре в течение примерно 1 ч, после чего охлаждали.
Получали раствор 33 мл изомасляной кислоты (4,37 экв.) в 100 мл анизола. Анизольный раствор охлаждали до температуры примерно -3°C. Полученную ранее реакционную смесь добавляли к анизольному раствору, так чтобы внутренняя температура раствора была ниже примерно 5°C. Затем удаляли баню со льдом (примерно через 15 мин внутренняя температура составляла примерно 7°C). Затем к смеси быстро добавляли 100 мл 10 масс.% водного раствора NaCl (температура реакционной смеси повышалась от примерно 7°C до примерно 15°C). После перемешивания в течение примерно 30 мин, разделяли реакционную смесь на две фазы. Органическую фазу промывали еще одной 100 мл-порцией 10 масс.% водного раствора NaCl. Органическую фазу переносили в колбу, используя 25 мл анизола, для облегчения перенесения продукта. Анизольный раствор концентрировали до 109 г. Затем добавляли 100 мл анизола.
К полученному анизольному раствору в количестве примерно 200 мл, добавляли 50 мл TFA (8 экв.), поддерживая внутреннюю температуру ниже примерно 45-50°C. Полученный раствор нагревали до примерно 45-50°C и перемешивали в течение примерно 15 ч, после чего охлаждали до 20-25°C. К этому раствору по каплям добавляли 300 мл MTBE и затем полученную смесь выдерживали при 20-25°C в течение 1 ч. Смесь фильтровали, и влажный слой осадка промывали примерно 50 мл MTBE. Влажный слой осадка выдерживали на фильтре в течение примерно 1 ч в атмосфере азота. При этом, слой осадка периодически перемешивали, и вновь разравнивали. Затем влажный слой осадка промывали 200 мл MTBE. Полученный влажный слой дополнительно выдерживали в течение примерно 2 ч (осадок перемешивали, и вновь разровняли примерно через 1,5 ч). Полученный влажный осадок высушивали в вакуумной печи примерно при 40°C в течение примерно 18 ч, получая соль соединения 9·TFA с чистотой примерно 97,3% (AUC), которая включала примерно 99,1% S-энантиомеров (например, хиральная чистота примерно 99,1%).
Соль соединение 9·TFA (3 г) суспендировали в 30 мл EtOAc примерно при 20°C. К суспензии в EtOAc добавляли 4,5 мл (2,2 экв.) 14% водного раствора гидроксида аммония и температура реакционной смеси понижалась примерно до 17°C. К двухфазной смеси добавляли воду (5 мл). Полученную двухфазную смесь перемешивали в течение 30 мин. Прекращали перемешивание и давали фазам разделиться. Водную фазу удаляли. К органической фазе (смешанной с 5 мл EtOAc) добавляли 10 мл 10% водного раствора HCl. Двухфазную смесь перемешивали в течение примерно 30 мин. Водную фазу удаляли. Органический слой концентрировали до 9 г. К полученной смеси с EtOAc добавляли 20 мл i-PrOAc. Полученную смесь концентрировали до 14,8 г. При перемешивании по каплям добавляли 10 мл н-гептана. Суспензию перемешивали в течение примерно 30 мин и затем добавляли еще 10 мл н-гептана. Полученную суспензию перемешивали в течение 1 ч. Суспензию фильтровали, и влажный слой осадка промывали дополнительной порцией гептана. Влажный слой осадка выдерживали в течение 20 мин в атмосфере азота, затем высушивали в вакуумной печи при температуре примерно 40°C, получая соединение 9 в форме свободного основания с чистотой примерно 99,3% (AUC), которое содержало примерно 99,2% S-энантиомера (например, хиральная чистота примерно 99,2%).
Пример 2B
Готовили смесь соединения 7 (100 г, 0,407 моль, 1 масс.ед.) и ТГФ (500 мл, 5 объемов) и охлаждали ее примерно до 3°C. Добавляли н-гексиллитий (2,3М в гексане, 400 мл, 0,920 моль, 2,26 экв.) в течение примерно 110 минут, поддерживая температуру ниже примерно 6°C. Полученный раствор перемешивали при 0±5°C в течение примерно 30 мин. Одновременно, готовили смесь соединения 2 (126 г, 0,541 моль, 1,33 экв.) и ТГФ (575 мл, 5,8 объемов). К полученной суспензии добавляли изопропилмагнийхлорид (2,0 М в ТГФ, 290 мл, 0,574 моль, 1,41 экв.) в течение примерно 85 мин, поддерживая температуру ниже примерно 5°C. Полученную смесь перемешивали в течение примерно 35 минут при 0±5°C. Смесь, содержащую магниевую соль соединения 2, добавляли к смеси, содержащей литиевую соль соединения 7, в течение примерно 1 часа, поддерживая температуру 0±5°C. Раствор перемешивали в течение примерно 6 минут после завершения добавления.
Полученный раствор при перемешивании добавляли к охлажденному примерно до -5°C раствору изомасляной кислоты (165 мл, 1,78 моль, 4,37 экв.) в анизоле (500 мл, 5 объемов) в течение примерно 20 минут, причем в течение этого времени температура не превышала примерно 6°C. Полученный раствор перемешивали в течение примерно 40 минут, при этом он нагревался примерно до 14°C. Затем к реакционной смеси быстро добавляли 10% раствор хлорида натрия (500 мл, 5 объемов). Температура поднималась примерно до 21°C. После перемешивания смеси в течение примерно 6 минут, перемешивание прекращали и удаляли нижний водный слой (примерно 700 мл). Добавляли вторую порцию 10% раствора хлорида натрия (500 мл, 5 объемов) и перемешивали смесь в течение 5 минут. Затем перемешивание прекращали и удаляли нижний водный слой. Объем органической фазы уменьшали отгонкой в вакууме примерно до 750 мл (7,5 объемов).
Добавляли трифторуксусную кислоту (250 мл, 3,26 моль, 8,0 экв.) и полученную смесь перемешивали примерно при 45°C в течение примерно 15 часов. Смесь охлаждали до примерно 35°C и добавляли MTBE (1,5 л, 15 объемов) в течение примерно 70 минут. По окончании добавления, смесь перемешивали в течение примерно 45 минут примерно при 25-30°C. Твердые вещества собирали вакуумным фильтрованием, и выдерживали в атмосфере N2 в течение примерно 20 часов, получая соль соединения 9·TFA с чистотой примерно 97,5% (AUC), которая имела хиральную чистоту примерно 99,3%.
Соль соединения 9·TFA (100 г) суспендировали в EtOAc (1 л, 10 объемов) и 14% водном растворе аммиака (250 мл, 2,5 объема). Смесь перемешивали в течение примерно 30 минут, затем удаляли нижний водный слой. К органическому слою добавляли вторую порцию 14% водного раствора аммиака (250 мл, 2,5 объемов). Смесь перемешивали в течение 30 минут, после чего удаляли нижний водный слой. Добавляли изопропилацетат (300 мл, 3 объема) и осуществляли отгонку растворителей из смеси в вакууме до объема 500 мл (5 объемов), периодически добавляя дополнительные порции изопропилацетата (1 л, 10 объемов).
Затем, после отгонки в вакууме до объема 600 мл (6 объемов), добавляли гептан (1,5 л, 15 объемов) в течение примерно 110 минут, поддерживая температуру от примерно 20°C до примерно 30°C. Полученную суспензию перемешивали в течение примерно 1 часа, после чего собирали твердое вещество вакуумным фильтрованием. Осадок промывали гептаном (330 мл, 3,3 объема) и выдерживали в течение примерно 1 часа. Твердое вещество высушивали примерно при 45°C в вакуумной печи в течение примерно 20 часов, получая соединение 9 в форме свободного основания с чистотой примерно 99,23% (AUC), которое имело хиральную чистоту примерно 99,4%.
Пример 3: Хиральное разделение (S)-3-(1-аминоэтил)-8-хлор-2-фенилизохинолин-1(2H)-она (соединение 9)
В некоторых случаях (S)-3-(1-аминоэтил)-8-хлор-2-фенилизохинолин-1(2H)-он (соединение 9), полученный в описанном выше синтезе, содержал незначительные количества соответствующего (R)-изомера. Применяли процесс хирального разделения для улучшения энантиомерной чистоты некоторых образцов (S)-3-(1-аминоэтил)-8-хлор-2-фенилизохинолин-1(2H)-она.
В одном из вариантов осуществления, соединение 9 (3,40 кг) обрабатывали D-винной кислотой в метаноле примерно при 55°C в течение примерно одного-двух часов. Смесь фильтровали и обрабатывали гидроксидом аммония в деионизированной воде (DI), получая соединение 9 с чистотой более примерно 99% (AUC), которое имело хиральную чистоту примерно 91% (AUC).
Согласно другой методике, MeOH (10 объемов) и соединение 9 (1 экв.) перемешивали при 55±5°C. Добавляли D-винную кислоту (0,95 экв.). Смесь выдерживали при 55±5°C в течение примерно 30 минут и затем охлаждали примерно до 20-25°C в течение примерно 3 ч. Смесь выдерживали в течение примерно 30 мин и затем фильтровали. Слой осадка на фильтре промывали MeOH (2,5 объема) и затем выдерживали. Осадок возвращали в реактор, и добавляли воду (16 объемов). Смесь перемешивали при 25±5°C. В течение примерно 1 ч добавляли NH4OH, доводя pH примерно до 8-9. Затем смесь фильтровали, слой осадка промывали водой (4 объема) и затем гептаном (4 объема). Осадок выдерживали и затем высушивали в вакууме при 45-50°C, получая соединение 9 в форме свободного основания с хиральной чистотой примерно 99,0%.
Пример 4: Синтез (S)-3-(1-(9H-пурин-6-иламино)этил)-8-хлор-2-фенилизохинолин-1(2H)-она

Получали смесь соединения 7 (1 эквивалент) и безводного ТГФ (5 объемов). Отдельно получали смесь соединения 2 (1,3 эквивалента) и безводного ТГФ (5 объемов). Обе смеси перемешивали в течение примерно 15 мин при температуре примерно 20-25°C и затем охлаждали до -25±15°C. К смеси соединения 7 добавляли н-гексиллитий (2,05 экв.), поддерживая температуру на уровне >5°C. К смеси соединения 2 добавляли i-PrMgCl (1,33 экв.), поддерживая температуру на уровне >5°C. Смесь соединения 2 добавляли к смеси соединения 7 в безводных условиях при 0±5°C. Полученную смесь нагревали до 20±2°C и затем выдерживали в течение примерно 1 ч. После этого реакционную смесь охлаждали до -5±5°C и добавляли 6н HCl (3,5 экв.) для гашения реакции, поддерживая температуру ниже примерно 25°C. Водный слой сливали, и органический слой отгоняли при пониженном давлении, оставляя 2-3 объемных единицы. Добавляли IPA (3 объема) и продолжали вакуумную отгонку, оставляя 2-3 объемных единицы. Добавляли IPA (8 объемов) и температуру смеси повышали примерно до 60-75°C. Добавляли концентрированную HCl (1,5 объемов) и затем выдерживали смесь в течение 4 часов. Осуществляли вакуумную отгонку растворителей из смеси при пониженном давлении до достижения объема 2,5-3,5 единицы объема. Температуру смеси доводили до 30±10°C. К смеси соответственно добавляли DI воду (3 объема) и DCM (7 объемов). Затем к смеси добавляли NH4OH, доводя pH до примерно 7,5-9. Температуру доводили примерно до 20-25°C. Слои разделяли, и водный слой промывали DCM (0,3 объема). Объединенные слои DCM отгоняли до достижения объема 2 единицы объема. Добавляли i-PrOAc (3 объема) и продолжали отгонку в вакууме до достижения 3 единиц объема. Температуру доводили примерно до 15-30°C. К органическому слою добавляли гептан (12 объемов) и выдерживали смесь в течение 30 мин. Смесь фильтровали, и слой осадка промывали гептаном (3 объема). Осадок высушивали в вакууме примерно при 45°C, получая соединение 9.
Затем смешивали MeOH (10 объемов) и соединение 9 (1 эквивалент) и перемешивали, поддерживая температуру 55±5°C. Добавляли D-винную кислоту (0,95 экв.). Смесь выдерживали при 55±5°C в течение примерно 30 мин и затем охлаждали примерно до 20-25°C в течение примерно 3 ч. Смесь выдерживали 30 мин и затем фильтровали. Слой осадка промывали MeOH (2,5 объема) и затем выдерживали. К осадку добавляли воду (16 объемов) и перемешивали смесь при 25±5°C. Добавляли NH4OH в течение 1 ч, доводя pH до значения примерно 8-9. Затем смесь фильтровали, и полученный осадок промывали водой (4 объема) и затем гептаном (4 объема). Осадок выдерживали и затем высушивали в вакууме при 45-50°C, получая соединение 9.
К смеси i-PrOH (4 объема) и соединения 9 (1 эквивалент) добавляли соединение 4 (1,8 эквивалента), Et3N (2,5 экв.) и i-PrOH (4 объема). Смесь перемешивали, и повышали температуру до 82±5°C. Выдерживали смесь в течение 24 ч. Затем смесь охлаждали примерно до 20-25°C в течение 2 ч. Смесь фильтровали, и осадок промывали i-PrOH (2 объема), DI водой (25 объемов) и н-гептаном (2 объема) в указанном порядке. Осадок выдерживали и затем высушивали в вакууме при 50±5°C, получая соединение 10.
К смеси EtOH (2,5 объема) и соединения 10 (1 экв.) добавляли EtOH (2,5 объема) и DI воду (2 объема). Смесь перемешивали примерно при 20-25°C. Добавляли конц. HCl (3,5 экв.) и повышали температуру до 35±5°C. Смесь выдерживали в течение примерно 1,5 ч. Смесь охлаждали до 25±5°C, и фильтровали через мелкий фильтр, в сосуд для жидкости, свободной от твердых частиц. Добавляли NH4OH, доводя pH примерно до 8-9. К смеси добавляли кристаллические затравки формы C соединения формулы (I) (0,3 масс.%) и выдерживали в течение 30 минут. В течение примерно 2 ч добавляли DI воду (13 объемов). Смесь выдерживали в течение 1 ч и затем фильтровали. Полученный осадок промывали DI водой (4 объема) и н-гептаном (2 объема) в указанном порядке. Осадок выдерживали в течение примерно 24 часов и затем добавляли DCM (5 объемов). Смесь перемешивали в течение примерно 12 ч примерно при 20-25°C. Смесь фильтровали, и промывали слой осадка DCM (1 объем). Осадок выдерживали в течение примерно 6 ч. Затем осадок высушивали в вакууме при 50±5°C. К осадку добавляли DI воду (10 объемов) и i-PrOH (0,8 объемов) и перемешивали смесь при 25±5°C в течение примерно 6 ч. Рентгенограмма XRPD подтвердила, что полученный образец соединения (I) представлял собой полиморфную форму C. Смесь фильтровали, и остаток промывали DI водой (5 объемов) и затем н-гептаном (3 объема). Осадок выдерживали и затем высушивали в вакууме при 50±5°C, получая соединение формулы (I) в виде полиморфной формы C.
Пример 5: Синтез (S)-3-(1-(9H-пурин-6-иламино)этил)-8-хлор-2-фенилизохинолин-1(2H)-она

Пример 5A
Соединение 9 (2,39 кг) обрабатывали соединением 4 и триэтиламином в изопропиловом спирте при 80°C в течение 24 часов. За ходом реакции наблюдали с помощью ВЭЖХ до ее завершения, получая 8-хлор-2-фенил-3-((1S)-1-(9-(тетрагидро-2H-пиран-2-ил)-9H-пурин-6-иламино)этил)изохинолин-1(2H)-он (соединение 10) в виде желто-коричневого твердого вещества с выходом 94% с чистотой 98% (AUC) по данным ВЭЖХ анализа.
8-хлор-2-фенил-3-((1S)-1-(9-(тетрагидро-2H-пиран-2-ил)-9H-пурин-6-иламино)этил)изохинолин-1(2H)-он (соединение 10) (3,63 кг) обрабатывали HCl в этаноле при 30°C в течение 2,3 часа. За ходом реакции наблюдали с помощью ВЭЖХ до ее завершения и получали соединение формулы (I) в виде желто-коричневого твердого вещества с выходом 92%, чистотой >99% (AUC) и ee 90,9% (AUC) по данным ВЭЖХ анализа.
Пример 5B
3-(1-аминоэтил)-8-хлор-2-фенилизохинолин-1(2H)-он (соединение 9) (0,72 ммоль), 6-хлор-9-(тетрагидро-2H-пиран-2-ил)-9H-пурин (соединение 4) (344 мг, 1,44 ммоль) и DIPEA (279 мг, 2,16 ммоль) растворяли в н-BuOH (20 мл), и полученную смесь перемешивали при кипячении с обратным холодильником в течение 16 ч. Реакционную смесь концентрировали в вакууме и очищали колоночной флэш-хроматографией на силикагеле (элюируя 30%-50% гексан/EtAc), получая продукт, т.е. 8-хлор-2-фенил-3-((1S)-1-(9-(тетрагидро-2H-пиран-2-ил)-9H-пурин-6-иламино)этил)изохинолин-1(2H)-он (соединение 10) в виде твердого вещества белого цвета (выход 60%).
8-хлор-2-фенил-3-((1S)-1-(9-(тетрагидро-2H-пиран-2-ил)-9H-пурин-6-иламино)этил)изохинолин-1(2H)-он (соединение 10) (0,42 ммоль) растворяли в HCl/EtOH (3М, 5 мл), и перемешивали полученную смесь при комнатной температуре в течение 1 ч. Реакционную смесь гасили насыщенным водным раствором NaHCO3 и доводили pH примерно до 7-8. Смесь экстрагировали CH2Cl2 (50 мл×3), высушивали над безводным Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме и остаток перекристаллизовывали из этилацетата и гексана (1:1). Твердое вещество собирали фильтрованием и высушивали в вакууме, получая продукт, т.е. (S)-3-(1-(9H-пурин-6-иламино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он (соединение формулы (I)) (выход 90%) в виде белого твердого вещества, представляющего собой полиморфную форму A.
Пример 5C
3-(1-аминоэтил)-8-хлор-2-фенилизохинолин-1(2H)-он (соединение 9) и 6-хлор-9-(тетрагидро-2H-пиран-2-ил)-9H-пурин (соединение 4) вводили в реакцию в присутствии триэтиламина и изопропилового спирта. Реакционный раствор нагревали при 82°C в течение 24 часов, получая соединение 10. Промежуточное соединение 10 обрабатывали концентрированной HCl и этанолом в водной среде при 35°C для удаления тетрагидропиранильной группы, получая (S)-3-(1-(9H-пурин-6-иламино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он. Выделение/очистка в водной среде позволила получить полиморфную форму C.
Пример 6: Синтез (S)-3-(1-(9H-пурин-6-иламино)этил)-8-хлор-2-фенилизохинолин-1(2H)-она

3-(1-аминоэтил)-8-хлор-2-фенилизохинолин-1(2H)-он (соединение 9) (150 г; ee 90%) и 6-хлор-9-(тетрагидро-2H-пиран-2-ил)-9H-пурин (соединение 4) (216 г, 1,8 экв.) помещали в круглодонную колбу, после чего загружали IPA (1,2 л; 8 объемов) и триэтиламин (175 мл; 2,5 экв.). Полученную суспензию перемешивали при кипячении с обратным холодильником в течение одного дня. По каплям в течение двух часов добавляли гептан (1,5 л; 10 объемов). Затем реакционную смесь охлаждали до 0-5°C, выдерживали в течение одного часа, и фильтровали. Слой осадка промывали гептаном (450 мл; 3 объема) и помещали обратно в реактор. Добавляли IPA (300 мл; 2 объема), и воду (2,25 л; 15 объемов), полученную суспензию перемешивали при 20-25°C в течение трех с половиной часов, и затем фильтровали. Слой осадка промывали водой (1,5 л; 10 объемов) и гептаном (450 мл; 3 объема), и затем высушивали в вакууме при 48°C в течение двух с половиной дней, получая 227 г (90,1%) интермедиата (соединение 10) в виде не совсем белого твердого вещества с чистотой >99% (AUC) и ee >94% (хиральная ВЭЖХ). Энантиомерный избыток определяли путем превращения образца осадка в конечный продукт и исследованием этого продукта с помощью хиральной ВЭЖХ.
Интермедиат (соединение 10) (200 г) суспендировали в смеси этанол (900 мл; 4,5 объема)/вода (300 мл; 1,5 объема) при 22°C, затем добавляли конц.HCl (300 мл; 1,5 объема) и выдерживали в течение полутора часов при 25-35°C. Добавление HCl приводило к полному растворению всех твердых продуктов с образованием темно-коричневого раствора. Добавляли гидроксид аммония (260 мл), доводя pH до 8-9. Затем добавляли кристаллические затравки полиморфной формы C продукта (0,5 г) (можно также использовать затравки полиморфной формы A), и выдерживали реакционную смесь в течение десяти минут, после чего в течение двух часов добавляли воду (3 л; 15 объемов), что приводило к кристаллизации продукта. Реакционную смесь выдерживали в течение 3,5 часов при 20-25°C и затем фильтровали. Слой осадка промывали водой (1 л, 5 объемов), затем гептаном (800 мл; 4 объема) и высушивали в вакууме при 52°C в течение 23 часов, получая 155,5 г (93,5%) продукта с чистотой 99,6% (AUC) и ee 93,8% (хиральная ВЭЖХ).
Пример 7: Синтез (S)-3-(1-(9H-пурин-6-иламино)этил)-8-хлор-2-фенилизохинолин-1(2H)-она

Получали смесь изопропанола (20,20 кг, 8 объемов), соединения 9 (3,17 кг, 9,04 моль, 1 экв.), соединения 4 (4,61 кг, 16,27 моль, 1,8 экв.) и триэтиламина (2,62 кг, 20,02 моль, 2,4 экв.) и нагревали ее до достижения внутренней температуры 82±5°C. Смесь перемешивали при этой же температуре в течение еще примерно 24 ч. Температуру медленно в течение примерно 2 ч доводили до 20±5°C, и отделяли твердое вещество вакуумным фильтрованием на 24” настольном полипропиленовом фильтре, снабженном бумагой Sharkskin. Слой осадка на фильтре последовательно промывали IPA (5,15 кг, 3 объема), очищенной водой (80,80 кг, 25 объемов) и н-гептаном (4,30 кг, 2 объема). Затем слой осадка высушивали в течение примерно 4 дней в вакууме при 50±5°C, получая соединение 10.
К смеси этанола (17,7 кг, 5 объемов), и соединения 10 (4,45 кг, 8,88 моль, 1,0 экв.) добавляли очищенную воду (8,94 кг, 2 объема). К этой смеси медленно добавляли концентрированную HCl (3,10 кг, 3,5 экв.), поддерживая температуру ниже примерно 35°C. Смесь перемешивали при 30±5°C в течение примерно 1,5 ч и ВЭЖХ анализ показал наличие соединения формулы (I) с чистотой 99,8% (AUC) по отношению к соединению 10.
Затем смесь, содержащую соединение формулы (I), охлаждали до 25±5°C. pH смеси доводили примерно до 8, используя предварительно профильтрованный гидроксид аммония (1,90 кг). После перемешивания в течение примерно 15 мин, добавляли кристаллические затравки формы C (13,88 г). После перемешивания в течение примерно 15 мин, добавляли очищенную воду (58,0 кг, 13 объемов) в течение примерно 2 ч. После перемешивания полученной смеси в течение 15 ч при 25±5°C, твердые вещества отделяли вакуумным фильтрованием через 24” полипропиленовый настольный фильтр, снабженный бумагой Sharkskin, поверх которой находилась фторопластовая сетка. Слой осадка промывали очищенной водой (18,55 кг, 4 объема) и затем предварительно профильтрованным н-гептаном (6,10 кг, 2 объема). После выдерживания слоя осадка на фильтре в течение примерно 24 ч, ВЭЖХ анализ осадка указал на наличие соединения формулы (I), имеющего чистоту примерно 99,2% (AUC).
К слою осадка на фильтре добавляли дихлорметан (29,9 кг, 5 объемов) и перемешивали суспензию при 25±5°C в течение примерно 24 часов. Твердые вещества отделяли вакуумным фильтрованием через 24” полипропиленовый настольный фильтр, снабженный бумагой Sharkskin, поверх которой находилась фторопластовая сетка, и слой осадка на фильтре промывали DCM (6,10 кг, 1 объем). После выдерживания слоя осадка на фильтре в течение примерно 22 ч, осадок высушивали в течение примерно 2 дней в вакууме при 50±5°C, получая соединение формулы (I) с чистотой 99,6% (AUC). Рентгенограмма XRPD полученного образца соединения формулы (I) соответствовала типовой дифракционной картине формы A.
К полученному твердому веществу добавляли очищенную воду (44,6 кг, 10 объемов) и предварительно профильтрованный 2-пропанол (3,0 кг, 0,8 объема). После перемешивания в течение примерно 6 ч, образец твердого вещества из суспензии анализировали XRPD, и полученная рентгенограмма соответствовала типовой рентгенограмме формы C. Твердые вещества отделяли вакуумным фильтрованием через 24” полипропиленовый настольный фильтр, снабженный бумагой Sharkskin, поверх которой находилась фторопластовая сетка, и слой осадка промывали очищенной водой (22,35 кг, 5 объемов) и затем предварительно профильтрованным н-гептаном (9,15 кг, 3 объема). После выдерживания осадка в течение примерно 18 ч, слой осадка высушивали в вакууме в течение примерно 5 дней при 50±5°C.
Описанный способ позволял получить соединение формулы (I) с чистотой примерно 99,6% (AUC) и хиральной чистотой более примерно 99% (AUC). Рентгенограмма XRPD твердого вещества соответствовала типовой рентгенограмме формы C. Спектры1H ЯМР (ДМСО-d6) и ИК соответствовали стандартным спектрам.
Пример 8: Данные физико-химического исследования (S)-3-(1-(9H-пурин-6-иламино)этил)-8-хлор-2-фенилизохинолин-1(2H)-она
В этом примере приведены аналитические данные для различных очищенных образцов (S)-3-(1-(9H-пурин-6-иламино)этил)-8-хлор-2-фенилизохинолин-1(2H)-она, т.е. соединения формулы (I). Подтверждение структуры соединения формулы (I) получали дифракцией рентгеновских лучей на монокристаллах, спектрами Фурье-ИК,1H ЯМР и13C ЯМР.
Получали монокристаллы сольвата трет-бутилметилового эфира с (S)-3-(1-(9H-пурин-6-иламино)этил)-8-хлор-2-фенилизохинолин-1(2H)-оном (например, полиморфной формой G) и регистрировали данные дифракции рентгеновских лучей на монокристалле. Структура приведена на фиг.26, и она дополнительно подтверждает, что абсолютная конфигурация соединения соответствует S-энантиомеру.
Регистрировали Фурье-ИК спектр формы C (S)-3-(1-(9H-пурин-6-иламино)этил)-8-хлор-2-фенилизохинолин-1(2H)-она, который приведен на Фиг.27.
Регистрировали1H-ЯМР и13C-ЯМР спектры формы C (S)-3-(1-(9H-пурин-6-иламино)этил)-8-хлор-2-фенилизохинолин-1(2H)-она, которые приведены на Фиг.28 и Фиг.29, соответственно.
Пример 9: Общие методики получения полиморфных форм A, B, C, D, E, F, G, H, I, J соединения формулы (I)
Общая методика A: Кристаллизация из системы с одним растворителем при быстром охлаждении или медленном охлаждении
Образец соединения формулы (I) (например, полиморфную форму A или полиморфную форму C) помещают во флакон, в котором находится якорь магнитной мешалки, и растворяют в минимальном количестве растворителя (например, приблизительно от 0,2 мл до 0,3 мл) при повышенной температуре. Полученный раствор фильтруют через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый флакон. После горячего фильтрования, флакон помещают на ночь в холодильник (с температурой, например, приблизительно 4°C) в методике быстрого охлаждения, или охлаждают до комнатной температуры со скоростью примерно 20°C/ч и дают прийти в температурное равновесие без перемешивания при комнатной температуре в течение ночи в методике медленного охлаждения. Образец, не содержащий твердых частиц, необязательно можно царапать устройством, известным в технике (например, шпателем), чтобы инициировать кристаллизацию. Раствор можно оставить для установления равновесия в течение определенного периода времени, например, приблизительно 8 часов. Для образца, который обрабатывают по методике медленного охлаждения, если царапание не привело к образованию твердого вещества через 8 часов, во флакон с образцом можно поместить якорь магнитной мешалки и перемешивать образец в течение ночи. Образец, в котором не происходит образования твердого вещества, можно выпаривать досуха в слабом токе газа, например, аргона, азота, воздуха и т.д. Выпавшее в осадок твердое вещество можно выделить вакуумным фильтрованием, фильтрованием центрифугированием или декантацией, с получением указанных ниже форм.
Общая методика B: Кристаллизация из системы с несколькими растворителями при быстром охлаждении или медленном охлаждении
Кристаллизацию можно проводить из системы с несколькими растворителями (например, из системы с двумя растворителями). Основные растворители включают, не ограничиваясь этим, этанол, изопропиловый спирт, метанол, тетрагидрофуран, ацетон, метилэтилкетон, диоксан, NMP, DME и ДМФА. Антирастворители включают, не ограничиваясь этим, MTBE, DCM, толуол, гептан и воду.
Образец соединения формулы (I) (например, образец формы A или формы C) помещают во флакон, снабженный якорем магнитной мешалки, и растворяют в минимальном количестве растворителя (например, от примерно 0,2 мл до примерно 0,3 мл) при повышенной температуре. Полученный раствор фильтруют через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый флакон. После фильтрования при повышенной температуре, добавляют антирастворитель до появления помутнения. После фильтрования при повышенной температуре, флакон помещают на ночь в холодильник (с температурой, например, приблизительно 4°C) в методике быстрого охлаждения, или охлаждают до комнатной температуры со скоростью примерно 20°C/ч и дают прийти в температурное равновесие без перемешивания при комнатной температуре в течение ночи в методике медленного охлаждения. Образец, не содержащий твердых частиц, необязательно можно царапать устройством, известным в технике (например, шпателем), чтобы инициировать кристаллизацию. Раствор можно оставить для установления равновесия в течение определенного периода времени, например, приблизительно 8 часов. Для образца, который обрабатывают по методике медленного охлаждения, если царапание не привело к образованию твердого вещества через 8 часов, во флакон с образцом можно поместить якорь магнитной мешалки и перемешивать образец в течение ночи. Образец, в котором не происходит образования твердого вещества, можно выпаривать досуха в слабом токе газа, например, аргона, азота, воздуха и т.д. Выпавшее в осадок твердое вещество можно выделить вакуумным фильтрованием, фильтрованием центрифугированием или декантацией для получения указанных ниже форм.
Общая методика C: Методики получения полиморфных форм соединения формулы (I), связанные с получением суспензий
Смесь одной или нескольких форм (например, формы A или формы C) соединения формулы (I) помещают в сосуд, снабженный якорем магнитной мешалки. В сосуд помещают минимальное количество растворителя (например, одного растворителя или смеси/раствора двух или нескольких растворителей) для получения гетерогенной суспензии. Для предотвращения испарения сосуд можно плотно закрыть. Суспензию перемешивают в течение периода времени в пределах от менее примерно часа, до примерно 6 часов, до примерно 12 часов, до примерно 24 часов, до примерно 2 дней, до примерно 4 дней, до примерно 1 недели, до примерно 1,5 недель, до примерно 2 недель или более. Во время перемешивания можно отбирать аликвоты смеси для определения формы твердого вещества с помощью, например, XRPD анализа. Во время перемешивания необязательно можно добавлять дополнительный растворитель (растворители). Необязательно, можно добавлять кристаллические затравки той или иной полимерной формы соединения формулы (I). В некоторых случаях суспензию затем перемешивают в течение определенного периода времени, находящегося в указанных выше пределах. Образовавшееся твердое вещество можно выделять вакуумным фильтрованием, фильтрованием при центрифугировании или декантировать, смотря по тому, какая методика более целесообразна, получая показанные ниже формы.
Пример 10: Получение полиморфных форм A, B, C, D, E, F, G, H, I, J соединения формулы (I)
Форма A: Кристаллизация из системы с одним растворителем для получения формы A соединения формулы (I)
1. Методика быстрого охлаждения при кристаллизации из MeCN: приблизительно 23 мг формы A соединения формулы (I) помещали в 20-мл стеклянный флакон, снабженный якорем магнитной мешалки. В сосуд добавляли минимальное количество ацетонитрила (7,4 мл) для того, чтобы твердое вещество только-только растворилось при 70°C. Полученный раствор фильтровали через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый сосуд. После фильтрования при повышенной температуре, сосуд помещали в холодильник (4°C) на ночь. При температуре 4°C содержимое сосуда периодически царапали шпателем, чтобы вызвать кристаллизацию, и затем давали прийти в равновесие в течение примерно 8 часов. Кристаллы собирали, удаляя жидкость декантацией, и высушивали в вакууме (30 дюймов Hg) при комнатной температуре в течение ночи. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой A.
2. Методика медленного охлаждения при кристаллизации из MeCN: приблизительно 24 мг формы A соединения формулы (I) помещали в 20-мл стеклянный флакон, снабженный якорем магнитной мешалки. В сосуд добавляли минимальное количество ацетонитрила (8 мл) для того, чтобы твердое вещество только-только растворилось при 70°C. Полученный раствор фильтровали через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый сосуд. После фильтрования при повышенной температуре, сосуд охлаждали до комнатной температуры со скоростью 20°C/ч, и давали прийти в равновесие без перемешивания при комнатной температуре, в течение ночи. После достижения равновесия при комнатной температуре, содержимое сосуда периодически царапали шпателем, чтобы вызвать кристаллизацию, и затем давали прийти в равновесие в течение примерно 8 часов. Кристаллы собирали, удаляя жидкость декантацией, и высушивали в вакууме (30 дюймов Hg) при комнатной температуре в течение ночи. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой A.
3. Методика медленного охлаждения при кристаллизации из н-бутанола: приблизительно 23 мг формы A соединения формулы (I) помещали в 2-драхмовый стеклянный флакон, снабженный якорем магнитной мешалки. В сосуд добавляли минимальное количество н-бутанола (0,6 мл) для того, чтобы твердое вещество только-только растворилось при 70°C. Полученный раствор фильтровали через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый сосуд. После фильтрования при повышенной температуре, сосуд охлаждали до комнатной температуры со скоростью 20°C/ч и давали прийти в равновесие без перемешивания при комнатной температуре в течение ночи. После достижения равновесия при комнатной температуре, содержимое флакона периодически царапали шпателем, чтобы вызвать кристаллизацию, и затем давали прийти в равновесие в течение примерно 8 часов. Для дальнейшего стимулирования кристаллизации, во флакон дополнительно помещали якорь магнитной мешалки и перемешивали содержимое в течение ночи. Полученные кристаллы собирали фильтрованием, и высушивали в вакууме (30 дюймов Hg) при комнатной температуре в течение ночи. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой A.
Кристаллизация из системы с двумя растворителями с получением формы A соединения формулы (I)
1. Методика быстрого охлаждения при кристаллизации из системы ацетон/DCM: приблизительно 23,5 мг формы A соединения формулы (I) помещали в 2-драхмовый стеклянный флакон, снабженный якорем магнитной мешалки. В сосуд добавляли минимальное количество ацетона (2,6 мл) для того, чтобы твердое вещество только-только растворилось при 50°C. Полученный раствор фильтровали через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый флакон. После фильтрования при повышенной температуре, порциями добавляли DCM (5,0 мл). После добавления антирастворителя, флакон помещали в холодильник (4°C) на ночь. При температуре 4°C содержимое флакона периодически царапали шпателем, чтобы вызвать кристаллизацию и затем давали прийти в равновесие в течение примерно 8 часов. Кристаллы собирали фильтрованием, и высушивали в вакууме (30 дюймов Hg) при комнатной температуре в течение ночи. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой A.
2. Методика быстрого охлаждения при кристаллизации из системы MEK/DCM: приблизительно 23 мг формы A соединения формулы (I) помещали в 2-драхмовый стеклянный флакон, снабженный якорем магнитной мешалки. Во флакон добавляли минимальное количество MEK (2,2 мл) для того, чтобы твердое вещество только-только растворилось при 70°C. Полученный раствор фильтровали через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый флакон. После фильтрования при повышенной температуре, порциями добавляли DCM (5,0 мл). После добавления антирастворителя, флакон помещали в холодильник (4°C) на ночь. При температуре 4°C содержимое флакона периодически царапали шпателем, чтобы вызвать кристаллизацию и затем давали прийти в равновесие в течение примерно 8 часов. Кристаллы собирали фильтрованием, и высушивали в вакууме (30 дюймов Hg) при комнатной температуре в течение ночи. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой A.
3. Методика быстрого охлаждения при кристаллизации из системы ДМФА/DCM: приблизительно 24 мг формы A соединения формулы (I) помещали в 2-драхмовый стеклянный флакон, снабженный якорем магнитной мешалки. Во флакон добавляли минимальное количество ДМФА (0,2 мл) для того, чтобы твердое вещество только-только растворилось при 70°C. Полученный раствор фильтровали через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый флакон. После фильтрования при повышенной температуре, порциями добавляли DCM (7,0 мл). После добавления антирастворителя, флакон помещали в холодильник (4°C) на ночь. При температуре 4°C содержимое флакона периодически царапали шпателем, чтобы вызвать кристаллизацию, и затем давали прийти в равновесие в течение примерно 8 часов. Кристаллы собирали фильтрованием, и высушивали в вакууме (30 дюймов Hg) при комнатной температуре в течение ночи. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой A.
4. Методика быстрого охлаждения при кристаллизации из системы диоксан/DCM: приблизительно 24,4 мг формы A соединения формулы (I) помещали в 2-драхмовый стеклянный флакон, снабженный якорем магнитной мешалки. Во флакон добавляли минимальное количество диоксана (0,8 мл) для того, чтобы твердое вещество только-только растворилось при 70°C. Полученный раствор фильтровали через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый флакон. После фильтрования при повышенной температуре, порциями добавляли DCM (7,0 мл). После добавления антирастворителя, флакон помещали в холодильник (4°C) на ночь. При температуре 4°C содержимое флакона периодически царапали шпателем, чтобы вызвать кристаллизацию, и затем давали прийти в равновесие в течение примерно 8 часов. Кристаллы собирали фильтрованием, и высушивали в вакууме (30 дюймов Hg) при комнатной температуре в течение ночи. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой A.
5. Методика медленного охлаждения при кристаллизации из системы ацетон/DCM: приблизительно 22 мг формы A соединения формулы (I) помещали в 2-драхмовый стеклянный флакон, снабженный якорем магнитной мешалки. В сосуд добавляли минимальное количество ацетона (2,5 мл) для того, чтобы твердое вещество только-только растворилось при 50°C. Полученный раствор фильтровали через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый флакон. После фильтрования при повышенной температуре, порциями добавляли DCM (5,0 мл). После добавления антирастворителя, флакон охлаждали до комнатной температуры со скоростью 20°C/ч, и давали прийти в равновесие без перемешивания при комнатной температуре, в течение ночи. После достижения равновесия при комнатной температуре, содержимое флакона периодически царапали шпателем, чтобы вызвать кристаллизацию, и затем давали прийти в равновесие в течение примерно 8 часов. Далее, для дополнительного стимулирования кристаллизации, во флакон помещали якорь магнитной мешалки, и перемешивали содержимое в течение ночи. Полученные кристаллы собирали фильтрованием, и высушивали в вакууме (30 дюймов Hg) при комнатной температуре в течение ночи. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой A.
6. Методика медленного охлаждения при кристаллизации из системы MEK/DCM: приблизительно 23,4 мг формы A соединения формулы (I) помещали в 2-драхмовый стеклянный флакон, снабженный якорем магнитной мешалки. В сосуд добавляли минимальное количество MEK (2,2 мл) для того, чтобы твердое вещество только-только растворилось при 70°C. Полученный раствор фильтровали через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый флакон. После фильтрования при повышенной температуре, порциями добавляли DCM (5,0 мл). После добавления антирастворителя, флакон охлаждали до комнатной температуры со скоростью 20°C/ч и давали прийти в равновесие без перемешивания при комнатной температуре в течение ночи. После достижения равновесия при комнатной температуре, содержимое флакона периодически царапали шпателем, чтобы вызвать кристаллизацию, и затем давали прийти в равновесие в течение примерно 8 часов. Полученные кристаллы собирали фильтрованием, и высушивали в вакууме (30 дюймов Hg) при комнатной температуре в течение ночи. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой A.
7. Методика медленного охлаждения при кристаллизации из системы диоксан/DCM: приблизительно 24 мг формы A соединения формулы (I) помещали в 2-драхмовый стеклянный флакон, снабженный якорем магнитной мешалки. В сосуд добавляли минимальное количество диоксана (0,8 мл) для того, чтобы твердое вещество только-только растворилось при 70°C. Полученный раствор фильтровали через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый флакон. После фильтрования при повышенной температуре, порциями добавляли DCM (7,0 мл). После добавления антирастворителя, флакон охлаждали до комнатной температуры со скоростью 20°C/ч, и давали прийти в равновесие без перемешивания, при комнатной температуре в течение ночи. После достижения равновесия при комнатной температуре, содержимое флакона периодически царапали шпателем, чтобы вызвать кристаллизацию, и затем давали прийти в равновесие в течение примерно 8 часов. Далее, для дополнительного стимулирования кристаллизации во флакон помещали якорь магнитной мешалки, и перемешивали содержимое в течение ночи. Полученные кристаллы собирали фильтрованием, и высушивали в вакууме (30 дюймов Hg) при комнатной температуре в течение ночи. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой A.
8. Методика медленного охлаждения при кристаллизации из системы ДМФА/DCM: приблизительно 23,5 мг формы A соединения формулы (I) помещали в 2-драхмовый стеклянный флакон, снабженный якорем магнитной мешалки. В сосуд добавляли минимальное количество ДМФА (0,2 мл) для того, чтобы твердое вещество только-только растворилось при 70°C. Полученный раствор фильтровали через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый флакон. После фильтрования при повышенной температуре, порциями добавляли DCM (7,0 мл). После добавления антирастворителя, флакон охлаждали до комнатной температуры со скоростью 20°C/ч, и давали прийти в равновесие без перемешивания при комнатной температуре, в течение ночи. После достижения равновесия при комнатной температуре, содержимое флакона периодически царапали шпателем, чтобы вызвать кристаллизацию, и затем давали прийти в равновесие в течение примерно 8 часов. Далее, для дополнительного стимулирования кристаллизации во флакон помещали якорь магнитной мешалки, и перемешивали содержимое в течение ночи. После этого, чтобы вызвать кристаллизацию, содержимое флакона концентрировали с помощью слабого тока азота почти досуха. Полученные кристаллы собирали фильтрованием, и высушивали в вакууме (30 дюймов Hg) при комнатной температуре в течение ночи. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой A.
Методика получения формы A соединения формулы (I) с использованием суспензии
1. Методика с использованием CH2Cl2 и IPA: Форму C (1 г) суспендировали в пяти объемах дихлорметана. После выдерживания в течение 15 часов, фильтрования и высушивания, выделяли форму A с выходом 82%. Эту же методику реализовывали в большем масштабе, используя в качестве исходного вещества 20 г влажного осадка формы C и получая форму A с выходом 92%. Высушивание при 70°C в течение шести дней не привело к ухудшению химической или хиральной чистоты. Суспендирование сухой формы C в изопропиловом спирте, с использованием аналогичной методики также привело к образованию формы A.
2. Методика проведения эксперимента по конкурентному образованию полиморфных форм в суспензии (с использованием форм A, B и C): Эксперименты по конкурентному образованию различных полиморфных форм в суспензии проводили, помещая смесь форм A и C в соотношении примерно 50/50 (11,2 мг формы A и 11,7 мг формы C) в 1-драхмовый стеклянный флакон, в котором находился стеклянный якорь магнитной мешалки. В этот флакон добавляли 600 мкл MeCN. Крышку флакона оборачивали парафинированной лентой для предотвращения испарения. Суспензию перемешивали в течение 1 дня и отбирали аликвоту. Содержимое флакона оставляли перемешиваться в течение еще одной недели и отбирали еще одну аликвоту. Обе аликвоты фильтровали центрифугированием в течение 5 минут при 8000 об/мин. Твердые вещества из каждой аликвоты анализировали XRPD, и анализ показал, что в оба момента времени соединение формулы (I) полностью превращалось в полиморфную форму A. После отбора последней аликвоты, к оставшейся суспензии добавляли еще 300 мкл ацетонитрила и давали прийти в равновесие в течение одного дня. В полученную суспензию вносили примерно 3,2 мг полиморфной формы B и давали прийти в равновесие в течение еще трех дней. Твердое вещество отделяли фильтрованием на центрифуге (5 минут при 8000 об/мин) и высушивали в течение ночи в вакууме. Исследовали кристаллический характер и форму высушенного твердого вещества с помощью методики XRPD, которая показала, что кристаллическое вещество является полиморфной формой A.
3. Методика проведения эксперимента по конкурентному образованию полиморфных форм в суспензии (с использованием форм A, C, D и E): Эксперименты по конкурентному образованию различных полиморфных форм в суспензии проводили, помещая смесь каждой из указанной форм в примерно равных количествах (7,8 мг формы A, 7,7 мг формы C, 7,7 мг формы D и 8,2 мг формы E) в 1-драхмовый стеклянный флакон, в котором находился стеклянный якорь магнитной мешалки. В этот флакон добавляли 1 мл 2-пропанола. Крышку флакона оборачивали парафинированной лентой для предотвращения испарения. Суспензию перемешивали в течение 1 дня и отбирали аликвоту. Содержимое флакона оставляли перемешиваться в течение еще одной недели и отбирали еще одну аликвоту. Обе аликвоты фильтровали центрифугированием в течение 5 минут при 8000 об/мин. Твердые вещества из каждой аликвоты анализировали XRPD, и анализ показал, что в оба момента времени соединение формулы (I) полностью превращалось в полиморфную форму A. После отбора последней аликвоты, оставшееся твердое вещество выделяли фильтрованием на центрифуге (5 минут при 8000 об/мин) и высушивали в течение ночи в вакууме. Исследовали кристаллический характер и форму высушенного твердого вещества с помощью методики XRPD, которая показала, что кристаллическое вещество является полиморфной формой A.
Форма B
В тигель прибора для термогравиметрического анализа (TGA) помещали 15-20 мг формы A соединения формулы (I). Аналогичным образом в этой методике можно использовать форму C. Кристаллический образец быстро нагревали до 250°C, и выдерживали при этой температуре внутри прибора для TGA в течение 5 минут. По окончании выдерживания, образец охлаждали до комнатной температуры с максимально возможной скоростью. Исследовали кристаллический характер и форму полученного образца с помощью методики XRPD, которая показала, что кристаллическое вещество является полиморфной формой B.
Форма C
Кристаллизация из системы с двумя растворителями для получения формы C соединения формулы (I)
Используя общую методику B примера 9, проводили следующие эксперименты, показанные в таблицах 1 и 2, получая форму C соединения формулы (I). Эксперименты, отображенные в таблице 1, проводили с помощью методики быстрого охлаждения, в то время как эксперименты таблицы 2 проводили по методике медленного охлаждения.
Методика получения формы C соединения формулы (I) с использованием суспензии
1. Методика проведения эксперимента по конкурентному образованию полиморфных форм в суспензии (с использованием форм A, C, D и E): Эксперименты по конкурентному образованию различных полиморфных форм в суспензии проводили, помещая смесь каждой из указанной форм в примерно равных количествах (7,9 мг формы A, 7,8 мг формы C, 7,8 мг формы D и 8,1 мг формы E) в 1-драхмовый стеклянный флакон, в котором находился стеклянный якорь магнитной мешалки. В этот флакон добавляли 1 мл воды. Крышку флакона оборачивали парафинированной лентой для предотвращения испарения. Суспензию перемешивали в течение 1 дня и отбирали аликвоту. Содержимое флакона оставляли перемешиваться в течение еще одной недели и отбирали еще одну аликвоту. Обе аликвоты фильтровали центрифугированием в течение пяти минут при 8000 об/мин. Твердые вещества из каждой аликвоты анализировали XRPD, и анализ показал, что в оба момента времени соединение формулы (I) полностью превращалось в полиморфную форму C. После отбора последней аликвоты, оставшееся твердое вещество выделяли фильтрованием на центрифуге (5 минут при 8000 об/мин) и высушивали в течение ночи в вакууме. Исследовали кристаллический характер, и форму высушенного твердого вещества с помощью методики XRPD, которая показала, что кристаллическое вещество является полиморфной формой C.
2. Методика проведения эксперимента по конкурентному образованию полиморфных форм в суспензии (с использованием форм B и C): Примерно 4,9 мг формы C помещали в 1-драхмовый флакон, в котором находился якорь магнитной мешалки. В этот флакон добавляли 0,3 мл воды, получая суспензию, которой давали прийти в равновесие в течение примерно 24 часов при комнатной температуре. Во флакон добавляли примерно равное количество (приблизительно 5,4 мг) формы B и давали суспензии прийти в равновесие в течение четырех дней при комнатной температуре. Полученное твердое вещество выделяли фильтрованием на центрифуге (5 минут при 8000 об/мин) и высушивали в вакууме в течение ночи. Исследовали кристаллический характер и форму высушенного твердого вещества с помощью методики XRPD, которая показала, что кристаллическое вещество является полиморфной формой C.
3. Методика проведения эксперимента по конкурентному образованию полиморфных форм в суспензии (с использованием форм A, B и C): Суспензию для исследования конкурентного образования полиморфных форм получали, помещая смесь форм A и C в соотношении примерно 50/50 (10,6 мг формы A и 12 мг формы C) в 1-драхмовый стеклянный флакон, в котором находится стеклянный якорь магнитной мешалки. Во флакон вводили 600 мкл смеси воды и этанола 50/50 объем/объем. Крышку флакона оборачивали парафинированной лентой для предотвращения испарения. Суспензию перемешивали в течение 1 дня, и отбирали аликвоту. Содержимое флакона оставляли перемешиваться в течение еще одной недели и отбирали еще одну аликвоту. Обе аликвоты фильтровали центрифугированием в течение пяти минут при 8000 об/мин. Твердые вещества из каждой аликвоты анализировали XRPD, и анализ показал, что в оба момента времени соединение формулы (I) полностью превращалось в полиморфную форму C. После отбора последней аликвоты, к оставшейся суспензии добавляли 300 мкл смеси воды и этанола 50/50 объем/объем, и давали прийти в равновесие в течение одного дня. Затем к суспензии добавляли примерно 3,6 мг кристаллических затравок формы B и давали прийти в равновесие в течение еще трех дней, после чего выделяли твердое вещество фильтрованием на центрифуге (5 минут при 8000 об/мин). Твердое вещество высушивали в течение ночи в вакууме при комнатной температуре. Исследовали кристаллический характер и форму высушенного твердого вещества с помощью методики XRPD, которая показала, что кристаллическое вещество является полиморфной формой C.
4. В 22 л круглодонную колбу помещали форму A (S)-3-(1-(9H-пурин-6-иламино)этил)-8-хлор-2-фенилизохинолин-1(2H)-она (1,20 кг) в 1,2 л изопропилового спирта и 12 л DI воды, и перемешивали при 20±5°C. После перемешивания в течение 3 часов, исследование образца с помощью XRPD показало, что образец представляет собой форму C. Смесь фильтровали через воронку Бюхнера, снабженную фильтровальной бумагой shark skin, которую затем промывали DI водой (6 л) и гептаном (3,6 л). Осадок выдерживали в течение 1 часа и высушивали при 50°C в вакуумной печи до постоянной массы, получая соединение формулы (I) в виде формы C (1,18 кг) с выходом 98%. Другие образцы формы C получали, исходя из формы A (S)-3-(1-(9H-пурин-6-иламино)этил)-8-хлор-2-фенилизохинолин-1(2H)-она, изменяя условия описанной методики, как показано в таблице 3:
Форма D:
Кристаллизация из системы с одним растворителем с получением формы D соединения формулы (I)
1. Методика быстрого охлаждения с кристаллизацией из тетрагидрофурана (ТГФ): Приблизительно 23 мг формы A соединения формулы (I) помещали в 2-драхмовый стеклянный флакон, снабженный якорем магнитной мешалки. Во флакон добавляли минимальное количество ТГФ (1,2 мл), чтобы твердое вещество только-только растворилось при 60°C. Полученный раствор фильтровали через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый сосуд. После фильтрования при повышенной температуре, сосуд помещали в холодильник (4°C) на ночь. При 4°C, содержимое флакона периодически царапали шпателем, чтобы вызвать кристаллизацию, и затем давали прийти в равновесие в течение примерно 8 часов. Полученные кристаллы собирали, удаляя жидкость декантацией, и высушивали в вакууме (30 дюймов Hg) при комнатной температуре в течение ночи. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой D.
2. Методика быстрого охлаждения с кристаллизацией из 2-бутанона (MEK): Приблизительно 23 мг формы A соединения формулы (I) помещали в 2-драхмовый стеклянный флакон, снабженный якорем магнитной мешалки. Во флакон добавляли минимальное количество MEK (2,0 мл), чтобы твердое вещество только-только растворилось при 70°C. Полученный раствор фильтровали через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый сосуд. После фильтрования при повышенной температуре, сосуд помещали в холодильник (4°C) на ночь. При 4°C, содержимое флакона периодически царапали шпателем, чтобы вызвать кристаллизацию, и затем давали прийти в равновесие в течение примерно 8 часов. Полученные кристаллы собирали, удаляя жидкость декантацией, и высушивали в вакууме (30 дюймов Hg) при комнатной температуре в течение ночи. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой D.
3. Методика быстрого охлаждения с кристаллизацией из диоксана: Приблизительно 25 мг формы A соединения формулы (I) помещали в 2-драхмовый стеклянный флакон, снабженный якорем магнитной мешалки. Во флакон добавляли минимальное количество диоксана (1,5 мл), чтобы твердое вещество только-только растворилось при 70°C. Полученный раствор фильтровали через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый сосуд. После фильтрования при повышенной температуре, сосуд помещали в холодильник (4°C) на ночь. При 4°C, содержимое флакона периодически царапали шпателем, чтобы вызвать кристаллизацию, и затем давали прийти в равновесие в течение примерно 8 часов. Далее, для стимулирования кристаллизации содержимое флакона упаривали почти досуха под действием слабого тока азота. Полученные кристаллы собирали, удаляя декантацией всю оставшуюся жидкость, и высушивали в вакууме (30 дюймов Hg) при комнатной температуре в течение ночи. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой D.
4. Методика быстрого охлаждения с кристаллизацией из N,N-диметилформамида (ДМФА): Приблизительно 25 мг формы A соединения формулы (I) помещали в 2-драхмовый стеклянный флакон, снабженный якорем магнитной мешалки. В сосуд добавляли минимальное количество ДМФА (0,3 мл), чтобы твердое вещество только-только растворилось при 70°C. Полученный раствор фильтровали через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый сосуд. После фильтрования при повышенной температуре, сосуд помещали в холодильник (4°C) на ночь. При 4°C, содержимое флакона периодически царапали шпателем, чтобы вызвать кристаллизацию, и затем давали прийти в равновесие в течение примерно 8 часов. Далее, для стимулирования кристаллизации содержимое флакона упаривали почти досуха под действием слабого тока азота. Полученные кристаллы собирали, удаляя декантацией всю оставшуюся жидкость, и высушивали в вакууме (30 дюймов Hg) при комнатной температуре в течение ночи. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой D.
5. Методика медленного охлаждения с кристаллизацией из тетрагидрофурана (ТГФ): Приблизительно 25 мг формы A соединения формулы (I) помещали в 2-драхмовый стеклянный флакон, снабженный якорем магнитной мешалки. Во флакон добавляли минимальное количество ТГФ (1,1 мл), чтобы твердое вещество только-только растворилось при 60°C. Полученный раствор фильтровали через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый сосуд. После фильтрования при повышенной температуре, сосуд охлаждали до комнатной температуры со скоростью 20°C/ч, и давали прийти в равновесие без перемешивания при комнатной температуре, в течение ночи. После достижения равновесия при комнатной температуре, содержимое флакона периодически царапали шпателем, чтобы вызвать кристаллизацию, и затем давали прийти в равновесие в течение примерно 8 часов. Полученные кристаллы собирали, удаляя жидкость декантацией, и высушивали в вакууме (30 дюймов Hg) при комнатной температуре в течение ночи. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой D.
6. Методика медленного охлаждения с кристаллизацией из 2-бутанона (MEK): Приблизительно 24,5 мг формы A соединения формулы (I) помещали в 2-драхмовый стеклянный флакон, снабженный якорем магнитной мешалки. Во флакон добавляли минимальное количество MEK (4 мл), чтобы твердое вещество только-только растворилось при 70°C. Полученный раствор фильтровали через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый сосуд. После фильтрования при повышенной температуре, сосуд охлаждали до комнатной температуры со скоростью 20°C/ч и давали прийти в равновесие без перемешивания при комнатной температуре в течение ночи. После достижения равновесия при комнатной температуре, содержимое флакона периодически царапали шпателем, чтобы вызвать кристаллизацию, и затем давали прийти в равновесие в течение примерно 8 часов. Полученные кристаллы собирали, удаляя жидкость декантацией, и высушивали в вакууме (30 дюймов Hg) при комнатной температуре в течение ночи. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой D.
7. Методика медленного охлаждения с кристаллизацией из диоксана: Приблизительно 24 мг формы A соединения формулы (I) помещали в 2-драхмовый стеклянный флакон, снабженный якорем магнитной мешалки. Во флакон добавляли минимальное количество диоксана (1,1 мл), чтобы твердое вещество только-только растворилось при 70°C. Полученный раствор фильтровали через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый сосуд. После фильтрования при повышенной температуре, сосуд охлаждали до комнатной температуры со скоростью 20°C/ч, и давали прийти в равновесие без перемешивания при комнатной температуре в течение ночи. После достижения равновесия при комнатной температуре, содержимое флакона периодически царапали шпателем, чтобы вызвать кристаллизацию, и затем давали прийти в равновесие в течение примерно 8 часов. Полученные кристаллы собирали, удаляя жидкость декантацией, и высушивали в вакууме (30 дюймов Hg) при комнатной температуре в течение ночи. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой D.
Кристаллизация из системы с двумя растворителями с получением формы D соединения формулы (I)
Применяя общую методику B примера 9, проводили эксперименты, позволявшие получить форму D соединения формулы (I), результаты которых более подробно показаны в Таблицах 4 и 5. В Таблице 4 показаны результаты экспериментов, в которых применялась методика быстрого охлаждения, тогда как в Таблице 5 показаны результаты экспериментов, в которых применялась методика медленного охлаждения.
Методика получения формы D соединения формулы (I) с использованием суспензии
1. Приблизительно 122 мг формы A соединения формулы (I) помещали в 8-мл флакон, снабженный якорем магнитной мешалки. Во флакон добавляли 3,0 мл 2-бутанона (MEK) с получением суспензии. Содержимое сосуда нагревали до 50°C, и выдерживали в течение примерно 1,5 часов. После выдерживания, содержимое сосуда медленно охлаждали со скоростью 20°C/ч до комнатной температуры. Затем смесь оставляли перемешиваться в течение ночи. Продукт выделяли вакуумным фильтрованием и высушивали в течение ночи в вакууме. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой D.
2. Методика проведения эксперимента по конкурентному образованию полиморфных форм в суспензии (с использованием форм A, B и C): Эксперименты по конкурентному образованию различных полиморфных форм в суспензии проводили, помещая смесь форм A и C в соотношении примерно 50/50 (10,3 мг формы A и 11,7 мг формы C) в 1-драхмовый стеклянный флакон, в котором находился стеклянный якорь магнитной мешалки. В этот флакон добавляли 600 мкл MEK. Крышку флакона оборачивали парафинированной лентой для предотвращения испарения. Суспензию перемешивали в течение 1 дня и отбирали аликвоту. Содержимое флакона оставляли перемешиваться в течение еще одной недели, и отбирали еще одну аликвоту. Обе аликвоты фильтровали центрифугированием в течение 5 минут при 8000 об/мин. Твердые вещества из каждой аликвоты анализировали XRPD, и анализ показал, что в оба момента времени соединение формулы (I) полностью превращалось в полиморфную форму D. После отбора последней аликвоты, к оставшейся суспензии добавляли еще 300 мкл MEK, и давали прийти в равновесие в течение одного дня. В полученную суспензию вносили примерно 4,5 мг полиморфной формы B и давали прийти в равновесие в течение еще трех дней, после чего твердое вещество отделяли фильтрованием на центрифуге (5 минут при 8000 об/мин). Твердое вещество высушивали в течение ночи в вакууме при комнатной температуре. Исследовали кристаллический характер и форму высушенного твердого вещества с помощью методики XRPD, которая показала, что кристаллическое вещество является полиморфной формой D.
3. Методика проведения эксперимента по конкурентному образованию полиморфных форм в суспензии (с использованием форм B и D): Примерно 6 мг формы D соединения формулы (I) помещали в 1-драхмовый флакон, в котором находился якорь магнитной мешалки. В этот флакон добавляли 0,3 мл MEK, получая суспензию, которой давали прийти в равновесие в течение примерно 24 часов при комнатной температуре. Во флакон добавляли примерно равное количество (приблизительно 6 мг) формы B и давали суспензии прийти в равновесие в течение четырех дней при комнатной температуре. Полученное твердое вещество выделяли фильтрованием на центрифуге (5 минут при 8000 об/мин) и высушивали в вакууме в течение ночи. Исследовали кристаллический характер и форму высушенного твердого вещества с помощью методики XRPD, которая показала, что кристаллическое вещество является полиморфной формой D.
Формы A, C и D
Методика получения форм A, C и D соединения формулы (I) с использованием суспензии
Используя общую методику C примера 9, осуществляли эксперименты по получению соответствующих полиморфных форм соединения формулы (I), результаты которых более подробно изложены в таблице 6:
Форма F
Кристаллизация из системы с одним растворителем для получения формы E соединения формулы (I)
Методика медленного охлаждения с кристаллизацией из метанола: Приблизительно 23,5 мг формы A соединения формулы (I) помещали в 2-драхмовый стеклянный флакон, снабженный якорем магнитной мешалки. Во флакон добавляли минимальное количество метанола (0,53 мл), чтобы твердое вещество только-только растворилось при 60°C. Полученный раствор фильтровали через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый сосуд. После фильтрования при повышенной температуре, сосуд охлаждали до комнатной температуры со скоростью 20°C/ч и давали прийти в равновесие без перемешивания при комнатной температуре в течение ночи. После достижения равновесия при комнатной температуре, собирали кристаллы, удаляя жидкость декантацией, и высушивали в вакууме (30 дюймов Hg) при комнатной температуре в течение ночи. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой E.
Кристаллизация из системы с двумя растворителями для получения формы E соединения формулы (I)
1. Методика быстрого охлаждения с кристаллизацией из смеси метанол/вода: приблизительно 23,4 мг формы A соединения формулы (I) помещали в 2-драхмовый стеклянный флакон, снабженный якорем магнитной мешалки. Во флакон добавляли минимальное количество метанола (0,6 мл) для того, чтобы твердое вещество только-только растворилось при 60°C. Полученный раствор фильтровали через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый флакон. После фильтрования при повышенной температуре, порциями добавляли воду (0,85 мл). После добавления антирастворителя, флакон помещали в холодильник (4°C) на ночь. Кристаллы собирали фильтрованием, и высушивали в вакууме (30 дюймов Hg) при комнатной температуре в течение ночи. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой E.
2. Методика медленного охлаждения при кристаллизации из системы метанол/вода: приблизительно 23 мг формы A соединения формулы (I) помещали в 2-драхмовый стеклянный флакон, снабженный якорем магнитной мешалки. В сосуд добавляли минимальное количество метанола (0,6 мл) для того, чтобы твердое вещество только-только растворилось при 60°C. Полученный раствор фильтровали через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый флакон. После фильтрования при повышенной температуре, порциями добавляли воду (0,83 мл). После добавления антирастворителя, флакон охлаждали до комнатной температуры со скоростью 20°C/ч, и давали прийти в равновесие без перемешивания при комнатной температуре в течение ночи. Полученные кристаллы собирали фильтрованием, и высушивали в вакууме (30 дюймов Hg) при комнатной температуре в течение ночи. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой E.
Методика получения формы E соединения формулы (I) с использованием суспензии
1. Приблизительно 127 мг формы A соединения формулы (I) помещали в 8-мл флакон, снабженный якорем магнитной мешалки. Во флакон добавляли 3,0 мл метанола с получением суспензии. Содержимое сосуда нагревали до 50°C, и выдерживали в течение примерно 1,5 часов. После выдерживания, содержимое сосуда медленно охлаждали со скоростью 20°C/ч до комнатной температуры. Затем смесь оставляли перемешиваться в течение ночи. Продукт выделяли вакуумным фильтрованием и высушивали в течение ночи в вакууме. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой E.
2. Приблизительно 5,6 мг формы E соединения формулы (I) помещали в 1-драхмовый флакон, снабженный якорем магнитной мешалки. Во флакон добавляли 0,3 мл метанола с получением суспензии, и этой суспензии давали прийти в равновесие в течение примерно 24 часов при комнатной температуре. Во флакон добавляли примерно эквивалентное количество (примерно 5,7 мг) формы B и давали прийти в равновесие в течение четырех дней при комнатной температуре. Полученное твердое вещество выделяли фильтрованием на центрифуге (5 минут при 8000 об/мин) и высушивали в течение ночи в вакууме. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой E.
Форма F
Кристаллизация из системы с двумя растворителями для получения формы F соединения формулы (I)
1. Методика быстрого охлаждения с кристаллизацией из смеси NMP/MTBE: приблизительно 23 мг формы A соединения формулы (I) помещали в 2-драхмовый стеклянный флакон, снабженный якорем магнитной мешалки. Во флакон добавляли минимальное количество NMP (0,2 мл) для того, чтобы твердое вещество только-только растворилось при 70°C. Полученный раствор фильтровали через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый флакон. После фильтрования при повышенной температуре, порциями добавляли MTBE (1,0 мл). После добавления антирастворителя, флакон помещали в холодильник (4°C) на ночь. Кристаллы собирали фильтрованием, и высушивали в вакууме (30 дюймов Hg) при комнатной температуре в течение ночи. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой F.
2. Методика медленного охлаждения при кристаллизации из системы NMP/MTBE: приблизительно 23 мг формы A соединения формулы (I) помещали в 2-драхмовый стеклянный флакон, снабженный якорем магнитной мешалки. В сосуд добавляли минимальное количество NMP (0,2 мл) для того, чтобы твердое вещество только-только растворилось при 70°C. Полученный раствор фильтровали через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый флакон. После фильтрования при повышенной температуре, порциями добавляли MTBE (1,0 мл). После добавления антирастворителя, флакон охлаждали до комнатной температуры со скоростью 20°C/ч и давали прийти в равновесие без перемешивания при комнатной температуре в течение ночи. Полученные кристаллы собирали фильтрованием, и высушивали в вакууме (30 дюймов Hg) при комнатной температуре в течение ночи. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой F.
Форма G
Кристаллизация из системы с двумя растворителями с получением формы G соединения формулы (I)
1. Методика быстрого охлаждения с кристаллизацией из смеси этанол/MTBE: приблизительно 24,3 мг формы A соединения формулы (I) помещали в 2-драхмовый стеклянный флакон, снабженный якорем магнитной мешалки. Во флакон добавляли минимальное количество этанола (0,78 мл) для того, чтобы твердое вещество только-только растворилось при 70°C. Полученный раствор фильтровали через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый флакон. После фильтрования при повышенной температуре, порциями добавляли MTBE (7,0 мл). После добавления антирастворителя, флакон помещали в холодильник (4°C) на ночь. Когда температура достигала 4°C, содержимое сосуда периодически царапали шпателем, чтобы вызвать кристаллизацию и затем давали прийти в равновесие в течение приблизительно 8 часов. Кристаллы собирали, декантируя всю жидкость, и высушивали в вакууме (30 дюймов Hg) при комнатной температуре в течение ночи. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой G.
2. Методика быстрого охлаждения с кристаллизацией из смеси IPA/MTBE: приблизительно 23,7 мг формы A соединения формулы (I) помещали в 2-драхмовый стеклянный флакон, снабженный якорем магнитной мешалки. Во флакон добавляли минимальное количество IPA (0,60 мл) для того, чтобы твердое вещество только-только растворилось при 70°C. Полученный раствор фильтровали через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый флакон. После фильтрования при повышенной температуре, порциями добавляли MTBE (6,0 мл). После добавления антирастворителя, флакон помещали в холодильник (4°C) на ночь. Когда температура достигала 4°C, содержимое сосуда периодически царапали шпателем, чтобы вызвать кристаллизацию и затем давали прийти в равновесие в течение приблизительно 8 часов. Кристаллы собирали вакуумным фильтрованием и высушивали в вакууме (30 дюймов Hg) при комнатной температуре в течение ночи. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой G.
3. Методика быстрого охлаждения с кристаллизацией из смеси метанол/MTBE: приблизительно 24,3 мг формы A соединения формулы (I) помещали в 2-драхмовый стеклянный флакон, снабженный якорем магнитной мешалки. Во флакон добавляли минимальное количество метанола (0,6 мл) для того, чтобы твердое вещество только-только растворилось при 60°C. Полученный раствор фильтровали через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый флакон. После фильтрования при повышенной температуре, порциями добавляли MTBE (6,0 мл). После добавления антирастворителя, флакон помещали в холодильник (4°C) на ночь. Когда температура достигала 4°C, содержимое сосуда периодически царапали шпателем, чтобы вызвать кристаллизацию и, затем давали прийти в равновесие в течение приблизительно 8 часов. Кристаллы собирали, декантируя всю жидкость, и высушивали в вакууме (30 дюймов Hg) при комнатной температуре в течение ночи. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой G.
Форма H
Кристаллизация из системы с двумя растворителями с получением формы H соединения формулы (I)
Методика медленного охлаждения с кристаллизацией из смеси диоксан/MTBE: приблизительно 23,2 мг формы A соединения формулы (I) помещали в 2-драхмовый стеклянный флакон, снабженный якорем магнитной мешалки. Во флакон добавляли минимальное количество диоксана (0,6 мл) для того, чтобы твердое вещество только-только растворилось при 70°C. Полученный раствор фильтровали через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый флакон. После фильтрования при повышенной температуре, порциями добавляли MTBE (1,0 мл). После добавления антирастворителя, флакон охлаждали до комнатной температуры со скоростью 20°C/ч, и давали прийти в равновесие без перемешивания при комнатной температуре, в течение ночи. Полученные кристаллы собирали фильтрованием и высушивали в вакууме (30 дюймов Hg) при комнатной температуре в течение ночи. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой H.
Форма I
Кристаллизация из системы с двумя растворителями с получением формы I соединения формулы (I)
1. Методика медленного охлаждения с кристаллизацией из смеси ацетон/толуол: приблизительно 23,3 мг формы A соединения формулы (I) помещали в 2-драхмовый стеклянный флакон, снабженный якорем магнитной мешалки. Во флакон добавляли минимальное количество ацетона (2,5 мл) для того, чтобы твердое вещество только-только растворилось при 50°C. Полученный раствор фильтровали через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый флакон. После фильтрования при повышенной температуре, порциями добавляли толуол (5,0 мл). После добавления антирастворителя, флакон охлаждали до комнатной температуры со скоростью 20°C/ч, и давали прийти в равновесие без перемешивания при комнатной температуре, в течение ночи. Полученные кристаллы собирали фильтрованием и высушивали в вакууме (30 дюймов Hg) при комнатной температуре в течение ночи. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой I.
2. Методика медленного охлаждения с кристаллизацией из смеси MEK/толуол: приблизительно 24,1 мг формы A соединения формулы (I) помещали в 2-драхмовый стеклянный флакон, снабженный якорем магнитной мешалки. Во флакон добавляли минимальное количество MEK (2,1 мл) для того, чтобы твердое вещество только-только растворилось при 70°C. Полученный раствор фильтровали через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый флакон. После фильтрования при повышенной температуре, порциями добавляли толуол (6,0 мл). После добавления антирастворителя, флакон охлаждали до комнатной температуры со скоростью 20°C/ч, и давали прийти в равновесие без перемешивания при комнатной температуре, в течение ночи. Полученные кристаллы собирали фильтрованием и высушивали в вакууме (30 дюймов Hg) при комнатной температуре в течение ночи. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой I.
3. Методика медленного охлаждения с кристаллизацией из смеси диоксан/толуол: приблизительно 24,5 мг формы A соединения формулы (I) помещали в 2-драхмовый стеклянный флакон, снабженный якорем магнитной мешалки. Во флакон добавляли минимальное количество диоксана (0,8 мл) для того, чтобы твердое вещество только-только растворилось при 70°C. Полученный раствор фильтровали через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый флакон. После фильтрования при повышенной температуре, порциями добавляли толуол (1,0 мл). После добавления антирастворителя, флакон охлаждали до комнатной температуры со скоростью 20°C/ч, и давали прийти в равновесие без перемешивания при комнатной температуре в течение ночи. Полученные кристаллы собирали фильтрованием, и высушивали в вакууме (30 дюймов Hg) при комнатной температуре в течение ночи. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой I.
Форма J
Кристаллизация из системы с двумя растворителями с получением формы J соединения формулы (I)
Методика медленного охлаждения с кристаллизацией из смеси ДМФА/толуол: приблизительно 24,2 мг формы A соединения формулы (I) помещали в 2-драхмовый стеклянный флакон, снабженный якорем магнитной мешалки. Во флакон добавляли минимальное количество ДМФА (0,2 мл) для того, чтобы твердое вещество только-только растворилось при 70°C. Полученный раствор фильтровали через 0,45 мкм шприцевый фильтр в чистый предварительно нагретый флакон. После фильтрования при повышенной температуре, порциями добавляли толуол (2,0 мл). После добавления антирастворителя, флакон охлаждали до комнатной температуры со скоростью 20°C/ч, и давали прийти в равновесие без перемешивания при комнатной температуре, в течение ночи. Полученные кристаллы собирали фильтрованием и высушивали в вакууме (30 дюймов Hg) при комнатной температуре в течение ночи. Кристалличность и форму высушенного твердого вещества оценивали с помощью методики XRPD, которая показала, что кристаллическое вещество являлось полиморфной формой J.
Пример 11: Получение аморфной формы соединения формулы (I)
К полиморфной форме A соединения формулы (I) (2,0 г) добавляли 50 мл т-бутанола и 25 мл воды. Смесь нагревали при перемешивании до 40°C в течение 0,5 часов. После обработки ультразвуком в течение примерно 20 минут, добавляли 25 мл т-бутанола. Затем смесь охлаждали до комнатной температуры, получая гомогенный раствор. После фильтрования, полученный раствор подвергали лиофилизации в течение 2 дней, и получали рыхлое твердое вещество. Аморфный характер этого твердого вещества подтверждали с помощью XRPD (смотрите фиг.11), DSC и TGA.
Пример 12: Исследование с помощью методики XRPD
Используя прибор для исследования дифракции рентгеновских лучей на порошке (XRPD), функционировавший при описанных выше параметрах, на рентгенограммах XRPD полиморфных форм A, B, C, D, E, F, G, H, I и J соединения формулы (I) регистрировали показанные ниже пики. Рентгенограммы XRPD десяти перечисленных полиморфных форм приведены на фиг.1-10, соответственно. Единицы, в которых положение пиков указано в таблице 7, представляют собой углы 2Θ в градусах (°). В одном из вариантов осуществления, данная полиморфная форма может быть охарактеризована наличием на рентгенограмме XRPD, по меньшей мере, одного из пяти пиков, приведенных в наборе пиков 1 в таблице 7. В другом варианте осуществления, та или иная форма может быть охарактеризована наличием на рентгенограмме XRPD, по меньшей мере, одного из пяти пиков, приведенных в наборе пиков 1, в комбинации с, по меньшей мере, одним пиком XRPD, приведенным в наборе пиков 2 в таблице 7. В некоторых вариантах осуществления, величина угла 2Θ одного или нескольких пиков может быть определена с учетом термина «примерно», описанного выше по тексту заявки. В других вариантах осуществления, положение любого конкретного пика находится в пределах ±0,2°2Θ (например, 9,6±0,2 2Θ).
Пример 13: Исследования по методике дифференциальной сканирующей калориметрии (DSC)
Используя прибор для проведения DSC, функционирующий с описанными выше параметрами, для полиморфных форм A, B, C, D, E, F, G, H, I и J соединения формулы (I) регистрировали показанные ниже пики DSC. Термограммы DSC для девяти перечисленных полиморфных форм приведены на фиг.12-24 соответственно, и положения пиков отображены в таблице 8. Дополнительные данные DSC для полиморфных форм A, B, C, D, E, F, G, H, I и J приведены ниже в таблице 9. За исключением данных, помеченных значком ^, который указывает на экзотермические пики, все пики являются эндотермическими.
Как можно видеть на фиг. 12-23, термограмма DSC каждой из полиморфных форм A, B, C, D, E, F, G, H и J имеет эндотермический пик в диапазоне от примерно 280°C до примерно 282°C. Этот пик отражает тот факт, что при нагревании, все эти формы рекристаллизуются в форму B (смотрите пример 10, где нагревание формы A или формы C примерно до 250°C с последующим охлаждением приводит к образованию формы B), которая демонстрирует характерный эндотермический пик в диапазоне от примерно 280°C до примерно 282°C.
Пример 14: Исследования по методике термогравиметрического анализа (TGA)
Используя прибор для термогравиметрического анализа и указанные выше параметры, для полиморфных форм C-J соединения формулы (I) регистрировали следующие TGA пики, показанные в таблице 9. Пики соответствовали потере массы (% масс.) при указанной температуре во время нагревания образца.
Пример 15: Краткое изложение способов получения и анализа полиморфных форм A-J соединения формулы (I)
В таблице 9 суммированы не ограничивающие примеры методик получения полиморфных форм A-J соединения формулы (I) и типовые аналитические данные, как описано ниже и во всем тексте заявки.
Пример 16: Исследование устойчивости
Проводили исследование устойчивости полиморфной формы A и полиморфной формы C, в которых несколько образцов каждой формы плотно закрывали, и подвергали действию определенной температуры и влажности, которые указаны в таблице 10. В каждый из указанных моментов времени, исследуемые образцы открывали, и исследовали на чистоту с помощью ВЭЖХ, на содержание влаги с помощью анализа Карла Фишера и подтверждали полиморфную форму с помощью XRPD. Во всех проведенных экспериментах, показанных в таблице 10 в каждый момент времени, не наблюдалось каких-либо признаков нестабильности полиморфных форм.
Пример 17: Анализ динамической сорбции паров
Анализ динамической сорбции паров (DVS) проводили для полиморфных форм A, B, C, D и E, используя прибор DVS, на котором устанавливали указанные выше параметры. Было выяснено, что форма A является немного гигроскопичной, и она продемонстрировала поглощение влаги 0,7 масс.% при относительной влажности (RH) 60% и поглощение влаги 2,6 масс.% при относительной влажности 90%. При исследовании гистерезиса было обнаружено образование гемигидрата (полугидрата). Было установлено, что форма B является немного гигроскопичной, и она продемонстрировала поглощение влаги 1,0 масс.% при относительной влажности (RH) 60% и поглощение влаги 1,7 масс.% при относительной влажности 90%. Было установлено, что форма С обладает умеренной гигроскопичностью и эта форма продемонстрировала поглощение влаги 4,2 масс.% при относительной влажности (RH) 60% и поглощение влаги 4,9 масс.% при относительной влажности 90% (смотрите фиг.30). Было установлено, что форма D является немного гигроскопичной, и она продемонстрировала поглощение влаги 0,4 масс.% при относительной влажности (RH) 60% и поглощение влаги 1,7 масс.% при относительной влажности 90%. Было установлено, что форма E является немного гигроскопичной, и она продемонстрировала поглощение влаги 1,9 масс.% при относительной влажности (RH) 60% и поглощение влаги 2,2 масс.% при относительной влажности 90%. Образцы форм A и C выдерживали во влажных камерах при относительной влажности 9% и 95%, причем не было обнаружено изменения этих форм в течение 1 недели.
Пример 18: Термическая устойчивость
Образцы полиморфных форм A, B, C, D и E выдерживали при 60°C в течение 10 дней и затем анализировали с помощью XRPD. В каждом случае в 8-мл флакон помещали примерно 20 мг вещества, за исключением формы B, для которой брали 10 мг вещества. Образцы выдерживали в печи в течение 10 дней. По данным XRPD не происходило изменения полиморфных форм. Оказалось, что все полиморфные формы являются устойчивыми.
Пример 19: Устойчивость при измельчении
Полиморфные формы A, C, D и E исследовали в экспериментах по измельчению, где измельчение производили вручную, используя ступку и пестик. Образцы подвергали не очень интенсивному растиранию в течение 2 минут и, затем анализировали с помощью XRPD. Затем вещества помещали обратно в ступку, и растирали в течение еще 3 минут, т.е. в общей сложности растирание продолжали 5 минут, после чего повторно анализировали XRPD. Было установлено, что форма A не изменялась как после 2, так и после 5 минут растирания. Форма C также не изменялась как после 2, так и после 5 минут растирания.
Пример 20: Краткая сводка результатов примеров 17-19
В таблице 11 суммированы не ограничивающие типовые данные анализов полиморфных форм A-E соединения формулы (I), которые описаны ниже по тексту и во всех остальных местах заявки.
Пример 21: Скрининг солей
Получали соли соединения формулы (I) с L-винной кислотой, п-толуолсульфоновой кислотой, D-глюкуроновой кислотой, этан-1,2-дисульфоновой кислотой (EDSA), 2-нафталинсульфоновой кислотой(NSA), хлористоводородной кислотой (HCl) (моно и бис), бромистоводородной кислотой (HBr), лимонной кислотой, нафталин-1,5-дисульфоновой кислотой (NDSA), DL-миндальной кислотой, фумаровой кислотой, серной кислотой, малеиновой кислотой, метансульфоновой кислотой (MSA), бензолсульфоновой кислотой (BSA), этансульфоновой кислотой (ESA), L-яблочной кислотой, фосфорной кислотой и аминоэтансульфоновой кислотой (таурином). Исследовали поведение различных солей и свободного основания в различных растворителях с точки зрения образования твердых кристаллических веществ, как показано на фиг.25. В таблицах 12 и 13 суммированы данные для примеров солей соединения формулы (I). Наблюдалось образование полукристаллических-кристаллических моносолей соединения формулы (I) с этан-1,2-дисульфоновой кислотой (EDSA), 2-нафталинсульфоновой кислотой (NSA), хлористоводородной кислотой (HCl), бромистоводородной кислотой (HBr), лимонной кислотой, аморфной моносоли с нафталин-1,5-дисульфоновой (NDSA) и аморфной бис-соли с HCl из различных вариантов растворителей.
Пример 22: Составы и дозированные формы
Пример 22A: Составы полиморфной формы C соединения формулы (I) в форме капсул
Капсулы, включающие полиморфную форму C соединения формулы (I) (API, действующий фармацевтический ингредиент), получали по следующим методикам. Капсулы включали твердые желатиновые капсулы, заполненные твердым порошкообразным наполнителем, включающим полиморфную форму C соединения формулы (I) и один или несколько эксципиентов. В некоторых примерах, компоненты наполнителя капсулы включают полиморфную форму C соединения формулы (I) (от примерно 1% до примерно 30% масс./масс.); наполнитель/скользящее вещество, например, силицифированную микрокристаллическую целлюлозу (от примерно 70% до примерно 99% масс./масс.); дезинтегрирующее вещество, например, кросповидон (от 0% до примерно 7% масс./масс.); и смазывающее средство (например, стеарат магния (от 0% до примерно 2% масс./масс.).
Другие эксципиенты, которые могут применяться в типовых составах капсул включают, не ограничиваясь этим, наполнители, например, лактозу, маннит, крахмал, сорбит, сахарозу, дикальцийфосфат и микрокристаллическую целлюлозу; дезинтегрирующие средства, например, натрий кросскармелозу и натрий крахмал гликолят; средства для скольжения, например, коллоидный диоксид кремния, диоксид кремния, силикат магния и тальк; смазывающие средства, например, стеарил фумарат натрия и стеариновую кислоту; и поверхностно-активные компоненты, например, лаурилсульфат натрия, додецилсульфат натрия, Tween®80 и Lutrol®. Выбор конкретного наполнителя/средства для скольжения и его процентной доли можно сделать на основании сыпучести смеси. Выбор дезинтегрирующего средства и его процентное содержание можно сделать на основании профиля высвобождения капсулы в 0,1н хлористоводородной кислоте в отсутствии ПАВ.
Для каждого конкретного состава, часть наполнителя/средства для скольжения и дезинтегрирующего средства, каждого в отдельности, просеивали через сито #30 меш. Полиморфную форму C соединения формулы (I) и часть наполнителя/средства для скольжения смешивали, и просеивали через сито #30 меш. Смазывающее средство пропускали через сито #40 меш. Каждый компонент, за исключением смазывающего средства, взвешивали, по отдельности переносили в V-образный блендер Patterson Kelley’s и перемешивали в течение примерно 5-15 минут после добавления каждого следующего компонента. Затем смесь подвергали размолу на устройстве Quadro®Comil®, используя сито 0,039R меш при скорости примерно 40 об/мин. На последнем этапе добавляли смазывающее средство и перемешивали смесь в течение примерно 5 минут. Затем полученной смесью наполняли подходящие капсулы, используя агрегат для заполнения капсул IN-CAP.
Не ограничивающие примеры составов и препаратов в форме капсул, приведены в таблице 14. Составы с небольшим содержанием действующего вещества были предназначены для капсул 1 мг/5 мг, и составы с высоким содержанием действующего вещества предназначались для капсул 25 мг/100 мг. Капсулы 1 мг и 25 мг представляли собой белые, непрозрачные твердые желатиновые капсулы 2-ого размера, в то время как 5-мг капсулы представляли собой оранжево-красные (краситель Swedish Orange) непрозрачные твердые желатиновые капсулы 2-го размера, и 100-мг капсулы представляли собой белые, непрозрачные твердые желатиновые капсулы 0-ого размера.
Пример 22B: Получение крупномасштабных составов полиморфной формы C соединения формулы (I)
Оценивали указанные составы с точки зрения технологичности получения, возможности применения для оборудования автоматического наполнения капсул, однородности содержимого, растворения и стабильности. Для оценки упомянутых факторов, получали большие партии образцов для капсул со всеми указанными дозировками действующего вещества. Для смеси 1/5 мг было изготовлено примерно 2 кг состава API, описанного в примере 22A, что позволило получить примерно 9000 капсул для каждой дозировки. Для смеси 25/100 мг было изготовлено примерно 2,5 кг состава API, описанного в примере 22A, что позволило получить примерно 6000 капсул для каждой дозировки. В помещенных ниже, таблицах 15 и 16 суммированы результаты ряда анализов этих составов.
Оценивали устойчивость капсул в контейнерной упаковке в условиях долговременного хранения и ускоренного старения. Использовали следующую контейнерную упаковку: (i) 60 куб.см. круглая белая бутылка с широким горлышком из полиэтилена высокой плотности (HDPE); и (ii) контейнер с безопасной для детей 33-мм белой пластиковой крышкой и вкладышем из фольги для индукционной термозапайки. Контейнеры, содержащие капсулы, находились в следующих условиях: (1) -20°C±5°C; (2) 5°C±3°C; (3) 25°C±2°C, 60% RH ± 5% RH; (4) 40°C±2°C, 75% RH ± 5% RH; (5) 25°C±2°C, 60% RH ± 5% RH, открытая бутылка; (6) 40°C±2°C, 75% RH ± 5% RH, открытая бутылка; и (7) 30°C±2°C, 65% RH ± 5% RH. Образцы состава в капсулах анализировали через определенные промежутки времени. Действующий фармацевтический ингредиент (API) оставался стабильным при 25°C±2°C, 60% RH ± 5% RH и 40°C±2°C, 45% RH ± 5% RH в течение, по меньшей мере, 6 месяцев. API оставался стабильным в течение, по меньшей мере, 6 месяцев при -20°C±5°C, 5°C±3°C при хранении в HDPE бутылках закрытых индукционной термозапайкой. API оставался стабильным в течение, по меньшей мере, 6 месяцев при 25°C±2°C, 60% RH ± 5% RH и 40°C±2°C, 75% RH ± 5% RH в открытых бутылках из HDPE.
Изготовление, упаковку, маркировку, хранение и тестирование капсул осуществляли в соответствии с текущими правилами организации производства лекарственных средств (cGMP). Капсулы упаковывали в бутылки из полиэтилена высокой плотности (HDPE). Другие подходящие упаковочные сосуды включают, не ограничиваясь этим, стеклянные бутыли, бутыли/барабаны из полиэтилена низкой плотности, барабаны из фиброкартона, барабаны из HDPE и блистерные упаковки, которые могут включать такие материалы, как алюминиевая фольга, Aclar® и/или пленки PVC/PVdC/PE.
Анализ API по способу Карла Фишера показал содержание воды примерно от 4% дл 5% масс./масс. (например, приблизительно 4,2%, приблизительно 4,3%, приблизительно 4,5%, приблизительно 4,7%, приблизительно 4,9%, приблизительно 5,0%).
Типовой профиль растворения капсул для 1, 5, 25 и 100-мг капсул показан на Фиг.31. Растворение капсул соответствовало свойствам твердой пероральной дозированной формы с немедленным высвобождением. Через 60 минут растворялось более, чем примерно 90% API. Условия проведения экспериментов по растворению включали установку USP Apparatus II (Paddle, лопастная мешалка), 0,1н HCl при 37°C, 500 мл (для 1, 5, 25 мг) или 900 мл (для 100 мг), скорость мешалки 50 об/мин.
Пример 23: Оценка биологической активности
Для скрининга соединений по настоящему изобретению применяли аналитический набор для исследования активности PI3-K киназ (№ по каталогу 33-016), приобретенный у Millipore Corporation. В этом анализе использовалось специфичное связывание с высоким сродством плекстрин гомологичного домена (PH) GRP1 с PIP3, т.е. продуктом действия PI3 киназы класса 1A или 1B на ее физиологический субстрат PIP2. В данном анализе на этапе детектирования формировался комплекс между GST-меченым PH доменом и биотинилированным PIP3 с короткой цепью. Флуорофоры, связанные с биотинилированным PIP3 и GST-меченым PH доменом (стрептавидин-аллофикоцианин и меченый европием анти-GST, соответственно) формируют структуру, способствующую резонансному переносу энергии флуоресценции (FRET), генерируя устойчивый разрешенный во времени сигнал FRET. Этот FRET комплекс конкурентным образом разрушался не биотинилированным PIP3, т.е. продуктом, образовавшимся при действии PI3 киназы.
Анализировали активность киназ PI3 α, β, γ и δ c использованием набора для исследования активности PI3-K киназ (№ по каталогу 33-016), приобретенного у Millipore Corporation. Очищенные рекомбинантные PI3Kα (номер по каталогу 14-602-K), PI3Kβ (номер по каталогу 14-603-K), PI3Kγ (номер по каталогу 14-558-K) и PI3Kδ (номер по каталогу 14-604-K) получали у Millipore Corporation. Очищенные рекомбинантные ферменты PI3K использовали для катализа фосфорилирования фосфатидилинозит 4,5-бифосфата (PIP2 при конц. 10 мкм) с образованием фосфатидилинозит 3,4,5-трифосфата (PIP3) в присутствии 10 мкМ АТФ (АТР). Исследование осуществляли в 384-луночном формате, и регистрировали результаты с помощью универсального считывателя планшетов Perkin Elmer EnVision Xcite Multilabel Reader. Относительные интенсивности излучения преобразовывали в ингибирование в процентах, и импортировали в программу GraphPadPrism®. Рассчитывали концентрации, необходимые для достижения ингибирования активности ферментов на 50% (IC50), в диапазонах концентраций от 20 мкМ до 0,1 нМ (12-точечные кривые). Значения IC50 вычисляли с использованием модели нелинейной регрессии, которая имеется в GraphPadPrism® 5 версии.
Пример 24: Химическая стабильность
Химическую стабильность одного или нескольких соединений по настоящему изобретению определяли по стандартным методикам, известным в технике. Ниже по тексту описаны подробности типовой методики для оценки химической стабильности соединений по настоящему изобретению. Буфер, используемый по умолчанию для исследования химической стабильности, представлял собой фосфатно-солевой буфер (PBS) с pH 7,4; могли применяться и другие подходящие буферы. Соединение по настоящему изобретению добавляли в виде 100 мкМ концентрированного раствора к аликвоте PBS (в двух параллельных экспериментах) до конечного объема анализируемого раствора 400 мкл, в котором содержалось 5 мкМ тестируемого соединения и 1% ДМСО (для определения времени полужизни готовили образцы с общим объемом 700 мкл). Реакционные смеси инкубировали при встряхивании, в течение 24 часов при 37°C; для определения времени полужизни образцы инкубировали в течение 0, 2, 4, 6 и 24 часов. Реакции останавливали, быстро добавляя 100 мкл инкубируемой смеси к 100 мкл ацетонитрила с последующим перемешиванием в течение 5 минут. Затем образцы хранили при -20°C до проведения анализа ВЭЖХ-МС/МС. Необязательно одновременно с интересующим соединением по настоящему изобретению тестировали контрольное соединение или эталонное соединение, например, хлорамбуцил (5 мкМ), т.к. это соединение в значительной степени подвергалось гидролизу в течение 24 часов. Образцы анализировалис помощью (RP) ВЭЖХ-МС/МС, используя контроль селективных реакций (SRM). Условия проведения ВЭЖХ включали двухкомпонентный ЖХ насос с автоматическим устройством подачи образцов, смешанный режим, колонку C12, 2×20 мм и градиентную программу. Площади пиков, соответствующих определяемым веществам, регистрировали с помощью ВЭЖХ-МС/МС. Отношение количества исходного соединения, оставшегося через 24 часа, к количеству в нулевой момент времени, выраженное в процентах, именуется химической стабильностью. При определении времени полужизни, это время полужизни определяли по наклону начального линейного участка логарифмической кривой зависимости количества оставшегося соединения (%) от времени, в предположении, что кинетика реакции являлась кинетикой первого порядка.
Пример 25: Исследование экспрессии и ингибирования p110α/p85α, p110β/p85α, p110δ/p85α и p110γ
Киназы PI3-K класса I можно либо приобрести (p110α/p85α, p110β/p85α, p110δ/p85α у Upstate и p110γ у Sigma) либо экспрессировать, как описано ранее (Knight et al., 2004). Значения IC50 измеряли, используя либо стандартный анализ ТСХ для определения активности липид киназы (описанный ниже), либо высокопроизводительный анализ, основанный на поглощении мембранами. Реакции, катализируемые киназами, проводили, получая реакционные смеси, содержащие киназу, ингибитор (конечная концентрация 2% в ДМСО), буфер (25 мМ HEPES, pH 7,4, 10 мМ MgCl2) и только что обработанный ультразвуком фосфатидилинозит (100 мкг/мл). Реакции инициировали добавлением АТФ (АТР), содержащего 10 мкКюри γ-32P-АТФ (АТР), до конечной концентрации 10 или 100 мкМ, и давали реакциям протекать в течение 5 минут при комнатной температуре. Затем для проведения ТСХ-анализа реакции прерывали добавлением 105 мкл 1н HCl и затем 160 мкл CHCl3:MeOH (1:1). Двухфазную смесь перемешивали, подвергали быстрому центрифугированию, и переносили органическую фазу в новую пробирку, используя предварительно покрытый наконечник пипетки для работы с гелями и CHCl3. Этот экстракт наносили на пластины для ТСХ, и обрабатывали в течение 3-4 часов в растворе 65:35 н-пропанол:1М уксусная кислота. Затем пластины для ТСХ высушивали, помещали на люминесцентный экран с фосфорным покрытием (Storm, Amersham) и измеряли сигнал. Для каждого из соединений активность киназы измеряли при 10-12 концентрациях ингибитора, полученных двукратными разбавлениями из наивысшей исследованной концентрации (как правило, 200 мкМ). Для соединений, демонстрирующих значительную активность, определение IC50 повторяли 2-4 раза, и приведенное значение являлось средним этих независимых измерений.
Имеются другие коммерческие наборы или системы для исследования активности PI3-K. Эти коммерчески доступные наборы или системы могут применяться для скрининга ингибиторов и/или агонистов киназ PI3-K, включая, но не ограничиваясь этим, PI 3-киназы α, β, δ и γ. Примером такой системы является набор для исследования PI 3-киназы (человека) HTRF® производства Upstate. Исследование можно было выполнять в соответствии с методикой, предложенной производителем. Вкратце, исследование представляло собой анализ FRET с временным разрешением, который косвенно измерял PIP3, т.е. продукт, образовывающийся в результате активности PI3-K. Реакцию, катализируемую киназой, проводили в микротитровальном планшете (например, 384-луночном микротитровальном планшете). Общий объем реакционной смеси составлял примерно 20 мкл на лунку. На первой стадии, в каждую лунку добавляли 2 мкл тестируемого соединения в 20% диметилсульфоксида, получая конечную концентрацию ДМСО 2%. Далее, в лунки добавляли примерно 14,5 мкл смеси киназа/PIP2 (разбавленной 1× реакционным буфером) до конечной концентрации киназы 0,25-0,3 мкг/мл и 10 мкМ PIP2. Планшет закрывали, и инкубировали в течение 15 мин при комнатной температуре. Для начала реакции, 3,5 мкл АТФ (АТР) (разводили в буфере для реакции IX) добавляли на лунку с целью получения конечной концентрации АТФ (АТР) 10мкМ. Планшет закрывали, и инкубировали в течение 1 ч при комнатной температуре. Реакцию останавливали добавлением 5 мкл стоп-раствора на лунку и, затем 5 мкл смеси для детектирования на лунку. Планшет закрывали, инкубировали в течение 1 часа при комнатной температуре и затем считывали на подходящем приборе для считывания планшетов. Данные анализировали, и вычисляли значения IC50, используя GraphPad Prism® 5.
Пример 26: Исследование активации и пролиферации B клеток
Способность одного или нескольких соединений по настоящему изобретению ингибировать активацию и пролиферацию B клеток определяли по стандартной методике, известной в технике. Например, осуществляли исследование клеточной пролиферации in vitro, во время которой измеряли метаболическую активность живых клеток. Анализ проводили в 96-луночном микротитровальном планшете, используя восстановление красителя Alamar Blue® (аламара синего). B-клетки селезенки Balb/c очищали на градиенте Ficoll-PaqueTM PLUS и затем магнитным разделением клеток, используя набор для выделения B клеток MACS (B cell Isolation Kit) (Miletenyi). Клетки помещали в ячейки планшета в объеме 90 мкл в количестве 50000 клеток/лунка в среде для B клеток (RPMI + 10% FBS + пенициллин/стрептомицин + 50 мкМ bME + 5 мкМ HEPES). Соединение по настоящему изобретению разбавляли средой для B клеток, и добавляли в объеме 10 мкМ. Планшеты инкубировали в течение 72 часов при 37°C и 5% CO2. В каждую лунку добавляли 15 мкл реагента Alamar Blue® и инкубировали планшеты в течение 5 часов при 37°C и 5% CO2. Флуоресценцию Alamar Blue® регистрировали при 560 возб./590 изл. и вычисляли значения IC50 или EC50, используя GraphPad Prism® 5.
Пример 27: Исследование пролиферации клеток опухолевых линий
Способность одного или нескольких соединений по настоящему изобретению, ингибировать пролиферацию клеток опухолевых линий можно определить по стандартной методике, известной в технике. Например, можно осуществить исследование пролиферации клеток in vitro для измерения метаболической активности живых клеток. Это исследование проводили в 96-луночном микротитровальном планшете, используя восстановление Alamar Blue®. Клетки опухолевых линий человека получали у ATCC (например, MCF7, U-87 MG, MDA-MB-468, PC-3), выращивали до конфлюэнтности в колбах T75, трипсинизировали с использованием 0,25% трипсина, один раз промывали средой для опухолевых клеток Tumor Cell Media (DMEM + 10%FBS) и помещали в планшеты в количестве 5000 клеток/лунку в объеме среды Tumor Cell Media 90 мкл. Соединение по настоящему изобретению разбавляли средой Tumor Cell Media и добавляли в объеме 10 мкл. Планшеты инкубировали в течение 72 часов при 37°C и 5% CO2. В каждую лунку добавляли реагент Alamar Blue® в объеме 10 мкл, и инкубировали планшеты в течение 3 часов при 37°C и 5% CO2. Флуоресценцию Alamar Blue® регистрировали при 560 возб./590 излуч., и вычисляли значения IC50, используя GraphPad Prism® 5.
Пример 28: Противоопухолевая активность in vivo
Действие соединений по настоящему изобретению можно оценить на группе человеческих и мышиных моделей опухолей.
Модели опухолей, маловосприимчивых к паклитакселу
1. Модель карциномы яичников, полученной у пациентов в клинических условиях
Модельную опухоль выращивали из биопсии опухолевой ткани пациента с раком яичников. Биопсию опухолевой ткани отбирали у пациента. Соединения по настоящему изобретению вводили безтимусным («голым») мышам, которым были привиты упомянутые опухоли, используя схему введения один раз в 2 дня х 5.
2. Ксенотрансплантат карциномы яичников человека A2780Tax (мутировавший тубулин)
A2780Tax представляла собой модель невосприимчивой к паклитакселу карциномы, яичников человека. Эти клетки получены из восприимчивой родительской линии A2780 путем совместного инкубирования клеток с паклитакселом и верапамилом, т.е. агентом, купирующим мультилекарственную устойчивость (MDR). Было показано, что механизм невосприимчивости этих клеток не являлся родственным с MDR, и упомянутая невосприимчивость была отнесена к мутации гена, кодирующего белок бета-тубулин. Соединения по настоящему изобретению можно было вводить мышам, которым были привиты упомянутые опухоли, используя схему введения один раз в 2 дня × 5.
3. Ксенотрансплантат карциномы ободочной кишки человека HCT116/VM46 (проявляющей мультилекарственную устойчивость)
HCT 116/VM46 представляет собой MDR-устойчивую карциному ободочной кишки, полученную из восприимчивой родительской линии HCT116. При выращивании in vivo в организмах бестимусных мышей, опухоли HCT 116/VM46 неизменно демонстрировали высокую невосприимчивость к паклитакселу. Соединения по настоящему изобретению можно вводить мышам, которым были привиты упомянутые опухоли, используя схему введения один раз в 2 дня х 5.
4. Мышиная модель саркомы M5076
M5076 представляет собой мышиную фибросаркому, которая имеет врожденную невосприимчивость к паклитакселу in vivo. Соединения по настоящему изобретению можно вводить мышам, которым были привиты упомянутые опухоли, используя схему введения один раз в 2 дня × 5.
Одно или несколько соединений по настоящему изобретению можно применять в комбинации с другими терапевтическими агентами in vivo в модели ксенотрансплантатов карциномы ободочной кишки человека HCT/VM46, обладающей мультилекарственной устойчивостью, или в любых других моделях, известных в технике, включая описанные в настоящей заявке.
Пример 29: Исследование стабильности соединений по настоящему изобретению в присутствии микросом
Стабильность одного или нескольких соединений по настоящему изобретению определяли по стандартным методикам, известным в технике. Например, стабильность одного или нескольких соединений по настоящему изобретению устанавливали с помощью исследования in vitro. Например, проводили исследование стабильности в присутствии микросом in vitro, в котором измеряли стабильность одного или нескольких соединений по настоящему изобретению при взаимодействии с мышиными, крысиными или человеческими микросомами из печени. Взаимодействие микросом с соединениями проводили в 1,5 мл пробирке Эппендорф. Каждая пробирка содержала 0,1 мкл 10,0 мг/мл NADPH; 75 мкл 20,0 мг/мл микросом из мышиной, крысиной или человеческой печени; 0,4 мкл 0,2 М фосфатного буфера; и 425 мкл ddH2O. Пробирки, служащие отрицательным контролем (без NADPH), содержали 75 мкл 20,0 мг/мл микросом из мышиной, крысиной или человеческой печени; 0,4 мкл 0,2 М фосфатного буфера; и 525 мкл ddH2O. Реакцию инициировали добавлением 1,0 мкл 10,0 мМ тестируемого соединения. Пробирки с реакционными смесями инкубировали при 37°C. После 0, 5, 10, 15, 30 и 60 минут протекания реакции в новые пробирки Эппендорф, содержащие 300 мкл охлажденного метанола, отбирали 100 мкл образцы реакционной смеси. Образцы центрифугировали при 15000 об/мин для удаления белка. Супернатант образцов после центрифугирования переносили в новую пробирку. Концентрацию соединения, не вступившего в реакцию с микросомами, в супернатанте измеряли с помощью жидкостной хроматографии/масс-спектрометрии (ЖХ-МС).
Пример 30: Исследование стабильности соединений по настоящему изобретению в плазме
Стабильность одного или нескольких соединений по настоящему изобретению в плазме определяли согласно стандартным методикам, известным в технике. Смотрите, например, Rapid Commun. Mass Spectrom., 10: 1019-1026. Приведенная ниже методика представляет собой исследование с применением ВЭЖХ-МС/МС, в котором используется человеческая плазма; может применяться плазма других видов, а именно обезьян, собак, крыс и мышей. Замороженную гепаринизированную плазму человека размораживали в бане с холодной водой и перед использованием вращали на центрифуге в течение 10 минут при 2000 об/мин при 4°C. Соединение по настоящему изобретению добавляли в виде 400 мкМ концентрированного раствора к аликвоте предварительно размороженной плазмы, получая конечный объем реакционной смеси 400 мкл (или 800 мкл для определения времени полужизни), в котором содержалось 5 мкМ тестируемого соединения и 0,5% ДМСО. Реакционные смеси инкубировали при встряхивании в течении 0 минут и 60 минут при 37°C, или в течение 0, 15, 30, 45 и 60 минут при 37°C для определения времени полужизни. Реакции прекращали путем перенесения 50 мкл инкубируемой смеси в 200 мкл ледяного ацетонитрила и перемешивания путем встряхивания в течение 5 минут. Образцы центрифугировали при 6000×g в течение 15 минут при 4°C и 120 мкл супернатанта переносили в чистые пробирки. Затем образцы упаривали досуха, и анализировали ВЭЖХ-МС/МС.
В одном из вариантов осуществления, одновременно с соединениями по настоящему изобретению анализировали одно или несколько контрольных или эталонных соединений (5 мкМ): одно из них представляло собой пропоксикаин, обладающий низкой устойчивостью в плазме, и другое являлось пропантелином, обладающим средней устойчивостью в плазме.
Образцы разбавляли смесью ацетонитрил/метанол/вода (1/1/2, объем/объем/объем), и исследовали (RP) ВЭЖХ-МС/МС, используя контроль селективных реакций (SRM). Условия проведения ВЭЖХ включали комбинированный ЖХ насос c автоматическим устройством подачи образцов, смешанный режим, колонку C12, 2×20 мм и градиентную программу. Площади пиков, соответствующих определяемым веществам, регистрировали с помощью ВЭЖХ-МС/МС. Отношение количества исследуемого соединения, оставшегося через 60 минут, к количеству, имевшемуся в нулевой момент времени, выраженное в процентах, являлось характеристикой стабильности в плазме. При определении времени полужизни, это время полужизни определяли по наклону начального линейного участка логарифмической кривой зависимости количества оставшегося соединения (%) от времени, в предположении, что кинетика реакции являлась кинетикой первого порядка.
Пример 31: Передача сигналов киназы в крови
Передачу сигнала PI3K/Akt/mTor в клетках крови измеряли, используя методику PhosFlow (Methods Enzymol. (2007) 434:131-54). По своей сути эта методика относится к анализу отдельных клеток, поэтому могла быть обнаружена неоднородность клеток, а не средние параметры популяции. Это давало возможность одновременно определять состояния сигнальных путей в различных популяциях, которые определялись по разным маркерам. Кроме того, методика PhosFlow позволяла получить количественные данные. Для исследования действия одного или нескольких соединений по настоящему изобретению, нефракционированные спленоциты или моноядерные клетки периферической крови стимулировали агентами против CD3, для инициирования передачи сигналов T-клеточных рецепторов. Затем клетки фиксировали, и окрашивали для выявления поверхностных маркеров и внутриклеточных фосфопротеинов. В условиях данного эксперимента, ингибиторы по настоящему изобретению ингибировали фосфорилирование Akt-S473 и S6, опосредованное агентом против CD3, тогда как рапамицин ингибировал фосфорилирование S6 и усиливал фосфорилирование Akt.
Аналогично, аликвоты цельной крови инкубировали в течение 15 минут с носителем (например, 0,1% ДМСО) или ингибиторами киназы в различных концентрациях, после чего добавляли агенты, стимулирующие сшивание T-клеточного рецептора (TCR) (агент против CD3 с вторичным антителом) или B-клеточного рецептора (BCR) с использованием антитела с легкой цепью анти-каппа (фрагменты Fab’2). Примерно через 5 и 15 минут образцы фиксировали (например, холодным 4% параформальдегидом) и исследовали по методике PhosFlow. Для того чтобы различить T и B клетки, применяли окрашивание поверхности с использованием антител, нацеленных на маркеры клеточной поверхности, которые известны в технике. Затем измеряли уровень фосфорилирования субстратов киназы, например, Akt и S6, инкубируя фиксированные клетки с мечеными антителами, специфичными для фосфорилированных изоформ этих белков. Затем популяцию клеток исследовали по методике цитометрии в потоке.
Пример 32: Исследование формирования колоний
Клетки костного мозга мышей, только что трансформированные ретровирусом p190 BCR-Abl (именуемые в тексте заявки p190-трансфектированными клетками), выдерживали в планшетах в присутствии различных комбинаций лекарственных средств в среде метилцеллюлозы M3630 вместе с рекомбинантным человеческим IL-7 в примерно 30% сыворотке в течение примерно 7 дней и визуально под микроскопом подсчитывали число сформировавшихся колоний.
В качестве альтернативы, моноядерные клетки периферической крови человека получали у пациентов положительных (Ph+) и отрицательных (Ph-) по филадельфийской хромосоме по факту первоначального диагноза или при рецидиве. Живые клетки изолировали, и обогащали предшественниками CD19+CD34+ B клеток. После культивирования жидкой культуры в течение ночи, клетки помещали в лунки планшетов в метилцеллюлозную среду Methocult GF+ H4435 (Stem Cell Tehnologies) с добавками цитокинов (IL-3, IL-6, IL-7, G-CSF, GM-CSF, CF, лиганда Flt3 и эритропоэтина), и различных концентраций известных химиотерапевтических агентов в комбинации с любыми соединениями по настоящему изобретению. Подсчитывали число колоний с помощью микроскопии через 12-14 дней. Эта методика могла применяться для обнаружения подтверждения аддитивной или синергетической активности.
Пример 33: Действие ингибиторов киназ на лейкемические клетки in vivo
Самок мышей подвергали смертельной дозе облучения из γ-источника двумя дозами с промежутком примерно 4 ч, при дозе поглощенного излучения примерно 5 Грей за каждый сеанс. Примерно через 1 ч после второго сеанса облучения, мышам внутривенно (i.v.) вводили примерно 1×106 лейкемических клеток (например, Ph+ человеческих или мышиных клеток, или p190 трансфектированных клеток костного мозга). Эти клетки вводили совместно с радиопротекторной дозой примерно 5×106 нормальных клеток костного мозга, взятых у мышей-доноров в возрасте 3-5 недель. Реципиентам давали антибиотики в воде и ежедневно наблюдали за ними. Мышей, которые заболевали примерно через 14 дней, подвергали эвтаназии и собирали лимфоидные органы для анализа. Введение ингибиторов киназы начинали примерно через 14 дней после инъекции лейкемических клеток и продолжали ежедневно до тех пор, пока мышь не заболевает или максимально в течение примерно 35 дней после трансплантации опухолевых клеток. Ингибиторы вводили путем перорального лаважа (вливания в рот).
Клетки периферической крови собирали примерно на 10-й день (перед введением) и после эвтаназии (после введения), вводили в контакт с мечеными антителами против hCD4 и подсчитывали по методике цитометрии в потоке. Эту методику можно было применять для демонстрации того, что синергетическое действие комбинации одного или нескольких соединений по настоящему изобретению с известными химиотерапевтическими агентами могло уменьшить количество лейкемических клеток в крови по сравнению с индивидуальной обработкой известными химиотерапевтическими агентами (например, Gleevec®) в аналогичных условиях.
Пример 34: Действие соединений в мышиной модели волчанки
У мышей с низкими уровнями ингибирующего рецептора FcγRIIb, который противодействовал передаче сигналов PI3K в B клетках, с высокой пенетрантностью развивалась волчанка. FcγRIIb-нокаутированные мыши (R2KO, Jackson Labs) считались достоверной моделью человеческого заболевания, поскольку некоторые пациенты с волчанкой демонстрировали пониженную экспрессию и активность FcγRIIb (S. Bolland and J. V. Ravtech 2000. Immunity 12:277-285).
У мышей R2KO развивались волчаночноподобные заболевания с антиядерными антителами, гломерулонефрит и протеинурия в возрасте примерно 4-6 месяцев. Для проведения этих экспериментов в качестве эталонного соединения использовали аналог рапамицина RAD001 (можно приобрести у LC Laboratories), который вводили перорально. Было показано, что это соединение облегчало симптомы волчанки в модели B6.Sle1z.Sle3z (T. Wu et al. J. Clin Invest.117:2186-2196).
Мышам, которые являлись моделями волчанки, например, R2KO, BXSB или MLR/lpr, в возрасте примерно 2 месяца вводили препараты в течение примерно двух месяцев. Мышам вводили: носитель, RAD001 в количестве примерно 10 мг/кг или соединения по настоящему изобретению, в дозировках от примерно 1 мг/кг до примерно 500 мг/кг. Образцы крови и мочи отбирали практически в течение всего периода исследования, и тестировали на антиядерные антитела (в разбавленной сыворотке) или концентрацию белка (в моче). Сыворотку также тестировали на антитела против ssДНК и антитела против dsДНК с помощью ELISA. Животных подвергали эвтаназии на 60-й день, и собирали ткани для измерения массы селезенки и выявления почечных заболеваний. Наличие гломерулонефрита определяли на срезах почек, окрашенных H&E. Других животных исследовали в течение примерно двух месяцев после прекращения введения препаратов, осуществляя в конце те же операции.
Эти известные в технике модели могли применяться для демонстрации того, что ингибиторы киназы по настоящему изобретению могли подавлять или отсрочивать начало симптомов волчанки в мышиной модели волчанки.
Пример 35: Исследование трансплантата мышиного костного мозга
Самок мышей подвергали смертельной дозе облучения из γ-источника. Примерно через 1 ч после получения дозы радиации, мышам производили инъекцию примерно 1×106 лейкемических клеток из раннего пассажа культур, трансдуцированных p190 (например, как описано в Cancer Genet Cytogenet. 2005 Aug; 161(1):51-6). Эти клетки вводили совместно с радиопротекторной дозой приблизительно 5×106 нормальных клеток костного мозга от донорных мышей в возрасте 3-5 недель. Реципиентам давали антибиотики в воде и осуществляли ежедневное наблюдение. Мышей, которые заболевали примерно через 14 дней, подвергали эвтаназии и собирали лимфоидные органы для проведения цитометрии в потоке и/или магнитного обогащения. Введение препаратов начинали примерно на 10-й день и продолжали осуществлять ежедневно, пока мыши не заболевали или в течение максимум примерно 35 дней после трансплантации лейкемических клеток. Препараты вводили принудительным питанием через зонд (перорально, p.o.). В первом эксперименте определяли дозу химиотерапевтического средства, которая не излечивала, но замедляла начало лейкоза примерно на неделю или менее; контрольным животным вводили носитель или химиотерапевтический агент, который, как было показано ранее, замедлял, но не предотвращал лейкемогенез в данной модели (например, иматиниб в дозировке примерно 70 мг/кг дважды в день). Для первой стадии эксперимента использовали клетки p190, которые экспрессировали eGFP, и посмертный анализ ограничивался определением процентной доли лейкемических клеток в костном мозге, селезенке и лимфатических узлах (LN) с помощью цитометрии в потоке. На второй стадии эксперимента использовали клетки p190, которые экспрессировали «бесхвостую» форму человеческого CD4, и посмертный анализ включал магнитную сортировку клеток hCD4+ из селезенки с последующим исследованием с помощью иммуноблоттинга ключевых конечных молекул сигнальных цепей: p Akt-T308 и S473; pS6 и p4EBP-1. В качестве контроля для иммуноблоттинга, сортированные клетки перед лизисом инкубировали в присутствии или отсутствии ингибиторов киназы по настоящему изобретению. В качестве варианта, использовали методику PhosFlow для обнаружения p Akt-S473 и pS6-S235/236 в hCD4-зависимых клетках без предварительной сортировки. Эти исследования сигнальных путей особенно применимы, если, например, у мышей, получавших препараты, не развивался клинический лейкоз в момент времени 35 дней. Строили графики срока выживания Каплана-Мейера и проводили статистический анализ по методикам, известным в технике. Результаты, полученные для клеток p190, анализировали по отдельности, а также в совокупности.
Образцы периферической крови (100-200 мкл) отбирали у мышей ежедневно, начиная с 10-го дня непосредственно перед началом введения препаратов. Плазму использовали для измерения концентрации лекарственного средства, и клетки исследовали на наличие маркеров лейкоза (eGFP или hCD4) и биомаркеров сигнальных путей, описанных в тексте заявки.
Описанный общий анализ, известный в технике, можно применять для демонстрации того, что терапевтически эффективные дозировки соединений по настоящему изобретению могут применяться для ингибирования пролиферации лейкемических клеток.
Пример 36: Исследование ангиогенеза в пробке из матригеля
Матригель, содержащий тестируемые соединения, вводили инъекциями подкожно или интраокулярно, где он затвердевал, образуя пробку. Эта пробка в организме животного рассасывалась через 7-21 день, и животное подвергали гистологическому исследованию для определения степени прорастания кровеносных сосудов в пробку. Ангиогенез измеряли путем подсчета сосудов в гистологических срезах. В качестве альтернативы, проводили флуоресцентное измерение объема плазмы, используя декстран 150, меченый флуоресцеин изотиоцианатом (FITC). Результаты исследований, как ожидалось, выявят одно или несколько соединений по настоящему изобретению, которые ингибировали ангиогенез и, следовательно, применимы в лечении глазных расстройств, связанных с нарушением ангиогенеза и/или проницаемости сосудов.
Пример 37: Исследование ангиогенеза в роговице
В роговице формировали карман и в этот карман помещали пробку, содержащую состав, стимулирующий ангиогенез (например, VEGF, FGF или опухолевые клетки), который приводил к прорастанию новых сосудов из периферической лимбальной сосудистой системы. Для введения веществ, вызывающих ангиогенез, в роговичный карман использовались материалы, медленно высвобождающие эти вещества, например, Elvax® (этиленвиниловый сополимер) или Hydron. В качестве альтернативы, использовали губчатые материалы.
Действие предполагаемых ингибиторов на местное индуцирование (например, при введении губчатого имплантата) ангиогенеза в роговице (например, под действием FGF, VEGF или опухолевых клеток). Тестируемое соединение вводили или перорально, системно или непосредственно в глаз. Системное введение осуществляли болюсной инъекцией или, что более эффективно, способом, обеспечивающим замедленное высвобождение, например, имплантацией осмотических насосов, заполненных тестируемым ингибитором. Введение в глаз осуществляли любым из способов, описанных в заявке, включая, но не ограничиваясь этим, глазные капли, поверхностное нанесение крема, эмульсии или геля, инъекцию в стекловидное тело.
За реакцией прорастания сосудов следили путем непосредственного наблюдения во время эксперимента, в случае мышей с использованием стереомикроскопа. Необходимая визуализация сосудистой системы роговицы достигалась введением высокомолекулярного декстрана, меченого флуорохромом. Количественное определение ангиогенеза осуществляли, измеряя площадь проникновения сосудистой системы, продвижение сосудов в направлении веществ, стимулирующих ангиогенез, со временем, или при использовании флуоресценции, анализом гистограммы или подсчетом пикселей, имеющих интенсивность выше определенного (порогового) уровня.
Результаты этого эксперимента могли выявить одно или несколько соединений по настоящему изобретению, которые ингибировали ангиогенез и, следовательно, могли найти применение при лечении глазных расстройств, связанных с нарушением ангиогенеза и/или проницаемости сосудов.
Пример 38: Исследование ангиогенеза в микротитровальных планшетах
Готовили планшет для данного исследования, помещая на дно каждой лунки коллагеновые пробки с 5-10 клеточными сфероидами на коллагеновую пробку, где каждый сфероид содержал 400-500 клеток. Каждую коллагеновую пробку покрывали 1100 мкл среды для хранения на лунку, и хранили до использования (1-3 дня при 37°C, 5% CO2). Планшет плотно закрывали крышкой. Тестируемые соединения растворяли в 200 мл среды для анализа, причем, по меньшей мере, одна лунка, содержащая VEGF, служила положительным контролем, и одна лунка без VEGF или тестируемого соединения служила отрицательным контролем. Аналитический планшет извлекали из инкубатора и осторожно удаляли пипеткой среду для хранения. Аналитическую среду, содержащую тестируемые соединения, наносили пипеткой на коллагеновую пробку. Пробку помещали в увлажненный инкубатор (37°C, 5% CO2) на 24-48 часов. Количественную оценку ангиогенеза осуществляли путем подсчета числа прорастающих сосудов, измерения средней длины проростков или определения совокупной длины проростков. Исследуемые пробки можно законсервировать для последующего анализа, путем удаления аналитической среды, добавления 1 мл 10% параформальдегида в Hanks BSS на лунку и хранения при 4°C. Ожидалось, что результаты этого эксперимента позволят выявить соединения, которые подавляли ангиогенез в различных типах протестированных клеток, включая клетки глазных тканей.
Пример 39: Комбинированное применение ингибиторов PI3K-δ и агентов, которые подавляют выработку или активность IgE
Соединения по настоящему изобретению могли обеспечивать синергетическую или аддитивную эффективность при введении в комбинации с агентами, которые ингибировали выработку или активность IgE. Агенты, которые ингибировали выработку IgE, включали, например один или несколько агентов из числа TEI-9874, 2-(4-(6-циклогексилокси-2-нафтилокси)фенилацетамид)бензойной кислоты, рапамицина, аналогов рапамицина (т.е. рапалогов), ингибиторов TORC1, ингибиторов TORC2 и любых других соединений, которые ингибировали mTORC1 и mTORC2. Агенты, которые ингибировали активность IGE, включали, например, антитела против IgE, например, омализумаб и TNX-901.
Одно или несколько соединений по настоящему изобретению, которые способны ингибировать PI3K-δ, могли оказаться эффективными при лечении аутоиммунных и воспалительных расстройств (AIID), например, ревматоидного артрита. Если любое из этих соединений вызывает выработку нежелательных уровней IgE, можно было назначить это соединение в комбинации с агентом, который ингибировал выработку IgE или активность IgE. Кроме того, введение ингибиторов PI3K-δ или PI3K-δ/γ по настоящему изобретению в комбинации с ингибиторами mTOR, могло также обеспечить синергию, за счет усиления ингибирования сигнального пути PI3K. Для выявления влияния такого комбинированного лечения на AIID могли использоваться различные in vivo и in vitro модели, которые включали, не ограничиваясь этим, (a) in vitro исследование выработки антител B-клетками, (b) in vivo исследование с использованием TNP (тринитрофенила) и (c) модель коллаген-индуцированного артрита у грызунов.
(a) B-клеточный анализ
Мышей подвергали эвтаназии, удаляли селезенки и диспергировали через нейлоновые сетки, получая суспензию из отдельных клеток. Спленоциты промывали (после удаления эритроцитов осмотическим ударом) и инкубировали с микрогранулами, конъюгированными с антителами против CD43 и против Mac-1 (Miltenyi Biotec). Клетки, связанные с гранулами, отделяли от несвязанных клеток, используя прибор для магнитной сортировки клеток. В намагниченной колонне удерживались нежелательные клетки, и оставшиеся B клетки собирали в проходящем потоке. Очищенные B клетки стимулировали липополисахаридами или антителами против CD-40 и интерлейкином 4. Стимулированные B-клетки обрабатывали только носителем или носителем с ингибиторами PI3K-δ по настоящему изобретению в присутствии, и в отсутствии ингибиторов mTOR, например, рапамицина, рапалогов или ингибиторов mTORC1/C2. Ожидалось, что результаты этого эксперимента продемонстрировали бы, что наличие только ингибиторов mTOR (например, рапамицина), не оказало никакого воздействия или окажет незначительное воздействие на ответы IgG и IgE. Однако ожидалось, что в присутствии ингибиторов PI3K-δ и mTOR, B-клетки продемонстрировали бы уменьшение ответа IgG по сравнению с B-клетками, обработанными только носителем, а также ожидалось, что B-клетки продемонстрировали уменьшение ответа IgE по сравнению с B-клетками, обработанными только ингибиторами PI3K-δ.
(b) исследование с использованием TNP
Мышей иммунизировали TNP-Ficoll или TNP-KHL и вводили им: носитель, ингибитор PI3K-δ, ингибитор mTOR, например, рапамицин, или ингибитор PI3K-δ в комбинации с ингибитором mTOR, например, рапамицином. Уровни антиген-специфичных IgE в сыворотке измеряли с помощью анализа ELISA, используя планшеты, покрытые TNP-BSA, и изотип-специфичные меченые антитела. Ожидалось, что мыши, получавшие только ингибитор mTOR, не продемонстрировали или продемонстрировали бы незначительное влияние на антиген-специфичный IgG3 ответ и отсутствие статистически значимого повышения IgE ответа по сравнению с контрольными животными, получавшими носитель. Кроме того, ожидалось, что мыши, получавшие комбинацию ингибитора PI3K-δ и ингибитора mTOR, продемонстрировали бы уменьшение антиген-специфичного IgG3 ответа, по сравнению с мышами, получавшими только носитель. Кроме того, мыши, получавшие комбинацию ингибитора PI3K-δ и ингибитора mTOR, демонстрировали уменьшение IgE ответа по сравнению с мышами, получавшими только ингибитор PI3K-δ.
(c) Модель коллаген-индуцированного артрита у крыс
Самкам крыс Lewis осуществляли анестезию, и в день 0 давали инъекции коллагена, получение и введение которых описано выше. На 6-й день животных подвергали анестезии, и давали вторую инъекцию коллагена. На 9-й день производили измерение штангенциркулем нормальных (до заболевания) правого и левого голеностопного суставов. На 10-11 день, как правило, возникал артрит и крыс, случайным образом, распределяли по экспериментальным группам. Распределение проводили после того, как опухание голеностопных суставов становилось очевидным, и служило хорошим доказательством двустороннего заболевания.
После отбора животных для включения в исследование, начинали введение препаратов. Животным вводили носитель, ингибитор PI3K-δ или ингибитор PI3K-δ в комбинации с рапамицином. Введение препаратов осуществляли в дни 1-6. Крыс взвешивали в дни 1-7 после обнаружения артрита, и каждый день измеряли суставы штангенциркулем. Последнее определение массы тела осуществляли на 7-й день, и проводили эвтаназию животных.
Комбинированное введение соединения по настоящему изобретению и рапамицина обеспечивало большую эффективность, чем введение только ингибитора PI3K-δ.
Пример 40: Модель гиперчувствительности замедленного типа (DTH)
Вызывали DTH, повышая чувствительность самцов мышей 60 BALB/c в 0-й и 1-й дни 0,05% раствором 2,4-динитрофторбензола(DNFB) в смеси 4:1 ацетон/оливковое масло. Мышей очень аккуратно удерживали, одновременно нанося 20 мкл раствора на ступни задних лап каждой мыши. Использовали подошвы задних лап, поскольку они являются тем участком тела, который можно легко изолировать, и обездвижить без анестезии. На 5-й день принудительным кормлением через зонд мышам вводили одну дозу носителя, соединение по настоящему изобретению в дозировке 10, 3, 1 или 0,3 мг/кг, или дексаметазон в дозировке 5 мг/кг. Через тридцать минут мышам проводили анестезию, и наносили 0,25% раствор DNFB в смеси 4:1 ацетон/оливковое масло на внешнюю и внутреннюю поверхность левого уха. Это нанесение привело к опуханию левого уха, и в условиях описанного эксперимента все животные прореагировали на это нанесение опуханием уха. Контрольный раствор носителя 4:1 ацетон/оливковое масло наносили на внешнюю и внутреннюю поверхности правого уха. Через 24 часа мышей подвергали анестезии, и осуществляли измерение левого и правого уха, используя цифровой микрометр. Разницу между размерами двух ушей регистрировали в качестве количественного показателя опухания, вызванного провоцирующим действием DNFB. Группы, получавшие препараты, сравнивали с контрольной группой, получавшей носитель, для определения уменьшения опухания ушей в процентах. В качестве положительного контроля обычно применяли дексаметазон, т.к. он обладал противовоспалительной активностью широкого спектра.
Пример 41: Модель артрита, вызванного пептидогликан-полисахаридами у крыс
(a) Модель системного артрита
Все инъекции проводили под анестезией. 60 самкам крыс Lewis (150-170) проводили анестезию путем вдыхания изофлурана, используя устройство для анестезии животных малого размера. Животных помещали в индукционную камеру, в которую вводили смесь 4-5% изофлурана c O2, пока не достигалась анестезия, и затем удерживали в этом состоянии на процедурном столе, используя носовой конус. Содержание изофлурана поддерживали на уровне 1-2%. Животным осуществляли одну интраперитонеальную (i.p.) инъекцию очищенного PG-PS 10S Group A, штамма D58 (в концентрации 25 мкг/г массы тела), суспендированного в стерильном 0,85% солевом растворе. Каждое животное получало в общей сложности 500 микролитров, причем инъекцию осуществляли в нижний левый квадрант живота, используя 1 мл шприц с иглой 23 размера. Положение иглы имело решающее значение для того, чтобы избежать введения PG-PS 10S либо в желудок, либо в слепую кишку. Животные находились под непрерывным наблюдением, пока они полностью не восстанавливались от анестезии, и не начинали двигаться по клетке. Острая реакция, которая заключалась в резком увеличении размеров суставов, как правило, на 20% от исходного уровня, достигала максимума в течение 3-5 дней после инъекции. Введение тестируемых соединений могло осуществляться PO (перорально), SC (подкожно), IV (внутривенно) или IP (интраперитонеально). Препараты вводили крысам не более двух раз в течение 24-часового отрезка времени. Введение можно было начать в 0-й или любой последующий день до 30-го дня. Животных взвешивали в дни 0, 1, 2, 3, 4, 5, 6, 7 и продолжали в дни 12-30 или до окончания исследования. Диаметр лап/суставов измеряли цифровым штангенциркулем с левой и правой стороны в 0-й день перед инъекцией и повторно в дни 1, 2, 3, 4, 5, 6 и 7. На 12-й день измерения возобновляли, и продолжали до 30-го дня. В это время животных можно было подвергнуть анестезии изофлураном, как описано выше, и отобрать последние образцы крови откачиванием из хвостовой вены для оценки уровня соединений в крови, клинической химии или гематологических параметров. Затем осуществляли эвтаназию животных избыточной дозой диоксида углерода. Можно было провести вскрытие грудной клетки в качестве средства подтверждения смерти.
b) Модель артрита в одном суставе
Все инъекции осуществляют под анестезией. 60 самок крыс Lewis (150-170) подвергали анестезии вдыханием изофлурана, используя устройство для анестезии животных малого размера. Животных помещали в индукционную камеру, в которую вводили смесь 4-5% изофлурана c O2, пока не достигалась анестезия, и затем удерживали в этом состоянии на процедурном столе, используя носовой конус. Содержание изофлурана поддерживали на уровне 1-2%. Животным проводили однократную внутрисуставную (i.a.) инъекцию очищенного PG-PS 100P Group A, штамм D58 (концентрация 500 мкг/мл), суспендированного в стерильном 0,85% солевом растворе. Каждая крыса получала препарат в общем объеме 10 микролитров, который вводили в пространство большеберцово-таранного сустава, используя 1-мл шприц с иглой 27 размера. Животные находились под постоянным наблюдением, пока они полностью не восстановились от анестезии и не стали двигаться по клетке. В исследование включали животных, которые примерно через 2-3 дня реагировали резким увеличением размера лодыжки, как правило, на 20% по сравнению с исходным значением при первой i.a. инъекции. На 14 день всем животным опять проводили анестезию, используя описанную выше методику. Животные получали внутривенную (i.v.) инъекцию PG-PS (в концентрации 250 мкл/мл). Каждой крысе в боковую хвостовую вену медленно вводили общий объем препарата 400 мкл, используя 1-мл шприц с иглой 27 размера. Перед IV инъекцией проводили измерения исходных размеров лодыжки, и продолжали эти измерения во время воспаления или вплоть до 10-го дня. Введение тестируемых соединений могло осуществляться PO, SC, IV или IP путями. Препараты крысам вводили не более 2 раз в течение 24-часового промежутка времени. Введение можно было начинать в день 0 или любой день после этого до дня 24. Животных взвешивали в дни 0, 1, 2, 3, 4, 5 и возобновляли взвешивание в дни 14-24 или до прекращения исследования. Диаметр лапы/лодыжки измеряли цифровым штангенциркулем с левой и правой стороны в день 0 перед инъекцией и повторно в дни 1, 2, 3, 4, 5 и повторно возобновляли в дни 14-24 или до прекращения исследования. В это время животных можно было подвергнуть анестезии изофлураном, как описано выше, и отобрать последние образцы крови откачиванием из хвостовой вены для оценки уровня соединений в крови, клинической химии или гематологических параметров. Затем осуществляли эвтаназию животных избыточной дозой диоксида углерода. Можно было провести вскрытие грудной клетки в качестве средства подтверждения смерти.
Пример 42: Фармакокинетические данные для однократного и многократного введения
Проводили рандомизированное, двойное слепое исследование однократного и многократного введения с контролем по плацебо, для оценки фармакокинетики (PK) полиморфной формы C соединения формулы (I) при пероральном введении здоровым взрослым субъектам мужского и женского пола. Субъекты получали одну пероральную дозу полиморфной формы C соединения формулы (I) в состоянии голодания, которая составляла 1 мг, 2 мг, 5 мг, 10 мг, 20 мг и 30 мг. Образцы крови для анализа плазмы отбирали перед введением и в моменты времени 0,5, 1, 1,5, 2, 3, 4, 6, 9, 12, 16 и 24 часа. Дозировки 1 мг, 2 мг, 5 мг, 10 мг, 20 мг и 30 мг давали значения Cmax в диапазоне от более 10 нг/мл до менее 1500 нг/мл, значения AUC0-24 в диапазоне от более 100 нг*ч/мл до менее 4000 нг*ч/мл, и величину времени полужизни в диапазоне от более 3 часов до менее 10 часов, дозозависимым образом.
При многократном пероральном введении, полиморфную форму C соединения формулы (I) вводили один раз в день (QD) по утрам в дни 1 и 14, и дважды в день (BID) в дни 2-13. Введение соединений осуществляли после голодания в течение ночи в дни 1 и 14. Образцы крови для анализа плазмы отбирали на 14 день после многократного введения доз 1, 2, 5 и 10 мг. Образцы крови в день 14 отбирали перед введением и через 0,5, 1, 1,5, 2, 3, 4, 6, 9, 12, 16 и 24 часа после введения для определения концентрации полиморфа C соединения формулы (I) в плазме. Дозировки 1 мг, 2 мг, 5 мг и 10 мг давали значение Cmax в диапазоне от более 10 нг/мл до менее 1000 нг/мл дозозависимым образом. Кроме того, дозировки 1 мг, 2 мг, 5 мг и 10 мг давали значение AUCtau,ss в диапазоне от более 100 нг*ч/мл до менее 2500 нг*ч/мл дозозависимым образом. Для режима введения BID, AUC в течение 24-часового интервала получали умножением AUCtau,ss на 2.
Хотя в заявке были показаны, и описаны различные варианты осуществления настоящего изобретения, специалисту в данной области должно быть очевидно, что эти варианты осуществления приведены только в качестве примера. Специалисту в данной области техники без труда придут в голову многочисленные варианты, изменения и замены, которые не выходят за пределы объема изобретения. Следует понимать, что в рамках настоящего изобретения могут применяться различные альтернативы вариантам осуществления, описанным в настоящей заявке.
Реферат
Изобретение относится к новым полиморфным формам соединения формулы (I), обладающим ингибирующим действием в отношении фосфоинозитид 3-киназы (PI3K). Соединения могут быть использованы для лечения рака, например лейкоза, лимфомы, воспалительного заболевания и аутоиммунного заболевания. Полиморфными формами соединения формулы (I)является полиморфная форма С гидрата соединения формулы (I), которая имеет характеристические пики на картине дифракции рентгеновских лучей на порошке (XRPD) 2θ = 10,4°(±0,2°), 13,3°(±0,2°) и 24,3°(±0,2°); полиморфная форма А, которая имеет характеристические пики на картине дифракции рентгеновских лучей на порошке (XRPD) 2θ = 9.6°(±0.2°), 12.2°(±0.2°) и 18.3°(±0.2°); полиморфная форма В, которая имеет характеристические пики на картине дифракции рентгеновских лучей на порошке (XRPD) 2θ = 7,9°(±0,2°), 13,4°(±0,2°) и 23,4°(±0,2°); полиморфная форма D, которая имеет характеристические пики на картине дифракции рентгеновских лучей на порошке (XRPD) 2θ = 11,4°(±0,2°), 17,4°(±0,2°) и 22,9°(±0,2°); полиморфная форма Е, которая имеет характеристические пики на картине дифракции рентгеновских лучей на порошке (XRPD) 2θ = 6,7°(±0,2°), 9,3°(±0,2°) и 24,4°(±0,2°); полиморфная форма F, которая имеет характеристические пики на картине дифракции рентгеновских лучей на порошке (XRPD) 2θ = 9,6°(±0,2°), 17,3°(±0,2°) и 24,6°(±0,2°); полиморфная форма G, которая представляет собой сольват трет-бутилметилового эфира соединения формулы (I) и имеет характеристические пики на картине дифракции рентгеновских лучей на порошке (XRPD) 2θ = 6,7°(±0,2°), 9,5°(±0,2°) и 19,0°(±0,2°); полиморфная форма Н, которая имеет характеристические пики на картине дифракции рентгеновских лучей на порошке (XRPD) 2θ = 8,9°(±0,2°), 9,2°(±0,2°) и 14,1°(±0,2°); полиморфная форма I, которая имеет характеристические пики на картине дифракции рентгеновских лучей на порошке (XRPD) 2θ = 9,7°(±0,2°), 19,3°(±0,2°) и 24,5°(±0,2°), и полиморфная форма J, которая имеет характеристические пики на картине дифракции рентгеновских лучей на порошке (XRPD) 2θ = 9,1°(±0,2°), 17,3°(±0,2°) и 18,3°(±0,2°). Изобретение также относится к вариантам способа получения формы С. Например, указанный способ включает (i) воздействие среды, содержащей воду, на композицию, включающую, по меньшей мере, одну полиморфную форму, не являющуюся формой С соединения формулы (I), в течение периода времени, достаточного для превращения, предпочтительно в течение 18-24 часов, по меньшей мере, 50% общего количества полиморфной формы (форм), не являющейся формой С; и (ii) выделение указанной полиморфной формы С. 18 н. и 66 з.п. ф-лы, 31 ил., 16 табл., 42 пр.
Формула



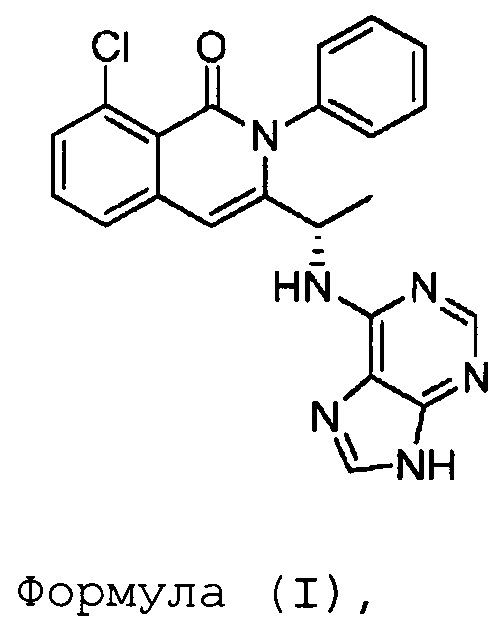
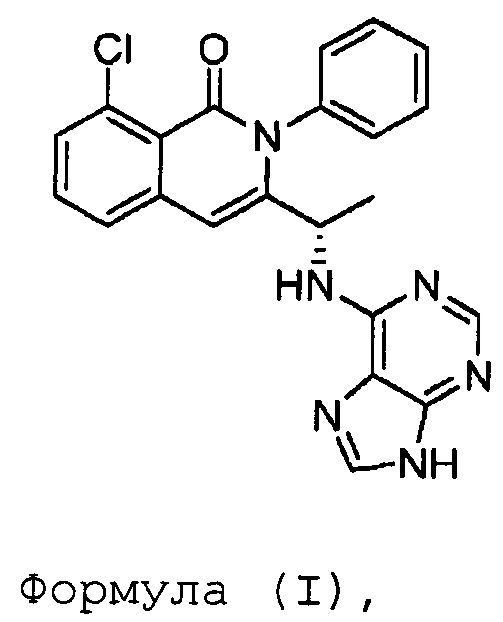
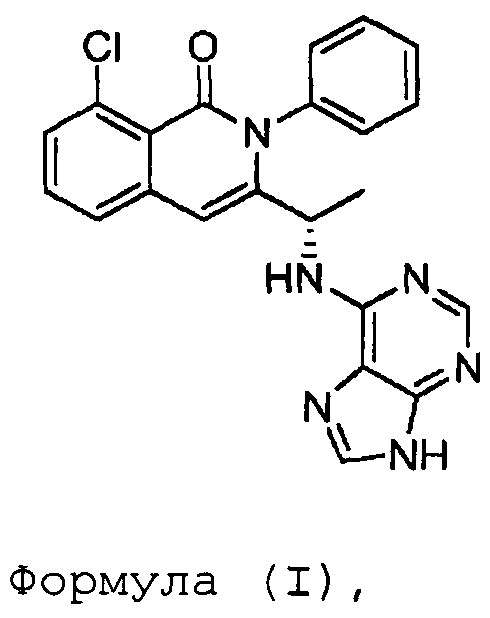
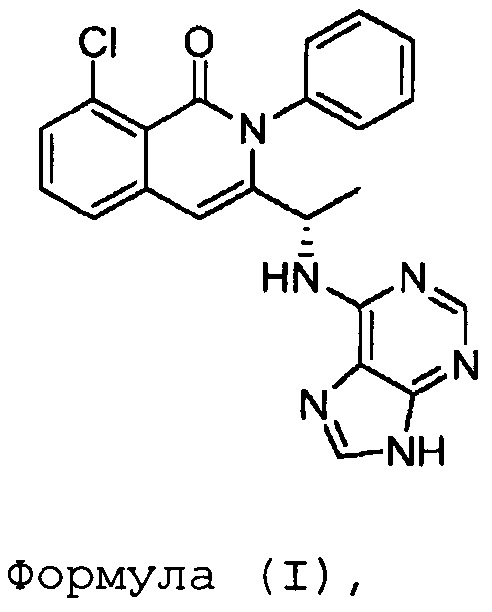
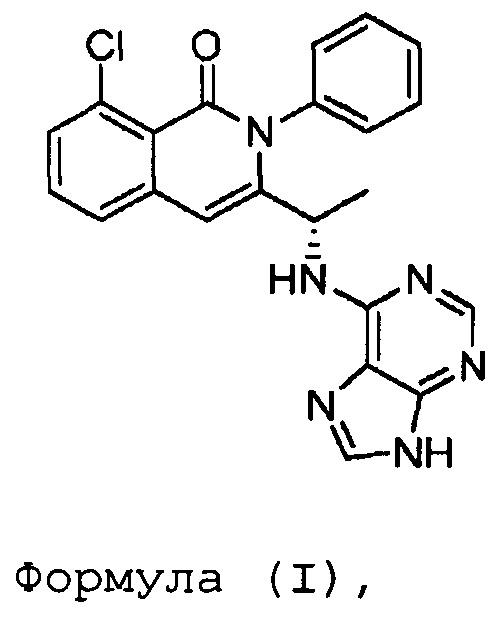








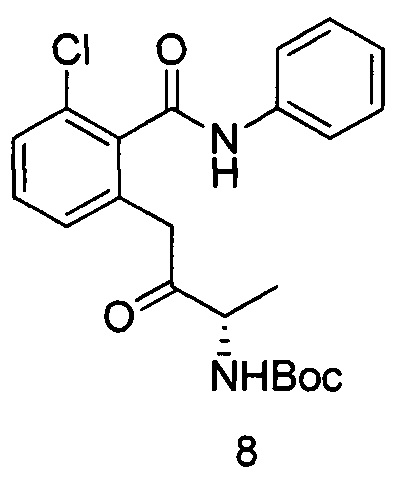

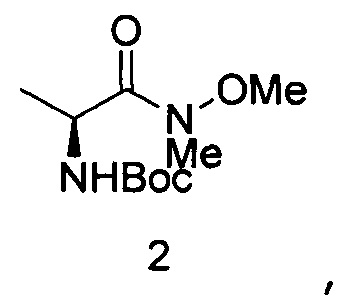


Документы, цитированные в отчёте о поиске
Некоторые химические соединения, композиции и способы
Некоторые химические соединения, композиции и способы

Комментарии