Ненуклеозидные ингибиторы обратной транскриптазы,фармацевтическая композиция, содержащая их, их применение при изготовлении лекарственных средств для лечения вич-1, промежуточные для их получения - RU2281284C2
Код документа: RU2281284C2
Описание
Область техники
Данное изобретение относится к ненуклеозидным ингибиторам обратной транскриптазы, активным против ВИЧ-1 и обладающим улучшенной устойчивостью и фармакокинетическим профилем. Изобретение также относится к новым промежуточным соединениям в синтезе таких соединений и использованию данных соединений в антивирусных способах и композициях.
Предпосылки изобретения
Ненуклеозидные ингибиторы обратной транскриптазы (non nucleoside reverse transcriptase ingibitors (NNRTI)) связываются с аллостерическим участком на обратной транскриптазе и представляют важную разработку в арсенале лекарственных средств против ВИЧ, в частности ВИЧ-1. Международная патентная заявка WO 93/03022 раскрывает NNRTI на основе тиомочевины, которые позже были обозначены «PETT» (фенилэтилтиазолилтиомочевина) соединениями в J.Med.Chem. 39 6 1329-1335 (1995) и J.Med.Chem. 39 21 4261-4274 (1996). Международные патентные заявки №№ WO 99/47501, WO 00/39095, WO 00/56736, WO 00/78315 и WO 00/78721 описывают производные тиомочевины РЕТТ, которые, как заявлено в этих документах, были оптимизированы против сложного RT-связывающего "кармана".
Международная патентная заявка № WO 95/06034 и J.Med.Chem. 42 4150-4160 (1999) раскрывает соединения мочевины, являющиеся изостерами РЕТТ NNRTI. Международная патентная заявка № WO 99/36406 раскрывает NNRTI соединения, представляющие собой соединения мочевины со свободно стоящим циклопропильным мостиком, где фенильное левое крыло обязательно содержит функциональную 6-гидроксигруппу, и Международная патентная заявка № WO 00/47561 раскрывает пролекарства таких соединений.
Несмотря на то, что NNRTI на основе мочевины и тиомочевины, раскрытые в приведенных выше документах, активны против обратной транскриптазы, в особенности обратной транскриптазы ВИЧ-1, природа вируса ВИЧ с его чрезмерной потерей репликативной точности и, вследствие этого, тенденцией к быстрому развитию резистентности, диктует необходимость дальнейшей разработки антиретровирусных средств с повышенным антивирусным действием против проблемных, устойчивых к лекарственным средствам мутантов, особенно по положениям 100, 103 и/или 181 RT.
Кроме того, современные схемы терапевтического лечения ВИЧ-инфекций, обозначенные HAART (высокоактивная антиретровирусная терапия (Highly Active Anti Retroviral Therapy)), предполагают введение антивирусных средств в виде комбинаций трех или более антивирусных средств различных классов, при этом такие комбинации вводят в течение продолжительных периодов времени, если не в течение жизни. HAART требует от пациента приема лекарственных средств по сложной схеме, при этом иногда предусматривается ежедневный прием большого количества таблеток в разное время суток, в некоторых случаях до, а в некоторых случаях после приема пищи. Таким образом, необходимы антиретровирусные препараты, допускающие большую гибкость в дозировании для удовлетворения потребностей пациента.
Краткое описание изобретения
В соответствии с первым аспектом изобретения представлены соединения формулы I

где
R1 представляет O, S;
R2 представляет необязательно замещенный, азотсодержащий гетероцикл, в котором азот расположен в положении 2 относительно связи с (тио)мочевиной;
R3 представляет H, C1-C3алкил;
R4-R7 независимо выбраны из H, С1 -C6алкила, С2-C6алкенила, С2-C6алкинила, галогенС1-C6алкила, С1-C6алканоила, галогенС1 -C6алканоила, С1-C6алкокси, галогенС1-C6алкокси, С1-C6алкилокси-С1-C6алкила, галогенС1 -C6алкилокси-С1-C6алкила, гидрокси-С1-C6алкила, амино-С1-C6алкила, карбокси-С1-C6алкила, циано-С1-C6алкила, амино, карбокси, карбамоила, циано, галогена, гидрокси, кето и т.п.;
X представляет -(CH2)n-D-(CH2)m-;
D представляет -NR8-, -O-, -S-, -S(=О)- или -S(=O)2-;
R8 представляет H, С1-C3алкил;
n и m представляют независимо 0 или 1,
и их фармацевтически приемлемые соли и пролекарства.
В данном случае предпочтительным значением для R1 является О, т.е. производное мочевины, хотя очень важным вариантом также является случай, когда R1 представляет S (т.е. производное тиомочевины).
Представленные значения для R2 включают тиазолил, пиридил, пиримидил, пиразинил, пиридазинил, пирролил, имидазолил, индолил, триазолил, тетразолил, пиперидил, пиперазинил и конденсированные кольца, такие как бензотиазолил, бензопиридил, бензодиазолил, бензимидазолил, хинолил, пуринил и подобные, при этом любая из указанных групп может быть необязательно замещена.
Предпочтительные значения R2 включают пирид-2-ил и тиазол-2-ил.
Необязательные заместители для R2 могут включать до трех заместителей, таких как С1-C6алкил, С1-C6 алкокси, С2-C6алкенил, С2-C8алкинил, С2-C8алкенокси, С1-C6алкоксиС1-C6алкил, С1 -C6алканоил, галогенС1-C6алкил, С1-C4алканоилокси, С1-C4алкилтио, амино (включая С1-C3алкилзамещенную аминогруппу), карбокси, карбамоил, циано, галоген, гидрокси, аминометил, карбоксиметил, гидроксиметил, нитро, арил (такой как фенил, пиррол-1-ил, тетразол-5-ил, триазол-4-ил, пиридил, пиримидил, пиразинил, имидазолил, индолил, пиперидил, пиперазинил и подобные), замещенный (как определено в данном описании) арил или -SO2Q, или -C(=O)Q, где Q представляет С1-C6 алкил, галогензамещенный С1-C6алкил, арил (как определено в данном описании), замещенный (как определено в данном описании) арил или амино. Гетероатомы в R2могут быть превращены в производные, например, с С1-C6алкилом, оксо и подобным. Необязательный заместитель R2 может быть в орто- или мета-положении относительно связи с (тио)мочевинной функциональной группой, но предпочтительным является пара-положение.
Предпочтительные необязательные заместители при R2 включают этинил, фенокси, пирид-1-ил, циклопропил, фенил, галогензамещенный фенил (особенно пара- и мета- хлор- и фторфенил) и диметиламино. Наиболее предпочтительные заместители R2 включают галоген (F, Br, Cl и I) и циано. Предпочтительные галогеновые группы включают Cl.
В данном случае предпочтительным значением для R3 является H.
R4, предпочтительно, представляет водород, галоген или гидрокси, особенно фтор.
R5, предпочтительно, представляет галоген, С1-C3алкилкарбонил, С1-C3алкилокси или Н, особенно фтор и наиболее предпочтительно Н.
R6, предпочтительно, представляет водород, галоген, С1-C3алкилокси, С1-C3алкилкарбонил, циано или этинил, особенно метокси или фтор и наиболее предпочтительно Н.
R7, предпочтительно, представляет водород, галоген, С1-C3алкилокси или С1-C3алкилкарбонил, наиболее предпочтительно фтор.
R5и R6, предпочтительно, представляют Н, и R4иR7, предпочтительно, представляют галоген, наиболее предпочтительно оба представляют фтор.
Предпочтительно, D представляет -O-, n равно 0, m равно 1, R1представляет О, R2представляет замещенный пирид-2-ил и R3представляет Н. Альтернативное предпочтительное воплощение охватывает соединения, в которых D представляет -O-, n равно 0, m равно 1, R1представляет S, R2представляет замещенный пирид-2-ил и R3представляет Н.
Соединения формулы I могут быть введены в виде рацемической смеси, но предпочтительно промежуточный циклопропильный фрагмент, (тио)мочевинная функциональная группа, Х и фенильное кольцо (обозначенное ниже Y) являются, по меньшей мере, на 75%, такими как до примерно 90%, энантиомерно чистыми по отношению к конформации:

Предпочтительные оптические изомеры соединений формулы I показывают отрицательную величину оптического вращения. Такие изомеры, например, когда Х представляет -О-СН2-, как правило, элюируются менее быстро из хиральной хроматографической колонки, например, хиральной AGP 150 x 10 мм, 5 мкм; Crom Tech LTD Colomn, скорость потока 4 мл/мин, подвижная фаза 89% об. 10 мМ НОАс/NH4OAc в ацетонитриле. На основании предварительного рентгеновского кристаллографического анализа самой предпочтительной конфигурацией оказалась:
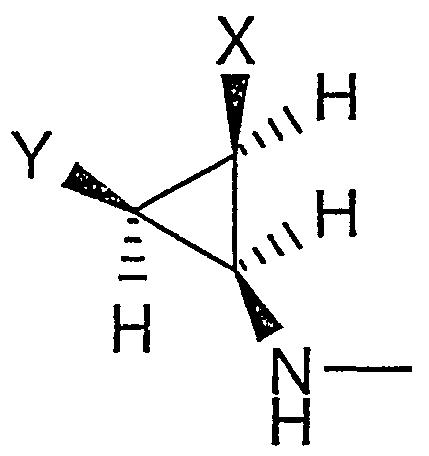
В данном случае предпочтительным значением для D является -O-. Подходящие значения для n и m включают 1:0 и 1:1. Предпочтительные значения n:m включают 0:2 и особенно 0:1, то есть хромановое производное. Особенно предпочтительные соединения имеют стереохимию, соответствующую (1S,1aR,7bR)-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-илу. В целях ясности, следует заметить, что структура

Выражение С1-Cnалкил, где n равно 3, 6, 7 и т.д., или низший алкил включает такие группы, как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил, н-пентил, н-гексил, 3-метилпентил и подобные. Термин галоген относится к хлору, брому, фтору и иоду, особенно к фтору. С1-Cnалкокси относится к группам, таким как метокси, этокси, пропокси, трет-бутокси и подобным. С2-Cnалкенил относится к группам, таким как винил, 1-пропен-2-ил, 1-бутен-4-ил, 1-пентен-5-ил, 1-бутен-1-ил и подобным. С1-Cnалкилтио включает метилтио, этилтио, трет-бутилтио и подобные. С1-Cnалканоилокси включает ацетокси, пропионокси, формилокси, бутирилокси и подобные. С2-Cnалкенокси включает этенилокси, пропенилокси, изобутоксиэтенил и подобные. ГалогенС1-Cnалкил (включая сложные заместители, содержащие такую группу, как галогенС1-Cnалкилокси) включает алкилы, как определено в данном описании, замещенные 1-3 раза галогеном, включая трифторметил, 2-дихлорэтил, 3,3-дифторпропил и подобные. Термин амин включает такие группы, как NH2, NHMe, N(Me)2, которые могут быть необязательно замещены галогеном, С1-C7ацилокси, С1-C6алкилом, С1-C6алкокси, нитро, карбокси, карбамоилом, карбамоилокси, циано, метилсульфониламино и т.п. Карбокси, карбоксиметил и карбамоил включают соответствующие фармацевтически приемлемые С1-C6алкиловые и ариловые сложные эфиры.
Пролекарства соединений формулы I представляют собой те соединения, которые после введения пациенту высвобождают in vivo соединения формулы I. Типичными пролекарствами являются фармацевтически приемлемые простые эфиры и, особенно, сложные эфиры (включая эфиры фосфорной кислоты), где любой из R4-R7 или необязательный заместитель для R2 представляет функциональную гидроксигруппу, фармацевтически приемлемые амиды или карбаматы, где любой из заместителей R2или R4-R7 представляет функциональную группу амина, или фармацевтически приемлемые сложные эфиры, где заместитель R2или R4-R7 представляет функциональную карбоксигруппу.
Соединения формулы I могут образовывать соли, которые представляют дополнительный аспект данного изобретения. Подходящие фармацевтически приемлемые соли соединений формулы I включают соли органических кислот, особенно карбоновых кислот, включая, но не ограничиваясь ими, ацетат, трифторацетат, лактат, глюконат, цитрат, тартрат, малеат, малат, пантотенат, изетионат, адипат, альгинат, аспартат, бензоат, бутират, диглюконат, циклопентанат, глюкогептанат, глицерофосфат, оксалат, гептаноат, гексаноат, фумарат, никотинат, пальмоат, пектинат, 3-фенилпропионат, пикрат, пивалат, проприонат, тартрат, лактобионат, пивалат, камфорат, ундеканоат и сукцинат, соли органических сульфоновых кислот, такие как метансульфонат, этансульфонат, 2-гидроксиэтансульфонат, камфорсульфонат, 2-нафталинсульфонат, бензолсульфонат, п-хлорбензолсульфонат и п-толуолсульфонат; и соли неорганических кислот, такие как гидрохлорид, гидробромид, гидроиодид, сульфат, бисульфат, гемисульфат, тиоцианат, персульфат, соли фосфорной и сульфоновой кислот.
Гидроксизащитная группа, как используемая в данном описании, относится к заместителю, который защищает гидроксильные группы от нежелательных реакций в процессе синтеза, например, -О-защитные группы, раскрытые в Greene, "Protective Groups in Organic Synthesis" (John Wiley & Sons, New York (1981)). Гидроксизащитные группы включают замещенные простые метиловые эфиры, например, метоксиметиловый, бензилоксиметиловый, 2-метоксиэтоксиметиловый, 2-(триметилсилил)этоксиметиловый, трет-бутиловый и другие простые низшие алкиловые эфиры, такие как изопропиловый, этиловый и особенно метиловый, бензиловый и трифенилметиловый; тетрагидропираниловые эфиры; замещенные простые этиловые эфиры, например, 2,2,2-трихлорэтиловый; простые силиловые эфиры, например, триметилсилиловый, трет-бутилдиметилсилиловый и трет-бутилдифенилсилиловый; и сложные эфиры, полученные взаимодействием гидроксильной группы с карбоновой кислотой, например, ацетат, пропионат, бензоат и подобные.
Изобретение также предлагает фармацевтические композиции, содержащие соединения данного изобретения и их фармацевтически приемлемые носители или разбавители. Дополнительные аспекты изобретения предлагают способы ингибирования ВИЧ, включающие введение соединения формулы I субъекту, страдающему или подверженному ВИЧ-1. ВИЧ-1 может включать мутант, устойчивый к лекарственным средствам, такой как штамм ВИЧ, включающий мутации при 100, 103 и/или 181 положениях, особенно K103N.
Изобретение также охватывает применение соединений формулы I в терапии, такой как изготовление лекарственных средств для лечения ВИЧ-инфекций.
При лечении состояний, вызванных ВИЧ, соединения формулы I предпочтительно вводят в количестве, которое необходимо для достижения уровня в плазме примерно 100-5000 нМ, такого как 300-2000 нМ. Это соответствует дозировке, в зависимости от биодоступности композиции, порядка 0,01-10 мг/кг/день, предпочтительно 0,1-2 мг/кг/день. Обычная доза для нормального взрослого пациента составляет примерно 0,05-5 г в день, предпочтительно 0,1-2 г, например, 500-750 мг, от одной до четырех единичных доз в день. Как и со всеми фармацевтическими средствами, доза будет изменяться в зависимости от веса и метаболизма пациента, а также от тяжести инфекции, и может быть необходимость приспособить ее к сопутствующей терапии.
В соответствии с обычной практикой применения ингибиторов ВИЧ является выгодным совместное введение одного-трех дополнительных антивирусных препаратов для получения синергических ответных реакций и для обеспечения дополнительной сопротивляемости. Такие дополнительные антивирусные препараты могут включать AZT, ddl, ddC, D4T, 3TC, DAPD, аловудин, абакавир, адефовир, адефовир дипивоксил, бис-POC-PMPA, GW420 867X, фоскарнет, гидроксимочевину, Hoechst-Bayer HBY 097, ефавиренз, тровирдин, каправирин, невирапин, делавиридин, типранавир, емтрицитабин, PFA, H2G (омацикловир), MIV-606 (валомацикловир стеарат), TMC-126, TMC-125, TMC-120, ефавиренз, DMP-450, ловирид, ритонавир (включая калетру), лопинавир, саквинавир, лазинавир, индинавир, ампренавир, ампренавирфосфат, нелфинавир и подобные, обычно в молярных соотношениях, отражающих их относительную активность и биодоступность. Главным образом, такое соотношение будет порядка 25:1 до 1:25, относительно соединения формулы I, но может быть ниже, например, в случае антагонистов цитохрома, таких как ритонавир.
Соединения изобретения обычно получают следующим образом:
Схема 1

(а) DPPA, Et3N, толуол; (b) замещенный 2-аминопиридин; (с) водный раствор HCl, диоксан; (d) замещенный 2-пиридилизотиоцианат.
Соединения общей формулы (I), где R1представляет О (мочевина) или S (тиомочевина), R2представляет, например, 5-замещенный пирид-2-ил и R3представляет Н, получают способами, показанными на схеме 1. Циклопропанкарбоновую кислоту 1-Схема-1 превращают в ацилазид и нагревают до 120°С, чтобы индуцировать перегруппировку Курциуса (Curtius) и получить изоцианат 2-Схема-1. Мочевину 3-Схема-1 получают реакцией сочетания изоцианата с подходящим образом замещенным 2-аминопиридином. Гидролиз изоцианата, как на стадии (с), приводящий к циклопропиламину 4-Схема-1, с последующей реакцией с 2-пиридилизотиоцианатом дает тиомочевину 5-Схема-1. Изотиоцианат может быть получен из необязательно замещенного на кольце 2-аминопиридина известными способами, такими как обработка тиофосгеном или тиокарбонилдиимидазолом. R3 варианты формулы I получают, соответственно, используя подходящим образом аминзамещенный амино-R2, т.е. 2-(N-метиламино)пиридин, для R3 в виде метила. Многие 2-аминопиридины являются коммерчески доступными, а другие описаны в литературе, например те, которые показаны на схеме 2. Соединения, где R1=S, альтернативно могут быть получены из изотиоцианата, соответствующего 2-Схема-2, или из амина 3-Схема-2 и амино-R2 в сочетании с RC(=S)R', оба, как описано в № WO 9303022. Хотя схема 1 проиллюстрирована с использованием замещенного пиридила, совершенно очевидно, что могут быть использованы соответствующие сочетания для других R2 вариантов, такие как необязательно замещенный тиазолил, пиразинил, бензотиазолил, пиримидинил и т.д.
Схема 2

(а) фенол, NaH, ДМФ; (b) 10% Pd/C, H2 1 атм, EtOH; (с) PdCl2 (PPh3)2, триметилсилилацетилен, CuI, диизопропиламин; (d) фторид трет-бутиламмония.
Замещение брома в 5-бром-2-нитропиридине феноксигруппой с последующим восстановлением нитрогруппы дает 2-амино-5-феноксипиридин. Сочетание Соногашира (Sonogashira) 2-амино-5-иодопиридина с концевым алкином SiMe3C≡CH в присутствии каталитических количеств дихлорида бис(трифенилфосфин)палладия и иодида меди, как на стадии (с), дает 2-амино-5-(2-триметилсилилэтинил)пиридин. Удаление силильной группы при помощи TBAF приводит к 2-амино-5-этинилпиридину, который может быть подвергнут реакции сочетания, как описано на схеме 1. Альтернативно, обработка TBAF может быть проведена с мочевиной 3-Схема-1 или тиомочевиной 5-Схема-1, где R10 представляет -С≡CSiMe3, для преобразования R10 в С≡СН.
Схема 3

(а) этилдиазоацетат, катализатор, CH2Cl2; (b) хроматография и затем кипячение с обратным холодильником с LiOH, H2O, MeOH; (с) кипячение с обратным холодильником с LiOH, H2O, MeOH и затем хроматография; (d) комнатная температура, NaOH, H2O, MeOH и затем кипячение с обратным холодильником с LiOH, H2O, MeOH.
Соединения общей формулы (I), где R1представляет О (мочевина) или S (тиомочевина), R2представляет, например, 5-замещенный пирид-2-ил, R3представляет Н, Х представляет -D-CH2, и где циклопропильный фрагмент имеет относительную конфигурацию

получают способами, показанными на схеме 3. Циклопропанирование двойной связи в хромене 1-Схема-3 этилдиазоацетатом катализируется солями меди или родия(II), такими как CuI, (CuOTf)2-бензол, и Rh2(OAc)4, в растворителях, таких как дихлорметан, 1,2-дихлорэтан или хлороформ. Реакция дает диастереомерную смесь этиловых эфиров циклопропанкарбоновой кислоты 2-Схема-3 с относительной конфигурацией для всех цис-изомеров и 3-Схема-3 для их транс-изомеров. Разделение колоночной хроматографией цис- и транс-диастереомеров может быть выполнено на данной стадии с последующим гидролизом выделенного 2-Схема-3, например, кипячением с обратным холодильником в водном метанольном растворе LiOH с получением рацемической смеси всех цис-изомеров циклопропанкарбоновой кислоты 4-Схема-3, как описано на стадии (b). Альтернативно, диастереомерная смесь этиловых эфиров может быть подвергнута гидролизу и разделению, проводимому на смеси циклопропанкарбоновых кислот, с выделением всего цис-изомерного продукта, как на стадии (с). Стадия (d) включает выделение цис-этилового сложного эфира 2-Схема-3, который также может быть получен селективным гидролизом транс-соединения 3-Схема-3 при низких температурах, например, обработкой водным метанольным раствором NaOH при температуре окружающей среды. Выделенный цис-этиловый эфир затем может быть гидролизован обычным способом до циклопропанкарбоновой кислоты 4-Схема-3. Циклопропанкарбоновую кислоту подвергают обработке способами, как показано на схеме 1, до получения мочевины или тиомочевины 5-Схема-3. Хромены 1-Схема-3 получают способами, показанными на схемах 4, 5 и 6.
Хотя схема 3 проиллюстрирована вариантом с D=O, должно быть понятно, что возможны соответствующие манипуляции с D=S, S=O; S(=O)2 и D=NR8 вариантами. Когда R8 представляет Н, азот обычно является защищенным традиционной защитной группой вторичного амина, такой как описано в Greene & Wuts, Protective Groups in Organic Synthesis 2nded, Wiley NY (1991).
Схема 4

(а) 3-бромпропин, К2СО3, ацетон; (b) N,N-диэтиланилин или PEG-200, 225°С.
Схема 4 описывает получение хроменов, включая многие из коммерчески доступных дизамещенных фенолов, таких как те, у которых замещение в бензольном кольце представляет собой следующее: R4 и R7представляют галоген; R4 и R6представляют галоген; R5 и R7представляют галоген; R4 представляет галоген и R7представляет С1-3алкилкарбонил; и R4 представляет гидрокси, в то время как R5представляет С1-3алкилкарбонил. Реакция доступного дизамещенного фенола 1-Схема-4 с 3-бромпропином в присутствии основания, такого как К2СО3 в ацетоне или NaH в ДМФ, приводит к нуклеофильному замещению галогенида с получением простого эфира 2-Схема-4. Замыкание кольца может быть осуществлено нагреванием эфира в N,N-диметиланилине или полиэтиленгликоле с получением хромена 3-Схема-4.
Схема 5

(a) NaBH4, EtOH; (b) п-толуолсульфоновая кислота, толуол, кипячение с обратным холодильником.
Схема 5 описывает получение хроменов, используемых в качестве исходного вещества на схеме 3, из соответствующим образом замещенных хроманонов, которые являются легко доступными из коммерчески доступных хроманонов, например таких, у которых одно из положений в R4-R7 замещено галогеном или С1-3алкокси. Преобразование карбонильной группы в 4-хроманон 1а-Схема-5 и до соответствующего спирта при помощи подходящего восстанавливающего агента, такого как боргидрид натрия в этаноле, дает 2-Схема-5. Кипячение с обратным холодильником спирта с небольшими количествами кислоты, такой как п-TsOH в толуоле, вызывает дегидратацию 2-Схема-5 до желаемого хромена 1-Схема-3. Соответствующие манипуляции возможны для других вариантов D. Например, соответствующий 2Н-1-бензотиопиран легко может быть получен из коммерчески доступных (замещенных) тиохроман-4-онов реакцией с восстановителем, таким как гидрид металла, например, литийалюмогидрид, в органическом растворителе, таком как эфир, с последующей дегидратацией, такой как кипячение с обратным холодильником с кислотой, например, кислым сульфатом калия или подобной.
Схема 6
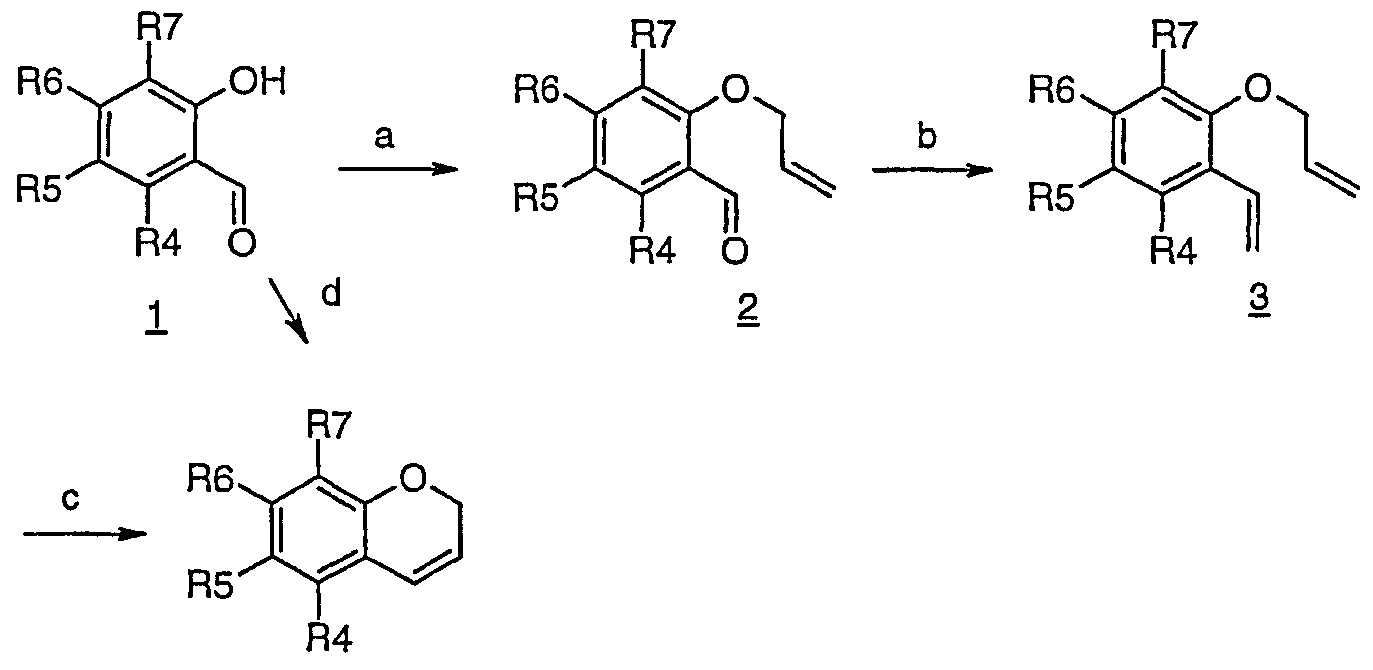
(а) аллилбромид, К2СО3, ацетон; (b) Ph3PCH3Br, NaH, ТГФ; (с) Cl2[Pcy3]2Ru=CHPh, CH2Cl2; (d) Ph3P+CH=CH2Br-, DBU.
Хромены для использования в качестве исходного материала на схеме 3 получают из замещенных о-гидроксибензальдегидов, как проиллюстрировано способами схемы 6. Реакция 1-Схема-6 с аллилбромидом в присутствии основания, такого как К2СО3 в ацетоне, приводит в результате к нуклеофильному замещению галогенида с получением простого эфира 2-Схема-6. Посредством реакции Виттинга (Witting) альдегидную группу превращают в олефин и получают 3-Схема-6. Пара концевых двойных связей может подвергаться внутримолекулярному обмену при помощи обработки катализатором, таким как катализатор Грабба (Grubb) на основе комплекса рутения, на стадии (с) с получением хромена. Альтернативно, 1-Схема-6 может быть циклизован непосредственно, как показано на стадии (d) в описании к схеме выше.
Схема 7

(а) Pd(O), DPPP, Et3N, (CH3)3SiC≡CH; (b) Pd(O), бутилвиниловый эфир, ДМФ; (с) Pd(O), Zn(CN)2, ДМФ; (d) NaOH, H2O, MeOH. Катализируемая Pd(O) реакция сочетания трифлата 1-Схема-7 приводит к замещению трифторметансульфонилоксигруппы и введению других заместителей при R6. Таким образом, схема 7 представляет собой получение синтезированных промежуточных соединений для использования в схеме 3 для получения мочевины или тиомочевины 5-Схема-3, где R6представляет циано, этинил или С1-3алкилкарбонил.
Схема 8

(a) BuLi/ZnCl2, ТГФ; Pd(OAc)2, BrCH=CHCOOEt; DIBAL
(b) TsNHN=CHCOCl; PhNMe2, NEt3, CH2Cl2
(c) Rh2(5-R-MEPY)4, абс. дегазированный дихлорметан
(d) 30% HBr, AcOH
(e) NaOH, H2O(f) NaOH; CO2; I-PrI/ДМСО
(g) iPrOH, HCl; DEAD, PPh3, ТГФ
(h) NaOH, MeOH:H2O
(i) 1. BBr3, CH2Cl2 2. CH3CN 3. NaOH, вода
(j) 1. BuLi/ZnCl2, ТГФ; Pd(OAc) 2. соединение 9-Схема-8 3. реагент Джонса (Jones) (хромовая кислота, серная кислота в ацетоне).
Удобные пути получения соединений, в которых Х представляет -СН2-О-, показаны на схеме 8, где Ra и Rbпредставляют необязательные заместители R4-R7, которые являются подходящим образом защищенными, в случае необходимости, подходящими защитными группами, и Rс представляет сложный низший алкиловый эфир. Необязательно замещенный фенол 1-Схема-8, который является гидроксизащищенным защитной группой, такой как метил, МОМ и подобными, подвергают взаимодействию с основанием, таким как BuLi или подобным, в растворителе, таком как ТГФ или подобный, и превращают в соль цинка при добавлении хлорида цинка или подобного. Катализатор, такой как Pd(OAc)2 или подобный, добавляют вместе с активированным акрилатом, таким как низший алкил-цис-3-галогенакрилат, например, BrCH=CHCOOEt или подобный. Реакционную смесь охлаждают и порциями добавляют восстановитель, такой как DIBAL или подобный, и реакцию гасят с получением на выходе 2-Схема-8. Гидразон, такой как п-толуолсульфонилгидразон или хлорангидрид глиоксиловой кислоты или подобный, и основание, такое как N,N-диметиланилин или подобное, добавляют в растворитель, такой как CH2Cl2 или подобный, с последующим добавлением другого основания, такого как Et3N или подобного, с получением 3-Схема-8. Продукт реакции растворяют в растворителе, таком как дихлорметан или подобный, который является предпочтительно дегазированным. Добавляют хиральный катализатор Дойла (Doyle), такой как Rh2(5-R-MEPy)4 (US 5175311, доступный от Aldrich или Johnson Matthey) или подобный, с получением 4-Схема-8 в большом энантиомерном избытке, например, более чем 80%, предпочтительно, более чем 90% ее. Предпочтительно, данное соединение сначала подвергают взаимодействию с BBr3 в дихлорметане с последующим добавлением к реакционной смеси ацетонитрила и в конце добавляют гидроксид натрия с получением 6-Схема-8. Альтернативно, продукт (4-Схема-8) подвергают реакции раскрытия кольца в присутствии электрофила, предпочтительно HBr или подобного, в сочетании с кислотой, такой как АсОН или подобной. В кислых условиях происходит спонтанное закрытие кольца с образованием хроменона 5-Схема-8. В случае, когда воздействие осуществляют в основных условиях, таких как NaOH или подобные, хроменон перегруппировывается с образованием хроменциклопропилкарбоновой кислоты 6-Схема-8. Альтернативно, соединение 4-Схема-8, например, в случае, если фенольная защитная группа представляет собой МОМ, взаимодействие может быть осуществлено в основных условиях, таких как NaOH в присутствии диоксида углерода и низшего алкилгалогенида, такого как iPrI, в растворителе, таком как ДМСО, что приводит к открытию лактона и получению сложного алкилового эфира 7-Схема-8. Замещение гидроксизащитной группы и замыкание кольца свободным гидроксиметильным фрагментом имеет место в кислых условиях, таких как iPrOH/HCl или подобное, с последующей обработкой DEAD; PPh3в органическом растворителе, таком как ТГФ или подобный.
Альтернативно, при другом подходе, соединение 1-Схема-8 подвергают взаимодействию с BuLi и превращают в соль цинка. Данную соль подвергают взаимодействию с циклопропилиодидом, 9-Схема-8, по реакции, катализируемой палладием, с получением после реакции с реагентом Джонса (Jones) соединения 4-Схема-8. Эту карбоновую кислоту, в свою очередь, превращают в изоцианат, как показано на схеме 1, а затем в гетероарилмочевину или гетероарилтиомочевину формулы I.
Следующий аспект изобретения предлагает новые промежуточные соединения, используемые в описанных выше способах получения соединения формулы I. Предпочтительная группа промежуточных соединений включает соединения формулы II:

где Х и R4-R7 являются такими, как определено выше, и R11 представляет -C(O)OR12, где R12 представляет Н или карбоксизащитную группу, такую как сложный низший алкиловый эфир; -NCO, -NCS или амин, такой как NH2. Предпочтительная подгруппа соединений формулы II имеет формулу III:

где R4 и R7представляют независимо галоген, наиболее предпочтительно фтор, и R11представляет -СООН, ее сложный низший алкиловый эфир, изоцианат, изотиоцианат или амино.
Следующая группа предпочтительных промежуточных соединений включает соединения формулы IV

где R4-R7 являются такими, как определено выше, PG представляет гидроксизащитную группу и PG* представляет гидроксизащитную группу или вместе со смежным атомом О обозначает функциональную кетогруппу.
Предпочтительной подгруппой соединений формулы IV являются соединения формулы V:

где R4 и R7независимо представляют галоген, наиболее предпочтительно фтор, PG представляет низший алкил, такой как изопропил, этил и, наиболее предпочтительно, метил, и PG* представляет низший алкил, такой как изопропил, этил, и наиболее предпочтительно, метил, или вместе со смежным атомом О обозначает кетогруппу.
Еще одна группа предпочтительных промежуточных соединений включает соединения формулы VI:

где R4-R7 являются такими, как определено выше, PG представляет гидроксизащитную группу и R13представляет Н, их сложный эфир или гидроксизащитную группу. Предпочтительная подгруппа в формуле VI имеет формулу VII:

где R4 и R7представляют независимо галоген, предпочтительно фтор, PG представляет низший алкил, такой как изопропил, этил и наиболее предпочтительно метил, и R12представляет Н или -С(=О)СН=N=N.
Предпочтительные соединения формулы I включают
цис-1-(5-цианопиридин-2-ил)-3-(1,1a,2, 7b-тетрагидроциклопропа[c|хромен-1-ил)мочевину,
цис-1-(5-цианопиридин-2-ил)-3-(1,1a,3,7b-тетрагидро-2-оксациклопропа[a]нафталин-1-ил)мочевину,
цис-1-(5-цианопиридин-2-ил)-3-(7-гидрокси-6-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
цис-1-(6-ацетил-7-гидрокси-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(5-цианопиридин-2-ил)мочевину,
цис-1-(5-цианопиридин-2-ил)-3-(7-фтор-4-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
цис-1-(5-цианопиридин-2-ил)-3-(7-фтор-4-метокси-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
цис-1-(5-цианопиридин-2-ил)-3-(7-фтор-4-хлор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
цис-1-(5-хлорпиридин-2-ил)-3-(4-хлор-7-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
цис-1-(5-бромпиридин-2-ил)-3-(4-хлор-7-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
цис-1-(5-цианопиридин-2-ил)-3-(5-циано-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
цис-1-(5-цианопиридин-2-ил)-3-(5-этинил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
цис-1-(5-ацетил-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(5-цианопиридин-2-ил)мочевину,
цис-1-(5-метокси-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(5-цианопиридин-2-ил)мочевину,
цис-1-(5-цианопиридин-2-ил)-3-(N-ацетил-1,1a,3,7b-тетрагидро-2-оксациклопропа[a]хинолин-1-ил))мочевину,
цис-1-(5-циано-3-метилпиридин-2-ил)-3-(4,7-дифтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
цис-1-(4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(5-этинилпиридин-2-ил)мочевину,
цис-1-(5-бромпиридин-2-ил)-3-(4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
цис-1-(4,7-дифтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(5-феноксипиридин-2-ил)мочевину,
цис-1-(5-цианопиридин-2-ил)-3-(4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)тиомочевину,
1-(6-хлор-5-цианопиридин-2-ил)-3-(5,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
1-(5-цианопиридин-2-ил)-3-(5,7-дифтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
цис-1-(4-бром-7-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(5-цианопиридин-2-ил)мочевину,
цис-1-(4-бром-7-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(6-хлор-5-цианопиридин-2-ил)мочевину,
цис-1-(4-бром-6-фтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(5-цианопиридин-2-ил)мочевину,
цис-1-(4-бром-6-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(6-хлор-5-цианопиридин-2-ил)мочевину,
цис-1-(5-цианопиридин-2-ил)-3-(6-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
цис-N-[1a, 6b-дигидро-1H-бензо[b]циклопропа[d]тиен-1-ил]-N'-(5-циано-2-пиридинил)мочевину,
N-[(1S,1aR,7bR) или (1R,1aS,7bS)-1,1a,2, 7b-тетрагидроциклопропа[c][1]бензотиопиран-1-ил]-N'-(5-циано-2-пиридинил)мочевину,
цис-N-(5-бром-2-пиридинил)-N'-(7-хлор-4-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
цис-N-(7-хлор-4-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-N'-(5-хлор-2-пиридинил)мочевину,
цис-N-(7-хлор-4-фтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)-N'-(5-циано-2-пиридинил)мочевину,
цис-N-(5-фенокси-2-пиридинил)-N'-(4,7-дихлор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
цис-N-(5-бром-2-пиридинил)-N'-(4,7-дихлор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
цис-N-(5-хлор-2-пиридинил)-N'-(4,7-дихлор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
цис-N-(5-циано-2-пиридинил)-N'-(4,7-дихлор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
N-[(1S,1aR,7bR)-4, 7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил]-N'-(5-фтор-2-пиридинил)мочевину,
N-[(1S,1aR,7bR)-4,7-дифтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил]-N'-(5-иод-2-пиридинил)мочевину,
N-[(1S,1aR,7bR)-4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил]-N'-(3-изоксазолил)мочевину,
N-[(1S,1aR,7bR)-4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил]-N'-[4-(4-хлорфенил)-1,3-тиазол-2-ил]мочевину,
N-[(1S,1aR,7bR)-4,7-дифтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил]-N'-(6-фтор-1,3-бензотиазол-2-ил)мочевину,
N-[(1S,1aR,7bR)-4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил]-N'-(4-пиримидинил)мочевину,
N-[(1S,1aR,7bR)-4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил]-N'-(2-пиразинил)мочевину,
N-[(1S,1aR,7bR)-4,7-дифтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил]-N'-(5-циклопропил-1Н-пиразол-3-ил)мочевину
и их фармацевтически приемлемые соли, особенно энантиомерно обогащенные, например, более чем 80% по массе, предпочтительно >90%, а именно >97% ее, или чистые препараты, включающие (-)энантиомер.
Особо предпочтительные соединения, таким образом, включают
(-)-цис-1-(5-цианопиридин-2-ил)-3-(4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
(-)-цис-1-(5-хлорпиридин-2-ил)-3-(4,7-дифтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину; или
(-)-цис-1-(5-цианопиридин-2-ил)-3-(4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)тиомочевину;
(-)-цис-1-(5-фторпиридин-2-ил)-3-(4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину,
(-)-цис-1-(5-фторпиридин-2-ил)-3-(4,7-дифтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)тиомочевину;
и их фармацевтически приемлемые соли.
Несмотря на то, что возможно введение активного агента отдельно, предпочтительно чтобы он присутствовал как часть фармацевтической композиции. Такая композиция содержит определенный выше активный агент вместе с одним или более приемлемыми носителями или эксципиентами и необязательно другими терапевтическими ингредиентами. Носитель(и) должен быть приемлемым в смысле его совместимости с другими ингредиентами композиции и безвредным для реципиента.
Композиции включают композиции, подходящие для ректального, назального, местного (включая буккальное и сублингвальное), вагинального или парентерального (включая подкожное, внутримышечное, внутривенное и внутрикожное) введения, но предпочтительно композиция представляет собой композицию для перорального введения. Композиции могут быть подходящим образом представлены в виде единичных дозированных форм, например таблеток и капсул с замедленным высвобождением, и могут быть получены любыми способами, хорошо известными в области фармацевтики.
Такие способы включают стадию объединения активного агента, определенного выше, с носителем. Главным образом, композиции получают путем однородного объединения активного агента с жидкими носителями или тонко измельченными твердыми носителями, или с обоими, и затем, если необходимо, с приданием формы продукту. Изобретение также касается способов получения фармацевтических композиций, включающих объединение или соединение соединения формулы I или его фармацевтически приемлемой соли с фармацевтически приемлемым носителем или растворителем. Если изготовление фармацевтических композиций включает тесное смешение фармацевтических эксципиентов и активного ингредиента в форме соли, в этом случае часто является предпочтительным использование эксципиентов, которые не основны по своей природе, т.е. являются либо кислыми, либо нейтральными. Композиции для перорального введения в данном изобретении могут быть представлены в виде отдельных единиц, таких как капсулы, саше или таблетки, каждая из которых содержит заранее определенное количество активного агента; в виде порошков или гранул; в виде раствора или суспензии активного вещества в водном растворе жидкости или не-водном растворе жидкости; или в виде жидкой эмульсии масло-в-воде или жидкой эмульсии вода-в-масле, или в виде болюса и т.д.
В отношении композиций для перорального введения (например, таблеток и капсул), термин "подходящий носитель" включает растворители, такие как обычно используемые эксципиенты, например, связывающие агенты, например, сироп, камедь акации, желатин, сорбит, трагакант, поливинилпирролидон (Povidone), метилцеллюлоза, этилцеллюлоза, натрийкарбоксиметилцеллюлоза, гидроксипропилметилцеллюлоза, сахароза и крахмал; наполнители и носители, например, кукурузный крахмал, желатин, лактоза, сахароза, микрокристаллическая целлюлоза, каолин, маннит, дикальцийфосфат, хлорид натрия и альгиновая кислота; и смазывающие вещества, такие как стеарат магния, стеарат натрия и другие стеараты металлов, стеариновая кислота, глицеринстеарат, силиконовая жидкость, тальковые воски, масла и коллоидный диоксид кремния. Также могут быть использованы ароматизирующие агенты, такие как перечная мята, масло грушанки, вишневый ароматизатор или подобные. При желании можно добавить краситель, чтобы сделать дозированную форму легко распознаваемой. Таблетки также могут быть покрыты способами, хорошо известными в данной области. Таблетку можно получить прессованием или формованием, необязательно с одним или более добавочными ингредиентами. Прессованные таблетки могут быть получены прессованием в подходящей машине активного агента в свободно текучей форме, такой как порошок или гранулы, необязательно смешанного со связывающим агентом, смачивающим агентом, инертным разбавителем, консервантом, поверхностно-активным веществом или диспергатором. Формованные таблетки могут быть получены формованием в подходящей машине смеси порошкообразного соединения, увлажненного инертным жидким разбавителем. Таблетки необязательно могут быть покрыты или помечены и могут быть составлены таким образом, чтобы обеспечить медленное или контролируемое высвобождение активного агента.
Другие композиции, подходящие для перорального введения, включают лепешки, содержащие активный агент в ароматизированной основе, обычно в сахарозе или камеди акации или трагаканте; пастилки, включающие активный ингредиент в инертном основании, таком как желатин и глицерин, или сахароза и аравийская камедь; и жидкости для полоскания рта, включающей активный агент в подходящем жидком носителе.
Подробное описание изобретения
Различные аспекты данного изобретения будут проиллюстрированы только со ссылкой на следующие неограничивающие примеры.
Пример 1
(±)-цис-1-(5-Цианопиридин-2-ил)-3-(1,1a,2,7b-тетрагидроциклопропа[c|хромен-1-ил)мочевина
а) Этиловый эфир (±)-цис-1,1a,2, 7b-тетрагидроциклопропа[c|хромен-1-карбоновой кислоты

К смеси 2Н-хромена (4,89 г, 37 ммоль) и (CuOTf)2-бензола (186 мг, 0,37 ммоль) в 1,2-дихлорэтане (80 мл) при 20°С добавляли по каплям (3 часа) раствор этилдиазоацетата (8,44 г, 74 ммоль) в 1,2-дихлорэтане (20 мл). Через 15 мин при 20°С реакционную смесь промывали Н2О (100 мл). Н2О фазу промывали СН2Cl2 (50 мл) и растворитель объединенных органических фаз удаляли при пониженном давлении. Неочищенный продукт хроматографировали на колонке (силикагель, 20→50% EtOAc в гексане) с получением 1,96 г (24%) этилового эфира (±)-цис-1,1a,2, 7b-тетрагидроциклопропа[c|хромен-1-карбоновой кислоты и 3,87 г (48%) этилового эфира (±)-транс-1,1a,2,7b-тетрагидроциклопропа[c|хромен-1-карбоновой кислоты в качестве побочного продукта.
1Н-ЯМР (CDCl3): 7,26 (д, 1H), 7,10 (дд, 1H), 6,90 (дд, 1H), 6,78 (д, 1H), 4,49 (дд, 1H), 4,20 (дд, 1H), 3,97 (кв, 2H), 2,44 (дд, 1H), 2,14 (дд, 1H), 2,07-1,95 (м, 1H), 1,02 (т, 3H).
b) (±)-цис-1,1a,2,7b-Тетрагидроциклопропа[c|хромен-1-карбоновая кислота

Смесь этилового эфира (±)-цис-1,1a,2,7b-тетрагидроциклопропа[c|хромен-1-карбоновой кислоты (1,96 г, 9,0 ммоль), LiOH (539 мг, 22,5 ммоль), Н2О (10 мл) и МеОН (20 мл) кипятили с обратным холодильником в течение 2 час. Реакционную смесь концентрировали до приблизительно 10 мл, добавляли по каплям 4N HCl с получением белого осадка. Реакционную смесь экстрагировали CH2Cl2 (3х15 мл) и растворитель объединенных органических фаз удаляли при пониженном давлении. Неочищенный продукт кристаллизовали из смеси EtOAc/гексан с получением 435 мг (25%) (±)-цис-1,1a,2,7b-тетрагидроциклопропа[c|хромен-1-карбоновой кислоты в виде твердого вещества белого цвета.
1Н-ЯМР (CDCl3): 9,80 (ушир.с, 1H), 7,22 (д, 1H), 7,10 (дд, 1H), 6,89 (дд, 1H), 6,77 (д, 1H), 4,45 (дд, 1H), 4,22 (дд, 1H), 2,45 (дд, 1H), 2,14-1,98 (м, 2H).
с) (± )-цис-1-(5-Цианопиридин-2-ил)-3-(1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина
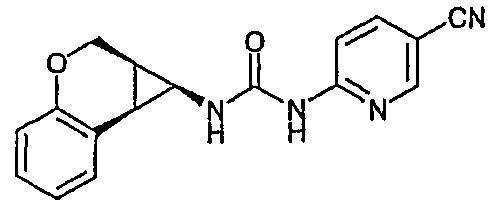
К раствору (±)-цис-1,1a,2,7b-тетрагидроциклопропа[c|хромен-1-карбоновой кислоты (285 мг, 1,5 ммоль) и триэтиламина (209 мкл, 1,5 ммоль) в толуоле (1,5 мл) при 20°С добавляли дифенилфосфорилазид (413 мг, 1,5 ммоль). Через 30 мин при 20°С реакционную смесь нагревали до 120°С в течение 15 мин, после чего добавляли раствор 2-амино-5-цианопиридина (197 мг, 1,65 ммоль) в ДМФ (1 мл). Через 3 часа при 120°С реакционную смесь оставляли до достижения комнатной температуры. Реакционную смесь концентрировали при пониженном давлении, добавляли бензол (20 мл) и реакционную смесь промывали 1N HCl (30 мл), Н2О (30 мл) и насыщенным раствором соли (30 мл). Растворитель органических фаз удаляли при пониженном давлении. Неочищенный продукт кристаллизовали из EtOH/CH2Cl2 с получением 133 мг (29%) (±)-цис-1-(5-цианопиридин-2-ил)-3-(1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевины.
1Н-ЯМР (ДМСО-d6): 9,78 (с, 1H), 8,31 (д, 1H), 7,99 (дд, 1H), 7,83 (д, 1H), 7,43 (д, 1H), 7,27 (д, 1H), 7,09 (дд, 1H), 6,89 (дд, 1H), 6,80 (д, 1H), 4,25 (дд, 1H), 4,14 (дд, 1H), 3,43 (м, 1H), 2,35 (дд, 1H), 1,92 (м, 1H).
Пример 2
(±)-цис-1-(5-Цианопиридин-2-ил)-3-(1,1a,3,7b-тетрагидро-2-оксациклопропа[a]нафталин-1-ил)мочевина
а) Этиловый эфир (±)-цис-1,1a,3,7b-тетрагидро-2-оксациклопропа[a]нафталин-1-карбоновой кислоты

Этиловый эфир (±)-цис-1,1a,3,7b-тетрагидро-2-оксациклопропа[a]нафталин-1-карбоновой кислоты синтезировали аналогично примеру 1а из 1Н-изохромена (3,57 г, 27 ммоль) с получением 910 мг (15%) этилового эфира (±)-цис-1,1a,3,7b-тетрагидро-2-оксациклопропа[a]нафталин-1-карбоновой кислоты.
1Н-ЯМР (CDCl3): 7,34 (д, 1H), 7,25 (дд, 1H), 7,18 (дд, 1H), 7,03 (д, 1H), 4,81 (д, 1H), 4,51 (д, 1H), 4,28 (дд, 1H), 3,95 (кв, 2H), 2,43 (дд, 1H), 2,05 (дд, 1H), 1,04 (т, 3H).
b) (±)-цис-1,1a,3, 7b-Тетрагидро-2-оксациклопропа[a]нафталин-1-карбоновая кислота

(± )-цис-1,1a,3,7b-Тетрагидро-2-оксациклопропа[a]нафталин-1-карбоновую кислоту синтезировали аналогично примеру 1b из этилового эфира (±)-цис-1,1a,3, 7b-тетрагидро-2-оксациклопропа[a]нафталин-1-карбоновой кислоты (436 мг, 2 ммоль) с получением 86 мг (22%) (±)-цис-1,1a,3,7b-тетрагидро-2-оксациклопропа[a]нафталин-1-карбоновой кислоты в виде твердого вещества белого цвета. Неочищенный продукт хроматографировали на колонке (силикагель, 1→5% МеОН в CH2Cl2).
1Н-ЯМР (CDCl3): 8, 50 (ушир.с, 1H), 7,39 (д, 1H), 7,30 (дд, 1H), 7,21 (дд, 1H), 7,07 (д, 1H), 4,87 (д, 1H), 4,57 (д, 1H), 4,38 (дд, 1H), 2,59 (дд, 1H), 2,15 (дд, 1H).
с) (± )-цис-1-(5-Цианопиридин-2-ил)-3-(1,1a,3,7b-тетрагидро-2-оксациклопропа[a]нафталин-1-ил)мочевина

(±)-цис-1-(5-Цианопиридин-2-ил)-3-(1,1a,3,7b-тетрагидро-2-оксациклопропа[a]нафталин-1-ил)мочевину синтезировали аналогично примеру 1с из (±)-цис-1,1a,3, 7b-тетрагидро-2-оксациклопропа[a]нафталин-1-карбоновой кислоты (86 мг, 0,45 ммоль). Неочищенный продукт хроматографировали на колонке (силикагель, 1→5% МеОН в CH2Cl2) с получением 21 мг (15%) (±)-цис-1-(5-цианопиридин-2-ил)-3-(1,1a,3,7b-тетрагидро-2-оксациклопропа[a]нафталин-1-ил)мочевины.
1Н-ЯМР (ДМСО-d6): 9,62 (с, 1H), 8, 29 (д, 1H), 7,98 (дд, 1H), 7,52-7,44 (м, 2H), 7,27-7,05 (м, 4H), 4,69 (д, 1H), 4,45 (д, 1H), 4,05 (дд, 1H), 3,25-3,10 (м, 1H), 2,22 (дд, 1H).
Пример 3
(± )-цис-1-(5-Цианопиридин-2-ил)-3-(7-гидрокси-6-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина
а) 1-(2-Гидрокси-4-проп-2-инилоксифенил)пропан-1-он

Смесь 2',4'-дигидроксипропиофенона (24,9 г, 0,15 моль), 3-бромпропина (24,2 г, 0,20 моль) и К2СО3 (20,7 г, 0,15 моль) в ацетоне (500 мл) кипятили с обратным холодильником в течение 12 час. Реакционную смесь оставляли до достижения комнатной температуры и осадок удаляли фильтрованием. Фильтрат концентрировали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией (силикагель, 0→2% МеОН в Н2О) с получением 26,2 г (85%) 1-(2-гидрокси-4-проп-2-инилоксифенил)пропан-1-она.
1Н-ЯМР (CDCl3): 12,80 (с, 1H), 7,69 (д, 1H), 6,52 (м, 2H), 4,72 (д, 2H), 2,96 (кв, 2H), 2,56 (т, 1H), 1,23 (т, 3H).
3b) 1-(5-Гидрокси-2Н-хромен-6-ил)пропан-1-он

Смесь 1-(2-гидрокси-4-проп-2-инилоксифенил)пропан-1-она (19,8 г, 97 ммоль) и N,N-диэтиланилина (100 мл) кипятили с обратным холодильником в течение 3 час. Реакционную смесь концентрировали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией (силикагель, 5→10% EtOAc в гексане) и затем перекристаллизовывали из смеси EtOAc/гексан с получением 8,91 г (45%) 1-(5-гидрокси-2Н-хромен-6-ил)пропан-1-она.
1Н-ЯМР (CDCl3): 13,00 (с, 1H), 7,49 (д, 1H), 6,75 (дт, 1H), 6,27 (д, 1H), 5,67 (дт, 1H), 4,86 (дд, 2H), 2,90 (кв, 2H), 1,19 (т, 3H).
3с) Этиловый эфир 7-гидрокси-6-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты

К смеси 1-(5-гидрокси-2Н-хромен-6-ил)пропан-1-она (511 мг, 2,5 ммоль) и (Rh(II)Ac2)2 (11 мг, 0,025 ммоль) в 1, 2-дихлорэтане (8 мл) при 20°С добавляли по каплям (3 часа) раствор этилдиазоацетата (571 мг, 5 ммоль) в 1,2-дихлорэтане (2 мл). Через 20 мин при 20°С реакционную смесь промывали Н2О (10 мл). Н2О фазу промывали CH2Cl2(10 мл) и растворитель объединенных органических фаз удаляли при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией (силикагель, 1→5% МеОН в CH2Cl2) с получением 300 мг (41%) этилового эфира 7-гидрокси-6-пропионил-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (смесь 33/64 цис- и транс-изомеров).
1Н-ЯМР (CDCl3): 13,13-13,07 (м, 1H), 7,57-7,49 (м, 1H), 6,41-6,38 (м, 1H), 4,65-3,92 (м, 4H), 3,01-1,95 (м, 5H), 1,29-1,08 (м, 6H).
3d) (±)-цис-7-Гидрокси-6-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновая кислота
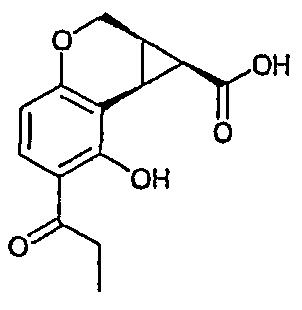
(±)-цис-7-Гидрокси-6-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновую кислоту синтезировали аналогично примеру 2b из этилового эфира 7-гидрокси-6-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (299 мг, 1,03 ммоль, смесь 33/64 цис- и транс-изомеров) с получением 39,3 мг (15%) (±)-цис-7-гидрокси-6-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты в виде твердого вещества белого цвета и (± )-транс-7-гидрокси-6-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты в качестве побочного продукта. Неочищенный продукт очищали колоночной хроматографией (силикагель, 1→ 5% МеОН в CH2Cl2).
1Н-ЯМР (ДМСО-d6): 7,67 (д, 1H), 6,35 (д, 1H), 4,57 (дд, 1H), 4,36 (дд, 1H), 2,98 (кв, 2H), 2,55-2,46 (м, 1H), 2,18-2,00 (м, 2H), 1,10 (т, 3H).
3е) (±)-цис-1-(5-Цианопиридин-2-ил)-3-(7-гидрокси-6-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина
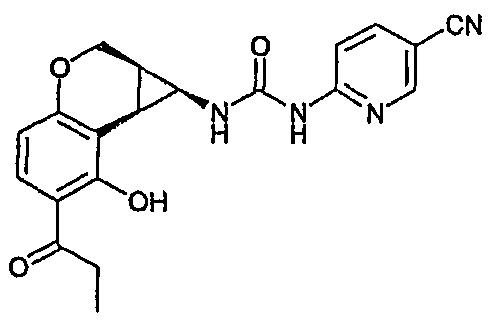
(±)-цис-1-(5-Цианопиридин-2-ил)-3-(7-гидрокси-6-пропионил-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину синтезировали аналогично примеру 1с из (±)-цис-7-гидрокси-6-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (39,3 мг, 0,15 ммоль). Неочищенный продукт очищали ВЭЖХ (С18, 5→95% ацетонитрила в Н2О) с получением 2,9 мг (5,1%) (±)-цис-1-(5-цианопиридин-2-ил)-3-(7-гидрокси-6-пропионил-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)мочевины.
1Н-ЯМР (ДМСО-d6): 13,15 (с, 1H), 9,71 (с, 1H), 8,30 (д, 1H), 8,01 (дд, 1H), 7,73 (д, 1H), 7,57 (д, 1H), 7,50 (д, 1H), 6,43 (д, 1H), 4,42 (дд, 1H), 4,13 (дд, 1H), 3,45-3,32 (м, 1H), 3,01 (кв, 2H), 2,49-2,42 (м, 1H), 1,97-1,86 (м, 1H), 1,12 (т, 3H).
Пример 4
(± )-цис-1-(6-Ацетил-7-гидрокси-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(5-цианопиридин-2-ил)мочевина
4а) 1-(2-Гидрокси-4-проп-2-инилоксифенил)этанон

1-(2-Гидрокси-4-проп-2-инилоксифенил)этанон синтезировали аналогично примеру 3а из 1-(2, 4-дигидроксифенил)этанона (20 г, 131 ммоль) с получением 22 г (88%) 1-(2-гидрокси-4-проп-2-инилоксифенил)этанона.
1Н-ЯМР (CDCl3): 12,70 (с, 1H), 7,66 (д, 1H), 6, 52 (м, 2H), 4,72 (д, 2H), 2,58-2,55 (м, 4H).
4b) 1-(5-Гидрокси-2Н-хромен-6-ил)этанон

1-(5-Гидрокси-2Н-хромен-6-ил)этанон синтезировали аналогично примеру 3b из 1-(2-гидрокси-4-проп-2-инилоксифенил)этанона (17 г, 89 ммоль) с получением 6,0 г (35%) 1-(5-гидрокси-2Н-хромен-6-ил)этанона.
1Н-ЯМР (CDCl3): 12,92 (с, 1H), 7,51 (д, 1H), 6,79 (дт, 1H), 6,32 (д, 1H), 5,71 (дт, 1H), 4,89 (дд, 2H), 2,55 (с, 3H).
4с) Этиловый эфир 6-ацетил-7-гидрокси-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты

Этиловый эфир 6-ацетил-7-гидрокси-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (смесь 40/60 цис- и транс-изомеров) синтезировали аналогично примеру 3с из 1-(5-гидрокси-2Н-хромен-6-ил)этанона.
1Н-ЯМР (CDCl3): 13,05-12,97 (м, 1H), 7,54-7,47 (м, 1H), 6,43-6,33 (м, 1H), 4,63-3,94 (м, 4H), 3, 02-1,96 (м, 6H), 1,31-1,08 (м, 3H).
4d) 6-Ацетил-7-гидрокси-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновая кислота

6-Ацетил-7-гидрокси-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновую кислоту синтезировали аналогично примеру 1b из этилового эфира 6-ацетил-7-гидрокси-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (2 г, 8,1 ммоль, смесь 40/60 цис- и транс-изомеров) с получением 300 мг (17%) 6-ацетил-7-гидрокси-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (смесь 40/60 цис- и транс-изомеров). Неочищенный продукт очищали колоночной хроматографией (силикагель, 1→5% МеОН в CH2Cl2).
1Н-ЯМР (CDCl3): 7,55-7,45 (м, 1H), 6,45-6,30 (м, 1H), 4,65-4,00 (м, 2H), 3,05-1,95 (м, 6H).
4е) (±)-цис-1-(6-Ацетил-7-гидрокси-1, 1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(5-цианопиридин-2-ил)мочевина

(±)-цис-1-(6-Ацетил-7-гидрокси-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(5-цианопиридин-2-ил)мочевину синтезировали аналогично примеру 1с из 6-ацетил-7-гидрокси-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (300 мг, 1,21 ммоль, смесь 40/60 цис- и транс-изомеров). Неочищенный продукт очищали ВЭЖХ (С18, 5→95% ацетонитрила в Н2О) с получением 7,7 мг (17%) (±)-цис-1-(6-ацетил-7-гидрокси-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(5-цианопиридин-2-ил)мочевины и 9,0 мг (20%) (± )-транс-1-(6-ацетил-7-гидрокси-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(5-цианопиридин-2-ил)мочевины в качестве побочного продукта.
1Н-ЯМР (CDCl3+CD3OD): 7,98 (д, 1H), 7,74 (дд, 1H), 7,60 (д, 1H), 7,01 (д, 1H), 6,40 (д, 1H), 4,43 (дд, 1H), 4,29 (дд, 1H), 3,57 (дд, 1H), 2,69 (м, 1H), 2,61 (с, 3H), 2,00-1,86 (м, 1H).
Пример 5
(±)-цис-1-(5-Цианопиридин-2-ил)-3-(7-фтор-4-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина
5а) 1-(4-Фтор-2-проп-2-инилоксифенил)пропан-1-он

К смеси NaH (95%, 278 мг, 11 ммоль) в ДМФ (20 мл) при 0°С добавляли 1-(4-фтор-2-гидроксифенил)пропан-1-он (1,68 г, 10 ммоль) в ДМФ (5 мл). Через 15 мин при 0°С к реакционной смеси добавляли 3-бромпропин (3,02 г, 20 ммоль). Через 1 час при 0°С реакционную смесь оставляли до достижения комнатной температуры. Реакционную смесь экстрагировали Н2О (100 мл). Н2О фазу промывали Et2O (3х100 мл) и растворитель объединенных органических фаз удаляли при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией (силикагель, CH2Cl2) с получением 1,40 г (68%) 1-(4-фтор-2-проп-2-инилоксифенил)пропан-1-она.
1Н-ЯМР (CDCl3): 7,64 (дд, 1H), 6,69 (дд, 1H), 6,60 (ддд, 1H), 4,68 (д, 2H), 2,85 (кв, 2H), 2,58 (т, 1H), 1,03 (т, 3H).
5b) 1-(5-Фтор-2Н-хромен-8-ил)пропан-1-он

1-(5-Фтор-2Н-хромен-8-ил)пропан-1-он синтезировали аналогично примеру 3b из 1-(4-фтор-2-проп-2-инилоксифенил)пропан-1-она (1,34 г, 6,5 ммоль) с получением 619 мг (46%) 1-(5-фтор-2Н-хромен-8-ил)пропан-1-она.
1Н-ЯМР (CDCl3): 7,60 (дд, 1H), 6,67-6,58 (м, 2H), 5,86 (дт, 1H), 4,76 (дд, 2H), 2,93 (кв, 2H), 1,23 (т, 3H).
5с) Этиловый эфир (±)-цис-7-фтор-4-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты

Этиловый эфир (±)-цис-7-фтор-4-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты синтезировали в соответствии со способом 3с) из 1-(5-фтор-2Н-хромен-8-ил)пропан-1-она (619 мг, 3 ммоль) с получением 142 мг (16%) этилового эфира (±)-цис-7-фтор-4-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты и этилового эфира (±)-транс-7-фтор-4-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты в качестве побочного продукта.
1Н-ЯМР (CDCl3): 7, 59 (дд, 1H), 6,65 (м, 1H), 4,50-4,46 (м, 2H), 3,95 (кв, 2H), 2,89 (кв, 2H), 2,57 (дд, 1H), 2,20 (дд, 1H), 1,13-1,03 (м, 1H), 1,12-1,01 (м, 6H).
5d) (±)-цис-7-Фтор-4-пропионил-1, 1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновая кислота

(± )-цис-7-Фтор-4-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновую кислоту синтезировали аналогично примеру 1b из этилового эфира (±)-цис-7-фтор-4-пропионил-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (140,3 мг, 0,48 ммоль) с получением 83 мг (65%) (±)-цис-7-фтор-4-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты в виде твердого вещества белого цвета. Неочищенный продукт очищали колоночной хроматографией (силикагель, 1→5% МеОН в CH2Cl2).
1Н-ЯМР (ДМСО-d6): 12,15 (ушир.с, 1H), 7,46 (дд, 1H), 6,78 (дд, 1H), 4,57 (дд, 1H), 4,43 (дд, 1H), 2,93-2,80 (м, 2H), 2,55 (дд, 1H), 2,24 (дд, 1H), 2,20-2,10 (м, 1H), 1,02 (т, 3H).
5е) (± )-цис-1-(5-Цианопиридин-2-ил)-3-(7-фтор-4-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина

(±)-цис-1-(5-Цианопиридин-2-ил)-3-(7-фтор-4-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину синтезировали аналогично примеру 1с из (±)-цис-7-фтор-4-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (81,9 мг, 0,31 ммоль). Неочищенный продукт очищали ВЭЖХ (С18, 5→95% ацетонитрила в Н2О) с получением 12 мг (10%) (±)-цис-1-(5-цианопиридин-2-ил)-3-(7-фтор-4-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевины.
1Н-ЯМР (ДМСО-d6): 9,81 (с, 1H), 8,33 (д, 1H), 8,04 (дд, 1H), 7,83 (ушир.с, 1H), 7,49-7,40 (м, 2H), 6,89 (дд, 1H), 4,41 (дд, 1H), 4,34 (дд, 1H), 3,46-3,38 (м, 1H), 2,76 (кв, 2H), 2,56-2,46 (м, 1H), 2,09-1,98 (м, 1H), 0,93 (т, 3H).
Пример 6
(±)-цис-1-(5-Цианопиридин-2-ил)-3-(7-фтор-4-метокси-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина
6а) 6-Фтор-2-гидрокси-3-метоксибензальдегид
1М Трихлорид бора в дихлорметане (25 мл, 25 моль) добавляли к раствору 6-фтор-2,3-диметоксибензальдегида [Cantrell, Amanda S.; Engelhardt, Per; Hoegberg, Marita; Jaskunas, S. Richard; Johansson, Nils Gunnar; et al.; J.Med.Chem.; 39; 21; 1996; 4261-4274] (4,26 г, 23 ммоль) в дихлорметане (30 мл), поддерживая температуру реакции при -70°С. Реакционную смесь перемешивали при комнатной температуре в течение ночи и гидролизовали водой. Органические фазы разделяли, промывали водой и выпаривали в вакууме. Остаток хроматографировали (силикагель, ЕА:Hex, 5:1) с получением 3,72 г (94%) 6-фтор-2-гидрокси-3-метоксибензальдегида в виде желтых кристаллов.
1Н-ЯМР (CDCl3): 11,61 (с, 1H), 10,23 (с, 1H), 7,02 (дд, 1H), 6,55 (прибл.т, 1H), 3,87 (с, 3H).
6b) 5-Фтор-8-метокси-2Н-хромен
6-Фтор-2-гидрокси-3-метоксибензальдегид (3,32 г, 19 ммоль) растворяли в ацетонитриле (20 мл) и добавляли DBU (2,97 мл, 19 моль) с последующим добавлением винилтрифенилфосфинбромида (7,2 г, 19 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 48 час, разбавляли водой и экстрагировали эфиром (3х50 мл). Органическую фазу промывали водой, 10% гидроксидом натрия, водой и насыщенным раствором соли и выпаривали в вакууме. Остаток подвергали колоночной хроматографии (силикагель, ЕА:Hex, 1:20) с получением 1,2 г 5-фтор-8-метокси-2Н-хромена (34%).
1Н-ЯМР (CDCl3): 6,65 (м, 2H), 6,54 (т, 1H), 5, 83 (дт, 1H), 4,88 (дд, 2H), 3,83 (с, 3H).
6с) Этиловый эфир (±)-цис-7-фтор-4-метокси-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты
Указанное в заголовке соединение синтезировали аналогично примеру 3с из 5-фтор-8-метокси-2Н-хромена.
1Н-ЯМР (CDCl3): 6,7-6,5 (м, 2H), 4,48 (м, 2H), 3,99 (м, 2H), 3,80 (с, 3H), 2,57 (прибл.т, 1H), 2,20 (прибл.т, 1H), 2,05 (м, 1H), 1,08 (т, 3H).
6d) (±)-цис-7-Фтор-4-метокси-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновая кислота
Указанное в заголовке соединение синтезировали аналогично примеру 1b из этилового эфира (±)-цис-7-фтор-4-метокси-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты.
1Н-ЯМР (CDCl3): 6,7-6,5 (м, 2H), 4,48 (м, 2H), 3,80 (с, 3H), 2,61 (прибл.т, 1H), 2,17 (прибл.т, 1H), 2,06 (м, 1H).
6е) (± )-цис-1-(5-Цианопиридин-2-ил)-3-(7-фтор-4-метокси-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина
Указанное в заголовке соединение синтезировали аналогично примеру 1с из (± )-цис-7-фтор-4-метокси-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (62 мг, 0,17 ммоль). Выход 38 мг (40%).
1Н-ЯМР (CDCl3): 10,06 (ушир.с, 1H), 9, 40 (ушир.д, 1H), 8,11 (д, 1H), 7,70 (дд, 1H), 6,91 (д, 1H), 6,68 (м, 2H), 4,48 (дд, 1H), 4,28 (дд, 1H), 3,90-3,72 (м, 4H), 2,64 (прибл.т, 1H), 1,96 (м, 1H).
Пример 7
(±)цис-1-(5-Цианопиридин-2-ил)-3-(7-фтор-4-хлор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина
7а) 1-Хлор-4-фтор-2-проп-2-инилоксибензол
Указанное в заголовке соединение синтезировали аналогично примеру 15а) из 2-хлор-5-фторфенола (2,5 г). Выход 2,8 г (90%).
1Н-ЯМР (CDCl3): 7,32 (дд, 1H), 6,85 (дд, 1H), 6,68 (м, 1H), 4,77 (д, 2H), 2,58 (т, 1H).
7b) 5-Фтор-8-хлор-2Н-хромен
Указанное в заголовке соединение синтезировали аналогично примеру 15b) из 1-хлор-4-фтор-2-проп-2-инилоксибензола (2,8 г). Выход 0,97 г (35%).
1Н-ЯМР (CDCl3): 7,09 (дд, 1H), 6,63 (дт, 1H), 6,56 (т, 1H), 5,84 (дт, 1H), 4,95 (дд, 2H).
7с) Этиловый эфир (±)-цис-7-фтор-4-хлор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты
Указанное в заголовке соединение синтезировали аналогично примеру 15с) из 5-фтор-8-хлор-2Н-хромена.
1Н-ЯМР (CDCl3): 7,14 (дд, 1H), 6,60 (т, 1H), 4,51 (м, 2H), 4,01 (м, 2H), 2,60 (прибл.т, 1H), 2,23 (т, 1H), 2,09 (м, 1H), 1,08 (т, 3H).
7d) (±)-цис-7-Фтор-4-хлор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновая кислота
Указанное в заголовке соединение синтезировали аналогично примеру 15d) из этилового эфира (±)-цис-7-фтор-4-хлор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (850 мг). Выход 43 мг (96%).
1Н-ЯМР (CDCl3): 8,86 (ушир.с, 1H), 7,13 (дд, 1H), 6,59 (т, 1H), 4,50 (м, 2H), 2,63 (т, 1H), 2,23-2,05 (м, 2H).
7е) (±)-цис-1-(5-Цианопиридин-2-ил)-3-(7-фтор-4-хлор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина
Указанное в заголовке соединение синтезировали аналогично примеру 1с из (±)-цис-7-фтор-4-хлор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (63 мг). Выход 52 мг (56%).
1Н-ЯМР (CDCl3): 9,79 (ушир.с, 1H), 9,34 (ушир.с, 1H), 8,22 (д, 1H), 7,72 (дд, 1H), 7,17 (дд, 1H), 6,87 (д, 1H), 6,67 (т, 1H), 4,54 (дд, 1H), 4,33 (дд, 1H), 3,84 (прибл.кв, 1H), 2,68 (дд, 1H), 2,00 (м, 1H).
Пример 8
(± )-цис-1-(5-Хлорпиридин-2-ил)-3-(4-хлор-7-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина
(±)-цис-1-(5-Хлорпиридин-2-ил)-3-(4-хлор-7-фтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину (15 мг, 24%) получали в соответствии со способом, описанным в примере 1с, из (±)-цис-(4-хлор-7-фтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен)-1-карбоновой кислоты (40 мг, 0,16 ммоль) и 2-амино-5-хлорпиридина (76 мг, 0,57 ммоль).
1Н-ЯМР (400 МГц, CDCl3) δ м.д.: 9, 29 (ушир.с, 1H), 9,26 (ушир.с 1H), 7,84 (д, 1H), 7,47 (дд, 1H), 7,16 (дд, 1H), 6,76 (д, 1H), 6,67 (дд, 1H), 4,65 (дд, 1H), 4,34 (дд, 1H), 3,82 (дд, 1H), 2,62 (дд, 1H), 1,96 (м, 1H).
Пример 9
(±)-цис-1-(5-Бромпиридин-2-ил)-3-(4-хлор-7-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина
(± )-цис-1-(5-Бромпиридин-2-ил)-3-(4-хлор-7-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину (13 мг, 19%) получали в соответствии с методикой, описанной в примере 1с, из (± )-цис-(4-хлор-7-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен)-1-карбоновой кислоты (40 мг, 0,16 ммоль) и 2-амино-5-бромпиридина (99 мг, 0,57 ммоль).
1Н-ЯМР (400 МГц, CDCl3) δ м.д.: 9,27 (ушир.с, 1H), 9,02 (ушир.с, 1H), 7,95 (д, 1H), 7,60 (дд, 1H), 7,16 (дд, 1H), 6,70 (д, 1H), 6,67 (дд, 1H), 4,50 (дд, 1H), 4,35 (дд, 1H), 3,81 (дд, 1H), 2,63 (дд, 1H), 1,97 (м, 1H).
Пример 10
(±)-цис-1-(5-Цианопиридин-2-ил)-3-(5-циано-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина
10а) 4-Формил-3-гидроксифениловый эфир трифторметансульфоновой кислоты
Раствор ангидрида трифторметансульфоновой кислоты (1,77 мл, 10,5 ммоль) в дихлорметане (10 мл) добавляли к смеси 2, 4-дигидроксибензальдегида (1,38 г, 10 ммоль) и пиридина (0,85 мл, 10,5 ммоль) в дихлорметане (30 мл) при -70°С. Баню с сухим льдом удаляли и реакционную смесь перемешивали в течение 2 час при комнатной температуре. Реакционную смесь разбавляли дихлорметаном, промывали водой, насыщенным раствором соли и выпаривали в вакууме. Неочищенный продукт очищали колоночной хроматографией (силикагель, ЕА:Нех, 1:6) с получением 1,55 г 4-формил-3-гидроксифенилового эфира трифторметансульфоновой кислоты (57%).
1Н-ЯМР (CDCl3): 11,28 (с, 1H), 9,93 (с, 1H), 7,67 (д, 1H), 6,95 (м, 2H).
10b) 3-Аллилокси-4-формилфениловый эфир трифторметансульфоновой кислоты
Карбонат калия (1,6 г, 11,5 ммоль) и аллилбромид (1 мл, 11,5 ммоль) добавляли к раствору 4-формил-3-гидроксифенилового эфира трифторметансульфоновой кислоты (1,55 г, 5,7 ммоль) в ацетоне (50 мл). Реакционную смесь перемешивали при 55°С в течение 2 час, фильтровали и выпаривали в вакууме. Остаток хроматографировали (силикагель, ЕА:Нех, 1:20) с получением 1,3 г (73%) 3-аллилокси-4-формилфенилового эфира трифторметансульфоновой кислоты.
1 Н-ЯМР (CDCl3): 10,47 (с, 1H), 7,93 (д, 1H), 6,95 (д, 1H), 6,90 (с, 1H), 6,05 (м, 1H), 5,47 (д, 1H), 5,40 (д, 1H), 4,69 (д, 2H).
10с) 3-Аллилокси-4-винилфениловый эфир трифторметансульфоновой кислоты.
Метилтрифенилфосфонийбромид (1,95 г, 5,45 ммоль) добавляли к суспензии гидрида натрия (60% в масле) (0,25 г, 6,3 ммоль) в ТГФ (35 мл) при 0°С и смесь перемешивали в течение 30 мин при комнатной температуре. К указанному выше раствору добавляли раствор 3-аллилокси-4-формилфенилового эфира трифторметансульфоновой кислоты (1,3 г, 4,2 ммоль) в ТГФ (15 мл) и реакционную смесь перемешивали в течение 2 час при комнатной температуре. Реакционную смесь разбавляли гексаном и экстрагировали водой. Органическую фазу промывали насыщенным раствором соли и выпаривали. Колоночная хроматография с силикагелем (ЕА:Нех, 1:20) давала 3-аллилокси-4-винилфениловый эфир трифторметансульфоновой кислоты (0,68 г, 53%).
1Н-ЯМР (CDCl3): 7,51 (д, 1H), 7,02 (дд, 1H), 6,85 (дд, 1H), 6,77 (д, 1H), 6,05 (м, 1H), 5,76 (дд, 1H), 5,43 (м, 1H), 5,32 (м, 2H), 4,58 (дт, 2H).
10d) 2Н-Хромен-7-иловый эфир трифторметансульфоновой кислоты
К раствору 3-аллилокси-4-винилфенилового эфира трифторметансульфоновой кислоты (0,68 г, 2,2 ммоль) в дихлорметане (5 мл) добавляли катализатор Ru (катализатор Грабба) (36 мг, 2 мол.%) и реакционную смесь перемешивали в течение 2 час при комнатной температуре. После завершения реакции (газовая хроматография (ГХ)) реакционную смесь использовали на следующей стадии без дополнительной обработки. После удаления растворителя колоночной хроматографией на силикагеле (ЕА:Нех, 1:20) получали аналитический образец.
1Н-ЯМР (CDCl3): 6,97 (д, 1H), 6,76 (дд, 1H), 6,68 (д, 1H), 6,39 (дт, 1H), 5,81 (дт, 1H), 4,98 (дд, 2H).
10е) Этиловый эфир (±)-цис-5-трифторметансульфонилокси-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты
Rh(OAc)2 (19 мг, 2 мол.%) добавляли к раствору соединения, полученному в 10d, и добавляли раствор EDA (0,44 мл, 4,4 ммоль) в 1 мл дихлорметана шприцевым насосом в течение 5 час при комнатной температуре. После завершения реакции (ГХ) дихлорметан выпаривали, остаток растворяли в этилацетате и промывали насыщенным раствором хлорида аммония и насыщенным раствором соли. Органическую фазу выпаривали и неочищенную смесь цис- и транс-изомеров (1:1,3) разделяли колоночной хроматографией (силикагель, ЕА:Hex, 1:6) с получением 0,4 г (50%) этилового эфира (±)-цис-5-трифторметансульфонилокси-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты.
1Н-ЯМР (CDCl3): 7, 29 (д, 1H), 6,82 (дд, 1H), 6,73 (д, 1H), 4,51 (дд, 1H), 4,29 (дд, 1H), 3,98 (м, 2H), 2,45 (т, 1H), 2,19 (т, 1H), 2,05 (м, 1H), 1,03 (т, 3H).
10f) Этиловый эфир (±)-цис-5-циано-1, 1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты
Этиловый эфир (±)-цис-5-трифторметансульфонилокси-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (154 мг, 0,42 ммоль), Pd(OAc)2 (9 мг, 10 мол.%) и PPh3 (44 мг, 40 мол.%) смешивали в ДМФ (4 мл) и через реакционную смесь в течение 10 мин пропускали слабый поток азота. Добавляли Zn(CN)2(74 мг, 0,63 ммоль), емкость запаивали и реакционную смесь перемешивали при 120°С в течение ночи. Реакционную смесь разбавляли этилацетатом и экстрагировали насыщенным хлоридом аммония. Органическую фазу выпаривали и остаток хроматографировали (силикагель, ЕА:Нех, 1:5) с получением 53 г (52%) этилового эфира (±)-цис-5-циано-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты.
1Н-ЯМР (CDCl3): 7,33 (д, 1H), 7,19 (дд, 1H), 7,05 (д, 1H), 4,50 (дд, 1H), 4,25 (дд, 1H), 3,99 (кв, 2H), 2, 46 (т, 1H), 2,25 (т, 1H), 2,11 (м, 1H), 1,06 (т, 3H).
10g) (±)-цис-5-Циано-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновая кислота
Этиловый эфир (± )-цис-5-циано-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (53 мг, 0,22 ммоль) и NaOH (35 мг, 0,88 ммоль) растворяли в смеси метанола и воды (1:1) (5 мл). Реакционную смесь перемешивали в течение 30 мин при 60°С. Метанол выпаривали в вакууме и добавляли 20 мл воды. Полученный раствор экстрагировали эфиром. Водную фазу концентрировали, подкисляли 1М HCl до pH˜2 и экстрагировали эфиром. Органическую фазу промывали насыщенным раствором соли и упаривали с получением 42 мг (90%) (±)-цис-5-циано-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты.
1Н-ЯМР (CDCl3): 7,33 (д, 1H), 7,19 (дд, 1H), 7,06 (д, 1H), 4,51 (дд, 1H), 4,31 (дд, 1H), 2,53 (прибл.т, 1H), 2,27 (прибл.т, 1H), 2,16 (м, 1H).
10h) (±)-цис-1-(5-Цианопиридин-2-ил)-3-(5-циано-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина
(±)-цис-5-Циано-1, 1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновую кислоту (42 мг, 0,19 ммоль) и ТЕА (0,032 мл, 0,21 ммоль) растворяли в 3 мл толуола. Добавляли DPPA (0,046 мл, 0,21 ммоль) и 2-амино-5-цианопиридин (25 мг, 0,21 ммоль). Реакционную смесь кипятили с обратным холодильником при перемешивании в течение 3 час. Полученный осадок фильтровали и промывали горячим этанолом (3 мл) с получением 41 мг (63%) (±)-цис-1-(5-цианопиридин-2-ил)-3-(5-циано-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевины.
1Н-ЯМР (ДМСО-d6): 9,86 (с, 1H), 8,48 (д, 1H), 8,07 (дд, 1H), 7,97 (ушир.с, 1H), 7,51 (д, 1H), 7,43 (д, 1H), 7,37 (д, 1H), 7,34 (дд, 1H), 4,39 (дд, 1H), 4,19 (дд, 1H), 3,57 (прибл.кв, 1H), 2,54 (прибл.т, 1H), 2,09 (м, 1H).
Пример 11
(±)-цис-1-(5-Цианопиридин-2-ил)-3-(5-этинил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина
11а) Этиловый эфир (±)-цис-5-триметилсиланилэтинил-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты
Этиловый эфир (±)-цис-5-трифторметансульфонилокси-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (152 мг, 0, 41 ммоль), DPPP (38 мг, 20 мол.%), PD(dba)2 (24 мг, 10 мол.%), CuI (3 мг, 4 мол.%) смешивали в 3 мл триэтиламина и через реакционную смесь в течение 10 мин пропускали слабый поток азота. Добавляли триметилсилилацетилен (0,088 мл, 0,62 ммоль), емкость запаивали и реакционную смесь перемешивали при 120°С в течение ночи. Реакционную смесь разбавляли этилацетатом, промывали водой, насыщенным раствором соли и выпаривали. Остаток очищали колоночной хроматографией на силикагеле (ЕА:Нех, 1:15) с получением 0,1 г (77%) этилового эфира (±)-цис-5-триметилсиланилэтинил-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты.
1Н-ЯМР (CDCl3): 7,15 (д, 1H), 7,01 (дд, 1H), 6,88 (д, 1H), 4,47 (дд, 1H), 4,16 (дд, 1H), 3,96 (кв, 2H), 2, 38 (т, 1H), 2,13 (т, 1H), 2,01 (м, 1H), 1,04 (т, 3H), 0,22 (с, 9H).
11b) (±)-цис-5-Этинил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновая кислота
Этиловый эфир (±)-цис-5-триметилсиланилэтинил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (0,1 г, 0,32 ммоль) и гидроксид натрия (0,076 г, 1,9 ммоль) растворяли в смеси метанол:вода (1:1) (5 мл). Реакционную смесь нагревали в течение 5 час при 60°С, затем ее подкисляли 1М HCl до pH˜2 и экстрагировали эфиром. Органическую фазу промывали насыщенным раствором соли и выпаривали с получением 66 мг (97%) (±)-цис-5-этинил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты.
1Н-ЯМР (CDCl3): 7,17 (д, 1H), 7,03 (дд, 1H), 6,91 (д, 1H), 4,45 (дд, 1H), 4,23 (дд, 1H), 3,02 (с, 1H), 2,46 (т, 1H), 2,13 (т, 1H), 2,07 (м, 1H).
11с) (±)-цис-1-(5-Цианопиридин-2-ил)-3-(5-этинил-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина
Указанное в заголовке соединение синтезировали аналогично примеру 10h из (±)-цис-5-этинил-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (66 мг, 31 ммоль). Выход 53 мг (52%).
1Н-ЯМР (ДМСО-d6): 9,88 (с, 1H), 8,41 (д, 1H), 8,06 (дд, 1H), 7,86 (ушир.с, 1H), 7,46 (д, 1H), 7,32 (д, 1H), 7,02 (дд, 1H), 6,93 (д, 1H), 4,31 (дд, 1H), 4,16 (дд, 1H), 4,12 (с, 1H), 3,47 (кв, 1H), 2,43 (прибл.т, 1H), 2,00 (м, 1H).
Пример 12
(±)-цис-1-(5-Ацетил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(5-цианопиридин-2-ил)мочевина
12а) Этиловый эфир (±)-цис-5-ацетил-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты
Этиловый эфир (±)-цис-5-трифторметансульфонилокси-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (117 мг, 0, 32 ммоль), DPPP (7,3 мг, 50 мол.%), PD(ОАс)2 (2 мг, 25 мол.%) и триэтиламин (0,09 мл, 0,64 ммоль) смешивали в ДМФ (3 мл) и через реакционную смесь в течение 10 мин пропускали слабый поток азота. Добавляли бутилвиниловый эфир (0,21 мл, 1,6 ммоль), емкость запаивали и реакционную смесь перемешивали при 100°С в течение 2 час. Добавляли 5% HCl (5 мл) и реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Полученную смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным хлоридом аммония и выпаривали. Остаток очищали колоночной хроматографией на силикагеле (ЕА:Нех, 1:5) с получением 76 мг (91%) этилового эфира (±)-цис-5-ацетил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты.
1 Н-ЯМР (CDCl3): 7,52 (дд, 1H), 7,36 (д, 1H), 7,34 (д, 1H), 4,51 (дд, 1H), 4,21 (дд, 1H), 3,98 (кв, 2H), 2,53 (с, 3H), 2,47 (т, 1H), 2,23 (т, 1H), 2,08 (м, 1H), 1,05 (т, 3H).
12b) (±)-цис-5-Ацетил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновая кислота
Указанное в заголовке соединение синтезировали аналогично примеру 10g из этилового эфира (±)-цис-5-ацетил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (76 мг, 29 ммоль). Выход 66 мг (97%).
1Н-ЯМР (CDCl3): 7,52 (дд, 1H), 7,37 (д, 1H), 7,34 (д, 1H), 4,52 (дд, 1H), 4,26 (дд, 1H), 2,55 (с, 3H), 2,53 (т, 1H), 2,25 (т, 1H), 2,13 (м, 1H).
12с) (±)-цис-1-(5-Цианопиридин-2-ил)-3-(5-ацетил-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина
Указанное в заголовке соединение синтезировали аналогично примеру 10h из (±)-цис-5-ацетил-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (66 мг, 28 ммоль). Выход 58 мг (59%).
1Н-ЯМР (ДМСО-d6): 9,87 (с, 1H), 8,42 (д, 1H), 8,05 (дд, 1H), 7,88 (ушир.с, 1H), 7,52 (дд, 1H), 7,49-7,44 (м, 2H), 7,37 (д, 1H), 4,39 (дд, 1H), 4,18 (дд, 1H), 3,55 (кв, 1H), 2,55-2,50 (м, 4H, пик сверхналожения на остаточный ДМСО-d6), 2,07 (м, 1H).
Пример 13
(±)-цис-1-(5-Метокси-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(5-цианопиридин-2-ил)мочевина
Указанное в заголовке соединение синтезировали аналогично примеру 10 из 2-гидрокси-4-метоксибензальдегида.
1Н-ЯМР (CDCl3): 8,44 (ушир.с, 1H), 8,06 (д, 1H), 7,70 (дд, 1H), 7,18 (д, 1H), 6,82 (ушир.д, 1H), 6,55 (дд, 1H), 6,36 (д, 1H), 4,32 (дд, 1H), 4,24 (дд, 1H), 3,76 (с, 3H), 3,58 (кв, 1H), 2,36 (дд, 1H), 1,86 (м, 1H).
Пример 14
(± )-цис-1-(5-Цианопиридин-2-ил)-3-(N-ацетил-1,1a,3,7b-тетрагидро-2-оксациклопропа[a]хинолин-1-ил))мочевина
а) N-Ацетил-1,2-дигидрохинолин
Хинолин (19,37 г, 150 ммоль) растворяли в безводном диэтиловом эфире (500 мл) и охлаждали до 0°С в инертной атмосфере. По каплям добавляли DIBAL, 1,5 М в толуоле (100 мл, 150 ммоль) в течение 2 час и реакционную смесь перемешивали при 0°С в течение 30 мин. По каплям добавляли уксусный ангидрид (500 мл) в течение 30 мин и реакционную смесь перемешивали при 0°С в течение 30 мин. Осторожно добавляли Н2О. Реакционную смесь экстрагировали диэтиловым эфиром и концентрировали с получением N-ацетил-1,2-дигидрохинолина (11,5 г, 44%).
b) Этиловый эфир (± )-цис-(N-ацетил-1,1a,2,7b-тетрагидроциклопропа[c]хинолин)-1-карбоновой кислоты
Этиловый эфир (±)-цис-(N-ацетил-1,1a,2,7b-тетрагидроциклопропа[с]хинолин)-1-карбоновой кислоты получали в соответствии с методикой, описанной в примере 1а, из N-ацетил-1,2-дигидрохинолина (10 г, 58 ммоль). Продукт очищали колоночной хроматографией на силикагеле (EtOAc/гексан 5%→50%) с получением этилового эфира (±)-цис-(N-ацетил-1,1a,2,7b-тетрагидроциклопропа[c]хинолин-1-карбоновой кислоты (2,0 г, 13%).
с) (±)-цис-(N-Ацетил-1,1a,2, 7b-тетрагидроциклопропа[c]хинолин-1-карбоновая кислота
(±)-цис-(N-ацетил-1,1a,2,7b-тетрагидроциклопропа[c]хинолин)-1-карбоновую кислоту (425 мг, 24%) получали в соответствии с методикой, описанной в примере 1b, из этилового эфира (±)-цис-(N-ацетил-1,1a,2,7b-тетрагидроциклопропа[c]хинолин-1-карбоновой кислоты (2,0 мг, 7,7 ммоль).
d) (± )-цис-1-(5-Цианопиридин-2-ил)-3-(N-ацетил-1,1a,3,7b-тетрагидро-2-оксациклопропа[a]хинолин-1-ил))мочевина
(±)-цис-1-(5-Цианопиридин-2-ил)-3-(N-ацетил-1,1a,3, 7b-тетрагидро-2-оксациклопропа[a]хинолин-1-ил))мочевину (250 мг, 40%) получали в соответствии с методикой, описанной в примере 1с, из (±)-цис-(N-ацетил-1,1a,2, 7b-тетрагидроциклопропа[c]хинолин-1-карбоновой кислоты (416 мг, 1,8 ммоль)
1Н-ЯМР (250 МГц, ДМСО-d6) δ м.д.: 9,51 (ушир.с, 1H), 8,30 (д 1H), 8,01 (дд, 1H), 7,54 (дд, 1H), 7,44, (дд, 1H), 7,36 (д, 1H), 7,23-7,18 (м, 3H), 4,10 (д, 1H), 3,60 (дд, 1H), 3,12-3,05 (м, 1H), 2,37 (т, 1H), 2,0-1,92 (м, 4H).
Пример 15
(+/-)-цис-1-(5-Цианопиридин-2-ил)-3-(4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина

15а) 2,4-Дифтор-2-пропинилоксибензол
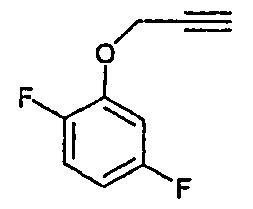
Коммерчески доступный 2,5-дифторфенол (20 г, 0,15 моль), К2СО3 (53 г, 0,38 моль) и коммерчески доступный 3-бромпропин (45 г, 0,38 моль) растворяли в ацетоне (300 мл), кипятили с обратным холодильником в течение ночи, охлаждали и фильтровали. Растворитель удаляли, неочищенный продукт растворяли в эфире и промывали водой и насыщенным раствором соли. Органическую фазу упаривали и неочищенный продукт повторно растворяли в небольшом количестве эфира и фильтровали через колонку основного Al2O3. Выпаривание и сушка давали 20 г (80%) 2, 4-дифтор-2-пропинилоксибензола.
15b) 5,8-Дифтор-2Н-хромен

2, 4-Дифтор-2-пропинилоксибензол (20 г, 0,12 моль) растворяли в N,N-диэтиланилине (100 мл) и нагревали в атмосфере аргона при 225°С на масляной бане в течение 6-8 час. Добавляли эфир (150 мл) и анилин удаляли экстракцией, используя 2М HCl(водн.). Очистка хроматографией (силикагель, н-гексан) давала 5,8-дифтор-2Н-хромен 5,8 г (29%).
15с) Этиловый эфир (+/-)-цис-4, 7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты

5, 8-Дифтор-2Н-хромен (5 г, 0,03 моль), (Rh(II)Ac2)2(0,39 г, 0,00089 моль) растворяли в 1,2-дихлорэтане (60 мл) или хлороформе, не содержащем этанола. Добавляли по каплям этилдиазоацетат (9,4 мл, 0,0089 моль) в том же растворителе в течение периода времени приблизительно 5 час, в атмосфере N2. Затем растворитель удаляли в вакууме и смесь переносили в этилацетат, промывали NaHCO3(водн.), водой и насыщенным раствором соли и растворитель удаляли. Продукт (33% цис, 66% транс) очищали хроматографией (0→10% этилацетата в н-гексане) с получением 2,2 г указанного в заголовке соединения (30%).
15d) цис-4,7-Дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновая кислота

Этиловый эфир цис-4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (2 г, 0,008 ммоль) нагревали в 1М LiOH в смеси метанол-вода (25%) при 80°С в течение 2 час. Объем уменьшали наполовину и подкисляли. Экстракция эфиром с последующей хроматографией (силикагель, эфир) давала указанное в заголовке соединение (35%).
15е) (+/-)-цис-1-(5-Цианопиридин-2-ил)-3-(4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина

(+/-)-цис-1-(5-Цианопиридин-2-ил)-3-(4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину получали аналогично примеру 1с, но используя цис-4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновую кислоту (0,2 г, 0,00088 моль), с получением 0,130 г (42%) чистого указанного в заголовке соединения. Неочищенный продукт очищали экстракцией между 0,01М HCl (водн.) и этилацетатом и хроматографией (силикагель, 0→1% МеОН в эфире). Растворитель выпаривали и твердое вещество промывали холодным раствором 50% ацетона в н-гексане.
1Н-ЯМР (CDCl3-MeOD): 8,16 (д, 1H), 7,72 (дд, 1H), 6,97-6,86 (м, 2H), 6,69-6,61 (м, 1H), 4,47 (дд, 1H), 4,31 (дд, 1H), 3,75 (м, 1H), 2,65 (т, 1H), 2,05-1,96 (м, 1H).
Пример 16
(±)-цис-1-(5-Циано-3-метилпиридин-2-ил)-3-(4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина

(±)-цис-1-(5-Циано-3-метилпиридин-2-ил)-3-(4,7-дифтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину получали аналогично примеру 1с, но используя цис-4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновую кислоту (168 мг, 0,74 ммоль) и 6-амино-5-метилникотинонитрил (109 мг, 0,82 ммоль), с получением (±)-цис-1-(5-циано-3-метилпиридин-2-ил)-3-(4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевины, 52 мг (20%). Неочищенный продукт очищали экстракцией между 0,01М HCl (водн.) и этилацетатом и хроматографией (силикагель, 0→25% МеОН в эфире). Растворитель выпаривали и твердое вещество промывали 25% ацетоном в н-гексане.
1Н-ЯМР (CDCl3-MeOD): 8,02 (д, 1H), 7,61 (дд, 1H), 6,97-6,87 (м, 1H), 6,70-6,62 (м, 1H), 4,48 (дд, 1H), 4,30 (дд, 1H), 3,78 (т, 1H), 3,37 (с, 3H), 2,66 (т, 1H), 2,03(м, 1H).
Пример 17
(±)-цис-1-(5-Хлорпиридин-2-ил)-3-(4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина

(±)-цис-1-(5-Хлорпиридин-2-ил)-3-(4,7-дифтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину получали аналогично примеру 1с, но используя цис-4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновую кислоту (90 мг, 0,4 ммоль) и 6-амино-5-хлорпиридин (51 мг, 0,44 ммоль), с получением (±)-цис-1-(5-хлорпиридин-2-ил)-3-(4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевины (50 мг, 35%). Неочищенный продукт очищали экстракцией между 0,01М HCl (водн.) и смесью этилацетат:эфир (1:1) и хроматографией (силикагель, эфир).
1Н-ЯМР (CDCl3): 9,2 (ушир.с, NH), 8,6 (ушир.с, NH), 7,81 (дд, 1H), 7,48 (дд, 1H), 6,89 (м, 1H), 6,75 (д, 1H), 6,69 (м, 1H), 4,45 (дд, 1H), 4,33 (дд, 1H), 3,75 (м, 1H), 2,61 (м, 1H), 1,97 (м, 1H).
Пример 18
(± )-цис-1-(4,7-Дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(5-этинилпиридин-2-ил)мочевина
(±)-цис-1-(4,7-Дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(5-этинилпиридин-2-ил)мочевину получали аналогично примеру 1с), но используя цис-4,7-дифтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновую кислоту (100 мг, 0,44 ммоль) и 5-триметилсиланилэтинилпиридин-2-иламин (93 мг, 0,49 ммоль), что давало 25 мг (17 %) желаемого продукта. Неочищенный продукт очищали экстракцией между 0,01М HCl (водн.) и смесью этилацетат:эфир (1:1) и хроматографией (силикагель, эфир). Полученную смесь (содержащую указанное в заголовке соединение вместе с силилированным соединением) перемешивали с Bu4N+F- в 25% воды в ТГФ в течение 30 мин и повторно хроматографировали с получением чистой (±)-цис-1-(4,7-дифтор-1, 1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(5-этинилпиридин-2-ил)мочевины.
1Н-ЯМР (CDCl3): 9,2 (ушир.с, NH), 7,95 (д, 1H), 7,59 (дд, 1H), 7,48 (ушир.с, 1H), 6, 89 (тд, 1H), 6,64 (тд, 1H), 6,57 (д, 1H), 4,46 (дд, 1H), 4,33 (дд, 1H), 3,78 (кв, 1H), 3,11 (с, 1H), 2,62 (т, 1H), 1,99-1,97 (м, 1H).
Пример 19
(± )-цис-1-(5-Бромпиридин-2-ил)-3-(4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина

(±)-цис-1-(5-Бромпиридин-2-ил)-3-(4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину получали аналогично примеру 1с, но используя цис-4,7-дифтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновую кислоту (50 мг, 0,22 ммоль) и 6-амино-5-бромпиридин (42 мг, 0,24 ммоль), с получением (±)-цис-1-(5-бромпиридин-2-ил)-3-(4,7-дифтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)мочевины (50 мг, 35%). Неочищенный продукт очищали экстракцией между 0,01 М HCl (водн.) и этилацетатом и хроматографией (силикагель, эфир).
1Н-ЯМР (CDCl3): 9,2 (ушир.с, NH), 7,88 (д, 1H), 7,75 (ушир.с, 1H), 7,60 (дд, 1H), 6,89 (м, 1H), 6,63 (тд, 1H), 6,59 (д, 1H), 4,45 (дд, 1H), 4,33 (дд, 1H), 3,78 (кв, 1H), 2,62 (т, 1H), 1,98 (м, 1H).
Пример 20
(±)-цис-1-(4,7-Дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(5-феноксипиридин-2-ил)мочевина

(±)-цис-1-(4,7-Дифтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(5-феноксипиридин-2-ил)мочевину получали аналогично примеру 1с), но используя цис-4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновую кислоту (60 мг, 0,26 ммоль) и 6-амино-5-феноксипиридин (56 мг, 0,29 ммоль), с получением 32 мг (30%) указанного в заголовке соединения. Неочищенный продукт очищали экстракцией между 0,01М HCl (водн.) и этилацетатом и хроматографией (силикагель, 20% эфир в н-гексане).
1Н-ЯМР (CDCl3): 7,60 (д, 1H), 7,45 (ушир.с, 1H), 7,37-7,34 (м, 2H), 7,27-7,24 (м, 2H), 7,14-7,11 (м, 1H), 6,94-9,92 (м, 2H), 6,79-7,74 (м, 1H), 6,63 (д, 1H), 6,59-6,55 (м, 1H), 4,43 (дд, 1H), 4,36 (дд, 1H), 3,75 (кв, 1H), 2,59 (т, 1H), 1,98-1,94 (м, 1H).
Пример 21
(±)-цис-1-(5-Цианопиридин-2-ил)-3-(4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)тиомочевина

цис-4,7-Дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновую кислоту (113 мг, 0,5 ммоль), DPPA (118,6 мкл, 055 ммоль) и ТЕА (70,7 мкл, 0,55 ммоль) кипятили с обратным холодильником в толуоле (2 мл) в течение 1 часа. Затем добавляли диоксан (3 мл) и HCl(водн.) (1,5 мл, 6М) и реакционную смесь оставляли при 50°С на 1 час. Затем добавляли эфир и воду и слои разделяли. Водную фазу промывали эфиром и затем подщелачивали аммиаком(водн.). Экстракция дихлорметаном и сушка давали промежуточное соединение 4,7-дифтор-1,1a, 2,7b-тетрагидроциклопропа[c]хромен-1-иламин, который сразу же обрабатывали 6-изотиоцианатоникотинонитрилом (34 мг, 0,55 ммоль) в ацетонитриле (4 мл) при комнатной температуре в течение ночи. Осажденные кристаллы отфильтровывали и промывали холодным ацетонитрилом с получением 30 мг (17%) чистой (±)-цис-1-(5-цианопиридин-2-ил)-3-(4,7-дифтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)тиомочевины. LC-MS:m/z 358,9.
Пример 22
1-(6-Хлор-5-цианопиридин-2-ил)-3-(5,7-дифтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина

1-(6-Хлор-5-цианопиридин-2-ил)-3-(5,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину получали аналогично примеру 1с), но используя цис-5,7-дифтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновую кислоту (280 мг, 1,21 ммоль) и 6-амино-2-хлор-3-цианопиридин (203 мг, 1,33 ммоль), с получением указанного в заголовке соединения в небольшом количестве. Неочищенный продукт очищали экстракцией между 0,01 М HCl (водн.) и эфиром и хроматографией (силикагель, эфир), затем промывали смесью ацетон-эфир.
1Н-ЯМР (ДМСО-d6 ): 10 (ушир.с, NH), 8,20 (д, 1H), 7,70 (д, 1H), 6,9 (ушир.с, NH), 6,8 (м, 1H), 6,6 (м, 1H), 4,4 (дд, 1H), 4,2 (дд, 1H), 3,2 (м, 1H), 2,4 (т, 1H), 1,9 (м, 1H).
Пример 23
1-(5-Цианопиридин-2-ил)-3-(5,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина

1-(5-Цианопиридин-2-ил)-3-(5,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину получали аналогично примеру 1с), но с использованием цис-5,7-дифтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (390 мг, 1,72 ммоль) и 2-амино-5-цианопиридина (226 мг, 1,89 ммоль). Неочищенный продукт очищали экстракцией между 0,01 М HCl (водн.) и эфиром, перекристаллизацией, несколькими промывками ацетоном и ацетонитрилом и хроматографией (силикагель, 1% EtOAc в эфире) с получением 28 мг указанного в заголовке соединения.
1 Н-ЯМР (CDCl3-MeOD): 8,16 (т, 1H), 7,78 (дд, 1H), 7,09 (д, 1H), 6,56-6,34 (м, 2H), 4,34 (м, 2H), 3,54 (т, 1H), 2,57 (дд, 1H), 2,00-1,90 (м, 1H).
Пример 24
цис-1-(4-Бром-7-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(5-цианопиридин-2-ил)мочевина

цис-1-(4-Бром-7-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(5-цианопиридин-2-ил)мочевину получали аналогично примеру 1с), но с использованием цис-4-бром-7-фтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (178 мг, 0,62 ммоль) и 2-амино-5-цианопиридина (0,81 мг, 0,68 ммоль). Неочищенный продукт хроматографировали (силикагель, эфир) и промывали ацетоном с получением 40 мг (16%) цис-1-(4-бром-7-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(5-цианопиридин-2-ил)мочевины.
1Н-ЯМР (CDCl3): 9,85 (с, 1H), 9,3 (с, 1H), 7,75 (дд, 1H), 7,33 (дд, 1H), 6,95 (д, 1H), 6,65 (т, 1H), 4,05 (дд, 1H), 4,32 (дд, 1H), 3,35 (т, H), 2,65 (т, 1H), 2,05-1,95 (м, 1H).
Пример 25
цис-1-(4-Бром-7-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(6-хлор-5-цианопиридин-2-ил)мочевина

цис-1-(4-Бром-7-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(6-хлор-5-цианопиридин-2-ил)мочевину получали аналогично примеру 1с, но с использованием цис-4-бром-7-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (178 мг, 0,62 ммоль) и 2-амино-6-хлор-5-цианопиридина (105 мг, 0,68 ммоль). Неочищенный продукт хроматографировали (силикагель, 0→1% МеОН в эфире) и промывали смесью ацетон-гексан с получением 40 мг (13%) цис-1-(4-бром-7-фтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(6-хлор-5-цианопиридин-2-ил)мочевины.
1Н-ЯМР (CDCl3): 9,90 (с, 1H), 8,30 (с, 1H), 7,75 (д, 1H), 7,25 (д, 1H), 6,60 (т, 1H), 4,5 (дд, 1H), 4,35 (дд, 1H), 3,5 (м, 1H), 2,65 (м, 1H), 2,1-1,95 (м, 1H).
Пример 26
цис-1-(4-Бром-6-фтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(5-цианопиридин-2-ил)мочевина

цис-1-(4-Бром-6-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(5-цианопиридин-2-ил)мочевину получали аналогично примеру 1с, но с использованием цис-4-бром-6-фтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (177 мг, 0,62 ммоль) и 2-амино-5-цианопиридина (81 мг, 0,68 ммоль). Неочищенный продукт экстрагировали между эфиром и 0,02 М HCl(водн.), хроматографировали (силикагель, 0→1% МеОН в эфире) и промывали смесью ацетон-гексан с получением 42 мг (17%) цис-1-(4-бром-6-фтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(5-цианопиридин-2-ил)мочевины.
1Н-ЯМР (CDCl3-MeOD): 8,37 (м, 1H), 7,75 (дд, 1H), 7,14 (дд, 1H), 7,05 (дд, 1H), 6,93 (д, 1H), 4,56 (дд, 1H), 4,21 (дд, 1H), 3,77 (т, 1H), 2,42 (дд, 1H), 2,00 (м, 1H).
Пример 27
цис-1-(4-Бром-6-фтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(6-хлор-5-цианопиридин-2-ил)мочевина

цис-1-(4-Бром-6-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(6-хлор-5-цианопиридин-2-ил)мочевину получали аналогично примеру 1с), но с использованием цис-4-бром-6-фтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (177 мг, 0,62 ммоль) и 2-амино-6-хлор-5-цианопиридина (105 мг, 0,68 ммоль). Неочищенный продукт экстрагировали между эфиром и 0,01 М HCl(водн.), хроматографировали (силикагель, 0→1% МеОН в эфире) и промывали смесью ацетон-гексан с получением 46 мг (17%) цис-1-(4-бром-6-фтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)-3-(6-хлор-5-цианопиридин-2-ил)мочевины.
1Н-ЯМР (CDCl3): 9,41 (с, 1H,), 8,28 (дд, 1H), 7,04 (дд, 1H), 4,54 (дд, 1H), 4,25 (дд, 1H), 3,50 (м, 1H), 2,41 (дд, 1H), 2,06-1,98 (м, 1H).
Пример 28
цис-1-(5-Цианопиридин-2-ил)-3-(6-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина

цис-1-(5-Цианопиридин-2-ил)-3-(6-фтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину получали аналогично примеру 1с), но с использованием цис-6-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (168 мг, 0,8 ммоль) и 2-амино-5-цианопиридина (105 мг, 0,88 ммоль). Неочищенный продукт экстрагировали между эфиром и 0,01 М HCl(водн.), хроматографировали (силикагель, 0→1% МеОН в эфире) и промывали смесью ацетон-гексан с получением только 10 мг (4%) цис-1-(5-цианопиридин-2-ил)-3-(6-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевины.
1Н-ЯМР (CDCl3 -MeOD): 8,16 (д, 1H), 7,73 (дд, 1H), 7,05 (дд, 1H), 6,96 (д, 1H), 6,84 (тд,1H), 6,76 (дд, 1H), 4,39 (дд, 1H), 4,17 (дд, 1H), 3,67 (т, 1H), 2,39 (дд, 1H), 1,96-1,92 (м, 1H).
Пример 29
Промежуточные соединения
29а) 6-Фторхроман-4-ол

6-Фторхроман-4-он (10 г, 61 ммоль) растворяли в этаноле (100 мл). Добавляли NaBH4 (избыток) и охлаждали на ледяной бане. Смесь затем оставляли при комнатной температуре на 2 часа с последующим кипячением с обратным холодильником в течение 4 час. Очистка хроматографией (силикагель, эфир-гексан, 1:5) давала 8 г (80%) чистого 6-фторхроман-4-ола.
29b) 6-Фтор-2Н-хромен

6-Фторхроман-4-ол (8 г, 48 ммоль) и толуол-4-сульфоновую кислоту (1 г) растворяли в толуоле и кипятили с обратным холодильником в течение ночи с постепенным удалением воды. Смесь затем охлаждали и промывали NaHCO3(водн.) и очищали хроматографией (силикагель, н-гексан) с получением 4,2 г (52%) чистого 6-фтор-2Н-хромена.
29с) Этиловый эфир (±)-цис-6-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты
Данное соединение получали аналогично получению этилового эфира цис-4,7-дифтор-1,1a, 2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты, но используя 6-фтор-2Н-хромен, с получением 1,9 г (29%) указанного в заголовке соединения.
29d) цис-6-Фтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновая кислота

Данное соединение получали аналогично получению цис-4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты, но используя этиловый эфир цис-6-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (1,9 г, 8 ммоль), с получением 350 мг (21%) чистой цис-6-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты.
29е) 1-Бром-4-фтор-2-проп-2-инилоксибензол

Данное соединение получали аналогично получению 2,4-дифтор-2-пропинилоксибензола, но используя 2-бром-5-фторфенол (15 г, 78 ммоль), с получением 1-бром-4-фтор-2-проп-2-инилоксибензола 15,6 г (87%).
29f) 2-Бром-4-фтор-1-проп-2-инилоксибензол

Данное соединение получали аналогично получению 2,4-дифтор-2-пропинилоксибензола, но используя 2-бром-4-фторфенол (15 г, 78 ммоль), с получением 2-бром-4-фтор-1-проп-2-инилоксибензола, 15 г (84%).
29g) 1,3-Дифтор-5-проп-2-инилоксибензол

Данное соединение получали аналогично получению 2,4-дифтор-2-пропинилоксибензола, но используя 3,5-дифторфенол (14 г, 107 ммоль), с получением 12 г (67%) 1,3-дифтор-5-проп-2-инилоксибензола.
29h) 8-Бром-6-фтор-2Н-хромен

Данное соединение получали аналогично получению 5,8-дифтор-2Н-хромена, но используя (15 г, 65 ммоль) 2-бром-4-фтор-1-проп-2-инилоксибензол, с получением 7 г (46%) указанного в заголовке соединения.
29i) 8-Бром-5-фтор-2Н-хромен

Данное соединение получали аналогично получению 5,8-дифтор-2Н-хромена, но используя (15 г, 65 ммоль) 1-бром-4-фтор-2-проп-2-инилоксибензол, с получением (3,7 г, 25%) указанного в заголовке соединения.
29j) 5,7-Дифтор-2Н-хромен

Данное соединение получали аналогично получению 5,8-дифтор-2Н-хромена, но используя (18 г, 107 ммоль) 1,3-дифтор-5-проп-2-инилоксибензол и PEG-200 в качестве растворителя, с получением 4 г (23%) указанного в заголовке соединения.
29k) Этиловый эфир (±)-цис-4-бром-6-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты

Данное соединение получали аналогично получению этилового эфира (±)-цис-4,7-дифтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты, но используя 5 г (22 ммоль) 8-бром-6-фтор-2Н-хромена, с получением 1,9 г (30%) этилового эфира цис-6-фтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты.
29l) Этиловый эфир (±)-цис-4-бром-7-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты

Данное соединение получали аналогично получению этилового эфира (±)-цис-4,7-дифтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты, но используя 3,5 г (15,3 ммоль) 8-бром-5-фтор-2Н-хромена, с получением 1,6 г (33%) этилового эфира (±)-цис-4-бром-7-фтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты.
29m) Этиловый эфир (±)-цис-5,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты

Данное соединение получали аналогично получению этилового эфира (±)-цис-4,7-дифтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты, но используя 2 г (12 ммоль) 5,7-дифтор-2Н-хромена, с получением 0,9 г (29%) этилового эфира (±)-цис-5,7-дифтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты.
Пример 30
Оптические изомеры цис-1-(5-цианопиридин-2-ил)-3-(4,7-дифтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)мочевины
Рацемическую (±)-цис-1-(5-цианопиридин-2-ил)-3-(4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину (см. пример 15) разделяли на оптически активные соединения с использованием хиральной колонки AGP 150 х 10 мм, 5 мкм; Crom Tech LTD. Скорость потока достигала 4 мл/мин. Подвижная фаза составляла 89 об.% 10мМ НОАс/NH4OAc в ацетонитриле. Наблюдали два пика элюирования. Изомер, элюирующийся вторым, обычно показывающий отрицательное вращение, является особенно активным.
Не желая никоим образом быть связанным данным наблюдением, полагают, что наиболее медленно элюирующийся изомер несет абсолютную конфигурацию, изображенную ниже, которая была определена на основании полученных методом рентгеновской кристаллографии координат незамещенного аналога примера 1, связанного лигандом в ферменте обратной транскриптазы. Конфигурация, изображенная ниже, четко видна в разделенной структуре, в то время как другой энантиомер не присутствует.
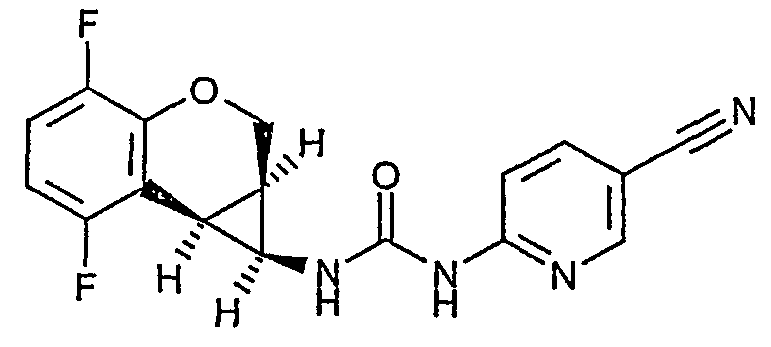
Пример 31
(-)цис-1-(5-Хлорпиридин-2-ил)-3-(4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина
Рацемическую (±)-цис-1-(5-хлорпиридин-2-ил)-3-(4,7-дифтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину (см. пример 17) разделяли на оптически активные соединения с использованием хиральной колонки AGP 150 х 10 мм, 5 мкм; Crom Tech LTD. Скорость потока достигала 4 мл/мин. Подвижная фаза составляла 89 об.% 10мМ НОАс/NH4OAc в ацетонитриле. Наблюдали два пика элюирования на 27,7 мин и 33,2 мин. Указанный в заголовке изомер элюировался при 33, 2 мин, обычно показывая отрицательное вращение, и являлся особенно активным.
Пример 32
(-)цис-1-(5-Цианопиридин-2-ил)-3-(7-фтор-4-хлор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина
а) Разделение рацемической цис-7-фтор-4-хлор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты
0,32 г (1,32 ммоль) рацемической цис-7-фтор-4-хлор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты растворяли в горячем ацетонитриле (50 мл) и добавляли (1R,2R)-2-бензилоксициклопентиламин (0,25 г, 1, 32 ммоль). Полученный раствор оставляли для кристаллизации. Через несколько часов маточную жидкость декантировали и кристаллы промывали ацетонитрилом. Вторая кристаллизация из ацетонитрила давала 92 мг чистой диастереомерной соли. Соль обрабатывали 1 М HCl и полученную смесь экстрагировали этилацетатом. Органическую фазу промывали водой, насыщенным раствором соли и выпаривали с получением 0,05 г энантиомерной цис-7-фтор-4-хлор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты.
b) (-)цис-1-(5-Цианопиридин-2-ил)-3-(7-фтор-4-хлор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина
Указанное в заголовке соединение синтезировали аналогично примеру 1с) из энантиомерной цис-7-фтор-4-хлор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (50 мг). Выход 60,2 мг (84%). [α]D=-0,388 (c=0,5, CHCl3).
Пример 33
(± )-цис-N-(5-циано-2-пиридинил)-N-(4,7-дихлор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина
а) 1,4-Дихлор-2-(2-пропинилокси)бензол

2,5-Дихлорфенол (8 г, 49 ммоль) смешивали с карбонатом калия (13,6 г, 98 ммоль) и 80% раствором пропаргилбромида в толуоле (11 мл, 98 ммоль) в ацетоне (100 мл) и перемешивали в течение ночи при комнатной температуре. Осадок удаляли фильтрованием и промывали ацетоном. Полученный ацетоновый раствор концентрировали роторным выпариванием и выдерживали в вакууме в течение 5 час. Получали продукт в виде желтого масла с количественным выходом. Его использовали для дальнейших преобразований без дополнительной очистки.
b) 5,8-Дихлор-2Н-хромен

1, 4-Дихлор-2-(2-пропинилокси)бензол дегазировали и нагревали при перемешивании в атмосфере аргона в течение 4 час при 224°С. Реакционную смесь затем подвергали дистилляции в аппарате Kugelrohr (150-175°С/4,1х10-2 мбар) с получением 3,58 г желаемого продукта в виде твердого вещества белого цвета. Выход 36% от исходного дихлорфенола.
с) (±)-цис-Этил 4, 7-дихлор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоксилат

5, 8-Дихлор-2Н-хромен (3,15 г, 16 ммоль), (Rh(II)Ac2)2 (30 мг, 0,1 мол.%) растворяли в дегазированном сухом метиленхлориде (3 мл). Добавляли этилдиазоацетат (3 мл, 2 экв.) в том же растворителе при помощи шприца при скорости потока 0,4 мл/час, в течение приблизительно 5 час в атмосфере N2. Реакционную смесь затем промывали NH4Cl (водн.), водой и насыщенным раствором соли и растворитель удаляли. Продукт (45% цис и 55% транс) очищали хроматографией на силикагеле (200 г, этилацетат/н-гексан 1:15) с получением 0,9 г чистого цис-продукта (рацемат). Выход 20%. М+=287.
1Н-ЯМР (CDCl3): 7,15 (д, 1H, J=8,5 Гц), 6,91 (д, 1H, J=8,8 Гц), 4,59 (дд, 1H, J1=12,02, J2=7,03), 4,48 (дд, 1H, J1=12,02, J2=4,10), 4,07-3,94 (м, 3H), 2,62 (т, 1H, J=8,8 Гц), 2,27 (т, 1H, J=8,36 Гц), 2,20-2,12 (м, 1H), 1,1 (т, 3H).
d) (±)-цис-4,7-Дихлор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновая кислота

(±)-цис-Этил 4, 7-дихлор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоксилат смешивали с метанолом (3 мл) и водным раствором NaOH (1,5 экв., 3 мл) и нагревали при перемешивании в течение 1,5 час при 60°С. Экстракция основной реакционной смеси в гексан показала отсутствие исходного вещества. Реакционную смесь подкисляли избытком 3 М раствора HCl (рН 1). Образовавшийся осадок собирали всасыванием и промывали водой. Полученное твердое вещество белого цвета сушили в высоком вакууме (выход 80%).
е) (±)-цис-N-(5-Циано-2-пиридинил)-N-(4,7-дихлор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина

(±)-цис-4,7-Дихлор-1,1a, 2,7b-тетрагидроциклопропа[c]хромен-1-карбоновую кислоту (100 мг, 0,39 ммоль) смешивали с толуолом (3 мл), триэтиламином (1,1 экв.), DPPA (1,1 экв.) и барботировали аргоном в течение приблизительно 5 мин. Реакционную смесь затем нагревали при перемешивании при 115°С в течение 3 час в атмосфере аргона. Реакционную смесь концентрировали выпариванием на роторном испарителе и смешивали с небольшим количеством сухого этанола. Образовавшийся осадок собирали всасыванием и промывали этанолом (2х2 мл). Желаемый продукт (+/-)-цис-изомер) получали в виде бежевато-белого порошка (65 мг, выход 45%).
1Н-ЯМР (ДМСО-d6): 9,83 (с, 1H), 8,34 (д, 1H), 8,03 (дд, 1H), 7,75 (ушир.с, 1H), 7,44 (д, 1H), 7,30 (д, 1H), 7,10 (д, 1H), 4,43 (дд, 1H), 4,18 (дд, 1H), 3, 55-3,45 (м, ˜1H, перекрывающийся с сигналом H2O), 2,54 (дд, 1H), 2,10-2,02 (м, 1H).
Пример 34
(±)-цис-N-(5-Хлор-2-пиридинил)-N-(4,7-дихлор-1,1a, 2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина

(± )-цис-N-(5-Хлор-2-пиридинил)-N-(4,7-дихлор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину синтезировали аналогично примеру 33 из (±)-цис-4,7-дихлор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (100 мг, 0,39 ммоль) и 2-амино-5-хлорпиридина (1,1 экв.) с получением 66 мг продукта в виде белого порошка. Выход 44%.
1 Н-ЯМР (ДМСО-d6): 9,47 (с, 1H), 7,98 (д, 1H), 7,86 (ушир.с, ˜1H), 7,83 (дд, 1H), 7,30 (д, 1H), 7,23 (д, 1H), 7,10 (д, 1H), 4,44 (дд, 1H), 4,18 (дд, 1H), 3,55-3,48 (м, 1H), 2,54 (дд, 1H), 2,10-2,02 (м, 1H).
Пример 35
(±)-цис-N-(5-Бром-2-пиридинил)-N'-(4,7-дихлор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина

(±)-цис-N-(5-Бром-2-пиридинил)-N'-(4,7-дихлор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину синтезировали аналогично примеру 33 из (±)-цис-4,7-дихлор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (100 мг, 0,39 ммоль) и 2-амино-5-бромпиридина (1,1 экв.) с получением 35 мг продукта в виде серого порошка. Выход 21%.
1Н-ЯМР (ДМСО-d6): 9,47 (с, 1H), 7,97 (д, 1H), 7,86 (ушир.с, ˜1H), 7,83 (дд, 1H), 7,30 (д, 1H), 7,23 (д, 1H), 7,10 (д, 1H), 4,43 (дд, 1H), 4,18 (дд, 1H), 3,55-3,48 (м, 1H), 2,54 (дд, ˜1H, перекрывающийся с сигналом ДМСО), 2,08-2,01 (м, 1H).
Пример 36
(±)-цис-N-(5-Фенокси-2-пиридинил)-N'-(4,7-дихлор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина

(±)-цис-N-(5-Фенокси-2-пиридинил)-N'-(4,7-дихлор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину синтезировали аналогично примеру 33 из (±)-цис-4,7-дихлор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (58 мг, 0,22 ммоль) и 2-амино-5-феноксипиридина (1,1 экв.) с получением 49 мг продукта в виде слегка коричневатого порошка. Выход 49%.
1Н-ЯМР (CDCl3): 9,30 (ушир.с, 1H), 8,26 (с, 1H), 7,53 (д, 1H), 7,35 (м, 2H), 7,25 (дд, 1H), 7,16-7,10 (дд, ˜ 1H, перекрывающийся с сигналом CHCl3), 7,05 (д, 1H), 6,97-6,90 (м, 3H), 6,72 (д, 1H), 4,46 (дд, 1H), 4,30 (дд, 1H), 2,73 (м, 1H), 2,63 (дд, 1H), 2,05-1,95 (м, 1H).
Пример 37
(±)-цис-N-(7-Хлор-4-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-N'-(5-циано-2-пиридинил)мочевина
а) 5-Хлор-2-фторфенол

5-Хлор-2-фторанилин (10 г, 68 ммоль) растворяли в 6 М серной кислоте и охлаждали на бане лед/насыщенный раствор соли до -5°С. Раствор NaNO2 (5,2 г, 76 ммоль) в минимальном количестве воды добавляли по каплям к перемешиваемой суспензии при температуре не выше чем -2°С. После добавления образовавшийся чистый желтый раствор оставляли перемешиваться в течение дополнительных 30 мин при охлаждении. CuSO4 растворяли водой (80 мл) и смешивали с серной кислотой (32 мл). Соль диазония добавляли по каплям к предварительно нагретому (160°С) раствору сульфата меди и продукт удаляли из реакционной колбы перегонкой с паром. До полного завершения время реакции составило около 2 час. Раствор вода/фенол экстрагировали в эфир, промывали насыщенным раствором соли и сушили над Na2SO4. Концентрирование давало 4 г неочищенного фенола (40%).
b) 4-Хлор-1-фтор-2-(2-пропинилокси)бензол

4-Хлор-1-фтор-2-(2-пропинилокси)бензол синтезировали аналогично примеру 33а из (4 г, 27 ммоль) 4-хлор-1-фторфенола с получением 4,6 г продукта (очищенного колоночной хроматографией на силикагеле, этилацетат/н-гексан 1:15) в виде желтого масла. Выход 90%.
с) 5-Хлор-8-фтор-2Н-хромен
5-Хлор-8-фтор-2Н-хромен синтезировали аналогично примеру 33b) из 4-хлор-1-фтор-2-(2-пропинилокси)бензола (4,6 г, 25 ммоль) с получением 1 г продукта (очищенного колоночной хроматографией на оксиде алюминия, этилацетат/н-гексан 1:15) в виде бесцветного масла. Выход 22%.
d) Этил (±)-цис-7-хлор-4-фтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоксилат

Этил (± )-цис-7-хлор-4-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоксилат синтезировали аналогично примеру 33с из 5-хлор-8-фтор-2Н-хромена (1 г, 5,4 ммоль) с получением 360 мг (+/-)-цис-продукта (очищенного колоночной хроматографией на силикагеле, этилацетат/н-гексан 1:20) в виде твердого белого вещества. Выход 25%.
е) (±)-цис-7-Хлор-4-фтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновая кислота

(± )-цис-7-Хлор-4-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновую кислоту синтезировали аналогично примеру 33d из этил (±)-цис-7-хлор-4-фтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоксилата (360 мг, 1,3 ммоль) с получением 259 мг (+/-)-цис-кислоты (80%).
f) (±)-цис-N-(7-Хлор-4-фтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)-N'-(5-циано-2-пиридинил)мочевина

(±)-цис-N-(7-Хлор-4-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-N'-(5-циано-2-пиридинил)мочевину синтезировали аналогично примеру 33е из (±)-цис-7-хлор-4-фтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (60 мг, 0,25 ммоль) и 2-амино-5-хлорпиридина (1,1 экв.) с получением 59 мг продукта в виде белого порошка. Выход 66%.
1 Н-ЯМР (ДМСО-d6): 9,47 (ушир.с, 1H), 7,89 (д, 1H), 7,80 (ушир.с, 1H), 7,74 (дд, 1H), 7,32 (д, 1H), 7,16-7,05 (м, 2H), 4,39 (дд, 1H), 4,16 (дд, 1H), 3,55-3,48 (м, 1H), 2,51 (дд, ˜1H, перекрывающийся с сигналом ДМСО), 2,08-2,01 (м, 1H).
Пример 38
(±)-цис-N-(7-хлор-4-фтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)-N'-(5-хлор-2-пиридинил)мочевина

(±)-цис-N-(7-Хлор-4-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-N'-(5-хлор-2-пиридинил)мочевину синтезировали аналогично примеру 5 из (±)-цис-7-хлор-4-фтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (60 мг, 0,25 ммоль) и 2-амино-5-хлорпиридина (1,1 экв.) с получением 59 мг продукта в виде белого порошка. Выход 65%.
1 Н-ЯМР (ДМСО-d6): 9,47 (ушир.с, 1H), 7,89 (д, 1H), 7,80 (ушир.с, 1H), 7,74 (дд, 1H), 7,32 (д, 1H), 7,16-7,04 (м, 2H), 4,39 (дд, 1H), 4,16 (дд, 1H), 3,55-3,48 (м, 1H), 2,51 (дд, ˜1H, перекрывающийся с сигналом ДМСО), 2,06-2,01 (м, 1H).
Пример 39
(±)-цис-N-(5-Бром-2-пиридинил)-N'-(7-хлор-4-фтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина

(± )-цис-N-(5-Бром-2-пиридинил)-N'-(7-хлор-4-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевину синтезировали аналогично примеру 32е из (±)-цис-7-хлор-4-фтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (60 мг, 0,25 ммоль) и 2-амино-5-бромпиридина (1,1 экв.) с получением 56 мг продукта в виде белого порошка. Выход 55%.
1 Н-ЯМР (ДМСО-d6): 9,46 (ушир.с, 1H), 7,96 (д, 1H), 7,83 (дд, 1H), 7,81 (ушир.с, 1H), 7,27(д, 1H), 7,16-7,04 (м, 2H), 4,38 (дд, 1H), 4,17 (дд, 1H), 3,55-3,48 (м, 1H), 2,51 (дд, ˜1H, перекрывающийся с сигналом ДМСО), 2,07-2,00 (м, 1H).
Пример 40
(±)-цис-N-(7-Хлор-4-фтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)-N'-(5-фенокси-2-пиридинил)мочевина

(±)-цис-N-(7-Хлор-4-фтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)-N'-(5-фенокси-2-пиридинил)мочевину синтезировали аналогично примеру 32е из (±)-цис-7-хлор-4-фтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (60 мг, 0,25 ммоль) и 2-амино-5-феноксипиридина (1,1 экв.) с получением 76 мг продукта в виде слегка коричневатого порошка. Выход 73%.
1Н-ЯМР (CDCl3): 9,33 (ушир.с, 1H), 7,93 (с, 1H), 7,51 (д, 1H), 7,38-7,32 (м, 2H), 7,25 (дд, ˜1H, перекрывающийся с сигналом CHCl3), 7,16-7,10 (м, 1H), 6,96-6,88 (м, 3H), 6,79 (дд, 1H), 6,68 (д, 1H), 4,45 (дд, 1H), 4,25 (дд, 1H), 3,75-3,70 (м, 1H), 2,61 (дд, 1H), 2,05-1,95 (м, 1H).
Пример 41
N-[(1S,1aR,7bR) или (1R,1aS, 7bS)-1,1a,2,7b-тетрагидроциклопропа[c][1]бензотиопиран-1-ил]-N'-(5-циано-2-пиридинил)мочевина
а) 3,4-Дигидро-2Н-1-бензотиопиран-4-ол

Раствор тиохроман-4-она (9 г) в эфире (27 мл) медленно добавляли к смеси литийалюмогидрида (0,53 г) в эфире (54 мл). После завершения добавления смесь кипятили с обратным холодильником в течение 2 час. Реакционную смесь охлаждали и добавляли лед с последующим добавлением воды и 20% раствора Н2SO4. Водную фазу дважды промывали эфиром. Эфирную фазу дважды промывали 2N NaOH, один раз водой, сушили над MgSO4 и выпаривали. Чистое масло (8,9 г) кристаллизовали спустя несколько часов. Rdt=97%.
b) 2Н-1-Бензотиопиран и 4Н-1-бензотиопиран

4-Тиохроманол (8,9 г) и кислый сульфат калия (0,89 г) помещали в колбу и создавали вакуум до 1 мм. Колбу помещали в ванну, нагреваемую при 90°С до тех пор, пока спирт не расплавится. Включали магнитную мешалку и температуру ванны медленно доводили до 120°С. Дегидратация проходила быстро, смесь продукта и воды отгоняли и собирали в охлаждаемом льдом резервуаре. Продукт переносили в эфир и сушили. Неочищенный продукт (7 г, Rdt=88%) не очищали. Спектр ЯМР показал присутствие 10% 4Н-1-бензотиопирана.
с) Этиловый эфир (1S,1aR,7bR) или (1R,1aS,7bS)-1,1a,2, 7b-тетрагидроциклопропа[c][1]бензотиопиран-1-карбоновой кислоты

Этилдиазоацетат медленно добавляли к 500 мг тиохромена при 140°С. Реакцию контролировали методом газовой хроматографии и останавливали, когда все исходные вещества были израсходованы (около 7 часов). Остаток очищали флэш-хроматографией (5% эфира в гексане). Цис-изомер (46,5 мг, Rdt=6%) идентифицировали с помощью ЯМР-спектроскопии.
d) (1S,1aR,7bR) или (1R,1aS,7bS)-1,1a,2, 7b-тетрагидроциклопропа[c][1]-бензотиопиран-1-карбоновая кислота

Смесь цис-изомера (46,5 мг), LiOH (4 экв., 19 мг) в 5 мл метанола/25% воды кипятили с обратным холодильником в течение 1 часа. После выпаривания растворителя в вакууме остаток растворяли в воде и промывали эфиром. Водную фазу подкисляли концентрированной HCl и дважды экстрагировали дихлорметаном. После сушки органическую фазу выпаривали с получением желаемой кислоты (30 мг). Rdt=73%.
е) N-[(1S,1aR,7bR) или (1R,1aS,7bS)-1,1a,2,7b-Тетрагидроциклопропа[c][1]бензотиопиран-1-ил]-N'-(5-циано-2-пиридинил)мочевина

Цис-кислоту (30 мг) кипятили с обратным холодильником в течение 4 часов в толуоле (2 мл) в присутствии Et3N (0,02 мл), дифенилфосфорилазида (0, 03 мл) и 2-амино-6-цианопиридина (19,5 мг). После охлаждения толуольную фазу промывали водой, затем раствором HCl (0,01 М). Органическую фазу сушили и выпаривали. Остаток очищали флэш-хроматографией (EtOAc 2/гексан 1) и получали 10 мг желаемого соединения. Rdt=22%.
1Н-ЯМР (ДМСО-d6): 1,96 (1H, м); 2,30 (1H, т, 8,6); 2,71 (1H, ддт, 13,65, 6,24); 3,24 (2H, м); 7, 19 (3H, м); 7,37 (1H, дд, 7,4, 1,56); 7,42 (1H, дд, 9,0, 3,1); 7,60 (1H, NH); 8,02 (1H, дд, 9,0, 2,3); 8,15 (1H, с); 9,89 (1H, NH)
Масс: 322 (М+), 321 (М-H).
Пример 42
(1S,1aR,7bS)-4,7-Дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновая кислота
а) (2Z)-3-(3,6-Дифтор-2-метоксифенил)-2-пропен-1-ол

Раствор BuLi (2,5М) в гексане (9,6 мл, 0,024 моль) добавляли к перемешиваемому раствору 2, 5-дифторанизола (2,88 г, 0,02 моль) в сухом ТГФ (30 мл) при -70°С с последующим добавлением через 2 часа раствора хлорида цинка (3,6 г, 0,026 моль) в сухом ТГФ (50 мл). Температуру реакции доводили до комнатной температуры и затем перемешивание поддерживали при комнатной температуре в течение 30 мин. Добавляли Pd(OAc)2 (8 мг, 0,2 мол.%), затем этил цис-3-бромакрилат (3,58 г, 0,02 моль). Реакционную смесь помещали на предварительно нагретую масляную баню и кипятили с обратным холодильником в течение 1 часа. Полученную реакционную смесь охлаждали до -78°С и добавляли по каплям 60 мл (0,06 моль) DIBAL (1M раствор в гексане). Перемешивание продолжали при -78°С в течение 2 час и в течение 1 часа при комнатной температуре. Реакционную смесь гасили водой и все твердые вещества растворяли добавлением HCl. Органическую фазу разбавляли эфиром, разделяли, промывали 5N HCl, насыщенным раствором соли и упаривали в вакууме. Остаток отгоняли в аппарате Kugelrohr (1, 5х10-2 мбар, 150°С) с получением 3,7 г (92%) неочищенного (2Z)-3-(3,6-дифтор-2-метоксифенил)-2-пропен-1-ола, содержего ˜6% других региоизомеров. Неочищенный продукт использовали на следующей стадии без дополнительной очистки.
1Н-ЯМР (CDCl3): 7,00 (м, 1H); 6,77 (м, 1H); 6,31 (прибл.д, 1H); 6,12 (прибл.дт, 1H); 4,08 (ушир.т, 2H); 3,89 (д, 3H); 1,80 (ушир.т, 1H).
b) (2Z)-3-(3,6-Дифтор-2-метоксифенил)проп-2-енилдиазоацетат

п-Толуолсульфонилгидрозон хлорангидрида глиоксиловой кислоты (5,16 г, 0,02 моль) добавляли к раствору (2Z)-3-(3,6-дифтор-2-метоксифенил)-2-пропен-1-ола (3,6 г, 0,018 моль) в сухом CH2Cl2 (50 мл) при -5°С и медленно добавляли N,N-диметиланилин (2,5 мл, 0,02 моль). После перемешивания в течение 30 мин при -5°С медленно добавляли Et3N (12 мл, 0,09 моль). Полученную смесь перемешивали в течение 15 мин при -5°С и затем в течение 30 мин при комнатной температуре, после этого добавляли воду (˜50 мл). Органическую фазу отделяли промыванием водой, насыщенным раствором соли и концентрированием в вакууме. Флэш-хроматография (силикагель, ЕА:Нех; 1:15) давала 3,86 г (80%) продукта в виде твердого вещества желтого цвета.
1Н-ЯМР (CDCl3): 7,00 (м, 1H); 6,76 (м, 1H); 6,41 (прибл.д, J=12,2 Гц; 1H); 6,00 (прибл.дт, J=12,2; 6,10 Гц; 1H); 4,71 (ушир.с, 1H); 4,67 (дт, 2H); 3,89 (д, 3H).
с) (1S,5R,6S)-6-(3,6-Дифтор-2-метоксифенил)-3-оксабицикло[3.1.0]гексан-2-он

(2Z)-3-(3,6-Дифтор-2-метоксифенил)проп-2-енилдиазоацетат (3,45 г, 0,013 моль) растворяли в 100 мл сухого дегазированного дихлорметана и добавляли по каплям к раствору хирального катализатора Дойла (Doyle) (Aldrich, также доступный от Johnsson Matthey, 10 мг, 0,1 мол.%) в 50 мл дихлорметана в атмосфере аргона при температуре окружающей среды в течение периода ˜6 час. К концу добавления исходный синий цвет переходит в оливковый. Реакционную смесь концентрировали в вакууме и неочищенный продукт очищали флэш-хроматографией (силикагель, ЕА:Нех, 1:5→1:1) с получением 2,72 г (88%) (1S,5R,6S)-6-(3,6-дифтор-2-метоксифенил)-3-оксабицикло[3.1.0]гексан-2-она в виде бесцветного твердого вещества. Энантиомерная чистота может быть проверена на этой стадии с использованием колонки Chiracel OD, 10% IPA в гексане - 94% ее.
1Н-ЯМР (CDCl3): 7,00 (м, 1H); 6,72 (м, 1H); 4,33 (дд, 1H); 4, 10 (д, 1H); 4,02 (д, 3H); 2,66 (м, 2H); 2,37 (т, 1H).
d) (1S,1aR,7bS)-1-(Бромметил)-4,7-дифтор-1a,7b-дигидроциклопропа[c]хромен-2(1Н)-он

(1S,5R,6S)-6-(3,6-Дифтор-2-метоксифенил)-3-оксабицикло[3.1.0]гексан-2-он (130 мг, 0,55 ммоль) смешивали с 1,2 мл 30% HBr/AcOH (6 ммоль) и нагревали в запаянном сосуде при перемешивании в течение приблизительно 4 час при 90°С. Реакционную смесь затем охлаждали, смешивали с водой и экстрагировали в диэтиловый эфир (3х20 мл). Эфирный экстракт промывали насыщенным раствором бикарбоната натрия и насыщенным раствором соли. Сушили над сульфатом магния. Концентрирование давало 160 мг твердого белого вещества. Выход 98%.
1Н-ЯМР (CDCl3): 7,08 (м, 1H); 6,88 (м, 1H); 3,44 (дд, 1H); 3,06 (т, 1H); 2,96 (дд, 1H); 2,64 (дд, 1H); 2,46 (м, 1H).
е) (1S,1aR,7bS)-4, 7-Дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновая кислота

(1S,1aR, 7bS)-1-(Бромметил)-4,7-дифтор-1a,7b-дигидроциклопропа[c]хромен-2(1Н)-он (360 мг, 1,2 ммоль) смешивали с раствором NaOH (0,1 г, 2,5 ммоль) в 5 мл воды и нагревали при перемешивании в течение 1 часа при 90°С. После завершения реакции смесь охлаждали и экстрагировали в диэтиловый эфир (2х20 мл). Водную фазу подкисляли конц. HCl. Образовавшийся осадок собирали фильтрованием с получением 180 мг чистого продукта. Маточный раствор экстрагировали в эфир и промывали насыщенным раствором соли, сушили над сульфатом магния. Концентрирование давало дополнительные 70 мг продукта (содержащего до 15% примесей). Общий выход около 92%.
1Н-ЯМР (CDCl3): 6,86 (м, 1H); 6,54 (м, 1H); 4,48 (м, 2H); 2,62 (т, 1H); 2,20 (т, 1H); 2,11 (м, 1H).
Пример 43
(+/-)-цис-N-[1a,6b-Дигидро-1H-бензо[b]циклопропа[d]тиен-1-ил]-N'-(5-циано-2-пиридинил)мочевина
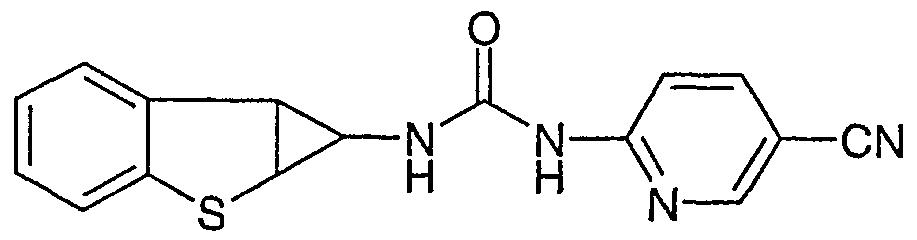
а) Этиловый эфир (1S,1aS,6bR) или (1R,1aR,6bS)-цис-1a,6b-дигидро-1H-бензо[b]циклопропа[d]тиофен-1-карбоновой кислоты

Этилдиазоацетат медленно добавляли к 10 г тиофена при 140°С. Реакцию контролировали газовой хроматографией и останавливали через 7 час. Остаток очищали флэш-хроматографией (5% эфира в гексане). Цис-изомер (917 мг, Rdt=6%) идентифицировали ЯМР-спектроскопией.
Ссылка: Badger G.M. et al, J. Chem. Soc., 1958, 1179-1184.
Badger G.M. et al, J. Chem. Soc., 1958, 4777-4779.
b) (1S,1aS,6bR) или (1R,1aR,6bS)-цис-1a, 6b-Дигидро-1H-бензо[b]циклопропа[d]тиофен-1-карбоновая кислота

Смесь цис-изомера (443 мг), LiOH (193 мг) в 15 мл метанола/25% Н2О кипятили с обратным холодильником в течение 1 часа. После выпаривания растворителя в вакууме осадок растворяли в воде и промывали эфиром. Водную фазу подкисляли концентрированной HCl и дважды экстрагировали дихлорметаном. После сушки органическую фазу выпаривали и получали желаемую кислоту (313,6 мг). Rdt=81%.
с) (+/-)-цис-N-[1a,6b-Дигидро-1H-бензо[b]циклопропа[d]тиен-1-ил]-N'-(5-циано-2-пиридинил)мочевина

Цис-кислоту (313 мг) кипятили с обратным холодильником в течение 4 часов в толуоле (20 мл) в присутствии Et3N(0,25 мл), дифенилфосфорилазида (0,3 мл) и 2-амино-6-цианопиридина (220 мг). После охлаждения толуольную фазу промывали водой, затем раствором HCl (0,01 М). Органическую фазу сушили и выпаривали. Остаток очищали флэш-хроматографией (EtOAc 2/гексан 1) и получали 10 мг желаемого соединения. Rdt=2%.
1Н-ЯМР (ДМСО-d6): 3,32 (1H, м); 3,39 (1H, тд, 8,05, 7,69); 3,52 (1H, дд, 7, 69, 6,22); 7,08 (1H, тд, 7,32, 1,1); 7,15 (1H, тд, 7,32, 1,1); 7,22 (1H, дд, 8,4, 0,8); 7,39 (2H, м); 7,50 (1H, NH); 8,00 (1H, дд, 8,79, 2,2); 8,23 (1H, д, 2,2); 9,76 (1H, NH)
13C-ЯМР (ДМСО-d6): 25,6 (CH), 29,5 (CH), 33,7 (CH), 101,5 (C), 112,1 (CH), 118,0 (C), 122,1 (CH), 124,9 (CH), 127,3 (CH), 128,0 (CH), 136,3 (C), 141,7 (CH), 143,7 (C), 151,6 (CH), 155, 1 (C), 156,1 (C)
Масс: 310 (М+2), 309 (М+H).
Пример 44
(-)-цис-1-(5-Хлорпиридин-2-ил)-3-(4,7-дифтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина

Данное соединение получали аналогично примеру 1с, но с использованием хиральной (+)-цис-4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (см. пример 42е) (1,3 г, 5,75 ммоль). Продукт, очищенный на силикагеле, перекристаллизовывали из ацетонитрила с получением 0,95 г (47%) указанного в заголовке продукта. Абсолютная стереохимическая конфигурация определена как для примера 30.
1Н-ЯМР (CDCl3): 9,25 (ушир.с, 1H), 8,67 (с, 1H), 7,79 (д, 1H), 7,48 (дд, 1H), 6,92-6,86 (м, 1H), 6,71 (д, 1H), 6,65-6,60 (м, 1H), 4,45 (дд, 1H), 4,34 (дд, 1H), 3,80 (кв, 1H), 2, 61 (т, 1H), 2,00-1,98 (м, 1H).
Пример 45
(-)-цис-1-(5-Цианопиридин-2-ил)-3-(4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина
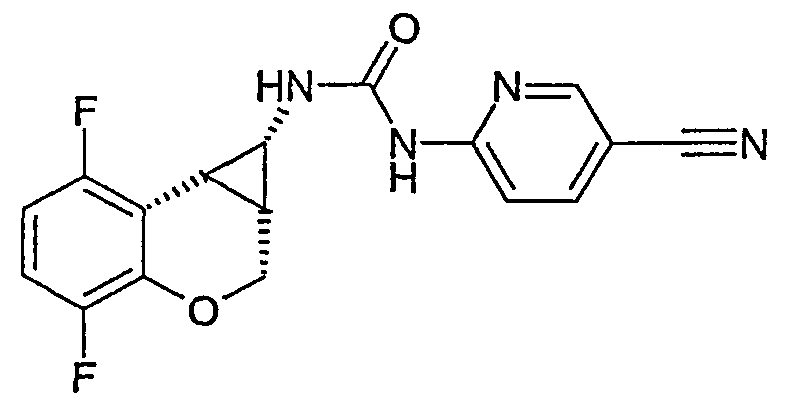
(+)-цис-4,7-Дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновую кислоту (см. пример 42е) (1, 18 г, 5,2 ммоль), дифенилфосфорилазид [1340 мкл, 6,3 ммоль (d=1,277)], триэтиламин (870 мкл, 6,3 ммоль) и 2-амино-5-цианопиридин (740 мг, 6,3 ммоль) растворяли в толуоле (15 мл) и кипятили с обратным холодильником в течение 4 час. Растворитель затем удаляли в вакууме, неочищенный продукт растворяли в эфире, промывали (3х100 мл 0,01 М HCl) и очищали хроматографией (силикагель, 0→1% МеОН в эфире) с получением чистой (-)-цис-1-(5-цианопиридин-2-ил)-3-(4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевины (1,1 г, 64%). Энантиомерный избыток составил 92%, как было определено с помощью ВЭЖХ на колонке Chiral AGP, элюент 11% ацетонитрил в натрий-фосфатном буфере, скорость потока 0,9 мл/мин. Абсолютная стереохимическая конфигурация определена как для примера 30.
1Н-ЯМР (CDCl3): 9 (с, NH), 8,42 (с, NH), 8,16 (д, 1H), 7,72 (дд, 1H), 6,97-6,76 (м, 2H), 6,69-6,61 (м, 1H), 4,47 (дд, 1H), 4,31 (дд, 1H), 3,75 (м, 1H), 2,65 (т, 1H), 2, 05-1,96 (м, 1H).
Пример 46
(-)-цис-1-(5-Цианопиридин-2-ил)-3-(4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)тиомочевина

(+)-цис-4,7-Дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновую кислоту (2,2 г, 9,7 ммоль), DPPA [2380 мкл, 10,7 ммоль 97% (d=1,277)] и ТЕА (1510 мкл, 11,7 ммоль) кипятили с обратным холодильником в течение 2 час в толуоле (20 мл). Затем добавляли диоксан (26 мл) и HCl(водн.) (26 мл, 6М) и реакционную смесь оставляли на 1-2 часа при 50°С. Добавляли воду (50 мл), водную фазу промывали эфиром (2 х 25 мл) и затем подщелачивали аммиаком(водн.). Экстракция дихлорметаном и сушка давали промежуточное соединение 4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-иламин (1,37 г, 71%), который сразу же обрабатывали 6-изотиоцианатоникотинонитрилом (1,25 г, 7,7 ммоль) в ацетонитриле (2 мл) при комнатной температуре в течение уик-энда. Осажденные кристаллы отфильтровывали, растворитель удаляли в вакууме и хроматографировали (силикагель, 20% эфир в пентане). Полученный продукт объединяли с кристаллами и неочищенный продукт (900 мг) подвергали перекристаллизации (этанол-ацетон) с получением чистой (-)-цис-1-(5-цианопиридин-2-ил)-3-(4,7-дифтор-1, 1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)тиомочевины (590 мг, 18%). Абсолютная стереохимическая конфигурация определена как для примера 30.
1Н-ЯМР (CDCl3-MeOD): 8,1 (д, 1H), 7,77 (дд, 1H), 6,99-6,91 (м, 1H), 6,74 (дд, 1H) 6,73-6,66 (м, 1H), 4,48 (дд, 1H), 4,33 (дд, 1H), 4,20 (дд, 1H), 2,78 (т, 1H), 2,16-2,1 (м, 1H).
Пример 47
(+/-)-цис-1-(5-Бромпиридин-2-ил)-3-(7-фтор-4-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина

а) 1-(4-Фтор-2-проп-2-инилоксифенил)пропан-1-он
К смеси NaH (95%, 278 мг, 11 ммоль) в ДМФ (20 мл) при 0°С добавляли 1-(4-фтор-2-гидроксифенил)пропан-1-он (1,68 г, 10 ммоль) в ДМФ (5 мл). Через 15 мин при 0°С к реакционной смеси добавляли 3-бромпропин (3,02 г, 20 ммоль). Через 1 час при 0°С реакционную смесь оставляли до достижения комнатной температуры. Реакционную смесь экстрагировали Н2О (100 мл). Н2О фазу промывали Et2O (3х100 мл) и растворитель объединенных органических фаз удаляли при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией (силикагель, CH2Cl2) с получением 1,40 г (68%) 1-(4-фтор-2-проп-2-инилоксифенил)пропан-1-она.
1Н-ЯМР (CDCl3): 7,64 (дд, 1H), 6,69 (дд, 1H), 6,60 (ддд, 1H), 4,68 (д, 2H), 2,85 (кв, 2H), 2,58 (т, 1H), 1,03 (т, 3H).
b) 1-(5-Фтор-2Н-хромен-8-ил)пропан-1-он
1-(5-Фтор-2Н-хромен-8-ил)пропан-1-он синтезировали аналогично примеру 3b из 1-(4-фтор-2-проп-2-инилоксифенил)пропан-1-она (1,34 г, 6,5 ммоль) с получением 619 мг (46%) 1-(5-фтор-2Н-хромен-8-ил)пропан-1-она.
1Н-ЯМР (CDCl3): 7,60 (дд, 1H), 6,67-6,58 (м, 2H), 5,86 (дт, 1H), 4,76 (дд, 2H), 2,93 (кв, 2H), 1,23 (т, 3H).
с) Этиловый эфир (±)-цис-7-фтор-4-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты
Этиловый эфир (± )-цис-7-фтор-4-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты синтезировали в соответствии с методикой примера 3с) из 1-(5-фтор-2Н-хромен-8-ил)пропан-1-она (619 мг, 3 ммоль) с получением 142 мг (16%) этилового эфира (±)-цис-7-фтор-4-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты и этилового эфира (±)-транс-7-фтор-4-пропионил-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты в качестве побочного продукта.
1Н-ЯМР (CDCl3): 7,59 (дд, 1H), 6,65 (м, 1H), 4,50-4,46 (м, 2H), 3,95 (кв, 2H), 2,89 (кв, 2H), 2,57 (дд, 1H), 2,20 (дд, 1H), 1,13-1,03 (м, 1H), 1,12-1,01 (м, 6H).
d) (±)-цис-7-Фтор-4-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновая кислота
(±)-цис-7-Фтор-4-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновую кислоту синтезировали аналогично примеру 1b из этилового эфира (±)-цис-7-фтор-4-пропионил-1, 1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты (140,3 мг, 0,48 ммоль) с получением 83 мг (65%) (±)-цис-7-фтор-4-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты в виде твердого вещества белого цвета. Неочищенный продукт очищали колоночной хроматографией (силикагель, 1→5% МеОН в CH2Cl2).
1Н-ЯМР (ДМСО-d6): 12,15 (ушир.с, 1H), 7,46 (дд, 1H), 6,78 (дд, 1H), 4,57 (дд, 1H), 4,43 (дд, 1H), 2,93-2,80 (м, 2H), 2,55 (дд, 1H), 2,24 (дд, 1H), 2,20-2,10 (м, 1H), 1,02 (т, 3H).
е) (±)-цис-1-(5-Бромпиридин-2-ил)-3-(7-фтор-4-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил)мочевина
Указанное в заголовке соединение синтезировали аналогично примеру 1с) взаимодействием 1 эквивалента (±)-цис-7-фтор-4-пропионил-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновой кислоты и 1 экв. триэтиламина в толуоле с 1 экв. дифенилфосфорилазида в течение 30 мин при комнатной температуре. Реакционную смесь нагревали до 120°С и добавляли приблизительно эквимолярный раствор 2-амино-5-бромпиридина. Через 3 часа раствор оставляли до достижения комнатной температуры и указанное в заголовке соединение экстрагировали, как показано выше.
Пример 48
(1S,5R,6S)-6-(3, 6-Дифтор-2-метоксифенил)-2-метокси-3-оксабицикло[3.1.0]гексан

а) Иод-3-оксабицикло[3.1.0]гексан-2-он

Указанное в заголовке соединение синтезировали в указанной стереохимии, как описано Doyle J Amer Chem Soc 117 (21) 5763-5775 (1993).
b) Иод-2-метокси-3-оксабицикло[3.1.0]гексан

Указанное в заголовке соединение синтезировали в указанной стереохимии, как описано Martin et al Tett Lett 39 1521-1524 (1998).
с) (1S,5R,6S)-6-(3,6-Дифтор-2-метоксифенил)-2-метокси-3-оксабицикло[3.1.0]гексан

2,4-Дифторанизол (90 мг, 0,62 ммоль) растворяли в безводном, дегазированном ТГФ (7 мл) и охлаждали до -78°С в атмосфере N2. Добавляли nBuLi, 2,5 М в гексане (0,30 мл, 0,77 ммоль) и реакционную смесь перемешивали при -78°С в течение 2 час. Добавляли ZnCl2 (150 мг, 1,1 ммоль) в виде раствора в безводном ТГФ (7 мл) и реакционную смесь оставляли нагреваться до температуры окружающей среды в течение 2 час. Иод-2-метокси-3-оксабициклогексан (150 мг, 0,63 ммоль), Pd(OAc)2 (1,5 мг, 6,2 мкмоль) и лиганд трис(2,4-ди-трет-бутилфенил)фосфит (40 мг, 62 мкмоль) смешивали в безводном ТГФ (7 мл) и добавляли к реакционной смеси. Реакционную смесь кипятили с обратным холодильником в течение 3 дней и гасили Н2О. Добавляли диэтиловый эфир и слои разделяли, органический слой промывали Н2О и водным насыщенным NaCl, сушили над MgSO4, фильтровали и концентрировали с получением указанного в заголовке соединения, иначе называемого 2,4-дифтор-5-(циклопропилацеталь)анизол. Колоночная хроматография на силикагеле (EtOAc/гексан 1:3) давала (4) 50 мг, 31%.
1Н-ЯМР (CDCl3): 6,88-6,94 (м, 1H, ArH), 6,68-6,73 (м, 1H, ArH), 4,82 (с, 1H, CHOCH3), 3,97-3,98 (м, 1H, CHOCH), 3,94 (с, 3H, OCH3), 3,79-3,81 (м, 1H, CHOCH), 3, 30 (с, 3H, OCH3), 2,13-2,19 (м, 2H, 2x CH-циклопропил), 1,89 (тр, J=7,81Гц, 1H, CH-циклопропил).
Пример 49
цис-4,7-Дифтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновая кислота

1М Раствор BBr3 в CH2Cl2 (5,8 мл, 5,8 ммоль, 2,1 экв.) добавляли к исходному лактону (1S,5R,6S)-6-(3,6-дифтор-2-метоксифенил)-3-оксабицикло[3.1.0]гексан-2-ону из примера 42с) (0,66 г, 2, 75 ммоль) при 0°С. Реакционную смесь перемешивали при 0°С в течение 1 часа. Добавляли ацетонитрил (5,8 мл) и перемешивание продолжали в течение 3 час при 0°С. Реакционную смесь гасили добавлением воды и органическую фазу отделяли. Водную фазу экстрагировали CH2Cl2и объединенные органические фазы выпаривали. К полученному осадку добавляли NaOH (0,33 г, 8,25 ммоль, 3 экв.) в воде (˜5 мл) и перемешивали при 80°С в течение 45 мин. Реакционную смесь экстрагировали эфиром, чтобы удалить некислотные примеси. Оставшийся в водной фазе эфир выпаривали в вакууме и добавляли конц. HCl до уровня рН˜3. Через ˜1 час твердое вещество отфильтровывали с получением на выходе 0,497 г (80%) неочищенной конечной кислоты в виде коричневатого твердого вещества. Неочищенную кислоту растворяли в 6 мл EtOH/H2О (40/60 об/об) и обрабатывали активированным углем. Горячий раствор фильтровали и оставляли для кристаллизации. Выход 0,4 г (64%).
Пример 50
N-[(1S,1aR,7bR)-4,7-Дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил]-N-(5-фтор-2-пиридинил)мочевина

(1S,1aR,7bS)-4,7-Дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновую кислоту (50 мг, 0, 22 ммоль, ее ˜90%) смешивали с толуолом (1 мл), триэтиламином (0,034 мл, 1,1 экв.), 2-амино-5-фторпиридином (28 мг, 1,1 экв.), DPPA (0,054 мл, 1,1 экв.). Реакционную смесь затем нагревали при перемешивании при 110°С в течение 3 час. Реакционную смесь концентрировали выпариванием на роторном испарителе и очищали колоночной хроматографией на силикагеле (50 г, этилацетат/гексан 1:1) с получением 30 мг продукта в виде твердого вещества белого цвета.
1Н-ЯМР (ДМСО-d6): 9,34 (ушир.с, ˜1H), 7,85 (ушир.д, 2H), 7,6 (дт, 1H), 7,33 (дд, 1H), 7,06 (м, 1H), 6,77 (дт, 1H), 4,29 (м, 2H), 3,48 (м, 1H), 2,48 (м, 1H/перекрывающийся с сигналом ДМСО), 2,00 (м, 1H). LC-MS: M+ 336.
Пример 51
N-[(1S,1aR,7bR)-4, 7-Дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил]-N-(5-иод-2-пиридинил)мочевина

(1S,1aR,7bS)-4,7-Дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновую кислоту (50 мг, 0,22 ммоль, ее ˜90%) смешивали с толуолом (1 мл), триэтиламином (0,034 мл, 1,1 экв.), 2-амино-5-иодпиридином (54 мг, 1,1 экв.), DPPA (0,054 мл, 1,1 экв.). Реакционную смесь затем нагревали при перемешивании при 110°С в течение 3 час. Реакционную смесь концентрировали выпариванием на роторном испарителе и очищали колоночной хроматографией на силикагеле (50 г, этилацетат/гексан 1:1) с получением 35 мг продукта в виде твердого вещества белого цвета.
1Н-ЯМР (ДМСО-d6): 9,4 (ушир.с, ˜1H), 8,07 (д, 1H), 8,02 (ушир.с, ˜1H), 7,91 (дд, 1H), 7,11 (д, 1H), 7,06 (м, 1H), 6,77 (дт, 1H), 4,29 (ушир.д, 2H), 3,5 (м, 1H), 2, 46 (м, 1H/перекрывающийся с сигналом ДМСО), 2,00 (м, 1H), LC-MS: M+444.
Пример 52
N-[(1S,1aR,7bR)-4,7-Дифтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил]-N-(3-изоксазолил)мочевина

(1S,1aR, 7bS)-4,7-Дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновую кислоту (50 мг, 0,22 ммоль, ее ˜90%) смешивали с толуолом (1 мл), триэтиламином (0,034 мл, 1,1 экв.), 3-аминоизоксазолом (0, 018 мл, 1,1 экв.), DPPA (0,054 мл, 1,1 экв.). Реакционную смесь затем нагревали при перемешивании при 110°С в течение 3 час. Реакционную смесь концентрировали выпариванием на роторном испарителе и очищали колоночной хроматографией на силикагеле (50 г, этилацетат/гексан 1:1) с получением 10 мг продукта в виде твердого вещества белого цвета.
1Н-ЯМР (ДМСО-d6): 9,45 (ушир.с, ˜1H), 8,6 (д, 1H), 7,06 (м, 1H), 6,75 (дт, 1H), 6,63 (д, 1H), 6,33 (ушир.с, ˜1H), 4,29 (м, 2H), 3,37 (перекрывающийся с сигналом воды), 2,43 (м, 1H), 1,98 (м, 1H), LC-MS: M+ 308.
Пример 53
N-[(1S,1aR,7bR)-4,7-Дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил]-N'-[4-(4-хлорфенил)-1, 3-тиазол-2-ил]мочевина
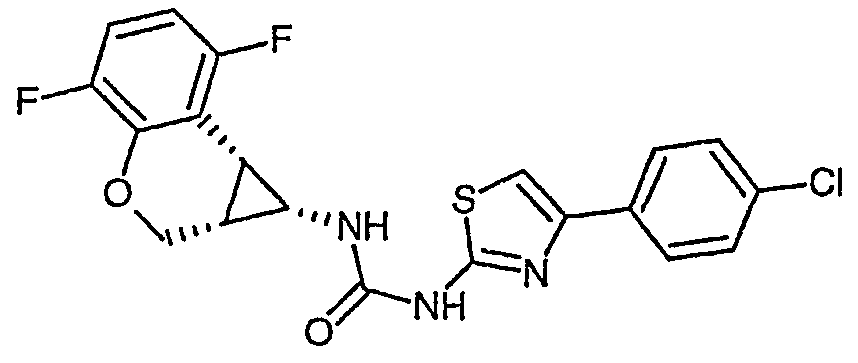
(1S,1aR,7bS)-4,7-Дифтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-карбоновую кислоту (50 мг, 0,22 ммоль, ее ˜90%) смешивали с толуолом (1 мл), триэтиламином (0,034 мл, 1,1 экв.), 2-амино-4-(4-хлорфенил)-1,3-тиазолом (52 мг, 1,1 экв.), DPPA (0,054 мл, 1,1 экв.). Реакционную смесь затем нагревали при перемешивании при 110°С в течение 3 час. Реакционную смесь концентрировали выпариванием на роторном испарителе, продукт кристаллизовали из этанола и собирали фильтрованием с получением 50 мг продукта в виде твердого вещества белого цвета.
1Н-ЯМР (CDCl3): 10,32 (ушир.с, ˜1H), 7,68 (д, 2H), 7,37 (с, 1H), 7,32 (д, 2H), 6,96 (с, 1H), 6,87 (м, 1H), 6,62 (дт, 1H), 4,44 (дд, 1H), 4,33 (дд, 1H), 3,53 (м, 1H), 2,56 (м, ˜1H), 1,96 (м, 1H), LC-MS: M+ 434.
Пример 54
N-[(1S,1aR,7bR)-4,7-Дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил]-N'-(6-фтор-1,3-бензотиазол-2-ил)мочевина

(1S,1aR,7bS)-4,7-Дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновую кислоту (50 мг, 0,22 ммоль, ее ˜90%) смешивали с толуолом (1 мл), триэтиламином (0,034 мл, 1,1 экв.), 2-амино-6-фтор-1,3-бензотиазолом (41 мг, 1,1 экв.), DPPA (0,054 мл, 1,1 экв.). Реакционную смесь затем нагревали при перемешивании при 110°С в течение 3 час. Реакционную смесь концентрировали выпариванием на роторном испарителе, продукт кристаллизовали из этанола и собирали фильтрованием с получением 20 мг продукта в виде твердого вещества белого цвета.
1Н-ЯМР (CDCl3): 10,58 (ушир.с, ˜1H), 7,78 (ушир.д, 1H), 7,52 (дд, 1H), 7,45 (дд, 1H), 7,05 (дт, 1H), 6, 94 (м, 1H), 6,65 (дт, 1H), 4,44 (дд, 1H), 4,33 (дд, 1H), 3,53 (м, 1H), 2,58 (м, ˜1H), 2,03 (м, 1H), LC-MS: М+434.
Пример 55
N-[(1S,1aR,7bR)-4, 7-Дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил]-N'-(4-пиримидинил)мочевина

(1S,1aR,7bS)-4,7-Дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновую кислоту (50 мг, 0,22 ммоль, ее ˜90%) смешивали с толуолом (1 мл), триэтиламином (0,034 мл, 1,1 экв.), 4-аминопиримидином (25 мг, 1,1 экв.), DPPA (0,054 мл, 1,1 экв.). Реакционную смесь затем нагревали при перемешивании при 110°С в течение 3 час. Реакционную смесь концентрировали выпариванием на роторном испарителе, продукт кристаллизовали из этанола и собирали фильтрованием с получением 20 мг продукта в виде твердого вещества белого цвета.
1Н-ЯМР (ДМСО-d6 ): 9,71 (ушир.с, 1H), 8,4 (ушир.с, 1H), 8,39 (д, 1H), 7,86 (ушир.с, 1H), 7,31 (д, 1H), 7,08 (м, 1H), 6,77 (дт, 1H), 4,31 (м, 2H), 3,48 (м, 1H), 2,48 (м, ˜1H, перекрывающийся с сигналом ДМСО), 2, 02 (м, 1H).
Пример 56
N-[(1S,1aR,7bR)-4,7-Дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-ил]-N'-(2-пиразинил)мочевина

(1S,1aR,7bS)-4,7-Дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновую кислоту (50 мг, 0,22 ммоль, ее ˜90%) смешивали с толуолом (1 мл), триэтиламином (0,034 мл, 1,1 экв.), 4-аминопиразином (25 мг, 1,1 экв.), DPPA (0,054 мл, 1,1 экв.). Реакционную смесь затем нагревали при перемешивании при 110°С в течение 3 час. Реакционную смесь концентрировали выпариванием на роторном испарителе, продукт кристаллизовали из этанола и собирали фильтрованием с получением 5 мг продукта в виде твердого вещества белого цвета.
1Н-ЯМР (ДМСО-d6 ): 9,57 (ушир.с, 1H), 8,67 (ушир.с, 1H), 8,10 (д, 1H), 7,95 (ушир.с, 1H), 7,64 (ушир.с, 1H), 7,05 (м, 1H), 6,77 (дт, 1H), 4,31 (м, 2H), 3,49 (м, 1H), 2,48 (м, ˜1H, перекрывающийся с сигналом ДМСО), 2,02 (м, 1H).
Пример 57
N-[(1S,1aR,7bR)-4,7-Дифтор-1,1a,2, 7b-тетрагидроциклопропа[c]хромен-1-ил]-N'-(5-циклопропил-1Н-пиразол-3-ил)мочевина

(1S,1aR,7bS)-4,7-Дифтор-1,1a,2,7b-тетрагидроциклопропа[c]хромен-1-карбоновую кислоту (50 мг, 0,22 ммоль, ее ˜90%) смешивали с толуолом (1 мл), триэтиламином (0,034 мл, 1,1 экв.), 3-амино-5-циклопропил-1Н-пиразолом (30 мг, 1,1 экв.), DPPA (0,054 мл, 1,1 экв.). Реакционную смесь затем нагревали при перемешивании при 110°С в течение 3 час. Реакционную смесь концентрировали выпариванием на роторном испарителе и два соединения разделяли колоночной хроматографией на силикагеле (50 г, этилацетат/гексан 1:3) с получением 3 мг указанного в заголовке продукта. Структуру подтверждали экспериментами13С, gHMBC, gHMQC и NOESY ЯМР.
1Н-ЯМР (CDCl3): 7,05 (ушир.д, ˜1H), 6,88 (м, 1H), 6,64 (дт, 1H), 5,24 (д, 1H), 4,49 (дд, 1H), 4,33 (дд, 1H), 3,63 (м, 1H), 2,61 (м, ˜2H), 1,99 (м, 1H), 0,99 (м, 2H), 0,58 (м, 2H).
Результаты биологических испытаний
Подробное руководство по исследованию испытуемых соединений на ферментном уровне и в клеточной культуре, включая выделение и/или отбор мутантных штаммов ВИЧ и мутантной RT, можно найти в DAIDS Virology Manual for HIV Laboratories complied by Division of AIDS, NIAID USA 1997. Исследования резистентности, включая подходящие для различных мутантов, устойчивых к лекарственным средствам, описаны в HIV Resistance Collaborative Group Data Analysis Plan for Resistance Studies, пересмотренной 31 августа 1999.
Соединения данного изобретения исследованы на ВИЧ-активность, например, с использованием множественных определений с ХТТ в клетках МТ-4 (Weislow et al, J Nat Cancer Inst 1989, vol 81 no 8, 577 et seq), предпочтительно включая определения в присутствии 40-50% сыворотки человека, чтобы установить вклад от связывания белка. Кратко, в ХТТ анализе используют MT-4 линию Т-клеток человека, выращенную в среде RPMI, дополненной 10% фетальной телячьей сывороткой (или 40-50% сывороткой человека как подходящей), пенициллином и стрептомицином, высеянную в 96-луночные микропланшеты (2·104 клеток/лунка), инфицированную 10-20 TCID50 на лунку ВИЧ-1IIIB (дикого типа) или мутантным вирусом, таким как вирус, несущий RT мутации Ile 100, Cys 181 или Asn 103. Серийно разбавленные тестируемые соединения добавляли в соответствующие лунки, культуру инкубировали при 37°С в атмосфере, обогащенной СО2, и жизнеспособность клеток определяли на пятый или шестой день с витальным красителем ХТТ. Результаты обычно представляют в виде ED50 мкМ.
Соединения данного изобретения были проанализированы в представленном выше ХТТ анализе с использованием ВИЧ-1IIIB (дикого типа), как показано в таблице:
Соединения являются активными предпочтительно против вируса дикого типа и мутантного вируса ВИЧ, особенно вируса, содержащего мутации, устойчивые к лекарственным средствам. Мутации, устойчивые к лекарственным средствам, представляют собой такие, которые появляются у пациентов из-за селективного воздействия антивирусного препарата предшествующего уровня техники и которые сообщают усиленную резистентность к такому антивирусному препарату. Data Analysis Plan, на который делались ссылки выше, кратко определяет важные мутанты, устойчивые к лекарственным средствам, для каждого класса антивирусных препаратов, которые в настоящее время поступают на рынок. Клоны, устойчивые к лекарственным средствам, легко выделяют у ВИЧ-пациентов, которые не поддаются конкретной антивирусной терапии. Альтернативно, получение RT-мутаций на известной генетической основе показано в №№ WO 97/27319, WO 99/61658 и WO 00/73511, в которых также показано использование таких мутантов в анализе профиля чувствительности.
К103 N является особенно релевантным мутантом, устойчивым к лекарственным средствам в контексте NNRTI терапии, и соединения данного изобретения предпочтительно имеют низкий ED50 против такого мутанта, особенно в анализах, имитирующих присутствие сыворотки человека. Соединения данного изобретения, такие как представлены в качестве примеров выше, показывают в таких исследованиях активность в микромолярных концентрациях.
Реферат
Изобретение относится к новым ненуклеозидным ингибиторам обратной транскриптазы формулы I:

где R1 представляет О, S; R2 представляет необязательно замещенный, азотсодержащий гетероцикл, в котором азот расположен в положении 2 относительно связи с (тио)мочевиной; R3 представляет Н, C1-С3алкил, R4-R7 независимо выбраны из Н, C1-С6алкила, С2-С6 алкенила, С2-С6алкинила, галогенС1-С6алкила, C1-С6алканоила, галогенС1-С6алканоила, C1-С6 алкокси, галогенС1-С6алкокси, гидрокси-С1-С6алкила, циано, галогена, гидрокси; Х представляет -(CHR8)n-D(CHR8)m -; D представляет -О- или -S-; R8 представляет Н, n и m представляют независимо 0, 1 или 2; и его фармацевтически приемлемым солям. Изобретение относится также к фармацевтической композиции на основе этих соединений, обладающей ингибирующей активностью в отношении обратной транскриптазы ВИЧ-1, а также к применению этих соединений при изготовлении лекарственных средств для лечения ВИЧ-1 и промежуточным соединениям. 6 н. и 39 з.п. ф-лы, 1 табл.
Формула


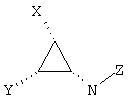




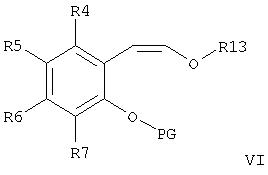

Документы, цитированные в отчёте о поиске
Циклические соединения мочевины, фармацевтическая композиция и способ лечения
4-оксоциклические соединения мочевины, фармацевтическая композиция и способ лечения

Комментарии