Нестероидные модуляторы глюкокортиодидных рецепторов для местной доставки лекарств - RU2731618C2
Код документа: RU2731618C2
Чертежи



Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к новым нестероидным соединениям, которые являются эффективными модуляторами глюкокортикоидного рецептора и промежуточным соединениям для их получения, к указанным соединениям для применения в терапии, фармацевтическим композициям, содержащим указанные соединения, к способам лечения заболеваний указанными соединениями, и к применению указанных соединений в производстве лекарственных средств.
УРОВЕНЬ ТЕХНИКИ
Глюкокортикоидный рецептор (GR) является членом семейства ядерных гормональных рецепторов факторов транскрипции и членом семейства стероидных гормонов факторов транскрипции, которые при связывании с лигандом способствуют или подавляют транскрипцию генов. Агонисты глюкокортикоидных рецепторов встречаются в природе или могут быть получены синтетически. Глюкокортикоиды (GC), которые взаимодействуют с GR, являются мощными противовоспалительными средствами и используются как таковые для борьбы с широким спектром аллергических и воспалительных состояний, таких как астма, ревматоидный артрит, экзема и псориаз. Глюкокортикоиды также применяли благодаря их иммунодепрессивным свойствам и их противоопухолевым эффектам.
Глюкокортикоиды применяли локально для лечения дерматитов, астмы, конъюнктивита и других офтальмологических нарушений.
Однако применение глюкокортикоидов ограничено как местными, так и системными побочными эффектами, данные эффекты включают атрофию кожи и мышц, остеопороз, диабет, нарушение заживления ран, восприимчивость к инфекции, дисфункцию HPA, атрофию надпочечников, катаракту, пептические язвы, гипертонию, метаболический синдром и электролитный дисбаланс [Shacke et al., Pharmacology и Therapeutics (2002), vol. 96(1), 23-43].
Побочные эффекты обычно более серьезны после системного, а не местного применения. Однако даже местная терапия может вызывать системные побочные эффекты, наблюдаемые после кожной терапии для воспалительного дерматита и легочной терапии для астмы. Побочные эффекты проявляются с различной распространенностью, в разных органах и после терапий с различной продолжительностью. Тяжесть варьируется от более косметических аспектов, например телеангиэктазии и гипертрихоза, до серьезно инвалидизирующих и даже опасных для жизни ситуаций (например, желудочное кровотечение). [Shacke et al., Pharmacology и Therapeutics (2002), vol. 96(1), 23-43].
Глюкокортикоидный рецептор активируется связыванием глюкокортикоидного гормона кортизола и его синтетических производных, а также нестероидных агонистов. Таким образом, аналоги глюкокортикоидов на основе стероидов и нестероидные аналоги глюкокортикоидов хорошо известны в данной области техники.
В WO2008/076048 описан индазолиловый эфир и амидные производные для лечения опосредованных глюкокортикоидным рецептором нарушений.
В WO2009/142571 описаны фенил- и бензодиоксинилзамещенные производные индазолов в качестве модуляторов глюкокортикоидного рецептора.
В WO2009/142569 описаны фенил- и пиридинилзамещенные производные индазолов в качестве модуляторов глюкокортикоидного рецептора.
Существует постоянная потребность в разработке новых нестероидных модуляторов глюкокортикоидных рецепторов (например, агонистов, антагонистов, частичных агонистов или частичных антагонистов). В частности, разработка нестероидных глюкокортикоидов, которые сохраняют противовоспалительную эффективность глюкокортикоидов при минимизации побочных эффектов, будет иметь большие преимущества для большого числа пациентов с воспалительными заболеваниями. Разработка актуальных нестероидных глюкокортикоидов с высоким системным клиренсом и/или коротким периодом полувыведения может обеспечить наличие соединений с уменьшенными побочными эффектами при сохранении актуальной противовоспалительной эффективности. Для местного применения было бы полезно разработать нестероидные глюкокортикоиды с пониженной фототоксичностью.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Целью данного изобретения является создание новых нестероидных соединений, которые представляют собой модуляторы, в частности агонисты или частичные агонисты, глюкокортикоидного рецептора, и которые обладают сильной противовоспалительной активностью, и которые обладают преимуществами в отношении побочных эффектов, эффективности, токсичности и/или метаболизма.
Более конкретно, данное изобретение относится к новым соединениям, которые представляют собой модуляторы, в частности агонисты или частичные агонисты глюкокортикоидного рецептора; которые обладают противовоспалительным эффектом и имеют профиль устойчивости в биологической ткани, что подразумевает, что только очень низкое системное воздействие соединений будет наблюдаться, например, при местном введении. Особым преимуществом некоторых соединений по данному изобретению является то, что они имеют высокий клиренс в микросомах печени человека. Кроме того, некоторые соединения по данному изобретению быстро гидролизуются в цельной крови человека, а некоторые соединения по данному изобретению в то же время демонстрируют стабильность в отношении ферментативного гидролиза в кератиноцитах человека. Кроме того, некоторые соединения по данному изобретению демонстрируют пониженную фототоксичность.
Соответственно, данное изобретение относится к соединениям формулы (I)

где
R1 выбирают из группы, состоящей из 5- и 6- членного гетероарила, (C1-C6)алкила, (C3-C6)циклоалкила, (4-6)-членного гетероциклоалкила и фенила, причем указанный 5- и 6-членный гетероарил, (C1-C6)алкил, (C3-C6)циклоалкил, (4-6)-членный гетероциклоалкил и фенил необязательно замещен одним или большим количеством заместителей, независимо выбранных из (C1-C4)алкила, (C1-C4)алкокси, галогена, гидроксила и циано;
R2 выбирают из (C1-C3)алкила и галоген(C1-C3)алкила;
R3 выбирают из фенила, 5-членного гетероарила и 6-членного гетероарила, где указанный фенил, 5-членный гетероарил и 6-членный гетероарил необязательно замещены одним или большим количеством заместителей, независимо выбранных из R5;
R4 выбирают из водорода, галогена, (C1-C4)алкила и галоген(C1-C4)алкила;
R5 выбирают из галогена, циано, (C1-C6)алкила, (C3-C6)циклоалкила, (C1-C6)алкокси, галоген(C1-C6)алкила, галоген(C1-C6)алкокси, гидрокси(C1-C6)алкила, фенила, 5-членного гетероарила, 6-членного гетероарила и -S(O)2Ra, где Ra представляет собой (C1-C4)алкил;
X1 выбирают из CH, C(Rb) и N, где Rb представляет собой галоген, (C1-C4)алкил или галоген(C1-C4)алкил;
X2 выбирают из CH и N;
Y выбирают из -NH- и -O-;
m равно 0 или 1; n равно 0 или 1;
L представляет собой связь, -O-, -NH- или -N(Rc)-, где Rc представляет собой (C1-C4)алкил;
или его фармацевтически приемлемым солям, гидратам или сольватам.
Кроме того, данное изобретение относится к соединениям формулы (I) для применения в терапии.
Также, данное изобретение относится к соединениям формулы (I) для применения в профилактике, лечении или улучшении состоянии при воспалительных, аллергических или пролиферативных дерматологических заболеваниях или патологических состояниях.
Краткое описание графических материалов
Фиг. 1 представляет собой график, на котором изображена ДСК (дифференциальная сканирующая калориметрия) (сплошная линия) и ТГА (термогравиметрический анализ) (пунктирная линия) кривая полиморфа F соединения 37.
На Фиг. 2 изображена картина пРСА (порошковый рентгеноструктурный анализ) полиморфа F соединения 37.
На Фиг. 3 изображена ORTEP-диаграмма абсолютной кристаллической структуры полиморфа F соединения 37. Структура имеет только одну молекулу в асимметричной элементарной ячейке.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Определения
Термин «алкил» предназначен для обозначения радикала, полученного при удалении одного атома водорода из разветвленного или линейного углеводорода. Указанный алкил включает 1-6, предпочтительно 1-4, например, 1-3, например, 2-3 или, например, 1-2 атома углерода. Термин включает подклассы нормальный алкил (н-алкил), вторичный и третичный алкил, такой как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил и изогексил.
Термин «алкиллен» предназначен для обозначения двухвалентной насыщенной алифатической гидрокарбильной группы, предпочтительно имеющей от 1 до 6 и более предпочтительно от 1 до 3 атомов углерода, которая является линейной или разветвленной. Данный термин иллюстрируется такими группами, как метилен (-CH2-), этилен (-CH2CH2-), н-пропилен (-CH2CH2CH2-), изо-пропилен (-CH2CH(CH3)-) или (-CH(CH3)CH2-), и т.п.
Термины «алкилокси» и «алкокси» предназначены для обозначения радикала формулы -OR ', где R' представляет собой алкил, в соответствии с определением в данном документе, где алкильная группа присоединена к исходной молекулярной части через атом кислорода, например. метокси (-OCH3), этокси (-OCH2CH3), н-пропокси, изопропокси, бутокси, трет-бутокси, и т.п. Поэтому, термин ʺ(C1-C4)алкоксиʺ предназначен для обозначения радикала формулы -O(C1-C4)алкил, например, метокси (-OCH3), этокси (-OCH2CH3), н-пропокси, изопропокси, н-бутокси, изо-бутокси или трет-бутокси.
Термин «алкилтио» предназначен для обозначения радикала формулы -S-R ', где R' представляет собой алкил, в соответствии с определением в данном документе, где алкильная группа присоединена к исходному молекулярному фрагменту через атом серы, например. -S-CH3 (метилтио) или -S-CH2CH3 (этилтио).
Термин «арил» предназначен для обозначения радикала ароматических карбоциклических колец, содержащих 6-13 атомов углерода, например, 6-9 атомов углерода, например, 6 атомов углерода, в частности 5- или 6-членные кольца, включая конденсированные карбоциклические кольца с по меньшей мере одним ароматическим кольцом. Если арильная группа представляет собой конденсированное карбоциклическое кольцо, то точка присоединения арильной группы к исходной молекулярной части может быть через ароматический или через алифатический атом углерода внутри арильной группы. Типичные примеры арила включают, но не ограничиваются ими, фенил, нафтил, инденил, инданил, дигидронафтил, тетрагидронафтил и флуоренил.
Термин «циано» предназначен для обозначения группы -CN, присоединенной к исходной молекулярной части через атом углерода.
Термин «циклоалкил» предназначен для обозначения насыщенного циклоалканового углеводородного радикала, содержащего 3-6 атомов углерода, предпочтительно 3-5 атомов углерода, например, 3-4 атомов углерода, например, циклопропила, циклобутила, циклопентила и циклогексила. Аналогично, термин ʺ(C3-C6)циклоалкилʺ предназначен для обозначения насыщенного циклоалканового углеводородного радикала, содержащего 3-6 атомов углерода, например, циклопропила, циклобутила, циклопентила и циклогексила.
Термин «галогеналкил» предназначен для обозначения алкильной группы, в соответствии с определением в данном документе, замещенной одним или большим количеством атомов галогена, в соответствии с определением в данном документе, например, фтор или хлор, такой как фторметил, дифторметил или трифторметил. Таким образом, термин ʺгалоген(C1-C3)алкилʺ предназначен для обозначения (C1-C3)алкильной группы, в соответствии с определением в данном документе,замещенной одним или большим количеством атомов галогена, в соответствии с определением в данном документе, например, фторметила, дифторметила, трифторметила, дифторэтила, трифторэтила или фторпропила. Аналогично, термин ʺгалоген(C1-C6)алкилʺ предназначен для обозначения (C1-C6)алкильной группы, в соответствии с определением в данном документе, замещенной одним или большим количеством атомов галогена, в соответствии с определением в данном документе..
Термины «галогеналкилокси» и «галоалкокси» предназначены для обозначения галогеналкильной группы, в соответствии с определением в данном документе, которая присоединена к исходному фрагменту через атом кислорода, такой как дифторметокси или трифторметокси. Таким образом, термин ʺгалоген(C1-C6)алкилоксиʺ предназначен для обозначения галоген(C1-C6)алкильной группы, в соответствии с определением в данном документе, которое добавляется к исходному молекулярному фрагменту через атом кислорода.
Термин «галоген» предназначен для обозначения заместителя из 7-й основной группы Периодической таблицы, такого как фтор, хлор и бром.
Термин «гетероарил» предназначен для обозначения радикалов моноциклических гетероароматических колец, содержащих 5- или 6-членное кольцо, которое содержит от 1 до 5 атомов углерода и из 1-5 гетероатомов, выбранных из кислорода, серы и азота, например, 1-3 атомов углерода и 2-4 гетероатомов, выбранных из O, N и S, например, 2-3 атома углерода и 2-3 гетероатома, выбранных из O, N и S, например, 1 атом углерода и 4 гетероатома, выбранных из O, N и S, например, 2 атома углерода и 3 гетероатома, выбранных из O, N и S, например, 3 атома углерода и 2 гетероатома, выбранных из O, N и S, например, 4 атома углерода и 1 гетероатом, выбранный из O, N и S, например, 3 атома углерода и 3 гетероатома, выбранных из N, например, 4 атома углерода и 2 гетероатома, выбранных из N, например, 5 атомов углерода и 1 гетероатом, выбранный из N. Гетероарильный радикал может быть связан с исходным молекулярным фрагментом через атом углерода или атом азота, содержащийся в гетероарильной группе. Типовые примеры гетероарильных групп включают, но не ограничиваются ими, фуранил, имидазолил, изотиазолил, изоксазолил, оксадиазолил, оксазолил, пиразинил, пиразолил, пиридазинил, пиридил, пиримидинил, пирролил, тетразолил, тиадиазолил, тиазолил, тиенил, триазолил.
Термин «5-членный гетероарил» предназначен для обозначения гетероарила, в соответствии с определением в данном документе, который содержит 5 кольцевых атомов, который содержит 1-4 атома углерода и 1-4 гетероатомов, выбранных из кислорода, серы и азота, таких как 1- 3 атома углерода и 2-4 гетероатома, выбранных из O, N и S, например, 2-3 атома углерода и 2-3 гетероатома, выбранных из O, N и S, например, 1 атом углерода и 4 гетероатома, выбранных из O, N и S, например, 2 атома углерода и 3 гетероатома, выбранных из O, N и S, например, 3 атома углерода и 2 гетероатома, выбранных из O, N и S, например, 4 атома углерода и 1 гетероатом, выбранный из O, N и S. Типичные примеры 5-членных гетероарильных групп включают, но не ограничиваются ими, фуранил, имидазолил, изотиазолил, изоксазолил, оксадиазолил, оксазолил, пиразолил, пирролил, тетразолил, тиадиазолил, тиазолил, тиенил, триазолил.
Термин «6-членный гетероарил» предназначен для обозначения гетероарила, в соответствии с определением в данном документе, который содержит 6 кольцевых атомов, который состоит из от 1 до 5 атомов углерода и от 1-5 гетероатомов, выбранных из кислорода, серы и азота, например, 2- 4 атома углерода и 2-4 гетероатома, выбранных из O, N и S, например, 2-3 атома углерода и 3-4 гетероатома, выбранных из O, N и S, например, 3 атома углерода и 3 гетероатома, выбранных из N, например, 4 атома углерода и 2 гетероатома, выбранных из N, например, 5 атомов углерода и 1 гетероатом, выбранный из N. Характерные примеры гетероарильных групп включают, но не ограничиваются ими, пиразинил, пиридазинил, пиридил, пиримидинил.
Термин «гетероциклоалкил» предназначен для обозначения циклоалканового радикала, в соответствии с определением в данном документе, в котором один или большее количество атомов углерода замещены гетероатомами, содержащего 1-6 атомов углерода, например, 2-5 или 2-4 атома углерода, дополнительно содержащего 1-3 гетероатома, предпочтительно от 1 до 2 гетероатомов, выбранных из O, N или S. Гетероциклоалкильный радикал может быть связан с исходным молекулярным фрагментом через атом углерода или атом азота, содержащийся в гетероциклоалкильной группе. Типовые примеры гетероциклоалкильных групп включают, но не ограничиваются ими, азепанил, азетидинил, азиридинил, диоксоланил, диоксолил, имидазолидинил, морфолинил, оксетанил, пиперазинил, пиперидинил, пирролидинил, тетрагидрофуранил, тетрагидропиранил, тетрагидротиофенил, тетрагидротиопиранил.
Термин «(4-6) членный гетероциклоалкил» предназначен для обозначения гетероцилоалкила, в соответствии с определением в данном документе, содержащего 4-6 атомов в кольце, и содержащего 1-5 атомов углерода, например, 2-5, 3-5, 4-5 или 2-4 атома углерода, дополнительно содержащего 1-5, 1-4 или 1-3 гетероатома, предпочтительно от 1 до 2 гетероатомов, выбранных из O, N или S. Типовые примеры (4-6) членного гетероциклоалкила включают азетидинил, диоксанил, диоксоланил, имидазолидинил, морфолинил, оксетанил, пиперазинил, пиперидинил, пирролидинил, тетрагидрофуранил, тетрагидропиранил, тетрагидротиопиранил, тетрагидротиофенил, тиетанил.
Термин «углеводородный радикал» предназначен для обозначения радикала, содержащего только атомы водорода и углерода, он может содержать одну или большее количество двойных и/или тройных углерод-углеродных связей, и он может содержать циклические фрагменты в сочетании с разветвленными или линейными фрагментами. Указанный углеводород содержит 1-6 атомов углерода и предпочтительно содержит 1-5, например, 1-4, например, 1-3, например, 1-2 атома углерода.
Термин «гидрокси» или «гидроксил» предназначен для обозначения группы -ОН, присоединенной к исходному фрагменту молекулы через атом кислорода.
Термин ʺгидрокси(C1-C6)алкилʺ предназначен для обозначения (C1-C6)алкильной группы, в соответствии с определением в данном документе, замещенной одной или большим количеством гидроксильных групп, в соответствии с определением в данном документе (-ОН), такими как, например, гидроксиметил, гидроксиэтил, гидроксипропил или дигидроксипропил.
В некоторых случаях количество атомов углерода в углеводородном радикале (например,алкил, циклоалкил и арил) обозначается префиксом ʺ(Ca-Cb)ʺ, где a - минимальное число и b - максимальное количество атомов углерода в углеводородном радикале. Таким образом, например, (C1-C4)алкил предназначен для обозначения алкильного радикала, содержащего от 1 до 4 атомов углерода, (C1-C6)алкил предназначен для обозначения алкильного радикала, содержащего от 1 до 6 атомов углерода и (C3-C6)циклоалкил предназначен для обозначения циклоалкильного радикала, содержащего от 3 до 6 атомов углерода в кольце.
Термин «гидроксиалкил» предназначен для обозначения алкильной группы, в соответствии с определением выше, замещенной одной или большим количеством гидроксильных групп, например, гидроксиметил, гидроксиэтил, гидроксипропил.
Термин «оксо» предназначен для обозначения атома кислорода, который связан с исходным фрагментом молекулы посредством двойной связи (=O).
Термин «тиоксо» предназначен для обозначения атома серы, который связан с исходным фрагментом молекулы посредством двойной связи (=S).
Группа C(O) предназначена для обозначения карбонильной группы (C=O)
Термин «фармацевтически приемлемая соль» предназначен для обозначения солей, полученных взаимодействием соединения формулы I, которые содержат фрагмент основания, с подходящей неорганической или органической кислотой, такой как хлористоводородная, бромистоводородная, иодистоводородная, серная, азотная, фосфорная, муравьиная, уксусная, 2,2-дихлоруксусная, адипиновая, аскорбиновая, L-аспарагиновая, L-глутаминовая, галактаровая, молочная, малеиновая, L-яблочная, фталевая, лимонная, пропионовая, бензойная, глутаровая, глюконовая, D-глюкуроновая, метансульфоновая, салициловая, янтарная, малоновая, винная, бензолсульфоновая, этан-1,2-дисульфоновая, 2-гидроксиэтансульфоновая кислота, толуолсульфоновая, сульфаминовая или фумаровая кислота. Фармацевтически приемлемые соли соединений формулы I, содержащие фрагмент кислоты, также могут быть получены реакцией с подходящим основанием, таким как гидроксид натрия, гидроксид калия, гидроксид магния, гидроксид кальция, гидроксид серебра, аммиак или тому подобное или подходящими нетоксичными аминами, такими как низшие алкиламины, гидрокси-содержащие низшие алкиламины, циклоалкиламины или бензиламины, или L-аргинин или L-лизин. Другие примеры фармацевтически приемлемых солей перечислены в Berge, S.M.; J. Pharm. Sci.; (1977), 66(1), 1-19, которые включены в данный документ посредством ссылки.
Термин «сольват» предназначен для обозначения соединения, образованного взаимодействием между соединением, например, соединением формулы I и растворителем, например, спиртом, глицерином или водой, причем указанное соединение находится в кристаллической или некристаллической форме. Когда вода является растворителем, указанное соединение называют гидратом.
В контексте данного документа, термин «лечение» означает оказание медицинской помощи и ухода за пациентом с целью борьбы с болезнью, расстройством или патологическим состоянием. Данный термин предназначен для того, чтобы включать в себя задержку прогрессирования заболевания, расстройства или патологического состояния, улучшение, частичное снятие или облегчение симптомов и осложнений и/или лечение или устранение заболевания, расстройства или патологического состояния. Данный термин также может включать предотвращение патологического состояния, при котором профилактику следует понимать как оказание медицинской помощи и ухода за пациентом с целью борьбы с болезнью, патологическим состоянием или расстройством и включает введение активных соединений для предотвращения появления симптомов или осложнений. Тем не менее профилактические (предупреждающие) и терапевтические (лечебные) методы лечения представляют собой два отдельных аспекта.
Все ссылки, включая публикации, патентные заявки и патенты, приведенные в данном документе, настоящим включены в качестве ссылки во всей их полноте и в той же степени, как если бы каждая ссылка была индивидуально и конкретно указана для включения в качестве ссылки, независимо от любого отдельно предоставленного включения конкретных документов, сделанных в другом месте в данном документе.
Варианты реализации данного изобретения
В одном варианте реализации данного изобретения предложено соединение формулы (I),
где R1 выбирают из группы, состоящей из 5-членного гетероарила, (C1-C6)алкила, (C3-C6)циклоалкила и (4-6)-членного гетероциклоалкила, причем указанный 5-членный гетероарил, (C1-C6)алкил, (C3-C6)циклоалкил и (4-6)-членный гетероциклоалкил необязательно замещен одним или большим количеством заместителей, независимо выбранных из (C1-C4)алкила, (C1-C4)алкокси, галогена и гидроксила.
В одном варианте реализации данного изобретения предложено соединение формулы (I), где R2 представляет собой метил.
В одном варианте реализации данного изобретения предложено соединение формулы (I), где R3 представляет собой фенил, который замещен одним или большим количеством заместителей, независимо выбранных из R5.
В одном варианте реализации данного изобретения предложено соединение формулы (I), где R5 выбирают из галогена, (C1-C6)алкила, (C3-C6)циклоалкила и фенила.
В одном варианте реализации данного изобретения предложено соединение формулы (I), где R5 выбирают из брома, метила, этила, циклопропила и фенила.
В одном варианте реализации данного изобретения предложено соединение формулы (I), где R4 представляет собой водород.
В одном варианте реализации данного изобретения предложено соединение формулы (I), где X1 выбирают из CH и N.
В одном варианте реализации данного изобретения предложено соединение формулы (I), где X2 представляет собой CH.
В одном варианте реализации данного изобретения предложено соединение формулы (I), где X1 представляет собой N, X2 представляет собой CH и Y представляет собой -NH-.
В одном варианте реализации данного изобретения предложено соединение формулы (I), где X1 представляет собой CH, X2 представляет собой CH и Y представляет собой -O-.
В одном варианте реализации данного изобретения предложено соединение формулы (I) в котором m равно 0 и n равно 1.
В одном варианте реализации данного изобретения предложено соединение формулы (I), где L представляет собой связь, -O- или -NH-.
В одном варианте реализации данного изобретения предложено соединение формулы (I), причем указанное соединение выбирают из
N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамида,
5-[(1R,2S)-1-(4-циклопропилфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамида,
5-[(1R,2S)-1-(4-циклопропилфенил)-2-(2,2-дифторпропаноиламино)пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамида,
N-[(1S,2R)-2-(4-циклопропилфенил)-1-метил-2-[[6-[[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]карбамоил]-3-пиридил]окси]этил]изотиазол-3-карбоксамида,
N-[(1S,2R)-2-(4-циклопропилфенил)-1-метил-2-[[6-[[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]карбамоил]-3-пиридил]окси]этил]изотиазол-5-карбоксамида,
N-[(1S,2R)-2-(4-циклопропилфенил)-1-метил-2-[[6-[[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]карбамоил]-3-пиридил]окси]этил]оксазол-2-карбоксамида,
N-[(1S,2R)-2-(4-циклопропилфенил)-1-метил-2-[[6-[[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]карбамоил]-3-пиридил]окси]этил]тиазол-4-карбоксамида,
N-[(1S,2R)-2-(4-циклопропилфенил)-1-метил-2-[[6-[[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]карбамоил]-3-пиридил]окси]этил]-3-метил-изоксазол-5-карбоксамида,
N-[(1S,2R)-2-(4-циклопропилфенил)-1-метил-2-[[6-[[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]карбамоил]-3-пиридил]окси]этил]оксазол-5-карбоксамида,
5-[(1R,2S)-1-(4-циклопропилфенил)-2-[[(2S)-2-гидроксибутаноил]амино]пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамида,
5-[(1R,2S)-1-(4-циклопропилфенил)-2-[[(2R)-2гидроксипропаноил]амино]пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамида,
N-[(1S,2R)-2-(4-циклопропилфенил)-1-метил-2-[[6-[[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]карбамоил]-3-пиридил]окси]этил]изоксазол-5-карбоксамида,
5-[(1R,2S)-1-(4-циклопропилфенил)-2-[[(2R)-2-гидроксибутаноил]амино]пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамида,
5-[(1R,2S)-1-(4-циклопропилфенил)-2-[(2-метоксиацетил)амино]пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамида,
5-[(1R,2S)-1-(4-циклопропилфенил)-2-[(2-гидрокси-2-метил-пропаноил)амино]пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамида,
5-[(1R,2S)-1-(4-циклопропилфенил)-2-(3-гидроксипропаноиламино)пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамида,
5-[(1R,2S)-1-(4-циклопропилфенил)-2-[(1-гидроксициклобутанкарбонил)амино]пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамида,
5-[(1R,2S)-1-(4-циклопропилфенил)-2-[(1-гидроксициклопропанкарбонил)амино]пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамида,
N-[(1S,2R)-2-(4-циклопропилфенил)-1-метил-2-[[6-[[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]карбамоил]-3-пиридил]окси]этил]оксазол-4-карбоксамида,
5-[(1R,2S)-1-(4-циклопропилфенил)-2-[[(2S)-тетрагидрофуран-2-карбонил]амино]пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамида,
5-[(1R,2S)-1-(4-циклопропилфенил)-2-[(2-гидроксиацетил)амино]пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамида,
5-[(1R,2S)-1-(4-циклопропилфенил)-2-[[(2R)-тетрагидрофуран-2-карбонил]амино]пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамида,
N-[(1S,2R)-2-(4-циклопропилфенил)-1-метил-2-[[6-[[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]карбамоил]-3-пиридил]окси]этил]изоксазол-3-карбоксамида,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-(1,2,5-тиадиазол-3-карбониламино)пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(5-метилтиазол-2-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-(тиазол-5-карбониламино)пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(4-метил-1,2,5-оксадиазол-3-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(5-метилтиазол-4-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(4-метилтиазол-5-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(5-метил-1,3,4-оксадиазол-2-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(4-метилтиадиазол-5-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(4-метилоксазол-5-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(2-метоксиацетил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(2-метилпиразол-3-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(2-метилтиазол-5-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[[(2R)-тетрагидрофуран-2-карбонил]амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(3-метилтриазол-4-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-(1,2,4-оксадиазол-3-карбониламино)пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(1-метилимидазол-2-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(3-метилизоксазол-5-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(5-метил-1,2,4-оксадиазол-3-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(1-метилимидазол-4-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-(изотиазол-3-карбониламино)пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(3-метилизоксазол-4-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-(тиазол-2-карбониламино)пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-(изотиазол-5-карбониламино)пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(5-метилизотиазол-4-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-(оксазол-2-карбониламино)пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-(оксазол-5-карбониламино)пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-(изоксазол-3-карбониламино)пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-(тиадиазол-4-карбониламино)пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(5-метилизоксазол-3-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-(изоксазол-5-карбониламино)пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-(тиазол-4-карбониламино)пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(3-метил-1,2,4-оксадиазол-5-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(1-метилпиразол-3-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-(2,2-дифторпропаноиламино)пропокси]бензоата,
N-[(3R)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамида,
N-[(3R)-1-[(3S)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамида,
N-[(3R)-1-[(2S)-5-оксотетрагидрофуран-2-карбонил]-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамида,
N-[(3R)-1-[(2R)-5-оксотетрагидрофуран-2-карбонил]-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамида,
N-[(3S)-1-[(3S)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамида,
N-[(3S)-1-[(2S)-5-оксотетрагидрофуран-2-карбонил]-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамида,
N-[(3R)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]пирролидин-3-ил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамида,
5-[(1R,2S)-1-(4-этилфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамида,
5-[(1R,2S)-1-(4-бромфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамида,
N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]-5-[(1R,2S)-1-(4-фенилфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамида,
N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]-4-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензамида,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензоата,
N-[(3S)-1-[[(3S)-5-оксотетрагидрофуран-3-ил]карбамоил]-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамид,
N-[(3S)-1-[[(3R)-5-оксотетрагидрофуран-3-ил]карбамоил]-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамида,
[(3S)-2-оксотетрагидрофуран-3-ил] (3S)-3-[[5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилата,
[(3R)-2-оксотетрагидрофуран-3-ил] (3S)-3-[[5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилата,
[(3S)-5-оксотетрагидрофуран-3-ил] (3S)-3-[[5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилата или
[(34)-5-оксотетрагидрофуран-3-ил] (3S)-3-[[5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилата
или их фармацевтически приемлемых солей, гидратов или сольватов.
Любая комбинация двух или более вариантов реализации изобретения, описанных в данном документе, рассматривается в рамках данного изобретения.
Данное изобретение включает все варианты реализации изобретения, где R1, R2, R3, R4, R5, X1, X2, Y, m, n и L объединены в любой комбинации, как описано в любом месте данного документа.
В одном варианте реализации данного изобретения предложено соединение формулы (Ia).

В одном варианте реализации данного изобретения предложено соединение формулы (Ib).

В одном варианте реализации данного изобретения предложено соединение формулы (Ic).

В одном варианте реализации данного изобретения предложено соединение формулы (Id).

В одном варианте реализации данного изобретения предложено соединение формулы (Ie).
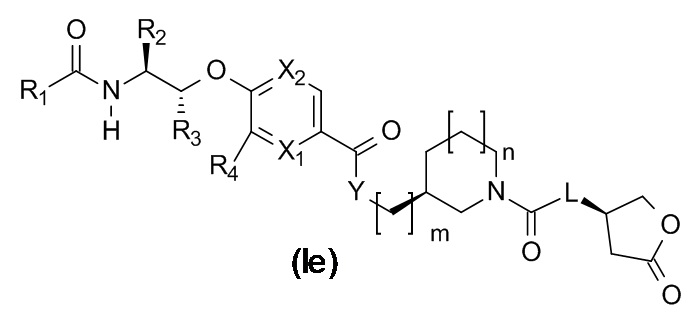
В одном варианте реализации данного изобретения предложено соединение формулы (If), где m равно 0 и n равно 1.

В варианте реализации данного изобретения предложено соединение формулы (Ig), где m равно 0 и n равно 1.
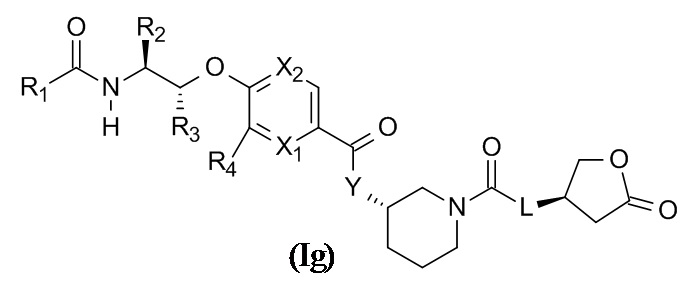
В одном варианте реализации данного изобретения предложено соединение формулы (Ih),

В одном варианте реализации данного изобретения предложено соединение формулы I, указанное соединение представляет собой [(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[[(2R)-тетрагидрофуран-2-карбонил]амино]пропокси]бензоат (Соединение 37)
В одном варианте реализации данного изобретения предложено соединение формулы I, указанное соединение представляет собой N-[(1S,2R)-2-(4-циклопропилфенил)-1-метил-2-[[6-[[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]карбамоил]-3-пиридил]окси]этил]изоксазол-3-карбоксамид (Соединение 23)
В одном варианте реализации данного изобретения предложено соединение формулы I, указанное соединение представляет собой N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамид (Соединение 1)
В одном варианте реализации данного изобретения предложено соединение формулы (I), где R2 представляет собой метил; R3 представляет собой фенил, причем указанный фенил замещен одним или большим количеством заместителей, независимо выбранных из R5; R4 представляет собой водород и X2 представляет собой CH.
В одном варианте реализации данного изобретения предложено соединение формулы (I), где R3 представляет собой фенил, который замещен в пара-положении заместителем, выбранным из R5.
В одном варианте реализации данного изобретения предложено соединение формулы (I), где R1 представляет собой 5-членный гетероарил, необязательно замещенный одним или большим количеством заместителей, независимо выбранных из (C1-C4)алкила, (C1-C4)алкокси, галогена, гидроксила и циано; R2 представляет собой метил; R3 представляет собой фенил, причем указанный фенил замещен одним или большим количеством заместителей, независимо выбранных из R5; R4 представляет собой водород и X2 представляет собой CH.
В одном варианте реализации данного изобретения предложено соединение формулы (I), где R1 представляет собой (C1-C6)алкил, необязательно замещенный одним или большим количеством заместителей, независимо выбранных из (C1-C4)алкила, (C1-C4)алкокси, галогена, гидроксила и циано; R2 представляет собой метил; R3 представляет собой фенил, причем указанный фенил замещен одним или большим количеством заместителей, независимо выбранных из R5; R4 представляет собой водород и X2 представляет собой CH.
В одном варианте реализации данного изобретения предложено соединение формулы (I), где R2 представляет собой метил; R3 представляет собой фенил, причем указанный фенил замещен одним или большим количеством заместителей, независимо выбранных из R5; R4 представляет собой водород; X2 представляет собой CH; m равно 0; n равно 1 и L представляет собой связь.
В одном варианте реализации данного изобретения предложено соединение формулы (I), где R2 представляет собой метил; R3 представляет собой фенил, причем указанный фенил замещен одним или большим количеством заместителей, независимо выбранных из R5; R4 представляет собой водород; X1 представляет собой CH; X2 представляет собой CH; Y представляет собой -O-; m равно 0; n равно 1 и L представляет собой связь.
В одном варианте реализации данного изобретения предложено соединение формулы (I), где R2 представляет собой метил; R3 представляет собой фенил, причем указанный фенил замещен одним или большим количеством заместителей, независимо выбранных из R5; R4 представляет собой водород; X1 представляет собой N; X2 представляет собой CH; Y представляет собой -NH-; m равно 0; n равно 1 и L представляет собой связь.
Соединения формулы I могут быть получены в кристаллической форме либо непосредственно путем концентрирования из органического растворителя, либо путем кристаллизации или перекристаллизации из органического растворителя или смеси указанного растворителя и совместного растворителя, который может быть органическим или неорганическим, таким как вода. Кристаллы могут быть выделены в основном без растворителя или в виде сольвата, такого как гидрат. Изобретение охватывает все кристаллические формы, такие как полиморфы и псевдополиморфы, а также их смеси.
Соединения формулы I содержат асимметрически замещенные (хиральные) атомы углерода, которые приводят к существованию изомерных форм, например, энантиомеры и, возможно, диастереомеры. Данное изобретение относится ко всем таким изомерам либо в оптически чистой форме, либо в виде их смесей (например, рацемических смесей или частично очищенных оптически активных смесей). Чистые стереоизомерные формы соединений и промежуточные соединения по данному изобретению могут быть получены с применением методик, известных в данной области техники. Разнообразные изомерные формы могут быть разделены физическими методами разделения, такими как селективная кристаллизация и хроматографические методы, например, высокоэффективной жидкостной хроматографией с использованием хиральных стационарных фаз. Энантиомеры могут быть отделены друг от друга путем избирательной кристаллизации их диастереомерных солей, которые могут быть образованы с оптически активными аминами, такими как l-эфедрин, или с оптически активными кислотами.Оптически чистые соединения могут быть впоследствии выделены из указанных очищенных диастереомерных солей. Энантиомеры также могут быть разделены путем образования диастереомерных производных. Альтернативно, энантиомеры могут быть разделены хроматографическими методами с использованием хиральных стационарных фаз. Чистые стереоизомерные формы также могут быть получены из соответствующих чистых стереоизомерных форм подходящих исходных материалов при условии, что реакция протекает стереоселективно или стереоспецифически. Предпочтительно, если желателен конкретный стереоизомер, указанное соединение будет синтезировано стереоселективными или стереоспецифическими способами получения. Данные способы будут преимущественно использовать хирально чистые исходные вещества.
Данное изобретение включает фармацевтически приемлемые меченые изотопами соединения формулы I, в которых один или большее количество атомов замещены атомами, имеющими один и тот же атомный номер, но атомную массу или массовое число, отличное от числа атомной массы, которое преобладает в природе. Примеры изотопов, подходящих для включения в соединения, включают изотопы водорода, такие как2H и3H, изотопы углерода, такие как11C,13C и14C, изотопы азота, такие как13N и15N, изотопы кислорода, такие как15O,17O и18O и изотопы фтора, такие как18F.
В одном варианте реализации данного изобретения предложены промежуточные соединения
5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоновой кислоты,
5-[(1R,2S)-1-(4-этилфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоновой кислоты,
4-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензойной кислоты,
5-[(1R,2S)-1-(4-бромфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоновой кислоты,
4-[(1R,2S)-1-(4-бромфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензойной кислоты.
В одном варианте реализации данного изобретения предложены промежуточные соединения
N-[(3S)-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамида,
N-[(3R)-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамида,
5-[(1R,2S)-1-(4-этилфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]-N-[(3S)-3-пиперидил]пиридин-2-карбоксамида,
5-[(1R,2S)-1-(4-циклопропилфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]-N-[(3S)-3-пиперидил]пиридин-2-карбоксамида,
5-[(1R,2S)-1-(4-циклопропилфенил)-2-[[(2R)-тетрагидрофуран-2-карбонил]амино]пропокси]-N-[(3S)-3-пиперидил]пиридин-2-карбоксамида,
N-[(1S,2R)-2-(4-циклопропилфенил)-1-метил-2-[[6-[[(3S)-3-пиперидил]карбамоил]-3-пиридил]окси]этил]изоксазол-3-карбоксамида,
5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]-N-[(3R)пирролидин-3-ил]пиридин-2-карбоксамида,
5-[(1R,2S)-1-(4-бромфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]-N-[(3S)-3-пиперидил]пиридин-2-карбоксамида,
N-[(3S)-3-пиперидил]-4-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензамида,
[(3S)-3-пиперидил] 4-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензоата.
В одном варианте реализации данного изобретения предложены промежуточные соединения трет-бутил-(3S)-3-[[5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилата,
трет-бутил-(3S)-3-[[5-[(1R,2S)-1-(4-бромфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилата,
трет-бутил-(3S)-3-[[5-[(1R,2S)-1-(4-циклопропилфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилата,
трет-бутил-(3S)-3-[[5-[(1R,2S)-1-(4-циклопропилфенил)-2-[[(2R)-тетрагидрофуран-2-карбонил]амино]пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилата,
трет-бутил-(3S)-3-[[5-[(1R,2S)-1-(4-циклопропилфенил)-2-(изоксазол-3-карбониламино)пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилата,
трет-бутил-(3S)-3-[4-[(1R,2S)-1-(4-бромфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензоил]оксипиперидин-1-карбоксилата,
трет-бутил-(3S)-3-[4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензоил]оксипиперидин-1-карбоксилата,
трет-бутил-(3R)-3-[[5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбонил]амино]пирролидин-1-карбоксилата,
трет-бутил-(3S)-3-[[4-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензоил]амино]пиперидин-1-карбоксилата и
трет-бутил-(3S)-3-[4-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензоил]оксипиперидин-1-карбоксилата, и
трет-бутил-(3S)-3-[[5-[(1S,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилата
В одном и более вариантах реализации данного изобретения соединения формулы (I), в соответствии с определением в данном документе, пригодны в терапии и особенно пригодны для лечения атопического дерматита, псориаза или экземы.
Соединения по данному изобретению, необязательно в комбинации с другими активными соединениями, были бы пригодны для лечения воспалительных, аллергических или пролиферативных дерматологических заболеваний или патологических состояний, в частности для лечения атопического дерматита, псориаза или экземы.
В одном варианте реализации данного изобретения предложено соединение общей формулы (I) для применения при лечении заболевания, расстройства или патологического состояния, при котором заболевание, расстройство или патологическое состояние реагирует на модуляцию глюкокортикоидного рецептора.
В одном варианте реализации данного изобретения предложено соединение формулы (I) в производстве лекарственного средства для профилактики, лечения или уменьшения симптомов воспалительных, аллергических или пролиферативных дерматологических заболеваний или патологических состояний.
В одном варианте реализации данного изобретения предложено соединение общей формулы (I) при изготовлении лекарственного средства для профилактики, лечения или улучшения атопического дерматита, псориаза или экземы.
В одном варианте реализации данного изобретения предложен способ профилактики, лечения или облегчения воспалительных, аллергических или пролиферативных дерматологических заболеваний или патологических состояний, включающий введение человеку, страдающему по меньшей мере одним из указанных заболеваний или расстройств эффективного количества одного или большего количества соединений общей формулы (I ), необязательно вместе с фармацевтически приемлемым носителем или одним или большим количеством эксципиентов, необязательно в сочетании с другими терапевтически активными соединениями.
В одном варианте реализации данного изобретения предложен способ профилактики, лечения или облегчения воспалительного, аллергического или пролиферативного атопического дерматита, псориаза или экземы, включающий введение человеку, страдающему по меньшей мере одним из указанных заболеваний или расстройств, эффективного количества одного или большего количества соединений общей формулы(I).
Кроме того, что они пригодны для лечения человека, соединения по данному изобретению также могут быть пригодны для ветеринарного лечения животных, включая млекопитающих, таких как лошади, крупный рогатый скот, овец, свиней, собак и кошек.
Фармацевтические композиции по данному изобретению
Для использования в терапии соединения по данному изобретению обычно находятся в форме фармацевтической композиции. Следовательно, изобретение относится к фармацевтической композиции, содержащей соединение формулы I, необязательно вместе с одним или большим количеством другого терапевтически активного соединения (соединений) вместе с фармацевтически приемлемым эксципиентом, несущей средой или носителем(ями). Эксципиент должен быть «приемлемым» в смысле совместимости с другими компонентами композиции и не вреден для его реципиента.
Традиционно принято, что активный компонент содержит от 0,0001 до 99,9% мас. препарата.
В форме единицы дозирования соединение может вводиться один или несколько раз в день с соответствующими интервалами, всегда зависящее, однако, от состояния пациента и в соответствии с предписанием, сделанным врачом. Традиционно принято, что единицы дозирования композиции содержит от 0,001 до 1000 мг, предпочтительно от 0,01 до 100 мг, например, 0,1-50 мг соединения формулы I.
Подходящая доза соединения по данному изобретению будет зависеть, в частности, от возраста и состояния пациента, от тяжести заболевания, подлежащего лечению, и от других факторов, хорошо известных практикующему врачу. Соединение могут вводить перорально, парентерально, местно, трансдермально или интрадермально+другими путями в соответствии с различными режимами дозирования, например, ежедневно, еженедельно или ежемесячно. В общем разовая доза будет находиться в диапазоне от 0,001 до 400 мг/кг массы тела. Соединение можно вводить в виде болюса (то есть весь ежедневный прием вводится сразу) или в разделенных дозах два или более раз в день
.
В контексте местного лечения может быть более целесообразным назвать «единицу применения», которая обозначает единичную дозу, которая может быть введена пациенту и которая может быть легко обработана и упакована, оставаясь физически и химически стабильной единичной дозой, содержащей либо активный материал как таковой, либо его смесь с твердыми, полутвердовыми или жидкими фармацевтическими разбавителями или носителями.
Термин «единица применения» в связи с местным применением означает унитарную, то есть единичную дозу, способную вводить местно пациенту в виде применения на квадратный сантиметр обрабатываемой области от 0,001 микрограмма до 1 мг и предпочтительно от 0,05 мкг до 0,5 мг активного компонента.
Также предусматривается, что в некоторых режимах лечения может быть пригодно введение с более длинными интервалами, например, каждый день, каждую неделю или даже с более длинными интервалами.
Если лечение включает введение другого терапевтически активного соединения, рекомендуется проконсультироваться Goodman & Gilman's The Pharmacological Basis of Therapeutics, 12th Ed., J.G. Hardman и L.E. Limbird (Eds.), McGraw-Hill 2011, для установления пригодных доз указанных соединений.
Введение соединения по данному изобретению с одним или большим количеством других активных соединений может быть либо одновременным, либо последовательным.
Препараты включают, например, препараты в форме, пригодной для перорального (включая устойчивое или контролируемое высвобождение), ректального, парентерального (включая подкожное, внутрибрюшинное, внутримышечное, внутрисуставное и внутривенное), трансдермального, интрадермального, офтальмологического, местного, назального, сублингвального или буккального введения
.
Препараты могут быть удобным образом представлены в единичной дозированной форме и могут быть приготовлены, но не ограничены каким-либо из методов, хорошо известных в фармации, например. как описано в Remington, The Science и Practice of Pharmacy, 21ed ed., 2005. Все способы включают этап присоединения активного компонента к носителю, который составляет один или большее количество вспомогательных компонентов. Как правило, препараты получают путем равномерного и тщательного введения активного компонента в ассоциацию с жидким носителем, полутвердым носителем или тонко измельченным твердым носителем или их комбинациями, а затем, при необходимости, формованием продукта в желаемый препарат.
Препараты по данному изобретению, пригодные для перорального и буккального введения, могут находиться в виде дискретных единиц в виде капсул, саше, таблеток, жевательной резинки или пастилок, каждая из которых содержит предварительно определенное количество активного компонента; в виде порошка, гранул или пеллет; в форме раствора или суспензии в жидкости на водной основе или жидкости на неводной основе, такой как этанол или глицерин; или в виде геля, нано- или микроэмульсии, эмульсии «масло в воде», эмульсии типа «вода в масле» или других дозирующих систем.Масла могут быть пищевыми маслами, такими как, но не ограничиваясь ими, например, хлопковое масло, кунжутное масло, кокосовое масло или арахисовое масло. Подходящие диспергирующие или суспендирующие агенты для водных суспензий включают синтетические или природные поверхностно-активные вещества и вяжущие агенты, такие как, но не ограниченные трагакантом, альгинатом, арахией, декстраном, натрийкарбоксиметилцеллюлозой, желатином, метилцеллюлозой, гидроксипропилметилцеллюлозой, гидроксипропилцеллюлозой, карбомерами, поливинилпирролидоном, полисорбатами, сложными эфирами сорбитановой жирной кислоты. Активные компоненты также можно вводить в виде болюса, электуария или пасты.
Таблетку можно изготавливать путем прессования, формования или лиофильной сушки активного компонента, необязательно с одним или большим количеством вспомогательных компонентов. Прессованные таблетки могут быть приготовлены путем прессования в подходящей машине активного компонента (компонентов) в свободной текучей форме, такой как порошок или гранулы, необязательно смешанные со связующим и/или наполнителем, таким как, например, лактоза, глюкоза, манитный крахмал желатин, камедь акации, трагакантовая камедь, альгинат натрия, фосфаты кальция, микрокристаллическая целлюлоза, карбоксиметилцеллюлоза, метилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, этилцеллюлоза, гидроксиэтилцеллюлоза, полиэтиленгликоль, воски или тому подобное; смазочным материалом, таким как, например, олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия или тому подобное; дезинтегрирующим агентом, таким как, например, крахмал, метилцеллюлоза, агар, бентонит, кроскармеллоза натрия, крахмала гликолят натрия, кросповидон или тому подобное или диспергирующим агентом, таким как полисорбат 80.Формованные таблетки могут быть изготовлены путем формования в подходящей машине смеси порошкообразного активного компонента и подходящего носителя, смоченного инертным жидким разбавителем. Лиофилизированные таблетки могут быть образованы в лиофилизаторе из раствора лекарственного вещества. Может быть включен подходящий наполнитель.
Препараты для ректального введения могут находиться в форме суппозиториев, в которых соединение по данному изобретению смешивают с твердыми веществами с низкой температурой плавления, водорастворимыми или нерастворимыми твердыми веществами, такими как масло какао, гидрогенизированные растительные масла, сложные эфиры полиэтиленгликоля или сложные эфиры жирных кислот и полиэтиленгликолей, в то время как эликсиры могут быть получены с использованием миристилпальмитата.
Препараты, пригодные для парентерального введения, традиционно включают стерильный масляный или водный препарат активных компонентов, который предпочтительно является изотоничным крови реципиента, например, изотоническим солевым раствором, изотоническим раствором глюкозы или буферным раствором. Кроме того, препарат может содержать сорастворитель, солюбилизирующий агент и/или комплексообразователи. Препарат можно удобно стерилизовать, например, фильтрованием через задерживающий бактерии фильтр, добавлением стерилизатора к препарату, облучением препарата или нагреванием композиции. Липосомные композиции, как описано, например,. Encyclopedia of Pharmaceutical Technology, vol,9, 1994, также пригодны для парентерального введения.
В альтернативном варианте, соединения формулы I могут быть представлены в виде стерильного твердого препарата, например. лиофилизированного порошка, который легко растворяется в стерильном растворителе непосредственно перед использованием.
Трансдермальные препараты могут находиться в виде гипсовых, пластырных, микроигольных, липосомальных или наноразмерных систем доставки или других кожных препаратов, применяемых к коже
Препараты, подходящие для офтальмологического введения, могут находиться в форме стерильного препарата активных компонентов на водной основе, который может находиться в микрокристаллической форме, например, в виде микрокристаллической суспензии на водной основе. Липосомальные препараты или биоразлагаемые полимерные системы, например. как описано в Encyclopedia of Pharmaceutical Technology, vol,2, 1989, также могут применяться для введения активного компонента для офтальмологического введения.
Композиции, подходящие для местного применения, такие как дермальное, внутрикожное или офтальмологическое введение, включают жидкие или полутвердые препараты, такие как линименты, лосьоны, гели, аппликации, спреи, пены, формирующие пленку системы, микроиголки, микро- или наноэмульсии, эмульсии ''масло в водн'' или ''вода в масле'', такие как кремы, мази или пасты; или растворы или суспензии, такие как капли.
Для местного применения соединение формулы I может обычно присутствовать в количестве от 0,001 до 20% мас. композиции, например от 0,01% до 10%, например 0,5-5%, но также может присутствовать в количество до около 100% композиции.
Препараты, подходящие для назального или буккального введения, включают порошкообразные, самораспыляющиеся и аэрозольные препараты, такие как аэрозоли и распылители. Такие композиции описаны более подробно, например,. Modern Pharmaceutics, 2nd ed., G.S. Banker и C.T. Rhodes (Eds.), page 427-432, Marcel Dekker, New York; Modern Pharmaceutics, 3th ed., G.S. Banker и C.T. Rhodes (Eds.), page 618-619 и 718-721, Marcel Dekker, New York и Encyclopedia of Pharmaceutical Technology, vol. 10, J. Swarbrick и J.C. Boylan (Eds), page 191-221, Marcel Dekker, New York.
В дополнение к вышеупомянутым компонентам препаратов соединения формулы I могут включать один или большее количество дополнительных компонентов, таких как разбавители, буферы, ароматизаторы, красители, поверхностно-активные агенты, загустители, агенты, усиливающие проникновение, растворимость, консерванты для консервирующих агентов, например, метилгидроксибензоат (в том числе антиоксиданты), эмульгаторы и тому подобное.
Когда активный компонент вводят в форме солей с фармацевтически приемлемыми нетоксичными кислотами или основаниями, предпочтительные соли, например, легко водорастворимы или слабо растворяются в воде, чтобы получить конкретную и соответствующую скорость поглощения.
Медицинское применение
Из-за их способности связываться с глюкокортикоидным рецептором, соединения по данному изобретению пригодны в качестве противовоспалительных агентов, а также могут проявлять антиаллергические, иммунодепрессивные и антипролиферативные действия. Таким образом, соединение формулы (I) можно применять в качестве лекарственного средства для лечения или профилактики одного или большего количества следующих патологических состояний (болезненных состояний) у млекопитающих:
Дерматологические заболевания, которые совмещаются с воспалительными, аллергическими и/или пролиферативными процессами: Атопический дерматит, псориаз, экзема, такая как, например, атопическая экзема, себорейная экзема, острая экзема или ксерозная экзема, эксфолиативный дерматит, эритематозные заболевания, вызванные различными видами того, что пагубно для здоровья, например, радиация или химические вещества, ожоги, ожоги кислотой, пустые дерматозы, такие как, например, аутоиммунный пемфигус вульгарный или буллезный пемфигоид, заболевания лихеноидной группы, розацеа, экссудативная многоформная эритема, нодозная эритема, баланит, зуд, например, аллергического происхождения, проявление сосудистых заболеваний, вульвиты, алопеция, такие как гнездная алопеция, генерализованная алопеция или универсальная алопеция, дискоидная волчанка, кожная Т-клеточная лимфома, сыпь любого происхождения или дерматозы, красный волосистый питириаз.
Болезни легких, которые совмещаются с воспалительными, аллергическими и/или пролиферативными процессами: Хронические обструктивные заболевания легких любого типа, в основном бронхиальная астма, хроническая обструктивная болезнь легких, бронхит разного происхождения, респираторный дистресс-синдром взрослых (ОРДС), синдром острого респираторного дистресс-синдрома, бронхиопатия, все формы рестриктивных заболеваний легких, главным образом аллергический альвеолит, все формы отека легких, главным образом токсический отек легких, саркоидозы и гранулематозы, такие как болезнь Бока.
Глазные болезни, которые совмещаются с воспалительными, аллергическими и/или пролиферативными процессами: аллергический ринит, а также хронические формы кератита, такие как аденовирус и кератит Тайгесона, крапивный кератоконъюнктивит, пингвикулит, эписклерит, увеит, ирит, конъюнктивит, блефарит, неврит зрительного нерва, хориоидит, симпатическая офтальмия.
Заболевания области ушной раковины и горла, которые совмещаются с воспалительными, аллергическими и/или пролиферативными процессами: аллергический ринит, сенная лихорадка, вторичный отит, средний отит.
Аллергии, которые совпадают с воспалительными, аллергическими и/или пролиферативными процессами: Все формы аллергических реакций, например, отек Квинке, укусы насекомых, контактный дерматит, такой как аллергический и раздражительный, крапивница.
СПОСОБЫ ПОЛУЧЕНИЯ
Соединения по данному изобретению могут быть получены несколькими способами, хорошо известными специалистам в области синтеза. Соединения формулы I могут быть, например, получены с использованием реакций и методов, описанных ниже, вместе со способами, известными в области синтетической органической химии, или их вариациями, как это было понятно специалистам в данной области техники. Предпочтительные способы включают, но не ограничиваются ими, описанные ниже. Реакции проводят в растворителях, соответствующих реагентам и используемым материалам, подходящим для превращений. Кроме того, в методах синтеза, описанных ниже, следует понимать, что все предлагаемые условия реакции, включая выбор растворителя, реакционной атмосферы, температуры реакции, продолжительности эксперимента и методов обработки, выбираются как стандартные условия для данной реакции, которые будут легко поняты специалистом в данной области техники. Не все соединения, попадающие в данный класс, могут быть совместимы с некоторыми условиями реакции, требуемыми в некоторых описанных методах. Такие ограничения для заместителей, которые совместимы с условиями реакции, будут очевидны для специалиста в данной области техники, и могут быть использованы альтернативные способы. Соединения по данному изобретению или любое промежуточное соединение могут быть очищены, если требуется, с использованием стандартных методов, хорошо известных химику-синтетику в области органической химии, например, методы, описанные в ʺPurification of Laboratory Chemicalsʺ, 6th ed. 2009, W. Amarego и C. Chai, Butterworth-Heinemann. Исходные материалы являются либо известными, либо коммерчески доступными, либо могут быть получены традиционно принятыми синтетическими методами, хорошо известными специалисту в данной области техники.
Синтетические подходы
Следующие схемы иллюстрируют получение соединений формулы (I), в которых X1, X2, R1, R2, R3, R4, Y, L, m и n находятся в соответствии с описаниями выше:

Схема 1
Когда L представляет собой связь, то:
Кислоты, подходящие для использования в качестве соединения (III), являются коммерчески доступными, известны в литературе или могут быть получены, как указано на Схеме 5,1
Стадия (a):Кислоту (III) вводят в реакцию с амином (II) для получения соединения формулы (I). Данную реакцию проводят стандартными методами. Конденсация может быть выполнена с использованием как
(i) Производного хлорангидрида кислоты (III)+амина (II) с избытком основания в подходящем растворителе, так и
(ii) Кислоты (III) с традиционно принятым конденсирующим агентом+амином (II), необязательно в присутствии катализатора, с избытком основания в подходящем растворителе.
Типовые условия следующие:
(i) хлорангидрид кислоты (III) (полученный in situ), избыток амина (II), необязательно с избытком 3° амина, такого как Et3N, основание Хюнига или NMM, в ДХМ или ТГФ, без нагревания в течение от 1 до 24 ч,
или
(ii) кислота (III), WSCDI /DCC и HOBT /HOAT, избыток амина (II) с избытком NMM, Et3N, основание Хюнига в ТГФ, ДХМ или EtOAc, при комнатной температуре в течение от 4 до 48 ч; или, кислота (III), PYBOP®/PyBrOP®/реагент Мукаямы, избыток амина (II), с избытком NMM, Et3N, основание Хюнига в ТГФ, ДХМ или EtOAc, при комнатной температуре в течение от 4 до 24 ч.
Предпочтительные условия: 1,5 экв. хлорангидрида кислоты (III) (полученного in situ), 1 экв. амина (II), в ДХМ при комнатной температуре в течение 16 часов, или 1,5 карбоновой кислоты (III), 1 экв. HOBt, 1 экв. WSCDI, 1 экв. амина (II) в дихлорметане при комнатной температуре в течение 18 часов.
Когда L представляет собой NH, N(Rc) или O, тогда:
Соединение (I) может быть получено, как проиллюстрировано на Схеме 1.1

Схема 1.1
Амины и спирты, подходящие для использования в качестве Соединения (IV), являются коммерчески доступными или известны в литературе.
LG представляет собой уходящую группу, обычно хлор, соединения, подходящие для использования в качестве соединения (V), известны в литературе или являются коммерчески доступными.
Стадия (b):Амин или спирт (IV) превращают in situ в реакционноспособный промежуточный продукт (IV'), если LG представляет собой хлор, тогда (IV') представляет собой изоцианат, карбамоилхлорид или карбонохлоримидат. Типовые условия представляют собой,
(i) Амин или спирт (IV) в подходящем апротонном растворителе с фосгеном, трифосгеном, дифосгеном или CDI в присутствии третичного основания, без нагревания в течение от 1 до 24 часов.
Предпочтительные условия: Амин или спирт (IV) в ДХМ с трифосгеном (0,4 экв.) с основанием Хюнига (2 экв.) без нагревания в течение 2 часов.
Стадия (c): Реакционноспосо бный промежуточный продукт (IV ') вводят в реакцию с амином (II). Типовые условия представляют собой,
(i) Реакционноспособное промежуточное соединение (IV ') в подходящем апротонном растворителе с амином (II) в присутствии третичного основания, такого как NMM, основание Хюнига, триэтиламин без нагревания в течение от 1 до 24 часов.
Предпочтительные условия: Реакционноспособный промежуточный продукт (IV') (2 экв.) с амином (II) с триэтиламином (3 экв.) в ДМФА при комнатной температуре в течение 1 часа.
В альтернативном варианте, когда L представляет собой NH, N(Rc) или O, тогда:
Соединение (I) может быть получено, как проиллюстрировано на Схеме 1,2

Схема 1.2
Амины и спирты, подходящие для использования в качестве Соединения (IV), являются коммерчески доступными или известны в литературе.
LG представляет собой уходящую группу, например хлор, соединения, подходящие для использования в качестве соединения (V), известны в литературе или являются коммерчески доступными или могут быть получены, как проиллюстрировано на Схеме 6.1.
Стадия (b):Амин (II) превращают in situ в реакционноспособный промежуточный продукт (II '), если LG представляет собой хлор, тогда (IV') представляет собой карбамоилхлорид.
Типовые условия представляют собой,
(ii) Амин (II) в подходящем апротонном растворителе с фосгеном, трифосгеном, дифосгеном или CDI в присутствии третичного основания без нагревания в течение от 1 до 24 часов.
Предпочтительные условия: Амин (II) в ДХМ с трифосгеном (0,4 экв.) с основанием Хюнига (2 экв.) без нагревания в течение 2 часов.
Стадия (c): Реакционноспособный промежуточный продукт (II ') вводят в реакцию с амином или спиртом (IV). Типовые условия представляют собой,
(ii) Реакционноспособное промежуточное соединение (II ') в подходящем апротонном растворителе с амином или спиртом (II) в присутствии третичного основания, такого как NMM, основание Хюнига, триэтиламин или сильное основание, такое как гидрид натрия при нагревании в течение от 1 до 24 часов.
Предпочтительные условия: Реакционноспособный промежуточный продукт (II ') с амином или спиртом (IV) (2 экв.) с триэтиламином (3 экв.) в ДМФА при 50°C в течение 5 часов.
Соединения, подходящие для использования в качестве соединений (II), могут быть получены, как проиллюстрировано на Схеме 2.1 и 2.2.

Схема 2.1
PROT* представляет собой подходящую защитную группу для азота. Используется стандартная методология для азот-защитных групп, например, как та, которая может быть найдена в учебных пособиях, (например, ʺProtecting Groups in Organic Synthesisʺ T.W. Greene и P. Wutz).
Соединения, подходящие для использования в качестве соединения (VII), являются коммерчески доступными или известны в литературе.
Стадия (d*): Снятие защиты соединения (V) осуществляется с использованием стандартной методологии, как описано в ʺProtecting Groups in Organic Synthesisʺ T.W. Greene и P. Wutz".
Когда PROT* представляет собой Boc, то предпочтительный метод представляет собой хлористый водород в подходящем растворителе, таком как 1,4-диоксан, при комнатной температуре в течение 1-16 часов или раствор трифторуксусной кислоты в дихлорметане в течение 1-2 часов.
Когда PROT* представляет собой CBz, то предпочтительный метод представляет собой гидролиз с использованием подходящего палладиевого катализатора в растворителе, таком как этанол.
Когда PROT* представляет собой аллилкарбамат, предпочтительные условия представляют собой использование тиобензойной кислоты и подходящего палладиевого катализатора, такого как Pd2(dba)3, с подходящей фосфиновой добавкой, такой как 1,4-бис(дифенилфосфино)бутан в тетрагидрофуране в течение 20 минут.
Стадия (a):Кислоту (VI) вводят в реакцию с амином или спиртом (VII) с получением соединения формулы (V). Данную реакцию проводят стандартными методами. Конденсация может быть выполнено с использованием как
(i) Хлорангидридного производного кислоты (VI)+амина или спирта (VII) с избытком основания в подходящем растворителе, так и
(ii) Кислоты (VI) с обычным конденсирующим агентом+амином или спиртом (VII), необязательно в присутствии катализатора, с избытком основания в подходящем растворителе.
Типовые условия представляют собой следующие:
(ii) хлорангидрид кислоты (VI) (полученный in situ), избыток амина или спирта (VII), необязательно с избытком 3° амина, такого как Et3N, основание Хюнига или NMM, в ДХМ или ТГФ, без нагревания в течение от 1 до 24 часов,
или когда Y представляет собой NH,
(iii) кислота (VI), WSCDI /DCC и HOBT /HOAT, избыток амина (VII), с избытком NMM, Et3N, основания Хюнига в ТГФ, ДХМ, ДМФА или EtOAc, при комнатной температуре в течение от 4 до 48 ч; или, кислота (VI), PYBOP®/PyBrOP®/реагент Мукаямы, избыток амина (VII), с избытком NMM, Et3N, основания Хюнига в ТГФ, ДХМ, ДМФА или EtOAc, при комнатной температуре в течение от 4 до 24 ч.
или когда Y представляет собой O
(iv) кислота (VI), EDC избыток спирта (VII) в ДХМ, ТГФ или ДМФА с DMAP при комнатной температуре в течение от 1 до 24 ч.
Предпочтительные условия: 1,5 экв. хлорангидрида кислоты (VI) (полученный in situ), 1 экв. амина или спирта (VII), в ДХМ при комнатной температуре в течение 16 часов, или 1 экв. карбоновой кислоты (VI), 1 экв. HOBt, 1 экв.WSCDI, 1,5 экв. амина (VII) в ДМФА при комнатной температуре в течение 18 часов или
или 1,2 экв. карбоновой кислоты (VI), EDC, 1 экв. спирта (VII) с DMAP (2,5 экв.) в ДМФА при комнатной температуре в течение 18 часов.

Схема 2.2
PROT и PROT* представляют собой подходящие ортогональные защитные группы для азота, защита с которых по определению может быть снята независимо друг от друга. Используется стандартная методология для защитных групп азота, например, найденная в учебниках, (например, ʺProtecting Groups in Organic Synthesisʺ T.W. Greene и P. Wutz).
Соединения, подходящие для использования в качестве соединения (X), являются коммерчески доступными или известны в литературе.
Соединения (V') могут быть получены аналогично Соединению (V), как проиллюстрировано на Схеме 2.1
Обычно, PROT представляет собой ТФК, FMOC и PROT* представляет собой BOC, CBz. но специалисты в данной области техники поймут, что PROT может представлять собой BOC, CBz и PROT* TFA, FMOC.
Когда PROT представляет собой ТФК и PROT* представляет собой BOC
Стадия (d): Соединение (IX) в протонном растворителе, таком как этанол, метанол или смешивающиеся с водой растворители, такие как диоксан, ТГФ, ДМФА, ДМСО с гидроксидом натрия, гидроксидом лития или гидроксидом калия.
Предпочтительно,
Соединение (IX) в диоксане с 1,2 экв. гидроксида лития при комнатной температуре в течение 20 ч.
Соединения (VI) могут быть получены как проиллюстрировано на Схеме 3.1
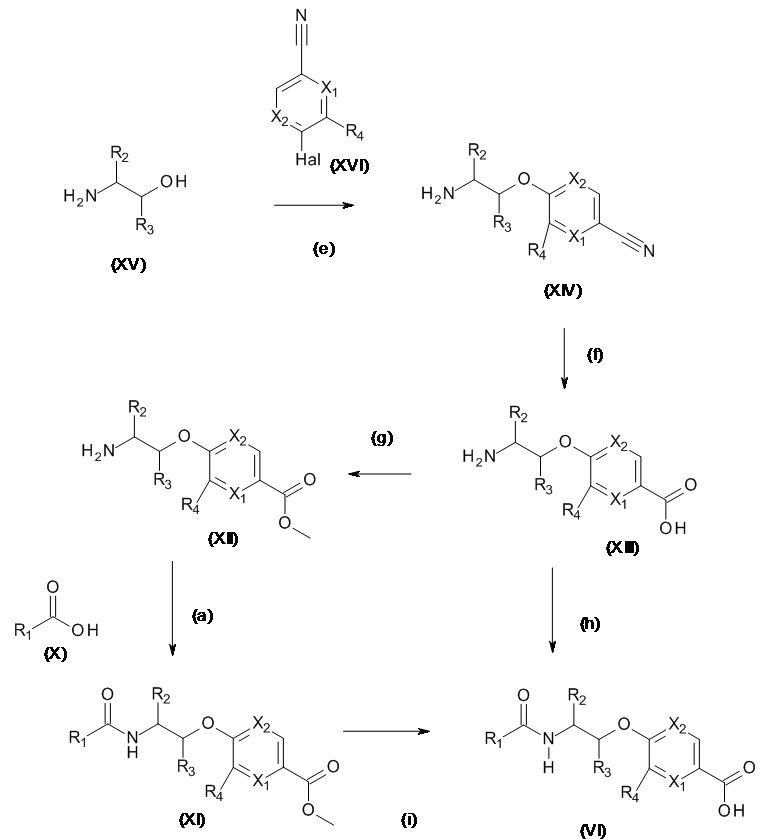
Схема 3.1
Нитрилы, подходящие для использования в качестве соединений (XVI), являются коммерчески доступными, известными в литературе или могут быть получены из коммерчески доступных промежуточных продуктов, используя способы, описанные, среди прочих, Kondolff, Tetrahedron 60(17), 3813 (2004), Mormino et al., Organic letters, 16(6), 1744-47, 2014, Maillard PCT 2004024081 и Tet. Letters 2002, 43, 6987-6990.
Стадия (e): Аминоспирт (XV) с сильным основанием, подобным гидриду металла или гексаметилдисилазиду металла в подходящем апротонном растворителе с нитрилом (XVI), при от 0°C до 70°C в течение от 1 до 6 ч.
Когда X1 представляет собой N
Предпочтительно, аминоспирт (XV) с 1,5 экв. NaH в ТГФ при 50°C в течение 1 ч, охладили до 0°C и прибавили 1,2 экв. нитрила (XVI), выдержали при 0°C в течение от 4 до 8 ч.
Когда X1 представляет собой CH, C(Rb)
Предпочтительно, аминоспирт (XV) с 1,5 экв. NaH в ТГФ при 50oC в течение 1 часа, добавляли 1,2 экв. нитрила (XVI), нагревали до 50°C в течение от 1 до 4 ч.
Стадия (f): Аминонитрил (XIV) в протонном растворителе, таком как этанол, метанол или смешивающиеся с водой растворители, такие как диоксан, ТГФ, ДМФА, ДМСО с гидроксидом натрия, гидроксидом лития или гидроксидом калия, при нагревании в течение от 1 часа до 48 ч.
Предпочтительно, когда X1 представляет собой N, тогда
Соединение (XIV) в этаноле и воде с 5 экв. гидроксида натрия нагревают при 85°C в течение 2 ч.
Когда X1 представляет собой CH, C(Rb),
тогда соединение (XIV) в этаноле и воде с 5 экв. гидроксида натрия нагревают при 85°C в течение от 16 до 48 ч.
Стадия (g): Аминокислота (XIII) в метаноле с сильно кислым катализатором при нагревании. Как правило, аминокислота (XIII) в безводном метаноле с 0,2 экв. 98% серной кислоты при 85°C в течение от 16 ч до 48 ч.
Стадия (h): Аминокислота (XIII) в подходящем растворителе, таком как диэтиловый эфир, ТГФ, диоксан, ацетонитрил, ДХМ с избытком хлорангидрида кислоты или ангидридом кислоты (X), необязательно в присутствии 3o основания, такого как триэтиламин, NMM, пиридин или водного неорганического основания, необязательно при нагревании в течение от 1 до 6 ч.
Обычно,
аминокислота (XIII) в ДХМ с избытком хлорангидрида кислоты (X) в присутствии избытка водного гидроксида натрия в течение от 1 до 6 ч.
Или если R1 представляет собой CF3,
аминокислота (XIII) в ацетонитриле пиридине с избытком TFAA в присутствии избытка пиридина при 0°C в течение от 1 до 4 ч.
Стадия (i): Аминоэфир (XI) в протонном растворителе, таком как этанол, метанол или смешивающиеся с водой растворители, такие как диоксан, ТГФ, ДМФА, ДМСО с гидроксидом натрия, гидроксидом лития или гидроксидом калия, необязательно при нагревании в течение от 1 ч до 48 ч.
Когда X1 представляет собой N и R1 представляет собой CF3
Обычно, аминоэфир (XI) в метаноле с 1,5 экв. гидроксида натрия при комнатной температуре в течение 6 ч,
Когда X1 представляет собой CH, C(Rb) и R1 не представляет собой CF3
Обычно,
аминоэфир (XI) в метаноле с 1,5 экв. гидроксида натрия при нагревании до 60°C в течение 2ч.
Аминоспирты, подходящие для использования в качестве соединения (XV), являются коммерчески доступными или известны в литературе или могут быть получены с использованием способов, описанных на Схеме 4.1, и конкретно в Схемах 7.1 и 7.2.

Схема 4.1
Соединения, подходящие для использования в качестве амида (XIX), известны в литературе или имеются в продаже.
Met представляет собой металл, обычно Li, Mg, Zn
X представляет собой галоген, обычно хлор, бром или иод.
Стадия (k):Амид (XIX) в подходящем апротонном растворителе, таком как ТГФ, диэтиловый эфир, диоксан с металлоорганическим соединением (XX) при низкой температуре в течение от 1 часа до 24 ч.
Обычно, амид (XIX) с 2,5 экв. реактива Гриньяра (XX) (Met представляет собой Mg) в ТГФ при от 0°C до комнатной температуры в течение от 6 ч до 18 ч.
Стадия (m):Кетон (XVIII) в подходящем растворителе с восстановителем. Обычно,
(i) Кетон (XVIII) в водном спирте, метаноле, этаноле или ИПС с борогидридом натрия/лития/калия при комнатной температуре в течение от 1 до 4 ч.
(ii) Кетон (XVIII) в толуоле и ИПС с каталитическим количеством изопропоксида алюминия при нагревании в течение от 6 до 24 ч.
(iii) Кетон (XVIII) в апротонном растворителе, таком как ТГФ, диэтиловый эфир или диоксан при низкой температуре с DIBAL.
Предпочтительно, Кетон (XVIII) в толуоле и ИПС с 0,5 экв. изопропоксида алюминия при 60°C в течение 8 ч.

Схема 5.1
Соединения (XXI) известны в литературе.
Стадия (n):Алкин (XXI) в подходящем растворителе в условиях окислительного расщепления. Как правило, алкен (XXI) в ацетонитриле, четыреххлористом углероде и воде с 5% хлорида рутения (III) и избытком периодата натрия.

Соединения, пригодные для использования в виде бороновой кислоты (или сложного эфира) (XXII), являются коммерчески доступными или известными в литературе.
Hal представляет собой галогенид, иод, бром или хлор.
Стадия (p):Галогенид (V') в подходящем растворителе с бороновой кислотой (или сложным эфиром) (XXII) в присутствии палладиевого катализатора и фосфинового лиганда в присутствии основания при нагревании в течение от 1 до 48 часов.
Как правило, Галогенид (V') с 0,05 экв. ацетата палладия (II), 0,15 экв. трициклогексилфосфина, 3 экв. ацетата калия, 1,5 экв. бороновой кислоты (XXII) в толуоле/воде нагревали в инертной атмосфере (азот или аргон) до 100°C в течение 6 часов.
Специалистам в данной области техники будет понятно, что при необходимости порядок, в котором выполняются стадии, может быть изменен, но может потребовать дополнительных стадий защиты/снятия защиты для чувствительной функциональной группы. Используется стандартная методология для защиты групп, например, та, которая может быть найдена в учебных пособиях (например, ʺProtecting Groups in Organic Synthesisʺ T.W. Greene и P. Wutz, John Wiley & Sons Inc.).
ОБЩИЕ МЕТОДИКИ, СПОСОБЫ ПОЛУЧЕНИЯ, И ПРИМЕРЫ
Следующие аббревиатуры были использованы повсеместно в данном документе:
Et3N Триэтиламин
основание Хюнига Диизопропилэтиламин
NMM N-Метилморфолин
ДХМ Дихлорметан
ТГФ Тетрагидрофуран
EDAC/WSCDI N-(3-Диметиламинопропил) -N'-этилкарбодиимид гидрохлорид
DCC N, N'-Дициклогексилкарбодиимид
HOBt 1-Гидроксибензотриазол
HOAt 1-Гидрокси-7-азабензотриазол
EtOAc Этилацетат
PyBOP®(Бензотриазол-1-илокси) трипирролидинофосфоний гексафторфосфат
PyBrOP®Бромтрипирролидинофосфоний гексафторфосфат
реагент Мукаямы 1-метил-2-хлорпиридиний иодид
CDI Карбонилдиимидазол
ДМФА Диметилформамид
1H спектры ядерного магнитного резонанса (ЯМР) регистрировались при 300 МГц, если не указано иное. Значения химических сдвигов (δ, в м.д.) цитируются относительно внутреннего стандарта тетраметилсилана (δ=0,00). Значения мультиплета, либо определенного дублета (d), триплета (t), квартета (q)) или нет (m) в приблизительной средней точке, если не указан диапазон. (br) обозначает уширенный пик, тогда как (s) обозначает синглет. Все спектры ЯМР записываются в ДМСО-d6 если не указан иной растворитель.
Используемые органические растворители обычно были безводными. Указанные соотношения растворителей относятся к v: v, если не указано иное.
СВЭЖХ-МС Метод 1.
Колонка: Waters Aquity UPLC HSS T3 1,8мкм, 2,1×50 мм.
Температура колонки: 60oC.
УФ: PDA 210-400 нм.
Объем введенной пробы: 2мкл.
Элюенты: A: 10 мM Ацетат аммония с 0,1% муравьиной кислотой.
B: 100% Ацетонитрил с 0,1% муравьиной кислотой.
Градиент: Время A% B% Поток
0,0 95 5 1,2
0,9 5 95 1,2
0,91 5 95 1,3
1,2 5 95 1,3
1,21 5 95 1,2
1,4 95 5 1,2
MС: Переключение электрораспыления между положительной и отрицательной ионизацией. Инструменты: Waters Aquity UPLC, Waters SQD
СВЭЖХ-МС Метод 2:
Колонка: Acquity UPLC HSS T3 1,8мкм ; 2,1×50мм
Поток: 0,7мл/мин
Температура колонки: 40°C
Подвижные фазы: A: 10 мM Ацетат аммония+0,1% муравьиная кислота
B: 100% Ацетонитрил+0,1% муравьиная кислота
УФ: 240-400 нм
Объем введенной пробы: 2мкл
Градиент: Время A% B%
0,0 99% A 1% B
0,5 94% A 6% B
1,0 94% A 6% B
2,6 5% A 95% B
3,8 5% A 95% B
3,81 99% A 1% B
4,8 99% A 1% B
СВЭЖХ (метод ввода): XE Metode 7 CM
МС - метод: PosNeg_50_1000
Инструменты: Waters Acquity UPLC, Waters LCT Premier XE
Порошковый рентгеноструктурный анализ (пРСА): Дифрактограмму получали на обычном дифрактометре X'pert PRO MPD от PANalytical, который сконфигурирован с геометрией пропускания и оснащен детектором PIXcel. Непрерывный 2θ диапазон сканирования 3-30° использовали с излучением CuKα λ=1,5418. Å источник и мощность генератора 40кВ и 45мА. Использовали размер шага 2θ 0,0070°/шаг с временем шага 148,92 с. Калибровку прибора выполняли с использованием кремниевого стандартного образца. Образец осторожно сплющивали на лунке в 96-луночном планшете для измерений пропускания. Лунки планшета перемещали вперед и назад в направлении х, и эксперимент проводили при комнатной температуре.
Дифференциальная сканирующая калориметрия (ДСК): Эксперимент ДСК проводили с использованием системы Perkin Elmer DSC8500. Около 1,7 мг образца использовали для измерения. Использованный для анализа алюминиевый резервуар был герметично закрыт, применяя ручное давление и толкая каждую часть резервуара вместе. Температура повышалась от -60 до 250°C при 20°C/мин. Азот использовали в качестве продувочного газа со скоростью потока 20 мл/мин.
Термогравиметрический анализ (ТГА): ТГА эксперимент проводили с использованием инстуремента Perkin Elmer Pyris 1 TGA. Около 1,4 мг образца загружали в керамический резервуар для измерения. Температуру образца изменяли от 25 до 500°C при 10°C/мин. Азот использовали в качестве продувочного газа со скоростью потока 40 мл/мин.
Данные монокристальной рентгеновской дифрактометрии
Данные собирали, используя SuperNova, Двойной дифрактометр с детектором поверхности CCD Atlas (Температура: 120(2) K; Cu Kα Излучение λ=1,5418 Å; метод сбора данных: ω сканы). Более подробную информацию можно найти в Таблице 3. Программа(ы), используемые для решения структуры: CrysAlisPro, Agilent Technologies, Version 1,171,37,34 (выпуск 22-05-2014 CrysAlis171.NET), ShelXL (Sheldrick, 2008) использовали для уточнения структуры и Olex2 (Dolomanov et al., 2009) для диаграмм ORTEP.
Указанные диапазоны погрешностей в данной заявке для спектроскопических характеристик, в том числе в формуле изобретения, могут более или менее зависеть от факторов, хорошо известных специалисту в области спектроскопии и могут, например, зависеть от образца из подготовительного синтеза, например, от распределения размера частиц или, если кристаллическая форма является составной частью препарата, то и от состава препарата, а также от инструментальных флуктуаций и других факторов.
СПОСОБЫ ПОЛУЧЕНИЯ

Схема 7.1
Подготовительный синтез 1: (S)-трет-Бутил-(1-метокси(метил)амино)-1-оксопропан-2-ил)карбамат
N-(3-диметиламинопропил)-N'-этилкарбодиимид гидрохлорид (455 г, 2378,4 ммоль), 1-гидроксибензотриазол (214,3 г, 1585,6 ммоль) и триэтиламин (571,9 мл, 3964 ммоль) прибавили к перемешиваемому раствору (2S)-2-(трет-бутоксикарбониламино)пропановой кислоты(300 г, 1585,6 ммоль) в дихлорметане (3 л) при 0 °C, с последующим прибавлением N, O- диметилгидроксиламин гидрохлорида (185,6 г, 1902,7 ммоль). Реакционную смесь оставили перемешиваться при комнатной температуре в течение 16 ч. По окончании, реакционную смесь концентрировали при пониженном давлении. Прибавили воду (1 л) к полученному сырому продукту и смесь перемешивали в течение 0,5 ч, отфильтровали и сушили для получения указанного в заголовке соединения в виде белого твердого вещества (290 г, 78,8%).
ТСХ система: 30% этилацетат в петролейном эфире, Rf: 0,2.
1H ЯМР (400МГц, CDCl3) δ=5,25 (ш. д, J=6,1 Гц, 1H), 4,68 (ш. с, 1H), 3,77 (с, 3H), 3,21 (с, 3H), 1,44 (с, 9H), 1,31 (дд, J=6,7 Гц, 3H).
Подготовительный синтез 2: (S)-трет-Бутил(1-оксо-1-(п-толил)пропан-2-ил)карбамат

4-Метилфенилмагнийбромид (3 экв., 646 ммоль) [свежеполученный из 4-бромтолуола (106 мл, 619,7 ммоль) с использованием магниевых стружек (22,3 г, 929 ммоль), иода (кат.) и 1,2-дибромэтана (0,5 мл) в тетрагидрофуране (1 л) при комнатной температуре] медленно прибавляли в течение 1 ч к перемешиваемому раствору амида из Подготовительного синтеза 1 (50 г, 215,5 ммоль) в тетрагидрофуране (1 л) при 0°C. После прибавления реакционную смесь оставили перемешиваться при комнатной температуре в течение 16 ч. По окончании реакционную смесь охладили до 5°C и погасили насыщенным водным раствором хлорида аммония (1 л) и экстрагировали этилацетатом (2x 1 л). Объединенные фазы этилацетата промывали водой (1 л), насыщенным водным раствором хлорида натрия (250 мл), сушили над сульфатом натрия и выпарили при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (100-200 меш), элюируя градиентом этилацетата (3-10%) в петролейном эфире для получения указанного в заголовке соединения в виде белого твердого вещества (31 г, 53%, белое твердое вещество).
ТСХ система: 10% этилацетат в петролейном эфире, Rf: 0,5.
1H ЯМР (300МГц, CDCl3) δ=7,87 (д, J=8,1 Гц, 2H), 7,29 (д, J=8,1 Гц, 2H), 5,58 (ш. д, J=6,3 Гц, 1H), 5,27 (тд, J=7,1, 14,3 Гц, 1H), 2,42 (с 3H), 1,46 (с, 9H), 1,39 (д, J=7,1 Гц, 3H).
Подготовительный синтез 3: трет-Бутил((1R, 2S)-1-гидрокси-1-(п-толил)пропан-2-ил)карбамат

Изопропоксид алюминия (32,9 г, 161,5 ммоль) и изопропанол (255 мл) прибавили к перемешиваемому раствору кетона из Подготовительного синтеза 2 (85 г, 323,2 ммоль) в толуоле (425 мл) при комнатной температуре. Реакционную смесь перемешивали при 60°C в течение 16 ч. По окончании, реакционную смесь охладили до 5°C и погасили водной 1N соляной кислотой (300 мл) и экстрагировали этилацетатом (2x 500 мл). Объединенные фазы этилацетата промывали водой (300 мл), насыщенным водным раствором хлорида натрия (200 мл), сушили над сульфатом натрия и выпарили при пониженном давлении. Полученный остаток растирали со 1 смесью (1:1) н-пентана и диэтилового эфира (2x 150 мл) и сушили для получения указанного в заголовке соединения в виде белого твердого вещества(80 г, 93,43%).
ТСХ система: 20% этилацетат в петролейном эфире, Rf: 0,4
1H ЯМР (300МГц, CDCl3) δ=7,25-7,20 (м, 2H), 7,19-7,11 (м, 2H), 4,82 (т, J=3,5 Гц, 1H), 4,60 (ш. с, 1H), 3,99 (ш. с, 1H), 3,10 (ш. с, 1H), 2,34 (с, 3H), 1,46 (с, 9H), 0,99 (д, J=7,0 Гц, 3H). Чистота ВЭЖХ: 97%
Подготовительный синтез 4: (1R, 2S)-2-амино-1-(п-толил)пропан-1-ол

1,1,1-Трифторуксусную кислоту (2 л, 18113 ммоль) медленно прибавили к перемешиваемому раствору карбамата из Подготовительного синтеза 3 (80 г, 301,8 ммоль) в дихлорметане (600 мл) и воде (600 мл) при 0°C, в течение 1,5 ч. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 4 ч. Фазу дихлорметана отделили и фазу водной 1,1,1-трифторуксусной кислоты концентрировали до меньшего объема при пониженном давлении. Полученный водный раствор затем охладили на ледяной бане перед подщелачиванием, 10% водным раствором гидроксида натрия и экстрагировали дихлорметаном (2x 1 л). Объединенные фазы дихлорметана промывали насыщенным водным раствором хлорида натрия (100 мл), сушили над сульфатом натрия и выпарили при пониженном давлении с получением указанного в заголовке соединения в виде белого твердого вещества (40 г, 80,3%).
ТСХ система: 10% метанол в дихлорметане, Rf: 0,1
1H ЯМР (400МГц, ДМСО-d6) δ=7,20-7,16 (м, 2H), 7,13-7,09 (м, 2H), 5,05 (ш. с, 1H), 4,26 (д, J=4,9 Гц, 1H), 2,94-2,74 (м, 1H), 2,28 (s, 3H), 1,23 (ш.с, 2H), 0,84 (д, J=6,7 Гц, 3H)

Схема 7.2
Подготовительный синтез 5: (S)-трет-Бутил-(1-(4-бромфенил)-1-оксопропан-2-ил)карбамат

Используя методику, аналогичную описанной для Подготовительного синтеза 2, но используя 4-бромфенилмагнийбромид, указанное в заголовке соединение получили в виде белого твердого вещества (30 г, 42,6%).
ТСХ система: 10% этилацетат в петролейном эфире, Rf: 0,5
1H ЯМР (400МГц, CDCl3) δ=7,84 (д, J=8,5 Гц, 2H), 7,64 (д, J=8,5 Гц, 2H), 5,48 (ш. д, J=6,7 Гц, 1H), 5,23 (ш. т, J=7,2 Гц, 1H), 1,45 (с, 9H), 1,38 (д, J=7,3 Гц, 3H).
Подготовительный синтез 6: трет-Бутил-((1R, 2S)-1-(4-бромфенил)-1-гидроксипропан-2-ил)карбамат

Используя методику, аналогичную описанной для Подготовительного синтеза 3, но используя соединение из Подготовительного синтеза 5, указанное в заголовке соединение получили в виде белого твердого вещества (78 г, 96,9%).
ТСХ система: 20% этилацетат в петролейном эфире, Rf: 0,45
1H ЯМР (400МГц, CDCl3) δ=7,53-7,40 (м, 2H), 7,22 (д, J=8,2 Гц, 2H), 4,81 (д, J=2,4 Гц, 1H), 4,55 (ш. с, 1H), 3,98 (ш.с, 1H), 3,42 (ш.с, 1H), 1,46 (с, 9H), 0,98 (д, J=7,0 Гц, 3H).
Подготовительный синтез 7: (1R, 2S)-2-амино-1-(4-бромфенил)пропан-1-ол

Используя методику, аналогичную описанной для Подготовительного синтеза 4, но используя соединение, описанное в Подготовительном синтезе 6, указанное в заголовке соединение получили в виде белого твердого вещества (20 г, 71,8%).
ТСХ система: 10% метанол в дихлорметане, Rf: 0,1
1H ЯМР (400МГц, ДМСО-d6) δ=7,52-7,47 (м, 2H), 7,26 (д, J=8,2 Гц, 2H), 5,25 (ш. с, 1H), 4,30 (д, J=4,9 Гц, 1H), 2,86 (м, 1H), 1,53-1,08 (м, 2H), 0,83 (д, J=6,7 Гц, 3H).
Подготовительный синтез 8: трет-бутил-N-[(1S)-2-(4-этилфенил)-1-метил-2-oксo-этил]карбамат

Используя методику, аналогичную описанной для Подготовительного синтеза 2, но используя 4-этилфенилмагнийбромид, указанное в заголовке соединение получили в виде белого твердого вещества (25 г, 69%).
ТСХ система: 20% этилацетат в петролейном эфире, Rf=0,5
1H ЯМР (300МГц, CDCl3) δ=7,90 (д, J=8,0 Гц, 2H), 7,31 (д, J=8,0 Гц, 2H), 5,58 (ш. д, J=6,9 Гц, 1H), 5,27 (ш. т, J=7,1 Гц, 1H), 2,72 (к, J=7,7 Гц, 2H), 1,46 (с, 9H), 1,40 (д, J=6,9 Гц, 3H), 1,26 (т, J=7,7 Гц, 3H). ЖХ-МС: 97,9%, Масса (M+H)=278,4.
Подготовительный синтез 9: трет-бутил-N-[(1S,2R)-2-(4-этилфенил)-2-гидрокси-1-метил-этил]карбамат

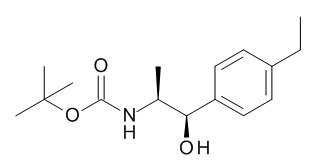
Используя методику, аналогичную описанной для Подготовительного синтеза 3, но используя соединение из Подготовительного синтеза 8, указанное в заголовке соединение получили в виде белого твердого вещества (20 г, 80,3%).
ТСХ система: 20% этилацетат в петролейном эфире, Rf=0,4
1H ЯМР (300МГц, CDCl3) δ=7,26-7,22 (м, 2H), 7,20-7,14 (м, 2H), 4,82 (т, J=3,4 Гц, 1H), 4,61 (ш.с, 1H), 3,99 (ш. с, 1H), 3,05 (ш с, 1H), 2,64 (к, J=7,6 Гц, 2H), 1,46 (с, 9H), 1,23 (т, J=7,7 Гц, 3H), 1,00 (д, J=6,9 Гц, 3H), ЖХ-МС: 99,7%, Масса (M+H)=280,4.
Подготовительный синтез 10: (1R,2S)-2-амино-1-(4-этилфенил)пропан-1-ол
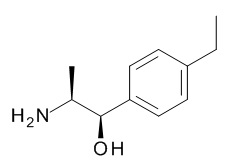
Используя методику, аналогичную описанной для Подготовительного синтеза 4, но используя соединение, описанное в Подготовительном синтезе 9, указанное в заголовке соединение получили в виде белого твердого вещества (23 г, 81,4%).
ТСХ система: 10% метанол в дихлорметане, Rf: 0,2.
1H ЯМР (400МГц, CDCl3) δ=7,26-7,23 (м, 2H), 7,20-7,16 (м, 2H), 4,49 (д, J=4,9 Гц, 1H), 3,26-3,10 (м, 1H), 2,65 (к, J=7,4 Гц, 2H), 1,68-1,39 (м, 2H), 1,24 (т, J=7,6 Гц, 3H), 0,99 (д, J=6,4 Гц, 3H)
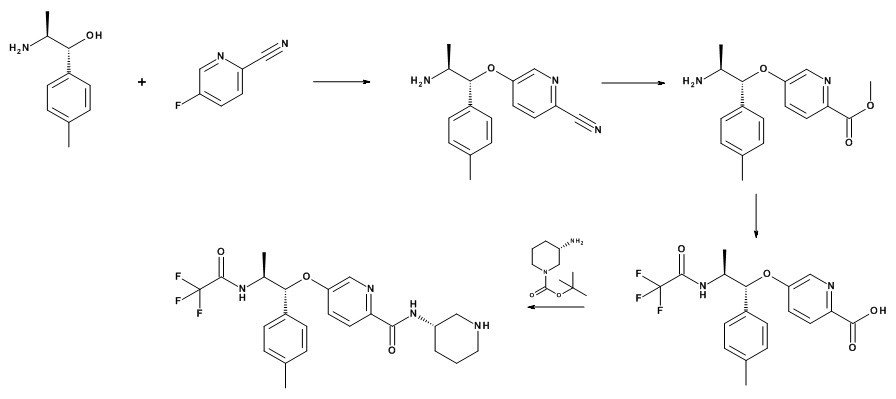
Подготовительный синтез 11: 5-[(1R,2S)-2-амино-1-(п-толил)пропокси]пиридин-2-карбонитрил

Гидрид натрия (60% мас./мас. в минеральном масле, 2,99 г, 74,6 ммоль) небольшими порциями прибавили к раствору аминоспирта из Подготовительного синтеза 4 (10 г, 57,4 ммоль) в тетрагидрофуране (200 мл). Реакционную смесь перемешивали при 50°C в течение 1 ч перед охлаждением до -25oC. 5-Фторпиридин-2-карбонитрил (7,93 г, 64,9 ммоль) растворили в тетрагидрофуране (100 мл) и прибавляли в течение 15 мин к охлажденной реакционной смеси. Реакционную смесь оставили нагреваться до 0°C и перемешивали в течение 3 ч перед тем, как погасили, вылив в ледяной насыщенный водный раствор хлорида аммония (500 мл). Продукт экстрагировали этилацетатом (4×250 мл). Объединенные органические фазы сушили над сульфатом магния, отфильтровали и выпарили при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (100-200 меш), элюируя смесью 2:1 этилацетат:гептан до тех пор, пока не будут элюированы высокоидущие примеси с последующим элюированием 90:10:1 этилацетат:метанол:0,880 водный раствор аммиака. Чистые фракции выпарили при пониженном давлении, чтобы получить указанное в заголовке соединение в виде масла (10,04 г, 65%).
1H ЯМР (300 МГц, CDCl3) δ 8,35 (дд, J=2,9, 0,6 Гц, 1H), 7,47 (дд, J=8,6, 0,6 Гц, 1H), 7,25-7,14 (м, 4H), 7,09 (дд, J=8,7, 2,9 Гц, 1H), 4,93 (д, J=5,4 Гц, 1H), 3,38 (кд, J=6,5, 5,3 Гц, 1H), 2,33 (с, 3H), 1,19 (д, J=6,5 Гц, 3H).
Подготовительный синтез 12: Метил-5-[(1R,2S)-2-амино-1-(п-толил)пропокси]пиридин-2-карбоксилат

Гидроксид натрия (32% мас. в воде, 27 г, 216 ммоль) прибавили к раствору нитрила из Подготовительного синтеза 11 (10,0 г, 37,4 ммоль) в этаноле (100 мл) и полученную смесь нагревали до 85°C в течение 2 ч. Растворитель удалили путем выпаривания при пониженном давлении с последующей азеотропной перегонкой с толуолом (3×150 мл). Полученное твердое вещество суспендировали в метаноле (300 мл) и прибавляли 98% конц. серную кислоту (12 мл, 224 ммоль) в течение 0,05 ч. Реакционную смесь нагревали до 85°C в течение 18 ч. Смесь охладили и концентрировали, выпаривая при пониженном давлении до меньшего объема. Полученный остаток вылили в смесь ледяного насыщенного раствора гидрокарбоната натрия (300 мл) и этилацетата (300 мл). Водный слой экстрагировали еще три раза этилацетатом (3×200 мл). Объединенные фазы этилацетата сушили над сульфатом магния, отфильтровали и выпарили, чтобы получить указанное в заголовке соединение в виде масла (8,82 г, 78%).
1H ЯМР (300 МГц, CDCl3) δ=8,37 (дт, J=2,9, 0,6, 1H), 7,94 (дт, J=8,7, 0,6, 1H), 7,22-7,09 (м, 5H), 5,01 (д, J=5,2, 1H), 3,92 (д, J=0,6, 3H), 3,46-3,31 (м, 1H), 2,32 (с, 3H), 1,20 (дд, J=6,6, 0,6, 3H).
Подготовительный синтез 13: Метил-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксилат

Трифторуксусный ангидрид (4,5 мл, 32 ммоль) прибавили к раствору аминоэфира из Подготовительного синтеза 12 (7,4 г, 25 ммоль) и триэтиламин растворили в дихлорметане (74 мл). Смесь перемешивали при комнатной температуре в течение 0,5 ч реакционную смесь погасили путем прибавления насыщенного водного раствора гидрокарбоната натрия (75 мл) и экстрагировали дихлорметаном (3×75 мл). Объединенные фазы дихлорметана сушили над сульфатом магния, отфильтровали и выпарили. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (100-200 меш), элюируя градиентом этилацетата (25-100%) в гептане, чтобы получить указанное в заголовке соединение в виде масла (7,90 г, 81%).
1H ЯМР (300 МГц, ДМСО-d6) δ=9,50 (д, J=8,4, 1H), 8,35 (д, J=3,0, 1H), 7,92 (д, J=8,7, 1H), 7,33 (дд, J=8,8, 2,9, 1H), 7,25 (д, J=8,1, 2H), 7,16 (д, J=8,0, 2H), 5,43 (д, J=6,0, 1H), 4,25 (дт, J=14,1, 6,9, 1H), 3,80 (с, 3H), 2,26 (с 3H), 1,29 (д, J=6,8, 3H).
Подготовительный синтез 14: 5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоновая кислота

Гидроксид натрия (0,866 г, 21,6 ммоль) растворили в воде (19,7 мл) и прибавили к раствору сложного эфира из Подготовительного синтеза 13 (7,8 г, 19,7 ммоль) растворенного в метаноле (80 мл). Смесь перемешивали при 50°C в течение 8 ч. Метанол удалили путем выпаривания при пониженном давлении и остаток подвергли лиофильной сушке. Сухой остаток растворили в небольшом количестве метанола (10 мл) и прибавили воду (40 мл). Смесь немного подкислили 4 M водной соляной кислотой (pH=4) и экстрагировали этилацетатом (3×150 мл). Объединенные фазы этилацетата сушили над сульфатом магния, отфильтровали и выпарили, чтобы получить указанное в заголовке соединение в виде розового твердого вещества (6,71 г, 89,2%).
1H ЯМР (300 МГц, CDCl3) δ=8,22 (дд, J=2,8, 0,6, 1H), 8,04 (дд, J=8,7, 0,7, 1H), 7,23-7,16 (м, 5H), 6,44 (д, J=8,8, 1H), 5,43 (д, J=3,2, 1H), 4,50 (с, 1H), 2,35 (с, 3H), 1,29 (д, J=6,8, 3H).
Подготовительный синтез 15: трет-бутил-(3S)-3-[[5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилат

O-(7-Aзaбензотриазол-1-ил)-N,N,N',N'-тетраметилуроний гексафторфосфат (8,53 г, 22,4 ммоль)прибавили к раствору кислоты из Подготовительного синтеза 14 (5,72 г, 15,0 ммоль), трет-бутил-(3S)-3-аминопиперидин-1-карбоксилату (4,49 г, 22,4 ммоль) и триэтиламину (6,06 г, 60 ммоль) в N,N-диметилформамиде (150 мл). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Смесь выпарили при пониженном давлении и полученный остаток растворили в диэтиловом эфире (500 мл). Указанный раствор диэтилового эфира промывали 10% водным раствором лимонной кислоты (3×50 мл) с последующим промыванием 10% водным раствором аммиака, насыщенным водным раствором хлорида натрия и сушили над сульфатом магния, отфильтровали и выпарили. Остаток очищали с помощью колоночной хроматографии на силикагеле (100-200 меш), элюируя 50% этилацетатом в гептане, чтобы получить указанное в заголовке соединение в виде аморфного твердого вещества (7,2 г, 86%).
1H ЯМР (300 МГц, ДМСО-d6) δ=9,47 (д, J=8,4, 1H), 8,27 (д, J=8,1, 1H), 8,21 (дд, J=2,9, 0,6, 1H), 7,89 (дд, J=8,7, 0,6, 1H), 7,39 (дд, J=8,8, 2,9, 1H), 7,25 (д, J=8,2, 2H), 7,15 (д, J=7,8, 2H), 5,41 (д, J=6,1, 1H), 4,27 (h, J=6,8, 1H), 3,55 (с, 3H), 2,97 (с 2H), 2,26 (с, 3H), 1,77 (с, 1H), 1,62 (с, 2H), 1,50-1,24 (м, 13H).
СВЭЖХ-МС Метод 2: Масса иона 564,26 (M+), Rt=2,63 мин.
Подготовительный синтез 16: N-[(3S)-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамид

Трифторуксусную кислоту (50 мл, 653 ммоль) прибавили к раствору карбамата из Подготовительного синтеза 15 (7,2 г, 12,8 ммоль) растворенного в дихлорметане (100 мл). Реакционную смесь перемешивали при комнатной температуре в течение 20 мин. Реакционную смесь выпарили, разделили между диэтиловым эфиром и 10% водным раствором аммиака. Фазу диэтилового эфира промывали 10% водным раствором лимонной кислоты (5 x100 мл). затем объединенные фазы, содержащие лимонную кислоту,промывали небольшим объемом диэтилового эфира (50 мл). Объединенные фазы, содержащие лимонную кислоту,затем подщелочили раствором аммиака и экстрагировали диэтиловым эфиром (3×200 мл). Указанные фазы диэтилового эфира объединили и промывали небольшим объемом насыщенного водного раствора хлорида натрия, затем сушили над сульфатом магния, отфильтровали и выпарили, чтобы получить указанное в заголовке соединение в виде белой пены с металлическим оттенком (5,86 г, 99%).
1H ЯМР (300 МГц, CDCl3) δ=8,15 (дд, J=2,9, 0,6, 1H), 8,09-7,95 (м, 2H), 7,21-7,11 (м, 5H), 6,61 (д, J=8,8, 1H), 5,37 (д, J=3,3, 1H), 4,47 (с, 1H), 4,03 (тк, J=7,5, 3,7, 1H), 3,11 (дд, J=11,9, 3,4, 1H), 2,86 (м, 1H), 2,81-2,60 (м, 2H), 2,33 (с, 3H), 1,89 (тд, J=7,6, 3,7, 1H), 1,73 (м, 1H), 1,60-1,48 (м, 2H), 1,27 (д, J=6,9, 3H).
СВЭЖХ-МС Метод 2: Масса иона 464,2 (M+), Rt=2,02 мин.
Подготовительный синтез 17: N-[(3R)-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамид

Используя методику, аналогичную описанной для Подготовительного синтеза 15, но используя (3R)-3-аминопиперидин-1-карбоксилат, с последующим использованием методики аналогичной, описанной в Подготовительном синтезе 16, указанное в заголовке соединение получили в виде белой пены (0,156 г, 64%).
1H ЯМР (300 МГц, ДМСО-d6) δ=9,49 (д, J=8,4, 1H), 8,38 (д, J=8,6, 1H), 8,24 (д, J=2,8, 1H), 7,88 (д, J=8,7, 1H), 7,38 (дд, J=8,7, 2,9, 1H), 7,25 (д, J=8,0, 2H), 7,15 (д, J=7,9, 2H), 5,40 (д, J=6,2, 1H), 4,27 (к, J=7,1, 1H), 3,99-3,81 (м, 1H), 2,95 (дд, J=11,8, 3,7, 1H), 2,88-2,77 (м, 1H), 2,61 (дд, J=11,6, 8,4, 2H), 2,26 (м 3H), 1,78-1,40 (м, 4H), 1,30 (д, J=6,8, 3H).
СВЭЖХ-МС Метод 2: Масса иона 464,2 (M+), Rt=2,01 мин.
Подготовительный синтез 18: 5-[(1R,2S)-2-амино-1-(4-этилфенил)пропокси]пиридин-2-карбонитрил

Используя методику, аналогичную описанной для Подготовительного синтеза 11, но используя аминоспирт, описанный в Подготовительном синтезе 10, указанное в заголовке соединение получили в виде коричневого масла (0,55 г, 70%).
1H ЯМР (300 МГц, CDCl3) δ=8,35 (дд, J=2,9, 0,6, 1H), 7,48 (дд, J=8,6, 0,6, 1H), 7,20 (м, 4H), 7,09 (дд, J=8,7, 2,9, 1H), 4,93 (д, J=5,4, 1H), 3,45-3,24 (м, 1H), 2,63 (к, J=7,6, 2H), 1,25-1,18 (м, 6H).
Подготовительный синтез 19: Метил-5-[(1R,2S)-2-амино-1-(4-этилфенил)пропокси]пиридин-2-карбоксилат

Используя методику, аналогичную описанной для Подготовительного синтеза 12, но используя соединение, описанное в Подготовительном синтезе 18, указанное в заголовке соединение получили в виде коричневого масла (0,48 г, 79%).
1H ЯМР (300 МГц, CDCl3) δ=8,37 (д, J=2,7, 1H), 7,95 (дд, J=8,7, 0,6, 1H), 7,25-7,11 (м, 5H), 5,01 (д, J=5,2, 1H), 3,93 (с, 3H), 3,48-3,24 (м, 1H), 2,62 (к, J=7,6, 2H), 1,24-1,17 (м, 6H).
Подготовительный синтез 20: 5-[(1R,2S)-1-(4-этилфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоновая кислота

Используя методику, аналогичную описанной для Подготовительного синтеза 13, но используя соединение, описанное в Подготовительном синтезе 19, с последующей методикой аналогичной, использованной в Подготовительном синтезе 14, указанное в заголовке соединение получили в виде масла (0,089 г, 71%).
1H ЯМР (300 МГц, ДМСО-d6) δ=9,50 (д, J=8,4, 1H), 8,33 (д, J=2,9, 1H), 7,91 (д, J=8,8, 1H), 7,33 (дд, J=8,8, 2,9, 1H), 7,30-7,17 (м, 4H), 5,44 (д, J=5,9, 1H), 4,46-4,09 (м, 1H), 2,56 (к, J=7,6, 2H), 1,29 (д, J=6,8, 3H), 1,14 (т J=7,6, 3H).
Подготовительный синтез 21: 5-[(1R,2S)-1-(4-этилфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]-N-[(3S)-3-пиперидил]пиридин-2-карбоксамид

Используя методику, аналогичную описанной для Подготовительного синтеза 15, но используя соединение из Подготовительного синтеза 20, с последующей методикой аналогичной, описанной в Подготовительном синтезе 16, указанное в заголовке соединение получили в виде масла (0,066 г, 54%).
1H ЯМР (300 МГц, CDCl3) δ=8,35-8,22 (м, 2H), 8,18 (д, J=2,7, 1H), 7,94 (д, J=8,7, 1H), 7,20 (с, 4H), 7,09 (дд, J=8,7, 2,8, 1H), 6,67 (д, J=8,7, 1H), 5,39 (д, J=3,2, 1H), 4,60-4,42 (м, 1H), 4,37-4,14 (м, 1H), 3,31 (дд, J=12,9, 3,9, 1H), 3,19-2,94 (м, 3H), 2,63 (к, J=8,0, 2H), 2,09-1,91 (м, 2H), 1,89-1,63 (м, 2H), 1,28 (д, J=6,9, 3H), 1,22 (т, J=7,6, 3H).
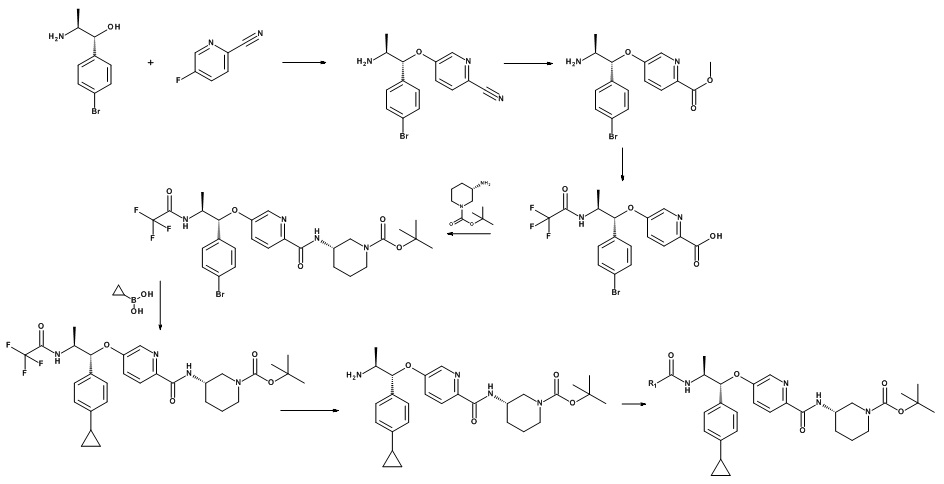
Подготовительный синтез 22: 5-[(1R,2S)-2-амино-1-(4-бромфенил)пропокси]пиридин-2-карбонитрил

Используя методику, аналогичную описанной для Подготовительного синтеза 11, но используя аминоспирт, описанный в Подготовительном синтезе 7, указанное в заголовке соединение получили в виде масла (2 г, 85%).
1H ЯМР (300 МГц, ДМСО-d6) δ=8,44 (дд, J=3,0, 0,7, 1H), 7,89 (дд, J=8,7, 0,6, 1H), 7,61-7,52 (м, 2H), 7,42 (дд, J=8,7, 2,9, 1H), 7,38-7,33 (м, 2H), 5,34 (д, J=5,1, 1H), 3,28-3,20 (м, 1H), 1,03 (д, J=6,5, 3H).
Подготовительный синтез 23: метил-5-[(1R,2S)-1-(4-бромфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксилат

Используя методику, аналогичную описанной для Подготовительного синтеза 12, но используя соединение, описанное в Подготовительном синтезе 22, с последующей методикой аналогичной, описанной в Подготовительном синтезе 13, указанное в заголовке соединение получили в виде аморфного твердого вещества (1,73 г, 62,3%).
1H ЯМР (300 МГц, ДМСО-d6) δ=9,51 (д, J=8,5, 1H), 8,38 (дд, J=3,0, 0,6, 1H), 7,94 (дд, J=8,8, 0,6, 1H), 7,67-7,51 (м, 2H), 7,44-7,27 (м, 3H), 5,48 (д, J=6,0, 1H), 4,30 (h, J=6,7, 1H), 3,81 (с, 3H), 1,30 (д, J=6,8, 3H).
Подготовительный синтез 24: трет-бутил-(3S)-3-[[5-[(1R,2S)-1-(4-бромфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилат

Используя методику, аналогичную описанной для Подготовительного синтеза 14, но используя соединение, описанное в Подготовительном синтезе 23 ииспользуя 2M водный раствор гидроксида натрия (2,5 экв.) в N,N-диметилформамиде (10 мл/г) для получения промежуточного продукта кислоты, 5-[(1R,2S)-1-(4-бромфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоновой кислоты, с последующей методикой аналогичной, описанной в Подготовительном синтезе 15,но используяO-(бензотриазол-1-ил)-N,N,N',N'-тетраметилуроний гексафторфосфат вместо O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилуроний гексафторфосфата, указанное в заголовке соединение получили в виде аморфного твердого вещества белого цвета с металлическим оттенком (1,08 г, 54%).
1H ЯМР (300 МГц, ДМСО-d6) δ=9,50 (д, J=8,4, 1H), 8,29 (д, J=8,1, 1H), 8,23 (д, J=2,8, 1H), 7,91 (д, J=8,7, 1H), 7,56 (д, 2H), 7,42 (дд, J=8,7, 2,9, 1H), 7,33 (д, 2H), 5,45 (д, J=6,2, 1H), 4,30 (h, J=6,8, 1H), 3,91-3,39 (м, 3H), 3,27-2,71 (м, 2H), 1,78 (с, 1H), 1,72-1,56 (м, 2H), 1,51-1,29 (м, 13H).
Подготовительный синтез 25: трет-бутил-(3S)-3-[[5-[(1R,2S)-1-(4-циклопропилфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилат

Ацетат палладия (II) (0,015 г, 0,06910 ммоль) прибавили к раствору бромида из Подготовительного синтеза 24 (0,87 г, 1,382 ммоль), циклопропилбороновой кислоты (0,154 г, 1,797 ммоль), трициклогексилфосфина (0,038 г, 0,1382 ммоль) и фосфата калия (1,03 г, 4,837 ммоль) в толуол:вода 20:1 (5,5 мл). После продувки сосуда аргоном он был герметично закрыт и реакционную смесь нагревали при 100°C в течение 2 ч. Реакционную смесь оставили охлаждаться и разбавили этилацетатом (50 мл) и промывали 10% водным раствором лимонной кислоты (2×20 мл). Фазу этилацетата сушили над сульфатом магния, отфильтровали и выпарили при пониженном давлении. Остаток очистили с помощью колоночной хроматографии на силикагеле (100-200 меш), элюируя градиентом этилацетата в гептане (от 50% до 100%), чтобы получить указанное в заголовке соединение в виде белой пены с металлическим оттенком (0,762 г, 93%).
1H ЯМР (600 МГц, ДМСО-d6) δ=9,55 (д, J=8,3, 1H), 8,48-8,26 (м, 1H), 8,21 (д, J=2,8, 1H), 7,89 (д, J=8,7, 1H), 7,39 (дд, J=8,7, 2,8, 1H), 7,22 (д, 2H), 7,04 (д, 2H), 5,41 (д, J=6,0, 1H), 4,25 (дт, J=8,3, 6,4, 1H), 3,94-3,43 (м, 3H), 3,23-2,69 (м, 2H), 1,86 (тт, J=8,4, 5,1, 1H), 1,80-1,72 (м, 1H), 1,72-1,55 (м, 2H), 1,53-1,16 (м, 13H), 0,97-0,87 (м, 2H), 0,69-0,54 (м, 2H).
Подготовительный синтез 26: трет-бутил-(3S)-3-[[5-[(1R,2S)-2-амино-1-(4-циклопропилфенил)пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилат

Водный раствор гидроксида лития (1M, 54 мл, 54 ммоль) прибавили к раствору соединения из Подготовительного синтеза 25 (3,2 г, 5,4 ммоль) в 1,4-диоксане (250 мл). Реакционную смесь нагревали до 50°C в течение 2 ч. По окончании смесь охладили и выпарили при пониженном давлении для удаления 1,4-диоксана. Остаток экстрагировали дихлорметаном (4×150 мл) и объединенные органические фазы сушили над сульфатом магния, отфильтровали и выпарили при пониженном давлении, чтобы получить указанное в заголовке соединение в виде белой пены (2,7 г, 100%).
СВЭЖХ-МС Метод 1: Масса иона 495 (MH+), Rt=0,67 мин
Подготовительный синтез 27:трет-бутил-(3S)-3-[[5-[(1R,2S)-1-(4-циклопропилфенил)-2-[[(2R)-тетрагидрофуран-2-карбонил]амино]пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилат
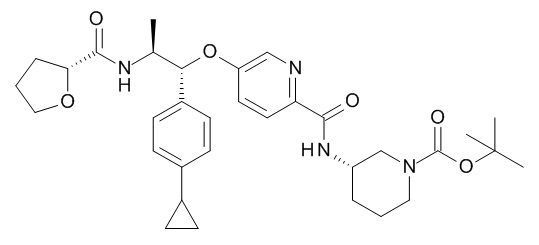
Оксалилхлорид (4,2 мл, 50 ммоль) прибавили к раствору (2R)-тетрагидрофуран-2-карбоновой кислоты (0,580 г, 5 ммоль) в дихлорметане (20 мл) с последующим прибавлением каталитического количества ДМФА (0,02 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч и затем выпарили при пониженном давлении с получением желтой смолы. Указанную смолу растворили в толуоле (20 мл) и выпарили при пониженном давлении, процесс повторили для удаления избытка оксалилхлорида. Полученный хлорангидрид (2R)-тетрагидрофуран-2-карбоновой кислоты прибавили к раствору амина из Подготовительного синтеза 26 (1,3 г, 2,7 ммоль) и 4-метилморфолину (1,5 мл, 14 ммоль) в дихлорметане (30 мл) при 5oC. Реакционную смесь перемешивали при 5°C в течение 0,5 ч и затем выпарили при пониженном давлении. Остаток разделили между трет-бутилметиловым эфиром (200 мл) и 5% водным раствором лимонной кислоты (2×50 мл). Объединенные водные фазы обратно экстрагировали трет-бутилметиловым эфиром (2×50 мл) и эфирные фазы объединили и промывали 5% водным раствором аммиака (2×50 мл), насыщенным водным раствором хлорида натрия (30 мл) и сушили над сульфатом магния, отфильтровали и выпарили с получением коричневой пены. Коричневую пену очищали колоночной хроматографией на силикагеле (120 г), элюируя градиентом этилацетата в гептане (от 0% до 100%), чтобы получить указанное в заголовке соединение в виде аморфного твердого вещества (1,24 г, 77%).
СВЭЖХ-МС Метод 1: Масса иона 593 (MH+), Rt=0,88 мин
Подготовительный синтез 28: трет-бутил-(3S)-3-[[5-[(1R,2S)-1-(4-циклопропилфенил)-2-(изоксазол-3-карбониламино)пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилат

Используя методику, аналогичную описанной для Подготовительного синтеза 27, но используя изоксазол-3-карбоновую кислоту вместо (2R)-тетрагидрофуран-2-карбоновой кислоты, указанное в заголовке соединение получили в виде аморфного твердого вещества (1,46 г, 90%).
СВЭЖХ-МС Метод 1: Масса иона 590 (MH+), Rt=0,90 мин

Подготовительный синтез 29: 4-[(1R,2S)-2-амино-1-(4-бромфенил)пропокси]бензонитрил гидрохлорид

Гидрид натрия (60% мас./мас. в минеральном масле, 2,9 г, 73 ммоль) небольшими порциями прибавили к раствору аминоспирта из Подготовительного синтеза 7 (15,3 г, 66,5 ммоль) в N-метилпирролидин-2-оне (46 мл). Реакционную смесь перемешивали при 60°C в течение 0,5 ч перед прибавлением 4-фторбензонитрила (9,66 г, 79,8 ммоль) и нагреванием в течение дополнительных 0,5 ч. Реакционную смесь выпарили при пониженном давлении (3,2 мбар) при 70oC. Остаток разбавили этилацетатом (200 мл) и промывали 10% водным раствором лимонной кислоты (50 мл) с последующим промыванием насыщенным водным раствором гидрокарбоната натрия (2x 25 мл). Фазу этилацетата сушили над сульфатом магния, отфильтровали и фильтрат обработали 1M эфирным раствором хлористого водорода. Полученную смесь выпарили при пониженном давлении с получением белого твердого вещества с металлическим оттенком. Указанное твердое вещество растирали с небольшим объемом холодного этилацетата, чтобы получить указанное в заголовке соединение в виде белого твердого вещества (19,8 г, 81%).
1H ЯМР (300 МГц, ДМСО-d6) δ=8,52 (с, 3H), 7,74 (д, 2H), 7,62 (д, 2H), 7,34 (д, 2H), 7,06 (д, 2H), 5,86 (д, J=3,1, 1H), 3,91-3,47 (м, 1H), 1,18 (д, J=7,1, 3H).
Подготовительный синтез 30: трет-бутил-(3S)-3-[4-[(1R,2S)-1-(4-бромфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензоил]оксипиперидин-1-карбоксилат

Водный раствор гидроксида натрия (32% мас./мас., 8,6 мл, 93 ммоль) прибавили к раствору соединения из Подготовительного синтеза 29 (6,85 г, 18,6 ммоль) растворили в этаноле (44 мл). Полученный раствор нагревали до 85°C в течение 20 ч и затем охладили и выпарили при пониженном давлении. Остаток погасили 4M водной соляной кислотой (25 мл). Полученную смесь выпарили при пониженном давлении и остаток суспендировали в толуоле (3×100 мл) и выпарили при пониженном давлении с получением промежуточного продукта гидрохлоридной соли с незащищенной аминогруппой. Указанную соль суспендировали в смеси ацетонитрила (75 мл) и пиридина (75 мл) и затем охладили перед прибавлением трифторуксусного ангидрида (10 мл). Смесь перемешивали при комнатной температуре в течение 1 ч до выпаривания при пониженном давлении. Полученный остаток разделили между дихлорметаном (250 мл) и 10% водным раствором лимонной кислоты (3×50 мл). Фазу дихлорметана затем промывали насыщенным водным раствором гидрокарбоната натрия (25 мл) перед сушкой сульфатом магния, фильтрованием. Фильтрат выпарили при пониженном давлении с получением промежуточного продукта трифторацетамида с незащищенной аминогруппой, 4-[(1R,2S)-1-(4-бромфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензойной кислоты, в виде коричневого масла (8,3 г). Указанное масло растворили в дихлорметане (300 мл) перед прибавлением 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорида (7,14 г, 37,2 ммоль), N,N-диметиламинопиридина (6,8 г, 55,8 ммоль) и трет-бутил-(3S)-3-гидроксипиперидин-1-карбоксилата (4,12 г, 20,5 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 5 ч перед промыванием 10% водным раствором лимонной кислоты (2x 50 мл), насыщенным раствором гидрокарбоната натрия (2×25 мл) и сушкой сульфатом магния. Смесь отфильтровали и выпарили при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (220 г), элюируя градиентом этилацетата в гептане (от 0% до 100%), чтобы получить указанное в заголовке соединение в виде белого аморфного твердого вещества с металлическим оттенком (6,08 г, 52%).
СВЭЖХ-МС метод 1: Масса иона 573, 575 (MH+ [79Br]-tBu, MH+ [81Br]-tBu), 529, 531 (MH+ [79Br]-BOC, MH+ [81Br]-BOC) Rt=0,97 мин
Подготовительный синтез 31: трет-бутил-(3S)-3-[4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензоил]оксипиперидин-1-карбоксилат

Используя методику, аналогичную описанной для Подготовительного синтеза 25, но используя бромид, описанный в Подготовительном синтезе 30, указанное в заголовке соединение получили в виде аморфного твердого вещества (4,6 г, 97%).
СВЭЖХ-МС метод 1: Масса иона 535 (MH+-tBu), 491 (MH+-BOC, MH+) Rt=0,98 мин
Подготовительный синтез 32: трет-бутил-(3R)-3-[[5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбонил]амино]пирролидин-1-карбоксилат

Используя методику, аналогичную описанной для Подготовительного синтеза 15, но используя трет-бутил-(3R)-3-аминопирролидин-1-карбоксилат вместо трет-бутил-(3S)-3-аминопиперидин-1-карбоксилата, указанное в заголовке соединение получили в виде аморфного твердого вещества.
СВЭЖХ-МС метод 2: Масса иона 550,24 (M+), Rt=2,53 мин
Подготовительный синтез 33: (3R)-5-оксотетрагидрофуран-3-карбоновая кислота

Периодиат натрия (114 г, 533 ммоль) осторожно прибавляли небольшими порциями к быстро перемешиваемой смеси (4S)-4-винилтетрагидрофуран-2-она (15 г, 133 ммоль) и трихлорида рутения (1,39 г, 6,7 ммоль), растворенных в смеси тетрахлорметана (150 мл), ацетонитрила (150 мл) и воды (225 мл). Реакция очень экзотермическая и реакционной смеси дали достигнуть 50°C во время прибавления периодата натрия. Как только весь периодат натрия был прибавлен, смесь перемешивали в течение дополнительного 1 ч. Хлорид натрия (200 г) прибавили к реакционной смеси вместе с этилацетатом (250 мл) и затем быстро перемешивали в течение 5 минут. Этилацетат декантировали и заменили свежим этилацетатом (250 мл) и быстро перемешивали и декантировали, процесс повторяли еще с 4 порциями этилацетата. Экстракты этилацетата объединили и сушили над сульфатом магния, отфильтровали и выпарили при пониженном давлении с получением темно-коричневого масла. Масло хранили в морозильной камере в течение ночи, в течение которого оно становилось черным. Указанный черный материал растворили в дихлорметане (200 мл) и отфильтровали через небольшой слой силикагеля для удаления черной примеси. Фильтрат выпарили, чтобы получить указанное в заголовке соединение в виде кристаллического белого твердого вещества (12,2 г, 70%).
1H ЯМР (300 МГц, CDCl3d) δ=10,81 (с, 1H), 4,69-4,39 (м, 2H), 3,53 (дддд, J=9,6, 8,0, 6,9, 6,3, 1H), 3,05-2,67 (м, 2H).
Подготовительный синтез 34: (3S)-5-оксотетрагидрофуран-3-карбоновая кислота

Используя методику, аналогичную описанной для Подготовительного синтеза 33, но используя (4R)-4-винилтетрагидрофуран-2-он вместо (4S)-4-винилтетрагидрофуран-2-он, указанное в заголовке соединение получили в виде воскообразного коричневого твердого вещества.
1H ЯМР (300 МГц, CDCl3d) δ=10,81 (с, 1H), 4,69-4,39 (м, 2H), 3,53 (дддд, J=9,6, 8,0, 6,9, 6,3, 1H), 3,05-2,67 (м, 2H).
Подготовительный синтез 35: 4-[(1R,2S)-2-амино-1-(п-толил)пропокси] бензонитрил

Гидрид натрия (60% мас./мас. в минеральном масле, 0,67 г, 17 ммоль) прибавили маленькими порциями к раствору аминоспирта из Подготовительного синтеза 4 (2,5 г, 15 ммоль) в N-метилпирролидин-2-оне (30 мл). Реакционную смесь перемешивали при 60°C в течение 0,5 ч до прибавления 4- фторбензонитрила (2,2 г, 18 ммоль) и нагревания в течение дополнительных 0,5 ч. Реакционную смесь охладили и осторожно вылили в смесь диэтилового эфира (300 мл) и 4M водной соляной кислоты (150 мл). Фазу диэтилового эфира снова экстрагировали 4M водной соляной кислотой (100 мл). Объединенные водные фазы затем обратно экстрагировали гептаном (100 мл) и затем подщелочили 32% водным раствором гидроксида натрия и экстрагировали диэтиловым эфиром (2 x100 мл). Указанные фазы диэтилового эфира затем промывали водой (2x 30 мл), насыщенным водным раствором хлорида натрия и сушили над сульфатом натрия, отфильтровали и выпарили при пониженном давлении. Полученное масло очищали колоночной хроматографией на силикагеле (80 г), элюируя градиентом метанол:триэтиламин (1:1) в этилацетате (от 0% до 10%), чтобы получить указанное в заголовке соединение в виде бесцветного масла (1,38 г, 34%).
1H ЯМР (300 МГц, CDCl3-d) δ=7,56-7,40 (м, 1H), 7,22-7,04 (м, 1H), 7,01-6,69 (м, 1H), 4,91 (д, J=5,3, 0H), 3,40-3,24 (м, 0H), 2,33 (с, 1H), 1,16 (д, J=6,6, 1H).
Подготовительный синтез 36: 4-[(1R,2S)-2-амино-1-(п-толил)пропокси]бензойная кислота

2M водный раствор гидроксида натрия (62 мл, 124 ммоль) прибавили к раствору нитрила из Подготовительного синтеза 35 (1,38 г, 5,1 ммоль) в метаноле (12 мл) и полученную смесь нагревали до 85°C в течение 3 ч. Смесь концентрировали при пониженном давлении до меньшего объема (20 мл) и нейтрализовали (pH 7) 4M водной соляной кислотой. Объем смеси дополнительно уменьшили(20 мл) при пониженном давлении и полученное белое твердое вещество отфильтровали и промывали небольшим объемом холодной воды, чтобы получить указанное в заголовке соединение (1,16 г, 79%).
1H ЯМР (300 МГц, ДМСО-d6) δ=7,78 (д, J=8,8, 2H), 7,37-7,07 (м, 4H), 6,93 (д, J=8,8, 2H), 5,30 (д, J=4,6, 1H), 3,46-3,16 (м, 1H), 2,27 (с, 3H), 1,07 (д, J=6,5, 3H).
Подготовительный синтез 37: 4-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензойная кислота

Трифторуксусный ангидрид (1,13 мл, 8,13 ммоль) прибавили к суспензии аминокислоты из Подготовительного синтеза 36 в дихлорметане (50 мл), ацетонитрила (20 мл) и триэтиламина (5,66 мл, 40 ммоль). Смесь перемешивали в течение 1 ч до фильтрования. Фильтрат выпарили при пониженном давлении и очищали колоночной хроматографией на силикагеле (80 г), элюируя градиентом этилацетата в гептане (от 0% до 30%), чтобы получить указанное в заголовке соединение в виде аморфного твердого вещества (0,93 г, 60%).
1H ЯМР (300 МГц, CDCl3-d) δ=7,95 (д, J=8,9, 2H), 7,18 (с, 4H), 6,87 (д, J=9,0, 2H), 6,47 (д, J=8,9, 1H), 5,40 (д J=3,1, 1H), 4,62-4,39 (м, 1H), 2,34 (с, 3H), 1,25 (д, J=7,0, 3H).
Подготовительный синтез 38: трет-бутил-(3S)-3-[[4-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензоил]амино]пиперидин-1-карбоксилат

Используя методику, аналогичную описанной для Подготовительного синтеза 15,но используя кислоту из Подготовительного синтеза 37, указанное в заголовке соединение получили в виде аморфного твердого вещества (63 мг, 85%).
СВЭЖХ-МС метод 1: Масса иона 508 (MH+-tBu), 464 (MH+-BOC), Rt=0,89 мин
Подготовительный синтез 39: трет-бутил-(3S)-3-[4-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензоил]оксипиперидин-1-карбоксилат

1-Этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (25 мг, 0,131 ммоль) прибавили к раствору кислоты из Подготовительного синтеза 37 (25 мг, 0,066 ммоль), N,N-диметиламинопиридина (16 мг, 0,131 ммоль) и трет-бутил-(3S)-3-гидроксипиперидин-1-карбоксилата (20 мг, 0,098 ммоль) в N,N-диметилформамиде (3 мл). Полученную смесь встряхивали при комнатной температуре в течение 20 ч до разбавления этилацетатом (10 мл) и промывания 1M раствором водной соляной кислоты (2x 3 мл), насыщенным раствором гидрокарбоната натрия (2×2 мл) и сушкой над сульфатом магния, чтобы получить указанное в заголовке соединение в виде масла (30 мг, 80%).
СВЭЖХ-МС метод 1: Масса иона 563,3 (M-H+) Rt=0,98 мин
Подготовительный синтез 40: трет-бутил-(3S)-3-[4-[(1R,2S)-2-амино-1-(4-циклопропилфенил)пропокси]бензоил]оксипиперидин-1-карбоксилат гидрохлорид

1M Водный раствор гидроксида лития (68 мл, 69,8 ммоль) прибавили к раствору трифторацетамида из Подготовительного синтеза 31 (33 г, 55,88 ммоль) в тетрагидрофуране (330 мл) и полученную смесь перемешивали при комнатной температуре в течение 24 ч. Смесь концентрировали при пониженном давлении и полученный остаток разбавили водой (100 мл) и экстрагировали этилацетатом (4x 250 мл). Объединенные фазы этилацетата промывали 2M водной соляной кислотой (100 мл), насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. Смесь отфильтровали и фильтрпрессную лепешку сульфата магния промывали 20% метанола в этилацетате (5x 100мл). Объединенные фильтраты этилацетата выпарили при пониженном давлении с получением желтого твердого вещества. Желтое твердое вещество суспендировали с трет-бутил-метиловым эфиром (3x 100 мл) и отфильтровали и сушили при 70oC, чтобы получить указанное в заголовке соединение в виде очень бледно-желтого твердого вещества (23,4 г, 79%).
СВЭЖХ-МС метод 1: Масса иона 439 (MH+-tBu), 495 (MH+) Rt=0,74 мин
Подготовительный синтез 41: трет-бутил-(3S)-3-[4-[(1R,2S)-1-(4-циклопропилфенил)-2-[[(2R)-тетрагидрофуран-2-карбонил]амино]пропокси]бензоил]оксипиперидин-1-карбоксилат

Оксалилхлорид (36 мл, 0,425 моля) прибавили к раствору (2R)-тетрагидрофуран-2-карбоновой кислоты (9,87 г, 85 ммоль) в дихлорметане (300 мл). Прибавили диметилформамид (50 мкл, кат.) и полученную смесь перемешивали в течение 2 ч до выпаривания при пониженном давлении. Остаток перерастворили в дихлорметане (200 мл) и выпарили при пониженном давлении, этот процесс повторили дважды с получением промежуточного продукта (2R)-тетрагидрофуран-2-карбонилхлорида. (2R)-тетрагидрофуран-2-карбонилхлорид (7,5 г, 52,4 ммоль) растворили в дихлорметане (50мл) и по каплям прибавили к ледяному раствору амина из Подготовительного синтеза 40 (22,8 г, 42,9 ммоль) и 4-метилморфолина (14 мл, 129 ммоль) в дихлорметане (400 мл). Полученную смесь перемешивали при 5°C в течение 20 мин и затем выпарили при пониженном давлении. Полученный остаток ресуспендировали в этилацетате (500 мл) и промывали 1M водной соляной кислотой (3x 100 мл) с последующим промыванием насыщенным водным раствором гидрокарбоната натрия (2x 50 мл) и насыщенным водным раствором хлорида натрия. Этилацетатный раствор сушили над сульфатом магния, отфильтровали через небольшой слой силикагеля и выпарили при пониженном давлении. Остаток растворили в дихлорметане (3x 200 мл) и выпарили, чтобы получить указанное в заголовке соединение в виде бледно-желтой пены (23,5 г, 92%).
СВЭЖХ-МС метод 1: Масса иона 537 (MH+-tBu), Rt=0,95 мин
Подготовительный синтез 42: трет-бутил-(3S)-3-[4-[(1R,2S)-1-(4-циклопропилфенил)-2-[[(2S)-тетрагидрофуран-2-карбонил]амино]пропокси]бензоил]оксипиперидин-1-карбоксилат

EDAC (1520 мг, 7,9 ммоль) прибавили к раствору амина из Подготовительного синтеза 40 (3,0 г, 5,65 ммоль), (2S)-тетрагидрофуран-2-карбоновой кислоты (787 мг, 6,78 ммоль) и Oxyma® (этил-2-циано-2-оксиимин-ацетат) (321 мг, 2,26 ммоль) в ацетонитриле (30 мл). К полученной смеси прибавили триэтиламин (1,97 мл, 14 ммоль) и смесь перемешивали при комнатной температуре в течение 20 ч.
Реакционную смесь выпарили при пониженном давлении. Полученный остаток растворили в этилацетате (200 мл) и промывали 1M водной соляной кислотой (2x 100 мл) с последующим промыванием насыщенным водным раствором гидрокарбоната натрия (1x 100 мл). Раствор этилацетата совместно выпаривали с толуолом (2x 200 мл), чтобы получить указанное в заголовке соединение в виде прозрачного желтого масла (3,36 г, 100%).СВЭЖХ-МС метод 1: Масса иона 537 (MH+-tBu), Rt=0,954 мин
Подготовительный синтез 43: [(3S)-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[[(2R)-тетрагидрофуран-2-карбонил]амино]пропокси]бензоат гидрохлорид
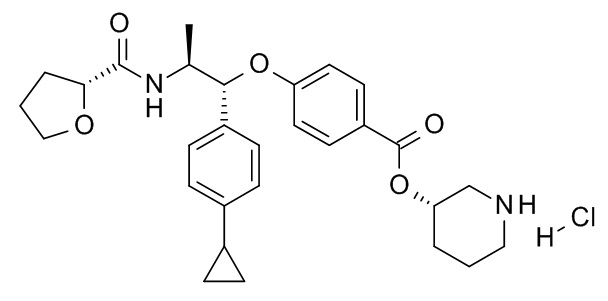
Соляную кислоту (4M в 1,4-диоксане, 60 мл) прибавили к раствору карбамата из Подготовительного синтеза 41(23 г, 38,8 ммоль) в дихлорметане (100 мл). Реакционную смесь быстро перемешивали при комнатной температуре в течение 0,33 ч и затем выпарили при пониженном давлении с получением указанного в заголовке соединенияв виде белой пены. (20,5 г, 100%)
СВЭЖХ-МС метод 1: Масса иона 493 (MH+), Rt 0,60 мин.
Подготовительный синтез 44: [(3S)-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[[(2S)-тетрагидрофуран-2-карбонил]амино]пропокси]бензоат гидрохлорид

Используя методику, аналогичную описанной для Подготовительного синтеза 43,но используя карбамат из Подготовительного синтеза 42, указанное в заголовке соединение получили в виде аморфного твердого вещества.
СВЭЖХ-МС метод 1: Масса иона 493 (MH+), Rt 0,62 мин.

Подготовительный синтез 45: [(1S,2S)-2-(трет-бутоксикарбониламино)-1-(п-толил)пропил]--4-нитробензоат

К перемешиваемому раствору спирта из Подготовительного синтеза 3 (5 г, 18,867 ммоль), трифенилфосфина (14,83 г, 56,6 ммоль) и 4-нитробензойной кислоты (3,78 г, 22,640 ммоль) в тетрагидрофуране (100 мл, 20 об.) прибавляли по каплям диэтилазодикарбоксилат (9,85 г, 56,6 ммоль) при 0°C в течение 5 мин. Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. По окончании, реакционную смесь разбавили водой (100 мл). Полученный раствор экстрагировали этилацетатом (2 X 100 мл). Объединенную органическую фазу сушили над сульфатом натрия и концентрировали при пониженном давлении. Сырой продукт очищали колоночной хроматографией на силикагеле (100-200 меш) (30-40% этилацетат в петролейном эфире в качестве элюента) для получения указанного в заголовке соединенияв виде бесцветной смолы (2,3 г, 33%).1H ЯМР (CDCl3, 400 МГц): δ=8,26 (с, 4H), 7,33 (м, J=7,8 Гц, 2H), 7,19 (д, J=7,8 Гц, 2H), 5,74-5,72 (м, 1H), 4,53-4,49 (м, 1H), 4,34-4,30 (м, 1H), 2,34 (с, 3H), 1,32 (с, 9H), 1,07 (м, J=6,8 Гц, 3H).
Подготовительный синтез 46: трет-бутил-N-[(1S,2S)-2-гидрокси-1-метил-2-(п-толил) этил]карбамат

К перемешиваемому раствору карбамата из Подготовительного синтеза 45 (2 г) в метаноле (20 мл, 10 об.) прибавили карбонат калия (1 г, 7,246 ммоль) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. По окончании реакционную смесь отфильтровали и промывали метанолом и концентрировали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией на силикагеле (100-200 меш) (20% этилацетат в гексане в качестве элюента) для получения указанного в заголовке соединения в виде белого твердого вещества с металлическим оттенком (1,1 г, 85%).1H ЯМР (CDCl3, 400 МГц): δ=7,20-7,24 (м, 2H), 7,13-7,19 (м, 2H), 4,83-4,80 (м, 1H), 4,62-4,59 (м, 1H), 4,00-3,98 (м, 1H), 3,09-3,07 (м, 1H), 2,28-2,39 (м, 3H), 1,37-1,52 (м, 9H), 0,99 (д, J=6,8 Гц, 3H). ЖХ-МС (ЭСИ): m/z 266 [M+H]+; RT=2,65 мин; (колонка KINETEX-1,7u XB-C18, 0,05% муравьиная кислота в воде с ацетонитрилом).
Подготовительный синтез 47: (1S,2S)-2-амино-1-(п-толил)пропан-1-ол

Используя методику, аналогичную описанной для Подготовительного синтеза 4,но используя карбамат из Подготовительного синтеза 46, указанное в заголовке соединение получили в виде бледно-коричневого твердого вещества.1H ЯМР (CDCl3, 400МГц): δ=7,21-7,24 (м, 2H), 7,12-7,17 (м, 2H), 4,21 (д, J=6,8 Гц, 1H), 3,09-3,07 (м, 2H), 2,34 (с, 3H), 1,80 (м, 2H), 1,03 (д, J=6,4 Гц, 3H) ЖХ-МС (ЭСИ): m/z 166 [M+H]+; 85%; RT=1,43 мин; (колонка KINETEX-1,7u XB-C18, 0,05% муравьиная кислота в воде с ацетонитрилом).
Подготовительный синтез 48: 5-[(1S,2S)-2-амино-1-(п-толил)пропокси]пиридин-2-карбонитрил

Используя методику, аналогичную описанной для Подготовительного синтеза 11,но используя аминоспирт из Подготовительного синтеза 47, указанное в заголовке соединение получили в виде бледно-желтого масла, (600 мг, 74%).1H ЯМР (CDCl3, 300МГц): δ=8,37 (д, J=2,6 Гц, 1H), 7,48 (д, J=8,8 Гц, 1H), 7,10-7,20 (м, 5H), 4,84 (д, J=6,6 Гц, 1H), 3,32-3,35 (м, 1H), 2,33 (s, 3H), 1,04 (с, J=6,6 Гц, 3H). ЖХ-МС (ЭСИ): m/z 268 [M+H]+; 97,85%; RT=1,97 мин (колонка KINETEX-1,7u XB-C18, 0,05% муравьиная кислота в воде с ацетонитрилом).
Подготовительный синтез 49: Метил-5-[(1S,2S)-2-амино-1-(п-толил)пропокси] пиридин-2-карбоксилат

Используя методику, аналогичную описанной для Подготовительного синтеза 12,но используя нитрил из Подготовительного синтеза 48, указанное в заголовке соединение получили в виде белого твердого вещества с металлическим оттенком, (500 мг, 74%).1H ЯМР (CDCl3, 300МГц): δ=8,37 (д, J=2,9 Гц, 1H), 7,95 (д, J=8,8 Гц, 1H), 7,12-7,21 (м, 5H), 4,86 (д, J=7,0 Гц, 1H), 3,93 (с, 3H), 3,31-3,38 (м, 1H), 2,31 (с, 3H), 1,05 (д, J=6,6 Гц, 3H) ЖХ-МС (ЭСИ): m/z 301 [M+H]+; 94%; RT=2,02 мин (колонка KINETEX-1,7u XB-C18, 0,05% муравьиная кислота в воде с ацетонитрилом).
Подготовительный синтез 50: метил-5-[(1S,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино] пропокси]пиридин-2-карбоксилат

Используя методику, аналогичную описанной для Подготовительного синтеза 13,но используя амин из Подготовительного синтеза 49, указанное в заголовке соединение получили в виде желтой жидкости, (800 мг, 75%).1H ЯМР (CDCl3, 400МГц): δ=8,37 (д, J=2,4 Гц, 1H), 7,98-7,95 (м, 1H), 7,06-7,20 (м, 5H), 6,31-6,54 (м, 1H), 5,25-5,43 (м, 1H), 4,43-4,60 (м, 1H), 3,94 (с, 3H), 2,31 (с, 3H), 1,23-1,38 (м, 3H) ЖХ-МС (ЭСИ): m/z 397 [M+H]+ ; 38,45%; RT=1,24 мин+59,63%; RT =2,84 (колонка KINETEX-1,7u XB-C18, 0,05% муравьиная кислота в воде с ацетонитрилом).
Подготовительный синтез 51: 5-[(1S,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино] пропокси]пиридин-2-карбоновая кислота
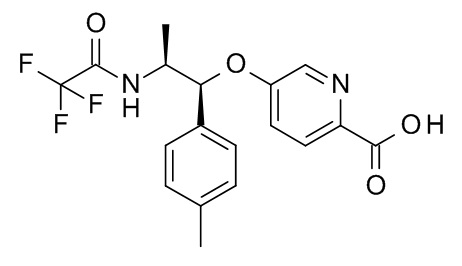
Используя методику, аналогичную описанной для Подготовительного синтеза 14,но используя сложный эфир из Подготовительного синтеза 50, указанное в заголовке соединение получили в виде белого твердого вещества с металлическим оттенком (600 мг, 89%).1H ЯМР (CDCl3, 400МГц): δ=8,25-8,23 (м, 1H), 8,03-8,05 (д, J=8,8 Гц, 1H), 7,15-7,17 (м, 5H), 6,29-6,30 (м, 1H), 5,30 (d, J=4,4 Гц, 1H), 4,50-4,55 (м, 1H), 2,35 (с, 3H), 1,35 (д, J=6,8 Гц, 3H). ЖХ-МС (ЭСИ): m/z 383 [M+H]+; 82,16%; RT=2,43 мин (колонка KINETEX-1,7u XB-C18, 0,05% муравьиная кислота в воде с ацетонитрилом).
Подготовительный синтез 52: трет-бутил-(3S)-3-[[5-[(1S,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилат

Используя методику, аналогичную описанной для Подготовительного синтеза 15,но используя кислоту из Подготовительного синтеза 51, за исключением того, что сырой материал очищали очисткой на SFC (Колонка: Chiralpak LuxCellulose-2(4,6*250) мм, 5мкм, %CO2:80%, % совместный растворитель:20% (100% Метанол), общий поток:100 г/мин, обратное давление:100 бар, УФ: 246 нм, стек время:3,2 мин, загрузка:10 мг) для получения указанного в заголовке соединения в виде белого твердого вещества с металлическим оттенком (400 мг).
1H ЯМР (CDCl3, 400МГц): δ=8,14-8,12 (м, 1H), 8,01 (д, J=8,8 Гц, 1H), 7,89-7,93 (м, 1H), 7,12-7,20 (м, 5H), 6,30-6,34 (м, 1H), 5,23 (д, J=4,4 Гц, 1H), 4,53 (м, 1H), 4,07 (м, 1H), 3,59 (м, 1H), 3,49 (д, J=5,4 Гц, 1H), 3,40 (м, 2H), 2,33 (с, 3H), 1,88 (м, 1H), 1,67-1,75 (м, 2H), 1,42 (с, 7H), 1,36 (д, J=6,8 Гц, 3H). ЖХ-МС (ЭСИ): m/z 565 [M+H]+; 98%; RT=3,11 мин (колонка KINETEX-1,7u XB-C18, 0,05% муравьиная кислота в воде с ацетонитрилом) и Хиральная ВЭЖХ~99,7%, Rt=3,41 мин [МЕТОД SFC: Объем введенной пробы:10, Растворитель: 0,5% DEA в метаноле, Колонка: Chiralpak LuxCellulose-2(4,6*250)мм,5мкм, Положение лунки:16D, Температура колонки:29,9, Поток:3, Давление:100, RT:3,41 мин пик 1 и RT:4,54 мин пик 2].
Подготовительный синтез 53: трет-бутил-(3S)-3-[[5-[(1S,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилат

Используя методику, аналогичную описанной для Подготовительного синтеза 15,но используя кислоту из Подготовительного синтеза 51, для получения указанного в заголовке соединения в виде бледно-зеленого твердого вещества (300 мг, 93%).1H ЯМР (ДМСО, 300МГц): δ=9,50-9,54 (м, 1H), 8,63-8,67 (м, 1H), 8,25 (д, J=2,6 Гц, 1H), 7,89 (д, J=8,4 Гц, 1H), 7,37-7,41 (м, 1H), 7,22-7,28 (м, 2H), 7,13-7,19 (м, 2H), 5,43 (д, J=6,2 Гц, 1H), 4,25-4,29 (м, 1H), 4,12-4,16 (м, 1H), 3,07-3,23 (м, 2H), 2,84-2,94 (м, 1H), 2,71-2,75 (м, 1H), 2,26 (с, 3H), 1,80-1,84 (м, 2H), 1,60-1,71 (м, 2H), 1,30 (д, J=6,6 Гц, 3H). ЖХ-МС (ЭСИ): m/z 465 [M+H]+ ; 99%; RT=1,24 мин. (колонка KINETEX-1,7u XB-C18, 0,05% муравьиная кислота в воде с ацетонитрилом) и хиральная ВЭЖХ~99%; МЕТОД SFC: Объем введенной пробы:10, Растворитель: 0,5% DEA в метаноле, Колонка: Chiralpak LuxCellulose 2(4,6*250)мм, 5мкм, Температура колонки:29,9, Поток:3, Давление:100, RT:4,17 мин.
ПРИМЕРЫ
Пример 1: N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамид (Соединение 1)

2M Оксалилхлорид (40 мл, 80 ммоль) в дихлорметане прибавили к раствору лактона из Подготовительного синтеза 33 (1,9 г, 14,6 ммоль) в дихлорметане (80 мл) с последующим прибавлением каталитического количества ДМФА (0,02 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч и затем выпарили при пониженном давлении с получением желтой смолы. Указанную смолу растворили в толуоле (50 мл) и выпарили при пониженном давлении, процесс повторили для удаления избытка оксалилхлорида. Полученный хлорангидрид кислоты растворили в дихлорметане (20 мл) и прибавили к раствору амина из Подготовительного синтеза 16 (5,52 г, 11,9 ммоль) и 4-метилморфолина (3 мл, 27,3 ммоль) в дихлорметане (150 мл) при 5oC. Реакционную смесь перемешивали при 5°C в течение 0,5 ч и затем выпарили при пониженном давлении. Остаток растворили в дихлорметане и очищали колоночной хроматографией на силикагеле (400 г), элюируя 100% этилацетатом с получением белой пены (6,7 г). Указанную белую пену растворили в этилацетате (25 мл) и медленно прибавили диэтиловый эфир (200 мл). Полученное белое липкое твердое вещество перемешивали в течение 2 ч и затем отфильтровали. Полученный белый порошок растворили в кипящем этилацетате (250 мл) и полученный раствор концентрировали при пониженном давлении до около 50 мл и закристаллизовали с небольшим количеством затравочных кристаллов (вышеописанного белого порошка). Указанную смесь хранили в морозильной камере в течение ночи и полученные белые кристаллы отфильтровали и сушили под вакуумом, чтобы получить указанное в заголовке соединение (4,8 г, 70%).
Т.пл.: 207,5oC.
СВЭЖХ-МС метод 1: Масса иона 577 (MH+), Rt=0,74 мин
СВЭЖХ-МС метод 2: Масса иона 576,22 (M+), Rt=2,3 мин
1H ЯМР (600 МГц, ДМСО-d6) Смесь ротационных изомеров δ=9,52 (с, 1H), 8,43 (дд, J=26,8, 8,3, 1H), 8,24 (дд, J=11,9, 2,8, 1H), 7,90 (дд, J=14,4, 8,7, 1H), 7,39 (тд, J=8,8, 2,9, 1H), 7,25 (д, J=7,9, 2H), 7,16 (д, J=7,9, 2H), 5,41 (дд, J=7,9, 6,0, 1H), 4,60 (т, J=8,5, 0,53H), 4,44 (т, J=8,4, 0,47H), 4,27 (ддд, J=8,4, 5,7, 2,5, 2H), 4,21 (дд, J=12,5, 4,1, 0,47H), 4,16-4,10 (м, 0,53H), 3,86-3,69 (м, 3H), 3,09-2,96 (м, 1H), 2,82-2,55 (м, 3H), 2,26 (с, 3H), 1,84 (м, J=11,8, 11,0, 3,4, 1H), 1,77-1,61 (м, 2H), 1,55-1,36 (м, 1H), 1,30 (дд, J=6,9, 1,2, 3H).
Пример 2: 5-[(1R,2S)-1-(4-циклопропилфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамид (Соединение 2)

Трифторуксусную кислоту (4 мл) прибавили к раствору карбамата из Подготовительного синтеза 25 (0,752 г, 1,275 ммоль) в ацетонитриле (4 мл) и полученный раствор перемешивали при комнатной температуре в течение 0,2 ч. Реакционную смесь выпарили при пониженном давлении. Полученный остаток растворили в 2M уксусной кислоты в метаноле и очистили ионообменной хроматографией (10г картридж SCX), элюируя 100% метанолом с последующим элюированием 2M аммиака в метаноле. Аммоний-содержащий метанольный элюент выпарили при пониженном давлении с получением сырого промежуточного продукта амина (5-[(1R,2S)-1-(4-циклопропилфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]-N-[(3S)-3-пиперидил]пиридин-2-карбоксамида). Указанный сырой промежуточный продукт амина растворили в N,N-диметилформамиде (30 мл) вместе с кислотой из Подготовительного синтеза 33 (0,248 г, 1,9 ммоль) и диизопропилэтиламином (0,89 мл, 5,1 ммоль) и в конце прибавили N,N,N′,N′-тетраметил-O-(1H-бензотриазол-1-ил)уроний гексафторфосфат (0,965 г, 2,55 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 1 ч до выпаривания при пониженном давлении. Полученный остаток растворили в этилацетате (150 мл) и промывали 10% водным раствором лимонной кислоты (2×20 мл) с последующим промыванием насыщенным раствором гидрокарбоната натрия (1×50 мл). Раствор сушили над сульфатом магния, отфильтровали и выпарили при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле, элюируя градиентом этилацетата в гептане (от 0% до 100%), чтобы получить указанное в заголовке соединение в виде белого аморфного твердого вещества (0,55 г, 72%).
СВЭЖХ-МС метод 2: Масса иона 602,24 (M+), Rt=2,36 мин.
1H ЯМР (300 МГц, ДМСО-d6) Смесь ротационных изомеров, δ=9,48 (д, J=8,5, 1H), 8,40 (дд, J=13,9, 8,1, 1H), 8,23 (дд, J=5,4, 2,8, 1H), 7,95-7,75 (м, 1H), 7,38 (ддд, J=7,8, 4,5, 2,9, 1H), 7,23 (д, J=8,1, 2H), 7,04 (д, J=8,2, 2H), 5,41 (т, J=5,1, 1H), 4,59 (т, J=8,5, 0,55H), 4,44 (т, J=8,4, 0,45H), 4,39-4,00 (м, 3H), 3,78 (м, 3H), 3,03 (м, 1H), 2,86-2,57 (м, 3H), 1,97-1,60 (м, 4H), 1,60-1,35 (м, 1H), 1,29 (д, J=6,8, 3H), 0,92 (дд, J=8,3, 2,4, 2H), 0,79-0,50 (м, 2H).

Пример 3: 5-[(1R,2S)-1-(4-циклопропилфенил)-2-(2,2-дифторпропаноиламино)пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамид (Соединение 3)

Водный раствор гидроксида лития (1M, 2 мл, 2 ммоль) прибавили к раствору соединения из Примера 2 (100 мг, 0,166 ммоль) и полученный раствор нагревали до 70°C в течение 1,5 ч. Реакционную смесь выпарили при пониженном давлении и полученный остаток суспендировали в толуолее (2×50 мл) и выпаривали, чтобы удалить остаточную воду для получения промежуточного соединения со снятой защитой и разомкнутым кольцом. Указанный промежуточный продукт (0,018 ммоль), 2,2-дифторпропановая кислота (3 мг, 0,027 ммоль) и N,N,N′,N′- тетраметил-O-(1H-бензотриазол-1-ил)гексафторфосфат урония (17 мг, 0,045 ммоль) растворили в N,N-диметилформамиде (0,5 мл) и в конце прибавили диизопропилэтиламин (0,013 мл, 0,072 ммоль). Полученную смесь нагревали до 40°C в течение и затем очищали препаративной обращенно-фазной ВЭЖХ с использованием градиента ацетонитрила в 0,1% водной муравьиной кислоте (от 10% до 100%), чтобы получить указанное в заголовке соединение в виде аморфного твердого вещества.
СВЭЖХ-МС метод 2: Масса иона 598,26 (M+), Rt=2,32 мин.
Пример 4-21:
Соединения следующих табличных примеров (Таблица 1) общей формулы:
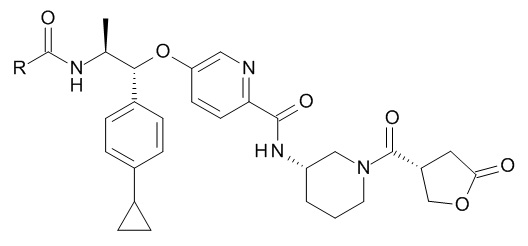
были получены способом, аналогичным способу Примера 3, с использованием подходящей кислоты вместо 2,2-дифторпропановой кислоты.
Таблица 1.
1. Использовали СВЭЖХ-МС метод 2.
2. Соединение 19: 1H ЯМР (600 МГц, ДМСО-d6) δ=8,57 (дд, J=2,0, 1,0, 1H), 8,50 (дд, J=2,2, 1,0, 1H), 8,45 (д, J=7,9, 0,5H), 8,40 (д, J=8,6, 0,5H), 8,25 (дд, J=11,0, 2,8, 1H), 8,12 (дд, J=8,9, 1,7, 1H), 7,89 (дд, J=14,9, 8,7, 1H), 7,38 (ддд, J=8,8, 7,7, 2,9, 1H), 7,26 (д, J=7,9, 2H), 7,07-6,97 (м, 2H), 5,57 (т, J=6,1, 1H), 4,68-4,36 (м, 2H), 4,31-4,09 (м, 2H), 3,78 (м, 3H), 3,11-2,97 (м, 1H), 2,82-2,55 (м, 3H), 1,84 (м, 2H), 1,80-1,57 (м, 2H), 1,28 (дд, J=6,8, 2,1, 3H), 0,90 (дт, J=8,4, 1,7, 2H), 0,72-0,46 (м, 2H).
Пример 22: 5-[(1R,2S)-1-(4-циклопропилфенил)-2-[[(2R)-тетрагидрофуран-2-карбонил]амино]пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамид (Соединение 22)

Соляную кислоту (4M в диоксане, 40 мл) прибавили к раствору карбамата из Подготовительного синтеза 27 (1,25 г, 2,11 ммоль) в дихлорметане (20 мл). Реакционную смесь быстро перемешивали при комнатной температуре в течение 0,33 ч и затем выпарили при пониженном давлении с получением промежуточного продукта с незащищенной аминогруппой (5-[(1R,2S)-1-(4-циклопропилфенил)-2-[[(2R)-тетрагидрофуран-2-карбонил]амино]пропокси]-N-[(3S)-3-пиперидил]пиридин-2-карбоксамида) (СВЭЖХ-МС метод 1: Масса иона 493 (MH+), Rt 0,56 мин). Тем временем, 2M оксалилхлорид (40 мл, 80 ммоль) в дихлорметане прибавили к раствору лактона из Подготовительного синтеза 33 (0,468 г, 3,6 ммоль) в дихлорметане (20 мл) с последующим прибавлением каталитического количества ДМФА (0,01 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч и затем выпарили при пониженном давлении с получением желтой смолы. Указанную смолу растворили в толуоле (50 мл) и выпарили при пониженном давлении, процесс повторили для удаления избытка оксалилхлорида. Полученный хлорангидрид кислоты растворили в дихлорметане (20 мл) и прибавили к раствору промежуточного амина (2,11 ммоль) в дихлорметане (50 мл) и 4-метилморфолине (2,6 мл, 24 ммоль). Указанную реакционную смесь перемешивали при 5°C в течение 0,5 ч до выпаривания при пониженном давлении. Остаток растворили в этилацетате (200 мл) и промывали 5% водным раствором лимонной кислоты (2×50 мл), насыщенным водным раствором гидрокарбоната натрия (1×50 мл), насыщенным водным раствором хлорида натрия (50 мл) и сушили над сульфатом магния, отфильтровали и фильтрат выпарили при пониженном давлении с получением коричневого аморфного твердого вещества (1,25 г). Указанное твердое вещество очищали с помощью колоночной хроматографии на силикагеле (40 г), элюируя 100% этилацетатом, затем градиентом ацетонитрила в этилацетате (от 0% до 70%). Полученное аморфное твердое вещество растворили в ацетонитриле (50 мл) и прибавили достаточное количество воды с получением мутного раствора (80 мл) и затем прибавили ацетонитрил (2 мл) с получением прозрачного раствора. Указанный раствор заморозили и затем лиофилизировали в течение 70 ч, чтобы получить указанное в заголовке соединение в виде белого аморфного твердого вещества (0,88 г, 70%).
СВЭЖХ-МС метод 1: Масса иона 605 (MH+), Rt=0,70 мин
СВЭЖХ-МС метод 2: Масса иона 604,29 (M+), Rt=2,21 мин
1H ЯМР (600 МГц, ДМСО-d6), Смесь ротационных изомеров, δ=8,45 (д, J=8,0, 1H), 8,24 (дд, J=10,5, 2,8, 1H), 7,90 (дд, J=14,6, 8,7, 1H), 7,62 (д, J=9,4, 1H), 7,38 (ддд, J=9,6, 7,1, 2,9, 1H), 7,24 (д, J=8,0, 2H), 7,02 (д, J=8,0, 2H), 5,39 (т, J=6,2, 1H), 4,60 (т, J=8,5, 0,53H), 4,44 (т, J=8,4, 0,47H), 4,34-4,06 (м, 4H), 3,89-3,65 (м, 5H), 3,11-2,96 (м, 1H), 2,83-2,55 (м, 3H), 1,87 (м, 3H), 1,78-1,57 (м, 3H), 1,54-1,38 (м, 1H), 1,32 (м, 2H), 1,23 (м, 3H), 0,91 (м, 2H), 0,67-0,53 (м, 2H).
Пример 23: N-[(1S,2R)-2-(4-циклопропилфенил)-1-метил-2-[[6-[[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]карбамоил]-3-пиридил]окси]этил]изоксазол-3-карбоксамид (Соединение 23)

Используя методику, аналогичную описанной для Примера 22,но используя карбамат из Подготовительного синтеза 28 (1,4 г, 2,4 ммоль) через промежуточный амин N-[(1S,2R)-2-(4-циклопропилфенил)-1-метил-2-[[6-[[(3S)-3-пиперидил]карбамоил]-3-пиридил]окси]этил]изоксазол-3-карбоксамид, указанное в заголовке соединение получили в виде белого аморфного твердого вещества (0,85 г, 60%).
СВЭЖХ-МС метод 1: Масса иона 602 (MH+), Rt=0,73 мин
СВЭЖХ-МС метод 2: Масса иона 601,25 (M+), Rt=2,29 мин
1H ЯМР (600 МГц, ДМСО-d6): Смесь ротационных изомеров, δ=9,05 (с, 1H), 8,80 (д, J=8,5, 1H), 8,45 (д, J=8,0, 1H), 8,24 (дд, J=11,8, 2,9, 1H), 7,89 (дд, J=14,7, 8,7, 1H), 7,37 (тд, J=8,3, 2,9, 1H), 7,26 (д, J=8,0, 2H), 7,03 (д, J=8,1, 2H), 6,80 (с, 1H), 5,51 (т, J=6,4, 1H), 4,60 (т, J=8,5, 0,5H), 4,51-4,37 (м, 1,5H), 4,33-4,10 (м, 2H), 3,92-3,68 (м, 3H), 3,09-2,95 (м, 1H), 2,81-2,55 (м, 3H), 1,85 (ддд, J=10,3, 8,4, 5,1, 2H), 1,79-1,59 (м, 2H), 1,55-1,36 (м, 1H), 1,35-1,23 (м, 3H), 0,90 (дд, J=8,5, 2,5, 2H), 0,66-0,56 (м, 2H).
Пример 24: [(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензоат (Соединение 24)

Используя методику, аналогичную описанной для Примера 2,но используя карбамат из Подготовительного синтеза 31 (4,6 г, 7,79 ммоль), указанное в заголовке соединение получили в виде белого аморфного твердого вещества (3,32 г, 90%).
СВЭЖХ-МС метод 2: Масса иона 602,22 (M+), Rt=2,51 мин
1H ЯМР (600 МГц, ДМСО-d6): Смесь ротационных изомеров, δ=9,73-9,31 (м, 1H), 7,90-7,66 (м, 2H), 7,21 (дд, J=8,3, 2,0, 2H), 7,06-7,01 (м, 2H), 7,00-6,96 (м, 1H), 6,95-6,92 (м, 1H), 5,34 (дд, J=11,6, 6,1, 1H), 4,93 (м, 1H), 4,45 (ддд, J=10,4, 8,8, 7,9, 1H), 4,27-4,14 (м, 2H), 3,89-3,80 (м, 1H), 3,77-3,70 (м, 1H), 3,68-3,50 (м, 2H), 3,38 (м, 0,5H), 3,29 (м, 0,5H), 2,75-2,63 (м, 1H), 2,58 (дд, J=17,2, 6,0, 0,5H), 2,47 (дд, J=17,2, 9,0, 0,5H), 1,97-1,63 (м, 4H), 1,57 (м, 0,5H), 1,50 (м, 0,5H), 1,32-1,23 (м, 3H), 0,97-0,86 (м, 2H), 0,68-0,56 (м, 2H).

Примеры 25-58:
Соединения следующих табличных примеров (Таблица 2) общей формулы:

были полученны в виде параллельного набора с использованием метода, описанного ниже.
Ди-трет-бутилдикарбонат (0,426 г, 1,96 ммоль) прибавили к раствору соединения из Примера 24 (0,59 г, 0,98 ммоль) и N,N-диметилпиридина (12 мг, 0,098 ммоль) в дихлорметане (5 мл). Полученный раствор перемешивали при комнатной температуре в течение 18 ч до разбавления дихлорметаном (100 мл) и промывали 10% водным раствором лимонной кислоты (2×20 мл), насыщенным водным раствором гидрокарбоната натрия (1×25 мл) и затем сушили над сульфатом магния, отфильтровали и выпарили при пониженном давлении с получением аморфного твердого вещества. Указанное твердое вещество растворили в тетрагидрофуране (100 мл) и прибавили 10% водный раствор карбоната натрия (5 мл). Полученный раствор перемешивали при комнатной температуре в течение 70 ч. Смесь выпарили при пониженном давлении и полученный остаток разбавили дихлорметаном (70 мл) и промывали 10% водным раствором лимонной кислоты (2×25 мл), насыщенным водным раствором гидрокарбоната натрия (1×25 мл) и затем сушили над сульфатом магния, отфильтровали и выпарили. Полученную смолу очищали с помощью колоночной хроматографии на силикагеле (120 г), элюируя градиентом этилацетата в гептане (от 0% до 100%) для получения промежуточного продукта карбамата. Указанный промежуточный продукт карбамата растворили в 4M соляной кислоты в диоксане (5 мл) и перемешивали при комнатной температуре в течение 0,5 ч. Данную смесь концентрировали, путем выпаривания при пониженном давлении, до меньшего объема. Полученную смесь отфильтровали с получением промежуточного продукта соли амина в виде белого твердого вещества. Указанный промежуточный продукт соли амина (0,015 ммоль) растворили в N,N-диметилформамиде (0,15 мл) и прибавили соответствующую кислоту (0,023 ммоль) с последующим прибавлением раствора N,N,N′,N′-тетраметил-O-(1H-бензотриазол-1-ил)уроний гексафторфосфата (0,03 ммоль) и диизопропилэтиламин в N,N-диметилформамиде (0,15 мл). Полученные смеси перемешивали при комнатной температуре в течение 1 ч и затем очищали препаративной обращенно-фазной ВЭЖХ с использованием градиента ацетонитрила в 0,1% водной муравьиной кислоте (от 10% до 100%), чтобы получить указанное в заголовке соединение в виде аморфных твердых веществ.
Таблица 2
1 Использовали СВЭЖХ-МС метод 2.
2 Соединение 31:1H ЯМР (300 МГц, ДМСО-d6), Смесь ротационных изомеров, δ=9,22 (д, J=8,7, 1H), 7,77 (дд, J=8,9, 7,7, 2H), 7,24 (д, J=8,1, 2H), 7,05-6,84 (м, 4H), 5,53-5,38 (м, 1H), 5,06-4,78 (м, 1H), 4,50-4,30 (м, 2H), 4,20 (ддд, J=14,7, 8,7, 5,4, 1H), 3,94-3,47 (м, 5H), 2,80-2,52 (м, 5H), 2,02-1,39 (м, 5H), 1,29 (д, J=6,7, 3H), 0,89 (дд, J=8,5, 2,4, 2H), 0,69-0,47 (м, 2H).
3 Соединение 34:1H ЯМР (300 МГц, ДМСО-d6) Смесь ротационных изомеров, δ=7,82-7,72 (м, 2H), 7,69 (д, J=8,7, 1H), 7,21 (д, J=8,1, 2H), 7,08-7,00 (м, 2H), 7,00-6,88 (м, 2H), 5,40 (т, J=5,0, 1H), 4,99-4,83 (м, 0H), 4,45 (тд, J=8,4, 5,1, 1H), 4,20 (ддд, J=15,4, 8,8, 5,5, 2H), 3,92-3,41 (м, 7H), 3,18 (с, 3H), 2,78-2,54 (м, 1H), 2,07 (с, 2H), 1,99-1,38 (м, 5H), 1,16 (д, J=6,8, 3H), 1,01-0,77 (м, 2H), 0,62 (т, J=5,7, 2H).
4 Соединение 37 может быть перекристаллизовано из этилацетата с последующим суспендированием в гептане при 60°C в течение 4 дней для получения полностью кристаллического твердого вещества Т.пл. 146oC.
1H ЯМР (300 МГц, ДМСО-d6) Смесь ротационных изомеров, δ=7,84-7,65 (м, 2H), 7,58 (д, J=9,3, 1H), 7,22 (д, J=8,1, 2H), 7,08-6,88 (м, 4H), 5,34 (дд, J=7,1, 3,8, 1H), 5,09-4,83 (м, 1H), 4,45 (тд, J=8,3, 6,2, 1H), 4,20 (ддд, J=16,0, 8,7, 5,3, 2H), 4,13-4,04 (м, 1H), 3,85 (дт, J=13,3, 7,0, 1H), 3,79-3,46 (м, 5H), 3,31 (с, 1H), 2,83-2,39 (м, 2H), 2,00-1,43 (м, 7H), 1,34 (к, J=3,4, 2H), 1,19 (д, J=6,7, 3H), 0,90 (дк, J=8,4, 1,3, 2H), 0,61 (тд, J=10,0, 8,8, 5,5, 2H).
5 Соединение 42:1H ЯМР (300 МГц, ДМСО-d6) Смесь ротационных изомеров, δ=8,88 (д, J=8,7, 1H), 7,83-7,69 (м, 2H), 7,24 (д, J=8,2, 2H), 7,11-6,79 (м, 4H), 5,47 (дд, J=6,2, 4,1, 1H), 5,12-4,75 (м, 1H), 4,53-4,31 (м, 2H), 4,20 (ддд, J=14,5, 8,8, 5,4, 1H), 3,92-3,51 (м, 4H), 3,49-3,37 (м, 1H), 2,80-2,52 (м, 5H), 2,01-1,40 (м, 2H), 1,27 (д, J=6,7, 3H), 1,01-0,79 (м, 2H), 0,73-0,51 (м, 2H).
Пример 37 Альтернативный метод: [(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[[(2R)-тетрагидрофуран-2-карбонил]амино]пропокси]бензоат (Соединение 37)


Оксалилхлорид (24 мл, 284 ммоль) прибавили к раствору лактона из Подготовительного синтеза 33 (7,38 г, 56,7 ммоль) в дихлорметане (250 мл) с последующим прибавлением каталитического количества ДМФА (0,09 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1,5 ч и затем выпарили при пониженном давлении с получением желтой смолы. Указанную смолу растворили в толуоле (2x 200 мл) и выпарили при пониженном давлении, процесс повторили для удаления избытка оксалилхлорида с получением промежуточного продукта с незащищенной аминогруппой (3R)-5-оксотетрагидрофуран-3-карбонилхлорида (8,4 г, 100%).
Промежуточный продукт (3R)-5-оксотетрагидрофуран-3-карбонилхлорид (8,4 г, 56,7 ммоль) растворили в дихлорметане (100 мл) и прибавили к ледяному раствору амина из Подготовительного синтеза 43 (20,0 г, 37,8 ммоль) в дихлорметане (400 мл) и 4-метилморфолине (19,3 мл, 151 ммоль). Указанную реакционную смесь перемешивали при 5°C в течение 2,5 ч до выпаривания при пониженном давлении. Остаток растворили в этилацетате (300 мл) и промывали 2M водной соляной кислотой (3×100 мл), насыщенным водным раствором гидрокарбоната натрия (1×50 мл), насыщенным водным раствором хлорида натрия (50 мл) и сушили над сульфатом магния, отфильтровали и фильтрат выпарили при пониженном давлении с получением темно-коричневого аморфного твердого вещества (25 г). Указанное твердое вещество очищали с помощью колоночной хроматографии на силикагеле (250 г), элюируя 100% этилацетатом. Полученное в результате кремовое твердое вещество дважды перекристаллизовывали из горячего этилацетата в белое кристаллическое твердое вещество (15,5 г). Указанное твердое вещество суспендировали в гептане и нагревали до 90°C в течение 5 ч и затем отфильтровали и сушили до постоянной массы в вакууме при 7 мм рт.ст. и 80oC, чтобы получить указанное в заголовке соединение.
1H ЯМР (300 МГц, ДМСО-d6) Смесь ротационных изомеров, δ=7,84-7,65 (м, 2H), 7,58 (д, J=9,3, 1H), 7,22 (д, J=8,1, 2H), 7,08-6,88 (м, 4H), 5,34 (дд, J=7,1, 3,8, 1H), 5,09-4,83 (м, 1H), 4,45 (тд, J=8,3, 6,2, 1H), 4,20 (ддд, J=16,0, 8,7, 5,3, 2H), 4,13-4,04 (м, 1H), 3,85 (дт, J=13,3, 7,0, 1H), 3,79-3,46 (м, 5H), 3,31 (с, 1H), 2,83-2,39 (м, 2H), 2,00-1,43 (м, 7H), 1,34 (к, J=3,4, 2H), 1,19 (д, J=6,7, 3H), 0,90 (дк, J=8,4, 1,3, 2H), 0,61 (тд, J=10,0, 8,8, 5,5, 2H).
СВЭЖХ-МС метод 1: Масса иона 604,29 (M+), Rt=0,755 мин
СВЭЖХ-МС метод 2: Масса иона 604,29 (M+), Rt=2,21 мин
Характеризация Полиморфа F Соединения 37
ДСК
Полиморф F соединения 37 имеет кривую дифференциальной сканирующей калориметрии (ДСК), содержащую эндотермическое событие с началом около 144 ° C (± 2 ° C) и отсутствие потери веса, связанного с процессом плавления; см. Фигура. 1.
пРСА
Полиморф F соединения 37 имеет дифрактограмму пРСА, по существу аналогичную, показанной на Фигуре. 2. Полиморф F соединения 37 характеризуют с помощью дифрактограммы пРСА, демонстрирующей один или более пиков отражения при около 2θ= 6,3, 8,2, 14,8, 17,2, 17,4, 21,1 и/или 21,3 (±0,1 градусов) соответственно (Жирная первая).
Монокристаллическая рентгеновская кристаллография
Полиморф F соединения 37 характеризует наличием монокристаллических параметров, которые по существу те же, что и в Таблице 3. Полиморф F соединения 37 имеет структуру, полученную с помощью монокристаллической рентгеновской кристаллографии (РК) как показано на Фигуре. 3.
Таблица 3. Параметры кристалла из определения монокристаллической структуры.
Соединение 37 представляет собой единственный энантиомер, абсолютная конфигурация молекулы может быть определена путем анализа аномального рассеивания рентгеновских лучей на кристалле. Различия в интенсивностях аномального рассеивания затем сравниваются с рассчитанными интенсивностями рассеивания для каждого энантиомера. Данные измеренные и рассчитанные интенсивности могут быть затем подогнаны к параметру, например, коэффициенту Флека (Flack) (См. Flack, H. D.; Bernardinelli, G. Acta Cryst. 1999, A55, 908; Flack, H. D.; Bernardinelli, G. Reporting и evaluating absolute-structure и absolute-configuration determinations, J. Appl. Cryst. 2000, 33, 1143). Коэффициент Флека (абсолютный структурный параметр), x(u) должен быть близким к 0, если конфигурация решенной структуры верна, в пределах статистических колебаний обычно |x|<2u или x будет близким к 1,если инверсная модель правильна. Измеренный коэффициент Флека для структуры формы F соединения 37 показан в Таблице 3 равен 0,1 при стандартной неопределенности 0,3. Данная структура содержит 5 хиральных центров, расположенных при C4, C6, C8, C25 и C31, которым была соответственно присвоена конфигурация R, S, R, S и R. Это согласуется с предлагаемой конфигурацией молекулы.
Данные координат для полиморфа F соединения 37.
Атом x y z
O 5,570414 9,768308 -0,773260
O 6,694541 3,522901 8,290236
O 6,498150 7,901364 3,789618
O 9,577783 2,677018 7,166688
O 5,145490 4,864314 9,222004
O 7,993789 2,420543 4,211591
O 6,444739 6,580276 -2,167699
N 8,183500 1,201077 8,166714
N 5,932253 7,743608 0,188496
H 6,092742 6,908371 0,057120
O 9,881556 3,393212 3,557140
C 5,798154 8,551746 -0,866794
C 5,890725 4,601064 8,308086
C 6,379705 7,042899 4,842338
C 6,065248 5,419848 7,085721
C 5,812917 8,238169 1,557945
H 6,177416 9,146961 1,599357
C 6,647561 7,326473 2,467579
H 6,264539 6,424456 2,460439
C 8,895762 1,648214 7,114281
C 10,793604 7,116454 1,242357
C 8,926682 8,368826 2,144851
H 8,584313 9,168254 2,474719
C 8,101428 7,252918 2,056316
C 7,045481 5,813755 4,913737
H 7,587371 5,532116 4,211163
C 7,183304 0,126786 8,141010
H 7,349833 -0,490690 8,870717
H 7,255329 -0,364872 7,308488
C 6,755336 2,681857 9,479044
H 6,700408 3,230617 10,288718
C 6,890834 5,020134 6,036143
H 7,343124 4,210061 6,091835
C 9,332014 2,501841 4,145475
C 10,249978 8,303014 1,749296
H 10,786774 9,058889 1,819268
C 5,566172 7,461001 5,891915
H 5,133589 8,282689 5,846219
C 8,840156 0,860401 5,807664
H 8,879523 -0,107429 5,961887
C 7,592738 1,263018 5,000845
H 7,310613 0,536178 4,422506
H 6,861141 1,491426 5,594892
C 5,401994 6,651896 7,002897
H 4,848532 6,926759 7,698331
C 5,776981 0,709419 8,272386
H 5,558760 1,199141 7,464140
H 5,138819 -0,014517 8,363778
C 4,367455 8,269140 2,000624
H 3,852019 8,780154 1,372305
H 4,307272 8,673692 2,868846
H 4,025530 7,372929 2,040608
C 9,964731 5,999578 1,165245
H 10,303963 5,197247 0,839662
C 8,644558 6,070230 1,566513
H 8,109623 5,312419 1,507965
C 5,876332 7,889750 -2,243383
H 4,976547 7,829745 -2,624658
C 8,123728 2,010183 9,380512
H 8,819856 2,685728 9,359092
H 8,269993 1,448842 10,157342
C 12,214464 7,123229 0,816814
H 12,767776 7,810388 1,243785
C 9,941995 1,329798 4,876610
H 10,725136 1,604662 5,379264
H 10,196054 0,628122 4,256859
C 5,651646 1,641440 9,470476
H 4,790141 2,086641 9,441916
H 5,693756 1,121715 10,287290
C 7,864164 6,741904 -2,269087
H 8,272472 5,937637 -2,624658
H 8,246487 6,922888 -1,395153
C 12,950438 5,875696 0,431255
H 13,890995 5,817626 0,662591
H 12,466999 5,035619 0,476951
C 6,782864 8,677564 -3,202997
H 6,399942 8,704663 -4,094067
H 6,911520 9,585388 -2,887410
C 12,559010 6,842558 -0,629747
H 11,835806 6,591890 -1,225221
H 13,259801 7,373897 -1,039582
C 8,096632 7,914914 -3,202997
H 8,314795 7,605208 -4,096923
H 8,819784 8,474319 -2,880270
Пример 59: N-[(3R)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамид (Соединение 59)

O-(7-Азабензотриазол-1-ил)-N, N, N', N'-тетраметилуроний гексафторфосфат (15 мг, 0,038 ммоль)прибавили к раствору кислоты из Подготовительного синтеза 33 (6 мг, 0,039 ммоль), амина из Подготовительного синтеза 17 (9 мг, 0,019 ммоль) и триэтиламина (20 μL, 0,095 ммоль) в N,N-диметилформамиде (0,5 мл). Реакцию встряхивали в течение 0,25 ч при комнатной температуре и очищали с помощью препаративной обращенно-фазной ВЭЖХ с использованием градиента ацетонитрила в 50 мM водного раствора гидрокарбоната аммония (от 5% до 95%), чтобы получить указанное в заголовке соединение в виде аморфного твердого вещества.
СВЭЖХ-МС метод 2: Масса иона 576,22 (M+), Rt=2,30 мин
Пример 60: N-[(3R)-1-[(3S)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамид (Соединение 60)

Используя методику, аналогичную описанной для Примера 59,но используя кислоту из Подготовительного синтеза 34, указанное в заголовке соединение получили в виде аморфного твердого вещества.
СВЭЖХ-МС метод 2: Масса иона 576,22 (M+), Rt=2,30 мин
Пример 61: N-[(3R)-1-[(2S)-5-оксотетрагидрофуран-2-карбонил]-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамид (Соединение 61)

Используя методику, аналогичную описанной для Примера 59,но используя (2S)-5-оксотетрагидрофуран-2-карбоновую кислотувместо кислоты из Подготовительного синтеза 33, указанное в заголовке соединение получили в виде аморфного твердого вещества.
СВЭЖХ-МС метод 2: Масса иона 576,22 (M+), Rt=2,29 мин
Пример 62: N-[(3R)-1-[(2R)-5-оксотетрагидрофуран-2-карбонил]-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамид (Соединение 62)
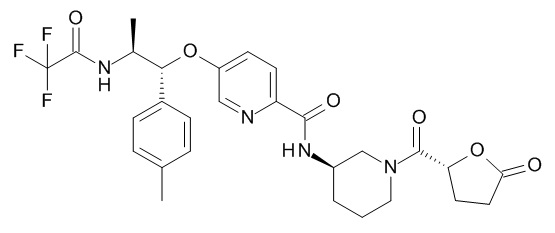
Используя методику, аналогичную описанной для Пример 59,но используя (2R)-5-оксотетрагидрофуран-2-карбоновую кислотувместо кислоты из Подготовительного синтеза 33, указанное в заголовке соединение получили в виде аморфного твердого вещества.
СВЭЖХ-МС метод 2: Масса иона 576,22 (M+), Rt=2,29 мин
Пример 63: N-[(3S)-1-[(3S)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамид (Соединение 63)

Используя методику, аналогичную описанной для Примера 59,но используя кислоту из Подготовительного синтеза 34 иамин из Подготовительного синтеза 16, указанное в заголовке соединение получили в виде аморфного твердого вещества.
СВЭЖХ-МС метод 2: Масса иона 576,22 (M+), Rt=2,30 мин
Пример 64: N-[(3S)-1-[(2S)-5-оксотетрагидрофуран-2-карбонил]-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамид (Соединение 64)

Используя методику, аналогичную описанной для Примера 59,но используя (2S)-5-оксотетрагидрофуран-2-карбоновую кислоту и амин из Подготовительного синтеза 16, указанное в заголовке соединение получили в виде аморфного твердого вещества.
СВЭЖХ-МС метод 2: Масса иона 576,22 (M+), Rt=2,29 мин
Пример 65: N-[(3R)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]пирролидин-3-ил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамид (Соединение 65)
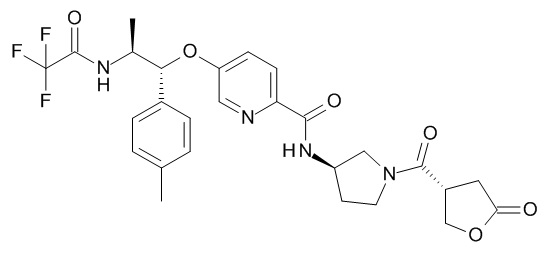
Используя методику, аналогичную описанной для Примера 2,но используя карбамат из Подготовительного синтеза 32 вместо карбамата из Подготовительного синтеза 25, через промежуточный амин 5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]-N-[(3R)пирролидин-3-ил]пиридин-2-карбоксамид, указанное в заголовке соединение получили в виде аморфного твердого вещества.
СВЭЖХ-МС метод 2: Масса иона 562,20 (M+), Rt=2,21 мин
Пример 66: 5-[(1R,2S)-1-(4-этилфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамид (Соединение 66)


Используя методику, аналогичную описанной для Примера 59,но используя амин из Подготовительного синтеза 21 вместо амина из Подготовительного синтеза 17, указанное в заголовке соединение получили в виде аморфного твердого вещества.
СВЭЖХ-МС метод 2: Масса иона 590,24 (M+), Rt=2,38 мин
Пример 67: 5-[(1R,2S)-1-(4-бромфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамид (Соединение 67)


Используя методику, аналогичную описанной для Пример 2,но используя карбамат из Подготовительного синтеза 24 вместо карбамата из Подготовительного синтеза 25 для получения промежуточного продукта амина 5-[(1R,2S)-1-(4-бромфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]-N-[(3S)-3-пиперидил]пиридин-2-карбоксамида, указанное в заголовке соединение получили в виде аморфного твердого вещества.
СВЭЖХ-МС метод 2: Масса иона 640,11 (M+), Rt=2,34 мин
1H ЯМР (600 МГц, ДМСО-d6) Смесь ротационных изомеров, δ=9,57 (д, J=8,5, 1H), 8,49 (дд, J=25,5, 8,4, 1H), 8,26 (дд, J=10,3, 2,9, 1H), 7,91 (дд, J=14,8, 8,7, 1H), 7,62-7,52 (м, 2H), 7,42 (ддд, J=10,5, 8,8, 2,9, 1H), 7,37-7,29 (м, 2H), 5,46 (дд, J=9,5, 6,2, 1H), 4,61 (т, J=8,5, 0,55H), 4,45 (дд, J=8,8, 8,0, 0,45H), 4,34-4,10 (м, 3H), 3,91-3,67 (м, 3H), 3,08-2,94 (м, 1H), 2,82-2,54 (м, 3H), 1,83 (с, 1H), 1,70 (дддд, J=27,2, 17,8, 13,0, 5,5, 2H), 1,56-1,34 (м, 0H), 1,54-1,34 (м, 1H), 1,30 (дд, J=6,8, 1,6, 3H).
Пример 68: N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]-5-[(1R,2S)-1-(4-фенилфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамид (Соединение 68)


[1,1′- Бис(дифенилфосфино)ферроцен]дихлорпалладий (II) (1,7 мг, 0,002 ммоль) прибавили к раствору бромида из Подготовительного синтеза 24 (24 мг, 0,0413 ммоль), фенилбороновой кислоты (5,5 мг, 0,045 ммоль), и водного раствора карбоната натрия (2M, 50 мкл, 0,1 ммоль) в толуоле:этаноле 4:1 (250 мкл). После продувания сосуда аргоном его герметично закрыли и реакционную смесь нагревали при 90°C в течение 2 ч. Реакционную смесь оставили охлаждаться и разбавили этилацетатом (50 мл) и промывали 10% водным раствором лимонной кислоты (2×20 мл). Фазу этилацетата сушили над сульфатом магния, отфильтровали и выпарили при пониженном давлении. Полученный промежуточный продукт карбамата подвергли условиям, аналогичным описанным в методике для Примера 2, чтобы получить указанное в заголовке соединение в виде аморфного твердого вещества.
СВЭЖХ-МС метод 2: Масса иона 638,24 (M+), Rt=2,43 мин
Пример 69: N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]-4-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензамид (Соединение 69)


Используя методику, аналогичную описанной для Примера 2,но используя карбамат из Подготовительного синтеза 38 вместо карбамата из Подготовительного синтеза 25 для получения промежуточного продукта амина N-[(3S)-3-пиперидил]-4-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензамида, указанное в заголовке соединение получили в виде аморфного твердого вещества.
СВЭЖХ-МС метод 2: Масса иона 575,22 (M+), Rt=2,30 мин
Пример 70: [(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензоат (Соединение 70)


Используя методику, аналогичную описанной для Примера 2,но используя карбамат из Подготовительного синтеза 39 вместо карбамата из Подготовительного синтеза 25 для получения промежуточного продукта амина [(3S)-3-пиперидил] 4-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензоата, указанное в заголовке соединение получили в виде аморфного твердого вещества.
СВЭЖХ-МС метод 2: Масса иона 576,21 (M+), Rt=2,45 мин
Пример 71: N-[(3S)-1-[[(3S)-5-оксотетрагидрофуран-3-ил]карбамоил]-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамид (Соединение 71)


Раствор триэтиламина (0,420 мл, 3,0 ммоль) и (4S)-4-амино-тетрагидрофуран-2-она (206 мг, 1,5 ммоль) в дихлорметане (3 мл) по каплям прибавили к раствору трифосгена (200 мг, 0,675 ммоль) в дихлорметане (5 мл), охлажденному до 0oC. Реакционную смесь перемешивали при комнатной температуре в течение 1 ч и затем отфильтровали и фильтрат выпарили при пониженном давлении. Полученный остаток растворили в этилацетате (10 мл) и перемешивали в течение 0,2 ч перед фильтрованием. Фильтрат выпарили при пониженном давлении с получением сырого промежуточного продукта изоцианата. указанный сырой продукт (4S)-4-изоцианатотетрагидрофуран-2-он (14 мг, 0,053 ммоль) прибавили к раствору амина из Подготовительного синтеза 16 (10 мг, 0,0215 ммоль) и триэтиламину (7,5 мкл, 0,053 ммоль) в N,N-диметилформамиде (0,3 мл) и полученную смесь перемешивали при комнатной температуре в течение 0,3 ч. Сырую реакционную смесь очищали с помощью обращенно-фазной ВЭЖХ с использованием градиента ацетонитрила в 50 мM водном растворе гидрокарбоната аммония (от 5% до 95%), чтобы получить указанное в заголовке соединение в виде аморфного твердого вещества (8 мг, 63%).
СВЭЖХ-МС метод 2: Масса иона 591,23 (M+), Rt=2,26 мин
Пример 72: N-[(3S)-1-[[(3R)-5-оксотетрагидрофуран-3-ил]карбамоил]-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамид (Соединение 72)
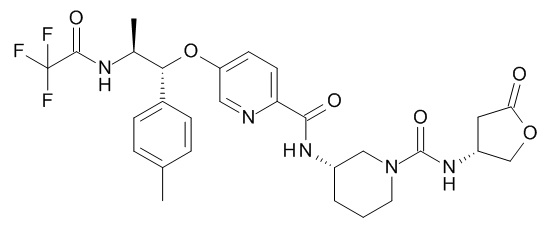

Используя методику, аналогичную описанной для Пример 71,но используя (4R)-4-аминотетрагидрофуран-2-он вместо (4S)-4-аминотетрагидрофуран-2-она, указанное в заголовке соединение получили в виде аморфного твердого вещества.
СВЭЖХ-МС метод 2: Масса иона 591,23 (M+), Rt=2,26 мин
Пример 73: [(3S)-2-оксотетрагидрофуран-3-ил] (3S)-3-[[5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилат (Соединение 73)


Раствор пиридина (0,192 мл, 2,4 ммоль) и трифосгена (267 мг, 0,9 ммоль) в дихлорметане (5 мл) по каплям прибавляли к раствору (3S)-3-гидрокси-тетрагидрофуран-2-она (204 мг, 2 ммоль) в дихлорметане (5 мл), охлажденному до 0oC. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч и затем выпарили при пониженном давлении. Полученный остаток растворили в этилацетате (10 мл) и перемешивали в течение 0,2 ч перед фильтрованием. Фильтрат выпарили при пониженном давлении с получением сырого промежуточного продукта карбонохлоридата. Указанный сырой продукт [(3S)-2-оксотетрагидрофуран-3-ил]карбонохлоридат (11 мг, 0,064 ммоль) прибавили к раствору амина из Подготовительного синтеза 16 (12 мг, 0,026 ммоль) и триэтиламина (11 мкл, 0,078 ммоль) в N,N-диметилформамиде (0,5 мл) и полученную смесь перемешивали при комнатной температуре в течение 0,3 ч. Сырую реакционную смесь очищали с помощью обращенно-фазной ВЭЖХ с использованием градиента ацетонитрила в 50 мM водного раствора гидрокарбоната аммония (от 5% до 95%), чтобы получить указанное в заголовке соединение в виде аморфного твердого вещества (10 мг, 52%).
СВЭЖХ-МС метод 2: Масса иона 592,21 (M+), Rt=2,39 мин
Пример 74: [(3R)-2-оксотетрагидрофуран-3-ил] (3S)-3-[[5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилат (Соединение 74)


Используя методику, аналогичную описанной для Примера 73,но используя (3R)-3-гидрокситетрагидрофуран-2-он вместо (3S)-3-гидрокситетрагидрофуран-2-она, указанное в заголовке соединение получили в виде аморфного твердого вещества.
СВЭЖХ-МС метод 2: Масса иона 592,21 (M+), Rt=2,39 мин
Пример 75: [(3S)-5-оксотетрагидрофуран-3-ил] (3S)-3-[[5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилат (Соединение 75)


Используя методику, аналогичную описанной для Примера 73,но используя (4S)-4-гидрокситетрагидрофуран-2-он вместо (3S)-3-гидрокситетрагидрофуран-2-она, указанное в заголовке соединение получили в виде аморфного твердого вещества.
СВЭЖХ-МС метод 2: Масса иона 592,21 (M+), Rt=2,37 мин
1H ЯМР (300 МГц, ДМСО-d6) δ=9,50 (д, J=8,4, 1H), 8,34 (д, J=8,0, 1H), 8,23 (д, J=2,8, 1H), 7,88 (д, J=8,7, 1H), 7,38 (дд, J=8,8, 2,8, 1H), 7,25 (д, J=7,9, 2H), 7,15 (д, J=7,8, 2H), 5,41 (д, J=6,1, 1H), 5,24 (д, J=6,3, 1H), 4,48 (дд, J=10,7, 4,6, 1H), 4,27 (дд, J=13,5, 8,6, 2H), 3,93-3,61 (м, 3H), 3,14-2,80 (м, 3H), 2,25 (с, 3H), 1,79 (с, 1H), 1,64 (с 2H), 1,44 (д, J=11,2, 1H), 1,30 (д, J=6,8, 3H).
Пример 76: [(34)-5-оксотетрагидрофуран-3-ил] (3S)-3-[[5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилат (Соединение 76)


Используя методику, аналогичную описанной для Примера 73,но используя (4R)-4-гидрокситетрагидрофуран-2-он вместо (3S)-3-гидрокситетрагидрофуран-2-она, указанное в заголовке соединение получили в виде аморфного твердого вещества.
СВЭЖХ-МС метод 2: Масса иона 592,21 (M+), Rt=2,37 мин
Пример 77: [(3S)-1-[(3S)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[[(2R)-тетрагидрофуран-2-карбонил]амино]пропокси]бензоат (Соединение 77)


EDAC (253 мг, 1,32 ммоль) прибавили к раствору амина из Подготовительного синтеза 43 (500 мг, 0,94 ммоль), кислоты из Подготовительного синтеза 34 (147 мг, 1,13 ммоль) и Oxyma® (этил-2-циано-2-оксиимин-ацетат) (53. мг, 0,37 ммоль) в этилацетате (5 мл). К полученной смеси прибавили триэтиламин (0,32 мл, 2,2681 ммоль) и смесь перемешивали при комнатной температуре в течение 4 ч.
Реакционную смесь выпарили при пониженном давлении. Полученный остаток растворили в этилацетате (20 мл) и промывали 1M водной соляной кислотой (2x 10 мл) с последующим промыванием насыщенным водным раствором гидрокарбоната натрия (1x 10 мл). Раствор в этилацетате выпарили при пониженном давлении, чтобы получить указанное в заголовке соединение в виде белого аморфного твердого вещества (0,54 г, 95%).СВЭЖХ-МС метод 1: Масса иона 604,29 (MH+), Rt=0,764 мин
Пример 78: [(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[[(2S)-тетрагидрофуран-2-карбонил]амино]пропокси]бензоат (Соединение 78)


Используя методику, аналогичную описанной для Примера 77,но используя амин из Подготовительного синтеза 44 икислоту из Подготовительного синтеза 33, указанное в заголовке соединение получили в виде аморфного твердого вещества.
СВЭЖХ-МС метод 2: Масса иона 604,29 (MH+), Rt=0,775 мин
Пример 79: [(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[[(2R)-тетрагидрофуран-2-карбонил]амино]пропокси]бензоат (Соединение 79)


Используя методику, аналогичную описанной для Примера 77,но используя амин из Подготовительного синтеза 44, указанное в заголовке соединение получили в виде аморфного твердого вещества.
СВЭЖХ-МС метод 2: Масса иона 604,29 (MH+), Rt=0,774 мин
Пример 80: N-[(3S)-1-[(3S)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]-5-[(1S,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамид (Соединение 80)


Используя методику, аналогичную описанной для Примера 77,но используя амин из Подготовительного синтеза 53, указанное в заголовке соединение получили в виде аморфного твердого вещества (35 мг, 29%).1H ЯМР (ДМСО, 400МГц): δ=9,11 (ш.с, 1H), 8,20 (д, J=2,9 Гц, 1H), 8,10 (д, J=7,8 Гц, 1H), 7,89 (д, J=8,8 Гц, 1H), 7,37 (д, J=8,6 Гц, 1H), 7,25 (д, J=8,3 Гц, 2H), 7,14 (д, J=7,8 Гц, 2H), 5,41 (д, J=6,4 Гц, 1H), 4,38-4,42 (м, 1H), 4,20-4,30 (м, 2H), 3,80-3,92 (м, 2H), 3,70-3,80 (м, 2H), 3,02-3,19 (м, 2H), 2,50-2,60 (м, 2H), 2,26 (с, 3H), 1,80-1,90 (м, 2H), 1,60-1,70 (м, 2H), 1,31 (д, J=6,8 Гц, 3H) ЖХ-МС (ЭСИ): m/z 565 [M+H]+; 99,6%; RT=2,7 мин (колонка KINETEX-1,7u XB-C18, 0,05% FA в воде с ACN) и Хиральная ВЭЖХ~96,9% МЕТОД СЖХ: Объем введенной пробы:10, Растворитель: 0,5% DEA в метаноле, Колонка: Chiralpak LuxCellulose-2(4,6*250) мм, 5мкм, Температура колонки:30, Поток:4, Давление:100, RT:2,9 мин.
Пример 81: N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]-5-[(1S,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамид (Соединение 81)


Используя методику, аналогичную описанной для Примера 77,но используя амин из Подготовительного синтеза 53 икислоту из Подготовительного синтеза 33, указанное в заголовке соединение получили в виде аморфного твердого вещества (35 мг, 29%).
1H ЯМР (ДМСО, 400МГц): δ=9,11 (м, 1H), 8,20 (д, J=2,9 Гц, 1H), 8,10 (д, J=7,8 Гц, 1H), 7,89 (д, J=8,8 Гц, 1H), 7,37 (д, J=8,6 Гц, 1H), 7,25 (dд, J=8,3 Гц, 2H), 7,14 (д, J=7,8 Гц, 2H), 5,41 (д, J=6,4 Гц, 1H), 4,50 (с, 1H), 4,20-4,30 (м, 2H), 3,80-3,92 (м, 2H), 3,70-3,80 (м, 2H), 3,02-3,19 (м, 2H), 2,55-2,60 (м, 2H), 2,26 (с, 3H), 1,80-1,90 (м, 2H), 1,60-1,70 (м, 2H), 1,31 (д, J=6,8 Гц, 3H) ЖХ-МС (ЭСИ): m/z 565 [M+H]+; 98%; RT=3,11 мин (колонка KINETEX-1,7u XB-C18, 0,05% FA в воде с ACN) и Хиральная ВЭЖХ~93% МЕТОД СЖХ: Объем введенной пробы:10, Растворитель:0,5% DEA в метаноле, Колонка: Chiralpak LuxCellulose-2 (4,6*250) мм, 5 мкм, Температура колонки:30, Поток:4, Давление:100, RT:2,67 мин.
Исследование связывания с глюкокортикоидным рецептором
Связывание GR измеряли с использованием коммерчески доступного набора (A-15897, Life Technologies) со считыванием флуоресцентной поляризации. 4 нM рекомбинантный полноразмерный рецепторный белок инкубировали с увеличением концентрации лиганда GR, 2,5 нM флуоресцентно меченного вещества (Fluormone GS1, Kd= 0,75нM +/- 0,25нM) и 100мкM стабилизирующего пептида в течение 2 ч при комнатной температуре. Тестируемые соединения разбавили ДМСО на семь порядков, дополнительно разбавили в аналитическом буфере и распределили по 384-луночным планшетам. Предел чувствительности данного анализа составлял 2-4 нM. Замена меченого вещества 10 мкM дексаметазоном была использована для определения окна анализа.
Данные обрабатывались путем подгонки к сигмоидальной кривой.
Абсолютные значения (Abs) IC50 и Emax определяли по кривой.
Диапазоны Abs IC50 исследования связывания с глюкокортикоидным рецептором
* Указывает Abs IC50<100 нM
** Указывает 100 нM < Abs IC50<300 нM
*** Указывает 300 нM < Abs IC50
Результаты приведены в Таблице 4.
Ингибирование ФНО-альфа из МКПК человека
МКПК выделили из свежего светлого края кровяного сгустка с помощью центрифугирования с использованием пробирок lymphoprep (Medinor AB, номер по каталогу 1019818). Выделенные МКПК промыли в аналитическом буфере (RPMI1640 с 25 мM HEPES, 1% пенициллин/стрептомицин, 200 мM L-глутамин и 10% околоплодной сыворотки теленка). Избыток МКПК был заморожен в питательной среде, содержащей дополнительное количество 10% околоплодной сыворотки теленка и 5% ДМСО. В день анализа свежие клетки или криоконсервированные клетки после оттаивания промывали в бессывороточной питательной среде (RPMI1640 с 25 мM HEPES, 1% пенициллин/стрептомицин, 200 мM L глутамин и 0,5% человеческий сывороточный альбумин) и подсчитывали, чтобы определить долю живых клеток (как правило, >95%).
Тестируемые соединения разбавили в ДМСО на семь порядков, дополнительно разбавили в бессывороточной питательной среде и распределили по 384-луночным планшетам. К клеткам прибавили LPS до окончательной концентрации 1мкг/мл. Сразу после этого добавляли титруемые тестируемые соединения и инкубировали 18 часов при 37oC
Уровень TNF-a в супернатанте культуры количественно определяли с помощью AlphaLISA (Perkin Elmer). 2-(3,5-дихлор-4-пиридинил)-1-(7-метоксиспиро[1,3-бензодиоксол-2,1'-циклопентан]-4-ил)этанон (CAS 185406-34-2) в 100 x IC50 использовали для определения окна анализа.
Данные обрабатывались путем подгонки к сигмоидальной кривой. EC50 и Emax определяли по кривой.
Ингибирование высвобождение ФНО-альфа; диапазоны EC50
* Указывает EC50<100 нM
** Указывает 100 нM < EC50<300 нM
*** Указывает 300 нM < EC50
Результаты приведены в Таблице 4.
Исследование микросом печени человека (HLM)
Инкубацию тестируемых соединений в ДМСО, разбавленных фосфатным буфером, pH 7,4, при 0,5 мкM проводили с микросомами печени человека (0,5 мг/мл). Процентное содержание органического растворителя в инкубируемых растворах составляло 1%. Микросомную суспензию печени человека в фосфатном буфере смешали с NADPH (1 мM) и предвраительно нагрели до 37°C перед прибавлением тестируемого соединения. Аликвоты отбирали через 0, 5, 10, 20 и 30 минут, и реакции завершили добавлением ацетонитрила, содержащего аналитический внутренний стандарт (IS).
Результаты были выражены в виде явного клиренса (Clapp) (мл/мин/кг) и коэффициента экстракции печенью (Eh) (%), рассчитанных исходя из константы скорости (k) (мин-1) деплеции тестируемого соединения.
* Указывает коэффициент экстракции (Eh) > 90%
** Указывает 50% < коэффициент экстракции (Eh) < 90%
*** Указывает коэффициент экстракции (Eh) < 50%
Результаты приведены в Таблице 4.
Исследование устойчивости цельной крови человека
Инкубацию тестируемых соединений в ДМСО, разбавленным фосфатным буфером, pH 7,4, при 0,1 мкM проводили со свежей цельной кровью человека, стабилизированной гепарином натрия. Процентное содержание органического растворителя в инкубируемых растворах составляло 1%. Инкубацию проводили при 37°C, отбирая аликвоты через 0, 15, 30, 60 и 120 минут, и реакции завершили добавлением ацетонитрила, содержащего аналитический внутренний стандарт (IS). Исследовали деплецию соединений, используя специфический для соединений ЖХ/МС/МС метод.
Результаты были выражены в виде времени полужизни (T½) в минутах, рассчитанном исходя из константы скорости (k) (мин-1) деплеции тестируемых соединений.
Некоторые соединения по данному изобретению тестировали в исследовании устойчивости цельной крови человека.
Исследование устойчивости кератиноцитов
Инкубацию исследуемых соединений в ДМСО, разбавленных питательной средой (питательная среда для кератиноцитов EpiLife, Cascade Biologics номер по каталогу M-EPI-500-CA, без добавок для роста или антибиотиков), pH ~7,4, в 1 мкM проводили с высеянными в чашки Петри кератиноцитами. Процентное содержание органического растворителя в инкубированных растворах составляло 0,01%. Инкубацию проводили при 37°C, отбирая аликвоты через 0, 1, 3 и 6 часов, и реакции завершили добавлением ацетонитрила, содержащего аналитический внутренний стандарт (IS).
Результаты были выражены в виде времени полужизни (T½) в минутах, расчитанном исходя из наблюдаемой константы скорости (k) (мин-1) деплеции соединения.
Некоторые соединения по данному изобретению тестировали в исследовании устойчивости кератиноцитов.
Таблица 4
Далее представлены дополнительные варианты реализации данного изобретения:
Вариант реализации изобретения 1. Соединение формулы (I)

где
R1 выбирают из группы, состоящей из 5- и 6-членного гетероарила, (C1-C6)алкила, (C3-C6)циклоалкила, (4-6)-членного гетероциклоалкила и фенила, причем указанный 5- и 6-членный гетероарил, (C1-C6)алкил, (C3-C6)циклоалкил, (4-6)-членный гетероциклоалкил и фенил необязательно замещен одним или большим количеством заместителей, независимо выбранных из (C1-C4)алкила, (C1-C4)алкокси, галогена, гидроксила и циано;
R2 выбирают из (C1-C3)алкила и галоген(C1-C3)алкила;
R3 выбирают из фенила, 5-членного гетероарила и 6-членного гетероарила, причем указанный фенил, 5-членный гетероарил и 6-членный гетероарил необязательно замещены одним или большим количеством заместителей, независимо выбранных из R5;
R4 выбирают из водорода, галогена, (C1-C4)алкила и галоген(C1-C4)алкила;
R5 выбирают из галогена, циано, (C1-C6)алкила, (C3-C6)циклоалкила, (C1-C6)алкокси, галоген(C1-C6)алкила, галоген(C1-C6)алкокси, гидрокси(C1-C6)алкила, фенила, 5-членного гетероарила, 6-членного гетероарила и -S(O)2Ra, где Ra представляет собой (C1-C4)алкил;
X1 выбирают из CH, C(Rb) и N, где Rb представляет собой галоген, (C1-C4)алкил или галоген(C1-C4)алкил;
X2 выбирают из CH и N;
Y выбран из -NH- и -O-;
m равно 0 или 1; n равно 0 или 1;
L представляет собой связь, -O-, -NH- или -N(Rc)-, егде Rc представляет собой (C1-C4)алкил;
или его фармацевтически приемлемые соли, гидраты или сольваты.
Вариант реализации изобретения 2. Соединение в соответствии с вариантом реализации изобретения 1 общей формулы (Ia).

где R1, R2, R3, R4, R5, X1, X2, Y, L, m, n и L являются такими, как указано в варианте реализации изобретения 1, или их фармацевтически приемлемые соли, гидраты или сольваты.
Вариант реализации изобретения 3. Соединение в соответствии с любым из вариантов реализации изобретения 1-2 общей формулы (Ib)

где R1, R2, R3, R4, R5, X1, X2, Y, L, m, n и L являются такими, как указано в варианте реализации изобретения 1, или их фармацевтически приемлемые соли, гидраты или сольваты.
Вариант реализации изобретения 4. Соединение в соответствии с любым из вариантов реализации изобретения 1-3 общей формулы (Ic)

где R1, R2, R3, R4, R5, X1, X2, Y, L, m, n и L являются такими, как указано в варианте реализации изобретения 1, или их фармацевтически приемлемые соли, гидраты или сольваты.
Вариант реализации изобретения 5. Соединение в соответствии с любым из вариантов реализации изобретения 1-3 общей формулы (Id).

где R1, R2, R3, R4, R5, X1, X2, Y, L, m, n и L являются такими, как указано в варианте реализации изобретения 1, или их фармацевтически приемлемые соли, гидраты или сольваты.
Вариант реализации изобретения 6. Соединение в соответствии с любым из вариантов реализации изобретения 1-5 общей формулы (Ie).

где R1, R2, R3, R4, R5, X1, X2, Y, L, m, n и L являются такими, как указано в варианте реализации изобретения 1, или их фармацевтически приемлемые соли, гидраты или сольваты.
Вариант реализации изобретения 7. Соединение в соответствии с любым из вариантов реализации изобретения 1-6 общей формулы (Ih),

где R1, R2, R3, R4, R5, X1, X2, Y, L, m, n и L являются такими, как указано в варианте реализации изобретения 1, или их фармацевтически приемлемые соли, гидраты или сольваты.
Вариант реализации изобретения 8. Соединение в соответствии с любым из вариантов реализации изобретения 1-7, где R1 выбирают из группы, состоящей из 5-членного гетероарила, (C1-C6)алкила, (C3-C6)циклоалкила и (4-6)-членного гетероциклоалкила, причем указанный 5-членный гетероарил, (C1-C6)алкил, (C3-C6)циклоалкил и (4-6)-членный гетероциклоалкил необязательно замещен одним или большим количеством заместителей, независимо выбранных из (C1-C4)алкила, (C1-C4)алкокси, галогена и гидроксила.
Вариант реализации изобретения 9. Соединение в соответствии с любым из вариантов реализации изобретения 1-7 где R1 представляет собой 5-членный гетероарил, необязательно замещенный одним или большим количеством заместителей, независимо выбранных из (C1-C4)алкила, (C1-C4)алкокси, галогена, гидроксила и циано; R2 представляет собой метил; R3 представляет собой фенил, причем указанный фенил замещен одним или большим количестом заместителей, независимо выбранных из R5; R4 представляет собой водород и X2 представляет собой CH.
Вариант реализации изобретения 10. Соединение в соответствии с любым из вариантов реализации изобретения 1-7, где R1 представляет собой (C1-C6)алкил, необязательно замещенный одним или большим количестом заместителей, независимо выбранных из (C1-C4)алкила, (C1-C4)алкокси, галогена, гидроксила и циано; R2 представляет собой метил; R3 представляет собой фенил, причем указанный фенил замещен одним или большим количестом заместителей, независимо выбранных из R5; R4 представляет собой водород и X2 представляет собой CH.
Вариант реализации изобретения 11. Соединение в соответствии с любым из вариантов реализации изобретения 1-7, где R1 представляет собой (4-6)-членный гетероциклоалкил, необязательно замещенный одним или большим количестом заместителей, независимо выбранных из (C1-C4)алкила, (C1-C4)алкокси, галогена, гидроксила и циано; R2 представляет собой метил; R3 представляет собой фенил, причем указанный фенил замещен одним или большим количестом заместителей, независимо выбранных из R5; R4 представляет собой водород и X2 представляет собой CH.
Вариант реализации изобретения 12. Соединение в соответствии с любым из вариантов реализации изобретения 1-7, где R1 выбирают из группы, состоящей из имидазолила, тиадиазолила, тиазолила, оксадиазолила, пиразолила, тетрагидрофуранила, триазолила, оксазолила, изоксазолила, изотиазолила, метила, этила, пропила, изопропила, циклопропила и циклобутила, причем указанный имидазолил, тиадиазолил, тиазолил, оксадиазолил, пиразолил, тетрагидрофуранил, триазолил, оксазолил, изоксазолил, изотиазолил, метил, этил, пропил, изопропил, циклопропил и циклобутил необязательно замещен одним или большим количеством заместителей, независимо выбранных из метила, метокси, гидроксила и фтора.
Вариант реализации изобретения 13. Соединение в соответствии с любым из вариантов реализации изобретения 1-8, где R2 представляет собой (C1-C3)алкил.
Вариант реализации изобретения 14. Соединение в соответствии с любым из вариантов реализации изобретения 1-13, где R2 представляет собой метил.
Вариант реализации изобретения 15. Соединение в соответствии с любым из вариантов реализации изобретения 1-14, где R3 представляет собой фенил, который замещен одним или большим количестом заместителей, независимо выбранных из R5.
Вариант реализации изобретения 16. Соединение в соответствии с любым из вариантов реализации изобретения 1-15, где R3 представляет собой фенил, который замещен одним или большим количестом заместителей, независимо выбранных из галогена, (C1-C6)алкила, (C3-C6)циклоалкила и фенила.
Вариант реализации изобретения 17. Соединение в соответствии с любым из вариантов реализации изобретения 1-16, где R5 выбран из галогена, (C1-C6)алкила, (C3-C6)циклоалкила и фенила.
Вариант реализации изобретения 18. Соединение в соответствии с любым из вариантов реализации изобретения 1-17, где R5 выбран из брома, метила, этила, циклопропила и фенила.
Вариант реализации изобретения 19. Соединение в соответствии с любым из вариантов реализации изобретения 1-18, где R4 представляет собой водород.
Вариант реализации изобретения 20. Соединение в соответствии с любым из вариантов реализации изобретения 1-19, где X1 выбран из CH и N.
Вариант реализации изобретения 21. Соединение в соответствии с любым из вариантов реализации изобретения 1-20, где X1 представляет собой CH.
Вариант реализации изобретения 22. Соединение в соответствии с любым из вариантов реализации изобретения 1-20, где X1 представляет собой N.
Вариант реализации изобретения 23. Соединение в соответствии с любым из вариантов реализации изобретения 1-22, где X2 представляет собой CH.
Вариант реализации изобретения 24. Соединение в соответствии с любым из вариантов реализации изобретения 1-23, где X1 представляет собой N, X2 представляет собой CH и Y представляет собой -NH-.
Вариант реализации изобретения 25. Соединение в соответствии с любым из вариантов реализации изобретения 1-23, где X1 представляет собой CH, X2 представляет собой CH и Y представляет собой -O-.
Вариант реализации изобретения 26. Соединение в соответствии с любым из вариантов реализации изобретения 1-25, в котором m равно 0 и n равно 1.
Вариант реализации изобретения 27. Соединение в соответствии с любым из вариантов реализации изобретения 1-26, где L представляет собой связь, -O- или -NH-.
Вариант реализации изобретения 28. Соединение в соответствии с любым из вариантов реализации изобретения 1-27, где L представляет собой связь.
Вариант реализации изобретения 29. Соединение в соответствии с любым из вариантов реализации изобретения 1-28, где X1 представляет собой CH, X2 представляет собой CH, Y представляет собой -O-, m равно 0, n равно 1 и L представляет собой связь.
Вариант реализации изобретения 30. Соединение в соответствии с любым из вариантов реализации изобретения 1-28, где X1 представляет собой CH, X2 представляет собой CH, Y представляет собой NH, m равно 0, n равно 1 и L представляет собой связь.
Вариант реализации изобретения 31. Соединение в соответствии с любым из вариантов реализации изобретения 1-28, где X1 представляет собой N, X2 представляет собой CH, Y представляет собой NH, m равно 0, n равно 1 и L представляет собой связь.
Вариант реализации изобретения 32. Соединение в соответствии с любым из вариантов реализации изобретения 1-31, выбранное из
N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамида,
5-[(1R,2S)-1-(4-циклопропилфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамида,
5-[(1R,2S)-1-(4-циклопропилфенил)-2-(2,2-дифторпропаноиламино)пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамида,
N-[(1S,2R)-2-(4-циклопропилфенил)-1-метил-2-[[6-[[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]карбамоил]-3-пиридил]окси]этил]изотиазол-3-карбоксамида,
N-[(1S,2R)-2-(4-циклопропилфенил)-1-метил-2-[[6-[[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]карбамоил]-3-пиридил]окси]этил]изотиазол-5-карбоксамида,
N-[(1S,2R)-2-(4-циклопропилфенил)-1-метил-2-[[6-[[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]карбамоил]-3-пиридил]окси]этил]оксазол-2-карбоксамида,
N-[(1S,2R)-2-(4-циклопропилфенил)-1-метил-2-[[6-[[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]карбамоил]-3-пиридил]окси]этил]тиазол-4-карбоксамида,
N-[(1S,2R)-2-(4-циклопропилфенил)-1-метил-2-[[6-[[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]карбамоил]-3-пиридил]окси]этил]-3-метил-изоксазол-5-карбоксамида,
N-[(1S,2R)-2-(4-циклопропилфенил)-1-метил-2-[[6-[[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]карбамоил]-3-пиридил]окси]этил]оксазол-5-карбоксамида,
5-[(1R,2S)-1-(4-циклопропилфенил)-2-[[(2S)-2-гидроксибутаноил]амино]пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамида,
5-[(1R,2S)-1-(4-циклопропилфенил)-2-[[(2R)-2гидроксипропаноил]амино]пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамид,
N-[(1S,2R)-2-(4-циклопропилфенил)-1-метил-2-[[6-[[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]карбамоил]-3-пиридил]окси]этил]изоксазол-5-карбоксамида,
5-[(1R,2S)-1-(4-циклопропилфенил)-2-[[(2R)-2-гидроксибутаноил]амино]пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамида,
5-[(1R,2S)-1-(4-циклопропилфенил)-2-[(2-метоксиацетил)амино]пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамида,
5-[(1R,2S)-1-(4-циклопропилфенил)-2-[(2-гидрокси-2-метил-пропаноил)амино]пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамида,
5-[(1R,2S)-1-(4-циклопропилфенил)-2-(3-гидроксипропаноиламино)пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамида,
5-[(1R,2S)-1-(4-циклопропилфенил)-2-[(1-гидроксициклобутанкарбонил)амино]пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамида,
5-[(1R,2S)-1-(4-циклопропилфенил)-2-[(1-гидроксициклопропанкарбонил)амино]пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамида,
N-[(1S,2R)-2-(4-циклопропилфенил)-1-метил-2-[[6-[[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]карбамоил]-3-пиридил]окси]этил]оксазол-4-карбоксамида,
5-[(1R,2S)-1-(4-циклопропилфенил)-2-[[(2S)-тетрагидрофуран-2-карбонил]амино]пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамида,
5-[(1R,2S)-1-(4-циклопропилфенил)-2-[(2-гидроксиацетил)амино]пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамида,
5-[(1R,2S)-1-(4-циклопропилфенил)-2-[[(2R)-тетрагидрофуран-2-карбонил]амино]пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамида,
N-[(1S,2R)-2-(4-циклопропилфенил)-1-метил-2-[[6-[[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]карбамоил]-3-пиридил]окси]этил]изоксазол-3-карбоксамида,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-(1,2,5-тиадиазол-3-карбониламино)пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(5-метилтиазол-2-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-(тиазол-5-карбониламино)пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(4-метил-1,2,5-оксадиазол-3-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(5-метилтиазол-4-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(4-метилтиазол-5-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(5-метил-1,3,4-оксадиазол-2-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(4-метилтиадиазол-5-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(4-метилоксазол-5-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(2-метоксиацетил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(2-метилпиразол-3-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(2-метилтиазол-5-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[[(2R)-тетрагидрофуран-2-карбонил]амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(3-метилтриазол-4-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-(1,2,4-оксадиазол-3-карбониламино)пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(1-метилимидазол-2-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(3-метилизоксазол-5-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(5-метил-1,2,4-оксадиазол-3-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(1-метилимидазол-4-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-(изотиазол-3-карбониламино)пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(3-метилизоксазол-4-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-(тиазол-2-карбониламино)пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-(изотиазол-5-карбониламино)пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(5-метилизотиазол-4-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-(оксазол-2-карбониламино)пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-(оксазол-5-карбониламино)пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-(изоксазол-3-карбониламино)пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-(тиадиазол-4-карбониламино)пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(5-метилизоксазол-3-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-(изоксазол-5-карбониламино)пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-(тиазол-4-карбониламино)пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(3-метил-1,2,4-оксадиазол-5-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(1-метилпиразол-3-карбонил)амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-(2,2-дифторпропаноиламино)пропокси]бензоата,
N-[(3R)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамида,
N-[(3R)-1-[(3S)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамида,
N-[(3R)-1-[(2S)-5-оксотетрагидрофуран-2-карбонил]-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамида,
N-[(3R)-1-[(2R)-5-оксотетрагидрофуран-2-карбонил]-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамида,
N-[(3S)-1-[(3S)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамида,
N-[(3S)-1-[(2S)-5-оксотетрагидрофуран-2-карбонил]-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамида,
N-[(3R)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]пирролидин-3-ил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамида,
5-[(1R,2S)-1-(4-этилфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамида,
5-[(1R,2S)-1-(4-бромфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]-N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]пиридин-2-карбоксамида,
N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]-5-[(1R,2S)-1-(4-фенилфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамида,
N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]-4-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензамида,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензоата,
N-[(3S)-1-[[(3S)-5-оксотетрагидрофуран-3-ил]карбамоил]-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамида,
N-[(3S)-1-[[(3R)-5-оксотетрагидрофуран-3-ил]карбамоил]-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамида,
[(3S)-2-оксотетрагидрофуран-3-ил] (3S)-3-[[5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилата,
[(3R)-2-оксотетрагидрофуран-3-ил] (3S)-3-[[5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилата,
[(3S)-5-оксотетрагидрофуран-3-ил] (3S)-3-[[5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилата,
[(34)-5-оксотетрагидрофуран-3-ил] (3S)-3-[[5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилата,
[(3S)-1-[(3S)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[[(2R)-тетрагидрофуран-2-карбонил]амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[[(2S)-тетрагидрофуран-2-карбонил]амино]пропокси]бензоата,
[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[[(2R)-тетрагидрофуран-2-карбонил]амино]пропокси]бензоата,
N-[(3S)-1-[(3S)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]-5-[(1S,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамида или
N-[(3S)-1-[(3R)-5-оксотетрагидрофуран-3-карбонил]-3-пиперидил]-5-[(1S,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамида
или их фармацевтически приемлемых солей, гидратов или сольватов.
Вариант реализации изобретения 33. Соединение в соответствии с любым из вариантов реализации изобретения 1-32 для применения в терапии.
Вариант реализации изобретения 34. Соединение в соответствии с любым из вариантов реализации изобретения 1-32 для применения в профилактике, лечении или облегчении воспалительных, аллергических или пролиферативных дерматологических заболеваний или патологических состояний.
Вариант реализации изобретения 35. Соединение в соответствии с вариантом реализации изобретения 34 для применения в профилактике, лечении или облегчении атопического дерматита, псориаза или экземы.
Вариант реализации изобретения 36. Фармацевтическая композиция, содержащая соединение в соответствии с любым из вариантов реализации изобретения 1-32 вместе с фармацевтически приемлемой несущей средой или эксципиентом или фармацевтически приемлемым носителем(ями).
Вариант реализации изобретения 37. Фармацевтическая композиция в соответствии с вариантом реализации изобретения 36 вместе с одним или большим количеством других терапевтически активного(ых) соединения (соединений).
Вариант реализации изобретения 38. Применение соединения в соответствии с вариантами реализации изобретения 1-32 в производстве лекарственного средства для профилактики, лечения или улучшения воспалительных, аллергических или пролиферативных дерматологических заболеваний или состояний.
Вариант реализации изобретения 39. Способ профилактики, лечения или облегчения воспалительных, аллергических или пролиферативных дерматологических заболеваний или патологических состояний, включающий введение человеку, страдающему по меньшей мере одним из указанных заболеваний или расстройств, эффективного количества одного или большего количества соединений в соответствии с любым из вариантов реализации изобретения 1-32, необязательно вместе с фармацевтически приемлемым носителем или одним или большим количеством эксципиентов, необязательно в сочетании с другими терапевтически активными соединениями.
Вариант реализации изобретения 40. Соединение в соответствии с любым из вариантов реализации изобретения 1-32 для применения при лечении заболевания, расстройства или патологического состояния, при котором заболевание, расстройство или патологическое состояние восприимчиво к модуляции глюкокортикоидного рецептора.
Вариант реализации изобретения 41. Соединение общей формулы (VI)

где
R1 выбирают из группы, состоящей из 5- и 6- членного гетероарила, (C1-C6)алкила, (C3-C6)циклоалкила, (4-6)-членного гетероциклоалкила и фенила, причем указанный 5- и 6-членный гетероарил, (C1-C6)алкил, (C3-C6)циклоалкил, (4-6)-членный гетероциклоалкил и фенил необязательно замещен одним или большим количеством заместителей, независимо выбранных из (C1-C4)алкила, (C1-C4)алкокси, галогена, гидроксила и циано;
R2 выбирают из (C1-C3)алкила и галоген(C1-C3)алкила;
R3 выбирают из фенила, 5-членного гетероарила и 6-членного гетероарила, причем указанный фенил, 5-членный гетероарил и 6-членный гетероарил необязательно замещены одним или большим количеством заместителей, независимо выбранных из R5;
R4 выбирают из водорода, галогена, (C1-C4)алкила и галоген(C1-C4)алкила;
R5 выбирают из галогена, циано, (C1-C6)алкила, (C3-C6)циклоалкила, (C1-C6)алкокси, галоген(C1-C6)алкила, галоген(C1-C6)алкокси, гидрокси(C1-C6)алкила, фенила, 5-членного гетероарила, 6-членного гетероарила и -S(O)2Ra, где Ra представляет собой (C1-C4)алкил;
X1 выбирают из CH, C(Rb) и N, где Rb представляет собой галоген, (C1-C4)алкил или галоген(C1-C4)алкил;
X2 выбирают из CH и N.
Вариант реализации изобретения 42. Соединение в соответствии с вариантом реализации изобретения 41, выбранное из
5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоновой кислоты,
5-[(1R,2S)-1-(4-этилфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоновой кислоты,
4-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензойной кислоты,
5-[(1R,2S)-1-(4-бромфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоновой кислоты,
4-[(1R,2S)-1-(4-бромфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензойной кислоты,
5-[(1S,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино] пропокси]пиридин-2-карбоновой кислоты.
Вариант реализации изобретения 43. Соединение общей формулы (II)

где
R1 выбирают из группы, состоящей из 5- и 6- членного гетероарила, (C1-C6)алкила, (C3-C6)циклоалкила, (4-6)-членного гетероциклоалкила и фенила, причем указанный 5- и 6-членный гетероарил, (C1-C6)алкил, (C3-C6)циклоалкил, (4-6)-членный гетероциклоалкил и фенил необязательно замещен одним или большим количеством заместителей, независимо выбранных из (C1-C4)алкила, (C1-C4)алкокси, галогена, гидроксила и циано;
R2 выбирают из (C1-C3)алкила и галоген(C1-C3)алкила;
R3 выбирают из фенила, 5-членного гетероарила и 6-членного гетероарила, причем указанный фенил, 5-членный гетероарил и 6-членный гетероарил необязательно замещены одним или большим количеством заместителей, независимо выбранных из R5;
R4 выбран из водорода, галогена, (C1-C4)алкила и галоген(C1-C4)алкила;
R5 выбирают из галогена, циано, (C1-C6)алкила, (C3-C6)циклоалкила, (C1-C6)алкокси, галоген(C1-C6)алкила, галоген(C1-C6)алкокси, гидрокси(C1-C6)алкила, фенила, 5-членного гетероарила, 6-членного гетероарила и -S(O)2Ra, где Ra представляет собой (C1-C4)алкил;
X1 выбирают из CH, C(Rb) и N, где Rb представляет собой галоген, (C1-C4)алкил или галоген(C1-C4)алкил;
X2 выбирают из CH и N;
Y выбирают из -NH- и -O-;
m равно 0 или 1; n равно 0 или 1,
или его фармацевтически приемлемая соль.
Вариант реализации изобретения 44. Соединение в соответствии с вариантом реализации изобретения 43, выбранное из
N-[(3S)-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамида,
N-[(3R)-3-пиперидил]-5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбоксамида,
5-[(1R,2S)-1-(4-этилфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]-N-[(3S)-3-пиперидил]пиридин-2-карбоксамида,
5-[(1R,2S)-1-(4-циклопропилфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]-N-[(3S)-3-пиперидил]пиридин-2-карбоксамида,
5-[(1R,2S)-1-(4-циклопропилфенил)-2-[[(2R)-тетрагидрофуран-2-карбонил]амино]пропокси]-N-[(3S)-3-пиперидил]пиридин-2-карбоксамида,
N-[(1S,2R)-2-(4-циклопропилфенил)-1-метил-2-[[6-[[(3S)-3-пиперидил]карбамоил]-3-пиридил]окси]этил]изоксазол-3-карбоксамида,
5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]-N-[(3R)пирролидин-3-ил]пиридин-2-карбоксамида,
5-[(1R,2S)-1-(4-бромфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]-N-[(3S)-3-пиперидил]пиридин-2-карбоксамида,
N-[(3S)-3-пиперидил]-4-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензамида,
[(3S)-3-пиперидил] 4-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензоата,
[(3S)-3-пиперидил] 4-[(1R,2S)-1-(4-циклопропилфенил)-2-[[(2S)-тетрагидрофуран-2-карбонил]амино]пропокси]бензоат гидрохлорида,
трет-бутил-(3S)-3-[[5-[(1S,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилата.
Вариант реализации изобретения 45. Соединение общей формулы (Va)

где
R1 выбирают из группы, состоящей из 5- и 6- членного гетероарила, (C1-C6)алкила, (C3-C6)циклоалкила, (4-6)-членного гетероциклоалкила и фенила, причем указанный 5- и 6-членный гетероарил, (C1-C6)алкил, (C3-C6)циклоалкил, (4-6)-членный гетероциклоалкил и фенил необязательно замещен одним или большим количеством заместителей, независимо выбранных из (C1-C4)алкила, (C1-C4)алкокси, галогена, гидроксила и циано;
R2 выбирают из (C1-C3)алкила и галоген(C1-C3)алкила;
R3 выбирают из фенила, 5-членного гетероарила и 6-членного гетероарила, причем указанный фенил, 5-членный гетероарил и 6-членный гетероарил необязательно замещены одним или большим количеством заместителей, независимо выбранных из R5;
R4 выбирают из водорода, галогена, (C1-C4)алкила и галоген(C1-C4)алкила;
R5 выбирают из галогена, циано, (C1-C6)алкила, (C3-C6)циклоалкила, (C1-C6)алкокси, галоген(C1-C6)алкила, галоген(C1-C6)алкокси, гидрокси(C1-C6)алкила, фенила, 5-членного гетероарила, 6-членного гетероарила и -S(O)2Ra, где Ra представляет собой (C1-C4)алкил;
X1 выбирают из CH, C(Rb) и N, где Rb представляет собой галоген, (C1-C4)алкил или галоген(C1-C4)алкил;
X2 выбирают из CH и N;
Y выбирают из -NH- и -O-;
m равно 0 или 1; n равно 0 или 1.
Вариант реализации изобретения 46. Соединение в соответствии с вариантом реализации изобретения 45, выбранное из
трет-бутил-(3S)-3-[[5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилата,
трет-бутил-(3S)-3-[[5-[(1R,2S)-1-(4-бромфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилата,
трет-бутил-(3S)-3-[[5-[(1R,2S)-1-(4-циклопропилфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилата,
трет-бутил-(3S)-3-[[5-[(1R,2S)-1-(4-циклопропилфенил)-2-[[(2R)-тетрагидрофуран-2-карбонил]амино]пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилата,
трет-бутил-(3S)-3-[[5-[(1R,2S)-1-(4-циклопропилфенил)-2-(изоксазол-3-карбониламино)пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилата,
трет-бутил-(3S)-3-[4-[(1R,2S)-1-(4-бромфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензоил]оксипиперидин-1-карбоксилата,
трет-бутил-(3S)-3-[4-[(1R,2S)-1-(4-циклопропилфенил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензоил]оксипиперидин-1-карбоксилата,
трет-бутил-(3R)-3-[[5-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбонил]амино]пирролидин-1-карбоксилата,
трет-бутил-(3S)-3-[[4-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензоил]амино]пиперидин-1-карбоксилата и
трет-бутил-(3S)-3-[4-[(1R,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]бензоил]оксипиперидин-1-карбоксилата,
трет-бутил-(3S)-3-[[5-[(1S,2S)-1-(п-толил)-2-[(2,2,2-трифторацетил)амино]пропокси]пиридин-2-карбонил]амино]пиперидин-1-карбоксилата.
Реферат
Настоящее изобретение относится к новым нестероидным соединениям, которые являются эффективными модуляторами глюкокортикоидного рецептора, и промежуточным соединениям для иполучения, к указанным соединениям для применения в терапии, фармацевтическим композициям, содержащим указанные соединения, к способам лечения заболеваний указанными соединениями и применению указанных соединений в производстве лекарственных средств. 7 н. и 5 з.п. ф-лы, 4 табл., 3 ил., 81 пр.
Формула

Документы, цитированные в отчёте о поиске
Пиримидинциклогексильные модуляторы глюкокортикоидных рецепторов
Способ получения нестероидного модулятора глюкокортикоидных рецепторов и промежуточные соединения







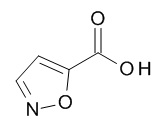



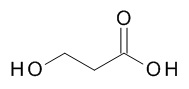
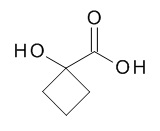






















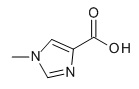












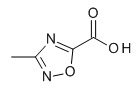


Комментарии