Блокатор натриевых каналов - RU2705578C1
Код документа: RU2705578C1
Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится соединению, имеющему активность блокирования натриевых каналов, способу его получения и его применению.
УРОВЕНЬ ТЕХНИКИ
Потенциалуправляемые натриевые (Nav) каналы обнаружены во всех возбудимых клетках, включая мышечные и нервные клетки центральной и периферической нервных систем. Натриевые каналы являются важными для инициации и распространения электрического сигнала в нервной системе. Следовательно, корректная работа функция натриевых каналов является важной для нормального функционирования нервов. В конечном счете, аномальные Nav каналы играют важную роль в развитии различных заболеваний, таких как эпилепсия, аритмия, миотония, атаксия, множественный склероз, синдром раздраженного кишечника, непроизвольное мочеиспускание, висцеральная боль, депрессия и различные типы боли. К настоящему времени в человеческом организме обнаружено десять типов Nav каналов (Nav 1.1-1.9, Nax). Среди них имеется четыре канала Nav1.3, Nav1.7, Nav1.8 и Nav1.9, о которых известно, что они тесно связаны с передачей болевого сигнала и которые, таким образом, признаны важными мишенями для обезболивающих средств.
В общей сложности найдено десять типов Nav каналов, представленных в приведенной ниже таблице 1. Среди этих десяти типов девять типов каналов Nav1.1-Nav1.9, включая NG 1.3, Nav1.6, Nav1.7, Nav1.8 и Nav1.9, экспрессируются в DRG.
Таблица 1
В частности, известно, что Nav1.7 предпочтительно экспрессируется в дорсальных корешковых ганглиях (DRG) и симпатических ганглиях. В DRG сенсорных ганглиях, канал Nav1.7 экспрессируется в A- или C-нервных волокнах, но часто распределен в нейронах малого размера, имеющих тесную связь с болью. В частности, 85% DRG присутствуют в клетках, определенных как ноцицепторы. Этот факт указывает на то, что Nav1.7 тесно связан с болью.
Тот факт, что Nav1.7 канал имеет тесную связь с болью хорошо доказан результатами исследований не только на животных, но также исследованиями заболеваний у человека. Результаты исследований на животных указывают на то, что при воспалении в значительной степени увеличивается уровень транскрипта гена Nav1.7, а также усиливается экспрессия белков. Предполагается, что такое увеличение транскрипта обусловлено увеличением уровня NGF. Считается, что повышенная экспрессия Nav1.7 является непосредственной причиной увеличения возбудимости сенсорных клеток. В частности, при удалении или уменьшении Nav1.7 канала воспалительная боль уменьшается в значительной степени. Однако исследования на животных не указывают на то, что удаление или уменьшение гена канала Nav1.7 ослабляет невропатическую боль. При этом, имеется много свидетельств участия Nav1.7 в невропатической боли у людей.
Результаты исследования представителей родословных линий, которые испытывают сильную боль или не ощущают боли, позволили ответить на многие вопросы, связанные с изучением боли. В частности, эти результаты непосредственно указывают на важную роль Nav1.7 в ощущении боли. Существует два типа наследственных заболеваний, которые вызывают сильные боли. Среди этих заболеваний следует отметить случаи эритромелалгии или эритермалгии, при которых иногда ощущается сильная боль в течение нескольких часов, когда тело слегка разогрето или в случае физических нагрузок. В некоторых случаях кожа становится красной, а руки, ступни или лицо опухают. Результаты генетических исследований показали, что SCN9A (название человеческого гена Nav1.7) находится на хромосомных участках, связанных с заболеваниями. К настоящему времени обнаружено девять мутаций Nav1.7. Эти мутации снижают порог активации или приводят к медленной инактивации канала. Таким образом, эти мутации могут легко генерировать потенциал действия даже при деполяризации некоторых нейронов (см. Dib-Hajj, S D. et al., Trends in Neurosci., 30, 555-563:(2007)).
В случае пароксизмального экстремального болевого расстройства (PEPD), являющимся другим наследственным заболеванием, боль ощущается в течение всей жизни и возникает при опорожнении кишечника или стимуляции анальной области. Дополнительно к болевым ощущениям краснеют ноги. Как известно в данной области техники, в случае PEPD Nav1.7 содержит восемь мутаций. Эти мутации находятся в основном на участках, которые вызывают инактивацию. Канал Nav имеет инактивационный ʺшарикʺ (ворота) в линкере между доменами III и IV, и участок приема пептида в линкере между сегментами S5 и S6 доменов III и IV. Интересным оказалось то, что все мутации, которые вызывают PEPD, находятся в этих двух участках. Вероятно, они связаны с проблемой инактивации Nav1.7. Как и ожидалось, эти мутации затрудняют инактивацию Nav1.7, что приводит к медленной инактивации этого канала (см. Fertleman, C. R. et al., Neuron, 52, 767-774 (2006)). Таким образом, количество электрического тока, поступающее через этот канал, увеличивается.
Еще одним наследственным заболеванием является врожденная нечувствительность к боли (CIP). Это заболевание является результатом мутации канала Nav1.7 и существует среди представителей родственных линий в Пакистане и Китае. Лица, страдающие этим заболеванием, не ощущают боль (см. Cox, J. J. et al., Nature, 444, 894-898 (2006)). CIP вызывает потерю функции канала Nav1.7. В частности, мутация в этом канале подавляет экспрессию этого канала. Таким образом, этот канал не экспрессируется (см. Cox, J. J. et al., Nature, 444, 894-898 (2006)). Интересным оказалось то, что нокаут Nav1.7 не влияет на другие ощущения. Однако он влияет на обонятельное ощущение. Этот факт является прямым указанием того, что Nav1.7 не перекрывается с другими каналами при передаче болевых сигналов, и его функция не компенсируется другими каналами Nav.
Как описано выше для вышеуказанных заболеваний, когда мутация в канале Nav1.7 вызывает усиление функции, ощущается сильная боль, а когда она вызывает потерю функции, боль облегчается. Это хороший клинический пример, который является непосредственной демонстрацией того, что канал Nav1.7 является основной причиной боли. Таким образом, разумно предположить, что что антагонист, ингибирующий этот канал, естественным образом обеспечит обезболивающий эффект.
Однако, если антагонист канала Nav1.7 подавляет множество Nav-каналов, включая канал Nav1.7, он может оказывать неблагоприятное воздействие, вызывая различные нарушения ЦНС, такие как нечеткость зрения, головокружение, рвота и депрессия. В частности, если он ингибирует канал Nav1.5, он может вызвать сердечную аритмию и сердечную недостаточность, угрожающие жизни. По этим причинам очень важным является селективное ингибирование каналов Nav1.7.
Боли можно разделить на три основные группы: острая боль, воспалительная боль и невропатическая боль. Острая боль играет важную защитную функцию поддержания безопасности организмов от стимулов, которые могут вызвать повреждение тканей. Следовательно, такая боль, как правило, является временной и интенсивной. С другой стороны, воспалительная боль может быть более продолжительной, и ее интенсивность нарастает. Воспалительная боль опосредуется различными веществами, которые выделяются во время воспаления, включая вещество P, гистамин, кислоты, простагландин, брадикинин, CGRP, цитокины, АТФ и другие вещества. Третий тип боли, невропатическая боль, связан с поражением нервов или поражением нервов, вызванным вирусной инфекцией. В этом случае происходит восстановление каскада событий с участием нейрональных белков, вызывая патологическую ʺсенсибилизациюʺ, что может приводить к хронической боли, длящейся в течение нескольких лет. Этот тип боли не обеспечивает адаптируемость и трудно поддается терапии.
В частности, невропатическая боль и некупируемая боль представляют собой до сих пор еще не решенные важные проблемы в медицине. Несколько сотен миллионов пациентов страдают от сильной боли, которая плохо купируется современными терапевтическими методами. Лекарства, которые в настоящее время используются для лечения боли, включают NSAIDS, ингибиторы COX-2, опиоиды, трициклические антидепрессанты и противосудорожные препараты. Невропатическая боль особенно трудна для лечения, поскольку она слабо реагирует на малые дозы опиоидов. В настоящее время габапентин является наиболее широко используемым препаратом в качестве терапевтического средства против невропатической боли, но он эффективен для 60% пациентов и не является высокоэффективным. Этот препарат в целом безопасен, но является проблематичным с точки зрения седативного действия при высоких дозах.
Соответственно, исследования по открытию новых регуляторов канала Nav1.7 и их использованию для лечения острой боли, хронической острой, воспалительной боли и невропатической боли активно проводились глобальными фармацевтическими компаниями, включая Merck, AstraZeneca и т. П. (см. US2010-0197655, US2012-0010183, WO2013-086229, WO2013-177224, US2012-0238579, WO2007-145922).
Принимая во внимание вышеизложенное, в результате изучения новых соединений, авторы настоящего изобретения обнаружили, что соединение, имеющее химическую структуру, отличающуюся от известных к настоящему времени блокаторов натриевых каналов, обладает превосходными эффектами блокирования натриевых каналов, что является результатом настоящего изобретения. Соединения, относящиеся к настоящему изобретению, в основном имеют активность ингибирования натриевых каналов сами по себе, но не исключают возможности проявления фармакологической активности через среду организма или продукты метаболического процесса после абсорбции в организм.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Техническая задача
Одной из задач настоящего изобретения является предоставление соединения, имеющего блокирующий эффект натриевых ионных каналов, в частности Nav 1.7, способа его получения и его применения.
Техническое решение
Для решения вышеуказанных задач настоящее изобретение предоставляет соединение, представленное ниже химической формулой 1, или его фармацевтически приемлемую соль:
Химическая формула 1

в химической формуле 1,
R1 представляет собой водород, C1-4 алкил, C1-4 алкокси, C1-4 галогеналкил, C1-4 галогеналкокси, галоген или циано,
каждый из R2 и R3 независимо представляет собой водород или галоген,
R4 представляет собой C5-10гетероарил, содержащий один или два элемента, каждый из которых независимо выбирают из группы, состоящей из N, S и O,
где C5-10гетероарил является незамещенным или замещенным C1-4алкилом или галогеном,
R5 представляет собой -CH2CH2-N(R7)(R8) или -CH2CH2CH2-N(R7)(R8),
R6представляет собой водород или C1-4 алкил; или R5 и R6вместе образуют C3-5 алкилен, (C2-4 алкилен)-N(R9)-(C2-4 алкилен) или (C2-4 алкилен)-O-(C2-4 алкилен),
где каждый из C3-5 алкилена или C2-4 алкилена независимо является незамещенным или замещенным одним или двумя R10,
каждый из R7, R8 и R9 независимо представляет собой водород или C1-4 алкил,
R10 представляет собой C1-4 алкил, C1-4 алкокси, галоген, амино, NH(C1-4 алкил), N(C1-4 алкил)2, NHCO(C1-4 алкил) или пирролидинил,
X1 представляет собой C-R' или N, где R' представляет собой водород или галоген,
X2 представляет собой CH или N, и
X3 представляет собой N-R", где R" представляет собой водород или C1-4 алкил.
Предпочтительно, соединение, представленное химической формулой 1, представлено химической формулой 1':
Химическая формула 1'

где,
R1 представляет собой водород, C1-4 алкил, C1-4 алкокси, C1-4 галогеналкил, C1-4 галогеналкокси, галоген или циано,
каждый из R2 и R3 независимо представляет собой водород или галоген,
R4 представляет собой C5-10гетероарил, содержащий один или два элемента, каждый из которых независимо выбирают из группы, состоящей из N, S и O,
R11представляет собой водород или C1-4алкил,
R12 представляет собой водород, C1-4 алкил, C1-4 алкокси, галоген, амино, NH(C1-4алкил), N(C1-4 алкил)2, NHCO(C1-4 алкил) или пирролидинил,
X1 представляет собой C-R' или N, где R' представляет собой водород или галоген,
X2 представляет собой CH или N, и
X3 представляет собой N-R", где R" представляет собой водород или C1-4 алкил,
X4 представляет собой связь, NH, N(C1-4алкил) или O (кислород), и
n является целым числом от 1 до 4.
Предпочтительно, R1 представляет собой водород, метил, метокси, трифторметил, дифторметокси, трифторметокси, фтор, хлор или циано.
Предпочтительно, каждый из R2 и R3 независимо представляет собой водород, фтор или хлор.
Предпочтительно, R4 представляет собой тиазолил, изоксазолил, оксазолил, пиразинил, пиразолил, пиридинил, пиримидинил или тиадиазолил, где R4 является незамещенным или замещенным C1-4 алкилом или галогеном.
Предпочтительно, R5 и R6вместе образуют C3-5 алкилен, (C2-4 алкилен)-N(R9)-(C2-4 алкилен) или (C2-4 алкилен)-O-(C2-4 алкилен), где каждый из C3-5 алкилена или C2-4 алкилена независимо незамещен или замещен метилом, метокси, фтором, амино, NHCH3, N(CH3)2, N(CH2CH3)2, NHCOCH3 или пирролидинилом.
Предпочтительно, R5, R6 и R5 и R6вместе с азотом, к которому они присоединены образуют любую структуру, выбранную из группы, состоящей из:

где, R10 является таким, как определено выше.
Предпочтительно, R5 представляет собой -CH2CH2-NH-CH3, -CH2CH2CH2-NH-CH3 или -CH2CH2-N(CH3)2, и R6 представляет собой водород иди метил.
Предпочтительно, X1 представляет собой CH, CF или N, X2 представляет собой CH или N, при условии, что оба X1 и X2не являются N.
Предпочтительно, X3 представляет собой NH.
Репрезентативные примеры соединения, представленные химической формулой 1, или его фармацевтически приемлемой соли являются следующими:
1) 5-хлор-2-фтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
2) 5-хлор-4-((4-хлор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид,
3) (R)-5-хлор-4-((4-хлор-2-(2-метилпиперазин-1-ил)фенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид,
4) (R)-5-хлор-4-((4-хлор-2-(3-(метиламино)пиперидин-1-ил)фенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид,
5) (R)-N-(1-(5-хлор-2-((2-хлор-5-фтор-4-(N-(тиазол-4-ил)сульфамоил)фенил)амино)фенил)пирролидин-3-ил)ацетамид,
6) 5-хлор-4-((4-хлор-2-(3-(диэтиламино)пирролидин-1-ил)фенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид,
7) 4-((2-([1,3'-бипирролидин]-1'-ил)-4-хлорфенил)амино)-5-хлор-2-фтор-N-(тиазол-4-ил)бензолсульфонамид,
8) 5-хлор-2-фтор-4-((4-метил-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
9) (S)-5-хлор-4-((4-хлор-2-(3-метилпиперазин-1-ил)фенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид,
10) 4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
11) 3-хлор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
12) 3,5-дифтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
13) 2-фтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
14) 4-((2-(3-(метиламино)пирролидин-1-ил)-4-(трифторметокси)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
15) 3,5-дифтор-4-((2-(3-(метиламино)пирролидин-1-ил)-4-(трифторметокси)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
16) 2-фтор-4-((2-(3-(метиламино)пирролидин-1-ил)-4-(трифторметокси)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
17) 5-хлор-2-фтор-4-((2-(3-(метиламино)пирролидин-1-ил)-4-(трифторметокси)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
18) 5-хлор-4-((5-хлор-3-(3-(метиламино)пирролидин-1-ил)пиридин-2-ил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид,
19) 5-хлор-4-((6-хлор-2-(3-(метиламино)пирролидин-1-ил)пиридин-3-ил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид,
20) 5-хлор-2-фтор-4-((2-(3-(метиламино)пирролидин-1-ил)-4-(трифторметил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
21) 5-хлор-4-((4-(дифторметокси)-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид,
22) (R)-4-((4-фтор-2-(3-(метиламино)пиперидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
23) (R)-2-фтор-4-((4-фтор-2-(3-(метиламино)пиперидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
24) (R)-3-хлор-4-((4-фтор-2-(3-(метиламино)пиперидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
25) (R)-3,5-дифтор-4-((4-фтор-2-(3-(метиламино)пиперидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
26) (R)-5-хлор-2-фтор-4-((4-фтор-2-(3-(метиламино)пиперидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
27) (R)-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
28) (R)-2-фтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
29) (R)-3-хлор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
30) (R)-3,5-дифтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
31) (R)-5-хлор-2-фтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
32) 5-хлор-2-фтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
33) 4-((2-(3-аминопирролидин-1-ил)-4-фторфенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид,
34) 4-((2-(3-аминопирролидин-1-ил)-4-фторфенил)амино)-3-хлор-N-(тиазол-4-ил)бензолсульфонамид,
35) 4-((2-(3-аминопирролидин-1-ил)-4-фторфенил)амино)-5-хлор-2-фтор-N-(тиазол-4-ил)бензолсульфонамид,
36) 4-((2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
37) 2-фтор-4-((2-(3-(метиламино)пирролидин-1-ил)-4-(трифторметил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
38) 3-хлор-4-((2-(3-(метиламино)пирролидин-1-ил)-4-(трифторметил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
39) 4-((4-(дифторметокси)-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид,
40) 3-хлор-4-((4-(дифторметокси)-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
41) (R)-4-((4-фтор-2-(3-фторпирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
42) (R)-2-фтор-4-((4-фтор-2-(3-фторпирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
43) (R)-3-хлор-4-((4-фтор-2-(3-фторпирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
44) (R)-3,5-дифтор-4-((4-фтор-2-(3-фторпирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
45) (R)-5-хлор-2-фтор-4-((4-фтор-2-(3-фторпирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
46) 2-фтор-4-((3-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
47) 3-хлор-4-((3-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
48) 5-хлор-2-фтор-4-((3-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
49) 2-фтор-4-((2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
50) 3-хлор-4-((2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
51) 3,5-дифтор-4-((2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
52) 5-хлор-2-фтор-4-((2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
53) 2-фтор-4-((4-метокси-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
54) 3-хлор-4-((4-метокси-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
55) 5-хлор-2-фтор-4-((4-метокси-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
56) (R)-4-((4-метокси-2-(3-(метиламино)пиперидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
57) (R)-2-фтор-4-((4-метокси-2-(3-(метиламино)пиперидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
58) (R)-3-хлор-4-((4-метокси-2-(3-(метиламино)пиперидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
59) (R)-3,5-дифтор-4-((4-метокси-2-(3-(метиламино)пиперидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
60) (R)-5-хлор-2-фтор-4-((4-метокси-2-(3-(метиламино)пиперидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
61) 3-хлор-4-((4-фтор-2-(4-метилпиперазин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
62) 5-хлор-2-фтор-4-((4-фтор-2-(4-метилпиперазин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
63) (S)-5-хлор-4-((2-(3-(диметиламино)пирролидин-1-ил)-4-фторфенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид,
64) (S)-5-хлор-4-((2-(3-(диметиламино)пирролидин-1-ил)-4-(трифторметил)фенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид,
65) 5-хлор-2-фтор-4-((2-(4-метилпиперазин-1-ил)-4-(трифторметил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
66) 5-хлор-4-((4-(дифторметокси)-2-(4-метилпиперазин-1-ил)фенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид,
67) 5-хлор-2-фтор-4-((2-(4-метилпиперазин-1-ил)-4-(трифторметокси)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
68) (S)-3-хлор-4-((2-(3-(диметиламино)пирролидин-1-ил)-4-(трифторметил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
69) (S)-2-фтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
70) (S)-5-хлор-2-фтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
71) (S)-5-хлор-4-((2-(3-(диметиламино)пирролидин-1-ил)-4-метоксифенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид,
72) (S)-5-хлор-4-((4-(дифторметокси)-2-(3-(диметиламино)пирролидин-1-ил)фенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид,
73) (R)-5-хлор-4-((2-(3-(диметиламино)пирролидин-1-ил)-4-фторфенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид,
74) (R)-5-хлор-4-((2-(3-(диметиламино)пирролидин-1-ил)-4-(трифторметил)фенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид,
75) (R)-5-хлор-4-((4-(дифторметокси)-2-(3-(диметиламино)пирролидин-1-ил)фенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид,
76) 4-((2-(1,4-диазепан1-ил)-4-фторфенил)амино)-5-хлор-2-фтор-N-(тиазол-4-ил)бензолсульфонамид,
77) 5-хлор-4-((4-циано-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид,
78) (R)-N-(1-(2-((2-хлор-5-фтор-4-(N-(тиазол-4-ил)сульфамоил)фенил)амино)-5-(трифторметил)фенил)пирролидин-3-ил)ацетамид,
79) (R)-N-(1-(2-((2-хлор-4-(N-(тиазол-4-ил)сульфамоил)фенил)амино)-5-(трифторметил)фенил)пирролидин-3-ил)ацетамид,
80) (S)-3-хлор-4-((2-(3-(метиламино)пирролидин-1-ил)-4-(трифторметил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
81) (S)-5-хлор-2-фтор-4-((2-(3-(метиламино)пирролидин-1-ил)-4-(трифторметил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
82) 5-хлор-2-фтор-4-((4-фтор-2-(3-(метиламино)азетидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
83) 4-((2-(3-аминоазетидин-1-ил)-4-фторфенил)амино)-5-хлор-2-фтор-N-(тиазол-4-ил)бензолсульфонамид,
84) 5-хлор-4-((2-(3-(диметиламино)азетидин-1-ил)-4-фторфенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид,
85) N-(1-(2-((2-хлор-5-фтор-4-(N-(тиазол-4-ил)сульфамоил)фенил)амино)-5-фторфенил)азетидин-3-ил)ацетамид,
86) 5-хлор-2-фтор-4-((4-фтор-2-(3-метоксипирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
87) 5-хлор-2-фтор-4-((2-(3-метоксипирролидин-1-ил)-4-(трифторметил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
88) (R)-N-(1-(2-((2-хлор-5-фтор-4-(N-(тиазол-4-ил)сульфамоил)фенил)амино)-5-фторфенил)пирролидин-3-ил)ацетамид,
89) 3-хлор-4-((4-фтор-2-(3-метоксипирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
90) 3-хлор-4-((2-(3-метоксипирролидин-1-ил)-4-(трифторметил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
91) (R)-N-(1-(2-((2-хлор-4-(N-(тиазол-4-ил)сульфамоил)фенил)амино)-5-фторфенил)пирролидин-3-ил)ацетамид,
92) 5-хлор-2-фтор-4-((4-фтор-2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
93) 3-хлор-4-((2-((2-(диметиламино)этил)(метил)амино)-4-фторфенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
94) 5-хлор-4-((2-((2-(диметиламино)этил)(метил)амино)-4-фторфенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид,
95) 5-хлор-2-фтор-4-((2-(метил(2-(метиламино)этил)амино)-4-(трифторметил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
96) 5-хлор-2-фтор-4-((4-фтор-2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(5-фторпиримидин-2-ил)бензолсульфонамид,
97) 5-хлор-2-фтор-N-(5-фторпиримидин-2-ил)-4-((2-(метил(2-(метиламино)этил)амино)-4-(трифторметил)фенил)амино)бензолсульфонамид,
98) 5-хлор-4-((4-(дифторметокси)-2-(метил(2-(метиламино)этил)амино)фенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид,
99) 5-хлор-4-((4-циано-2-(метил(2-(метиламино)этил)амино)фенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид,
100) 5-хлор-4-((4-циано-2-(метил(2-(метиламино)этил)амино)фенил)амино)-2-фтор-N-(5-фторпиримидин-2-ил)бензолсульфонамид,
101) 5-хлор-4-((4-(дифторметокси)-2-(метил(2-(метиламино)этил)амино)фенил)амино)-2-фтор-N-(5-фторпиримидин-2-ил)бензолсульфонамид,
102) 5-хлор-2-фтор-N-(5-фторпиримидин-2-ил)-4-((2-(метил(2-(метиламино)этил)амино)фенил)амино)бензолсульфонамид,
103) 5-хлор-2-фтор-4-((4-фтор-2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(5-фторпиридин-2-ил)бензолсульфонамид,
104) 5-хлор-2-фтор-4-((4-фтор-2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(пиридин-2-ил)бензолсульфонамид,
105) 5-хлор-2-фтор-4-((4-фтор-2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(тиазол-2-ил)бензолсульфонамид,
106) 5-хлор-4-((4-циано-2-(метил(2-(метиламино)этил)амино)фенил)амино)-2-фтор-N-(5-фторпиридин-2-ил)бензолсульфонамид,
107) 5-хлор-4-((4-циано-2-(метил(2-(метиламино)этил)амино)фенил)амино)-2-фтор-N-(пиридин-2-ил)бензолсульфонамид,
108) 5-хлор-4-((4-циано-2-(метил(2-(метиламино)этил)амино)фенил)амино)-2-фтор-N-(тиазол-2-ил)бензолсульфонамид,
109) 5-хлор-2-фтор-N-(5-фторпиридин-2-ил)-4-((2-(метил(2-(метиламино)этил)амино)-4-(трифторметил)фенил)амино)бензолсульфонамид,
110) 5-хлор-2-фтор-4-((2-(метил(2-(метиламино)этил)амино)-4-(трифторметил)фенил)амино)-N-(пиридин-2-ил)бензолсульфонамид,
111) 5-хлор-2-фтор-4-((2-(метил(2-(метиламино)этил)амино)-4-(трифторметил)фенил)амино)-N-(тиазол-2-ил)бензолсульфонамид,
112) 5-хлор-2-фтор-N-(5-фторпиридин-2-ил)-4-((2-(метил(2-(метиламино)этил)амино)фенил)амино)бензолсульфонамид,
113) 5-хлор-2-фтор-4-((2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(пиридин-2-ил)бензолсульфонамид,
114) 5-хлор-2-фтор-4-((2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(тиазол-2-ил)бензолсульфонамид,
115) 5-хлор-4-((4-(дифторметокси)-2-(метил(2-(метиламино)этил)амино)фенил)амино)-2-фтор-N-(5-фторпиридин-2-ил)бензолсульфонамид,
116) 5-хлор-4-((4-(дифторметокси)-2-(метил(2-(метиламино)этил)амино)фенил)амино)-2-фтор-N-(тиазол-2-ил)бензолсульфонамид,
117) 5-хлор-4-((4-(дифторметокси)-2-(метил(2-(метиламино)этил)амино)фенил)амино)-2-фтор-N-(пиридин-2-ил)бензолсульфонамид,
118) 5-хлор-2-фтор-N-(5-фторпиридин-2-ил)-4-((4-метокси-2-(метил(2-(метиламино)этил)амино)фенил)амино)бензолсульфонамид,
119) 5-хлор-2-фтор-4-((4-метокси-2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(тиазол-2-ил)бензолсульфонамид,
120) 5-хлор-2-фтор-4-((4-метокси-2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
121) 5-хлор-2-фтор-4-((2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
122) 5-хлор-2-фтор-N-(5-фторпиримидин-2-ил)-4-((4-метокси-2-(метил(2-(метиламино)этил)амино)фенил)амино)бензолсульфонамид,
123) 5-хлор-4-((4-хлор-2-(метил(2-(метиламино)этил)амино)фенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид,
124) 5-хлор-4-((4-хлор-2-(метил(2-(метиламино)этил)амино)фенил)амино)-2-фтор-N-(5-фторпиримидин-2-ил)бензолсульфонамид,
125) 5-хлор-4-((4-хлор-2-(метил(2-(метиламино)этил)амино)фенил)амино)-2-фтор-N-(5-фторпиридин-2-ил)бензолсульфонамид,
126) 5-хлор-4-((4-хлор-2-(метил(2-(метиламино)этил)амино)фенил)амино)-2-фтор-N-(тиазол-2-ил)бензолсульфонамид,
127) 5-хлор-N-(5-хлортиазол-2-ил)-2-фтор-4-((4-фтор-2-(метил(2-(метиламино)этил)амино)фенил)амино)бензолсульфонамид,
128) 5-хлор-2-фтор-4-((4-фтор-2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(5-фтортиазол-2-ил)бензолсульфонамид,
129) 5-хлор-N-(5-хлортиазол-2-ил)-2-фтор-4-((2-(метил(2-(метиламино)этил)амино)фенил)амино)бензолсульфонамид,
130) 5-хлор-N-(5-хлортиазол-2-ил)-2-фтор-4-((4-метокси-2-(метил(2-(метиламино)этил)амино)фенил)амино)бензолсульфонамид,
131) 5-хлор-2-фтор-N-(5-фтортиазол-2-ил)-4-((2-(метил(2-(метиламино)этил)амино)фенил)амино)бензолсульфонамид,
132) 5-хлор-2-фтор-N-(5-фтортиазол-2-ил)-4-((4-метокси-2-(метил(2-(метиламино)этил)амино)фенил)амино)бензолсульфонамид,
133) 5-хлор-2-фтор-4-((4-фтор-2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(5-метилизоксазол-3-ил)бензолсульфонамид,
134) 5-хлор-2-фтор-4-((2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(5-метилизоксазол-3-ил)бензолсульфонамид,
135) 5-хлор-2-фтор-4-((4-фтор-2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(5-метил-1H-пиразол-3-ил)бензолсульфонамид,
136) 5-хлор-2-фтор-4-((2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(5-метил-1H-пиразол-3-ил)бензолсульфонамид,
137) 5-хлор-4-((2-((2-(диметиламино)этил)(метил)амино)-4-фторфенил)амино)-2-фтор-N-(5-фторпиридин-2-ил)бензолсульфонамид,
138) 5-хлор-4-((2-((2-(диметиламино)этил)(метил)амино)-4-фторфенил)амино)-2-фтор-N-(тиазол-2-ил)бензолсульфонамид,
139) 5-хлор-N-(5-хлортиазол-2-ил)-4-((2-((2-(диметиламино)этил)(метил)амино)-4-фторфенил)амино)-2-фторбензолсульфонамид,
140) 5-хлор-N-(5-хлортиазол-2-ил)-4-((2-((2-(диметиламино)этил)(метил)амино)фенил)амино)-2-фторбензолсульфонамид,
141) 5-хлор-2-фтор-4-((4-фтор-2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(5-метилтиазол-2-ил)бензолсульфонамид,
142) 5-хлор-2-фтор-4-((4-фтор-2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(оксазол-2-ил)бензолсульфонамид,
143) N-(5-(трет-бутил)изоксазол-3-ил)-5-хлор-2-фтор-4-((4-фтор-2-(метил(2-(метиламино)этил)амино)фенил)амино)бензолсульфонамид,
144) N-(5-(трет-бутил)изоксазол-3-ил)-5-хлор-2-фтор-4-((2-(метил(2-(метиламино)этил)амино)фенил)амино)бензолсульфонамид,
145) 5-хлор-2-фтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(1,2,4-тиадиазол-5-ил)бензолсульфонамид,
146) 5-хлор-2-фтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(1-метил-1H-пиразол-3-ил)бензолсульфонамид,
147) 5-хлор-2-фтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(пиримидин-4-ил)бензолсульфонамид,
148) 5-хлор-2-фтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(5-фторпиримидин-2-ил)бензолсульфонамид,
149) 5-хлор-2-фтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(пиразин-2-ил)бензолсульфонамид,
150) 5-хлор-2-фтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(5-метилизоксазол-3-ил)бензолсульфонамид,
151) 5-хлор-2-фтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(пиримидин-5-ил)бензолсульфонамид,
152) 5-хлор-2-фтор-4-((4-фтор-2-((2-(метиламино)этил)амино)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид,
153) 5-хлор-4-((2-((2-(диметиламино)этил)амино)-4-фторфенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид и
154) 5-хлор-2-фтор-4-((4-фтор-2-(метил(3-(метиламино)пропил)амино)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид.
Кроме того, соединения по настоящему изобретению могут существовать в форме солей, в частности фармацевтически приемлемых солей. В качестве солей можно использовать соли, обычно используемые в данной области, такие как кислотно-аддитивные соли, образованные фармацевтически приемлемыми свободными кислотами. Используемый здесь термин ʺфармацевтически приемлемая сольʺ относится к любой органической или неорганической аддитивной соли соединения, представленного химической формулой 1, концентрация которого является относительно нетоксичной и безвредной для пациента, и которое является эффективным, и побочные эффекты которого не ухудшают эффективность вышеуказанного соединения.
В качестве свободной кислоты можно использовать органическую кислоту и неорганическую кислоту. Примерами неорганических кислот являются соляная кислота, фосфорная кислота, серная кислота, азотная кислота, винная кислота и т.п. Примерами органических кислот являются, без ограничения, метансульфоновая кислота, п-толуолсульфоновая кислота, уксусная кислота, трифторуксусная кислота, малеиновая кислота, янтарная кислота, щавелевая кислота, бензойная кислота, винная кислота, фумаровая кислота, миндальная кислота, пропионовая кислота, лимонная кислота, молочная кислота, гликолевая кислота, глюконовая кислота, галактуроновая кислота, глутаминовая кислота, глутаровая кислота, глюкуроновая кислота, аспарагиновая кислота, аскорбиновая кислота, угольная кислота, ванилиновая кислота, йодистоводородная кислота и т.п.
Кроме того, фармацевтически приемлемая соль металла может быть получена обычным способом путем использования основания. Например, соединение, представленное химической формулой 1, растворяют в избыточном количестве раствора гидроксида щелочного металла или гидроксида щелочно-земельного металла, нерастворимую соль фильтруют, и фильтрат выпаривают и сушат, получая фармацевтически приемлемую соль металла. При этом, особенно предпочтительной в качестве соли металла является натриевая соль, калиевая соль или соль кальция.
Фармацевтически неприемлемую соль или сольват соединения химической формулы 1 можно использовать в качестве промежуточного соединения при получении соединения химической формулы 1 или его фармацевтически приемлемой соли или сольвата.
Кроме того, соединение химической формулы 1 по настоящему изобретению включает не только его фармацевтически приемлемые соли, но также сольваты, такие как гидраты, которые могут быть получены из этого соединения, и включает все возможные стереоизомеры, без ограничения. Сольват и стереоизомер соединения химической формулы 1 могут быть получены из соединения химической формулы 1 общепринятыми способами, известными в данной области.
Кроме того, соединение химической формулы 1 по настоящему изобретению может быть получено либо в кристаллической форме, либо в некристаллической форме, и когда соединение химической формулы 1 получают в кристаллической форме, оно необязательно может быть гидратировано или сольватировано. В настоящем изобретении соединение химической формулы 1 может включать не только стехиометрический гидрат, но также соединение, содержащее различные количества воды. Сольват соединения химической формулы 1 по настоящему изобретению включает как стехиометрические сольваты, так и нестехиометрические сольваты.
Кроме того, в качестве примера, соединение по настоящему изобретению, представленное химической формулой 1, может быть получено посредством приведенной ниже реакционной схемы 1.
Реакционная схема 1

в реакционной схеме 1, X1 до X4, R1-R6 и nявляются такими, как определено выше в химической формуле 1.
Согласно стадиям i, ii и iii, соответствующие соединения, представленные химическими формулами 1-3 и 1-6, могут быть получены в качестве промежуточных соединений. Стадия i предпочтительно представляет собой реакцию, проводимую при 50-60°C в присутствии карбоната калия и растворителя диметилформамида. Стадию ii предпочтительно проводят при температуре от 50 до 60°С в присутствии гипосульфита натрия, а в качестве растворителя предпочтительно используют смешанный растворитель, состоящий из этанола и воды (1:1). Стадию iii предпочтительно проводят при -78°С в присутствии гексаметилдисилиламида лития, а растворителем предпочтительно является тетрагидрофуран.
Промежуточное соединение, представленное химической формулой 1-7, может быть получено в соответствии со стадией iv. Вышеуказанная стадия представляет собой стадию взаимодействия соединения, представленного химической формулой 1-3, с соединением, представленным химической формулой 1-6. Реакцию предпочтительно проводят при 120°С в присутствии диацетата палладия, бис(дифенилфосфино)бинафтила и карбоната цезия, а растворителем предпочтительно является диоксан.
Соединение, представленное химической формулой 1, может быть получено согласно стадии v. Реакцию предпочтительно проводят при температуре от 60 до 80°С в присутствии соляной кислоты, и растворитель предпочтительно представляет собой метанол. Кроме того, в зависимости от типа заместителя R1-R6, если необходима защита при проведении реакции на стадиях i-iv, эти стадии можно проводить, используя защитные группы, которые затем могут быть удалены на стадии v.
Кроме того, настоящее изобретение относится к фармацевтической композиции для профилактики или лечения заболеваний, которая эффективна с точки зрения обеспечения активности блокирования натриевых каналов и которая содержит в качестве активного ингредиента соединение, представленное химической формулой 1, или его фармацевтически приемлемую соль, гидрат, сольват или его изомер.
В этом случае заболевание включает острую боль, хроническую боль, невропатическую боль, послеоперационную боль, мигрень, артралгию, невропатию, поражение нервов, диабетическую невропатию, невротическое заболевание, эпилепсию, аритмию, миотонию, атаксию, рассеянный склероз, синдром раздраженного кишечника, непроизвольное мочеиспускание, висцеральную боль, депрессию, эритралгию, PEPD (пароксизмальное экстремальное болевое расстройство) и т.п.
Используемый в настоящем описании термин ʺпрофилактикаʺ относится к любому действию, обеспечивающему задержку или подавления возникновения, распространения или рецидиву вышеупомянутых заболеваний путем введения композиции по настоящему изобретению, а ʺлечениеʺ относится к любому действию по облегчению или изменению симптомов вышеуказанных заболеваний в лучшую сторону путем введения композиции по настоящему изобретению.
Фармацевтическая композиция по настоящему изобретению может быть составлена для пероральных или парентеральных введений в соответствии со стандартной фармацевтической практикой. Эти составы могут содержать, дополнительно к активному ингредиенту, вспомогательные вещества, такие как фармацевтически приемлемый носитель, адъювант или разбавитель.
Подходящие носители включают, например, физиологический раствор, полиэтиленгликоль, этанол, растительное масло и изопропил миристат, и т.п. Разбавители включают, без ограничения, например, лактозу, декстрозу, сахарозу, маннит, сорбит, целлюлозу и/или глицин и т.п. Кроме того, соединения по настоящему изобретению могут быть растворены в маслах, пропиленгликоле или других растворителях, обычно используемых при приготовлении инъекционных растворов. Помимо этого, соединения по настоящему изобретению могут быть приготовлены в виде мазей или кремов для местного нанесения.
Предпочтительная доза соединения по настоящему изобретению может варьировать в зависимости от состояния и веса пациента, тяжести заболевания, типа лекарственного средства и способа и продолжительности введения; она может быть соответствующим образом подобрана специалистом в данной области. Однако для достижения нужных эффектов соединение по настоящему изобретению можно вводить ежедневно в дозе от 0,0001 до 100 мг/кг (массы тела) и предпочтительно от 0,001 до 100 мг/кг (массы тела). Введение можно осуществлять перорально или парентерально один раз в день или дробными дозами каждый день.
В зависимости от способа введения фармацевтическая композиция может содержать соединение по настоящему изобретению в количестве от 0,001 до 99 мас. %, предпочтительно от 0,01 до 60 мас.%.
Фармацевтическую композицию по настоящему изобретению можно вводить млекопитающим, таким как крыса, мышь, домашнее животное, человек, различными способами введения. Введение можно осуществлять любым возможным способом, например, перорально, ректально, внутривенно, внутримышечно, подкожно, путем интраэндометриальной или интрацеребровентрикулярной инъекции.
ПРЕИМУЩЕСТВЕННЫЕ ЭФФЕКТЫ
Соединение, представленное химической формулой 1 по настоящему изобретению, или его фармацевтически приемлемая соль, гидрат, сольват или изомер можно эффективно использовать для профилактики или лечения заболеваний, связанных с блокаторами натриевых каналов.
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Настоящее изобретение более подробно описано ниже с помощью примеров. Однако эти примеры приведены исключительно с целью иллюстрации и не должны толковаться как ограничивающие объем настоящего изобретения.
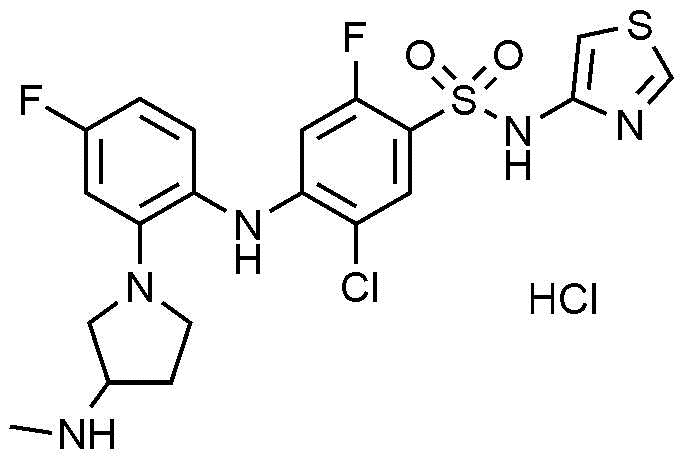
Пример 1: Получение 5-хлор-2-фтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид гидрохлорида
Стадия 1) Получение трет-бутил (1-(2-амино-5-фторфенил)пирролидин-3-ил)(метил)карбамата
2,4-дифтор-1-нитробензол (2,0 г, 12,6 ммоль) и трет-бутилметил(пирролидин-3-ил)карбамат (2,5 г, 1,0 экв.) растворяли в DMF (20 мл), и затем к этому раствору добавляли K2CO3 (2,6 г, 1,5 экв.). Поддерживая внутреннюю температуру на уровне от 60 до 70°C, реакционную смесь перемешивали в течение 2 часов. Когда реакционная смесь приобрела темно-желтый цвет, завершение реакции подтверждали методом TLC. После охлаждения до комнатной температуры добавляли этилацетат (EA)/H2О и перемешивали, а затем слои разделяли. К отделенному органическому слою добавляли MgSO4, который перемешивали, сушили и затем фильтровали. Фильтрат концентрировали при пониженном давлении, и осадок растворяли в EtOH (10 мл) и дистиллированной воде (10 мл), затем добавляли Na2S2O4(13,0 г, 6 экв.). Поддерживая внутреннюю температуру на уровне от 60 до 70°C, реакционную смесь перемешивали в течение 2 часов. Когда желтый цвет реакционного раствора побледнел, и раствор стал практически бесцветным, завершение реакции проверяли методом TLC. После охлаждения до комнатной температуры добавляли дистиллированную воду (50 мл), и выполняли двойную экстракцию этилацетатом (100 мл). К органическому слою добавляли MgSO4, который перемешивали, сушили и затем фильтровали. Фильтрат концентрировали при пониженном давлении, и полученный осадок разделяли с помощью колоночной хроматографии (n-гексан/EA=3/1) с получением указанного в заголовке соединения (2,0 г, 51,1%).
1Н ЯМР (MeOD): 6,73(м, 1H), 6,57(т, 1H), 3,23(м, 1H), 3,10(м, 2H), 2,94(м, 1H), 2,91(с, 3H), 2,25(м, 1H), 1,99(м, 1H)
Стадия 2) Получение трет-бутил-тиазол-4-ил карбамата
Тиазол-4-карбоновую кислоту (5,0 г, 38,8 ммоль) растворяли в t-BuOH (100 мл), и затем к раствору добавляли TEA (8,1 мл, 1,5 экв.) и DPPA (7,1 мл, 1,5 экв.). Поддерживая внутреннюю температуру на уровне от 90 до 100°C, реакционную смесь перемешивали в течение 3 дней, и затем завершение реакции проверяли методом TLC. Продукт концентрировали при пониженном давлении, добавляли дистиллированную воду (50 мл), и выполняли двойную экстракцию этилацетатом (100 мл). К органическому слою добавляли MgSO4, который перемешивали, сушили и затем фильтровали. Фильтрат концентрировали при пониженном давлении, и осадок добавляли к небольшому количеству EA и перемешивали. Полученное твердое вещество фильтровали с получением соединения белого цвета, указанного в заголовке (4,0 г, 51,5%).
1Н ЯМР (MeOD): 8,73(с, 1H), 7,24(с, 1H), 1,52(с, 9H)
Стадия 3) Получение трет-бутил((4-бром-5-хлор-2-фторфенил)сульфонил)(тиазол-4-ил)карбамата
Трет-бутил-тиазол-4-ил карбамат (4,0 г, 20,0 ммоль), полученный на стадии 2), добавляли в реакционный сосуд, и внутренний объем сосуда замещали газообразным азотом. После растворения в THF (32 мл) раствор охлаждали до -78°C, используя сухой лед-ацетон. После охлаждения медленно добавляли LiHMDS (22,4 мл, 1,5 экв.), и реакционную смесь перемешивали в течение 30 минут. 4-Бром-5-хлор-2-фторбензолсульфонил хлорид (6,0 г, 1,0 экв.) растворяли в THF (10 мл) и затем медленно добавляли к реакционному раствору. Реакционную смесь перемешивали в течение ночи, и завершение реакции проверяли методом TLC. Добавляли дистиллированную воду (50 мл), и выполняли двойную экстракцию этилацетатом (100 мл). К органическому слою добавляли MgSO4, который перемешивали, сушили и затем фильтровали. Фильтрат концентрировали при пониженном давлении, и осадок кристаллизовали смесью THF/n-гексан с получением указанного в заголовке соединения (4,4 г, 59,0%).
1Н ЯМР (MeOD): 9,00(с, 1H), 8,22(д, 1H), 7,90(д, 1H), 7,78(с, 1H), 1,35(с, 9H)
Стадия 4) Получение трет-бутил (1-(2-((4-(N-(трет-бутоксикарбонил)-N-(тиазол-4-ил)сульфамоил)-2-хлор-5-фторфенил)амино)-5-фторфенил)пирролидин-3-ил)(метил)карбамата
Трет-бутил(1-(2-амино-5-фторфенил)пирролидин-3-ил)(метил)карбамат (0,5 г, 1.1 ммоль), полученный на стадии 1), и трет-бутил((4-бром-5-хлор-2-фторфенил)сульфонил)(тиазол-4-ил)карбамат (0,9 г, 1.2 экв.), полученный на стадии 3), растворяли в 1,4-диоксане (10 мл). К реакционному раствору доббавляли Pd(OAc)2(0,03 г, 0,1 экв.), rac-BINAP (0,19 г, 0,2 экв.) и Cs2CO3 (1.5 г, 3,0 экв.). После проведения реакции при 120°C в течение 30 минут, используя источник микроволнового излучения, завершение реакции проверяли методом TLC. Добавляли дистиллированную воду (50 мл), и выполняли двойную экстракцию этилацетатом (100 мл). К органическому слою добавляли MgSO4, который перемешивали, фильтровали и затем сушили. Фильтрат концентрировали при пониженном давлении, и осадок разделяли с помощью колоночной хроматографии (EA/н-Гексан=1/1). Эту процедуру повторяли дважды с получением указанного в заголовке соединения (2,0 г, 88,2%).
1Н ЯМР (MeOD): 8,95(с, 1H), 7,94(д, 1H), 7,65(с, 1H), 7,14(т, 1H), 6,70(д, 1H), 6,64(т, 1H), 6,07(д, 1H), 3,40(м, 1H), 3,28(м, 2H), 3,16(м, 1H), 2,64(с, 3H), 2,06(м, 1H), 1,89(м, 1H), 1,41(с, 9H), 1,36(с, 9H)
Стадия 5) Получение 5-хлор-2-фтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид гидрохлорида
К трет-бутил(1-(2-((4-(N-(трет-бутоксикарбонил)-N-(тиазол-4-ил)сульфамоил)-2-хлор-5-фторфенил)амино)-5-фторфенил)пирролидин-3-ил)(метил)карбамата (2,0 г, 2,9 ммоль), полученного на стадии 4), добавляли 1,25M HCl в MeOH (15 мл). После перемешивания смеси в течение ночи при нагревании до 40-50°C, завершение реакции проверяли методом TLC. Продукт концентрировали, и к полученному осадку добавляли метиленхлорид (15 мл), перемешивали в течение 1 часа, и полученное твердое вещество фильтровали с получением соединения, указанного в заголовке (0,9 г, 58,8%).
1Н ЯМР (MeOD): 8,73(с, 1H), 7,75(д, 1H), 7,12(т, 1H), 7,00(с, 1H), 6,69(д, 1H), 6,67(т, 1H), 6,05(д, 1H), 3,73(м, 1H), 3,54(м, 1H), 3,45(м, 1H), 3,38(м, 1H), 3,26(м, 1H), 2,63(с, 3H), 2,31(м, 1H), 1,96(м, 1H)
Соединения приведенные ниже в примерах 2-9 получали таким же образом, как описано в примере 1, за исключением того, что использовали реагенты, соответствующие структурам получаемых соединений.
Пример 2: Получение 5-хлор-4-((4-хлор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид гидрохлорида

1Н ЯМР (500 МГц, MeOD): 8,79(с, 1H), 7,74(д, 1H), 7,09(д, 1H), 7,02(с, 1H), 6,98(с, 1H), 6,92(д, 1H), 6,13(д, 1H), 3,76(м, 1H), 3,53(м, 3H), 2,64(с, 3H), 2,31(м, 1H), 2,01(м, 1H), 1,27(м, 1H)
Пример 3: Получение (R)-5-хлор-4-((4-хлор-2-(2-метилпиперазин-1-ил)фенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид гидрохлорида

1Н ЯМР (500 МГц, MeOD): 8,73(д, 1H), 7,84(д, 1H), 7,38(д, 1H), 7,30(д, 1H), 7,28(д, 1H), 7,04(д, 1H), 6,99(д, 1H), 3,40(м, 3H), 3,15(м, 2H), 3,07(м, 1H), 2,86(м, 1H), 0,93(м, 3H)
Пример 4: Получение (R)-5-хлор-4-((4-хлор-2-(3-(метиламино)пиперидин-1-ил)фенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид гидрохлорида

1Н ЯМР (500 МГц, MeOD): 8,75(д, 1H), 7,80(д, 1H), 7,28(д, 1H), 7,20(д, 1H), 7,17(м, 1H), 7,03(д, 1H), 6,58(д, 1H), 3,44(м, 1H), 3,02(м, 1H), 2,94(м, 1H), 2,78(м, 1H), 2,67(с, 3H), 2,08(м, 1H), 1,79(м, 1H), 1,50(м, 1H), 1,41(м, 1H), 0,87(м, 1H)
Пример 5: Получение (R)-N-(1-(5-хлор-2-((2-хлор-5-фтор-4-(N-(тиазол-4-ил)сульфамоил)фенил)амино)фенил)пирролидин-3-ил)ацетамид гидрохлорида

1Н ЯМР (500 МГц, MeOD): 8,78(м, 1H), 7,76(д, 1H), 7,17(д, 1H), 7,08(м, 1H), 7,02(с, 1H), 6,92(м, 1H), 6,15(т, 1H), 4,26(м, 1H), 3,55(м, 1H), 3,35(м, 1H), 3,25(м, 1H), 2,27(м, 1H), 1,93(м, 1H), 1,90(с, 3H)
Пример 6: Получение 5-хлор-4-((4-хлор-2-(3-(диэтиламино)пирролидин-1-ил)фенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид гидрохлорида

1Н ЯМР (500 МГц, MeOD): 8,78(д, 1H), 7,77(д, 1H), 7,12(д, 1H), 7,03(м, 1H), 6,99(дд, 1H), 6,03(д, 1H), 4,08(м, 1H), 3,52(м, 3H), 3,17(м, 4H), 3,05(м, 1H), 2,39(м, 1H), 2,01(м, 1H), 1,26(м, 6H)
Пример 7: Получение 4-((2-([1,3'-бипирролидин]-1'-ил)-4-хлорфенил)амино)-5-хлор-2-фтор-N-(тиазол-4-ил)бензолсульфонамид гидрохлорида

1Н ЯМР (500 МГц, MeOD): 8,76(д, 1H), 7,77(д, 1H), 7,11(д, 1H), 7,02(м, 2H), 6,97(м, 1H), 6,07(д, 1H), 3,91(м, 1H), 3,50(м, 5H), 3,22(м, 1H), 3,05(м, 2H), 2,36(м, 1H), 1,97(м, 5H)
Пример 8: Получение 5-хлор-2-фтор-4-((4-метил-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид гидрохлорида

1Н ЯМР (500 МГц, MeOD): 8,76(д, 1H), 7,74(д, 1H), 7,02(м, 2H), 6,91(с, 1H), 6,85(д, 1H), 6,16(д, 1H), 3,78(м, 1H), 3,45(м, 3H), 3,23(м, 1H), 2,65(с, 3H), 2,35(с, 3H), 2,34(м, 1H), 2,01(м, 1H)
Пример 9: Получение (S)-5-хлор-4-((4-хлор-2-(3-метилпиперазин-1-ил)фенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид гидрохлорида

1Н ЯМР (500 МГц, MeOD): 8,73(д, 1H), 7,79(д, 1H), 7,29(д, 1H), 7,20(м, 2H), 7,03(д, 1H), 6,54(д, 1H), 3,88(м, 1H), 3,44(с, 3H), 3,04(м, 1H), 2,97(м, 1H), 2,80(м, 1H), 1,27(м, 3H)
Пример 10: Получение 4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

Промежуточное соединение, трет-бутил(1-(2-((4-(N-(трет-бутоксикарбонил)-N-(тиазол-4-ил)сульфамоил)фенил)амино)-5-фторфенил)пирролидин-3-ил)(метил)карбамат, получали таким же образом, как описано на стадиях 1-4 Примера 1, за исключением того, что на стадии 3 Примера 1 вместо 4-бром-5-хлор-2-фторбензолсульфонил хлорида использовали 4-бромбензолсульфонил хлорид.
К полученному промежуточному соединению добавляли 1,25M HCl в MeOH (15 мл). После перемешивания смеси в течение ночи при нагревании до 40-50°C завершение реакции проверяли методом TLC. Продукт концентрировали, и полученный осадок отделяли и очищали методом PLC с получением 0,05 г целевого соединения (выход: 48%).
1Н ЯМР (500 МГц, MeOD): 8,68(с, 1H), 7,57(д, 2H), 7,07(т, 1H), 6,92(с, 1H), 6,66-6,54(м, 4H), 3,42-3,30(м, 4H), 3,14-3,13(м, 1H), 2,42(с, 3H), 2,18-2,16(м, 1H), 1,84-1,40(м, 1H)
Соединения, приведенные ниже в примерах 11-91, получали таким же образом, как описано в примере 10, за исключением того, что использовали реагенты, соответствующие структурам получаемых соединений.
Пример 11: Получение 3-хлор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,69(с, 1H), 7,74(с, 1H), 7,47(д, 1H), 7,05(т, 1H), 6,93(с, 1H), 6,63(д, 1H), 6,54(т, 1H), 6,33(д, 1H), 3,40-3,37(м, 2H), 3,17-3,11(м, 3H), 2,31(с, 3H), 2,08-2,00(м, 1H), 1,72-1,68(м, 1H)
Пример 12: Получение 3,5-дифтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,73(с, 1H), 7,43(д, 2H), 7,04(с, 1H), 6,63(т, 1H), 6,75(д, 1H), 6,60(т, 1H), 3,66-3,63(м, 1H), 3,49-3,35(м, 3H), 3,08-3,04(м, 1H), 2,63(с, 3H), 2,31-2,28(м, 1H), 1,96-1,93(м, 1H)
Пример 13: Получение 2-фтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,68(с, 1H), 7,56(т, 1H), 7,03(т, 1H), 6,84(с, 1H), 6,63(д, 1H), 6,55(т, 1H), 6,40(д, 1H), 6,23(д, 1H), 3,35-3,30(м, 3H), 3,18-3,16(м, 2H), 2,36(с, 3H), 2,11-2,05(м, 1H), 1,78-1,75(м, 1H)
Пример 14: Получение 4-((2-(3-(метиламино)пирролидин-1-ил)-4-(трифторметокси)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,68(с, 1H), 7,60(д, 2H), 7,16(д, 1H), 6,92(с, 1H), 6,77-6,68(м, 4H), 3,38-3,61(м, 1H), 3,35-3,33(м, 2H), 3,28-3,27(м, 1H), 3,09-3,06(м, 1H), 2,36(с, 3H), 2,36-2,35(м, 1H), 1,85-1,83(м, 1H)
Пример 15: Получение 3,5-дифтор-4-((2-(3-(метиламино)пирролидин-1-ил)-4-(трифторметокси)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида
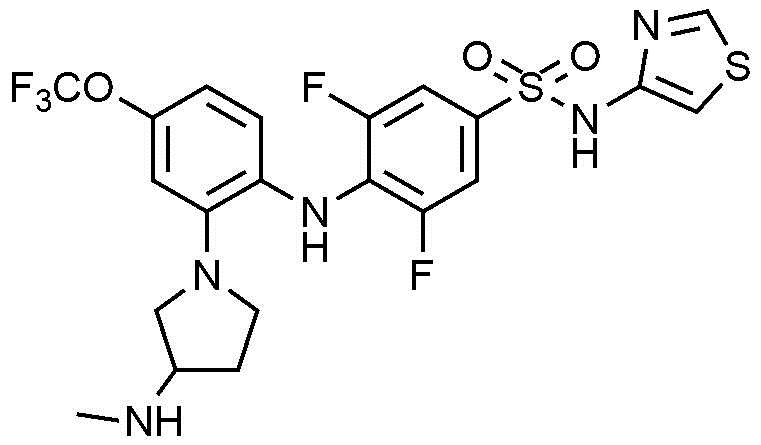
1Н ЯМР (500 МГц, MeOD): 8,62(с, 1H), 7,41(д, 2H), 6,87(с, 1H), 6,76-6,75(м, 1H), 6,69-6,67(м, 2H), 3,59(с, 1H), 3,49-3,47(м, 2H), 3,25-3,23(м, 1H), 2,99-2,98(м, 1H), 2,59(с, 3H), 2,29-2,27(м, 1H), 1,99-1,97(м, 1H)
Пример 16: Получение 2-фтор-4-((2-(3-(метиламино)пирролидин-1-ил)-4-(трифторметокси)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,68(с, 1H), 7,58(т, 1H), 7,16(д, 1H), 6,84(с, 1H), 6,84-6,83(м, 2H), 6,49(д, 1H), 6,35(д, 1H), 3,38-3,34(м, 3H), 3,23-3,21(м, 1H), 3,12-3,10(м, 1H), 2,41(с, 3H), 2,18-2,16(м, 1H), 1,85-1,83(м, 1H)
Пример 17: Получение 5-хлор-2-фтор-4-((2-(3-(метиламино)пирролидин-1-ил)-4-(трифторметокси)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,68(с, 1H), 7,74(д, 1H), 7,15(д, 1H), 6,85(с, 1H), 6,75-6,74(м, 2H), 6,04(д, 1H), 3,45-3,38(м, 3H), 3,19-3,17(м, 2H), 2,40(с, 3H), 2,13-2,12(м, 1H), 1,80-1,79(м, 1H)
Пример 18: Получение 5-хлор-4-((5-хлор-3-(3-(метиламино)пирролидин-1-ил)пиридин-2-ил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,68(д, 1H), 8,30(д, 1H), 7,96(д, 1H), 7,84(д, 1H), 7,53(д, 1H), 6,87(д, 1H), 3,44(м, 3H), 3,10(м, 2H), 2,50(с, 3H), 2,36(м, 1H), 1,95(м, 1H)
Пример 19: Получение 5-хлор-4-((6-хлор-2-(3-(метиламино)пирролидин-1-ил)пиридин-3-ил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамида
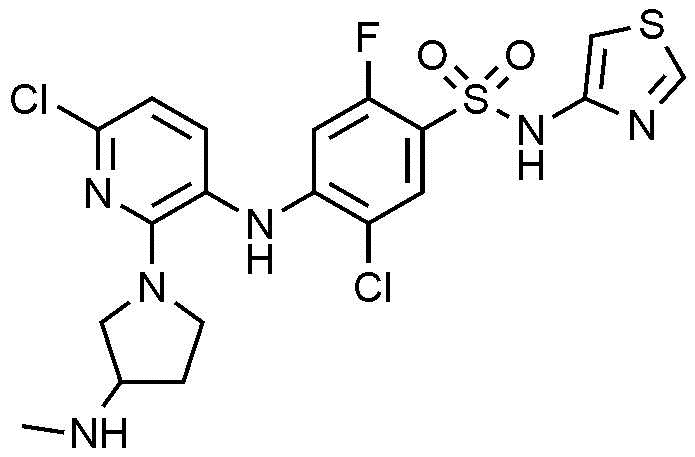
1Н ЯМР (500 МГц, MeOD): 8,69(с, 1H), 7,76(с, 1H), 7,34(с, 1H), 6,90(м, 2H), 6,70(с, 1H), 6,01(д, 1H), 3,45(м, 3H), 2,99(м, 2H), 2,49(с, 3H), 2,11(м, 2H)
Пример 20: Получение 5-хлор-2-фтор-4-((2-(3-(метиламино)пирролидин-1-ил)-4-(трифторметил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,67(д, 1H), 7,78(д, 1H), 7,26(д, 1H), 7,16(м, 2H), 6,81(д, 1H), 6,21(д, 1H), 3,39(м, 3H), 3,17(м, 2H), 2,43(с, 3H), 2,13(м, 1H), 1,94(м, 1H)
Пример 21: Получение 5-хлор-4-((4-(дифторметокси)-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,63(д, 1H), 7,73(д, 1H), 7,07(д, 1H), 6,70(т, 2H), 6,62(т, 2H), 6,03(д, 1H), 3,40(м, 3H), 3,23(м, 2H), 2,42(с, 3H), 2,11(м, 1H), 1,83(м, 1H)
Пример 22: Получение (R)-4-((4-фтор-2-(3-(метиламино)пиперидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида
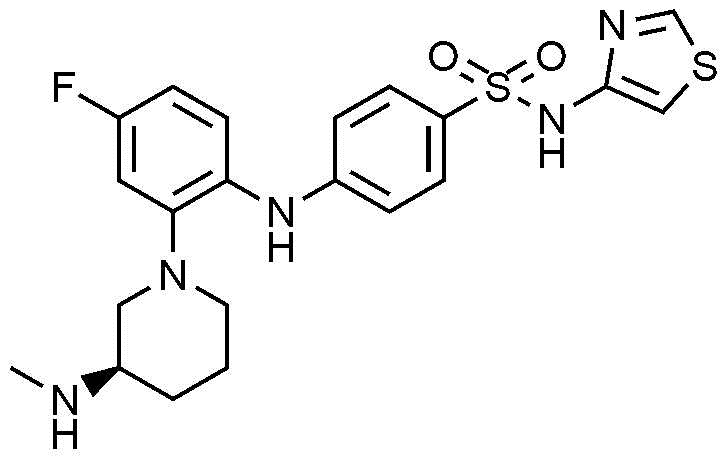
1Н ЯМР (500 МГц, MeOD): 8,68(с, 1H), 7,61(д, 2H), 7,17(т, 1H), 6,89(с, 1H), 6,77-6,75(м, 3H), 6,74-6,73(м, 1H), 3,34-3,30(м, 1H), 2,88-2,59(м, 4H), 2,32(с, 3H), 1,82-1,70(м, 2H), 1,45-1,44(м, 2H)
Пример 23: Получение (R)-2-фтор-4-((4-фтор-2-(3-(метиламино)пиперидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,68(с, 1H), 7,61(т, 1H), 7,20(т, 1H), 6,87(д, 1H), 6,85-6,81(м, 2H), 6,78(д, 1H), 6,67(д, 1H), 3,34(с, 1H), 2,92-2,79(м, 4H), 2,48(с, 3H), 1,89-1,87(м, 2H), 1,79-1,78(м, 1H), 1,47-1,46(м, 1H)
Пример 24: Получение (R)-3-хлор-4-((4-фтор-2-(3-(метиламино)пиперидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,69(с, 1H), 7,80(с, 1H), 7,54(с, 1H), 7,24-7,21(м, 1H), 6,89-6,77(м, 4H), 3,01-2,97(м, 1H), 2,68-2,41(м, 3H), 2,30(с, 3H), 1,86-1,84(м, 1H), 1,68-1,66(м, 1H), 1,40-1,35(м, 2H)
Пример 25: Получение (R)-3,5-дифтор-4-((4-фтор-2-(3-(метиламино)пиперидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,64(с, 1H), 7,41(д, 2H), 6,85(д, 1H), 6,75-6,66(м, 3H), 3,26-3,24(м, 1H), 2,88-2,78(м, 4H), 2,55(с, 3H), 1,87-1,86(м, 1H) 1,85-1,83(м, 1H), 1,74-1,72(м, 1H), 1,37-1,35(м, 1H)
Пример 26: Получение (R)-5-хлор-2-фтор-4-((4-фтор-2-(3-(метиламино)пиперидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,66(с, 1H), 7,77(д, 1H), 7,22(т, 1H), 6,89-6,84(м, 2H), 6,81(с, 1H), 6,35(д, 1H), 3,38-3,36(м, 1H), 3,03-3,01(м, 1H), 2,63-2,61(м, 1H), 2,48-2,44(м, 2H), 2,37(с, 3H), 1,89-1,87(м, 1H), 1,68-1,66(м, 1H), 1,32-1,32(м, 2H)
Пример 27: Получение (R)-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,68(с, 1H), 7,56(д, 2H), 7,04(т, 1H), 6,92(с, 1H), 6,63-6,53(м, 4H), 3,24-3,21(м, 3H), 3,14-3,10(м, 2H), 2,31(с, 3H), 2,11-2,08(м, 1H), 1,73-1,70(м, 1H)
Пример 28: Получение (R)-2-фтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,68(с, 1H), 7,57-7,53(м, 1H), 7,05-7,03(м, 1H), 6,83(с, 1H), 6,62(д, 1H), 6,55-6,53(м, 1H), 6,40(д, 1H), 6,23(д, 1H), 3,34-3,30(м, 2H), 3,28-3,27(м, 1H), 3,18-3,15(м, 2H), 2,36(с, 3H), 2,13-2,10(м, 1H), 1,76-1,74(м, 1H)
Пример 29: Получение (R)-3-хлор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,68(с, 1H), 7,75(с, 1H), 7,47-7,45(м, 1H), 7,06-7,04(м, 1H), 6,92(с, 1H), 6,62(д, 1H), 6,54(д, 1H), 6,32(д, 1H), 3,40-3,37(м, 2H), 3,17-3,11(м, 3H), 2,33(с, 3H), 2,08-2,05(м, 1H), 1,72-1,69(м, 1H)
Пример 30: Получение (R)-3,5-дифтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,65(с, 1H), 7,37(д, 2H), 6,77-6,74(м, 2H), 6,69(д, 1H), 6,56-6,52(м, 1H), 3,41-3,26(м, 3H), 3,26-3,24(м, 1H), 3,05-3,02(м, 1H), 2,48(с, 3H), 2,20-2,18(м, 1H), 1,83-1,81(м, 1H)
Пример 31: Получение (R)-5-хлор-2-фтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,67(с, 1H), 7,72(д, 1H), 7,04(т, 1H), 6,81(д, 1H), 6,62(т, 1H), 5,98(д, 1H), 5,48(с, 1H), 3,43-3,36(м, 2H), 3,39-3,36(м, 1H), 3,30-3,26(м, 2H), 2,36(с, 3H), 2,36-2,10(м, 1H), 1,77-1,73(м, 1H)
Пример 32: Получение 5-хлор-2-фтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,68(с, 1H), 7,73(д, 1H), 7,06(т, 1H), 6,83(с, 1H), 6,64(д, 1H), 6,57(т, 1H), 6,01(д, 1H), 3,50-3,40(м, 3H), 3,28-3,23(м, 2H), 2,48(с, 3H), 2,20-2,19(м, 1H), 1,95-1,93(м, 1H)
Пример 33: Получение 4-((2-(3-аминопирролидин-1-ил)-4-фторфенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамида
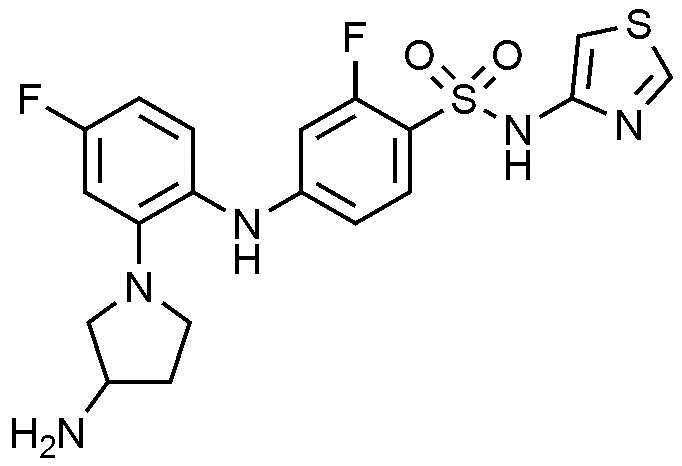
1Н ЯМР (500 МГц, MeOD): 8,72(с, 1H), 7,58(т, 1H), 7,10(т, 1H), 6,93(м, 1H), 6,68(д, 1H), 6,62(д, 1H), 6,45(д, 1H), 6,33(д, 1H), 3,79(м, 1H), 3,50(м, 2H), 3,30(м, 1H), 3,20(м, 1H), 2,29(м, 1H), 1,95(м, 1H)
Пример 34: Получение 4-((2-(3-аминопирролидин-1-ил)-4-фторфенил)амино)-3-хлор-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,70(д, 1H), 7,75(с, 1H), 7,47(д, 1H), 7,07(т, 1H), 7,07(т, 1H), 6,64(д, 1H), 6,58(т, 1H), 6,37(д, 1H), 3,71(м, 1H), 3,59(м, 2H), 3,25(м, 1H), 3,13(м, 1H), 2,13(м, 1H), 1,77(м, 1H)
Пример 35: Получение 4-((2-(3-аминопирролидин-1-ил)-4-фторфенил)амино)-5-хлор-2-фтор-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,72(с, 1H), 7,74(д, 1H), 7,10(т, 1H), 6,98(д, 1H), 6,68(д, 1H), 6,63(т, 1H), 6,06(д, 1H), 3,73(м, 1H), 3,53(м, 2H), 3,24(м, 2H), 2,23(м, 1H), 1,87(м, 1H)
Пример 36: Получение 4-((2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,68(с, 1H), 7,58(д, 2H), 7,14(д, 1H), 7,05(т, 1H), 6,96(д, 1H), 6,91-6,87(м, 2H), 6,75(д, 2H), 3,34-3,30(м, 2H), 3,18-3,15(м, 2H), 3,00-2,97(м, 1H), 2,35(с, 3H), 2,15-2,12(м, 1H), 1,75-1,71(м, 1H)
Пример 37: Получение 2-фтор-4-((2-(3-(метиламино)пирролидин-1-ил)-4-(трифторметил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,69(д, 1H), 7,65(т, 1H), 7,35(д, 1H), 7,20(м, 2H), 6,87(д, 1H), 6,74(д, 1H), 6,66(д, 1H), 3,65(м, 1H), 3,47(м, 1H), 3,37(м, 2H), 3,03(м, 1H), 2,60(с, 3H), 2,30(м, 1H), 2,02(м, 1H)
Пример 38: Получение 3-хлор-4-((2-(3-(метиламино)пирролидин-1-ил)-4-(трифторметил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,67(д, 1H), 7,80(д, 1H), 7,53(д, 1H), 7,25(д, 1H), 7,17(с, 1H), 7,13(д, 1H), 6,89(д, 1H), 6,59(д, 1H), 3,35(м, 2H), 3,28(м, 1H), 3,12(м, 2H), 2,37(с, 3H), 2,11(м, 1H), 1,75(м, 1H)
Пример 39: Получение 4-((4-(дифторметокси)-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,69(с, 1H), 7,58(т, 1H), 7,12(д, 1H), 6,70(т, 1H), 6,66(м, 2H), 6,50(д, 1H), 6,38(д, 1H), 3,59(м, 1H), 3,41(м, 2H), 3,32(м, 1H), 3,12(м, 1H), 2,54(с, 3H), 2,24(м, 1H), 1,93(м, 1H)
Пример 40: Получение 3-хлор-4-((4-(дифторметокси)-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,69(с, 1H), 7,76(с, 1H), 7,47(д, 1H), 7,09(д, 1H), 6,81(т, 2H), 6,65(м, 2H), 6,39(д, 1H), 3,40(м, 3H), 3,18(м, 2H), 2,44(с, 3H), 2,15(м, 1H), 1,81(м, 1H)
Пример 41: Получение (R)-4-((4-фтор-2-(3-фторпирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,68(с, 1H), 7,54(д, 2H), 7,02(т, 1H), 6,92(с, 1H), 6,60(д, 1H), 6,52-6,49(м, 3H), 3,57-3,53(м, 1H), 3,49-3,46(м, 1H), 3,26-3,21(м, 3H), 2,10-2,06(м, 1H), 2,00-1,94(м, 1H)
Пример 42: Получение (R)-2-фтор-4-((4-фтор-2-(3-фторпирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,69(с, 1H), 7,54(т, 1H), 7,01(т, 1H), 6,90(д, 1H), 6,59(т, 1H), 6,50(д, 1H), 6,32(д, 1H), 6,17(д, 1H), 3,43-3,41(м, 2H), 3,26-3,21(м, 2H), 2,21-1,94(м, 3H)
Пример 43: Получение (R)-3-хлор-4-((4-фтор-2-(3-фторпирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,69(с, 1H), 7,73(с, 1H), 7,44(д, 1H), 7,04(т, 1H), 6,92(с, 1H), 6,61(д, 1H), 6,53(т, 1H), 6,28(д, 1H), 3,47-3,41(м, 3H), 3,26-3,24(м, 2H), 2,12-1,97(м, 2H)
Пример 44: Получение (R)-3,5-дифтор-4-((4-фтор-2-(3-фторпирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,73(с, 1H), 7,34(д, 2H), 7,04(с, 1H), 6,92(т, 1H), 6,57(д, 1H), 6,47(т, 1H), 3,56-3,25(м, 4H), 3,13-3,11(м, 1H), 2,04-1,99(м, 2H)
Пример 45: Получение (R)-5-хлор-2-фтор-4-((4-фтор-2-(3-фторпирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,70(с, 1H), 7,70(д, 1H), 7,04(т, 1H), 6,96(д, 1H), 6,65(д, 1H), 6,55(т, 1H), 5,92(д, 1H), 3,46-3,40(м, 3H), 3,37-3,33(м, 2H), 2,15-1,96(м, 2H)
Пример 46: Получение 2-фтор-4-((3-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,69(д, 1H), 7,65(т, 1H), 7,08(lm, 2H), 6,88(м, 3H), 6,74(м, 1H), 3,56(м, 1H), 3,37(м, 2H), 3,34(м, 1H), 3,17(м, 1H), 3,16(с, 3H), 2,35(м, 1H), 2,05(м, 1H)
Пример 47: Получение 3-хлор-4-((3-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,67(д, 1H), 7,84(д, 1H), 7,63(д, 1H), 7,19(д, 1H), 7,05(м, 2H), 6,87(с, 1H), 6,79(м, 1H), 3,60(м, 1H), 3,52(м, 1H), 3,33(м, 1H), 3,26(м, 1H), 3,20(м, 1H), 2,56(с, 3H), 2,27(м, 1H), 1,90(м, 1H)
Пример 48: Получение 5-хлор-2-фтор-4-((3-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,65(с, 1H), 7,81(д, 1H), 7,10(м, 1H), 7,05(м, 1H), 6,84(м, 3H), 3,53(м, 3H), 3,25(м, 2H), 2,56(с, 3H), 2,26(м, 1H), 1,91(м, 1H)
Пример 49: Получение 2-фтор-4-((2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида
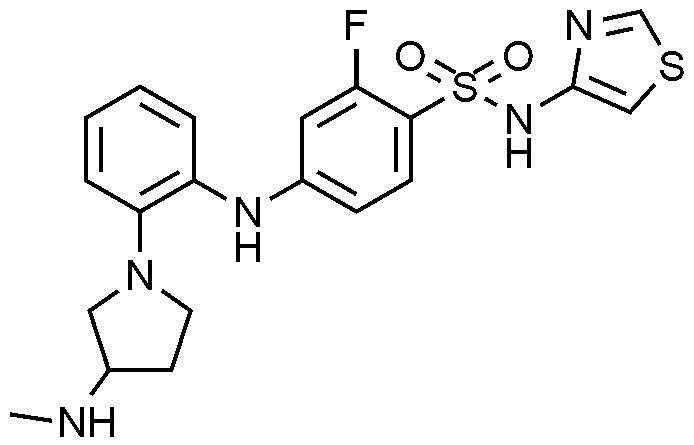
1Н ЯМР (500 МГц, MeOD): 8,68(с, 1H), 7,57(т, 1H), 7,14-7,09(м, 2H), 6,97(д, 1H), 6,92-6,90(м, 1H), 6,84(с, 1H), 6,55(д, 1H), 6,40(д, 1H), 3,42-3,41(м, 1H), 3,34-3,30(м, 1H), 3,26-3,21(м, 2H), 3,04-3,02(м, 1H), 2,42(с, 3H), 2,20-2,17(м, 1H), 1,85-1,81(м, 1H)
Пример 50: Получение 3-хлор-4-((2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,66(с, 1H), 7,76(с, 1H), 7,48(д, 1H), 7,15-7,10(м, 2H), 6,96(д, 1H), 6,89-6,86(м, 1H), 6,83(с, 1H), 6,52(д, 1H), 3,30-3,25(м, 3H), 3,11-3,07(м, 2H), 2,34(с, 3H), 2,10-2,07(м, 1H), 1,73-1,69(м, 1H)
Пример 51: Получение 3,5-дифтор-4-((2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,65(с, 1H), 7,43(д, 2H), 7,04(д, 1H), 6,93-6,87(м, 2H), 6,75(с, 1H), 6,64(д, 1H), 3,63-3,60(м, 1H), 3,45-3,43(м, 2H), 3,19-3,17(м, 1H), 2,96-2,92(м, 1H), 2,61(с, 3H), 2,32-2,28(м, 1H), 1,98-1,95(м, 1H)
Пример 52: Получение 5-хлор-2-фтор-4-((2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,66(с, 1H), 7,74(д, 1H), 7,20(т, 1H), 7,12(д, 1H), 6,96(д, 1H), 6,92-6,89(м, 1H), 6,79(с, 1H), 6,12(д, 1H), 3,30(с, 3H), 3,16-3,11(м, 2H), 2,40(с, 3H), 2,15-2,12(м, 1H), 1,79-1,78(м, 1H)
Пример 53: Получение 2-фтор-4-((4-метокси-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,71(с, 1H), 7,55(т, 1H), 7,02(д, 1H), 6,89(с, 1H), 6,49(м, 3H), 6,33(д, 1H), 3,78(с, 3H), 3,67(м, 1H), 3,42(м, 1H), 3,38(м, 2H), 3,10(м, 1H), 2,58(с, 3H), 2,27(м, 1H), 1,99(м, 1H)
Пример 54: Получение 3-хлор-4-((4-метокси-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида
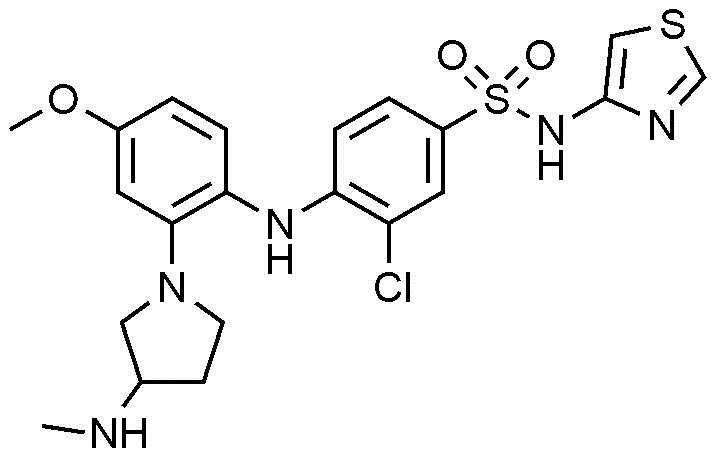
1Н ЯМР (500 МГц, MeOD): 8,70(д, 1H), 7,74(д, 1H), 7,45(д, 1H), 7,00(д, 1H), 6,94(д, 1H), 6,49(м, 2H), 6,37(д, 1H), 3,78(с, 3H), 3,47(м, 1H), 3,38(м, 2H), 3,27(м, 1H), 3,16(м, 1H), 2,46(с, 3H), 2,17(м, 1H), 1,83(м, 1H)
Пример 55: Получение 5-хлор-2-фтор-4-((4-метокси-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,71(д, 1H), 7,72(д, 1H), 7,01(д, 1H), 6,89(д, 1H), 6,51(м, 2H), 6,48(д, 1H), 3,81(с, 3H), 3,67(м, 1H), 3,45(м, 3H), 3,20(м, 1H), 2,59(с, 3H), 2,27(м, 1H), 1,96(м, 1H)
Пример 56: Получение (R)-4-((4-метокси-2-(3-(метиламино)пиперидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,68(с, 1H), 7,59(д, 2H), 7,13(д, 1H), 6,93(с, 1H), 6,78(д, 2H), 6,62(д, 2H), 3,77(с, 3H), 3,25(м, 1H), 2,87-2,65(м, 4H), 2,39(с, 3H), 1,85(м, 1H), 1,70(м, 1H), 1,54(м, 2H)
Пример 57: Получение (R)-2-фтор-4-((4-метокси-2-(3-(метиламино)пиперидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,70(с, 1H), 7,58(т, 1H), 7,12(д, 1H), 6,88(с, 1H), 6,65-6,58(м, 3H), 6,49(д, 1H), 3,78(с, 3H), 3,25(м, 1H), 2,89-2,77(м, 4H), 2,47(с, 3H), 1,88(м, 2H), 1,46(м, 2H)
Пример 58: Получение (R)-3-хлор-4-((4-метокси-2-(3-(метиламино)пиперидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,68(с, 1H), 7,77(с, 1H), 7,51(д, 1H), 7,17(д, 1H), 6,90(с, 1H), 6,72(д, 1H), 6,67(д, 2H), 3,78(с, 3H), 2,96-2,94(м, 1H), 2,70-2,45(м, 3H), 2,33(с, 3H), 1,88(м, 1H), 1,68(м, 1H), 1,44-1,37(м, 3H)
Пример 59: Получение (R)-3,5-дифтор-4-((4-метокси-2-(3-(метиламино)пиперидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,68(с, 1H), 7,40(д, 2H), 6,80(т, 2H), 6,63(с, 1H), 6,56(д, 1H), 3,74(с, 3H), 2,90-2,70(м, 4H), 2,53(с, 3H), 1,86-1,28(м, 5H)
Пример 60: Получение (R)-5-хлор-2-фтор-4-((4-метокси-2-(3-(метиламино)пиперидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,68(с, 1H), 7,74(д, 1H), 7,15(д, 1H), 6,81(с, 1H), 6,69(д, 2H), 6,31(д, 1H), 3,79(с, 3H), 2,99(м, 1H), 2,67-2,49(м, 3H), 2,39(с, 3H), 1,88(м, 1H), 1,68(м, 1H), 1,35-1,28(м, 3H)
Пример 61: Получение 3-хлор-4-((4-фтор-2-(4-метилпиперазин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,70(с, 1H), 7,81(с, 1H), 7,54(д, 1H), 7,24(д, 1H), 7,00(с, 1H), 6,89-6,79(м, 3H), 2,98-2,92(м, 4H), 2,37(м, 4H), 2,20(с, 3H)
Пример 62: Получение 5-хлор-2-фтор-4-((4-фтор-2-(4-метилпиперазин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,71(с, 1H), 7,77(д, 1H), 7,24(т, 1H), 6,98(с, 1H), 6,91-6,82(м, 2H), 6,40(д, 1H), 2,96(м, 4H), 2,36(м, 4H), 2,15(с, 3H)
Пример 63: Получение (S)-5-хлор-4-((2-(3-(диметиламино)пирролидин-1-ил)-4-фторфенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, CDCl3): 8,62(д, 1H), 7,79(д, 1H), 6,98(м, 2H), 6,52(м, 2H), 6,23(м, 2H), 3,22(м, 3H), 3,14(м, 1H), 2,70(м, 1H), 2,23(с, 6H), 1,78(м, 2H)
Пример 64: Получение (S)-5-хлор-4-((2-(3-(диметиламино)пирролидин-1-ил)-4-(трифторметил)фенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, CDCl3): 8,63(с, 1H), 7,83(д, 1H), 7,17(м, 3H), 6,99(с, 1H), 6,64(с, 1H), 6,56(д, 1H), 3,25(м, 4H), 2,81(м, 1H), 2,24(с, 6H), 1,85(м, 2H)
Пример 65: Получение 5-хлор-2-фтор-4-((2-(4-метилпиперазин-1-ил)-4-(трифторметил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида
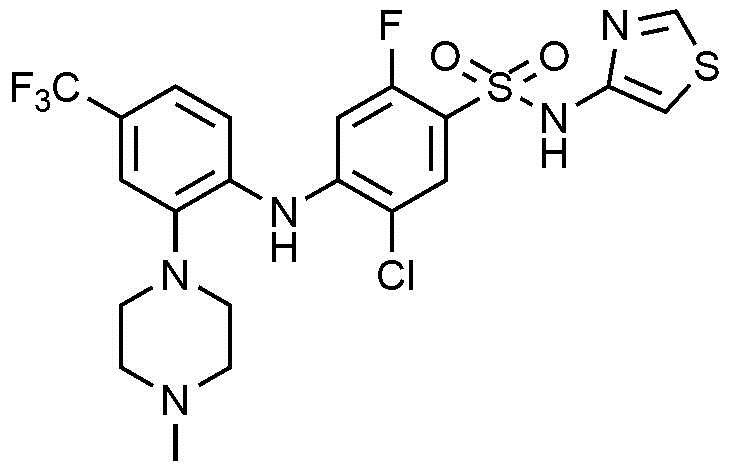
1Н ЯМР (500 МГц, MeOD): 8,71(с, 1H), 7,72(д, 1H), 7,28(м, 3H), 6,06(с, 1H), 6,06(д, 1H), 3,37(м, 4H), 2,66(м, 4H), 2,37(с, 3H)
Пример 66: Получение 5-хлор-4-((4-(дифторметокси)-2-(4-метилпиперазин-1-ил)фенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамида
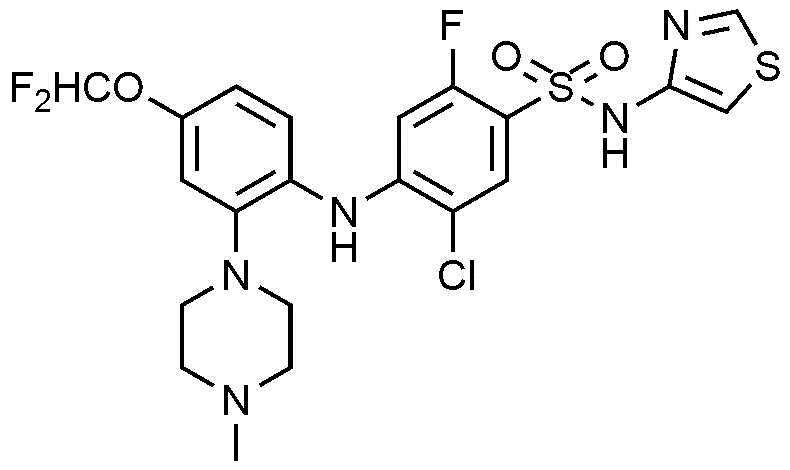
1Н ЯМР (500 МГц, MeOD): 8,72(с, 1H), 7,78(с, 1H), 7,28(д, 1H), 6,98-6,82(м, 4H), 6,49(д, 1H), 3,39-3,30(м, 4H), 2,97(м, 4H), 2,25(с, 3H)
Пример 67: Получение 5-хлор-2-фтор-4-((2-(4-метилпиперазин-1-ил)-4-(трифторметокси)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,71(с, 1H), 7,81(д, 1H), 7,35(д, 1H), 7,03-6,98(м, 3H), 6,59(д, 1H), 4,09(д, 1H), 2,97(м, 4H), 2,42(м, 4H), 2,22(с, 3H)
Пример 68: Получение (S)-3-хлор-4-((2-(3-(диметиламино)пирролидин-1-ил)-4-(трифторметил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, CDCl3): 8,66(д, 1H), 7,80(д, 1H), 7,52(дд, 1H), 7,28(с, 1H), 7,14(м, 2H), 7,05(д, 1H), 6,89(д, 1H), 6,64(с, 1H), 3,22(м, 2H), 3,16(м, 2H), 2,79(м, 1H), 2,23(с, 6H), 2,10(м, 1H), 2,06(м, 1H)
Пример 69: Получение (S)-2-фтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,70(д, 1H), 7,56(т, 1H), 7,06(т, 1H), 6,90(д, 1H), 6,65(д, 1H), 6,57(т, 1H), 6,43(д, 1H), 6,30(д, 1H), 3,37(м, 3H),l 3,24(м, 1H), 3,13(м, 1H), 2,44(с, 3H), 2,18(м, 1H), 2,00(м, 1H)
Пример 70: Получение (S)-5-хлор-2-фтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,71(с, 1H), 7,73(д, 1H), 7,07(т, 1H), 6,92(с, 1H), 6,67(д, 1H), 6,59(т, 1H), 6,01(д, 1H), 3,45(м, 3H), 3,23(м, 2H), 2,46(с, 3H), 2,17(м,1H), 1,83(м, 1H)
Пример 71: Получение (S)-5-хлор-4-((2-(3-(диметиламино)пирролидин-1-ил)-4-метоксифенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, CDCl3): 8,58(д, 1H), 7,76(д, 1H), 6,99(м, 2H), 6,37(м, 2H), 6,26(м, 2H), 3,80(с, 3H), 3,25-3,21(м, 5H), 2,76(м, 1H), 2,21(с, 6H), 2,05(м, 1H)
Пример 72: Получение (S)-5-хлор-4-((4-(дифторметокси)-2-(3-(диметиламино)пирролидин-1-ил)фенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, CDCl3): 8,63(д, 1H), 7,79(д, 1H), 7,04(м, 1H), 6,96(д, 1H), 6,57(м, 2H), 6,50(д, 1H), 6,29(м, 2H), 3,22(м, 4H), 2,75(м, 1H), 2,22(с, 6H), 2,05(м, 1H), 1,78(м, 1H)
Пример 73: Получение (R)-5-хлор-4-((2-(3-(диметиламино)пирролидин-1-ил)-4-фторфенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, CDCl3): 8,64(с, 1H), 7,79(д, 1H), 7,01(т, 1H), 6,98(с, 1H), 6,51(м, 2H), 6,23(м, 2H), 3,24(м, 5H), 2,71(м, 1H), 2,20(с, 6H), 1,77(м, 1H)
Пример 74: Получение (R)-5-хлор-4-((2-(3-(диметиламино)пирролидин-1-ил)-4-(трифторметил)фенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, CDCl3): 8,64(д, 1H), 7,84(д, 1H), 7,24(д, 1H), 7,12(м, 2H), 6,98(д, 1H), 6,66(с, 1H), 6,54(д, 1H), 3,23(м, 4H), 2,83(м, 1H), 2,23(с, 6H), 1,90(м, 2H)
Пример 75: Получение (R)-5-хлор-4-((4-(дифторметокси)-2-(3-(диметиламино)пирролидин-1-ил)фенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, CDCl3): 8,62(д, 1H), 7,79(д, 1H), 7,05(д, 1H), 6,98(д, 1H), 6,57(с, 1H), 6,50(т, 1H), 6,31(м, 2H), 3,24(м, 3H), 3,15(м, 1H), 2,74(м, 1H), 2,21(с, 6H), 1,77(м, 2H)
Пример 76: Получение 4-((2-(1,4-диазепан1-ил)-4-фторфенил)амино)-5-хлор-2-фтор-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,69(с, 1H), 7,76(д, 1H), 7,20(м, 1H), 6,97(д, 1H), 6,92(с, 1H), 6,82(т, 1H), 6,22(д, 1H), 3,30(м, 2H), 3,20(т, 2H), 3,10(м, 4H), 1,95(м, 2H)
Пример 77: Получение 5-хлор-4-((4-циано-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,69(с, 1H), 7,80(д, 1H), 7,29(с, 1H), 7,24(м, 2H), 6,90(с, 1H), 6,33(д, 1H), 3,42(м, 3H), 3,16(м, 2H), 2,47(с, 3H), 2,18(м, 1H), 1,85(м, 1H)
Пример 78: Получение (R)-N-(1-(2-((2-хлор-5-фтор-4-(N-(тиазол-4-ил)сульфамоил)фенил)амино)-5-(трифторметил)фенил)пирролидин-3-ил)ацетамида
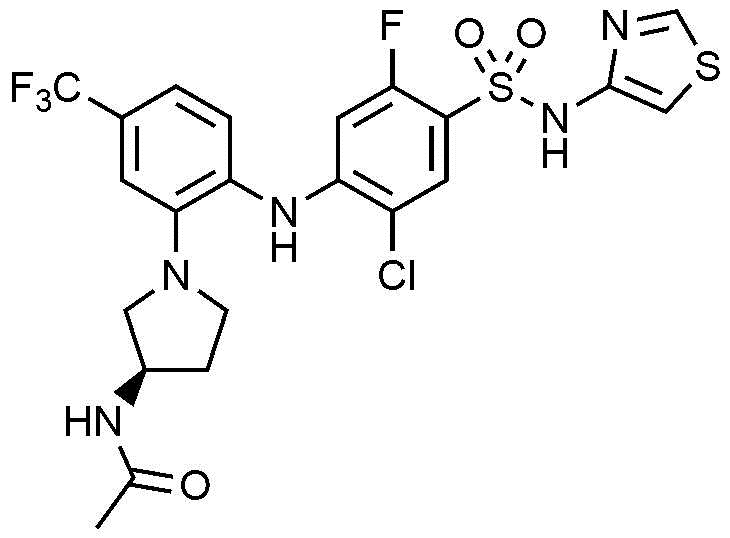
1Н ЯМР (500 МГц, CDCl3): 9,25(широкий, 1H), 8,64(д, 1H), 7,84(д, 1H), 7,18(м, 2H), 7,02(д, 1H), 6,69(с, 1H), 6,52(д, 1H), 5,60(д, 1H), 4,50(м, 1H), 3,37(м, 1H), 3,27(м, 1H), 3,09(м, 2H), 2,27(м, 1H), 1,95(с, 3H), 1,77(м, 1H)
Пример 79: Получение (R)-N-(1-(2-((2-хлор-4-(N-(тиазол-4-ил)сульфамоил)фенил)амино)-5-(трифторметил)фенил)пирролидин-3-ил)ацетамида

1Н ЯМР (500 МГц, CDCl3): 9,34(с, 1H), 8,69(д, 1H), 7,79(д, 1H), 7,52(д, 1H), 7,28(д, 1H), 7,18(м, 2H), 7,07(с, 1H), 6,86(д, 1H), 6,69(с, 1H), 5,59(д, 1H), 4,51(м, 1H), 3,49(с, 3H), 3,33(м, 1H), 3,26(м, 1H), 3,06(м, 2H), 2,27(м, 1H), 1,94(с, 3H), 1,75(м, 1H)
Пример 80: Получение (S)-3-хлор-4-((2-(3-(метиламино)пирролидин-1-ил)-4-(трифторметил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,70(с, 1H), 7,82(с, 1H), 7,55(д, 1H), 7,23(м, 3H), 6,95(с, 1H), 6,69(д, 1H), 3,60(м, 1H), 3,44(м, 2H), 3,30(м, 1H), 3,15(м, 1H), 2,57(с, 3H), 2,24(м, 1H), 1,94(м, 1H
Пример 81: Получение (S)-5-хлор-2-фтор-4-((2-(3-(метиламино)пирролидин-1-ил)-4-(трифторметил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,65(с, 1H), 7,77(д, 1H), 7,24(д, 1H), 7,19(с, 1H), 7,16(д, 1H), 6,74s, 1H), 6,24(д, 1H), 3,57(м, 1H), 3,45(м, 2H), 3,30(м, 1H), 3,17(м, 1H), 2,54(с, 3H), 2,22(м, 1H), 1,93(м, 1H)
Пример 82: Получение 5-хлор-2-фтор-4-((4-фтор-2-(3-(метиламино)азетидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,86(с, 1H), 8,17(с, 1H), 7,07(д, 1H), 6,84(д, 1H), 6,79(д, 1H), 6,40(м, 1H), 6,33(с, 1H), 3,93-3,70 (м, 4H), 3,35(м, 1H), 3,23(с, 3H)
Пример 83: Получение 4-((2-(3-аминоазетидин-1-ил)-4-фторфенил)амино)-5-хлор-2-фтор-N-(тиазол-4-ил)бензолсульфонамида
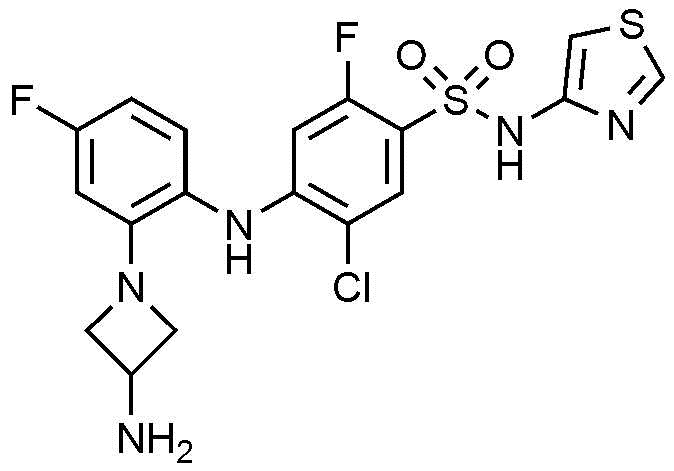
1Н ЯМР (500 МГц, MeOD): 8,84(с, 1H), 8,07(с, 1H), 7,11(д, 1H), 6,85(д, 1H), 6,81(д, 1H), 6,40(м, 1H), 6,33(с, 1H), 4,03-3,82 (м, 4H), 3,42(м, 1H)
Пример 84: Получение 5-хлор-4-((2-(3-(диметиламино)азетидин-1-ил)-4-фторфенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, MeOD): 8,76(с, 1H), 8,10(с, 1H), 7,07(д, 1H), 6,84(д, 1H), 6,79(д, 1H), 6,40(м, 1H), 6,33(с, 1H), 3,99-3,65 (м, 4H), 3,33(м, 1H), 3,12(с, 6H)
Пример 85: Получение N-(1-(2-((2-хлор-5-фтор-4-(N-(тиазол-4-ил)сульфамоил)фенил)амино)-5-фторфенил)азетидин-3-ил)ацетамида
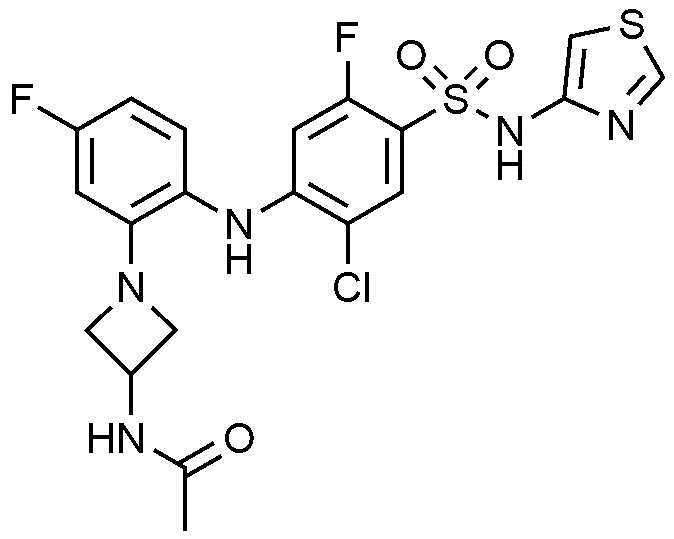
1Н ЯМР (500 МГц, MeOD): 8,56(с, 1H), 8,00(с, 1H), 7,00(д, 1H), 6,77(д, 1H), 6,71(д, 1H), 6,30(м, 1H), 6,29(с, 1H), 3,91-3,55 (м, 4H), 3,35(м, 1H), 2,13(с, 3H)
Пример 86: Получение 5-хлор-2-фтор-4-((4-фтор-2-(3-метоксипирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, CDCl3): 10,93(с, 1H), 8,74(д, 1H), 7,81(д, 1H), 6,99(т, 1H), 6,50(м, 2H), 6,24(м, 2H), 3,92(т, 1H), 3,32(м, 2H), 3,26(с, 3H), 3,11(м, 2H), 2,01(м, 1H), 1,92(м, 1H), 1,69(м, 1H)
Пример 87: Получение 5-хлор-2-фтор-4-((2-(3-метоксипирролидин-1-ил)-4-(трифторметил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида
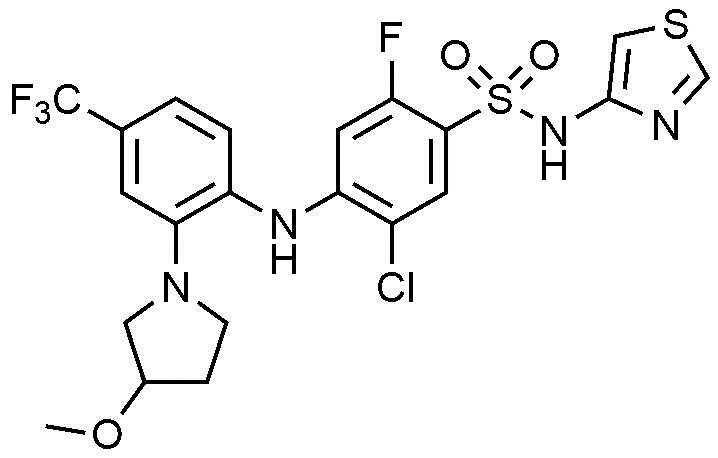
1Н ЯМР (500 МГц, CDCl3): 10,79(с, 1H), 8,74(д, 1H), 7,85(д, 1H), 7,25(м, 2H), 7,15(с, 1H), 7,11(д, 1H), 6,94(д, 1H), 6,66(с, 1H), 6,56(д, 1H), 3,97(т, 1H), 3,31(м, 2H), 3,30(с, 3H), 3,12(м, 2H), 2,04(м, 2H)
Пример 88: Получение (R)-N-(1-(2-((2-хлор-5-фтор-4-(N-(тиазол-4-ил)сульфамоил)фенил)амино)-5-фторфенил)пирролидин-3-ил)ацетамида

1Н ЯМР (500 МГц, CDCl3): 10,63(с, 1H), 8,70(д, 1H), 7,78(д, 1H), 7,01(м, 1H), 6,94(д, 1H), 6,51(м, 2H), 6,30(с, 1H), 6,17(д, 1H), 5,78(д, 1H), 4,44(м, 1H), 3,38(м, 1H), 3,27(м, 1H), 3,10(м, 1H), 3,03(м, 1H), 2,15(м, 1H), 1,90(с, 3H), 1,75(м, 1H)
Пример 89: Получение 3-хлор-4-((4-фтор-2-(3-метоксипирролидин-1-ил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида
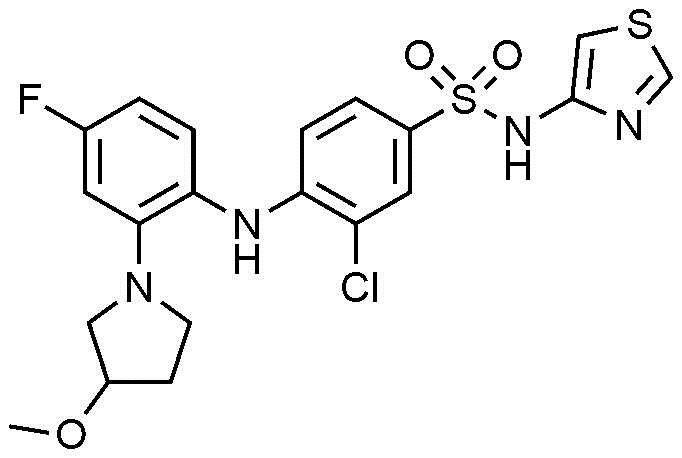
1Н ЯМР (500 МГц, CDCl3): 10,74(с, 1H), 8,77(с, 1H), 7,72(с, 1H), 7,42(д, 1H), 7,01(м, 2H), 6,53(м, 3H), 6,18(с, 1H), 3,90(с, 1H), 3,34(м, 2H), 3,25(с, 3H), 3,12(м, 2H), 1,99(м, 1H), 1,89(м, 1H)
Пример 90: Получение 3-хлор-4-((2-(3-метоксипирролидин-1-ил)-4-(трифторметил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамида

1Н ЯМР (500 МГц, CDCl3): 10,38(с, 1H), 8,76(с, 1H), 7,78(с, 1H), 7,50(д, 1H), 7,26(д, 1H), 7,14(м, 2H), 7,02(с, 1H), 6,91(д, 1H), 6,65(с, 1H), 3,97(с, 1H), 3,33(м, 5H), 3,12(м, 2H), 2,03(м, 2H)
Пример 91: Получение (R)-N-(1-(2-((2-хлор-4-(N-(тиазол-4-ил)сульфамоил)фенил)амино)-5-фторфенил)пирролидин-3-ил)ацетамида

1Н ЯМР (500 МГц, CDCl3): 10,43(широкий, 1H), 8,76(с, 1H), 7,71(с, 1H), 7,41(с, 1H), 7,03(с, 2H), 6,54(м, 3H), 6,25(с, 1H), 5,90(с, 1H), 4,40(с, 1H), 3,28(м, 2H), 2,98(м, 3H), 2,15(м, 1H), 2,03-1,74(м, 3H)
Пример 92: Получение 5-хлор-2-фтор-4-((4-фтор-2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид гидрохлорида

Стадия 1) Получение трет-бутил(2-((2-амино-5-фторфенил)(метил)амино)этил)(метил)карбамата (iii)
2,4-Дифтор-1-нитробензол (i, 2,0 г, 12,6 ммоль) и трет-бутилметил(2-(метиламино)этил)карбамат (ii, 2,4 г, 1,0 экв.) растворяли в DMF (20 мл), и затем к раствору добавляли K2CO3 (2,6 г, 1,5 экв.). Поддерживая внутреннюю температуру на уровне от 60 до 70°C, реакционную смесь перемешивали в течение 2 часов. Когда реакционный раствор приобрел темно-желтый цвет, завершение реакции проверяли методом TLC. После охлаждения до комнатной температуры добавляли EA/H2О и перемешивали, затем слои разделяли. К отделенному органическому слою добавляли MgSO4, который перемешивали, фильтровали и затем сушили. Фильтрат концентрировали при пониженном давлении, и осадок растворяли в MeOH (0,13 г, 0,1 экв.), а затем добавляли Pd/C (0,13 г, 0,1 экв.). Внутренний объем замещали газообразным водородом, и реакционную смесь перемешивали при комнатной температуре в течение 6 часов. Когда желтый цвет реакционного раствора побледнел, и раствор стал практически бесцветным, завершение реакции проверяли методом TLC. Металлический катализатор фильтровали через целит. Фильтрат концентрировали при пониженном давлении, и полученный осадок разделяли с помощью колоночной хроматографии (Hx/EA=3/1) с получением целевого соединения (iii, 2,5 г, 66,9%).
1Н ЯМР (500 МГц, CDCl3): 6,76(д, 1H), 6,64(м, 2H),3,36(м, 2H), 2,94(м, 2H), 2,86(м, 3H), 2,68(с, 3H), 1,45(с, 9H)
Стадия 2) Получение трет-бутил-тиазол-4-ил карбамата (v)
Тиазол-4-карбоновую кислоту (iv, 5,0 г, 38,8 ммоль) растворяли в t-BuOH (100 мл), и затем к раствору добавляли TEA (8,1 мл, 1,5 экв.) и DPPA (7,1 мл, 1,5 экв.). Поддерживая внутреннюю температуру на уровне от 90 до 100°C, реакционную смесь перемешивали в течение 3 дней, и затем завершение реакции проверяли методом TLC. Реакционную смесь концентрировали при пониженном давлении, к которой добавляли H2O (50 мл), и выполняли двойную экстракцию этилацетатом (EA, 100 мл). К органическому слою добавляли MgSO4, который перемешивали, фильтровали и сушили. Фильтрат концентрировали при пониженном давлении, и осадок добавляли к небольшому количеству EA и суспендировали. Полученное твердое вещество фильтровали с получением соединения белого цвета, указанного в заголовке (v, 4,0 г, 51,5%).
1Н ЯМР (500 МГц, MeOD): 8,73(с, 1H), 7,24(с, 1H), 1,52(с, 9H)
Стадия 3) Получение трет-бутил((4-бром-5-хлор-2-фторфенил)сульфонил)(тиазол-4-ил)карбамата (vii)
Трет-бутил-тиазол-4-ил карбамат (v, 4,0 г, 20,0 ммоль) добавляли в реакционный сосуд, и внутренний объем сосуда замещали газообразным азотом. После растворения в THF (32 мл) раствор охлаждали до -78°C, используя сухой лед-ацетон. После охлаждения медленно добавляли LiHMDS (22,4 мл, 1,5 экв.), и реакционную смесь перемешивали в течение 30 минут. Затем, 4-бром-5-хлор-2-фторбензолсульфонил хлорид (vi, 6,0 г, 1,0 экв.) растворяли в THF (10 мл) и медленно добавляли к реакционному раствору. Реакционную смесь перемешивали в течение ночи, и завершение реакции проверяли методом TLC. Добавляли H2O (50 мл), и выполняли двойную экстракцию этилацетатом (EA, 100 мл). К органическому слою добавляли MgSO4, который перемешивали, фильтровали и сушили. Фильтрат концентрировали при пониженном давлении, и осадок кристаллизовали смесью THF/н-гексан с получением указанного в заголовке соединения (vii, 4,4 г, 59,0%).
1Н ЯМР (500 МГц, MeOD): 9,00(с, 1H), 8,22(д, 1H), 7,90(д, 1H), 7,78(с, 1H), 1,35(с, 9H)
Стадия 4) Получение трет-бутил(2-((2-((4-(N-(трет-бутоксикарбонил)-N-(тиазол-4-ил)сульфамоил)-2-хлор-5-фторфенил)амино)-5-фторфенил)(метил)амино)этил(метил)карбамата (viii)
Трет-бутил(2-((2-амино-5-фторфенил)(метил)амино)этил(метил)карбамат (iii, 10,0 г, 33,7 ммоль) и трет-бутил((4-бром-5-хлор-2-фторфенил)сульфонил)(тиазол-4-ил)карбамат (vii, 13,0 г, 1,0 экв.) растворяли в 1,4-диоксане (200 мл). К реакционному раствору добавляли Pd(OAc)2(0,7 г, 0,1 eq), rac-BINAP (4,11 г, 0,2 экв.) и Cs2CO3 (21,2 г, 2,0 экв.). Поддерживая внутреннюю температуру на уровне от 90 до 100°C, реакционную смесь перемешивали в течение 5 часов, и затем завершение реакции проверяли методом TLC. Добавляли H2O (100 мл), и выполняли двойную экстракцию этилацетатом (EA, 1000 мл). К органическому слою добавляли MgSO4, который перемешивали, фильтровали и затем сушили. Фильтрат концентрировали при пониженном давлении, и осадок разделяли с помощью колоночной хроматографии, используя подвижную фазу EA/Hex=1/4, с получением указанного в заголовке соединения (16,0 г, 69,1%).
1Н ЯМР (500 МГц, MeOD): 8,95(д, 1H), 7,96(д, 1H), 7,68(с, 1H), 7,26(с, 1H), 6,95(т, 1H), 6,8(с, 1H), 6,39(с, 1H), 3,27(с, 2H), 3,14(с, 2H), 2,79(с, 3H), 2,70(д, 3H), 1,40(с, 9H), 1,37(с, 9H)
Стадия 5) Получение 5-хлор-2-фтор-4-((4-фтор-2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид гидрохлорида
К трет-бутил(2-((2-((4-(N-(трет-бутоксикарбонил)-N-(тиазол-4-ил)сульфамоил)-2-хлор-5-фторфенил)амино)-5-фторфенил)(метил)амино)этил(метил)карбамата (vii, 14,0 г, 20,3 ммоль) добавляли 1M HCl в этилацетате (200 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали, и к полученному осадку добавляли MC (200 мл) и перемешивали в течение 1 часа. Полученное твердое вещество фильтровали с получением целевого соединения (9,1 г, 85,3%).
1Н ЯМР (500 МГц, MeOD): 8,73(д, 1H), 7,79(д, 1H), 7,26(дд, 1H), 7,03(м, 2H), 6,90(тд, 1H), 6,43(д, 1H), 3,26(т, 2H), 3,09(т, 2H), 2,70(с, 3H), 2,65(с, 3H)
Пример 93: Получение 3-хлор-4-((2-((2-(диметиламино)этил)(метил)амино)-4-фторфенил)амино)-N-(тиазол-4-ил)бензолсульфонамида
Промежуточное соединение получали таким же образом, как описано в примере 92, за исключением того, что вместо трет-бутилметил(2-(метиламино)этил)карбамата (ii) использовали N,N,N'-триметилэтан-1,2-диамин, и вместо 4-бром-5-хлор-2-фторбензолсульфонил хлорида (vi) использовали 4-бром-5-хлорбензолсульфонил хлорид. К полученному промежуточному соединению, трет-бутил((3-хлор-4-((2-((-(диметиламино)этил)(метил)амино)-4-фторфенил)амино)фенил)сульфонил)(тиазол-4-ил)карбамат (0,05 г, 0,09 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 48,0%).
1Н ЯМР (500 МГц, MeOD): 8,73(с, 1H), 7,81(с, 1H), 7,54(д, 1H), 7,21(дд, 1H), 7,00(м, 2H), 6,82(дд, 1H), 6,75(д, 1H), 3,20(т, 2H), 2,93(т, 2H), 2,70(с, 3H), 2,55(с, 3H)
Пример 94: Получение 5-хлор-4-((2-((2-(диметиламино)этил)(метил)амино)-4-фторфенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамида

Промежуточное соединение получали таким же образом, как описано в примере 92, за исключением того, что вместо трет-бутил метил(2-(метиламино)этил)карбамата (ii) использовали N,N,N'-триметилэтан-1,2-диамин. К полученному промежуточному соединению, трет-бутил((5-хлор-4-((2-(диметиламино)этил)(метил)амино)-4-фторфенил)амино)-2-фторфенил)сульфонил)(тиазол-4-ил)карбамат (0,05 г, 0,08 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 49,8%).
1Н ЯМР (500 МГц, MeOD): 8,72(с, 1H), 7,76(д, 1H), 7,2(т, 1H), 6,95(м, 2H), 6,80(т, 1H), 6,38(д, 1H), 3,01(т, 2H), 2,68(с, 3H), 2,40(т, 2H), 2,15(с, 3H)
Пример 95: Получение 5-хлор-2-фтор-4-((2-(метил(2-(метиламино)этил)амино)-4-(трифторметил)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 92, за исключением того, что вместо 2,4-дифтор-1-нитробензола (i) использовали 2-фтор-1-нитро-4-(трифторметил)бензол. К полученному промежуточному соединению, трет-бутил(2-((2-((4-(N-(трет-бутоксикарбонил)-N-(тиазол-4-ил)сульфамоил)-2-хлор-5-фторфенил)амино)-5-(трифторметил)фенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 55,5%).
1Н ЯМР (500 МГц, MeOD): 8,74(с, 1H), 7,88(д, 1H), 7,54(с, 1H), 7,42(м, 2H), 7,06(с, 1H), 7,02(д, 1H), 3,35(т, 2H), 3,16(т, 2H), 2,73(с, 3H), 2,70(с, 3H)
Пример 96: Получение 5-хлор-2-фтор-4-((4-фтор-2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(5-фторпиримидин-2-ил)бензолсульфонамид гидрохлорида

Вместо соединения, получаемого на стадии 2 примера 92, получали N-(2,4-диметоксибензил)-5-фторпиримидин-2-амин (v). В частности, 2-хлор-5-фторпиримидин (iv, 0,48 г, 3,62 ммоль), (2,4-диметоксифенил)метанамин (0,60 г, 1,0 экв.) и триметиламин (0,76 мл, 1,5 экв.) растворяли в EtOH (10 мл). После перемешивания смеси в течение ночи при нагревании до 70-80°C завершение реакции проверяли методом TLC. Раствор концентрировали при пониженном давлении, и полученный осадок разделяли с помощью колоночной хроматографии, используя мобильную фазу EA/Hex=1/2, с получением 0,32 г (выход 34%) целевого соединения (v).
1Н ЯМР (500 МГц, MeOD): 8,20(с, 2H), 7,13(д, 1H), 6,51(с, 1H), 6,41(д, 1H), 4,44(с, 2H), 3,82(с, 3H), 3,76(с, 3H)
Целевое соединение получали таким же образом, как описано на стадиях 1, 3, 4 и 5 примера 92, за исключением того, что вместо трет-бутилтиазол-4-илкарбамата (v) в примере 92 использовали полученный выше N-(2,4-диметоксибензил)-5-фторпиримидин-2-амин.
1Н ЯМР (500 МГц, MeOD): 8,43(м, 2H), 7,99(т, 1H), 7,27(дд, 1H), 7,03(д, 1H), 6,88(т, 1H), 6,45(д, 1H), 3,20(т, 2H), 3,10(т, 2H), 2,71(с, 3H), 2,67(с, 3H)
Пример 97: Получение 5-хлор-2-фтор-N-(5-фторпиримидин-2-ил)-4-((2-(метил(2-(метиламино)этил)амино)-4-(трифторметил)фенил)амино)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 96, за исключением того, что вместо 2,4-дифтор-1-нитробензола (i) использовали 2-фтор-1-нитро-4- (трифторметил)бензол. К полученному промежуточному соединению, трет-бутил(2-((2-((2-хлор-4-(N-(2,4-диметоксибензил)-N-(5-фторпиримидин-2-ил)сульфамоил)-5-фторфенил)амино)-5-(трифторметил)фенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,06 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 58,3%).
1Н ЯМР (500 МГц, MeOD): 8,47(с, 1H), 8,29(с, 1H), 8,05(м, 1H), 7,53(д, 1H), 7,41(м, 2H), 7,01(т, 1h), 3,45(т, 2H), 3,16(т, 2H), 2,74(с, 3H), 2,69(с, 3H)
Пример 98: Получение 5-хлор-4-((4-(дифторметокси)-2-(метил(2-(метиламино)этил)амино)фенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 92, за исключением того, что вместо 2,4-дифтор-1-нитробензола (i) использовали 4-(дифторметокси)-2-фтор-1-нитробензол. К полученному промежуточному соединению, трет-бутил(2-((2-((4-(N-(трет-бутоксикарбонил)-N-(тиазол-4-ил)сульфамоил)-2-хлор-5-фторфенил)амино)-5-(дифторметокси)фенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 55,7%).
1Н ЯМР (500 МГц, MeOD): 8,73(с, 1H), 7,80(д, 1H), 7,29(д, 1H), 7,02(с, 2H), 6,94(д, 1H), 6,85(т, 1H), 6,55(д, 1H), 3,25(т, 2H), 3,10(т, 2H), 2,70(с, 3H), 2,66(с, 3H)
Пример 99: Получение 5-хлор-4-((4-циано-2-(метил(2-(метиламино)этил)амино)фенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 92, за исключением того, что вместо 2,4-дифтор-1-нитробензола (i) использовали 3-фтор-4-нитробензонитрил. К полученному промежуточному соединению, трет-бутил (2-((2-((4-(N-(трет-бутоксикарбонил)-N-(тиазол-4-ил)сульфамоил)-2-хлор-5-фторфенил)амино)-5-цианофенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 56,1%).
1Н ЯМР (500 МГц, MeOD): 8,75(с, 1H), 7,91(д, 1H), 7,62(д, 1H), 7,47(т, 1H), 7,32(д, 1H), 7,17(д, 1H), 7,07(д, 1H), 3,28(т, 2H), 3,17(т, 2H), 2,71(с, 3H), 2,70(с, 3H)
Пример 100: Получение 5-хлор-4-((4-циано-2-(метил(2-(метиламино)этил)амино)фенил)амино)-2-фтор-N-(5-фторпиримидин-2-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 96, за исключением того, что вместо 2,4-дифтор-1-нитробензола (i) использовали 3-фтор-4-нитробензонитрил. К полученному промежуточному соединению, трет-бутил(2-((2-((2-хлор-4-(N-(2,4-диметоксибензил)-N-(5-фторпиримидин-2-ил)сульфамоил)-5-фторфенил)амино)-5-цианофенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 59,7%).
1Н ЯМР (500 МГц, MeOD): 8,43(с, 2H), 8,10(д, 1H), 7,63(с, 1H), 7,48(д, 1H), 7,36(д, 1H), 7,17(д, 1H), 3,34-3,32(м, 2H), 3,19-3,16(м, 2H), 2,72(с, 3H), 2,71(с, 3H)
Пример 101: Получение 5-хлор-4-((4-(дифторметокси)-2-(метил(2-(метиламино)этил)амино)фенил)амино)-2-фтор-N-(5-фторпиримидин-2-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 96, за исключением того, что вместо 2,4-дифтор-1-нитробензола (i) использовали 4-(дифторметокси)-2-фтор-1-нитробензол. К полученному промежуточному соединению, трет-бутил(2-((2-((2-хлор-4-(N-(2,4-диметоксибензил)-N-(5-фторпиримидин-2-ил)сульфамоил)-5-фторфенил)амино)-5-(дифторметокси)фенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,06 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 58,2%).
1Н ЯМР (500 МГц, MeOD): 8,42(с, 2H), 8,01(д, 1H), 7,33-7,17(м, 3H), 6,71(д, 1H), 3,35-3,32(м, 2H), 3,13-3,10(м, 2H), 2,68(с, 3H), 2,67(с, 3H)
Пример 102: Получение 5-хлор-2-фтор-N-(5-фторпиримидин-2-ил)-4-((2-(метил(2-(метиламино)этил)амино)фенил)амино)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 96, за исключением того, что вместо 2,4-дифтор-1-нитробензола (i) использовали 1-фтор-2-нитробензол. К полученному промежуточному соединению, трет-бутил(2-((2-((2-хлор-4-(N-(2,4-диметоксибензил)-N-(5-фторпиримидин-2-ил)сульфамоил)-5-фторфенил)амино)фенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 60,7%).
1Н ЯМР (500 МГц, MeOD): 8,42(с, 2H), 8,00(д, 1H), 7,30(д, 1H), 7,03(д, 1H), 6,94(д, 1H), 6,69(с, 1H), 6,52(д, 1H), 3,34-3,32(м, 2H), 3,12-3,10(м, 2H), 2,70(с, 3H), 2,67(с, 3H)
Пример 103: Получение 5-хлор-2-фтор-4-((4-фтор-2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(5-фторпиридин-2-ил)бензолсульфонамид гидрохлорида

Вместо соединения, получаемого на стадии 2 примера 92, получали N-(2,4-диметоксибензил)-5-фторпиридин-2-амин (v). В частности, 5-фторпиридин-2-амин (iv, 0,55 г, 0,01 ммоль) и 2,4-диметоксибензальдегид (0,45 г, 0,9 экв.) растворяли в DCM (10 мл). После перемешивания при комнатной температуре в течение 1 часа добавляли триацетоксиборгидрид натрия (1,0 г, 1 экв.) три раза с 15-ти минутными интервалами. После перемешивания смеси в течение ночи завершение реакции проверяли методом TLC. Добавляли H2O (10 мл), и выполняли двойную экстракцию дихлорметаном (10 мл). К органическому слою добавляли MgSO4, который перемешивали, фильтровали и сушили. Фильтрат концентрировали при пониженном давлении, и затем полученный осадок разделяли с помощью колоночной хроматографии, используя мобильную фазу EA/Hex=1/4, с получением 0,65 г (выход 51%) N-(2,4-диметоксибензил)-5-фторпиридин-2-амина (v).
1Н ЯМР (500 МГц, CDCl3): 7,90(д, 1H), 7,16(м, 2H), 6,46(д, 1H), 6,41(д, 1H), 6,34(м, 1H), 4,36(с, 2H), 3,81(с, 3H), 3,77(с, 3H)
Целевое соединение получали таким же образом, как описано на стадиях 1, 3, 4 и 5 примера 92, за исключением того, что вместо трет-бутилтиазол-4-илкарбамата (v) в примере 92 использовали полученный выше N-(2,4-диметоксибензил)-5-фторпиридин-2-амин.
1Н ЯМР (500 МГц, MeOD): 8,05(д, 1H), 7,89(д, 1H), 7,51(д, 1H), 7,26-6,87(м, 4H), 6,42(д, 1H), 3,38-3,25(м, 2H), 3,10-3,09(м, 2H), 2,69(с, 3H), 2,65(с, 3H)
Пример 104: Получение 5-хлор-2-фтор-4-((4-фтор-2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(пиридин-2-ил)бензолсульфонамид гидрохлорида
Промежуточное соединение получали таким же образом, как описано в примере 103, за исключением того, что вместо 5-фторпиридин-2-амина (iv) использовали пиридин-2-амин. К полученному промежуточному соединению, трет-бутил(2-((5-хлор-2-((2-хлор-4-(N-(2,4-диметоксибензил)-N-(пиридин-2-ил)сульфамоил)-5-фторфенил)амино)фенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 60,0%).
1Н ЯМР (500 МГц, MeOD): 8,01-7,92(м, 2H), 7,29-7,24(м, 3H), 7,03(д, 2H), 6,87(д, 1H), 6,46(д, 1H), 3,42-3,40(м, 2H), 3,11-3,08(м, 2H), 2,70(с, 3H), 2,66(с, 3H)
Пример 105: Получение 5-хлор-2-фтор-4-((4-фтор-2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(тиазол-2-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 103, за исключением того, что вместо 5-фторпиридин-2-амина (iv) использовали тиазол-2-амин. К полученному промежуточному соединению, трет-бутил(2-((5-хлор-2-((2-хлор-4-(N-(2,4-диметоксибензил)-N-(тиазол-2-ил)сульфамоил)-5-фторфенил)амино)фенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 59,8%).
1Н ЯМР (500 МГц, MeOD): 7,84(д, 2H), 7,28-7,04(м, 3H), 6,89(д, 1H), 6,74(д, 1H), 6,46(д, 1H), 3,26-3,24(м, 2H), 3,11-3,08(м, 2H), 2,71(с, 3H), 2,66(с, 3H)
Пример 106: Получение 5-хлор-4-((4-циано-2-(метил(2-(метиламино)этил)амино)фенил)амино)-2-фтор-N-(5-фторпиридин-2-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 103, за исключением того, что вместо 2,4-дифтор-1-нитробензола (i) использовали 3-фтор-4-нитробензонитрил. К полученному промежуточному соединению, трет-бутил(2-((2-((2-хлор-4-(N-(2,4-диметоксибензил)-N-(5-фторпиридин-2-ил)сульфамоил)-5-фторфенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 56,0%).
1Н ЯМР (500 МГц, MeOD): 8,05-8,01(м, 2H), 7,62(с, 1H), 7,55-7,46(м, 2H), 7,33(д, 1H), 7,14(д, 1H), 3,34-3,32(м, 2H), 3,18-3,17(м, 2H), 2,72(с, 3H), 2,71(с, 3H)
Пример 107: Получение 5-хлор-4-((4-циано-2-(метил(2-(метиламино)этил)амино)фенил)амино)-2-фтор-N-(пиридин-2-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 103, за исключением того, что вместо 2,4-дифтор-1-нитробензола (i) использовали 3-фтор-4-нитробензонитрил, и вместо 5-фторпиридин-2-амина (iv) использовали пиридин-2-амин. К полученному промежуточному соединению, трет-бутил(2-((2-((2-хлор-4-(N-(2,4-диметоксибензил)-N-(пиридин-2-ил)сульфамоил)-5-фторфенил)амино)-5-цианофенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 57,2%).
1Н ЯМР (500 МГц, MeOD): 8,05(д, 1H), 7,97-7,86(с, 2H), 7,62(с, 1H), 7,46(д, 1H), 7,33-7,19(м, 3H), 7,01-6,97(м, 1H), 3,32-3,31(м, 2H), 3,19-3,16(м, 2H), 2,72(с, 3H), 2,71(с, 3H)
Пример 108: Получение 5-хлор-4-((4-циано-2-(метил(2-(метиламино)этил)амино)фенил)амино)-2-фтор-N-(тиазол-2-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 103, за исключением того, что вместо 2,4-дифтор-1-нитробензола (i) использовали 3-фтор-4-нитробензонитрил, и вместо 5-фторпиридин-2-амина (iv) использовали тиазол-2-амин. К полученному промежуточному соединению, трет-бутил(2-((2-((2-хлор-4-(N-(2,4-диметоксибензил)-N-(тиазол-2-ил)сульфамоил)-5-фторфенил)амино)-5-цианофенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 60,2%).
1Н ЯМР (500 МГц, MeOD): 7,96(д, 1H), 7,62(с, 1H), 7,46(д, 1H), 7,28-7,14(м, 3H), 6,77(д, 1H), 3,32-3,30(м, 2H), 3,20-3,17(м, 2H), 2,72(с, 3H), 2,71(с, 3H)
Пример 109: Получение 5-хлор-2-фтор-N-(5-фторпиридин-2-ил)-4-((2-(метил(2-(метиламино)этил)амино)-4-(трифторметил)фенил)амино)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 103, за исключением того, что вместо 2,4-дифтор-1-нитробензола (i) использовали 2-фтор-1-нитро-4-(трифторметил)бензол. К полученному промежуточному соединению, трет-бутил(2-((2-((2-хлор-4-(N-(2,4-диметоксибензил)-N-(5-фторпиридин-2-ил)сульфамоил)-5-фторфенил)амино)-5-(трифторметил)фенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,06 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 58,2%).
1Н ЯМР (500 МГц, MeOD): 8,05(д, 1H), 7,99(д, 1H), 7,53(м, 2H), 7,43(с, 2H), 7,17(м, 1H), 7,02(д, 1H), 3,47(т, 2H), 3,17(т, 2H), 2,74(с, 3H), 2,70(с, 3H)
Пример 110: Получение 5-хлор-2-фтор-4-((2-(метил(2-(метиламино)этил)амино)-4-(трифторметил)фенил)амино)-N-(пиридин-2-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 103, за исключением того, что вместо 2,4-дифтор-1-нитробензола (i) использовали 2-фтор-1-нитро-4-(трифторметил)бензол, и вместо 5-фторпиридин-2-амина (iv) использовали пиридин-2-амин. К полученному промежуточному соединению, трет-бутил(2-((2-((2-хлор-4-(N-(2,4-диметоксибензил)-N-(пиридин-2-ил)сульфамоил-5-фторфенил)амино)-5-(трифторметил)фенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,06 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 58,8%).
1Н ЯМР (500 МГц, MeOD): 8,02(д, 1H), 7,98(т, 1H), 7,86(т, 1H), 7,53(с, 1H), 7,40(м, 2H), 7,31(д, 1H), 7,05(д, 1H), 6,99(м, 1H), 3,34(т, 2H), 3,17(т, 2H), 2,74(с, 3H), 2,71(с, 3H)
Пример 111: Получение 5-хлор-2-фтор-4-((2-(метил(2-(метиламино)этил)амино)-4-(трифторметил)фенил)амино)-N-(тиазол-2-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 103, за исключением того, что вместо 2,4-дифтор-1-нитробензола (i) использовали 2-фтор-1-нитро-4-(трифторметил)бензол, и вместо 5-фторпиридин-2-амина (iv) использовали тиазол-2-амин. К полученному промежуточному соединению, трет-бутил(2-((2-((2-хлор-4-(N-(2,4-диметоксибензил)-N-(тиазол-2-ил)сульфамоил)-5-фторфенил)амино)-5-(трифторметил)фенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,06 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 58,6%).
1Н ЯМР (500 МГц, MeOD): 7,93(д, 1H), 7,53(с, 1H), 7,41(м, 2H), 7,13(д, 1H), 7,07(д, 1H), 6,77(д, 1H), 3,34(т, 2H), 3,18(т, 2H), 2,75(с, 3H), 2,71(с, 3H)
Пример 112: Получение 5-хлор-2-фтор-N-(5-фторпиридин-2-ил)-4-((2-(метил(2-(метиламино)этил)амино)фенил)амино)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 103, за исключением того, что вместо 2,4-дифтор-1-нитробензола (i) использовали 1-фтор-2-нитробензол. К полученному промежуточному соединению, трет-бутил(2-((2-((2-хлор-4-(N-(2,4-диметоксибензил)-N-(5-фторпиридин-2-ил)сульфамоил)-5-фторфенил)амино)фенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 61,3%).
1Н ЯМР (500 МГц, MeOD): 8,06(д, 1H), 7,91(д, 1H), 7,51(м, 1H), 7,30(м, 2H), 7,22(т, 1H), 7,15(м, 2H), 6,70(д, 1H), 3,26(т, 2H), 3,11(т, 2H), 2,67(с, 6H)
Пример 113: Получение 5-хлор-2-фтор-4-((2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(пиридин-2-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 103, за исключением того, что вместо 2,4-дифтор-1-нитробензол (i) использовали 1-фтор-2-нитробензол, и вместо 5-фторпиридин-2-амина (iv) использовали пиридин-2-амин. К полученному промежуточному соединению, трет-бутил(2-((2-((2-хлор-4-(N-(2,4-диметоксибензил)-N-(пиридин-2-ил)сульфамоил)-5-фторфенил)амино)фенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 61,6%).
1Н ЯМР (500 МГц, MeOD): 8,03(д, 1H), 7,96(д, 1H), 7,90(д, 1H), 7,30(т, 3H), 7,23(т, 1H), 7,17(т, 1H), 7,04(м, 1H), 6,73(д, 1H), 3,26(т, 2H), 3,12(т, 2H), 2,68(с, 3H), 2,67(с, 3H)
Пример 114: Получение 5-хлор-2-фтор-4-((2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(тиазол-2-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 103, за исключением того, что вместо 2,4-дифтор-1-нитробензола (i) использовали 1-фтор-2-нитробензол, и вместо 5-фторпиридин-2-амина (iv) использовали тиазол-2-амин. К полученному промежуточному соединению, трет-бутил(2-((2-((2-хлор-4-(N-(2,4-диметоксибензил)-N-(тиазол-2-ил)сульфамоил)-5-фторфенил)амино)фенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 61,3%).
1Н ЯМР (500 МГц, MeOD): 7,86(д, 1H), 7,30(м, 2H), 7,20(м, 2H), 7,12(д, 1H), 6,75(м, 2H), 3,26(т, 2H), 3,12(т, 2H), 2,70(с, 3H), 2,68(с, 3H)
Пример 115: Получение 5-хлор-4-((4-(дифторметокси)-2-(метил(2-(метиламино)этил)амино)фенил)амино)-2-фтор-N-(5-фторпиридин-2-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 103, за исключением того, что вместо 2,4-дифтор-1-нитробензола (i) использовали 4-(дифторметокси)-2-фтор-1-нитробензол. К полученному промежуточному соединению, трет-бутил(2-((2-((2-хлор-4-(N-(2,4-диметоксибензил)-N-(5-фторпиридин-2-ил)сульфамоил)-5-фторфенил)амино)-5-(дифторметил)фенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,06 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 58,2%).
1Н ЯМР (500 МГц, MeOD): 8,06(д, 1H), 7,90(д, 1H), 7,52(м, 1H), 7,29(д, 1H), 7,16(м, 1H), 7,02(д, 1H), 6,94(м, 1H), 6,84(т, 1H), 6,53(д, 1H), 3,26(т, 2H), 3,10(т, 2H), 2,70(с, 3H), 2,66(с, 3H)
Пример 116: Получение 5-хлор-4-((4-(дифторметокси)-2-(метил(2-(метиламино)этил)амино)фенил)амино)-2-фтор-N-(тиазол-2-ил)бензолсульфонамид гидрохлорида
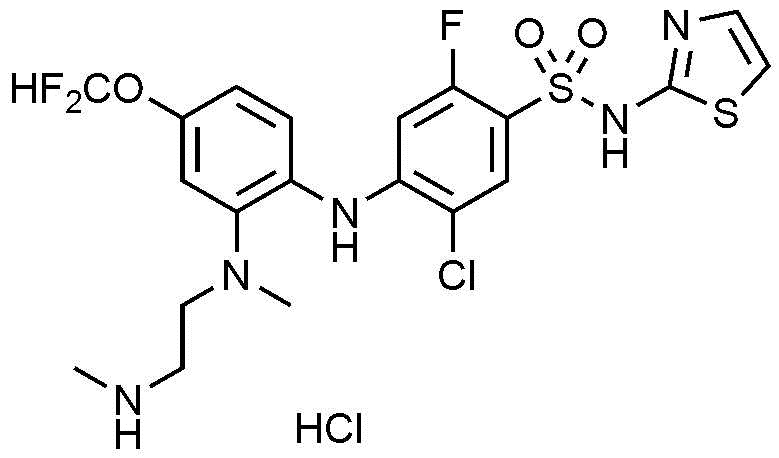
Промежуточное соединение получали таким же образом, как описано в примере 103, за исключением того, что вместо 2,4-дифтор-1-нитробензола (i) использовали 4-(дифторметокси)-2-фтор-1-нитробензол, и вместо 5-фторпиридин-2-амина (iv) использовали тиазол-2-амин. К полученному промежуточному соединению, трет-бутил(2-((2-((2-хлор-4-(N-(2,4-диметоксибензил)-N-(тиазол-2-ил)сульфамоил)-5-фторфенил)амино)-5-(дифторметокси)фенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,06 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 58,7%).
1Н ЯМР (500 МГц, MeOD): 7,85(д, 1H), 7,29(д, 1H), 7,11(д, 1H), 7,03(д, 1H), 6,94(д, 1H), 6,85(т, 1H), 6,75(д, 1H), 6,58(д, 1H), 3,23(т, 2H), 3,12(т, 2H), 2,72(с, 3H), 2,67(с, 3H)
Пример 117: Получение 5-хлор-4-((4-(дифторметокси)-2-(метил(2-(метиламино)этил)амино)фенил)амино)-2-фтор-N-(пиридин-2-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 103, за исключением того, что вместо 2,4-дифтор-1-нитробензола (i) использовали 4-(дифторметокси)-2-фтор-1-нитробензол, и вместо 5-фторпиридин-2-амина (iv) использовали пиридин-2-амин. К полученному промежуточному соединению, трет-бутил(2-((2-((2-хлор-4-(N-(2,4-диметоксибензил)-N-(пиридин-2-ил)сульфамоил)-5-фторфенил)амино)-5-(дифторметокси)фенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,06 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 59,3%).
1Н ЯМР (500 МГц, MeOD): 8,04(д, 1H), 7,95(д, 1H), 7,90(т, 1H), 7,30(м, 2H), 7,06(м, 2H), 6,93(д, 1H), 6,84(т, 1H), 6,56(д, 1H), 3,26(т, 2H), 3,11(т, 2H), 2,70(с, 3H), 2,67(с, 3H)
Пример 118: Получение 5-хлор-2-фтор-N-(5-фторпиридин-2-ил)-4-((4-метокси-2-(метил(2-(метиламино)этил)амино)фенил)амино)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 103, за исключением того, что вместо 2,4-дифтор-1-нитробензола (i) использовали 2-фтор-4-метокси-1-нитробензол. К полученному промежуточному соединению, трет-бутил(2-((2-((2-хлор-4-(N-(2,4-диметоксибензил)-N-(5-фторпиридин-2-ил)сульфамоил)-5-фторфенил)амино)-5-(метоксифенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 59,5%).
1Н ЯМР (500 МГц, MeOD): 8,05(д, 1H), 7,86(д, 1H), 7,53-7,50(м, 1H), 7,18-7,14(м, 2H), 6,80-6,73(м, 2H), 6,35(д, 1H), 3,82(с, 3H), 3,25-3,23(м, 2H), 3,09-3,07(м, 2H), 2,67(с, 3H), 2,64(с, 3H)
Пример 119: Получение 5-хлор-2-фтор-4-((4-метокси-2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(тиазол-2-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 103, за исключением того, что вместо 2,4-дифтор-1-нитробензола (i) использовали 2-фтор-4-метокси-1-нитробензол, и вместо 5-фторпиридин-2-амина (iv) использовали тиазол-2-амин. К полученному промежуточному соединению, трет-бутил(2-((2-((2-хлор-4-(N-(2,4-диметоксибензил)-N-(тиазол-2-ил)сульфамоил)-5-фторфенил)амино)-5-метоксифенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 60,0%).
1Н ЯМР (500 МГц, MeOD): 7,81(д, 1H), 7,20(д, 1H), 7,11(д, 1H), 6,81-6,73(м, 3H), 6,40(д, 1H), 3,82(с, 3H), 3,30-3,28(м, 2H), 3,25-3,24(м, 2H), 2,69(с, 3H), 2,66(с, 3H)
Пример 120: Получение 5-хлор-2-фтор-4-((4-метокси-2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 92, за исключением того, что вместо 2,4-дифтор-1-нитробензола (i) использовали 2-фтор-4-метокси-1-нитробензол. К полученному промежуточному соединению, трет-бутил(2-((2-((4-(N-(трет-бутоксикарбонил)-N-(тиазол-4-ил)сульфамоил)-2-хлор-5-фторфенил)амино)-5-метоксифенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 55,5%).
1Н ЯМР (500 МГц, MeOD): 8,73(д, 1H), 7,76(д, 1H), 7,18(д, 1H), 7,02(д, 1H), 6,82(д, 1H), 6,75(д, 1H), 6,36(д, 1H), 3,85(с, 3H), 3,26-3,24(м, 2H), 3,09-3,07(м, 2H), 2,69(с, 3H), 2,64(с, 3H)
Пример 121: Получение 5-хлор-2-фтор-4-((2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 92, за исключением того, что вместо 2,4-дифтор-1-нитробензола (i) использовали 1-фтор-2-нитробензол. К полученному промежуточному соединению, трет-бутил(2-((2-((4-(N-(трет-бутоксикарбонил)-N-(тиазол-4-ил)сульфамоил)-2-хлор-5-фторфенил)амино)фенил(метил)амино)этил)(метил)карбамат (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 57,5%).
1Н ЯМР (500 МГц, MeOD): 8,74(д, 1H), 7,81(д, 1H), 7,33-7,18 (м, 4H), 7,04(д, 1H), 6,70(д, 1H), 3,26-3,24(м, 2H), 3,12-3,09(м, 2H), 2,69(с, 3H), 2,66(с, 3H)
Пример 122: Получение 5-хлор-2-фтор-N-(5-фторпиримидин-2-ил)-4-((4-метокси-2-(метил(2-(метиламино)этил)амино)фенил)амино)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 96, за исключением того, что вместо 2,4-дифтор-1-нитробензола (i) использовали 2-фтор-4-метокси-1-нитробензол. К полученному промежуточному соединению, трет-бутил(2-((2-((2-хлор-4-(N-(2,4-диметоксибензил)-N-(5-фторпиримидин-2-ил)сульфамоил)-5-фторфенил)амино)-5-метоксифенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,06 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 59,5%).
1Н ЯМР (500 МГц, MeOD): 8,42(с, 2H), 7,96(д, 1H), 7,18 (д, 1H), 6,82(д, 1H), 6,76(д, 1H), 6,36(д, 1H), 3,81(с, 3H), 3,27-3,25(м, 2H), 3,17-3,08(м, 2H), 2,70(с, 3H), 2,65(с, 3H)
Пример 123: Получение 5-хлор-4-((4-хлор-2-(метил(2-(метиламино)этил)амино)фенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 92, за исключением того, что вместо 2,4-дифтор-1-нитробензола (i) использовали 4-хлор-2-фтор-1-нитробензол. К полученному промежуточному соединению, трет-бутил(2-((2-((4-(N-(трет-бутоксикарбонил)-N-(тиазол-4-ил)сульфамоил)-2-хлор-5-фторфенил)амино)-5-хлорфенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 55,8%).
1Н ЯМР (500 МГц, MeOD): 8,74(с, 1H), 7,81(д, 1H), 7,31-7,14 (м, 3H), 7,04(д, 1H), 6,64(д, 1H), 3,26-3,24(м, 2H), 3,11-3,10(м, 2H), 2,69(с, 3H), 2,66(с, 3H)
Пример 124: Получение 5-хлор-4-((4-хлор-2-(метил(2-(метиламино)этил)амино)фенил)амино)-2-фтор-N-(5-фторпиримидин-2-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 96, за исключением того, что вместо 2,4-дифтор-1-нитробензола (i) использовали 4-хлор-2-фтор-1-нитробензол. К полученному промежуточному соединению, трет-бутил(2-((5-хлор-2-((2-хлор-4-(N-(2,4-диметоксибензил)-N-(5-фторпиримидин-2-ил)сульфамоил)-5-фторфенил)амино)фенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,06 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 59,3%).
1Н ЯМР (500 МГц, MeOD): 8,42(с, 2H), 8,01(д, 1H), 7,27(д, 2H), 7,15-7,13(м, 1H), 6,64(д, 1H), 3,27-3,25(м, 2H), 3,13-3,11(м, 2H), 2,70(с, 3H), 2,67(с, 3H)
Пример 125: Получение 5-хлор-4-((4-хлор-2-(метил(2-(метиламино)этил)амино)фенил)амино)-2-фтор-N-(5-фторпиридин-2-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 103, за исключением того, что вместо 2,4-дифтор-1-нитробензола (i) использовали 4-хлор-2-фтор-1-нитробензол. К полученному промежуточному соединению, трет-бутил(2-((5-хлор-2-((2-хлор-4-(N-(2,4-диметоксибензил)-N-(5-фторпиридин-2-ил)сульфамоил)-5-фторфенил)амино)фенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 59,3%).
1Н ЯМР (500 МГц, MeOD): 8,06(д, 1H), 7,91(д, 1H), 7,54-7,50(м, 2H), 7,27-7,13(м, 4H), 6,63(д, 1H), 3,27-3,25(м, 2H), 3,11-3,09(м, 2H), 2,69(с, 3H), 2,66(с, 3H)
Пример 126: Получение 5-хлор-4-((4-хлор-2-(метил(2-(метиламино)этил)амино)фенил)амино)-2-фтор-N-(тиазол-2-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 103, за исключением того, что вместо 2,4-дифтор-1-нитробензола (i) использовали 4-хлор-2-фтор-1-нитробензол, и вместо 5-фторпиридин-2-амина (iv) использовали тиазол-2-амин. К полученному промежуточному соединению, трет-бутил(2-((5-хлор-2-((2-хлор-4-(N-(2,4-диметоксибензил)-N-(тиазол-2-ил)сульфамоил)-5-фторфенил)амино)фенил)(метил)амино)этил)(метил) карбамат (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 59,8%).
1Н ЯМР (500 МГц, MeOD): 7,87(д, 1H), 7,27(д, 2H), 7,15-7,12(м, 2H), 6,75-6,68(м, 2H), 3,26-3,25(м, 2H), 3,13-3,10(м, 2H), 2,71(с, 3H), 2,68(с, 3H)
Пример 127: Получение 5-хлор-N-(5-хлортиазол-2-ил)-2-фтор-4-((4-фтор-2-(метил(2-(метиламино)этил)амино)фенил)амино)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 103, за исключением того, что вместо 5-фторпиридин-2-амина (iv) использовали 5-хлортиазол-2-амин. К полученному промежуточному соединению, трет-бутил(2-((2-((2-хлор-4-(N-(5-хлортиазол-2-ил)-N-(2,4-диметоксибензил)сульфамоил)-5-фторфенил)амино)-5-фторфенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,06 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 59,2%).
1Н ЯМР (500 МГц, MeOD): 7,82(д, 1H), 7,29(д, 1H), 7,27(с, 1H), 7,05(д, 1H), 6,90(т, 1H), 6,48(д, 1H), 3,27-3,25(м, 2H), 3,12-3,09(м, 2H), 2,71(с, 3H), 2,67(с, 3H)
Пример 128: Получение 5-хлор-2-фтор-4-((4-фтор-2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(5-фтортиазол-2-ил)бензолсульфонамид гидрохлорид

Промежуточное соединение получали таким же образом, как описано в примере 103, за исключением того, что вместо 5-фторпиридин-2-амина (iv) использовали 5-фтортиазол-2-амин. К полученному промежуточному соединению, трет-бутил(2-((2-((2-хлор-4-(N-(2,4-диметоксибензил)-N-(5-фтортиазол-2-ил)сульфамоил)-5-фторфенил)амино)-5-фторфенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 59,8%).
1Н ЯМР (500 МГц, MeOD): 7,82(т, 1H), 7,30(т, 1H), 7,05-6,91(м, 3H), 6,48(д, 1H), 3,27-3,25(м, 2H), 3,12-3,10(м, 2H), 2,72(с, 3H), 2,67(с, 3H)
Пример 129: Получение 5-хлор-N-(5-хлортиазол-2-ил)-2-фтор-4-((2-(метил(2-(метиламино)этил)амино)фенил)амино)бензолсульфонамид гидрохлорид

Промежуточное соединение получали таким же образом, как описано в примере 103, за исключением того, что вместо 5-фторпиридин-2-амина (iv) использовали 5-хлортиазол-2-амин, и вместо 2,4-дифтор-1-нитробензола (i) использовали 1-фтор-2-нитробензол. К полученному промежуточному соединению, трет-бутил(2-((2-((2-хлор-4-(N-(5-хлортиазол-2-ил)-N-(2,4-диметоксибензил)сульфамоил)-5-фторфенил)амино)фенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 59,8%).
1Н ЯМР (500 МГц, MeOD): 7,84(д, 1H), 7,33(д, 1H), 7,40(д, 1H), 7,19(м, 3H), 6,75(д, 1H), 3,26(т, 2H), 3,13(т, 2H), 2,70(с, 3H), 2,69(с, 3H)
Пример 130: Получение 5-хлор-N-(5-хлортиазол-2-ил)-2-фтор-4-((4-метокси-2-(метил(2-(метиламино)этил)амино)фенил)амино)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 103, за исключением того, что вместо 5-фторпиридин-2-амина (iv) использовали 5-хлортиазол-2-амин, и вместо 2,4-дифтор-1-нитробензола (i) использовали 2-фтор-4-метокси-1-нитробензол. К полученному промежуточному соединению, трет-бутил(2-((2-((2-хлор-4-(N-(5-хлортиазол-2-ил)-N-(2,4-диметоксибензил)сульфамоил)-5-фторфенил)амино)-5-метоксифенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,06 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 58,7%).
1Н ЯМР (500 МГц, MeOD): 7,79(д, 1H), 7,20(д, 1H), 7,19(с, 1H), 6,80(д, 1H), 6,75(дд, 1H), 6,41(д, 1H), 3,82(с, 3H), 3,26(т, 2H), 3,10(т, 2H), 2,70(с, 3H), 2,68(с, 3H)
Пример 131: Получение 5-хлор-2-фтор-N-(5-фтортиазол-2-ил)-4-((2-(метил(2-(метиламино)этил)амино)фенил)амино)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 103, за исключением того, что вместо 5-фторпиридин-2-амина (iv) использовали 5-фтортиазол-2-амин, и вместо 2,4-дифтор-1-нитробензола (i) использовали 1-фтор-2-нитробензол. К полученному промежуточному соединению, трет-бутил(2-((2-((2-хлор-4-(N-(2,4-диметоксибензил)-N-(5-фтортиазол-2-ил)сульфамоил)-5-фторфенил)амино)фенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 60,5%).
1Н ЯМР (500 МГц, MeOD): 7,84(д, 1H), 7,31(м, 2H), 7,22(м, 2H), 7,00(с, 1H), 6,76(д, 1H), 3,27(т, 2H), 3,13(т, 2H), 2,70(с, 3H), 2,69(с, 3H)
Пример 132: Получение 5-хлор-2-фтор-N-(5-фтортиазол-2-ил)-4-((4-метокси-2-(метил(2-(метиламино)этил)амино)фенил)амино)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 103, за исключением того, что вместо 5-фторпиридин-2-амина (iv) использовали 5-фтортиазол-2-амин, и вместо 2,4-дифтор-1-нитробензола (i) использовали 2-фтор-4-метокси-1-нитробензол. К полученному промежуточному соединению, трет-бутил(2-((2-((2-хлор-4-(N-(2,4-диметоксибензил)-N-(5-фтортиазол-2-ил)сульфамоил)-5-фторфенил)амино)-5-метоксифенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 59,3%).
1Н ЯМР (500 МГц, MeOD): 7,79(т, 1H), 7,22(т, 1H), 6,99(с, 1H), 6,86(д, 1H), 6,78(дд, 1H), 6,40(д, 1H), 3,83(с, 3H), 3,34(т, 2H), 3,11(т, 2H), 2,75(с, 3H), 2,67(с, 3H)
Пример 133: Получение 5-хлор-2-фтор-4-((4-фтор-2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(5-метилизоксазол-3-ил)бензолсульфонамид гидрохлорида

Вместо соединений, получаемых на стадиях 2 и 3 примера 92, получали трет-бутил((4-бром-5-хлор-2-фторфенил)сульфонил)(5-метилизоксазол-3-ил)карбамат (vii). В частности, 5-метилизоксазол-3-амин (iv, 1,00 г, 10,19 ммоль), (4-бром-5-хлор-2-фторбензолсульфонил хлорид (vi, 3,14 г, 1,0 экв.) и пиридин (2,4 мл, 3,0 экв.) растворяли в DCM (25 мл). После перемешивания смеси в течение ночи завершение реакции проверяли методом TLC. Добавляли H2O (30 мл), и выполняли двойную экстракцию дихлорметаном (10 мл). К реакционной смеси добавляли MgSO4, и выполняли двойную экстракцию этилацетатом. К органическому слою добавляли MgSO4, который перемешивали, фильтровали и затем сушили. Фильтрат концентрировали при пониженном давлении, и затем полученный осадок разделяли с помощью колоночной хроматографии, используя мобильную фазу EA/Hex=1/1, с получением 1,0 г (выход 27%) соединения, указанного в заголовке (v).
1Н ЯМР (500 МГц, CDCl3): 8,66(д, 1H), 7,96(д, 1H), 7,44(д, 1H), 5,88(широкий, 1H), 2,33 (с, 3H)
Полученное выше соединение, 4-бром-5-хлор-2-фтор-N-(5-метилизоксазол-3-ил)бензолсульфонамид (v, 1,00 г, 2,71 ммоль), N,N-диметиламинопиридин (0,06 г, 0,2 экв.) и ди-трет-бутил дикарбонат (1,1 мл, 2,0 экв.) растворяли в тетрагидрофуране (20 мл). После перемешивания реакционного раствора в течение ночи при комнатной температуре завершение реакции проверяли методом TLC. К реакционному продукту добавляли H2O (30 мл), и смесь дважды экстрагировали этилацетатом. К органическому слою добавляли MgSO4, который перемешивали, фильтровали и затем сушили. Фильтрат концентрировали при пониженном давлении, и полученный осадок разделяли с помощью колоночной хроматографии, используя мобильную фазу EA/Hex=1/2, с получением 0,40 г (выход 31%) соединения, указанного в заголовке (vii).
1Н ЯМР (500 МГц, MeOD): 8,19(д, 1H), 7,93(д, 1H), 6,34(с, 1H), 2,49(с, 3H), 1,36(с, 9H)
Целевое соединение получали таким же образом, как описано на стадиях 1, 4 и 5 примера 1, за исключением того, что использовали полученный выше трет-бутил((4-бром-5-хлор-2-фторфенил)сульфонил)(5-метилизоксазол-3-ил)карбамат (vii).
1Н ЯМР (500 МГц, MeOD): 7,8(д, 1H), 7,34-7,31(м, 2H), 7,25(т, 1H), 7,21-7,19(м, 1H), 6,71(д, 1H), 6,07(с, 1H), 2,70(с, 3H), 2,67(с, 3H), 2,32(с, 3H)
Пример 134: Получение 5-хлор-2-фтор-4-((2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(5-метилизоксазол-3-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 133, за исключением того, что вместо 2,4-дифтор-1-нитробензола (i) использовали 1-фтор-2-нитробензол. К полученному промежуточному соединению, трет-бутил(2-((2-((4-(N-(трет-бутоксикарбонил)-N-(5-метилизоксазол-3-ил)сульфамоил)-2-хлор-5-фторфенил)амино)фенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 65,6%).
1Н ЯМР (500 МГц, MeOD): 7,79(д, 1H), 7,21(т, 1H), 7,00(д, 1H), 6,98(т, 1H), 6,41(д, 1H), 5,85(с, 1H), 3,24-3,23(м, 2H), 3,05-3,03(м, 2H), 2,69(с, 3H), 2,58(с, 3H), 2,22(с, 3H)
Пример 135: Получение 5-хлор-2-фтор-4-((4-фтор-2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(5-метил-1H-пиразол-3-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 133, за исключением того, что вместо 5-метилизоксазол-3-амина (iv) использовали трет-бутил 3-амино-5-метил-1H-пиразол-1-карбоксилат. К полученному промежуточному соединению, трет-бутил 3-((N-(трет-бутоксикарбонил)-4-(2-(2-((трет-бутоксикарбонил)(метил)амино)этил)(метил)амино)-4-фторфенил)амино)-5-хлор-2-фторфенил)сульфонамидо)-5-метил-1H-пиразол-1-карбоксилат (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 64,7%).
1Н ЯМР (500 МГц, MeOD): 7,86(1H), 7,27(т, 1H), 7,06(д, 1H), 6,89(т, 1H), 6,47(д, 1H), 6,08(д, 1H), 3,15-3,12(м, 2H), 2,71(с, 3H), 2,67(с, 3H), 2,34(с, 3H)
Пример 136: Получение 5-хлор-2-фтор-4-((2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(5-метил-1H-пиразол-3-ил)бензолсульфонамид гидрохлорида
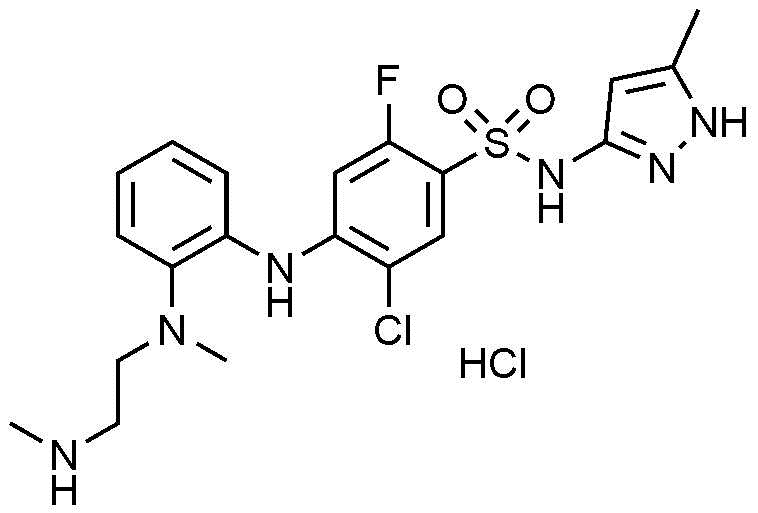
Промежуточное соединение получали таким же образом, как описано в примере 133, за исключением того, что вместо 5-метилизоксазол-3-амина (iv) использовали трет-бутил 3-амино-5-метил-1H-пиразол-1-карбоксилат, и вместо 2,4-дифтор-1-нитробензола (i) использовали 1-фтор-2-нитробензол. К полученному промежуточному соединению, трет-бутил 3-((N-(трет-бутоксикарбонил)-4-(2-(2-((трет-бутоксикарбонил)(метил)амино)этил)(метил)амино)фенил)амино)-5-хлор-2-фторфенил)сульфонамидо)-5-метил-1H-пиразол-1-карбоксилат (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 65,7%).
1Н ЯМР (500 МГц, MeOD): 7,88(д, 1H), 7,35-7,21(м, 4H), 6,72(д, 1H), 6,08(с, 1H), 3,35-3,33(м, 2H), 3,14-3,11(м, 2H), 2,72(с, 3H), 2,68(с, 3H), 2,34(с, 3H)
Пример 137: Получение 5-хлор-4-((2-((2-(диметиламино)этил)(метил)амино)-4-фторфенил)амино)-2-фтор-N-(5-фторпиридин-2-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение (viii) получали таким же образом, как описано в примере 103 за исключением того, что вместо трет-бутилметил(2-(метиламино)этил)карбамата (ii) использовали N,N,N'-триметилэтан-1,2-диамин. К полученному промежуточному соединению, 5-хлор-N-(2,4-диметоксибензил)-4-((2-(диметиламино)этил)(метил)амино)-4-фторфенил)амино)-2-фтор-N-(5-фторпиридин-2-ил)бензол сульфонамид (viii, 0,05 г, 0,08 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 48,3%).
1Н ЯМР (500 МГц, MeOD): 8,06(д, 1H), 7,88(д, 1H), 7,53(м, 1H), 7,25(дд, 1H), 7,16(дд, 1H), 7,04(м, 1H), 6,88(м, 1H), 6,35(д, 1H), 3,33(т, 2H), 3,20(т, 2H), 2,92(с, 6H), 2,71(с, 3H)
Пример 138: Получение 5-хлор-4-((2-((2-(диметиламино)этил)(метил)амино)-4-фторфенил)амино)-2-фтор-N-(тиазол-2-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 137 за исключением того, что вместо 5-фторпиридин-2-амина (iv) использовали тиазол-2-амин. К полученному промежуточному соединению, 5-хлор-N-(2,4-диметоксибензил)-4-((2-(диметиламино)этил)(метил)амино)-4-фторфенил)амино)-2-фтор-N-(тиазол-2-ил)бензол сульфонамид (0,05 г, 0,08 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 48,4%).
1Н ЯМР (500 МГц, MeOD): 7,83(д, 1H), 7,27(м, 1H), 7,12(т, 1H), 7,04(м, 1H), 6,90(т, 1H), 6,75(д, 1H), 6,40(д, 1H), 3,34(т, 2H), 3,22(т, 2H), 2,83(с, 6H), 2,73(с, 3H)
Пример 139: Получение 5-хлор-N-(5-хлортиазол-2-ил)-4-((2-((2-(диметиламино)этил)(метил)амино)-4-фторфенил)амино)-2-фторбензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 137 за исключением того, что вместо 5-фторпиридин-2-амина (iv) использовали 5-хлортиазол-2-амин. К полученному промежуточному соединению, 5-хлор-N-(5-хлортиазол-2-ил)-N-(2,4-диметоксибензил)-4-((2-((2-(диметиламино)этил)(метил)амино)-4-фторфенил)амино)-2-фторбензол сульфонамид (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 47,9%).
1Н ЯМР (500 МГц, MeOD): 7,82(д, 1H), 7,28(т, 1H), 7,19(д, 1H), 7,05(д, 1H), 6,89(т, 1H), 6,41(д, 1H), 3,30(т, 2H), 3,23(т, 2H), 2,84(с, 6H), 2,74(с, 3H)
Пример 140: Получение 5-хлор-N-(5-хлортиазол-2-ил)-4-((2-((2-(диметиламино)этил)(метил)амино)фенил)амино)-2-фторбензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 137 за исключением того, что вместо 5-фторпиридин-2-амина (iv) использовали 5-хлортиазол-2-амин, и вместо 2,4-дифтор-1-нитробензола (i) использовали 2-фтор-1-нитробензол. К полученному промежуточному соединению, 5-хлор-N-(5-хлортиазол-2-ил)-N-(2,4-диметоксибензил)-4-((2-((2-(диметиламино)этил)(метил)амино)фенил)амино)-2-фторбензол сульфонамид (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 48,2%).
1Н ЯМР (500 МГц, MeOD): 7,84(д, 1H), 7,31(т, 2H), 7,25(т, 1H), 7,20(т, 2H), 6,40(д, 1H), 3,36(т, 2H), 3,24(т, 2H), 2,86(с, 6H), 2,72(с, 3H)
Пример 141: Получение 5-хлор-2-фтор-4-((4-фтор-2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(5-метилтиазол-2-ил)бензолсульфонамид гидрохлорида
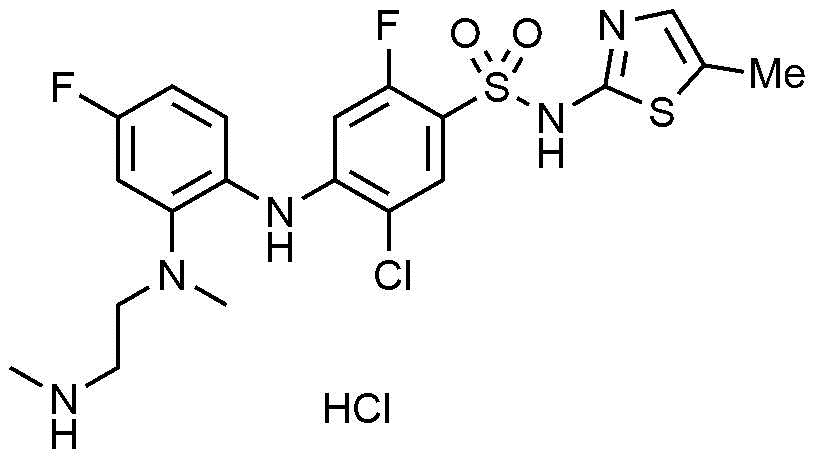
Промежуточное соединение получали таким же образом, как описано в примере 103 за исключением того, что вместо 5-фторпиридин-2-амина (iv) использовали 5-метилтиазол-2-амин. К полученному промежуточному соединению, трет-бутил 2-((2-((2-хлор-4-(N-(2,4-диметоксибензил)-N-(5-метилтиазол-2-ил)сульфамоил)-5-фторфенил)амино)-5-фторфенил)(метил)амино)этил)(метил)карбамат (0,05 г, 0,06 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 53,0%).
1Н ЯМР (500 МГц, MeOD): 7,83(д, 1H), 7,29(дд, 1H), 7,05(дд, 1H), 6,89(т, 1H), 6,82(с, 1H), 6,47(д, 1H), 3,27(т, 2H), 2,11(т, 2H), 2,72(с, 3H), 2,67(с, 3H), 2,24(с, 3H)
Пример 142: Получение 5-хлор-2-фтор-4-((4-фтор-2-(метил(2-(метиламино)этил)амино)фенил)амино)-N-(оксазол-2-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 133 за исключением того, что вместо 5-метилизоксазол-3-амина (iv) использовали оксазол-2-амин. К полученному промежуточному соединению, трет-бутил (2-((2-((4-(N-(трет-бутоксикарбонил)-N-(оксазол-2-ил)сульфамоил)-2-хлор-5-фторфенил)амино)-5-фторфенил)(метил)амино)этил)(метил)карбамат (0,03 г, 0,05 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,01 г, 47,5%).
1Н ЯМР (500 МГц, MeOD): 1Н ЯМР (500 МГц, MeOD): 7,87(д, 1H), 7,25-7,22(м, 2H), 7,01 (д, 1H), 6,85-6,84(м, 1H), 6,42(д, 1H), 5,48(с, 1H), 3,25-3,24(м, 2H), 3,09-3,07(м, 2H), 2,71(с, 3H), 2,61(с, 3H)
Пример 143: Получение N-(5-(трет-бутил)изоксазол-3-ил)-5-хлор-2-фтор-4-((4-фтор-2-(метил(2-(метиламино)этил)амино)фенил)амино)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 133 за исключением того, что вместо 5-метилизоксазол-3-амина (iv) использовали 5-(трет-бутил)изоксазол-3-амин. К полученному промежуточному соединению, трет-бутил(2-((2-((4-(N-(трет-бутоксикарбонил)-N-(5-трет-бутил)изоксазол-3-ил)сульфамоил)-2-хлор-5-фторфенил)амино)-5-фторфенил)(метил)амино)этил)(метил)карбамат (0,03 г, 0,04 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,01 г, 46,4%).
1Н ЯМР (500 МГц, MeOD): 7,78(д, 1H), 7,19-7,16(м, 1H), 6,97(д, 1H), 6,82-6,79(м, 1H), 6,42(д, 1H), 5,87(с, 1H), 3,30-3,29(м, 2H), 2,67(с, 3H), 2,64(с, 3H), 1,23(с, 9H)
Пример 144: Получение N-(5-(трет-бутил)изоксазол-3-ил)-5-хлор-2-фтор-4-((2-(метил(2-(метиламино)этил)амино)фенил)амино)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 133 за исключением того, что вместо 5-метилизоксазол-3-амина (iv) использовали 5-(трет-бутил)изоксазол-3-амин, и вместо 2,4-дифтор-1-нитробензола (i) использовали 1-фтор-2-нитробензол. К полученному промежуточному соединению, трет-бутил(2-((2-((4-(N-(трет-бутоксикарбонил)-N-(5-трет-бутил)изоксазол-3-ил)сульфамоил)-2-хлор-5-фторфенил)амино)фенил)(метил)амино)этил)(метил)карбамат (0,03 г, 0,04 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,01 г, 46,0%).
1Н ЯМР (500 МГц, MeOD): 7,83(д, 1H), 7,23(д, 2H), 7,14-7,10(м, 2H), 6,70(д, 1H), 5,89(с, 1H), 3,30-3,27(м, 2H), 3,13-3,11(м, 2H), 2,66(с, 6H), 1,23(с, 9H)
Пример 145: Получение 5-хлор-2-фтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(1,2,4-тиадиазол-5-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 133 за исключением того, что вместо 5-метилизоксазол-3-амина (iv) использовали 1,2,4-тиадиазол-5-амин, и вместо трет-бутилметил(2-(метиламино)этил)карбамата (ii) использовали трет-бутилметил(пирролидин-3-ил)карбамат. К полученному промежуточному соединению, трет-бутил(1-(2-((4-(N-(трет-бутоксикарбонил)-N-(1,2,4-тиадиазол-5-ил)сульфамоил)-2-хлор-5-фторфенил)амино)-5-фторфенил)пирролидин-3-ил)(метил)карбамат (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 56,0%).
1Н ЯМР (500 МГц, MeOD): 8,39(с, 1H), 7,80(д, 1H), 7,14(т, 1H), 6,73(д, 1H), 6,68(т, 1H), 6,08(д, 1H), 3,78(т, 1H), 3,58(дд, 1H), 3,48(м, 1H), 3,40(дд, 1H), 2,67(с, 3H), 2,34(м, 1H), 1,99(м, 1H)
Пример 146: Получение 5-хлор-2-фтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(1-метил-1H-пиразол-3-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 133, за исключением того, что вместо 5-метилизоксазол-3-амина (iv) использовали 1-метил-1H-пиразол-3-амин, и вместо трет-бутилметил(2-(метиламино)этил)карбамата (ii) использовали трет-бутилметил(пирролидин-3-ил)карбамат. К полученному промежуточному соединению, трет-бутил(1-(2-((4-(N-(трет-бутоксикарбонил)-N-(1-метил-1H-пиразол-3-ил)сульфамоил)-2-хлор-5-фторфенил)амино)-5-фторфенил)пирролидин-3-ил)(метил)карбамат (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C, завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 56,1%).
1Н ЯМР (500 МГц, MeOD): 7,68(д, 1H), 7,38(с, 1H), 7,13(т, 1H), 6,75(дд, 1H), 6,86(т, 1H), 6,06(д, 1H), 6,00(с, 1H), 3,78(т, 1H), 3,70(с, 3H), 3,56(дд, 1H), 3,48(м, 1H), 3,41(дд, 1H), 3,39(с, 3H), 2,36(м, 1H), 1,98(м, 1H)
Пример 147: Получение 5-хлор-2-фтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(пиримидин-4-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 133, за исключением того, что вместо 5-метилизоксазол-3-амина (iv) использовали пиримидин-4-амин, и вместо трет-бутил метил(2-(метиламино)этил)карбамата (ii) использовали трет-бутил метил(пирролидин-3-ил)карбамат. К полученному промежуточному соединению, трет-бутил ((4-((2-(3-((трет-бутоксикарбонил)(метил)амино)пирролидин-1-ил)-4-фторфенил)амино)-5-хлор-2-фторфенил)сульфонил)(пиримидин-4-ил)карбамат (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C, завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 56,2%).
1Н ЯМР (500 МГц, MeOD): 8,45(с, 1H), 8,44(с, 1H), 7,95(д, 1H), 7,12(д, 1H), 7,00(т, 1H), 6,72(дд, 1H), 6,66(тд, 1H), 6,04(д, 1H), 3,78(т, 1H), 3,56(дд, 1H), 3,47(м, 1H), 3,40(дд, 1H), 2,65(с, 3H), 2,31(м, 1H), 1,98(м, 1H)
Пример 148: Получение 5-хлор-2-фтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(5-фторпиримидин-2-ил)бензолсульфонамид гидрохлорида
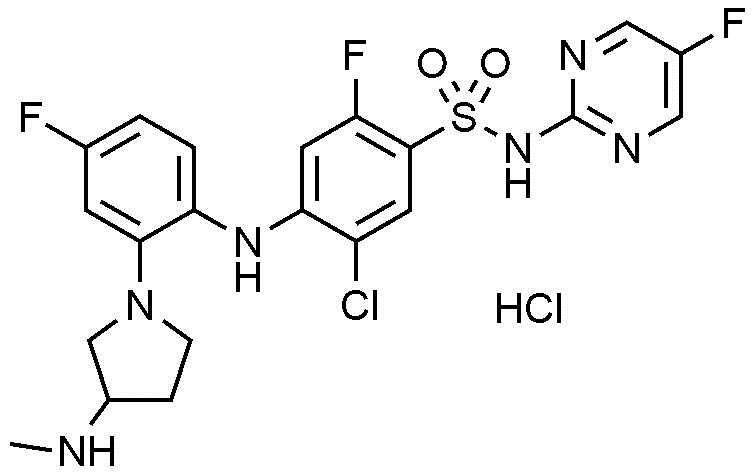
Промежуточное соединение получали таким же образом, как описано в примере 96, за исключением того, что вместо трет-бутилметил(2-(метиламино)этил)карбамата (ii) использовали трет-бутилметил(пирролидин-3-ил)карбамат. К полученному промежуточному соединению, трет-бутил (1-(2-((2-хлор-4-(N-(2,4-диметоксибензил)-N-(5-фторпиримидин-2-ил)сульфамоил)-5-фторфенил)амино)-5-фторфенил)пирролидин-3-ил)(метил)карбамат (0,05 г, 0,06 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C, завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 59,8%).
1Н ЯМР (500 МГц, MeOD): 8,46(с, 2H), 7,94(д, 1H), 7,11(тд, 1H), 6,72(д, 1H), 6,66(тд, 1H), 6,04(д, 1H), 3,77(т, 1H), 3,57(дд, 1H), 3,48(м, 1H), 3,41(дд, 1H), 2,66(с, 3H), 2,33(м, 1H), 1,99(м, 1H)
Пример 149: Получение 5-хлор-2-фтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(пиразин-2-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 96, за исключением того, что вместо 2-хлор-5-фторпиримидина (iv) использовали 2-хлорпиразин, и вместо трет-бутилметил(2-(метиламино)этил)карбамата (ii) использовали трет-бутилметил(пирролидин-3-ил)карбамат. К полученному промежуточному соединению, трет-бутил(1-(2-((2-хлор-4-(N-(2,4-диметоксифенил)-N-(пиразин-2-ил)сульфамоил)-5-фторфенил)амино)-5-фторфенил)пирролидин-3-ил)(метил)карбамат (0,05 г, 0,06 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C, завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 60,9%).
1Н ЯМР (500 МГц, MeOD): 8,29(с, 1H), 8,15(с, 1H), 8,09(с, 1H), 7,88(д, 1H), 7,09(дд, 1H), 6,70(дд, 1H), 6,64(т, 1H), 6,05(д, 1H), 5,45(д, 1H), 3,76(м, 1H), 3,54(дд, 1H), 3,44(м, 2H), 2,67(с, 3H), 2,29(м, 1H), 1,90(м, 1H)
Пример 150: Получение 5-хлор-2-фтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(5-метилизоксазол-3-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 133, за исключением того, что вместо трет-бутилметил(2-(метиламино)этил)карбамата (ii) использовали трет-бутилметил(пирролидин-3-ил)карбамат. К полученному промежуточному соединению, трет-бутил(1-(2-((4-(N-(трет-бутоксикарбонил)-N-(5-метилизоксазол-3-ил)сульфамоил)-2-хлор-5-фторфенил)амино)-5-фторфенил)пирролидин-3-ил)(метил)карбамат (0,05 г, 0,06 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C, завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 56,1%).
1Н ЯМР (500 МГц, MeOD): 7,80(д, 1H), 7,14(дд, 1H), 6,73(д, 1H), 6,69(дд, 1H), 6,09(д, 1H), 6,07(с, 1H), 3,76(т, 1H), 3,58(м, 2H), 3,43(м, 2H), 2,66(с, 3H), 2,32(с, 3H), 2,05(м, 2H)
Пример 151: Получение 5-хлор-2-фтор-4-((4-фтор-2-(3-(метиламино)пирролидин-1-ил)фенил)амино)-N-(пиримидин-5-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 133, за исключением того, что вместо 5-метилизоксазол-3-амина (iv) использовали пиримидин-5-амин, и вместо трет-бутилметил(пирролидин-3-ил)карбамата (ii) использовали трет-бутилметил(пирролидин-3-ил)карбамат. К полученному промежуточному соединению, трет-бутил (1-(2-((4-(N-(трет-бутоксикарбонил)(пиримидин-5-ил)сульфамоил)-2-хлор-5-фторфенил)амино)пирролидин-3-ил)(метил)карбамат (0,05 г, 0,07 ммоль) добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C, завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 56,2%).
1Н ЯМР (500 МГц, MeOD): 8,87(с, 1H), 8,59(д, 2H), 7,79(д, 1h), 7,12(тд, 1H), 6,73(д, 1H), 6,67(тд, 1H), 6,07(д, 1H), 3,76(т, 1H), 3,50(м, 2H), 3,54(м, 2H), 2,67(с, 3H), 2,32(м, 1H), 1,98(м, 1H)
Пример 152: Получение 5-хлор-2-фтор-4-((4-фтор-2-((2-(метиламино)этил)амино)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 92, за исключением того, что вместо трет-бутилметил(2-(метиламино)этил)карбамата (ii) использовали трет-бутил(2-аминоэтил)(метил)карбамат. К полученному промежуточному соединению, трет-бутил(2-((2-((4-(N-(трет-бутоксикарбонил)-N-(тиазол-4-ил)сульфамоил)-2-хлор-5-фторфенил)амино)-5-фторфенил)амино)этил)(метил)карбамат (0,05 г, 0,07 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C, завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 56,9%).
1Н ЯМР (500 МГц, MeOD): 8,72(с, 1H), 7,75(д, 1H), 7,07(т, 1H), 7,00(с, 1H), 6,63(д, 1H), 6,49(т, 1H), 6,05(д, 1H), 3,46(т, 2H), 3,17(т, 2H), 2,70(с, 3H)
Пример 153: Получение 5-хлор-4-((2-((2-(диметиламино)этил)амино)-4-фторфенил)амино)-2-фтор-N-(тиазол-4-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 92, за исключением того, что вместо трет-бутилметил(2-(метиламино)этил)карбамата (ii) использовали N,N-диметилэтан-1,2-диамин(3-(метиламино)пропил)карбамат. К полученному промежуточному соединению, трет-бутил(2-((4-(N-(трет-бутоксикарбонил)-N-(тиазол-4-ил)сульфамоил)-2-хлор-5-фторфенил)амино)-5-фторфенил)(2-(диметиламино)этил)карбамат (0,02 г, 0,0003 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C, завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,01 г, 70,5%).
1Н ЯМР (500 МГц, MeOD): 8,73(с, 1H), 7,75(д, 1H), 7,08(т, 1H), 7,01(с, 1H), 6,66(д, 1H), 6,50(т, 1H), 6,04(д, 1H), 3,53(т, 2H), 3,30(т, 2H), 2,90(с, 6H)
Пример 154: Получение 5-хлор-2-фтор-4-((4-фтор-2-(метил(3-(метиламино)пропил)амино)фенил)амино)-N-(тиазол-4-ил)бензолсульфонамид гидрохлорида

Промежуточное соединение получали таким же образом, как описано в примере 92, за исключением того, что вместо трет-бутилметил(2-(метиламино)этил)карбамата (ii) использовали трет-бутилметил(3-(метиламино)пропил)карбамат. К полученному промежуточному соединению, трет-бутил(3-((2-((4-(N-(трет-бутоксикарбонил)-N-(тиазол-4-ил)сульфамоил)-2-хлор-5-фторфенил)амино)-5-фторфенил)(метил)амино)пропил)(метил)карбамат (0,05 г, 0,7 ммоль), добавляли 1M HCl в этилацетате (5 мл). После перемешивания смеси в течение ночи при нагревании до 50-60°C, завершение реакции проверяли методом TLC. Реакционный раствор фильтровали с получением целевого соединения (0,02 г, 55,9%).
1Н ЯМР (500 МГц, MeOD): 8,74(с, 1H), 7,78(д, 1h), 7,25(м, 1H), 7,03(м, 2H), 6,88(м, 1H), 6,29(д, 1H), 3,06(д, 2H), 2,80(д, 2H), 2,70(с, 3H), 2,60(с, 3H), 1,81(д, 2H)
Экспериментальный пример
Для измерения активности заявленных соединений в качестве антагонистов, эксперимент по блокированию эффекта натриевого ионного канала 1.7 (Nav1.7) и натриевого ионного канала 1.5 (Nav1.5) выполняли следующим образом.
1) Клеточная культура
Клеточная линия hNav1.7 HEK 293 представляет собой клеточную линию из клеток эмбриональной почки человека (HEK) 293, в которой стабильно экспрессируется человеческий ген натриевого ионного канала 1.7 (альфа-субъединица потенциалуправляемого натриевого канала типа IX), которая была приобретена у компании Millipore. Используемую культуральную среду готовили путем добавления 1% 100X NEAA и 10% инактивированного нагреванием FBS к DMEM F-12, и последующего добавления к этой смеси 1% P/S в качестве антибиотика. В качестве рестрикционного фермента в субкультуру добавляли G-418. Клетки hNav1.7 HEK293 культивировали до конфлюентности примерно 80% в 5% СО2-инкубаторе при 37°C в колбе T75 в течение 2 или 3 дней и отделяли от колбы обработкой 0,05% раствором трипсина. Затем клетки собирали путем центрифугирования и использовали в эксперименте.
Клеточная линия hNav1.5 HEK 293 представляет собой клеточную линию из клеток эмбриональной почки человека (HEK) 293, в которой стабильно экспрессируется человеческий ген натриевого ионного канала 1.5 (альфа субъединица потенциалуправляемого натриевого канала Homo sapiens типа V (SCN 5 A)), которая была приобретена у компании Creacell. Используемую культуральную среду готовили путем смешивания 2% 100X L-глутамина и 10% инактивированного нагреванием FBS в DMEM, и последующего добавления к этой смеси 1% P/S в качестве антибиотика. В качестве рестрикционного фермента в субкультуру добавляли G-418, и клетки hNav1.5 HEK293 культивировали до конфлюентности примерно 80% в 5% СО2-инкубаторе при 37°C в колбе T75 в течение 2 или 3 дней, затем клетки отделяли от колбы обработкой 0,05% раствором трипсина. После этого клетки собирали путем центрифугирования и использовали в эксперименте.
2) Получение образцов соединений
Соединения, полученные в примерах настоящего изобретения, растворяли в диметилсульфоксиде (DMSO) и использовали в эксперименте. Для каждого соединения готовили 90 мМ и 10 мМ маточные растворы DMSO, которые разбавляли внеклеточным раствором (4 мМ KCl, 138 мМ NaCl, 1 мМ MgCl2, 1,8 мМ CaCl2, 5,6 мМ глюкозы, 10 мМ HEPES, pH 7,45) в разных концентрациях так, чтобы конечная концентрация DMSO составляла 0,3% или менее.
3) Измерение эффекта блокирования натриевого ионного канала
Для измерения эффекта блокирования натриевого ионного канала использовали систему автоматизированной фиксации потенциала IonFlux16 Auto (Fluxion, Inc.) и используемый для этих целей планшет. Клетки переносили во внеклеточный раствор (4 мМ KCl, 138 мМ NaCl, 1 мМ MgCl2, 1,8 мМ CaCl2, 5,6 мМ глюкозы, 10 мМ HEPES, pH 7,45) и затем дозировали в указанной области планшета, и каждый из приготовленных образцов соединения разбавляли до разных концентраций и затем дозировали в указанной области планшета. После дозирования клеток, образцов соединений и внутриклеточного раствора (100 мМ CsF, 45 мМ CsCl, 5 мМ NaCl, 5 мМ EGTA, 10 мМ HEPES, pH 7,2) на планшете, этот планшет устанавливали в системе фиксации потенциала, и измеряли степень ингибирования ионного канала этими соединениями в соответствии с установленной программой.
В частности, для каждого соединения задавали восемь концентраций, и процент ингибирования определяли путем вычисления процента ингибирования пикового тока, генерируемого после 50 секундной обработки клеток соединениями для каждой концентрации соединений, относительно пикового тока, генерируемого до обработки этими соединениями, и значение IC50 рассчитывали с помощью программы Sigma plot. Результаты расчета показаны ниже в таблицах 2-5.
Таблица 2
Таблица 3
Таблица 4
Таблица 5
Реферат
Изобретение относится к соединению, представленному химической формулой 1, а также к фармацевтическим композициям на его основе. Технический результат: получены новые соединения, которые могут быть использованы для профилактики или лечения заболеваний, связанных с блокатором натриевого ионного канала. 2 н. и 10 з.п. ф-лы, 5 табл., 154 пр.формула 1
Формула

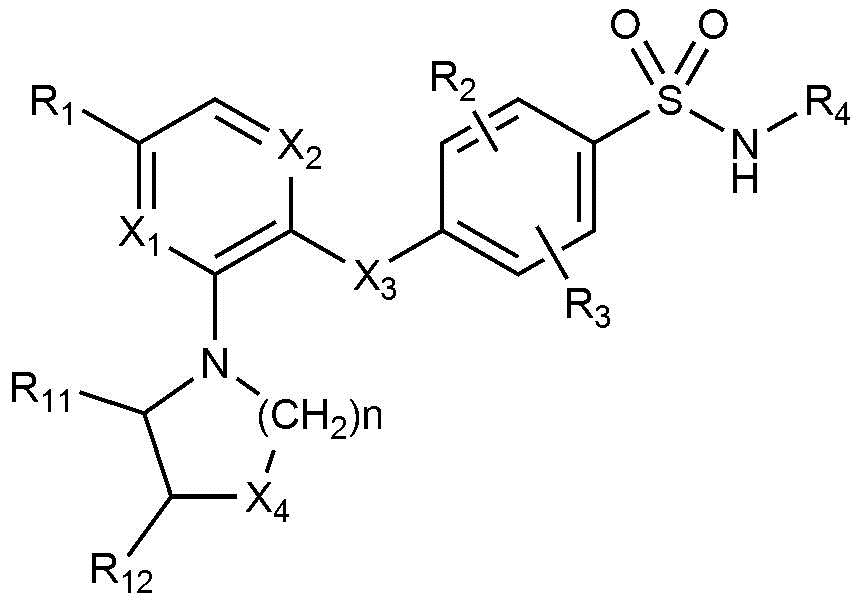

Документы, цитированные в отчёте о поиске
Сульфонамиды, фармацевтическая композиция на их основе, способ лечения эндотелин-зависимых заболеваний, способ ингибирования связывания эндотелинового пептида с эндотелинa-(етa) илиb-(етb) рецепторами, способ изменения вызываемой эндотелиновыми рецепторам
N-фениларилсульфонамид, фармацевтическая композиция, содержащая указанное соединение в качестве активного ингредиента, соединение, являющееся промежуточным в синтезе указанного соединения, и способ его получения

Комментарии