Соединение, имеющее действие ингибирования агрегации тромбоцитов, и его соль, и содержащая такие соединения композиция для предупреждения или лечения тромботических заболеваний - RU2739915C2
Код документа: RU2739915C2
Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к новому соединению, имеющему ингибирующее действие на агрегацию тромбоцитов, и его соли. Конкретнее, настоящее изобретение относится к новому ингибитору агрегации тромбоцитов, который может селективно ингибировать вызванную напряжением сдвига агрегацию тромбоцитов; фармацевтической композиции, включающей такой ингибитор в качестве активного ингредиента; и способу его получения.
Уровень техники
Человеческий организм имеет систему самозаживления или защитную систему для лечения и предотвращения кровопотери в местах ранений, что достигается путем модуляции и равновесия между свертыванием тромбоцитов и плазмы, деградацией фибрина и ингибированием коагуляции. Когда собственное регулирование и баланс нарушаются различными факторами, происходит анормальная агрегация тромбоцитов, и это ведет к тромботическим заболеваниям.
Тромбоз относится к состоянию, при котором система кровообращения нарушается сгустком крови в кровеносном сосуде или, в самом худшем случае, ток крови блокируется. Тромбообразование может вызывать тромбоз артерии, флеботромбоз, тромбоз воротной вены печени, тромбоэмболию легких, хроническую ишемию конечностей, варикоз, тромботические заболевания глубоких вен, стенокардию, церебральный инфаркт и т.п., и оно также может вносить вклад в инфекцию, повреждение сосудов, послеоперационные осложнения, болезни системы коагуляции и т.п.. Такое тромбообразование может быть генерировано взаимодействием между стенками анормальных кровеносных сосудов, гемодинамическими силами, белками свертывания плазмы и тромбоцитами. Тромбоциты активируются различными агонистами, такими как аденозиндифосфат, тромбоксан А2 и тромбин, и активированные гликопротеины тромбоцитов, такие как IIb/IIIa, объединяются с белком агрегации в крови (фибриногеном, фактором Виллебранда и т.д.), вызывая реакцию агрегации.
В последнее время стало известно, что тромбоциты анормально активируются не только химическими агонистами, но также физической стимуляцией, приводящей к тромбозу. Из физических стимулов напряжение сдвига является наиболее влиятельным фактором в активации тромбоцитов. Напряжение сдвига относится к воздействию кровотока на клетки в кровеносных сосудах, такие как тромбоциты, красные клетки крови и эндотелиальные клетки. Анормальное изменение напряжения сдвига является основной причиной развития патологической артериальной тромбоэмболии in vivo, которая вызывается рассечением артерии из-за чрезкожного венечного вмешательства, такого как установка стента, атерэктомия и баллонная ангиопластика; спазмом сосудов или заболеваниями, такими как гипертензия и атеросклероз.
Когда напряжение сдвига повышается анормально, тромбоциты активируются, и гликопротеины IIb/IIIa активированных тромбоцитов непосредственно связываются с фактором фон Виллебранда, что приводит к агрегации. Такие явления ускоряют сигнальный путь в тромбоцитах, повышают концентрацию внутриклеточного кальция и вызывают высвобождение различных активирующих факторов из гранул, причем посредством этого промотируется агрегация тромбоцитов и появление тромбоза (Nesbitt et al., Nature Medicine, 15, 665-673 (2009)).
Используемые в настоящее время средства для предупреждения и лечения тромботических заболеваний включают антитромбоцитарные средства, которые противодействуют химическим агонистам (например, аспирин, клопидогрель и т.д.), антикоагулянты (например, гепарин, варфарин и т.д.), тромболитические средства для лечения уже сформировавшейся тромбоэмболии (например, тканевый активатор плазминогена) и так далее. Известно, что аспирин вызывает побочное действие, такое как желудочно-кишечное кровотечение и пептическая язва, хотя он довольно эффективен. Большинство других антикоагулянтов нельзя вводить перорально, и они проявляют различное побочное действие после длительного приема, такое как кровотечение, гемолиз, иммунная реакция, лихорадка и аллергия, из-за их низкой селективности в отношении тромбоза. Кроме таких указанных побочных действий и неэффективности, существует другая проблема чрезмерно высоких цен на некоторые коммерчески доступные терапевтические средства.
В силу указанных выше причин существует потребность в разработке антитромбоцитарного средства, которое селективно воздействует на вызываемую напряжением сдвига агрегацию тромбоцитов и имеет слабое побочное действие (Kiefer and Becker, Circulation, 2009, 120: 2488-2495/Gilbert et al., Circulation, 2007, 116: 2678-2686).
Раскрытие изобретения
Решаемая проблема
Настоящее изобретение основано на открытии, что некоторые соединения, имеющие структуры амидов и сложных эфиров, которые получены при исследовании ингибировании агрегации тромбоцитов по соотношению активности структур, применимы для предупреждения или лечения тромботических заболеваний, причем в то же время имеют слабое побочное действие, такое как кровотечение.
Способы решения проблемы]
Один аспект настоящего изобретения относится к соединению, представленному приведенными далее формулами (I) или (II), или его фармацевтически приемлемой соли или изомеру.


в которых
R1 представляет собой гидрокси или C1-C10-алкокси;
X представляет собой N или O;
R2 представляет собой -(CH2)p-(5-12-членный гетероцикл)-(CH2)p-C6-C12-арил, 5-12-членный гетероцикл, -(CH2)p-NHC(=O)-C6-C12-арил, -CHR4R5, 5-12-членный гетероарил, C6-C12-арил, -C6-C12-арил-O-(5-12-членный гетероарил), -(CH2)p-(5-12-членный гетероарил) или -(CH2)p-C6-C12-арил,
причем p равен целому числу от 1 до 10; R4 и R5 представляют собой, каждый независимо, C1-C6-алкоксикарбонил или -CH2-(5-12-членный гетероарил); указанные гетероцикл и гетероарил могут содержать от 1 до 3 гетероатомов, выбранных из N, O и S; и указанные гетероцикл, гетероарил и арил могут быть замещены 1-4 заместителями, выбранными из группы, включающей галоген, оксо, аминокарбонил, C1-C6-алкил, нитро, C1-C6-алкокси, нитрил, C1-C6-алкиламинокарбонил, гидрокси и гидрокси-C1-C6-алкил;
R3 представляет собой водород;
когда X представляет собой O, R3 не существует;
когда X представляет собой N, X, взятый вместе с R2 и R3, может образовывать 5-12-членный гетероцикл, содержащий 1-3 гетероатома, выбранных из O, N и S; причем указанный гетероцикл может быть замещен C6-C12-арилом; 6-12-членный гетероарил, содержащий 1-3 гетероатома, выбранных из O, N и S, который является незамещенным или замещен галогеном; или -O-CHR6R7; и причем R6 и R7 представляют собой, каждый независимо, C6-C12-арил или 6-10-членный гетероарил, содержащий 1-3 гетероатома, выбранных из O, N и S, которые оба являются незамещенными или замещены галогеном.
Конкретными примерами являются следующие далее соединения.
1. (6,7-Дигидротиено[3,2-c]пиридин-5(4H)-ил)(3,4-дигидроксифенил)метанон
2. (3,4-Дигидроксифенил)(4-(5-фторбензо[d]изоксазол-3-ил)пиперидин-1-ил)метанон
3. N-((4-(4-Фторбензил)морфолин-2-ил)метил)-3,4-дигидроксибензамид
4. 3,4-Дигидрокси-N-(2-оксотетрагидротиофен-3-ил)бензамид
5. N,N'-(Нонан-1,9-диил)бис(3,4-дигидроксибензамид)
6. (4-((4-Хлорфенил)(пиридин-2-ил)метокси)пиперидин-1-ил)(3,4-дигидроксифенил)метанон
7. (S)-(4-((4-Хлорфенил)(пиридин-2-ил)метокси)пиперидин-1-ил)(3,4-дигидроксифенил)метанон
8. (S)-Метил-2-(3,4-дигидроксибензамидо)-3-(1H-индол-3-ил)пропаноат
9. 4-(3,4-Дигидроксибензамидо)-1-метил-3-пропил-1H-пиразол-5-карбоксамид
10. 2-Метил-4-оксо-4H-пиран-3-ил-3,4-дигидроксибензоат
11. (3,4-Дигидроксифенил)(4-фенилпиперазин-1-ил)метанон
12. (6,7-Дигидротиено[3,2-c]пиридин-5(4H)-ил)(4-гидрокси-3-метоксифенил)метанон
13. 2-Этил-4-оксо-4H-пиран-3-ил-4-гидрокси-3-метоксибензоат
14. 2-Метил-4-оксо-4H-пиран-3-ил-4-гидрокси-3-метоксибензоат
15. 4-Гидрокси-3-метокси-N-(4-метокси-2-нитрофенил)бензамид
16. N-(3-Этилфенил)-4-гидрокси-3-метоксибензамид
17. 4-(4-(4-Гидрокси-3-метоксибензамидо)фенокси)-N-метилпиколинамид
18. 4-((4-Хлорфенил)(пиридин-2-ил)метокси)пиперидин-1-ил)(4-гидрокси-3-метоксифенил)метанон
19. 4-Гидрокси-N-((3-гидрокси-5-(гидроксиметил)-2-метилпиридин-4-ил)метил)-3-метоксибензамид
20. (6,7-Дигидротиено[3,2-c]пиридин-5(4H)-ил)(2,5-дигидроксифенил)метанон
21. (4-((4-Хлорфенил)(пиридин-2-ил)метокси)пиперидин-1-ил)(2,5-дигидроксифенил)метанон
22. N-((4-(4-Фторбензил)морфолин-2-ил)метил)-2,5-дигидроксибензамид
23. (2,5-Дигидроксифенил)(4-(5-фторбензо[d]изоксазол-3-ил)пиперидин-1-ил)метанон
24. N-(3,4-Диметоксифенетил)-2,5-дигидроксибензамид
25. 2,5-Дигидрокси-N-(2-(тиофен-2-ил)этил)бензамид
26. 2,5-Дигидрокси-N-(2-оксотетрагидротиофен-3-ил)бензамид
Другой аспект настоящего изобретения относится к соединению, которое выбрано отдельно из вышеприведенной группы, или к его фармацевтически приемлемой соли или изомеру.
Еще один аспект настоящего изобретения относится к композиции для предупреждения или лечения тромботических заболеваний из-за агрегации тромбоцитов, включающей в качестве активного ингредиента соединение формулы (I) или (II) или его фармацевтически приемлемую соль или изомер. Тромботические заболевания, упоминаемые в настоящем описании, могут включать, но без ограничения, например, легочную эмболию, тромбофлебит, тромбоз глубоких вен, портальный тромбоз, стенокардию, артериосклероз или церебральный инфаркт.
Фармацевтическую композицию по настоящему изобретению можно получить в подходящей форме вместе с обычно используемыми фармацевтически приемлемым(и) носителем(ями). Термин «фармацевтически приемлемый» относится к ингредиенту, который физиологически приемлем, и который, как правило, не вызывает аллергической реакции, такой как желудочно-кишечное расстройство и головокружение, или подобной реакции, когда вводится людям. Примеры таких фармацевтически приемлемых носителей включают такие носители, как вода, подходящие масла, физиологический раствор, водная глюкоза и гликоли для парентерального введения.
Кроме того, композиция по настоящему изобретению может также включать стабилизатор и консервант. Подходящие стабилизаторы могут включать антиоксиданты, такие как бисульфит натрия, сульфит натрия и аскорбиновая кислота. Подходящие консерванты могут включать хлорид бензалкония, метил- или пропилпарабен и хлорбутанол. Кроме того, композиция по настоящему изобретению при необходимости может подобающе включать суспендирующие вещества, солюбилизаторы, стабилизаторы, тонические средства, консерванты, антиадгезивы, поверхностно-активные вещества, разбавители, эксципиенты, регуляторы рН, болеутоляющие средства от боли при инъекции, буферирующие вещества, антиоксиданты и т.п., в зависимости от путей введения и лекарственных форм. Фармацевтически приемлемые носители и препараты, подходящие для настоящего изобретения, включая описанные выше как примеры, подробно описаны в литературе [Remington's Pharmaceutical Sciences, Current Edition]. Композиции по настоящему изобретению можно получить в стандартной лекарственной форме или можно получить путем включения в многодозовый контейнер. В фармацевтической композиции соединения по настоящему изобретению присутствуют в количестве 0,0001-10 мас.%, предпочтительно 0,001-1 мас.% относительно общей массы всей композиции.
Способ введения фармацевтической композиции по настоящему изобретению можно легко выбрать в зависимости от типа препарата, который можно различными путями вводить млекопитающим, таким как домашний скот и люди, в указанных далее формах для перорального или парентерального введения.
Примеры препаратов для перорального введения включают таблетки, пилюли, твердые и мягкие капсулы, жидкости, суспензии, эмульсии, сиропы, гранулы, эликсиры, пастилки и т.п.. Такие препараты могут содержать, кроме активного ингредиента, разбавители (например, лактозу, декстрозу, сахарозу, маннит, сорбит, целлюлозу и/или глицин) и лубриканты (например, диоксид кремния, тальк, стеариновую кислоту и ее магниевую или кальциевую соль и/или полиэтиленгликоль). Таблетки также могут содержать связующие вещества, такие как алюмосиликат магния, крахмальная паста, желатин, метилцеллюлоза, натрий карбоксиметилцеллюлоза и/или поливинилпирролидон, и могут, необязательно, содержать дезинтеграторы, такие как крахмал, агар, альгиновая кислота или ее натриевая соль; или шипучие смеси и/или абсорбенты, красители, отдушки и подслащивающие вещества.
Препараты для парентерального введения включают стерильные водные растворы, неводные растворы, суспензии, эмульсии, высушенные вымораживанием (лиофилизованные) препараты и суппозитории. Пропиленгликоль, полиэтиленгликоль, растительное масло, такое как оливковое масло, инъецируемый эфир, такой как этилолеат, и т.п., можно использовать для неводных растворов и суспензий. Витепсол, макрогол, твин 61, масло какао, севум лаурин, глицерин, желатин и т.п. можно использовать как основу для суппозиториев. Для того, чтобы получить препарат для парентерального введения, соединения формулы (I) или (II) или их фармацевтически приемлемые соли можно стерилизовать и/или смешать в воде с добавками, такими как консерванты, стабилизаторы, увлажняющие агенты или ускорители эмульгирования, соли и/или буферы для регулирования осмотического давления, и другими терапевтически полезными веществами, и получить растворы или суспензии, которые можно получить в стандартных лекарственных формах в ампулах или флаконах.
Предпочтительные дозы фармацевтической композиции по настоящему изобретению, которая включает соединения формулы (I) или (II) в качестве активного ингредиента, для человеческого организма будут изменяться в зависимости от состояния и массы пациента, тяжести заболевания, типа лекарственного средства, пути введения и длительности лечения, но могут быть соответственно выбраны специалистами в данной области техники. Однако предпочтительно соединения по настоящему изобретению можно вводить в суточной дозе 0,001-100 мг/кг массы тела, предпочтительнее 0,01-30 мг/кг массы тела. Введение можно осуществить один раз в день или разделить на несколько раз в сутки. Дозы могут изменяться в зависимости от различных условий, таких как масса тела пациента, возраст, пол, состояние здоровья, питание, время введения, способ введения, скорость экскреции и тяжесть заболевания, и таким образом, для специалиста в данной области техники будет очевидно, что дозы можно увеличить или сократить. Следовательно, указанные выше дозы никоим образом не ограничивают объем изобретения. Число введений может равняться одному или составлять несколько раз в день в пределах нужного интервала, и период введения особо не ограничивается.
Соединения, представленные формулой (I) или (II), описанными выше, активируют ингибирование агрегации тромбоцитов.
Напряжение сдвига является физическим стимулом, прилагаемым кровотоком к клеткам крови, таким как тромбоциты и красные клетки крови, и к сосудистому эпителию. В нормальных состояниях оно поддерживается на низком уровне 300-1500 с-1, но оно анормально повышается и даже возрастает до 10000 с-1 или больше, когда кровеносные сосуды сужены по причинам патологии, такой как стеноз, артериосклероз, рак и вазоспазм. Такое чрезмерно повышенное напряжение сдвига может непосредственно активировать агрегацию тромбоцитов, и такое состояние определяется как агрегация тромбоцитов, вызванная напряжением сдвига (SIPA). Агрегация тромбоцитов, вызванная напряжением сдвига, инициируется связыванием фактора фон Виллебранда (vWF) с гликопротеином (GP) Ib, и за ним следует повышенная внутриклеточная концентрация кальция, секреция активных факторов из гранулы и экспрессия адгерентных белков, что ведет к устойчивой агрегации тромбоцитов и тромбогенезу.
В частности, напряжение сдвига является одной из наиболее важных причин патологического артериального тромбоза in vivo, на сегодняшний день не разработано или не разрабатывается лекарственное средство, которое нацелено на агрегацию тромбоцитов, вызванную напряжением сдвига. Следовательно, разработка такого лекарственного средства будет первой в своем роде, и как ожидается, проложит путь для новых рынков, а также замене существующих продуктов. В частности, в отличие от химических агонистов, такое лекарство вызывает активацию тромбоцитов через новый механизм и является выгодным в отображении in vivo окружающей среды, вызванной изменениями в кровотоке, и ожидается, что его механизм действия подразделяется на 5 этапов: связывание vWF-GP Ib, изменение внутриклеточного Са2+, активация GP IIb/IIIa, секреция vWF и активация ADAMTS13.
Кроме того, соединения, представленные формулой (I) или (II) по настоящему изобретению, в отличие от обычных антитромбоцитарных средств, почти не показывают побочное действие, такое как кровотечение, даже когда принимаются длительное время.
Используемый в настоящем описании термин «предупреждение» относится к любому действию, которое ингибирует или отодвигает появление соответственного заболевания после введения композиции по изобретению. Специалистам в данной области техники следует иметь в виду, что композиция по настоящему изобретению может предупреждать такое заболевание, когда вводится до или на ранней стадии появления симптомов.
Используемый в настоящем описании термин «лечение» относится к любому действию, которое улучшает или изменяет к лучшему симптомы соответственного заболевания после введения композиции по изобретению, и он включает облегчение и улучшение. Любое лицо, являющееся специалистом в данной области техники, будет способно выяснить точные критерии заболевания и сможет определить степень облегчения, улучшения и лечения заболевания, обратившись к данным, представленным Корейской медицинской ассоциацией, и т.д.
Еще один аспект настоящего изобретения относится к способу лечения или предупреждения тромбоза, включающему введение субъекту, нуждающемуся в лечении тромбоза, терапевтически эффективного количества композиции по настоящему изобретению.
Термин «субъект», используемый в настоящем описании, относится к субъекту, нуждающемуся в лечении заболевания, и конкретнее, относится к млекопитающим, включая людей, приматов, не относящихся к людям, мышей, крыс, собак, кошек, лошадей и коров.
Способ введения субъекту композиции по настоящему изобретению может быть осуществлен так, как описано выше.
Термин «терапевтически эффективное количество», используемый в настоящем описании, относится к количеству соединений по настоящему изобретению или фармацевтических композиций, включающих указанные соединения, которое является достаточным для лечения, ингибирования, облегчения или предупреждения тромбоза, описанного выше, которое можно определить, проведя определение отношения польза/риск, которое применяют к любому лекарству. Однако общую суточную дозу можно определить согласно мнению врача. Кроме того, суточную дозу для определенного пациента также можно определить, учитывая различные факторы, известные в технике, такие как, например, тип конкретного заболевания, тяжесть заболевания, тип определенного вводимого лекарства, тип используемой композиции, возраст пациента, масса тела, общее состояние здоровья, пол, питание, время введения, путь введения, абсорбция, распределение и скорость экскреции лекарства, длительность введения, тип других используемых лекарств и т.п.. Кроме того, на начальной стадии введения лекарства лекарство вводят в количестве меньшем, чем требуемое для желательного действия, и дозу постепенно повышают до тех пор, пока не получат желаемое действие.
Эффект изобретения
Соединения по настоящему изобретению или их фармацевтически приемлемые соли или изомеры оказывают действие ингибирования агрегации тромбоцитов, и композиция, включающая их, может эффективно предупреждать или лечить тромботическое заболевание с незначительным побочным действием, таким как кровотечение.
Конкретные воплощения изобретения
Далее, для того, чтобы облегчить понимание настоящего изобретения, будут представлены примеры. Однако следующие далее примеры приводятся только с целью облегчить понимание настоящего изобретения, и настоящее изобретение не ограничивается следующими далее примерами.
Примеры
Подготовка к экспериментам и приборы
1. Аналитические приборы
Для идентификации структуры продукта, полученного в данном эксперименте, используют указанные далее приборы. Спектр ядерного магнитного резонанса (1Н-ЯМР) получают при 300 МГц и 400 МГц, и растворителями являются CDCl3 и ДМСО-d6. Константу взаимодействия (J) выражают в Гц. Масс-спектрометр (изготовитель JEOL/название модели спектрометр JMS-AX 505wA; или изготовитель JEOL/название модели спектрометр JMS-HX/HX 110A) используют согласно руководству изготовителя, и масс-спектр выражают в форме m/z.
2. ТСХ и колоночная хроматография
Для тонкослойной хроматографии (ТСХ) используют силикагель (Merck F254) от Merck, и для колоночной хроматографии используют диоксид кремния (Merck EM 9385, 230-400 меш). Кроме того, для подтверждения отдельных веществ ТСХ пластину контролируют под УФ-лампой (при 254 нм), или пластину погружают в проявляющие цветные реагенты анисовый альдегид и перманганат калия (KMnO4) с последующим нагреванием.
3. Используемые реагенты
Реагенты, используемые в этом эксперименте, закупают у Sigma-Aldrich, Lancaster или Fluka, и растворители, используемые в реакции, закупают у Sigma-Aldrich, Merck или Junsei Chemical Co. (Япония). Реагенты первого сорта используют без очистки. ТГФ, используемый в качестве растворителя, подготавливают кипячением с обратным холодильником над металлическим натрием в присутствии бензофенона в токе аргона до тех пор, пока он не станет голубым. Дихлорметан (CH2Cl2) подготавливают путем добавления CaH2 в токе аргона и кипячения с обратным холодильником. Этилацетат и гексан кипятят с обратным холодильником в токе аргона и очищают.
Препаративный пример 1. Получение 3,4-диацетоксибензойной кислоты
К смеси 150 мл очищенной воды и 36,1 мл ТЕА добавляют 10,0 г РСА, и по каплям добавляют 18,4 мл уксусного ангидрида при температуре 20°C или ниже. Смесь перемешивают при комнатной температуре в течение ночи. К смеси добавляют хлороводородную кислоту до достижения рН 3,0, и смесь перемешивают при комнатной температуре в течение 1 часа. Полученное твердое вещество отфильтровывают, промывают очищенной водой и сушат при 40оС, и получают 9,2 г названного в заголовке соединения в виде белого твердого вещества.
Выход 59,5%.
1H ЯМР (400 МГц, CDCl3) δ 8,05 (дд, J=2,0 и 8,4 Гц, 1H), 7,97 (д, J=2,0 Гц, 1H), 7,35 (д, J=8,8 Гц, 1H), 2,35 (с, 3H), 2,34 (с, 3H).
Препаративный пример 2. Получение 4-ацетокси-3-метоксибензойной кислоты
К смеси 150 мл очищенной воды и 16,5 мл ТЕА добавляют ванилиновую кислоту (10,0 г), и по каплям добавляют 8,4 мл уксусного ангидрида при температуре 20°C или ниже. Смесь перемешивают при комнатной температуре в течение ночи. К смеси добавляют хлороводородную кислоту до достижения рН 3,0, и смесь перемешивают при комнатной температуре в течение 1 часа. Полученное твердое вещество отфильтровывают, промывают очищенной водой и сушат при 40оС, и получают 10,7 г названного в заголовке соединения в виде бледно-желтого твердого вещества.
Выход 85,5%.
1H ЯМР (400 МГц, CDCl3) δ 7,78 (дд, J=6,4 и 8,4 Гц, 1H), 7,73 (д, J=2,0 Гц, 1H), 7,16 (д, J=8,4 Гц, 1H), 3,93 (с, 3H), 2,37 (с, 3H).
Пример 1. (6,7-Дигидротиено[3,2-c]пиридин-5(4Н)-ил)(3,4-дигидроксифенил)метанон
К 10 мл DCM добавляют 0,5 г 3,4-диацетоксибензойной кислоты, полученной в препаративном примере 1, и смесь перемешивают при 10оС. При температуре 10°C или ниже добавляют 0,66 г PCl5, смесь перемешивают в течение 2 часов, поддерживая температуру 0-10оС, и добавляют 10 мл очищенной воды для экстрагирования. Водный слой отбрасывают, и органический слой сушат над Na2SO4 и фильтруют. Фильтрат концентрируют, добавляют 10 мл DCM, охлаждают смесь до 0оС. и добавляют 0,33 г гидрохлорида 4,5,6,7-тетрагидротиено[3,2-c]пиридина. Добавляют по каплям 0,44 мл ТЕА, поддерживая температуру 0оС, температуру постепенно поднимают до комнатной температуры, и смесь перемешивают в течение 2 часов. Фазу DCM концентрируют, добавляют 10 мл EtOAc и 10 мл очищенной воды, и слои разделяют. Водный слой дополнительно экстрагируют 10 мл EtOAc, оставшийся водный слой отбрасывают, и органический слой концентрируют. К концентрату добавляют 5 мл МеОН, 5 мл очищенной воды и 2,9 мл ТЕА, и смесь кипятят с обратным холодильником в течение 4 часов. Фазу МеОН концентрируют, добавляют 10 мл EtOAc и 10 мл очищенной воды, и слои разделяют. Органический слой концентрируют, и после добавления небольшого количества DCM обрабатывают ультразвуком в течение 5 минут. Полученное твердое вещество отфильтровывают, промывают небольшим количеством DCM, и получают 0,38 г названного в заголовке соединения в виде белого твердого вещества.
Выход 65,7%.
1H ЯМР (400 МГц, ДМСО-d6) δ 9,30 (ушс, 2H), 7,35 (д, J=4,0 Гц, 1H), 6,88 (ушс, 1H), 6,84 (с, 1H), 6,77 (д, J=4,0 Гц, 1H), 4,64 (с, 1H), 3,96 (с, 1H), 3,87 (с, 1H), 2,89 (с, 1H), 2,81 (с, 1H).
Пример 2. (3,4-Дигидроксифенил)(4-(5-фторбензо[d]изоксазол-3-ил)пиперидин-1-ил)метанон
К 10 мл DCM добавляют 0,5 г 3,4-диацетоксибензойной кислоты, полученной в препаративном примере 1, и смесь перемешивают при 10оС. При температуре 10°C или ниже добавляют 0,66 г PCl5, смесь перемешивают в течение 2 часов, поддерживая температуру 0-10оС, и добавляют 10 мл очищенной воды для экстрагирования. Водный слой отбрасывают, и органический слой сушат над Na2SO4 и фильтруют. Фильтрат концентрируют, добавляют 10 мл DCM, охлаждают смесь до 0оС, и добавляют 0,48 г гидрохлорида 6-фтор-3-(4-пиперидинил)-1,2-бензизоксазола. Добавляют по каплям 0,44 мл ТЕА, поддерживая температуру 0оС, температуру постепенно поднимают до комнатной температуры, и смесь перемешивают в течение 2 часов. Фазу DCM концентрируют, добавляют 10 мл EtOAc и 10 мл очищенной воды, и слои разделяют. Водный слой дополнительно экстрагируют 10 мл EtOAc, оставшийся водный слой отбрасывают, и органический слой концентрируют. К концентрату добавляют 5 мл МеОН, 5 мл очищенной воды и 2,9 мл ТЕА, и смесь кипятят с обратным холодильником в течение 4 часов. Фазу МеОН концентрируют, добавляют 10 мл EtOAc и 10 мл очищенной воды, и слои разделяют. Органический слой концентрируют, и после добавления небольшого количества DCM обрабатывают ультразвуком в течение 5 минут. Полученное твердое вещество отфильтровывают, промывают небольшим количеством DCM, и получают 0,42 г названного в заголовке соединения в виде белого твердого вещества.
Выход 56,1%.
1H ЯМР (400 МГц, ДМСО-d6) δ 9,23 (ушс, 2H), 8,07 (дд, J=5,6 и 8,8 Гц, 1H), 7,71 (дд, J=2,0 и 9,2 Гц, 1H), 7,30 (тд, J=2,0 и 9,2 Гц, 1H), 6,84 (д, J=1,6 Гц, 1H), 6,76~6,75 (м, 2H), 4,19 (ушс, 2H), 3,53~3,46 (м, 2H), 3,12 (ушс, 1H), 2,10~2,07 (м, 2H), 1,83~1,73 (м, 1H).
Пример 3. N-((4-(4-Фторфенил)морфолин-2-ил)метил)-3,4-дигидроксибензамид
К 60 мл DCM добавляют 3,0 г 3,4-диацетоксибензойной кислоты, полученной в препаративном примере 1, и смесь перемешивают при 10оС. При температуре 10°C или ниже добавляют 3,9 г PCl5, смесь перемешивают в течение 2 часов, поддерживая температуру 0-10оС, и добавляют 60 мл очищенной воды, и слои разделяют. Водный слой отбрасывают, и органический слой сушат над Na2SO4 и фильтруют. Фильтрат концентрируют, добавляют 60 мл DCM, охлаждают смесь до 0оС, и добавляют 2,7 г 3-аминоэтил-4-(4-фторбензил)морфолина. Добавляют по каплям 5,2 мл ТЕА, поддерживая температуру 0оС, температуру постепенно поднимают до комнатной температуры, и смесь перемешивают в течение 2 часов. Фазу DCM концентрируют, и добавляют для экстрагирования 60 мл EtOAc и 60 мл очищенной воды. Водный слой дополнительно экстрагируют 60 мл EtOAc, оставшийся водный слой отбрасывают, и органический слой концентрируют. К концентрату добавляют 3 мл МеОН, 3 мл очищенной воды и 17,5 мл ТЕА, и смесь кипятят с обратным холодильником в течение 4 часов. Фазу МеОН концентрируют, и добавляют для экстрагирования 60 мл EtOAc и 60 мл очищенной воды. Органический слой концентрируют, очищают колоночной флэш-хроматографией, сушат в вакууме, и получают 2,9 г названного в заголовке соединения в виде пены.
Выход 63,8%.
1H ЯМР (400 МГц, ДМСО-d6) δ 9,45 (ушс, 1H), 9,11 (ушс, 1H), 8,18 (т, J=5,6 Гц, 1H), 7,33 (дд, J=5,6 и 8,4 Гц, 2H), 7,27 (д, J=1,6 Гц, 1H), 7,19~7,11 (м, 3H), 6,75 (д, J=8,4 Гц, 1H), 3,77 (д, J=10,8 Гц, 1H), 3,59~3,40 (м, 4H), 3,29~3,17 (м, 2H), 2,73 (д, J=11,2 Гц, 1H), 2,55 (д, J=11,2 Гц, 1H), 2,04 (т, J=10,4 Гц, 1H), 1,82 (д, J=10,4 Гц, 1H).
Пример 4. 3,4-Дигидрокси-N-(2-оксотетрагидротиофен-3-ил)бензамид
К 10 мл ДМФА добавляют 0,5 г протокатеховой кислоты, 0,68 г EDC, 0,48 г HOBt, 1,4 мл ТЕА и 0,55 г гидрохлорида гомоцистеинтиолактона, и смесь перемешивают при 60-80°C в течение 4 часов. К реакционной смеси добавляют 10 мл EtOAc и 10 мл очищенной воды, и слои разделяют. Водный слой экстрагируют один раз 10 мл EtOAc, и водный слой отбрасывают. Органический слой промывают три раза 10 мл очищенной воды, сушат над Na2SO4 и фильтруют. Фильтрат концентрируют перегонкой при пониженном давлении, очищают колоночной флэш-хроматографией, и получают 0,28 г названного в заголовке соединения в виде белого твердого вещества.
Выход 34,1%.
1H ЯМР (400 МГц, ДМСО-d6) 9,52 (ушс, 1H), 9,17 (ушс, 1H), 8,42 (д, J=8,0, 1H), 7,29 (д, J=2,0, 1H), 7,20 (дд, J=2,0 и 8,4, 1H), 6,77 (д, J=8,8, 1H), 4,79 (секст, J=7,6, 1H), 3,47~3,29 (м, 2H), 2,46~2,22 (м, 2H).
Пример 5. N,N'-(Нонан-1,9-диил)бис(3,4-дигидроксибензамид)
К 10 мл DCM добавляют 0,5 г 3,4-диацетоксибензойной кислоты, полученной в препаративном примере 1, и смесь перемешивают при 10оС. При температуре 10°C или ниже добавляют 0,66 г PCl5, смесь перемешивают в течение 2 часов, поддерживая температуру 0-10оС, добавляют 10 мл очищенной воды, и слои разделяют. Водный слой отбрасывают, и органический слой сушат над Na2SO4 и фильтруют. Фильтрат концентрируют, добавляют 10 мл DCM, охлаждают смесь до 0оС, и добавляют 0,13 г 1,9-диаминононана. Добавляют по каплям 0,44 мл ТЕА, поддерживая температуру 0оС, температуру постепенно поднимают до комнатной температуры, и смесь перемешивают в течение 2 часов. Слой DCM концентрируют, добавляют 10 мл EtOAc и 10 мл очищенной воды, и слои разделяют. Водный слой экстрагируют 10 мл EtOAc, водный слой отбрасывают, и органический слой концентрируют. К концентрату добавляют 5 мл МеОН, 5 мл очищенной воды и 2,9 мл ТЕА, и смесь кипятят с обратным холодильником в течение 4 часов. Раствор МеОН концентрируют, добавляют 10 мл EtOAc и 10 мл очищенной воды, и слои разделяют. Органический слой концентрируют при пониженном давлении, очищают колоночной флэш-хроматографией, и получают 0,65 г названного в заголовке соединения в виде белого твердого вещества.
Выход 71,9%.
1H ЯМР (400 МГц, ДМСО-d6) δ 9,40 (ушс, 2H), 9,08 (ушс, 2H), 8,10 (т, J=5,6 Гц, 2H), 7,26 (д, J=2,4 Гц, 2H), 7,17 (дд, J=2,0 и 8,0 Гц, 2H), 6,74 (д, J=8,0 Гц, 2H), 3,09 (к, J=6,8 Гц, 4H), 1,47 (т, J=6,0 Гц, 4H), 1,27 (с, 10H).
Пример 6. (4-((4-Хлорфенил)(пиридин-2-ил)метокси)пиперидин-1-ил)(3,4-дигидроксифенил)метанон
К 10 мл DCM добавляют 0,5 г 3,4-диацетоксибензойной кислоты, полученной в препаративном примере 1, и смесь перемешивают при 10оС. При температуре 10°C или ниже добавляют 0,66 г PCl5, смесь перемешивают в течение 2 часов, поддерживая температуру 0-10оС, добавляют 10 мл очищенной воды, и слои разделяют. Водный слой отбрасывают, и органический слой сушат над Na2SO4 и фильтруют. Фильтрат концентрируют, добавляют 10 мл DCM, охлаждают смесь до 0оС, и добавляют 0,57 г 2-[(4-хлорфенил)(4-пиперидинилокси)метил)]пиридина. Добавляют по каплям 0,44 мл ТЕА, поддерживая температуру 0оС, температуру постепенно поднимают до комнатной температуры, и смесь перемешивают в течение 2 часов. Фазу DCM концентрируют, добавляют 10 мл EtOAc и 10 мл очищенной воды, и слои разделяют. Водный слой дополнительно экстрагируют 10 мл EtOAc, оставшийся водный слой отбрасывают, и органический слой концентрируют. К концентрату добавляют 5 мл МеОН, 5 мл очищенной воды и 2,9 мл ТЕА, и смесь кипятят с обратным холодильником в течение 4 часов. Фазу МеОН концентрируют, добавляют 10 мл EtOAc и 10 мл очищенной воды, и слои разделяют. Органический слой концентрируют при пониженном давлении, очищают колоночной флэш-хроматографией, и получают 0,72 г названного в заголовке соединения в виде пены.
Выход 78,1%.
1H ЯМР (400 МГц, ДМСО-d6) δ 9,25 (ушс, 2H), 8,47 (д, J=4,8 Гц, 1H), 7,81 (тд, J=1,6 и 7,6 Гц, 1H), 7,57 (д, J=8,0 Гц, 1H), 7,44~7,24 (м, 5H), 6,80~6,67 (м, 3H), 5,70 (с, 1H), 3,76 (ушс, 1H), 3,66 (ушс, 2H), 3,19 (ушс, 2H), 1,85 (ушс, 2H), 1,53 (ушс, 2H).
Пример 7. (S)-(4-((4-Хлорфенил)(пиридин-2-ил)метокси)пиперидин-1-ил)(3,4-дигидроксифенил)метанон
К 10 мл DCM добавляют 0,5 г 3,4-диацетоксибензойной кислоты, полученной в препаративном примере 1, и смесь перемешивают при 10оС. При температуре 10°C или ниже добавляют 0,66 г PCl5, смесь перемешивают в течение 2 часов, поддерживая температуру 0-10оС, добавляют 10 мл очищенной воды, и слои разделяют. Водный слой отбрасывают, и органический слой сушат над Na2SO4 и фильтруют. Фильтрат концентрируют, добавляют 10 мл DCM, охлаждают смесь до 0оС, и добавляют 0,57 г (S)-2-[(4-хлорфенил)(4-пиперидинилокси)метил)]пиридина. Добавляют по каплям 0,44 мл ТЕА, поддерживая температуру 0оС, температуру постепенно поднимают до комнатной температуры, и смесь перемешивают в течение 2 часов. Фазу DCM концентрируют, добавляют 10 мл EtOAc и 10 мл очищенной воды, и слои разделяют. Водный слой дополнительно экстрагируют 10 мл EtOAc, оставшийся водный слой отбрасывают, и органический слой концентрируют. К концентрату добавляют 5 мл МеОН, 5 мл очищенной воды и 2,9 мл ТЕА, и смесь кипятят с обратным холодильником в течение 4 часов. Фазу МеОН концентрируют, добавляют 10 мл EtOAc и 10 мл очищенной воды, и слои разделяют. Органический слой концентрируют при пониженном давлении, очищают колоночной флэш-хроматографией, и получают 0,47 г названного в заголовке соединения в виде пены.
Выход 51,0%.
1H ЯМР (400 МГц, CDCl3) δ 8,50 (ушс, 2H), 7,72 (т, J=6,8 Гц, 1H), 7,52 (д, J=7,6 Гц, 1H), 7,38~7,21 (м, 5H), 6,84 (с, 1H), 6,72 (с, 2H), 5,65 (с, 1H), 3,91 (ушс, 1H), 3,69 (ушс, 2H), 3,40 (ушс, 1H), 3,31 (ушс, 1H), 1,73 (ушс, 4H).
Пример 8. (S)-Метил-2-(3,4-дигидроксибензамидо)-3-(1Н-индол-3-ил)пропаноат
К 10 мл ДМФА добавляют 0,5 г (3,24 ммоль) протокатеховой кислоты, 0,68 г (3,57 ммоль) EDC, 0,48 г (3,57 ммоль) HOBt, 1,58 мл (11,35 ммоль) ТЕА и 1,0 г (3,89 ммоль) гидрохлорида метилового эфира D-триптофана, и смесь перемешивают при 60-80°C в течение 4 часов. К реакционной смеси добавляют 10 мл EtOAc и 10 мл очищенной воды, и слои разделяют. Водный слой экстрагируют один раз 10 мл EtOAc, и водный слой отбрасывают. Органический слой промывают три раза 10 мл очищенной воды, сушат над Na2SO4 и фильтруют. Фильтрат концентрируют перегонкой при пониженном давлении, очищают колоночной флэш-хроматографией, и получают 0,37 г названного в заголовке соединения в виде пены.
Выход 33,6%.
1H ЯМР (400 МГц, ДМСО-d6) δ 10,84 (с, 1H), 9,51 (с, 1H), 9,14 (с, 1H), 8,42 (д, J=7,2 Гц, 1H), 7,54 (д, J=7,6 Гц, 1H), 7,33 (д, J=8,0 Гц, 1H), 7,26 (д, J=2,0 Гц, 1H), 7,21~7,19 (м, 2H), 7,08~6,97 (м, 2H), 6,75 (д, J=8,0 Гц, 1H), 4,63 (тд, J=5,6 и 7,6 Гц, 1H), 3,61 (с, 3H), 3,27~3,21 (м, 2H).
Пример 9. 4-(3,4-Дигидроксибензамидо)-1-метил-3-пропил-1Н-пиразол-5-карбоксамид
К 10 мл DCM добавляют 0,5 г 3,4-диацетоксибензойной кислоты, полученной в препаративном примере 1, и смесь перемешивают при 10оС. При температуре 10°C или ниже добавляют 0,66 г PCl5, смесь перемешивают в течение 2 часов, поддерживая температуру 0-10оС, добавляют 10 мл очищенной воды, и слои разделяют. Водный слой отбрасывают, и органический слой сушат над Na2SO4 и фильтруют. Фильтрат концентрируют, добавляют 10 мл DCM, охлаждают смесь до 0оС, и добавляют 0,41 г гидрохлорида 4-амино-1-метил-3-пропил-1Н-пиразол-5-карбоксамида. Добавляют по каплям 0,44 мл ТЕА, поддерживая температуру 0оС, температуру постепенно поднимают до комнатной температуры, и смесь перемешивают в течение 2 часов. Фазу DCM концентрируют, добавляют 10 мл EtOAc и 10 мл очищенной воды, и слои разделяют. Водный слой дополнительно экстрагируют 10 мл EtOAc, водный слой отбрасывают, и органический слой концентрируют. К концентрату добавляют 5 мл МеОН, 5 мл очищенной воды и 2,9 мл ТЕА, и смесь кипятят с обратным холодильником в течение 4 часов. Фазу МеОН концентрируют, добавляют 10 мл EtOAc и 10 мл очищенной воды, и слои разделяют. Органический слой концентрируют перегонкой при пониженном давлении, и получают остаток в форме пены. Остаток кристаллизуют в смешанном растворителе EtOAc/DCM, и получают 0,21 г названного в заголовке соединения в виде не совсем белого твердого вещества.
Выход 31,4%.
1H ЯМР (400 МГц, CDCl3) δ 9,83 (с, 1H), 9,69 (ушс, 1H), 9,29 (ушс, 1H), 7,38 (д, J=2,0 Гц, 1H), 7,34 (дд, J=2,0 и 8,0 Гц, 1H), 6,84 (д, J=8,4 Гц, 1H), 3,94 (с, 3H), 1,56 (секстет, J=7,2 Гц, 2H), 1,17 (т, J=7,2 Гц, 2H), 0,85 (т, J=7,2 Гц, 3H).
Пример 10. 2-Метил-4-оксо-4Н-пиран-3-ил-3,4-дигидроксибензоат
К 10 мл DCM добавляют 0,5 г 3,4-диацетоксибензойной кислоты, полученной в препаративном примере 1, и смесь перемешивают при 10оС. При температуре 10°C или ниже добавляют 0,66 г PCl5, смесь перемешивают в течение 2 часов, поддерживая температуру 0-10оС, добавляют 10 мл очищенной воды, и слои разделяют. Водный слой отбрасывают, и органический слой сушат над Na2SO4 и фильтруют. Фильтрат концентрируют, добавляют 10 мл DCM, охлаждают смесь до 0оС, и добавляют 0,24 г мальтола. Добавляют по каплям 0,44 мл ТЕА, поддерживая температуру 0оС, температуру постепенно поднимают до комнатной температуры, и смесь перемешивают в течение 2 часов. Фазу DCM концентрируют, добавляют 10 мл EtOAc и 10 мл очищенной воды, и слои разделяют. Водный слой дополнительно экстрагируют 10 мл EtOAc, водный слой отбрасывают, и органический слой концентрируют. К концентрату добавляют 5 мл МеОН, 5 мл очищенной воды и 2,9 мл ТЕА, и смесь кипятят с обратным холодильником в течение 4 часов. Фазу МеОН концентрируют, добавляют 10 мл EtOAc и 10 мл очищенной воды, и слои разделяют. Органический слой концентрируют, и после добавления небольшого количества DCM обрабатывают ультразвуком в течение 5 минут. Полученное твердое вещество отфильтровывают, промывают небольшим количеством DCM, и получают 0,40 г названного в заголовке соединения в виде белого твердого вещества.
Выход 72,6%.
1H ЯМР (400 МГц, CDCl3) δ 9,79 (ушс, 2H), 8,19 (д, J=5,6 Гц, 1H), 7,47~7,44 (м, 2H), 6,89 (д, J=8,8 Гц, 1H), 6,46 (д, J=6,0 Гц, 1H), 2,26 (с, 3H).
Пример 11. (3,4-Дигидроксифенил)(4-фенилпиперазин-1-ил)метанон
К 10 мл DCM добавляют 0,5 г 3,4-диацетоксибензойной кислоты, полученной в препаративном примере 1, и смесь перемешивают при 10оС. При температуре 10°C или ниже добавляют 0,66 г PCl5, смесь перемешивают в течение 2 часов, поддерживая температуру 0-10оС, добавляют 10 мл очищенной воды, и слои разделяют. Водный слой отбрасывают, и органический слой сушат над Na2SO4 и фильтруют. Фильтрат концентрируют, добавляют 10 мл DCM, охлаждают смесь до 0оС, и добавляют 0,31 г 1-фенилпиперазина. Добавляют по каплям 0,44 мл ТЕА, поддерживая температуру 0оС, температуру постепенно поднимают до комнатной температуры, и смесь перемешивают в течение 2 часов. Фазу DCM концентрируют, добавляют 10 мл EtOAc и 10 мл очищенной воды, и затем слои разделяют. Водный слой дополнительно экстрагируют 10 мл EtOAc, водный слой отбрасывают, и органический слой концентрируют. К концентрату добавляют 5 мл МеОН, 5 мл очищенной воды и 2,9 мл ТЕА, и смесь кипятят с обратным холодильником в течение 4 часов. Фазу МеОН концентрируют, добавляют 10 мл EtOAc и 10 мл очищенной воды, и слои разделяют. Органический слой концентрируют перегонкой при пониженном давлении, очищают колоночной флэш-хроматографией, и получают 0,28 г названного в заголовке соединения в виде белого твердого вещества.
Выход 45,2%.
1H ЯМР (400 МГц, CDCl3) δ 9,35 (с, 1H), 9,21 (с, 1H), 7,24~7,21 (м, 2H), 6,96~6,75 (м, 6H), 3,62 (ушс, 4H), 3,14 (ушс, 4H).
Пример 12. (6,7-Дигидротиено[3,2-c]пиридин-5(4Н)-ил)(4-гидрокси-3-метоксифенил)метанон
К 10 мл DCM добавляют 0,5 г 4-ацетокси-3-метоксибензойной кислоты, полученной в препаративном примере 2, и смесь перемешивают при 10оС. При температуре 10°C или ниже добавляют 0,74 г PCl5, смесь перемешивают в течение 2 часов, поддерживая температуру 0-10оС, к смеси добавляют 10 мл очищенной воды, и слои разделяют. Водный слой отбрасывают, и органический слой сушат над Na2SO4 и фильтруют. Фильтрат концентрируют, добавляют 10 мл DCM, охлаждают смесь до 0оС, и добавляют 0,4 г гидрохлорида 4,5,6,7-тетрагидротиено[3,2-c]пиридина. Добавляют по каплям 0,5 мл ТЕА, поддерживая температуру 0оС, температуру постепенно поднимают до комнатной температуры, и смесь перемешивают в течение 2 часов. Фазу DCM концентрируют, добавляют 10 мл EtOAc и 10 мл очищенной воды, и слои разделяют. Водный слой дополнительно экстрагируют 10 мл EtOAc, водный слой отбрасывают, и органический слой концентрируют. К концентрату добавляют 5 мл МеОН, 5 мл очищенной воды и 3,3 мл ТЕА, и смесь кипятят с обратным холодильником в течение 4 часов. Фазу МеОН концентрируют, полученное твердое вещество отфильтровывают и промывают очищенной водой, и получают 0,55 г названного в заголовке соединения в виде белого твердого вещества.
Выход 79,9%.
1H ЯМР (400 МГц, ДМСО-d6) δ 9,48 (с, 1H), 7,35 (д, J=4,4 Гц, 1H), 7,01 (д, J=1,6 Гц, 1H), 6,93-6,90 (м, 2H), 6,83 (д, J=8,0 Гц, 1H), 4,60 (с, 1Н), 3,79 (с, 3Н), 3,74 (ушс, 2Н), 2,88 (т, J=4,8 Гц, 2H).
Пример 13. 2-Этил-4-оксо-4Н-пиран-3-ил-4-гидрокси-3-метоксибензоат
К 10 мл DCM добавляют 0,5 г 4-ацетокси-3-метоксибензойной кислоты, полученной в препаративном примере 2, и смесь перемешивают при 10оС. При температуре 10°C или ниже добавляют 0,74 г PCl5, смесь перемешивают в течение 2 часов, поддерживая температуру 0-10оС, к смеси добавляют 10 мл очищенной воды, и затем слои разделяют. Водный слой отбрасывают, и органический слой сушат над Na2SO4 и фильтруют. Фильтрат концентрируют, добавляют 10 мл DCM, охлаждают смесь до 0оС, и добавляют 0,31 г этилмальтола. Добавляют по каплям 0,5 мл ТЕА, поддерживая температуру 0оС, температуру постепенно поднимают до комнатной температуры, и смесь перемешивают в течение 2 часов. Слой DCM концентрируют, добавляют 10 мл EtOAc и 10 мл очищенной воды, и затем слои разделяют. Водный слой экстрагируют 10 мл EtOAc, водный слой отбрасывают, и органический слой концентрируют. К концентрату добавляют 5 мл МеОН, 5 мл очищенной воды и 3,3 мл ТЕА, и смесь кипятят с обратным холодильником в течение 4 часов. Слой МеОН концентрируют, добавляют 10 мл EtOAc и 10 мл очищенной воды, и слои разделяют. Органический слой перегоняют при пониженном давлении, очищают колоночной флэш-хроматографией, и получают 0,34 г названного в заголовке соединения в виде белого твердого вещества.
Выход 49,2%.
1H ЯМР (400 МГц, ДМСО-d6) δ 10,24 (с, 1H), 8,23 (д, J=5,2 Гц, 1H), 7,63 (д, J=7,6 Гц, 1H), 7,53(с, 1H), 6,95 (д, J=8,0 Гц, 1H), 6,48 (д, J=5,6 Гц, 1H), 3,85(с, 3H), 2,62 (к, J=6,8 Гц, 2H), 1,15 (т, J=7,2 Гц, 3H).
Пример 14. 2-Метил-4-оксо-4Н-пиран-3-ил-4-гидрокси-3-метоксибензоат
К 10 мл DCM добавляют 0,5 г 4-ацетокси-3-метоксибензойной кислоты, полученной в препаративном примере 2, и смесь перемешивают при 10оС. При температуре 10°C или ниже добавляют 0,74 г PCl5, смесь перемешивают в течение 2 часов, поддерживая температуру 0-10оС, к смеси добавляют 10 мл очищенной воды, и затем слои разделяют. Водный слой отбрасывают, и органический слой сушат над Na2SO4 и фильтруют. Фильтрат концентрируют, добавляют 10 мл DCM, охлаждают смесь до 0оС, и добавляют 0,27 г мальтола. Добавляют по каплям 0,5 мл ТЕА, поддерживая температуру 0оС, температуру постепенно поднимают до комнатной температуры, и смесь перемешивают в течение 2 часов. Слой DCM концентрируют, добавляют 10 мл EtOAc и 10 мл очищенной воды, и затем слои разделяют. Водный слой экстрагируют 10 мл EtOAc, водный слой отбрасывают, и органический слой концентрируют. К концентрату добавляют 5 мл МеОН, 5 мл очищенной воды и 3,3 мл ТЕА, и смесь кипятят с обратным холодильником в течение 4 часов. Слой МеОН концентрируют, полученное твердое вещество отфильтровывают и промывают очищенной водой, и получают 0,35 г названного в заголовке соединения в виде белого твердого вещества.
Выход 53,2%.
1H ЯМР (400 МГц, ДМСО-d6) δ 10,24 (с, 1H), 8,21 (д, J=5,6 Гц, 1H), 7,63 (д, J=8,4 Гц, 1H), 7,53(с, 1H), 6,95 (д, J=8,0 Гц, 1H), 6,48 (д, J=5,6 Гц, 1H), 3,85 (с, 3H), 2,83(с, 3H).
Пример 15. 4-Гидрокси-3-метокси-N-(4-метокси-2-нитрофенил)бензамид
К 10 мл DCM добавляют 0,5 г 4-ацетокси-3-метоксибензойной кислоты, полученной в препаративном примере 2, и смесь перемешивают при 10оС. При температуре 10°C или ниже добавляют 0,74 г PCl5, смесь перемешивают в течение 2 часов, поддерживая температуру 0-10оС, к смеси добавляют 10 мл очищенной воды, и затем слои разделяют. Водный слой отбрасывают, и органический слой сушат над Na2SO4 и фильтруют. Фильтрат концентрируют, добавляют 10 мл DCM, охлаждают смесь до 0оС, и добавляют 0,40 г 4-метокси-2-нитроанилина. Добавляют по каплям 0,5 мл ТЕА, поддерживая температуру 0оС, температуру постепенно поднимают до комнатной температуры, и смесь перемешивают в течение 2 часов. Слой DCM концентрируют, добавляют 10 мл EtOAc и 10 мл очищенной воды, и затем слои разделяют. Водный слой экстрагируют 10 мл EtOAc, водный слой отбрасывают, и органический слой концентрируют. К концентрату добавляют 5 мл МеОН, 5 мл очищенной воды и 3,3 мл ТЕА, и смесь кипятят с обратным холодильником в течение 4 часов. Слой МеОН концентрируют, добавляют 10 мл EtOAc и 10 мл очищенной воды, и слои разделяют. Органический слой перегоняют при пониженном давлении и очищают колоночной флэш-хроматографией, и получают 0,54 г названного в заголовке соединения в виде красного твердого вещества.
Выход 71,3%.
1H ЯМР(400 МГц, ДМСО-d6) 10,32 (с, 1H), 9,81 (ушс, 1H), 7,63 (д, J=8,8, 1H), 7,52~7,46 (м, 3H), 7,35 (дд, J=2,8 и 8,8, 1H), 3,86 (с, 1H), 3,85 (с, 3H).
Пример 16. N-(3-Этилфенил)-4-гидрокси-3-метоксибензамид
К 10 мл DCM добавляют 0,5 г 4-ацетокси-3-метоксибензойной кислоты, полученной в препаративном примере 2, и смесь перемешивают при 10оС. При температуре 10°C или ниже добавляют 0,74 г PCl5, смесь перемешивают в течение 2 часов, поддерживая температуру 0-10оС, к смеси добавляют 10 мл очищенной воды, и затем слои разделяют. Водный слой отбрасывают, и органический слой сушат над Na2SO4 и фильтруют. Фильтрат концентрируют, добавляют 10 мл DCM, охлаждают смесь до 0оС, и добавляют 0,25 г 3-аминофенилацетилена. Добавляют по каплям 0,5 мл ТЕА, поддерживая температуру 0оС, температуру постепенно поднимают до комнатной температуры, и смесь перемешивают в течение 2 часов. Слой DCM концентрируют, добавляют 10 мл EtOAc и 10 мл очищенной воды, и затем слои разделяют. Водный слой экстрагируют 10 мл EtOAc, водный слой отбрасывают, и органический слой концентрируют. К концентрату добавляют 5 мл МеОН, 5 мл очищенной воды и 3,3 мл ТЕА, и смесь кипятят с обратным холодильником в течение 4 часов. Слой МеОН концентрируют, добавляют 10 мл EtOAc и 10 мл очищенной воды, и слои разделяют. Органический слой перегоняют при пониженном давлении. К полученному твердому веществу добавляют небольшое количество IPA и перемешивают, и получают 0,30 г названного в заголовке соединения в виде белого твердого вещества.
Выход 47,2%.
1H ЯМР (400 МГц, ДМСО-d6) δ 10,07 (с, 1H), 9,75 (ушс, 1H), 7,92 (д, J=1,2 Гц, 1H), 7,80 (дд, J=1,2 и 8,4 Гц, 1H), 7,54~7,50 (м, 2H), 7,36 (т, J=8,0 Гц, 1H), 7,10 (дд, J=1,2 и 8,0 Гц, 1H), 6,90 (д, J=8,0 Гц, 1H), 4,18 (с, 1H), 3,87 (с, 3H).
Пример 17. 4-(4-(4-Гидрокси-3-метоксибензамидо)фенокси)-N-метилпиколинамид
К 10 мл DCM добавляют 0,5 г 4-ацетокси-3-метоксибензойной кислоты, полученной в препаративном примере 2, и смесь перемешивают при 10оС. При температуре 10°C или ниже добавляют 0,74 г PCl5, смесь перемешивают в течение 2 часов, поддерживая температуру 0-10оС, к смеси добавляют 10 мл очищенной воды, и затем слои разделяют. Водный слой отбрасывают, и органический слой сушат над Na2SO4 и фильтруют. Фильтрат концентрируют, добавляют 10 мл DCM, охлаждают смесь до 0оС, и добавляют 0,55 г 4-(4-аминофенокси)-N-метилпиколинамида. Добавляют по каплям 0,5 мл ТЕА, поддерживая температуру 0оС, температуру постепенно поднимают до комнатной температуры, и смесь перемешивают в течение 2 часов. Слой DCM концентрируют, добавляют 10 мл EtOAc и 10 мл очищенной воды, и затем слои разделяют. Водный слой экстрагируют 10 мл EtOAc, водный слой отбрасывают, и органический слой концентрируют. К концентрату добавляют 5 мл МеОН, 5 мл очищенной воды и 3,3 мл ТЕА, и смесь кипятят с обратным холодильником в течение 4 часов. Слой МеОН концентрируют, добавляют 10 мл EtOAc и 10 мл очищенной воды, и слои разделяют. Органический слой перегоняют при пониженном давлении и очищают колоночной флэш-хроматографией, и получают 0,48 г названного в заголовке соединения в виде светло-желтого твердого вещества.
Выход 51,3%.
1H ЯМР (400 МГц, CDCl3) 8,60 (с, 1H), 8,39 (д, J=5,6, 1H), 8,10 (к, J=5,2, 1H), 7,71~7,65 (м, 3H), 7,52 (д, J=2,0, 1H), 7,43 (дд, J=2,0 и 8,4, 1H), 7,04~6,90 (м, 4H), 6,73 (ушс, 1H), 3,78 (с, 3H), 3,01 (д, J=5,2, 3H).
Пример 18. 4-((4-Хлорфенил)(пиридин-2-ил)метокси)пиперидин-1-ил)(4-гидрокси-3-метоксифенил)метанон
К 10 мл ДМФА добавляют 0,5 г ванилиновой кислоты, 0,51 г EDC, 0,44 г HOBt, 1,44 мл ТЕА и 0,99 г 2-[(4-хлорфенил)(4-пиперидинилокси)метил]пиридина, и смесь перемешивают при 60-80°C в течение 4 часов. К реакционной смеси добавляют 10 мл EtOAc и 10 мл очищенной воды, и слои разделяют. Водный слой экстрагируют один раз 10 мл EtOAc, и водный слой отбрасывают. Органический слой промывают три раза 10 мл очищенной воды, сушат над Na2SO4 и фильтруют. Фильтрат перегоняют при пониженном давлении, очищают колоночной флэш-хроматографией, и получают 0,40 г названного в заголовке соединения в виде бледно-желтого твердого вещества.
Выход 31,6%.
1H ЯМР (400 МГц, ДМСО-d6) δ 9,41 (ушс, 1H), 8,47 (д, J=4,0 Гц, 1H), 7,81 (т, J=7,0, 1H), 7,57 (д, J=8,0 Гц, 1H), 7,44~6,94 (м, 6H), 6,84~6,67 (м, 3H), 5,71 (с, 1H), 3,87(с, 3H), 3,74~3,69 (м, 2H), 3,37 (ушс, 2H), 1,85 (ушс, 2H), 1,72 (ушс, 2H).
Пример 19. 4-Гидрокси-N-((3-гидрокси-5-(гидроксиметилметил)-2-метилпиридин-4-ил)метил)-3-метоксибензамид
К 10 мл ДМФА добавляют 0,5 г ванилиновой кислоты, 0,51 г EDC, 0,44 г HOBt, 1,44 мл ТЕА и 0,72 г пиридоксоамин.2HCl, и смесь перемешивают при 60-80°C в течение 4 часов. К реакционной смеси добавляют 10 мл EtOAc и 10 мл очищенной воды, и слои разделяют. Водный слой экстрагируют один раз 10 мл EtOAc, и водный слой отбрасывают. Органический слой промывают три раза 10 мл очищенной воды, сушат над Na2SO4 и фильтруют. Фильтрат перегоняют при пониженном давлении, очищают колоночной флэш-хроматографией, и получают 0,62 г названного в заголовке соединения в виде бледно-желтого твердого вещества.
Выход 65,6%.
1H ЯМР (400 МГц, ДМСО-d6) 10,50 (с, 1H), 9,76 (с, 1H), 9,18 (т, J=5,6, 1H), 7,29 (с, 1H), 7,47 (д, J=2,0, 1H), 7,42 (дд, J=2,0 и 8,4, 1H), 6,83 (д, J=8,4, 1H), 5,25 (т, J=5,2, 1H), 4,67 (д, J=4,8, 2H), 4,48 (д, J=6,0, 2H), 3,82 (с, 3H), 2,35 (с, 3H).
Пример 20. (6,7-Дигидротиено[3,2-c]пиридин-5(4Н)-ил)(2,5-дигидроксифенил)метанон
К 10 мл ДМФА добавляют 0,5 г гентизиновой кислоты, 0,93 г EDC, 0,66 г HOBt, 1,35 мл ТЕА и 0,62 г гидрохлорида 4,5,6,7-тетрагидротиено[3,2-c]пиридина, и смесь перемешивают при 60-80°C в течение 4 часов. К реакционной смеси добавляют 10 мл EtOAc и 10 мл очищенной воды и перемешивают. Полученное твердое вещество отфильтровывают, кипятят с обратным холодильников в 10 мл EtOAc в течение 1 часа и затем отфильтровывают. Филльтрат промывают небольшим количеством EtOAc, и получают 0,38 г названного в заголовке соединения в виде твердого вещества абрикосового цвета.
Выход 42,6%.
1H ЯМР (400 МГц, ДМСО-d6) δ 9,08 (с, 1H), 8,93 (с, 1H), 7,34 (ушс, 1H), 7,35 (д, J=4,4 Гц, 1H), 7,01 (д, J=1,6 Гц, 1H), 6,93~6,90 (м, 2H), 6,83 (д, J=8,0 Гц, 1H), 4,60 (с, 1H), 3,79 (с, 3H), 3,74 (ушс, 2H), 2,86 (т, J=4,8 Гц, 1H).
Пример 21. (4-((4-Хлорфенил)(пиридин-2-ил)метокси)пиперидин-1-ил)(2,5-дигидроксифенил)метанон
К 10 мл ДМФА добавляют 0,5 г гентизиновой кислоты, 0,68 г EDC, 0,48 г HOBt, 1,4 мл ТЕА и 1,08 г 2-[(4-хлорфенил)(4-пиперидинилокси)метил]пиридина, и смесь перемешивают при 60-80°C в течение 4 часов. К реакционной смеси добавляют 10 мл EtOAc и 10 мл очищенной воды, и слои разделяют. Водный слой экстрагируют один раз 10 мл EtOAc, и водный слой отбрасывают. Органический слой промывают три раза 10 мл очищенной воды, сушат над Na2SO4 и фильтруют. Фильтрат перегоняют при пониженном давлении, очищают колоночной флэш-хроматографией, и получают 0,78 г названного в заголовке соединения в виде пены.
Выход 54,9%.
1H ЯМР (400 МГц, ДМСО-d6) 9,05 (с, 1H), 8,89 (с, 1H), 8,47 (дд, J=0,8 и 4,0, 1H), 7,81 (тд, J=1,6 и 8,0, 1H), 7,57 (д, J=7,6, 1H), 7,43~7,25 (м, 5H), 6,67~6,60 (м, 2H), 6,46 (д, J=2,8, 1H), 5,69 (с, 1H), 3,93 (ушс, 1H), 3,64 (p, J=4,4, 1H), 3,14 (ушс, 2H), 1,85 (ушс, 1H), 1,55~1,52 (м, 2H).
Пример 22. N-((4(4-Фторбензил)морфолин-2-ил)метил)-2,5-дигидроксибензамид
К 10 мл ДМФА добавляют 0,5 г гентизиновой кислоты, 0,68 г EDC, 0,48 г HOBt, 1,4 мл ТЕА и 0,73 г 3-аминометил-4-(4-фторбензил)морфолина, и смесь перемешивают при 60-80°C в течение 4 часов. К реакционной смеси добавляют 10 мл EtOAc и 10 мл очищенной воды, и слои разделяют. Водный слой экстрагируют один раз 10 мл EtOAc, и водный слой отбрасывают. Органический слой промывают три раза 10 мл очищенной воды, сушат над Na2SO4 и фильтруют. Фильтрат перегоняют при пониженном давлении, очищают колоночной флэш-хроматографией, и получают 0,80 г названного в заголовке соединения в виде пены.
Выход 68,5%.
1H ЯМР (400 МГц, CDCl3) 7,31~7,27 (м, 2H), 7,05~7,00 (м, 4H), 6,89~6,88 (м, 2H), 3,96~3,67 (м, 4H), 3,49~3,33 (м, 3H), 2,79 (д, J=11,6, 1H), 2,69 (д, J=11,6, 1H), 2,24~1,91 (м, 2H).
Пример 23. (2,5-Дигидроксифенил)(4-(5-фторбензо[d]изоксазол-3-ил)пиперидин-1-ил)метанон
К 10 мл ДМФА добавляют 0,5 г гентизиновой кислоты, 0,68 г EDC, 0,48 г HOBt, 1,4 мл ТЕА и 0,83 г гидрохлорида 6-фтор-3-(4-пиперидинил)-1,2-бензоизоксазола, и смесь перемешивают при 60-80°C в течение 4 часов. К реакционной смеси добавляют 10 мл EtOAc и 10 мл очищенной воды, и слои разделяют. Водный слой экстрагируют один раз 10 мл EtOAc, и водный слой отбрасывают. Органический слой промывают три раза 10 мл очищенной воды, сушат над Na2SO4 и фильтруют. Фильтрат перегоняют при пониженном давлении, очищают колоночной флэш-хроматографией, и получают 0,64 г названного в заголовке соединения в виде белого твердого вещества.
Выход 55,4%.
1H ЯМР (400 МГц, ДМСО-d6) 9,07 (с, 1H), 8,92 (с, 1H), 8,02 (дд, J=5,6 и 8,8, 1H), 7,70 (дд, J=1,6 и 8,8, 1H), 6,70~6,54 (м, 3H), 4,57 (ушс, 1H), 3,61~3,45 (м, 3H), 3,09 (ушс, 2H), 2,06 (ушс, 2H), 1,80 (ушс, 2H).
Пример 24. N-(3,4-Диметоксифенетил)-2,5-дигидроксибензамид
К 10 мл ДМФА добавляют 0,5 г гентизиновой кислоты, 0,68 г EDC, 0,48 г HOBt, 1,4 мл ТЕА и 0,6 мл 3,4-диметоксифенетиламина, и смесь перемешивают при 60-80°C в течение 4 часов. К реакционной смеси добавляют 10 мл EtOAc и 10 мл очищенной воды, и слои разделяют. Водный слой экстрагируют один раз 10 мл EtOAc, и водный слой отбрасывают. Органический слой промывают три раза 10 мл очищенной воды, сушат над Na2SO4 и фильтруют. Фильтрат перегоняют при пониженном давлении, очищают колоночной флэш-хроматографией, и получают 0,73 г названного в заголовке соединения в виде белого твердого вещества.
Выход 71,0%.
1H ЯМР (400 МГц, ДМСО-d6) 11,63 (ушс, 1H), 9,00 (ушс, 1H), 8,72 (т, J=5,2, 1H), 7,22 (д, J=2,8, 1H), 6,88~6,71 (м, 5H), 3,72 (с, 3H), 3,71 (с, 3H), 3,50 (к, J=6,8, 2H), 2,78 (т, J=7,6, 2H).
Пример 25. 2,5-Дигидрокси-N-(2-(тиофен-2-ил)этил)бензамид
К 10 мл ДМФА добавляют 0,5 г гентизиновой кислоты, 0,68 г EDC, 0,48 г HOBt, 1,4 мл ТЕА и 0,4 мл тиофен-2-этиламина, и смесь перемешивают при 60-80°C в течение 4 часов. К реакционной смеси добавляют 10 мл EtOAc и 10 мл очищенной воды, и слои разделяют. Водный слой экстрагируют один раз 10 мл EtOAc, и водный слой отбрасывают. Органический слой промывают три раза 10 мл очищенной воды, сушат над Na2SO4 и фильтруют. Фильтрат перегоняют при пониженном давлении, очищают колоночной флэш-хроматографией, и получают 0,56 г названного в заголовке соединения в виде белого твердого вещества.
Выход 65,6%.
1H ЯМР (400 МГц, ДМСО-d6) 11,62 (ушс, 1H), 9,03 (ушс, 1H), 8,83 (т, J=5,2, 1H), 7,34 (дд, J=1,2 и 4,8, 1H), 7,23 (д, J=3,2, 1H), 6,97~6,85 (м, 3H), 6,73 (д, J=8,8, 1H), 3,53 (к, J=6,8, 2H), 3,08 (т, J=6,8, 2H).
Пример 26. 2,5-Дигидрокси-N-(2-оксотетрагидротиофен-3-ил)бензамид
К 10 мл ДМФА добавляют 0,5 г гентизиновой кислоты, 0,68 г EDC, 0,48 г HOBt, 1,4 мл ТЕА и 0,55 г гидрохлорида гомоцистеинтиолактона, и смесь перемешивают при 60-80°C в течение 4 часов. К реакционной смеси добавляют 10 мл EtOAc и 10 мл очищенной воды, и слои разделяют. Водный слой экстрагируют один раз 10 мл EtOAc, и водный слой отбрасывают. Органический слой промывают три раза 10 мл очищенной воды, сушат над Na2SO4 и фильтруют. Фильтрат перегоняют при пониженном давлении, очищают колоночной флэш-хроматографией, и получают 0,21 г названного в заголовке соединения в виде белого твердого вещества.
Выход 25,6%.
1H ЯМР (400 МГц, ДМСО-d6) 11,33 (ушс, 1H), 9,06 (ушс, 1H), 8,92 (д, J=8,0, 1H), 7,24 (д, J=3,2, 1H), 6,89 (дд, J=2,8 и 8,8, 1H), 6,77 (д, J=8,8, 1H), 4,84 (секст, J=5,6, 1H), 3,50~3,25 (м, 2H), 2,56~2,26 (м, 2H).
[Таблица 1]
Экспериментальные примеры
Экспериментальный пример 1. Измерение ингибирующего действия на агрегацию тромбоцитов, вызванную напряжением сдвига
1-1. Измерение ингибирующего действия на агрегацию тромбоцитов с использованием человеческой обогащенной тромбоцитами плазмы (PRP)
Кровь берут из вен здоровых мужчин-доброваольцев, которые не принимали какое-либо лекарственное средство в течение долее 2 недель. Все родственные исследования проводят с утверждением Seoul National University Institutional Review Board (IRB No. 1305/001-016). На протяжении всего исследования избегают применения стеклянных контейнеров или стеклянных пипеток, и выполняют эксперименты при комнатной температуре. Для того, чтобы отделить обогащенную тромбоцитами плазму (PRP), кровь собирают с 3,2% цитрата натрия как антикоагулянта. Цельную кровь центрифугируют при 150 g в течение 15 минут, и получают супернатант (PRP), и центрифугируют остаток при 2000 g в течение 20 минут, и получают плазму, обедненную тромбоцитами (РРР). Число тромбоцитов в полученной таким образом PRP подсчитывают с помощью оптического микроскопа с использованием гемоцитометра. PRP разбавляют РРР так, чтобы получить 3×108 тромбоцитов на 1 мл, и затем используют в экспериментах. PRP помещают в плоскоконический вискозиметр (RotoVisco 1, Thermo Fischer Scientific, USA), и прикладывают напряжение сдвига к PRP при 37°C в течение 3 минут при скорости сдвига 10800 с-1. Для того, чтобы оценить вещества-кандидаты, перед индукцией агрегации тромбоцитов 598,8 мкл PRP обрабатывают 1,2 мкл 25 мкМ вещества-кандидата и инкубируют при 37°C в течение 3 минут с использованием термомиксера. После приложения напряжения сдвига 20 мкл PRP фиксируют в 280 мкл буфера для суспензии, содержащего 0,5% глутарового альдегида (134 мM NaCl, 2,9 мM KCl, 1,0 мM MgCl2·6H2O, 10,0 мM HEPES, 5,0 мM декстрозы, 12,0 мM NaHCO3, 0,34 мM Na2HPO4, 0,3% BSA, pH 7,4). Затем подсчитывают число отдельных тромбоцитов в суспензии с использованием гемоцитометра. Степень ингибирования веществом-кандидатом вычисляют согласно приведенной далее формуле (1). Степень ингибирования определяют методом, описанным ниже. В качестве контроля служит группа без приложения напряжения сдвига, и в качестве положительного контроля служит группы только с приложением напряжения сдвига.
Формула 1
Степень ингибирования (%)=[(1-A/B)×100]/[(1-A/C)×100]
А: число отдельных тромбоцитов в образце с приложением напряжения сдвига после обработки веществом-кандидатом;
В: число отдельных тромбоцитов в контрольной группе без приложения напряжения сдвига;
С: число отдельных тромбоцитов в положительной контрольной группе только с приложением напряжения сдвига.
[Таблица 2]
Ингибирующее действие веществ-кандидатов на агрегацию тромбоцитов в PRP
Как видно из приведенной выше таблицы 2, подтверждается, что действие ингибирования агрегации тромбоцитов, вызванной напряжением сдвига, составляет 30% или больше для соединений примера 14 и примера 20 (25 мкМ каждого). Кроме того, подтверждается, что действие ингибирования составляет 20-30% для соединений примера 1, примера 12, примера 13, примера 15 и примера 23 (25 мкМ каждого).
1-2. Измерение ингибирующего действия на агрегацию тромбоцитов с использованием человеческих отмытых тромбоцитов (WP)
Для того, чтобы выделить человеческие отмытые тромбоциты (WP), берут кровь из вен у здоровых мужчин с использованием в качестве антикоагулянта цитрат-декстрозы (ACD). Во время отбора крови активацию тромбоцитов ингибируют обработкой 1 мкМ простагландина E1 (PGE1). Собранную кровь центрифугируют при 150 g в течение 15 минут, и получают PRP из супернатанта, который для получения тромбоцитов центрифугируют при 500 g в течение 10 минут. Тромбоциты суспендируют и промывают в буфере для промывки (134 мМ NaCl, 2,9 мМ KCl, 1,0 мМ MgCl2.6H2O, 10,0 мМ HEPES, 5,0 мМ декстрозы, 12,0 мМ NaHCO3, 0,34 мМ Na2HPO4, 10% ACD, 0,3% бычьего сывороточного альбумина, 1 мкМ PGE1, pH 7,4), и затем повторно центрифугируют при 400 g в течение 10 минут. Тромбоциты, полученные таким образом, суспендируют в буфере для суспензии. Число тромбоцитов в WP подсчитывают с использованием гемоцитометра. Тромбоциты разбавляют буфером для суспензии так, чтобы получить 3×108 тромбоцитов на 1 мл, добавляют CaCl2 до получения конечной концентрации 2 мМ и затем используют в экспериментах. К WP добавляют vWF до получения конечной концентрации 10 мкг/мл. WP помещают в плоскоконический вискозиметр, и прикладывают напряжение сдвига к WP при 37°C в течение 3 минут при скорости сдвига 10800 с-1. Для того, чтобы оценить эффективность веществ-кандидатов, перед индукцией агрегации тромбоцитов WP обрабатывают 10, 25 и 50 мкМ веществ-кандидатов и инкубируют при 37°C в течение 3 минут с использованием термомиксера. После приложения напряжения сдвига 20 мкл WP фиксируют в 280 мкл буфера для суспензии, содержащего 0,5% глутарового альдегида. Затем подсчитывают число отдельных тромбоцитов в суспензии с использованием гемоцитометра. Степень ингибирования веществом-кандидатом вычисляют согласно формуле (1). Степень ингибирования определяют методом, описанным ниже. В качестве контроля служит группа без приложения напряжения сдвига, и в качестве положительного контроля служит группа только с приложением напряжения сдвига.
[Таблица 3]
Ингибирующее действие веществ-кандидатов на агрегацию тромбоцитов в WP
Как видно из таблицы 3, приведенной выше, подтверждается, что соединение примера 1, примера 12, примера 13, примера 14, примера 15 и примера 20 ингибирует вызванную напряжением сдвига агрегацию тромбоцитов в WP в зависимости от дозы.
Экспериментальный пример 2. Оценка эффективности лекарственного средства на модели артериального тромбоза
Не получавшим корма в течение ночи самцам крысы Sprague-Dawley (250-300 г) вводят перорально среду (ДМСО:твин 80:DW=1:2:17) или вещество-кандидат (25 мг/кг). Через 30 минут после введения крысам дают наркоз интраперитонеальной инъекцией уретана (1,25 г/кг). Животных под наркозом фиксируют на операционном столе, и во время всей операционной процедуры температуру тела поддерживают с использованием грелки. Делают надрез вокруг шеи животного, осторожно обнажая сонную артерию, и осторожно удаляют жировые ткани, присоединенные к кровеносным сосудам. В открытой сонной артерии фиксируют доплеровский зонд (диаметр 0,5 мм, MA0.5PSB, Transonic System Inc., USA), и с ним соединяют доплеровский измеритель скорости потока (TS420, Transonic System Inc., USA). Через 60 минут после перорального введения кусок фильтровальной бумаги Whatman № 1 (2 мм × 1 мм), смоченный 50% раствором FeCl3, прикрепляют к кровеносным сосудам ниже которых фиксирован зонд. Фильтровальную бумагу удаляют через 10 минут, и измеряют изменение кровотока из-за образования тромба в сонной артерии в течение 60 минут с момента удаления. Время окклюзии определяют как время, когда кровоток впервые останавливался долее, чем на одну минуту.
[Таблица 4]
Ингибирующее действие веществ-кандидатов на тромбогенез
Как видно из таблицы 4, приведенной выше, подтверждается, что веществами-кандидатами, показывающими действие на модели вызванного (FeCl3) тромбогенеза в 2,5 раза большее по сравнению с контролем, являются соединения примера 1 и примера 20.
Экспериментальный пример 3. Измерение ингибирующего действия веществ-кандидатов на тромбоз на модели напряжения сдвига в сонной артерии
Самцам крысы Sprague-Dawley (250-300 г) вводят перорально среду (0,5% метилцеллюлоза), клопидогрель (8 мг/кг), аспирин (50 мг/кг) или вещество-кандидат. Через 2 часа после введения крысам дают наркоз коктейлем кетамин/ромпун (кетамин/ксилазин) (1,25 г/кг). За исключением здоровой контрольной группы, у подопытных животных надрезают кожу на шее справа для обнажения общей сонной артерии. Хирургическую трубку длиной 1 мм и внутренним диаметром 0,58 мм вставляют в обнаженную сонную артерию и привязывают одной нитью. Место вскрытия и место операции обрабатывают антиадгезивом и затем сшивают для восстановления животных. После операции среду, клопидогрель, аспирин или вещество-кандидат вводят крысам перорально дважды в день в течение 3 дней. На четвертый день через 2 часа после последнего введения крысам вводят интраперитонеально уретан (100 мг/300 мкл/100 г) для индукции наркоза, и место операции открывают для отделения в целом 1 см кровеносного сосуда на 5 мм выше и на 5 мм ниже хирургической трубки. Отделенный кровеносный сосуд перфузируют 0,2 мл 0,9% физиологического раствора при 0,3 мл/мин для удаления оставшейся крови и затем сохраняют в 1 мл буфера для лизиса белка (2 г NaOH, 0,1 г Na2CO3 в 500 мл D.W.). После отбора кровеносный сосуд с тромбом кипятят два раза в воде вместе с буфером для лизиса белка. К 10 мкл нагретого тромба добавляют 200 мкл реакционного раствора (10 мл раствора бицинхониновой кислоты+200 мкл 4% водного раствора сульфата меди), проводят реакцию в смеси при 37°C в течение 30 минут и проводят количественное определение на спектрофотометре для ELISA (562 нм).
[Таблица 5]
Ингибирующее действие веществ-кандидатов на тромбоз на модели напряжения сдвига в сонной артерии
Как видно из приведенной выше таблицы 5, подтверждается, что у животных, которым вводили перорально соединения примера 1, примера 12, примера 13, примера 14, примера 15, примера 20 и примера 23, вызванный напряжением сдвига тромбогенез в сонной артерии существенно, в заметной степени ингибируется по сравнению с контрольной группой. Это предполагает, что уровень ингибирования веществ-кандидатов против тромбогенеза является хорошим, так как сравним с клопидогрелем, когда проводят сравнение с группой, которой вводили клопидогрель, который обычно является наиболее часто используемым антитромбоцитарным средством.
Формула 2
Степень ингибирования (%)=100 - [(C-A)×100/(B-A)]
А: количество тромба у здорового контроля;
В: количество тромба у отрицательного контроля;
С: количество тромба при обработке веществом-кандидатом.
Экспериментальный пример 4. Измерение ингибирующего действия веществ-кандидатов на агрегацию тромбоцитов, вызванную химическим агонистом (физиологическим агонистом)
Для того, чтобы исследовать, имеет ли вещество-кандидат селективность ингибирования в отношении агрегации тромбоцитов, вызванной напряжением сдвига, который является физическим стимулом, исследуют ингибирующее действие вещества-кандидата в эксперименте, который, для исследования ингибирующего действия вещества-кандидата, проводят, активируя тромбоциты физиологическими агонистами, т.е., тромбином, коллагеном и АТФ.
Человеческую PRP (598,8 мкл) обрабатывают 1,2 мкл раствора вещества-кандидата различной концентрации (25, 100, 250 мкМ), и проводят реакцию при 37°C в течение 3 минут с использованием термомиксера. Затем PRP (495 мкл) помещают в кювету агрегометра и предварительно инкубируют в течение 1 минуты, и затем обрабатывают реагентом, вызывающим агрегацию тромбоцитов, тромбином (0,6-0,8 Е/мл), коллагеном (2-5 мкг/мл) или АДФ (аденозиндифосфатом, 15-20 мкМ) в минимальной концентрации, вызывающей максимальную агрегацию. Степень агрегации тромбоцитов измеряют по изменению мутности, используя люмиагрегометр (Chrono-Log Co., USA). Мутность PRP принимают за 0%, и мутность PPP принимают за 100%. Во время измерения реакционную смесь непрерывно перемешивают при 1000 об/мин магнитной мешалкой со стержнем, покрытым силиконом. Реакцию наблюдают в течение 5 минут в случае тромбина или АДФ и в течение 6 минут в случае коллагена.
[Таблица 6]
Результаты измерения степени агрегации тромбином
1) DTI: прямой ингибитор тромбина
Как видно из приведенной выше таблицы 6, подтверждается, что при сравнении с группой, обработанной только тромбином, вещества-кандидаты не показывают ингибирующего действия на агрегацию тромбоцитов до 250 мкМ. Напротив, подтверждается, что агрегация тромбоцитов ингибируется при обработке положительным контролем DTI.
[Таблица 7]
Результаты измерения степени агрегации коллагеном
Как видно из приведенной выше таблицы 7, подтверждается, что при сравнении с группой, обработанной только коллагеном, вещества-кандидаты не показывают ингибирующего действия на агрегацию тромбоцитов до 250 мкМ.
[Таблица 8]
Результаты измерения степени агрегации АДФ
Как видно из приведенной выше таблицы 8, подтверждается, что при сравнении с группой, обработанной только АДФ, вещества-кандидаты не показывают ингибирующего действия на агрегацию тромбоцитов до 250 мкМ. Напротив, подтверждается, что агрегация тромбоцитов ингибируется при обработке положительным контролем клопидогрелем.
Экспериментальный пример 5. Оценка цитотоксичности веществ-кандидатов
5-1. Оценка цитотоксичности веществ-кандидатов с использованием клеточной линии EA.hy926
Эксперименты по определению цитотоксичности веществ-кандидатов проводят в клетках сосудистого эндотелия человека (EA.hy926). EA.hy926 высевают в DMEM (минимальная поддерживающая среда Дульбекко) с добавлением 10% сыворотки плода коровы (FBS) при 5% CO2/37°C. Клетки культивируют в 96-луночном планшете при 1×104 клетки/лунка в течение 48 часов, дважды промывают DMEM и затем культивируют в течение 24 часов. Вещества-кандидаты готовят в конечных концентрациях 25 и 100 мкМ, вносят в лунки по 200 мкл на лунку и культивируют в течение 24 часов. Используют анализ МТТ для измерения поглощения при 570 нм после окрашивания фиолетовым красителем.
[Таблица 9]
Результаты оценки цитотоксичности веществ-кандидатов в клеточной линии EA.hy926
Как видно из приведенной выше таблицы 9, подтверждается, что в клеточной линии EA.hy926 вещества-кандидаты не показывают токсичность до 100 мкМ.
5-2. Оценка цитотоксичности веществ-кандидатов с использованием человеческих тромбоцитов
Утечку лактатдегидрогеназы (LDH) из тромбоцитов измеряют методом спектрофотометрии. К 598,8 мкл PRP добавляют 1,2 мкл испытываемого вещества, и проводят реакцию в смеси при 37°С в течение 3 минут с использованием термомиксера. По окончании реакции 100 мкл образца центрифугируют при 12000 g в течение 2 минут, берут 80 мкл супернатанта и до оценки хранят в холодильнике. Оценку выполняют в пределах 24 часов. Контрольную группу (положительный контроль) обрабатывают 50 мкл дигитонина в течение 1 часа. К 1 мл предварительно нагретого раствора трис-ЭДТК NaDH (56 мМ трис(гидроксиметил)аминометана, 5,6 мМ ЭДТК, 0,17 мМ β-NaDH, рН 7,4), и проводят реакцию в смеси в течение 5 минут при 37°С. Затем к реакционной смеси добавляют 100 мкл 14 мМ раствора пирувата, предварительно нагретого до 37°С, и сразу же измеряют поглощение при длине волны 339 нм в течение 1 минуты с использованием спектрофотометра (спектрофотометр UV-Vis, UV-2201, Shidamadzu, Япония). Скорость снижения поглощения означает скорость окисления NADH, указывая на активность LDH, высвобожденную из тромбоцитов. Общую активность LDH измеряют, вызывая лизис тромбоцитов 0,3% тритоном X-100. Измеряют базальный уровень LDH (контроль) в плазме. Активность каждого образца измеряют в виде процента от общей активности LDH.
[Таблица 10]
Результаты оценки токсичности веществ-кандидатов в тромбоцитах
Как видно из приведенной выше таблицы 10, подтверждается, что вещества-кандидаты не показывают токсичность в тромбоцитах до 250 мкМ.
5-3. Оценка цитотоксичности веществ-кандидатов с использованием клеток печени человека
Эксперименты по оценке цитотоксичности проводят в клетках печени человека (НерG2). Клетки НерG2, которые являются клетками карциномы печени человека, культивируют в DMEM (минимальная поддерживающая среда Дульбекко) с добавлением 10% FBS (сыворотка плода коровы) и 1% пенициллина/стрептомицина при 37°C и 5% CO2. Клетки культивируют в 48-луночном планшете при 4×104 клетки/лунка в течение 24 часов и затем используют в экспериментах. Клетки НерG2 обрабатывают веществами-кандидатами (250 мкМ) в течение 18 часов, затем среду удаляют, добавляют WST-1 и затем затеняют в течение 3 часов для реакции. Через 3 часа берут супернатант, и измеряют поглощение при 450 нм. Жизнеспособность клеток вычисляют путем сравнения с поглощением, измеренным после добавления WST-1 к клеткам НерG2, необработанным веществами-кандидатами. В качестве контроля используют ацетаминофен (40 мМ).
[Таблица 11]
Результаты оценки цитотоксичности 250 мкМ веществ-кандидатов в клеточной линии НерG2
Как видно из приведенной выше таблицы 11, подтверждается, что вещества-кандидаты не показывают гепатотоксичность в клеточной линии НерG2 до 250 мкМ.
Экспериментальный пример 6. Измерение времени коагуляции плазмы
Для того, чтобы отделить плазму, собирают кровь с 3,2% цитрата натрия как антикоагулянта. Цельную кровь центрифугируют при 2000 g в течение 20 минут, и получают плазму. После обработки плазмы испытываемыми веществами в течение 3 минут измеряют время коагуляции плазмы. Для времени коагуляции плазмы измеряют активированное парциальное тромбопластиновое время (аРТТ) и протромбиновое время (РТ) с использованием фиброметра BBL® (Becton Dickinson, Cockeysville, MD). Для измерения aPTT плазму обрабатывают реагентами PTT в чашке фиброметра, и проводят реакцию при 37°C в течение 3 мин. По окончании реакции добавляют CaCl2 и сразу же измеряют время коагуляции. Для измерения РТ к нагретой плазме добавляют реагент PT и сразу же измеряют время коагуляции. В качестве контроля используют DTI, известный как удлиняющий время коагуляции плазмы.
[Таблица 12]
Результаты измерения времени коагуляции плазмы - аРТТ
Как видно из приведенной выше таблицы 12, подтверждается, что вещества-кандидаты не изменяют существенно точки аРТТ по сравнению с контролем, что показывает, что вещества-кандидаты не влияют на аРТТ.
[Таблица 13]
Результаты измерения времени коагуляции в плазме - РТ
Как видно из приведенной выше таблицы 13, подтверждается, что вещества-кандидаты не изменяют существенно точки РТ по сравнению с контролем, что показывает, что вещества-кандидаты не влияют на РТ.
Экспериментальный пример 7. Оценка побочного действия кровотечения (времени кровотечения) на подопытных животных
Самцам крыс Sprague-Dawley (200-300 г) не дают корм в течение ночи, и затем им вводят перорально вещества-кандидаты в каждой концентрации. Через 1 час крысам дают наркоз инъекцией уретана (1,25 г/кг). Отрезают 3-мм часть кончика хвоста и осторожно вытирают каждые 30 секунд. Время кровотечения измеряют по часам до тех пор, пока кровь больше не выступает, и когда кровотечение длится долее 30 минут, время кровоточения регистрируют как 30 минут.
[Таблица 14]
Как видно из приведенной выше таблицы 14, обнаружено, что кровотечение, которое ожидается как побочное действие веществ-кандидатов, слабее, чем в случае клопидрогеля и аспирина как контрольных веществ. Подтверждается, что все соединения примеров не показывают побочного действия кровотечения.
Экспериментальный пример 8. Оценка побочного действия кровотечения путем повторного введения
Вещества-кандидаты (50 мг/кг), клопидрогель (15 мг/кг) или аспирин (100 мг/кг) вводят, каждое, перорально мышам ICR (самцы, 35-40 г) один раз в день в течение 7 дней. Через один час после последнего введения мышам дают наркоз через дыхание, и мышам отрезают 4-мм часть кончика хвоста. Затем кончик хвоста мыши погружают в прозрачную 15-мл пробирку, содержащую предварительно подогретый до 37°С физиологический раствор. Измеряют время, когда кровь больше не выделяется, и кровотечение прекращается.
[Таблица 15]
Как видно из приведенной выше таблицы 15, время, принятое за остановку кровотечения при клинической дозе, в случае клопидрогеля превышает 35 минут, и таким образом, время замедляется примерно в 22 раза по сравнению с контрольной группой. В случае аспирина время, принятое за остановку кровотечения, превышает 22 минуты, и таким образом, время замедляется примерно в 7,6 раз. Однако, когда соединения примера 13 и примера 14 вводят повторно один раз в день в течение 7 дней, время, принятое за остановку кровотечения, почти такое же, как в случае контроля, и время кровотечения составляет примерно 1 минуту и 30 секунд. Следовательно, для веществ-кандидатов побочное действие кровотечение почти не наблюдают, и подтверждается, что вещества-кандидаты являются новым антитромбоцитарным средством, которое преодолевает проблему побочного действия кровотечения существующих антитромбоцитарных средств.
Экспериментальный пример 9. Исследование токсичности при повторении доз в течение 2 недель
После перорального введения среды (0,5% метилцеллюлоза) или веществ-кандидатов в малой дозе, средней дозе и высокой дозе (100, 300, 1000 мг/кг) мышам ICR (самки, самцы, 18-26 г) один раз в день в течение 2 недель величины NOAEL веществ-кандидатов вычисляют, наблюдая и регистрируя смертность, изменение массы тела, клинические наблюдения, потребление корма и питьевой воды, общие результаты вскрытия, гистопатологическую оценку анормального органа и массу органов.
[Таблица 16]
Как видно из приведенной выше таблицы 16, когда соединения примера 13 или примера 14 вводят перорально в дозах 100, 300 и 1000 мг/кг один раз в день в течение 2 недель, не наблюдают погибших животных, и не наблюдают анормальных результатов по изменению массы тела, клиническим наблюдениям, потреблению корма и питьевой воды, общим результатам вскрытия и массе органов. Следовательно, подтверждается, что величина NOAEL веществ-кандидатов может составлять 1000 мг/кг или больше.
Экспериментальный пример 10. Статистика
Значимость результатов испытаний оценивают как значимые, когда р равен 0,05 или меньше, через t-критерий Стъюдента и критерий одностороннего ANOVA.
Реферат
Изобретение относится к соединению, представленному приведенными далее формулами (I) или (II), или его фармацевтически приемлемой соли или стереоизомеру, которые обладают свойством ингибирования агрегации тромбоцитов. В формулах (I) и (II) R1представляет собой гидрокси или C1-C10-алкокси, X представляет собой N или O, R2представляет собой -(CH2)p-(5-12-членный гетероцикл)-(CH2)p-C6-C12-арил, 5-12-членный гетероцикл, -(CH2)p-NHC(=O)-C6-C12-арил, -CHR4R5, 5-12-членный гетероарил, C6-C12-арил, -C6-C12-арил-O-(5-12-членный гетероарил) или -(CH2)p-(5-12-членный гетероарил), причем p равен целому числу от 1 до 10, R4и R5представляют собой, каждый независимо, C1-C6-алкоксикарбонил или -CH2-(5-12-членный гетероарил), указанные гетероцикл и гетероарил могут содержать от 1 до 3 гетероатомов, выбранных из N, O и S, указанный арил замещен 1-4 заместителями, выбранными из группы, состоящей из нитро, нитрила и гидрокси-C1-C6-алкила, указанный гетероцикл замещен 1-4 заместителями, выбранными из группы, состоящей из галогена и оксо, указанный гетероарил замещен 1-4 заместителями, выбранными из группы, состоящей из оксо, аминокарбонила, C1-C6-алкила, C1-C6-алкиламинокарбонила, гидрокси и гидрокси-C1-C6-алкила, при условии, что когда R2представляет собой -(CH2)p-(5-12-членный гетероарил), то гетероарил не является пиразином, индолом или пиридином, и когда R2представляет собой 5-12-членный гетероарил, то гетероарил не является бензотиазолом, R3представляет собой водород, когда X представляет собой O, R3не существует, когда X представляет собой N, X, взятый вместе с R2и R3, может образовывать 6-членный гетероцикл, содержащий 1-3 гетероатома, выбранных из N, причем указанный гетероцикл может быть замещен C6-C12-арилом или -O-CHR6R7, причем R6и R7представляют собой, каждый независимо, C6-C12-арил или 6-10-членный гетероарил, содержащий 1-3 гетероатома, выбранных из O, N и S, которые оба являются незамещенными или замещены галогеном. Изобретение относится также к конкретным соединениям и фармацевтической композиции для предупреждения или лечения тромботических заболеваний, содержащей указанные соединения. 3 н. и 1 з.п. ф-лы, 16 табл., 35 пр.
Формула


Документы, цитированные в отчёте о поиске
Производное циклического амина, содержащее гетероарильный цикл
















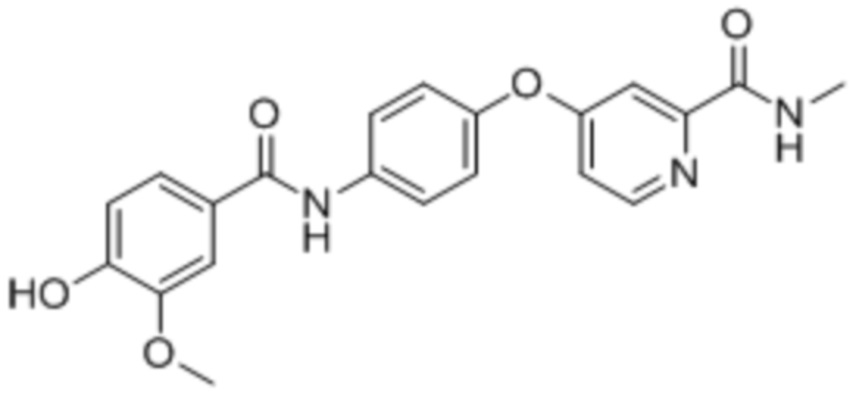



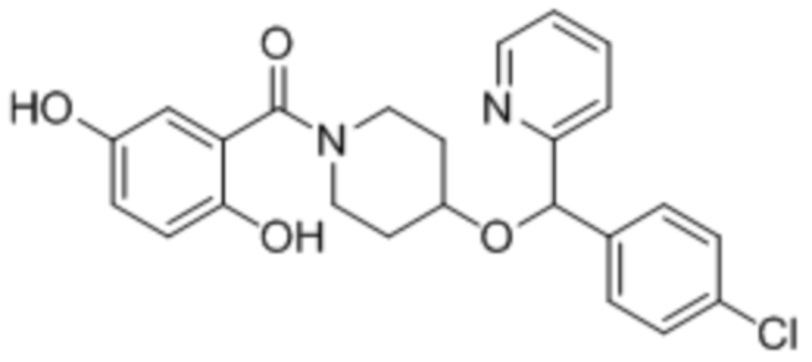






Комментарии