Производное циклического амина, содержащее гетероарильный цикл - RU2346935C2
Код документа: RU2346935C2
Описание
Настоящее изобретение относится к соединениям, проявляющим активность в ингибировании агрегации тромбоцитов, их фармакологически приемлемым солям и их пролекарствам.
С недавних пор число пациентов с сердечно-сосудистыми заболеваниями, связанными со старением населения и с изменениями привычек в питании и стиля жизни, заметно возросло. Поскольку болезни, связанные с тромбозом, такие как церебральный инфаркт, инфаркт миокарда и нарушения периферического кровообращения, приводят не только к высокой смертности, но и к неблагоприятному прогнозу и ограничению активности повседневной жизни, пациенты с указанными нарушениями испытывают чрезмерный груз личной и общественной недееспособности. Хорошо известно, что непосредственными причинами указанных заболеваний являются ангиостеноз, вызываемый тромбом, образующимся в результате активации тромбоцитов (прилипание к поврежденным участкам кровеносных сосудов, выделение физиологически активных веществ, образование сгустков и т.д.), и ишемия, связанная с ангиостенозом. Таким образом, противотромботические средства, которые ингибируют активность тромбоцитов, играют важную роль в предотвращении возникновения и рецидива указанных заболеваний, а также в их лечении. Кроме того, считается, что указанные средства станут все более и более важными в будущем, так как количество пациентов с заболеваниями, связанными с тромбозом, увеличивается.
Известны некоторые биологические вещества, связанные с агрегацией тромбоцитов, такие как аденозин 5'-дифосфат (ADP; АДФ), тромбоксан А2 (ТХА2), коллаген, серотонин (5-НТ) и тому подобное. Кроме того, известны P2Y1 и P2Y12 рецепторы как АДФ рецепторы. Некоторые существующие противотромботические средства оказывают антагонистическое действие на указанные рецепторы. Примерами таких противотромботических средств являются тиклопидин и клопидогрел, которые имеют структуру тиенопиридина.
Кроме того, известны соединения, описанные в WO98/08811 или WO99/43648, как соединения, имеющие нетиенопиридиновую структуру и обладающие антагонистическим действием на АДФ рецепторы. Однако существуют некоторые проблемы, связанные с тем, что указанные соединения являются химически неустойчивыми или низкоактивными.
Чтобы создать новые противотромботические средства, авторы настоящего изобретения тщательно исследовали химически устойчивые соединения, имеющие нетиенопиридиновую структуру и обладающие активностью в отношении ингибирования агрегации тромбоцитов, и установили, что соединения, имеющие общую формулу (I) по настоящему изобретению, их фармакологически приемлемые соли и их пролекарства, обладают требуемыми характеристиками и тем самым являются объектом настоящего изобретения.
В соответствии с настоящим изобретением предлагаются фармацевтические композиции, содержащие соединения, имеющие общую формулу (I), их фармакологически приемлемые соли и их пролекарства в качестве активных компонентов (в частности, фармацевтические композиции для профилактических или лечебных средств против заболеваний, связанных с образованием тромбов или эмболов), применение соединений, имеющих общую формулу (I), их фармакологически приемлемых солей и их пролекарств для изготовления фармацевтических композиций (в частности, фармацевтических композиций для профилактических или лечебных средств против заболеваний, связанных с образованием тромбов или эмболов) и способы профилактики или лечения заболеваний (в частности, заболеваний, связанных с образованием тромбов или эмболов) введением соединений, имеющих общую формулу (I), их фармакологически приемлемых солей и их пролекарств теплокровным животным (в частности, людям) с фармакологически эффективными дозами.
Настоящее изобретение относится к соединению, имеющему общую формулу (I), представленную ниже:

[где R1 представляет собой атом водорода, С1-С6 алкильную группу, которая может быть замещенной (указанная замещающая группа представляет собой атом галогена или С1-С6 алкоксигруппу), С3-С6 циклоалкильную группу, которая может быть замещенной (указанная замещающая группа представляет собой атом галогена или С1-С6 алкоксигруппу), С1-С6 алкоксигруппу, которая может быть замещенной (указанная замещающая группа представляет собой атом галогена или С1-С6 алкоксигруппу), или С6-С10 арильную группу, которая может быть замещенной (указанная замещающая группа представляет собой атом галогена, С1-С6 алкильную группу, С1-С6 алкоксигруппу, цианогруппу или нитрогруппу);
R2 представляет собой атом водорода, С1-С7 алканоильную группу, С7-С11 арилкарбонильную группу, группу формулы R4-(СН2)l-СО- (где R4 представляет собой С1-С6 алкоксигруппу, аминогруппу, С1-С6 алкиламиногруппу, ди-(С1-С6 алкил)аминогруппу или карбоксильную группу и l представляет собой целое число от 0 до 4), С6-С10 арилсульфонильную группу, С7-С16 алкиларилсульфонильную, С1-С6 алкилсульфанильную группу или С1-С6 алкилсульфанильную группу, замещенную 1 или 2 заместителями, выбранными из группы, состоящей из «аминогруппы, карбоксильной группы, С1-С6 ациламиногруппы и С2-С7 алкоксикарбонильной группы»;
R3 представляет собой С6-С10 арильную группу, С6-С10 арильную группу, замещенную 1-5 заместителями, выбранными из <группы α заместителей>, гетероарильную группу или гетероарильную группу, замещенную 1-5 заместителями, выбранными из <группы α заместителей>;
Х1, Х2, Х3, Х4 и Х5 независимо представляют собой атом водорода, атом галогена, аминогруппу, карбоксильную группу, карбамоильную группу, цианогруппу, нитрогруппу, С1-С6 алкильную группу, галоген-С1-С6 алкильную группу, С1-С6 алкоксигруппу или галоген-С1-С6 алкоксигруппу;
n представляет собой целое число от 0 до 2; и
<группу α заместителей> составляют атом галогена, аминогруппа, карбоксильная группа, карбамоильная группа, цианогруппа, нитрогруппа, С1-С6 алкильная группа, галоген-С1-С6 алкильная группа, С1-С6 алкильная группа, замещенная гетероарильной группой(ами), С1-С6 алкоксигруппа, галоген-С1-С6 алкоксигруппа, гидрокси-С1-С6 алкильная группа, С2-С12 алкоксиалкильная группа, С2-С7 алканоильная группа, С4-С7 циклоалкилкарбонильная группа, С1-С6 алкиламиногруппа, ди-(С1-С6 алкил)аминогруппа, С2-С7 алкилкарбамоильная группа, ди-(С1-С6 алкил)карбамоильная группа, группа формулы R5-СО-CHR6-(СН2)m- (где R5 представляет собой гидроксильную группу, аминогруппу, С1-С6 алкильную группу, С1-С6 алкиламиногруппу, ди-(С1-С6 алкил)аминогруппу, гидроксиаминогруппу, С1-С6 алкоксиаминогруппу или С1-С6 алкоксигруппу; R6 представляет собой атом водорода, С1-С6 алкильную группу, С2-С7 карбоксиалкильную группу или С3-С13 алкоксикарбонилалкильную группу и m представляет собой целое число от 0 до 5) и сульфамоил-С1-С6 алкильная группа], его фармакологически приемлемым солям и его пролекарствам.
Соединение, имеющее вышеуказанную общую формулу (I), его фармакологически приемлемые соли и его пролекарства предпочтительно представляют собой:
(1) соединение, где R1 представляет собой C1-C6 алкильную группу, галоген-С1-C6 алкильную группу, C3-C6 циклоалкильную группу, галоген-С3-C6 циклоалкильную группу или C1-C6 алкоксигруппу, его фармакологически приемлемые соли или его пролекарства;
(2) соединение, где R1 представляет собой C3-C6 циклоалкильную группу, галоген-С3-C6 циклоалкильную группу или C1-C6 алкоксигруппу, его фармакологически приемлемые соли или его пролекарства;
(3) соединение, где R1 представляет собой C3-C6 циклоалкильную группу или C1-C6 алкоксигруппу, его фармакологически приемлемые соли или его пролекарства;
(4) соединение, где R1 представляет собой циклопропильную группу или метоксигруппу, его фармакологически приемлемые соли или его пролекарства;
(5) соединение, где R1 представляет собой циклопропильную группу, его фармакологически приемлемые соли или его пролекарства;
(6) соединение, где R2 представляет собой атом водорода или C2-C7 алканоильную группу, его фармакологически приемлемые соли или его пролекарства;
(7) соединение, где R2 представляет собой атом водорода или ацетильную группу, его фармакологически приемлемые соли или его пролекарства;
(8) соединение, где R2 представляет собой атом водорода, его фармакологически приемлемые соли или его пролекарства;
(9) соединение, где R3 представляет собой гетероарильную группу или гетероарильную группу, замещенную 1 или 2 заместителями, выбранными из <группы α заместителей>, его фармакологически приемлемые соли или его пролекарства;
(10) соединение, где R3 представляет собой гетероарильную группу или гетероарильную группу, замещенную одним заместителем, выбранным из <группы α заместителей>, его фармакологически приемлемые соли или его пролекарства;
(11) соединение, где R3 представляет собой гетероарильную группу, замещенную одним заместителем, выбранным из <группы α заместителей>, его фармакологически приемлемые соли или его пролекарства;
(12) соединение, где R3 представляет собой гетероарильную группу, замещенную одним заместителем, выбранным из <группы α заместителей>, и указанный заместитель, выбранный из <группы α заместителей>, представляет собой группу формулы R5-CO-CHR6-(CH2)m- (где R5 представляет собой гидроксильную группу, аминогруппу, C1-C6 алкильную группу, C1-C6 алкиламиногруппу, ди-(Cl-C6 алкил)аминогруппу, гидроксиаминогруппу, C1-C6 алкоксиаминогруппу или C1-C6 алкоксигруппу; R6 представляет собой атом водорода и m представляет собой целое число от 0 до 5), его фармакологически приемлемые соли или его пролекарства;
(13) соединение, где R3 представляет собой гетероарильную группу, замещенную одним заместителем, выбранным из <группы α заместителей>, и указанный заместитель, выбранный из <группы α заместителей>, представляет собой группу формулы R5-CO-CHR6-(CH2)m- (где R5 представляет собой гидроксильную группу, гидроксиаминогруппу, C1-C6 алкоксиаминогруппу или C1-C6 алкоксигруппу; R6 представляет собой атом водорода и m представляет собой целое число от 0 до 5), его фармакологически приемлемые соли или его пролекарства;
(14) соединение, где R3 представляет собой гетероарильную группу, замещенную одним заместителем, выбранным из <группы α заместителей>, и указанный заместитель, выбранный из <группы α заместителей>, представляет собой группу формулы R5-CO-CHR6-(CH2)m- (где R5 представляет собой гидроксильную группу; R6 представляет собой атом водорода и m представляет собой целое число от 0 до 2), его фармакологически приемлемые соли или его пролекарства;
(15) соединение, где гетероарильная группа R3 представляет собой фурильную группу, тиенильную группу, пирролильную группу, пиразолильную группу, имидазолильную группу, оксазолильную группу, изоксазолильную группу, тиазолильную группу, триазолильную группу, тетразолильную группу, тиадиазолильную группу, оксадиазолильную группу, пиридильную группу, пиридазинильную группу, пиримидинильную группу, пиразинильную группу, индолильную группу или хинолильную группу, его фармакологически приемлемые соли или его пролекарства;
(16) соединение, где гетероарильная группа R3 представляет собой пирролильную группу, пиразолильную группу, имидазолильную группу, триазолильную группу или тетразолильную группу, его фармакологически приемлемые соли или его пролекарства;
(17) соединение, где гетероарильная группа R3 представляет собой пиразолильную группу, триазолильную группу или тетразолильную группу, его фармакологически приемлемые соли или его пролекарства;
(18) соединение, где R3 представляет собой:
1-(карбоксиметил)-1H-пиразол-3-ильную,
1-(2-карбоксиэтил)-1H-пиразол-3-ильную,
1-(3-карбоксипропил)-1H-пиразол-3-ильную,
1-(карбоксиметил)-1H-пиразол-4-ильную,
1-(2-карбоксиэтил)-1H-пиразол-4-ильную,
1-(3-карбоксипропил)-1H-пиразол-4-ильную,
1-(карбоксиметил)-1H-1,2,3-триазол-4-ильную,
1-(2-карбоксиэтил)-1H-1,2,3-триазол-4-ильную,
1-(3-карбоксипропил)-1H-1,2,3-триазол-4-ильную,
1-(4-карбоксибутил)-1H-1,2,3-триазол-4-ильную,
1-(карбоксиметил)-1H-1,2,3-триазол-5-ильную,
1-(2-карбоксиэтил)-1H-1,2,3-триазол-5-ильную,
1-(3-карбоксипропил)-1H-1,2,3-триазол-5-ильную,
1-(4-карбоксибутил)-1H-1,2,3-триазол-5-ильную,
2-(карбоксиметил)-2H-1,2,3-триазол-4-ильную,
(2-карбоксиэтил)-2H-1,2,3-триазол-4-ильную,
2-(3-карбоксипропил)-2H-1,2,3-триазол-4-ильную,
1-(карбоксиметил)-1H-тетразол-5-ильную,
1-(2-карбоксиэтил)-1H-тетразол-5-ильную,
(3-карбоксипропил)-1H-тетразол-5-ильную,
1-(4-карбоксибутил)-1H-тетразол-5-ильную,
2-(карбоксиметил)-2H-тетразол-5-ильную,
(2-карбоксиэтил)-2H-тетразол-5-ильную,
2-(3-карбоксипропил)-2H-тетразол-5-ильную или
2-(4-карбоксибутил)-2H-тетразол-5-ильную группу, его фармакологически приемлемые соли или его пролекарства;
(19) соединение, где X1, X2, X3, X4 и X5 независимо представляют собой атом водорода или атом галогена, его фармакологически приемлемые соли или его пролекарства;
(20) соединение, где X1 и X2 независимо представляют собой атом водорода или атом галогена и X3, X4 и X5 представляют собой атом водорода, его фармакологически приемлемые соли или его пролекарства;
(21) соединение, где X1 представляет собой атом галогена и X2, X3, X4и X5 представляют собой атом водорода, его фармакологически приемлемые соли или его пролекарства;
(22) соединение, где X1 представляет собой атом фтора и X2, X3, X4 и X5 представляют собой атом водорода, его фармакологически приемлемые соли или его пролекарства;
(23) соединение, где n представляет собой 0 или 1, его фармакологически приемлемые соли или его пролекарства; или
(24) соединение, где n представляет собой 1, его фармакологически приемлемые соли или его пролекарства.
Далее, в каждой из групп (1)-(5), (6)-(8), (9)-(18), (19)-(22) и (23)-(24) описанных выше пунктов более предпочтительным является соединение с бóльшим номером [то же самое применимо к каждому соединению из группы (25)-(28) пунктов, описанных ниже]. Предпочтительным также является соединение, полученное выбором группы R1из пунктов (1)-(5), группы R2 из пунктов (6)-(8), группы R3 из пунктов (9)-(18), групп X1, X2, X3, X4 и X5 из пунктов (19)-(22) и n из пунктов (23)-(24), соответственно, с последующим произвольным объединением указанных выбранных групп, которое может представлять собой следующее:
(25) соединение, где R1 представляет собой C3-C6 циклоалкильную группу или C1-C6 алкоксигруппу;
R2 представляет собой атом водорода или C2-C7 алканоильную группу;
R3 представляет собой гетероарильную группу, замещенную одним заместителем, выбранным из <группы α заместителей>, указанный заместитель, выбранный из <группы α заместителей>, представляет собой группу формулы R5-CO-CHR6-(CH2)m- (где R5 представляет собой гидроксильную группу, гидроксиаминогруппу, C1-C6 алкоксиаминогруппу или C1-C6 алкоксигруппу; R6 представляет собой атом водорода и m представляет собой целое число от 0 до 5), причем гетероарильная группа R3 представляет собой пирролильную группу, пиразолильную группу, имидазолильную группу, триазолильную группу или тетразолильную группу;
X1 и X2 независимо представляют собой атом водорода или атом галогена;
X3, X4 и X5 представляют собой атом водорода; и
n представляет собой 0 или 1, его фармакологически приемлемые соли или его пролекарства;
(26) соединение, где R1 представляет собой циклопропильную группу или метоксигруппу;
R2 представляет собой атом водорода или ацетильную группу;
R3 представляет собой гетероарильную группу, замещенную одним заместителем, выбранным из <группы α заместителей>, указанный заместитель, выбранный из <группы α заместителей>, представляет собой группу формулы R5-CO-CHR6-(CH2)m- (где R5 представляет собой гидроксильную группу, гидроксиаминогруппу, C1-C6 алкоксиаминогруппу или C1-C6 алкоксигруппу; R6 представляет собой атом водорода и m представляет собой целое число от 0 до 5), причем гетероарильная группа R3 представляет собой пирролильную группу, пиразолильную группу, имидазолильную группу, триазолильную группу или тетразолильную группу;
X1 представляет собой атом галогена;
X2, X3, X4 и X5 представляют собой атом водорода; и
n представляет собой 1, его фармакологически приемлемые соли или его пролекарства;
(27) соединение, где R1 представляет собой циклопропильную группу или метоксигруппу;
R2 представляет собой атом водорода;
R3 представляет собой гетероарильную группу, замещенную одним заместителем, выбранным из <группы α заместителей>, указанный заместитель, выбранный из <группы α заместителей>, представляет собой группу формулы R5-CO-CHR6-(CH2)m- (где R5 представляет собой гидроксильную группу; R6 представляет собой атом водорода и m представляет собой целое число от 0 до 2), причем гетероарильная группа R3 представляет собой пиразолильную группу, триазолильную группу или тетразолильную группу;
X1 представляет собой атом фтора;
X2, X3, X4 и X5 представляют собой атом водорода; и
n представляет собой 1, его фармакологически приемлемые соли или его пролекарства; или
(28) соединение, где R1 представляет собой циклопропильную группу или метоксигруппу;
R2 представляет собой атом водорода;
R3 представляет собой 1-(карбоксиметил)-1H-пиразол-3-ильную,
1-(2-карбоксиэтил)-1H-пиразол-3-ильную,
1-(3-карбоксипропил)-1H-пиразол-3-ильную,
1-(карбоксиметил)-1H-пиразол-4-ильную,
1-(2-карбоксиэтил)-1H-пиразол-4-ильную,
1-(3-карбоксипропил)-1H-пиразол-4-ильную,
1-(карбоксиметил)-1H-1,2,3-триазол-4-ильную,
1-(2-карбоксиэтил)-1H-1,2,3-триазол-4-ильную,
1-(3-карбоксипропил)-1H-1,2,3-триазол-4-ильную,
1-(4-карбоксибутил)-1H-1,2,3-триазол-4-ильную,
1-(карбоксиметил)-1H-1,2,3-триазол-5-ильную,
1-(2-карбоксиэтил)-1H-1,2,3-триазол-5-ильную,
1-(3-карбоксипропил)-1H-1,2,3-триазол-5-ильную,
(4-карбоксибутил)-1H-1,2,3-триазол-5-ильную,
2-(карбоксиметил)-2H-1,2,3-триазол-4-ильную,
(2-карбоксиэтил)-2H-1,2,3-триазол-4-ильную,
2-(3-карбоксипропил)-2H-1,2,3-триазол-4-ильную,
1-(карбоксиметил)-1H-тетразол-5-ильную,
1-(2-карбоксиэтил)-1H-тетразол-5-ильную,
1-(3-карбоксипропил)-1H-тетразол-5-ильную,
1-(4-карбоксибутил)-1H-тетразол-5-ильную,
2-(карбоксиметил)-2H-тетразол-5-ильную,
2-(2-карбоксиэтил)-2H-тетразол-5-ильную,
2-(3-карбоксипропил)-2H-тетразол-5-ильную или
2-(4-карбоксибутил)-2H-тетразол-5-ильную группу;
X1 представляет собой атом фтора;
X2, X3, X4 и X5 представляют собой атом водорода и
n представляет собой 1, его фармакологически приемлемые соли или его пролекарства.
Кроме того, в соответствии с другим аспектом настоящего изобретения предлагается лекарственное средство, содержащее соединение, его фармакологически приемлемые соли или его пролекарства, описанные выше в пунктах (1)-(28) (предпочтительно противотромботическое средство).
Предпочтительными являются также соединение, имеющее общую формулу (I'), представленную ниже:
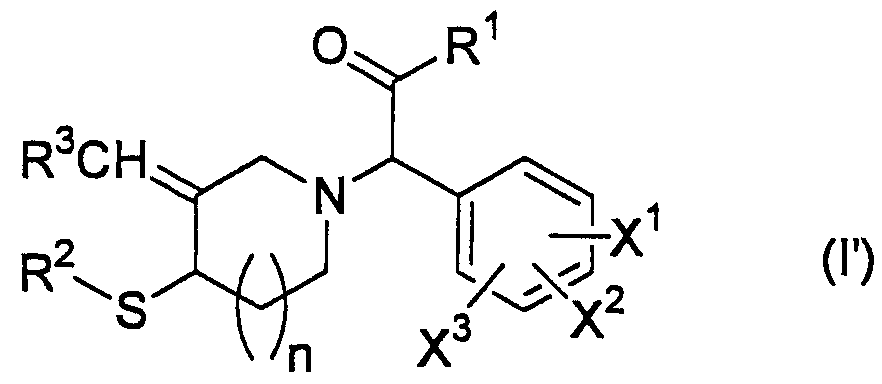
где R1 представляет собой C1-C6 алкильную группу, галоген-С1-C6 алкильную группу, C3-C6 циклоалкильную группу, галоген-С3-C6 циклоалкильную группу, C1-C6 алкоксигруппу, галоген-С1-C6 алкоксигруппу, C6-C10 арильную группу или галоген-С6-C10 арильную группу;
R2 представляет собой атом водорода, C2-C7 алканоильную группу, C7-C11 арилкарбонильную группу, группу формулы R4-(CH2)1-CO- (где R4представляет собой C1-C6 алкоксигруппу, аминогруппу, C1-C6 алкиламиногруппу, ди-(Cl-C6 алкил)аминогруппу или карбоксильную группу; и l представляет собой целое число от 0 до 4), C6-C10 арилсульфонильную группу, С7-С16 алкиларилсульфонильную, С1-С6 алкилсульфанильную группу или С1-С6 алкилсульфанильную группу, замещенную 1 или 2 заместителями, выбранными из группы, состоящей из «аминогруппы, карбоксильной группы, С1-С6 ациламиногруппы и С2-С7 алкоксикарбонильной группы»;
R3 представляет собой С6-С10 арильную группу, С6-С10 арильную группу, замещенную 1 или 2 заместителями, выбранными из <группы α' заместителей>, гетероарильную группу или гетероарильную группу, замещенную 1 или 2 заместителями, выбранными из <группы α' заместителей>; и
Х1, Х2 и Х3 независимо представляют собой атом водорода, атом галогена, аминогруппу, карбоксильную группу, карбамоильную группу, цианогруппу, нитрогруппу, С1-С6 алкильную группу, галоген-С1-С6 алкильную группу, С1-С6 алкоксигруппу или галоген-С1-С6 алкоксигруппу;
n представляет собой целое число от 0 до 2; и
<группу α' заместителей> составляют атом галогена, аминогруппа, карбоксильная группа, карбамоильная группа, цианогруппа, нитрогруппа, С1-С6 алкильная группа, галоген-С1-С6 алкильная группа, С1-С6 алкильная группа, замещенная гетероарильной группой(ами), С1-С6 алкоксигруппа, галоген-С1-С6 алкоксигруппа, С2-С12 алкоксиалкильная группа, С2-С7 алканоильная группа, С4-С7 циклоалкилкарбонильная группа, С1-С6 алкиламиногруппа, ди-(С1-С6 алкил)аминогруппа, С2-С7 алкилкарбамоильная группа, ди-(С1-С6 алкил)карбамоильная группа, группа формулы R5-СО-CHR6-(СН2)m- (где R5 представляет собой гидроксильную группу, аминогруппу, С1-С6 алкильную группу, С1-С6 алкиламиногруппу, ди-(С1-С6 алкил)аминогруппу, группу HO-NH- или С1-С6 алкоксигруппу; R6 представляет собой атом водорода, С1-С6 алкильную группу, С2-С7 карбоксиалкильную группу или С3-С13 алкоксикарбонилалкильную группу и m представляет собой целое число от 0 до 5) и сульфамоил-С1-С6 алкильная группа], его фармакологически приемлемые соли и его пролекарства.
«C1-C6-алкильная группа» в вышеприведенной общей формуле (I) может представлять собой, например, неразветвленную или разветвленную алкильную группу, содержащую от 1 до 6 углеродных атомов, такую как метильная, этильная, пропильная, изопропильная, бутильная, изобутильная, втор-бутильная, трет-бутильная, пентильная, изопентильная, 2-метилбутильная, неопентильная, 1-этилпропильная, гексильная, изогексильная, 4-метилпентильная, 3-метилпентильная, 2-метилпентильная, 1-метилпентильная, 3,3-диметилбутильная, 2,2-диметилбутильная, 1,1-диметилбутильная, 1,2-диметилбутильная, 1,3-диметилбутильная, 2,3-диметилбутильная или 2-этилбутильная группа, и является предпочтительно неразветвленной или разветвленной алкильной группой, содержащей от 1 до 4 углеродных атомов, а более предпочтительно метильной группой.
«Галоген-C1-C6 алкильная группа» в вышеприведенной общей формуле (I) означает группу, в которой указанная «C1-C6 алкильная группа» является замещенной атомом(ами) галогена и которая может представлять собой, например, трифторметильную, трихлорметильную, дифторметильную, дихлорметильную, дибромметильную, фторметильную, 2,2,2-трифторэтильную, 2,2,2-трихлорэтильную, 2-бромэтильную, 2-хлорэтильную, 2-фторэтильную, 2-иодэтильную, 3-хлорпропильную, 4-фторбутильную, 6-иодгексильную или 2,2-дибромэтильную группу, а предпочтительно является трифторметильной группой.
«C3-C6 циклоалкильная группа» в вышеприведенной общей формуле (I) может представлять собой, например, 3-6-членную насыщенную циклическую углеводородную группу, такую как циклопропильная, циклобутильная, циклопентильная или циклогексильная группа, а предпочтительно является циклопропильной группой.
«Галоген-C3-C6 циклоалкильная группа» в вышеприведенной общей формуле (I) означает группу, в которой указанная «C3-C6 циклоалкильная группа» является замещенной атомом(ами) галогена и которая может представлять собой, например, 2-фторциклопропильную, 2-хлорциклопропильную, 2-фторциклопентильную, 2-хлорциклопентильную, 2-фторциклогексильную или 2-хлорциклогексильную группу, а предпочтительно является 2-фторциклопропильной группой.
«C1-C6 алкоксигруппа» в вышеприведенной общей формуле (I) означает группу, в которой указанная «C1-C6 алкильная группа» присоединена к атому кислорода и которая может представлять собой, например, неразветвленную или разветвленную алкоксигруппу, содержащую от 1 до 6 углеродных атомов, такую как метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси, н-пентилокси, изопентилокси, 2-метилбутокси, неопентилокси, н-гексилокси, 4-метилпентилокси, 3-метилпентилокси, 2-метилпентилокси, 3,3-диметилбутокси, 2,2-диметилбутокси, 1,1-диметилбутокси, 1,2-диметилбутокси, 1,3-диметилбутокси или 2,3-диметилбутоксигруппа, и является предпочтительно неразветвленной или разветвленной алкоксигруппой, содержащей от 1 до 4 углеродных атомов, а более предпочтительно метокси или этоксигруппой.
«Галоген-С1-C6 алкоксигруппа» в вышеприведенной общей формуле (I) означает группу, в которой указанная «C1-C6 алкоксигруппа» является замещенной атомом(ами) галогена и которая может представлять собой, например, трифторметокси, трихлорметокси, дифторметокси, дихлорметокси, дибромметокси, фторметокси, 2,2,2-трихлорэтокси, 2,2,2-трифторэтокси, 2-бромэтокси, 2-хлорэтокси, 2-фторэтокси или 2,2-дибромэтоксигруппу, а предпочтительно является 2-бромэтокси, 2-хлорэтокси и 2-фторэтоксигруппой.
«C6-C10 арильная группа» в вышеприведенной общей формуле (I) может представлять собой, например, ароматическую углеводородную группу, содержащую от 6 до 10 углеродных атомов, такую как фенильная или нафтильная группа, а предпочтительно является фенильной группой.
«Галоген-С6-C10 арильная группа» в вышеприведенной общей формуле (I) означает группу, в которой указанная «C1-C10 арильная группа» является замещенной атомом(ами) галогена и которая может представлять собой, например, 4-хлорфенильную, 4-фторфенильную, 2,4-дихлорфенильную или 2,4-дифторфенильную группу, а предпочтительно является 4-хлорфенильной группой.
«C2-C7 алканоильная группа» в вышеприведенной общей формуле (I) может представлять собой, например, неразветвленную или разветвленную алканоильную группу, содержащую от 2 до 7 углеродных атомов, такую как ацетильная, пропионильная, бутирильная, изобутирильная, пентаноильная, пивалоильная, валерильная, изовалерильная, гексаноильная или гептаноильная группа, а предпочтительно является ацетильной группой.
«C7-C11 арилкарбонильная группа» в вышеприведенной общей формуле (I) означает группу, в которой указанная «C6-C10 арильная группа» присоединена к карбонильной группе и которая может представлять собой, например, бензоильную, α-нафтоильную или β-нафтоильную группу, а предпочтительно является бензоильной группой.
«C1-C6 алкиламиногруппа» в вышеприведенной общей формуле (I) означает группу, в которой указанная «C1-C6 алкильная группа» присоединена к аминогруппе и которая может представлять собой, например, неразветвленную или разветвленную алкиламиногруппу, содержащую от 1 до 6 углеродных атомов, такую как метиламино, этиламино, пропиламино, изопропиламино, бутиламино, изобутиламино, втор-бутиламино, трет-бутиламино, пентиламино, изопентиламино, 2-метилбутиламино, неопентиламино, 1-этилпропиламино, гексиламино, изогексиламино, 4-метилпентиламино, 3-метилпентиламино, 2-метилпентиламино, 1-метилпентиламино, 3,3-диметилбутиламино, 2,2-диметилбутиламино, 1,1-диметилбутиламино, 1,2-диметилбутиламино, 1,3-диметилбутиламино, 2,3-диметилбутиламино или 2-этилбутиламиногруппа, и является предпочтительно неразветвленной или разветвленной алкиламиногруппой, содержащей от 1 до 4 углеродных атомов, а более предпочтительно метиламиногруппой.
«Ди-(C1-C6 алкил)аминогруппа» в вышеприведенной общей формуле (I) означает группу, в которой аминогруппа является замещенной двумя «C1-C6 алкильными группами» и которая может представлять собой, например, диметиламино, метилэтиламино, диэтиламино, ди-н-пропиламино, диизопропиламино N-(н-пропил)-N-этиламино, ди-н-бутиламино, диизобутиламино, ди-втор-бутиламино, ди-трет-бутиламино, ди-н-пентиламино, диизопентиламино, ди-2-метилбутиламино, динеопентиламино, ди-1-этилпропиламино, ди-н-гексиламино, диизогексиламино, ди-4-метилпентиламино, ди-3-метилпентиламино, ди-2-метилпентиламино, ди-1-метилпентиламино, ди-3,3-диметилбутиламино, ди-2,2-диметилбутиламино, ди-1,1-диметилбутиламино, ди-1,2-диметилбутиламино, ди-1,3-диметилбутиламино, ди-2,3-диметилбутиламино или ди-2-этилбутиламиногруппу, а предпочтительно является диметиламино, метилэтиламино или диэтиламиногруппой.
«C6-C10 арилсульфонильная группа» в вышеприведенной общей формуле (I) означает группу, в которой указанная «C6-C10 арильная группа» присоединена к сульфонильной группе и которая может представлять собой, например, бензолсульфонильную, α-нафталинсульфонильную или β-нафталинсульфонильную группу, а предпочтительно является фенилсульфонильной группой.
«C7-C16 алкиларилсульфонильная группа» в вышеприведенной общей формуле (I) означает группу, в которой указанная «C1-C6 алкильная группа» присоединена к указанной «C6-C10 арилсульфонильной группе» и которая может представлять собой, например, 2-метилбензолсульфонильную, 3-метилбензолсульфонильную, 4-метилбензолсульфонильную, 2-этилбензолсульфонильную, 3-этилбензолсульфонильную, 4-этилбензолсульфонильную, 2,4,6-триметилбензолсульфонильную, 3,4,5-триметилбензолсульфонильную, 2-н-пропилбензолсульфонильную, 4-н-пропилбензолсульфонильную, 2-изопропилбензолсульфонильную, 4-изопропилбензолсульфонильную, 2-бутилбензолсульфонильную или 4-бутилбензолсульфонильную группу, а предпочтительно является 4-метилбензолсульфонильной группой.
«C1-C6 алкилсульфанильная группа» в вышеприведенной общей формуле (I) означает группу, в которой указанная «C1-C6 алкильная группа» присоединена к атому серы и которая может представлять собой, например, неразветвленную или разветвленную алкилсульфанильную группу, содержащую от 1 до 6 углеродных атомов, такую как метилсульфанильная, этилсульфанильная, н-пропилсульфанильная, изопропилсульфанильная, н-бутилсульфанильная, изобутилсульфанильная, втор-бутилсульфанильная, трет-бутилсульфанильная, н-пентилсульфанильная, изопентилсульфанильная, 2-метилбутилсульфанильная, неопентилсульфанильная, 1-этилпропилсульфанильная, н-гексилсульфанильная, изогексилсульфанильная, 4-метилпентилсульфанильная, 3-метилпентилсульфанильная, 2-метилпентилсульфанильная, 1-метилпентилсульфанильная, 3,3-диметилбутилсульфанильная, 2,2-диметилбутилсульфанильная, 1,1-диметилбутилсульфанильная, 1,2-диметилбутилсульфанильная, 1,3-диметилбутилсульфанильная, 2,3-диметилбутилсульфанильная или 2-этилбутилсульфанильная группа, и является предпочтительно неразветвленной или разветвленной алкилсульфанильной группой, содержащей от 1 до 4 углеродных атомов, а более предпочтительно метилсульфанильной группой.
«C1-C6 ациламиногруппа» в вышеприведенной общей формуле (I) означает неразветвленную или разветвленную ациламиногруппу, содержащую от 1 до 6 углеродных атомов, такую как формиламино, ацетиламино, пропиониламино, бутириламино, изобутириламино, пентаноиламино, пивалоиламино, валериламино, изовалериламино или гексаноиламиногруппа, а предпочтительно является ацетиламиногруппой.
«C2-C7 алкоксикарбонильная группа» в вышеприведенной общей формуле (I) означает неразветвленную или разветвленную алкоксисарбонильную группу, содержащую от 2 до 7 углеродных атомов, такую как метоксикарбонильная, этоксикарбонильная, н-пропоксикарбонильная, изопропоксикарбонильная, н-бутоксикарбонильная, изобутоксикарбонильная, втор-бутоксикарбонильная, трет-бутоксикарбонильная, н-пентилоксикарбонильная, изопентилоксикарбонильная, 2-метилбутоксикарбонильная, неопентилоксикарбонильная, н-гексилоксикарбонильная, 4-метилпентилоксикарбонильная, 3-метилпентилоксикарбонильная, 2-метилпентилоксикарбонильная, 3,3-диметилбутоксикарбонильная, 2,2-диметилбутоксикарбонильная, 1,1-диметилбутоксикарбонильная, 1,2-диметилбутоксикарбонильная, 1,3-диметилбутоксикарбонильная или 2,3-диметилбутоксикарбонильная группа, а предпочтительно является метоксикарбонильной или этоксикарбонильной группой.
«Гетероарильная группа» в вышеприведенной общей формуле (I) может представлять собой, например, 5-7-членную ароматическую гетероциклическую группу, содержащую от 1 до 4 гетероатомов, выбранных из атома(ов) серы, атома(ов) кислорода и/или атома(ов) азота, такую, как фурильная, тиенильная, пирролильная, пиразолильная, имидазолильная, оксазолильная, изоксазолильная, тиазолильная, изотиазолильная, триазолильная, тетразолильная, тиадиазолильная, оксадиазолильная, пиранильная, пиридильная, пиридазинильная, пиримидинильная или пиразинильная группа, или ароматическую гетероциклическую группу, конденсированную с другими циклическими группами, такими как изоиндолильная, индолильная, изохинолильная или хинолильная группа, а предпочтительно является 5-7-членной ароматической гетероциклической группой, содержащей по крайней мере один атом азота, а более предпочтительно пиразолильной, триазолильной или тетразолильной группой.
«Гидрокси-С1-C6 алкильная группа» в вышеприведенной общей формуле (I) означает группу, в которой указанная «C1-C6 алкильная группа» замещена гидроксильной группой(ами) и которая может представлять собой, например, гидроксиметильную, 1-гидроксиэтильную, 2-гидроксиэтильную, 1-гидрокси-2-метилэтильную, 2-гидрокси-2-метилэтильную, 1-гидроксипропильную, 2-гидроксипропильную, 3-гидроксипропильную, 1-гидроксибутильную, 2-гидроксибутильную, 3-гидроксибутильную, 4-гидроксибутильную, 5-гидроксипентильную или 6-гидроксигексильную группу, а предпочтительно является гидроксиметильной, 2-гидроксиэтильной или 3-гидроксипропильной группой.
«C2-C12 алкоксиалкильная группа» в вышеприведенной общей формуле (I) означает группу, в которой указанная «C1-C6 алкоксигруппа» присоединена к указанной «C1-C6 алкильной группе» и которая может представлять собой, например, метоксиметильную, этоксиметильную, н-пропоксиметильную, изопропоксиметильную, н-бутоксиметильную, изобутоксиметильную, втор-бутоксиметильную, трет-бутоксиметильную, н-пентилоксиметильную, изопентилоксиметильную, 2-метилбутоксиметильную, неопентилоксиметильную, н-гексилоксиметильную, 4-метилпентилоксиметильную, 3-метилпентилоксиметильную, 2-метилпентилоксиметильную, 3,3-диметилбутоксиметильную, 2,2-диметилбутоксиметильную, 1,1-диметилбутоксиметильную, 1,2-диметилбутоксиметильную, 1,3-диметилбутоксиметильную, 2,3-диметилбутоксиметильную, 2-метоксиэтильную, 2-этоксиэтильную, 2-(н-пропокси)этильную, 2-(изопропокси) этильную, 2-(н-бутокси)этильную, 2-(изобутокси)этильную, 2-(втор-бутокси)этильную, 2-(трет-бутокси)этильную, 2-(н-пентилокси)этильную, 2-(изопентилокси)этильную, 2-(2-метилбутокси)этильную, 2-(неопентилокси)этильную, 2-(н-гексилокси)этильную, 2-(4-метилпентилокси)этильную, 2-(3-метилпентилокси)этильную, 2-(2-метилпентилокси)этильную, 2-(3,3-диметилбутокси)этильную, 2,2-диметилбутоксиэтильную, 1,1-диметилбутоксиэтильную, 1,2-диметилбутоксиэтильную, 1,3-диметилбутоксиэтильную или 2,3-диметилбутоксиэтильную группу, а предпочтительно является неразветвленной или разветвленной алкоксиалкильной группой, содержащей от 2 до 4 углеродных атомов, и более предпочтительно - метоксиметильной или метоксиэтильной группой.
«C4-C7 циклоалкилкарбонильная группа» в вышеприведенной общей формуле (I) означает группу, в которой указанная «C3-C6 циклоалкильная группа» присоединена к карбонильной группе» и которая может представлять собой, например, циклопропилкарбонильную, циклобутилкарбонильную, циклопентилкарбонильную или циклогексилкарбонильную группу, а предпочтительно является циклопропилкарбонильной группой.
«C2-C7 алкилкарбамоильная группа» в вышеприведенной общей формуле (I) означает группу, в которой указанная «C1-C6 алкильная группа» присоединена к карбамоильной группе» и которая может представлять собой, например, метилкарбамоильную, этилкарбамоильную, пропилкарбамоильную, изопропилкарбамоильную, бутилкарбамоильную, изобутилкарбамоильную, втор-бутилкарбамоильную, трет-бутилкарбамоильную, пентилкарбамоильную, изопентилкарбамоильную, 2-метилбутилкарбамоильную, неопентилкарбамоильную, 1-этилпропилкарбамоильную, гексилкарбамоильную, изогексилкарбамоильную, 4-метилпентилкарбамоильную, 3-метилпентилкарбамоильную, 2-метилпентилкарбамоильную, 1-метилпентилкарбамоильную, 3,3-диметилбутилкарбамоильную, 2,2-диметилбутилкарбамоильную, 1,1-диметилбутилкарбамоильную, 1,2-диметилбутилкарбамоильную, 1,3-диметилбутилкарбамоильную, 2,3-диметилбутилкарбамоильную или 2-этилбутилкарбамоильную группу, а предпочтительно является алкилкарбамоильной группой, содержащей от 2 до 5 углеродных атомов, а более предпочтительно - метилкарбамоильной или этилкарбамоильной группой.
«Ди-(C1-C6 алкил) карбамоильная группа» в вышеприведенной общей формуле (I) означает группу, в которой карбамоильная группа является замещенной двумя «C1-C6 алкильными группами» и которая может представлять собой, например, диметилкарбамоильную, метилэтилкарбамоильную, диэтилкарбамоильную, ди-н-пропилкарбамоильную, диизопропилкарбамоильную, N-(н-пропил)-N-этилкарбамоильную, ди-н-бутилкарбамоильную, диизобутилкарбамоильную, ди-втор-бутилкарбамоильную, ди-трет-бутилкарбамоильную, ди-н-пентилкарбамоильную, диизопентилкарбамоильную, ди-2-метилбутилкарбамоильную, динеопентилкарбамоильную, ди-1-этилпропилкарбамоильную, ди-н-гексилкарбамоильную, диизогексилкарбамоильную, ди-4-метилпентилкарбамоильную, ди-3-метилпентилкарбамоильную, ди-2-метилпентилкарбамоильную, ди-1-метилпентилкарбамоильную, ди-3,3-диметилбутилкарбамоильную, ди-2,2-диметилбутилкарбамоильную, ди-1,1-диметилбутилкарбамоильную, ди-1,2-диметилбутилкарбамоильную, ди-1,3-диметилбутилкарбамоильную, ди-2,3-диметилбутилкарбамоильную или ди-2-этилбутилкарбамоильную группу, а предпочтительно является диметилкарбамоильной, метилэтилкарбамоильной или диэтилкарбамоильной группой.
«C1-C6 алкоксиаминогруппа» в вышеприведенной общей формуле (I) означает группу, в которой атом кислорода гидроксиаминогруппы является замещенным указанной «C1-C6 алкильной группой» и которая может представлять собой, например, метоксиамино, этоксиамино, н-пропоксиамино, изопропоксиамино, н-бутоксиамино, изобутоксиамино, втор-бутоксиамино, трет-бутоксиамино, н-пентилоксиамино, изопентилоксиамино, 2-метилбутоксиамино, неопентилоксиамино, н-гексилоксиамино, 4-метилпентилоксиамино, 3-метилпентилоксиамино, 2-метилпентилоксиамино, 3,3-диметилбутоксиамино, 2,2-диметилбутоксиамино, 1,1-диметилбутоксиамино, 1,2-диметилбутоксиамино, 1,3-диметилбутоксиамино или 2,3-диметилбутоксиаминогруппу, а предпочтительно является метоксиаминогруппой.
«C2-C7 карбоксиалкильная группа» в вышеприведенной общей формуле (I) означает группу, в которой указанная «C1-C6 алкильная группа» замещена карбоксильной группой(ами) и которая может представлять собой, например, карбоксиметильную, 1-карбоксиэтильную, 1-карбоксипропильную, 1-карбоксибутильную, 1-карбоксипентильную, 1-этил-1-карбоксипропильную, 1-карбоксигексильную, 2-карбоксиэтильную, 2-карбоксипропильную, 2-карбоксибутильную, 2-карбоксипентильную, 1-этил-2-карбоксипропильную, 3-карбоксипропильную, 4-карбоксибутильную, 5-карбоксипентильную или 6-карбоксигексильную группу, а предпочтительно является карбоксиметильной или 2-карбоксиэтильной группой.
«C3-C13 алкоксикарбонилалкильная группа» в вышеприведенной общей формуле (I) означает группу, в которой указанная «C1-C6 алкильная группа» замещена «C2-C7 алкоксикарбонильной группой» и которая может представлять собой, например, метоксикарбонилметильную, 2-метоксикарбонилэтильную, 3-метоксикарбонилпропильную, 4-метоксикарбонилбутильную, 5-метоксикарбонилпентильную, 1-этил-1-метоксикарбонилпропильную, 6-метоксикарбонилгексильную, 2-метоксикарбонилпропильную, 2-метоксикарбонилбутильную, 2-метоксикарбонилпентильную, 1-этил-2-метоксикарбонилпропильную, этоксикарбонилметильную, 3-этоксикарбонилпропильную, 4-этоксикарбонилбутильную, 5-этоксикарбонилпентильную, 1-этил-1-этоксикарбонилпропильную, 6-этоксикарбонилгексильную, 2-этоксикарбонилэтильную, 2-этоксикарбонилпропильную, 2-этоксикарбонилбутильную, 2-этоксикарбонилпентильную, 1-этил-2-этоксикарбонилпропильную, пропоксикарбонилметильную, бутоксикарбонилметильную или трет-бутоксикарбонилметильную группу, а предпочтительно является метоксикарбонилметильной, 2-метоксикарбонилэтильной, этоксикарбонилметильной или 2-этоксикарбонилэтильной группой.
«Атом галогена» в вышеприведенной общей формуле (I) может представлять собой, например, атом фтора, атом хлора, атом брома или атом иода, а предпочтительно является атомом фтора или атомом хлора, а более предпочтительно - атомом фтора.
В соединениях (I) по настоящему изобретению могут присутствовать оптические изомеры, обусловленные асимметрическим углеродным атомом, находящимся в их структуре (включая диастереомеры), и, кроме того, в тех же самых соединениях могут также присутствовать геометрические изомеры, обусловленные двойной углерод-углеродной связью. Настоящее изобретение охватывает все указанные изомеры. Геометрическая структура двойной связи, к которой присоединена группа R3, является предпочтительной для получения Е-изомера.
Так как соединения (I) по настоящему изобретению содержат в своей структуре различные группы, такие как сульфанильная группа, карбоксильная группа, гидроксильная группа или аминогруппа, «их пролекарство» означает производное, в котором любая из указанных групп модифицирована подходящей функциональной группой, которая может быть отщеплена в результате биологического процесса, такого как гидролиз in vivo. В указанных случаях определить, является ли производное «подходящей функциональной группой, которая может быть отщеплена в результате биологического процесса, такого, как гидролиз in vivo» или нет по тому, можно ли обнаружить образование первоначального соединения или его фармакологически приемлемой соли, можно введением производного животному для опыта, такому как крыса или мышь, внутривенной инъекцией, подкожной инъекцией или пероральным введением и затем количественным определением жидкости в организме животного.
Когда соединения (I) по настоящему изобретению содержат сульфанильную группу, функциональную группу, используемую для образования их пролекарства, особо не ограничивают и она может представлять собой, например, «алифатическую ацильную группу», включающую алканоильную группу, такую как формильная, ацетильная, пропионильная, бутирильная, изобутирильная, пентаноильная, пивалоильная, валерильная, изовалерильная, октаноильная, нонаноильная, деканоильная, 3-метилнонаноильная, 8-метилнонаноильная, 3-этилоктаноильная, 3,7-диметилоктаноильная, ундеканоильная, додеканоильная, тридеканоильная, тетрадеканоильная, пентадеканоильная, гексадеканоильная, 1-метилпентадеканоильная, 14-метилпентадеканоильная, 13,13-диметилтетрадеканоильная, гептадеканоильная, 15-метилгексадеканоильная, октадеканоильная, 1-метилгептадеканоильная, нонадеканоильная, эйкозаноильная или генэйкозаноильная группа, алкилкарбонильную группу, замещенную карбоксильной группой, такую как сукциноильная, глутароильная или адипоильная группа, карбонильную группу, замещенную галоген-низшей алкильной группой, такую как хлорацетильная, дихлорацетильная, трихлорацетильная или трифторацетильная группа, насыщенную циклическую углеводород-карбонильную группу, такую как циклопропилкарбонильная, циклобутилкарбонильная, циклопентилкарбонильная, циклогексилкарбонильная, циклогептилкарбонильная или циклооктилкарбонильная группа, алкилкарбонильную группу, замещенную низшей алкоксигруппой(ами), такую как метоксиацетильная группа, и ненасыщенную алкилкарбонильную группу, такую как (E)-2-метил-2-бутеноильная группа (предпочтительно C1-C6 алканоильная группа); «карбонилоксиалкильную группу», включающую оксодиоксоленилметильную группу, такую как (5-метил-2-оксо-1,3-диоксолен-4-ил)метильная или (5-фенил-2-оксо-1,3-диоксолен-4-ил)метильная группа; «ароматическую ацильную группу», включающую арилкарбонильную группу, такую как бензоильная, α-нафтоильная, β-нафтоильная, пиридоильная, тиеноильная или фуроильная группа, галогенарилкарбонильную группу, такую как 2-бромбензоильная или 4-хлорбензоильная группа, арилкарбонильную группу, замещенную низшей алкильной группой(ами), такую как 2,4,6-триметилбензоильная или 4-толуоильная группа, низшую алкоксилированную арилкарбонильную группу, такую как 4-анизоильная группа, арилкарбонильную группу, замещенную карбоксильной группой(ами), такую как 2-карбоксибензоильная, 3-карбоксибензоильная или 4-карбоксибензоильная группа, нитрованную арилкарбонильную группу, такую как 4-нитробензоильная или 2-нитробензоильная группа, арилкарбонильную группу, замещенную низшей алкоксикарбонильной группой(ами), такую как 2-(метоксикарбонил)бензоильная группа, и арилкарбонильную группу, замещенную арильной группой(ами), такую как 4-фенилбензоильная группа; «аралкилкарбонильную группу», включающую карбонильную группу, замещенную низшей алкильной группой, которая является замещенной 1-3 арильными группами, такую как фенилацетильная, α-нафтилпропионильная, β-нафтилбутирильная, дифенилизобутирильная, трифенилацетильная, α-нафтилдифенилизобутирильная или 9-антрилпентаноильная группа, и низшую алкилкарбонильную группу, замещенную 1-3 арильными группами, арильный цикл которых является замещенным низшей алкильной группой(ами), низшей алкоксигруппой(ами), нитрогруппой(ами), атомом(ами) галогена или цианогруппой(ами), такую как 4-метилфенилацетильная, 2,4,6-триметилфенилформильная, 3,4,5-триметилфенилбутирильная, 4-метоксифенилизобутирильная, 4-метоксифенилдифенилпивалоильная, 2-нитрофенилацетильная, 4-нитрофенилпропионильная, 4-хлорфенилбутирильная, 4-бромфенилацетильная или 4-цианфенилпентаноильная группа; «тетрагидропиранильную или тетрагидротиопиранильную группу», такую как тетрагидропиран-2-ильная, 3-бромтетрагидропиран-2-ильная, 4-метокситетрагидропиран-4-ильная, тетрагидротиопиран-2-ильная или 4-метокситетрагидротиопиран-4-ильная группа; «тетрагидрофуранильную или тетрагидротиофуранильную группу», такую как тетрагидрофуран-2-ильная или тетрагидротиофуран-2-ильная группа; «алкоксиметильную группу», включающую низшую алкоксиметильную группу, такую как метоксиметильная, 1,1-диметил-1-метоксиметильная, этоксиметильная, пропоксиметильная, изопропоксиметильная, бутоксиметильная или трет-бутоксиметильная группа, низшую алкоксиметильную группу, замещенную низшей алкоксигруппой(ами), такую как 2-метоксиэтоксиметильная группа, и галоген-низшую алкоксиметильную группу, такую как 2,2,2-трихлорэтоксиметильная или бис(2-хлорэтокси)метильная группа; «замещенную этильную группу», включающую низшую алкоксилированную этильную группу, такую как 1-этоксиэтильная или 1-(изопропокси)этильная группа, и галогенированную этильную группу, такую, как 2,2,2-трихлорэтильная группа; «аралкильную группу», включающую низшую алкильную группу, замещенную 1-3 арильными группами, такую как бензильная, α-нафтилметильная, β-нафтилметильная, дифенилметильная, трифенилметильная, α-нафтилдифенилметил или 9-антрилметильная группа, и низшую алкильную группу, замещенную 1-3 арильными группами, арильный цикл которых является замещенным низшей алкильной группой(ами), низшей алкоксигруппой(ами), нитрогруппой(ами), атомом(ами) галогена или цианогруппой(ами), такую как 4-метилбензильная, 2,4,6-триметилбензильная, 3,4,5-триметилбензильная, 4-метоксибензильная, 4-метоксифенилдифенилметильная, 2-нитробензильная, 4-нитробензильная, 4-хлорбензильная, 4-бромбензильная или 4-цианбензильная группа; «алкоксикарбонильную группу», включающую низшую алкоксикарбонильную группу, такую как метоксикарбонильная, этоксикарбонильная, трет-бутоксикарбонильная или изобутоксикарбонильная группа, и низшую алкоксикарбонильную группу, замещенную атомом(ами) галогена или три-низшей алкилсилильной группой(ами), такую как 2,2,2-трихлорэтоксикарбонильная или 2-триметилсилилэтоксикарбонильная группа; «алкенилоксикарбонильную группу», такую как винилоксикарбонильная или аллилоксикарбонильная группа; «аралкилоксикарбонильную группу», арильный цикл которой может быть замещенным 1 или 2 заместителями, выбранными из низшей алкоксигруппы(групп) или нитрогруппы(групп), такую как бензилоксикарбонильная, 4-метоксибензилоксикарбонильная, 3,4-диметоксибензилоксикарбонильная, 2-нитробензилоксикарбонильная или 4-нитробензилоксикарбонильная группа; неразветвленную или разветвленную алкилсульфанильную группу, содержащую от 1 до 6 углеродных атомов, такую как метилсульфанильная этилсульфанильная, н-пропилсульфанильная, изопропилсульфанильная, н-бутилсульфанильная, изобутилсульфанильная, втор-бутилсульфанильная, трет-бутилсульфанильная, н-пентилсульфанильная, изопентилсульфанильная, 2-метилбутилсульфанильная, неопентилсульфанильная, 1-этилпропилсульфанильная, н-гексилсульфанильная, изогексилсульфанильная, 4-метилпентилсульфанильная, 3-метилпентилсульфанильная, 2-метилпентилсульфанильная, 1-метилпентилсульфанильная, 3,3-диметилбутилсульфанильная, 2,2-диметилбутилсульфанильная, 1,1-диметилбутилсульфанильная, 1,2-диметилбутилсульфанильная, 1,3-диметилбутилсульфанильная, 2,3-диметилбутилсульфанильная или 2-этилбутилсульфанильная группа; или «аминоацильную группу α-аминокислоты», такую, как фенилаланин, а предпочтительно является группой, которая образует фармакологически приемлемый сложный эфир, такой как «алифатическая ацильная группа» или «ароматическая ацильная группа», или «C1-C6 алкилсульфанильной группой», такой как метилсульфанильная, этилсульфанильная, н-пропилсульфанильная, изопропилсульфанильная, н-бутилсульфанильная, изобутилсульфанильная, втор-бутилсульфанильная или трет-бутилсульфанильная группа, более предпочтительно - группой, которая образует фармакологически приемлемый сложный эфир, особенно предпочтительно - «C1-C6 алканоильной группой», такой как формильная, ацетильная, пропионильная, бутирильная, изобутирильная, пентаноильная или пивалоильная группа, и наиболее предпочтительно - ацетильной группой.
Когда соединения (I) по настоящему изобретению содержат карбоксильную группу, функциональная группа, используемая для образования их пролекарства, может представлять собой, например, «низшую алкильную группу», такую как метильная, этильная, н-пропильная, изопропильная, н-бутильная, изобутильная, втор-бутильная, трет-бутильная, н-пентильная, изопентильная, 2-метилбутильная, неопентильная, 1-этилпропильная, н-гексильная, изогексильная, 4-метилпентильная, 3-метилпентильная, 2-метилпентильная, 1-метилпентильная, 3,3-диметилбутильная, 2,2-диметилбутильная, 1,1-диметилбутильная, 1,2-диметилбутильная, 1,3-диметилбутильная, 2,3-диметилбутильная или 2-этилбутильная группа (предпочтительно C1-C6 алкильную группу); «алкокси-низшую алкильную группу», включающую низшую алкокси-низшую алкильную группу, такую как метоксиметильная, 1-этоксиэтильная, 1-метил-1-метоксиэтильная, 1-(изопропокси)этильная, 2-метоксиэтильная, 2-этоксиэтильная, 1,1-диметил-1-метоксиметильная, этоксиметильная, н-пропоксиметильная, изопропоксиметильная, н-бутоксиметильная или трет-бутоксиметильная группа, низшую алкоксилированную низшую алкокси-низшую алкильную группу, такую как 2-метоксиэтоксиметильная группа, «арил»окси«низшую алкильную группу», такую, как феноксиметильная группа, и галогенированную низшую алкокси-низшую алкильную группу, такую как 2,2,2-трихлорэтоксиметильная или бис(2-хлорэтокси)метильная группа; «низшую алкокси»карбонил«низшую алкильную группу», такую как метоксикарбонилметильная группа; циан«низшую алкильную группу», такую как цианметильная или 2-цианэтильная группа; «низшую алкил»тиометильную группу, такую как метилтиометильная или этилтиометильная группа; «арил»тиометильную группу, такую как фенилтиометильная или нафтилтиометильная группа; «низшую алкил»сульфонил«низшую алкильную группу», которая может быть замещенной атомом(ами) галогена, такую как 2-метансульфонилэтильная или 2-трифторметансульфонилэтильная группа; «арил»сульфонил«низшую алкильную группу», такую как 2-бензолсульфонилэтильная или 2-толуолсульфонилэтильная группа; ацилокси«низшую алкильную группу», включающую «алифатический ацил»окси«низшую алкильную группу», такую как формилоксиметильная, ацетоксиметильная, пропионилоксиметильная, бутирилоксиметильная, пивалоилоксиметильная, валерилоксиметильная, изовалерилоксиметильная, гексаноилоксиметильная, 1-формилоксиэтильная, 1-ацетоксиэтильная, 1-пропионилоксиэтильная, 1-бутирилоксиэтильная, 1-пивалоилоксиэтильная, 1-валерилоксиэтильная, 1-изовалерилоксиэтильная, 1-гексаноилоксиэтильная, 2-формилоксиэтильная, 2-ацетоксиэтильная, 2-пропионилоксиэтильная, 2-бутирилоксиэтильная, 2-пивалоилоксиэтильная, 2-валерилоксиэтильная, 2-изовалерилоксиэтильная, 2-гексаноилоксиэтильная, 1-формилоксипропильная, 1-ацетоксипропильная, 1-пропионилоксипропильная, 1-бутирилоксипропильная, 1-пивалоилоксипропильная, 1-валерилоксипропильная, 1-изовалерилоксипропильная, 1-гексаноилоксипропильная, 1-ацетоксибутильная, 1-пропионилоксибутильная, 1-бутирилоксибутильная, 1-пивалоилоксибутильная, 1-ацетоксипентильная, 1-пропионилоксипентильная, 1-бутирилоксипентильная, 1-пивалоилоксипентильная или 1-пивалоилоксигексильная группа, «циклоалкил»карбонилокси«низшую алкильную группу», такую как циклопентаноилоксиметильная, циклогексаноилоксиметильная, 1-циклопентаноилоксиэтильная, 1-циклогексаноилоксиэтильная, 1-циклопентаноилоксипропильная, 1-циклогексаноилоксипропильная, 1-циклопентаноилоксибутильная или 1-циклогексаноилоксибутильная группа, и «ароматический ацил»окси«низшую алкильную группу», такую как бензоилоксиметильная группа; «(алкоксикарбонилокси)алкильную группу», такую как метоксикарбонилоксиметильная, этоксикарбонилоксиметильная, пропоксикарбонилоксиметильная, изопропоксикарбонилоксиметильная, бутоксикарбонилоксиметильная, изобутоксикарбонилоксиметильная, пентилоксикарбонилоксиметильная, гексилоксикарбонилоксиметильная, циклогексилоксикарбонилоксиметильная, циклогексилоксикарбонилокси(циклогексил)метильная, 1-(метоксикарбонилокси)этильная, 1-(этоксикарбонилокси)этильная, 1-пропоксикарбонилоксиэтильная, 1-(изопропоксикарбонилокси)этильная, 1-бутоксикарбонилоксиэтильная, 1-изобутоксикарбонилоксиэтильная, 1-(трет-бутоксикарбонилокси)этильная, 1-пентилоксикарбонилоксиэтильная, 1-гексилоксикарбонилоксиэтильная, 1-циклопентилоксикарбонилоксиэтильная, 1-циклопентилоксикарбонилоксипропильная, 1-циклогексилоксикарбонилоксипропильная, 1-циклопентилоксикарбонилоксибутильная, 1-циклогексилоксикарбонилоксибутильная, 1-(циклогексилоксикарбонилокси)этильная, 1-(этоксикарбонилокси)пропильная, 2-метоксикарбонилоксиэтильная, 2-этоксикарбонилоксиэтильная, 2-пропоксикарбонилоксиэтильная, 2-изопропоксикарбонилоксиэтильная, 2-бутоксикарбонилоксиэтильная, 2-изобутоксикарбонилоксиэтильная, 2-пентилоксикарбонилоксиэтильная, 2-гексилоксикарбонилоксиэтильная, 1-метоксикарбонилоксипропильная, 1-этоксикарбонилоксипропильная, 1-пропоксикарбонилоксипропильная, 1-изопропоксикарбонилоксипропильная, 1-бутоксикарбонилоксипропильная, 1-изобутоксикарбонилоксипропильная, 1-пентилоксикарбонилоксипропильная, 1-гексилоксикарбонилоксипропильная, 1-метоксикарбонилоксибутильная, 1-этоксикарбонилоксибутильная, 1-пропоксикарбонилоксибутильная, 1-изопропоксикарбонилоксибутильная, 1-бутоксикарбонилоксибутильная, 1-изобутоксикарбонилоксибутильная, 1-метоксикарбонилоксипентильная, 1-этоксикарбонилоксипентильная, 1-метоксикарбонилоксигексильная или 1-этоксикарбонилоксигексильная группа; «карбонилоксиалкильную группу», включающую оксодиоксоленилметильную группу, такую как (5-фенил-2-оксо-1,3-диоксолен-4-ил)метильная, [5-(4-метилфенил)-2-оксо-1,3-диоксолен-4-ил]метильная, [5-(4-метоксифенил)-2-оксо-1,3-диоксолен-4-ил]метильная, [5-(4-фторфенил)-2-оксо-1,3-диоксолен-4-ил]метильная, [5-(4-хлорфенил)-2-оксо-1,3-диоксолен-4-ил]метильная, (2-оксо-1,3-диоксолен-4-ил)метильная, (5-метил-2-оксо-1,3-диоксолен-4-ил)метильная, (5-этил-2-оксо-1,3-диоксолен-4-ил)метильная, (5-пропил-2-оксо-1,3-диоксолен-4-ил)метильная, (5-изопропил-2-оксо-1,3-диоксолен-4-ил)метильная или (5-бутил-2-оксо-1,3-диоксолен-4-ил)метильная группа; «фталидильную группу», такую как фталидильная, диметилфталидильная или диметоксифталидильная группа; «арильную группу», такую как фенильная или инданильная группа; «карбоксиалкильную группу», такую как карбоксиметильная группа; или «остаточную группу, образующую амид аминокислоты», такую как фенилаланин, а предпочтительно является группой, которая образует фармакологически приемлемые сложные эфиры, такой как «алкильная группа», «алкоксиалкильная группа», «карбонилоксиалкильная группа» или (алкоксикарбонилокси)алкильная группа, более предпочтительно - «C1-C6 алкильной группой», такой как метильная, этильная, н-пропильная, изопропильная, н-бутильная, изобутильная, втор-бутильная, трет-бутильная, н-пентильная, изопентильная, 2-метилбутильная, неопентильная, 1-этилпропильная, н-гексильная, изогексильная, 4-метилпентильная, 3-метилпентильная, 2-метилпентильная или 1-метилпентильная группа, и особенно предпочтительно - метильной или этильной группой.
Когда соединения (I) по настоящему изобретению содержат гидроксильную группу, функциональная группа, используемая для образования их пролекарства, может представлять собой, например, «алифатическую ацильную группу», включающую алкилкарбонильную группу, такую как формильная, ацетильная, пропионильная, бутирильная, изобутирильная, пентаноильная, пивалоильная, валерильная, изовалерильная, октаноильная, нонаноильная, деканоильная, 3-метилнонаноильная, 8-метилнонаноильная, 3-этилоктаноильная, 3,7-диметилоктаноильная, ундеканоильная, додеканоильная, тридеканоильная, тетрадеканоильная, пентадеканоильная, гексадеканоильная, 1-метилпентадеканоильная, 14-метилпентадеканоильная, 13,13-диметилтетрадеканоильная, гептадеканоильная, 15-метилгексадеканоильная, октадеканоильная, 1-метилгептадеканоильная, нонадеканоильная, эйкозаноильная или генэйкозаноильная группа, карбоксилированную алкилкарбонильную группу, такую как сукциноильная, глутароильная или адипоильная группа, галоген-низшую алкилкарбонильную группу, такую как хлорацетильная, дихлорацетильная, трихлорацетильная или трифторацетильная группа, низшую алкокси-низшую алкилкарбонильную группу, такую как метоксиацетильная группа, и ненасыщенную алкилкарбонильную группу, такую как (E)-2-метил-2-бутеноильная группа (предпочтительно C1-C6 алканоильную группу); «ароматическую ацильную группу», включающую арилкарбонильную группу, такую как бензоильная, α-нафтоильную или β-нафтоильную группу, галогенарилкарбонильную группу, такую как 2-бромбензоильная или 4-хлорбензоильная группа, низшую алкилированную арилкарбонильную группу, такую как 2,4,6-триметилбензоильная или 4-толуоильная группа, низшую алкоксилированную арилкарбонильную группу, такую как 4-анизоильная группа, карбоксилированную арилкарбонильную группу, такую как 2-карбоксибензоильная, 3-карбоксибензоильная или 4-карбоксибензоильная группа, нитрованную арилкарбонильную группу, такую как 4-нитробензоильная или 2-нитробензоильная группа, низшую алкоксикарбонилированную арилкарбонильную группу, такую как 2-(метоксикарбонил)бензоильная группа, и арилированную арилкарбонильную группу, такую как 4-фенилбензоильная группа; ацилоксиалкильную группу, такую как этилкарбонилоксиметильная, пивалоилоксиметильная, диметиламиноацетилоксиметильная или 1-ацетоксиэтильная группа; 1-(алкоксикарбонилокси)алкильную группу, такую как 1-(метоксикарбонилокси)этильная, 1-(этоксикарбонилокси)этильная, этоксикарбонилоксиметильная, 1-(изопропоксикарбонилокси)этильная, 1-(трет-бутоксикарбонилокси)этильная, 1-(этоксикарбонилокси)пропильная или 1-(циклогексилоксикарбонилокси)этильная группа; фталидильную группу; «карбонилоксиалкильную группу», включающую оксодиоксоленилметильную группу, такую как 4-метилоксодиоксоленилметильная, 4-фенилоксодиоксоленилметильная или оксодиоксоленилметильная группа; «остаточную группу соли полуэфира янтарной кислоты»; «остаточную группу соли сложного эфира фосфорной кислоты»; «остаточную группу, образующую сложный эфир аминокислоты»; карбамоильную группу; карбамоильную группу, замещенную 1 или 2 низшими алкильными группами; или «карбонилоксиалкилоксикарбонильную группу», такую как пивалоилоксиметоксикарбонильная группа, а предпочтительно является группой, которая образует фармакологически приемлемый сложный эфир, такую как «алифатическая ацильная группа» или «ароматическая ацильная группа», более предпочтительно - «C1-C6 алканоильной группой», такой как ацетильная, пропионильная, бутирильная, изобутирильная, пентаноильная или пивалоильная группа, и особенно предпочтительно - ацетильной группой.
Когда соединения (I) по настоящему изобретению содержат аминогруппу, функциональная группа, используемая для образования их пролекарства может представлять собой, например, алифатическую ацильную группу, состоящую из: алканоильной группы, такой как формильная, ацетильная, пропионильная, бутирильная, изобутирильная, пентаноильная, пивалоильная, валерильная, изовалерильная, октаноильная, лауроильная, пальмитоильная или стеароильная группа, галоген-низшей алкилкарбонильной группы, такой как хлорацетильная, дихлорацетильная, трихлорацетильная или трифторацетильная группа, низшей алкокси-низшей алкилкарбонильной группы, такой как метоксиацетильная группа, и ненасыщенной алкилкарбонильной группы, такой как (E)-2-метил-2-бутеноильная группа (предпочтительно C1-C6 алканоильной группы); ароматическую ацильную группу, состоящую из: арилкарбонильной группы, такой как бензоильная, α-нафтоильная или β-нафтоильная группа, галогенарилкарбонильной группы, такой как 2-бромбензоильная или 4-хлорбензоильная группа, низшей алкилированной арилкарбонильной группы, такой, как 2,4,6-триметилбензоильная или 4-толуоильная группа, низшей алкоксилированной арилкарбонильной группы, такой как 4-анизоильная группа, нитрованной арилкарбонильной группы, такой как 4-нитробензоильная или 2-нитробензоильная группа, низшей алкоксикарбонилированной арилкарбонильной группы, такой как 2-(метоксикарбонил)бензоильная группа, и арилированной арилкарбонильной группы, такой как 4-фенилбензоильная группа; алкоксикарбонильную группу, включающую низшую алкоксикарбонильную группу, такую как метоксикарбонильная, этоксикарбонильная, трет-бутоксикарбонильная или изобутоксикарбонильная группа, и низшую алкоксикарбонильную группу, замещенную атомом(ами) галогена или три-низшей алкилсилильной группой(ами), такую как 2,2,2-трихлорэтоксикарбонильная или 2-триметилсилилэтоксикарбонильная группа; алкенилоксикарбонильную группу, такую как винилоксикарбонильная или аллилоксикарбонильная группа; и арилоксикарбонильную группу, арильный цикл которой может быть замещенным 1 или 2 заместителями, выбранными из низшей алкоксигруппы(групп), нитрогруппы(групп) и атома(ов) галогена, такую как феноксикарбонильная, 4-метоксифеноксикарбонильная, 3,4-диметоксифеноксикарбонильная, 2-нитрофеноксикарбонильная, 4-нитрофеноксикарбонильная или 4-фторфеноксикарбонильная группа, а предпочтительно является C1-C6 алканоильной группой.
«Пролекарство» соединений, имеющих формулу (I), предпочтительно представляет собой их фармакологически приемлемые сложные эфиры, которые получают преобразованием сульфанильной группы, карбоксильной группы или гидроксильной группы, находящихся в указанных соединениях, соответственно.
«Их фармакологически приемлемые соли» означает соль, которую получают из соединений (I) по настоящему изобретению. Указанная соль представляет собой предпочтительно соль металла, включающую соль щелочного металла, такую как натриевая соль, калиевая соль или литиевая соль, соль щелочноземельного металла, такую как кальциевая соль или магниевая соль, алюминиевую соль, железную соль, цинковую соль, медную соль, никелевую соль и кобальтовую соль; соль амина, включающую неорганическую соль, такую как аммониевая соль, и органическую соль, такую как трет-октиламиновую соль, дибензиламиновую соль, морфолиновую соль, глюкозаминовую соль, соль алкилового сложного эфира фенилглицина, этилендиаминовую соль, N-метилглюкаминовую соль, гуанидиновую соль, диэтиламиновую соль, триэтиламиновую соль, дициклогексиламиновую соль, N,N'-дибензилэтилендиаминовую соль, хлорпрокаиновую соль, прокаиновую соль, диэтаноламиновую соль, N-бензилфенетиламиновую соль, пиперазиновую соль, тетраметиламмониевую соль или трис(гидроксиметил)аминометановую; соль неорганической кислоты, включающую соль галогеноводородной кислоты, такую как гидрофторид, гидрохлорид, гидробромид или гидроиодид, нитрат, перхлорат, сульфат и фосфат; низший алкансульфонат, такой как метансульфонат, трифторметансульфонат или этансульфонат; арилсульфонат, такой как бензолсульфонат или п-толуолсульфонат; соль органической кислоты, такую как ацетат, малат, фумарат, сукцинат, цитрат, тартрат, оксалат или малеат; или соль аминокислоты, такую как глициновая соль, лизиновая соль, аргининовая соль, орнитиновая соль, соль глутаминовой кислоты или соль аспарагиновой кислоты, а более предпочтительно соль неорганической кислоты.
Кроме того, соединения (I) по настоящему изобретению могут существовать в виде их гидратов.
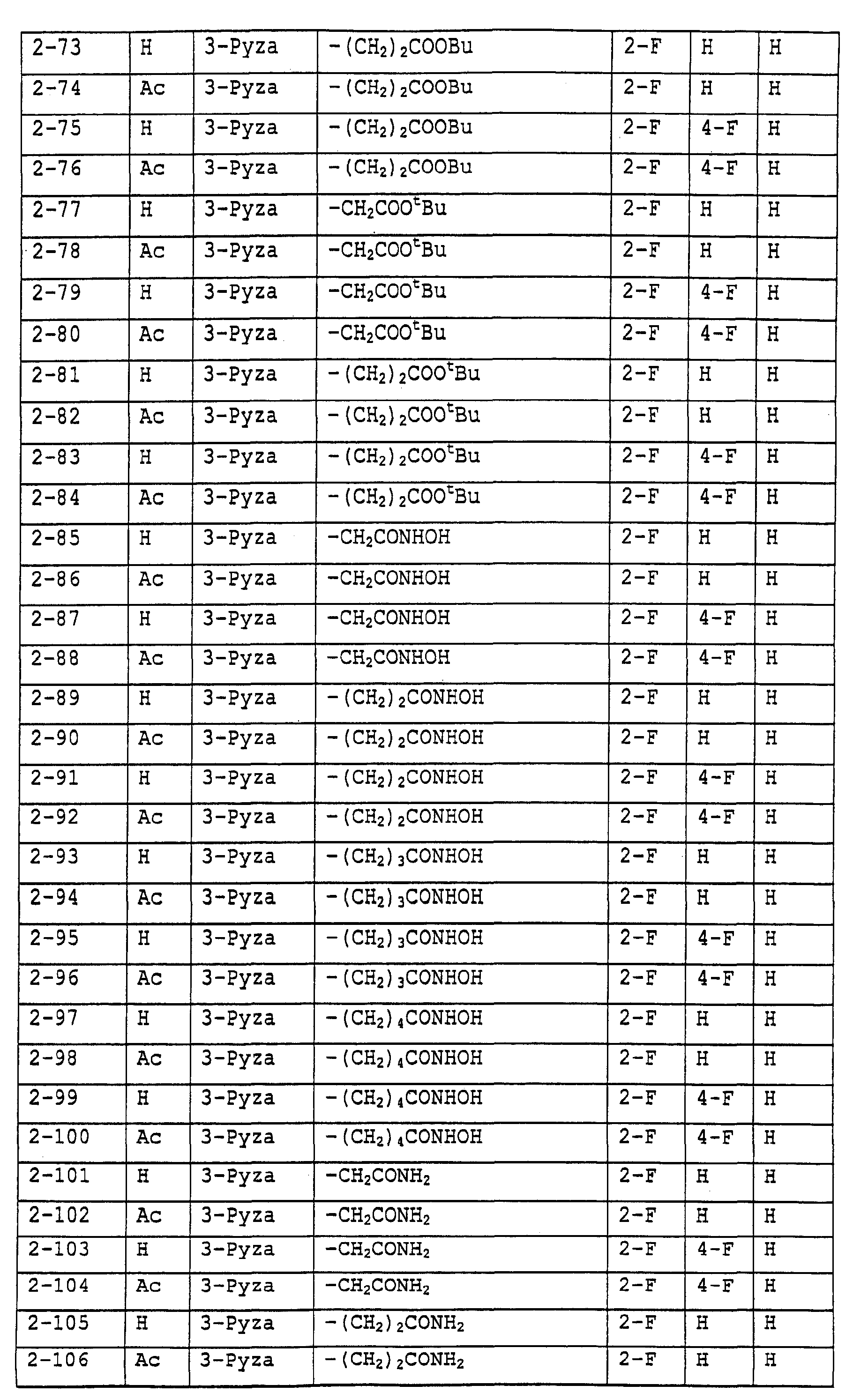
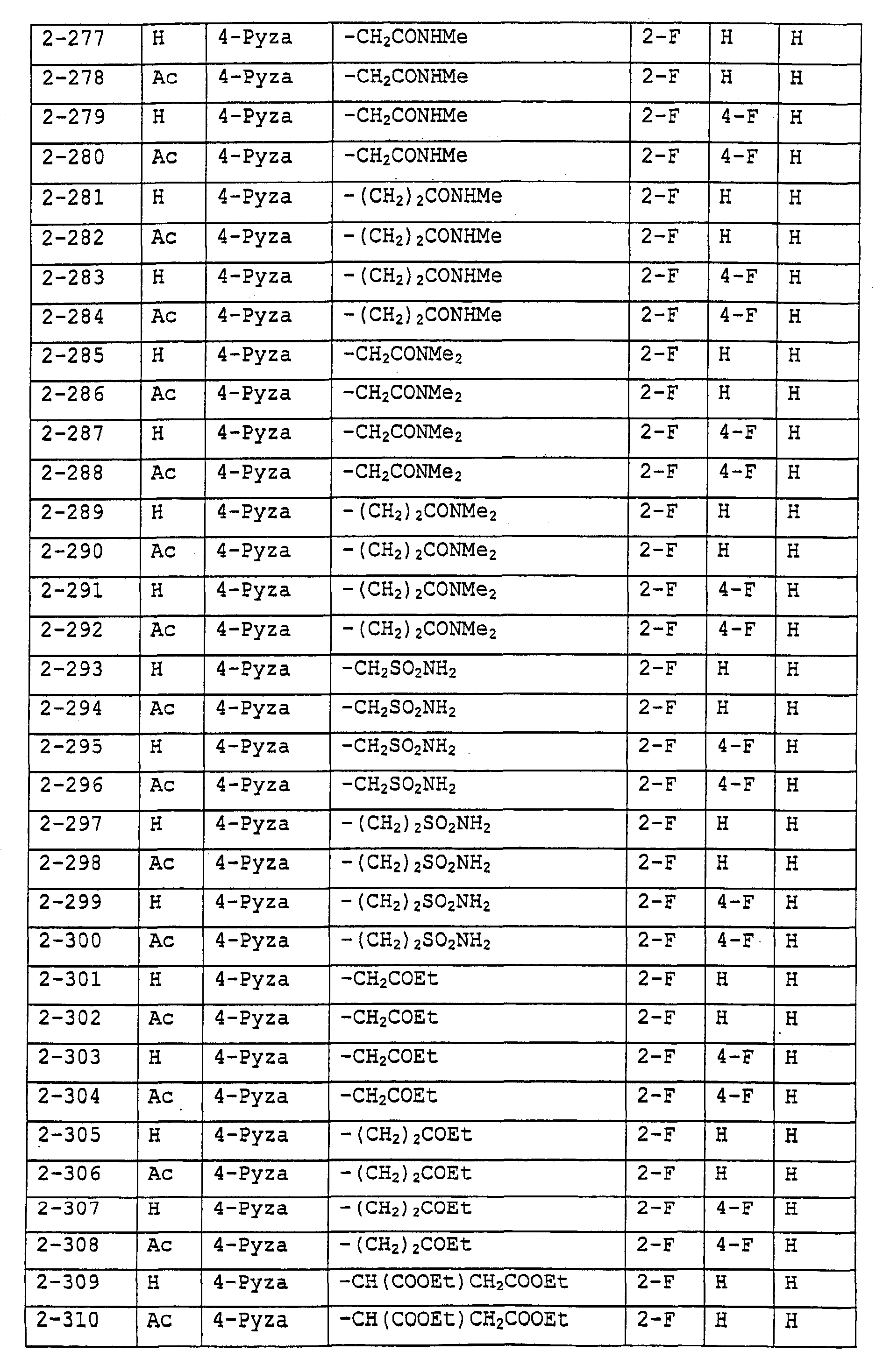
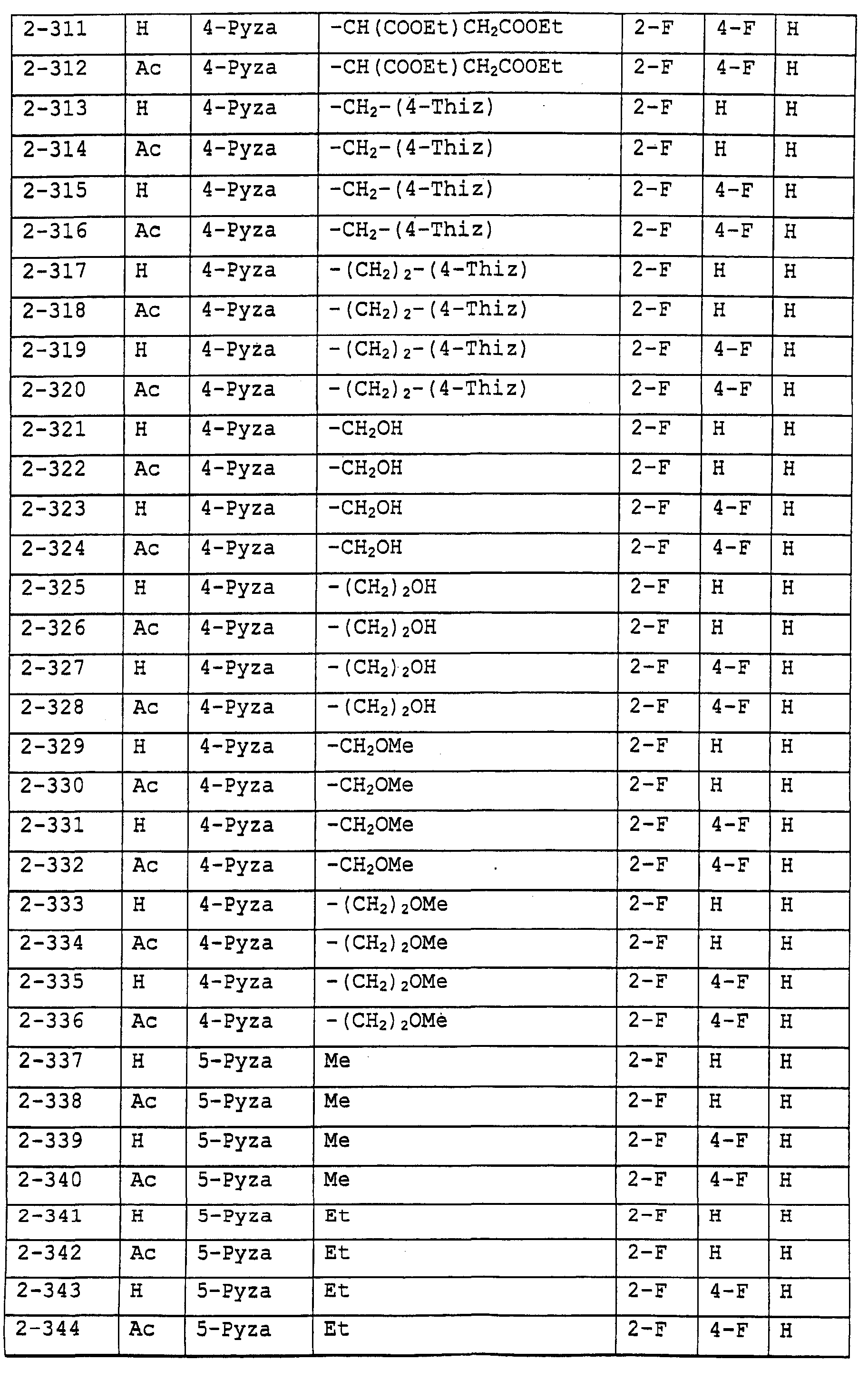
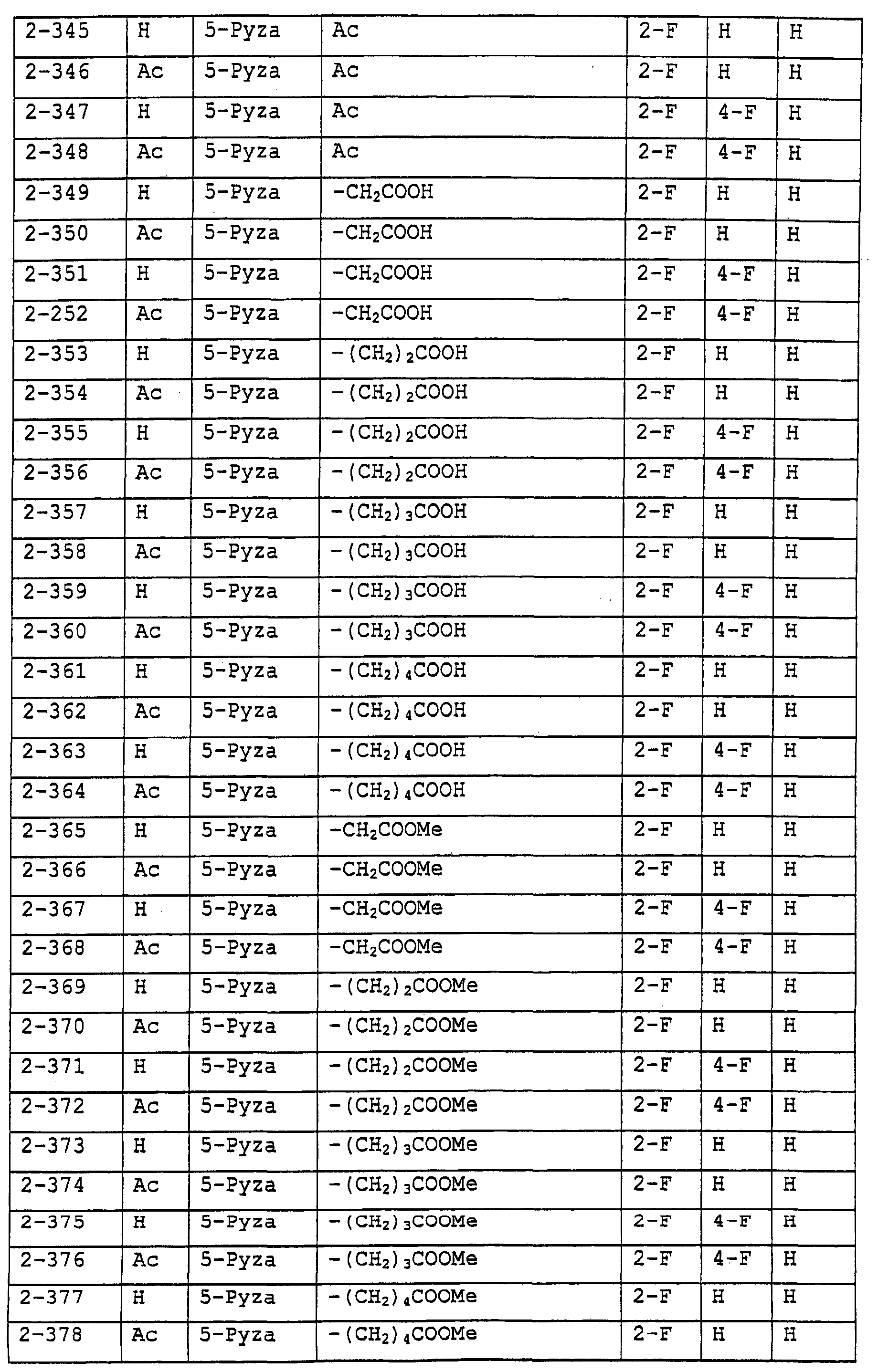
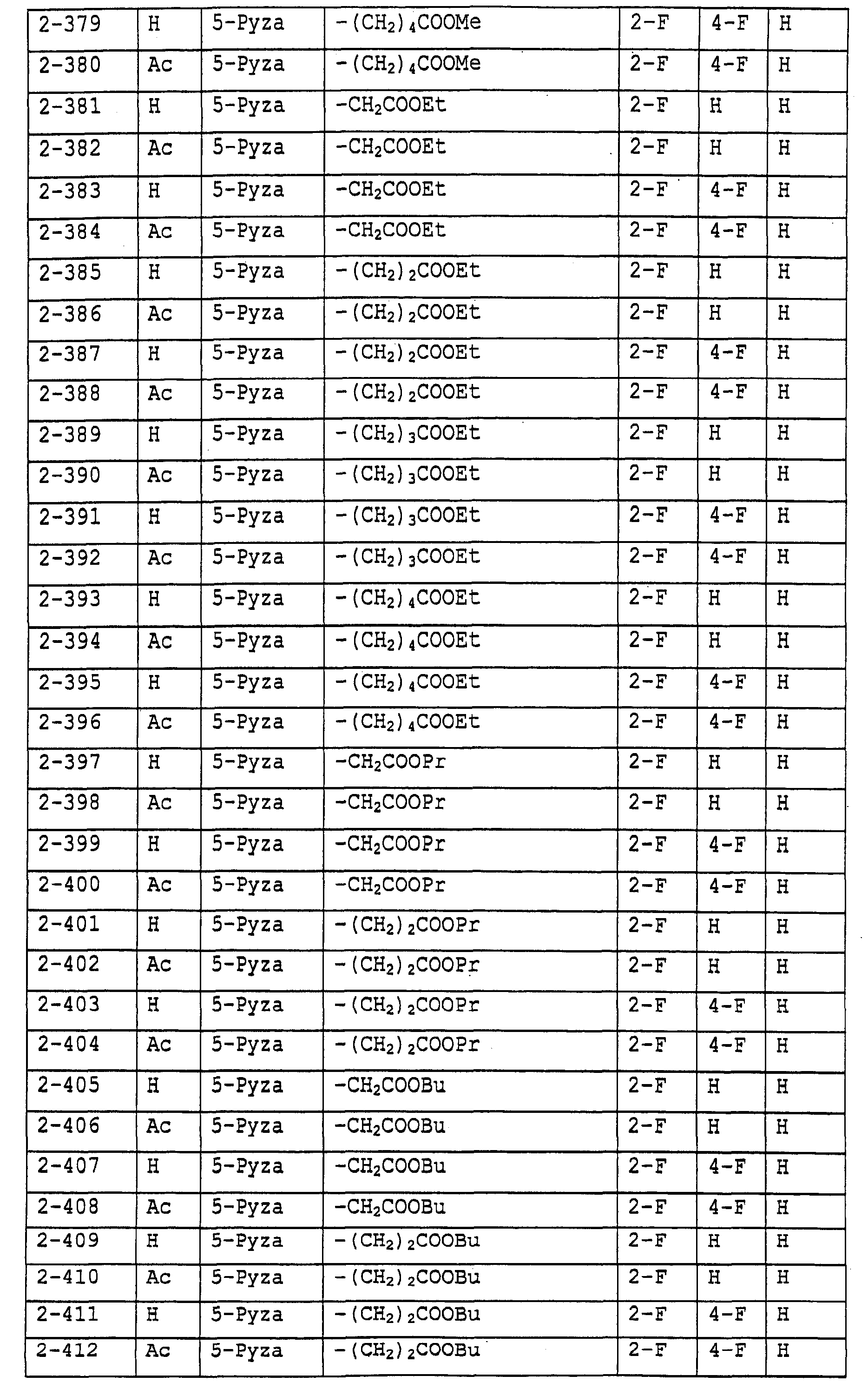
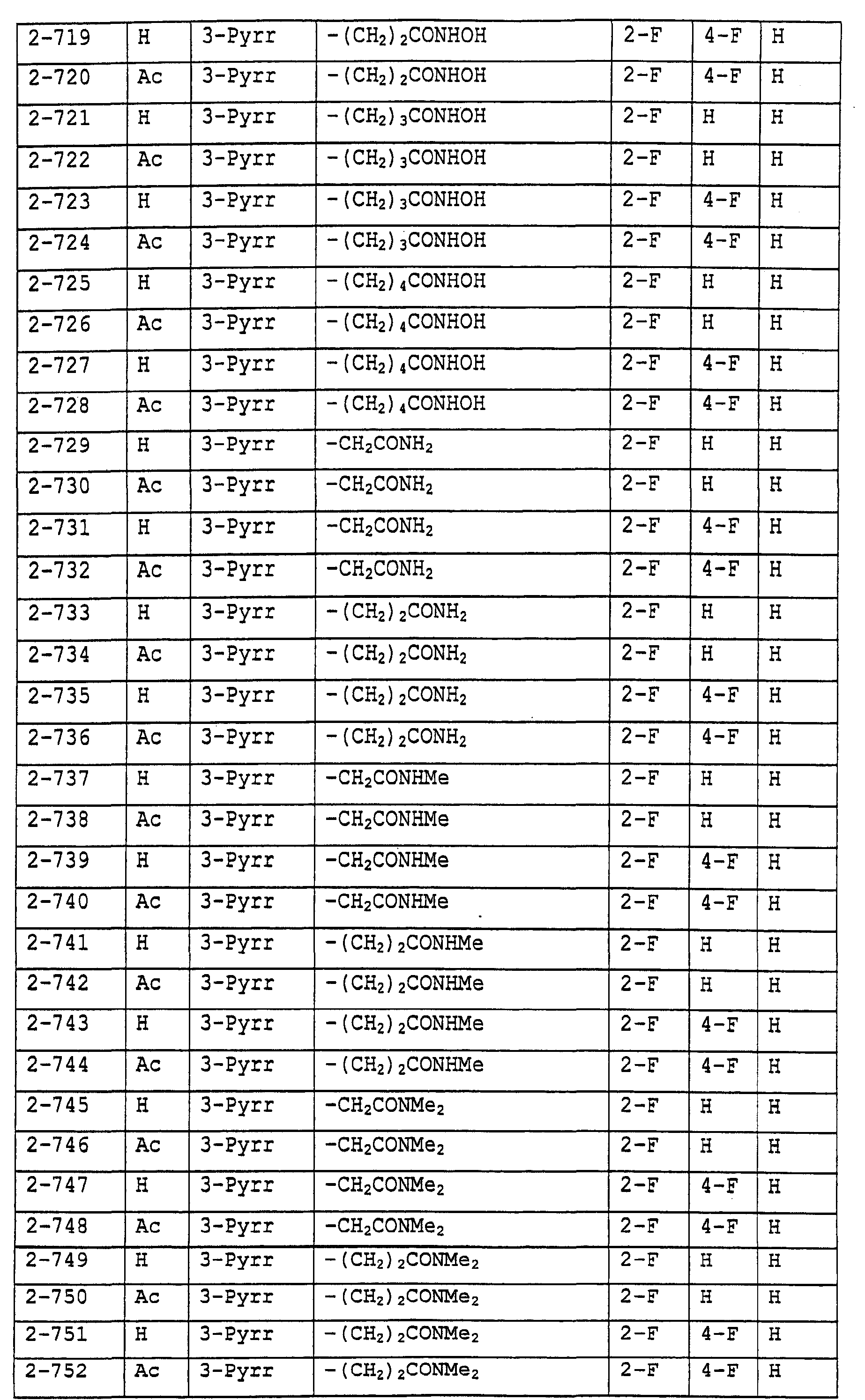
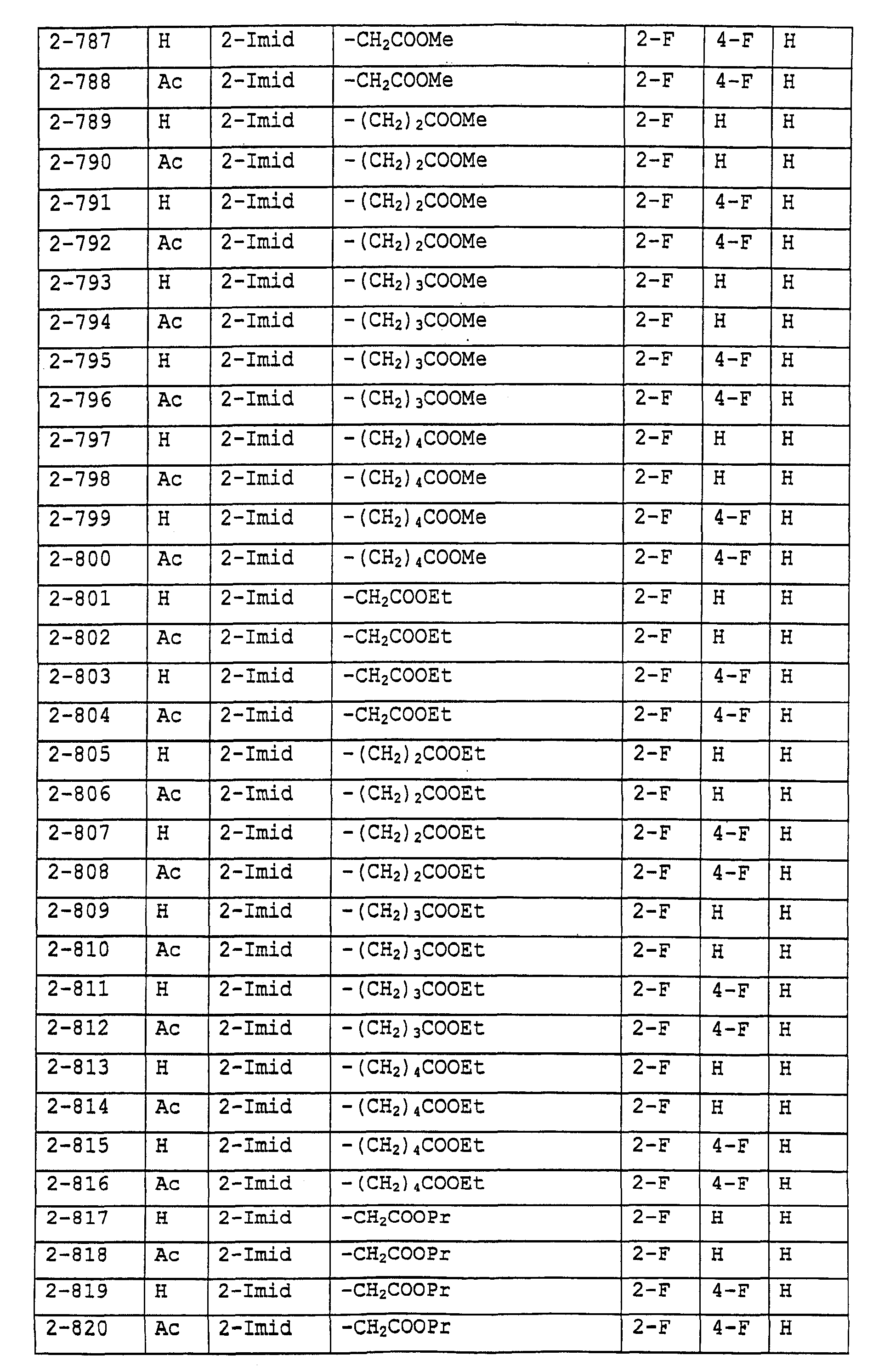
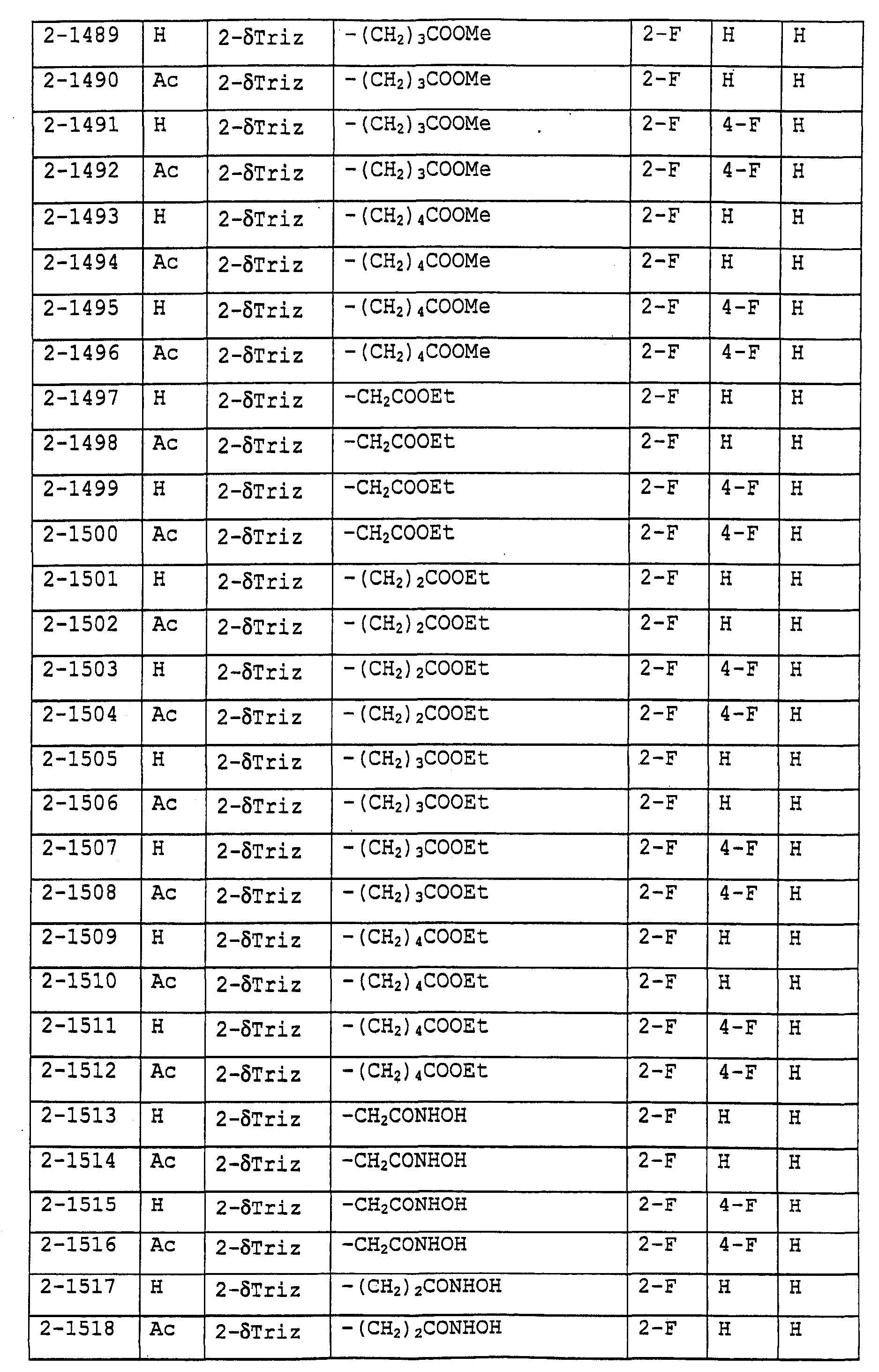
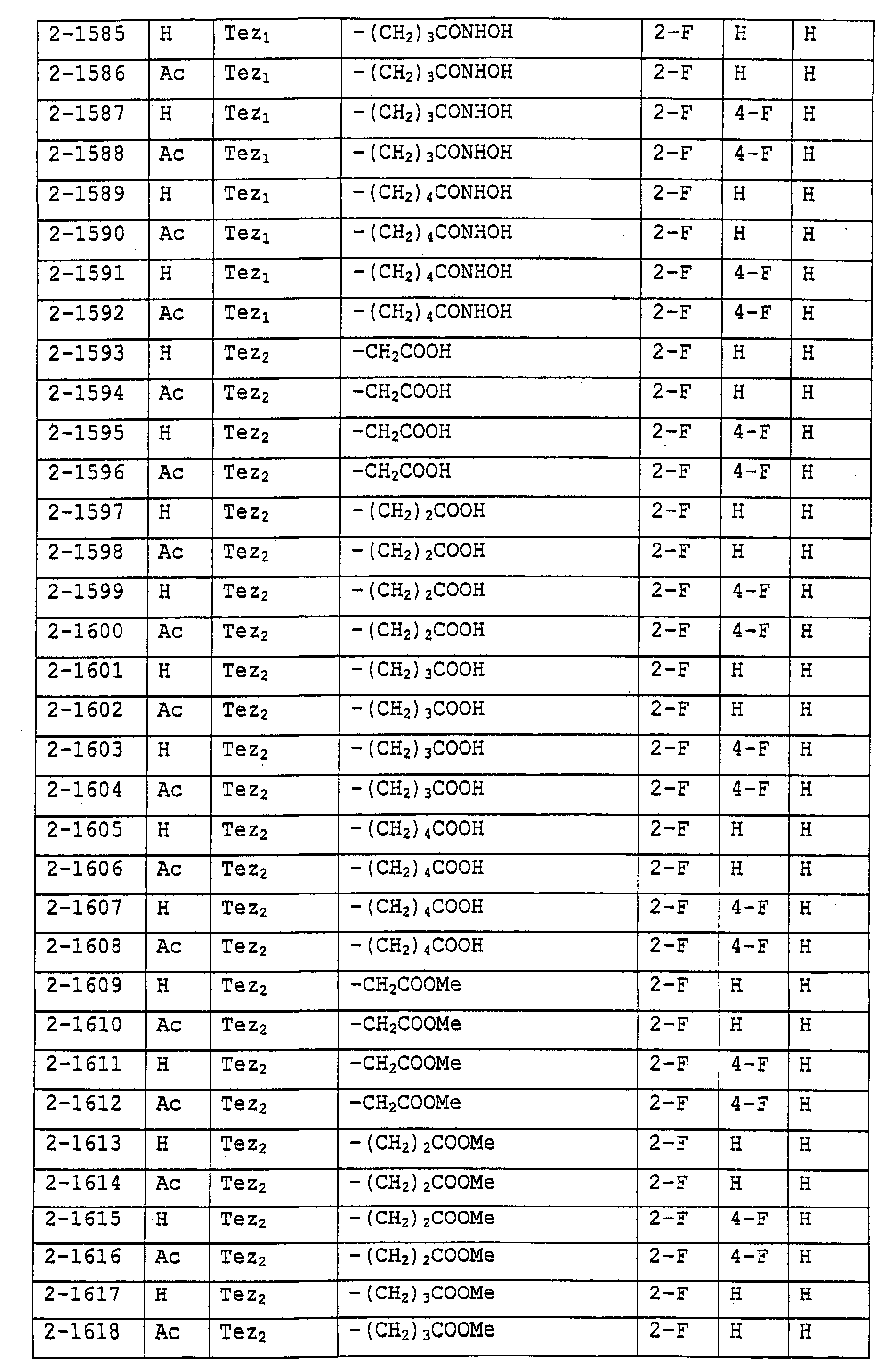
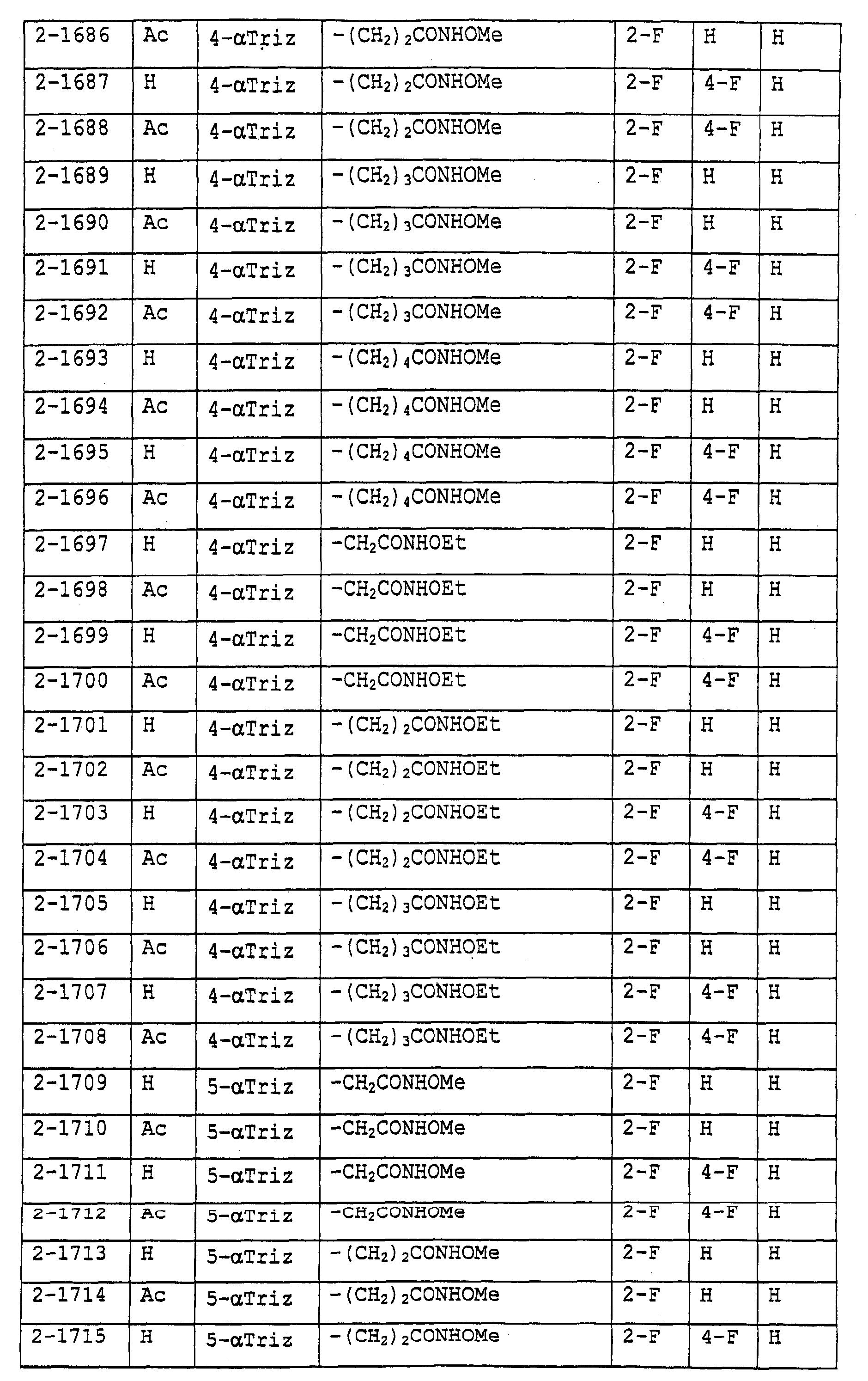
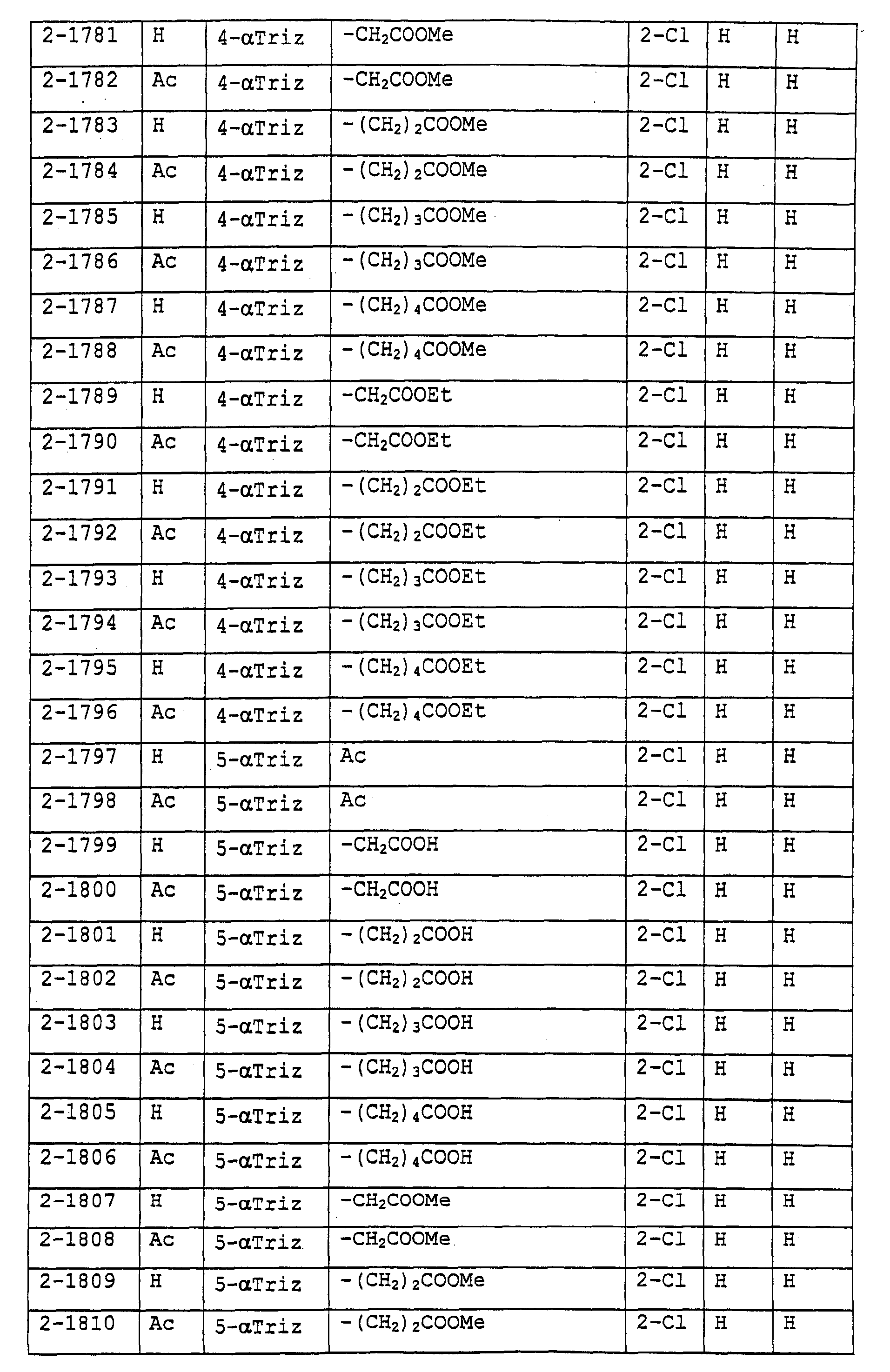
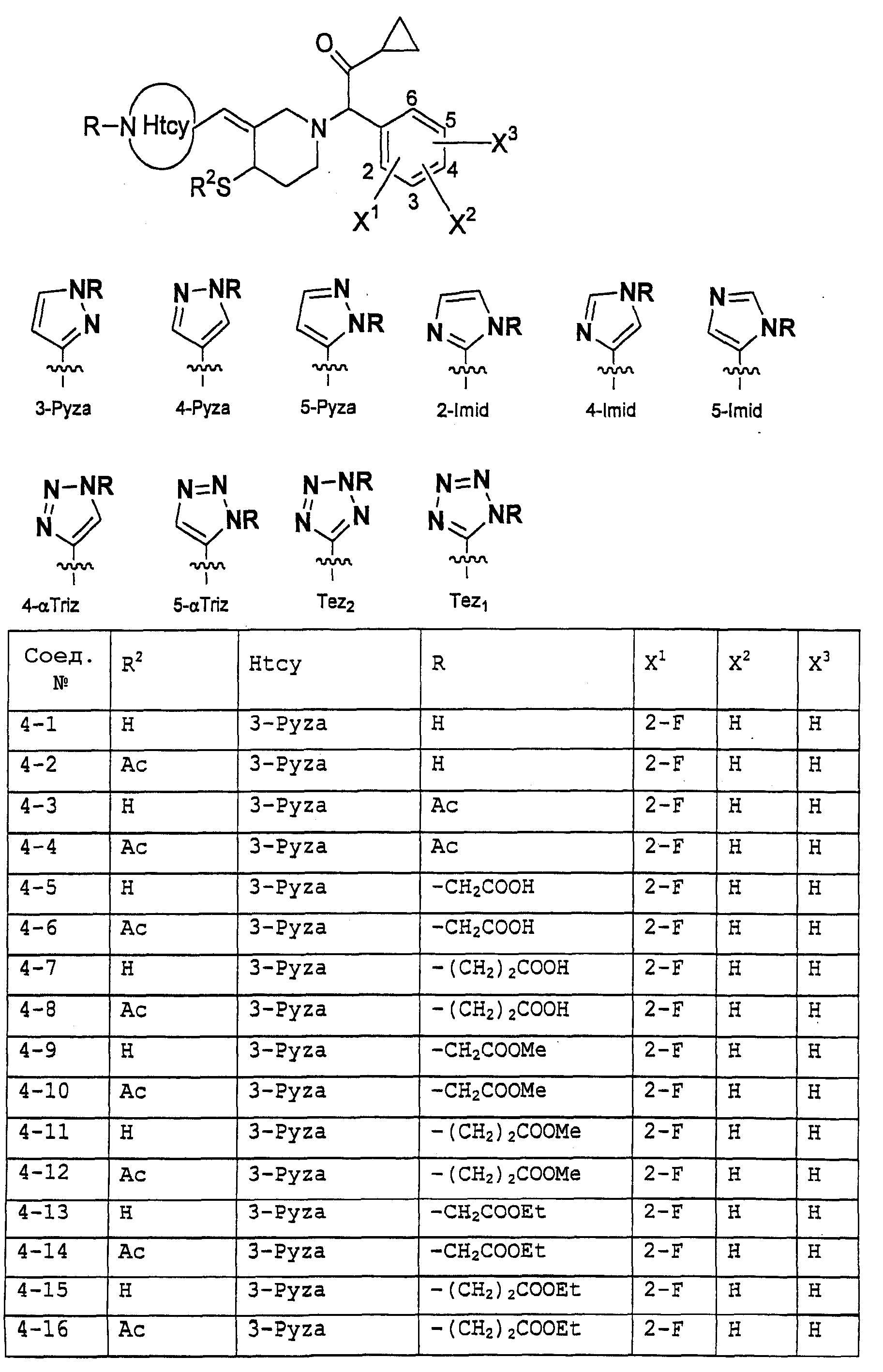
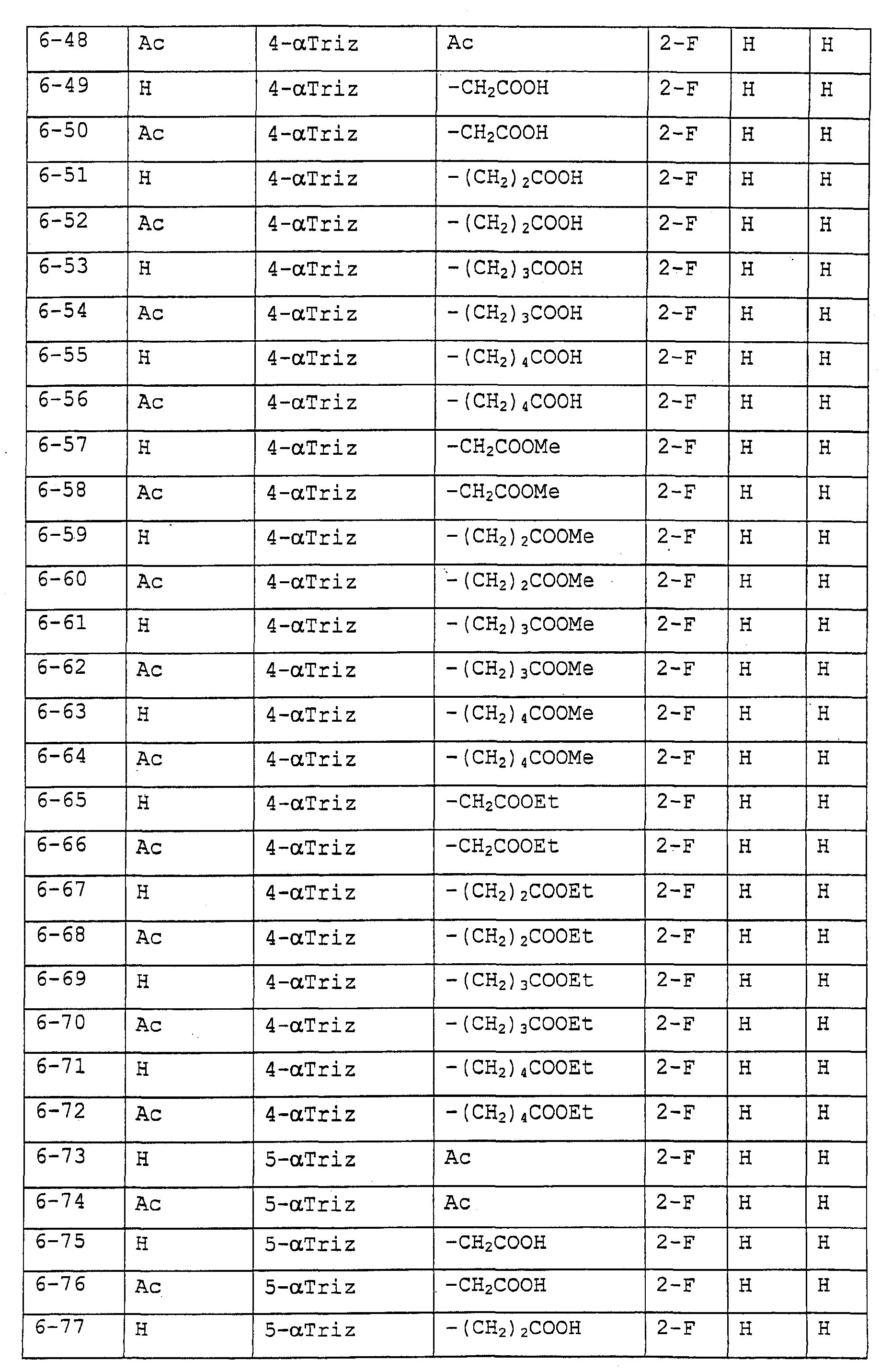
Предпочтительными примерами соединений общей формулы (I) могут быть конкретно представленные в таблицах 1-6 соединения, но объем настоящего изобретения не должен быть ограничен указанными соединениями.
Ниже показаны значения сокращений в следующих далее таблицах.
Ac: ацетильная группа
Me: метильная группа
Et: этильная группа
N-AcCys: N-ацетилцистеинильная группа
Ph: фенильная группа
2-Thi: 2-тиенильная группа
3-Thi: 3-тиенильная группа
2-Fur: 2-фурильная группа
3-Fur: 3-фурильная группа
3-Pyza: пиразол-3-ильная группа
4-Pyza: пиразол-4-ильная группа
5-Pyza: пиразол-5-ильная группа
1,3,4-dMePyza: 1,3-диметилпиразол-4-ильная группа
1,3,5-dMePyza: 1,3-диметилпиразол-5-ильная группа
2-Thiz: 1,3-тиазол-2-ильная группа
4-Thiz: 1,3-тиазол-4-ильная группа
5-Thiz: 1,3-тиазол-5-ильная группа
4,2-NH2Thiz: 4-амино-1,3-тиазол-2-ильная группа
2,4-NH2Thiz: 2-амино-1,3-тиазол-4-ильная группа
2,5-NH2Thiz: 2-амино-1,3-тиазол-5-ильная группа
2-Imid: имидазол-2-ильная группа
4-Imid: имидазол-4-ильная группа
5-Imid: имидазол-5-ильная группа
Tez: тетразол-5-ильная группа
4-Triz1: 1,2,3-триазол-4-ильная группа
3-Triz2: 1,2,4-триазол-3-ильная группа
2-Pyr: 2-пиридильная группа
3-Pyr: 3-пиридильная группа
4-Pyr: 4-пиридильная группа
6,2-MePyr: 6-метилпиридин-2-ильная группа
2-Oxa: 1,3-оксазол-2-ильная группа
4-Oxa: 1,3-оксазол-4-ильная группа
5-Oxa: 1,3-оксазол-5-ильная группа
3-Isox: изоксазол-3-ильная группа
4-Isox: изоксазол-4-ильная группа
5-Isox: изоксазол-5-ильная группа
4-αThiad: 1,2,3-тиадиазол-4-ильная группа
5-αThiad: 1,2,3-тиадиазол-5-ильная группа
3-βThiad: 1,2,4-тиадиазол-3-ильная группа
5-βThiad: 1,2,4-тиадиазол-5-ильная группа
3-γThiad: 1,2,5-тиадиазол-3-ильная группа
3-Ind: индол-3-ильная группа
3-Quin: 3-хинолильная группа
3-Pyzn: пиридазин-3-ильная группа
4-Pyzn: пиридазин-4-ильная группа
4-αOxdad: 1,2,3-оксадиазол-4-ильная группа
5-αOxdad: 1,2,3-оксадиазол-5-ильная группа
3-βOxdad: 1,2,4-оксадиазол-3-ильная группа
5-βOxdad: 1,2,4-оксадиазол-5-ильная группа
3-γOxdad: 1,2,5-оксадиазол-3-ильная группа
2-Pyrr: 2-пиррол-2-ильная группа
3-Pyrr: 2-пиррол-3-ильная группа
2-Pyz: пиразин-2-ильная группа
2-Pym: пиримидин-2-ильная группа
4-Pym: пиримидин-4-ильная группа
5-Pym: пиримидин-5-ильная группа
(Таблица 1)







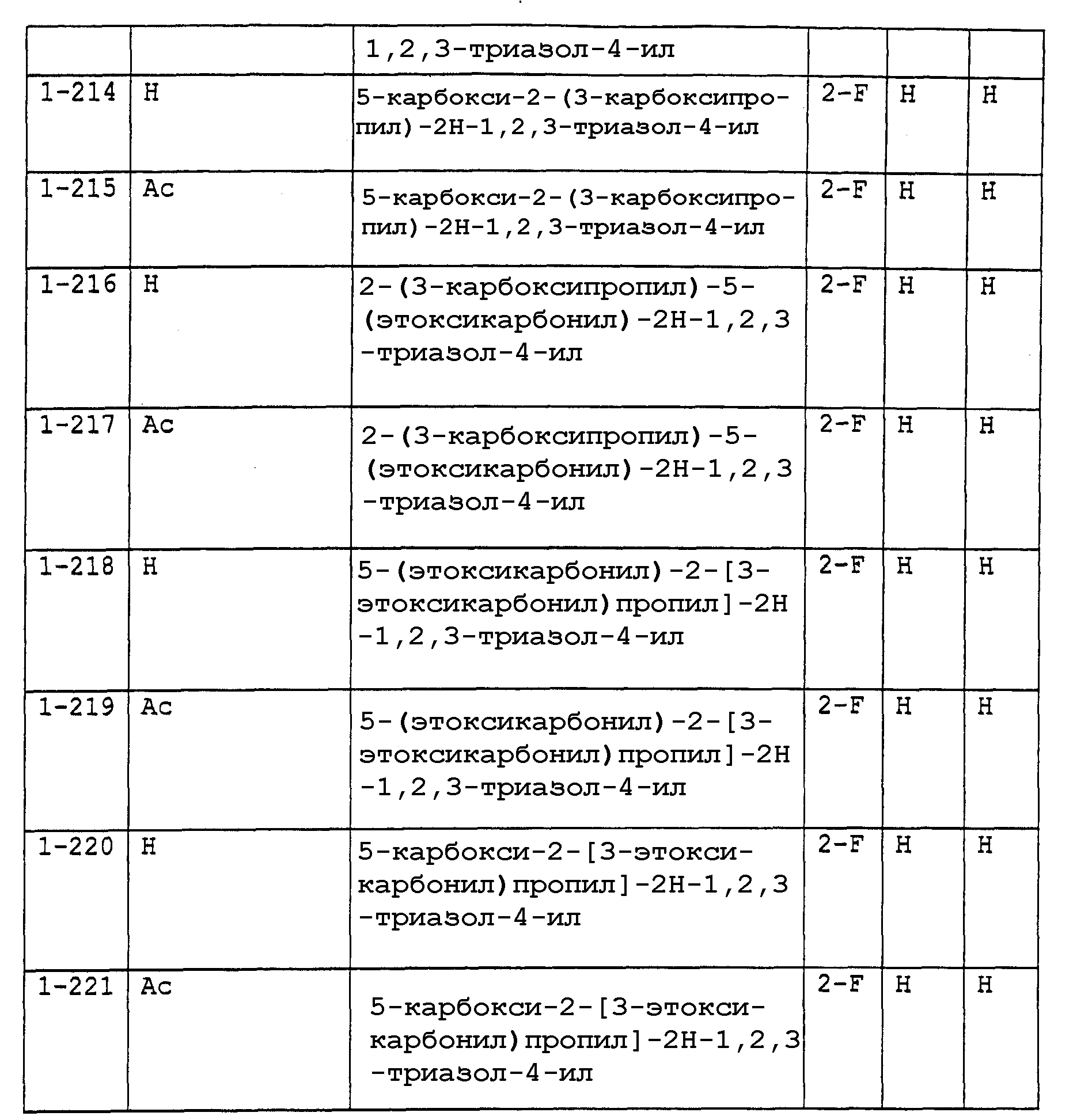
Когда группа R3, показанная в таблице 1, представляет собой пиразолильную группу, триазолильную группу и тетразолильную группу, присутствуют таутомеры, обусловленные положением атома водорода. Названные в качестве примеров соединения включают все указанные таутомеры.
(Таблица 2)
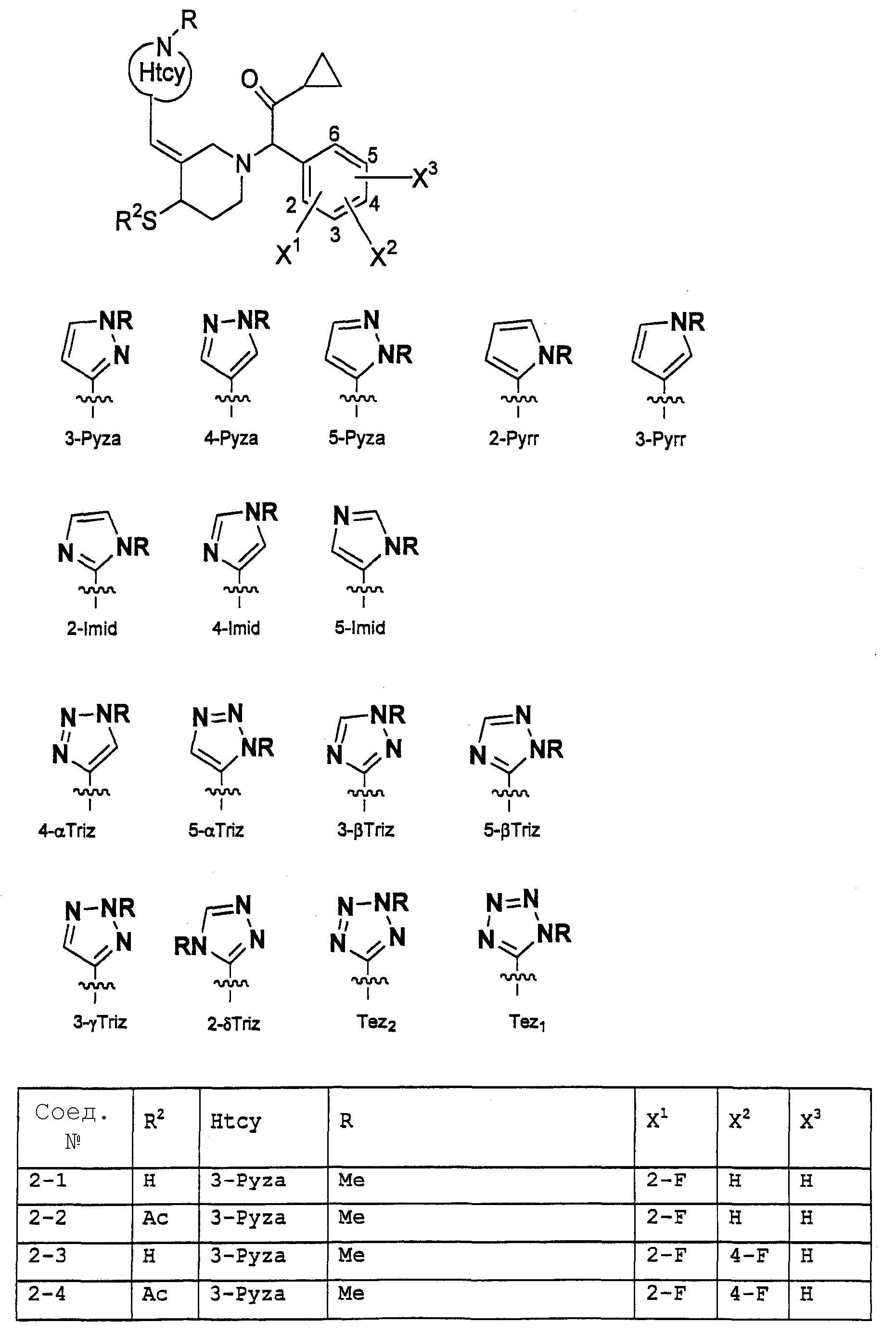
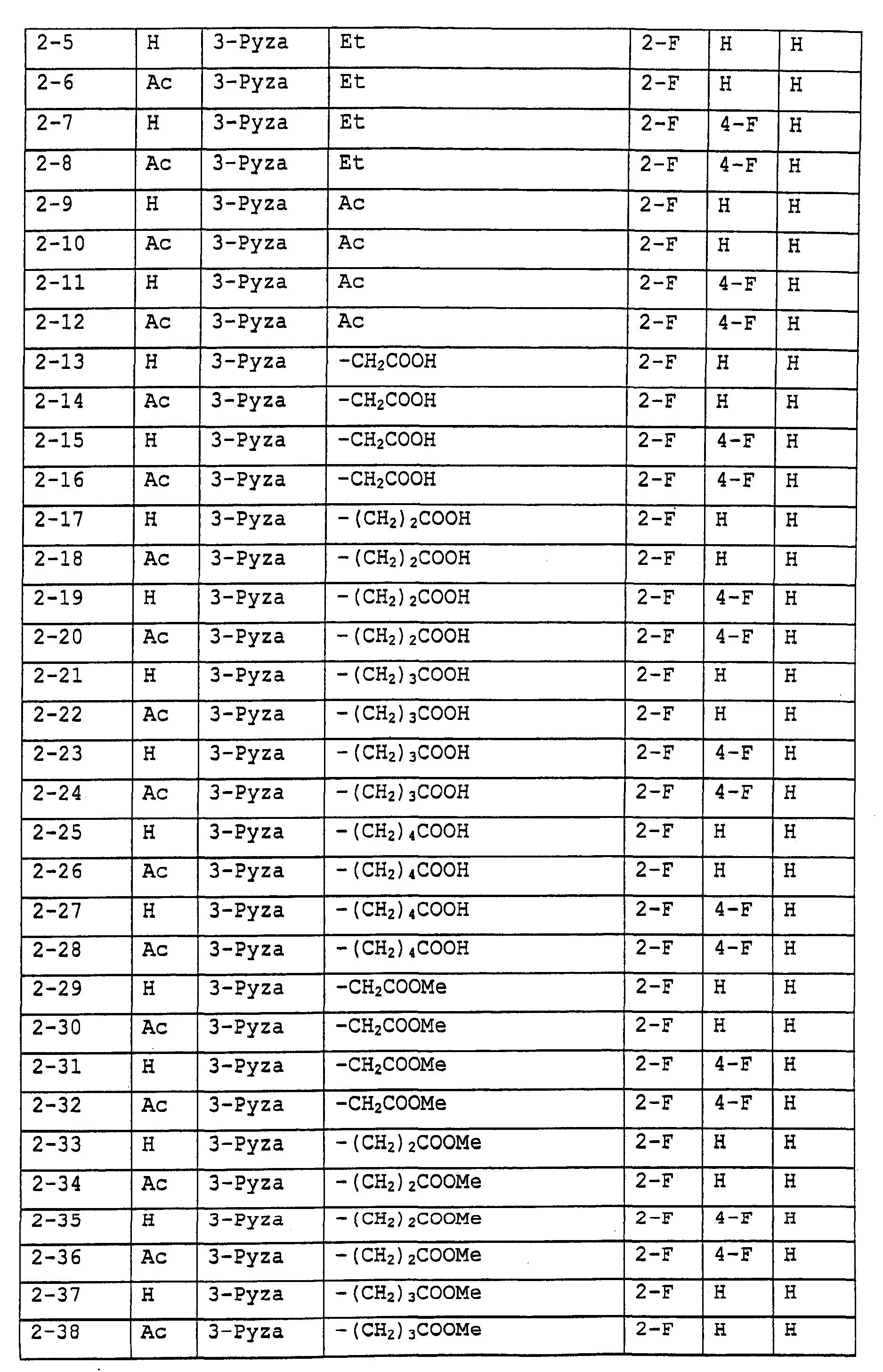












































(Таблица 3)

(Таблица 4)

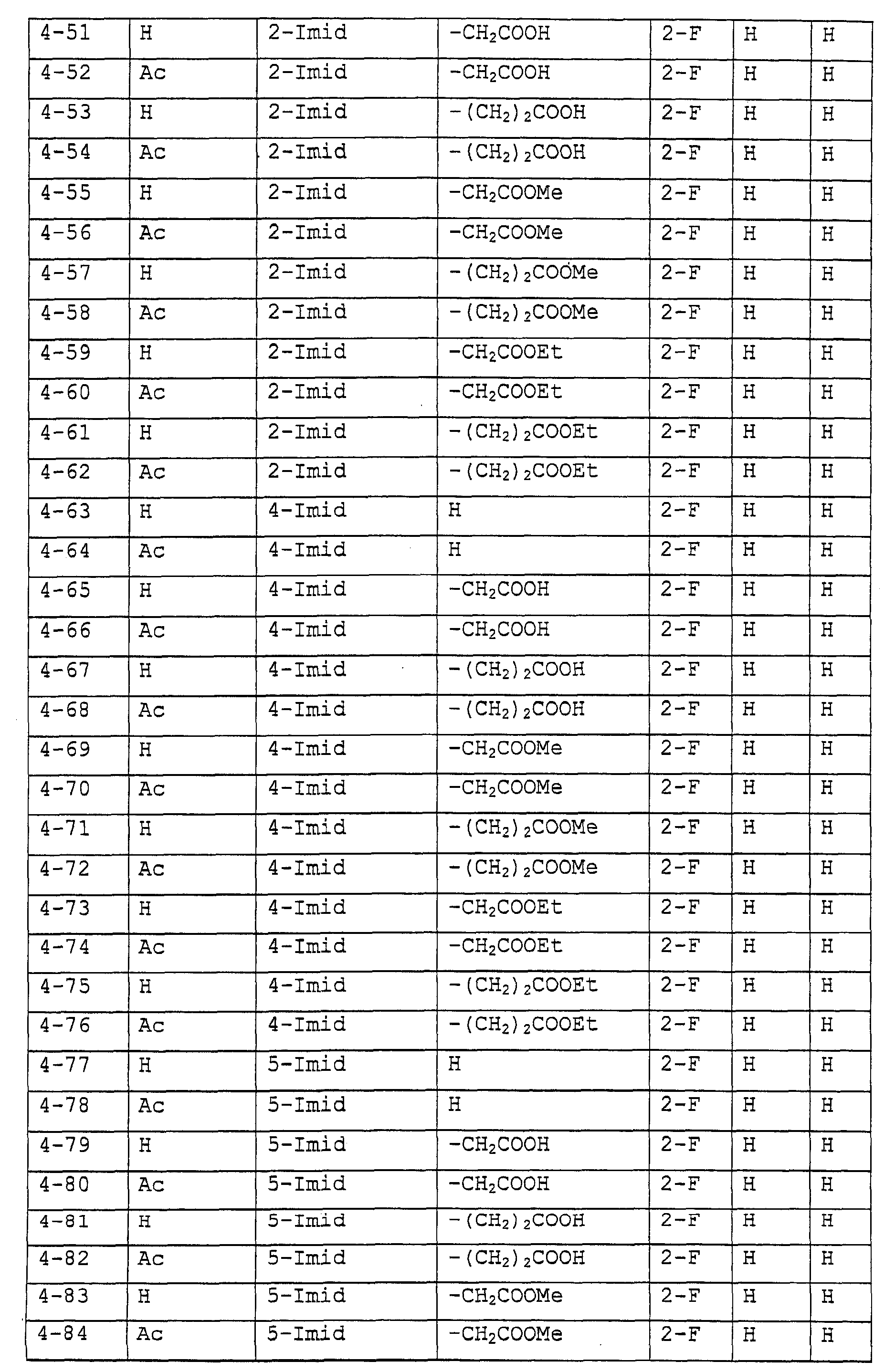




(Таблица 5)




(Таблица 6)







более предпочтительными являются соединения №№:



еще более предпочтительными являются соединения №№:

особенно предпочтительными соединениями являются:
соединение № 2-13:
(E)-3-{[1-(карбоксиметил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидин,
соединение № 2-17:
(E)-3-{[1-(2-карбоксиэтил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидин,
соединение № 2-21:
(E)-3-{[1-(3-карбоксипропил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидин,
соединение № 2-181:
(E)-3-{[1-(карбоксиметил)-1H-пиразол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидин,
соединение № 2-185:
(E)-3-{[1-(2-карбоксиэтил)-1H-пиразол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидин,
соединение № 2-189:
(E)-3-{[1-(3-карбоксипропил)-1H-пиразол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидин,
соединение № 2-1145:
(E)-3-{[1-(карбоксиметил)-1H-1,2,3-триазол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидин,
соединение № 2-1149:
(E)-3-{[1-(2-карбоксиэтил)-1H-1,2,3-триазол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидин,
соединение № 2-1153:
(E)-3-{[1-(3-карбоксипропил)-1H-1,2,3-триазол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидин,
соединение № 2-1157:
(E)-3-{[1-(4-карбоксибутил)-1H-1,2,3-триазол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидин,
соединение № 2-1209:
(E)-3-{[1-(карбоксиметил)-1H-1,2,3-триазол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидин,
соединение № 2-1213:
(E)-3-{[1-(2-карбоксиэтил)-1H-1,2,3-триазол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидин,
соединение № 2-1217:
(E)-3-{[1-(3-карбоксипропил)-1H-1,2,3-триазол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидин,
соединение № 2-1221:
(E)-3-{[1-(4-карбоксибутил)-1H-1,2,3-триазол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидин,
соединение № 2-1401:
(E)-3-{[2-(карбоксиметил)-2H-1,2,3-триазол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидин,
соединение № 2-1405:
(E)-3-{[2-(2-карбоксиэтил)-2H-1,2,3-триазол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидин,
соединение № 2-1409:
(E)-3-{[3-(3-карбоксипропил)-2H-1,2,3-триазол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидин,
соединение № 2-1529:
(E)-3-{[1-(карбоксиметил)-1H-тетразол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидин,
соединение № 2-1533:
(E)-3-{[1-(2-карбоксиэтил)-1H-тетразол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидин,
соединение № 2-1537:
(E)-3-{[1-(3-карбоксипропил)-1H-тетразол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидин,
соединение № 2-1541:
(E)-3-{[1-(4-карбоксибутил)-1H-тетразол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидин,
соединение № 2-1593:
(E)-3-{[2-(карбоксиметил)-2H-тетразол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидин,
соединение № 2-1597:
(E)-3-{[2-(2-карбоксиэтил)-2H-тетразол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидин,
соединение № 2-1601:
(E)-3-{[2-(3-карбоксипропил)-2H-тетразол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидин,
соединение № 2-1605:
(E)-3-{[2-(4-карбоксибутил)-2H-тетразол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидин,
соединение № 5-7:
(E)-1-[1-(2-фторфенил)-2-метокси-2-оксоэтил]-3-{[1-(2-карбоксиэтил)-1H-пиразол-3-ил]метилиден}-4-сульфанилпиперидин,
соединение № 5-9:
(E)-1-[1-(2-фторфенил)-2-метокси-2-оксоэтил]-3-{[1-(3-карбоксипропил)-1H-пиразол-3-ил]метилиден}-4-сульфанилпиперидин,
соединение № 5-23:
(E)-1-[1-(2-фторфенил)-2-метокси-2-оксоэтил]-3-{[1-(2-карбоксиэтил)-1H-пиразол-4-ил]метилиден}-4-сульфанилпиперидин,
соединение № 5-25:
(E)-1-[1-(2-фторфенил)-2-метокси-2-оксоэтил]-3-{[1-(3-карбоксипропил)-1H-пиразол-4-ил]метилиден}-4-сульфанилпиперидин,
соединение № 5-31:
(E)-1-[1-(2-фторфенил)-2-метокси-2-оксоэтил]-3-{[1-(2-карбоксиэтил)-1H-пиразол-5-ил]метилиден}-4-сульфанилпиперидин,
соединение № 5-33:
(E)-1-[1-(2-фторфенил)-2-метокси-2-оксоэтил]-3-{[1-(3-карбоксипропил)-1H-пиразол-5-ил]метилиден}-4-сульфанилпиперидин,
соединение № 5-43:
(E)-1-[1-(2-фторфенил)-2-метокси-2-оксоэтил]-3-{[1-(2-карбоксиэтил)-1H-1,2,3-триазол-4-ил]метилиден}-4-сульфанилпиперидин,
соединение № 5-45:
(E)-1-[1-(2-фторфенил)-2-метокси-2-оксоэтил]-3-{[1-(3-карбоксипропил)-1H-1,2,3-триазол-4-ил]метилиден}-4-сульфанилпиперидин,
соединение № 5-71:
(E)-1-[1-(2-фторфенил)-2-метокси-2-оксоэтил]-3-{[1-(2-карбоксиэтил)-1H-1,2,3-триазол-5-ил]метилиден}-4-сульфанилпиперидин,
соединение № 5-73:
(E)-1-[1-(2-фторфенил)-2-метокси-2-оксоэтил]-3-{[1-(3-карбоксипропил)-1H-1,2,3-триазол-5-ил]метилиден}-4-сульфанилпиперидин,
соединение № 5-95:
(E)-1-[1-(2-фторфенил)-2-метокси-2-оксоэтил]-3-{[1-(2-карбоксиэтил)-1H-тетразол-5-ил]метилиден}-4-сульфанилпиперидин,
соединение № 5-97:
(E)-1-[1-(2-фторфенил)-2-метокси-2-оксоэтил]-3-{[1-(3-карбоксипропил)-1H-тетразол-5-ил]метилиден}-4-сульфанилпиперидин,
соединение № 5-103:
(E)-1-[1-(2-фторфенил)-2-метокси-2-оксоэтил]-3-{[2-(2-карбоксиэтил)-2H-тетразол-5-ил]метилиден}-4-сульфанилпиперидин и
соединение № 5-105:
(E)-1-[1-(2-фторфенил)-2-метокси-2-оксоэтил]-3-{[2-(3-карбоксипропил)-2H-тетразол-5-ил]метилиден}-4-сульфанилпиперидин.
Соединения по настоящему изобретению химически устойчивы и обладают высокой антикоагуляционной активностью в отношении тромбоцитов и ингибирующим действием против тромбообразования. Кроме того, соединения по настоящему изобретению оказывают указанные действия с короткой латентностью начала действия и проявляют низкую токсичность. Поэтому соединения по настоящему изобретению могут быть пригодны для профилактики, предупреждения рецидива и лечения (особенно последнего) болезней, вызываемых активацией тромбоцитов, такой как тромбообразование и коагуляция тромбобцитов, и секретирующими реакциями тромбоцитов, например, при чрескожном коронарном вмешательстве (PCI), ангиопластике, эндартерэктомии, рестенозе после стентирования, остром коронарном синдроме, стабильной и нестабильной стенокардии, инфаркте миокарда, фибрилляции предсердий, церебральной ишемической атаке, церебральном инфаркте и атеросклерозе, и болезней, вызываемых тромбообразованием или образованием эмболов в связи с сахарным диабетом, заболеванием периферических артерий, вызванной гепарином тромбоцитопенией (HIT), тромбоцитопенической тромбогемолитической пурпурой (ТТР), синдромом антител к фосфолипидам, венозным тромбозом и пиемией.
Наилучший способ осуществления изобретения
Соединение (I) в настоящем изобретении может быть получено способом А или способом В, описанными ниже.

В вышеприведенных формулах R1-R3 и Х1-Х5 имеют такие же значения, как определенные выше; R2а представляет собой R2, описанный выше, или защитную группу для меркаптогруппы; R3а представляет собой R3, описанный выше, или группу, которой может быть защищена аминогруппа в R3, если это необходимо, защитной группой для аминогруппы; и Lv представляет собой уходящую группу.
Защитная группа для меркаптогруппы R2а может быть такой же группой, как группа, указанная в качестве защитной группы для меркаптогруппы описанного выше «пролекарства», и предпочтительно является ацетильной группой.
Защитную группу для аминогруппы R3а особо не ограничивают при условии, что она может обычным образом защищать аминогруппу в химических реакциях и, в частности, является защитной группой, которая может быть удалена осуществлением химического процесса, такого как гидрогенолиз, гидролиз, электролиз и фотолиз. Указанной защитной группой, может быть, например, «алифатическая ацильная группа», описанная выше; «ароматическая ацильная группа», описанная выше; «алкоксикарбонильная группа», описанная выше; «аралкилоксикарбонильная группа», описанная выше; «силильная группа», описанная выше; «аралкильная группа», описанная выше; «замещенная метиленовая группа», которая может образовывать основание Шиффа, такая как N,N-диметиламинометиленовая, бензилиденовая, 4-метоксибензилиденовая, 4-нитробензилиденовая, салицилиденовая, 5-хлорсалицилиденовая, дифенилметиленовая или (5-хлор-2-гидроксифенил)фенилметиленовая группа; «ароматическая сульфонильная группа», состоящая из арилсульфонильной группы, такой как бензолсульфонильная группа, и арилсульфонильной группы, замещенной низшей алкильной или низшей алкоксигруппой(ами), такой как п-толуолсульфонильная, пентаметилбензолсульфонильная, п-метоксибензолсульфонильная, 2,4,6-триметоксибензолсульфонильная или 3-метокси-4-трет-бутилбензолсульфонильная группа; и «алифатическая сульфонильная группа», включающая алкилсульфонильную группу, такую как метансульфонильная или трет-бутилсульфонильная группа, и алкилсульфонильную группу, замещенную атомом(ами) галогена, силильной группой(ами) или арильной группой(ами), такую как трифторметилсульфонильная, трисилилэтансульфонильная или бензилсульфонильная группа.
Уходящую группу Lv особо не ограничивают при условии, что данная группа является функциональной группой, которая может обеспечить реакцию замещения путем взаимодействия с нуклеофильным заместителем, и может представлять собой, например, «атом галогена», описанный выше; «низшую алкилсульфонилоксигруппу, такую как метансульфонилокси или этансульфонилоксигруппа; «галогенированную низшую алкилсульфонилоксигруппу», такую как трифторметансульфонилоксигруппа; или «ароматическую сульфонилоксигруппу», включающую арилсульфонилоксигруппу, такую как бензолсульфонилоксигруппа, низшую алкилированную арилсульфонилоксигруппу, такую как п-толуолсульфонилоксигруппа, галогенированную арилсульфонилоксигруппу, такую как п-хлорбензолсульфонилоксигруппа, и нитрованную арилсульфонилоксигруппу, такую как п-нитробензолсульфонилоксигруппа.
Далее подробно описана каждая стадия способа А и способа В.
(Способ А)
Способ А - это стадия получения соединения (I) проведением нуклеофильной реакции замещения в присутствии основания с использованием соединения (II), полученного способом С, и соединения (III), которое хорошо известно или может быть легко получено из известных соединений (стадия А-1). Кроме того, при необходимости могут быть осуществлены также некоторые реакции, такие как удаление защитной группы для меркаптогруппы (стадия А-2), введение заместителя в меркаптогруппу (стадия А-3), гидролиз сложноэфирной группы (стадия А-4), превращение карбоксильной группы в амидную группу (стадия А-5), превращение карбоксильной группы в сложноэфирную группу (стадия А-6), удаление защитной группы для аминогруппы (стадия А-7) и превращение карбоксильной группы в гидроксиаминогруппу (стадия А-8). Стадии от А-2 до А-8 могут быть проведены до или после стадии А-1, а порядок указанных стадий может быть легко выбран в зависимости от обстоятельств специалистом в данной области.
(А-1)
Используемым растворителем может быть, например, ароматический углеводород, такой как бензол, толуол или ксилол; галогенированный углеводород, такой как дихлорметан, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол или дихлорбензол; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир ди(этиленгликоля); кетон, такой, как ацетон, метилэтилкетон, метилизобутилкетон, изофорон или циклогексанон; нитрил, такой, как ацетонитрил или изобутиронитрил; амид, такой как формамид, N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидинон или гексаметилфосфорный триамид; или сульфоксид, такой как диметилсульфоксид или сульфолан, предпочтительно галогенированный углеводород, нитрил или амид, а более предпочтительно N,N-диметилформамид, N,N-диметилацетамид, ацетонитрил или дихлорметан.
Используемым основанием может быть, например, неорганическое основание, включающее карбонат щелочного металла, такой как карбонат натрия, карбонат калия или карбонат лития; гидрокарбонат щелочного металла, такой как гидрокарбонат натрия, гидрокарбонат калия или гидрокарбонат лития; гидрид щелочного металла, такой как гидрид лития, гидрид натрия или гидрид калия; гидроксид щелочного металла, такой как гидроксид натрия, гидроксид калия или гидроксид лития, и фторид щелочного металла, такой как фторид натрия или фторид калия; алкоксид щелочного металла, такой как метоксид натрия, этоксид натрия, трет-бутоксид калия или метоксид лития; меркаптан щелочного металла, такой как метилмеркаптан натрия или этилмеркаптан натрия; или органическое основание, такое как N-метилморфолин, триэтиламин, трипропиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин, N-метилпиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(N,N-диметиламино)пиридин, 2,6-ди-(трет-бутил)-4-метилпиридин, хинолин, N,N-диметиланилин, N,N-диэтиланилин, 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,4-диазабицикло[2.2.2]октан (DABCO) или 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU), предпочтительно карбонат щелочного металла или органическое основание, а более предпочтительно карбонат калия или триэтиламин.
Температура реакции зависит от исходного материала и реагента и составляет от -50°С до 100°С, предпочтительно от 0°С до 50°С.
Время реакции зависит от температуры реакции, исходного материала, реагента и вида используемого растворителя и составляет обычно от 30 минут до 48 часов, предпочтительно от 1 часа до 24 часов.
По окончании реакции требуемое соединение данной реакции может быть получено, например концентрированием реакционной смеси, добавлением к смеси органического растворителя, не смешивающегося с водой, такого как этилацетат, промывкой смеси водой, отделением органического слоя, содержащего требуемое соединение, сушкой органического слоя над безводным сульфатом магния или тому подобным и затем выпариванием органического растворителя с получением требуемого продукта.
Полученный продукт при необходимости дополнительно очищают традиционными методами обработки, например перекристаллизацией, переосаждением, колоночной хроматографией на силикагеле или тому подобным.
(А-2)
Данная стадия является стадией удаления защитной группы для меркаптогруппы и может быть легко проведена по методикам, хорошо известным специалисту в данной области (например, методика, описанная в Protective Groups in Organic Synthesis Third Edition, T. W. Green et al., John Wiley & Sons, Inc. (1999)), а предпочтительно ее осуществляют методом снятия защиты в присутствии кислоты (стадия А-2а) или методом снятия защиты в присутствии основания (стадия 2b).
(А-2а)
Используемым растворителем может быть, например, ароматический углеводород, такой как бензол, толуол или ксилол; галогенированный углеводород, такой как дихлорметан, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол или дихлорбензол; сложный эфир такой как этилформиат, этилацетат, пропилацетат, бутилацетат или диэтилкарбонат; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир ди(этиленгликоля); спирт, такой как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол или 2-метоксиэтанол; амид, такой как формамид, N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидинон или гексаметилфосфорный триамид; сульфоксид, такой как диметилсульфоксид или сульфолан; или смесь указанных растворителей, предпочтительно спирт или смесь галогенированного углеводорода и спирта, а более предпочтительно метанол, этанол или смесь дихлорметана и метанола или этанола.
Используемую кислоту особо не ограничивают, при условии, что она может быть использована в обычных реакциях, и предпочтительно она представляет собой неорганическую кислоту, такую как хлороводородная кислота, хлороводород, бромоводородная кислота, серная кислота, перхлорная кислота или фосфорная кислота, или органическую кислоту, такую как уксусная кислота, муравьиная кислота, щавелевая кислота, метансульфоновая кислота, п-толуолсульфоновая кислота, камфорсульфоновая кислота, трифторуксусная кислота или трифторметансульфоновая кислота, и предпочтительно она является неорганической кислотой, а более предпочтительно - хлороводородом.
Температура реакции зависит от исходного материала и реагента и составляет от -50°С до 100°С, предпочтительно от 0°С до 50°С.
Время реакции зависит от температуры реакции, исходного материала, реагента и вида использованного растворителя и составляет обычно от 30 минут до 48 часов, предпочтительно от 1 часа до 24 часов.
По окончании реакции требуемое соединение данной реакции может быть получено, например концентрированием реакционной смеси, добавлением к смеси органического растворителя, не смешивающегося с водой, такого как этилацетат, промывкой смеси водой, отделением органического слоя, содержащего требуемое соединение, сушкой органического слоя над безводным сульфатом магния или тому подобным и затем выпариванием органического растворителя с получением требуемого продукта.
Полученный продукт при необходимости дополнительно очищают традиционными методами обработки, например перекристаллизацией, переосаждением, колоночной хроматографией на силикагеле или тому подобным.
(А-2b)
Используемым растворителем может быть, например, ароматический углеводород, такой как бензол, толуол или ксилол; галогенированный углеводород, такой, как дихлорметан, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол или дихлорбензол; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир ди(этиленгликоля); спирт, такой как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол или 2-метоксиэтанол; амид, такой как формамид, N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидинон или гексаметилфосфорный триамид; сульфоксид, такой, как диметилсульфоксид или сульфолан; вода; или смесь указанных растворителей, предпочтительно спирт или смесь спирта и воды, а более предпочтительно метанол, этанол, метанол, содержащий воду или этанол, содержащий воду.
Используемым основанием может быть, например, неорганическое основание, включающее карбонат щелочного металла, такой как карбонат натрия, карбонат калия или карбонат лития; гидрокарбонат щелочного металла, такой как гидрокарбонат натрия, гидрокарбонат калия или гидрокарбонат лития; гидрид щелочного металла, такой как гидрид лития, гидрид натрия или гидрид калия; гидроксид щелочного металла, такой как гидроксид натрия, гидроксид калия или гидроксид лития, и фторид щелочного металла, такой как фторид натрия или фторид калия; алкоксид щелочного металла, такой как метоксид натрия, этоксид натрия, метоксид калия, этоксид калия, трет-бутоксид калия или метоксид лития; меркаптан щелочного металла, такой как метилмеркаптан натрия или этилмеркаптан натрия; или органическое основание, такое как N-метилморфолин, триэтиламин, трипропиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин, N-метилпиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(N,N-диметиламино)пиридин, 2,6-ди-(трет-бутил)-4-метилпиридин, хинолин, N,N-диметиланилин, N,N-диэтиланилин, 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,4-диазабицикло[2.2.2]октан (DABCO) или 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU), предпочтительно карбонат щелочного металла или гидроксид щелочного металла, а более предпочтительно карбонат калия или гидроксид натрия.
Температура реакции зависит от исходного материала и реагента и составляет от -50°С до 100°С, предпочтительно от -20°С до 50°С.
Время реакции зависит от температуры реакции, исходного материала, реагента и вида использованного растворителя и составляет обычно от 1 минуты до 24 часов, предпочтительно от 5 минут до 5 часов.
По окончании реакции требуемое соединение данной реакции может быть получено, например концентрированием реакционной смеси, добавлением к смеси органического растворителя, не смешивающегося с водой, такого как этилацетат, промывкой смеси водой, отделением органического слоя, содержащего требуемое соединение, сушкой органического слоя над безводным сульфатом магния или тому подобным и затем выпариванием органического растворителя с получением требуемого продукта.
Полученный продукт при необходимости дополнительно очищают традиционными методами обработки, например перекристаллизацией, переосаждением, колоночной хроматографией на силикагеле или тому подобным.
(А-3)
Данная стадия является стадией введения заместителя в меркаптогруппу в присутствии основания или тому подобного. Когда в качестве реагента используют хлорангидрид кислоты, ангидрид кислоты, сульфанилгалогенид или активный сложный эфир, данную стадию осуществляют в присутствии основания (А-3а), когда используют карбоновую кислоту, данную стадию осуществляют в присутствии конденсирующего агента (А-3b), а когда используют тиол, данную стадию осуществляют в присутствии иода или основания (А-3с).
(А-3а)
Используемым растворителем может быть, например, ароматический углеводород, такой как бензол, толуол или ксилол; галогенированный углеводород, такой как дихлорметан, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол или дихлорбензол; сложный эфир такой как этилформиат, этилацетат, пропилацетат, бутилацетат или диэтилкарбонат; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир ди(этиленгликоля); кетон, такой, как ацетон, метилэтилкетон, метилизобутилкетон, изофорон или циклогексанон; амид, такой как формамид, N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидинон или гексаметилфосфорный триамид; сульфоксид, такой как диметилсульфоксид или сульфолан, предпочтительно галогенированный углеводород, кетон или амид, а более предпочтительно N,N-диметилформамид, N,N-диметилацетамид, дихлорметан или ацетон.
Основанием, используемым в данной реакции, может быть, например, неорганическое основание, включающее карбонат щелочного металла, такой как карбонат натрия, карбонат калия или карбонат лития; гидрокарбонат щелочного металла, такой как гидрокарбонат натрия, гидрокарбонат калия или гидрокарбонат лития; гидрид щелочного металла, такой как гидрид лития, гидрид натрия или гидрид калия; гидроксид щелочного металла, такой как гидроксид натрия, гидроксид калия или гидроксид лития, и фторид щелочного металла, такой как фторид натрия или фторид калия; алкоксид щелочного металла, такой как метоксид натрия, этоксид натрия, метоксид калия, этоксид калия, трет-бутоксид калия или метоксид лития; меркаптан щелочного металла, такой как метилмеркаптан натрия или этилмеркаптан натрия; или органическое основание, такое как N-метилморфолин, триэтиламин, трипропиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин, N-метилпиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(N,N-диметиламино)пиридин, 2,6-ди-(трет-бутил)-4-метилпиридин, хинолин, N,N-диметиланилин, N,N-диэтиланилин, 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,4-диазабицикло[2.2.2]октан (DABCO) или 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU), предпочтительно карбонат щелочного металла, гидрид щелочного металла или органическое основание, а более предпочтительно гидрид натрия, карбонат калия или триэтиламин.
Температура реакции зависит от исходного материала и реагента и составляет от -30°С до 100°С, предпочтительно от -10°С до 50°С.
Время реакции зависит от температуры реакции, исходного материала, реагента и вида использованного растворителя и составляет обычно от 5 минут до 24 часов, предпочтительно от 15 минут до 10 часов.
По окончании реакции требуемое соединение данной реакции может быть получено, например концентрированием реакционной смеси, добавлением к смеси органического растворителя, не смешивающегося с водой, такого как этилацетат, промывкой смеси водой, отделением органического слоя, содержащего требуемое соединение, сушкой органического слоя над безводным сульфатом магния или тому подобным и затем выпариванием органического растворителя с получением требуемого продукта.
Полученный продукт при необходимости дополнительно очищают традиционными методами обработки, например перекристаллизацией, переосаждением, колоночной хроматографией на силикагеле или тому подобным.
(А-3b)
Используемым растворителем может быть, например, ароматический углеводород, такой как бензол, толуол или ксилол; галогенированный углеводород, такой как дихлорметан, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол или дихлорбензол; сложный эфир, такой как этилформиат, этилацетат, пропилацетат, бутилацетат или диэтилкарбонат; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир ди(этиленгликоля); кетон, такой как ацетон, метилэтилкетон, метилизобутилкетон, изофорон или циклогексанон; амид, такой как формамид, N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидинон или гексаметилфосфорный триамид; сульфоксид, такой как диметилсульфоксид или сульфолан, предпочтительно галогенированный углеводород или амид, а более предпочтительно N,N-диметилформамид, N,N-диметилацетамид или дихлорметан.
Используемым «конденсирующим агентом» может быть:
(i) комбинация фосфатного сложного эфира, такого как диэтилфосфорилцианид, дифенилфосфорилазид и диэтилцианофосфонат, и основания, показанного ниже;
(ii) карбодиимид, такой как 1,3-дициклогексилкарбодиимид (DCC), 1,3-диизопропилкарбодиимид и 1-(3-диметиламинопропил)-3-этилкарбодиимид (WSC); комбинация указанного карбодиимида и основания, описанного ниже; комбинация указанного карбодиимида и N-гидроксиимида, такого как N-гидроксисукцинимид, 1-гидроксибензотриазол и N-гидрокси-5-норборнен-2,3-дикарбоксиимид; и комбинация указанного карбодиимида или указанного N-гидроксиимида и основания, описанного ниже;
(iii) комбинация дисульфида, такого как 2,2'-дипиридилдисульфид и 2,2'-дибензотиазолилдисульфид, и фосфина, такого как трифенилфосфин и трибутилфосфин;
(iv) карбонат, такой как N,N'-дисукцинимидилкарбонат, диэтилпирокарбонат(DEPC) ди-2-пиридилкарбонат и S,S'-бис(1-фенил-1Н-тетразол-5-ил)дитиокарбонат;
(v) фосфинхлорид, такой как N,N'-бис(2-оксо-3-оксазолидинил)фосфинхлорид;
(vi) оксалат, такой как N,N'-дисукцинимидилоксалат, N,N'-дифталимидоксалат, N,N'-бис(5-норборнен-2,3-дикарбоксиимидил)оксалат, 1,1'-бис(бензотриазолил)оксалат, 1,1'-бис(6-хлорбензотриазолил)оксалат и 1,1'-бис(6-трифторметилбензотриазолил)оксалат;
(vii) комбинация указанного фосфина и азодикарбоксилата или азодикарбоксиамида, такого как диэтилазодикарбоксилат и 1,1'-(азодикарбонил)дипиперидин;
(viii) N-низший алкил-5-арилизоксазолий-3'-сульфонат, такой как N-этил-5-фенилизоксазолий-3'-сульфонат;
(ix) ди-гетероарилдиселенид, такой как ди-2-пиридилдиселенид;
(x) арилсульфонилтриазолид, такой как п-нитробензолсульфонилтриазолид;
(xi) 2-галоген-1-низший алкилпиридинийгалогенид, такой как 2-хлор-1-метилпиридинийиодид;
(xii) имидазол, такой как 1,1'-оксалилдиимидазол и N,N'-карбонилдиимидазол (CDI);
(xiii) 3-низший алкил-2-галогенбензотиазолийфторборат, такой как 3-этил-2-хлорбензотиазолийфторборат;
(xiv) 3-низший алкилбензотиазол-2-селон, такой как 3-метилбензотиазол-2-селон;
(xv) фосфат, такой как фенилдихлорфрсфат и сложный полифосфатный эфир;
(xvi) галогенсульфонилизоцианат, такой как хлорсульфонилизоцианат;
(xvii) галогенсилан, такой как триметилсилилхлорид и триэтилсилилхлорид;
(xviii) комбинация низшего алкансульфонилгалогенида, такого как метансульфонилхлорид, и основания, описанного ниже;
(xix) N,N,N',N'-тетра-низший алкилгалогенформамидийхлорид, такой как N,N,N',N'-тетраметилхлорформамидийхлорид; или
(xx) комбинация соли пиридиния (реактив Мукайямы (Mukaiyama)), такой как 1-метил-2-хлорпиридинийхлорид и 1-этил-2-бромпиридинийхлорид, и основания, описанного ниже; а предпочтительно им является карбодиимид и более предпочтительно - 1-(3-диметиламинопропил)-3-этилкарбодиимид или 1,3-дициклогексилкарбодиимид.
Используемым основанием может быть, например, органическое основание, такое как N-метилморфолин, триэтиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин, N-метилпиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(N,N-диметиламино)пиридин, 2,6-ди-(трет-бутил)-4-метилпиридин, хинолин, N,N-диметиланилин или N,N-диэтиланилин.
Температура реакции зависит от исходного материала и реагента и составляет от -30°С до 100°С, предпочтительно от -10°С до 50°С.
Время реакции зависит от температуры реакции, исходного материала, реагента и вида использованного растворителя и составляет обычно от 5 минут до 24 часов, предпочтительно от 30 минут до 10 часов.
По окончании реакции требуемое соединение данной реакции может быть получено, например концентрированием реакционной смеси, добавлением к смеси органического растворителя, не смешивающегося с водой, такого, как этилацетат, промывкой смеси водой, отделением органического слоя, содержащего требуемое соединение, сушкой органического слоя над безводным сульфатом магния или тому подобным и затем выпариванием органического растворителя с получением требуемого продукта.
Полученный продукт при необходимости дополнительно очищают традиционными методами обработки, например перекристаллизацией, переосаждением, колоночной хроматографией на силикагеле или тому подобным.
(А-3с)
Используемым растворителем может быть, например, ароматический углеводород, такой как бензол, толуол или ксилол; галогенированный углеводород, такой как дихлорметан, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол или дихлорбензол; сложный эфир такой как этилформиат, этилацетат, пропилацетат, бутилацетат или диэтилкарбонат; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир ди(этиленгликоля); кетон, такой как ацетон, метилэтилкетон, метилизобутилкетон, изофорон или циклогексанон; амид, такой как формамид, N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидинон или гексаметилфосфорный триамид; сульфоксид, такой как диметилсульфоксид или сульфолан, предпочтительно простой эфир, а более предпочтительно тетрагидрофуран.
Температура реакции зависит от исходного материала и реагента и составляет от -30°С до 100°С, предпочтительно от -10°С до 50°С.
Время реакции зависит от температуры реакции, исходного материала, реагента и вида использованного растворителя и составляет обычно от 1 минуты до 5 часов, предпочтительно от 5 минут до 1 часа.
По окончании реакции требуемое соединение данной реакции может быть получено, например концентрированием реакционной смеси, добавлением к смеси органического растворителя, не смешивающегося с водой, такого, как этилацетат, промывкой смеси водой, отделением органического слоя, содержащего требуемое соединение, сушкой органического слоя над безводным сульфатом магния или тому подобным и затем выпариванием органического растворителя с получением требуемого продукта.
Полученный продукт при необходимости дополнительно очищают традиционными методами обработки, например перекристаллизацией, переосаждением, колоночной хроматографией на силикагеле или тому подобным.
(А-4)
На данной стадии осуществляют гидролиз сложноэфирной группы (А-4).
Данную стадию проводят способом, подобным описанному выше в (А-2).
(А-5)
На данной стадии осуществляют превращение карбоксильной группы, полученной на стадии А-4, в активный сложный эфир с последующим осуществлением взаимодействия указанного активного сложного эфира с требуемым аминосоединением.
Используемым растворителем может быть, например, ароматический углеводород, такой как бензол, толуол или ксилол; галогенированный углеводород, такой как дихлорметан, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол или дихлорбензол; сложный эфир, такой как этилформиат, этилацетат, пропилацетат, бутилацетат или диэтилкарбонат; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир ди(этиленгликоля); кетон, такой как ацетон, метилэтилкетон, метилизобутилкетон, изофорон или циклогексанон; амид, такой как формамид, N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидинон или гексаметилфосфорный триамид; сульфоксид, такой как диметилсульфоксид или сульфолан, предпочтительно галогенированный углеводород или амид, а более предпочтительно N,N-диметилформамид, N,N-диметилацетамид или дихлорметан.
Используемый реагент особо не ограничивают, лишь бы он был реагентом, используемым для образования активного сложного эфира, и им, например, может быть изобутилхлорформиат.
Используемым основанием может быть, например, неорганическое основание, включающее карбонат щелочного металла, такой как карбонат натрия, карбонат калия или карбонат лития; гидрокарбонат щелочного металла, такой как гидрокарбонат натрия, гидрокарбонат калия или гидрокарбонат лития; гидрид щелочного металла, такой как гидрид лития, гидрид натрия или гидрид калия; гидроксид щелочного металла, такой как гидроксид натрия, гидроксид калия или гидроксид лития, и фторид щелочного металла, такой как фторид натрия или фторид калия; алкоксид щелочного металла, такой как метоксид натрия, этоксид натрия, метоксид калия, этоксид калия, трет-бутоксид калия или метоксид лития; меркаптан щелочного металла, такой как метилмеркаптан натрия или этилмеркаптан натрия; или органическое основание, такое как N-метилморфолин, триэтиламин, трипропиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин, N-метилпиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(N,N-диметиламино)пиридин, 2,6-ди-(трет-бутил)-4-метилпиридин, хинолин, N,N-диметиланилин, N,N-диэтиланилин, 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,4-диазабицикло[2.2.2]октан (DABCO) или 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU), предпочтительно карбонат щелочного металла или органическое основание, а более предпочтительно карбонат калия или триэтиламин.
Температура реакции зависит от исходного материала и реагента и составляет от -30°С до 100°С, предпочтительно от -10°С до 50°С.
Время реакции зависит от температуры реакции, исходного материала, реагента и вида использованного растворителя и составляет обычно от 10 минут до 24 часов, предпочтительно от 30 минут до 10 часов.
По окончании реакции требуемое соединение данной реакции может быть получено, например концентрированием реакционной смеси, добавлением к смеси органического растворителя, не смешивающегося с водой, такого как этилацетат, промывкой смеси водой, отделением органического слоя, содержащего требуемое соединение, сушкой органического слоя над безводным сульфатом магния или тому подобным и затем выпариванием органического растворителя с получением требуемого продукта.
Полученный продукт при необходимости дополнительно очищают традиционными методами обработки, например перекристаллизацией, переосаждением, колоночной хроматографией на силикагеле или тому подобным.
(А-6)
На данной стадии проводят реакцию дегидратирующей конденсации между карбоновой кислотой, полученной на стадии А-4, и спиртом (А-6а) или реакцию переэтерификации с использованием сложного эфира в присутствии кислоты или основания непосредственно без выполнения процесса стадии А-4 (А-6b).
(А-6а)
Используемым растворителем может быть, например, ароматический углеводород, такой как бензол, толуол или ксилол; галогенированный углеводород, такой как дихлорметан, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол или дихлорбензол; простой эфир, такой, как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир ди(этиленгликоля); спирт, такой как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол или 2-метоксиэтанол; амид, такой как формамид, N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидинон или гексаметилфосфорный триамид; сульфоксид, такой как диметилсульфоксид или сульфолан; и смесь спирта и указанного выше растворителя. Но при использовании спирта в качестве растворителя в указанной выше реакции добавление спирта в качестве реагента необязательно.
Используемой кислотой может быть, например, неорганическая кислота, такая как хлороводородная кислота, хлороводород, бромоводородная кислота, серная кислота, перхлорная кислота или фосфорная кислота, или сульфоновая кислота, такая как метансульфоновая кислота, п-толуолсульфоновая кислота или камфорсульфоновая кислота, предпочтительно неорганическая кислота, а более предпочтительно хлороводород.
Температура реакции зависит от исходного материала и реагента и составляет от -30°С до 100°С, предпочтительно от -10°С до 50°С.
Время реакции зависит от температуры реакции, исходного материала, реагента и вида использованного растворителя и составляет обычно от 10 минут до 24 часов, предпочтительно от 30 минут до 10 часов.
По окончании реакции требуемое соединение данной реакции может быть получено, например концентрированием реакционной смеси, добавлением к смеси органического растворителя, не смешивающегося с водой, такого как этилацетат, промывкой смеси водой, отделением органического слоя, содержащего требуемое соединение, сушкой органического слоя над безводным сульфатом магния или тому подобным и затем выпариванием органического растворителя с получением требуемого продукта.
Полученный продукт при необходимости дополнительно очищают традиционными методами обработки, например перекристаллизацией, переосаждением, колоночной хроматографией на силикагеле или тому подобным.
Данную стадию проводят способом, подобным описанному выше в (А-3b).
(А6-b)
На данной стадии в качестве растворителя используют спирт, соответствующий требуемой алкоксигруппе. При использовании кислоты такой кислотой могут быть, например, неорганическая кислота, такая как хлороводородная кислота, хлороводород, бромоводородная кислота, серная кислота, перхлорная кислота или фосфорная кислота, и сульфоновая кислота, такая как метансульфоновая кислота, п-толуолсульфоновая кислота или камфорсульфоновая кислота, предпочтительно неорганическая кислота, а более предпочтительно хлороводород.
При использовании основания таким основанием может быть, например, неорганическое основание, включающее карбонат щелочного металла, такой как карбонат натрия, карбонат калия или карбонат лития; гидрокарбонат щелочного металла, такой как гидрокарбонат натрия, гидрокарбонат калия или гидрокарбонат лития; гидрид щелочного металла, такой как гидрид лития, гидрид натрия или гидрид калия; гидроксид щелочного металла, такой как гидроксид натрия, гидроксид калия или гидроксид лития, и фторид щелочного металла, такой, как фторид натрия или фторид калия; предпочтительно карбонат щелочного металла, а более предпочтительно карбонат калия.
Температура реакции зависит от исходного материала и реагента и составляет от -30°С до 100°С, предпочтительно от -10°С до 50°С.
Время реакции зависит от температуры реакции, исходного материала, реагента и вида использованного растворителя и составляет обычно от 10 минут до 24 часов, предпочтительно от 30 минут до 10 часов.
По окончании реакции требуемое соединение данной реакции может быть получено, например концентрированием реакционной смеси, добавлением к смеси органического растворителя, не смешивающегося с водой, такого как этилацетат, промывкой смеси водой, отделением органического слоя, содержащего требуемое соединение, сушкой органического слоя над безводным сульфатом магния или тому подобным и затем выпариванием органического растворителя с получением требуемого продукта.
Полученный продукт при необходимости дополнительно очищают традиционными методами обработки, например перекристаллизацией, переосаждением, колоночной хроматографией на силикагеле или тому подобным.
(А-7)
Данную стадию проводят способом, подобным описанному выше в А-2. При применении кислоты используют в качестве особо предпочтительного реагента трифторуксусную кислоту или газообразный хлороводород.
Когда требуемое соединение получают в виде его геометрического изомера, требуемое соединение получают проведением реакции фотоизомеризации, описанной ниже.
Используемым растворителем может быть, например, сложный эфир, такой как этилформиат, этилацетат, пропилацетат, бутилацетат или диэтилкарбонат; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир ди(этиленгликоля); спирт, такой как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол или метилцеллозольв; нитрил, такой, как ацетонитрил или изобутиронитрил; амид, такой как формамид, N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидинон, N-метилпирролидинон или гексаметилфосфорный триамид; сульфоксид, такой как диметилсульфоксид или сульфолан; вода; или смесь указанных растворителей, предпочтительно вода, спирт, нитрил или смесь указанных растворителей.
Используемым источником света является ртутная лампа низкого давления (20-100 Вт, предпочтительно 32 Вт).
Используемым сенсибилизатором могут быть, например, бензофенон, флуоренон и антрахинон.
Реакция может быть также осуществлена с добавлением органического соединения серы, такого как диметилдисульфид, диэтилдисульфид или дифенилдисульфид, для ускорения реакции.
Температура реакции зависит от исходного материала и реагента и составляет от -20°С до 100°С, предпочтительно от 0°С до 50°С.
Время реакции зависит от температуры реакции, исходного материала, реагента и вида использованного растворителя и составляет обычно от 5 минут до 8 часов, предпочтительно от 10 минут до 3 часов.
По окончании реакции требуемое соединение данной реакции может быть получено, например концентрированием реакционной смеси, добавлением к смеси органического растворителя, не смешивающегося с водой, такого как этилацетат, промывкой смеси водой, отделением органического слоя, содержащего требуемое соединение, сушкой органического слоя над безводным сульфатом магния или тому подобным и затем выпариванием органического растворителя с получением требуемого продукта.
Полученный продукт при необходимости дополнительно очищают традиционными методами обработки, например перекристаллизацией, переосаждением, колоночной хроматографией на силикагеле или тому подобным.
(А-8)
Данная стадия является стадией превращения карбоксильной группы в гидроксиламиногруппу и может быть легко осуществлена по методикам, хорошо известным специалисту в данной области (например, методами, описанными by A. Sekar Reddy, M. Suresh Kumar and G. Rabindra Reddy: Tetrahedron Letters 41 (2000) 6285-6288).
(Способ В)
Способ В - это стадии получения соединения (V) проведением нуклеофильной реакции замещения в присутствии основания с использованием соединений (III), которые хорошо известны или могут быть легко получены из известных соединений, и соединений (IV), полученных способом С, описанным ниже (В-1), и получения соединения (I) преобразованием гидроксигруппы соединения (V) (В-2). Кроме того, при необходимости в способе В могут быть осуществлены также удаление защитной группы для меркаптогруппы (В-3), введение заместителя в меркаптогруппу (В-4), гидролиз сложноэфирной группы (В-5), превращение карбоксильной группы в амидную группу (В-6), превращение карбоксильной группы в сложноэфирную группу (В-7), удаление защитной группы для аминогруппы (В-8) и превращение карбоксильной группы в гидроксиаминогруппу (В-9). Стадии от В-3 до В-9 могут быть проведены до или после стадий В-1 и В-2, а порядок указанных стадий может быть выбран в соответствии с обстоятельствами специалистом в данной области.
(В-1)
Используемым растворителем может быть, например, ароматический углеводород, такой как бензол, толуол или ксилол; галогенированный углеводород, такой как дихлорметан, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол или дихлорбензол; сложный эфир, такой как этилформиат, этилацетат, пропилацетат, бутилацетат или диэтилкарбонат; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир ди(этиленгликоля); кетон, такой как ацетон, метилэтилкетон, метилизобутилкетон, изофорон или циклогексанон; амид, такой как формамид, N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидинон или гексаметилфосфорный триамид; или сульфоксид, такой, как диметилсульфоксид или сульфолан, предпочтительно галогенированный углеводород или амид, а более предпочтительно N,N-диметилформамид, N,N-диметилацетамид или дихлорметан.
Используемым основанием может быть, например, неорганическое основание, включающее карбонат щелочного металла, такой как карбонат натрия, карбонат калия или карбонат лития; гидрокарбонат щелочного металла, такой как гидрокарбонат натрия, гидрокарбонат калия или гидрокарбонат лития; гидрид щелочного металла, такой как гидрид лития, гидрид натрия или гидрид калия; гидроксид щелочного металла, такой как гидроксид натрия, гидроксид калия или гидроксид лития, и фторид щелочного металла, такой как фторид натрия или фторид калия; алкоксид щелочного металла, такой как метоксид натрия, этоксид натрия, метоксид калия, этоксид калия, трет-бутоксид калия или метоксид лития; меркаптан щелочного металла, такой как метилмеркаптан натрия или этилмеркаптан натрия; или органическое основание, такое как N-метилморфолин, триэтиламин, трипропиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин, N-метилпиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(N,N-диметиламино)пиридин, 2,6-ди-(трет-бутил)-4-метилпиридин, хинолин, N,N-диметиланилин, N,N-диэтиланилин, 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,4-диазабицикло[2.2.2]октан (DABCO) или 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU), предпочтительно карбонат щелочного металла или органическое основание, а более предпочтительно карбонат калия или триэтиламин.
Температура реакции зависит от исходного материала и реагента и составляет от -30°С до 100°С, предпочтительно от -10°С до 50°С.
Время реакции зависит от температуры реакции, исходного материала, реагента и вида использованного растворителя и составляет обычно от 10 минут до 48 часов, предпочтительно от 30 минут до 24 часов.
По окончании реакции требуемое соединение данной реакции может быть получено, например концентрированием реакционной смеси, добавлением к смеси органического растворителя, не смешивающегося с водой, такого как этилацетат, промывкой смеси водой, отделением органического слоя, содержащего требуемое соединение, сушкой органического слоя над безводным сульфатом магния или тому подобным и затем выпариванием органического растворителя с получением требуемого продукта.
Полученный продукт при необходимости дополнительно очищают традиционными методами обработки, например перекристаллизацией, переосаждением, колоночной хроматографией на силикагеле или тому подобным.
(В-2)
Данную стадию проводят, используя реакцию Мицунобу (Mitsunobu) (В-2а) с применением амидацетального реагента (В-2b) или реакцию замещения после превращения гидроксильной группы в уходящую группу (В-2с).
(В-2а)
Используемым растворителем может быть, например, ароматический углеводород, такой как бензол, толуол или ксилол; галогенированный углеводород, такой как дихлорметан, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол или дихлорбензол; или простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир ди(этиленгликоля), предпочтительно галогенированный углеводород или простой эфир, а более предпочтительно дихлорметан или тетрагидрофуран.
Реагент, используемый в реакции Мицунобу, особо не ограничивают, лишь бы он был реагентом, обычно используемым в реакции Мицунобу, и им является, например, предпочтительно комбинация азосоединения, включающего ди-низший алкилазодикарбоксилат, такой как диэтилазодикарбоксилат или диизопропилазодикарбоксилат, или гетероциклилазодикарбонил, такой как 1,1'-(азодикарбонил)дипиперидин, и фосфина, включающего триарилфосфин, такой как трифенилфосфин или три-низший алкилфосфин, такой, как три-н-бутилфосфин, более предпочтительно комбинацией ди-низшего алкилазодикарбоксилата и триарилфосфина и наиболее предпочтительно комбинацией диэтилазодикарбоксилата или диизопропилазодикарбоксилата и трифенилфосфина.
Температура реакции зависит от исходного материала и реагента и составляет от -50°С до 100°С, предпочтительно от -10°С до 60°С.
Время реакции зависит от температуры реакции, исходного материала, реагента и вида использованного растворителя и составляет обычно от 10 минут до 48 часов, предпочтительно от 30 минут до 24 часов.
По окончании реакции требуемое соединение данной реакции может быть получено, например концентрированием реакционной смеси, добавлением к смеси органического растворителя, не смешивающегося с водой, такого как этилацетат, промывкой смеси водой, отделением органического слоя, содержащего требуемое соединение, сушкой органического слоя над безводным сульфатом магния или тому подобным и затем выпариванием органического растворителя с получением требуемого продукта.
Полученный продукт при необходимости дополнительно очищают традиционными методами обработки, например перекристаллизацией, переосаждением, колоночной хроматографией на силикагеле или тому подобным.
(В-2b)
Используемым растворителем может быть, например, ароматический углеводород, такой как бензол, толуол или ксилол; галогенированный углеводород, такой как дихлорметан, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол или дихлорбензол; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир ди(этиленгликоля); или амид, такой как формамид, N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидинон или гексаметилфосфорный триамид; предпочтительно ароматический углеводород, а более предпочтительно толуол.
Используемым амидацетальным реагентом может быть, например, группа общей формулы (CH3)2NCH(OR')2 (где R' представляет собой C1-C6 алкильную группу или C7-C15 аралкильную группу), предпочтительно динеопентилацеталь N,N-диметилформамида.
Температура реакции зависит от исходного материала и реагента и составляет от -50°С до 150°С, предпочтительно от -10°С до 120°С.
Время реакции зависит от температуры реакции, исходного материала, реагента и вида использованного растворителя и составляет обычно от 1 минуты до 24 часов, предпочтительно от 5 минут до 5 часов.
По окончании реакции требуемое соединение данной реакции может быть получено, например концентрированием реакционной смеси, добавлением к смеси органического растворителя, не смешивающегося с водой, такого как этилацетат, промывкой смеси водой, отделением органического слоя, содержащего требуемое соединение, сушкой органического слоя над безводным сульфатом магния или тому подобным и затем выпариванием органического растворителя с получением требуемого продукта.
Полученный продукт при необходимости дополнительно очищают традиционными методами обработки, например перекристаллизацией, переосаждением, колоночной хроматографией на силикагеле или тому подобным.
(В-2с)
Используемым растворителем может быть, например, ароматический углеводород, такой как бензол, толуол или ксилол; галогенированный углеводород, такой, как дихлорметан, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол или дихлорбензол; сложный эфир, такой как этилформиат, этилацетат, пропилацетат, бутилацетат или диэтилкарбонат; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир ди(этиленгликоля); кетон, такой как ацетон, метилэтилкетон, метилизобутилкетон, изофорон или циклогексанон; нитросоединение, такое как нитроэтан или нитробензол; нитрил, такой как цетонитрил или изобутиронитрил; амид, такой, как формамид, N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидинон или гексаметилфосфорный триамид; или сульфоксид, такой как диметилсульфоксид или сульфолан, предпочтительно галогенированный углеводород, амид или сульфоксид, а более предпочтительно N,N-диметилформамид, N,N-диметилацетамид, дихлорметан или диметилсульфоксид.
Преобразование в уходящую группу осуществляют добавлением к реакционному раствору галогенирующего агента или сульфонилирующего агента. Используемым галогенирующим агентом может быть тетрагалогенид углерода, такой как тетрабромид углерода или тетрахлорид углерода, и в указанных случаях в качестве реагента используют фосфин. Указанный фосфин может представлять собой, например, три-С1-С6 алкилфосфин, такой как триметилфосфин, триэтилфосфин, трипропилфосфин, трибутилфосфин, трипентилфосфин или тригексилфосфин; три-С6-С10 арилфосфин, такой как трифенилфосфин, триинденилфосфин или тринафтилфосфин; или три-С6-С10 арилфосфин, который может содержать в качестве заместителя(ей) С1-С4 алкильную группу(ы), такой как толилдифенилфосфин, тритолилфосфин, тримезитилфосфин, трибутилфенилфосфин или три-6-этил-2-нафтилфосфин, и предпочтительно представляет собой три-С1-С6 алкилфосфин (в частности, триметилфосфин, триэтилфосфин, трипропилфосфин или трибутилфосфин) или три-С6-С10 арилфосфин (в частности, трифенилфосфин, триинденилфосфин или тринафтилфосфин), а более предпочтительно представляет собой три-С6-С10 арилфосфин (в частности, трифенилфосфин). Используемый сульфонилирующий агент может представлять собой, например, сульфонилгалогенид, такой как метансульфонилхлорид, этансульфонилхлорид или тозилхлорид, и предпочтительно представляет собой метансульфонилхлорид.
Используемым основанием может быть, например, неорганическое основание, включающее карбонат щелочного металла, такой как карбонат натрия, карбонат калия или карбонат лития; гидрокарбонат щелочного металла, такой как гидрокарбонат натрия, гидрокарбонат калия или гидрокарбонат лития; гидрид щелочного металла, такой как гидрид лития, гидрид натрия или гидрид калия; гидроксид щелочного металла, такой как гидроксид натрия, гидроксид калия или гидроксид лития, и фторид щелочного металла, такой как фторид натрия или фторид калия; алкоксид щелочного металла, такой как метоксид натрия, этоксид натрия, метоксид калия, этоксид калия, трет-бутоксид калия или метоксид лития; меркаптан щелочного металла, такой как метилмеркаптан натрия или этилмеркаптан натрия; или органическое основание, такое как N-метилморфолин, триэтиламин, трипропиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин, N-метилпиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(N,N-диметиламино)пиридин, 2,6-ди-(трет-бутил)-4-метилпиридин, хинолин, N,N-диметиланилин, N,N-диэтиланилин, 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,4-диазабицикло[2.2.2]октан (DABCO) или 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU), предпочтительно карбонат щелочного металла или органическое основание, а более предпочтительно карбонат калия или триэтиламин.
Температура реакции зависит от исходного материала и реагента и составляет от -50°С до 100°С, предпочтительно от -20°С до 80°С.
Время реакции зависит от температуры реакции, исходного материала, реагента и вида использованного растворителя и составляет обычно от 30 минут до 24 часов, предпочтительно от 1 часа до 10 часов.
По окончании реакции требуемое соединение данной реакции может быть получено, например концентрированием реакционной смеси, добавлением к смеси органического растворителя, не смешивающегося с водой, такого как этилацетат, промывкой смеси водой, отделением органического слоя, содержащего требуемое соединение, сушкой органического слоя над безводным сульфатом магния или тому подобным и затем выпариванием органического растворителя с получением требуемого продукта.
Полученный продукт при необходимости дополнительно очищают традиционными методами обработки, например перекристаллизацией, переосаждением, колоночной хроматографией на силикагеле или тому подобным.
(В-3)-(В-9)
Каждую из данных стадий осуществляют способом, подобным описанному выше в (А-2)-(А-8) соответственно.

(Способ С)
В показанных выше формулах R2а и R3а имеют такие же значения, как указанные ранее, R3b представляет собой такую же группу, как указанная для R3а, которая описана ранее, и Pro представляет собой защитную группу для аминогруппы.
Защитная группа для аминогруппы, показанная как Pro, является такой же, как указанная для R3а.
Способ С описан далее подробно.
(С-1)
Данная стадия является стадией получения соединения (VII) осуществлением взаимодействия соединения (VI), которое хорошо известно или может быть легко получено из известных соединений, с соединением, имеющим формулу R3b-СНО, которое хорошо известно или может быть легко получено из известных соединений, и проводят ее енаминированием (С-1а) или кросс-альдольной конденсацией (С-1b).
(С-1а)
Используемым основанием может быть, например, органическое основание, такое как N-метилморфолин, триэтиламин, трипропиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин, N-метилпиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(N,N-диметиламино)пиридин, 2,6-ди-(трет-бутил)-4-метилпиридин, хинолин, N,N-диметиланилин, N,N-диэтиланилин, 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,4-диазабицикло[2.2.2]октан (DABCO) или 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU), предпочтительно пирролидин, пиперидин или морфолин.
Используемым растворителем может быть, например, ароматический углеводород, такой как бензол, толуол или ксилол; галогенированный углеводород, такой как дихлорметан, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол или дихлорбензол; спирт, такой как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол или 2-метоксиэтанол; или простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир ди(этиленгликоля), и предпочтительно им является бензол, толуол или этанол.
Температура реакции зависит от исходного материала и реагента и составляет от 0°С до 200°С, предпочтительно от 50°С до 150°С.
Время реакции зависит от температуры реакции, исходного материала, реагента и вида использованного растворителя и составляет обычно от 30 минут до 24 часов, предпочтительно от 1 часа до 10 часов.
По окончании реакции требуемое соединение данной реакции может быть получено, например концентрированием реакционной смеси, добавлением к смеси органического растворителя, не смешивающегося с водой, такого как этилацетат, промывкой смеси водой, отделением органического слоя, содержащего требуемое соединение, сушкой органического слоя над безводным сульфатом магния или тому подобным и затем выпариванием органического растворителя с получением требуемого продукта.
Полученный продукт при необходимости дополнительно очищают традиционными методами обработки, например перекристаллизацией, переосаждением, колоночной хроматографией на силикагеле или тому подобным.
Когда остается соединение, имеющее гидроксильную группу, то есть промежуточное соединение реакции, и реакция оказывается не законченной, требуемый продукт может быть получен проведением дополнительно реакции дегидратации в присутствии основания.
Используемым растворителем может быть, например, галогенированный углеводород, такой как дихлорметан, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол или дихлорбензол; или простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир ди(этиленгликоля), и предпочтительно им является галогенированный углеводород, а более предпочтительно - дихлорметан.
Используемым основанием может быть, например, органическое основание, такое как N-метилморфолин, триэтиламин, трипропиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин, N-метилпиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(N,N-диметиламино)пиридин, 2,6-ди-(трет-бутил)-4-метилпиридин, хинолин, N,N-диметиланилин, N,N-диэтиланилин, 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,4-диазабицикло[2.2.2]октан (DABCO) или 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU), и предпочтительно им является 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU).
Используемый реагент особо не ограничивают, лишь бы он образовывал уходящую группу при взаимодействии с гидроксильной группой, причем преобразование в уходящую группу осуществляют добавлением к реакционному раствору галогенирующего агента или сульфонилирующего агента. Используемым галогенирующим агентом может быть тетрагалогенид углерода, такой как тетрабромид углерода или тетрахлорид углерода, и в указанных случаях в качестве реагента используют фосфин. Указанный фосфин может представлять собой, например, три-С1-С6 алкилфосфин, такой, как триметилфосфин, триэтилфосфин, трипропилфосфин, трибутилфосфин, трипентилфосфин или тригексилфосфин; три-С6-С10 арилфосфин, такой как трифенилфосфин, триинденилфосфин или тринафтилфосфин; или три-С6-С10 арилфосфин, который может содержать в качестве заместителя(ей) С1-С4 алкильную группу(ы), такой как толилдифенилфосфин, тритолилфосфин, тримезитилфосфин, трибутилфенилфосфин или три-6-этил-2-нафтилфосфин, и предпочтительно представляет собой три-С1-С6 алкилфосфин (в частности, триметилфосфин, триэтилфосфин, трипропилфосфин или трибутилфосфин) или три-С6-С10 арилфосфин (в частности, трифенилфосфин, триинденилфосфин или тринафтилфосфин), а более предпочтительно представляет собой три-С6-С10 арилфосфин (в частности, трифенилфосфин). Используемый сульфонилирующий агент может представлять собой, например, сульфонилгалогенид, такой как метансульфонилхлорид, этансульфонилхлорид или тозилхлорид, и предпочтительно представляет собой метансульфонилхлорид.
Температура реакции зависит от исходного материала и реагента и составляет от -50°С до 100°С, предпочтительно от -20°С до 80°С.
Время реакции зависит от температуры реакции, исходного материала, реагента и вида использованного растворителя и составляет обычно от 30 минут до 24 часов, предпочтительно от 1 часа до 10 часов.
По окончании реакции требуемое соединение данной реакции может быть получено, например концентрированием реакционной смеси, добавлением к смеси органического растворителя, не смешивающегося с водой, такого как этилацетат, промывкой смеси водой, отделением органического слоя, содержащего требуемое соединение, сушкой органического слоя над безводным сульфатом магния или тому подобным и затем выпариванием органического растворителя с получением требуемого продукта.
Полученный продукт при необходимости дополнительно очищают традиционными методами обработки, например перекристаллизацией, переосаждением, колоночной хроматографией на силикагеле или тому подобным.
(С-1b)
Используемым основанием может быть, например, органическое основание, такое как N-метилморфолин, триэтиламин, трипропиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин, N-метилпиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(N,N-диметиламино)пиридин, 2,6-ди-(трет-бутил)-4-метилпиридин, хинолин, N,N-диметиланилин, N,N-диэтиланилин, 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,4-диазабицикло[2.2.2]октан (DABCO) или 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU); или металлоорганическое основание, такое,как бутиллитий, диизопропиламид лития, бис(триметилсилил)амид лития, бис(триметилсилил)амид натрия или бис(триметилсилил)амид калия, и предпочтительно им является гексадисилазид лития, гексадисилазид натрия, гексадисилазид калия или диизопропиламид лития.
Используемым растворителем может быть, например, ароматический углеводород, такой как бензол, толуол или ксилол; галогенированный углеводород, такой как дихлорметан, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол или дихлорбензол; спирт, такой как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол или 2-метоксиэтанол; или простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир ди(этиленгликоля), и предпочтительно им является тетрагидрофуран.
Температура реакции зависит от исходного материала и реагента и составляет от -100°С до 20°С, предпочтительно от -78°С до 0°С.
Время реакции зависит от температуры реакции, исходного материала, реагента и вида использованного растворителя и составляет обычно от 30 минут до 24 часов, предпочтительно от 1 часа до 5 часов.
По окончании реакции требуемое соединение данной реакции может быть получено, например концентрированием реакционной смеси, добавлением к смеси органического растворителя, не смешивающегося с водой, такого как этилацетат, промывкой смеси водой, отделением органического слоя, содержащего требуемое соединение, сушкой органического слоя над безводным сульфатом магния или тому подобным и затем выпариванием органического растворителя с получением требуемого продукта.
Полученный продукт при необходимости дополнительно очищают традиционными методами обработки, например перекристаллизацией, переосаждением, колоночной хроматографией на силикагеле или тому подобным.
Когда остается соединение, имеющее гидроксильную группу, то есть промежуточное соединение реакции, может быть проведена реакции дегидратации способом, подобным описанному в (С-1а).
(С-2)
Данная стадия является стадией восстановления карбонильной группы соединения (VII), полученного на стадии С-1, до гидроксильной группы.
Используемым растворителем может быть, например, ароматический углеводород, такой как бензол, толуол или ксилол; галогенированный углеводород, такой как дихлорметан, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол или дихлорбензол; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир ди(этиленгликоля); спирт, такой как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол или 2-метоксиэтанол; или смесь спирта и галогенированного углеводорода, и предпочтительно им является спирт, смесь спирта и галогенированного углеводорода или простой эфир, а более предпочтительно - метанол, этанол, тетрагидрофуран или смесь указанного спирта и дихлорметана.
Используемый реагент особо не ограничивают, лишь бы его можно было использовать для восстановления карбонильной группы до гидроксильной группы, и он может представлять собой, например, гидрид алюминия или соединение бора, такое, как борогидрид натрия или диборан, а предпочтительно представляет собой борогидрид натрия.
Температура реакции зависит от исходного материала и реагента и составляет от -78°С до 100°С, предпочтительно от 0°С до 50°С.
Время реакции зависит от температуры реакции, исходного материала, реагента и вида использованного растворителя и составляет обычно от 10 минут до 12 часов, предпочтительно от 30 минут до 5 часов.
По окончании реакции требуемое соединение данной реакции может быть получено, например концентрированием реакционной смеси, добавлением к смеси органического растворителя, не смешивающегося с водой, такого как этилацетат, промывкой смеси водой, отделением органического слоя, содержащего требуемое соединение, сушкой органического слоя над безводным сульфатом магния или тому подобным и затем выпариванием органического растворителя с получением требуемого продукта.
Полученный продукт при необходимости дополнительно очищают традиционными методами обработки, например перекристаллизацией, переосаждением, колоночной хроматографией на силикагеле или тому подобным.
Когда R3b отличается от R3а, то при необходимости можно вводить заместитель в аминогруппу. В таком случае после удаления защитной группы для аминогруппы способом, подобным описанному в (А-7), может быть осуществлено введение заместителя так, как описано ниже.
Используемым растворителем может быть, например, ароматический углеводород, такой как бензол, толуол или ксилол; галогенированный углеводород, такой как дихлорметан, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол или дихлорбензол; сложный эфир, такой как этилформиат, этилацетат, пропилацетат, бутилацетат или диэтилкарбонат; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир ди(этиленгликоля); кетон, такой как ацетон, метилэтилкетон, метилизобутилкетон, изофорон или циклогексанон; амид, такой как формамид, N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидинон или гексаметилфосфорный триамид; или сульфоксид, такой как диметилсульфоксид или сульфолан, предпочтительно галогенированный углеводород или амид, а более предпочтительно N,N-диметилформамид, N,N-диметилацетамид или дихлорметан.
Используемый реагент особо не ограничивают, лишь бы его можно было использовать в реакции замещения аминогруппой, и он может представлять собой, например, реагент, в котором уходящая группа, такая как атом галогена или сульфонильная группа, присоединена к требуемой функциональной группе.
Используемым основанием может быть, например, неорганическое основание, включающее карбонат щелочного металла, такой как карбонат натрия, карбонат калия или карбонат лития; гидрокарбонат щелочного металла, такой как гидрокарбонат натрия, гидрокарбонат калия или гидрокарбонат лития; гидрид щелочного металла, такой как гидрид лития, гидрид натрия или гидрид калия; гидроксид щелочного металла, такой как гидроксид натрия, гидроксид калия или гидроксид лития, и фторид щелочного металла, такой как фторид натрия или фторид калия; алкоксид щелочного металла, такой, как метоксид натрия, этоксид натрия, метоксид калия, этоксид калия, трет-бутоксид калия или метоксид лития; меркаптан щелочного металла, такой как метилмеркаптан натрия или этилмеркаптан натрия; или органическое основание, такое как N-метилморфолин, триэтиламин, трипропиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин, N-метилпиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(N,N-диметиламино)пиридин, 2,6-ди-(трет-бутил)-4-метилпиридин, хинолин, N,N-диметиланилин, N,N-диэтиланилин, 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,4-диазабицикло[2.2.2]октан (DABCO) или 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU), предпочтительно карбонат калия, гидрид натрия или DBU.
Температура реакции зависит от исходного материала и реагента и составляет от -30°С до 150°С, предпочтительно от 0°С до 100°С.
Время реакции зависит от температуры реакции, исходного материала, реагента и вида использованного растворителя и составляет обычно от 5 минут до 48 часов, предпочтительно от 10 минут до 15 часов.
По окончании реакции требуемое соединение данной реакции может быть получено, например концентрированием реакционной смеси, добавлением к смеси органического растворителя, не смешивающегося с водой, такого как этилацетат, промывкой смеси водой, отделением органического слоя, содержащего требуемое соединение, сушкой органического слоя над безводным сульфатом магния или тому подобным и затем выпариванием органического растворителя с получением требуемого продукта.
Полученный продукт при необходимости дополнительно очищают традиционными методами обработки, например перекристаллизацией, переосаждением, колоночной хроматографией на силикагеле или тому подобным.
(С-3)
Данную стадию осуществляют способом, подобным описанному в А-7, наиболее предпочтительно с использованием трифторуксусной кислоты или уксусной кислоты.
(С-4)
Данную стадию осуществляют способом, подобным описанному в В-2.
(С-5)
Данную стадию осуществляют способом, подобным описанному в С-3.
Соединение (I) по настоящему изобретению, его фармакологически приемлемые соли или его пролекарства обладают ингибирующей активностью по отношению к агрегации тромбоцитов. Кроме того, соединение (I) по настоящему изобретению, его фармакологически приемлемые соли или его пролекарства проявляют превосходную фармакокинетику, такую как всасывание, распределение, период полураспада в плазме и тому подобное, и низкую токсичность в органах, таких как почка, печень и тому подобное. Поэтому соединение (I) по настоящему изобретению, его фармакологически приемлемые соли или его пролекарства пригодны, например, в качестве лекарственных средств и особенно пригодны как лечебные или профилактические средства для различных тромботических заболеваний.
Когда соединение по настоящему изобретению применяют как профилактическое или лечебное средство для заболеваний, определенными выше, указанное соединение, имеющее общую формулу (I), или его фармакологически приемлемые соли или пролекарства могут быть введены отдельно или в виде смеси с подходящими фармакологически приемлемыми наполнителями, разбавителями и тому подобным в различных лекарственных формах, таких как таблетки, капсулы, гранулы, порошки, сиропы или тому подобное для перорального введения и инъекционные растворы, суппозитории, пластыри, наружная аппликация или тому подобное для парентерального введения.
Каждая из указанных лекарственных форм может быть изготовлена по хорошо известной технологии с применением добавок, таких как наполнители (например, органические наполнители, включающие производные сахара, такие как лактоза, сахароза, глюкоза, маннит или сорбит; производные крахмала, такие как кукурузный крахмал, картофельный крахмал, α-крахмал или декстрин; производные целлюлозы, такие как кристаллическая целлюлоза; аравийскую камедь; декстран; пуллулан, и неорганические наполнители, включающие производные силиката, такие как ангидрид легкой кремниевой кислоты, синтетический силикат алюминия, силикат кальция или алюмометасиликат магния; производные фосфата, такие как гидрофосфат кальция; производные карбоната, такие, как карбонат кальция; или производные сульфата, такие как сульфат кальция), смазывающие вещества (например, стеариновая кислота; металлические производные стеарата, такие как стеарат кальция или стеарат магния; тальк; коллоидный диоксид кремния; воски, такие, как пчелиный воск или спермацет; борная кислота; адипиновая кислота; производные сульфата, такие как сульфат натрия; гликоль; фумаровая кислота; бензоат натрия; DL-лейцин; производные лаурилсульфата, такие как лаурилсульфат натрия или лаурилсульфат магния; производные кремниевой кислоты, такие как кремниевый ангидрид или гидрат кремниевой кислоты; или описанные выше производные крахмала), связывающие вещества (например, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, поливинилпирролидон, макрогол или наполнители, аналогичные описанным выше), разрыхлители (например, производные целлюлозы, такие как низкозамещенная гидроксипропилцеллюлоза, карбоксиметилцеллюлоза, кальций-карбоксиметилцеллюллоза или натрий-карбоксиметилцеллюлоза с внутренними поперечными связями; или химически модифицированные производные крахмала или целлюлозы, такие как карбоксиметилкрахмал, натрий-карбоксиметилкрахмал или сетчатый поливинилпирролидон), эмульгаторы (например, коллоидальная глина, такая, как бентонит или veegum; гидроксиды металлов, такие как гидроксид магния или гидроксид алюминия; анионные поверхностно-активные вещества, такие как лаурилсульфат натрия или стеарат кальция; катионные поверхностно-активные вещества, такие как бензалконийхлорид; и неионные поверхностно-активные вещества, такие как простые полиоксиэтиленалкиловые эфиры, сложные полиоксиэтиленсорбитановые эфиры жирных кислот или сложные сахарозные эфиры жирных кислот), стабилизаторы (например, сложноэфирные производные пара-гидроксибензойной кислоты, такие как метилпарабен или пропилпарабен; производные спиртов, такие как хлорбутанол, бензиловый спирт или фенилэтиловый спирт; бензалконийхлорид; производные фенола, такие как фенол или крезол; тимеросал; дегидроуксусная кислота или сорбиновая кислота), корригенты (например, обычно используемые подслащиватели, подкисляющие средства, ароматизаторы или тому подобное) и разбавители.
Конкретная доза соединения по настоящему изобретению изменяется в зависимости от тяжести симптомов у пациента, его возраста и тому подобного. Для перорального введения взрослому человеку количество активного компонента в стандартной лекарственной форме может находится в интервале от 1 мг (предпочтительно 30 мг) до 2000 мг (предпочтительно 1500 мг). Стандартная доза для внутривенного введения может находится в интервале от 0,5 мг (предпочтительно 5 мг) до 500 мг (предпочтительно 250 мг) соединения по настоящему изобретению. Стандартная доза может быть введена взрослому человеку 1-6 раз в сутки в зависимости от тяжести симптомов пациента.
Примеры
Настоящее изобретение далее описано более подробно на примерах, примерах испытаний и примерах изготовления лекарственных форм.
В примерах данные ЯМР-спектра соединения в форме хлороводородной соли представлены в виде данных ЯМР-спектра не содержащего хлороводородной соли производного соответствующего соединения, когда в качестве растворителя при определении спектральных данных ЯМР используют CDCl3. Не содержащее хлороводородной соли производное может быть получено обработкой небольшого количества соединения в форме хлороводородной соли водным раствором гидрокарбоната натрия с последующим экстрагированием образованного бессолевого производного этилацетатом или дихлорметаном.
(Пример 1) (E)-4-(Ацетилсульфанил)-3-бензилиден-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидин (соединение № 1-2)
(a) (E)-3-Бензилиден-1-(трифенилметил)пиперидин-4-он
К раствору 1-(трифенилметил)пиперидин-4-она (4,22 г) в бензоле (50 мл) добавляли пирролидин (1,02 мл) при комнатной температуре и полученную смесь кипятили с обратным холодильником в течение 3 часов. После охлаждения до комнатной температуры к реакционной смеси добавляли бензальдегид (1,26 мл) и полученную смесь еще кипятили с обратным холодильником в течение 2 часов. После кипячения с обратным холодильником реакционную смесь разбавляли этилацетатом, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Удаляли в вакууме растворитель и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из этилацетата и гексана (1:3), с получением указанного в заголовке соединения (3,92 г, выход: 74%) в виде желтого масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,67 (2H, шс), 2,77 (2H, т, J=6,0), 3,43 (2H, шс), 7,04-7,58 (20H, м).
(b) (E)-3-Бензилиден-1-(трифенилметил)пиперидин-4-ол
К раствору (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она (3,91 г) в смешанном растворителе из этанола (30 мл) и дихлорметана (30 мл) добавляли борогидрид натрия (0,34 г) при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в течение 2 часов. После перемешивания к реакционной смеси добавляли насыщенный водный раствор хлорида аммония и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Удаляли в вакууме растворитель и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из этилацетата и гексана (3:7), с получением указанного в заголовке соединения (2,61 г, выход: 66%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,85-1,94 (1H, м), 1,99-2,20 (2H, м), 2,53-2,78 (2H, м), 3,39-3,57 (1H, м), 4,13-4,21 (1H, м), 6,68 (1H, с), 6,99-7,38 (20H, м).
(c) (E)-4-(Ацетилсульфанил)-3-бензилиденпиперидина гидрохлорид
К раствору трифенилфосфина (6,39 г) в тетрагидрофуране (100 мл) добавляли раствор диизопропилазодикарбоксилата в толуоле (13,11 мл) при охлаждении льдом и полученную смесь перемешивали при той же самой температуре в течение 1 часа. Затем к реакционной смеси добавляли по каплям раствор (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-ола (5,26 г) и тиоуксусной кислоты (1,74 мл) в тетрагидрофуране (50 мл) при той же самой температуре и полученную смесь дополнительно перемешивали при комнатной температуре в течение 2,5 часов. Реакционную смесь упаривали в вакууме и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из этилацетата и гексана (2:23), с получением (E)-4-(ацетилсульфанил)-3-бензилиден-1-(трифенилметил)пиперидина (содержащего примеси) в виде бледно-желтого аморфного твердого вещества.
Затем к раствору полученного, как описано выше, неочищенного продукта в диоксане (50 мл) добавляли 4 н. раствор хлороводорода в диоксане (30 мл) при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь упаривали в вакууме и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из метанола и дихлорметана (1:9), с получением указанного в заголовке соединения (1,28 г, выход: 38%) в виде желтого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,02-2,11 (1H, м), 2,38 (3H, с), 2,49-2,62 (1H, м), 3,07-3,19 (1H, м), 3,28-3,39 (1H, м), 3,63 (1H, д, J=14,0), 4,10 (1H, д, J=14,0), 4,60 (1H, м), 6,96 (1H, с), 7,19-7,37 (5H, м).
(d) (E)-4-(Ацетилсульфанил)-3-бензилиден-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидин
К раствору (E)-4-(ацетилсульфанил)-3-бензилиден-пиперидина гидрохлорида и 2-бром-2-(2-фторфенил)-1-циклопропилэтанона (713 мг) в N,N-диметилформамиде (10 мл) добавляли карбонат калия (256 мг) при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь разбавляли этилацетатом и промывали насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом натрия. Удаляли в вакууме растворитель и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из этилацетата и гексана (3:17), с получением указанного в заголовке соединения (531 мг, выход: 68%) в виде желтого масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,38-0,95 (4H, м), 1,82-1,93 (1H, м), 2,12-2,35 (2H, м), 2,33 (3H, с), 2,38-2,47 и 2,56-2,64 (общая 1H, каждый м), 2,72-2,87 (1H, м), 2,98 и3,08 (общая 1H, каждый д, J=13,0), 3,57 и 3,72 (общая 1H, каждый д, J=13,0),4,51 (1H, м), 4,57 и 4,64 (общая 1H, каждый с), 6,65 и 6,67 (общая 1H, каждый с), 7,01-7,30 (8H, м), 7,33-7,43 (1H, м);
МС (FAB) m/z : 424 (М+H)+.
(Пример 2) (E)-3-Бензилиден-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидротрифторацетат (соединение № 1-1)
В раствор (E)-4-(ацетилсульфанил)-3-бензилиден-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина (126 мг) в этаноле (10 мл) барботировали хлороводород при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в герметически закрытом состоянии в течение ночи. Реакционную смесь упаривали в вакууме и остаток очищали, используя препаративную ВЭЖХ [YMC-Pack ODS-A; YMC, подвижная фаза: ацетонитрил/0,026 н. водный раствор трифторуксусной кислоты (55:45, об./об.)] с получением указанного в заголовке соединения (121 мг, выход: 82%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,42-0,95 (4H, м), 1,76-1,86 (1H, м), 2,10-2,37 (2H, м), 2,58-2,92 (2H, м), 3,36 (1H, д, J=12,5), 3,44 (1H, д, J=12,5), 3,92 и 3,96 (общая 1H, каждый т, J=6,0), 4,61 и 4,66 (общая 1H, каждый с), 6,62 (1H, с), 6,94-7,25 (9H, м);
МС (FAB) m/z : 382 (М+H)+.
(Пример 3) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(тиофен-2-ил)метилиден]пиперидин (соединение № 1-6)
(a) (E)-3-[(Тиофен-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-он
Указанное в заголовке соединение синтезировали с выходом 74% в виде желтого аморфного твердого вещества, используя тиофен-2-карбальдегид вместо бензальдегида, проведением реакции, подобной описанной в примере 1 (a).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2, 67 (2H, шс), 2,76 (2H, т, J=6,0), 3,52 (2H, шс), 7,06 (1H, дд, J=5,0, 3,5), 7,15-7,21 (3H, м), 7,23 (1H, д, J=3,5), 7,25-7,32 (6H, м), 7,44 (1H, д, J=5,0), 7,52-7,58 (6H, м), 7,76 (1H, с).
(b) (E)-3-[(Тиофен-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 84% в виде бесцветного аморфного твердого вещества, используя (E)-3-[(тиофен-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1 (b).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,86-1,97 (1H, м), 2,07-2,21 (2H, м), 2,65-2,84 (2H, м), 3,53-3,76 (1H, м), 4,15-4,22 (1H, м), 6,69 (1H, с), 6,83 (1H, д, J=3,5), 6,90 (1H, дд, J=5,0, 3,5), 7,08-7,21 (10H, м), 7,39-7,45 (6H, м).
(c) (E)-4-(Ацетилсульфанил)-3-[(тиофен-2-ил)метилиден]пиперидина гидрохлорид
Указанное в заголовке соединение синтезировали с выходом 12% в виде бесцветного аморфного твердого вещества, используя (E)-3-[(тиофен-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-ола, последовательным проведением реакций, подобных описанным в примере 1 (c).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,01-2,09 (1H, м), 2,36 (3H, с), 2,53-2,63 (1H, м), 3,10-3,19 (1H, м), 3,38-3,45 (1H, м), 3,71 (1H, д, J=14,5), 4,49 (1H, д, J=14,5), 4,60 (1H, м), 6,93 (1H, с), 6,99 (1H, дд, J=5,0, 3,5), 7,06 (1H, д, J=3,5), 7,31 (1H, д, J=5,0).
(d) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(тиофен-2-ил)метилиден]пиперидин
Указанное в заголовке соединение синтезировали с выходом 29% в виде желтого масла, используя (E)-4-(ацетилсульфанил)-3-[(тиофен-2-ил)метилиден]пиперидина гидрохлорид вместо (E)-4-(ацетилсульфанил)-3-бензилиденпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 1 (d).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,63-1,02 (4H, м), 1,84-1,92 (1H, м), 2,21-2,36 (2H, м), 2,31 (3H, с), 2 , 43-2 , 49 и 2 , 56-2 , 63 (общая 1H, каждый м), 2,75-2,81 и 2,82-2,88 (общая 1H, каждый м), 3,04 и 3,17 (общая 1H, каждый д, J=13,0), 3,89 и 3,97 (общая 1H, каждый д, J=13,0), 4,52 (1H, м), 4,70 и 4,72 (общая 1H, каждый с), 6,69 и 6,70 (общая 1H, каждый с), 6,84-6,96 (2H, м), 7,05-7,22 (3H, м), 7,27-7,35 (1H, м), 7,39-7,44 (1H, м);
ИК (Жидкостная пленка, см-1): 1693, 1488.
(Пример 4) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанил-3-[(тиофен-2-ил)метилиден]пиперидина гидрохлорид (соединение № 1-6)
Указанное в заголовке соединение синтезировали с выходом 34% в виде желтого масла, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(тиофен-2-ил)метилиден]пиперидин вместо (E)-4-(ацетилсульфанил)-3-бензилиден-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина, проведением реакции, подобной описанной в примере 2.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,63-1,08 (4H, м), 1,76-1,85 (1H, м), 2,16-2,37 (2H, м), 2,62-2,93 (2H, м), 3,46-3,75 (2H, м), 3,92-3,97 (1H, м), 4,74 и 4,76 (общая 1H, каждый с), 6,63 и 6,64 (общая 1H, каждый с), 6,84-6,86 (2H, м), 7,05-7,23 (3H, м), 7,25-7,34 (1H, м), 7,38-7,46 (1H, м);
ИК (Тонкая пленка, см-1): 2559, 1713, 1670.
(Пример 5) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(тиофен-3-ил)метилиден]пиперидин (соединение № 1-10)
(a) (E)-3-[(Тиофен-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-он
Указанное в заголовке соединение синтезировали с выходом 90% в виде желтого аморфного твердого вещества, используя тиофен-3-карбальдегид вместо бензальдегида, проведением реакции, подобной описанной в примере 1 (a).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,68 (2H, шс), 2,75 (2H, т, J=5,5), 3,47 (2H, шс), 6,99 (1H, д, J=5,0), 7,12-7,34 (11H, м), 7,45-7,57 (7H, м).
(b) (E)-3-[(Тиофен-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 76% в виде бесцветного аморфного твердого вещества, используя (E)-3-[(тиофен-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1 (b).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,84-1,96 (1H, м), 2,08-2,19 (2H, м), 2,63-2,78 (2H, м), 3,41-3,66 (1H, м), 4,12-4,20 (1H, м), 6,56 (1H, с), 6,91-6,95 (2H, м), 7,06-7,21 (10H, м), 7,34-7,41 (6H, м).
(c) (E)-4-(Ацетилсульфанил)-3-[(тиофен-3-ил)метилиден]пиперидина гидрохлорид
Указанное в заголовке соединение синтезировали с выходом 16% в виде бледно-желтого аморфного твердого вещества, используя (E)-3-[(тиофен-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-ола, последовательным проведением реакций, подобных описанным в примере 1 (c).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,00-2,08 (1H, м), 2,37 (3H, с), 2,49-2,58 (1H, м), 3,08-3-19 (1H, м), 3,32-3,41 (1H, м), 3,65 (1H, д, J=14,0), 4,24 (1H, д, J=14,0), 4,57 (1H, м), 6,81 (1H, с), 7,04 (1H, д, J=5,0), 7,28-7,31 (2H, м).
(d) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(тиофен-3-ил)метилиден]пиперидин
Указанное в заголовке соединение синтезировали с выходом 42% в виде желтого масла, используя (E)-4-(ацетилсульфанил)-3-[(тиофен-3-ил)метилиден]пиперидина гидрохлорид вместо (E)-4-(ацетилсульфанил)-3-бензилиденпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 1 (d).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,55-1,02 (4H, м), 1,82-1,93 (1H, м), 2,13-2,36 (2H, м), 2,32 (3H, с), 2,40-2,49 и 2,55-2,64 (общая 1H, каждый м), 2,72-2,80 и 2,81-2,88 (общая 1H, каждый м), 2,99 и 3,11 (общая 1H, каждый д, J=13,0), 3,70 и 3,80 (общая 1H, каждый д, J=13,0), 4,49 (1H, м), 4,64 и 4,69 (общая 1H, каждый с), 6,54 и 6,56 (общая 1H, каждый с), 6,85-7,00 (2H, м), 7,03-7,44 (5H, м);
ИК (Тонкая пленка, см-1): 1694, 1488.
(Пример 6) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанил-3-[(тиофен-3-ил)метилиден]пиперидина гидрохлорид (соединение № 1-9)
Указанное в заголовке соединение синтезировали с выходом 55% в виде желтого аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(тиофен-3-ил)метилиден]пиперидин вместо (E)-4-(ацетилсульфанил)-3-бензилиден-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина, проведением реакции, подобной описанной в примере 2.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,55-1,01 (4H, м), 1,74-1,85 (1H, м), 2,08-2,37 (2H, м), 2,57-2,92 (2H, м), 3,38-3,57 (2H, м), 3,85-3,97 (1H, м), 4,68 и 4,72 (общая 1H, каждый с), 6,51 (1H, с), 6,86-7,45 (7H, м);
ИК (KBr, см-1): 2519, 1712.
(Пример 7) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-2-ил)метилиден]пиперидин (соединение № 1-14)
(a) (E)-3-[(Фуран-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-он
Указанное в заголовке соединение синтезировали с выходом 58% в виде бледно-желтого аморфного твердого вещества, используя 2-фуральдегид вместо бензальдегида, проведением реакции, подобной описанной в примере 1 (a).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,65 (2H, шс), 2,74 (2H, т, J=6,0), 3,57 (2H, шс), 6,40-6,42 (2H, м), 7,14-7,22 (3H, м), 7,25-7,31 (6H, м), 7,31-7,33 (1H, м), 7,49-7,59 (7H, м).
(b) (E)-3-[(Фуран-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 72% в виде бледно-желтого аморфного твердого вещества, используя (E)-3-[(фуран-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1 (b).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,82-1,94 (2H, м), 1,95-2,07 (1H, м), 2,08-2,18 (1H, м), 2,72-2,83 (2H, м), 4,05-4,12 (1H, м), 6,16 (1H, д, J=3,0), 6,29-6,32 (1H, м), 6,37 (1H, шс), 7,09-7,17 (3H, м), 7,18-7,24 (6H, м), 7,41-7,53 (7H, м).
(c) (E)-3-[(Фуран-2-ил)метилиден]пиперидин-4-ола гидроацетат
К раствору (E)-3-[(фуран-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-ола (3,70 г) в дихлорметане (75 мл) добавляли уксусную кислоту (10 мл) при охлаждении льдом и полученную смесь перемешивали при 60°C в течение 3 часов. После перемешивания к реакционной смеси добавляли уксусную кислоту (10 мл) и полученную смесь дополнительно перемешивали при 60°C в течение 1,5 часов. Реакционную смесь упаривали в вакууме и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из метанола и дихлорметана (1:19-1:9), с получением указанного в заголовке соединения (2,81 г, выход: количественный) в виде бледно-коричневого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,29-1,42 (1H, м), 1,76-1,87 (1H, м), 2,48-2,62 (1H, м), 2,81-2,90 (1H, м), 3,05 (1H, д, J=13,0), 3,96-4,02 (1H, м), 4,10 (1H, д, J=13,0), 6,18 (1H, шс), 6,26-6,28 (1H, м), 6,41-6,43 (1H, м), 7,52-7,54 (1H, м).
(d) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-2-ил)метилиден]пиперидин-4-ол
К раствору (E)-3-[(фуран-2-ил)метилиден]пиперидин-4-ола гидроацетата (2,81 г) и 2-бром-2-(2-фторфенил)-1-циклопропилэтанона (2,71 г) в N,N-диметилформамиде (60 мл) добавляли триэтиламин (1,22 мл) при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в течение 1 часа. После перемешивания к реакционной смеси добавляли воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом натрия. Удаляли в вакууме растворитель и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из этилацетата и гексана (3:7-1:1), с получением указанного в заголовке соединения (2,30 г, выход: 74%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,70-1,11 (4H, м), 1,61-1,86 (2H, м), 2,23-2,32 (1H, м), 2,43-2,60 (1H, м), 2,84-2,95 (1H, м), 3,20 и 3,36 (общая 1H, каждый д, J=13,0), 3,96 и 4,01 (общая 1H, каждый д, J=13,0), 4,19-4,25 (1H, м), 4,73 (1H, с), 6,15-6,22 (1H, м), 6,30-6,36 (2H, м), 7,03-7,19 (2H, м), 7,20-7,37 (2H, м), 7,42-7,51 (1H, м).
(e) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-2-ил)метилиден]пиперидин
К раствору (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-2-ил)метилиден]пиперидин-4-ола (2,30 г) в толуоле (50 мл) добавляли тиоуксусную кислоту (0,92 мл) и динеопентилацеталь N,N-диметилформамида (3,61 г) при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в течение 1 часа. После перемешивания к реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом натрия. Удаляли в вакууме растворитель и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из этилацетата и гексана (1:19-1:9), с получением указанного в заголовке соединения (0,58 г, выход: 22%) в виде оранжевого масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,69-1,09 (4H, м), 1,81-1,92 (1H, м), 2,21-2,38 (2H, м), 2,31 (3H, с), 2 , 38-2 , 48 и 2 , 52-2 , 63 (общая 1H, каждый м), 2,75-2,81 и 2,82-2,89 (общая 1H, каждый м), 3,22 и 3,04 (общая 1H, каждый д, J=13,0), 4,09-4,20 (1H, м), 4,46-4,51 (1H, м), 4,69 и 4,72 (общая 1H, каждый с), 6,15 и 6,21 (общая 1H, каждый д, J=3,0), 6,28-6,35 (1H, м), 6,35 и 6,36 (общая 1H, каждый с), 7,04-7,19 (2H, м), 7,24-7,37 (2H, м), 7,43-7,51 (1H, м);
МС (FAB) m/z : 414 (М+H)+.
(Пример 8) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-2-ил)метилиден]-4-сульфанилпиперидин (соединение № 1-13)
К раствору (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-2-ил)метилиден]пиперидина (100 мг) в метаноле (2,5 мл) добавляли карбонат калия (50 мг) при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в течение 15 минут. После перемешивания к реакционной смеси добавляли воду и полученную смесь экстрагировали дихлорметаном. Экстракт промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом натрия. Удаляли в вакууме растворитель и остаток очищали, используя препаративную ВЭЖХ [YMC-Pack ODS-A; YMC, подвижная фаза: смесь 70% метанол/вода, содержащая уксусную кислоту (0,20%) и триэтиламин (0,45%), (70:30, об./об.)]. Элюированную фракцию, содержащую продукт реакции, экстрагировали этилацетатом и органический слой сушили над безводным сульфатом натрия и упаривали в вакууме с получением указанного в заголовке соединения (40 мг, выход: 45%) в виде бледно-коричневых кристаллов.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,68-1,08 (4H, м), 1,75-1,83 (1H, м), 2,20-2,35 (2H, м), 2,61-2,73 (1H, м), 2,74-2,91 (1H, м), 3,41-3,44 (1H, м), 3,54-3,93 (2H, м), 4,74 и 4,78 (общая 1H, каждый с), 6,15 и 6,21 (общая 1H, каждый д, J=3,0), 6,28-6,36 (2H м), 7,05-7,22 (2H, м), 7,25-7,36 (2H, м), 7,41-7,52 (1H, м);
МС (FAB) m/z : 372 (М+H)+.
(Пример 9) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-3-ил)метилиден]пиперидин (соединение № 1-18)
(a) (E)-3-[(Фуран-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-он
Указанное в заголовке соединение синтезировали с выходом 46% в виде желтого аморфного твердого вещества, используя 3-фуральдегид вместо бензальдегида, проведением реакции, подобной описанной в примере 1 (a).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,56 (2H, шс), 2,74 (2H, т, J=5,5), 3,35 (2H, шс), 6,27 (1H, д, J=1,5), 7,15-7,22 (3H, м), 7,25-7,33 (6H, м), 7,36 (1H, т, J=1,5), 7,38 (1H, м), 7,40 (1H, с), 7,48-7,57 (6H, м).
(b) (E)-3-[(Фуран-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 44% в виде бледно-желтого аморфного твердого вещества, используя (E)-3-[(фуран-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1 (b).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,82-1,94 (1H, м), 2,07-2,21 (2H, м), 2,58-2,71 (2H, м), 3,33-3,55 (1H, м), 4,15 (1H, м), 6,23 (1H, м), 6,33 (1H, с), 7,08-7,25 (10H, м), 7,30 (1H, т, J=1,5), 7,36-7,50 (6H, м).
(c) (E)-4-(Ацетилсульфанил)-3-[(фуран-3-ил)метилиден]пиперидина гидрохлорид
Указанное в заголовке соединение синтезировали с выходом 7% в виде бесцветного аморфного твердого вещества, используя (E)-3-[(фуран-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-ола, последовательным проведением реакций, подобных описанным в примере 1 (c).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 2,02-2,09 (1H, м), 2,37 (3H, с), 2,49-2,59 (1H, м), 3,15-3,23 (1H, м), 3,38-3,46 (1H, м), 3,66 (1H, д, J=14,5), 4,25 (1H, д, J=14,5), 4,57 (1H, т, J=4,0), 6,46 (1H, м), 6,63 (1H, с), 7,40 (1H, с), 7,54 (1H, с).
(d) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-3-ил)метилиден]пиперидин
Указанное в заголовке соединение синтезировали с выходом 88% в виде желтого масла, используя (E)-4-(ацетилсульфанил)-3-[(фуран-3-ил)метилиден]пиперидина гидрохлорид вместо (E)-4-(ацетилсульфанил)-3-бензилиденпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 1 (d).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,64-1,03 (4H, м), 1,81-1,90 (1H, м), 2,13-2,35 (2H, м), 2,30 и 2,31 (общая 3H, каждый с), 2,40-2,48 и 2,53-2,61 (общая 1H, каждый м), 2,70-2,77 и 2,79-2,86 (общая 1H, каждый м),2,93 и 3,08 (общая 1H, каждый д, J=13,0),3,66 и 3,73 (общая 1H, каждый д, J=13,0), 4,48 (1H, м), 4,68 и 4,72 (общая 1H, каждый с), 6,21 и 6,32 (общая 1H, каждый с), 6,33 и 6,35 (общая 1H, каждый с), 7,05-7,17 (2H, м), 7,24-7,35 (3H, м), 7,36-7,44 (1H, м);
МС (FAB) m/z : 414 (М+H)+.
(Пример 10) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-3-ил)метилиден]-4-сульфанилпиперидина гидротрифторацетат (соединение № 1-17)
Указанное в заголовке соединение синтезировали с выходом 56% в виде желтого масла, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-3-ил)метилиден]пиперидин вместо (E)-4-(ацетилсульфанил)-3-бензилиден-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина, проведением реакции, подобной описанной в примере 2.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,65-1,07 (4H, м), 1,72-1,82 (1H, м), 2,10-2,52 (3H, м), 2,58-2,90 (2H, м), 3,34-3,50 (1H, м), 3,90 (1H, м), 4,72 и 4,75 (общая 1H, каждый с), 6,23 и 6,28 (общая 1H, каждый с), 6,30 и 6,31 (общая 1H, каждый с), 7,04-7,18 (2H, м), 7,22-7,48 (4H, м);
МС (FAB) m/z : 372 (М+H)+.
(Пример 11) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1H-пиразол-3(5)-ил]метилиден}пиперидина дигидрохлорид (соединение № 1-22)
(a) (E)-3-{[1-(трет-Бутоксикарбонил)-1H-пиразол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-он
Указанное в заголовке соединение синтезировали с выходом 39% в виде желтого аморфного твердого вещества, используя 1-(трет-бутоксикарбонил)-1H-пиразол-3-карбальдегид вместо бензальдегида, проведением реакции, подобной описанной в примере 1(a).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,60 (9H, с), 2,65 (2H, шс), 2,76 (2H, т, J=6,0), 3,70 (2H, шс), 6,28 (1H, д, J=3,0), 7,13-7,18 (3H, м), 7,22-7,28 (6H, м), 7,41 (1H, с), 7,48-7,55 (6H, м), 8,02 (1H, д, J=3,0).
(b) (E)-3-{[1-(трет-Бутоксикарбонил)-1H-пиразол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 99% в виде бесцветного аморфного твердого вещества, используя (E)-3-{[1-(трет-бутоксикарбонил)-1H-пиразол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1 (b).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,59 (9H, с), 1,86-1,94 (1H, м), 2,11-2,18 (2H, м), 2,76-2,89 (2H, м), 3,25-3,36 (1H, м), 4,11-4,18 (1H, м), 6,22 (1H, д, J=3,0), 6,53 (1H, с), 7,05-7,18 (9H, м), 7,36-7,43 (6H, м), 7,99 (1H, д, J=3,0).
(c) (E)-4-(Ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-1H-пиразол-3-ил]метилиден}пиперидина гидрохлорид
К раствору (E)-3-{[1-(трет-бутоксикарбонил)-1H-пиразол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола (15,0 г) в дихлорметане (300 мл) добавляли последовательно метансульфонилхлорид (2,5 мл) и триэтиламин (4,5 мл) при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в течение 1 часа и затем упаривали в вакууме. Затем к раствору полученного остатка в диметилсульфоксиде (200 мл) добавляли тиоацетат калия (16,5 г) при комнатной температуре и полученную смесь перемешивали при 50°C в течение 30 минут. После перемешивания к реакционной смеси добавляли воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом магния. Удаляли растворитель и остаток очищали хроматографией на колонке с силикагелем, используя смешанный растворитель из этилацетата, гексана и дихлорметана (1:8:1), с получением (E)-4-(ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-1H-пиразол-3-ил]метилиден}-1-(трифенилметил)пиперидина (содержащего примеси) в виде желтого аморфного твердого вещества.
Затем к раствору полученного, как описано выше, неочищенного продукта в диоксане (60 мл) добавляли 4 н. раствор хлороводорода в диоксане (20 мл) при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь упаривали в вакууме и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из метанола и дихлорметана (1:19), с получением указанного в заголовке соединения (1,2 г, выход: 11%) в виде желтого твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,63 (9H, с), 2,07-2,14 (1H, м), 2,34 (3H, с), 2,58-2,67 (1H, м), 3,14-3,23 (1H, м), 3,48-3,55 (1H, м), 3,82 (1H, д, J=14,5), 4,59 (1H, м), 4,95 (1H, д, J=14,5), 6,40-6,41 (1H, м), 6,68 (1H, с), 7,97-7,99 (1H, м).
(d) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1H-пиразол-3(5)-ил]метилиден}пиперидина дигидрохлорид
К раствору (E)-4-(ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-1H-пиразол-3-ил]метилиден}пиперидина гидрохлорида (1,15 г) и 2-бром-2-(2-фторфенил)-1-циклопропилэтанона (0,88 г) в N,N-диметилформамиде (20 мл) добавляли карбонат калия (0,24 г) при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь разбавляли этилацетатом и промывали насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом натрия. Удаляли в вакууме растворитель и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из этилацетата и гексана (1:3-1:1), с получением (E)-4-(ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина (0,48 г, выход: 27%) в виде бесцветного аморфного твердого вещества.
Затем к полученному продукту (0,48 г) добавляли 4 н. раствор хлороводорода в диоксане (10 мл) при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь упаривали в вакууме и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из метанола и дихлорметана (1:19-1:4), с получением указанного в заголовке соединения (0,43 г, выход: 95%) в виде желтого аморфного твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,69-0,89 (2H, м), 1,05-1,14 (2H, м), 1,83-2,04 (2H, м), 2,16-2,25 (1H, м), 2,29 и 2,33 (общая 3H, каждый с), 2,29-2,36 и 2,63-2,70 (общая 1H, каждый м), 2,47-2,59 (1H, м), 2,78-2,88 (1H, м), 3,26 и 3,82 (общая 1H, каждый м), 4,39 и 4,45 (общая 1H, каждый м), 4,81 и 4,91 (общая 1H, каждый с), 6,13 и 6,19 (общая 1H, каждый д, J=2,0), 6,48 (1H, с), 7,09-7,18 (2H, м), 7,22-7,39 (2H, м), 7,50 и 7,52 (общая 1H, каждый д, J=2,0);
ИК (KBr, см-1): 1701, 1494.
(Пример 12) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1H-пиразол-3(5)-ил]метилиден}-4-сульфанилпиперидина дигидрохлорид (соединение № 1-21)
Указанное в заголовке соединение синтезировали с выходом 35% в виде бесцветного аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1H-пиразол-3(5)-ил]метилиден}пиперидина дигидрохлорид вместо (E)-4-(ацетилсульфанил)-3-бензилиден-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина, проведением реакции, подобной описанной в примере 2.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,70-0,79 (2H, м), 0,80-0,89 (2H, м), 1,75-1,85 (1H, м), 1,91-2,02 (1H, м), 2,20-2,35 (1H, м), 2,52-2,58 и 2,60-2,67 (общая 1H, каждый м), 2,76-2,84 (1H, м), 3,17-3,28 и 3,68-3,72 (общая 1H, каждый м), 3,39 и 3,50 (общая 1H, каждый д, J=ll, 5), 3,73-3,78 и 3,84-3,89 (общая 1H, каждый м), 4,88 и 4,89 (общая 1H, каждый с), 6,15 и 6,20 (общая 1H, каждый д, J=2,0), 6,47 и 6,52 (общая 1H, каждый с), 7,10-7,19 (2H, м), 7,24-7,38 (2H, м), 7,51 и 7,53 (общая 1H, каждый д, J=2,0);
ИК (KBr, см-1): 2558, 1711.
(Пример 13) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1H-пиразол-4-ил)метилиден]пиперидина дигидрохлорид (соединение № 1-14)
(a) (E)-3-{[1-(трет-бутоксикарбонил)-1H-пиразол-4-ил]метилиден}-1-(трифенилметил)пиперидин-4-он
К раствору 1-(трифенилметил)пиперидин-4-она (15,4 г) в тетрагидрофуране (250 мл) добавляли по каплям 0,5 н. раствор бис(триметилсилил)амида калия в толуоле (90,4 мл) при -70°C и полученную смесь перемешивали при той же самой температуре в течение 30 минут. Затем к реакционной смеси добавляли по каплям раствор 1-(трет-бутоксикарбонил)-1H-пиразол-4-карбальдегида (8,9 г) в тетрагидрофуране (50 мл) при -70°C и полученную смесь перемешивали при той же самой температуре в течение 1 часа. После перемешивания к реакционной смеси добавляли насыщенный водный раствор хлорида аммония и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом магния. Удаляли в вакууме растворитель и остаток очищали хроматографией на колонке с силикагелем, используя смешанный растворитель из этилацетата, гексана и дихлорметана (1:5:1), с получением производного спирта (14,8 г) в виде бесцветного аморфного твердого вещества.
Затем к раствору полученных производных спирта (14,8 г) в дихлорметане (150 мл) добавляли последовательно метансульфонилхлорид (4,3 мл) и триэтиламин (9,6 мл) при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в течение 15 минут. После охлаждения до 0°C к реакционной смеси добавляли при перемешивании 1,8-диазабицикло[5.4.0]ундец-7-ен (8,3 мл) и полученную смесь перемешивали при комнатной температуре в течение 15 минут. После перемешивания к реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом магния. Удаляли в вакууме растворитель и остаток очищали хроматографией на колонке с силикагелем, используя смешанный растворитель из этилацетата, гексана и дихлорметана (1:4:1), с получением указанного в заголовке соединения (5,86 г, выход: 31%) в виде желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,64 (9H, с), 2,70 (2H, шс), 2,75 (2H, т, J=5,5), 3,37 (2H, шс), 7,15-7,21 (3H, м), 7,25-7,32 (6H, м), 7,38 (1H, с), 7,48-7,54 (6H, м), 7,56 (1H, с), 7,97 (1H, с).
(b) (E)-4-(Ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-1H-пиразол-4-ил]метилиден}пиперидина гидротрифторацетат
К раствору (E)-3-{[1-(трет-бутоксикарбонил)-1H-пиразол-4-ил]метилиден}-1-(трифенилметил)пиперидин-4-она (1020 мг) в метаноле (40 мл) добавляли борогидрид натрия (89 мг) при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в течение 10 минут. После перемешивания к реакционной смеси добавляли насыщенный водный раствор хлорида аммония и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом магния. Удаляли растворитель в вакууме с получением производного спирта (1020 мг) в виде бесцветного аморфного твердого вещества.
Затем к раствору производного спирта (1020 мг) в дихлорметане (20 мл) добавляли последовательно метансульфонилхлорид (0,16 мл) и триэтиламин (0,33 мл) при охлаждении льдом и полученную смесь перемешивали при той же самой температуре в течение 3 часов. После перемешивания к реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом магния и упаривали в вакууме. Затем к раствору остатка в диметилсульфоксиде (20 мл) добавляли тиоацетат калия (1340 мг) при комнатной температуре и полученную смесь перемешивали при 50°C в течение 1 часа. После перемешивания к реакционной смеси добавляли воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом магния. Удаляли в вакууме растворитель и остаток очищали хроматографией на колонке с силикагелем, используя смешанный растворитель из этилацетата, гексана и дихлорметана (1:6:1), с получением производного сложного тиоэфира (420 мг, выход: 38%) в виде желтого аморфного твердого вещества.
Затем к раствору полученного производного сложного тиоэфира (420 мг) в дихлорметане (30 мл) добавляли трифторуксусную кислоту (0,17 мл) при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в течение 10 минут. После перемешивания реакционную смесь упаривали в вакууме и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из метанола и дихлорметана (1:19-1:9), с получением указанного в заголовке соединения (161 мг, выход: 49%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,63 (9H, с), 2,08 (1H, м), 2,38 (3H, с), 2,48 (1H, м), 3,21 (1H, м), 3,40 (1H, м), 3,73 (1H, д, J=14,0), 4,18 (1H, д, J=14,0), 4,58 (1H, м), 6,62 (1H, с), 7,65 (1H, с), 8,01 (1H, с).
(c) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1H-пиразол-4-ил)метилиден]пиперидина дигидрохлорид
Указанное в заголовке соединение синтезировали с выходом 68% в виде бесцветного аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-1H-пиразол-4-ил]метилиден}пиперидина гидротрифторацетат вместо (E)-4-(ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-1H-пиразол-3-ил]метилиден}пиперидина гидрохлорида, проведением реакции, подобной описанной в примере 11 (d).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,63-0,86 (2H, м), 0,90-1,05 (2H, м), 1,81-1,92 (1H, м), 2,07-2,17 (1H, м), 2,19-2,38 (1H, м), 2,31 и 2,32 (общая 3H, каждый с), 2,41-2,50 и 2,53-2,62 (общая 1H, каждый м), 2,69-2,77 и 2,80-2,87 (общая 1H, каждый м), 2,92 и 3,09 (общая 1H, каждый д, J=12,5), 3,61-3,81 (1H, м), 4,49 (1H, т, J=4,5), 4,71 и 4,76 (общая 1H, каждый с), 6,41 и 6,43 (общая 1H, каждый с), 7,05-7,20 (2H, м), 7,28-7,45 (2H, м), 7,44 (1H, с), 7,52 (1H, с);
МС (FAB) m/z: 414 (М+H)+.
(Пример 14) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1H-пиразол-4-ил)метилиден]-4-сульфанилпиперидина дигидрохлорид (соединение № 1-25)
Указанное в заголовке соединение синтезировали с выходом 20% в виде бесцветного аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1H-пиразол-4-ил)метилиден]пиперидин вместо (E)-4-(ацетилсульфанил)-3-бензилиден-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина, проведением реакции, подобной описанной в примере 2.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,64-0,85 (2H, м), 1,03-1,17 (2H, м), 1,74-1,83 (1H, м), 2,06-2,16 (1H, м), 2,20-2,36 (1H, м), 2,58-2,72 (1H, м), 2,73-2,90 (1H, м), 3,38 и 3,46 (общая 1H, каждый д, J=13,0), 3,48 и 3,50 (общая 1H, каждый д, J=13,0), 3,87-3,94 (1H, м), 4,76 и 4,78 (общая 1H, каждый с),6,37 и 6,38 (общая 1H, каждый с), 7,05-7,18 (2H, м), 7,28-7,43 (2H, м), 7,45 (1H, с), 7,51 (1H, с);
ИК (KBr, см-1): 2548, 1709.
(Пример 15) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,3-тиазол-2-ил)метилиден]пиперидин (соединение № 1-30)
(a) (E)-3-[(1,3-Тиазол-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-он
Указанное в заголовке соединение синтезировали с выходом 81% в виде желтого аморфного твердого вещества, используя 1,3-тиазол-2-карбальдегид вместо бензальдегида, проведением реакции, подобной описанной в примере 1 (a).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 2,69 (2H, шс), 2,80 (2H, т, J=6,0), 3,76 (2H, шс), 7,14-7,20 (3H, м), 7,24-7,31 (6H, м), 7,41 (1H, д, J=3,0), 7,51-7,56 (6H, м), 7,66 (1H, с), 7,86 (1H, д, J=3,0).
(b) (E)-3-[(1,3-Тиазол-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 99% в виде желтого аморфного твердого вещества, используя (E)-3-[(1,3-тиазол-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1 (b).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,85-2,03 (1H, м), 2,10-2,22 (2H, м), 2,44-2,69 (1H, м), 2,83-2,97 (1H, м), 4,09-4,20 (1H, м), 4,24-4,48 (1H, м), 6,82 (1H, с), 7,06-7,19 (9H, м), 7,21 (1H, д, J=3,5), 7,37-7,44 (6H, м), 7,58 (1H, д, J=3,5).
(c) (E)-4-(Ацетилсульфанил)-3-[(1,3-тиазол-2-ил)метилиден]пиперидина гидрохлорид
Указанное в заголовке соединение синтезировали с выходом 12% в виде желтого аморфного твердого вещества, используя (E)-3-[(1,3-тиазол-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-ола, последовательным проведением реакций, подобных описанным в примере 1 (c).
1H ЯМР (500 МГц, ДМСО-d6) δ м.д.: 1,97-2,04 (1H, м), 2,28-2,37 (1H, м), 2,40 (3H, с), 3,07-3,17 (1H, м), 3,30-3,40 (1H, м), 4,03-4,11 (1H, м), 4,59 (1H, м), 4,99-5,06 (1H, м), 7,01 (1H, с), 7,86 (1H, д, J=3,5), 7,98 (1H, д, J=3,5).
(d) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,3-тиазол-2-ил)метилиден]пиперидин
Указанное в заголовке соединение синтезировали с выходом 28% в виде желтого аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-3-[(1,3-тиазол-2-ил)метилиден]пиперидина гидрохлорид вместо (E)-4-(ацетилсульфанил)-3-бензилиденпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 1 (d).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,65-0,82 (2H, м), 0,87-1,06 (2H, м), 1,91 (1H, м), 2,22-2,37 (2H, м), 2,31 и 2,32 (общая 3H, каждый с), 2,45-2,52 и 2,61-2,68 (общая 1H, каждый м), 2,79-2,87 (1H, м), 3,32 и 3,40 (общая 1H, каждый д, J=13,5), 4,38-4,43 и 4,48-4,54 (общая 2H, каждый м), 4,72 и 4,75 (общая 1H, каждый с), 6,74 (1H, с), 7,03-7,17 (2H, м), 7,22 и 7,24 (общая 1H, каждый д, J=3,5), 7,26-7,33 (1H, м), 7,38-7,45 (1H, м), 7,65 и 7,71 (общая 1H, каждый д, J=3,5);
ИК (Жидкостная пленка, см-1): 1694, 1488.
(Пример 16) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанил-3-[(1,3-тиазол-2-ил)метилиден]пиперидина гидротрифторацетат (соединение № 1-29)
Указанное в заголовке соединение синтезировали с выходом 37% в виде бледно-желтого аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,3-тиазол-2-ил)метилиден]пиперидин вместо (E)-4-(ацетилсульфанил)-3-бензилиден-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина, проведением реакции, подобной описанной в примере 2.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,66-0,81 (2H, м), 0,84-1,08 (2H, м), 1,81-1,89 (1H, м), 2,18-2,26 (1H, м), 2,28-2,38 (1H, м), 2,65-2,74 (1H, м), 2,78-2,85 и 2,88-2,96 (общая 1H, каждый м), 3,83-3,95 (2H, м), 3,97-4,08 (1H, м), 4,76 и 4,78 (общая 1H, каждый с), 6,74 (1H, с), 7,03-7,15 (2H, м), 7,23 и 7,25 (общая 1H, каждый д, J=3,0), 7,27-7,33 (1H, м), 7,38-7,44 (1H, м), 7,68 и 7,70 (общая 1H, каждый д, J=3,0);
ИК (KBr, см-1): 2553, 1713, 1672.
(Пример 17) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,3-тиазол-5-ил)метилиден]пиперидин (соединение № 1-38)
(a) (E)-3-[(1,3-Тиазол-5-ил)метилиден]-1-(трифенилметил)пиперидин-4-он
Указанное в заголовке соединение синтезировали с выходом 55% в виде оранжевого аморфного твердого вещества, используя 1,3-тиазол-5-карбальдегид вместо бензальдегида, проведением реакции, подобной описанной в примере 1 (a).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 2,69 (2H, шс), 2,78 (2H, т, J=6,0), 3,46 (2Н, шс), 7,16-7,21 (3Н, м), 7,25-7,31 (6Н, м), 7,50-7,56 (6Н, м), 7,76 (1Н, с), 7,98 (1H, с), 8,81 (1H, с).
(b) (E)-3-[(1,3-Тиазол-5-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 99% в виде желтого аморфного твердого вещества, используя (E)-3-[(1,3-тиазол-5-ил)метилиден]-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1 (b).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,88-1,97 (1H, м), 2,02-2,21 (2H, м), 2,46-2,65 (1H, м), 2,80-2,92 (1H, м), 3,59-3,80 (1H, м), 4,14-4,22 (1H, м), 6,73 (1H, с), 7,08-7,23 (9H, м), 7,37-7,46 (6H, м), 7,66 (1H, с), 8,61 (1H, с).
(c) (E)-4-(Ацетилсульфанил)-3-[(1,3-тиазол-5-ил)метилиден]пиперидина гидрохлорид
Указанное в заголовке соединение синтезировали с выходом 20% в виде желтого аморфного твердого вещества, используя (E)-3-[(1,3-тиазол-5-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-ола, последовательным проведением реакций, подобных описанным в примере 1 (c).
1H ЯМР (500 МГц, ДМСО-d6) δ м.д.: 1,94-2,02 (1H, м), 2,27-2,34 (1H, м), 2,40 (3H, с), 3,05-3,16 (1H, м), 3,27-3,36 (1H, м), 3,75-3,86 (1H, м), 4,06-4,15 (1H, м), 4,58 (1H, м), 7,01 (1H, с), 8,03 (1H, с), 9,17 (1H, с).
(d) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,3-тиазол-5-ил)метилиден]пиперидин
Указанное в заголовке соединение синтезировали с выходом 25% в виде коричневого масла, используя (E)-4-(ацетилсульфанил)-3-[(1,3-тиазол-5-ил)метилиден]пиперидина гидрохлорид вместо (E)-4-(ацетилсульфанил)-3-бензилиденпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 1 (d).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,67-0,87 (2H, м), 0,91-1,05 (2H, м), 1,84-1,95 (1H, м), 2,14 (1H, м), 2,21-2,36 (1H, м), 2,32 (3H, с), 2,48-2,63 (1H, м), 2,75-2,82 и 2,85-2,91 (общая 1H, каждый м), 3,01 и 3,22 (общая 1H, каждый д, J=12,5), 3,71-3,78 (1H, м), 4,52 (1Н, м), 4,73 и 4,74 (общая 1H, каждый с), 6,70 (1H, с), 7,05-7,19 (2H, м), 7,27-7,40 (2H, м), 7,67 и 7,70 (общая 1H, каждый с), 8,63 и 8,67 (общая 1H, каждый с);
ИК (Тонкая пленка, см-1): 1695, 1488.
(Пример 18) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанил-3-[(1,3-тиазол-5-ил)метилиден]пиперидина трифторацетат (соединение № 1-37)
Указанное в заголовке соединение синтезировали с выходом 61% в виде бесцветного масла, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,3-тиазол-5-ил)метилиден]пиперидин вместо (E)-4-(ацетилсульфанил)-3-бензилиден-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина, проведением реакции, подобной описанной в примере 2.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,68-0,85 (2H, м), 0,92-1,04 (2H, м), 1,77-1,88 (1H, м), 2,09-2,17 (1H, м), 2,25-2,38 (1H, м), 2,63-2,77 (1H, м), 2,81-2,92 (1H, м), 3,42-3,64 (2H, м), 3,88-3,95 (1H, м), 4,77 и 4,78 (общая 1H, каждый с), 6,64 и 6,67 (общая 1H, каждый с), 7,05-7,18 (2H, м), 7,27-7,42 (2H, м), 7,66 и 7,69 (общая 1H, каждый с), 8,64 и 8,67 (общая 1H, каждый с);
ИК (KBr, см-1): 2546, 1712, 1674.
(Пример 19) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1H-имидазол-2-ил)метилиден]пиперидина дигидрохлорид (соединение № 1-42)
(a) (E)-3-{[1-(трет-Бутоксикарбонил)-1H-имидазол-2-ил]метилиден}-1-(трифенилметил)пиперидин-4-он
Указанное в заголовке соединение синтезировали с выходом 12% в виде желтого аморфного твердого вещества, используя 1-(трет-бутоксикарбонил)-1H-имидазоле-2-карбальдегид вместо 1-(трет-бутоксикарбонил)-1H-пиразол-4-карбальдегида, проведением реакции, подобной описанной в примере 13 (a).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,66 (9H, с), 2,63 (2H, шс), 2,77 (2Н, т, J=6,0), 3,82 (2H, шс), 6,92 (1H, д, J=1,5), 7,11-7,18 (3H, м), 7,20-7,30 (6H, м), 7,39 (1H, д, J=1,5), 7,42-7,55 (6H, м), 7,97 (1H, т, J=2,0).
(b) (E)-3-{[1-(трет-Бутоксикарбонил)-1H-имидазол-2-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 63% в виде бесцветного аморфного твердого вещества, используя (E)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-2-ил]метилиден}-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1 (b).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,71 (9H, с), 1,84-2,01 (3H, м), 2,10-2,18 (1H, м), 2,43 (1H, шс), 2,88 (1H, шс), 4,13 (1H, м), 6,72 (1H, д, J=1,5), 6,87 (1H, д, J=1,5), 7,05-7,20 (10H, м), 7,37 (1Н, д, J=1,5), 7,35-7,40 (5H, м).
(c) (E)-4-(Ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-2-ил]метилиден}-1-(трифенилметил)пиперидин
К раствору (E)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-2-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола (2,45 г) в толуоле (100 мл) добавляли последовательно тиоуксусную кислоту (0,60 мл) и динеопентилацеталь N,N-диметилформамида (2,36 мл) при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в течение 30 минут. После перемешивания к реакционной смеси добавляли воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом магния. Удаляли в вакууме растворитель и остаток очищали хроматографией на колонке с силикагелем, используя смешанный растворитель из этилацетата, гексана и дихлорметана (1:5:1), с получением указанного в заголовке соединения (0,72 г, выход: 26%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,72 (9H, с), 1,87-1,99 (1H, м), 2,00-2,14 (1H, м), 2,25 (3H, с), 2,31-2,48 (2H, м), 2,62-2,89 (2H, м), 4,49 (1H, м), 6,69 (1H, д, J=1,5), 6,90 (1H, с), 7,06-7,18 (10H, м), 7,33 (1H, д, J=1,5), 7,35-7,40 (3H, м), 7,47-7,53 (2H, м).
(d) (E)-4-(Ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-2-ил]метилиден}пиперидина гидротрифторацетат
К раствору (E)-4-(ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-2-ил]метилиден}-1-(трифенилметил)пиперидина (0,72 г) в дихлорметане (20 мл) добавляли трифторуксусную кислоту (0,29 мл) при охлаждении льдом и полученную смесь перемешивали при той же самой температуре в течение 15 минут. Реакционную смесь упаривали в вакууме и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из метанола и дихлорметана (1:20-1:10), с получением указанного в заголовке соединения (0,58 г, выход: количественный) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,64 (9H, с), 2,13 (1H, м), 2,37 (3H, с), 2,50 (1H, м), 3,30 (1H, м), 3,42 (1H, м), 3,90 (1H, д, J=14,5), 4,62 (1H, т, J=4,0), 4,85 (1H, д, J=14,5), 7,08 (1H, д, J=1,5), 7,21 (1H, с), 7,44 ,(1H, д, J=1,5).
(e) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1H-имидазол-2-ил)метилиден]пиперидина дигидрохлорид
Указанное в заголовке соединение синтезировали с выходом 49% в виде бесцветного аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-2-ил]метилиден}пиперидина гидротрифторацетат вместо (E)-4-(ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-1H-пиразол-3-ил]метилиден}пиперидина гидрохлорида, последовательным проведением реакций, подобных описанным в примере 11 (d).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,77-0,86 (1H, м), 0,88-0,95 (1H, м), 1,05-1,17 (2H, м), 1,82-1,93 (2H, м), 2,12-2,19 и 2,24-2,31 (общая 1H, каждый м), 2,28 и 2,32 (общая 3H, каждый с), 2,50-2,83 (2H, м), 2,88 и 3,36 (общая 1H, каждый д, J=12,5), 3,42 и 3,77 (общая 1H, каждый д, J=12,5), 4,28 и 4,41 (общая 1H, каждый т, J=5,0), 4,90 и 4,97 (общая 1H, каждый с), 6,54 (1H, с), 7,07-7,13 (1H, м), 7,10 (1H, с), 7,14-7,23 (2H, м), 7,14 (1H, с), 7,34-7,42 (1H, м);
ИК (KBr, см-1): 1704, 1493.
(Пример 20) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1H-имидазол-2-ил)метилиден]-4-сульфанилпиперидина дигидрохлорид (соединение № 1-41)
Указанное в заголовке соединение синтезировали с выходом 71% в виде бесцветного аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1H-имидазол-2-ил)метилиден]пиперидина дигидрохлорид вместо (E)-4-(ацетилсульфанил)-3-бензилиден-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина, проведением реакции, подобной описанной в примере 2.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,78-0,86 (1H, м), 0,89-0,96 (1H, м), 1,05-1,17 (2H, м), 1,72-1,91 (2H, м), 2,18 и 2,26 (общая 1H, каждый м), 2,47 и 2,58 (общая 1H, каждый м), 2,70-2,80 (общая 1H, каждый м), 3,07 и 3,35 (общая 1H, каждый д, J=12,5), 3,45 и 3,74 (общая 1H, каждый д, J=12,5), 3,70 и 3,86 (общая 1H, каждый м), 4,95 и 4,97 (общая 1H, каждый с), 6,55 и 6,61 (общая 1H, каждый с), 7,07-7,13 (1H, м), 7,11 (1H, с), 7,14-7,26 (3H, м), 7,34-7,42 (1H, м);
ИК (KBr, см-1): 2562, 1709.
(Пример 21) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1H-имидазол-4(5)-ил]метилиден}пиперидина дигидрохлорид (соединение № 1-46)
(a) (E)-3-{[1-(трет-Бутоксикарбонил)-1H-имидазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-он
Указанное в заголовке соединение синтезировали с выходом 50% в виде желтого аморфного твердого вещества, используя 1-(трет-бутоксикарбонил)-1H-имидазоле-5-карбальдегид вместо бензальдегида, проведением реакции, подобной описанной в примере 1 (a).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,60 (9H, с), 2,66 (2H, шс), 2,75 (2H, т, J=6,0), 3,63 (2H, шс), 7,14-7,20 (3H, м), 7,23-7,30 (7H, м), 7,38 (1H, с), 7,49-7,57 (6H, м), 7,95 (1H, с).
(b) (E)-3-{[1-(трет-Бутоксикарбонил)-1H-имидазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 99% в виде желтого аморфного твердого вещества, используя (E)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1 (b).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,60 (9H, с), 1,84-1,94 (1H, м), 2,01-2,19 (2H, м), 2,65-2,85 (2H, м), 3,72-3,93 (1H, м), 4,10-4,19 (1H, м), 6,44 (1H, с), 7,02 (1H, с), 7,05-7,23 (9H, м), 7,34-7,49 (6H, м), 7,90 (1H, с).
(c) (E)-4-(Ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-5-ил]метилиден}пиперидина гидротрифторацетат
К раствору (E)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола (6,00 г) в толуоле (100 мл) добавляли последовательно тиоуксусную кислоту (1,64 мл) и динеопентилацеталь N,N-диметилформамида (6,40 мл) при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в течение 1 часа. После перемешивания к реакционной смеси добавляли воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом магния. Удаляли в вакууме растворитель и остаток очищали хроматографией на колонке с силикагелем, используя смешанный растворитель из этилацетата, гексана и дихлорметана (1:3:1), с получением (E)-4-(ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-5-ил]метилиден}-1-(трифенилметил)пиперидина (содержащего примеси) в виде желтого аморфного твердого вещества.
Затем к раствору полученного, как описано выше, неочищенного продукта в дихлорметане (100 мл) добавляли трифторуксусную кислоту (0,83 мл) при охлаждении льдом и полученную смесь перемешивали при той же самой температуре в течение 45 минут. Реакционную смесь упаривали в вакууме и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из метанола и дихлорметана (1:19), с получением указанного в заголовке соединения (0,59 г, выход: 32%) в виде желтого аморфного твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,61 (9H, с), 2,03-2,10 (1H, м), 2,36 (3H, с), 2,47-2,56 (1H, м), 3,14-3,26 (1H, м), 3,37-3,45 (1H, м), 3,79-3,88 (1H, м), 4,56 (1H, м), 5,48-5,56 (1H, м), 6,54 (1H, С), 7,31 (1H, с), 8,04 (1H, с).
(d) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1H-имидазол-4(5)-ил]метилиден}пиперидина дигидрохлорид
Указанное в заголовке соединение синтезировали с выходом 48% в виде желтого аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-5-ил]метилиден}пиперидина гидротрифторацетат вместо (E)-4-(ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-1H-пиразол-3-ил]метилиден}пиперидина гидрохлорида, последовательным проведением реакций, подобных описанным в примере 11 (d).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,65-1,22 (4H, м), 1,78-1,93 (2H, м), 2,08-2,37 и 2,74-2,83 (общая 2H, каждый м), 2,28 и 2,34 (общая 3H, каждый с), 2,44-2,61 (1H, м), 2,68 и 3,20 (общая 1H, каждый д, J=12,0), 3,29 и 3,66 (общая 1H, каждый д, J=12,0), 4,30 и 4,41 (общая 1H, каждый м), 4,88 и 4,99 (общая 1H, каждый с), 6,45 (1H, с), 6,96 и 6,99 (общая 1H, каждый с), 7,12-7,24 (2H, м), 7,25-7,47 (2H, м), 7,68 (1H, с);
ИК (KBr, см-1): 1702, 1494.
(Пример 22) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1H-имидазол-4(5)-ил]метилиден}-4-сульфанилпиперидина дигидрохлорид (соединение № 1-45)
Указанное в заголовке соединение синтезировали с выходом 69% в виде бледно-желтого аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1H-имидазол-4(5)-ил]метилиден}пиперидина дигидрохлорид вместо (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-2-ил]метилиден]пиперидина, проведением реакции, подобной описанной в примере 8.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,76-0,85 (2H, м), 0,87-0,95 (2H, м), 1,71-1,83 (1H, м), 1,87-1,96 (1H, м), 2,15-2,32 (1H, м), 2,45-2,52 и 2,55-2,62 (общая 1H, каждый м), 2,70-2,82 (1H, м), 3,01-3,14 (1H, м), 3,32 и 3,42 (общая 1H, каждый д, J=12,0), 3,63-3,74 и 3,80-3,87 (общая 1H, каждый м), 4,93 (1H, с), 6,46 и 6,52 (общая 1H, каждый с), 7,00 и 7,03 (общая 1H, каждый с), 7,13-7,22 (2H, м), 7,23-7,29 (1H, м), 7,33-7,41 (1H, м), 7,69 и 7,70 (общая 1H, каждый с);
ИК (KBr, см-1): 2597, 1710.
(Пример 23) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,2,4-триазол-3-ил)метилиден]пиперидина дигидрохлорид (соединение № 1-54)
(a) (E)-3-{[1-(трет-Бутоксикарбонил)-1,2,4-триазол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-он
Указанное в заголовке соединение синтезировали с выходом 31% в виде желтого аморфного твердого вещества, используя 1-(трет-бутоксикарбонил)-1,2,4-триазол-3-карбальдегид вместо бензальдегида, проведением реакции, подобной описанной в примере 1 (a).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,62 (9H, с), 2,65 (2H, шс), 2,78 (2H, т, J=6,5), 3,87 (2H, шс), 7,12-7,19 (3H, м), 7,21-7,28 (6H, м), 7,40 (1H, с), 7,48-7,55 (6H, м), 8,62 (1H, с).
(b) (E)-3-{[1-(трет-Бутоксикарбонил)-1,2,4-триазол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 91% в виде бледно-желтого аморфного твердого вещества, используя (E)-3-{[1-(трет-бутоксикарбонил)-1,2,4-триазол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1 (b).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,63 (9H, с), 1,86-1,99 (1H, м), 2,06-2,25 (2H, м), 2,76-3,06 (2H, м), 3,23-3,39 (1H, м), 4,07-4,18 (1H, м), 6,62 (1H, с), 7,05-7,22 (9H, м), 7,36-7,45 (6H, м), 8,57 (1H, с).
(c) (E)-4-(Ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-1,2,4-триазол-3-ил]метилиден}пиперидина гидротрифторацетат
Указанное в заголовке соединение синтезировали с выходом 20% в виде желтого аморфного твердого вещества, используя (E)-3-{[1-(трет-бутоксикарбонил)-1,2,4-триазол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол вместо (E)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола, последовательным проведением реакций, подобных описанным в примере 21 (c).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,66 (9H, с), 2,08-2,16 (1H, м), 2,37 (3H, с), 2,46-2,56 (1H, м), 3,21-3,31 (1H, м), 3,37-3,46 (1H, м), 4,06 (1H, д, J=14,0), 4,61 (1H, м), 5,32 (1H, д, J=14,0), 6,84 (1H, с), 8,68 (1H, с).
(d) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,2,4-триазол-3-ил)метилиден]пиперидина дигидрохлорид
Указанное в заголовке соединение синтезировали с выходом 47% в виде желтого аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-1,2,4-триазол-3-ил]метилиден}пиперидина трифторацетат вместо (E)-4-(ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-1H-пиразол-3-ил]метилиден}пиперидина гидрохлорида, последовательным проведением реакций, подобных описанным в примере 11 (d).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,74-0,97 (2H, м), 1,08-1,23 (2H, м), 1,76-1,96 (2H, м), 2,13-2,39 (2H, м), 2,29 и 2,33 (общая 3H, каждый с), 2,49-2,68 (1H, м), 2,71-2,99 (1H, м), 3,46-3,91 (1H, м), 4,27 и 4,44 (общая 1H, каждый м), 4,94 и 4,98 (общая 1H, каждый с), 6,57 (1H, с), 7,12-7,30 (3H, м), 7,34-7,44 (1H, м), 7,97 и 7,99 (общая 1H, каждый с);
ИК (KBr, см-1): 1704, 1494.
(Пример 24) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанил-3-[(1,2,4-триазол-3-ил)метилиден]пиперидина дигидрохлорид (соединение № 1-53)
Указанное в заголовке соединение синтезировали с выходом 98% в виде бледно-желтого аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,2,4-триазол-3-ил)метилиден]пиперидина дигидрохлорид вместо (E)-4-(ацетилсульфанил)-3-бензилиден-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина, проведением реакции, подобной описанной в примере 2.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,74-0,98 (2H, м), 1,08-1,23 (2H, м), 1,68-1,88 (2H, м), 2,21-2,37 (1H, м), 2,48-2,57 и 2,58-2,65 (общая 1H, каждый м), 2,73-2,88 (1H, м), 2,89-3,07 (1H, м), 3,35-3,56 (1H, м), 3,60-3,73 и 3,82-3,90, (общая 1H, каждый м), 4,98 (1H, с), 6,58 и 6,68 (общая 1H, каждый с), 7,13-7,25 (3H, м), 7,34-7,42 (1H, м), 7,99 и 8,00 (общая 1H, каждый с);
ИК (KBr, см-1): 2564, 1710.
(Пример 25) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(пиридин-2-ил)метилиден]пиперидин (соединение № 1-62)
(a) (E)-3-[(Пиридин-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-он
Указанное в заголовке соединение синтезировали с выходом 66% в виде бледно-желтого аморфного твердого вещества, используя пиридин-2-карбальдегид вместо бензальдегида, проведением реакции, подобной описанной в примере 1 (a).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,60-2,70 (2H, м), 2,78 (2H, т, J=6,0), 3,89 (2H, шс), 7,06-7,17 (4H, м), 7,19-7,33 (7H, м), 7,40 (1H, т, J=2,0), 7,47-7,54 (6H, м), 7,64 (1H, дт, J=7,5, 2,0), 8,40-8,44 (1H, м).
(b) (E)-3-[(Пиридин-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 91% в виде бесцветного аморфного твердого вещества, используя (E)-3-[(пиридин-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1 (b).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,85-2,04 (2H, м), 2,12-2,22 (2H, м), 2,47-2,91 (2H, м), 4,15 (1H, м), 6,71 (1H, с), 6,97-7,18 (11H, м), 7,29-7,42 (6Н, м), 7,64 (1Н, дт, J=7,5, 2,0), 8,31-8,36 (1Н, м).
(c) (E)-4-(Ацетилсульфанил)-3-[(пиридин-2-ил)метилиден]пиперидина дигидрохлорид
Указанное в заголовке соединение синтезировали с выходом 18% в виде желтого масла, используя (E)-3-[(пиридин-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол вместо (E)-3-{[1-(трет-бутоксикарбонил)-1H-пиразол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола, последовательным проведением реакций, подобных описанным в примере 11 (c).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 2,15-2,23 (1H, м), 2,42 (3H, с), 2,64-2,75 (1H, м), 3,24-3,36 (1H, м), 3,51-3,59 (1H, м), 3,92-4,02 (1H, м), 4,19 (1H, д, J=14,5), 4,64 (1H, т, J=4,5), 7,02 (1H, с), 7,83 (1H, д, J=8,0), 7,94 (1H, т, J=6,0), 8,44 (1H, т, J=8,0), 8,94 (1H, д, J=6,0).
(d) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(пиридин-2-ил)метилиден]пиперидин
Указанное в заголовке соединение синтезировали с выходом 18% в виде желтого масла, используя (E)-4-(ацетилсульфанил)-3-[(пиридин-2-ил)метилиден]пиперидина дигидрохлорид вместо (E)-4-(ацетилсульфанил)-3-бензилиденпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 1 (d).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,50-0,75 (2H, м), 0,78-0,87 (1H, м), 0,89-0,97 (1H, м), 1,85-1,95 (1H, м), 2,21-2,40 (2H, м), 2,31 (3H, с), 2,45-2,52 и 2,57-2,64 (общая 1H, каждый м), 2,75-2,81 и 2,83-2,89 (общая 1H, каждый м), 3,13 и 3,31 (общая 1H, каждый д, J=13,5), 4,42 (1H, д, J=13,5), 4,53 (1H, м), 4,64 и 4,68 (общая 1H, каждый с), 6,62 и 6,64 (общая 1H, каждый с), 7,00-7,16 (4H, м), 7,22-7,31 (1H, м), 7,36-7,46 (1H, м), 7,52-7,60 (1H, м), 8,35 и 8,47 (общая 1H, каждый д, J=4,0);
МС (FAB) m/z: 425 (М+H)+.
(Пример 26) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(пиридин-2-ил)метилиден]-4-сульфанилпиперидина бис(гидротрифторацетат) (соединение № 1-61)
Указанное в заголовке соединение синтезировали с выходом 88% в виде коричневого масла, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(пиридин-2-ил)метилиден]пиперидин вместо (E)-4-(ацетилсульфанил)-3-бензилиден-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина, проведением реакции, подобной описанной в примере 2.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,52-0,96 (4H, м), 1,79-1,89 (1H, м), 2,20-2,40 (2H, м), 2,61-2,74 (1H, м), 2,78-2,95 (1H, м), 3,69 и 3,82 (общая 1H, каждый д, J=13,0), 3,88-4,02 (2H, м), 4,68 и 4,71 (общая 1H, каждый с), 6,61 и 6,63 (общая 1H, каждый с), 6,99-7,17 (4H, м), 7,23-7,31 (1H, м), 7,37-7,46 (1H, м), 7,52-7,61 (1H, м), 8,39-8,42 и 8,45-8,48 (общая 1H, каждый м);
МС (FAB) m/z: 383 (М+H)+.
(Пример 27) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(пиридин-3-ил)метилиден]пиперидин (соединение № 1-70)
(a) (E)-3-[(Пиридин-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-он
Указанное в заголовке соединение синтезировали с выходом 51% в виде бледно-желтого аморфного твердого вещества, используя никотинальдегид вместо бензальдегида, проведением реакции, подобной описанной в примере 1 (a).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,69 (2H, шс), 2,70 (2H, т, J=6,0), 3,42 (2H, шс), 7,11-7,18 (3H, м), 7,19-7,32 (7H, м), 7,41-7,48 (6H, м), 7,49-7,57 (2H, м), 8,43-8,51 (2H, м).
(b (E)-3-[(Пиридин-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 92% в виде бесцветного аморфного твердого вещества, используя (E)-3-[(пиридин-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1 (b).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,78-1,97 (2H, м), 1,98-2,22 (2H, м), 2,73-2,91 (1H, м), 3,43-3,68 (1H, м), 4,12-4,23 (1H, м), 6,66 (1H, с), 6,98-7,19 (10H, м), 7,22-7,38 (6H, м), 7,43 (1H, д, J=8,0), 8,36-8,42 (2H, м).
(c) (E)-4-(Ацетилсульфанил)-3-[(пиридин-3-ил)метилиден]-1-(трифенилметил)пиперидин
К раствору (E)-3-[(пиридин-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-ола (5,40 г) в дихлорметане (85 мл) добавляли последовательно метансульфонилхлорид (1,93 мл) и триэтиламин (3,49 мл) при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь упаривали в вакууме и остаток разбавляли этилацетатом и промывали насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом натрия и выпаривали в вакууме растворитель. Затем к раствору полученного остатка в диметилсульфоксиде (75 мл) добавляли тиоацетат калия (7,10 г) при комнатной температуре и полученную смесь перемешивали при 40°C в течение 1 часа. Реакционную смесь разбавляли этилацетатом и промывали насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом натрия. Удаляли растворитель и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из этилацетата и гексана (1:9), с получением указанного в заголовке соединения (2,68 г, выход: 42%) в виде бледно-коричневого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,88-1,98 (1H, м), 2,20-2,46 (2H, м), 2,40 (3H, с), 2,56-2,87 (2H, м), 3,27-3,49 (1H, м), 4,42-4,53 (1H, м), 6,65 (1H, с), 6,99-7,16 (9H, м), 7,17-7,24 (1H, м), 7,25-7,35 (6H, м), 7,36-7,45 (1H, м), 8,34-8,41 (2H, м).
(d) (E)-4-(Ацетилсульфанил)-3-[(пиридин-3-ил)метилиден]пиперидина бис(гидротрифторацетат)
Указанное в заголовке соединение синтезировали с выходом 99% в виде бледно-коричневого аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-3-[(пиридин-3-ил)метилиден]-1-(трифенилметил)пиперидин вместо (E)-4-ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-2-ил]метилиден}-1-(трифенилметил)пиперидина, проведением реакции, подобной описанной в примере 19 (d).
1H ЯМР (500 МГц, d-MeOH) δ м.д.: 2,11-2,19 (1H, м), 2,38-2,46 (1H, м), 2,40 (3H, с), 3,18-3,27 (1H, м), 3,39-3,47 (1H, м), 3,75 (1H, д, J=14,5), 4,09 (1H, д, J=14,5), 4,66-4,72 (1H, м), 7,04 (1H, с), 7,54-7,61 (1H, м), 7,81-7,87 (1H, м), 8,48-8,57 (2H, м).
(e) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(пиридин-3-ил)метилиден]пиперидин
Указанное в заголовке соединение синтезировали с выходом 63% в виде желтого масла, используя (E)-4-(ацетилсульфанил)-3-[(пиридин-3-ил)метилиден]пиперидина бис(гидротрифторацетат) вместо (E)-4-(ацетилсульфанил)-3-бензилиденпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 1 (d).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,66-0,99 (4H, м), 1,83-1,96 (1H, м), 2,06-2,23 (2H, м), 2,34 (3H, с), 2,40-2,53 и 2,57-2,71 (общая 1H, каждый м), 2,73-2,89 (1H, м), 2,98 и 3,12 (общая 1H, каждый д, J=12,5), 3,44 и 3,56 (общая 1H, каждый д, J=12,5), 4,46-4,55 (1H, м),4,63 и 4,67 (общая 1H, каждый с), 6,60 и 6,61 (общая 1H, каждый с), 7,00-7,17 (2H, м), 7,17-7,49 (4H, м), 8,33-3,51 (2H, м);
МС (FAB) m/z: 425 (М+H)+.
(Пример 28) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(пиридин-3-ил)метилиден]-4-сульфанилпиперидина дигидрохлорид (соединение № 1-69)
Указанное в заголовке соединение синтезировали с выходом 8% в виде бесцветных порошкообразных кристаллов, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(пиридин-3-ил)метилиден]пиперидин вместо (E)-4-(ацетилсульфанил)-3-бензилиден-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина, проведением реакции, подобной описанной в примере 2.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,60-0,98 (4H, м), 1,76-1,91 (1H, м), 2,02-2,16 (1H, м), 2,23-2,39 (1H, м), 2,59-2,73 (1H, м), 2,75-2,93 (1H, м), 3,21-3,33 (1H, м), 3,41 и 3,49 (общая 1H, каждый д, J=12,5), 3,86-3,96 (1H, м), 4,69 и 4,66 (общая 1H, каждый с), 6,58 (1H, с), 6,98-7,12 (2H, м), 7,13-7,21 (1H, м), 7,22-7,38 (2H, м), 7,38-7,50 (1H, м), 8,34-3,48 (2H, м);
МС (FAB) m/z: 383 {М+H)+.
(Пример 29) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(пиридин-4-ил)метилиден]пиперидин (соединение № 1-74)
(a) (E)-3-[(Пиридин-4-ил)метилиден]-1-(трифенилметил)пиперидин-4-он
Указанное в заголовке соединение синтезировали с выходом 71% в виде бледно-желтого аморфного твердого вещества, используя изоникотинальдегид вместо бензальдегида, проведением реакции, подобной описанной в примере 1 (a).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 2,68 (2H, шс), 2,79 (2H, т, J=6,0), 3,38 (2H, шс), 7,04 (2H, д, J=6,0), 7,13-7,18 (3H, м), 7,22-7,28 (6H, м), 7,40-7,48 (7H, м), 8,53 (2H, д, J=6,0).
(b) (E)-3-[(Пиридин-4-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 79% в виде бесцветных порошкообразных кристаллов, используя (E)-3-[(пиридин-4-ил)метилиден]-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1 (b).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,85-2,04 (2H, м), 2,11-2,31 (1H, м), 2,49 (1H, м), 2,86 (1H, м), 3,58-3,85 (1H, м), 4,14 (1H, м), 6,64 (1H, с), 7,04 (2H, д, J=6,0), 7,05-7,17 (9H, м), 7,25-7,38 (6H, м), 8,44 (2H, д, J=6,0).
(c) (E)-4-(Ацетилсульфанил)-3-[(пиридин-4-ил)метилиден]-1-(трифенилметил)пиперидин
Указанное в заголовке соединение синтезировали с выходом 33% в виде желтого аморфного твердого вещества, используя (E)-3-[(пиридин-4-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол вместо (E)-3-[(пиридин-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-ола, проведением реакции, подобной описанной в примере 27 (c).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,88-1,98 (1H, м), 2,01-2,21 (1H, м), 2,28 (3H, с), 2,33-2,45 (1H, м), 2,54-2,82 (2H, м), 3,33-3,60 (1H, м), 4,45 (1H, м), 6,61 (1H, с), 6,99 (2H, д, J=6,0), 7,03-7,37 (15H, м), 8,43 (2H, д, J=6,0).
(d) (E)-4-(Ацетилсульфанил)-3-[(пиридин-4-ил)метилиден]пиперидина бис(гидротрифторацетат)
Указанное в заголовке соединение синтезировали с выходом 54% в виде желтого аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-3-[(пиридин-4-ил)метилиден]-1-(трифенилметил)пиперидин вместо (E)-4-(ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-2-ил]метилиден}-1-(трифенилметил)пиперидина, проведением реакции, подобной описанной в примере 19 (d).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 2,09-2,17 (1H, м), 2,41 (3H, с), 2,48-2,58 (1H, м), 3,15-3,24 (1H, м), 3,32-3,40 (1H, м), 3,76 (1H, д, J=14,5), 4,04 (1H, д, J=14,5), 4,61 (1H, т, J=4,0), 6,96 (1H, с), 7,47 (2H, д, J=6,0), 8,64 (2H, д, J=6,0).
(e) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(пиридин-4-ил)метилиден]пиперидин
Указанное в заголовке соединение синтезировали с выходом 46% в виде желтого масла, используя (E)-4-(ацетилсульфанил)-3-[(пиридин-4-ил)метилиден]пиперидина бис(гидротрифторацетат) вместо (E)-4-(ацетилсульфанил)-3-бензилиденпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 1 (d).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,52-0,99 (4H, м), 1,83-1,95 (1H, in), 2,01-2,38 (2H, м), 2,34 (3H, с), 2,44-2,68 (1H, м), 2,72-2,93 (1H, м), 2,94 и 3,18 (общая 1H, каждый д, J=12,5), 3,51 и 3,54 (общая 1H, каждый д, J=12,5), 4,48 (1H, т, J=4,5), 4,66 и 4,67 (общая 1H, каждый с), 6,56 и 6,57 (общая 1H, каждый с), 6,98 и 7,02 (общая 2H, каждый д, J=6,0), 7,04-7,16 (2H, м), 7,26-7,41 (2H, м), 8,42 и 8,48 (общая 2H, каждый д, J=6,0);
МС (FAB) m/z: 425 (М+H)+.
(Пример 30) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(пиридин-4-ил)метилиден]-4-сульфанилпиперидина дигидрохлорид (соединение № 1-73)
Указанное в заголовке соединение синтезировали с выходом 98% в виде бесцветного твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(пиридин-4-ил)метилиден]пиперидин вместо (E)-4-(ацетилсульфанил)-3-бензилиден-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина, проведением реакции, подобной описанной в примере 2.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,56-0,78 (2H, м), 0,82-0,99 (2H, м), 1,83-1,91 (1H, м), 2,03-2,11 (1H, м), 2,23-2,38 (1H, м), 2,58-2,76 (1H, м), 2,80-2,91 (1H, м), 3,25 и 3,29 (общая 1H, каждый д, J=12,5), 3,39 и 3,54 (общая 1H, каждый д, J=12,5), 3,88 (1H, м), 4,67 и 4,70 (общая 1H, каждый с), 6,54 и 6,55 (общая 1H, каждый с), 6,99 и 7,03 (общая 2H, каждый д, J=6,0), 7,02-7,13 (2H, м), 7,24-7,38 (2H, м), 8,44 и 8,47 (общая 2H, каждый д, J=6,0);
МС (FAB) m/z: 383 (М+H)+.
(Пример 31) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(пиразин-2-ил)метилиден]пиперидина гидрохлорид (соединение № 1-102)
(a) (E)-3-[(Пиразин-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-он
Указанное в заголовке соединение синтезировали с выходом 26% в виде желтого аморфного твердого вещества, используя пиразин-2-карбальдегид вместо 1-(трет-бутоксикарбонил)-1H-пиразол-4-карбальдегида, последовательным проведением реакций, подобных описанным в примере 13 (a).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,67 (2H, шс), 2,81 (2H, т, J=6,0), 3,87 (2H, шс), 7,12-7,18 (3H, м), 7,21-7,28 (5H, м), 7,40 (1H, т, J=2,0), 7,46-7,53 (7H, м), 8,35 (1H, д, J=3,0), 8,38 (1H, дд, J=3,0, 1,5), 8,59 (1H, д, J=1,5).
(b) (E)-3-[(Пиразин-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 99% в виде бесцветного аморфного твердого вещества, используя (E)-3-[(пиразин-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1 (b).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,85-2,03 (2H, м), 2,18 (1H, м), 2,47 (1H, шс), 2,93 (1H, шс), 4,17 (1H, шс), 4,37 (1H, шс), 6,73 (1H, с), 7,04-7,17 (10H, м), 7,33-7,40 (5H, м), 8,23 (1H, дд, J=3,0, 1,5), 8,30 (1H, д, J=3,0), 8,48 (1H, д, J=1,5).
(c) (E)-4-(Ацетилсульфанил)-3-[(пиразин-2-ил)метилиден]пиперидина гидротрифторацетат
Указанное в заголовке соединение синтезировали с выходом 20% в виде бесцветного аморфного твердого вещества, используя (E)-3-[(пиразин-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол вместо (E)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола, последовательным проведением реакций, подобных описанным в примере 21 (c).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,18 (1H, м), 2,41 (3H, с), 2,53 (1H, м), 3,32 (1H, м), 3,53 (1H, д, J=14,0), 4,03 (1H, дд, J=12,5, 9,0), 4,66 (1H, т, J=4,0), 5,50 (1H, д, J=14,0), 6,92 (1H, с), 8,20 (1H, шс), 8,40-8,91 (2H, м).
(d) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(пиразин-2-ил)метилиден]пиперидина гидрохлорид
Указанное в заголовке соединение синтезировали с выходом 41% в виде бледно-желтого аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-3-[(пиразин-2-ил)метилиден]пиперидина гидротрифторацетат вместо (E)-4-(ацетилсульфанил)-3-бензилиденпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 1 (d).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,58-0,81 (2H, м), 0,84-1,01 (2H, м), 1,86-1,97 (1H, м), 2,15-2,27 (1H, м), 2,27-2,41 (1H, м), 2,32 (3H, с), 2,47-2,56 и 2,56-2,65 (общая 1H, каждый м), 2,80 и 2,88 (общая 1H, каждый м), 3,18 и 3,38 (общая 1H, каждый д, J=14,0), 4,45 (1H, д, J=14,0), 4,53 (1H, т, J=4,0), 4,69 и 4,70 (общая 1H, каждый с), 6,59 и 6,60 (общая 1H, каждый с), 6,97-7,12 (2H, м), 7,21-7,32 (1H, м), 7,32-7,41 (1H, м), 8,24 и 8,35 (общая 1H, каждый дд, J=3,0, 1,5), 8,26 и 8,29 (общая 1H, каждый д, J=3,0), 8,38 и 8,40 (общая 1H, каждый д, J=1,5);
ИК (KBr, см-1): 1699, 1493.
(Пример 32) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,3-оксазол-2-ил)метилиден]пиперидин (соединение № 1-78)
(a) (E)-3-[(1,3-Оксазол-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-он
Указанное в заголовке соединение синтезировали с выходом 66% в виде бледно-желтого аморфного твердого вещества, используя 1,3-оксазол-2-карбальдегид вместо бензальдегида, проведением реакции, подобной описанной в примере 1 (a).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,66 (2H, шс), 2,79 (2H, т, J=6,0), 3,82 (2H, шс), 7,14-7,32 (11H, м), 7,49-7,57 (6H, м), 7,59 (1H, с).
(b) (E)-3-[(1,3-Оксазол-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 97% в виде бесцветного аморфного твердого вещества, используя (E)-3-[(1,3-оксазол-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1 (b).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,83-1,98 (2H, м), 2,11-2,22 (1H, м), 2,36-2,56 (1H, м), 2,88-3,01 (1H, м), 4,05-4,15 (1H, м), 4,34-4,60 (1H, м), 6,55 (1H, с), 7,04 (1H, с), 7,09-7,24 (9H, м), 7,39-7,49 (7H, м).
(c) (E)-4-(Ацетилсульфанил)-3-[(1,3-оксазол-2-ил)метилиден]-1-(трифенилметил)пиперидин
Указанное в заголовке соединение синтезировали с выходом 47% в виде коричневого масла, используя (E)-3-[(1,3-оксазол-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол вместо (E)-3-[(пиридин-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-ола, проведением реакции, подобной описанной в примере 27 (c).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,90-1,99 (1H, м), 2,08-2,22 (1H, м), 2,26 (3H, с), 2,33-2,44 (1H, м), 2,56-2,73 (1H, м), 2,90-3,12 (1H, м), 3,91-4,12 (1H, м), 4,43 (1H, т, J=4,5), 6,49 (1H, с), 7,01 (1H, с), 7,09-7,25 (9H, м), 7,36-7,50 (7H, м).
(d) (E)-4-(Ацетилсульфанил)-3-[(1,3-оксазол-2-ил)метилиден]пиперидина гидротрифторацетат
Указанное в заголовке соединение синтезировали с выходом 86% в виде коричневого твердого вещества, используя (E)-4-(ацетилсульфанил)-3-[(1,3-оксазол-2-ил)метилиден]-1-(трифенилметил)пиперидин вместо (E)-4-(ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-2-ил]метилиден}-1-(трифенилметил)пиперидина, проведением реакции, подобной описанной в примере 19 (d).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д.: 1,93-2,03 (1H, м), 2,21-2,33 (1H, м), 2,39 (3H, м), 3,10-3,33 (2H, м), 4,14 (1H, д, J=14,5), 4,60 (1H, т, J=4,5), 4,84 (1H, д, J=14,5), 6,68 (1H, с), 7,40 (1H, с), 8,18 (1H, с).
(e) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,3-оксазол-2-ил)метилиден]пиперидин
Указанное в заголовке соединение синтезировали с выходом 85% в виде бледно-коричневого масла, используя (E)-4-(ацетилсульфанил)-3-[(1,3-оксазол-2-ил)метилиден]пиперидина гидротрифторацетат вместо (E)-4-(ацетилсульфанил)-3-бензилиденпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 1 (d).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,69-0,85 (2H, м), 0,90-1,09 (2H, м), 1,84-1,94 (1H, м), 2,20-2,29 (2H, м), 2,31 и 2,32 (общая 3H, каждый с), 2,42-2,71 (1H, м), 2,75-2,86 (1H, м), 3,38-3,46 (1H, м), 4,30 и 4,42 (общая 1H, каждый д, J=13,0), 4,45-4,51 (1H, м), 4,74 и 4,77 (общая 1H, каждый с), 6,45 (1H, с), 7,03-7,17 (3H, м), 7,27-7,35 (1H, м), 7,37-7,52 (2H, м);
ИК (Жидкостная пленка, см-1): 1696, 1488.
(Пример 33) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,3-оксазол-2-ил)метилиден]-4-сульфанилпиперидин (соединение № 1-77)
Указанное в заголовке соединение синтезировали с выходом 84% в виде бесцветного масла, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,3-оксазол-2-ил)метилиден]пиперидин вместо (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-2-ил) метилиден]пиперидина, проведением реакции, подобной описанной в примере 8.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,72-0,82 (2H, м), 0,91-1,08 (2H, м), 1,78-1,89 (1H, м), 2,21-2,37 (2H, м), 2,62-2,97 (2H, м), 3,83-4,06 (3H, м), 4,77 и 4,79 (общая 1H, каждый с), 6,45 и 6,46 (общая 1H, каждый с), 7,05-7,18 (3H, м), 7,27-7,34 (1H, м), 7,39-7,46 (1H, м), 7,47 и 7,51 (общая 1H, каждый с);
ИК (Жидкостная пленка, см-1): 2563, 1699, 1488.
(Пример 34) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,3-оксазол-4-ил)метилиден]пиперидин (соединение № 1-82)
(a) (E)-3-[(1,3-Оксазол-4-ил)метилиден]-1-(трифенилметил)пиперидин-4-он
Указанное в заголовке соединение синтезировали с выходом 19% в виде желтого масла, используя 1,3-оксазол-4-карбальдегид вместо бензальдегида, проведением реакции, подобной описанной в примере 1 (a).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,66 (2H, шс), 2,76 (2H, т, J=6,0), 3,61 (2H, шс), 7,15-7,34 (9H, м), 7,35 (1H, с), 7,51-7,57 (6H, м), 7,59 (1H, с), 7,76 (1H, с).
(b) (E)-3-[(1,3-Оксазол-4-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 57% в виде бледно-коричневого масла, используя (E)-3-[(1,3-оксазол-4-ил)метилиден]-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1 (b).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,82-1,95 (1H, м), 2,09-2,19 (1H, м), 2,42-2,86 (3H, м), 3,77-4,18 (2H, м), 6,42 (1H, с), 7,08-7,23 (9H, м), 7,36-7,48 (7H, м), 7,69 (1H, с).
(c) (E)-4-(Ацетилсульфанил)-3-[(1,3-оксазол-4-ил)метилиден]-1-(трифенилметил)пиперидин
Указанное в заголовке соединение синтезировали с выходом 57% в виде желтого масла, используя (E)-3-[(1,3-оксазол-4-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол вместо (E)-3-[(пиридин-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-ола, проведением реакции, подобной описанной в примере 27 (c).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,88-2,20 (3H, м), 2,26 (3H, с), 2,33-2,44 (1H, м), 2,65 (1H, шс), 3,83 (1H, шс), 4,46 (1H, т, J=4,5), 6,41 (1H, с), 7,08-7,24 (9H, м), 7,34-7,52 (7H, м), 7,66 (1H, с).
(d) (E)-4-(Ацетилсульфанил)-3-[(1,3-оксазол-4-ил)метилиден]пиперидина гидротрифторацетат
Указанное в заголовке соединение синтезировали с выходом 88% в виде коричневого твердого вещества, используя (E)-4-(ацетилсульфанил)-3-[(1,3-оксазол-4-ил)метилиден]-1-(трифенилметил)пиперидин вместо (E)-4-(ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-2-ил]метилиден}-1-(трифенилметил)пиперидина, проведением реакции, подобной описанной в примере 19 (d).
1H ЯМР (500 МГц, CDCl3) δ м.д.:2,03-2,11 (1H, м), 2,36 (3H, с), 2,46-2,57 (1H, м), 3,12-3,25 (1H, м), 3,35-3,44 (1H, м), 3,84 (1H, д, J=14,0), 4,57 (1H, т, J=3,5), 5,40 (1H, д, J=14,0), 6,59 (1H, с), 7,68 (1H, с), 7,84 (1H, с).
(e) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,3-оксазол-4-ил)метилиден]пиперидин
Указанное в заголовке соединение синтезировали с выходом 76% в виде желтого масла, используя (E)-4-(ацетилсульфанил)-3-[(1,3-оксазол-4-ил)метилиден]пиперидина гидротрифторацетат вместо (E)-4-(ацетилсульфанил)-3-бензилиденпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 1 (d).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,69-0,85 (2H, м), 0,91-1,07 (2H, м), 1,83-1,91 (1H, м), 2,17-2,35 (2H, м), 2,30 (3H, с), 2,41-2,66 (1H, м), 2,75-2,85 (1H, м), 3,15 и 3,24 (общая 1H, каждый д, J=13,0), 4,13 и 4,22 (общая 1H, каждый д, J=13,0), 4,47 (1H, т, J=4,5), 4,73 и 4,76 (общая 1H, каждый с), 6,38 (1H, с), 7,04-7,18 (2H, м), 7,28-7,45 (2H, м), 7,54 и 7,59 (общая 1H, каждый с), 7,71 и 7,76 (общая 1H, каждый с);
ИК (Жидкостная пленка, см-1): 1694, 1488.
(Пример 35) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,3-оксазол-4-ил)метилиден]-4-сульфанилпиперидин (соединение № 1-81)
Указанное в заголовке соединение синтезировали с выходом 92% в виде желтого масла, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,3-оксазол-4-ил)метилиден]пиперидин вместо (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-2-ил)метилиден]пиперидина, проведением реакции, подобной описанной в примере 8.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,70-0,82 (2H, м), 0,91-1,06 (2H, м), 1,75-1,84 (1H, м), 2,14-2,34 (2H, м), 2,60-2,69 (1H, м), 2,74-2,92 (1H, м), 3,63-3,80 (2H, м), 3,85-3,91 (1H, м), 4,76 и 4,78 (общая 1H, каждый с), 6,36 (1H, с), 7,05-7,18 (2H, м), 7,27-7,45 (2H, м), 7,55 и 7,60 (общая 1H, каждый с), 7,74 и 7,77 (общая 1H, каждый с);
ИК (KBr, см-1): 2569, 1694, 1487.
(Пример 36) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,3-оксазол-5-ил)метилиден]пиперидина гидрохлорид (соединение № 1-86)
(a) (E)-4-(трет-Бутилдиметилсилилокси)-3-[(этоксикарбонил)метилиден]-1-(трифенилметил)пиперидин
К раствору (E)-3-[(этоксикарбонил)метилиден]-1-(трифенилметил)пиперидин-4-ола (14,97 г) в N,N-диметилформамиде (130 мл) добавляли последовательно трет-бутилдиметилсилилхлорид (6,86 г), 1H-имидазол (3,34 г) и 4-диметиламинопиридин (0,43 г) при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли этилацетатом и промывали насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом натрия. Удаляли растворитель и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из этилацетата и гексана (1:19), с получением указанного в заголовке соединения (16,38 г, выход: 86%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,01 (3H, с), 0,02 (3H, с), 0,90 (9H, с), 1,12 (3H, т, J=7,0), 1,59-1,74 (1H, м), 1,83-2,01 (3H, м), 3,00-3,12 (1H, м), 3,90 (1H, т, J=9,0), 3,96-4,15 (2H, м), 4,73 (1H, м), 6,06 (1H, с), 7,11-7,18 (3H, м), 7,20-7,28 (6H, м), 7,36-7,54 (6H, м).
(b) (E)-4-(трет-Бутилдиметилсилилокси)-3-(2-гидроксиэтилиден]-1-(трифенилметил)пиперидин
К раствору (E)-4-(трет-бутилдиметилсилилокси)-3-[(этоксикарбонил)метилиден]-1-(трифенилметил)пиперидина (15,14 г) в дихлорметане (110 мл) добавляли по каплям 1,01 н. раствор гидрида диизобутилалюминия в толуоле (66,40 мл) при -70°C и полученную смесь перемешивали при той же самой температуре в течение 3 часов. После перемешивания к реакционной смеси добавляли насыщенный водный раствор хлорида аммония и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом натрия. Удаляли в вакууме растворитель и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из этилацетата и гексана (1:3), с получением указанного в заголовке соединения (13,22 г, выход: 95%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,01 (6H, с), 0,88 (9H, с), 1,62-2,00 (4H, м), 2,88-3,05 (1H, м), 3,51-3,71 (1H, м), 3,86 (1H, м), 4,07-4,24 (2H, м), 5,79 (1H, т, J=7,0), 7,11-7,33 (9H, м), 7,36-7,58 (6H, м).
(c) (E)-4-(трет-Бутилдиметилсилилокси)-3-(формилметилиден)-1-(трифенилметил)пиперидин
К раствору (E)-4-(трет-бутилдиметилсилилокси)-3-(2-гидроксиэтилиден)-1-(трифенилметил)пиперидина (8,50 г) в дихлорметане (120 мл) добавляли диоксид марганца (8,87 г) при комнатной температуре и полученную смесь перемешивали при комнатной температуре в течение 45 часов. После перемешивания отфильтровывали нерастворимые материалы. Фильтрат упаривали в вакууме и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из этилацетата и гексана (3:17), с получением указанного в заголовке соединения (7,54 г, выход: 89%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,01 (3H, с), 0,02 (3H, с), 0,89 (9H, с), 1,59-1,88 (1H, м), 1,96-2,07 (3H, м), 3,08-3,18 (1H, м), 3,95 (1H, т, J=9,0), 4,37 (1H, м), 6,24 (1H, д, J=9,0), 7,14-7,22 (3H, м), 7,24-7,33 (6H, м), 7,39-7,55 (6H, м), 9,85 (1H, д, J=9,0).
(d) (E)-4-(трет-Бутилдиметилсилилокси)-3-[(1,3-оксазол-5-ил)метилиден]-1-(трифенилметил)пиперидин
К раствору (E)-4-(трет-бутилдиметилсилилокси)-3-(формилметилиден)-1-(трифенилметил)пиперидина (112 мг) в метаноле (2,5 мл) добавляли последовательно п-толуолсульфонилметилизоцианид (45 мг) и карбонат калия (32 мг) и полученную смесь кипятили с обратным холодильником в течение 3,5 часов. После кипячения с обратным холодильником к реакционной смеси добавляли воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом натрия. Удаляли в вакууме растворитель и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из этилацетата и гексана (1:19-1:3), с получением указанного в заголовке соединения (40 мг, выход: 32%) в виде желтого масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,02 (3H, с), 0,04 (3H, с), 0,91 (9H, с), 1,64-2,11 (4H, м), 3,00-3,10 (1H, м), 3,98 (1H, т, J=7,0), 4,26-4,38 (1H, м), 6,46 (1H, с), 6,86 (1H, с), 7,09-7,33 (9H, м), 7,37-7,51 (6H, м), 7,56 (1H, с).
(e) (E)-3-[(1,3-Оксазол-5-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол
К раствору (E)-4-(трет-бутилдиметилсилилокси)-3-(1,3-оксазол-5-ил)метилиден]-1-(трифенилметил)пиперидина (499 мг) в тетрагидрофуране (8 мл) добавляли тетрабутиламмонийфторид (483 мг) при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в течение 22 часов. Реакционную смесь разбавляли этилацетатом и промывали водой и насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом натрия. Удаляли в вакууме растворитель и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из этилацетата и гексана (3:7), с получением указанного в заголовке соединения (254 мг, выход: 65%) в виде желтого масла.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,85-1,99 (2H, м), 2,11-2,19 (1H, м), 2,36-2,54 (1H, м), 2,85-2,98 (1H, м), 3,93-4,14 (2H, м), 6,45 (1H, с), 6,88 (1H, с), 7,11-7,24 (9H, м), 7,41-7,51 (6H, м), 7,58 (1H, с).
(f) (E)-4-(Ацетилсульфанил)-3-[(1,3-оксазол-5-ил)метилиден]-1-(трифенилметил)пиперидин
Указанное в заголовке соединение синтезировали с выходом 45% в виде желтого твердого вещества, используя (E)-3-[(1,3-оксазол-5-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол вместо (E)-3-[(пиридин-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-ола, проведением реакции, подобной описанной в примере 27 (c).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,89-2,29 (3H, м), 2,27 (3H, с), 2,35-2,45 (1H, м), 2,64-2,79 (1H, м), 3,69-3,85 (1H, м), 4,42-4,48 (1H, м), 6,42 (1H, с), 6,86 (1H, с), 7,12-7,28 (9H, м), 7,41-7,49 (6H, м), 7,56 (1H, с).
(g) (E)-4-(Ацетилсульфанил)-3-[(1,3-оксазол-5-ил)метилиден]пиперидина гидротрифторацетат
Указанное в заголовке соединение синтезировали с выходом 94% в виде коричневого аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-3-[(1,3-оксазол-5-ил)метилиден]-1-(трифенилметил)пиперидин вместо (E)-4-(ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-2-ил]метилиден}-1-(трифенилметил)пиперидина, проведением реакции, подобной описанной в примере 19 (d).
1H ЯМР (500 МГц, CDCl3+ДМСО-d6) δ м.д.: 2,01-2,09 (1H, м), 2,37-2,43 (1H, м), 2,38 (3H, с), 3,14-3,42 (2H, м), 3,90 (1H, д, J=14,5), 4,47-4,59 (2H, м), 6,68 (1H, с), 7,92-7,97 (1H, м), 8,17-8,21 (1H, м).
(h) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,3-оксазол-5-ил)метилиден]пиперидина гидрохлорид
Указанное в заголовке соединение синтезировали с выходом 81% в виде бледно-коричневого твердого вещества, используя (E)-4-(ацетилсульфанил)-3-[(1,3-оксазол-5-ил)метилиден]пиперидина гидротрифторацетат вместо (E)-4-(ацетилсульфанил)-3-бензилиденпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 1 (d).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,72-0,87 (2H, м), 0,93-1,09 (2H, м), 1,83-1,94 (1H, м), 2,15-2,36 (2H, м), 2,32 (3H, с), 2,48-2,62 (1H, м), 2,76-2,92 (1H, м), 3,07 и 3,30 (общая 1H, каждый д, J=13,0), 3,90 (1H, д, J=13,0), 4,45-4,50 (1H, м), 4,75 (1H, с), 6,38 и 6,40 (общая 1H, каждый с), 6,86 и 6,93 (общая 1H, каждый с), 7,05-7,19 (2H, м), 7,29-7,45 (2H, м), 7,64 и 7,71 (общая 1H, каждый с);
ИК (KBr, см-1): 1698, 1494.
(Пример 37) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,3-оксазол-5-ил)метилиден]-4-сульфанилпиперидина гидрохлорид (соединение № 1-85)
Указанное в заголовке соединение синтезировали с количественным выходом в виде бледно-желтого твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,3-оксазол-5-ил)метилиден]пиперидина гидрохлорид вместо (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-2-ил)метилиден]пиперидина, проведением реакции, подобной описанной в примере 8.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,73-0,86 (2H, м), 0,93-1,07 (2H, м), 1,77-1,87 (1H, м), 2,13-2,36 (2H, м), 2,61-2,75 (1H, м), 2,81-2,91 (1H, м), 3,51-3,78 (2H, м), 3,81-3,91 (1H, м), 4,77 и 4,78 (общая 1H, каждый с), 6,36 и 6,39 (общая 1H, каждый с), 6,86 и 6,92 (общая 1H, каждый с), 7,0 6-7,19 (2H, м), 7,29-7,4 6 (2H, м), 7,66 и 7,70 (общая 1H, каждый с);
ИК (KBr, см-1): 1712, 1494.
(Пример 38) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(изоксазол-3-ил)метилиден]пиперидина гидрохлорид (соединение № 1-90)
(a) (E)-3-[(Изоксазол-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-он
Указанное в заголовке соединение синтезировали с выходом 82% в виде бледно-желтого масла, используя изоксазол-3-карбальдегид вместо бензальдегида, проведением реакции, подобной описанной в примере 1 (a).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,68 (2H, шс), 2,79 (2H, т, J=6,0), 3,60 (2H, шс), 6,25 (1H, с), 7,14-7,22 (3H, м), 7,23-7,38 (7H, м), 7,48-7,56 (6H, м), 8,35 (1H, с).
(b) (E)-3-[(Изоксазол-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 69% в виде бесцветного твердого вещества, используя (E)-3-[(изоксазол-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1 (b).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,86-1,98 (2H, м), 2,10-2,20 (1H, м), 2,31-2,50 (1H, м), 2,83-2,97 (1H, м), 3,84-4,17 (2H, м), 6,19 (1H, д, J=1,5), 6,53 (1H, с), 7,07-7,21 (9H, м), 7,32-7,45 (6H, м), 8,29 (1H, д, J=1,5).
(c) (E)-4-(Ацетилсульфанил)-3-[(изоксазол-3-ил)метилиден]-1-(трифенилметил)пиперидин
Указанное в заголовке соединение синтезировали с выходом 75% в виде желтого аморфного твердого вещества, используя (E)-3-[(изоксазол-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол вместо (E)-3-[(пиридин-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-ола, проведением реакции, подобной описанной в примере 27 (c).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,91-1,99 (1H, м), 2,12-2,22 (1H, м), 2,27 (3H, с), 2,34-2,44 (1H, м), 2,58-2,96 (2H, м), 3,51-3,69 (1H, м), 4,46 (1H, м), 6,13 (1H, с), 6,51 (1H, с), 7,08-7,31 (9H, м), 7,34-7,47 (6H, м), 8,25 (1H, с).
(d) (E)-4-(Ацетилсульфанил)-3-[(изоксазол-3-ил)метилиден]пиперидина гидротрифторацетат
Указанное в заголовке соединение синтезировали с выходом 68% в виде белого твердого вещества, используя (E)-4-(ацетилсульфанил)-3-[(изоксазол-3-ил)метилиден]-1-(трифенилметил)пиперидин вместо (E)-4-(ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-2-ил]метилиден}-1-(трифенилметил)пиперидина, проведением реакции, подобной описанной в примере 19 (d).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,08-2,16 (1H, м), 2,38 (3H, с), 2,49-2,62 (1H, м), 3,15-3,25 (1H, м), 3,38-3,46 (1H, м), 3,83 (1H, д, J=14,5), 4,62 (1H, т, J=4,5), 4,80 (1H, д, J=14,5), 6,32 (1H, с), 6,63 (1H, с), 8,37 (1H, с).
(e) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(изоксазол-3-ил)метилиден]пиперидина гидрохлорид
Указанное в заголовке соединение синтезировали с выходом 69% в виде бледно-желтого твердого вещества, используя (E)-4-(ацетилсульфанил)-3-[(изоксазол-3-ил)метилиден]пиперидина гидротрифторацетат вместо (E)-4-(ацетилсульфанил)-3-бензилиденпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 1 (d).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,69-0,85 (2H, м), 0,91-1,05 (2H, м), 1,85-1,94 (1H, м), 2,12-2,35 (2H, м), 2,32 (3H, с), 2,45-2,68 (1H, м), 2,75-2,83 (1H, м), 3,18 и 3,26 (общая 1H, каждый д, J=13,5), 3,86 и 3,93 (общая 1H, каждый д, J=13,5), 4,50 (1H, т, J=4,5), 4,71 и 4,76 (общая 1H, каждый с), 6,27 и 6,31 (общая 1H, каждый д, J=2,0), 6,48 (1H, с), 7,06-7,18 (2H, м), 7,28-7,42 (2H, м), 8,30 и 8,33 (общая 1H, каждый д, J=2,0);
ИК (KBr, см-1): 1698, 1495.
(Пример 39) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(изоксазол-3-ил)метилиден]-4-сульфанилпиперидина гидрохлорид (соединение № 1-89)
Указанное в заголовке соединение синтезировали с выходом 84% в виде бесцветного твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(изоксазол-3-ил)метилиден]пиперидина гидрохлорид вместо (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-2-ил)метилиден]пиперидина, проведением реакции, подобной описанной в примере 8.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,69-0,82 (2H, м), 0,91-1,04 (2H, м), 1,79-1,87 (1H, м), 2,09-2,18 (1H, м), 2,23-2,36 (1H, м), 2,60-2,69 (1H, м), 2,75-2,93 (1H, м), 3,54 и 3,57 (общая 1H, каждый д, J=12,5), 3,65 и 3,70 (общая 1H, каждый д, J=12,5), 3,85-3,92 (1H, м), 4,75 и 4,77 (общая 1H, каждый с), 6,29 и 6,34 (общая 1H, каждый д, J=1,5), 6,49 и 6,50 (общая 1H, каждый с), 7,06-7,17 (2H, м), 7,28-7,41 (2H, м), 8,31 и 8,33 (общая 1H, каждый д, J=1,5);
ИК (KBr, см-1): 1713, 1495.
(Пример 40) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(изоксазол-5-ил)метилиден]пиперидин (соединение № 1-98)
(a) (E)-3-[(Изоксазол-5-ил)метилиден]-1-(трифенилметил)пиперидин-4-он
Указанное в заголовке соединение синтезировали с выходом 70% в виде желтого аморфного твердого вещества, используя изоксазол-5-карбальдегид вместо бензальдегида, проведением реакции, подобной описанной в примере 1 (a).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,69 (2H, шс),2,80 (2H, т, J=6,0), 3,63 (2H, шс), 6,21 (1H, с), 7,16-7,21 (3H, м), 7,24-7,32 (6H, м), 7,36 (1H, с), 7,48-7,55 (6H, м), 8,19 (1H, с).
(b) (E)-3-[(Изоксазол-5-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 69% в виде бесцветного твердого вещества, используя (E)-3-[(изоксазол-5-ил)метилиден]-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1 (b).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,85-1,98 (2H, м), 2,11-2,21 (1H, м), 2,30-2,47 (1H, м), 2,89-3,02 (1H, м), 4,02-4,16 (2H, м), 5,98 (1H, с), 6,60 (1H, с), 7,09-7,25 (9H, м), 7,37-7,49 (6H, м), 8,11 (1H, с).
(c) (E)-4-(Ацетилсульфанил)-3-[(изоксазол-5-ил)метилиден]-1-(трифенилметил)пиперидин
Указанное в заголовке соединение синтезировали с выходом 68% в виде коричневого аморфного твердого вещества, используя (E)-3-[(изоксазол-5-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол вместо (E)-3-[(пиридин-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-ола, проведением реакции, подобной описанной в примере 27 (c).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,92-2,00 (1H, м), 2,08-2,24 (1H, м), 2,28 (3H, с), 2,34-2,46 (1H, м), 2,58-2,72 (1H, м), 2,78-2,96 (1H, м), 3,61-3,78 (1H, м), 4,46 (1H, т, J=5,0), 5,95 (1H, с), 6,54 (1H, с), 7,12-7,25 (9H, м), 7,39-7,47 (6H, м), 8,08 (1H, с).
(d) (E)-4-(Ацетилсульфанил)-3-[(изоксазол-5-ил)метилиден]пиперидина гидротрифторацетат
Указанное в заголовке соединение синтезировали с выходом 90% в виде бледно-коричневого твердого вещества, используя (E)-4-(ацетилсульфанил)-3-[(изоксазол-5-ил)метилиден]-1-(трифенилметил)пиперидин вместо (E)-4-(ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-2-ил]метилиден}-1-(трифенилметил)пиперидина, проведением реакции, подобной описанной в примере 19 (d).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,08-2,16 (1H, м), 2,38 (3H, с), 2,51-2,64 (1H, м), 3,14-3,25 (1H, м), 3,42-3,51 (1H, м), 3,91 (1H, д, J=14,5), 4,59 (1H, т, J=4,0), 4,84 (1H, д, J=14,5), 6,28 (1H, с), 6,70 (1H, с), 8,20 (1H, с).
(e) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(изоксазол-5-ил)метилиден]пиперидин
Указанное в заголовке соединение синтезировали с выходом 89% в виде желтого масла, используя (E)-4-(ацетилсульфанил)-3-[(изоксазол-5-ил)метилиден]пиперидина гидротрифторацетат вместо (E)-4-(ацетилсульфанил)-3-бензилиденпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 1 (d).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,75-0,87 (2H, м), 0,95-1,09 (2H, м), 1,86-1,95 (1H, м), 2,12-2,35 (2H, м), 2,32 (3H, с), 2,43-2,67 (1H, м), 2,77-2,85 (1H, м), 3,20 и 3,32 (общая 1H, каждый д, J=14,0), 3,93 и 3,96 (общая 1H, каждый д, J=14,0), 4,47 (1H, т, J=4,5), 4,76 и 4,78 (общая 1H, каждый с), 6,09 и 6,14 (общая 1H, каждый с), 6,50 (1H, с), 7,07-7,20 (2H, м), 7,29-7,42 (2H, м), 8,13 и 8,15 (общая 1H, каждый с);
ИК (Жидкостная пленка, см-1): 1695, 1488.
(Пример 41) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(изоксазол-5-ил)метилиден]-4-сульфанилпиперидина гидрохлорид (соединение № 1-97)
Указанное в заголовке соединение синтезировали с количественным выходом в виде бесцветного аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(изоксазол-5-ил)метилиден]пиперидин вместо (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-2-ил)метилиден]пиперидина, проведением реакции, подобной описанной в примере 8.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,74-0,86 (2H, м), 0,94-1,08 (2H, м), 1,80-1,88 (1H, м), 2,11-2,18 (1H, м), 2,25-2,36 (1H, м), 2,62-2,70 (1H, м), 2,76-2,93 (1H, м), 3,59 и 3,60 (общая 1H, каждый д, J=13,0), 3,68 и 3,77 (общая 1H, каждый д, J=13,0), 3,82-3,88 (1H, м), 4,79 и 4,80 (общая 1H, каждый с), 6,10 и 6,15 (общая 1H, каждый с), 6,51 (1H, с), 7,07-7,20 (2H, м), 7,29-7,42 (2H, м), 8,14 и 8,16 (общая 1H, каждый с);
ИК (KBr, см-1): 1712, 1494.
(Пример 42) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,2,3-тиадиазол-4-ил)метилиден]пиперидина гидрохлорид (соединение № 1-126)
(a) (E)-3-[(1,2,3-Тиадиазол-4-ил)метилиден]-1-(трифенилметил)пиперидин-4-он
Указанное в заголовке соединение синтезировали с выходом 36% в виде оранжевого аморфного твердого вещества, используя 1,2,3-тиадиазол-4-карбальдегид вместо бензальдегида, проведением реакции, подобной описанной в примере 1(a).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 2,71 (2H, шс), 2,83 (2H, т, J=6,5), 3,82 (2H, шс), 7,13-7,19 (3H, м), 7,22-7,30 (6H, м), 7,49-7,56 (6H, м), 7,74 (1H, с), 8,41 (1H, с).
(b) (E)-3-[(1,2,3-Тиадиазол-4-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 95% в виде оранжевого аморфного твердого вещества, используя (E)-3-[(1,2,3-тиадиазол-4-ил)метилиден]-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1(b).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,90-2,02 (2H, м), 2,14-2,25 (1H, м), 2,40-2,63 (1H, м), 2,85-2,99 (1H, м), 3,97-4,13 (1H, м), 4,18-4,27 (1H, м), 6,97 (1H, 5), 7,03-7,20 (ЭН, м), 7,31-7,42 (6H, м), 8,14 (1H, с).
(c) (E)-4-(Ацетилсульфанил)-3-[(1,2,3-тиадиазол-4-ил)метилиден]пиперидина гидротрифторацетат
Указанное в заголовке соединение синтезировали с выходом 19% в виде бледно-желтого аморфного твердого вещества, используя (E)-3-[(1,2,3-тиадиазол-4-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол вместо (E)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола, последовательным проведением реакций, подобных описанным в примере 21(c).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 2,11-2,21 (1H, м), 2,39 (3H, с), 2,54-2,67 (1H, м), 3,17-3,29 (1H, м), 3,44-3,54 (1H, м), 3,90-4,02 (1H, м), 4,68 (1H, м), 5,29-5,36 (1H, м), 6,97 (1H, с), 8,44 (1H, с).
(d) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,2,3-тиадиазол-4-ил)метилиден]пиперидина гидрохлорид
Указанное в заголовке соединение синтезировали с выходом 54% в виде оранжевого аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-3-[(1,2,3-тиадиазол-4-ил)метилиден]пиперидина гидротрифторацетат вместо (E)-4-(ацетилсульфанил)-3-бензилиденпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 1(d).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,64-0,84 (2H, м), 0,90-1,05 (2H, м), 1,88-1,98 (1H, м), 2,05-2,13 (1H, м), 2,27-2,39 (1H, м), 2,33 и 2, 34 (общая 3H, каждый с),2,52 и 2, 65 (общая 1H, каждый м), 2,76-2,88 (1H, м), 3,22 и 3,36 (общая 1H, каждый д, J=12,0), 4,12-4,12 (1H, м); 4,53-4,59 (1H, м), 4,76 и 4,79 (общая 1H, каждый с), 6,91 (1H, с), 7,03-7,17 (2H, м), 7,27-7,40 (2H, м), 8,42 и 8,44 (общая 1H, каждый с);
ИК (KBr, см-1): 1698, 1495.
(Пример 43) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанил-3-[(1,2,3-тиадиазол-4-ил)метилиден]пиперидина гидрохлорид (соединение № 1-125)
Указанное в заголовке соединение синтезировали с выходом 89% в виде желтого аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,2,3-тиадиазол-4-ил)метилиден]пиперидина гидрохлорид вместо (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-2-ил)метилиден]пиперидина, проведением реакции, подобной описанной в примере 8.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,65-0,85 (2H, м), 0,89-1,04 (2H, м), 1,82-1,91 (1H, м), 2,01-2,12 (1H, м), 2,28-2,40 (1H, м), 2,60-2,73 (1H, м), 2,80-2,94 (1H, м), 3,59-3,73 и 3,76-3,83 (общая 2H, каждый м), 3,91-3,98 (1H, м), 4,79 и 4,81 (общая 1H, каждый с), 6,95 и 6,96 (общая 1H, каждый с), 7,03-7,18 (2H, м), 7,27-7,40 (2H, м), 8,47 и 8,49 (общая 1H, каждый с);
ИК (KBr, см-1): 2449, 1712.
(Пример 44) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,2,5-тиадиазол-3-ил)метилиден]пиперидина гидрохлорид (соединение № 1-142)
(a) (E)-3-[(1,2,5-Тиадиазол-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-он
Указанное в заголовке соединение синтезировали с выходом 49% в виде коричневого масла, используя 1,2,5-тиадиазол-3-карбальдегид вместо бензальдегида, проведением реакции, подобной описанной в примере 1(a)
1H ЯМР (500 МГц, CDCl3) δ м.д.: 2,68 (2H, шс), 2,81 (2H, т, J=6,0), 3,85 (2H, шс), 7,14-7,20 (3H, м), 7,22-7,30 (6H, м), 7,49-7,59 (7H, м), 8,56 (1H, с).
(b) (E)-3-[(1,2,5-Тиадиазол-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 63% в виде бесцветного масла, используя (E)-3-[(1,2,5-тиадиазол-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1(b).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,88-1,99 (2H, м), 2,15-2,22 (1H, м), 2,35-2,53 (1H, м), 2,91-3,03 (1H, м), 4,15-4,21 (1H, м), 4,25-4,43 (1H, м), 6,82 (1H, с), 7,07-7,19 (9H, м), 7,32-7,53 (7H, м), 8,43 (1H, с).
(c) (E)-4-(Ацетилсульфанил)-3-[(1,2,5-тиадиазол-3-ил)метилиден]-1-(трифенилметил)пиперидин
Указанное в заголовке соединение синтезировали с выходом 46% в виде коричневого масла, используя (E)-3-[(1,2,5-тиадиазол-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол вместо (E)-3-[(пиридин-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-ола, проведением реакции, подобной описанной в примере 27(c).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,93-2,02 (1H, м), 2,09-2,24 (1H, м), 2,28 (3H, с), 2,38-2,49 (1H, м), 2,63-2,76 (1H, м), 2,80-3,01 (1H, м), 3,90-4,08 (1H, м), 4,50 (1H, т, J=4,5), 6,78 (1H, с), 7,08-7,19 (9H, м), 7,34-7,41 (6H, м), 8,39 (1H, с).
(d) (E)-4-(Ацетилсульфанил)-3-[(1,2,5-тиадиазол-3-ил)метилиден]пиперидина гидротрифторацетат
Указанное в заголовке соединение синтезировали с выходом 31% в виде бесцветного твердого вещества, используя (E)-4-(ацетилсульфанил)-3-[(1,2,5-тиадиазол-3-ил)метилиден]-1-(трифенилметил)пиперидин вместо (E)-4-ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-2-ил]метилиден}-1-(трифенилметил)пиперидина, проведением реакции, подобной описанной в примере 19(d).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 2,08-2,18 (1H, м), 2,39 (3H, с), 2,50-2,63 (1H, м), 3,13-3,24 (1H, м), 3,33-3,43 (1H, м), 3,92 (1H, д, J=14,5), 4,64 (1H, т, J=4,5), 5,25 (1H, д, J=14,5), 6,99 (1H, с), 8,49 (1H, с).
(e) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,2,5-тиадиазол-3-ил)метилиден]пиперидина гидрохлорид
Указанное в заголовке соединение синтезировали с выходом 69% в виде бледно-коричневого твердого вещества, используя (E)-4-(ацетилсульфанил)-3-[(1,2,5-тиадиазол-3-ил)метилиден]пиперидина гидротрифторацетат вместо (E)-4-(ацетилсульфанил)-3-бензилиденпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 1(d).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,65-1,07 (4H, м), 1,87-1,98 (1H, м), 2,13-2,39 (2H, м), 2,33 (3H, с), 2,47-2,68 (1H, м), 2,80-2,90 (1H, м), 3,27 и 3,43 (общая 1H, каждый д, J=13,5), 4,31 и 4,35 (общая 1H, каждый д, J=13,5), 4,50-4,56 (1H, м), 4,75 и 4,76 (общая 1H, каждый с), 6,75 и 6,76 (общая 1H, каждый с), 7,02-7,17 (2H, м), 7,27-7,42 (2Н, м), 8,40 и 8,42 (общая 1H, каждый с);
ИК (KBr, см-1): 1698, 1494.
(Пример 45) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанил-3-[(1,2,5-тиадиазол-3-ил)метилиден]пиперидина гидрохлорид (соединение № 1-141)
Указанное в заголовке соединение синтезировали с выходом 71% в виде бесцветного твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,2,5-тиадиазол-3-ил)метилиден]пиперидина гидрохлорид вместо (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-2-ил)метилиден]пиперидина, проведением реакции, подобной описанной в примере 8.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,66-0,82 (2H, м), 0,90-1,05 (2H, м), 1,80-1,92 (1H, м), 2,11-2,20 (1H, м), 2,28-2,39 (1H, м), 2,65-2,74 (1H, м), 2,82-2,96 (1H, м), 3,81-3,98 (3H, м), 4,76 и 4,78 (общая 1H, каждый с), 6,75 (1H, с), 7,03-7,16 (2H, м), 7,28-7,41 (2H, м), 8,42 и 8,43 (общая 1H, каждый с);
ИК (KBr, см-1): 2599, 1713, 1494.
(Пример 46) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(индол-3-ил)метилиден]пиперидин (соединение № 1-166)
(a) (E)-3-{[1-(трет-Бутоксикарбонил)индол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-он
Указанное в заголовке соединение синтезировали с выходом 62% в виде желтого кристалла, используя 1-(трет-бутоксикарбонил)индол-3-карбальдегид вместо бензальдегида, проведением реакции, подобной описанной в примере 1(a).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,62 (9H, с), 2,49-2,60 (1H, м), 2,64-2,74 (1H, м), 2,76-2,83 (1H, м), 3,24-3,37 (2H, м), 3,49 (1H, шс), 7,14-7,23 (3H, м), 7,24-7,44 (7H, м), 7,48-7,63 (9H, м), 7,75-7,85 (1H, м), 8,12-8,18 (1H, м).
(b) (E)-3-{[1-(трет-Бутоксикарбонил)индол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 32% в виде бледно-желтого аморфного твердого вещества, используя (E)-3-{[1-(трет-бутоксикарбонил)индол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1(b).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,62 (9H, с), 1,65-1,74 (1H, м), 1,86-1,99 (2H, м), 2,03-2,27 (2H, м), 2,65-2,83 (1H, м), 4,28 (1H, шс), 6,62 (1H, с), 6,93-7,13 (9H, м), 7,15 (1H, с), 7,23-7,39 (8H, м), 7,63 (1H, д, J=7,5), 8,08-8,20 (1H, м).
(c) (E)-3-{[1-(трет-Бутоксикарбонил)индол-3-ил]метилиден}пиперидин-4-ола гидроацетат
Указанное в заголовке соединение синтезировали с выходом 99% в виде бесцветного кристалла, используя (E)-3-{[1-(трет-бутоксикарбонил)индол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол вместо (E)-3-[1-(фуран-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-ола, проведением реакции, подобной описанной в примере 7(c).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,45-1,57 (1H, м), 1,64 (9H, с), 1,88-1,98 (1H, м), 2,62-2,74 (1H, м), 2,92-3,03 (1H, м), 3,11 (1H, д, J=13,5), 3,77 (1H, д, J=13,5), 4,14-4,23 (1H, м), 6,47 (1H, с), 7,28 (1H, т, J=7,5), 7,36 (1H, т, J=7,5), 7,51 (1H, с), 7,59 (1H, д, J=7,5), 8,05 (1H, д, J=7,5).
(d) (E)-3-{[1-(трет-Бутоксикарбонил)индол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 76% в виде бледно-желтого аморфного твердого вещества, используя (E)-3-{[1-(трет-бутоксикарбонил)индол-3-ил]метилиден}пиперидин-4-ола гидроацетат вместо (E)-3-[(фуран-2-ил)метилиден]пиперидин-4-ола гидроацетата, проведением реакции, подобной описанной в примере 7(d).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,50-0,71 (2H, м), 0,78-0,96 (2H, м), 1,69 (9H, с), 1,90-1,93 (1H, м), 2,03-2,17 (2H, м), 2,41-2,51 и 2,56-2,66 (общая 1H, каждый м), 2,79-2,88 и 2,89-2,97 (общая 1H, каждый м),3,15 и 3,25 (общая 1H, каждый д, J=13,0),3,60 и 3,74 (общая 1H, каждый д, J=13,0), 4,30-4,39 (1H, м), 4,69 и 4,71 (общая 1H, каждый с), 6,59 и 6,61 (общая 1H, каждый с), 6,93-7,09 (2H, м), 7,19-7,28 (2Н, м), 7,29-7,37 (2Н, м), 7,45 (1Н, с), 7,53-7,58 (1H, м), 8,15 (1H, д, J=7,5).
(e) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(индол-3-ил)метилиден]пиперидин
К раствору (E)-3-{[1-(трет-бутоксикарбонил)индол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидин-4-ола (1,58 г) в толуоле (32 мл) добавляли тиоуксусную кислоту (0,45 мл) и динеопентилацеталь N,N-диметилформамида (1,75 мл) при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в течение 1 часа. После перемешивания к реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом натрия. Выпаривали в вакууме растворитель и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из этилацетата и гексана (1:9), с получением (E)-4-(ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)индол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина (0,66 г, выход: 38%) в виде бледно-желтого аморфного твердого вещества.
К раствору полученного, как описано выше, соединения добавляли при охлаждении льдом 4 н. раствор хлороводорода в диоксане (14,60 мл) и полученную смесь перемешивали при комнатной температуре в течение 7 часов. Реакционную смесь упаривали в вакууме и остаток разбавляли этилацетатом. Полученную смесь промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом натрия. Выпаривали в вакууме растворитель и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из этилацетата и гексана (1:4), с получением указанного в заголовке соединения (0,32 г, выход: 59%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,41-0,94 (4H, м), 1,85-1,93 (1H, м), 2,07-2,23 (2H, м), 2,33 (3H, с), 2,39-2,48 и 2,62-2,70 (общая 1Н, каждый м), 2,73-2,84 (1H, м), 3,09 (1H, д, J=13,0), 3,75 и 3,89 (общая 1H, каждый д, J=13,0), 4,58-4,66 (1H, м), 4,64 и 4,74 (общая 1H, каждый с), 6,76 и 6,77 (общая 1H, каждый с), 6,99-7,30 (5H, м), 7,31-7,44 (2H, м), 7,59-7,65 (1H, м), 8,25-8,31 (1H, м);
МС (FAB) m/z: 463 (М+H)+.
(Пример 47) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(индол-3-ил)метилиден]-4-сульфанилпиперидина дигидрохлорид (соединение № 1-165)
Указанное в заголовке соединение синтезировали с выходом 43% в виде оранжевого кристалла, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(индол-3-ил)метилиден]пиперидин вместо (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-2-ил)метилиден]пиперидина, проведением реакции, подобной описанной в примере 8.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,37-0,93 (4H, м), 1,67-1,75 (1H, м), 1,76-1,85 (1H, м), 2,01-2,16 (1H, м), 2,24-2,37 (1H, м), 2,61-2,69 (1H, м), 2,70-2,78 и 2,86-2,97 (общая 1H, каждый м), 3,48 и 3,68 (общая 1H, каждый д, J=12,5), 4,00-4,15 (1H, м), 4,69 и 4,76 (общая 1H, каждый с), 6,69 и 6,72 (общая 1H, каждый с), 6,97-7,29 (5H, м), 7,31-7,42 (2H, м), 7,61 (1H, д, J=7,5)), 8,20-8,34 (1H, м);
МС (FAB) m/z : 421 (М+H)+.
(Пример 48) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(хинолин-3-ил)метилиден]пиперидин (соединение № 1-170)
(a) (E)-3-[Хинолин-3-ил]метилиден]-1-(трифенилметил)пиперидин-4-он
Указанное в заголовке соединение синтезировали с выходом 48% в виде желтого масла, используя хинолин-3-карбальдегид вместо бензальдегида, проведением реакции, подобной описанной в примере 1(a).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,69-2,78 (2H, м), 2,80-2,86 (2H, м), 3,54 (2H, шс), 7,08-7,16 (3H, м), 7,18-7,31 (7H, м), 7,43-7,53 (6H, м), 7,56 (1H, т, J=8,0), 7,90 (1H, т, J-8,0), 7,93-8,08 (2H, м), 8,21 (1Н, д, J=8,0), 8.65 (1Н, с).
(b) (E)-3-[(Хинолин-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 55% в виде бледно-желтого аморфного твердого вещества, используя (E)-3-[(хинолин-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1(b).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,89-2,08 (2H, м), 2,13-2,25 (1H, м), 2,35-2,60 (1H, м), 2,84 (1H, шс), 3,66 (1H, шс), 4,18-4,28 (1H, м), 6,83 (1H, с), 6,84-7,07 (9H, м), 7,19-7,35 (6H, м), 7,52 (1H, т, J=8,0), 7,65-7,72 (2H, м), 7,89 (1H, с), 8,04 (1H, д, J=8,0), 8,70 (1H, с).
(c) (E)-3-[(Хинолин-3-ил)метилиден]пиперидин-4-ола бис(гидроацетат)
Указанное в заголовке соединение синтезировали с выходом 94% в виде бледно-желтого кристалла, используя (E)-3-[(хинолин-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол вместо (E)-3-[(фуран-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-ола, проведением реакции, подобной описанной в примере 7(c).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,46-1,59 (1H, м), 1,92-2,01 (1H, м), 2,62-2,72 (1H, м), 2,93-3,03 (1H, м), 3,11 (1H, д, J=13,5), 3,80 (1H, д, J=13,5), 4,15-4,24 (1H, м), 6,66 (1H, с), 7,60 (1H, т, J=8,0), 7,72 (1H, т, J=8,0), 7,93-8,04 (2H, м), 8,15 (1H, с), 8,78 (1H, с).
(d) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(хинолин-3-ил)метилиден]пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 94% в виде коричневого масла, используя (E)-3-[(хинолин-3-ил)метилиден]пиперидин-4-ола бис(гидроацетат) вместо (E)-3-[(фуран-2-ил)метилиден]пиперидин-4-олацетата, проведением реакции, подобной описанной в примере 7(d).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,42-0,92 (4H, м), 1,80-1,94 (2H, м), 1,99-2,07 (1Н,"м), 2,09-2,18 (1H, м), 2,45-2,53 и 2,56-2,63 (общая 1H, каждый м),3,03 и 3,10 (общая 1H, каждый д, J=12,5), 3,64-3,76 (1H, м), 4,29-4,37 (1H, м), 4,70 и 4,73 (общая 1H, каждый с), 6,76 и 6,78 (общая 1H, каждый с), 6,91-7,04 (2H, м), 7,11-7,19 (1H, м), 7,23-7,36 (1H, м), 7,55 (1H, т, J=8,0), 7,69 (1H, т, J=8,0), 7,82 (1H, т, J=8,0), 8,04-8,10 (2H, м), 8,74 и 8,75 (общая 1H, каждый с).
(e) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(хинолин-3-ил)метилиден]пиперидин
Указанное в заголовке соединение синтезировали с выходом 13% в виде бледно-коричневого масла, используя (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(хинолин-3-ил)метилиден]пиперидин-4-ол вместо (E)-3-[(пиридин-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-ола, проведением реакции, подобной описанной в примере 27(c).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,38-0,94 (4H, м), 1,87-2,09 (2H, м), 2,29-2,40 (1H, м), 2,38 (3H, с), 2,46-2,55 и 2,61-2,70 (общая 1H, каждый м), 2,77-2,87 (1H, м), 3,08 и 3,18 (общая 1H, каждый д, J=12,5), 3,57 и 3,68 (общая 1H, каждый д, J=12,5), 4,52-4,60 (1Н,м), 4,67 и 4,71 (общая 1H, каждый с), 6,77 и 6,79 (общая 1H, каждый с), 6,90-7,07 (2H, м), 7,10-7,36 (2H, м), 7,49-7,58 (1H, м), 7,65-7,85 (2H, м), 7,95-8,10 (2H, м), 8,69 и 8,72 (общая 1H, каждый с);
МС (FAB) m/z : 475 (М+H)+.
(Пример 49) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(хинолин-3-ил)метилиден]-4-сульфанилпиперидина дигидрохлорид (соединение № 1-169)
Указанное в заголовке соединение синтезировали с выходом 65% в виде желтого порошкообразного кристалла, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(хинолин-3-ил)метилиден]пиперидин вместо (E)-4-(ацетилсульфанил)-3-бензилиден-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина, проведением реакции, подобной описанной в примере 2.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,38-0,94 (4H, м), 1,80-1,92 (1H, м), 1,98-2,07 (1H, м), 2,28-2,39 (1H, м), 2,61-2,72 (1H, м), 2,78-2,87 и 2,88-2,95 (общая 1H, каждый м), 3,33 и 3,42 (общая 1H, каждый д, J=12,5), 3,51 и 3,57 (общая 1H, каждый д, J=12,5), 3,90-4,03 (1H, м), 4,70 и 4,72 (общая 1H, каждый с), 6,75 и 6,78 (общая 1H, каждый с), 6,91-7,02 (2H, м), 7,08-7,18 (1H, м), 7,21-7,34 (1H, м), 7,50-7,59 (1Н, м), 7,65-7,72 (1H, м), 7,75-7,85 (1H, м), 7,96-8,10 (2H, м), 8,67-8,75 (1H, м);
МС (FAB) m/z: 433 (М+H)+.
(Пример 50) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(6-метилпиридин-2-ил)метилиден]пиперидин (соединение № 1-66)
(a) (E)-3-[(6-Метилпиридин-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-он
Указанное в заголовке соединение синтезировали с выходом 56% в виде бледно-желтого кристалла, используя 6-метилпиридин-2-карбальдегид вместо бензальдегида, проведением реакции, подобной описанной в примере 1(a).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 2,24 (3H, с), 2,60-2,71 (2H, м), 2,73-2,81 (2H, м), 4,01 (2H, шс), 6,94 (1H, д, J=7,5), 7,11-7,18 (4H, м), 7,19-7,27 (6H, м), 7,36 (1H, с), 7,46-7,56 (7H, м).
(b) (E)-3-[(6-Метилпиридин-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 99% в виде бледно-желтого аморфного твердого вещества, используя (E)-3-[(6-метилпиридин-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1(b).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,75-1,83 (1H, м), 1,87-2,07 (2H, м), 2,11-2,22 (1H, м), 2,19 (3H, с), 2,55-2,89 (2H, м), 4,08-4,20 (1H, м), 6,66 (1H, с), 6,90 (1H, д, J=7,5), 6,97 (1H, д, J=7,5), 7,00-7,15 (9H, м), 7,29-7,40 (6H, м), 7,47 (1H, т, J=7,5).
(c) (E)-3-[(6-Метилпиридин-2-ил)метилиден]пиперидин-4-ола бис(гидроацетат)
Указанное в заголовке соединение синтезировали с выходом 65% в виде желтовато-зеленого кристалла, используя (E)-3-[(6-метилпиридин-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол вместо (E)-3-[(фуран-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-ола, проведением реакции, подобной описанной в примере 7(c).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,42-1,54 (1H, м), 1,88,-1,97 (1H, м), 2,44 (3H, с), 2,58-2,70 (1H, м), 2,90-3,00 (1H, м), 3,12-3,21 (1H, м), 4,05-4,13 (1H, м), 4,52 (1H, д, J=14,0), 6,45 (1H, с), 7,01-7,07 (2H, м), 7,61 (1H, т, J=7,5).
(d) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(6-метилпиридин-2-ил)метилиден]пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 99% в виде красновато-коричневого масла, используя (E)-3-[(6-метилпиридин-2-ил)метилиден]пиперидин-4-ола бис(гидроацетат) вместо (E)-3-[(фуран-2-ил)метилиден]пиперидин-4-олацетата, проведением реакции, подобной описанной в примере 7(d).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,52-0,94 (4H, м), 1,81-1,92 (1H, м), 1,96-2,13 (2H, м), 2,18-2,25 (1H, м), 2,38-2,58 (1H, м), 2,42 (3H, с), 2,84-2,98 (1H, м), 3,25 и 3,38 (общая 1H, каждый д, J=13,0), 4,23-4,31 (1H, м), 4,68 (1H, с), 6,61 (1H, с), 6,91-7,11 (4H, м), 7,21-7,29 (1H, м), 7,33-7,41 (1H, м), 7,44-7,50 (1H, м).
(e) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(6-метилпиридин-2-ил)метилиден]пиперидин
Указанное в заголовке соединение синтезировали с выходом 28% в виде бледно-желтого масла, используя (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(6-метилпиридин-2-ил)метилиден]пиперидин-4-ол вместо (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-2-ил)метилиден]пиперидин-4-ола, проведением реакции, подобной описанной в примере 7(e).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,45-0,99 (4H, м), 1,84-1,95 (1H, м), 2,17-2,38 (2H, м), 2,31 (3H, с), 2,43 (3H, с), 2,57-2,65 (1H, м), 2,73-2,87 (1H, м), 3,16 и 3,29 (общая 1H, каждый д, J=13,0), 4,42 (1H, д, J=13,0), 4,49-4,55 (1H, м), 4,67 и 4,68 (общая 1H, каждый с), 6,60 и 6,62 (общая 1H, каждый с), 6,87-6,97 (2H, м), 6,99-7,13 (2H, м), 7,22-7,30 (1H, м), 7,31-7,50 (2H, м);
МС (FAB) m/z: 439 (М+H)+.
(Пример 51) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(6-метилпиридин-2-ил)метилиден]-4-сульфанилпиперидина дигидрохлорид (соединение № 1-65)
Указанное в заголовке соединение синтезировали с выходом 69% в виде бесцветного аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(6-метилпиридин-2-ил)метилиден]пиперидин вместо (E)-4-(ацетилсульфанил)-3-бензилиден-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина, проведением реакции, подобной описанной в примере 2.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,47-0,95 (4H, м), 1,77-1,90 (1H, м), 2,17-2,38 (2H, м), 2,44 (3H, с), 2,59-2,73 (1H, м), 2,76-2,93 (1H, м), 3,67 и 3,76 (общая 1H, каждый д, J=13,0), 3,88-3,98 (2H, м), 4,68 и 4,71 (общая 1H, каждый с), 6,60 и 6,61 (общая 1H, каждый с), 6,89-7,11 (4H, м), 7,21-7,30 (1H, м), 7,33-7,51 (2H, м);
МС (FAB) m/z: 397 (М+H)+.
(Пример 52) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1-метил-1H-имидазол-2-ил)метилиден]пиперидин (соединение № 2-762)
(a) (E)-3-[(1-Метил-1H-имидазол-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-он
Указанное в заголовке соединение синтезировали с выходом 51% в виде бледно-желтого аморфного твердого вещества, используя 1-метил-1H-имидазол-2-карбальдегид вместо бензальдегида, проведением реакции, подобной описанной в примере 1(a).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 2,63 (2H, шс), 2,76 (2H, т, J=6,0), 3,73 (3H, с), 3,93 (2H, шс), 6,87 (1H, с), 7,02 (1H, с), 7,12-7,17 (3H, м), 7,22-7,28 (6H, м), 7,30 (1H, с), 7,50-7,57 (6H, м).
(b) (E)-3-[(1-Метил-1H-имидазол-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 78% в виде бледно-желтого аморфного твердого вещества, используя (E)-3-[(1-метил-1H-имидазол-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1(b).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,83-1,94 (1H, м), 2,07-2,24 (3H, м), 2,87-2,98 (1H, м), 3,68 (3H, с), 4,00-4,06 (1H, м), 4,13-4,25 (1Н, м), 6,34 (1H, с), 6,80 (1H, с), 6,82 (1H, с), 7,02-7,16 (9H, м), 7,29-7,39 (6H, м).
(c) (E)-4-(Ацетилсульфанил)-3-[(1-метил-1H-имидазол-2-ил)метилиден]пиперидина гидротрифторацетат
К раствору (E)-3-[(1-метил-1H-имидазол-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-ола (4,50 г) в дихлорметане (100 мл) добавляли метансульфонилхлорид (0,90 мл) и триэтиламин (1,60 мл) при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь упаривали в вакууме. К раствору остатка в диметилсульфоксиде (100 мл) добавляли тиоацетат калия (5,90 г) при комнатной температуре и полученную смесь перемешивали при 50°C в течение 30 минут. После перемешивания к реакционной смеси добавляли воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом натрия. Выпаривали в вакууме растворитель и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из метанола и дихлорметана (1:19), с получением (E)-4-(ацетилсульфанил)-3-[(1-метил-1H-имидазол-2-ил)метилиден]-1-(трифенилметил)пиперидина (1,00 г, выход: 19%) в виде красновато-коричневого аморфного твердого вещества.
К раствору полученного, как описано выше, соединения (1,00 г) в дихлорметане (20 мл) добавляли трифторуксусную кислоту (0,31 мл) при охлаждении льдом и полученную смесь перемешивали при той же самой температуре в течение 1,5 часов. Реакционную смесь упаривали в вакууме и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из метанола и дихлорметана (1:19-1:4), с получением указанного в заголовке соединения (0,44 г, выход: 45%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 2,10-2,17 (1H, м), 2,38 (3H, с), 2,55-2,64 (1H, м), 3,17-3,25 (1H, м), 3,38-3,47 (1H, м), 3,74 (3H, с), 4,00 (1H, д, J=14,5), 4,20 (1H, д, J=14,5), 4,60 (1H, м), 6,59 (1H, с), 7,14 (1H, с), 7,40 (1H, с).
(d) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1-метил-1H-имидазол-2-ил)метилиден]пиперидин
Указанное в заголовке соединение синтезировали с выходом 12% в виде бледно-оранжевого аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-3-[(1-метил-1H-имидазол-2-ил)метилиден]пиперидина гидротрифторацетат вместо (E)-4-(ацетилсульфанил)-3-бензилиденпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 1(d).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,67-0,82 (2H, м), 0,86-1,05 (2H, м), 1,83-1,91 (1H, м), 2,16-2,26 (2H, м), 2,28 и 2,30 (общая 3H, каждый с), 2,31-2,36 и 2,65-2,72 (общая 1H, каждый м), 2,76-2,82 и 2,84-2,90 (общая 1H, каждый м), 3,20 и 3,37 (общая 1H, каждый д, J=13,5), 3,60 и 3,61 (общая 3H, каждый с), 4,47-4,55 (2H, м), 4,71 и 4,75 (общая 1H, каждый с), 6,35 и 6,36 (общая 1H, каждый с), 6,76 и 6,78 (общая 1H, каждый с), 6,90 и 6,97 (общая 1H, каждый с), 7,01-7,15 (2H, м), 7,24-7,31 (1H, м), 7,37-7,49 (1H, м).
(Пример 53) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1-метил-1H-имидазол-2-ил)метилиден]-4-сульфанилпиперидина гидротрифторацетат (соединение № 2-761)
Указанное в заголовке соединение синтезировали с выходом 9% в виде бледно-желтого аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1-метил-1H-имидазол-2-ил)метилиден]пиперидин вместо (E)-4-(ацетилсульфанил)-3-бензилиден-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина, проведением реакции, подобной описанной в примере 2.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,66-0,80 (2H, м), 0,87-1,02 (2H, м), 1,76-1,87 (1H, м), 2,15-2,22 (1H, м), 2,24-2,34 (1H, м), 2,52-2,59 и 2,95-3,02 (общая 1H, каждый м), 2,68-2,80 (1H, м), 3,61 (3H, с), 3,76 и 3,86 (общая 1H, каждый д, J=13,5), 3,80-3,85 и 3,91-3,95 (общая 1H, каждый м), 4,10 и 4,15 (общая 1H, каждый д, J=13,5), 4,74 и 4,76 (общая 1H, каждый с), 6,33 и 6,42 (общая 1H, каждый с), 6,77 и 6,78 (общая 1H, каждый с), 6,92 и 6,94 (общая 1H, каждый с), 7,02-7,08 (1H, м), 7,09-7,15 (1H, м), 7,25-7,31 (1H, м), 7,38-7,45 (1H, м);
ИК (Жидкостная пленка, см-1): 2532, 1712, 1672.
(Пример 54) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1-метил-1H-пиразол-5-ил)метилиден]пиперидина гидрохлорид (соединение № 2-338)
(a) (E)-3-[(1-Метил-1H-пиразол-5-ил)метилиден]-1-(трифенилметил)пиперидин-4-он
Указанное в заголовке соединение синтезировали с выходом 76% в виде бледно-желтого аморфного твердого вещества, используя 1-метил-1H-пиразол-5-карбальдегид вместо бензальдегида, проведением реакции, подобной описанной в примере 1(a).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 2,69 (2H, шс), 2,78 (2H, т, J=6,0), 3,39 (2H, шс), 3,96 (3H, с), 5,93 (1H, с), 7,15-7,21 (3H, м), 7,24-7,31 (6H, м), 7,39 (1H, с), 7,45 (1H, с), 7,48-7,54 (6H, м).
(b) (E)-3-[(1-Метил-1H-пиразол-5-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 99% в виде бледно-желтого аморфного твердого вещества, используя (E)-3-[(1-метил-1H-пиразол-5-ил)метилиден]-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1(b).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,87-2,01 (2H, м), 2,12-2,19 (1H, м), 2,28-2,40 (1H, м), 2,85-2,93 (1H, м), 3,67-3,77 (1H, м), 3,91 (3H, с), 4,12-4,19 (1H, м), 5,86 (1H, с), 6,43 (1H, с), 7,07-7,21 (10H, м)r 7,31-7,40 (6H, м).
(c) (E)-4-(Ацетилсульфанил)-3-[(1-метил-1H-пиразол-5-ил)метилиден]пиперидина гидротрифторацетат
Указанное в заголовке соединение синтезировали с выходом 64% в виде пурпурного аморфного твердого вещества, используя (E)-3-[(1-метил-1H-пиразол-5-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол вместо (E)-3-[(1-метил-1H-имидазол-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-ола, последовательным проведением реакций, подобных описанным в примере 52(c).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 2,04-2,12 (1H, м), 2,39 (3H, с), 2,44-2,54 (1Н, м), 3,07-3,16 (1H, м), 3,21-3,28 (1H, м), 3,68 (1H, д, J=14,5), 3,80 (3H, с), 4,18 (1H, д, J=14,5), 4,62 (1H, м), 6,10 (1H, с), 6,68 (1H, с), 7,40 (1H, с).
(d) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1-метил-1H-пиразол-5-ил)метилиден]пиперидина гидрохлорид
Указанное в заголовке соединение синтезировали с выходом 39% в виде бледно-желтого аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-3-[(1-метил-1H-пиразол-5-ил)метилиден]пиперидина гидротрифторацетат вместо (E)-4-(ацетилсульфанил)-3-бензилиденпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 1(d).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,65-0,85 (2H, м), 0,90-1,04 (2H, м), 1,83-1,95 (1H, м), 2,06-2,14 (1H, м), 2,23-2,37 (1H, м), 2,32 (3H, с), 2,41-2,50 и 2,55-2,64 (общая 1H, каждый м), 2,76-2,89 (1H, м), 3,00 и 3,11 (общая 1H, каждый д, J=13,0), 3,62 и 3,72 (общая 1H, каждый д, J=13,0), 3,78 и 3,80 (общая 3H, каждый с), 4,47-4,54 (1H, м), 4,71 и 4,72 (общая 1H, каждый с), 5,94 и 6,04 (общая 1H, каждый д, J=2,0), 6,39 и 6,40 (общая 1H, каждый с), 7,05-7,18 (2H, м), 7,28-7,38 (3H, м);
ИК (KBr, см-1): 1700, 1494.
(Пример 55) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1-метил-1H-пиразол-5-ил)метилиден]-4-сульфанилпиперидина гидрохлорид (соединение № 2-337)
Указанное в заголовке соединение синтезировали с выходом 21% в виде бесцветного аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1-метил-1H-пиразол-5-ил)метилиден]пиперидина гидрохлорид вместо (E)-4-(ацетилсульфанил)-3-бензилиден-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина, проведением реакции, подобной описанной в примере 2.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,66-0,85 (2H, м), 0,89-1,04 (2H, м), 1,78-1,87 (1H, м), 2,04-2,12 (1H, м), 2,25-2,35 (1H, м), 2,62-2,73 (1Н, м), 2,77-2,86 и 2,87-2,95 (общая 1H, каждый м), 3,30-3,42 (1H, м), 3,47-3,58 (1H, м), 3,80 и 3,81 (общая 3H, каждый с), 3,84-3,93 (1H, м), 4,73 и 4,75 (общая 1H, каждый с), 5,96 и 6,03 (общая 1H, каждый с),6,37 и 6,39 (общая 1H, каждый с), 7,04-7,18 (2H, м), 7,28-7,39 (3H, м);
ИК (KBr, см-1): 2536, 1710.
(Пример 56) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,3-диметил-1H-пиразол-5-ил)метилиден]пиперидина гидрохлорид (соединение № 1-178)
(a) (E)-3-[(1,3-Диметил-1H-пиразол-5-ил)метилиден]-1-(трифенилметил)пиперидин-4-он
Указанное в заголовке соединение синтезировали с выходом 78% в виде желтого аморфного твердого вещества, используя 1,3-диметил-1H-пиразол-5-карбальдегид вместо бензальдегида, проведением реакции, подобной описанной в примере 1(a).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 2,17 (3H, с), 2,68 (2H, шс), 2,76 (2H, т, J=6,0), 3,35 (2H, шс), 3,88 (3H, с), 5,68 (1H, с), 7,16-7,22 (3H, м), 7,25-7,32 (6H, м), 7,38 (1H, с), 7,47-7,55 (6H, м).
(b) (E)-3-[(1,3-Диметил-1H-пиразол-5-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 99% в виде желтого аморфного твердого вещества, используя (E)-3-[(1,3-диметил-1H-пиразол-5-ил)метилиден]-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1(b).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,85-1,97 (2H, м), 2,10 (3H, с), 2,10-2,18 (1H, м), 2,28-2,40 (1H, м), 2,82-2,93 (1H, м), 3,66-3,79 (1H, м), 3,82 (3H, с), 4,08-4,16 (1H, м), 5,64 (1H, с), 6,38 (1H, с), 7,09-7,24 (9H, м), 7,33-7,44 (6H, м).
(c) (E)-4-(Ацетилсульфанил)-3-[(1,3-диметил-1H-пиразол-5-ил)метилиден]пиперидина гидротрифторацетат
Указанное в заголовке соединение синтезировали с выходом 44% в виде коричневого аморфного твердого вещества, используя (E)-3-[(1,3-диметил-1H-пиразол-5-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол вместо (E)-3-[(1-метил-1H-имидазол-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-ола, последовательным проведением реакций, подобных описанным в примере 52(c).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 2,02-2,11 (1H, м), 2,20 (3H, с), 2,38 (3H, с), 2,44-2,54 (1H, м), 3,07-3,16 (1H, м), 3,20-3,27 (1H, м), 3,68 (1H, д, J=14,0), 3,72 (3H, с), 4,20 (1H, д, J=14,0), 4,61 (1H, м), 5,88 (1H, с), 6,64 (1H, с).
(d) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,3-диметил-1H-пиразол-5-ил)метилиден]пиперидина гидрохлорид
Указанное в заголовке соединение синтезировали с выходом 28% в виде желтого аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-3-[(1,3-диметил-1H-пиразол-5-ил)метилиден]пиперидина гидротрифторацетат вместо (E)-4-(ацетилсульфанил)-3-бензилиденпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 1(d).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,66-0,86 (2H, м), 0,90-1,04 (2H, м), 1,83-1,94 (1H, м), 2,11-2,18 (1H, м), 2,13 и 2,18 (общая 3H, каждый с), 2,24-2,34 (1H, м), 2,32 (3H, с), 2,45-2,53 и 2,54-2,60 (общая 1H, каждый м), 2,77-2,83 и 2,85-2,91 (общая 1H, каждый м), 2,97 и 3,13 (общая 1H, каждый д, J=13,0), 3,60 и 3,70 (общая 1H, каждый д, J=13,0), 3,69 и 3,72 (общая 3H, каждый с), 4,46-4,52 (1H, м), 4,70 (1H, с), 5,61 и 5,75 (общая 1H, каждый с), 6,34 и 6,35 (общая 1H, каждый с), 7,05-7,18 (2H, м), 7,28-7,41 (2H, м);
ИК (KBr, см-1): 1701, 1494.
(Пример 57) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,3-диметил-1H-пиразол-5-ил)метилиден]-4-сульфанилпиперидина гидрохлорид (соединение № 1-177)
Указанное в заголовке соединение синтезировали с выходом 50% в виде бледно-зеленого аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,3-диметил-1H-пиразол-5-ил)метилиден]пиперидина гидрохлорид вместо (E)-4-(ацетилсульфанил)-3-бензилиден-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина, проведением реакции, подобной описанной в примере 2.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,66-0,86 (2H, м), 0,89-1,03 (2H, м), 1,76-1,87 (1H, м), 2,08-2,20 (1H, м), 2,15 и 2,17 (общая 3H, каждый с), 2,25-2,35 (1H, м), 2,61-2,73 (1H, м), 2,81-2,92 (1H, м), 3,32 и 3,37 (общая 1H, каждый д, J=13,0), 3,47 и 3,54 (общая 1H, каждый д, J=13,0), 3,71 и 3,72 (общая 3H, каждый с), 3,84-3,92 (1H, м), 4,71 и 4,72 (общая 1H, каждый с), 5,65 и 5,73 (общая 1H, каждый с), 6,32 (1H, с), 7,04-7,18 (2H, м), 7,27-7,42 (2H, м);
ИК (KBr, см-1): 2541, 1710.
(Пример 58) (E)-4-(Ацетилсульфанил)-1-[1-(2-фторфенил)-2-метокси-2-оксоэтил]-3-{[1H-пиразол-3(5)-ил]метилиден}пиперидина дигидрохлорид (соединение № 3-10)
Указанное в заголовке соединение синтезировали с выходом 82% в виде бледно-коричневого аморфного твердого вещества, используя метил бром(2-фторфенил)ацетат вместо 2-бром-2-(2-фторфенил)-1-циклопропилэтанона, последовательным проведением реакций, подобных описанным в примере 11(d).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,83-1,91 (1H, м), 2,16-2,28 (1H, м), 2,30 и 2,33 (общая 3H, каждый с), 2,53-3,02 (3H, м), 3,35 и 3,95 (общая 1H, каждый д, J=13,0), 3,73 (3H, с), 4,40 и 4,46 (общая 1H, каждый т, J=4,5), 4,64 и 4,72 (общая 1H, каждый с), 6,13 и 6,15 (общая 1H, каждый с), 6,48 (1H, с), 7,04-7,18 (2H, м), 7,28-7,52 (3H, м);
ИК (KBr, см-1): 1697, 1495.
(Пример 59) (E)-1-[1-(2-Фторфенил)-2-метокси-2-оксоэтил]-3-{[1H-пиразол-3(5)-ил]метилиден}-4-сульфанилпиперидина бис(гидротрифторацетат) (соединение № 3-9)
Указанное в заголовке соединение синтезировали с выходом 59% в виде бесцветного масла, используя (E)-4-(ацетилсульфанил)-1-[1-(2-фторфенил)-2-метокси-2-оксоэтил]-3-{[1H-пиразол-3(5)-ил]метилиден}пиперидина дигидрохлорид вместо (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-2-ил]метилиден}пиперидина, проведением реакции, подобной описанной в примере 8.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,75-1,85 (1H, м), 2,19-2,34 (1H, м), 2,57-2,69 (1H, м), 2,81-2,91 (1H, м), 3,30 и 3,49 (общая 1H, каждый д, J=12,5), 3,59-3,90 (2H, м), 3,72 и 3,73 (общая 3H, каждый с), 4,70 (1H, с), 6,13 и 6,17 (общая 1H, каждый д, J=2,0), 6,47 и 6,52 (общая 1H, каждый с), 7,05-7,45 (4H, м), 7,50 и 7,52 (общая 1H, каждый д, J=2,0);
ИК (Тонкая пленка, см-1): 2560, 1670, 1496.
(Пример 60) (E)-4-(Ацетилсульфанил)-1-[1-(2-хлорфенил)-2-метокси-2-оксоэтил]-3-{[1H-пиразол-3(5)-ил]метилиден}пиперидина дигидрохлорид (соединение № 3-14)
Указанное в заголовке соединение синтезировали с выходом 18% в виде желтого аморфного твердого вещества, используя метил бром(2-хлорфенил)ацетат вместо 2-бром-2-(2-фторфенил)-1-циклопропилэтанона, последовательным проведением реакций, подобных описанным в примере 11(d).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,83-1,90 (1H, м), 2,17-2,32 (1H, м), 2,32 и 2,34 (общая 3H, каждый с), 2,54-2,74 (1H, м), 2,82-2,90 и 3,18-3,30 (общая 1H, каждый м), 3,62-3,68 (1H, м), 3,69 и 3,71 (общая 3H, каждый с), 3,87-3,94 (1H, м), 4,44-4,49 (1H, м), 4,79 (1H, с), 6,04 и 6,14 (общая 1H, каждый с), 6,50 (1H, с), 7,23-7,29 (2H, м), 7,36-7,43 (1H, м), 7,46 и 7,49 (общая 1H, каждый с), 7,52-7,62 (1H, м);
ИК (KBr, см-1): 1751, 1437.
(Пример 61) (E)-1-[1-(2-Хлорфенил)-2-метокси-2-оксоэтил]-3-{[1H-пиразол-3(5)-ил]метилиден}-4-сульфанилпиперидина дигидрохлорид (соединение № 3-13)
В раствор (E)-4-(ацетилсульфанил)-1-[1-(2-хлорфенил)-2-метокси-2-оксоэтил]-3-{[1H-пиразол-3(5)-ил]метилиден}пиперидина дигидрохлорида (50 мг) в метаноле (10 мл) барботировали хлороводород при охлаждении льдом и полученную смесь перемешивали в герметически закрытом состоянии при комнатной температуре в течение 2,5 часов. Реакционную смесь упаривали в вакууме и остаток очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, подвижная фаза: 30% ацетонитрил/вода (0,2% трифторуксусная кислота) с получением указанного в заголовке соединения (45 мг, выход: 62%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,72-1,83 (1H, м), 2,18-2,32 (1H, м), 2,54-2,61 и 2,63-2,71 (общая 1H, каждый м), 2,81-2,91 (1H, м), 3,40-3,58 (1H, м), 3,63-3,69 (1H, м), 3,70 и 3,71 (общая 3H, каждый с), 3,81-3,90 (1H, м), 4,86 и 4,87 (общая 1H, каждый с), 6,08 и 6,13 (общая 1H, каждый с), 6,47 и 6,51 (общая 1H, каждый с), 7,23-7,28 (2H, м), 7,37-7,43 (1H, м), 7,48 и 7,49 (общая 1H, каждый с), 7,54-7,59 (1H, м);
ИК (Тонкая пленка, см-1): 2567, 1753.
(Пример 62) (E)-4-(Ацетилсульфанил)-1-[1-(2-фторфенил)-2-метокси-2-оксоэтил]-3-[(1,3-тиазол-2-ил)метилиден]пиперидин (соединение № 3-12)
Указанное в заголовке соединение синтезировали с выходом 48% в виде бесцветного масла, используя метил бром(2-фторфенил)ацетат вместо 2-бром-2-(2-фторфенил)-1-циклопропилэтанона, проведением реакции, подобной описанной в примере 15 (d).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,85-1,94 (1H, м), 2,26-2,35 (1H, м), 2,32 (3H, с), 2,52-2,91 (2H, м), 3,43-3,49 (1H, м), 3,68 и 3,71 (общая 3H, каждый с), 4,46-4,61 (2H, м), 4,68 и 4,69 (общая 1H, каждый a), 6,73 (1H, с), 7,00-7,16 (2H, м), 7,20-7,34 (2H, м), 7,47-7,55 (1H, м), 7,66 и 7,69 (общая 1H, каждый д, J=3,5);
ИК (Жидкостная пленка, см-1): 1693, 1489.
(Пример 63) (E)-1-[1-(2-Фторфенил)-2-метокси-2-оксоэтил]-4-сульфанил-3-[(1,3-тиазол-2-ил)метилиден]пиперидин (соединение № 3-11)
Указанное в заголовке соединение синтезировали с выходом 32% в виде бесцветного масла, используя (E)-4-(ацетилсульфанил)-1-[1-(2-фторфенил)-2-метокси-2-оксоэтил]-3-[(1,3-тиазол-2-ил)метилиден]пиперидин вместо (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-2-ил)метилиден]пиперидина, проведением реакции, подобной описанной в примере 8.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,79-1,88 (1H, м), 2,26-2,36 (1H, м), 2,66-2,79 (1H, м), 2,83-3,03 (1H, м), 3,69 и 3,70 (общая 3H, каждый с), 3,86-3,93 (1H, м), 3,99 (1H, д, J=13,0), 4,08 (1H, д, J=13,0), 4,70 (1H, с), 6,72 и 6,73 (общая 1H, каждый с), 7,00-7,15 (2H, м), 7,20-7,33 (2H, м), 7,48-7,55 (1H, м), 7,67 и 7,69 (общая 1H, каждый д, J=3,5);
ИК (KBr, см-1): 2539, 1675, 1495.
(Пример 64) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-(изобутирилсульфанил)-3-[(1,2,3-тиазол-4-ил)метилиден]пиперидина гидрохлорид (соединение № 1-187)
К раствору (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанил-3-[(1,2,3-тиазол-4-ил)метилиден]пиперидина гидрохлорида (110 мг) в дихлорметане (3 мл) добавляли изобутирилхлорид (0,03 мл) и триэтиламин (0,08 мл) при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в течение 15 минут. После перемешивания к реакционной смеси добавляли воду и полученную реакционную смесь экстрагировали дихлорметаном. Экстракт промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом магния. Выпаривали в вакууме растворитель и к раствору остатка в дихлорметане (3 мл) добавляли 4 н. раствор хлороводорода в диоксане (0,03 мл). Реакционную смесь концентрировали с получением указанного в заголовке соединения (120 мг, выход: 93%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,65-0,72 (2H, м), 0,90-1,03 (2H, м), 1,16-1,21 (6H, м), 1,87-1,96 (1H, м), 2,0 6-2,13 (1H, м), 2,26-2,38 (1H, м), 2,51-2,57 и 2,63-2,75 (общая 2H, каждый м), 2,76-2,87 (1H, м), 3,23 и 3,36 (общая 1H, каждый д, J=13,0), 4,05 и 4,09 (общая 1Н, каждый д, J=13,0), 4,51-4,55 (1H, м), 4,76 и 4,79 (общая 1H, каждый с), 6,91 (1H, с), 7,04-7,17 (2H, м), 7,28-7,40 (2H, м), 8,41 и 8,45 (общая 1H, каждый с);
ИК (KBr, см-1): 1713, 1495.
(Пример 65) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-(метоксиацетилсульфанил)-3-[(1,2,3-тиадиазол-4-ил)метилиден]пиперидина гидрохлорид (соединение № 1-188)
Указанное в заголовке соединение синтезировали с выходом 93% в виде бесцветного аморфного твердого вещества, используя метоксиацетилхлорид вместо изобутирилхлорида, проведением реакции, подобной описанной в примере 64.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,65-0,85 (2H, м), 0,90-1,04 (2H, м), 1,88-1,99 (1H, м), 2,04-2,12 (1H, м), 2,29-2,44 (1H, м), 2,50-2,58 и 2,64-2,72 (общая 1H, каждый м), 2,78-2,91 (1H, м), 3,21 и 3,36 (общая 1H, каждый д, J=13,0), 4,07 и 4,12 (общая 1H, каждый д, J=13,0), 3,48 (3H, с), 4,09 (2H, с), 4,59-4,64 (1H, м), 4,77 и 4,81 (общая 1H, каждый с), 6,94 (1H, с), 7,04-7,19 (2H, м), 7,28-7,41 (2H, м), 8,45 и 8,47 (общая 1H, каждый с);
ИК (KBr, см-1): 1709, 1495.
(Пример 66) (E)-4-(Аминоацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,2,3-тиадиазол-4-ил)метилиден]пиперидина дигидрохлорид (соединение № 1-189)
К раствору (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанил-3-[(1,2,3-тиадиазол-4-ил)метилиден]пиперидина гидрохлорида (100 мг) и N-(трет-бутоксикарбонил)глицина (50 мг) в N,N-диметилформамиде (5 мл) добавляли 1-гидроксибензотриазол (70 мг) и 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (100 мг) при комнатной температуре при перемешивании и полученную смесь перемешивали при комнатной температуре в течение 30 минут. После перемешивания к реакционной смеси добавляли триэтиламин (0,11 мл) и полученную смесь дополнительно перемешивали при комнатной температуре в течение 50 минут. После перемешивания к реакционной смеси добавляли воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Удаляли растворитель в вакууме с получением промежуточного продукта (140 мг) в виде желтого масла.
К полученному продукту (140 мг) добавляли при охлаждении льдом 4 н. раствор хлороводорода в диоксане (5 мл) и реакционную смесь перемешивали при комнатной температуре в течение 30 минут. После перемешивания реакционную смесь упаривали в вакууме и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента метанол и дихлорметан (1:19-1:1), с получением указанного в заголовке соединения (120 мг, выход: 89%) в виде желтого аморфного твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,65-0,85 (2H, м), 0,91-1,03 (2H, м), 1,88-1,98 (1H, м), 2,04-2,11 (1H, м), 2,29-2,42 (1H, м), 2,49-2,56 и 2,63-2,70 (общая 1H, каждый м), 2,78-2,89 (1H, м), 3,20 и 3,35 (общая 1H, каждый д, J=13,0), 4,07 и 4,12 (общая 1H, каждый д, J=13,0), 3,60 (2H, с), 4,58-4,63 (1H, м), 4,77 и 4,81 (общая 1H, каждый с), 6,92 и 6,93 (общая 1H, каждый с), 7,04-7,17 (2H, м), 7,28-7,39 (2H, м), 8,45 и 8,46 (общая 1H, каждый с);
ИК (KBr, см-1): 1705, 1494.
(Пример 67) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-(N,N-диметиламино)ацетилсульфанил-3-[(1,2,3-тиадиазол-4-ил)метилиден]пиперидина дигидрохлорид (соединение № 1-190)
Указанное в заголовке соединение синтезировали с выходом 78% в виде желтого аморфного твердого вещества, используя N,N-диметиламиноацетилхлорида гидрохлорид вместо изобутирилхлорида, проведением реакции, подобной описанной в примере 64.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,64-0,85 (2H, м), 0,89-1,04 (2H, м), 1,86-1,97 (1H, м), 2,04-2,13 (1H, м), 2,28-2,42 (1H, м), 2,35 (3H, с), 2,36 (3H, с), 2,49-2,58 и 2,63-2,71 (общая 1H, каждый м), 2,76-2,89 (1H, м), 3,20 и 3,35 (общая 1H, каждый д, J=13,O), 3,23 (2H, с), 4,06 и 4,11 (общая 1H, каждый д, J=13,0), 4,52-4,57 (1H, м), 4,76 и 4,80 (общая 1H, каждый с), 6,93 (1H, с), 7,03-7,17 (2H, м), 7,28-7,40 (2H, м), 8,44 и 8,46 (общая 1H, каждый с);
ИК (KBr, см-1): 1702, 1494.
(Пример 68) (E)-4-[(R)-2-Ацетиламино-2-карбоксиэтилдисульфанил]-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,2,3-тиадиазол-4-ил)метилиден]пиперидина гидрохлорид (соединение № 1-191)
К раствору (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанил-3-[(1,2,3-тиадиазол-4-ил)метилиден]пиперидина гидрохлорида (100 мг) и N-ацетил-L-цистеина (840 мг) в тетрагидрофуране (10 мл) добавляли по каплям при перемешивании и охлаждении льдом иодид в тетрагидрофуране, пока в реакционной смеси не оставался цвет иодида, и полученную смесь перемешивали при комнатной температуре в течение 5 минут. После перемешивания избыточный иодид удаляли хроматографией на колонке с силикагелем, используя тетрагидрофуран в качестве элюента. Удаляли в вакууме растворитель и остаток очищали, используя препаративную ВЭЖХ [YMC-Pack ODS-A; YMC, подвижная фаза: 30% ацетонитрил/вода (0,2% водный раствор хлороводородной кислоты)] с получением указанного в заголовке соединения (30 мг, выход: 19%) в виде желтого аморфного твердого вещества.
1H ЯМР (500 МГц, ДМСО-d6) δ м.д.: 0,80-1,20 (4H, м), 1,78-2,29 (3H, м), 1,85 (3H, с), 2,44-3,17 (4H, м), 3,28-3,81 (3H, м), 4,10-4,21 (1H, м), 4,49 и 4,50 (общая 1H, каждый с), 7,03 и 7,08 (общая 1H, каждый с), 7,29-7,73 (4H, м), 8,37 (1H, с);
ИК (KBr, см-1): 1713, 1494.
(Пример 69) (E)-4-[(3-Карбоксипропаноил)сульфанил]-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,2,3-тиадиазол-4-ил)метилиден]пиперидина гидрохлорид (соединение № 1-192)
К раствору (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанил-3-[(1,2,3-тиадиазол-4-ил)метилиден]пиперидина гидрохлорид (100 мг) в ацетоне (10 мл) добавляли безводную янтарную кислоту (26 мг) и иодид калия (45 мг) при перемешивании при комнатной температуре и полученную смесь перемешивали при комнатной температуре в течение 2 часов. После перемешивания еще добавляли безводную янтарную кислоту (130 мг) и иодид калия (180 мг) и полученную смесь дополнительно перемешивали при комнатной температуре в течение 1,5 часов. После упаривания реакционной смеси в вакууме остаток очищали хроматографией на колонке с силикагелем, используя смесь метанола и дихлорметана (1:50) в качестве элюента. Полученное аморфное твердое вещество растворяли в 4 н. растворе хлороводорода в диоксане (2 мл) и полученную смесь упаривали в вакууме с получением указанного в заголовке соединения (40 мг, выход: 29%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,66-0,84 (2H, м), 0,91-1,04 (2H, м), 1,89-1,98 (1H, м), 2,04-2,10 (1H, м), 2,27-2,39 (1H, м), 2,51-2,58 и 2,77-2,86 (общая 1H, каждый м), 2,62-2,73 (4H, м), 2,87-2,92 (1H, м), 3,25 и 3,40 (общая 1H, каждый д, J=13,5), 4,03 и 4,04 (общая 1H, каждый д, J=13,5), 4,56-4,61 (1H, м), 4,78 и 4,81 (общая 1H, каждый с), 6,91 (1H, с), 7,04-7,16 (2H, м), 7,28-7,39 (2H, м), 8,45 и 8,47 (общая 1H, каждый с);
ИК (KBr, см-1): 1709, 1494.
(Пример 70) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1,2,3-тиадиазол-4-ил)метилиден]-4-(тозилсульфанил)пиперидина гидрохлорид (соединение № 1-193)
Указанное в заголовке соединение синтезировали с выходом 33% в виде бесцветного аморфного твердого вещества, используя п-толуолсульфонилбромид вместо изобутирилхлорида, проведением реакции, подобной описанной в примере 64.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,63-0,83 (2H, м), 0,87-1,01 (2H, м), 1,97-2,13 (2H, м), 2,27-2,41 (1H, м), 2,23 (3H, с), 2,43-2,52 и 2,59-2,67 (общая 1H, каждый м), 2,70-2,81 (1H, м), 3,07 и 3,21 (общая 1H, каждый д, J=13,5),3,94 и 4,00 (общая 1H, каждый д, J=13,5), 4,35-4,42 (1H, м), 4,70 и 4,77 (общая 1H, каждый с), 6,58 и 6,59 (общая 1H, каждый с), 7,02-7,16 (2H, м), 7,20 (2H, д, J=8,0), 7,22-7,37 (2H, м), 7,76 (2H, д, J=8,0), 8,30 и 8,33 (общая 1H, каждый с);
ИК (KBr, см-1): 1712, 1494.
(Пример 71) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1-метил-1H-пиразол-3-ил)метилиден]пиперидин (соединение № 2-2)
(a) (E)-3-[(1-Метил-1H-пиразол-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-он
Указанное в заголовке соединение синтезировали с выходом 22% в виде бледно-желтого аморфного твердого вещества, используя 1-метил-1H-пиразол-3-карбальдегид вместо бензальдегида, проведением реакции, подобной описанной в примере 1 (a).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 2,66 (2H, шс), 2,74 (2H, т, J=6,0), 3,60 (2H, шс), 3,80 (3H, с), 6,12 (1H, д, J=2,0), 7,14-7,19 (3H, м), 7,23-7,29 (7H, м), 7,45 (1H, с), 7,50-7,55 (6H, м).
(b) (E)-3-[(1-Метил-1H-пиразол-3-ил)метилиден]-1-трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 99% в виде бесцветного аморфного твердого вещества, используя (E)-3-[(1-метил-1H-пиразол-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1 (b).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,83-1,94 (2H, м), 2,01-2,18 (2H, м), 2,61-2,80 (1H, м), 3,69 (3H, с), 3,71-3,98 (1H, м), 4,12-4,19 (1H, м), 6,04 (1H, д, J=2,0), 6,48 (1H, с), 7,05-7,21 (9H, м), 7,21 (1H, д, J=2,0), 7,35-7,49 (6H, м).
(c) (E)-4-(Ацетилсульфанил)-3-[(1-метил-1H-пиразол-3-ил)метилиден]пиперидина гидротрифторацетат
Указанное в заголовке соединение синтезировали с выходом 29% в виде бесцветного аморфного твердого вещества, используя (E)-3-[(1-метил-1H-пиразол-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-ол вместо (E)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола, последовательным проведением реакций, подобных описанным в примере 21 (c).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 2,01-2,09 (1H, м), 2,35 (3H, с), 2,41-2,51 (1H, м), 3,14-3,23 (1H, м), 3,32-3,39 (1H, м), 3,79 (1H, д, J=14,5), 3,85 (3H, с), 4,59 (1H, м), 5,14 (1H, д, J=14,5), 6,19 (1H, д, J=2,0), 6,62 (1H, с), 7,27 (1H, м).
(d) E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1-метил-1H-пиразол-3-ил)метилиден]пиперидин
Указанное в заголовке соединение синтезировали с выходом 32% в виде желтого аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-3-[(1-метил-1H-пиразол-3-ил)метилиден]пиперидина гидротрифторацетат вместо (E)-4-(ацетилсульфанил)-3-бензилиденпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 1 (d).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,60-0,81 (2H, м), 0,84-1,02 (2H, м), 1,82-1,92 (1H, м), 2,21-2,36 (2H, м), 2,30 (3H, с), 2,43-2,50 и 2,56-2,62 (общая 1H, каждый м), 2,71-2,78 и 2,80-2,86 (общая 1H, каждый м), 3,07 и 3,23 (общая 1H, каждый д, J=13,0), 3,76 и 3,83 (общая 3H, каждый с), 4,15 и 4,17 (общая 1H, каждый д, J=13,0), 4,50 (1H, м), 4,67 и 4,69 (общая 1H, каждый с), 6,04 и 6,13 (общая 1H, каждый д, J=2,0), 6,47 и 6,49 (общая 1H, каждый с), 7,03-7,15 (2H, м), 7,17-7,32 (2H, м), 7,40-7,47 (1H, м).
(Пример 72) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1-метил-1H-пиразол-3-ил)метилиден]-4-сульфанилпиперидина гидрохлорид (соединение № 2-1)
Указанное в заголовке соединение синтезировали с выходом 12% в виде бесцветного аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1-метил-1H-пиразол-3-ил)метилиден]пиперидин вместо (E)-4-(ацетилсульфанил)-3-бензилиден-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина, проведением реакции, подобной описанной в примере 2.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,61-0,80 (2H, м), 0,85-1,02 (2H, м), 1,75-1,84 (1H, м), 2,22-2,36 (2H, м), 2,59-2,72 (1H, м), 2,73-2,80 и 2,83-2,91 (общая 1H, каждый м), 3,55 и 3,67 (общая 1H, каждый д, J=13,0),3,80 и 3,85 (общая 1H, каждый д, J=13,0),3,78 и 3,83 (общая 3H, каждый с), 3,92-3,97 (1H, м), 4,71 и 4,74 (общая 1H, каждый с), 6,04 и 6,13 (общая 1H, каждый д, J=2,0), 6,44 и 6,46 (общая 1H, каждый с), 7,03-7,15 (2H, м), 7,21 и 7,24 (общая 1H, каждый м), 7,26-7,32 (1H, м), 7,40-7,47 (1H, м);
ИК (KBr, см-1): 2486, 1710.
(Пример 73) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(2-метоксиэтил)-1H-пиразол-3-ил]метилиден}пиперидин (соединение № 2-166)
(a) (E)-3-{[1H-Пиразол-3(5)-ил]метилиден}-1-(трифенилметил)пиперидин-4-он
К раствору (E)-3-{[1-(трет-бутоксикарбонил)-1H-пиразол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-она (690 мг) в смешанном растворителе из метанола (4 мл) и дихлорметана (1 мл) добавляли карбонат калия (551 мг) при комнатной температуре и полученную смесь перемешивали при комнатной температуре в течение 1,5 часов. После перемешивания реакционную смесь разбавляли этилацетатом и промывали насыщенным водным раствором хлорида натрия. Затем органический слой сушили над безводным сульфатом натрия. Удаляли растворитель в вакууме с получением указанного в заголовке соединения (568 мг, выход: количественный) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 2,68 (2H, шс), 2,77 (2H, т, J=6,0), 3,56 (2H, шс), 6,15 (1H, д, J=2,0), 7,14-7,21 (3H, м), 7,23-7,32 (6H, м), 7,47-7,57 (8H, м).
(b) (E)-3-{[1H-Пиразол-3(5)-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с количественным выходом в виде бесцветного аморфного твердого вещества, используя (E)-3-{[1H-пиразол-3(5)-ил]метилиден}-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1 (b).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,86-2,08 (2H, м), 2,11-2,1Э (1H, м), 2,47-2,66 (1H, м), 2,75-2,90 (1H, м), 3,72-3,92 (1H, м), 4,09-4,18 (1H, м), 6,06 (1H, д, J=2,0), 6,55 (1H, с), 7,05-7,23 (9H, м), 7,34-7,48 (7H, м).
(c) (E)-3-{[1-(2-Метоксиэтил)-1H-пиразол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол
К раствору (E)-3-{[1H-пиразол-3(5)-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола (1,00 г) и 2-метоксиэтилбромида (1,12 мл) в N,N-диметилформамиде (15 мл) добавляли карбонат калия (0,83 г) и иодид калия (2,00 г) при перемешивании при комнатной температуре и полученную смесь перемешивали при 80°C в течение 1,5 часов. Еще добавляли к реакционной смеси 2-метоксиэтилбромид (1,12 мл), карбонат калия (0,83 г) и иодид калия (2,00 г) и полученную смесь перемешивали при 80°C в течение 5,5 часов. После перемешивания к реакционной смеси добавляли воду и полученную реакционную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом натрия. Удаляли в вакууме растворитель и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смесь метанола и дихлорметана (1:19), с получением указанного в заголовке соединения (0,57 г, выход: 50%) в виде коричневого аморфного твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,85-1,94 (1H, м), 2,11-2,20 (2H, м), 2,64-3,02 (2H, м), 3,32 (3H, с), 3,56-3,61 (2H, м), 3,65-3,87 (1H,, м), 4,06-4,11 (2H, м), 4,13-4,20 (1H, м), 6,04 (1H, д, J=2,5), 6,50 (1H, с), 7,06-7,22 (9H, м), 7,32 (1H, д, J=2,5), 7,38-7,45 (6H, м).
(d) (E)-4-(Ацетилсульфанил)-3-{[1-(2-метоксиэтил)-1H-пиразол-3-ил]метилиден}-1-пиперидина гидротрифторацетат
Указанное в заголовке соединение синтезировали с выходом 11% в виде бесцветного масла, используя (E)-3-{[1-(2-метоксиэтил)-1H-пиразол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол вместо (E)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола, последовательным проведением реакций, подобных описанным в примере 21 (c).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 2,01-2,10 (1H, м), 2,35 (3H, с), 2,41-2,51 (1H, м), 3,13-3,24 (1H, м), 3,31 (3H, с), 3,32-3,39 (1H, м), 3,70 (2H, т, J=5,5), 3,79 (1H, д, J=14,0), 4,22 (2H, т, J=5,5), 4,59 (1H, м), 5,12 (1H, д, J=14,0), 6,19 (1H, д, J=2,5), 6,64 (1H, с), 7,39 (1H, д, J=2,5).
(e) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(2-метоксиэтил)-1H-пиразол-3-ил]метилиден}пиперидин
Указанное в заголовке соединение синтезировали с выходом 62% в виде бесцветного масла, используя (E)-4-(ацетилсульфанил)-3-{[1-(2-метоксиэтил)-1H-пиразол-3-ил]метилиден}пиперидина гидротрифторацетат вместо (E)-4-(ацетилсульфанил)-3-бензилиденпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 1 (d).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,62-0,81 (2H, м), 0,83-1,01 (2H, м), 1,84-1,92 (1H, м), 2,21-2,35 (2H, м), 2,30 (3H, с), 2,43-2,50 и 2,57-2,64 (общая 1H, каждый м), 2,72-2,78 и 2,79-2,85 (общая 1H, каждый м), 3,10 и 3,23 (общая 1H, каждый д, J=13,5), 3,31 и 3,32 (общая 3H, каждый с), 3,64 и 3,70 (общая 2H, каждый т, J=5,0), 4,11-4,18 (1H, м), 4,13 и 4,20 (общая 2H, каждый т, J=5,0), 4,51 (1H, м), 4,68 и 4,70 (общая 1H, каждый с), 6,04 и 6,13 (общая 1H, каждый д, J=2,5), 6,49 и 6,50 (общая 1H, каждый с), 7,03-7,16 (2H, м), 7,25-7,32 (1H, м), 7,31 и 7,36 (общая 1H, каждый д, J=2,5), 7,40-7,46 (1H, м).
(Пример 74) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(2-метоксиэтил)-1H-пиразол-3-ил]метилиден}-4-сульфанилпиперидина гидрохлорид (соединение № 2-165)
Указанное в заголовке соединение синтезировали с выходом 48% в виде бесцветного аморфного твердого вещества, используя (E)-4-ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(2-метоксиэтил)-1H-пиразол-3-ил]метилиден}пиперидин вместо (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-2-ил)метилиден]пиперидина, проведением реакции, подобной описанной в примере 8.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,63-0,81 (2H, м), 0,84-1,02 (2H, м), 1,75-1,84 (1H, м), 2,21-2,36 (2H, м), 2,60-2,79 и 2,83-2,91 (общая 2H, каждый м), 3,32 и 3,33 (общая 3H, каждый с), 3,55 и 3,65 (общая 1H, каждый д, J=13,0), 3,67 и 3,71 (общая 2H, каждый т, J=5,5), 3,80-3,88 (1H, м), 3,91-3,97 (1H, м), 4,16 и 4,20 (общая 2H, каждый т, J=5,5), 4,72 и 4,75 (общая 1H, каждый с), 6,04 и 6,13 (общая 1H, каждый д, J=2,5), 6,45 и 6,47 (общая 1H, каждый с), 7,04-7,16 (2H, м), 7,25-7,32 (1H, м), 7,33 и 7,37 (общая 1H, каждый д, J=2,5), 7,40-7,46 (1H, м);
ИК (KBr, см-1): 2524, 1710.
(Пример 75) (E)-4-(Ацетилсульфанил)-3-{[1-(трет-бутоксикарбонилметил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидин (соединение № 2-78)
(a) (E)-3-{[1-(трет-Бутоксикарбонилметил)-1H-пиразол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-он
К раствору (E)-3-{[1H-пиразол-3(5)-ил]метилиден}-1-(трифенилметил)пиперидин-4-она (3,2 г) и трет-бутилбромацетата (5,7 мл) в N,N-диметилформамиде (30 мл) добавляли карбонат калия (2,7 г) и иодид калия (6,4 г) при комнатной температуре и полученную смесь перемешивали при 80°C в течение 1 часа. После перемешивания к реакционной смеси добавляли воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом магния. Удаляли в вакууме растворитель и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смесь этилацетата, гексана и дихлорметана (1:4:1), с получением указанного в заголовке соединения (4,1 г, выход: 90%) в виде желтого аморфного твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,45 (9H, с), 2,65 (2H, шс), 2,74 (2H, т, J=6,0), 3,59 (2H, шс), 4,68 (2H, с), 6,19 (1H, д, J=2,5), 7,13-7,19 (3H, м), 7,23-7,29 (6H, м), 7,37 (1H, д, J=2,5), 7,45 (1H, с), 7,49-7,54 (6H, м).
(b) (E)-3-{[1-(трет-Бутоксикарбонилметил)-1H-пиразол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 80% в виде желтого аморфного твердого вещества, используя (E)-3-{[1-(трет-бутоксикарбонилметил)-1H-пиразол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1 (b).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,48 (9H, с), 1,84-1,93 (1H, м), 2,06-2,18 (2H, м), 2,64-2,94 (2H, м), 3,71-3,89 (1H, м), 4,11-4,18 (1H, м), 4,59 (2H, с), 6,11 (1H, д, J=2,0), 6,50 (1H, с), 7,07-7,22 (9H, м), 7,33 (1H, д, J=2,0), 7,39-7,45 (6H, м).
(c) (E)-4-(Ацетилсульфанил)-3-{[1-(трет-бутоксикарбонилметил)-1H-пиразол-3-ил]метилиден}пиперидина гидротрифторацетат
Указанное в заголовке соединение синтезировали с выходом 30% в виде бесцветного аморфного твердого вещества, используя (E)-3-{[1-(трет-бутоксикарбонилметил)-1H-пиразол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол вместо (E)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола, последовательным проведением реакций, подобных описанным в примере 21 (c).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,47 (9H, с), 2,01-2,09 (1H, м), 2,35 (3H, с), 2,41-2,51 (1H, м), 3,14-3,22 (1H, м), 3,31-3,38 (1H, м), 3,78 (1H, д, J=14,5), 4,58 (1H, м), 4,71-4,82 (2H, м), 5,04 (1H, д, J=14,5), 6,27 (1H, д, J=2,0), 6,63 (1H, с), 7,39 (1H, д, J=2,0).
(d) (E)-4-(Ацетилсульфанил)-3-{[1-(трет-бутоксикарбонилметил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидин
Указанное в заголовке соединение синтезировали с выходом 60% в виде бледно-желтого аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-3-{[1-(трет-бутоксикарбонилметил)-1H-пиразол-3-ил]метилидена гидротрифторацетат вместо (E)-4-(ацетилсульфанил)-3-бензилиденпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 1 (d).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,64-0,81 (2H, м), 0,86-1,02 (2H, м), 1,48 (9H, с), 1,83-1,92 (1H, м), 2,21-2,35 (2H, м), 2,29 (3H, с), 2,42-2,49 и 2,55-2,63 (общая 1H, каждый м), 2,71-2,78 и 2,79-2,86 (общая 1H, каждый м), 3,07 и 3,22 (общая 1H, каждый д, J=13,5), 4,09-4,16 (1H, м), 4,50 (1H, м), 4,65 и 4,73 (общая 2H, каждый с), 4,66 и 4,68 (общая 1H, каждый с), 6,13 и 6,22 (общая 1H, каждый д, J=2,0), 6,47 и 6,49 (общая 1H, каждый с), 7,04-7,16 (2H, м), 7,25-7,32 (1H, м) 7,32 и 7,37 (общая 1H, каждый д, J=2,0), 7,41-7,47 (1H, м).
(Пример 76) (E)-4-(Ацетилсульфанил)-3-{[1-(карбоксиметил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина гидрохлорид (соединение № 2-14)
К раствору (E)-4-(ацетилсульфанил)-3-{[1-(трет-бутоксикарбонилметил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина (770 мг) в дихлорметане (10 мл) добавляли трифторуксусную кислоту (10 мл) при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали в вакууме и остаток разбавляли этилацетатом и промывали насыщенным водным раствором гидрокарбоната натрия. Органический слой нейтрализовали 1 н. хлороводородной кислотой и сушили над безводным сульфатом магния. Удаляли в вакууме растворитель и остаток растворяли в дихлорметане (10 мл) и к полученной смеси добавляли 4 н. раствор хлороводорода в диоксане (1,1 мл). Реакционную смесь удаляли в вакууме и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смесь метанола и дихлорметана (1:40), с получением указанного в заголовке соединения (640 мг, выход: 80%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,68-1,08 (4H, м), 1,85-2,02 (1H, м), 2,17-3,04 (4H, м), 2,30 (3H, с), 3,32-3,69 (1H, м), 4,08-4,17 (1H, м), 4,41-4,52 (1H, м), 4,63-4,83 (3H, м), 6,05-6,22 (1H, м), 6,48-6,59 (1H, м), 7,05-7,49 (5H, м);
ИК (KBr, см-1): 1699, 1495.
(Пример 77) (E)-3-{[1-(Карбоксиметил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-13)
Указанное в заголовке соединение синтезировали с выходом 44% в виде бесцветного аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-3-{[1-(карбоксиметил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина гидрохлорид вместо (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-2-ил)метилиден]пиперидина, проведением реакции, подобной описанной в примере 8.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д.: 0,81-1,16 (4H, м), 1,82-1,99 (1H, м), 2,12-3,11 (4H, м), 3,22-4,09 (3H, м), 4,62 (1H, м), 4,96 (2H, м), 6,24 (1H, м), 6,63 (1H, м), 7,35-7,83 (5H, м);
ИК (KBr, см-1): 2561, 1741, 1711.
(Пример 78) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-пиразол-3-ил]метилиден}-4-сульфанилпиперидина гидрохлорид (соединение № 2-45)
В раствор (E)-4-(ацетилсульфанил)-3-{[1-(карбоксиметил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина гидрохлорида (600 мг) в этаноле (15 мл) барботировали хлороводород при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в герметически закрытом состоянии в течение 4 часов. После перемешивания реакционную смесь упаривали в вакууме и остаток очищали препаративной ВЭЖХ [YMC-Pack ODS-A; YMC, подвижная фаза: 40% ацетонитрил/вода (0,2% раствор хлороводородной кислоты)] с получением указанного в заголовке соединения (250 мг, выход: 37%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,65-0,81 (2H, м), 0,86-1,01 (2H, м), 1,29 (3H, т, J=7,0), 1,75-1,84 (1H, м), 2,22-2,35 (2H, м), 2,60-2,66 и 2,67-2,72 (общая 1H, каждый м), 2,73-2,79 и 2,83-2,89 (общая 1H, каждый м), 3,53 и 3,66 (общая 1H, каждый д, J=12,5), 3,81 и 3,83 (общая 1H, каждый д, J=12,5), 3,90-3,96 (1H, м), 4,24 (2H, кв, J=7,0), 4,70 и 4,73 (общая 1H, каждый с), 4,77 и 4,82 (общая 2H, каждый с), 6,13 и 6,23 (общая 1H, каждый д, J=2,0), 6,44 и 6,47 (общая 1H, каждый с), 7,03-7,17 (2H, м), 7,24-7,32 (1H, м), 7,34 и 7,38 (общая 1H, каждый д, J=2,0), 7,41-7,46 (1H, м);
ИК (KBr, см-1): 2486, 1749, 1712.
(Пример 79) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-пиразол-3-ил]метилиден}пиперидина гидрохлорид (соединение № 2-46)
К раствору (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-пиразол-3-ил]метилиден}-4-сульфанилпиперидина гидрохлорида (140 мг) в дихлорметане (5 мл) добавляли ацетилхлорид (0,02 мл) и триэтиламин (0,12 мл) и полученную смесь перемешивали при комнатной температуре в течение 40 минут. К полученной реакционной смеси добавляли ацетилхлорид (0,02 мл) и триэтиламин (0,4 мл) и полученную смесь перемешивали при комнатной температуре в течение 80 минут. Реакционную смесь концентрировали в вакууме и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смесь метанола и дихлорметана (1:19). Полученный желтый маслянистый продукт растворяли в дихлорметане (3 мл) и к полученному раствору добавляли 4 н. раствор хлороводорода в диоксане (0,11 мл). После выпаривания растворителя из реакционной смеси при пониженном давлении, получали указанное в заголовке соединение (70 мг, выход: 46%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,64-0,82 (2H, м), 0,86-1,02 (2H, м), 1,29 (3H, т, J=7,0), 1,83-1,92 (1H, м), 2,21-2,33 (2H, м), 2,30 (3H, с), 2,43-2,50 и 2,55-2,62 (общая 1H, каждый м), 2,71-2,78 и 2,80-2,85 (общая 1H, каждый м), 3,06 и 3,23 (общая 1H, каждый д, J=13,0), 4,11 и 4,12 (общая 1H, каждый д, J=13,0), 4,24 (2H, кв, J=7,0), 4,50 (1H, м), 4,67 и 4,69 (общая 1H, каждый с), 4,78 и 4,82 (общая 2H, каждый с), 6,14 и 6,22 (общая 1H, каждый д, J=3,0), 6,47 и 6,50 (общая 1H, каждый с), 7,04-7,16 (2H, м), 7,25-7,31 (1H, м), 7,33 и 7,38 (общая 1H, каждый д, J=3,0), 7,41-7,47 (1H, м);
ИК (KBr, см-1): 1697, 1495.
<Другой способ синтеза>
(a) (E)-3-{[1-(Этоксикарбонилметил)-1H-пиразол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол (соединение A) и (E)-3-{[1-(2-гидроксиэтил)-1H-пиразол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол (соединение B)
К раствору (E)-3-{[1H-пиразол-3(5)-ил]метилиден}-1-(трифенилметил)пиперидин-4-она (40,6 г) и этилбромацетата (53,9 мл) в N,N-диметилформамиде (420 мл) добавляли карбонат калия (33,4 г) и иодид калия (80,3 г) при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в течение 30 минут и затем еще перемешивали при 80°C в течение 30 минут. После перемешивания к реакционной смеси добавляли воду и полученную смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Удаляли в вакууме растворитель и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из этилацетата, гексана и дихлорметана (1:2:1), с получением (E)-3-{[1-(этоксикарбонилметил)-1H-пиразол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-она (содержащего примеси) в виде желтого твердого вещества.
К раствору указанной выше смеси в смешанном растворителе из этанола (500 мл) и дихлорметана (200 мл) добавляли борогидрид натрия (1,9 г) при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в течение 1 часа. После перемешивания к реакционной смеси добавляли воду и полученную смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Удаляли в вакууме растворитель и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из этилацетата и дихлорметана (1:4-1:1), с получением указанных в заголовке соединений, соединения A (27,0 г, выход: 54%), соединения B (10,0 г, выход: 22%), и смешанных соединений (1,5 г) (E)-3-{[1-(этоксикарбонилметил)-1H-пиразол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола и (E)-3-({1-[1,2-бис(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидин-4-ола в виде желтого масла, соответственно.
(соединение A)
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,29 (3H, т, J=7,0), 1,83-1,95 (1H, м), 2,08-2,20 (2H, м), 2,64-2,78 (2H, м), 3,39-3,59 (1H, м), 4,10-4,18 (1Н, м), 4,12 (2H, кв, J=7,0), 4,68 (2H, с), 6,13 (1H, д, J=2,0), 6,50 (1H, с), 7,07-7,21 (9H, м), 7,35 (1H, д, J=2,0), 7,39-7,46 (6H, м).
(соединение B)
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,86-1,94 (1H, м), 2,11-2,18 (2H, м), 2,67-2,87 (2H, м), 3,46-3,52 (1H, м), 3,63-3,76 (2H, м), 3,95-4,08 (2H, м), 4,12-4,20 (1H, м), 6,12 (1H, д, J=2,0), 6,48 (1H, с), 7,05-7,21 (9H, м), 7,29 (1H, д, J=2,0), 7,37-7,46 (6H, м).
(b) (E)-4-(Ацетилсульфанил)-3-{[1-(этоксикарбонилметил)-1H-пиразол-3-ил]метилиден}пиперидина гидротрифторацетат
Указанное в заголовке соединение синтезировали с выходом 16% в виде белого твердого вещества, используя (E)-3-{[1-(этоксикарбонилметил)-1H-пиразол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол вместо (E)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола, последовательным проведением реакций, подобных описанным в примере 21 (c).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,28 (3H, т, J=7,0), 2,03-2,11 (1H, м), 2,36 (3H, с), 2,40-2,49 (1H, м), 3,16-3,24 (1H, м), 3,33-3,40 (1H, м), 3,79 (1H, д, J=14,5), 4,23 (2H, кв, J=7,0), 4,58 (1H, м), 4,86 и 4,87 (общая 2H, каждый с), 5,04 (1H, д, J=14,5), 6,28 (1H, д, J=2,5), 6,64 (1H, с), 7,40 (1H, д, J=2,5).
(c) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-пиразол-3-ил]метилиден}пиперидина гидрохлорид
Указанное в заголовке соединение синтезировали с выходом 59% в виде бледно-желтого аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-3-{[1-(этоксикарбонилметил)-1H-пиразол-3-ил]метилиден}пиперидина гидротрифторацетат вместо (E)-4-(ацетилсульфанил)-3-бензилиденпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 1 (d).
(Пример 80) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)-1H-пиразол-3-ил]метилиден}-4-сульфанилпиперидина гидрохлорид (соединение № 2-29)
В раствор (E)-4-(ацетилсульфанил)-3-{[1-(трет-бутоксикарбонилметил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина (120 мг) в метаноле (20 мл) барботировали хлороводород при охлаждении льдом и полученную реакционную смесь перемешивали при комнатной температуре в герметически закрытом состоянии в течение 2,5 часов. Реакционную смесь концентрировали в вакууме и остаток очищали препаративной ВЭЖХ [YMC-Pack ODS-A; YMC, подвижная фаза: 33% ацетонитрил/вода (0,2% раствор хлороводородной кислоты)] с получением указанного в заголовке соединения (100 мг, выход: 85%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,64-0,82 (2H, м), 0,86-1,02 (2H, м), 1,75-1,84 (1H, м), 2,21-2,36 (2H, м), 2,60-2,66 и 2,67-2,72 (общая 1H, каждый м), 2,73-2,80 и 2,82-2,89 (общая 1H, каждый м), 3,53 и 3,67 (общая 1H, каждый д, J=13,0), 3,77 и 3,84 (общая 1H, каждый д, J=13,0), 3,77 и 3,78 (общая 3H,, каждый с), 3,90-3,96 (1H, м), 4,71 и 4,73 (общая 1H, каждый с), 4,83 (2H, с), 6,14 и 6,23 (общая 1H, каждый д, J=2,5), 6,44 и 6,47 (общая 1H, каждый с), 7,04-7,15 (2H, м), 7,25-7,32 (1H, м), 7,34 и 7,38 (общая 1H, каждый д, J=2,5), 7,40-7,46 (1H, м);
ИК (KBr, см-1): 2492, 1750, 1711.
(Пример 81) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)-1H-пиразол-3-ил]метилиден}пиперидина гидрохлорид (соединение № 2-30)
Указанное в заголовке соединение синтезировали с выходом 69% в виде бледно-желтого аморфного твердого вещества, используя (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)-1H-пиразол-3-ил]метилиден}-4-сульфанилпиперидина гидрохлорид вместо (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-пиразол-3-ил]метилиден}-4-сульфанилпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 79.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,63-0,82 (2H, м), 0,86-1,02 (2H, м), 1,83-1,92 (1H, м), 2,21-2,35 (2H, м), 2,30 (3H, с), 2,43-2,50 и 2,55-2,62 (общая 1H, каждый м), 2,71-2,77 и 2,80-2,86 (общая 1H, каждый м), 3,06 и 3,24 (общая 1H, каждый д, J=12,5), 4,10 и 4,12 (общая 1H, каждый д, J=12,5), 3,77 (3H, с), 4,50 (1H, м), 4,67 и 4,69 (общая 1H, каждый с), 4,76 и 4,84 (общая 2H, каждый с), 6,14 и 6,22 (общая 1H, каждый д, J=2,5), 6,47 и 6,49 (общая 1H, каждый с), 7,03-7,16 (2H, м), 7,26-7,31 (1H, м), 7,33 и 7,37 (общая 1H, каждый д, J=2,5), 7,40-7,46 (1H, м);
ИК (KBr, см-1): 1696, 1495.
(Пример 82) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(пропоксикарбонилметил)-1Н-пиразол-3-ил]метилиден}-4-сульфанилпиперидина гидрохлорид (соединение № 2-61)
Указанное в заголовке соединение синтезировали с выходом 64% в виде бесцветного аморфного твердого вещества, используя н-пропанол вместо метанола, проведением реакции, подобной описанной в примере 80.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,64-0,82 (2H, м), 0,86-1,02 (2H, м), 0,93 (3H, т, J=8,0), 1,63-1,71 (2H, м), 1,75-1,84 (1H, м), 2,22-2,36 (2H, м), 2,59-2,80 и 2,82-2,89 (общая 2H, каждый м), 3,53 и 3,67 (общая 1H, каждый д, J=13,5), 3,80 и 3,83 (общая 1H, каждый д, J=13,5), 3,90-3,96 (1H, м), 4,11-4,16 (2H, м), 4,70 и 4,73 (общая 1H, каждый с), 4,78 и 4,83 (общая 2H, каждый с), 6,13 и 6,23 (общая 1H, каждый д, J=2,5), 6,44 и 6,47 (общая 1H, каждый с), 7,04-7,16 (2H, м), 7,25-7,32 (1H, м), 7,34 и 7,39 (общая 1H, каждый д, J=2,5), 7,41-7,47 (1H, м);
ИК (KBr, см-1): 2520, 1749, 1713.
(Пример 83) (E)-3-{[1-(Бутоксикарбонилметил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-69)
Указанное в заголовке соединение синтезировали с выходом 55% в виде бесцветного аморфного твердого вещества, используя н-бутанол вместо метанола, проведением реакции, подобной описанной в примере 80.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,66-0,80 (2H, м), 0,86-1,02 (2H, м), 0,93 (3H, т, J=7,5), 1,32-1,41 (2H, м), 1,58-1,66 (2H, м), 1,76-1,84 (1Н, м), 2,22-2,35 (2H, м), 2,60-2,79 и 2,82-2,89 (общая 2H, каждый м), 3,52 и 3,66 (общая 1H, каждый д, J=13,0), 3,81 и 3,84 (общая 1H, каждый д, J=13,0), 3,91-3,96 (1H, м), 4,15-4,20 (2H, м), 4,70 и 4,73 (общая 1H, каждый с), 4,77 и 4,82 (общая 2H, каждый с), 6,13 и 6,23 (общая 1H, каждый д, J=2,5), 6,44 и 6,47 (общая 1H, каждый с), 7,04-7,15 (2H, м), 7,26-7,32 (1H, м), 7,34 и 7,38 (общая 1H, каждый д, J=2,5), 7,41-7,47 (1H, м);
ИК (KBr, см-1): 2518, 1749, 1713.
(Пример 84) (E)-4-(Ацетилсульфанил)-3-{[1-(карбамоилметил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидин (соединение № 2-102)
К раствору (E)-4-(ацетилсульфанил)-3-{[1-(карбоксиметил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина гидрохлорида (190 мг) в дихлорметане (15 мл) добавляли изобутилхлорформиат (0,06 мл) и триэтиламин (0,18 мл) при охлаждении льдом и полученную смесь перемешивали при той же самой температуре в течение 30 минут. К полученной реакционной смеси добавляли 28% водный раствор аммиака (0,03 мл) и полученную смесь перемешивали при комнатной температуре в течение 45 минут. После перемешивания к реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали дихлорметаном. Экстракт сушили над безводным сульфатом магния. Удаляли в вакууме растворитель и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из метанола и дихлорметана (1:19), с получением указанного в заголовке соединения (80 мг, выход: 42%) в виде желтого масла.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,68-1,01 (4H, м), 1,86-1,96 (1H, м), 2,07-2,13 (1H, м), 2,21-2,30 (1H, м), 2,30 и 2,31 (общая 3H, каждый с), 2,43-2,52 и 2,54-2,62 (общая 1H, каждый м), 2,68-2,75 и 2,81-2,88 (общая 1H, каждый м),3,05 и 3,25 (общая 1H, каждый д, J=12,5), 4,21-4,31 (1H, м), 4,47-4,52 (1H, м), 4,63-4,73 (2H, м), 4,75 и 4,76 (общая 1H, каждый с), 6,17 и 6,23 (общая 1H, каждый д, J=2,0), 6,46 и 6,47 (общая 1H, каждый с), 7,06-7,17 (2H, м), 7,25-7,41 (3H, м);
МС (FAB) m/z: 471 (М+H)+.
(Пример 85) (E)-3-{[1-(Карбамоилметил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-101)
Указанное в заголовке соединение синтезировали с выходом 19% в виде бесцветного аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-3-{[1-(карбамоилметил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидин вместо (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-2-ил)метилиден]пиперидина, проведением реакции, подобной описанной в примере 8.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,69-0,86 (2H, м), 0,88-1,00 (2H, м), 1,76-1,84 (1H, м), 2,05-2,12 (1H, м), 2,22-2,38 (1H, м), 2,56-2,63 и 2,66-2,73 (общая 1H, каждый м), 2,74-2,81 и 2,82-2,89 (общая 1H, каждый м), 3,56 и 3,71 (общая 1H, каждый д, J=12,5), 3,87-3,97 (2H, м), 4,66-4,73 (3H, м), 6,17 и 6,23 (общая 1H, каждый д, J=2,0), 6,42 и 6,44 (общая 1H, каждый с), 7,07-7,17 (2H, м), 7,29-7,40 (2H, м), 7,35 и 7,38 (общая 1H, каждый д, J=2,0);
ИК (KBr, см-1): 2531, 1708.
(Пример 86) (E)-3-{(1-Ацетил-1H-пиразол-3-ил)метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидротрифторацетат (соединение № 2-9)
Указанное в заголовке соединение синтезировали с выходом 25% в виде бесцветного аморфного твердого вещества, используя (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1H-пиразол-3(5)-ил]метилиден}-4-сульфанилпиперидина бис(гидротрифторацетат) вместо (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-пиразол-3-ил]метилиден}-4-сульфанилпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 79.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,65-0,81 (2H, м), 0,85-0,99 (2H, м), 1,79-1,89 (1H, м), 2,12-2,19 (1H, м), 2,27-2,38 (1H, м), 2,52 и 2,58 (общая 3H, каждый с), 2,64-2,75 (1H, м), 2,82-2,93 (1H, м), 3,66 и 3,79 (общая 1H, каждый д, J=13,5), 3,82 и 3,88 (общая 1H, каждый д, J=13,5), 3,90-3,95 (1H, м), 4,78 и 4,79 (общая 1H, каждый с), 6,30 и 6,35 (общая 1H, каждый д, J=3,0), 6,44 и 6,45 (общая 1H, каждый с), 7,02-7,13 (2H, м), 7,26-7,32 (1H, м), 7,34-7,39 (1H, м), 8,12 и 8,15 (общая 1H, каждый д, J=3,0);
ИК (Тонкая пленка, см-1): 2564, 1713, 1672.
(Пример 87) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)пиррол-2-ил)метилиден]пиперидин (соединение № 2-546)
(a) (E)-3-[(Пиррол-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-он
К раствору 1-(трифенилметил)пиперидин-4-она (17,00 г) в тетрагидрофуране (400 мл) добавляли по каплям 0,5 н. раствор бис(триметилсилил)амида калия в толуоле (100 мл) при -70°C и полученную смесь перемешивали при той же самой температуре в течение 20 минут. Затем к реакционной смеси добавляли по каплям раствор 1-(трет-бутоксикарбонил)пиррол-2-карбальдегида (11,00 г) в тетрагидрофуране (100 мл) при -70°C и полученную смесь перемешивали при той же самой температуре в течение 1 часа. После добавления насыщенного водного раствора хлорида аммония полученную реакционную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом магния. Удаляли в вакууме растворитель и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из этилацетата, гексана и дихлорметана (1:3:1), с получением указанного в заголовке соединения (7,26 г, выход: 35%) в виде желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,67 (2H, шс), 2,74 (2H, т, J=5,5), 3,41 (2H, шс), 6,11 (1H, шс), 6,25 (1H, м), 6,94 (1H, м), 7,15-7,21 (3H, м), 7,25-7,32 (5H, м), 7,49 (1H, шс), 7,51-7,58 (7H, м).
(b) (E)-3-{[1-(Этоксикарбонилметил)пиррол-2-ил]метилиден]-1-(трифенилметил)пиперидин-4-он
К раствору (E)-3-[(пиррол-2-ил)метилиден]-1-(трифенилметил)пиперидин-4-она (7,16 г) и этилбромацетата (8,60 г) в N,N-диметилформамиде (80 мл) добавляли карбонат калия (7,10 г) и иодид калия (8,50 г) при перемешивании при комнатной температуре и полученную смесь перемешивали при 80°C в течение 4 часов. После фильтрования реакционную смесь разбавляли дихлорметаном, затем промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом магния. Удаляли в вакууме растворитель и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из этилацетата, гексана и дихлорметана (1:2:1), с получением указанного в заголовке соединения (7,13 г, выход: 83%) в виде желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,29 (3H, т, J=7,5), 2,66 (2H, шс), 2,72 (2H, т, J=5,0), 3,40 (2H, шс), 4,23 (2H, кв, J=7,5), 4,76 (2H, с), 6,05 (1H, д, J=4,0), 6,20 (1H, т, J=3,0), 6,80 (1H, шс), 7,13-7,20 (3H, м), 7,24-7,32 (5H, м), 7,36 (1H, шс), 7,49-7,58 (7H, м).
(c) (E)-3-{[1-(Этоксикарбонилметил)пиррол-2-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 83% в виде желтого аморфного твердого вещества, используя (E)-3-{[1-(этоксикарбонилметил)пиррол-2-ил]метилиден}-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1 (b).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,30 (3H, т, J=7,5), 1,86 (1H, м), 2,03-2,16 (2H, м), 2,61-2,79 (2H, м), 3,64 (1H, шс), 4,15 (1H, м), 4,25 (2H, кв, J=7,5), 4,68, (2H, с), 5,83 (1H, д, J=3,0), 6,01 (1H, т, J=3,0), 6,27 (1H, с), 6,64 (1H, т, J=2,0), 7,07-7,24 (9H, м), 7,35-7,43 (6H, м).
(d) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)пиррол-2-ил]метилиден}пиперидин
К раствору (E)-3-{[1-(этоксикарбонилметил)пиррол-2-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола (5,64 г) в толуоле (100 мл) добавляли тиоуксусную кислоту (1,64 мл) и динеопентилацеталь N,N-диметилформамида (6,2 мл) при комнатной температуре и полученную смесь перемешивали при той же самой температуре в течение 15 минут. После добавления к реакционной смеси воды полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом магния. Удаляли в вакууме растворитель и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из этилацетата и гексана (1:3), с получением производного сложного тиоэфира (содержащего примеси) в виде желтого аморфного твердого вещества.
Затем к раствору указанной выше смеси в дихлорметане (200 мл) добавляли трифторуксусную кислоту (2,0 мл) при охлаждении льдом и полученную смесь перемешивали при той же самой температуре в течение 15 минут. После добавления к реакционной смеси гидрокарбоната натрия отфильтровывали нерастворимые продукты. Удаляли в вакууме растворитель и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из метанола и дихлорметана (1:5), с получением производного детрифенилметила (содержащего примеси).
Затем к раствору указанной выше смеси и 2-бром-2-(2-фторфенил)-1-циклопропилэтанона (3,26 г) в N,N-диметилформамиде (50 мл) добавляли триэтиламин (1,8 мл) при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в течение 2 часов. После добавления к реакционной смеси воды полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом магния. Удаляли в вакууме растворитель и остаток очищали хроматографией на колонке с силикагелем, используя смешанный растворитель из этилацетата, гексана и дихлорметана (1:3:1) в качестве элюента. Полученное желтое аморфное твердое вещество растворяли в метаноле (30 мл) и полученную смесь перемешивали при 50°C в течение 1 дня. Реакционную смесь концентрировали в вакууме с получением указанного в заголовке соединения (1,41 г, выход: количественный) в виде желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,65-0,83 (2H, м), 0,87-1,04 (2H, м), 1,27 и 1,29 (общая 3H, каждый т, J=7,5), 1,80-1,90 (1Н, м), 2,18-2,27 (2H, м), 2,28 (3H, с), 2,38 и 2,61 (общая 1H, каждый дт, J=11,0, 2,0), 2,75-2,83 (1H, м), 3,04 и 3,06 (общая 1H, каждый д, J=13,0), 3,72 и 3,93 (общая 1H, каждый д, J=13,0),4,20 и 4,22 (общая 2H, каждый кв, J=7,5), 4,45 и 4,49 (общая 1H, каждый т, J=4,0), 4,56 и 4,58 (общая 2H, каждый с), 4,65 и 4,69 (общая 1H, каждый с), 5,91 и 6,02 (общая 1H, каждый д, J=3,5), 6,06 и 6,13 (общая 1H, каждый т, J=3,5), 6,26 и 6,27 (общая 1H, каждый с), 6,59 и 6,62 (общая 1H, каждый т, J=1,5), 7,04-7,19 (2H, м), 7,26-7,42 (2H, м);
ИК (Тонкая пленка, см-1): 1753, 1692, 1487, 1476.
(Пример 88) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)пиррол-2-ил]метилиден}-4-сульфанилпиперидин (соединение № 2-545)
К раствору (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)пиррол-2-ил]метилиден}пиперидина (1,41 г) в этаноле (30 мл) добавляли карбонат калия (4,00 г) при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в течение 2 часов. После фильтрования к фильтрату добавляли воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом магния. Удаляли в вакууме растворитель и остаток очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, подвижная фаза: 80% ацетонитрил/вода) с получением указанного в заголовке соединения (0,49 г, выход: 38%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,65-0,83 (2H, м), 0,85-1,03 (2H, м), 1,27 и 1,28 (общая 3H, каждый т, J=7,5), 1,73-1,82 (1H, м), 2,12-2,21 (1H, м), 2,21-2,35 (1H, м), 2,63-2,82 (1H, м), 2,75 и 2,97 (общая 1H, каждый м), 3,53 и 3,55 (общая 1H, каждый д, J=13,0), 3,62 и 3,68 (общая 1H, каждый д, J=13,0), 3,88 и 3,93 (общая 1H, каждый м), 4,21 и 4,22 (общая 2H, каждый кв, J=7,5), 4,58 и 4,59 (общая 2H, каждый с), 4,75 и 4,79 (общая 1H, каждый с), 5,94 и 6,00 (общая 1H, каждый д, J=3,5), 6,09 и 6,12 (общая 1H, каждый т, J=3,5), 6,24 и 6,27 (общая 1H, каждый с), 6,59-6,64 (1H, м), 7,04-7,18 (2H, м), 7,27-7,34 (1H, м), 7,37-7,44 (1H, м);
ИК (Тонкая пленка, см-1): 1752, 1700.
(Пример 89) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)пиррол-3-ил]метилиден}пиперидин (соединение № 2-674)
(a) (E)-3-{[1-(Этоксикарбонилметил)пиррол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-он
Указанное в заголовке соединение синтезировали с выходом 26% в виде желтого аморфного твердого вещества, используя 1-(этоксикарбонилметил)пиррол-3-карбальдегид вместо бензальдегида, проведением реакции, подобной описанной в примере 1 (a).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,26 (3H, т, J=7,5), 2,64 (2H, шс), 2,71 (2H, т, J=5,0), 3,39 (2H, шс), 4,20 (2H, кв, J=7,5), 4,54 (2H, с), 6,04 (1H, т, J=2,5), 6,57 (1H, т, J=2,5), 6,73 (1H, т, J=1,5), 7,13-7,20 (3H, м), 7,24-7,31 (5H, м), 7,48 (1H, т, J=1,5), 7,51-7,56 (7H, м).
(b) (E)-3-{[1-(Этоксикарбонилметил)пиррол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с количественным выходом в виде бледно-желтого аморфного твердого вещества, используя (E)-3-{[1-(этоксикарбонилметил)пиррол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1 (b).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,28 (3H, т, J=7,5), 2,07-2,18 (1H, м), 2,26 (1H, м), 2,54 (1H, м), 3,02 (1H, м), 3,29 (1H, м), 4,16 (1H, м), 4,22 (2H, кв, J=7,5), 4,46 (2H, с), 6,02 (1H, дд, J=3,0, 2,0), 6,35 (1H, шс), 6,45 (1H, т, J=2,0), 6,51 ЦН, т, J=3,0), 7,08-7,32 (7H, м), 7,42-7,56 (8H, м).
(c) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)пиррол-3-ил]метилиден}пиперидин
Указанное в заголовке соединение синтезировали с выходом 38% в виде бледно-желтого аморфного твердого вещества, используя (E)-3-{[1-(этоксикарбонилметил)пиррол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол вместо (E)-3-{[1-(этоксикарбонилметил)пиррол-2-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола, последовательным проведением реакций, подобных описанным в примере 87 (d).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,65-0,84 (2H, м), 0,87-1,04 (2H, м), 1,29 (3H, т, J=7,5), 1,81-1,92 (1H, м), 2,19-2,33 (2H, м), 2,29 (3H, с), 2,43 и 2,61 (общая 1H, каждый м), 2,76 и 2,86 (общая 1H, каждый м),2,98 и 3,06 (общая 1H, каждый д, J=13,0),3,84 и 3,95 (общая 1H, каждый д, J=13,0), 4,22 (2H, кв, J=7,5), 4,49 и 4,54 (общая 2H, каждый с), 4,51 и 4,54 (общая 1H, каждый м), 4,68 и 4,75 (общая 1H, каждый с), 5,98 и 6,10 (общая 1H, каждый с), 6,40 и 6,42 (общая 1H, каждый с), 6,46 и 6,51 (общая 1H, каждый с), 6,56 и 6,57 (общая 1H, каждый с), 7,04-7,19 (2H, м), 7,27-7,35 (1H, м), 7,45-7,51 (1H, м);
ИК (Жидкостная пленка, см-1): 1754, 1692, 1488.
(Пример 90) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)пиррол-3-ил]метилиден}-4-сульфанилпиперидин (соединение № 2-657)
Указанное в заголовке соединение синтезировали с выходом 69% в виде бледно-желтого аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)пиррол-3-ил]метилиден}пиперидин вместо (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-2-ил)метилиден]пиперидина, проведением реакции, подобной описанной в примере 8.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,64-0,83 (2H, м), 0,86-1,03 (2H, м), 1,71-1,80 (1H, м), 2,18-2,33 (2H, м), 2,58-2,76 (1H, м), 2,70 и 2,84 (общая 1H, каждый м), 3,39 и 3,45 (общая 1H, каждый д, J=13,0), 3,58 и 3,70 (общая 1H, каждый д, J=13,0), 3,76 (3H, с), 3,91-3,98 (1H, м), 4,51 и 4,56 (общая 2H, каждый с), 4,62 и 4,72 (общая 1H, каждый с), 5,99 и 6,09 (общая 1H, каждый с), 6,31 и 6,34 (общая 1H, каждый с), 6,44 и 6,51 (общая 1H, каждый с), 6,56 (1H, с), 7,04-7,17 (2H, м), 7,26-7,33 (1H, м), 7,43-7,50 (1H, м);
ИК (Жидкостная пленка, см-1): 1756, 1698, 1488.
(Пример 91) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-имидазол-4-ил]метилиден}пиперидин (соединение № 2-930)
(a) (E)-3-{[1-(Этоксикарбонилметил)-1H-имидазол-4-ил]метилиден}-1-(трифенилметил)пиперидин-4-он
Указанное в заголовке соединение синтезировали с выходом 35% в виде желтого аморфного твердого вещества, используя 1-(этоксикарбонилметил)-1H-имидазол-4-карбальдегид вместо бензальдегида, проведением реакции, подобной описанной в примере 1 (a).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,27 (3H, т, J=7,0), 2,64 (2H, шс), 2,73 (2H, т, J=5,0), 3,64 (2H, шс), 4,23 (2H, кв, J=7,0), 4,61 (2H, с), 6,90 (1H, с), 7,13-7,29 (9H, м), 7,39 (1H, с), 7,43 (1H, с), 7,51-7,56 (6H, м).
(b) (E)-3-{[1-(Этоксикарбонилметил)-1H-имидазол-4-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 93% в виде желтого аморфного твердого вещества, используя (E)-3-{[1-(этоксикарбонилметил)-1H-имидазол-4-ил]метилиден}-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1 (b).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,31 (3H, т, J=7,0), 1,84-1,92 (1H, м), 2,08-2,21 (2H, м), 2,59-2,70 (1H, м), 2,78-3,02 (1H, м), 3,58-3,81 (1H, м), 4,13-4,18 (1H, м), 4,25 (2H, кв, J=7,0), 4,53 (2H, с), 6,46 (1H, с), 6,64 (1H, с), 7,08-7,20 (9H, м), 7,34 (1H, с), 7,40-7,48 (6H, м).
(c) (E)-4-(Ацетилсульфанил)-3-{[1-(этоксикарбонилметил)-1H-имидазол-4-ил]метилиден}пиперидина гидротрифторацетат
Указанное в заголовке соединение синтезировали с выходом 17% в виде белого твердого вещества, используя (E)-3-{[1-(этоксикарбонилметил)-1H-имидазол-4-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол вместо (E)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола, последовательным проведением реакций, подобных описанным в примере 21 (c).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,31 (3H, т, J=7,5), 2,10-2,19 (1H, м), 2,39 (3H, с), 2,44-2,54 (1H, м), 3,25-3,36 (1H, м), 3,44-3,53 (1H, м), 3,82-3,91 (1H, м), 4,05-4,13 (1H, м), 4,28 (2H, кв, J=7,5), 4,57 (1H, т, J=4,0), 4,95 (2H, с), 6,69 (1H, с), 7,28 (1H, с), 8,75 (1H, с).
(d) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-имидазол-4-ил]метилиден}пиперидин
Указанное в заголовке соединение синтезировали с выходом 59% в виде бледно-желтого масла, используя (E)-4-(ацетилсульфанил)-3-{[1-(этоксикарбонилметил)-1H-имидазол-4-ил]метилиден}пиперидина гидротрифторацетат вместо (E)-4-(ацетилсульфанил)-3-бензилиденпиперидина, проведением реакции, подобной описанной в примере 1 (d).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,66-0,82 (2H, м), 0,87-1,05 (2H, м), 1,30 (3H, т, J=7,0), 1,82-1,90 (1H, м), 2,22-2,35 (2H, м), 2,29 (3H, с), 2,39-2,67 (1H, м), 2,73-2,82 (1H, м), 3,18 (1H, д, J=12,5), 4,23 и 4,39,(общая 1H, каждый д, J=12,5), 4,25 (2H, кв, J=7,0), 4,47-4,51 (1H, м), 4,58 и 4,61 (общая 2H, каждый с), 4,68 и 4,74 (общая 1H, каждый с), 6,43 (1H, с), 6,74 и 6,83 (общая 1H, каждый с), 7,03-7,16 (2H, м), 7,26-7,31 (1H, м), 7,34 и 7,39 (общая 1H, каждый с), 7,43-7,50 (1H, м);
МС (FAB) m/z: 500 (М+H)+.
(Пример 92) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-имидазол-4-ил]метилиден}-4-сульфанилпиперидина гидрохлорид (соединение № 2-929)
Указанное в заголовке соединение синтезировали с выходом 84% в виде бледно-желтого твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-имидазол-4-л]метилиден}пиперидин вместо (E)-4-(ацетилсульфанил)-3-бензилиден-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина, проведением реакции, подобной описанной в примере 2.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,65-0,82 (2H, м), 0,84-1,03 (2H, м), 1,30 (3H, т, J=7,0), 1,71-1,82 (1H, м), 2,19-2,34 (2H, м), 2,58-2,92 (2H, м), 3,61-3,67 (1H, м), 3,77-3,98 (2H, м), 4,25 (2H, кв, J=7,0), 4,58 и 4,62 (общая 2H, каждый с), 4,73 и 4,76 (общая 1H, каждый с), 6,40 и 6,41 (общая 1H, каждый с), 6,72 и 6,84 (общая 1H, каждый с), 7,03-7,16 (2H, м), 7,27-7,33 (1H, м), 7,37 и 7,40 (общая 1H, каждый с), 7,43-7,49 (1H, м).
(Пример 93) (E)-3-{[1-(Карбоксиметил)-1H-имидазол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-897)
К раствору (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-имидазол-4-ил]метилиден}-4-сульфанилпиперидина гидрохлорида (72,6 мг) в смешанном растворителе из тетрагидрофурана (2 мл) и воды (1 мл) добавляли 1 н. водный раствор гидроксида натрия (0,55 мл) при перемешивании при охлаждении льдом и полученную смесь перемешивали при той же самой температуре в течение 3 минут. К реакционной смеси добавляли 1 н. раствор хлороводородной кислоты (1,00 мл). Реакционную смесь концентрировали в вакууме и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из метанола и дихлорметана (1:4), с получением указанного в заголовке соединения (55,4 мг, выход: 80%) в виде бледно-желтого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д.: 0,81-1,11 (4H, м), 1,82-1,98 (3H, м), 2,27-2,57 (2H, м), 4,02-4,47 (3H, м), 4,93-5,13 (3H, м), 5,77-6,01 (1H, м), 6,63 и 6,66 (общая 1H, каждый с), 7,31-7,66 (5H, м);
ИК (KBr, см-1): 2601, 1711, 1494.
(Пример 94) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2,4-дифторфенил)-2-оксоэтил]-3-{[1H-имидазол-4(5)-ил]метилиден}пиперидина дигидрохлорид (соединение № 1-48)
(a) 2-(2,4-Дифторфенил)-1-циклопропилэтанон
Магний (142 мг) суспендировали в диэтиловом эфире (10 мл) в атмосфере азота и к суспензии добавляли по каплям раствор 4-дифторбензилбромида (1000 мг) в диэтиловом эфире (10 мл) при перемешивании при комнатной температуре. Полученную смесь перемешивали при той же самой температуре в течение 1 часа. К раствору циклопропилцианида (0,36 мл) в диэтиловом эфире (10 мл) добавляли по каплям полученный ранее диэтилэфирный раствор и полученную смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли водный раствор хлорида аммония и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом натрия. Удаляли в вакууме растворитель и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из этилацетата и гексана (1:25), с получением указанного в заголовке соединения (357 мг, выход: 38%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,87-0,93 (2H, м), 1,03-1,10 (2H, м), 1,94-2, 02 (1H, м), 3,84 (2H, с), 6,80-6,89 (2H, м), 7,13-7,20 (1H, м).
(b) 2-Бром-2-(2,4-дифторфенил)-1-циклопропилэтанон
К раствору 2-(2,4-дифторфенил)-1-циклопропилэтанона (329 мг) в тетрахлориде углерода (10 мл) добавляли N-бромсукцинимид (360 мг) и 75% бензоилпероксид при перемешивании при комнатной температуре и полученную смесь кипятили с обратным холодильником в течение 3,5 часов. После фильтрования реакционной смеси к фильтрату добавляли 1 н. водный раствор гидроксида натрия. Полученную смесь экстрагировали этилацетатом и экстракт промывали насыщенным раствором хлорида натрия. Органический слой сушили над безводным сульфатом натрия и удаляли растворитель в вакууме с получением указанного в заголовке соединения (390 мг, выход: 84%) в виде желтого масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,93-1,29 (4H, м), 2,12-2,20 (1H, м), 5,89 (1H, с), 6,80-6,97 (2H, м), 7,47-7,56 (1H, м).
(c) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2,4-дифторфенил)-2-оксоэтил]-3-{[1H-имидазол-4(5)-ил]метилиден}пиперидина дигидрохлорид
Указанное в заголовке соединение синтезировали с выходом 83% в виде бледно-желтого твердого вещества, используя 2-бром-2-(2,4-дифторфенил)-1-циклопропилэтанон вместо 2-бром-2-(2-фторфенил)-1-циклопропилэтанона, последовательным проведением реакций, подобных описанным в примере 21 (d).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,75-0,95 (2H, м), 1,01-1,12 (2H, м), 1,80-2,34 (4H, м), 2,29 и 2,33 (общая 3H, каждый с), 2,40-2,84 (2H, м), 2,77 и 3,15 (общая 1H, каждый д, J=12,5), 4,33-4,46 (1H, м), 4,77 и 4,88 (общая 1H, каждый с), 6,46 (1H, с), 6,85-7,03 (3H, м), 7,19-7,37 (1H, м), 7,65 (1H, с);
ИК (KBr, см-1): 1703, 1506.
(Пример 95) (E)-1-[2-Циклопропил-1-(2,4-дифторфенил)-2-оксоэтил]-3-{[1H-имидазол-4(5)-ил]метилиден}-4-сульфанилпиперидина дигидрохлорид (соединение № 1-47)
Указанное в заголовке соединение синтезировали с выходом 81% в виде бледно-желтого твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2,4-дифторфенил)-2-оксоэтил]-3-{[1H-имидазол-4(5)-ил]метилиден}пиперидина дигидрохлорид вместо (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-2-ил)метилиден]пиперидина, проведением реакции, подобной описанной в примере 8.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,77-0,96 (2H, м), 1,02-1,14 (2H, м), 1,71-1,83 (1H, м), 1,88-2,01 (1H, м), 2,14-2,32 (1H, м), 2,44-2,62 (1H, м), 2,70-2,80 (1H, м), 3,17-3,70 (2H, м), 3,73-3,89 (1H, м), 4,85 и 4,86 (общая 1H, каждый с), 6,47 и 6,49 (общая 1H, каждый с), 6,87-7,09 (3H, м), 7,23-7,33 (1H, м), 7,64-7,73 (1H, с);
ИК (KBr, см-1): 2599, 1709, 1506.
(Пример 96) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2,5-дифторфенил)-2-оксоэтил]-3-{[1H-имидазол-4(5)-ил]метилиден}пиперидина дигидрохлорид (соединение № 1-182)
(a) 2-(2,5-Дифторфенил)-1-циклопропилэтанон
Указанное в заголовке соединение синтезировали с выходом 35% в виде бледно-желтого масла, используя 2,5-дифторбензилбромид вместо 2,4-дифторбензилбромида, последовательным проведением реакций, подобных описанным в примере 94 (a).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,88-0,95 (2H, м), 1,06-1,12 (2H, м), 1,96-2,03 (1H, м), 3,86 (2H, с), 6,89-7,06 (3H, м).
(b) 2-Бром-2-(2,5-дифторфенил)-1-циклопропилэтанон
Указанное в заголовке соединение синтезировали с выходом 85% в виде желтого масла, используя 2-(2,5-дифторфенил)-1-циклопропилэтанон вместо 2-(2,4-дифторфенил)-1-циклопропилэтанона, проведением реакции, подобной описанной в примере 94 (b).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,95-1,25 (4H, м), 2,14-2,21 (1H, м), 5,87 (1H, с), 7,01-7,08 (2H, м), 7,22-7,28 (1H, м).
(c) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2,5-дифторфенил)-2-оксоэтил]-3-{[1H-имидазол-4(5)-ил]метилиден}пиперидина дигидрохлорид
Указанное в заголовке соединение синтезировали с выходом 74% в виде бледно-желтого твердого вещества, используя 2-бром-2-(2,5-дифторфенил)-1-циклопропилэтанон вместо 2-бром-2-(2-фторфенил)-1-циклопропилэтанона, последовательным проведением реакций, подобных описанным в примере 21 (d).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,77-0,96 (2H, м), 1,02-1,13 (2H, м), 1,82-1,91 (1H, м), 1,95-2,08 (1H, м), 2,14-2,28 (1H, м), 2,30 и 2,33 (общая 3H, каждый с), 2,40-2,58 (1H, м), 2,59-2,81 (1H, м), 2,89 и 3,15 (общая 1H, каждый д, J=12,5), 3,65-3,92 (1H, м), 4,40 и 4,43 (общая 1H, каждый т, J=4,5), 4,76 и 4,84 (общая 1H, каждый с), 6,47 (1H, с), 6,96-7,16 (4H, м), 7,62-7,69 (1H, м);
ИК (KBr, см-1): 1701, 1499.
(Пример 97) (E)-1-[2-Циклопропил-1-(2,5-дифторфенил)-2-оксоэтил]-3-{[1H-имидазол-4(5)-ил]метилиден}-4-сульфанилпиперидина дигидрохлорид (соединение № 1-181)
Указанное в заголовке соединение синтезировали с выходом 70% в виде бесцветного твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2,5-дифторфенил)-2-оксоэтил]-3-{[1H-имидазол-4(5)-ил]метилиден}пиперидина дигидрохлорид вместо (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-2-ил)метилиден]пиперидина, проведением реакции, подобной описанной в примере 8.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,78-0,96 (2H, м), 1,04-1,11 (2H, м), 1,72-1,83 (1H, м), 1,94-2,06 (1H, м), 2,16-2,32 (1H, м), 2,47-2,62 (1H, м), 2,71-2,82 (1H, м), 3,23-3,67 (2H, м), 3,77-3,88 (1H, м), 4,84 (1H, с), 6,48 (1H, с), 6,97-7,20 (4H, м), 7,66 (1H, с);
ИК (KBr, см-1): 2598, 1711, 1499.
(Пример 98) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)-1H-пиразол-4-ил]метилиден}пиперидина гидрохлорид (соединение № 2-198)
(a) (E)-3-[(1H-Пиразол-4-ил)метилиден]-1-(трифенилметил)пиперидин-4-он
Указанное в заголовке соединение синтезировали с количественным выходом в виде желтого аморфного твердого вещества, используя (E)-3-{[1-(трет-бутоксикарбонил)-1H-пиразол-4-ил]метилиден}-1-(трифенилметил)пиперидин-4-он вместо (E)-3-{[1-(трет-бутоксикарбонил)-1H-пиразол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 73 (a).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,69 (2H, шс), 2,75 (2H, т, J=6,0), 3,38 (2H, шс), 7,08-7,58 (18H, м).
(b) (E)-3-[(1H-Пиразол-4-ил)метилиден}-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с количественным выходом в виде бледно-желтого аморфного твердого вещества, используя (E)-3-[(1H-пиразол-4-ил)метилиден]-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1 (b).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,83-1,95 (1H, м), 2,08-2,21 (2H, м), 2,69 (2H, шс), 3,43 (1H, шс), 4,16 (1H, т, J=6,0), 6,41 (1H, с), 7,05-7,49 (17Н, м).
(c) (E)-3-{[1-(Метоксикарбонилметил)-1H-пиразол-4-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол
К раствору (E)-3-[(1H-пиразол-4-ил)метилиден]-1-(трифенилметил)пиперидин-4-ола (10,31 г) и метилбромацетата (7,0 мл) в N,N-диметилформамиде (150 мл) добавляли карбонат калия (10,20 г) и иодид калия (12,30 г) при перемешивании при комнатной температуре и полученную смесь кипятили с обратным холодильником в течение 1 часа. После добавления воды реакционную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом магния. Удаляли в вакууме растворитель и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из этилацетата, гексана и дихлорметана (2:1:1), с получением указанного в заголовке соединения (4,74 г, выход: 39%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,62-1,94 (1H, м), 2,08-2,19 (2H, м), 2,61-2,78 (2H, шс), 3,41 (1H, шс), 3,77 (3H, с), 4,16 (1H, м), 4,76 (2H, д, J=4,0), 6,35 (1H, с), 7,08-7,51 (17H, м).
(d) (E)-4-(Ацетилсульфанил)-3-{[1-(метоксикарбонилметил)-1H-пиразол-4-ил]метилиден}пиперидина гидротрифторацетат
Указанное в заголовке соединение синтезировали с выходом 18% в виде бледно-желтого аморфного твердого вещества, используя (E)-3-{[1-(метоксикарбонилметил)-1H-пиразол-4-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол вместо (E)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола, последовательным проведением реакций, подобных описанным в примере 21 (c).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,06 (1H, м), 2,37 (3H, с), 2,39-2,47 (1H, м), 3,21 (1H, шс), 3,38 (1H, д, J=13,5), 3,65-3,77 (1H, м), 4,25 (1H, д, J=13,5 ), 4,57 (1H, т, J=3,5), 4,90 (2H, с), 6,64 (1H, с), 7,50(1H, с), 7,55 (1H, с).
(e) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)-1H-пиразол-4-ил]метилиден}пиперидина гидрохлорид
Указанное в заголовке соединение синтезировали с выходом 43% в виде бледно-желтого аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-3-{[1-(метоксикарбонилметил)-1H-пиразол-4-ил]метилиден}пиперидина гидротрифторацетат вместо (E)-4-(ацетилсульфанил)-3-бензилиденпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 1 (d).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,66-0,86 (2H, м), 0,89-1,05 (2H, м), 1,80-1,92 (1H, м), 2,12-2,35 (2H, м), 2,31 (3H, с), 2,4 6 и 2,55 (общая 1H, каждый дд, J=11,0, 3,0), 2,72 и 2,85 (общая 1H, каждый м), 2,92 и 3,08 (общая 1H, каждый д, J=13,0), 3,64 и 3,70 (общая 1H, каждый д, J=13,0), 3,78 (3H, с), 4,48 (1H, т, J=4,5), 4,70 и 4,72 (общая 1H, каждый с), 4,81 и 4,86 (общая 2H, каждый с), 6,35 и 6,38 (общая 1H, каждый с), 7,05-7,19 (2H, м), 7,27 и 7,32 (общая 1H, каждый с), 7,27-7,37 (1H, м), 7,40 и 7,42 (общая 1H, каждый с), 7,41-7,45 (1H, м);
ИК (KBr, см-1): 1753, 1695, 1493.
(Пример 99) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)-1H-пиразол-4-ил]метилиден}-4-сульфанилпиперидина гидрохлорид (соединение № 2-197)
Указанное в заголовке соединение синтезировали с выходом 48% в виде бледно-желтого аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)-1H-пиразол-4-ил]метилиден}пиперидина гидрохлорид вместо (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-2-ил)метилиден]пиперидина, проведением реакции, подобной описанной в примере 8.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,66-0,86 (2H, м), 0,90-1,04 (2H, м), 1,73-1,82 (1H, м), 2,09-2,19 (1H, м), 2,19-2,34 (1H, м), 2,61 и 2,70 (общая 1H, каждый м), 2,74-2,87 (1H, м), 3,36 и 3,42 (общая 1H, каждый д, J=12,5), 3,44 и 3,48 (общая 1H, каждый д, J=12,5), 3,78 (3H, с), 3,87-3,93 (1H, м), 4,74 и 4,76 (общая 1H, каждый с), 4,82 и 4,86 (общая 2H, каждый с), 6,31 и 6,33 (общая 1H, каждый с), 7,05-7,19 (2H, м), 7,26 и 7,29 (общая 1H, каждый с), 7,28-7,37 (1H, м), 7,39 и 7,42 (общая 1H, каждый с), 7,38-7,46 (1H, м);
ИК (KBr, см-1): 2524, 1748, 1710, 1493.
(Пример 100) (E)-3-{[1-(трет-Бутоксикарбонилметил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-77)
Указанное в заголовке соединение синтезировали с выходом 32% в виде бледно-желтого аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-3-{[1-(трет-бутоксикарбонилметил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидин вместо (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-2-ил)метилиден]пиперидина, проведением реакции, подобной описанной в примере 8.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,65-0,81 (2H, м), 0,86-1,02 (2H, м), 1,48 (9H, с), 1,75-1,83 (1H, м), 2,22-2,35 (2H, м), 2,60-2,79 и 2,83-2,89 (общая 2H, каждый м), 3,54 и 3,66 (общая 1H, каждый д, J=12,5), 3,83 (1H, м), 3,90-3,96 (1H, м), 4,68 и 4,72 (общая 2H, каждый с), 4,70 и 4,72 (общая 1H, каждый с), 6,13 и 6,22 (общая 1H, каждый д, J=2,0), 6,45 и 6,47 (общая 1H, каждый с), 7,04-7,15 (2H, м), 7,26-7,32 (1H, м), 7,33 и 7,37 (общая 1H, каждый д, J=2,0), 7,41-7,47 (1H, м);
ИК (KBr, см-1): 2474, 1745, 1714.
(Пример 101) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(2-оксобутил)-1H-пиразол-3-ил]метилиден}пиперидина гидрохлорид (соединение № 2-134)
(a) (E)-3-{[1-(2-Оксобутил)-1H-пиразол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 76% в виде коричневого аморфного твердого вещества, используя 1-бром-2-бутанон вместо 2-метоксиэтилбромида, проведением реакции, подобной описанной в примере 73 (c).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,03 (3H, т, J=7,0), 1,86-1,94 (1H, м), 2,11-2,18 (2H, м), 2,25-2,31 (2H, м), 2,67-2,70 (2H, м), 3,68-3,92 (1H, м), 4,11-4,19 (1H, м), 4,66 (2H, с), 6,15 (1H, д, J=2,0), 6,49 (1H, с), 7,06-7,22 (9H, м), 7,30 (1H, д, J=2,0), 7,37-7,46 (6H, м).
(b) (E)-4-(Ацетилсульфанил)-3-{[1-(2-оксобутил)-1H-пиразол-3-ил]метилиден}пиперидина гидротрифторацетат
Указанное в заголовке соединение синтезировали с выходом 15% в виде бледно-желтого твердого вещества, используя (E)-3-{[1-(2-оксобутил)-1H-пиразол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол вместо (E)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола, последовательным проведением реакций, подобных описанным в примере 21 (c).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,07 (3H, т, J=7,0), 2,03-2,11 (1H, м), 2,36 (3H, с), 2,43 (2H, кв, J=7,0), 2,44-2,50 (1H, м), 3,15-3,24 (1H, м), 3,33-3,40 (1H, м), 3,78 (1H, д, J=14,5), 4,58 (1H, м), 4,89 и 4,90 (общая 2H, каждый с), 5,04 (1H, д, J=14,5), 6,29 (1H, д, J=2,0), 6,64 (1H, с), 7,35 (1H, д, J=2,0).
(c) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(2-оксобутил)-1H-пиразол-3-ил]метилиден}пиперидина гидрохлорид
Указанное в заголовке соединение синтезировали с выходом 62% в виде желтого аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-3-{[1-(2-оксобутил)-1H-пиразол-3-ил]метилиден}пиперидина гидротрифторацетат вместо (E)-4-(ацетилсульфанил)-3-бензилиденпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 1 (d).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,66-0,83 (2H, м), 0,87-1,01 (2H, м), 1,04 и 1,06 (общая 3H, каждый т, J=7,0), 1,84-1,93 (1H, м), 2,19-2,27 (2H, м), 2,28-2,41 (2H, м), 2,30 (3H, с), 2,43-2,50 и 2,55-2,62 (общая 1H, каждый м), 2,72-2,77 и 2,81-2,86 (общая 1H, каждый м), 3,07 и 3,23 (общая 1H, каждый д, J=13,0), 4,13 и 4,14 (общая 1H, каждый д, J=13,0), 4,50 (1H, м), 4,69 и 4,70 (общая 1H, каждый с), 4,73 и 4,81 (общая 2H, каждый с), 6,15 и 6,24 (общая 1H, каждый д, J=2,5), 6,47 и 6,49 (общая 1H, каждый с), 7,05-7,16 (2H, м), 7,27-7,31 (1H, м), 7,28 и 7,32 (общая 1H, каждый д, J=2,5), 7,40-7,44 (1H, м);
ИК (KBr, см-1): 2514, 1708.
(Пример 102) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(2-оксобутил)-1H-пиразол-3-ил]метилиден}-4-сульфанилпиперидина гидрохлорид (соединение № 2-133)
Указанное в заголовке соединение синтезировали с выходом 93% в виде желтого аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(2-оксобутил)-1H-пиразол-3-ил]метилиден}пиперидина гидрохлорид вместо (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-2-ил)метилиден]пиперидина, проведением реакции, подобной описанной в примере 8.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,66-0,82 (2H, м), 0,87-1,01 (2H, м), 1,05 и 1,06 (общая 3H, каждый т, J=7,5), 1,76-1,84 (1H, м), 2,18-2,32 (2H, м), 2,35 и 2,38 (общая 2H, каждый кв, J=7,5), 2,60-2,66 и 2,67-2,73 (общая 1H, каждый м), 2,73-2,80 и 2,83-2,89 (общая 1H, каждый м), 3,54 и 3,66 (общая 1H, каждый д, J=13,0), 3,83 и 3,84 (общая 1H, каждый д, J=13,0), 3,91-3,96 (1H, м), 4,72 и 4,74 (общая 1H, каждый с), 4,76 и 4,81 (общая 2H, каждый с), 6,15 и 6,24 (общая 1H, каждый д, J=2,0), 6,44 и 6,46 (общая 1H, каждый с), 7,05-7,15 (2H, м), 7,26-7,32 (1H, м), 7,29 и 7,33 (общая 1H, каждый д, J=2,0), 7,39-7,45 (1H, м);
ИК (KBr, см-1): 2500, 1733, 1712.
(Пример 103) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(N-метилкарбамоилметил)-1H-пиразол-3-ил]метилиден]пиперидина гидрохлорид (соединение № 2-110)
Указанное в заголовке соединение синтезировали с выходом 80% в виде бледно-желтого аморфного твердого вещества, используя 40% водный раствор метиламина вместо 28% водного раствора аммиака, проведением реакции, подобной описанной в примере 84.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,68-0,99 (4H, м), 1,83-1,92 (1H, м), 2,06-2,14 (1H, м), 2,22-2,38 (1H, м), 2,31 и 2,32 (общая 3H, каждый с), 2,42-2,49 и 2,55-2,62 (общая 1H, каждый м), 2,68-2,74 и 2,81-2,88 (общая 1H, каждый м), 2,78, 2,79, 2,80 и 2,81 (общая 3H, каждый с), 3,11 и 3,22 (общая 1H, каждый д, J=13,5), 4,23 и 4,32 (общая 1H, каждый д, J=13,5), 4,50 (1H, м), 4,70 и 4,72 (общая 1H, каждый с), 4,73 и 4,76 (общая 2H, каждый с), 6,16 и 6,22 (общая 1H, каждый д, J=2,0), 6,46 и 6,47 (общая 1H, каждый с), 7,04-7,16 (2H, м), 7,24-7,41 (2H, м), 7,30 и 7,34 (общая 1H, каждый д, J=2,0);
ИК (KBr, см-1): 2548, 1691.
(Пример 104) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(N-метилкарбамоилметил)-1H-пиразол-3-ил]метилиден}-4-сульфанилпиперидина гидрохлорид (соединение № 2-109)
Указанное в заголовке соединение синтезировали с выходом 70% в виде бесцветного аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(N-метилкарбамоилметил)-1H-пиразол-3-ил]метилиден}пиперидина гидрохлорид вместо (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-2-ил)метилиден]пиперидина, проведением реакции, подобной описанной в примере 8.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,69-1,00 (4H, м), 1,77-1,84 (1H, м), 2,05-2,13 (1H, м), 2,23-2,37 (1H, м), 2,57-2,63 и 2,66-2,73 (общая 1H, каждый м), 2, 74-2 ,81 и 2,83-2,90 (общая 1H, каждый м), 2,79, 2,80, 2,81 и 2,82 (общая 3H, каждый с), 3,62 и 3,67 (общая 1H, каждый д, J=13,0), 3,92 и 3,99 (общая 1H, каждый д, J=13,0), 3,93 (1H, м), 4,71 и 4,72 (общая 1H, каждый с), 4,79 и 4,85 (общая 2H, каждый с), 6,16 и 6,22 (общая 1H, каждый д, J=2,5), 6,43 и 6,44 (общая 1H, каждый с), 7,05-7,16 (2H, м), 7,28-7,36 (1H, м), 7,32 и 7,35 (общая 1H, каждый д, J=2,5), 7,36-7,41 (1H, м);
ИК (KBr, см-1): 2539, 1711, 1675.
(Пример 105) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(N,N-диметилкарбамоилметил)-1H-пиразол-3-ил]метилиден}пиперидина гидрохлорид (соединение № 2-118)
Указанное в заголовке соединение синтезировали с выходом 78% в виде бледно-желтого аморфного твердого вещества, используя 50% водный раствор диметиламина вместо 28% водного раствора аммиака, проведением реакции, подобной описанной в примере 84.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,64-1,01 (4H, м), 1,83-1,91 (1H, м), 2,22-2,35 (2H, м), 2,30 (3H, с), 2,41-2,48 и 2,56-2,64 (общая 1H, каждый м), 2,71-2,85 (1H, м), 2,97 и 2,98 (общая 3H, каждый с), 3,04 и 3,08 (общая 3H, каждый с), 3,10 и 3,20 (общая 1H, каждый д, J=13,0), 4,12 и 4,16 (общая 1H, каждый д, J=13,0), 4,48-4,52 (1H, м), 4,66 и 4,70 (общая 1H, каждый с), 4,83 и 4,90 (общая 2H, каждый с), 6,12 и 6,21 (общая 1H, каждый д, J=2,0), 6,48 и 6,49 (общая 1H, каждый с), 7,04-7,16 (2H, м), 7,24-7,32 (1H, м), 7,39 и 7, 44 (общая 1H, каждый д, J=2,0), 7,41-7,46 (1H, м);
ИК (KBr, см-1): 2483, 1694, 1666.
(Пример 106) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(N,N-диметилкарбамоилметил)-1H-пиразол-3-ил]метилиден}-4-сульфанилпиперидина гидрохлорид (соединение № 2-117)
Указанное в заголовке соединение синтезировали с выходом 70% в виде бесцветного аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(N,N-диметилкарбамоилметил)-1H-пиразол-3-ил]метилиден}пиперидина гидрохлорид вместо (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-2-ил)метилиден]пиперидина, проведением реакции, подобной описанной в примере 8.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,65-1,00 (4H, м), 1,75-1,83 (1H, м), 2,21-2,35 (2H, м), 2,60-2,70 (1H, м), 2,71-2,78 и 2,83-2,90 (общая 1H, каждый м), 2,98 и 2,99 (общая 3H, каждый с), 3,05 и 3,08 (общая 3H, каждый с), 3,55 и 3,63 (общая 1H, каждый д, J=13,0), 3,83 и 3,87 (общая 1H, каждый д, J=13,0), 3,94 (1H, м), 4,71 и 4,73 (общая 1H, каждый с), 4,85 и 4,90 (общая 2H, каждый с), 6,12 и 6,21 (общая 1Н, каждый д, J=2,5), 6,44 и 6,45 (общая 1H, каждый с), 7,04-7,15 (2H, м), 7,24-7,32 (1H, м), 7,40 и 7,44 (общая 1H, каждый д, J=2,5), 7,41-7,46 (1H, м);
ИК (KBr, см-1): 2447, 1713, 1663.
(Пример 107) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-пиразол-5-ил]метилиден]-4-сульфанилпиперидина гидрохлорид (соединение № 2-381)
(a) (E)-4-(Ацетилсульфанил)-3-{[1-(этоксикарбонилметил)-1H-пиразол-5-ил]метилиден}пиперидина гидротрифторацетат (соединение A) и (E)-4-(ацетилсульфанил)-3-({1-[1,2-бис(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)пиперидина гидротрифторацетат (соединение B)
Указанные в заголовке соединение A (выход: 14%) и соединение B (выход: 13%) получали в виде бесцветного аморфного твердого вещества, соответственно, используя смесь (E)-3-{[1-(этоксикарбонилметил)-1H-пиразол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола и (E)-3-({1-[1,2-бис(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидин-4-ола которые были получены в примере 79, <другой способ синтеза> (a), вместо (E)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола, последовательным проведением реакций, подобных описанным в примере 21 (c).
Соединение A
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,29 (3H, т, J=7,0), 2,04-2,11 (1H, м), 2,38 (3H, с), 2,41-2,51 (1H, м), 3,11-3,20 (1H, м), 3,28-3,35 (1H, м), 3,70 (1H, д, J=14,5), 4,14 (1H, д, J=14,5), 4,22 (2H, кв, J=7,0), 4,57 (1H, м), 4,85 (2H, с), 6,19 (1H, д, J=1,5), 6,62 (1H, с), 7,49 (1H, д, J=1,5).
Соединение B
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,17-1,26 (6H, м), 2,05-2,13 (1H, м), 2,36 (3H, с), 2,40-2,46 (1H, м), 3,12-3,30 (3H, м), 3,38-3,46 (1H, м), 3,76-3,85 (1H, м), 4,0 6-4,25 (4H, м), 4,58 (1H, м), 4,97-5,07 (1H, м), 5,26-5,34 (1H, м), 6,24 (1H, д, J=2,0), 6,63 (1H, с), 7,48 (1Н, д, J=2,0).
(b) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-пиразол-5-ил]метилиден}-4-сульфанилпиперидина гидрохлорид
Смесь указанного в заголовке соединения и (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-пиразол-5-ил]метилиден}пиперидина получали в виде бесцветного аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-3-{[1-(этоксикарбонилметил)-1H-пиразол-5-ил]метилиден}пиперидина гидротрифторацетат вместо (E)-4-(ацетилсульфанил)-3-бензилиденпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 1 (d).
Указанное в заголовке соединение синтезировали с выходом 30% в виде бесцветного аморфного твердого вещества, используя смесь указанных выше соединений вместо (E)-4-(ацетилсульфанил)-3-бензилиден-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина, проведением реакции, подобной описанной в примере 2.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,67-0,83 (2H, м), 0,89-1,01 (2H, м), 1,27 и 1,28 (общая 3H, каждый т, J=7,0), 1,76-1,84 (1H, м), 2,06-2,13 (1H, м), 2,22-2,32 (1H, м), 2,60-2,68 (1H, м), 2,76-2,82 и 2,85-2,92 (общая 1H, каждый м), 3,28 и 3,34 (общая 1H, каждый д, J=13,0), 3,48 и 3,52 (общая 1H, каждый д, J=13,0), 3,79-3,88 (1H, м), 4,22 и 4,23 (общая 2H, каждый кв, J=7,0), 4,71 и 4,72 (общая 1H, каждый с), 4,85 и 4,87 (общая 2H, каждый с), 6,04 и 6,09 (общая 1H, каждый д, J=1,5), 6,28 и 6,29 (общая 1H, каждый с), 7,04-7,16 (2H, м), 7,26-7,37 (2H, м), 7,41 и 7,43 (общая 1H, каждый д, J=1,5);
ИК (KBr, см-1): 2448, 1747, 1713.
(Пример 108) (E)-3-{[1-(Карбоксиметил)-1H-пиразол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-349)
К раствору (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-пиразол-5-ил]метилиден}-4-сульфанилпиперидина гидрохлорида (70 мг) в 3 н. водном растворе хлороводородной кислоты (15 мл) и полученную смесь перемешивали при 50°C в течение 2,5 часов. Реакционную смесь концентрировали в вакууме и остаток очищали препаративной ВЭЖХ [YMC-Pack ODS-A; YMC, подвижная фаза: 25-27% ацетонитрил/вода (0,02% водный раствор хлороводородной кислоты)] с получением указанного в заголовке соединения (50 мг, выход: 75%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, пиридин-d5) δ м.д.: 0,67-0,80 (2H, м), 0,93-1,12 (2H, м), 1,77-1,90 (1H, м), 2,20-2,34 (1H, м), 2,39-2,48 (1H, м), 2,63-2,78 (1H, м), 2,84-2,93 и 2,94-3,04 (общая 1H, каждый м), 3,66-3,74 и 3,79-3,90 (общая 2H, каждый м), 3,95-4,07 (1H, м), 4,95 и 4,96 (общая 1H, каждый с), 5,37 и 5,38 (общая 2H, каждый с), 6,38 и 6,44 (общая 1H, каждый д, J=1,5), 6,86 и 6,90 (общая 1H, каждый с), 7,14-7,25 (2H, м), 7,28-7,36 (1H, м), 7,60-7,70 (1H, м), 7,72 и 7,74 (общая 1H, каждый д, J=1,5);
ИК (KBr, см-1): 2559, 1739, 1711.
(Пример 109) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[1,2-бис(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)пиперидина гидрохлорид (соединение № 2-142)
Указанное в заголовке соединение синтезировали с выходом 33% в виде бледно-желтого аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-3-({1-[1,2-бис(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)пиперидина гидротрифторацетат, полученный в примере 107(a), вместо (E)-4-(ацетилсульфанил)-3-бензилиденпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 1 (d).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,65-0,82 (2H, м), 0,85-1,03 (2H, м), 1,21-1,27 (6H, м), 1,83-1,92 (1H, м), 2,20-2,28 (2H, м), 2,30 (3H, с), 2,39-2,50 и 2,56-2,64 (общая 1H, каждый м), 2,72-2,84 (1H, м), 3,00-3,33 (3H, м), 4,00-4,26 (5H, м), 4,47-4,52 (1H, м), 4,68-4,72 (1H, м), 5,19-5,24 и 5,26-5,31 (общая 1H, каждый м), 6,08 и 6,16 (общая 1H, каждый д, J=2,5), 6,46 и 6,48 (общая 1H, каждый с), 7,04-7,17 (2H, м), 7,26-7,33 (1H, м), 7,37-7,45 (2H, м);
ИК (KBr, см-1): 2505, 1737, 1696.
(Пример 110) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[1,2-бис(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (соединение № 2-141)
Указанное в заголовке соединение синтезировали с выходом 56% в виде бесцветного аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[1,2-бис(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)пиперидина гидрохлорид вместо (E)-4-(ацетилсульфанил)-3-бензилиден-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина, проведением реакции, подобной описанной в примере 2.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,65-0,82 (2H, м), 0,86-1,04 (2H, м), 1,22-1,28 (6H, м), 1,75-1,84 (1H, м), 2,17-2,35 (2H, м), 2,61-2,77 и 2,83-2,89 (общая 2H, каждый м), 3,00-3,32 (2H, м), 3,45-3,66 (1H, м), 3,72-3,98 (2H, м), 4,09-4,27 (4H, м), 4,72-4,77 (1H, м), 5,21-5,31 (1H, м), 6,08 и 6,18 (общая 1H, каждый м), 6,41-6,47 (1H, м), 7,04-7,17 (2H, м), 7,24-7,34 (1H, м), 7,38-7,46 (2H, м);
ИК (KBr, см-1): 2446, 1737.
(Пример 111) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)пиперидина гидрохлорид (соединение № 2-50)
(a) (E)-3-({1-[2-(Этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидин-4-он
К раствору (E)-3-{[1H-пиразол-3(5)-ил]метилиден}-1-(трифенилметил)пиперидин-4-она (2,68 г) в бензоле (30 мл) добавляли по каплям раствор тетрабутиламмонийсульфата (1,64 г) в 50% водном растворе гидроксида натрия (30 мл) при 4°C при перемешивании. К полученной смеси дополнительно добавляли по каплям этил 3-бромпропионат (3,30 мл) при той же самой температуре и полученную смесь перемешивали в течение 10 минут. После добавления к реакционной смеси воды полученную смесь экстрагировали смешанным растворителем из этилацетата и бензола. Экстракт промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом натрия. Удаляли в вакууме растворитель и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из гексана и этилацетата (17:3-7:3), с получением указанного в заголовке соединения (2,61 г, выход: 79%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,24 (3H, т, J=7,5), 2,61-2,78 (6H, м), 3,64 (2H, шс), 4,13 (2H, кв, J=7,5), 4,27 (2H, т, J=7,0), 6,15 (1H, с), 7,13-7,19 (3H, м), 7,23-7,34 (7H, м), 7,42 (1H, с), 7,49-7,56 (6H, м).
(b) (E)-3-({1-[2-(Этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 91% в виде бесцветного аморфного твердого вещества, используя (E)-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1 (b).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,26 (3H, т, J=7,0), 1,86-1,94 (1H, м), 2,09-2,19 (1H, м), 2,55-2,73 (4H, м), 4,09-4,22 {7H, м), 6,04 (1H, д, J=2,5), 6,48 (1H, с), 7,06-7,30 (10H, м), 7,37-7,45 (6H, м).
(c) (E)-4-(Ацетилсульфанил)-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)пиперидина гидротрифторацетат
Указанное в заголовке соединение синтезировали с выходом 19% в виде бесцветного масла, используя (E)-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидин-4-ол вместо (E)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола, последовательным проведением реакций, подобных описанным в примере 21 (c).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,22 (3H, т, J=7,0), 2,12-2,20 (1H, м), 2,38 (3H, с), 2,41-2,50 (1H, м), 2,86 (2H, т, J=7,0), 3,29-3,40 (1H, м), 3,50 (1H, д, J=14,0), 3,83-3,92 (1H, м), 4,13 (2H, кв, J=7,0), 4,43 (2H, т, J=7,0), 4,59 (1H, т, J=4,0), 4,94 (1H, д, J=14,0), 6,21 (1Н, с), 6,68 (1H, с), 7,47 (1H, с).
(d) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)пиперидина гидрохлорид
Указанное в заголовке соединение синтезировали с выходом 71% в виде бесцветного аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)пиперидина гидротрифторацетат вместо (E)-4-(ацетилсульфанил)-3-бензилиденпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 1 (d).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,66-0,82 (2H, м), 0,87-1,05 (2H, м), 1,30 (3H, т, J=7,0), 1,82-1,90 (1H, м), 2,22-2,35 (2H, м), 2,29 (3H, с), 2,39-2,67 (1H, м), 2,71-2,87 (3H, м), 3,18 (1H, д, J=12,5), 4,23 и 4,39 (общая 1H, каждый д, J=12,5), 4,25 (2H, кв, J=7,0), 4,47-4,51 (1H, м), 4,58 и 4,61 (общая 2H, каждый с), 4,68 и 4,74 (общая 1H, каждый с), 6,43 (1H, с), 6,74 и 6,83 (общая 1H, каждый с), 7,03-7,16 (2H, м), 7,26-7,31 (1H, м), 7,34 и 7,39 (общая 1H, каждый с), 7,43-7,50 (1H, м);
ИК (KBr, см-1): 1695, 1495.
(Пример 112) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (соединение № 2-49)
Указанное в заголовке соединение синтезировали с выходом 98% в виде бесцветного аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)пиперидина гидрохлорид вместо (E)-4-(ацетилсульфанил)-3-бензилиден-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина, проведением реакции, подобной описанной в примере 2.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,62-1,02 (4H, м), 1,25 (3H, т, J=7,0), 1,74-1,84 (1H, м), 2,19-2,36 (2H, м), 2,59-2,90 (4H, м), 3,53 и 3,66 (общая 1H, каждый д, J=13,5), 3,81-3,88 (1H, м), 3,90-3,96 (1H, м), 4,14 (2H, кв, J=7,0), 4,28 и 4,32 (общая 2H, каждый т, J=7,0), 4,72 и 4,73 (общая 1H, каждый с), 6,01 и 6,10 (общая 1H, каждый д, J=2,5), 6,42 и 6,44 (общая 1H, каждый с), 7,03-7,16 (2H, м), 7,25-7,34 (2H, м), 7,39-7,47 (1H, м);
ИК (KBr, см-1): 2612, 1716, 1494.
(Пример 113) (E)-3-{[1-(2-Карбоксиэтил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-17)
Указанное в заголовке соединение синтезировали с выходом 95% в виде бесцветного аморфного твердого вещества, используя (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-4-сульфанилпиперидина гидрохлорид вместо (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-пиразол-5-ил]метилиден}-4-сульфанилпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 108.
1H ЯМР (400 МГц, пиридин-d5) δ м.д.: 0,61-0,76 (2H, м), 0,93-1,01 (1H, м), 1,07-1,15 (1H, м), 2,26-2,88 (4H, м), 2,91-3,04 (1H, м), 3,08 и 3,14 (общая 2H, каждый т, J=7,0), 3,83-4,10 (2H, м), 4,30 и 4,41 (общая 1H, каждый д, J=13,0), 4,50 и 4,56 (общая 2H, каждый д, J=7,0), 4,98 (1H, м), 6,24 и 6,31 (общая 1H, каждый д, J=2,0), 6,69 и 6,74 (общая 1H, каждый с), 7,15-7,39 (3H, м), 7,67-7,77 (2H, м);
ИК (KBr, см-1): 2618, 1712, 1494.
(Пример 114) (E)-4-(Ацетилсульфанил)-3-{[1-(2-карбоксиэтил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина гидрохлорид (соединение № 2-18)
К раствору (E)-3-{[1-(2-карбоксиэтил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорида (90 мг) в дихлорметане (4 мл) добавляли уксусный ангидрид (0,09 мл) и триэтиламин (0,13 мл) при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в течение 3,5 часов. Затем добавляли к реакционной смеси воду (0,40 мл). Полученную смесь концентрировали в вакууме и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из метанола и дихлорметана (3:200). К раствору полученного бесцветного аморфного твердого вещества в ацетонитриле (3 мл) добавляли 4 н. раствор хлороводорода в диоксане (0,07 мл) при перемешивании. Реакционную смесь концентрировали в вакууме с получением указанного в заголовке соединения (45 мг, выход: 43%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,66-1,04 (4H, м), 1,83-1,94 (1H, м), 2,06-2,19 (1H, м), 2,25-2,36 (4H, м), 2,42-2,95 (4H, м), 3,20 и 3,22 (общая 1H, каждый д, J=13,5), 4,08-4,36 (3H, м), 4,45-4,52 (1H, м), 4,82 и 4,93 (общая 1H, каждый с), 6,07 и 6,14 (общая 1H, каждый д, J=2,5), 6,46 и 6,48 (общая 1H, каждый с), 7,07-7,37 (4H, м), 7,40-7,47 (1H, м);
ИК (KBr, см-1): 1710, 1494.
(Пример 115) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[3-(этоксикарбонил)пропил]-1H-пиразол-3-ил}метилиден)пиперидина гидрохлорид (соединение № 2-54)
(a) (E)-3-({1-[3-(Этоксикарбонил)пропил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидин-4-он
Указанное в заголовке соединение синтезировали с выходом 72% в виде бесцветного аморфного твердого вещества, используя этил 4-бромбутират вместо трет-бутилбромацетата, проведением реакции, подобной описанной в примере 75 (a).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,26 (3H, т, J=7,5), 2,00 (2H, т, J=7,0), 2,12 (2H, т, J=7,0), 2,60-2,79 (4H, м), 3,34-3,71 (2H, м), 4,06 (2H, т, J=7,0), 4,13 (2H, кв, J-7,5), 6,18 (1H, a), 7,13-7,30 (10H, м), 7,44 (1H, с), 7,48-7,55 (6H, м).
(b) (E)-3-({1-[3-(Этоксикарбонил)пропил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с выходом 99% в виде бесцветного аморфного твердого вещества, используя (E)-3-({1-[3-(этоксикарбонил)пропил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1 (b).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,27 (3H, т, J=7,0), 1,85-2,26 (6H, м), 2,64-2,93 (1H, м), 3,40-3,83 (1H, м), 3,98 (2H, т, J=7,0), 4,09-4,20 (5H, м), 6,05 (1H, с), 6,49 (1H, с), 7,07-7,28 (10H, м), 7,33-7,45 (6H, м).
(c) (E)-4-(Ацетилсульфанил)-3-({1-[3-(этоксикарбонил)пропил]-1H-пиразол-3-ил}метилиден)пиперидина гидротрифторацетат
Указанное в заголовке соединение синтезировали с выходом 19% в виде коричневого масла, используя (E)-3-({1-[3-(этоксикарбонил)пропил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидин-4-ол вместо (E)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола, последовательным проведением реакций, подобных описанным в примере 21 (c).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,24 (3H, т, J=7,0), 2,04-2,19 (3H, м), 2,27 (2H, т, J=7,0), 2,36 (3H, с), 2,40-2,50 (1H, м), 3,18-3,27 (1H, м), 3,35-3,42 (1H, м), 3,81 (1H, д, J=14,5), 4,07-4,17 (4H, м), 4,59 (1H, шс), 5,11 (1H, д, J=14,5), 6,19 (1H, с), 6,63 (1H, с), 7,31 (1H, с).
(d) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[3-(этоксикарбонил)пропил]-1H-пиразол-3-ил}метилиден)пиперидина гидрохлорид
Указанное в заголовке соединение синтезировали с количественным выходом в виде бесцветного аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-3-({1-[3-(этоксикарбонил)пропил]-1H-пиразол-3-ил}метилиден)пиперидина гидротрифторацетат вместо (E)-4-(ацетилсульфанил)-3-бензилиденпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 1 (d).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,63-1,02 (4H, м), 1,26 (3H, т, J=7,0), 1,82-1,93 (1H, м), 2,03-2,35 (7H, м), 2,28 (3H, с), 2,43-2,65 (1H, м), 2,72-2,85 (1H, м), 3,10 и 3,22 (общая 1H, каждый д, J=13,0), 4,01-4,16 (4H, м), 4,50 (1H, т, J=4,5),4,69 и 4,70 (общая 1H, каждый с), 6,03 и 6,12 (общая 1H, каждый д, J=2,5), 6,48 и 6,49 (общая 1H, каждый с), 7,04-7,16 (2H, м), 7,21-7,33 (2H, м).
(Пример 116) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[3-(этоксикарбонил)пропил]-1H-пиразол-3-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (соединение № 2-53)
Указанное в заголовке соединение синтезировали с выходом 90% в виде бледно-желтого аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[3-(этоксикарбонил)пропил]-1H-пиразол-3-ил}метилиден)пиперидина гидрохлорид вместо (E)-4-(ацетилсульфанил)-3-бензилиден-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина, проведением реакции, подобной описанной в примере 2.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,64-0,80 (2H, м), 0,85-1,02 (2H, м), 1,26 (3H, т, J=7,0), 1,75-1,84 (1H, м), 2,06-2,18 (2H, м), 2,21-2,34 (4H, м), 2,60-2,92 (2H, м), 3,54 и 3,64 (общая 1H, каждый д, J=13,0), 3,79-3,86 (1H, м), 3,90-3,96 (1H, м), 4,03-4,17 (4H, м), 4,72 и 4,74 (общая 1H, каждый с), 6,03 и 6,13 (общая 1H, каждый с), 6,44 и 6,46 (общая 1H, каждый с), 7,04-7,15 (2H, м), 7,21-7,31 (2H, м), 7,39-7,46 (1H, м);
ИК (KBr, см-1): 2611, 1728, 1494.
(Пример 117) (E)-3-{[1-(3-Карбоксипропил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-21)
Указанное в заголовке соединение синтезировали с выходом 87% в виде бесцветного аморфного твердого вещества, используя (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[3-(этоксикарбонил)пропил]-1H-пиразол-3-ил}метилиден)-4-сульфанилпиперидина гидрохлорид вместо (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-пиразол-5-ил]метилиден}-4-сульфанилпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 108.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,66-1,04 (4H, м), 2,04-2,37 (5H, м), 2,55-2,76 (2H, м), 2,91-2,99 (1H, м), 3,49-3,66 (2H, м), 3,80-3,99 (2H, м), 4,09-4,22 (2H, м), 4,82 и 4,84 (общая 1H, каждый с), 6,07 и 6,14 (общая 1H, каждый с), 6,45 и 6,50 (общая 1H, каждый с), 7,05-7,41 (5H, м);
ИК (KBr, см-1): 2622, 1711, 1494.
(Пример 118) (E)-4-(Ацетилсульфанил)-3-{[1-(3-карбоксипропил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина гидрохлорид (соединение № 2-22)
Указанное в заголовке соединение синтезировали с выходом 59% в виде бледно-желтого аморфного твердого вещества, используя (E)-3-{[1-(3-карбоксипропил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид вместо (E)-3-{[1-(2-карбоксиэтил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 114.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,66-1,03 (4H, м), 1,83-1,93 (1H, м), 2,04-2,20 (3H, м), 2,25-2,35 (4H, м), 2,38-2,93 (4H, м), 3,15 и 3,25 (общая 1H, каждый д, J=13,0), 3,94-4,23 (3H, м), 4,45 и 4,50 (общая 1H, каждый т, J=4,5), 4,81 и 4,86 (общая 1H, каждый с), 6,07 и 6,15 (общая 1H, каждый д, J=2,0), 6,49 и 6,51 (общая 1H, каждый с), 7,08-7,19 (2H, м), 7,24-7,42 (3H, м);
ИК (KBr, см-1): 1709, 1494.
(Пример 119) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[4-(этоксикарбонил)бутил]-1H-пиразол-3-ил}метилиден)пиперидина гидрохлорид (соединение № 2-58)
(a) (E)-3-({1-[4-(Этоксикарбонил)бутил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидин-4-он
Указанное в заголовке соединение синтезировали с выходом 65% в виде белого твердого вещества, используя этил 5-бромвалерат вместо трет-бутилбромацетата, проведением реакции, подобной описанной в примере 75 (a).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,26 (3H, т, J=7,0), 1,45-1,78 (4H, м), 2,24 (2H, т, J=7,5), 2,60-2,79 (4H, м), 3,58-3,70 (2H, м), 4,00 (2H, т, J=7,0), 4,13 (2H, кв, J=7,0), 6,17 (1H, с), 7,12-7,30 (10H, м), 7,43-7,56 (7H, м).
(b) (E)-3-({1-[4-(Этоксикарбонил)бутил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидин-4-ол
Указанное в заголовке соединение синтезировали с количественным выходом в виде бесцветного аморфного твердого вещества, используя (E)-3-({1-[4-(этоксикарбонил)бутил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидин-4-он вместо (E)-3-бензилиден-1-(трифенилметил)пиперидин-4-она, проведением реакции, подобной описанной в примере 1 (b).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,25 (3H, т, J=7,0), 1,67-1,77 (2H, м), 1,83-1,97 (2H, м), 2,09-2,20 (2H, м), 2,29 (2H, т, J=8,0), 2,60-2,97 (2H, м), 3,92 (2H, т, J=7,0), 4,08-4,22 (5H, м), 6,04 (1H, с), 6,49 (1H, с), 7,06-7,24 (10H, м), 7,32-7,45 (6H, м).
(c) (E)-4-(Ацетилсульфанил)-3-({1-[4-(этоксикарбонил)бутил]-1H-пиразол-3-ил}метилиден)пиперидина гидротрифторацетат
Указанное в заголовке соединение синтезировали с выходом 20% в виде коричневого масла, используя (E)-3-({1-[4-(этоксикарбонил)бутил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидин-4-ол вместо (E)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола, последовательным проведением реакций, подобных описанным в примере 21 (c).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,24 (3H, т, J=7,0), 1,43-1,54 (2H, м), 1,82-1,92 (2H, м), 2,05-2,13 (1H, м), 2,28-2,34 (2H, м), 2,36 (3H, с), 2,39-2,49 (1H, м), 3,19-3,28 (1H, м), 3,36-3,44 (1H, м), 3,81 (1H, д, J=14,5), 4,04-4,15 (4H, м), 4,59 (1H, шс), 5,10 (1H, д, J=14,5), 6,19 (1H, с), 6,64 (1H, с), 7,31 (1H, с).
(d) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[4-(этоксикарбонил)бутил]-1H-пиразол-3-ил}метилиден)пиперидина гидрохлорид
Указанное в заголовке соединение синтезировали с количественным выходом в виде бесцветного аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-3-({1-[4-(этоксикарбонил)бутил]-1H-пиразол-3-ил}метилиден)пиперидина гидротрифторацетат вместо (E)-4-(ацетилсульфанил)-3-бензилиденпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 1 (d).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,63-1,02 (4H, м), 1,25 (3H, т, J=7,0), 1,52-1,66 (2H, м), 1,76-1,93 (3H, м), 2,22-2,35 (7H, м), 2,43-2,65 (1H, м), 2,71-2,85 (1H, м), 3,10 и 3,22 (общая 1H, каждый д, J=12,5), 3,98 и 4,05 (общая 2H, каждый т, J=7,0), 4,07-4,16 (3H, м), 4,50 (1H, т, J=5,0), 4,69 и 4,70 (общая 1H, каждый с), 6,03 и 6,12 (общая 1H, каждый с), 6,48 и 6,50 (общая 1H, каждый с), 7,03-7,16 (2H, м), 7,20-7,32 (2H, м), 7,40-7,45 (1H, м);
ИК (KBr, см-1): 1710, 1495.
(Пример 120) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[4-(этоксикарбонил)бутил]-1H-пиразол-3-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (соединение № 2-57)
Указанное в заголовке соединение синтезировали с выходом 64% в виде бесцветного аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[4-(этоксикарбонил)бутил]-1H-пиразол-3-ил}метилиден)пиперидина гидрохлорид вместо (E)-4-(ацетилсульфанил)-3-бензилиден-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина, проведением реакции, подобной описанной в примере 2.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,63-0,81 (2H, м), 0,84-1,02 (2H, м), 1,25 (3H, т, J=7,0), 1,55-1,92 (5H, м), 2,21-2,36 (4H, м), 2,59-2,92 (2H, м), 3,55 и 3,64 (общая 1H, каждый д, J=12,5), 3,77-3,89 (2H, м), 4,01 и 4,05 (общая 2H, каждый т, J=7,0),4,13 (2H, кв, J=7,0), 4,73 и 4,74 (общая 1H, каждый с), 6,03 и 6,12 (общая 1H, каждый д, J=2,0), 6,45 и 6,47 (общая 1H, каждый с), 7,03-7,15 (2H, м), 7,21-7,33 (2H, м), 7,40-7,47 (1H, м);
ИК (KBr, см-1): 1716, 1495.
(Пример 121) (E)-3-{[1-(4-Карбоксибутил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-25)
Указанное в заголовке соединение синтезировали с выходом 74% в виде бесцветного аморфного твердого вещества, используя (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[4-(этоксикарбонил)бутил]-1H-пиразол-3-ил}метилиден)-4-сульфанилпиперидина гидрохлорид вместо (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-пиразол-5-ил]метилиден}-4-сульфанилпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 108.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,65-0,82 (2H, м), 0,84-1,03 (2H, м), 1,56-1,92 (5H, м), 2,14-2,37 (4H, м), 2,61-2,94 (2H, м), 3,55-4,14 (5H, м), 4,78 и 4,80 (общая 1H, каждый с), 6,04 и 6,13 (общая 1H, каждый д, J=2,0), 6,44 и 6,46 (общая 1H, каждый с), 7,06-7,16 (2H, м), 7,21-7,33 (2H, м), 7,38-7,43 (1H, м);
ИК (KBr, см-1): 2614, 1711, 1495.
(Пример 122) (E)-4-(Ацетилсульфанил)-3-{[1-(4-карбоксибутил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина гидрохлорид (соединение № 2-26)
Указанное в заголовке соединение синтезировали с выходом 37% в виде бледно-желтого твердого вещества, используя (E)-3-{[1-(4-карбоксибутил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид вместо (E)-3-{[1-(2-карбоксиэтил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 114.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,63-1,04 (4H, м), 1,54-1,70 (2H, м), 1,80-2,36 (9H, м), 2,37-2,47 и 2,60-2,69 (общая 1H, каждый м), 2,74-2,87 (1H, м), 3,13-3,21 (1H, м), 3,98-4,26 (4H, м), 4,46-4,53 (1H, м), 4,75 и 4,79 (общая 1H, каждый с), 6,05 и 6,13 (общая 1H, каждый д, J=2,5), 6,48 и 6,49 (общая 1H, каждый с), 7,06-7,45 (5H, м);
ИК (KBr, см-1): 1709, 1494.
(Пример 123) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(N-гидроксикарбамоилметил)-1H-пиразол-3-ил]метилиден}пиперидин (соединение № 2-86)
К раствору (E)-4-(ацетилсульфанил)-3-{[1-(карбоксиметил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина (300 мг) в диэтиловом эфире (5 мл) добавляли по каплям этилхлорформиат (0,073 мл) и N-метилморфолин (0,091 мл) при охлаждении льдом и полученную смесь перемешивали при той же самой температуре в течение 15 минут. Затем к реакционной смеси добавляли раствор гидроксиламина, полученного из гидроксиламингидрохлорида (67 мг) и гидроксида калия (54 мг), в метаноле (5 мл). Полученную смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь концентрировали в вакууме и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из этилацетата и дихлорметана (5:1), с получением указанного в заголовке соединения (160 мг, выход: 51%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,71-1,01 (4H, м), 1,84-1,91 (1H, м), 2,00-2,09 (1H, м), 2,21-2,40 (1H, м), 2,30 и 2,32 (общая 3H, каждый с), 2,39-2,47 и 2,52-2,60 (общая 1H, каждый м), 2,65-2,73 и 2,81-2,88 (общая 1H, каждый м),3,08 и 3,20 (общая 1H, каждый д, J=13,5), 4,32 и 4,37 (общая 1H, каждый д, J=13,5), 4,48 (1H, м), 4,72 и 4,77 (общая 2H, каждый с), 4,78 и 4,81 (общая 1H, каждый с), 6,16 и 6,22 (общая 1H, каждый д, J=2,0), 6,44 и 6,45 (общая 1H, каждый с), 7,07-7,18 (2H, м), 7,28-7,40 (2H, м), 7,34 и 7,38 (общая 1H, каждый д, J=2,0).
(Пример 124) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(N-гидроксикарбамоилметил)-1H-пиразол-3-ил]метилиден}-4-сульфанилпиперидина гидрохлорид (соединение № 2-85)
Указанное в заголовке соединение синтезировали с выходом 20% в виде бесцветного аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(N-гидроксикарбамоилметил)-1H-пиразол-3-ил]метилиден}пиперидин вместо (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-2-ил)метилиден]пиперидина, проведением реакции, подобной описанной в примере 8.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,70-1,03 (4H, м), 1,76-1,85 (1H, м), 2,00-2,08 (1H, м), 2,22-2,40 (1H, м), 2,54-2,61 и 2,64-2,71 (общая 1H, каждый м), 2,72-2,79 и 2 , 81-2,88 (общая 1H, каждый м), 3,63 и 3,69 (общая 1H, каждый д, J=12,5),3,91 (1H, м), 3,96 и 4,00 (общая 1H, каждый д, J=12,5), 4,73 (1H, с), 4,77, 4,78, 4,82, и 4,83 (общая 2H, каждый с), 6,16 и 6,21 (общая 1H, каждый д, J=2,0), 6,41 и 6,42 (общая 1H, каждый с), 7,08-7,17 (2H, м), 7,28-7,41 (2H, м), 7,36 и 7,39 (общая 1H, каждый д, J=2,0);
ИК (KBr, см-1): 2555, 1708.
(Пример 125) (E)-3-{[1-(Карбоксиметил)-1H-пиразол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-181)
Указанное в заголовке соединение синтезировали с выходом 38% в виде бледно-желтого аморфного твердого вещества, используя (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)-1H-пиразол-4-ил]метилиден}-4-сульфанилпиперидин вместо (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-пиразол-5-ил]метилиден}-4-сульфанилпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 108.
1H ЯМР (400 МГц, пиридин-d5) δ м.д.: 0,69-0,76 (2H, м), 0,96-1,12 (2H, м), 1,85-1,С7 (1H, м), 2,27-2,44 (2H, м), 2,58 ana 2,71 (общая 1H, каждый м), 2,89-3,01 (1H, м), 3,59-3,87 (2H, м), 4,03 (1H, шс), 4,94 и 4,95 (общая 1H, каждый с), 5,29 и 5,32 (общая 2H, каждый с), 6,55 и 6,56 (общая 1H, каждый с), 7,17-7,22 (2H, м), 7,23-7,35 (1H, м), 7,65-7,80 (1H, м), 7,74 и 7,79 (общая 1H, каждый с), 7,82 и 7,91 (общая 1H, каждый с);
ИК (KBr, см-1): 2520, 1742, 1710.
(Пример 126) (E)-4-(Ацетилсульфанил)-3-{[1-(карбоксиметил)-1H-пиразол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина гидрохлорид (соединение № 2-182)
Указанное в заголовке соединение синтезировали с выходом 60% в виде бледно-желтого аморфного твердого вещества, используя (E)-3-{[1-(карбоксиметил)-1H-пиразол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид вместо (E)-3-{[1-(2-карбоксиэтил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорида, проведением реакции, подобной описанной в примере 114.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,67-0,91 (2H, м), 0,95-1,07 (2H, м), 1,72-1,96 (2H, м), 2,27 и 2,31 (общая 3H, каждый с), 2,27-2,46 (2H, м), 2,82-2,90 и 2,93-2,99 (общая 1H, каждый м), 3,07 и 3,31 (общая 1H, каждый д, J=13,0), 3,69 и 3,93 (общая 1H, каждый д, J=13,0), 4,35-4,41 и 4,46-4,50 (общая 1H, каждый м), 4,74-4,85 (2H, м), 5,11 и 5,29 (общая 1H, каждый с), 6,41 и 6,46 (общая 1H, каждый с), 7,11-7,31 (2H, м), 7,34-7,46 (3H, м), 7,51 и 7,63 (общая 1H, каждый с);
ИК (KBr, см-1): 1741, 1705.
(Пример 127) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)пиррол-3-ил]метилиден}пиперидина гидрохлорид (соединение № 2-658)
(a) (E)-3-{[1-(Метоксикарбонилметил)пиррол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол
К раствору (E)-3-{[1-(этоксикарбонилметил)пиррол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-она (19,4 г) в этаноле (100 мл) добавляли борогидрид натрия (3,0 г) при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли водный раствор хлорида аммония и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом натрия и удаляли растворитель в вакууме. К раствору остатка в метаноле (100 мл) добавляли карбонат калия (10,6 г) и полученную смесь перемешивали при комнатной температуре в течение 15 минут. К реакционной смеси добавляли воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом натрия. Удаляли растворитель в вакууме с получением указанного в заголовке соединения (12,1 г, выход: 64%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,82-1,92 (1H, м), 2,12 (1H, м), 2,23 (1H, м), 2,54 (1H, м), 3,03 (1H, м), 3,30 (1H, м), 3,76 (3H, с), 4,16 (1H, м), 4,48 (2H, с), 6,02 (1H, дд, J=3,0, 2,0), 6,35 (1H, шс), 6,44 (1H, т, J=2,0), 6,51 (1H, т, J=3,0), 7,08-7,30 (7H, м), 7,43-7,51 (8H, м).
(b) (E)-4-(Ацетилсульфанил)-3-{[1-(метоксикарбонилметил)пиррол-3-ил]метилиден}-1-(трифенилметил)пиперидин
К раствору (E)-3-{[1-(метоксикарбонилметил)пиррол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола (12,1 г) в толуоле (100 мл) добавляли тиоуксусную кислоту (3,5 мл) и динеопентилацеталь N,N-диметилформамида (13,7 мл) при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в течение 30 минут. К реакционной смеси добавляли воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом магния. Удаляли в вакууме растворитель и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из этилацетата и гексана (1:3). Полученное аморфное твердое вещество растворяли в метаноле (100 мл) и полученную смесь перемешивали при 50°C 2 дней. Реакционную смесь концентрировали в вакууме с получением указанного в заголовке соединения (12,8 г, выход: 95%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,83-1,95 (1H, м), 1,98-2,12 (1H, м), 2,24 (3H, с), 2,32-2,43 (1H, м), 2,50-2,74 (2H, м), 3,65-3,80 (1H, м), 3,74 (3H, с), 4,46 (2H, с), 4,47-4,54 (1H, м), 5,98 (1H, шс), 6,40 (1H, шс), 6,41 (1H, шс), 6,48 (1H, т, J=3,0), 7,07-7,33 (7H, м), 7,41-7,51 (8H, м).
(c) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)пиррол-3-ил]метилиден}пиперидина гидрохлорид
К раствору (E)-4-(ацетилсульфанил)-3-{[1-(метоксикарбонилметил)пиррол-3-ил]метилиден}-1-(трифенилметил)пиперидина (3,47 г) в дихлорметане (100 мл) добавляли трифторуксусную кислоту (1,2 мл) при охлаждении льдом и полученную смесь перемешивали при той же самой температуре в течение 5 минут. Реакционную смесь концентрировали в вакууме и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из метанола и дихлорметана (20:1-1:4) с получением производного детрифенилметила.
К раствору указанного выше соединения и 2-бром-2-(2-фторфенил)-1-циклопропилэтанона (3,24 г) в N,N-диметилформамиде (50 мл) добавляли триэтиламин (1,8 мл) при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в течение 1 часа. После перемешивания добавляли к реакционной смеси воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом магния. Удаляли в вакууме растворитель и остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смешанный растворитель из этилацетата, гексана и дихлорметана (1:3:1), с получением указанного в заголовке соединения (1,48 г, выход: 45%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,64-0,84 (2H, м), 0,86-1,04 (2H, м), 1,79-1,91 (1H, м), 2,16-2,35 (2H, м), 2,29 (3H, с), 2,35-2,44 и 2,51-2,60 (общая 1H, каждый м), 2,69-2,77 и 2,80-2,87 (общая 1H, каждый м), 2,94 и 3,03 (общая 1H, каждый д, J=13,0), 3,76 (3H, с), 3,78 и 3,93 (общая 1H, каждый д, J=13,0), 4,50 (1H, м), 4,51 и 4,56 (общая 2H, каждый с), 4,65 и 4,68 (общая 1H, каждый с), 5,97 и 6,11 (общая 1Н, каждый дд, J=3,0, 2,0), 6,38 и 6,41 (общая 1H, каждый с), 6,43 и 6,50 (общая 1H, каждый т, J=2,0), 6,54-6,58 (1H, м), 7,04-7,17 (2H, м), 7,26-7,34 (1H, м), 7,44-7,50 (1H, м);
ИК (KBr, см-1): 1752, 1708, 1693.
(Пример 128) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2,4,5-трифторфенил)-2-оксоэтил]-3-{[1H-имидазол-4(5)-ил]метилиден}пиперидина дигидрохлорид (соединение № 1-184)
(a) 2-(2,4,5-Трифторфенил)-1-циклопропилэтанон
Указанное в заголовке соединение синтезировали с выходом 70% в виде бледно-желтого масла, используя 2,4,5-трифторбензилбромид вместо 2,4-дифторбензилбромида, последовательным проведением реакций, подобных описанным в примере 94 (a).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,90-0,97 (2H, м), 1,06-1,12 (2H, м), 1,95-2,03 (1H, м), 3,83 (2H, с), 6,88-6,97 (1H, м), 6,99-7,17 (1H, м).
(b) 2-Бром-2-(2,4,5-трифторфенил)-1-циклопропилэтанон
Указанное в заголовке соединение синтезировали с выходом 50% в виде бесцветного игольчатого кристалла, используя 2-(2,4,5-трифторфенил)-1-циклопропилэтанон вместо 2-(2,4-дифторфенил)-1-циклопропилэтанона, проведением реакции, подобной описанной в примере 94 (b).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,98-1,24 (4H, м), 2,15-2,22 (1H, м), 5,83 (1H, с), 6,92-6,99 (1H, м), 7,37-7,45 (1H, м).
(c) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2,4,5-трифторфенил)-2-оксоэтил]-3-{[1H-имидазол-4(5)-ил]метилиден}пиперидина дигидрохлорид
Указанное в заголовке соединение синтезировали с выходом 51% в виде бледно-желтого твердого вещества, используя 2-бром-2-(2,4,5-трифторфенил)-1-циклопропилэтанон вместо 2-бром-2-(2-фторфенил)-1-циклопропилэтанона, проведением реакции, подобной описанной в примере 21 (d).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,96-1,30 (4H, м), 1,89-2,01 (1H, м), 2,11-2,24 (1H, м), 2,37 и 2,38 (общая 3H, каждый с), 2,44-2,66 (1Н, м), 3,21-3,55 (2H, м), 3,92-4,39 (2H, м), 4,58 и 4,63 (общая 1H, каждый т, J=5,0), 4,85 (1H, с), 6,00 и 6,06 (общая 1H, каждый с), 6,81 и 6,83 (общая 1H, каждый с), 7,53 (1H, м), 7,61-7,76 (1H, м), 7,78 и 7,85 (общая 1H, каждый с);
ИК (KBr, см-1): 2596, 1702, 1520.
(Пример 129) (E)-1-[2-Циклопропил-1-(2,4,5-трифторфенил)-2-оксоэтил]-3-{[1H-имидазол-4(5)-ил]метилиден}-4-сульфанилпиперидина дигидрохлорид (соединение № 1-183)
Указанное в заголовке соединение синтезировали с выходом 86% в виде бесцветного твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2,4,5-трифторфенил)-2-оксоэтил]-3-{[1H-имидазол-4(5)-ил]метилиден}пиперидина дигидрохлорид вместо (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-2-ил)метилиден]пиперидина, проведением реакции, подобной описанной в примере 8.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,79-0,96 (2H, м), 1,01-1,11 (2H, м), 1,73-1,82 (1H, м), 1,98-2,11 (1H, м), 2,16-2,32 (1H, м), 2,45-2,62 (1H, м), 2,70-2,82 (1H, м), 3,41-3,66 (1H, м), 3,46 и 3,64 (общая 1H, каждый д, J=12,5), 3,82-3,88 (1H, м), 4,77 (1H, с), 6,46 и 6,48 (общая 1H, каждый с), 6,95-7,05 (1H, м), 6,98 и 7,00 (общая 1H, каждый с), 7,16-7,27 (1H, м), 7,64 и 7,65 (общая 1H, каждый с);
ИК (KBr, см-1): 2599, 1710, 1520.
(Пример 130) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2,3,4-трифторфенил)-2-оксоэтил]-3-{[1H-имидазол-4(5)-ил]метилиден}пиперидина дигидрохлорид (соединение № 1-186)
(a) 2-(2,3,4-Трифторфенил)-1-циклопропилэтанон
Указанное в заголовке соединение синтезировали с выходом 66% в виде белого твердого вещества, используя 2,3,4-трифторбензилбромид вместо 2,4-дифторбензилбромида, последовательным проведением реакций, подобных описанным в примере 94 (a).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,91-0,97 (2H, м), 1,06-1,12 (2H, м), 1,96-2,04 (1H, м), 3,88 (2H, с), 6,86-6,96 (2H, м).
(b) 2-Бром-2-(2,3,4-трифторфенил)-1-циклопропилэтанон
Указанное в заголовке соединение синтезировали с выходом 52% в виде желтого масла, используя 2-(2,3,4-трифторфенил)-1-циклопропилэтанон вместо 2-(2,4-дифторфенил)-1-циклопропилэтанона, проведением реакции, подобной описанной в примере 94 (b).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,96-1,24 (4H, м), 2,15-2,24 (1H, м), 5,85 (1H, с), 6,98-7,07 (1H, м), 7,22-7,31 (1H, м).
(c) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2,3,4-трифторфенил)-2-оксоэтил]-3-{[1H-имидазол-4(5)-ил]метилиден}пиперидина дигидрохлорид
Указанное в заголовке соединение синтезировали с выходом 33% в виде бледно-желтого твердого вещества, используя 2-бром-2-(2,3,4-трифторфенил)-1-циклопропилэтанон вместо 2-бром-2-(2-фторфенил)-1-циклопропилэтанона, последовательным проведением реакций, подобных описанным в примере 21 (d).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,95-1,30 (4H, м), 1,90-1,99 (1H, м), 2,12-2,24 (1H, м), 2,37 (3H, с), 2,42-2,62 (1H, м), 3,18-3,36 (2H, м), 3,88-4,35 (2H, м), 4,57 и 4,62 (общая 1H, каждый т, J=5,0), 4,86 (1H, с), 6,03 и 6,09 (общая 1H, каждый с), 6,80 и 6,83 (общая 1H, каждый с), 7,33-7,61 (2H, м), 7,76 и 7,84 (общая 1H, каждый с);
ИК (KBr, см-1): 2596, 1701, 1490.
(Пример 131) (E)-1-[2-Циклопропил-1-(2,3,4-трифторфенил)-2-оксоэтил]-3-{[1H-имидазол-4(5)-ил]метилиден}-4-сульфанилпиперидина дигидрохлорид (соединение № 1-185)
Указанное в заголовке соединение синтезировали с выходом 97% в виде бесцветного твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2,3,4-трифторфенил)-2-оксоэтил]-3-{[1H-имидазол-4(5)-ил]метилиден}пиперидина дигидрохлорид вместо (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(фуран-2-ил)метилиден]пиперидина, проведением реакции, подобной описанной в примере 8.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,78-0,96 (2H, м), 1,11-1,21 (2H, м), 1,72-1,83 (1H, м), 1,94-2,08 (1H, м), 2,16-2,31 (1H, м), 2,45-2,54 и 2,55-2,64 (общая 1H, каждый м), 2,71-2,82 (1H, м), 3,32-3,58 (1H, м), 3,41 и 3,64 (общая 1H, каждый д, J=12,5), 3,77-3,88 (1H, м), 4,81 и 4,82 (общая 1H, каждый с), 6,45 (1H, с), 6,93-7,18 (2H, м), 6,96 и 6,97 (общая 1H, каждый с);7,61 (1H, с);
ИК (KBr, см-1): 2599, 1711, 1490.
(Пример 132) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-5-ил}метилиден)пиперидина гидрохлорид (соединение № 2-1230)
(a) Метил 3-[5-(гидроксиметил)-1H-1,2,3-триазол-1-ил]пропаноат и метил 3-[4-(гидроксиметил)-1H-1,2,3-триазол-1-ил]пропаноат
К раствору метил 3-азидопропаноата (41,9 г) в толуоле (800 мл) добавляли пропаргиловый спирт (25,0 г) и полученную смесь перемешивали при 110°C в течение 20 часов. После охлаждения смеси до комнатной температуры ее концентрировали при пониженном давлении с получением неочищенной изомерной смеси двух указанных в заголовке соединений (51,52 г, общий выход: 86%, изомерное отношение: приблизительно 1:1) в виде масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,94 и 3,07 (общая 2H, каждый т, J=7,0), 3,65 и 3,67 (общая 3H, каждый с), 4,57-4,64 (2H, м), 4,72 и 4,76 (общая 2H, каждый с), 7,51 и 7,62 (общая 1H, каждый с).
Полученный продукт использовали на следующей стадии без дополнительной очистки.
(b) Метил 3-(5-формил-1H-1,2,3-триазол-1-ил)пропаноат и метил 3-(4-формил-1H-1,2,3-триазол-1-ил)пропаноат
К перемешиваемому раствору неочищенного продукта (51,52 г), полученного в процессе, описанном выше, в дихлорметане (800 мл) добавляли молекулярные сита 4A (100 г) и пиридинийдихромат (160 г) и полученную смесь перемешивали при комнатной температуре в течение 30 минут. После фильтрования реакционной смеси фильтрат промывали 1 н. водным раствором хлороводородной кислоты и органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. После выпаривания растворителя при пониженном давлении остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (20:1), с получением смеси двух указанных в заголовке изомеров (17,14 г, выход: 34%, изомерное отношение: приблизительно 1:1) в виде масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,98 и 3,00 (общая 2H, каждый т, J=7,0), 3,66 и 3,68 (общая 3H, каждый с), 4,71 и 4,96 (общая 2H, каждый т, J=7,0), 8,82 и 8,83 (общая 1H, каждый с), 10,00 и 10,01 (общая 1H, каждый с).
(c) (E)-3-({1-[2-(Метоксикарбонил)этил]-1H-1,2,3-триазол-5-ил}метилиден)-1-(трифенилметил)пиперидин-4-он и (E)-3-({1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-4-ил}метилиден)-1-(трифенилметил)пиперидин-4-он
К раствору 1-(трифенилметил)пиперидин-4-она (32,0 г) в бензоле (500 мл) добавляли пирролидин (7,8 мл) и полученную смесь кипятили с обратным холодильником в течение 3 часов, удаляя воду с помощью аппарата Дина-Старка. После охлаждения до комнатной температуры добавляли смесь (17,14 г) метил 3-(5-формил-1H-1,2,3-триазол-1-ил)пропаноата и метил 3-(4-формил-1H-1,2,3-триазол-1-ил)пропаноата, которая была получена, как описано выше. Полученную смесь кипятили с обратным холодильником в течение еще 3 часов. После охлаждения смеси до комнатной температуры и разбавления водой продукты экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. После выпаривания растворителя при пониженном давлении остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана, этилацетата и дихлорметана (1:1:1), с получением смеси двух указанных в заголовке изомеров (32,89 г, выход: 69%, изомерное отношение: приблизительно 1:1) в виде масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,62-2,83 (общая 4H, м), 2,89 и 3,02 (общая 2H, каждый т, J=6,5), 3,37 и 3,57 (общая 2H, каждый шс), 3,62 и 3,69 (общая 3H, с), 4,59 и 4,65 (общая 2H, каждый т, J=6,5), 7,11-7,58 (17H, м).
Смесь дополнительно очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана и этилацетата (1:1), с получением менее полярного изомера (E)-3-({1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-5-ил}метилиден)-1-(трифенилметил)пиперидин-4-она (12,87 г), более полярного изомера (E)-3-({1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-4-ил}метилиден)-1-(трифенилметил)пиперидин-4-она (13,36 г) и смеси (5,21 г) двух указанных изомеров, все в виде бледно-желтых аморфных твердых веществ.
(d) (E)-3-({1-[2-(Метоксикарбонил)этил]-1H-1,2,3-триазол-5-ил}метилиден)-1-(трифенилметил)пиперидин-4-ол
(E)-3-({1-[2-(Метоксикарбонил)этил]-1H-1,2,3-триазол-5-ил}метилиден)-1-(трифенилметил)пиперидин-4-он (12,87 г) растворяли в смешанном растворителе из дихлорметана (100 мл) и метанола (100 мл). Перемешивая раствор при 0°C, добавляли к нему борогидрид натрия (480 мг). Полученную смесь перемешивали при 0°C в течение 30 минут и останавливали реакцию добавлением насыщенного водного раствора хлорида аммония. Продукт экстрагировали дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Удаляли растворитель при пониженном давлении с получением неочищенного указанного в заголовке соединения (13,22 г) в виде бледно-желтого аморфного твердого вещества. Полученный продукт использовали в следующем процессе без дополнительной очистки.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,85-1,95 (2H, м), 2,11-2,17 (1H, м), 2,18-2,24 (2H, м), 2,90-2,98 (1H, м), 3,05 (2H, т, J=7,0), 3,68 (3H, с), 4,13 (1H, шс), 4,56 (2H, дт, J=7,0, 2,5), 6,45 (1H, с), 7,07-7,18 (10H, м), 7,30-7,35 (6H, м).
(e) (E)-4-(Ацетилсульфанил)-3-({1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-5-ил}метилиден)-1-(трифенилметил)пиперидин и 5-((ацетилсульфанил){1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-5-ил}метил)-1-(трифенилметил)-1,2,3,6-тетрагидропиридин
К раствору (E)-3-({1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-5-ил}метилиден)-1-(трифенилметил)пиперидин-4-ола (13,22 г) в толуоле (200 мл) добавляли тиоуксусную кислоту (3,7 мл) и динеопентилацеталь N,N-диметилформамида (14,5 мл) при перемешивании при комнатной температуре и полученную смесь перемешивали при той же самой температуре в течение 2 часов. После добавления водного раствора хлорида натрия продукты экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом магния. После выпаривания растворителя при пониженном давлении остаток очищали хроматографией на силикагеле, используя в качестве элюента смешанный растворитель из этилацетата и гексана (2:1), с получением 5-((ацетилсульфанил){1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-5-ил}метил)-1-(трифенилметил)-1,2,3,6-тетрагидропиридина (8,17 мг, выход: 55%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,13-2,33 (2H, м), 2,29 (3H, с), 2,34-2,48 (1H, м), 2,71 (1H, д, J=15,0), 2,8 6-3,11 (4H, м), 3,65 (3H, с), 4,43-4,50 (2H, м), 5,12 (1H, с), 5,59 (1H, шс), 7,08-7,50 (15H, м), 7,55 (1H, с).
Дополнительное элюирование смешанным растворителем из этилацетата и гексана (1:1) дало (E)-4-(ацетилсульфанил)-3-({1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-5-ил}метилиден)-1-(трифенилметил) пиперидин (4,27 г, выход: 29%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,91-2,02 (1H, м), 2,08-2,25 (1H, м), 2,28 (3H, с), 2,34-2,47 (1H, м), 2,59-2,78 (2H, м), 3,03 (2H, т, J=7,0), 3,27-3,45 (1H, м), 3,72 (3H, с), 4,46-4,53 (1H, м), 4,57 (2H, т, J=7,0), 6,43 (1H, с), 7,08-7,51 (16H, м).
(f) (E)-4-(Ацетилсульфанил)-3-({1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-5-ил}метилиден)пиперидина гидротрифторацетат
К раствору (E)-4-(ацетилсульфанил)-3-({1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-5-ил}метилиден)-1-(трифенилметил)пиперидина (4,27 г) в дихлорметане (100 мл) добавляли трифторуксусную кислоту (1,2 мл) при перемешивании при 0°C. Полученную смесь перемешивали при 0°C в течение 15 минут и растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (10:1), с получением указанного в заголовке соединения (2,0 мг, выход: 61%) в виде желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,09-2,21 (1H, м), 2,38 (3H, с), 2,46-2,58 (1H, м), 3,04 (2H, т, J=6,0), 3,21-3,36 (1H, м), 3,51 (1H, д, J=13,5), 3,64 (3H, с), 3,83-3,94 (1H, м), 4,10 (1H, д, J=13,5), 4,52 (2H, т, J=6,0), 4,60-4,65 (1H, м), 6,82 (1H, с), 7,92 (1H, с).
(g) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-5-ил}метилиден)пиперидина гидрохлорид
К раствору (E)-4-(ацетилсульфанил)-3-({1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-5-ил}метилиден)пиперидина гидротрифторацетата (3,5 г) в ацетонитриле (100 мл) добавляли 2-бром-2-(2-фторфенил)-1-циклопропилэтанон (4,1 г) и триэтиламин (3,3 мл) и полученную смесь перемешивали при комнатной температуре в течение 15 минут. После добавления водного раствора хлорида натрия продукты экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом магния. После выпаривания растворителя при пониженном давлении остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана, этилацетата и дихлорметана (1:2:1), с получением свободного основания указанного в заголовке соединения (1,97 г) в виде бледно-желтого аморфного твердого вещества.
Полученное свободное основание обрабатывали хлороводородом (4 н. диоксановый раствор, 4 мл). Растворитель и избыточный хлороводород удаляли при пониженном давлении с получением указанного в заголовке соединения (2,2 г, выход: 51%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,64-0,87 (2H, м), 0,91-1,05 (2H, м), 1,79-1,94 (1H, м), 1,95-2,04 (1H, м), 2,20-2,40 (1H, м), 2,31 и 2,32 (общая 3H, каждый с), 2,43-2,62 (1H, м), 2,72-2,89 (1H, м), 2,90-3,21 (3H, м), 3,43-3,54 (1H, м), 3,68 и 3,70 (общая 3H, каждый с), 4,40-4,54 (3H, м), 4,73 и 4,74 (общая 1H, каждый с), 6,40 (1H, с), 7,05-7,18 (2H, м), 7,21-7,38 (2H, м), 7,39 и 7,45 (общая 1H, каждый с);
ИК (KBr, см-1): 2471, 1737, 1699.
(Пример 133) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-1,2,3-триазол-5-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (соединение № 2-1245)
Хлороводород пропускали через раствор (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-5-ил}метилиден)пиперидина гидрохлорида (2,0 г) в этаноле (5,0 мл) при перемешивании при 0°C в течение одного часа и полученную смесь перемешивали при комнатной температуре в герметически закрытом состоянии в течение 4 часов. После того как реакционную смесь концентрировали при пониженном давлении, остаток очищали, используя препаративную ВЭЖХ [YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. водный раствор хлороводородной кислоты (33:67, об./об.)]. Элюат обрабатывали хлороводородом (4 н. диоксановый раствор, 2 мл). Растворитель и избыточный хлороводород удаляли при пониженном давлении с получением указанного в заголовке соединения (1,29 г, выход: 68 %) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,66-0,83 (2H, м), 0,92-1,02 (2H, м), 1,19-1,27 (3H, м), 1,78-1,8 6 (1H, м), 1,95-2,02 (1H, м), 2,24-2,34 (1H, м), 2,62-2,70 (1H, м), 2,80-2,91 (1H, м), 2,92-3,01 (2H, м), 3,18 и 3,54 (общая 1H, каждый д, J=13,0), 3,25 и 3,40 (общая 1H, каждый д, J=13,0), 3,83-3,89 (1H, м), 4,08-4,17 (2H, м), 4,46-4,53 (2H, м), 4,74 и 4,75 (общая 1H, каждый с), 6,40 и 6,41 (общая 1H, каждый с), 7,05-7,17 (2H, м), 7,24-7,35 (2H, м), 7,38 и 7,44 (общая 1H, каждый с);
ИК (KBr, см-1): 2452, 1731, 1715.
(Пример 134) (E)-3-{[1-(2-Карбоксиэтил)-1H-1,2,3-триазол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-1213)
К (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-1,2,3-триазол-5-ил}метилиден)-4-сульфанилпиперидина гидрохлориду (500 мг) добавляли 3 н. водный раствор хлороводородной кислоты (20 мл) и полученную смесь перемешивали при 50°C в течение 3 часов. После того как реакционную смесь концентрировали при пониженном давлении, остаток очищали, используя препаративную ВЭЖХ [YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. водный раствор хлороводородной кислоты (25:75, об./об.)] с получением указанного в заголовке соединения (410 мг, выход: 87%) в виде тускло-бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, пиридин-d5) δ м.д.: 0,56-0,78 (2H, м), 0,86-1,08 (2H, м), 1,76-1,92 (1H, м), 2,19-2,36 (1H, м), 2,60-2,77 (1H, м), 2,82-3,04 (2H, м), 3,20-3,33 (2H, м), 3,55 и 3,79 (общая 1H, каждый д, J=12,5), 3,57-3,73 (общая 1H, каждый д, J=12,5), 4,00-4,07 (1H, м), 4,75-4,82 (2H, м), 4,94 и 4,95 (общая 1H, каждый с), 6,81 и 6,83 (общая 1H, каждый с), 7,13-7,21 (2H, м), 7,24-7,32 (1H, м), 7,55-7,62 (1H, м), 7,87 и 7,92 (общая 1H, каждый с);
ИК (KBr, см-1): 3403, 2552, 1712.
(Пример 135) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-4-ил}метилиден)пиперидин (соединение № 2-1166)
(a) (E)-3-({1-[2-(Метоксикарбонил)этил]-1H-1,2,3-триазол-4-ил}метилиден)-1-(трифенилметил)пиперидин-4-ол
При использовании (E)-3-({1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-4-ил}метилиден)-1-(трифенилметил)пиперидин-4-она (13,36 г), полученного в примере 132 (c), реакция, подобная описанной в примере 132 (d), дала неочищенное указанное в заголовке соединение (13,15 г; общий выход: 100%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,84-1,95 (1H, м), 1,97-2,11 (2H, м), 2,11-2,21 (1H, м), 2,58 (1H, шс), 2,78 (1H, шс), 2,83-2,93 (2H, м), 3,70 (3H, с), 4,16 (1H, шс), 4,49 (2H, т, J=7,0), 6,61 (1H, с), 7,05-7,20 (10H, м), 7,35-7,45 (6H, м).
Полученный продукт использовали в следующем процессе без дополнительной очистки.
(b) (E)-4-(Ацетилсульфанил)-3-({1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-4-ил}метилиден)пиперидина гидротрифторацетат
К раствору (E)-3-({1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-4-ил}метилиден)-1-(трифенилметил)пиперидин-4-ола (13,15 г) в толуоле (200 мл) добавляли тиоуксусную кислоту (3,7 мл) и динеопентилацеталь N,N-диметилформамида (14,5 мл) при комнатной температуре и полученную смесь перемешивали при той же самой температуре в течение 30 минут. После добавления водного раствора хлорида натрия продукты экстрагировали этилацетатом и экстракт промывали насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния. После выпаривания растворителя при пониженном давлении, остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь этилацетата и гексана (1:1), с получением смеси (12,92 г) (E)-4-(ацетилсульфанил)-3-({1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-4-ил}метилиден)-1-(трифенилметил)пиперидина и 5-((ацетилсульфанил){1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-4-ил}метил)-1-(трифенилметил)-1,2,3,6-тетрагидропиридина.
К раствору полученной смеси в диметилсульфоксиде (180 мл) добавляли тиоацетат калия (326,0 г) и полученную смесь перемешивали при 80°C в течение 4 часов. После охлаждения смеси до комнатной температуры добавляли воду и продукты экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом магния. Удаляли растворитель при пониженном давлении с получением смеси, приблизительно 3:1, (E)-4-(ацетилсульфанил)-3-({1-2-(метоксикарбонил)этил]-1H-1,2,3-триазол-4-ил}метилиден)-1-(трифенилметил)пиперидина и его (Z)-изомера (12,92 г, содержащего небольшое количество 5-((ацетилсульфанил){1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-4-ил}метил)-1-(трифенилметил)-1,2,3,6-тетрагидропиридина).
К раствору полученной смеси в дихлорметане (400 мл) добавляли трифторуксусную кислоту (4,2 мл) и полученную смесь перемешивали при комнатной температуре в течение 15 минут. После выпаривания растворителя при пониженном давлении остаток очищали хроматографией на силикагеле, используя смешанный растворитель из дихлорметана и метанола (10:1), с получением указанного в заголовке соединения (3,62 г, выход: 38%) в виде желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,05-2,13 (1H, м), 2,33 (3H, с), 2,44-2,56 (1H, м), 2,91 (2H, т, J=6,5), 3,15-3,25 (1H, м), 3,43-3,48 (1H, м), 3,66 (3H, с), 3,87 (1H, д, J=14,0), 4,53-4,61 (3H, м), 5,17 (1H, д, J=14,0), 6,60 (1H, с), 7,62 (1H, с).
Дополнительное элюирование тем же самым растворителем дало смесь (2,22 г) (Z)-4-(ацетилсульфанил)-3-({1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-4-ил}метилиден)пиперидина гидротрифторацетата и 5-((ацетилсульфанил){1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-4-ил}метил)-1,2,3,6-тетрагидропиридина гидротрифторацетата в виде бесцветного аморфного твердого вещества.
(c) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-4-ил}метилиден]пиперидин
При использовании (E)-4-(ацетилсульфанил)-3-({1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-5-ил}метилиден)пиперидина гидротрифторацетата (3,62 г), реакция, подобная описанной в примере 132(g), дала указанное в заголовке соединение (2,72 г, выход: 66%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,62-1,05 (4H, м), 1,75-1,91 (1H, м), 2,06-2,18 (1H, м), 2,16-2,30 (1H, м), 2,28 (3H, с), 2,38-2,49 и 2,54-2,66 (общая 1H, каждый м), 2,69-2,81 (1H, м), 2,92 и 2,94 (общая 2H, каждый т, J=7,0), 3,14 и 3,21 (общая 1H, каждый д, J=13,0), 3,69 (3H, с), 3,87 и 3,99 (общая 1H, каждый д, J=13,0), 4,42-4,48 (1H, м), 4,56 и 4,59 (общая 2H, каждый т, J=7,0), 4,72 и 4,75 (общая 1H, каждый с), 6,51 и 6,52 (общая 1H, каждый с), 7,03-7,16 (2H, м), 7,26-7,40 (2H, м), 7,52 и 7,59 (общая 1H, каждый с).
(Пример 136) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-1,2,3-триазол-4-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (соединение № 2-1181)
При использовании (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-4-ил}метилиден)пиперидина (3,13 г), реакция, подобная описанной в примере 133, дала указанное в заголовке соединение (2,42 г, выход: 82%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,63-0,86 (2H, м), 0,89-1,06 (2H, м), 1,19-1,30 (3H, м), 1,71-1,84 (1H, м), 2,05-2,16 (1H, м), 2,18-2,34 (1H, м), 2,54-2,68 (1H, м), 2,71-2,91 (1H, м), 2,93 (2H, кв, J=7,0), 3,50-3,67 (2H, м), 3,85-3,92 (1H, м), 4,10-4,15 (общая 2H, кв, J=7,0), 4,53-4,63 (2H, м), 4,77 и 4,78 (общая 1H, каждый a), 6,53 и 6,54 (общая 1H, каждый с), 7,03-7,18 (2H, м), 7,26-7,42 (2H, м), 7,54 и 7,62 (общая 1H, каждый с);
ИК (KBr, см-1): 2916, 2516, 2452, 1731, 1716.
(Пример 137) (E)-3-{[1-(2-Карбоксиэтил)-1H-1,2,3-триазол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-1149)
При использовании (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-1,2,3-триазол-4-ил}метилиден)-4-сульфанилпиперидина гидрохлорида (600 мг), реакция, подобная описанной в примере 134, дала указанное в заголовке соединение (470 мг, выход: 83%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (500 МГц, пиридин-d5) δ м.д.: 0,62-0,75 (2H, м), 0,90-1,03 (1H, м), 1,04-1,20 (1H, м), 1,76-1,92 (1H, м), 2,22-2,35 (1H, м), 2,35-2,45 (1H, м), 2,65-2,77 (1H, м), 2,85-2,92 и 2,96-3,03 (общая 1H, каждый м), 3,19 (2H, кв, J=7,0), 3,95-4,31 (3H, м), 4,81 (2H, кв, J=7,0), 4,96 и 4,97 (общая 1H, каждый с), 6,74 и 6,97 (общая 1H, каждый с), 7,12-7,22 (2H, м), 7,26-7,34 (1H, м), 7,61-7,70 (1H, м), 7,99 и 8,07 (общая 1H, каждый с);
ИК (KBr, см-1): 2927, 2560, 1712.
(Пример 138) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-5-ил}метилиден)пиперидина гидрохлорид (соединение № 2-1250)
(a) Этил 4-(5-формил-1H-1,2,3-триазол-1-ил)бутаноат и этил 4-(4-формил-1H-1,2,3-триазол-1-ил)бутаноат
К раствору этил 4-азидобутаноата (60 г) в толуоле (500 мл) добавляли пропаргиловый спирт (31 мл). Полученную смесь перемешивали при 110°C в течение 18 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении с получением неочищенного продукта, состоящего из смеси этил 4-[5-(гидроксиметил)-1H-1,2,3-триазол-1-ил]бутаноата и этил 3-[4-(гидроксиметил)-1H-1,2,3-триазол-1-ил]бутаноата (82 г, общий выход: количественный, изомерное отношение: приблизительно 1:1) в виде масла. Неочищенный продукт, без дополнительной очистки, растворяли в дихлорметане (700 мл) и к раствору добавляли при перемешивании молекулярные сита 4Å (100 г). Затем к реакционной смеси осторожно добавляли пиридинийдихромат (145 г) при охлаждении с использованием водяной бани. После перемешивания смеси при комнатной температуре в течение одного часа ее фильтровали через целит и фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (19:1), с получением смеси двух указанных в заголовке изомеров (31 г, выход: 38%, изомерное отношение: приблизительно 1:1) в виде желтого масла.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,26 (3H, т, J=7,0), 1,27 (3H, т, J=7,0), 2,23 (2H, т, J=7,0), 2,28 (2H, т, J=7,0), 2,34-2,40 (4H, м), 4,13 (2H, кв, J=7,0), 4,16 (2H, кв, J=7,0), 4,54 (2H, т, J=7,0), 4,79 (2H, т, J=7,0), 8,13 (1H, с), 8,26 (1H, с), 10,01 (1H, с), 10,15 (1H, с).
(b) (E)-3-({1-[3-(Этоксикарбонил)пропил]-1H-1,2,3-триазол-5-ил}метилиден)-1-(трифенилметил)пиперидин-4-он и (E)-3-({1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-4-ил}метилиден)-1-(трифенилметил)пиперидин-4-он
К раствору 1-(трифенилметил)пиперидин-4-она (24,3 г) в бензоле (200 мл) добавляли пирролидин (6,46 мл) и полученную смесь кипятили с обратным холодильником в течение 3,5 часов, удаляя воду с помощью аппарата Дина-Старка. Реакционную смесь охлаждали льдом и добавляли к ней полученную, как описано выше, смесь (15,0 г) этил 4-(5-формил-1H-1,2,3-триазол-1-ил)бутаноата и этил 4-(4-формил-1H-1,2,3-триазол-1-ил)бутаноата. Полученную смесь кипятили с обратным холодильником в течение еще 5,5 часов, охлаждали до комнатной температуры и разбавляли водой. Продукт экстрагировали этилацетатом. После промывки органического слоя насыщенным водным раствором хлорида натрия его сушили над безводным сульфатом магния. После выпаривания растворителя при пониженном давлении остаток 4 раза очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана и этилацетата (1:1), с получением менее полярного изомера, (E)-3-({1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-5-ил}метилиден}-1-(трифенилметил)пиперидин-4-она (14,48 г, выход: 38%) в виде бледно-желтого кристаллического твердого вещества и более полярного изомера, (E)-3-({1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-4-ил}метилиден}-1-(трифенилметил)пиперидин-4-она (13,08 г, выход: 34%) в виде желтого кристаллического твердого вещества, соответственно.
Менее полярный изомер (E)-3-({1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-5-ил}метилиден)-1-(трифенилметил)пиперидин-4-он:
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,27 (3H, т, J=7,0), 2,21 (2H, т, J=7,0), 2,33 (2H, т, J=7,0), 2,73 (2H, шс), 2,80 (2H, т, J=6,0), 3,38 (2H, шс), 4,16 (2H, кв, J=7,0), 4,51 (2H, т, J=7,0), 7,16-7,53 (17H, м).
Более полярный изомер (E)-3-({1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-4-ил}метилиден)-1-(трифенилметил)пиперидин-4-он:
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,26 (3H, т, J=7,0), 2,13-2,19 (2H, м), 2,25 (2H, т, J=7,0), 2,67 (2H, шс), 2,77 (2H, т, J=6,0), 3,63 (2H, шс), 4,14 (2H, кв, J=7,0), 4,39 (2H, т, J=7,0), 7,16 (3H, т, J=7,0), 7,23-7,56 (14H, м).
(c) (E)-3-({1-[3-(Этоксикарбонил)пропил]-1H-1,2,3-триазол-5-ил}метилиден)-1-(трифенилметил)пиперидин-4-ол
К раствору (E)-3-({1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-5-ил}метилиден)-1-(трифенилметил)пиперидин-4-она (14,48 г) в смешанном растворителе из дихлорметана (50 мл) и этанола (200 мл) добавляли борогидрид натрия (1,13 г) с перемешиванием при охлаждении льдом. После перемешивания полученной смеси при комнатной температуре в течение 30 минут реакцию останавливали добавлением водного раствора хлорида аммония. Продукт экстрагировали этилацетатом. После промывки органического слоя насыщенным водным раствором хлорида натрия его сушили над безводным сульфатом магния. Удаляли при пониженном давлении растворители с получением указанного в заголовке соединения (14,63 г, выход: количественный) в виде бесцветного кристаллического твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,28 (3H, т, J=7,0), 1,84-1,97 (2H, м), 2,11-2,33 (4H, м), 2,34-2,51 (2H, м), 2,99 (1H, шс), 3,75 (1H, шс), 4,07-4,22 (3H, м), 4,35-4,51 (2H, м), 6,45 (1H, с), 7,07-7,42 (16H, м).
(d) (E)-4-(Ацетилсульфанил)-3-({1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-5-ил}метилиден)-1-(трифенилметил)пиперидин
К раствору (E)-3-({1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-5-ил}метилиден)-1-(трифенилметил)пиперидин-4-ола (14,34 г) в N,N-диметилформамиде (100 мл) добавляли динеопентилацеталь N,N-диметилформамида (14,90 мл). Затем к реакционной смеси добавляли при охлаждении льдом тиоуксусную кислоту (3,58 мл). Полученную смесь перемешивали при комнатной температуре в течение 30 минут и затем дополнительно добавляли динеопентилацеталь N,N-диметилформамида (14,90 мл) и тиоуксусную кислоту (3,58 мл) и полученную смесь перемешивали в течение одного часа. Еще добавляли динеопентилацеталь N,N-диметилформамида (14,90 мл) и тиоуксусную кислоту (3,58 мл) и полученную смесь перемешивали в течение 30 минут. И еще добавляли динеопентилацеталь N,N-диметилформамида (14,90 мл) и тиоуксусную кислоту (3,58 мл) и полученную смесь перемешивали в течение 30 минут. Затем к реакционной смеси добавляли водный раствор хлорида натрия и продукт экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом магния. После выпаривания растворителя при пониженном давлении остаток очищали три раза хроматографией на силикагеле, используя в качестве элюента смесь этилацетата и гексана (1:1 или 2:1), с получением менее полярного изомера указанного в заголовке соединения (7,45 г, выход: 47%) в виде желтой пены и более полярного изомера, 5-(ацетилсульфанил){1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-5-ил}метил)-1-(трифенилметил)-1,2,3,6-тетрагидропиридина (5,58 г, выход: 35%) в виде оранжевой пены, соответственно.
Менее полярный изомер указанного в заголовке соединения (E)-4-(ацетилсульфанил)-3-({1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-5-ил}метилиден)-1-(трифенилметил)пиперидина:
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,26 (3H, т, J=7,0), 1,92-2,01 (1H, м), 2,06-2,27 (2H, м), 2,29 (3H, с), 2,35-2,46 (3H, м), 2,70 (2H, шс), 3,30 (1H, д, J=5,0), 3,41 (1H, шс), 4,17 (2H, кв, J=7,0),'4,40 (2H, т, J=7,0), 4,48-4,53 (1H, м), 6,38 (1H, с), 7,11-7,43 (16H, м).
Более полярный изомер 5-((ацетилсульфанил){1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-5-ил}метил)-1-(трифенилметил)-1,2,3,6-тетрагидропиридин:
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,21-1,30 (3H, м), 2,09-2,50 (7H, м), 2,59-2,75 (1H, м), 2,86-3,10 (2H, м), 3,17-3,24 (1Н,м), 3,28-3,34 (2H, м), 4,05-4,18 (2H,м), 4,21-4,36 (2H, м), 5,07 (1H, шс), 5,58 (1H, шс), 7,12-7,57 (16H, м).
(e) (E)-4-(Ацетилсульфанил)-3-({1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-5-ил}метилиден)пиперидина гидротрифторацетат
К раствору (E)-4-(ацетилсульфанил)-3-({1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-5-ил}метилиден)-1-(трифенилметил)пиперидина (7,45 г) в дихлорметане (80 мл) добавляли трифторуксусную кислоту (2,86 мл) при перемешивании при комнатной температуре. После перемешивания полученной смеси при комнатной температуре в течение одного часа удаляли при пониженном давлении растворители. Остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (10:1), с получением указанного в заголовке соединения (5,39 г, включая примеси) в виде оранжевого масла.
1H ЯМР (500 МГц, CDCl3, выборочные сигналы) δ м.д.: 1,22-1,28 (3H, м), 1,79-1,93 (1H, м), 2,09-2,19 (3H, м), 2,33-2,38 (2H, м), 2,40 (3H, с), 2,47-2,57 (1H, м), 3,14-3,22 (1H, м), 3,36-3,43 (1H, м), 3,76 (1H, д, J=14,0), 4,08-4,15 (2H, м), 4,30-4,39 (2H, м), 4,61-4,65 (1H, м), 6,67 (1H, с), 7,60-7,64 (1H, м).
Полученный продукт использовали в следующем процессе без дополнительной очистки.
(f) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-5-ил}метилиден)пиперидина гидрохлорид
К 2-бром-2-(2-фторфенил)-1-циклопропилэтанону (4,46 г) добавляли при перемешивании раствор неочищенного продукта (E)-4-(ацетилсульфанил)-3-({1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-5-ил}метилиден)пиперидина гидротрифторацетата (5,39 г), полученного так, как описано выше, в ацетонитриле (100 мл) и затем к полученной смеси добавляли триэтиламин (4,05 мл). Полученную смесь перемешивали при комнатной температуре в течение 2,5 часов и разбавляли водой. Продукт экстрагировали этилацетатом и экстракт промывали насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния. После выпаривания растворителя при пониженном давлении остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана и этилацетата (1:2), с получением свободного основания указанного в заголовке соединения (3,24 г, выход: 53%) в виде желтого масла.
К раствору полученного свободного основания в дихлорметане (30 мл) добавляли хлороводород (4 н. диоксановый раствор, 4,60 мл). Растворитель и избыточный хлороводород удаляли при пониженном давлении с получением указанного в заголовке соединения (4,22 г, выход по свободному основанию: количественный) в виде бледно-желтой пены.
1H ЯМР (500 МГц, пиридин-d5) δ м.д.: 0,64-0,78 (2H, м), 0,96-1,09 (2H, м), 1,09-1,15 (3H, м), 1,89-1,98 (1H, м), 2,18-2,30 (3H, м), 2,34 (3H, д, J=11,0), 2,39-2,45 (2H, м), 2,57-2,64 и 2,65-2,72(общая 1H, каждый м), 2,81-2,88 и 2,91-2,99 (общая 1H, каждый м), 3,24 и 3,43 (общая 1H, каждый д, J=13,0), 3,89 (1H, кв, J=7,0), 4,06-4,13 (2H, м), 4,50 (2H, т, J=7,0), 4,70 (1H, шс), 5,00 (1H, д, J=8,0), 6,70 (1H, шс), 7,20-7,28 (2H, м), 7,33-7,39 (1H, м), 7,58-7,65 (1H, м), 7,95 и 7,98 (общая 1H, каждый с);
МС (FAB) m/z: 529 (М+H)+;
ИК (KBr, см-1): 1709, 1493.
(Пример 139) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-5-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (соединение № 2-1249)
Хлороводород пропускали при перемешивании через раствор (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-5-ил}метилиден)пиперидина гидрохлорида (4,15 г) в этаноле (50 мл) при охлаждении льдом в течение одного часа и полученную смесь перемешивали при комнатной температуре в течение ночи в условиях герметического уплотнения. После концентрирования реакционной смеси при пониженном давлении к остатку добавляли этилацетат и водный раствор гидрокарбоната натрия. Органический слой собирали, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. После выпаривания растворителя при пониженном давлении остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана и этилацетата (1:3), и полученную при этом неочищенную фракцию дополнительно очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. водный раствор хлороводородной кислоты, 40:60, об./об.). Полученную фракцию нейтрализовали водным раствором гидрокарбоната натрия. Полученное свободное основание экстрагировали этилацетатом и органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Удаляли растворитель при пониженном давлении с получением свободного основания указанного в заголовке соединения (1,93 г, выход: 54%) в виде бледно-желтого масла.
К раствору полученного описанным образом свободного основания (1,93 г) в дихлорметане (20 мл) добавляли хлороводород (4 н. диоксановый раствор, 2,97 мл). Через 10 минут удаляли при пониженном давлении растворитель и избыточный хлороводород с получением указанного в заголовке соединения (2,37 г, выход по свободному основанию: количественный) в виде бледно-желтой пены.
1H ЯМР (500 МГц, пиридин-d5) δ м.д.: 0,63-0,77 (2H, м), 0,94-1,00 (1H, м), 1,01-1,07 (1H, м), 1,12 (3H, т, J=7,0), 1,85-1,94 (1H, м), 2,21-2,38 (4H, м), 2,40-2,45 (2H, м), 2,67-2,79 (1H, м), 2,92-3,04 (1Н, м), 3,54-3,61 (1H, м), 3,75 и 3,83 (общая 1H, каждый д, J=12,0), 4,06-4,13 (3H, м), 4,50 (2H, т, J=7,0), 4,98 (1H, шс), 6,69 (1H, шс), 7,19-7,25 (2H, м), 7,30-7,37 (1H, м) 7,59-7,65 (1H, м), 7,90 и 7,95 (общая 1H, каждый с);
МС (FAB) m/z: 487 (М+H)+;
ИК (KBr, см-1): 1716, 1493.
(Пример 140) (E)-3-{[1-(3-Карбоксипропил)-1H-1,2,3-триазол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-1217)
При использовании (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-5-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (1,58 г), реакция, подобная описанной в примере 134, дала указанное в заголовке соединение (696 мг, выход: 47%) в виде бледно-желтой пены.
1H ЯМР (500 МГц, пиридин-d5) δ м.д.: 0,64-0,78 (2H, м), 0,93-1,00 (1H, м), 1,01-1,08 (1H, м), 1,85-1,94 (1H, м), 2,28-2,39 (3H, м), 2,55-2,61 (2H, м), 2,68-2,77 (1H, м), 2,91-3,03 (2H, м), 3,61 (1H, д, J=13,0), 3,77 и 3,85 (общая 1H, каждый д, J=13,0), 4,11 (1H, шс), 4,60 (2H, т, J=7,0), 4,99 (1H, с), 6,77 (1H, д, J=4,0), 7,18-7,25 (2H, м), 7,28-7,36 (1H, м) 7,59-7,68 (1H, м), 7,91 и 7,97 (общая 1H, каждый с);
МС (FAB) m/z: 259 (М+H)+;
ИК (KBr, см-1): 1711, 1493.
(Пример 141) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-4-ил}метилиден)пиперидина гидрохлорид (соединение № 2-1186)
(a) (E)-3-({1-[3-(Этоксикарбонил)пропил]-1H-1,2,3-триазол-4-ил}метилиден)-1-(трифенилметил)пиперидин-4-ол
При использовании (E)-3-({1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-4-ил}метилиден)-1-(трифенилметил)пиперидин-4-она (13,08 г), полученного так, как описано в примере 138(b), реакция, подобная описанной в примере 138(c), дала указанное в заголовке соединение (13,69 г, выход: количественный) в виде бледно-желтой пены.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,23-1,29 (3H, м), 1,75 (1H, шс), 1,85-1,96 (1H, м), 2,05-2,21 (3H, м), 2,27 (2H, т, J=7,0), 2,49-2,68 (1H, м), 2,70-2,85 (1H, м), 3,75 (1H, шс), 4,08-4,19 (3H, м), 4,22-4,31 (2H, м), 6,64 (1H, с), 7,03-7,22 (10H, м), 7,33-7,46 (6H, м).
(b) (E)-4-(Ацетилсульфанил)-3-({1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-4-ил}метилиден)пиперидина гидротрифторацетат
К раствору (E)-3-({1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-4-ил}метилиден)-1-(трифенилметил)пиперидин-4-ола (13,7 г) в N,N-диметилформамиде (50 мл) добавляли динеопентилацеталь N,N-диметилформамида (14,2 мл) и тиоуксусную кислоту (3,4 мл) с перемешиванием при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 0,5 часа и затем добавляли воду и этилацетат для разделения слоев. После промывки органического слоя насыщенным водным раствором хлорида натрия его сушили над безводным сульфатом магния. После выпаривания растворителя при пониженном давлении остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь этилацетата, гексана и дихлорметана (2:1:1-1:1:1), с получением смеси (приблизительно 1:2) (12,8 г) (E)-4-(ацетилсульфанил)-3-({1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-4-ил}метилиден)-1-(трифенилметил)пиперидина и 5-((ацетилсульфанил){1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-4-ил}метил)-1-(трифенилметил)-1,2,3-тетрагидропиридина. Полученная смесь содержала также небольшое количество (Z)-4-(ацетилсульфанил)-3-({1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-4-ил}метилиден)-1-(трифенилметил)пиперидина.
К раствору смеси (12,8 г), полученной в процессе, описанном выше, в дихлорметане (100 мл) добавляли трифторуксусную кислоту (4,91 мл) при комнатной температуре. После перемешивания смеси при комнатной температуре в течение одного часа удаляли при пониженном давлении растворители и остаток очищали два раза хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (10:1), с получением наименее полярного изомера, (Z)-4-(ацетилсульфанил)-3-({1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-4-ил}метилиден)пиперидина гидротрифторацетата (0,46 мг, общий выход от процесса (a): 3,9%) в виде бледно-желтого масла, более полярного изомера указанного в заголовке соединения (2,37 г, общий выход от процесса (a): 21%) в виде бесцветного кристаллического твердого вещества и наиболее полярного изомера, 5-((ацетилсульфанил){1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-4-ил}метил)-1,2,3,6-тетрагидропиридина гидротрифторацетата (6,49 г, общий выход от процесса (a): 55%) в виде желтого масла, соответственно.
Указанное в заголовке соединение (E)-4-(ацетилсульфанил)-3-({1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-4-ил}метилиден)пиперидина гидротрифторацетат:
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,26 (3H, т, J=7,0), 1,84 (1H, шс), 2,07-2,14 (1H, м), 2,14-2,22 (2H, м), 2,33 (2H, т, J=7,0), 2,37 (3H, с), 2,49-2,59 (1H, м), 3,22 (1H, т, J=12,0), 3,45-3,52 (1H, м), 3,89(1H, д, J=14,0), 4,14 (2H, кв, J=7,0), 4,40 (2H, т, J=7,0), 4,57-4,61 (1H, м), 5,22 (1H, д, J=14,0), 6,66 (1H, с), 7,55 (1Н, с).
(c) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-4-ил}метилиден)пиперидина гидрохлорид
К 2-бром-2-(2-фторфенил)-1-циклопропилэтанону (1,96 г) добавляли раствор (E)-4-(ацетилсульфанил)-3-({1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-4-ил}метилиден)пиперидина гидротрифторацетата (2,37 г) в ацетонитриле (40 мл) при перемешивании и затем добавляли триэтиламин (1,78 мл). После перемешивания смеси при комнатной температуре в течение 2,5 часов добавляли воду, продукт экстрагировали этилацетатом, экстракт промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом магния. После выпаривания растворителя при пониженном давлении остаток очищали хроматографией на колонке с силикагелем, используя в качестве элюента смесь гексана и этилацетата (1:2), с получением свободного основания указанного в заголовке соединения (2,07 г, выход: 77%) в виде желтого масла.
К раствору полученного свободного основания в дихлорметане (20 мл) добавляли хлороводород (4 н. диоксановый раствор, 2,94 мл). Растворитель и избыточный хлороводород удаляли при пониженном давлении с получением указанного в заголовке соединения (2,42 г, выход по свободному основанию: количественный) в виде бледно-желтой пены.
1H ЯМР (500 МГц, пиридин-d5) δ м.д.: 0,68-0,79 (2H, м), 0,99-1,05 (1H, м), 1,10-1,20 (4H, м), 1,91-2,00 (1H, м), 2,18-2,26 (2H, м), 2,27 (3H, с), 2,32-2,46 (5H, м), 2,55-2,61 и 2,72-2,79 (общая 1H, каждый м), 2,89-2,96 (1H, м), 3,51-3,59 (1H, м), 4,06-4,13 (2H, м), 4,44-4,51 (2H, м), 4,72-4,77 (1H, м), 5,02 (1H, д, J=11,0), 6,90 (1H, д, J=9,0), 7,20-7,27 (2H, м), 7,32-7,40 (1H, м), 7,64-7,72 (1H, м), 7,91 и 8,00 (общая 1H, каждый с);
МС (FAB) m/z: 529 (М+H)+;
ИК (KBr, см-1): 1710, 1494.
(Пример 142) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-4-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (соединение № 2-1185)
Указанное в заголовке соединение (1,32 г) синтезировали с выходом 62% в виде бледно-желтой пены, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-4-ил}метилиден)пиперидина гидрохлорид (2,33 г), проведением реакции, подобной описанной в примере 139.
1H ЯМР (500 МГц, пиридин-d5) δ м.д.: 0,67-0,78 (2H, м), 0,97-1,03 (1H, м), 1,10-1,17 (4H, м), 1,84-1,94 (1H, м), 2,21-2,29 (2H, м), 2,29-2,38 (1H, м), 2,38-2,44 (4H, м), 2,72-2,79 (1H, м), 2,90-2,96 и 3,00-3,07 общая 1H, м), 4,00-4,26 (4H, м), 4,45-4,52 (2H, м), 5,02 (1H, д, J=5,0), 6,83 и 6,86 (общая 1H, каждый с), 7,19-7,25 (2H, м), 7,32-7,37 (1H, м), 7,65-7,73 (1H, м), 7,90 и 7,99 (общая 1H, каждый с);
МС (FAB) m/z: 487 (М+H)+;
ИК (KBr, см-1): 1727, 1493.
(Пример 143) (E)-3-{[1-(3-Карбоксипропил)-1H-1,2,3-триазол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-1153)
Указанное в заголовке соединение (444 мг, выход: 72%) получали в виде бесцветной пены, используя в качестве исходного материала (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[3-(этоксикарбонил)пропил]-1H-1,2,3-триазол-4-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (648 мг), проведением реакции, подобной описанной в примере 140.
1H ЯМР (500 МГц, пиридин-d5) δ м.д.: 0,66-0,77 (2H, м), 0,97-1,04 (1H, м), 1,11-1,18 (1H, м), 1,84-1,94 (1H, м), 2,28-2,38 (3H, м), 2,38-2,45 (1H, м), 2,54-2,60 (2H, м), 2,66-2,72 (1H, м), 2,72-2,80 (1H, м), 2,91-2,98 и 3,00-3,07 (общая 1H, м), 4,02-4,10 и 4,20-4,27 (общая 3H, м), 4,52-4,59 (2H, м), 5,02 (1H, д, J=3,0), 6,83 и 6,86 (общая 1H, каждый с), 7,18-7,25 (2H, м), 7,31-7,39 (1H, м), 7,66-7,73 (1H, м), 7,87 и 7,97 (общая 1H, каждый с);
МС (FAB) m/z: 459 (М+H)+;
ИК (KBr, см-1): 1711, 1493.
(Пример 144) (E)-3-[(1-Ацетил-5-метил-1H-пиразол-3-ил)метилиден]-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидротрифторацетат
(E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(трет-бутоксикарбонил)-5-метил-1H-пиразол-3-ил]метилиден}пиперидин (389,6 мг), полученный проведением реакций, подобных описанным в примере 11, с использованием 1-(трет-бутоксикарбонил)-5-метил-1H-пиразол-3-карбальдегида в качестве исходного материала, обрабатывали 4 н. диоксановым раствором хлороводорода (8 мл) при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,026 н. водный раствор трифторуксусной кислоты, 45/55, об./об.) с получением указанного в заголовке соединения (140,0 мг, выход: 35%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,74-1,17 (4H, м), 1,88-2,21 (3H, м), 2,11 (3H, с), 2,43 и 2,54 (общая 3H, каждый с), 3,47-3,94 (3H, м), 3,76 и 4,00 (общая 1H, каждый д, J=14,5), 5,03 и 5,11 (общая 1H, каждый с), 5,06 и 5,26 (общая 1H, каждый д, J=14,5), 6,07 и 6,18 (общая 1H, каждый с),6,51 и 6,68 (общая 1H, каждый с), 6,96-7,53 (4H, м);
ИК (CHC13 раствор, см-1): 1701, 1636.
(Пример 145) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(пиразин-2-ил)метилиден]-4-сульфанилпиперидина гидрохлорид (соединение № 1-101)
(E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(пиразин-2-ил)метилиден]пиперидин (пример 31, свободное основание, 540 мг) обрабатывали хлороводородом в этаноле способом, подобным описанному в примере 133, и неочищенный продукт очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. хлороводородная кислота, 25/75, об./об.) с получением указанного в заголовке соединения (295 мг, выход: 60%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, CD3OD) δ м.д.: 0,84-1,34 (4H, м), 1,73-1,92 (1H, м), 1,96-2,18 (1H, м), 2,21-3,09 (3H, м), 3,45-3,56 (1H, м), 3,58-3,67 (1H, м), 4,22 (1H, шс), 5,94 и 5,96 (общая 1H, каждый с), 7,29-7,55 (3H, м), 7,59-7,74 (1H, м), 8,15-8,29 (3H, м);
ИК (KBr, см-1): 3408, 2928, 2543, 1710.
(Пример 146) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[(1,3-тиазол-4-ил)метил]-1H-пиразол-3-ил}метилиден)пиперидина гидрохлорид (соединение № 2-146)
(a) (E)-3-({1-[(1,3-Тиазол-4-ил)метил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидин-4-он
К раствору (E)-3-([1H-пиразол-3(5)-ил]метилиден)-1-(трифенилметил)пиперидин-4-она (пример 73-(a), 5,0 г) в ацетонитриле (50 мл) добавляли гидрохлорид 4-(хлорметил)-1,3-тиазола (4,0 г) и 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU) (7,0 мл). Смесь перемешивали при 50°C в течение 1,5 часов. После охлаждения добавляли воду и этилацетат для разделения слоев. Органический слой собирали, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Удаляли растворитель выпариванием при пониженном давлении и остаток очищали хроматографией на силикагеле (гексан: этилацетат:дихлорметан = 4:3:3, затем 1:1:1) и затем 1:2:2) с получением указанного в заголовке соединения (1,96 г, выход: 37%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 2,65 (2H, шс), 2,75 (2H, т, J=5,0), 3,64 (2H, шс), 5,37 (2H, с), 6,24 (1H, д, J=2,5), 6,75 (1H, шс), 7,13-7,30 (9H, м), 7,44 (1H, д, J=2,5), 7,45 (1H, шс), 7,47-7,55 (6H, м) 8,75 (1H, д, J=2,0).
(b) (E)-4-(Ацетилсульфанил)-3-({1-[(1,3-тиазол-4-ил)метил]-1H-пиразол-3-ил}метилиден)пиперидина бис(гидротрифторацетат)
К раствору (E)-3-({1-[(1,3-тиазол-4-ил)метил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидин-4-она (2,48 г) в метаноле (25 мл) добавляли борогидрид натрия (0,09 г) при комнатной температуре. После перемешивания при той же самой температуре в течение 0,5 часа добавляли воду и этилацетат и продукт экстрагировали. Отделенный органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Выпаривание растворителя при пониженном давлении дало (E)-3-({1-[(1,3-тиазол-4-ил)метил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидин-4-ол (приблизительно 2,5 г) в виде неочищенного бледно-желтого аморфного твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,84-1,95 (1H, м), 2,08-2,19 (2H, м), 2,66-2,79 (2H, м), 3,44-3,58 (1H, м), 4,13-4,19 (1H, м), 5,29 (1H, д, J=16,0), 5,33 (1H, д, J=16,0), 6,13 (1H, д, J=2,5), 6,51 (1H, шс), 6,69 (1H, шс), 7,05-7,20 (9H, м), 7,38 (1H, д, J=2,0), 7,39-7,45 (6H, м), 8,77 (1H, д, J=2,0).
Полученный продукт, без дополнительной очистки, растворяли в толуоле (25 мл) и к раствору добавляли динеопентилацеталь N,N-диметилформамида (2,7 мл) и тиоуксусную кислоту (0,65 мл) при комнатной температуре. После перемешивания смеси при той же самой температуре в течение 0,5 часа, добавляли воду и этилацетат и продукт экстрагировали. Отделенный органический слой промывали последовательно водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Выпаривание растворителя при пониженном давлении дало неочищенный (E)-4-(ацетилсульфанил)-3-({1-[(1,3-тиазол-4-ил)метил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидин (приблизительно 2,9 г) в виде желтого аморфного твердого вещества.
Полученный продукт, без дополнительной очистки, растворяли в дихлорметане (25 мл) и к раствору добавляли трифторуксусную кислоту (1,1 мл). После перемешивания при комнатной температуре в течение 0,5 часа, смесь концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (19:1), с получением указанного в заголовке соединения (400 мг, выход: 14%) в виде желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,02-2,12 (1H, м), 2,36 (3H, с), 2,37-2,49 (1H, м), 3,13-3,24 (1H, м), 3,31-3,40 (1H, м), 3,78 (1H, д, J=14,5), 4,58 (1H, м), 5,11 (1H, д, J=14,5), 5,43 (2H, с), 6,24 (1H, д, J=2,5), 6,63 (1H, шс), 7,21 (1H, шс), 7,46 (1H, д, J=2,0), 8,78 (1H, д, J=2,0).
(c) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[(1,3-тиазол-4-ил)метил]-1H-пиразол-3-ил}метилиден)пиперидина гидрохлорид
К раствору (E)-4-(ацетилсульфанил)-3-({1-[(1,3-тиазол-4-ил)метил]-1H-пиразол-3-ил}метилиден)пиперидина бис(гидротрифторацетата) (400 мг) в N,N-диметилформамиде (10 мл) добавляли 2-бром-2-(2-фторфенил)-1-циклопропилэтанон (370 мг) и триэтиламин (400 мкл). После перемешивания при комнатной температуре в течение 0,5 часа смесь распределяли между водой и этилацетатом. Органический слой отделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Растворитель выпаривали при пониженном давлении и полученный остаток обрабатывали 4 н. диоксановым раствором хлороводорода (1,8 мл) и очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана, этилацетата и метанола (5:5:1), а затем смесь дихлорметана и метанола (1:1). После концентрирования фракций, содержащих целевое соединение, добавляли эфир и собирали фильтрованием нерастворимые материалы с получением указанного в заголовке соединения (450 мг, включая влагу из-за гигроскопичности) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,60-1,00 (4H, м), 1,83-1,92 (1H, м), 2,19-2,36 (2H, м), 2,30 (3H, с), 2,43-2,50 и 2,56-2,63 (общая 1H, каждый м), 2,71-2,77 и 2,79-2,85 (общая 1H, каждый м), 3,09 и 3,23 (общая 1H, каждый д, J=13,0), 4,09-4,17 (1H, м), 4,50 (1H, м), 4,68 и 4,70 (общая 1H, каждый с), 5,35 и 5,42 (общая 2H, каждый с), 6,10 и 6,18 (общая 1H, каждый д, J=2,0), 6,49 и 6,51 (общая 1H, каждый шс), 7,03-7,17 (3H, м), 7,24-7,31 (1H, м), 7,37-7,45 (2H, м), 8,78 (1H, шс);
ИК (KBr, см-1): 1695.
(Пример 147) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[(1,3-тиазол-4-ил)метил]-1H-пиразол-3-ил}метилиден)-4-сульфанилпиперидина дигидрохлорид (соединение № 2-145)
Дихлорметан и водный раствор гидрокарбоната натрия добавляли к (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[(1,3-тиазол-4-ил)метил]-1H-пиразол-3-ил}метилиден)пиперидина гидрохлориду (приблизительно 200 мг, включая влагу), полученному в примере 146. Органический слой отделяли, сушили над безводным сульфатом магния и концентрировали с получением свободного основания (160 мг) в виде бледно-желтого аморфного твердого вещества.
К раствору полученного так, как описано выше, твердого вещества в метаноле (4 мл) добавляли карбонат калия (44 мг) при комнатной температуре. После перемешивания смеси при той же самой температуре в течение 0,5 часа добавляли 1 н. хлороводородную кислоту (3,1 мл) и отфильтровывали нерастворимые материалы, используя мембранный фильтр. Фильтрат концентрировали и остаток очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. хлороводородная кислота, 30/70, об./об.) с получением указанного в заголовке соединения (90 мг, выход: 53%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,61-1,00 (4H, м), 1,75-1,85 (1H, м), 2,16-2,37 (2H, м), 2,59-2,80 и 2,83-2,92 (общая 2H, каждый м), 3,54 и 3,65 (общая 1H, каждый д, J=12,5), 3,84 (1H, д, J=12,5), 3,94 (1H, м), 4,72 и 4,74 (общая 1H, каждый с), 5,38 и 5,42 (общая 2H, каждый с), 6,10 и 6,19 (общая 1H, каждый д, J=2,5), 6,46 и 6,48 (общая 1H, каждый шс), 7,03-7,18 (3H, м), 7,24-7,31 (1H, м), 7,38-7,48 (2H, м), 8,79 (1H, д, J=2,0);
ИК (KBr, см-1): 2532, 1711.
(Пример 148) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(2-гидроксиэтил)-1H-пиразол-3-ил]метилиден}пиперидина гидрохлорид (соединение № 2-158)
(a) (E)-4-(Ацетилсульфанил)-3-{[1-(2-гидроксиэтил)-1H-пиразол-3-ил]метилиден}пиперидина бис(гидротрифторацетат)
(E)-3-([1H-Пиразол-3(5)-ил]метилиден)-1-(трифенилметил)пиперидин-4-он (пример 73-(a), 40,6 г) распределяли между двумя реакционными колбами. К растворам соединения в N,N-диметилформамиде (420 мл, общее количество в двух колбах) добавляли этилбромацетат (53,9 мл, общее количество в двух колбах), карбонат калия (33,4 г, общее количество в двух колбах) и иодид калия (80,3 г, общее количество в двух колбах) при охлаждении льдом. Смеси перемешивали при комнатной температуре в течение 0,5 часа и затем при 80°C в течение 0,5 часа. К реакционным смесям добавляли воду и этилацетат, после чего смеси объединяли и полученные слои разделяли. Органический слой промывали последовательно водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Удаляли растворитель при пониженном давлении и остаток очищали хроматографией на силикагеле (элюент: гексан/этилацетат/дихлорметан = 2/2/1) с получением (E)-3-{[1-(этоксикарбонил)-1H-пиразол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-она (49 г, содержащего небольшое количество региоизомера, относящегося к положению в пиразольном цикле) в виде желтого твердого вещества. Полученный продукт, без дополнительной очистки, растворяли в этаноле (500 мл) и к раствору добавляли борогидрид натрия (1,9 г) при 0°C. После перемешивания смеси при комнатной температуре в течение 1 часа добавляли дихлорметан (200 мл) для разбавления реакционного раствора. Затем добавляли воду и этилацетат и смесь концентрировали при пониженном давлении для удаления большей части дихлорметана и этанола. Продукты экстрагировали этилацетатом и органический слой промывали последовательно водой и насыщенным водным раствором хлорида натрия. Экстракт сушили над безводным сульфатом магния и растворитель выпаривали при пониженном давлении. Остаток очищали хроматографией на силикагеле, используя в качестве элюентов смесь дихлорметана и этилацетата (4:1-1:1), а затем смесь дихлорметана и метанола (9:1-4:1), с получением (E)-3-{[1-(2-гидроксиэтил)-1H-пиразол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола (10 г, выход: 22%).
При использовании части (7,0 г) полученного продукта в качестве исходного материала указанное в заголовке соединение (400 мг, выход: 28%) получали в виде бесцветного аморфного твердого вещества по методике, подобной описанной в примере 132-(e)˜(f), осуществляя взаимодействие с тиоуксусной кислотой и динеопентилацеталем N,N-диметилформамида с последующими обработкой трифторуксусной кислотой и очисткой хроматографией на силикагеле.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 2,03-2,11 (1H, м), 2,36 (3H, с), 2,40-2,50 (1H, м), 3,16-3,25 (1H, м), 3,32-3,40 (1H, м), 3,77 (1H, д, J=14,0), 3,83-3,90 (1H, м), 3,96-4,04 (1H, м), 4,12 (2H, м), 4,56 (1H, м), 5,21 (1H, д, J=14,0), 6,19 (1H, д, J=2,0), 6,62 (1H, шс), 7,34 (1H, д, J=2,0).
(b) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(2-гидроксиэтил)-1H-пиразол-3-ил]метилиден}пиперидина гидрохлорид
К раствору (E)-4-(ацетилсульфанил)-3-{[1-(2-гидроксиэтил)-1H-пиразол-3-ил]метилиден}пиперидина бис(гидротрифторацетата) (400 мг) в N,N-диметилформамиде (10 мл) добавляли 2-бром-2-(2-фторфенил)-1-циклопропилэтанон (410 мг) и триэтиламин (440 мкл). Смесь перемешивали при комнатной температуре в течение 0,5 часа и затем распределяли между водой и этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Удаляли растворитель при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметана/этилацетат/метанол=10/10/1) с получением свободного основания указанного в заголовке соединения (630 мг, выход: 96%) в виде желтого масла.
Полученное свободное основание (320 мг) обрабатывали 4 н. диоксановым раствором хлороводорода (2,8 мл). Растворитель и избыточный хлороводород удаляли при пониженном давлении и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана, этилацетата и метанола (10:10:1), с получением указанного в заголовке соединения в виде бесцветного аморфного твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,65-1,03 (4H, м), 1,83-1,91 (1H, м), 2,10-2,38 (2H, м), 2,29 и 2,31 (общая 3H, каждый с), 2,40-2,48 и 2,56-2,64 (общая 1H, каждый м), 2,70-2,84 (1H, м), 3,07 и 3,24 (общая 1H, каждый д, J=12,5), 3,87-4,02 (2H, м), 4,09-4,25 (3H, м), 4,50 (1H, м), 4,74 и 4,78 (общая 1H, каждый с), 6,10 и 6,17 (общая 1H, каждый д, J=2,5), 6,49 (1H, шс), 7,04-7,17 (2H, м), 7,28-7,41 (3H, м);
ИК (KBr, см-1): 1696.
(Пример 149) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(2-гидроксиэтил)-1H-пиразол-3-ил]метилиден}-4-сульфанилпиперидина гидрохлорид (соединение № 2-157)
(E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(2-гидроксиэтил)-1H-пиразол-3-ил]метилиден}пиперидин (свободное основание, 310 мг), полученный в примере 148, обрабатывали карбонатом калия в метаноле способом, подобным описанному в примере 147. Полученный при этом продукт очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. хлороводородная кислота, 25/75, об./об.) с получением указанного в заголовке соединения (100 мг, выход: 32%) в виде бесцветного высокогигроскопичного аморфного твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,64-1,02 (4H, м), 1,75-1,84 (1H, м), 2,08-2,38 (2H, м), 2,58-2,78 и 2,83-2,91 (общая 2H, каждый м), 3,55 и 3,69 (общая 1H, каждый д, J=12,5), 3,82-4,02 (4H, м), 4,13-4,20 (2H, м), 4,78 и 4,80 (общая 1H, каждый с), 6,09 и 6,17 (общая 1H, каждый д, J=2,5), 6,45 и 6,47 (общая 1H, каждый шс), 7,05-7,17 (2H, м), 7,28-7,41 (3H, м);
ИК (KBr, см-1): 2524, 1709.
(Пример 150) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[2-(метоксикарбонилметил)-2H-тетразол-5-ил]метилиден}пиперидина гидрохлорид (соединение № 2-1610)
(a) Метил [5-(гидроксиметил)-2H-тетразол-2-ил]ацетат и метил [5-(гидроксиметил)-1H-тетразол-1-ил]ацетат
К раствору [1(2)H-тетразол-5-ил]метанола (7,08 г) в ацетонитриле (400 мл) добавляли метил бромацетат (26,8 мл) и триэтиламин (40 мл). После перемешивания при комнатной температуре в течение 1 дня смесь концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле, используя смесь этилацетата и метанола (19:1) в качестве элюента, с получением изомерной смеси двух указанных в заголовке соединений (10,82 г, выход: 89%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 3,79 (3H, с), 4,92 и 4,97 (общая 2H, каждый с), 5,34 и 5,41 (общая 2H, каждый с).
(b) Метил (5-формил-2H-тетразол-2-ил)ацетат и метил (5-формил-1H-тетразол-1-ил)ацетат
К раствору полученной выше смеси метил [5-(гидроксиметил)-2H-тетразол-2-ил]ацетата и метил [5-(гидроксиметил)-1H-тетразол-1-ил]ацетата (10,82 г) в дихлорметане (250 мл) добавляли молекулярные сита 4Å (47,5 г) и пиридинийдихромат (47,5 г). После перемешивания при комнатной температуре в течение 1 часа смесь фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле, используя смесь этилацетата и метанола (10:1) в качестве элюента, с получением изомерной смеси двух указанных в заголовке соединений (5,76 г, выход: 54%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 3,78 и 3,80 (общая 3H, каждый с), 5,46 и 5,53 (общая 2H, каждый с), 10,20 и 10,22 (общая 1H, каждый с).
(c) (E)-3-{[2-(Метоксикарбонилметил)-2H-тетразол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-он и (E)-3-{[1-(Метоксикарбонилметил)-1H-тетразол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-он
К раствору 1-(трифенилметил)пиперидин-4-она (11,6 г) в бензоле (300 мл) добавляли пирролидин (2,8 мл). Смесь кипятили с обратным холодильником в течение 3 часов, используя аппарат Дина-Старка для удаления воды. После охлаждения смеси до комнатной температуры добавляли к ней раствор полученной выше смеси метил (5-формил-2H-тетразол-2-ил)ацетата и метил (5-формил-1H-тетразол-1-ил)ацетата в дихлорметане. Смесь кипятили с обратным холодильником в течение еще 5 часов, после чего реакционную смесь охлаждали и гасили добавлением воды. Продукты экстрагировали этилацетатом и органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Удаляли растворитель при пониженном давлении и остаток очищали хроматографией на силикагеле, используя смесь гексана, этилацетата и дихлорметана (2:1:1) в качестве элюента, с получением двух указанных в заголовке соединений.
Менее полярный изомер (E)-3-{[2-(метоксикарбонилметил)-2H-тетразол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-он; количество: 5,39 г, выход: 32%, желтое аморфное твердое вещество.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,68 (2H, шс), 2,81 (2H, т, J=6,0), 3,77 (3H, с), 3,79-3,85 (2H, м), 5,30 (2H, с), 7,11-7,32 (10H, м), 7,47-7,54 (6H, м).
Более полярный изомер (E)-3-{[1-(метоксикарбонилметил)-1H-тетразол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-он; количество: 2,24 г, выход: 13%, желтое аморфное твердое вещество.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,70 (2H, шс), 2,83 (2H, т, J=6,0), 3,84 (3H, с), 3,94 (2H, шс), 5,20 (2H, с), 7,04-7,29 (10H, м), 7,47-7,54 (6H, м).
(d) (E)-3-{[2-(Метоксикарбонилметил)-2H-тетразол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол
Борогидрид натрия (400 мг) добавляли к раствору (E)-3-{[2-(метоксикарбонилметил)-2H-тетразол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-она (5,18 г) в тетрагидрофуране (100 мл) при 0°C. После перемешивания смеси при той же самой температуре в течение 2 часов реакционную смесь гасили добавлением насыщенного водного раствора хлорида аммония. Смесь экстрагировали этилацетатом и экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Экстракт концентрировали при пониженном давлении и всплывшее целевое вещество собирали фильтрованием. Маточную жидкость концентрировали и остаток очищали хроматографией на силикагеле, используя смесь гексана, этилацетата и дихлорметана (1:1:1) в качестве элюента, с получением дополнительного количества указанного в заголовке соединения в виде бесцветного аморфного твердого вещества. Общее количество: 1,5 г, общий выход: 29%.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д.: 1,67-1,83 (2H, м), 1,99-2,06 (1H, м), 2,82 (1H, шс), 3,73 (3H, с), 3,95 (1H, шс), 4,40 (1H, шс), 5,32 (1H, д, J=4,5), 5,49 (1H, д, J=17,0), 5,73 (1H, д, J=17,0), 6,61 (1H, с), 7,07-7,34 (15H, м).
(e) (E)-4-(Ацетилсульфанил)-3-{[2-(метоксикарбонилметил)-2H-тетразол-5-ил]метилиден}пиперидина гидротрифторацетат
К раствору (E)-3-{[2-(метоксикарбонилметил)-2H-тетразол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола (1,5 г) в смешанном растворителе из дихлорметана (30 мл) и толуола (30 мл) добавляли тиоуксусную кислоту (2,2 мл) и динеопентилацеталь N,N-диметилформамида (8,5 мл). После перемешивания смеси при 50°C в течение 2 часов ее охлаждали, добавляли к ней воду и дихлорметан и разделяли слои. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Экстракт концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле, используя смесь гексана, этилацетата и дихлорметана (2:1:1) в качестве элюента, с получением (E)-4-(ацетилсульфанил)-3-{[2-(метоксикарбонилметил)-2H-тетразол-5-ил]метилиден}-1-(трифенилметил)пиперидина (вместе с примесями общее количество: 880 мг, общий выход: 58,4%).
Полученное выше соединение растворяли в дихлорметане (40 мл) и обрабатывали трифторуксусной кислотой (350 мкл). Через 15 минут смесь концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (20:1), с получением указанного в заголовке соединения (450 мг, выход: 67%) в виде желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,06-2,19 (1H, м), 2,37 (3H, с), 2,44-2,60 (1H, м), 3,16-3,29 (1H, м), 3,39-3,49 (1H, м), 3,79 (3H, с), 4,01 (1H, д, J=14,5), 4,63 (1H, м), 5,14 (1H, д, J=14,5), 5,38 (2H, с), 6,90 (1H, с).
(f) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[2-(метоксикарбонилметил)-2H-тетразол-5-ил]метилиден}пиперидина гидрохлорид
Следуя процедуре, подобной описанной в примере 132-(g), (E)-4-(ацетилсульфанил)-3-{[2-(метоксикарбонилметил)-2H-тетразол-5-ил]метилиден}пиперидина гидротрифторацетат (450 мг) подвергали взаимодействию с 2-бром-2-(2-фторфенил)-1-циклопропилэтаноном и триэтиламином и продукт очищали хроматографией на силикагеле с получением свободного основания указанного в заголовке соединения (347 мг, выход: 67%), которое аналогичным образом обрабатывали 4 н. диоксановым раствором хлороводорода с получением указанного в заголовке соединения (404 мг) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,65-0,83 (2H, м), 0,86-1,05 (2H, м), 1,85-1,97 (1H, м), 2,15-2,38 (2H, м), 2,30 и 2,31 (общая 3H, каждый с), 2,46-2,55 и 2,60-2,69 (общая 1H, каждый м), 2,75-2,85 (1H, м), 3,39 и 3,49 (общая 1H, каждый д, J=14,0), 3,79 (3H, с), 4,25 и 4,30 (общая 1H, каждый д, J=14,0), 4,48-4,54 (1H, м), 4,73 (1H, с), 5,26 и 5,31 (общая 2H, каждый д, J=4,5), 6,66 и 6,67 (общая 1H, каждый с), 7,02-7,15 (2H, м), 7,23-7,32 (1H, м), 7,35-7,42 (1H, м);
ИК (KBr, см-1): 1775, 1755, 1699.
(Пример 151) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[2-(метоксикарбонилметил)-2H-тетразол-5-ил]метилиден}-4-сульфанилпиперидина гидрохлорид (соединение № 2-1609)
Карбонат калия (275 мг) добавляли к раствору (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[2-(метоксикарбонилметил)-2H-тетразол-5-ил]метилиден}пиперидина гидрохлорида (347 мг) в метаноле (10 мл). После перемешивания при комнатной температуре в течение 15 минут реакционную смесь разбавляли этилацетатом и гасили добавлением воды. Органический слой отделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Удаляли при пониженном давлении растворитель с последующей очисткой остатка препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. хлороводородная кислота, 35/65, об./об.) с получением указанного в заголовке соединения (185 мг, выход: 58%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, пиридин-d5) δ м.д.: 0,64-0,79 (2H, м), 0,92-1,04 (1H, м), 1,09-1,20 (1H, м), 1,81-1,97 (1H, м), 2,26-2,39 (1H, м), 2,39-2,52 (1H, м), 2,68-2,86 (1H, м), 2,88-3,08 (1H, м), 3,64 (3H, с), 3,98-4,06 (1H, м), 4,15-4,34 (2H, м), 4,96 и 4,98 (общая 1H, каждый с), 5,90-5,98 (2H, м), 6,92 (1H, с), 7,13-7,22 (2H, м), 7,2 6-7,34 (1H, м), 7,61-7,70 (1H, м);
ИК (KBr, см-1): 2443, 1756, 1712.
(Пример 152) (E)-3-{[2-(Карбоксиметил)-2H-тетразол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-1593)
(E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[2-(метоксикарбонилметил)-2H-тетразол-5-ил]метилиден}-4-сульфанилпиперидина гидрохлорид (135 мг) подвергали процедуре, подобной описанной в примере 134. После очистки препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. хлороводородная кислота, 25/75, об./об.) получили указанное в заголовке соединение (91,6 мг, выход: 70%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, пиридин-d5) δ м.д.: 0,65-0,78 (2H, м), 0,91-0,99 (1Н, м), 1,07-1,19 (1H, м), 1,81-1,95 (1H, м), 2,26-2,36 (1H, м), 2,41-2,50 (1H, м), 2,68-2,81 (1H, м), 2,89-3,03 (1H, м), 4,01 (1H, шс), 4,14-4,39 (2H, м), 4,95 и 4,96 (общая 1H, каждый с), 5,84-5,96 (2H, м), 6,94 и 6,96 (общая 1H, каждый с), 7,12-7,23 (2H, м), 7,26-7,34 (1H, м), 7,63-7,71 (1H, м);
ИК (KBr, см-1): 2927, 1746, 1712.
(Пример 153) (Z)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-пиразол-3-ил]метилиден}пиперидина гидрохлорид (соединение № 4-14)
(a) (E)- и (Z)-4-(Ацетилсульфанил)-3-{[1-(этоксикарбонилметил)-1H-пиразол-3-ил]метилиден}пиперидина гидротрифторацетат
Следуя процедуре, подобной описанной в примере 75-(a) и (b), с использованием этилбромацетата вместо трет-бутилбромацетата, получали (E)-4-(ацетилсульфанил)-3-{[1-(этоксикарбонилметил)-1H-пиразол-3-ил]метилиден}-1-(трифенилметил)пиперидин. К раствору полученного соединения (18,02 г) в диметилсульфоксиде (150 мл) добавляли тиоацетат калия (36,4 г). После перемешивания смеси при 80°C в течение 5 часов ее охлаждали и продукты экстрагировали этилацетатом. После промывки органического слоя водным раствором хлорида натрия и сушки над безводным сульфатом магния органический слой концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь гексана и этилацетата (3:2), с получением смеси геометрических изомеров 4-(ацетилсульфанил)-3-{[1-(этоксикарбонилметил)-1H-пиразол-3-ил]метилиден}-1-(трифенилметил)пиперидина (11,7 г, выход:65%) в виде коричневого масла.
Полученную выше смесь (11 г) растворяли в дихлорметане (100 мл) и к раствору добавляли трифторуксусную кислоту (4,43 мл). После перемешивания смеси при комнатной температуре в течение 1 часа растворители выпаривали при пониженном давлении. Остаток подвергали хроматографии на силикагеле (дихлорметан/метанол = 10/1) с получением менее полярного изомера, (E)-4-(ацетилсульфанил)-3-{[1-(этоксикарбонилметил)-1H-пиразол-3-ил]метилиден}пиперидина гидротрифторацетата (3,24 г, выход: 38%), в виде бледно-оранжевого кристаллического твердого вещества. Дополнительное элюирование смешанным растворителем из дихлорметана и метанола (4:1) дало более полярный изомер, (Z)-4-(ацетилсульфанил)-3-{[1-(этоксикарбонилметил)-1H-пиразол-3-ил]метилиден}пиперидина гидротрифторацетат (3,57 г, выход: 42%), в виде бледно-желтого кристаллического твердого вещества.
Более полярный изомер, (Z)-4-(ацетилсульфанил)-3-{[1-(этоксикарбонилметил)-1H-пиразол-3-ил]метилиден}пиперидина гидротрифторацетат:
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,27 (3H, т, J=7,0), 2,01-2,03 (1H, м), 2,35-2,38 (4H, м), 3,22-3,33 (1H, м), 3,35-3,45 (1H, м), 3,56-3,69 (1H, м), 3,78-3,87 (1H, м), 4,21 (2H, кв, J=7,0), 4,84 (2H, с), 5,60-5,65 (1H, м), 6,30 (1H, с), 6,39 (1H, шс), 7,41 (1H, с).
(b) (Z)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-пиразол-3-ил]метилиден}пиперидина гидрохлорид
Следуя процедуре, подобной описанной в примере 132-(g), (Z)-4-(ацетилсульфанил)-3-{[1-(этоксикарбонилметил)-1H-пиразол-3-ил]метилиден}пиперидина гидротрифторацетат (1,5 г) подвергали взаимодействию с 2-бром-2-(2-фторфенил)-1-циклопропилэтаноном и триэтиламином. Полученный при этом продукт очищали хроматографией на силикагеле с получением свободного основания указанного в заголовке соединения (0,66 г) в виде желтой пены, которое обрабатывали 4 н. диоксановым раствором хлороводорода с получением указанного в заголовке соединения (0,83 г, выход: 45%) в виде желтой пены.
1H ЯМР (500 МГц, пиридин-d5) δ м.д.: 0,75-0,87 (2H, м), 1,04 (3H, т, J=7,0), 1,09-1,17 (2H, м), 1,88-2,01 (1H, м), 2,20-2,39 (3H, м), 2,51-2,58 и 2,70-2,78(общая 2H, каждый м), 2,91-3,01 (1Н,м), 3,05-3,18 (1H, м), 3,48-3,71 (2H, м), 4,07 (2H, кв, J=7,0), 4,90 (1H, д, J=11,0), 5,22 (2H, д, J=6,5), 5,97-6,03 (1H, м), 6,50-6,63 (2H, м), 7,20-7,27 (2H, м), 7,29-7,37 (1H, м), 7,67-7,76 (1H, м), 7,80-7,85 (1H, м);
МС (FAB) m/z : 500 (М+H)+;
ИК (KBr, см-1): 1695, 1493.
(Пример 154) (Z)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-пиразол-3-ил]метилиден}-4-сульфанилпиперидина гидрохлорид (соединение № 4-15)
(Z)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-пиразол-3-ил]метилиден}пиперидина гидрохлорид (0,80 г) обрабатывали хлороводородом способом, подобным описанному в примере 133, и продукт очищали препаративной ВЭЖХ с получением свободного основания указанного в заголовке соединения (0,31 г) в виде бледно-желтой пены, которое обрабатывали 4 н. диоксановым раствором хлороводорода с получением указанного в заголовке соединения (0,38 г, выход: 51%) в виде бледно-желтой пены.
1H ЯМР (500 МГц, пиридин-d5) δ м.д.: 0,79-0,83 (2H, м), 0,99-1,08 (4H, м), 1,09-1,15 (1H, м), 1,73 и 1,80 (общая 1H, каждый д, J=14), 2,18-2,27 и 2,27-2,36 (общая 1H, каждый м), 2,52-2,59 (1H, м), 2,65-3,04 (2H, м), 3,37 и 3,67 (общая 1H, каждый д, J=12,5), 3,52 (1H, т, J=14,0), 4,06-4,12 (2H, м), 4,92 (1H, д, J=8,0), 5,27 (2H, д, J=7,0), 5,47-5,51 (1H, м), 6,27 и 6,38 (общая 1H, каждый с), 6,53 и 6,59 (общая 1H, каждый с), 7,19-7,25 (2H, м), 7,28-7,34 (1H, м), 7,71-7,77 (1H, м), 7,85 и 7,87 (общая 1H, каждый д, J=2,0);
МС (FAB) m/z: 458 (М+H)+;
ИК (KBr, см-1): 2523, 1712, 1493.
(Пример 155) (Z)-3-{[1-(Карбоксиметил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 4-5)
К раствору (Z)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-пиразол-3-ил]метилиден}-4-сульфанилпиперидина гидрохлорида (309 мг) добавляли 3 н. хлороводородную кислоту (10 мл) и смесь перемешивали при 60°C в течение 1 часа. Смесь концентрировали при пониженном давлении, после чего остаток очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. хлороводородная кислота, 40/60, об./об.) с получением указанного в заголовке соединения (227 мг, выход: 67%) в виде бесцветного кристаллического твердого вещества.
1H ЯМР (500 МГц, пиридин-d5) δ м.д.: 0,77-0,84 (2H, м), 0,98-1,04 (1H, м), 1,09-1,15 (1H, м), 1,73 и 1,80 (общая 1H, каждый д, J=14), 2,18-2,27 и 2,27-2,36 (общая 1H, каждый м), 2,53-2,61 (1H, м), 2,65-3,04 (3H, м), 3,38 и 3,67 (общая 1H, каждый д, J=12,0), 3,49-3,57(1Н,м), 4,92 (1H, д, J=9,0), 5,36 (2H, д, J=9,0), 5,48-5,56 (1H, м), 6,30 и 6,42 (общая 1H, каждый с), 6,57 и 6,62 (общая 1H, каждый с), 7,14-7,35 (3H, м), 7,72-7,77 (1H, м), 7,90-7,95 (1H, м);
МС (FAB) m/z: 430 (М+H)+;
ИК (KBr, см-1): 2550, 1711, 1493.
(Пример 156) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1(2)H-тетразол-5-ил]метилиден}пиперидина гидротрифторацетат (соединение № 1-58)
(a) [2-(4-Метоксибензил)-2H-тетразол-5-ил]метанол и [1-(4-метоксибензил)-1H-тетразол-5-ил]метанол
К раствору [1(2)-тетразол-5-ил]метанола (5 г) в ацетонитриле (60 мл) добавляли триэтиламин (8,3 мл) и 4-метоксибензилхлорид (8,1 мл). После перемешивания смеси при комнатной температуре в течение 1 часа и 15 минут и затем при 75°C в течение 45 минут ее охлаждали. Остаток, который получали обычным экстрагированием, очищали хроматографией на силикагеле, используя в качестве элюентов смесь гексана, этилацетата и дихлорметана (1:1:1) и затем смесь гексана и этилацетата (1:3), с получением смеси двух указанных в заголовке изомеров (3,17 г, выход: 29%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 3,79 (3H, с), 4,83 и 4,93 (общая 2H, каждый с), 5,57 и 5,66 (общая 2H, каждый с), 6,86 и 6,87 (общая 2H, каждый д, J=9,0), 7,24 и 7,31 (общая 2H, каждый д, J=9,0).
(b) 2-(4-Метоксибензил)-2H-тетразол-5-карбальдегид и 1-(4-метоксибензил)-1H-тетразол-5-карбальдегид
Следуя процедуре, подобной описанной в примере 132-(b), смесь (27,82 г) [2-(4-метоксибензил)-2H-тетразол-5-ил]метанола и [1-(4-метоксибензил)-1H-тетразол-5-ил]метанола окисляли в дихлорметане (400 мл) пиридинийдихроматом (95,0 г) в присутствии молекулярных сит 4A (95 г). Смесь фильтровали и концентрировали, после чего остаток очищали хроматографией на силикагеле, используя этилацетат в качестве элюента, с получением смеси двух указанных в заголовке изомеров (12,89 г, выход: 47%) в виде желтого масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 3,79 и 3,81 (общая 3H, каждый с), 5,80 и 5,81 (общая 2H, каждый с), 6,87 и 6,91 (общая 2H, каждый д, J=8,5), 7,36 и 7, 81 (общая 2H, каждый д, J=8,0), 10,20 и 10,26 (общая 1H, каждый с).
(c) (E)-3-{[2-(4-Метоксибензил)-2H-тетразол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-он и (E)-3-{[1-(4-метоксибензил)-1H-тетразол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-он
Следуя процедуре, подобной описанной в примере 132-(c), смесь, полученную в примере 156-(b) (11,89 г), подвергали взаимодействию с 1-(трифенилметил)пиперидин-4-оном (18,6 г) и пирролидином (4,5 мл) и продукт очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана и этилацетата (3:1), с получением смеси двух указанных в заголовке изомеров (16,88 г, выход: 57%) в виде желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,60-2,70 (2H, шс), 2,78 (2H, дд, J=13,5, 6,0), 3,81 (3H, с), 3,82-3,87 (2H, м), 5,53 (2H, с), 6,82-6,88 (2H, м), 7,11-7,17 (4H, м), 7,19-7,29 (7H, м), 7,45-7,48 (7H, м).
(d) (E)-3-{[2-(4-Метоксибензил)-2H-тетразол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол и (E)-3-{[1-(4-метоксибензил)-1H-тетразол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол
Следуя процедуре, подобной описанной в примере 132-(d), смесь (17,88 г) (E)-3-{[2-(4-метоксибензил)-2H-тетразол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-она и (E)-3-{[1-(4-метоксибензил)-1H-тетразол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-она восстанавливали борогидридом натрия (1,25 г) в смешанном растворителе из дихлорметана (100 мл) и метанола (100 мл). Продукты экстрагировали обычным способом и очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана и этилацетата (2:1), с получением менее полярного изомера указанного в заголовке соединения (9,33 г, выход: 52%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,84-1,87 (4H, м), 2,14-2,19 (1H, м), 2,89-2,99 (1H, м), 3,61 (3H, с), 5,38 (1H, д, J=14,5), 5,54 (1H, д, J=14,5), 6,69 (1H, с), 6,88 (2H, д, J=8,0), 7,12-7,17 (11H, м), 7,89-7,90 (7H, м).
Дополнительное элюирование смесью гексан/этилацетат (1/2) дало более полярный изомер указанного в заголовке соединения (4,55 г, выход: 25,4%) в виде бесцветного аморфного твердого вещества.
(e) (E)-4-(Ацетилсульфанил)-3-{[2-(4-метоксибензил)-2H-тетразол-5-ил]метилиден}пиперидина гидротрифторацетат или (E)-4-(ацетилсульфанил)-3-{[1-(4-метоксибензил)-1H-тетразол-5-ил]метилиден}пиперидина гидротрифторацетат
Следуя процедуре, подобной описанной в примере 132-(e), менее полярный изомер (9,33 г), полученный в примере 156-(d), подвергали взаимодействию с тиоуксусной кислотой (11,3 мл) и динеопентилацеталем N,N-диметилформамида (48,0 мл) в толуоле (100 мл). После обычного экстрагирования продукт очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана и этилацетата (3:1), с получением тиоацетата (6,7 г, включая примеси) в виде коричневого масла. Полученное соединение обрабатывали трифторуксусной кислотой (2,2 мл) в дихлорметане (100 мл) способом, подобным описанному в примере 132-(f), и продукт очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (20:1-5:1) с получением того или другого (в соответствии с исходным материалом) изомера указанных в заголовке соединений (3,11 г, выход: 38%) в виде коричневого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,07-2,14 (1H, м), 2,37 (3H, с), 2,45-2,53 (1H, м), 3,19-3,25 (2H, м), 3,42-3,47 (1H, м), 3,79 (3H, с), 3,99 (1H, д, J=15,0), 4,59-4,61 (1H, м), 5,19 (1H, д, J=14,0), 5,63 (2H, с), 6,86-6,88 (3H, с), 7,29 (2H, д, J=9,0).
(f) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[2-(4-метоксибензил)-2H-тетразол-5-ил]метилиден}пиперидин или (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(4-метоксибензил)-1H-тетразол-5-ил]метилиден}пиперидин
Следуя процедуре, подобной описанной в примере 132-(g), соединение (3,11 г), полученное в примере 156-(e), подвергали взаимодействию с 2-бром-2-(2-фторфенил)-1-циклопропилэтаноном (2,03 г) и триэтиламином (2,2 мл) в ацетонитриле (50 мл). Неочищенный продукт, который получали обычным экстрагированием, очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана и этилацетата (2:1), с получением того или другого (в соответствии с исходным материалом) изомера указанных в заголовке соединений (2,08 г, выход: 59%) в виде коричневатого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,66-0,99 (4H, м), 1,86-1,93 (1H, м), 2,18-2,25 (2H, м), 2,30 (3H, с), 2,46-2,61 (1H, м), 2,76-2,83 (1H, м), 3,42-3,47 (1H, м), 3,80 (3H, с), 4,22 (1H, д, J=13,5), 4,48-4,52 (1H, м), 4,74 (1H, д, J=3,0), 5,51-5,64 (2H, м), 6,64 (1H, с), 6,87-6,90 (2H, м), 7,04-7,14 (2H, м), 7,29-7,40 (4H, м).
(g) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1(2)H-тетразол-5-ил]метилиден}пиперидина гидротрифторацетат
Раствор соединения (2,08 г), полученного в примере 156-(f), в трифторуксусной кислоте (20 мл) перемешивали при 60°C в течение 14,5 часов. После охлаждения смесь концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (20:1), с получением указанного в заголовке соединения (2,65 г, выход: 100%) в виде коричневого масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,86-0,94 (1H, м), 0,99-1,06 (1H, м), 1,15-1,22 (2H, м), 1,66-1,75 (1H, м), 2,12-2,18 (1H, м), 2,35 (3H, с), 2,56-2,68 (1H, м), 3,08-3,14 (1H, м), 3,32-3,38 (1H, м), 3,60 (1H, с), 4,47-4,49 (1H, м), 4,55-4,61 (2H, м), 5,62 (1H, с), 6,89 (1H, д, J=10,0), 7,29-7,45 (3H, м), 7,57-7,62 (1H, м).
(Пример 157) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанил-3-{[1(2)H-тетразол-5-ил]метилиден}пиперидина гидрохлорид (соединение № 1-57)
Следуя процедуре, подобной описанной в примере 133, (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1(2)H-тетразол-5-ил]метилиден}пиперидина гидротрифторацетат (500 мг) обрабатывали хлороводородом и продукт очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. хлороводородная кислота, 30/70, об./об.) с получением указанного в заголовке соединения (310 мг, выход: 80%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (500 МГц, пиридин-d5) δ м.д.: 0,64-0,75 (2H, м), 0,91-1,01 (1H, м), 1,06-1,21 (1H, м), 1,81-1,96 (1H, м), 2,23-2,35 (1H, м), 2,36-2,44 (1H, м), 2,61-2,69 и 2,73-2,82 (общая 1H, каждый м), 2,84-2,93 и 3,00-3,10 (общая 1H, каждый м), 3,99 и 4,05 (общая 1H, каждый т, J=5,5), 4,22 и 4,50 (общая 1H, каждый д, J=13,0), 4,33 и 4,46 (общая 1H, каждый д, J=13,0), 5,01 и 5,02(общая 1H, каждый с), 7,01 и 7,06 (общая 1H, каждый с), 7,12-7,19 (2H, м), 7,24-7,30 (1H, м), 7,59-7,66 (1H, м),
ИК (KBr, см-1): 2939, 1710.
(Пример 158) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)-1H-тетразол-5-ил]метилиден}пиперидина гидрохлорид (соединение № 2-1546)
(a) (E)-3-{[1-(Метоксикарбонилметил)-1H-тетразол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол
Следуя процедуре, подобной описанной в примере 150-(d), (E)-3-{[1-(метоксикарбонилметил)-1H-тетразол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-он (пример 150-(c), 2,2 г) восстанавливали борогидридом натрия. Очистка дала указанное в заголовке соединение (1,5 г, выход: 68%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д.: 1,65-1,80 (2H, м), 1,98-2,05 (1H, м), 2,80-3,10 (2H, м), 3,29-3,31 (1H, м), 3,79 (3H, с), 3,99 (1H, шс), 5,75 (2H, с), 6,47 (1H, с), 7,06-7,41 (15H, м).
(b) (E)-4-(Ацетилсульфанил)-3-{[1-(метоксикарбонилметил)-1H-тетразол-5-ил]метилиден}пиперидина гидротрифторацетат
Следуя процедуре, подобной описанной в примере 150-(e), (E)-3-{[1-(метоксикарбонилметил)-1H-тетразол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол (1,5 г) подвергали взаимодействию с тиоуксусной кислотой и динеопентилацеталем N,N-диметилформамида. Продукт очищали хроматографией на силикагеле с получением (E)-4-(ацетилсульфанил)-3-{[1-(метоксикарбонилметил)-1H-тетразол-5-ил]метилиден}-1-(трифенилметил)пиперидина (980 мг). Указанный продукт аналогичным образом обрабатывали трифторуксусной кислотой в дихлорметане и полученный продукт очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (20:1), с получением указанного в заголовке соединения (342 мг, общий выход: 27%) в виде желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,07-2,18 (1H, м), 2,36 (3H, с), 2,52-2,65 (1H, м), 3,12-3,26(1H, м), 3,44-3,55 (1H, м), 3,82 (3H, с), 3,91 (1H, д, J=15,0), 4,60 (1H, т, J=4,0), 5,08 (1H, д, J=15,0), 5,10 (1H, д, J=17,5), 5,23 (1H, д, J=17,5), 6,57 (1H, с).
(c) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)-1H-тетразол-5-ил]метилиден}пиперидина гидрохлорид
К раствору (E)-4-(ацетилсульфанил)-3-{[1-(метоксикарбонилметил)-1H-тетразол-5-ил]метилиден}пиперидина гидротрифторацетата (342 мг) в ацетонитриле (10 мл) добавляли 2-бром-2-(2-фторфенил)-1-циклопропилэтанона (414 мг) и триэтиламин (340 мкл). После перемешивания при комнатной температуре в течение 3 часов смесь распределяли между водой и этилацетатом. Органический слой отделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Удаление растворителя выпариванием при пониженном давлении с последующей очисткой остатка колоночной хроматографией на силикагеле с использованием смеси гексана, этилацетата и дихлорметана (2:1:1) в качестве элюента дали свободное основание указанного в заголовке соединения, которое дополнительно очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. хлороводородная кислота, 30/70, об./об.) с получением указанного в заголовке соединения (176 мг, выход: 42%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, пиридин-d5) δ м.д.: 0,67-0,78 (2H, м), 0,94-1,21 (2H, м), 1,81-1,91 (1H, м), 2,19 (3H, с), 2,22-2,33 (1H, м), 2,33-2,47 (1H, м), 2,43-2,52 и 2,69-2,78 (общая 1H, каждый м), 2,81-2,97 (1H, м), 3,58 и 3,65 (общая 1H, каждый д, J=14,0),3,59 (3H, с), 4,59-4,67 (1Н, м), 4,77 и 4,92 (общая 1H, каждый д, J=14,0), 4,99 и 5,03 (общая 1H, каждый с), 5,85 (2H, с), 6,90 и 6,92 (общая 1H, каждый с), 7,12-7,35 (3H, м), 7,57-7,63 (1H, м,);
ИК (KBr, см-1): 2504, 1753, 1706.
(Пример 159) (E)-3-{[1-(Карбоксилметил)-1H-тетразол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-1529)
Карбонат калия (74 мг) добавляли к раствору (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)-1H-тетразол-5-ил]метилиден}пиперидина гидрохлорида (128 мг) в метаноле (5 мл). После перемешивания при комнатной температуре в течение 15 минут смесь распределяли между водой и этилацетатом. Органический слой отделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Концентрирование при пониженном давлении давало остаток, который очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. хлороводородная кислота, 30/70, об./об.) с получением (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)-1H-тетразол-5-ил]метилиден}-4-сульфанилпиперидина гидрохлорида (57 мг, общий выход: 49%, часть полученного продукта была гидролизована у метилового сложноэфирного фрагмента). Полученный продукт (40 мг) обрабатывали хлороводородной кислотой способом, подобным описанному в примере 134, и полученный продукт очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. хлороводородная кислота, 25/75, об./об.) с получением указанного в заголовке соединения (13 мг, выход: 34%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (500 МГц, пиридин-d5) δ м.д.: 0,67-0,77 (2H, м), 0,94-1,02 (1H, м), 1,07-1,18 (1H, м), 1,77-1,89 (1H, м), 2,21-2,32 (1H, м), 2,37-2,47 (1H, м), 2,60-2,67 и 2,72-2,80 (общая 1H, каждый м), 2,82-2,89 и 2,99-3,07 (общая 1H, каждый м), 3,94-4,07 (1H, м), 4,23 и 4,51 (общая 1H, каждый д, J=13,0), 4,27 и 4,37 (общая 1H, каждый д, J=13,0), 4,99 и 5,01 (общая 1H, каждый с), 5,77 (2H, с), 7,00 и 7,03 (общая 1H, каждый с), 7,10-7,49 (3H, м), 7,58-7,65 (1H, м);
FAB-МС [М+H]+: 432.
(Пример 160) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)-1H-1,2,3-триазол-5-ил]метилиден}пиперидина гидрохлорид (соединение № 2-1226)
(a) Метил [5-(гидроксиметил)-1H-1,2,3-триазол-1-ил]ацетат и метил [4-(гидроксиметил)-1H-1,2,3-триазол-1-ил]ацетат
К раствору метилазидоацетата (24,41 г) в толуоле (400 мл) добавляли пропаргиловый спирт (11,9 г) и смесь кипятили с обратным холодильником в течение 8 часов. После охлаждения смеси растворитель и непрореагировавшие исходные материалы удаляли выпариванием при пониженном давлении с получением смеси двух указанных в заголовке изомеров (31,74 г, выход: 87%, изомерное отношение: приблизительно 1:1) в виде желтого масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 3,78 и 3,79 (общая 3H, с), 4,72 и 4,76 (общая 2H, каждый с), 5,15 и 5,26 (общая 2H, каждый с), 7,54 и 7,64 (общая 1H, с).
(b) Метил (5-формил-1H-1,2,3-триазол-1-ил)ацетат и метил (4-формил-1H-1,2,3-триазол-1-ил)ацетат
Активный диоксид марганца (30,5 г) добавляли к раствору полученной выше смеси метил [5-(гидроксиметил)-1H-1,2,3-триазол-1-ил]ацетата и метил [4-(гидроксиметил)-1H-1,2,3-триазол-1-ил]ацетата (6,0 г) в дихлорметане (100 мл). После перемешивания при комнатной температуре в течение 3 часов смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (20:1), с получением смеси двух указанных в заголовке изомеров (1,93 г, выход: 33%, изомерное отношение: приблизительно 1:4) в виде желтого масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 3,79 и 3,84 (общая 3H, каждый с), 5,25 и 5,29 (общая 2H, каждый с), 8,25 и 8,28 (общая 1H, каждый с), 10,20 и 10,22 (общая 1H, каждый с).
(c) (E)-3-{[1-(Метоксикарбонилметил)-1H-1,2,3-триазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-он и (E)-3-{[1-(метоксикарбонилметил)-1H-1,2,3-триазол-4-ил]метилиден}-1-(трифенилметил)пиперидин-4-он
Следуя процедуре, подобной описанной в примере 132-(c), полученную выше смесь (13,0 г) метил (5-формил-1H-1,2,3-триазол-1-ил)ацетата и метил (4-формил-1H-1,2,3-триазол-1-ил)ацетата подвергали взаимодействию с 1-(трифенилметил)пиперидин-4-оном (13,0 г). Неочищенные продукты, полученные экстрагированием, отделяли и очищали хроматографией на силикагеле, используя смесь гексана, этилацета и дихлорметана (2:1:1) в качестве элюента, с получением соответственно двух указанных в заголовке изомеров.
Менее полярный изомер (E)-3-{[1-(метоксикарбонилметил)-1H-1,2,3-триазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-он; количество: 3,74 г, выход: 15%, желтое аморфное твердое вещество.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,64 (2H, шс), 2,71 (2H, т, J=6,0), 3,32 (2H, шс), 3,73 (3H, с), 5,14 (2H, с), 7,05-7,50 (17H, м).
Более полярный изомер (E)-3-{[1-(метоксикарбонилметил)-1H-1,2,3-триазол-4-ил]метилиден}-1-(трифенилметил)пиперидин-4-он; количество: 10,53 г, выход: 41%, желтое аморфное твердое вещество.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,67 (2H, шс), 2,76 (2H, т, J=6,0), 3,67 (2H, шс), 3,78 (3H, с), 5,09 (2H, с), 7,10-7,27 (10H, м), 7,44-7,56 (7H, м).
(d) (E)-3-{[1-(Метоксикарбонилметил)-1H-1,2,3-триазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол
Борогидрид натрия (830 мг) добавляли к раствору (E)-3-{[1-(метоксикарбонилметил)-1H-1,2,3-триазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-она (21,46 г) в тетрагидрофуране (500 мл) при 0°C. После перемешивания смеси при 0°C в течение 4 часов ее фильтровали и фильтрат разбавляли этилацетатом. Затем реакционную смесь гасили добавлением насыщенного водного раствора хлорида аммония. Смесь экстрагировали этилацетатом и отделенный органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Экстракт концентрировали при пониженном давлении и остаток очищали хроматографией на силикагеле, используя смесь гексана, этилацетата и дихлорметана (1:2:1) в качестве элюента, с получением указанного в заголовке соединения (6,27 г, выход: 29%)в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д.: 1,63-1,81 (2H, м), 2,14 (1H, шс), 2,72 (1H, шс), 3,60 (1H, шс), 3,74 (3H, с), 3,92 (1H, шс), 5,22 (1H, шс), 5,39 (1H, д, J=17,5), 5,46 (1H, д, J=17,5), 6,31 (1H, с), 7,01-7,49 (16H, м).
(e) (E)-4-(Ацетилсульфанил)-3-{[1-(метоксикарбонилметил)-1H-1,2,3-триазол-5-ил]метилиден}пиперидина гидротрифторацетат
К раствору (E)-3-{[1-(метоксикарбонилметил)-1H-1,2,3-триазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола (6,27 г) в смешанном растворителе из дихлорметана (100 мл) и толуола (100 мл) добавляли тиоуксусную кислоту (3,62 мл) и динеопентилацеталь N,N-диметилформамида (14,0 мл). После перемешивания смеси при комнатной температуре в течение 1 часа добавляли к ней воду и продукты экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Концентрировали его при пониженном давлении, после чего остаток очищали хроматографией на силикагеле, используя смесь гексана, этилацетата и дихлорметана (2:1:1) в качестве элюента, с получением неочищенного (E)-4-(ацетилсульфанил)-3-{[1-(метоксикарбонилметил)-1H-1,2,3-триазол-5-ил]метилиден}-1-(трифенилметил)пиперидина (4,0 г).
Полученный выше продукт растворяли в дихлорметане (200 мл) и к раствору добавляли трифторуксусную кислоту (1,11 мл). Смесь перемешивали при комнатной температуре в течение 15 минут и затем концентрировали при пониженном давлении. Остаток очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,026 н. водный раствор трифторуксусной кислоты, 15/85, об./об.) с получением указанного в заголовке соединения (1,06 г, выход: 20%) в виде желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,08-2,17 (1H, м), 2,37 (3H, с), 2,43-2,55 (1H, м), 3,25 (1H, шс), 3,49 (1H, д, J=13,5), 3,79 (3H, с), 3,79-3,88 (1H, м), 4,09 (1H, д, J=13,5), 4,56 (1H, т, J=4,0), 5,09 (1H, д, J=17,5), 5,15 (1H, д, J=17,5), 6,58 (1H, с), 7,83 (1H, с).
(f) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)-1H-1,2,3-триазол-5-ил]метилиден}пиперидина гидрохлорид
Следуя процедуре, подобной описанной в примере 150-(g),(E)-4-(ацетилсульфанил)-3-{[1-(метоксикарбонилметил)-1H-1,2,3-триазол-5-ил]метилиден}пиперидина гидротрифторацетат (1,06 г) подвергали взаимодействию с 2-бром-2-(2-фторфенил)-1-циклопропилэтаноном и триэтиламином и свободное основание, которое получали хроматографией на силикагеле, аналогичным образом обрабатывали хлороводородом с получением указанного в заголовке соединения (650 мг, выход: 50%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,67-0,83 (2H, м), 0,89-1,02 (2H, м), 1,80-1,90 (1H, м), 1,94-2,01 (1H, м), 2,16-2,28 (1H, м), 2,28 и 2,29 (общая 3H, каждый с), 2,41-2,57 (1H, м), 2,72-2,77 и 2,80-2,87 (общая 1H, каждый м),2,88 и 3,12 (общая 1H, каждый д, J=13,0), 3,44 и 3,47 (общая 1H, каждый д, J=13,0), 3,74 и 3,76 (общая 3H, каждый с), 4,38-4,43 (1H, м), 4,70 и 4,72 (общая 1H, каждый с), 5,02-5,10 (2H, м), 6,21 (1H, с), 7,04-7,18 (2H, м), 7,23-7,36 (2H, м), 7,43 и 7,48 (общая 1H, каждый с);
ИК (KBr, см-1): 2470, 1753, 1699.
(Пример 161) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)-1H-1,2,3-триазол-5-ил]метилиден}-4-сульфанилпиперидина гидрохлорид (соединение № 2-1225)
Следуя процедуре, подобной описанной в примере 151, (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)-1H-1,2,3-триазол-5-ил]метилиден}пиперидина гидрохлорид (560 мг) обрабатывали карбонатом калия в метаноле и концентрированный экстракт очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. хлороводородная кислота, 30/70, об./об.) с получением указанного в заголовке соединения (370 мг, выход: 72%) в виде желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,65-0,85 (2H, м), 0,89-1,02 (2H, м), 1,73-1,84 (1H, м), 1,91-2,02 (1H, м), 2,18-2,32 (1H, м), 2,56-2,70 (1Н, м), 2,77-2,91 (1H, м), 3,13 и 3,20 (общая 1H, каждый д, J=12,5), 3,38 и 3,53 (общая 1H, каждый д, J=12,5), 3,71-3,84 (1H, м), 3,76 (3H, с), 4,73 и 4,74 (общая 1H, каждый с), 5,09 (2H, с), 6,22 и 6,23 (общая 1H, каждый с), 7,05-7,17 (2H, м), 7,23-7,36 (2H, м), 7,43 и 7,48 (общая 1H, каждый с);
ИК (KBr, см-1): 2449, 1752, 1711.
(Пример 162) (E)-3-{[1-(Карбоксиметил)-1H-1,2,3-триазол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-1209)
Следуя процедуре, подобной описанной в примере 134, (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)-1H-1,2,3-триазол-5-ил]метилиден}-4-сульфанилпиперидина гидрохлорид (200 мг) обрабатывали хлороводородной кислотой и остаток, полученный концентрированием, очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. хлороводородная кислота, 25/75, об./об.) с получением указанного в заголовке соединения (174 мг, выход: 90%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, пиридин-d5) δ м.д.: 0,61-0,77 (2H, м), 0,90-1,08 (2H, м), 1,74-1,86 (1H, м), 2,16-2,36 (2H, м), 2,58-2,82 (1H, м), 2,82-3,00 (1H, м), 3,60 и 3,62 (общая 1H, каждый д, J=13,0), 3,75 и 3,82 (общая 1H, каждый д, J=13,0), 3,93-4,01 (1H, м), 4,94 и 4,95 (общая 1H, каждый с), 5,65 (2H, с), 6,83 и 6,85 (общая 1H, каждый с), 7,12-7,23 (2H, м), 7,24-7,34 (1H, м), 7,52-7,63 (1H, м), 7,96 и 8,03 (общая 1H, каждый с);
ИК (KBr, см-1): 2923, 2519, 1740, 1710.
(Пример 163) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)-1H-1,2,3-триазол-5-ил]метилиден}пиперидин-4-ола гидрохлорид (соединение № 2-1162)
(a) (E)-3-{[1-(Метоксикарбонилметил)-1H-1,2,3-триазол-4-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол
Борогидрид натрия (508 мг) добавляли к раствору (E)-3-{[1-(метоксикарбонилметил)-1H-1,2,3-триазол-4-ил]метилиден}-1-(трифенилметил)пиперидин-4-она (6,61 г), полученного в примере 160-(c), в тетрагидрофуране (150 мл) при 0°C. После перемешивания при 0°C в течение 6 часов смесь фильтровали и фильтрат разбавляли этилацетатом, после чего реакционную смесь гасили добавлением насыщенного водного раствора хлорида аммония. Продукты экстрагировали этилацетатом и отделенный органический слой промывали насыщенным водным раствором хлорида натрия. Концентрирование при пониженном давлении давало твердое вещество, которое собирали фильтрованием и промывали смешанным растворителем гексан-этилацетат-дихлорметан (1:1:1), с получением указанного в заголовке соединения (4,7 г, выход: 71%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д.: 1,67-1,82 (2H, м), 1,91-2,03 (1H, м), 2,62-2,76 (1H, м), 3,36-3,47 (1H, м), 3,72 (3H, с), 3,91 (1H, шс), 5,08 (1H, шс), 5,21 (1H, д, J=17,5), 5,32 (1H, д, J=17,5), 6,48 (1H, с), 7,00-7,53 (15H, м), 7,85 (1H, с)
(b) (E)-4-(Ацетилсульфанил)-3-{[1-(метоксикарбонилметил)-1H-1,2,3-триазол-4-ил]метилиден}пиперидина гидротрифторацетат
Следуя процедуре, подобной описанной в примере 160-(e), (E)-3-{[1-(метоксикарбонилметил)-1H-1,2,3-триазол-4-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол (4,7 г) обрабатывали тиоуксусной кислотой и динеопентилацеталем N,N-диметилформамида. После экстрагирования полученное вещество очищали хроматографией на силикагеле с получением (E)-4-(ацетилсульфанил)-3-{[1-(метоксикарбонилметил)-1H-1,2,3-триазол-4-ил]метилиден}-1-(трифенилметил)пиперидина (2,6 г). Полученное соединение аналогичным образом обрабатывали трифторуксусной кислотой в дихлорметане и остаток, полученный концентрированием реакционной смеси, очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,026 н. водный раствор трифторуксусной кислоты, 18/82, об./об.) с получением указанного в заголовке соединения (550 мг, выход: 14%) в виде желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,09-2,16 (1H, м), 2,37 (3H, с), 2,42-2,56 (1H, м), 3,23-3,36 (1H, м), 3,51 (1H, д, J=12,0), 3,79 (3H, с), 3,90-4,00 (1H, м), 4,58 (1H, т, J=4,0), 5,04 (1H, д, J=14,0), 5,14 (2Н, д, J=5,0), 6,70 (1H, с), 7,72 (1H, с).
(c) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)-1H-1,2,3-триазол-4-ил]метилиден}пиперидина гидрохлорид
Следуя процедуре, подобной описанной в примере 150-(g), (E)-4-(ацетилсульфанил)-3-{[1-(метоксикарбонилметил)-1H-1,2,3-триазол-4-ил]метилиден}пиперидина гидротрифторацетат (550 мг) подвергали взаимодействию с 2-бром-2-(2-фторфенил)-1-циклопропилэтаноном и триэтиламином и свободное основание, которое получали хроматографической очисткой на силикагеле, обрабатывали хлороводородом с получением указанного в заголовке соединения (380 мг, выход: 56%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,64-0,83 (2H, м), 0,86-1,00 (2H, м), 1,80-1,89 (1H, м), 2,07-2,15 (1H, м), 2,19-2,30 (1H, м), 2,27 (3H, с), 2,37-2,46 и 2,55-2,64 (общая 1H, каждый м), 2,68-2,79 (1Н, м), 3,15 и 3,19 (общая 1H, каждый д, J=12,5), 3,77 (3H, с), 3,90 и 4,02 (общая 1H, каждый д, J=12,5), 4,45 (1H, т, J=5,0), 4,70 и 4,74 (общая 1H, каждый с), 5,06-5,13 (2H, м), 6,54 (1H, с), 7,02-7,14 (2H, м), 7,25-7,30 (1H, м), 7,32-7,39 (1H, м), 7,55 и 7,63 (общая 1H, каждый с);
ИК (KBr, см-1): 2505, 1753, 1697.
(Пример 164) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)-1H-1,2,3-триазол-4-ил]метилиден}-4-сульфанилпиперидина гидрохлорид (соединение № 2-1161)
Следуя процедуре, подобной описанной в примере 151, (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)-1H-1,2,3-триазол-4-ил]метилиден}пиперидина гидрохлорид (300 мг) обрабатывали карбонатом калия в метаноле и концентрированный экстракт очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. хлороводородная кислота, 25/75, об./об.) с получением указанного в заголовке соединения (130 мг, выход: 47%) в виде желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,64-1,06 (4H, м), 1,72-1,85 (1H, м), 2,02-2,15 (1H, м), 2,18-2,35 (1H, м), 2,54-2,68 (1H, м), 2,69-2,92 (1H, м), 3,52-3,65 (2H, м), 3,81 (3H, с), 3,86-3,93 (1H, м), 4,78 и 4,80 (общая 1H, каждый с), 5,08-5,15 (2H, м), 6,56 и 6,58 (общая 1H, каждый с), 7,05-7,16 (2H, м), 7,26-7,42 (2H, м), 7,60 и 7,69 (общая 1H, каждый с);
ИК (KBr, см-1): 2515, 2463, 1753, 1712.
(Пример 165) (E)-3-{[1-(Карбоксиметил)-1H-1,2,3-триазол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-1145)
Следуя процедуре, подобной описанной в примере 134, (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)-1H-1,2,3-триазол-4-ил]метилиден}-4-сульфанилпиперидина гидрохлорид (82,8 мг) обрабатывали хлороводородной кислотой и остаток, полученный концентрированием реакционной смеси, очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. хлороводородная кислота, 25/75, об./об.) с получением указанного в заголовке соединения (76,0 мг, выход: 95%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, пиридин-d5) δ м.д.: 0,61-0,79 (2H, м), 0,91-1,03 (1H, м), 1,05-1,21 (1H, м), 1,76-1,93 (1H, м), 2,22-2,36 (1H, м), 2,38-2,47 (1H, м), 2,65-2,77 (1H, м), 2,82-2,93 и 2,94-3,06 (общая 1H, каждый м), 3,92-4,41 (3H, м), 4,95 и 4,97 (общая 1H, каждый с), 5,55-5,65 (2H, м), 6,84 (1H, с), 7,11-7,22 (2H, м), 7,24-7,32 (1H, м), 7,60-7,72 (1H, м), 8,13 и 8,20 (общая 1H, каждый с);
ИК (KBr, см-1): 2913, 1743, 1710.
(Пример 166) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)-1H-1,2,4-триазол-3-ил]метилиден}пиперидина гидрохлорид (соединение № 2-1290)
(a) (E)-3-[(1,2,4-Триазол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-он
Ди(трет-бутил)дикарбонат (50,0 г) и карбонат калия (41,0 г) добавляли к раствору гидрохлорида 1,2,4-триазол-3-карбальдегида (19,8 г) в смешанном растворителе из 2-пропанола (300 мл) и воды (300 мл). После перемешивания смеси при комнатной температуре в течение 2 часов продукт экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Экстракт концентрировали при пониженном давлении и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана и этилацетата (1:1), с получением 1-(трет-бутоксикарбонил)-1H-1,2,4-триазол-3-карбальдегида (10,26 г).
Пирролидин (4,3 мл) добавляли к раствору 1-(трифенилметил)пиперидин-4-она (17,7 г) в бензоле (500 мл). Смесь кипятили с обратным холодильником в течение 3 часов, удаляя воду с помощью аппарата Дина-Старка. Смесь охлаждали до комнатной температуры и добавляли 1-(трет-бутоксикарбонил)-1H-1,2,4-триазол-3-карбальдегид (10,2 г). Смесь кипятили с обратным холодильником в течение еще 3 часов, после чего ее охлаждали и затем добавляли воду и продукты экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. После концентрирования при пониженном давлении остаток обрабатывали метанолом (200 мл) при комнатной температуре в течение 30 минут. Раствор распределяли между водой и этилацетатом и органический слой промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния. Концентрирование при пониженном давлении давало остаток, который очищали хроматографией на силикагеле, используя смесь гексана, этилацетата и дихлорметана (1:2:1) в качестве элюента, с получением указанного в заголовке соединения (2,92 г, выход: 13%) в виде желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,66 (2H, шс), 2,79 (2H, т, J=6,0), 3,88 (2H, шс), 7,10-7,55 (16H, м), 8,04 (1H, с).
(b) (E)-3-{[1-(Метоксикарбонилметил)-1H-1,2,4-триазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол и (E)-3-{[1-(метоксикарбонилметил)-1H-1,2,4-триазол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол
Борогидрид натрия (131 мг) добавляли к раствору (E)-3-[(1,2,4-триазол-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-она (2,92 г) в смешанном растворителе из дихлорметана (60 мл) и метанола (60 мл) при 0°C. После перемешивания смеси при комнатной температуре в течение 30 минут реакционную смесь гасили добавлением насыщенного водного раствора хлорида аммония. Продукты экстрагировали этилацетатом и экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Удаляли при пониженном давлении растворители с получением неочищенного (E)-3-[(1,2,4-триазол-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-ола. Неочищенный продукт растворяли в ацетонитриле (60 мл) и к раствору добавляли метилбромацетат (920 мкл). Добавляли DBU (1,25 мл) при охлаждении при 0°C, после чего смесь перемешивали при 0°C в течение 15 минут. Добавляли к смеси воду и этилацетат и разделяли слои. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Удаление растворителя выпариванием при пониженном давлении дало смесь (приблизительно 1:3) двух указанных в заголовке изомеров (2,98 г, выход: 87%) в виде бледно-желтого аморфного твердого вещества.
Менее полярный изомер (E)-3-{[1-(метоксикарбонилметил)-1H-1,2,4-триазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол:1H ЯМР (500 МГц, CDCl3, выборочные сигналы) δ м.д.: 1,69-1,79 (1H, м), 1,85-1,95 (1H, м), 2,08-2,17 (1H, м), 3,01 (1H, шс), 3,82 (3H, с), 4,03-4,15 (1H, м), 4,61 (1H, шс), 5,03 (2H, с), 6,36 (1Н, с), 7,04-7,21 (8H, м), 7,29-7,42 (7H, м), 7,65 (1H, с).
Более полярный изомер (E)-3-{[1-(метоксикарбонилметил)-1H-1,2,4-триазол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол:1H ЯМР (500 МГц, CDCl3, выборочные сигналы) δ м.д.: 1,82 (1H, шс), 1,86-1,93 (2H, м), 2,10-2,18 (2H, м), 2,83 (1H, шс), 3,80 (3H, с), 4,08-4,15 (1H, м), 4,30 (1H, шс), 4,72 (2H, д, J=17,5), 6,55 (1H, с), 7,03-7,19 (8H, м), 7,36-7,45 (7H, м), 8,00 (1H, с).
(c) (E)-4-(Ацетилсульфанил)-3-{[1-(метоксикарбонилметил)-1H-1,2,4-триазол-5-ил]метилиден}-1-(трифенилметил)пиперидин и (E)-4-(ацетилсульфанил)-3-{[1-(метоксикарбонилметил)-1H-1,2,4-триазол-3-ил]метилиден}-1-(трифенилметил)пиперидин
Смесь (2,98 г) (E)-3-{[1-(метоксикарбонилметил)-1H-1,2,4-триазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола и (E)-3-{[1-(метоксикарбонилметил)-1H-1,2,4-триазол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола, полученную в примере 166-(b), растворяли в смешанном растворителе из дихлорметана (40 мл) и толуола (40 мл) и к раствору добавляли тиоуксусную кислоту (1,3 мл) и динеопентилацеталь N,N-диметилформамида (5,0 мл). После перемешивания смеси при комнатной температуре в течение 2 часов ее распределяли между водой и этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель выпаривали при пониженном давлении с получением остатка, который очищали хроматографией на силикагеле, используя смесь гексана, этилацетата и дихлорметана (1:1:1), с получением (E)-4-(ацетилсульфанил)-3-{[1-(метоксикарбонилметил)-1H-1,2,4-триазол-5-ил]метилиден}-1-(трифенилметил)пиперидина (с примесями 1,52 г, общий выход: 46%) как менее полярного изомера и (E)-4-(ацетилсульфанил)-3-{[1-(метоксикарбонилметил)-1H-1,2,4-триазол-3-ил]метилиден}-1-(трифенилметил)пиперидина (2,08 г, выход: 62%) как полярного изомера, соответственно.
(d) (E)-4-(Ацетилсульфанил)-3-{[1-(метоксикарбонилметил)-1H-1,2,4-триазол-3-ил]метилиден}пиперидина гидротрифторацетат
Следуя процедуре, подобной описанной в примере 132-(f), (E)-4-(ацетилсульфанил)-3-{[1-(метоксикарбонилметил)-1H-1,2,4-триазол-3-ил]метилиден}-1-(трифенилметил)пиперидин, полученный в примере 166-(c), обрабатывали трифторуксусной кислотой в дихлорметане и неочищенный продукт очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (20:1-10:1), с получением указанного в заголовке соединения (860 мг, выход: 54%) в виде желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,02-2,14 (1H, м), 2,34 (3H, с), 2,38-2,51 (1H, м), 3,14-3,29 (1H, м), 3,32-3,43 (1H, м), 3,74 (3H, с), 3,95 (1H, д, J=14,0), 4,56 (1H, м), 4,90 (2H, с), 5,28 (1H, д, J=14,0), 6,73 (1H, с), 8,12 (1H, с).
(e) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)-1H-1,2,4-триазол-3-ил]метилиден}пиперидина гидрохлорид
Следуя процедуре, подобной описанной в примере 132-(g), (E)-4-(ацетилсульфанил)-3-{[1-(метоксикарбонилметил)-1H-1,2,4-триазол-3-ил]метилиден}пиперидина гидротрифторацетат (860 мг) подвергали взаимодействию с 2-бром-2-(2-фторфенил)-1-циклопропилэтаноном и продукт, очистив хроматографией на силикагеле, аналогичным образом обрабатывали хлороводородом с получением указанного в заголовке соединения (916 мг, выход: 86%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,61-1,08 (4H, м), 1,77-1,96 (1H, м), 2,20-2,36 (2H, м), 2,30 (3H, с), 2,42-2,54 и 2,59-2,71 (общая 1H, каждый м), 2,72-2,86 (1H, м), 3,38 и 3,45 (общая 1H, каждый д, J=13,5), 3,80 (3H, с), 4,38-4,53 (2H, м), 4,71 и 4,73 (общая 1H, каждый с), 4,83 и 4,89 (общая 2H, каждый с), 6,53 и 6,54 (общая 1H, каждый с), 7,03-7,17 (2H, м), 7,24-7,33 (1H, м), 7,40-7,48 (1H, м), 8,01 и 8,05 (общая 1H, каждый с);
ИК (KBr, см-1): 2507, 1754, 1699.
(Пример 167) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)-1H-1,2,4-триазол-3-ил]метилиден}-4-сульфанилпиперидина гидрохлорид (соединение № 2-1289)
Следуя процедуре, подобной описанной в примере 151, (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)-1H-1,2,4-триазол-3-ил]метилиден}пиперидина гидрохлорид (820 мг) обрабатывали карбонатом калия и неочищенный продукт очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. хлороводородная кислота, 30/70, об./об.) с получением указанного в заголовке соединения (560 мг, выход: 74%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,64-0,88 (2H, м), 0,84-1,06 (2H, м), 1,74-1,87 (1H, м), 2,22-2,37 (2H, м), 2,58-2,72 (1H, м), 2,72-2,82 и 2,86-2,95 (общая 1H, каждый м), 3,79 (3H, с), 3,80-3,94 (2H, м), 4,17 и 4,20 (общая 1H, каждый д, J=13,0), 4,74 и 4,75 (общая 1H, каждый с), 4,83 и 4,87 (общая 2H, каждый с), 6,49 и 6,50 (общая 1H, каждый с), 7,01-7,14 (2H, м), 7,23-7,31 (1H, м), 7,39-7,47 (1H, м), 8,01 и 8,03 (общая 1H, каждый с);
ИК (KBr, см-1): 2480, 1753, 1711.
(Пример 168) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-имидазол-5-ил]метилиден}пиперидин (соединение № 2-1058)
(a) Этил (5-формил-1H-имидазол-1-ил)ацетат
К раствору 1H-имидазол-4(5)-карбальдегида (5,5 г) в ацетонитриле (100 мл) добавляли этилбромацетат (7,65 мл), карбонат калия (15,8 г) и иодид калия (11,4 г) при перемешивании. Смесь перемешивали при 50°C в течение 3,5 часов и после охлаждения удаляли фильтрованием осадки и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали последовательно хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (10:1), и препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/вода, 15/85, об./об.) с получением этил (4-формил-1H-имидазол-1-ил)ацетата (4,60 г, выход: 44%) как более подвижного изомера и указанного в заголовке соединения (1,95 г, выход: 19%) как менее подвижного изомера, обоих в виде желтого масла.
Менее подвижный, указанный в заголовке изомер:1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,30 (3H, т, J=7,0), 4,26 (2H, кв, J=7,0), 5,05 (2H, с), 7,68 (1H, с), 7,84 (1H, с), 9,75 (1H, с).
(b) (E)-3-{[1-(этоксикарбонилметил)-1H-имидазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-он
К раствору 1-(трифенилметил)пиперидин-4-она (3,66 г) в бензоле (40 мл) добавляли пирролидин (0,97 мл) и смесь кипятили с обратным холодильником в течение 3,5 часов. К указанной смеси добавляли раствор этил (5-формил-1H-имидазол-1-ил)ацетата (1,95 г) в бензоле (10 мл) при охлаждении с помощью ледяной бани. Затем полученную смесь опять кипятили с обратным холодильником в течение 8,5 часов. После охлаждения смесь распределяли между водой и этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Экстракт концентрировали при пониженном давлении и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана и этилацетата (1:3), с получением указанного в заголовке соединения (1,0 г, выход: 19%) в виде желтого масла.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,30 (3H, т, J=7,0), 2,62-2,78 (4H, м),3,38 (2H, шс),4,26 (2H, кв, J=7,0), 4,75 (2H, с), 7,14-7,58 (18H, м).
(c) (E)-3-{[1-(Этоксикарбонилметил)-1H-имидазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол
Борогидрид натрия (0,06 г) добавляли к раствору (E)-3-{[1-(этоксикарбонилметил)-1H-имидазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-она (1,5 г) в смешанном растворителе из дихлорметана (10 мл) и этанола (10 мл) при 0°C. После перемешивания смеси при 0°C в течение 0,5 часа и затем при комнатной температуре в течение 1,5 часов ее распределяли между водой и этилацетатом. Органический слой отделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Удаляли растворитель при пониженном давлении и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (19:1), с получением указанного в заголовке соединения (560 мг, выход: 37%) в виде желтого аморфного твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,26 (3H, т, J=7,0), 1,84-1,93 (1H, м), 1,95-2,16 (2H, м), 2,33-2,52 (1H, м), 2,79-2,92 (1H, м), 3,65-3,79 (1H, м), 4,11-4,19 (1H, м), 4,29 (2H, кв, J=7,0), 4,71 (2H, с), 6,21 (1H, с), 6,69 (1H, с), 7,08-7,23 (9H, м), 7,33-7,42 (6H, м) 7,48 (1H, с).
(d) (E)-4-(Ацетилсульфанил)-3-{[1-(этоксикарбонилметил)-1H-имидазол-5-ил]метилиден}пиперидина гидротрифторацетат
К раствору (E)-3-{[1-(этоксикарбонилметил)-1H-имидазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола (560 мг) в N,N-диметилформамиде (5 мл) добавляли динеопентилацеталь N,N-диметилформамида (2,5 мл) и тиоуксусную кислоту (0,6 мл) при комнатной температуре. После перемешивания при той же самой температуре в течение 1,5 часов смесь распределяли между этилацетатом и водой. Органический слой отделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Растворители удаляли при пониженном давлении и остаток очищали хроматографией на силикагеле, используя смесь гексана, этилацетата и дихлорметана (1:2:2) в качестве элюента. В отдельном опыте дополнительный исходный материал, (E)-3-{[1-(этоксикарбонилметил)-1H-имидазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол (1,0 г), подвергали подобной процедуре проведения реакции и очистки. Оба продукта объединяли с получением смеси (приблизительно 5:2) (E)-4-(ацетилсульфанил)-3-{[1-(этоксикарбонилметил)-1H-имидазол-5-ил]метилиден}-1-(трифенилметил)пиперидина и 5-{(ацетилсульфанил)[1-(этоксикарбонилметил)-1H-имидазол-5-ил]метил}-1-(трифенилметил)-1,2,3,6-тетрагидропиридина (500 мг, общий выход: 29%), в виде желтого аморфного твердого вещества.
Трифторуксусную кислоту (1 мл) добавляли по каплям к раствору полученной выше смеси (500 мг) в дихлорметане (10 мл) при комнатной температуре в течение 2,5 часов при перемешивании. Смесь концентрировали при пониженном давлении и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (19:1-2:1), с получением смеси (370 мг, общий выход: 76%) указанного в заголовке соединения и 5-{(ацетилсульфанил)[1-(этоксикарбонилметил)-1H-имидазол-5-ил]метил}-1,2,3,6-тетрагидропиридина гидротрифторацетата в виде желтого аморфного твердого вещества.
1H ЯМР (500 МГц, CDCl3, выборочные сигналы) δ м.д.: 1,33 (3H, т, J=7,0), 2,06-2,09 (1H, м), 2,38 (3H, с), 2,48-2,62 (1H, м), 3,12-3,33 (1H, м), 3,38-3,46 (1H, м), 3,76 (1H, д, J=15,0), 4,22-4,34 (2H, м), 4,23 (1H, д, J=15,0), 4,58 (1H, м), 4,76-4,96 (2H, м), 6,42 (1H, с), 7,26 (1H, с), 8,73 (1H, с).
(e) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-имидазол-5-ил]метилиден}пиперидин
К раствору смеси (370 мг), полученной в примере 168-(d), в ацетонитриле (10 мл) добавляли 2-бром-2-(2-фторфенил)-1-циклопропилэтанон (270 мг) и триэтиламин (290 мкл). После перемешивания при комнатной температуре в течение 0,5 часа смесь концентрировали при пониженном давлении и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (19:1), с получением указанного в заголовке соединения (240 мг, включая примеси, общий выход: 56%) в виде желтого масла.
1H ЯМР (500 МГц, CDCl3, выборочные сигналы) δ м.д.: 0,68-0,87 (2H, м), 0,92-1,05 (2H, м), 1,28 (3H, т, J=7,0), 1,81-1,91 (1H, м), 2,07-2,29 (2H, м), 2,30 (3H, с), 2,40-2,48 (1H, м), 2,57-2,69 (1H, м), 3,01 и 3,11 (общая 1H, каждый д, J=13,0), 3,61 и 3,70 (общая 1H, каждый д, J=13,0), 4,23 (2H, кв, J=7,0), 4,43-4,49 (1H, м), 4,59 и 4,62 (общая 2H, каждый с), 4,70 и 4,72 (общая 1H, каждый с), 6,17 и 6,18 (общая 1H, шс), 6,75 и 6,85 (общая 1H, каждый шс), 7,06-7,19 (2H, м), 7,28-7,38 (2H, м), 7,44 и 7,47 (общая 1H, каждый шс).
(Пример 169) (E)-3-{[1-(карбоксилметил)-1H-имидазол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-1025)
(E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-имидазол-5-ил]метилиден}пиперидин (240 мг, включая примеси), полученный в примере 168, растворяли в метаноле (5 мл) и к раствору добавляли карбонат калия (67 мг) при комнатной температуре. После перемешивания при той же самой температуре в течение 0,5 часа смесь распределяли между водой и этилацетатом. Органический слой отделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Удаление растворителя выпариванием при пониженном давлении давало неочищенный (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-имидазол-5-ил]метилиден}-4-сульфанилпиперидин (160 мг). Полученный продукт обрабатывали 3 н. хлороводородной кислотой способом, подобным описанному в примере 134, и остаток, полученный концентрированием реакционной смеси, очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. хлороводородная кислота, 10/90, об./об.) с получением указанного в заголовке соединения (90 мг, выход: 40%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (500 МГц, пиридин-d5) δ м.д.: 0,70-0,79 (2H, м), 0,93-1,02 (1H, м), 1,04-1,12 (1H, м), 1,76-1,88 (1H, м), 2,20-2,32 (1H, м), 2,38-2,46 (1H, м), 2,61-2,75 (1H, м), 2,83-2,92 и 2,95-3,04 (общая 1H, каждый м), 3,75 и 3,82 (общая 1H, каждый д, J=12,5), 3,87 и 3,92 (общая 1H, каждый д, J=12,5), 3,99 и 4,05 (общая 1H, каждый м), 4,93 и 4,95 (общая 1H, каждый с), 5,16 (2H, шс), 6,73 и 6,77 (общая 1H, каждый шс), 7,15-7,24 (2H, м), 7,27-7,34 (1H, м), 7,36 и 7,42 (общая 1H, каждый шс), 7,60-7,66 (1H, м), 8,15 и 8,16 (общая 1H, каждый шс);
ИК (KBr см-1): 2601, 1739, 1710.
(Пример 170) (Z)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)пиперидин (соединение № 4-16)
(a) 5-((Ацетилсульфанил){1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метил)-1-(трифенилметил)-1,2,3,6-тетрагидропиридин
К раствору (E)-3-{1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидин-4-ола (пример 111-(b), 70,74 г) в толуоле (400 мл) добавляли тиоуксусную кислоту (20 мл) и динеопентилацеталь N,N-диметилформамида (76 мл) при 0°C. После перемешивания при той же самой температуре в течение 0,5 часа смесь разбавляли этилацетатом и промывали последовательно водой и насыщенным водным раствором хлорида натрия. После сушки экстракта над безводным сульфатом натрия его концентрировали при пониженном давлении и собирали фильтрованием бесцветные осадки с получением указанного в заголовке соединения (35,26 г, выход: 45%) в виде бесцветного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,26 (3H, т, J=7,5), 2,16-2,37 (5H, м), 2,71-2,91 (4H, м), 4,08-4,18 (4H, м), 4,31 (2H, т, J=6,5), 5,21 (1H, с), 5,76 (1H, шс), 6,07 (1H, д, J=2,5), 7,08-7,52 (16H, м).
(b) (Z)-4-(Ацетилсульфанил)-3-{1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)пиперидина гидротрифторацетат
Тиоацетат калия (5,91 г) добавляли к раствору 5-((ацетилсульфанил){1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метил)-1-(трифенилметил)-1,2,3,6-тетрагидропиридина (3,00 г) в диметилсульфоксиде (30 мл). Смесь перемешивали при 80°C в течение 4 часов. После охлаждения до комнатной температуры смесь разбавляли этилацетатом и промывали последовательно водой и насыщенным водным раствором хлорида натрия. После сушки экстракта над безводным сульфатом натрия его концентрировали при пониженном давлении и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь этилацетата и гексана (1:9-2:3), с получением неочищенного продукта, состоящего из 4-(ацетилсульфанил)-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидина (2,93 г) в виде смеси геометрических изомеров.
Трифторуксусную кислоту (1,2 мл) добавляли к раствору полученного выше неочищенного продукта в дихлорметане (25 мл). После перемешивания при комнатной температуре в течение 1 часа смесь концентрировали при пониженном давлении и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и этанола (99:1-4:1). Сначала получили, как менее полярный элюат, (E)-4-(ацетилсульфанил)-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)пиперидина гидротрифторацетат (1,15 г, выход: 40%), соответствующий (E)-изомеру указанного в заголовке соединения, в виде коричневого масла. Дополнительное элюирование дало указанное в заголовке соединение в форме (Z)-изомера (822,2 мг, выход: 28%) в виде темно-коричневого твердого вещества. Последний продукт содержал региоизомер 5-((ацетилсульфанил){1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метил)-1,2,3,6-тетрагидропиридина гидротрифторацетат (отношение указанного в заголовке соединения и его региоизомера составляло приблизительно 3:1).
1H ЯМР (500 МГц, CDCl3, выборочные сигналы) δ м.д.: 1,24 (3H, т, J=7,0), 1,99-2,07 (1H, м), 2,31-2,4 6 (1H, м), 2,40 (3H, с), 2,90 (2H, т, J=6,5), 3,28-3,44 (2H, м), 3,64-3,82 (2H, м), 4,13 (2H, кв, J=7,0), 4,37 (2H, т, J=6,5), 5,79 (1H, шс), 6,21 (1H, д, J=2,0), 6,39 (1H, с), 7,40 (1H, д, J=2,0).
(c) (Z)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)пиперидин
Следуя процедуре, подобной описанной в примере 132-(g), смесь (822 мг), полученную в примере 170-(b), подвергали взаимодействию с 2-бром-2-(2-фторфенил)-1-циклопропилэтаноном и триэтиламином и неочищенный продукт очищали хроматографией на силикагеле (элюент: этилацетат/гексан = 1/3-1/1) с получением указанного в заголовке соединения (224,7 мг, выход: 30%) в виде бледно-желтого масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,79-0,91 (2H, м), 0,94-1,09 (2H, м), 1,23 и 1,24 (общая 3H, каждый т, J=7,5), 1,72-1,85 (1H, м), 2,12-2,40 (2H, м), 2,33 и 2,34 (общая 3H, каждый с), 2,54-2,99 (5H, м), 3,24 и 3,43 (общая 1H, каждый д, J=12,5), 4,08-4,17 (2H, м), 4,32-4,41 (2H, м), 4,62 и 4,66 (общая 1H, каждый с), 5,44 (1H, шс), 6,15-6,30 (2H, м), 7,06-7,21 (2H, м), 7,25-7,40 (2H, м), 7,42-7,52 (1H, м).
(Пример 171) (Z)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (соединение № 4-15)
Хлороводород пропускали через раствор (Z)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)пиперидина (514 мг) в этаноле (10 мл) при 0°C в течение 10 минут и герметически закрытую смесь перемешивали при комнатной температуре в течение 6 часов. Смесь концентрировали при пониженном давлении и остаток очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,026 н. водный раствор трифторуксусной кислоты, 33/67, об./об.) с получением соли указанного в заголовке соединения с трифторуксусной кислотой, которую (соль) обрабатывали водным раствором гидрокарбоната натрия. Высвобожденное свободное основание экстрагировали этилацетатом. Экстракт сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением свободного основания указанного в заголовке соединения (218 мг, выход: 46%) в виде бесцветного масла.
Часть (59,3 мг) полученного выше свободного основания растворяли в ацетонитриле (2 мл) и обрабатывали 4 н. диоксановым раствором хлороводорода (100 мкл). Растворитель и избыточный хлороводород удаляли выпариванием при пониженном давлении. Кроме того, использовали ацетонитрил для азеотропного удаления при пониженном давлении растворителя и избыточного хлороводорода с получением указанного в заголовке соединения (59,2 мг, выход: 92%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,78-1,10 (4H, м), 1,24 (3H, т, J=7,0), 1,67-1,80 (1H, м), 2,14-2,35 (2H, м), 2,45-2,94 (4H, м), 3,11 и 3,26 (общая 1H, каждый д, J=12,5), 3,30 и 3,44 (общая 1H, каждый д, J=12,5), 4,14 (2H, кв, J=7,0), 4,39 и 4,40 (общая 2H, каждый т, J=6,5), 4,69 и 4,72 (общая 1H, каждый с), 5,01 (1H, шс), 5,97 и 6,08 (общая 1H, каждый с), 6,23 и 6,25 (общая 1H, каждый д, J=2,5), 7,06-7,22 (2H, м), 7,25-7,40 (2H, м), 7,42-7,53 (1H, м);
ИК (KBr, см-1): 2615, 1716, 1494.
(Пример 172) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)-1H-1,2,4-триазол-5-ил]метилиден}пиперидина гидрохлорид (соединение № 2-1354)
(a) (E)-4-(Ацетилсульфанил)-3-{[1-(метоксикарбонилметил)-1H-1,2,4-триазол-5-ил]метилиден}пиперидина гидротрифторацетат
Следуя процедуре, подобной описанной в примере 132-(f), неочищенный (E)-4-(ацетилсульфанил)-3-{[1-(метоксикарбонилметил)-1H-1,2,4-триазол-5-ил]метилиден}-1-(трифенилметил)пиперидин (1,57 г), полученный в примере 166-(c), обрабатывали трифторуксусной кислотой в дихлорметане и продукт очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (20:1-10:1), с получением указанного в заголовке соединения (330 мг, выход: 29%) в виде желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,12-2,22 (1H, м), 2,38 (3H, с), 2,47-2,57 (1H, м), 3,25-3,37 (1H, м), 3,53 (1H, д, J=13,0), 3,82 (3H, с), 3,97 (1H, д, J=13,0), 4,44 (1H, д, J=14,5 Hz), 4,56 (1H, т, J=3,5), 4,97 (2H, с), 6,66 (1H, с), 8,13 (1H, с).
(b) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)-1H-1,2,4-триазол-5-ил]метилиден}пиперидина гидрохлорид
Следуя процедуре, подобной описанной в примере 132-(g), (E)-4-(ацетилсульфанил)-3-{[1-метоксикарбонилметил)-1H-1,2,4-триазол-5-ил]метилиден}пиперидина гидротрифторацетат (330 мг) подвергали взаимодействию с 2-бром-2-(2-фторфенил)-1-циклопропилэтаноном и продукт очищали хроматографией на силикагеле с получением свободного основания указанного в заголовке соединения, которое обрабатывали хлороводородом с получением указанного в заголовке соединения (184 мг, выход: 45%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,66-0,86 (2H, м), 0,87-1,07 (2H, м), 1,81-1,95 (1H, м), 2,12-2,24 (1H, м), 2,25-2,35 (1H, м), 2,29 и 2,30 (общая 3H, каждый с), 2,36-2,44 и 2,59-2,70 (общая 1H, каждый м), 2,74-2,92 (1H, м), 3,27 и 3,30 (общая 1H, каждый д, J=13,5), 3,79 (3H, с), 4,31-4,53 (2H, м), 4,71 и 4,75 (общая 1H, каждый с), 4,92 и 4, 93 (общая 2H, каждый с),6,28 и 6,29 (общая 1H, каждый с), 7,01-7,15 (2H, м), 7,24-7,40 (2H, м), 7,73 и 7,79 (общая 1H, каждый с);
ИК (KBr, см-1): 2545, 2507, 1752, 1699.
(Пример 173) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)-1H-1,2,4-триазол-5-ил]метилиден}-4-сульфанилпиперидина гидрохлорид (соединение № 2-1353)
Следуя процедуре, подобной описанной в примере 151, (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(метоксикарбонилметил)-1H-1,2,4-триазол-5-ил]метилиден}пиперидина гидрохлорид (140 мг) обрабатывали карбонатом калия и неочищенный продукт очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. хлороводородная кислота, 30/70, об./об.) с получением указанного в заголовке соединения (82,7 мг, выход: 64%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,65-0,80 (2H, м), 0,85-1,03 (2H, м), 1,74-1,88 (1H, м), 2,09-2,19 (1H, м), 2,21-2,35 (1H, м), 2,53-2,62 и 2,66-2,74 (общая 1H, каждый м), 2,78-2,86 и 2,92-3,00 (общая 1H, каждый м), 3,63-3,88 (2H, м), 3,78 (3H, с), 3,98 и 4,07 (общая 1H, д, J=13,5), 4,74 и 4,75 (общая 1H, каждый с), 4,94 (2H, с), 6,32 и 6,37 (общая 1H, каждый с), 7,01-7,14 (2H, м), 7,24-7,38 (2H, м), 7,77 и 7,78 (общая 1H, каждый с);
ИК (KBr, см-1): 2954, 2449, 1752, 1712.
(Пример 174) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[(2-пиридил)метил]-1H-пиразол-3-ил}метилиден)пиперидин (соединение № 2-1678)
(a) (E)-3-({1-[(2-пиридил)метил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидин-4-он
К раствору (E)-3-{[1H-пиразол-3(5)-ил]метилиден}-1-(трифенилметил)пиперидин-4-она (пример 73-(a), 5,0 г) в ацетонитриле (100 мл) добавляли 2-(бромметил)пиридина гидробромид (2,9 г), DBU (3,4 мл) и иодид калия (1,9 г) при комнатной температуре. После перемешивания смеси при 50°C в течение 2 часов еще добавляли 2-(бромметил)пиридина гидробромид (2,9 г), DBU (3,4 мл) и иодид калия (1,9 г) и все перемешивали при 50°C в течение 1,5 часов. После охлаждения смесь распределяли между водой и этилацетатом. Органический слой отделяли, промывали последовательно водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Удаляли растворитель выпариванием при пониженном давлении и остаток очищали хроматографией на силикагеле, используя в качестве элюентов смесь гексана, этилацетата и дихлорметана (3:3:4) и затем смесь этилацетата и дихлорметана (1:1), с получением указанного в заголовке соединения (780 мг, выход: 15%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 2,65 (2H, шс), 2,74 (2H, т, J=5,5), 3,62 (2H, шс), 5,31 (2H, с), 6,25 (1H, д, J=2,5), 6,78-6,81 (1H, м), 7,12-7,29 (9H, м), 7,43-7,55 (10H, м), 8,54-8,57 (1H, м).
(b) (E)-4-(Ацетилсульфанил)-3-({1-[(2-пиридил)метил]-1H-пиразол-3-ил}метилиден)пиперидина бис(гидротрифторацетат)
Следуя процедуре, подобной описанной в примере 146-(b), (E)-3-({1-[(2-пиридил)метил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидин-4-он (1,8 г) обрабатывали борогидридом натрия с получением (E)-3-({1-[(2-пиридил)метил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидин-4-ола в виде желтого аморфного твердого вещества с количественным выходом.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,85-1,95 (1H, м), 2,06-2,20 (2H, м), 2,63-2,83 (2H, м), 3,46-3,53 (1H, м), 4,13-4,20 (1H, м), 5,23 (1H, д, J=16,0), 5,27 (1H, д, J=16,0), 6,12 (1H, д, J=2,5), 6,53 (1H, шс), 6,81-6,84 (1H, м), 7,06-7,31 (10H, м), 7,37-7,46 (7H, м), 7,56-7,62 (1H, м), 8,55-8,58 (1H, м).
Полученное соединение подвергали взаимодействию с динеопентилацеталем N,N-диметилформамида и тиоуксусной кислотой с получением неочищенного продукта, (E)-4-(ацетилсульфанил)-3-({1-[(2-пиридил)метил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидина, который затем обрабатывали трифторуксусной кислотой, после чего продукт очищали дважды хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (19:1), с получением указанного в заголовке соединения (190 мг, выход: 9%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,00-2,11 (1H, м), 2,35 (3H, с), 2,36-2,49 (1H, м), 3,09-3,24 (1H, м), 3,28-3,38 (1H, м), 3,75 (1H, д, J=14,0), 4,56 (1H, м), 5,07 (1H, д, J=14,0), 5,38 (2H, с), 6,24 (1H, д, J=2,5), 6,61 (1H, шс), 7,05-7,11 (1H, м), 7,19-7,28 (1H, м), 7,44 (1H, д, J=2,5), 7,66-7,74 (1H, м), 8,52-8,57 (1H, м).
(c) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[(2-пиридил)метил]-1H-пиразол-3-ил}метилиден)пиперидин
К раствору (E)-4-(ацетилсульфанил)-3-({1-[(2-пиридил)метил]-1H-пиразол-3-ил}метилиден)пиперидина бис(гидротрифторацетата) (190 мг) в ацетонитриле (5 мл) добавляли 2-бром-2-(2-фторфенил)-1-циклопропилэтанон (180 мг) и триэтиламин (190 мкл). После перемешивания при комнатной температуре в течение 0,5 часа смесь распределяли между водой и этилацетатом. Органический слой отделяли, промывали последовательно водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и этилацетата (1:1), с получением указанного в заголовке соединения (140 мг, выход: 81%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,59-0,99 (4H, м), 1,82-1,92 (1H, м), 2,18-2,38 (2H, м), 2,30 (3H, с), 2,43-2,51 и 2,55-2,64 (общая 1H, каждый м), 2,71-2,79 и 2,80-2,87 (общая 1H, каждый м), 3,08 и 3,25 (общая 1H, каждый д, J=13,0), 4,09-4,20 (1H, м), 4,51 (1H, м), 4,68 и 4,69 (общая 1H, каждый с), 5,29 и 5,36 (общая 2H, каждый с), 6,12 и 6,20 (общая 1H, каждый д, J=2,0), 6,50 и 6,52 (общая 1H, каждый шс), 6,89-6,92 и 6,98-7,13 (общая 3H, каждый м), 7,18-7,31 (2H, м), 7,35-7,44 (2H, м), 7,61-7,67 (1H, м), 8,55-8,59 (1H, м).
(Пример 175) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[(2-пиридил)метил]-1H-пиразол-3-ил}метилиден)-4-сульфанилпиперидина дигидрохлорид (соединение № 2-1677)
Карбонат калия (39 мг) добавляли к раствору (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[(2-пиридил)метил]-1H-пиразол-3-ил}метилиден)пиперидина (140 мг) в метаноле (5 мл). После перемешивания в течение 0,5 часа к смеси добавляли 1 н. хлороводородную кислоту (3 мл). Смесь фильтровали, используя мембранный фильтр. Фильтрат концентрировали при пониженном давлении и остаток очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. хлороводородная кислота, 25/75, об./об.) с получением указанного в заголовке соединения (120 мг, выход: 80%) в виде желтого аморфного твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,61-0,98 (4H, м), 1,76-1,84 (1H, м), 2,17-2,36 (2H, м), 2,60-2,90 (2H, м), 3,53 и 3,67 (общая 1H, каждый д, J=13,0), 3,84 и 3,87 (общая 1H, каждый д, J=13,0), 3,94 (1H, м), 4,72 и 4,74 (общая 1H, каждый с), 5,32 и 5,36 (общая 2H, каждый с), 6,12 и 6,21 (общая 1H, каждый д, J=2,5), 6,46 и 6,49 (общая 1H, каждый шс), 6,94 и 7,00 (общая 1H, каждый д, J=8,0), 7,03-7,12 (2H, м), 7,19-7,29 (2H, м), 7,37-7,44 (2H, м), 7,62-7,67 (1H, м), 8,55-8,58 (1Н, м);
ИК (KBr, см-1): 2555, 1710.
(Пример 176) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[5(3)-(этоксикарбонилметил)-1H-пиразол-3(5)-ил]метилиден}пиперидина гидротрифторацетат (соединение № 1-209)
(a) Этил {5(3)-[(трет-бутилдиметилсилилокси)метил]-1H-пиразол-3(5)-ил}ацетат
Безводный гидразин (4,25 мл) добавляли к раствору этил 6-(трет-бутилдиметилсилилокси)-3,5-диоксогексаноата (36,3 г) в этаноле (500 мл) при 0°C. После кипячения смеси с обратным холодильником в течение 30 минут удаляли при пониженном давлении растворители. Остаток растворяли в этилацетате и промывали последовательно водой и насыщенным водным раствором хлорида натрия. Экстракт сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана и этилацетата (2:1), с получением указанного в заголовке соединения (27,3 г, выход: 76%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,08 (6H, с), 0,90 (9H, с), 1,25 (3H, т, J=7,0), 3,68 (2H, с), 4,16 (2H, кв, J=7,0), 4,73 (2H, с), 6,10 (1H, с).
(b) Этил {1-(трет-бутоксикарбонил)-3-[(трет-бутилдиметилсилилокси)метил]-1H-пиразол-5-ил}ацетат и этил {1-(трет-бутоксикарбонил)-5-[(трет-бутилдиметилсилилокси)метил]-1H-пиразол-3-ил}ацетат
Ди(трет-бутил)дикарбонат (40,0 г) и тетраметиламмонийгидроксид (33,2 г) добавляли к раствору этил {5(3)-[(трет-бутилдиметилсилилокси)метил]-1H-пиразол-3(5)-ил}ацетата (27,3 г) в ацетонитриле (1000 мл). После перемешивания смеси при комнатной температуре в течение 1 часа реакционную смесь гасили добавлением воды и продукт экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Удаляли растворитель при пониженном давлении и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана и этилацетата (4:1), с получением смеси (приблизительно 1:1) двух указанных в заголовке соединений (34,04 г, выход: 93%) в виде бесцветного масла.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,07 и 0,09 (общая 6H, каждый с), 0,89 и 0,92 (общая 9H, каждый с), 1,20-1,28 (3H, м), 1,60 и 1,61 (общая 9H, каждый с), 3,69 и 3,94 (общая 2H, каждый с), 4,12-4,19 (2H, м), 4,72 и 4,91 (общая 2H, каждый с), 6,31 и 6,41 (общая 1H, каждый с).
(c) Этил [1-(трет-бутоксикарбонил)-3-формил-1H-пиразол-5-ил]ацетат
1 н. Тетрагидрофурановый раствор (90 мл) тетрабутиламмонийфторида добавляли к раствору смеси (34,04 г), полученной в примере 176-(b), в тетрагидрофуране (500 мл). После перемешивания смеси при комнатной температуре в течение 30 минут реакционную смесь гасили добавлением воды. Продукт экстрагировали дихлорметаном. Удаление растворителя при пониженном давлении дало неочищенный этил [1-(трет-бутоксикарбонил)-3-(гидроксиметил)-1H-пиразол-5-ил]ацетат.
К раствору полученного выше продукта в дихлорметане (800 мл) добавляли молекулярные сита 4Å (50,0 г) и пиридинийдихромат (50,0 г). После перемешивания при комнатной температуре в течение 1 часа смесь фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали колоночной хроматографией, используя в качестве элюента смесь гексана и этилацетата (1:1), с получением указанного в заголовке соединения (7,84 г, выход: 26%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,25 (3H, т, J=7,0), 1,65 (9H, с), 4,00 (2H, с), 4,17 (2H, кв, J=7,0), 6,72 (1H, с), 10,03 (1H, с).
(d) (E)-3-{[1-(трет-Бутоксикарбонил)-5-(этоксикарбонилметил)-1H-пиразол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-он
Следуя процедуре, подобной описанной в примере 132-(c), этил [1-(трет-бутоксикарбонил)-3-формил-1H-пиразол-5-ил]ацетат (7,84 г) подвергали взаимодействию с 1-(трифенилметил)пиперидин-4-оном в бензоле, используя пирролидин. Полученный при этом неочищенный продукт очищали хроматографией на силикагеле, используя смесь гексана, этилацетата и дихлорметана (3:1:1) в качестве элюента, с получением указанного в заголовке соединения (9,64 г, выход: 57%) в виде желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,24 (3H, т, J=7,5), 1,55 (9H, с), 2,62 (2H, шс), 2,76 (2H, т, J=6,0), 3,72 (2H, шс), 3,92 (2H, с), 4,16 (2H, кв, J=7,5), 6,21 (1H, с), 7,10-7,36 (10H, м), 7,47-7,56 (6H, м).
(e) (E)-3-{[1-(трет-Бутоксикарбонил)-5-(этоксикарбонилметил)-1H-пиразол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол
Борогидрид натрия (300 мг) добавляли к раствору (E)-3-{[1-(трет-бутоксикарбонил)-5-(этоксикарбонилметил)-1H-пиразол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-она (9,64 г) в этаноле (100 мл) при 0°C. После перемешивания смеси при той же самой температуре в течение 1,5 часов реакционную смесь гасили добавлением насыщенного водного раствора хлорида аммония. Продукт экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Выпаривали растворитель при пониженном давлении, после чего остаток очищали хроматографией на силикагеле, используя смесь гексана, этилацетата и дихлорметана (1:1:1) в качестве элюента, с получением указанного в заголовке соединения (7,7 г, выход: 80%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,26 (3H, т, J=7,0), 1,54 (9H, с), 1,76-2,19 (3H, м), 2,40-3,00 (3H, м), 3,89 (2H, д, J=2,0), 4,08-4,22 (3H, м), 6,10 (1H, с), 6,48 (1H, с), 7,00-7,47 (15H, м).
(f) (E)-4-(Ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-5-(этоксикарбонилметил)-1H-пиразол-3-ил]метилиден}пиперидина гидротрифторацетат
Следуя процедуре, подобной описанной в примере 132-(e), (E)-3-{[1-(трет-бутоксикарбонил)-5-(этоксикарбонилметил)-1H-пиразол-3-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол (7,7 г) подвергали взаимодействию с тиоуксусной кислотой и динеопентилацеталем N,N-диметилформамида и полученный при этом неочищенный продукт очищали хроматографией на силикагеле (элюент: гексан /этилацетат/дихлорметан=4/1/1) с получением смеси (приблизительно 1:1) (E)-4-(ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-5-(этоксикарбонилметил)-1H-пиразол-3-ил]метилиден}-1-(трифенилметил)пиперидина и 5-{(ацетилсульфанил)[1-(трет-бутоксикарбонил)-5-(этоксикарбонилметил)-1H-пиразол-3-ил]метил}-1-(трифенилметил)-1,2,3,6-тетрагидропиридина (6,34 г, выход: 75%).
Обработка полученной выше смеси (6,2 г) трифторуксусной кислотой в дихлорметане способом, подобным описанному в примере 132-(f), и очистка неочищенного продукта хроматографией на силикагеле с использованием в качестве элюента смеси дихлорметана и метанола (15:1) дали указанное в заголовке соединение (1,23 г, выход: 25%) в виде желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,23 (3H, т, J=7,0), 1,57 (9H, с), 1,98-2,10 (1H, м), 2,33 (3H, с), 2,40-2,55 (1H, м), 3,10-3,25 (1H, м), 3,36 (1H, д, J=13,5), 3,82 (1H, д, J=15,0), 3,90 (2H, с), 4,15 (2H, кв, J=7,0), 4,51-4,60 (1H, м), 4,92 (1H, д, J=15,0), 6,23 (1H, с), 6,60 (1H, с).
(g) (E)-4-(Ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-5-(этоксикарбонилметил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидин
Следуя процедуре, подобной описанной в примере 132-(g), (E)-4-(ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-5-(этоксикарбонилметил)-1H-пиразол-3-ил]метилиден}пиперидина гидротрифторацетат (1,23 г) подвергали взаимодействию с 2-бром-2-(2-фторфенил)-1-циклопропилэтаноном. Продукт очищали хроматографией на силикагеле с получением указанного в заголовке соединения (1,11 г, выход: 81%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,58-1,06 (4H, м), 1,19-1,28 (3H, м), 1,60 (9H, с), 1,81-1,91 (1H, м), 2,20-2,32 (2H, м), 2,28 (3H, с), 2,40-2,50 и 2,55-2,63 (общая 1H, каждый м), 2,71-2,83 (1H, м), 3,17 и 3,22 (общая 1H, каждый д, J=13,5), 3,83-4,21 (5H, м), 4,42-4,50 (1H, м), 4,67 и 4,73 (общая 1H, каждый с), 6,06 и 6,16 (общая 1H, каждый с), 6,47 и 6,48 (общая 1H, каждый с), 7,01-7,17 (2H, м), 7,23-7,44 (2H, м).
(h) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[5(3)-(этоксикарбонилметил)-1H-пиразол-3(5)-ил]метилиден}пиперидина гидротрифторацетат
Трифторуксусную кислоту (20 мл) добавляли к (E)-4-(ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-5-(этоксикарбонилметил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидину (1,11 г) при 0°C и после перемешивания смеси при 0°C в течение 20 минут ее концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле с получением указанного в заголовке соединения (1,00 г, выход: 88%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,71-1,00 (2H, м), 1,00-1,20 (2H, м), 1,19-1,32 (3H, м), 1,62-1,77 (1H, м), 1,92-2,07 (1H, м), 2,29 и 2,30 (3H, с), 2,42-2,54 (1H, м), 2,92-3,42 (2H, м), 3,61 и 3,81 (общая 1H, каждый д, J=13,5), 3,69 и 3,71 (общая 2H, каждый с), 4,18 (2H, кв, J=7,0), 4,22 и 4,60 (общая 1H, каждый д, J=13,5), 4,37-4,43 и 4,46-4,52 (общая 1H, каждый м), 5,50 и 5,55 (общая 1H, каждый с), 6,13 и 6,17 (общая 1H, каждый с), 6,60 и 6,68 (общая 1H, каждый с), 7,14-7,31 (2H, м), 7,37-7,53 (2H, м);
ИК (KBr, см-1): 1736, 1694.
(Пример 177) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[5(3)-(этоксикарбонилметил)-1H-пиразол-3(5)-ил]метилиден}-4-сульфанилпиперидина гидрохлорид (соединение № 1-208)
Хлороводород вдували в раствор (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[5(3)-(этоксикарбонилметил)-1H-пиразол-3(5)-ил]метилиден}пиперидина гидротрифторацетата (810 мг) в этаноле (80 мл) при 0°C в течение 1 часа. После перемешивания герметически закрытой смеси в течение 1 часа растворитель и избыточный хлороводород удаляли выпариванием при пониженном давлении. Остаток очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. хлороводородная кислота, 35/65, об./об.) с получением неочищенного целевого соединения, которое обрабатывали насыщенным водным раствором гидрокарбоната натрия. Полученное свободное основание экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Концентрирование при пониженном давлении давало остаток, который обрабатывали 4 н. диоксановым раствором хлороводорода. Растворитель и избыточный хлороводород удаляли выпариванием при пониженном давлении с получением указанного в заголовке соединения (645,2 мг, выход: 99%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,65-0,91 (2H, м), 1,02-1,14 (2H, м), 1,17-1,32 (3H, м), 1,70-1,83 (1H, м), 1,83-1,95 (1H, м), 2,17-2,36 (1H, м), 2,52-2,74 (1H, м), 2,75-2,90 (1H, м), 3,15 и 3,35 (общая 1H, каждый д, J=12,0), 3,54-3,90 (2H, м), 3,68 и 3,69 (общая 2H, каждый с), 4,17 (2H, кв, J=7,0), 4,95 и 4,97 (общая 1H, каждый с), 6,06 и 6,11 (общая 1H, каждый с), 6,40 и 6,49 (общая 1H, каждый с), 7,08-7,20 (2H, м), 7,26-7,39 (2H, м);
ИК (KBr, см-1): 2629, 2559, 1736, 1712.
(Пример 178) (E)-3-{[5(3)-(Карбоксиметил)-1H-пиразол-3(5)-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина дигидрохлорид (соединение № 1-206)
Следуя процедуре, подобной описанной в примере 134, (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[5(3)-(этоксикарбонилметил)-1H-пиразол-3(5)-ил]метилиден}-4-сульфанилпиперидина гидрохлорид (570 мг) обрабатывали 3 н. хлороводородной кислотой и полученный при этом неочищенный продукт очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. хлороводородная кислота, 25/75, об./об.) с получением указанного в заголовке соединения (498 мг, выход: 86%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, пиридин-d5) δ м.д.: 0,63-0,79 (2H, м), 0,88-1,01 (1H, м), 1,06-1,19 (1H, м), 1,77-1,92 (1H, м), 2,33-,236 (1H, м), 2,37-2,49 (1H, м), 2,62-2,80 (1H, м), 2,84-3,04 (1H, м), 3,87-4,22 (3H, м), 4,06 и 4,08 (общая 2H, каждый с), 4,92 и 4,94 (общая 1H, каждый с), 6,40 и 6,49 (общая 1H, каждый с), 6,83 и 6,85 (общая 1H, каждый с), 7,12-7,24 (2H, м), 7,25-7,33 (1H, м), 7,62-7,73 (1H, м);
ИК (KBr, см-1): 2924, 2660, 1710.
(Пример 179) (Z)-3-{[1-(2-Карбоксиэтил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 4-7)
(Z)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-4-сульфанилпиперидин (свободное основание, описанное в примере 171, 158 мг) обрабатывали 3 н. хлороводородной кислотой (5 мл) при 50°C в течение 2 часов. Смесь концентрировали при пониженном давлении и остаток очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. хлороводородная кислота, 35/65, об./об.) с получением указанного в заголовке соединения (156,6 мг, выход: 97%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, пиридин-d5) δ м.д.: 0,77-0,86 (2H, м), 0,98-1,14 (2H, м), 2,23-2,38 (1H, м), 2,50-2,59 (1H, м), 2,65-3,08 (3H, м), 3,13-3,22 (2H, м), 3,38 и 3,52 (общая 1H, каждый д, J=12,0), 3,56 и 3,68 (общая 1H, каждый д, J=12,0), 4,61 и 4,63 (общая 2H, каждый т, J=6,0), 4,93 и 4,95 (общая 1H, каждый с), 5,49 и 5,51 (общая 1H, каждый шс), 6,26 и 6,38 (общая 1H, каждый с), 6,43 и 6,48 (общая 1H, каждый д, J=2,0), 7,17-7,36 (3H, м), 7,72-7,80 (2H, м);
ИК (KBr, см-1): 2629, 1712, 1495.
(Пример 180) (4R)-(E)-4-(Ацетилсульфанил)-1-[(1RS)-2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)пиперидина гидрохлорид (соединение № 2-50)
(a) (4S)- и (4R)-(E)-4-(Ацетилсульфанил)-3-{1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)пиперидина гидротрифторацетат
Триэтиламин (16,2 мл) и хлортрифенилметан (10,91 г) добавляли к раствору рацемического (E)-4-(ацетилсульфанил)-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)пиперидина гидротрифторацетата (пример 111-(c), 22,09 г) в N,N-диметилформамиде (150 мл) при 0°C. После перемешивания смеси при комнатной температуре в течение 2 часов ее разбавляли смешанным растворителем из этилацетата и диэтилового эфира (2:1) и раствор промывали последовательно водой и насыщенным водным раствором хлорида натрия. Экстракт сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (элюент: гексан/этилацетат =95/5-30/70) с получением рацемического (E)-4-(ацетилсульфанил)-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидина (19,40 г, выход: 86%).
Оптическое разделение полученного выше рацемата осуществляли ВЭЖХ, используя хиральную колонку (Chiralcel OD-H, 0,46Ø x 250 мм, Daicel Chemical Industries Co., Ltd., элюент: 2-пропанол/гексан=1,5/98,5, 1,0 мл/минуту) с получением каждого энантиомера, показанного ниже.
Более подвижный энантиомер (4S)-(E)-4-(ацетилсульфанил)-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидин, время удерживания = 14,2 минуты.
Менее подвижный энантиомер (4R)-(E)-4-(ацетилсульфанил)-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидин, время удерживания = 18,4 минуты.
(4S)-(E)-4-(Ацетилсульфанил)-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидин (1,00 г) подвергали реакции детритилирования способом, подобным описанному в примере 132-(f) с получением (4S)-(E)-4-(ацетилсульфанил)-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)пиперидина гидротрифторацетат (842 мг, выход: 87%) в виде бесцветного масла.
1H-ЯМР-спектр: идентичен спектру рацемата.
[α]D -141,1° (c=1,63, CHCl3).
(4R)-(E)-4-(Ацетилсульфанил)-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидин (1,00 г) детритилировали способом, подобным описанному в примере 132-(f), с получением (4R)-(E)-4-(ацетилсульфанил)-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)пиперидина гидротрифторацетата (863 мг, выход: 89%) в виде бесцветного масла.
1H-ЯМР-спектр: идентичен спектру рацемата.
[α]D +150,3° (c=1,28, CHCl3).
(b) (4R)-(E)-4-(Ацетилсульфанил)-1-[(1RS)-2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)пиперидина гидрохлорид
(4R)-(E)-4-(Ацетилсульфанил)-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)пиперидина гидротрифторацетат (863,1 мг), полученный в примере 180-(a), подвергали реакции, подобной описанной в примере 132-(g). После экстрагирования продукт очищали хроматографией на силикагеле, используя смесь этилацетата и гексана (1:4-1:1) в качестве элюента, с получением свободного основания указанного в заголовке соединения (757 мг, выход: 96%) в виде бледно-желтого масла, часть (104,7 мг) которого обрабатывали 4 н. диоксановым раствором хлороводорода с получением указанного в заголовке соединения (108,5 мг, выход: 97%) в виде бледно-желтого аморфного твердого вещества.
1H-ЯМР- и ИК-спектры: идентичны спектрам рацемата, описанного в примере 111-(d).
(Пример 181) (4R)-(E)-1-[(1RS)-2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (соединение № 2-49)
(4R)-(E)-4-(Ацетилсульфанил)-1-[(1RS)-2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)пиперидин (свободное основание, описанное в примере 180-(b), 652,3 мг) подвергали реакции, подобной описанной в примере 133. Смесь концентрировали и полученный остаток очищали хроматографией на силикагеле, используя смесь дихлорметана и этанола (99:1-9:1) в качестве элюента, с получением указанного в заголовке соединения (568,4 мг, выход: 88%) в виде бледно-желтого аморфного твердого вещества.
1H-ЯМР- и ИК-спектры: идентичны спектрам рацемата, описанного в примере 112.
(Пример 182) (4R)-(E)-3-{[1-(2-Карбоксиэтил)-1H-пиразол-3-ил]метилиден}-1-[(1RS)-2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-17)
(4R)-(E)-1-[(1RS)-2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (424,2 мг) подвергали реакции, подобной описанной в примере 134, и полученный при этом неочищенный продукт очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. хлороводородная кислота, 30/70, об./об.) с получением указанного в заголовке соединения (369 мг, выход: 92%) в виде бесцветного аморфного твердого вещества.
1H-ЯМР- и ИК-спектры: идентичны спектрам рацемата, описанного в примере 113.
(Пример 183) (4R)-(E)-4-(Ацетилсульфанил)-3-{[1-(2-карбоксиэтил)-1H-пиразол-3-ил]метилиден}-1-[(1RS)-2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина гидрохлорид (соединение № 2-18)
К раствору (4R)-(E)-3-{[1-(2-карбоксиэтил)-1H-пиразол-3-ил]метилиден}-1-[(1RS)-2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорида (249,4 мг) в дихлорметане (12 мл) добавляли пиридин (0,24 мл) и уксусный ангидрид (0,24 мл) при 0°C. После перемешивания смеси при комнатной температуре в течение 2,5 часов растворители удаляли при пониженном давлении и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (99:1-93:7), с получением свободное основание указанного в заголовке соединения (75,5 мг), которое обрабатывали в ацетонитриле (2 мл) 4 н. диоксановым раствором хлороводорода (120 мкл). Растворитель и избыточный хлороводород удаляли при пониженном давлении с получением указанного в заголовке соединения (79,4 мг, выход: 29%) в виде бледно-желтого аморфного твердого вещества.
1H-ЯМР- и ИК-спектры: идентичны спектрам рацемата, описанного в примере 114.
(Пример 184) (4S)-(E)-4-(Ацетилсульфанил)-1-[(1RS)-2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)пиперидина гидрохлорид (соединение № 2-50)
(4S)-(E)-4-(Ацетилсульфанил)-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)пиперидина гидротрифторацетат, полученный в примере 180-(a), подвергали реакции, подобной описанной в примере 180-(b), с получением указанного в заголовке соединения в виде бледно-желтого аморфного твердого вещества с количественным выходом.
1H-ЯМР- и ИК-спектры: идентичны спектрам рацемата, описанного в примере 111-(d).
(Пример 185) (4S)-(E)-1-[(1RS)-2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (соединение № 2-49)
(4S)-(E)-4-(Ацетилсульфанил)-1-[(1RS)-2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)пиперидин подвергали реакции, подобной описанной в примере 181, с получением указанного в заголовке соединения в виде бледно-желтого аморфного твердого вещества с выходом 81%.
1H-ЯМР- и ИК-спектры: идентичны спектрам рацемата, описанного в примере 112.
(Пример 186) (4S)-(E)-3-{[1-(2-Карбоксиэтил)-1H-пиразол-3-ил]метилиден}-1-[(1RS)-2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-17)
(4S)-(E)-1-[(1RS)-2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-4-сульфанилпиперидина гидрохлорид подвергали реакции, подобной описанной в примере 182, с получением указанного в заголовке соединения в виде бесцветного аморфного твердого вещества с выходом 92%.
1H-ЯМР- и ИК-спектры: идентичны спектрам рацемата, описанного в примере 113.
(Пример 187) (4S)-(E)-4-(Ацетилсульфанил)-3-{[1-(2-карбоксиэтил)-1H-пиразол-3-ил]метилиден}-1-[(1RS)-2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина гидрохлорид (соединение № 2-18)
(4S)-(E)-3-{[1-(2-Карбоксиэтил)-1H-пиразол-3-ил]метилиден}-1-[(1RS)-2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидин подвергали реакции, подобной описанной в примере 183, с получением указанного в заголовке соединения в виде бледно-желтого аморфного твердого вещества с выходом 75%.
1H-ЯМР- и ИК-спектры: идентичны спектрам рацемата, описанного в примере 114.
(Пример 188) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1-{[1(2)H-тетразол-5-ил]метил}-1H-пиразол-3-ил)метилиден]пиперидина гидротрифторацетат (соединение № 2-1674)
(a) (E)-3-[(1-{[1-(4-Метоксибензил)-1H-тетразол-5-ил]метил}-1H-пиразол-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-он и (E)-3-[(1-{[2-(4-метоксибензил)-2H-тетразол-5-ил]метил}-1H-пиразол-3-ил)метилиден]-1-(трифенилметил)пиперидин-4-он
К раствору [1(2)H-тетразол-5-ил]метанола (9,26 г) в ацетонитриле (200 мл) добавляли 4-метоксибензилхлорид (42 мл) и триэтиламин (50 мл). После перемешивания смеси при комнатной температуре в течение ночи ее распределяли между водой и дихлорметаном. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле, используя смесь гексана, этилацетата и дихлорметана (1:1:2) в качестве элюента, с получением смеси [1-(4-метоксибензил)-1H-тетразол-5-ил]метанола и [2-(4-метоксибензил)-2H-тетразол-5-ил]метанола (12 г, выход: количественный, отношение компонентов: менее полярный изомер/более полярный изомер=1/3-1/4) в виде бесцветного твердого вещества.
(E)-3-{[1H-Пиразол-3(5)-ил]метилиден}-1-(трифенилметил)пиперидин-4-он (пример 73-(b), 9,0 г) растворяли в дихлорметане (100 мл) и к раствору добавляли полученную выше смесь [1-(4-метоксибензил)-1H-тетразол-5-ил]метанола и [2-(4-метоксибензил)-2H-тетразол-5-ил]метанола (5,7 г) и трифенилфосфин (6,8 г). К полученной смеси добавляли по каплям диэтилазодикарбоксилат при перемешивании при 0°C. После перемешивания смеси при комнатной температуре в течение ночи ее концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (элюент: дихлорметан/метанол=9/1, затем 8/1) с получением смеси двух указанных в заголовке изомеров (8,2 г, выход: 61%) в виде желтого аморфного твердого вещества. Дополнительное элюирование дало чистый полярный изомер (2,0 г, выход: 15%) в виде бесцветного аморфного твердого вещества.
Более полярный изомер:1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,65 (2H, шс), 2,76 (2H, т, J=5,5), 3,56 (2H, шс), 3,78 (3H, с), 5,25 (2H, с), 5,35 (2H, с), 6,19 (1H, д, J=2,5), 6,81 (2H, д, J=9,0), 7,03 (2H, д, J=9,0), 7,10-7,17 (3H, м), 7,20-7,26 (6H, м), 7,33 (1H, д, J=2,5), 7,40 (1H, м), 7,43-7,50 (6H, м).
(b) (E)-4-(Ацетилсульфанил)-3-[(1-{[1-(4-метоксибензил)-1H-тетразол-5-ил]метил}-1H-пиразол-3-ил)метилиден]пиперидина гидротрифторацетат или (E)-4-(ацетилсульфанил)-3-[(1-{[2-(4-метоксибензил)-2H-тетразол-5-ил]метил}-1H-пиразол-3-ил)метилиден]пиперидина гидротрифторацетат
Смесь двух изомеров (8,2 г), полученная в примере 188-(a), подвергали реакции, подобной описанной в примере 132-(d)-(f), с получением смеси двух указанных в заголовке изомеров, которую затем разделяли хроматографией на силикагеле с получением более полярного изомера (690 мг, выход: 9,4%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,01-2,11 (1H, м), 2,34 (3H, с), 2,39-2,53 (1H, м), 3,15-3,28 (1H, м), 3,34-3,42 (1H, м), 3,72-3,82 (1H, м), 3,79 (3H, с), 4,57 (1H, м), 5,06 (1H, д, J=15,0), 5,45 (1H, д, J=15,5), 5,49 (1H, д, J=15,5), 5,65 (2H, с), 6,22 (1H, д, J=2,5), 6,61 (1H, шс), 6,88 (2H, д, J=8,5), 7,32 (2H, д, J=8,5), 7,45 (1H, д, J=2,5).
(c) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1-{[1-(4-метоксибензил)-1H-тетразол-5-ил]метил}-1H-пиразол-3-ил)метилиден]пиперидин или (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1-{[2-(4-метоксибензил)-2H-тетразол-5-ил]метил}-1H-пиразол-3-ил)метилиден]пиперидин
Изомер, полученный в примере 188-(b) (690 мг), подвергали взаимодействию с 2-бром-2-(2-фторфенил)-1-циклопропилэтаноном (480 мг) и триэтиламином (430 мкл) в ацетонитриле (20 мл) способом, подобным описанному в примере 132-(g). Очистка неочищенного продукта хроматографией на силикагеле дала каждый изомер из двух указанных в заголовке соединений (470 мг, выход: 61%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,58-1,03 (4H, м), 1,80-1,92 (1H, м), 2,13-2,34 (2H, м), 2,29 (3H, с), 2,42-2,51 и 2,54-2,63 (общая 1H, каждый м), 2,71-2,86 (1H, м), 3,04 и 3,23 (общая 1H, каждый д, J=13,5), 3,80 (3H, с), 4,03-4,10 (1H, м), 4,48 (1H, м), 4,66 и 4,68 (общая 1H, каждый с), 5,40 и 5,47 (общая 2H, каждый с), 5,67 (2H, с), 6,10 и 6,18 (общая 1H, каждый д, J=2,5), 6,47 и 6,49 (общая 1H, каждый шс), 6,89 (2H, д, J=8,5), 7,01-7,15 (2H, м), 7,23-7,31 (1H, м), 7,34 (2H, д, J=8,5), 7,37-7,44 (1H, м), 7,39 и 7,43 (общая 1H, каждый д, J=2,5).
(d) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1-{[1(2)H-тетразол-5-ил]метил}-1H-пиразол-3-ил)метилиден]пиперидина гидротрифторацетат
К раствору соединения (470 мг), полученного в примере 188-(c), добавляли трифторуксусную кислоту (10 мл) и смесь перемешивали при 60°C в течение 4 часов. После охлаждения смесь концентрировали при пониженном давлении и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (9:1), с получением указанного в заголовке соединения (450 мг, выход: 96%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (500 МГц, пиридин-d5) δ м.д.: 0,57-0,75 (2H, м), 0,89-1,11 (2H, м), 1,88-2,00 (1H, м), 2,27 и 2,28 (общая 3H, каждый с), 2,29-2,43 (2H, м), 2,56-2,71 (1H, м), 2,82-2,89 и 2,92-2,99 (общая 1H, каждый м), 3,25 и 3,48 (общая 1H, каждый д, J=13,0), 4,46 и 4,47 (общая 1H, каждый д, J=13,0),4,70 (1H, м), 4,91 и 4,93 (общая 1H, каждый с), 5,91-6,06 (2H, м), 6,27 и 6,33 (общая 1H, каждый д, J=2,5), 6,70 и 6,73 (общая 1H, каждый шс), 7,13-7,23 (2H, м), 7,27-7,33 (1H, м), 7,60-7,67 (1H, м), 7,82 и 7,85 (общая 1H, каждый д, J=2,5);
ИК (KBr, см-1): 1698, 1671.
(Пример 189) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанил-3-[(1-{[1(2)H-тетразол-5-ил]метил}-1H-пиразол-3-ил)метилиден]пиперидина гидрохлорид (соединение № 2-1673)
Хлороводород пропускали через раствор (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-[(1-{[1(2)H-тетразол-5-ил]метил}-1H-пиразол-3-ил)метилиден]пиперидина гидротрифторацетата (200 мг) в этаноле (15 мл) при 0°C в течение 1 часа и герметически закрытой смеси давали постоять при комнатной температуре в течение ночи. Смесь концентрировали при пониженном давлении и остаток очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. хлороводородная кислота, 25/75, об./об.) с получением указанного в заголовке соединения (80 мг, выход: 49%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (500 МГц, пиридин-d5) δ м.д.: 0,57-0,74 (2H, м), 0,89-0,96 (1H, м), 1,02-1,10 (1H, м), 1,80-1,93 (1H, м), 2,24-2,43 (2H, м), 2,68-2,75 и 2,76-2,83 (общая 1H, каждый м), 2,89-3,02 (1H, м), 3,76 и 3,94 (общая 1H, каждый д, J=12,5),4,00 (1H, м), 4,10 и 4,15 (общая 1H, каждый д, J=12,5), 4,93 и 4,94 (общая 1H, каждый с), 5,94-6,06 (2H, м), 6,26 и 6,33 (общая 1H, каждый д, J=2,0), 6,61 и 6,63 (общая 1H, каждый шс), 7,12-7,21 (2H, м), 7,26-7,32 (1H, м), 7,61-7,69 (1H, м), 7,87 и 7,89 (общая 1H, каждый д, J=2,0),
ИК (KBr, см-1): 2562, 1710.
(Пример 190) (4R)-(E)-1-[(1S)-2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-4-сульфанилпиперидина гидрохлорид и (4R)-(E)-1-[(1R)-2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (соединение № 2-49)
(4R)-(E)-1-[(1RS)-2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (пример 181, 61,9 мг) обрабатывали водным раствором гидрокарбоната натрия. Полученнное свободное основание экстрагировали дихлорметаном и делили на три порции, каждую из которых подвергали препаративной ВЭЖХ, используя хиральную колонку (Chiralcel OD-H, 20 (внутренний диаметр) x 250 мм, Daicel Chemical Industries Co., Ltd.), для разделения двух изомеров.
Полученный при этом более подвижный изомер растворяли в ацетонитриле и обрабатывали 4 н. диоксановым раствором хлороводорода. Растворитель и избыточный хлороводород удаляли при пониженном давлении с получением (4R)-(E)-1-[(1S)-2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-4-сульфанилпиперидина гидрохлорида (18,7 мг) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,61-0,81 (2H, м), 0,86-1,01 (2H, м), 1,25 (3H, т, J=7,0), 1,73-1,84 (1H, м), 2,20-2,30 (2H, м), 2,57-2,88 (4H, м), 3,66 (1H, д, J=12,0), 3,81-3,96 (2H, м), 4,15 (2H, кв, J=7,0), 4,33 (2H, т, J=6,5), 4,72 (1H, с), 6,10 (1H, д, J=2,5), 6,45 (1H, с), 7,03-7,17 (2H, м), 7,22-7,36 (2H, м), 7,39-7,48 (1H, м);
[α]D = +74,2° (c=0,50, CHCl3).
Менее подвижный изомер обрабатывали хлороводородом способом, подобным описанному выше, с получением (4R)-(E)-1-[(1R)-2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1Н-пиразол-3-ил}метилиден)-4-сульфанилпиперидина гидрохлорида (28,2 мг) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,69-0,75 (2H, м), 0,82-0,91 (1H, м), 0,94-1,02 (1H, м), 1,25 (3H, т, J=7,0), 1,76-1,85 (1H, м), 2,20-2,36 (2H, м), 2,65-2,91 (4H, м), 3,53 (1H, д, J=13,0), 3,83-3,97 (2H, м), 4,14 (2H, кв, J=7,0), 4,28 (2H, т, J=6,5), 4,73 (1H, с), 6,01 (1H, д, J=2,0), 6,42 (1H, с), 7,05-7,16 (2H, м), 7,22-7,33 (2H, м), 7,39-7,47 (1H, м);
[α]D = -124,3° (c=0,53, CHC13).
(Пример 191) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(N-метоксикарбамоилметил)-1H-пиразол-3-ил]метилиден}пиперидина гидрохлорид (соединение № 2-1667)
Изобутилхлорформиат (74 мкл) и триэтиламин (78 мкл) добавляли к раствору (E)-4-(ацетилсульфанил)-3-{[1-(карбоксиметил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина (свободное основание, описанное в примере 76, 240 мг) в дихлорметане (3 мл) и смесь перемешивали при комнатной температуре в течение 30 минут. К смеси добавляли раствор O-метилгидроксиламина в метаноле (раствор получали добавлением гидроксида калия (60 мг) к раствору O-метилгидроксиламингидрохлорида (70 мг) в метаноле (3 мл) с последующим удалением полученных осадков фильтрованием). После перемешивания при комнатной температуре в течение 1 часа, смесь очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (19:1). Полученное описанным образом свободное основание обрабатывали 4 н. диоксановым раствором хлороводорода (70 мкл). Растворитель и избыточный хлороводород удаляли выпариванием при пониженном давлении с получением указанного в заголовке соединения (60 мг, выход: 22%) в виде желтого аморфного твердого вещества.
1H ЯМР (500 МГц, пиридин-d5) δ м.д.: 0,65-0,83 (2H, м), 0,91-1,03 (1H, м), 1,05-1,17 (1H, м), 1,88-2,03 (1H, м), 2,23-2,53 (2H, м), 2,28 (3H, с), 2,54-2,62 и 2,64-2,73 (общая 1H, каждый м), 2,83-3,01 (1H, м), 3,31 и 3,50 (общая 1H, каждый д, J=12,5), 3,83 (3H, с), 4,50-4,61 (1H, м), 4,69-4,77 (1H, м), 4,92 и 4,93 (общая 1H, каждый с), 5,07 и 5,12 (общая 2H, каждый с), 6,31 и 6,38 (общая 1H, шс), 6,78 и 6,81 (общая 1H, каждый шс), 7,18-7,28 (2H, м), 7,31-7,41 (1H, м), 7,62-7,73 (1H, м), 7,85 и 7,89 (общая 1H, каждый д, J=2,0);
ИК (KBr, см-1): 1698.
(Пример 192) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(N-метоксикарбамоилметил)-1H-пиразол-3-ил]метилиден}-4-сульфанилпиперидина гидрохлорид (соединение № 2-1666)
Следуя процедуре, подобной описанной в примере 151, (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(N-метоксикарбамоилметил)-1H-пиразол-3-ил]метилиден}пиперидин (свободное основание, описанное в примере 191, 130 мг) обрабатывали карбонатом калия в метаноле и полученный экстрагированием неочищенный продукт очищали хроматографией на силикагеле (элюент: дихлорметан/метанол=19/1). Полученное описанным образом свободное основание обрабатывали 4 н. диоксановым раствором хлороводорода (400 мкл) в дихлорметане. Растворитель и избыточный хлороводород удаляли выпариванием при пониженном давлении с получением указанного в заголовке соединения (60 мг, выход: 50%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (500 МГц, пиридин-d5) δ м.д.: 0,64-0,80 (2H, м), 0,89-1,00 (1H, м), 1,04-1,16 (1H, м), 1,81-1,95 (1H, м), 2,26-2,54 (2H, м), 2,68-2,85 (1H, м), 2,87-3,03 (1H, м), 3,75-3,88 и 3,92-3,99 (общая 1H, каждый м), 3,84 (3H, с), 4,00-4,08 (1H, м), 4,17-4,27 (1H, м), 4,93 и 4,94 (общая 1H, каждый с), 5,09 и 5,13 (общая 2H, каждый с), 6,29 и 6,37 (общая 1H, шс), 6,69 и 6,71 (общая 1H, каждый шс), 7,16-7,26 (2H, м), 7,31-7,39 (1H, м), 7,64-7,73 (1H, м), 7,87 и 7,90 (общая 1H, каждый д, J=2,0);
ИК (KBr, см-1): 2486, 1708.
(Пример 193) (E)-4-(Ацетилсульфанил)-3-[(2-амино-1,3-тиазол-4-ил)метилиден]-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина дигидрохлорид (соединение № 1-199)
(a) 2-(трет-Бутоксикарбониламино)-1,3-тиазол-4-карбальдегид
1,0 M Толуоловый раствор (142 мл) гидрида диизобутилалюминия добавляли по каплям к перемешиваемому раствору этил 2-(трет-бутоксикарбониламино)-1,3-тиазол-4-карбоксилата (14,9 г) в дихлорметане(250 мл) при охлаждении при -70°C. После перемешивания смеси последовательно при -78°C в течение 2 часов и при 0°C в течение 1 часа к смеси осторожно добавляли водный раствор тартрата калий-натрия и все дополнительно перемешивали в течение 2 часов. Смесь фильтровали, используя дихлорметан, и фильтрат распределяли между дихлорметаном и водой. Органический слой отделяли и сушили над безводным сульфатом магния. Концентрирование при пониженном давлении давало неочищенный продукт, состоящий из [2-(трет-бутоксикарбониламино)-1,3-тиазол-4-ил]метанола (9,2 г). Полученный выше продукт обрабатывали диоксидом марганца (70 г) в дихлорметане (300 мл) при перемешивании при комнатной температуре.
Смесь фильтровали через Целит, используя дихлорметан, и фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения (6,4 г, выход по сложному эфиру: 51%) в виде желтого твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,55 (9H, с), 7,81 (1H, с), 9,90 (1H, с).
(b) (E)-3-{[2-(трет-Бутоксикарбониламино)-1,3-тиазол-4-ил]метилиден}-1-(трифенилметил)пиперидин-4-он
Следуя процедуре, подобной описанной в примере 132-(c), 2-(трет-бутоксикарбониламино)-1,3-тиазол-4-карбальдегид (3,2 г) подвергали взаимодействию с 1-(трифенилметил)пиперидин-4-оном (4,8 г) и пирролидином (0,24 мл) и неочищенный продукт очищали хроматографией на силикагеле, используя смесь гексана, этилацетата и дихлорметана (1:3:1-1:5:1) в качестве элюента, с получением указанного в заголовке соединения (2,8 г, выход: 36%) в виде масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,55 (9H, с), 2,58 (2H, шс), 2,73 (2H, т, J=6,0), 3,83 (2H, шс), 6,91 (1H, с), 7,13-7,28 (10H, м), 7,48-7,54 (6H, м).
(c) (E)-3-{[2-(трет-Бутоксикарбониламино)-1,3-тиазол-4-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол
Борогидрид натрия (0,27 г) добавляли к раствору (E)-3-{[2-(трет-бутоксикарбониламино)-1,3-тиазол-4-ил]метилиден}-1-(трифенилметил)пиперидин-4-она (3,1 г) в смешанном растворителе из дихлорметана (15 мл) и этанола (15 мл) при перемешивании при 0°C. После перемешивания при комнатной температуре в течение 1,5 часов смесь распределяли между водой и этилацетатом. Органический слой отделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Экстракт концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде желтого аморфного твердого вещества с количественным выходом.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,57 (9H, с), 1,81-2,06 (2H, м), 2,07-2,18 (2H, м), 2,66-2,84 (2H, м), 4,00-4,14 (1H, м), 6,42 (1H, с), 6,65 (1H, с), 7,04-7,34 (9H, м), 7,39-7,54 (6H, м).
(d) (E)-4-(Ацетилсульфанил)-3-{[2-(трет-бутоксикарбониламино)-1,3-тиазол-4-ил]метилиден}пиперидина гидротрифторацетат
(E)-3-{[2-(трет-бутоксикарбониламино)-1,3-тиазол-4-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол (все количество, полученное в примере 193-(c)) подвергали реакциям, подобным описанным в примере 132-(e)˜(f). Продукт очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (19:1), с получением указанного в заголовке соединения (420 мг, выход: 15%) в виде желтого аморфного твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,41 (9H, с), 2,04-2,12 (1H, м), 2,37 (3H, с), 2,49-2,59 (1H, м), 3,13-3,24 (1H, м), 3,28-3,36 (1H, м), 3,63-3,73 (1H, м), 4,61 (1H, м), 5,39-5,48 (1H, м), 6,62 (1H, с), 6,89 (1H, с).
(e) (E)-4-(Ацетилсульфанил)-3-{[2-амино-1,3-тиазол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина дигидрохлорид
Следуя процедуре, подобной описанной в примере 132-(g), (E)-4-(ацетилсульфанил)-3-{[2-(трет-бутоксикарбониламино)-1,3-тиазол-4-ил]метилиден}пиперидина гидротрифторацетат (420 мг) подвергали взаимодействию с 2-бром-2-(2-фторфенил)-1-циклопропилэтаноном (340 мг) и триэтиламином (310 мкл) в ацетонитриле (5 мл). Продукт, полученный обычным эктрагированием, очищали хроматографией на силикагеле (элюент: гексан/этилацетат=2/1-2/3) с получением (E)-4-(ацетилсульфанил)-3-{[2-(трет-бутоксикарбониламино)-1,3-тиазол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина (230 мг) в виде бледно-желтого аморфного твердого вещества.
Часть (110 мг) полученного выше соединения растворяли в дихлорметане (5 мл) и к раствору добавляли трифторуксусную кислоту (1 мл). Смесь перемешивали при 50°C в течение 1,5 часов. После охлаждения смесь обрабатывали водным раствором гидрокарбоната натрия и полученное свободное основание экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Растворители удаляли при пониженном давлении и остаток очищали хроматографией на силикагеле, используя смесь гексана, этилацетата и дихлорметана (1:2:1) в качестве элюента, с получением свободное основание указанного в заголовке соединения (55 мг), все количество которого обрабатывали 4 н. диоксановым раствором хлороводорода. Растворитель и избыточный хлороводород выпаривали при пониженном давлении с получением указанного в заголовке дигидрохлорида (60 мг, общий выход: 29%) в виде желтого аморфного твердого вещества.
1H ЯМР (400 МГц, пиридин-d5) δ м.д.: 0,67-0,83 (2H, м), 0,93-1,01 и 1,05-1,17 и 1,23-1,32 (общая 2H, каждый м), 1,88-2,01 (1H, м), 2,23 и 2,24 (общая 3H, каждый с), 2,32-2,46 (1H, м), 2,47-2,61 и 2,69-2,79 (общая 2H, каждый м), 2,92-3,02 (1H, м), 3,48 и 3,52 (общая 1H, каждый д, J=13,0), 4,70 (1H, м), 4,96 и 5,00 (общая 1H, каждый с), 5,23 и 5,34 (общая 1H, каждый д, J=13,0), 6,59 и 6,61 (общая 1H, с), 6,64 и 6,66 (общая 1H, каждый с), 7,12-7,23 (2H, м), 7,25-7,33 (1H, м), 7,67-7,74 (1H, м),
ИК (KBr, см-1): 1702, 1626.
(Пример 194) (E)-3-[(2-Амино-1,3-тиазол-4-ил)метилиден]-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина дигидрохлорид (соединение № 1-198)
Удаляли группу Boc обработкой (E)-4-(ацетилсульфанил)-3-{[2-(трет-бутоксикарбониламино)-1,3-тиазол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина (описанного в примере 193-(e), соединение до удаления группы Boc, 40 мг) трифторуксусной кислотой способом, подобным описанному в примере 193-(e). Полученный при этом неочищенный (E)-4-(ацетилсульфанил)-3-[(2-амино-1,3-тиазол-4-ил)метилиден]-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина бис(гидротрифторацетат) растворяли в этаноле (5 мл) и через полученный раствор пропускали хлороводород при охлаждении льдом в течение 45 минут. После перемешивания герметически закрытой смеси при комнатной температуре в течение 4 часов растворитель и избыточный хлороводород удаляли при пониженном давлении и остаток обрабатывали водным раствором гидрокарбоната натрия. Высвобожденное основание экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Свободное основание указанного в заголовке соединения (20 мг), полученное после концентрирования, обрабатывали в дихлорметане 4 н. диоксановым раствором хлороводорода и растворитель и избыточный хлороводород удаляли выпариванием при пониженном давлении с получением указанного в заголовке соединения (20 мг, общий выход: 57%) в виде оранжевого аморфного твердого вещества.
1H ЯМР (500 МГц, пиридин-d5) δ м.д.: 0,63-1,39 (4H, м), 1,79-1,93 (1H, м), 2,29-2,41 (1H, м), 2,47-2,65 (1H, м), 2,74-2,84 (1H, м), 2,86-2,97 и 3,02-3,10 (общая 1H, каждый м), 4,01 и 4,05 (общая 1H, каждый м),4,12 и 4 ,13 (общая 1H, каждый д, J=13,0),4,79 и 4,89 (общая 1H, каждый д, J=13,0), 4,97 и 5,02 (общая 1H, каждый с), 6,54-6,61 (2H, м), 7,10-7,39 (3H, м), 7,74 (1H, м),
ИК (KBr, см-1): 2565, 1711, 1626.
(Пример 195) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-имидазол-2-ил]метилиден}пиперидина гидрохлорид (соединение № 2-802)
(a) Этил (2-формил-1H-имидазол-1-ил)ацетат
К раствору 1H-имидазол-2-карбальдегида (4,47 г) в ацетонитриле (80 мл) добавляли карбонат калия (12,93 г), этилбромацетат (6,2 мл) и иодид калия (7,78 г) при комнатной температуре. Смесь перемешивали при 50°C в течение 1 часа. После охлаждения до комнатной температуры смесь фильтровали для удаления осадков. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (99:1-96:4), с получением указанного в заголовке соединения (5,23 г, выход: 62%) в виде коричневого масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,30 (3H, т, J=7,0), 4,26 (2H, кв, J=7,0), 5,14 (2H, с), 7,16 (1H, с), 7,34 (1H, с), 9,80 (1H, с).
(b) (E)-3-{[1-(Этоксикарбонилметил)-1H-имидазол-2-ил]метилиден}-1-(трифенилметил)пиперидин-4-он
Этил (2-формил-1H-имидазол-1-ил)ацетат (5,94 г) подвергали взаимодействию с 1-(трифенилметил)пиперидин-4-оном (11,10 г) и пирролидином (2,7 мл) в бензоле (250 мл) способом, подобным описанному в примере 132-(c). Неочищенный продукт, полученный экстрагированием обычным способом, очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана и этилацетата (9:1-4:6), с получением указанного в заголовке соединения (11,32 г, выход: 69%) в виде желтого аморфного твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,30 (3H, т, J=7,5), 2,58-2,78 (4H, м), 3,86-3,99 (2H, м), 4,25 (2H, кв, J=7,5), 4,78 (2H, с), 6,93 (1H, с), 7,07 (1H, с), 7,11-7,30 (10H, м), 7,47-7,57 (6H, м).
(c) (E)-3-{[1-(Этоксикарбонилметил)-1H-имидазол-2-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол
(E)-3-{[1-(Этоксикарбонилметил)-1H-имидазол-2-ил]метилиден}-1-(трифенилметил)пиперидин-4-он (11,32 г) восстанавливали борогидридом натрия (941 мг) в смешанном растворителе из этанола (120 мл) и дихлорметана (40 мл) способом, подобным описанному в примере 138-(c). Неочищенный продукт, полученный обычным экстрагированием, очищали хроматографией на силикагеле, используя смесь этилацетата и гексана (3: 7-10:0) в качестве элюента, с получением указанного в заголовке соединения (10,11 г, выход: 89%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,31 (3H, т, J=7,0), 1,66-1,92 (2H, м), 2,02-2,30 (2H, м), 2,82-2,98 (1H, м), 3,32-3,56 (1H, м), 3,96-4,06 (1H, м), 4,26 (2H, кв, J=7,0), 4,72 (2H, с), 6,21 (1H, с), 6,84 (1H, с), 6,88 (1H, с), 7,00-7,39 (15H, м).
(d) (E)-4-(Ацетилсульфанил)-3-{[1-(этоксикарбонилметил)-1H-имидазол-2-ил]метилиден}пиперидина бис(гидротрифторацетат)
К раствору (E)-3-{[1-(этоксикарбонилметил)-1H-имидазол-2-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола (4,52 г) в толуоле (80 мл) добавляли динеопентилацеталь N,N-диметилформамида (5,0 мл) и тиоуксусную кислоту (1,3 мл) при 0°C. После перемешивания смеси при комнатной температуре реакционную смесь гасили добавлением воды. Продукт экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Удаление растворителя при пониженном давлении с последующей очисткой остатка хроматографией на силикагеле с использованием смеси этилацетата и гексана (25:75-70:30) в качестве элюента дали 5-{(ацетилсульфанил)[1-(этоксикарбонилметил)-1H-имидазол-2-ил]метил}-1-(трифенилметил)-1,2,3,6-тетрагидропиридин (3,92 г, выход: 78%) в виде бледно-желтого аморфного твердого вещества.
Все полученное выше твердое вещество растворяли в диметилсульфоксиде (60 мл) и к раствору добавляли тиоацетат калия (7,94 г). Смесь перемешивали при 80°C в течение 5 часов. После охлаждения смесь разбавляли этилацетатом промывали последовательно водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Удаление растворителя выпариванием при пониженном давлении с последующей очисткой остатка хроматографией на силикагеле (элюент: этилацетат/гексан = 3/7-6/4) дали три показанные ниже фракции.
Менее полярный изомер (E)-4-(ацетилсульфанил)-3-{[1-(этоксикарбонилметил)-1H-имидазол-2-ил]метилиден}-1-(трифенилметил)пиперидин: 0,57 г, выход от производного тетрагидропиридина: 15%, коричневое масло.
Более полярный изомер (Z)-4-(ацетилсульфанил)-3-{[1-(этоксикарбонилметил)-1H-имидазол-2-ил]метилиден}-1-(трифенилметил)пиперидин: 0,29 г, выход от производного тетрагидропиридина: 7%, коричневое масло.
Смесь указанных выше двух компонентов: 2,00 г, выход от производного тетрагидропиридина: 51%.
Трифторуксусную кислоту (230 мкл) добавляли по каплям к раствору указанного выше менее полярного изомера (0,57 г) в дихлорметане (10 мл) при 0°C. Смесь перемешивали при комнатной температуре в течение 20 минут и затем удаляли при пониженном давлении растворители. Остаток очищали хроматографией на силикагеле (элюент: метанол/дихлорметан = 3/97-20/80) с получением указанного в заголовке соединения (396,8 мг, выход стадии детрифенилметилирования: 71%) в виде коричневого масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,33 (3H, т, J=7,0), 2,07-2,16 (1H, м), 2,37 (3H, с), 2,49-2,62 (1H, м), 3,18-3,29 (1H, м), 3,38-3,45 (1H, м), 3,95 (1H, д, J=15,0), 4,22-4,36 (3H, м), 4,55 (1H, т, J=4,0), 4,72 (1H, д, J=17,5), 4,79 (1H, д, J=17,5), 6,52 (1H, с), 7,14 (1H, с), 7,29 (1H, с).
(e) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-имидазол-2-ил]метилиден}пиперидина гидрохлорид
Следуя процедуре, подобной описанной в примере 132-(g), (E)-4-(ацетилсульфанил)-3-{[1-(этоксикарбонилметил)-1H-имидазол-2-ил]метилиден}пиперидина бис(гидротрифторацетат) (396,8 мг) подвергали взаимодействию с 2-бром-2-(2-фторфенил)-1-циклопропилэтаноном (229,3 мг) и триэтиламином (400 мкл) в ацетонитриле (7 мл). Продукт очищали хроматографией на силикагеле (элюент: этилацетат/гексан=1/4-1/0) с получением свободного основания указанного в заголовке соединения (225,8 мг) в виде коричневого масла, которое обрабатывали 4 н. диоксановым раствором хлороводорода (0,34 мл) в ацетонитриле (5 мл), и растворитель и избыточный хлороводород удаляли при пониженном давлении с получением указанного в заголовке соединения (243,7 мг, выход: 63%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,67-1,04 (4H, м), 1,29 и 1,30 (общая 3H, каждый т, J=7,0), 1,81-1,91 (1H, м), 2,20-2,88 (7H, м), 3,21 и 3,33 (общая 1H, каждый д, J=13,5), 4,24 и 4,25 (общая 2H, каждый кв, J=7,0), 4,40 и 4,62 (общая 1H, каждый д, J=13,5), 4,46 и 4,49 (общая 1H, каждый т, J=4,5), 4,64-4,67 (2H, м), 4,67 и 4,74 (общая 1H, каждый с), 6,25 и 6,26 (общая 1H, каждый с), 6,83 и 6,86 (общая 1H, каждый с), 6,95 и 7,02 (общая 1H, каждый с), 7,03-7,16 (2H, м), 7,24-7,45 (2H, м);
ИК (KBr, см-1): 1705, 1494.
(Пример 196) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-имидазол-2-ил]метилиден}-4-сульфанилпиперидина гидрохлорид (соединение № 2-801)
Хлороводород пропускали через раствор (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-имидазол-2-ил]метилиден}пиперидина гидрохлорида (169,4 мг) в этаноле (4 мл) при 0°C и герметически закрытую смесь перемешивали при комнатной температуре в течение 6,5 часов. Смесь концентрировали при пониженном давлении и остаток очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,026 н. водный раствор трифторуксусной кислоты, 25/75, об./об.). Полученную при этом соль указанного в заголовке соединения с трифторуксусной кислотой нейтрализовали водным раствором гидрокарбоната натрия и высвобожденное свободное основание экстрагировали два раза дихлорметаном. Экстракт сушили над безводным сульфатом натрия и растворители удаляли при пониженном давлении с получением свободного основания указанного в заголовке соединения (67,7 мг, выход: 47%) в виде бесцветного масла. Полученное описанным образом масло обрабатывали 4 н. диоксановым раствором хлороводорода (120 мкл) в ацетонитриле (3 мл). Растворитель и избыточный хлороводород удаляли выпариванием при пониженном давлении с получением указанного в заголовке соединения (88,9 мг) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,65-0,79 (2H, м), 0,84-1,02 (2H, м), 1,30 (3H, т, J=7,5), 1,72-1,89 (1H, м), 2,15-2,32 (2H, м), 2,49-3,02 (2H, м), 3,63-4,13 (3H, м), 4,25 (2H, кв, J=7,5), 4,67 (2H, с), 4,71 и 4,73 (общая 1H, каждый с), 6,26 и 6,33 (общая 1H, каждый с), 6,86 и 6,87 (общая 1H, каждый с), 6,96-7,16 (3H, м), 7,22-7,45 (2H, м);
ИК (KBr, см-1): 2659, 1711, 1494.
(Пример 197) (E)-3-{[1-(Карбоксиметил)-1H-имидазол-2-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-769)
Следуя процедуре, подобной описанной в примере 134, (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-имидазол-2-ил]метилиден}-4-сульфанилпиперидина гидрохлорид (155,6 мг) обрабатывали 3 н. хлороводородной кислотой (5 мл) при 50°C в течение 2,5 часов. После того как реакционный раствор концентрировали при пониженном давлении, остаток очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. хлороводородная кислота, 15/85, об./об.) с получением указанного в заголовке соединения (149,0 мг, выход: количественный) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, пиридин-d5) δ м.д.: 0,68-0,81 (2H, м), 0,96-1,22 (2H, м), 1,76-1,90 (1H, м), 2,24-2,35 (1H, м), 2,50-3,10 (4H, м), 3,96 и 4,05 (общая 1H, каждый т, J=4,5), 4,20 и 4,46 (общая 1H, каждый д, J=13,0), 4,62 и 4,99 (общая 1H, каждый д, J=13,0), 4,98 и 5,02 (общая 1H, каждый с), 5,16 и 5,17 (общая 2H, каждый с), 6,83 и 6,88 (общая 1H, каждый с), 7,11-7,36 (4H, м), 7,68-7,76 (1H, м);
ИК (KBr, см-1): 2717, 1711, 1494.
(Пример 198) (E)-4-(Ацетилсульфанил)-3-{[1-(карбоксиметил)-1H-имидазол-2-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина гидрохлорид (соединение № 2-770)
К раствору (E)-3-{[1-(карбоксиметил)-1H-имидазол-2-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорида (85,6 мг) в дихлорметане (4 мл) добавляли триэтиламин (120 мкл) и уксусный ангидрид (80 мкл) при 0°C. После перемешивания смеси при комнатной температуре в течение 3 часов растворители удаляли при пониженном давлении и остаток очищали хроматографией на силикагеле, используя смесь метанола и дихлорметана (5:95-25:75) в качестве элюента, с получением свободного основания указанного в заголовке соединения (57,7 мг, выход: 71%) в виде бесцветного масла.
Полученное описанным выше образом соединение (59,7 мг) обрабатывали 4 н. диоксановым раствором хлороводорода (150 мкл) в ацетонитриле (3 мл). Растворитель и избыточный хлороводород удаляли при пониженном давлении с получением указанного в заголовке соединения (58,2 мг, общий выход: 64%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,69-1,02 (4H, м), 1,80-2,08 (2H, м), 2,29 (3Н, с), 2,20-2,33 (1H, м), 2,42-2,8 9 (2H, м), 3,25 и 3,33 (общая 1H, каждый д, J=13,0), 3,72-3,87 (1H, м), 4,42 (1H, т, J=4,5), 4,64 (2H, с), 4,83 и 4,89 (общая 1H, каждый с), 6,39 (1H, с), 7,05-7,40 (6H, м);
ИК (KBr, см-1): 1707, 1494.
(Пример 199) (Z)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-имидазол-2-ил]метилиден}пиперидина гидрохлорид (соединение № 4-60)
(a) (Z)-4-(Ацетилсульфанил)-3-{[1-(этоксикарбонилметил)-1H-имидазол-2-ил]метилиден}пиперидина бис(гидротрифторацетат)
Трифторуксусную кислоту (120 мкл) добавляли к раствору (Z)-4-(ацетилсульфанил)-3-{[1-(этоксикарбонилметил)-1H-имидазол-2-ил]метилиден}-1-(трифенилметил)пиперидина (описанного в примере 195-(d), 0,29 г) в дихлорметане (5 мл) при 0°C. После перемешивания смеси при комнатной температуре в течение 2 часов растворители удаляли при пониженном давлении и остаток очищали хроматографией на силикагеле, используя смесь метанола и дихлорметана (5:95-20:80) в качестве элюента, с получением указанного в заголовке соединения (185,2 мг, выход: 65%) в виде коричневого масла.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,32 (3H, т, J=7,0), 2,00-2,10 (1H, м), 2,29 (3H, с), 2,75-2,86 (1H, м), 3,18-3,29 (1H, м), 3,39-3,47 (1H, м), 3,97 (1H, д, J=13,5), 4,05 (1H, д, J=13,5), 4,28 (2H, кв, J=7,0), 4,73 (1H, д, J=17,5), 4,78 (1H, д, J=17,5), 4,83 (1H, шс), 6,41 (1H, с), 7,24 (1H, с), 7,41 (1H, с).
(b) (Z)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-имидазол-2-ил]метилиден}пиперидина гидрохлорид
Следуя процедуре, подобной описанной в примере 132-(g), (Z)-4-(ацетилсульфанил)-3-{[1-(этоксикарбонилметил)-1H-имидазол-2-ил]метилиден}пиперидина бис(гидротрифторацетат) (185,2 мг) подвергали взаимодействию с 2-бром-2-(2-фторфенил)-1-циклопропилэтаноном (99,3 мг) и триэтиламином (190 мкл) в ацетонитриле (4 мл). Продукт очищали хроматографией на силикагеле (элюент: этилацетат/гексан = 1/9-1/0) с получением свободного основания указанного в заголовке соединения (113,5 мг) в виде бледно-желтого масла, которое растворяли в ацетонитриле (3 мл) и к раствору добавляли 4 н. диоксановый раствор хлороводорода (170 мкл). Растворитель и избыточный хлороводород удаляли при пониженном давлении с получением указанного в заголовке соединения (119,6 мг, выход: 64%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,78-1,09 (4H, м), 1,29 (3H, т, J=7,0), 1,81-1,95 (1H, м), 2,18-2,36 (5H, м), 2,37-2,68 (1H, м), 2,75-3,10 (2H, м), 3,26 и 3,38 (общая 1H, каждый д, J=12,01, 4,18-4,27 (2H, м), 4,55-4,79 (3H, м), 5,87-6,02 (2H, м), 6,88 (1H, д, J=3,5), 7,07-7,46 (5H, м);
ИК (KBr, см-1): 1708, 1495.
(Пример 200) (Z)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-имидазол-2-ил]метилиден}-4-сульфанилпиперидина гидрохлорид (соединение № 4-59)
К раствору смеси (Z)-4-(ацетилсульфанил)-3-{[1-(этоксикарбонилметил)-1H-имидазол-2-ил]метилиден}-1-(трифенилметил)пиперидина и его (Е)-изомера (2,00 г), полученной в примере 195-(d), в дихлорметане (30 мл) добавляли трифторуксусную кислоту (810 мкл) при 0°C. После перемешивания смеси при комнатной температуре в течение 1 часа растворители удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, используя смесь метанола и дихлорметана (5:95-20:80) в качестве элюента. Полученный при этом неочищенный продукт дополнительно очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,026 н. водная трифторуксусная кислота, 15/85, об./об.) с получением смеси (Z)-4-(ацетилсульфанил)-3-{[1-(этоксикарбонилметил)-1H-имидазол-2-ил]метилиден}пиперидина бис(гидротрифторацетата) и его (E)-изомера (1,55 г, выход: 80%).
Часть (1,00 г) полученной смеси обрабатывали 2-бром-2-(2-фторфенил)-1-циклопропилэтаноном (557,5 мг) и триэтиламином (1,0 мл) в ацетонитриле (15 мл) способом, подобным описанному в примере 132-(g), и продукт очищали хроматографией на силикагеле (элюент: этилацетат/гексан = 2/8-1/0) с получением смеси (Z)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-имидазол-2-ил]метилиден}пиперидина и его (Е)-изомера (609,9 мг, выход: 67%) в виде бледно-коричневого аморфного твердого вещества.
Хлороводород пропускали через раствор всего количества указанной выше смеси в этаноле (10 мл) при 0°C и герметически закрытую смесь перемешивали при комнатной температуре в течение 7 часов. Смесь концентрировали при пониженном давлении и остаток очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,026 н. водный раствор трифторуксусной кислоты, 25/75, об./об.) с получением указанного в заголовке соединения (115,8 мг, выход: 19%) в виде бесцветного аморфного твердого вещества. Дополнительное элюирование дало (E)-изомер (127,6 мг, выход: 21%).
Спектральные данные (Z)-изомера были следующими:
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,77-0,92 (2H, м), 0,97-1,10 (2H, м), 1,31 (3H, т, J=7,0), 1,72-1,85 (1H, м), 2,13-2,35 (2H, м), 2,44-2,92 (2H, м), 3,18 и 3,30 (общая 1H, каждый д, J=12,5), 3,34 и 3,52 (общая 1H, каждый д, J=12,5), 4,26 (2H, кв, J=7,0), 4,57-4,72 (2H, м), 4,79 и 4,81 (общая 1H, каждый с), 5,30-5,42 (1H, м), 5,72 и 5,80 (общая 1H, каждый с), 6,87 и 6,89 (общая 1H, каждый с), 7,08-7,23 (3H, м), 7,29-7,46 (2H, м);
ИК (KBr, см-1): 2646, 1712, 1494.
(Пример 201) (Z)-3-{[1-(Карбоксиметил)-1H-имидазол-2-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 4-51)
Следуя процедуре, подобной описанной в примере 134, (Z)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-имидазол-2-ил]метилиден}-4-сульфанилпиперидина гидрохлорид (73,5 мг) обрабатывали 3 н. хлороводородной кислотой (3 мл) при 50°C в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении и остаток очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. хлороводородная кислота, 10/90, об./об.) с получением указанного в заголовке соединения (52,3 мг, выход: 95%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, пиридин-d5) δ м.д.: 0,68-0,86 (2H, м), 0,94-1,10 (2H, м), 1,79-1,90 (1H, м), 2,29-3,03 (4H, м),, 3,43 и 3,53 (общая 1H, каждый д, J=12,5), 3,63 и 3,74 (общая 1H, каждый д, J=12,5), 4,88 и 4,94 (общая 1H, каждый с), 5,10-5,28 (2H, м), 6,10-6,16 (1H, м), 6,43 и 6,47 (общая 1H, каждый с), 7,04-7,43 (5H, м), 7,58-7,64 (1H, м);
ИК (KBr, см-1): 2712, 1712, 1494.
(Пример 202) (4R)-(E)-4-(Ацетилсульфанил)-1-[(1RS)-1-(2-фторфенил)-2-метокси-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)пиперидин (соединение № 5-16)
К раствору (4R)-(E)-4-(ацетилсульфанил)-3-{1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)пиперидина гидротрифторацетата (пример 180-(a), 766,6 мг) в ацетонитриле (10 мл) добавляли метилбром(2-фторфенил)ацетат (406,1 мг) и триэтиламин (570 мкл) при 0°C. После перемешивания при комнатной температуре в течение 1 часа смесь разбавляли этилацетатом. Раствор промывали последовательно водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на силикагеле, используя смесь этилацетата и гексана (3:7 to 6:4) в качестве элюента, с получением указанного в заголовке соединения (530,2 мг, выход: 77%) в виде бледно-желтого масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,26 (3H, т, J=7,0), 1,81-1,92 (1H, м), 2,19-2,34 (4H, м), 2,51-2,71 (1H, м), 2,73-2,88 (3H, м), 3,17 и 3,28 (общая 1H, каждый д, J=13,5), 3,67 и 3,70 (общая 3H, каждый с), 4,07-4,34 (5H, м), 4,44-4,53 (1H, м), 4,62 (1H, с), 6,00 и 6,04 (общая 1H, каждый с), 6,45 (1H, д, J=4,5), 7,00-7,15 (2H, м), 7,23-7,34 (2H, м), 7,49-7,58 (1H, м);
ИК (KBr, см-1): 1732, 1496.
(Пример 203) (4R)-(E)-1-[(1RS)-1-(2-Фторфенил)-2-метокси-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден) 4-сульфанилпиперидина гидрохлорид (соединение № 5-11)
Хлороводород пропускали через раствор (4R)-(E)-4-(ацетилсульфанил)-1-[(1RS)-1-(2-фторфенил)-2-метокси-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)пиперидина (223,8 мг) в метаноле (6 мл) при перемешивании при 0°C и герметически закрытую смесь перемешивали при комнатной температуре в течение 7 часов. Растворитель и избыточный хлороводород выпаривали при пониженном давлении и остаток очищали хроматографией на силикагеле, используя смесь метанола и дихлорметана (3:97-15:85, об./об.) в качестве элюента, с получением указанного в заголовке соединения (213,9 мг, выход: 99%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,72-1,84 (1H, м), 2,19-2,34 (1H, м), 2,63-2,98 (4H, м), 3,59-3,72 (7H, м), 3,85-3,96 (2H, м), 4,25-4,35 (2H, м), 4,65 (1H, с), 5,99 и 6,06 (общая 1H, каждый д, J=2,5), 6,41 и 6,43 (общая 1H, каждый с), 7,00-7,15 (2H, м), 7,25-7,33 (2H, м), 7,50-7,58 (1H, м);
ИК (KBr, см-1): 2607, 1750, 1496.
(Пример 204) (4R)-(E)-1-[(1S)-1-(2-Фторфенил)-2-метокси-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-4-сульфанилпиперидина гидрохлорид и (4R)-(E)-1-[(1R)-1-(2-фторфенил)-2-метокси-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (соединение № 5-11)
(4R)-(E)-1-[(1RS)-1-(2-Фторфенил)-2-метокси-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-4-сульфанилпиперидина гидрохлорид обрабатывали водным раствором гидрокарбоната натрия. Высвобожденное основание экстрагировали дихлорметаном. Полученное описанным образом свободное основание (приблизительно 200 мг) делили на пять порций и подвергали препаративной ВЭЖХ (Chiralcel OD-H, 20Ø x 250 мм, Daicel Chemical Industries Co., Ltd., элюент: 2-пропанол/гексан = 1/2, 4 мл/минуту) с получением более подвижного изомера, (4R)-(E)-1-[(1S)-1-(2-фторфенил)-2-метокси-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-4-сульфанилпиперидина (103,9 мг), и менее подвижного изомера, (4R)-(E)-1-[(1R)-1-(2-фторфенил)-2-метокси-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-4-сульфанилпиперидина (100,3 мг), обоих в виде бесцветного масла.
Оба изомера обрабатывали 4 н. диоксановым раствором хлороводорода в ацетонитриле. Растворитель и избыточный хлороводород удаляли при пониженном давлении с получением соответственно двух указанных в заголовке хлороводородных солей, обеих в виде бесцветного аморфного твердого вещества.
(4R)-(E)-1-[(1S)-1-(2-Фторфенил)-2-метокси-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-4-сульфанилпиперидина гидрохлорид:
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,73-1,84 (1H, м), 2,19-2,29 (1H, м), 2,64-2,73 (1H, м), 2,80-2,90 (3H, м), 3,65-3,72 (7H, м), 3,87-3,95 (2H, м), 4,29-4,35 (2H, м), 4,65 (1H, с), 6,06 (1H, д, J=2,5), 6,43 (1H, с), 7,01-7,15 (2H, м), 7,24-7,34 (2H, м), 7,52-7,58 (1H, м);
[α]D = +14,7° (c=0,54, CHCl3).
(4R)-(E)-1-[(1R)-1-(2-Фторфенил)-2-метокси-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-3-ил}метилиден)-4-сульфанилпиперидина гидрохлорид:
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,74-1,84 (1H, м), 2,22-2,34 (1H, м), 2,66-2,74 (1H, м), 2,82 (2H, т, J=7,0), 2,88-2,96 (1H, м), 3,60-3,72 (7H, м), 3,86-3,97 (2H, м), 4,28 (2H, т, J=7,0), 4,65 (1H, с), 5,99 (1H, д, J=2,5), 6,41 (1H, с), 7,03-7,16 (2H, м), 7,24-7,33 (2H, м), 7,51-7,58 (1H, м);
[α]D = -78,3° (c=0,51, CHCl3).
(Пример 205) (Z)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-имидазол-5-ил]метилиден}пиперидина гидрохлорид (соединение № 4-88)
(a) (Z)-4-(Ацетилсульфанил)-3-{[1-(этоксикарбонилметил)-1H-имидазол-5-ил]метилиден}пиперидина бис(гидротрифторацетат)
К раствору (E)-3-{[1-(этоксикарбонилметил)-1H-имидазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола (3,15 г) в толуоле (50 мл) добавляли динеопентилацеталь N,N-диметилформамида (3,5 мл) и тиоуксусную кислоту (0,89 мл) при комнатной температуре. После перемешивания при комнатной температуре в течение 1 часа смесь разбавляли этилацетатом, промывали последовательно водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Удаление растворителя при пониженном давлении с последующей очисткой остатка хроматографией на силикагеле с использованием смеси этилацетата и гексана (1:4-1:0) в качестве элюента дали неочищенный (E)-4-(ацетилсульфанил)-3-{[1-(этоксикарбонилметил)-1H-имидазол-5-ил]метилиден}-1-(трифенилметил)пиперидин (3,29 г) в виде желтого аморфного твердого вещества.
Полученный выше продукт растворяли в диметилсульфоксиде (50 мл) и к раствору добавляли тиоацетат калия (6,56 г). Смесь перемешивали при 80°C в течение 4 часов. После охлаждения смесь распределяли между водой и этилацетатом. Органический слой отделяли, промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Удаление растворителя при пониженном давлении с последующей очисткой остатка хроматографией на силикагеле (элюент: этилацетат/гексан = 1/1˜1/0) дали смесь (приблизительно 1:1) (Z)-4-(ацетилсульфанил)-3-{[1-(этоксикарбонилметил)-1H-имидазол-5-ил]метилиден}-1-(трифенилметил)пиперидина и его (Е)-изомера (2,73 г).
Трифторуксусную кислоту (1,1 мл) добавляли к раствору полученной выше смеси в дихлорметане (40 мл) при 0°C. После перемешивания при комнатной температуре в течение 15 минут смесь концентрировали при пониженном давлении и остаток очищали хроматографией на силикагеле (элюент: метанол/дихлорметан = 5/95-25/75) с получением указанного в заголовке соединения (1,44 г, общий выход: 54%) в виде бледно-желтого масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,32 (3H, т, J=7,5), 2,04-2,32 (2H, м), 2,42 (3H, с), 3,28-3,63 (2H, м), 3,88 (1H, д, J=12,0), 4,00 (1H, д, J=12,0), 4,28 (2H, кв, J=7,5), 4,80-4,99 (3H, м), 6,26 (1H, с), 7,47 (1H, с), 8,98 (1H, с).
(b) (Z)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-имидазол-5-ил]метилиден}пиперидина гидрохлорид
Следуя процедуре, подобной описанной в примере 132-(g), (Z)-4-(ацетилсульфанил)-3-{[1-(этоксикарбонилметил)-1H-имидазол-5-ил]метилиден}пиперидина бис(гидротрифторацетат) (784,7 мг) подвергали взаимодействию с 2-бром-2-(2-фторфенил)-1-циклопропилэтаноном (442,9 мг) и триэтиламином (790 мкл) в ацетонитриле (10 мл). Продукт, полученный обычной доработкой, очищали хроматографией на силикагеле, используя смесь этилацетата и гексана (3:7-7:3) и затем смесь метанола и дихлорметана (1:19) в качестве элюентов, с получением свободного основания указанного в заголовке соединения (608,8 мг, выход: 86%) в виде желтого масла.
Часть (73,7 мг) полученного выше свободного основания обрабатывали 4 н. диоксановым раствором хлороводорода (4 мл) в дихлорметане (4 мл). Растворитель и избыточный хлороводород удаляли при пониженном давлении с получением указанного в заголовке соединения (74,7 мг, общий выход: 81%) в виде бледно-коричневого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,77-0,92 (2H, м), 0,98-1,09 (2H, м), 1,28 и 1,30 (общая 3H, каждый т, j=7,0), 1,72-1,86 (1H, м), 2,07-2,67 (3H, м), 2,32 и 2,33 (общая 3H, каждый с), 2,76-3,01 (2H, м), 3,31 и 3,41 (общая 1H, каждый д, J=13,0), 4,26 (2H, кв, J=7,0), 4,61 и 4,65 (общая 2H, каждый с), 4,74 и 4,78 (общая 1H, каждый с), 4,93 (1H, шс), 5,86 и 5,94 (общая 1H, каждый с), 7,01 и 7,02 (общая 1H, каждый с), 7,08-7,23 (2H, м), 7,31-7,42 (2H, м), 7,49 и 7,50 (общая 1H, каждый с);
ИК (KBr, см-1): 1701, 1494.
(Пример 206) (Z)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1H-имидазол-4(5)-ил]метилиден}пиперидина гидрохлорид (соединение № 4-64)
(a) (Z)-4-(Ацетилсульфанил)-3-{[1H-имидазол-4(5)-ил]метилиден}пиперидина бис(гидротрифторацетат)
К раствору неочищенного (E)-4-(ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-1H-имидазол-5-ил]метилиден}-1-(трифенилметил)пиперидина (4,00 г), полученного способом, описанным в примере 21(c), в диметилсульфоксиде (50 мл) добавляли тиоацетат калия (7,90 г). Полученную смесь перемешивали при 80°C в течение 2,5 часов, охлаждали и распределяли между этилацетатом и водой. Отделенный органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Удаляли в вакууме растворитель и остаток очищали хроматографией на силикагеле, используя смесь этилацетата и гексана (3:7-7:3) и затем смесь метанола и дихлорметана (1:9) в качестве элюентов, с получением смеси (Z)-4-(ацетилсульфанил)-3-{[1H-имидазол-4(5)-ил]метилиден}-1-(трифенилметил)пиперидина и его (Е)-изомера в виде коричневого аморфного твердого вещества (2,35 г).
К части (2,09 г) полученного выше соединения в смешанном растворителе из дихлорметана (38 мл) и метанола (2 мл) добавляли трифторуксусную кислоту (1,0 мл) при 0°C. Полученную смесь перемешивали при 0°C в течение одного часа, концентрировали в вакууме и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь метанола и дихлорметана (5:95-40:60), с получением смеси указанного в заголовке соединения и его (Е)-изомера (1,37 г). Продукт дополнительно очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент:ацетонитрил/0,026 н. водная трифторуксусная кислота, 11/89, об./об.) с получением указанного в заголовке соединения в виде желтого твердого вещества (749 мг, общий выход: 26%).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д.: 1,86-1,97 (1H, м), 2,16-2,32 (1H, м), 2,37 (3H, с), 3,02-3,17 (1H, м), 3,28-4,02 (3H, м), 4,97 (1H, шс), 6,47 (1H, с), 7,54 (1H, с), 8,91-9,07 (1H, с).
(b) (Z)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1H-имидазол-4(5)-ил]метилиден}пиперидина гидрохлорид
(Z)-4-(Ацетилсульфанил)-3-{[1H-имидазол-4(5)-ил]метилиден}пиперидина бис(гидротрифторацетат) (749 мг) обрабатывали 2-бром-2-(2-фторфенил)-1-циклопропилэтаноном (374 мг) и триэтиламином (670 мкл) в ацетонитриле (15 мл) способом, подобным описанному в примере 132(g), и неочищенный остаток, полученный по обычной методике экстрагирования, очищали хроматографией на силикагеле, используя в качестве элюента смесь метанола и дихлорметана (1:99-15:85), с получением свободного основания указанного в заголовке соединения в виде желтого масла (506 мг). К части свободного основания (93,6 мг) в ацетонитриле (4 мл) добавляли 4 н. раствор хлороводорода в диоксане (230 мкл). Растворитель и избыточный хлороводород удаляли в вакууме с получением указанного в заголовке гидрохлорида в виде бледно-желтого аморфного твердого вещества (93,9 мг, общий выход: 70 %).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,78-0,93 (2H, м), 0,97-1,08 (2H, м), 1,74-1,86 (1H, м), 2,12-2,58 (3H, м), 2,38 (3H, м), 2,81-3,06 (2H, м), 3,26 и 3,42 (общая 1H, каждый д, J=12,5),4,71 и 4,75 (общая 1H, каждый с), 5,02 (1H, шс), 6,15 и 6,24 (общая 1H, каждый с), 7,03 и 7,05 (общая 1H, каждый с), 7,08-7,23 (2H, м), 7,30-7,43 (2H, м), 7,76 (1H, с);
ИК (KBr, см-1): 1700, 1494.
(Пример 207) (Z)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1H-имидазол-4(5)-ил]метилиден}-4-сульфанилпиперидина гидрохлорид (соединение № 4-63)
(Z)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1H-имидазол-4(5)-ил]метилиден}пиперидину (258 мг) давали возможность взаимодействовать с хлороводородом в этаноле (8 мл) способом, подобным описанному в примере 133. Реакционную смесь концентрировали в вакууме и остаток очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент:ацетонитрил/0,024 н. водная HCl, 15/85, об./об.) с получением указанного в заголовке соединения в виде бесцветного аморфного твердого вещества (226 мг, выход: 89%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,82-1,20 (4H, м), 1,80-1,99 (2H, м), 2,59-2,77 (1H, м), 3,07-3,45 (2H, м), 3,71-3,8 4 (1H, м), 3,92-4,04 (1H, м), 4,45-4,58 (1H, м), 5,57 и 5,61 (общая 1H, каждый с), 6,43 и 6,46 (общая 1H, каждый с), 7,19-7,37 (2H, м), 7,44-7,77 (3H, м), 8,90 и 8,96 (общая 1H, каждый с);
ИК (KBr, см-1): 2652, 1710, 1494.
(Пример 208) (Z)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1H-пиразол-3(5)-ил]метилиден}пиперидина гидрохлорид (соединение № 4-2)
(a) (Z)-4-(Ацетилсульфанил)-3-{[1H-пиразол-3(5)-ил]метилиден}пиперидина бис(гидротрифторацетат)
К раствору неочищенного (E)-4-(ацетилсульфанил)-3-{[1-(трет-бутоксикарбонил)-1H-пиразол-3-ил]метилиден}-1-(трифенилметил)пиперидина (7,67 г), полученного по методике, описанной в примере 11(c), в диметилсульфоксиде (80 мл) добавляли тиоацетат калия (14,92 г). Полученную смесь перемешивали при 80°C в течение 4 часов, охлаждали и распределяли между этилацетатом и водой. Отделенный органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Удаляли в вакууме растворитель и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь этилацетата и гексана (3:7-7:3) и затем смесь метанола и дихлорметана (1:19-2:18), с получением смеси (Z)-4-(ацетилсульфанил)-3-{[1H-пиразол-3(5)-ил]метилиден}-1-(трифенилметил)пиперидина и его (Е)-изомера в виде коричневых аморфных твердых частиц (3,42 г).
К раствору полученной выше смеси в дихлорметане (60 мл) добавляли трифторуксусную кислоту (5,5 мл) при 0°C. Полученную смесь перемешивали при 0°C в течение 0,5 часа, концентрировали в вакууме и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь метанола и дихлорметана (5:95-50:50), с получением смеси указанного в заголовке соединения и его (Е)-изомера (1,56 г). Продукт дополнительно очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,026 н. водная трифторуксусная кислота, 15/85, об./об.) с получением указанного в заголовке соединения в виде бесцветного твердого вещества (261 мг, общий выход: 4%).
1H ЯМР (500 МГц, ДМСО-d6) δ м.д.: 1,86-1,95 (1H, м), 2,10-2,22 (1H, м), 2,38 (3H, с), 3,09-3,63 (3H, м), 3,90 (1H, д, J=14,0), 5,50 (1H, шс), 6,26 (1H, с), 6,56 (1H, с), 7,73 (1H, с).
(b) (Z)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1H-пиразол-3(5)-ил]метилиден}пиперидина гидрохлорид
(Z)-4-(Ацетилсульфанил)-3-{[1H-пиразол-3(5)-ил]метилиден}пиперидина бис(гидротрифторацетат) (261 мг) обрабатывали 2-бром-2-(2-фторфенил)-1-циклопропилэтаноном (140 мг) и триэтиламином (230 мкл) в ацетонитриле (6 мл) способом, подобным описанному в примере 132(g), и неочищенный остаток, полученный обычным экстрагированием, очищали хроматографией на силикагеле, используя в качестве элюента смесь этилацетата и гексана (2:8-6:4), с получением свободного основания указанного в заголовке соединения в виде желтого масла (165 мг с примесями). Продукт дополнительно очищали препаративной ВЭЖХ [YMC-Pack ODS-A; YMC, элюент: ацетонитрил/водная уксусная кислота (0,5%), затем ацетонитрил/водный триэтиламин (0,5%) 60/40-65/35, об./об.]. Продукт экстрагировали из фракций с помощью этилацетата. Экстракт сушили над безводным сульфатом натрия и удаляли растворитель в вакууме с получением свободного основания указанного в заголовке соединения (134 мг). Основание растворяли в ацетонитриле (4 мл) и к раствору добавляли 4 н. раствор HCl в диоксане (400 мкл), растворитель и избыточный HCl удаляли в вакууме с получением указанного в заголовке гидрохлорида в виде бесцветного аморфного твердого вещества (155 мг, общий выход: 43%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,76-0,92 (2H, м), 0,98-1,10 (2H, м), 1,71-1,88 (1H, м), 2,11-2,27 (2H, м), 2,36 (3H, с), 2,52-2,64 (1H, м), 2,83 (1H, д, J=12,0), 3,02 (1H, д, J=12,0), 3,33 и 3,46 (общая 1H, каждый д, J=12,0), 4,71-4,80 (1H, м), 5,19 (1H, шс), 6,22-6,36 (2H, м), 7,06-7,58 (5H, м);
ИК (KBr, см-1): 1697, 1494.
(Пример 209) (Z)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1H-пиразол-3(5)-ил]метилиден}-4-сульфанилпиперидина гидрохлорид (соединение № 4-1)
(Z)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1H-пиразол-3(5)-ил]метилиден}пиперидину (266,8 мг) давали возможность взаимодействовать с HCl в этаноле (7 мл) способом, подобным описанному в примере 133. Реакционную смесь концентрировали в вакууме и остаток очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент:ацетонитрил/0,024 н. водная хлороводородная кислота, 20/80-25/75, об./об.) с получением указанного в заголовке соединения в виде бесцветного аморфного твердого вещества (170 мг, выход: 65%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,75-0,93 (2H, м), 0,98-1,11 (2H, м), 1,65-1,81 (1H, м), 2,11-2,34 (2H, м), 2,49-2,97 (2H, м), 3,15-3,27 (1H, м), 3,31-3,46 (1H, м), 4,73-4,83 (2H, м), 6,09 и 6,21 (общая 1H, каждый с), 6,36 и 6,39 (общая 1H, каждый с), 7,08-7,49 (4H, м), 7,53-7,60 (1H, м);
ИК (KBr, см-1): 2654, 1710, 1494.
(Пример 210) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({2-[3-(этоксикарбонил)пропил]-2H-тетразол-5-ил}метилиден)пиперидин (соединение № 2-1634)
(a) Этил 4-(5-формил-2H-тетразол-2-ил)бутаноат
К раствору [1(2)H-тетразол-5-ил]метанола (10 г) в ацетонитриле (80 мл) добавляли триэтиламин (27,7 мл) и этил 4-бромбутаноат (28,9 мл). Полученную смесь перемешивали при комнатной температуре в течение 24 часов, концентрировали в вакууме и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь этилацетата и метанола (19:1), с получением неочищенного этил 4-[5-(гидроксиметил)-2H-тетразол-2-ил]бутаноата в виде желтого масла (25,9 г).
К раствору указанного неочищенного продукта в ацетоне (100 мл) добавляли активный диоксид марганца (86,9 г) при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 15 часов, фильтровали и фильтрат концентрировали в вакууме. Остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (20:1, затем 10:1), с получением указанного в заголовке соединения в виде желтого масла (4,94 г, выход: 23%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,25-1,29 (3H, м), 2,24-2,31 (2H, м), 2,26-2,39 (2H, м), 4,11-4,17 (2H, м), 4,54 (2H, т, J=7,0), 8,64 (1H, с).
(b) (E)-3-({2-[3-(Этоксикарбонил)пропил]-2H-тетразол-5-ил}метилиден)-1-(трифенилметил)пиперидин-4-он
К раствору 1-(трифенилметил)пиперидин-4-она (7,63 г) в бензоле (200 мл) добавляли пирролидин (1,9 мл) и полученную смесь кипятили с обратным холодильником в течение 2,5 часов, удаляя воду с помощью аппарата Дина-Старка. Реакционную смесь охлаждали до комнатной температуры и добавляли к ней этил 4-(5-формил-2H-тетразол-2-ил)бутаноат (4,74 г). Полученную смесь кипятили с обратным холодильником в течение 3 часов, охлаждали и разбавляли водой. Продукт экстрагировали этилацетатом, растворитель сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь этилацетата и гексана (5:95-14:6), с получением указанного в заголовке соединения в виде светло-желтого масла (3,86 г, выход: 32%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,27 (3H, т, J=7,0), 2,11-2,27 (4H, м), 2,62-2,84 (4H, м), 3,74-3,86 (2H, м), 4,16 (2H, кв, J=7,0), 4,59 (2H, т, J=6,5), 7,11-7,33 (10H, м), 7,45-7,58 (6H, м).
(c) (E)-3-({2-[3-(Этоксикарбонил)пропил]-2H-тетразол-5-ил}метилиден)-1-(трифенилметил)пиперидин-4-ол
(E)-3-({2-[3-(Этоксикарбонил)пропил]-2H-тетразол-5-ил}метилиден)-1-(трифенилметил)пиперидин-4-он (3,93 г) восстанавливали борогидридом натрия (281 мг) в смешанном растворителе из дихлорметана (30 мл) и этанола (30 мл) способом, подобным описанному в примере 138(c), и неочищенный продукт, полученный по обычной методике экстрагирования, очищали хроматографией на силикагеле, используя в качестве элюента смесь этилацетата и гексана (1:9-7:3), с получением указанного в заголовке соединения в виде желтого масла (1,46 г, выход: 37%).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,27 (3H, т, J=7,0), 1,69-1,99 (3H, м), 2,08-2,33 (5H, м), 2,89-3,00 (1H, м), 4,09-4,20 (4H, м), 4,38-4,55 (2H, м), 6,72 (1H, с), 7,05-7,46 (15H, м).
(d) (E)-4-(Ацетилсульфанил)-3-({2-[3-(этоксикарбонил)пропил]-2H-тетразол-5-ил}метилиден)пиперидина бис(гидротрифторацетат)
При использовании (E)-3-({2-[3-(этоксикарбонил)пропил]-2H-тетразол-5-ил}метилиден)-1-(трифенилметил)пиперидин-4-ола (3,51 г) в качестве исходного материала способ, подобный описанному в примере 132(e), давал (E)-4-(ацетилсульфанил)-3-({2-[3-(этоксикарбонил)пропил]-2H-тетразол-5-ил}метилиден)-1-(трифенилметил)пиперидин в виде желтого масла (3,10 г). Полученное соединение обрабатывали трифторуксусной кислотой (1,2 мл) в смешанном растворителе из дихлорметана (36 мл) и этанола (4 мл) способом, подобным описанному в примере 132(f). Реакционную смесь концентрировали и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь этанола и дихлорметана (2:98-10:90), с получением указанного в заголовке соединения (1,41 г, выход: 46%) в виде коричневого масла.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,26 (3H, т, J=7,0), 2,11-2,19 (1H, м), 2,25-2,42 (7H, м), 2,49-2,60 (1H, м), 3,22-3,32 (1H, м), 3,45-3,53 (1H, м), 4,03 (1H, д, J=14,0), 4,14 (2H, кв, J=7,0), 4,61-4,72 (3H, м), 5,20 (1H, д, J=14,0), 6,89 (1H, с).
(e) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({2-[3-(этоксикарбонил)пропил]-2H-тетразол-5-ил}метилиден)пиперидин
(E)-4-(Ацетилсульфанил)-3-({2-[3-(этоксикарбонил)пропил]-2H-тетразол-5-ил}метилиден)пиперидина бис(гидротрифторацетат) (1,51 г) обрабатывали 2-бром-2-(2-фторфенил)-1-циклопропилэтаноном (1,01 г) и триэтиламином (1,41 мл) в ацетонитриле (25 мл) способом, подобным описанному в примере 132(g), и неочищенные продукты, экстрагированные по обычной методике, очищали хроматографией на силикагеле, используя в качестве элюента смесь этилацетата и гексана (1:4-2:3), с получением указанного в заголовке соединения в виде светло-желтого масла (1,13 г, выход: 66%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,68-1,0 6 (4H, м), 1,27 (3H, т, J=7,0), 1,86-1,97 (1H, м), 2,15-2,39 (9H, м), 2,46-2,71 (1H, м), 2,77-2,86 (1H, м), 3,42 и 3,50 (общая 1H, каждый д, J=13,5),4,15 (2H, кв, J=7,0), 4,25 и 4,33 (общая 1H, каждый д, J=13,5), 4,48-4,66 (3H, м), 4,75 и 4,7 6 (общая 1H, каждый с), 6,66 (1H, с), 7,04-7,19 (2H, м), 7,25-7,43 (2H, м).
(Пример 211) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({2-[3-(этоксикарбонил)пропил]-2H-тетразол-5-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (соединение № 2-1633)
(E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({2-[3-(этоксикарбонил)пропил]-2H-тетразол-5-ил}метилиден}пиперидин (1,08 г) обрабатывали хлороводородом в этаноле (20 мл) способом, подобным описанному в примере 133. Реакционную смесь концентрировали в вакууме и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь этанола и дихлорметана (2:98-10:90), с получением указанного в заголовке соединения в виде бледно-желтого аморфного твердого вещества (976 мг, выход: 91%).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,69-1,09 (4H, м), 1,27 (3H, т, J=7,0), 1,81-1,93 (1H, м), 2,08-2,43 (6H, м), 2,61-3,01 (2H, м), 3,81-4,22 (5H, м), 4,51-4,66 (2H, м), 4,81 (1H, шс), 6,66 (1H, с), 7,01-7,19 (2H, м), 7,23-7,48 (2H, м);
ИК (KBr, см-1): 2609, 1730, 1494.
(Пример 212) (E)-3-{[2-(3-Карбоксипропил)-2H-тетразол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-1603)
(E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({2-[3-(этоксикарбонил)пропил]-2H-тетразол-5-ил}метилиден}-4-сульфанилпиперидина гидрохлорид (854 мг) обрабатывали 3 н. водным раствором хлороводородной кислоты (16 мл) при 50°C в течение одного часа способом, подобным описанному в примере 134. Реакционную смесь концентрировали в вакууме и остаток очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. водная хлороводородная кислота, 30/70-35/65, об./об.) с получением указанного в заголовке соединения в виде бесцветного аморфного твердого вещества (801 мг, выход: 99%).
1H ЯМР (500 МГц, пиримидин-d5) δ м.д.: 0,64-0,79 (2H, м), 0,93-1,19 (2H, м), 1,85-1,97 (1H, м), 2,29-2,51 (4H, м), 2,56-2,66 (2H, м), 2,72-2,93 (2H, м), 2,93-3,09 (1H, м), 4,03-4,11 (1H, м), 4,20 и 4,34 (общая 1H, каждый д, J=13,0), 4,75-4,88 (2H, м), 5,02 (1H, с), 6,96 (1H, с), 7,16-7,27 (2H, м), 7,30-7,40 (1H, м), 7,65-7,74 (1H, м);
ИК (KBr, см-1): 2622, 1712, 1494.
(Пример 213) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[3-(этоксикарбонил)пропил]-1H-тетразол-5-ил}метилиден)пиперидин (соединение № 2-1570)
(a) (E)-4-(трет-Бутилдиметилсилилокси)-3-(цианометилиден)-1-(трифенилметил)пиперидин
К раствору (E)-4-(трет-бутилдиметилсилилокси)-3-(формилметилиден)-1-(трифенилметил)пиперидина (пример 36(b), 46,81 г) в тетрагидрофуране (150 мл) добавляли гидроксид натрия (9,0 г) в воде (150 мл) и гидроксиламингидрохлорид (7,8 г). После перемешивания полученной смеси при комнатной температуре в течение 3 часов добавляли дополнительный гидроксиламингидрохлорид (2 г). Полученную смесь перемешивали при комнатной температуре еще 1,5 часа и добавляли 50% водный раствор гидроксиламина (4,0 мл). Полученную смесь перемешивали при комнатной температуре еще 1 час и добавляли дополнительный 50% водный раствор гидроксиламина (4,0 мл). Полученную смесь перемешивали при комнатной температуре в течение 40 минут, удаляли в вакууме растворитель и остаток экстрагировали этилацетатом. Органический слой промывали последовательно водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением неочищенного оксима в виде желтого масла.
К раствору полученного выше соединения в ацетонитриле (300 мл) добавляли трифенилфосфин (25,0 г), триэтиламин (19,5 мл) и тетрахлорид углерода (14,9 мл). Полученную смесь перемешивали при комнатной температуре в течение 6 часов и распределяли между этилацетатом и водой. Отделенный органический слой промывали последовательно водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Удаляли в вакууме растворитель и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана и этилацетата (15:1), с получением указанного в заголовке соединения в виде светло-желтых порошкообразных кристаллов (28,8 г, выход: 62%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,03 (6H, с), 0,90 (9H, с), 1,8 9-1,98 (4H, м), 3,13-3,17 (1H, м), 3,87-3,92 (1H, м), 4,16-4,20 (1H, м), 5,59 (1H, с), 7,17-7,20 (4H, м), 7,26-7,31 (5H, м), 7,47 (6H, шс).
(b) (E)-4-(трет-Бутилдиметилсилилокси)-3-{[1(2)H-тетразол-5-ил]метилиден}-1-(трифенилметил)пиперидин
К раствору (E)-4-(трет-бутилдиметилсилилокси)-3-(цианометилиден)-1-(трифенилметил)пиперидина (28,8 г) в 1,2-диметоксиэтане (300 мл) добавляли азид трибутилолова (30,0 г). Полученную смесь кипятили с обратным холодильником в течение 2 суток, охлаждали до комнатной температуры и добавляли дополнительный азид трибутилолова (10,0 г). Полученную смесь кипятили с обратным холодильником в течение еще одних суток, охлаждали до комнатной температуры и удаляли в вакууме растворитель. Остаток распределяли между этилацетатом и водой. Полученный органический слой промывали последовательно водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Удаляли в вакууме растворитель и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана и этилацетата (15:1-10:1-1:1) в качестве элюентов с получением указанного в заголовке соединения в виде светло-желтого аморфного твердого вещества (7,63 г, выход 24%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,03 и 0,05 (общая 6H, каждый с), 0,92 (9H, с), 1,36-1,41 (2H, м), 1,65-1,68 (2H, м), 1,95-1,99 (1H, м), 3,08 (1H, шс), 4,04-4,07 (1H, м), 6,68 (1H, с), 7,10 (10H, шс), 7,84 (6H, шс).
(c) (E)-4-(трет-Бутилдиметилсилилокси)-3-({1-[3-этоксикарбонил]пропил]-1H-тетразол-5-ил}метилиден)-1-(трифенилметил)пиперидин
Смесь (E)-4-(трет-бутилдиметилсилилокси)-3-{[1(2)H-тетразол-5-ил]метилиден}-1-(трифенилметил)пиперидина (7,63 г), ацетонитрила (100 мл), N,N-диметилформамида (20 мл), триэтиламина (3,8 мл) и этил 4-бромбутилата (2 мл) перемешивали при комнатной температуре в течение 21,5 часа. К полученной реакционной смеси добавляли последовательно 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU) (2,1 мл) и этил 4-бромбутилат (2 мл). Полученную смесь перемешивали при комнатной температуре в течение одного часа и удаляли в вакууме растворитель. Остаток распределяли между этилацетатом и водой. Отделенный органический слой промывали последовательно водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Удаляли в вакууме растворитель и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана и этилацетата (4:1), с получением указанного в заголовке соединения в виде желтого аморфного твердого вещества (980 мг, выход 11%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,04 и 0,08 (общая 6H, каждый с), 0,95 (9H, с), 1,28 (3H, т, J=7,0), 1,63-1,69 (2H, м), 1,96-2,03 (3H, м), 2,27-2,84 (2H, м), 2,47 (2H, т, J=7,0), 3,12-3,15 (1H, м), 4,06-4,10 (1H, м), 4,18 (2H, кв, J=7,0), 4,45-4,50 (2H, м), 6,50 (1H, с), 7,14 (10H, шс), 7,86-7,87 (5H, м).
(d) (E)-3-({1-[3-Этоксикарбонил]пропил]-1H-тетразол-5-ил}метилиден)-1-(трифенилметил)пиперидин-4-ол
К раствору (E)-4-(трет-бутилдиметилсилилокси)-3-({1-[3-этоксикарбонил]пропил]-1H-тетразол-5-ил}метилиден)-1-(трифенилметил)пиперидина (980 мг) в тетрагидрофуране (15 мл) добавляли 75% водный тетрабутиламмонийфторид (617 мг). Полученную смесь перемешивали при комнатной температуре в течение 30 минут, разбавляли этилацетатом и промывали последовательно водой и насыщенным водным раствором хлорида натрия. Органический растворитель сушили над безводным сульфатом натрия и удаляли в вакууме. Остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь этилацетата и гексана (1:9-10:0), с получением указанного в заголовке соединения в виде бесцветного аморфного твердого вещества (716 мг, выход 89%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,29 (3H, т, J=7,0), 1,72-1,83 (1H, м), 1,8 6-2,00 (1H, м), 2,13-2,34 (4H, м), 2,44-2,51 (2H, м), 3,04-3,13 (1H, м), 4,20 (2H, кв, J=7,0), 4,39-4,61 (4H, м), 6,52 (1H, с), 7,06-7,20 (9H, м), 7,30-7,40 (6H, м).
(e) (E)-4-(Ацетилсульфанил)-3-({1-[3-этоксикарбонил]пропил]-1H-тетразол-5-ил}метилиден)пиперидина трифторацетат
К раствору (E)-3-({1-[3-этоксикарбонил]пропил]-1H-тетразол-5-ил}метилиден)-1-(трифенилметил)пиперидин-4-ола (715,6 мг) в N,N-диметилформамиде (10 мл) добавляли тиоуксусную кислоту (950 мкл) и динеопентилацеталь N,N-диметилформамида (3,7 мл). Полученную смесь перемешивали при комнатной температуре в течение одного часа. Затем еще добавляли тиоуксусную кислоту (950 мкл) и динеопентилацеталь N,N-диметилформамида (3,7 мл) и реакционную смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь распределяли между этилацетатом и водой. Полученный органический слой промывали последовательно водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Удаляли в вакууме растворитель и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь этилацетата и гексана (1:9-3:7), с получением неочищенного (E)-4-(ацетилсульфанил)-3-({1-[3-этоксикарбонил]пропил]-1H-тетразол-5-ил}метилиден)-1-(трифенилметил)пиперидина (419 мг) в виде желтого масла.
К раствору полученного выше продукта в смешанном растворителе из дихлорметана и этанола (9:1, 7 мл) добавляли трифторуксусную кислоту (160 мкл) при 0°C. Полученную смесь перемешивали при 0°C в течение 15 минут и к реакционной смеси добавляли дихлорметан (33 мл). Раствор подвергали хроматографии на силикагеле, используя в качестве элюента смесь этанола и дихлорметана (2:98-10:90), с получением указанного в заголовке соединения в виде желтого масла (220 мг, общий выход: 36%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,27 (3H, т, J=7,0), 2,12-2,27 (3H, м), 2,36-2,45 (5H, м), 2,58-2,71 (1H, м), 3,17-3,28 (1H, м), 3,51-3,60 (1H, м), 3,98 (1H, д, J=15,0), 4,16 (2H, кв, J=7,0), 4,43 (2H, т, J=7,0), 4,66 (1H, шс), 5,26 (1H, д, J=15,0), 6,71 (1H, с).
(f) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[3-(этоксикарбонил)пропил]-1H-тетразол-5-ил}метилиден)пиперидин
К раствору (E)-4-(ацетилсульфанил)-3-({1-[3-этоксикарбонил]пропил]-1H-тетразол-5-ил}метилиден)пиперидина трифторацетата (220 мг) в ацетонитриле (5 мл) добавляли 2-бром-2-(2-фторфенил)-1-циклопропилэтанон (190 мг) и триэтиламин (200 мкл) при 0°C. Полученную смесь перемешивали при 0°C в течение 20 минут, затем при комнатной температуре в течение одного часа. Реакционную смесь распределяли между этилацетатом и водой. Отделенный органический слой промывали последовательно водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Удаляли в вакууме растворитель и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь этилацетата и гексана (1:4-1:0) и затем смесь этанола и дихлорметана (1:19), с получением указанного в заголовке соединения в виде бесцветного масла (139 мг, выход: 56%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,70-1,09 (4H, м), 1,27 и 1,28 (общая 3H, каждый т, J=7,0), 1,85-1,98 (1H, м), 2,01-2,44 (9H, м), 2,67-2,99 (2H, м), 3,35 и 3,48 (общая 1H, каждый д, J=13,5), 4,07-4,58 (6H, м), 4,79 и 4,80 (общая 1H, каждый с), 6,39 и 6,40 (общая 1H, каждый с), 7,02-7,21 (2H, м), 7,27-7,43 (2H, м).
(Пример 214) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[3-(этоксикарбонил)пропил]-1H-тетразол-5-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (соединение № 2-1569)
Хлороводород пропускали через раствор (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[3-(этоксикарбонил)пропил]-1H-тетразол-5-ил}метилиден)пиперидина (139 мг) в этаноле (4 мл) при 0°C. Смесь перемешивали в герметически закрытом состоянии при комнатной температуре в течение 3,5 часов. Растворитель и избыточное количество хлороводорода удаляли в вакууме и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь этанола и дихлорметана (2:98-12:88), с получением указанного в заголовке соединения в виде бледно-желтого аморфного твердого вещества (136 мг, выход 99%).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,72-0,84 (2H, м), 0,93-1,04 (2H, м), 1,27 (3H, т, J=7,0), 1,81-1,93 (1H, м), 2,03-2,10 (1H, м), 2,18-2,43 (5H, м), 2,53-3,07 (2H, м), 3,56-4,03 (2H, м), 4,12-4,23 (3H, м), 4,41 (2H, т, J=7,0), 4,79, и 4,80 (общая 1Н, каждый с), 6,44 и 6,51 (общая 1H, каждый с), 7,03-7,19 (2H, м), 7,28-7,38 (2H, м).
(Пример 215) (E)-3-{[1-(3-Карбоксипропил)-1H-тетразол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-1537)
Раствор (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[3-(этоксикарбонил)пропил]-1H-тетразол-5-ил}метилиден)-4-сульфанилпиперидина гидрохлорида (134 мг) в 3 н. HCl (4 мл) перемешивали при 50°C в течение 2 часов. Растворитель и избыточный HCl удаляли в вакууме и остаток очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. водный раствор HCl, 30/70, об./об.) с получением указанного в заголовке соединения в виде бесцветного аморфного твердого вещества (91 мг, выход: 72%).
1H ЯМР (500 МГц, C5D5N) δ м.д.: 0,67-0,78 (2H, м), 0,95-1,04 (1H, м), 1,09-1,19 (1H, м), 1,88-1,96 (1H, м), 2,28-2,46 (4H, м), 2,58 (2H, т, J=7,0), 2,66-2,86 (1H, м), 2,89-3,13 (1H, м), 4,02-4,14 (1H, м), 4,21 и 4,28 (общая 1H, каждый д, J=13,0), 4,43 (1H, д, J=13,0), 4,63 (2H, т, J=7,0), 5,03 и 5,04 (общая 1H, каждый с), 6,88 и 6,91 (общая 1H, каждый с), 7,13-7,35 (3H, м), 7,62-7,70 (1H, м);
ИК (KBr, см-1): 2557, 1713, 1495.
(Пример 216) (E)-3-{[1-(2-Аминоэтил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина дигидрохлорид (соединение № 2-1661)
(a) (E)-3-({1-[2-(трет-Бутоксикарбониламино)этил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидин-4-он
К раствору 2-(трет-бутоксикарбониламино)этанола (5,0 мл) в дихлорметане (100 мл) добавляли триэтиламин (13,5 мл) и метансульфоновый ангидрид (8,35 г). Полученную смесь перемешивали при 0°C в течение 45 минут, добавляли к смеси воду и продукт экстрагировали дихлорметаном. Отделенный органический слой сушили над безводным сульфатом натрия и удаляли в вакууме растворитель с получением неочищенного 2-(трет-бутоксикарбониламино)этилметансульфоната в виде коричневого масла.
К раствору полученного выше продукта в N,N-диметилформамиде (100 мл) добавляли (E)-3-{[1H-пиразол-3(5)-ил]метилиден}-1-(трифенилметил)пиперидин-4-он (пример 73-(a), 6,85 г) и 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU) (5,0 мл). После перемешивания полученной смеси при 60°C в течение 6 часов добавляли DBU (2,5 мл) и тетрабутиламмонийиодид (1,20 г) и смесь перемешивали в течение еще 4,5 часов. Реакционную смесь охлаждали до комнатной температуры, разбавляли этилацетатом и органический слой промывали последовательно водой и насыщенным водным раствором хлорида натрия. Удаляли в вакууме растворитель и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь этилацетата и гексана (2:8-4:6), с получением указанного в заголовке соединения в виде бледно-желтого аморфного твердого вещества (6,41 г, выход от исходного производного пиразола: 35%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,44 (9H, с), 2,59-2,80 (6H, м), 3,29-3,72 (2H, м), 4,06-4,17 (2H, м), 6,20 (1H, с), 7,11-7,61 (17H, м).
(b) (E)-3-({1-[2-(трет-Бутоксикарбониламино)этил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидин-4-ол
К раствору (E)-3-({1-[2-(трет-бутоксикарбониламино)этил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидин-4-она (6,41 г) в смешанном растворителе из дихлорметана (40 мл) и метанола (40 мл) добавляли борогидрид натрия (436 мг) при 0°C. После перемешивания полученной смеси при 0°C в течение 30 минут к смеси добавляли воду для прекращения реакции и продукт экстрагировали этилацетатом. Органический слой промывали водой и насыщенным водным раствором хлорида натрия последовательно и сушили над безводным сульфатом натрия. Удаляли в вакууме растворитель и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь этилацетата и гексана (3:7-7:3), с получением указанного в заголовке соединения в виде бесцветного твердого вещества (5,35 г, выход: 84%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,46 (9H, с), 1,83-2,21 (4H, м), 2,55-2,80 (1H, м), 3,25-3,36 (2H, м), 3,96-4,21 (4H, м), 6,08 (1H, с), 6,50 (1H, с), 7,05-7,47 (16H, м).
(c) (E)-4-(Ацетилсульфанил)-3-({1-[2-(трет-бутоксикарбониламино)этил]-1H-пиразол-3-ил}метилиден)пиперидина бис(гидротрифторацетат)
К раствору (E)-3-({1-[2-(трет-бутоксикарбониламино)этил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидин-4-ола (3,67 г) в N,N-диметилформамиде (50 мл) добавляли тиоуксусную кислоту (4,6 мл) и динеопентилацеталь N,N-диметилформамида (18 мл). Полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли этилацетатом. Органический слой промывали водой и насыщенным водным раствором хлорида натрия последовательно и сушили над безводным сульфатом натрия. Удаляли в вакууме растворитель и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь этилацетата и гексана (1:9-1:1), с получением неочищенного (E)-4-(ацетилсульфанил)-3-({1-[2-(трет-бутоксикарбониламино)этил]-1H-пиразол-3-ил}метилиден)-1-(трифенилметил)пиперидина (4,29 г) в виде коричневого масла. К раствору полученного масла в дихлорметане (50 мл) добавляли трифторуксусную кислоту (1,5 мл) при 0°C. Полученную смесь перемешивали при комнатной температуре в течение 30 минут и удаляли растворитель в вакууме. Остаток очищали два раза хроматографией на силикагеле, используя в качестве элюента смесь метанола и дихлорметана (1:99-7:93), с получением указанного в заголовке соединения в виде коричневого масла (1,46 г, общий выход: 37%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,41 (9H, с), 2,03-2,11 (1H, м), 2,36 (3H, с), 2,37-2,49 (1H, м), 3,13-3,57 (4H, м), 3,76 (1H, д, J=14,5), 4,08-4,25 (2H, м), 4,53-4,62 (1H, м), 5,13 (1H, д, J=14,5), 6,18 (1H, с), 6,63 (1H, с), 7,29 (1H, с).
(d) (E)-4-(Ацетилсульфанил)-3-({1-[2-(трет-бутоксикарбониламино)этил]-1H-пиразол-3-ил}метилиден)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидин
К раствору (E)-4-(ацетилсульфанил)-3-({1-[2-(трет-бутоксикарбониламино)этил]-1H-пиразол-3-ил}метилиден)пиперидина бис(гидротрифторацетата) (619 мг) в ацетонитриле (9 мл) добавляли 2-бром-2-(2-фторфенил)-1-циклопропилэтанон (392 мг) и триэтиламин (430 мкл) и полученную смесь перемешивали при 0°C в течение 2 часов. Реакционную смесь разбавляли этилацетатом. Органический слой промывали водой и насыщенным водным раствором хлорида натрия последовательно и сушили над безводным сульфатом натрия. Удаляли в вакууме растворитель и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь этилацетата и гексана (3:7-6:4), с получением указанного в заголовке соединения в виде желтого аморфного твердого вещества (478 мг, выход: 84%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,63-1,02 (4H, м), 1,44 (9H, с), 1,82-1,93 (1H, м), 2,06-2,28 (2H, м), 2,29 и 2,31 (общая 3H, каждый с), 2,42-2,63 (1H, м), 2,66-2,86 (1H, м), 2,98 и 3,31 (общая 1H, каждый д, J=13,5), 3,42-3,59 (2H, м), 4,04-4,43 (3H, м), 4,46-4,55 (1H, м), 4,73 и 4,77 (общая 1H, каждый с), 6,07 и 6,13 (общая 1H, каждый с), 6,49 (1H, с), 7,03-7,44 (5H, м).
(e) (E)-3-{[1-(2-Аминоэтил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина дигидрохлорид
Раствор (E)-4-(ацетилсульфанил)-3-({1-[2-(трет-бутоксикарбониламино)этил]-1H-пиразол-3-ил}метилиден)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина (479 мг) в 4 н. растворе хлороводорода (в диоксане, 8 мл) перемешивали при комнатной температуре в течение одного часа. Растворитель и хлороводород удаляли в вакууме и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь метанола и дихлорметана (2:98-20:80), с получением (E)-4-(ацетилсульфанил)-3-{[1-(2-аминоэтил)-1H-пиразол-3-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина дигидрохлорида в виде бледно-коричневого аморфного твердого вещества (450 мг). Часть полученного соединения (104,2 мг) растворяли в этаноле (4 мл) и через полученный раствор пропускали газообразный хлороводород при перемешивании при 0°C и полученную смесь перемешивали в герметически закрытом состоянии при комнатной температуре в течение 5 часов. Удаляли в вакууме растворитель и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь этанола и дихлорметана (5:95-25:75), с получением указанного в заголовке соединения в виде бесцветного аморфного твердого вещества (86,3 мг, общий выход: 90%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,65-1,02 (4H, м), 1,66-1,72 (1H, м), 2,17-2,38 (2H, м), 2,59-2,92 (2H, м), 3,05-3,15 (2H, м), 3,56 и 3,65 (общая 1H, каждый д, J=12,5), 3,80-3,98 (2H, м), 4,01-4,13 (2H, м), 4,74 и 4,76 (общая 1H, каждый с), 6,07 и 6,16 (общая 1H, каждый с), 6,46 и 6,47 (общая 1H, каждый с), 7,03-7,46 (5H, м);
ИК (KBr, см-1): 2556, 1710, 1494.
(Пример 217) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[4-(этоксикарбонил)бутил]-1H-1,2,3-триазол-4-ил}метилиден)пиперидин (соединение № 2-1190)
(a) Этил 5-(4-формил-1H-1,2,3-триазол-1-ил)пентаноат и этил 5-(5-формил-1H-1,2,3-триазол-1-ил)пентаноат
К раствору этил 5-азидопентаноата (32,93 г) в толуоле (250 мл) добавляли пропаргиловый спирт (10,5 мл). Полученную смесь кипятили с обратным холодильником в течение 8 часов, охлаждали до комнатной температуры и концентрировали в вакууме с получением бледно-желтого масла (40,29 г). Поскольку в неочищенном продукте все еще оставался 5-азидопентаноат, продукт растворяли в толуоле (250 мл) и к полученной смеси добавляли пропаргиловый спирт (4,2 мл). Затем полученную смесь кипятили с обратным холодильником в течение 2 часов. После охлаждения смеси до комнатной температуры реакционную смесь концентрировали в вакууме с получением неочищенной смеси этил 5-[4-(гидроксиметил)-1H-1,2,3-триазол-1-ил)пентаноата и этил 5-[5-(5-гидроксиметил)-1H-1,2,3-триазол-1-ил)пентаноата в виде бледно-желтого масла (42,81 г).
К раствору указанного выше продукта (37,27 г) в дихлорметане (300 мл) добавляли активный диоксид марганца. Полученную смесь перемешивали при комнатной температуре в течение 18 часов, фильтровали и фильтрат упаривали в вакууме. Остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь этилацетата и гексана (2:8-5:5), с получением смеси двух указанных в заголовке соединений в виде бледно-желтого масла (22,73 г, общий выход: 62%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,23-1,29 (3H, м), 1,62-1,73 (2H, м), 1,90-2,07 (2H, м), 2,35 и 2,37 (общая 2H, каждый т, J=7:0), 4,12 и 4,14 (общая 2H, каждый кв, J=7,0), 4,47 и 4,74 (общая 2H, каждый т, J=7,0), 8,13 и 8,26 (общая 1H, каждый с), 10,01 и 10,15 (общая 1H, каждый с).
(b) (E)-3-({1-[4-(Этоксикарбонил)бутил]-1H-1,2,3-триазол-4-ил}метилиден)-1-(трифенилметил)пиперидин-4-он и (E)-3-({1-[4-(этоксикарбонил)бутил]-1H-1,2,3-триазол-5-ил}метилиден)-1-(трифенилметил)пиперидин-4-он
Региоизомерную смесь двух альдегидов (22,73 г), полученных так, как описано выше, обрабатывали 1-(трифенилметил)пиперидин-4-оном (34,23 г) и пирролидином (8,4 мл) в бензоле (500 мл) способом, подобным описанному в примере 132(c). Неочищенные продукты, экстрагированные обычным способом, очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана и этилацетата (2:8-6:4), и кристаллизацией (кристаллизацией получали только менее полярный изомер, растворитель: смешанный растворитель из этилацетата и гексана) с получением двух региоизомеров.
Менее полярный изомер: (E)-3-({1-[4-(этоксикарбонил)бутил]-1H-1,2,3-триазол-5-ил}метилиден)-1-(трифенилметил)пиперидин-4-он (4,87 г, выход: 9%, бесцветные кристаллические твердые частицы).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,25 (3H, т, J=7,5), 1,60-1,70 (2H, м), 1,88-2,00 (2H, м), 2,35 (2H, т, J=7,5), 2,65-2,85 (4H, м), 3,31-3,44 (2H, м), 4,13 (2H, кв, J=7,5), 4,44 (2H, т, J=7,5), 7,11-7,56 (17H, м).
Более полярный изомер: (E)-3-({1-[4-(этоксикарбонил)бутил]-1H-1,2,3-триазол-4-ил}метилиден)-1-(трифенилметил)пиперидин-4-он в виде желтых аморфных твердых частиц (18,87 г, выход: 34%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,26 (3H, т, J=7,5), 1,53-1,64 (2H, м), 1,85-1,96 (2H, м), 2,33 (2H, т, J=7,0), 2,62-2,80 (4H, м), 3,58-3,70 (2H, м), 4,14 (2H, кв, J=7,5), 4,32 (2H, т, J=7,0), 7,12-7,57 (17H, м).
(c) (E)-3-({1-[4-(Этоксикарбонил)бутил]-1H-1,2,3-триазол-4-ил}метилиден)-1-(трифенилметил)пиперидин-4-ол
(E)-3-({1-[4-(Этоксикарбонил)бутил]-1H-1,2,3-триазол-4-ил}метилиден)-1-(трифенилметил)пиперидин-4-ону (18,87 г) давали возможность взаимодействовать с борогидридом натрия (1,32 г) способом, подобным описанному в примере 132(d). Неочищенный продукт, полученный экстрагированием, очищали хроматографией на силикагеле, используя в качестве элюента смесь этилацетата и гексана (4:6-6:4), а затем смесь метанола и дихлорметана (5:9-10:90), с получением указанного в заголовке соединения в виде бледно-коричневого аморфного твердого вещества (18,59 г).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,26 (3H, т, J=7,0), 1,57-1,68 (2H, м), 1,80-1,96 (3H, м), 2,06-2,21 (1H, м), 2,34 (2H, т, J=7,0), 2,58-2,84 (2H, м), 3,53-3,69 (1H, м), 4,07-4,28 (6H, м), 6,63 (1H, с), 7,07-7,47 (16H, м).
(d) (E)-4-(Ацетилсульфанил)-3-({1-[4-(этоксикарбонил)бутил]-1H-1,2,3-триазол-4-ил}метилиден)пиперидина гидротрифторацетат
Используя (E)-3-({1-[4-(этоксикарбонил)бутил]-1H-1,2,3-триазол-4-ил}метилиден)-1-(трифенилметил)пиперидин-4-ол (18,59 г) в качестве исходного материала, осуществляли тиоацетилирование и удаление трифенилметильной группы способом, подобным описанному в примерах 132(e) и (f). Неочищенный продукт очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,026 н. водная трифторуксусная кислота, 30/70, об./об.) с получением указанного в заголовке соединения (2,29 г, выход: 23%) в виде коричневого масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,25 (3H, т, J=7,0), 1,56-1,69 (2H, м), 1,87-2,00 (2H, м), 2,09-2,21 (1H, м), 2,31-2,59 (6H, м), 3,2 6-3,32 (1H, м), 3,47-3,60 (1H, м), 3,96 (1H, д, J=14,5), 4,13 (2H, кв, J=7,0), 4,37 (2H, т, J=6,5), 4,60 (1H, шс), 5,07 (1H, д, J=14,5), 6,71 (1H, с), 7,62 (1H, с).
(e) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[4-(этоксикарбонил)бутил]-1H-1,2,3-триазол-4-ил}метилиден)пиперидин
Способом, подобным описанному в примере 132(g), (E)-4-(ацетилсульфанил)-({1-[4-(этоксикарбонил)бутил]-1H-1,2,3-триазол-4-ил}метилиден)пиперидина гидротрифторацетат (2,29 г) подвергали взаимодействию с 2-бром-2-(2-фторфенил)-1-циклопропилэтаноном (1,59 г). Неочищенный экстракт очищали хроматографией на силикагеле, используя в качестве элюента смесь этилацетата и гексана (35:65-65:35), с получением указанного в заголовке соединения в виде желтого масла (1,58 г, выход: 76%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,68-1,05 (4H, м), 1,26 (3H, т, J=7,5), 1,57-1,71 (2H, м), 1,82-2,00 (3H, м), 2,08-2,16 (1H, м), 2,17-2,39 (6H, м), 2,42-2,67 (1H, м), 2,69-2,84 (1H, м), 3,13 и 3,24 (общая 1H, каждый д, J=13,5), 3,88 и 3,96 (общая 1H, каждый д, J=13,5), 4,14 (2H, кв, J=7,5), 4,31 и 4,34 (общая 2H, каждый т, J=7,0), 4,43-4,52 (1H, м), 4,76 и 4,78 (общая 1H, каждый с), 6,57 и 6,58 (общая 1H, каждый с), 7,05-7,20 (2H, м), 7,27-7,44 (2H, м), 7,50 и 7,59 (общая 1H, каждый с).
(Пример 218) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[4-(этоксикарбонил)бутил]-1H-1,2,3-триазол-4-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (соединение № 2-1189)
Способом, подобным описанному в примере 133, (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[4-(этоксикарбонил)бутил]-1H-1,2,3-триазол-4-ил}метилиден)пиперидина (1,32 г) обрабатывали хлороводородом. Неочищенный продукт очищали хроматографией на силикагеле, используя в качестве элюента смесь метанола и дихлорметана (1:99-10:90), с получением указанного в заголовке соединения в виде бледно-желтого аморфного твердого вещества (1,44 г, выход: 92%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,68-1,04 (4H, м), 1,26 (3H, т, J=7,0), 1,61-1,72 (2H, м), 1,88-2,15 (3H, м), 2,19-2,40 (4H, м), 2,56-2,90 (2H, м), 3,50-3,70 (2H, м), 3,87-3,95 (1H, м), 4,14 (2H, кв, J=7,0), 4,32 и 4,35 (общая 2H, каждый т, J=7,0), 4,80 (1H, шс), 6,58 (1H, с), 7,06-7,21 (2H, м), 7,28-7,45 (2H, м), 7,54 и 7,63 (общая 1H, каждый с);
ИК (KBr, см-1): 2515, 1726, 1495.
(Пример 219) (E)-3-{[1-(4-Карбоксибутил)-1H-1,2,3-триазол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-1157)
Способом, подобным описанному в примере 134, (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[4-(этоксикарбонил)бутил]-1H-1,2,3-триазол-4-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (1,32 г) обрабатывали 3 н. раствором HCl. Неочищенный продукт очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. HCl, 20/80, об./об.) с получением указанного в заголовке соединения в виде бесцветного аморфного твердого вещества (1,22 г, выход: 97%).
1H ЯМР (500 МГц, пиридин-d5) δ м.д.: 0,65-0,78 (2H, м), 0,95-1,05 (1H, м), 1,07-1,19 (1H, м), 1,72-2,05 (5H, м), 2,28-2,47 (2H, м), 2,53 (2H, т, J=7,0), 2,63-2,80 (1H, м), 2,88-3,08 (1H, м), 3,99-4,11 (2H, м), 4,22-4,45 (3H, м), 5,00 и 5,01 (общая 1H, каждый с), 6,83 и 6,87 (общая 1H, каждый с), 7,17-7,28 (2H, м), 7,29-7,40 (1H, м), 7,65-7,75 (1H, м), 7,85 и 7,94 (общая 1H, каждый с);
ИК (KBr, см-1): 2612, 1711, 1494.
(Пример 220) (E)-4-(Ацетилсульфанил)-3-{[1-(4-карбоксибутил)-1H-1,2,3-триазол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидин (соединение № 2-1158)
Способом, подобным описанному в примере 183, (E)-3-{[1-(4-карбоксибутил)-1H-1,2,3-триазол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (190 мг) обрабатывали уксусным ангидридом. Неочищенный продукт, экстрагированный по традиционной методике, очищали хроматографией на силикагеле, используя в качестве элюента смесь метанола и дихлорметана (1:99-7:93), с получением указанного в заголовке соединения в виде бесцветного масла (190 мг, выход: 99%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,67-1,05 (4H, м), 1,60-1,73 (2H, м), 1,82-2,13 (4H, м), 2,18-2,34 (4H, м), 2,40 (2H, т, J=7,0), 2,44-2,84 (2H, м), 3,13 и 3,26 (общая 1H, каждый д, J=12,5), 3,88 и 3,91 (общая 1H, каждый д, J=12,5), 4,33 и 4,36 (общая 2H, каждый т, J=7,0), 4,46 и 4,48 (общая 1H, каждый т, J=4,5), 4,80 и 4,83 (общая 1H, каждый с), 6,59 и 6,60 (общая 1H, каждый с), 7,06-7,20 (2H, м), 7,30-7,42 (2H, м), 7,56, и 7,63 (общая 1H, каждый с).
(Пример 221) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[4-(N-метоксикарбамоил)бутил]-1H-1,2,3-триазол-4-ил}метилиден)пиперидин (соединение № 2-1694)
Используя (E)-4-(ацетилсульфанил)-3-{[1-(4-карбоксибутил)-1H-1,2,3-триазол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидин (478 мг) в качестве исходного материала, проводили реакцию, подобную описанной в примере 191. Экстрагированный обычным способом неочищенный продукт очищали хроматографией на силикагеле, используя в качестве элюента смесь метанола и дихлорметана (1:99-5:95), с получением указанного в заголовке соединения (154,4 мг, выход: 31%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,68-1,05 (4H, м), 1,62-2,34 (12H, м), 2,41-2,83 (2H, м), 3,14-3,28 (1H, м), 3,74 (3H, с), 3,90 и 3,97 (общая 1H, каждый д, J=13,0), 4,33 и 4,35 (общая 2H, каждый т, J=6,5), 4,47 и 4,48 (общая 1H, каждый т, J=5,0), 4,76 и 4,80 (общая 1H, каждый с), 6,57 и 6,58 (общая 1H, каждый с), 7,05-7,21 (2H, м), 7,27-7,43 (2H, м), 7,50 и 7,59 (общая 1H, каждый с).
(Пример 222) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[4-(N-метоксикарбамоил)бутил]-1H-1,2,3-триазол-4-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (соединение № 2-1693)
К раствору (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[4-(N-метоксикарбамоил)бутил]-1H-1,2,3-триазол-4-ил}метилиден)пиперидина (154 мг) в метаноле (4 мл) добавляли карбонат калия (157 мг) при 0°C. Полученную смесь перемешивали при комнатной температуре в течение 30 минут и распределяли между этилацетатом и водой. Отделенный органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Удаляли в вакууме растворитель и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь метанола и дихлорметана (1:99-5:95), с получением свободного основания указанного в заголовке соединения (89,4 мг, выход: 63%).
К раствору полученного выше свободного основания в ацетонитриле (3 мл) добавляли 4 н. HCl в диоксане. Удаление в вакууме растворителя и избыточного хлороводорода дало указанное в заголовке соединение в виде бесцветного аморфного твердого вещества (97,7 мг).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,68-1,05 (4H, м), 1,63-1,84 (3H, м), 1,88-2,38 (6H, м), 2,41-2,93 (2H, м), 3,49-3,68 (2H, м), 3,74 (3H, с), 3,87-3,95 (1H, м), 4,29-4,41 (2H, м), 4,81 (1H, с), 6,58 (1H, с), 7,06-7,21 (2H, м), 7,29-7,44 (2H, м), 7,53 и 7,62 (общая 1H, каждый с);
ИК (KBr, см-1): 2625, 1712, 1494.
(Пример 223) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[4-(N-гидроксикарбамоил)бутил]-1H-1,2,3-триазол-4-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (соединение № 2-1205)
(a) (E)-4-(Ацетилсульфанил)-3-({1-[4-(N-трет-бутилдиметилсилилокси)карбамоил)бутил]-1H-1,2,3-триазол-4-ил}метилиден)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидин
Способом, подобным описанному ниже в примере 262, (E)-4-(ацетилсульфанил)-3-{[1-(4-карбоксибутил)-1H-1,2,3-триазол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидину (190 мг) как исходному материалу давали возможность взаимодействовать с O-(трет-бутилдиметилсилил)гидроксиламином (71,7 мг). Неочищенный продукт, полученный экстрагированием по обычной методике, очищали хроматографией на силикагеле, используя в качестве элюента смесь этилацетата и дихлорметана (1:9-6:4), с получением указанного в заголовке соединения в виде бесцветного аморфного твердого вещества (148 мг, выход: 62%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,18 (6H, с), 0,67-1,05 (13H, м), 1,60-1,71 (2H, м), 1,81-2,35 (10H, с), 2,41-2,84 (2H, м), 3,06-3,28 (1Н, м), 3,81-4,02 (1H, м), 4,31 и 4,34 (общая 2H, каждый т, J=6,5), 4,47 и 4,49 (общая 1H, каждый т, J=4,5), 4,76 и 4,79 (общая 1H, каждый с), 6,57 и 6,58 (общая 1H, каждый с), 7,05-7,21 (2H, м), 7,29-7,43 (2H, м), 7,48 и 7,57 (общая 1H, каждый с).
(b) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[4-(N-гидроксикарбамоил)бутил]-1H-1,2,3-триазол-4-ил}метилиден)-4-сульфанилпиперидина гидрохлорид
К раствору (E)-4-(ацетилсульфанил)-3-[(1-{4-[N-(трет-бутилдиметилсилилокси)карбамоил]бутил}-1H-1,2,3-триазол-4-ил)метилиден]-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина (148 мг) в дихлорметане (3 мл) добавляли 4 н. раствор хлороводорода в диоксане (230 мкл) при 0°C. Полученную смесь перемешивали при комнатной температуре в течение 15 минут. Растворитель и избыточный хлороводород удаляли в вакууме и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь метанола и дихлорметана (3:97-15:85), с получением (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[4-(N-гидроксикарбамоил)бутил]-1H-1,2,3-триазол-4-ил}метилиден)пиперидина гидрохлорида (110 мг).
К раствору указанного выше соединения в метаноле (2 мл) добавляли карбонат калия (103 мг) при 0°C. Полученную смесь перемешивали при комнатной температуре в течение 0,5 часа и добавляли к ней 4 н. раствор хлороводорода в диоксане (0,39 мл). Растворитель выпаривали в вакууме и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь метанола и дихлорметана (3:97-25:75), а затем препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. HCl, 22/78, об./об.) с получением указанного в заголовке соединения в виде бесцветного аморфного твердого вещества (39,6 мг, выход: 26%).
1H ЯМР (400 МГц, пиридин-d6) δ м.д.: 0,64-0,78 (2H, м), 0,93-1,19 (2H, м), 1,75-2,02 (5H, м), 2,24-2,48 (4H, м), 2,62-2,80 (2H, м), 2,83-3,10 (1H, м), 3,98-4,11 (2H, м), 4,24-4,37 (2H, м), 5,01 (1H, с), 6,80 и 6,84 (общая 1H, каждый с), 7,23-7,40 (2H, м), 7,53-7,88 (3H, м);
ИК (KBr, см-1): 2562, 1711, 1494.
(Пример 224) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[4-(этоксикарбонил)бутил]-1H-1,2,3-триазол-5-ил}метилиден)пиперидин (соединение № 2-1254)
(a) (E)-3-({1-[4-(Этоксикарбонил)бутил]-1H-1,2,3-триазол-5-ил}метилиден)-1-(трифенилметил)пиперидин-4-ол
При использовании (E)-3-({1-[4-(этоксикарбонил)бутил]-1H-1,2,3-триазол-5-ил}метилиден)-1-(трифенилметил)пиперидин-4-она (пример 217(b), 4,87 г) в качестве исходного материала реакция, подобная описанной в примере 217(c), дала указанное в заголовке соединение (4,91 г, выход: количественный) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,26 (3H, т, J=7,5), 1,71-2,08 (6H, м), 2,12-2,47 (5H, м), 2,93-3,06 (1H, м), 3,69-3,85 (1H, м), 4,06-4,21 (2H, м), 4,29-4,49 (2H, м), 6,42 (1H, с), 7,08-7,45 (16H, м).
(b) (E)-4-(Ацетилсульфанил)-3-({1-[4-(этоксикарбонил)бутил]-1H-1,2,3-триазол-5-ил}метилиден)пиперидина гидротрифторацетат
При использовании (E)-3-({1-[4-(этоксикарбонил)бутил]-1H-1,2,3-триазол-5-ил}метилиден)-1-(трифенилметил)пиперидин-4-ола (4,91 г) в качестве исходного материала реакция, подобная описанной в примере 217(d), дала указанное в заголовке соединение (1,62 г, выход: 31%) в виде бледно-коричневого масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,24 (3H, т, J=7,0), 1,44-1,59 (2H, м), 1,86-1,94 (2H, м), 2,12-2,24 (1H, м), 2,34 (2H, т, J=7,5), 2,41 (3H, с), 2,45-2,59 (1H, м), 3,23-3,36 (1H, м), 3,48-3,59 (1H, м), 3,93 (1H, д, J=14,5), 4,10 (2H, кв, J=7,0), 4,17-4,48 (3H, м), 4,65 (1H, шс), 6,68 (1H, с), 7,88 (1H, с).
(c) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[4-(этоксикарбонил)бутил]-1H-1,2,3-триазол-5-ил}метилиден)пиперидин
При использовании (E)-4-(ацетилсульфанил)-3-({1-[4-(этоксикарбонил)бутил]-1H-1,2,3-триазол-5-ил}метилиден)пиперидина гидротрифторацетата (1,62 г) в качестве исходного материала способ, подобный описанному в примере 217(e), дал указанное в заголовке соединение (1,00 г, выход: 55%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,69-0,87 (2H, м), 0,96-1,06 (2H, м), 1,26 (3H, т, J=7,5), 1,57-1,70 (2H, м), 1,81-2,06 (3H, м), 2,21-2,38 (7H, м), 2,43-2,61 (1H, м), 2,74-2,93 (1H, м), 2,91 и 3,18 (общая 1H, каждый д, J=13,0), 3,49-3,59 (1H, м), 4,06-4,30 (4H, м), 4,49 (1H, шс), 4,75 (1H, с), 6,33 (1H, с), 7,06-7,22 (2H, м), 7,25-7,40 (2H, м), 7,41 и 7,48 (общая 1H, каждый с).
(Пример 225) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[4-(этоксикарбонил)бутил]-1H-1,2,3-триазол-5-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (соединение № 2-1253)
При использовании (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[4-(этоксикарбонил)бутил]-1H-1,2,3-триазол-5-ил}метилиден)пиперидина (1,00 г) в качестве исходного материала способ, подобный описанному в примере 218, дал указанное в заголовке соединение (884 мг, выход: 89%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,69-0,86 (2H, м), 0,93-1,06 (2H, м), 1,25 (3H, т, J=7,0), 1,59-1,70 (2H, м), 1,78-2,05 (4H, м), 2,24-2,39 (3H, м), 2,61-2,71 (1H, м), 2,82-2,94 (1H, м), 3,16 и 3,25 (общая 1H, каждый д, J=13,0), 3,43 и 3,58 (общая 1H, каждый д, J=13,0), 3,80-3,88 (1H, м), 4,13 (2H, кв, J=7,0), 4,24-4,34 (2H, м), 4,76 (1H, с), 6,32 и 6,34 (общая 1H, каждый с), 7,05-7,21 (2H, м), 7,23-7,38 (2H, м), 7,40 и 7,47(общая 1H, каждый с).
(Пример 226) (E)-3-{[1-(4-Карбоксибутил)-1H-1,2,3-триазол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-1221)
При использовании (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[4-(этоксикарбонил)бутил]-1H-1,2,3-триазол-5-ил}метилиден)-4-сульфанилпиперидина гидрохлорида (874 мг) в качестве исходного материала способ, подобный описанному в примере 219, дал указанное в заголовке соединение (640 мг, выход: 77%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, пиридин-d5) δ м.д.: 0,62-0,77 (2H, м), 0,94-1,09 (2H, м), 1,69-2,07 (5H, м), 2,25-2,56 (4H, м), 2,65-3,05 (2H, м), 3,58 (1H, д, J=12,0), 3,77 и 3,84 (общая 1H, каждый д, J=12,0), 4,02-4,11 (1H, м), 4,42 (2H, т, J=7,5), 4,98 (1H, с), 6,68 и 6,69 (общая 1H, каждый с), 7,15-7,37 (2H, м), 7,55-7,70 (2H, м), 7,90 и 7,96 (общая 1H, каждый с);
ИК (KBr, см-1): 2530, 1712, 1494.
(Пример 227) (E)-4-(Ацетилсульфанил)-3-{[1-(4-карбоксибутил)-1H-1,2,3-триазол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидин (соединение № 2-1222)
При использовании (E)-3-{[1-(4-карбоксибутил)-1H-1,2,3-триазол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорида (509 мг) в качестве исходного материала способ, подобный описанному в примере 220, дал указанное в заголовке соединение (233 мг, выход: количественный) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,68-0,88 (2H, м), 0,97-1,05 (2H, м), 1,45-1,71 (2H, м), 1,74-2,12 (3H, м), 2,18-2,42 (7H, м), 2,66-2,88 (1H, м), 3,00-3,47 (2H, м), 3,69 (1H, д, J=13,0), 4,24-4,54 (3H, м), 4,83 (1H, с), 6,33 и 6,35 (общая 1H, каждый с), 7,12-7,47 (5H, м).
(Пример 228) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[4-(N-метоксикарбамоил)бутил]-1H-1,2,3-триазол-5-ил}метилиден)пиперидин (соединение № 2-1722)
При использовании (E)-4-(ацетилсульфанил)-3-{[1-(4-карбоксибутил)-1H-1,2,3-триазол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина (233 мг) в качестве исходного материала способ, подобный описанному в примере 221, дал указанное в заголовке соединение (172 мг, выход: 80%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,68-1,06 (4H, м), 1,59-1,72 (2H, м), 1,81-2,13 (3H, м), 2,19-2,39 (7H, м), 2,44-2,61 (1H, м), 2,71-3,25 (2H, м), 3,42-3,60 (1H, м), 3,74 (3H, с), 4,21-4,34 (2H, м), 4,42-4,53 (1H, м), 4,76 и 4,77 (общая 1H, каждый с), 6,33 (1H, с), 7,07-7,49 (5H, м).
(Пример 229) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[4-(N-метоксикарбамоил)бутил]-1H-1,2,3-триазол-5-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (соединение № 2-1721)
При использовании (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[4-(N-метоксикарбамоил)бутил]-1H-1,2,3-триазол-5-ил}метилиден)пиперидина (172 мг) в качестве исходного материала способ, подобный описанному в примере 222, дал указанное в заголовке соединение (44 мг, выход: 26%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,67-0,90 (2H, м), 0,92-1,04 (2H, м), 1,56-2,14 (8H, м), 2,23-2,38 (1H, м), 2,57-2,72 (1H, м), 2,79-2,95 (1H, м), 3,03-3,63 (2H, м), 3,74 (3H, с), 3,79-3,92 (1H, м), 4,23-4,38 (2H, м), 4,77 и 4,78 (общая 1H, каждый с), 6,32 и 6,35 (общая 1H, каждый с), 7,08-7,47 (5H, м);
ИК (KBr, см-1): 2522, 1711, 1494.
(Пример 230) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[4-(N-гидроксикарбамоил)бутил]-1H-1,2,3-триазол-5-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (соединение № 2-1269)
(a) (E)-4-(Ацетилсульфанил)-3-({1-[4-(N-трет-бутилдиметилсилилокси)карбамоил)бутил]-1H-1,2,3-триазол-5-ил}метилиден)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидин
При использовании (E)-4-(ацетилсульфанил)-3-{[1-(4-карбоксибутил)-1H-1,2,3-триазол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина (291 мг) в качестве исходного материала способ, подобный описанному в примере 223(a), дал указанное в заголовке соединение (336 мг, выход: 92%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,18 (6H, с), 0,70-1,07 (13H, м), 1,57-1,71 (2H, м), 1,82-2,16 (6H, м), 2,18-2,39 (4H, м), 2,41-2,61 (1H, м), 2,72-3,23 (2H, м), 3,44-3,57 (1H, м), 4,18-4,33 (2H, м), 4,42-4,51 (1H, м), 4,75 и 4,76 (общая 1H, каждый с), 6,32 (1H, с), 7,06-7,50 (5H, м).
(b) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[4-(N-гидроксикарбамоил)бутил]-1H-1,2,3-триазол-5-ил}метилиден)-4-сульфанилпиперидина гидрохлорид
При использовании (E)-4-(ацетилсульфанил)-3-({1-[4-(N-трет-бутилдиметилсилилокси)карбамоил)бутил]-1H-1,2,3-триазол-5-ил}метилиден)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина (336 мг) в качестве исходного материала способ, подобный описанному в примере 223(b), дал, через (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[4-(N-гидроксикарбамоил)бутил]-1H-1,2,3-триазол-5-ил}метилиден)пиперидина гидрохлорид, указанное в заголовке соединение (66 мг, выход: 24%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, пиридин-d5) δ м.д. : 0,63-0,80 (2H, м), 0,93-1,10 (2H, м), 1,78-2,05 (5H, м), 2,24-2,48 (4H, м), 2,66-3,07 (2H, м), 3,60 (1H, д, J=12,5), 3,74 и 3,83 (общая 1H, каждый д, J=12,5), 4,09 (1H, шс), 4,34-4,45 (2H, м), 4,98 (1H, м), 6,66 (1H, с), 7,16-7,37 (3H, м), 7,57-7,68 (1H, м), 7,88 и 7,94 (общая 1H, каждый с);
ИК (KBr, см-1): 2661, 1711, 1494.
(Пример 231) (Z)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-5-ил}метилиден)пиперидина гидрохлорид (соединение № 4-148)
(a) (Z)-4-(Ацетилсульфанил)-3-({1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-5-ил}метилиден)пиперидина гидротрифторацетат и его (Е)-изомер
К раствору 5-(ацетилсульфанил){1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-5-ил}метил)-1-(трифенилметил)-1,2,3,6-тетрагидропиридина [пример 132(d), 8,15 г] в диметилсульфоксиде (100 мл)добавляли тиоацетат калия (16,5 г). Полученную смесь перемешивали при 80°C в течение 4 часов, охлаждали до комнатной температуры и распределяли между водой и этилацетат. Отделенный органический слой промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия. Удаляли в вакууме растворитель и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана, этилацетата и дихлорметана (1:1:1), с получением смеси (Z)-4-(ацетилсульфанил)-3-({1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-5-ил}метилиден)-1-(трифенилметил)пиперидина и его (Е)-изомера с изомерным отношением приблизительно 1:1 (6,65 г, выход: 81,6%).
Часть полученной смеси (6,43 г) обрабатывали трифторуксусной кислотой способом, подобным описанному в примере 132 (f). Остаток, полученный концентрированием, очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (10:1). Затем полученную смесь изомеров разделяли препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,026 н. водная трифторуксусная кислота, 20/80, об./об.) с получением указанных в заголовке изомеров, обоих в виде желтого аморфного твердого вещества.
Более подвижный изомер: (E)-4-(ацетилсульфанил)-3-({1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-5-ил}метилиден)пиперидина гидротрифторацетат: 1,5 г, выход: 30%.
1H ЯМР: идентичен описанному в примере 132 (f).
Менее подвижный изомер:(Z)-4-(ацетилсульфанил)-3-({1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-5-ил}метилиден)пиперидина гидротрифторацетат: 1,2 г, выход: 24%.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,02-2,13 (1H, м), 2,32-2,47 (1H, м), 2,40 (3H, с), 2,96-3,10 (2H, м), 3,27-3,45 (1H, м), 3,54 (1H, д, J=13,0), 3,64 (3H, с), 3,82-3,92 (1H, м), 4,07 (1H, д, J=14,0), 4,46-4,61 (2H, м), 4,76-4,80 (1H, м), 6,59 (1H, с), 7,82 (1H, с).
(b) (Z)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-5-ил}метилиден)пиперидина гидрохлорид
При использовании (Z)-4-(ацетилсульфанил)-3-({1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-5-ил}метилиден)пиперидина гидротрифторацетата (1,2 г) в качестве исходного материала способ, подобный описанному в примере 132(g), дал указанное в заголовке соединение (820 мг, выход: 56%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,71-0,94 (2H, м), 0,97-1,10 (2H, м), 1,70-1,87 (1H, м), 2,01-2,32 (2H, м), 2,29 и 2,30 (общая 3H, каждый с), 2,29-2,41 и 2,51-2,63 (общая 1H, каждый м), 2,72-2,86 (1H, м), 2,88-3,12 (3H, м), 3,41 и 3,50 (общая 1H, каждый д, J=13,5), 3,67 и 3,69 (общая 3H, каждый с), 4,42-4,59 (2H, м), 4,72-4,81 (1H, м), 4,76 и 4,79 (общая 1H, каждый с), 6,10 и 6,18 (общая 1H, каждый с), 7,08-7,24 (2H, м), 7,29-7,40 (2H, м), 7,57 и 7,58 (общая 1H, каждый с);
ИК (KBr, см-1): 2954, 2496, 1737, 1698.
(Пример 232) (Z)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-1,2,3-триазол-5-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (соединение № 4-147)
При использовании (Z)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(метоксикарбонил)этил]-1H-1,2,3-триазол-5-ил}метилиден)пиперидина гидрохлорида (760 мг) в качестве исходного материала способ, подобный описанному в примере 133, дал указанное в заголовке соединение (540 мг, выход: 75%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,73-0,95 (2H, м), 0,96-1,12 (2H, м), 1,22 и 1,24 (общая 3H, каждый т, J=7,5), 1,62-1,82 (1H, м), 1,99-2,33 (2H, м), 2,53-3,13 (4H, м), 3,24 и 3,29 (общая 1H, каждый д, J=13,0), 3,38 и 3,44 (общая 1H, каждый д, J=13,0), 4,06-4,18 (2H, м), 4,23-4,29 (1H, м), 4,40-4,60 (2H, м), 4,82 и 4,84 (общая 1H, каждый с), 6,00 и 6,08 (общая 1H, каждый с), 7,09-7,23 (2H, м), 7,30-7,40 (2H, м), 7,79 и 7,83 (общая 1H, каждый с);
ИК (KBr, см-1): 2978, 2447, 1730.
(Пример 233) (Z)-3-{[1-(4-Карбоксиэтил)-1H-1,2,3-триазол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 4-139)
При использовании (Z)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-1,2,3-триазол-5-ил}метилиден)-4-сульфанилпиперидина гидрохлорида (420 мг) в качестве исходного материала способ, подобный описанному в примере 134, дал указанное в заголовке соединение (230 мг, выход: 58%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, пиридин-d5) δ м.д.: 0,69-0,92 (2H, м), 0,95-1,17 (2H, м), 1,64-1,83 (1H, м), 2,16-2,37 (1H, м), 2,37-2,52 (1H, м), 2,70-3,08 (2H, м), 3,16-,3,39 (2H, м), 3,52 (1H, a), 3,63 (1H, с), 4,48-4,56 (1H, м), 4,68-4,87 (2H, м), 4,96 и 5,00 (общая 1H, каждый с), 6,46 и 6,52 (общая 1H, каждый с), 7,13-7,34 (3H, м), 7,61-7,70 (1H, м), 8,28 и 8,30 (общая 1H, каждый с);
ИК (KBr, см-1): 2926, 2549, 1711.
(Пример 234) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1(2)H-1,2,3-триазол-4(5)-ил}метилиден)пиперидин (соединение № 1-50)
(a) 1-(4-Метоксибензил)-1H-1,2,3-триазол-4-карбальдегид
К тетрагидрофурану (ТГФ, 500 мл) осторожно добавляли литийалюминийгидрид (7,3 г) при перемешивании. Полученную смесь перемешивали при 0°C и добавляли к ней по каплям раствор этил 1-(4-метоксибензил)-1H-1,2,3-триазол-4-карбоксилата (50,0 г) в ТГФ (500 мл). Полученную смесь перемешивали при комнатной температуре в течение 30 минут и реакцию останавливали осторожным добавлением декагидрата сульфата натрия. Смесь в виде взвеси перемешивали при комнатной температуре в течение еще 2 часов, фильтровали для удаления твердых частиц и фильтрат концентрировали в вакууме с получением [1-(4-метоксибензил)-1H-1,2,3-триазол-4-ил]метанола (39,51 г, выход: 94%).
К раствору полученного соединения в дихлорметане (600 мл) добавляли молекулярные сита 4A (80,0 г) и пиридинийдихромат (80,0 г). Полученную смесь перемешивали при комнатной температуре в течение 50 минут, фильтровали для удаления твердых частиц и фильтрат концентрировали в вакууме. Остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана, этилацетата и дихлорметана (1:1:1), с получением указанного в заголовке соединения в виде бесцветного масла (12,35 г, выход: 32%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 3,81 (3H, с), 5,52 (2H, с), 6,92 (2H, д, J=9,0), 7,27 (2H, д, J=9,0), 7,96 (1H, с), 10,11 (1H, с).
(b) (E)-3-{[1-(4-Метоксибензил)-1H-1,2,3-триазол-4-ил]метилиден}-1-(трифенилметил)пиперидин-4-он
К раствору 1-(трифенилметил)пиперидин-4-она (19,4 г) в бензоле (500 мл) добавляли пирролидин (4,7 мл). Полученную смесь кипятили с обратным холодильником в течение 3 часов, удаляя воду с помощью аппарата Дина-Старка. Реакционную смесь охлаждали до комнатной температуры и добавляли к ней 1-(4-метоксибензил)-1H-1,2,3-триазол-4-карбальдегид (12,35 г). Полученную смесь кипятили с обратным холодильником в течение 7 часов, охлаждали, разбавляли водой и продукты экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Выпаривали в вакууме растворитель и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана, этилацетата и дихлорметана (2:1:1), с получением указанного в заголовке соединения в виде желтого аморфного твердого вещества (17,64 г, выход: 57%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,66 (2H, шс), 2,75 (2H, т, J=5,5), 3,45 (2H, шс), 3,86 (3H, с), 5,41 (2H, с), 6,91 (2H, д, J=8,5), 7,10-7,30 (15H, м), 7,44-7,55 (4H, м), (c).
(c) (E)-3-{[1-(4-Метоксибензил)-1H-1,2,3-триазол-4-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол
При использовании (E)-3-{[1-(4-метоксибензил)-1H-1,2,3-триазол-4-ил]метилиден}-1-(трифенилметил)пиперидин-4-она (17,64 г) в качестве исходного материала способ, подобный описанному в примере 132(d), дал указанное в заголовке соединение (17,45 г, выход: количественный) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,96-2,33 (3H, м), 2,61 (1H, шс), 2,89 (1H, шс), 3,65 (1H, шс), 3,95 (3H, с), 4,27 (1H, шс), 5,45 (2H, д, J=15,0), 6,75 (1H, с), 7,00 (2H, д, J=8,5), 7,10 (1H, с), 7,19 (2Н, д, J=8,5), 7,21-7,30 (8H, м), 7,46-7,53 (7H, м).
(d) (E)-4-(Ацетилсульфанил)-3-{[1-(4-метоксибензил)-1H-1,2,3-триазол-4-ил]метилиден}пиперидина гидротрифторацетат и его (Z)-изомер
К раствору (E)-3-{[1-(4-метоксибензил)-1H-1,2,3-триазол-4-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола (17,45 г) в толуоле (300 мл) добавляли тиоуксусную кислоту (4,6 мл) и динеопентилацеталь N,N-диметилформамида (18 мл). Полученный раствор перемешивали при комнатной температуре в течение 15 минут и затем останавливали реакцию добавлением насыщенного водного раствора хлорида натрия. Продукты экстрагировали этилацетатом и экстракт сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана, этилацетата и дихлорметана (1:1:1), с получением смеси (приблизительно 1:3) (E)-4-(ацетилсульфанил)-3-{[1-(4-метоксибензил)-1H-1,2,3-триазол-4-ил]метилиден}-1-(трифенилметил)пиперидина и 5-(ацетилсульфанил){[1-(4-метоксибензил)-1H-1,2,3-триазол-4-ил]метилиден}метил)-1-(трифенилметил)-1,2,3,6-тетрагидропиридина (17,83 г, выход: 92%).
К раствору всего количества полученной выше смеси в диметилсульфоксиде (200 мл) добавляли тиоацетат калия (25 г). Полученную смесь перемешивали при 80°C в течение 4 часов, охлаждали до комнатной температуры и затем останавливали реакцию добавлением воды. Продукты экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворители выпаривали в вакууме и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана, этилацетата и дихлорметана (1:1:1), с получением смеси (приблизительно 2:1) (E)-4-(ацетилсульфанил)-3-{[1-(4-метоксибензил)-1H-1,2,3-триазол-4-ил]метилиден}-1-(трифенилметил)пиперидина и его (Z)-изомера (19,3 г).
К раствору части полученной выше смеси (17,83 г) в дихлорметане (400 мл) добавляли трифторуксусную кислоту (6,0 мл). Полученную смесь перемешивали при комнатной температуре в течение 15 минут и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (10:1), с получением (E)-4-(ацетилсульфанил)-3-{[1-(4-метоксибензил)-1H-1,2,3-триазол-4-ил]метилиден}пиперидина гидротрифторацетата (6,03 г, выход: 43%) как менее полярного изомера и (Z)-4-(ацетилсульфанил)-3-{[1-(4-метоксибензил)-1H-1,2,3-триазол-4-ил]метилиден}пиперидина гидротрифторацетата (3,86 г, выход: 28%) как более полярного изомера, обоих в виде желтых аморфных твердых частиц.
Менее полярный изомер (E)-4-ацетилсульфанил)-3-{[1-(4-метоксибензил)-1H-1,2,3-триазол-4-ил]метилиден}пиперидина гидротрифторацетат:
1H ЯМР (400 МГц, ДМСО-d6) δ м.д.: 1,89-2,01 (1H, м), 2,17-2,31 (1H, м), 2,37 (3H, с), 3,06-3,19 (1H, м), 3,27-3,41 (1H, м), 3,72 (3H, с), 4,01 (1H, д, J=14,0), 4,54 (1H, т, J=4,5), 4,81 (1H, д, J=14,0), 5,52 (2H, с), 6,67 (1H, с), 6,92 (2H, д, J=8,5), 7,27 (2H, д, J=8,5), 8,28 (1H, с).
Более полярный изомер (Z)-4-(ацетилсульфанил)-3-{[1-(4-метоксибензил)-1H-1,2,3-триазол-4-ил]метилиден}пиперидина гидротрифторацетат:
1H ЯМР (400 МГц, ДМСО-d6) δ м.д.: 1,88,-1,98 (1H, м), 2,10-2,13 (1H, м), 2,34 (3H, с), 3,07-3,21 (1H, м), 3,26-3,40 (1H, м), 3,61 (1H, д, J=14,0), 3,73 (3H, с), 3,90 (1H, д, J=14,0), 5,52 (2H, с), 5,62 (1H, шс), 6,57 (1H, с), 6,93 (2H, д, J=8,5), 7,29 (2H, д, J=8,5), 8,12 (1H, с).
(e) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(4-метоксибензил)-1H-1,2,3-триазол-4-ил]метилиден}пиперидин
К раствору (E)-4-(ацетилсульфанил)-3-{[1-(4-метоксибензил)-1H-1,2,3-триазол-4-ил]метилиден}пиперидина гидротрифторацетата (6,03 г) в ацетонитриле (100 мл) добавляли 2-бром-2-(2-фторфенил)-1-циклопропилэтанон (5,0 г) и триэтиламин (3,5 мл). Полученную смесь перемешивали при комнатной температуре в течение 15 минут. Затем останавливали реакцию добавлением насыщенного водного раствора хлорида натрия и продукты экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана, этилацетата и дихлорметана (1:1:1), с получением указанного в заголовке соединения в виде бледно-желтого аморфного твердого вещества (5,11 г, выход: 75%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,62-1,04 (4H, м), 1,78-1,93 (1H, м), 2,05-2,15 (1H, м), 2,15-2,32 (1H, м), 2,30 (3H, с), 2,39-2,50 и 2,55-2,67 (общая 1H, каждый м), 2,67-2,82 (1H, м), 3,09 и 3,20 (общая 1H, каждый д, J=13,0), 3,81 (3H, с), 3,86 и 3,93 (общая 1H, каждый д, J=13,0), 4,41-4,49 (1H, м), 4,72 и 4,76 (общая 1H, каждый с), 5,36-5,48 (2H, м), 6,54 и 6,55 (общая 1H, каждый с), 6,89 (2H, д, J=8,5), 7,03-7,40 (6H, м), 7,44 и 7,50 (общая 1H, каждый с).
(f) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1(2)H-1,2,3-триазол-4(5)-ил}метилиден)пиперидин
К раствору (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(4-метоксибензил)-1H-1,2,3-триазол-4-ил]метилиден}пиперидина (5,01 г) в трифторуксусной кислоте (250 мл) добавляли анизол (50 мл). Полученную смесь перемешивали при 80°C в течение 2,5 суток и охлаждали до комнатной температуры, после чего выпаривали в вакууме растворители. К остатку добавляли насыщенный водный раствор гидрокарбоната натрия и продукты экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворители выпаривали в вакууме и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана и этилацетата (1:1), с получением указанного в заголовке соединения в виде бледно-желтого аморфного твердого вещества (3,5 г, выход: 90%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,65-0,90 (2H, м), 0,99-1,16 (2H, м), 1,81-1,93 (1H, м), 1,92-2,07 (1H, м), 2,15-2,36 (1H, м), 2,28 и 2,32 (общая 3H, каждый с), 2,47-2,62 (1H, м), 2,64-2,88 (1H, м), 3,30 (1H, д, J=13,0), 4,39 (1H, шс), 4,47 (1H, т, J=4,5), 4,83 и 4,90 (общая 1H, каждый с), 6,50 и 6,51 (1H, с), 7,07-7,19 (2H, м), 7,27-7,39 (2H, м), 7,54 и 7,58 (общая 1H, каждый с).
(Пример 235) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанил-3-{[1(2)H-1,2,3-триазол-4(5)-ил]метилиден}пиперидина гидрохлорид (соединение № 1-49)
К раствору (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1(2)H-1,2,3-триазол-4(5)-ил]метилиден}пиперидина гидрохлорида (HCl соль продукта примера 234, 670 мг) в метаноле (20 мл) добавляли карбонат калия (620 мг). Полученную смесь перемешивали при комнатной температуре в течение 15 минут, останавливали реакцию добавлением воды и продукты экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия и затем выпаривали в вакууме растворитель. Остаток очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. HCl, 27/73, об./об.) с получением указанного в заголовке соединения в виде бесцветного аморфного твердого вещества (510 мг, выход: 84%).
1H ЯМР (400 МГц, пиридин-d5) δ м.д.: 0,57-0,77 (2H, м), 0,86-1,00 (1H, м), 1,01-1,14 (1H, м), 1,80-1,95 (1H, м), 2,23-2,50 (2H, м), 2,64-2,80 (1H, м), 2,84-3,06 (1H, м), 3,98-4,29 (3H, м), 4,97 и 4,99 (общая 1H, каждый с), 6,86 и 6,88 (общая 1H, каждый с), 7,09-7,31 (3H, м), 7,63-7,73 (1H, м), 7,93 и 7,99 (общая 1H, каждый с);
ИК (KBr, см-1): 2914, 2643, 1709.
(Пример 236) (Z)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1(2)H-1,2,3-триазол-4(5)-ил]метилиден}пиперидин (соединение № 4-92)
(a) (Z)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(4-метоксибензил)-1H-1,2,3-триазол-4-ил]метилиден}пиперидин
При использовании (Z)-4-(ацетилсульфанил)-3-{[1-(4-метоксибензил)-1H-1,2,3-триазол-4-ил]метилиден}пиперидина гидротрифторацетата [пример 234 (d), 3,86 г] в качестве исходного материала способ, подобный описанному в примере 234(e), дал указанное в заголовке соединение (3,01 г, выход: 69%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,72-0,92 (2H, м), 0,91-1,09 (2H, м), 1,66-,180 (1H, м), 2,11-2,34 (2H, м), 2,25 и 2,26 (общая 3H, каждый с), 2,46-2,85 (2H, м), 2,94 (1H, д, J=12,0), 3,27 и 3,44 (общая 1H, каждый д, J=12,0), 3,79 (3H, с), 4,62 и 4,66 (общая 1H, каждый с), 5,03 (1H, шс), 5,35-5,51 (2H, м), 6,29 и 6,39 (общая 1H, каждый с), 6,89 (2H, д, J=9,0), 7,04-7,21 (2H, м), 7,24 (2H, д, J=9,0), 7,27-7,35 (1H, м), 7,39-7,47 (2H, м).
(b) (Z)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1(2)H-1,2,3-триазол-4(5)-ил]метилиден}пиперидин
При использовании (Z)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(4-метоксибензил)-1H-1,2,3-триазол-4-ил]метилиден}пиперидина (3,01 г) в качестве исходного материала способ, подобный описанному в примере 234(f), дал указанное в заголовке соединение (2,14 г, выход: 92%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,73-0,94 (2H, м), 0,96-1,11 (2H, м), 1,72-1,89 (1H, м), 2,07-2,65 (3H, м), 2,33 (3H, с), 2,82 (1H, д, J=12,0), 3,02 (1H, д, J=12,0), 3,33 и 3,48 (1H, д, J=12,5), 4,73 и 4,77 (общая 1H, каждый с), 5,22 (1H, шс), 6,26 и 6,35 (общая 1H, каждый с), 7,08-7,24 (2H, м), 7 ,29-7 , 44 (2H, м), 7,63 и 7 , 64 (общая 1H, каждый с);
ИК (KBr, см-1): 2912, 2537, 1696.
(Пример 237) (Z)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-([1(2)H-1,2,3-триазол-4(5)-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (соединение № 4-91)
При использовании (Z)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1(2)H-1,2,3-триазол-4(5)-ил]метилиден}пиперидина гидрохлорида (HCl соль продукта примера 236, 540 мг) в качестве исходного материала способ, подобный описанному в примере 235, дал указанное в заголовке соединение (430 мг, выход: 88%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, пиридин-d5) δ м.д.: 0,69-0,85 (2H, м), 0,94-1,17 (2H, м), 1,70-1,90 (1H, м), 2,18-2,44 (1H, м), 2,46-2,55 (1H, м), 2,70-3,08 (2H, м), 3,42 и 3,59 (общая 1H, каждый д, J=12,5), 3,53 и 3,69 (общая 1H, каждый д, J=12,5), 4,94 и 4,96 (общая 1H, каждый с), 5,39-5,46 (1H, м), 6,39 и 6,50 (общая 1H, каждый с), 7,17-7,35 (3H, м), 7,68-7,76 (1H, м), 8,12 и 8,16 (общая 1H, каждый с);
ИК (KBr, см-1): 2911, 2543, 1709.
(Пример 238) (Z)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[2-(метоксикарбонилметил)-2H-1,2,3-триазол-4-ил]метилиден}пиперидин (соединение № 2-1418)
К раствору (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1(2)H-1,2,3-триазол-4(5)-ил]метилиден}пиперидина (1,0 г) в ацетонитриле (15 мл) добавляли метилбромацетат (1,1 г) и 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU) (1,0 мл). Полученный раствор перемешивали при комнатной температуре в течение 15 минут и затем останавливали реакцию добавлением насыщенного водного раствора хлорида натрия. Продукты экстрагировали этилацетатом и экстракт сушили над безводным сульфатом натрия. Выпаривали в вакууме растворитель и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана, этилацетата и дихлорметана (1:1:1), с получением указанного в заголовке соединения (550 мг, выход: 47%)в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,63-0,84 (2H, м), 0,84-1,04 (2H, м), 1,80-1,94 (1H, м), 2,11-2,39 (2H, м), 2,30 (3H, с), 2,44-2,60 (1H, м), 2,68-2,79 и 2,81-2,92 (общая 1H, каждый м), 3,01 и 3,30 (общая 1H, каждый д, J=13,5), 3,76 (3H, с), 3,97 и 4,05 (общая 1H, каждый д, J=13,5), 4,45-4,52 (1H, м), 4,69 и 4,70 (общая 1H, каждый с), 5,03 и 5,11 (общая 2H, каждый с), 6,46 и 6,48 (общая 1H, каждый с), 7,02-7,16 (2H, м), 7,25-7,34 (1H, м), 7,36-7,42 (1H, м), 7,43 и 7,51 (общая 1H, каждый с).
(Пример 239) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[2-(метоксикарбонилметил)-2H-1,2,3-триазол-4-ил]метилиден}-4-сульфанилпиперидина гидрохлорид (соединение № 2-1417)
При использовании (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[2-(метоксикарбонилметил)-2H-1,2,3-триазол-4-ил]метилиден}пиперидина (550 мг) в качестве исходного материала, проведение реакции, подобной описанной в примере 151, дало указанное в заголовке соединение (260 мг, выход: 48%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, пиридин-d5) δ м.д.: 0,60-0,76 (2H, м), 0,88-0,99 (1H, м), 1,01-1,11 (1H, м), 1,79-1,91 (1H, м), 2,22-2,45 (2H, м), 2,62-2,71 и 2,73-2,83 (общая 1H, каждый м), 2,89-3,01 (общая 1H, каждый с), 3,55-3,63 (3H, м), 3,80 и 3,95 (общая 1H, каждый д, J=13,0), 3,96-4,02 (1H, м), 4,04 и 4,11 (общая 1H, каждый д, J=13,0), 4,93 и 4,94 (общая 1H, каждый с), 5,48-5,55 (2H, м), 6,63 и 6,68 (общая 1H, каждый с), 7,13-7,22 (2H, м), 7,26-7,33 (1H, м), 7,62-7,69 (1H, м), 7,81-7,88 (общая 1H, каждый с);
ИК (KBr, см-1): 2954, 2452, 1754, 1712.
(Пример 240) (E)-3-{[2-(Карбоксиметил)-2H-1,2,3-триазол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-1401)
При использовании (E)-3-{[2-(метоксикарбонилметил)-2H-1,2,3-триазол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорида (106 мг) в качестве исходного материала способ, подобный описанному в примере 134, дал указанное в заголовке соединение (86,0 мг, выход: 84%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, пиридин-d5) δ м.д.: 0,60-0,76 (2H, м), 0,85-0,99 (1H, м), 0,99-1,14 (1H, м), 1,75-1,94 (1H, м), 2,21-2,47 (2H, м), 2,61-2,74 и 2,74-2,86 (общая 1H, каждый м), 2,87-3,02 (1H, м), 3,80 и 4,00 (общая 1H, каждый д, J=13,0), 3,96-4,04 (1H, м), 4,08 и 4,19 (общая 1H, каждый д, J=13,0), 4,93 и 4,94 (общая 1H, каждый с), 5,52-5,61 (2H, м), 6,65 и 6,71 (общая 1H, каждый с), 7,13-7,37 (3H, м), 7,63-7,71 (1H, м), 7,82 и 7,89 (общая 1H, каждый с);
ИК (KBr, см-1): 2929, 1743, 1711.
(Пример 241) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({2-[2-(этоксикарбонил)этил]-2H-1,2,3-триазол-4-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (соединение № 2-1437)
К раствору (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1(2)H-1,2,3-триазол-4(5)-ил]метилиден}пиперидина (900 мг) в ацетонитриле (10 мл) добавляли этилакрилат (660 мг) и 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU) (1,0 мл). Полученный раствор перемешивали при комнатной температуре в течение 30 минут и останавливали реакцию добавлением насыщенного водного раствора хлорида натрия. Продукты экстрагировали этилацетатом и экстракт сушили над безводным сульфатом натрия. Выпаривали в вакууме растворитель и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана, этилацетата и дихлорметана (1:1:1), с получением неочищенного (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({2-[2-(этоксикарбонил)этил]-2H-1,2,3-триазол-4-ил]метилиден}пиперидина (300 мг). В раствор полученного соединения в этаноле (30 мл) вводили газообразный HCl при 0°C в течение 30 минут. Колбу закупоривали, смесь перемешивали в течение одного часа и удаляли в вакууме растворитель и избыточный HCl. Остаток очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. HCl, 35/65, об./об.) с получением фракции, содержащей продукт. Полученную фракцию обрабатывали насыщенным водным раствором гидрокарбоната натрия и высвобожденное основание экстрагировали этилацетатом с получением свободного основания указанного в заголовке соединения.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,63-0,86 (2H, м), 0,87-1,05 (2H, м), 1,26 (3H, т, J=7,0), 1,75-1,89 (1H, м), 2,09-2,22 (1H, м), 2,22-2,41 (1H, м), 2,62-2,70 и 2,72-2,79 (общая 1H, каждый м), 2,81-2,97 (3H, м), 3,55 и 3,70 (общая 1H, каждый д, J=13,0), 3,78 и 3,82 (общая 1H, каждый д, J=13,0), 3,86-3,96 (1H, м), 4,18 (2H, кв, J=7,0), 4,58 и 4,61 (общая 2H, каждый т, J=7,5), 4,78 и 4,79 (общая 1H, каждый с), 6,42 и 6,46 (общая 1H, каждый с), 7,04-7,18 (2H, м), 7,28-7,36 (1H, м), 7,36 и 7,43 (общая 1H, каждый с), 7,39-7,46 (1H, м);
ИК (Тонкая пленка, см-1) : 2932, 2458, 1732.
Полученное описанным образом свободное основание обрабатывали 4 н. раствором хлороводорода в диоксане и растворитель и избыточный хлороводород удаляли в вакууме с получением указанного в заголовке соединения в виде бесцветного аморфного твердого вещества (200 мг, общий выход: 18%).
(Пример 242) (E)-3-{[2-(Карбоксиэтил)-2H-1,2,3-триазол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-1405)
При использовании (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({2-[2-(этоксикарбонил)этил]-2H-1,2,3-триазол-4-ил}метилиден)-4-сульфанилпиперидина гидрохлорида (160 мг) в качестве исходного материала способ, подобный описанному в примере 134, дал указанное в заголовке соединение (70 мг, выход: 46%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, пиридин-d5) δ м.д.: 0,57-0,79 (2H, м), 0,89-0,99 (1H, м), 1,00-1,14 (1H, м), 1,76-1,95 (1H, м), 2,23-2,45 (2H, м), 2,63-2,74 и 2,76-2,85 (общая 1H, каждый м), 2,91-3,02 (1H, м), 3,19-3,30 (2H, м), 3,81 и 3,99 (общая 1H, каждый д, J=13,0), 3,96-4,05 (1H, м), 4,06 и 4,14 (общая 1H, каждый д, J=13,0), 4,82-4,92 (2H, м), 4,97 (1H, с), 6,62 и 6,66 (общая 1H, каждый с), 7,14-7,25 (2H, м), 7,29-7,38 (1H, м), 7,64-7,72 (1H, м), 7,75 и 7,76 (общая 1H, каждый с);
ИК (Тонкая пленка, см-1): 3405, 2957, 2569, 1713.
(Пример 243) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({2-[3-(этоксикарбонил)пропил]-2H-1,2,3-триазол-4-ил}метилиден)пиперидин (соединение № 2-1442)
К раствору (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1(2)H-1,2,3-триазол-4(5)-ил]метилиден}пиперидина (900 мг) в ацетонитриле (10 мл) добавляли этил 4-бромбутилат (1,3 г) и 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU) (1,0 мл). Полученную смесь перемешивали при комнатной температуре в течение 30 минут и останавливали реакцию добавлением насыщенного водного раствора хлорида натрия. Продукты экстрагировали этилацетатом и экстракт сушили над безводным сульфатом натрия. Выпаривали в вакууме растворитель и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана, этилацетата и дихлорметана (1:1:1), с получением указанного в заголовке соединения в виде бледно-желтого аморфного твердого вещества (570 мг, выход: 50%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,62-0,86 (2H, м), 0,88-1,05 (2H, м), 1,22-1,29 (3H, м), 1,82-1,96 (1H, м), 2,11-2,38 (6H, м), 2,31 (3H, с), 2,46-2,63 (1H, м), 2,73-2,81 и 2,83-2,91(общая 1H, каждый м), 3,06 и 3,29 (общая 1H, каждый д, J=13,0), 4,01 и 4,05 (общая 1H, каждый д, J=13,0), 4,07-4,19 (2H, м), 4,29-4,43 (2H, м), 4,46-4,54 (1H, м), 4,72 и 4,74 (общая 1H, каждый с), 6,46 и 6,48 (общая 1H, каждый с), 7,04-7,18 (2H, м), 7,26-7,44 (2H, м), 7,34 и 7,43 (общая 1H, каждый с).
(Пример 244) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({2-[3-(этоксикарбонил)пропил]-2H-1,2,3-триазол-4-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (соединение № 2-1441)
В раствор (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({2-[3-(этоксикарбонил)пропил]-2H-1,2,3-триазол-4-ил}метилиден)пиперидина (570 мг) в этаноле (50 мл) вводили газообразный HCl при 0°C в течение 30 минут. Смесь перемешивали в герметически закрытом состоянии в течение 2 часов, после чего растворитель и избыточный хлороводород удаляли в вакууме. Остаток очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. HCl, 35/65, об./об.) с получением фракции, содержащей продукт. Полученную фракцию обрабатывали насыщенным водным раствором гидрокарбоната натрия и выделенное основание экстрагировали этилацетатом с получением свободного основания указанного в заголовке соединения.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,77-0,96 (2H, м), 1,00-1,16 (2H, м), 1,37 (3H, т, J=7,0), 1,88-1,99 (1H, м), 2,23-2,48 (6H, м), 2,73-2,88 (1H, м), 2,91-3,03 (1H, м), 3,65 и 3,79 (общая 1H, каждый д, J=13,0), 3,86 и 3,87 (общая 1H, каждый д, J=13,0), 3,98-4,07 (1H, м), 4,25 (2H, кв, J=7,0), 4,44-4,53 (2H, м), 4,88 (1H, с), 6,55 и 6,58 (общая 1H, каждый с), 7,16-7,28 (2H, м), 7,39-7,47 (1H, м), 7,47 и 7,54 (общая 1H, каждый с), 7,49-7,55 (1H, м);
ИК (KBr, см-1): 2935, 2459, 1729.
Полученное выше свободное основание обрабатывали 4 н. раствором хлороводорода в диоксане, после чего растворитель и избыточный хлороводород удаляли в вакууме с получением указанного в заголовке соединения в виде бесцветного аморфного твердого вещества (420 мг, общий выход: 75%).
(Пример 245) (E)-3-{[2-(Карбоксипропил)-2H-1,2,3-триазол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-1409)
При использовании (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({2-[3-(этоксикарбонил)пропил]-2H-1,2,3-триазол-4-ил}метилиден)-4-сульфанилпиперидина гидрохлорида (380 мг) в качестве исходного материала способ, подобный описанному в примере 134, дал указанное в заголовке соединение (290 мг, выход: 81%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, пиридин-d5) δ м.д.: 0,53-0,81 (2H, м), 0,88-1,13 (2H, м), 1,79-1,96 (1H, м), 2,23-2,64 (6H, м), 2,65-3,08 (2H, м), 3,80-4,18 (3H, м), 4,50-4,62 (2H, м), 5,01 (1H, с), 6,66 и 6,70 (общая 1H, каждый с), 7,14-7,26 (2H, м), 7,29-7,38 (1H, м), 7,65-7,73 (1H, м), 7,76 (1H, с);
ИК (KBr, см-1): 3349, 2939, 2560, 1711.
(Пример 246) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-пиразол-4-ил]метилиден}пиперидин (соединение № 2-214)
(a) (E)-3-[(1H-Пиразол-4-ил)метилиден]-1-(трифенилметил)пиперидин-4-он
Смесь 1H-пиразол-4-карбальдегида (14,5 г), ацетонитрила (300 мл), ди(трет-бутил)дикарбоната (36,0 г) и гидроксида тетраметиламмония перемешивали при комнатной температуре в течение 30 минут. Останавливали реакцию добавлением насыщенного водного раствора хлорида натрия и продукты экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Выпаривали в вакууме растворитель и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана и этилацетата (2:1), с получением 1-(трет-бутоксикарбонил)-1H-пиразол-4-карбальдегида (24,74 г, выход: 84%).
К раствору 1-(трифенилметил)пиперидин-4-она (42,8 г) в бензоле (800 мл) добавляли пирролидин (10,4 мл) и полученную смесь кипятили с обратным холодильником в течение 3 часов, удаляя воду с помощью аппарата Дина-Старка. Реакционную смесь охлаждали до комнатной температуры и добавляли к ней 1-(трет-бутоксикарбонил)-1H-пиразол-4-карбальдегид (24,6 г), полученный так, как описано выше. Полученную смесь кипятили с обратным холодильником в течение 5 часов, охлаждали, разбавляли насыщенным водным раствором хлорида натрия и продукты экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Выпаривали в вакууме растворитель и остаток очищали хроматографией на силикагеле. Элюирование смешанным растворителем из гексана, этилацетата и дихлорметана (3:1:1) сначала дало (E)-3-{[1-(трет-бутоксикарбонил)-1H-пиразол-4-ил]метилиден}-1-(трифенилметил)пиперидин-4-он (16,07 г, выход: 25% от альдегида). Затем элюирование смешанным растворителем из гексана и этилацетата (1:2) дало указанное в заголовке соединение в виде желтого аморфного твердого вещества (15,25 г, выход: 29% от альдегида).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2,61-2,78 (4H, м), 3,21-3,43 (2H, м), 7,10-7,32 (9H, м), 7,44-7,57 (9H, м).
К раствору полученного выше (E)-3-{[1-(трет-бутоксикарбонил)-1H-пиразол-4-ил]метилиден}-1-(трифенилметил)пиперидин-4-она (16,0 г) в метаноле (200 мл) добавляли карбонат калия (12,8 г). Полученную смесь перемешивали при комнатной температуре в течение 30 минут и распределяли между водой и этилацетат. Отделенный органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Удаляли растворитель в вакууме с дополнительным получением указанного в заголовке соединения (8,85 г, выход: 68% от Boc соединения).
(b) (E)-3-{[1-(Этоксикарбонилметил)-1H-пиразол-4-ил]метилиден}-1-(трифенилметил)пиперидин-4-он
К раствору (E)-3-[(1H-пиразол-4-ил)метилиден]-1-(трифенилметил)пиперидин-4-она (6,0 г) в ацетонитриле (100 мл) добавляли этилбромацетат (7,2 г) и 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU) (6,4 мл). Полученную смесь перемешивали при комнатной температуре в течение одного часа и затем останавливали реакцию добавлением насыщенного водного раствора хлорида натрия. Продукты экстрагировали этилацетатом и органический слой сушили над безводным сульфатом натрия. Выпаривали в вакууме растворитель и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана, этилацетата и дихлорметана (2:1:1), с получением указанного в заголовке соединения в виде желтого аморфного твердого вещества (6,08 г, выход: 84%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,27 (3H, т, J=7,0), 2,60-2,78 (4H, м), 3,37 (2H, шс), 4,23 (2H, кв, J=7,0), 4,84 (2H, с), 7,14-7,31 (9H, м), 7,39 (1H, с), 7,43-7,56 (8H, м).
(c) (E)-3-{[1-(Этоксикарбонилметил)-1H-пиразол-4-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол
К раствору (E)-3-{[1-(этоксикарбонилметил)-1H-пиразол-4-ил]метилиден}-1-(трифенилметил)пиперидин-4-она (6,08 г) в этаноле (100 мл) добавляли борогидрид натрия (230 мг). Полученную смесь перемешивали при комнатной температуре в течение 30 минут и затем останавливали реакцию добавлением насыщенного водного раствора хлорида аммония. Продукты экстрагировали этилацетатом и органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель выпаривали в вакууме с получением указанного в заголовке соединения в виде желтого аморфного твердого вещества (6,2 г, выход: количественный).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,28 (3H, т, J=7,0), 1,80-1,95 (1H, м), 2,06-2,21 (2H, м), 2,57-2,84 (2H, м), 3,40 (1H, шс), 4,07-4,17 (1H, м), 4,22 (2H, кв, J=7,0), 4,74 (2H, д, J=3,5), 6,34 (1H, с), 7,07-7,23 (10H, м), 7,37 (1H, с), 7,39-7,47 (6H, м).
(d) (E)-4-(Ацетилсульфанил)-3-{[1-(этоксикарбонилметил)-1H-пиразол-4-ил]метилиден}пиперидина гидротрифторацетат
К раствору (E)-3-{[1-(этоксикарбонилметил)-1H-пиразол-4-ил]метилиден}-1-(трифенилметил)пиперидин-4-ола (6,2 г) в толуоле (100 мл) добавляли тиоуксусную кислоту (1,8 мл) и динеопентилацеталь N,N-диметилформамида (6,8 мл). Полученную смесь перемешивали при комнатной температуре в течение 15 минут и останавливали реакцию добавлением насыщенного водного раствора хлорида натрия. Продукты экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворители выпаривали в вакууме и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана, этилацетата и дихлорметана (1:1:1), с получением смеси (E)-4-(ацетилсульфанил)-3-{[1-(этоксикарбонилметил)-1H-пиразол-4-ил]метилиден}-1-(трифенилметил)пиперидина и 5-{(ацетилсульфанил)[1-(этоксикарбонилметил)-1H-пиразол-4-ил]метил}-1-(трифенилметил)-1,2,3,6-тетрагидропиридина (6,11 г).
К раствору полученной выше смеси в диметилсульфоксиде (100 мл) добавляли тиоацетат калия (12,3 г). Полученную смесь перемешивали при 80°C в течение 15 часов, охлаждали до комнатной температуры и разбавляли водой для остановки реакции. Продукты экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным хлоридом натрия и выпаривали в вакууме растворители. Остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана, этилацетата и дихлорметана (2:1:1), с получением смеси (приблизительно 7:6:1) (E)-4-(ацетилсульфанил)-3-{[1-(этоксикарбонилметил)-1H-пиразол-4-ил]метилиден}-1-(трифенилметил)пиперидина, его (Z)-изомера и 5-{(ацетилсульфанил)[1-(этоксикарбонилметил)-1H-пиразол-4-ил]метил}-1-(трифенилметил)-1,2,3,6-тетрагидропиридина (5,52 г). К раствору полученной смеси в дихлорметане (300 мл) добавляли трифторуксусную кислоту (1,9 мл). Полученную смесь перемешивали при комнатной температуре в течение 15 минут. Выпаривали в вакууме растворитель и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (10:1), с получением указанного в заголовке соединения в виде желтого аморфного твердого вещества (1,75 г, общий выход: 33%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,26 (3H, т, J=7,0), 2,00-2,09 (1H, м), 2,32-2,53 (2H, м), 2,34 (3H, с), 3,08-3,22 (1H, м), 3,31 (1H, д, J=14,0), 3,65 (1H, д, J=14,0), 4,20 (2H, кв, J=7,0), 4,56 (1H, т, J=4,0), 4,84 (2H, с), 6,62 (1H, с), 7,45 (1H, с), 7,49 (1H, с).
(e) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-пиразол-4-ил]метилиден}пиперидин
При использовании (E)-4-(ацетилсульфанил)-3-{[1-(этоксикарбонилметил)-1H-пиразол-4-ил]метилиден}пиперидина гидротрифторацетата (1,75 г) в качестве исходного материала способ, подобный описанному в примере 132(g), дал указанное в заголовке соединение (1,0 г, выход: 50%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,64-0,86 (2H, м), 0,87-1,04 (2H, м), 1,22-1,30 (3H, м), 1,77-1,91 (1H, м), 2,11-2,20 (1H, м), 2,22-2,33 (1H, м), 2,29 и 2,30 (3H, с), 2,39-2,47 и 2,49-2,58 (общая 1H, каждый м), 2,67-2,75 и 2,80-2,88 (общая 1H, каждый м), 2,89 и 3,06 (общая 1H, каждый д, J=13,0),3,63 и 3,69 (общая 1H, каждый д, J=13,0), 4,18-4,2 6 (2H, м), 4,43-4,49 (1H, м), 4,68 и 4,70 (общая 1H, каждый с), 4,76-4,84 (2H, м), 6,34 и 6,36 (общая 1H, каждый с), 7,03-7,18 (2H, м), 7,26-7,44 (4H, м).
(Пример 247) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-пиразол-4-ил]метилиден}-4-сульфанилпиперидина гидрохлорид (соединение № 2-213)
При использовании (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1-(этоксикарбонилметил)-1H-пиразол-4-ил]метилиден}пиперидина (1,0 г) в качестве исходного материала способ, подобный описанному в примере 133, дал указанное в заголовке соединение (780 мг, выход: 79%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,62-0,87 (2H, м), 0,87-1,05 (2H, м), 1,18-1,34 (3H, м), 1,70-1,84 (1H, м), 2,11 (1H, шс), 2,27 (1H, шс), 2,56-2,96 (2H, м), 3,29-3,58 (2H, м), 3,84-3,95 (1H, м), 4,22 (2H, м), 4,75-4,85 (3H, м), 6,31 и 6,34 (общая 1H, каждый с), 7,04-7,18 (2H, м), 7,26-7,48 (2H, м), 7,34 (1H, с), 7,40 (1H, с);
ИК (KBr, см-1): 2926, 2460, 1750, 1711.
(Пример 248) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-4-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (соединение № 2-217)
(a) (E)-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-4-ил}метилиден)-1-(трифенилметил)пиперидин-4-он
К раствору (E)-3-[(1H-пиразол-4-ил)метилиден]-1-(трифенилметил)пиперидин-4-она (пример 98(a), 6,0 г) в ацетонитриле (100 мл) добавляли этилакрилат (4,7 мл) и 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU) (6,4 мл). Полученную смесь перемешивали при комнатной температуре в течение 15 минут и затем останавливали реакцию добавлением насыщенного водного раствора хлорида натрия. Продукты экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и растворители выпаривали в вакууме. Остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана, этилацетата и дихлорметана (2:1:1), с получением указанного в заголовке соединения в виде желтого аморфного твердого вещества (6,12 г, выход: 82%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,20 (3H, т, J=7,0), 2,62-2,76 (4H, м), 2,82 (2H, т, J=6,0), 3,32 (2H, шс), 4,07 (2H, кв, J=7,0), 4,35 (2H, т, J=6,0), 7,13-7,58 (18H, м).
(b) (E)-3-({1-[2-(Этоксикарбонил)этил]-1H-пиразол-4-ил}метилиден]-1-(трифенилметил)пиперидин-4-ол
При использовании (E)-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-4-ил}метилиден)-1-(трифенилметил)пиперидин-4-она (6,12 г) в качестве исходного материала способ, подобный описанному в примере 246(c), дал указанное в заголовке соединение (6,19 г, выход: 100%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,24 (3H, т, J=7,0), 1,80-1,94 (1H, м), 2,06-2,22 (2H, м), 2,55-2,82 (2H, м), 2,79 (2H, т, J=7,0), 3,36 (1H, шс), 4,06-4,16 (1H, м), 4,13 (2H, кв, J=7,0), 4,25 (2H, т, J=7,0), 6,32 (1H, с), 7,07-7,22 (10H, м), 7,32 (1H, с), 7,38-7,46 (6H, м).
(c) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-4-ил}метилиден)-4-сульфанилпиперидина гидрохлорид
При использовании (E)-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-4-ил}метилиден)-1-(трифенилметил)пиперидин-4-ола (6,19 г) в качестве исходного материала последовательные процессы, подобные описанным в примере 246(d) и (e), дали указанное в заголовке соединение (540 мг, выход: 10%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,64-0,87 (2H, м), 0,89-1,06 (2H, м), 1,24 (3H, т, J=7,0), 1,70-1,84 (1H, м), 2,05-2,18 (1H, м), 2,18-2,39 (1H, м), 2,59-2,95 (4H, м), 3,31-3,58 (2H, м), 3,84-3,97 (1H, м), 4,15 (2H, кв, J=7,0), 4,31 и 4,34 (общая 2H, каждый т, J=7,0), 4,78 и 4,80 (общая 1H, каждый с), 6,29 и 6,32 (общая 1H, каждый с), 7,05-7,21 (2H, м), 7,27-7,50 (4H, м);
ИК (KBr, см-1): 2927, 2460, 1730, 1714.
(Пример 249) (E)-3-{[2-(Карбоксиэтил)-1H-пиразол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-185)
При использовании (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-пиразол-4-ил}метилиден)-4-сульфанилпиперидина гидрохлорида (520 мг) в качестве исходного материала способ, подобный описанному в примере 134, дал указанное в заголовке соединение (480 мг, выход: 98%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, пиридин-d5) δ м.д.: 0,56-0,77 (2H, м), 0,88-1,12 (2H, м), 1,73-1,90 (1H, м), 2,18-2,43 (2H, м), 2,63-2,83 (1H, м), 2,86-3,01 (1H, м), 3,09-3,23 (2H, м), 3,57-3,79 (2H, м), 3,95-4,06 (1H, м), 4,53-4,62 (2H, м), 4,94 (1H, с), 6,48 и 6,49 (общая 1H, каждый с), 7,16-7,24 (2H, м), 7,29-7,36 (1H, м), 7,62-7,77 (3H, м);
ИК (KBr, см-1): 2922, 2617, 2540, 1729, 1711.
(Пример 250) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[3-(этоксикарбонил)пропил]-1H-пиразол-4-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (соединение № 2-221)
(a) (E)-3-({1-[3-(Этоксикарбонил)пропил]-1H-пиразол-4-ил}метилиден)-1-(трифенилметил)пиперидин-4-он
К раствору (E)-3-[(1H-пиразол-4-ил)метилиден]-1-(трифенилметил)пиперидин-4-она (пример 98(a), 6,0 г) в ацетонитриле (100 мл) добавляли этил 4-бромбутилат (8,4 г) и 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU) (6,4 мл). Полученную смесь перемешивали при комнатной температуре в течение одного часа и затем останавливали реакцию добавлением насыщенного водного раствора хлорида натрия. Продукты экстрагировали этилацетатом и экстракт сушили над безводным сульфатом натрия. Выпаривали в вакууме растворитель и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана, этилацетата и дихлорметана (2:1:1), с получением указанного в заголовке соединения в виде желтого аморфного твердого вещества (5,45 г, выход: 71%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,14 (3H, т, J=7,0), 2,00 (2H, т, J=7,0), 2,09 (2H, т, J=7,0), 2,52-2,64 (4H, м), 3,22 (2H, шс), 4,01 (4H, кв, J=7,0), 7,03-7,44 (18H, м).
(b) (E)-3-({1-[3-(Этоксикарбонил)пропил]-1H-пиразол-4-ил}метилиден)-1-(трифенилметил)пиперидин-4-ол
При использовании (E)-3-({1-[3-(этоксикарбонил)пропил]-1H-пиразол-4-ил}метилиден)-1-(трифенилметил)пиперидин-4-она (5,45 г) в качестве исходного материала способ, подобный описанному в примере 246(c), дал указанное в заголовке соединение (5,54 г, выход: 100%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,25 (3H, т, J=7,0), 1,81-1,93 (1H, м), 2,06 (2H, т, J=7,0), 2,06-2,19 (2H, м), 2,19 (2H, т, J=7,0), 2,С3-2,97 (2H, м), 3,35 (1H, шс), 4,01 (2H, т, J=7,0), 4,03-4,16 (3H, м), 6,32 (1H, с), 7,06 (1H, с), 7,09-7,22 (8H, м), 7,33 (1H, с), 7,38-7,46 (7H, м).
(c) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[3-(этоксикарбонил)пропил]-1H-пиразол-4-ил}метилиден)-4-сульфанилпиперидина гидрохлорид
При использовании (E)-3-({1-[3-(этоксикарбонил)пропил]-1H-пиразол-4-ил}метилиден)-1-(трифенилметил)пиперидин-4-ола в качестве исходного материала последовательные процессы, подобные описанным в примере 246(d) и (e), дали указанное в заголовке соединение (430 мг, выход: 8%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,65-0,87 (2H, м), 0,90-1,06 (2H, м), 1,25 (3H, т, J=7,0), 1,73-1,84 (1H, м), 2,00-2,20 (3H, м), 2,21-2,43 (3H, м), 2,66-3,00 (2H, м), 3,34-3,69 (2H, м), 3,85-3,99 (1H, м), 4,04-4,18 (4H, м), 4,84 и 4,88 (общая 1H, каждый с), 6,33 и 6,36 (общая 1H, каждый с), 7,04-7,21 (2H, м), 7,26-7,39 (3H, м), 7,42-7,54 (1H, м);
ИК (KBr, см-1): 2935, 2514, 1727, 1716.
(Пример 251) (E)-3-{[1-(Карбоксипропил)-1H-пиразол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-189)
При использовании (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[3-(этоксикарбонил)пропил]-1H-пиразол-4-ил}метилиден)-4-сульфанилпиперидина гидрохлорида (350 мг) в качестве исходного материала способ, подобный описанному в примере 134, дал указанное в заголовке соединение (280 мг, выход: 85%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (500 МГц, пиридин-d5) δ м.д.: 0,60-0,81 (2H, м), 0,89-1,12 (2H, м), 1,76-1,93 (1H, м), 2,21-2,42 (4H, м), 2,45-2,58 (2H, м), 2,63-2,73 и 2,77-2,87 (общая 1H, каждый м), 2,89-3,02 (1H, м), 3,62 и 3,73 (общая 1H, каждый д, J=12,5), 3,77 (1H, с), 3,99-4,07 (1H, м), 4,20-4,31 (2H, м), 4,96 и 4,97 (общая 1H, каждый с), 6,50 и 6,53 (общая 1H, каждый с), 7,15-7,26 (2H, м), 1,29-1,39 (1H, м), 7,64 (1H, с), 7,65-7,73 (1H, м), 7,71 (1H, с),
ИК (KBr, см-1): 2636, 2616, 2535, 1711.
(Пример 252) (E)-3-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-{[1-(этоксикарбонилметил)-1H-пиразол-4-ил]метилиден}пирролидина гидрохлорид (соединение № 6-28)
(a) Этил (4-формил-1H-пиразол-1-ил)ацетат
К смеси 1H-пиразол-4-карбальдегида (5,5 г) и этилбромацетата (19,0 г) в дихлорметане (150 мл) добавляли 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU) (10 мл) при 0°C. Полученную смесь перемешивали при комнатной температуре в течение 30 минут и затем останавливали реакцию добавлением насыщенного водного раствора хлорида натрия. Продукты экстрагировали этилацетатом и экстракт сушили над безводным сульфатом натрия. Выпаривали в вакууме растворитель и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана и этилацетата (1:3), с получением указанного в заголовке соединения в виде бесцветного масла (8,09 г, выход: 78%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,28 (3H, т, J=7,0), 4,24 (2H, кв, J=7,0), 4,95 (2H, с), 7,99 (1H, с), 8,03 (1H, с), 9,87 (1H, с).
(b) (E)-1-(трет-Бутоксикарбонил)-4-{[1-(этоксикарбонилметил)-1H-пиразол-4-ил]метилиден}пирролидин-3-он
К раствору 1-(трет-бутоксикарбонил)пирролидин-3-она (6,8 г) в этаноле (200 мл) добавляли этил (4-формил-1H-пиразол-1-ил)ацетат (8,0 г) и пирролидин (600 мкл). Полученную смесь перемешивали при 80°C в течение 45 минут, охлаждали до комнатной температуры и выпаривали в вакууме растворитель. Остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана, этилацетата и дихлорметана (2:1:1), с получением указанного в заголовке соединения в виде желтого аморфного твердого вещества (4,47 г, выход: 35%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,28 (3H, т, J=7,0), 1,48 (9H, с), 3,93 (2H, с), 4,24 (2H, кв, J=7,0), 4,47 (2H, с), 4,92 (2H, с), 7,41 (1H, с), 7,69 (1H, с), 7,71 (1H, с).
(c) (E)-1-(трет-Бутоксикарбонил)-4-{[1-(этоксикарбонилметил)-1H-пиразол-4-ил]метилиден}пирролидин-3-ол
При использовании (E)-1-(трет-бутоксикарбонил)-4-{[1-(этоксикарбонилметил)-1H-пиразол-4-ил]метилиден}пирролидин-3-она (4,47 г) в качестве исходного материала способ, подобный описанному в примере 246(c), дал указанное в заголовке соединение (1,55 г, выход: 35%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,27 (3H, т, J=7,0), 1,47 (9H, с), 3,41 (1H, дд, J=11,5, 4,0), 3,57-3,72 (1H, м), 4,05-4,15 (1H, м), 4,23 (2H, кв, J=7,0), 4,21-4,31 (1H, м), 4,67-4,75 (1H, м), 4,88 (2H, шс), 6,49 (1H, с), 7,42 (1H, шс), 7,51 (1H, с).
(d) (E)-3-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-{[1-(этоксикарбонилметил)-1H-пиразол-4-ил]метилиден}пирролидина гидрохлорид
При использовании (E)-1-(трет-бутоксикарбонил)-4-{[1-(этоксикарбонилметил)-1H-пиразол-4-ил]метилиден}пирролидин-3-ола (1,55 г) в качестве исходного материала способ, подобный описанному в примере 246(d) и (e), дал свободное основание указанного в заголовке соединения. Свободное основание очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. HCl, 35/65, об./об.) с получением указанного в заголовке гидрохлорида (205 мг, общий выход: 9%) в виде бледно-желтого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,77-0,93 (2H, м), 0,95-1,07 (2H, м), 1,26 (3H, т, J=7,0), 2,15-2,27 (1H, м), 2,34 (3H, с), 2,72-2,85 (1H, м), 2,98-3,11 (1H, м), 3,27 и 3,73 (общая 1H, каждый д, J=14,0), 3,46 (1H, с), 4,18-4,26 (2H, м), 4,62-4,69 (1H, м), 4,71 и 4,75 (общая 1H, каждый с), 4,84 и 4,86 (общая 2H, каждый с), 6,34-6,41 (1H, м), 7,07-7,21 (2H, м), 7,24-7,42 (3H, м), 7,43-7,55 (1H, м).
(Пример 253) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-{[1-(этоксикарбонил)метил]-1H-пиразол-4-ил]метилиден}-3-сульфанилпирролидина гидрохлорид (соединение № 6-27)
При использовании (E)-3-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-{[1-(этоксикарбонилметил)-1H-пиразол-4-ил]метилиден}пирролидина гидрохлорида (205 мг) в качестве исходного материала способ, подобный описанному в примере 133, дал указанное в заголовке соединение (180 мг, выход: 96%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (500 МГц, пиридин-d5) δ м.д.: 0,60-0,78 (2H, м), 0,91-1,10 (5H, м), 2,26-2,42 (1H, м), 2,72-2,78 и 2,78-2,84 (общая 1H, каждый м), 3,18-3,28 (1H, м), 3,61 и 3,65 (общая 1H, каждый д, J=14,0),3,83 и 3,94 (общая 1H, каждый д, J=14,0), 4,00-4,08 (2H, м), 4,09-4,16 (1H, м), 4,90 и 4,93 (общая 1H, каждый с), 5,18 и 5,19 (общая 2H, каждый с), 6,64-6,70 (1H, м), 7,11-7,34 (4H, м), 7,72 и 7,75 (общая 1H, каждый с), 7,85 и 7,87 (общая 1H, каждый с);
ИК (KBr, см-1): 2931, 2512, 1747, 1711.
(Пример 254) (E)-4-{[1-(Карбоксиметил)-1H-пиразол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-сульфанилпирролидина гидрохлорид (соединение № 6-31)
При использовании (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-{[1-(этоксикарбонил)метил]-1H-пиразол-4-ил]метилиден}-3-сульфанилпирролидина (110 мг) в качестве исходного материала способ, подобный описанному в примере 134, дал указанное в заголовке соединение (87 мг, выход: 84%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, пиридин-d5) δ м.д.: 0,58-0,77 (2H, м), 0,89-1,08 (2H, м), 2,29-2,40 (1H, м), 2,70-2,77 и 2,78-2,84 (общая 1H, каждый м), 3,16-3,27 (1H, м), 3,58-3,68 (1H, м), 3,85 и 3,96 (общая 1H, каждый д, J=14,5), 4,06-4,18 (1H, м), 4,90 и 4,92 (общая 1H, каждый с),5,26 и 5,27 (общая 2H, каждый с), 6,65-6,72 (общая 1H, каждый с), 7,08-7,33 (4H, м), 7,74 и 7,76 (общая 1H, каждый с), 7,90 и 7,91 (общая 1H, каждый с);
ИК (KBr, см-1): 3404, 2925, 2528, 1744, 1710.
(Пример 255) (E)-4-(Ацетилсульфанил)-3-{[1-(карбоксиметил)-1H-1,2,3-триазол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина гидрохлорид (соединение № 2-1210)
При использовании (E)-3-{[1-(карбоксиметил)-1H-1,2,3-триазол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорида в качестве исходного материала способ, подобный описанному в примере 198, дал указанное в заголовке соединение (44 мг, выход: 23%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,70-0,76 (2H, м), 0,98-1,08 (2H, м), 1,85-1,92 (1H, м), 2,21 и 2,23 (общая 3H, каждый с), 2,24-2,34 (1H, м), 2,55-2,60 и 2,65-2,70 (общая 1H, каждый м), 2,80-2,83 и 2,8 9-2,92 (общая 1H, каждый м),3,28 и 3,46 (общая 1H, каждый д, J=12,5), 3,68-3,71, (1H, м), 3,91-4,11 (1H, м), 4,66 (1H, дд, J=8,0, 4,5), 4,97 и 4,99 (общая 1H, каждый с), 5,64-5,66 (2H, м), 6,88 и 6,89 (общая 1H, каждый с), 7,18-7,25 (1H, м), 7,31-7,36 (1H, м), 7,57-7,62 (2H, м), 8,02 и 8,06 (общая 1H, каждый с);
ИК (KBr, см-1): 1699, 1474.
(Пример 256) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({2-[2-(этоксикарбонил)этил]-2H-тетразол-5-ил}метилиден)пиперидин (соединение № 2-1630) и (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({2-[2-(этоксикарбонил)этил]-1H-тетразол-5-ил}метилиден)пиперидин (соединение № 2-1566)
Смесь (E)-4-(ацетилсульфанил)-3-{[1(2)H-тетразол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина гидротрифторацетата (пример 156, 2,0 г), 2-пропанола (25 мл), этилакрилата (4,1 мл) и триэтиламина (2,6 мл) кипятили с обратным холодильником в течение одного часа. После охлаждения реакционный раствор концентрировали в вакууме и остаток распределяли между этилацетатом и водой. Отделенный органический слой промывали последовательно водой и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана и этилацетата (2:1, затем 1,5:1 и наконец 1:1), с получением каждого из двух указанных в заголовке изомеров.
Менее полярный изомер (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({2-[2-(этоксикарбонил)этил]-2H-тетразол-5-ил}метилиден)пиперидин: желтое масло (674 мг, выход: 35%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,68-0,82 (2H, м), 0,89-1,01 (2H, м), 1,22-1,25 (3H, м), 1,97-1,99 (1H, м), 2,15-2,21 (1H, м), 2,24-2,27 (1H, м), 2,29 и 2,30 (общая 3H, каждый с), 2,47-2,53 и 2,61-2,67 (общая 1H, каждый м), 2,76-2,83 (1H, м), 2,94 и 3,00 (общая 2H, т, каждый J=7,0), 3,37 и 3,48 (общая 1H, каждый д, J=14,0), 4,17 (2H, дд, J=14,0, 7,0), 4,22-4,30 (1H, м), 4,50 (1H, м), 4,74 (2H, м), 4,77-4,81 (1H, м), 6,63 (1H, с), 7,04-7,14 (2H, м), 7,27-7,32 (1H, м), 7,36-7,40 (1H, м).
Более полярный изомер (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-тетразол-5-ил}метилиден)пиперидин: бесцветное масло (311 мг, выход: 16%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,75-0,86 (2H, м), 0,96-1,05 (2H, м), 1,23-1,28 (3H, м), 1,89-1,97 (1H, м), 2,06-2,11 (1H, м), 2,26-2,29 (1H, м), 2,82 и 2,84 (общая 3H, каждый с), 2,72-2,81 (1H, м), 2,91-2,95 (1H, м), 3,00-3,04 (2H, м), 3,37 и 3,51 (общая 1H, каждый д, J=13,5), 4,10-4,19 (2H, м), 4,36 (1H, д, J=13,5), 4,51-4,57 (3H, м), 4,79 (1H, д, J=6,0), 6,50 (1H, с), 7,05-7,18 (2H, м), 7,31-7,37 (2H, м).
(Пример 257) (E)-3-{[2-(2-Карбоксиэтил)-2H-тетразол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-1597)
Указанное в заголовке соединение (232 мг) синтезировали с выходом 37% в виде бесцветного аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({2-[2-(этоксикарбонил)этил]-2H-тетразол-5-ил}метилиден)пиперидин (674 мг), последовательным осуществлением процедур, подобных описанным в примерах 133 и 134.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,70-0,76 (2H, м), 0,95-1,01 (1H, м), 1,11-1,16 (1H, м), 1,88-1,95 (1H, м), 2,28-2,37 (1H, м), 2,41-2,50 (1H, м), 2,72-2,80 (2H, м), 2,93-3,05 (1H, м), 3,30-3,37 (2H, м), 4,04 (1H, шс), 4,18 и 4,32 (общая 1H, каждый д, J=13,0), 4,30 (1H, с), 5,00 (1H, с), 5,0С-5,12 (2H, м), 6,92 (1H, с), 7,18-7,24 (1H, м), 7,31-7,38 (1H, м), 7,66-7,71 (1H, м),
ИК (KBr, см-1): 1712, 1191.
(Пример 258) (E)-3-{[1-(2-Карбоксиэтил)-1H-тетразол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 2-1533)
Указанное в заголовке соединение (108,6 мг) синтезировали с выходом 38% в виде бесцветного аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[2-(этоксикарбонил)этил]-1H-тетразол-5-ил}метилиден)пиперидин (пример 256, более полярный изомер, 311 мг), последовательным осуществлением процедур, подобных описанным в примерах 133 и 134.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,67-0,72 (2H, м), 0,94-1,00 (1H, м), 1,08-1,16 (1H, м), 1,87-1,96 (1H, м), 2,29-2,37 (1H, м), 2,38-2,44 (1H, м), 2,65-2,70 и 2,78-2,83 (общая 1H, каждый м), 2,88-2,94 (1H, м), 3,05-3,11 (1H, м), 3,29 (2H, т, J=6,5), 4,02-4,05 и 4,09-4,12 (общая 1H, каждый м), 4,17 и 4,23 (общая 1H, каждый д, J=13,0), 4,40 (1H, дд, J=13,0, 8,0), 4,82 (2H, д, J=6,5), 5,01 и 5,02 (общая 1H, каждый с), 6,99 и 7,04 (общая 1H, каждый с), 7,14-7,20 (1H, м), 7,26-7,31 (1H, м), 7,60-7,65 (1H, м);
ИК (KBr, см-1): 1712, 1190.
(Пример 259) (Z)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1(2)H-тетразол-5-ил}метилиден)пиперидина гидротрифторацетат (соединение № 4-170)
(a) (E)-3-(2-Ацетоксиэтилиден)-1-(трет-бутоксикарбонил)-4-(трет-бутилдиметилсилилокси)пиперидин
К раствору (E)-4-(трет-бутилдиметилсилилокси)пиперидин-3-(2-гидроксиэтилиден)-1-(трифенилметил)пиперидина [пример 36(b), 20 г] в дихлорметане (100 мл) добавляли триэтиламин (17 мл) и уксусный ангидрид (11 мл) при 0°C. Полученную смесь перемешивали при комнатной температуре в течение ночи и распределяли между водой и этилацетат. Отделенный органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель выпаривали в вакууме с получением неочищенного (E)-3-(2-ацетоксиэтилиден)-4-(трет-бутилдиметилсилилокси)-1-(трифенилметил)пиперидина (22,6 г).
К раствору полученного выше соединения в дихлорметане (100 мл) добавляли трифторуксусную кислоту (3,2 мл) при 0°C. Полученную смесь перемешивали при комнатной температуре в течение 3,5 часов и еще добавляли трифторуксусную кислоту (3,2 мл). Выпаривали в вакууме растворитель и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (19:1-9:1), с получением неочищенного (E)-3-(2-ацетоксиэтилиден)-4-(трет-бутилдиметилсилилокси)пиперидина гидротрифторацетата (12,9 г) в виде желтого масла.
К раствору полученной выше соли в дихлорметане (100 мл) добавляли триэтиламин (9,5 мл) и ди(трет-бутил)дикарбонат (7,5 г) при 0°C. Полученную смесь концентрировали в вакууме и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана и этилацетата (5:1-1:1), с получением указанного в заголовке соединения в виде бесцветного масла (13,8 г, выход: 77%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,04 (3H, с), 0,07 (3H, с), 0,90 (9H, с), 1,45 (9H, с), 1,57-1,66 (1H, м), 1,75-1,86 (1H, м), 2,05 (3H, с), 3,34-3,42 (1H, м), 3,63-3,75 (1H, м), 3,78-3,90 (1H, м), 4,15-4,24 (2H, м), 4,62-4,73 (2H, м), 5,56-5,61 (1H, м).
(b) 1-(трет-Бутоксикарбонил)-4-(трет-бутилдиметилсилилокси)пиперидин-3-он
В раствор (E)-3-(2-ацетоксиэтилиден)-1-(трет-бутоксикарбонил)-4-(трет-бутилдиметилсилилокси)пиперидина (9,9 г) в дихлорметане (100 мл) вводили газообразный озон при -78°C в течение 2 часов. После удаления избыточного озона барботированием газообразного азота в течение 1 часа, добавляли при той же самой температуре трифенилфосфин (13 г). Полученную смесь перемешивали при комнатной температуре в течение одного часа и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана, этилацетата и дихлорметана (5:1:1-1:1:1), с получением указанного в заголовке соединения в виде светло-желтого масла (4,6 г, выход: 56%).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,07 (3H, с), 0,12 (3H, с), 0,90 (9H, с), 1,45 (9H, с), 1,90-2,00 (1H, м), 2,11-2,19 (1H, м), 3,50 (1Н, м), 3,76-4,01 (2H, м), 4,15-4,21 (2H, м).
(c) (Z)-1-(трет-Бутоксикарбонил)-4-(трет-бутилдиметилсилилокси)-3-(цианметилиден)пиперидин
К раствору триметилсилилацетонитрила (1,3 мл) в тетрагидрофуране (ТГФ)(30 мл) добавляли при -78°C диизопропиламид лития (2,0 M в гексане, 4,7 мл). Полученную смесь перемешивали при -78°C в течение 0,5 часа и затем добавляли при той же самой температуре раствор 1-(трет-бутоксикарбонил)-4-(трет-бутилдиметилсилилокси)пиперидин-3-она (3 г) в ТГФ (10 мл). Полученную смесь перемешивали в течение одного часа, повышая при этом температуру до комнатной температуры. Смесь концентрировали в вакууме и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана и этилацетата (9:1), с получением указанного в заголовке соединения (880 мг, выход: 27%) как менее полярного изомера в виде желтого масла.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,10 (3H, с), 0,15 (3H, с), 0,90 (9H, с), 1,45 (9H, с), 1,68-1,8 6 (2H, м), 3,25-3,40 (1H, м), 3,68-4,01 (2H, м), 4,15-4,45 (1H, м), 4,85 (1H, м), 5,19-5,29 (1H, м).
Дополнительное элюирование дало геометрический изомер (E)-1-(трет-бутоксикарбонил)-4-(трет-бутилдиметилсилилокси)-3-(цианметилиден)пиперидин (1040 мг, выход: 32%).
(d) (Z)-1-(трет-Бутоксикарбонил)-4-(трет-бутилдиметилсилилокси)-3-{[1(2)H-тетразол-5-ил]метилиден}пиперидин
Смесь (Z)-1-(трет-бутоксикарбонил)-4-(трет-бутилдиметилсилилокси)-3-(цианметилиден)пиперидина (1,09 г), 1,2-диметоксиэтана (30 мл) и азида трибутилолова (1,3 мл) перемешивали при 110°C в течение 7 суток. После охлаждения реакционной смеси выпаривали в вакууме растворитель. Остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана и этилацетата (4:1), с получением указанного в заголовке соединения в виде бесцветного твердого вещества (750 мг, выход: 61%).
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0,10 (3H, с), 0,19 (3H, с), 0,96 (9H, с), 1-60 (9H, с), 1,85-2,02 (2H, м), 3,53-3,66 (1H, м), 3,97-4,08 (1H, м), 4,12-4,23 (1H, м), 4,45-4,56 (1H, м), 6,19-6,29 (1H, м), 6,48 (1Н, шс).
(e) (Z)-1-(трет-Бутоксикарбонил)-4-(трет-бутилдиметилсилилокси)-3-{[2-(4-метоксибензил)-2H-тетразол-5-ил]метилиден}пиперидин и (Z)-1-(трет-бутоксикарбонил)-4-(трет-бутилдиметилсилилокси)-3-{[1-(4-метоксибензил)-1H-тетразол-5-ил]метилиден}пиперидин
К раствору (Z)-1-(трет-бутоксикарбонил)-4-(трет-бутилдиметилсилилокси)-3-{[1(2)H-тетразол-5-ил]метилиден}пиперидина (750 мг) в смешанном растворителе из дихлорметана (10 мл) и ацетонитрила (10 мл) добавляли триэтиламин (530 мкл) и 4-метоксибензилхлорид (520 мкл). Полученную смесь перемешивали при 80°C в течение 2,5 часов и еще добавляли триэтиламин (530 мкл) и 4-метоксибензилхлорид (260 мкл). После охлаждения реакционной смеси ее концентрировали в вакууме и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана и этилацетата (3:1), с получением каждого из двух указанных в заголовке изомеров (какой продукт, какому изомеру соответствует, еще не определятся).
Менее полярный изомер: 500 мг, выход: 51%, желтое масло.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 0,16 (3H, с), 0,22 (3H, с), 1,04 (9H, с), 1,66 (9H, с), 1,90-2,01 (2H, м), 3,46-3,65 (1H, м), 4,01 (3H, с), 4,05-4,28 (2H, м), 4,41-4,69 (1H, м), 5,85 (1H, д, J=14,5),5,93 (1H, д, J=14,5), 6,01 (1H, м), 6,50-6,62 (1H, м), 7,10 (2H, д, J=8,5), 7,54 (2H, д, J=8,5).
Более полярный изомер: 330 мг, выход: 33%.
(f) (Z)-1-(трет-Бутоксикарбонил)-3-{[2-(4-метоксибензил)-2H-тетразол-5-ил]метилиден}пиперидин-4-ол или (Z)-1-(трет-бутоксикарбонил)-3-{[1-(4-метоксибензил)-1H-тетразол-5-ил]метилиден}пиперидин-4-ол
К раствору полученного выше менее полярного изомера (500 мг) в тетрагидрофуране (ТГФ, 5 мл) добавляли тетрабутиламмонийфторид (1,0 M в ТГФ, 2,0 мл). Полученную смесь перемешивали при комнатной температуре в течение 1,75 часа и дополнительно добавляли тетрабутиламмонийфторид (1,0 M в ТГФ, 0,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 0,25 часа и еще добавляли тетрабутиламмонийфторид (1,0 M в ТГФ, 0,5 мл). Реакционную смесь перемешивали в течение 0,25 часа и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (19:1), с получением одного из двух указанных в заголовке соединений в виде желтого масла (460 мг, выход: количественный).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,46 (9H, с), 1,90-2,02 (2H, м), 3,44-3,69 (2H, м), 3,80 (3H, с), 4,21-4,37 (1H, м), 5,03-5,16 (1H, м), 5,67 (1H, д, J=14,0), 5,71 (1H, д, J=14,0), 6,44-6,55 (1H, м), 6,90 (2H, д, J=8,5), 7,35 (2H, д, J=8,5).
(g) (Z)-4-(Ацетилсульфанил)-3-{[2-(4-метоксибензил)-2H-тетразол-5-ил]метилиден}пиперидина гидрохлорид или (Z)-4-(ацетилсульфанил)-3-{[1-(4-метоксибензил)-1H-тетразол-5-ил]метилиден}пиперидина гидрохлорид
Раствор полученного выше соединения (480 мг), дихлорметана (10 мл), триэтиламина (400 мкл) и метансульфонилхлорида (220 мкл) перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь распределяли между водой и дихлорметаном, отделенный органический слой промывали водой и сушили над безводным сульфатом натрия. Растворитель выпаривали в вакууме с получением неочищенного мезилата. К раствору мезилата в диметилсульфоксиде добавляли тиоацетат калия (680 мг). Реакционную смесь перемешивали при 50°C в течение 30 минут и распределяли между водой и этилацетатом. Отделенный органический слой промывали последовательно водой и насыщенным водным раствором хлорида натрия и сушили над безводным хлоридом натрия. Растворитель выпаривали в вакууме с получением неочищенного тиоацетата в виде коричневого масла (520 мг). Полученное масло обрабатывали 4 н. раствором хлороводорода в диоксане (10 мл) при комнатной температуре в течение 0,5 часа. Растворитель и избыточный хлороводород выпаривали в вакууме и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (19:1-9:1), с получением одного из двух указанных в заголовке соединений в виде желтого твердого вещества (190 мг, общий выход: 39%).
1H ЯМР (500 МГц, ДМСО-d6) δ м.д.: 1,93-2,00 (1с, м), 2,180-2,27 (1Н, м), 2,35 (3H, с), 3,10-3,18 (1H, м), 3,27-3,37 (1H, м), 3,68 (1H, д, J=14,0), 3,74 (3H, с), 4,02 (1H, д, J=14,0), 5,75 (1H, м), 5,82 (1H, д, J=14,5), 5,87 (1H, д, J=14,5), 6,80 (1H, шс), 6,94 (2H, д, J=8,5), 7,36 (2H, д, J=8,5).
(h) (Z)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1(2)H-тетразол-5-ил}метилиден)пиперидина гидротрифторацетат
Раствор полученного на стадии (g) соединения (190 мг), ацетонитрила (5 мл), N,N-диметилформамида (5 мл), 2-бром-2-(2-фторфенил)-1-циклопропилэтанона (225 мг) и триэтиламина (240 мкл) перемешивали при комнатной температуре в течение 1,5 часов. Реакционную смесь концентрировали в вакууме и полученный желтый маслянистый остаток распределяли между этилацетатом и водой. Отделенный органический слой концентрировали и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана, этилацетата и дихлорметана (2:1:1), с получением требуемого алкилированного продукта в виде желтого аморфного твердого вещества (150 мг).
Полученный выше продукт обрабатывали трифторуксусной кислотой (8 мл) при 60-70°C в течение 3 часов. После охлаждения реакционной смеси до комнатной температуры ее концентрировали в вакууме и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (9:1), с получением указанного в заголовке продукта в виде желтого масла (150 мг, общий выход: 58%).
1H ЯМР (400 МГц, пиридин-d5) δ м.д.: 0,75-0,90 (2H, м), 1,00-1,17 (2H, м), 2,01-2,12 (1H, м), 2,21 (3H, с), 2,37-2,52 (2H, м), 2,54-2,63 и 2,76-2,85 (общая 1H, каждый м), 2,95-3,02 и 3, 05-3,13 (общая 1H, каждый м), 3,13 и 3,29 (общая 1H, каждый д, J=12,5), 3,65 и 3,75 (общая 1H, каждый д, J=12,5), 4,96 и 5,01 (общая 1H, каждый с), 6,50 (1H, м), 6,78 и 6,83 (общая 1H, каждый шс), 7,22-7,28 (2H, м), 7,31-7,38 (1H, м), 7,61-7,69 (1H, м).
(Пример 260) (Z)-3-{[1(2)H-Тетразол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 4-169)
Указанное в заголовке соединение (70 мг) синтезировали с выходом 60% в виде бесцветного аморфного твердого вещества, используя (Z)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[1(2)H-тетразол-5-ил}метилиден)пиперидина гидротрифторацетат (150 мг) в качестве исходного материала, осуществлением процедуры, подобной описанной в примере 133.
1H ЯМР (500 МГц, пиридин-d5) δ м.д.: 0,76-0,92 (2H, м), 0,99-1,15 (2H, м), 1,82-1,96 (1H, м), 2,28-2,51 (2H, м), 2,62-2,70 и 2,85-2,95 и 2,98-3,04 (общая 2H, каждый м), 3,50 и 3,60 (общая 1H, каждый д, J=12,5),3,61 и 3,73 (общая 1H, каждый д, J=12,5),4,94 и 5,00 (общая 1H, каждый с), 5,83-5,87 (1H, м), 6,56 и 6,64 (общая 1H, каждый с), 7,22-7,29 (2H, м), 7,34-7,41 (1H, м), 7,64-7,69 (1H, м);
ИК (KBr, см-1): 2560, 1711.
(Пример 261) (E)-4-(Ацетилсульфанил)-3-{[1-(3-карбоксипропил)-1H-1,2,3-триазол-5-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидин (соединение № 2-1217)
К раствору (E)-3-{[1-(3-карбоксипропил)-1H-1,2,3-триазол-5-ил]метилиден}-1-[2-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорида (пример 140, 510 мг) в дихлорметане (5 мл) добавляли пиридин (250 мкл) и уксусный ангидрид (150 мкл). Полученную смесь перемешивали при комнатной температуре в течение 2 часов, добавляя при этом дополнительные пиридин (98 мкл) и уксусный ангидрид (113 мкл). Реакционную смесь концентрировали в вакууме и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (29:1), с получением указанного в заголовке продукта в виде бесцветного масла (450 мг, выход: 83%).
1H ЯМР (500 МГц, пиридин-d5) δ м.д.: 0,63-0,79 (2H, м), 0,95-1,10 (2H, м), 1,87-1,98 (1H, м), 2,15 (3H, с), 2,24-2,41 (4H, м), 2,57 (2H, т, J=7,0), 2,60 и 2,69 (общая 1H, каждый м), 2,81-2,88 и 2,90-2,98 (общая 1H, каждый м),3,26 и 3,44 (общая 1H, каждый д, J=13,0), 3,90 (1H, д, J=13,0), 4,58 (2H, т, J=7,0), 4,70-4,74 (1H, м), 4,98 и 5,00 (общая 1H, каждый с), 6,75 и 6,76 (общая 1H, каждый шс), 7,18-7,26 (2Н, м), 7,30-7,37 (1Н, м), 7,55-7,66 (1H, м), 7,94 и 7,99 (общая 1H, каждый шс).
(Пример 262) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[3-(N-гидроксикарбамоил)пропил]-1H-1,2,3-триазол-5-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (соединение № 2-1265)
К раствору (E)-4-(ацетилсульфанил)-3-{[1-(3-карбоксипропил)-1H-1,2,3-триазол-5-ил]метилиден}-1-[2-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина (450 мг) в дихлорметане (5 мл) добавляли изобутилхлорформиат (270 мкл) и триэтиламин (375 мкл) при 0°C. Полученную смесь перемешивали при комнатной температуре в течение 10 минут и добавляли O-(трет-бутилдиметилсилил)гидроксиламин (300 мг). Полученную смесь перемешивали при комнатной температуре в течение одного часа, концентрировали в вакууме и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (19:1), с получением (E)-4-(ацетилсульфанил)-3-[(1-{3-[N-(трет-бутилдиметилсилилокси)карбамоил]пропил}-1H-1,2,3-триазол-5-ил)метилиден]-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина (330 мг с примесями) в виде бесцветного масла.
К раствору полученного выше масла в дихлорметане (5 мл) добавляли 4 н. раствор хлороводорода в диоксане (530 мкл). Полученную смесь перемешивали при комнатной температуре в течение 30 минут и концентрировали в вакууме с получением неочищенного (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[3-(N-гидроксикарбамоил)пропил]-1H-1,2,3-триазол-5-ил}метилиден)пиперидина гидрохлорида.
К раствору полученного выше соединения в метаноле (5 мл) добавляли карбонат натрия (150 мг). Раствор перемешивали при комнатной температуре в течение 30 минут и добавляли к нему 4 н. раствор хлороводорода в диоксане (800 мкл). Полученную реакционную смесь концентрировали в вакууме и остаток очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. HCl, 20/80, об./об.) с получением указанного в заголовке соединения в виде бесцветного аморфного твердого вещества (60 мг, общий выход: 13%).
1H ЯМР (500 МГц, пиридин-d5) δ м.д.: 0,63-0,81 (2H, м), 0,92-1,06 (2H, м), 1,84-1,95 (1H, м), 2,23-2,48 (6H, м), 2,65-2,78 (1H, м), 2,83-3,01 (1H, м), 3,59 (1H, д, J=12,5), 3,70 и 3,78 (общая 1H, каждый д, J=12,5), 4,09-4,14 (1H, м), 4,53 (2H, т, J=l,0), 4,96 и 4,97 (общая 1H, каждый с), 6,72 и 6,73 (общая 1H, каждый шс), 7,20-7,27 (2H, м), 7,32-7,39 (1H, м), 7,59-7,66 (1H, м), 7,85 и 7,91 (общая 1H, каждый шс),
ИК (KBr, см-1): 2558, 1710, 1651.
(Пример 263) (E)-4-(Ацетилсульфанил)-3-{[1-(3-карбоксипропил)-1H-1,2,3-триазол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидин (соединение № 2-1154)
Указанное в заголовке соединение (410 мг) синтезировали с выходом 85% в виде бесцветного масла, используя (E)-3-{[1-(3-карбоксипропил)-1H-1,2,3-триазол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (пример 143, 500 мг) в качестве исходного материала, осуществлением процедуры, подобной описанной в примере 261.
1H ЯМР (600 МГц, пиридин-d5) δ м.д.: 0,66-0,79 (2H, м), 0,98-1,06 (1H, м), 1,09-1,22 (1H, м), 1,90-2,01 (1H, м), 2,15 (3H, с), 2,28-2,47 (4H, м), 2,54 (2H, м), 2,69 и 2,75 (общая 1H, каждый м), 2,88-2,98 (1H, м), 3,52 и 3,57 (общая 1H, каждый д, J=12,5), 4,46-4,57 (3H, м), 4,76 (1H, м), 5,00 и 5,02 (общая 1H, каждый с), 6,90 и 6,92 (общая 1H, каждый шс), 7,18-7,26 (2H, м), 7,30-7,39 (1H, м), 7,63-7,71 (1H, м), 7,86 и 7,95 (общая 1H, каждый шс).
(Пример 264) (E)-1-[2-Циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-[3-(N-гидроксикарбамоил)пропил]-1H-1,2,3-триазол-4-ил}метилиден)-4-сульфанилпиперидина гидрохлорид (соединение № 2-1201)
Указанное в заголовке соединение (70 мг) синтезировали с выходом 16% в виде бесцветного аморфного твердого вещества, используя (E)-4-(ацетилсульфанил)-3-{[1-(3-карбоксипропил)-1H-1,2,3-триазол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидин (410 мг) в качестве исходного материала, осуществлением процедуры, подобной описанной в примере 262.
1H ЯМР (500 МГц, пиридин-d5) δ м.д.: 0,64-0,80 (2H, м), 0,94-1,04 (1H, м), 1,07-1,18 (1H, м), 1,84-1,95 (1H, м), 2,29-2,51 (6H, м), 2,73-2,82 (1H, м), 2,90-2,98 и 3,00-3,08 (общая 1H, каждый м), 3,97-4,10 и 4,23-4,31 (общая 3H, каждый м), 4,48-4,58 (2H, м), 5,02 (1H, шс), 6,78 и 6,81 (общая 1H, каждый шс), 7,18-7,29 (2H, м), 7,34-7,44 (1H, м), 7,65-7,75 (1H, м), 7,86 и 7,97 (общая 1H, каждый шс);
ИК (KBr, см-1): 1710, 1653.
(Пример 265) (Z)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[5-(этоксикарбонил)-1H-1,2,3-триазол-4-ил}метилиден)пиперидина гидрохлорид (соединение № 1-213)
(a) Этил 5-формил-1-(4-метоксибензил)-1H-1,2,3-триазол-4-карбоксилат и этил 4-формил-1-(4-метоксибензил)-1H-1,2,3-триазоле-5-карбоксилат
К раствору триметил(проп-2-инилокси)силана (15 мл) в тетрагидрофуране (100 мл) добавляли бутиллитий (2,6 M в гексане, 38 мл) при -78°C. Полученную смесь перемешивали при той же самой температуре в течение 0,5 часа и добавляли к ней этилхлорформиат (10 мл). Полученную смесь перемешивали при -78°C в течение 1,5 часов и вливали в ледяную воду. Полученные материалы экстрагировали этилацетатом. Органический слой промывали последовательно водой и насыщенным водным раствором хлорида натрия. Экстракт сушили над безводным сульфатом натрия и растворители выпаривали в вакууме с получением этил 4-(триметилсилилокси)бут-2-иноата (16,5 г).
Раствор полученного выше соединения (16,5 г) и 4-метоксибензилазида в толуоле (200 мл) перемешивали при 120°C в течение 8 часов. После охлаждения реакционной смеси до комнатной температуры к ней добавляли тетрабутиламмонийфторид (1,0 M в тетрагидрофуране) и полученную смесь перемешивали при комнатной температуре в течение 0,5 часа. Смесь распределяли между водой и этилацетатом. Отделенный органический слой промывали последовательно водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия. Растворители выпаривали в вакууме с получением смеси этил 5-(гидроксиметил)-1-(4-метоксибензил)-1H-1,2,3-триазол-4-карбоксилата и этил 4-(гидроксиметил)-1-(4-метоксибензил)-1H-1,2,3-триазол-5-карбоксилата (25 г) в виде коричневого масла.
Описанный выше неочищенный продукт (26 г, включая продукт, подобным образом полученный в другом опыте) растворяли в дихлорметане (500 мл) и к раствору добавляли молекулярные сита 4Å (50 г). При перемешивании смеси при 20°C добавляли к ней пиридинийдихромат (47 г) в течение 30 минут. Полученную смесь перемешивали при комнатной температуре в течение 1,5 часов и фильтровали. Осадок промывали дихлорметаном. Фильтрат и промывную жидкость объединяли. Выпаривали в вакууме растворители и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (19:1), с получением смеси двух указанных в заголовке соединений в виде коричневого масла. Смесь опять очищали хроматографией на силикагеле с получением менее полярного изомера из двух указанных в заголовке соединений в виде желтого масла (10,9 г).
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,44 (3H, т, J=7,0), 3,77 (3H, с), 4,50 (2H, кв, J=7,0), 5,85 (2H, с), 6,84 (2H, д, J=9,0), 7,33 (2H, д, J=9,0), 10,47 (1H, с).
(b) (E)-3-{[4-(Этоксикарбонил)-1-(4-метоксибензил)-1H-1,2,3-триазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-она или (E)-3-{[5-(этоксикарбонил)-1-(4-метоксибензил)-1H-1,2,3-триазол-4-ил]метилиден}-1-(трифенилметил)пиперидин-4-он
Обработкой менее полярного изомера, полученного в примере 265 (a) (10,9 г), 1-(трифенилметил)пиперидин-4-оном (14,0 г) способом, подобным описанному в примере 132(c), получали одно из двух указанных в заголовке соединений (региоизомер, соответствующий использованному исходному материалу, 7,2 г, выход: 31%) в виде бледно-желтого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,30 (3H, т, J=7,0), 2,59 (2H, шс), 2,75 (2Н, т, J=6,0), 2,92 (2H, шс), 3,77 (3H, с), 4,28 (2H, кв, J=7,0), 5,40 (2H, с), 6,86 (2H, д, J=8,5), 7,10-7,23 (12H, м), 7,24-7,32 (6H, м).
(c) (E)-3-{[4-(Этоксикарбонил)-1-(4-метоксибензил)-1H-1,2,3-триазол-5-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол или (E)-3-{[5-(этоксикарбонил)-1-(4-метоксибензил)-1H-1,2,3-триазол-4-ил]метилиден}-1-(трифенилметил)пиперидин-4-ол
При использовании соединения, полученного на стадии (b) (3,6 г), в качестве исходного материала, получали одно из двух указанных в заголовке соединений (региоизомер, соответствующий исходному материалу, использованному на стадии (b), 3,6 г, выход: количественный) в виде бесцветного твердого вещества.
1H ЯМР (500 МГц, CDCl3) δ м.д.: 1,32 (3H, м), 1,81-1,93 (2H, м), 1,95-2,03 (1H, м), 2,06-2,14 (1H, м), 2,83-2,99 (1H, м), 3,09-3,34 (1H, м), 3,77 (3H, с), 4,05-4,16 (1H, м), 4,33 (2H, м), 5,44 (2H, м), 6,39 (1H, шс), 6,82-6,92 (2H, м), 6,97-7,22 (17H, м).
(d) (E)-4-(Ацетилсульфанил)-3-{[4-(этоксикарбонил)-1-(4-метоксибензил)-1H-1,2,3-триазол-5-ил]метилиден}пиперидина гидротрифторацетат или (E)-4-(ацетилсульфанил)-3-{[5-(этоксикарбонил)-1-(4-метоксибензил)-1H-1,2,3-триазол-4-ил]метилиден}пиперидина гидротрифторацетат
Используя в качестве исходного материала соединение (3,6 г), полученное на стадии (c), проводили реакцию способом, подобным описанному в примере 132(e). Неочищенные продукты очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана и этилацетата (1:1), с получением одного (региоизомера, соответствующего исходному материалу, использованному на стадии (b)) из (E)-4-(ацетилсульфанил)-3-{[4-(этоксикарбонил)-1-(4-метоксибензил)-1H-1,2,3-триазол-5-ил]метилиден}-1-(трифенилметил)пиперидина или (E)-4-(ацетилсульфанил)-3-{[5-(этоксикарбонил)-1-(4-метоксибензил)-1H-1,2,3-триазол-4-ил]метилиден}-1-(трифенилметил)пиперидина (2,6 г, выход: 65%) в виде оранжевого аморфного твердого вещества.
Трифенилметильную группу полученного выше соединения удаляли способом, подобным описанному в примере 132(f), и неочищенный продукт очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (19:1-9:1), с получением одного из двух указанных в заголовке соединений (региоизомера, соответствующего исходному материалу, использованному на стадии (b), 1,7 г, выход на стадии удаления трифенилметильной группы: 52%) в виде оранжевого аморфного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1,39 (3H, т, J=7,0), 2,11-2,20 (1H, м), 2,36-2,52 (1H, м), 2,40 (3H, с), 3,21-3,31 (1H, м), 3,33-3,42 (1H, м), 3,52 (1H, д, J=14,5), 3,63 (1H, д, J=14,5), 3,80 (3H, с), 4,37 (2H, кв, J=7,0), 4,54 (1H, м), 5,39 (1H, д, J=15,0), 5,45 (1H, д, J=15,0), 6,38 (1H, с), 6,87 (2H, д, J=8,5), 7,17 (2H, д, J=8,5).
(e) (Z)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[5-(этоксикарбонил)-1H-1,2,3-триазол-4-ил}метилиден)пиперидина гидрохлорид
Соединение (1,7 г), полученное на стадии (d), обрабатывали 2-бром-2-(2-фторфенил)-1-циклопропилэтаноном (1,0 г) способом, подобным описанному в примере 132 (g). Неочищенный продукт очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана и этилацетата (1:1), с получением одного (региоизомера, соответствующего исходному материалу, использованному на стадии (b)) из (E)-4-(ацетилсульфанил)-3-{[4-(этоксикарбонил)-1-(4-метоксибензил)-1H-1,2,3-триазол-5-ил}метилиден)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина или (E)-4-(ацетилсульфанил)-3-{[5-(этоксикарбонил)-1-(4-метоксибензил)-1H-1,2,3-триазол-4-ил}метилиден)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]пиперидина (2,0 г с примесями) в виде желтого аморфного твердого вещества.
Полученное выше соединение обрабатывали трифторуксусной кислотой при 80°C в течение одного часа. После охлаждения смеси до комнатной температуры добавляли к реакционной смеси насыщенный водный раствор гидрокарбоната натрия и продукты экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Выпаривали в вакууме растворитель и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (19:1), с получением свободного основания указанного в заголовке соединения. Указанное свободное основание обрабатывали 4 н. раствором хлороводорода в диоксане (0,5 мл) и удаляли в вакууме растворитель и избыточный HCl с получением указанного в заголовке соединения в виде бледно-желтого аморфного твердого вещества (440 мг, общий выход: 23%).
1H ЯМР (500 МГц, пиридин-d5) δ м.д.: 0,61-0,75 (2H, м), 0,90-0,98 (1H, м), 1,04-1,15 (1H, м), 1,30 (3H, т, J=7,0), 1,94-2,06 (1H, м), 2,30 (3H, с), 2,35-2,54 (2H, м), 2 , 57-2,65 и 2,76-2,83 (общая 1H, каждый м), 2,87-2,95 (1H, м), 3,77 и 3,80 (общая 1H, каждый д, J=13,0), 4,40 и 4,41 (общая 2H, каждый кв, J=7,0), 4,65 и 4,82 (общая 1H, каждый д, J=13,0), 4,85 и 4,88 (общая 1H, каждый м), 4,98 и 5,00 (общая 1H, каждый с), 7,12-7,30 (3H, м), 7,55 и 7,56 (общая 1H, каждый с), 7,64-7,72 (1H, м);
ИК (KBr, см-1): 1713.
(Пример 266) (E)-3-{[5-Карбокси-(1H-1,2,3-триазол-4-ил)метилиден-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 1-210)
Используя в качестве исходного материала (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[5-(этоксикарбонил)-1H-1,2,3-триазол-4-ил}метилиден)пиперидина гидрохлорид (380 мг), удаляли ацетильную и этильную группы способами, подобными описанным в примерах 133 и 134. Неочищенные продукты очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. HCl, 25/75, об./об.) с получением указанного в заголовке соединения (170 мг, выход: 52%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (500 МГц, пиридин-d5) δ м.д.: 0,62-0,76 (2H, м), 0,89-0,97 (1H, м), 1,07-1,18 (1H, м), 1,85-1,99 (1H, м), 2,32-2,43 (1H, м), 2,47-2,57 (1H, м), 2,72-2,83 (1H, м), 2,87-2,95 и 3,01-3,10 (общая 1H, каждый м), 4,15 и 4,21 (общая 1H, каждый м), 4,16 и 4,26 (общая 1H, каждый д, J=13,0), 4,47 и 4,68 (общая 1H, каждый д, J=13,0), 4,98 и 5,00 (общая 1H, каждый с), 7,13-7,32 (3H, м), 7,62 и 7,64 (общая 1H, каждый с), 7,67-7,75 (1H, м);
ИК (KBr, см-1): 2565, 1713.
(Пример 267) (E)-3-{[5-Карбокси-2-(3-карбоксипропил)-2H-1,2,3-триазол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорид (соединение № 1-214)
Смесь (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[5-(этоксикарбонил)-1H-1,2,3-триазол-4-ил}метилиден)пиперидина гидрохлорида (680 мг), ацетонитрила (20 мл), этил 4-бромбутилата (300 мкл) и 1,8-диазабицикло[5.4.0]ундец-7-ена (DBU) (310 мкл) перемешивали при комнатной температуре в течение одного часа и затем при 50°C в течение 1,5 часов. Выпаривали в вакууме растворитель и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана, этилацетата и дихлорметана (1:1:1), с получением (E)-4-(ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[5-(этоксикарбонил)-2-[3-(этоксикарбонил)пропил]-2H-1,2,3-триазол-4-ил}метилиден)пиперидина (630 мг с примесями) в виде желтого масла.
Полученное выше соединение деацетилировали способом, подобным описанному в примере 133. Реакционную смесь концентрировали в вакууме с получением неочищенного (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-{[5-(этоксикарбонил)-2-[3-(этоксикарбонил)пропил]-2H-1,2,3-триазол-4-ил}метилиден)-4-сульфанилпиперидина гидрохлорида (620 мг с примесями) в виде желтого масла. Полученное соединение деэтилировали способом, подобным описанному в примере 134. Остаток, полученный после концентрирования реакционной смеси, очищали препаративной ВЭЖХ (YMC-Pack ODS-A; YMC, элюент: ацетонитрил/0,024 н. HCl, 25/75, об./об.) с получением указанного в заголовке соединения (200 мг, общий выход: 27%) в виде бесцветного аморфного твердого вещества.
1H ЯМР (500 МГц, пиридин-d5) δ м.д.: 0,63-0,81 (2H, м), 0,91-1,00 (1H, м), 1,05-1,13 (1H, м), 1,86-1,99 (1H, м), 2,33-2,54 (4H, м), 2,59-2,68 (2H, м), 2,74-2,81 и 2,86-2,93 (общая 1H, каждый м), 2,97-3,07 (1H, м), 3,90 и 4,19 (общая 1H, каждый д, J=13,0), 4,13-4,2 0 (1H, м), 4,32 и 4,48 (общая 1H, каждый д, J=13,0), 4,54-4,70 (2H, м), 5,00 и 5,03 (общая 1H, каждый с), 7,18-7,30 (2H, м), 7,35-7,45 (1Н, м), 7,57 и 7,60 (общая 1H, каждый с), 7,70-7,76 (1H, м);
ИК (KBr, см-1): 2564, 1713.
(Пример 268) (E)-4-(Ацетилсульфанил)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({5-(этоксикарбонил)-2-[3-(этоксикарбонил)пропил]-2H-1,2,3-триазол-4-ил}метилиден)пиперидина гидрохлорид (соединение № 1-219)
Хлороводород пропускали через раствор (E)-3-{[5-карбокси-2-(3-карбоксипропил)-2H-1,2,3-триазол-4-ил]метилиден}-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-4-сульфанилпиперидина гидрохлорида (140 мг) в этаноле (20 мл) при охлаждении льдом в течение 3 часов. Смесь перемешивали в герметически закрытом состоянии при комнатной температуре в течение ночи. Растворитель и избыточный хлороводород удаляли в вакууме. К остатку добавляли воду и полученную смесь концентрировали в вакууме для дополнительного удаления растворителей и хлороводорода. Остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана и метанола (19:1), с получением (E)-1-[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-3-({1-(этоксикарбонил)-2-[3-(этоксикарбонил)пропил]-2H-1,2,3-триазол-3-ил}метилиден)-4-сульфанилпиперидина гидрохлорида (80 мг с примесями) в виде бесцветного масла. К раствору полученного соединения в дихлорметане (5 мл) добавляли триэтиламин (50 мкл) и ацетилхлорид (15 мкл). Перемешивая полученную смесь при комнатной температуре в течение одного часа, дополнительно добавляли триэтиламин (50 мкл) и ацетилхлорид (15 мкл). Реакционную смесь концентрировали в вакууме и остаток очищали хроматографией на силикагеле, используя в качестве элюента смесь гексана, этилацетата и дихлорметана (3:2:3), с получением свободного основания указанного в заголовке соединения. К раствору свободного основания в дихлорметане добавляли 4 н. хлороводород в диоксане (70 мкл) и растворитель и избыточный хлороводород удаляли при пониженном давлении. Дополнительная очистка азеотропным выпариванием с водой дала указанное в заголовке соединение в виде бледно-желтого аморфного твердого вещества (70 мг, выход 42%).
1H ЯМР (500 МГц, пиридин-d5) δ м.д.: 0,65-0,83 (2H, м), 0,94-1,02 (1H, м), 1,06-1,12 (1H, м), 1,14 и 1,15 (общая 3H, каждый т, J=7,0), 1,31 и 1,32 (общая 3H, каждый т, J=7,0), 1,94-2,05 (1H, м), 2,24-2,50 (6H, м), 2,32 и 2,33 (общая 3H, каждый с), 2,69-2,78 (1H, м), 2,85-2,93 и 2,97-3,03 (общая 1H, каждый м), 3,51 и 3,80 (общая 1H, каждый д, J=13,5), 4,10 и 4,11 (общая 2H, каждый кв, J=7,0), 4,40 и 4,41 (общая 2H, каждый кв, J=7,0), 4,44-4,61 (3H, м), 4,78-4,83 (1H, м), 4,98 и 5,04 (общая 1H, каждый с), 7,22-7,33 (2H, м), 7,37-7,46 (2H, м), 7,67-7,73 (1H, м);
ИК (KBr, см-1): 1730.
(Пример 1 испытаний) Подтверждение ингибирующей активности испытуемых соединений в отношении коагуляции тромбоцитов in vitro
В данном испытании использовали три-четыре крысы-самца Sprague-Dawley (возраст 8 недель, Japan SLC., Inc.) в группе. Коагуляцию тромбоцитов определяли с помощью агрегометра тромбоцитов (MCM Hema Tracer 313M, MC Medical, Inc.) по методике, описанной Born et al. (Journal of Physiology, vol. 168, 178 (1963)). Кровь (6,3 мл) брали из брюшной аорты крыс, анестезированных натрий-пентобарбиталом (40 мг/кг), микрошприцем, содержащим в качестве антикоагулянта 0,7 мл цитрата натрия с концентрацией 3,8%. Полученную кровь, содержащую цитрат натрия, центрифугировали (230 x g в течение 15 минут при комнатной температуре) и выделяли фракцию богатой тромбоцитами плазмы (далее называемой как PRP). Кроме того, после выделения PRP кровь дополнительно центрифугировали (2,000 x g в течение 10 минут при комнатной температуре) и выделяли фракцию бедной тромбоцитами плазмы (далее называемой как PPP). Количество тромбоцитов в PRP определяли с помощью автоматизированного гематологического анализатора (KX-21N, SYSMEX CORPORATION) и доводили до 5 × 108/мл. После помещения в каждую кювету PRP (239 мкл) к раствору PRP добавляли испытуемое вещество, растворенное в диметилсульфоксиде (ДМСО, 1 мкл), и оценивали состояние с помощью автоматизированного гематологического анализатора. В контрольной группе вместо раствора испытуемого соединения к раствору PRP добавляли раствор ДМСО (1 мкл). После прогревания при 37°C в течение 1,5 минут добавляли 10 мкл раствора аденозин-5'-дифосфата (АДФ) (конечная концентрация: 10 мкл) и вызывали коагуляцию тромбоцитов. Коагуляцию тромбоцитов определяли в течение 5 минут, после чего определяли максимальную степень коагуляции. Результаты показаны в таблице 7.
Как показано в таблице 7, соединения по настоящему изобретению обладают заметной ингибирующей активностью в отношении коагуляции тромбоцитов. Следовательно, предлагаемые соединения могут быть пригодны в качестве антикоагулянтов.
(Пример 2 испытания) Подтверждение ингибирующей активности испытуемых соединений в отношении коагуляции тромбоцитов ex vivo
В данном испытании использовали три-четыре крысы-самца Sprague-Dawley (возраст 8 недель, Japan SLC., Inc.) в группе. Коагуляцию тромбоцитов определяли с помощью агрегометра тромбоцитов (MCM Hema Tracer 313M, MC Medical, Inc.) по методике, описанной Born et al. (Journal of Physiology, vol. 168, 178 (1963)). За 4 часа до взятия крови крысам вводили перорально испытуемые соединения, растворенные в 5% растворе аравийской камеди или суспендированные в смешанном растворе, состоящем из 10% диметилацетамида, 6,4% полиэтиленгликоля 400 и 16% Твин 80, в объеме 1 мл/кг. В контрольной группе аналогичным образом за 4 часа до взятия крови вводили перорально носитель в объеме 1 мл/кг. Кровь (6,3 мл) брали из брюшной аорты крыс, анестезированных натрий-пентобарбиталом (40 мг/кг), микрошприцем, содержащим в качестве антикоагулянта 0,7 мл цитрата натрия с концентрацией 3,8%. Полученную кровь, содержащую цитрат натрия, центрифугировали (230 x g в течение 15 минут при комнатной температуре) и выделяли фракцию PRP. Кроме того, после выделения PRP кровь дополнительно центрифугировали (2,000 x g в течение 10 минут при комнатной температуре) и выделяли фракцию PPP. Количество тромбоцитов в PRP определяли с помощью автоматизированного гематологического анализатора (KX-21N, SYSMEX CORPORATION) и доводили до 5 × 108/мл. После помещения в каждую кювету PRP (240 мкл) оценивали коагуляцию тромбоцитов с помощью автоматизированного гематологического анализатора. После прогревания при 37°C в течение 1,5 минут добавляли 10 мкл раствора АДФ (конечная концентрация: 3 мкл) и вызывали коагуляцию тромбоцитов. Коагуляцию тромбоцитов определяли в течение 5 минут, после чего определяли максимальную степень коагуляции. Результаты показаны в таблице 8.
Как показано в таблице 8, соединения по настоящему изобретению обладают заметной ингибирующей активностью в отношении коагуляции тромбоцитов. Следовательно, предлагаемые соединения могут быть пригодны в качестве антикоагулянтов.
(Пример 1 изготовления лекарственного средства) Твердые капсулы
Отдельные капсулы изготавливают помещением 100 мг соединения примера 1, 150 мг лактозы, 50 мг целлюлозы и 6 мг стеарата магния в капсулы обычной конструкции, состоящие из двух частей, после чего капсулы промывают и высушивают.
(Пример 2 изготовления лекарственного средства) Мягкие капсулы
Отдельные мягкие капсулы изготавливают введением соединения примера 2, смешанного со съедобным маслянистым веществом, например маслом из линкольн-бобов, хлопковым маслом или оливковым маслом, в желатиновую капсулу нагнетательным насосом, после чего капсулы промывают и высушивают.
(Пример 3 изготовления лекарственного средства) Таблетки
В соответствии с традиционными способами изготавливают таблетки, используя 100 мг соединения примера 3, 0,2 мг коллоидального диоксида кремния, 5 мг стеарата магния, 275 мг микрокристаллической целлюлозы, 11 мг крахмала и 98,8 мг лактозы.
При необходимости таблетки снабжают покрытием.
(Пример 4 изготовления лекарственного средства) Суспендированный раствор
Суспендированный раствор изготавливают из 100 мг тонкоизмельченного соединения примера 4 100 мг карбоксиметилцеллюлозы, 5 мг бензоата натрия, 1,0 г раствора сорбита (фармакопея Японии) и 0,025 мл ванилина.
(Пример 5 изготовления лекарственного средства) Крем
Крем изготавливают подмешиванием 5 г тонкоизмельченного соединения примера 5 в крем, содержащий белый вазелин, микрокристаллизованный воск, ланолин, Спан 20, Твин 80 и воду с концентрациями 40, 3, 10, 5, 0,3 и 41,7% соответственно.
(Пример 6 изготовления лекарственного средства) Инъекционный раствор
Инъекционный раствор изготавливают перемешиванием 1,5% по массе соединения примера 6 в 10% по массе полиэтиленгликоля и регулированием объема в соответствии с инъекционным способом введения, с последующей стерилизацией.
[Преимущество изобретения]
Соединения по настоящему изобретению химически устойчивы и обладают высокой антикоагуляционной активностью в отношении тромбоцитов и ингибирующим действием против тромбообразования. Кроме того, соединения по настоящему изобретению оказывают указанные действия с короткой латентностью начала действия и проявляют низкую токсичность. Поэтому соединения по настоящему изобретению могут быть пригодны для профилактики, предупреждения рецидива и лечения (особенно последнего) болезней, вызываемых активацией тромбоцитов, такой как тромбообразование и коагуляция тромбобцитов, и секретирующими реакциями тромбоцитов, например, при чрескожном коронарном вмешательстве (PCI), ангиопластике, эндартерэктомии, рестенозе после стентирования, остром коронарном синдроме, стабильной и нестабильной стенокардии, инфаркте миокарда, фибрилляции предсердий, церебральной ишемической атаке, церебральном инфаркте и атеросклерозе, и болезней, вызываемых тромбообразованием или образованием эмболов в связи с сахарным диабетом, заболеванием периферических артерий, вызванной гепарином тромбоцитопенией (HIT), тромбоцитопенической тромбогемолитической пурпурой (ТТР), синдромом антител к фосфолипидам, венозным тромбозом и пиемией.
Реферат
Настоящее изобретение относится к соединениям, проявляющим активность в ингибировании агрегации тромбоцитов, их фармакологически приемлемым солям. Конкретно к соединениям, имеющим общую формулу (I) (где R1 представляет собой С1-С6 алкил и т.д., R2 представляет собой водород, С2-С7 алканоил, С7-С11 арилкарбонил, группу формулы R4-(CH2)1- и т.д., R3 представляет собой С6-С10 арил и т.д., X1, X2, X3, X4 и X5независимо представляют собой каждый водород, галоген и т.д. и n представляет собой целое число от 0 до 2), его фармакологически приемлемые соли. В соответствии с настоящим изобретением предлагаются фармацевтические композиции, ингибирующие активацию тромбоцитов и содержащие в качестве активного начала заявляемые соединения. Указанные соединения пригодны в качестве средств для профилактики и лечения заболеваний, связанных с тромбо- или эмболообразованием. 3 н. и 23 з.п. ф-лы, 8 табл.
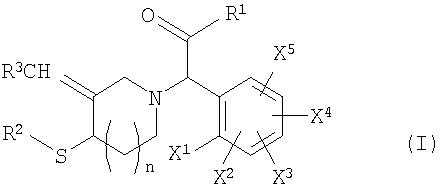
Формула

Документы, цитированные в отчёте о поиске
Циклические аминопроизводные, фармацевтическая композиция и способ профилактики заболевания

Комментарии