Адамантилсодержащие производные 1,2,4-триазола и 1,3,4-тиадиазола, имеющие монотерпеноидные фрагменты, используемые в качестве ингибиторов фермента тирозил-днк-фосфодиэстеразы 1 - RU2761880C1
Код документа: RU2761880C1
Чертежи



Описание
Изобретение относится к молекулярной биологии, биохимии и медицине, а именно к применению адамантилсодержащих соединений общей формулы I и II,

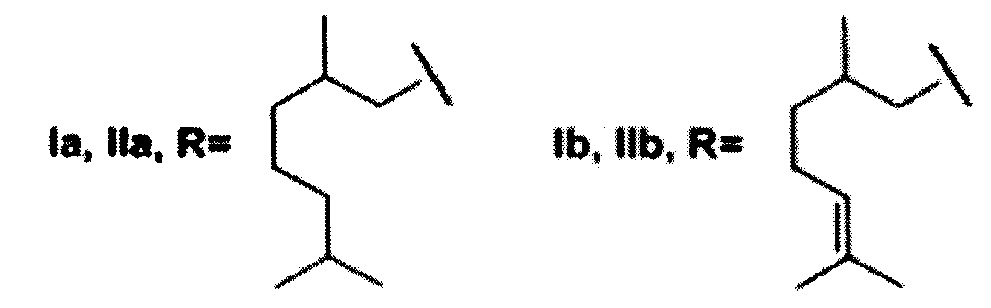

где R может быть 3,7-диметилоктил, 3,7-диметилокт-6-ен-1-ил, (6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)метил, (6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)этил (включая их пространственные изомеры, в том числе стереоизомеры), в качестве ингибиторов фермента тирозил-ДНК-фосфодиэстеразы 1 человека.
Для жизнедеятельности клетки во многих случаях нужно внесение разрывов в молекулу ДНК. Одним из ферментов, который выполняют данную функцию в клетке, является топоизомераза 1 (Top1), контролирующая степень спирализации ДНК и играющая важную роль в репликации и транскрипции. Top1 вносит разрыв в одну цепочку ДНК, ковалентно присоединяясь к 3'-концу, что позволяет свободно вращаться второй части разрезанной цепочки ДНК относительно интактной, затем Top1 лигирует разрезанную цепь, восстанавливая ее целостность и высвобождаясь из ковалентного комплекса. Процесс отщепления Top1 может ингибироваться различными соединениями, например, камптотецином и его производными [Cortes, 2009], что приводит к невозможности восстановления целостности ДНК и, в конечном итоге, к гибели клетки. Этим и определяется противораковая активность камптотецина и его клинически важных производных, таких как топотекан и иринотекан [Ulukan, 2002]. Серьезной проблемой для такого типа противораковой терапии является способность систем репарации ДНК устранять нанесенные повреждения, предотвращая тем самым гибель опухолевых клеток. Одним из важных ферментов, участвующих в репарации таких повреждений, является тирозил-ДНК-фосфодиэстераза 1 (Tdp1) [Pouliot, 2001; Pouliot, 1999; Yang, 1996], которая может отщеплять объемные заместители с 3'-конца ДНК [Interthal, 2005]. Системы репарации клетки получают возможность восстановить целостность двуцепочечной ДНК [Iyama, 2013]. В связи с этим ингибирование Tdp1 может повысить эффективность лекарственных средств, основной механизм действия которых связан с повреждением ДНК раковых клеток за счет ингибирования Top1. Действительно, есть основания предполагать, что за лекарственную устойчивость некоторых видов рака ответственна именно Tdp1 [Dexheimer, 2008; Beretta, 2010]. Более того, показано, что ингибирование Tdp1 увеличивает чувствительность опухолевых клеток к противораковым препаратам с другими механизмами действия: темозоломиду (метилирование пуринов), метилметансульфонату (образование апуриновых/апиримидиновых сайтов), блеомицину (одноцепочечные/двухцепочечные разрывы с 3'-фосфогликолятами) и ионизирующему излучению (разрывы и др. виды повреждений) [Alagoz, 2014; Murai, 2014; Inamdar, 2002; El-Khamisy, 2007].
В литературе описано довольно много ингибиторов Tdp1, активных в диапазоне концентраций 0.02 - 100 мкМ, однако, ни один из них пока не достиг клинических испытаний [Brettrager, 2019; Zakharenko, 2019]. Коммерчески доступным ингибитором TDP1 является фурамидин (Рис. 1), который проявляет умеренные ингибиторные характеристики (IC50 (концентрация ингибитора, при которой активность фермента снижена наполовину) в микромолярном диапазоне) [Antony, 2007; Dyrkheeva, 2019].
Наиболее близкими к заявляемым соединениям являются вторичные амины III и IV (Рис. 1), представляющие собой адамантилсодержащие производные монотерпеноидов миртеналя и цитронеллаля, соответственно [Ponomarev, 2018]. Эти соединения ингибируют Tdp1 в нижнем микромолярном диапазоне (IC50 6.0 мкМ и 3.5 мкМ, соответственно), имеют низкую цитотоксичность и демонстрируют синергию с топотеканом. Недостатком данных соединений является умеренная ингибирующая активность

Задачей изобретения является создание более эффективных ингибиторов тирозил-ДНК-фосфодиэстеразы 1 человека на основе монотерпеноидных производных адамантана.
Технический результат: расширение ассортимента ингибиторов тирозил-ДНК-фосфодиэстеразы 1 человека.
Поставленная задача решается применением адамантилсодержащих соединений общей формулы I и II,


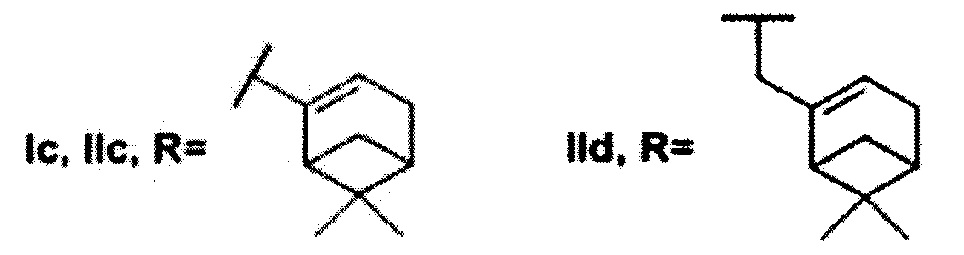
где R может быть 3,7-диметилоктил, 3,7-диметилокт-6-ен-1-ил, (6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)метил, (6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)этил (включая их пространственные изомеры, в том числе стереоизомеры), в качестве ингибиторов фермента тирозил-ДНК-фосфодиэстеразы 1 человека.
Амиды Ia-с могут быть получены по схеме 1 взаимодействием 5-(1-адамантил)-1,3,4-тиадиазол-2-амина V с соответствующими хлорангидридами кислот VIa-c.
Хлорангидриды VIa-c могут быть получены взаимодействием карбоновых кислот VIIa-с с тионилхлоридом. 3,7-Диметилоктановая кислота VIIa может быть синтезирована окислением 3,7-диметилоктанола VIIIa с помощью реагента Джонса в ацетоне (Схема 2). Синтез миртеновой кислоты VIIc может быть осуществлен по реакции миртеналя VIIIc с хлоритом натрия (NaClO2). Карбоновая кислота VIIb является коммерчески доступной.
2-Амино-1,3,4-тиадиазол V может быть получен в две стадии взаимодействием коммерчески доступного хлорангидрида 1-адамантанкарбоновой кислоты IX с тиосемикарбазидом X с последующей циклизацией полученного соединения XI в среде концентрированной H2SO4 [Kadi, 2010; Paparisva, 2016].
2-Амино-1,3,4-тиадиазол V может быть получен в две стадии взаимодействием коммерчески доступного хлорангидрида 1-адамантанкарбоновой кислоты IX с тиосемикарбазидом X с последующей циклизацией полученного соединения XI в среде концентрированной H2SO4 [Kadi, 2010; Paparisva, 2016].
Получение тиопроизводных 1,2,4-триазола IIa-d может быть осуществлено взаимодействием триазола XII с бромпроизводными XIIIa-d в присутствии основания, например, метилата натрия.
Бромпроизводные XIIIa-d могут быть синтезированы из соответствующих спиртов XIVa-d в соответствии со схемой 5 по известным методикам [Chattopadhyay, 1990; Akgun, 2016].
Синтез триазолина XII может быть осуществлен циклизацией соединения XI в основных условиях в соответствии со схемой 6 [Paparisva, 2016].
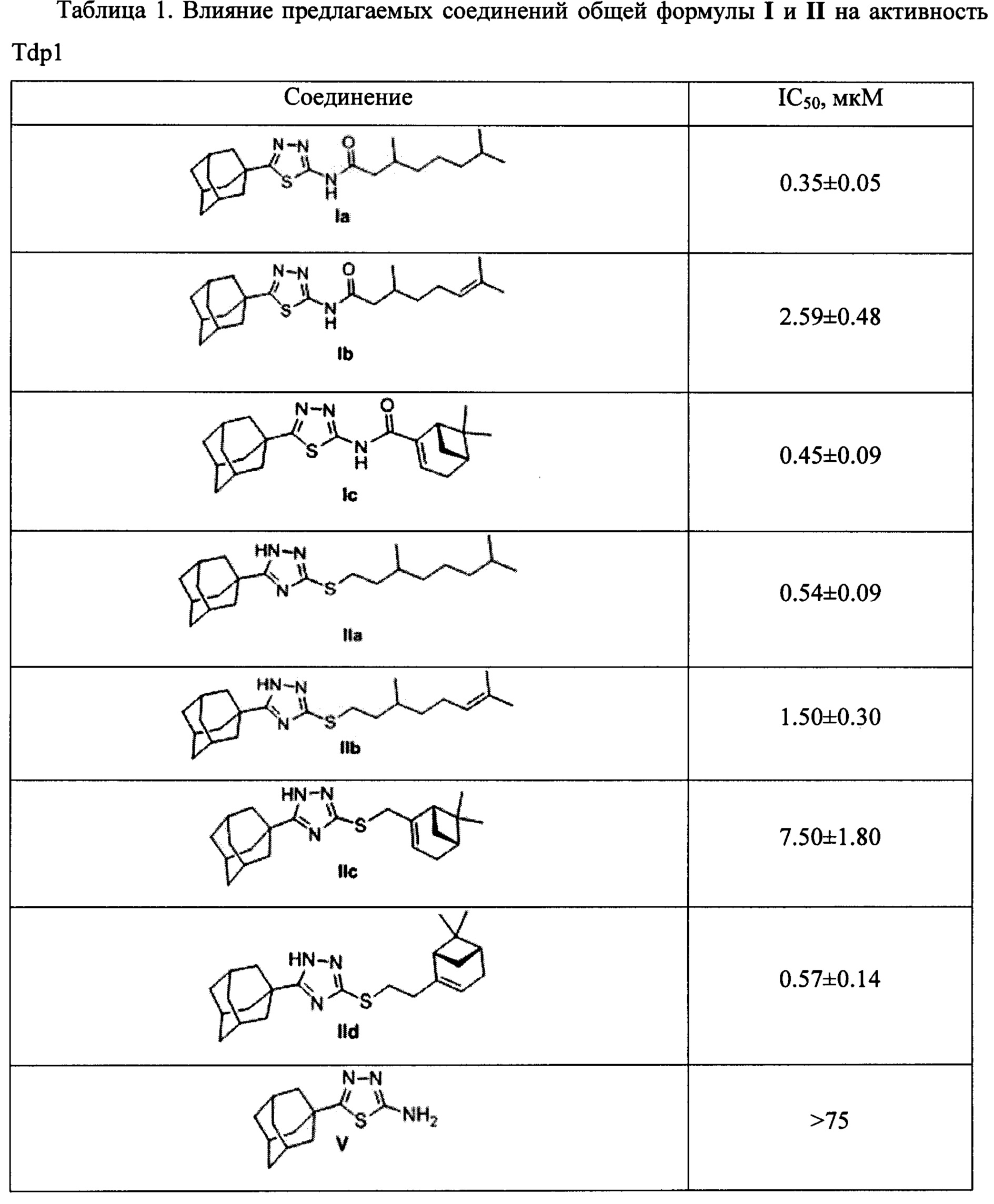
Для определения ингибирующих свойств предлагаемых соединений была использована реакция удаления тушителя флуоресценции BlackHoleQuencher 1 (BHQ1) с 3'-конца олигонуклеотида, катализируемая Tdp1. На 5'-конце олигонуклеотида находится (5,6)-FAM - флуорофор, интенсивность флуоресценции которого возрастает при удалении тушителя. Данные по ингибирующей активности IC50 (концентрация ингибитора, при которой активность фермента снижена наполовину) соединений Ia-с и IIa-d приведены в таблице 1. В качестве положительного контроля использовался фурамидин, являющийся коммерчески доступным ингибитором Tdp1 [Antony, 2007].
Найдено, что все полученные соединения общей формулы I и II проявляют ингибирующую активность в нижнем микромолярном и субмикромолярном диапазонах концентраций. Амид Ia с фрагментом 3,7-диметилоктановой кислоты проявил несколько более высокую активность, чем соединение IIa, которое имеет аналогичный алифатический остаток. Сходная тенденция наблюдается в парах соединений Ib-IIb (где R=3,7-диметилокт-6-ен-1-ил) и Ic-IIc (где R=(6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)метил). Отметим, что соединения V и XIII, не содержащие фрагмента монотерпеноида, не оказали влияния на активность Tdp1.
Показано, что из амидных производных 1,3,4-тиадиазола, соединения Ia и Ic проявляют более выраженную активность. Среди производных 1,2,4-триазола соединения IIa и IId, содержащие фрагменты 3,7-диметилоктанола и нопола, соответственно, оказали наиболее сильное ингибирующее действие на Tdp1.

Таким образом, нами обнаружен новый структурный тип высокоэффективных ингибиторов фермента репарации ДНК тирозил-ДНК-фосфодиэстеразы 1 человека, перспективной мишени для противораковой терапии.
Спектральные исследования выполнены в Химическом Сервисном Центре коллективного пользования СО РАН.
Изобретение иллюстрируется следующими примерами:
Пример 1. N-(5-1-адамантил)-1,3,4-тиадиазол-2-ил)-3,7-диметилоктанамид (соединение Ia).
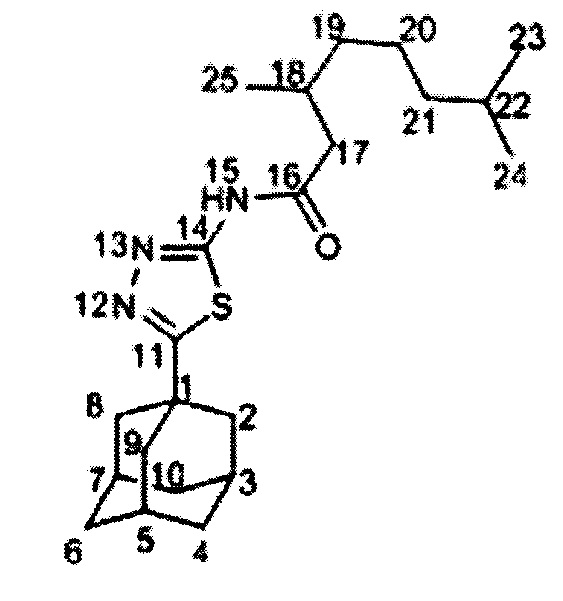
К раствору 50 мг 5-(1-адамантил)-1,3,4-тиадиазол-2-амина (0.2 ммоль) V, 100 мкл триэтиламина в 7 мл сухого толуола добавили раствор соответствующего хлорангидрида карбоновой кислоты (0.25 ммоль в 1 мл сухого толуола). Перемешивали реакционную смесь в течение 12 часов, после чего добавили 10%-ный раствор KOH (20 мл). Органическую фазу отделили, сушили над Na2SO4. После растворитель отгоняли на ротационном испарителе. Целевое соединение было очищено методом колоночной хроматографии на силикагеле, в качестве элюента использовалась смесь гексан-этилацетат. Выход соединения Ia составил 61%. Спектр ЯМР1Н (600 МГц, CDC13, δ, м.д., J/Гц): 0.81 (6Н, д, J(23,22)=J(24,22)=6.7 Гц, С23Н3, С24Н), 0.97 (3Н, д, J(25,18)=6.7 Гц, С25Н3), 1.08-1.16 (2Н, м, 2Н21), 1.20-1.43 (4Н, м, 2Н19, 2Н20), 1.43-1.51 (1H, м, Н22), 1.73-1.82 (6Н, м, 2Н4, 2Н6, 2Н10), 2.06 (6Н, д,3J=2.8 Гц, 2Н2, 2Н8, 2Н9), 2.07-2.15 (4Н, м, Н3, Н5, Н7, Н18), 2.58 (1Н, дд,2J=14.1 Гц, J(17, 18)=8.5 Гц, Н17), 2.72 (1H, дд,2J=14.1 Гц, J(17', 18)=6.1 Гц, H17'). Спектр ЯМР13С (150 МГц, CDC13, δ, м.д.): 37.71 (С, С1), 43.07 (СН2, С2, С8, С9), 28.29 (СН, С3, С5, С7), 36.29 (СН2, С4, С6, С10), 174.22 (С, С11), 159.87 (С, С14), 171.69 (С=0, С16), 43.72 (СН2, С17), 30.95 (СН, С18), 36.88 (СН2, С19), 24.37 (СН2, С20), 39.04 (СН2, С21), 27.76 (СН, С22), 22.41 (СН3, С23), 22.56 (СН3, С24), 19.28 (СН3, С25). Найдено m/z 389.2495 (вычислено для (C22H35O1N3Si)+', 389.2496). ИК спектр (KBr, v, см-1): 1721 (С=O), 1595 (C=N).
Пример 2. N-(5-(1-адамантил)-1,3,4-тиадиазол-2-ил)-3,7-диметилокт-6-енамид (соединение Ib).

Амид Ib был получен по методике, приведенной в примере 1, с выходом 52%. Спектр ЯМР1H (600 МГц, CDC13, δ, м.д., J/Гц): 0.99 (3Н, д, J(25,18)=6.8 Гц, С25Н3), 1.26-1.33 (1Н, м, Н19), 1.43-1.50 (1H, м, Н19'), 1.55 (3Н, с, С24Н3), 1.63 (3Н, м, С23Н3), 1.73-1.82 (6Н, м, 2Н4. 2Н6, 2Н10), 1.92-2.07 (2Н, м, 2Н20), 2.05 (6Н, д,3J=2.8 Гц, 2Н2, 2Н8, 2Н9), 2.07-2.17 (4Н, м, Н3, Н5, Н7, Н18), 2.59 (1Н, дд,2J=14.0 Гц, J(17,18)=8.5 Гц, Н17), 2.73 (1Н, дд,2J=14.0 Гц, J(17,18)=6.1 Гц, Н17'), 5.06 (1Н, т.м, J(21,20)=7.0 Гц, Н21). Спектр ЯМР13С (150 МГц, CDCl3, δ, м.д.): 37.74 (С, С1), 43.04 (СН2, С2, С8, С9), 28.29 (СН, С3, С5, С7), 36.26 (СН2, С4, С6, С10), 174.27 (С, С11), 159.90 (С, С14), 171.59 (С=O, С16), 43.58 (СН2, С17), 30.66 (СН, С18), 36.68 (СН2, С19), 25.20 (СН2, С20), 124.27 (СН, С21), 131.25 (С, С22), 25.56 (СН3, С23), 17.50 (СН3, С24), 19.21 (СН3, С25). Найдено m/z 387.2339 (вычислено для (C22H33O1N3S1)+, 387.2337). ИК спектр (KBr, ν, см-1): 1697 (С=O), 1593 (C=N).
Пример 3. N-(5-(1-адамантил)-1,3,4-тиадиазол-2-ил)-6,6-диметилбицикло[3.1.1]-гепт-2-ен-2-карбоксамид (соединение Ic).

Амид Ic был получен по методике, приведенной в примере 1, с выходом 50%. Спектр ЯМР1Н (600 МГц, CDC13, δ, м.д., J/Гц): 0.84 (3Н, с, С25Н3), 1.21 (1Н, д, J(23анти, 23 син)=9.2 Гц, Н23анти), 1.34 (3Н, с, С24Н3), 1.72-1.81 (6Н, м, 2Н4, 2Н6, 2Н10), 2.05 (6Н, д,3J=2.7 Гц, 2Н2, 2Н8, 2Н9), 2.07-2.11 (3Н, м, Н3, Н5, Н7), 2.14-2.19 (1H, м, Н20), 2.47-2.53 (2Н, м, Н19, Н23син), 2.56 (1H, ддд,2J=19.7 Гц, J(19', 18)=J(19', 20)=3.0 Гц, Н19'), 2.91 (1H, ддд, J(22, 23 син)=5.6 Гц, J(22, 18)=1.5 Гц, Н22), 7.13-7.16 (1Н, м, Н18). Спектр ЯМР13С (150 МГц, CDCl3, δ, м.д.): 37.68 (С, С1), 43.07 (СН2, С2, С8, С9), 28.28 (СН, С3, С5, С7), 36.29 (СН2, С4, С6, С10), 173.99 (С, С11), 160.51 (С, С14), 164.92 (С=O, С16), 140.86 (С, С17), 136.01 (СН, С18), 32.33 (СН2, С19), 40.16 (СН, С20), 37.83 (С, С21), 41.17 (СН, С22), 31.23 (СН2, С23), 25.76 (СН3, С24), 20.93 (СН3, С25). Найдено m/z 383.2026 (вычислено для (C22H29O1N3S1)+', 383.2022). ИК спектр (KBr, ν, см-1): 1690 (С=O), 1589 (C=N).
Пример 4. 3-((3,7-Диметилоктил)тио)-5-(1-адамантил)-1,2,4-триазол (соединение IIa).

К суспензии, содержащей 0.05 г (0.21 ммоль) триазола XII и 0.3 мл безводного МеОН, медленно добавили 0.05 мл (0.21 ммоль) 20%-ного раствора MeONa в МеОН. Перемешивали раствор при комнатной температуре в течение 30 минут, после чего медленно добавили раствор соответствующего бромпроизводного (0.21 ммоль) в безводном МеОН (0.2 мл). Реакционную смесь выдерживали при 60°С и перемешивали в течение 12 часов. После проведения реакции метанол упарили на ротационном испарителе, продукт экстрагировали Et2O (3 раза по 15 мл). Целевое соединение было очищено методом колоночной хроматографии на силикагеле, в качестве элюента использовалась смесь гексан-этилацетат. Выход соединения Па составил 87%. Продукт выделяется в виде бесцветного масла. Спектр ЯМР1Н (600 МГц, CDC13, δ, м.д., J/Гц): 0.82 (6Н, д, J(23,22)=J(24,22)=6.7 Гц, С23Н3, С24Н), 0.84 (3Н, д, J(25,18)=6.5 Гц, С25Н3), 1.03-1.12 (3Н, м, Н19, 2Н21), 1.15-1.29 (3Н, м, Н19', 2Н20), 1.42-1.55 (3Н, м, Н17, Н18, Н22), 1.62-1.69 (1Н, м, Н17'), 1.70-1.77 (6Н, м, 2Н4, 2Н6, 2Н10), 1.96 (6Н, д.3J=3.0 Гц, 2Н2, 2Н8, 2Н9), 2.02-2.06 (3Н, м, Н3, Н5, Н7), 3.02 (1Н, ддд, J(16, 16')=12.5 Гц, J(16,17)=9.5 Гц, J(16,17')=6.3 Гц, Н16), 3.10 (1Н, ддд, J(16',16)=12.5 Гц, J(16',17')=9.8 Гц, J(16',17)=5.4 Гц, Н16'). Спектр ЯМР13С (150 МГц, CDC13, δ, м.д.): 34.12 (С, С1), 40.68 (СН2, С2, С8,С9), 27.91 (СН, С3, С5, С7), 36.25 (СН2, С4, С6, С10), 166.49 (С, С11), 159.05 (С, С13), 30.24 (СН2, С16), 36.58 (СН2, С17), 32.10 (СН, С18) 36.76 (СН2, С19), 24.49 (СН2, С20), 39.08 (СН2, С21), 27.81 (СН, С22), 22.45 (СН3, С23), 22.55 (СН3, С24), 19.17 (СН3, С25). Найдено m/z 375.2705 (вычислено для (C22H37N3S1)+', 375.2703). ИК спектр (KBr, v, см-1): 3435,1653 (N-H), 1569 (C=N).
Пример 5. (S)-3-((3,7-диметилокт-6-ен-1-ил)тио)-5-(1-адамантил)-1,2,4-триазол (соединение IIb).

Вещество IIb было получено по методике, приведенной в примере 4, с выходом 76%. Продукт выделяется в виде бесцветного масла. Спектр ЯМР1Н (600 МГц, CDCl3, δ, м.д., J/Гц): 0.84 (3Н, д, J(25,18)=6.5 Гц, С25Н3), 1.07-1.14 (1H, м, Н19), 1.25-1.32 (1H, м, Н19'), 1.42-1.55 (2Н, м, Н17, Н18), 1.54 (3Н, ш.с, С24Н3), 1.62 (3Н, м, все J<2.0 Гц, С23Н3), 1.61-1.68 (1H, м, Н17'), 1.68-1.75 (6Н, м, 2Н4. 2Н6, 2Н10), 1.84-1.98 (2Н, м, 2Н20), 1.94 (6Н, д,3J=3.0 Гц, 2Н2, 2Н8, 2Н9), 2.00-2.04 (3Н, м, Н3, Н5, Н7), 3.01 (1Н, ддд, J(16,16')=12.4 Гц, J(16,17)=9.4 Гц, J(16, 17')=6.2 Гц, Н16), 3.08 (1Н, ддд, J(16',16)=12.4 Гц, J(16',17')=9.8 Гц, J(16', 17)=5.4 Гц, Н16'), 5.03 (1Н, тм, J(21,20)=7.1 Гц, другие J~1.5 Гц, Н21). Спектр ЯМР13С (150 МГц, CDC13, δ, м.д.): 34.11 (С, С1), 40.65 (СН2, С2, С8, С9), 27.90 (СН, С3, С5, С7), 36.22 (СН2, С4, С6, С10), 177.45 (С, С11), 158.99 (С, С13), 30.15 (СН2, С16), 36.47 (СН2, С17), 31.73 (СН, С18), 36.54 (СН2, С19), 25.23 (СН2, С20), 124.47 (СН, С21), 131.02 (С, С22), 25.52 (СН3, С23), 17.47 (СН3, С24), 19.02 (СН3, С25). Найдено m/z 373.2542 (вычислено для (C22H35N3S1)+', 373.2546). ИК спектр (KBr, v, см-1): 3326, 1672 (N-H), 1542 (C=N).
Пример 6. 3-(1-Адамантил)-5-((((1R,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)метил)тио)-1,2,4-триазол (соединение IIc).

Вещество IIc было получено по методике, приведенной в примере 4, с выходом 67%. Продукт выделяется в виде бесцветного масла. Спектр ЯМР1Н (600 МГц, CDC13, δ, м.д., J/Гц): 0.72 (3Н, с, С25Н3), 1.07 (1Н, д, J(23анти, 23 син)=8.7 Гц, Н23анти), 1.23 (3Н, с, С24Н3), 1.70-1.78 (6Н, м, 2Н4, 2Н6, 2Н10), 1.97 (6Н, д,3J=3.0 Гц, 2Н2, 2Н8, 2Н9), 2.00-2.09 (4Н, м, Н3, Н5,Н7, Н20), 2.14 (1H, дм, J(19,19')=17.8 Гц, другие J<3.5 Гц, Н19), 2.17-2.23 (2Н, м, Н19', Н22), 2.34 (1H, ддд, J(23 син, 23анти)=8.7 Гц, J(23 син, 20)=J(23син, 22)=5.6 Гц, Н23син), 3.66-3.72 (2Н, м, 2Н16), 5.45-5.48 (1Н, м, Н18). Спектр ЯМР13С (150 МГц, CDC13, δ, м.д.): 34.17 (С, С1), 40.73 (СН2, С2, С8, С9), 23.93 (СН, С3, С5, С7), 36.29 (СН2, С4, С6, С10), 166.83 (С, С11), 158.17 (С, С13), 38.88 (СН2, С16), 142.70 (С, С17), 121.11 (СН, С18), 31.20 (СН2, С19), 40.31 (СН, С20), 37.97 (С, С21), 44.97 (СН, С22), 31.56 (СН2, С23), 25.96 (СН3, С24), 20.95 (СН3, С25). Найдено m/z 369.2233 (вычислено для (C22H31N3S1)+', 369.2234). ИК спектр (KBr, ν, см-1): 3419, 1648 (N-H), 1538 (C=N).
Пример 7. 3-(1-Адамантил)-5-((2-((1R,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)этил)тио)-1,2,4-триазол (соединение IId).

Вещество IId было получено по методике, приведенной в примере 4, с выходом 77%. Продукт выделяется в виде бесцветного масла. Спектр ЯМР1Н (500 МГц, CDC13, δ, м.д., J/Гц): 0.78 (3Н, с, С26Н3), 1.10 (1Н, д, J(24анти, 24син)=8.6 Гц, Н24анти), 1.22 (3Н, с, С25Н3), 1.69-1.76 (6Н, м, 2Н4, 2Н6, 2Н10), 1.95 (6Н, д,3J=3.0 Гц, 2Н2, 2Н8, 2Н9), 1.99-2.05 (5Н, м, Н3, Н5, Н7, Н21, Н23), 2.14 (1Н, д.м, J(20, 20')=17.6 Гц, другие J<3.5 Гц, H20'), 2.25-2.32 (3Н, м, 2Н17, Н24син), 3.02-3.11 (2Н, м, 2Н16), 5.19-5.22 (1Н, м, Н19). Спектр ЯМР13С (125 МГц, CDC13, δ, м.д.): 34.12 (С, С1), 40.67 (СН2, С2, С8, С9), 27.90 (СН, С3, С5, С7), 36.24 (СН2, С4, С6, С10), 166.45 (С, С11), 159.01 (С, С13), 30.25 (СН2, С16), 36.89 (СН2, С17), 146.03 (С, С18), 117.65 (СН, С19), 31.11 (СН2, С20), 40.58 (СН, С21), 37.83 (С, С22), 45.39 (СН, С23), 31.47 т (СН2, С24), 26.12 (СН3, С25), 21.03 (СН3, С26). Найдено m/z 383.2388 (вычислено для (C23H33N3S1)+', 383.2390). ИК спектр (KBr, ν, см-1): 3402, 1654 (N-H), 1542 (ON).
Пример 8. Изучение ингибирующих свойств полученных соединений.
Рекомбинантная тирозил ДНК фосфодиэстераза 1 человека (КФ 3.1.4.) была экспрессирована в системе Escherichiacoli (плазмида рЕТ 16В Tdpl предоставлена доктором Кальдекотт К.У., Университет Сассекса, Великобритания (Dr. K.W. Caldecott, University of Sussex, United Kingdom) и выделена как описано в работах [Interthal, 2001; Lebedeva, 2011]. Активность фермента определяли, используя метод флуоресцентной детекции активности Tdp1, описанный в работе [Zakharenko, ВМС, 2015]. Реакционные смеси объемом 200 мкл содержали буфер (50 мМ Трис HCl, рН 8.0; 50 мМ NaCl; 7 мМ меркаптоэтанол), 50 нМ олигонуклеотид-биосенсор (структура приведена ниже), а также ингибиторы в различных концентрациях. Реакцию запускали добавлением Tdp1 до конечной концентрации 1.3 нМ. Измерения проводили в линейном диапазоне зависимости скорости реакции от времени (до 8 мин), аликвоты отбирали из реакционных смесей через каждые 55 с. Влияние исследуемых соединений на активность фермента оценивали, используя величину IC50 (концентрация ингибитора, при которой активность фермента снижена наполовину). Обсчет значений IC50 проводили с помощью программы MARS DataAnalysis 2.0 (BMG LABTECH). В качестве сенсора использован олигонуклеотид 5'-(5,6 FAM-AAC GTC AGGGTC ТТС C-BHQ1)-3', синтезированный в Лаборатории медицинской химии ИХБФМ СО РАН.
Результаты тестирования приведены в Таблице 1.
Литература
Akgun В, et al., Angew. Chem. Int. Ed., 2016, 12, 3909-3913.
Alagoz M, et al., Nucleic Acids Res., 2014, 42(5), 3089-3103.
Antony, S et al., Nucleic Acids Res. 2007, 35, 4474-4484.
Beretta GL, et al., Curr. Med. Chem., 2010, 17, 1500-1508.
Brettrager EJ, et al., Cancer Drug Resist., 2019, 2, 1153-1163.
Chattopadhyay S, et al, Synth. Commun., 1990, 6, 825-837.
Cortes Ledesma F, et al., Nature, 2009, 461, 674-678.
Dexheimer TS, et al., Anticancer Agents Med Chem. 2008, 8, 381-389.
DyrkheevaN, etal., PlantaMed., 2019, 85(2), 103-111.
El-Khamisy SF, et al., DNA Repair (Amst), 2007, 6, 1485-1495.
Interthal, H., et al., J. Biol. Chem., 2005, 280(43), 36518-36528.
Iyama T, et al., DNA Repair (Amst)., 2013, 12(8), 620-636.
Inamdar KV, et al., J. Biol. Chem., 2002, 277, 27162-27168.
Interthal H, et al., Proc. Natl. Acad. Sci. U. S. A., 2001, 98(21), 12009-12014.
Kadi AA, et al., Eur. J. Med. Chem., 2010, 11, 5006-5011.
LebedevaNA, et al., FEBS Lett., 2011, 585(4), 683-686.
Murai J, et al., DNA Repair (Amst), 2014, 21,177-182.
Paparisva A, et al., Arab. J. Chem., 2016, 10, 342-351.
Pouliot JJ, et al., Genes Cells, 2001, 6(8), 677-687.
Pouliot JJ, et al., Science, 1999, 286, 552-555.
Ponomarev K, et al, Bioorg. Chem., 2018, 76, 392-399.
Ulukan H, et al., Drugs, 2002, 62, 2039-2057.
Yang SW, et al., Proc Natl Acad Sci USA, 1996, 93, 11534-11539.
Zakharenko A, et al., Med Res Rev., 2019, 39(4), 1427-1441.
Zakharenko A, et al., Bioorg. Med. Chem., 2015, 23, 2044-2052.
Реферат
Изобретение относится к молекулярной биологии, биохимии и биотехнологии, конкретно к адамантил-монотерпеновым гибридам, сочлененным через 1,3,4-тиадиазол-2-аминовый и 1H-1,2,4-триазол-3-тиольный фрагменты. Предложено применение адамантилсодержащих производных 1,2,4-триазола и 1,3,4-тиадиазола, имеющих монотерпеноидные фрагменты, в качестве ингибиторов фермента тирозил-ДНК-фосфодиэстеразы 1 человека. Изобретение расширяет арсенал ингибиторов данного фермента и может быть использовано для разработки лекарственных препаратов, применимых в противоопухолевой терапии. 1 табл., 8 пр., 6 схем.
Формула



Документы, цитированные в отчёте о поиске
1-адамантил-3-(((1r,4as,10ar)-7-изопропил-1,4а-диметил-1,2,3,4,4а,9,10,10а-октагидрофенантрен-1-ил)метил)мочевина, проявляющая ингибирующее действие в отношении фермента тирозил-днк-фосфодиэстеразы 1 человека и увеличивающая активность темозоломида в отно
Гидразинотиазоловые производные усниновой кислоты, проявляющие ингибирующее действие в отношении фермента тирозил-днк-фосфодиэстеразы 1 человека
Средство для ингибирования фермента тирозил-днк-фосфодиэстеразы 1 человека

Комментарии