Производные тиогидантоина, полезные в качестве антагонистов рецептора андрогена - RU2598854C2
Код документа: RU2598854C2
Описание
Область техники
Данное изобретение относится к новым замещенным соединениям тиоимидазолидинона и фармацевтическим композициям, содержащим такие соединения, для лечения связанных с андрогеновым рецептором заболеваний или расстройств, таких как рак простаты, доброкачественная гипертрофия простаты, потеря волос у мужчин, потеря мышечной массы, акне и гирсутизм.
Уровень техники
Андрогеновый рецептор (АР) представляет собой 110-кДа стероидный ядерный рецептор. Одной из его ключевых функций является активированная андрогеном транскрипция гена. Андрогеновый рецептор играет важную роль во многих заболеваниях, связанных с мужскими гормонами, таких как рак простаты, доброкачественная гипертрофия простаты, потеря волос у мужчин, потеря мышечной массы и гирсутизм (гипертрихоз). По этой причине селективные антагонисты андрогенового рецептора могут применяться для таких состояний и заболеваний, включающих, но не ограниченных ими: мужскую контрацепцию; лечения множества состояний, связанных с мужскими гормонами, таких как гиперсексуальность и половые отклонения; лечения состояний, включающих доброкачественную гиперплазию простаты, акне, андрогенную алопецию и гирсутизм; предупреждения симптомов, связанных с пониженным тестостероном, таких как приливы после кастрации; целевого предупреждения или противодействия маскулинизации в случае транссексуальных женщин, проходящих терапию по коррекции пола; в качестве антинеопластического агента и паллиативного средства, адъюванта или неоадъюванта при гормональной терапии рака простаты; и для снижения возникновения, остановки или регрессии рака простаты.
Рак простаты является одним из наиболее часто встречающихся видов рака у мужчин по всему миру, и является одной из основных причин смерти от рака у мужчин в Соединенных Штатах Америки. Современное стандартное лечение местно рака простаты включает хирургическое вмешательство и облучение. К сожалению, рак повторяется у одной трети леченных пациентов. Вместе с пациентами, у которых диагностирована поздняя стадия рака простаты, их лечат хирургической кастрацией или химической кастрацией, которую называют гормональной терапией (ГТ). Часто ГТ также объединяют с лекарственными средствами, действующими как антагонисты андрогенового рецептора. Гормональная терапия является высокоэффективной для контроля раковых клеток у большинства пациентов с поздней стадией рака простаты. Однако клетки рака простаты со временем адаптируются к низкоандрогенной окружающей среде и становятся резистентными к ГТ. В результате, рак возобновляется у почти всех таких пациентов через 2-5 лет.
Антагонисты андрогенового рецептора, такие как флутамид и бикалутамид, изначально были созданы для того, чтобы избежать побочных эффектов ГТ и преодолеть резистентность у пациентов с раком простаты. Хотя эти антагонисты андрогенового рецептора хорошо работают в качестве совместного лечения с ГТ у интактных пациентов с раком простаты, их эффективность против не поддающегося лечению рака простаты, в качестве единственного агента, или совместного лечения, ограничена. Были представлены данные, что агонизм к андрогену наблюдался для гидроксифлуамида (активной формы флутамида) и бикалутамида. Остаточное агонистическое действие может быть ответственно за отсутствие эффективности лекарственного средства при преодолении резистентности. Терапевтическая польза таких лекарственных антагонистов андрогенового рецептора также затрудняется значительными побочными эффектами, такими как токсичность для печени, характерная для флутамида и бикалутамида. Недавние исследования позволяют предположить, что реактивация сигнального пути АР может быть основной причиной развития резистентности к ГТ. Мутация и сверхэкспрессия АР являются двумя из обычных основных молекулярных механизмов для наблюдения резистентности.
Поэтому существует значительная медицинская необходимость в лучших антагонистах андрогенового рецептора, которые будут обладать мощным антагонистическим действием, но избегать какого-либо агонизма при лечении резистентных к кастрации клеток рака простаты. Также существует необходимость в снижении отмечаемых побочных эффектов, таких как токсичность для печени, имеющихся у существующих лекарственных антагонистов андрогенового рецептора.
Сущность изобретения
Данное изобретение включает соединения представленных ниже формул (Ia), (I), (II), (III) или (IV), способы применения таких соединений в качестве антагонистов андрогеновых рецепторов и фармацевтические композиции, содержащие такие соединения и их соли.
В одном варианте изобретение относится к соединениям и фармацевтическим композициям, содержащим соединение формулы (Ia):

или его фармацевтически приемлемую соль, сольват, гидрат, пролекарство или производное,
где R1 выбирают из

где Z выбирают из водорода, CF3, C1-C3 алкокси, CF3O, галогена, циано и C1-C4 алкила, необязательно замещенного одним или более галогенами;
Y независимо выбирают из одного или двух галогенов, C1-C3 алкокси, гидроксила, CF3O и циано;
W выбирают из кислорода, серы и двух атомов водорода;
R3 и R4 независимо выбирают из C1-C4 алкила, необязательно замещенного одним или более атомами фтора или гидроксильными группами, или R3 и R4 и атом углерода, к которому они присоединены, образуют 3-6-членное циклоалкильное кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более атомами фтора или гидроксильными группами, и где один из атомов углерода необязательно замещен кислородом или азотом; и
R2 является замещенной или незамещенной алкильной, арильной, гетероарильной или гетероциклической группой.
В определенных вариантах Y является галогеном или циано. В определенных вариантах Z является галогеном, метокси, циано, метилом или CF3. В определенных вариантах W является кислородом.
В определенных вариантах R2 является -A1-A2, где A1 является арильной группой или гетероарильной группой, необязательно замещенной одной или более C1-C4 алкильной, циано, гидроксильной, метокси, этокси, галогеном или 5-6-членной гетероарильной группой; и A2 является (CF2)a(CH2)mY1(CH2)nQ, где a, m и n являются целыми числами, независимо выбранными из 0-4, и где, по крайней мере, один из a или m или n не равен нулю, или A2 является (CH2)mY1(CH2)nQ, где m и n являются целыми числами, независимо выбранными из 0-4, и где, по крайней мере, один из m или n не равен нулю; Q выбирают из C(O)NHR′′, C(RxRy)C(O)NR′′R1′′, SO2R′′, SO2NR′′R1′′, циано, гидроксила, C1-C3 алкокси, C(S)NR′′R1′′, C(O)OR′′, OC(O)NR′′R1′′, C(O)NR′′R1′′, необязательно замещенного 5-6-членного гетероарила и необязательно замещенного 4-6-членного гетероцикла; и Y1 выбирают из прямой связи, -O-, -S- и -NR′′-; R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила, или NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором; Rx и Ry независимо выбирают из водорода или метила; или
C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо или 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином.
В другом варианте изобретение относится к соединениям и фармацевтическим композициям, содержащим соединение формулы (I):

или его фармацевтически приемлемую соль, сольват, гидрат, пролекарство или производное,
где Z выбирают из водорода, CF3, C1-C3 алкокси, CF3O, галогена, циано и C1-C4 алкила, необязательно замещенного одним или более галогенами;
Y выбирают из галогена, C1-C3 алкокси, гидроксила, CF3O и циано;
W выбирают из кислорода, серы и двух атомов водорода;
R3 и R4 независимо выбирают из C1-C4 алкила, необязательно замещенного одним или более атомами фтора или гидроксильными группами, или R3 и R4 и атом углерода, к которому они присоединены, образуют 3-6-членное циклоалкильное кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более атомами фтора или гидроксильными группами, и где один из атомов углерода необязательно замещен кислородом или азотом;
A1 является арильной группой или гетероарильной группой, необязательно замещенной одним или более C1-C4 алкилом, циано, гидроксилом, метокси, этоксилом, галогеном или необязательно замещенной 5-6-членной гетероарильной группой;
A2 является (CF2)a(CH2)mY1(CH2)nQ, где a, m и n являются целыми числами, независимо выбранными из 0-4, и где, по крайней мере, один из a или m или n не равен нулю, или A2 является (CH2)mY1(CH2)nQ, где m и n являются целыми числами, независимо выбранными из 0-4, и где, по крайней мере, один из m или n не равен нулю; Q выбирают из C(O)NHR′′, C(RxRy)C(O)NR′′R1′′, SO2R′′, SO2NR′′R1′′, циано, гидроксила, C1-C3 алкокси, C(S)NR′′R1′′, C(O)OR′′, OC(O)NR′′R1′′, C(O)NR′′R1′′, необязательно замещенного 5-6-членного гетероарила и необязательно замещенного 4-6-членного гетероцикла; и Y1 выбирают из прямой связи, -O-, -S- и -NR′′-; R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила, или NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором; Rx и Ry независимо выбирают из водорода или метила; или C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо или 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином.
В определенных вариантах соединений формулы (I), Z является галогеном, метокси, циано, метилом или CF3. В других вариантах W является кислородом. В других вариантах A1 является фенильной группой или пиридильной группой, необязательно замещенной одним или более C1-C4 алкилом, циано, гидроксилом, метокси, этокси, галогеном или необязательно замещенной 5-6-членной гетероарильной группой. В других вариантах Q является необязательно замещенной 5-6-членной гетероарильной группой.
В других вариантах A2 является (CH2)mY1(CH2)nQ′, где Y1 является связью, m и n являются целыми числами, независимо выбранными из 0-2, где, по крайней мере, один из m или n не равен нулю; Q′ выбирают из C(O)NHR′′, C(RxRy)C(O)NR′′R1′′, SO2R′′, SO2NR′′R1′′, циано, гидроксила, С1-C3 алкокси, C(S)NR′′R1′′, C(O)OR′′, OC(O)NR′′R1′′, C(O)NR′′R1′′, необязательно замещенного 5-6-членного гетероарила и необязательно замещенного 4-6-членного гетероцикла; и R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила, или NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором; Rx и Ry независимо выбирают из водорода или метила; или C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо или 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином. В других вариантах m+n равно 2 или 3.
В других вариантах Q′ выбирают из C(RxRy)C(O)NR′′R1′′, OC(O)NR′′R1′′, необязательно замещенного 5-6-членного гетероарила и необязательно замещенного 4-6-членного гетероцикла; и R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила, или NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором; Rx и Ry независимо выбирают из водорода или метила; или C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо или 3-5-членн циклическое кольцо, где один атом углерода заменен кислородом или амином. В других вариантах Q′ является необязательно замещенной 5-6-членной гетероарильной группой.
В другом варианте изобретение относится к соединениям и фармацевтическим композициям, содержащим соединение формулы (II):

или его фармацевтически приемлемую соль, сольват, гидрат, пролекарство или производное,
где Z1 выбирают из CF3O, метила, CH2F, CHF2, CF3, метокси, галогена и циано;
X выбирают из галогена, C1-C3 алкокси, CF3O, гидроксила и циано;
W выбирают из кислорода, серы и двух атомов водорода;
R′′3 и R′′4 являются метилом, или R′′3 и R′′4 и атом углерода, к которому они присоединены, образуют 3-6-членное циклоалкильное кольцо, необязательно замещенное одним или более атомами фтора или гидроксильными группами;
B независимо выбирают из одного или более водорода, циано, метила, CF3 или галогена; и
A является (CF2)a(CH2)mY1(CH2)nQ, где a, m и n являются целыми числами, независимо выбранными из 0-4, и где, по крайней мере, один из a или m или n не равен нулю; или A является (CH2)mY1(CH2)nQ, где m и n являются целыми числами, независимо выбранными из 0-4, и где, по крайней мере, один из m или n не равен нулю; Q выбирают из C(O)NHR′′, C(RxRy)C(O)NR′′R1′′, SO2R′′, SO2NR′′R1′′, циано, гидроксила, C1-C3 алкокси, C(S)NR′′R1′′, C(O)OR′′, OC(O)NR′′R1′′, C(O)NR′′R1′′, необязательно замещенного 5-6-членного гетероарила и необязательно замещенного 4-6-членного гетероцикла; и Y1 выбирают из прямой связи, -O-, -S- и -NR′′-; R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила, или NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором; Rx и Ry независимо выбирают из водорода или метила; или C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо или 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином.
В определенных вариантах соединений формулы (II), Z1 является CF3, метокси, галогеном. В других вариантах X является фтором. В других вариантах R′′3 и R′′4 являются метилом, или R′′3 и R′′4 и атом углерода, к которому они присоединены, образуют циклопропильное или циклобутильное или циклопентильное или циклогексильное кольцо, которое может быть необязательно замещено одним или более фтором или гидроксильными группами. В других вариантах Q выбирают из C(RxRy)C(O)NR′′R1′′, OC(O)NR′′R1′′, необязательно замещенного 5-6-членного гетероарила и необязательно замещенного 4-6-членного гетероцикла; и R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила, или NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором; Rx и Ry независимо выбирают из водорода или метила; или C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо или 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином. В других вариантах Q является 5-6-членной гетероарильной группой.
В других вариантах A является (CH2)kQ′, где k является целым числом, выбранным из 1-5; Q′ выбирают из C(O)NHR′′, C(RxRy)C(O)NR′′R1′′, SO2R′′, SO2NR′′R1′′, циано, гидроксила, С1-C3 алкокси, C(S)NR′′R1′′, C(O)OR′′, OC(O)NR′′R1′′, C(O)NR′′R1′′, необязательно замещенного 5-6-членного гетероарила и необязательно замещенного 4-6-членного гетероцикла; и R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила, или NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором; Rx и Ry независимо выбирают из водорода или метила; или C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо или гетероциклическое кольцо или 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином.
В других вариантах Q′ выбирают из C(RxRy)C(O)NR′′R1′′, OC(O)NR′′R1′′, необязательно замещенного 5-6-членного гетероарила и необязательно замещенного 4-6-членного гетероцикла; и R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила, или NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором; Rx и Ry независимо выбирают из водорода или метила; или C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо или 3-5-членное циклическое кольцо, где один атом углерода замещен кислородом или амином. В других вариантах k равно 2 или 3. В других вариантах Q′ является 5-6-членной гетероарильной группой. В других вариантах B является водородом или фтором в положении орто радикала A. В других вариантах W является кислородом.
В другом варианте изобретение относится к соединениям и фармацевтическим композициям, содержащим соединение формулы (III):

или его фармацевтически приемлемую соль, сольват, гидрат, пролекарство или производное,
где Z1 выбирают из CF3O, метила, CH2F, CHF2, CF3, метокси, галогена и циано;
X выбирают из галогена, C1-C3 алкокси, CF3O, гидроксила и циано;
W выбирают из кислорода, серы и двух атомов водорода;
R′′3 и R′′4 являются метилом, или R′′3 и R′′4 и атом углерода, к которому они присоединены, образуют 3-6-членное циклоалкильное кольцо, необязательно замещенное одним или более атомами фтора или гидроксильными группами; и
A является (CF2)a(CH2)mY1(CH2)nQ, где a, m и n являются целыми числами, независимо выбранными из 0-4, и где, по крайней мере, один из a или m или n не равен нулю; или A является (CH2)mY1(CH2)nQ, где m и n являются целыми числами, независимо выбранными из 0-4, и где, по крайней мере, один из m или n не равен нулю; Q выбирают из C(O)NHR′′, C(RxRy)C(O)NR′′R1′′, SO2R′′, SO2NR′′R1′′, циано, гидроксила, C1-C3 алкокси, C(S)NR′′R1′′, C(O)OR′′, OC(O)NR′′R1′′, C(O)NR′′R1′′, необязательно замещенного 5-6-членного гетероарила и необязательно замещенного 4-6-членного гетероцикла; и Y1 выбирают из прямой связи, -O-, -S-, и -NR′′-; R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила, или NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором; Rx и Ry независимо выбирают из водорода или метила; или C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо или 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином.
В другом варианте соединений формулы (III), Z1 является CF3, метокси, галогеном. В другом варианте X является фтором. В другом варианте R′′3 и R′′4 являются метилом, или R′′3 и R′′4 и атом углерода, к которому они присоединены, образуют циклопропильное или циклобутильное или циклопентильное или циклогексильное кольцо, которое может быть необязательно замещено одним или более атомами фтора или гидроксильными группами. В другом варианте Q является 5-6-членной гетероарильной группой.
В другом варианте A является (CH2)mY1(CH2)nQ′, где Y1 является связью, m и n являются целыми числами, независимо выбранными из 0-2, и где, по крайней мере, один из m или n не равен нулю; Q′ выбирают из C(O)NHR′′, C(RxRy)C(O)NR′′R1′′, SO2R′′, SO2NR′′R1′′, циано, гидроксила, C1-C3 алкокси, C(S)NR′′R1′′, C(O)OR′′, OC(O)NR′′R1′′, C(O)NR′′R1′′, необязательно замещенного 5-6-членного гетероарила и необязательно замещенного 4-6-членного гетероцикла; и R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила, или NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором; Rx и Ry независимо выбирают из водорода или метила; или C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо или 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином.
В другом варианте A является (CH2)kQ′, где k является целым числом, выбранным из 1-5; Q′ выбирают из C(O)NHR′′, C(RxRy)C(O)NR′′R1′′, SO2R′′, SO2NR′′R1′′, циано, гидроксила, С1-C3 алкокси, C(S)NR′′R1′′, C(O)OR′′, OC(O)NR′′R1′′, C(O)NR′′R1′′, необязательно замещенного 5-6-членного гетероарила и необязательно замещенного 4-6-членного гетероцикла; и R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила, или NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором; Rx и Ry независимо выбирают из водорода или метила; или C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо или гетероциклическое кольцо или 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином. В другом варианте k равно 2 или 3.
В другом варианте Q′ выбирают из C(RxRy)C(O)NR′′R1′′, OC(O)NR′′R1′′, необязательно замещенного 5-6-членного гетероарила и необязательно замещенного 4-6-членного гетероцикла; и R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила, или NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором; Rx и Ry независимо выбирают из водорода или метила; или C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо или 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином. В другом варианте Q′ является 5-6-членной гетероарильной группой. В другом варианте W является кислородом.
В другом варианте изобретение относится к соединениям и фармацевтическим композициям, содержащим соединение формулы (IV):

или его фармацевтически приемлемую соль, сольват, гидрат, пролекарство или производное,
где Zp выбирают из CF3, метокси, галогена и циано;
W выбирают из кислорода, серы и двух атомов водорода;
R′′p и R′′p являются метилом, или R′′p и R′′p и атом углерода, к которому они присоединены, образуют 3-6-членное циклоалкильное кольцо, необязательно замещенное одним или более атомами фтора или гидроксильными группами; и
Ap является (CH2)mY1(CH2)nQ, где m и n являются целыми числами, независимо выбранными из 0-4, и где, по крайней мере, один из a или m или n не равен нулю; Q выбирают из C(O)NHR′′, C(RxRy)C(O)NR′′R1′′, SO2R′′, SO2NR′′R1′′, циано, гидроксила, C1-C3 алкокси, C(S)NR′′R1′′, C(O)OR′′, OC(O)NR′′R1′′, C(O)NR′′R1′′, необязательно замещенного 5-6-членного гетероарила и необязательно замещенного 4-6-членного гетероцикла; и Y1 выбирают из прямой связи, -O-, -S- и -NR′′-; R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила, или NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором; Rx и Ry независимо выбирают из водорода или метила; или C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо или 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином.
В других вариантах, представлены фармацевтические композиции, содержащие соединение одной из представленных формул и фармацевтически приемлемый носитель, разбавитель или наполнитель. В другом варианте данное изобретение относится к фармацевтической композиции, содержащей соединение одной из представленных формул или его фармацевтически приемлемую соль, пролекарство или раствор в качестве активного ингредиента. В другом варианте представлена местная фармацевтическая композиция, содержащая соединение одной из представленных формул, в одном варианте, для применения на коже.
В других вариантах представлены способы предупреждения, снижения развития, лечения или регресса заболевания или расстройства, связанных с активностью андрогенового рецептора, введением пациенту, подверженному развитию или пораженному ими, соединения любой из представленных выше формул или его фармацевтической композиции. В других вариантах заболевание или расстройство выбирают из чувствительного к гормонам рака простаты или гормонорезистентного рака простаты, доброкачественной гиперплазии простаты, акне, гирсутизма, избытка кожного сала и облысения. В другом варианте представлено применение соединения любой из представленных выше формул или его фармацевтической композиции для мужской контрацепции. В других вариантах представлено применение соединения любой из представленных выше формул или его фармацевтической композиции для лечения гиперсексуальности, половых отклонений, доброкачественной гиперплазии простаты, акне, андрогенной алопеции или гирсутизма. В других вариантах представлено применение соединения любой из представленных выше формул или его фармацевтической композиции для целевого предупреждения или противодействия маскулинизации в случае транссексуальных женщин, проходящих терапию по коррекции пола. В других вариантах представлено применение соединения любой из представленных выше формул или его фармацевтической композиции в качестве антинеопластического агента или паллиативного средства, адъюванта или неоадъюванта при гормональной терапии рака простаты. В другом варианте представлено применение соединения любой из представленных выше формул или его фармацевтической композиции для снижения возникновения, остановки или регрессии рака простаты.
Определения
Термин ′′алифатический′′, в данном описании, включает насыщенные и ненасыщенные, прямые (т.е., неразветвленные) или разветвленные алифатические углеводороды, которые необязательно замещены одной или более функциональными группами. Как понятно специалисту в данной области техники, ′′алифатический′′ включает, но не ограничен ими, алкильные, алкенильные или алкинильные группы. Таким образом, в данном описании, термин ′′алкил′′ включает прямые и разветвленные алкильные группы. Аналогичное определение применяется к другим общим обозначениям, таким как ′′алкенил′′, ′′алкинил′′ и подобные. Более того, в данном описании, термины ′′алкил′′, ′′алкенил′′, ′′алкинил′′ и подобные охватывают замещенные и незамещенные группы. В определенных вариантах, в данном описании, ′′низший алкил′′ обозначает алкильные группы (замещенные, незамещенные, разветвленные и неразветвленные), содержащие 1-6 атомов водорода. ′′Низший алкенил′′ и ′′низший алкинил′′, соответственно, включают соответствующие 1-6 углеродные группы.
В определенных вариантах алкильные, алкенильные и алкинильные группы, применяемые в соответствии с данным изобретением, содержат 1-20; 2-20; 3-20; 4-20; 5-20; 6-20; 7-20 или 8-20 алифатических атомов углерода. В других вариантах алкильные, алкенильные и алкинильные группы, применяемые в соответствии с данным изобретением, содержат 1-10; 2-10; 3-10; 4-10; 5-10; 6-10; 7-10 или 8-10 алифатических атомов углерода. В еще других вариантах алкильные, алкенильные и алкинильные группы, применяемые в соответствии с данным изобретением, содержат 1-8; 2-8; 3-8; 4-8; 5-8; 6-20 или 7-8 алифатических атомов углерода. В еще других вариантах алкильные, алкенильные и алкинильные группы, применяемые в соответствии с данным изобретением, содержат 1-6; 2-6; 3-6; 4-6 или 5-6 алифатических атомов углерода. В еще других вариантах алкильные, алкенильные и алкинильные группы, применяемые в соответствии с данным изобретением, содержат 1-4; 2-4 или 3-4 атомов углерода. Иллюстративные алифатические группы включают, но не ограничены ими, например, метил, этил, н-пропил, изопропил, аллил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил, втор-пентил, изопентил, трет-пентил, н-гексил, втор-гексил и подобные, которые снова могут иметь один или более заместителей. Алкенильные группы включают, но не ограничены ими, например, этенил, пропенил, бутенил, 1-метил-2-бутен-1-ил и подобные. Типовые алкинильные группы включают, но не ограничены ими, этинил, 2-пропинил (пропаргил), 1-пропинил и подобные.
Термин ′′алициклический′′, в данном описании, относится к соединениям, которые объединяют свойства алифатических и циклических соединений и включают, но не ограничены ими, моноциклические или полициклические алифатические углеводороды и мостиковые циклоалкильные соединения, которые необязательно замещены одной или более функциональными группами. Как понятно специалисту в данной области техники, ′′алициклический′′ включает, но не ограничен ими, циклоалкильные, циклоалкенильные и циклоалкинильные группы, которые необязательно замещены одной или более функциональными группами. Иллюстративные алициклические группы включают, но не ограничены ими, например, циклопропил, -CH2-циклопропил, циклобутил, -CH2-циклобутил, циклопентил, -CH2-циклопентил, циклогексил, -CH2-циклогексил, циклогексенилэтил, циклогексанилэтил, норборнил и подобные, которые снова могут иметь один или более заместителей.
Термин ′′алкокси′′ или ′′алкилокси′′, в данном описании, относится к насыщенной (т.е., O-алкильной) или ненасыщенной (т.е., O-алкенильной и O-алкинильной) группам, присоединенным к основной молекуле через атом кислорода. В определенных вариантах алкильная группа содержит 1-20; 2-20; 3-20; 4-20; 5-20; 6-20; 7-20 или 8-20 алифатических атомов углерода. В других вариантах алкильная группа содержит 1-10; 2-10; 3-10; 4-10; 5-10; 6-10; 7-10 или 8-10 алифатических атомов углерода. В еще других вариантах алкильные, алкенильные и алкинильные группы, применяемые в соответствии с данным изобретением, содержат 1-8; 2-8; 3-8; 4-8; 5-8; 6-20 или 7-8 алифатических атомов углерода. В еще других вариантах алкильная группа содержит 1-6; 2-6; 3-6; 4-6 или 5-6 алифатических атомов углерода. В еще других вариантах, алкильная группа содержит 1-4; 2-4 или 3-4 алифатических атомов углерода. Примеры алкокси включают, но не ограничены ими, метокси, этокси, пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси, неопентокси, н-гексокси и подобные.
Некоторые примеры заместителей указанных выше алифатических (и других) групп соединений в соответствии с данным изобретением включают, но не ограничены ими алифатические; алициклические; гетероалифатические; гетероциклические; ароматические; гетероароматические; арильные; гетероарильные; алкиларильные; гетероалкиларильные; алкилгетероарильные; гетероалкилгетероарильные; алкокси; арилокси; гетероалкокси; гетероарилокси; алкилтио; арилтио; гетероалкилтио; гетероарилтио; F; Cl; Br; I; -OH; -NO2; -CN; -CF3; -CH2CF3; -CHCl2; -CH2OH; -CH2CH2OH; -CH2NH2; -CH2SO2CH3; -C(=O)Rx; -CO2(Rx); -C(=O)N(Rx)2; -OC(=O)Rx; -OCO2Rx; -OC(=O)N(Rx)2; -N(RX)2; -ORx; -SRX; -S(O)Rx; -S(O)2Rx; -NRx(CO)Rx; -N(Rx)CO2Rx; -N(Rx)S(O)2Rx; -N(Rx)C(=O)N(Rx)2; -S(O)2N(Rx)2; где каждый Rx независимо включает, но не ограничен ими, алифатические, алициклические, гетероалифатические, гетероциклические, арильные, гетероарильные, алкиларильные, алкилгетероарильные, гетероалкиларильные или гетероалкилгетероарильные заместители, где любой из алифатических, алициклических, гетероалифатических, гетероциклических, алкиларильных или алкилгетероарильных заместителей описан выше и здесь может быть замещен или не замещен, разветвленный или неразветвленный, насыщенный или ненасыщенный, и где любой из арильных или гетероарильных заместителей описан выше и здесь может быть замещенным или незамещенным. Дополнительные примеры обычно применяемых заместителей показаны в конкретных вариантах, представленных в примерах, которые описаны здесь.
В общем, термин ′′ароматическая группа′′ в данном описании относится к стабильной моно- или полициклической ненасыщенной группе, содержащей предпочтительно 3-14 атомов углерода, каждый из которых может быть замещен или не замещен. В определенных вариантах термин ′′ароматическая группа′′ относится к плоскому кольцу, имеющему p-орбитали, перпендикулярные плоскости кольца в каждом атоме кольца, и удовлетворяющему правилу Хакеля, где число пи-электронов в кольце составляет (4n+2), где n является целым числом. Моно- или полициклическая ненасыщенная группа, которая не удовлетворяет одному или всем этим критериям для ароматичности, определена здесь как ′′неароматическая′′ и охватывается термином ′′алициклический′′.
В общем, термин ′′гетероароматическая группа′′ в данном описании относится к стабильной моно- или полициклической, ненасыщенной группе, имеющей предпочтительно 3-14 атомов углерода, каждый из которых может быть замещенным или незамещенным; и содержащей, по крайней мере, один гетероатом, выбранный из O, S и N, в кольце (т.е., вместо атома углерода кольца). В определенных вариантах термин ′′гетероароматическая группа′′ относится к плоскому кольцу, содержащему, по крайней мере, один гетероатом, имеющему p-орбитали, перпендикулярные плоскости кольца в каждом атоме кольца, и удовлетворяющему правилу Хакеля, где число пи-электронов в кольце составляет (4n+2), где n является целым числом.
Также понятно, что ароматические и гетероароматические группы, такие, как определены здесь, могут быть присоединены через алкильную или гетероалкильную группу и, таким образом, включают -(алкил)ароматические, -(гетероалкил)ароматические, -(гетероалкил)гетероароматические и -(гетероалкил)гетероароматические группы. Таким образом, в данном описании, фразы ′′ароматические или гетероароматические группы′′ и ′′ароматические, гетероароматические, -(алкил)ароматические, -(гетероалкил)ароматические, -(гетероалкил)гетероароматические и -(гетероалкил)гетероароматические′′ являются взаимозаменяемыми. Заместители включают, но не ограничены ими, любые из представленных выше заместителей, т.е. заместители, перечисленные для алифатических групп или для других описанных здесь групп, позволяющие получать стабильное соединение.
Термин ′′арил′′ в данном описании значительно не отличается от общепринятого значения этого термина в данной области техники и относится к ненасыщенной циклической группе, содержащей, по крайней мере, одно ароматическое кольцо. В определенных вариантах ′′арил′′ относится к моно- или бициклической карбоциклической системе колец, имеющей одно или два ароматических колца, включающих, но не ограниченных ими, фенил, нафтил, тетрагидронафтил, инданил, инденил и подобные.
Термин ′′гетероарил′′ в данном описании значительно не отличается от общепринятого значения этого термина в данной области техники и относится к циклическому ароматическому радикалу, имеющему от пяти до десяти атомов в кольце, из которых один атом в кольце выбирают из S, O и N; ноль, один или два атома являются дополнительными гетероатомами, независимо выбранными из S, O и N; и оставшиеся атомы кольца являются углеродом, где радикал соединен с остальной молекулой через один из атомов кольца, такому как, например, пиридил, пиразинил, пиримидинил, хинолинил, изохинолинил и подобные.
Должно быть понятно, что арильные и гетероарильные группы (включая бициклические арильные группы) могут быть не замещены или замещены, где замещение включает замену одного или более атомов водорода независимо любой одной или более представленными ниже группами, включающими, но не ограниченными ими: алифатические; алициклические; гетероалифатические; гетероциклические; ароматические; гетероароматические; арильные; гетероарильные; алкиларильные; гетероалкиларильные; алкилгетероарильные; гетероалкилгетероарильные; алкокси; арилокси; гетероалкокси; гетероарилокси; алкилтио; арилтио; гетероалкилтио; гетероарилтио; F; Cl; Br; I; -OH; -NO2; -CN; -CH2(CH2)0-6CN; -CF3; -CH2CF3; -CHCl2; -CH2OH; -CH2CH2OH; -CH2NH2; -CH2SO2CH3; -C(=O)Rx; -CO2(Rx); -C(=O)N(Rx)2; -C(=O)NHRx; -CH2(CH2)0-6 C(=O)N(Rx)2; -CH2(CH2)0-6 C(=O)NHRx; -OC(=O)Rx; -OCO2Rx; -OC(=O)N(Rx)2; -N(RX)2; -ORx; -SRX; -S(O)Rx; -S(O)2Rx; -NRx(CO)Rx; -N(Rx)CO2Rx; -N(Rx)S(O)2Rx; -N(Rx)C(=O)N(Rx)2; -S(O)2N(Rx)2; где каждый Rx независимо включает, но не ограничен ими, алифатическую, алициклическую, гетероалифатическую, гетероциклическую, ароматическую, гетероароматическую, арильную, гетероарильную, алкиларильную, алкилгетероарильную, гетероалкиларильную или гетероалкилгетероарильную группу, где любой из алифатических, алициклических, гетероалифатических, гетероциклических, алкиларильных или алкилгетероарильных заместителей описан выше и здесь может быть замещенным или незамещенным, разветвленным или неразветвленным, насыщенным или ненасыщенным, и где любой из ароматических, гетероароматических, арильных, гетероарильных, -(алкил)арильных или -(алкил)гетероарильных заместителей описан выше и здесь может быть замещенным или незамещенным. Дополнительно, понятно, что любые две соседние группы, взятые вместе, могут представлять 4-, 5-, 6- или 7-членную замещенную или незамещенную алициклическую или гетероциклическую группу. Дополнительные примеры обычно применяемых заместителей показаны в конкретных вариантах, представленных в примерах, которые описаны здесь.
Термин ′′циклоалкил′′ в данном описании относится конкретно к группам, имеющим от трех до семи, предпочтительно от трех до десяти атомов углерода. Подходящие циклоалкилы включают, но не ограничены ими, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и подобные, которые, как и для алифатических, алициклических, гетероалифатических или гетероциклических групп, могут необязательно быть замещены заместителями, включающими, но не ограниченными ими, алифатические; алициклические; гетероалифатические; гетероциклические; ароматические; гетероароматические; арильные; гетероарильные; алкиларильные; гетероалкиларильные; алкилгетероарильные; гетероалкилгетероарильные; алкокси; арилокси; гетероалкокси; гетероарилокси; алкилтио; арилтио; гетероалкилтио; гетероарилтио; F; Cl; Br; I; -OH; -NO2; -CN; -CF3; -CH2CF3; -CHCl2; -CH2OH; -CH2CH2OH; -CH2NH2; -CH2SO2CH3; -C(=O)Rx; -CO2(Rx); -C(=O)N(Rx)2; -OC(=O)Rx; -OCO2Rx; -OC(=O)N(Rx)2; -N(RX)2; -ORx; -SRX; -S(O)Rx; -S(O)2Rx; -NRx(CO)Rx; -N(Rx)CO2Rx; -N(Rx)S(O)2Rx; -N(Rx)C(=O)N(Rx)2; -S(O)2N(Rx)2; где каждый Rx независимо включает, но не ограничен ими, алифатические, алициклические, гетероалифатические, гетероциклические, ароматические, гетероароматические, арильные, гетероарильные, алкиларильные, алкилгетероарильные, гетероалкиларильные или гетероалкилгетероарильные заместители, где любой из алифатических, алициклических, гетероалифатических, гетероциклических, алкиларильных или алкилгетероарильных заместителей описан выше и здесь может быть замещенным или незамещенным, разветвленным или неразветвленным, насыщенным или ненасыщенным, и где любой из ароматических, гетероароматических, арильных или гетероарильных заместителей описан выше и здесь может быть замещенным или незамещенным. Дополнительные примеры обычно применяемых заместителей показаны в конкретных вариантах, представленных в примерах, которые описаны здесь.
Термин ′′гетероалифатические′′ в данном описании относится к алифатическим группам, в которых один или более атомов углерода в основной цепи замещен гетероатомом. Таким образом, гетероалифатическая группа относится к алифатической цепи, которая содержит один или более атомов кислорода, серы, азота, фосфора или кремния, например, вместо атомов углерода. Гетероалифатические группы могут быть линейными или разветвленными и насыщенными или ненасыщенными. В определенных вариантах гетероалифатические группы являются замещенными независимым замещением одного или более атомов водорода одной или более группами, включающими, но не ограниченными ими, алифатические; алициклические; гетероалифатические; гетероциклические; ароматические; гетероароматические; арильные; гетероарильные; алкиларильные; алкилгетероарильные; алкокси; арилокси; гетероалкокси; гетероарилокси; алкилтио; арилтио; гетероалкилтио; гетероарилтио; F; Cl; Br; I; -OH; -NO2; -CN; -CF3; -CH2CF3; -CHCl2; -CH2OH; -CH2CH2OH; -CH2NH2; -CH2SO2CH3; -C(=O)Rx; -CO2(Rx); -C(=O)N(Rx)2; -OC(=O)Rx; -OCO2Rx; -OC(=O)N(Rx)2; -N(RX)2; -ORx; -SRX; -S(O)Rx; -S(O)2Rx; -NRx(CO)Rx; -N(Rx)CO2Rx; -N(Rx)S(O)2Rx; -N(Rx)C(=O)N(Rx)2; -S(O)2N(Rx)2; где каждый Rx независимо включает, но не ограничен ими, алифатические, алициклические, гетероалифатические, гетероциклические, ароматические, гетероароматические, арильные, гетероарильные, алкиларильные, алкилгетероарильные, гетероалкиларильные или гетероалкилгетероарильные, где любой из алифатических, алициклических, гетероалифатических, гетероциклических, алкиларильных или алкилгетероарильных заместителей описан выше и здесь может быть замещенным или незамещенным, разветвленным или неразветвленным, насыщенным или ненасыщенным, и где любой из ароматических, гетероароматических, арильных или гетероарильных заместителей описан выше и здесь может быть замещенным или незамещенным. Дополнительные примеры обычно применяемых заместителей показаны в конкретных вариантах, представленных в примерах, которые описаны здесь.
Термин ′′гетероциклоалкил′′, ′′гетероцикл′′ или ′′гетероциклическое′′ в данном описании относится к соединениям, которые объединяют свойства гетероалифатических и циклических соединений и включают, но не ограничены ими, насыщенные и ненасыщенные моно- или полициклические циклические системы колец, содержащих 5-16 атомов, где, по крайней мере, один атом в кольце является гетероатомом, выбранным из O, S и N (где гетероатомы азота и серы могут быть необязательно окислены), где системы колец являются необязательно замещенными одной или более функциональными группами, такими, как определены здесь. В определенных вариантах термин ′′гетероциклоалкил′′, ′′гетероцикл′′ или ′′гетероциклическое′′ относится к неароматическому 5-, 6- или 7-членному кольцу или полициклической группе, где, по крайней мере, один атом кольца является гетероатомом, выбранным из O, S и N (где гетероатомы азота и серы могут быть необязательно окислены), включающим, но не ограниченными ими, би- или трициклическую группу, содержащую конденсированные шестичленные кольца, имеющие от одного до трех гетероатомов, независимо выбранных из кислорода, серы и азота, где (i) каждое 5-членное кольцо имеет от 0 до 2 двойных связей, каждое 6-членное кольцо имеет от 0 до 2 двойных связей и каждое 7-членное кольцо имеет от 0 до 3 двойных связей, (ii) гетероатомы азота и серы могут быть необязательно окислены, (iii) гетероатом азота необязательно может быть кватернизирован, и (iv) любое из указанных выше гетероциклических колец может быть конденсировано с арильным или гетероарильным кольцом. Типовые гетероциклы включают, но не ограничены ими, гетероциклы, такие как фуранил, тиофуранил, пиранил, пирролил, пиразолил, имидазолил, тиенил, пирролидинил, пиразолинил, пиразолидинил, имидазолинил, имидазолидинил, пиперидинил, пиперазинил, оксазолил, оксазолидинил, изоксазолил, изоксазолидинил, диоксазолил, тиадиазолил, оксадиазолил, тетразолил, триазолил, тиатриазолил, оксатриазолил, тиадиазолил, оксадиазолил, морфолинил, тиазолил, тиазолидинил, изотиазолил, изотиазолидинил, дитиазолил, дитиазолидинил, тетрагидрофурил и их бензконденсированные производные. В определенных вариантах применяют ′′замещенную гетероциклическую или гетероциклоалкильную или гетероциклическую′′ группу, и в данном описании она относится к гетероциклической или гетероциклоалкильной или гетероциклической группе, такой, как определена выше, замещенной независимым замещением одного, двух или трех из атомов водорода, без ограничений, алифатическим; алициклическим; гетероалифатическим; гетероциклическим; ароматическим; гетероароматическим; арильным; гетероарильным; алкиларильным; гетероалкиларильным; алкилгетероарильным; гетероалкилгетероарильным; алкокси; арилокси; гетероалкокси; гетероарилокси; алкилтио; арилтио; гетероалкилтио; гетероарилтио; F; Cl; Br; I; -OH; -NO2; -CN; -CF3; -CH2CF3; -CHCl2; -CH2OH; -CH2CH2OH; -CH2NH2; -CH2SO2CH3; -C(=O)Rx; -CO2(Rx); -C(=O)N(Rx)2; -OC(=O)Rx; -OCO2Rx; -OC(=O)N(Rx)2; -N(RX)2; -ORx; -SRX; -S(O)Rx; -S(O)2Rx; -NRx(CO)Rx; -N(Rx)CO2Rx; -N(Rx)S(O)2Rx; -N(Rx)C(=O)N(Rx)2; -S(O)2N(Rx)2; где каждый Rx независимо включает, но не ограничен ими, алифатические, алициклические, гетероалифатические, гетероциклические, ароматические, гетероароматические, арильные, гетероарильные, алкиларильные, алкилгетероарильные, гетероалкиларильные или гетероалкилгетероарильные, где любой из алифатических, алициклических, гетероалифатических, гетероциклических, алкиларильных или алкилгетероарильных заместителей описан выше и здесь может быть замещенным или незамещенным, разветвленным или неразветвленным, насыщенным или ненасыщенным, и где любой из ароматических, гетероароматических, арильных или гетероарильных заместителей описан выше и здесь может быть замещенным или незамещенным. Дополнительные примеры обычно применяемых заместителей показаны в конкретных вариантах, представленных в примерах, которые описаны здесь.
Дополнительно, должно быть понятно, что любая из алициклических или гетероциклических групп, описанных выше, может содержать арильную или гетероарильную группу, конденсированную с ними. Дополнительные примеры обычно применяемых заместителей показаны в конкретных вариантах, показанных в примерах, представленных ниже.
Термины ′′гало′′ и ′′галоген′′ в данном описании относятся к атому, выбранному из фтора, хлора, брома и йода.
Термин ′′галогеналкил′′ означает алкильную группу, такую, как определена выше, имеющую один, два или три атома галогена, присоединенные к ней, которая представлена такими группами, как хлорметил, бромэтил, трифторметил и подобные.
Термин ′′амино′′ в данном описании относится к первичному (-NH2), вторичному (-NHRX), третичному (-NRxRy) или четвертичному (-NRxRyRz) амину, где Rx, Ry и Rz независимо являются алифатической, алициклической, гетероалифатической, гетероциклической, ароматической или гетероароматической группой, такой, как определена выше. Примеры аминогрупп включают, но не ограничены ими, метиламино, диметиламино, этиламино, диэтиламино, диэтиламинокарбонил, метилэтиламино, изопропиламино, пиперидино, триметиламино и пропиламино.
Термин ′′ацил′′ в данном описании относится к группе, имеющей общую формулу -C(=O)R, где R является алифатической, алициклической, гетероалифатической, гетероциклической, ароматической или гетероароматической группой, такой, как определена выше.
Термин ′′C1-C6 алкенилиден′′ в данном описании относится к замещенному или незамещенному, линейному или разветвленному ненасыщенному двухвалентному радикалу, содержащему только атомы углерода и водорода, имеющему от двух до шести атомов углерода, имеющему свободную валентность ′′-′′ на обоих концах радикала, и где ненасыщенность присутствует только виде двойных связей, и где двойная связь может существовать между первым атомом углерода цепи и остальной молекулой.
В данном описании термины ′′алифатическая′′, ′′гетероалифатическая′′, ′′алкильная′′, ′′алкенильная′′, ′′алкинильная′′, ′′гетероалкильная′′, ′′гетероалкенильная′′, ′′гетероалкинильная′′ и подобные охватывают замещенные и незамещенные, насыщенные и ненасыщенные, и линейные и разветвленные группы. Также, термины ′′алициклическая′′, ′′гетероциклическая′′, ′′гетероциклоалкильная′′, ′′гетероциклическая′′ и подобные охватывают замещенные и незамещенные и насыщенные и ненасыщенные группы. Дополнительно, термины ′′циклоалкильная′′, ′′циклоалкенильная′′, ′′циклоалкинильная′′, ′′гетероциклоалкильная′′, ′′гетероциклоалкенильная′′, ′′гетероциклоалкинильная′′, ′′ароматическая′′, ′′гетероароматическая′′, ′′арильная′′, ′′гетероарильная′′ и подобные охватывают замещенные и незамещенные группы.
В определенных вариантах описанных здесь соединений, W является двумя атомами водорода. Например, в формуле Ia, если W является двумя атомами водорода, формула Ia является I′a. В формуле I, если W является двумя атомами водорода, формула I является I′. В формуле II, если W является двумя атомами водорода, формула II является II′. В формуле III, если W является двумя атомами водорода, формула III является ΙΙI′. Они показаны ниже.

В других вариантах один или более атомов водорода описанного здесь соединения могут быть заменены атомом дейтерия. Такие дейтерированные производные полностью охватываются данным описанием. В определенных вариантах водород на атоме углерода арильной группы или гетероарильной группы R1 или R2 (формула Ia) или A1 или A2 (формула I) заменен дейтерием. В другом варианте водород на атоме углерода алкильной группы в Y, Z, R′, Y′ формулы Ia, I, II или III или алкоксигруппы в Y, Y′, Z формулы Ia, I, II или III заменен дейтерием. В другом варианте водород на атоме углерода алкильной группы или алкоксигруппы, если присутствуют в A или B формулы II, заменен дейтерием. В другом варианте водород на атоме углерода алкильной группы или алкоксигруппы в A формулы III заменен дейтерием. В другом варианте водород на атоме углерода метиленовой группы в (CH2)mY1(CH2)nQ формулы II или III, где A является (CH2)mY1(CH2)nQ, заменен дейтерием. В другом варианте водород на атоме углерода метиленовой группы в Q формулы II или III, где A является (CH2)mY1(CH2)nQ, заменен дейтерием. В другом варианте водород на атоме углерода гетероарильной группы в Q формулы II или III, где A является (CH2)mY1(CH2)nQ, заменен дейтерием. В другом варианте водород на атоме углерода алкильной группы в R3/R4, R′3/R′4 формулы Ia, I, II или III заменен дейтерием.
Фраза ′′фармацевтически приемлемое производное′′ в данном описании означает любую фармацевтически приемлемую соль, сложный эфир или соль такого сложного эфира, такого соединения или любого другого аддукта или производного, которое при введении пациенту способно давать (прямо или косвенно) соединение, описанное здесь, или его метаболит или остаток. Таким образом, фармацевтически приемлемые производные включают, среди прочих, пролекарства. Пролекарством (также обозначено как про-лекарство) является производное соединения, обычно со значительно пониженным фармакологическим действием, которое содержит дополнительную группу, которая подвержена удалению in vivo с получением исходной молекулы в виде фармакологически активного вида. Примером пролекарства является сложный эфир, который расщепляется in vivo с получением интересующего соединения. Другим примером является N-метиловое производное соединения, которое подвержено окислительному метаболизму с получением N-деметилирования. Пролекарства множества соединений, и материалы и способы превращения исходных соединений с получением пролекарств, известны и могут быть адаптированы к данному изобретению. Конкретные примеры фармацевтических композиций и фармацевтически приемлемых производных описаны более подробно ниже.
В данном описании термин ′′выделенное′′ при применении к соединениям в соответствии с данным изобретением относится к таким соединениям, которые (i) отделяют от, по крайней мере, некоторых компонентов, с которыми они связаны в природе или когда их получают, и/или (ii) получают, готовят или производят вручную человеком.
В данном описании термин ′′биологический образец′′ включает, без ограничений, клеточные культуры или экстракты; биопсированный материал, полученный у животных (например, млекопитающих) или его экстракты; и кровь, слюну, мочу, фекалии, семенную жидкость, слезы и другие жидкости тела или их экстракты; или их очищенные варианты. Например, термин ′′биологический образец′′ относится к любому твердому или жидкому образцу, полученному из, выведенному или секретированному живым организмом, включая одноклеточные микроорганизмы (такие как бактерии и дрожжи) и многоклеточные организмы (такие как растения и животные, например, позвоночные или млекопитающие, и, в частности, здоровые или практически здоровые люди или пациенты, страдающие состоянием или заболеванием, диагностированным или исследуемым). Биологический образец может быть в любой форме, включая твердый материал, такой как ткань, клетки, сгусток клеток, экстракт клеток, гомогенаты клеток или фракции клеток; или биопсия или биологическая жидкость. Биологическая жидкость может быть получена из любого места (например, крови, слюны (или полоскания рта, содержащего ротовые клетки), слез, плазмы, сыворотки, мочи, желчи, семенной жидкости, спинномозговой жидкости, околоплодной жидкости, брюшинной жидкости и плевральной жидкости, или из их клеток, жидкой части стекловидного тела или любой секреции тела), включает транссудат, экссудат (например, жидкость, полученная из абсцесса или любого другого места заражения или воспаления), или жидкость, полученную из сустава (например, нормального сустава или сустава, поврежденного болезнью, такой как ревматоидный артрит, остеоартрит, подагра или септический артрит). Биологический образец может быть получен из любого органа или ткани (включая образец биопсии или аутопсии) или может включать клетки (первичные клетки или культивированные клетки) или среду, которой добавлены любые клетки, ткань или орган. Биологические образцы также могут включать срезы тканей, такие как замороженные срезы, взятые для гистологических целей. Биологические образцы также включают смеси биологических молекул, включая белки, жиры, углеводы и нуклеиновые кислоты, полученные частичным или полным фракционированием гомогенатов клеток или тканей. Хотя образец предпочтительно берут у человека, биологические образцы могут быть взяты у любого животного, растения, бактерии, вируса, дрожжей и т.д. Термин животное в данном описании относится к человеку, а также к не человекообразным животным на любой стадии развития, включая, млекопитающих, птиц, рептилий, амфибий, рыбу, червей и одноклеточных. Культуры клеток и живые ткани могут быть взяты у множества животных. В определенных конкретных вариантах, не человекообразным млекопитающим является млекопитающее (например, грызун, мышь, крыса, кролик, обезьяна, собака, кошка, овца, крупный рогатый скот, примат или свинья). Животным может быть трансгенное животное или клон человека. При желании, биологический образец может быть подвергнут предварительной обработке, включая методы предварительного отделения.
Подробное описание изобретения
Селективные антагонисты андрогенового рецептора (АР), включенные в данное изобретение, применяют для множества состояний и заболеваний, таких как, но не ограниченных ими, мужская контрацепция; лечения множества связанных с мужскими гормонами состояний, таких как гиперсексуальность и половые отклонения; лечения состояний, включающих доброкачественную гиперплазию простаты, акне, андрогенную алопецию и гирсутизм; целевого предупреждения или противодействия маскулинизации в случае транссексуальных женщин, проходящих терапию по коррекции пола; в качестве антинеопластического агента и паллиативного средства, адъюванта или неоадъюванта при гормональной терапии рака простаты; и для снижения возникновения, остановки или регрессии рака простаты.
Как отмечено выше, рак простаты является одним из наиболее часто встречающихся видов рака у мужчин по всему миру, и является одной из основных причин смерти от рака у мужчин в Соединенных Штатах Америки. Лекарственные антагонисты андрогенового рецептора, такие как флутамид или бикалутамид, изначально созданы так, чтобы избежать побочных эффектов ГТ, но наблюдается андрогенный агонизм у гидроксифлуамида (активной формы флутамида) и бикалутамида. Данное изобретение отвечает на значительную медицинскую потребность в лучших антагонистах андрогенового рецептора, которые обладают мощным антагонизмом, но не обладают каким-либо агонизмом, и имеют пониженные побочные эффекты, такие как токсичность для печени, имеющиеся у существующих лекарственных антагонистов андрогенового рецептора.
Соединения в соответствии с данным изобретением являются антагонистами андрогенового рецептора, которые могут применяться для облегчения любого состояния, связанного с аномальной активацией андрогенового рецептора. Кроме рака простаты, другие примеры таких состояний включают акне, гирсутизм, себорею, избыточное кожное сало и облысение. Для того чтобы получить терапевтические свойства, описанные выше, необходимо вводить соединения в дозе, достаточной для ингибирования активации андрогенового рецептора. В типовом варианте соединения вводят местно, что особенно подходит для гирсутизма, облысения, акне и гиперсебореи. Андрогены, оказывающие сильное действие на потерю волос, стимулируют рост волос через пролонгирование фазы роста цикла волосяной луковицы (анаген) и повышают размер фолликулы. Рост волос на коже черепа не требует андрогенов, но, парадоксально, андрогены необходимы для облысения кожи черепа у генетически предрасположенных личностей (андрогенное облысение), где существует прогрессирующее снижение длительности анагена и размер волосяной фолликулы. Соединения также могут применяться местно для снижения образования себореи и, более конкретно, для облегчения гиперсебореи (жирной кожи), которая может применяться местно для облегчения акне.
1) Общее описание соединений в соответствии с данным изобретением
Данное изобретение включает соединения формул (I)-(IV) ниже, способы применения таких соединений в качестве антагонистов андрогеновых рецепторов и фармацевтические композиции, содержащие такие соединения и их соли.
В определенном варианте соединения в соответствии с данным изобретением включают соединения общей формулы (Ia):

или их фармацевтически приемлемую соль, сольват, гидрат, пролекарство или производное,
где R1 выбирают из

где Z выбирают из водорода, CF3, C1-C3 алкокси, CF3O, галогена, циано и C1-C4 алкила, необязательно замещенного одним или более галогенами;
Y независимо выбирают из одного или двух галогенов, C1-C3 алкокси, гидроксила, CF3O и циано;
W выбирают из кислорода, серы и двух атомов водорода;
R3 и R4 независимо выбирают из C1-C4 алкила, необязательно замещенного одним или более атомами фтора или гидроксильными группами, или R3 и R4 вместе образуют 3-6-членное циклоалкильное кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более атомами фтора или гидроксильными группами, и где один из атомов углерода необязательно замещен кислородом или азотом; и
R2 является замещенной или незамещенной алкильной, арильной, гетероарильной или гетероциклической группой.
В определенных вариантах -R2 является -A1-A2, где A1 является арильной группой или гетероарильной группой, необязательно замещенной одним или более C1-C4 алкилом, циано, гидроксилом, метокси, этокси, галогеном или 5-6-членной гетероарильной группой; и A2 является (CF2)a(CH2)mY1(CH2)nQ, где a, m и n являются целыми числами, независимо выбранными из 0-4, и где, по крайней мере, один из a или m или n не равен нулю, или A2 является (CH2)mY1(CH2)nQ, где m и n являются целыми числами, независимо выбранными из 0-4, и где, по крайней мере, один из m или n не равен нулю; Q выбирают из C(O)NHR′′, C(RxRy)C(O)NR′′R1′′, SO2R′′, SO2NR′′R1′′, циано, гидроксила, C1-C3 алкокси, C(S)NR′′R1′′, C(O)OR′′, OC(O)NR′′R1′′, C(O)NR′′R1′′, необязательно замещенного 5-6-членного гетероарила и необязательно замещенного 4-6-членного гетероцикла; и Y1 выбирают из прямой связи, -O-, -S-, и -NR′′-; R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила, или NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором; Rx и Ry независимо выбирают из водорода или метила; или C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо или 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином.
В определенных вариантах соединений формулы (Ia), представлены соединения формулы (I):

или их фармацевтически приемлемая соль, сольват, гидрат, пролекарство или производное,
где Z выбирают из водорода, CF3, C1-C3 алкокси, CF3O, галогена, циано и C1-C4 алкила, необязательно замещенного одним или более галогенами;
Y выбирают из галогена, C1-C3 алкокси, гидроксила, CF3O и циано;
W выбирают из кислорода, серы и двух атомов водорода;
R3 и R4 независимо выбирают из C1-C4 алкила, необязательно замещенного одним или более атомами фтора или гидроксильными группами, или R3 и R4 и атом углерода, к которому они присоединены, образуют 3-6-членное циклоалкильное кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более атомами фтора или гидроксильными группами, и где один из атомов углерода необязательно замещен кислородом или азотом;
A1 является арильной группой или гетероарильной группой, необязательно замещенной одним или более C1-C4 алкилом, циано, гидроксилом, метокси, этоксилом, галогеном или 5-6-членной гетероарильной группой;
A2 является (CF2)a(CH2)mY1(CH2)nQ, где a, m и n являются целыми числами, независимо выбранными из 0-4, и где, по крайней мере, один из a или m или n не равен нулю, или A2 является (CH2)mY1(CH2)nQ, где m и n являются целыми числами, независимо выбранными из 0-4, и где, по крайней мере, один из m или n не равен нулю; Q выбирают из C(O)NHR′′, C(RxRy)C(O)NR′′R1′′, SO2R′′, SO2NR′′R1′′, циано, гидроксила, C1-C3 алкокси, C(S)NR′′R1′′, C(O)OR′′, OC(O)NR′′R1′′, C(O)NR′′R1′′, необязательно замещенного 5-6-членного гетероарила и необязательно замещенного 4-6-членного гетероцикла; и Y1 выбирают из прямой связи, -O-, -S- и -NR′′-; R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила, или NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором; Rx и Ry независимо выбирают из водорода или метила; или C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо или 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином.
В определенных вариантах соединения формулы (I), Y является галогеном или циано. В других вариантах Z является галогеном, метокси, циано, метилом или CF3. В других вариантах W является кислородом. В других вариантах A1 является фенильной группой или пиридильной группой, необязательно замещенной одним или более C1-C4 алкилом, циано, гидроксилом, метокси, этоксилом, галогеном или 5-6-членной гетероарильной группой. В определенных вариантах A1 выбирают из:
В других вариантах Q является необязательно замещенной 5-6-членной гетероарильной группой, такой как, но не ограниченной ими, пиридил, пиразинил, пиримидинил, пирролил, пиразолил, имидазолил, тиенил, оксазолил, изоксазолил, диоксазолил, тиадиазолил, оксадиазолил, тетразолил, триазолил, тиатриазолил, оксатриазолил, тиадиазолил, оксадиазолил, тиазолил, изотиазолил, дитиазолил. 5-6-членная гетероарильная группа может быть замещена гидроксилом, C1-C3 алкокси, C1-C6 алкилом, галогеном или циано. В других вариантах Q выбирают из

В других вариантах Q является необязательно замещенным 4-6-членным гетероциклом, таким как, но не ограниченными ими, фуранил, тиофуранил, пиранил, пирролидинил, пиразолинил, пиразолидинил, имидазолинил, имидазолидинил, пиперидинил, пиперазинил, оксазолидинил, изоксазолидинил, морфолинил, тиазолидинил, изотиазолидинил, дитиазолидинил и тетрагидрофурил. 4-6-членный гетероцикл может быть замещен гидроксилом, C1-C3 алкокси, C1-C6 алкилом, галогеном или циано.
В других вариантах соединения формулы (I), A2 является (CH2)mY1(CH2)nQ′, где Y1 является связью, m и n являются целыми числами, независимо выбранными из 0-2, где, по крайней мере, один из m или n не равен нулю; Q′ выбирают из C(O)NHR′′, C(RxRy)C(O)NR′′R1′′, SO2R′′, SO2NR′′R1′′, циано, гидроксила, C1-C3 алкокси, C(S)NR′′R1′′, C(O)OR′′, OC(O)NR′′R1′′, C(O)NR′′R1′′, необязательно замещенного 5-6-членного гетероарила и необязательно замещенного 4-6-членного гетероцикла; и R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила, или NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором; Rx и Ry независимо выбирают из водорода или метила; или C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо или 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином.
В определенных вариантах соединения формулы (I), Q′ выбирают из

В определенных вариантах соединения формулы (I), m+n равно 2 или 3.
В определенных вариантах соединения формулы (I), Q′ выбирают из C(RxRy)C(O)NR′′R1′′, OC(O)NR′′R1′′, необязательно замещенного 5-6-членного гетероарила и необязательно замещенного 4-6-членного гетероцикла; и R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила, или NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором; Rx и Ry независимо выбирают из водорода или метила; или C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо или 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином. В других вариантах Q′ является 5-6-членной гетероарильной группой.
В определенных вариантах соединений формулы (I), NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором, такое как, но не ограниченное ими, азетидин, азетидин-3-ол, азетидин-3-ил амин, 3-фторазетидин, азетидин-3-карбонитрил, пирролидин, пирролидин-3-ол, пирролидин-3,4-диол, пиперидин-4-ол, морфолин, 4-метилпиперазин, пиперазин или 4,4-дифторпиперидин.
В определенных вариантах C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо. Необязательные заместители включают один или более гидроксил, амино, циано или фтор. Неограничивающие примеры такого NR′′R1′′ включают, но не ограничены ими, циклопропил, циклобутил, циклопентил или циклобутан-3-ол.
В определенных вариантах C(RxRy) вместе образуют 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином, такое как, но не ограниченное ими, азетидин, N-метилазетидин или оксетан.
Множество важных подклассов соединений формулы (I) заслуживают особого упоминания.
1) Z является водородом;
2) Z является C1-C4 алкилом, таким как, но не ограниченным ими, метил или этил, необязательно замещенный одной или более галогеновыми группами;
3) Z является CF3;
4) Z является C1-C3 алкокси;
5) Z является CF3O;
6) Z является галогеном;
7) Z является циано;
8) Z является фтором;
9) Y является галогеном;
10) Y является алкокси, таким как, но не ограниченным ими, метокси и этокси;
11) Y является гидроксилом;
12) Y является CF3O;
13) Y является циано;
14) W является кислородом;
15) W является серой;
16) W является двумя атомами водорода;
17) R3 и R4 независимо являются метильными, этильными, пропильными или бутильными группами;
18) R3 и R4 и атом углерода, к которому они присоединены, образуют 3-6-членное циклоалкильное кольцо, необязательно замещенное одним или более атомами фтора, и в котором один из атомов углерода необязательно замещен кислородом или азотом;
19) R3 и R4 и атом углерода, к которому они присоединены, образуют циклопропил;
20) R3 и R4 и атом углерода, к которому они присоединены, образуют циклобутил;
21) R и R4 и атом углерода, к которому они присоединены, образуют циклопентил;
22) R3 и R4 и атом углерода, к которому они присоединены, образуют азетидин, пирролидин или пиперидин;
23) R3 и R4 и атом углерода, к которому они присоединены, образуют оксетан, тетрагидрофуран или тетрагидропиран;
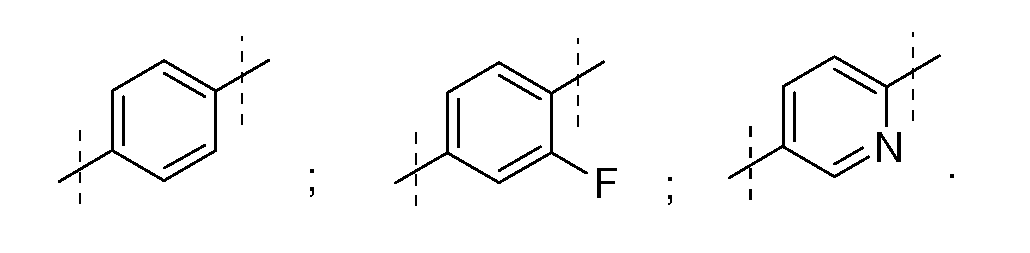
24) А1 является фенилом или нафтилом;
25) А1 является замещенной арильной группой, такой как, но не ограниченной ею,

26) А1 является замещенной гетероарильной группой, такой как, но не ограниченной ею,
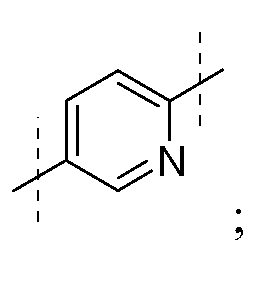
27) А1 замещен одним или более C1-C6 алкилами;
28) А1 замещен одним или более циано;
29) А1 замещен одним или более гидроксилами;
30) А1 замещен одним или более алкокси, таким как метокси и этокси;
31) А1 замещен одним или более галогенами;
32) А1 замещен одной или более необязательно замещенными 5-6-членными гетероарильными группыми, такими как, но не ограниченными ими

33) Y1 является прямой связью;
34) Y1 является -O-;
35) Y1 является -S-;
36) Y1 является -NR′′-; где R′′ является водородом, C1-C6 алкилом, C1-C6 циклоалкилом или C1-C6 алкенилом;
37) A2 является (CH2)mY1(CH2)nQ′, где Y1 является связью, m и n являются целыми числами, независимо выбранными из 0-2, где, по крайней мере, один из m или n не равен нулю; и Q′ выбирают из C(RxRy)C(O)NR′′R1′′, OC(O)NR′′R1′′, необязательно замещенного 5-6-членного гетероарила и необязательно замещенного 4-6-членного гетероцикла; и R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6циклоалкила и C1-C6 алкенила, или NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором; Rx и Ry независимо выбирают из водорода или метила; или C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо или 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином;
38) A2 является (CH2)mY1(CH2)nQ′, где Y1 является связью, m и n являются целыми числами, независимо выбранными из 0-2, где, по крайней мере, один из m или n не равен нулю; и Q′ является необязательно замещенной 5-6-членной гетероарильной группой, такой как, но не ограниченной ими,

39) A2 является (CH2)mY1(CH2)nQ′, где Y1 является связью, m и n являются целыми числами, независимо выбранными из 0-2, где, по крайней мере, один из m или n не равен нулю; и Q′ выбирают из необязательно замещенного 4-6-членного гетероцикла, такого как, но не ограниченного ими,

40) A2 является (CH2)mY1(CH2)nQ′, где Y1 является связью, m и n являются целыми числами, независимо выбранными из 0-2, где, по крайней мере, один из m или n не равен нулю; и Q′ выбирают из C(RxRy)C(O)NR′′R1′′ или OC(O)NR′′R1′′, и R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила; и Rx и Ry независимо выбирают из водорода или метила; или C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо или 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином;
41) A2 является (CH2)mY1(CH2)nQ′, где Y1 является связью, m и n являются целыми числами, независимо выбранными из 0-2, где, по крайней мере, один из m или n не равен нулю; и Q′ выбирают из C(RxRy)C(O)NR′′R1′′ или OC(O)NR′′R1′′, и NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором, такое как

Rx и Ry независимо выбирают из водорода или метила;
42) A2 является (CH2)mY1(CH2)nQ′, где Y1 является связью, m и n являются целыми числами, независимо выбранными из 0-2, где, по крайней мере, один из m или n не равен нулю; и Q′ выбирают из C(RxRy)C(O)NR′′R1′′, OC(O)NR′′R1′′, и NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором; и Rx и Ry независимо выбирают из водорода или метила;
43) A2 является (CH2)mY1(CH2)nQ′, где Y1 является связью, m и n являются целыми числами, независимо выбранными из 0-2, где, по крайней мере, один из m или n не равен нулю; и Q′ выбирают из C(RxRy)C(O)NR′′R1′′, OC(O)NR′′R1′′; и R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила, или NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором; и C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо, такое как

44) A2 является (CH2)mY1(CH2)nQ′, где Y1 является связью, m и n являются целыми числами, независимо выбранными из 0-2, где, по крайней мере, один из m или n не равен нулю; и Q′ выбирают из C(RxRy)C(O)NR′′R1′′, OC(O)NR′′R1′′; и R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила, или NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором; и C(RxRy) вместе образуют 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином, такое как

45) Q′ является необязательно замещенным 5-6-членным гетероарилом, таким как, но не ограниченным ими, пиридил, пиразинил, пиримидинил, фуранил, тиофуранил, пиранил, пирролил, пиразолил, имидазолил, тиенил, оксазолил, изоксазолил, диоксазолил, тиадиазолил, оксадиазолил, тетразолил, триазолил, тиатриазолил, оксатриазолил, тиадиазолил, оксадиазолил, тиазолил, изотиазолил, дитиазолил;
46) Q′ является 5-6-членной гетероарильной группой, замещенной гидроксилом, C1-C3 алкокси, C1-C6 алкилом, галогеном или циано;
47) Q′ является необязательно замещенным 4-6-членным гетероциклом, таким как, но не ограниченным ими, пирролидинил, пиразолинил, пиразолидинил, имидазолинил, имидазолидинил, пиперидинил, пиперазинил, оксазолидинил, изоксазолидинил, морфолинил, тиазолидинил, изотиазолидинил, дитиазолидинил, тетрагидрофурил;
48) Q′ является 4-6-членным гетероциклом, замещенным гидроксилом, C1-C3 алкокси, C1-C6 алкилом, галогеном или циано;
49) C(RxRy) вместе образуют 3-5-членное циклическое алкильное кольцо, которое необязательно замещено одним или более гидроксилом, амино, циано или фтором, такое как циклопропил, 2-гидроксициклопропил, циклобутил, 3-гидроксициклобутил или циклопентил; или
50) C(RxRy) вместе образуют 3-5-членное циклическое кольцо, где один атом углерода замещен кислородом или амином, такое как, но не ограниченное ими, азетидин, оксетан или N-метилазетидин.
Неограничивающие примеры соединений формулы (I) включают:
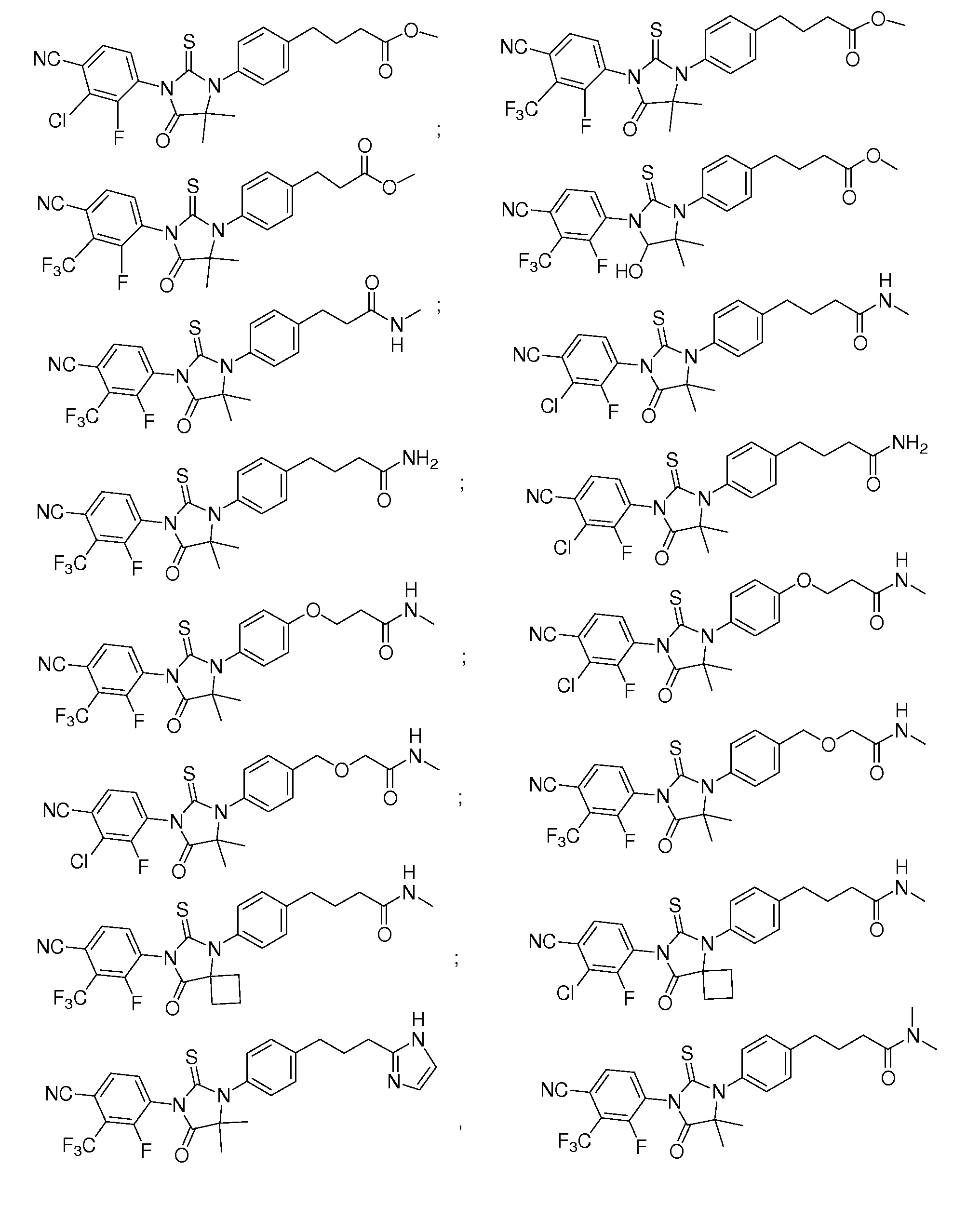

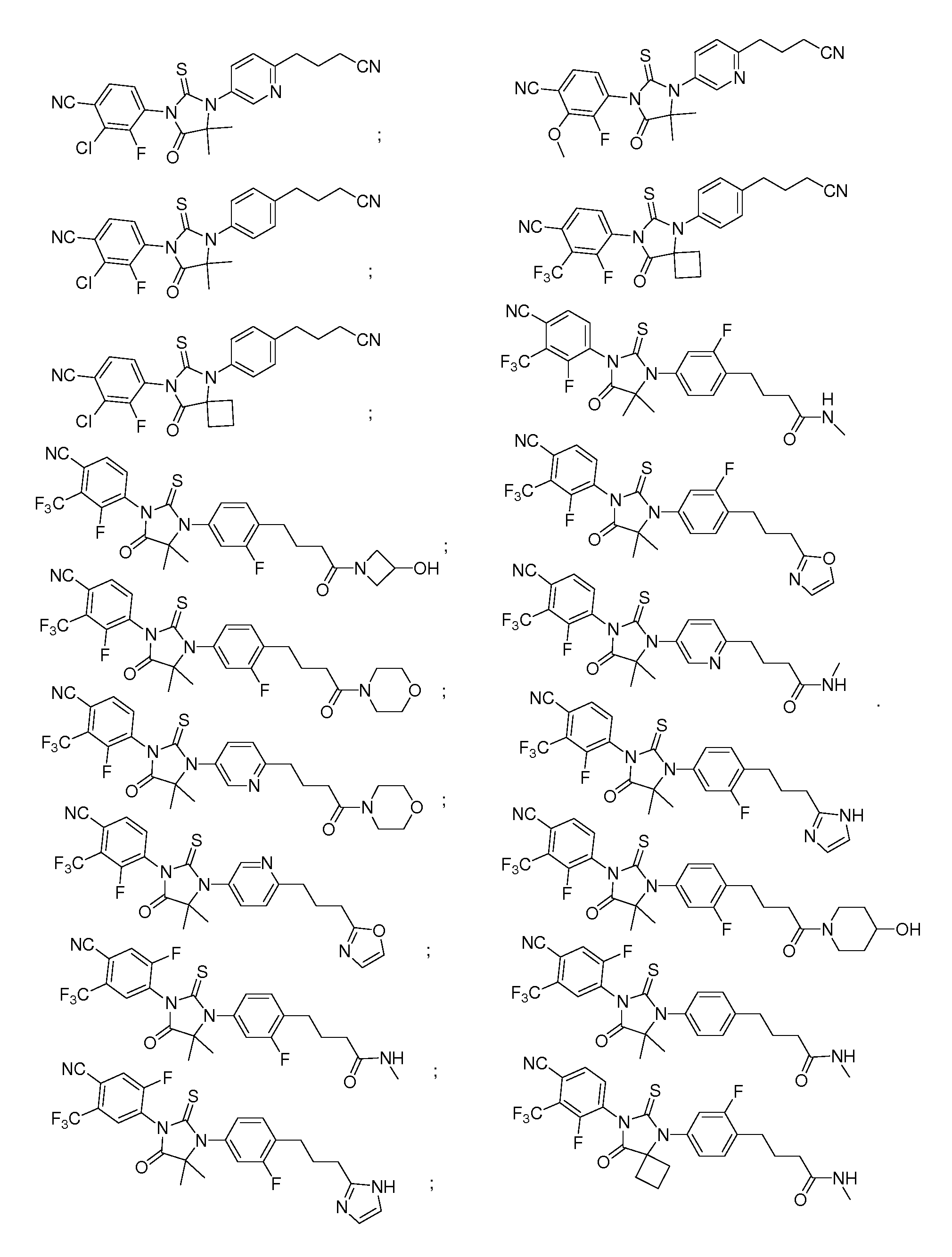

В определенных вариантах данное изобретение относится к определенному классу особенно интересных соединений, в одном аспекте соединений формулы (II):

или их фармацевтически приемлемой соли, сольвату, гидрату, пролекарству или производному,
где Z1 выбирают из CF3O, метила, CH2F, CHF2, CF3, метокси, галогена и циано;
X выбирают из галогена, C1-C3 алкокси, CF3O, гидроксила и циано;
W выбирают из кислорода, серы и двух атомов водорода;
R′′3 и R′′4 являются метилом, или R′′3 и R′′4 и атом углерода, к которому они присоединены, образуют 3-6-членное циклоалкильное кольцо, необязательно замещенное одним или более атомами фтора или гидроксильными группами;
B независимо выбирают из одного или более атомов водорода, циано, метила, CF3 или галогена; и
A является (CF2)a(CH2)mY1(CH2)nQ, где a, m и n являются целыми числами, независимо выбранными из 0-4, и где, по крайней мере, один из a или m или n не равен нулю; или A является (CH2)mY1(CH2)nQ, где m и n являются целыми числами, независимо выбранными из 0-4, и где, по крайней мере, один из m или n не равен нулю; Q выбирают из C(O)NHR′′, C(RxRy)C(O)NR′′R1′′, SO2R′′, SO2NR′′R1′′, циано, гидроксила, C1-C3 алкокси, C(S)NR′′R1′′, C(O)OR′′, OC(O)NR′′R1′′, C(O)NR′′R1′′, необязательно замещенного 5-6-членного гетероарила и необязательно замещенного 4-6-членного гетероцикла; и Y1 выбирают из прямой связи, -O-, -S- и -NR′′-; R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила, или NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором; Rx и Ry независимо выбирают из водорода или метила; или C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо или 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином.
В определенных вариантах соединений формулы (II), Z1 является CF3, метокси, галогеном. В определенных вариантах X является фтором. В определенных вариантах R′′3 и R′′4 являются метилом, или R′′3 и R′′4 и атом углерода, к которому они присоединены, образуют циклопропильное или циклобутильное или циклопентильное или циклогексильное кольцо, которое может быть необязательно замещено одним или более атомами фтора или гидроксильными группами.
В определенных вариантах соединений формулы (II), Q выбирают из

В других вариантах соединений формулы (II), Q выбирают из C(RxRy)C(O)NR′′R1′′, OC(O)NR′′R1′′, необязательно замещенного 5-6-членного гетероарила и необязательно замещенного 4-6-членного гетероцикла; и R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила, или NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором; Rx и Ry независимо выбирают из водорода или метила; или C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо или 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином. В определенных вариантах Q является 5-6-членной гетероарильной группой.
В других вариантах соединений формулы (II), A является (CH2)kQ′, где k является целым числом, выбранным из 1-5; Q′ выбирают из C(O)NHR′′, C(RxRy)C(O)NR′′R1′′, SO2R′′, SO2NR′′R1′′, циано, гидроксила, C1-C3 алкокси, C(S)NR′′R1′′, C(O)OR′′, OC(O)NR′′R1′′, C(O)NR′′R1′′, необязательно замещенного 5-6-членного гетероарила и необязательно замещенного 4-6-членного гетероцикла; и R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила, или NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором; Rx и Ry независимо выбирают из водорода или метила; или C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо или гетероциклическое кольцо или 3-5-членное циклическое кольцо, где один атом углерода замещен кислородом или амином. 4-5-членная гетероарильная группа или 4-6-членный гетероцикл может быть замещен гидроксилом, C1-C3 алкокси, C1-C6 алкилом, галогеном или циано. В определенных вариантах Q′ выбирают из
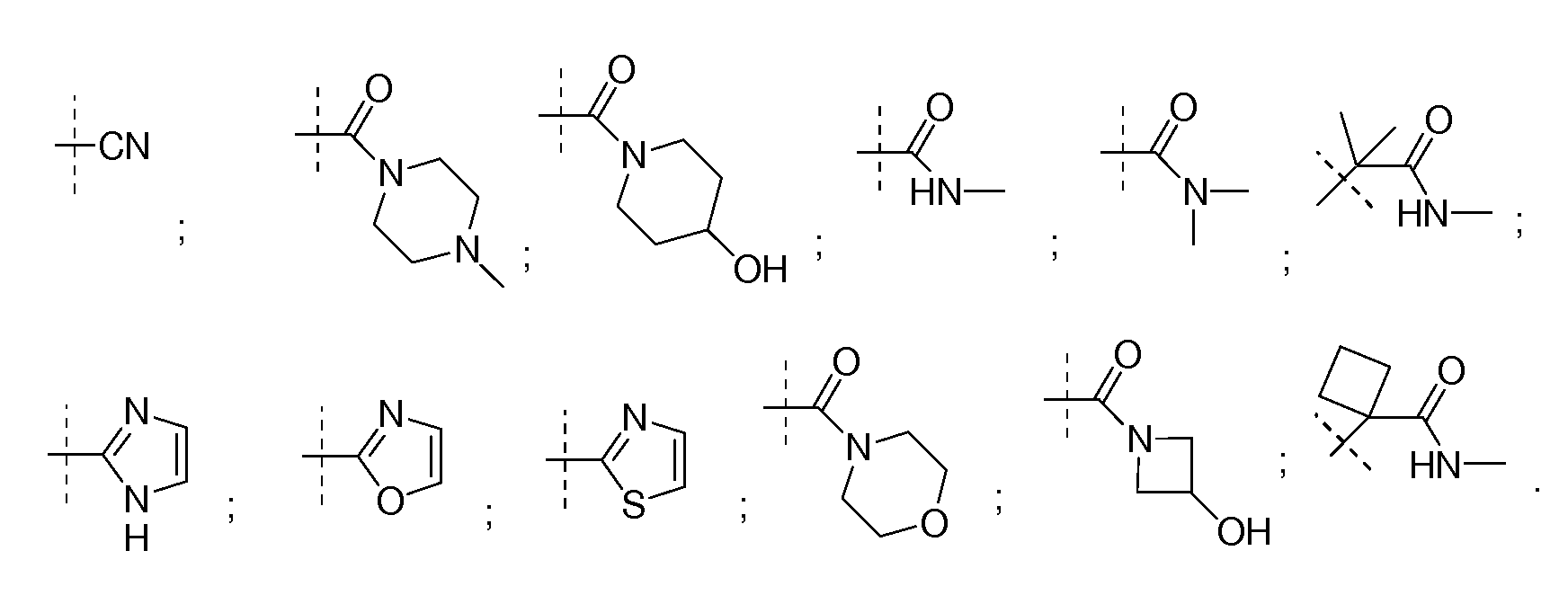
В других вариантах Q′ выбирают из C(RxRy)C(O)NR′′R1′′, OC(O)NR′′R1′′, необязательно замещенного 5-6-членного гетероарила и необязательно замещенного 4-6-членного гетероцикла; и R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила, или NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором; Rx и Ry независимо выбирают из водорода или метила; или C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо или 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином. В определенных вариантах k равно 2 или 3.
В определенных вариантах, Q′ является необязательно замещенной 5-6-членной гетероарильной группой.
В определенных вариантах соединений формулы (II), B является водородом или фтором в положении орто радикала A.
В определенных вариантах соединений формулы (II), W является кислородом.
Несколько важных подклассов соединений формулы (II) заслуживают особого упоминания.
1) Z является водородом;
2) Z является C1-C4 алкилом, таким как, но не ограниченным ими, метил или этил, необязательно замещенный одной или более галогеновыми группами;
3) Z является CF3;
4) Z является C1-C3 алкокси;
5) Z является CF3O;
6) Z является галогеном;
7) Z является циано;
8) Z является фтором;
9) W является кислородом;
10) W является серой;
11) W является двумя атомами водорода;
12) R3′′ и R4′′ независимо являются метильными, этильными, пропильными или бутильными группами;
13) R3′′ и R4′′ и атом углерода, к которому они присоединены, образуют 3-6-членное циклоалкильное кольцо, необязательно замещенное одним или более атомами фтора, и в котором один из атомов углерода необязательно замещен кислородом или азотом; R3′′ и R4′′ и атом углерода, к которому они присоединены, вместе образуют циклопропил;
14) R3′′ и R4′′ и атом углерода, к которому они присоединены, вместе образуют циклобутил;
15) R3′′ и R4′′ и атом углерода, к которому они присоединены, вместе образуют циклопентил;
16) R3′′ и R4′′ и атом углерода, к которому они присоединены, вместе образуют азетидин, пирролидин или пиперидин;
17) R3′′ и R4′′ и атом углерода, к которому они присоединены, вместе образуют оксетан, тетрагидрофуран или тетрагидропиран.
18) Y1 является прямой связью;
19) Y1 является -O-;
20) Y1 является -S-;
21) Y1 является -NR′′-; где R′′ является водородом, C1-C6 алкилом, C1-C6 циклоалкилом или C1-C6 алкенилом;
22) B является водородом, циано, метилом, CF3 или галогеном;
23) A2 является (CH2)kQ′, где k равно целому числу от 1 до 5, и Q′ является необязательно замещенным 5-6-членным гетероарилом, таким как, но не ограниченным ими, фуранил, тиофуранил, пиранил, пирролил, пиразолил, имидазолил, тиенил, оксазолил, изоксазолил, диоксазолил, тиадиазолил, оксадиазолил, тетразолил, триазолил, тиатриазолил, оксатриазолил, тиадиазолил, оксадиазолил, тиазолил, изотиазолил и дитиазолил;
24) Q′ является 5-6-членной гетероарильной группой, замещенной гидроксилом, C1-C3 алкокси, C1-C6 алкилом, галогеном или циано;
25) A2 является (CH2)kQ′, где k равно целому числу от 1 до 5, и Q′ является необязательно замещенным 5-6-членным гетероциклом, таким как, но не ограниченным ими, пирролидинил, пиразолинил, пиразолидинил, имидазолинил, имидазолидинил, пиперидинил, пиперазинил, оксазолидинил, изоксазолидинил, морфолинил, тиазолидинил, изотиазолидинил, дитиазолидинил и тетрагидрофурил;
26) Q′ является 4-6-членным гетероциклом, замещенным гидроксилом, C1-C3 алкокси, C1-C6 алкилом, галогеном или циано;
27) Q′ является

28) Q′ является необязательно замещенным 4-6-членным гетероциклом, таким как, но не ограниченными ими

29) Q′ является необязательно замещенной 5-6-членной гетероарильной группой, такой как, но не ограниченной ими,

30) A2 является (CH2)kQ′, где k равно целому числу от 1 до 5, и Q′ является C(RxRy)C(O)NR′′R1′′, где R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила; и Rx и Ry независимо выбирают из водорода или метила; или C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо или 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином;
31) A2 является (CH2)kQ′, где k равно целому числу от 1 до 5, и Q′ является C(RxRy)C(O)NR′′R1′′, где NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором; Rx и Ry независимо выбирают из водорода или метила; или C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо или 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином;
32) A2 является (CH2)kQ′, где k равно целому числу от 1 до 5, и Q′ выбирают из OC(O)NR′′R1′′, где R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила, или NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором;
33) NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором, такое как, но не ограниченное ими,
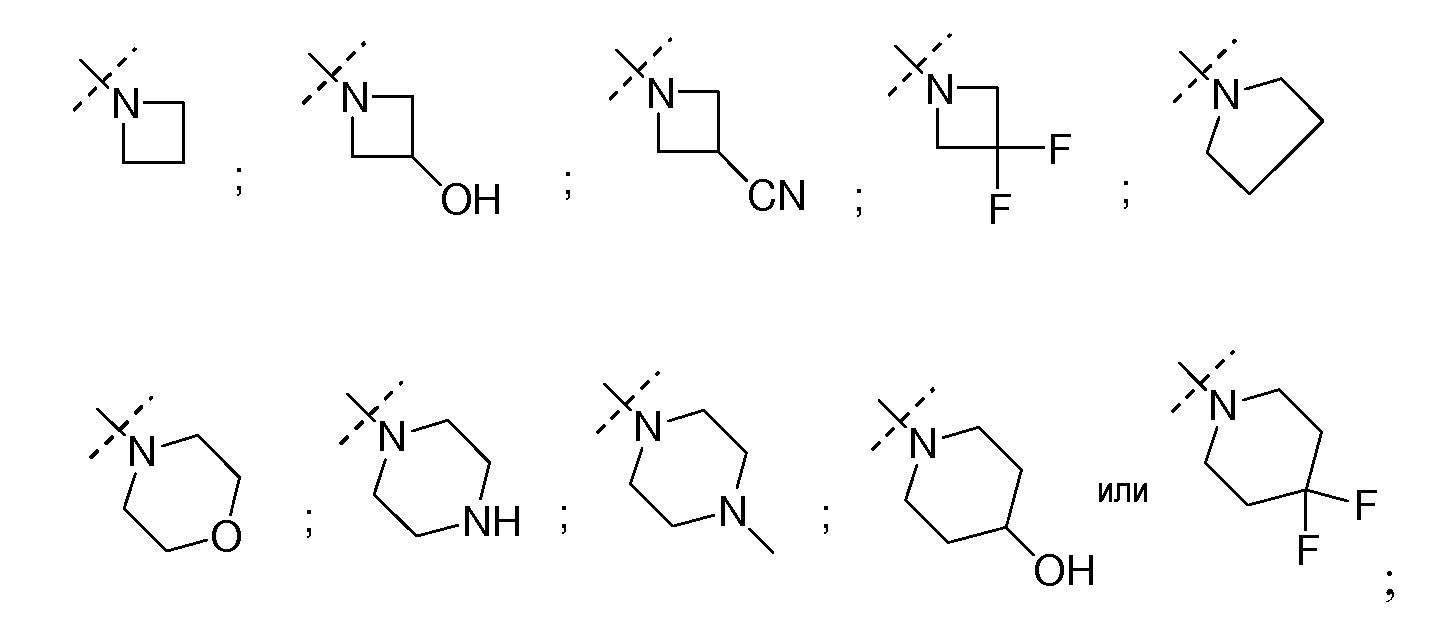
34) C(RxRy) вместе образуют 3-5-членное циклическое алкильное кольцо, которое необязательно замещено одним или более гидроксилом, амино, циано или фтором, такое как циклопропил, 2-гидроксициклопропил, циклобутил, 2-гидроксициклобутил или циклопентил; или
35) C(RxRy) вместе образуют 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином, таким как, но не ограниченным ими, азетидин, оксетан или N-метилазетидин.
Неограничивающие примеры соединений формулы (II) включают:



В другом варианте представлены соединения формулы (III):

или их фармацевтически приемлемая соль, сольват, гидрат, пролекарство или производное,
где Z1 выбирают из CF3O, метила, CH2F, CHF2, CF3, метокси, галогена и циано;
X выбирают из галогена, C1-C3 алкокси, CF3O, гидроксила и циано;
W выбирают из кислорода, серы и двух атомов водорода;
R′′3 и R′′4 являются метилом, или R′′3 и R′′4 и атом углерода, к которому они присоединены, вместе образуют 3-6-членное циклоалкильное кольцо, необязательно замещенное одним или более атомами фтора или гидроксильными группами; и
A является (CF2)a(CH2)mY1(CH2)nQ, где a, m и n являются целыми числами, независимо выбранными из 0-4, и где, по крайней мере, один из a или m или n не равен нулю; или A является (CH2)mY1(CH2)nQ, где m и n являются целыми числами, независимо выбранными из 0-4, и где, по крайней мере, один из m или n не равен нулю; Q выбирают из C(O)NHR′′, C(RxRy)C(O)NR′′R1′′, SO2R′′, SO2NR′′R1′′, циано, гидроксила, C1-C3 алкокси, C(S)NR′′R1′′, C(O)OR′′, OC(O)NR′′R1′′, C(O)NR′′R1′′, необязательно замещенного 5-6-членного гетероарила и необязательно замещенного 4-6-членного гетероцикла; и Y1 выбирают из прямой связи, -O-, -S- и -NR′′-; R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила, или NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором; Rx и Ry независимо выбирают из водорода или метила; или C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо или 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином.
В определенных вариантах соединений формулы (III), Z1 является CF, метокси, галогеном.
В определенных вариантах соединений формулы (III), X является фтором.
В определенных вариантах соединений формулы (III), R′′3 и R′′4 являются метилом, или R′′3 и R′′4 и атом углерода, к которому они присоединены, образуют циклопропильное или циклобутильное или циклопентильное или циклогексильное кольцо, которое может быть необязательно замещено одним или более фтором или гидроксильными группами.
В определенных вариантах соединений формулы (III), Q выбирают из

В определенных вариантах соединений формулы (III), Q является необязательно замещенной 5-6-членной гетероарильной группой или необязательно замещенным 4-6-членным гетероциклом. В определенных вариантах 5-6-членная гетероарильная группа или 4-6-членный гетероцикл может быть замещен гидроксилом, C1-C3 алкокси, C1-C6 алкилом, галогеном или циано.
В определенных вариантах соединений формулы (III), A является (CH2)mY1(CH2)nQ′, где Y1 является связью, m и n являются целыми числами, независимо выбранными из 0-2, и где, по крайней мере, один из m или n не равен нулю; Q′ выбирают из C(O)NHR′′, C(RxRy)C(O)NR′′R1′′, SO2R′′, SO2NR′′R1′′, циано, гидроксила, C1-C3 алкокси, C(S)NR′′R1′′, C(O)OR′′, OC(O)NR′′R1′′, C(O)NR′′R1′′, необязательно замещенного 5-6-членного гетероарила и необязательно замещенного 4-6-членного гетероцикла; и R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила, или NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором; Rx и Ry независимо выбирают из водорода или метила; или C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо или 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином.
В определенных вариантах соединений формулы (III), Q′ является необязательно замещенной 5-6-членной гетероарильной группой или необязательно замещенным 4-6-членным гетероциклом. В определенных вариантах 5-6-членная гетероарильная группа или 4-6-членный гетероцикл может быть замещен гидроксилом, C1-C3 алкокси, C1-C6 алкилом, галогеном или циано.
В определенных вариантах соединений формулы (III), Q′ выбирают из
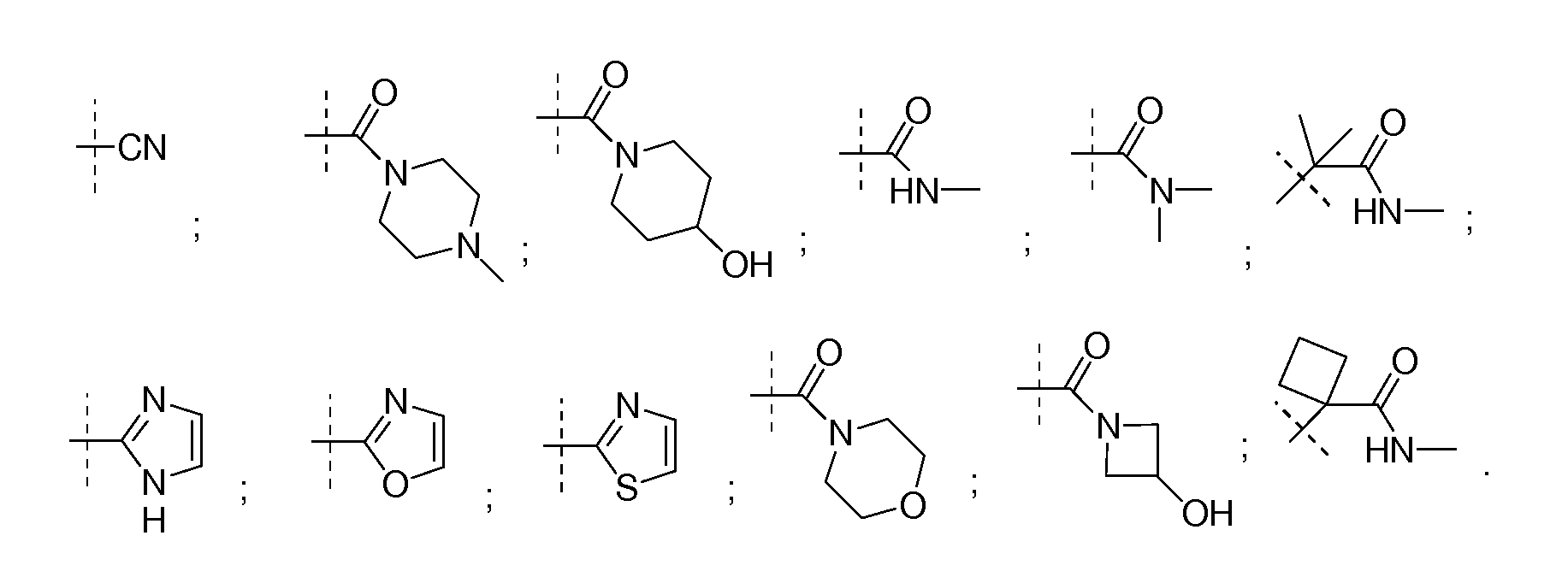
В определенных вариантах соединений формулы (III), A является (CH2)kQ′, где k является целым числом, выбранным из 1-5; Q′ выбирают из C(O)NHR′′, C(RxRy)C(O)NR′′R1′′, SO2R′′, SO2NR′′R1′′, циано, гидроксила, C1-C3 алкокси, C(S)NR′′R1′′, C(O)OR′′, OC(O)NR′′R1′′, C(O)NR′′R1′′, необязательно замещенного 5-6-членного гетероарила и необязательно замещенного 4-6-членного гетероцикла; и R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила, или NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором; Rx и Ry независимо выбирают из водорода или метила; или C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо или гетероциклическое кольцо или 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином. В определенных вариантах k равно 2 или 3.
В определенных вариантах соединений формулы (III), Q′ является необязательно замещенной 5-6-членной гетероарильной группой или необязательно замещенным 4-6-членным гетероциклом. В определенных вариантах 5-6-членная гетероарильная группа или 4-6-членный гетероцикл может быть замещен гидроксилом, C1-C3 алкокси, C1-C6 алкилом, галогеном или циано.
В определенных вариантах соединений формулы (III), Q′ выбирают из C(RxRy)C(O)NR′′R1′′, OC(O)NR′′R1′′, необязательно замещенного 5-6-членного гетероарила и необязательно замещенного 4-6-членного гетероцикла; и R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила, или NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором; Rx и Ry независимо выбирают из водорода или метила; или C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо или 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином. В определенных вариантах Q′ является необязательно замещенной 5-6-членной гетероарильной группой. В определенных вариантах 5-6-членная гетероарильная группа может быть замещена гидроксилом, C1-C3 алкокси, C1-C6 алкилом, галогеном или циано.
В определенных вариантах соединений формулы (III), W является кислородом.
Множество важных подклассов соединений формулы (III) заслуживают особого упоминания:
36) Z является водородом;
37) Z является C1-C4 алкилом, таким как, но не ограниченным ими, метил или этил, необязательно замещенный одной или более галогеновыми группами;
38) Z является CF3;
39) Z является C1-C3 алкокси;
40) Z является CF3O;
41) Z является галогеном;
42) Z является циано;
43) Z является фтором;
44) W является кислородом;
45) W является серой;
46) W является двумя атомами водорода;
47) R3′′ и R4′′ независимо являются метильной, этильной, пропильной или бутильной группами;
48) R3′′ и R4′′ и атом углерода, к которому они присоединены, вместе образуют 3-6-членное циклоалкильное кольцо, необязательно замещенное одним или более фтором, и в котором один из атомов углерода необязательно замещен кислородом или азотом; R3′′ и R4′′ и атом углерода, к которому они присоединены, вместе образуют циклопропил;
49) R3′′ и R4′′ и атом углерода, к которому они присоединены, вместе образуют циклобутил;
50) R3′′ и R4′′ и атом углерода, к которому они присоединены, вместе образуют циклопентил;
51) R3′′ и R ′′ и атом углерода, к которому они присоединены, вместе образуют азетидин, пирролидин или пиперидин;
52) R3′′ и R4′′ и атом углерода, к которому они присоединены, вместе образуют оксетан, тетрагидрофуран или тетрагидропиран;
53) Y1 является прямой связью;
54) Y1 является -O-;
55) Y1 является -S-;
56) Y1 является -NR′′-; где R′′ является водородом, C1-C6 алкилом, C1-C6 циклоалкилом или C1-C6 алкенилом;
57) B является водородом, циано, метилом, CF3 или галогеном;
58) A2 является (CH2)kQ′, где k равно целому числу от 1 до 5, и Q′ является необязательно замещенным 5-6-членным гетероарилом, таким как, но не ограниченным ими, пиридил, пиразинил, пиримидинил, фуранил, тиофуранил, пиранил, пирролил, пиразолил, имидазолил, тиенил, оксазолил, изоксазолил, диоксазолил, тиадиазолил, оксадиазолил, тетразолил, триазолил, тиатриазолил, оксатриазолил, тиадиазолил, оксадиазолил, тиазолил, изотиазолил и дитиазолил;
Q′ является 5-6-членной гетероарильной группой, замещенной гидроксилом, C1-C3 алкокси, C1-C6 алкилом, галогеном или циано;
59) A2 является (CH2)kQ′, где k равно целому числу от 1 до 5, и Q′ является необязательно замещенным 5-6-членным гетероциклом, таким как, но не ограниченными ими, пирролидинил, пиразолинил, пиразолидинил, имидазолинил, имидазолидинил, пиперидинил, пиперазинил, оксазолидинил, изоксазолидинил, морфолинил, тиазолидинил, изотиазолидинил, дитиазолидинил и тетрагидрофурил;
60) Q′ является 4-6-членным гетероциклом, замещенным гидроксилом, C1-C3 алкокси, C1-C6 алкилом, галогеном или циано;
61) Q′ является

62) Q′ является необязательно замещенным 4-6-членным гетероциклом, таким как, но не ограниченным ими,

63) Q′ является необязательно замещенной 5-6-членной гетероарильной группой, такой как, но не ограниченной ими,

64) A2 является (CH2)kQ′, где k равно целому числу от 1 до 5, и Q′ является C(RxRy)C(O)NR′′R1′′, где R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила; и Rx и Ry независимо выбирают из водорода или метила; или C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо или 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином;
65) A2 является (CH2)kQ′, где k равно целому числу от 1 до 5, и Q′ является C(RxRy)C(O)NR′′R1′′, где NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором; Rx и Ry независимо выбирают из водорода или метила; или C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо или 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином;
66) A2 является (CH2)kQ′, где k равно целому числу от 1 до 5, и Q′ выбирают из OC(O)NR′′R1′′, где R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила, или NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором;
67) NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором, такое как, но не ограниченное ими,

68) C(RxRy) вместе образуют 3-5-членное циклическое алкильное кольцо, которое необязательно замещено одним или более гидроксилом, амино, циано или фтором, такое как циклопропил, 2-гидроксициклопропил, циклобутил, 2-гидроксициклобутил или циклопентил; или
69) C(RxRy) вместе образуют 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином, такое как, но не ограниченное ими, азетидин, оксетан или N-метилазетидин.
Неограничивающие примеры соединений формулы (III) включают:

В другом, особенно интересном варианте соединения формулы (III-a) представляют собой:

где Z1 выбирают из CF3O, метила, CH2F, CHF2, CF3, метокси, галогена и циано;
X выбирают из галогена, C1-C3 алкокси, CF3O, гидроксила и циано;
W выбирают из кислорода, серы и двух атомов водорода;
R′′3 и R′′4 являются метилом, или R′′3 и R′′4 и атом углерода, к которому они присоединены, вместе образуют 3-6-членное алкильное кольцо, которое может быть необязательно замещено одним или более атомами фтора или гидроксильными группами;
B1 является водородом, галогеном или цианогруппой;
m равно 0, 1, 2, 3 или 4, и n равно 0, 1, 2, 3 или 4, при условии, что по крайней мере, один из m или n не равен нулю;
Q выбирают из C(O)NHR′′, SO2R′′, SO2NHR′′, циано, гидроксила, C1-C3 алкокси, C(S)NHR′′, C(O)OR′′, OC(O)NHR′′, необязательно замещенного 5-6-членного гетероарила и необязательно замещенного 4-6-членного гетероцикла; и
R′′ выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила.
Множество важных подклассов соединений формулы (III-a) заслуживают особого упоминания и включают соединения, содержащие один или более из следующих заместителей.
1) Z1 является Cl;
2) Z1 является CF3;
3) Z1 является MeO;
4) Х является Cl;
5) Х является F;
6) Х является Br;
7) W является O;
8) W является S;
9) W является двумя атомами водорода;
10) R′′3 и R′′4 являются метильными группами;
11) R′′3 и R′′4 и атом углерода, к которому они присоединены, вместе образуют циклобутил;
12) R′′3 и R′′4 и атом углерода, к которому они присоединены, вместе образуют циклопентил;
13) B1 является водородом;
14) B1 является фтором;
15) B1 является цианогруппой;
16) m равно 0;
17) m равно 1;
18) m равно 2;
19) n равно 1;
20) n равно 2;
21) n равно 3;
22) Q является -C(O)NHMe;
23) Q является -C(O)NH2;
24) Q является -OC(O)NHMe;
25) Q является -OC(O)NH2;
26) Q является необязательно замещенным 5-6-членным гетероарилом, таким как, но не ограниченным ими, пиридил, пиразинил, пиримидинил, фуранил, тиофуранил, пиранил, пирролил, пиразолил, имидазолил, тиенил, оксазолил, изоксазолил, диоксазолил, тиадиазолил, оксадиазолил, тетразолил, триазолил, тиатриазолил, оксатриазолил, тиадиазолил, оксадиазолил, тиазолил, изотиазолил и дитиазолил;
27) Q является 5-6-членной гетероарильной группой, замещенной гидроксилом, C1-C3 алкокси, C1-C6 алкилом, галогеном или циано;
Q является необязательно замещенным 4-6-членным гетероциклом, таким как, но не ограниченным ими, пирролидинил, пиразолинил, пиразолидинил, имидазолинил, имидазолидинил, пиперидинил, пиперазинил, оксазолидинил, изоксазолидинил, морфолинил, тиазолидинил, изотиазолидинил, дитиазолидинил и тетрагидрофурил;
Q является 4-6-членным гетероциклом, замещенным гидроксилом, C1-C3 алкокси, C1-C6 алкилом, галогеном или циано.
28) Q является 1Н-имидазол-2-илом;
29) Q является 1-метил-1Н-имидазол-2-илом;
30) Q является 4,5-дигидро-1Н-имидазол-2-илом;
31) Q является гидроксильной группой;
32) Q является 1-метил-1Н-имидазол-2-илом, если m равно 0 и n равно 1;
33) Q является 1-метил-1Н-имидазол-2-илом, если m равно 0 и n равно 2;
34) Q является 1-метил-1Н-имидазол-2-илом, если m равно 1 и n равно 1;
35) Q является 1Н-имидазол-2-илом, если m равно 0 и n равно 1;
36) Q является 1Н-имидазол-2-илом, если m равно 0 и n равно 2;
37) Q является 1Н-имидазол-2-илом, если m равно 1 и n равно 1;
38) Q является 1Н-имидазол-2-илом, если m равно 1 и n равно 2;
39) Q является 1Н-имидазол-2-илом, если m равно 2 и n равно 0;
40) Q является 1Н-имидазол-2-илом, если m равно 2 и n равно 1;
41) Q является -C(O)NHMe, если m равно 0 и n равно 1;
42) Q является -C(O)NHMe, если m равно 0 и n равно 2;
43) Q является -C(O)NHMe, если m равно 0 и n равно 3;
44) Q является -C(O)NHMe, если m равно 1 и n равно 1;
45) Q является -C(O)NHMe, если m равно 1 и n равно 0;
46) Q является -C(O)NHMe, если m равно 1 и n равно 2;
47) Q является -C(O)NHMe, если m равно 2 и n равно 1;
48) Q является -C(O)NHMe, если m равно 2 и n равно 0;
49) Q является 4,5-дигидро-1Н-имидазол-2-илом, если m равно 0 и n равно 1;
50) Q является 4,5-дигидро-1Н-имидазол-2-илом, если m равно 0 и n равно 2;
51) Q является 4,5-дигидро-1Н-имидазол-2-илом, если m равно 1 и n равно 1;
52) Q является -C(O)NH2, если m равно 0 и n равно 1;
53) Q является -C(O)NH2, если m равно 0 и n равно 2;
54) Q является -C(O)NH2, если m равно 1 и n равно 1;
55) Q является гидроксильной группой, если m равно 0 и n равно 2;
56) Q является гидроксильной группой, если m равно 0 и n равно 3;
57) Q является гидроксильной группой, если m равно 1 и n равно 2;
58) Q является -OC(O)NHMe, если m равно 0 и n равно 2;
59) Q является -OC(O)NH2, если m равно 0 и n равно 2.
Неограничивающие примеры соединений формулы III-a включают:

В другом варианте представлены соединения, имеющие структуру формулы (IV):

или их фармацевтически приемлемая соль, сольват, гидрат, пролекарство или производное,
где Zp выбирают из CF3, метокси, галогена и циано;
W выбирают из кислорода, серы и двух атомов водорода;
R′′p и R′′p являются метилом, или R′′p и R′′p и атом углерода, к которому они присоединены, вместе образуют 3-6-членное циклоалкильное кольцо, необязательно замещенное одним или более атомами фтора или гидроксильными группами; и
Ap является (CH2)mY1(CH2)nQ, где m и n являются целыми числами, независимо выбранными из 0-4, и где, по крайней мере, один из a или m или n не равен нулю; Q выбирают из C(O)NHR′′, C(RxRy)C(O)NR′′R1′′, SO2R′′, SO2NR′′R1′′, циано, гидроксила, C1-C3 алкокси, C(S)NR′′R1′′, C(O)OR′′, OC(O)NR′′R1′′, C(O)NR′′R1′′, необязательно замещенного 5-6-членного гетероарила и необязательно замещенного 4-6-членного гетероцикла; и Y1 выбирают из прямой связи, -O-, -S- и -NR′′-; R′′ и R1′′ независимо выбирают из водорода, C1-C6 алкила, C1-C6 циклоалкила и C1-C6 алкенила или NR′′R1′′ вместе образуют 3-7-членное гетероциклическое кольцо, где один или более атомов углерода могут быть необязательно замещены одним или более гидроксилом, амино, циано или фтором; Rx и Ry независимо выбирают из водорода или метила; или C(RxRy) вместе образуют необязательно замещенное 3-5-членное циклическое алкильное кольцо или 3-5-членное циклическое кольцо, где один атом углерода заменен кислородом или амином.
Неограничивающие примеры соединений формулы (IV) включают:

В другом варианте представлены соединения, имеющие следующие формулы:

Некоторые из представленных выше соединений могут содержать один или более асимметрических центров и, следовательно, могут существовать в различных изомерных формах, например, в виде стереоизомеров и/или диастереомеров. Таким образом, соединения в соответствии с данным изобретением и их фармацевтические композиции могут быть в виде отдельного энантиомера, диастереомера или геометрического изомера, или могут быть в виде смеси стереоизомеров. В определенных вариантах соединения в соответствии с данным изобретением являются энантиочистыми соединениями. В определенных других вариантах представлены смеси стереоизомеров или диастереомеров.
Более того, определенные описанные здесь соединения могут иметь одну или более двойных связей, которые могут существовать в виде Z или E изомера, если не указано иначе. Изобретение дополнительно охватывает соединения в виде отдельных изомеров, практически не содержащих другие изомеры, и, альтернативно, в виде смесей различных изомеров, например, рацемических смесей стереоизомеров. В дополнение в указанным выше соединениям, данное изобретение также охватывает фармацевтически приемлемые производные этих соединений и композиции, содержащие одно или более соединений в соответствии с данным изобретением и один или более фармацевтически приемлемых наполнителей или добавок.
Соединения в соответствии с данным изобретением могут быть получены кристаллизацией соединений формул (I), (II), (III) и (IV) в различных условиях, и могут существовать в виде одного или сочетания полиморфов соединений общих формул (I), (II), (III) и (IV), составляя часть данного изобретения. Например, различные полиморфы могут быть идентифицированы и/или получены с применением различных растворителей или различных смесей растворителей для перекристаллизации; проведением кристаллизации при различных температурах; или с применением различных методов охлаждения, от очень быстрого до очень медленного охлаждения во время кристаллизации. Полиморфы также могут быть получены нагреванием или плавлением соединения с последующим постепенным или быстрым охлаждением. Присутствие полиморфов может быть определено ЯМР спектроскопией с твердой пробой, ИК спектроскопией, дифференциальной сканирующей калориметрией, порошковой рентгеновской дифрактограммой и/или другими методами. Таким образом, данное изобретение охватывает соединения в соответствии с данным изобретением, их производные, их таутомерные формы, их стереоизомеры, их фармацевтически приемлемые соли, их фармацевтически приемлемые сольваты и фармацевтически приемлемые композиции, содержащие их.
2) Фармацевтические композиции
В другом варианте данное изобретение относится к фармацевтической композиции, содержащей соединения формул (Ia), (I), (II), (III) или (IV) или их фармацевтически приемлемую соль, пролекарство или раствор, в качестве активного ингредиента.
Следовательно, в другом аспекте данного изобретения, представлены фармацевтические композиции, которые содержат одно или более из описанных здесь соединений (или их пролекарств, фармацевтически приемлемых солей или других фармацевтически приемлемых производных) и необязательно содержат фармацевтически приемлемый носитель. В определенных вариантах эти композиции необязательно также содержат один или более дополнительных терапевтических агентов. Альтернативно, соединение в соответствии с данным изобретением может вводиться пациенту, нуждающемуся в таковом, в сочетании с введением одного или более других терапевтических агентов. Например, дополнительными терапевтическими агентами для совместного введения или включения в фармацевтическую композицию с соединением в соответствии с данным изобретением могут быть одобренные агенты для лечения того же или родственного показания, или ими могут быть любые из множества агентов, проходящих утверждение в Управлении по продовольствию и лекарствам, которые, в конечном счете, будут одобрены для лечения любого расстройства, связанного с активностью андрогенового рецептора. Также понятно, что определенные соединения в соответствии с данным изобретением могут существовать в свободной форме для лечения или, где это применимо, в качестве фармацевтически приемлемого производного. В соответствии с данным изобретением, фармацевтически приемлемое производное включает, но не ограничено ими, фармацевтически приемлемые соли, сложные эфиры, соли таких сложных эфиров или пролекарства или другой продукт присоединения или производное соединения в соответствии с данным изобретением, которые при введении пациенту, нуждающемуся в таковом, способны давать, прямо или косвенно, соединение, описанное здесь, или его метаболит или остаток.
В данном описании термин ′′фармацевтически приемлемая соль′′ относится к тем солям, которые, с точки зрения медицины, подходят для применения в контакте с тканями человека и низших животных, не вызывая токсичность, раздражение, аллергическую реакцию и подобные, и соизмеримы с разумным соотношением польза/риск. Фармацевтически приемлемые соли аминов, карбоновых кислот и других типов соединений хорошо известны в данной области техники. Например, S.M. Berge, et al. подробно описывают фармацевтически приемлемые соли в J. Pharmaceutical Sciences, 66: 1-19 (1977), которая включена сюда в качестве ссылки. Соли могут быть получены in situ во время конечного выделения и очистки соединений в соответствии с данным изобретением или отдельно взаимодействием свободного основания или свободной кислоты с подходящим реагентом, как описано ниже. Например, функциональная группа свободного основания может взаимодействовать с подходящей кислотой. Более того, если соединения в соответствии с данным изобретением имеют кислотную группу, подходящие фармацевтически приемлемые соли включают соли металлов, такие как соли щелочных металлов, например, соли натрия и калия; и соли щелочноземельных металлов, например, соли кальция или магния. Примеры фармацевтически приемлемых нетоксичных солей включают соли аминогруппы, полученные с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота и перхлорная кислота, или с органическими кислотами, такими как уксусная кислота, щавелевая кислота, малеиновая кислота, винная кислота, лимонная кислота, янтарная кислота или малоновая кислота, или с применением других методов, применяемых в данной области техники, таких как ионный обмен. Другие фармацевтически приемлемые соли включают адипат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат, глюконат, гемисульфат, гептаноат, гексаноат, гидройодид, 2-гидроксиэтансульфонат, лактобионат, лактат, лаурат, лаурилсульфат, малат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, п-толуолсульфонат, унлеканоат, валерат и подобные. Типовые соли щелочных или щелочноземельных металлов включают соли натрия, лития, калия, кальция, магния и подобные. Другие фармацевтически приемлемые соли включают, если применимо, нетоксичные аммониевые, четвертичные аммониевые и аминовые катионы, полученные с применением противоионов, такие как галогенид, гидроксид, карбоксилат, сульфат, фосфат, нитрат, низший алкилсульфонат и арилсульфонат.
Дополнительно, в данном описании, термин ′′фармацевтически приемлемый сложный эфир′′ относится к сложным эфирам, которые гидролизуются in vivo и включают эфиры, которые легко разлагаются в человеческом теле с получением исходного соединения или его соли. Подходящие сложные эфирные группы включают, например, группы, полученные из фармацевтически приемлемых алифатических карбоновых кислот, особенно, алкановых, алкеновых, циклоалкановых и алкандикислот, в которых каждая алкильная или алкенильная группа предпочтительно имеет не более 6 атомов углерода. Примеры конкретных сложных эфиров включают формиаты, ацетаты, пропионаты, бутираты, акрилаты и этилсукцинаты.
Более того, термин ′′пролекарства′′ или ′′фармацевтически приемлемые пролекарства′′ в данном описании относится к пролекарствам соединений в соответствии с данным изобретением, которые, с точки зрения медицины, подходят для применения в контакте с тканями человека и низших животных и не вызывают токсичность, раздражение, аллергическую реакцию и подобное, соизмеримы с разумным соотношением польза/риск и эффективны в предполагаемом применении, а также к цвиттерионным формам, если возможны, соединений в соответствии с данным изобретением. Термин ′′пролекарство′′ относится к соединениям, которые быстро трансформируются in vivo с получением исходного соединения указанной выше формулы, например, гидролизом в крови или N-деметилированием соединения в соответствии с данным изобретением. Подробное обсуждение представлено в T. Higuchi and V. Stella, Pro-drugs as Novel Delivery Systems, Vol. 14 of the A.C.S. Symposium Series, и в Edward B. Roche, ed., Bioreversible Carriers in Drug Design, American Pharmaceutical Association and Pergamon Press, 1987, которые обе включены сюда в качестве ссылки. Например, здесь включены N-метилированные пролекарства в соответствии с данным изобретением.
Как описано выше, фармацевтические композиции в соответствии с данным изобретением дополнительно включают фармацевтически приемлемый носитель, который, в данном описании, включает любые и все растворители, разбавители или другие жидкие носители, добавки для диспергирования или суспендирования, поверхностно-активные вещества, изотонические агенты, загущающие или эмульгирующие агенты, консерванты, твердые связующие агенты, смазывающие агенты и подобные, подходящие дл определенных желаемых лекарственных форм. В Remington′s Pharmaceutical Sciences, Sixteenth Edition, E.W. Martin (Mack Publishing Co., Easton, Pa., 1980) описаны различные носители, применяемые в составлении фармацевтических композиций, и известные методики их получения. За исключением случаев, когда обычная среда носителя не совместима с соединениями в соответствии с данным изобретением, например, вызывает нежелательное биологическое действие или другим образом взаимодействует с другими компонентами фармацевтической композиции, их применение рассматривается в объеме данного изобретения. Некоторые примеры материалов, которые могут служить фармацевтически приемлемыми носителями, включают, но не ограничены ими, сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлоза и ее производные, такие как карбоксиметилцеллюлоза натрия, этилцеллюлоза и ацетат целлюлозы; порошковый трагакант; солод; желатин; тальк; наполнители, такие как масло какао и воск для суппозиториев; масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, конопляное масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферные агенты, такие как гидроксид магния и гидроксид алюминия; альгиновая кислота; апирогенная вода; изотонический физиологический раствор; раствор Рингера; этиловый спирт и растворы с фосфатным буфером, а также другие нетоксичные совместимые смазывающие агенты, такие как лаурилсульфат натрия и стеарат магния, а также красители, антиадгезивы, покрытия, подсластители, вкусовые добавки и отдушки, консерванты и антиоксиданты также могут присутствовать в композиции, учитывая мнение составителя.
Жидкие лекарственные формы для перорального введения включают, но не ограничены ими, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Кроме активных соединений жидкая лекарственная форма может содержать инертные разбавители, обычно применяемые в данной области техники, такие как, например, вода или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, хлопковое, земляного ореха (арахисовое), кукурузное, проростковое, оливковое, касторовое и конопляное масла), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот сорбитана и их смеси. Кроме инертных разбавителей пероральные композиции также могут включать адъюванты, такие как смачивающие агенты, эмульгирующие и суспендирующие агенты, подсластители, вкусовые добавки и отдушки.
Препараты для инъекций, например, стерильные водные или масляные суспензии для инъекций, могут быть составлены, как принято в данной области техники, с применением подходящих диспергирующих или смачивающих агентов и суспендирующих агентов. Стерильные препараты для инъекций также могут включать стерильный раствор, суспензию или эмульсию для инъекций в нетоксичном, парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. Приемлемые носители и растворители, которые могут применяться, включают воду, раствор Рингера, U.S.P. и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла обычно применяют в качестве растворителя или суспендирующей среды. Для этой цели может применяться любое безвкусное нелетучее масло, включая синтетические моно- или дигдицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, применяют в получении препаратов для инъекций.
Композиции для инъекций могут быть стерилизованы, например, фильтрацией через удерживающий бактерии фильтр или добавлением стерилизующих агентов в виде стерильных твердых композиций, которые могут быть растворены или диспергированы в стерильной воде или другой стерильной среде для инъекций перед применением.
Для пролонгирования действия лекарственного средства часто желательно замедлить абсорбцию лекарственного средства при подкожной или внутримышечной инъекции. Это может быть достигнуто применением жидкой суспензии или кристаллического или аморфного материала с плохой растворимостью в воде. Скорость абсорбции лекарственного средства поэтому зависит от скорости его растворения, которая, в свою очередь, может зависеть от размера кристалла и кристаллической формы. Альтернативно, замедленная абсорбция парентерально вводимого лекарственного средства достигается растворением или суспендированием лекарственного средства в масляном носителе. Депо для инъекций получают формированием микроинкапсулирующих матриц лекарственного средства в биоразлагаемых полимерах, таких как полилактид-полигликолид. В зависимости от отношения лекарственного средства к полимеру и природы конкретного применяемого полимера, скорость выделения лекарственного средства может контролироваться. Примеры других биоразлагаемых полимеров включают сложные поли(ортоэфиры) и поли(ангидриды). Депо для инъекций также получают улавливанием лекарственного средства в липосомы или микроэмульсии, которые совместимы с тканями тела.
Композиции для ректального и вагинального введения включают предпочтительно суппозитории, которые могут быть получены смешиванием соединений в соответствии с данным изобретением с подходящими, не вызывающими раздражения наполнителями или носителями, такими как масло какао, полиэтиленгликоль или воск для суппозиториев, который является твердым при температуре окружающей среды, но плавится в заднем проходе или вагинальной полости и выделяет активное соединение.
Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах активное соединение смешивают с, по крайней мере, одним инертным фармацевтически приемлемым наполнителем или носителем, таким как цитрат натрия или фосфат дикальция, и/или a) наполнителями или разбавителями, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и кремниевая кислота, b) связующими агентами, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидинон, сахароза и аравийская камедь, c) увлажнителями, такими как глицерин, d) разрыхляющими агентами, такими как агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, определенные силикаты и карбонат натрия, e) раствором замедлителей, таких как парафин, f) усилителями абсорбции, такими как соединения четвертичного аммония, g) смачивающими агентами, такими как, например, цетиловый спирт и моностеарат глицерина, h) абсорбентами, такими как каолин и бентонитовая глина, и i) смазывающими агентами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия, и их смесями. Для капсул, таблеток и пилюль лекарственная форма может также содержать буферные агенты.
Твердые композиции такого типа также могут применяться как наполнители в мягких и твердых желатиновых капсулах с применением таких наполнителей, как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и подобные. Твердые лекарственные формы в виде таблеток, драже, капсул, пилюль и гранул могут быть получены с покрытиями и оболочками, такими как энтеросолюбильные покрытия и другие покрытия, известные в области фармацевтики. Они могут необязательно содержать опалесцирующие агенты и также могут представлять собой композицию, которая выделяет активный ингредиент(ы) только, или преимущественно, в определенной части кишечного тракта, необязательно отложенным образом. Примеры оболочечных композиций, которые могут применяться, включают полимерные вещества и воск. Твердые композиции подобного типа также могут применяться в качестве наполнителей в мягких и твердых желатиновых капсулах с применением таких наполнителей, как лактоза или молочный сахар, а также высокомолекулярных полиэтиленгликолей и подобных.
Активные соединения также могут быть микроинкапсулированы с одним или более наполнителями, описанными выше. Твердые лекарственные формы таблеток, драже, капсул, пилюль и гранул могут быть получены с покрытиями и оболочками, такими как энтеросолюбильные покрытия, покрытия, контролирующие выделение, и другие покрытия, хорошо известные в области фармацевтики. В таких твердых формах активное соединение может быть смешано с, по крайней мере, одним инертным разбавителем, таким как сахароза, лактоза и крахмал. Такие лекарственные формы также могут содержать, в качестве нормальной практики, дополнительные вещества, отличные от инертных разбавителей, например, таблетирующие смазывающие агенты и другие таблетирующие добавки, такие как стеарат магния и микрокристаллическая целлюлоза. Для капсул, таблеток и пилюль лекарственные формы также могут содержать буферные агенты. Они могут необязательно содержать опалесцирующие агенты и также могут представлять собой композицию, которая выделяет активный ингредиент(ы) только, или преимущественно, в определенной части кишечного тракта, необязательно отложенным образом. Примеры оболочечных композиций, которые могут применяться, включают полимерные вещества и воск.
Данное изобретение охватывает фармацевтически приемлемые местные композиции в соответствии с данным изобретением. Термин ′′фармацевтически приемлемая местная композиция′′ в данном описании означает любую композицию, которая является фармацевтически приемлемой для чрескожного введения соединения в соответствии с данным изобретением через нанесение композиции на эпидермис. В определенных вариантах данного изобретения местная композиция содержит систему носителей. Фармацевтически эффективные носители включают, но не ограничены ими, растворители (например, спирты, многоатомные спирты, вода), кремы, лосьоны, мази, масла, пластыри, липосомы, порошки, эмульсии, микроэмульсии и буферные растворы (например, гипотонический или буферный физиологический раствор) или любой другой носитель, известный в данной области техники для композиций местного применения. Более полный список известных в данной области техники носителей представлен в ссылочных текстах, стандартных в данной области техники, например, в Remington′s Pharmaceutical Sciences, 16th Edition, 1980 и 17th Edition, 1985, оба опубликованы Mack Publishing Company, Easton, Pa., описание которых включено сюда в качестве ссылки полностью. В определенных других вариантах местные композиции в соответствии с данным изобретением могут содержать наполнители. Любые фармацевтически приемлемые наполнители, известные в данной области техники, могут применяться для получения фармацевтически приемлемых местных композиций в соответствии с данным изобретением. Примеры наполнителей, которые могут быть включены в местные композиции в соответствии с данным изобретением, включают, но не ограничены ими, консерванты, антиоксиданты, увлажняющие агенты, мягчители, буферные агенты, солюбилизирующие агенты, другие агенты, облегчающие проникновение, защитные агенты для кожи, поверхностно-активные вещества и пропеллянты и/или дополнительные терапевтические агенты, применяемые в сочетании с соединением в соответствии с данным изобретением. Подходящие консерванты включают, но не ограничены ими, спирты, четвертичные амины, органические кислоты, парабены и фенолы. Подходящие антиоксиданты включают, но не ограничены ими, аскорбиновую кислоту и ее сложные эфиры, бисульфит натрия, бутилированный гидрокситолуол, бутилированный гидроксианизол, токоферолы и хелатирующие агенты, такие как ЭДТК и лимонная кислота. Подходящие увлажняющие агенты включают, но не ограничены ими, глицерин, сорбит, полиэтиленгликоли, мочевину и пропиленгликоль. Подходящие буферные агенты для применения в соответствии с данным изобретением включают, но не ограничены ими, буферы на основе лимонной, хлористоводородной и молочной кислоты. Подходящие солюбилизирующие агенты включают, но не ограничены ими, хлориды четвертичного аммония, циклодекстрины, бензилбензоат, лецитин и полисорбаты. Подходящие защитные для кожи агенты, которые могут применяться в местных композициях в соответствии с данным изобретением, включают, но не ограничены ими, масло витамина E, аллатоин, диметикон, глицерин, вазелин и оксид цинка.
В определенных вариантах фармацевтически приемлемые местные композиции в соответствии с данным изобретением содержат, по крайней мере, соединение в соответствии с данным изобретением и агент, улучшающий проникновение. Выбор местной композиции зависит от нескольких факторов, включая лечимое состояние, физико-химические характеристики соединения в соответствии с данным изобретением и другие присутствующие наполнители, их стабильность в композиции, доступное производственное оборудование и ограничения на издержки. В данном описании термин ′′агент, улучшающий проникновение′′ означает агент, способный переносить фармакологически активное соединение через роговой слой в эпидермис или дерму, предпочтительно, при незначительной или отсутствующей системной абсорбции. Множество соединений оценивают для определения эффективности в улучшении скорости проникновения лекарственных средств через кожу. См., например, Percutaneous Penetration Enhancers, Maibach H.I. and Smith H.E. (eds.), CRC Press, Inc., Boca Raton, Fla. (1995), в которых дан обзор применения и тестирования различных улучшителей проникновения в кожу, и Buyuktimkin et al., Chemical Means of Transdermal Drug Permeation Enhancement in Transdermal and Topical Drug Delivery Systems, Gosh T.K., Pfister W.R., Yum S.I. (Eds.), Interpharm Press Inc., Buffalo Grove, 111. (1997). В определенных типовых вариантах агенты, улучшающие проникновение, для применения в соответствии с данным изобретением включают, но не ограничены ими, триглицериды (например, солевое масло), композиции алоэ (например, гель алоэ-вера), этиловый спирт, изопропиловый спирт, октилфенилполиэтиленгликоль, олеиновую кислоту, полиэтиленгликоль 400, пропиленгликоль, N-децилметилсульфоксид, сложные эфиры жирной кислоты (например, изопропилмиристат, метиллаурат, глицеринмоноолеат и пропиленгликольмоноолеат) и N-метилпирролидон.
В определенных вариантах композиции могут быть в форме мазей, паст, кремов, лосьонов, гелей, порошков, растворов, спреев, ингаляторов или пластырей. В определенных примерных вариантах композиции в соответствии с данным изобретением включают кремы, которые могут также содержать насыщенные или ненасыщенные жирные кислоты, такие как стеариновая кислота, пальмитиновая кислота, олеиновая кислота, пальмито-олеиновая кислота, цетиловый или олеиловый спирты, где особенно предпочтительна стеариновая кислота. Кремы в соответствии с данным изобретением также могут содержать неионное поверхностно-активное вещество, например, полиокси-40-стеарат. В определенных вариантах активное соединение смешивают в стерильных условиях с фармацевтически приемлемым носителем и любыми необходимыми консервантами или буферами, которые могут потребоваться. Глазные композиции, ушные капли и глазные капли также включены в объем данного изобретения. Композиции для внутриглазного введения также включены. Дополнительно, данное изобретение охватывает применение чрескожных пластырей, которые имеют дополнительное преимущество контролируемой доставки соединения в тело. Такие лекарственные формы получают растворением или диспергированием соединения в подходящей среде. Как описано выше, агенты, улучшающие проникновение, также могут применяться для повышения прохождения соединения через кожу. Скорость может контролироваться либо контролирующей скорость мембраной, либо диспергированием соединения в полимерной матрице или геле.
Также понятно, что соединения и фармацевтические композиции в соответствии с данным изобретением могут быть составлены и применяться в комбинированной терапии, то есть соединения и фармацевтические композиции могут быть составлены или вводиться одновременно с, до или после одной или более других желаемых терапевтических или медицинских процедур. При конкретном сочетании терапий (лекарственных или процедурных), применяемых в комбинированном режиме, принимается во внимание совместимость желаемых лекарственных средств и/или процедур и желаемого терапевтического эффекта. Также понятно, что применяемые здесь терапии могут давать желаемый эффект для конкретного расстройства, например, прямо повышая рост волос или убивая клетки рака простаты; или могут быть достигнуты косвенные эффекты, которые благоприятны для конкретного расстройства или его лечения (например, снижение побочных эффектов, различный режим дозирования, различные пути введения). В неограничивающих примерах одно или более соединений в соответствии с данным изобретением могут быть составлены с, по крайней мере, другим биологическим агентом, таким как Sipuleucel-T (PROVENGE®), или с, по крайней мере, другим низкомолекулярным соединением. Неограничивающие примеры фармацевтических агентов, которые могут быть терапевтически объединены с соединениями в соответствии с данным изобретением, включают: ГТ агенты, такие как LUPRON®, DEGAPELIX® и ABIRATERONE®; ингибиторы онкогенных киназ, например, VEGF, mTOR, EGFR, SRC и PI3K; противораковые химиотерапевтические агенты, такие как таксаны, этопозид, эстрамустин фосфат и доксорубицин; HSP90 ингибиторы; агенты или природные экстракты, известные как усилители роста волос; агенты или природные экстракты, известные для лечения акне; или агенты или природные экстракты, известные для лечения гирсутизма.
В определенных вариантах фармацевтические композиции в соответствии с данным изобретением также включают один или более дополнительных терапевтически активных ингредиентов (например, противовоспалительных и/или паллиативных). Для целей данного изобретения термин ′′паллиативные′′ относится к лечению, которое сфокусировано на облегчении симптомов заболевания и/или побочных эффектов терапевтического режима, но не является лечебным. Например, паллиативное лечение включает болеутоляющие средства, средства против тошноты и средства против рвоты.
3) Способы применения
Как отмечено выше, данное изобретение может применяться в качестве антагонистов андрогенового рецептора. Селективные антагонисты андрогенового рецептора (АР), рассматриваемые здесь, применяются для множества состояний и заболеваний, таких как, но не ограниченных ими, мужская контрацепция; для лечения множества связанных с гормоном состояний, таких как гиперсексуальность и половые отклонения; лечения состояний, включающих доброкачественную гиперплазию простаты, акне, андрогенную алопецию и гирсутизм; предупреждения симптомов, связанных с пониженным тестостероном, таких как прилив после кастрации; целевого предупреждения или противодействия маскулинизации в случае транссексуальных женщин, проходящих терапию по коррекции пола; в качестве антинеопластического агента и паллиативного средства, адъюванта или неоадъюванта при гормональной терапии рака простаты; и для снижения возникновения, остановки или регрессии рака простаты.
Рак простаты, как отмечено выше, является одним из наиболее часто встречающихся видов рака у мужчин по всему миру, и является одной из основных причин смерти от рака у мужчин в Соединенных Штатах Америки. Лекарственные антагонисты андрогенового рецептора, такие как флутамид и бикалутамид, изначально созданы так, чтобы избежать побочных эффектов ГТ, но агонизм к андрогену наблюдался для гидроксифлуамида (активной формы флутамида) и бикалутамида. Данное изобретение отвечает значительной медицинской потребности в лучших антагонистах андрогенового рецептора, которые обладают мощным антагонизмом, но не имеют какого-либо агонизма и снижают имеющиеся побочные эффекты, такие как токсичность для печени, найденная у существующих лекарственных антагонистов андрогенового рецептора. Соединения в соответствии с данным изобретением являются решением этой проблемы.
Кроме рака простаты, некоторые другие состояния и заболевания могут лечиться антагонистом АР. Соединения в соответствии с данным изобретением являются антагонистами андрогенового рецептора, которые могут применяться для облегчения любого состояния, связанного с аномальной активацией андрогенового рецептора. Кроме рака простаты, другие примеры таких состояний включают акне, гирсутизм, себорею, избыточное кожное сало и облысение. Для того чтобы продемонстрировать описанные выше терапевтические свойства, соединения необходимо вводить в количестве, достаточном для ингибирования активации андрогенового рецептора. В типовом варианте соединения вводят местно, что особенно подходит для гирсутизма, облысения, акне и гиперсебореи. Андрогены, имеющие сильное действие на потерю волос, стимулируют рост волос, пролонгируя фазу роста цикла волоса (анаген) и увеличивая размер фолликулы. Рост волос на скальпе не требует андрогенов, но, парадоксально, андрогены необходимы для облысения скальпа у генетически предрасположенных личностей (андрогенное облысение), где существует прогрессирующее снижение длительности анагена и размера волосяной фолликулы. Соединения также могут применяться местно для снижения образования перхоти и, более конкретно, для облегчения гиперсебореи (масляная кожа), а также могут применяться местно для облечения акне. В других вариантах изобретение включает способ введения таких соединений формул (I)-(IV) или фармацевтических композиций для лечения заболевания или расстройства, связанного с активностью андрогенового рецептора, в качестве неограничивающего примера, лечения чувствительного к гормонам рака простаты или не чувствительного к гормонам рака простаты, лечения доброкачественной гиперплазии простаты, лечения акне, лечения гирсутизма, лечения избыточного кожного сала и лечения облысения вследствие расстройства андрогенового рецептора.
Соединения в соответствии с данным изобретением являются антагонистом андрогенового рецептора. Определенные соединения обладают мощным антагонистическим действием (IC50<1мкМ) без значительного агонистического действия. Соединения в соответствии с данным изобретением могут применяться отдельно или в сочетании с одним или более другими терапевтическими агентами.
Как видно из представленных ниже примеров, биологическое действие рассматриваемых здесь соединений тестируют на чувствительных к гормонам (LNCaP, LAPC4) и резистентных к гормонам клетках рака простаты (LNCaP-АР, LAPC4-АР, LNCaP C4-2, 22RV1, LNCaP-AI и LNCaP-abl) для определения их антагонистического и агонистического действий. Уровень специфического к простате антигена (СПА) также может применяться в качестве маркера антагонистического действия андрогенового рецептора. Исследование МТС (4,5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2H-тетразолия) также применяют для оценки соединений в соответствии с данным изобретением для определения ингибирования роста клеток. Селективные мощные антагонисты андрогенового рецептора с приемлемой для грызунов пероральной дозой также оценивают для определения in vivo эффективности с применением ксенотрансплантатов рака простаты. Колонии клеток могут быть выбраны из LNCaP, LAPC4, LAPC9, CWR22, LNCaP-АР, LNCaP C4-2, 22RV1, LNCaP-abl и LNCaP-AI.
Как видно из примеров ниже, анализ СПА (Тестирование ингибирования соединением в соответствии с данным изобретением образования специфического к простате антигена (СПА) в различных клетках рака простаты) продемонстрировал, что в то время как бикалутамид ингибирует образование СПА в клетках LNCaP с IC50 3,1 микромоля, предпочтительные соединения показали IC50 менее около 0,5 микромолей. Таким образом, соединения в соответствии с данным изобретением показали сильное действие на подавление образования СПА.
В другом исследовании, которое может применяться для оценки биологической активности рассматриваемых здесь соединений через измерение жизнеспособности клеток, LNCaP и 22RV1 клетки могут применяться для того, чтобы показать, что соединения в соответствии с данным изобретением ингибируют жизнеспособность. Обычно ожидается ингибирование 60-90%. Таким образом, соединения в соответствии с данным изобретением предположительно демонстрируют сильное ингибирующее действие против чувствительных к гормонам и резистентных к гормонам клеток, по сравнению с бикалутамидом.
В in vivo анализе активности рассматриваемых здесь соединений применяют модель роста волос у мышей C57BL/6. Растворы, содержащие тестируемые соединения в различных концентрациях, могут местно наноситься на бритую нижнюю часть спины. Режим лечения включает нанесение дважды в день (ДД) в течение 4 недель. Местное раздражение записывают перед каждым нанесением, и степень роста волос записывают через день. Через 4 недели лечения, мышей также наблюдают в течение одной недели, во время которой рост волос и раздражение кожи записывают через день. Для оценки роста волос применяют шкалу. Ожидают, что результаты этой модели показывают, что соединения в соответствии с данным изобретением демонстрируют in vivo активность в стимулировании роста волос и обладают желаемыми физико-химическими свойствами для доставки на кожу, что показывает, что соединения в соответствии с данным изобретением являются превосходным терапевтическим средством для способствования росту волос и/или других клинических показаний, таких как снижение масляной кожи благодаря их желаемому местному биологическому действию против андрогенового рецептора, и обладают низким системным воздействием для избегания нежелательных побочных эффектов.
Как подробно описано в разделе примеров ниже, в исследованиях для определения способности соединений ингибировать образование СПА клетками рака простаты, определенные соединения в соответствии с данным изобретением имеют значения IC50≤5 мкМ. В определенных других вариантах, соединения в соответствии с данным изобретением имеют IC50≤2,5 мкМ. В определенных вариантах, соединения в соответствии с данным изобретением имеют IC50≤1 мкМ. В определенных других вариантах, соединения в соответствии с данным изобретением имеют IC50≤750 нМ. В определенных других вариантах, соединения в соответствии с данным изобретением имеют IC50≤500 нМ. В определенных других вариантах, соединения в соответствии с данным изобретением имеют IC50≤250 нМ. В определенных других вариантах соединения в соответствии с данным изобретением имеют IC50≤100 нМ. В других вариантах соединения в соответствии с данным изобретением имеют IC50≤75 нМ. В других вариантах соединения в соответствии с данным изобретением имеют IC50≤50 нМ. В других вариантах соединения в соответствии с данным изобретением имеют IC50≤40 нМ. В других вариантах соединения в соответствии с данным изобретением имеют IC50≤30 нМ. В других вариантах соединения в соответствии с данным изобретением имеют IC50≤20 нМ. В других вариантах соединения в соответствии с данным изобретением имеют IC50≤10 нМ. В других вариантах соединения в соответствии с данным изобретением имеют IC50≤5 нМ.
Набор для лечения
В других вариантах данное изобретение относится к набору для удобного и эффективного осуществления способов в соответствии с данным изобретением. В общем, фармацевтическая упаковка или набор содержит один или более контейнеров, заполненных одним или более ингредиентами фармацевтических композиций в соответствии с данным изобретением. Такие наборы особенно подходят для введения твердых лекарственных форм, таких как таблетки или капсулы или местные формы. Такой набор предпочтительно включает множество единичных доз, и может также включать карточку, показывающую дозы в порядке их предполагаемого применения. При желании, может быть предоставлена памятка, например, в виде цифр, букв или других отметок на прилагаемом календаре, для обозначения дней в расписании лечения, в которые следует принимать дозу. Альтернативно, плацебо или кальциевые питательные добавки, в форме, отличающейся или одинаковой с формой фармацевтических композиций, могут быть включены для получения набора, в котором дозу принимают каждый день. Необязательно, в таком контейнере может быть аннотация в форме, предписанной правительственными органами по регулированию производства, применения или продажи фармацевтических продуктов, где аннотация отражает разрешение органа по производству, применению или продаже на использование человеком.
ЭКВИВАЛЕНТЫ
Типовые примеры, которые представлены ниже, помогают проиллюстрировать данное изобретение, и не предназначены, и не должны считаться ограничивающими объем данного изобретения. Конечно, различные модификации данного изобретения и множество его других вариантов, в дополнение к показанным и описанным здесь, очевидны специалистам в данной области техники из полного содержания этого документа, включая представленные ниже примеры и ссылки на научную и патентную литературу, данные здесь. Также понятно, что содержание этих ссылок включено сюда в качестве ссылки для иллюстрации состояния уровня техники.
Представленные ниже примеры содержат важную дополнительную информацию, примеры и руководство, которые могут быть адаптированы к практике данного изобретения в его различных вариантах и эквивалентах.
ПОЯСНЕНИЕ ПРИМЕРОВ
Соединения в соответствии с данным изобретением и их получение может быть понято из представленных ниже примеров, которые иллюстрируют некоторые способы, в которых данные соединения получают или используют. Должно быть понятно, однако, что эти примеры не ограничивают данное изобретение. Варианты данного изобретения, известные сейчас или которые будут разработаны позднее, считаются попадающими в объем данного изобретения, описанного здесь и заявленного в формуле изобретения.
Общее описание методов синтеза:
Практик имеет хорошо известную литературу по химии образования малых молекул, в сочетании с содержащейся здесь информацией, в качестве руководства к стратегиям синтеза, защитным группам и другим материалам и методам, применяемым для синтеза соединений в соответствии с данным изобретением.
В различных представленных здесь ссылках дана полезная информация по получению соединений, похожих на соединения в соответствии с данным изобретением, описанные здесь или родственных промежуточных соединений, а также информация по составлению, применению и введению таких соединений, которые могут быть интересны.
Более того, практик может применять конкретное руководство и представленные в этом документе примеры, относящиеся к различным примерным соединениям и их промежуточным соединениям.
Соединения в соответствии с данным изобретением и их получение может быть понято далее из примеров, которые иллюстрируют некоторые способы получения или применения этих соединений. Понятно, однако, что эти примеры не ограничивают данное изобретение. Варианты изобретения, неизвестные или еще неразработанные, попадают в объем данного изобретения, описанный здесь и заявленный в формуле изобретения.
В соответствии с данным изобретением, любая доступная методика может применяться для получения или приготовления соединений в соответствии с данным изобретением или композиций, включающих их. Например, множество методов синтеза в растворе, таких, как подробно описаны ниже, могут применяться. Альтернативно или дополнительно, соединения в соответствии с данным изобретением могут быть получены с применением множества комбинированных методик, параллельного синтеза и/или методов твердофазного синтеза, известных в данной области техники.
Как описано ниже, должно быть понятно, что множество соединений в соответствии с данным изобретением могут быть синтезированы описанными здесь способами. Исходные материалы и реагенты, применяемые для получения этих соединений, либо доступны от коммерческих поставщиков, таких как Aldrich Chemical Company (Milwaukee, WI), Bachem (Torrance, CA), Sigma (St. Louis, MO), либо могут быть получены способами, хорошо известными специалисту в данной области техники, с применением методик, описанных в таких ссылках, как Fieser and Fieser 1991, ′′Reagents for Organic Synthesis′′, vols. 1-17, John Wiley and Sons, New York, NY, 1991; Rodd 1989 ′′Chemistry of Carbon Compounds′′, vols. 1-5 and supps., Elsevier Science Publishers, 1989; ′′Organic Reactions′′, vols. 1-40, John Wiley and Sons, New York, NY, 1991; March 2001, ′′Advanced Organic Chemistry′′, 5th ed. John Wiley and Sons, New York, NY; and Larock 1990, ′′Comprehensive Organic Transformations: A Guide to Functional Group Preparations′′, 2nd ed. VCH Publishers. Эти схемы являются только иллюстративными к некоторым способам, которыми могут быть синтезированы соединения в соответствии с данным изобретением, и различные модификации этих схем могут быть проведены и предложены специалисту в данной области техники, имеющему отношение к этому описанию.
Исходные материалы, промежуточные соединения и соединения в соответствии с данным изобретением могут быть выделены и очищены с применением обычных методов, включая фильтрацию, дистилляцию, кристаллизацию, хроматографию и подобные. Они могут быть охарактеризованы с применением обычных методов, включая физические константы и спектральные данные.
Общие методики реакций:
Если не указано иначе, реакционные смеси перемешивают с применением магнитной мешалки. Инертная атмосфера относится либо к сухому аргону, либо к сухому азоту. Реакции отслеживают тонкослойной хроматографией, протонным ядерным магнитным резонансом (ЯМР) или высокоэффективной жидкостной хроматографией (ВЭЖХ) подходящим образом обработанного образца реакционной смеси.
Общие методики обработки:
Если не указано иначе, реакционные смеси охлаждают до комнатной температуры или ниже, затем гасят, при необходимости, либо водой, либо насыщенным водным раствором хлорида натрия. Желаемые продукты экстрагируют разделением между водой и подходящим не смешиваемым с водой растворителем (например, этилацетатом, дихлорметаном, диэтиловым эфиром). Содержащие желаемый продукт экстракты промывают подходящим образом водой, затем насыщенным солевым раствором. В случаях, когда экстракт, содержащий продукт, содержит остаточные окислители, экстракт промывают 10% раствором сульфита натрия в насыщенном водном растворе бикарбоната натрия, до указанной выше процедуры промывания. В случаях, когда экстракт, содержащий продукт, содержит остаточные кислоты, экстракт промывают насыщенным водным раствором бикарбоната натрия до указанной выше процедуры промывания (за исключением тех случаев, когда сам желаемый продукт имеет кислый характер). В случаях, когда экстракт, содержащий продукт, содержит остаточные основания, экстракт промывают 10% водным раствором лимонной кислоты до указанной выше процедуры промывания (за исключением тех случаев, когда сам желаемый продукт имеет щелочной характер). После промывания экстракты, содержащие желаемый продукт, сушат над безводным сульфатом магния и затем фильтруют. Затем неочищенные продукты выделяют удалением растворителей на роторном испарителе при пониженном давлении при подходящей температуре (обычно менее 45°C).
Общие методики очистки:
Если не указано иначе, хроматографическая очистка относится к флэш-хроматографии на двуокиси кремния с применением одного растворителя или смешанного растворителя в качестве элюента. Элюаты, содержащие подходящим образом очищенный желаемый продукт, объединяют и концентрируют при пониженном давлении при подходящей температуре (обычно менее 45°C) до постоянной массы. Конечные соединения растворяют в 50% водном ацетонитриле, фильтруют и переносят во флаконы, затем сушат вымораживанием в высоком вакууме перед проведением биологического тестирования.
ПРИМЕРЫ
Примеры синтеза. Синтез соединений в соответствии с данным изобретением
Соединения формул I-III в соответствии с данным изобретением могут быть получены, как показано на представленных ниже схемах реакций (формула I взята в качестве примера) и их описании.

Как показано на схеме 1, изотиоцианат 3 может быть получен из анилина 1 обработкой тиофосгеном. Промежуточное соединение 6 может быть синтезировано конденсацией амина или анилина 4 и кетона 5 в присутствии TMSCN или цианида натрия. Конденсация также может проводиться взаимодействием анилина 4 и подходящего кетона цианоангидрина в присутствии MgSO4. Конечный тиоимидазолидинон, соединение формулы I, может быть получен взаимодействием между соединениями 3 и 6. Анилин 1 может быть коммерчески доступен или может быть получен способами, показанными ниже или известными в литературе, например, восстановлением нитробензолов.
Синтез изотиоцианата 3a

Получение соединения 8

К раствору соединения 7 (7,5 г, 44 ммоль) в толуоле (150 мл) добавляют ТЭА (7 мл, 48 ммоль, 1,1 экв.), затем DPPA (10,5 мл, 48,4 ммоль, 1,1 экв.). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Затем добавляют 2-метил-2-пропанол (6,3 мл, 66 ммоль, 1,5 экв.) и полученную смесь нагревают при температуре кипения с обратным холодильником в течение 2 ч. Растворитель удаляют в вакууме и остаток разбавляют этилацетатом (200 мл), промывают водой (1×50 мл). Органический слой сушат (Na2SO4), фильтруют и концентрируют с получением указанного в заголовке соединения 8 в виде светло-желтого твердого вещества (8,9 г, 90% выход), которое применяют на следующей стадии без дальнейшей очистки. ИЭР-МС (M-C4H9)+: 186.
Получение соединения 9

К раствору соединения 8 (24 г, 100 ммоль) в дихлорметане (100 мл) медленно добавляют ТФК (40 мл) при 0°C. Реакционную смесь перемешивают при комнатной температуре в течение ночи, затем экстрагируют H2O (2×300 мл). Водную фазу нейтрализуют добавлением насыщенного водного раствора NaHCO3 до pH=8, затем экстрагируют этилацетатом (3×100 мл). Объединенные органические слои сушат (Na2SO4), фильтруют и концентрируют с получением указанного в заголовке соединения 9 в виде коричневой жидкости (13 г, 92% выход). ИЭР-МС (M-C4H9)+: 142.
Получение соединения 10

К раствору соединения 9 (13 г, 92 ммоль) в ДМФ (100 мл) добавляют раствор NBS (16,4 г, 92 ммоль, 1,0 экв.) в ДМФ (100 мл) по каплям. Реакционную смесь перемешивают при комнатной температуре в течение 3 ч, затем разбавляют этилацетатом (500 мл) и промывают насыщенным раствором соли (2×150 мл). Органическую фазу сушат (Na2SO4), фильтруют и концентрируют с получением указанного в заголовке соединения 10 в виде коричневого масла (23 г, 98% выход). ИЭР-МС (M+H)+: 219,9.
Получение соединения 11

Соединение 10 (11,2 г, 51 ммоль) растворяют в 10 мл Ac2O и перемешивают при комнатной температуре в течение 1 ч. Раствор концентрируют в вакууме и в остаток добавляют лед (~10 г) и бикарбонат натрия (до pH=7). Полученную смесь экстрагируют этилацетатом (3×100 мл). Органические слои объединяют, сушат (Na2SO4), фильтруют и концентрируют с получением указанного в заголовке соединения 11 в виде коричневого твердого вещества (9,8 г, 74% выход).
1H ЯМР (400 МГц, CDCl3) δ 7,94-7,91 (м, lH), 7,55 (уш, lH), 7,28-7,26 (м, lH), 3,93 (с, 3H), 2,08 (с, 3H); ИЭР-MC (M+H)+ 263,9.
Получение соединения 12

Смесь соединения 11 (5,0 г, 19 ммоль) и CuCN (2,5 г, 29 ммоль, 1,5 экв.) в ДМФ (20 мл) нагревают при 145°C под азотом в течение ночи. Реакционную смесь охлаждают до комнатной температуры и затем выливают в ледяную воду (50 мл). Добавляют этилацетат (100 мл) и нерастворимое твердое вещество отфильтровывают (промывают этилацетатом [2×30 мл]). Органический слой отделяют, и водный слой экстрагируют этилацетатом (2×50 мл). Объединенные экстракты промывают насыщенным водным раствором NaHCO3 (1×150 мл), насыщенным раствором соли (3×100 мл) и сушат над MgSO4. Полученный продукт концентрируют, и остаток очищают хроматографией на силикагеле (петролейный эфир:этилацетат, 10:1) с получением указанного в заголовке соединения 12 в виде светло-желтого твердого вещества (2,6 г, 66% выход).
1H ЯМР (400 МГц, ДМСО-d6) δ 10,13 (с, 1H), 7,93 (д, 1H), 7,53 (д, 1H), 4,05 (с, 3H), 2,15 (с, 3H); ИЭР-MC (M+H)+: 209.
Получение соединения 1a

К раствору соединения 12 (4,0 г, 192 ммоль) в этаноле (30 мл) добавляют концентрированный раствор HCl (12н, 10 мл). Смесь нагревают при температуре кипения с обратным холодильником в течение 1 ч. Растворитель удаляют в вакууме. Остаток повторно растворяют в воде (50 мл). К полученному водному раствору добавляют насыщенный водный раствор NaHCO3 до pH=7~8, затем экстрагируют этилацетатом (3×150 мл). Объединенные органические слои сушат с Na2SO4, фильтруют и концентрируют с получением указанного в заголовке соединения 1a в виде светло-желтого твердого вещества (3,2 г, 90% выход).
1H ЯМР (400 МГц, ДМСО-d6) δ 7,18 (д, 1H), 6,50 (т, 1H), 6,28 (с, 2H), 3,97 (с, 3H); ESI-MS (M+H)+: 167.
Получение соединения 3a

К раствору соединения 1a (332 мг, 2 ммоль) в ТГФ (5 мл) медленно добавляют раствор тиофосгена (2 мл) в воде (5 мл) при комнатной температуре. Реакционную смесь перемешивают в течение 1 ч, затем концентрируют. Остаток разделяют между H2O (50 мл) и этилацетатом (30 мл). Полученную водную фазу экстрагируют этилацетатом (2×30 мл). Органические экстракты объединяют, промывают насыщенным раствором соли (2×50 мл), сушат с безводным MgSO4, фильтруют и концентрируют с получением указанного в заголовке соединения 3a в виде светло-желтого твердого вещества, которое сразу применяют на следующей стадии без дальнейшей очистки.
Синтез изотиоцианата 3b
Получение соединения 14
К раствору соединения 13 (2,88 г, 16,1 ммоль) в ДМФ (30мл) добавляют раствор в ДМФ (30 мл) NBS (2,86 г, 16,1 ммоль) по каплям при комнатной температуре. Через 3 ч реакционную смесь разбавляют Et2O (100 мл) и промывают насыщенным раствором соли (2×100 мл). Отделенную органическую фазу сушат (Na2SO4) и концентрируют с получением указанного в заголовке соединения 14 в виде масла (3,1 г, 75% выход).
1H ЯМР (400 МГц, ДМСО-d6) δ 7,32 (д, 1H), 6,96 (т, 1H), 5,847 (с, 2Н); ИЭР-MC (М+Н)+: 259,8.
Получение соединения 15
Смесь соединения 14 (2,58 г) и уксусного ангидрида (5 мл) перемешивают при комнатной температуре в течение 3 ч, затем концентрируют в вакууме. К остатку добавляют лед (~10 г) и бикарбонат натрия (до pH=7). Полученную смесь экстрагируют этилацетатом (3×100 мл). Органические слои объединяют, сушат (Na2SO4), фильтруют и концентрируют с получением указанного в заголовке соединения 15 (2,68 г, 85% выход). ИЭР-МС (M+H)+: 301,8.
Получение соединения 16
Смесь соединения 15 (1,5 г, 5 ммоль), CuCN (0,72 г, 6 ммоль) в ДМФ (8 мл) нагревают при 145°C под азотом в течение ночи. Реакционную смесь охлаждают до комнатной температуры и затем выливают в ледяную воду (25 мл). Этилацетат (30 мл) добавляют, и нерастворимое твердое вещество отфильтровывают [промывают этилацетатом (3×10 мл)]. Органический слой отделяют, и водный слой экстрагируют этилацетатом (1×50 мл). Объединенные экстракты промывают насыщенным водным NaHCO3 (2×50 мл), насыщенным раствором соли (3×50 мл), сушат над MgSO4, фильтруют и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (10:1 петролейный эфир:этилацетат) с получением указанного в заголовке соединения 16 в виде светло-желтого твердого вещества (1,1 г, 80% выход). ИЭР-МС (M+H)+: 246,9.
Получение соединения 1b
К раствору соединения 16 (1,45 г, 5,89 ммоль) в EtOH (10 мл) добавляют концентрированный раствор HCl (12н, 10 мл). Смесь нагревают при температуре кипения с обратным холодильником в течение 1 ч, охлаждают до комнатной температуры, затем концентрируют в вакууме. Полученное белое твердое вещество растворяют в этилацетате (25 мл), промывают насыщенным водным NaHCO3 (1×25 мл), сушат над MgSO4 и концентрируют с получением соединения 1b (1,0 г, 90% выход) в виде белого твердого вещества. ИЭР-МС (M+H)+: 205.
Получение соединения 3b
Синтез соединения 3b из 1b проводят по методике получения соединения 3a. Указанное в заголовке соединение 3b получают с 95% выходом.
Синтез изотиоцианата 3c

Получение соединения 18
К раствору соединения 17 (5 г, 0,034 моль) в ДМФ (50 мл) добавляют раствор в ДМФ (50 мл) NBS (6,05 г, 0,034 моль) по каплям при комнатной температуре. Через 16 ч реакционную смесь разбавляют этилацетатом (100 мл) и промывают насыщенным раствором соли (2×100 мл). Отделенную органическую фазу сушат над Na2SO4 и концентрируют с получением указанного в заголовке соединения 18 в виде масла (5,0 г, 65% выход). ИЭР-МС (M+H)+: 223,92.
Получение соединения 19
Смесь соединения 18 (5,0 г, 22 ммоль), уксусного ангидрида (5 мл) и пиридина (0,1 мл) перемешивают при комнатной температуре в течение 50 мин, затем концентрируют в вакууме. К остатку добавляют лед (~10 г) и бикарбонат натрия (до pH=7). Полученную смесь экстрагируют этилацетатом (3×50 мл). Органические слои объединяют, сушат (Na2SO4), фильтруют и концентрируют с получением указанного в заголовке соединения 19 (4,0 г, 68% выход). ИЭР-МС (M+H)+: 265,93.
Получение соединения 20
Смесь соединения 19 (4,0 г, 15 ммоль) и CuCN (1,59 г, 18 ммоль) в ДМФ (40 мл) нагревают при 145°C в атмосфере азота в течение ночи. Реакционную смесь охлаждают до комнатной температуры, выливают в ледяную воду (20 мл). Этилацетат (25 мл) добавляют, и нерастворимое твердое вещество отфильтровывают [промывают этилацетатом (3×10 мл)]. Органический слой отделяют, и водный слой экстрагируют этилацетатом (1×25 мл). Объединенные экстракты промывают насыщенным водным раствором NaHCO3 (2×30 мл), насыщенным раствором соли (3×40 мл), сушат (MgSO4) и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (5:1 петролейный эфир:этилацетат) с получением указанного в заголовке соединения 20 в виде светло-желтого твердого вещества (2,56 г, 80% выход). ИЭР-МС (M+H)+: 213,02
Получение соединения 1c
К раствору соединения 20 (2,56 г, 12 ммоль) в EtOH (10 мл) добавляют концентрированный раствор HCl (12н, 10 мл). Смесь нагревают при температуре кипения с обратным холодильником в течение 1 ч и затем концентрируют в вакууме. Полученное белое твердое вещество растворяют в этилацетате (50 мл). Раствор промывают насыщенным водным раствором NaHCO3 (1×50 мл), сушат над MgSO4 и концентрируют с получением указанного в заголовке соединения 1c (1,8 г, 88% выход) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,55 (д, J=6,0 Гц, 1H), 7,07-7,04 (м, lH), 6,82 (уш.с, 2H), ИЭР-MC (M+H)+: 171,00.
Получение соединения 3c
К раствору соединения 1c (1,8 г, 11 ммоль) в ТГФ (20 мл) добавляют раствор тиофосгена (11 мл) в воде (11 мл) медленно при комнатной температуре. Реакционную смесь перемешивают в течение 1 ч, затем концентрируют в вакууме. Остаток растворяют в H2O (50 мл). Водный раствор экстрагируют этилацетатом (3×50 мл). Органические экстракты объединяют и промывают насыщенным раствором соли (2×50 мл), сушат с безводным MgSO4, фильтруют, концентрируют с получением указанного в заголовке соединения 3c в виде светло-желтого твердого вещества, которое сразу применяют на следующей стадии без дальнейшей очистки.
Синтез 5-фтор-4-изотиоцианато-2-трифторметилбензонитрила 3d

Получение 4-бром-2-фтор-5-(трифторметил)анилина 22
К раствору соединения 21 (2,2 г, 12,3 ммоль) в ДМФ (10 мл) добавляют по каплям раствор (10 мл) NBS (2,19 г, 12,3 ммоль) при комнатной температуре. Через 3 ч реакционную смесь разбавляют EtOAc и промывают насыщенным раствором соли. Отделенную органическую фазу сушат над Na2SO4 и концентрируют с получением указанного в заголовке соединения 22 (3,6 г, 99%) в виде желтого масла.
Получение N-(4-бром-2-фтор-5-(трифторметил)фенил)ацетамида 23
Смесь соединения 22 (3,6 г, 14 ммоль), уксусного ангидрида (8 мл) и пиридина (0,1 мл) перемешивают при комнатной температуре в течение 1 ч, затем концентрируют в вакууме. К остатку добавляют лед и бикарбонат натрия (до pH=7). Полученную смесь экстрагируют EtOAc. Органические слои объединяют, промывают насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют с получением указанного в заголовке соединения 23 (3,5 г, 83%).
1H ЯМР (400 МГц, CDCl3) δ 8,79 (д, 1H, J=7,8 Гц), 7,46 (д, 1H. J=10,0 Гц), 7,38 (уш.с, 1H), 2,24 (с, 3H).
Получение N-(4-циано-2-фтор-5-(трифторметил)фенил)ацетамида 24
Смесь соединения 23 (300 мг, 1 ммоль), CuCN (355 мг, 4 ммоль) в ДМФ (6 мл) нагревают при 150°С под N2 в течение ночи. Реакционную смесь охлаждают до комнатной температуры и затем выливают в ледяную воду. EtOAc добавляют, и нерастворимое твердое вещество отфильтровывают (промывают EtOAc). Органический слой отделяют, и водный слой экстрагируют EtOAc. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (PE:EtOAc=4:1) с получением указанного в заголовке соединения 24 (140 мг, 28%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 8,99 (д, 1H, J=7,2 Гц), 7,55 (д, 1H, J=10,0 Гц), 2,92 (с, 3H).
Получение 4-амино-5-фтор-2-(трифторметил)бензонитрила 25
К раствору соединения 24 (800 мг, 3,25 ммоль) в EtOH (10 мл) добавляют концентрированный раствор HCl (12н, 5 мл). Смесь нагревают при температуре кипения с обратным холодильником в течение 1 ч, охлаждают до комнатной температуры, концентрируют в вакууме. Полученное белое твердое вещество растворяют в EtOAc, промывают насыщенным водным NaHCO3, сушат над Na2SO4 и концентрируют с получением соединения 25 (660 мг, 99%) в виде светло-желтого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,40 (д, 1H, J=7,2 Гц), 7,09 (д, 1H, J=10,0 Гц), 4,48 (уш.с, 2H).
Получение 5-фтор-4-изотиоцианато-2-(трифторметил)бензонитрила 3d
К раствору соединения 25 (660 мг, 3,25 ммоль) в ТГФ (6 мл) добавляют раствор тиофосгена (1 мл, 13 ммоль) в воде (1 мл) медленно при комнатной температуре. Реакционную смесь перемешивают в течение 1 ч, затем концентрируют в вакууме. Остаток разбавляют H2O. Водный раствор экстрагируют этилацетатом. Органические слои объединяют и промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют с получением указанного в заголовке соединения 3d (700 мг, 88%) в виде светло-желтого твердого вещества, которое сразу применяют на следующей стадии без дальнейшей очистки.
1H ЯМР (400 МГц, CDCl3) δ 7,63 (д, 1H, J=8,5 Гц), 7,57 (д, 1H, J=6,9 Гц).
Синтез цианоамина 28

Получение метил 4-(4-аминофенил)бутаноата 27
К смеси соединения 26 (0,92 г, 5,13 ммоль) в CH3OH (20 мл) добавляют по каплям тионилхлорид (1,9 мл, 25,7 ммоль) при 0°С при перемешивании. После добавления реакционную смесь перемешивают при 80°С в течение 16 ч, концентрируют в вакууме. Остаток разбавляют водн. NaHCO3 и экстрагируют этилацетатом. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют досуха с получением соединения 27 (0,7 г, 70%) в виде светло-желтого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 6,97 (д, 2H, J=8,3 Гц), 6,64 (д, 2H, J=8,3 Гц), 3,68 (уш.с, 2H), 3,66(с, 3H), 2,54 (т, 2H, J=7,4 Гц), 2,3l (т, 2H, J=7,4 Гц), 1,85-1,95 (м, 2H).
Получение метил 4-(4-((2-цианопропан-2-ил)амино)фенил)бутаноата 28
TMSCN (1,44 мл, 10,8 ммоль) добавляют к смеси соединения 27 (0,7 г, 3,6 ммоль), ацетона (1,60 мл, 21,6 ммоль) и I2 (50 мг, 0,4 ммоль) при перемешивании. Реакционную смесь перемешивают при 50°С в течение 0,5 ч. Реакционную смесь концентрируют в вакууме. Остаток разбавляют водн. Na2SO3 и экстрагируют этилацетатом. Объединенные органические слои промывают водн. Na2SO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют досуха с получением соединения 28 (0,9 г) в виде светло-желтого масла. Неочищенный продукт применяют сразу на следующей стадии без очистки.
1H ЯМР (400 МГц, CDCl3) δ 7,07 (д, 2H, J=8,3 Гц), 6,87 (д, 2H, J=8,3 Гц), 3,66 (с, 3H), 2,58 (т, 2H, J=7,4 Гц), 2,32 (т, 2H, J=7,4 Гц), 1,85-1,95 (м, 2H), 1,68 (с, 6H).
Синтез соединения 31

Получение 4-(4-аминофенил)-N-метилбутанамида 30
Раствор соединения 27 (450 мг, 2,33 ммоль) в CH3NH2/CH3OH (29, 50 мл) перемешивают при комнатной температуре в течение ночи. Реакционную смесь концентрируют досуха с получением соединения 30 (450 мг, 95%) в виде белого твердого вещества. Неочищенный продукт применяют сразу на следующей стадии без очистки.
1H ЯМР (400 МГц, CDCl3) δ 6,95 (д, 2H, J=8,3 Гц), 6,61 (д, 2H, J=8,3 Гц), 5,30 (уш.с, 1H), 3,50 (уш.с, 2H), 2,78 (д, 3H, J=4,8 Гц), 2,54 (т, 2H, J=7,4 Гц), 2,14 (т, 2H, J=7,4 Гц), 1,85-1,95 (м, 2H).
Получение 4-(4-((2-цианопропан-2-ил)амино)фенил)-N-метилбутанамида 31
TMSCN (0,1 мл, 0,78 ммоль) добавляют к смеси соединения 30 (50 мг, 0,26 ммоль), ацетона (0,12 мл, 1,56 ммоль) и I2 (4 мг, 0,03 ммоль) при перемешивании. Реакционную смесь перемешивают при 40°С в течение 1 ч и концентрируют в вакууме. Остаток разбавляют водн. Na2SO3, и экстрагируют этилацетатом. Объединенные органические слои промывают водн. Na2SO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют досуха с получением соединения 31 в виде светло-желтого масла. Неочищенный продукт применяют сразу на следующей стадии без очистки.
1H ЯМР (400 МГц, CDCl3) δ 7,07 (д, 2Н, J=8,4 Гц), 6,88 (д, 2H, J=8,4 Гц), 5,33 (уш.с, 1H), 2,79 (д, 3H, J=4,8 Гц), 2,59 (т, 2H, J=7,4 Гц), 2,16 (т, 2H, J=7,4 Гц), 1,85-1,95 (м, 2H), 1,68 (с, 6H).
Синтез соединения 34

Получение 4-(4-аминофенил)бутанамида 33
К раствору соединения 27 (300 мг, 1,55 ммоль) в CH3OH (5 мл) добавляют NH4OH (32) при комнатной температуре при перемешивании. Реакционную смесь перемешивают при комнатной температуре в течение 6 ч и концентрируют в вакууме. Остаток разбавляют водой и экстрагируют ДХМ/CH3OH (10:1). Объединенные органические слои сушат над Na2SO4 и концентрируют досуха с получением соединения 33 (194 мг, 70%) в виде белого твердого вещества. Неочищенный продукт применяют сразу на следующей стадии без очистки.
1H ЯМР (400 МГц, CDC13) δ 6,96 (д, 2H, J=8,1 Гц), 6,61 (д, 2H, J=8,1 Гц), 5,29 (уш.с, 2H), 3,55 (уш.с, 2H), 2,57 (т, 2H, J=7,4 Гц), 2,20 (т, 2H, J=7,4 Гц), 1,85-1,95 (м, 2H).
Получение 4-(4-((2-цианопропан-2-ил)амино)фенил)бутанамида 34
TMSCN (0,3 мл, 2,36 ммоль) добавляют к смеси соединения 33 (140 мг, 0,79 ммоль), ацетона (0,35 мл, 1,56 ммоль) и I2 (10 мг, 0,08 ммоль). Реакционную смесь перемешивают при 40°С в течение 1 ч. Реакционную смесь концентрируют в вакууме. Остаток разбавляют водн. Na2SO3 и экстрагируют этилацетатом. Объединенные органические слои промывают водн. Na2SO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют досуха с получением соединения 34 (80 мг) в виде светло-желтого масла. Неочищенный продукт применяют сразу на следующей стадии без очистки.
1H ЯМР (400 МГц, CDCl3) δ 7,08 (д, 2H, J=8,5 Гц), 6,88 (д, 2H, J=8,5 Гц), 5,29 (уш.с, 1H), 2,61 (т, 2H, J=7,4 Гц), 2,20 (т, 2H, J=7,4 Гц), 1,87-1,97 (м, 2H), 1,68 (с, 6H).
Синтез соединения 37

Получение метил 3-(4-аминофенил)пропаноата 36
Методику и обработку проводят по методике синтеза соединения 27. Соединение 36 получают с 96% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 6,99 (д, 2H, J=8,2 Гц), 6,62 (д, 2H, J=8,2 Гц), 3,66 (с, 3H), 3,65 (уш.с, 2H), 2,85 (т, 2H, J=7,6 Гц), 2,57 (т, 2H, J=8,1 Гц).
Получение метил 3-(4-((2-цианопропан-2-ил)амино)фенил)пропаноата 37
Методику и обработку проводят по методике синтеза соединения 31. Неочищенный продукт берут на следующую стадию без дальнейшей очистки.
1H ЯМР (400 МГц, CDCl3) δ 7,09 (д, 2H, J=8,2 Гц), 6,87 (д, 2H, J=8,2 Гц), 3,67 (с, 3H), 2,89 (т, 2H, J=7,6 Гц), 2,60 (т, 2H, J=8,1 Гц), 1,68 (с, 3H).
Получение 3-(4-((2-цианопропан-2-ил)амино)фенил)-N-метилпропанамида 38.

К раствору соединения 37 (20 мг, 0,08 ммоль) в CH3OH (3 мл) добавляют по каплям раствор CH3NH2 в CH3OH (3 мл) при 0°С при перемешивании. Реакционную смесь перемешивают при 0°С в течение 6 ч. Ледяную воду добавляют в реакционную смесь. Водную фазу экстрагируют ДХМ. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют досуха с получением соединения 38 (25 мг) в виде светло-желтого масла. Неочищенный продукт применяют сразу на следующей стадии без очистки.
1H ЯМР (400 МГц, CDCl3) δ 7,09 (д, 2H, J=8,2 Гц), 6,86 (д, 2H, J=8,2 Гц), 2,90 (т, 2H, J=7,4 Гц), 2,77 (д, 3H, J=4,8 Гц), 2,43 (т, 2H, J=7,4 Гц), 1,68 (с, 6H).
Синтез метил 4-(4-(3-(3-хлор-4-циано-2-фторфенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил)фенил)бутаноата (ПРИМЕР 1)

Смесь соединения 3c (66 мг, 0,31 ммоль) и соединения 28 (50 мг, 0,19 ммоль) в ДМФ (0,2 мл) перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют CH3OH (10 мл) и водн. 3н HCl (10 мл). Вторую смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в холодную воду и экстрагируют ДХМ. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют в вакууме досуха. Остаток очищают хроматографией на колонке с силикагелем с применением петролейного эфира:этилацетата (3:1) с получением указанного в заголовке соединения ПРИМЕРА 1 (5 мг, 5%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,59-7,64 (м, 1H), 7,48-7,53 (м, 1H), 7,55 (д, 2H, J=8,2 Гц), 7,22 (д, 2H, J=8,2 Гц), 3,69 (с, 3H), 2,73 (т, 2H, J=7,5 Гц), 2,39 (т, 2H, J=7,4 Гц), 1,95-2,05 (м, 2H), 1,57 (д, 6H, J=5,7 Гц).
Синтез метил 4-(4-(3-(4-циано-2-фтор-3-(трифторметил)фенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил)фенил)бутаноата (ПРИМЕР 2)

Смесь соединения 28 (800 мг, 3,07 ммоль) и соединения 3b (1,1 г, 4,60 ммоль) в ДМФ (0,7 мл) перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют CH3OH (6 мл) и водн. 3н HCl (5 мл). Вторую смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в холодную воду и экстрагируют ДХМ. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют в вакууме досуха. Остаток очищают хроматографией на колонке с силикагелем с применением петролейного эфира:этилацетата (10:1) с получением указанного в заголовке соединения ПРИМЕРА 2 (1,1 г, 68%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,75-7,85 (м, 2H), 7,35 (д, 2H, J=8,3 Гц), 7,22 (д, 2H, J=8,3 Гц), 3,69 (с, 3H), 2,73 (т, 2H, J=7,5 Гц), 2,39 (т, 2H, J=7,4 Гц), 1,98-2,08 (м, 2H), 1,58 (д, 6H, J=4,9 Гц).
Синтез метил 3-(4-(3-(4-циано-2-фтор-3-(трифторметил)фенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил)фенил)пропаноата (ПРИМЕР 3)
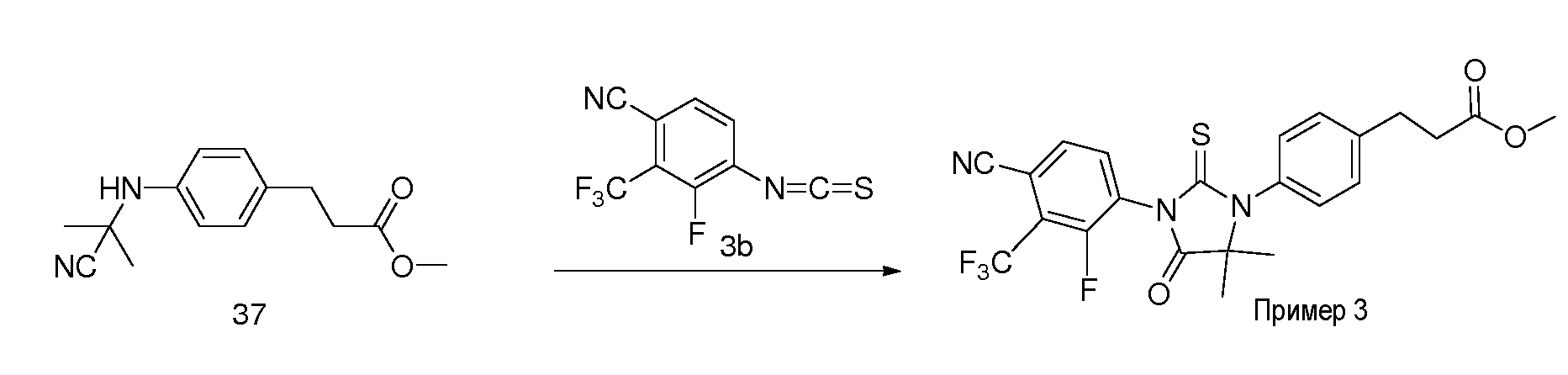
Смесь соединения 37 (600 мг, 2,44 ммоль) и соединения 3b (1,08 г, 4,38 ммоль) в ДМФ (1 мл) перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют CH3OH (10 мл) и водн. 3н HCl (10 мл). Вторую смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в холодную воду и экстрагируют ДХМ. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют в вакууме досуха. Остаток очищают хроматографией на колонке с силикагелем с применением петролейного эфира:этилацетата (10:1) с получением указанного в заголовке соединения ПРИМЕРА 3 (950 мг, 79%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDC13) δ 7,81-7,86 (м, 1H), 7,76-7,81 (м, 1H), 7,37 (д, 2H, J=8,2 Гц), 7,22 (д, 2H, J=8,2 Гц), 3,69 (с, 3H), 3,04 (т, 2H, J=7,6 Гц), 2,69 (т, 2H, J=7,8 Гц), 1,58 (д, 6H, J=4,9 Гц).
Синтез 3-(4-(3-(4-циано-2-фтор-3-(трифторметил)фенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил)фенил)-N-метилпропанамида (ПРИМЕР 4)

Соединение ПРИМЕРА 4 синтезируют реакцией между соединением 3b и соединением 38 по методике синтеза ПРИМЕРА 3. Соединение ПРИМЕРА 4 получают с 8% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,75-7,85 (м, 2H), 7,37 (д, 2H, J=8,2 Гц), 7,22 (д, 2H, J=8,2 Гц), 5,36 (уш.с, 1H), 3,06 (т, 2H, J=7,4 Гц), 2,81(д, 3H, J=3,8 Гц), 2,52 (т, 2H, J=7,4 Гц), 1,58 (д, 6H, J=4,9 Гц), ЖХМС (M+H)+: 493,2.
Синтез 4-(4-(3-(4-циано-2-фтор-3-(трифторметил)фенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил)фенил)-N-метилбутанамида (ПРИМЕР 5)

Соединение ПРИМЕРА 5 синтезируют реакцией между соединением 3b и соединением 31 по методике синтеза ПРИМЕРА 3. Соединение ПРИМЕРА 5 получают с 60% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDC13) δ 7,75-7,85 (м, 2H), 7,35 (д, 2H, J=8,2 Гц), 7,21 (д, 2H, J=8,2 Гц), 5,39 (уш.с, 1H), 2,82 (д, 3H, J=4,8 Гц), 2,74 (т, 2H, J=7,6 Гц), 2,23 (т, 2H, J=7,3 Гц), 1,98-2,08 (м, 2H), 1,58 (д, 6H, J=4,9 Гц), ЖХМС (M+H)+: 493,2.
Синтез 4-(4-(3-(4-циано-2-фтор-5-(трифторметил)фенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил)фенил)-N-метилбутанамида (ПРИМЕР 6)

Соединение ПРИМЕРА 6 синтезируют реакцией между соединением 3d и соединением 31 по методике синтеза ПРИМЕРА 3. Соединение ПРИМЕРА 6 получают с 45% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,93 (д, 1H, J=6,4 Гц), 7,73 (д, 1H, J=8,3 Гц), 7,35 (д, 2H, J=8,3 Гц), 7,25 (д, 2H, J=8,3 Гц), 5,38 (уш.с, 1H), 2,82 (д, 3H, J=4,7 Гц), 2,74 (т, 2H, J=7,5 Гц), 2,23 (т, 2H, J=7,3 Гц), 1,97-2,09 (м, 2H), 1,58 (д, 6H, J=5,7 Гц), ЖХМС (M+H)+: 507,4.
Синтез 4-(4-(3-(3-хлор-4-циано-2-фторфенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил)фенил)-N-метилбутанамида (ПРИМЕР 7)

Соединение ПРИМЕРА 7 синтезируют реакцией между соединением 3c и соединением 31 по методике синтеза ПРИМЕРА 3. Соединение ПРИМЕРА 7 получают с 10% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,60-7,64 (м, 1H), 7,48-7,52 (м, 1H), 7,35 (д, 2H, J=8,2 Гц), 7,21 (д, 2H, J=8,2 Гц), 5,39 (уш.с, 1H), 2,82 (д, 3H, J=4,8 Гц), 2,74 (т, 2H, J=7,8 Гц), 2,23 (т, 2H, J=8,3 Гц), 1,98-2,08 (м, 2H), 1,57 (д, 6H, J=5,8 Гц), ЖХМС (M+H)+: 473,2.
Синтез 4-(4-(3-(4-циано-2-фтор-3-(трифторметил)фенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил)фенил)бутанамида (ПРИМЕР 8)

Соединение ПРИМЕРА 8 синтезируют реакцией между соединением 3b и соединением 34 по методике синтеза ПРИМЕРА 3. Соединение ПРИМЕРА 8 получают с 10% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,75-7,85 (м, 2H), 7,35 (д, 2H, J=8,2 Гц), 7,21 (д, 2H, J=8,2 Гц), 5,39 (уш.с, 2H), 2,76 (т, 2H, J=7,6 Гц), 2,29 (т, 2H, J=7,3 Гц), 1,98-2,10 (м, 2H), 1,58 (д, 6H, J=4,9 Гц), ЖХМС (M+H)+: 493,7.
Синтез 4-(4-(3-(3-хлор-4-циано-2-фторфенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил)фенил)бутанамида (ПРИМЕР 9)

Соединение ПРИМЕРА 9 синтезируют реакцией между соединением 3c и соединением 34 по методике синтеза ПРИМЕРА 3. Соединение ПРИМЕРА 9 получают с 16% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,58-7,64 (м, 1H), 7,48-7,52 (м, 1H), 7,35 (д, 2Н, J=8,2 Гц), 7,21 (д, 2H, J=8,2 Гц), 5,41 (уш.с, 2H), 2,76 (т, 2H, J=7,4 Гц), 2,30 (т, 2H, J=7,3 Гц), 1,98-2,08 (м, 2H), 1,57 (д, 6H, J=5,8 Гц), ЖХМС (M+H): 459,2.
Синтез соединения ПРИМЕРА 10

Получение 4-(4-((1-цианоциклобутил)амино)фенил)-N-метилбутанамида 39
TMSCN (0,09 мл, 0,70 ммоль) добавляют к смеси соединения 30 (90 мг, 0,47 ммоль), циклобутанона (0,05 мл, 0,70 ммоль) и I2 (6 мг, 0,05 ммоль) при перемешивании. Реакционную смесь перемешивают при комнатной температуре в течение 10 мин и концентрируют в вакууме. Остаток разбавляют водн. Na2SO3 и экстрагируют ДХМ. Объединенные органические слои промывают водн. Na2SO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Остаток очищают хроматографией на колонке с силикагелем с применением петролейного эфира:этилацетата (10:1) с получением соединения 39 (85 мг, 67%) в виде светло-желтого масла.
1H ЯМР (400 МГц, CDCl3) δ 6,98 (д, 2H, J=8,4 Гц), 6,56 (д, 2H, J=8,4 Гц), 5,39 (уш.с, 1H), 2,66-2,76 (м, 5H), 2,50 (т, 2H, J=8,4 Гц), 2,28-2,40 (м, 2H), 2,10-2,22 (м, 2H), 2,08 (т, 2H, J=8,4 Гц), 1,80-1,90 (м, 2H).
Синтез 4-(4-(7-(4-циано-2-фтор-3-(трифторметил)фенил)-8-оксо-6-тиоксо-5,7-диазаспиро[3,4]октан-5-ил)фенил)-N-метилбутанамида (ПРИМЕР 10)
Соединение ПРИМЕРА 10 синтезируют реакцией между соединением 3b и соединением 39 по методике синтеза ПРИМЕРА 3. Соединение ПРИМЕРА 10 получают с 56% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,58-7,64 (м, 1H), 7,48-7,52 (м, 1H), 7,41 (д, 2H, J=8,2 Гц), 7,24 (д, 2H, J=8,2 Гц), 5,51 (уш.с, 1H), 2,83 (д, 3H, J=3,7 Гц), 2,72-2,80 (м, 2H), 2,62-2,70 (м, 2H), 2,50-2,60 (м, 2H), 2,20-2,30 (м, 3H), 2,00-2,10 (м, 2H), 1,65-1,72 (м, 1H), ЖХМС (M+H)+: 519,8.
Синтез 4-(4-(7-(3-хлор-4-циано-2-фторфенил)-8-оксо-6-тиоксо-5,7-диазаспиро[3,4]октан-5-ил)фенил)-N-метилбутанамида (ПРИМЕР 11)

Соединение ПРИМЕРА 11 синтезируют реакцией между соединением 3c и соединением 39 по методике синтеза ПРИМЕРА 3. Соединение ПРИМЕРА 11 получают с 72% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,60-7,64 (м, 1H), 7,48-7,54 (м, 1H), 7,41 (д, 2H, J=8,2 Гц), 7,24 (д, 2H, J=8,2 Гц), 5,51 (уш.с, 1H), 2,83 (д, 3H, J=3,7 Гц), 2,72-2,80 (м, 2H), 2,62-2,70 (м, 2H), 2,50-2,60 (м, 2H), 2,20-2,30 (м, 3H), 2,00-2,10 (м, 2H), 1,65-1,72 (м, 1H), ЖХМС (M+H)+: 485,4.
Получение соединения 40

Раствор соединения 27 (500 мг, 2,33 ммоль) в (CH3)2NH (водн.) (50 мл)/MeOH (50 мл) перемешивают при комнатной температуре в течение 72 ч. После удаления основной части MeOH, остаток разбавляют H2O и экстрагируют ДХМ. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют с получением соединения 40 (450 мг, 84,3%) в виде белого твердого вещества. Неочищенный продукт применяют сразу на следующей стадии без дальнейшей очистки.
1H ЯМР (400 МГц, CDCl3) δ 6,97 (д, J=8,0 Гц, 2H), 6,61 (д, J=8,0 Гц, 2H), 2,93 (с, 6H), 2,58-2,55 (м, 2H), 2,36-2,30 (м, 2H), 1,93-1,89 (м, 2H).
Получение соединения 41

TMSCN (0,6 мл, 4,8 ммоль) добавляют к смеси соединения 40 (330 мг, 1,6 ммоль), ацетона (1,20 мл) и I2 (10 мг) при перемешивании. Реакционную смесь перемешивают при КТ в течение 3 ч. Смесь разбавляют водн. Na2SO3 и экстрагируют этилацетатом. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют с получением соединения 41 (240 мг, 54,6%) в виде масла. Неочищенный продукт применяют сразу на следующей стадии без очистки.
Синтез 4-{4-[3-(4-циано-2-фтор-3-трифторметилфенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил]фенил}-N,N-диметилбутирамида (ПРИМЕР 12)
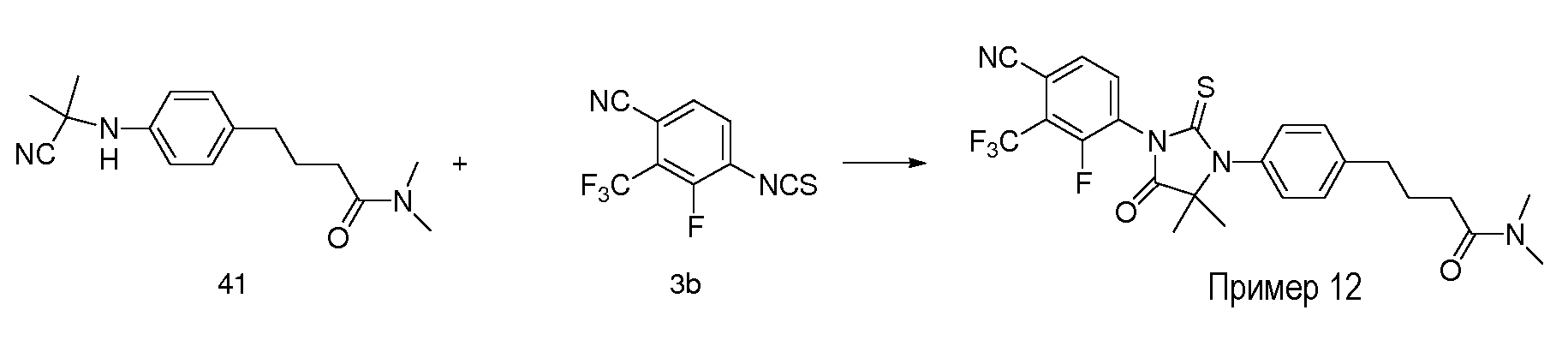
Смесь соединения 41 (50 мг, 0,19 ммоль) и соединения 3b (72 мг, 0,29 ммоль) в ДМФ (0,7 мл) перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют MeOH (6 мл) и 2н HCl (5 мл). Вторую смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в холодную воду и экстрагируют ДХМ. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Остаток очищают преп-ТСХ с получением указанного в заголовке соединения ПРИМЕРА 12 (40 мг, 39,8%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,85-7,76 (м, 2H), 7,77 (д, J=8,0 Гц, 2H), 7,21 (д, J=8,0 Гц, 2H), 2,97 (с, 6H), 2,78-2,75 (м, 2H), 2,41-2,37 (м, 2H), 2,05-2,01 (м, 2H), 1,58 (д, J=4,8 Гц, 6H), ЖХМС (M+H)+: 521,6.
Синтез 4-{4-[3-(4-циано-2-фтор-3-метоксифенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил]фенил}-N,N-диметилбутирамида (ПРИМЕР 13)

Смесь соединения 41 (50 мг, 0,19 ммоль) и соединения 3a (57 мг, 0,28 ммоль) в ДМФ (0,7 мл) перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют MeOH (6 мл) и 2н HCl (5 мл). Вторую смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в холодную воду и экстрагируют ДХМ. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Остаток очищают преп-ТСХ с получением указанного в заголовке соединения ПРИМЕРА 13 (15 мг, 15,9%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,48~7,46 (м, 1H), 7,36 (д, J=8,0 Гц, 2H), 7,21-7,16 (м, 3H), 4,19 (д, J=2,8 Гц, 3H), 2,96 (д, J=5,6 Гц, 6H), 2,89-2,74 (м, 2H), 2,41-2,37 (м, 2H), 2,05-2,01 (м, 2H), 1,57 (д, J=2,8 Гц, 6H), ЖХМС (M+H)+: 483,6.
Синтез 4-{4-[3-(3-хлор-4-циано-2-фторфенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил]фенил}-N,N-диметилбутирамида (Пример 14)

Смесь соединения 41 (50 мг, 0,19 ммоль) и соединения 3c (58 мг, 0,28 ммоль) в ДМФ (0,7 мл) перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют MeOH (6 мл) и 2н HCl (5 мл). Вторую смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в холодную воду и экстрагируют ДХМ. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Остаток очищают преп-ТСХ с получением указанного в заголовке соединения Примера 14 (25 мг, 28,1%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,64-7,62 (м, 1H), 7,53-7,49 (м, 1H), 7,37 (д, J=8,0 Гц, 2H), 7,21 (д, J=8,0 Гц, 2H), 2,96 (д, J=5,6 Гц, 6H), 2,78-2,74 (м, 2H), 2,40-2,36 (м, 2H), 2,05-2,00 (м, 2H), 1,57 (д, J=6,0 Гц, 6H), ЖХМС (M+H)+: 487,5.
Получение соединения 46:

Смесь соединения 42 (15 г, 107,9 ммоль), соединения 43 (35,1 г, 325 ммоль) и KOH (27,3 г, 488 ммоль) в 150 мл воды и 150 мл EtOH кипятят с обратным холодильником в течение 3ч. Полученную смесь охлаждают до комнатной температуры и подкисляют концентрированной HCl до pH=1. Водный слой экстрагируют этилацетатом (100 мл ×3). Объединенные органические слои промывают насыщенным раствором NaHCO3 (100 мл ×2). Водный слой NaHCO3 подкисляют концентрированной HCl и экстрагируют этилацетатом (100 мл ×3). Объединенные слои ЭА промывают насыщенным раствором соли (100 мл ×2), сушат над безводным Na2SO4 и концентрируют. Остаток кристаллизуют из Et2O и гексана с получением желаемого продукта 44 (4,0 г, 17,5%) в виде белого твердого вещества. ЖХМС (M+1)+: 212.
Смесь соединения 44 (4,0 г, 19,0 ммоль) в 50 мл SOCl2 перемешивают при 40°C в течение 1 ч. Растворитель удаляют при пониженном давлении. Остаток растворяют в 20 мл ТГФ и добавляют к раствору метиламина (33% масс. в этаноле, 40 мл, 326,2 ммоль) в 30 мл ТГФ по каплям при 0°C. Полученную смесь перемешивают при комнатной температуре в течение еще 1 ч. Растворитель удаляют при пониженном давлении. Добавляют 100 мл воды, и водный слой экстрагируют этилацетатом (200 мл ×3). Объединенные органические слои промывают насыщенным раствором соли (100 мл ×2), сушат над безводным Na2SO4 и концентрируют. Остаток подвергают хроматографии на силикагеле (ПЭ:ЭА 3:1) с получением желаемого продукта 45 (3,5 г, 82,2%) в виде белого твердого вещества. ЖХМС (М+1)+: 225.

Смесь соединения 45 (2,0 г, 8,93 ммоль), Pd/C (0,35 г) в 12 мл AcOH и 150 мл EtOH перемешивают под H2 давлением баллона при комнатной температуре в течение 1,5 часов. Растворитель удаляют при пониженном давлении. Добавляют 100 мл насыщенного NaHCO3 раствора, и водный слой экстрагируют этилацетатом (100 мл ×5). Объединенные органические слои промывают насыщенным раствором соли (100 мл ×1), сушат над безводным Na2SO4 и концентрируют. Остаток очищают флэш-хроматографией на колонке (силикагель) (ПЭ:MeOH 30:1) с получением желаемого продукта 46 (1,6 г, 92,4%) в виде бледно-желтого твердого вещества. ЖХМС (М+1)+: 195.
Синтез 3-{4-[3-(4-циано-2-фтор-3-трифторметилфенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил]фенокси}-N-метилпропионамида (ПРИМЕР 15)

Получение 3-(4-((2-цианопропан-2-ил)амино)фенокси)-N-метилпропанамида 47
TMSCN (0,11 мл, 0,82 ммоль) добавляют к смеси соединения 46 (53 мг, 0,27 ммоль), ацетона (0,12 мл, 1,62 ммоль) и I2 (4 мг, 0,03 ммоль) при перемешивании при комнатной температуре. Реакционную смесь перемешивают при 40°С в течение 30 мин и концентрируют в вакууме. Остаток разбавляют водн. Na2SO3 и экстрагируют этилацетатом. Объединенные органические слои промывают водн. Na2SO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют досуха с получением соединения 47 (60 мг, 86%) в виде светло-желтого масла. Неочищенный продукт применяют сразу на следующей стадии без очистки.
1H ЯМР (400 МГц, CDCl3) δ 6,97 (д, 2H, J=8,9 Гц), 6,85 (д, 2H, J=8,9 Гц), 5,85 (уш.с, 1H), 4,22 (т, 2H, J=6,0 Гц), 2,84 (д, 3H, J=4,8 Гц), 2,64 (т, 2H, J=6,0 Гц), 1,22 (с, 6H).
Синтез 3-(4-(3-(4-циано-2-фтор-3-(трифторметил)фенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил)фенокси)-N-метилпропанамида (ПРИМЕР 15)
Смесь соединения 47 (60 мг, 0,23 ммоль) и соединения 3b (85 мг, 0,35 ммоль) в ДМФ (0,1 мл) перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют CH3OH (1 мл) и водн. 3н HCl (1 мл). Вторую смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в холодную воду и экстрагируют ДХМ. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют в вакууме досуха. Остаток очищают ТСХ ДХМ:ацетон = 7:1) с получением указанного в заголовке соединения соединения ПРИМЕРА 15 (50 мг, 43%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,75-7,85 (м, 2H), 7,22 (д, 2H, J=8,7 Гц), 7,04 (д, 2H, J=8,7 Гц), 5,56 (уш.с, 1H), 4,32 (т, 2H, J=5,7 Гц), 2,86 (д, 3H), 2,39 (т, 2H, J=5,7 Гц), 1,58 (д, 6H, J=4,8 Гц), ЖХМС (M+H)+: 509,6.
Синтез 3-(4-(3-(3-хлор-4-циано-2-фторфенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил)фенокси)-N-метилпропанамида (ПРИМЕР 16)

Соединение ПРИМЕРА 16 синтезируют реакцией между соединением 3c и соединением 47 по методике синтеза ПРИМЕРА 15. Соединение ПРИМЕРА 16 получают с 40% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,60-7,65 (м, 1H), 7,47-7,53 (м, 1H), 7,22 (д, 2H, J=8,7 Гц), 7,04 (д, 2H, J=8,7 Гц), 5,56 (уш.с, 1H), 4,32 (т, 2H, J=5,7 Гц), 2,86 (д, 3H), 2,39 (т, 2H, J=5,7 Гц), 1,58 (д, 6H, J=4,8 Гц), ЖХМС (M+H)+: 475,6.
Получение соединения 53:

К смеси соединения 48 (5 г, 32,7 ммоль) и соединения 49 (7 г, 75 ммоль) в ДМФ (60 мл) добавляют NaH (60%, 1,45 г, 35 ммоль) медленно при 0°C и перемешивают в течение 3 ч. Медленно добавляют 50 мл H2O и перемешивают в течение 10 минут. Раствор экстрагируют ЭА (300 мл ×3). Объединенные органические слои промывают насыщенным раствором соли (100 мл ×2), сушат над безводным Na2SO4 и концентрируют с получением неочищенного продукта 50 (6,7 г, 71%). ЖХМС (М+1)+: 268.

Соединение 50 (3 г) растворяют в ТГФ (20 мл) и 20 мл HCl (36%) и перемешивают в течение 2 ч при КТ. Раствор экстрагируют ЭА (200 мл ×3). Объединенные органические слои промывают насыщенным раствором соли (100 мл ×2), сушат над безводным Na2SO4 и концентрируют с получением неочищенного продукта 51 (2,25 г, 95%). ЖХМС (М+1)+: 212.

Соединение 51 (2,2 г) растворяют в SOCl2 (15 мл) и перемешивают в течение 2 ч при 30°C. Раствор концентрируют в вакууме, и остаток растворяют в ТГФ (10 мл). Раствор капают в ТГФ/NH2Me (5 мл/15 мл) при 0°C и перемешивают в течение 0,5 ч. Раствор экстрагируют ЭА (200 мл ×3). Объединенные органические слои промывают насыщенным раствором соли (100 мл ×2), сушат над безводным Na2SO4 и концентрируют с получением неочищенного продукта 52 (2,2 г, 95%). ЖХМС (М+1)+: 225.

Соединение 52 (2,2 г) растворяют в EtOH/AcOH (20 мл/1 мл). Добавляют Pd/C (70%, 0,5 г) и перемешивают. Добавляют большой баллон H2 и перемешивают в течение ночи. Раствор фильтруют и переносят в вакууме и экстрагируют ЭА (200 мл ×3). Объединенные органические слои промывают насыщенным раствором соли (100 мл ×2), сушат над безводным Na2SO4 и концентрируют с получением неочищенного продукта 53 (1,7 г, 90%). ЖХМС (M+23)+: 217.

Получение 2-((4-((2-цианопропан-2-ил)амино)бензил)окси)-N-метилацетамида 54
TMSCN (0,1 мл, 0,78 ммоль) добавляют к смеси соединения 53 (50 мг, 0,26 ммоль), ацетона (0,2 мл, 2,6 ммоль) и ZnCl2 (16 мг, 0,12 ммоль) при перемешивании. Реакционную смесь перемешивают при комнатной температуре в течение 1 ч и концентрируют в вакууме. Остаток разбавляют водой и экстрагируют ДХМ. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют досуха с получением соединения 54 (60 мг, 86%) в виде светло-желтого масла. Неочищенный продукт применяют сразу на следующей стадии без очистки.
1H ЯМР (400 МГц, CDCl3) δ 7,23 (д, 2H, J=8,4 Гц), 6,92 (д, 2H, J=8,4 Гц), 6,51 (уш.с, 1H), 4,48 (с, 2H), 3,97 (с, 2H), 2,84 (д, 3H, J=5,0 Гц), 1,72 (с, 6H).
Синтез 2-((4-(3-(4-циано-2-фтор-3-(трифторметил)фенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил)бензил)окси)-N-метилацетамида (ПРИМЕР 17)
Соединение ПРИМЕРА 17 синтезируют реакцией между соединением 3b и соединением 54 по методике синтеза ПРИМЕРА 15. Соединение ПРИМЕРА 17 получают с 59% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,75-7,85 (м, 2H), 7,51 (д, 2H, J=8,2 Гц), 7,33 (д, 2H, J=8,2 Гц), 6,55 (уш.с, 1H), 4,66 (с, 2H), 4,06 (с, 2H), 2,88 (д, 3H, J=4,8 Гц), 1,60 (д, 6H, J=4,0 Гц), ЖХМС (M+H)+: 509,6.
Синтез 2-((4-(3-(3-хлор-4-циано-2-фторфенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил)бензил)окси)-N-метилацетамида (ПРИМЕР 18)

Соединение ПРИМЕРА 18 синтезируют реакцией между соединением 3c и соединением 54 по методике синтеза ПРИМЕРА 15. Соединение ПРИМЕРА 18 получают с 50% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,61-7,65 (м, 1H), 7,48-7,53 (м, 3H), 7,33 (д, 2H, J=8,2 Гц), 6,55 (уш.с, 1H), 4,66 (с, 2H), 4,06 (с, 2H), 2,88 (д, 3H, J=4,8 Гц), 1,60 (д, 6H J=4,9 Гц), ЖХМС (M+H)+: 475,6.
Синтез соединения ПРИМЕРА 19

Получение 4-(3-(4,5-дигидро-1Н-имидазол-2-ил)пропил)анилина 55
Этилендиамин (6,23 мл, 93,1 ммоль) добавляют по каплям к перемешиваемому раствору AlMe3/Tol (толуол) (58 мл, 2M), так, чтобы температура не превышала -20°С. Реакционную смесь перемешивают при комнатной температуре в течение 10 мин, затем к смеси добавляют по каплям раствор соединения 27 (4,5 г, 23,3 ммоль) в толуоле (290 мл). Реакционную смесь перемешивают при 120°С в течение ночи. После охлаждения раствор обрабатывают по каплям водой, разбавляют ДХМ и CH3OH и фильтруют над MgSO4. Фильтрат концентрируют и очищают хроматографией на колонке с силикагелем (EtOAc:CH3OH:ТЭА=3:1:0,2) с получением соединения 55 (4,5 г, 96%) в виде светло-желтого масла.
1H ЯМР (400 МГц, CDCl3) δ 6,96 (д, 2H, J=8,3 Гц), 6,62 (д, 2H, J=8,3 Гц), 3,56 (с, 4H), 2,55 (т, 2H, J=7,4 Гц), 2,23 (д, 2H, J=7,4 Гц), 1,84-1,94 (м, 2H)
Получение бензил (4-(3-(4,5-дигидро-1Н-имидазол-2-ил)пропил)фенил)карбамата 56.
К раствору соединения 55 (318 мг, 1,56 ммоль) в ДМФ (1 мл) добавляют по каплям CbzCl (0,29 мл, 2,03 ммоль) при 0°С при перемешивании. Реакционную смесь перемешивают при комнатной температуре в течение 3 ч. ДМФ удаляют в вакууме. Остаток очищают хроматографией на колонке с силикагелем (EtOAc:CH3OH:ТЭА=3:1:0,2) с получением соединения 56 (400 мг, 76%) в виде светло-желтого масла.
1H ЯМР (400 МГц, CDCl3) δ 7,70 (с, 1H), 7,30-7,40 (м, 5H), 7,25 (д, 2H, J=8,3 Гц), 6,98 (д, 2H, J=8,3 Гц), 5,15 (с, 2H), 3,65 (с, 4H), 2,50 (т, 2H, J=7,4 Гц), 2,43 (д, 2H, J=7,4 Гц), 1,85-1,97 (м, 2H).
Получение бензил (4-(3-(1Н-имидазол-2-ил)пропил)фенил)карбамата 57
Соединение 56 (274 мг, 0,81 ммоль) сначала растворяют в ацетонитриле (10 мл), в раствор партиями добавляют перманганат калия (192 мг, 1,22 моль) и окись алюминия (567 мг, 0,3 моль). После перемешивания полученной смеси при комнатной температуре в течение 40 мин, CH3OH (1 мл) добавляют для снижения избытка окислителя. Смесь фильтруют, и твердый продукт промывают ДХМ:CH3OH=10:1. Фильтрат выпаривают, и полученный неочищенный продукт очищают хроматографией на колонке с силикагелем (ПЭ:EtOAc:ТЭА = 3:1:0,2) с получением соединения 57 (110 мг, 41%) в виде светло-желтого масла.
1H ЯМР (400 МГц, CDCl3) δ 7,32-7,43 (м, 6H), 7,28 (д, 2H, J=8,3 Гц), 7,09 (д, 2H, J=8,3 Гц), 6,90-9,95 (м, 2H), 6,70 (уш.с, 1H), 5,19 (с, 2H), 2,65 (т, 2H, J=7,4 Гц), 2,62 (д, 2H, J=7,4 Гц), 1,98-2,07 (м, 2H).
Получение трет-бутил 2-(3-(4-(((бензилокси)карбонил)амино)фенил)пропил)-1Н-имидазол-1-карбоксилата 58
К раствору соединения 57 (500 мг, 1,5 ммоль) в ДХМ (25 мл) добавляют по каплям ТЭА (0,3 мл, 2,3 ммоль) и (Boc)2O (0,42 мл, 1,8 ммоль) при 0°С при перемешивании. Реакционную смесь перемешивают при комнатной температуре в течение ночи, концентрируют и очищают хроматографией на колонке с силикагелем (ПЭ:EtOAc=3:1) с получением соединения 58 (415 мг, 51%) в виде светло-желтого масла.
1H ЯМР (400 МГц, CDCl3) δ 7,32-7,43 (м, 8H), 7,28 (д, 2H, J=8,3 Гц), 7,14 (д, 2H, J=8,3 Гц), 6,65 (уш.с, 1H), 5,19 (с, 2H), 2,95-3,08 (м, 2H), 2,65-2,73 (м, 2H), 2,00-2,15 (м, 2H), 1,61 (с, 9H).
Получение трет-бутил 2-(3-(4-аминофенил)пропил)-1Н-имидазол-1-карбоксилата 59
Раствор соединения 58 (80 мг, 0,18 ммоль) в EtOAc (5 мл) добавляют Pd/C (10 мг, 10%) под N2. Суспензию дегазируют в вакууме и продувают H2 несколько раз. Смесь перемешивают под H2 баллоном при комнатной температуре в течение 2 ч. Суспензию фильтруют, и твердое вещество промывают EtOAc. Фильтраты концентрируют досуха с получением соединения 59 (38 мг, 70%) в виде светло-желтого масла. Неочищенный продукт применяют сразу на следующей стадии без очистки.
1H ЯМР (400 МГц, CDCl3) δ 7,32-7,43 (м, 1H), 6,96-7,02 (м, 3H), 6,93 (д, 2H, J=8,3 Гц), 3,17 (т, 2H, J=7,4 Гц), 2,66 (т, 2H, J=7,4 Гц), 2,05-2,13 (м, 2H), 1,62 (с, 9H).
Получение трет-бутил 2-(3-(4-((2-цианопропан-2-ил)амино)фенил)пропил)-1Н-имидазол-1-карбоксилата 60
Соединение 60 синтезируют из соединения 59 по методике синтеза соединения 54. Его получают с 94% выходом в виде светло-желтого масла.
1H ЯМР (400 МГц, CDCl3) δ 7,30-7,40 (м, 1H), 7,11 (д, 2H, J=8,3 Гц), 6,85-7,02 (м, 1H), 6,86 (д, 2H, J=8,3 Гц), 3,00-3,20 (м, 2H), 2,52-2,54 (м, 2H), 2,00-2,02 (м, 2H), 1,67 (с, 6H), 1,62 (с, 9H).
Синтез 4-(3-(4-(3-(1Н-имидазол-2-ил)пропил)фенил)-4,4-диметил-5-оксо-2-тиоксоимидазолидин-1-ил)-3-фтор-2-(трифторметил)бензонитрила (ПРИМЕР 19)
Соединение ПРИМЕРА 19 синтезируют реакцией между соединением 3b и соединением 60 по методике синтеза ПРИМЕРА 15. Соединение ПРИМЕРА 19 получают с 50% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,75-7,88 (м, 2H), 7,36 (д, 2H, J=8,2 Гц), 7,19 (д, 2H, J=8,2 Гц), 7,07 (уш.с, 2H), 3,00-3,20 (м, 2H), 2,73-2,81 (м, 2H), 2,20-2,34 (м, 2H), 1,58 (д, 6H, J=4,9 Гц), ЖХМС (M+H)+: 516,2.
Синтез 2-хлор-3-фтор-4-(3-{4-[3-(1Н-имидазол-2-ил)пропил]фенил}-4,4-диметил-5-оксо-2-тиоксоимидазолидин-1-ил)бензонитрила (ПРИМЕР 20)

Смесь соединения 60 (50 мг, 0,14 ммоль) и соединения 3c (43 мг, 0,21 ммоль) в ДМФ (0,7 мл) перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют MeOH (6 мл) и 2н HCl (5 мл). Вторую смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в холодную воду и экстрагируют ДХМ. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Остаток очищают преп-ТСХ с получением указанного в заголовке соединения ПРИМЕРА 20 (25 мг, 38,3%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 10,46-10,44 (уш.с, 1H), 7,64-7,62 (м, 1H), 7,54-7,50 (м, 1H), 7,29-7,27 (м, 1H), 7,18-7,10 (м, 4H), 6,86-6,80 (м, 1H), 3,07-2,83 (м, 2H), 2,69-2,64 (м, 2H), 2,03-1,79 (м, 2H), 1,55 (д, J=4,8 Гц, 6H), ЖХМС (M+H)+: 483,5.
Синтез 3-фтор-4-(3-{4-[3-(1Н-имидазол-2-ил)пропил]фенил}-4,4-диметил-5-оксо-2-тиоксоимидазолидин-1-ил)-2-метоксибензонитрила (ПРИМЕР 21)

Смесь соединения 60 (50 мг, 0,14 ммоль) и соединения 3a (42 мг, 0,21 ммоль) в ДМФ (0,7 мл) перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют MeOH (6 мл) и 2н HCl (5 мл). Вторую смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в холодную воду и экстрагируют ДХМ. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Остаток очищают преп-ТСХ с получением указанного в заголовке соединения ПРИМЕРА 21 (15 мг, 23,9%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 10,85-10,80 (уш.с, 1H), 7,48-7,46 (м, 1H), 7,20-7,16 (м, 4H), 7,08-7,01 (м, 2H), 6,85-6,82 (м, 1H), 4,19 (д, J=3,2 Гц, 3H), 3,03-3,00 (м, 2H), 2,69-2,67 (м, 2H), 2,15-2,12 (м, 2H), 1,54 (д, J=5,2 Гц, 6H), ЖХМС (M+H)+: 478,1.
Синтез соединения 61

Получение соединения 61b
Смесь оксалилдихлорида (11,5 г, 87 ммоль) в CH2Cl2 (180 мл) охлаждают до -78°C, затем по каплям добавляют ДМСО (8,9 г, 113 ммоль) в CH2Cl2 (40 мл) в течение более 10 минут, затем добавляют раствор спирта 61a (10 г) в 40 мл CH2Cl2. После добавления смесь перемешивают в течение 15 минут при -78°C. Et3N (52 мл, 378 ммоль) добавляют по каплям и нагревают до к.т. Реакционную смесь гасят водой (200 мл) и экстрагируют ЭА (100 мл ×2). Сушат и удаляют растворитель с получением чистого продукта 61b (8,8 г, 88%) в виде масла.
Получение соединения 61d
Смесь диэтил 4-нитробензилфосфоната (2,5 г, 9,16 ммоль) в ТГФ (50 мл) охлаждают до 0°C, затем NaH (0,5 г, 11,2 ммоль) добавляют осторожно и смесь перемешивают в течение 10 минут. Соединение 61b (1,6 г, 11,2 ммоль) в ТГФ (10 мл) добавляют по каплям. После добавления смесь нагревают до к.т. и перемешивают в течение 1 часа при к.т. Реакционную смесь гасят 1н HCl (40 мл). Смесь экстрагируют ЭА (100 мл ×2). Сушат и удаляют ЭА с получением неочищенного продукта. Неочищенный продукт очищают флэш-хроматографией (силикагель, ПЭ:ЭА=8:1) с получением соединения 61d (1,6 г, 70%) в виде белого твердого вещества.
Получение соединения 61e
Смесь соединения 61d (1,6 г, 6,42 моль), (Boc)2O (2,1 г, 9,6 моль) и Pd/C (0,32 г) в MeOH (65 мл) под давлением газа H2 (1 атм.) перемешивают в течение ночи. Смесь фильтруют через целатом и промывают MeOH. Удаляют растворитель с получением продукта 61e (1,9 г, 90%) в виде белого твердого вещества.
Получение соединения 61f
К смеси соединения 61e (1,9 г, 5,9 ммоль) в ТГФ/MeOH (20 мл/20 мл) добавляют водный NaOH (20 мл, 20% M/M), затем смесь перемешивают в течение ночи при к.т. Растворитель удаляют, и 100 мл воды добавляют, смесь экстрагируют простым эфиром (100 мл). PH водного слоя подкисляют 1н HCl, затем экстрагируют ЭА (100 мл ×2). Сушат, и удаляют растворитель с получением чистого продукта 61f (1,6 г, 89%) в виде белого твердого вещества.
Получение соединения 61g
К смеси соединения 61f (1,6 г, 5,2 ммоль), Et3N (2,2 мл, 7,8 ммоль) и гидрохлорида метанамина (0,52 г, 7,8 ммоль) в CH2Cl2 (50 мл) добавляют ГАТУ (2,9 г, 7,8 ммоль), затем смесь перемешивают в течение 2 часов. Смесь гасят 1н HCl (50 мл). Отделяют, и водный слой экстрагируют CH2Cl2 (50 мл). Органические слои промывают 1н HCl (30 мл), водой (50 мл), сушат, и удаляют растворитель с получением неочищенного продукта 61g (1,6 г, 85%).
Получение соединения 61
Суспензию соединения 61g (1,6 г, 5 ммоль) в HCl/ЭА (20 мл) перемешивают в течение 3 часов при к.т. Фильтруют и промывают ЭА (10 мл) с получением продукта. Твердое вещество перемешивают с насыщенным водным NaHCO3 и экстрагируют ЭА (100 мл ×2). Сушат и удаляют растворитель с получением неочищенного продукта. Неочищенный продукт очищают флэш-хроматографией (силикагель, ПЭ:ЭА=8:1) с получением соединения 61 (0,9 г, 75%) в виде масла.
Получение соединения 62

TMSCN (0,34 мл, 2,7 ммоль) добавляют к смеси соединения 61 (200 мг, 0,9 ммоль), ацетона (0,5 мл, 5,4 ммоль) и ZnCl2 (10 мг) при перемешивании. Реакционную смесь перемешивают при КТ в течение 3 ч. Смесь разбавляют H2O и экстрагируют этилацетатом. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют с получением соединения 62 (240 мг, 91,8%) в виде масла. Неочищенный продукт применяют сразу на следующей стадии без очистки.
Синтез 4-{4-[3-(4-циано-2-фтор-3-трифторметилфенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил]фенил}-2,2,N-триметилбутирамида (ПРИМЕР 22)

Смесь соединения 62 (50 мг, 0,17 ммоль) и соединения 3b (64 мг, 0,26 ммоль) в ДМФ (0,7 мл) перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют MeOH (6 мл) и 2н HCl (5 мл). Вторую смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в холодную воду и экстрагируют ДХМ. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Остаток очищают преп-ТСХ с получением указанного в заголовке соединения ПРИМЕРА 22 (49 мг, 52,8%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,84-7,76 (м, 2H), 7,34 (д, J=8,0 Гц, 2H), 7,19 (д, J=8,0 Гц, 2H), 5,68-5,65 (уш.с, 1H), 2,84 (д, J=4,4 Гц, 3H), 2,63-2,59 (м, 2H), 1,89-1,85 (м, 2H), 1,57 (д, J=4,8 Гц, 6H), 1,26 (с, 6H), ЖХМС (M+H)+: 535,0.
Синтез 4-{4-[3-(4-циано-2-фтор-3-метоксифенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил]фенил}-2,2,N-триметилбутирамида (ПРИМЕР 23)

Смесь соединения 62 (50 мг, 0,19 ммоль) и соединения 3a (54 мг, 0,28 ммоль) в ДМФ (0,7 мл) перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют MeOH (6 мл) и 2н HCl (5 мл). Вторую смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в холодную воду и экстрагируют ДХМ. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Остаток очищают преп-ТСХ с получением указанного в заголовке соединения ПРИМЕРА 23 (40 мг, 46,3%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,45 (д, J=8,0 Гц, 2H), 7,33 (д, J=8,0 Гц, 2H), 7,21-7,16 (м, 2H), 5,69-5,64 (уш.с, 1H), 4,19 (д, J=2,4 Гц, 3H), 2,84 (д, J=4,4 Гц, 3H), 2,63-2,59 (м, 2H), 1,90-1,85 (м, 2H), 1,55 (д, J=2,8 Гц, 6H), 1,26 (с, 6H), ЖХМС (M+H)+: 497,6.
Синтез 4-{4-[3-(3-хлор-4-циано-2-фторфенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил]фенил}-2,2,N-триметилбутирамида (ПРИМЕР 24)

Смесь соединения 62 (50 мг, 0,19 ммоль) и соединения 3c (55 мг, 0,28 ммоль) в ДМФ (0,7 мл) перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют MeOH (6 мл) и 2н HCl (5 мл). Вторую смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в холодную воду и экстрагируют ДХМ. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Остаток очищают преп-ТСХ с получением указанного в заголовке соединения ПРИМЕРА 24 (45 мг, 51,6%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,62 (д, J=8,4 Гц, 1H), 7,53-7,49 (м, 1H), 7,34 (д, J=8,0 Гц, 2H), 7,19 (д, J=8,0 Гц, 2H), 5,69-5,64 (уш.с, 1H), 2,84 (д, J=4,4 Гц, 3H), 2,63-2,59 (м, 2H), 1,90-1,85 (м, 2H), 1,56 (д, J=2,8 Гц, 6H), 1,26 (с, 6H), ЖХМС (M+H)+: 501,5.
Получение соединения 63

TMSCN (0,34 мл, 2,7 ммоль) добавляют к смеси соединения 61 (200 мг, 0,9 ммоль), циклобутанона (0,4 мл, 5,4 ммоль) и ZnCl2 (10 мг) в 1,4-диоксане (2 мл) при перемешивании. Реакционную смесь перемешивают при КТ в течение 3 ч. Смесь разбавляют H2O и экстрагируют этилацетатом. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют с получением соединения 63 (230 мг, 84,8%) в виде желтого масла. Неочищенный продукт применяют сразу на следующей стадии без очистки.
Синтез 4-{4-[7-(4-циано-2-фтор-3-трифторметилфенил)-8-оксо-6-тиоксо-5,7-диазаспиро[3,4]окт-5-ил]фенил}-2,2,N-триметилбутирамида (ПРИМЕР 25)

Смесь соединения 63 (60 мг, 0,20 ммоль) и соединения 3b (74 мг, 0,30 ммоль) в ДМФ (0,7 мл) перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют MeOH (6 мл) и водн. 2н HCl (5 мл). Вторую смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в холодную воду и экстрагируют ДХМ. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Остаток очищают преп-ТСХ с получением указанного в заголовке соединения ПРИМЕРА 25 (65 мг, 59,4%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,84-7,75 (м, 2H), 7,39 (д, J=8,0 Гц, 2H), 7,21 (д, J=8,0 Гц, 2H), 5,72-5,70 (уш.с, 1H), 2,85 (д, J=3,6 Гц, 3H), 2,66-2,62 (м, 4H), 2,56-2,51 (м, 2H), 2,25-2,18 (м, 1H), 1,93-1,88(м, 2H), 1,67-1,66 (м, 1H), 1,28 (с, 6H), ЖХМС (M+H)+: 547,5.
Синтез 4-{4-[7-(4-циано-2-фтор-3-метоксифенил)-8-оксо-6-тиоксо-5,7-диазаспиро[3,4]окт-5-ил]фенил}-2,2,N-триметилбутирамида (ПРИМЕР 26)

Смесь соединения 63 (60 мг, 0,20 ммоль) и соединения 3a (64 мг, 0,30 ммоль) в ДМФ (0,7 мл) перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют MeOH (6 мл) и водн. 2н HCl (5 мл). Вторую смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в холодную воду и экстрагируют ДХМ. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Остаток очищают преп-ТСХ с получением указанного в заголовке соединения ПРИМЕРА 26 (35 мг, 34,3%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,46 (д, J=8,0 Гц, 1H), 7,38 (д, J=8,0 Гц, 2H) 7,23-7,21 (м, 2H), 7,18-7,16 (м, 1H), 5,68-5,64 (уш.с, 1H), 4,19 (д, J=2,4 Гц, 3H), 2,84 (д, J=4,4 Гц, 3H), 2,66-2,61 (м, 4H), 2,58-2,49 (м, 2H), 2,25-2,18 (м, 1H), 1,92-1,88 (м, 2H), 1,62-2,60 (м, 1H), 1,26 (с, 6H), ЖХМС (M+H)+: 510,7.
Синтез 4-{4-[7-(3-хлор-4-циано-2-фторфенил)-8-оксо-6-тиоксо-5,7-диазаспиро[3,4]окт-5-ил]фенил}-2,2,N-триметилбутирамида (ПРИМЕР 27)

Смесь соединения 63 (60 мг, 0,20 ммоль) и соединения 3c (64 мг, 0,30 ммоль) в ДМФ (0,7 мл) перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют MeOH (6 мл) и водн. 2н HCl (5 мл). Вторую смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в холодную воду и экстрагируют ДХМ. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Остаток очищают преп-ТСХ с получением указанного в заголовке соединения ПРИМЕРА 27 (40 мг, 38,9%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,61 (д, J=8,4 Гц, 1H), 7,52-7,48 (м, 1H), 7,39 (д, J=8,0 Гц, 2H), 7,22 (д, J=8,0 Гц, 2H), 5,69-5,64 (уш.с, 1H), 2,84 (д, J=4,0 Гц, 3H), 2,68-2,65 (м, 4H), 2,60-2,58 (м, 2H), 2,25-2,17 (м, 1H), 1,92-1,88 (м, 2H), 1,66-1,63 (м, 1H), 1,27 (с, 6H), ЖХМС (M+H)+: 513,5.
Синтез соединения ПРИМЕРА 28

Получение диметил 2-(2-фтор-4-нитрофенил)малоната 65
К суспензии NaH (3,8 г, 95 ммоль, 60%) в сухом ДМФ (50 мл) добавляют по каплям диметилмалонат (9,9 мл, 86 ммоль) при 0°С при перемешивании. Смесь перемешивают при0°С в течение 30 мин, затем к смеси добавляют по каплям раствор соединения 64 в ДМФ (100 мл) под N2. Смесь перемешивают при 70°С в течение ночи и затем охлаждают до комнатной температуры. Реакционную смесь гасят насыщенным NH4Cl, и полученное твердое вещество собирают фильтрацией с получением соединения 65 (7,8 г, 67%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 8,07 (дд, 1H, J=8,6, 2,2 Гц), 7,98 (дд, 1H, J=9,3, 2,2 Гц), 7,74 (дд, 1H J=8,6, 7,1 Гц), 5,08 (с, 1H), 3,81 (с, 6H).
Получение метил 4-циано-2-(2-фтор-4-нитрофенил)бутаноата 66
К раствору соединения 65 (3 г, 11 ммоль) и акрилонитрила (3,2 мл, 51 ммоль) в абсолютном CH3OH (50 мл) добавляют каталитическое количество CH3ONa (71 мг, 1,32 ммоль) при комнатной температуре при перемешивании под N2. Смесь перемешивают при комнатной температуре в течение ночи под N2. Смесь разбавляют водн. NaHCO3 и экстрагируют ДХМ. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4, концентрируют и очищают хроматографией на колонке с силикагелем (ПЭ:EtOAc=5:1) с получением соединения 66 (1,9 г, 64%) в виде светло-желтого твердого вещества.
Получение 4-(2-фтор-4-нитрофенил)бутаннитрила 67
Смесь соединения 66 (1,2 г, 4,5 ммоль), NaCl (0,8 г, 13,5 ммоль) и воды (1,4 мл) в ДМСО (30 мл) перемешивают при 160°С в течение 24 ч под N2. После охлаждения смесь разбавляют водой и экстрагируют EtOAc. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4, концентрируют и очищают хроматографией на колонке с силикагелем (ПЭ:EtOAc=5:1) с получением соединения 67 (1,6 г, 43%) в виде желтого масла.
1H ЯМР (400 МГц, CDCl3) δ 7,99-8,04 (м, 1H), 7,91-7,96 (м, 1H), 7,38-7,44 (м, 1H), 2,93 (т, 2H, J=7,5 Гц), 2,41 (т, 2H, J=7,0 Гц), 1,98-2,07 (м, 2H).
Получение 4-(4-амино-2-фторфенил)бутаннитрила 68
Смесь соединения 67 (1,32 г, 6,3 ммоль), NH4Cl (5,08 г, 95 ммоль) и железного порошка (3,52 г, 63 ммоль) в воде (30 мл) и CH3OH (50 мл) перемешивают при 90°С в течение 1 ч. После охлаждения реакционную смесь фильтруют, и твердое вещество промывают ДХМ. Фильтраты отделяют, органический слой промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют досуха с получением соединения 68 (1,07 г, 96%) в виде светло-желтого масла.
1H ЯМР (400 МГц, CDCl3) δ 6,88-6,97 (м, 1H), 6,30-6,44 (м, 1H), 3,65 (уш.с, 2H), 2,67 (т, 2H, J=7,3 Гц), 2,3l (т, 2H, J=7,2 Гц), 1,86-1,96 (м, 2H).
Получение 4-(4-((2-цианопропан-2-ил)амино)-2-фторфенил)бутаннитрила 69.
TMSCN (0,37 мл, 2,78 ммоль) добавляют к смеси соединения 68 (165 мг, 0,93 ммоль), ацетона (0,41 мл, 5,58 ммоль) и ZnCl2 (12 мг, 0,09 ммоль) при перемешивании. Реакционную смесь перемешивают при комнатной температуре в течение 1 ч и концентрируют в вакууме. Остаток разбавляют водой и экстрагируют ДХМ. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют досуха с получением соединения 69 (220 мг, 96%) в виде светло-желтого масла. Неочищенный продукт применяют сразу на следующей стадии без очистки.
1H ЯМР (400 МГц, CDCl3) δ 7,02-7,10 (м, 1H), 6,58-6,65 (м, 2H), 2,72 (т, 2H, J=7,3 Гц), 2,34 (т, 2H, J=7,1 Гц), 1,90-2,00 (м, 2H), 1,71 (с, 6H).
Синтез 4-(3-(4-(3-цианопропил)-3-фторфенил)-4,4-диметил-5-оксо-2-тиоксоимидазолидин-1-ил)-3-фтор-2-(трифторметил)бензонитрила (ПРИМЕР 28)

Соединение ПРИМЕРА синтезируют реакцией между соединением 3b и соединением 69 по методике синтеза ПРИМЕРА 15. Соединение ПРИМЕРА 28 получают с 31% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,75-7,85 (м, 2H), 7,36-7,42 (м, 1H), 7,02-7,11 (м, 2H), 2,90 (т, 2H, J=7,6 Гц), 2,43 (т, 2H, J=7,4 Гц), 2,00-2,10 (м, 2H), 1,60 (д, 6H, J=3,9 Гц), ЖХМС (M+H)+: 493,4.
Синтез 2-хлор-4-(3-(4-(3-цианопропил)-3-фторфенил)-4,4-диметил-5-оксо-2-тиоксоимидазолидин-1-ил)-3-фторбензонитрила (ПРИМЕР 29)

Соединение ПРИМЕРА синтезируют реакцией между соединением 3c и соединением 69 по методике синтеза ПРИМЕРА 15. Соединение ПРИМЕРА 29 получают с 27% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,60-7,65 (м, 1H), 7,47-7,53 (м, 1H), 7,36-7,42 (м, 1H), 7,02-7,11 (м, 2H), 2,90 (т, 2H, J=7,6 Гц), 2,43 (т, 2H, J=7,0 Гц), 2,00-2,10 (м, 2H), 1,60 (д, 6H, J=5,1 Гц), ЖХМС (M+H)+: 459,4.
Синтез 4-(3-(4-(3-цианопропил)-3-фторфенил)-4,4-диметил-5-оксо-2-тиоксоимидазолидин-1-ил)-3-фтор-2-метоксибензонитрила (ПРИМЕР 30)

Соединение ПРИМЕРА синтезируют реакцией между соединением 3a и соединением 69 по методике синтеза ПРИМЕРА 15. Соединение ПРИМЕРА 30 получают с 55% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,45-7,50 (м, 1H), 7,35-7,40 (м, 1H), 7,14-7,20 (м, 1H), 7,02-7,11 (м, 2H), 4,20 (с, 3H), 2,90 (т, 2H, J=7,5 Гц), 2,43 (т, 2H, J=7,0 Гц), 2,00-2,10 (м, 2H), 1,60 (д, 6H, J=4,3 Гц), ЖХМС (M+H)+: 455,5.
Синтез соединения ПРИМЕРА 31

Получение 4-(4-((2-цианопропан-2-ил)амино)-2-фторфенил)бутаннитрила 70
TMSCN (0,14 мл, 1,01 ммоль) добавляют к смеси соединения 68 (60 мг, 0,34 ммоль), циклобутанона (0,15 мл, 2,04 ммоль) и ZnCl2 (4 мг, 0,04 ммоль) в диоксане (1 мл) при перемешивании. Реакционную смесь перемешивают при комнатной температуре в течение 1 ч и концентрируют в вакууме. Остаток разбавляют водой и экстрагируют ДХМ. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют досуха с получением соединения 70 (80 мг, 91%) в виде светло-желтого масла. Неочищенный продукт применяют сразу на следующей стадии без очистки.
Синтез 4-(5-(4-(3-цианопропил)-3-фторфенил)-8-оксо-6-тиоксо-5,7-диазаспиро[3,4]октан-7-ил)-3-фтор-2-(трифторметил)бензонитрила (ПРИМЕР 31)
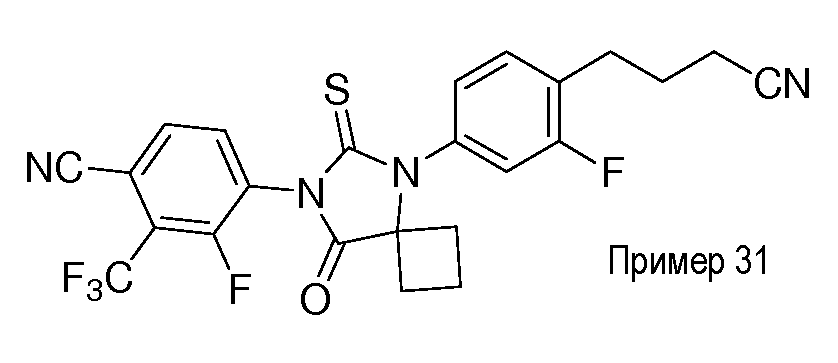
Соединение ПРИМЕРА 31 синтезируют реакцией между соединением 3b и соединением 70 по методике синтеза ПРИМЕРА 15. Соединение ПРИМЕРА 31 получают с 44% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,75-7,85 (м, 2H), 7,40-7,46 (м, 1H), 7,05-7,14 (м, 2H), 2,90 (т, 2H, J=7,5 Гц), 2,62-2,72 (м, 2H), 2,50-2,62 (м, 2H), 2,43 (т, 2H, J=7,0 Гц), 2,20-2,30 (м, 1H), 2,00-2,10 (м, 2H), 1,65-1,75 (м, 1H), ЖХМС (M+H)+: 505,5.
Синтез 4-(5-(4-(3-цианопропил)-3-фторфенил)-8-оксо-6-тиоксо-5,7-диазаспиро[3,4]октан-7-ил)-3-фтор-2-метоксибензонитрила (ПРИМЕР 32)

Соединение ПРИМЕРА 32 синтезируют реакцией между соединением 3a и соединением 70 по методике синтеза ПРИМЕРА 15. Соединение ПРИМЕРА 32 получают с 28% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,40-7,50 (м, 2H), 7,14-7,20 (м, 1H), 7,06-7,13 (м, 2H), 4,20 (д, 3H, J=2,3 Гц), 2,90 (т, 2H, J=7,5 Гц), 2,62-2,72 (м, 2H), 2,50-2,62 (м, 2H), 2,43 (т, 2H, J=7,0 Гц), 2,20-2,30 (м, 1H), 2,00-2,10 (м, 2H), 1,65-1,75 (м, 1H), ЖХМС (M+H)+: 467,5.
Синтез 2-хлор-4-(5-(4-(3-цианопропил)-3-фторфенил)-8-оксо-6-тиоксо-5,7-диазаспиро[3,4]октан-7-ил)-3-фторбензонитрила (ПРИМЕР 33)

Соединение ПРИМЕРА 33 синтезируют реакцией между соединением 3c и соединением 70 по методике синтеза ПРИМЕРА 15. Соединение ПРИМЕРА 33 получают с 45% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,60-7,65 (м, 1H), 7,47-7,53 (м, 1H), 7,40-7,46 (м, 1H), 7,05-7,14 (м, 2H), 2,92 (т, 2H, J=7,5 Гц), 2,62-2,72 (м, 2H), 2,50-2,62 (м, 2H), 2,43 (т, 2H, J=7,0 Гц), 2,20-2,30 (м, 1H), 2,00-2,10 (м, 2H), 1,65-1,75 (м, 1H), ЖХМС (M+H)+: 471,3.
Синтез соединения 71

Получение соединения 71b
Смесь диметилциклобутан-1,1-дикарбоксилата (5 г, 29 ммоль) в CH2Cl2 (120 мл) охлаждают до -78°C под защитой N2, затем DIBALH (58 мл, 1M, 58 ммоль) добавляют по каплям, сохраняя температуру ниже -65°C. После добавления смесь перемешивают в течение 2 часов. Реакционную смесь гасят 1н HCl (50мл). Отделяют и сушат, удаляют растворитель с получением неочищенного продукта 71b (3 г, выход 50%) для следующих стадий без очистки.
Синтез соединения 71d
Смесь диэтил 4-нитробензилфосфоната (2,5 г, 9,16 ммоль) в ТГФ (50мл) охлаждают до 0°C, затем осторожно добавляют NaH (0,73 г, 18,3 ммоль), и смесь перемешивают в течение 10 минут. Соединение 71b (3 г, 21 ммоль) добавляют по каплям в ТГФ (10 мл). После добавления смесь нагревают до к.т. и перемешивают в течение 1 часа при к.т. Реакционную смесь гасят 1н HCl (40 мл). Смесь экстрагируют ЭА (100 мл ×2). Сушат и удаляют ЭА с получением неочищенного продукта. Неочищенный продукт очищают флэш-хроматографией (силикагель, ПЭ:ЭА=8:1) с получением соединения 71d (1,6 г, выход 70%) в виде белого твердого вещества.
Получение соединения 71e
Соединение 71e получают из соединения 71d по методике синтеза соединения 61e.
Получение соединения 71f
Соединение 71f получают из соединения 71e по методике синтеза соединения 61f.
Получение соединения 71g
Соединение 71g получают из соединения 71f по методике синтеза соединения 61g.
Получение соединения 71
Соединение 71 получают из соединения 71g по методике синтеза соединения 61.
Получение соединения 72

TMSCN (0,17 мл, 1,29 ммоль) добавляют к смеси соединения 71 (100 мг, 0,43 ммоль), ацетона (0,5 мл, 5,40 ммоль) и ZnCl2 (10 мг) при перемешивании. Реакционную смесь перемешивают при КТ в течение 3 ч. Смесь разбавляют H2O и экстрагируют этилацетатом. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют с получением соединения 72 (120 мг, 93,1%). Неочищенный продукт применяют сразу на следующей стадии без очистки.
Синтез метиламида 1-(2-{4-[3-(4-циано-2-фтор-3-трифторметилфенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил]фенил}этил)циклобутанкарбоновой кислоты (ПРИМЕР 34)

Смесь соединения 72 (50 мг, 0,17 ммоль) и соединения 3b (61 мг, 0,25 ммоль) в ДМФ (0,7 мл) перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют MeOH (6 мл) и водн. 2н HCl (5 мл). Вторую смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в холодную воду и экстрагируют ДХМ. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Остаток очищают преп-ТСХ с получением указанного в заголовке соединения ПРИМЕРА 34 (25 мг, 27,4%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,82-7,76 (м, 2H), 7,35 (д, J=8,0 Гц, 2H), 7,21 (д, J=8,0 Гц, 2H), 5,49-5,00 (уш.с, 1H), 3,49 (с, 3H), 2,86-2,85 (м, 2H), 2,62-2,57 (м, 2H), 2,40-2,36 (м, 2H), 2,13-2,08 (м, 3H), 1,99-1,86 (м, 1H), 1,59 (д, J=8,0 Гц, 6H), ЖХМС (M+H)+: 547,8.
Получение соединения 73

TMSCN (0,16 мл, 1,29 ммоль) добавляют к смеси соединения 71 (100 мг, 0,43 ммоль), циклобутанона (0,2 мл, 2,58 ммоль) и ZnCl2 (20 мг) в 1,4-диоксане (2 мл) при перемешивании. Реакционную смесь перемешивают при КТ в течение 3 ч. Смесь разбавляют H2O и экстрагируют этилацетатом. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют с получением соединения 73 (120 мг, 89,5%). Неочищенный продукт применяют сразу на следующей стадии без очистки.
Синтез метиламида 1-(2-{4-[7-(4-циано-2-фтор-3-трифторметилфенил)-8-оксо-6-тиоксо-5,7-диазаспиро[3,4]окт-5-ил]фенил}этил)циклобутанкарбоновой кислоты (ПРИМЕР 35)

Смесь соединения 73 (50 мг, 0,16 ммоль) и соединения 3b (60 мг, 0,24 ммоль) в ДМФ (0,7 мл) перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют MeOH (6 мл) и водн. 2н HCl (5 мл). Вторую смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в холодную воду и экстрагируют ДХМ. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Остаток очищают преп-ТСХ с получением указанного в заголовке соединения ПРИМЕРА 35 (39 мг, 39,0%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,84-7,75 (м, 2H), 7,39 (д, J=8,0 Гц, 2H), 7,23 (д, J=8,0 Гц, 2H), 5,51-5,49 (уш.с, 1H), 2,86 (д, J=4,8 Гц, 3H), 2,65-2,61 (м, 6H), 2,40-2,39 (м, 2H), 2,26-2,11 (м, 3H), 1,89-1,86 (м, 4H), 1,67-1,63 (м, 1H).
Синтез соединения ПРИМЕРА 36

Получение диметил 2-(5-нитропиридин-2-ил)малоната 75
К суспензии NaH (5,2 г, 129 ммоль, 60%) в сухом ДМФ (50 мл) добавляют по каплям диметилмалонат (14 мл, 122 ммоль) при 0°С при перемешивании. Смесь перемешивают при 0°С в течение 30 мин, затем к смеси добавляют по каплям раствор соединения 74 (9,6 г, 61 ммоль) в ДМФ (100 мл) под N2. Смесь перемешивают при 70°С в течение ночи и затем охлаждают до комнатной температуры. Реакционную смесь гасят насыщенным NH4Cl, и полученное твердое вещество собирают фильтрацией с получением соединения 75 (10,5 г, 68%) в виде белого твердого вещества.
Получение диметил 2-(2-цианоэтил)-2-(5-нитропиридин-2-ил)малоната 76
К раствору соединения 75 (10,5 г, 41 ммоль) и акрилонитрила (17,4 г, 328 ммоль) в абсолютном CH3OH (100 мл) добавляют каталитическое количество CH3ONa (216 мг, 4 ммоль) при комнатной температуре при перемешивании под N2. Смесь перемешивают при комнатной температуре в течение 10 ч под N2. Смесь разбавляют водн. NaHCO3 и экстрагируют ДХМ. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4, концентрируют и очищают хроматографией на колонке с силикагелем (ПЭ:EtOAc=5:1) с получением соединения 76 (3,3 г, 20%) в виде светло-желтого масла.
Получение 4-(5-нитропиридин-2-ил)бутаннитрила 77
К раствору соединения 76 (3,3 г, 10,7 ммоль) в CH3OH (100 мл) добавляют раствор LiOH (15,4 г, 64,2 ммоль) в H2O (100 мл) при комнатной температуре при перемешивании. Смесь перемешивают при комнатной температуре в течение 2 ч. Метанол удаляют в вакууме, и остаточный водный раствор промывают EtOAc (два раза), затем подкисляют до pH=2 добавлением 1н HCl. Водную фазу экстрагируют EtOAc. Объединенный органический экстракт сушат над Na2SO4, затем перемешивают при 50°С в течение ночи. Раствор концентрируют с получением соединения 77 (1,9 г, 95%) в виде желтого масла.
Получение 4-(5-аминопиридин-2-ил)бутаннитрила 78
Смесь соединения 77 (158 мг, 0,83 ммоль), NH4Cl (666 мг, 12 ммоль) и железного порошка (463 мг, 8,3 ммоль) в воде (5 мл) и CH3OH (5 мл) перемешивают при 90°С в течение 1 ч. После охлаждения реакционную смесь фильтруют, и твердое вещество промывают ДХМ. Фильтраты отделяют, органический слой промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют досуха с получением соединения 78 (100 мг, 75%) в виде светло-желтого масла.
1H ЯМР (400 МГц, CDCl3) δ 8,04 (с, 1H), 6,90-7,00 (м, 2H), 3,53 (уш.с, 2H), 2,83 (т, 2H, J=7,1 Гц), 2,36 (т, 2H, J=7,1 Гц), 2,02-2,12 (м, 2H).
Получение 4-(5-((2-цианопропан-2-ил)амино)пиридин-2-ил)бутаннитрила 79
TMSCN (0,24 мл, 1,8 ммоль) добавляют к смеси соединения 78 (100 мг, 0,6 ммоль), ацетона (0,27 мл, 3,6 ммоль) и ZnCl2 (10 мг, 0,08 ммоль) при перемешивании. Реакционную смесь перемешивают при комнатной температуре в течение 1 ч и концентрируют в вакууме. Остаток разбавляют водой и экстрагируют ДХМ. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют досуха с получением соединения 79 (140 мг, 98%) в виде светло-желтого масла. Неочищенный продукт применяют сразу на следующей стадии без очистки.
1H ЯМР (400 МГц, CDCl3) δ 8,12 (с, 1H), 7,20-7,25 (м, 1H), 7,00-7,06 (м, 1H), 2,81 (т, 2H, J=7,1 Гц), 2,32 (т, 2H, J=7,1 Гц), 1,98-2,12 (м, 2H), 1,69 (с, 6H).
Синтез 4-(3-(6-(3-цианопропил)пиридин-3-ил)-4,4-диметил-5-оксо-2-тиоксоимидазолидин-1-ил)-3-фтор-2-(трифторметил)бензонитрила (ПРИМЕР 36)

Соединение ПРИМЕРА 36 синтезируют реакцией между соединением 3b и соединением 79 по методике синтеза ПРИМЕРА 15. Соединение ПРИМЕРА 36 получают с 35% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 8,49-8,55 (м, 1H), 7,77-7,86 (м, 2H), 7,62-7,68 (м, 1H), 7,38-7,44 (м, 1H), 3,09 (т, 2H, J=7,1 Гц), 2,50 (т, 2H, J=5,8 Гц), 2,18-2,27 (м, 2H), 1,61 (с, 6H), ЖХМС (M+H)+: 476,0.
Синтез 2-хлор-4-(3-(6-(3-цианопропил)пиридин-3-ил)-4,4-диметил-5-оксо-2-тиоксоимидазолидин-1-ил)-3-фторбензонитрила (ПРИМЕР 37)

Соединение ПРИМЕРА 37 синтезируют реакцией между соединением 3c и соединением 79 по методике синтеза ПРИМЕРА 15. Соединение ПРИМЕРА 37 получают с 38% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 8,49-8,55 (м, 1H), 7,62-7,72 (м, 2H), 7,48-7,54 (м, 1H), 7,40-7,45 (м, 1H), 3,09 (т, 2H, J=7,1 Гц), 2,50 (т, 2H, J=6,7 Гц), 2,18-2,27 (м, 2H), 1,61 (с, 6H), ЖХМС (M+H)+: 442,6.
Получение соединения 3e

Соединение 3e получают из коммерчески доступного 4-амино-2-трифторметилбензонитрила по методике синтеза соединения 3b.
Синтез 4-(3-(6-(3-цианопропил)пиридин-3-ил)-4,4-диметил-5-оксо-2-тиоксоимидазолидин-1-ил)-2-(трифторметил)бензонитрила (ПРИМЕР 38)

Соединение ПРИМЕРА 38 синтезируют реакцией между соединением 3e и соединением 79 по методике синтеза ПРИМЕРА 15. Соединение ПРИМЕРА 38 получают с 34% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 8,49-8,55 (м, 1H), 7,94-8,02 (м, 2H), 7,80-7,86 (м, 1H), 7,62-7,72 (м, 1H), 7,48-7,54 (м, 1H), 3,12 (т, 2H, J=7,1 Гц), 2,52 (т, 2H, J=6,7 Гц), 2,18-2,27 (м, 2H), 1,60 (с, 6H), ЖХМС (M+H)+: 458,5.
Синтез 4-(3-(6-(3-цианопропил)пиридин-3-ил)-4,4-диметил-5-оксо-2-тиоксоимидазолидин-1-ил)-3-фтор-2-метоксибензонитрила (ПРИМЕР 39)

Соединение ПРИМЕРА 39 синтезируют реакцией между соединением 3a и соединением 79 по методике синтеза ПРИМЕРА 15. Соединение ПРИМЕРА 39 получают с 30% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 8,49-8,55 (м, 1H), 7,62-7,72 (м, 1H), 7,48-7,54 (м, 1H), 7,38-7,45 (м, 1H), 7,15-7,20 (м, 1H), 4,20 (д, 3H, J=2,9 Гц), 3,09 (т, 2H, J=7,1 Гц), 2,50 (т, 2H, J=6,9 Гц), 2,18-2,27 (м, 2H), 1,60 (д, 6H, J=6,9 Гц), ЖХМС (M+H)+: 438,1.
Синтез соединения ПРИМЕРА 40

Получение 4-(4-нитрофенил)бутанамида 81
К раствору соединения 80 (5 г, 22,4 ммоль) в CH3OH (200 мл) добавляют NH4OH (300 мл) при комнатной температуре при перемешивании. Реакционную смесь перемешивают при комнатной температуре в течение 24 ч и концентрируют в вакууме. Остаток экстрагируют ДХМ/CH3OH (10:1). Объединенные органические слои сушат над Na2SO4 и концентрируют досуха с получением соединения 81 (3,1 г, 66%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 8,16 (д, 2H, J=8,1 Гц), 7,35 (д, 2H, J=8,1 Гц), 5,40 (уш.с, 2H), 2,80 (т, 2H, J=7,7 Гц), 2,25 (т, 2H, J=7,3 Гц), 1,97-2,07 (м, 2H).
Получение 4-(4-нитрофенил)бутаннитрила 82
К раствору соединения 81 (3,2 г, 22,4 ммоль) в ДХМ (60 мл) добавляют ТЭА (10 мл, 77 ммоль) при комнатной температуре при перемешивании. Затем к смеси добавляют по каплям TFAA (4 мл, 30,8 ммоль) при 0°С. Реакционную смесь перемешивают при комнатной температуре в течение 4 ч. Затем смесь разбавляют ДХМ, промывают водой и насыщенным раствором соли, сушат над Na2SO4 и концентрируют досуха с получением соединения 82 (2,7 г, 93%) в виде желтого масла.
1H ЯМР (400 МГц, CDCl3) δ 8,12 (д, 2H, J=8,1 Гц), 7,30 (д, 2H, J=8,1 Гц), 2,85 (т, 2H, J=7,5 Гц), 2,31 (т, 2H, J=7,3 Гц), 1,92-2,05(м, 2H).
Получение 4-(4-аминофенил)бутаннитрила 83
Смесь соединения 82 (2,67 г, 14 ммоль), NH4Cl (11,2 г, 210 ммоль) и железного порошка (7,8 г, 140 ммоль) в воде (90 мл) и CH3OH (90 мл) перемешивают при 90°С в течение 1 ч. После охлаждения реакционную смесь фильтруют, и твердое вещество промывают ДХМ. Фильтраты отделяют, и органический слой промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют досуха с получением соединения 83 (1,85 г, 83%) в виде светло-желтого масла.
1H ЯМР (400 МГц, CDCl3) δ 6,90 (д, 2H, J=8,1 Гц), 6,58 (д, 2H, J=8,1 Гц), 3,30 (уш.с, 2H), 2,59 (т, 2H, J=7,4 Гц), 2,22 (т, 2H, J=7,4 Гц), 1,80-1,90 (м, 2H).
Получение 4-(4-((2-цианопропан-2-ил)амино)фенил)бутаннитрила 84
TMSCN (0,3 мл, 2,25 ммоль) добавляют к смеси соединения 83 (120 мг, 0,75 ммоль), ацетона (0,33 мл, 4,5 ммоль) и ZnCl2 (10 мг, 0,08 ммоль) при перемешивании. Реакционную смесь перемешивают при комнатной температуре в течение 1 ч и концентрируют в вакууме. Остаток разбавляют водой и экстрагируют ДХМ. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют досуха с получением соединения 84 (170 мг, 99%) в виде светло-желтого масла. Неочищенный продукт применяют сразу на следующей стадии без очистки.
1H ЯМР (400 МГц, CDCl3) δ 7,08 (д, 2H, J=8,1 Гц), 6,88 (д, 2H, J=8,1 Гц), 2,72 (т, 2H, J=7,4 Гц), 2,32 (т, 2H, J=7,4 Гц), 1,90-2,00 (м, 2H), 1,69 (с, 6H).
Синтез 4-(3-(4-(3-цианопропил)фенил)-4,4-диметил-5-оксо-2-тиоксоимидазолидин-1-ил)-3-фтор-2-(трифторметил)бензонитрила (ПРИМЕР 40)

Соединение ПРИМЕРА 40 синтезируют реакцией между соединением 3b и соединением 84 по методике синтеза ПРИМЕРА 15. Соединение ПРИМЕРА 40 получают с 16% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,75-7,85 (м, 2H), 7,37 (д, 2H, J=8,2 Гц), 7,26 (д, 2H, J=8,2 Гц), 2,87 (т, 2H, J=7,5 Гц), 2,40 (т, 2H, J=7,0 Гц), 2,00-2,08 (м, 2H), 1,58 (д, 6H, J=4,2 Гц), ЖХМС (M+H)+: 475,8.
Синтез 2-хлор-4-(3-(4-(3-цианопропил)фенил)-4,4-диметил-5-оксо-2-тиоксоимидазолидин-1-ил)-3-фторбензонитрила (ПРИМЕР 41)

Соединение ПРИМЕРА 41 синтезируют реакцией между соединением 3c и соединением 84 по методике синтеза ПРИМЕРА 15. Соединение ПРИМЕРА 41 получают с 43% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,62-7,65 (м, 1H), 7,48-7,54 (м, 1H), 7,37 (д, 2H, J=8,2 Гц), 7,26 (д, 2H, J=8,2 Гц), 2,87 (т, 2H, J=7,5 Гц), 2,40 (т, 2H, J=7,0 Гц), 2,00-2,08 (м, 2H), 1,58 (д, 6H, J=5,2 Гц), ЖХМС (M+H)+: 441,2.
Синтез соединения ПРИМЕРА 42

Получение 1-((4-(3-цианопропил)фенил)амино)циклобутанкарбонитрила 85
Соединение 85 получают из соединения 83 по методике синтеза соединения 84.
1H ЯМР (400 МГц, CDCl3) δ 7,06 (д, 2H, J=8,1 Гц), 6,61 (д, 2H, J=8,1 Гц), 3,09 (т, 2H, J=7,4 Гц), 2,75-2,85 (м, 2H), 2,65-2,73 (м, 2H), 2,42 (т, 2H, J=7,0 Гц), 2,20-2,30 (м, 1H), 2,00-2,10 (м, 2H), 1,65-1,72 (м, 1H).
Синтез 4-(5-(4-(3-цианопропил)фенил)-8-оксо-6-тиоксо-5,7-диазаспиро[3,4]октан-7-ил)-3-фтор-2-(трифторметил)бензонитрила (ПРИМЕР 42)

Соединение ПРИМЕРА 42 синтезируют реакцией между соединением 3b и соединением 85 по методике синтеза ПРИМЕРА 15. Соединение ПРИМЕРА 42 получают с 21% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,75-7,85 (м, 2Н), 7,42 (д, 2Н, J=8,2 Гц), 7,28 (д, 2H, J=8,2 Гц), 2,90 (т, 2H, J=7,4 Гц), 2,62-2,70 (м, 2H), 2,50-2,60 (м, 2H), 2,42 (т, 2H, J=7,0 Гц), 2,20-2,30 (м, 1H), 2,00-2,10 (м, 2H), 1,65-1,72 (м, 1H), ЖХМС (M+H)+: 488,4.
Синтез 2-хлор-4-(5-(4-(3-цианопропил)фенил)-8-оксо-6-тиоксо-5,7-диазаспиро[3,4]октан-7-ил)-3-фторбензонитрила (ПРИМЕР 43)

Соединение ПРИМЕРА 43 синтезируют реакцией между соединением 3c и соединением 85 по методике синтеза ПРИМЕРА 15. Соединение ПРИМЕРА 43 получают с 35% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,62-7,65 (м, 1H), 7,48-7,54 (м, 1H), 7,42 (д, 2H, J=8,2 Гц), 7,28 (д, 2H, J=8,2 Гц), 2,90 (т, 2H, J=7,4 Гц), 2,62-2,70 (м, 2H), 2,50-2,60 (м, 2H), 2,42 (т, 2H, J=7,0 Гц), 2,20-2,30 (м, 1H), 2,00-2,10 (м, 2H), 1,65-1,72 (м, 1H), ЖХМС (M+H)+: 452,3.
Синтез соединений ПРИМЕРА 44, ПРИМЕРА 46

Получение соединения 65

К суспензии NaH (3,8 г, 95 ммоль, 60%) в сухом ДМФ (50 мл) добавляют по каплям диметилмалонат (87, 9,9 мл, 86 ммоль) при 0°С при перемешивании. Смесь перемешивают при 0°С в течение 30 мин и затем к смеси добавляют по каплям раствор соединения 86 в ДМФ (100 мл) под N2. Смесь перемешивают при 70°С в течение ночи и затем охлаждают до КТ. Реакционную смесь гасят насыщенным NH4Cl, и полученное твердое вещество собирают фильтрацией с получением соединения 65 (7,8 г, 67%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 8,07 (дд, J=8,6, 2,2 Гц, 1H), 7,98 (дд, J=9,3, 2,2 Гц, 1H), 7,74 (дд, J=8,6, 7,2 Гц, 1H), 5,08 (с, 1H), 3,81 (с, 6H).
Получение соединений 88 и 89
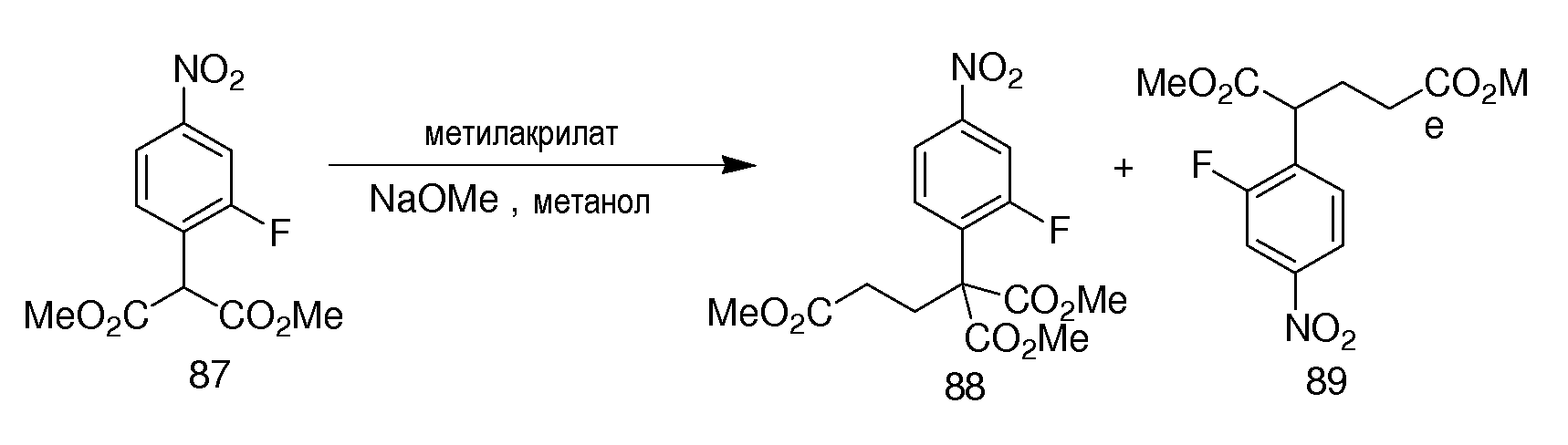
К раствору соединения 65 (4,84 г, 17,8 ммоль) и метилакрилата (13,4 мл, 147,6 ммоль) в абсолютном CH3OH (60 мл) добавляют каталитическое количество CH3ONa (149 мг, 2,76 ммоль) при КТ при перемешивании под N2. Смесь перемешивают при КТ в течение ночи под N2. Смесь разбавляют водн. NaHCO3 и экстрагируют ДХМ. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют с получением смеси соединения 88 и соединения 89 (4,75 г). Неочищенный продукт применяют сразу на следующей стадии без дальнейшей очистки.
Получение соединения 90

Смесь соединения 88 и соединения 89 (4,75 г), NaCl (2,73 г, 47,1 ммоль) и воды (3,7 мл) в ДМСО (70 мл) перемешивают при 155°С в течение 24 ч под N2. После охлаждения смесь разбавляют водой и экстрагируют EtOAc. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4, концентрируют и очищают хроматографией на колонке с силикагелем (ПЭ:ЭА=5:1) с получением указанного в заголовке соединения 90 (2,1 г, 65,6%) в виде желтого масла.
1H ЯМР (400 МГц, CDCl3) δ 7,98-7,95 (м, 1H), 7,90-7,87 (м, 1H), 7,39-7,35 (м, 1H), 3,67 (с, 3H), 2,80-2,75 (м, 2H), 2,38-2,34 (м, 2H), 2,02-1,95 (м, 2H).
Получение соединения 91
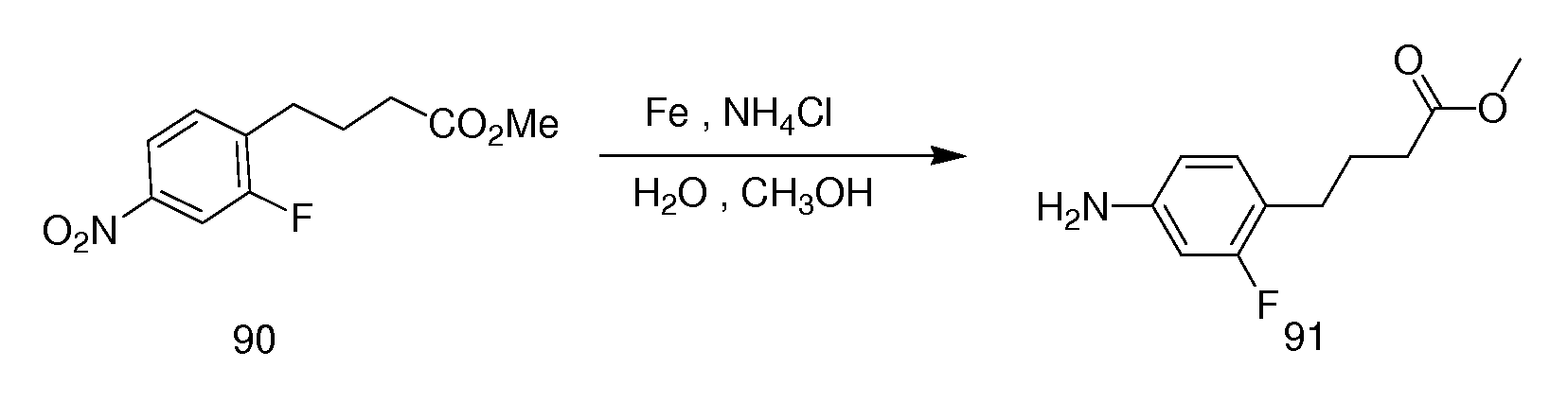
Смесь соединения 90 (1,7 г, 7,0 ммоль), NH4Cl (6,3 г, 118 ммоль) и Fe (4,22 г, 75 ммоль) в воде (40 мл) и CH3OH (50 мл) перемешивают при 90°С в течение 1 ч. После охлаждения реакционную смесь фильтруют и твердое вещество промывают ДХМ. Фильтраты отделяют, органический слой промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют с получением соединения 91 (1,21 г, 81,2%) в виде светло-желтого масла.
1H ЯМР (400 МГц, CDCl3) δ 6,96-6,92 (м, 1H), 6,41-6,35 (м, 2H), 3,68 (с, 3H), 2,60-2,56 (м, 2H), 2,36-2,32 (м, 2H), 1,93-1,89 (м, 2H).
Получение соединения 92

К раствору соединения 91 (812 мг, 3,84 ммоль) в CH3NH2/MeOH (70 мл) перемешивают при комнатной температуре в течение 72 ч. После удаления основной части MeOH, остаток разбавляют H2O и экстрагируют ДХМ. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют с получением соединения 92 (700 мг, 87,3%) в виде белого твердого вещества. Неочищенный продукт применяют сразу на следующей стадии без дальнейшей очистки.
1H ЯМР (400 МГц, CDCl3) δ 6,95-6,93 (м, 1H), 6,42-6,35 (м, 2H), 2,81 (д, J=4,8 Гц, 3H), 2,60-2,56 (м, 2H), 2,20-2,16 (м, 2H), 2,00-1,90 (м, 2H).
Получение соединения 93
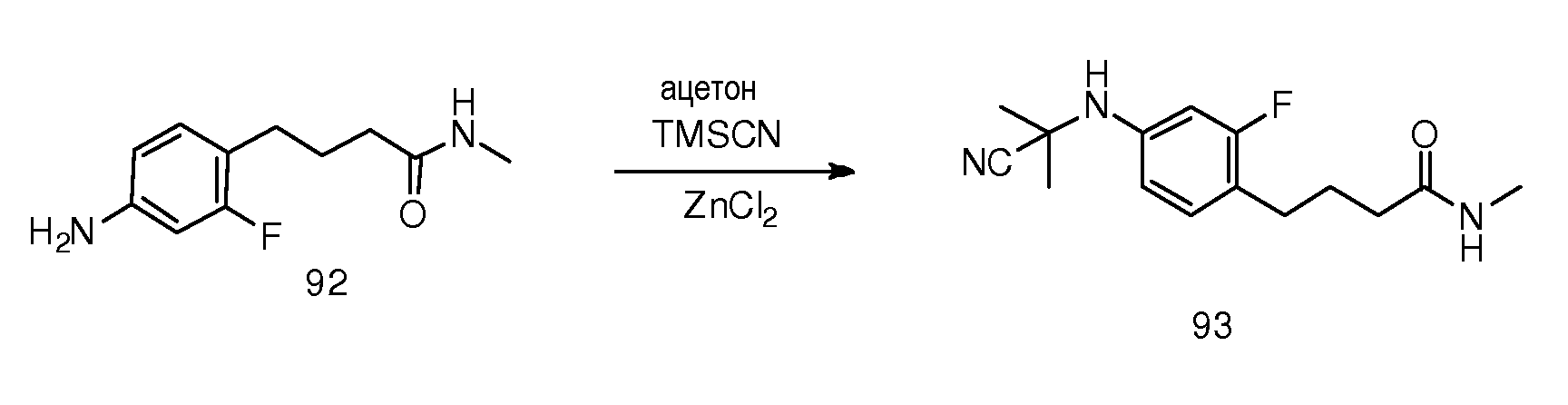
TMSCN (0,15 мл, 1,14 ммоль) добавляют к смеси соединения 92 (80 мг, 0,38 ммоль), ацетона (0,50 мл) и ZnCl2 (10 мг) при перемешивании. Реакционную смесь перемешивают при КТ в течение 3 ч. Смесь разбавляют H2O и экстрагируют этилацетатом. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют с получением соединения 93 (100 мг, 97,6%) в виде масла. Неочищенный продукт применяют сразу на следующей стадии без очистки.
Синтез 4-{4-[3-(4-циано-2-фтор-3-трифторметилфенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил]-2-фторфенил}-N-метилбутирамида (ПРИМЕР 44)

Смесь соединения 93 (50 мг, 0,18 ммоль) и соединения 3b (67 мг, 0,27 ммоль) в ДМФ (0,7 мл) перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют MeOH (6 мл) и водн. 2н HCl (5 мл). Вторую смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в холодную воду и экстрагируют ДХМ. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Остаток очищают преп-ТСХ с получением указанного в заголовке соединения ПРИМЕРА 44 (20 мг, 21,8%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,84-7,77 (м, 2H), 7,40-7,36 (м, 1H), 7,05-6,99 (м, 2H), 2,82 (д, J=4,4 Гц, 3H), 2,76-2,74 (м, 2H), 2,27-2,23 (м, 2H), 2,05-1,98 (м, 2H), 1,60 (д, J=4,4 Гц, 6H), ЖХМС (M+H)+: 525,2.
Синтез 4-(4-(3-(4-циано-2-фтор-5-(трифторметил)фенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил)-2-фторфенил)-N-метилбутанамида (ПРИМЕР 45)
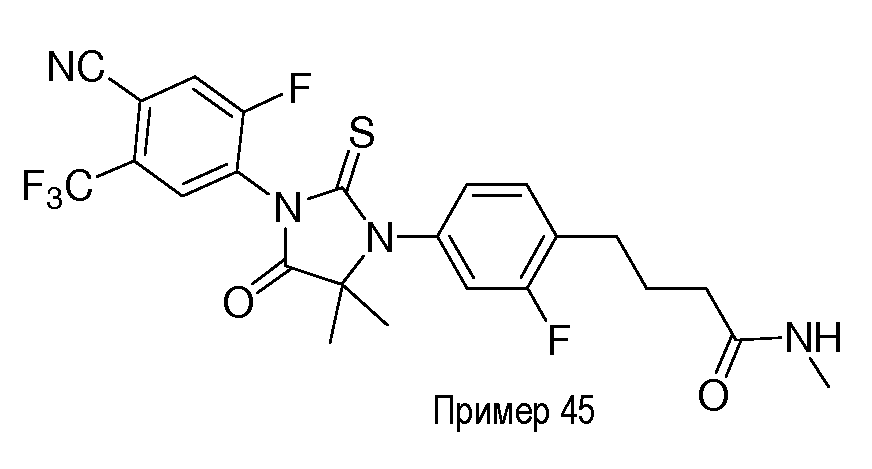
Соединение ПРИМЕРА 45 синтезируют реакцией между соединением 3d и соединением 93 по методике синтеза ПРИМЕРА 15. Соединение ПРИМЕРА 45 получают с 20% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,93 (д, 1H J=6,4 Гц), 7,73 (д, 1H J=8,3 Гц), 7,35-7,42 (м, 1H), 6,98-7,08 (м, 2H), 5,39 (уш.с, 1H), 2,82 (д, 3H, J=4,3 Гц), 2,76 (т, 2H, J=7,3 Гц), 2,25 (т, 2H, J=7,3 Гц), 1,97-2,09 (м, 2H), 1,59 (д, 6H, J=5,3 Гц), ЖХМС (M+H)+: 525,4.
Получение соединения 94

TMSCN (0,27 мл, 2,14 ммоль) добавляют к смеси соединения 92 (150 мг, 0,71 ммоль), циклобутанона (0,32 мл, 4,28 ммоль) и ZnCl2 (20 мг) в 1,4-диоксане (2 мл) при перемешивании. Реакционную смесь перемешивают при КТ в течение 3 ч. Смесь разбавляют водн. Na2SO3 и экстрагируют этилацетатом. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют с получением соединения 94 (200 мг, 96,8%) в виде масла. Неочищенный продукт применяют сразу на следующей стадии без очистки.
Синтез 4-{4-[7-(4-циано-2-фтор-3-трифторметилфенил)-8-оксо-6-тиоксо-5,7-диазаспиро[3,4]окт-5-ил]-2-фторфенил}-N-метилбутирамид (ПРИМЕР 46)

Смесь соединения 94 (100 мг, 0,35 ммоль) и соединения 3b (127 мг, 0,52 ммоль) в ДМФ (1,0 мл) перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют MeOH (6 мл) и водн. 2н HCl (5 мл). Вторую смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в холодную воду и экстрагируют ДХМ. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Остаток очищают преп-ТСХ с получением указанного в заголовке соединения ПРИМЕРА 46 (20 мг, 11,8%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,83-7,76 (м, 2H), 7,45-7,41 (м, 1H), 7,07-7,02 (м, 2H), 5,45-5,42 (уш.с, 1H), 2,83 (д, J=3,6 Гц, 3H), 2,80-2,76 (м, 2H), 2,67-2,65 (м, 2H), 2,58-2,50 (м, 2H), 2,28-2,23 (м, 3H), 2,06-2,02 (м, 2H), 1,73-1,69 (м, 1H).
Синтез соединений ПРИМЕРОВ 47-48

Получение 4-(2-фтор-4-нитрофенил)бутановой кислоты 95

К раствору соединения 90 (511 мг, 2,12 ммоль) в MeOH (13 мл) добавляют раствор NaOH (2,1 г, 52,5 ммоль) в H2O (35 мл). Реакционную смесь перемешивают при комнатной температуре в течение 5 ч. Метанол удаляют в вакууме, и остаточный водный раствор промывают EtOAc (два раза), затем подкисляют до pH=2 добавлением 1н HCl. Водную фазу экстрагируют ДХМ. Объединенный органический экстракт сушат над Na2SO4 и концентрируют с получением соединения 95 (436 мг, 91%) в виде светло-желтого твердого вещества.
Получение соединения 96

Смесь соединения 95 (350 мг, 1,54 ммоль, полученного из соединения 90 щелочным гидролизом) и HATU (ГАТУ) (878 мг, 2,31 ммоль) в ДХМ (10 мл) добавляют Et3N (1 мл) при комнатной температуре. Через 10 мин добавляют азетидин-3-ол (170 мг, 2,31 ммоль). Смесь перемешивают при КТ в течение 2 ч, разбавляют H2O и экстрагируют ДХМ. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Остаток очищают хроматографией на колонке с силикагелем с получением указанного в заголовке соединения 96 (360 мг, 82,6%).
1H ЯМР (400 МГц, CDCl3) δ 7,98-7,96 (м, 1H), 7,90-7,87 (м, 1H), 7?42-7,38 (м, 1H), 4,69-4,64 (м, 1H), 4,26-4,25 (м, 2H), 3,92-3,87 (м, 2H), 2,78-2,76 (м, 2H), 2,16-2,12 (м, 2H), 2,00-1,93 (м, 2H)/
Получение соединения 97

К перемешиваемому раствору соединения 96 (100 мг, 0,35 ммоль) в ДХМ (5 мл) добавляют имидазол (48 мг, 0,70 ммоль) и TBSCl (80 мг, 0,51 ммоль) при 0°С. После перемешивания в течение ночи при комнатной температуре, реакционную смесь промывают водой, насыщенным раствором соли и концентрируют в вакууме, остаток 97 (180 мг) используют сразу на следующей стадии без дальнейшей очистки.
1H ЯМР (400 МГц, CDCl3) δ 7,92-7,90 (м, 1H), 7,84-7,81 (м, 1H), 7,36-7,20 (м, 1H), 4,55-4,53 (м, 1H), 4,16-4,12 (м, 2H), 3,80-3,78 (м, 2H), 2,74-2,70 (м, 2H), 2,08-2,04 (м, 2H), 1,94-1,89 (м, 2H), 0,83 (с, 9H), 0,00 (с, 6H).
Получение соединения 98

Смесь соединения 97 (180 мг, 0,46 ммоль), NH4Cl (437 мг, 8,17 ммоль) и Fe (228 мг, 4,09 ммоль) в воде (8 мл) и CH3OH (10 мл) перемешивают при 90°С в течение 2 ч. После охлаждения реакционную смесь фильтруют, и твердое вещество промывают ДХМ. Фильтраты отделяют, органический слой промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют досуха с получением соединения 98 (150 мг, 90,1%) в виде светло-желтого масла.
1H ЯМР (400 МГц, CDCl3) δ 6,90-6,86 (м, 1H), 6,36-6,30 (м, 2H), 4,53-4,50 (м, 1H), 4,16-4,09 (м, 2H), 3,83-3,72 (м, 2H), 2,52-2,48 (м, 2H), 2,03-1,98 (м, 2H), 1,85-1,80 (м, 2H), 0,83 (с, 9H), 0,00 (с, 6H).
Получение соединения 99

TMSCN (0,15 мл, 1,2 ммоль) добавляют к смеси соединения 98 (150 мг, 0,4 ммоль), ацетона (0,20 мл, 2,4 ммоль) и ZnCl2 (20 мг) при перемешивании. Реакционную смесь перемешивают при КТ в течение 3 ч. Смесь разбавляют H2O и экстрагируют этилацетатом. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют с получением соединения 99 (160 мг, 84,6%). Неочищенный продукт применяют сразу на следующей стадии без очистки.
Синтез 3-фтор-4-(3-{3-фтор-4-[4-(3-гидроксиазетидин-1-ил)-4-оксобутил]фенил}-4,4-диметил-5-оксо-2-тиоксоимидазолидин-1-ил)-2-трифторметилбензонитрила (ПРИМЕР 47)

Смесь соединения 99 (80 мг, 0,18 ммоль) и соединения 3b (68 мг, 0,27 ммоль) в ДМФ (0,7 мл) перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют MeOH (6 мл) и водн. 2н HCl (5 мл). Вторую смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в холодную воду и экстрагируют ДХМ. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Остаток очищают преп-ТСХ с получением указанного в заголовке соединения ПРИМЕРА 47 (18 мг, 17,2%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,96~7,85 (м, 2H), 7,44-7,36 (м, 1H), 6,99 (м, 2H), 4,68-4,65 (м, 1H), 4,29-4,24 (м, 2H), 3,91-3,88 (м, 2H), 2,78-2,74 (м, 2H), 2,18-2,15 (м, 2H), 2,04-1,98 (м, 2H), 1,60 (д, J=4,8 Гц, 6H), ЖХМС (M+H)+: 567,2,
Синтез 4-(3-{3-Фтор-4-[4-(3-гидроксиазетидин-1-ил)-4-оксобутил]фенил}-4,4-диметил-5-оксо-2-тиоксоимидазолидин-1-ил)-2-трифторметилбензонитрил (ПРИМЕР 48)

Смесь соединения 99 (80 мг, 0,18 ммоль) и соединения 3e (63 мг, 0,27 ммоль) в ДМФ (0,7 мл) перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют MeOH (6 мл) и водн. 2н HCl (5 мл). Вторую смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в холодную воду и экстрагируют ДХМ. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Остаток очищают преп-ТСХ с получением указанного в заголовке соединения ПРИМЕРА 48 (18 мг, 17,7%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,98-7,95 (м, 2H), 7,84-7,83 (м, 1H), 7,43-7,41 (м, 1H), 7,04-6,98 (м, 2H), 4,67-4,66 (м, 1H), 4,29-4,25 (м, 2H), 3,91-3,88 (м, 2H), 2,78-2,75 (м, 2H), 2,19-2,15 (м, 2H), 2,05-1,98 (м, 2H), 1,60 (д, J=7,6 Гц, 6H).
Синтез соединений ПРИМЕРА 49, ПРИМЕРА 50

Получение соединения 100

Раствор соединения 90 (500 мг, 2,07 ммоль) в NH3H2O (20 мл)/MeOH (20 мл) перемешивают при комнатной температуре в течение 48 ч. После удаления основной части MeOH, остаток разбавляют H2O и экстрагируют ДХМ. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют с получением соединения 100 (400 мг, 83,3%) в виде белого твердого вещества. Неочищенный продукт применяют сразу на следующей стадии без дальнейшей очистки.
Получение соединения 101

Смесь соединения 100 (500 мг, 2,20 ммоль) и виниленкарбоната (50 мг, 2,85 ммоль) в полифосфорной кислоте (5 г) нагревают при 160°С в течение 3 ч. Остаток добавляют к воде и экстрагируют этилацетатом. Объединенные органические экстракты промывают водой и насыщенным раствором соли, сушат и выпаривают. Остаток очищают хроматографией на колонке с применением петролейного эфира:этилацетата (4:1) с получением указанного в заголовке соединения 101 (100 мг, 18,1%).
1H ЯМР (400 МГц, CDCl3) δ 7,98-7,96 (м, 1H), 7,91-7,88 (м, 1H), 7,57 (д, J=0,8 Гц, 1H), 7,41-7,37 (м, 1H), 7,02 (с, 1H), 2,86-2,81 (м, 4H), 2,16-2,12 (м, 2H).
Получение соединения 102

Смесь соединения 101 (100 мг, 0,40 ммоль), NH4Cl (213 мг, 4,0 ммоль) и Fe (133 мг, 2,4 ммоль) в воде (8 мл) и CH3OH (10 мл) перемешивают при 90°С в течение 2 ч. После охлаждения реакционную смесь фильтруют, и твердое вещество промывают ДХМ. Фильтраты отделяют, органический слой промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют досуха с получением соединения 102 (150 мг, 90,1%) в виде светло-желтого масла.
Получение соединения 103

TMSCN (0,15 мл, 1,23 ммоль) добавляют к смеси соединения 102 (90 мг, 0,41 ммоль), ацетона (0,5 мл) и ZnCl2 (10 мг) при перемешивании. Реакционную смесь перемешивают при КТ в течение 3 ч. Смесь разбавляют H2O и экстрагируют этилацетатом. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют с получением соединения 103 (90 мг, 76,6%) в виде желтого масла. Неочищенный продукт применяют сразу на следующей стадии без очистки.
Синтез 3-Фтор-4-{3-[3-фтор-4-(3-оксазол-2-илпропил)фенил]-4,4-диметил-5-оксо-2-тиоксоимидазолидин-1-ил}-2-трифторметилбензонитрила (ПРИМЕР 49)

Смесь соединения 103 (60 мг, 0,20 ммоль) и соединения 3b (77 мг, 0,30 ммоль) в ДМФ (0,7 мл) перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют MeOH (6 мл) и водн. 2н HCl (5 мл). Вторую смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в холодную воду и экстрагируют ДХМ. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Остаток очищают преп-ТСХ с получением указанного в заголовке соединения ПРИМЕРА 49 (30 мг, 26,9%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,83-7,76 (м, 2H), 7,58 (с, 1H), 7,40-7,25 (м, 1H), 7,05-7,00 (м, 3H), 2,90-2,86 (м, 2H), 2,86-2,79 (м, 2H), 2,21-2,13 (м, 2H), 1,59 (д, J=4,8 Гц, 6H), MS (M+H)+: 536,4.
Синтез 4-{3-[3-фтор-4-(3-оксазол-2-илпропил)фенил]-4,4-диметил-5-оксо-2-тиоксоимидазолидин-1-ил}-2-трифторметилбензонитрила (ПРИМЕР 50)

Смесь соединения 103 (40 мг, 0,14 ммоль) и соединения 3e (47 мг, 0,20 ммоль) в ДМФ (0,7 мл) перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют MeOH (6 мл) и водн. 2н HCl (5 мл). Вторую смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в холодную воду и экстрагируют ДХМ. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Остаток очищают преп-ТСХ с получением указанного в заголовке соединения ПРИМЕРА 50 (10 мг, 13,9%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,98-7,95 (м, 2H), 7,84-7,81 (м, 1H), 7,60 (с, 1H), 7,41-7,37 (м, 1H), 7,08-6,99 (м, 3H), 2,95-2,91 (м, 2H), 2,84-2,78 (м, 2H), 2,21-2,16 (м, 2H), 1,59 (д, J=4,8 Гц, 6H), ЖХМС (M+H)+: 516,8.
Синтез соединений ПРИМЕРА 51 и ПРИМЕРА 52

Получение соединения 104

Смесь соединения 95 (150 мг, 0,66 ммоль, полученного из соединения 90 щелочным гидролизом) и HATU (ГАТУ) (376 мг, 0,99 ммоль) в ДХМ (10 мл) добавляют Et3N (0,5 мл) при комнатной температуре. Через 10 мин добавляют пиперидин-4-ол (100 мг, 0,99 ммоль). Смесь перемешивают при КТ в течение 2 ч, разбавляют H2O и экстрагируют ДХМ. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Остаток очищают хроматографией на колонке с силикагелем с получением указанного в заголовке соединения 104 (200 мг, 97,6%).
1H ЯМР (400 МГц, CDCl3) δ 7,99-7,96 (м, 1H), 7,90-7,88 (м, 1H), 7,43-7,39 (м, 1H), 3,97-3,93 (м, 2H), 3,70-3,68 (м, 1H), 3,25-3,20 (м, 2H), 2,85~2,79 (м, 2H), 2,41-2,38 (м, 2H), 2,07-1,95 (м, 2H), 1,91-1,85 (м, 2H), 1,53-1,49 (м, 2H).
Получение соединения 105

К перемешиваемому раствору соединения 104 (200 мг, 0,64 ммоль) в ДХМ (5 мл) добавляют имидазол (88 мг, 1,29 ммоль) и TBSCl (145 мг, 0,97 ммоль) при 0°С. После перемешивания в течение ночи при комнатной температуре, реакционную смесь промывают водой, насыщенным раствором соли и концентрируют в вакууме, остаток (соединение 105, 200 мг, 73,1%) применяют сразу на следующей стадии без дальнейшей очистки.
1H ЯМР (400 МГц, CDCl3) δ 7,92-7,89 (м, 1H), 7,84-7,81 (м, 1H), 7,37-7,33 (м, 1H), 3,92-3,87 (м, 1H), 3,64-3,59 (м, 1H), 3,55-3,49 (м, 2H), 3,24-3,18 (м, 1H), 2,76-2,72 (м, 2H), 2,32-2,28 (м, 2H), 1,97-1,89 (м, 2H), 1,67-1,60 (м, 2H), 1,43 (м, 2H), 0,83 (с, 9H), 0,00 (с, 6H).
Получение соединения 106

Смесь соединения 105 (200 мг, 0,81 ммоль), NH4Cl (270 мг, 5,04 ммоль) и Fe (169 мг, 3,02 ммоль) в воде (8 мл) и CH3OH (10 мл) перемешивают при 90°С в течение 2 ч. После охлаждения реакционную смесь фильтруют, и твердое вещество промывают ДХМ. Фильтраты отделяют, органический слой промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют досуха с получением соединения 106 (180 мг, 99,1%) в виде светло-желтого масла.
Получение соединения 107
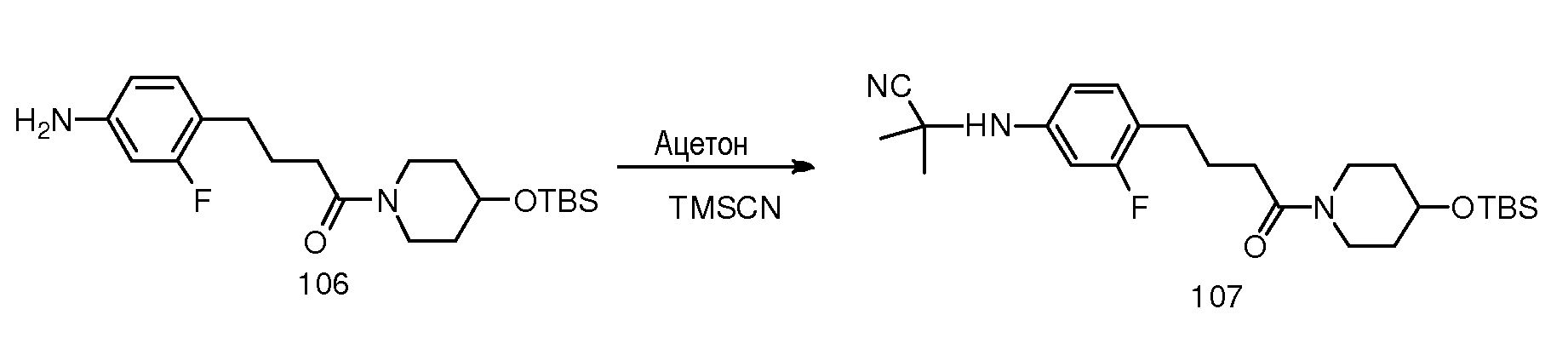
TMSCN (0,17 мл, 1,4 ммоль) добавляют к смеси соединения 106 (180 мг, 0,45 ммоль), ацетона (0,20 мл, 2,8 ммоль) и ZnCl2 (20 мг) при перемешивании. Реакционную смесь перемешивают при КТ в течение 3 ч. Смесь разбавляют H2O и экстрагируют этилацетатом. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют с получением соединения 107 (200 мг, 95,6%). Неочищенный продукт применяют сразу на следующей стадии без очистки.
Синтез 3-фтор-4-(3-{3-фтор-4-[4-(4-гидроксипиперидин-1-ил)-4-оксобутил]фенил}-4,4-диметил-5-оксо-2-тиоксоимидазолидин-1-ил)-2-трифторметилбензонитрила (ПРИМЕР 51)

Смесь соединения 107 (100 мг, 0,22 ммоль) и соединения 3b (79 мг, 0,33 ммоль) в ДМФ (0,7 мл) перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют MeOH (6 мл) и водн. 2н HCl (5 мл). Вторую смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в холодную воду и экстрагируют ДХМ. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ с получением указанного в заголовке соединения ПРИМЕРА 51 (30 мг, 23,2%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,82-7,75 (м, 2H), 7,41-7,37 (м, 1H), 7,05-6,99 (м, 2H), 3,95-3,90 (м, 1H), 3,24-3,17 (м, 2H), 2,80-2,76 (м, 2H), 2,43-2,39 (м, 2H), 2,03-1,99 (м, 2H), 1,90-1,86 (м, 2H), 1,60 (д, J=4,8 Гц, 6H), 1,56-1,53 (м, 2H), 1,49-1,46 (м, 2H), ЖХМС (M+H)+: 595,3.
Синтез 4-(3-{3-фтор-4-[4-(4-гидроксипиперидин-1-ил)-4-оксобутил]фенил}-4,4-диметил-5-оксо-2-тиоксоимидазолидин-1-ил)-2-трифторметилбензонитрила (ПРИМЕР 52)

Смесь соединения 107 (100 мг, 0,22 ммоль) и соединения 3e (74 мг, 0,33 моль) в ДМФ (0,7 мл) перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют MeOH (6 мл) и водн. 2н HCl (5 мл). Вторую смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в холодную воду и экстрагируют ДХМ. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ с получением указанного в заголовке соединения ПРИМЕРА 52 (30 мг, 24,0%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,97~7,95 (м, 2H), 7,83-7,81 (м, 1H), 7,42-7,37 (м, 1H), 7,04-6,98 (м, 2H), 3,97-3,91 (м, 1H), 3,24-3,19 (м, 2H), 2,80-2,77 (м, 2H), 2,43-2,40 (м, 2H), 2,05-2,00 (м, 2H), 1,91-1,86 (м, 2H), 1,59 (с, 6H), 1,53-1,49 (м, 2H), 1,49-1,46 (м, 2H), ЖХМС (M+H)+: 577,3.
Синтез соединений ПРИМЕРОВ 53-54

Получение соединения 108

Смесь соединения 95 (250 мг, 1,10 ммоль, получен из соединения 90 щелочным гидролизом) и HATU (ГАТУ) (327 мг, 1,65 ммоль) в ДХМ (10 мл) добавляют Et3N (0,5 мл) при комнатной температуре. Через 10 мин добавляют 1-метилпиперазин (165 мг, 1,65 ммоль). Смесь перемешивают при КТ в течение 2 ч, разбавляют H2O и экстрагируют ДХМ. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Остаток очищают хроматографией на колонке с силикагелем с получением указанного в заголовке соединения 108 (250 мг, 73,4%).
1H ЯМР (400 МГц, CDCl3) δ 7,98-7,96 (м, 1H), 7,90-7,88 (м, 1H), 7,43-7,39 (м, 1H), 3,65-3,63 (м, 2H), 3,46-3,43 (м, 2H), 2,83-2,79 (м, 2H), 2,38-2,32 (м, 6H), 2,31-2,19 (м, 3H), 2,01-1,93 (м, 2H).
Получение соединения 109

Смесь соединения 108 (250 мг, 0,84 ммоль), NH4Cl (207 мг, 3,88 ммоль) и Fe (270 мг, 4,85 ммоль) в воде (15 мл) и CH3OH (20 мл) перемешивают при 90°С в течение 2 ч. После охлаждения реакционную смесь фильтруют, и твердое вещество промывают ДХМ. Фильтраты отделяют, органический слой промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют досуха с получением соединения 109 (150 мг, 66,1%) в виде светло-желтого масла.
Получение соединения 110

TMSCN (0,21 мл, 1,61 ммоль) добавляют к смеси соединения 109 (150 мг, 0,54 ммоль), ацетона (0,24 мл, 3,22 ммоль) и ZnCl2 (20 мг) при перемешивании. Реакционную смесь перемешивают при КТ в течение 3 ч. Смесь разбавляют H2O и экстрагируют этилацетатом. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют с получением соединения 110 (150 мг, 80,6%). Неочищенный продукт применяют сразу на следующей стадии без очистки.
Синтез 3-фтор-4-(3-{3-фтор-4-[4-(4-метилпиперазин-1-ил)-4-оксобутил]фенил}-4,4-диметил-5-оксо-2-тиоксоимидазолидин-1-ил)-2-трифторметилбензонитрила (ПРИМЕР 53)

Смесь соединения 110 (100 мг, 0,29 ммоль) и соединения 3b (106 мг, 0,43 ммоль) в ДМФ (1,0 мл) перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют MeOH (6 мл) и водн. 2н HCl (5 мл). Вторую смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в холодную воду и экстрагируют ДХМ. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ с получением указанного в заголовке соединения ПРИМЕРА 53 (14 мг, 8,2%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,80-7,78 (м, 2H), 7,41-7,25 (м, 1H), 7,06-6,99 (м, 2H), 3,71-3,68 (м, 2H), 3,54-3,52 (м, 2H), 2,79-2,75 (м, 2H), 2,49-2,41 (м, 4H), 2,39-2,37 (м, 2H), 2,36-2,31 (м, 3H), 2,03-1,99 (м, 2H), 1,60 (д, J=4,8 Гц, 6H), ЖХМС (M+H)+: 594,3.
Синтез 4-(3-{3-фтор-4-[4-(4-метилпиперазин-1-ил)-4-оксобутил]фенил}-4,4-диметил-5-оксо-2-тиоксоимидазолидин-1-ил)-2-трифторметилбензонитрила (ПРИМЕР 54)

Смесь соединения 110 (40 мг, 0,11 ммоль) и соединения 3e (40 мг, 0,17 ммоль) в ДМФ (0,7 мл) перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют MeOH (6 мл) и водн. 2н HCl (5 мл). Вторую смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в холодную воду и экстрагируют ДХМ. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ с получением указанного в заголовке соединения ПРИМЕРА 54 (7 мг, 10,5%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,98-7,96 (м, 2H), 7,84-7,81 (м, 1H), 7,41-7,37 (м, 1H), 7,04-6,99 (м, 2H), 3,67 (с, 2H), 3,49 (с, 2H), 2,79-2,76 (м, 2H), 2,43-2,38 (м, 6H), 2,33 (с, 3H), 2,16-2,01 (м, 2H), 1,59 (д, J=4,8 Гц, 6H), ЖХМС (M+H)+: 576,3.
Синтез соединения ПРИМЕРА 55

Получение соединения 111

К раствору соединения 75 (20,0 г, 78,7 ммоль) и метилакрилата (68,0 мл, 629,6 ммоль) в абсолютном CH3OH (200 мл) добавляют каталитическое количество CH3ONa (850 мг, 15,7 ммоль) при КТ при перемешивании под N2. Смесь перемешивают при КТ в течение ночи под N2. Смесь разбавляют водн. NH4Cl и экстрагируют ДХМ. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4, концентрируют с получением смеси соединения 111 и соединения 112 (24,3 г). Неочищенный продукт применяют сразу на следующей стадии без дальнейшей очистки.
Получение соединения 113

Смесь соединения 111 и соединения 112 (24,3 г) растворяют в MeOH (300 мл) и H2O (100 мл), и затем добавляют LiOH (10,2 г, 0,41 моль). Смесь перемешивают при КТ в течение 2 ч. Затем концентрируют, остаток растворяют в H2O, 1н HCl добавляют до pH 3, и смесь экстрагируют ЭА. Органический слой промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют с получением неочищенного продукта. Раствор неочищенного продукта ЭА перемешивают при 40°С в течение ночи и удаляют ЭА с получением соединения 113 (16 г). Его применяют на следующей стадии без дальнейшей очистки.
1H ЯМР (400 МГц, CDCl3) δ 9,38 (д, J=6,8 Гц, 1H), 8,45-8,42 (м, 1H), 7,40 (д, J=8,4 Гц, 1H), 3,04 (т, J=7,6 Гц, 2H), 2,47 (т, J=7,2 Гц, 2H), 2,20-2,12 (м, 2H).
Получение соединения 114
К смеси соединения 113 (525 мг, 2,50 ммоль), морфолина (325 мг, 2,75 ммоль) и триэтиламина (1,05 мл) в ДХМ (30 мл) добавляют ГАТУ (1,41 г, 3,75 ммоль) при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 5 ч. Затем смесь разбавляют ДХМ, промывают 2н HCl, H2O, 5% NaHCO3 и затем H2O. Органический слой сушат над Na2SO4, фильтруют и концентрируют в вакууме с получением соединения 114 (660 мг, 94,6%) в виде масла.
Получение соединения 115
Смесь соединения 114 (660 мг, 2,36 ммоль), NH4Cl (1,26 г, 14,2 ммоль) и железного порошка (791 мг, 23,6 ммоль) в воде (10 мл) и CH3OH (10 мл) перемешивают при 90°С в течение 1 ч. После охлаждения реакционную смесь фильтруют, и твердое вещество промывают ДХМ. Фильтраты отделяют, органический слой промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют досуха с получением соединения 115 (435 мг, 73,8%) в виде светло-желтого масла.
Получение соединения 116
Соединение 116 получают из соединения 115 по методике синтеза соединения 110. Неочищенный продукт переносят на следующую стадию без дальнейшей очистки.
Синтез 4-{4,4-диметил-3-[6-(4-морфолин-4-ил-4-оксобутил)пиридин-3-ил]-5-оксо-2-тиоксоимидазолидин-1-ил}-3-фтор-2-трифторметилбензонитрила (ПРИМЕР 55)

Соединение ПРИМЕРА 55 синтезируют реакцией между соединением 3b и соединением 116 по методике синтеза ПРИМЕРА 15. Соединение ПРИМЕРА 55 получают с 27,4% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 8,52-8,50 (уш.с, 1H), 7,83-7,77 (м, 2H), 7,66-7,64 (м, 1H), 7,46-7,43 (уш.с, 1H), 3,72-3,67 (м, 6H), 3,48-3,45 (м, 2H), 3,04-2,96 (м, 2H), 2,45-2,43 (м, 2H), 2,18-2,12 (м, 2H), 1,61 (д, J=2,8 Гц, 6H).
Синтез 4-{4,4-диметил-3-[6-(4-морфолин-4-ил-4-оксобутил)пиридин-3-ил]-5-оксо-2-тиоксоимидазолидин-1-ил}-2-трифторметилбензонитрила (Пример 56)

Соединение ПРИМЕРА 56 синтезируют реакцией между соединением 3e и соединением 116 по методике синтеза ПРИМЕРА 15. Соединение ПРИМЕРА 56 получают с 14,9% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 8,54-8,48 (уш.с, 1H), 7,99-7,96 (м, 2H), 7,85-7,82 (м, 1H), 7,62-7,60 (м, 1H), 7,50-7,38 (уш.с, 1H), 3,67-3,62 (м, 6H), 3,48-3,40 (м, 2H), 2,99-2,96 (м, 2H), 2,46-2,43 (м, 2H), 2,18-2,12 (м, 2H), 1,60 (с, 6H).
Синтез 4-{5-[3-(4-циано-2-фтор-3-трифторметилфенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил]пиридин-2-ил}-N-метилбутирамида (ПРИМЕР 57)

Соединение ПРИМЕРА синтезируют по методике синтеза ПРИМЕРА 55. На стадии реакции превращения соединения 113 в соединение 114 применяют метиламин вместо морфолина.
1H ЯМР (400 МГц, CDCl3) δ 8,53-8,51 (уш.с, 1H), 7,83-7,79 (м, 2H), 7,68-7,66 (м, 1H), 7,46-7,44 (м, 1H), 5,57-5,55 (уш.с, 1H), 3,01-2,97 (м, 2H), 2,82-2,81 (м, 2H), 2,32-2,29 (м, 2H), 2,16 (с, 3H), 1,61 (д, J=2,4 Гц, 6H).
Синтез соединения Примера 58

Получение соединения 118
К смеси соединения 95 (436 мг, 1,92 ммоль), морфолина (117, 250 мг, 2,88 ммоль) и триэтиламина (568 мг, 5,76 ммоль) в ДХМ (20 мл) добавляют ГАТУ (1,6 г, 2,88 ммоль) при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 5 ч. Затем смесь разбавляют ДХМ, промывают 2н HCl, H2O, 5% NaHCO3 и затем H2O. Органический слой сушат над Na2SO4, фильтруют и концентрируют в вакууме с получением соединения 118 (560 мг, 99%) в виде масла.
Получение соединения 119
Смесь соединения 118 (550 мг, 1,86 ммоль), NH4Cl (1,48 г, 27,7 ммоль) и железного порошка (1,01 г, 18,0 ммоль) в воде (20 мл) и CH3OH (20 мл) перемешивают при 90°С в течение 1 ч. После охлаждения реакционную смесь, и твердое вещество промывают ДХМ. Фильтраты отделяют, органический слой промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют досуха с получением соединения 119 (480 мг, 97%) в виде светло-желтого масла.
Получение соединения 120
Соединение 120 получают из соединения 119 по методике синтеза соединения 110. Неочищенный продукт переносят на следующую стадию без дальнейшей очистки.
Синтез 3-фтор-4-(3-(3-фтор-4-(4-морфолино-4-оксобутил)фенил)-4,4-диметил-5-оксо-2-тиоксоимидазолидин-1-ил)-2-(трифторметил)бензонитрила (ПРИМЕР 58)

Соединение ПРИМЕРА 58 синтезируют реакцией между соединением 3b и соединением 120 по методике синтеза ПРИМЕРА 3. Соединение ПРИМЕРА 58 получают с 15% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,78-7,86 (м, 2H), 7,39-7,45 (м, 1H), 77,01-7,10 (м, 2H), 3,62-3,72 (м, 6H), 3,44-3,48 (м, 2H), 2,81 (т, 2H, J=7,6 Гц), 2,42 (т, 2H, J=7,4 Гц), 2,00-2,10 (м, 2H), 1,61 (д, 6H, J=4,8 Гц), ЖХМС (M+H)+: 581,2.
Синтез соединения ПРИМЕРА 59

Получение 2-(3-(2-фтор-4-нитрофенил)пропил)-4,5-дигидро-1H-имидазола 121
Этилендиамин (2,07 мл, 41,5 ммоль) добавляют по каплям к перемешиваемому раствору AlMe3/Tol (32 мл, 2M) так, чтобы температура не превышала -20°С. Реакционную смесь перемешивают при комнатной температуре в течение 10 мин, затем к смеси добавляют по каплям раствор соединения 90 (1,5 г, 8,29 ммоль) в Tol (толуол) (50 мл). Реакционную смесь перемешивают при 100°С в течение 20 мин. После охлаждения раствор обрабатывают по каплям CH3OH при 0°С, разбавляют ДХМ, фильтруют над MgSO4. Фильтрат концентрируют и очищают хроматографией на колонке с силикагелем (EtOAc:ТЭА=1:0,1) с получением соединения 121 (938 мг, 45%) в виде светло-желтого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,94-8,00 (м, 1H), 7,86-7,92 (м, 1H), 7,36-7,44 (м, 1H), 3,59 (с, 4H), 2,82 (т, 2H, J=7,6 Гц), 2,28 (д, 2H, J=7,6 Гц), 1,95-2,05 (м, 2H).
Получение 2-(3-(2-фтор-4-нитрофенил)пропил)-1H-имидазола 122.
Соединение 121 (888 мг, 3,53 ммоль) сначала растворяют в ацетонитриле (100 мл), при добавлении перманганата калия (1,12 г, 7,07 ммоль) и окиси алюминия (4,9 г) партиями. После перемешивания полученной смеси при комнатной температуре в течение 40 мин, CH3OH (1 мл) добавляют для снижения избытка окислителя. Смесь затем фильтруют, и твердый продукт промывают ДХМ:CH3OH=10:1. Фильтрат выпаривают досуха с получением соединения 122 (600 мг, 68%) в виде светло-желтого масла. Неочищенный продукт применяют сразу на следующей стадии без очистки.
1H ЯМР (400 МГц, CDCl3) δ 7,94-7,99 (м, 1H), 7,85-7,91 (м, 1H), 7,35-7,41 (м, 1H), 6,96 (уш.с, 2H), 2,75-2,85 (м, 4H), 2,06-2,19 (м, 2H).
Получение трет-бутил 2-(3-(2-фтор-4-нитрофенил)пропил)-1H-имидазол-1-карбоксилата 123.
К раствору соединения 122 (615 мг, 2,85 ммоль) в ДХМ (20 мл) добавляют по каплям ТЭА (1,05 мл, 7,53 ммоль) и (Boc)2O (675 мг, 3,01 ммоль) при 0°С при перемешивании. Реакционную смесь перемешивают при комнатной температуре в течение ночи, концентрируют и очищают хроматографией на колонке с силикагелем (ПЭ:EtOAc=5:1) с получением соединения 123 (718 мг, 82%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,94-7,99 (м, 1H), 7,85-7,91 (м, 1H), 7,35-7,41 (м, 1H), 7,29-7,31 (м, 1H), 6,85-6,87 (м, 1H), 3,08 (т, 2H, J=7,5 Гц), 2,86 (т, 2H, J=7,7 Гц), 2,10-2,19 (м, 2H), 1,61 (с, 9H).
Получение трет-бутил 2-(3-(4-амино-2-фторфенил)пропил)-1H-имидазолкарбоксилата 124
В раствор соединения 123 (150 мг, 0,43 ммоль) в EtOAc (10 мл) добавляют Pd/C (25 мг, 10%) под N2. Суспензию дегазируют в вакууме и продувают H2 несколько раз. Смесь перемешивают под H2 баллоном при комнатной температуре в течение 2 ч. Суспензию фильтруют, и твердое вещество промывают EtOAc. Фильтраты концентрируют досуха с получением соединения 124 (100 мг, 64%) в виде светло-желтого масла.
1H ЯМР (400 МГц, CDCl3) δ 7,28-7,32 (м, 1H), 6,93-6,98 (м, 1H), 6,82-6,86 (м, 1H), 6,30-6,40 (м, 2H), 3,02 (т, 2H, J=7,6 Гц), 2,63 (т, 2H, J=7,6 Гц), 1,97-2,09 (м, 2H), 1,62 (с, 9H).
Получение трет-бутил 2-(3-(4-((2-цианопропан-2-ил)амино)-2-фторфенил)пропил)-1H-имидазол-1-карбоксилата 125
Соединение 125 синтезируют из соединения 124 по методике синтеза соединения 120. Его получают с 96% выходом в виде желтого масла.
1H ЯМР (400 МГц, CDCl3) δ 7,28-7,32 (м, 1H), 7,05-7,10 (м, 1H), 6,82-6,86 (м, 1H), 6,58-6,62 (м, 2H), 3,64 (уш.с, 1H), 3,02 (т, 2H, J=7,6 Гц), 2,68 (т, 2H, J=7,6 Гц), 1,97-2,09 (м, 2H), 1,69 (с, 6H), 1,62 (с, 9H).
Синтез 2-хлор-4-(3-(4-(3-цианопропил)фенил)-4,4-диметил-5-оксо-2-тиоксоимидазолидин-1-ил)-3-фторбензонитрила (ПРИМЕР 59)
Соединение ПРИМЕРА 59 синтезируют реакцией между соединением 3b и соединением 125 по методике синтеза ПРИМЕРА 15. Соединение ПРИМЕРА 59 получают с 45% выходом в виде светло-желтого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,75-7,85 (м, 2H), 7,30-7,38 (м, 1H), 6,95-7,08 (м, 4H), 2,91 (т, 2H, J=7,6 Гц), 2,76 (т, 2H, J=7,6 Гц), 2,05-2,20 (м, 2H), 1,58 (д, 6H, J=3,5 Гц), ЖХМС (M+H)+: 534,7.
Синтез 4-(3-(4-(3-(1H-имидазол-2-ил)пропил)-3-фторфенил)-4,4-диметил-5-оксо-2-тиоксоимидазолидин-1-ил)-5-фтор-2-(трифторметил)бензонитрила (ПРИМЕР 60)
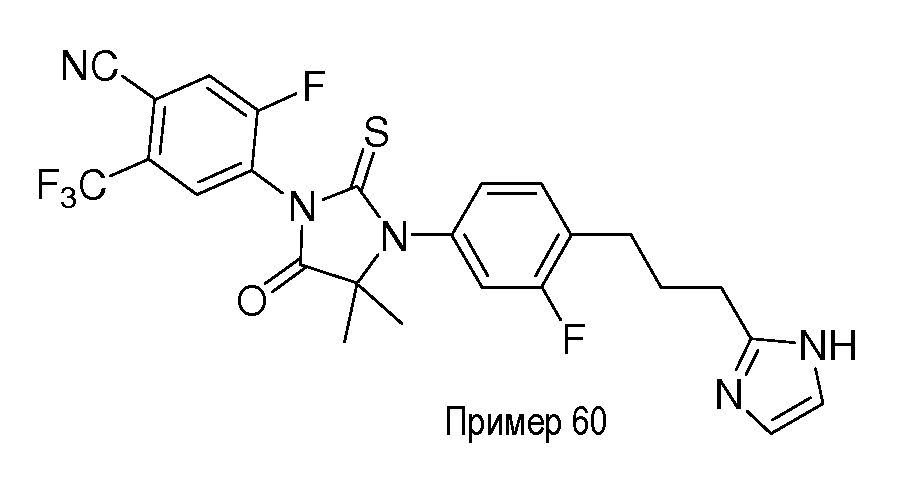
Соединение ПРИМЕРА Соединение ПРИМЕРА 60 синтезируют реакцией между соединением 3d и соединением 125 по методике синтеза ПРИМЕРА 15. Соединение ПРИМЕРА 60 получают с 35% выходом в виде светло-желтого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,93 (д, 1H, J=6,4 Гц), 7,73 (д, 1H, J=8,3 Гц), 7,31-7,39 (м, 1H), 6,98-7,08 (м, 4H), 2,88 (т, 2H, J=7,6 Гц), 2,77 (т, 2H, J=7,6 Гц), 2,09-2,20 (м, 2H), 1,59 (д, 6H, J=5,6 Гц), ЖХМС (M+H)+: 534,3.
Синтез соединений ПРИМЕРОВ 61-62

Получение соединения 126

TMSCN (0,15 мл, 1,2 ммоль) добавляют к смеси соединения 98 (150 мг, 0,4 ммоль), циклобутанона (0,18 мл, 2,4 ммоль) и ZnCl2 (20 мг) при перемешивании. Реакционную смесь перемешивают при КТ в течение 3 ч. Смесь разбавляют H2O и экстрагируют этилацетатом. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют с получением соединения 126 (200 мг). Неочищенный продукт применяют сразу на следующей стадии без очистки.
Синтез 3-фтор-4-(5-{3-фтор-4-[4-(3-гидроксиазетидин-1-ил)-4-оксобутил]фенил}-8-оксо-6-тиоксо-5,7-диазаспиро[3,4]окт-7-ил)-2-трифторметилбензонитрила (ПРИМЕР 61)
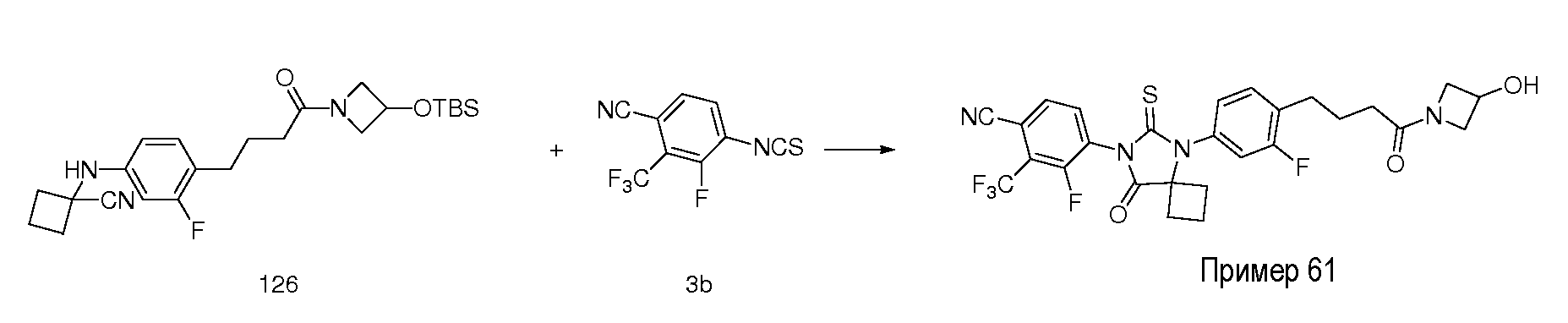
Смесь соединения 126 (100 мг, 0,22 ммоль) и соединения 3b (83 мг, 0,33 ммоль) в ДМФ (1,0 мл) перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют MeOH (6 мл) и водн. 2н HCl (5 мл). Вторую смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в холодную воду и экстрагируют ДХМ. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Остаток очищают преп-ТСХ с получением указанного в заголовке соединения ПРИМЕРА 61 (25 мг, 19,2%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,83~7,79 (м, 2H), 7,45-7,42 (м, 1H), 7,08-7,05 (м, 2H), 4,69-4,66 (м, 1H), 4,31-4,25 (м, 2H), 3,96-3,85 (м, 2H), 2,81-2,76 (м, 2H), 2,68-2,64 (м, 2H), 2,60-2,55 (м, 2H), 2,23-2,16 (м, 2H), 2,05-2,00 (м, 2H), 1,73-1,69 (м, 2H).
Синтез 4-(5-{3-фтор-4-[4-(3-гидроксиазетидин-1-ил)-4-оксобутил]фенил}-8-оксо-6-тиоксо-5,7-диазаспиро[3,4]окт-7-ил)-2-трифторметилбензонитрила (ПРИМЕР 62)

Смесь соединения 126 (100 мг, 0,22 ммоль) и соединения 3e (77 мг, 0,33 ммоль) в ДМФ (1,0 мл) перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют MeOH (6 мл) и водн. 2н HCl (5 мл). Вторую смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в холодную воду и экстрагируют ДХМ. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Остаток очищают преп-ТСХ с получением указанного в заголовке соединения ПРИМЕРА 62 (25 мг, 19,9%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,98-7,96 (м, 2H), 7,85-7,83 (м, 1H), 7,46-7,42 (м, 1H), 7,07-6,99 (м, 2H), 4,70-4,66 (м, 1H), 4,32-4,24 (м, 2H), 3,97-3,85 (м, 2Н), 2,81-2,77 (м, 2Н), 2,67-2,65 (м, 2Н), 2,58-2,55 (м, 2Н), 2,25-2,19 (м, 2Н), 2,04-2,01 (м, 2Н), 1,73-1,67 (м, 2Н).
Синтез соединений ПРИМЕРОВ 63-64
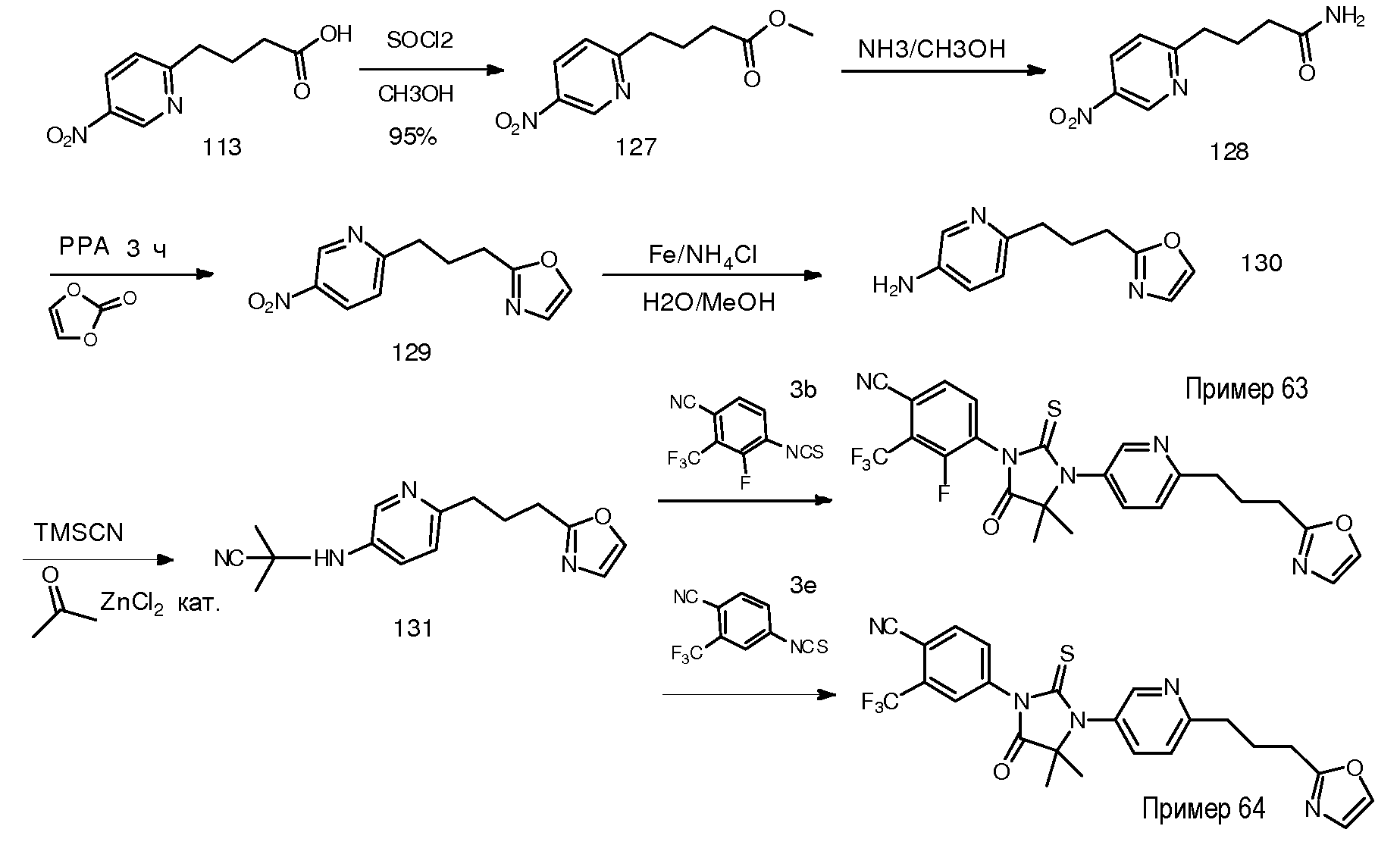
Получение соединения 127

К раствору соединения 113 (5,0 г, 23,8 ммоль) в CH3OH (50 мл) добавляют по каплям тионилхлорид (12,5 мл, 142,7 ммоль) при 0°С при перемешивании. После добавления реакционную смесь перемешивают при 80°С в течение 2 ч и затем концентрируют в вакууме. Остаток разбавляют водн. NaHCO3 и экстрагируют этилацетатом. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют досуха с получением соединения 127 (2,9 г, 54,3%).
1H ЯМР (400 МГц, CDCl3) δ 9,38 (д, J=6,8 Гц, 1H), 8,41-8,38 (м, 1H), 7,38-7,35 (м, 1H), 3,71 (с, 3H), 3,00 (т, J=6,8 Гц, 2H), 2,40 (т, J=7,2 Гц, 2H), 2,20-2,12 (м, 2H).
Получение соединения 128

Раствор соединения 127 (500 мг, 2,07 ммоль) в NH3H2O (20 мл)/MeOH (20 мл) перемешивают при комнатной температуре в течение 48 ч. После удаления основной части MeOH остаток разбавляют H2O и экстрагируют ДХМ. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют с получением соединения 128 (670 мг, 71,8%) в виде белого твердого вещества. Неочищенный продукт применяют сразу на следующей стадии без дальнейшей очистки.
1H ЯМР (400 МГц, CDCl3) δ 9,34 (д, J=2,8 Гц, 1H), 8,40-8,37 (м, 1H), 7,39-7,35 (м, 1H), 6,20-5,52 (уш.с, 2H), 3,00 (т, J=7,2 Гц, 2H), 2,30 (т, J=7,2 Гц, 2H), 2,15-2,12 (м, 2H).
Получение соединения 129

Смесь соединения 128 (570 мг, 2,72 ммоль) и карбоната винилена (281 мг, 3,27 ммоль) в полифосфорной кислоте (6 г) нагревают при 160°С в течение 3 ч. Остаток добавляют к воде и экстрагируют этилацетатом. Объединенные органические экстракты промывают водой и насыщенным раствором соли, сушат и выпаривают. Остаток очищают хроматографией на колонке с применением петролейного эфира:этилацетата (4:1) с получением указанного в заголовке соединения 129 (130 мг, 20,1%).
1H ЯМР (400 МГц, CDCl3) δ 9,35 (с, 1H), 8,39-8,36 (м, 1H), 7,56 (с, 1H), 7,36 (д, J=8,0 Гц, 1H), 7,01 (с, 1H), 3,01 (т, J=6,8 Гц, 2H), 2,87 (т, J=7,2 Гц, 2H), 2,30-2,26 (м, 2H).
Получение соединения 130

Смесь соединения 129 (200 мг, 0,86 ммоль), NH4Cl (458 мг, 8,58 ммоль) и Fe (287 мг, 5,15 ммоль) в воде (10 мл) и CH3OH (15 мл) перемешивают при 90°С в течение 2 ч. После охлаждения реакционную смесь фильтруют, и твердое вещество промывают ДХМ. Фильтраты отделяют, органический слой промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют досуха с получением соединения 130 (150 мг, 86,1%) в виде светло-желтого масла.
Получение соединения 131

TMSCN (0,24 мл, 1,92 ммоль) добавляют к смеси соединения 130 (130 мг, 0,64 ммоль), ацетона (0,50 мл) и ZnCl2 (20 мг) при перемешивании. Реакционную смесь перемешивают при КТ в течение 3 ч. Смесь разбавляют H2O и экстрагируют этилацетатом. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют с получением соединения 131 (130 мг, 75,2%) в виде масла. Неочищенный продукт применяют сразу на следующей стадии без очистки.
Синтез 4-{4,4-диметил-3-[6-(3-оксазол-2-илпропил)пиридин-3-ил]-5-оксо-2-тиоксоимидазолидин-1-ил}-3-фтор-2-трифторметилбензонитрила (ПРИМЕР 63)

Смесь соединения 131 (100 мг, 0,37 ммоль) и соединения 3b (136 мг, 0,55 ммоль) в ДМФ (1,0 мл) перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют MeOH (6 мл) и водн. 2н HCl (5 мл). Вторую смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в холодную воду и экстрагируют ДХМ. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ с получением указанного в заголовке соединения ПРИМЕРА 63 (30 мг, 15,7%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 8,30 (с, 1H), 7,83-7,76 (м, 2H), 7,61-7,56 (м, 2H), 7,38-7,36 (м, 1H), 7,02 (с, 1H), 3,01-2,98 (м, 2H), 2,92-2,87 (м, 2H), 2,35-2,27 (м, 2H), 1,62 (д, J=3,2 Гц, 6H), ЖХМС (M+H)+: 518,6.
Синтез 4-{4,4-диметил-3-[6-(3-оксазол-2-ил-пропил)пиридин-3-ил]-5-оксо-2-тиоксоимидазолидин-1-ил}-2-трифторметилбензонитрила (ПРИМЕР 64)

Смесь соединения 131 (30 мг, 0,11 ммоль) и соединения 3e (38 мг, 0,16 ммоль) в ДМФ (0,7 мл) перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют MeOH (6 мл) и водн. 2н HCl (5 мл). Вторую смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в холодную воду и экстрагируют ДХМ. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют в вакууме досуха. Остаток очищают преп-ТСХ с получением указанного в заголовке соединения ПРИМЕРА 64 (5 мг, 9,1%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 8,51 (с, 1H), 7,98-7,96 (м, 2H), 7,84-7,82 (м, 1H), 7,58-7,57 (м, 2H), 7,38-7,37 (м, 1H), 7,04 (с, 1H), 3,01-2,98 (м, 2H), 2,92-2,88 (м, 2H), 2,33-2,29 (м, 2H), 1,32 (с, 6H), ЖХМС (M+H)+: 501,5.
Синтез 3-фтор-4-{5-[6-(3-оксазол-2-илпропил)пиридин-3-ил]-8-оксо-6-тиоксо-5,7-диазаспиро[3,4]окт-7-ил}-2-трифторметилбензонитрила (ПРИМЕР 65)

Соединение ПРИМЕРА 65 синтезируют по методике синтеза ПРИМЕРА 63. На стадии реакции превращения соединения 130 в соединение 131 применяют циклобутанон вместо ацетона.
1H ЯМР (400 МГц, CDCl3) δ 8,52 (д, J=2,4 Гц, 1H), 7,83-7,75 (м, 2H), 7,62-7,57 (м, 2H), 7,42-7,39 (м, 1H), 7,01 (с, 1H), 3,03-2,98 (м, 2H), 2,94-2,91 (м, 2H), 2,73-2,67 (м, 2H), 2,51-2,46 (м, 2H), 2,37-2,29 (м, 2H), 1,73-1,64 (м, 2H), ЖХМС (M+H)+: 530,2.
Синтез соединения ПРИМЕРА 66

Получение 2-(3-(4,5-дигидро-1H-имидазол-2-ил)пропил)-5-нитропиридина 132
Этилендиамин (1,04 мл, 15,6 ммоль) добавляют по каплям к перемешиваемому раствору AlMe3/Tol (11 мл, 2M) так, чтобы температура не превышала -20°С. Реакционную смесь перемешивают при комнатной температуре в течение 10 мин, затем к смеси добавляют по каплям раствор соединения 127 (1 г, 4,5 ммоль) в Tol (толуол) (15 мл). Реакционную смесь перемешивают при 60°С в течение 3 ч. После охлаждения раствор обрабатывают по каплям CH3OH при 0°С, разбавляют ДХМ, фильтруют над MgSO4. Фильтрат концентрируют и очищают хроматографией на колонке с силикагелем (EtOAc:CH3OH:ТЭА=6:1:0,1) с получением соединения 132 (400 мг, 38%) в виде черного твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 9,29-9,32 (м, 1H), 8,40-8,45 (м, 1H), 7,50-7,55 (м, 1H), 3,96 (уш.с, 4H), 3,04 (т, 2H, J=7,6 Гц), 2,83 (д, 2H, J=7,6 Гц), 2,25-2,35 (м, 2H).
Получение 2-(3-(1H-имидазол-2-ил)пропил)-5-нитропиридина 133
Соединение 132 (400 мг, 1,71 ммоль) сначала растворяют в ацетонитриле (20 мл), при добавлении перманганата калия (952 мг, 5,13 ммоль) и окиси алюминия (1,2 г) партией. После перемешивания полученной смеси при комнатной температуре в течение 40 мин, CH3OH (1 мл) добавляют для снижения избытка окислителя. Смесь затем фильтруют, и твердый продукт промывают ДХМ:CH3OH=10:1. Фильтрат концентрируют и очищают хроматографией на колонке с силикагелем (EtOAc:ТЭА=1:0,1) с получением соединения 133 (110 мг, 30%) в виде желтого твердого вещества.
lH ЯМР (400 МГц, CDCl3) δ 9,32-9,37 (м, 1H), 8,37-8,42 (м, 1H), 7,35-7,41 (м, 1H), 6,97 (уш.с, 2H), 2,98 (т, 2H, J=7,2 Гц), 2,78 (д, 2H, J=7,2 Гц), 2,17-2,26 (м, 2H).
Получение трет-бутил 2-(3-(5-нитропиридин-2-ил)пропил)-1H-имидазол-1-карбоксилата 134
К раствору соединения 133 (110 мг, 0,47 ммоль) в ДХМ (10 мл) добавляют по каплям ТЭА (0,26 мл, 1,88 ммоль) и (Boc)2O (300 мг, 1,37 ммоль) при 0°С при перемешивании. Реакционную смесь перемешивают при комнатной температуре в течение ночи, концентрируют и очищают хроматографией на колонке с силикагелем (ПЭ:EtOAc=5:1) с получением соединения 134 (110 мг, 71%) в виде светло-желтого масла.
1H ЯМР (400 МГц, CDCl3) δ 9,32-9,37 (м, 1H), 8,37-8,42 (м, 1H), 7,35-7,41 (м, 1H), 7,27-7,31 (м, 1H), 6,85-6,87 (м, 1H), 3,11 (т, 2H, J=7,2 Гц), 3,05 (т, 2H, J=7,6 Гц), 2,23-2,33 (м, 2H), 1,61 (с, 9H).
Получение трет-бутил 2-(3-(5-аминопиридин-2-ил)пропил)-1H-имидазол-1-карбоксилата 135
Раствор соединения 134 (50 мг, 0,15 ммоль) в EtOAc (10 мл) добавляют Pd/C (10 мг, 10%) под N2. Суспензию дегазируют в вакууме и продувают H2 несколько раз. Смесь перемешивают под H2 баллоном при комнатной температуре в течение 2 ч. Суспензию фильтруют, и твердое вещество промывают EtOAc. Фильтраты концентрируют досуха с получением соединения 135 (45 мг, 99%) в виде светло-желтого масла.
1H ЯМР (400 МГц, CDCl3) δ 8,02-8,05 (м, 1H), 7,28-7,31 (м, 1H), 6,92-7,02 (м, 2H), 6,82-6,86 (м, 1H), 3,05 (т, 2H, J=7,6 Гц), 2,81 (т, 2H, J=7,6 Гц), 2,10-2,20 (м, 2H), 1,62 (с, 9H).
Получение трет-бутил 2-(3-(5-((2-цианопропан-2-ил)амино)пиридин-2-ил)пропил)-1H-имидазол-1-карбоксилата 136
Соединение 136 синтезируют из соединения 135 по методике синтеза соединения 131. Его получают с 98% выходом в виде желтого масла.
Синтез 4-(3-(6-(3-(1H-имидазол-2-ил)пропил)пиридин-3-ил)-4,4-диметил-5-оксо-2-тиоксоимидазолидин-1-ил)-3-фтор-2-(трифторметил)бензонитрила (ПРИМЕР 66)
Соединение ПРИМЕРА синтезируют реакцией между соединением 3b и соединением 136 по методике синтеза ПРИМЕРА 15. Соединение ПРИМЕРА 66 получают с 36% выходом в виде светло-желтого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 8,50-8,55 (м, 1H), 7,75-7,85 (м, 2H), 7,60-7,65 (м, 1H), 7,38-7,44 (м, 1H), 7,03 (уш.с, 2H), 2,96 (т, 2H, J=6,8 Гц), 2,88 (т, 2H, J=6,8 Гц), 2,18-2,28 (м, 2H), 1,69 (д, 6H, J=2,0 Гц), ЖХМС (M+H)+: 517,2.
Синтез соединения ПРИМЕРА 67

Получение 4-(5-нитропиридин-2-ил)бутантиоамида 137
Раствор соединения 128 (1,2 г, 5,7 ммоль) и реагента Льюиссона (1,55 г, 3,8 ммоль) в ТГФ (50 мл) перемешивают при комнатной температуре в течение 1 ч, затем концентрируют и очищают хроматографией на колонке с силикагелем (ПЭ:EtOAc=3:1) с получением соединения 137 (700 мг, 55%) в виде светло-желтого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 9,25-9,45 (м, 1H), 8,36-8,46 (м, 1H), 7,35-7,45 (м, 3H), 3,04 (т, 2H, J=7,2 Гц), 2,73 (д, 2H, J=7,2 Гц), 2,18-2,35 (м, 2H).
Получение 2-(3-(5-нитропиридин-2-ил)пропил)тиазола 138
К раствору соединения 137 (2,1 г, 9,3 ммоль) и 2-бром-1,1-диметоксиэтана (6,31 г, 37,3 ммоль) в ДМЭ (100 мл) добавляют по каплям 10 капель концентрированной HCl при комнатной температуре. Реакционную смесь перемешивают при 90°С в течение 5 ч, обрабатывают водн. NaHCO3 и экстрагируют ДХМ. Объединенные органические слои промывают насыщенным раствором соли (30 мл), сушат над Na2SO4, концентрируют и очищают хроматографией на колонке с силикагелем (ПЭ:EtOAc=3:1) с получением соединения 138 (1,8 г, 76%) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 9,33-9,38 (м, 1H), 8,34-8,40 (м, 1H), 7,65-7,70 (м, 1H), 7,32-7,36 (м, 1H), 7,18-7,23 (м, 1H), 3,12 (т, 2H, J=7,6 Гц), 3,03 (д, 2H, J=7,2 Гц), 2,25-2,35 (м, 2H).
Получение 6-(3-(тиазол-2-ил)пропил)пиридин-3-амина 139
Смесь соединения 138 (2,32 г, 9,3 ммоль), NH4Cl (7,46 г, 140 ммоль) и железного порошка (5,19 г, 93 ммоль) в воде (100 мл) и CH3OH (100 мл) перемешивают при 90°С в течение 1 ч. После охлаждения реакционную смесь фильтруют, и твердое вещество промывают ДХМ. Фильтраты отделяют, органический слой промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют досуха с получением соединения 139 (2,0 г, 83%) в виде светло-желтого масла.
1H ЯМР (400 МГц, CDCl3) δ 8,00-8,10 (м, 1H), 7,63-7,70 (м, 1H), 7,13-7,20 (м, 1H), 6,92-7,05 (м, 2H), 3,06 (т, 2H, J=7,4 Гц), 2,81 (т, 2H, J=7,4 Гц), 2,16-2,26 (м, 2H).
Получение 2-метил-2-((6-(3-(тиазол-2-ил)пропил)пиридин-3-ил)амино)пропаннитрила 140
TMSCN (3,7 мл, 27,9 ммоль) добавляют к смеси соединения 139 (2,04 г, 9,3 ммоль), ацетона (4,1 мл, 55,8 ммоль) и ZnCl2 (122 мг, 0,9 ммоль) при перемешивании. Реакционную смесь перемешивают при 40°С в течение 0,5 ч и концентрируют в вакууме. Остаток разбавляют водой и экстрагируют ДХМ. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют досуха с получением соединения 140 (2,6 г, 99%) в виде светло-желтого масла. Неочищенный продукт применяют сразу на следующей стадии без очистки.
1H ЯМР (400 МГц, CDCl3) δ 8,18-8,32 (м, lH), 7,62-7,80 (м, 1H), 7,26-7,40 (м, 1H), 7,18-7,25 (м, 1H), 7,08-7,16 (м, 1H), 3,10 (т, 2H, J=7,6 Гц), 2,87 (т, 2H, J=7,6 Гц), 2,15-2,25 (м, 2H), 1,70 (с, 6H).
Синтез 4-(4,4-диметил-5-оксо-3-(6-(3-(тиазол-2-ил)пропил)пиридин-3-ил)-2-тиоксоимидазолидин-1-ил)-3-фтор-2-(трифторметил)бензонитрила (ПРИМЕР 67)
Смесь соединения 140 (2,66 г, 9,3 ммоль) и соединения 3b (3,43 г, 14,0 ммоль) в ДМФ (1 мл) перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют CH3OH (15 мл) и водн. 3н HCl (15 мл). Вторую смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры, реакционную смесь выливают в холодную воду и экстрагируют ДХМ. Объединенные органические слои промывают водн. NaHCO3 и насыщенным раствором соли, сушат над Na2SO4 и концентрируют в вакууме досуха. Остаток очищают хроматографией на колонке с силикагелем (ПЭ:EtOAc=2:1) с получением соединения ПРИМЕРА 67 (2,0 г, 45%) в виде светло-желтого твердого вещества.
lH ЯМР (400 МГц, CDCl3) δ 8,50-8,55 (м, 1H), 7,72-7,85 (м, 2H), 7,68-7,72 (м, 1H), 7,57-7,65 (м, 1H), 7,37-7,44 (м, 1H), 7,22-7,26 (м, 1H), 3,20 (т, 2H, J=7,6 Гц), 3,03 (т, 2H, J=7,6 Гц), 2,32-2,42 (м, 2H), 1,59 (д, 6H, J=2,8 Гц), ЖХМС (M+H)+: 534,2.
Получение 1-((6-(3-(тиазол-2-ил)пропил)пиридин-3-ил)амино)циклобутанкарбонитрила 141

TMSCN (0,13 мл, 0,96 ммоль) добавляют к смеси соединения 139 (70 мг, 0,32 ммоль), циклобутанона (0,15 мл, 1,92 ммоль) и ZnCl2 (4 мг, 0,03 ммоль) при перемешивании. Реакционную смесь перемешивают при комнатной температуре в течение 5 ч и концентрируют в вакууме. Остаток разбавляют водой и экстрагируют ДХМ. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют досуха с получением соединения 141 (90 мг) в виде светло-желтого масла. Неочищенный продукт применяют сразу на следующей стадии без очистки.
Синтез 3-фтор-4-(8-оксо-5-(6-(3-(тиазол-2-ил)пропил)пиридин-3-ил)-6-тиоксо-5,7-диазаспиро[3,4]октан-7-ил)-2-(трифторметил)бензонитрила (ПРИМЕР 68)

Соединение ПРИМЕРА синтезируют реакцией между соединением 3b и соединением 141 по методике синтеза ПРИМЕРА 15. Соединение ПРИМЕРА 68 получают с 4% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 8,50-8,55 (м, lH), 7,72-7,85 (м, 2H), 7,68-7,72 (м, 1H), 7,57-7,65 (м, lH), 7,38-7,44 (м, 1H), 7,18-7,22 (м, 1H), 3,19 (т, 2H, J=7,2 Гц), 3,03 (т, 2H, J=7,2 Гц), 2,64-2,76 (м, 2H), 2,44-2,56 (м, 2H), 2,32-2,42 (м, 2H), 2,20-2,30 (м, 1H), 1,65-1,76 (м, 1H), ЖХМС (M+H)+: 546,2.
Получение соединения 3f

Соединение 3f получают из 4-амино-2-метоксибензонитрила по методике синтеза соединения 3b.
Синтез 4-(4,4-диметил-5-оксо-3-(6-(3-(тиазол-2-ил)пропил)пиридин-3-ил)-2-тиоксоимидазолидин-1-ил)-2-метоксибензонитрила (ПРИМЕР 69)

Соединение ПРИМЕРА 69 синтезируют реакцией между соединением 3f и соединением 140 по методике синтеза ПРИМЕРА 15. Соединение ПРИМЕРА 69 получают с 6% выходом в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 8,50-8,55 (м, lH), 7,68-7,72 (м, 2H), 7,60-7,65 (м, 1H), 7,34-7,40 (м, 1H), 7,18-7,22 (м, 1H), 7,05-7,14 (м, 2H), 3,97 (уш.с, 3H), 3,17 (т, 2H, J=7,2 Гц), 3,03 (т, 2H, J=7,2 Гц), 2,32-2,42 (м, 2H), 1,59 (с, 6H), ЖХМС (M+H)+: 478,2.
Применяя методики, такие как описаны выше, и подходящие реагенты, легко синтезируют соединения в соответствии с данным изобретением, имеющие Y1, который является -S- или -NR′′-, где R′′ является водородом, алкилом, алкенилом или алкинилом. Например, соединения формулы (I), где Y1 является -S-, могут быть синтезированы по методике синтеза Примера 15 или Примера 17, где исходное соединение 42 или соединение 48 меняют на соединение 42S или соединение 48S, соответственно.

Соединения формулы (I), где Y1 является -NR′′-, могут быть синтезированы по методике синтеза Примера 15 или Примера 17, где исходное соединение 42 или соединение 48 меняют на соединение 42N или соединение 48N, соответственно. Если R′′ является водородом, азот в -NH может быть защищен, например, но не ограниченным ими, Boc-группой, которая может быть расщеплена во время обработки HCl на конечной стадии синтеза Примера.

Тесты. Биологическая активность.
Соединения в соответствии с данным изобретением являются антагонистами андрогенового рецептора. Определенные соединения обладают мощным антагонистическим действием (IC50<1 мкМ) без какого-либо серьезного агонизма. Как описано в разделе, посвященном уровню техники, селективные антагонисты применяют для лечения связанных с андрогеновым рецептором состояний, особенно рака простаты, включая чувствительное к гормону и резистентное к гормону заболевание. Соединения в соответствии с данным изобретением могут применяться отдельно или в сочетании с одним или более другими терапевтическими агентами.
Соединения в соответствии с данным изобретением подвергают скринингу через тестирование чувствительных к гормону (LNCaP, LAPC4, VCAP) и резистентных к гормону клеток рака простаты (LNCaP-АР, LAPC4-АР, LNCaP C4-2, 22RV1, LNCaP-AI и LNCaP-abl) на антагонистическое и агонистическое действие. Уровень специфичного к простате антигена (СПА) также может применяться в качестве маркера антагонистического действия к андрогеновому рецептору. Анализ МТС также применяют для оценки соединений в соответствии с данным изобретением на степень ингибирования роста клеток. Селективные мощные антагонисты андрогенового рецептора с приемлемой пероральной биодоступностью у грызунов далее оценивают на in vivo эффективность с применением ксенотрансплантатов рака простаты. Применяемые колонии клеток выбирают из LNCaP, LAPC4, LAPC9, CWR22, LNCaP-АР, LNCaP C4-2, 22RV1, VCAP, LNCaP-abl и LNCaP-AI.
Анализ СПА (Тестирование ингибирования соединениями в соответствии с данным изобретением образования специфичного к простате антигена в различных клетках рака простаты).
Андроген-зависимые клетки LNCaP получают у American Type Culture Collection (ATCC, Manassas, VA). Эти клетки выращивают в среде RPMI 1640 с добавлением 10% фетальной бычьей сыворотки (ФБС), 100 ед./мл пенициллина, 100 мкг/мл стрептомицина и 0,25 мкг/мл амфотерицина B. Клетки выдерживают при 37°C и 5% CO2. Клетки LNCaP между переносом 20 и 35 применяют для экспериментов. LNCaP является чувствительной к гормону колонией клеток. Для анализа СПА клетки человеческого рака простаты LNCaP высевают в 96-луночный планшет в концентрации 5000 клеток/100 мкл/лунку. На следующий день добавляют Метилтриенолон (R1881, агонист АР) (конечная концентрация 1 нг/мл), тестируемые соединения или бикалутамид (Casodex®, AstraZeneca) (конечная концентрация от 0,005 до 20 мкМ). Через три дня после добавления концентрацию СПА в надосадочной жидкости культурального раствора измеряют с применением ELISA. ELISA для человеческого СПА в культуральной среде проводят с применением метода ультрачувствительного исследования и реагентов в наборе для исследования СПА Active™ PSA assay kit (Diagnostic Systems Laboratories Inc., Webster, TX). Культуральную среду и стандарты (200 мкл/лунку) инкубируют в покрытых антителами планшетах в течение 2 ч при комнатной температуре на встряхивателе для титровальных планшетов при 500-600 об./мин. Затем лунки промывают пять раз. HRP конъюгат разбавляют 1:20 буфером для анализа и 100 мкл добавляют во все лунки. Планшеты инкубируют в течение 30 мин при комнатной температуре на встряхивателе и промывают как раньше, и добавляют 100 мкл TMB (3,3′,5,5′-тетраметилбензидина, 0,4 г/л). Планшеты инкубируют в течение 10 мин на встряхивателе, и реакцию заканчивают добавлением 100 мкл стоп-реагента. Планшеты считывают с применением планшетного ридера при 450 нм с 650 нм ссылочный фильтр. Уровни СПА нормализуют для устранения разниц в росте клеток LNCaP после различных обработок, как определено в анализе МТС. Значения IC50 для СПА рассчитывают на основании семиточечного исследования (концентрации тестируемых соединений) и выражают в микромолях (мкМ). Результаты показаны в Таблице 1.


Как понятно из Таблицы 1, предпочтительные соединения в соответствии с данным изобретением показали более высокий потенциал в подавлении образования СПА в клетках рака простаты по сравнению с бикалутамидом.
Анализы жизнеспособности клеток
Клетки LNCaP и 22RV1 выдерживают в среде RPMI 1640 с добавлением 10% фетальной бычьей сыворотки (ФБС), 100 ед./мл пенициллина, 100 мкг/мл стрептомицина и 0,25 мкг/мл амфотерицина B, разделяя клетки, когда они достигают 80-90% конфлюентности. Для тестирования соединений 10000 клеток/лунку помещают в 96-луночные культуральные планшеты с применением 100 мкл/лунку пластинчатой среды, культивируют в течение ночи при 37°C в инкубаторе для клеточных культур. После осторожного удаления пластинчатой среды добавляют 80 мкл/лунку предварительно нагретой среды для исследования, затем добавляют 10 мкл/лунку тестируемых соединений или бикалутамида (конечная концентрация от 20 мкМ до 0,1 мкМ), инкубируют при 37°C в течение 30 минут, затем добавляют 10 мкл/лунку свежеприготовленного метилтриенолона (R1881, агонист АР) (конечная концентрация 1 нг/мл) в каждую лунку, инкубируют при 37°C в течение 48 часов. В конце инкубирования в каждую лунку добавляют 20 мкл MTT (2,5 мг/мл в ФРФБ), и клетки далее инкубируют в течение 2 ч при 37°С для полной реакции между красителем и ферментной митохондриальной дегидрогеназой в жизнеспособных клетках. После удаления остаточного красителя и среды 100 мкл диметилсульфоксида добавляют в каждую лунку, и абсорбцию при 570 нм измеряют с помощью микропланшетного ридера. Кратную индукцию над фоном на 1 нМ R1881 в отсутствие тестируемых соединений стандартизируют как 100%, и результаты эксперимента выражают как процент ингибирования тестируемыми соединениями в дозе 2,5 микромолей (мкМ). С помощью этого способа может быть определено ингибирование роста клеток.
Модели ксенотрансплантата опухоли
Более мощные ингибиторы в анализах СПА или анализах жизнеспособности клеток, описанных выше, с подходящими фармакокинетическими свойствами могут быть оценены далее на моделях ксенотрансплантата опухоли у мышей (например, LNCAP, 22rv1, VCAP) для определения эффективности in vivo. В этих исследованиях опухолевые клетки имплантируют животным с иммунодефицитом, и действие соединения на выживание, рост и метастазы опухолевых клеток, кроме других свойств, оценивают введением тестируемого соединения животному, обычно начиная в различное время после имплантации. С помощью этого исследования можно продемонстрировать, что соединения способны подавлять рост опухоли при лечении мышей соединениями. Более предпочтительно, соединения могут предотвращать повторный рост опухолей даже после остановки лечения лекарственными средствами (4-6 недель).
Модель роста волос у мышей C57BL/6
Мышей C57BL/6 в возрасте 6-8 недель, находящихся на стадии телогена цикла развития волоса, весящих 15-20 г, покупают и размещают в общую клетку в стандартных условиях. Фазу роста цикла развития волоса (анаген) вызывают на коже спины мышей, у которых все фолликулы находятся в стадии покоя цикла развития волоса (телоген; определяется гомогенным розовым цветом кожи) будучи сбритыми в нижней части спины с применением электрической бритвы под умеренной анестезией. В исследовании используют только мышей в телогенной фазе (розовая кожа). Двадцать микролитров тестируемого соединения в двух концентрациях в пропиленгликоле/этаноле (30:70, об./об.) или контрольного носителя наносят местно на бритую нижнюю часть спины мышей на площадь приблизительно 1 см2 (20 мкл/см2). В каждой группе используют пять мышей. Мышей обрабатывают соединением с помощью местного нанесения два раза в сутки (ДВД) в течение 4 недель. Местное раздражение записывают ежедневно перед каждым нанесением, и степень роста волос записывают дважды в неделю. Система оценки роста волос мышей включает от 0 до 4: 0 = нет роста волос, розовый цвет кожи; 1 = цвет кожи на бритых областях изменяется с розового на серый без видимого цвета волос, что указывает на наступление анагена; 2 = цвет кожи на бритых областях становится черным с тонкими волосками; 3 = короткие черные волосы на бритых областях; и 4 = волосы на бритых областях практически такие же, как вокруг. Ссылочный антагонист андрогенового рецептора (RU-58841) включен во все исследования для сравнения.
Реферат
Изобретение относится к области органической химии, а именно к новым производным тиогидантоина общей формулы (I) или к их фармацевтически приемлемым солям, где Z выбирают из CF, С-Салкокси и галогена; Y выбирают из галогена; W означает кислород; Rи Rнезависимо выбирают из С-Салкила, или Rи Rи атом углерода, к которому они присоединены, образуют 3-6-членное циклоалкильное кольцо; Aпредставляет собой фенил или пиридил, необязательно замещенные одним галогеном; Аявляется (СН)Y(СН)Q, где m и n являются целыми числами, независимо выбранными из 0-2, и где, по крайней мере, один из m или n не равен нулю; Q выбирают из C(O)NHR″, C(RR)C(O)NR″R″, циано, С(О)OR″, C(O)NR″R″ и 5-членного гетероарила, содержащего 2 гетероатома, выбранных из азота, кислорода и серы; и Yвыбирают из прямой связи и -О-; R″ и R″ независимо выбирают из водорода, С-Салкила, или NR″R″ вместе образуют 4-6-членное гетероциклическое кольцо, дополнительно содержащее 0-1 атомов кислорода, где один атом углерода может быть необязательно замещен одним гидроксилом; Rи Rнезависимо выбирают из водорода или метила; или C(RR) вместе образуют 3-5-членное циклическое алкильное кольцо. Также изобретение относится к фармацевтической композиции и местной фармацевтической композиции на основе производного тиогидантоина формулы (I). Технический результат: получены новые производные тиогидантоина, полезные для антагонизирования активности андрогенового рецептора. 4 н. и 13 з.п. ф-лы, 1 табл., 69 пр.
Формула

или его фармацевтически приемлемая соль,
где Z выбирают из CF3, С1-С3 алкокси и галогена;
Y выбирают из галогена;
W означает кислород;
R3 и R4 независимо выбирают из С1-С4 алкила, или R3 и R4 и атом углерода, к которому они присоединены, образуют 3-6-членное циклоалкильное кольцо;
A1 представляет собой фенил или пиридил, необязательно замещенные одним галогеном;
А2 является (СН2)mY1(СН2)nQ, где m и n являются целыми числами, независимо выбранными из 0-2, и где, по крайней мере, один из m или n не равен нулю; Q выбирают из C(O)NHR″, C(RxRy)C(O)NR″R1″, циано, С(О)OR″, C(O)NR″R1″ и 5-членного гетероарила, содержащего 2 гетероатома, выбранных из азота, кислорода и серы; и
Y1 выбирают из прямой связи и -О-;
R″ и R1″ независимо выбирают из водорода, С1-С6 алкила, или NR″R1″ вместе образуют 4-6-членное гетероциклическое кольцо, дополнительно содержащее 0-1 атомов кислорода, где один атом углерода может быть необязательно замещен одним гидроксилом;
Rx и Ry независимо выбирают из водорода или метила; или C(RxRy) вместе образуют 3-5-членное циклическое алкильное кольцо.












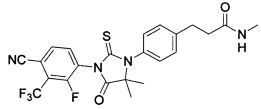












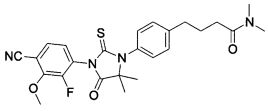
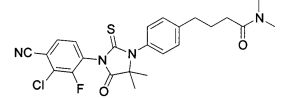
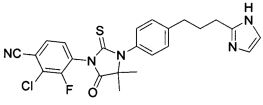

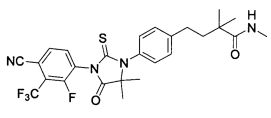
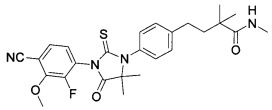





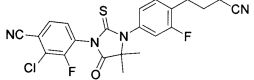








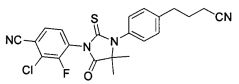




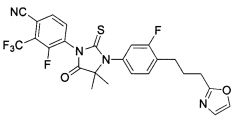
















или его фармацевтически приемлемая соль,
где Z означает CF3;
Y означает галоген;
W означает кислород;
R3 и R4 независимо выбирают из C1-C4 алкила;
A1 представляет собой фенил, замещенный одним галогеном;
А2 является (СН2)mY1(СН2)nQ, где m и n являются целыми числами, независимо выбранными из 0-3, и где, по крайней мере, один из m или n не равен нулю; Q означает

и Y1 означает прямую связь.
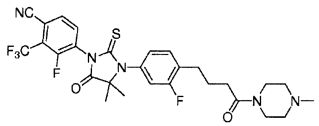
или его фармацевтически приемлемая соль.
Документы, цитированные в отчёте о поиске
Замещенные фенилимидазолидины, способы их получения (варианты) и фармацевтическая композиция на их основе

Комментарии