Замещенные 2-тиоксо-имидазолидин-4-оны и их спироаналоги, противораковый активный компонент, фармацевтическая композиция, лекарственный препарат, способ лечения рака простаты - RU2557235C1
Код документа: RU2557235C1
Описание
Настоящее изобретение относится к новым (R)-стереоизомерам замещенных 2-тиоксо-имидазолидин-4-онов и их спироаналогам, противораковому активному компоненту, фармацевтической композиции, противораковому лекарственному препарату, способу лечения рака простаты и рака молочной железы.
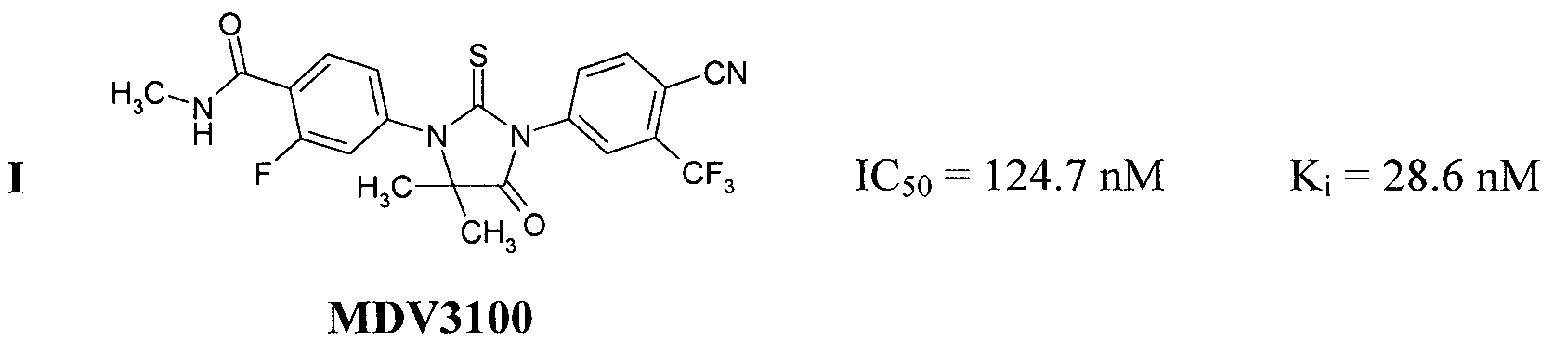
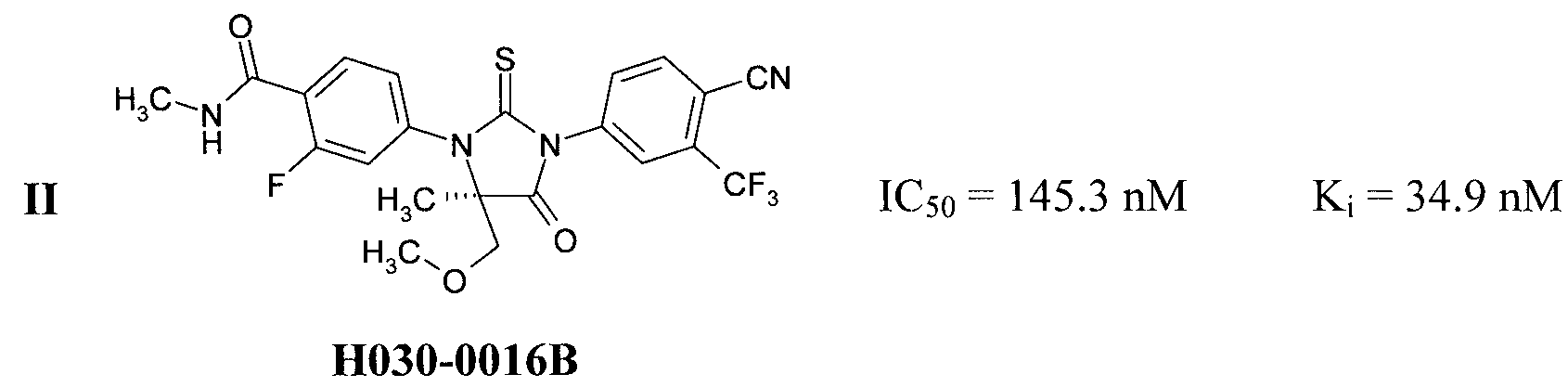
Известны антагонисты андрогеновых рецепторов, представляющие собой замещенные 2-тиоксо-имидазолидин-4-оны I [(a) WO/2006/124118 A1; (b) Sanford, M. Enzalutamide: A Review of Its Use in Metastatic, Castration-Resistant Prostate Cancer. Drugs (2013), 73 (15), 1723-1732, DOI: 10.1007/s40265-013-0129-9] и II WO/2012/011840]:
Известны также антагонисты андрогеновых рецепторов, представляющие собой замещенные спироаналоги 2-тиоксо-имидазолидин-4-онов III [Rathkopf DE1, Morris MJ, Fox JJ, Danila DC, Slovin SF, Hager JH, Rix PJ, Chow Maneval E, Chen I, Gönen M, Fleisher M, Larson SM, Sawyers CL, Scher HI. Phase I study of ARN-509, a novel antiandrogen, in the treatment of castration-resistant prostate cancer. J Clin Oncol. 2013 Oct 1; 31(28):3525-30. doi: 10.1200/JCO.2013.50.1684. Epub 2013 Sep 3.] и IV [(a) WO/2012/011840; (b) Ivachtchenko, A.V.; Mitkin, O.D.; Kudan, E.V.; Rjahovsky, A.A.; Vorobiev, A.A.; Trifelenkov, A.S.; Shevkun, N.A.; Proskurina, O.V.; Kravchenko, D.V.; Karapetian, R.N. Preclinical Development of ONC1-13B, Novel Antiandrogen for Prostate Cancer Treatment. J. Cancer 2014; 5(2):133-142. doi: 10.7150/jca.7773.]:
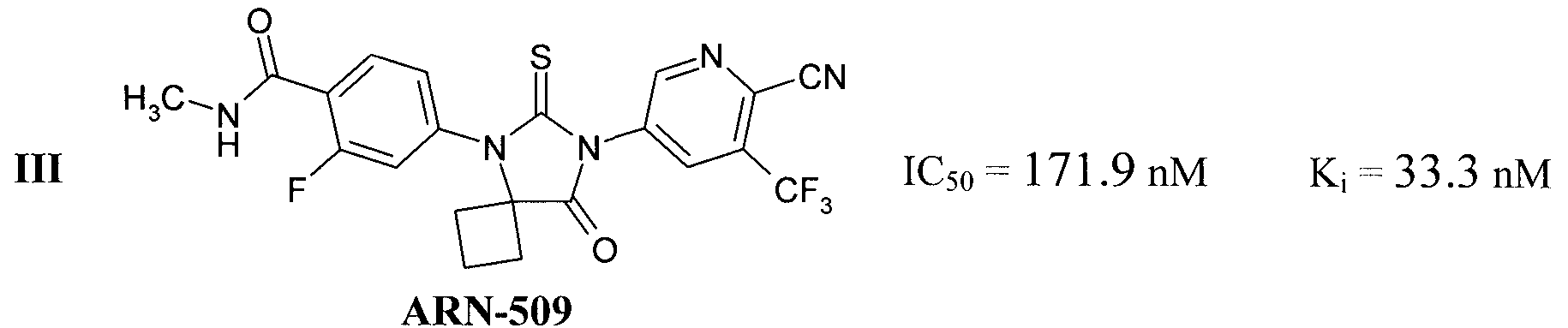
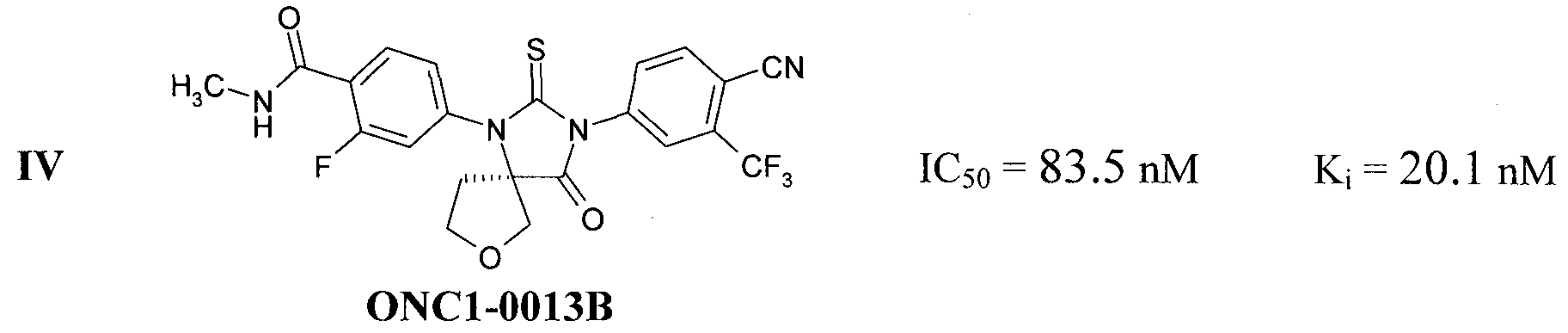
Антагонисты андрогеновых рецепторов III и IV в настоящее время находятся на стадии клинических исследований, а антагонист I, известный как Enzalutamide и Xtandi, a ранее известный как MDV3100, получил одобрение FDA в августе 2012 г. в качестве лекарства для лечения рака простаты [http://en.wikipedia.org/wiki/Enzalutamide].
Известно также, что антагонисты андрогеновых рецепторов перспективны для лечения рака молочной железы [D.R. Cochrane, B.M. Jacobsen, D.M. Cittelly, E.N. Howe, A. Jean, N.S. Spoelstra, S. Bernales, A.A. Protter, A.D. Elias, J.K. Richer. Abstract LB-109: MDV3100, an androgen receptor signaling inhibitor, inhibits tumor growth in breast cancer preclinical models regardless of estrogen receptor status. Cancer Research: April 15, 2012; Volume 72, Issue 8, Supplement 1. doi: 10.1158/1538-7445.AM2012-LB-109. Proceedings: AACR 103rd Annual Meeting Mar 31 - Apr 4, 2012; Chicago, IL 2012 American Association for Cancer Research, http://cancerres.aacrjournals.org/cgi/content/short/72/8_MeetingAbstracts/LB-109?rss=1].
Учитывая положительные результаты клинических исследований антагонистов андрогеновых рецепторов в качестве препаратов для лечения рака простаты, поиск более эффективных противораковых лекарственных препаратов, обладающих повышенной активностью и пониженной токсичностью, по-прежнему является одним из основных направлений создания новых фармакологических средств для лечения рака, в том числе и рака простаты. В этой связи актуальным является разработка новых противораковых субстанций, фармацевтических композиций и лекарственных препаратов, а также способов их получения и применения.
Подробное описание изобретения.
Ниже приведены определения терминов, которые использованы в описании этого изобретения.
«Алкил» означает алифатическую углеводородную линейную или разветвленную группу с 1-12 атомами углерода в цепи. Разветвленная означает, что алкильная цепь имеет один или несколько «низших алкильных» заместителей. Алкил может иметь один или несколько одинаковых или различных заместителей («алкильных заместителей») включая галоген, алкенилокси, циклоалкил, арил, гетероарил, гетероциклил, ароил, циано, гидрокси, алкокси, карбокси, алкинилокси, аралкокси, арилокси, арилоксикарбнил, алкилтио, гетероарилтио, аралкилтио, арилсульфонил, алкилсульфонилгетероаралкилокси и т.п.
«Алкилокси», или «Алкокси», означает алкил-O-группу, в которой алкил определен в данном разделе. Предпочтительными алкилокси группами являются метокси, этокси, н-пропокси, изо-пропокси и н-бутокси.
«Арил» означает ароматическую моноциклическую или полициклическую систему, включающую от 6 до 14 атомов углерода, преимущественно от 6 до 10 атомов углерода. Арил может содержать один или более «заместителей циклической системы», которые могут быть одинаковыми или разными. Представителями арильных групп являются фенил или нафтил, замещенный фенил или замещенный нафтил. Арил может быть анелирован с неароматической циклической системой или гетероциклом.
«Гетероциклил» означает ароматическую или неароматическую насыщенную моноциклическую или полициклическую систему, включающую от 3 до 10 атомов углерода, преимущественно от 5 до 6 атомов углерода, в которой один или несколько атомов углерода заменены на гетероатом, такой как азот, кислород, сера. Приставка «аза», «окса» или «тиа» перед гетероциклилом означает наличие в циклической системе атома азота, атома кислорода или атома серы соответственно. Гетероциклил может иметь один или несколько «заместителей циклической системы», которые могут быть одинаковыми или разными. Атомы азота и серы, находящиеся в гетероциклиле, могут быть окислены до N-оксида, S-оксида или S-диоксида. Представителями гетероциклилов являются пиперидин, пирролидин, пиперазин, морфолин, тиоморфолин, тиазолидин, 1,4-диоксан, тетрагидрофуран, тетрагидротиофен и др.
«Гидрат» - продукт присоединения воды (гидратации) к молекулам, атомам или ионам.
«Заместитель» означает химический радикал который присоединяется к скэффолду (фрагменту), например «заместитель алкильный», «заместитель амино группы», «заместитель карбамоильный», «заместитель циклической системы», значения которых определен в данном разделе.
«Лекарственная субстанция» (лекарственное вещество, drug-substance) означает физиологически активное вещество синтетического или иного (биотехнологического, растительного, животного, микробного и прочего) происхождения, обладающее фармакологической активностью и являющееся активным началом фармацевтической композиции, используемой для производства и изготовления лекарственного препарата (средства).
«Лекарственное средство (препарат)» - вещество (или смесь веществ в виде фармацевтической композиции) в виде таблеток капсул инъекций, мазей и др. готовых форм, предназначенное для восстановления, исправления или изменения физиологических функций у человека и животных, а также для лечения и профилактики болезней, диагностики, анестезии, контрацепции, косметологии и прочего.
«Низший алкил» означает линейный или разветвленный алкил с 1-4 атомами углерода.
«Терапевтический коктейль» представляет одновременно администрируемую комбинацию двух и более лекарственных препаратов, обладающих различным механизмом фармакологического действия и направленных на различные биомишени, участвующие в патогенезе заболевания.
«Фармацевтическая композиция» обозначает композицию, включающую в себя соединение формулы 1 и, по крайней мере, один из компонентов, выбранных из группы, состоящей из фармацевтически приемлемых и фармакологически совместимых наполнителей, растворителей, разбавителей, носителей, вспомогательных, распределяющих и воспринимающих средств, средств доставки, таких как консерванты, стабилизаторы, наполнители, измельчители, увлажнители, эмульгаторы, суспендирующие агенты, загустители, подсластители, отдушки, ароматизаторы, антибактериальные агенты, фунгициды, лубриканты, регуляторы пролонгированной доставки, выбор и соотношение которых зависит от природы и способа назначения и дозировки. Примерами суспендирующих агентов являются этоксилированный изостеариловый спирт, полиоксиэтилен, сорбитол и сорбитовый эфир, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, а также смеси этих веществ. Защита от действия микроорганизмов может быть обеспечена с помощью разнообразных антибактериальных и противогрибковых агентов, например, таких как, парабены, хлорбутанол, сорбиновая кислота и подобные им соединения. Композиция может включать также изотонические агенты, например, сахара, хлористый натрий и им подобные. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного начала, например, моностеарат алюминия и желатин. Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол, полиспирты, а также их смеси, растительные масла (такие, как оливковое масло) и инъекционные органические сложные эфиры (такие, как этилолеат). Примерами наполнителей являются лактоза, молочный сахар, цитрат натрия, карбонат кальция, фосфат кальция и им подобные. Примерами измельчителей и распределяющих средств являются крахмал, алгиновая кислота и ее соли, силикаты. Примерами лубрикантов являются стеарат магния, лаурилсульфат натрия, тальк, а также полиэтиленгликоль с высоким молекулярным весом. Фармацевтическая композиция для перорального, сублингвального, трансдермального, внутримышечного, внутривенного, подкожного, местного или ректального введения активного начала, одного или в комбинации с другим активным началом, может быть введена животным и людям в стандартной форме введения, в виде смеси с традиционными фармацевтическими носителями. Пригодные стандартные формы введения включают пероральные формы, такие как таблетки, желатиновые капсулы, пилюли, порошки, гранулы, жевательные резинки и пероральные растворы или суспензии, сублингвальные и трансбуккальные формы введения, аэрозоли, имплантаты, местные, трансдермальные, подкожные, внутримышечные, внутривенные, интраназальные или внутриглазные формы введения и ректальные формы введения. Фармацевтические композиции, как правило, получают с помощью стандартных процедур, предусматривающих смешение активного соединения с жидким или тонкоизмельченным твердым носителем.
Известные антагонисты андрогеновых рецепторов I-IV содержат 2-фтор-N-метил-4-(4-оксо-2-тиоксо-имидазолидин-1-ил)-бензамидный фрагмент. Авторы неожиданно обнаружили, что новые антагонисты андрогеновых рецепторов, содержащие вместо указанного фрагмента 2-фтор-4-(4-оксо-2-тиоксо-имидазолидин-1-ил)-бензамидный фрагмент или фрагмент 2-фтор-4-(4-оксо-2-тиоксо-имидазолидин-1-ил)-бензойной кислоты или ее алкилового или циклоалкилового эфира, проявляют более высокую антагонистическую активность по отношению к андрогеновым рецепторам.
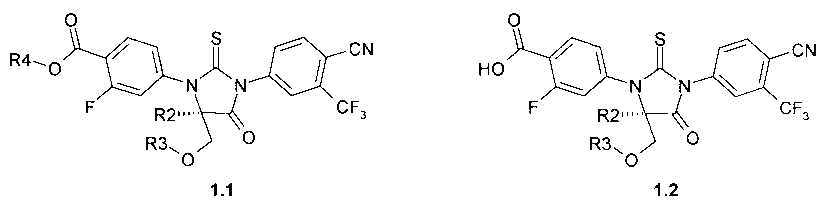
Предметом данного изобретения являются новые замещенные 2-тиоксо-имидазолидин-4-оны и их спироаналоги общей формулы 1:
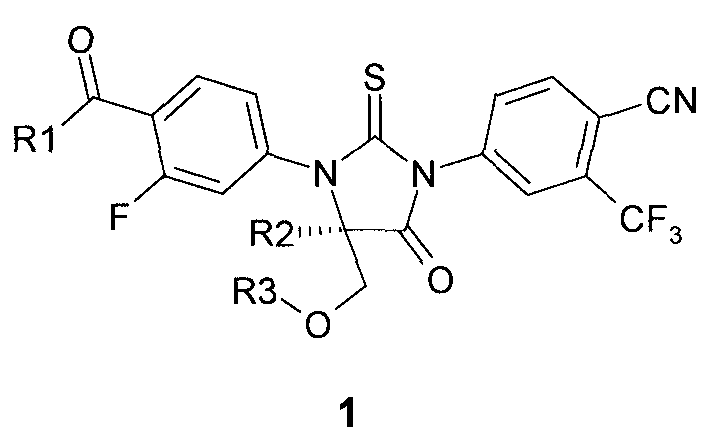
где R1 представляет собой OH, NH2, или OR4 группу;
R2 и R3 представляют собой метил, или
R2 и R3 вместе представляю собой CH2-CH2 группу;
R4 представляет собой C1-C4алкил или циклопропил.
Предпочтительными соединениями являются замещенные 2-тиоксо-имидазолидин-4-оны или их спироаналоги общей формулы 1.1 и 1.2:
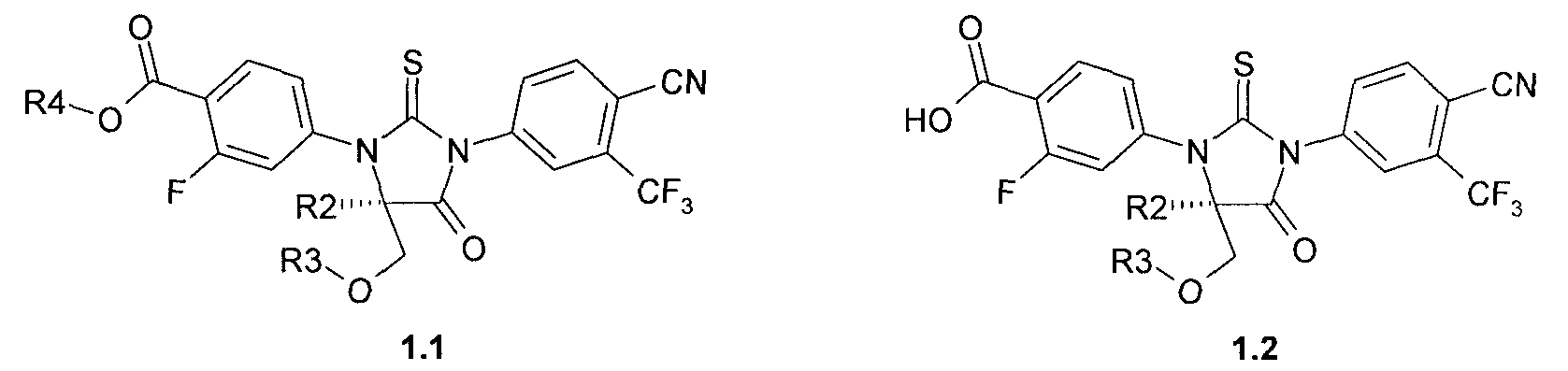
где R2, R3 и R4 имеют вышеуказанное значение.
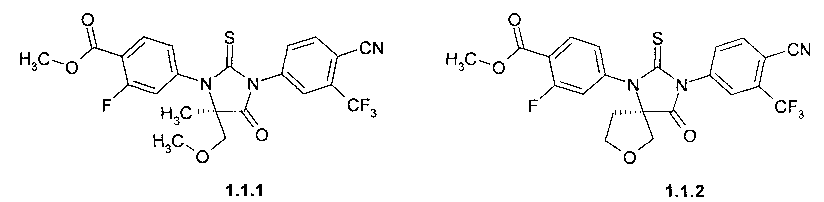
Более предпочтительными соединениями являются:
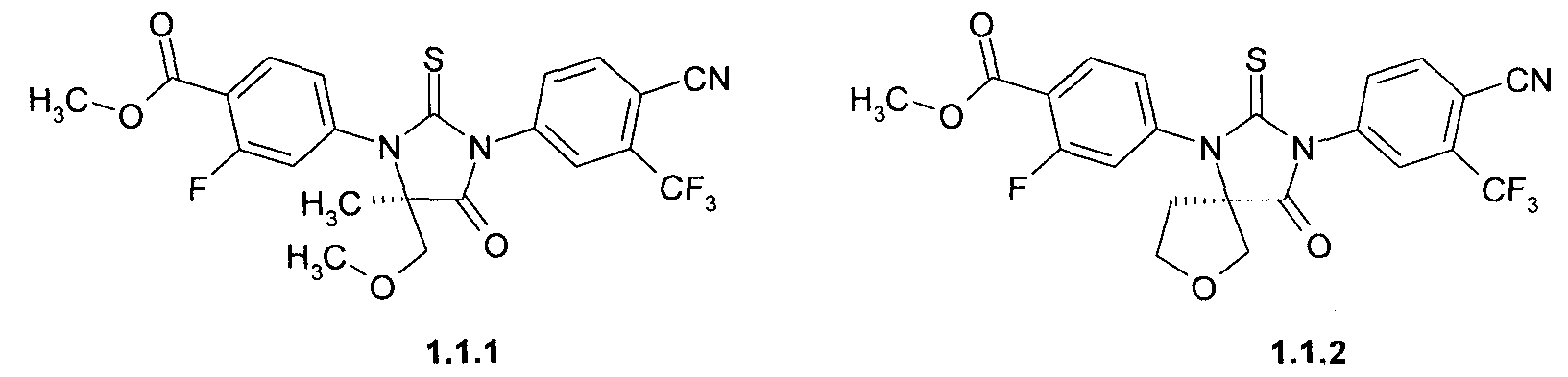
метил 4-[(R)-3-(3-метил-4-циано-фенил)-5-метил-5-метоксиметил-4-оксо-2-тиоксо-имидазолидин-1-ил]-2-фтор-бензоат 1.1.1,
метил 4-[(R)-3-(3-метил-4-циано-фенил)-4-оксо-2-тиоксо-7-окса-1,3-диаза-спиро[4.4]нон-1-ил]-2-фтор-бензоат 1.1.2,
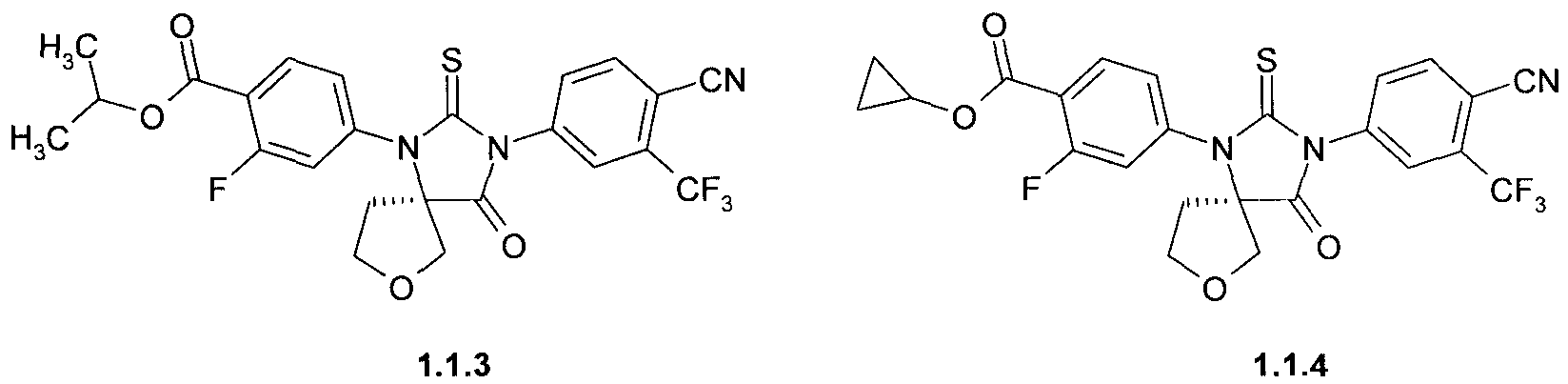
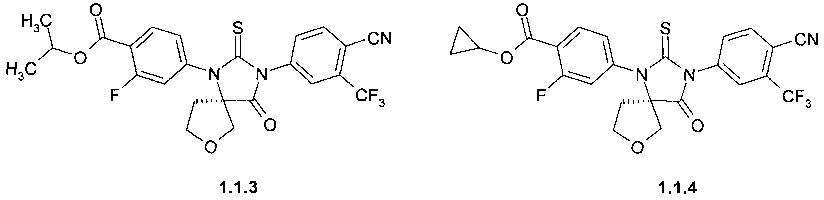
изопропил 4-[(R)-3-(3-метил-4-циано-фенил)-4-оксо-2-тиоксо-7-окса-1,3-диаза-спиро[4.4]нон-1-ил]-2-фтор-бензоат 1.1.3,
циклопропил 4-[(R)-3-(3-метил-4-циано-фенил)-4-оксо-2-тиоксо-7-окса-1,3-диаза-спиро[4.4]нон-1-ил]-2-фтор-бензоат 1.1.4,
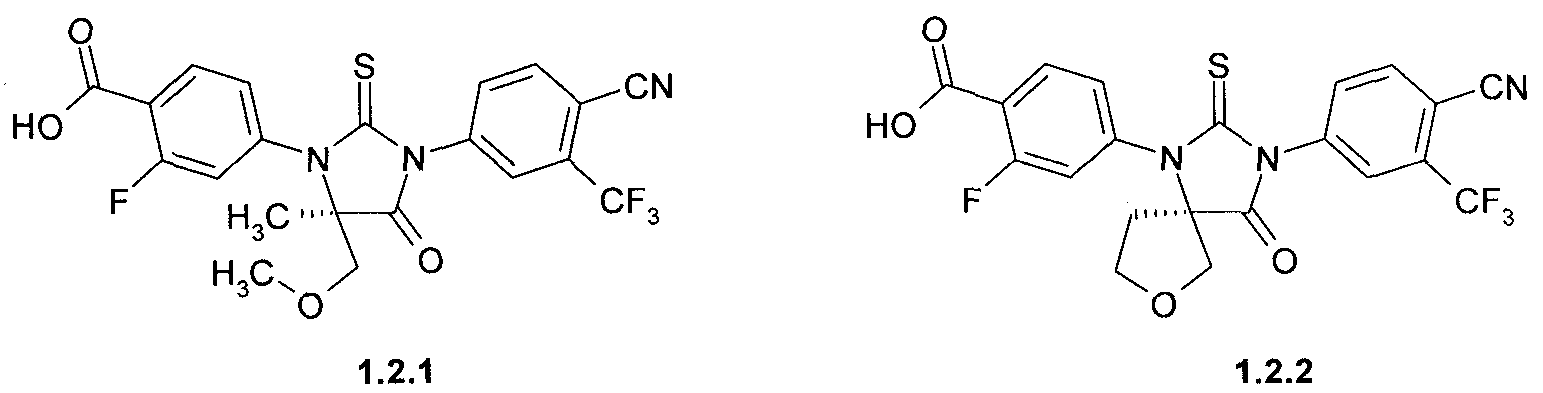
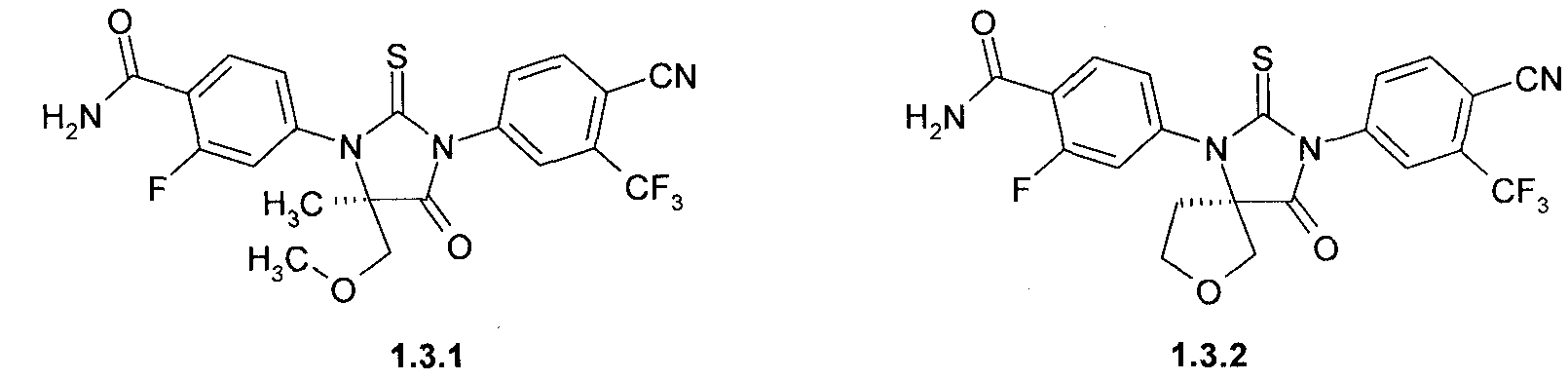
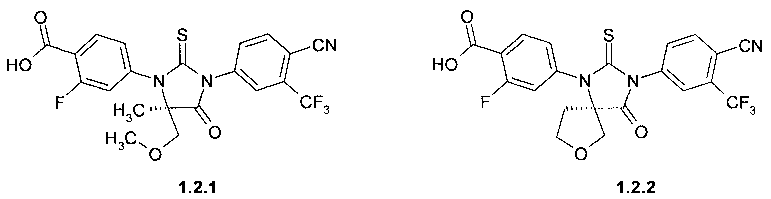
4- [(R)-3-(3-метил-4-циано-фенил)-5-метил-5-метоксиметил-4-оксо-2-тиоксо-имидазолидин-1-ил]-2-фтор-бензойная кислота 1.2.1,
4-[(R)-3-(3-метил-4-циано-фенил)-4-оксо-2-тиоксо-7-окса-1,3-диаза-спиро [4.4]нон-1-ил]-2-фтор-бензойная кислота 1.2.2,
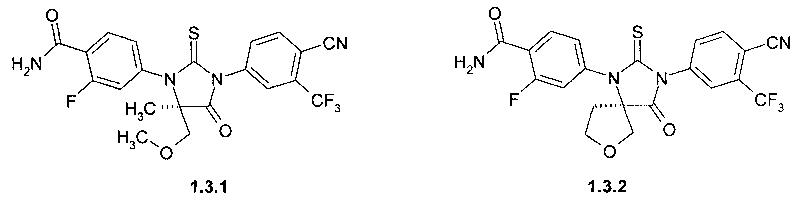
4-[(R)-3-(3-метил-4-циано-фенил)-5-метил-5-метоксиметил-4-оксо-2-тиоксо-имидазолидин-1-ил]-2-фтор-бензамид 1.3.1, или
4-[(R)-3-(3-метил-4-циано-фенил)-4-оксо-2-тиоксо-7-окса-1,3-диаза-спиро[4.4]нон-1-ил]-2-фтор-бензамид 1.3.2:
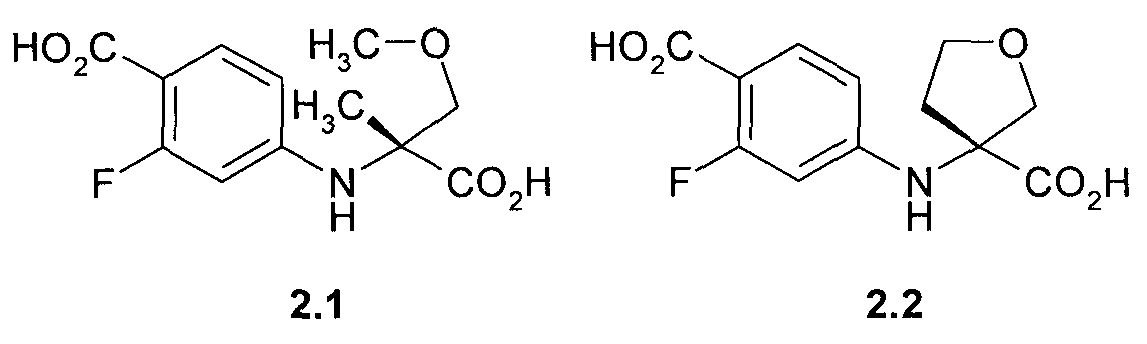
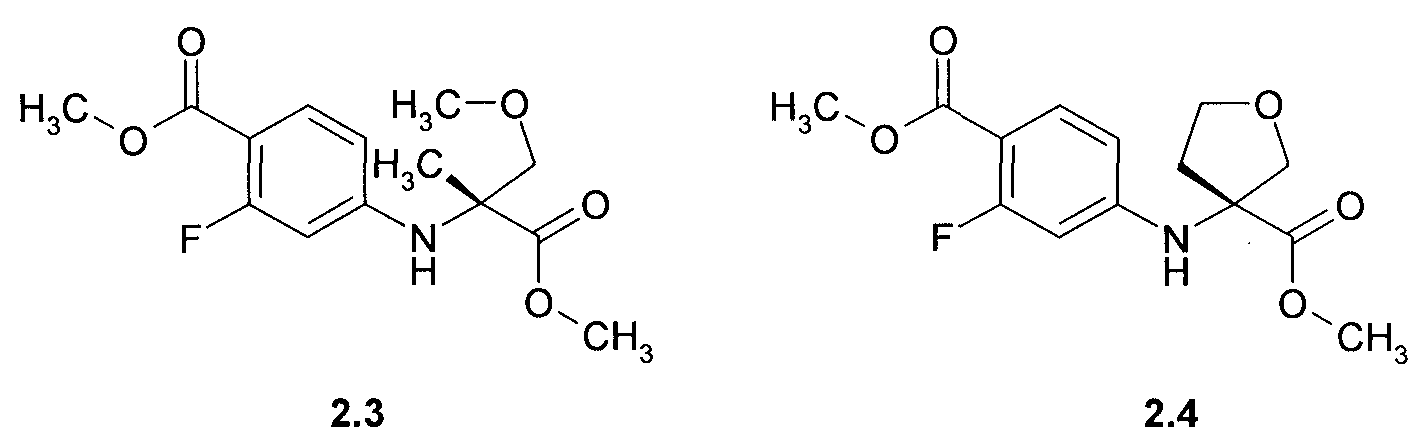
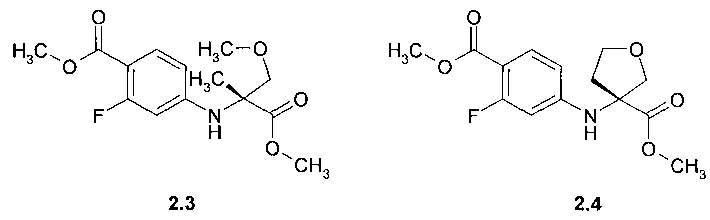
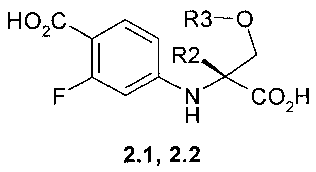
Предметом данного изобретения являются соединения, выбранные из группы, включающей в себя 4-((R)-1-карбокси-1-метил-2-метокси-этиламино)-2-фтор-бензойная кислота 2.1, (R)-3-(4-карбокси-3-фтор-фениламино)-тетрагидрофуран-3-карбоновая кислота 2.2, метил 4-((R)-1-метил-2-метокси-1-метоксикарбонил-этиламино)-2-фтор-бензоат 2.3, и метил (R)-3-(4-метоксикарбонил-3-фтор-фениламино)-тетрагидрофуран-3-карбоксилат 2.4, которые являются полупродуктами синтеза соединений общей формулы 1:
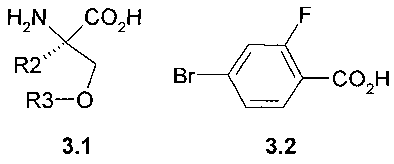
Предметом данного изобретения является способ получения соединений общей формулы 2.1 и 2.2, который заключается во взаимодействии (R)-стереоизомера аминокислоты общей формулы 3.1 с 4-бром-2-фторбензойной кислотой 3.2 в диметилформамиде в присутствии Cul и основания при повышенной температуре (Схема 1):
Схема 1
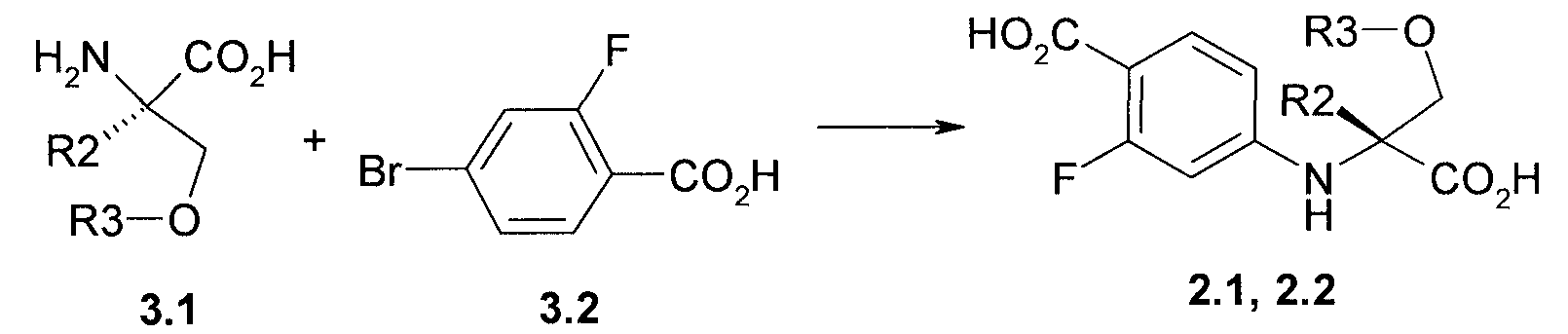
где R2=R3=CH3 или R2 и R3 вместе представляюет собой CH2-CH2 группу.
Предметом данного изобретения является способ получения соединений общей формулы 2.3 и 2.4, который заключается во взаимодействии соответствующих (R)-стереоизомеров дикислот 2.1 и 2.2 со спиртом в присутствии хлористого тионила (Схема 2):
Схема 2
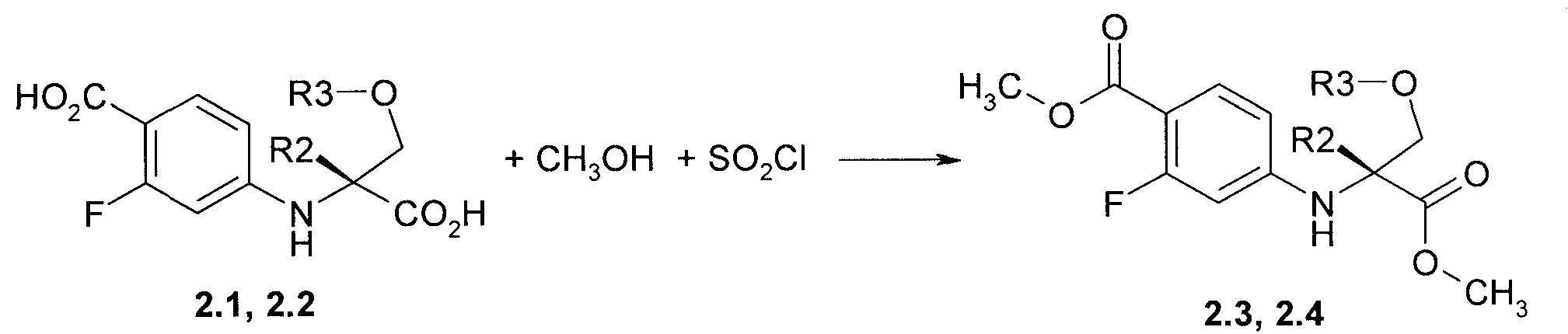
где R2=R3=CH3 или R2 и R3 вместе представляюет собой CH2-CH2 группу.
Предметом данного изобретения является способ получения соединений общей формулы 1.1.1, 1.1.2, который заключается во взаимодействии соответствующих (R)-стереоизомеров диэфиров 2.3 и 2.4 с 4-циано-3-трифторметил-бензолизотиоцианатом 3.3 при повышенной температуре (Схема 3):
Схема 3
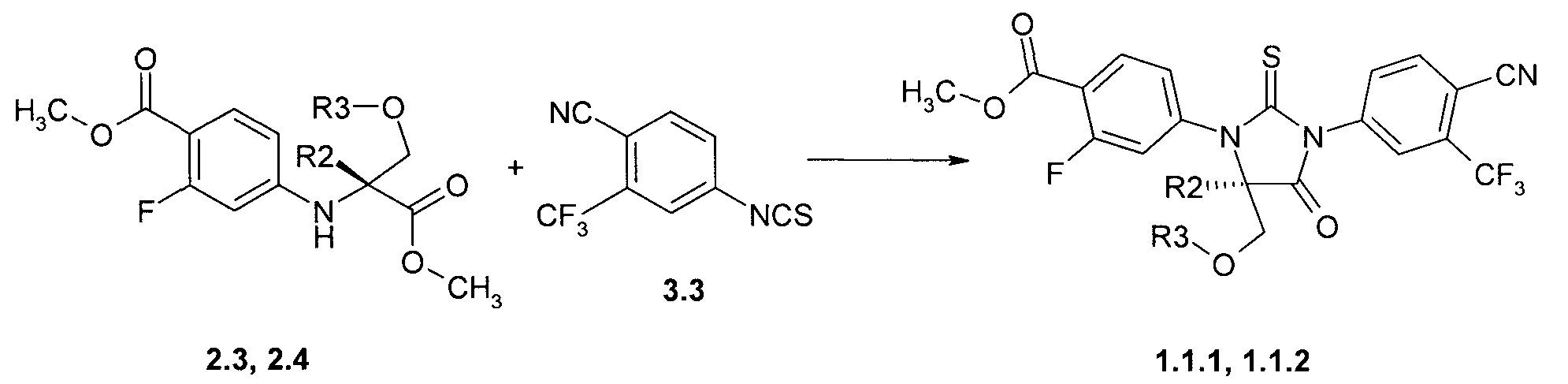
где R2 и R3 имеют вышеуказанное значение.
Предметом данного изобретения является способ получения (R)-стереоизомеров кислот формулы 1.2.1, 1.2.2, щелочным гидролизом (R)-стереоизомеров эфиров общей формулы 1.1.1, 1.1.2 (Схема 4):
Схема 4
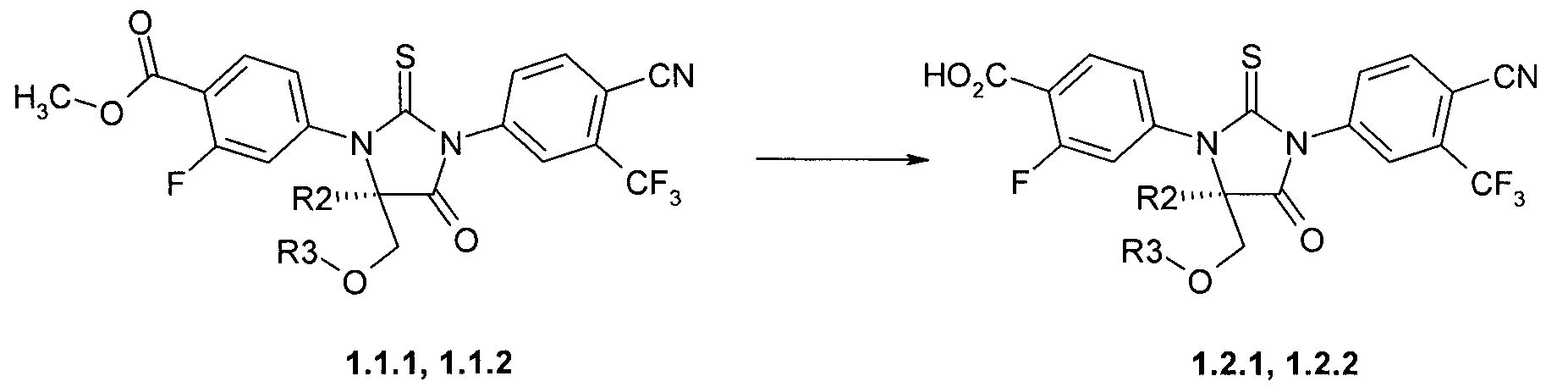
где R2 и R3 имеют вышеуказанное значение.
Предметом данного изобретения является способ получения (R)-стереоизомеров эфиров общей формулы 1.1, который заключается во взаимодействии (R)-стереоизомеров кислот формулы 1.2 со спиртом R4OH и хлористым тионилом (Схема 5):
Схема 5
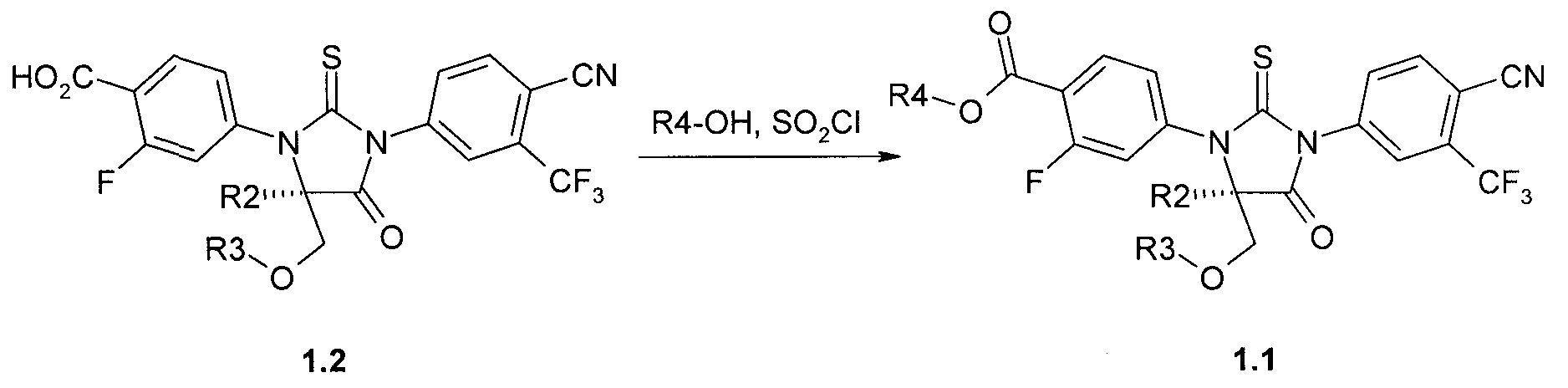
где R2, R3 и R4 имеют вышеуказанное значение.
Предметом данного изобретения является способ получения (R)-стереоизомеров амидов 1.3.1, 1.3.2, который заключается во взаимодействии (R)-стереоизомеров кислот общей формулы 1.2 с хлористым аммонием в присутствии N-(3-диметиламинопропил)-N′-этилкарбодиимида, 1-гидроксибензотриазола, и триэтиламина в диметилформамиде (Схема 6:
Схема 6
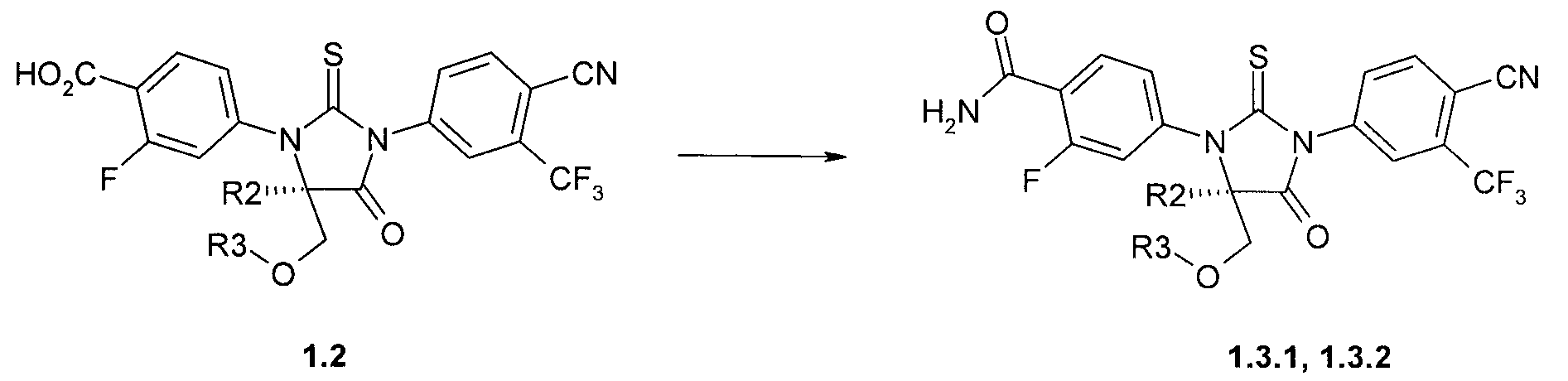
где R2 и R3 имеют вышеуказанное значение.
Новые соединения общей формулы 1 являются антагонистами андрогеновых рецепторов, причем неожиданно по активности они превосходят все известные антагонисты андрогеновых рецепторов (Табл. 1). Как видно из Табл. 1, новые соединения более активны, чем известные аналоги, причем наиболее активным из них является соединение 1.1.2 с Ki=5,6 nM, которое в 5,1 раз активнее MDV3100, в 5,9 раз активнее ARN-509, и в 3,6 раз активнее ONC1-0013B. Отметим, что более высокая активность препаратов позволяет использовать при лечении рака более низкие дозы, что при прочих равных условиях приводит к снижению токсичности и, следовательно, уменьшению действия побочных эффектов.
Предметом данного изобретения является новый противораковый активный компонент, представляющий собой по крайней мере одно соединение общей формулы 1.
Предметом данного изобретения является также фармацевтическая композиция, обладающая противораковой активностью и содержащая в качестве активного компонента по крайней мере одно соединение общей формулы 1.
Более предпочтительной является фармацевтическая композиция, предназначенная для лечения рака простаты, содержащая в качестве активного компонента по крайней мере одно соединение общей формулы 1.
Более предпочтительной является также фармацевтическая композиция, предназначенная для лечения рака молочной железы, содержащая в качестве активного компонента по крайней мере одно соединение общей формулы 1.
Фармацевтические композиции могут включать фармацевтически приемлемые эксципиенты. Под фармацевтически приемлемыми экспициентами подразумеваются применяемые в сфере фармацевтики разбавители, вспомогательные агенты и/или носители. Фармацевтическая композиция наряду с соединением общей формулы 1 по настоящему изобретению может включать и другие активные компоненты, в том числе обладающие противораковой активностью, при условии, что они не вызывают нежелательных эффектов.
При необходимости использования фармацевтической композиции по настоящему изобретению в клинической практике она может смешиваться с традиционными фармацевтическими носителями.
Носители, используемые в фармацевтических композиций по настоящему изобретению, представляют собой носители, которые применяются в сфере фармацевтики для получения распространенных форм, в том числе в пероральных формах используются связующие вещества, смазывающие агенты, дезинтеграторы, растворители, разбавители, стабилизаторы, суспендирующие агенты, бесцветные агенты, корригенты вкуса; в формах для инъекций используются антисептические агенты, солюбилизаторы, стабилизаторы; в местных формах используются основы, разбавители, смазывающие агенты, антисептические агенты.
Целью настоящего изобретения также является способ получения фармацевтической композиции.
Поставленная цель достигается смешением активного компонента с инертным наполнителем и/или растворителем, отличительная особенность которого состоит в том, что в качестве активного компонента используется по крайней мере одно соединение общей формулы 1.
Предметом данного изобретения является также лекарственный препарат в форме таблеток, капсул или инъекций, включающий в свой состав новый активный компонент или новую фармацевтическую композицию, предназначенный для лечения рака.
Более предпочтительными лекарственными препаратами, включающими в свой состав новый активный компонент или новую фармацевтическую композицию, являются препараты, предназначенные для лечения рака простаты.
Предметом данного изобретения являются также терапевтические коктейли для лечения раковых заболеваний, в том числе заболеваний рака простаты, включающие в качестве одного из компонентов новый лекарственный препарат или новую фармацевтическую композицию, содержащие в качестве активного компонента по крайней мере одно соединение общей формулы 1.
Терапевтический коктейль для лечения рака простаты наряду с лекарственным средством по данному изобретению может включать другие известные препараты, предназначенные для лечения раковых заболеваний.
В соответствии с данным изобретением способ лечения раковых заболеваний животных и людей, в том числе рака простаты, заключается во введении теплокровному животному или человеку нового лекарственного препарата, новой фармацевтической композиции или нового терапевтического коктейля.
Лекарственные средства могут вводиться перорально или парентерально (например, внутривенно, подкожно, внутрибрюшинно или местно). Клиническая дозировка активного компонента общей формулы 1 у пациентов может корректироваться в зависимости от терапевтической эффективности и биодоступности активных ингредиентов в организме, скорости их обмена и выведения из организма, а также в зависимости от возраста, пола и стадии заболевания пациента, при этом суточная доза у взрослых обычно составляет 10~500 мг, предпочтительно - 50~300 мг. Поэтому во время приготовления из фармацевтической композиции лекарственного средства по настоящему изобретению в виде единиц дозировки необходимо учитывать вышеназванную эффективную дозировку, при этом каждая единица дозировки препарата должна содержать 10~500 мг активного компонента общей формулы 1 предпочтительно - 50~500 мг. В соответствии с указаниями врача или фармацевта данные препараты могут приниматься несколько раз в течение определенных промежутков времени (предпочтительно - от одного до шести раз).
В представленных ниже примерах описан синтез соединений общей формулы 1 и их биологические испытания. Представленные ниже примеры демонстрируют, но не ограничивают данное изобретение.
Пример 1. Общий способ получения 4-((R)-1-карбокси-1-метил-2-метокси-этиламино)-2-фтор-бензойной кислоты 2.1 и (R)-3-(4-карбокси-3-фтор-фениламино)-тетрагидрофуран-3-карбоновой кислоты 2.2. Смесь (R)-стереоизомера аминокислоты 3.1 (85 ммоль), 15.5 г (71 ммоль) 4-бром-2-фторбензойной кислоты 3.2, 39.3 г (284 ммоль) K2CO3, 2.02 г (10.6 ммоль) Cul и 2 г (14.3 ммоль) 2-ацетилциклогексанона в 150 мл диметилформамида и 35 мл воды перемешивают при 100°C 2 дня. Реакционную массу упаривают в вакууме, остаток обрабатывают водой, подкисленной соляной кислотой до pH 2-3, и снова упаривают в вакууме. Получают 4-((R)-1-карбокси-1-метил-2-метокси-этиламино)-2-фтор-бензойную кислоту 2.1 (LC-MS (ESI) 272 (M+H)+) или (R)-3-(4-карбокси-3-фтор-фениламино)-тетрагидрофуран-3-карбоновую кислоту 2.2 (LC-MS (ESI) 270 (M+H)+), которые используют в дальнейших синтезах без дополнительной очистки.
Пример 2. Общий способ получения метил 4-((R)-1-метил-2-метокси-1-метоксикарбонил-этиламино)-2-фтор-бензоата 2.3 и метил (R)-3-(4-метоксикарбонил-3-фтор-фениламино)-тетрагидрофуран-3-карбоксилата 2.4. К раствору полученной в примере 1 дикислоты 2.1 или 2.2 в 150 мл метанола, охлажденному в ледяной бане, прибавляют 13 мл (177 ммоль) тионил хлорида. Полученную смесь кипятят 15 часов, охлаждают до комнатной температуры и упаривают в вакууме. К остатку прибавляют 200 мл этилацетата и раствор 8.95 г (107 ммоль) NaHCO3 в 100 мл воды. Отделяют органический слой, упаривают в вакууме, остаток хроматографируют на силикагеле, элюэнт-дихлорметан. Получают метил 4-((R)-1-метил-2-метокси-1-метоксикарбонил-этиламино)-2-фтор-бензоат 2.3 с выходом 62% (LC-MS (ESI) 300 (M+H)+) или метил (R)-3-(4-метоксикарбонил-3-фтор-фениламино)-тетрагидрофуран-3-карбоксилат 2.4 с выходом 58%: LC-MS (ESI) 298 (M+H)+;1H NMR (CDCl3, 400 MHz) δ 7.78 (t, J=8.8 Hz, 1H), 6.32 (dd, J1=8.8 Hz, J2=2.4 Hz, 1H), 6.21 (dd, J1=13.6 Hz, J2=2.4 Hz, 1H), 4.82 (brs, 1H), 4.18 (d, J=9.4 Hz, 1H), 4.07 (m, 2H), 4.00 (d, J=9.4 Hz, 1H), 3.88 (s, 3H), 3.77 (s, 3H), 2.71 (m, 1H), 2.29 (m, 1H).
Пример 3. Общий способ получения метил 4-[(R)-3-(3-метил-4-циано-фенил)-5-метил-5-метоксиметил-4-оксо-2-тиоксо-имидазолидин-1-ил]-2-фтор-бензоата 1.1.1 или метил 4-[(R)-3-(3-метил-4-циано-фенил)-4-оксо-2-тиоксо-7-окса-1,3-диаза-спиро[4.4]нон-1-ил]-2-фтор-бензоата 1.1.2. Смесь 41 ммоль метил 4-((R)-1-метил-2-метокси-1-метоксикарбонил-этиламино)-2-фтор-бензоата 2.3 или метил (R)-3-(4-метоксикарбонил-3-фтор-фениламино)-тетрагидрофуран-3-карбоксилата 2.4, 18.7 г (82 ммоль) 4-циано-3-трифторметил-бензолизотиоцианата 3.3, 2.9 мл диметилсульфоксида и 16 мл этилацетата перемешивают при 85°C 48 h, добавляют 2 мл метанола и перемешивают еще 30 мин при 85°C. Реакционную массу охлаждают до 20°C, упаривают в вакууме и остаток хроматографируют на силикагеле, элюэнт-дихлорметан. После перекристаллизации из метанола получают 4-[(R)-3-(3-метил-4-циано-фенил)-5-метил-5-метоксиметил-4-оксо-2-тиоксо-имидазолидин-1-ил]-2-фтор-бензоат 1.1.1 с выходом 42% (LC-MS (ESI) 496 (M+H)+) или метил 4-[(R)-3-(3-метил-4-циано-фенил)-4-оксо-2-тиоксо-7-окса-1,3-диаза-спиро[4.4]нон-1-ил]-2-фтор-бензоат 1.1.2 с выходом 34%: LC-MS (ESI) 494 (M+H)+;1H NMR (CDCl3, 400 MHz) δ 8.14 (t, J=8.0 Hz, 1H), 8.01 (d, J=8.4 Hz, 1H), 7.97 (d, J=2.9 Hz, 1H), 7.85 (dd, J1=8.4 Hz, J2=2.0 Hz, 1H), 7.27 (m, 2H), 4.42 (d, J=10.2 Hz, 1H), 4.15 (d, J=10.2 Hz, 1H), 3.99 (s, 3H), 3.96 (m, 1H), 3.76 (m, 1H), 2.73 (m, 1H), 2.47 (m, 1H).
Пример 4. Общий способ получения 4-[(R)-3-(3-метил-4-циано-фенил)-5-метил-5-метоксиметил-4-оксо-2-тиоксо-имидазолидин-1-ил]-2-фтор-бензойной кислоты 1.2.1 или 4-[(R)-3-(3-метил-4-циано-фенил)-4-оксо-2-тиоксо-7-окса-1,3-диаза-спиро[4.4]нон-1-ил]-2-фтор-бензойной кислоты 1.2.2. К раствору метилового эфира 1.1.1 или 1.1.2 (0.41 ммоль) в 3 мл метанола прибавляют 16.5 мг (0.41 ммоль) NaOH в 2 мл воды и перемешивают полученную смесь 12 часов, после чего упаривают в вакууме. К остатку добавляют 10 мл воды и подкисляют полученный раствор до pH 3 соляной кислотой. Выпавший осадок отфильтровывают, промывают водой и сушат в вакууме. Получают кислоту 1.1.1 с выходом 90%, LC-MS (ESI) 493 (M+H)+ или кислоту 1.1.2 с выходом 92%, LC-MS (ESI) 490 (M+H)+;1H NMR (DMSO-d6, 400 MHz) δ 13.53 (brs, 1H), 8.40 (d, J=8.4 Hz, 1H), 8.26 (s, 1H), 8.08 (dd, J1=8.4 Hz, J2=1.2 Hz, 1H), 8.03 (t, J=8.4 Hz, 1H), 7.57 (dd, J1=11.2 Hz, J2=1.2 Hz, 1H), 7.48 (dd, J1=8.4 Hz, J2=1.2 Hz, 1H), 4.43 (d, J=10.8 Hz, 1H), 3.94 (d, J=10.8 Hz, 1H), 3.75 (q, J=8.0 Hz, 1H), 3.53 (q, J=8.0 Hz, 1H), 2.58 (t, J=7.2 Hz, 2H).
Пример 5. Общий способ получения 4-[(R)-3-(3-метил-4-циано-фенил)-5-метил-5-метоксиметил-4-оксо-2-тиоксо-имидазолидин-1-ил]-2-фтор-бензамида 1.3.1 или 4-[(R)-3-(3-метил-4-циано-фенил)-4-оксо-2-тиоксо-7-окса-1,3-диаза-спиро[4.4]нон-1-ил]-2-фтор-бензамида 1.3.2. Смесь 0.37 ммоль кислоты 1.2.1 или 1.2.2, 107 мк (0.55 ммоль) N-(3-диметиламинопропил)-N′-этилкарбодиимида (EDAC), 75 мг (0.55 ммоль) 1-гидроксибензотриазола (HOBt), 26 мг (0.48 ммоль) хлорида аммония и 52 мл (0.37 ммоль) триэтиламина в 3 мл ДМФА перемешивают 2 часа. Реакционную массу упаривают, остаток растворяют в дихлорметане, промывают 10% водным раствором карбоната натрия, сушат сульфатом натрия, упаривают и очищают с помощью HPLC. Выход амида 1.3.1 51%, LC-MS (ESI) 491 (M+H)+. Выход амида 1.3.2 48%, LC-MS (ESI) 489 (M+H)+;1H NMR (DMSO-d6, 400 MHz) δ 8.40 (d, J=8.0 Hz, 1H), 8.26 (d, J=1.6 Hx, 1H), 8.08 (dd, J1=8.0 Hz, J2=1.6 Hz, 1H), 7.92 (s, 1H), 7.79 (t, J=8.0 Hz, 1H), 7.76 (s, 1H), 7.53 (dd, J1=10.8 Hz, J2=1.6 Hz, 1H), 7.43 (dd, J1=8.0 Hz, J2=1.6 Hz, 1H), 4.42 (d, J=10.6 Hz, 1H), 3.94 (d, J=10.6 Hz, 1H). 3.75 (m, 1H), 3.53 (m, 1H), 2.58 (m, 2H).
Пример 6. Общий способ получения метил 4-[(R)-3-(3-метил-4-циано-фенил)-5-метил-5-метоксиметил-4-оксо-2-тиоксо-имидазолидин-1-ил]-2-фтор-бензоата 1.1.1, метил 4-[(R)-3-(3-метил-4-циано-фенил)-4-оксо-2-тиоксо-7-окса-1,3-диаза-спиро[4.4]нон-1-ил]-2-фтор-бензоата 1.1.2, изопропил 4-[(R)-3-(3-метил-4-циано-фенил)-4-оксо-2-тиоксо-7-окса-1,3-диаза-спиро[4.4]нон-1-ил]-2-фтор-бензоата 1.1.3 или циклопропил 4-[(R)-3-(3-метил-4-циано-фенил)-4-оксо-2-тиоксо-7-окса-1,3-диаза-спиро[4.4]нон-1-ил]-2-фтор-бензоата 1.1.4. К раствору кислоты 1.2.1 или 1.2.2 в 150 мл соответствующего спирта, охлажденному на ледяной бане, прибавляют 13 мл (177 ммоль) тионил хлорида. Полученную смесь кипятят 15 часов, охлаждают 20°C и упаривают. К остатку прибавляют 200 мл этилацетата и раствор 8.95 г (107 ммоль) NaHCO3 в 100 мл воды. Отделяют органический слой, упаривают в вакууме, а остаток хроматографируют на силикагеле, элюэнт-дихлорметан. Получают эфиры 1.1.1 (LC-MS (ESI) 496 (M+H)+), 1.1.2 (LC-MS (ESI) 494 (M+H)+), 1.1.3 (LC-MS (ESI) 522 (M+H)+) или 1.1.4 (LC-MS (ESI) 500 (M+H)+) с выходом 55-62%.
Пример 7. Определение антагонистической активности новых соединений общей формулы 1 и их аналогов по отношению к андрогеновым рецепторам. Способность новых соединений общей формулы 1 и их аналогов блокировать андрогеновые рецепторы определяли по их эффективности ингбирования ситмулированной дегидротестостероном экспрессии специфического для простаты антигена (ПСА) в канцерных клетках простаты человека LNCap, полученных из Американского банка тканевых культур (ATCC, США). Эти клетки чувствительны к 5-α-дигидротестостерону (ДГТ) и продуцируют канцерный маркер (ПСА) в его присутствии. Клетки выращивали в RPMI 1640 среде (Invitrogen, США), содержащей 10% телячью сыворотку (Hyclone, США), 1% антибактериальную/антигрибковую смесь (Sigma, США) и 4,5% глюкозу. Перед экспериментами клетки отмывали и суспендировали в ту же среду, где, однако, телячья сыворотка была заменена на сыворотку, обработанную для удаления следов гормонов активированным углем. Клетки разливали по 100 мкл (10000 клеток) в ячейки 96-луночноых плашек и оставляли на 4 суток в инкубаторе при 37°C (100% влажности) в атмосфере 95% воздух/5% CO2. После 4-дневной инкубации к клеткам добавляли последовательно соединения общей формулы 1 или их аналоги в различных концентрациях и 20 nM ДГТ (концентрация соответствующая 80-90% от максимальной стимуляции). Клетки оставляли на 5 суток для дополнительной инкубации в тех же условиях. Затем образцы надклеточной среды отбирали для анализа на содержание ПСА. Анализ проводили по протоколу, рекомендованному производителем набора для определения ПСА (Alpha Diagnostic International, США). После увлажнения лунок, содержащих на донышке прикрепленные антитела против ПСА, к ним добавляли по 25 мкл образцов и затем по 100 мкл антител так же против ПСА, к которым конъюгирована пероксидаза хрена. После 30-минутной инкубации при комнатной температуре содержимое лунок удаляли, лунки несколько раз промывали и в лунки заливали по 100 мкл хромогенного субстрата пероксидазы. Плашки выдерживали 15 минут при комнатной температуре, в лунки добавляли по 50 мкл стоп раствора, и интенсивность развившейся окраски измеряли по поглощению при 450 нм. Интенсивность поглощения пропорциональна концентрации ПСА в образце. Определение концентрационных зависимостей блокирования андрогеновых рецепторов позволило определить IC50 и Ki, которые представлены Табл. 1.
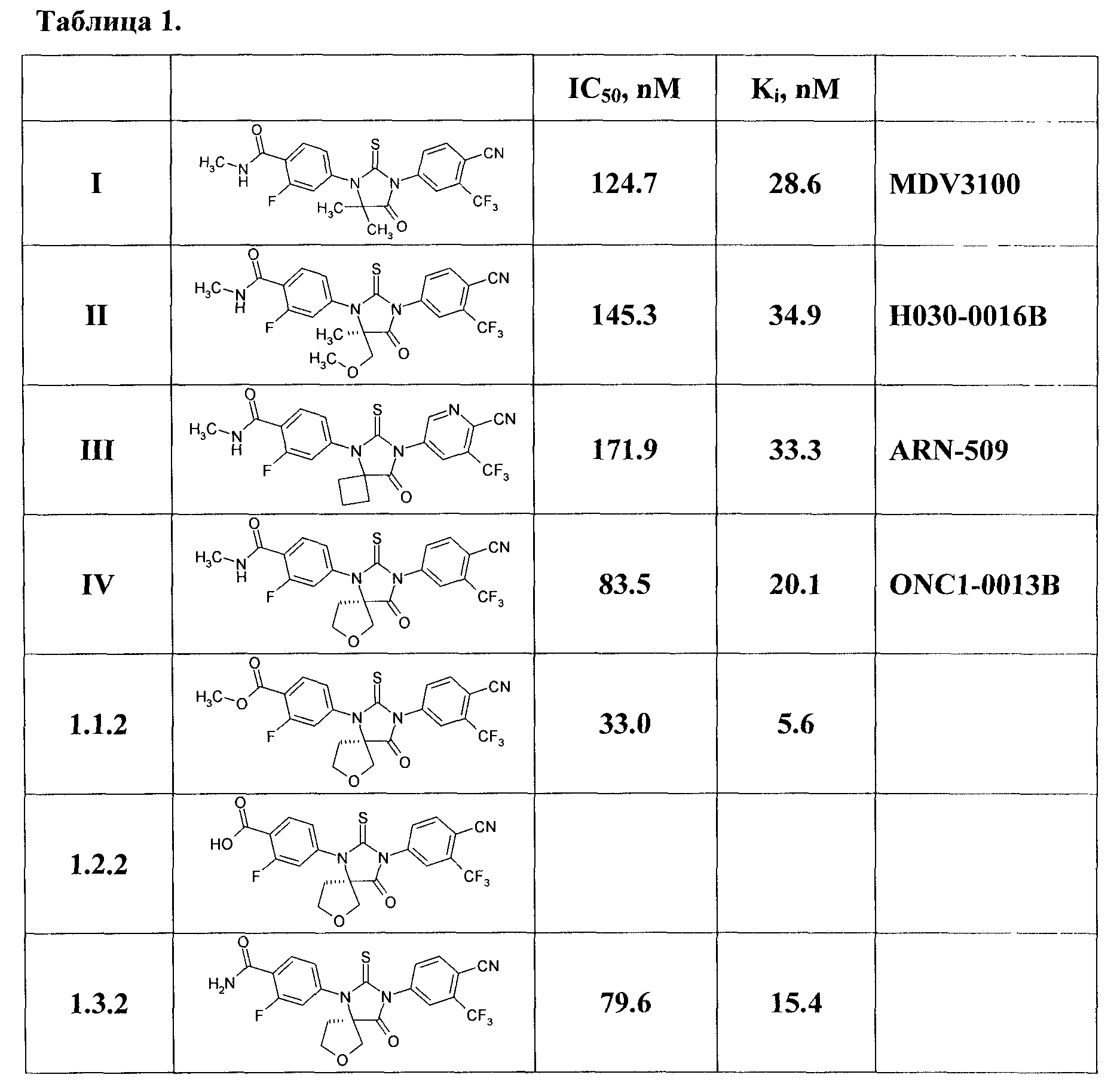
Как видно из Табл. 1, новые соединения более активны, чем известные аналоги, причем наиболее активным из них является соединение 1.1.2 с Ki=5,6 nM, которое в 5,1 раз активнее MDV3100, в 5,9 раз активнее ARN-509, и в 3,6 раз активнее ONC1-0013B. Отметим, что более высокая активность препаратов позволяет использовать при лечении рака более низкие дозы, что приводит к снижению побочных эффектов, а также токсичности.
Пример 8. Получение лекарственного препарата в форме таблеток. Смешивают 1600 мг крахмала, 1600 мг измельченной лактозы, 400 мг талька и 1000 мг соединения 1.1.2. Полученную фармацевтическую композицию спрессовывают в брусок. Брусок измельчают в гранулы и просеивают через сита, собирая гранулы размером 14-16 меш. Полученные гранулы таблетируют в подходящую форму таблетки весом 560 мг каждая.
Пример 9. Получение лекарственного препарата в форме капсул. Тщательно смешивают соединения 1.1.2 с порошком лактозы в соотношении 2:1. Полученную фармацевтическую композицию упаковывают по 300 мг в желатиновые капсулы подходящего размера.
Пример 10. Получение лекарственного препарата в форме инъекционных композиций для внутримышечных, внутрибрюшинных или подкожных инъекций. Смешивают 500 мг соединения 1.1.2 с 300 мг хлорбутанола, 2 мл пропиленгликоля и 100 мл инъекционной воды. Полученный раствор фильтруют и помещают по 1 мл в ампулы, которые запаивают.
Реферат
Изобретение относится к новым (R)-стереоизомерам замещенных 2-тиоксо-имидазолидин-4-онов формулы 1 или их спироаналогам, которые обладают свойствами антагониста андрогенового рецептора, к вариантам способа их получения и к промежуточным соединениям 2.1-.2.4 для получения соединений формулы 1. Соединения формулы 1 могут быть использованы для получения лекарственного средства, пригодного для лечения ракового заболевания, такого как рак простаты, рак молочной железы. Изобретение также относится к фармацевтической композиции в форме таблеток, капсул, инъекций. В формуле 1R1 представляет собой OH, NH, или OR4 группу; R2 и R3 представляют собой метил, илиR2 и R3 представляют собой CH-CHгруппу; R4 представляет собой C-Cалкил или циклопропил. Соединения 2.1-2.4 соответствуют структурным формулам:8 н. и 9 з. п. ф-лы, 1 табл., 10 пр.
Формула
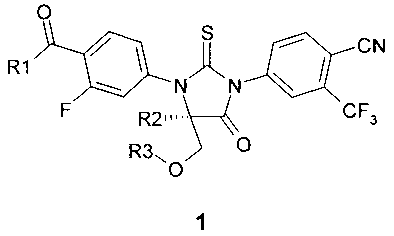
где R1 представляет собой OH, NH2, или OR4 группу;
R2 и R3 представляют собой метил, или
R2 и R3 вместе представляю собой CH2-CH2 группу;
R4 представляет собой C1-C4алкил или циклопропил.
где R2, R3 и R4 имеют вышеуказанное значение.
метил 4-[(R)-3-(3-метил-4-циано-фенил)-5-метил-5-метоксиметил-4-оксо-2-тиоксо-имидазолидин-1-ил]-2-фтор-бензоат (1.1.1),
метил 4-[(R)-3-(3-метил-4-циано-фенил)-4-оксо-2-тиоксо-7-окса-1,3-диаза-спиро[4.4]нон-1-ил]-2-фтор-бензоат (1.1.2),
изопропил 4-[(R)-3-(3-метил-4-циано-фенил)-4-оксо-2-тиоксо-7-окса-1,3-диаза-спиро[4.4]нон-1-ил]-2-фтор-бензоат (1.1.3),
циклопропил 4-[(R)-3-(3-метил-4-циано-фенил)-4-оксо-2-тиоксо-7-окса-1,3-диаза-спиро[4.4]нон-1-ил]-2-фтор-бензоат (1.1.4),
4-[(R)-3-(3-метил-4-циано-фенил)-5-метил-5-метоксиметил-4-оксо-2-тиоксо-имидазолидин-1-ил]-2-фтор-бензойная кислота (1.2.1),
4-[(R)-3-(3-метил-4-циано-фенил)-4-оксо-2-тиоксо-7-окса-1,3-диаза-спиро[4.4]нон-1-ил]-2-фтор-бензойная кислота (1.2.2),
4-[(R)-3-(3-метил-4-циано-фенил)-5-метил-5-метоксиметил-4-оксо-2-тиоксо-имидазолидин-1-ил]-2-фтор-бензамид (1.3.1) или
4-[(R)-3-(3-метил-4-циано-фенил)-4-оксо-2-тиоксо-7-окса-1,3-диаза-спиро [4.4]нон-1-ил]-2-фтор-бензамид (1.3.2):
(R)-3-(4-карбокси-3-фтор-фениламино)-тетрагидрофуран-3-карбоновая кислота (2.2), метил 4-((R)-1-метил-2-метокси-1-метоксикарбонил-этиламино)-2-фтор-бензоат (2.3) или
метил (R)-3-(4-метоксикарбонил-3-фтор-фениламино)-тетрагидрофуран-3-карбоксилат (2.4):

где R2=R3=CH3 или R2 и R3 вместе представляют собой CH2-CH2 группу.
где: R2=R3=CH3 или R2 и R3 вместе представляюет собой CH2-CH2 группу.
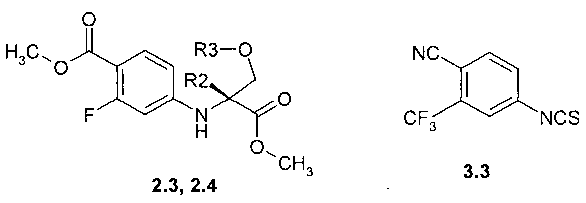
где R2 и R3 имеют вышеуказанное значение.
Документы, цитированные в отчёте о поиске
Замещенные (r)-3-(4-метилкарбамоил-3-фторфениламино)-тетрагидро-фуран-3-енкарбоновые кислоты и их эфиры, способ их получения и применения

Комментарии