Замещенные (r)-3-(4-метилкарбамоил-3-фторфениламино)-тетрагидро-фуран-3-енкарбоновые кислоты и их эфиры, способ их получения и применения - RU2520134C1
Код документа: RU2520134C1
Описание
Настоящее изобретение относится к новым химическим соединениям - полупродуктам синтеза ингибиторов андрогеновых рецепторов, представляющих интерес в качестве противораковых препаратов. Предметом изобретения являются также способы получения новых соединений - ингибиторов андрогеновых рецепторов.
Известны ингибиторы андрогеновых рецепторов, в том числе Enzalutamide, известный ранее как MDV3100, который в конце 2012 вышел на рынок как Xtandi и предназначен для лечения рака простаты [WO 2011/106570 А1], и ARN-509, успешно проходящий фазу II клинических исследований в качестве препарата для лечения рака простаты [WO 2008/119015 А2]
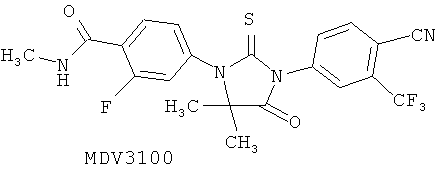
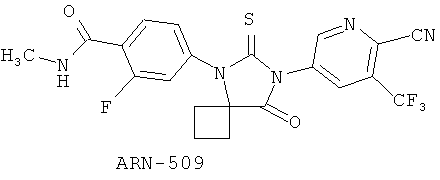
Ниже приведены определения терминов, которые использованы в описании данного изобретения.
«Алкил» означает алифатическую углеводородную линейную или разветвленную группу с 1-12 атомами углерода в цепи. Разветвленная означает, что алкильная цепь имеет один или несколько «заместителей алкила». Алкил может иметь один или несколько одинаковых или различных заместителей («алкильных заместителей»), включая галоген, алкенилокси, циклоалкил, арил, гетероарил, гетероциклил, ароил, циано, гидрокси, алкокси, карбокси, алкинилокси, аралкокси, арилокси, арилоксикарбонил, алкилтио, гетероарилтио, аралкилтио, арилсульфонил, алкилсульфонилгетероаралкилокси, аннелированный гетероарилциклоалкенил, аннелированный гетероарилциклоалкил, аннелированный гетероарилгетероцикленил, аннелированный гетероарилгетероциклил, аннелированный арилциклоалкенил, аннелированный арилциклоалкил, аннелированный арилгетероцикленил, аннелированный арилгетероциклил, алкоксикарбонил, аралкоксикарбонил, гетероаралкилоксикарбонил или RkaRk+1aN-, RkaRk+1aNC(=O)-, RkaRk+1aNC(=S)-, RkaRk+1aNSO2-, где Rka и Rk+1a независимо друг от друга представляют собой «заместители аминогруппы», значение которых определено в данном разделе, например атом водорода, алкил, арил, аралкил, гетероаралкил, гетероциклил или гетероарил, или Rka и Rk+1a вместе с атомом N, с которым они связаны, образуют через Rka и Rk+1a 4-7-членный гетероциклил или гетероцикленил. Предпочтительными алкильными группами являются метил, трифторметил, циклопропилметил, циклопентилметил, этил, н-пропил, изо-пропил, н-бутил, трет-бутил, н-пентил, 3-пентил, метоксиэтил, карбоксиметил, метоксикарбонилметил, этоксикарбонилметил, бензилоксикарбонилметил, метокси-карбонилметил и пиридилметилоксикарбонилметил. Предпочтительными «алкильными заместителями» являются циклоалкил, арил, гетероарил, гетероциклил, гидрокси, алкокси, алкоксикарбонил, аралкокси, арилокси, алкилтио, гетероарилтио, аралкилтио, алкилсульфонил, арилсульфонил, алкоксикарбонил, аралкоксикарбонил, гетероаралкилоксикарбонил или RkaRk+1aN-, RkaRk+1aNC(=O)-, аннелированный арилгетероцикленил, аннелированный арилгетероциклил.
«Алкокси» или «алкилокси» означает алкил-О- группу, в которой алкил определен в данном разделе. Предпочтительными алкилоксигруппами являются метокси, этокси, н-пропокси, изо-пропокси и н-бутокси, триметилэтилокси.
«Алкоксикарбонил» или «алкилоксикарбонил» означает алкил-O-С(=O)- группу, в которой алкил определен в данном разделе. Предпочтительными алкоксикарбонильными группами являются метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутилоксикарбонил и трет-бутилоксикарбонил.
«Алкоксикарбонилалкил» или «алкилоксикарбонилалкил» означает алкил-O-С(=O)-алкил- группу, в которой алкил определен в данном разделе. Предпочтительными алкоксикарбонилалкильными группами являются: метоксикарбонилметил, этоксикарбонилметил, пропоксикарбонилметил, изопропоксикарбонилметил, бутилоксикарбонилметил и трет-бутилоксикарбонилметил.
«Аминогруппа» означает RkaRk+1aN - группу замещенную или незамещенную «заместителем аминогруппы» Rka и Rk+1a, значение которых определено в данном разделе, например амино (H2N-), метиламино, диметиламино, N-(триметилсилилэтоксиметил)метиламино, диэтиламино, пирролидин, морфолин, бензиламино или фенетиламино.
«Аминокарбонил» означает C(=O)N RkaRk+1a - группу, замещенную или незамещенную необязательно одинаковыми «заместителями карбамоильными» Rka и Rk+1a, включая водород, алкенил, алкил, арил, гетероарил, гетероциклил, значение которых определено в данном разделе.
«Арил» означает ароматическую моноциклическую или полициклическую систему, включающую от 6 до 14 атомов углерода, преимущественно от 6 до 10 атомов углерода. Арил может содержать один или более «заместителей циклической системы», которые могут быть одинаковыми или разными. Представителями арильных групп являются фенил или нафтил, замещенный фенил или замещенный нафтил. Арил может быть аннелирован с неароматической циклической системой или гетероциклом. «Ацил» означает Н-С(=O)- или алкил-С(=O)-, циклоалкил-С(=O)-, гетероциклил-С(=O)-, гетероциклилалкил-С(=O)-, арил-С(=O)- арилалкил-С(=O)-, гетероарил-С(=O)- или гетероарилалкил-С(=O)- группу, в которых алкил-, циклоалкил-, гетероциклил-, гетероциклилалкил, арил-, арилалкил, гетероарил-, гетероарилалкил- определены в данном разделе.
«Ациламино» означает ацил-NH- группу, в которой значение ацил определено в данном разделе.
«Галоген» означает фтор, хлор, бром и йод. Предпочтительными являются фтор, хлор и бром.
«Гетероарил» означает ароматическую моноциклическую или полициклическую систему, включающую от 5 до 14 атомов углерода, предпочтительно от 5 до 10, в которой один или больше атомов углерода замещены гетероатомом или гетероатомами, такими как азот, сера или кислород. Приставка «аза», «окса» или «тиа» перед «гетероарил» означает наличие в циклической системе атома азота, атома кислорода или атома серы соответственно. Атом азота, находящийся в гетероариле, может быть окисленным до N-оксида. Гетероарил может иметь один или несколько «заместителей циклической системы», которые могут быть одинаковыми или разными. Представителями гетероарилов являются тетрагидрофуранил, пирролил, фуранил, тиенил, пиридил, пиразинил, пиримидинил, изооксазолил, изотиазолил, тетразолил, охазолил, тиазолил, пиразолил, фуразанил, триазолил, 1,2,4-тиадиазолил, пиридазинил, хиноксалинил, фталазинил, имидазо[1,2-а]пиридинил, имидазо[2,1-b]тиазолил, бензофуразанил, индолил, азаиндолил, бензимидазолил, бензотиазенил, хинолинил, имидазолил, тиенопиридил, хиназолинил, тиенопиримидинил, пирролопиридин, имидазопиридил, изохинолинил, бензоазаиндолил, 1,2,4-триазинил, тиенопирролил, фуропирролил, и др.
«Гетероциклил» означает ароматическую или неароматическую насыщенную моноциклическую или полициклическую систему, включающую от 3 до 10 атомов углерода, преимущественно от 5 до 6 атомов углерода, в которой один или несколько атомов углерода заменены на гетероатом, такой как азот, кислород, сера. Приставка «аза», «окса» или «тиа» перед гетероциклилом означает наличие в циклической системе атома азота, атома кислорода или атома серы соответственно. Гетероциклил может иметь один или несколько «заместителей циклической системы», которые могут быть одинаковыми или разными. Атомы азота и серы, находящиеся в гетероциклиле, могут быть окислены до N-оксида, S-оксида или S-диоксида. Представителями гетероциклилов являются тетрагидрофуран, пиперидин, пирролидин, пиперазин, морфолин, тиоморфолин, тиазолидин, 1,4-диоксан, тетрагидротиофен и др.
«Заместитель» означает химический радикал, который присоединяется к скэффолду (фрагменту), например «заместитель алкильный», «заместитель аминогруппы», «заместитель гидроксигруппы», «заместитель карбамоильный», «заместитель циклической системы», значения которых определен в данном разделе. «Заместитель алкильный» означает заместитель, присоединенный к алкилу, алкенилу, значение которых определены в данном разделе. Заместитель алкильный представляет собой водород, алкил, галоген, алкенилокси, циклоалкил, арил, гетероарил, гетероциклил, ароил, циано, гидрокси, алкокси, карбокси, алкинилокси, аралкокси, арилокси, арилоксикарбонил, алкилтио, гетероарилтио, аралкилтио, арилсульфонил, алкилсульфонилгетероаралкилокси, аннелированный гетероарилциклоалкенил, аннелированный гетероарилциклоалкил, аннелированный гетероарилгетероцикленил, аннелированный гетероарилгетероциклил, аннелированный арилциклоалкенил, аннелированный арилциклоалкил, аннелированный арилгетероцикленил, аннелированный арилгетероциклил, алкоксикарбонил, аралкоксикарбонил, гетероаралкилоксикарбонил или RkaRk+1aN-, RkaRk+1aNC(=O)-, RkaRk+1aNSO2-, где Rka и Rk+1a независимо друг от друга представляют собой «заместители аминогруппы», значение которых определено в данном разделе, например атом водорода, алкил, арил, аралкил, гетероаралкил, гетероциклил или гетероарил, или Rka и Rk+1a вместе с атомом N, с которым они связаны, образуют через Rka и Rk+1a 4-7-членный гетероциклил или гетероцикленил. Предпочтительными алкильными группами являются метил, трифторметил, триметилсилил, циклопропилметил, циклопентилметил, этил, н-пропил, изо-пропил, н-бутил, трет-бутил, н-пентил, 3-пентил, метоксиэтил, карбоксиметил, метоксикарбонилметил, этоксикарбонилметил, бензилоксикарбонилметил, метоксикарбонилметил и пиридилметилоксикарбонилметил. Предпочтительными «алкильными заместителями» являются триметилсилил, циклоалкил, арил, гетероарил, гетероциклил, гидрокси, алкокси, алкоксикарбонил, аралкокси, арилокси, алкилтио, гетероарилтио, аралкилтио, алкилсульфонил, арилсульфонил, алкоксикарбонил, аралкоксикарбонил, гетероаралкил-оксикарбонил или RkaRk+1aN-, RkaRk+1aNC(=O)-, аннелированный арилгетероцикленил, аннелированный арилгетероциклил. Значение «заместителей алкильных» определено в данном разделе.
«Заместитель аминогруппы» означает заместитель, присоединенный к аминогруппе. Заместитель аминогруппы представляет собой водород, алкил, циклоалкил, арил, гетероарил, гетероциклил, ацил, ароил, алкилсульфонил, арилсульфонил, гетероарилсульфонил, алкиламинокарбонил, ариламинокарбонил, гетероариламинокарбонил, гетероциклиламинокарбонил, алкиламинотиокарбонил, ариламинотиокарбонил, гетероариламинотиокарбонил, гетероциклиламинотиокарбонил, аннелированный гетероарилциклоалкенил, аннелированный гетероарилциклоалкил, аннелированный гетероарилгетероцикленил, аннелированный гетероарилгетероциклил, аннелированный арилциклоалкенил, аннелированный арилциклоалкил, аннелированный арилгетероцикленил, аннелированный арилгетероциклил, алкоксикарбонилалкил, аралкоксикарбонилалкил, гетероаралкилоксикарбонилалкил. Предпочтительно заместители выбираются из группы: водород, триметилсилилэтоксиметил, метил, замещенный фторфенил, замещенный алкил.
«Заместитель гидроксигруппы» означает заместитель, присоединенный к гидроксигруппе, включая алкил, арил, гетероарил, аралкил, гетероаралкил, гидроксиалкил, ацил, ароил, алкилоксиалкил, арилоксиалкил, гетероциклилоксиалкил и т.п. Предпочтительными заместителями являются водород, метил, этил, пропил, изопропил, бутил, третбутил, триметилсилилэтил.
«Заместитель карбамоильный» означает заместитель, присоединенный к карбамоильной группе, значение которой определено в данном разделе. Заместитель карбамоильный представляет собой водород, алкил, циклоалкил, арил, гетероарил, гетероциклил, алкоксикарбонилалкил, аралкоксикарбонилалкил, гетероаралкилоксикарбонилалкил или RkaRk+1aN-, RkaRk+1aNC(=O)-алкил аннелированный гетероарилциклоалкенил, аннелированный гетероарилциклоалкил, аннелированный гетероарилгетероцикленил, аннелированный гетероарилгетероциклил, аннелированный арилциклоалкенил, аннелированный арилциклоалкил, аннелированный арилгетероцикленил, аннелированный арилгетероциклил. Предпочтительными «заместителями карбамоильными» являются алкил, циклоалкил, арил, гетероарил, гетероциклил, алкоксикарбонилалкил, аралкоксикарбонилалкил, гетероаралкилоксикарбонилалкил или RkaRk+1aN-, RkaRk+1aNC(=O)-алкил, аннелированный арилгетероцикленил, аннелированный арилгетероциклил.
«Заместитель карбоксильный» означает заместитель, присоединенный к кислороду карбоксильной группы, значение которой определено в данном разделе. Заместитель карбоксильный представляет собой алкил, циклоалкил, арил, гетероарил, гетероциклил, алкоксикарбонилалкил, аралкоксикарбонилалкил, гетероаралкилоксикарбонилалкил или RkaRk+1aN-, RkaRk+1aNC(=O)-aлкил аннелированный гетероарилциклоалкенил, аннелированный гетероарилциклоалкил, аннелированный гетероарилгетероцикленил, аннелированный гетероарилгетероциклил, аннелированный арилциклоалкенил, аннелированный арилциклоалкил, аннелированный арилгетероцикленил, аннелированный арилгетероциклил. Предпочтительными «заместителями карбоксильными» являются алкил, циклоалкил, арил, гетероарил, гетероциклил, алкоксикарбонилалкил, аралкоксикарбонилалкил, гетероаралкилоксикарбонилалкил или RkaRk+1aN- алкил, RkaRk+1aNC(=O)-алкил, аннелированный арилгетероцикленил, аннелированный арилгетероциклил. Предпочтительно С1-С4алкил (метил, этил, пропил, изопропил, бутил, третбутил и проч.).
«Заместитель циклической системы» означает заместитель, присоединенный к ароматической или неароматической циклической системе, включая водород, алкил, алкенил, алкинил, арил, гетероарил, аралкил, гетероаралкил, гидрокси, гидроксиалкил, амино, аминоалкил, алкокси, арилокси, ацил, ароил, галоген (фтор, хлор, бром), нитро, циано, карбокси, алкоксикарбонил, арилоксикарбонил, аралкоксикарбонил, алкилоксиалкил, арилоксиалкил, гетероциклилоксиалкил, арилалкилоксиалкил, гетероциклилалкилоксиалкил, алкилсульфонил, арилсульфонил, гетероциклилсульфонил, алкилсульфинил, арилсульфинил, гетероциклилсульфинил, алкилтио, арилтио, гетероциклилтио, алкилсульфонилалкил, арилсульфонилалкил, гетероциклилсульфонилалкил, алкилсульфинилалкил, арилсульфинилалкил, гетероциклилсульфинилалкил, алкилтиоалкил, арилтиоалкил, гетероциклилтиоалкил, арилалкилсульфонилалкил, гетероциклилалкилсульфонилалкил, арилалкилтиоалкил, гетероциклилалкилтиоалкил, циклоалкил, циклоалкенил, гетероциклил, гетероцикленил, амидино, RkaRk+1aN-, RkaN=, RkaRk+1aN-алкил-, RkaRk+1aNC(=O)- или RkaRk+1aNSO2-, где Rka и Rk+1a представляют собой независимо друг от друга «заместители аминогруппы», значение которых определено в данном разделе, например водород, замещенный алкил (замещенный амином, каброксигруппой, карбонильной группой), необязательно замещенный арил, необязательно замещенный аралкил, или необязательно замещенный гетероаралкил, или заместитель RkaRk+1aN-, в котором Rka может быть ацил или ароил, а значение Rk+1a определено выше, или «заместителями циклической системы» являются RkaRk+1aNC(=O)- или RkaRk+1aNSO2-, в которых Rka и Rk+1a вместе с атомом азота, с которым они связаны, образуют через Rka и Rk+1a 4-7-членный гетероциклил или гетероцикленил.
«Карбамоил» означает C(=O)N RkaRk+1a - группу. Карбамоил может иметь один или несколько одинаковых или различных «заместителей карбамоильных» Rka и Rk+1a, включая водород, алкенил, алкил, арил, гетероарил, гетероциклил, значение которых определено в данном разделе.
«Карбоксил» означает HOC(=O)-(карбоксильную) группу.
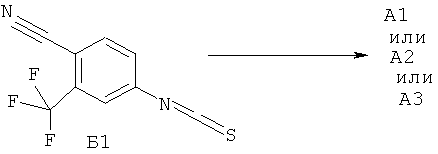
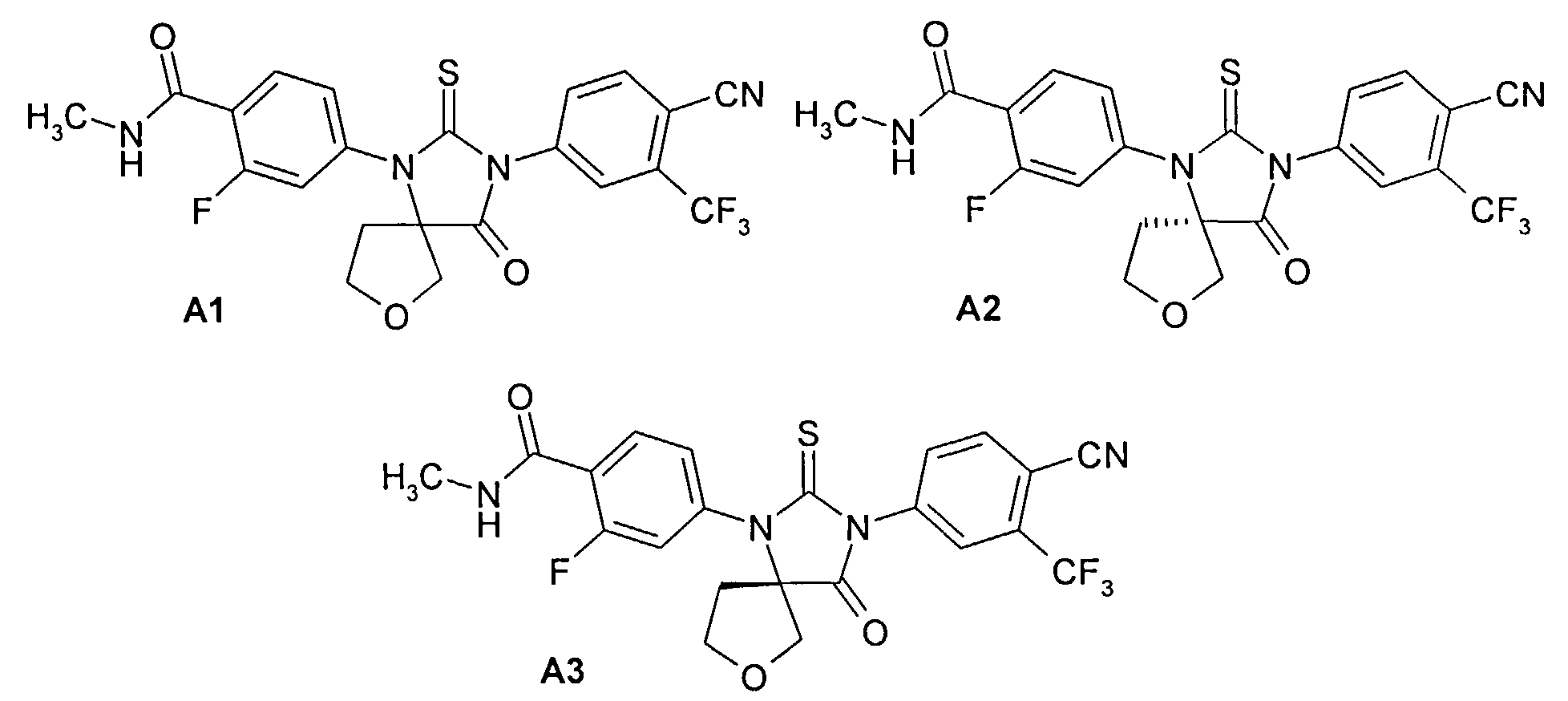
Недавно были получены эффективные ингибиторы андрогеновых рецепторов, представляющие собой 4-[3-(3-трифторметил-4-цианофенил)-4-оксо-2-тиокео-7-окса-1,3-диазаспиро[4.4]нон-1-ил]-2-фтор-N-метилбензамид А1 и его (R)- А2 и (S)- A3 стереоизомеры [патент RU 2434851, опубл. 27.11.2011; WO 2012/011840, опубл. 26.01.2012]
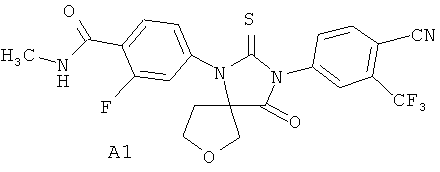
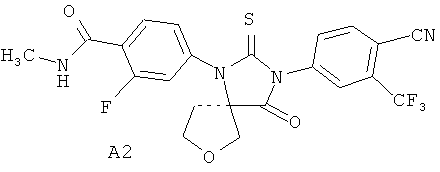
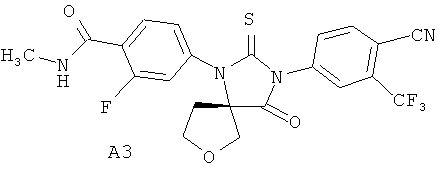
Синтез 4-[3-(3 -трифторметил-4-цианофенил)-4-оксо-2-тиоксо-7-окса-1,3-диаза-спиро[4.4]нон-1-ил]-2-фтор-К-метилбензамида А1 был осуществлен взаимодействием в микроволновой печи 4-тиоизоцианата-2-(трифторметил)бензонитрила Б1 с 4-(3-циано-тетрагидрофуран-3-иламино)-2-фтор-М-метилбензаминдом Б2 в диметилформамиде при 100°C в течение 12 часов по схеме 1. Продукт реакции А1 был выделен из реакционной смеси с использованием жидкостной хроматографии высокого давления и разделен на стереоизомеры А2 и A3 с помощью жидкостной хроматографии высокого давления на Chiralpak HD-H 25×1 см (Chiral Technologies Inc., USA).
Схема 1
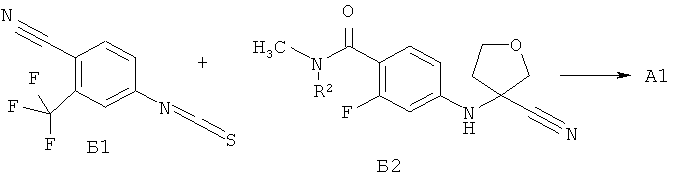
Выделение целевого продукта А1 и его оптических изомеров А2 и A3 с помощью жидкостной хроматографии высокого давления, в том числе с использованием хиральных хроматографических колонок, усложняет и удорожает процесс их получения. В этой связи поиск новых полупродуктов для синтеза ингибиторов андрогеновых рецепторов A1, А2 и A3 является актуальной задачей.
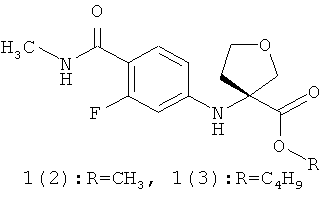
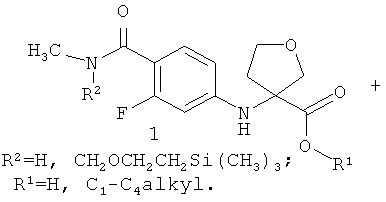
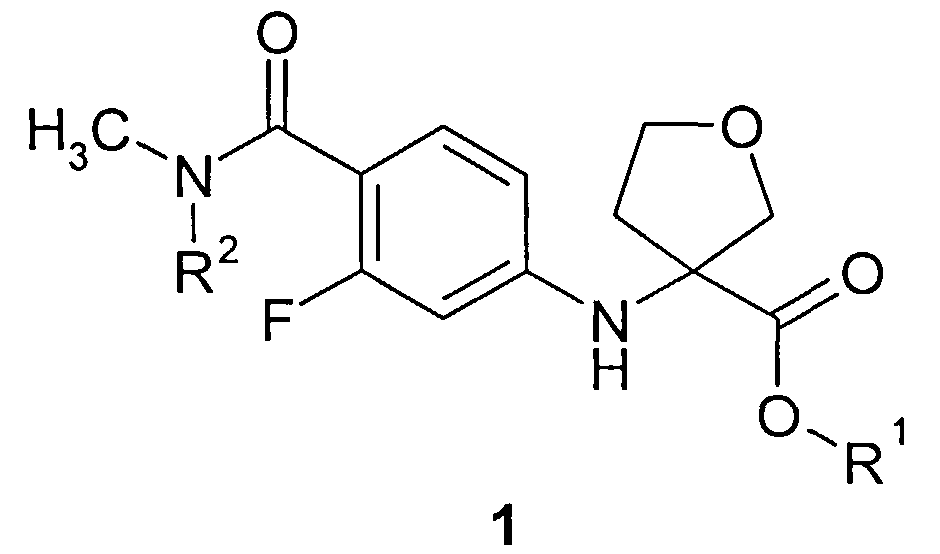
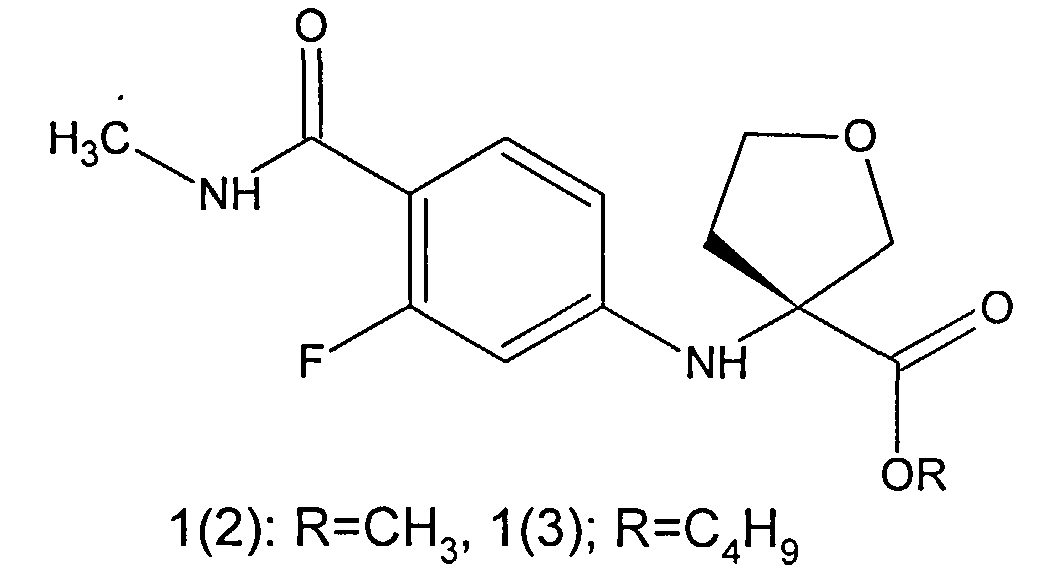
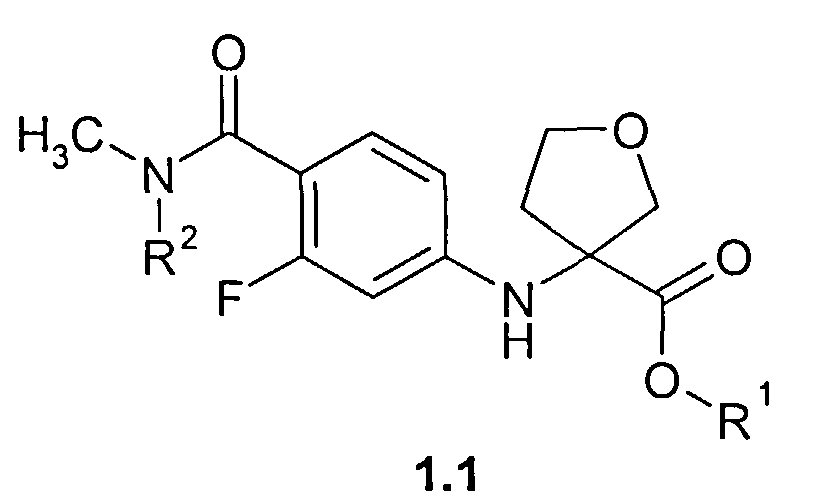
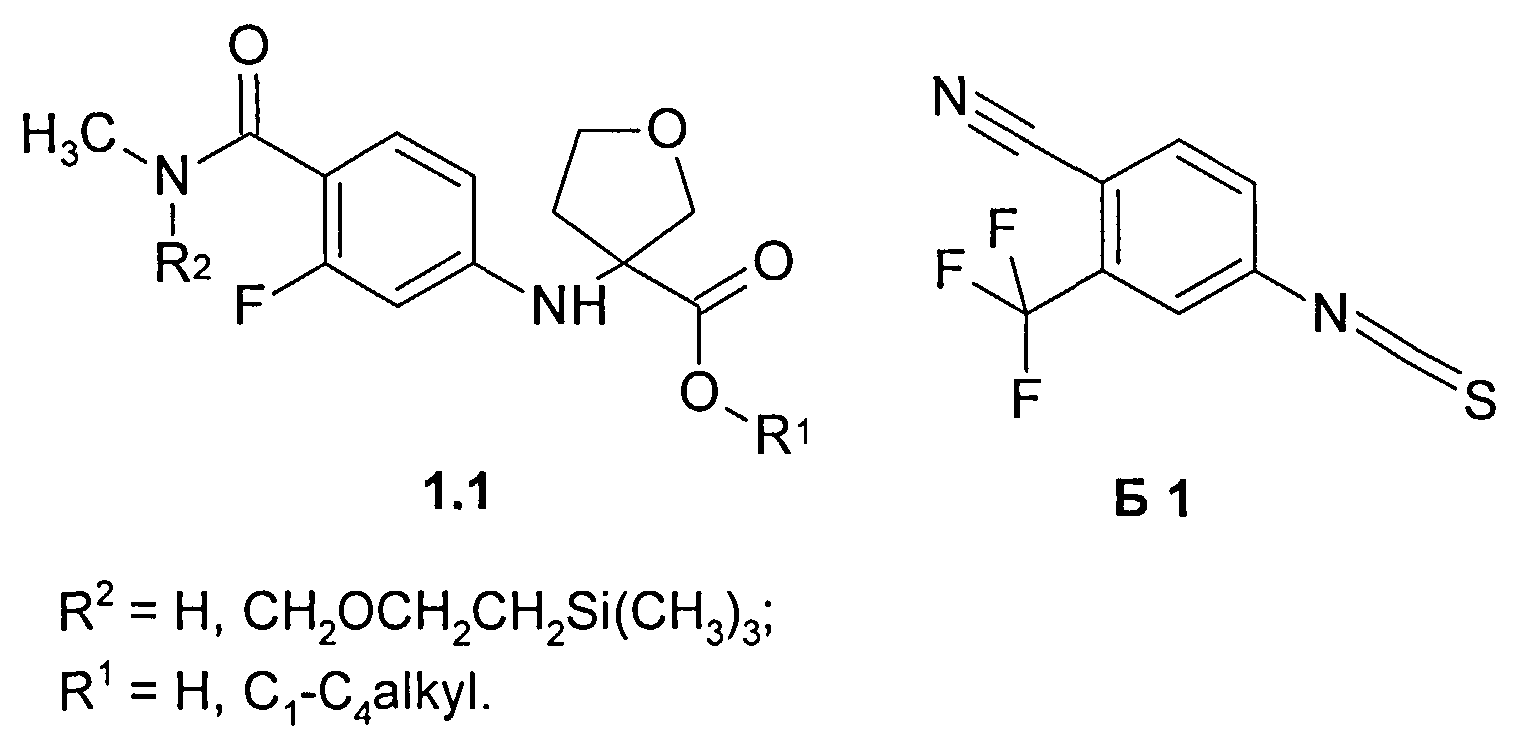
Предметом данного изобретения являются неизвестные ранее соединения 3-(4-метилкарбамоил-3-фторфениламино)тетрагидрофуран-3-енкарбоновые кислоты, их эфиры общей формулы 1 и их стереоизомеры,
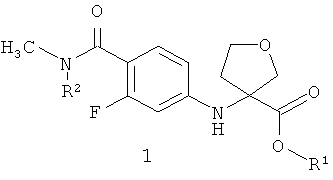
где R1=Н, С1-С4алкил; R2=Н,CH2OCH2CH2Si(CH3)3.
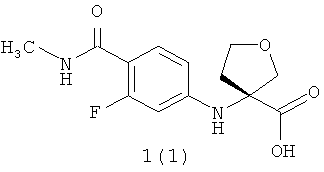
Более предпочтительными соединениями общей формулы 1 являются (R)-3-(4-метилкарбамоил-3-фторфениламино)тетрагидрофуран-3-енкарбоновая кислота 1(1), метил (R)-3-(4-метилкарбамоил-3-фторфениламино)тетрагидрофуран-3-енкарбоксилат 1(2) или бутил (R)-3-(4-метилкарбамоил-3-фторфениламино)тетрагидрофуран-3-енкарбоксилат 1(3)
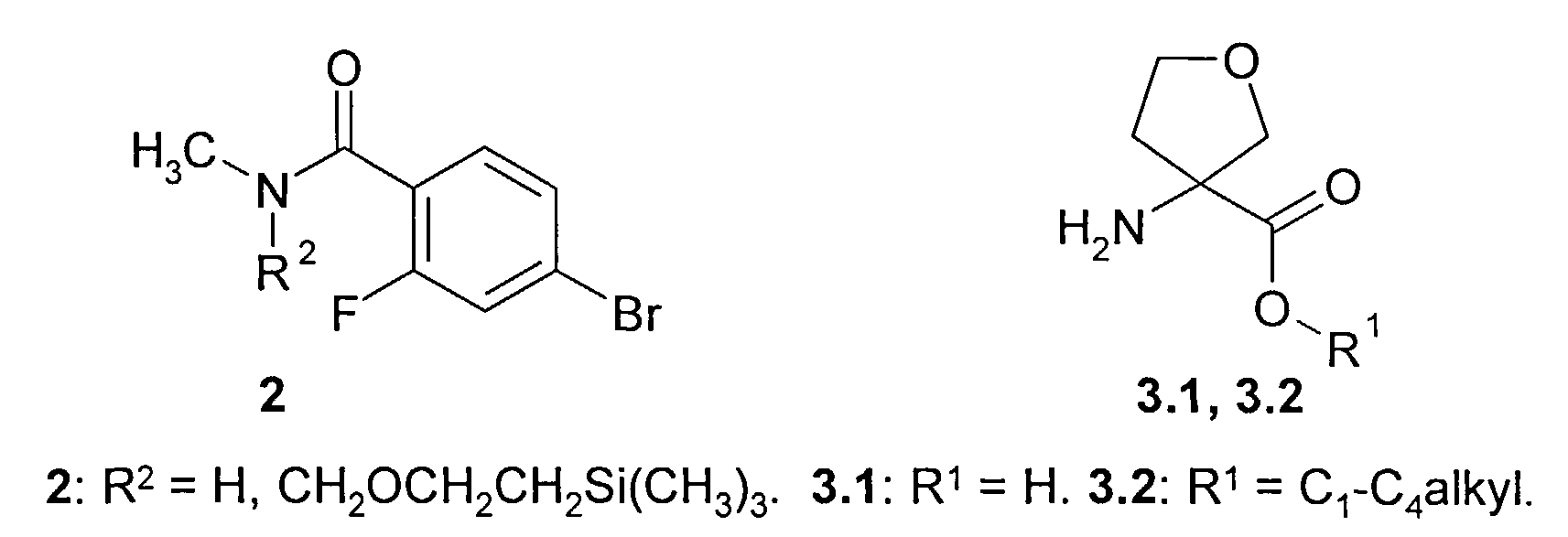
Предметом данного изобретения является способ получения соединения общей формулы 1 и его стереоизомеров 1(1)-1(3) взаимодействием 4-бром-2-фтор-N-метилбензамида общей формулы 2 с 3-аминотетрагидрофуран-3-карбоновой кислотой 3.1, ее эфиром общей формулы 3.2 или их стереоизомерами
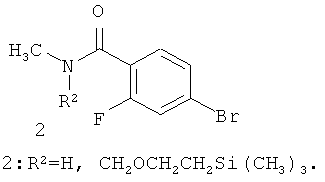
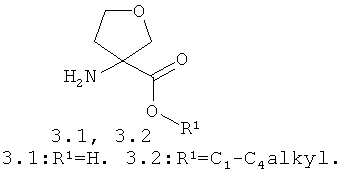
Лучшие результаты были достигнуты при взаимодействии реагентов 2 с 3.1 или 3.2 в среде водного диметилформамида в присутствии йодида меди (I), поташа, триэтиламина и 2-ацетилциклогексанона.
Предметом данного изобретения являются также полупродукты синтеза 4-[3-(3-трифторметил-4-цианофенил)-4-оксо-2-тиоксо-7-окса-1,3-диазаспиро[4.4]нон-1-ил]-2-фтор-N-метилбензамидов A1, А2 и A3, представляющие собой соединения общей формулы 1 или его стереоизомеры
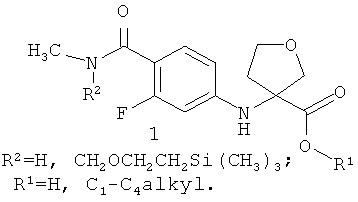
Более предпочтительными полупродуктами являются (11)-3-(4-метилкарбамоил-3-фторфениламино)тетрагидрофуран-3-енкарбоновая кислота 1(1), метил (R)-3-(4-метилкарбамоил-3-фторфениламино)тетрагидрофуран-3-енкарбоксилат 1(2), бутил (R)-3-(4-метилкарбамоил-3-фторфениламино)тетрагидрофуран-3-енкарбоксилат 1(3).


Предметом данного изобретения является также способ получения 4-[3-(3-трифторметил-4-цианофенил)-4-оксо-2-тиоксо-7-окса-1,3-диазаспиро[4.4]нон-1-ил]-2-фтор-N-метилбензамидов A1, А2 и A3, заключающийся во взаимодействии соединения общей формулы 1 или его стереоизомера с 4-изотиоцианато-2-трифторметилбензонитрилом Б1 в смеси диметилсульфоксида и этилацетата при повышенной температуре по схеме 2.
Схема 2
Лучшие результаты были достигнуты при проведении реакции в эквивалентном соотношении 1:2 диметилсульфоксида и этилацетата соответственно под аргоном.
Использование данного изобретения позволяет упростить процесс получения ингибиторов андрогеновых рецепторов A1, А2 и A3, повысить их выход до 70% и отказаться от использования хиральной хроматографии.
Изобретение иллюстрируется, но не ограничивается, представленными ниже примерами.
Пример 1. Общий способ получения замещенной 3-(4-метилкарбамоил-3-фторфениламино)тетрагидрофуран-3-енкарбоновой кислоты, ее эфира общей формулы 1 и их стереоизомера
В круглодонную колбу, снабженную магнитной мешалкой, обратным холодильником и масляной баней с терморегулятором, вносили 1,2 экв. кислоты 3.1 или ее эфира общей формулы 3.2, 1 экв. 4-бром-2-фтор-N-метилбензамида общей формулы 2, 0,35 г (0,15 экв.) йодида меди (I), 6,76 г (4 экв.) поташа, 6 мл воды, 27,5 мл диметилформамида и 0,2 мл триэтиламина. Включали перемешивание и через 10 минут добавляли 0,35 г (0,2 экв.) 2-ацетилциклогексанона. Смесь выдерживали при перемешивании и 100°C в течение 2 суток. Растворители по окончании реакции отгоняли в вакууме. Получали эфир общей формулы 1, в котором R1=С1-С4алкил, который смешивали с водой и подкисляли соляной кислотой (конц.) до pH среды, равной 2-3. При перемешивании через 20-30 минут образовался осадок, который отфильтровали, промыли водой, высушили. После чего промыли эфиром. Получили кислоту общей формулы 1, в которой R1=Н. Выход более 80%.
(R)-3-{4-[Метил-(2-триметилсилилэтоксиметил)карбамоил]-3-фторфениламино}тетрагидрофуран-3-карбоновая кислота 1 [R1=Н, R2=CH2OCH2CHSi(CH3)3]. LC MS m/e 413 (М+1);1Н ЯМР (DMSO, 400 МГц) δ 12.85 (ус, 1Н), 7.05 (т, 1H), 6.97 (ус, 1Н), 6.30 (м, 1Н), 6.15 (д, 1H), 4.84 (с, 1Н), 4.60 (с, 1Н), 4.09 (д, 1Н), 3.88 (т, 3Н), 3.50 (ус, 1Н), 3.32 (ус, 1Н), 2.90 (м, 3Н), 2.56 (м, 1H), 2.16 (м, 1Н), 0.87 (ус, 1H), 0.76 (ус, 1Н), 0.00 (м, 9Н).
(R)-3-(4-Метилкарбамоил-3-фторфениламино)тетрагидрофуран-3-енкарбоновая кислота 1(1), LC MS m/e 283 (М+1);1Н ЯМР (DMSO, 400 МГц) δ 13.01 (ус, 1H), 7.68 (с, 1H), 7.46 (т, 1Н), 7.13 (с, 1Н), 6.31 (д, 1H), 6.11 (д, 1Н), 4.09 (д, 1H), 3.86 (м, 3Н), 2.71 (м, 4Н), 2.14 (м, 1Н).
Пример 2. Способ получения метил (R)-3-(4-метилкарбамоил-3-фторфениламино)тетрагидрофуран-3-енкарбоксилата 1(2)
Способ А. Смешивали 500 мг (R)-3-(4-метилкарбамоил-3-фторфениламино)тетрагидрофуран-3-енкарбоновой кислоты 1(1) и 294 мг (1.2 экв.) поташа в 4 мл ДМФА. Смесь нагревали до температуры 30°C и вносили 1.2 экв. метила йодистого. Повышали температуру до 40°C и выдерживали в течение часа. Затем добавляли 40 мл воды и смесь нагревали до 60°C. Отфильтровывали, водный слой экстрагировали хлороформом (дважды по 50 мл). Объединенные органические слои промывали насыщенным водным раствором хлорида натрия, растворитель отгоняли в вакууме. Продукт затирали в эфире. Получили 372 мг (70%) продукта 1(2).
Способ Б. Растворяли 10 г (R)-3-(4-метилкарбамоил-3-фторфениламино)тетрагидрофуран-3-енкарбоновой кислоты 1(1) в ацетонитриле, добавляли 6,89 г (1.2 экв.) карбодиимида. Смесь перемешивали при 60°C в течение 1 часа и вносили 20 мл метанола. Оставляли перемешиваться в течение 2-3 часов. Затем отгоняли растворители в вакууме, к остатку добавляли воду. Выпавший осадок отфильтровали, высушили. Выход эфира 1(2) 7,5 г (71%).
Способ В. Растворяли 15,5 г (R)-3-(4-метилкарбамоил-3-фторфениламино)тетрагидрофуран-3-енкарбоновой кислоты 1(1) в 150 мл метанола. Колбу охлаждали льдом с водой и в течение 10 минут, прикапали избыток (1.2 экв.) хлористого тионила. Затем реакционную массу доводили до кипения и кипятили 4 часа. После чего отгоняли растворитель и избыток тионила в вакууме. Остаток растворяли в 200 мл хлороформа, промывали насыщенным раствором гидрокарбоната натрия (50 мл), затем насыщенным раствором рассола хлорида натрия (50 мл). Хлороформ отгоняли в вакууме, к остатку добавляли эфир и отфильтровывали продукт. Выход эфира 1(2) 12,5 г (77%).
Метил (R)-3-(4-метилкарбамоил-3-фторфениламино)тетрагидрофуран-3-енкарбоксилат 1(2), LC MS m/e 297 (M+1);1H ЯМР (CDCl3, 400 МГц) δ 7.94 (т, 1H). 6.59 (ус, 1H), 6.38 (д, 1H), 6.20 (д, 1H), 4.80 (ус, 1H), 4.19 (д, 1H), 4.05 (м, 3H), 3.76 (с, 3H), 3.01 (д, 3H), 2.51 (м, 1H), 2.19 (м, 1H).
Пример 3. Способ получения бутил (R)-3-(4-метилкарбамоил-3-фторфениламино)тетрагидрофуран-3-енкарбоксилата 1(3)
Смешивали 0,55 г бутил (R)-3-аминотетрагидрофуран-3-карбоксилата 3.2(1), 0,68 г (1 экв.) 4-бром-2-фтор-N-метил-N-{[2-(триметилсилил)этокси]метил}бензамида 2.1, 0,27 г (0,1 экв.) Pd*DBA, 0,37 г (0,2 экв.) BINAP в 10 мл диоксана. Смесь кипятили 2 суток под аргоном. Реакционную массу выливали в воду, экстрагировали хлороформом, экстракт промывали насыщенным раствором хлорида натрия. Хлороформ отгоняли в вакууме, а остаток хроматографировали на силикагеле. Получали бутил (R)-3-(4-метилкарбамоил-3-фторфениламино)тетрагидрофуран-3-енкарбоксилата 1(3), LC MS m/e 339 (M+1) с выходом ~10%.
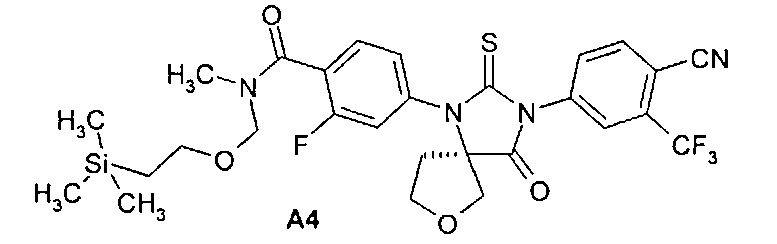
Пример 4. Способы получения 4-[3-(3-трифторметил-4-цианофенил)-4-оксо-2-тиоксо-7-окса-1,3-диазаспиро[4.4]нон-1-ил]-2-фтор-N-метилбензамида A1, 4-[(R)-3-(3-трифторметил-4-цианофенил)-4-оксо-2-тиоксо-7-окса-1,3-диазаспиро[4.4]нон-1-ил]-2-фтор-N-метилбензамида A2, 4-[(S)-3-(3-трифторметил-4-цианофенил)-4-оксо-2-тиоксо-7-окса-1,3-диазаспиро[4.4]нон-1-ил]-2-фтор-N-метилбензамида A3, 4-[(R)-3-(3-трифторметил-4-цианофенил)-4-оксо-2-тиоксо-7-окса-1,3-диазаспиро[4.4|нон-1-ил]-2-фтор-N-метил-N-(2-триметилсилилэтоксиметил)бензамида A4.а
Способ A. В круглодонную колбу емкостью 250 мл, снабженную магнитной мешалкой, обратным холодильником, хлоркальцевой трубкой и масляной баней с терморегулятором IKAR- ETS-D4, помещали 10.7 г (R)-3-{4-[метил-(2-триметилсилилэтоксиметил)карбамоил]-3-фторфениламино}тетрагидрофуран-3-карбоновой кислоты 1 [R1=H, R2=CH2OCH2CH2Si(CH3)3] и 1.5 экв. 4-тиозоцианата-2-(трифторметил)бензонитрила Б1 в 100 мл пиридина. Перемешивали при 80°C 48 часов. По окончании реакции (отсутствие исходных продуктов по данным LCMS) отгоняли большую часть пиридина в вакууме. Остаток растворяли в этилацетате и отфильтровывали через слой силикагеля, растворитель отгоняли в вакууме, а к остатку добавляли этанол. Выпавший осадок отфильтровывали и сушили. Получали 4.84 г 4-[(R)-3-(3-трифторметил-4-цианофенил)-4-оксо-2-тиоксо-7-окса-1,3-диазаспиро[4.4]нон-1-ил]-2-фтор-N-метил-N-(2-триметилсилилэтоксиметил)бензамида А4, LC MS m/e 623 (M+1);1H ЯМР (CDCl3, 400 МГц) δ 8.01 (д, 1H), 7.98 (с, 1H), 7.85 (д, 1H), 7.57 (м, 1H), 7.22 (м, 2H), 4.97 (с, 1H), 4.55 (с, 1H), 4.32 (д, 1H), 4.06 (д, 1H), 3.86 (кв. 1H), 3.66 (м, 1H), 3.57 (т, 1H), 3.26 (т, 1H), 3.10 (с, 2H), 2.89 (с, 1H), 2.64 (м, 1H), 2.41 (м, 2H), 0.91 (т, 1H). 0.77 (т, 1H), 0.06 (с, 3H), 0.00 (с, 6H).
Перемешивали при комнатной температуре в течение 2-3 часов 4.8 г 4-[(R)-3-(3-трифторметил-4-цианофенил)-4-оксо-2-тиоксо-7-окса-1,3-диазаспиро[4.4]нон-1-ил]-2-фтор-N-метил-N-(2-триметилсилилэтоксиметил)бензамида А4 и 15 мл трифторуксусной кислоты в 30 мл хлористого метилена. После завершения реакции (отсутствие исходного соединения А4 по данным LCMS), реакционную массу упаривали в вакууме, а остаток подвергали хроматографической очистке на силикагеле. В качестве элюента использовали систему хлороформ - метанол (60:1). Собирали фракцию с длиной Rf=0,4. Получали с выходом 78% 4-[(R)-3-(3-трифторметил-4-цианофснил)-4-оксо-2-тиоксо-7-окса-1,3-диазаспиро[4.4]нон-1-ил]-2-фтор-N-метилбензамид А2, LC MS m/e 493 (M+1);1H ЯМР (CDCl3, 400 МГц) δ 8.30 (т, 1H), 8.06 (д, 1H), 7.96 (с, 1H), 7.83 (д, 1H), 7.32 (д, 1H), 7.23 (д, 1H), 6.71 (м, 1H), 4.93 (д, 1H), 4.16 (д, 1H), 3.95 (кв, 1H), 3.42 (кв. 1H), 3.08 (д, 3H), 2.73 (м, 1H), 2.47 (м, 1H).
Способ Б. Перемешивали 48 часов при 80°C 5.09 г (R)-3-(4-метилкарбамоил-3-фторфениламино)тетрагидрофуран-3-енкарбоновой кислоты 1(1) и 1.5 экв. 4-тиоизоцианата-2-(трифторметил)бензонитрила Б1 в 50 мл пиридина. По окончании реакции (отсутствие исходных по данным LCMS) отгоняли большую часть пиридина в вакууме. Остаток подвергали хроматографированию на силикагеле. В качестве элюента использовали систему хлористый метилен - метанол (60:1). Собирали фракцию с Rf=0.6. В результате получали 630 мг (выход 7,6%) продукта A2 с чистотой 99.2%, LC MS m/e 493 (M+1);1H ЯМР (CDCl3, 400 МГц) δ 8.30 (т, 1H), 8.06 (д, 1H), 7.96 (с, 1H), 7.83 (д. 1H), 7.32 (д, 1H), 7.23 (д, 1H), 6.71 (м, 1H), 4.93 (д, 1H), 4.16 (д, 1H), 3.95 (кв, 1H), 3.42 (кв, 1H), 3.08 (д, 3H), 2.73 (м, 1H), 2.47 (м, 1H).
Примечание. Проведение этой реакции: в микроволновом реакторе в пиридине (70°C, 3 ч) давало выход 10% целевого продукта A2; в ацетонитриле в присутствии K2CO3 (60°C, 12 ч) давало выход 8% целевого продукта A2; в ацетонитриле в присутствии (C2H5)3N под аргоном (75°C, 3 ч) давало выход 28% целевого продукта A2.
Способ В. Перемешивали 48 часов при 85°C под аргоном 1.05 г метил (R)-3-(4-метилкарбамоил-3-фторфениламино)тетрагидрофуран-3-енкарбоксилата 1(2) и 1,62 г (2.0 экв.) 4-тиоизоцианата-2-(трифторметил)бензонитрила Б1 в смеси из 252 мкл (1 экв.) ДМСО и 692 мкл (2 экв.) этилацетата. По окончании реакции (контроль по LCMS и ТСХ) отгоняли растворители в вакууме. Остаток подвергали флеш-хроматографии на силикагеле. В качестве элюента использовали хлороформ. Собирали фракцию с Rf=0.6 (ТСХ в системе 60:1 хлороформ - метанол), растворитель отгоняли в вакууме, а остаток кристаллизовали из этанола. Получали продукт A2 с выходом 60-70%, содержащий 99,5% основного вещества, LC MS m/e 493 (M+1);1H ЯМР (CDCl3, 400 МГц) δ 8.30 (т, 1H), 8.06 (д, 1H), 7.96 (с, 1H), 7.83 (д, 1H), 7.32 (д, 1H), 7.23 (д, 1H), 6.71 (м, 1H), 4.93 (д. 1H), 4.16 (д, 1H), 3.95 (кв, 1H), 3.42 (кв, 1H), 3.08 (д, 3H), 2.73 (м, 1H). 2.47 (м, 1H). Аналогично получают 4-[(S)-3-(3-трифторметил-4-цианофенил)-4-оксо-2-тиоксо-7-окса-1,3-диазаспиро[4.4]нон-1-ил]-2-фтор-N-метилбензамид A3 из соответствующей (S)-3-(4-метилкарбамоил-3-фторфениламино)тетрагидрофуран-3-енкарбоновой кислоты формулы 1, выход 60-65%, LC MS m/e 493 (M+1).
Аналогично получают 4-[3-(3-трифторметил-4-цианофенил)-4-оксо-2-тиоксо-7-окса-1,3-диазаспиро[4.4]нон-1-ил]-2-фтор-N-метилбензамид A1 из соответствующей 3-(4-метилкарбамоил-3-фторфениламино)тетрагидрофуран-3-енкарбоновой кислоты формулы 1, выход 60-65%, LC MS m/e 493 (M+1).
Реферат
Изобретение относится к новым замещенным 3-(4-метилкарбамоил-3-фторфениламино)тетрагидрофуран-3-енкарбоновой кислоты или их эфирам общей формулы 1 и их стереоизомерам. Соединения формулы 1 являются полупродуктами синтеза ингибиторов андрогеновых рецепторов формулы А1, А2, А3,представляющих интерес в качестве противораковых препаратов. Изобретение также относится к способам получения соединений формулы 1и соединений формулА1, А2, А3. В общей формуле 1R=Н, С-Салкил; R=Н, CHOCHCHSi(CH).Способ получения соединений формулы (1)заключается во взаимодействии соединений общей формулы 2ссоединениями3(1)или3(2)в ДМФАКСОс одновременным добавлением в реакционную массу йодида меди, воды и триэтиламина.При взаимодействии соединений формулы 1полученных по вышеуказанному способус4-изотиоцианато-2-трифторметилбензонитрилом в смеси диметилсульфоксида и этилацетата в соотношении 1:2 и повышенной температуре получают соответственно соединения А1, А2, А3,структура которых указана в формуле изобретения. Использование новых промежуточных продуктов позволяет увеличить выход и стереоселективность способа получения соединений А1, А2, А3. 3 н. и 1 з.п. ф-лы, 6 пр.
Формула
где R1=C1-C4алкил; R2=H, CH2OCH2CH2Si(CH3)3.
где R1=H, C1-C4алкил; R2=H, CH2OCH2CH2Si(CH3)3;
1(1): R1=H, R2=H.
Документы, цитированные в отчёте о поиске
Циклические n, n'-диарилтиомочевины или n, n'-диарилмочевины - антагонисты андрогенных рецепторов, противораковое средство, способ получения и применения

Комментарии