Использование 3-n-бутил изоиндолин кетонов при приготовлении лекарственных средств для профилактики и лечения церебрального инфаркта - RU2625797C2
Код документа: RU2625797C2
Чертежи



Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к области фармацевтических составов, в частности к использованию 3-н-бутил изоиндолин кетона и его лекарственного препарата в приготовлении лекарств для профилактики и лечения церебрального инфаркта.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Церебральный инфаркт (ЦИ), также известный как церебральный ишемический инсульт (ЦИИ), представляет собой очаговое размягчение и некроз тканей головного мозга в результате нарушения кровообращения, ишемии и гипоксии. Основной причиной ЦИ является атеросклероз и тромбообразование в артериях, снабжающих головной мозг кровью, что ведет к сужению или закупорке артерий и вследствие этого к острому заболеванию, связанному с фокальной ишемией головного мозга; также причиной может быть попадание в церебральные артерии или сонную артерию инородных предметов (твердых веществ, жидкостей, газов), обеспечивающих мозговой кровоток, что ведет к закупорке сосудов и последующему размягчению и некрозу тканей головного мозга на соответствующих участках.
ЦИ является одной из трех основных причин смертности, угрожающих человеческой жизни и здоровью, уступая только заболеваниям сердца и раку. Помимо этого, высокий показатель нетрудоспособности (75%) у пациентов с ЦИ приводит к тяжелым страданиям пациентов и финансовым проблемам их семей. Таким образом, поиск идеальных лекарств для лечения ЦИ был одной из основных проблем в медицине.
В настоящий момент времени наиболее эффективным признанным способом лечения острого ишемического ЦИ является тромболитическая терапия. Чаще всего используется такой препарат, как тканевый активатор плазминогена (ТАП), однако же его применение в лечении связано с высоким риском внутричерепного кровоизлияния, последствия которого могут быть критичными. Другие существующие нейропротекторы показывают меньшую эффективность в клинической практике, и их применение связано с достаточно серьезными побочными эффектами.
В 1990-х гг. знаменитый фармаколог Фенг Йипу в ходе неустанных попыток разработал новое лекарство для лечения ишемического ЦИ - бутилфталид, имеющий торговое наименование НБП (NBP). ИБП - это третий химический препарат в Китае, на который зарегистрированы независимые права интеллектуальной собственности, помимо артемизинина и бициклола. В ходе исследования фармакодинамики и фармакологического действия было обнаружено, что бутилфталид является нейропротекторным препаратом, адаптированным для улучшения мозгового кровотока, а также блокировки множества патологических проявлений ишемии головного мозга. Бутилфталид имеет натуральное растительное происхождение, впервые он был обнаружен в экстракте семян сельдерея, а впоследствии синтезирован искусственным путем. После множества клинических испытаний была подтверждена клиническая эффективность бутилфталида, его высокая безопасность, удобство применения и незначительность побочных явлений.
Бутилфталид является многоцелевым лекарственным препаратом для лечения ишемии головного мозга, механизмы действия которого представлены в следующих аспектах:
1) улучшение функционирования митохондрии, повышение уровня оксида азота (NO) и простациклина (PGI2) в сосудистом эндотелии головного мозга, а также замедление выработки глютаминовой кислоты;
2) улучшение местного мозгового кровотока, капиллярного кровообращения в головном мозге, а также уменьшение энергетического метаболизма при ишемии головного мозга и облегчение симптомов отека головного мозга, вызванных церебральной ишемией;
3) уменьшение содержания арахидоновой кислоты и концентрации кальция в клетке, ингибирование свободных радикалов кислорода, а также усиление действия антиоксидантных ферментов;
4) антитромботическое и антиагрегантное действие, уменьшение нарушений памяти при ишемии головного мозга и неврологических расстройствах, а также области поражения при ЦИ.
В китайской патентной публикации номер CN 1257706 А было описано использование бутилфталида в изготовлении антитромботических и антиагрегантных лекарств. В китайской публикации номер CN 102008464 А было описано использование L-бутилфталида в изготовлении лекарств для профилактики и лечения ЦИ.
Хотя бутилфталид показал хорошую эффективность в лечении ЦИИ, он может быть приготовлен только в форме маслорастворимого препарата, так как обладает маслянистой структурой, вследствие чего нерастворим в воде, и возможность изготовления различных лекарственных форм существенно ограничена.
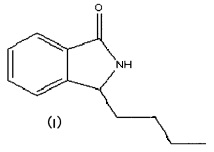
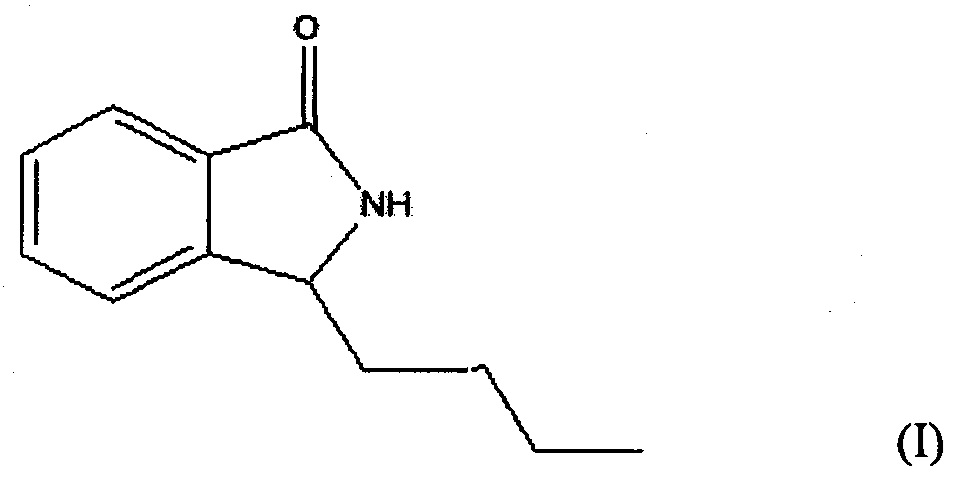
Изобретение представляет собой соединение 3-н-бутил-изоиндолин кетон, имеющее структуру, аналогичную структуре бутилфталида, т.е. в нем -О- заменено на -NH-, при этом двуядерная структура остается без изменений; при этом 3-n-бутил изоиндолин кетон представляет собой белое кристаллическое вещество, что очень удобно для выполнения требований к препаратам. Так как описанное соединение и бутилфталид имеют схожую структуру и молекулярный вес, предполагается, что оно имеет такую же эффективность, как и бутилфталид. В исследовании фармакодинамики указано, что 3-n-бутил изоиндолин кетон имеет явное действие в лечении ЦИ, вызванного очаговой ишемией головного мозга, и что существенное статистическое различие в эффективности лечения по сравнению с бутилфталидом отсутствует. Таким образом, соединение 3-n-бутил изоиндолин кетон адаптировано для сохранения эффективности в лечении ишемии головного мозга и преодоления недостатков уже существующих препаратов бутилфталида, что придает ему особое значение в лечении заболеваний, вызванных ишемией головного мозга.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Для преодоления проблем в использовании бутилфталида при уровне, известном до настоящего изобретения, одной из целей изобретения было обеспечение использования соединения 3-n-бутил изоиндолин кетон, представленного формулой I, для профилактики или лечения ишемии головного мозга и подтверждение того, что соединение 3-n-бутил изоиндолин кетон не имеет существенного статистического различия в лечении ишемии головного мозга по сравнению с бутилфталидом; достижение этих целей предполагается через проведение фармакодинамических экспериментов. В то же время, так как соединение 3-n-бутил изоиндолин кетон имеет кристаллическую структуру, для него характерен расширенный диапазон лекарственных форм, благодаря чему преодолены ограничения, присущие препаратам бутилфталида, что имеет большое значение в промышленном производстве и уменьшении себестоимости лекарства.
Для достижения описанной выше цели принято следующее техническое решение согласно изобретению:
Изобретение относится к использованию соединения или лекарственного препарата 3-n-бутил изоиндолин кетон в лечении ЦИ, вызванного очаговой ишемией.
Исследования показали, что по сравнению с 3-n-бутилфталидом, 3-n-бутил изоиндолин кетон не показал статистического различия в лечении ЦИИ.
Сконструирована модель закупорки средней артерии головного мозга (ЗСАГМ) у крыс для наблюдения противоишемического действия 3-n-бутил изоиндолин кетона. Модель ЗСАГМ разделена на три группы: 1) контрольная группа, получавшая отрицательную пробу, т.е. растительное масло, 3 мл/кг; 2) контрольная группа, получавшая 3-n-бутил изоиндолин кетон, 30 мг/кг; 3) контрольная группа, получавшая положительную пробу, т.е. 3-n-бутилфталид, 30 мг/кг. Введение в организмы всех трех групп осуществляется посредством внутрибрюшинной инъекции. Отобраны крысы линии Спрега-Доули мужского пола массой тела 250 г с однократным введением в течение 15 минут после ишемии. Через два часа после церебрального инфаркта и 24 часа реперфузии срезы мозга подготавливаются и проводится окрашивание тетразолия хлоридом. Программное обеспечение Image J используется для обработки результатов окрашивания, расчета площади поражения при инфаркте и сравнения результатов по различным группам. По результатам известно, что средняя площадь поражения при инфаркте у контрольной группы, получавшей холостую пробу, составила 24,430%, группы, получавшей 3-n-бутил изоиндолин кетон - 14,365%, а группы, получавшей бутилфталид - 14,402%. Статистические результаты указывают на то, что 3-n-бутил изоиндалин кетон не имеет существенного статистического различия в лечении ишемии головного мозга по сравнению с бутилфталидом.
Результаты исследования подтверждают, что 3-n-бутил изоиндолин кетон имеет хорошую эффективность в лечении ишемии головного мозга. Помимо этого, по сравнению с маслянистой и жидкой структурой бутилфталида, твердая кристаллическая структура 3-n-бутил изоиндолин кетона дает больше возможностей для изготовления лекарственных форм, изменения путей введения, а также снижает себестоимость, повышая при этом эффективность лекарственного средства. Таким образом, 3-n-бутил изоиндолин кетон имеет большие перспективы применения.
Изобретение также представляет собой лекарственный препарат, состоящий из 3-n-бутил изоиндолин кетона в качестве активного компонента и фармацевтически приемлемого носителя или вспомогательного вещества. Обычно лекарственный препарат содержит от 0,1 до 95% 3-n-бутил изоиндолина по весу соединения.
Лекарственный препарат может быть приготовлен с помощью хорошо известных в технической области методов. Для этой цели соединение 3-n-бутил изоиндолин кетон или представляющий его лекарственный препарат адаптированы для смешивания с различными вспомогательными веществами и/или носителями при необходимости, в силу чего становится возможным изготовление лекарств для людей и животных в различной лекарственной форме и дозировке.
Что касается аспектов приготовления, так как 3-n-бутил изоиндолин кетон имеет кристаллическую структуру, лекарственный препарат из него может быть изготовлен в формах жидкой дозировки, газовой дозировки, полутвердой дозировки и твердой дозировки. Например, к формам жидкой дозировки относятся: истинные растворы, эмульсии, суспензии, формы направленной доставки, а также коллоидные формы. К газовым формам дозировки относятся: аэрозоли, спреи и сухие ингаляции. К полутвердым формам дозировки относятся: пасты для перорального приема, наружного приема и прочие пасты. К твердым лекарственным формам относятся: таблетки, капсулы, пилюли, порошки, суппозитории, гранулы, лиофилизированный порошок и прочее.
Соединение 3-n-бутил изоиндолин кетон или представляющий его лекарственный препарат вводятся в форме одноразовой дозы. Введение осуществляется энтеральным или парэнтеральным способом, например орально, внутримышечно, подкожно, назально, через слизистую полости рта, кожу, брюшную полость и прямую кишку.
Пути введения соединения 3-n-бутил изоиндолин кетон и его лекарственного препарата включают введение посредством инъекции, в том числе внутривенную инъекцию, внутримышечную инъекцию, подкожную инъекцию, внутрикожную инъекцию и акупунктурную инъекцию.
Соединение 3-n-бутил изоиндолин кетон или представляющий его лекарственный препарат производятся в виде обычных препаратов, препаратов с пролонгированным действием, систем направленной доставки лекарств и прочих систем доставки.
Для изготовления стандартных лекарственных форм может быть использовано множество известных в технической области вспомогательных веществ и носителей. К ним относятся: разбавители и абсорбенты, такие как крахмал, декстрин, сульфат кальция, лактоза, маннитол, сахароза, хлорид натрия, глюкоза, мочевина, карбонат кальция, каолин, микрокристаллическая целлюлоза и силикат алюминия и т.д.; увлажнители и связующие вещества, такие как вода, глицерин, полиэтиленгликоль, этиловый, изопропиловый спирт, крахмальный клейстер, декстрин, сироп, мед, раствор глюкозы, аравийская камедь, желатин, натрий-карбоксиметилцеллюлоза, шеллак, метилцеллюлоза, фосфат калия, поливинилпирролидон и т.д.; разрыхлители, такие как сухой крахмал, альгинат, порошок агара, бикарбонат натрия и лимонная кислота, карбонат кальция, полиоксиэтиленовый эфир сорбита и жирной кислоты, додецилсульфат натрия, метилцеллюлоза, а также этилцеллюлоза и т.д.; а также ингибиторы распада, такие, как сахароза, тристеарат глицерина, какао-масло, гидрогенизированное масло и т.д.; ускорители впитывания, такие как четвертичные аммониевые соли и додецилсульфат натрия и т.д., смазочные материалы, такие как тальк, двуокись кремния, кукурузный крахмал, соли стеариновой кислоты, борная кислота, вазелиновое масло, полиэтиленгликоль и прочее. Таблетки также могут производиться в виде таблеток с покрытием, таких как таблетки со сладкой оболочкой, пленочной оболочкой, кишечнорастворимой оболочкой, а также таблетки с двухслойной и многослойной оболочкой.
Например, для изготовления стандартных лекарственных форм в виде таблеток может быть использовано множество известных в технической области вспомогательных веществ. Вспомогательные вещества для пилюль представляют собой: разбавители и адсорбенты, такие как глюкоза, лактоза, крахмал, какао-масло, гидрогенерированное растительное масло, поливинилпирролидон, каолин, тальк и т.д.; связующие вещества, такие как аравийская камедь, тракангант, желатин, этиловый спирт, мед, глюкозный сироп, рисовый клейстер или хлебная паста и т.д.; а также разрыхлители, такие как порошок агара, сухой крахмал; альгинат, додецилсульфат натрия, метилцеллюлоза, этилцеллюлоза и т.д.
Например, для получения лекарственной формы с однократной дозировкой в капсулах активное вещество 3-n-бутил изоиндолин кетон и перечисленные выше вспомогательные вещества смешиваются, а получаемая в результате смесь заключается в твердые желатиновые или мягкие капсулы. Или действующий компонент 3-n-бутил изоиндолин кетон формуется в микрокапсулы, которые взвешиваются в водных растворах для образования суспензии, или в твердые капсулы, или для применения в виде инъекций.
Например, для приготовления из стандартных лекарственных форм препаратов для инъекций, таких как растворы, суспензии, эмульсии, лиофилизированные порошки, такие препараты могут быть водными или безводными и включать в себя один и/или несколько различных фармацевтически приемлемых носителей, разбавителей, связующих веществ, смазывающих веществ, консервантов, сурфактантов или диспергирующих веществ. Например, к разбавителям могут быть отнесены вода, этиловый спирт, полиэтиленгликоль, 1,3-пропиленгликоль, этоксилированные изостеариловые спирты, сложные оксидированные изостеариловые спирты, а также полиоксиэтиленовые эфиры сорбита и жирной кислоты. Также для приготовления изотонических растворов для инъекций может быть добавлена надлежащая доза хлорида натрия, глюкозы или глицерина. Также могут быть добавлены совместные растворители, буферные растворы и регуляторы кислотности. Такие добавки обычно используются в области технического применения.
В дополнение к этому, при необходимости, в ходе приготовления лекарственных препаратов могут быть добавлены красители, консерванты, ароматизаторы, вкусовые добавки, подсластители или какие-либо иные вещества.
Для достижения цели введения препарата и повышения эффективности лечения лекарственное средство или лекарственный препарат, описанный в изобретении, могут быть введены любыми известными способами.
Дозировка лекарственного препарата 3-n-бутил изоиндолин кетон определяется различными факторами, например характером и тяжестью заболевания, которое необходимо предотвратить или вылечить, а также полом, возрастом, массой, характером и индивидуальной реакцией пациентов или животных, а также способом ведения, временем введения и целью лечения. Таким образом, терапевтическая доза лекарственного препарата может варьироваться от случая к случаю в пределах достаточно большого диапазона. Обычно доза лекарственных препаратов известна специалистам в данной области и может быть надлежащим образом скорректирована в соответствии с фактическим содержанием ингредиентов в готовом к употреблению препарате 3-n-бутил изоиндолин кетон для получения количества, необходимого для эффективного лечения и достижения цели профилактики или лечения. Надлежащая доза препарата 3-n-бутил изоиндолин кетон предпочтительно составляет от 0,1 до 100 мг на 1 кг массы тела в день и более предпочтительно 0,1-100 мг/день/человек. Указанная выше доза может иметь форму, предназначенную для однократного приема, или быть разделена на несколько доз, например две, три или четыре дозы для многократного приема, что определяется клиническим опытом врачей и способами введения прочих лечебных средств.
Общая доза, необходимая для каждого конкретного случая, может быть разделена на несколько приемов или приниматься однократно. Препарат может приниматься отдельно или вместе с другими лекарствами или симптоматическими лекарственными средствами в скорректированной дозировке.
Изобретение подробно описано ниже вместе с примерами, и следует отметить, что следующие примеры не ограничивают применение изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1 представлено цифровое изображение результатов окрашивания срезов мозга крыс через 2 часа после ЗСАГМ и через 24 часа после реперфузии в контрольной группе, получавшей холостую пробу;
На фиг. 2 представлено цифровое изображение результатов окрашивания срезов мозга крыс через 2 часа после ЗСАГМ и через 24 часа после реперфузии в контрольной группе, получавшей 3-n-бутил изоиндолин кетон;
На фиг. 3 представлено цифровое изображение результатов окрашивания срезов мозга крыс через 2 часа после ЗСАГМ и через 24 часа после реперфузии в контрольной группе, получавшей бутилфталид;
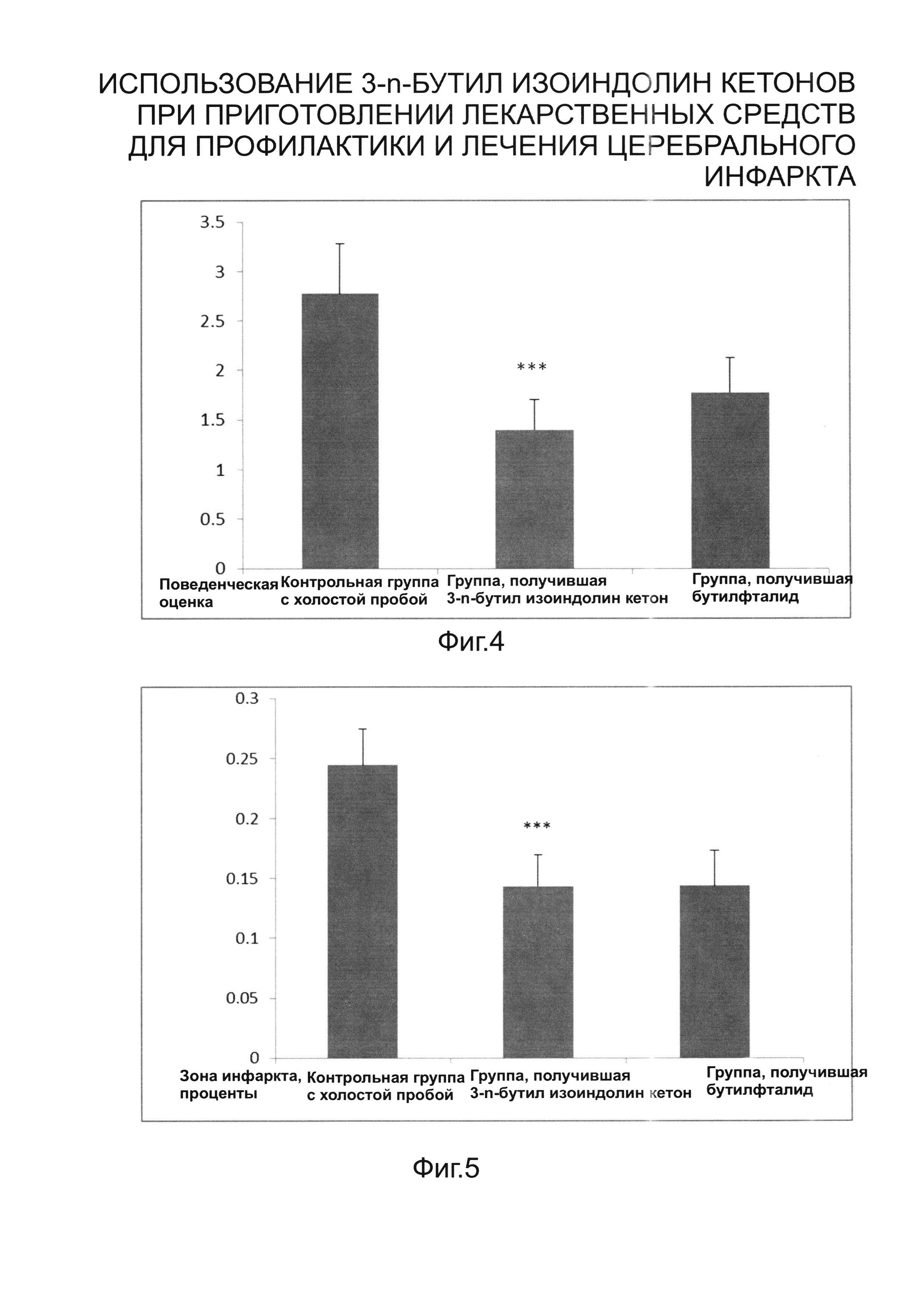
На фиг. 4 представлена блок-схема, показывающая поведение контрольной группы, получавшей холостую пробу, группы, получавшей 3-n-бутил изоиндолин кетон, и группы, получавшей бутилфталид; а также
На фиг. 5 представлена блок-схема, показывающая процент поражения при инфаркте у контрольной группы, получавшей холостую пробу, группы, получавшей 3-n-бутил изоиндолин кетон, и группы, получавшей бутилфталид.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Пример 1. Приготовление таблеток 3-n-бутил изоиндолин кетона

3-n-бутил изолиндолин кетон отбирается с точной постоянной массой в соответствии с рецептом, перемалывается в порошок и просеивается через сито 100 ячеек/лин. дюйм. Далее берется крахмал с точной постоянной массой и просеивается через сито 100 ячеек/лин. дюйм. После просеивания 3-n-бутил изоиндолин кетон и крахмал перемешиваются до однородности, добавляется надлежащее количество этилового спирта 50% объема, в результате чего получается сырая смесь. Для грануляции применяется нейлоновое сито 18 ячеек/лин. дюйм. Гранулы подсушиваются при температуре от 60 до 70°С. Затем используется сито 18 ячеек/лин. дюйм для формирования гранул. После этого добавляются карбоксиметилкрахмал натрия и стеарат магния, и смесь перемешивается до однородности. Для изготовления таблеток используется пресс-форма диаметром 8 мм.
Пример 2. Приготовление твердых капсул 3-n-бутил изоиндолин кетона

Метод влажной грануляции здесь такой же, как и в Примере 1. 3-n-бутил изолиндолин кетон отбирается с точной постоянной массой в соответствии с рецептом, перемалывается в порошок и просеивается через сито 100 ячеек/лин. дюйм. Далее отбирается крахмал с точной постоянной массой и просеивается через сито 100 ячеек/лин. дюйм. После просеивания 3-n-бутил изоиндолин кетон и крахмал перемешиваются до однородности и добавляется надлежащее количество этилового спирта 50% объема, в результате чего получается сырая смесь. Для грануляции применяется нейлоновое сито 18 ячеек/лин. дюйм. Гранулы подсушиваются при температуре от 60 до 70°С. Затем используется сито 18 ячеек/лин. дюйм для формирования гранул. После этого измеряется содержание ингредиентов, соответствующие требованиям гранулы помещаются в капсулы номер 1.
Пример 3. Приготовление мягких капсул 3-n-бутил изоиндолин кетона
Берется 1 г подготовленного 3-n-бутил изоиндолин кетона, 10 г растительного масла, 1 г полиглицериновых эфиров, после чего смесь перемешивается до однородности в шаровой мельнице для приготовления содержимого мягких капсул. Желатин, глицерин, вода и замутнитель берутся в соотношении 1:0.4:0.8:0.01 в качестве сырья для изготовления капсул. Для изготовления мягких капсул используется метод формования прессованием. Мягкие капсулы отвердевают и высушиваются прохладным воздухом, промываются и высушиваются с помощью подходящих растворителей, изготавливается 100 гранул мягких капсул.
Пример 4. Приготовление сухого порошка 3-n-бутил изоиндолин кетона
Берется 1 г 3-n-бутил изоиндолин кетона и растворяется в 800 мл воды для инъекций. После этого добавляется 6 г маннитола. После полного растворения добавляется вода для инъекций в таком объеме, чтобы объем получившегося в результате раствора составил 1000 мл. Получившийся раствор обезуглероживается с помощью активированного угля и пропускается через микропористую мембрану, а затем разливается в пенициллиновые пузырьки 7 мл по 4 мл в каждый. Затем вставляются запорные крышки. После этого пузырьки высушиваются и закрываются колпачком. В результате получается 4 мг сухого порошка 3-n-бутил изоиндолин кетона в каждом пузырьке.
Пример 5. Приготовление раствора для инъекций 3-n-бутил изоиндолин кетона
1 г подготовленного 3-n-бутил изоиндолин кетона и 9 г хлорида натрия разбавляются 900 мл воды для инъекций и корректируется значение рН получившейся в результате смеси до тех пор, пока оно не будет в пределах 6,5-7,2. Добавляется 3 г кристаллизованного угля, перемешивается до однородности, после чего смесь кипятится в течение 15 минут. Затем горячий раствор фильтруется через фильтровальную бумагу для удаления угля и проходит тонкую очистку путем фильтрования через микропористую мембрану 22 мкм. Добавляется вода для инъекций в таком объеме, чтобы объем получившегося в результате раствора составил 1000 мл. После этого проверяется прозрачность раствора, и проверенный раствор разливается в ампулы 5 мл. Ампулы заплавляются, после чего проходят стерилизацию под давлением при температуре 110°С в течение 30 минут.
Пример 6. Действие 3-n-бутил изоиндолин кетона на объем инфаркта в моделях ЗСАГМ у крыс
1) Структура модели закупорки средней артерии головного мозга (ЗСАГМ) у крыс
Отбираются крысы линии Спрега-Доули мужского пола с массой тела от 250 до 270 г. Крысы линии Спрега-Доули содержатся при комнатной температуре 25 °С и не получают корма, помимо воды, в течение 12 часов до операции. Модели ЗСАГМ построены по методу Лонга или аналогичному методу. Для обезболивания крыс используется хлоралгидрат 10%, который вводится внутрибрюшинно в дозировке 350 мг/кг. Затем крыса фиксируется на спине на пластине в лежачем положении и подсвечивается лампой накаливания для поддержки температуры тела на уровне 37±0,5°С. Шерсть крыс в средней части шеи удаляется, кожа в этом месте рассекается после дезинфекции. Общая сонная артерия (ОСА), наружная сонная артерия (НСА) и внутренняя сонная артерия (ВСА) с правой стороны осторожно отделяются друг от друга. ВСА разрезается, разрезанный конец выпрямляется и совмещается с ВСА, после чего вставляется нить из этого места. Нить вставляется на глубину примерно 19,0±0,5 мм. Через два часа часть нити вытягивается для осуществления реперфузии. После сшивания раны крыса снова помещается в клетку. Через двадцать четыре часа после реперфузии срезы головного мозга подготавливаются для окрашивания.
2) Разделение на группы и введение лекарств
Крысы делятся на три группы, по 10 в каждой: 1) контрольная группа, получавшая холостую пробу, т.е. растительное масло, 3 мл/кг; 2) контрольная группа, получавшая 3-н-бутил изоиндолин кетон, 30 мг/кг; 3) контрольная группа, получавшая положительную пробу, т.е. 3-n-бутилфталид, 30 мг/кг. Введение в организмы всех трех групп осуществляется посредством внутрибрюшинной инъекции.
3) Оценка нейроповеденческих функций
Согласно шкале оценки Зи Лонго (Zea Longa), изучение поведения животных проводится через 2 часа после моделирования и 24 часа после реперфузии и до умерщвления крыс. Хвост крысы захватывается для подъема ее примерно на 1 фут над поверхностью и наблюдения состояния левой передней конечности. Крыса помещается на ровную поверхность, после чего правое и левое плечи крысы вытягиваются с правой стороны и с левой стороны, соответственно, для сравнения силы сопротивления с каждой стороны. Крыса помещается на ровную поверхность и отпускается, нужно наблюдать за условиями перемещения крысы. Принят четырехступенчатый метод суммарной оценки (оценка от 0 до 5), чем выше оценка, тем серьезнее нарушение нейроповеденческих функций.
1. Если поведение не отличается от нормального, ставится оценка 0.
2. Поднимите крысу за хвост от поверхности, если крыса согнет переднюю конечность со стороны, противоположной операции, ставится оценка 1.
3. Поместите крысу на поверхность, руками потяните ее с двух сторон, чтобы понять, какова сила сопротивления, если сопротивление со стороны, противоположной операции, меньше, ставится оценка 2.
4. Поместите крысу на поверхность и посмотрите, как она ходит, если она делает круги вокруг стороны, противоположной операции, ставится оценка 3.
5. Если повреждение очень серьезно и крыса не способна выполнять какие-либо самостоятельные действия, ставится оценка 4.
Чем выше оценка, тем более серьезно повреждение мозга, в качестве модели заключительного испытания не могут быть отобраны слишком легкие или слишком тяжелые повреждения. Стандартное моделирование выполнено удовлетворительно, когда оценка нейроповеденческих функций через два часа после моделирования и до вытягивания нити составляет 3, т.е. наблюдаются явные круги при перемещении крысы.
Через 24 часа после реперфузии в моделях ЗСАГМ у крыс проводится повторная оценка нейроповеденческих функций, результаты которой регистрируются.
4) Измерение и расчет площади поражения при церебральном инфаркте
Через 24 часа после реперфузии из умерщвленных крыс извлекается мозг, который помещается в чашки Петри. Ткани головного мозга быстро собираются и помещаются в морозильную камеру, где они держатся при температуре -20°С в течение 20 минут, а затем вынимаются. Обонятельная луковица, мозжечок и нижняя часть ствола удаляются, после чего оставшаяся часть мозга разрезается пять раз с промежутком 2 мм, соответственно, получается шесть последовательных фронтальных срезов мозга. В чашки Петри добавляется красящий раствор тетразолия хлорида 2% для погружения срезов мозга в него. Чашки Петри помещаются в условия с температурой 37°С и выдерживаются при отсутствии света 25-30 минут, в течение которых срезы мозга переворачиваются каждые 5 минут. После окрашивания срезов мозга тетразолия хлоридом, нормальные ткани приобретают красный цвет, а области, пораженные ишемией - белый. По завершении окрашивания тетразолия хлоридом, раствор тетразолия хлорида удаляется из чашек Петри с помощью шприцев. После этого туда добавляется раствор формалина в количестве, необходимом для погружения срезов мозга, и чашки Петри помещаются в темное место. Через 24 часа отвердевшие срезы мозга вынимаются и располагаются по порядку на синем фоне для их фотографирования. Для обработки изображений используется программное обеспечение для анализа изображений Image J, которое рассчитывает общую площадь среза мозга и площадь поражения, и исходя из этих данных получается процент поражения при церебральном инфаркте с помощью следующего уравнения: процент поражения при церебральном инфаркте (%) = (площадь поражения/общая площадь среза мозга) × 100%. Так как каждый срез имеет одинаковую толщину 2 мм, площадь поражения может в определенной степени дать представление об объеме инфаркта.
5) Результаты эксперимента
Из результатов оценки нейроповеденческих функций известно, что в группе, получавшей растворитель, оценка 0 у крыс не зарегистрирована, в то время как преобладает оценка 2 или 3. Крысы, которые подгибают передние конечности при подъеме и демонстрируют меньшее сопротивление с противоположной операции стороны при приложении внешней силы для вытягивания, получили оценку 2. Крысы, которые перемещались по кругу, получили 3. Некоторые крысы показали относительно серьезные симптомы и не могли перемещаться, они получили оценку 4. Данные эксперимента проходят линейную обработку в статистическом программном обеспечении SPSS 17.0; для рассмотрения различий нейроповеденческих функций по группам используется однофакторный дисперсионный анализ, который указывает на то, что контрольная группа, получавшая 3-n-бутил изоиндолин кетон, показала существенные различия (Р=0,003<0,01) нарушения нейроповеденческих функций по сравнению с группой, получавшей холостую пробу, и не показала существенные различия (Р=0,384>0,05) по сравнению с группой, получавшей бутилфталид, также наблюдаются существенные различия нарушений нейроповеденческих функций группы, получавшей бутилфталид, по сравнению с группой, получавшей холостую пробу (Р=0,031<0,05). По результатам оценки нейроповеденческих функций подтвердилось, что 3-n-бутил изоиндолин кетон обладает определенной эффективностью в уменьшении симптомов, вызванных очаговой ишемией головного мозга у крыс, эффективность 3-n-бутил изоиндолин кетона в уменьшении таких симптомов несколько выше, чем эффективность бутилфталида. Заключение совпадает с результатами окрашивания срезов головного мозга, а также указывает на то, что повышение эффективности лекарства при нарушениях нейроповеденческих функций находится в параллельной корреляции с действием на уменьшения площади поражения при инфаркте.
Действие 3-n-бутил изоиндолин кетона на объем церебрального инфаркта показано на сопровождающих документ иллюстрациях, отображающих результаты эксперимента.
Площадь поражения и общая площадь среза мозга всех групп получены с помощью программы Image J, которая рассчитывает процент поражения при инфаркте. Подтверждено, что эффективность 3-n-бутил изоиндолин кетона в уменьшении области поражения при инфаркте очевидна и даже выше, чем в контрольной группе, получавшей бутилфталид. По сравнению с контрольной группой, получавшей растворитель, объем инфаркта у группы, получавшей 3-н-бутил изоиндолин кетон, меньше на 41,199%, что доказывает очевидность его действия. Действие на уменьшение области поражения при инфаркте в трех группах сравнивается с помощью однофакторного дисперсионного анализа, который выявил, что контрольная группа, получавшая 3-n-бутил изоиндолин кетон, продемонстрировала существенные различия по сравнению (Р<0,001) в уменьшении площади поражения по сравнению с контрольной группой, получавшей холостую пробу, а различие между группой, получавшей 3-n-бутил изоиндолин кетон и бутилфталид, не имеет какого-либо статистического значения (Р=0,989). Бутилфталид также показал существенные различия (Р<0,01) в уменьшении площади поражения при инфаркте по сравнению с контрольной группой, получавшей холостую пробу.
Представленные выше результаты подтверждают, что 3-n-бутил изоиндолин кетон оказывает определенное терапевтическое действие при ишемическом церебральном инфаркте и имеет большое значение в лечении церебрального инфракта.
Реферат
Изобретение относится к применению 3-н-бутил изоиндолин кетона формулы I, для приготовления лекарственных средств для профилактики и лечения церебрального инфаркта. Соединение может быть использовано в различных лекарственных формах и дает большие возможности клинического применения. 2 н. и 5 з.п. ф-лы, 5 ил., 6 пр.
Формула
Документы, цитированные в отчёте о поиске
Применение l-бутилфталида для изготовления лекарственного средства для профилактики и лечения церебрального инфаркта

Комментарии