Применение l-бутилфталида для изготовления лекарственного средства для профилактики и лечения церебрального инфаркта - RU2336870C2
Код документа: RU2336870C2
Чертежи
Описание
Область техники
Изобретение относится к применению L-н-бутилфталида и содержащей его композиции для изготовления лекарственных средств для профилактики и лечения церебрального инфаркта, в частности церебрального инфаркта, индуцированного фокальной церебральной ишемией.
Предшествующий уровень техники
Цереброваскулярные заболевания являются одной из основных причин смертности в Китае, поэтому необходимы лучшие терапевтические агенты для лечения острого ишемического церебрального инсульта во всем мире. Тромболитический агент ТАП (тканевый активатор плазминогена), который был одобрен Управлением по контролю за пищевыми продуктами и лекарственными средствами США (FDA) в 1996 году, имеет спорный терапевтический эффект на эти заболевания из-за наличия побочных эффектов, связанных с высоким риском мозгового кровотечения. Результаты испытаний различных агентов, защищающих мозг, показали, что клинические терапевтические эффекты многих лекарств либо являются недостаточными либо эти лекарства имеют серьезные побочные эффекты. Ряд лекарств еще находится на стадии клинических испытаний.
Более чем 10 лет назад авторы настоящего изобретения обнаружили, что рацемический бутилфталид (или бутилфталид, н-БФ) является лекарством, которое обладает сильным терапевтическим действием на острый ишемический церебральный инсульт. Его фармакодинамические характеристики включают:
1) улучшение энергетического метаболизма в ишемическом мозге;
2) значительное сокращение области церебрального инфаркта у крыс, индуцированного фокальной церебральной ишемией, и ослабление дефицита мозговой функции;
3) ослабление отека мозга, индуцированного фокальной церебральной ишемией;
4) значительное улучшение фокального церебрального кровотока в ишемической области и микроциркуляции в сосудистой мозговой оболочке у крыс;
5) значительное ослабление расстройств памяти, индуцированных фокальной церебральной ишемией.
Кроме того, это вещество является менее токсичным. Заявителем было получено два патента на применение в соответствующей области, это - Китайский патент №ZL93117148 под названием "Применение бутилфталида для изготовления лекарственных средств для профилактики и лечения заболеваний, индуцированных церебральной ишемией", опубликованный в 1999 году, и Китайский патент №ZL98125618.X под названием "Применение бутилфталида для изготовления лекарственных средств против тромбоза", опубликованный в 2002 году, кл. А61К 31/34.
После доклинических испытаний было проведено 542 клинических испытания фазы II и фазы III, 192 из которых были многоцентровыми, рандомизированными с двойным слепым плацебо-контролем. Было обнаружено, что общая эффективность в лечебных группах составила 70,7%, а в группе плацебо - 41,0%. Был получен хороший терапевтический эффект. Были получены Сертификат на новое лекарство и лицензия на изготовление лекарства I класса с бутилфталидом для лечения острого ишемического церебрального инсульта в Государственном Управлении по контролю за лекарственными средствами Китая в 2002 году (Национальные Лицензии на лекарство №№ Н20020374; Н20020375; 2002Н0551 и 2002Н0552).
Было проведено химическое разделение рацемического бутилфталида (далее - DL-БФ) на левовращающий бутилфталид (далее - L-БФ) и правовращающий бутилфталид (далее - D-БФ). Заявитель данной заявки подал в Китае заявку на патент №99109673.8, номер публикации - CN1283621A, под названием "Способ получения оптически активного 3-н-бутилфталида". Кроме того, функция L-бутилфталида не упоминалась в предыдущем китайском патенте №ZL93117148.
Раскрытие изобретения
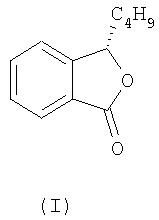
Настоящее изобретение решает проблемы, известные из предшествующего уровня техники, и предлагает применение L-бутилфталида (далее - L-БФ) формулы
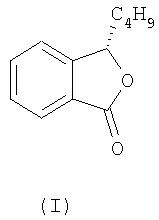
для изготовления лекарственных средств для профилактики и лечения церебрального инфаркта.
L-н-бутилфталид, который предназначен для применения согласно изобретению, получают путем химического синтеза рацемического н-бутилфталида, который затем разделяют на оптические изомеры с получением левовращающего изомера н-бутилфталида.
После анализа методами ядерной магнитной спектроскопии, масс-спектроскопии, инфракрасной спектроскопии и т.п., особенно анализа на газовом хроматографе HP 5890 с использованием хиральной колонки (Chiraldex G-TA) было подтверждено, что продукт представляет собой один чистый оптический стереоизомер - левовращающий н-бутилфталид, имеющий следующие характеристики: удельная оптическая активность > -66,49°, оптическая чистота >98%, химическая чистота >98%. Способ разделения был раскрыт в китайской заявке на патент №99109673.8 под названием "Способ получения оптически активного 3-н-бутилфталида", номер публикации CN1283621. Этот продукт имеет химическую формулу, которая идентична формуле н-бутилфталида, содержащегося в сельдерее и его семенах.
Исследования показали, что оптический изомер L-бутилфталид оказывает лучшее терапевтическое действие на церебральную ишемию у крыс, чем DL-бутилфтапид, содержащий такое же количество L-бутилфталида.
В настоящих исследованиях изучали терапевтический эффект оптического изомера L-бутилфталида на церебральную ишемию на крысиной модели ишемического церебрального инсульта, который был индуцирован путем двухчасовой окклюзии средней церебральной артерии, за которой следовала 24-часовая реперфузия. Крысы с индуцированной фокальной церебральной ишемией были разделены на 8 групп по 10 животных в каждой группе. Контрольная группа 1 принимала плацебо-растворитель с 1 мг/кг растительного масла, группы 2 и 3 принимали 40 и 80 мг/кг DL-бутилфталида; группы 4 и 5 принимали 20 и 40 мг/кг D-бутилфталида; группы 6 и 7 принимали 20 и 40 мг/кг L-бутилфталида; и группа 8 принимала 0,1 мг/кг МК801. Группам 1-7 лекарство вводили перорально, а группе 8 - интраперитониально. Растворитель бутилфталида и лекарство для контроля вводили через 15 минут после индуцирования фокальной церебральной ишемии. Значительные различия между каждой группой анализировали методом ANOVA, который показал, что объем инфаркта значительно уменьшился дозо-зависимым образом в группах L-бутилфталида (в обеих группах, принимавших 20 и 40 мг/кг). Эффект уменьшения был более значительным в группе 40 мг/кг L-бутилфталида, объем инфаркта уменьшился до 80,4% (р<0,001 по сравнению с группой плацебо). Терапевтический эффект в этой группе был аналогичным группе МК801 (объем инфаркта был уменьшен до 81,8%, р<0,001), хотя в группах с D-БФ и DL-БФ не было заметного эффекта (см. фиг.1 и 2). Эти результаты показали, что эффект L-БФ на уменьшение объема инфаркта был выше, чем D-БФ. Хотя объем инфаркта в группах DL-БФ (80 мг/кг) и D-БФ (40 мг/кг) был уменьшен по сравнению с группой плацебо, между ними не было существенного различия. Поскольку DL-БФ (80 мг/кг) содержит L-БФ (40 мг/кг), полученный результат предполагает, что присутствие D-БФ в DL-БФ вероятно антагонизирует эффект L-БФ.
Согласно поведенческой оценке по неврологической шкале большинство животных в группе плацебо имело балл 2, который характеризуется контралатеральной флексией передних частей конечностей и уменьшением сопротивления к боковому нажиму. Контралатеральные круговые движения наблюдались у меньшего количества крыс, которым присвоили балл 3. Еще меньшее количество животных показало только контралатеральную флексию передних частей, которым присвоили балл 1; или имело сильные симптомы и отсутствие автономного движения, что оценивали баллом 4. Средний балл по неврологической шкале в группе контроля был 2,6±0,3. Было показано, что пероральное введение 20 или 40 мг/кг L-БФ через 15 минут после ишемии улучшает неврологические симптомы (1,4, р<0,01; и 1,1, р<0,001), эффект МК801 был наиболее значительным (0,8,р<0,001), а в группах D-БФ и DL-БФ не наблюдалось значительного улучшения. Что касается животных в группе МК801, хотя симптомы индуцированной церебральной ишемии были значительно снижены, конечности были слабыми, разъезжались и дрожали, наблюдались атаксия, односторонние повороты. Поведенческая оценка предполагает, что степень улучшения поведения соответствует действию лекарства на объем инфаркта.
В заключение следует отметить, что были получены согласованные результаты биохимических и молекулярно-биологических испытаний, а также испытаний на животных моделях, что подтверждает, что защитное действие L-БФ на мозг существенно выше, чем действие на мозг D-БФ и DL-БФ, и что присутствие D-БФ в DL-БФ антагонизирует действие L-БФ, что приводит к снижению защитного эффекта DL-БФ против церебральной ишемии.
Более ранние исследования показали, что действие L-БФ против агрегации тромбоцитов и против тромбоза является похожим на действие аспирина и тиклопидина. Кроме того, L-БФ также имеет защитное действие на мозг и улучшает микроциркуляцию (D-БФ не имеет такого эффекта), а аспирин и тиклопидин не обладают таким действием. Следовательно, L-БФ имеет такой широкий спектр терапевтического действия, что его можно использовать для лечения острого ишемического церебрального инсульта, а также для профилактики инфаркта миокарда и лечения заболеваний периферической сосудистой системы.
Изобретение направлено на разработку нового лекарства для увеличения терапевтического эффекта и снижения токсических побочных эффектов путем разделения рацемической смеси лекарственного вещества на оптические изомеры, исследования характеристик каждого из них и разработки новых хиральных лекарств, содержащих оптические изомеры с сильным действием и низкими побочными эффектами. В этом контексте L-БФ в рацемическом бутилфталиде обладает относительно сильным действием на ингибирование церебральной ишемии. D-БФ имеет не только слабый ингибирующий эффект, но и антагонизирует ингибирующий эффект L-БФ. Следовательно, является целесообразным создать новое хиральное лекарство для лечения острого ишемического церебрального инсульта из L-БФ.
Изобретение также относится к фармацевтической композиции, содержащей соединение согласно изобретению в качестве активного ингредиента и традиционные фармацевтически приемлемые носители или адъюванты. В общем случае фармацевтическая композиция согласно изобретению содержит 0,1-95 масс.% соединения согласно изобретению.
Фармацевтическая композиция, содержащая соединение согласно изобретению, может быть получена способами, известными в данной области техники. Если необходимо, соединение согласно изобретению можно объединить с одним или более чем одним твердым или жидким фармацевтически приемлемым носителем или адъювантом с получением подходящих для введения лекарственных форм для медицины или ветеринарии.
Соединение согласно изобретению и содержащую его композицию можно вводить в виде единичной лекарственной формы, путь введения может быть интестинальным или парентеральным, таким как перорапьный, внутримышечный, подкожный, назальный, через слизистую рта, трансдермальный, интраперитониальный, ректальный и др.
Путь введения и композиция могут представлять собой инъекцию, включая внутривенную инъекцию, внутримышечную инъекцию, подкожную инъекцию, внутрикожную инъекцию и аккупунктурную инъекцию.
Композиция может быть в виде жидкого или твердого препарата. Например, жидкий препарат может быть раствором, коллоидным раствором, раствором с микрочастицами, эмульсией и суспензией. Можно также использовать другие препараты, такие как таблетки, капсулы, пилюли, аэрозоли, пастилки, порошки, растворы, суспензии, эмульсии, дисперсии, суппозитории, лиофилизованные порошки и др.
Соединение согласно изобретению можно получить в виде традиционных препаратов, а также в виде препаратов с замедленным высвобождением, с контролируемым высвобождением, направленного действия и различных систем для введения микрочастиц.
Для изготовления таких единичных лекарственных форм как таблетки можно использовать различные широко известные носители. Примерами носителей являются, например, разбавители, абсорбенты, такие как крахмал, декстрин, сульфат кальция, лактоза, маннит, сахароза, хлорид натрия, глюкоза, мочевина, карбонат кальция, белая глина (bolus alba), микрокристаллическая целлюлоза, силикат алюминия, и т.п.; увлажняющие и связующие агенты, такие как вода, глицерин, полиэтиленгликоль, этанол, пропанол, суспензия крахмала, декстрин, сироп, мед, раствор глюкозы, суспензия гуммиарабика, желатина, карбоксиметилцеллюлоза натрия, шеллак, метилцеллюлоза, фосфат калия, поливинилпироллидон, и т.п.; дезинтегранты, такие как сухой крахмал, альгинат, порошок агара, крахмал Phaeophyta, гидрокарбонат натрия и лимонная кислота, карбонат кальция, эфир полиоксиэтиленсорбитана и жирной кислоты, лаурилсульфонат натрия, метилцеллюлоза, этилцеллюлоза, и т.п.; агенты, ингибирующие дезинтеграцию, такие как сахароза, тристеарат глицерина, масло какао, гидрогенизированное масло, и т.п.; агенты, усиливающие абсорбцию, такие как соли четвертичного аммония, додецилсульфат натрия, и т.п.; лубриканты, такие как порошок талька, двуокись кремния, кукурузный крахмал, стеаратная соль, борная кислота, жидкий парафин, полиэтиленгликоль, и т.п. Таблетки могут быть изготовлены в виде покрытых оболочкой таблеток, например таблеток с сахарным покрытием, с пленочным покрытием, с энтеропокрытием, в виде двухслойных или многослойных таблеток.
Для изготовления таких единичных лекарственных форм как пастилки можно использовать различные широко известные носители. Примерами носителей являются, например, разбавители, абсорбенты, такие как глюкоза, лактоза, крахмал, масло какао, гидрогенизированное масло, поливинилпироллидон, каолин, порошок талька, и т.п.; связующие агенты, такие как гуммиарабик, трагакантовая смола, желатин, этанол, мед, жидкий сахар, рисовая паста, разваренный хлеб с сахаром и пряностями; дезинтегранты, такие как порошок агара, сухой крахмал, альгинат, лаурилсульфонат натрия, метилцеллюлоза, этилцеллюлоза и т.п.
Для изготовления таких единичных лекарственных форм как капсулы соединение согласно изобретению смешивают с различными носителями, описанными выше, и помещают в твердые желатиновые капсулы или в мягкие капсулы. Соединение согласно изобретению можно включить в микрокапсулы, которые смешивают с водной средой с образованием суспензии и заполняют твердые капсулы, или получить препарат для применения в виде инъекции.
Например, из соединения согласно изобретению можно получить препарат для инъекции, такой как раствор, суспензия, эмульсия, лиофилизованный порошок для инъекции, который может быть водным или неводным и может содержать один или более чем один фармацевтически приемлемый носитель, разбавитель, связующий агент, лубрикант, консервант, сурфактант или диспергатор. Разбавитель может быть выбран из группы, включающей воду, этанол, полиэтиленгликоль, 1,3-пропиленгликоль, этоксилированный изостеариновый спирт, мультиоксилированный изостеариновый спирт, эфир полиоксиэтиленсорбитана и жирной кислоты, и т.п. Кроме того, в препарат для инъекций можно добавить хлорид натрия, глюкозу или глицерин для получения изотонических препаратов. Также можно добавить традиционные растворители, буферные агенты, агенты, регулирующие рН. Такие адъюванты широко применяются в данной области.
При необходимости в фармацевтические препараты можно добавлять красители, консерванты, вкусоароматические агенты, подсластители и т.п.
Для достижения цели введения и усиления терапевтического эффекта лекарство или композицию можно вводить любыми известными методами.
Доза введения фармацевтической композиции, содержащей соединение согласно изобретению, зависит от многих факторов, таких как природа и тяжесть заболевания, которая подлежит лечению или профилактике, пол, возраст, масса тела, особенности и индивидуальный ответ пациента или животного, путь введения, частота введения и терапевтическая цель. Следовательно, терапевтическая доза находится в широком диапазоне. В общем случае, фармацевтические ингредиенты согласно изобретению хорошо известны специалистам и их можно регулировать в зависимости от точного количества лекарства, содержащегося в конечном препарате, содержащем соединение согласно изобретению, для получения терапевтически эффективной дозы для достижения профилактической или терапевтической цели настоящего изобретения. Подходящая ежедневная доза предпочтительно находится в диапазоне 0,1-100 мг/кг в день. Лекарственная форма может быть единичной формой либо может быть разделена на более чем две, три, четыре дозы, которые зависят от клинического опыта специалистов, режима приема с использованием других терапевтических средств.
Общая доза, необходимая для каждой терапии, может быть введена более чем в одной дозе либо в одной дозе. Соединение или композицию согласно изобретению можно вводить отдельно или в сочетании с другими терапевтическими агентами или гетеропатическими агентами в установленном количестве.
Термины:
DL-БФ: рацемический бутилфталид
D-БФ: правовращающий бутилфталид
L-БФ: левовращающий н-бутилфталид
tMCAO: модель временной фокальной церебральной ишемии
Краткое описание графических материалов
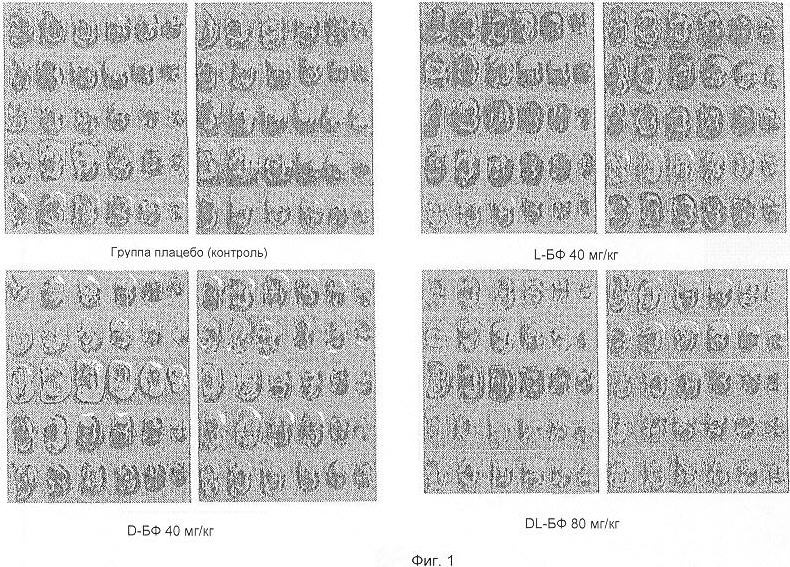
Фиг.1 - цифровая фотография, демонстрирующая влияние введения н-БФ на объем инфаркта мозга у крыс через 15 минут после временной окклюзии средней церебральной артерии.
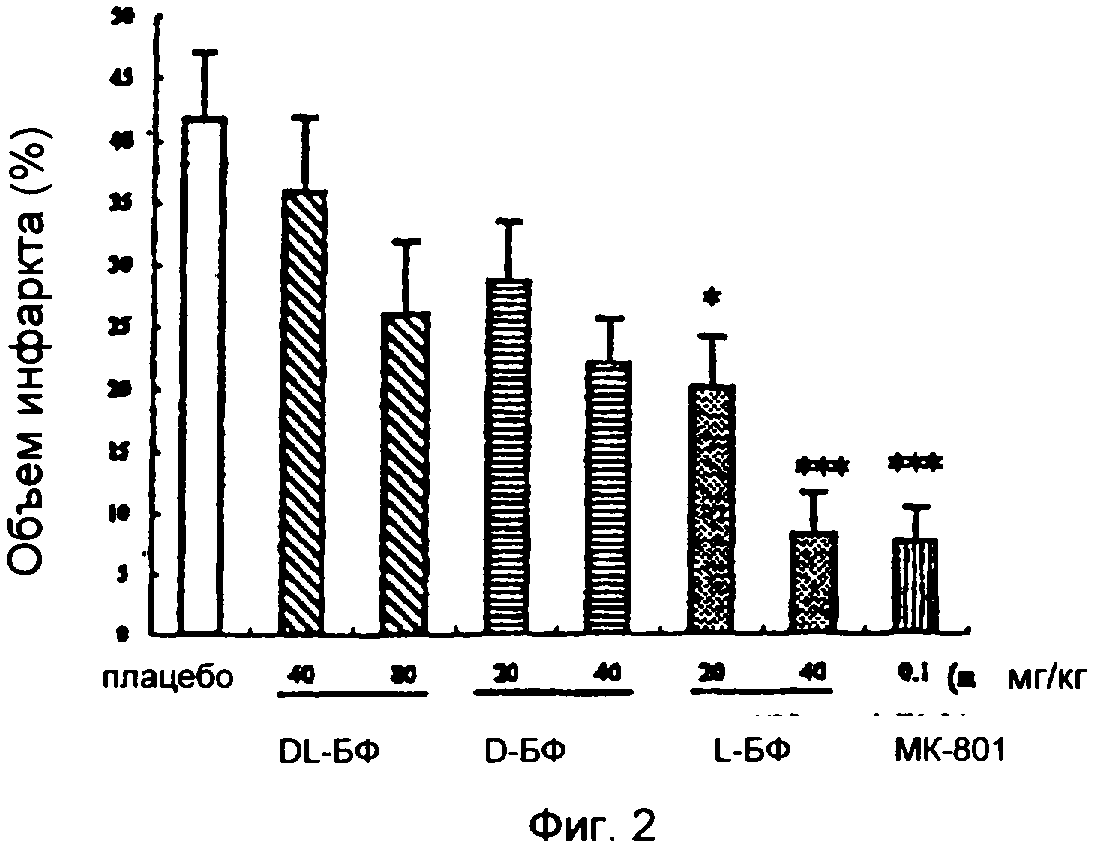
На фиг.2 показано влияние введения н-БФ на объем инфаркта мозга у крыс через 15 минут после временной окклюзии средней церебральной артерии. Данные представлены как объем инфаркта в процентах, полученный путем деления объема инфаркта на объем контралатерального (нормального) полушария, и представляют собой среднее значение ± стандартная погрешность.
*Р<0,05, **Р<0,01, ***Р<0,001 по сравнению с группой плацебо.
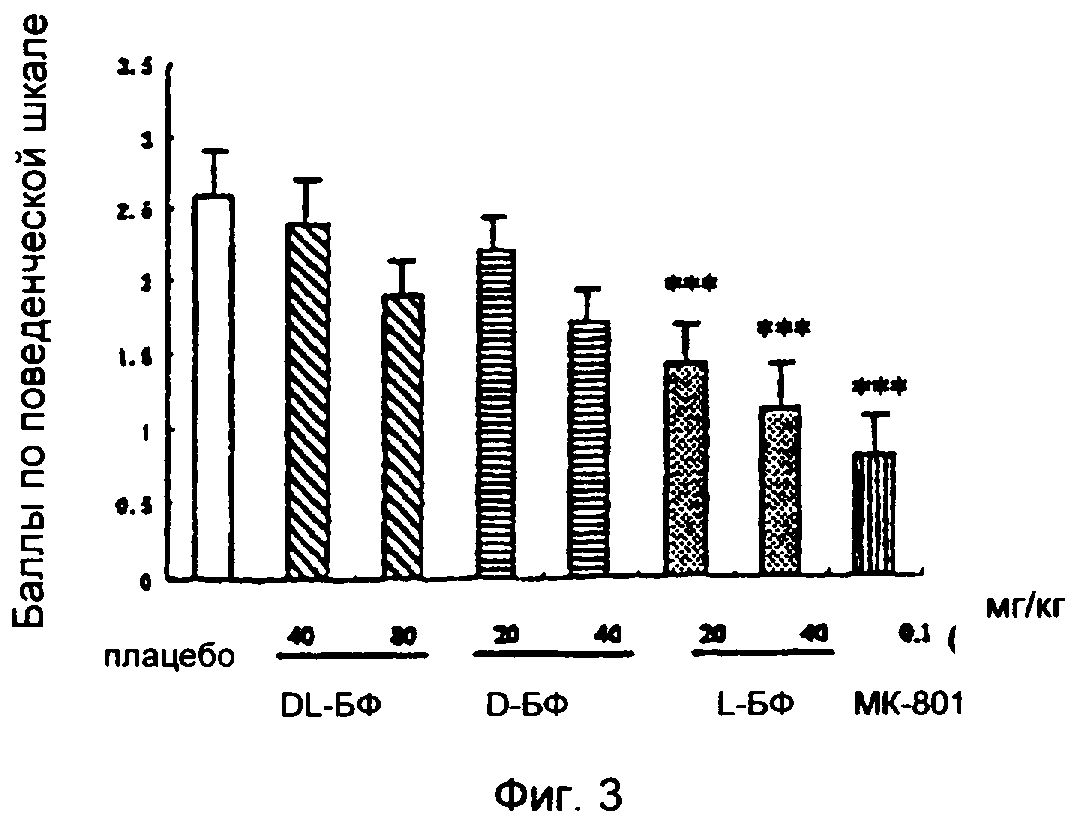
На фиг.3 показано влияние введения н-БФ на баллы по поведенческой шкале у крыс через 15 минут после временной окклюзии средней церебральной артерии. Данные представляют собой среднее значение±стандартная погрешность.
*Р<0,05, **Р<0,01, ***Р<0,001 по сравнению с группой плацебо.
Сведения, подтверждающие возможность осуществления изобретения
Пример 1
Влияние оптически чистого бутилфталида на объем инфаркта мозга на крысиной модели временной фокальной церебральной ишемии (tMCAO).
Материалы и методы
Реагенты и лекарства
L-БФ, D-БФ и DL-БФ были предоставлены отделением синтетической фармацевтической химии нашего института, оптическая и химическая чистота этих веществ была >99%, оптическая активность была -66,49°, +66,88° и 0° соответственно. Они были смешаны с растительным маслом. МК801, который является продуктом Sigma, был смешан с физиологическим раствором. Трифенилтетразола хлорид (ТТХ), произведенный на Пекинском химическом заводе, был смешан с водой с получением 4% раствора.
Подготовка модели временной фокальной церебральной ишемии (tMCAO)
Использовали самцов крыс Вистар весом 280-320 г, причем каждые 5 крыс держали в одной клетке. Животным был предоставлен свободный доступ к пище и воде при комнатной температуре 23°С. Крыс подвергали анестезии пентобарбиталом натрия в количестве 40 мг/кг. Под хирургическим микроскопом был сделан разрез кожи по середине шеи для доступа справа к сонной артерии. Затем внутренняя сонная артерия (IСА) и внешняя сонная артерия (ЕСА) были высвобождены от окружающих нервов и фасции, анастомозирующая ветвь была перевязана. Внешняя сонная артерия была перевязана и вырезана, вытянута прямо и в линию с внутренней сонной артерией. Нейлоновая нить с закругленным наконечником и диаметром 0,28 мм (покрытая поли-L-лизином) была выведена из ЕСА в просвет IСА примерно на 20 мм и продвинута к исходной точке средней церебральной артерии. Через 2 часа ишемии нейлоновая нить была осторожно вынута, ЕСА была перевязана у выхода. Крысам наложили швы и поместили обратно в клетки, оставив для восстановления кровотока на 24 часа. Во время этих процедур температуру в помещении поддерживали на уровне 24-25°С. Крыс помещали на подогреваемую пластину при 37°С для поддержания температуры тела во время процедур. Через 15 минут после ишемии вводили лекарство.
Формирование групп и введение лекарства
Крыс разделяли на 8 групп по 10 животных в каждой. Контрольная группа 1 принимала плацебо-растворитель с 1 мг/кг растительного масла, группы 2 и 3 принимали 40 и 80 мг/кг DL-бутилфталида; группы 4 и 5 принимали 20 и 40 мг/кг D-бутилфталида; группы 6 и 7 принимали 20 и 40 мг/кг L-бутилфталида; и группа 8 принимала 0,1 мг/кг МК801. Группам 1-7 лекарство вводили перорально, а группе 8 - интраперитониально.
Неврологическая оценка поведения
Неврологическую оценку поведения осуществляли через 24 часа после ишемии. Крыс подвешивали за хвост на 1 дюйм над уровнем пола и наблюдали за поведением обеих конечностей. Оба плеча прижимали, чтобы проверить различия в силе сопротивления обеих сторон. Затем крыс опускали на пол и наблюдали за их движениями. Присваивали баллы в соответствии со следующими критериями.
0: сильные передние части конечностей, симметричная ориентация относительно пола, одинаковое сопротивление обоих плеч, нормальная ходьба.
1: контралатеральная флексия плеч, флексия передних частей конечностей, одинаковое сопротивление обоих плеч, нормальная ходьба.
2: контралатеральная флексия плеч, флексия передних частей конечностей, пониженное сопротивление обоих плеч к нажатию, нормальная ходьба.
3: контралатеральная флексия плеч, флексия передних частей конечностей, пониженное сопротивление обоих плеч к нажатию, поворачивание при ходьбе.
4: контралатеральная флексия плеч, флексия передних частей конечностей, неспособность к автономному движению.
Чем выше балл, тем сильнее расстройство поведения животного.
Измерение объема церебрального инфаркта
Через 24 часа после операции животных анестезировали 100 мг/кг пентобарбитала натрия и обезглавливали. Мозг быстро удаляли, разрезали на 6 корональных частей (каждая из 1-5 частей была толщиной 2 мм, шестая - 4 мм), быстро помещали в 5 мл раствора, содержащего 1,5 мл 14% ТТХ и 0,1 мл 1М К2HPO4 и защищали от света. Инкубировали при 37°С в течение 30 минут, переворачивая через каждые 7-8 минут. После выдерживания в ТТХ нормальная ткань мозга приобрела розовый цвет, а инфарктная ткань была белой с выраженной границей. После выдерживания каждую группу образцов мозга устанавливали по порядку и фотографировали цифровой камерой. Каждый образец анализировали с помощью системы компьютерного анализа изображений (программное обеспечение SPOT 3.5), рассчитывали объем инфаркта интегрированием площади инфаркта. Объем инфаркта выражали как процент полушария мозга, чтобы исключить влияние отека мозга. Уравнение для расчета: объем инфаркта мозга (%)=(объем неоперированного полушария - объем неинфарктнной части оперированного полушария)/объем неоперированного полушария.
Статистический анализ
Результаты представляют собой среднее значение±стандартная погрешность. Баллы по неврологической поведенческой шкале и объем инфаркта мозга статистически анализировали методом ANOVA, а различия между группами анализировали с использованием теста posthoc LSD. Считали, что имеют место значительные различия, когда р<0,05.
Результаты
Действие оптически чистого бутилфталида на объем инфаркта мозга на крысиной модели tMCAO
Значительные различия между каждой группой анализировали методом ANOVA, который показал, что объем инфаркта значительно уменьшился дозо-зависимым образом в группах L-бутилфталида (в обеих группах, принимавших 20 и 40 мг/кг). Эффект уменьшения был более значительным в группе 40 мг/кг L-бутилфталида, объем инфаркта уменьшился до 80,4% (р<0,001 по сравнению с группой плацебо). Терапевтический эффект в этой группе был аналогичным группе МК801 (объем инфаркта был уменьшен до 81,8%, р<0,001), хотя в группах с D-БФ и DL-БФ не было заметного эффекта (см. фиг.1 и 2). Эти результаты показали, что эффект L-БФ на уменьшение объема инфаркта был лучше, чем D-БФ. Хотя объем инфаркта в группах DL-БФ (80 мг/кг) и D-БФ (40 мг/кг) был уменьшен по сравнению с группой плацебо, между ними не было статистически существенного различия, что предполагает, что присутствие D-БФ в DL-БФ вероятно антагонизирует эффект L-БФ.
Поведенческая оценка
Согласно неврологической шкале большинство животных в группе плацебо имело балл 2, который характеризуется контралатеральной флексией передних частей конечностей и уменьшением сопротивления к боковому нажиму. Контралатеральные круговые движения наблюдались у меньшего количества крыс, которым присвоили балл 3. Еще меньшее количество животных показало только контралатеральную флексию передних частей, которым присвоили балл 1; или имело сильные симптомы и было не способно к автономному движению, что оценивали баллом 4. Средний балл по неврологической шкале был 2,6±0,3. Было показано, что пероральное введение 20 или 40 мг/кг L-БФ через 15 минут после ишемии улучшает неврологические симптомы (1,4, р<0,01; и 1,1, р<0,001), эффект МК801 был наиболее значительным (0,8, р<0,001), а в группах D-БФ и DL-БФ не наблюдалось значительного улучшения. Что касается животных в группе МК801, хотя симптомы индуцированной церебральной ишемии были значительно снижены, конечности были слабыми, разъезжались и дрожали, наблюдались атаксия, односторонние повороты. Поведенческая оценка предполагает, что степень улучшения поведения соответствует эффекту лекарства на объем инфаркта (см. фиг.3).
Обсуждение
Ранее нами использовались модели «постоянной» фокальной ишемии (со сжиганием средней церебральной артерии), а в этих исследованиях использовали временную модель фокальной церебральной ишемии (2 часа ишемии плюс 24 часа реперфузии). Последняя модель имеет больший объем церебрального инфаркта, чем предыдущая. Хотя доза DL-БФ была выбрана такой же, как и в предыдущей модели, DL-БФ не имел снижающего действия на инфаркт мозга в использованных дозах (40 мг/кг и 80 мг/кг). Эти различия результатов обусловлены отличием между этими двумя моделями.
В данных исследованиях получены согласованные результаты биохимических и молекулярно-биологических испытаний, а также испытаний на животных моделях, что подтверждает, что защитное действие L-БФ на мозг существенно выше, чем действие на мозг D-БФ и DL-БФ, и что присутствие D-БФ в DL-БФ антагонизирует действие L-БФ, что приводит к снижению защитного эффекта DL-БФ против церебральной ишемии.
Как описано в литературе и согласно требованиям к созданию нового лекарства для увеличения терапевтического эффекта и снижения токсических побочных эффектов, желательно разделять рацемическую смесь лекарственного вещества на оптические изомеры, чтобы прояснить характеристики каждого из них и разработать новое хиральное лекарство из оптического изомера с сильным действием и низкими побочными эффектами. В этом контексте L-БФ в рацемическом бутилфталиде обладает относительно сильным защитным действием против церебральной ишемии. D-БФ обладает не только более слабым действием, но и антагонизирует ингибирующий эффект L-БФ против церебральной ишемии. Следовательно, является целесообразным получить из L-БФ новое хиральное лекарство для лечения острого ишемического церебрального инсульта.
Более ранние исследования показали, что ингибирующее действие L-БФ против агрегации тромбоцитов и против тромбоза является похожим на действие аспирина и тиклопидина. Кроме того, L-БФ также имеет защитное действие на мозг и улучшает микроциркуляцию (D-БФ не имеет такого эффекта), а аспирин и тиклопидин не обладают таким действием. Следовательно, L-БФ имеет такой широкий спектр терапевтического действия, что его можно использовать для лечения острого ишемического церебрального инсульта, а также для последующей профилактики церебрального инсульта, профилактики инфаркта миокарда и для лечения заболеваний периферической сосудистой системы. Благодаря созданию лекарства из L-БФ для лечения церебрального инсульта можно получить существенную общественную и экономическую выгоду. До сих пор нигде в мире не было описано, что левовращающий бутилфталид обладает терапевтическим действием на фокальную церебральную ишемию.
Реферат
Изобретение относится к применению L-бутилфталида и содержащей его композиции для изготовления лекарственных средств для профилактики и лечения церебрального инфаркта, в частности церебрального инфаркта, индуцированного фокальной церебральной ишемией. Применение L-бутилфталида для приготовления лекарственных средств для профилактики и лечения церебрального инфаркта позволяет снизить риск возникновения побочных реакций и усилить терапевтическое действие лекарственных средств для профилактики и лечения церебрального инфаркта. 2 н. и 3 з.п. ф-лы, 3 ил.
Формула

Документы, цитированные в отчёте о поиске
Ароматическое амидиновое производное и фармацевтическая композиция
Тромболитические средства

Комментарии