Ингибиторы протеазы вируса гепатита с и их применение - RU2523790C2
Код документа: RU2523790C2
Чертежи























Описание
Перекрестные ссылки на родственные заявки
[0001] Настоящее изобретение испрашивает приоритет согласно предварительной заявке на патент США, серийный №61/016110, поданной 21 декабря 2007, предварительной заявке на патент США, серийный №61/016,473, поданной 23 декабря 2007, предварительной заявке на патент США, серийный №61/075,001, поданной 23 июня 2008, и предварительной заявке на патент США, серийный №61/098,675, поданной 19 сентября 2008, содержимое которых полностью включено в настоящий документ посредством ссылки.
Область техники
[0002] Настоящее изобретение относится к соединениям, которые могут быть полезны в качестве ингибиторов протеазы вируса гепатита С. Настоящее изобретение также обеспечивает фармацевтически приемлемые композиции, содержащие соединения согласно настоящему изобретению, и способы применения указанных композиций для лечения различных заболеваний.
Уровень техники
[0003] По оценкам исследователей, около 170 миллионов людей по всему миру поражены вирусом гепатита С (ВГС). ВГС представляет собой доминирующий серотип, составляющий 3% по всему миру и является основной причиной большинства случаев заболевания гепатитами, отличными от гепатитов А и В (Alberti, A. et al., J. Hepatology 31., (Suppl. I): 17-24, 1999). Хотя у некоторых пациентов симптомы острого гепатита ослабевают, по меньшей мере в 85% случаев инфекция, вызванная ВГС, переходит в хроническую форму и у 20% инфицированных развивается цирроз печени. Уровень выживаемости через четыре года после постановки диагноза цирроза печени составляет менее 50%. Хроническая инфекция ВГС также связана с увеличением случаев заболеванием гепатоцеллюлярной карциномой.
[0004] ВГС относится к вирусам, содержащим «±цепь» РНК, геном которого кодирует полипротеин, состоящий приблизительно из 3000 аминокислотных остатков. После процессинга этого белка-предшественника образуется по меньшей мере 10 вирусных структурных и не структурных белков: С, E1, Е2, р7, NS2, NS3, NS4A, NS4B, NS5A, и NS5B (Blight, K.J. et al., AntiviralTher. 3, Suppl. 3: 71-81, 1998). Не структурные (NS) белки ВГС образуются в результате протеолитического расщепления полипротеина, и предполагают, что они обеспечивают основные белки, катализирующие репликацию вируса.
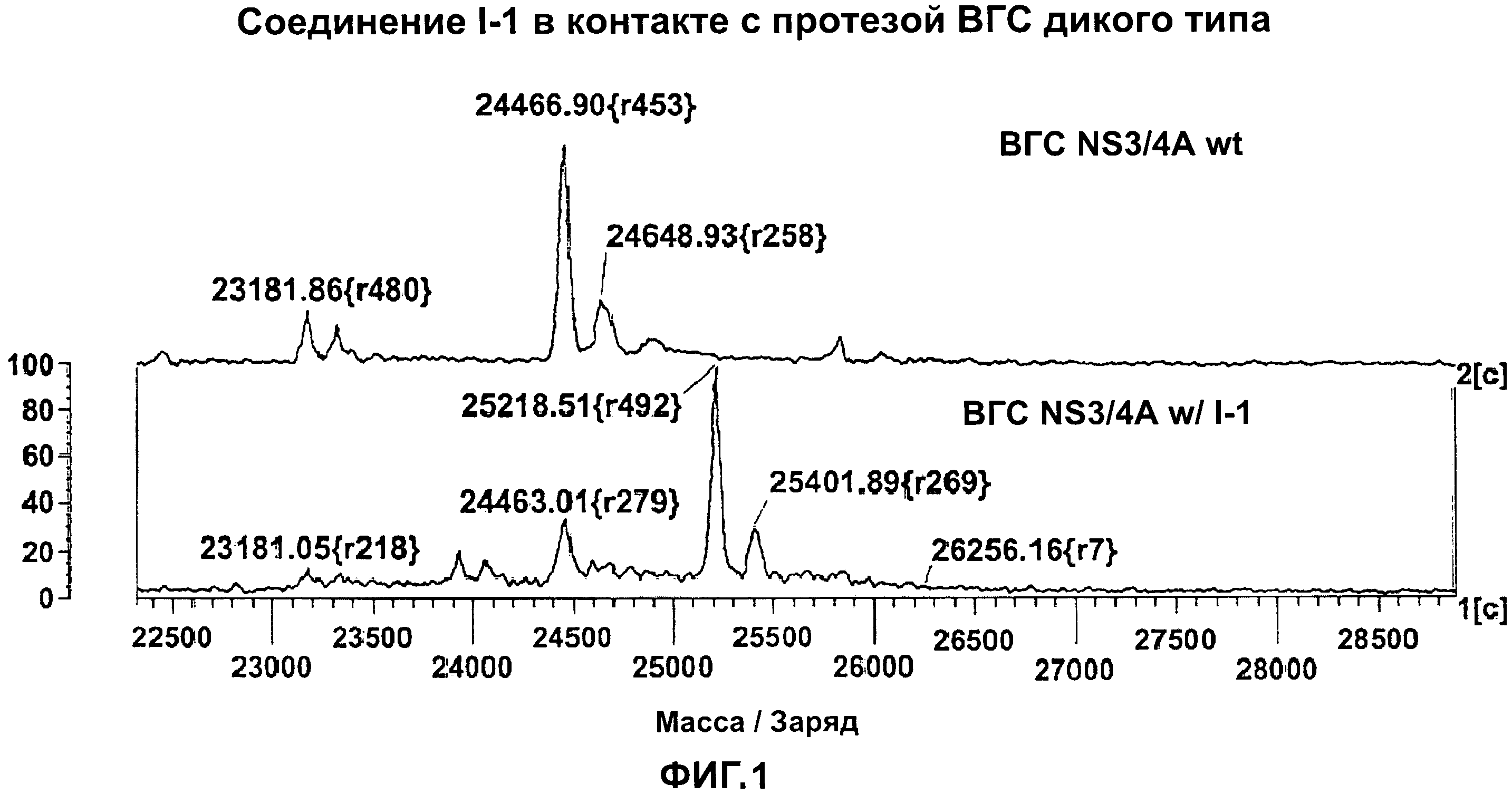
[0005] NS3 представляет собой белок размером приблизительно 68 Kda, содержащий в своем N-концевом домене сериновую протеазу, и домен РНК-зависимой АТФ-азы на С-конце. Было показано, что белок NS4A выполняет функции ко-фактора активности NS3 в качестве сериновой протеазы. NS3 функционирует как протеолитический фермент, высвобождающий другие неструктурные белки, необходимые для репликации ВГС, и является полезной терапевтической мишенью для антивирусной химиотерапии.
[0006] В настоящее время не существует вакцин против ВГС, и разработанная терапия, предусматривающая лечение интерфероном, эффективна только в 15-20% случаев (Weiland, О., FEMSMicrobiol. Rev. 14: 279-88, 1994) и имеет значительные побочные эффекты (Walker, M.A., et al., DDT4: 518-29, 1999; Moradpour, D., et al., Eur. J. Gastroenterol. Hepatol. 11: 1199-1202, 1999). Хотя существующий стандарт ухода за больными, который представляет собой терапию пэгилированным интерфероном α в сочетании с рибавирином, является более эффективным и, по-видимому, снижает вероятность развития гепатоцеллюлярной карциномы у пациентов, страдающих ассоциированным с ВГС циррозом (Hung, C.H. et al., JViral Hepatitis 13(6): 409-414, 2006), у этого способа лечения также выявили побочные эффекты, такие как развитие дисфункции щитовидной железы (Huang, J.F., et al., J Viral Hepatitis 13(6): 396-401, 2006).
[0007] Неблагоприятный прогноз для пациентов, страдающих от инфекции ВГС, и существующий в настоящее время недостаток эффективных, одобренных способов лечения указывают на существующую потребность в новых ингибиторах протеазы ВГС NS3.
Краткое описание изобретения
[0008] Было обнаружено, что соединения согласно настоящему изобретению и фармацевтически приемлемые композиции, которые содержат указанные соединения, эффективны в качестве ингибиторов протеазы ВГС. Указанные соединения представляют собой соединения общей формулы I:

или фармацевтически приемлемые соли указанных соединений, где значения R1, R1', R2a, R3, R4, Rw, Rx, Rx' и Ry определены в настоящем описании.
[0009] Соединения согласно настоящему изобретению, и фармацевтически приемлемые композиции, содержащие такие соединения, эффективны для лечения множества заболеваний, нарушений и состояний, связанных с ВГС. Такие заболевания, нарушения и состояния включают описанные в тексте настоящей заявки.
[0010] Соединения согласно настоящему изобретению также полезны при исследовании роли протеазы ВГС в биологических и патологических процессах; при исследовании путей внутриклеточной передачи сигнала, опосредуемого протеазой ВГС; и для сравнительной оценки новых ингибиторов протеазы ВГС.
Краткое описание рисунков
[0011] На Фигуре 1 приведены результаты масс-спектрального анализа протеазы ВГС NS3/4A дикого типа в присутствии тестового соединения I-1.
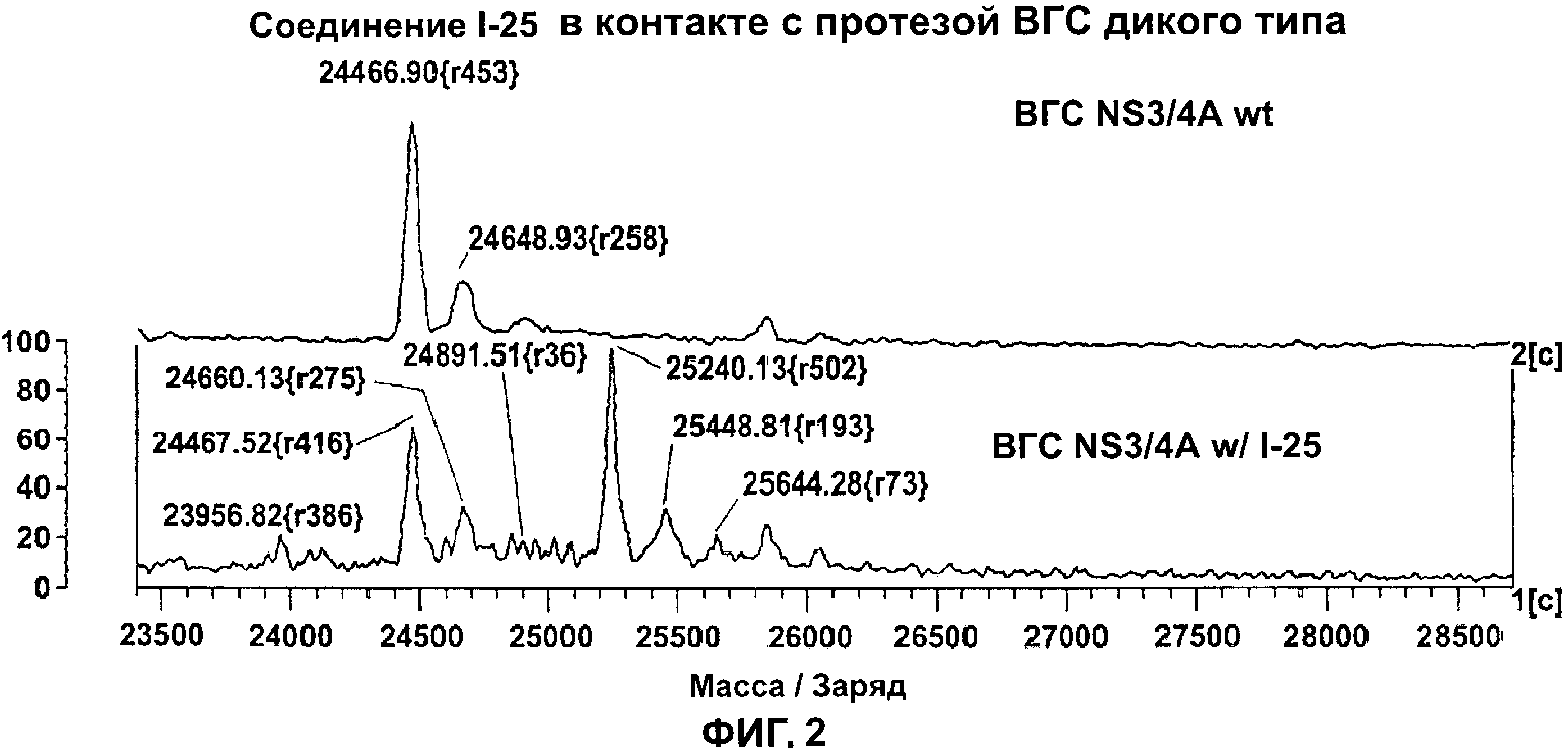
[0012] На Фигуре 2 приведены результаты масс-спектрального анализа протеазы ВГС NS3/4A дикого типа в присутствии тестового соединения I-25.
[0013] На Фигуре 3 приведены результаты масс-спектрального анализа протеазы ВГС NS3/4A.
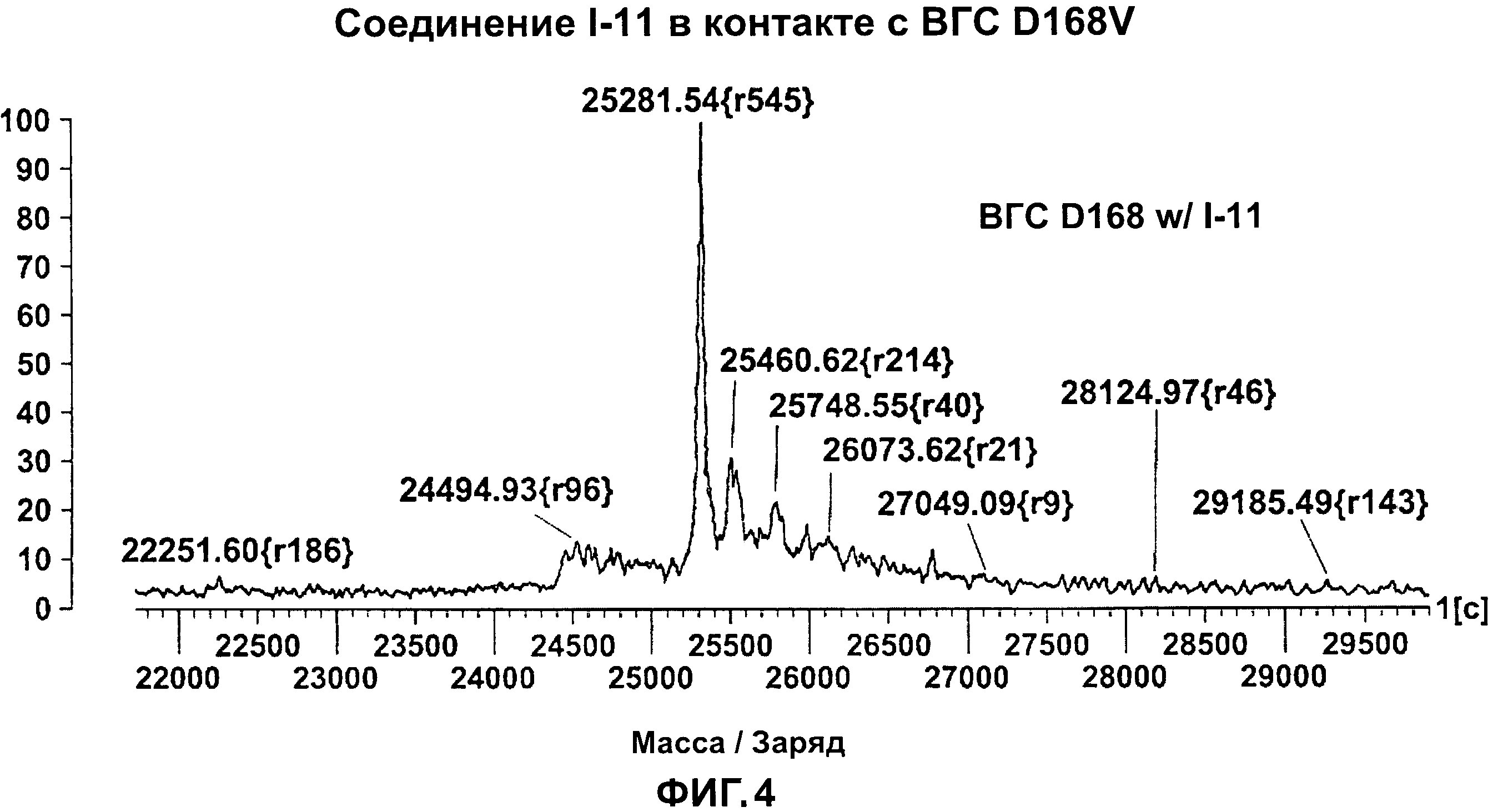
[0014] На Фигуре 4 приведены результаты масс-спектрального анализа мутанта протеазы ВГС NS3/4A D168V в присутствии тестового соединения I-11.
[0015] На Фигуре 5 приведены результагы масс-спектрального анализа мутанта протеазы ВГС NS3/4A A156S в присутствии тестового соединения I-11.
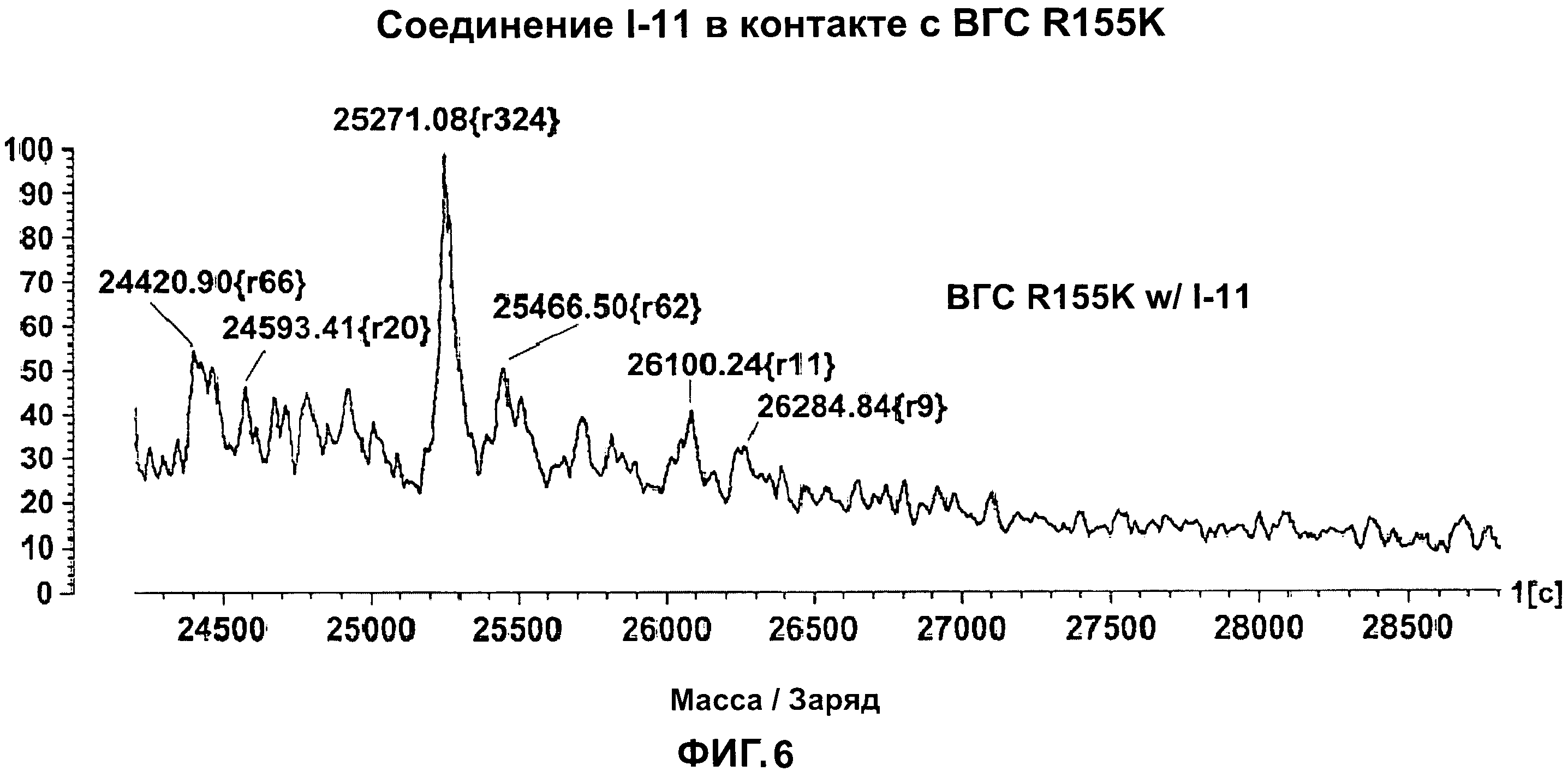
[0016] На Фигуре 6 приведены результаты масс-спектрального анализа мутанта протеазы ВГС NS3/4A R155K в присутствии тестового соединения I-11.
[0017] На Фигуре 7 приведены результаты масс-спектрального анализа мутанта протеазы ВГС NS3/4A А156Т в присутствии тестового соединения I-11.
[0018] На Фигуре 8 отражено то, что продукты внутреннего автопротеолиза протеазы NS3 ингибируются при воздействии на клетки, несущие репликон, Соединением 1-47 в течение 16 часов.
[0019] На Фигуре 9 показано, что необратимый ковалентный ингибитор протеазы NS3 (соединение I-11) обеспечивает длительное ингибирование активности протеазы NS3 в клетках дикого типа, несущих репликон, которое определяли через величину автопротеолиза после удаления соединений.
[0020] На Фигуре 10 показано, что необратимый ковалентный ингибитор протеазы NS3 (соединение I-25) обеспечивает длительное ингибирование активности протеазы NS3 в клетках дикого типа, несущих репликон, которое определяли через величину автопротеолиза, после удаления соединений.
Подробное описание некоторых вариантов реализации
1. Общее описание соединений согласно настоящему изобретению
[0021] Согласно некоторым вариантам реализации настоящего изобретения предложено соединение формулы I:

или фармацевтически приемлемая соль указанного соединения, где:
R1 и R1' независимо представляют собой водород или возможно содержащий заместители С1-6 алифатический углеводород, или R1 и R1' соединены вместе с образованием возможно содержащего заместители 3-7-членного карбоциклического кольца;
R2a представляет собой -ОН или -NHSO2R2;
R2 представляет собой -N(R)2 или возможно содержащую заместители группу, выбранную из следующих: С3-7 циклоалкил, связанный мостиком бицикл, 6-10-членный арил, 5-10-членный гетероарил, содержащий 1-4 гетероатома, которые независимо выбраны из азота, кислорода или серы, или 4-7-членный гетероцикл, содержащий 1-2 гетероатома, которые независимо выбраны из азота, кислорода или серы;
каждый R независимо представляет собой водород, возможно содержащую заместители С1-6 алифатическую группу, или:
два R совместно с атомом азота, к которому они присоединены, образуют 4-7-членное гетероциклическое кольцо, содержащее 1-2 гетероатома, которые независимо выбраны из азота, кислорода или серы;
R3 представляет собой головную группу, или:
R3 и R1 совместно с находящимися между ними атомами образуют возможно содержащее заместители насыщенное или ненасыщенное 10-12-членное кольцо, содержащее 2-6 гетероатомов, которые выбраны из: азота, кислорода или серы, причем указанное образованное этими заместителями кольцо включает головную группу; или
R3 и кольцо, образованное R1 и R1', совместно с атомами, находящимися между ними, образуют возможно содержащее заместители насыщенное или ненасыщенное 12-18-членное кольцо, содержащее 2-6 гетероатомов, которые независимо выбраны из азота, кислорода или серы, причем указанное образованное кольцо включает головную группу;
R4 представляет собой Н, -NHC(O)R5, -NHC(O)OR6,

каждый R5 независимо представляет собой -N(R)2 или возможно содержащую заместители группу, выбранную из следующих: С1-6 алифатический углеводород, связанный мостиком бицикл, 6-10-членный арил, 5-10-членный гетероарил, содержащий 1-4 гетероатома, которые независимо выбраны из азота, кислорода или серы, или 4-7-членный гетероциклил, содержащий 1-2 гетероатома, которые независимо выбраны из азота, кислорода или серы;
R6 представляет собой возможно содержащую заместители группу, выбранную из следующих: С1-6 алифатический углеводород, связанный мостиком бицикл, 6-10-членный арил, 5-10-членный гетероарил, содержащий 1-4 гетероатомов, которые независимо выбраны из азота, кислорода или серы, или 4-7-членный гетероциклил, содержащий 1-2 гетероатомов, которые независимо выбраны из азота, кислорода или серы; и
R7 представляет собой возможно содержащую заместители группу, выбранную из следующих: С1-6 алифатический углеводород, соединенный мостиком бицикл, 6-10-членный арил, 5-10-членный гетероарил, содержащий 1-4 гетероатомов, которые независимо выбраны из азота, кислорода или серы, или 4-7-членный гетероциклил, содержащий 1-2 гетероатомов, которые независимо выбраны из азота, кислорода или серы.
RZ представляет собой

каждый из Ry независимо выбран из следующего: галоген, -ORo, -CN, -NO2, -N(Ro)2, или возможно содержащая заместители С1-4алифатическая группа; и
m представляет собой целое число от 0 до 4 включительно;
s представляет собой целое число от 0 до 4 включительно;
t представляет собой целое число от 0 до 4 включительно;
причем сумма s и t не равна нулю.
2. Вещества и определения
[0022] Соединения согласно настоящему изобретению включают соединения, в общих чертах описанные выше, а также далее приведенные в качестве примеров в настоящей заявке классы, подклассы и виды. В настоящем описании будут использоваться приведенные ниже определения за исключением оговоренных особо случаев. В контексте настоящего изобретения определения химических элементов приведены в соответствии с периодической системой элементов, версия CAS, Hand book of Chemistry and Physics, 75th Ed. В дополнение, общие принципы органической химии описаны в "Organic Chemistry", Thomas Sorrell, University Science Books, Sausalito: 1999, и "March's Advanced Organic Chemistry", 5th Ed., Ed.: Smith, M.B. and March, J., John Wiley&Sons, New York: 2001, описание которых полностью включено в настоящий документ посредством ссылки.
[0023] Термины "алифатический углеводород" или "алифатическая группа", используемые в настоящем описании, относятся к прямой (т.е. неразветвленной) или разветвленной углеводородной цепи, содержащей или не содержащей заместители, полностью насыщенной или включающей один или более ненасыщенных участков, а также к моноциклическому или бициклическому углеводороду, полностью насыщенному или включающему один или более ненасыщенных участков, но не являющемуся ароматическим (эти определения также относятся к употребляемым в настоящем описании терминам "карбоцикл", "циклоалифатический углеводород" или "циклоалкил"), имеющему одну точку связывания с остальной молекулой. За исключением оговоренных особо случаев алифатическая группа включает от 1 до 6 алифатических атомов углерода. В некоторых вариантах реализации алифатическая группа включает 1-5 алифатических атомов углерода. В других вариантах реализации алифатическая группа включает 1-4 алифатических атомов углерода. В других вариантах реализации алифатическая группа включает 1-3 алифатических атомов углерода, также существуют варианты реализации согласно которым алифатические группы включают 1-2 алифатических атомов углерода. В некоторых вариантах реализации "циклоалифатический углеводород" (или "карбоцикл", или "циклоалкил") относится к моноциклическому углеводороду С3-С6, полностью насыщенному или содержащему один или более ненасыщенных участков, но не являющемуся ароматическим, имеющему одну точку связывания с остальной молекулой. Подходящие алифатические группы включают, но не ограничиваются следующими примерами: линейные или разветвленные, содержащие или не содержащие заместители алкильные, алкенильные, алкинильные группы и их комбинации, такие как (циклоалкил)алкил, (циклоалкенил)алкил или (циклоалкил)алкенил.
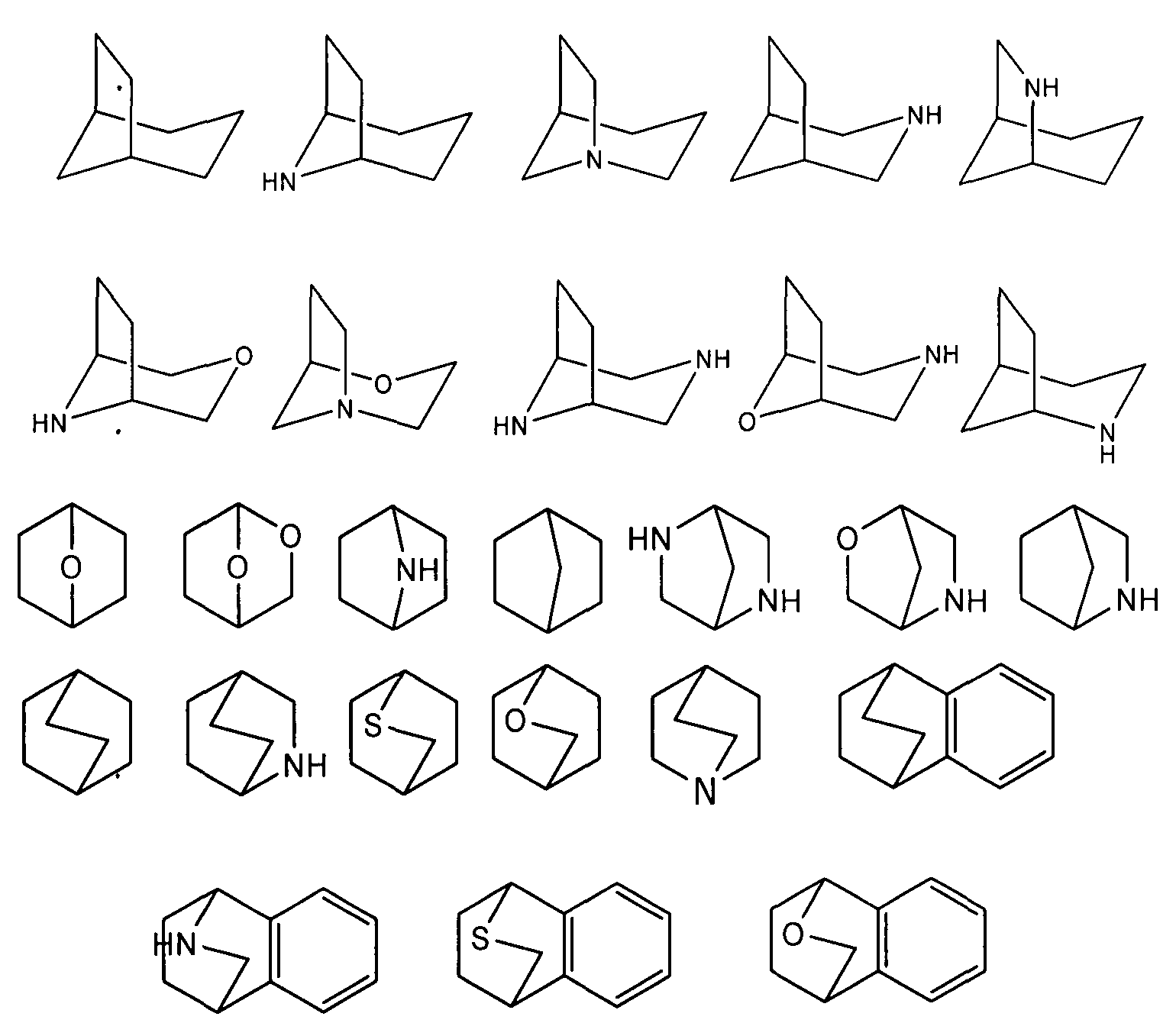
[0024] Термин "бициклический углеводород (бицикл), соединенный (связанный) мостиком", употребляемый в настоящем описании, относится к любой системе, состоящей из двух колец, т.е. карбоциклической или гетероциклической, насыщенной или включающей ненасыщенные участки, содержащей по меньшей мере один мостик. Как определено по номенклатуре IUPAC, "мостиком" является неразветвленная цепь атомов, или атом, или валентная связь, связывающая два атома в голове мостика, где "атом в голове мостика" является любым атомом углеводородного скелета циклической системы, связанным с тремя или более атомами скелета (исключая водород). В некоторых вариантах реализации бициклическая группа, связанная мостиком, содержит 7-12 атомов в составе кольца и 0-4 гетероатома, независимо выбранных из азота, кислорода или серы. Такие бициклические группы, связанные мостиком, хорошо известны в данной области и включают группы, приведенные ниже, где каждая из групп присоединена к остальной молекуле у любого атома углерода или азота, к которому может присоединяться заместитель. За исключением оговоренных особо случаев бициклическая группа, соединенная мостиком, может содержать один или более заместителей, как описано для алифатических групп. Дополнительно или как альтернативный вариант, любой атом азота, к которому может быть присоединен заместитель бициклической группы, связанной мостиком, может быть замещен. Примеры связанных мостиком бициклов включают:
[0025] Термин "низший алкил" относится к прямой или разветвленной алкильной группе С1-4. Примерами низших алкильных групп являются метил, этил, пропил, изопропил, бутил, изобутил и трет-бутил.
[0026] Термин "низший галоалкил" относится к прямой или разветвленной алкильной группе С1-4, содержащей в качестве заместителей один или более атомов галогена.
[0027] Термин "гетероатом" обозначает один или более из следующих: кислород, сера, азот, фосфор или кремний (включая любую окисленную форму азота, серы, фосфора или кремния; четвертичную форму любого азотистого основания или; азот, к которому может быть присоединен заместитель, гетероциклического кольца, например, N (как в составе 3,4-дигидро-2H-пирролила), NH (как в составе пирролидинила) или NR+ (как в составе N-з-пирролидинила)).
[0028] Термин "ненасыщенный" в тексте настоящей заявки относится к группе, содержащей в своем составе одну или более ненасыщенных областей.
[0029] Термин "двухвалентная насыщенная или ненасыщенная, разветвленная или не разветвленная углеводородная цепь C1-8 (или С1-6)" в тексте настоящей заявки относится к прямым или разветвленным, как определено в настоящем описании, двухвалентным алкиленовым, алкениленовым и алкиниленовым цепям.
[0030] Термин "алкилен" относится в двухвалентной алкильной группе. "Алкиленовая цепь" представляет собой полиметиленовую группу, т.е. -(CH2)n-, где n является положительным значением, предпочтительно находящимся в интервале от 1 до 6, от 1 до 4, от 1 до 3, от 1 до 2 или от 2 до 3. Алкиленовая цепь, содержащая заместители, представляет собой полиметиленовую группу, в которой вместо одного или более атомов водорода в составе метиленовой группы содержится заместитель. Подходящие заместители включают заместители, описанные ниже для алифатической группы.
[0031] Термин "алкенилен" относится к двухвалентной алкенильной группе. Алкениленовая цепь, содержащая заместители, представляет собой полиметиленовую группу, содержащую по меньшей мере одну двойную связь, при которой вместо одного или более атомов водорода в молекуле содержится заместитель. Подходящие заместители включают заместители, описанные ниже для алифатической группы.
[0032] Термин "циклопропиленил" в настоящем описании относится к двухвалентной циклопропильной группе, имеющей структуру, описываемую следующей схемой:

[0033] Термин "галоген" относится к атомам F, Cl, Br или I.
[0034] Термин "арил", употребляемый отдельно или в качестве составной части в названии групп большего размера, таких как "аралкил", "аралкокси", или "арилоксиалкил", относится к моноциклической или бициклической системе, общее число атомов в которой равно от пяти до четырнадцати, в которой по меньшей мере одно кольцо является ароматическим и каждое кольцо состоит из 3-7 атомов. Термины "арил" и "арильное кольцо" могут использоваться взаимозаменяемо.
[0035] Термин "арил", употребляемый отдельно или в качестве составной части в названии групп большего размера, таких как "аралкил," "аралкокси" или "арилоксиалкил", относится к моноциклической или бициклической системе, общее число атомов в которой составляет от пяти до четырнадцати, в которой по меньшей мере одно кольцо является ароматическим и каждое кольцо состоит из 3-7 атомов. Термины "арил" и "арильное кольцо" могут использоваться взаимозаменяемо. В некоторых вариантах реализации настоящего изобретения "арил" относится к ароматической замкнутой в кольцо системе, включая, но не ограничиваясь следующими примерами: фенил, дифенил, нафтил, антрацил и подобные им соединения, которые могут содержать один или более заместителей. Также в настоящем описании термин "арил" может означать группу, в которой ароматическое кольцо конденсировано с одним или более не ароматических колец, например инданил, фталимидил, нафтимидил, фенантридинил или тетрагидронафтил и им подобные.
[0036] Термины "гетероарил" и "гетероар-", употребляемые отдельно или в качестве составной части в названии групп большего размера, таких как "гетероаралкил" или "гетероаралкокси", относятся к группам, состоящим из 5-10 атомов, замкнутых в кольцо, предпочтительно из 5, 6 или 9 атомов, замкнутых в кольцо; имеющих 6, 10 или 14 электронов, распределенных по циклической системе; и содержащим, помимо атомов углерода, от одного до пяти гетероатомов. Термин "гетероатом" относится к азоту, кислороду, или сере, а также к любой окисленной форме азота или серы и к любой четвертичной форме азотистого основания. Гетероарильные группы включают, но не ограничиваются следующими примерами: тиенил, фуранил, пирролил, имидазолил, пиразолил, триазолил, тетразолил, оксазолил, изоксазолил, оксадиазолил, тиазолил, изотиазолил, тиадиазолил, пиридил, пиридазинил, пиримидинил, пиразинил, индолизинил, пиринил, нафтиридинил и птеридинил. Значение терминов "гетероарил" и "гетероар-", употребляемых в настоящем описании, также включает группы, в составе которых гетероароматическое кольцо конденсировано с одним или более арильным, циклоалифатическим или гетероциклическими кольцами таким образом, что радикал или точка соединения находится на гетероароматическом кольце. Примеры таких соединений не ограничиваются следующими: индолил, изоиндолил, бензотиенил, бензофуранил, дибензофуранил, индазолил, бензимидазолил, бензтиазолил, квинолил, изоквинолил, цицнолипил, фталазицил, квипазолинил, квиноксалинил, 4H-квиполизинил, карбазолил, акридинил, феназинил, фенотиазинил, феноксазинил, тетрагидроквинолинил, тетрагидроизоквинолинил и пиридо-[2,3-b]-1,4-оксазин-3(4Н)-он. Гетероарильная группа может быть моно- или бициклической. Термины "гетероарил", "гетероарильное кольцо", "гетероарильная группа" или "гетероароматический углеводород" могут использоваться взаимозаменяемо, и значение любого из перечисленных терминов включает циклические системы, возможно содержащие заместители. Термин "гетероаралкил" относится к алкильной группе, содержащей в качестве заместителя гетероарил, где алкильный и гетероарильный участки могут содержать заместители.
[0037] Термины "гетероцикл", "гетероциклил", "гетероциклический радикал" и "гетероциклическое кольцо", используемые в настоящем описании, употребляются взаимозаменяемо и относятся к устойчивым 5-7-членным моноциклическим или 7-10-членным бициклическим гетероциклическим молекулам, которые могут быть как насыщенными, так и содержать ненасыщенные участки, и содержащим, помимо атомов углерода, один или более, предпочтительно от одного до четырех, гетероатомов, как описано выше. Значение термина "азот", употребляемого в отношении атома кольца гетероцикла, включает азот, содержащий заместители. В качестве примера, в насыщенном или содержащем ненасыщенные участки кольце, содержащем 0-3 гетероатомов, выбранных из кислорода, серы или азота, азот может находиться в следующих формах: N (как в составе 3,4-дигидро-2H-пирролила), NH (как в составе пирролидинила) или+NR (как в составе N-замещенного пирролидинила).
[0038] Гетероциклическое кольцо может быть соединено с его концевой группой у любого гетероатома или атома углерода, обеспечивающего стабильную структуру, и любой из атомов кольца может содержать заместители. Примеры таких насыщенных или содержащих ненасыщенные участки гетероциклических радикалов включают, но не ограничиваются следующими: тетрагидрофуранил, тетрагидротиофенил пирролидинил, пиперидинил, пирролинил, тетрагидроквинолинил, тетрагидроизоквинолинил, декагидроквинолинил, оксазолидинил, пиперазинил, диоксанил, диоксоланил, диазепинил, оксазепинил, тиазепинил, морфолинил и квинуклидинил. Термины "гетероцикл", "гетероциклил", "гетероциклильное кольцо", "гетероциклическая группа", "гетероциклическая молекула" и "гетероциклический радикал" используются в настоящем описании взаимозаменяемо и также включают группы, в составе которых гетероциклильное кольцо конденсировано с одним или более арильным, гетероарильным или циклоалифатическими кольцами, такие как индолинил, 3H-индолил, хроманил, или тетрагидроквинолинил, где радикал или точка соединения находится на гетероциклильном кольце. Термин "гетероциклилалкил" относится к алкильной группе, содержащей в качестве заместителя гетероциклил, в которой алкильные и гетероциклильные участки независимо могут содержать заместители.
[0039] Термин "частично ненасыщенный", используемый в настоящем описании, относится к кольцевой молекуле, содержащей по меньшей мере одну двойную или тройную связь. Термин "частично ненасыщенный" употребляется для определения колец, содержащих несколько ненасыщенных участков, но его значение не включает арильные или гетероарильные молекулы, как определено в настоящем описании.
Фраза "группа боковой цепи природной аминокислоты", употребляемая в настоящем описании, относится к группе боковой цепи любой из 20 аминокислот, встречающихся в природе в составе белков. Такие природные аминокислоты включают неполярные или гидрофобные аминокислоты, глицин, аланин, валин, лейцин, изолейцин, метионин, фенилаланин, триптофан и пролин. Цистеин в некоторых случаях относят к неполярным или гидрофобным аминокислотам, в других случаях - к полярным. Природные аминокислоты также включают полярные или гидрофильные аминокислоты, такие как тирозин, серии, треонин, аспарагиновая кислота (также называемая аспартатом, в заряженном состоянии), глутаминовая кислота (также называемая глутаматом, в заряженном состоянии), аспарагин и глутамин. Некоторые полярные или гидрофильные аминокислоты, содержат заряженные боковые цепи. Такие заряженные аминокислоты включают лизин, аргинин и гистидин. Обычному специалисту в данной области понятно, что защита боковой цепи полярной или гидрофильной аминокислоты может перевести такую аминокислоту в неполярную форму. К примеру, подходящим образом защищенная гидроксильная группа тирозина может перевести этот тирозин в неполярную и гидрофобную форму благодаря защите гидроксильной группы.
[0040] Фраза "группа боковой цепи неприродной аминокислоты", употребляемая в настоящем описании, относится к группе боковой цепи аминокислоты, не входящей в список 20 аминокислот, встречающихся в природе в составе белков, приведенных выше. Такие аминокислоты включают D-изомеры любой из 20 аминокислот, встречающихся в природе. Неприродные аминокислоты могут включать гомосерин, орнитин, норлейцин и тироксин. Боковые цепи других неприродных аминокислот широко известны обычным специалистам в данной области и включают неприродные алифатические боковые цепи. Также к неприродным аминокислотам относятся модифицированные аминокислоты, включая N-алкилированные, циклизованные, фосфорилированные, ацетилированные, амидированные, азидилированные, аминокислоты, в которые внесены метки, и т.д. В некоторых вариантах реализации неприродная аминокислота представляет собой D-изомер. В некоторых вариантах реализации неприродная аминокислота представляет собой L-изомер.
[0041] Как описано в тексте настоящей заявки, вещества согласно настоящему изобретению могут содержать группы, "возможно содержащие заместители". В общем, термин "содержащий заместители", как предваряемый термином "возможно", так и нет, означает, что один или более атомов водорода указанной группы заменены на подходящий заместитель. За исключением оговоренных особо случаев, группа, "возможно содержащая заместители", может содержать подходящий заместитель в любом положении, в которое можно ввести заместитель, и в случаях, когда один или более заместителей, выбранных из соответствующих групп, можно ввести в одном или более положений в любой данной структуре, заместители могут быть как одинаковыми во всех положениях, так и различными. Комбинации заместителей, предусмотренные настоящим изобретением, предпочтительно являются способствующими формированию устойчивых и химически приемлемых веществ. Термин "устойчивый", используемый в настоящем описании, относится к веществам, существенно не изменяющимся под влиянием условий, требуемых для их производства, определения и в некоторых вариантах реализации их выделения, очистки и применения для одной или нескольких целей, приведенных в настоящем описании.
[0042] Подходящие (соответствующие) одновалентные заместители у подходящего атома углерода в составе группы, "возможно содержащей заместители", независимо представляют собой галоген; -(CH2)0-4Ro; -(СН2)0-4ORo; -O(СН2)0-4Ro, -O-(CH2)0-4C(O)ORo; -(CH2)0-4CH(ORo)2; -(CH2)0-4SRo; -(CH2)0-4Ph, который может содержать в качестве заместителей Ro; -(CH2)0-4O(CH2)0-1Ph, который может содержать в качестве заместителей Ro; -CH=CHPh, который может содержать в качестве заместителей Ro; -(СН2)0-4О(СН2)0-1-пиридил, который может содержать в качестве заместителей Ro; -NO2; -CN; -N3; -(CH2)0-4N(Ro)2; -(CH2)0-4N(Ro)C(O)Ro; -N(Ro)C(S)Ro; -(CH2)0-4N(Ro)C(O)NRo2; -N(Ro)C(S)NRo2; -(CH2)0-4N(Ro)C(O)ORo; -N(Ro)N(Ro)C(O)Ro; -N(Ro)N(Ro)C(O)NRo2; -N(Ro)N(Ro)C(O)ORo; -(CH2)0-4C(O)Ro; -C(S)Ro; -(CH2)0-4C(O)ORo; -(CH2)0-4C(O)SRo; -(CH2)0-4C(O)OSiRo3; -(CH2)0-4OC(O)Ro; -OC(O)(CH2)0-4SR-, SC(S)SRo; -(CH2)0-4SC(O)Ro; -(CH2)0-4C(O)NRo2; -C(S)NRo2; -C(S)SRo; -SC(S)SRo, -(CH2)0-4OC(O)NRo2; -C(O)N(ORo)Ro; -C(O)C(O)Ro; -C(O)CH2C(O)Ro; C(NORo)Ro; -(CH2)0-4SSRo; -(СН2)0-4S(O)2Ro; -(CH2)0-4S(O)2ORo; -(CH2)0-4OS(O)2Ro; -S(O)2NRo2; -(CH2)0-4S(O)Ro; -N(Ro)S(O)2NRo2; -N(Ro)S(O)2Ro; -N(ORo)Ro; -C(NH)NRo2; -P(O)2Ro; -P(O)Ro2; -OP(O)Ro2; -OP(O)(ORo)2; SiRo3; - (прямой или разветвленный алкилен C1-4)O-N(Ro)2; или - (прямой или разветвленный алкилен C1-4)C(O)O-N(Ro)2, где каждый Ro может содержать заместители согласно описанному выше и независимо представляет собой водород, С1-6 алифатический углеводород, -CH2Ph, -O(CH2)0-1Ph, -CH2-(5-6-членное гетероарильное кольцо), или 5-6-членное насыщенное, частично ненасыщенное, или арильное кольцо, содержащее 0-4 гетероатомов, независимо выбранных из азота, кислорода или серы, или, вне зависимости от определенного выше, два независимых Ro, вместе с их промежуточными атомами, формируют 3-12-членное насыщенное, частично ненасыщенное, или арильное моно- или бициклическое кольцо, содержащее 0-4 гетероатомов, независимо выбранных из азота, кислорода или серы, которое может содержать заместители, согласно определенному ниже.
[0043] Подходящие одновалентные заместители у Ro (или кольца, образованного двумя независимыми Ro вместе с их промежуточными атомами), независимо представляют собой водород, -(CH2)0-2R•, -(галоR•), -(СН2)0-2ОН, -(СН2)0-2OR•, -(CH2)0-2CH(OR•)2; -O(галоR•), -CN, -N3, -(CH2)0-2C(O)R•, -(CH2)0-2C(O)OH, - (CH2)0-2C(O)OR•, -(CH2)0-2SR•, -(CH2)0-2SH, -(CH2)0-2NH2, -(CH2)0-2NHR•, -(CH2)0-2NR•2, -NO2, -SiR•3, -OSiR•3, -C(O)SR•, -(C1-4 неразветвленный или разветвленный алкилен)С(O)OR•, или -SSR•, где каждый R• не содержит заместители, или в случаях, когда в его названии есть приставка "гало", содержит в качестве заместителей только один или более атомов галогенов, и независимо выбран из следующих групп: С1-4 алифатический углеводород, -CH2Ph, -O(CH2)0-1Ph, или 5-6-членное насыщенное, частично ненасыщенное, или арильное кольцо, содержащее в качестве заместителей 0-4 гетероатомов, независимо выбранных из азота, кислорода или серы. Подходящие двухвалентные заместители у насыщенного атома углерода Ro включают =O и =S.
[0044] Подходящие двухвалентные заместители у атома углерода группы, "возможно содержащей заместители" включают следующие: =O, =S, =NNR*2, =NNHC(O)R*, =NNHC(O)OR*, =NNHS(O)2R*, =NR*, =NOR*, -O(С(R*2))2-3О-, или -S(C(R*2))2-3S-, где каждый независимый вариант реализации R* выбран из водорода, С1-6 алифатического углеводорода, возможно содержащего заместители как описано ниже, или не содержащего заместители 5-6-членного насыщенного, частично ненасыщенного, или арильного кольца, содержащего 0-4 гетероатомов, независимо выбранных из азота, кислорода или серы. Подходящие двухвалентные заместители, связанные с соседними атомами углерода, к которым можно присоединить заместители, в составе группы, "возможно содержащей заместители" включают: -O(CR*2)2-3O-, где каждый независимый вариант реализации R* выбран из водорода, С1-6 алифатического углеводорода, возможно содержащего заместители как описано ниже, или не содержащего заместители 5-6-членного насыщенного, частично ненасыщенного, или арильного кольца, содержащего 0-4 гетероатомов, независимо выбранных из азота, кислорода или серы.
[0045] Подходящие заместители у алифатической группы R* включают галоген, -R•, -(галоR•), -ОН, -OR•, -O(галоR•), -CN, -C(O)OH, -C(O)OR•, -NH2, -NHR•, -NR•2, или -NO2, где каждый R• не содержит заместителей, или в случаях, когда в его названии есть приставка "гало", содержит в качестве заместителей только один или более атомов галогенов, и независимо выбран из следующих групп: С1-4 алифатический углеводород, -CH2Ph, -O(CH2)0-1Ph, или 5-6-членное насыщенное, частично ненасыщенное, или арильное кольцо, содержащее 0-4 гетероатомов, независимо выбранных из азота, кислорода или серы.
[0046] Соответствующие заместители у азота в составе группы "возможно содержащей заместители" включают -R†, -NR†2, -С(O)R†, -C(O)OR†, -C(O)C(O)R†, -C(O)CH2C(O)R†, -S(O)2R†, -S(O)2NR†2, -C(S)NR†2, -C(NH)NR†2 или -N(R†)S(O)2R†; где каждый R† независимо представляет собой водород, или С1-6 алифатический углеводород, возможно содержащий заместители, как описано ниже, не содержащий заместители -OPh, или не содержащее заместители 5-6-членное насыщенное, частично ненасыщенное, или арильное кольца, содержащее 0-4 гетероатомов, независимо выбранных из азота, кислорода или серы, или, вне зависимости от определенного выше, два независимых варианта R† совместно с находящимися между ними атомами образуют не содержащее заместители 3-12-членное насыщенное, частично ненасыщенное, или арильное моно- или бициклическое кольцо, содержащее 0-4 гетероатома, независимо выбранные из азота, кислорода или серы.
[0047] Подходящие заместители у алифатической группы R† независимо представляют собой галоген, -R•, -(галоR•), -ОН, -OR•, -O(галоR•), -CN, -C(O)OH, -C(O)OR•, -NH2, -NHR•, -NR•2, или -NO2, где каждый R• не содержит заместителей, или, когдав его названии присутствует приставка "гало", содержит в качестве заместителей только один или более атомов галогена, и независимо представляет собой алифатический углеводород C1-4, -CH2Ph, -O(CH2)0-1Ph, или 5-6-членное насыщенное, частично ненасыщенное, или арильное кольцо, содержащее 0-4 гетероатомов, которые независимо выбраны из азота, кислорода или серы.
[0048] Термин "фармацевтически приемлемая соль", используемый в настоящем описании, относится к солям, которые в рациональных пределах с медицинской точки зрения подходят для применения в контакте с тканями человека и животных, не обладающими токсичностью, не вызывающими раздражения и аллергических ответов, и т.д., и имеющим соответствующий приемлемый коэффициент риска. Фармацевтически приемлемые соли широко известны в данной области. Например, S.M.Berge et al., подробно описывают фармацевтически приемлемые соли в J. Pharmaceutical Sciences, 1977, 66, 1-19, включенном в настоящий документ посредством ссылки. Фармацевтически приемлемые соли веществ согласно настоящему изобретению включают соли, полученные из соответствующих неорганических и органических кислот и оснований. Примерами фармацевтически приемлемых, нетоксичных кислотно-аддитивных солей являются соли аминогрупп, полученные посредством добавления неорганических кислот, таких как соляная кислота, бромистоводородная кислота, фосфорная кислота, серная и хлорная кислоты, или посредством добавления органических кислот, таких как уксусная кислота, щавелевая кислота, малеиновая кислота, винная кислота, лимонная кислота, янтарная кислота или малоновая кислота, или при помощи других методов, применяемых в данной области, таких как ионный обмен. Другие фармацевтически приемлемые соли включают адипат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентан пропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат, глюконат, гемисульфат, гептаноат, гексаноат, гидроидид, 2-гидроксиэтансульфонат, лактобиосукцинат, лактат, лаурат, лаурилсульфат, малат, малеат, малонат, матансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пивалат, пропионат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, п-толуол сульфонат, ундеканоат, соли валериановой кислоты и им подобные.
[0049] Соли, полученные путем взаимодействия с соответствующими основаниями, включают соли щелочных металлов, щелочноземельных металлов, соли аммония и N+(C1-4алкил)4. Примеры солей щелочных или щелочноземельных металлов включают соли натрия, лития, калия, кальция, магния и им подобных. Далее, фармацевтически приемлемые соли включают, когда это целесообразно, нетоксичные соли аммиака, четвертичные аммонийные соли и катионы аминов, образованные при помощи таких противоинов, как галид, гидроксид, карбоксилат, сульфат, фосфат, нитрат, сульфонаты низших алкилов и арил сульфонат.
[0050] За исключением оговоренных особо случаев химические структуры, приведенные в настоящем описании, также подразумевают под собой все изомерные (например, энантиомерные, диастериомерные и геометрические (или конформационные) формы; например, R и S конфигурации для каждого центра асимметрии, Z и Е изомеры вокруг двойной связи и Z и Е конформационные изомеры. Таким образом, объем настоящего изобретения охватывает стереохимические изомеры, а также энантиомеры, диастериомеры и геометрические (и конформационные) смеси соединений согласно изобретению. За исключением оговоренных особо случаев, объем настоящего изобретения охватывает все таутомерные формы соединений. Также за исключением оговоренных особо случаев химические структуры, приведенные в настоящем описании, также предназначены для обозначения соединений, различающихся между собой только присутствием одного или более изотонически обогащенных атомов. Например, объем настоящего изобретения охватывает соединения, имеющие приведенную в настоящем описании структуру, включая замещение водорода на дейтерий или тритий или замещение углерода на13С- или14С-обогащенный углерод. Такие соединения могут быть полезны, например, в качестве аналитического инструмента, в качестве зондов в биологических анализах или в качестве терапевтических агентов согласно настоящему изобретению. В некоторых вариантах реализации головная группа, R3, или соединение согласно настоящему изобретению содержит в своем составе один или более атомов дейтерия.
[0051] Термин "необратимый" или "необратимый ингибитор", используемый в настоящем изобретении, относится к ингибитору (т.е. к соединению), способному ковалентно связываться с протеазой ВГС, по существу, необратимым образом. Тогда как обратимый ингибитор способен присоединяться к протеазе ВГС (но обычно не способен образовать с ней ковалентную связь) и, таким образом, может диссоциировать от протеазы ВГС, необратимый ингибитор после образования ковалентной связи остается связанным с протеазой ВГС. Необратимые ингибиторы обычно проявляют временную зависимость, при которой степень ингибирования возрастает в зависимости от времени, в течение которого ингибитор находится в контакте с ферментом. В некоторых вариантах реализации необратимый ингибитор остается, по существу, связанным с протеазой после формирования ковалентной связи и остается связанным с ней в течение периода времени, более долгого, чем время жизни белка.
[0052] Способы определения способности вещества выступать в роли необратимого ингибитора известны обычному специалисту в данной области. Такие способы включают, но не ограничиваются кинетическим анализом профиля ингибирования соединения протеазой ВГС в ферментативной реакции, применением масс-спектрометрии препарата белка-мишени, модифицированного в присутствии вещества-ингибитора, экспериментами с периодическим воздействием, также известным как "перфузия" (отмывка) и внесением меток, например внесением радиоактивной метки в состав ингибитора, для исследования ковалентной модификации фермента, а также другими способами, известными специалисту в данной области.
[0053] Обыкновенному специалисту в данной области будет понятно, что некоторые реакционно-способные функциональные группы могут выступать в роли "головных групп". Термин "головная группа", используемый в настоящем описании, относится к функциональной группе, входящей в состав соединения согласно настоящему изобретению, обладающей способностью ковалентно связываться с аминокислотным остатком (например, с цистеином, лизином, гистидином или с другими аминокислотными остатками, подверженными ковалентной модификации), расположенной в области связывающего "кармана" белка-мишени, и, таким образом, необратимо ингибирующей белок. Следует понимать, что под группой -L-Y, согласно определенному и описанному в тексте настоящей заявки, подразумеваются указанные головные группы, обеспечивающие ковалентное и необратимое ингибирование белка.
[0054] Термин "ингибитор" в настоящем описании определяется как соединение, в значительной мере связывающееся с протеазой ВГС и/или ингибирующее ее. В некоторых вариантах реализации значения IC50 и/или константы связывания ингибитора меньше приблизительно 50 нМ, меньше приблизительно 1 нМ, меньше приблизительно 500 нМ, меньше приблизительно 100 нМ, меньше приблизительно 10 нМ или меньше приблизительно 1 нМ.
[0055] Соединение согласно настоящему изобретению можно связать с детектируемым веществом. Специалисту в данной области будет понятно, что детектируемое вещество можно присоединять к соединению согласно настоящему изобретению посредством подходящей замещающей группы. Термин "подходящая замещающая группа", используемый в настоящем описании, относится к функциональной группе, способной ковалентно присоединяться к детектируемому. Такие функциональные группы хорошо известны обыкновенным специалистам в данной области и включают содержащие, например карбоксилатную группу, аминогруппу, тиоловую группу или гидроксильную группу и другие. Следует понимать, что такие группы можно присоединять непосредственно к соединению согласно настоящему изобретению, либо при помощи связывающей группы, например, двухвалентной насыщенной или ненасыщенной углеводородной цепи. Согласно некоторым вариантам реализации указанные группы можно присоединять при помощи реакций Click-химии. Согласно другим вариантам реализации указанные группы можно присоединять при помощи 1,3-циклоприсоединения азида с алкином, например в присутствии медного катализатора. Способы применения реакций Click-химии известны в данной области и включают способы, описанные в Rostovtsev el al., Angew. Chem. Int. Ed. 2002, 41, 2596-99 и Sun et al., Bioconjugate Chem., 2006, 17, 52-57.
[0056] Термин "контрастное вещество", используемый в настоящем описании, употребляется взаимозаменяемо с термином "метка" и относится к группе, которую возможно детектировать, например к первичным меткам и вторичным меткам. Первичные метки, такие как радиоизотопы (например, тритий,32P,33Р,35S или14С), масс-метки, и флуоресцентные метки являются передающими сигнал "ренортерными" группами, которые можно детектировать без дальнейших модификаций. Детектируемые группы также включают люминесцентные и фосфоресцентные группы.
[0057] Термин "вторичная метка", используемый в настоящем описании, относится к таким группам, как биотин и различные антигены белковой природы, нуждающиеся в присутствии вторичных интермедиатов для генерации детектируемого сигнала. Для биотина вторичные интермедиаты могут включать конъюгаты стрептавидин-фермент. Для антигенных меток вторичные интермедиаты могут включать конъюгаты фермент-антитело. Некоторые флуоресцентные группы выступают в роли вторичных меток, так как в процессе резонансного переноса энергии флуоресценции (FRET, РПЭФ) они переносят заряд на другую функциональную группу и детектируемый сигнал генерируется второй группой.
[0058] Термины "флуоресцентная метка", "флуоресцентный краситель" и "флуорофор", используемые в настоящем описании, относятся к группам, поглощающим энергию излучения при определенной длине волны возбуждения и излучающим световую энергию на другой длине волны. Примеры флуоресцентных меток включают, но не ограничиваются следующими: Alexa Fluor dyes (Alexa Fluor 350, Alexa Fluor 488, Alexa Fluor 532, Alexa Fluor 546, Alexa Fluor 568, Alexa Fluor 594, Alexa Fluor 633, Alexa Fluor 660 and Alexa Fluor 680), AMCA, AMCA-S, BODIPY dyes (BODIPY FL, BODIPY R6G, BODIPY TMR, BODIPY TR, BODIPY 530/550, BODIPY 558/568, BODIPY 564/570, BODIPY 576/589, BODIPY 581/591, BODIPY 630/650, BODIPY 650/665), карбоксиродамин 6G, карбокси-Х-родамин (ROX), Cascade Blue, Cascade Yellow, кумарин 343, цианиновые красители (Су3, Су5, Су3.5, Су5.5), дансил, дапоксил, диалкиламинокумарин, 4',5'-дихлор-2',7'-диметокси-флуоресцин, DM-NERF, эозин, эритрозин, флуоресцин, FAM, гидроксикумарин, IR Dyes (IRD 40, IRD 700, IRD 800), JOE, лиссамин-родамин В, MarinaBlue, метоксикумарин, нафтофлуоресцин, Oregon Green 488, Oregon Green 500, Oregon Green 514, Pacific Blue, PyMPO, пирен, родамин В, родамин 6G, родаминовый зеленый, родаминовый красный, родол зеленый, 2',4',5',7'-тетра-бромсульфон-флуоресцин, тетраметил-родамин (TMR), карбокситетраметилродамин (TAMRA), Texas Red, Texas Red-X.
[0059] Термин "масс-метка", используемый в настоящем описании, относится к любой группе, которую возможно однозначно детектировать на основании ее массы при помощи масс-спектрометрических (МС) методов детекции. Примеры масс-меток включают метки с электрофорным высвобождением, такие как N-[3-[4'-[(п-метокситетрафторобензил)окси] фенил]-3-метилглицеронил]изонипекотиновая кислота, 4'-[2,3,5,6-тетрафтор-4-(пентафторфеноксил)]метил ацетофенон, и их производные. Синтез и применение таких масс-меток описаны в патентах США №4,650,750, 4,709,016, 5,360,8191, 5,516,931, 5,602,273, 5,604,104, 5,610,020 и 5,650,270. Другие варианты масс-меток включают, но не ограничиваются следующими примерами: нуклеотиды, дидезоксинуклеотиды, олигонуклеотиды различной длины и нуклеотидного состава, олигопептиды, олигосахариды и другие синтетические полимеры различной длины и мономерного состава. Также в качестве масс-меток можно применять большое разнообразие органических молекул, как не заряженных, так и несущих заряд (биомолекулы или синтетические вещества), масса которых находится в диапазоне (100-2000 Да).
[0060] Термины "значительная способность" и "ингибирует в значительной степени", используемые в настоящем описании, означают изменение, подверженное измерению, в активности протеазы ВГС в образце, содержащем соединение согласно настоящему изобретению или композицию таких соединений и протеазу ВГС, относительно активности протеазы ВГС в составе равноценного образна, не содержащего указанных соединений или их композиции.
3. Примеры соединений согласно настоящему изобретению:
[0061] Согласно некоторым вариантам реализации предложено соединение формулы I:
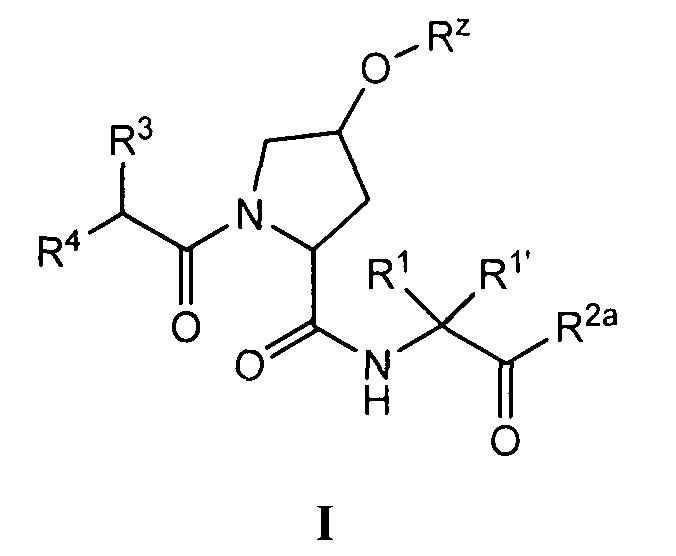
или фармацевтически приемлемая соль указанного соединения, где:
R1 и R1' независимо представляют собой водород или возможно содержащий заместители C1-6 алифатический углеводород, или R1 и R1' совместно образуют возможно содержащее заместители 3-7-членное карбоциклическое кольцо;
R2a представляет собой -ОН или -NHSO2R2;
R2 представляет собой -N(R)2 или возможно содержащую заместители группу, выбранную из следующих: С3-7циклоалкил, соединенный мостиком бицикл, 6-10-членный арил, 5-10-членный гетероарил, содержащий 1-4 гетероатома, которые независимо выбраны из азота, кислорода или серы, или 4-7-членный гетероцикл, содержащий 1-2 гетероатома, которые независимо выбраны из азота, кислорода или серы;
каждый R независимо представляет собой водород, возможно содержащий заместители С1-6 алифатический углеводород, или:
два R совместно с атомом азота, к которому они присоединены, образуют 4-7-членное гетероциклическое кольцо, содержащее 1-2 гетероатома, которые независимо выбраны из азота, кислорода или серы;
R3 представляет собой -L-Y, где:
L представляет собой ковалентную связь или двухвалентную, насыщенную или ненасыщенную, неразветвленную или разветвленную C1-8 углеводородную цепь, причем одна, две или три метиленовые структурные единицы L могут быть независимо замещены на циклопропилен, -NR-, -N(R)C(O)-, -C(O)N(R)-, -N(R)SO2-, -SO2N(R)-, -O-, -C(O)-, -OC(O)-, -C(O)O-, -S-, -SO-, -SO2-, -C(=S)-, -C(=NR)-, -N=N-, или -C(=N2)-;
Y представляет собой водород, С1-6 алифатический углеводород, возможно содержащий в качестве заместителей оксогруппу, галоген, NO2 или CN; или 3-10-членное моноциклическое или бициклическое, насыщенное, частично ненасыщенное или арильное кольцо, содержащее 0-3 гетероатомов, которые независимо выбраны из азота, кислорода или серы, и где указанное кольцо содержит в качестве заместителей 1-4 группы Re; и
каждый Re независимо выбран из следующих: -Q-Z, оксогруппа, NO2, галоген, CN, соответствующая уходящая группа или C1-6 алифатический углеводород, возможно содержащий в качестве заместителей оксогруппу, галоген, NO2 или CN, где:
Q представляет собой двухвалентную, насыщенную или ненасыщенную, неразветвленную или разветвленную С1-6 углеводородную цепь, причем одна, две или три метиленовые структурные единицы Q могут быть независимо замещены на: -N(R)-, -S-, -О-, -С(O)-, -ОС(O)-, -С(O)O-, -SO-, или -SO2-, -N(R)C(O)-, -C(O)N(R)-, -N(R)SO2- или -SO2N(R)-; и
Z представляет собой водород или С1-6 алифатический углеводород, возможно содержащий в качестве заместителей оксогруппу, галоген, NO2, или CN; или
R3 и кольцо, образованное R1 и R1', совместно с находящимися между ними атомами образуют возможно содержащее заместители насыщенное или ненасыщенное 12-18-членное кольцо, содержащее 2-6- гетероатомов, которые независимо выбраны из азота, кислорода или серы, причем образованное кольцо содержит головную группу;
R4 представляет собой Н, -NHC(O)R5, -NHC(O)OR6,
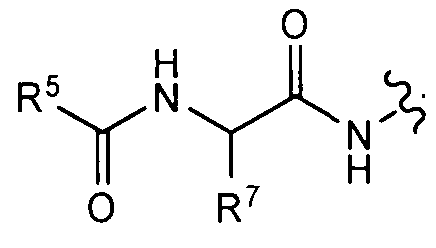
каждый R5 независимо представляет собой -N(R)2 или возможно содержащую заместители группу, выбранную из следующих: С1-6 алифатический углеводород, соединенный мостиком бицикл, 6-10-членный арил, 5-10-членный гетероарил, содержащий 1-4 гетероатомов, которые независимо выбраны из азота, кислорода или серы, или 4-7-членный гетероциклил, содержащий 1-2 гетероатомов, которые независимо выбраны из азота, кислорода или серы;
R6 представляет собой возможно содержащую заместители группу, выбранную из следующих: С1-6 алифатический углеводород, соединенный мостиком бицикл, 6-10-членный арил, 5-10-членный гетероарил, содержащий 1-4 гетероатомов, которые независимо выбраны из азота, кислорода или серы, или 4-7-членный гетероциклил, содержащий 1-2 гетероатомов, которые независимо выбраны из азота, кислорода или серы; и
R7 представляет собой возможно содержащую заместители группу, выбранную из следующих примеров: С1-6 алифатический углеводород, соединенный мостиком бицикл, 6-10-членный арил, 5-10-членный гетероарил, содержащий 1-4 гетероатомов, которые независимо выбраны из азота, кислорода или серы или 4-7-членный гетероциклил, содержащий 1-2 гетероатомов, которые независимо выбраны из азота, кислорода или серы.
RZ представляет собой

каждый из Ry независимо выбран из следующего: галоген, -ORo, -CN, -NO2, -N(Ro)2 или возможно содержащая заместители С1-4 алифатическая группа; и
m представляет собой целое число от 0 до 4 включительно;
s представляет собой целое число от 0 до 4 включительно;
t представляет собой целое число от 0 до 4 включительно;
причем сумма s и t не равна нулю.
[0062] В некоторых вариантах реализации L представляет собой ковалентную связь.
[0063] В некоторых вариантах реализации L представляет собой двухвалентную, насыщенную или ненасыщенную, прямую или разветвленную С1-8 углеводородную цепь, причем одна, две или три метиленовые единицы в составе L могут быть независимо, замещены на: циклопропилен, -NR-, -N(R)C(O)-, -C(O)N(R)-, -N(R)SO2-, -SO2N(R)-, -O-, -C(O)-, -OC(O)-, -C(O)O-, -S-, -SO-, -SO2-, -C(=S)-, -C(=NR)-, -N=N- или -C(=N2)-.
[0064] В некоторых вариантах реализации L представляет собой двухвалентную насыщенную или ненасыщенную, неразветвленную или разветвленную С1-8 углеводородную цепь. В некоторых вариантах реализации L представляет собой -СН2-.
[0065] В некоторых вариантах реализации L представляет собой ковалентную связь, -СН2-, -NH-, -CH2NH-, -NHCH2-, -NHC(O)-, -NHC(O)CH2OC(O)-, -CH2NHC(O)-, -NHSO2-, -NHSO2CH2-, -NHC(O)CH2OC(O)-, или -SO2NH-.
[0066] В некоторых вариантах реализации L представляет собой двухвалентную неразветвленную или разветвленную С2-8 углеводородную цепь, причем L содержит в своем составе по меньшей мере одну двойную связь, и одна или две дополнительные метиленовые структурные единицы L могут быть независимо замещены на -NRC(O)-, -C(O)NR-, -N(R)SO2-, -SO2N(R)-, -S-, -S(O)-, -SO2-, -OC(O)-, -C(O)O-, -О-, -N(R)- или -C(O)-.
[0067] В некоторых вариантах реализации L представляет собой двухвалентную неразветвленную или разветвленную С2-8 углеводородную цепь, причем L содержит в своем составе по меньшей мере одну двойную связь, и по меньшей мере одна метиленовая структурная единица L замещена на -С(O)-, -NRC(O)-, -C(O)NR-, -N(R)SO2-, -SO2N(R)-, -S-, -S(O)-, -SO2-, -OC(O)-, или -С(O)O-, и одна или две дополнительные метиленовые структурные единицы L могут быть независимо замещены на циклопропилен, -О-, -N(R)- или -С(O)-.
[0068] В некоторых вариантах реализации L представляет собой двухвалентную неразветвленную или разветвленную С2-8 углеводородную цепь, причем L содержит в своем составе по меньшей мере одну двойную связь, и по меньшей мере одна метиленовая структурная единица L замещена на -С(O)-, и одна или две дополнительные метиленовые структурные единицы L, могут быть независимо замещены на циклопропилен, -О-, -N(R)-, или -С(O)-.
[0069] Согласно описанному выше в некоторых вариантах реализации L представляет собой двухвалентную неразветвленную или разветвленную С2-8 углеводородную цепь, причем L содержит в своем составе по меньшей мере одну двойную связь. Обыкновенному специалисту в данной области будет понятно, что такая двойная связь может находиться внутри углеводородной цепи, а может быть "экзо-связью" по отношению к углеводородному скелету, формируя, таким образом, алкилиденовую группу. В качестве примера можно привести такую группу L, содержащую алкилиденовую разветвленную цепь, включающую -СН2С(=СН2)СН2-. Таким образом, в некоторых вариантах реализации L представляет собой двухвалентную неразветвленную или разветвленную углеводородную цепь C2-8, где L содержит в своем составе по меньшей мере одну алкилидениловую двойную связь. Примеры групп L включают -NHC(O)C(-CH2)CH2-.
[0070] В некоторых вариантах реализации L представляет собой двухвалентную неразветвленную или разветвленную углеводородную цепь С2-8, где по меньшей мере одна метиленовая единица в составе L замещена на -С(O)-. В некоторых вариантах реализации L представляет собой -С(O)СН=СН(СН3)-, С(O)СН=CHCH2NH(СН3)-, -С(O)СН=СН(СН3)-, -С(O)СН=СН-, -СН2С(O)СН=СН-, -СН2С(O)СН=СН(СН3)-, -СН2СН2С(O)СН=СН-, -СН2СН2С(O)CH=СНСН2-, СН2СН2С(O)СН=CHCH2NH(СН3)-, или -CH2-CH2C(O)CH=CH(CH3)-, или -СН(СН3)ОС(O)СН=СН-.
[0071] В некоторых вариантах реализации L представляет собой двухвалентную неразветвленную или разветвленную C2-8 углеводородную цепь, причем L содержит в своем составе по меньшей мере одну двойную связь, и по меньшей мере одна метиленовая единица в составе L замещена на -ОС(O)-.
[0072] В некоторых вариантах реализации L представляет собой двухвалентную неразветвленную или разветвленную С2-8 углеводородную цепь, причем L содержит в своем составе по меньшей мере одну двойную связь, и по меньшей мере одна метиленовая единица в составе L замещена на -NRC(O)-, -C(O)NR-, -N(R)SO2-, -SO2N(R)-, -S-, -S(O)-, -SO2-, -OC(O)-, или -С(O)O-, и одна или две дополнительные метиленовые единицы в составе L могут быть независимо замещены на циклопропилен, -О-, -N(R)- или -С(O)-. В некоторых вариантах реализации L представляет собой -CH2OC(O)СН=СНСН2-, -СН2-ОС(O)СН=СН- или -СН(СН=СН2)ОС(O)СН=СН-.
[0073] В отдельных вариантах реализации L представляет собой -NRC(O)СН-СН-, -NRC(O)CH=CHCH2N(CH3)-, -NRC(O)CH=CHCH2O-, -CH2NRC(O)CH=CH-, -NRSO2CH=CH-, -NRSO2CH=CHCH2-, -NRC(O)(C=N2)C(O)-, -NRC(O)CH=CHCH2N(CH3)-, -NRSO2CH=CH-, -NRSO2CH-CHCH2-, -NRC(O)CH=CHCH2O-, -NRC(O)C(=CH2)CH2-, -CH2NRC(O)-, -CH2NRC(O)CH=CH-, -CH2CH2NRC(O)- или -CH2NRC(O)циклопропилен-, где каждый R независимо представляет собой водород или возможно содержащую заместители С1-6 алифатическую группу.
[0074] В отдельных вариантах реализации L представляет собой -NHC(O)CH=CH-, -NHC(O)CH=CHCH2N(CH3)-, -NHC(O)CH=CHCH2O-, -CH2NHC(O)CH=CH-, -NHSO2CH=CH-, -NHSO2CH=CHCH2-, -NHC(O)(C=N2)C(O)-, -NHC(O)CH=CHCH2N(CH3)-, -NHSO2CH-CH-, -NHSO2CH=CHCH2-, -NHC(O)CH=CHCH2O-, -NHC(O)C(=CH2)CH2-, -CH2NHC(O)-, -CH2NHC(O)CH=CH-, -CH2CH2NHC(O)- или -CH2NHC(O)циклопропилен-.
[0075] В некоторых вариантах реализации L представляет собой двухвалентную неразветвленную или разветвленную С2-8 углеводородную цепь, причем L содержит в своем составе по меньшей мере одну тройную связь. В отдельных вариантах реализации L представляет собой двухвалентную неразветвленную или разветвленную С2-8 углеводородную цепь, причем L содержит в своем составе по меньшей мере одну тройную связь, и одна или две дополнительные метиленовые структурные единицы L могут быть независимо замещены на -NRC(O)-, -C(O)NR-, -S-, -S(O)-, -SO2-, -C(=S)-, -C(=NR)-, -O-, -N(R)- или -С(O)-. В некоторых вариантах реализации L содержит в своем составе по меньшей мере одну тройную связь, и по меньшей мере одна метиленовая структурная единица L замещена на -N(R)-, -N(R)C(O)-, -С(O)-, -С(O)O-, или -ОС(O)-, или -О-.
[0076] Примеры групп L включают -С≡С-, -С≡ССН2Н(изопропил)-, -NHC(O)C≡CCH2CH2-, -CH2-C≡C-CH2-, -С≡CCH2O-, -СН2С(O)С≡С-, -С(O)С≡С- или -CH2OC(=O)С≡С-.
[0077] В отдельных вариантах реализации L представляет собой двухвалентную неразветвленную или разветвленную С2-8 углеводородную цепь, причем одна метиленовая единица L замещена на циклопропилен, и одна или дне дополнительные метиленовые структурные единицы L независимо замещены на -С(O)-, -NRC(O)-, -C(O)NR-, -N(R)SO2- или -SO2N(R)-. Примеры групп L включают -NHC(O)-циклопропилен-SO2- и -NHC(O)-циклопропилен-.
[0078] Как в общих чертах было определено выше, Y представляет собой водород, С1-6 алифатический углеводород, возможно содержащий в качестве заместителей оксогруппу, галоген, NO2, или CN, или 3-10-членное моноциклическое или бициклическое, насыщенное, частично ненасыщенное или арильное кольцо, содержащее 0-3 гетероатомов, которые независимо выбраны из азота, кислорода или серы, и где указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждый Re независимо выбран из следующего: -Q-Z, оксогруппа, NO2, галоген, CN, соответствующая уходящая группа, или С1-6 алифатическая группа, где Q представляет собой ковалентную связь или двухвалентную насыщенную или ненасыщенную, неразветвленную или разветвленную С1-6 углеводородную цепь, причем одна или две метиленовые структурные единицы Q могут быть независимо замещены на -N(R)-, -S-, -О-, -С(O)-, -ОС(O)-, -С(O)O-, -SO- или -SO2-, -N(R)C(O)-, -C(O)N(R)-, -N(R)SO2- или -SO2N(R)-; и Z представляет собой водород или углеводородную цепь С1-6, возможно содержащую в качестве заместителей оксогруппу, галоген, NO2 или CN.
[0079] В отдельных вариантах реализации Y представляет собой водород.
[0080] В отдельных вариантах реализации Y представляет собой С1-6 алифатическую группу, возможно содержащую в качестве заместителей оксогруппу, галоген, NO2, или CN. В некоторых вариантах реализации Y представляет собой C2-6 алкенил, возможно содержащий в качестве заместителей оксогруппу, галоген, NO2 или CN. В других вариантах реализации Y представляет собой C2-6 алкинил, возможно содержащий в качестве заместителей оксогруппу, галоген, NO2 или CN. В некоторых вариантах реализации Y представляет собой С2-6 алкенил. В других вариантах реализации Y представляет собой C2-4 алкинил.
[0081] В других вариантах реализации Y представляет собой C1-6 алкил, содержащий в качестве заместителей оксогруппу, галоген, NO2 или CN. Такие группы Y включают -CH2F, -CH2Cl, -CH2CN и -CH2NO2.
[0082] В отдельных вариантах реализации Y представляет собой насыщенное 3-6-членное кольцо, содержащее 0-3 гетероатомов, которые независимо выбраны из азота, кислорода или серы, причем Y содержит в качестве заместителей 1-4 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки.
[0083] В некоторых вариантах реализации Y представляет собой насыщенное 3-4-членное гетероциклическое кольцо, содержащее 1 гетероатом, который выбран из кислорода или азота, причем указанное кольцо содержит в качестве заместителей 1-2 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки. Примерами таких колец являются эпоксидные и окситановые кольца, где каждое кольцо содержит в качестве заместителей 1-2 группы Re, где каждая группа Reопределена выше и описана в тексте настоящей заявки.
[0084] В других вариантах реализации Y представляет собой насыщенное 5-6-членное гетероциклическое кольцо, содержащее 1-2 гетероатомов, которые выбраны из кислорода и азота, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки. Примеры таких колец включают пиперидиновые и пирролидиновые кольца, где каждое кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки. В некоторых вариантах реализации Y представляет собой


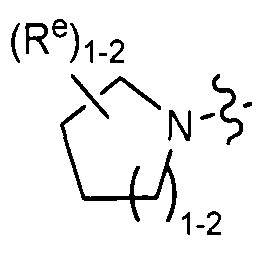
[0085] В некоторых вариантах реализации Y представляет собой насыщенное 3-6-членное карбоциклическое кольцо, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки. В некоторых вариантах реализации Y представляет собой циклопропил, циклобутил, циклопентил или циклогексил, причем каждое кольцо содержит в качестве заместителей 1-4 группы Re где каждая группа Re определена выше и описана в тексте настоящей заявки. В отдельных вариантах реализации Y представляет собой
[0086] В некоторых вариантах реализации Y представляет собой частично ненасыщенное 3-6-членное моноциклическое кольцо, содержащее 0-3 гетероатомов, которые независимо выбраны из азота, кислорода или серы, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки.
[0087] В некоторых вариантах реализации Y представляет собой частично ненасыщенное 3-6-членное карбоциклическое кольцо, причем указанное кольцо содержит в качестве заместителей 1-4 групп Re, где каждая группа Re определена выше и описана в тексте настоящей "заявки. В некоторых вариантах реализации Y представляет собой циклопропенил, циклобутенил, циклопентенил, или циклогексенил, причем каждое кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Reопределена выше и описана в тексте настоящей заявки. В некоторых вариантах реализации Y представляет собой

[0088] В некоторых вариантах реализации Y представляет собой частично ненасыщенное 4-6-членное гетероциклическое кольцо, содержащее 1-2 гетероатомов, которые независимо выбраны из азота, кислорода или серы, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки. В некоторых вариантах реализации Y выбран из следующих примеров:

где каждый R и Re определен выше и описан в тексте настоящей заявки.
[0089] В некоторых вариантах реализации Y представляет собой 6-членное ароматическое кольцо, содержащее в своем составе 0-2 атомов азота, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки. В некоторых вариантах реализации Y представляет собой фенил, пиридил или пиримидинил, где каждое кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки.
[0090] В некоторых вариантах реализации Y выбран из следующих примеров:

где каждый Re определен выше и описан в тексте настоящей заявки.
[0091] В других вариантах реализации Y представляет собой 5-членное гетероарильное кольцо, содержащее 1-3 гетероатомов, которые независимо выбраны из азота, кислорода или серы, причем указанное кольцо содержит в качестве заместителей 1-3 группы Re где каждая группа Re определена выше и описана в тексте настоящей заявки. В некоторых вариантах реализации Y представляет собой 5-членное частично ненасыщенное или арильное кольцо, содержащее 1-3 гетероатомов, которые независимо выбраны из азота, кислорода или серы, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки. Примеры таких колец включают изоксазолил, оксадиазол, тиазолил, имидазолил, пиразолил, пирролил, фуранил, тиенил, триазол, тиадиазол и оксадиазол, причем каждое кольцо содержит в качестве заместителей 1-3 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки. В некоторых вариантах реализации Y выбран из следующих примеров:

где каждый R и Re определен выше и описан в тексте настоящей заявки.
[0092] В отдельных вариантах реализации Y представляет собой 8-10-членное бициклическое, насыщенное, частично ненасыщенное или арильное кольцо, содержащее 0-3 гетероатомов, которые независимо выбраны из азота, кислорода или серы, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки. Согласно другому аспекту настоящего изобретения Y представляет собой 9-10-членное бициклическое, частично ненасыщенное, или арильное кольцо, содержащее 1-3 гетероатомов, которые независимо выбраны из азота, кислорода или серы, где указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки. Примеры таких бициклических колец включают 2,3-дигидробензо[d]изотиазол, где указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки.
[0093] Как в общих чертах было определено выше, каждая группа Re независимо выбрана из следующих примеров: -Q-Z, оксогруппа, NO2, галоген, CN, соответствующая уходящая группа, или С1-6 алифатическая группа, возможно содержащая в качестве заместителей оксогруппу, галоген, NO2, или CN, где Q представляет собой ковалентную связь или двухвалентную насыщенную или ненасыщенную, неразветвленную или разветвленную С1-6 углеводородную цепь, причем одна или две метиленовые структурные единицы в составе Q могут быть независимо замещены на -N(R)-, -S-, -О-, -С(O)-, -ОС(O)-, -С(O)O-, -SO-, или -SO2-, -N(R)C(O)-, -C(О)N(R)-, -N(R)SO2- или -SO2N(R)-; и Z представляет собой водород или алифатическую группу C1-6, возможно содержащую в качестве заместителей оксогруппу, галоген, NO2 или CN.
[0094] В отдельных вариантах реализации Re представляет собой C1-6 алифатическую группу, возможно содержащую в качестве заместителей оксогруппу, галоген, NO2 или CN. В других вариантах реализации Re представляет собой оксогруппу, NO2, галоген или CN.
[0095] В некоторых вариантах реализации Re представляет собой -Q-Z, где Q является ковалентной связью и Z является водородом (т.е. Re является водородом). В других вариантах реализации Re представляет собой -Q-Z, где Q является двухвалентной насыщенной или ненасыщенной, неразветвленной или разветвленной С1-6 углеводородной цепью, и одна или две метиленовые единицы в составе Q могут быть независимо замещены на -NR-, -NRC(O)-, -C(O)NR-, -S-, -О-, -С(O)-, -SO- или -SO2-. Также существуют варианты реализации согласно которым Q представляет собой двухвалентную неразветвленную или разветвленную С2-6 углеводородную цепь, содержащую по меньшей мере одну двойную связь, причем одна или две метиленовые единицы в составе Q, могут быть независимо замещены на -NR-, -NRC(O)-, -C(O)NR-, -S-, -О-, -С(O)-, -SO- или -SO2-. В некоторых вариантах реализации Z в составе группы Re представляет собой водород. В некоторых вариантах реализации -Q-Z представляет собой -NHC(O)CH=CH2 или -С(O)СН=СН2.
[0096] В отдельных вариантах реализации каждый Re независимо выбран из следующего: оксогруппа, NO2, CN, фтор, хлор, -NHC(O)CH=CH2, -C(O)CH=CH2, -СН2СН=СН2, -С≡СН, -C(O)OCH2Cl, -C(O)OCH2F, -C(O)OCH2CN, -C(O)CH2Cl, -C(O)CH2F, -C(O)CH2CN или -СН2С(O)СН3.
[0097] В некоторых вариантах реализации Re представляет собой подходящую уходящую группу, т.е. группу, которую подвергают нуклеофильному замещению. "Подходящая уходящая группа" представляет собой химическую группу, которую с легкостью возможно заместить на требуемую приходящую химическую функциональную группу, например, на тиоловую группу или на цистеин согласно настоящему изобретению. Соответствующие уходящие группы хорошо известны в данной области, например, см. "Advanced Organic Chemistry," Jerry March, 5th Ed., pp.351-357, John Wiley and Sons, N.Y. Такие уходящие группы включают, но не ограничиваются следующими примерами: галоген, алкокси-, сульфонилокси-; возможно содержащая заместители алкилсульфонилокси-; возможно содержащая заместители алкенилсульфонилокси-; возможно содержащая заместители арилсульфонилоксигруппа, ацильная и диазонийная функциональные группы. Примеры соответствующих уходящих групп включают также следующие группы: хлор-, йод-, бром-, фтор-, ацетокси-, метансульфонилокси- (мезилокси-), тозилокси-, трифлилокси-, питро-фенилсульфонилокси- (нозилокси-) и бром-фенилсульфонилокси- (брозилокси-группу).
[0098] В отдельных вариантах реализации применяют следующие варианты осуществления и комбинации -L-Y:
(a) L представляет собой двухвалентную неразветвленную или разветвленную С2-8 углеводородную цепь, где L содержит по меньшей мере одну двойную связь, и одна или две дополнительные метиленовые структурные единицы в составе L могут быть независимо замещены на -NRC(O)-, -C(O)NR-, -N(R)SO2-, -SO2N(R)-, -S-, -S(O)-, -SO2-, -OC(O)-, -C(O)O-, циклопропилен, -О-, -N(R)- или -С(O)-; и Y представляет собой водород или алифатическую группу С1-6, возможно содержащую в качестве заместителей оксогруппу, галоген, NO2 или CN; или
(b) L представляет собой двухвалентную неразветвленную или разветвленную С2-8 углеводородную цепь, причем L содержит по меньшей мере одну двойную связь, и по меньшей мере одна метиленовая структурная единица в составе L замещена на -С(O)-, -NRC(O)-, -C(O)NR-, -N(R)SO2-, -SO2N(R)-, -S-, -S(O)-, -SO2-, -OC(O)-, или -С(O)O-, и одна или две дополнительные метиленовые структурные единицы в составе L, могут быть независимо замещены на циклопропилен, -О-, -N(R)- или -С(O)-; и Y представляет собой водород или С1-6 алифатическую группу, возможно содержащую в качестве заместителей оксогруппу, галоген, NO2 или CN; или
(c) L представляет собой двухвалентную неразветвленную или разветвленную C2-8 углеводородную цепь, причем L содержит по меньшей мере одну двойную связь, и по меньшей мере одна метиленовая структурная единица в составе L замещена на -С(O)-, и одна или две дополнительные метиленовые структурные единицы в составе L могут быть независимо замещены на циклопропилен, -О-, -N(R)- или -С(O)-; и Y представляет собой водород или С1-6 алифатическую группу, возможно содержащую в качестве заместителей оксогруппу, галоген, NO2 или CN; или
(d) L представляет собой двухвалентную неразветвленную или разветвленную C2-8 углеводородную цепь, причем L содержит по меньшей мере одну двойную связь, и по меньшей мере одна метиленовая структурная единица в составе L замещена на -С(O)-; и Y представляет собой водород или С1-6 алифатическую группу, возможно содержащую в качестве заместителей оксогруппу, галоген, NO2 или CN; или
(e) L представляет собой двухвалентную неразветвленную или разветвленную C2-8 углеводородную цепь, причем L содержит по меньшей мере одну двойную связь, и по меньшей мере одна метиленовая структурная единица в составе L замещена на -ОС(O)-; и Y представляет собой водород, или C1-6 алифатическую группу, возможно содержащую в качестве заместителей оксогруппу, галоген, NO2 или CN; или
(f) L представляет собой -NRC(O)CH=CH-, -NRC(O)CH=CHCH2N(CH3)-, -NRC(O)CH=CHCH2O-, -CH2NRC(O)CH=CH-, -NRSO2CH=CH-, -NRSO2CH=CHCH2-, -NRC(O)(C=N2)-, -NRC(O)(C=N2)C(O)-, -NRC(O)CH=CHCH2N(CH3)-, -NRSO2CH=CH-, -NRSO2CH=CHCH2-, -NRC(O)CH=CHCH2O-, -NRC(O)C(=CH2)CH2-, -CH2NRC(O)-, -CH2NRC(O)CH=CH-, -CH2CH2NRC(O)- или -CH2NRC(O)циклопропилен-; где R представляет собой Н или возможно содержащую заместители C1-6 алифатическую группу; и Y представляет собой водород или С1-6 алифатическую группу, возможно содержащую в качестве заместителей оксогруппу, галоген, NO2, или CN; или
(g) L представляет собой -NHC(O)CH=CH-, -NHC(O)CH=CHCH2N(CH3)-, -NHC(O)CH=CHCH2O-, -CH2NHC(O)CH=CH-, -NHSO2CH=CH-, -NHSO2CH=CHCH2-, -NHC(O)(C=N2)-, -NHC(O)(C=N2)C(O)-, -NHC(O)CH=CHCH2N(CH3)-, -NHSO2CH=CH-, -NHSO2CH=CHCH2-, -NHC(O)CH=CHCH2O-, -NHC(O)C(=CH2)CH2, -CH2NHC(O)-, -CH2NHC(O)CH=CH-, -CH2CH2NHC(O)- или -CH2NHC(O)циклопропилен-; и Y представляет собой водород или С1-6 алифатическую группу, возможно содержащую в качестве заместителей оксогруппу, галоген, NO2 или CN; или
(h) L представляет собой двухвалентную неразветвленную или разветвленную C2-8 углеводородную цепь, причем L содержит по меньшей мере одну алкилидениловую двойную связь, и по меньшей мере одна метиленовая структурная единица в составе L замещена на -С(O)-, -NRC(O)-, -C(O)NR-, -N(R)SO2-, -SO2N(R)-, -S-, -S(O)-, -SO2-, -OC(O)-или -С(O)O-, и одна или две дополнительные метиленовые структурные единицы в составе L могут быть независимо замещены на циклопропилен, -О-, -N(R)- или -С(O)-; и Y представляет собой водород или С1-6 алифатическую группу, возможно содержащую в качестве заместителей оксогруппу, галоген, NO2 или CN; или
(i) L представляет собой двухвалентную неразветвленную или разветвленную С2-8 углеводородную цепь, причем L содержит по меньшей мере одну тройную связь, и одна или две дополнительные метиленовые структурные единицы в составе L могут быть независимо замещены на -NRC(O)-, -C(O)NR-, -N(R)SO2-, -SO2N(R)-, -S-, -S(O)-, -SO2-, -OC(O)- или -С(O)O-, и Y представляет собой водород или С1-6 алифатическую группу, возможно содержащую в качестве заместителей оксогруппу, галоген, NO2 или CN; или
(j) L представляет собой -С≡С-, -С≡CCH2N(изопропил)-, -NHC(O)C≡CCH2CH2-, -СН2-C≡С-СН2-, -С≡CCH2O-, -СН2С(O)С≡С-, -С(O)С≡С-, или -CH2OC(=O)С≡С-; и Y представляет собой водород или С1-6 алифатическую группу, возможно содержащую в качестве заместителей оксогруппу, галоген, NO2 или CN; или
(k) L представляет собой двухвалентную неразветвленную или разветвленную C2-8 углеводородную цепь, причем одна метиленовая единица в составе L замещена на циклопропилен, и одна или две дополнительные метиленовые структурные единицы в составе L независимо замещены на -NRC(O)-, -C(O)NR-, -N(R)SO2-, -SO2N(R)-, -S-, -S(O)-, -SO2-, -OC(O)- или -С(O)O-; и Y представляет собой водород, или С1-6 алифатическую группу, возможно содержащую в качестве заместителей оксогруппу, галоген, NO2 или CN; или
(l) L представляет собой ковалентную связь, и Y выбран из следующих примеров:
(i) С1-6 алкил, содержащий в качестве заместителей оксогруппу, галоген, NO2 или CN;
(ii) С2-6 алкенил, возможно содержащий в качестве заместителей оксогруппу, галоген, NO2 или CN; или
(iii) С2-6 алкинил, возможно содержащий в качестве заместителей оксогруппу, галоген, NO2 или CN; или
(iv) насыщенное 3-4-членное гетероциклическое кольцо, содержащее 1 гетероатом, который выбран из кислорода и азота, причем указанное кольцо возможно содержит в качестве заместителей 1-2 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(v) насыщенное 5-6-членное гетероциклическое кольцо, содержащее 1-2 гетероатомов, которые выбраны из кислорода и азота, причем указанное кольцо содержит в качестве заместителей 1-4 групп Re, где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(vi)

(vii) насыщенное 3-6-членное карбоциклическое кольцо, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, причем каждая группа Re определена выше и описана в тексте настоящей заявки; или
(viii) частично ненасыщенное 3-6-членное моноциклическое кольцо, содержащее 0-3 гетероатомов, которые независимо выбраны из азота, кислорода или серы, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Reопределена выше и описана в тексте настоящей заявки; или
(ix) частично ненасыщенное 3-6-членное карбоциклическое кольцо, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(х)

(xi) частично ненасыщенное 4-6-членное гетероциклическое кольцо, содержащее 1-2 гетероатомов, которые независимо выбраны из азота, кислорода или серы, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Reопределена выше и описана в тексте настоящей заявки; или
(xii)

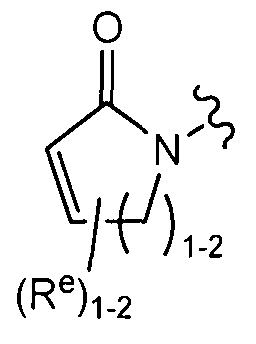
где каждая группа R и Ry соответствуют определенному выше и описанному в тексте настоящей заявки; или
(xiii) 6-членное ароматическое кольцо, содержащее в своем составе 0-2 атомов азота, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки;
(xiv)

где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(xv) 5-членное гетероарильное кольцо, содержащее 1-3 гетероатомов, которые независимо выбраны из азота, кислорода или серы, причем указанное кольцо содержит в качестве заместителей 1-3 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки; или
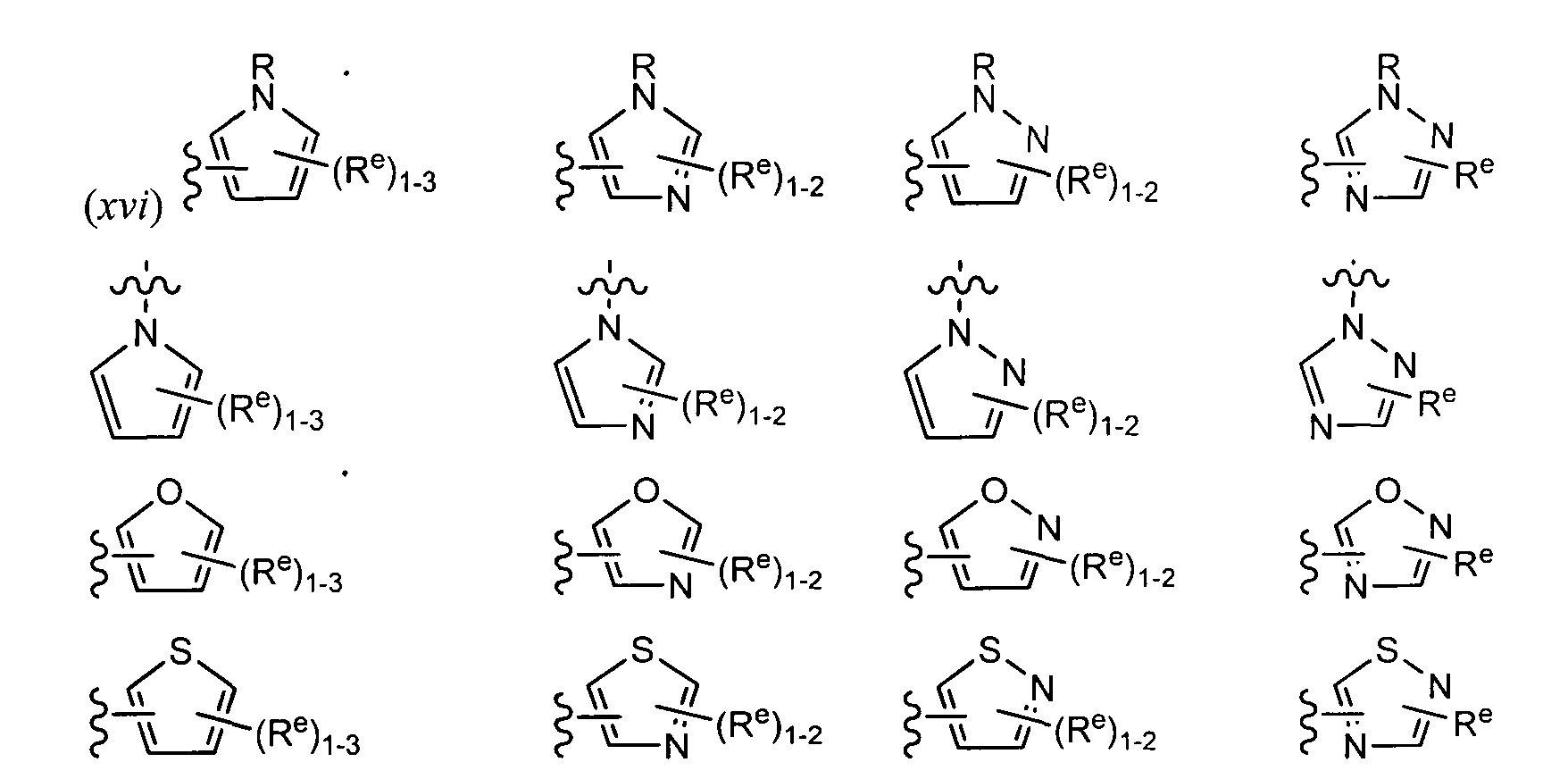
где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(xvii) 8-10-членное бициклическое, насыщенное, частично ненасыщенное или арильное кольцо, содержащее 0-3 гетероатомов, которые независимо выбраны из азота, кислорода или серы, где указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки;
(m) L представляет собой -С(O)-, и Y выбран из следующих примеров:
(i) С1-6 алкил, содержащий в качестве заместителей оксогруппу, галоген, NO2 или CN; или
(ii) С2-6 алкенил, возможно содержащий в качестве заместителей оксогруппу, галоген, NO2 или CN; или
(iii) С2-6 алкинил, возможно содержащий в качестве заместителей оксогруппу, галоген, NO2 или GN; или
(iv) насыщенное 3-4-членное гетероциклическое кольцо, содержащее 1 гетероатом, который выбран из кислорода и азота, причем указанное кольцо содержит в качестве заместителей 1-2 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(v) насыщенное 5-6-членное гетероциклическое кольцо, содержащее 1-2 гетероатомов, которые выбраны из кислорода и азота, где указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(vi)


(vii) насыщенное 3-6-членное карбоциклическое кольцо, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(viii) частично ненасыщенное 3-6-членное моноциклическое кольцо, содержащее 0-3 гетероатомов, которые независимо выбраны из азота, кислорода или серы, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(ix) частично ненасыщенное 3-6-членное карбоциклическое кольцо, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(х)

(xi) частично ненасыщенное 4-6-членное гетероциклическое кольцо, содержащее 1-2 гетероатомов, которые независимо выбраны из азота, кислорода или серы, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(xii)


где каждая из групп R и Re определена выше и описана в тексте настоящей заявки; или
(xiii) 6-членное ароматическое кольцо, содержание в своем составе 0-2 атомов азота, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(xiv)

где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(xv) 5-членное гетероарильное кольцо, содержащее 1-3 гетероатомов, которые независимо выбраны из азота, кислорода или серы, причем указанное кольцо содержит в качестве заместителей 1-3 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(xvi)

где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(xvii) 8-10-членное бициклическое насыщенное, частично ненасыщенное, или арильное кольцо, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, где группа Re определена выше и описана в тексте настоящей заявки;
(n) L представляет собой -N(R)C(O)-, и Y выбран из следующих примеров:
(i) алкил С1-6, содержащий в качестве заместителей оксогруппу, галоген, NO2 или CN; или
(ii) С2-6 алкенил, возможно содержащий в качестве заместителей оксогруппу, галоген, NO2 или CN; или
(iii) C2-6 алкинил, возможно содержащий в качестве заместителей оксогруппу, галоген, NO2 или CN; или
(iv) насыщенное 3-4-членное гетероциклическое кольцо, содержащее 1 гетероатом, который выбран из кислорода или азота, причем указанное кольцо содержит в качестве заместителей 1-2 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(v) насыщенное 5-6-членное гетероциклическое кольцо, содержащее 1-2 гетероатомов, которые выбраны из кислорода и азота, причем указанное кольцо содержит в качестве заместителей 1-4 группы R0, где каждая группа R0 определена выше и описана в тексте настоящей заявки; или
(vi)


(vii) насыщенное 3-6-членное карбоциклическое кольцо, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, причем каждая группа Re определена выше и описана в тексте настоящей заявки; или
(viii) частично ненасыщенное 3-6-членное моноциклическое кольцо, содержащее 0-3 гетероатомов, которые независимо выбраны из азота, кислорода или серы, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Reопределена выше и описана в тексте настоящей заявки; или
(ix) частично ненасыщенное 3-6-членное карбоциклическое кольцо, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(х)

(xi) частично ненасыщенное 4-6-членное гетероциклическое кольцо, содержащее 1-2 гетероатомов, которые независимо выбраны из азота, кислорода или серы, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Reопределена выше и описана в тексте настоящей заявки; или
(xii)
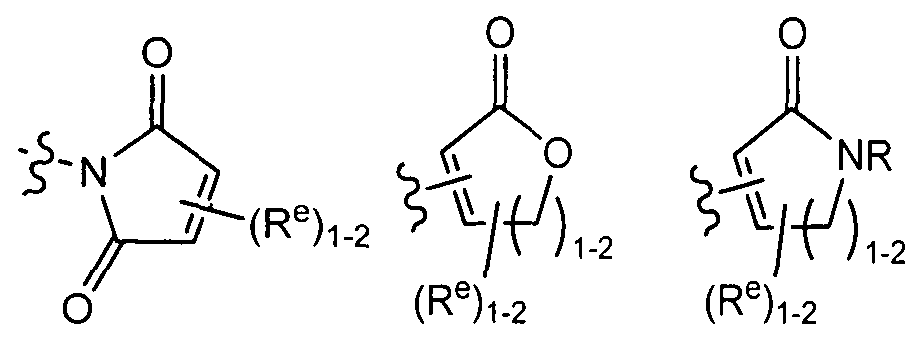

где каждая из групп R и Re определена выше и описана в тексте настоящей заявки; или
(xiii) 6-членное ароматическое кольцо, содержащее 0-2 атомов азота, причем указанное кольцо содержит в качестве заместителей 1-4 групп Re, где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(xiv)
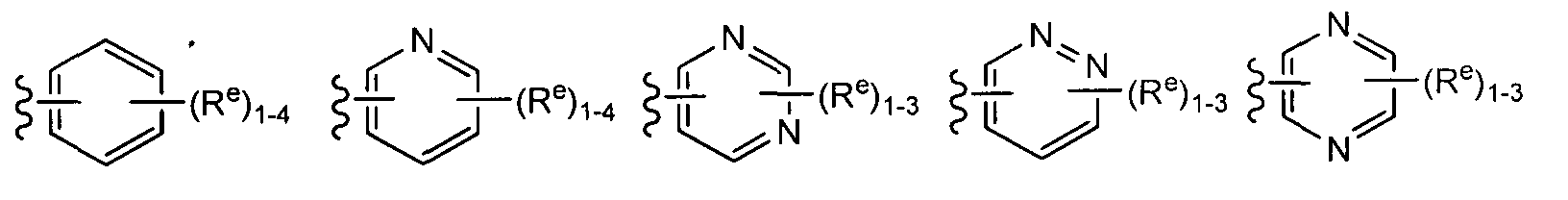
где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(xv) 5-членное гетероарильное кольцо, содержащее 1-3 гетероатомов, которые независимо выбраны из азота, кислорода или серы, причем указанное кольцо содержит в качестве заместителей 1-3 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(xvi)

где каждая из групп R и Re определена выше и описана в тексте настоящей заявки; или
(xvii) 8-10-членное бициклическое насыщенное, частично ненасыщенное, или арильное кольцо, содержащее 0-3 гетероатомов, которые независимо выбраны из азота, кислорода или серы, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, где группа Re определена выше и описана в тексте настоящей заявки;
(о) L представляет собой двухвалентную насыщенную или ненасыщенную, неразветвленную или разветвленную C1-8 углеводородную цепь; и Y выбран из следующих примеров:
(i) С1-6 алкил; содержащий в качестве заместителей оксогруппу, галоген, NO2 или CN;
(ii) С2-6 алкенил, возможно содержащий в качестве заместителей оксогруппу, галоген, NO2 или CN; или
(iii) С2-6 алкинил, возможно содержащий в качестве заместителей оксогруппу, галоген, NO2 или CN; или
(iv) насыщенное 3-4-членное гетероциклическое кольцо, содержащее 1 гетероатом, который выбран из кислорода и азота, причем указанное кольцо содержит в качестве заместителей 1-2 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(v) насыщенное 5-6-членное гетероциклическое кольцо, содержащее 1-2 гетероатомов, которые выбраны из кислорода и азота, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(vi)


(vii) насыщенное 3-6-членное карбоциклическое кольцо, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(viii) частично ненасыщенное 3-6-членное моноциклическое кольцо, содержащее 0-3 гетероатомов, которые независимо выбраны из азота, кислорода или серы, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(ix) частично ненасыщенное 3-6-членное карбоциклическое кольцо, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(х)
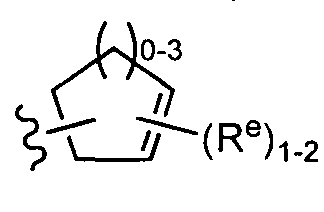
(xi) частично ненасыщенное 4-6-членное гетероциклическое кольцо, содержащее 1-2 гетероатомов, которые независимо выбраны из азота, кислорода или серы, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Reопределена выше и описана в тексте настоящей заявки; или
(xii)
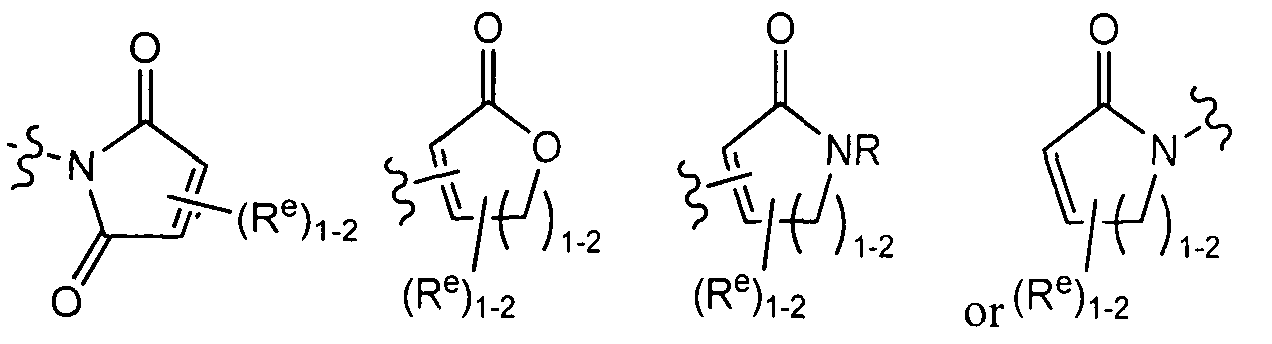
где каждая из групп R и Re определена выше и описана в тексте настоящей заявки; или
(xiii) 6-членное ароматическое кольцо, содержащее в своем составе 0-2 атомов азота, причем указанное кольцо содержит в качестве заместителей 1-4 групп Re, где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(xiv)

где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(xv) 5-членное гетероарильное кольцо, содержащее 1-3 гетероатомов, которые независимо выбраны из азота, кислорода или серы, причем указанное кольцо содержит в качестве заместителей 1-3 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(xvi)

где каждая из групп R и Re определена выше и описана в тексте настоящей заявки; или
(xvii) 8-10-членное бициклическое насыщенное, частично ненасыщенное или арильное кольцо, содержащее 0-3 гетероатомов, которые независимо выбраны из азота, кислорода или серы, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, где группа Re определена выше и описана в тексте настоящей заявки;
(p) L представляет собой ковалентную связь, -CH2-, -NH-, -C(O)-, -CH2NH-, -NHCH2-, -NHC(O)-, -NHC(O)CH2OC(O)-, -CH2NHC(O)-, -NHSO2-, -NHSO2CH2-, -NHC(O)CH2OC(О)- или -SO2NH-; и Y выбран из следующих примеров:
(i) С1-6 алкил, содержащий в качестве заместителей оксогруппу, галоген, NO2 или CN; или
(ii) С2-6 алкенил, возможно содержащий в качестве заместителей оксогруппу, галоген, NO2 или CN; или
(iii) С2-6 алкинил, возможно содержащий в качестве заместителей оксогруппу, галоген, NO2 или CN; или
(iv) насыщенное 3-4-членное гетероциклическое кольцо, содержащее 1 гетероатом, который выбран из кислорода и азота, причем указанное кольцо содержит в качестве заместителей 1-2 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(v) насыщенное 5-6-членное гетероциклическое кольцо, содержащее 1-2 гетероатомов, которые выбраны из кислорода и азота, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(vi)


(vii) насыщенное 3-6-членное карбоциклическое кольцо, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(viii) частично ненасыщенное 3-6-членное моноциклическое кольцо, 0-3 гетероатомов в составе которого независимо выбраны из азота, кислорода или серы, где указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Reопределена выше и описана в тексте настоящей заявки; или
(ix) частично ненасыщенное 3-6-членное карбоциклическое кольцо, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Reопределена выше и описана в тексте настоящей заявки; или
(х)

(xi) частично ненасыщенное 4-6-членное гетероциклическое кольцо, содержащее 1-2 гетероатомов, которые независимо выбраны из азота, кислорода или серы, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(xii)


где каждая из групп R и Re определена выше и описана в тексте настоящей заявки; или
(xiii) 6-членное ароматическое кольцо, содержащее в своем составе 0-2 атомов азота, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(xiv)

где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(xv) 5-членное гетероарильное кольцо, содержащее 1-3 гетероатомов, которые независимо выбраны из азота, кислорода или серы, где указанное кольцо содержит в качестве заместителей 1-3 группы Re, где каждая группа Re определена выше и описана в тексте настоящей заявки; или
(xvi)

где каждая из групп R и Re определена выше и описана в тексте настоящей заявки; или
(xvii) 8-10-членное бициклическое насыщенное, частично ненасыщенное, или арильное кольцо, содержащее 0-3 гетероатомов, которые независимо выбраны из азота, кислорода или серы, причем указанное кольцо содержит в качестве заместителей 1-4 групп Re, где каждая группа Re определена выше и описана в тексте настоящей заявки.
[0099] В отдельных вариантах реализации группа Y формулы I выбрана из групп, представленных в Таблице 1, приведенной ниже, где каждая волнистая линия обозначает точку присоединения к остальной части молекулы.
Таблица 1. Примеры Групп Y формулы I:
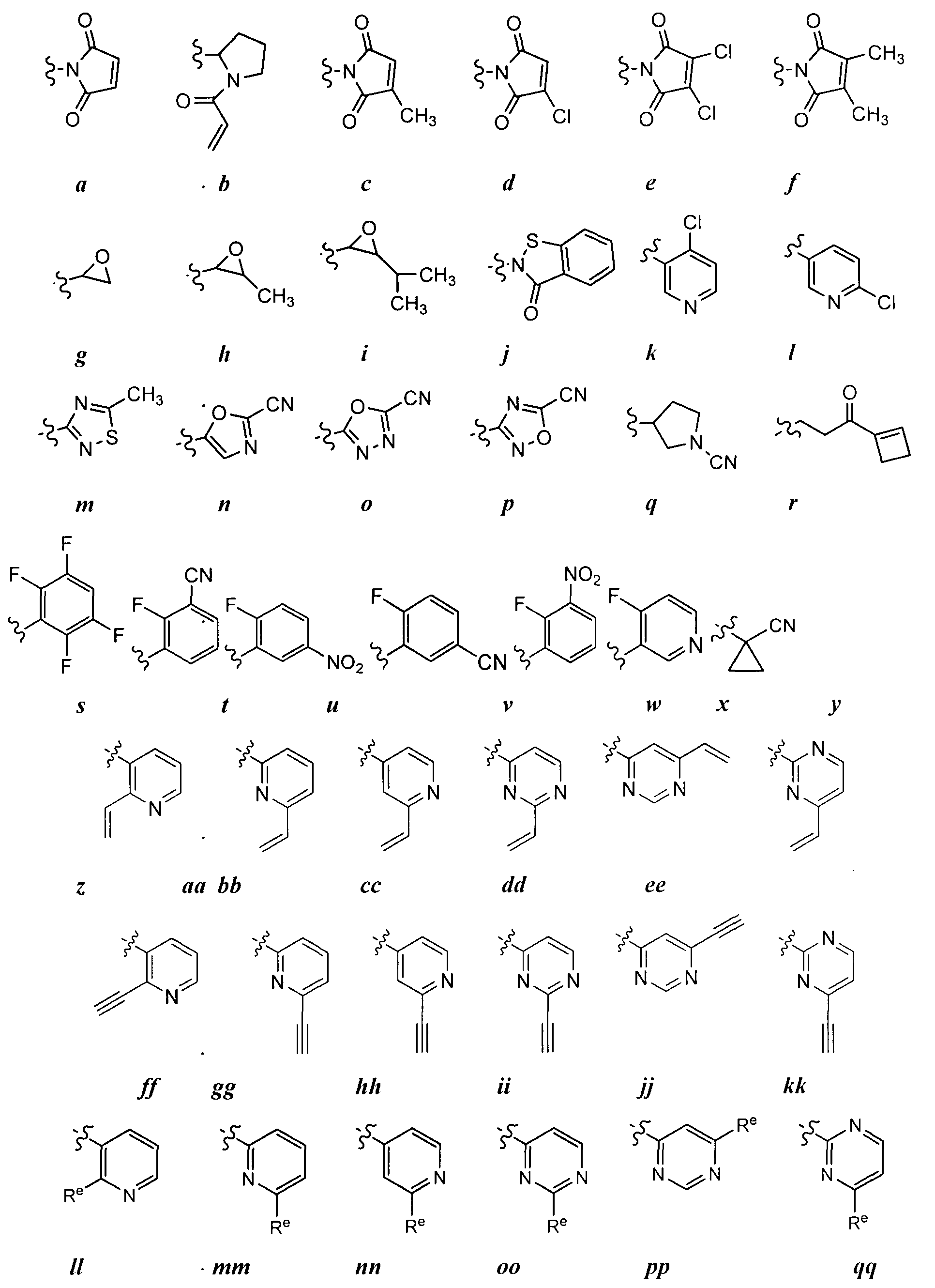


где каждый Re независимо представляет собой соответствующую уходящую группу, NO2, CN или оксогруппу.
[00100] В некоторых вариантах реализации группа R3 согласно формуле I выбрана из групп, представленных в Таблице 2, приведенной ниже, где каждая волнистая линия обозначает точку присоединения к остальной части молекулы.
Таблица 2. Примеры Групп R3:


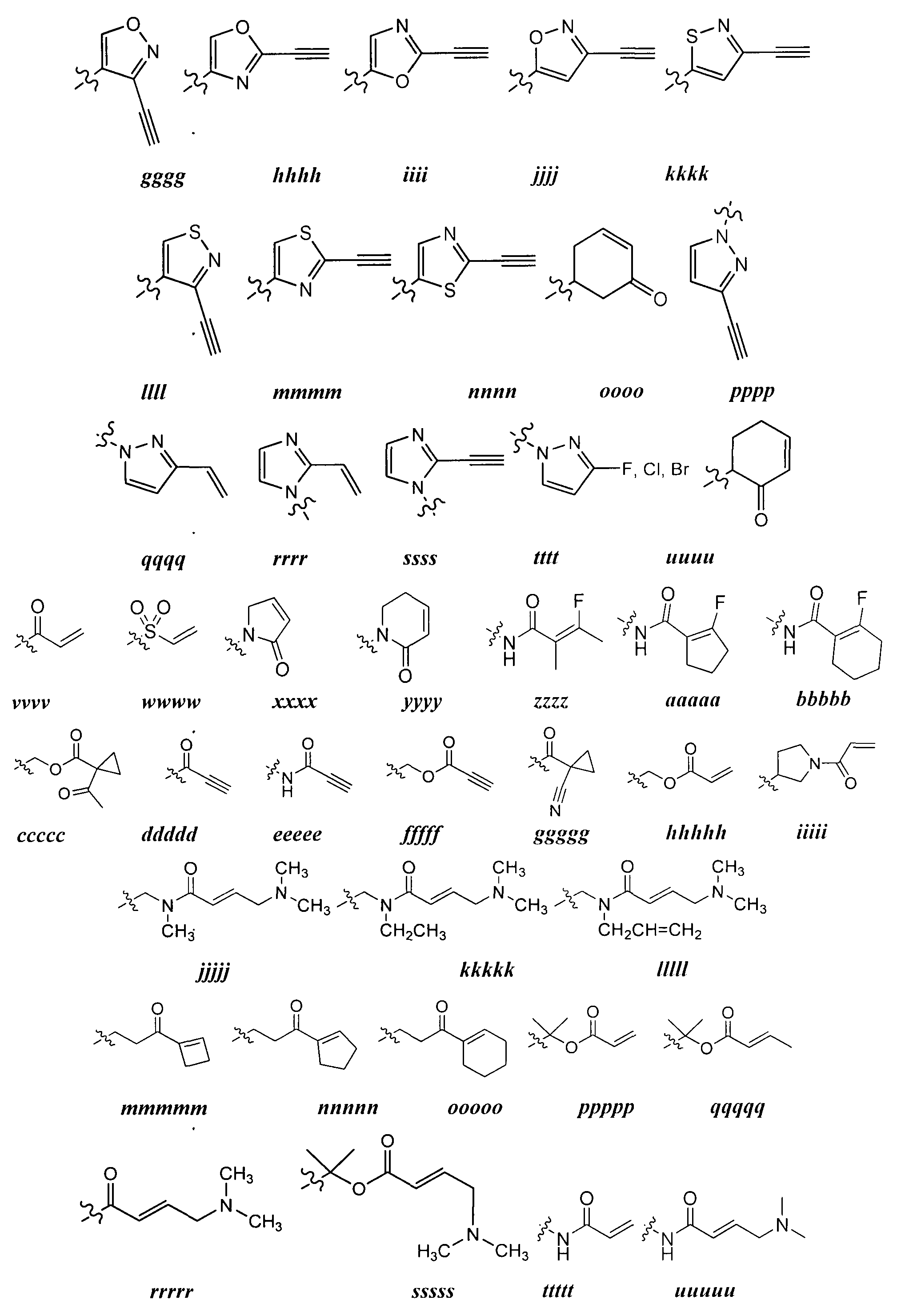

где каждый Re независимо представляет собой соответствующую уходящую группу, NO2, CN или оксогруппу.
[00101] В некоторых вариантах реализации группы R1 и R1' формулы I независимо представляют собой водород или возможно содержащую заместители С1-6 алифатическую группу. В некоторых вариантах реализации R1 представляет собой водород и R1' представляет собой С1-4 алифатическую группу. В других вариантах реализации R1 представляют собой водород и R1' представляет собой н-пропил.
[00102] В некоторых вариантах реализации группы R1 и R1' формулы I совместно образуют возможно содержащее заместители 3-7-членное карбоциклическое кольцо. В некоторых вариантах реализации группы R1 и R1' формулы I совместно образуют возможно содержащее заместители циклопропильное кольцо. В некоторых вариантах реализации группы R1 и R1' формулы I совместно образуют циклопропильное кольцо, содержащее в качестве заместителей этил или винил.
[00103] В некоторых вариантах реализации R4 представляет собой Н, -NHC(O)R5, -NHC(O)OR6,

[00104] В отдельных вариантах реализации группа R4 формулы I представляет собой -NHC(O)R5. В некоторых вариантах реализации группа R4 формулы I представляет собой -NHC(O)OR6. В других вариантах реализации группа R4 формулы I представляет собой

[00105] Существуют варианты реализации согласно которым, когда R4представляет собой -NHC(O)R5, R5 представляет собой C1-6 алифатическую группу, или возможно содержащую заместители группу, выбранную из следующих примеров: соединенный мостиком бицикл, 5-10-членный гетероарил, содержащий 1-4 гетероатомов, которые независимо выбраны из азота, кислорода или серы, или 4-7-членный гетероцикл, содержащий 1-2 гетероатомов, которые независимо выбраны из азота, кислорода или серы.
[00106] Существуют варианты реализации согласно которым, если R4представляет собой -NHC(O)R6, R6 представляет собой С1-6 алифатическую группу или возможно содержащую заместители группу, выбранную из следующих примеров: соединенный мостиком бицикл, 5-10-членный гетероарил, содержащий 1-4 гетероатомов, которые независимо выбраны из азота, кислорода или серы, или 4-7-членный гетероцикл, содержащий 1-2 гетероатомов, которые независимо выбраны из азота, кислорода или серы.
[00107] В некоторых вариантах реализации группа R4 формулы I представляет собой боковую группу аминокислоты. В некоторых вариантах реализации группа R4 формулы I представляет собой боковую группу неприродной аминокислоты. В некоторых вариантах реализации группа R4 формулы I представляет собой алифатическую боковую группу неприродной аминокислоты. В некоторых вариантах реализации группа R4 формулы I представляет собой боковую группу неприродного аланина, содержащего в качестве заместителей одну, две или три группы Ro, где каждый Ro соответствует определенному выше. В некоторых вариантах реализации группа R4формулы I представляет собой боковую группу природной аминокислоты.
[00108] В отдельных вариантах реализации группа R4 формулы I представляет собой боковую группу природного аланина (т.е. R4 представляет собой метил). В некоторых вариантах реализации группа R4 формулы I представляет собой боковую группу природного D-аланина. Существуют варианты реализации согласно которым группа R4 формулы I представляет собой боковую группу природного L-аланина.
[00109] В других вариантах реализации группа R4 формулы I представляет собой боковую группу природного валина. В некоторых вариантах реализации группа R4формулы I представляет собой боковую группу природного остатка D-валина. В некоторых вариантах реализации группа R4 формулы I представляет собой боковую группу природного L-валина.
[00110] В некоторых вариантах реализации группа R4 формулы I состоит из смеси боковых групп аминокислот как в D-, так и в L-конфигурациях. Такие группы R4именуются в настоящем описании "D,L-смешанные боковые группы аминокислот". В некоторых вариантах реализации соотношение D-конфигураций боковых групп аминокислот к L-конфигурациям выбрано из следующих соотношений: 6:1, 5:1, 4:1, 3:1, 2:1, 1:1, 1:2, 1:3, 1:4; 1:5 и 1:6. Таким образом, в некоторых вариантах реализации группа R4 формулы I является D,L-смешанной боковой группой аланина. В других вариантах реализации группа R4 формулы I является D,L-смешанной боковой группой валина.
[00111] Без ограничения какой-либо конкретной теорией, считают, что для соединений формулы I боковые группы аминокислот в которых находятся в D-конфигурации, целесообразно допускать принятие веществом пространственной ориентации, способствующей связыванию протеазы ВГС.
[00112] В некоторых вариантах реализации группы R5 и R7 формулы I независимо представляют собой возможно содержащие заместители группы, выбранные из следующих примеров: возможно содержащая заместители, C1-6 алифатическая группа, 6-10-членный арил, 5-10-членный гетероарил, содержащий 1-4 гетероатомов, которые независимо выбраны из азота, кислорода или серы, или 4-7-членный гетероциклил, содержащий 1-2 гетероатомов, которые независимо выбраны из азота, кислорода или серы. В некоторых вариантах реализации R5 представляет собой возможно содержащий заместители 5-10-членный гетероарил, содержащий 1-4 гетероатомов, которые независимо выбраны из азота, кислорода или серы, и R7 представляет собой возможно содержащую заместители С1-6 алифатическую группу. Существуют варианты реализации в которых R5 представляет собой

[00113] В отдельных вариантах реализации R4 представляет собой -NHC(O)R5, где R5 независимо представляет собой -N(R)2 или возможно содержащую заместители группу, выбранную из С1-6 алифатических групп. В некоторых вариантах реализации R5 представляет собой -N(R)2 и каждый R независимо представляет собой водород возможно содержащую заместители С1-6 алифатическую группу, или два Ry совместно с атомом азота, к которому они присоединены, образуют 4-7-членное гетероциклическое кольцо, содержащее 1-2 гетероатомов, которые независимо выбраны из азота, кислорода или серы. В некоторых вариантах реализации R5 представляет собой -N(R)2 и каждый R независимо представляет собой водород или т-бутил.
[00114] В отдельных вариантах реализации группа R5 формулы I представляет собой возможно содержащее заместители 5-10-членное гетероарильное кольцо, содержащее 1-4 гетероатомов, которые независимо выбраны из азота, кислорода или серы. В некоторых вариантах реализации R5 представляет собой возможно содержащий заместители 6-членный гетероарил, содержащий в своем составе от 1 до 2 атомов азота. В отдельных вариантах реализации R5 представляет собой пиперазинил.
[00115] В отдельных вариантах реализации группа R7 формулы I представляет собой возможно содержащую заместители C1-6 алифатическую группу. В некоторых вариантах реализации R7 представляет собой разветвленную алкильную группу С1-5. В других вариантах реализации R7 представляет собой циклопентил или циклогексил.
[00116] В отдельных вариантах реализации RZ представляет собой

В отдельных вариантах реализации RZ представляет собой

В отдельных вариантах реализации RZ представляет собой

В отдельных вариантах реализации RZ представляет собой

В отдельных вариантах реализации RZ представляет собой
В отдельных вариантах реализации RZ представляет собой
В отдельных вариантах реализации RZ представляет собой

В отдельных вариантах реализации RZ представляет собой

В отдельных вариантах реализации RZ представляет собой
[00117] В некоторых вариантах реализации Ry представляет собой галоген. В других вариантах реализации Ry представляет собой С1-4 алифатическую группу. В отдельных вариантах реализации Ry представляет собой фтор. В отдельных вариантах реализации Ry представляет собой хлор. В отдельных вариантах реализации R5y представляет собой бром. В отдельных вариантах реализации Ry представляет собой йод. В других вариантах реализации Ry представляет собой винил.
[00118] В некоторых вариантах реализации m представляет собой целое число от 1 до 3 включительно. В некоторых вариантах реализации значение m составляет 1. В некоторых вариантах реализации значение m составляет 2. В некоторых вариантах реализации значение m составляет 3.
[00119] В некоторых вариантах реализации s представляет собой целое число от 1 до 3 включительно. В некоторых вариантах реализации значение s составляет 0. В некоторых вариантах реализации значение s составляет 1. Существуют варианты реализации в которых значение s составляет 2. В некоторых вариантах реализации значение s составляет 3. В некоторых вариантах реализации значение s составляет 4.
[00120] В некоторых вариантах реализации t представляет собой целое число от 1 и 3 включительно. В некоторых вариантах реализации значение t составляет 0. В некоторых вариантах реализации значение t составляет 1. В некоторых вариантах реализации значение t составляет 2. В некоторых вариантах реализации значение t составляет 3. В некоторых вариантах реализации значение t составляет 4.
[00121] В отдельных вариантах реализации группа R2a формулы I представляет собой -ОН. В некоторых вариантах реализации группа R2a формулы I представляет собой -NHSO2R2, где R2 соответствует определенному выше и описанному в тексте настоящей заявки. Таким образом, согласно настоящему изобретению предложено соединение согласно формулам I-а или I-b:
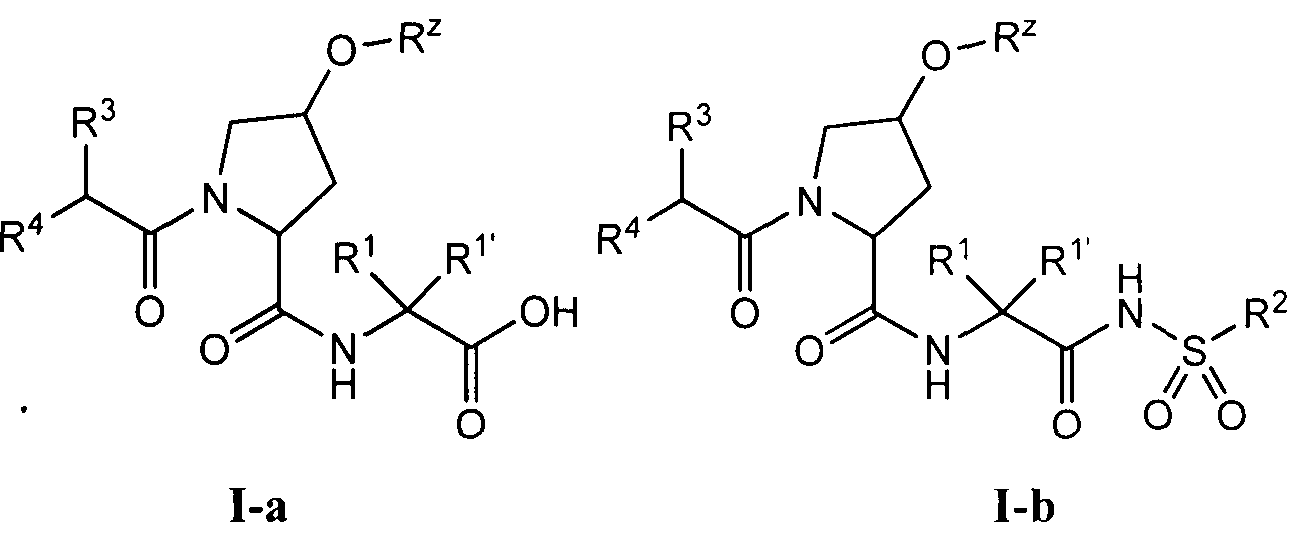
или фармацевтически приемлемая соль указанного соединения, где каждая из групп R1, R1', R2, R3, R4, и RZ соответствует определенному выше для формулы I, а также описанию классов и подклассов, приведенному в тексте настоящей заявки.
[00122] В отдельных вариантах реализации группа R2 формулы I-b представляет собой -N(R)2. В других вариантах реализации группа R2 формулы I-b представляет собой возможно содержащую заместители группу, выбранную из следующих примеров: С3-7 циклоалкил, 6-10-членный арил, 5-10-членный гетероарил, содержащий 1-4 гетероатомов, которые независимо выбраны из азота, кислорода или серы, или 4-7-членный гетероциклил, содержащий 1-2 гетероатомов, которые независимо выбраны из азота, кислорода или серы. В некоторых вариантах реализации R2представляет собой С3-7 циклоалкил или 6-10-членный арил. В некоторых вариантах реализации R2 представляет собой возможно содержащий заместители 6-10-членный арил. В некоторых вариантах реализации R2 представляет собой фенил. Существуют варианты реализации согласно которым R2 представляет собой циклопропил.
[00123] В отдельных вариантах реализации R2 выбран из следующих примеров: С3-7 циклоалкил, соединенный мостиком бицикл, 6-10-членный арил, 5-10-членный гетероарил, содержащий 1-4 гетероатомов, которые независимо выбраны из азота, кислорода или серы, или 4-7-членный гетероциклил, содержащий 1-2 гетероатомов, которые независимо выбраны из азота, кислорода или серы.
[00124] В отдельных вариантах реализации группа R3 формулы I представляет собой головную группу. Существуют варианты реализации настоящего изобретения, согласно которым группы R3 и R1 соединения формулы I совместно с находящимися между ними атомами образуют возможно содержащее заместители насыщенное или ненасыщенное 12-18-членное кольцо, содержащее 2-6 гетероатомов, которые независимо выбраны из азота, кислорода или серы, причем указанное кольцо содержит головную группу. В некоторых вариантах реализации R3 и кольцо, образованное R1 и R1' совместно с находящимися между ними атомами, образуют возможно содержащее заместители насыщенное или ненасыщенное 12-18-членное кольцо, содержащее 2-6 гетероатомов, которые независимо выбраны из азота, кислорода или серы, причем образованное кольцо содержит головную группу.
[00125] Согласно определенному в общих чертах выше, кольцо, образованное группами R3 и R1, в формуле I содержит головную группу. Фраза "содержит головную группу", употребляемая в настоящем описании, может означать как то, что кольцо, образованное R3 и R1, содержит головную группу в качестве заместителя, так и то, что указанная группа входит в состав самого кольца. Например, кольцо, образованное R3 и R1, может содержать в качестве заместителя головную группу -L-Y, где группы -L-Y соответствуют описанному выше. В качестве альтернативного варианта, кольцо, образованное R3 и R1, обладает свойствами головной группы, входящей в состав кольца. Например, кольцо, образованное R3 и R1, может содержать один или более ненасыщенных участков и возможных заместителей и/или гетероатомов, что в комбинации приводит к образованию группы, способной к ковалентному связыванию протеазы ВГС согласно настоящему изобретению. В некоторых вариантах реализации кольцо, образованное R3 и R1, может содержать заместители в α-, β-, γ- или δ-положениях относительно атома углерода, к которому присоединена группа R4.
[00126] Следует понимать, что, когда R3 и R1 связывают вместе с образованием возможно содержащего заместители насыщенного или ненасыщенного 12-18-членного кольца, содержащего 2-6 гетероатомов, которые независимо выбраны из азота, кислорода или серы, такие соединения включают соединения, образованные путем связывания R3 и кольца, образованного R1 и R1'.
[00127] Примеры соединений формулы I, где R3 и кольцо, образованное R1 и R1', связаны вместе, включают соединения согласно формулам I-c-1, I-c-2, I-c-3, I-c-4, I-с-5-, и I-с-6:

или фармацевтически приемлемые соли указанных соединений, где каждый из R2a, R4, Rw, Rx, Rx', и Ry соответствует определенному выше, а также описанию классов и подклассов, приведенному в тексте настоящей заявки. Следует понимать, что, хотя на формулах I-c-1, I-c-2, I-c-3, I-c-4, I-c-5, и I-c-6 изображено циклопропильное кольцо, образованное R1 и R1', эта группа приведена в качестве примера, и, таким образом, согласно настоящему описанию предусмотрены и другие группы R1 и R1'.
[00128] Примеры таких соединений включают соединения, приведенные ниже в Таблице 3.
[00129] Хотя соединения согласно формулам I-c-1, I-c-2, I-c-3, I-c-4, I-c-5 и I-с-6 изображены в форме Z-стереоизомеров по двойной связи в макроциклическом кольце, следует понимать, что в некоторых вариантах реализации соединения согласно формулам I-c-1, I-c-2, I-c-3, I-c-4, I-c-5 и I-c-6 могут находиться и в Е-стереоизомерном состоянии по двойной связи в макроциклическом кольце. Существуют также варианты реализации согласно которым предложены смеси обоих стереоизомеров. В других вариантах реализации соединения согласно формулам I-c-1, I-c-2, I-c-3, I-c-4, I-c-5 и I-c-6 возможно приводить в соответствующие условия с насыщением двойной связи.
[00130] В отдельных вариантах реализации R1 и R1' связаны вместе с образованием возможно содержащего заместители 3-7-членного карбоциклического кольца. В некоторых вариантах реализации такие соединения имеют структуру, приведенную на формуле I-d:
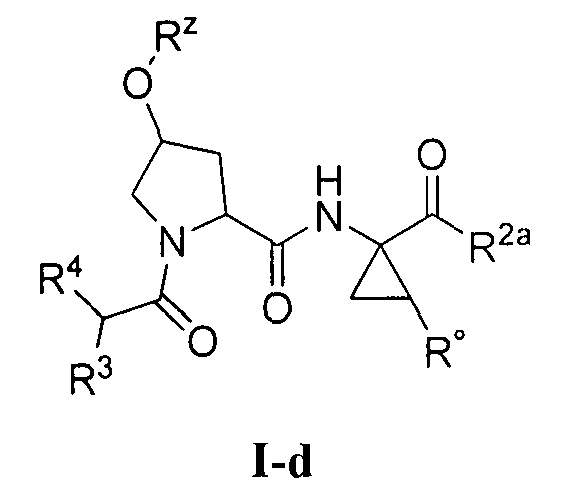
или фармацевтически приемлемой соли указанных соединений, где каждый из R2a, R3, R4, RZ и Ro соответствует определенному для формулы I и описаниям классов и подклассов, приведенным в тексте настоящей заявки.
[00131] В некоторых вариантах реализации Ro представляет собой возможно содержащую заместители группу, выбранную среди С1-6 алифатических групп. В некоторых вариантах реализации Ro представляет собой этил. В других вариантах реализации Ro представляет собой винил.
[00132] Примеры групп R3 формулы I-d включают группы, описанные выше и приведенные в тексте настоящей заявки, а также приведенные в Таблице 3 ниже.
[00133] В отдельных вариантах реализации группы R4 и Rx совместно с находящимися между ними атомами образуют возможно содержащее заместители, насыщенное или ненасыщенное 16-22-членное кольцо, содержащее 2-6 гетероатомов, которые независимо выбраны из азота, кислорода или серы. В некоторых вариантах реализации R4 и Rx совместно с находящимися между ними атомами образуют возможно содержащее заместители, ненасыщенное 18-22-членное кольцо, содержащее 3-5 гетероатомов, которые независимо выбраны из азота, кислорода или серы. В некоторых вариантах реализации кольцо, образованное R4 и Rx, содержит в качестве заместителей одну или более групп Rm, где каждый вариант Rm независимо представляет собой галоген, -ORo; -CN; -SCN; -SRo; -SORo; -SO2Ro; -NO2; -N(Ro)2; -NHC(O)Ro или возможно содержащую заместители группу, выбранную среди С1-6 алифатических групп и С3-7 циклоалкильных групп. В некоторых вариантах реализации согласно настоящему изобретению предложены соединения формулы I-е или I-f:

или фармацевтически приемлемые соли указанных соединений, где R23, R3 и Ro соответствуют определенному для формулы I и описанию классов и подклассов, приведенному в тексте настоящей заявки;
p может принимать целые значения от 1 до 6, включительно; и
каждый из Rm независимо представляет собой галоген, -ORo; -CN; -N(Ro)2; или возможно содержащую заместители группу, выбранную среди С1-6 алифатических групп и С3-7 циклоалкильных групп.
[00134] В некоторых вариантах реализации p равно 1. В некоторых вариантах реализации p равно 2.
[00135] В отдельных вариантах реализации Rm представляет собой С1-6 алифатическую группу. В некоторых вариантах реализации Rm представляет собой метил.
[00136] В некоторых вариантах реализации Ro является возможно содержащей заместители группой, выбранной из С1-6 алифатических групп. Существуют варианты реализации согласно которым Ro представляет собой этил. В других вариантах реализации Ro представляет собой винил.
[00137] Примеры групп R3 согласно формулам I-е и I-f включают группы, описанные в настоящем тексте и приведенные ниже в Таблице 3.
[00138] Несмотря на то, что соединения согласно формулам I-е и I-f изображены как в Z-, так и в Е-конформациях по двойной связи в макроциклическом кольце, следует понимать, что в некоторых вариантах реализации соединения согласно формулам I-е и I-f могут находиться в Е-стереоизомерном состоянии по двойной связи в макроциклическом кольце. В некоторых вариантах реализации соединения согласно формулам I-е и I-f могут находиться в Z-стереоизомерном состоянии по двойной связи в макроциклическом кольце. Согласно некоторым вариантам реализации предложена смесь обоих стереоизомеров. В других вариантах реализации соединения согласно формулам I-е и I-f можно подвергать воздействию соответствующих условий с образованием соединений согласно формулам I-g или I-h:

или фармацевтически приемлемых солей указанных соединений.
[00139] В некоторых вариантах реализации R4 и Rx связаны вместе согласно описанному выше, и R3 и кольцо, образованное R1 и R1' связаны вместе согласно описанному выше, с образованием новых бимакроциклических веществ. В некоторых вариантах реализации кольцо, образованное R4 и Rx, содержит в качестве заместителей одну или более групп Rm согласно описанному выше для формул I-е и I-f. В некоторых вариантах реализации макроциклическое кольцо, образованное R3 и кольцом, образованным R1 и R1', содержит в качестве заместителя головную группу -L-Y с образованием соединений формулы I-j или I-k:

или фармацевтически приемлемых солей указанных соединений; где каждая

[00140] В некоторых вариантах реализации метиленовая единица в составе кольца, образованного R3 и кольцом, образованным R1 и R1', замещена на группу L-Y с получением соединений формулы I-m или I-n:
или фармацевтически приемлемых солей указанных соединений; где каждая

[00141] Как было в общих чертах описано в тексте настоящей заявки, группа R4 в составе соединений формулы I представляет собой водород. Согласно отдельным вариантам реализации настоящего изобретения предложено соединение (формулы II-а или II-b:

где каждая из групп R1, R1', R2, R3 и RZ соответствует определенному выше для формулы I, а также описанию классов и подклассов, приведенному в тексте настоящей заявки.
[00142] Примеры соединений формулы I включают соединения, приведенные ниже в Таблице 3
Таблица 3. Примеры соединений формулы формуле I

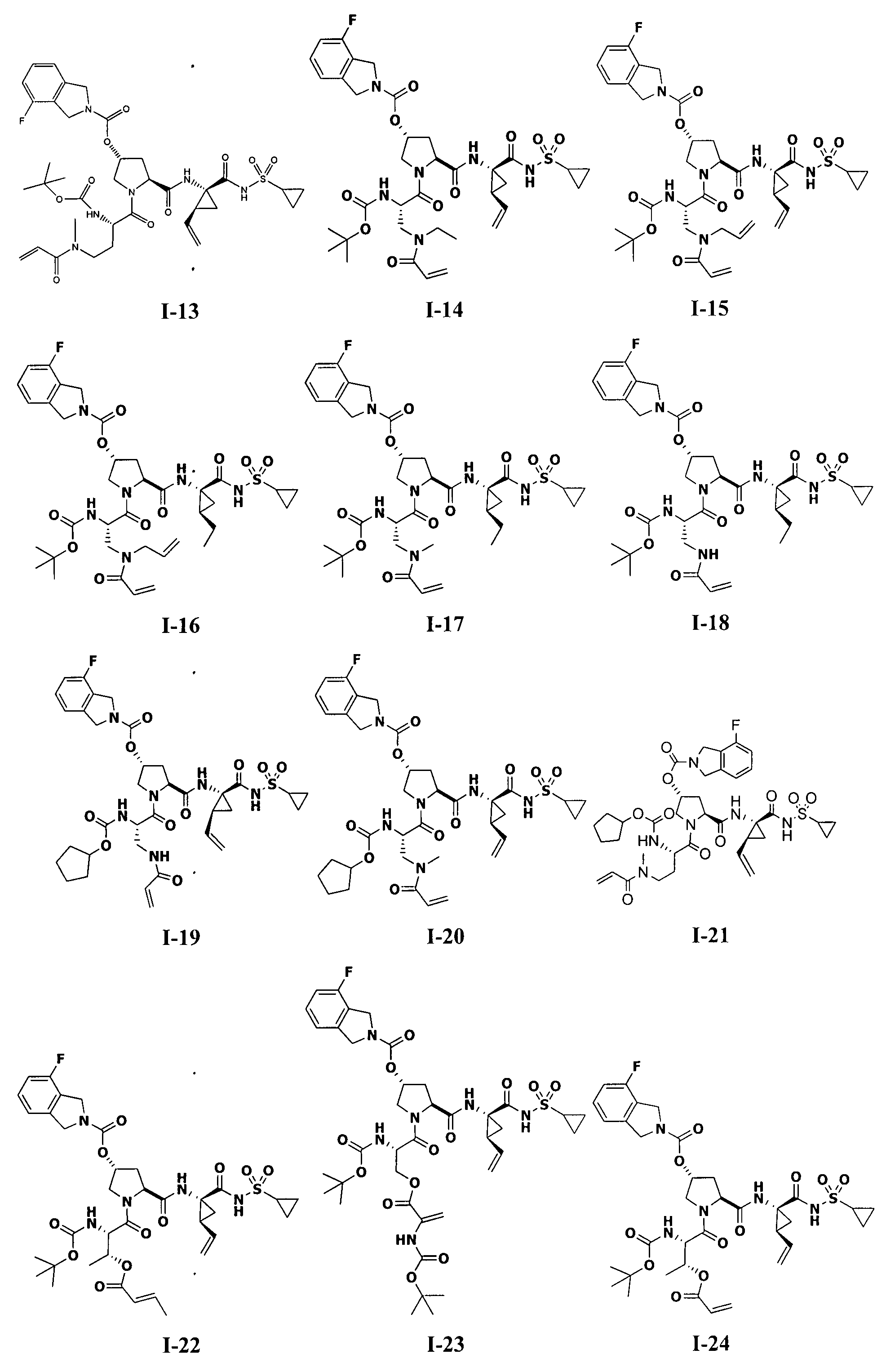
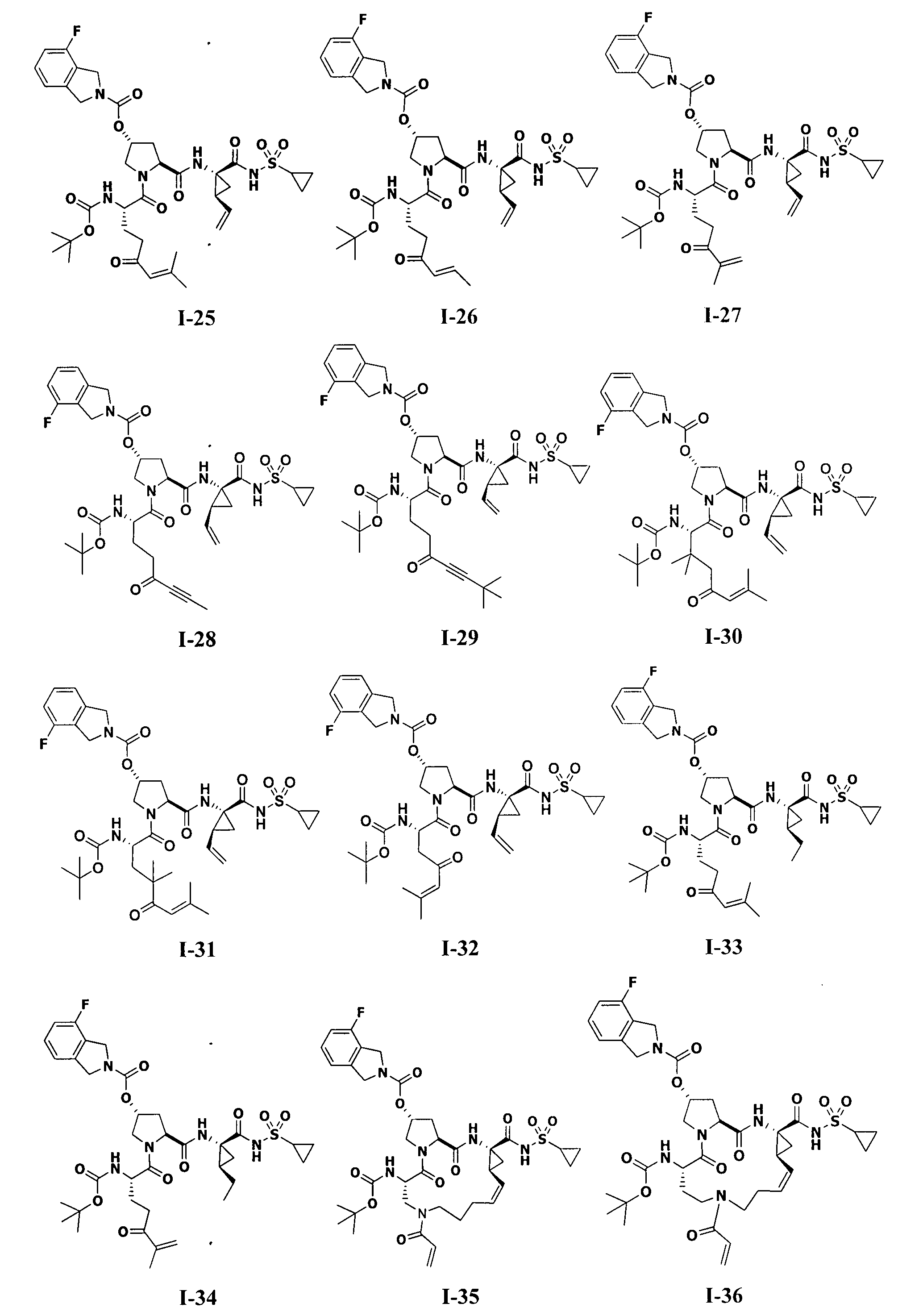




[00143] Согласно некоторым вариантам реализации настоящего изобретения предложено любое из приведенных выше в Таблице 3 соединений, или фармацевтически приемлемая соль указанного соединения.
[00144] Как было а общих чертах определено выше, R3 представляет собой головную группу. Без привязки к какой-либо конкретной теории, считают, что указанные группы R3, т.е. головные группы, особенно подходят для ковалентного связывания ключевого остатка цистеина в области связывания протеазы ВГС. Обыкновенному специалисту в данной области известно, что протеаза ВГС и ее мутанты содержат в составе области связывания остаток цистеина. В некоторых вариантах реализации соединения согласно настоящему изобретению содержат головную группу, благодаря свойствам которой указанные соединения могут быть нацелены на остаток цистеина С159 протеазы ВГС. В некоторых вариантах реализации соединения согласно настоящему изобретению содержат головную группу, благодаря свойствам которой указанные соединения нацелены на остаток цистеина С16 протеазы ВГС.
[00145] Таким образом, в некоторых вариантах реализации R3характеризуется тем, что группа -L-Y способна ковалентно связываться с остатком цистеина, и, таким образом, необратимо ингибировать указанный фермент. В некоторых вариантах реализации остатком цистеина является Cys159 протеазы ВГС, или ее мутантной формы, где нумерация остатков осуществляется согласно Uniprot (code Q91RS4).
[00146] Специалисту в данной области понятно, что для такого ковалентного связывания подходят различные головные группы, согласно определенному в настоящем описании. Такие группы R3 включают, но не ограничиваются группами, описанными в тексте настоящей заявки и приведенными выше в Таблице 3. Указанный процесс осуществляли путем проведения масс-спектрометрических экспериментов согласно протоколу, подробно описанному ниже, в Примерах 17-21.
[00147] Согласно другому аспекту настоящего изобретения предложен конъюгат, содержащий протеазу ВГС, или ее мутант, ковалентно связанную с группой-ингибитором в области Cys159. В некоторых вариантах реализации ингибитор ковалентно связывают при помощи линкерного участка.
[00148] Согласно некоторым вариантам реализации настоящего изобретения предложен конъюгат состава Cys159-линкер-ингибитор. Специалисту в данной области понятно, что "линкерная" группа (линкерный участок) соответствует головной группе -L-Y согласно описанному в настоящем тексте. Соответственно, в некоторых вариантах реализации описание линкерного участка соответствует приведенному выше описанию для группы -L-Y. Тем не менее, понятно, что линкерный участок является двухвалентным и, таким образом, соответствующая ему группа -L-Y также должна иметь валентность, равную двум, образовывающуюся в результате реакции головной группы с Cys16 протеазы ВГС или мутантной формы данного фермента.
[00149] В некоторых вариантах реализации группа ингибитора представляет собой соединение формулы А:
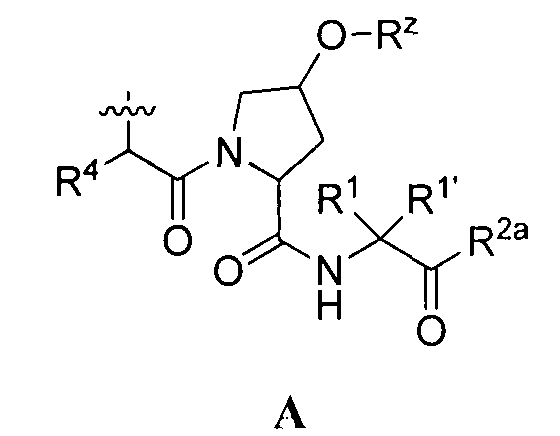
где каждая из групп R1, R1', R2a, R4, Rx и RZ формулы А соответствует определенному выше для формулы I и описанию классов и подклассов, приведенному в настоящем тексте. Таким образом, согласно некоторым вариантам реализации настоящего изобретения предложен конъюгат формулы:
где каждая из групп R1, R1', R2a, R4 и RZ в составе конъюгата соответствует приведенному выше описанию для формулы I, а также описанию классов и подклассов, приведенному в тексте настоящей заявки.
[00150] В некоторых вариантах реализации R3 характеризуется тем, что группа -L-Y способна ковалентно связываться с остатком цистеина и таким образом необратимо ингибировать фермент. В некоторых вариантах реализации остатком цистеина является Cys16 протеазы ВГС, или ее мутанта, где нумерация остатков осуществляется согласно Uniprot (code Q91RS4).
[00151] Согласно другому аспекту настоящего изобретения предложен конъюгат, содержащий протеазу ВГС или ее мутант, ковалентно связанную с ингибитором в области Cys16. В некоторых вариантах реализации ковалентное связывание ингибитора осуществляют при помощи линкерного участка.
[00152] Согласно некоторым вариантам реализации настоящего изобретения предложен конъюгат состава Cys16-линкер-ингибитор. Специалисту в данной области понятно, что "линкерный" участок соответствует головной группе -L-Y согласно описанному в настоящем тексте. Соответственно, в некоторых вариантах реализации описание линкерного участка соответствует приведенному выше описанию для группы -L-Y. Тем не менее, понятно, что линкерный участок является двухвалентным и, таким образом, соответствующая ему группа -L-Y также должна иметь валентность, равную двум, образовывающуюся в результате реакции головной группы с Cys16 протеазы ВГС или ее мутанта.
[00153] В некоторых вариантах реализации ингибитор имеет структуру формулы А-1:
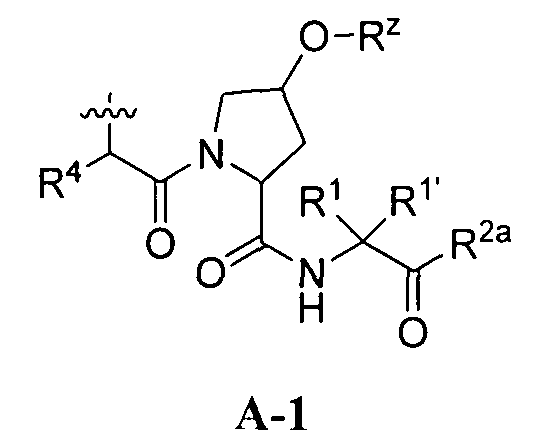
где каждая из групп R1, R1', R2a, R4 и RZ в составе конъюгата соответствует определенному выше для формулы I, а также описанию классов и подклассов, приведенному в тексте настоящей заявки. Соответственно, согласно настоящему изобретению предложен конъюгат формулы:
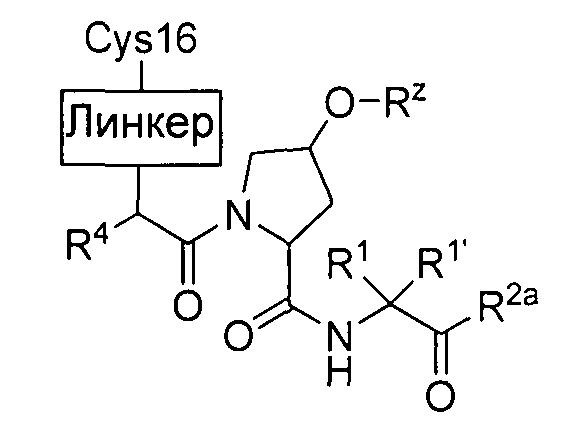
где каждая из групп R1, R1', R2a, R4 и RZ в составе конъюгата соответствует определенному выше для формулы I, а также описанию классов и подклассов, приведенному в тексте настоящей заявки.
Общие способы получения соединений согласно настоящему изобретению
[00154] Согласно некоторым вариантам реализации соединения согласно настоящему изобретению в общем случае получают в соответствии со Схемой 1, приведенной ниже:
Схема 1

[00155] Согласно одному аспекту настоящего изобретения предложены способы получения соединений формулы I в соответствии с этапами, указанными выше на Схеме 1, для которых определена и описана каждая переменная, и каждый PG является подходящей защитной группой. На этапе S-1 N-защищенное (например, Boc (трет-бутоксикарбонил)) производное пролина формулы А конденсируют с альфа-аминоэфиром формулы B в условиях сопряжения пептидов с получением дипептида формулы С. Соответствующие условия сопряжения пептидов хорошо известны в данной области и включают условия, подробно описанные в РСТ № WO2002094822 (US6825347), содержимое которой полностью включено в настоящее описание посредством ссылки. За исключением случаев, оговоренных особо, в тексте настоящей заявки указанные условия будут считаться соответствующими условиями сопряжения пептидов.
[00156] На этапе S-2 сложноэфирную группу подвергают гидролизу при помощи соответствующего основания и затем нейтрализуют с получением дипептида формулы D. Соответствующие основания включают, но не ограничиваются щелочными металлами, гидроксидами щелочноземельных металлов и их сочетаниями. В некоторых вариантах реализации основанием является гидроксид лития.
[00157] На этапе S-3 осуществляют сопряжение динептида формулы D с сульфонамидом формулы Е в соответствующих условиях сопряжения пептидов с получением ацилсульфонамида формулы F.
[00158] На этапе S-4 посредством отщепления защитной группы (например, удаления Boc) от дипептида формулы F получают амин формулы G. В некоторых вариантах реализации отщепления группы Вос достигают путем взаимодействия вещества формулы F с неорганической или органической кислотой в галогенированном углеводородном растворителе. В некоторых вариантах реализации в качестве кислоты применяют трифторуксусную кислоту, а растворителем является дихлорметан.
[00159] На этапе S-5 осуществляют сопряжение амина формулы G с карбоксильной кислотой формулы Н в соответствующих условиях сопряжения пептидов с получением промежуточного соединения формулы I-0.
[00160] Промежуточное соединение формулы I-0 преобразуют в соединения формулы I в ходе этапов, описанных в качестве примеров к настоящей заявке.
[00161] Как определено в общих чертах выше, группа PG формул А, С, D и F является соответствующей защитной аминогруппой. Соответствующие защитные аминогруппы хорошо известны в данной области и включают группы, подробно описанные в Protecting Groups in Organic Synthesis, Т. W. Greene and P. G. M. Wuts, 3rdedition, John Wiley & Sons, 1999, описание которой полностью включено в текст настоящей заявки посредством ссылки. Защищенные амины хорошо известны в данной области и включают группы, подробно описанные в Greene (1999). Далее, соответствующие монозащищенные амины включают, но не ограничиваются аралкиламинами, карбаматами, аллиламинами, амидами и им подобными. Примеры соответствующих монозащищенных аминогрупп включают следующие соединения: т-бутилоксикарбониламино-(-NHBOC), этилоксикарбониламино-, метилоксикарбониламино-, трихлорэтилоксикарбоксиламино-, аллилоксикарбониламино-(-NHAlloc), бензилоксикарбониламино- (-NHCBZ), аллиламино-, бензиламино- (-NHBn), фторэтилметилкарбонил- (-NHFmoc), формамидо-, ацетамидо-, хлорацетамидо, дихлорацетамидо-, трихлорацетамидо-, фенилацетамидо-, трифторацетамидо-, бензамидо-, т-бутилдифенилсилил и им подобные. Соответствующие дизащищенные амины включают амины, содержащие два заместителя, независимо выбранных из заместителей, описанных выше для монозащищенных аминов, и, далее, включают циклические имиды, такие как фталимид, малеинимид, сукцинимид и им подобные.
[00162] Согласно другим вариантам реализации соединения согласно настоящему изобретению получают в соответствии со Схемой 2, приведенной ниже.
Схема 2

[00163] Согласно одному аспекту настоящего изобретения предложены способы получения соединений согласно формуле I в соответствии с этапами, описанными выше на Схеме 1. На этапе S-6 производят удаление группы Boc из состава дипептида формулы С в условиях кислотного катализа с получением дипептидного эфира формулы J.
[00164] На этапе S-7 дипептидный эфир формулы J конденсируют с функционализированной аминокислотой формулы Н с применением соответствующих условий сопряжения пептидов с получение трипептида формулы K, который далее преобразуют (конвертируют) в трипептидный эфир формулы L в ходе этапов, описанных в примерах в тексте настоящей заявки.
[00165] На этапе S-8 сложноэфирную группу в составе соединения формулы L подвергают гидролизу с соответствующим основанием и затем нейтрализуют с получением трипептида формулы М. Соответствующие основания включают, но не ограничиваются щелочными металлами, гидроксидами щелочноземельных металлов, и их сочетаниями. В некоторых вариантах реализации основанием является гидроксид лития.
[00166] На этапе S-9 трипептид формулы М конденсируют с сульфонамидом формулы Е с применением соответствующих условий сопряжения пептидов с получением веществ формулы I.
[00167] Группа PG на формулах С, Н, и K представляет собой соответствующую аминозащитную группу согласно описанному выше.
4. Применение, лекарственные формы и способы введения согласно настоящему изобретению
Фармацевтически приемлемые композиции согласно настоящему изобретению
[00168] Согласно еще одному варианту реализации настоящего изобретения предложена композиция, содержащая в своем составе соединение согласно настоящему изобретению или фармацевтически приемлемое производное такого соединения, и фармацевтически приемлемый носитель, адъювант или растворитель. Количественное содержание указанного соединения в композициях согласно изобретению достаточно для эффективного измеряемого ингибирования протеазы ВГС или ее мутантной формы в биологическом образце или в организме пациента. В некоторых вариантах реализации количественное содержание указанного соединения в композициях согласно настоящему изобретению соответствует значительному ингибированию протеазы ВГС или ее мутанта в биологическом образце или в организме пациента. Согласно некоторым вариантам реализации настоящего изобретения указанную композицию получают в виде лекарственной формы, предназначенной для введения пациенту, нуждающемуся в такой композиции. В некоторых вариантах реализации композицию согласно настоящему изобретению оформляют в лекарственную форму, предназначенную для орального введения пациенту.
[00169] Термин "пациент", используемый в настоящем описании, относится к животному, предпочтительно - к млекопитающему, наиболее предпочтительно - к человеку.
[00170] Термин "фармацевтически приемлемый носитель, адъювант или растворитель" относится к не токсичному носителю, адъюванту или растворителю, не нарушающему фармакологическую активность вещества, содержащегося в составе лекарственной формы вместе с ним. Фармацевтически приемлемые носители, адъюванты или растворители, подходящие для применения в композициях согласно настоящему изобретению, включают, но не ограничиваются следующими примерами: иониты, окись алюминия, стерат алюминия, лецитин, белки сыворотки крови, такие как альбумин сыворотки человека, буферные вещества, такие как фосфаты, глицин, сорбиновая кислота, сорбат калия, смеси неполных глицеридов насыщенных растительных жирных кислот, вода, соли электролитов, такие как протаминсульфат, натрия дигидрофосфат, калия гидрофосфат, натрия хлорид, соли цинка, коллоидная окись кремния, магния трисиликат, поливинил пирролидон, вещества на основе целлюлозы, полиэтиленгликоль, натрий-карбоксиметилцеллюлоза, полиакрилаты, воски, полиэтилен-полиоксипропилен-блок-полимеры, полиэтиленгликоль и ланолин.
[00171] Термин "фармацевтически приемлемое производное" относится к любой нетоксичной соли, сложному эфиру, соли сложного эфира или другому производному соединения согласно настоящему изобретению, в результате введения пациенту способному образовать, прямо или опосредованно, соединение согласно настоящему изобретению, или обладающий ингибиторной активностью метаболит такого соединения, или его остаток.
[00172] Термин "обладающий ингибиторной активностью метаболит, или его остаток", используемый в настоящем описании, означает, что метаболит или остаток метаболита также является ингибитором протеазы ВГС или ее мутанта.
[00173] Введение композиций согласно настоящему изобретению можно осуществлять оральным, парентеральным путем, ингаляцией, местно, ректальным, назальным путем, буккально, вагинально или посредством имплантируемой емкости. Значение термина "парентерально", используемого в настоящем описании, включает методики внутривенных, подкожных, внутримышечных, внутрисуставных, интрасиновиальных, интрастенальных, интратекальных, внутрипеченочных, внутричерепных инъекций и инфузий и инъекций или иифузий в области пораженных тканей. Предпочтительно композиции согласно настоящему изобретению вводят оральным, внутрибрюшинным или внутривенным путем. Стерильные лекарственные формы композиций согласно настоящему изобретению могут находиться в виде водной или масляной суспензии. Такие суспензии можно оформлять в лекарственные формы в соответствии с методиками, известными в данной области, включающими применение соответствующих диспергирующих агентов или увлажняющих агентов и суспендирующих агентов. Стерильный препарат, предназначенный для инъекции, также может представлять собой стерильный раствор для введения или суспензию в нетоксичном, приемлемом для парентерального введения разбавителе или растворителе, например, в виде раствора 1,3-бутандиола. В качестве приемлемых носителей и растворителей, пригодных для применения, можно использовать воду, раствор Рингера, и изотонический раствор хлорида натрия. Также в качестве растворителя или суспендирующей среды можно применять стерильные жирные масла.
[00174] В указанных целях можно применять любое мягкое жирное масло, включая синтетические моно- или диглицериды. Жирные кислоты, такие как масляная кислота и ее глицеридные производные, полезны в изготовлении лекарственных форм, предназначенных для инъекций, так же как природное оливковое или касторовое масло, особенно в полиоксиэтилированных формах. Такие масляные растворы или суспензии также могут содержать растворитель или диспергирующее вещество на основе длинноцепочечного спирта, такие как карбоксиметилцеллюлоза, или сходные диспергирующие агенты, обычно применяемые при изготовлении фармацевтически приемлемой лекарственной формы, включая эмульсии и суспензии. Также при изготовлении лекарственной формы можно применять другие обычно используемые поверхностно-активные вещества, такие как Tweens, Spans и другие эмульгирующие агенты или вещества, повышающие биодоступность, которые обычно применяют в производстве фармацевтически приемлемых растворимых, жидких и других лекарственных форм.
[00175] Введение фармацевтически приемлемых композиций согласно настоящему изобретению можно осуществлять оральным путем в любой лекарственной форме, приемлемой для орального введения, включая, но не ограничиваясь капсулами, таблетками, водными суспензиями или растворами. При выборе таблеток для орального применения обычно используемые носители включают лактозу и кукурузный крахмал. Также обычно добавляют смазочные агенты, такие как стеарат магния. Полезные разбавители при оральном введении капсул включают лактозу и сухой кукурузный крахмал. В случае когда для орального применения требуются водные суспензии, активное вещество соединяют с эмульгирующими и суспендирующими агентами. По желанию, также возможно добавление определенных подслащивающих, вкусовых или окрашивающих агентов.
[00176] Также фармацевтически приемлемые композиции согласно настоящему изобретению можно применять в форме суппозиториев (медицинских свечей), предназначенных для ректального введения. Такую лекарственную форму можно изготовить путем смешивания агента с соответствующим не вызывающим раздражения наполнителем, находящимся в твердой форме при комнатной температуре и в жидкой форме при ректальной температуре и, таким образом, растворяющимся в прямой кишке с высвобождением препарата. Такие вещества включают какао-масло, пчелиный воск и полиэтиленгликоли.
[00177] Фармацевтически приемлемые композиции согласно настоящему изобретению также можно вводить местным образом, особенно в случаях, когда объект лечения включает области или органы, являющиеся легкодоступными при местном применении, включая заболевания глаз, кожи или нижних отделов пищеварительного тракта. Для каждой из указанных областей или органов существуют легкие в изготовлении лекарственные формы для местного применения.
[00178] Местное введение в нижние отделы пищеварительного тракта можно осуществлять в форме ректальных суппозиториев (см. выше) или в соответствующей лекарственной форме для введения при помощи клизмы. Также можно использовать трансдермальные пластыри местного применения.
[00179] В случае местного применения фармацевтически приемлемые композиции согласно настоящему изобретению можно изготавливать в форме соответствующих мазей, содержащих активное вещество, суспендированное или растворенное в одном или более носителей. Носители, применимые при местном введении веществ согласно изобретению включают, но не ограничиваются следующими примерами: минеральное масло, вазелиновое масло, белый (медицинский) вазелин, пропиленгликоль, полиоксиэтилен, полиоксипропилен, эмульгирующий воск и вода. Также фармацевтически приемлемые композиции согласно настоящему изобретению можно изготавливать в форме соответствующих лосьонов или кремов, содержащих активные вещества, суспендированные или растворенные в одном или более носителей. Соответствующие носители включают, но не ограничиваются следующими примерами: минеральное масло, сорбитан моностерат, полисорбат 60, цетиловые эфиры восков, цетеариловый спирт, 2-октилдодеканол, бензиловый спирт и вода.
[00180] Для офтальмологического применения, фармацевтически приемлемые композиции согласно настоящему изобретению можно изготавливать в форме тонкодисперсных суспензий в изотонических растворах, стерильных солевых растворах с отрегулированным показателем рН или, предпочтительно, в изотонических растворах, стерильных солевых растворах с отрегулированным значением рН, как с консервантом, например с бензалконий хлоридом, так и без него. Также фармацевтически приемлемые композиции согласно настоящему изобретению, предназначенные для офтальмологического применения, можно изготавливать в форме мазей, таких как вазелин.
[00181] Фармацевтически приемлемые композиции согласно настоящему изобретению также можно вводить в форме назального аэрозоля или ингаляции. Указанные композиции изготавливают в соответствии с методиками, хорошо известными в области лекарственных форм в фармацевтике, путем разведения в солевом растворе, с применением бензилового спирта или других соответствующих консервантов, веществ, способствующих абсорбции, для повышения биодоступности, фторуглеродов и/или других соответствующих агентов, повышающих растворимость, и диспергирующих агентов.
[00182] В наиболее предпочтительном варианте реализации фармацевтически приемлемые композиции согласно настоящему изобретению изготавливают в лекарственной форме, предназначенной для орального введения. Такие лекарственные формы можно вводить как одновременно с приемом пищи, так и вне зависимости от этого. В некоторых вариантах реализации фармацевтически приемлемые композиции согласно настоящему изобретению вводят не одновременно с приемом пищи. В других вариантах реализации фармацевтически приемлемые композиции согласно настоящему изобретению вводят одновременно с приемом пищи.
[00183] Количество соединения согласно настоящему изобретению, которое можно соединять с веществами-носителями с получением композиции для одноразовой дозировки, варьирует в зависимости от пациента, подвергаемого лечению, определенного режима введения. Предпочтительно композиции согласно настоящему изобретению следует изготавливать таким образом, чтобы пациент получал дозу ингибитора, составляющую 0.01-100 мг/кг массы тела.
[00184] Также следует понимать, что определенная дозировка и режим лечения для каждого конкретного пациента зависят от множества факторов, включая активность конкретного применяемого соединения, возраста пациента, массы тела, общего состояния, здоровья, пола, диеты, которой придерживается пациент, времени введения, степени развития заболевания, подвергаемого лечению. Также количественное содержание соединения согласно настоящему изобретению в составе композиции будет варьировать для каждого конкретного соединения.
Способы применения соединений и фармацевтически приемлемых композиций согласно настоящему изобретению
[00185] Соединения и композиции, описанные в тексте настоящей заявки, обычно являются полезными для ингибирования активности протеазы ВГС и/или ее мутанта. Таким образом, соединения согласно настоящему изобретению являются полезными для лечения гепатитов, отличных от гепатитов А и В, включая гепатит С.
[00186] ВГС является крайне вариабельным вирусом, образующим полиморфные группы вариантов в организме хозяина. К настоящему времени идентифицировано шесть различных генотипов по всему миру (Simmonds et al., Hepatology, Vol.42, №4, 2005). Впоследствии эти генотипы классифицировали на более близкородственные, генетически выраженные подтипы. Участки последовательности, используемые при сравнении, известные как консенсусные последовательности, приведены ниже, в Таблице 3а. Генотипы и подтипы ВГС имеют различные показатели распространения в разных частях мира, и в некоторых областях преобладают определенные генотипы. Генотипы 1-3 широко распространены по всему миру. Подтип 1а преобладает в Северной и Южной Америке, Европе и Австралии. Подтип 1b распространен в Северной Америке и Европе и также встречается в некоторых областях Азии. Генотип 2 представлен в наиболее развитых странах, но он менее распространен, чем генотип 1 (http://www.hcvadvocate.org/hepatitis/factsheets_pdf/genotype_FS.pdf). Другие генотипы преобладают в популяциях бывших жителей США и поэтому представляют собой важные мишени.
[00187] Примечателен тот факт, что цистеин в 159 аминокислотном положении в генотипе 1b является консервативным для всех генотипов и подтипов NS3 ВГС, секвенированных к настоящему времени, хотя в других генотипах и подтипах в этом положении может находиться другая аминокислота. Направленное присоединение ингибиторов по этому остатку цистеина дает возможность для развития соединений, обладающих эффективностью в отношении множества генотипов ВГС.
[00188] Как описано в тексте заявки, согласно настоящему изобретению предложены необратимые ингибиторы протеазы одного или более генотипов ВГС и их вариантов. Такие соединения, содержащие головную группу, обозначенную как R3, включают соединения формул I, I-a, I-b, I-c-1, I-c-2, I-c-3, I-c-4, I-c-5, I-c-6, I-d, I-е, I-f, I-g, I-h, II-a, II-b, III-a, III-b, IV-a, IV-b, IV-c, IV-d, V-a, V-b, V-c, V-d, VI-a, VI-b, VII-a, VII-b, VIII-a, и VIII-b, согласно описанному в настоящем тексте. В некоторых вариантах реализации R отличается тем, что группа -L-Y способна ковалентно связываться с остатком цистеина и, таким образом, необратимо ингибировать фермент. Без привязки к какой-либо конкретной теории, считается, что такие группы R3, т.е. головные группы, особенно подходят для ковалентного связывания с ключевым остатком цистеина в области связывания протеазы одного или более генотипов ВГС или его вариантов. В некоторых вариантах реализации один или более генотипов, протеаза которых подвергается ингибированию при взаимодействии с соединениями согласно изобретению, включают 1a, 1b, 2а, и 3а. В некоторых вариантах реализации один или более указанных вариантов включают А156Т, A156S, D168V, D168A и R155K.
[00189] Обычному специалисту в данной области будет понятно, что протеаза различных генотипов ВГС и его вариантов содержит один или более остатков цистеина рядом с областью связывания. Без привязки к какой-либо конкретной теории, считается, что соседство головной группы с остатком цистеина согласно настоящему изобретению усиливает ковалентную модификацию этого цистеина при помощи головной группы. В некоторых вариантах реализации остатком цистеина согласно настоящему изобретению является Cys159 протеазы ВГС подтипа 1b или его варианта, нумерация остатков осуществлена в соответствии с Uniprot (code Q91RS4). Остатки цистеина протеазы других генотипов и подтипов ВГС, которые возможно подвергнуть ковалентной модификации при помощи необратимых ингибиторов согласно настоящему изобретению, включают остатки, приведенные ниже в Таблице 3а, где выделенное жирным шрифтом и подчеркнутое "" относится к остатку цистеина, являющемуся консервативным в положении, эквивалентном Cys159 протеазы ВГС подтипа 1b.
[00190] Устойчивость к лекарственным препаратам становится серьезной проблемой для направленной терапии. Например, сообщают о развитии устойчивости к ингибиторам протеазы ВГС, находившимся в стадии разработки. Указанные соединения включают BILN 2061 и VX-950, разработанные Boehringer Ingelheim and Vertex Pharmaceuticals соответственно. Химическая структура BILN 2061 и VX-950 приведена ниже.

[00191] Известно, что недавняя статья, опубликованная Vertex Pharmaceuticals, озаглавленная "In Vitro Resistance Studies of Hepatitis С Virus Serine Protease," обращена непосредственно к проблеме устойчивости мутантов, наблюдаемой у VX-950 и BILN 2061. См. Lin et al., The Journal of Biological Chemistry, Vol.279, №17, Issue of April 23, p.17508-17514, 2004. В этой статье приводится заключение о том, что "будущая терапия, направленная на лечение гепатита С, включающая применение низкомолекулярных ингибиторов ферментов ВГС, может потребовать сочетания нескольких лекарственных препаратов, как в случае со способами лечения ВГС, применяемыми в настоящее время". (См. страницу 17513, последний параграф.)
[00192] Устойчивость к специфическим противовирусным препаратам является основным фактором, ограничивающим эффективность многих способов терапии, направленной против ретровирусов или РНК-содержащих вирусов. Способствующая ошибкам природа таких вирусов допускает возникновение мутаций, повышающих устойчивость к препаратам, доступным в настоящее время, и препаратам, проходящим клинические испытания. Проблема возникновения устойчивости является основным препятствием, встречаемым при разработке новых ингибиторов, специфичных к ВГС, предназначенных для лечения пациентов с ВГС.
[00193] Недавнее in vitro исследование устойчивости с использованием двух ингибиторов протеазы ВГС NS3-4A, VX-950 и BILN 2061 обнаружило, что мутации, отобранные при действии как первого, так и второго ингибитора вели к значительному снижению чувствительности к самому ингибитору. Тем не менее, первичные устойчивые мутанты к BILN 2061 обладали полной чувствительностью к VX-950, и вирусы, несущие главную мутацию устойчивости к VX-950, оставались чувствительны к BILN 2061 (Lin et al., Jour. Biol. Chem. 279(17): 17508-14, 2004).
[00194] Неожиданно было обнаружено, что соединения согласно настоящему изобретению ингибируют протеазу, по меньшей мере, пяти мутантов ВГС, включая А156Т, A156S, D168V, и D168A, и R155K. Этот факт контрастирует со свойствами других ингибиторов протеазы ВГС (например, VX-950 и BILN 2061), каждый из которых ингибирует протеазу только двух мутантов. Фактически ни один из лекарственных препаратов, известных из уровня техники, не показал эффективного ингибирования протеазы всех известных мутантов ВГС. Примером могут служить данные для BILN 2061 и VX-950, приведенные ниже в Таблицах 4а и 4b, опубликованные Lin et al., а также в другой литературе по ВГС, и данные для соединения 1-3, полученные в соответствии со способами, описанными ниже в Примерах. Без привязки к какой-либо конкретной теории, считается, что соединения согласно настоящему изобретению могут служить эффективными ингибиторами протеазы ВГС устойчивых к лекарственным препаратам форм. В то время как Таблица 4b демонстрирует активность вещества 1-3 против трех референтных вариантов ВГС (А156Т, A156S, D168V, и D168A), следующие примеры описывают другие соединения согласно настоящему изобретению, обладающие активностью, направленной против указанных вариантов, а также против пятого варианта ВГС (R155K).
[00195] Без привязки к какой-либо конкретной теории, считают, что соединение формулы I является более эффективным для ингибирования протеазы ВГС или ее мутанта, в сравнении с соответствующим соединением формулы I, в составе которого группа R3 формулы I не является головной группой, а представляет собой, например, неразветвленный алкил (например, алкил, не содержащий заместителей), разветвленный алкил, циклоалкил или алкенил. Например, соединение формулы I может являться более эффективным для ингибирования протеазы ВГС или ее мутанта, в сравнении с соответствующим соединением формулы I, в составе которого группа R3 формулы I не является головной группой, а представляет собой метил, этил, пропил, бутил (например, т-бутил), неразветвленный или разветвленный алкенил, не содержащий заместителей (например, C1-8 алкенил), циклогексил или циклопентил.
[00196] Соединение формулы I, как было описано выше, может обладать большей активностью, на основе значений IC50, против протеазы ВГС или ее мутантной формы, например А156Т, A156S, D168V, D168A, или других мутантов, таких как описанные в тексте настоящей заявки, чем соответствующее соединение формулы I, в составе которого группа R3 формулы I не является головной группой, а представляет собой метил, этил, пропил, бутил (например, т-бутил), неразветвленный или разветвленный алкенил, не содержащий заместителей (например, алкенил C1-8), циклогексил или циклопентил. Указанную сравнительную активность соединения формулы I относительно соответствующего соединения формулы I, в составе которого группа R3 формулы I не является головной группой, можно определить при помощи стандартных зависимых от времени способов анализа, например, способов, описанных ниже в Примерах. В некоторых вариантах реализации соединение формулы I является значительно более активным, чем соответствующее соединение формулы I, в составе которого группа R3 формулы I не является головной группой, а представляет собой метил, этил, пропил, бутил (например, т-бутил), неразветвленный или разветвленный алкенил, не содержащий заместителей (например, C1-8 алкенил), циклогексил или циклопентил. В некоторых вариантах реализации соединение формулы I является значительно более активным, когда активность соединения измеряют через приблизительно 1 минуту, приблизительно 2 минуты, приблизительно 5 минут, приблизительно 10 минут, приблизительно 20 минут, приблизительно 30 минут, приблизительно 1 час, приблизительно 2 часа, приблизительно 3 часа, приблизительно 4 часа, приблизительно 8 часов, приблизительно 12 часов, приблизительно 16 часов, приблизительно 24 часа или приблизительно 48 часов, относительно соответствующего соединения формулы I, в составе которого группа R3 формулы I не является головной группой, а представляет собой метил, этил, пропил, бутил (например, т-бутил), неразветвленный или разветвленный алкенил, не содержащий заместителей (например, C1-8 алкенил), циклогексил или циклопентил. В некоторых вариантах реализации соединение формулы I может обладать в приблизительно 1.5 раза, приблизительно 2 раза, приблизительно 5 раз, приблизительно 10 раз, приблизительно 20 раз, приблизительно 25 раз, приблизительно 50 раз, приблизительно 100 раз или даже в приблизительно 1000 раз большей активностью, чем соответствующее соединение формулы I, в составе которого группа R3 формулы I не является головной группой, а представляет собой метил, этил, пропил, бутил (например, t-бутил), неразветвленный или разветвленный алкенил, не содержащий заместителей (например, C1-8 алкенил), циклогексил или циклопентил.
[00197] Термин "клиническая устойчивость к лекарственным препаратам", используемый в настоящем описании, относится к потере чувствительности мишенью лекарственного препарата к лечению указанным препаратом вследствие мутации мишени препарата.
[00198] Термин «устойчивость», используемый в настоящем описании, относится к изменениям в последовательности нуклеиновой кислоты дикого типа, которая кодирует целевой белок, когда указанные изменения уменьшают или устраняют ингибирующее действие указанного ингибитора на указанный целевой белок.
[00199] Примеры протеаз, подвергаемых ингибированию соединениями и композициями согласно настоящему изобретению и для ингибирования активности которых полезны способы, описанные в тексте настоящей заявки, включают NS3, NS3·4A или их мутанты.
[00200] Активность соединения, применяемого согласно настоящему изобретению в качестве ингибитора протеаз NS3, NS3·4A или их мутантов, можно исследовать in vitro, in vivo или при помощи линии клеток. Способы анализа in vitro включают анализы, в ходе которых определяют ингибирование активности сериновой протеазы, и/или последующие функциональные следствия, или активность АТФазы активированных NS3, NS3·4A или их мутантов. Другие способы анализа in vitro заключаются в измерении способности ингибитора связываться с NS3 или NS3·4A. Связывание ингибитора можно измерять при помощи внесения радиоактивной метки в состав ингибитора перед связыванием, выделения комплекса ингибитор/NS3 или ингибитор/NS3·4A и определения количества связанной радиоактивной метки. Также связывание ингибитора можно определить при помощи конкурентного анализа, в ходе которого новые ингибиторы инкубируют с NS3 или NS3·4A, связанными с известными лигандами с радиоактивной меткой. Подробное описание условий для исследования соединения, применяемого согласно настоящему изобретению в качестве ингибитора NS3 или NS3'4A или их мутантов, приведено ниже в Примерах.
[00201] Сериновые протеазы составляют большое семейство протеолитических ферментов, расщепляющих пептидные связи в составе белков. Семейство сериновых протеаз включает пищеварительные ферменты химотрипсин, трипсин, и эластазу, и протеазы, играющие роль в свертывании крови. Сериновые протеазы обладают свойством "каталитической тирады", включающей серии, аспарагиновую кислоту и гистидин, которые совместным действием активируют серии с образованием ковалентной связи с субстратом фермента, проводя, таким образом, гидролиз пептидной связи. В дополнение к указанному выше, сериновые протеазы принимают участие во многих функциях, включая иммунитет и воспалительные процессы.
[00202] Термины "лечение", "подвергать лечению" и "лечить", используемые в настоящем описании, относятся к обращению течения болезни, облегчению симптоматики, задержке начала или препятствованию развитию болезни или нарушения или одного или более симптомов согласно описанному в тексте настоящей заявки. В некоторых вариантах реализации лечение можно назначить после развития одного или более симптомов. В других вариантах реализации лечение можно назначить в отсутствие симптомов. Например, реципиенту можно назначить лечение до появления симптомов (например, в свете истории болезни и/или в свете генетических или других предрасполагающих факторов). Также лечение можно продолжать после устранения симптомов, например, в целях предотвращения или отсрочки рецидива.
[00203] Соединения и композиции в соответствии со способами согласно настоящему изобретению можно вводить в любой дозировке и с применением любого режима введения, являющихся эффективными для лечения или ослабления тяжести рака, аутоиммунного заболевания, нейродегенеративного или нейрологического заболевания, шизофрении, заболеваний костей, печени или заболевания сердца. Точные дозировки, требуемые для лечения конкретного пациента, будут варьировать в зависимости от биологического вида, возраста и общего состояния здоровья пациента, тяжести инфекции, конкретного соединения, режима его введения, и других факторов. Соединения согласно настоящему изобретению предпочтительно изготавливают в форме единицы дозирования, характеризующейся легкостью при введении и универсальностью дозировки. Выражение "форма единицы дозирования", используемое в настоящем описании, относится к отдельной, в физическом плане, единице соединения, соответствующей курсу лечения пациента. Тем не менее, следует понимать, что общий дневной объем вводимых соединений и композиций согласно настоящему изобретению должен определяться в ходе посещения терапевта, в рамках здравого смысла, с медицинской точки зрения. Специфичный для каждого конкретного пациента или организма уровень дозировки зависит от множества факторов, включая заболевание, подвергаемое лечению, и его степень тяжести; активность конкретного применяемого соединения; возраст, массу тела, общее состояние здоровья, пол и диету, которой придерживается пациент; время введения, режим введения, степень выведения конкретного применяемого соединения; длительность лечения; лекарственные препараты, применяемые в сочетании с соединением согласно настоящему изобретению или употребление которых совпадает с конкретным применяемым соединением, и другие факторы, хорошо известные в медицинских областях. Термин "пациент", используемый в настоящем описании, относится к животному, предпочтительно млекопитающему и наиболее предпочтительно - к человеку.
[00204] Введение фармацевтически приемлемых композиций согласно настоящему изобретению можно осуществлять в организм человека и других животных оральным, ректальным, парентеральным, интрацистернальным, внутривагинальным, внутрибрюшинным путем, местно (например, в форме порошков, мазей или капель), буккально, например в форме орального или назального спрея, и другими путями, в зависимости от тяжести инфекции, подвергаемой лечению. В некоторых вариантах реализации соединения согласно настоящему изобретению можно вводить оральным или парентеральным путем в дозах, составляющих приблизительно от 0.01 мг/кг до приблизительно 50 мг/кг и предпочтительно от приблизительно 1 мг/кг до приблизительно 25 мг/кг массы тела пациента в день, один или более раз в день, для достижения желаемого терапевтического эффекта.
[00205] В некоторых вариантах реализации композицию согласно настоящему изобретению вводят нуждающемуся в этом пациенту один раз в день ежедневно. Без привязки к какой-либо конкретной теории, полагают, что увеличенная продолжительность действия необратимого ингибитора протеазы ВГС NS3 является особым преимуществом при введении пациенту, нуждающемуся в нем, по одному разу в день, ежедневно, для лечения заболевания, ассоциированного с протеазой ВГС. В некоторых вариантах реализации композицию согласно настоящему изобретению вводят пациенту, нуждающемуся в ней, по меньшей мере один раз в день, ежедневно. В других вариантах реализации композицию согласно настоящему изобретению вводят пациенту, нуждающемуся в ней, два, три или четыре раза в день, ежедневно.
[00206] Соединения формулы I, например, обычно обеспечивают увеличенную продолжительность действия при введении пациенту, по сравнению с соответствующим соединением формулы I, в составе которого вместо головной группы содержится такая группа, как неразветвленный алкил (например, не содержащий заместителей алкил), разветвленный алкил, циклоалкил или алкенил. Например, соединение формулы I может обеспечить увеличенную продолжительность действия при введении пациенту, в сравнении с соответствующим соединением формулы I, в составе которого группа R3 формулы I вместо головной группы представляет собой такую группу, как метил, этил, пропил, бутил (например, т-бутил), не содержащий заместителей неразветвленный или разветвленный алкенил (например, C1-8 алкенил), циклогексил или циклопентил.
[00207] Жидкие лекарственные формы, предназначенные для орального введения, включают, но не ограничиваются, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к действующим соединениям жидкие лекарственные формы могут содержать инертные разбавители, обычно используемые в данной области, такие как, например, вода или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этиловый эфир угольной кислоты, этил ацетат, бензиловый спирт, бензил бензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, хлопковое, арахисовое, кукурузное, масло проростков пшеницы, оливковое, касторовое и кунжутное масла), глицерол, тетрафторфурфуриловый спирт, полиэтиленгликоли и сложные эфиры сорбитана и жирных кислот и их смеси. Помимо инертных разбавителей, композиции, предназначенные для орального введения, также могут содержать адъюванты, такие как увлажняющие агенты, эмульгирующие и суспендирующие агенты, подслащивающие, вкусовые и ароматические агенты.
[00208] Лекарственные формы, предназначенные для введения путем инъекции, например стерильные суспензии на водной или масляной основе, предназначенные для инъекций, можно изготавливать согласно способам, известным в данной области, при применении соответствующих диспергирующих, или увлажняющих, или суспендирующих агентов. Стерильная лекарственная форма, предназначенная для инъекции, также может представлять собой раствор для инъекции, суспензию или эмульсию в нетоксичном парентерально приемлемом разбавителе или растворителе, например раствор в 1,3-бутандиоле. Среди приемлемых носителей и растворителей можно перечислить следующие примеры: вода, раствор Рингера, U.S.Р. и изотонический раствор натрия хлорида. Также в качестве растворителя или суспендирующей среды успешно применяют жирные масла. Для этой цели можно применять любое жирное масло мягкой консистенции, включая синтетические моно- или диглицериды. Также при изготовлении лекарственных форм, предназначенных для инъекции, применяют жирные кислоты, такие как масляная кислота.
[00209] Стерилизацию лекарственных форм, предназначенных для инъекций, можно проводить, например, при помощи фильтрации через задерживающий бактерии фильтр или путем заключения стерилизующих агентов в форму стерильных твердых композиций, которые возможно растворить или диспергировать перед применением в стерильной воде или в других стерильных средах, пригодных для инъекций.
[00210] В целях продления действия соединения согласно настоящему изобретению, часто желаемым является замедление всасывания соединения при введении подкожной или внутримышечной инъекции. Этого можно достичь путем применения соединения в форме жидкой кристаллической суспензии или в аморфной форме, обладающего низкой растворимостью в воде. Далее, степень всасывания соединения зависит от скорости растворения соединения, которая, в свою очередь, может находиться в зависимости от размера кристаллов и их формы. Также, как вариант замедленного всасывания соединения, при введении парентеральным путем, можно достичь путем растворения или суспендирования соединения в масляном носителе. Лекарственные формы соединений замедленного всасывания, предназначенные для инъекции, получают путем изготовления микроинкапсулированных форм соединения в биодеградируемых полимерах, таких как полилактид-полигликолид. В зависимости от соотношения соединения и полимера и природы конкретного применяемого полимера можно контролировать уровень высвобождения соединения. Примеры других биодеградируемых полимеров включают поли-ортоэфиры и поли-ангидриды. Лекарственные формы соединений замедленного всасывания, предназначенные для инъекции, также изготавливают путем помещения действующего соединения в липосомы или микроэмульсии, совместимые с тканями тела.
[00211] Композиции, предназначенные для ректального или вагиналыюго введения, предпочтительно представляют собой суппозитории, которые можно изготавливать путем смешивания соединений согласно настоящему изобретению с соответствующими не вызывающими раздражения наполнителями или носителями, такими как какао-масло, полиэтиленгликоль или воск для суппозиториев, находящимися в твердом состоянии при комнатной температуре, и переходящими в жидкое состоянии при температуре тела и, таким образом, растворяющимися в прямой кишке или вагинальном пространстве с высвобождением действующего соединения.
[00212] Твердые лекарственные формы, предназначенные для орального введения, включают капсулы, таблетки, пилюли, порошки и гранулы. В составе указанных твердых лекарственных форм действующее соединение смешивают по меньшей мере с одним инертным, фармацевтически приемлемым наполнителем или носителем, таким как цитрат натрия или дикальций фосфат, и/или: а) с наполнителями, такими как крахмал, лактоза, сахароза, маннитол и кремниевая кислота, b) со связующими соединениями, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидинон, сахароза и камедь, с) с гигроскопическими соединениями, такими как глицерол, d) с агентами, предназначенными для улучшения распадаемости, такими как агар-агар, карбонат кальция, картофельный или крахмал из кассавы, альгиновая кислота, отдельные силикаты и карбонат натрия, е) с агентами, замедляющими растворение, такими как парафин, f) с ускорителями всасывания, например с четвертичными аммонийными соединениями, g) с увлажняющими агентами, такими как, например, цетиловый спирт и глицеролмоностеарат, h) с абсорбентами, например с каолином и бентонитовой глиной, и i) с лубрикантами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия, и смесями указанных соединений. В случае капсул, таблеток и пилюль лекарственная форма также может содержать буферные агенты.
[00213] Подобные твердые композиции также можно применять в качестве наполнения в мягких и твердых желатиновых капсулах, с использованием таких наполнителей, как лактоза или молочный сахар, или высокомолекулярные гликоли и подобные им соединения. Твердые лекарственные формы, такие как таблетки, драже, капсулы, пилюли и гранулы, можно изготавливать с покрытиями и оболочками, такими как энтеросолюбильные покрытия и другие покрытия, хорошо известные в области фармацевтическоой продукции. Указанные композиции могут включать контрастные вещества, и их можно изготавливать таким образом, чтобы действующее соединение (соединения) высвобождались исключительно или предпочтительно в определенной части пищеварительного тракта, чтобы высвобождение могло иметь замедленный характер. Примеры композиций согласно настоящему изобретению, подходящих для применения, включают полимерные вещества и воски. Подобные композиции в твердой форме также возможно применять в качестве фильтров в мягких и твердых желатиновых капсулах, с использованием таких наполнителей, как лактоза или молочный сахар, или высокомолекулярных гликолей и подобных им соединений.
[00214] Действующие соединения также могут находиться в микроинкапсулированной форме, с одним или более наполнителем согласно описанному выше. Твердые лекарственные формы, такие как таблетки, драже, капсулы, пилюли и гранулы, возможно изготавливать с покрытиями и оболочками, такими как энтеросолюбильные покрытия, покрытия с контролируемым высвобождением, и другими покрытиями, хорошо известными в области фармацевтических препаратов. В указанных твердых лекарственных формах действующее соединение можно смешивать по меньшей мере с одним инертным растворителем, таким как сахароза, лактоза или крахмал. Указанные лекарственные формы также могут содержать, в соответствии с обычной практикой, другие дополнительные соединения, помимо инертных растворителей, например лубриканты и другие вспомогательные соединения, применяемые при изготовлении таблеток, например, стеарат магния и микрокристаллическая целлюлоза. В случае капсул, таблеток и пилюль лекарственные формы могут также содержать буферные агенты. Указанные лекарственные формы могут включать контрастные вещества, и их можно изготавливать таким образом, чтобы действующее соединение (соединения) высвобождались исключительно или предпочтительно в определенной части пищеварительного тракта, чтобы высвобождение могло иметь замедленный характер. Примеры композиций согласно настоящему изобретению, подходящих для применения, включают полимерные вещества и воски.
[00215] Лекарственные формы соединений согласно настоящему изобретению, предназначенные для местного или чрескожного введения, включают мази, пасты, кремы, лосьоны, гели, присыпки, растворы, спреи, ингаляторы или пластыри. Действующее соединение смешивают с фармацевтически приемлемым носителем и любыми консервантами или буферами, если это требуется. Лекарственные формы для офтальмологического применения, ушные капли и глазные капли также охватываются объемом настоящего изобретения. Также согласно настоящему изобретению, предложено применение чрескожных пластырей, имеющих дополнительное преимущество, состоящее в контролируемом высвобождении соединения в организме. Указанные лекарственные формы можно изготавливать путем растворения или диспергирования соединения в соответствующей среде. Также для повышения поступления соединения через кожу можно применять усилители абсорбции. Ее уровень можно контролировать как путем использования мембраны, предназначенной для этой цели, так и путем диспергирования соединения в полимерном матриксе или геле.
[00216] Согласно одному варианту реализации настоящее изобретение относится к способу ингибирования сериновой протеазы в биологическом образце, включающему этап приведения в контакт биологического образца и соединения согласно настоящему изобретению, или композиции, содержащей указанное соединение.
[00217] Согласно другому варианту реализации настоящее изобретение относится к способу ингибирования активности протеазы ВГС или ее мутанта, в биологическом образце, включающему этап приведения в контакт указанного биологического образца и соединения согласно настоящему изобретению, или композиции, содержащей указанное соединение. В отдельных вариантах реализации изобретение относится к способу необратимого ингибирования активности протеазы ВГС или ее мутанта, в биологическом образце, включающему этап приведения в контакт указанного биологического образца и соединения согласно настоящему изобретению, или композиции, содержащей указанное соединение.
[00218] Значение термина "биологический образец", используемого в настоящем описании, включает, без ограничений, культуры клеток или их экстракты; материал биопсии, полученный от млекопитающих, или его экстракты; а также образцы крови, слюны, мочи, кала, спермы, слезной жидкости или других жидкостей организма или их экстракты.
[00219] Ингибирование активности протеазы ВГС или ее мутантной формы, в биологическом образце, является полезным для многих целей, известных специалистам в данной области. Примеры указанных целей включают, но не ограничиваются переливанием крови, трансплантацией органов, хранением биологических образцов и биологическими анализами.
[00220] В другом варианте реализации настоящее изобретение относится к способу ингибирования активности протеазы ВГС или ее мутанта в организме пациента, включающему этап введения указанному пациенту соединения согласно настоящему изобретению, или композиции, содержащей указанное соединение.
[00221] Согласно другому варианту реализации настоящее изобретение относится к способу ингибирования активности протеазы ВГС или ее мутанта в организме пациента, включающему этап введения указанному пациенту соединения согласно настоящему изобретению или композиции, содержащей указанное соединение. Согласно отдельным вариантам реализации настоящее изобретение относится к способу необратимого ингибирования активности протеазы ВГС или ее мутанта в организме пациента, включающему этап введения указанному пациенту соединения согласно настоящему изобретению или композиции, содержащей указанное соединение. Согласно другим вариантам реализации настоящего изобретения предложен способ лечения заболевания, опосредованного протеазой ВГС или ее мутантом, у пациента, нуждающегося в таком лечении, включающий этап введения указанному пациенту соединения согласно настоящему изобретению или фармацевтически эффективной композиции, содержащей указанное соединение. Указанные заболевания подробно описаны в тексте настоящей заявки.
[00222] В зависимости от конкретного состояния или заболевания, которое подвергают лечению, в сочетании с соединениями или композициями согласно настоящему изобретению можно вводить дополнительные терапевтические агенты, обычно используемые для лечения указанного состояния. В настоящем описании дополнительные терапевтические агенты, обычно используемые для лечения определенного заболевания или состояния, определены как "агенты, подходящие для лечения заболевания или состояния".
[00223] В отдельных вариантах реализации соединение или композицию согласно настоящему изобретению вводят в сочетании с другим ингибитором протеазы ВГС или ее варианта. В некоторых вариантах реализации соединение или композицию согласно настоящему изобретению вводят в сочетании с другим противовирусным агентом. Такие противовирусные агенты включают, но не ограничиваются следующими примерами: иммуномодулирующие агенты, такие как α-, β- и γ-интерфероны, пэгилированные производные интерферона-α и тимозин; другие противовирусные агенты, такие как рибавирин, амантадин и телбивудин; другие ингибиторы протеаз гепатита С (ингибиторы NS2-NS3 и ингибиторы NS3-NS4A, например, BILN 2061 и VX-950); ингибиторы других мишеней в течение жизненного цикла ВГС, включая ингибиторы геликазы и полимеразы; ингибиторы внутренней посадки рибосом; ингибиторы вирусной активности широкого спектра, такие как ингибиторы IMPDH (например, микофеноловая кислота и ее производные); или комбинациями любых из перечисленных соединений.
[00224] В отдельных вариантах реализации можно осуществлять введение комбинации из 2-х или более противовирусных агентов. В отдельных вариантах реализации можно осуществлять введение комбинации из 3-х или более противовирусных агентов. В некоторых вариантах реализации противовирусные агенты выбраны из рибавирина и интерферона. В других вариантах реализации противовирусным агентом является α-интерферон.
[00225] Другие примеры агентов, с которыми можно комбинировать ингибиторы согласно настоящему изобретению, включают, без ограничения: терапевтические агенты, применяемые при лечении болезни Альцгеймера, такие как Aricept® и Excelon®; терапевтические агенты, применяемые при лечении ВИЧ, такие как ритонавир; терапевтические агенты, применяемые при лечении болезни Паркинсона, такие как L-DOPA/карбидопа, энтакапон, ропинрол, прамипексол, бромокриптин, перголид, тригекснфенидил и амантадин; терапевтические агенты, применяемые при лечении множественного склероза (МС), такие как бета-интерферон (например, Avonex® и Rebif®), Copaxone®, и митоксантон; терапевтические агенты, применяемые при лечении астмы, такие как альбутерол и Singulair®; агенты, применяемые при лечении шизофрении, такие как зипрекса, риспердал, сероквель и галоперидол; противовоспалительные агенты, такие как кортикостероиды, блокаторы ФНО (TNF), IL-1 RA, азатиоприн, циклофосфамид и сульфасалазин; иммуномодуляторные и иммуносупрессорные агенты, такие как циклоспорин, такролимус, рапамицин, микофенолат мофетил, интерфероны, кортикостероиды, циклофофамид, азатиоприн и сульфозалин; нейротрофные факторы, такие как ингибиторы ацетилхолинэстеразы, ингибиторы МАО, интерфероны, противосудорожные препараты, блокаторы ионных каналов, рилузол, и агенты, применяемые для лечения болезни Паркинсона; агенты, применяемые для лечения кардиоваскулярных заболеваний, такие как бета-блокаторы, ингибиторы ЭКН (АСЕ), диуретики, нитраты, блокаторы кальциевых каналов и статины; агенты, применяемые для лечения заболеваний печени, такие как кортикостероиды, холестирамин, интерфероны, и противовирусные агенты; агенты, применяемые для лечения заболеваний крови, такие как кортикостероиды, агенты, применяемые для лечения лейкемии, и факторы роста; агенты, которые продлевают или улучшают фармакокинетику, такие как ингибиторы цитохрома Р450 (например, ингибиторы метаболического расщепления) и ингибиторы CYP3A4 (например, кетокеназол и ритонавир), и агенты, применяемые для лечения заболеваний, вызывающих иммунодефицит, такие как гамма-глобин.
[00226] В отдельных вариантах реализации соединения или композиции согласно настоящему изобретению вводят в сочетании с моноклональным антителом или терапевтическим средством, включающим миРНК.
[00227] Указанные дополнительные агенты можно вводить отдельно от композиции, содержащей соединение согласно настоящему изобретению, как часть составного режима дозировки. Также в качестве альтернативного варианта, указанные агенты можно сделать составной частью единой лекарственной формы, в виде смеси с соединением согласно настоящему изобретению в одной композиции. При осуществлении введения в виде части составного режима дозировки два действующих соединения можно применять одновременно, последовательно или с перерывом, равным обычно пять часов между приемами соединений.
[00228] Термин "комбинация", "в комбинации" и подобные термины, используемые в настоящем описании, относятся к одновременному или последовательному введению терапевтических агентов согласно настоящему изобретению. Например, соединение согласно настоящему изобретению можно вводить одновременно с другим терапевтическим агентом или последовательно, в отдельных стандартных лекарственных формах или в единой стандартной лекарственной форме. Соответственно, согласно настоящему изобретению предложена единая стандартная лекарственная форма, содержащая соединение согласно формуле I, дополнительный терапевтический агент и фармацевтически приемлемый носитель, адъювант или переносчик.
[00229] Количество обоих соединений, соединения согласно настоящему изобретению и дополнительного терапевтического агента (в композициях, содержащих дополнительный терапевтический агент согласно описанному выше), которое возможно соединить с материалами-носителями с получением единой лекарственной формы, будет варьировать в зависимости от определенного режима введения. Предпочтительно композиции согласно настоящему изобретению следует изготавливать в дозировке, составляющей 0.01-100 мг/кг массы тела/день соединения согласно настоящему изобретению.
[00230] В композициях, содержащих дополнительный терапевтический агент, указанный дополнительный терапевтический агент и соединения согласно настоящему изобретению могут действовать совместно. Таким образом, количественное содержание дополнительного терапевтического агента в указанных композициях будет меньше, чем требуется при монотерапии с применением только одного терапевтического агента. В составе указанных композиций можно вводить дозировку дополнительного терапевтического агента, находящуюся в промежутке 0.01-100 мг/кг массы тела/день.
[00231] Количество дополнительного терапевтического агента в составе композиций согласно настоящему изобретению будет большим, чем количество, вводимое обычно в составе композиции, содержащей указанный терапевтический агент в качестве единственного действующего соединения. Предпочтительно количественное содержание дополнительного терапевтического агента в композициях, описанных в тексте настоящей заявки, будет варьировать от приблизительно 50% до 100% от количества, содержащегося обычно в композиции, содержащей указанный терапевтический агент в качестве единственного действующего соединения.
Примеры соединений согласно изобретению
[00232] Согласно описанному в приведенных ниже Примерах в отдельных иллюстративных вариантах реализации соединения согласно настоящему изобретению получают в соответствии со следующими общими способами. Следует понимать, что, хотя общий способ описывает получение отдельных соединений согласно настоящему изобретению, приведенные ниже общие способы, а также другие способы, известные специалистам в данной области, можно применять с получением всех соединений и подклассов и видов каждого из указанных соединений согласно описанному в тексте настоящей заявки.
[00233] Нумерация соединений, использованная ниже в Примерах, соответствует нумерации соединений, использованной выше в Таблице 3.
Пример 1

[00234] Указанное соединение получали в соответствии с этапами и промежуточными соединениями, описание которых приведено ниже.
Этап 1a: Промежуточное соединение 1a

[00235] К раствору толуолсульфоновой кислоты этилового эфира (1R,2S)-1-амино-2-винилциклопропан карбоновой кислоты (0.33 г, 1.0 мМоль) и (2S,4R)-1-(трет-бутоксикарбонил)-4-(4-фторизоиндолин-2-карбонилокси)пирролидин-2-карбоновой кислоты (0.4 г, 1.0 мМоль) в 10 мл ацетонитрила добавляли HATU (0.44 г, 1.2 мМоль) а затем DIEA (0.46 мл, 2.5 мМоль) при перемешивании. Смесь подвергали перемешиванию при r.t. (комнатной температуре) в течение двух часов. После полного израсходования исходных соединений, реакционную смесь выпаривали. Осадок растворяли в 30 мл этилацетата и дважды отмывали водой и солевым раствором, после чего высушивали над Na2SO4. После удаления растворителя проводили хроматографию неочищенного продукта с силикагелем (гексан:EtOAc=1:1). Получали 0.35 г указанного соединения: MS m/z: 532.0 (М+Н+).
Этап 1b: Промежуточное соединение 1b

[00236] К раствору продукта, полученного на этапе 1а (0.35 г 0.66 мМоль), в 5 мл THF/МеОН (1:1) добавляли 1N водный раствор LiOH (2 мл, 2.0 мМоль). После перемешивания в течение 10 часов при r.t. реакционную смесь нейтрализовали при помощи 1.0 NHCl. Органические растворители выпаривали под вакуумом и оставшуюся водную фазу закисляли до значения рН~3 при помощи 1.0 NHCl и экстрагировали при помощи EtOAc. Органический слой отмывали солевым раствором и высушивали над безводным сульфатом магния. После удаления растворителя получали 0.3 г указанного соединения: MSm/z: 526.2 (M+H+).
Этап 1с: Промежуточное соединение 1с

[00237] К раствору продукта, полученного на этапе 1b (0.30 г, 0.6 мМоль), в 10 мл ДХМ добавляли CDI (диалкилкарбодиимид) (0.16 г, 1.0 мМоль) и образованный раствор перемешивали при 40°С в течение 1 часа. К реакционной смеси добавляли циклопропилсульфонамид (0.18 г, 1.5 мМоль) и DBU (0.16 г, 1.0 мМоль). Смесь подвергали перемешиванию при 40°С в течение еще 10 часов. После этого удаляли растворитель и осадок разводили при помощи EtOAc и отмывали водным буфером NaOAc (рН~5, 2×10 мл), раствором NaHCO3 и солевым раствором. После высушивания над Na2SO4 и удаления растворителя осадок подвергали хроматографии с силикагелем с применением гексан/EtOAc (1:1~1:2). Общее количество полученного соединения составляло 0.30 г: Rf 0.1 (EtOAc:гексан=1:1), MS m/z: 605.0 (M-1).
Этап 1d: Промежуточное соединение 1d

[00238] Продукт, полученный на этапе 1с (0.25 г, 0.41 мМоль), растворяли в 4 NHCl в диоксане. Смесь подвергали перемешиванию при r.t. в течение 1 часа. После удаления растворителей в смесь вливали 10 мл ДХМ, после чего выпаривали ее досуха. Процедуру добавления ДХМ с последующим выпариванием повторяли четыре раза с получением твердого осадка, который непосредственно использовали на следующем этапе: MSm/z: 507.0 (M+H+).
Этап 1е: Промежуточное соединение 1е

[00239] К раствору продукта, полученного на этапе 1d (0.16 г, 0.28 мМоль), и N-Вос-3-(Fmoc)амино-L-аланина (0.15 г, 0.35 мМоль) в 5.0 мл ДМФ добавляли HATU (125 мг, 0.33 мМоль) и DIEA (130 мг, 1.0 мМоль) при r.t. при перемешивании. Через час, анализ методом TLC (тонкослойной хроматографии) показал завершение реакции. К смеси приливали EtOAc в объеме 20 мл, после чего смесь отмывали при помощи буфера (рН~4, AcONa/AcOH), NaHCO3 и солевого раствора и высушивали над MgSO4. После удаления растворителя продукт в виде неочищенного масла подвергали хроматографии с силикагелем (элюенты: EtOAc/гексан). В результате получали 0.14 г указанного соединения.
Этап 1f: Промежуточное соединение 1f

[00240] Раствор 0,10 г продукта, полученного на этапе 1е, в 1 мл ДМФ с 12% пиперидином перемешивали в течение 1.5 часов при r.t., после чего выпаривали досуха под высоким вакуумом. Осадок обрабатывали смесью гексан/эфир (4:1) с выходом указанного соединения, равным 70 мг.
Этап 1g:
Соединение (I-1)
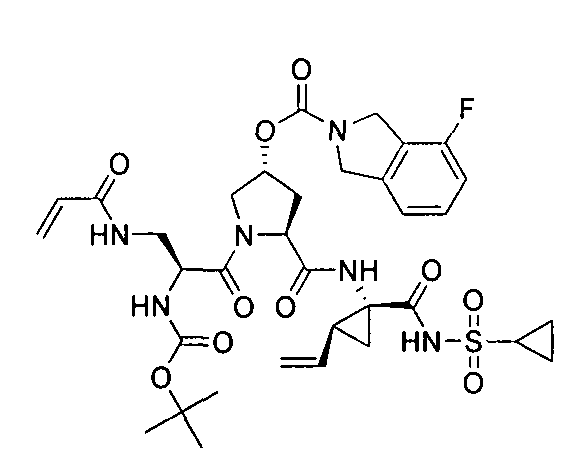
(00241] (3R,5S)-1-((S)-3-акриламидо-2-(трет-бутоксикарбониламидо)пропаноил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат: К раствору 55 мг (0.08 мМоль) продукта, полученного на этапе 1f, в 3 мл ДХМ, содержащем 3 экв. триэтиламина, капельным методом добавляли акрилоил хлорид (10 мкл, 0.12 мМоль) при 0°С при перемешивании. Реакционную смесь подвергали перемешиванию при r.t. в течение 1.5 часов, после чего разводили в 10 мл ДХМ. Образованный раствор дважды отмывали солевым раствором и высушивали над сульфатом магния. После удаления растворителя получали неочищенный продукт, который подвергали хроматографии с силикагелем, и предварительной элюцией при помощи смеси гексан/EtOAc (1:3 ~ 1:5) и последующей - при помощи ДХМ-метанола (50:1 ~ 25:1)). Общее количество полученного соединения, указанного в заголовке, составляло 27 мг: Rf 0.4 (ЕА:МеОН=10:1); MS m/z: 746.9 (M+H+).
[00242] При использовании аналогичным способом Промежуточного соединения 1f получали следующие соединения:

[00243] (3R,5S)-1-((S)-2-(трет-бутоксикарбониламино)-3-(винилсульфонамидо)пропаноил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат Rf: 0.50 (EtOAc/MeOH 10:1); MS m/z: 805.3 (M+H+).

[00244] (3R,5S)-1-((2S)-2-(трет-бутоксикарбониламино)-3-(2-хлор-2-фенилацетамидо)пропаноил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат: Rf: 0.50 (ДХМ/МеОН 95:5); MS m/z: 845.2 (M+H+).

[00245] (3R,5S)-1-((S)-2-(трет-бутоксикарбониламиио)-3-((Е)-4-(диметиламино)бут-2-енамидо)пропаноил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат: Rf: 0.35 (DCM/MeOH 9:1); MS m/z: 804.3 (M+H+).
[00246] Аналогичным способом, при использовании Промежуточного соединения 1d и (S)-4-(Fmoc-амино)-2-(трет-бутоксикарбониламино)бутановой кислоты получали следующее соединение:

[00247] (3R,5S)-1-((S)-4-акриламидо-2-(трет-бутоксикарбониламино)бутаноил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат: Rf: 0.40 (EtOAc/MeOH 10:1); MS m/z: 761.3 (M+H+).
Пример 2
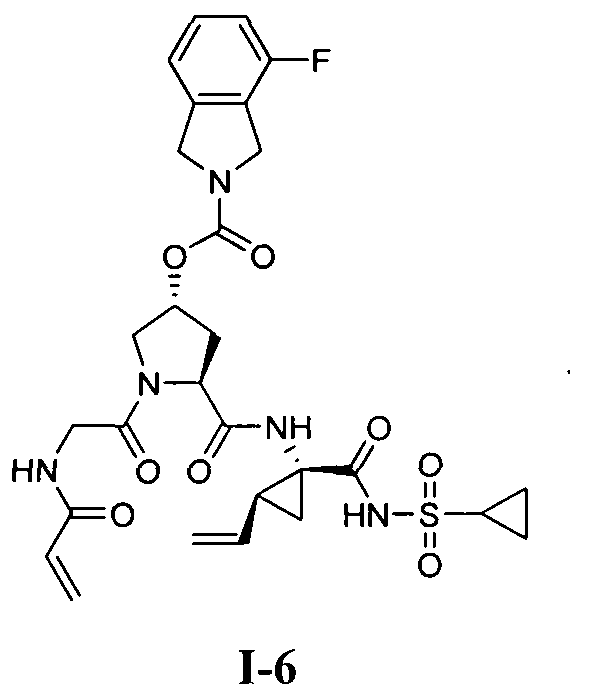
[00248] Указанное соединение получали в соответствии с описанием этапов и промежуточных соединений, приведенным ниже.
Этап 2а: Промежуточное соединение 2а

[00249] К раствору продукта, полученного на этапе 1d, из Примера 1 (0.12 г, 0.22 мМоль) и N-Boc-глицина (0.054 г, 0.31 мМоль) в 4.0 мл ацетонитрила добавляли HATU (133 мг, 0.35 мМоль) и DIEA (0.12 мл, 0.66 мМоль) при r.t. при перемешивании. Реакционную смесь подвергали перемешиванию в течение 2 часов. Анализы методами LC-MS и TLC показали окончание реакции сопряжения. К смеси приливали 10 мл EtOAc и производили отмывку смеси при помощи буфера (рН~4, AcONa/AcOH), NaHCO3 и солевого раствора и высушивание над Na2SO4. После удаления растворителя проводили хроматографию неочищенного продукта с силикагелем (элюенты: EtOAc/гексан). В результате получали 0.10 г соединения, указанного в заголовке: Rf 0.2 (EtOAc); MSm/z: 664.0 (M+H+).
Этап 2b: Промежуточное соединение 2b
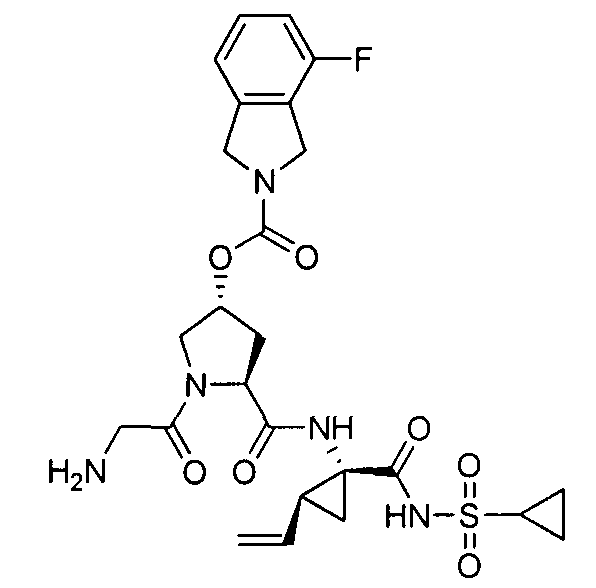
[00250] Продукт, полученный на этапе 2а (0.10 г 0.15 мМоль), растворяли в 2 мл 4 NHCl в диоксане и реакционную смесь перемешивали в течение 1 часа при RT. После удаления растворителей к смеси приливали ДХМ в объеме 3 мл, после чего выпаривали смесь досуха. Процедуру добавления ДХМ с последующим выпариванием повторяли три раза с образованием соединения, указанного в заголовке - Промежуточного соединения 2b в виде его HCl соли (0.10 г). MS m/z: 564.0 (M+H+).
Этап 2с:

[00251] (3R,5S)-1-(2-акриламидоацетил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат: Указанное соединение получали путем сопряжения Промежуточного соединения 2b и акриловой кислоты с применением HATU в соответствии с описанием реакций сопряжения, приведенным для Промежуточного соединения 2а. Получали 50 мг соединения, указанного в заголовке: Rf 0.1 (EtOAc); MSm/z: 617.9 (M+H+).
[00252] Аналогично, в соответствии с описанием способа, приведенным в Примере 2, получали следующие соединения:

[00253] (3R,5S)-1-(2-(Е)-бут-2-енамидоацетил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)пирролидин-3-ил-4-фторизоиндолин-2-карбоксилат: MS m/z: 632.0 (М+Н+).
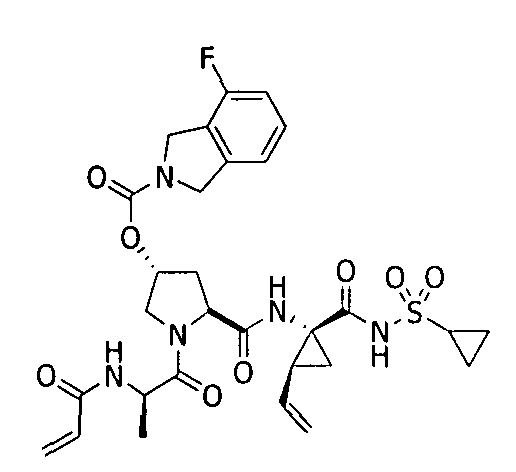
I-8
[00254] (3R,5S)-1-((R)-2-акриламидопропаноил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)пирролидин-3-ил-4-фторизоиндолин-2-карбоксилат: MS m/z: 632.1 (M+H+).
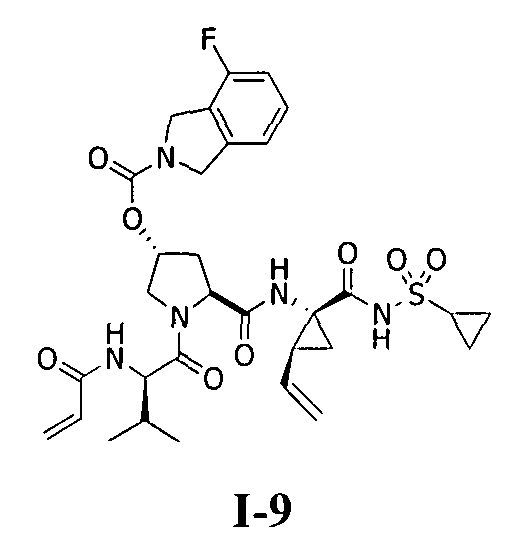
[00255] (3R,5S)-1-((R)-2-акриламидо-3-метилбутаноил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)пирролидин-3-ил-4-фторизоиндолин-2-карбоксилат: MS m/z: 660.2 (M+H+).

[00256] (3R,5S)-1-(2-(2-ацетоксибензамидо)ацетил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)пирролидин-3-ил-4-фторизоиндолин-2-карбоксилат: MS m/z: 724.0 (М+H+).

[00257] (5S)-1-((R)-2-(2-хлорпиримидин-4-иламино)пропаноил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2- винилциклопропилкарбамоил)пирролидин-3-ил-4-фторизоиндолин-2-карбоксилат: Rf: 0.35 (ДХМ/МеОН 95:5), MS m/z: 690.3 (M+H+).
[00258] Аналогично, в соответствии с описанием способа, приведенным в Примере 2, получали следующие соединения:

[00259] (5S)-1-(2-ацетамидо-2-(1-акрилоилазетидин-3-ил)ацетил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)пирролидин-3-ил-4-фторизоиндолин-2-карбоксилат: MS m/z: 715.2 (М+Н+).
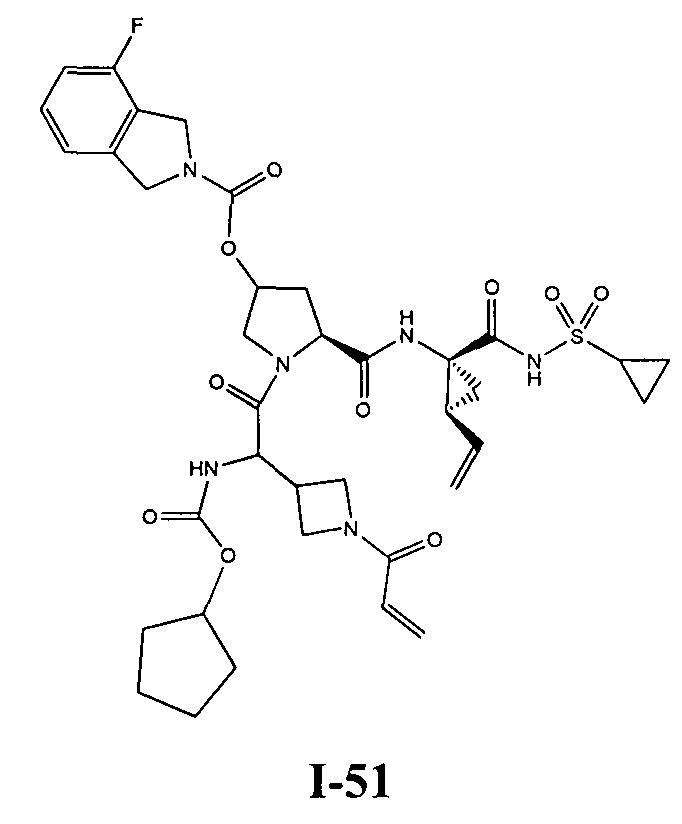
[00260] (5S)-1-(2-(1-акрилоилазетидин-3-ил)-2-(циклопентилоксикарбониламино)ацетил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)пирролидин-3-ил-4-фторизоиндолин-2-карбоксилат: MS m/z: 785.2 (M+H+).
Пример 3

[00261] Указанное соединение получали в соответствии с описанием этапов и промежуточных соединений, приведенным ниже.
Этап 3а: Промежуточное соединение 3а

[00262] К раствору (S)-3-амино-2-(трет-бутоксикарбониламино)пропановой кислоты (2.04 г, 10 мМоль), TEA (4.5 мл, 30 мМоль) в 50 мл CH2Cl2 добавляли нитробензолсульфонилхлорид (2.9 г, 13.0 мМоль) при RT. Смесь подвергали перемешиванию в течение 10 часов при RT. Растворитель удаляли под вакуумом, после чего добавляли 100 мл EtOAc. Органический слой отмывали при помощи 1 NHCl (до значения рН 3), воды и солевого раствора. После чего органический слой высушивали над Na2SO4, фильтровали и удаляли растворитель с образованием неочищенного продукта - Промежуточного соединения 3а (4.0 g).
Этап 3b: Промежуточное соединение 3b

[00263] Неочищенное Промежуточное соединение 3а (2.0 г), K2CO3 (1.5, 4 экв.) растворяли в 10 мл ДМФ. MeI (0.8 мл, 4 экв.) добавляли к реакционной смеси при RT. Образованную смесь подвергали перемешиванию в течение 20 часов. Основную часть ДМФ удаляли под вакуумом и добавляли 100 мл EtOAc, после чего отмывали смесь водой и солевым раствором. Органический слой высушивали над Na2SO4. После удаления растворителя неочищенный продукт пропускали через короткую колонку с силикагелем (элюенты: EtOAc/гексан) с получением 1.62 г Промежуточного соединения 3b. MS m/z: 439.9 (M+Na+).
Этап 3с: Промежуточное соединение 3с

[00264] К раствору Промежуточного соединения 3b (1.6 г, 3.8 мМоль) в 10 мл THF/MeOH (1:1) добавляли водный раствор 1 NLiOH (5.8 мл, 5.8 мМоль). После завершения перемешивания при r.t. в течение 10 часов реакционную смесь нейтрализовали при помощи 1.0 NHCl. Органический растворитель выпаривали под вакуумом и оставшуюся водную фазу ацидилировали до значения рН~3 при помощи 1.0 NHCl и экстрагировали при помощи EtOAc. Органический слой отмывали солевым раствором и высушивали над безводным сульфатом натрия. После удаления растворителя получали 1.5 г Промежуточного соединения 3с. MSm/z: 402.0 (M-1, светлый рисунок индикации).
Этап 3d: Промежуточное соединение 3d

[00265] К раствору Промежуточного соединения 1d (0.12 г, 0.20 мМоль) и Промежуточного соединения 3с (0.12 г, 0.3 мМоль) к 5.0 мл безводного ацетонитрила добавляли HATU (0.11 г, 0.3 мМоль) и DIEA (0.14 мл, 0.9 мМоль) при r.t. при перемешивании. Анализ методами TLC и LC-MS показал окончание реакции сопряжения по прошествии часа. К реакционной смеси приливали EtOAc в объеме 20 мл, и производили отмывку при помощи буфера (рН~4, AcONa/AcOH), NaHCO3 и солевого раствора. Органический слой высушивали над Na2SO4. После удаления растворителя, проводили хроматографию неочищенного продукта с силикагелем (элюенты: EtOAc/гексан). Общее количество полученного Промежуточного соединения 3d составляло 0.10 г: Rf 0.1 (EtOAc); MSm/z: 891.8 (M+H+).
Этап 3е: Промежуточное соединение 3е

[00266] К раствору Промежуточного соединения 3d (0.10 г, 0.11 мМоль) в 3 мл ДМФ добавляли фенилтиол (30 мг, 0.26 мМоль) и K2CO3 (40 мг, 0.3 мМоль). Образованную смесь подвергали перемешиванию в течение 20 часов при RT. Добавляли 30 мл EtOAc и производили отмывку реакционной смеси при помощи солевого раствора и воды. Органический слой высушивали над Na2SO4. После удаления растворителя проводили хроматографию неочищенного продукта с силикагелем (элюенты: EtOAc/гексан) с получением 0.1 г неочищенного продукта - Промежуточного соединения 3е. MS m/z: 706.9 (М+Н+).
Этап 3f: Соединение I-11

[00267] (3R,5S)-1-((S)-2-(трет-бутоксикарбониламино)-3-(N-метилакриламидо)пропаноил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат(I-11)акрилоил хлорид (9 мкл, 0.11 мМоль) добавляли капельным методом при 0°С к раствору 0.1 г (0.1 мМоль) продукта, полученного на этапе 3е, в 3 мл ДХМ, содержащего 0.04 мл (0.3 мМоль) триэтиламина, при перемешивании. Реакционную смесь подвергали перемешиванию при r.t. в течение 1.5 часов, после чего разводили при помощи 10 мл ДХМ. Образованный раствор отмывали дважды солевым раствором и высушивали над сульфатом магния. После удаления растворителя получали неочищенный продукт, который подвергали очистке методом хроматографии с силикагелем с предшествующей элюцией при помощи смеси гексан/EtOAc (1:3 ~ 1:5) и затем - при помощи EtOAc. Общее количество полученного соединения составляло 20 мг:
[00268] Rf 0.15 (EtOAc); MS m/z: 760.9 (M+H+).1HNMR (CD3ОD, 400 MHz) δ 7.32 (m, 1H), 7.13-6.98 (m, 2H), 6.75 (m, 1H), 6.23 (dd, 1H, J=2.3, 16.5 Гц), 5.73 (m, 2H), 5.45-5.29 (m, 2H), 5.12 (dd, 1H, J=1.4, 10.0 Гц), 4.72 (s, 4H), 4.45 (m, 1H), 4.25-4.09 (m, 1H), 3.91 (m, 1H), 3.75-3.50 (m, 1H), 3.15 (s, 3Н), 2.96 (m, 1H), 2.42 (m, 1H), 2.25 (m, 2H), 1.87 (m, 1H), 1.45-0.85 (m, 14H).
[00269] Аналогичным способом, при использовании Промежуточного соединения 3е, 2-хлорэтансульфонилхлорида и триэтиламина получали следующее соединение:
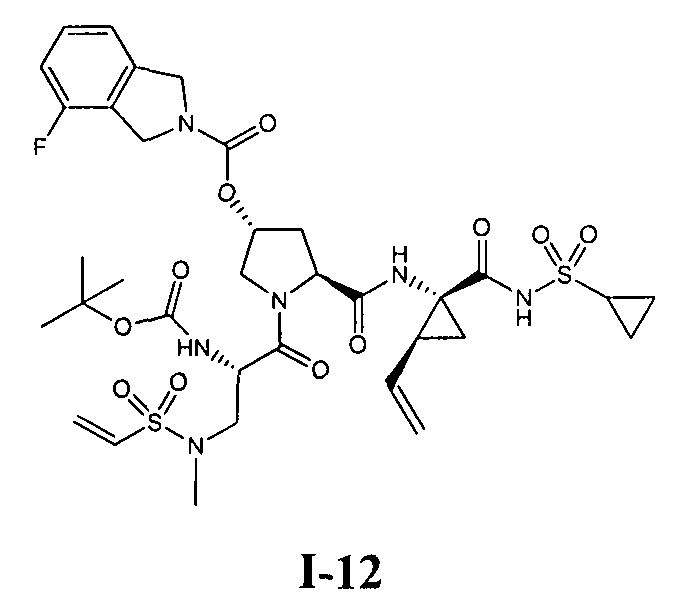
[00270] (3R,5S)-1-((S)-2-(трет-бутоксикарбониламино)-3-(N-метилвинилсульфонамидо)пропаноил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат: Rf: 0.55 (DCM/MeOH 95:5); MS m/z: 797.3 (M+H+).
[00271] Аналогичным способом, при использовании (S)-4-(Fmoc-амино)-2-(трет-бутоксикарбониламино)бутановой кислоты на этапе 3а вместо (S)-3-амино-2-(трет-бутоксикарбониламино)пропановой кислоты получали следующее соединение:

[00272] (3R,5S)-1-((S)-2-(трет-бутоксикарбониламино)-4-(N-метилакриламидо)бутаноил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат: Rf: 0.45 (DCM/MeOH 95:5); MS m/z: 775.3 (M+H+).
[00273] Аналогично, в соответствии с описанием способов, приведенным в Примере 3, можно получать соединение I-14 с применением этил иодида на этапе 3b вместо метил иодида:

(3R,5S)-1-((S)-2-(трет-бутоксикарбониламино)-3-(N-этилакриламидо)пропаноил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат
[00274] Соединение I-15 получали в соответствии с описанием способов, приведенным в Примере 3, с применением аллил бромида на этапе 3b вместо метил иодида.

[00275] (3R,5S)-1-((S)-3-(N-аллилакриламидо)-2-(трет-бутоксикарбониламино)пропаноил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)пирролидии-3-ил 4-фторизоиндолин-2-карбоксилат: Rf: 0.58 (ДХМ/МеОН 95:5); MS m/z: 787.3 (M+H+).
[00276] Соединения, приведенные ниже, можно получать путем использования в качестве исходного соединения этилового эфира (1R,2S)-1-амино-2-этилциклопропанкарбоновой кислоты на этапе 1а, путем следования соответствующим способам, описанным в Примере 3:
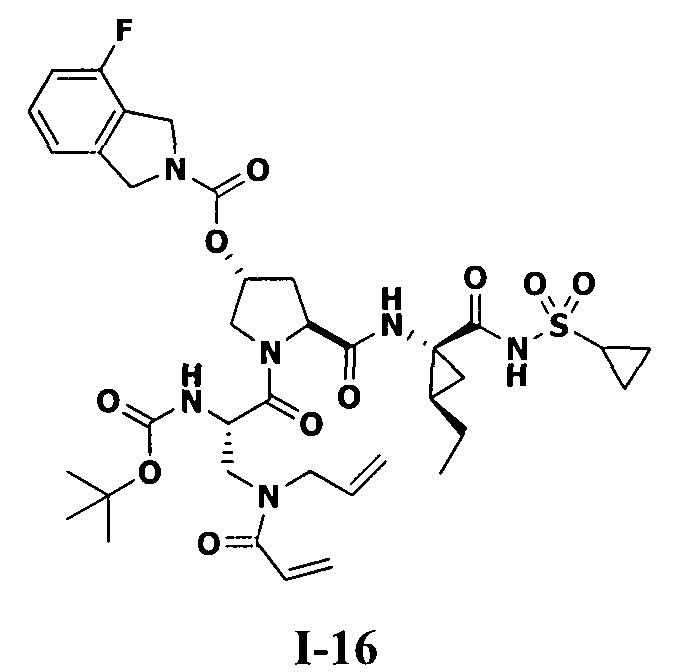
(3R,5S)-1-((S)-3-(N-аллилакриламидо)-2-(трет-бутоксикарбониламино)пропаноил)-5-((1R,2R)-1-(циклопропилсульфонилкарбамоил)-2-этилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат

(3R,5S)-1-((S)-2-(трет-бутоксикарбониламино)-3-(N-метилакриламидо)пропаноил)-5-((1R,2R)-1-(циклопропилсульфонилкарбамоил)-2-этилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат
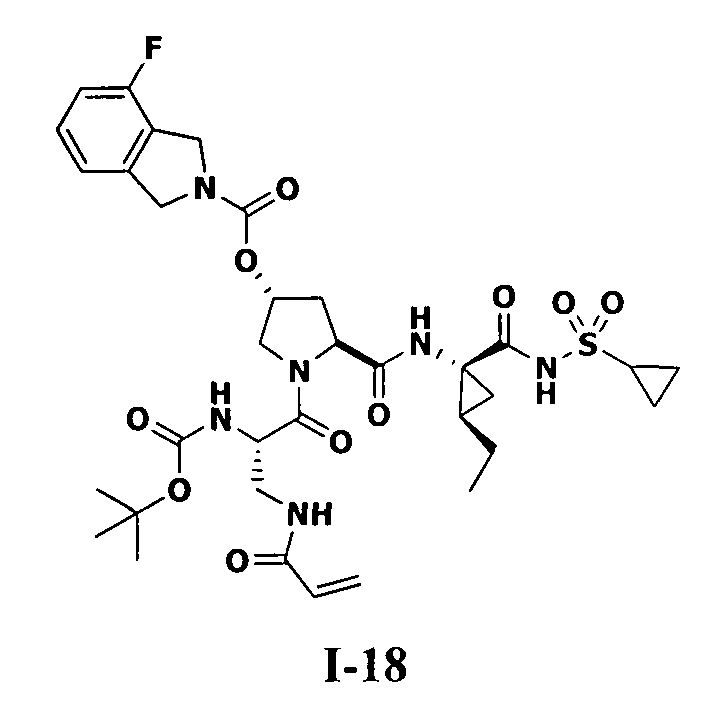
(3R,5S)-1-((S)-3-акриламидо-2-(трет-бутоксикарбониламино)пропаноил)-5-((1R,2R)-1-(циклопропилсульфонилкарбамоил)-2-этилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиидолии-2-карбоксилат
[00277] Аналогичным способом получали следующее соединение:

[00278] (5S)-1-(2-(трет-бутоксикарбониламиио)-3-((Е)-4-(диметиламино)-N-метилбут-2-енамидо)пропаноил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат:
[00279] Rf: 0.45 (ДХМ/МеОН 95:5); MS m/z: 818.5 (M+H+).
Пример 4

[00280] Соединение, указанное в заголовке, получали в соответствии с описанием этапов и промежуточных соединений, приведенным ниже.
Этап 4а: Промежуточное соединение 4а

[00281] На Промежуточное соединение 1e из этана 1e воздействовали 4 NHCl в соответствии с описанием способа, приведенным для этапа 1d, с получением Промежуточного соединения 4а в форме его HCl соли.
MS m/z: 815.2 (М+Н+).
Этап 4b: Промежуточное соединение 4b

[00282] Циклопентилхлорформат (1.5 экв.) добавляли капельным методом при 0°С к раствору Промежуточного соединения 4а (1 экв.) из этапа 4а, в ДХМ, содержащем 3 экв. триэтиламина, при перемешивании. Реакционную смесь подвергали перемешиванию при r.t. в течение 1.5 и затем разводили в 10 мл ДХМ. Образованный раствор дважды отмывали солевым раствором и высушивали над сульфатом магния. После удаления растворителя получали неочищенный продукт, который подвергали очистке методом хроматографии с силикагелем, с предшествующей элюцией при помощи смеси гексан/EtOAc (1:3 ~ 1:5) и затем при помощи EtOAc с получением указанного соединения (60-90%): MS m/z: 925.2 (M-1).
Этап 4с: Соединение I-19

[00283] (3R,5S)-1-((S)-3-акриламидо-2-(циклопентилоксикарбониламино)пропаноил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат: соединение, указанное в заголовке, получали на основе Промежуточного соединения 4b в соответствии с описанием способов, приведенным для этапа 1f и этапа 1g. MS m/z: 759.0 (M+H+).
[00284] Аналогично, путем использования в качестве исходных соответствующих промежуточных соединений получали следующие соединения:

[00285] (3R,5S)-1-((S)-2-(циклопентилоксикарбониламино)-3-(N-метилакриламидо)пропаноил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат: Rf: 0.4 (EtOAc/МеОН 20:1); MS m/z: 773.2 (M+H+).

[00286] (3R,5S)-1-((S)-2-(циклопентилоксикарбониламино)-4-(N-метилакриламидо)бутаноил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат: Rf: 0.4 (EtOAc/МеОН 20:1); MS m/z: 787.3 (M+H+).

[00287] (5S)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)-1-(2-(4-(метоксикарбонил)бицикло(2.2.2]октан-1- карбоксамидо)-3-(N-метилакриламидо)пропаноил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат:
[00288] Rf: 0.45 (EtOAc/MeOH 10:1); MS m/z: 855.3 (M+H+).
Пример 5

[00289] Указанное соединение получали в соответствии с описанием этапов и промежуточных соединений, приведенным ниже.
Этап 5а: Промежуточное соединение 5а

[00290] К раствору Boc-L-треонина (0.44 г, 2.0 мМоль) в 10.0 мл ДХМ добавляли кротил хлорид (0.32 г, 3.0 мМоль) при RT, а затем добавляли каталитически эффективное количество DMAP и TEA (1.0 мл, 6 мМоль). Реакционную смесь подвергали перемешиванию в течение 10 часов при RT. Реакцию прерывали путем добавления водного раствора NaHCO3 (10 мл). Через 2 часа производили медленное внесение водного раствора 1 NHCl до значения рН ~3. Слой ДХМ собирали и производили экстракцию водной фазы при помощи ДХМ (2×10 мл). Органический слой высушивали над Na2SO4, фильтровали и удаляли растворитель с получением неочищенного продукта.
Этап 5b: I-22

[00291] (3R,5S)-1-((2S,3R)-3-((Е)-бут-2-еноилокси)-2-(трет-бутоксикарбониламино)бутаноил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)пирролидин-3-ил-4-фторизоиндолин-2-карбоксилат: Соединение, указанное в заголовке, получали путем сопряжения Промежуточного соединения 1d из Примера 1 и Промежуточного соединения 5а с применением HATU, в соответствии с описанием реакций сопряжения, приведенным для Промежуточного соединения 1е в Примере 1. Общее количество вещества, полученного из 109 мг Промежуточного соединения 1d, составляло 90 мг: Rf 0.5 (EtOAc); MS m/z: 774.3 (М+H+).
[00292] Приведенные ниже соединения получали аналогичным способом, при применении в качестве исходного Промежуточного соединения 1d, путем сопряжения с соответствующими промежуточными соединениями:

[00293] (3R,5S)-1-((S)-2-(трет-бутоксикарбониламино)-3-(2-(трет-бутоксикарбониламино)акрилоилокси)пропаноил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат: MS m/z: 862.2 (M-1).

[00294] (3R,5S)-1-((2S,3R)-3-(акрилоилокси)-2-(трет-бутоксикарбониламино)бутаноил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат: Rf: 0.4 (EtOAc); MS m/z: 760.1 (M-1).
Пример 6
Соединение I-25

[00295] (I-25): Указанное соединение получали в соответствии с описанием этапов и промежуточных соединений, приведенным ниже.
Этап 6а: Промежуточное соединение 6а

[00296] К раствору N-Boc-пироглутаминовой кислоты (0.23 г, 1.0 мМоль) в 10.0 мл безводного ТГФ медленно добавляли (2-метилпроп-1-енил)магния бромид (0.5 М в ТТФ, 5 мл, 2.5 мМоль) при -78°С. Реакционную смесь подвергали перемешиванию в течение 1 часа при -78°С. После чего добавляли водный раствор 1 NHCl (2.5 мл) и смесь медленно нагревали до RT. Значение рН доводили до ~3-4 при помощи 1 N NHCl. Затем производили удаление ТГФ под вакуумом и оставшуюся водную фазу экстрагировали при помощи ДХМ (3×15 мл), органический слой высушивали над Na2SO4, производили фильтрацию и удаляли растворитель с получением неочищенного продукта.
Этап 6b: I-25

[00297] (3R,5S)-1-((S)-2-(трет-бутоксикарбониламино)-7-метил-5-оксоокт-6-еноил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат: Соединение, указанное в заголовке, получали путем сопряжения Промежуточного соединения 1d из Примера 1 и Промежуточного соединения 6а с применением HATU, в соответствии с описанием реакций сопряжения, приведенных для Промежуточного соединения 1е в Примере 1. Общее количество соединения, указанного в заголовке, полученного из 108 мг Промежуточного соединения 1d, составляло 80 мг: Rf 0.3 (EtOAc); MSm/z: 774.1 (M+H+).1HNMR (CD3OD, 400 МГц) δ 7.31 (dd, 1H, J=13.3, 7.4 Гц), 7.13-6.98 (m, 2H), 6.18 (s, 1H), 5.74 (m, 1H), 5.38 (s, 1H), 5.32 (d, 1H, J=17.0 Гц), 5.12 (d, 1H, J=10.1 Гц), 4.72 (s, 4H), 4.48 (dd, 1H, J=17.0, 9.16 Гц), 4.29 (m, 2H), 3.89 (m, 1H), 2.93 (m, 1H), 2.60-2.35 (m, 2H), 2.22 (m. 2H), 2.10 (s, 3H), 2.02-1.75 (br, 1H), 1.88 (s, 3Н), 1.46-0.80 (m, 14H).
13C NMR (CD3OD, 100 МГц):
δ 201.8, 175.3, 174.5, 170.6, 157.7, 156.9, 155.6, 141.1, 134.2, 131.2, 124.8, 119.9, 119.7, 118.6, 115.0, 1 14.8, 80.3, 76.1, 61.0, 55.0, 54.9, 54.8, 53.5, 53.3, 52.7, 50.3, 50.1, 42.6, 40.3, 35.7, 35.4, 32.1, 28.7, 28.5, 27.7, 26.9, 24.0, 20.9, 6.74, 6.47.
[00298] Приведенные ниже соединения получали при использовании в качестве исходного Промежуточного соединения 1d, путем сопряжения его с соответствующими промежуточными соединениями, в соответствии с описанием для Этапа 6а:

[00299] (3R,5S)-1-((S,Е)-2-(трет-бутоксикарбониламино)-5-оксоокт-6-еноил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)пирролидин-3-ил-4-фторизоиндолин-2-карбоксилат: Общее количество соединения, указанного в заголовке, полученного из 150 мг Промежуточного соединения 1d, составляло 80 мг: Rf 0.3 (EtOAc); MS m/z: 760.3 (M+H+).

[00300] (3R,5S)-1-((S)-2-(трет-бутоксикарбониламино)-6-метил-5-оксогепт-6-еноил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат: Общее количество соединения, указанного в заголовке, полученного из 150 мг Промежуточного соединения 1d, составляло 80 мг: Rf 0.4 (EtOAc); MSm/z: 782.2 (M+Na+).1HNMR (CD3OD, 400 МГц) δ 7.31 (dd, 1H, J=13.3, 7.4 Гц), 7.09 (dd, 1H, J=33, 7.4 Гц), 7.0 (m, 1H), 6.12 (s, 1H), 5.82 (s, 1H), 5.74 (m, 1H), 5.39 (s, 1H), 5.31 (dd, 1H, J=1.4, 17.0 Гц), 5.12 (dd, 1H, J=10.1, 1.4 Гц), 4.73 (m, 4H), 4.48 (m, 1H), 4.32 (m, 2H), 3.90 (m, 1H), 2.91 (m, 1H), 2.42 (m, 1H), 2.22 (m, 2H), 2.01 (m, 1H), 1.90-1.85 (m, 2H), 1.84 (s, 3H), 1.40-1.02 (m, 14H).

[00301] (3R,5S)-1-((S,Е)-2-(трет-бутоксикарбониламино)-6-метил-5-оксоокт-6-еноил)-5-((1R,2R)-1-(циклопропилсульфонилкарбамоил)-2-этилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат: Общее количество соединения, указанного в заголовке, полученного из 150 мг Промежуточного соединения 1d, составляло 80 мг: Rf 0.5 (EtOAc); MS m/z: 796.2 (M+Na+).
[00302] Приведенные ниже соединения получали при использовании в качестве исходного Промежуточного соединения 1d, путем сопряжения его с соответствующими промежуточными соединениями, в соответствии с описанием для
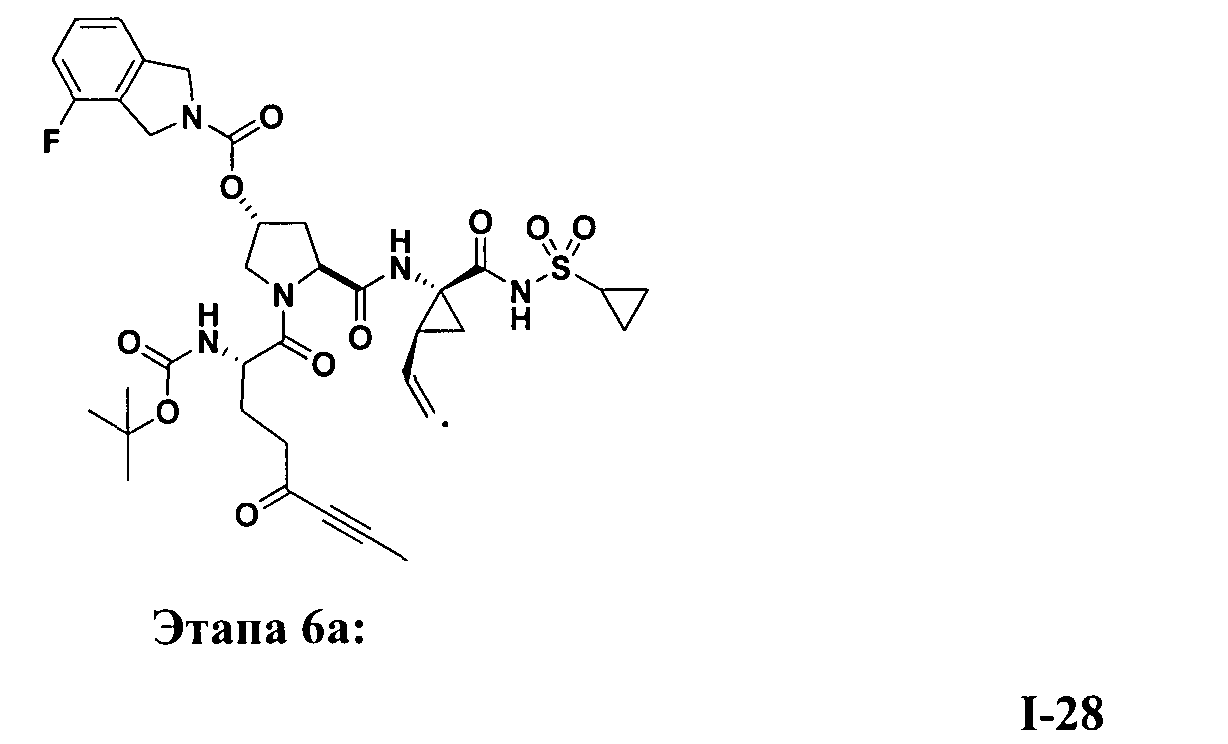
(3R,5S)-1-((S)-2-(трет-бутоксикарбониламино)-5-оксоокт-6-иноил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат

(3R,5S)-1-((S)-2-(трет-бутоксикарбониламино)-8,8-диметил-5-оксонон-6-иноил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат

(3R,5S)-1-((S)-2-(трет-бутоксикарбониламиио)-3,3,7-триметил-5-оксоокт-6-еноил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат

(3R,5S)-1-((S)-2-(трет-бутоксикарбониламино)-4,4,7-триметил-5-оксоокт-6-еноил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат

(3R,5S)-1-((S)-2-(трет-бутоксикарбониламино)-6-метил-4-оксогепт-5-еноил)-5-((1R,2S)-1-(циклопропилсульфонилкарбамоил)-2-винилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат
[00303] MS m/z: 760.1 (M+H+).
[00304] Приведенное ниже соединение получали при помощи катализируемого палладием гидрирования Промежуточного соединения 1d, после которого проводили реакцию сопряжения, описанную для этапа 6b:

[00305] (3R,5S)-1-((S)-2-(трет-бутоксикарбониламино)-7-метил-5-оксоокт-6-еноил)-5-((1R,2R)-1-(циклопропилсульфонилкарбамоил)-2-этилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат: Общее количество соединения, указанного в заголовке, полученного из 100 мг Промежуточного соединения 1d, составляло 33 мг: Rf 0.5 (EtOAc); MS m/z: 776.2 (M+H+).
[00306] Аналогичным способом получали следующие соединения:

(3R,5S)-1-((S)-2-(трет-бутоксикарбониламино)-6-метил-5-оксогепт-6-еноил)-5-((1R,2R)-1-(циклопропилсульфонилкарбамоил)-2-этилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат

(3R,5S)-1-((S)-2-(трет-бутоксикарбониламино)-6-метил-4-оксогепт-5-еноил)-5-((1R,2R)-1-(циклопропилсульфонилкарбамоил)-2-этилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат

I-61
(3R,5S)-1-((S)-2-(трет-бутоксикарбониламино)-5-циклобутенил-5-оксопентаноил)-5-((1R,2R)-1-(циклопропилсульфонилкарбамоил)-2-этилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат

(3R,5S)-1-((S)-2-(трет-бутоксикарбониламино)-6-циклобутилиден-5-оксогексаноил)-5-((1R,2R)-1-(циклопропилсульфонилкарбамоил)-2-этилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат

(3R,5S)-1-((S,Е)-2-(трет-бутоксикарбониламино)-8,8-диметил-5-оксонон-6-еноил)-5-((1R,2R)-1-(циклопропилсульфонилкарбамоил)-2-этилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат

(3R,5S)-1-((S)-2-(трет-бутоксикарбониламино)-2-((S)-2-оксоциклопент-3-енил)ацетил)-5-((1R,2R)-1-(циклопропилсульфонилкарбамоил)-2-этилциклопропилкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат
[00307] Приведенное ниже соединение получали при помощи катализируемого палладием гидрирования (24-48 часов) Промежуточного соединения 1d, после которого проводили реакцию сопряжения, описанную для этапа 6b:

(3R,5S)-1-((S)-2-(трет-бутоксикарбониламино)-7-метил-5-оксоокт-6-еноил)-5-(1-(циклопропансульфонамидо)-1-оксогексан-2-илкарбамоил)пирролидин-3-ил 4-фторизоиндолин-2-карбоксилат: Общее количество соединения, указанного в заголовке, полученного из 100 мг Промежуточного соединения 1d, составляло 58 мг: Ra 0.5 (EtOAc); MS m/z: 800.2 (M+Na+).
Пример 7

[00308] (1aR,3aS,5R,9S,16aS,Z)-11-(о-нитрофенилсульфонил)-9-(трет-бутоксикарбониламино)-1а-(циклопропилсульфонилкарбамоил)-3,8-диоксо-1,1а,2,3,3а,4,5,6,8,9,10,11,12,13,14,16а-гексадекагидроциклопропа[н]пирроло[2,1-с][1,4,8]триазациклопентадецин-5-ил-4-фторизоиндолин-2-карбоксилат (I-45): Указанное соединение получали в соответствии с описанием этапов и промежуточных соединений, приведенным ниже:
Этап 7а: Промежуточное соединение 7а

[00309] Промежуточное соединение 7а получали путем следования способам, описанным для синтеза Промежуточного соединения 3c с применением 5-бромпент-1-ена в качестве алкилирующего агента.
Этап 7b: Промежуточное соединение 7b

[00310] Промежуточное соединение 7b получали путем сопряжения Промежуточного соединения 1d из Примера 1 и Промежуточного соединения 7а с применением HATU, в соответствии с описанием реакций сопряжения, приведенным для Промежуточного соединения 1е в Примере 1. MS: 946.2 (M+1).
Этап 7с: соединение I-45
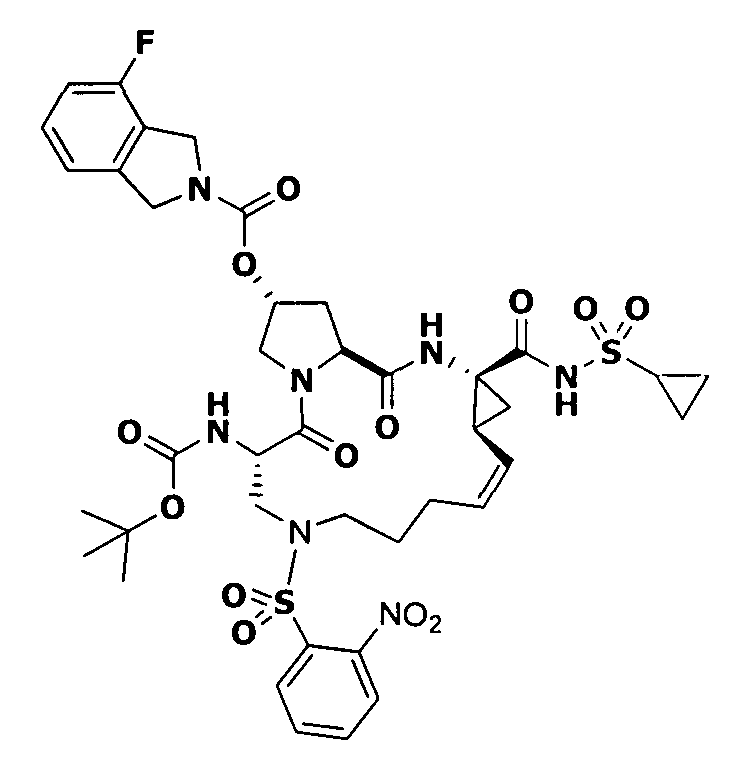
[00311] К раствору 540 мг Промежуточного соединения 7b в 150 мл безводного дихлорметана добавляли 100 мг 1,3-Bis(2,4,6-триметилфенил)-4,5-дигидроимидазол-2-илиден[2-(i-пропокси)-5-(N,N-диметиламиносульфонил)фенил]метиленрутения (II) (катализатор Жан 1В, RC-303, ZannanPharma Ltd.) под азотом. Образованную смесь нагревали при 48°С в течение ночи. Анализ методом LC-MS показал полное превращение в продукт реакции. Реакционный раствор подвергали флэш-хроматографии с силикагелем с элюентом (гептан/EtOAcv/v 1:1 к чистому EtOAc) с образованием 140 мг продукта согласно настоящему изобретению. MS: 916.3 (ES-).
[00312] Аналогичным способом, при использовании в качестве исходного соединения (S)-5-аллиламино-2-трет-бутоксикарбониламино-пентановой кислоты на этапе 7а, получали следующее соединение:
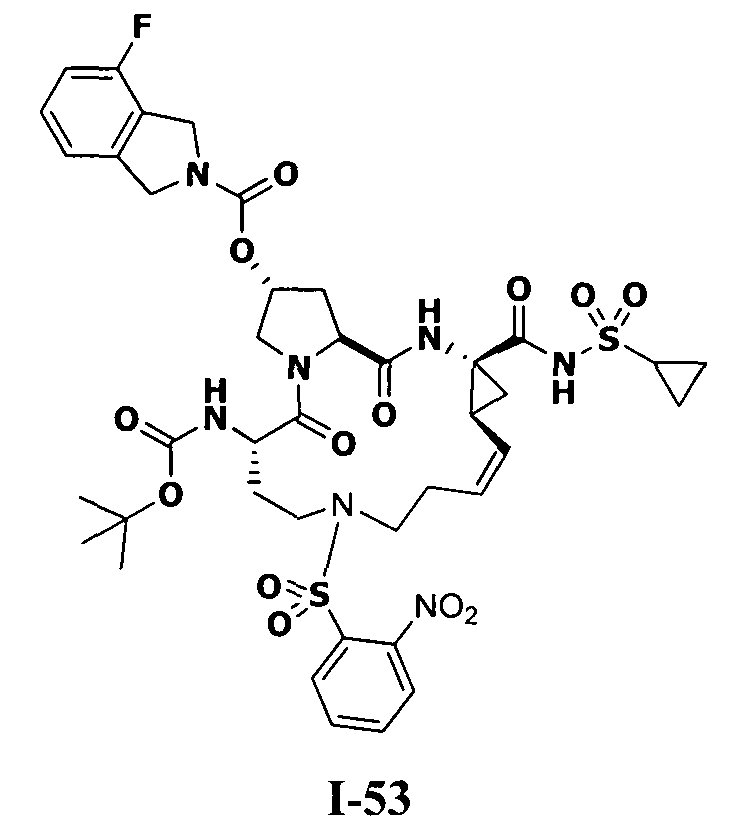
[00313] MS: 916.3 (ES-)
[00314] Аналогичным способом, при использовании в качестве исходного соединения ((S)-4-[But-3-енил-(2-нитробензолсульфонил)-амино]-2-трет-бутоксикарбониламино-масляной кислоты на этапе 7а, получали следующее соединение:

[00315] MS: 916.3 (ES-)
Пример 8

[00316] (1aR,3aS,5R,9S,16aS,Z)-11-акрилоил-9-(трет-бутоксикарбониламино)-1а-(циклопропилсульфонилкарбамоил)-3,8-диоксо-1,1а,2,3,3а,4,5,6,8,9,10,11,12,13,14,16а-гексадекагидроциклопропа[н]пирроло[2,1-с][1,4,8]триазациклопентадецин-5-ил-4-фторизоиндолин-2-карбоксилат(I-35): Указанное соединение получали в соответствии с описанием этапов и промежуточных соединений, приведенным ниже:
[00317] Этап 8а: Промежуточное соединение 8а:

[00318] Промежуточное соединение 8а получали путем воздействия на соединение I-45 из Примера 7 тиофенолом в соответствии со способами, описанными для этапа 3e. MS: 733.3 (М+1).
[00319] Этап 8b: Соединение I-35:

[00320] Указанное соединение получали путем воздействия на Промежуточное соединение 8а акрилоил хлоридом в соответствии с описанием способа, приведенным для этапа 3f. Rf 0.2 (5% МеОН в DCM); MS m/z: 787.3 (M+H+).
[00321] Аналогичным способом, при воздействии на Промежуточное соединение 8а хлорацетил хлоридом (1.2 экв.), получали следующее соединение:

(1aR,3aS,5R,9S,16aS,Z)-11-хлорацетил-9-(трет-бутоксикарбониламино)-1а-(циклопропилсульфонилкарбамоил)-3,8-диоксо-1,1а,2,3,3а,4,5,6,8,9,10,11,12,13,14,16а-гексадекагидроциклопропа[н]пирроло[2,1-с][1,4,8]триазациклопентадецин-5-ил-4-фторизоиндолин-2-карбоксилат (I-45)
[00322] MS: 831.2 (M+Na+).
[00323] Аналогичным способом, при воздействии на Промежуточное соединение 8а хлорацетил хлоридом (3.0 экв.), получали следующее соединение:
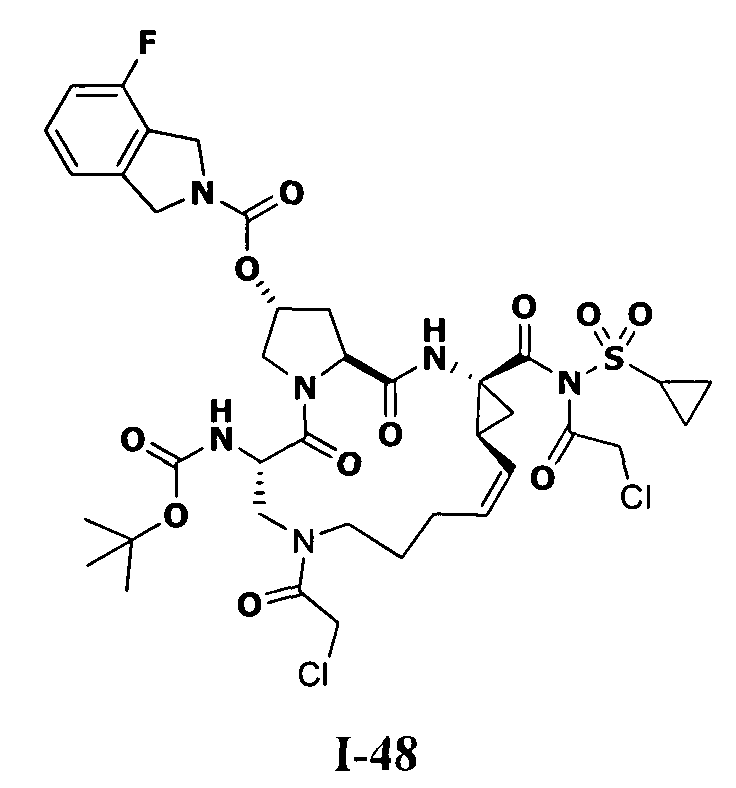
[00324] MS: 907.2 (M+Na+).
[00325] Аналогичным способом, при использовании в качестве исходных соединений I-53 и I-54 на этапе 8а, получали следующее соединение:
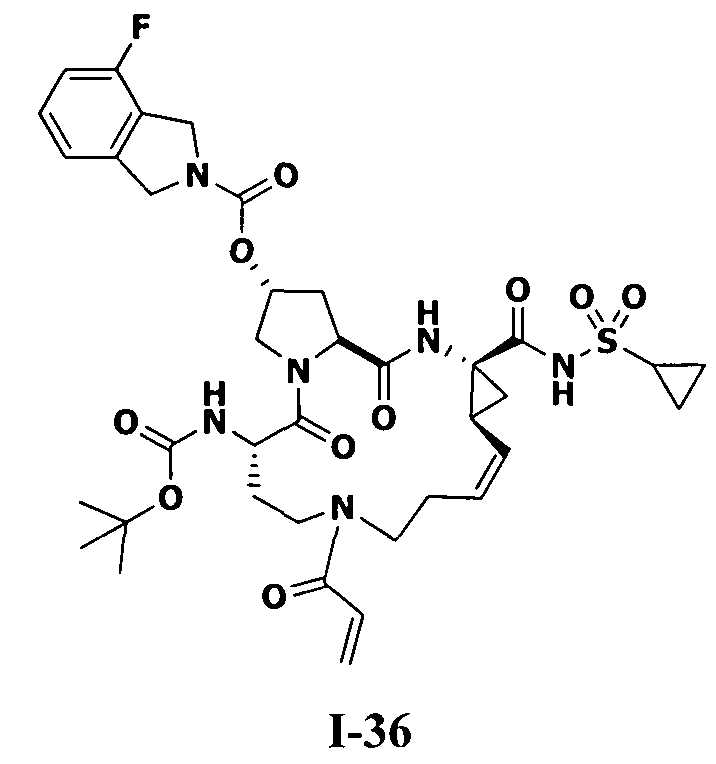
(1aR,3aS,5R,9S,16aS,Z)-12-акрилоил-9-(трет-бутоксикарбониламино)-1а-(циклопропилсульфонилкарбамоил)-3,8-диоксо-1,1а,2,3,3а,4,5,6,8,9,10,11,12,13,14,16а-гексадекагидроциклопропа[н]пирроло[2,1-с][1,4,9]триазациклопентадецин-5-ил 4-фторизоиндолин-2-карбоксилат
[00326] MS: 785.3 (ES-).
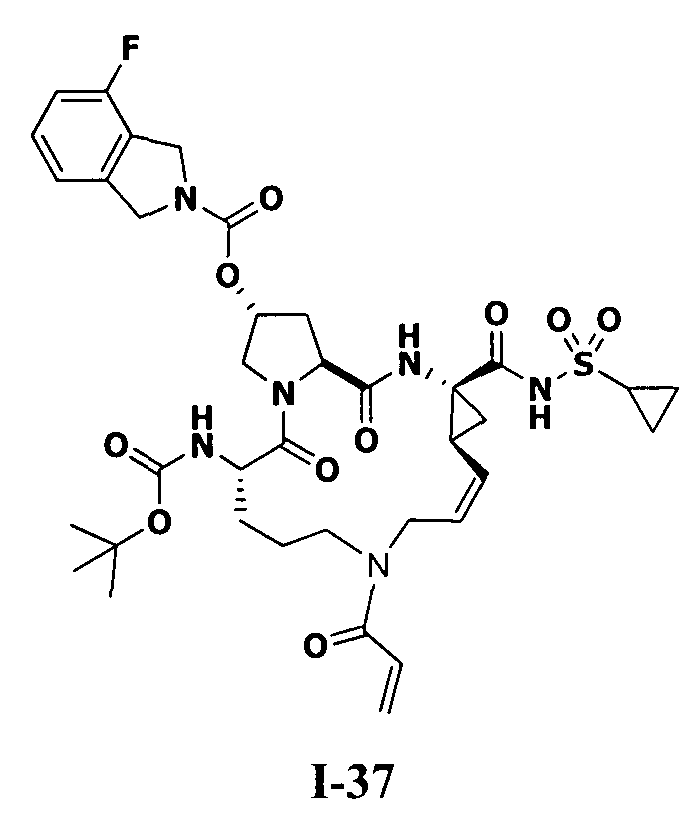
(1aR,3aS,5R,9S,16aS,Z)-13-акрилоил-9-(трет-бутоксикарбониламино)-1а-(циклопропилсульфонилкарбамоил)-3,8-диоксо-1,1а,2,3,3а,4,5,6,8,9,10,11,12,13,14,16а-гексадекагидроциклопропа[е]пирроло[1,2-а][1,4,10]триазациклопентадецин-5-ил 4-фторизоиндолин-2-карбоксилат
[00327] MS: 787.3 (ES+), 785.3 (ES-).
Пример 9 (I-40)

[00328] Указанное соединение получали в соответствии с описанием этапов и промежуточных соединений, приведенным ниже на схеме:
2,2-диметилгекс-5-енил карбонохлоридат
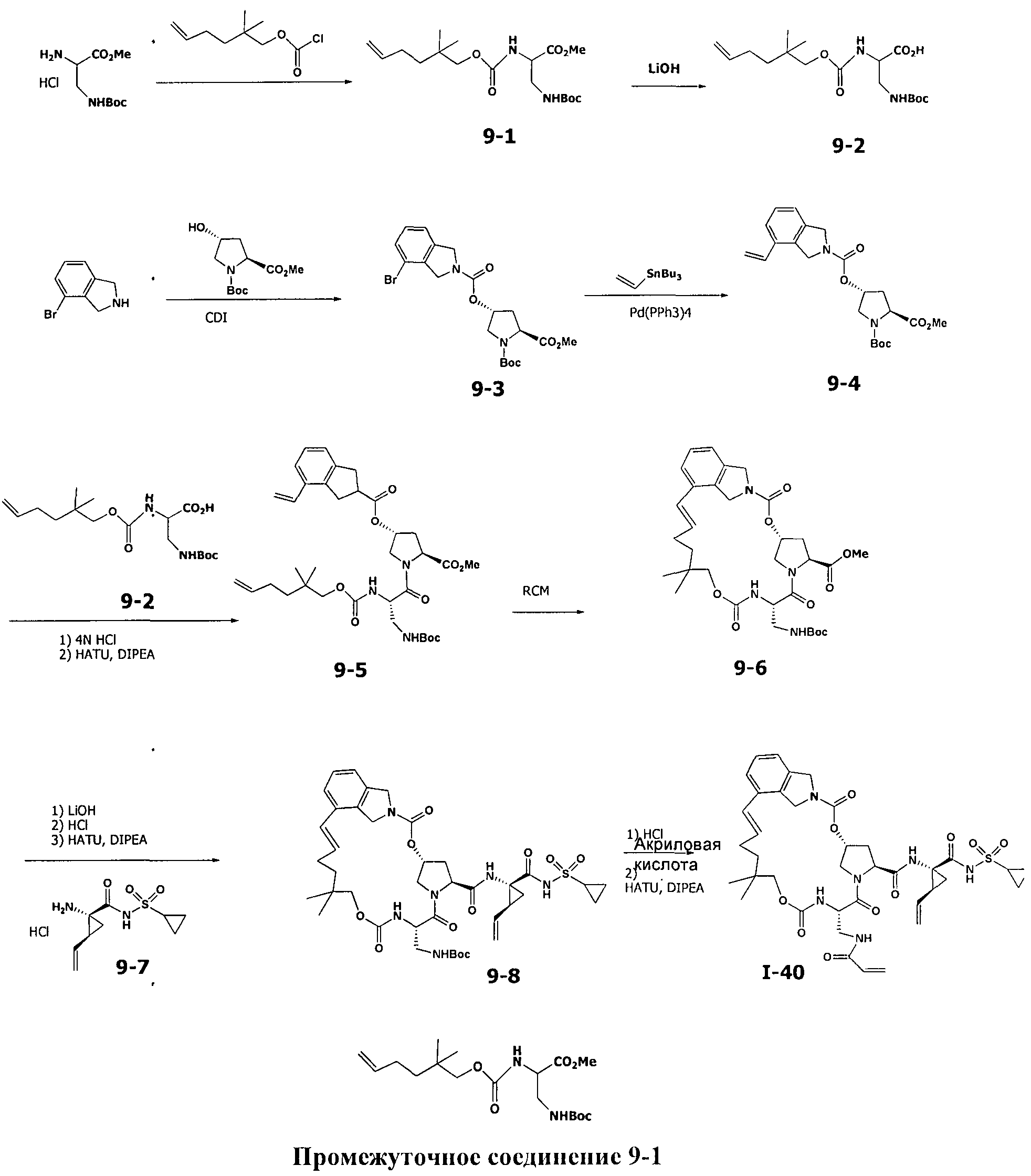
[00329] Метил-2,2,12,12-тетраметил-4,9-диоксо-3,10-диокса-5,8-диазагексадек-15-ен-7-карбоксилат (Промежуточное соединение 9-1). К раствору 381 мг метил-2-амино-3-(трет-бутоксикарбониламино)пропаноат гидрохлорида и 1 мл Et3N в 10 мл безводного ТГФ, добавляли 1.5 мМоль 2,2-диметилгекс-5-енилкарбоно хлоридата при перемешивании. Образованную смесь подвергали перемешиванию при r.t. в течение ночи, после чего концентрировали. Осадок подвергали хроматографии в колонке с силикагелем, со смесью гептан/EtOAc (v/v 7/1) в качестве элюента, с получением 500 мг бесцветного масла (90%).1HNMR (400 МГц, CDCl3) d 5.82 (m, 1H), 5.64 (br s, 1H), 5.02 (dd, 1H, J=13.2, 1.8 Гц), 4.95 (d, 1H, J=8.2 Гц), 4.83 (br s, 1H), 4.39 (br d, 1H, J=6.0 Гц), 3.83 (br s, 2H), 3.80 (s, 3H), 2.55 (m, 2H), 2.02 (m, 2H), 1.43 (s, 9H), 1.35 (m, 2H), 0.91 (s, 6H).

[00330] 2,2,12,12-тетраметил-4,9-диоксо-3,10-диокса-5,8-диазагексадек-15-ен-7-карбоновая кислота (Промежуточное соединение 9-2). К смеси 500 мг промежуточного соединения 8-1 в смешанном растворителе МеОН-ТГФ (5 мл-5 мл), добавляли 420 мг LiOH-H2O, a затем 5 воды при перемешивании. Реакционную смесь подвергали перемешиванию при r.t. в течение 30 минут, после чего закисляли при помощи 12 мл 1.0 NHCl и экстрагировали при помощи 60 мл дихлорметана. Органический слой отмывали при помощи солевого раствора и высушивали над MgSO4. После фильтрации и концентрирования в качестве продукта согласно настоящему изобретению получали 460 мг вязкого масла (95%). LC-MS: m/z=357.2 (ES-).

[00331] (2S,4R)-1-трет-бутил-2-метил-4-(4-бромизоиндолин-2-карбонилокси)пирролидин-1,2-дикарбоксилат (Промежуточное соединение 9-3). К раствору, содержащему 0.5 г (2S,4R)-1-трет-бутил-2-метил-4-гидроксипирролидин-1,2-дикарбоксилата (2 мМоль) в 5 мл N,N-диметилацетамида, добавляли 370 мг карбонил диимидазола (1.1 экв.). Реакционную смесь нагревали при 60°С в течение 1 часа, после чего добавляли 400 мг 4-бромизоиндола (2 мМоль). Реакцию продолжали при 60°С в течение ночи. После охлаждения производили экстракцию реакционной смеси при помощи 50 мл EtOAc и отмывку водой и солевым раствором, после чего высушивали над Na2SO4. После фильтрации и концентрирования осадок очищали при помощи флэш-хроматографии с силикагелем, с применением смеси гептан/EtOAc (v/v 5/2), с образованием твердого 75 мг соединения белого цвета (79%). LC-MS: m/z=369.2 (ES+, M+1 - Boc).
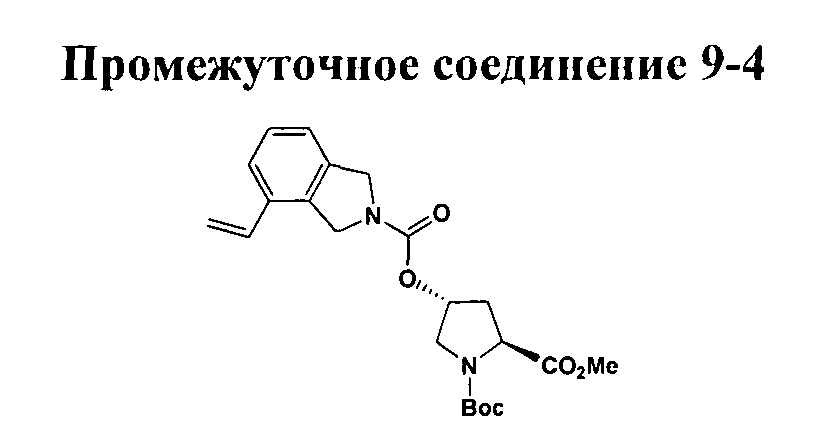
[00332] (2S,4R)-1-трет-бутил-2-метил-4-(4-винилизоиндолин-2-карбонилокси)пирролидин-1,2-дикарбоксилат (Промежуточное соединение 9-4). Под Ar, к раствору 745 мг промежуточного соединения 8-3 (1.58 мМоль) в 30 мл дегазированного толуола, добавляли 170 мг палладия тетракистрифенилфосфина, а затем - 700 мкл винил трибутилина (2.4 мМоль). Реакционную смесь нагревали при 100°С в течение ночи. После охлаждения удаляли растворитель при пониженном давлении и осадок очищали при помощи флэш-хроматографии с силикагелем с применением смеси гептан/EtOAc (v/v 9/1 - 3/1) в качестве элюента, с образованием 533 мг твердого соединения белого цвета (81%). LC-MS: m/z=317.2 (ES+, М+1-Вос).
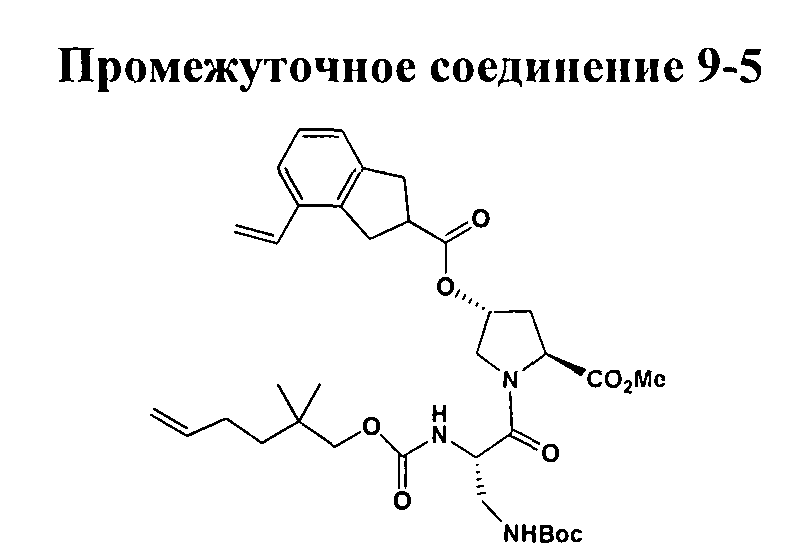
[00333] (2S,4R)-метил-1-((S)-3-(трет-бутоксикарбониламино)-2-((2,2-диметилгекс-5-енилокси)карбониламино)пропаноил)-4-(4-винил-2,3-дигидро-1H-инден-2-карбонилокси)пирролидин-2-карбоксилат (Промежуточное соединение 9-5). Из состава Промежуточного соединения 9-4 удаляли защитную группу Вос при помощи 4 NHCl в диоксане согласно настоящему описанию, приведенному в Примере 1. 288 мг указанного де-Вос промежуточного соединения (0.82 мМоль) добавляли к смеси, содержащей 358 мг Промежуточного соединения 9-2 (1.0 мМоль), 400 мг HATU (1.05 мМоль), 300 мкл DIPEA в 5 мл ТТФ, при перемешивании. После перемешивания в течение ночи реакционную смесь разводили в 60 мл EtOAc и отмывали насыщенным бикарбонатом натрия, растворяли HCl и высушивали над Na2SO4. После концентрирования и очистки методом флэш-хроматографии с силикагелем со смесью гептан/EtOAc (1/1) получали 485 мг твердого соединения белого цвета (90%). LC-MS: m/z=557.3 (ES+, М+1-Вос).
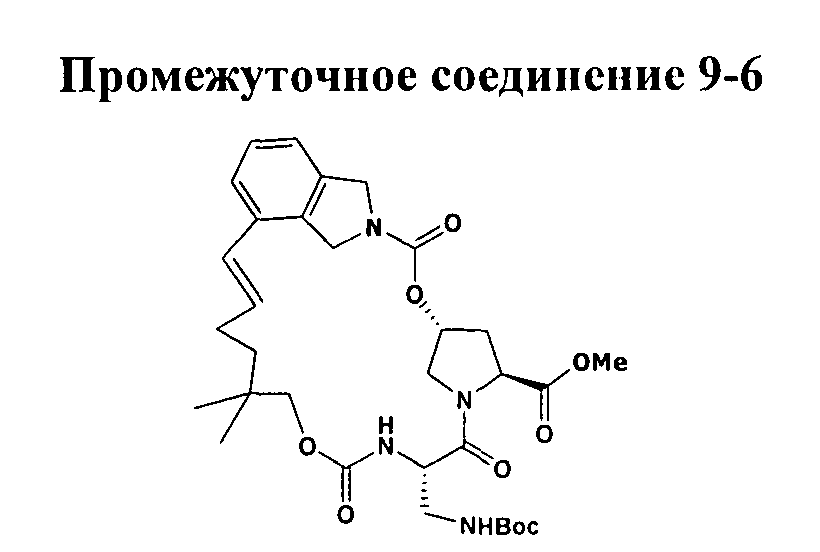
[00334] Макроциклическое Промежуточное соединение 9-6. Под N2 разбавленный раствор 485 мг промежуточного соединения 9-5 и 150 мг катализатора Жан 1B размешивали в 100 мл дегазированного дихлорэтана при 50°С в течение ночи. После этого реакционную смесь пропускали через короткую колонку и элюировали при помощи смеси гептан/EtOAc (v/v 1/3). После чего концентрированную фракцию подвергали пре-ВЭЖХ очистке с образованием 312 мг твердого соединения коричневатого цвета (70%). LC-MS: m/z=529.2 (ES+, М+1-Вос).

[00335] Макроциклическое Промежуточное соединение 9-8. 25 мг промежуточного соединения 9-6 подвергали гидролизу в 1 мл МеОН и 1 мл ТГФ, с применением 1 мл 1.0 NLiOH, в течение 1 часа. После этого добавляли 1.2 мл 1.0 NHCl и производили экстракцию реакционной смеси при помощи 30 мл дихлорметана. Органический слой отмывали солевым раствором и высушивали над MgSO4. После фильтрации и концентрирования осадок повторно растворяли в 1.5 мл безводного ацетонитрила, после чего следовало добавление 25 мг HATU, 200 мкл DIPEA и затем - 13 мг промежуточного соединения 9-7. После перемешивания при r.t. в течение 20 минут реакционную смесь концентрировали и непосредственно после этого очищали при помощи prep-ВЭЖХ с получением 20 мг твердого соединения желтого цвета (61%). LC-MS: m/z=727.2 (ES+, М+1-Вос, 825.2 (ES-).
[00336] I-40: К раствору 20 мг промежуточного соединения 9-8, размешанного в 1 л дихлорметана, добавляли 1.5 мл 4.0 MHCl в диоксане. По прошествии 30 минут реакционную смесь концентрировали. К осадку добавляли 1.5 мл ацетонитрила, 200 мкл DIPEA, 20 мг акриловой кислоты и 50 мг HATU. После перемешивания при r.t. в течение 30 минут реакционную смесь концентрировали и очищали методом prep-ВЭЖХ с получением 14.0 мг твердого соединения белого цвета (68%). LC-MS: m/z=779.3 (ES-), 781.2 (ES+)
[00337] Аналогичным способом, при использовании Промежуточного соединения 3c вместо Промежуточного соединения 3а в качестве исходного, можно получать следующее соединение:

[00338] Аналогичным способом, при использовании насыщенной формы Промежуточного соединения 9-6, можно получать следующее соединение:

[00339] LC-MS: m/z=781.3 (ES-), 783.2 (ES+).
[00340] Аналогичным способом, после гидрогенизации как Промежуточного соединения 9-7, так и Промежуточного соединения 9-8 перед сопряжением, можно получать следующее соединение:

Пример 10

[00341] Енон-макроцикл I-45. Указанное соединение получали в соответствии с описанием этапов и промежуточных соединений, приведенным ниже на схеме:
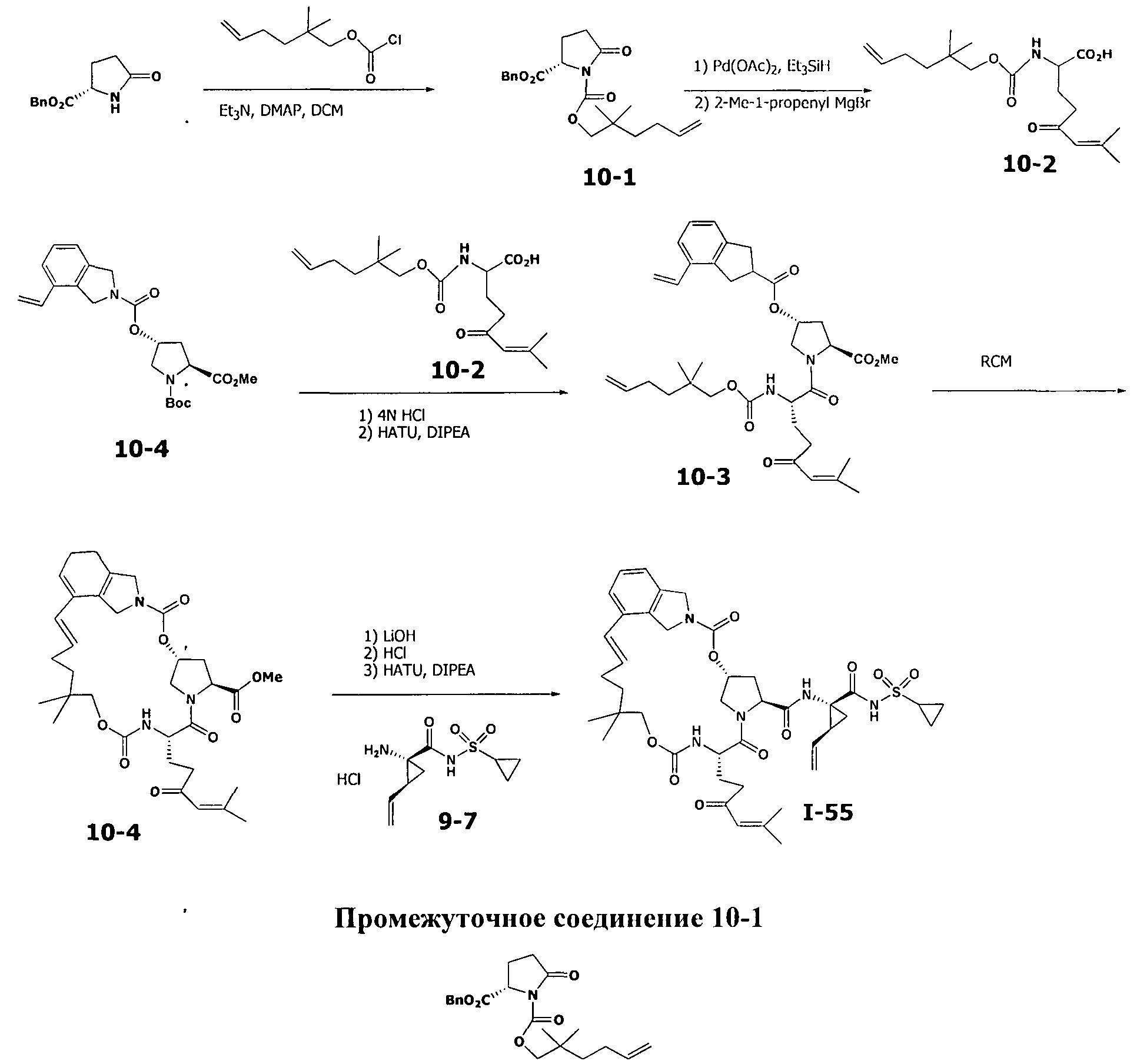
[00342] (S)-2-бензил-1-(2,2-диметилгекс-5-енил)-5-оксопирролидин-1,2-дикарбоксилат (Промежуточное соединение 10-1): При 0°С к раствору 440 мг бензилового эфира 5-оксо-пирролидин-2-карбоновой кислоты (2 мМоль), 300 мкл триэтиламина, 300 мг N,N-диметиламинопиридина (2.2 мМоль) в 7 мл дихлорметана добавляли 2 мМоль 4-пентенил-1-илхлорформата при перемешивании. Затем реакционную смесь нагревали до r.t. и подвергали перемешиванию в течение 24 часов. Осадок, образованный после концентрирования, растворяли в 40 мл EtOAc, отмывали 6 мл 1.0 N водного раствора HCl солевым раствором и высушивали над безводным сульфатом натрия. После этого выпаривали органический растворитель при пониженном давлении и осадок очищали при помощи флэш-хроматографии с силикагелем с применением смеси гептан/EtOAc (о/о 4/1-2/1), с получением 430 мг неокрашенного масла в качестве промежуточного соединения 10-1 (58%).

[00343] 2-((2,2-диметилгекс-5-енилокси)карбониламино)-7-метил-5-оксоокт-6-еновая кислота (Промежуточное соединение 10-2). При помощи 13 мг Pd(OAc)2, 24 мкл Et3H, 278 мкл Et3SiH осуществляли дебензилирование, в 2 мл дихлорметана при r.t. в течение 30 минут. После фильтрации концентрированный осадок подвергали воздействию реактива Гриньяра (2.5 экв.) при -78°С в течение 2 часов. После остановки реакции разбавленной кислотой продукт экстрагировали при помощи дихлорметана и высушивали над MgSO4. Концентрированный продукт представляет собой Промежуточное соединение 10-2 согласно настоящему изобретению, которое напрямую использовали на следующем этапе.
[00344] При применении общих способов, описанных в Примере 9, производили удаление защитной Boc-группы из состава Промежуточного соединения 9-4 при помощи 4 N HCl, затем осуществляли сопряжение его с промежуточным соединением 10-2 с образованием Промежуточного соединения 10-3. Промежуточное соединение 10-3 подвергали реакции олефинового обмена при применении катализатора Граббса или катализатора Жан с образованием макроциклического Промежуточного соединения 10-4. После проведения основного гидролиза при помощи LiOH осуществляли сопряжение кислой формы промежуточного соединения 10-4 с Промежуточным соединением 9-7 с получением соединения I-55. MS: m/e=806.3 (ES-).
[00345] Аналогичным способом можно получить соединение I-56 при использовании насыщенной формы Промежуточного соединения 9-7:

Пример 11
Экспрессия и очистка пептида одноцепочечной протеазы ВГС (wt)
[00346] Одноцепочечный протеолитический домен (NS4A21-32-GSGS-NS33-631) клонировали в клетки pET-14b (Novagen, Madison, WI) и трансформировали в клетки DH10B (Invitrogen). Образованную в результате плазмиду переносили в Escherichia coli BL21 (Novagen) для экспрессии белка, как описано ранее (1, 2). Вкратце, культуры выращивали при 37°С в среде LB, содержащей 100 мкг/мл ампициллина, до достижения величины оптической плотности при 600 нм (OD 600), равной 1.0, путем добавления изопропил-β-D-тиогалактопиранозида (IPTG) к 1 мМ. После дополнительного периода инкубации при 18°С в течение 20 часов собирали урожай клеток бактерий путем центрифугирования при 6000×g в течение 10 минут и ресуспендирования в лизирующем буфере, содержащем 50 мМ Na3PO4, рН 8.0, 300 мМ NaCl, 5 мМ 2-меркаптоэтанола, 10% глицерола, 0.5% Igepal CA630, и смесь ингибиторов протеаз, состоящую 1 мМ фенилметилсульфонил фторида, 0.5 мкг/мл леупептина, перстатина А и 2 мМ бензамидина. Клетки лизировали методом замораживания-оттаивания с последующим разрушением ультразвуком. Клеточный детрит отделяли путем центрифугирования при 12000×g в течение 30 минут. Супернатант подвергали дальнейшей очистке путем пропускания через 0.45-мкм фильтр (Corning), а затем - через HiTrap хелатирующую колонку, заряженную NiSO4 (Amersham Pharmacia Biotech). Связанный белок элюировали при помощи раствора имидазола в 100-до-500 мМ линейном градиенте. Отобранные фракции подвергали хроматографии в Ni2+ колонке и анализировали 10% натрий-додецил-сульфат (SDS)-полиакриламидном геле. Очищенный белок разделяли при помощи электрофореза в 12% SDS-PAGE (полиакриламидном) геле, после чего переносили на нитроцеллюлозную мембрану. После этого белок исследовали методом Вестерн-блоттинга с моноклональными антителами к NS3. Белки визуализировали при помощи набора для хемолюминесценции (Roche) антителами козла к антителам мыши, конъюгированными с пероксидазой хрена (Pierce) в качестве вторичных антител. Отбирали аликвоты белка и хранили их при -80°С.
Пример 12
Клонирование и экспрессия устойчивых к лекарственным препаратам мутантов протеазы ВГС A156S, А156Т, D168A, D168V и варианта C159S
[00347] При помощи метода ПЦР получали мутантные фрагменты ДНК NS4A/NS3 и клонировали их в экспрессионный вектор рЕТ. После трансформации в компетентные клетки BL21 экспрессию индуцировали при помощи IPTG в течение 2 часов. Белки слияния, меченные гистидином, очищали методом аффинной хроматографии, а затем - методом эксклюзионной хроматографии.
Пример 13
[00348] Аналитический буфер: 2% CHAPS, 50 мМ Tris pH 7.5, 50% глицерол, 2 мкм М-2235 (Bachem) субстрата. К 50 мкл добавляли 49 мкл аналитического буфера, 1 мкл (1U) сериновой протеазы ВГС (Bioenza). Инкубировали в течение 20 минут при комнатной температуре. Регистрацию результатов на планшете производили как при 350/460 нм (возбуждение/эмиссия) на флуоресцентном аппарате для чтения микропланшетов, так и осуществляли считывание с 1-минутными интервалами с получением кинетической кривой.
[00349] Фермент переносил воздействие 1% ДМСО и 2% метанола. В других экспериментах по исследованию соединений соединения растворяли в 10 раз в чистом ДМСО с 20% метанолом (10% ДМСО и 20% метанол). Раствор этих соединений добавляли к реакционной смеси (не превышая 10% итогового объема реакции). Итоговая концентрация органических растворителей составляла: 1% ДМСО и 2% метанола.
Пример 14
Дополнительные протоколы исследований
Способ А:
[00350] Соединения исследовали с целью оценки противовирусной активности и цитотоксичности соединений in vitro с применением репликонов РНК ВГС. В исследовании использовали линию клеток ЕТ (luc-ubi-neo/ET), представляющими собой линию клеток гепатомы человека Huh7, содержащих репликон РНК ВГС со стабильным репортером люциферазы (Luc) и тремя клеточными мутациями, несущими адаптивный характер для культуры. Уровни РНК ВГС напрямую измеряли путем применения вирус-специфической TaqMan RT-PCR:
Прямой праймер: ACGCAGAAAGCGTCTAGCCAT (SEQ ID NO:63)
Обратный праймер: TACTCACCGGTTCCGCAGA (SEQ ID NO:64)
проба: [6-FAM]-CCTGGAGGCTGCACGACACTCAT-[TAMRA] (SEQ ID NO:65)
[00351] Линию клеток ЕТ выращивали в модифицированной питательной среде Дульбекко (DMEM) с 10% эмбриональной бычьей сыворотки (FBS), 1% пенициллин-стрептомицина (pen-strep), 1% глутамина, 250 мкг/мл G418 в 5% инкубаторе с CO2 при 37°С. Все реагенты для культивирования получали в Mediatech (Manassas, VA). Клетки трипсинизировали (1% трипсин:ЭДТА) и наносили в количестве 5·103 клеток на лунку на 96-луночные аналитические планшеты (Costar) для измерений числа клеток (цитотоксичности) или противовирусной активности. Вносили препараты, в 3-кратных концентрациях, в 6 лунок каждый, и проводили анализ в среде DMEM, 5% FBS (ФБР), 1% pen-strep, 1% глутамина. В качестве положительного контроля при каждом анализе применяли интерферон альфа-2b человека (PBL Biolabs, New Brunswick, NJ). По прошествии 72 часов после внесения препаратов клетки все еще были субконфлюентными. Противовирусную активность измеряли путем анализа активности люциферазы, синтезированной с репликона при использовании Steady-Glo Luciferase Assay System (Promega, Madison, WI) в соответствии с инструкциями производителя. Число клеток в каждой лунке определяли путем применения реагента CytoTox-1 (Promega). Профиль соединения получали путем вычисления соответствующих значений ЕС50 (эффективная концентрация, при которой вирусная репликация ингибируется на приблизительно 50%), ЕС90 (эффективная концентрация, при которой вирусная репликация ингибируется на приблизительно 90%), IC50 (концентрация, при которой выживаемость клеток снижается до 50%) и SI50 (индекс селекции: ЕС50/IC50). Значения IC50 для некоторых соединений приведены ниже в Таблице 5.
Способ В: исследование протеазы ВГС при помощи метода РПЭФ
[00352] Для определения ингибиторов протеазы ВГС NS3/4A применяли количественный метод на основе резонансного переноса энергии флуоресценции (РПЭФ, FRET). В анализе применяли синтетический пептид для РПЭФ, полученный на основе сайта разрезания NS5A/5B ВГС, с протеазой ВГС для оценки активности соединений против протеазы, осуществлявшейся путем измерения расщепляющей активности комплекса. В синтетический пептид, содержащий в своем составе участок соединения NS5A-5B (NH2-EDVVCCSMSYK-COOH), вносили метку Dabcyl (диметиламинофенилазобензойной кислоты) и Edans по N- и С-концам соответственно (Invitrogen, Carlsbad, CA). Для измерения величины IC50 анализируемого соединения осуществляли измерения флуоресценции. Два флуорофора образуют пару, гасящую флуоресценцию, и формируют РПЭФ внутри структуры интактного пептида. Флуоресценция восстанавливается после расщепления пептида, обнаруживающего РПЭФ, комплексом протеиназ ВГС NS3/4A (100 нг/мл), и возможно продолжительное измерение в спектре возбуждения/испускания = 340/490 нм.
Пример 15
Анализ Протеазы ВГС Методом РПЭФ, проводимый на Ферментах Дикого Типа и Мутанте NS3/4A 1b (IC50)
[00353] Для получения значений IC50, таких как значения для соединения 239, приведенные выше в Таблице 4. Протокол представляет собой модифицированный анализ на основе РПЭФ (v_02), взятый из In Vitro Resistance Studies of HCV Serine Protease Inhibitors, 2004, JBC, vol. 279, №17, p.17508-17514. Специфическую эффективность соединений измеряли в отношении мутантов A156S, А156Т, D168A и D168V протеолитического фермента ВГС NS3/4A 1b следующими способами:
[00354] 10Х раствор протеолитического фермента NS3/4A, Bioenza (Mountain View, CA) и 1.13X 5-FAM/QXL™520 субстрата пептида РПЭФ Anaspec (San Jose, CA) помещали в 50 мМ HEPES, pH 7.8, с 100 мМ NaCl, 5 мМ DTT и 20% глицеролом. 5 мкл каждого фермента подвергали предварительной инкубации на 384-луночных черных необработанных микротитровальных планшетах Corning (#3573) (Corning, NY) в течение 30 минут при 25°C с 0.5 мкл 50% ДМСО и соединениями согласно настоящему изобретению, разведенными в параллелях в 50% ДМСО. Реакции протеаз начинали с добавления 45 мкл субстрата для РПЭФ и в течение 120 минут проводили измерения λех487/λem514 при помощи монохроматоров Quad4 в планшет-ридере Synergy4, BioTek (Winooski, VT). По результатам каждого анализа динамические кривые, полученные для каждой лунки, оценивали по линейным характеристикам реакции и статистическим значениям соответствия (R2, абсолютная сумма квадратов). Начальную скорость (от 0 минут до 30+ минут) для каждой реакции определяли по уклону графика зависимости относительных единиц флуоресценции от времени (в минутах), после чего строили график зависимости концентрации ингибитора для оценки величины IC50, исходя из log[Ингибитор] vs Ответ, модель Вариабельного Уклона в GraphPad Prism, GraphPad Software (San Diego, CA).
[00355] В Таблице 5 показана активность некоторых соединений согласно настоящему изобретению в анализе методом РПЭФ. Номера соединений соответствуют номерам соединений в Таблице 3. Соединения, активность которых определена как "А", показывали IC50≤10 нМ; соединения, активность которых определена как "В", показывали IC50>10 нМ и ≤100 нМ; соединения, активность которых определена как "С", показывали IC50>100 нМ и ≤1000 нМ; соединения, активность которых определена как "D", показывали IC50>1000 нМ и <10000 нМ; и соединения, активность которых определена как "Е", показывали IC50≥10000 нМ.
Пример 16
Анализ методом РПЭФ Протеазы ВГС Дикого Типа и Мутанта Фермента NS3/4A 1b (IC50_APP).
[00356] Для получения величин "кажущихся" IC50 (IC50_APP), приведенных ниже в Таблице 6, следовали приведенному ниже протоколу, без привязки к какой-либо конкретной теории, считается, что IC50_APP, по сравнению с величинами IC50, могут предоставить более применимые показатели ингибирования в зависимости от времени, и, следовательно, лучше описывают связывающую способность. Протокол представляет собой модифицированный способ анализа на основе РПЭФ (v_03), разработанный с целью оценки эффективности соединений, порядка и профилей устойчивости в отношении протеазы ВГС NS3/4A 1b дикого типа и мутантов C159S, A156S, А156Т, D168A. D168V, R155K следующим способом: 10Х растворы протеолитического фермента NS3/4A, Bioenza (Mountain View, СА) и 1.13Х 5-FAM/QXL™520 FRET субстрата пептида, Anaspec (San Jose, СА) помещали в 50 мМ Tris-HCl, pH 7.5, 5 мМ DTT, 2% CHAPS и 20% глицерол. 5 мкл каждого фермента вносили на 384-луночные черные микротитровальные планшеты Corning (#3575) (Corning, NY) после нанесения 0.5 мкл 50% ДМСО и соединений, разведенных в параллелях, в 50% ДМСО. Реакции протеаз были начаты непосредственно после добавления фермента с добавлением 45 мкл субстрата РПЭФ, и измерения проводили в течение 60-90 минут при λех485/λem520 на планшет-ридере Synergy4, BioTek (Winooski, VT). По результатам каждого анализа динамические кривые, полученные для каждой лунки, оценивали по линейным характеристикам реакции и статистическим значениям соответствия (R2, 95% доверительные интервалы, абсолютная сумма квадратов). Начальную скорость (от 0 минут до 15+ минут) для каждой реакции определяли по уклону графика зависимости относительных единиц флуоресценции от времени (в минутах), после чего строили график зависимости от концентрации в виде процентной доли от значения для контролей в отсутствие ингибитора и фермента для оценки кажущихся величин IC50 по log[Ингибитор] vs Ответ, Модель Вариабельного Уклона в GraphPad Prism, GraphPad Software (San Diego, СА).
[00357] В таблице 6 показана активность некоторых соединений согласно настоящему изобретению в анализе методом РПЭФ. Номера соединений соответствуют номерам веществ в Таблице 3. Соединения, активность которых определена как "А", показали IC50≤10 нМ; соединения, активность которых определена как "В", показали IC50>10 нМ и ≤100 нМ; соединения, активность которых определена как "С", показали IC50>100 нМ и ≤1000 нМ; соединения, активность которых определена как "D", показали IC50>1000 нМ и <10000 нМ; соединения, активность которых определена как "Е", показали IC50≥10000 нМ.
Пример 17
[00358] Проводили масс-спектрометрический анализ ВГС дикого типа или варианта C159S в присутствии анализируемого соединения согласно изобретению. 100 пмоль ВГС дикого типа (Bioenza CA) инкубировали с анализируемым веществом в течение 1 часа и 3 часов при 10-кратном избытке (1-3) по отношению к белку. Отбирали аликвоты образца объемом 1 мкл (общий объем 4.24 мкл), разбавляли 10 мкл 0.1% ТФА, а затем при помощи наконечника пипетки ZipTip C4 наносили непосредственно на мишень MALDI с применением синапиновой кислоты в качестве матрицы для десорбции (10 мг/мл в 0.1%ТФА:ацетонитрил 50:50). Анализы проводили на масс-спектрометре Shimadzu Biotech Axima TOF2 (Shimadzu Instruments) с времяпролетной лазерной ионизацией и десорбцией из матрицы (MALDI-TOF). При помощи того же описанного выше способа анализировали 100 мМоль мутанта протеазы ВГС C159S в течение 3 часов при 10-кратном избытке (I-3) по отношению к белку.
Пример 18
Модификация Cys159 протеазы ВГС дикого типа с применением метода триптического расщепления
[00359] ВГС инкубировали с анализируемым соединением согласно настоящему изобретению I-3 в течение 3 часов перед проведением триптического расщепления. В качестве алкилирующего агента после завершения инкубации соединения применяли иодоацетамид. Для триптических гидролизатов разводили аликвоты образцов объемом 2 мкл (0.06 мкг/мкл) в 10 мкл 0.1% ТФА, а затем при помощи наконечника пипетки ZipTip С4 наносили непосредственно на мишень MALDI с применением альфа-циано-4-гидрокси-фенилакриловой кислоты в качестве матрицы (5 мг/мл в 0.1%ТФА:ацетонитрил 50:50).
[00360] Для анализа триптических гидролизатов прибор устанавливали в режим работы на отражение с применением установок быстрого вывода 1800. Калибрацию проводили при помощи стандарта Laser Biolabs Pep Mix (1046.54, 1296.69, 1672.92, 2093.09, 2465.20). Для анализа методом CID/PSD выбирали пептид с применением курсоров для установки временной регулировки ионных затворов и фрагментацию наблюдали при силе излучения лазера выше приблизительно на 20%, в качестве газа, применяемого для столкновения в CID, использовали Не. Калибровку для фрагментов проводили при помощи калибровки фрагментации P14R для Рефлектрона с искривленным полем.
Пример 19
[00361] Как показано на Фигурах 1 и 2, масс-спектрометрический анализ ВГС дикого типа в присутствии анализируемых соединений согласно настоящему изобретению I-1 и I-25 проводили в соответствии со следующим протоколом: NS3/4ABFC дикого типа (wt) инкубировали в течение часа при 10-кратном избытке анализируемого соединения по отношению к белку. Отбирали аликвоты образца объемом 2 мкл, разбавляли 10 мкл 0.1% ТФА, а затем при помощи наконечника пипетки ZipTip C4 наносили непосредственно на мишень MALDI с применением синапиновой кислоты в качестве матрицы для десорбции (10 мг/мл в 0.1%TFA:ацетонитрил 50:50). Для измерения массы интактного белка прибор устанавливали в линейный режим с применением установок быстрого вывода 24500, и стандартом для калибровки прибора служил апомиоглобин.
[00362] Как показано на Фигуре 1, в сравнении с белком в отсутствие вещества согласно изобретению, белок, предварительно инкубированный с соединением I-1 реагировал в значительной степени с образованием новых частиц при MW 25218 Да, что является приблизительно на 751 Да тяжелее и сопоставимо с массой соединения I-1 составляющей 747 Да.
[00363] Как показано на Фигуре 2, через 1 час протекания реакции, наблюдали переход на новый пик при МН+ 25,240 Да, что является на 773 Да тяжелее, и сопоставимо с массой соединения I-25.
[00364] Соединения I-2, I-5, I-6, I-8, I-9, I-10, I-13, I-19, I-20, I-22, I-23, I-24, I-26 и I-27 исследовали аналогичным способом в соответствии со способами, описанными в Примере 17, и в ходе исследований наблюдали значительную модификацию NS3/4ABFC дикого типа.
Пример 20
[00365] Как изображено на Фигурах 4, 5, 6 и 7, проводили масс-спектрометрический анализ мутантов ВГС в присутствии соединения I-11. Мутанты ВГС (A156S), (R155K), (D168A), (А156Т) и (D168V) инкубировали в течение 3 часов при 10× избытке анализируемого соединения согласно настоящему изобретению по отношению к белку. Аликвоты образцов объемом 2 мкл разводили в 10 мкл 0.1% ТФА, а затем при помощи наконечника пипетки ZipTip С4 наносили непосредственно на мишень MALDI с применением синапиновой кислоты в качестве матрицы для десорбции (10 мг/мл в 0.1%ТФА:ацетонитрил 50:50). Для измерения массы интактного белка прибор устанавливали в линейный режим с применением установок быстрого вывода 24500, и стандартом для калибровки прибора служил апомиоглобин.
[00366] Как показано на Фигуре 4, для мутанта ВГС (D168V) наблюдали полное превращение через три часа протекания реакции. Различия по массе между новыми формами и не вступившим в реакцию мутантом сопоставимы с массой соединения I-11.
[00367] Как показано на Фигуре 5, для мутанта ВГС(А1568) наблюдали полное превращение через три часа протекания реакции. Различия по массе между новыми формами и не вступившим в реакцию мутантом сопоставимы с массой соединения I-11.
[00368] Как показано на Фигуре 6, для мутанта ВГС (R155K) наблюдали полное превращение через три часа протекания реакции. Различия по массе между новыми формами и не вступившим в реакцию мутантом сопоставимы с массой соединения I-11.
[00369] Как показано на Фигуре 7, для мутанта ВГС (А156Т) наблюдали полное превращение через три часа протекания реакции. Различия по массе между новыми формами и не вступившим в реакцию мутантом сопоставимы с массой соединения I-11.
[00370] Соединения I-19 и I-24 исследовали аналогично. В соответствии со способами, описанными в Примере 18, и в ходе исследований наблюдали значительную ковалентную модификацию NS3/4A ВГС D168A.
Пример 21
Культура клеток
[00371] Huh-luc/neo-ET, Huh7-Lunet получали в ReBLikon Gmbh (Heidelberg, Germany). Клетки выращивали в модифицированной по методу Дульбекко среде Игла (DMEM; Invitrogen), с добавлением 2 мМ L-глутамина, заменимых аминокислот, 100 мкл пенициллина/мл, 100 мкг стрептомицина/мл и 10% эмбриональной бычьей сыворотки. G418 (Geneticin; Invitrogen) добавляли в итоговой концентрации 400 мкг/мл. Huh7-Lunet выращивали в отсутствие G418.
Пример 22
Мутантные конструкции
[00372] Конструкции, несущие клинически значимые мутации, создавали путем сайт-направленного мутагенеза в плазмиде pFK-I389-luc-ubi-neo-NS3-3'ET (ReBLikon Gmbh (Heidelberg, Germany)), при помощи Набора для Сайт-Направленного Мутагенеза QuickChange II (Stratagene, La Jolla, CA) в соответствии с инструкциями производителя и с применением праймеров, описанных ниже в таблице 7.
Пример 23
Транскрипция in vitro
[00373] In vitro транскрипты ±цепей ВГС создавали в соответствии с протоколом, описанным у Lohmann V et al., J. Virol., 77:3007-3019, 2003. Для транскрипции ±цепей РНК ВГС, плазмидную ДНК (pFK I341 PI-Luc/NS3-3'/ET, полученную в ReBLikon Gmbh (Heidelberg, Germany)), последовательно подвергали воздействию AseI и Sca1. После расщепления рестриктазами экстрагировали ДНК при помощи фенола и хлороформа, осаждали при помощи этанола и растворяли в воде в отсутствие РНКаз. Реакционная смесь для транскрипции in vitro состояла из 80 мМ HEPES (рН 7.5), 12 мМ MgCl2, 2 мМ спермидина, 40 мМ дитиотреитола, 3.125 мМ концентраций каждого нуклеозид трифосфата, 1 мкл РНазин. Для реакции брали 5 мкг рестрицированнной плазмидной ДНК и 80 мкл РНК-полимеразы Т7 (Promega). Через 2 часа инкубации полимеразы при 37°С вносили дополнительные 40 мкл Т7 и реакционную смесь инкубировали в течение еще 2 часов. Терминацию транскрипции осуществляли путем внесения 1 мкл ДНказы в отсутствие РНКаз (Promega) на мкг плазмидной ДНК, после которого инкубировали смесь в течение 30 минут при 37°С. После экстракции при помощи фенола и хлороформа РНК осаждали при помощи изопропанола и растворяли в воде в отсутствие РНКаз. Концентрацию определяли путем измерения оптической плотности при 260 нм (OD260) и целостность РНК проверяли путем электрофореза в денатурирующем агарозном геле.
Пример 24
Трансфекция полноразмерного генома ВГС и селекция стабильных линий клеток
[00374] 7×104 Huh7-Lunet клеток культивировали в течение ночи на 12-луночном планшете, на следующий день трансфицировали 1 мкг РНК на лунку с применением набора Mirus Tx (Madison, WI). Трансфекцию осуществляли в соответствии с инструкциями производителя и через 24 часа после трансфекции клетки подвергали анализу люциферазы или селекции при помощи G418 (400 мкг/мл) с получением стабильных линий клеток.
Пример 25
Ингибирование Автопротеолиза Протеазы
[00375] Клетки Huh-7-Luc-Neo-ET помещали в Среду для Анализа Структуры Репликона (RPMI с добавлением 5% ФБР, IX заменимых аминокислот и пенициллина/стрептомицина) с плотностью клеток 1×105 клеток в лунке на 12-луночные планшеты. Через восемь часов среду удаляли и замещали на 1 мл среды, содержащей анализируемое соединение согласно настоящему изобретению (5 лунок на соединение) и 0.02% ДМСО, поле чего клетки возвращали в инкубатор на ночь. По прошествии шестнадцати часов 1 лунку для каждого соединения и 1 необработанную лунку промывали ФБР, затем клетки лизировали и соскабливали в 30 мкл Буфера для Клеточной Экстракции (Biosource, Camarillo, СА) с добавлением Полного Ингибитора Протеаз (Roche, Indianapolis, IN). Остальные лунки дважды промывали ФБР и затем заполняли Средой для Анализа Структуры Репликона и помещали обратно в инкубатор. Клетки промывали один раз каждый час путем удаления старой среды и замещения ее на свежую среду и лизировали и собирали через 4, 12, 24 и 48 часа после первого сбора клеток.
[00376] Лизаты клеток разделяли при помощи SDS-Page (4-20%) и переносили на мембрану Immobilon-P PVDF (Millipore Corporation, MA) и проводили блоттинг при помощи моноклональных антител к NS3 (Bioenza, CA). Блоты сканировали при помощи инфракрасного сканера Odyssey, Licor и бэнд FL и продукты расщепления подсчитывали отдельно при помощи Licor software, снабженного сканером. Продукт расщепления высчитывали как процент от общего содержания NS3 в каждом образце по отношению к контролю ДМСО таким образом, что контроль ДМСО отражает 100% активность.
Результаты и обсуждения
[00377] В результате ингибирования активности протеазы, автопротеолиза не происходит и единственными обнаруживаемыми белковыми частицами являются холоферменты. Через 16 часов непрерывного воздействия на клетки, несущие репликон, соединением-ингибитором NS3 продукты автопротеолиза не обнаруживали в подвергнутых обработке образцах, но их с легкостью обнаруживали в необработанных клетках, несущих репликон, применявшихся в качестве контроля. Продленный срок действия демонстрировали путем подвергания клеток, несущих репликон, воздействию ингибитора протеазы в течение 16 часов, после чего соединение согласно настоящему изобретению удаляли и клетки, несущие репликон, подвергали повторным отмывкам в течение еще нескольких часов. Ковалентные необратимые ингибиторы NS3 показали устойчивое ингибирование внутренней автопротеолитической активности NS3 в течение срока до 48 часов, в то время как при применении обратимых соединений автопротеолитическая активность протеазы быстро восстанавливалась (Фигура 8).
[00378] Фигура 8 показывает, что продукты внутреннего автопротеолиза NS3 ингибируются при воздействии на клетки, несущие репликон, Соединением I-47 в течение 16 часов.
[00379] На Фигуре 9 приведен необратимый ковалентный ингибитор (соединение I-11) протеазы NS3, показавший продленный срок ингибирования активности протеазы NS3 в клетках дикого типа, несущих репликон, который измеряли по величине автопротеолиза, после удаления указанного соединения. Соединение инкубировали с клетками, несущими репликон, в течение 16 часов, после чего соединение удаляли (временная точка 0). Даже в течение срока до 48 часов после удаления необратимого ковалентного ингибитора NS3 степень ингибирования автопротеолитической активности NS3 достигала, по меньшей мере, 50%, в то время как при применении препарата с обратимым действием, VX-950, практически полное возвращение активности наблюдали уже через 4 часа после удаления указанного препарата.
[00380] На Фигуре 10 приведен необратимый ковалентный ингибитор (соединение I-25) протеазы NS3, показавший увеличенный срок ингибирования активности протеазы NS3 в клетках дикого типа, несущих репликон, который измеряли по величине автопротеолиза, после удаления указанного соединения. Указанное соединение инкубировали с клетками, несущими репликон, в течение 16 часов, после чего соединение удаляли (временная точка 0). Даже в течение срока до 48 часов после удаления необратимого ковалентного ингибитора NS3, степень ингибирования автопротеолитическая активности NS3 достигала по меньшей мере 40%, в то время как при применении препарата с обратимым действием, VX-950, практически полное возвращение активности наблюдали уже через 4 часа после удаления препарата.
Пример 26
Анализ с применением Люциферазной системы
[00381] Соединения согласно настоящему изобретению исследовали с целью оценки противовирусной активности и цитотоксичности соединений в ходе анализа активности люциферазы, синтезированной с репликона. В анализе применяли линию клеток ЕТ (luc-ubi-neo/ET), представляющую собой линию клеток Huh7 гепатомы человека, содержащую РНК репликон ВГС с устойчивым репортером люциферазы (Luc) и мутациями, несущими адаптивный характер для клеток. Линию клеток ЕТ культивировали в инкубаторе с 5% CO2 при 37°С в модифицированной питательной среде Дульбекко (DMEM) с добавлением 2 мМ L-глутамина, заменимых аминокислот, 100 мкл пенициллина/мл, 100 мкг стрептомицина/мл и 10% эмбриональной бычьей сыворотки. G418 (Geneticin; Invitrogen) добавляли в итоговой концентрации 400 мкг/мл.
[00382] Все реагенты для культур клеток получали из Invitrogen (Carlsbad). Клетки трипсинизировали (1% трипсин:ЭДТА) и помещали в концентрации 5×103 клеток в лунке на 96-луночные аналитические планшеты (Costar) с целью измерения числа клеток (цитотоксичность) или исследования противовирусной активности. Анализируемые соединения добавляли в 3-кратной концентрации в 6 лунок каждое и анализ проводили в среде DMEM, 5% ФБР, 1% пен-стреп, 1% глутамин, 1% заменимые аминокислоты. В качестве положительного контроля в каждой постановке применяли интерферон альфа-2b человека (PBL Biolabs, New Brunswick, NJ). По прохождении 72 часов обработки клеток, после внесения анализируемого соединения, клетки были все субконфлюэнтными. Антивирусную активность измеряли путем анализа активности люциферазы, синтезированной с репликона, при применении Системы Анализа Люциферазы Steady-Glo (Promega, Madison, WI) в соответствии с инструкциями производителя. Число клеток в каждой лунке определяли при помощи Анализа Титра Клеток Blue (Promega). Профиль соединения получали путем вычисления соответствующих величин ЕС50 (эффективная концентрация, при которой степень ингибирования репликации вируса достигает приблизительно 50%), ЕС90 (эффективная концентрация, при которой степень ингибирования репликации вируса достигает приблизительно 90%), IC50 (концентрация, снижающая жизнеспособность клеток приблизительно до 50%) и SI50 (селективный индекс: EC50/IC50).
[00383] Хотя описано несколько вариантов реализации настоящего изобретения, очевидно, что основные приведенные примеры можно видоизменить с созданием других вариантов реализации, предусматривающих применение соединений и способов согласно настоящему изобретению. Таким образом, следует понимать, что объем изобретения определяется прилагаемой формулой, а не отдельными вариантами реализации, представленными в примерах.
Реферат
Изобретение относится к соединениям, которые могут использоваться в качестве ингибиторов протеазы вируса гепатита C, фармацевтическим композициям, которые содержат указанные соединения, и способам их применения. 9 н. и 32 з.п. ф-лы, 10 ил., 7 табл., 26 пр.
Формула
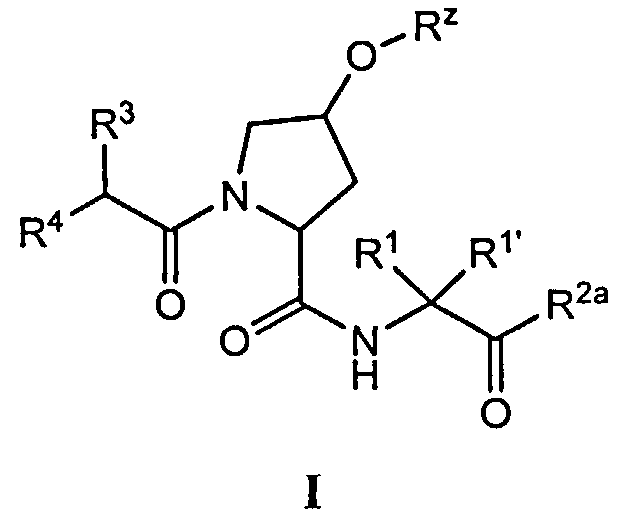
или фармацевтически приемлемая соль указанного соединения, где:
R1 и R1' независимо представляют собой водород или C1-6 алифатическую группу, или R1 и R1' совместно образуют 3-7-членное карбоциклическое кольцо, необязательно замещенное С1-6 алкилом или С2-6 алкенилом;
R2а представляет собой -NHSO2R2;
R2 представляет собой С3-7 циклоалкил;
каждый R независимо представляет собой водород или C1-6 алифатическую группу, необязательно замещенную оксогруппой или галогеном;
R3 представляет собой головную группу -L-Y, где -L-Y выбрана из следующего:
(a) L представляет собой двухвалентную линейную или разветвленную C2-8 углеводородную цепь, где L содержит по меньшей мере одну двойную связь, и одно или два дополнительных метиленовых звена в L независимо заменены на функциональную группу, выбранную из -NRC(O)-, -N(R)SO2-, -ОС(O)- или -С(O)-, где по меньшей мере одна двойная связь находится в альфа-бета положении по отношению к карбонильной или -SO2-функциональной группе; и Y представляет собой водород или C1-6 алифатическую группу; или
(b) L представляет собой двухвалентную линейную или разветвленную С2-8 углеводородную цепь, где L содержит по меньшей мере одну двойную связь, и по меньшей мере одно метиленовое звено в L заменено на функциональную группу, выбранную из -С(O)-, -NRC(O)-, -N(R)SO2- или -ОС(O)-, где по меньшей мере одна двойная связь находится в альфа-бета положении по отношению к карбонильной или -SO2-функциональной группе, и одно или два дополнительных звена в L необязательно и независимо заменены на -О-, -N(R)- или -С(O)-; и Y представляет собой водород или C1-6 алифатическую группу; или
(с) L представляет собой двухвалентную линейную или разветвленную С2-8 углеводородную цепь, где L содержит по меньшей мере одну двойную связь, и по меньшей мере одно метиленовое звено в L заменено на функциональную группу, выбранную из -С(O)-, где по меньшей мере одна двойная связь находится в альфа-бета положении по отношению к карбонильной функциональной группе, и одно или два дополнительных метиленовых звена в L необязательно и независимо заменены на -О-, -N(R)- или -С(O)-; и Y представляет собой водород или C1-6 алифатическую группу; или
(h) L представляет собой двухвалентную линейную или разветвленную C2-8 углеводородную цепь, где L содержит по меньшей мере одну алкилиденильную двойную связь, и по меньшей мере одно метиленовое звено в L заменено на функциональную группу, выбранную из -ОС(O)- или -С(O)-, где по меньшей мере одна двойная связь находится в альфа-бета положении по отношению к карбонильной функциональной группе, и одно или два дополнительных метиленовых звена в L необязательно и независимо заменены на -О-, -N(R)- или -С(O)-; и Y представляет собой водород или C1-6 алифатическую группу; или
(l) L представляет собой ковалентную связь, и Y выбран из:
(ii) C2-6 алкенила, замещенного оксогруппой и возможно замещенного галогеном; или
(iii) С2-6 алкинила, замещенного оксогруппой; или
(iv) насыщенного 3-4-членного гетероциклического кольца, содержащего 1 гетероатом, выбранный из азота, где указанное кольцо замещено 1-2 группами Re; или
(iх) частично ненасыщенного 3-6-членного карбоциклического кольца, где указанное кольцо замещено 1-4 группами Re; или
(m) L представляет собой -С(O)-, и Y выбран из:
(i) C1-6 алкила, замещенного галогеном; или
(ii) C2-6 алкенила; или
(n) L представляет собой -N(R)C(O)-, и Y выбран из:
(i) C1-6 алкила, замещенного галогеном; или
(ii) C2-6 алкенила; или
(xiii) 6-членного ароматического кольца, где указанное кольцо замещено 1-4 группами Re; или
(о) L представляет собой двухвалентную C1-8 насыщенную или ненасыщенную линейную или разветвленную углеводородную цепь; и Y выбран из:
(ii) С2-6 алкенила, замещенного оксогруппой; или
(iii) С2-6 алкинила, замещенного оксогруппой; или
(р) L представляет собой -СН2-, -NH-, -С(O)- или -CH2NH-; и Y выбран из:
(i) -СН2Сl; или
(ii) C2-6 алкенила, замещенного оксогруппой и возможно замещенного галогеном; или
(iii) C2-6 алкинила, замещенного оксогруппой; или
(iv) насыщенного 3-4-членного гетероциклического кольца, содержащего 1 гетероатом, выбранный из азота, где указанное кольцо замещено 1-2 группами Re; или
(vii) насыщенного 3-6-членного карбоциклического кольца, где указанное кольцо замещено 1-4 группами Re; или
(xiii) 6-членного ароматического кольца, содержащего 0-2 азота, где указанное кольцо замещено 1-4 группами Re;
где каждый Re независимо выбран из -Q-Z, оксо, NO2 или галогена:
Q представляет собой двухвалентную ненасыщенную линейную или разветвленную C1-6 углеводородную цепь, причем одно или два метиленовых звена в Q необязательно и независимо заменены на -О- или -С(O)-, и
Z представляет собой водород или C1-6 алифатическую группу;
или R3 и R1 совместно с находящимися между ними атомами образуют возможно замещенное насыщенное или ненасыщенное 12-18-членное кольцо, содержащее от 2 до 6 гетероатомов, которые независимо выбраны из азота, кислорода или серы, причем образованное кольцо содержит -L-Y; или
R3 и кольцо, образованное R1 и R1' совместно с находящимися между ними атомами, образуют возможно замещенное, насыщенное или ненасыщенное 12-18-членное кольцо, содержащее от 2 до 6 гетероатомов, которые независимо выбраны из азота, кислорода или серы, причем указанное кольцо содержит головную группу -L-Y;
R4 представляет собой Н, -NHC(O)R5, -NHC(O)OR6 или группу боковой цепи природной или неприродной аминокислоты, причем указанная группа боковой цепи представляет собой метил или изопропил;
каждый R5 независимо представляет собой C1-6 алифатическую группу или мостиковый бицикл, замещенный -(CH2)0-4C(O)R°, где R° представляет собой C1-6 алифатическую группу;
R6 представляет собой C1-6 алифатическую группу; и
Rz представляет собой
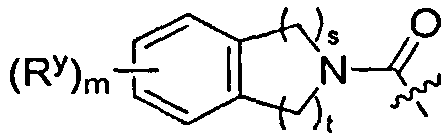
где указанное 16-22-членное кольцо возможно замещено (Rm)p, где:
р представляет собой целое число от 1 до 6 включительно; и
в каждом случае Rm независимо представляет собой C1-6 алифатическую группу; и
в каждом случае Ry независимо выбран из галогена или C1-4 алифатической группы; и
m представляет собой целое число от 0 до 4 включительно;
s представляет собой целое число от 0 до 4 включительно;
t представляет собой целое число от 0 до 4 включительно;
где сумма s и t не равна нулю.



где каждый Re независимо представляет собой галоген.

или фармацевтически приемлемая соль указанного соединения, где:
R1 и R1' независимо представляют собой водород или C1-6 алифатическую группу, или R1 и R1' совместно образуют 3-7-членное карбоциклическое кольцо, необязательно замещенное C1-6 алкилом или С2-6 алкенилом;
R2a представляет собой -NHSO2R2;
R2 представляет собой С3-7 циклоалкил;
каждый R независимо представляет собой водород или С1-6 алифатическую группу, необязательно замещенную оксогруппой или галогеном;
R3 представляет собой -L-Y, где:
L представляет собой двухвалентную насыщенную или ненасыщенную линейную или разветвленную C1-8 углеводородную цепь, причем одно, два или три метиленовых звена в L необязательно и независимо заменены на -С(O)-;
Y представляет собой 3-10-членное моноциклическое насыщенное или частично ненасыщенное кольцо; и
R4 представляет собой Н, -NHC(O)R5, -NHC(O)OR6 или группу боковой цепи природной или неприродной аминокислоты, причем указанная группа боковой цепи представляет собой метил или изопропил;
каждый R5 независимо представляет собой C1-6 алифатическую группу или мостиковый бицикл, замещенный -(СН2)0-4С(O)R°, где R° представляет собой C1-6 алифатическую группу;
R6 представляет собой С1-6 алифатическую группу; и
Rz представляет собой

где указанное 16-22-членное кольцо возможно замещено (Rm)p, где:
р представляет собой целое число от 1 до 6 включительно; и
в каждом случае Rm независимо представляет собой C1-6 алифатическую группу; и
в каждом случае Ry независимо выбран из галогена или С1-4 алифатической группы; и
m представляет собой целое число от 0 до 4 включительно;
s представляет собой целое число от 0 до 4 включительно;
t представляет собой целое число от 0 до 4 включительно;
где сумма s и t не равна нулю.


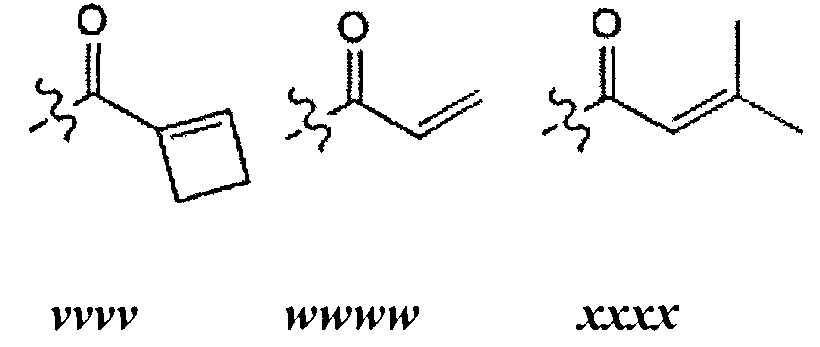
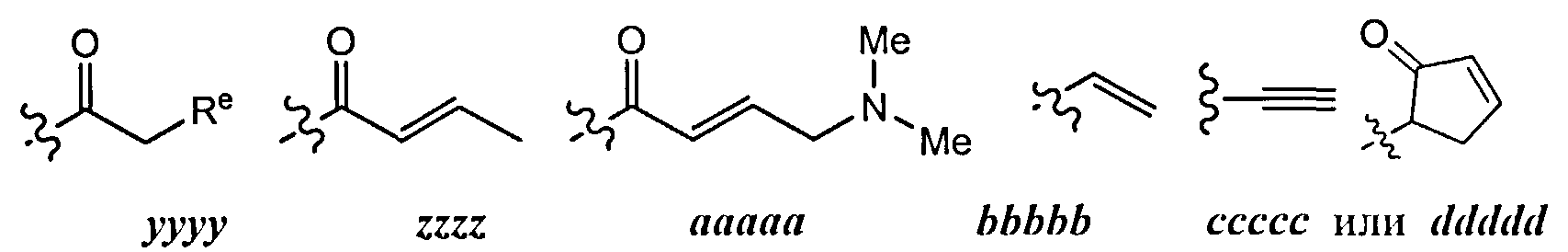
где каждый Re независимо представляет собой галоген.
L представляет собой двухвалентную линейную или разветвленную C2-8 углеводородную цепь, причем L содержит по меньшей мере одну двойную связь, и по меньшей мере одно метиленовое звено в L заменено на функциональную группу, выбранную из -NRC(O)-, -N(R)SO2-, -ОС(O)- или -С(O), где по меньшей мере одна двойная связь находится в альфа-бета положении по отношению к карбонильной или -SO2-функциональной группе, и одно или два дополнительных метиленовых звена в L необязательно и независимо заменены на -О-, -N(R)- или -С(O)-;
Y представляет собой водород или C1-6 алифатическую группу.
L представляет собой двухвалентную линейную или разветвленную C2-8 углеводородную цепь, причем L содержит по меньшей мере одну двойную связь, и по меньшей мере одно метиленовое звено в составе L заменено на функциональную группу, выбранную из -С(O)-, -NRC(O)-, -N(R)SO2- или -ОС(O)-, где по меньшей мере одна двойная связь находится в альфа-бета положении по отношению к карбонильной или -SO2-функциональной группе, и одно или два дополнительных метиленовых звена в L необязательно и независимо заменены на -О-, -N(R)- или -С(O)-; и
Y представляет собой водород или С1-6 алифатическую группу.

или фармацевтически приемлемая соль указанного соединения, где:
R1 и R1' независимо представляют собой водород или C1-6 алифатическую группу, или R1 и R1' совместно образуют 3-7-членное карбоциклическое кольцо, необязательно замещенное С1-6 алкилом или С2-6 алкенилом;
R2a представляет собой -NHSO2R2;
R2 представляет собой С3-7 циклоалкил;
каждый R независимо представляет собой водород или C1-6 алифатическую группу, необязательно замещенную оксогруппой или галогеном;
R3 представляет собой -L-Y, где L представляет собой ковалентную связь, -CH2-, -NH-, -C(O)-, -CH2NH- или двухвалентную, насыщенную или ненасыщенную, линейную или разветвленную C1-8 углеводородную цепь, и Y выбран из C2-6 алкинила, замещенного оксогруппой;
R4 представляет собой Н, -NHC(O)R5, -NHC(O)OR6 или боковую группу природной или неприродной аминокислоты, причем указанная боковая цепь представляет собой метил или изопропил;
каждый R5 независимо представляет собой C1-6 алифатическую группу или соединенный мостиком бицикл, замещенный -(CH2)0-4C(O)R°, где R° представляет собой C1-6 алифатическую группу;
R6 представляет собой C1-6 алифатическую группу;
Rz представляет собой

где указанное 16-22-членное кольцо возможно замещено (Rm)p, где:
р представляет собой целое число от 1 до 6 включительно; и
в каждом случае Rm независимо представляет собой C1-6 алифатическую группу; и в каждом случае Ry независимо выбран из галогена или С1-4 алифатической группы; и
m представляет собой целое число от 0 до 4 включительно;
s представляет собой целое число от 0 до 4 включительно;
t представляет собой целое число от 0 до 4 включительно;
где сумма s и t не равна нулю

или фармацевтически приемлемая соль указанного соединения, где:
R1 и R1' независимо представляют собой водород или C1-6 алифатическую группу или R1 и R1' совместно образуют 3-7-членное карбоциклическое кольцо, необязательно замещенное C1-6алкилом или С2-6 алкенилом;
R2a представляет собой -NHSO2R2;
R2 представляет собой С3-7 циклоалкил;
каждый R независимо представляет собой водород или C1-6 алифатическую группу, необязательно замещенную оксогруппой или галогеном;
R3 представляет собой -L-Y, где L представляет собой -СН2-, -NH-, -С(O)- или -CH2NH-; и Y выбран из
(i) -CH2Cl; или
(ii) С2-6 алкенила, замещенного оксогруппой и возможно замещенного галогеном; или
(iii) С2-6 алкинила, замещенного оксогруппой; или
(iv) насыщенного 3-4-членного гетероциклического кольца, содержащего 1 гетероатом, выбранный из азота, причем указанное кольцо замещено 1-2 группами Re; или
(vii) насыщенного 3-6-членного карбоциклического кольца, где указанное кольцо замещено 1-4 группами Re; или
(хiii) 6-членного ароматического кольца, содержащего 0-2 атома азота, где указанное кольцо замещено 1-4 группами Re;
R4 представляет собой Н, -NHC(O)R5, -NHC(O)OR6 или боковую группу природной или неприродной аминокислоты, причем указанная боковая цепь представляет собой метил или изопропил;
каждый R5 независимо представляет собой C1-6 алифатическую группу или соединенный мостиком бицикл, замещенный -(CH2)0-4C(O)R°, где R° представляет собой С1-6 алифатическую группу;
R6 представляет собой C1-6 алифатическую группу;
Rz представляет собой

где указанное 16-22-членное кольцо возможно замещено (Rm)p, где:
р представляет собой целое число от 1 до 6 включительно; и
в каждом случае Rm независимо представляет собой C1-6 алифатическую группу; и в каждом случае Ry независимо выбран из галогена или С1-4 алифатической группы; и
m представляет собой целое число от 0 до 4 включительно;
s представляет собой целое число от 0 до 4 включительно;
t представляет собой целое число от 0 до 4 включительно;
где сумма s и t не равна нулю.


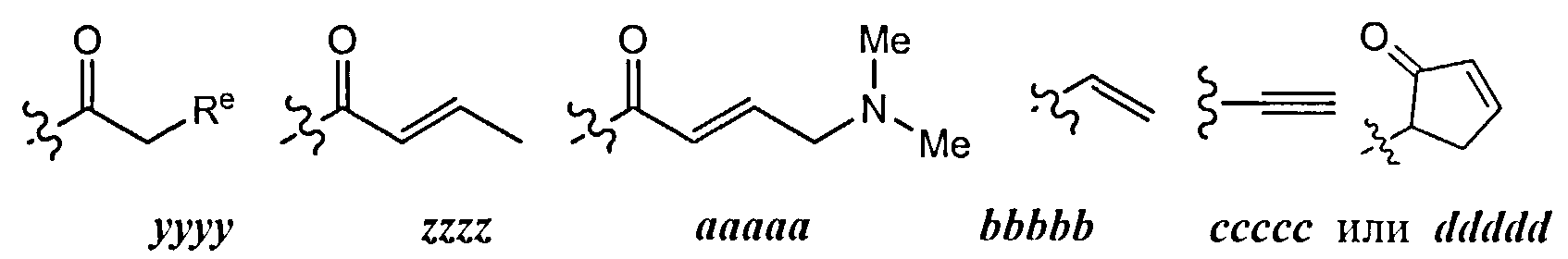
где каждый Re независимо представляет собой галоген.

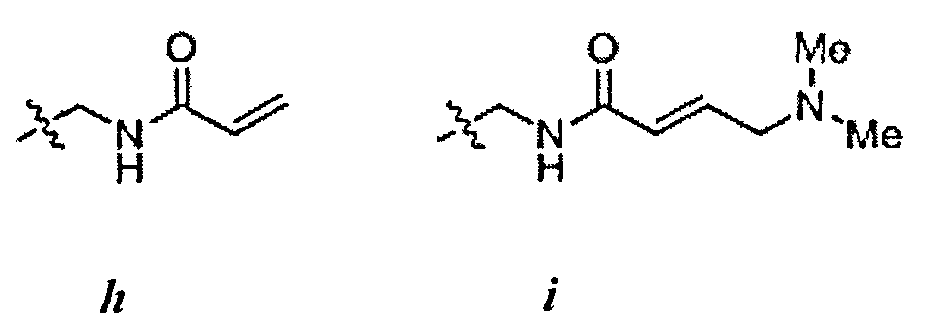

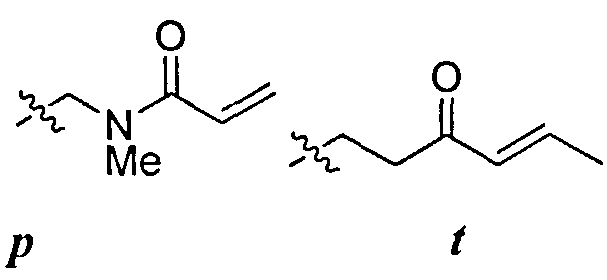

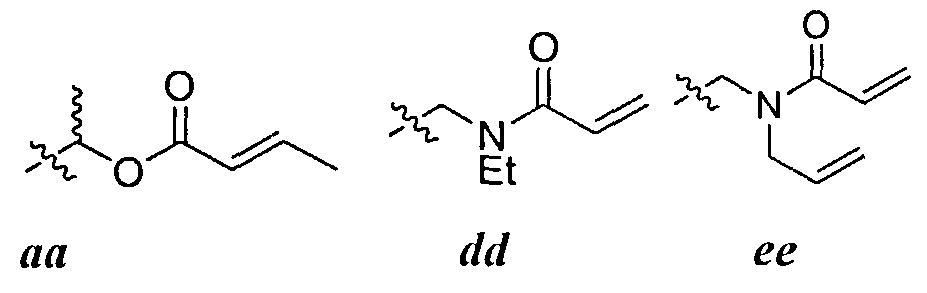







или фармацевтически приемлемая соль указанного соединения.
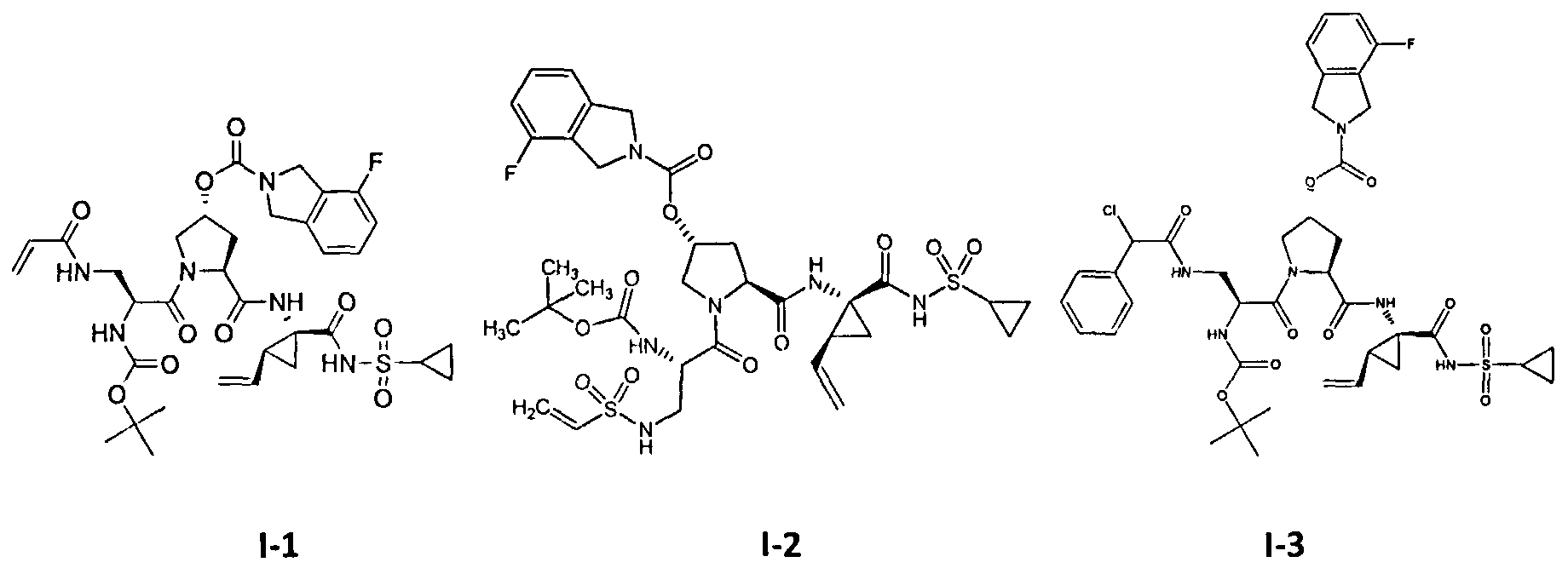





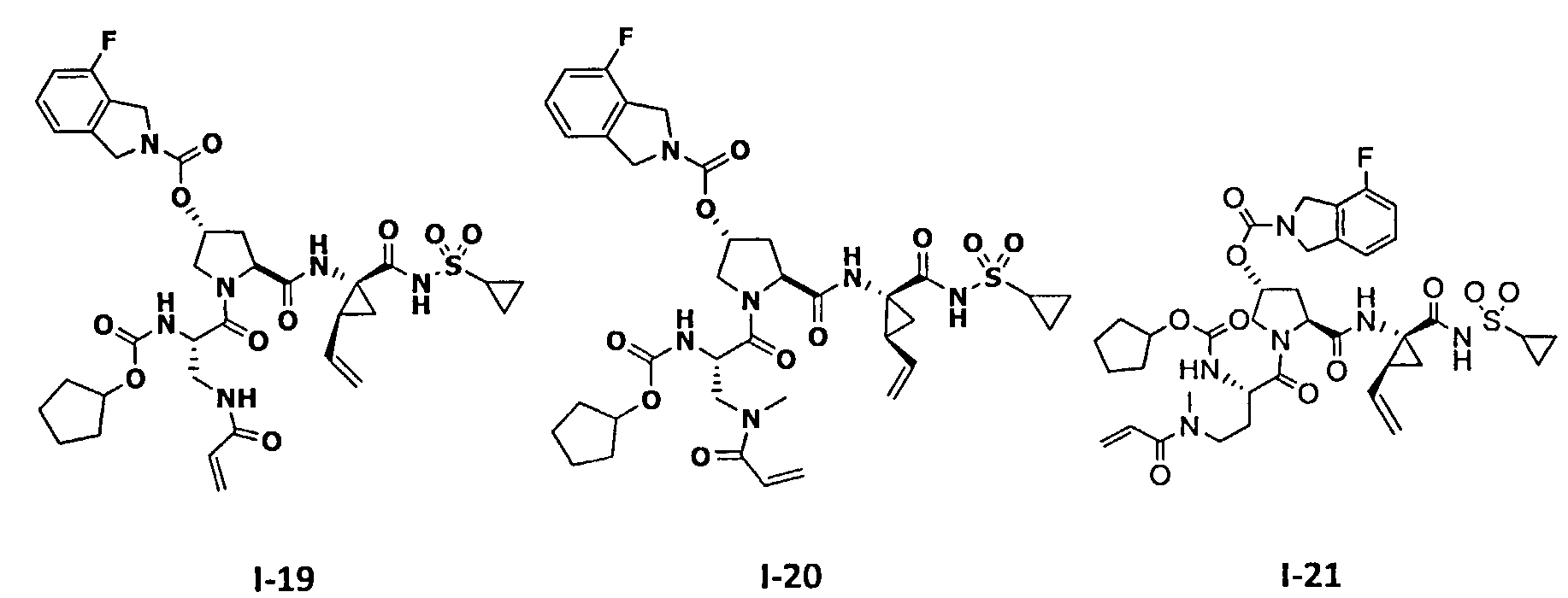



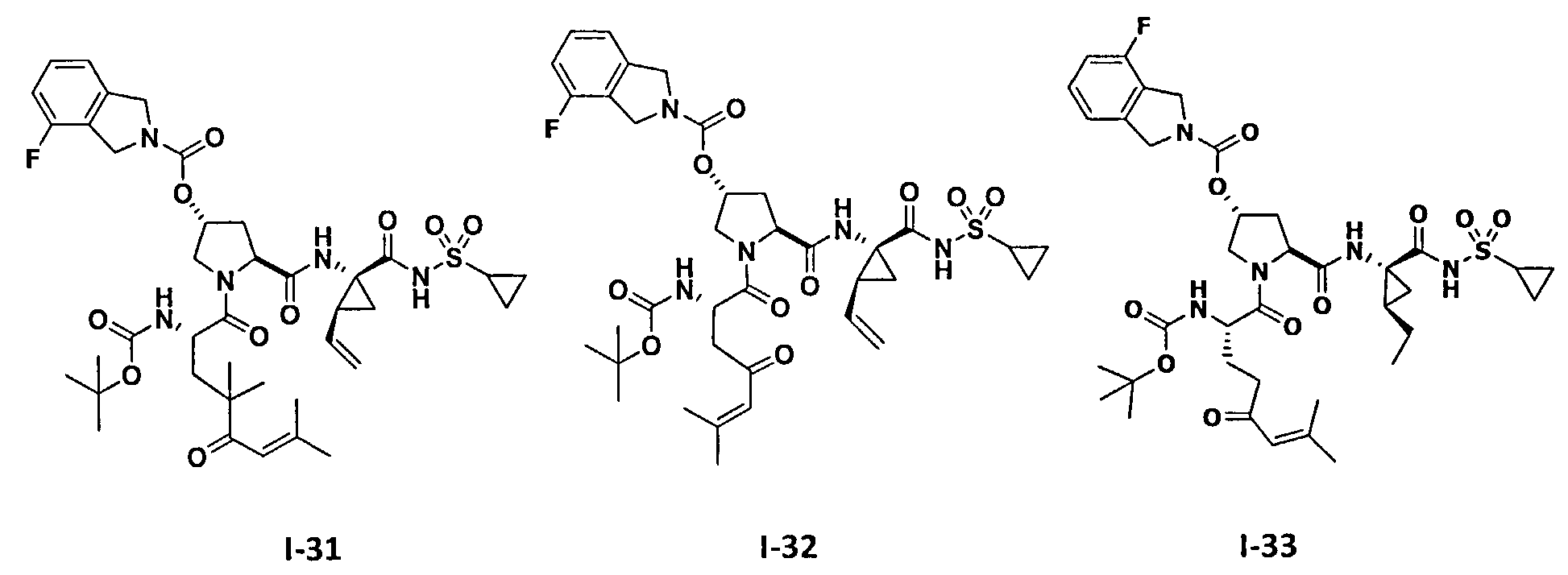






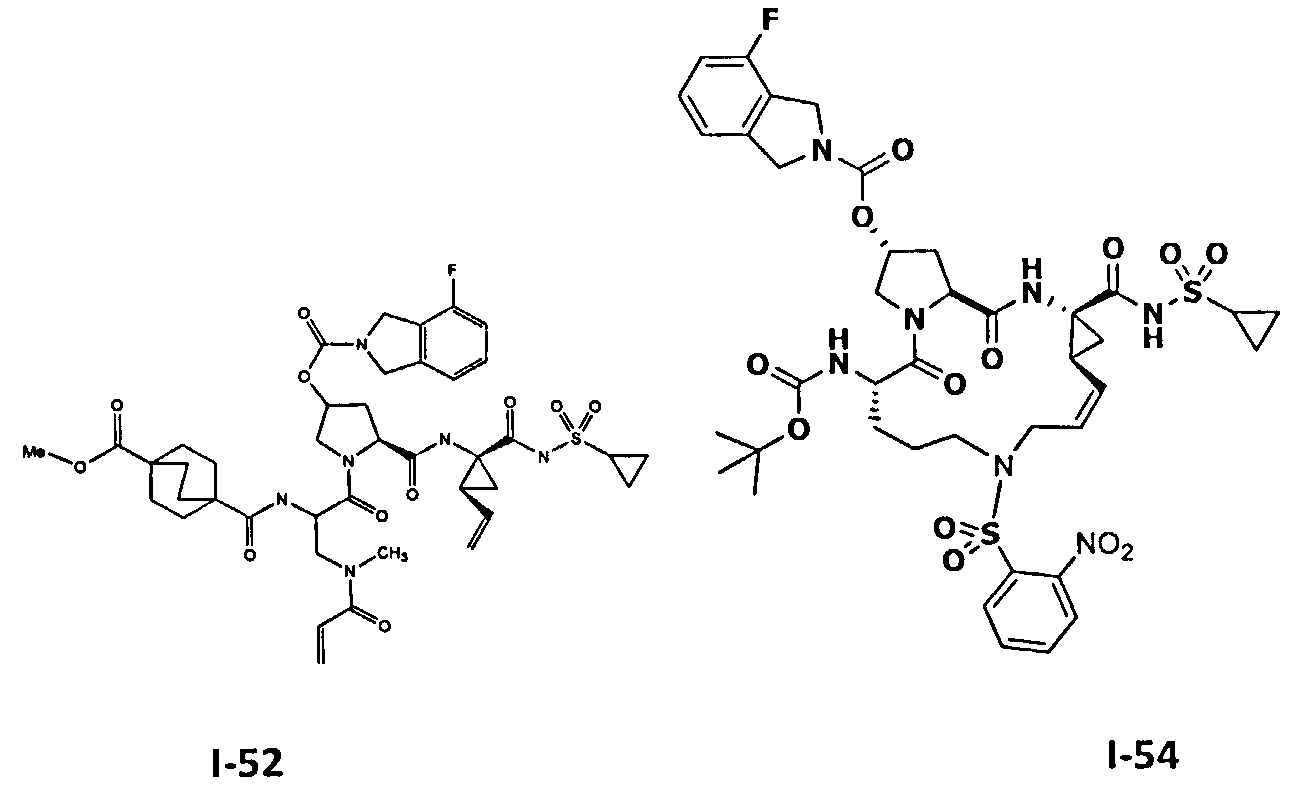



или их фармацевтически приемлемая соль.


или фармацевтически приемлемая соль указанного соединения, где
р представляет собой целое число от 0 до 6 включительно; и
каждый из Rm независимо представляет собой: галоген, -OR°; -CN; -N(R°)2; или возможно содержащую заместители группу, выбранную из следующих: C1-6 алифатическая группа и С3-7 циклоалкил; и
R° представляет собой возможно содержащую заместители группу, выбранную из C1-6 алифатических групп.
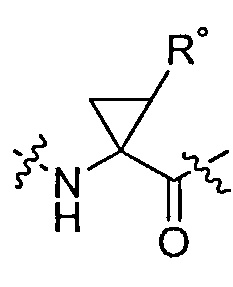
где R° представляет собой возможно содержащую заместители группу, выбранную из С1-6 алифатических групп.
Документы, цитированные в отчёте о поиске
Ингибиторы вируса гепатита с


Комментарии