Пролекарства нестероидных противовоспалительных средств (nsaia) c очень высокой скоростью проникновения через кожу и мембраны и новые медицинские применения указанных пролекарств - RU2509076C2
Код документа: RU2509076C2
Чертежи

Описание
Область техники
Настоящее изобретение относится к разработке и получению положительно заряженных и водорастворимых пролекарств нестероидных противовоспалительных средств (nonsteroidal anti-inflammatory agents, NSAIA) с очень высокой скоростью проникновения через кожу, для лечения шрамов и преодоления барьера кровь-молоко, гематоэнцефалического барьера и новым медицинским применениям указанных пролекарств для лечения и предотвращения диабета (I и II типа), аномальных уровней глюкозы и липидов в крови, удара, сердечного приступа и других сердечно-сосудистых заболеваний, болезни Альцгеймера, болезни Паркинсона и других нейродегенеративных заболеваний, псориаза, дискоидной красной волчанки, системной красной волчанки (SLE), аутоиммунного гепатита, склеродермии, синдрома Шегрена, ревматоидного артрита, полимиозита, склеродермии, тиреоидита Хашимото, ювенильного сахарного диабета, болезни Аддисона, витилиго, пернициозной анемии, гломерулонефрита и пневмофиброза, рассеянного склероза (MS), болезни Крона и других аутоиммунных заболеваний, бокового амиотрофического склероза (ALS), дистрофии мышц глазного яблока и глотки (OPMD), миотонической дистрофии (MD), мышечной дистрофии Дюшенна (DMD), полимиозита (PM), дерматомиозита (DM), миозита с включенными тельцами (IBM) и других мышечных нарушений, геморроя, воспаленного геморроя, постлучевого проктита, хронического неспецифического язвенного колита, криптита, других воспалительных состояний аноректума, анального зуда, простатита, простатоцистита, варикоза, аутоиммунного воспаления печени, аутоиммунного воспаления почек, воспаления толстой кишки, воспаления кишечника, воспалительных заболеваний вен, воспалительных заболеваний сосудов и других воспалений, раковых заболеваний кожи, рака молочной железы, рака толстой кишки, рака ротовой полости, рака легких и других органов дыхательной системы, рака матки, рака половых органов, раковых заболеваний органов мочевыделения, лейкемии и других раковых заболеваний крови и лимфатических тканей, и других видов раковых заболеваний, шрамов, патологических сосудистых поражений кожи, родимых пятен, родинок (невуса), папиллом, возрастных пятен (печеночных пятен) и других заболеваний кожи. Указанные пролекарства можно вводить трансдермально без помощи веществ, улучшающих проникновение через кожу.
Уровень техники
Нестероидные противовоспалительные средства (NSAIA) применяют для облегчения проявлений и симптомов ревматоидного артрита, остеоартрита и анкилозирующего спондилоартрита. NSAIA применяют отдельно или в качестве вспомогательных средств при лечении печеночных колик, лихорадки и боли при эпизиотомии. Указанные средства также применяют при лечении подагры, острой головной боли, связанной с мигренью, и почечных колик, а также при лечении послеоперационного воспаления у пациентов, которые подверглись удалению катаракты. Для предотвращения сердечных и сосудистых заболеваний применяют аспирин.
Тем не менее, применение NSAIA связано с рядом побочных эффектов, в частности желудочно-кишечных нарушений, таких как диспепсия, гастродуоденальное кровотечение, язва желудка и гастрит. Фишманом (Fishman; Robert, патент США 7052715) было показано, что дополнительная проблема, связанная с применением перорально вводимых лекарственных препаратов, состоит в том, что для эффективного лечения удаленных очагов боли или воспаления необходимо обеспечение значительных концентраций препарата в кровотоке. Указанные уровни концентрации часто намного превышают концентрации, которые были бы необходимы в случае, если бы существовала возможность точечного воздействия на конкретный очаг боли или повреждения. Фишманом и многими другими (Ван Энгеленом с соавторами (Van Engelen et al.), патент США 6416772; Макридсом с соавторами (Macrides et al.), патент США 6346278; Кирби с соавторами (Kirby et al.), патент США 6444234, Пирсоном с соавторами (Pearson et al.), патент США 6528040, и Боткнехтом с соавторами (Botknecht et al.), патент США 5885597) предпринимались попытки создания системы доставки для трансдермального применения путем разработки конкретных составов. Зонг с соавторами (Song et al.) разработали трансдермальную систему доставки лекарственного средства для доставки противовоспалительного болеутоляющего препарата, содержащего диэтиламмониевую соль диклофенака (Song, et al., патент США 6723337). Донати с соавторами (Donati et al.) разработали пластырь для местного применения, содержащий гепарин и диклофенак (Donati, et al., патент США 6592891). Кавайи с соавторами (Kawaji et al.) разработали маслосодержащий пластырь-повязку для наружного применения, содержащий диклофенак натрия (Kawaji et al., патент США 6262121). Эффринг с соавторами (Effing et al.) разработали устройство для трансдермальной доставки диклофенака (Effing et al., патент США 6193996). Однако доставка терапевтически эффективных количеств NSAIA в плазму хозяина за счет обеспечения подходящих составов является очень непростой задачей. Сьюзан Милосович с соавторами (Susan Milosovich et al.) разработали и синтезировали тестостеронил-4-диметиламинобутират.HCl (TSBH), содержащий липофильную часть и третичные аминогруппы, который существует в протонированной форме при физиологических значениях pH. Они обнаружили, что указанное пролекарство (TSBH) диффундирует через кожу человека примерно в 60 раз быстрее, чем сам лекарственный препарат (TS) [Susan Milosovich et al., J. Pharm. Sci., 82, 227(1993)].
Раскрытие изобретения
Техническая задача
NSAIA применяют в медицинских целях в течение более 100 лет. NSAIA показаны к применению для облегчения проявлений и симптомов ревматоидного артрита и остеоартрита, облегчения слабой или средней боли, облегчения лихорадки и лечения дисменореи. Указанные лекарственные препараты являются наиболее широко применяемыми лекарствами в мире.
Тем не менее, применение NSAIA связано с рядом побочных эффектов, в частности желудочно-кишечных нарушений, таких как диспепсия, изжога, рвота, гастродуоденальное кровотечение, язва желудка и гастрит. Гастродуоденальное кровотечение, вызываемое NSAIA, в целом является безболезненным, но может приводить к потере крови с калом и вызывать устойчивую железодефицитную анемию.
Трансдермальные системы доставки помогают избежать непосредственного повреждения желудочно-кишечного тракта и инактивирования лекарственных препаратов, обусловленного “пресистемным метаболизмом” в желудочно-кишечном тракте и печени. Традиционная трансдермальная доставка лекарственного препарата с применением вещества, улучшающего проникновение через кожу, имеет свои ограничения. Во-первых, скорости проникновения являются очень низкими (по шкале мкг/см2/ч). Во-вторых, в тело хозяина будут поступать большие количества вещества, улучшающего проникновение через кожу.
Техническое решение
Трансдермальные системы доставки помогают избежать непосредственного повреждения желудочно-кишечного тракта и инактивирования лекарственных препаратов, обусловленного “пресистемным метаболизмом” в желудочно-кишечном тракте и печени. Традиционная трансдермальная доставка лекарственного препарата с применением вещества, улучшающего проникновение через кожу, имеет свои ограничения. Во-первых, скорости проникновения являются очень низкими (по шкале мкг/см2/ч). Во-вторых, большие количества вещества, улучшающего проникновение через кожу, будут поступать в тело хозяина и могут вызывать дополнительные побочные эффекты. В-третьих, при традиционной трансдермальной доставке лекарственного препарата с применением веществ, улучшающих проникновение через кожу, указанные вещества, содержащиеся в составе в высоких концентрациях, могут способствовать проникновению лекарственного препарата через кожу. Однако после поступления указанных веществ и лекарственного препарата в кожу происходит сильное разбавление веществ, улучшающих проникновение, при этом указанные вещества больше не могут способствовать пересечению молекулой лекарственного препарата дальнейших биологических мембран; соответственно, затем молекулы лекарственного препарата будут накапливаться в жировом слое под кожей, при этом накапливающиеся лекарственные препараты могут вызывать очень серьезные и даже смертельные побочные эффекты.
Биологическую доступность лекарственного препарата определяют путем измерения относительного количества введенного лекарственного препарата, которое достигает общего кровотока. Однако общий кровоток не является “местом действия” для большинства лекарственных препаратов. Даже если молекулы лекарственного препарата поступили в общий кровоток, они должны пересечь дополнительные биологические мембраны, которые могут быть менее проницаемыми, чем желудочно-кишечные мембраны, и взаимодействовать с межклеточными и внутриклеточными жидкостями перед попаданием в труднодостижимую область, называемую “местом действия”; таким образом, большинство лекарственных препаратов будет подвергаться метаболизму на слизистых оболочках желудочно-кишечного тракта, в печени, крови, почках и легких до того, как они достигнут “места действия”. Это обстоятельство не только приводит к очень слабому фармакологическому эффекту, но также является причиной токсической нагрузки на слизистую оболочку кишечника, кровь, печень, почки и легкие. В случае обеспечения возможности увеличения скорости проникновения лекарственных препаратов через различные мембраны фармакологический эффект и клинический ответ лекарственных препаратов будет существенно возрастать, при этом будет требоваться меньшая доза лекарственного препарата и будет возникать меньше побочных эффектов. Трансдермальная доставка пролекарства с очень высокой скоростью проникновения через кожу и мембраны будет очень полезна не только для лечения местных заболеваний, но также для лечения системных заболеваний. Поскольку указанные пролекарства являются в десятки или сотни раз более эффективными, чем исходные лекарственные препараты, потребуется только несколько десятых или сотых долей от обычной дозы лекарственного препарата, при этом будет возникать гораздо меньше побочных эффектов. При этом будет обеспечиваться преимущество не только применительно к трансдермальной доставке лекарственного препарата, но также и к любым другим системам доставки лекарственных препаратов (таким как пероральные, подкожные, внутривенные, ингаляционные и назальные).
Авторами настоящего изобретения было обнаружено, что лекарственные препараты, содержащие липофильную часть и первичную, вторичную или третичную аминогруппу (предпочтительно третичные аминогруппы), которая существует в протонированной форме (гидрофильная часть) при физиологических значениях pH, могут проникать через кожу и преодолевать гематоэнцефалический барьер и барьер «кровь-молоко» с очень высокой скоростью (по шкале мг/см2/ч). Принципы разработки указанных пролекарств NSAIA являются следующими:
1. Пролекарство должно содержать липофильную часть и первичную, вторичную или третичную аминогруппу (предпочтительно, третичные аминогруппы), которая существует в протонированной форме (гидрофильная часть) при физиологических значениях pH.
2. Каждое пролекарство NSAIA должно содержать только одну или две (предпочтительно одну) первичную, вторичную или третичную аминогруппы, которые существуют в протонированной форме (гидрофильная часть) при физиологических значениях pH.
3. Основная роль указанной первичной, вторичной или третичной аминогруппы состоит в том, чтобы способствовать прохождению лекарственного препарата через кожу, шрамы, мембрану, гематоэнцефалический барьер или барьер «кровь-молоко» и другие барьеры. Первичная, вторичная или третичная аминогруппа может представлять собой любую структуру, которая является нетоксичной и не препятствует биологической активности исходных лекарственных препаратов.
В настоящем изобретении предложены некоторые из пролекарств всех NSAIA, которые имеют общую формулу (1) «структуры 1» согласно патентам (международные заявки PCT/IB2006/052732, PCT/IB2006/052318, PCT/IB2006/052815, PCT/IB2006/052563, PCT/IB2006/052575, PCT/IB2006/053741, PCT/IB2006/053091, PCT/IB2006/053090, PCT/IB2006/052549).

Структура 1
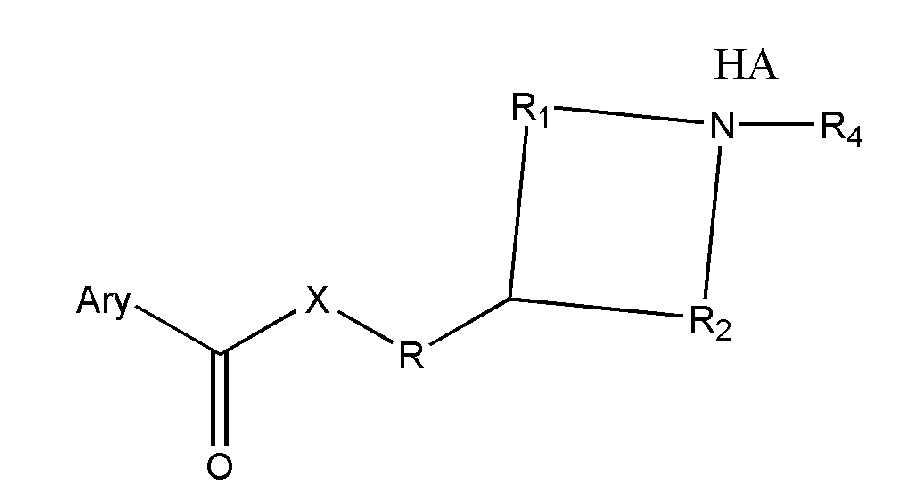
где R представляет собой разветвленную или линейную цепь -(CH2)n-, n=0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12,..., при этом в -(CH2)n- любой CH2 может быть заменен на O, S, NR8, CH=CH, C≡C, CHR8, CR8R9, арильные или гетероарильные остатки или любые другие группы, которые являются фармацевтически приемлемыми; R1представляет собой H, один из любых алкильных, алкилоксильных, алкенильных, перфторалкильных, алкилгалогенидных или алкинильных остатков, содержащих от 1 до 12 атомов углерода, арильные или гетероарильные группы, при этом любой CH2 может быть заменен на O, S, CH=CH, C≡C, CHR8, CR8R9, арильные или гетероарильные группы или любые другие группы, которые являются фармацевтически приемлемыми; или R2представляет собой H, один из любых алкильных, алкилоксильных, алкенильных, перфторалкильных, алкилгалогенидных или алкинильных остатков, содержащих от 1 до 12 атомов углерода, арильную или гетероарильную группы, при этом любой CH2 может быть заменен на O, S, CH=CH, C≡C, CHR8, CR8R9, арильные или гетероарильные группы или любые другие группы, которые являются фармацевтически приемлемыми; X представляет собой O, NH, NR8, S или отсутствует; R8 представляет собой H, OH, Cl, F, Br, I, один из любых алкильных, алкилоксильных, алкенильных, перфторалкильных, алкилгалогенидных или алкинильных остатков, содержащих от 1 до 12 атомов углерода, арильную или гетероарильную группы; R9представляет собой H, OH, Cl, F, Br, I, один из любых алкильных, алкилоксильных, алкенильных, перфторалкильных, алкилгалогенидных или алкинильных остатков, содержащих от 1 до 12 атомов углерода, арильную или гетероарильную группы; HA отсутствует или представляет собой HCl, HBr, HF, HI, HOAc, лимонную кислоту или любые кислоты, которые являются фармацевтически приемлемыми. Все группы R, R1, R2, R8, R9 и -(CH2)n- являются разветвленными или линейными и могут содержать C, H, O, Cl, Br, F, I, P, S, N или любые другие атомы, которые являются фармацевтически приемлемыми, и могут содержать одинарные, двойные и/или тройные связи; все R, R1, R2, R8, R9 или -(CH2)n- группы могут являться ахиральными или хиральными; если группа является хиральной, она может содержать один или более хиральных центров и может представлять собой отдельный (R)- или (S)-энантиомер или смесь (R)- и (S)-энантиомеров; Ary- представляет собой, но не ограничивается ими:






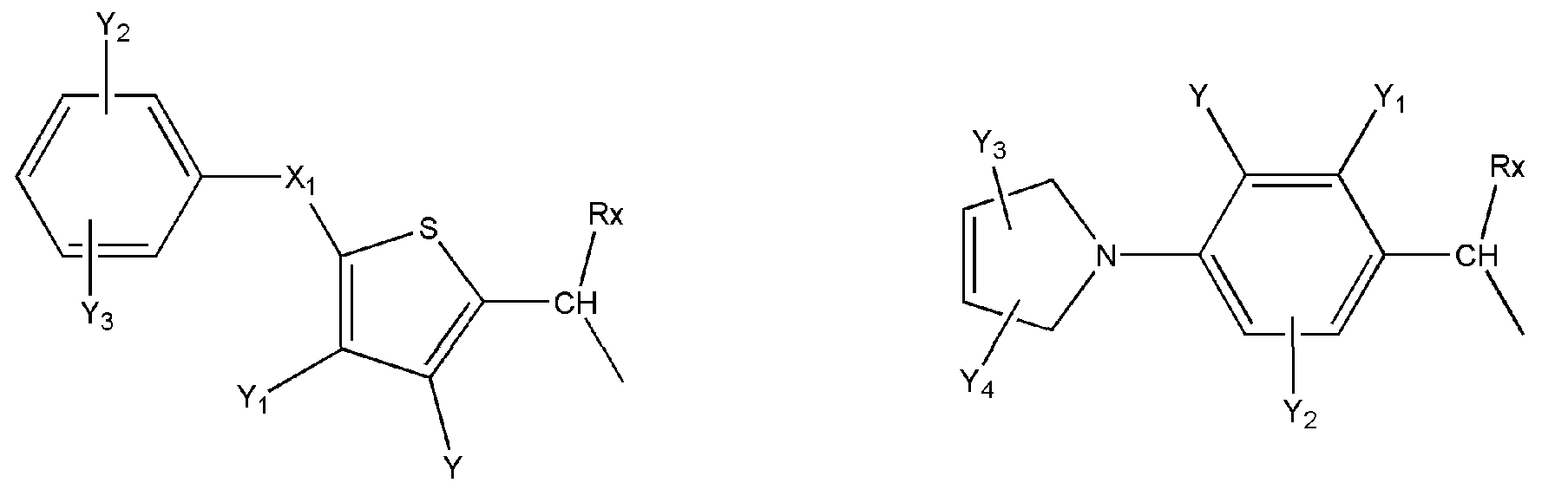
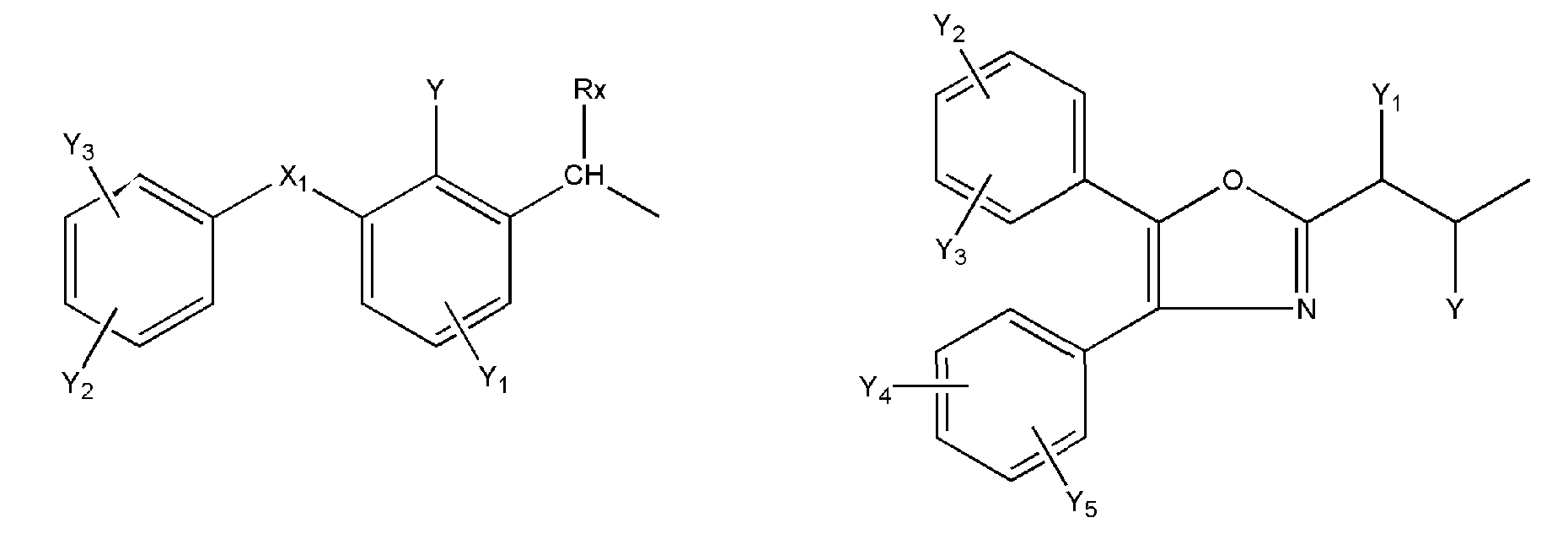
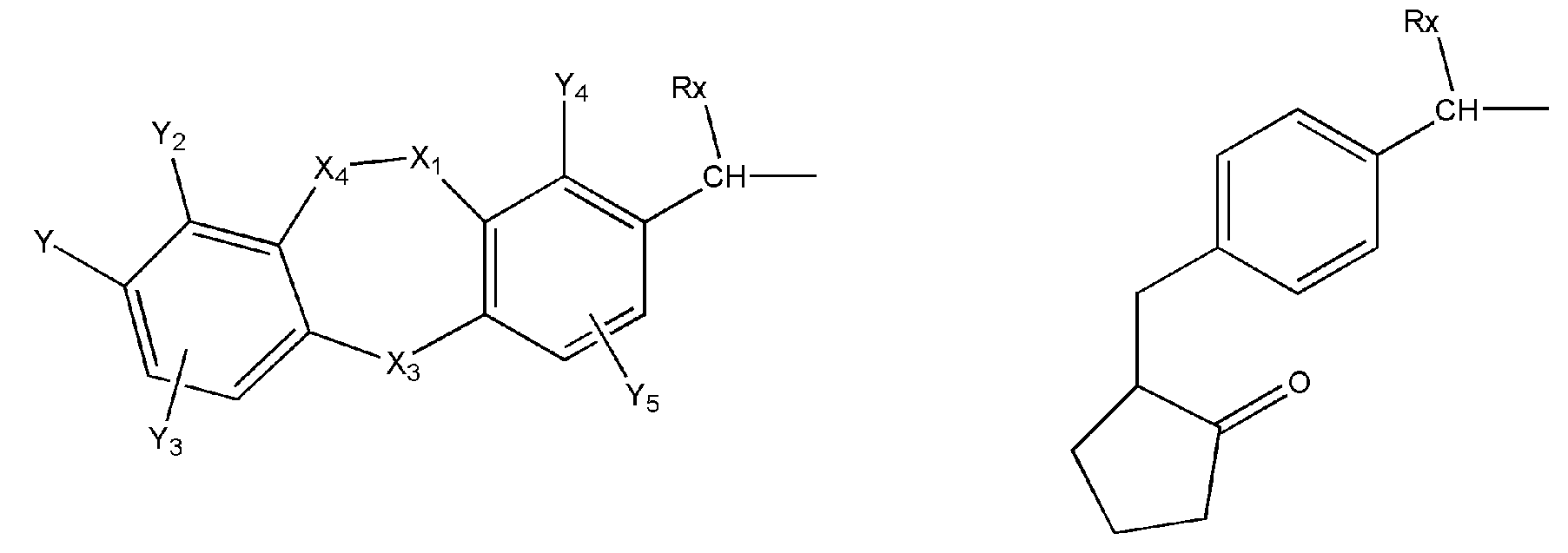



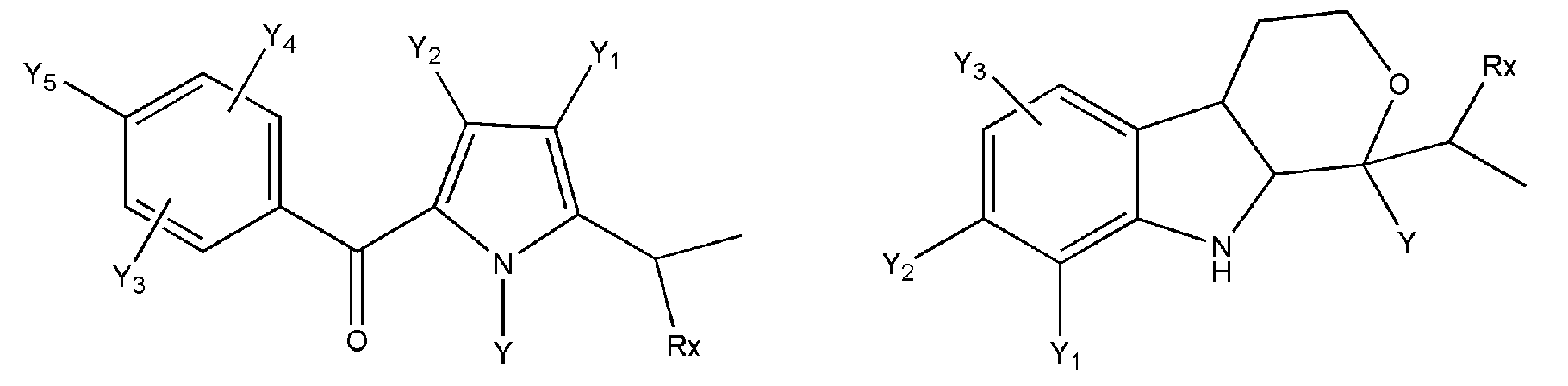
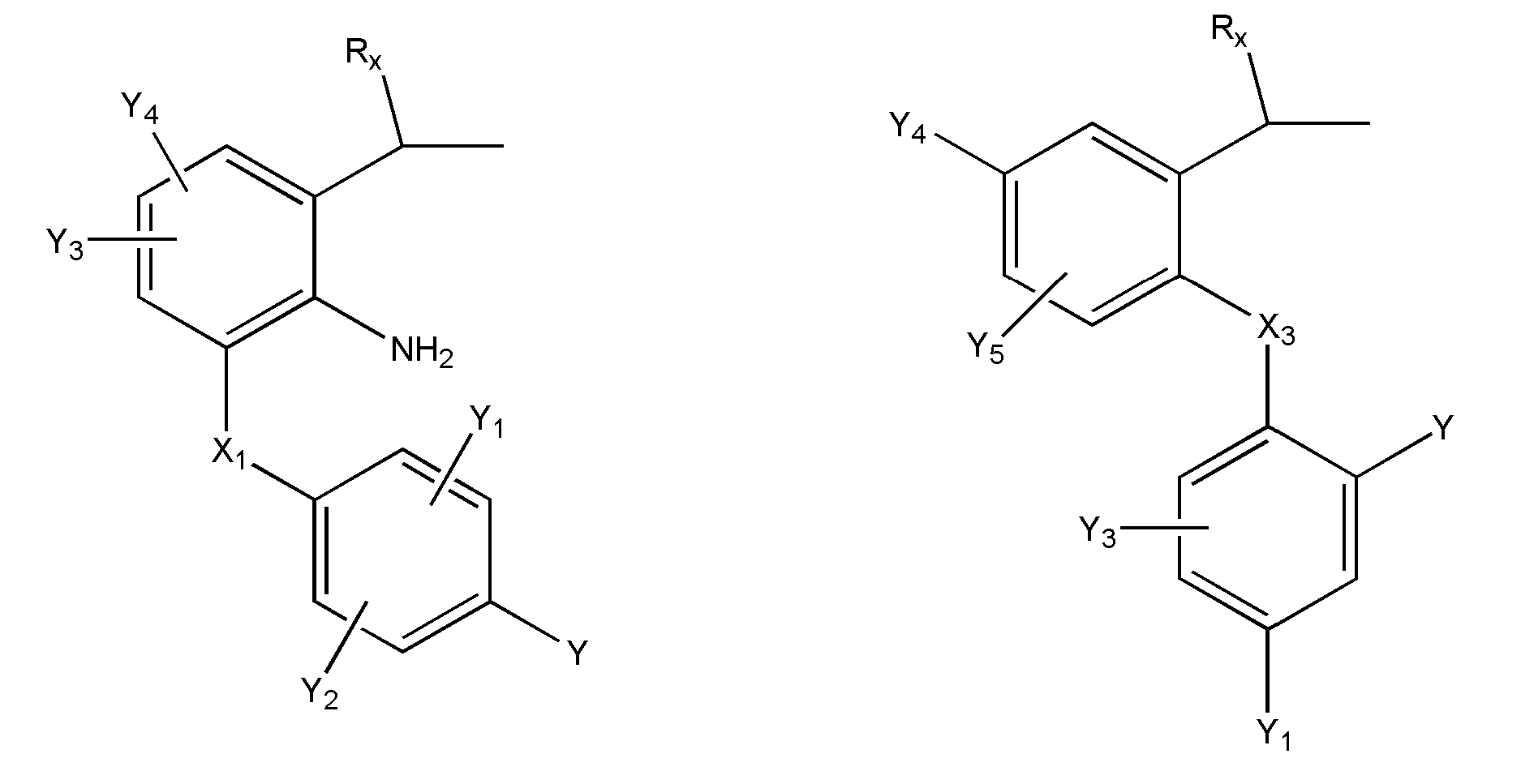



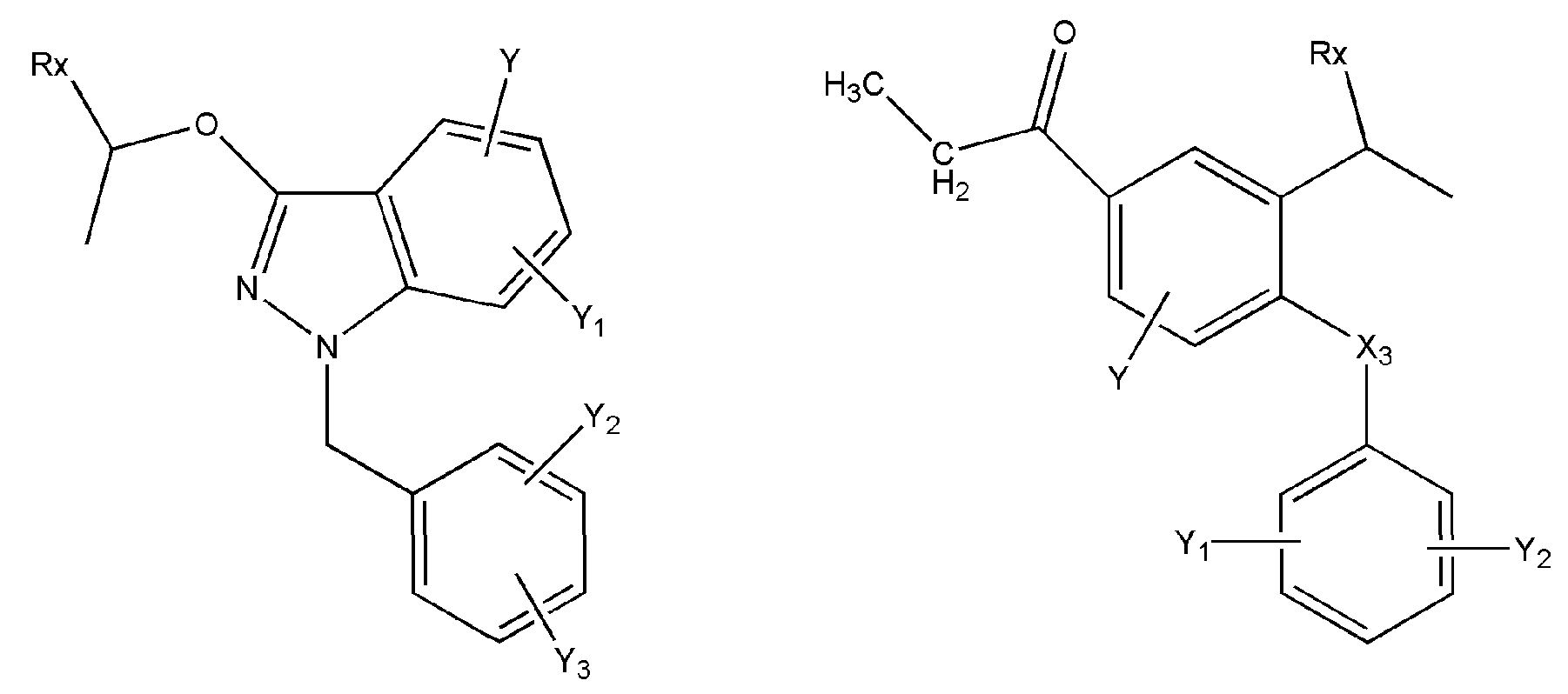







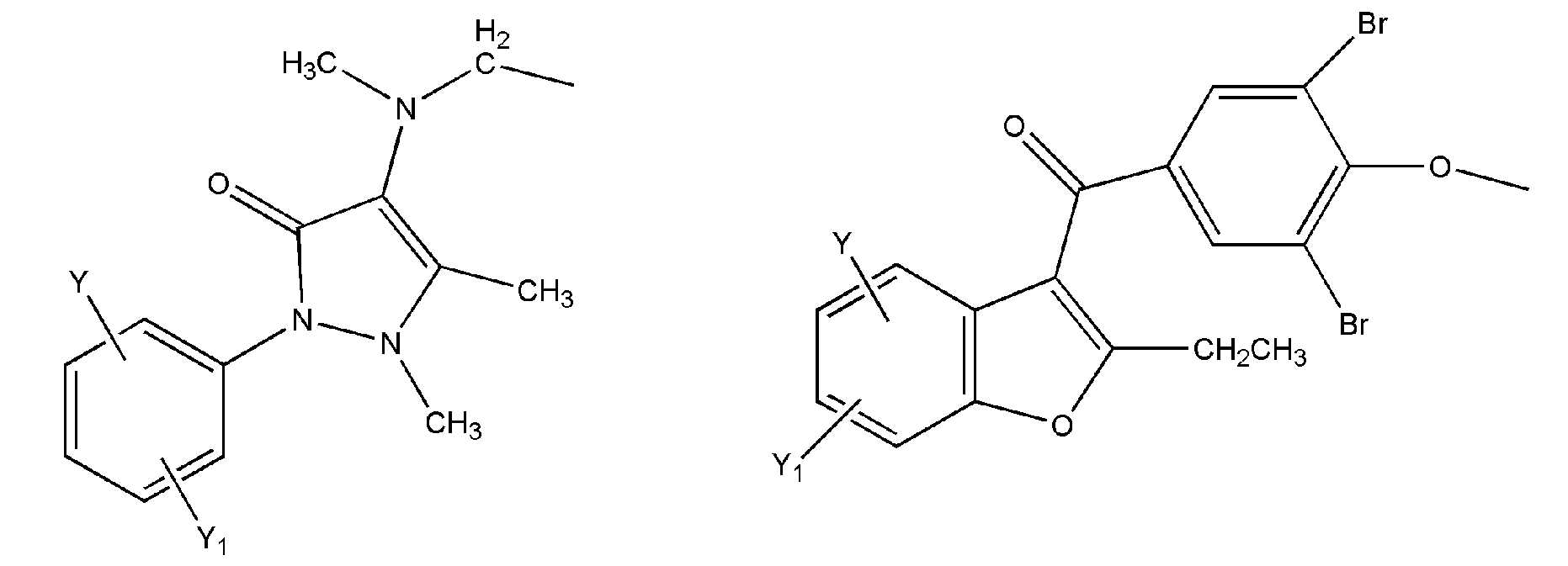

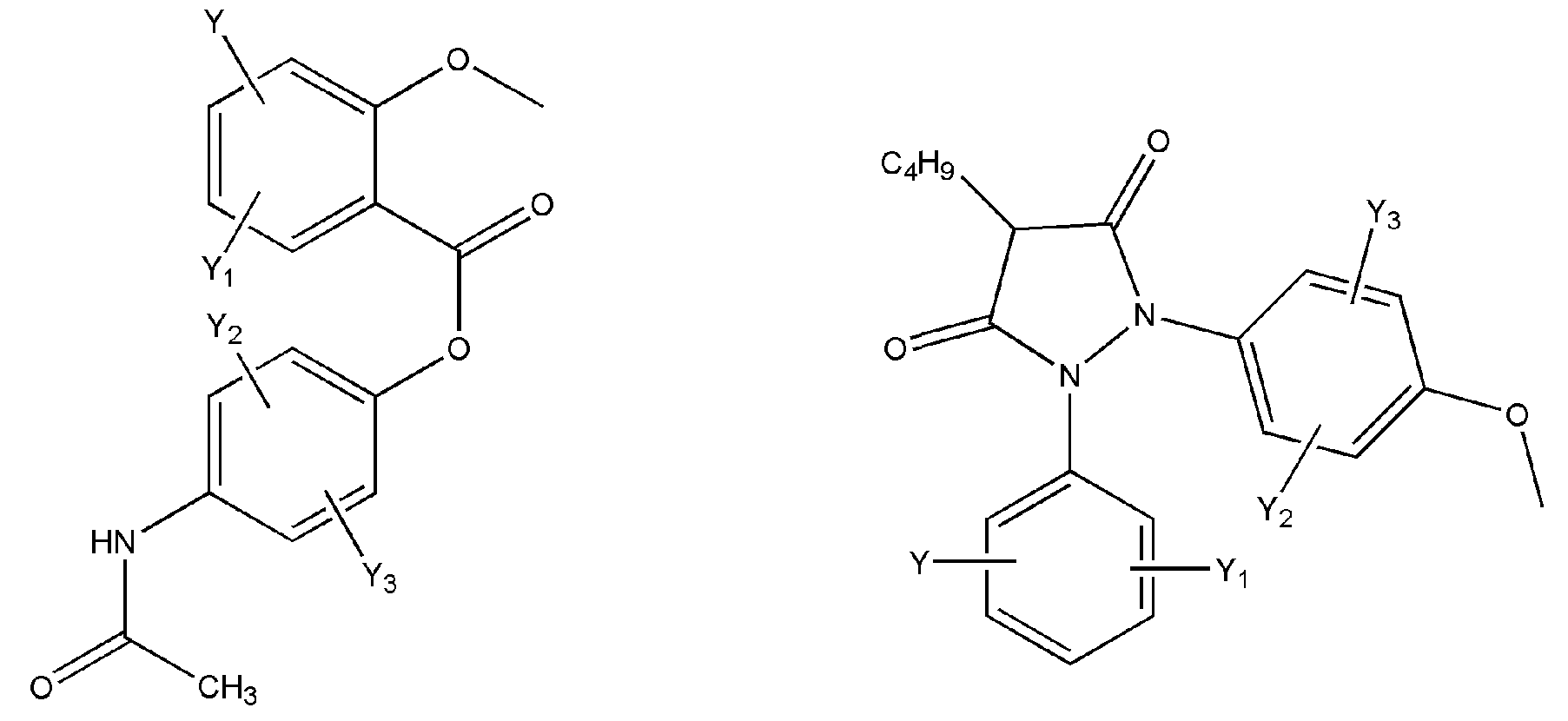




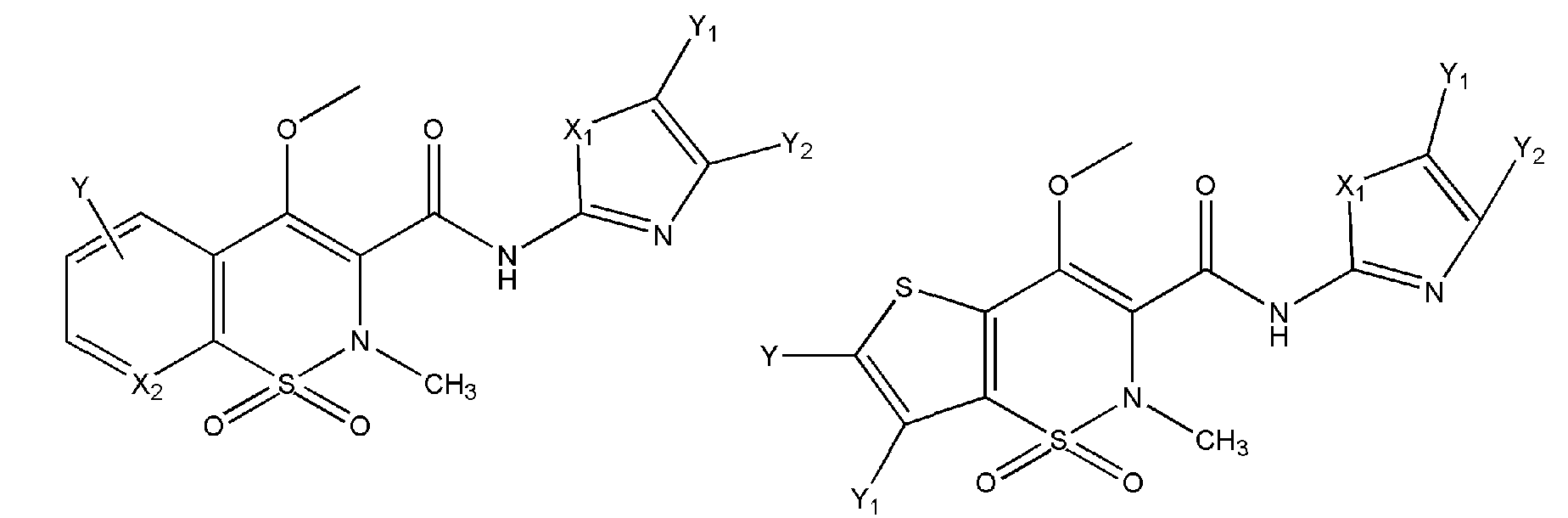




где Rx представляет собой H, CH3, CH3O, OH, CH3CH2, CF3, CHF2, CH2F, Cl, F, Br, F; Ry представляет собой H, один из любых алкильных, алкилоксильных, алкенильных, перфторалкильных, алкилгалогенидных или алкинильных остатков, содержащих от 1 до 12 атомов углерода, арильную или гетероарильную группы; X1 или X4представляет собой CH2, S, O, NH или CO; X2 или X5 представляет собой CH, CR8 или N; X3 представляет собой O, S, NH или NR8; Y, Y1, Y2, Y3, Y4, Y5илиY6 независимо представляет собой H, HO, CH3COO, RyCOO, HS, NO2, CN, CH3COS, NH2, CH3CONH, RyCONH, CH3, CH3CH2, C3H7, C4H9, CH3O, CH3CH2O,C3H7O,Cl, F, Br, I, CH3S, CHF2O, CF3O, CF3CF2O, C3F7O, CF3, CF3CF2,C3F7, C4F9,CH3SO2,RySO2,CH3SO,RySO, CH3CO, CH3CH2CO; любой Ary- может быть ахиральным или хиральным; Если Ary- является хиральным, он может содержать один или более хиральных центров и может представлять собой отдельный (R)- или (S)-энантиомер или смесь (R)- и (S)-энантиомеров.
Авторами настоящего изобретения было обнаружено, что основная роль первичной, вторичной или третичной аминогруппы состоит только в том, чтобы способствовать прохождению лекарственного препарата через кожу, мембрану, гематоэнцефалический барьер или барьер «кровь-молоко» и другие барьеры, поэтому первичная, вторичная или третичная аминогруппа может представлять собой структуры любого типа, которые являются нетоксичными и не препятствуют биологической активности исходных лекарственных препаратов. Таким образом, для обеспечения указанного свойства авторами настоящего изобретения были разработаны и получены аминогруппы различных типов. Новые пролекарства NSAIA отвечают общим формулам (2a, 2b, 2c или 2d), «структуры 2a, 2b, 2c или 2d».
где R представляет собой разветвленную или линейную цепь, -(CH2)n-, в которой n=0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 …, в -(CH2)n- любой CH2 может быть заменен на O, S, CH=CH, C≡C, CHR6,CR6R7, арильные или гетероарильные остатки или другие циклические системы; R1 представляет собой разветвленную или линейную цепь, -(CH2)a-, где a=0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10..., в -(CH2)a- любой CH2 может быть заменен на O, S, CH=CH, C≡C, CHR6,CR6R7, арильные или гетероарильные остатки или другие циклические системы; R2 представляет собой разветвленную или линейную цепь, -(CH2)b-, где b=0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10..., в -(CH2)b- любой CH2 может быть заменен на O, S, CH=CH, C≡C, CHR6, CR6R7, арильные или гетероарильные остатки или другие циклические системы; R3 представляет собой разветвленную или линейную цепь, -(CH2)c-, где c=0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10..., в -(CH2)c- любой CH2 может быть заменен на O, S, CH=CH, C≡C, CHR6, CR6R7, арильные или гетероарильные остатки или другие циклические системы; R4 представляет собой H, один из любых алкильных, алкилокси, алкенильных, перфторалкильных, алкилгалогенидных или алкинильных остатков, содержащих от 1 до 12 атомов углерода, арильные или гетероарильные группы, при этом, любой CH2 может быть заменен на O, S, CH=CH, C≡C, CHR6, CR6R7, арильные или гетероарильные группы или другие циклические группы; R5 представляет собой H, один из любых алкильных, алкилокси, алкенильных, перфторалкильных, алкилгалогенидных или алкинильных остатков, содержащих от 1 до 12 атомов углерода, арильные или гетероарильные группы, при этом, любой CH2 может быть заменен на O, S, CH=CH, C≡C, CHR6, CR7R6, арильные или гетероарильные группы или другие циклические группы; R6 представляет собой H, один из любых алкильных, алкилокси, алкенильных, перфторалкильных, алкилгалогенидных или алкинильных остатков, содержащих от 1 до 12 атомов углерода, арильные или гетероарильные группы, при этом, любой CH2 может быть заменен на O, S, CH=CH, C≡C, CHR6, CR7R5, арильные или гетероарильные группы или другие циклические группы, R7 представляет собой H, один из любых алкильных, алкилокси, алкенильных, перфторалкильных, алкилгалогенидных или алкинильных остатков, содержащих от 1 до 12 атомов углерода, арильные или гетероарильные группы, при этом, любой CH2 может быть заменен на O, S, CH=CH, C≡C, CHR6, CR7R5, арильные или гетероарильные группы или другие циклические группы; X отсутствует или представляет собой O, NH, NR6 или S; Ary- в общей формуле (2a, 2b, 2c или 2d) «структуры 2a, 2b, 2c или 2d» имеет то же определение, что и Ary- в общей формуле (1) «структура 1»; HA отсутствует или представляет собой HCl, HBr, HF, HI, HOAc, лимонную кислоту или любые кислоты, которые являются фармацевтически приемлемыми. Все R, R1, R2, R3, R4, R5, R6, R7 или -(CH2)n- группы представляют собой разветвленные или линейные цепи и могут включать C, H, O, Cl, Br, F, I, P, S, N или любые другие атомы, которые являются фармацевтически приемлемыми, и могут содержать одинарные, двойные и/или тройные связи; все R, R1, R2, R3, R4, R5, R6, R7 или -(CH2)n- группы могут являться ахиральными или хиральными; если группа является хиральной, она может содержать один или более хиральных центров и может представлять собой отдельный (R)- или (S)-энантиомер или смесь (R)- и (S)-энантиомеров.
Абсорбция лекарственных препаратов из желудочно-кишечного тракта или других участков требует прохождения лекарственного препарата в молекулярной форме через барьерную мембрану. Прежде всего, лекарственный препарат должен раствориться, и если лекарственный препарат обладает требуемыми биофармацевтическими свойствами, он будет переходить из области высокой концентрации в область низкой концентрации через мембрану в кровь или общий кровоток. Все биологические мембраны содержат в качестве основных компонентов липиды. Все молекулы, которые играют доминирующую роль в формировании мембран, содержат фосфатсодержащие высокополярные головные группы и, в большинстве случаев, два сильногидрофобных углеводородных хвоста. Мембраны являются двухслойными, при этом гидрофильные головные группы с обеих сторон направлены в сторону водных участков. Высокогидрофильные лекарственные препараты не могут пройти через гидрофобный слой мембраны, а высокогидрофобные лекарственные препараты остаются в гидрофобном слое в виде части указанной мембраны вследствие их подобия и не могут эффективно проникать в цитозоль с внутренней стороны.
Одна из задач настоящего изобретения состоит в том, чтобы избежать побочных эффектов NSAIA путем увеличения растворимости NSAIA в желудочном соке, что позволит вводить указанные препараты перорально, а также увеличения скорости проникновения NSAIA через мембрану и кожный барьер, что позволит вводить указанные препараты трансдермально (местное применение). Наиболее важная задача настоящего изобретения заключается в том, чтобы разработать пролекарства NSAIA, способные очень эффективно проникать через кожу, клеточную мембрану, особенно мембраны клеток мозга и нервных клеток, и оставаться в общем кровотоке в течение гораздо меньшего времени, являясь при этом в сотни раз более эффективными, чем исходные лекарственные препараты, при этом будет требоваться лишь несколько десятых или сотых долей от дозы обычного лекарственного средства и будет возникать гораздо меньше побочных эффектов. При этом будет обеспечиваться преимущество не только применительно к трансдермальной доставке лекарственного препарата, но также и к любым другим системам доставки лекарственных препаратов (таким как пероральные, подкожные, внутривенные, ингаляционные и назальные), что позволит лечить многие состояния, которые нельзя лечить с помощью соответствующих исходных лекарственных препаратов. Предложенные новые пролекарства NSAIA в целом имеют две структурные особенности: они содержат липофильную часть и первичную, вторичную или третичную аминогруппу, которая существует в протонированной форме (гидрофильная часть) при физиологических значениях pH. Такой гидрофильно-липофильный баланс необходим для эффективного прохождения через барьер мембраны [Susan Milosovich et al., J. Pharm. Sci., 82, 227(1993)]. Положительно заряженные аминогруппы значительно увеличивают растворимость лекарственных препаратов в воде. Положительный заряд на аминогруппах этих пролекарств будет связываться с отрицательным зарядом на фосфатной головной группе мембраны. Таким образом, локальная концентрация за пределами мембраны или кожи будет очень высокой, что будет способствовать переходу этих пролекарств из области высокой концентрации в область низкой концентрации. Указанное связывание будет немного повреждать мембрану и может создавать некоторое пространство для прохождения липофильной части пролекарства. Когда молекулы мембраны двигаются, мембрана может чуть-чуть “треснуть” вследствие связывания пролекарства. Это позволит пролекарству внедриться в мембрану. При pH 7,4 только примерно 99% аминогрупп являются протонированными. Если аминогруппа не является протонированной, связь между аминогруппой пролекарства и фосфатной головной группой мембраны будет диссоциировать и пролекарство полностью проникнет в мембрану. Когда аминогруппа пролекарства переходит на другую сторону мембраны и, соответственно, становится протонированной, то пролекарство втягивается в цитозоль, полужидкий концентрированный водный раствор или суспензию. Благодаря короткому времени пребывания в желудочно-кишечном тракте указанные пролекарства не вызывают повреждения клеток слизистой оболочки желудка. Скорости проникновения новых пролекарств через человеческую кожу измеряли in vitro с применением модифицированных клеток Франца, которые выделяли из ткани человеческой кожи (360-400 мкм толщиной) передних и задних участков бедра. Принимающую жидкость, которая состояла из 10 мл 2% бычьего сывороточного альбумина в нормальном физиологическом растворе, перемешивали при 600 об./мин. Кумулятивные количества пролекарств и лекарственных препаратов, проникающие через кожу, в зависимости от времени определяли с помощью конкретного способа методом высокоэффективной жидкостной хроматографии. Кажущиеся значения потока пролекарств NSAIA составляли 0,1-50 мг/см2/ч. Полученные результаты свидетельствуют о том, что пролекарство диффундирует через человеческую кожу по меньшей мере в сотни раз быстрее, чем соответствующие исходные лекарственные препараты. Результаты показывают, что положительный заряд на диалкиламиноэтильной группе играет очень важную роль в прохождении лекарственного препарата через барьер мембраны и кожный барьер.
Новые пролекарства NSAIA могут проникать через кожный барьер, гематоэнцефалический барьер и барьер «кровь-молоко». Было проведено сравнение скорости in vivo проникновения пролекарств и соответствующих исходных лекарственных препаратов через кожу интактных крыс. Донор, содержащий 20% пролекарств или соответствующих исходных лекарственных препаратов в 1 мл этанола, наносили на примерно 5 см2 участок на спине крыс (~200 г). Через 4 часа крыс убивали и 5 мл метанола добавляли к 1 мл крови, 1 г печени, 1 г почки или 1 г мозга (печень, почку или мозг промывали буфером с pH 7,2 три раза) и смеси гомогенизировали. Затем пробы центрифугировали в течение 5 мин и анализировали методом ВЭЖХ. Результаты показаны в таблице 1-5.
Затем 20% аспирина, диклофенака, кетопрофена, фенопрофена или ибупрофена в 1 мл этанола наносили на примерно 5 см2 участок на спине крыс. Через 4 часа крыс убивали и 5 мл метанола добавляли к 1 мл крови, 1 г печени, 1 г почки или 1 г мозга (печень, почку или мозг промывали буфером с pH 7,2 три раза) и смеси гомогенизировали. Ни один из этих лекарственных препаратов не был найден в каких-либо крысиных тканях или плазме. Результаты показали, что пролекарства NSAIA могут проникать через кожный барьер, гематоэнцефалический барьер и другие мембранные барьеры с очень высокой скоростью, а исходные NSAIA не могут проникать через кожный барьер в определяемых количествах.
Для пролекарств общей формулы (1) «структуры 1» была продемонстрирована противовоспалительная, обезболивающая, жаропонижающая и противоревматическая активность согласно полученным патентам (международные заявки PCT/IB2006/052732, PCT/IB2006/052318, PCT/IB2006/052815, PCT/IB2006/052563, PCT/IB2006/052575, PCT/IB2006/053741, PCT/IB2006/053091, PCT/IB2006/053090, PCT/IB2006/052549). Авторами настоящего изобретения было обнаружено, что все пролекарства общей формулы (2a, 2b, 2c или 2d) «структуры 2a, 2b, 2c или 2d», демонстрировали противовоспалительную, обезболивающую, жаропонижающую и противоревматическую активность. Основными задачами настоящего изобретения являются новые медицинские применения пролекарств NSAIA.
Хорошо известна связь между воспалением и раком. Доктор Thea D. Tlsty отметил в своей речи (Keystone Symposia: Inflammation and Cancer, Breckenridge, Colorado, USA, Feb. 27-March 3, 2005), что циклооксигеназа-2 (COX-2) стимулирует активность ароматазы, развитие кровеносных сосудов, пролиферацию, инвазию и синтез простагландина. Увеличение уровней простагландинов приводит к ингибированию апоптоза. Аспирин и другие NSAIA ингибируют COX-1 и COX-2. Совокупный относительный риск развития рака кишечника, рака пищевода, рака яичников или других видов рака уменьшается у людей, принимающих аспирин длительное время. Однако раковые клетки могут изменять структуру своих мембран и удерживать NSAIA от проникновения в раковые клетки. Новые пролекарства, предлагаемые в настоящем изобретении, могут проникать через любые мембранные барьеры и могут быть местно нанесены на наружный участок кожи в месте расположения раковой опухоли, при этом большие количества пролекарств будут проникать в раковые клетки при очень небольшом системном воздействии.
Для оценки противоопухолевой активности пролекарств NSAIA человеческие клетки рака молочной железы (BCAP-37, в случае каждой мыши применяли 2-3 мм3 ткани опухоли) подкожно ксенотрансплантировали «голым» мышам (BALB, 12 групп, 7 мышей в каждой группе). Через 14 дней опухоли вырастали до размеров 50±10 мм3 (0,05 мл). Затем 30 мкл 5% (соответствует 1,5 мг пролекарств) соли диэтиламиноэтилацетилсалицилат.ацетилсалициловой кислоты (P-1, в ацетоне); 1-пиперидинпропил-2[(2,6-дихлорфенил)амино]бензолацетата.AcOH (P-2, в воде), 1-пирролидинпропил-2-(3-бензоилфенил)пропионат.AcOH (P-3, в воде), 4-пиперидинметил-2-(3-феноксифенил)пропионата.AcOH (P-4, в воде), 3-пиперидинметил-2-(п-изобутилфенил)пропионата.AcOH (P-5, в воде), диэтиламиноэтил-1-(п-хлорбензоил)-5-метокси-2-метилиндол-3-ацетата.AcOH (P-11, в воде), 2-(4-морфолинил)этил-(Z)-5-фтор-2-метил-1-[(4-метилсульфинил)фенилметилен]-1H-инден-3-ацетата.AcOH (P-12, в воде), диэтиламиноэтил-2-(2,4-дихлорфенокси)бензолацетата.AcOH (P-19, в воде), диэтиламиноэтил-2-(8-метил-10,11-дигидро-11-оксодибенз(b,f)оксепин-2-ил)пропионата.AcOH (P-37, в воде), 1-пирролидинпропил-2-[[(3-(трифторметил)фенил)амино]бензоата.AcOH (P-48, в воде), 4-N,N-диметиламинобутирилокси-2-метил-N-2-пиридинил-2H,1,2-бензотиазин-3-карбоксамид-1,1-диоксид.HCl (P-51, в ацетоне) каждые 8 часов местно наносили на участок, где были имплантированы человеческие клетки рака молочной железы (около передней лапы). Размеры опухолей на 42 день показаны в таблице 6 и таблице 7.
Во втором исследовании противоопухолевого действия клетки рака толстой кишки человека (LS174J, в случае каждой мыши применяли 2-3 мм3 ткани опухоли) подкожно ксенотрансплантировали «голым» мышам (BALB). Через 7 дней опухоли вырастали до размеров 55±10 мм3 (0,055 мл). Затем примерно 30 мкл 5% (соответствует 1,5 мг пролекарств) соли диэтиламиноэтилацетилсалицилат.ацетилсалициловой кислоты (P-1, в ацетоне); 1-пиперидинпропил-2[(2,6-дихлорфенил)амино]бензолацетата.AcOH (P-2, в воде), 1-пирролидинпропил-2-(3-бензоилфенил)пропионата.AcOH (P-3, в воде), 4-пиперидинметил-2-(3-феноксифенил)пропионата.AcOH (P-4, в воде), 3-пиперидинметил-2-(п-изобутилфенил) пропионата.AcOH (P-5, в воде), диэтиламиноэтил-1-метил-5-(4-метилбензоил)-1H-пиррол-2-ацетата.AcOH (P-13, в воде), 2-(4-морфолинил)этил-2-амино-3-бензоилбензолацетата.AcOH (P-16, в воде), диэтиламиноэтил-2-(10,11-дигидро-10-оксодибензо(b,f)тиепин-2-ил)пропионата.AcOH (P-36), диэтиламиноэтил-2-[(2,3-диметилфенил)амино]бензоата.AcOH (P-46, в воде), диэтиламиноэтил-2-[(2,6-дихлор-3-метилфенил)амино]бензоата.AcOH (P-47, в воде), N-(2-тиазоил)-4-N,N-диметиламинобутирилокси-2-метил-2H,1,2-бензотиазин-3-карбоксамид-1,1-диоксида.HCl (P-52, в ацетоне) каждые 8 часов местно наносили на участок, куда были имплантированы человеческие клетки рака толстой кишки (около передней лапы). Размеры опухолей на 30 день показаны в таблице 8 и таблице 9.
Результаты показали, что пролекарства NSAIA обладают очень сильной противоопухолевой активностью и не имеют вообще или имеют очень небольшие побочные эффекты.
Гипогликемический эффект салицилатов впервые более 100 лет назад наблюдали немецкие медики (Edmund J. Hengesh, Principles of medicinal chemistry, 4th ed., pg 591, Williams & Wilkins, 1995). Салицилаты усиливают стимулированную глюкозой секрецию инсулина и ингибируют гликогенез из лактата и аланина (H. F. Woods et al. Clin. Exp. Pharmacol Physiol., 1, 534(1974). Некоторые салицилаты уменьшают уровни свободных жирных кислот, триглицеридов и холестерина в плазме. Поскольку повышенные уровни свободных жирных кислот в плазме ингибируют потребление глюкозы, уменьшение их концентрации могло бы внести свой вклад в гипогликемическое действие. К сожалению, для поддержания в крови соответствующего контроля уровней сахара и уровней липидов необходимы большие дозы (5 г ежедневно) салицилатов. При таких уровнях дозировки часто имеют место многочисленные побочные эффекты, такие как раздражение желудка, тошнота, рвота и шум в ушах. Новые пролекарства, предлагаемые в настоящем изобретении, имеют очень высокие скорости проникновения через кожу и мембраны. Они могут достигать “места действия” очень быстро, при этом фармакологический эффект и клиническая реакция этих пролекарств существенно увеличиваются, кроме того, потребуется гораздо меньшая (требуются только сотые - десятые доли от дозы исходного лекарственного препарата) доза лекарственного препарата и возникнет гораздо меньше побочных эффектов.
Пролекарства, предлагаемые в настоящем изобретении, понижали уровни глюкозы в крови в ходе исследований на крысах (SLAC/GK, диабет 2 типа, n=7). 50% ацетоновый раствор соли диэтиламиноэтил ацетилсалицилат.ацетилсалициловой кислоты (P-1, в ацетоне); 4-ацетамидофенил салицилдиметиламинобутират.HCl (P-6), соли диэтиламиноэтил-5-(2,4-дифторфенил)ацетилсалицилат.5-(2,4-дифторфенил)ацетилсалициловой кислоты (P-8), диэтиламиноэтил салицилсалицилат.AcOH (P-9), диэтиламиноэтил салицилат.AcOH (P-10), диэтиламиноэтил 5-ацетамидоацетилсалицилат (P-58), соли диэтиламиноэтил ацетилсалицилсалицилат.ацетилсалицилсалициловой кислоты (P-59), соли диэтиламиноэтил ацетилсалицилсалицилат. ацетилсалицилсалицилсалициловой кислоты (P-60) (соответствует 20 мг/кг NSAIA) вводили трансдермально в спины (примерно 1,5 см2) крыс (мех был сбрит) один раз в день (в 8 часов утра) в течение 5 недель. Уровни глюкозы в крови измеряли один раз каждые 3 дня в 4 часа дня (не натощак) со второй недели по пятую неделю. Результаты показаны в таблице 10. Уровни глюкозы в крови измерены в конце пятой недели. Результаты показаны в таблице 11.
Результаты показали, что пролекарства NSAIA очень эффективно понижали уровни глюкозы в крови в модели диабета на крысах и не влияли на уровни глюкозы в крови у обычных крыс. Наиболее интересным фактом является то, что уровни глюкозы в крови у крыс все еще оставались на нормальных уровнях (7-8 ммоль/л, не натощак) после прекращения лечения в течение 30 дней. Это означает, что пролекарства не только понижают уровни глюкозы в крови, но также могут излечивать диабет.
Результаты показали, что пролекарства NSAIA очень эффективно понижали уровни липидов в крови (общего холестерина и триглицеридов) в моделях диабета на крысах и не влияли на уровни ЛВП.
pH желудочного сока составляет 1-3. Отрицательный заряд на фосфатной головной группе мембраны нейтрализуется протоном, и положительный заряд на аминогруппах этих пролекарств не может связаться с фосфатной головной группой мембран, при этом пролекарства не могут пройти через стенку желудка и не будут травмировать или раздражать желудок. pH в двенадцатиперстной кишке составляет примерно 5-7, и пролекарства могут пройти через слизистую оболочку двенадцатиперстной кишки. Поджелудочная железа расположена поблизости, и большие количества пролекарств будут проникать в нее перед поступлением в печень, почки и общий кровоток, где лекарственный препарат будет подвергаться метаболизму, поэтому требуется только очень низкая доза этих пролекарств и будет возникать очень мало побочных эффектов, при этом побочные эффекты будут очень слабыми. 20% ацетоновый раствор соли диэтиламиноэтил ацетилсалицилат.ацетилсалициловой кислоты (P-1, в ацетоне); 4-ацетамидофенил салицилдиметиламинобутират.HCl (P-6), соли диэтиламиноэтил-5-(2,4-дифторфенил)ацетилсалицилат.5-(2,4-дифторфенил) ацетилсалициловой кислоты (P-8), диэтиламиноэтил салицилсалицилат.AcOH (P-9), диэтиламиноэтил салицилат.AcOH (P-10), диэтиламиноэтил 5-ацетамидоацетилсалицилат (P-58), соли диэтиламиноэтил ацетилсалицилсалицилат.ацетилсалицилсалициловой кислоты (P-59), соли диэтиламиноэтил ацетилсалицилсалицилат. ацетилсалицилсалицилсалициловой кислоты (P-60) (соответствующий 15 мг/кг NSAIA) смешивали с пищей и перорально вводили крысам (SLAC/GK, диабет 2 типа, n=7) с едой каждый день в течение 5 недель. Уровни глюкозы в крови измеряли один раз каждые три дня в 3 часа дня (не натощак) со второй недели по пятую неделю. Результаты показаны в таблице 12. Уровни липидов в крови измеряли в конце пятой недели. Результаты показаны в таблице 13.
Результаты показали, что пролекарства NSAIA очень эффективно понижали уровни глюкозы в крови в модели диабета на крысах и не влияли на уровни глюкозы в крови нормальных крыс при пероральном приеме пролекарств, при этом дозировки являются гораздо меньшими, чем в случае исходных лекарственных средств.
Результаты показали, что пролекарства NSAIA очень эффективно понижали уровни липидов в крови (общего холестерина и триглицеридов) у моделей диабетических крыс при пероральном приеме пролекарств, при этом дозировки являются гораздо меньшими, чем в случае исходных лекарственных средств.
Пролекарства, предлагаемые в этом изобретении, понижают уровни глюкозы в крови у моделей мышей (SLAC:NOD-IDDM, диабет 1 типа, n=7). 20% ацетоновый раствор соли диэтиламиноэтил ацетилсалицилат.ацетилсалициловой кислоты (P-1, в ацетоне); 4-ацетамидофенил салицилдиметиламинобутират.HCl (P-6), соли диэтиламиноэтил 5-(2,4-дифторфенил)ацетилсалицилат.5-(2,4-дифторфенил) ацетилсалициловой кислоты (P-8), диэтиламиноэтил салицилсалицилат.AcOH (P-9), диэтиламиноэтил салицилат.AcOH (P-10), диэтиламиноэтил 5-ацетамидоацетилсалицилат (P-58), соли диэтиламиноэтил ацетилсалицилсалицилат.ацетилсалицилсалициловой кислоты (P-59), соли диэтиламиноэтил ацетилсалицилсалицилат. ацетилсалицилсалицилсалициловой кислоты (P-60) (соответствующий 20 мг/кг NSAIA) вводили трансдермально в спины (примерно 1 см2) мышей (мех сбривали) один раз в день (в 8 утра) в течение 7 недель. Уровни глюкозы в крови измеряли один раз каждые три дня в 3 часа дня (не натощак) с четвертой недели по седьмую неделю. Результаты показаны в таблице 14.
Результаты показали, что пролекарства NSAIA очень эффективно понижали уровни глюкозы в крови у моделей диабетических мышей (тип I).
Были выбраны восемнадцать китайских белых кроликов с массой между 3,0 и 3,5 кг (в возрасте 6-7 месяцев) и распределены на три группы (контрольная, группы P-1 и P-10, n=6). За час до эксперимента были приготовлены тромбы путем аспирирования венозной крови (1 мл) в стерилизованную бутылку с целью свертывания. Чтобы избежать фрагментации и замедлить лизис, аутологические сгустки крови стабилизировали в течение 10 мин в дистиллированной воде при контролировании температуры (70°С). После анестезии раскрывали и дистально выделяли бедренные вены и инъецировали аутологические сгустки крови (0,05 г/кг) через постоянный катетер (20GA), которые помещали в бедренную вену, изолированную ранее. 50% Ацетоновый раствор соли диэтиламиноэтил ацетилсалицилат.ацетилсалициловой кислоты (P-1, в ацетоне, 15 мг/кг) и соли диэтиламиноэтил ацетилсалицилсалицилат. ацетилсалицилсалициловой кислоты (P-59, 15 мг/кг) местно наносили на спину кролика. Через 2 дня кроликов безболезненно умерщвляли посредством избыточной внутривенной инъекции амобарбитала натрия (60 мг/кг). Легкие и сердца отделяли с целью исследования, имеются ли тромбы в легочных артериях. Легкие погружали в 10% формалин на 24 ч. Последующие поперечные разрезы вдоль закупоренных легочных артерий заливали в парафин и окрашивали гематоксилин-эозином. В контрольной группе тромбоцитарный тромб и смешанный тромб окружали введенные сгустки, которые присутствовали также в крупных сосудах и растягивали стенки сосудов как в проксимальном, так и дистальном направлениях. Наблюдалась чрезмерная пролиферация эндотелиальных клеток и фиброцитов в этих сосудах. Кроме того, имелась острая легочная гиперемия. В группах P-1 и P-59, как легочная ткань, так и стенки сосудов были нормальными. Результаты показали, что тромбическую активность и связанное с эмболией распространение тромбов можно предотвратить с помощью указанных пролекарств NSAIA. Эти пролекарства могут быть очень полезными для предотвращения и лечения кровяных сгустков - основной причины ударов, сердечных приступов и отторжения трансплантата органов.
Пролекарства, предлагаемые в этом изобретении, могут помочь заживлению ран и смягчению и уменьшению шрамов от порезов и ожогов в моделях кроликов. Средняя площадь шрамов кроликов, подвергаемых лечению пролекарствами, составляет только одну треть от площади шрамов у кроликов из контрольной группы при одинаковых размерах порезов и ран в модели китайских белых кроликов, при этом шрамы являются такими же мягкими, как и нормальные не травмированные ткани.
COX-1 и COX-2 играют очень важную роль в иммунных реакциях у животных. NSAIA подавляет COX-1 и COX-2. Пролекарства NSAIA, предлагаемые в этом изобретении, могут быть очень полезными для лечения псориаза, дискоидной красной волчанки, системной красной волчанки (SLE) и других аутоиммунных заболеваний. Тяжелые суспензии маласезии [Rosenberg, E.W. et al., Mycopathologia, 72, 147-154 (1980)] накладывали на выбритую кожуна спине белых китайских кроликов (n=4×6) дважды (в 7 утра и 7 часов вечера) в день в течение 2 недель, при этом возникали повреждения, сходные с псориазом. Затем 5% водный раствор 3-пиперидинметил-2-(п-изобутилфенил) пропионат.AcOH (P-5), диэтиламиноэтил-1-метил-5-(4-метилбензоил)-1H-пиррол-2-ацетат.AcOH (P-13), диэтиламиноэтил-5-(4-хлорбензоил)-1,4-диметил-1H-пиррол-2-ацетат.AcOH (P-14), диэтиламиноэтил-1,8-диэтил-1,3,4,9-тетрагидропирано-[3,4-b]индол-1-ацетат.AcOH (P-15), диэтиламиноэтил-2-амино-3-(4-бромбензоил)бензолацетат.AcOH (P-17), диэтиламиноэтил-3-хлор-4-(2-пропенилокси)бензолацетат.AcOH (P-18), диэтиламиноэтил-1-(4-хлорбензоил-5-метокси-2-метил-1H-индол-3-ацетоксиацетат.AcOH (P-20), диэтиламиноэтил-4-(4-хлорфенил)-2-фенил-5-тиазолацетат.AcOH (P-21), диэтиламиноэтил-3-(4-хлорфенил)-1-фенил-1H-пиразол-4-ацетат.AcOH (P-22) накладывали на эти же участки через 3 часа (в 10 часов утра и 10 часов вечера) после наложения тяжелых суспензий маласезии (в 7 часов утра и 7 часов вечера). Через 10 дней после наложения этих пролекарств повреждения рассосались.
Для оценки активности против красной волчанки 5% соль диэтиламиноэтил ацетилсалицилат.ацетилсалициловой кислоты (P-1, в ацетоне, 30 мг/кг) или 3-пиперидинметил-2-(п-изобутилфенил)пропионат.AcOH (P-5, в воде, 30 мг/кг) местно наносили на кожу на спине мышей (MRL/LPR, n=5×3) с дискоидной красной волчанкой и системной красной волчанкой дважды в день. Через 6 недель у мышей, подвергаемых лечению пролекарствами, все кожные повреждения и люпус-нефрит рассосались, а состояние контрольных мышей ухудшалось.
Эти результаты показывают, что указанные пролекарства NSAIA являются многообещающими агентами для лечения псориаза, дискоидной красной волчанки, системной красной волчанки (SLE), рассеянного склероза (MS) и других аутоиммунных заболеваний у человека.
Патогенез некрозных клеток при боковом амиотрофическом склерозе (ALS) может включать эксайтотоксичность, обусловленную глутаматом, окислительное повреждение и апоптоз. Циклооксигеназа-2, присутствующая в спинномозговых нейронах и астроцитах, катализирует синтез простагландина E2. Простагландин E2 стимулирует выделение глутамата из астроцитов, тогда как циклооксигеназа-2 также играет ключевую роль в продуцировании провоспалительных цитокинов, реакционноспособных соединений кислорода и свободных радикалов. Лечение с помощью селективного ингибитора циклооксигеназы-2, целекоксиба, заметно ингибировало продуцирование простагландина E2 в спинном мозге мышей ALS. Лечение целекоксибом существенно замедляло наступление слабости и потери массы и продлевало выживание на 25%. Спинной мозг подвергаемых лечению мышей ALS демонстрировал существенное сохранение спинномозговых нейронов и уменьшение астроцитоза и микроглиальной активации (Merit. E. Cudkowicz et al., Annals of neurology, 52, 771-778, 2002). Эти результаты показывают, что ингибирование циклооксигеназы-2 может принести пользу ALS пациентам. Пролекарства NSAIA, предлагаемые в этом изобретении, могут проникать через кожу и мембранные барьеры нервных клеток при очень высоких скоростях (большинство NSAIA не может эффективно проникать в нервные клетки) и могут быть введены трансдермально, не травмируя желудочно-кишечный тракт, соответственно, эти пролекарства являются весьма многообещающими агентами для лечения рассеянного склероза (MS), болезни Крона и других аутоиммунных заболеваний, бокового амиотрофического склероза (ALS), дистрофии мышц глазного яблока и глотки (OPMD), миотонической дистрофии (MD), мышечной дистрофии Дюшенна (DMD), полимиозита (PM), дерматомиозита (DM), миозита с включенными тельцами (IBM) и других поражений мышц.
Механизмы воспаления были предложены в качестве важных посредников в патогенетическом развитии болезни Альцгеймера (McGeer PL, McGeer EG. The inflammatory response system of brain implications for the therapy of Alzheimer and other neurodegenerative diseases. Brain Res. Rev., 1995; 21: 195-218). В исследовании Veld et al. (the New England Journal of Medicine, 2001; 345, 1515), авторы исследовали почти 7000 человек с риском болезни Альцгеймера в течение почти семи лет. Их результаты свидетельствуют, что NSAIA могут уменьшать относительный риск у тех пациентов, у которых общее применение NSAIA составляло по меньшей мере два года и два или более лет до наступления деменции. Если бы нейропротективная способность NSAIA прекращалась в течение этих лет как раз перед наступлением деменции, то эти соединения не обеспечили бы защиту против прогрессирования для большинства пациентов с продромальной стадией заболеваний. Авторы полагают, что причина этого заключается в том, что ткани вокруг поврежденных нервных клеток образуют шрамы для защиты нервных клеток от дальнейшего повреждения. Большинство NSAIA имеют очень низкую скорость проникновения через барьер мозг-кровь и барьеры нервных клеток и не могут проникать через барьер шрама. Указанные пролекарства, предлагаемые в этом изобретении, имеют очень высокие скорости проникновения через барьеры кожи, кровь-мозг, мембраны нервных клеток и шрамов и являются очень многообещающими агентами для лечения болезни Альцгеймера, болезни Паркинсона и других прогрессирующих нейродегенеративных заболеваний.
Эти пролекарства могут помочь пациентам с повреждением спинного мозга, при котором излечение останавливается из-за защитных шрамов вокруг поврежденного спинного мозга. Большинство NSAIA не могут проникать через барьер шрама в терапевтически эффективном количестве, но пролекарства, предлагаемые в этом изобретении, могут проникать через барьер шрама, обладают противовоспалительной активностью и могут способствовать заживлению ран.
NSAIA являются не очень эффективными при лечении состояний, описанных выше, или имеют серьезные побочные эффекты, поскольку они не могут очень эффективно проникать через клеточную мембрану, особенно мозговых клеток и нервных клеток, и остаются в общем кровотоке слишком долго, соответственно, большинство лекарственных препаратов будет подвергаться метаболизму посредством слизистой оболочки кишечника, печени, почки и легкого до того, как они достигнут “места действия.” Это обстоятельство не только приводит к очень низкому фармакологическому эффекту, но также является причиной токсичной нагрузки на слизистую мембрану кишечника, печень, почки, легкие и другие части тела. Указанные пролекарства, предлагаемые в этом изобретении, проникают в кожу, мозг-кровь, клетки мозга, нервные клетки и другие мембранные барьеры очень хорошо и их эффективность в сотни раз больше, чем эффективность исходных лекарственных препаратов, при этом требуется только несколько десятых или сотых от обычной дозировки лекарственного препарата и возникает гораздо меньше побочных эффектов. Это принесет пользу не только трансдермальной доставке лекарственного препарата, но также любым другим системам доставки лекарственных препаратов (таким как пероральные, подкожные, внутривенные, путем ингаляции и назальные) и позволит лечить много состояний лучше, чем их могут лечить соответствующие исходные лекарственные препараты, и даже лечить некоторые состояния, которые нельзя лечить при помощи соответствующих исходных лекарственных препаратов.
Соединения общей формулы 1, 2a, 2b, 2c или 2d «структуры 1, 2a, 2b, 2c или 2d», указанные выше, можно получить из NSAIA посредством реакции с N,N'-дициклогексилкарбодиимидом, N, N'-диизопропилкарбодиимидом или другими связывающими реагентами с образованием ангидридов, которые затем реагируют с подходящими спиртами, тиолами или аминами.
Соединения общей формулы 1, 2a, 2b, 2c или 2d «структуры 1, 2a, 2b, 2c или 2d», указанные выше, можно получить из солей металлов, солей органических оснований или иммобилизованных основных солей NSAIA с применением подходящих галогенсодержащих соединений.
Трансдермальные системы для терапевтического применения на основе соединения общей формулы 1, 2a, 2b, 2c или 2d «структуры 1, 2a, 2b, 2c или 2d» или композиции, содержащей по меньшей мере одно соединение общей формулы 1, 2a, 2b, 2c или 2d «структуры 1, 2a, 2b, 2c или 2d» в качестве активного ингредиента, можно применять для лечения людей или животных с любыми состояниями, которые могут подвергаться лечению с помощью NSAIA, и любыми состояниями, указанными в настоящем изобретении. Указанные системы могут представлять собой повязку или пластырь, содержащие один основной слой, содержащий активное вещество, и непроницаемый защитный слой. Наиболее предпочтительной системой является резервуар с активным веществом, который имеет проницаемое дно, обращенное к коже. Путем контролирования скорости высвобождения такая система обеспечивает возможность поддержания постоянного оптимального уровня NSAIA в крови с увеличением эффективности и уменьшением побочных эффектов, вызываемых NSAIA. Такие системы можно носить на запястье, лодыжке, руке, ноге или любой части тела.
Преимущества, обеспечиваемые настоящим изобретением
NSAIA не очень эффективны при лечении состояний, описанных выше, или имеют серьезные побочные эффекты; поскольку они не способны эффективно проникать через мембрану клетки, особенно клеток мозга и нервных клеток, и остаются в общем кровотоке слишком долго, то большинство лекарственных препаратов подвергается метаболизму на слизистых оболочках желудочно-кишечного тракта, в печени, почках и легких до того, как достигнут “места действия”. Это обстоятельство не только приводит к очень слабому фармакологическому эффекту, но также является причиной токсической нагрузки на слизистые оболочки кишечника, а также печень, почки, легкие и любые другие части тела. Пролекарства, предложенные в настоящем изобретении, очень хорошо проникают через кожу, гематоэнцефалический барьер, мозговые клетки, нервные клетки и другие мембранные барьеры, при этом их эффективность в сотни раз больше, чем эффективность исходных лекарственных препаратов, и требуется только несколько десятых или сотых долей от обычной дозировки лекарственного препарата, и при этом возникает гораздо меньше побочных эффектов. При этом обеспечивается преимущество не только применительно к трансдермальной доставке лекарственного препарата, но также и к любым другим системам доставки лекарственных препаратов (таким как пероральные, подкожные, внутривенные, ингаляционные и назальные), что позволяет лечить множество состояний, которые нельзя лечить при помощи соответствующих исходных лекарственных препаратов. Указанные пролекарства могут быть введены не только трансдермально, но также перорально (они не будут травмировать желудок, поскольку они не могут проникать через стенки желудка) для терапевтического лечения любого вида и позволяют избежать большинства побочных эффектов, вызываемых NSAIA, в частности, желудочно-кишечных нарушений, таких как диспепсия, гастродуоденальное кровотечение, язва желудка и гастрит. Еще одно большое преимущество трансдермального введения указанных пролекарств состоит в том, что введение лекарственного препарата, особенно детям, является намного более простым.
Описание чертежей
R, R1, R2, R3, R4, R5, R6, R7, R8, R9, X, HA и Ary- в общих формулах (1, 2a, 2b, 2c или 2d) «структуры 1, 2a, 2b, 2c или 2d» определены при описании R, R1, R2, R3, R4, R5, R6, R7, R8, R9, X, HA и Ary- в пп.1-2.
Наилучший вариант реализации изобретения
Получение соли диэтиламиноэтилацетилсалицилата с ацетилсалициловой кислотой
180 г 2-ацетилсалициловой кислоты растворяли в 1000 мл хлороформа. Смесь охлаждали до 5°C. В смесь добавляли 103 г 1,3-дициклогексилкарбодиимида. Смесь перемешивали в течение 2 часов при комнатной температуре. Твердые отходы удаляли с помощью фильтрования и промывали хлороформом (3×300 мл). В реакционную смесь добавляли 59 г диэтиламиноэтанола. Смесь перемешивали в течение 3 часов при комнатной температуре. Органический раствор испаряли. После высушивания получали 220 г требуемого продукта (96%). Элементный анализ: C24H29NO8; мол. масса: 459,18. Рассчитано, % C: 62,73; H: 6,36; N: 3,05; O: 27,86; найдено, % C: 62,70; H: 6,40; Cl: N: 3,01; O: 27,90.
Реализация изобретения
Получение 1-пиперидинпропил-2[(2,6-дихлорфенил)амино]бензолацетат.AcOH
31,8 г (0,1 моль) 2[(2,6-дихлорфенил)амино]бензолацетата натрия суспендировали в 180 мл хлороформа. В смесь добавляли 28,6 г (0,1 моль) 1-пиперидинпропилбромид.HBr и смесь перемешивали в течение 5 часов при комнатной температуре. Смесь промывали 5% Na2CO3 (1×300 мл) и водой (3×100 мл). Смесь высушивали над безводным Na2SO4. Удаляли сульфат натрия с помощью фильтрования и промывали хлороформом (3×50 мл). В раствор добавляли 6 г уксусной кислоты. Раствор концентрировали в вакууме до 100 мл. Затем в раствор добавляли 300 мл гексана. Твердый продукт собирали путем фильтрации и промывали гексаном (3×100 мл). После высушивания получали 40 г требуемого продукта (86%). Элементный анализ: C24H30Cl2N2O4; мол. масса: 481,43. Рассчитано, % C: 59,88; H: 6,28; Cl: 14,73; N: 5,82; O: 13,29; найдено, % C: 59,83; H: 6,32; Cl: 14,71, N: 5,79; O: 13,35.
Получение 3-пиперидинметил-2-(п-изобутилфенил)пропионат.AcOH
60 г триэтиламина, связанного с полимером (3 ммоль/г, 100-200 меш), суспендировали в 500 мл хлороформа. В смесь при перемешивании добавляли 20,6 г (0,1 моль) 2-(п-изобутилфенил)пропионовой кислоты. В смесь добавляли 39 г (0,15 моль) 3-пиперидинметилбромид.HBr и смесь перемешивали в течение 10 часов при комнатной температуре. Полимер удаляли с помощью фильтрования и промывали ацетоном (3×50 мл). В раствор при перемешивании добавляли 300 мл 5% Na2CO3. Смесь перемешивали в течение 30 мин. Раствор хлороформа промывали водой (3×100 мл) и высушивали над Na2SO4. Сульфат натрия удаляли с помощью фильтрования и промывали хлороформом (3×100 мл). В смесь добавляли 6 г уксусной кислоты. Раствор концентрировали в вакууме до 100 мл. Затем в раствор добавляли 300 мл гексана. Твердый продукт собирали с помощью фильтрования и промывали гексаном (3×100 мл). После высушивания получали 35 г требуемого продукта (96%). Элементный анализ: C21H33NO4; мол. масса: 363,49. Рассчитано, % C: 69,39; H: 9,15; N: 3,85; O: 17,61; найдено, % C: 69,35; H: 9,18; N: 3,83; O: 17,64.
Промышленная применимость
Свойства пролекарств общей формулы (1, 2a, 2b, 2c или 2d) «структуры 1, 2a, 2b, 2c или 2d» превосходят соответствующие свойства NSAIA. Пролекарства согласно изобретению можно применять в медицинских целях для лечения любых состояний у человека или животного, которые могут подвергаться лечению с помощью NSAIA. Указанные пролекарства можно также использовать для лечения и предотвращения диабета (типов I и II), отклоняющихся от нормы уровней глюкозы и липидов в крови, удара, сердечного приступа и других сердечно-сосудистых заболеваний, болезни Альцгеймера, болезни Паркинсона и других нейродегенеративных заболеваний, псориаза, дискоидной красной волчанки, системной красной волчанки (SLE), аутоиммунного гепатита, склеродермии, синдрома Шегрена, ревматоидного артрита, полимиозита, склеродермии, тиреоидита Хашимото, ювенильного сахарного диабета, болезни Аддисона, витилиго, пернициозной анемии, гломерулонефрита и пневмофиброза, рассеянного склероза (MS), болезни Крона и других аутоиммунных заболеваний, бокового амиотрофического склероза (ALS), дистрофии мышц глазного яблока и глотки (OPMD), миотонической дистрофии (MD), мышечной дистрофии Дюшенна (DMD), полимиозита (PM), дерматомиозита (DM), миозита с включениями телец (IBM) и других мышечных нарушений, геморроя, воспаленного геморроя, постлучевого проктита, хронического неспецифического язвенного колита, криптита, других воспалительных состояний аноректума, анального зуда, простатита, простатоцистита, варикоза, аутоиммунного воспаления печени, аутоиммунного воспаления почек, воспалительных заболеваний сосудов и других воспалений, повреждений спинного мозга, шрамов, рака молочной железы, рака толстой кишки, рака ротовой полости, рака легких и других раковых заболеваний дыхательной системы, рака кожи, рака матки, рака половых органов, раковых заболеваний органов мочевыделения, лейкемии и других раковых заболеваний крови и лимфатических тканей, и других видов раковых заболеваний и многих других состояний. Указанные пролекарства можно вводить трансдермально без помощи веществ, улучшающих проникновение через кожу.
Реферат
Изобретение относится к новым положительно заряженным пролекарствам NSAIA общей формулы (1, 2a, 2b, 2c или 2d) «структуры 1, 2a, 2b, 2c или 2d»Значение радикалов R, R1, R2, R3, R4, R5, Ary, X представлены в пп.1, 2 формулы. 6 н. и 16 з.п. ф-лы, 14 табл.
Формула


R представляет собой разветвленную или линейную цепь -(CH2)n-, где
n составляет не более 12 в -(CH2)n-; и
любой CH2 может быть заменен на О, S, CH=CH, C≡C, CHR6, CR6R7, арильный остаток или другие циклические системы;
R1 представляет собой разветвленную или линейную цепь -(CH2)a-; где
а составляет не более 12 в -(CH2)a-; и
любой CH2 может быть заменен на О, S, CH=CH, C≡C, CHR6, CR6R7, арильный остаток или другие циклические системы;
R2 представляет собой разветвленную или линейную цепь -(CH2)b-, где
b составляет не более 12 в -(CH2)b-; и
любой СН2 может быть заменен на O, S, CH=CH, C≡C, CHR6, CR6R7, арильный остаток или другие циклические системы;
R3 представляет собой разветвленную или линейную цепь -(CH2)c-, где
c составляет не более 12 в -(СН2)с-; и
любой СН2 может быть заменен на О, S, CH=CH, C≡C, CHR6, CR6R7, арильный остаток или другие циклические системы;
R4 выбран из группы, состоящей из H, алкильного, алкилокси, алкенильного, перфторалкильного, алкилгалогенидного и алкинильного остатков, содержащих от 1 до 12 атомов углерода, арильной группы, при этом любой CH2 может быть заменен на O, S, CH=CH, C≡C, CHR6, CR6R7, арильную группу или другие циклические группы;
R5 выбран из группы, состоящей из H, алкильного, алкилокси, алкенильного, перфторалкильного, алкилгалогенидного и алкинильного остатков, содержащих от 1 до 12 атомов углерода, арильной группы, при этом любой СН2 может быть заменен на О, S, CH=CH, C≡C, CHR6, CR6R7, арильную группу или другие циклические группы;
R6 выбран из группы, состоящей из H, алкильного, алкилокси, алкенильного, перфторалкильного, алкилгалогенидного и алкинильного остатков, содержащих от 1 до 12 атомов углерода, арильной группы, при этом любой СН2 может быть заменен на O, S, CH=CH, C≡C, CHR6, CR6R7, арильную группу или другие циклические группы;
R7 выбран из группы, состоящей из H, алкильного, алкилокси, алкенильного, перфторалкильного, алкилгалогенидного и алкинильного остатков, содержащих от 1 до 12 атомов углерода, арильной группы, при этом любой CH2 может быть заменен на O, S, CH=CH, C≡C, CHR6, CR6R7, арильную группу или другие циклические группы;
X представляет собой O или S;
HA отсутствует или представляет собой HCl, HBr, HF, HI, HOAc, лимонную кислоту или любые кислоты, которые являются фармацевтически приемлемыми;
каждая R, R1, R2, R8, R9 или -(CH2)n- группа является разветвленной или линейной и может содержать C, H, O, Cl, Br, F, I, P, S, N или любые другие атомы, которые являются фармацевтически приемлемыми, и может содержать одинарные, двойные и/или тройные связи;
при этом все R, R1, R2, R8, R9 или -(CH2)n- группы могут являться ахиральными или хиральными, причем если группа является хиральной, она может содержать один или более хиральных центров и может представлять собой отдельный (R)- или (S)-энантиомер или смесь (R)- и (S)-энантиомеров; и
Ary - выбран из группы, состоящей из перечисленных ниже структур:












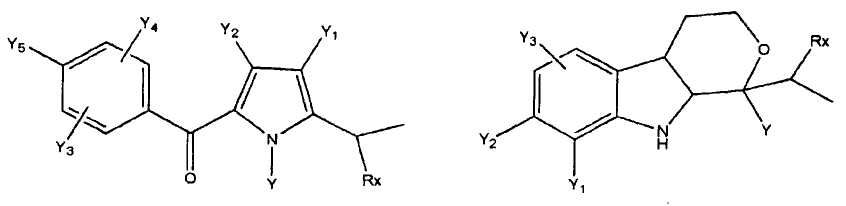








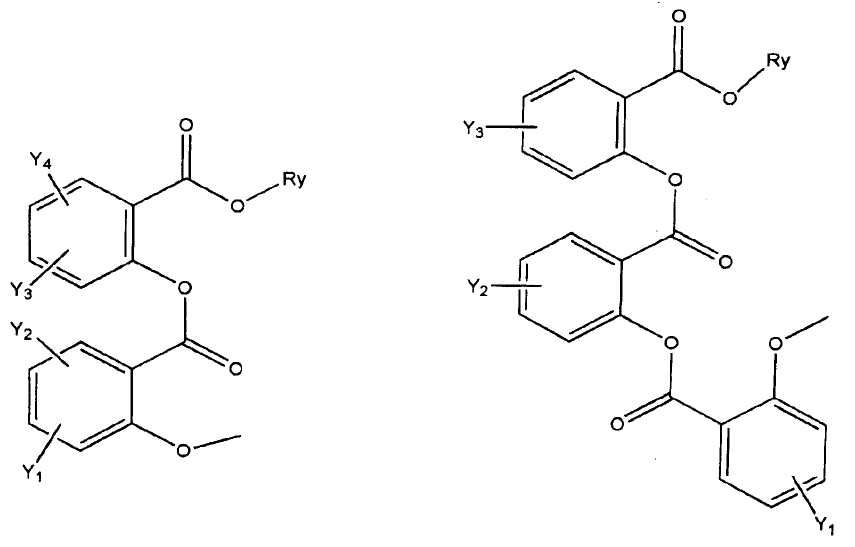




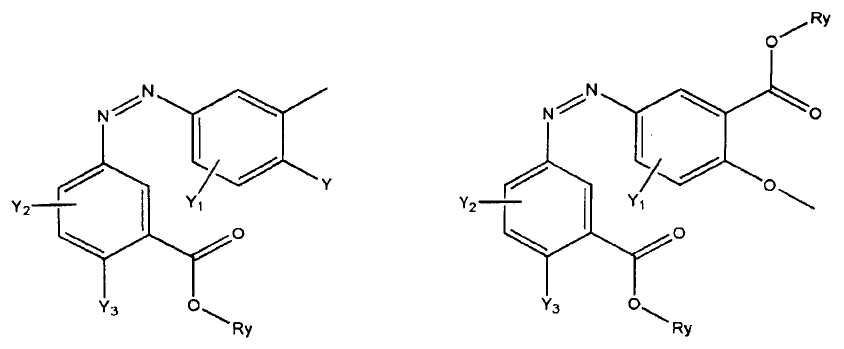










где Rx представляет собой H, CH3, CH3O, HO, CH3CH2, CF3, CHF2, CH2F, Cl, Br, или F;
Ry представляет собой H, один из любых алкильных, алкилоксильных, алкенильных, перфторалкильных, алкилгалогенидных или алкинильных остатков, содержащих от 1 до 12 атомов углерода, арильную группу;
X1 или X4 представляет собой CH2, S, O, NH или CO;
X2 или X5 представляет собой CH, CR8 или N;
X3 представляет собой O, S, NH или NR8;
Y, Y1, Y2, Y3, Y4, Y5 или Y6 представляет собой независимо H, HO, CH3COO, RyCOO, HS, NO2, CN, CH3COS, NH2, CH3CONH, RyCONH, CH3, CH3CH2, C3H7, C4H9, CH3O, CH3CH2O, C3H7O, Cl, F, Br, I, CH3S, CHF2O, CF3O, CF3CF2O, C3F7O, CF3, CF3CF2, C3F7, C4F9, CH3SO2, RySO2, CH3SO, RySO, CH3CO, CH3CH2CO;
любой Ary - может быть ахиральным или хиральным; при этом если Ary - является хиральным, он может содержать один или более хиральных центров и может представлять собой отдельный (R)- или (S)-энантиомер или смесь (R)- и (S)-энантиомеров;
при условии, что количество атомов углерода в арильной и другой циклической структуре составляет не более 12,
при условии, что:

Ary не может означать группу
когда Y=Y1=Y4=H и Y2=Y3=CH3; и

Ary не может означать группу
когда Y=H;
Y1=H, F, Cl, Br, I, CH3;
Y2=Y3=Y4=H, F, Cl, Br, I, CH3, CF3;
и при условии, что пролекарство содержит липофильную часть и первичную, вторичную или третичную аминогруппу, которая существует в протонированной форме при физиологических значениях pH.

R представляет собой разветвленную или линейную цепь -(CH2)n-,
где n составляет не более 12 в -(CH2)n-; и любой CH2 может быть заменен на O, S, NR8, CH=CH, C≡C, CHR8, CR8R9, арильный остаток или любые другие группы, которые являются фармацевтически приемлемыми;
R1 выбран из группы, состоящей из Н, алкильного, алкилокси, алкенильного, перфторалкильного, алкилгалогенидного и алкинильного остатков, содержащих от 1 до 12 атомов углерода, арильной группы, при этом любой CH2 может быть заменен на O, S, CH=CH, C≡C, CHR8, CR8R9, арильную группу или любые другие группы, которые являются фармацевтически приемлемыми;
R2 выбран из группы, состоящей из H, алкильного, алкилокси, алкенильного, перфторалкильного, алкилгалогенидного и алкинильного остатков, содержащих от 1 до 12 атомов углерода, арильной группы, при этом любой СН2 может быть заменен на O, S, CH=CH, C≡C, CHR8, CR8R9, арильную группу или любые другие группы, которые являются фармацевтически приемлемыми;
X представляет собой О или S;
R8 выбран из группы, состоящей из H, OH, Cl, F, Br, I, алкильного, алкилокси, алкенильного, перфторалкильного, алкилгалогенидного и алкинильного остатков, содержащих от 1 до 12 атомов углерода, и арильной группы;
R9 выбран из группы, состоящей из H, OH, Cl, F, Br, I, алкильного, алкилокси, алкенильного, перфторалкильного, алкилгалогенидного и алкинильного остатков, содержащих от 1 до 12 атомов углерода, и арильной группы;
Ary - имеет значения, указанные в п.1;
HA отсутствует или выбран из группы, состоящей из HCl, HBr, HF, HI, HOAc, лимонной кислоты и любой другой фармацевтически приемлемой кислоты;
все R, R1, R2, R8, R9 или -(CH2)n- группы являются разветвленными или линейными и могут содержать C, H, O, Cl, Br, F, I, P, S, N или любые другие атомы, которые являются фармацевтически приемлемыми, и могут содержать одинарные, двойные и/или тройные связи;
при этом все R, R1, R2, R8, R9 или -(CH2)n- группы могут являться ахиральными или хиральными; причем если группа является хиральной, она может содержать один или более хиральных центров и может представлять собой отдельный (R)- или (S)-энантиомер или смесь (R)- и (S)-энантиомеров;
при условии, что количество атомов углерода в арильной и другой циклической структуре составляет не более 12, при условии, что

Ary не может означать группу
когда Y3=Y4=Y1=Y2=H; Y=Rx=H или Y=F и Rx=CH3;

Ary не может означать группу
когда Y=H; Y1=Y2=Y3=Y4=H, CH3, CH3CH2, C3H7, C4H9, CH3O, CH3CH2O, C3H7O, Cl, F, Br, I, CHF2O, CF3O, CF3CF2O, C3F7O, CF3, CF3CF2, C3F7, C4F9; и
Ary не может означать группы


когда Y1=Y2=H; Y=OCOCH3;
и при условии, что пролекарство содержит липофильную часть и первичную, вторичную или третичную аминогруппу, которая существует в протонированной форме при физиологических значениях pH.
активный ингредиент, представляющий собой пролекарство по п.1 или 2 необязательно в форме композиции;
повязку или пластырь, имеющие один основной слой, содержащий активное вещество, и непроницаемый защитный слой;
где указанная трансдермальная система для терапевтического применения предназначена для лечения или предупреждения состояний у человека или животного, где указанное состояние выбрано из группы, состоящей из состояний, которые могут подвергаться лечению с помощью NSAIA, боли, нарушений обмена веществ, аномального кровяного давления, сердечных и сосудистых заболеваний, отторжения трансплантата органа, нейродегенеративных заболеваний, кожных заболеваний, аутоиммунных заболеваний, мышечных нарушений, воспалительных состояний аноректума и анального зуда, воспалений, лихорадки, рака, головной боли при острой мигрени, острого подагрического артрита, анкилозирующего спондилоартрита, ревматоидного артрита, остеоартрита, дисменореи и деменции, воспалительных состояний, повреждений спинного мозга и шрамов.
Документы, цитированные в отчёте о поиске
Бициклическое гетероциклическое соединение и фармацевтическая композиция




Комментарии