Бициклическое гетероциклическое соединение и фармацевтическая композиция - RU2059627C1
Код документа: RU2059627C1
Чертежи
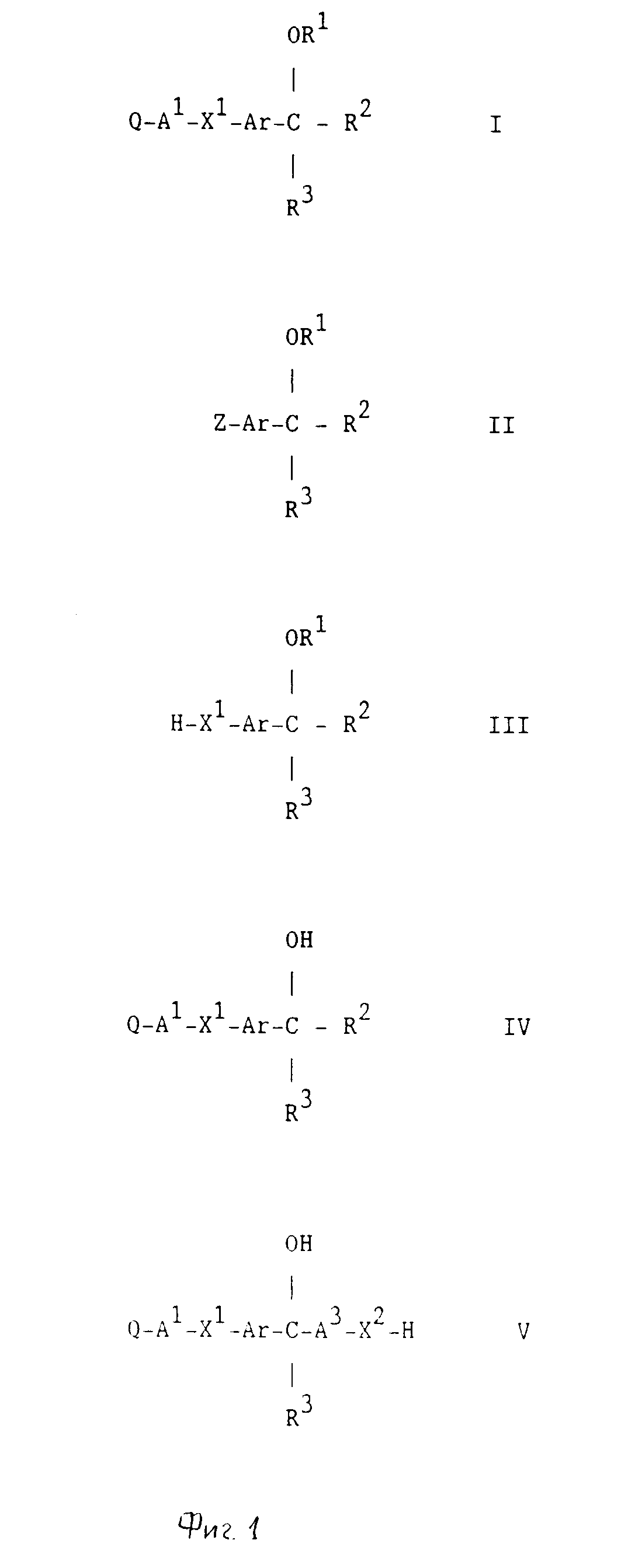
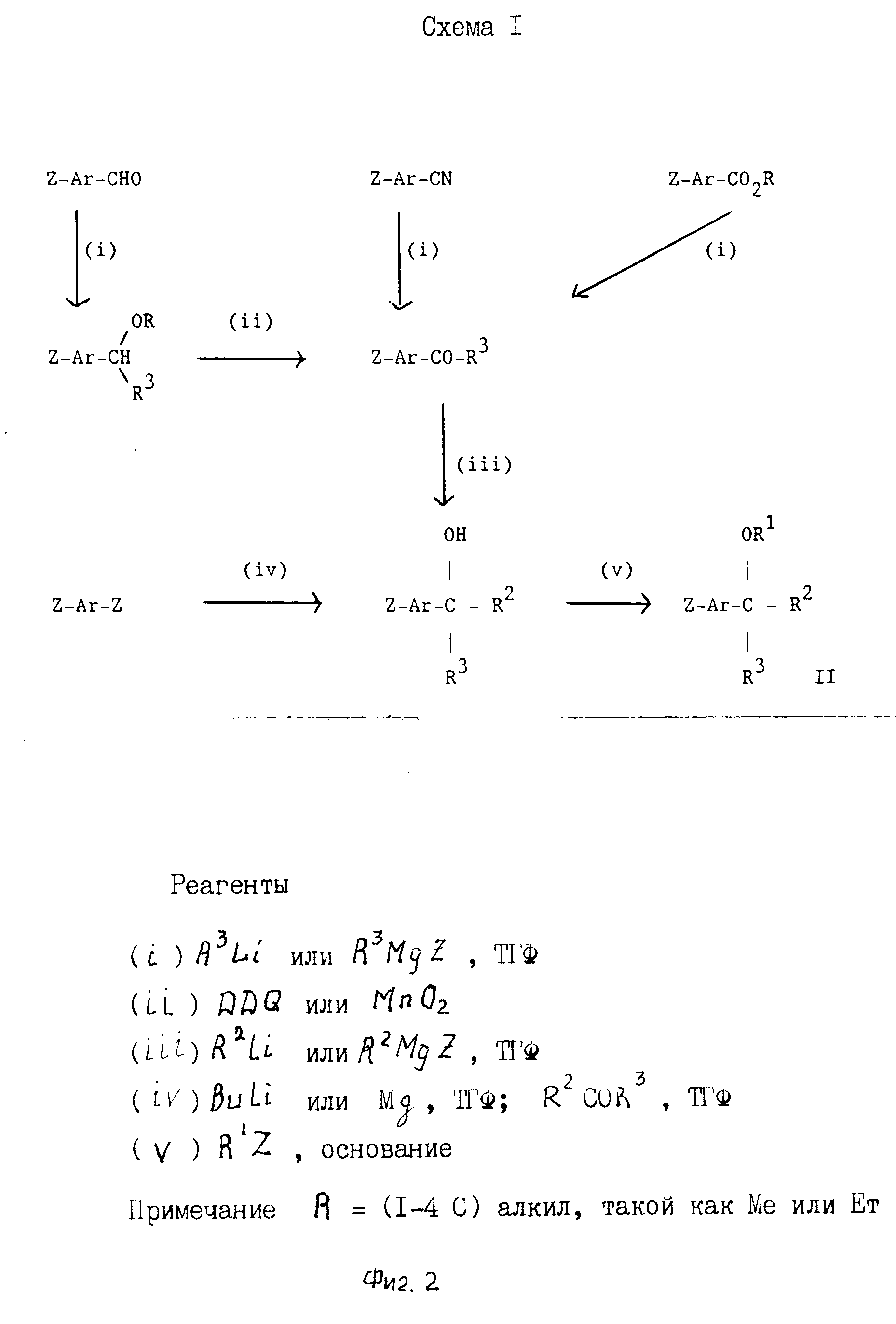
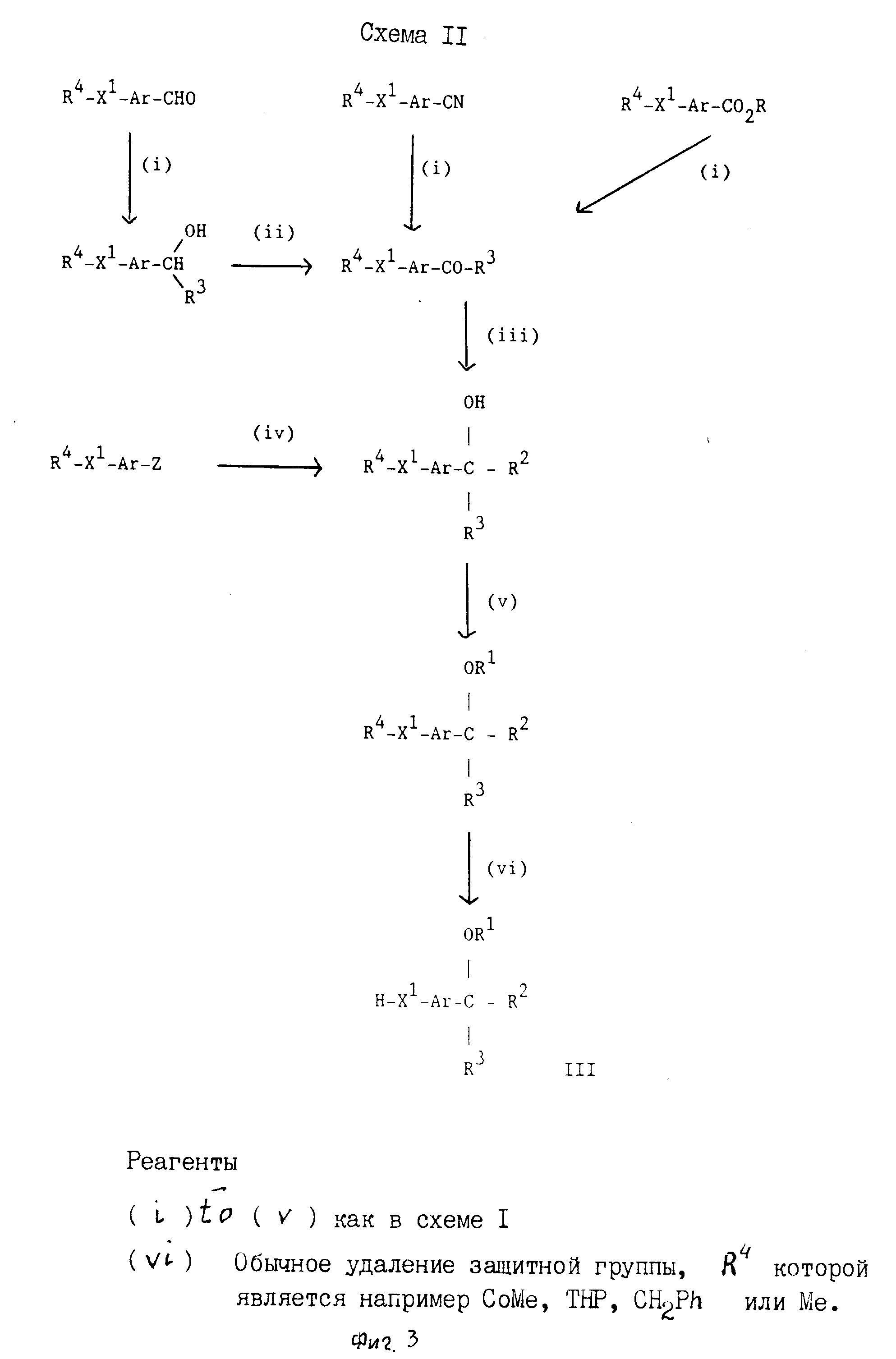

Описание
Изобретение касается новых бициклических гетероциклических соединений, и особенно новых бициклических гетероциклических соединений, которые являются ингибиторами фермента 5-липоксигеназы (называемой здесь далее как LO). Изобретение касается также способов получения указанных бициклических гетероциклических соединений и новых фармацевтических композиций, содержащих их. В изобретение также включено использование указанных бициклических гетероциклических соединений при лечении различных воспалительных и/или аллергических заболеваний, в которые вовлечены прямые или косвенные продукты катализированного ферментом 5-LO окисления арахидоновой кислоты, и производство новых медикаментов для такого применения.
Как указано выше, описанные здесь ниже бициклические гетероциклические соединения, являются ингибиторами 5-LO, об этом ферменте известно, что он вследствие каскадного процесса (включающего ряд реакций) вызывает образование физиологически активных лейкотриенов, таких как лейкотриен В4 (αТВ4) и пептидо-липидных лейкотриенов, таких как лейкотриен С4 (αТС4) и лейкотриен Д4 (αТД4) и различных метаболитов.
Биосинтетическая взаимосвязь и физиологические свойства лейкотриенов суммированы авторами G. W.Taylon и S.R.Clarke в работе "Trendsin Pharmacological Science", 1986, 7 100-103. Лейкотриены и их метаболиты вовлечены в процесс возникновения и развития различных воспалительных и аллергических заболеваний, таких как воспаление суставов (особенно ревматоидного артрита, остеоартрита и подагры, воспаление желудочно-кишечного тракта), (особенно воспалительное заболевание пищеварительного тракта, язвенный колит и гастрит), заболевание кожи (особенно псориаз, экзема и дерматит) и респираторные заболевания (особенно, астма, бронхит и аллергический ринит), и в процесс возникновения и развития разнообразных сердечно-сосудистых и цереброваскулярных расстройств, таких как инфаркт миокарда, ангина и заболевание периферических сосудов. В дополнение к сказанному лейкотриены являются медиаторами или посредниками воспалительных заболеваний ввиду их способности модулировать функцию лимфоцитов и лейкоцитов. Другие физиологически активные метаболиты арахидоновой кислоты, такие как простангландины и тромбоксаны, возникают вследствие действия на арахидоновую фермента циклогексигеназы.
В настоящее время обнаружено, что некоторые бициклические гетероциклические соединения являются эффективными в качестве ингибиторов фермента 5-LO и таким образом биосинтеза лейкотриенов. Таким образом, такие соединения представляют ценность в качестве терапевтических агентов при лечении, например, аллергических состояний, псориаза, астмы, сердечно-сосудистых и цереброваскулярных нарушений и/или воспалительных и артритных состояний, посредником которых полностью или частично является один или более лейкотриенов.
Согласно изобретению
представляется бициклическое гетероциклическое соединение формулы I
Q-A1
-X1-Ar-
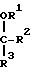
в которой AI является прямой связью с ХI или является /1-3C/-алкиленом,
в которой XI является окси, тио, сульфинилом или сульфонилом,
в которой Аr является фениленом, который может необязательно нести один или два заместителя, выбранные из галогено, окси, амино, /1-4C/ алкила, /1-4C/ алкокси, /1-4C/ алкиламино, ди-/1-4C/ /алкил/ амино и фтор-/1-4C/ алкила,
в которой R1 является /1-4C/ алкилом, /3-4C/ алкенилом или /3-4C/ алкинилом, и
в которой R2 и R3 вместе образуют группу формулы -А2-Х2-А3-, которая вместе с атомом углерода, к которому А2 и А3 присоединены, определяет кольцо, содержащее 5 или 6 кольцевых атомов, в которой А2 и А3, которые могут быть как одинаковыми, так и различными, каждый является /1-3C/ алкиленом, а Х2 является окси,
причем кольцо может неяти один или два /1-4C/ алкильных заместителя,
или его приемлемые с фармацевтической точки зрения соли.
В данном описании общий термин "алкил" включает алкильные группы, как с прямой цепью, так и с разветвленной цепью. Однако ссылки на индивидуальные алкильные группы, такие как "пропил" являются конкретными только для варианта групп с прямой цепью, а ссылки на индивидуальные алкильные группы с разветвленной цепью, такие как "изопропил" являются конкретными только для варианта с разветвленной цепью. Аналогичное условие применимо к другим общим терминам.
Следует понимать, что постольку, поскольку некоторые из соединений формулы 1 могут обнаруживать явление таутомеризма, а любое из изображений формулы, представленной здесь, может представлять только одну из возможных таутомерных форм, изобретение включает в свое определение любую таутомерную форму соединений формулы 1, которая обладает свойством ингибирования 5-LO и не должно ограничиваться лишь какой-либо одной таутомерной формой, использованной при изобретении формул.
Следует также понимать, что поскольку некоторые из соединений формулы I, определенной здесь, могут существовать в оптически активной или рацемической формах вследствие одного или более заместителей, содержащих асимметричный атом углерода, изобретение включает в своем определении любую такую оптически активную или рацемическую форму, которая обладает свойством ингибирования 5-LO. Синтез оптически активных форм может осуществляться с помощью стандартных методом органической химии, хорошо известных в технике, например, с помощью синтеза из оптически активных исходных материалов, или с помощью расщепления рацемических форм. Аналогичным образом, ингибирующие свойства в отношении 5-LO могут оцениваться с использованием стандартных лабораторных приемов, на которые дается ссылка ниже.
Подходящими значениями для общих (родовых) терминов, упоминаемых выше, являются значения, представленные ниже.
Подходящие значения заместителей, которые могут присутствовать у Q или Ar включают, например,
для
галогена: фтор, хлор, бром и йод
для /1-4C/ алкила: метил, этил, пропил,
изопрпил, бутил,
изобутил, и втор-бутил,
для /1-4C/ алкокси: метокси, этокси, пропокси,
изопропокси и бутокси
для фтор /1-4C/ алкила: фторметил, дифторметил,
трифторметил,
2-фторэтил, 2,2,2-трифторэтил и пентафторэтил,
для /1-4C/ алкиламино: метиламино,
этиламино, пропиламино
и бутиламино, и
для ди [/1-4C/ алкил] амино:
диметиламино, диэтиламино
и дипропиламино,
Подходящим значением для А1, когда он
представляет /1-3C/ алкилен, является, например, метилен, этилен или триметилен.
Подходящим значением для Ar, когда он представляет фенилен, является, например, 1,3-фенилен или 1, 4-фенилен.
Подходящим значением для R1, когда он представляет /1-4C/ алкил, является, например, метил, этил, пропил или бутил, когда он представляет /3-4C/ алкенил, им является, например, аллил, 2-бутенил или 3-бутенил, и когда он представляет /3-4C/ алкинил, им является например, 2-пропипинил или 2-бутинил.
Когда R2 и R3 вместе
образуют группу формулы -А2-Х2-А3-, которая вместе с
атомом углерода, к которому присоединены А2 и А3, определяет кольцо, имеющее 5-6 кольцевых
атомов, тогда подходящим значением А2 или А3, которые могут быть
одинаковыми или различными, когда каждый из них представляет /1-3C/ алкилен, является например, метилен, этилен
или триметилен. Подходящие значения для заместителей, которые могут присутствовать у
указанного 5- 7-членного кольца включает, например:
для /1-4C/ алкила: метил, этил, пропил, изопропил,
бутил, и изобутил
Подходящей фармацевтически приемлемой солью
бициклического гетероциклического соединения изобретения, является, например, кислотно-аддитивная соль бициклического
гетероциклического соединения изобретения, которое является достаточно основным,
например, кислотно-аддитивная соль, например, с неорганической или органической кислотой, например, соляной,
бромистоводородной, серной, фосфорной, трфторуксусной, лимонной или малеиновой кислотой. В
дополнение к сказанному подходящей фармацевтически приемлемой солью бициклического гетероциклического
соединения изобретения, которое является достаточно кислотным, является соль щелочного металла,
например, натриевая или калиевая соль, соль щелочно-земельного металла, например, кальциевая или
магниевая соль, аммониевая соль или соль с органическим основанием, которое дает физиологически
приемлемый катион, например соль с метиламином, диметиламином, триметиламином, пиперидином, морфолином
или трис-2-гидроксиэтиламином.
Конкретными новыми соединениями изобретения
являются, например, бициклические гетероциклические соединения формулы I, в которой
/a/ Q
представляет 4Н-1,4-бензоксазинил, 4Н-1,4-бензотиазинил или их соответствующие 2,
3-дигидропроизводные, которые могут необязательно нести один оксо или тиоксозаместитель и до четырех заместителей,
имеющих значения, определенные выше для дополнительного заместителя у Q, и А1, Х1, Ar, R1, R2 и R3 имеют любое из значений определенных выше;
/b/ Q представляет 2,3-дигидро-4Н-бензоксазинил,2,3-дигидро-4Н-1,
4-бензо-тиазинил, 1,2-дигидро-4Н-3,1-бензоксазинил или 2,3-дигидро-4Н-пиридо/3,2-/ /1,4-/оксазинил, которые могут необязательно
нести один оксо или тиоксо заместитель и до четырех заместителей,
имеющих значения, определенные здесь выше для дополнительных заместителей у группы Q, и А1, Х1, Ar, R1
, R2 и R3 имеют значения, определенные
здесь выше,
/c/ Q представляет собой 3-оксо-2,3-дигидро-4Н-1,4-бензоксазин-2-ил, 3-оксо-2,3-дигидро-4Н-1,4-бензоксазин-6-ил, или
3-оксо-2,3-дигидро-4Н-1,4-бензоксазин-6-ил или их
соответствующие 3-тиоксо-производные, или 3-оксо-2,3-дигидро-4Н-бензо- тиазин-2-ил, 3-оксо-2,3-дигидро-4Н-1,4-бензотиазин-6- или 3-оксо-2,
3-дигидро-4Н-1,4-бензотиазин-7-ил или их соответствующие
3-тиоксо производные, гетероциклический фрагмент которых может необязательно иметь до четырех заместителей, имеющих значения, определенные выше
для дополнительных заместителей у группы Q; и А1, Х1, Ar, R1, R2 и R3 имеют любое из значений определенных выше;
/e/ Q представляет
3-оксо-2,3-дигидро-4Н-1,4-бензоксазин-6-ил или 3-оксо-2,
3-дигидро-4Н-1,4-бензоксазин-7-ил или их соответствующие 3-тиоксо производные, 3-оксо-2,3-дигидро-4Н-1,4-бензтиазин-6-ил или 3-оксо-2,
3-дигидро-4Н-1,4-бензотиазин-7-ил или их соответствующие
3-тиоксо- производные, 2-оксо-1,2-дигидро-4Н-3,1-бензоксазин-6-ил или 2-оксо-1,2-дигидро-4Н-3,1-бензоксазин-7-ил или их соответствующие
2-тиоксо производные, или 3-оксо-2,3-дигидро-4Н-пиридо/3,
2-b/ /1,4/оксазин-6-ил или 3-оксо-2,3-дигидро-4Н-пиридо /3,2-b/ /1,4/оксазин-7-ил или их соответствующие 3-тиоксо производные,
гетероциклический фрагмент которых может необязательно иметь до четырех
заместителей, имеющих значения, определенные здесь выше для дополнительных заместителей у группы Q; и А1, Х1, Ar, R1, R2 и R3 имеют любое из
значений, определенных здесь выше;
/f/ А1 представляет прямую связь с Х1, и Х1
представляет окси, тио, сульфинил или сульфонил; и Q, Ar, R1, R2 и R3 имеют любое из значений, определенных выше;
/g/ А1 представляет метилен, и
Х1 представляет окси, тио, сульфинил или сульфонил; и Q, Ar, R1, R2 и R3 имеют любое из значений, определенных выше;
/h/ Ar представляет 1,
3-фенилен или 1,4-фенилен, который может необязательно иметь один или два заместителя,
выбранных из фтора, хлора, гидрокси, амино, нитро, уреидо, метила, метокси, метиламино, диметиламино,
трифторметила и ацетамидо; Q, А1, Х1, R1, R2 и R3 имеют любое из значений, определенных выше;
/i/ Ar представляет 3,5-пиридилен; и Q,
А1, Х1, R1, R2 и R3 имеют любое из значений,
определенных выше;
/j/ R1 представляет метил, этил, аллил или 2-пропинил; и Q,
А1, Х1, Ar, R2 и R3 имеют любое из значений,
определенных выше;
/k/ R2 и R3 вместе образуют группу формулы -А2
-Х2-А3-, которая вместе с атомом углерода, к которому присоединены
А2 и А3, определяют кольцо, имеющее 5-7 кольцевых атомов, где А2 и А3, которые могут быть одинаковыми или различными, каждый представляет собой метилен,
этилен или триметилен, и Х2 представляет окси, и это кольцо может иметь один или два заместителя,
выбранных из гидрокси, метила, этила, пропила, метокси и этокси; и Q, А1, Х1, Ar и R1 имеют любое из значений, определенных выше; или
/l/ R1 и
R2 вместе образуют группу формулы -А2-Х2-А3-,
которая вместе с атомом кислорода, к которому присоединен А2, и с атомом углерода, к которому
присоединен А3, ограничивает кольцо, имеющее 5-7 кольцевых атомов, где А2
и А3, которые могут быть одинаковыми или различными, каждый представляет метилен или этилен,
и Х2 представляет окси, и это кольцо, может иметь один, два или три заместителя,
выбранных из метила, этила и пропила, и R3 представляет метил или этил; и Q, А1, Х1 и Ar имеют любое из значений, определенных выше;
или их фармацевтические
приемлемые соли.
Предпочтительные соединения изобретения включают бициклические
гетероциклические соединения формулы I, в которой Q представляет 4Н-1,4-бензоксазинил, 4Н-1,
4-бензотиазинил или их соответствующие 2,3-дигидро-производные, которые могут необязательно иметь один оксо
или тиоксо заместитель и до четырех заместителей, выбранных из фтора, хлора, брома,
гидрокси, циано, амино, метила, этила, пропила, метокси, трифторметила, 2-фторэтила, 2,2,2-трифторэтила,
2-метиламиноэтил, 2-диметиламиноэтила, фенила и бензила, и где указанный фенильный или
бензильный заместитель может необязательно иметь заместитель, выбранный из хлора, метила и метокси;
А1 представляет прямую связь с Х1 или является метиленом;
Х1 представляет собой окси, тио, сульфинил или сульфонил;
Ar представляет 1,3-фенилен или 1,
4-фенилен, который может необязательно иметь один или два заместителя, выбранных из
фтора, хлора, гидрокси, амино, нитро, уреидо, метокси, диметиламино, трифторметила и ацетамидо; или
Ar
представляет собой 3,5-пиридилен;
R1 представляет метил, этил,
аллил или 2-пропинил; и
R2 и R3 вместе образуют группу формулы -А2-Х2-А3-, которая вместе с атомом углерода, к которому присоединены
А2 и А3, определяет кольцо, имеющее 5 или 6 кольцевых атомов, где А2 представляет
этилен, А3 представляет метилен или этилен, и Х2 представляет
окси, и это кольцо может иметь один или два заместителя, выбранных из метила, этила, пропила, метокси и этокси;
или R1 и R2 вместе образуют группу формулы -А2
-Х2-А3-, которая вместе с атомом кислорода, к которому присоединен А2, и с атомом
углерода, к которому присоединен А3, определяет кольцо, имеющее 5 или 6
кольцевых атомов, где А2 представляет метилен, А3 представляет метилен или этилен, и Х2 представляет окси, и которое /кольцо/ может иметь один, два или три
заместителя, выбранных из метила, этила и пропила, и R3 представляет метил или этил; или их фармацевтически
приемлемые соли.
Дополнительные предпочтительные соединения
изобретения включают бициклические гетероциклические соединения формулы I, где Q представляет 3-оксо-2,3-дигидро-4Н-1,
4-бензоксазин-7-ил или 3-оксо-2,3-дигидро-4Н-1,4-бензотиазин-7-ил, который может
необязательно иметь один, два или три заместителя, выбранных из фтора, хлора, метила, этила, пропила, 2-фторэтила,
2-диметиламиноэтила, фенила и бензила;
А1 представляет прямую
связь с Х1 или является метиленом;
Х1 представляет окси, тио, сульфинил или сульфонил;
Ar представляет 1,3-фенилен или 1,4-фенилен, который может необязательно
иметь один или два заместителя, выбранных из фтора, гидрокси, амино, нитро, уреидо, метокси, диметиламино,
трифторметила и ацетамидо; или
Ar представляет 3,5-пиридилен;
R1
представляет метил, этил, аллил или 2-пропинил; и
R2 и R3 вместе образуют
группу формулы -А2-Х2-А3-, которая вместе с атомом углерода,
к которому присоединены А2 и А3, ограничивает кольцо, имеющее 5 или 6 кольцевых
атомов, где А2 представляет этилен, А3 метилен или этилен, и Х2
окси, и которое /кольцо/ может иметь один или два заместителя, выбранных из метила и этила;
или R1 и R2 вместе образуют группу формулы -А2-Х2
-А3-, которая вместе с атомом кислорода, к которому присоединен А2 и с атомом
углерода, к которому присоединен А3, ограничивает кольцо, имеющее 5 кольцевых атомов,
где А2 представляет метилен, А3 представляет метилен, и Х2
представляет окси, и которое /кольцо/ может иметь один, два или три заместителя, выбранных из метила и
этила, и R3 представляет метил или этил;
или их фармацевтически приемлемые
соли.
Следующие предпочтительные соединения изобретения включают бициклические
гетероциклические соединения формулы I, в которой Q представляет 3-оксо-2,3-дигидро-4Н-1,
4-бензоксазин-7-ил или 3-оксо-2,3-дигидро-4Н-1,4-бензотиазин-7-ил, или их соответствующие 4-метильные
производные, которые могут необязательно иметь один или два заместителя, выбранных из метила и
этила;
А1 представляет прямую связь с Х1 или является метиленом;
Х1 представляет окси, тио, сульфинил или сульфонил;
Ar представляет 1,
3-фенилен, который может необязательно иметь один или два заместителя, выбранных из фтора, метокси и
трифторметила;
R1 представляет метил, этил или аллил; и
R2
и R3 вместе образуют группу формулы -А2-Х2-А3-, которая
вместе с атомом углерода, к которому присоединены А2 и А3, определяет кольцо,
имеющее 5 или 6 кольцевых атомов, где А2 представляет этилен, А3 представляет
метилен или этилен, и Х2 представляет окси, и которое может иметь заместитель, выбранный
из метила, этила, пропила и метокси;
или их фармацевтически приемлемые соли.
Следующая предпочтительная группа соединений изобретения включает бициклические гетероциклические
соединения формулы 1, в которой Q представляет 4-метил-3-оксо-2,3-дигидро-4Н-1,
4-бензоксазин- 7-ил или 4-метил-3-оксо-2,3-дигидро-4Н-1,4-бензотиазин-7-ил, или их соответствующие 2,2-диметильные
производные;
А1 представляет метилен;
Х1
представляет окси;
Ar представляет 1,3-фенилен или 5-фтор-1,3-фенилен;
R1 представляет
метилен; и R2 и R3 вместе образуют группу формулы -А2-Х2-А3-, которая вместе с атомом углерода, к которому присоединены А2 и А3, ограничивает кольцо, имеющее 6 кольцевых атомов, где каждый из А2 и А3 представляет этилен, и Х2 представляет окси, и которое может иметь метильный или
этильный заместитель в альфа-положении относительно Х2;
или их
фармацевтически приемлемые соли.
Дополнительно предпочтительные соединения изобретения включают
бициклические гетероциклические соединения формулы I, где Q представляет 3-оксо-2,
3-дигидро-4Н-1,4-бензоксазин-6-ил, 3-оксо-2,3-дигидро-4Н-1,4-бекнзоксазин-7-ил, 3-тиоксо-2,3-дигидро-4Н-1,
4-бензоксазин-7-ил, 2-оксо-1,2-дигидро-4н-3,1-бензоксазин-6-ил, 3-оксо-2,3-дигидро-4н-1,
4-бензотиазин-7-ил или 3-оксо-2,3-дигидро-4Н- пиридо/3,2-b//1,4/оксазин-7-ил или их соответствующие N-метильные
производные, которые могут необязательно иметь один или два заместителя, выбранных из
метила и этила;
А1 представляет прямую связь с Х1, или является метиленом;
Х1 представляет окси, тио, сульфинил или сульфонил;
Ar
представляет 1,3-фенилен, который может необязательно иметь один или два заместителя, выбранных из фтора, метокси и
трифторметила; R1 представляет метил, этил или аллил; и R2 и
R3 вместе образуют группу формулы -А2-Х2-А3-, которая вместе с атомом
углерода, к которому присоединены В2 и А3, ограничивает кольцо,
имеющее 5 или 6 кольцевых атомов, где А2 представляет этилен, А3 представляет метилен или
этилен, и Х2 представляет окси, и которое может иметь заместитель, выбранный
из метила, этила, пропила и метокси, или их фармацевтически приемлемые соли.
Следующие
предпочтительные соединения изобретения включают бициклические гетероциклические соединения
формулы I, в которой Q представляет 4-метил-3-оксо-2,3-дигидро-4Н-1,4-бензоксазин- 6-ил, 4-метил-3-оксо-2,
3-4Н-1,4-бензоксазин-7-ил, 2,2,4-триметил-3-оксо-2,3-дигидро-4Н-1,4-бензоксазин-7-ил,
4-метил- 3-тиоксо-2,3-дигидро-4Н-1,4-бензоксазин-7-ил, 1-метил-2-оксо-1,2-дигидро-4Н-3,1-бензоксазин-6-ил или
4-метил-3-оксо-2,3-дигидро- 4Н-пиридо /3,2-b//1,4/оксазин-7-ил;
А1
представляет прямую связь с Х1, или является метиленом;
Х1 представляет окси или
тио;
Ar представляет 1,3-фенилен или 5-фтор-1,3-фенилен;
R1
представляет метил; и R2 и R3 вместе образуют группу формулы -А2-Х2
-А3-, которая вместе с атомом углерода к которому присоединены А2
и А3, ограничивает кольцо, имеющее 6 кольцевых атомов, где А2 и А3 представляет
каждый этилен, и Х2 представляет окси, и которое может иметь метильный или
этильный заместитель в альфа-положении относительно Х2;
или их фармацевтически приемлемые
соли.
Конкретные особенности: предпочтительные соединения изобретения включают, например, следующие бициклические гетероциклические соединения формулы I или их фармацевтически приемлемые соли: 4-[5-фтор-3-(4-метил-3-оксо-2,3-дигидро-4Н-1,4-бензоксазин-7-ил метокси)фенил] -4-метокситетрагидропиран, 4-[5-фтор-3-(2,2,4- триметил-3-оксо-2,3-дигидро-4Н-1,4-бензо- ксазин-7-ил метокси)фенил]-4-метокситетрагидропиран и 4-[5-фтор-3-(2,2,4-триметил-3-оксо-2, 3-дигидро-4Н-1,4-бензотиазин-7-ил метокси)фенил]-4-метокситетрагидропиран.
Дополнительные особенности: предпочтительные соединения изобретения включают следующие бициклические гетероциклические соединения формулы I или их фармацевтически приемлемые соли: 4-[5-фтор-3-(4-метил-3-тиоксо-2,3-дигидро-4Н- 1, 4-бензоксазин-7-ил тио)фенил-4-метокситетрагидропиран, 4-[5-фтор-3-(4-метил-3-оксо-2,3-дигидро-4Н-1,4-бензоксазин-7-ил- тио)фенил]-4-метокситетрагидропиран, (2S, 4R)-4-[5-фтор-3-(4-метил-3-оксо-2, 3-дигидро- 4Н-1,4-бензоксазин-7-илтио)фенил] -4-ме- токси-2-метилтетрагидропиран; (S)-(+)-4-[5-фтор-3-(2,4-диметил-3-оксо-2,3-дигидро-4Н-1,4-бензоксазин-7-илт ио)фенил] -4-меток-ситетрагидропиран и (R)-(-)-4-[5-фтор-3-(2,4-диметил-3-оксо-2, 3-дигидро-4Н-1,4-бензо-ксазин-7-ил тио)фенил] -4-метокситетрагид- ропиран.
Соединения изобретения, включающие бициклические гетероциклические соединения формулы I или их фармацевтически приемлемые соли, могут получаться с помощью любого процесса, известного в применении для получения структурно родственных соединений. Такие приемы предусматриваются в качестве дополнительного аспекта изобретения и иллюстрируются следующими характерными примерами, в которых, если нет иных указаний, Q, А1, Х1, Ar, R1, R2 и R3 имеют любое из значений, определенных здесь выше.
/a/ Реакция сочетания, предпочтительно в присутствии подходящего основания, соединения формулы 0-А1-Х1 -Н с соединением формулы II, где Z представляет замещаемую группу; при условии, что, когда у группы Q, Ar, R2 и R3 есть амино, алкиламино или гидрокси группа, любая амино, алкиламино или гидрокси группа может быть защищенной обычной защитной группой, или альтернативно любая такая группа не нуждается в защите, после чего любая нежелательная защитная группа у групп Q, Ar, R2 и R3 удаляется с помощью общепринятых средств.
Подходящей замещаемой группой Z является, например, галоидная или сульфонилокси группа, например, фтор, хлор, бром, иод, метансульфонилокси или толуол-п-сульфонилокси группа.
Подходящим основанием для реакции сочетания является, например, карбонат, (1-4С)алкоголят, гидроокись или гидрид щелочного или щелочно-земельного металла, например, карбонат натрия, карбонат калия, этилат натрия, бутилат натрия, гидроокись натрия, гидроокись калия, гидрид натрия или гидрид калия, или металлоорганическое основание, такое как (1-4С)алкил-литий, например, н-бутил-литий. Реакция сочетания удобным образом проводится в подходящем инертном растворителе или разбавителе, например, N, N-диметил-формамиде, N, N-диметилацетамиде, N-метилпирролидин-2-оне, диметилсульфоксиде, ацетоне, 1,2-диметоксиэтане или тетрагидрофуране, и при температуре в интервале, например, 10-150о С, удобным образом при температуре, равной или близкой к 100о С.
Реакция удобно может проводиться в присутствии подходящего катализатора, например, металлического катализатора, например, палладиевого (0) или медного (1), такого как тетракис(трифенилфосфин) палладий, хлористая медь или бромид меди.
Подходящей защитной группой для амино или алкиламино группы является, например, ацильная группа, например, (2-4С)алканоильная группа (особенно ацетильная), (1-4С), алкоксикарбонильная группа (особенно, метоксикарбонильная, этоксикарбонильная или трет-бутоксикарбонильная), арилметоксикарбонильная группа (особенно бензилоксикарбонильная) или ароильная группа (особенно бензоил). Условия деблокирования или снятия защиты указанными защитными группами обязательно варьируют в зависимости от выбора защитной группы. Так, например, ацильная группа, такая как алканоильная, или алкоксикарбонильная или ароильная группа, могут удаляться, например, с помощью гидролиза подходящим основанием, таким как гидроокись щелочного металла, например гидроокись лития или натрия. Альтернативно арилметильная группа такая как бензильная, может удаляться, например, с помощью гидрирования над катализатором таким, как палладий на активированном угле.
Исходные вещества формулы 0-А1-Х1-Н и формулы II могут получаться с помощью стандартных приемов органической химии. Получение таких исходных материалов описывается в сопровождающих неограничивающих примерах, которые представлены только для целей иллюстрации.
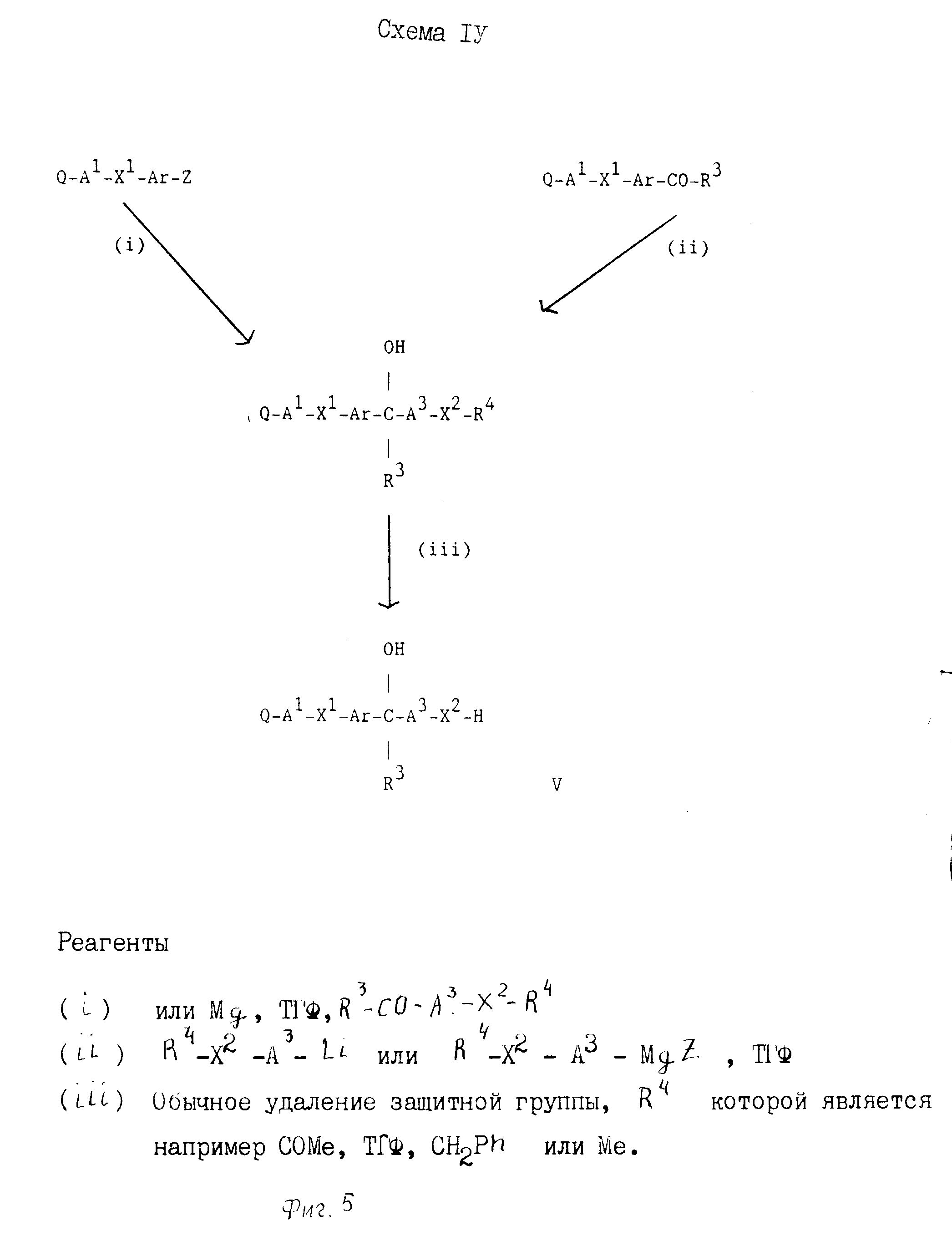
Промежуточные соединения формулы II, в которой Z, Ar, R1, R2 и R3 имеют значения, определенные выше, могут удобным образом получаться с использованием соединений формулы Z-Ar-Y, в которой Z и Ar имеют значения, определенные выше, и Y представляет, например галоид, формил, алканоил, нитрильную или алкоксикарбонильную группу. Так, например, в сопровождающих описание неограничивающих примерах показано, как превращать соединение формулы Z-Ar-Y, в которой Y представляет галоидную группу, в соединение формулы II (фиг.1).
Также понятно, что промежуточное соединение формулы II может удобным образом получаться из соединения формулы Z-Ar-Y, определенной выше, с помощью обратного порядка введения групп R2 и R3, который используется по схеме I (фиг.2).
/b/ Алкилирование, предпочтительно, в присутствии подходящего основания, определенного выше, соединения формулы III соединением формулы 0-А1-Z, где Z представляет замещаемую группу, определенную выше; при условии, что, когда в группах Q, Ar, R2 или R3 есть амино, алкиламино или гидрокси группа, любая амино, алкиламино или гидрокси группа может быть защищена общепринятой защитной группой, определенной здесь ранее, или альтернативно любая такая группа является незащищенной, после чего любая нежелательная защитная группа в группах Q, Ar, R2 или R3 удаляется с помощью обычных средств.
Реакция алкилирования удобным образом проводится в подходящем инертном растворителе, определенном здесь выше, и при температуре в интервале, например 10-150о С, удобным образом при температуре равной или близкой к 100о С. Реакция может удобно проводиться в присутствии подходящего катализатора, определенного здесь выше.
Исходные материалы формулы Q-A1-Z и формулы III могут быть получены с помощью стандартных приемов органической химии. Получение таких исходных материалов описывается в сопровождающих неограничительных примерах, которые приводятся только для целей иллюстрации. Альтернативно необходимые исходные материалы могут получаться с помощью процедур, аналогичных процедурам, проиллюстрированным на схеме II (фиг.3), представленной ниже, или с помощью модификации их, которые известны специалистам органической химии.
Подходящей защитной группой R4, применяемой по схеме II, является, например, любая из многих таких групп, известных в технике, и включает она любую подходящую защитную группу, определенную выше. Примеры таких групп даны на схеме II. Условия введения и удаления таких защитных групп описываются в стандартных справочниках по органической химии, таких как, например Protective Groups in Organanic Synthesis авторов Т.W.Green, (изд-во J.Wiley and Sons, 1981).
/c/ Алкилирование предпочтительно в присутствии подходящего основания, определенного выше, соединения формулы IV соединением формулы R1-Z, где R1 и Z имеют значения, определенные выше; при условии, что, когда у групп Q, X1, Ar, R2 или R3 есть амино, имино, алкиламино или гидрокси группа, любая амино, имино, алкиламино или гидрокси группа может быть защищена обычной защитной группой, или альтернативно любая такая группа является незащищенной, после чего любая нежелательная защитная группа у групп Q, X1, Ar, R2 или R3 удаляется с помощью обычных средств.
Подходящей защитной группой для имино групп является, например, любая из защитных групп, определенных выше для амино или алкиламино группы.
Третичный спирт, исходный материал формулы IV, может быть получен с помощью стандартных приемов органической химии. Удобным образом, и как проиллюстрировано на схеме III (фиг.4) представленной ниже, промежуточные соединения формулы Q-A1-X1-Ar-Y, где Q, А1, Х1 и Ar имеют значения, определенные выше, и Y представляет, например, галоидную, формильную, алканоильную, нитрильную или алкоксикарбонильную группу, могут использоваться при получении третичного спиртового исходного материала формулы IV.
/d/ Для получения тех соединений формулы I, в которой R1 и R2 вместе образуют группу формулы -А2-Х2-А3-, которая вместе с атомом кислорода, к которому присоединен А2, определяет кольцо, имеющее 5-7 кольцевых атомов, и где А2, Х2 и А3 имеют значения, определенные выше, и где R3 имеет значения, определенные выше; циклизация соединения формулы IV по реакции с соответствующим альдегидом или кетоном, или с полуацеталем или ацеталем его, или с соединением формулы Z-А2-Z, где Z имеет значения, определенные выше; при условии, что, когда у групп Q, Х1 или Ar есть амино, имино, алкиламино или гидрокси группа, любая амино, имино, алкиламино или гидрокси группа является защищенной обычной защитной группой, после этого любая нежелательная защитная группа у групп Q, Х1 или Ar удаляется с помощью обычных средств.
Циклизация соединения формулы V подходящим альдегидом или кетоном или его полуацеталем или ацеталем, удобным образом осуществляется в присутствии подходящей кислоты. Подходящей кислотой для реакции циклизации является, например, неорганическая кислота такая, как соляная, серная или фосфорная, или, например, органическая кислота, такая, как п-толуолсульфокислота или трифторуксусная кислота. Реакция циклизации удобно проводится в подходящем инертном растворителе или разбавителе, например 1,2-диметоксиэтане или тетрагидрофуране. Предпочтительно реакция проводится с использованием соответствующего альдегида или кетона, или его полуацеталя или ацетального производного в качестве как реагента, так и разбавителя. Циклизация проводится при температуре в интервале, например, 20-150о С, удобным образом при температуре, равной или близкой к точке кипения разбавителя или растворителя.
Циклизация соединения формулы V соединением формулы Z-А2-Z удобно осуществляется в присутствии подходящего основания, определенного выше.
Третичный спирт и исходный материал формулы V может получаться с помощью стандартных приемов органической химии. Удобным образом, и как проиллюстрировано на сопровождающей схеме IV (фиг.5), промежуточные соединения формулы Q-А1-Х1-Ar-Y, в которой Q, А1, Х1, Ar и Y имеют значения, определенные выше, могут использоваться при получении третичного спирта, исходного материала формулы V.
Применяется подходящая защитная группа R4, определенная выше.
/e/ Для получения соединений формулы I, в которой Х1 представляет сульфинильную или сульфонильную группу, где R2 и R3 вместе образуют группу формулы -А2-Х2-А3-, Х2 представляет сульфинильную или сульфонильную группу или R1 и R2 вместе образуют группу формулы -А2-Х2-А3-, и R2 представляет сульфинильную или сульфонильную группу, окисление соединения формулы I, в которой Х1 представляет тио группу, где R2 и R3 вместе образуют группу формулы -А2 -Х2-А3-, и Х2 представляет тио группу или, где R1 и R2 вместе образуют группу формулы -А2-Х2 -А3-, и Х2 представляет тио группу.
Подходящим окисляющим агентом является, например, любой агент, известный в технике для окисления тио в сульфинил или и/или сульфонил, например перекись водорода, надкислота (такая как 3-хлорпероксибензойная или пероксиуксусная кислота), пероксисульфат щелочного металла (такой как пероксимоносульфат калия), трехокись хрома или газообразный кислород в присутствии платины. Окисление обычно осуществляется по возможности в мягких условиях и с помощью требуемого стехиометрического количества окисляющего агента для того, чтобы снизить риск чрезмерного окисления и повреждения других функциональных групп. Обычно реакция осуществляется в подходящем растворителе или разбавителе, таком как метиленхлорид, хлороформ, ацетон, тетрагидрофуран или трет-бутилметиловый эфир, и при температуре, например, равной или близкой к температуре окружающей среды, то есть, в пределах 15-35о С. Когда требуется соединение, несущее сульфинильную группу, может также использоваться более мягко окисляющий агент, например, метапериодат натрия или калия, удобным образом в полярном растворителе таком, как уксусная кислота или этанол. Когда требуется соединение формулы I, содержащее сульфонильную группу, оно может получаться при окислении соответствующего сульфинильного соединения, а также соответствующего тио соединения.
/f/ Для получения соединения формулы I, где Ar имеет алканоиламино заместитель, ацилирование соединения формулы I, в которой Ar несет амино заместитель.
Подходящим ацилирующим агентом является, например, любой агент известный в технике для ацилирования амино в ациламино, например, ацилгалогенид, например, (2-6С)алканоилхлорид или бромид, в присутствии подходящего соединения; алкановой кислоты, например, ангидрид (2-6С)алкановой кислоты, или смешанный ангидрид алкановой кислоты, например, смешанный ангидрид, образуемый при реакции алкановой кислоты и (1-4С)алкоксикарбонил галогенида, например (1-4С)алкоксикарбонил- хлорида, в присутствии подходящего основания. Обычно реакция осуществляется в подходящем растворителе или разбавителе, такой как метиленхлорид, ацетон, тетрагидрофуран или трет-бутилметиловый эфир, и при температуре, например, равной или близкой комнатной температуре, то есть в интервале 15-35о С. Подходящим основанием, когда оно требуется, является, например, пиридин, 4-диметиламинопиридин, триэтиламин, этилдиизопропиламин, N-метилморфолин, карбонат щелочного металла, например, карбонат калия, или карбоксилат щелочного металла, например, ацетат натрия.
/g/ Для получения соединений формулы I, в которой Q несет алкильный или замещенный алкильный заместитель у доступного атома азота, или в котором Ar несет алкокси или замещенный алкокси заместитель, алкилирование соединения формулы I, в котором Q несет атом водорода, у указанного доступного атома азота, или в котором Ar несет гидроксизаместитель.
Подходящим алкилирующим агентом является, например, любой агент, известный в технике для алкилирования доступного атома азота, или гидрокси в алкокси или замещенный алкокси, например, алкил или замещенный алкилгалогенид, например, (1-6С)алкилхлорид, -бромид или -иодид, или замещенный (1-4С)алкилхлорид, -бромид или -иодид, в присутствии подходяшего основания. Подходящим основанием для реакции алкилирования является, например, карбонат щелочного или щелочно-земельного металла, гидроокись натрия, гидроокись калия, гидрид натрия или гидрид калия. Реакция алкилирования предпочтительно проводится в подходящем инертном растворителе или разбавителе, например, N, N-диметилформамиде, диметилсульфоксиде, ацетоне, 1,2-диметоксиэтане или тетрагидрофуране, и при температуре в интервале, например, 10-150о С, удобным образом при температуре, равной или близкой к комнатной.
/h/ Для получения соединений формулы I, в которой Q несет один или два тиоксо заместителя, реакция бициклического гетероциклического соединения формулы I, в которой Q несет один или два оксозаместителя, с реагентом таилирования, чтобы каждый оксозаместитель превращался в тиоксо заместитель; при условии, что, когда у групп Q, Х1, Ar, R2 или R3 имеется амино, имино, алкиламино или гидрокси группа, любая такая группа может быть защищенной общепринятой защитной группой, или альтернативно любая такая группа не защищена, после этого любая ненужная защитная группа у групп Q, Х1, Ar, R2 и R3 удаляется с помощью обычных средств.
Подходящим агентом тиалирования является, например, любой агент, известный в технике для превращения оксогруппы в тиоксогруппу, такой, как, например, 2, 4-бис-/4-метоксифенил/-1,3-дитиа-2,4-дифосфе-нат-2,4-дисульфид (реагент Lawesson'a) или пятисернистый фосфор. Реакция тиалирования обычно осуществляется с использованием требуемого стехиометрического количества агента тиалирования для того, чтобы уменьшить риск затрагивания других функциональных групп. Обычно реакция осуществляется в подходящем растворителе или разбавителе, таком как толуол, ксилол или тетрагидрофуран, и при температуре, например, равной или близкой к температуре дефлегмации растворителя или разбавителя, то-есть в интервале 65-150о С.
Когда требуется фармацевтически приемлемая соль нового соединения формулы I, она может быть получена, например, с помощью реакции указанного соединения с подходящей кислотой или основанием с использованием обычной процедуры. Когда требуется оптически активная форма соединения формулы I, она может быть получена с помощью осуществления одной из названных процедур, использующих оптически активный исходный материал, или путем расщепления рацемической формы указанного соединения с использованием обычной процедуры.
Многие из промежуточных соединений, определенных здесь, являются новыми, например, соединения формул IV и V, эти соединения предлагаются в качестве дополнительного аспекта изобретения.
Как указывалось ранее, новые соединения формулы I являются ингибиторами фермента 5-LO. Эффект данного ингибирования может быть продемонстрирован с использованием одной или более стандартных процедур, представленных ниже.
а/ Спектрофотометрическая ферментативная система анализа ин витро, которая оценивает ингибирующие свойства испытываемого соединения в свободной от клеток системе с использованием 5-LO, выделенного из изолированных нейтрофилов морской свинки и, как описано авторами D.Aharony L E.L.Stein (J. Biol Chem, 1986, 261(25) 11512-11519). Данный опыт дает меру присущих ингибиторных свойств испытываемого соединения в отношении растворимой 5-LO во внеклеточной среде.
b/ Система анализа ин витро, предусматривающая инкубацию испытываемого соединения с гепаринизированной кровью человека, перед введением провокационной пробы кальциевого ионофора А2387, а затем непосредственно измерение ингибирующего на 5-LO с помощью анализа количества αТВ4 с использованием специфического радиоиммуноанализа, описанного авторами Carey and Forder /F. Carey L R.A.Forder, Prostaglandins, Leukotrienes Med. 1986, 22, 57; Rostaglandins, 1984, 28, 666; Brit. J.Pharmacol, 1985, 84, 34Р/, который предусматривает использование белково- αТВ4 конъюнгата, полученного с использованием процедуры Young и др. /Prostaglandins, 1983, 26 (4), 605-613/. Действие испытываемого соединения на фермент циклооксигеназу (которая вовлечена в альтернативный метаболический процесс арахидоновой кислоты и вызывает возникновение простагландинов, тромбоксанов и связанных с ними метаболитов) может быть измерено в то же самое время с использованием специфического радиоиммуноанализа на тромбоксан В2/Т х В2/, описанного авторами Carey и Forder (см. выше). Данное испытание дает указание на эффект испытываемого соединения против 5-LO, а также циклооксигеназы в присутствии кровяных клеток и белков. Оно позволяет оценить селективность ингибирующего действия на 5-LO или циклооксигеназу.
c/ Система анализа ин витpо, которая является видоизменением испытания b/, описанного выше, предусматривающим введение испытываемого соединения (обычно орально в виде суспензии, полученной; когда раствор испытываемого соединения в диметилсульфоксиде добавляется к карбоксиметилцеллюлозе), взятие крови, гепаринизацию, введение провокационной дозы А23187 и радиоиммуноанализ αТВ4 и ТхВ2. Данное испытание свидетельствует о биодоступности испытываемого соединения как ингибитора 5-LO или циклооксигеназы.
d/ Система анализа ин витро, предусматривающая измерение ингибирующих свойств испытываемого соединения против освобождения αТС4 и РGE2, вызываемого цимозаном на примере перитонеального макрофага мышей, с использованием процедуры описанной авторами Humes и др. (J.L.Humes et alia, Biochem. Pharmacol, 1983, 32, 2319-2322) и обычные системы радиоиммуноанализа для измерения αТС4 и PGH2. Данное испытание дает показатель ингибирующего эффекта в отношении 5-LO и циклооксигеназы в небелковой системе.
e/ Система ин виво, предусматривающая измерение эффекта испытываемого соединения по ингибированию воспалительной реакции на арахидоновую кислоту на модели кожи кролика, разработанная авторами D.Aked и др. (Brit. J.Pharmacol. 1986, 89, 431-438). Данное испытание дает модель ин виво для ингибиторов 5-LO, вводимых топически или орально.
f/ Система ин виво, предусматривающая измерение действия испытываемого соединения, назначаемого орально или внутривенно, на лейкотриен -зависимую бронхоконстрикцию, вызванную введением провокационной дозы антигена, на морских свинках, которым предварительно введен антигистамин (мепирамин), β-адренэргический блокирующий агент (пропанолол) и ингибитор циклооксигеназы (индометацин), с использованием процедуры авторов W. H. Andersen и др. (British J.Pharmacology, 1983, 78(1), 67-574). Данное испытание дает дополнительное испытание ин виво на обнаружение ингибиторов 5-LO.
g/ Система ин виво, предусматривающая измерение эффекта испытываемого соединения, назначаемого орально, против освобождения αТВ4, вызванного цимозаном в воздушном мешке, образовавшемся в подкожной ткани спинки самцов крыс. Крыс анестезируют, и образуют воздушные мешки путем инъекции стерильного воздуха (20 мл). Через 3 дня дается дополнительная инъекция воздуха (10 мл). Через 6 дней после начальной воздушной инъекции назначается испытываемое соединение (обычно орально в виде суспензии, полученной при добавлении испытываемого соединения в диметилсульфоксиде к гидроксипропилметилцеллюлозе), с последующей внутримешочной инъекцией цимозана (1 мл 1%-ной суспензии в физиологическом растворе). Через 3 ч крыс убивают, воздушные мешки промываются физиологическим раствором, и используется описанный выше специфический радиоиммуноанализ для анализа αТВ4 в промывной жидкости. Данное испытание дает показатель ингибирующего эффекта в отношении 5-LO в воспалительной среде.
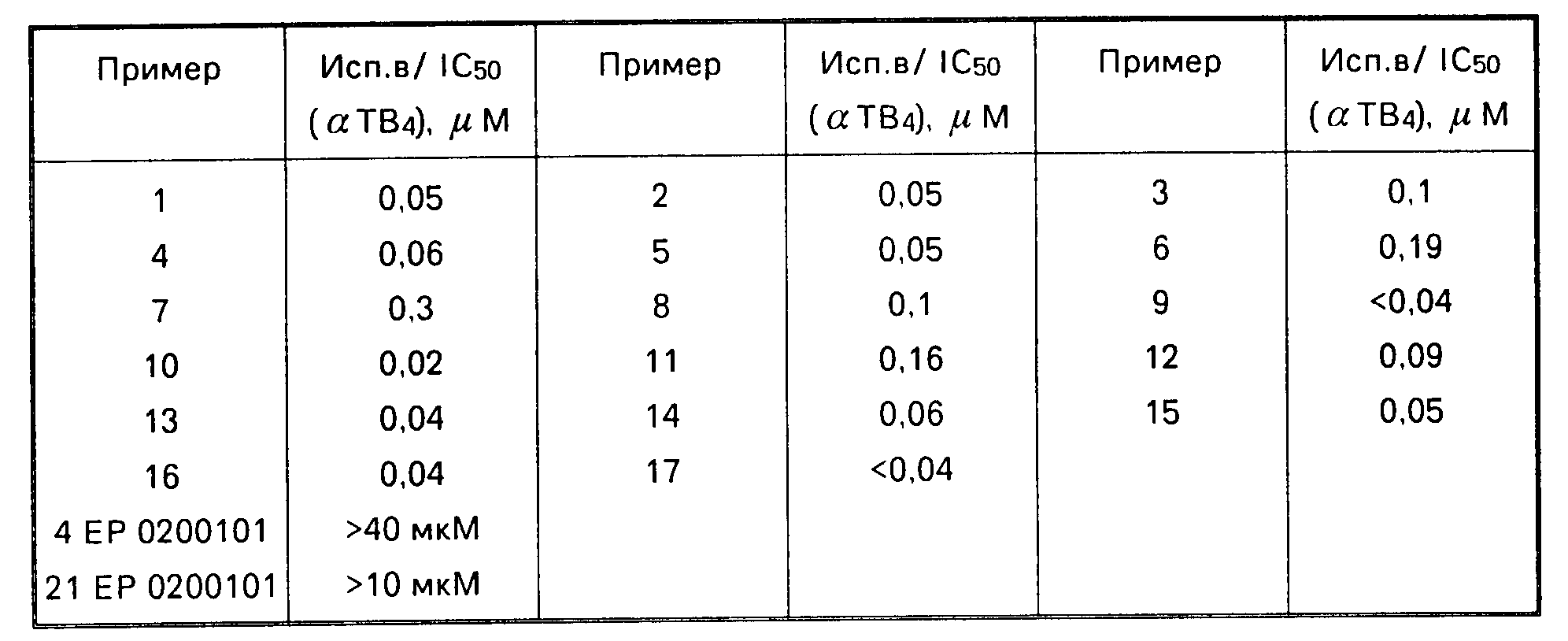
Фармакологические данные приведенные в таблице.
Соединение патента ЕР 0200101:


Хотя, как и ожидается, фармакологические свойства соединений формулы I варьируются в зависимости от структурных изменений, обычно соединения формулы I обладают свойствами ингибирования 5-LO при следующих концентрациях или дозах в одном или более из следующих выше испытаний а) -f):
Испытание а): IС50 в интервале, например, 0,01-30 мкм,
Испытание b): ИК50 (αТВ4) в интервале, например, 0, 01-40 мкм
ИК50 (ТхВ2) в интервале, например 40-100 мкм
Испытание с): оральная ЕД50 (αТВ) в интервале, например, 0,1-100 мг/кг.
Испытание d): ИК50 ( ТС4) в интервале,
например, 0,001-1 мкм,
ИК50 (PGE2) в интервале, например, 20-1000 мкм;
Испытание е): ингибирование
воспаления в интервале, например, 0,3-100 мкг, внутрикожно;
Испытание f): ЕД50 в интервале, например, 0,5-10 мг/кг в.в.
Испытание g): оральная ЕД50 (αТВ4) в интервале, например, 0,1-50 мг/кг.
Никакой чрезмерной токсичности или других побочных действий не наблюдалось в испытаниях с), е), f) и/или g), когда соединения формулы I назначались при нескольких многократных дозах по сравнению с их минимальными ингибирующими дозами или концентрациями.
Так, например, соединение 4-[5-фтор-3-(2,2, 4-триметил-3-оксо-2,3-дигидро-4Н-1,4-бензоксазин-7-илметокс и)фенил]-4-метокситетрагидропиран имеет ИК50 0,05 мкм против αТВ4 в испытании b), и оральную ЕД50 1, 5 мг/кг против αТВ4 в испытании g); соединение 4-[5-фтор-3-(4-метил-3-оксо-2,3-дигидро-4Н-1,4-7-ил-метокси)фенил] -4-ме-токс итетрагидропиран имеет ИК50 0,04 мкм против αТВ4 в испытании b), и оральную ЕД50 0,4 мг/кг против αТВ4 в испытании g); соединение 4-[5-фтор-3-(4-метил-3-тиоксо-2,3-дигидро-4Н-1, 4-бензоксазин-7-илтио) фенил]-4-метокситетрагидропиран имеет ИК50 0,3 мкм против αТВ4 в испытании b), и оральную ЕД50 1,5 мг/кг против αТВ4 в испытании g); соединение 4-[5-фтор-3-(4-метил-3-оксо-2,3-дигидро-4Н-1, 4-бензоксазин- 7-илтио)фенил] -4-метокситетрагидропи-ран имеет ИК50 0,05 мкм против αТВ4 в испытании b),з и оральную ЕД50 0,15 мг/кг против αТВ4 в испытании g). Обычно те соединения формулы I, которые особенно предпочитаются, имеют ИК50 менее 1 мкм против αТВ4 в испытании b), и оральную ЕД50 менее 100 мг/кг против αТВ4 в испытаниях с) и/или g).
Эти соединения являются примерами соединений изобретения, которые обнаруживают селективные ингибирующие свойства в отношении 5-LO в противоположность циклооксигеназе и следует ожидать, что эти селективные свойства придают улучшенные терапевтические свойства, например, уменьшение или освобождение от желудочно-кишечных побочных эффектов, часто связанных с ингибиторами циклооксигеназы, такими как индометацин.
Согласно дальнейшему аспекту изобретения предлагается фармацевтическая композиция, которая включает бициклические гетероциклические соединения формулы I, или фармацевтические приемлемые соли их, в сочетании с фармацевтически приемлемым разбавителем или носителем.
Композиции могут быть представлены в форме, подходящей для орального использования, например в виде таблеток: капсул, водных или масляных растворов, суспензий или эмульсий; для топического использования, например, в виде кремов, мазей, гелей или водных или масляных растворов или суспензий; для назального (носового) использования, например в виде лекарственного порошка для вдыхания через нос, назального спрея или носовых капель; для вагинального (влагалищного) или ректального (через прямую кишку) использования, например в виде медицинских свечей; для назначения с помощью ингаляции, например, в виде тонкодисперсного порошка или жидкого аэрозоля; для использования под язык или щечного (ротового) использования, например, в виде таблеток или капсул; или для парэнтерального использования (включая внутривенное, подкожное, внутримышечное, внутрисосудистое использование или вливание), например, в виде стерильных водных или масляных растворов или суспензий. Обычно указанные композиции могут приготавливаться обычным образом с использованием общепринятых эксципиентов.
Количество активного ингредиента (то-есть бициклического гетероциклического соединения формулы I или его фармацевтически приемлемой соли), которое объединяется с одним или более эксципиентами для получения единичной дозировочной формы, обязательно будет меняться в зависимости от подвергаемого лечению пациента и конкретного способа назначения. Например, препаративная форма, предназначенная для орального назначения людям, обычно содержит, например, 0,5-2 г активного агента, скомбинированного с соответствующим и удобным количеством эксципиентов, которое может варьироваться примерно 5-98% по массе от всей композиции. Единичные дозировочные формы обычно содержат около 1 мг 500 мг активного ингредиента.
Согласно следующему аспекту изобретения предлагается бициклическое гетероциклическое соединение формулы I или его фармацевтически приемлемой соли для использования в способе лечения организма человека или животного методом терапии.
Изобретение также включает способ лечения болезней или медицинских состояний, причиной которых полностью или частично является один или более лейкотриенов, который предусматривает назначение теплокровному животному, нуждающемуся в таком лечении эффективного количества активного ингредиента, определенного выше. Изобретение также предлагает использование такого активного ингредиента при получении новых медикаментов для применения при лечении заболеваний или медицинских состояний, посредником которых являются лейкотриены.
Размер дозы для терапевтических или профилактических целей соединения формулы I будет естественно меняться в зависимости от характера и тяжести состояния, возраста и пола животного или пациента и от способа назначения, в соответствии с хорошо известными принципами или основами медицины. Как упоминалось выше, соединения формулы I являются полезными при лечении тех аллергических и воспалительных состояний, которые являются следствием единственно или частично действий метаболитов арахидоновой кислоты, возникающих за счет непосредственного действия, катализируемого 5-LO и, в частноти лейкотриенов, получение которых вызвано действием 5-LO. Как упоминалось выше, такие состояния включают, например, астматические состояния, аллергические реакции, аллергический ринит, аллергический шок, псориаз, атопический дерматит, сердечно-сосудистые и цереброваскулярные расстройства воспалительного характера, артрит и воспалительные заболевания суставов, и воспалительные заболевания пищеварительного тракта.
При использовании соединений формулы I для терапевтических или профилактических целей соединение обычно назначается так, чтобы дневная доза находилась в интервале, например 0,5-75 мг на кг массы тела при приеме, если необходимо, в виде раздельных доз. Обычно, когда применяется парэнтеральный путь, назначаются более низкие дозы. Так, например, для внутривенного назначения обычно используется доза в интервале, например от 0,5 мг до 30 мг на кг массы тела. Аналогичным образом, для назначения с помощью ингаляции будет использоваться доза в интервале, например, от 0,5 мг до 25 мг на кг массы тела.
Хотя соединения формулы I прежде всего представляют ценность в качестве терапевтических агентов для использования в отношении теплокровных животных (включая людей), они также полезны однако, когда это требуется, для ингибирования фермента 5-LO. Так они полезны в качестве фармакологических стандартов для использования при разработке новых биологических тестов и при исследованиях в поиске новых фармакологических агентов.
Вследствие их действия на получение лейкотриенов, соединения формулы I обладают некоторыми цитозащитными эффектами, например они полезны при уменьшении или подавлении некоторых отрицательных желудочно-кишечных действий, вызываемых нестероидными противовоспалительными агентами (NSAIA), ингибирующими циклооксигеназу, такими как индометацин, ацетилсалициловая кислота, ибупрофен, сульфиндак, толметин и пироксикам. Кроме того, совместное назначение ингибитора 5-LO формулы I с NSAIA может приводить в результате к уменьшению количества последнего агента, требуемого для достижения терапевтического эффекта, посредством, чего уменьшается вероятность отрицательных побочных эффектов. Согласно следующему аспекту изобретения предлагается фармацевтическая композиция, которая включает бициклическое гетероциклическое соединение формулы I или его фармацевтически приемлемую соль, как они определены выше, в сочетании или в смеси с нестероидным противовоспалительным агентом, ингибирующим циклооксигеназу (таким, как упомянутые выше) и фармацевтически приемлемым разбавителем или носителем.
Цитозащитные действия соединений формулы I могут быть продемонстрированы, например, с помощью стандартной лабораторной модели, которая дает возможность оценки защитного действия от вызываемого индометацином или этанолом изъявления желудочно-кишечного тракта крыс.
Композиции изобретения могут в дополнение к сказанному содержать один или более терапевтических или профилактических агентов, которые известны как представляющие ценность в случае заболевания, подвергаемого лечению. Так, например, для использования при лечении сердечных или сосудистых заболеваний или состояний в фармацевтической композиции изобретения могут также полезно присутствовать известные ингибиторы агрегации тромбоцитов, гиполипидемические агенты, противогипертензивные агенты, бетаадренэргические блокаторы или вазодиляторы. Аналогичным образом, для использования при лечении легочных заболеваний в фармацевтической композиции изобретения могут полезно присутствовать также, например, антигистамины, стероиды, (такие как беклометазондипропионат), кромогликат натрия, ингибитор фосфодиэстеразы или бета-андренэргический стимулирующий агент.
Изобретение будет теперь проиллюстрировано с помощью
следующих ниже неограничивающих примеров, в которых используются следующие
обозначения:
/I/ выпаривание осуществлялось с помощью вращательного выпаривания в вакууме, а процедуры обработки
осуществлялись после удаления остаточных твердых веществ с помощью фильтрации;
/II/ операции осуществлялись при комнатной температуре, то-есть в интервале 18-25о С, и в атмосфере
инертного газа, такого как аргон;
/III/ хроматография на
колонке (с
помощью мгновенного приема) и жидкостная хроматография среднего давления (МРLC) выполнялись на двуокиси кремния Мерк
Кизельгель (Арт. 9385) или Мерк Лихропреп RP-18 (Арт. 9303) обратно-фазной двуокиси
кремния, оставляемой фирмой Е.Мерк, Дармштадт, Зап. Германия;
/IV/ выходы даны только для иллюстрации и
необязательно являются максимально достижимыми;
/V/ конечные продукты формулы
I имеют удовлетворительные данные микроанализа, и их структуры подтверждались данными ЯМР и спектрометрального
анализа;
/VI/ промежуточные продукты обычно не полностью характеризовались, а
чистота оценивалась по данным тонко-слойного хроматографического, инфракрасного (ИК) или ЯМР-анализа;
/VII/ точки плавления являются нескорректированными и определялись с использованием
автоматического прибора определения точки плавления Меттлер Р62 или прибора с использованием масляной бани; точки
плавления конечных продуктов формулы I определялись после кристаллизации из обычных
органических растворителей, таких как этанол, метанол, ацетон, простой эфир или гексан, применяемых по одному или в
смеси; и
/VIII/ использовались следующие сокращения:
ТГФ
тетрагидрофуран
ДМСО диметилсульфоксид
ДМФ диметилформамид
ДМА N,N-диметилацетамид.
П р и м е р 1. 7-Бромметил-4-метил-3-оксо-2,3-дигидро-4Н-1,4-бензоксазин (0,127 г) добавляли к смеси 4-(5-фтор-3-гидроксифенил)-4-метокситетрагидропирана (0,113 г), карбоната калия (0,083 г) и ДМФ (1 мл). Смесь перемешивали при комнатной температуре в течение 24 ч. Смесь распределялась между диэтиловым эфиром и водой. Органическая фаза промывалась водой, сушилась (сульфатом магния) и выпаривалась. Остаток очищался с помощью хроматографии на колонке и использованием в качестве элюента 9:1 объем/объем смеси метиленхлорида и диэтилового эфира. Таким образом получался 4-[5-фтор-3-(4-метил-3-оксо-2,3-дигидро-4Н-1,4-бензоксазин- 7-ил-метокси)фенил] -4-метокситетрагидро- пиран (0,132 г, 68%), температура плавления 87-89о С (перекристаллизованный из гексана).
ЯМР Спектр (СДСl3, δ величины) 1,75-2,0 (м.
4Н), 2,98 (с. 3Н),
3,37 (с. 3Н), 3,65-3,9 (м. 4Н),
4,62 (с. 2Н), 4,98 (с. 2Н),
6,5-7,
2 (м. 6Н).
7-Бромметил-4-метил-3-оксо-2,3-дигид- ро-4Н-1,4-бензоксазин, используемый в качестве исходного материала, получался следующим образом.
Этилбромацетат (20 г) добавлялся к смеси 5-метил-2-нитрофенола (17 г) карбоната калия (17 г) и ацетона (170 мл), и смесь нагревалась до 60о С в течение 90 мин. Смесь охлаждалась до комнатной температуры и распределялась между диэтиловым эфиром и водой. Органическая фаза промывалась поочередно 1 н. водным раствором гидроокиси натрия, водой и солевым раствором, сушилась (сульфатом магния) и выпаривалась. Остаток перекристаллизовывался из смеси диэтилового эфира и гексана. Таким образом получался этил 2,5-метил-2-нитрофенокси(ацетат) (21,5 г, 82%), температура плавления 67о С.
Смесь полученного таким образом продукта, катализатора палладия на древесном угле (10 мас./мас. 0,6 г) и этанола (300 мл) перемешивалась при комнатной температуре в атмосфере водорода в течение 1 ч. Смесь фильтровалась. Фильтрат растворялся в толуоле, и раствор нагревался до 50о С в течение 30 мин. Смесь выпаривалась. Остаток растирался в диэтиловом эфире, давая 7-метил-3-оксо-4Н-1,4-бензоксазин (14 г, 95%), температура плавления 197о С.
Порция (11,4 г) полученного таким образом продукта добавлялась к перемешиваемой суспензии гидрида натрия (60 мас./мас. дисперсия в минеральном масле, 3,36 г; масло удалялось с помощью промывки петролейным эфиром в ДМФ (70 мл), и смесь перемешивалась при комнатной температуре в течение 1 ч. Добавлялся метилиодид (14,9 г), и смесь перемешивалась при комнатной температуре в течение 1 ч. Смесь распределялась между водой и 1:1 объем/объем смесью диэтилового эфира и этилацетата. Органическая фаза промывалась насыщенным водным раствором тиосульфата натрия и солевым раствором, сушилась (сульфатом магния) и выпаривалась. Таким образом получался 4,7-диметил-3-оксо-2, 3-дигидро-4Н-1,4-бензоксазин (11,5 г, 92%), температура плавления 107о С.
N-Бромсукцинимид (4, 27 г) и перекись бензоила (0,1 г) добавлялись поочередно к смеси полученного таким образом продукта (3,54 г) и четыреххлористого углерода (50 мл), и смесь нагревалась до температуры дефлегмации в течение 15 мин. Смесь охлаждалась до комнатной температуры, фильтровалась и выпаривалась. Остаток очищался с помощью хроматографии на колонке с использованием в качестве элюента сначала смеси метиленхлорида и петролейного эфира (т. кип. 40-60о С), а затем метиленхлорида. Таким образом получалось масло, которое кристаллизовывалось после растирания с диэтиловым эфиром, давая требуемый исходный материал (0,27 г, 5%).
4-(5-Фтор-3-гидроксифенил)-4-метокси- тетрагидропиран, используемый в качестве исходного материала: получался следующим образом.
Гидрид натрия (50 мас./мас. дисперсия в минеральном масле, 12,4 г) добавлялся порциями к смеси бензилового спирта (26,7 мл) и ДМА (500 мл), и смесь перемешивалась при комнатной температуре в течение 1 ч. Осторожно добавлялся 1-бром-3,5-дифторбензол (50 г) для регулирования степени прохождения экзотермической реакции. Смесь перемешивалась при комнатной температуре в течение 2 ч, и растворитель выпаривался. Остаток распределялся между метиленхлоридом и водой, и органическая фаза промывалась водой (4 х 50 мл), сушилась сульфатом магния и выпаривалась. Остаток очищался с помощью перегонки, давая 3-бензилокси-1-бром-5-фторбензол (41, 8 г, 57%) в виде бесцветной жидкости (т.кип. 124-130о С/ 0,3 мм рт.ст.).
Раствор порции (9,7 г) данного продукта в ТГФ (150 мл) охлаждался до -75о С, и по каплям добавлялся н-бутил-литий (1,6 М в гексане, 22 мл). Смесь перемешивалась при -75о С в течение 1 ч, и добавлялся раствор тетрагидропиран-4-она (3,47 г) в ТГФ (10 мл) по каплям. Смесь перемешивалась при -75о С в течение 1 ч, а затем оставалась подогреваться до 0о С. Добавлялся насыщенный водный раствор хлористого аммония (60 мл), и органическая фаза отделялась, сушилась (сульфатом магния) и выпаривалась. Остаток очищался с помощью хроматографии на колонке с использованием в качестве элюента 1:1 объем/объем смеси толуола и этилацетата. Получался таким образом 4-(3-бензилокси-5-фторфенил)-4-гидрокси-тетрагидропиран (7,4 г, 71%) в виде масла.
После соответствующего повторения упомянутой реакции полученный таким образом продукт (12,1 г) растворялся в ТГФ (150 мл), и порциями добавлялся гидрид натрия (50 мас./мас. дисперсия в минеральном масле, 2,11 г). Смесь перемешивалась при комнатной температуре в течение 1 ч, охлаждалась на ледяной бане, и по каплям добавлялся метилодид (3,75 мл). Смесь перемешивалась при комнатной температуре в течение 18 ч, добавлялось 2 н. соляная кислота (3 капли), и органический растворитель выпаривался. Остаток распределялся между этилацетатом и водой. Органическая фаза отделялась, промывалась водой и солевым раствором, сушилась (сульфатом магния) и выпаривалась. Получался таким образом 4-(3-бензилокси-5-фторфенил)-4-метокситетрагидропиран (12,5 г, 99% ) в виде бледно-желтого масла, которой использовалось без дальнейшей очистки.
Раствор полученного таким образом продукта в этаноле (100 мл) гидрировался в присутствии 10% палладиевого катализатора на древесном угле в течение 3 ч. Смесь фильтровалась и фильтрат выпаривался. Таким образом получался 4-(5-фтор-3-гидроксифенил)-4-метокситетрагидропиран (7,7 г, 86%), температура плавления 123-124о С.
П р и м е р 2. Процедура, описанная в примере 1, повторялась за исключением того, что вместо 7-бромметил-4-метил-3-оксо-2,3-дигидро-4Н-1,4-бензоксазина использовался 7-бромметил-2,2,4-триметил-3-оксо-2, 3-дигидро-4Н-1,4-бензоксазин. Таким образом получался 4-[5-фтор-3-(2,2,4-триметил-3-оксо-2,3-ди- гидро-4Н-1,4-бензоксазин-7-илметокси)фе- нил]-4-метокситетрагидропиран с выходом 35% температура плавления 118о С.
ЯМР Спектр
(СДСl3, δ величины) 1,50 (с. 6Н), 1,75-2,0 (м. 4Н),
2,98 (с. 3Н), 3,36 (с. 3Н),
3,65-3,95 (м. 4Н), 4.98 (с.
2Н),
6,95-7,25 (м. 6Н).
7-Бромметил-2,2,4-триметил-3-оксо-2,3- дигидро-4Н-1,4-бензоксазин, используемый в качестве исходного материала, получался следующим образом.
Метил 2-бром-2-метилпропионат (5,43 г) добавлялся к смеси 5-метил-2-нитрофенола (4,59 г), карбоната калия (4,14 г) и ацетона (50 мл), и смесь нагревалась до температуры дефлегмации в течение 90 мин. Так как скорость реакции была медленной, масса ацетона выпаривалась, добавлялся ДМФ (25 мл) и смесь нагревалась до 100о С в течение 3 ч, а затем до 50о С в течение 16 ч. Смесь охлаждалась до комнатной температуры и распределялась между разбавленной водной соляной кислотой и 1:1 объем/объем смесью диэтилового эфира и этилацетата. Органическая фаза промывалась водой, сушилась (сульфатом магния) и выпаривалась. Остаток очищался с помощью хроматографии на колонке с использованием в качестве элюента метиленхлорида. Таким образом получался 2-метил-2-5-метил-2-нитрофенокси/пропионат (1,2 г, 16%), температура плавления 60-61о С (перекристаллизованный из гексана).
С использованием процедур, описанных в абзацах со
второго до четвертого раздела примера 1, который касается получения
7-бромметил-4-метил-3-оксо-2,3-дигидро-4Н-1,4-бензоксазина, полученный таким образом продукт превращался в требуемый исходный
материал с выходом 29%
П р и м е р 3. Процедура, описанная в
примере 1, повторялась за исключением того, что вместо 7-бромметил-4-метил-3-оксо-2,3-дигидро-4Н-1,4-бензоксазина использовался
7-бромметил-2,2,4-триметил-3-оксо-2,3-дигидро-4Н-1,4-бензотиазин. Таким
образом получался 4-[5-фтиор-3-(2,2,4-триметил-3-оксо-2,3-дигидро-4Н-1,4-бензотиазин-7-илметок си)фенил]
-4-меток- ситетрагидропиран с выходом 51% температура плавления 141-142о С.
ЯМР Спектр (СДСl3, δ величины) 1,43 (с. 6Н), 1,8-2,1 (м. 4Н),
2,98 (с.
3Н), 3,46 (с. 3Н), 3,75-3,95 (м. 4Н), 4,99 (с. 2Н), 6,5-7,5 (м. 6Н).
7-Бромметил-2,2,4-триметил-3-оксо-2,3-дигидро-4Н-1,4-бензотиазин, используемый в качестве исходного материала получался следующим образом.
Метил тиогликоля (3,18 г) добавлялся к смеси 3-фтор-4-нитротолуола (4,65 г), бикарбоната натрия (3 г) и метанола (46 мл), и смесь нагревалась до 70о С в течение 5 ч. Смесь охлаждалась до комнатной температуры и распределялась между диэтиловым эфиром и водой. Органическая фаза промывалась насыщенным водным раствором бикарбоната натрия и солевым раствором, сушилась (сульфатом магния) и выпаривалась. Остаток перекристаллизовывался из смеси диэтилового эфира и гексана, давая метил 2-(5-метил-2-нитрофенилтио)ацетат (6,5 г, 90%), температура плавления 74-75о С.
Смесь порциями (4 г) полученного таким образом продукта, палладия на древесном угле (10% 0,4 г) и метанола перемешивалась под давлением водорода, равном 4 атмосферам, в течение 5 ч. Смесь фильтровалась, и фильтрат выпаривался. Остаток растворялся в толуоле и раствор нагревался до температуры дефлегмации в течение 3,5 ч. Смесь выпаривалась, и остаточное твердое вещество промывалось диэтиловым эфиром. Таким образом получался 7-метил-3-оксо-2,3-дигидро-4Н-1,4-бензотиазин (2,1 г, 70%), температура плавления 207о С.
Полученный таким образом продукт растворялся в ДМФ (5 мл) и добавлялся по каплям к перемешиваемой суспензии гидрида натрия (60 мас./мас. в масле, 0,64 г), промытого петролейным эфиром в ДМФ (10 мл). Смесь перемешивалась при комнатной температуре в течение 30 мин, а затем охлаждалась на водно-ледяной бане. По каплям добавлялся метилиодид (1,15 мл), и смесь перемешивалась в течение 30 мин. Смесь распределялась между диэтиловым эфиром и водой. Органическая фаза промывалась водой и солевым раствором, сушилась (сульфатом магния) и выпаривалась. Остаток очищался с помощью хроматографии на колонке с использованием в качестве элюента 9:1 объем/объем смеси метиленхлорида и диэтилового эфира. Таким образом получался 4,7-диметил-3-оксо-2,3-дигидро-4Н-1,4-бензотиазин (2,07 г, 88%), температура плавления 84-86о С.
Порция (1,35 г) продукта, полученного таким образом, растворялась в ДМФ (15 мл). Порциями добавлялся гидрид натрия (60 мас./мас. дисперсия в масле, 0,84 г), и смесь перемешивалась при комнатной температуре в течение 30 мин. По каплям добавлялся метилиодид (0,69 мл), и смесь перемешивалась при комнатной температуре в течение 16 ч. Поочередно добавлялись дополнительные порции дисперсии гидрида натрия (0,28 г) и метилиодида (1,38 мл), и смесь нагревалась до 45о С в течение 1 ч. Смесь распределялась между водой и 1:1 объем/объем смесью диэтилового эфира и этилацетата. Органическая фаза промывалась водой и солевым раствором, сушилась (сульфатом магния) и выпаривалась. Остаток очищался с помощью хроматографии на колонке с использованием в качестве элюента смеси 19:1 метиленхлорида и диэтилового эфира. Таким образом получался 2,2,4,7-тетраметил-3-оксо-2,3-дигидро4Н- 1,4-бензотиазин (1,02 г, 66%).
Перекись бензоила (5 мг) добавлялась к смеси порции (0,22 г) продукта, полученного таким образом, N-бросукцинимида (0,242 г) и четыреххлористого углерода (5 мл). Смесь облучалась светом от лампы в 250 Вт и нагревалась до 40о С в течение 90 мин. Смесь охлаждалась до комнатной температуры, добавлялся диэтиловый эфир (5 мл), и смесь фильтровалась. Фильтрат выпаривался, давая требуемый исходный материал (0,33 г, 78% (70% чистоты по данным ЯМР)) в виде масла, которое использовалось без дальнейшей очистки.
П р и м е р 4. Смесь 6-хлорметил-4-метил-3-оксо-2, 3-дигидро-4Н-1,4-бензоксази- на (0,106 г), 4-(5-фтор-3-гидроксифенил)-4-метокситетрагидропирана (0,113 г), карбоната калия (0,083 г) и ДМФ (1 мл) нагревалась до 80о С в течение 3 ч и до 60о С еще в течение дополнительного часа. Смесь охлаждалась до комнатной температуры и распределялась между этилацетатом и водой. Органическая фаза промывалась водой, сушилась (сульфатом магния) и выпаривалась. Остаток очищался с помощью хроматографии на колонке с использованием в качестве элюента 93:7 объем/объем (о/о) смеси метиленхлорида и ацетона. Таким образом получался 4-[5-фтор-3-(4-метил-3-оксо-2, 3-дигидро-4Н-1,4-бензоксазин-6-илметокси)фенил -4-метокситетрагидропиран (0,065 г, 32% ), температура плавления 124-131о С.
ЯМР спектр (СДСl3, δ величины) 1,8-2,05 (м. 4Н), 2,99 (с. 3Н), 3,38 (с. 3Н), 3,68-3,90 (м. 4Н), 5,62 (с. 2Н) 5,0 (с. 2Н), 6,5-7,25 (м. 6Н).
6-Хлорметил-4-метил-3-оксо-2, 3-дигид- ро-4Н-1,4-бензоксазин, используемый в качестве исходного материала, получался следующим образом.
Раствор хлорацетилхлорида (31,2 г) в хлороформе (100 мл) добавлялся по каплям к смеси 2-аминофенола (25 г), бензилметиламмонийхлорида (52,4 г), бикарбоната натрия (77 г) и хлороформа (500 мл), которая охлаждалась на ледяной бане. Смесь перемешивалась в течение 1 ч и оставлялась подогреваться до комнатной температуры. Смесь нагревалась до 55о С в течение 5 ч, а затем перемешивалась при комнатной температуре в течение 16 ч. Смесь выпаривалась, и остаток распределялся между этилацетатом и водным раствором карбоната калия. Органическая фаза промывалась разбавленной водяной соляной кислотой и водой, сушилась (сульфатом магния) и выпаривалась. Остаток промывался смесью гексана и диэтилового эфира, оставляя 3-оксо-2,3-дигидро-4Н-1,4-бензоксазин (11 г, 32%), температура плавления 172-173о С.
Порция (5,2 г) продукта, полученного таким образом, добавлялась порциями к перемешиваемой суспензии гидрида натрия (60 мас./мас. дисперсия в минеральном масле, 1,66 г), масло удалялось с помощью промывки твердого вещества петролейным эфиром) и ДМФ (45 мл), и смесь перемешивалась при комнатной температуре в течение 30 мин. Смесь охлаждалась на ледяной бане, и по каплям добавлялся (метилиодид (2,3 мл). Смесь перемешивалась в течение 1 ч и оставлялась подогреваться до комнатной температуры. Смесь выливалась в воду, подкислялась с помощью добавления разбавленной водной кислоты и экстрагировалась этилацетатом. Органическая фаза промывалась водой, сушилась (сульфатом магния) и выпаривалась. Полученное в результате масло кристаллизовалось после растирания в смеси 1:9 о/о диэтилового эфира и гексана. Таким образом получался 4-метил-3-оксо-2,3-дигидро-4Н-1,4-бензо-ксазин (4 г, 70%), температура плавления 57-58о С.
Смесь порции (0,489 г) продукта, полученного таким образом, параформальдегида (0, 135 г), ледяной уксусной кислоты (3 мл) и концентрированной соляной кислотой (3 мл) нагревалась до 60о С в течение 90 мин. Смесь охлаждалась до комнатной температуры и распределялась между этилацетатом и водой. Органическая фаза промывалась водой, сушилась (сульфатом магния) и выпаривалась. Остаток очищался с помощью хроматографии на колонке с использованием метиленхлорида в качестве элюента. Таким образом получался требуемый исходный материал (0,368 г, 58%) в виде твердого вещества.
П р и м е р 5. Бутил-литий (1,6 М в гексане, 1 мл) добавлялся по каплям к смеси 7-меркапто-4-метил-3-оксо-2,3-дигидро-4Н-1,4-бензоксазина (0,292 г), 4-(3,5-дифторфенил)-4-метокситетрагидропирана (0,342 г) и N-метилпирролидин-2-она (3,75 мл), который предварительно охлаждался на ледяной бане. Смесь перемешивалась и оставлялась подогреваться до комнатной температуры. Смесь нагревалась до 145о С в течение 90 мин, причем гексан отгонялся из реакционной смеси. Смесь охлаждалась до комнатной температуры и распределялась между этилацетатом и водой. Органическая фаза промывалась водой и водным раствором гидроокиси натрия, сушилась (сульфатом магния) и выпаривалась. Остаток очищался с помощью хроматографии на колонке с использованием 15:1 о/о смеси метиленхлорида и диэтилового эфира в качестве элюента. Таким образом получался 4-[5-фтор-3-(4-метил-3-оксо-2, 3-дигидро-4Н-1,4-бензоксазин-7-илтио)фенил] -4- меток-ситетрагидропиран (0,202 г, 33% ), температура плавления 131-133о С.
ЯСР Спектр (СДСl3, δ величины) 1,8-2,1 (м. 4Н), 2,98 (с. 3Н), 3,37 (с. 3Н), 3,75-3,95 (м. 4Н), 4,63 (с. 2Н), 6,76-7,25 (м. 6Н).
7-Меркапто-4-метил-3-оксо-2, 3-дигидро- 4Н-1,4-бензоксазин, используемый в качестве исходного материала получался следующим образом.
Смесь 5-фтор-2-нитрофенила (10,05 г), карбонат калия (10,6 г) и ацетона (125 мл) нагревалась до температуры дефлегмации в течение 10 мин. Смесь охлаждалась до комнатной температуры, и по каплям добавлялся раствор этилбромацетата (7,8 мл) в ацетане (10 мл). Смесь нагревалась до дефлегмации в течение 2,5 ч. Смесь выпаривалась, и остаток распределялся между диэтиловым эфиром и водой. Органическая фаза промывалась водой, сушилась (сульфатом магния) и выпаривалась. Таким образом получался этил 2-(5-фтор-2-нитрофенокси/ацетат (14,28 г, 92%), темпеpатура плавления 44-46о С.
Смесь этил 2-(5-фтор-2-нитрофенокси) ацетата (11 г), бензил-меркаптана (5,2 г), триэтиламина (5,08 г) и ДМФ (50 мл) перемешивалась и нагревалась до 80о С в течение 7 ч. Смесь охлаждалась, выливалась в воду и подкислялась добавлением разбавленной водной соляной кислоты. Смесь экстрагировалась диэтиловым эфиром. Органическая фаза промывалась водой и солевым раствором, сушилась (сульфатом магния) и выпаривалась, давая этил(5-бензилтио-2-нитрофенокси) ацетат (10,6 г, 68%) в виде твердого вещества.
Смесь порции (6,68 г) продукта, полученного таким образом, дигидрата хлористого олова (Tet. Let. 1984, 839, 28.1 г), этилацетата (5 мл) и этанола (50 мл) нагревалась до дефлегмации в течение 30 мин. Смесь выливалась в лед, и добавлялся насыщенный водный раствор бикарбоната натрия. Полученный в результате осадок удалялся фильтрованием, и фильтрат экстрагировался этилацетатом. Органическая фаза промывалась водой и солевым раствором, сушилась (сульфатом магния) и выпаривалась, давая 7-бензил-тио-3-оксо-2,3- 4Н-1,4-бензоксазин (3,32 г, 49%), температура плавления 153-154о С.
Порция (2,7 г) продукта, полученного таким образом, добавлялась к перемешиваемой суспензии гидрида натрия (60 мас./мас. дисперсия в минеральном масле, 0,52 г масло удалялось промыванием дисперсии твердого вещества петролейным эфиром) в ДМФ (10 мл), и смесь перемешивалась при комнатной температуре в течение 30 мин. Добавлялся метилиодид (2,13 г), и смесь перемешивалась при комнатной температуре в течение 30 мин. Смесь распределялась между диэтиловым эфиром и водой. Органическая фаза промывалась водой и солевым раствором, сушилась (сульфатом магния) и выпаривалась, давая 7-бензилтио-4-метил-3-оксо-2,3-дигидро-4Н-1,4-бензоксазин (2,6 г, 91%) в виде твердого вещества.
Раствор 3-хлорнадбензойной кислоты (1,72 г) в хлороформе (10 мл) добавлялся по каплям к раствору порции (2 г) бензоксазина, полученного таким образом, в хлороформе (15 мл), который охлаждался до 0о С, и смесь перемешивалась при 0о С в течение 4 ч. Добавлялась гидроокись кальция (0,74 г) и смесь перемешивалась при комнатной температуре в течение 15 мин. Смесь фильтровалась, и фильтрат выпаривался, давая 7-бензилсульфинил-4-метил-3-оксо-2, 3-ди- гидро-4Н-1,4-бензоксазин (2,1 г) в виде твердого вещества, которое использовалось без дополнительной очистки.
Трифторуксусная кислота (4,2 г) добавлялась по каплям к перемешиваемой суспензии порции (1,5 г) бензоксазина, полученного таким образом, в метиленхлориде (45 мл), и полученный таким образом раствор перемешивался при комнатной температуре в течение 30 мин, а затем нагревался до дефлегмации в течение 30 мин. Смесь выпаривалась и остаток распределялся между этилацетатом и водой. Органическая фаза промывалась водой и насыщенным водным раствором бикарбоната натрия, сушилась (сульфатом магния) и выпаривалась. Остаток очищался с помощью хроматографии на колонке с использованием нарастательно полярных смесей метиленхлорида и диэтилового эфира в качестве элюента. Таким образом получался ди-(4-метил-3-оксо-2, 3-дигидро-4Н-1,4-бензоксазин-7-ил)дисульфид (0,69 г, 60%), температура плавления 133-135о С.
После повторения предыдущей стадии добавлялся трифенилфосфин (0,576 г) к суспензии дисульфида (0,776 г) в 1,4-диоксане (9 мл). Поочередно добавлялись вода (2,5 мл) и концентрированная соляная кислота (1 капля), и смесь нагревалась до 50о С в течение 1 ч. Смесь охлаждалась до комнатной температуры и распределялась между этилацетатом и 0,5 н. водным раствором гидроокиси натрия. Органическая фаза промывалась водой и солевым раствором, сушилась (сульфатом магния) и выпаривалась. Таким образом получался требуемый исходный материал (0,425 г, 55%), температура плавления 95-96о С.
4-(3,5-Дифторфенил)-4-метокситетра- гидропиран, используемый в качестве исходного материала, получался следующим образом.
Реактив Гриньяра приготавливался из 3, 5-дифторбромбензола (38,6 г) и магния (4,88 г) в смеси толуола (100 мл) и ТГФ (50 мл) с использованием следующего метода. 3,5-Дифторбромбензол растворялся в толуоле (50 мл), и порция (приблизительно 5%) раствора добавлялась к перемешиваемой суспензии магния в смеси толуола (50 мл) и ТГФ (50 мл). Смесь перемешивалась при комнатной температуре в течение приблизительно 40 мин до тех пор, пока не наблюдалось начало экзотермического образования реактива Гриньяра. Смесь охлаждалась на ледяной бане до температуры в интервале 15-20о С, при этом добавлялся остаток раствора 3, 5-дифторбромбензола. Смесь перемешивалась при комнатной температуре в течение 2 ч.
Тетрагидропиран-4-он (10,69 г) добавлялся на протяжении 1 ч к порции (100 мл) реактива Гриньяра, полученного таким образом, который охлаждался до температуры в интервале 15-20о С. Смесь перемешивалась при комнатной температуре в течение 2 ч. Смесь охлаждалась на ледяной бане, и поочередно добавлялись водный раствор соляной кислоты (50 мас./о, 25 мл) и солевой раствор (30 мас./о, 52 мл). Толуольный слой отделялся, а водный слой экстрагировался толуолом (32 мл). Органические растворы объединялись и промывались водой (4 х 32 мл). Раствор выпаривался при пониженном давлении до объема 16,3 мл. Таким образом получался концентрированный (90 мас./о) раствор 4-(3, 5-дифторфенил)-4-гидрокситетрагидропирана в толуоле. Концентрат подогревался до 60о С и добавлялся хлорбензол (22,25 мл), при этом температура поддерживалась при 60о С. Смеси давали возможность охладиться до комнатной температуры, а затем она охлаждалась на ледяной бане до температуры в интервале 0-5о С. Осадок выделялся и промывался гексаном (2 х 10 мл). Таким образом получался 4-(3,5-дифторфенил)-4-гидрокситетрагидро- пиран (12,2 г).
Порция (7,15 г) материала, полученного таким образом, растворялась в N-метилпирролидин-2-оне (25 мл) и добавлялась к суспензии гидрида натрия (60 мас. /мас. дисперсия в минеральной масле, 3,34 г) в N-метилпирролидин-2-оне (32 мл), которая охлаждалась на ледяной бане приблизительно до 20о С. Смесь перемешивалась при данной температуре в течение 30 мин. Метилиодид (5,22 г) растворялся в N-метилпирролидин-2-оне (2 мл) и добавлялся к смеси. Полученная смесь подогревалась до 30о С и перемешивалась в течение 2 ч. Смесь выпаривалась. Таким образом получался 4-(3,5-дифторфенил)-4-метокситетрагидропиран, который использовался без дальнейшей очистки.
П р и м е р 6. Раствор пероксимоносульфата калия (0,115 г) в воде (1 мл) добавлялся к раствору 4-[5-фтор-3-(4-метил-3-оксо-2,3-дигидро-4Н-1,4-бензоксазин-7-илтио)фенил] 4-метокситетрагидропирана (0,102 г) в смеси метиленхлорида (1 мл) и хлороформа (1 мл) и полученная в результате смесь перемешивалась при комнатной температуре в течение 24 ч. Смесь распределялась между этилацетатом и водой. Органическая фаза промывалась водой, водным раствором бисульфата натрия и солевым раствором, сушилась (сульфатом магния) и выпаривалась. Остаток очищался с помощью хроматографии на колонке с использованием в качестве элюента нарастательно полярных смесей метиленхлорида и диэтилового эфира. Таким образом получался 4-[5-фтор-3-(4-метил-3-оксо-2,3-дигидро-4Н-1, 4-бензокса- зин-7-илсульфонил)фенил] -4-метокситетра- гидропиран (0,066 г), температура плавления 190-191о С.
Спектр ЯМР (СДСl3, δ величины) 1,85-2,1 (м. 4Н), 2,89 (с. 3Н), 3,37 (с. 3Н), 3, 8-3,95 (м. 4Н), 4,66 (с. 2Н), 7,0-7,8 (м. 6Н).
П р и м е р 7. 2,4-Бис(4-метоксифенил)-1,3-дитиа-2,4-дифосфетан-2,4-дисульфид (реагент Lawesson'a, 0, 121 г) добавлялся порциями к раствору 4-[5-фтор-3-(4-метил-3-оксо-2,3-дигидро-4Н-1,4-бензоксазин-7-ил- тио)фенил]-4-метокситетрагидропирана (0,12 г) в толуоле (10 мл), и смесь перемешивалась и нагревалась до дефлегмации в течение 15 мин. Смесь выпаривалась и остаток очищался с помощью хроматографии на колонке с использованием 19:1 о/о смеси метиленхлорида и диэтилового эфира в качестве элюента. Таким образом получался 4-[5-фтор-3-(4-метил-3-тиоксо-2,3-дигидро-4Н-1,4-бензоксазин-7-илтио)фенил]- 4-ме- токситетрагидропиран (0,089 г, 70%), температура плавления -125-127о С.
Спектр ЯМР (СДСl3, δ величины) 1,65-2,05 (м. 4Н), 2,92 (с. 3Н), 3,6-3,8 (м. 7Н), 4,85 (с. 2Н), 6,65-7,15 (м. 6Н).
П р и м е р 8. Смесь 6-иод-1-метил-2-оксо-1,2-дигидро-4Н-3, 1-бензоксазина (0,289 г), 4-(3-меркаптофенил)-4-метокситетрагидропирана (0,324 мг), карбоната калия (0,225 г), хлористой меди (0,03 г) и ДМФ (3 мл) нагревалась до 140о С в течение 3 ч. Смесь охлаждалась до комнатной температуры и распределялась между этилацетатом и водой. Органическая фаза промывалась водой и солевым раствором, сушилась (сульфатом магния) и выпаривалась. Остаток очищался с помощью хроматографии на колонке с использованием 1:1 о/о смеси толуола и этилацетата в качестве элюента. Таким образом получался 4-метокси-4-(3-(1-метил-2-оксо-1,2-дигидро-4Н-3, 1-бензоксазин-6-илтио)фенил) тетрагидропиран (0,164 г, 43%) в виде масла.
Спектр ЯМР (СДСl3, δ величины) 1,85-2,05 (м. 4Н), 2,95 (с. 3Н), 3,4 (с. 3Н), 3,75-3,90 (м. 4Н), 5,15 (с. 2Н), 6,9 (д. 1Н), 7,1-7,4 (м. 6Н).
6-Иод-1-метил-2-оксо-1,2-дигидро-4Н-3,1- бензоксазин, используемый в качестве исходного материала, получался следующим образом.
Фосген (20 мас./о в толуоле, 54 мл) добавлялся по каплям к перемешиваемой смеси 2-аминобензилового спирта (12,32 г), триэтиламина (27, 9 мл) и толуола (500 мл), которая осаждалась на ледяной бане до приблизительно 15о С. Смесь перемешивалась при комнатной температуре в течение 2 ч, а затем нагревалась до 85о С в течение 2 ч. Смесь выливалась в воде (500 мл) и фильтровалась. Твердое вещество (4,6 г) сушилось. Органическая фаза фильтрата промывалась водой, сушилась (сульфатом магния) и выпаривалась. Остаток и твердое вещество, которое предварительно отфильтровывалось, очищалось с помощью хроматографии на колонке с использованием 7:3 о/о смеси толуола и этилацетата в качестве элюента. Таким образом получался 2-оксо-1,2-дигидро-4Н-3,1-бензоксазин (7,8 г, 52%), температура плавления 115-116о С.
Гидрит натрия (55 мас./мас. дисперсия в минеральном масле, 0,32 г) добавлялся к смеси порции (1 г) бензоксазина, полученного таким образом, в ДМФ (25 мл), который предварительно охлаждался приблизительно до 3о С, и смесь перемешивалась при комнатной температуре в течение 1 ч. Добавлялся метилиодид (1 мл), и смесь перемешивалась при комнатной температуре в течение 16 ч. Смесь распределялась между этилацетатом и водой. Органическая фаза промывалась водой и солевым раствором, сушилась (сульфатом магния) и выпаривалась. Остаток очищался с помощью хроматографии на колонке и использованием в качестве элюента 7:3 о/о смеси толуола и этилацетата. Таким образом получался -метил-2-оксо-1, 2-дигидро-4Н-3,1-бензоксазин (0,8 г, 73% ) в виде масла.
Спектр ЯМР (СДСl3, δ величины) 3,38 (с. 3Н), 5,20 (с. 2Н), 6,92-7,39 (м. 4Н).
Смесь порции (0,77 г) бензоксазина, полученного таким образом, концентрированной серной кислоты (0,5 мл) и ледяной уксусной кислоты (4 мл) перемешивалась при комнатной температуре, и поочередно добавлялись иодистая кислота (0,276 г) и иод (0,6 г). Полученная в результате смесь нагревалась до 95-100о С в течение 2 ч. Смесь охлаждалась до комнатной температуры, добавлялся метиленхлорид (10 мл), и смесь нейтрализовалась добавлением насыщенного водного раствора бикарбоната натрия. Смесь промывалась насыщенным водным раствором сульфита натрия и солевым раствором, сушилась (сульфатом магния) и выпаривалась. Остаток очищался с помощью хроматографии на колонке с использованием 4:1 о/о смеси толуола и этилацетата в качестве элюента. Таким образом получался требуемый исходный материал (0,45 г, 33%) в виде твердого вещества.
Спектр ЯМР (СДСl3, δ величины) 3,35 (с. 3Н), 5,15 (с. 2Н), 6,7 (д. 1Н), 7,45 (д. 1Н), 7,65 (м. 1Н).
4-(3-Меркаптофенил)-4-метокситетрагидро- пиран, используемый в качестве исходного вещества, получался следующим образом.
Раствор 1, 3-дибромбензола (23,8 г) в ТГФ (120 мл) охлаждался до -78о С в атмосфере аргона, и по каплям добавлялся н-бутиллитий (1,6 М в гексане, 62,5 мл). Смесь перемешивалась при -78о С в течение 30 мин, и добавлялся раствор тетрагидропиран-4-она (10 г) в ТГФ (40 мл). Полученная в результате суспензия перемешивалась при -78о С в течение 1 ч, оставлялась подогреваться до комнатной температуры, а затем перемешивалась в течение 30 мин. Смесь выливалась в солевой раствор (250 мл) и экстрагировалась диэтиловым эфиром. Органическая фаза сушилась (сульфатом магния) и выпаривалась. Остаток растирался с гексаном и получающееся в результате твердое вещество (16,8 г) отфильтровывалось.
Раствор полученного таким образом продукта в ДМФ (100 мл) добавлялся по каплям к суспензии гидрида натрия (60 мас./мас. дисперсия в минеральном масле; 5,25 г) в ДМФ (10 мл), и смесь перемешивалась при комнатной температуре в течение 90 мин. Добавлялся метилодид (36,5 г), и смесь перемешивалась при комнатной температуре в течение 16 ч. Поочередно добавлялись этанол (2 мл) и вода (500 мл), и смесь экстрагировалась диэтиловым эфиром (3 х 200 мл). Объединенные экстракты промывались водой, сушились (сульфатом магния) и выпаривались. Остаток очищался с помощью хроматографии на колонке с использованием нарастающе полярных смесей гексана и этилацетата в качестве элюента. Таким образом получался 4-(3-бромфенил)-4-метокситетрагидропиран (12 г, 44%) в виде твердого вещества.
Спектр ЯМР (СДСl3, δ величины) 1,88-2,1 (м. 4Н), 3,0 (с. 3Н), 3,78-3,95 (м. 4Н), 7, 2-7,35 (м. 2Н), 7,42 (м. 1Н), 7,55 (м. 1Н).
Раствор порции (1 г) продукта, полученного таким образом, в ТГФ (4 мл) охлаждался до -80о С в атмосфере аргона, и добавлялся по каплям н-бутиллитий (1,6 М в гексане, 2,4 мл). Смесь перемешивалась при -80о С в течение 30 мин, добавлялась сера (0,12 г) и смесь перемешивалась при -80о С еще в течение 30 мин. Добавлялась вода (10 мл) и смеси давали возможность подогреться до комнатной температуры. Смесь экстрагировалась диэтиловым эфиром (10 мл). Водная фаза подкислялась до рН 4 добавлением разбавленного водного раствора соляной кислоты и экстрагировалась диэтиловым эфиром (2 х 10 мл). Объединенные органические экстракты сушились (сульфатом магния) и выпаривались. Таким образом получался требуемый исходный материал в виде масла (0,5 г), которое кристаллизовалось при стоянии, и использовании без дальнейшей очистки.
П р и м е р 9. процедура, описанная в примере 5, повторялась за исключением того, что вместо 4-(3,5-дифторфенил)-4-темокситетрагидропирана использовался (2RS, 4SR)- 4-(3, 5-дифторфенил)-4-метокси-2-метилтет- рагидропиран. Таким образом получался (2RS, 4SR)-4-[5-фтор-3-(4-метил-3-оксо-2,3-дигид- ро-4Н-1,4-бензоксазин-7-илтио)фенил]-4- метокси-2-метилтетрагидропиран с выходом 20% температура плавления 110-112о С.
ЯМР Спектр (СДСl3 δ значения) 1,20 (д. 3Н), 1,5-2,15 (м. 4Н), 2,98 (с. 3Н), 3,37 (с. 3Н), 3,75-4,10 (м. 3Н), 3,63 (с. 2Н), 6,75-7,25 (м. 6Н).
(2RS, 4SR)-2(3,5-дифторфенил)-4-метокси-2-метилентетрагидропиран, используемый в качестве исходного материала получался следующим образом.
Приготавливался реактив Гриньяра из 3, 5-дифторбромбензола (0,772 н), 1,2-дибромэтана (2 капли), магния (0,106 г) и ТГФ (5 мл). Смесь перемешивалась при комнатной температуре в течение 15 мин, а затем нагревалась до 50о С в течение 15 мин. Смеси давали возможность повторно охладиться до комнатной температуры, и добавлялся по каплям раствор 2-метилтетрагидропиран-4-она (J. Amer. Chemical Soc. 1982, 104, 4666) в ТГФ (1 мл). Смесь перемешивалась при комнатной температуре в течение 1 ч. Смесь выливалась в разбавленную водную соляную кислоту и экстрагировалась диэтиловым эфиром. Органическая фаза промывалась солевым раствором, сушилась (сульфатом магния) и выпаривалась. Остаток очищался с помощью хроматографии на колонке с использованием 9:1 о/о смеси метиленхлорида и диэтилового эфира в качестве элюента. Таким образом получался менее полярный изомер, (2RS, 4SR)-4-(3,5-дифторфенил)-4-гидрокси-2-метилентетра-гидропиран (0,25 г), 36% имеющий 2-метильный и 4-гидрокси заместители в транс-взаимосвязи.
Гидрид натрия (50 мас. /мас. дисперсия в минеральном масле, 0,053 г) добавлялся к смеси продукта, полученного таким образом, метилиодида (0,233 г) и ДМФ (3 мл). Смесь перемешивалась при комнатной температуре в течение 30 мин. Смесь подкислялась до рН 3 с помощью добавления раствора соляной кислоты и экстрагировалась диэтиловым эфиром. Органическая фаза промывалась водой с солевым раствором, сушилась (сульфатом магния) и выпаривалась. Остаток очищался с помощью хроматографии на колонке с использованием 19:1 о/о смеси метиленхлорида и диэтилового эфира в качестве элюента. Таким образом получался требуемый исходный материал (0,23 г, 87%) в виде масла.
П р и м е р 10. Процедура, описанная в примере 5, повторялась с тем исключением, что вместо 4-(3, 5-дифторфенил)-4-метокситетрагидропирана использовался (2S, 4R)-4-(3,5-дифторфенил)-4-метокси-2-метилтетра- гидропиран. Таким образом получался (2S, 4R)-4-(5-фтор-3-)4-метил-3-оксо-2,3-дигидро- 4Н-1, 4-бензоксазин-7-ил-тио(фенил)-4-метокси-2-метилтетрагидропиран с выходом 16% температура плавления 115-117о С.
(2S, 4R)-4-(3, 5-дифторфенил)-4-метокси-2-метилтетрагидропиран, используемый в качестве исходного вещества, получался с использованием процедур, описанных в разделе примера 9, который касается получения исходных веществ, за исключением того, что вместо рацемического соединения, т.е. (2SR)-2-метилтетрагидропиран-4-она использовался (2S)-2-метилтетрагиропиран-4-он (европейская патентная заявка N 0385663) пример 20 заявки). Таким образом получался требуемый исходный материал с выходом 18% в виде масла.
П р и м е р 11. Смесь 7-бром-4-метил-2,3-дигидро-4Н-пиридо(3,2-b)(1, 4)-оксазин-3- она (0,244 г), 4-(3-меркаптофенил)-4-метокситетрагидропирана (0,224 г), карбоната калия (0,223 г), хлористой меди (0,029 г) и ДМФ (1,1 мл) нагревалась до 140о С в течение 5 ч. Смесь охлаждалась до комнатной температуры и распределялась между этилацетатом и водой. Органическая фаза промывалась водой и солевым раствором, сушилась (сульфатом магния) и выпаривалась. Остаток очищался с помощью хроматографии на колонке с использованием 1: 1 о/о гексана и этилацетата в качестве элюента. Таким образом получался 4-метокси-4-[3-(4-метил-3-оксо-2,3-дигидро-4Н-пиридо(3,2-b)(1, 4)окса- зин-7-илтиофенил]тетрагидропиран (0,1 г, 26%), температура плавления 118-120о С.
7-Бром-4-метил-2,3-дигидро-4Н-пиридо- (3,2-b)(1,4)оксазин-3-он, используемый в качестве исходного материала, получался следующим образом.
2,3-Дигидро-4Н-пиридо(3,2-b)(1,4)-окса- зин-3-он (патент США N 3854926, 1,5 г) добавлялся порциями к перемешиваемой суспензии гидрида натрия (60 мас. /мас. дисперсия в минеральном масле, 0,4 г) в ДМФ (30 мл), которая предварительно охлаждалась на ледяной бане. Смеси давали возможность подогреться до 30 мин. Добавлялся метилиодид (0,65 г), и смесь перемешивалась при комнатной температуре в течение 16 ч. Смесь выливалась в насыщенный водный раствор хлористого аммония и экстрагировалась этилацетатом. Органическая фаза промывалась водой и солевым раствором, сушилась (сульфатом магния) и выпаривалась, давая 4-метил-2,3-дигидро-4Н-пиридо (3,2-b)(1,4)оксазин-3-он (1,58 г), который использовался без дальнейшей очистки.
Смесь порциями (0,9 г) полученного таким образом вещества, N-бромсукцинимида (1,2 г) и ДМФ (10 мл) перемешивалась при комнатной температуре в течение 24 ч. Добавлялась вода (6 мл), и смесь охлаждалась на ледяной бане. Осадок (0,3 г) отделялся и сушился. Фильтрат распределялся между этилацетатом и насыщенным водным раствором хлористого аммония. Органическая фаза промывалась водой, водным раствором тиосульфата натрия и солевым раствором, сушилась (сульфатом магния) и выпаривалась. Остаток очищался с помощью хроматографии на колонке с использованием в качестве элюента 19:1 о/о смеси толуола и этилацетата. Продукт, полученный таким образом, объединялся с выделенным осадком, давая требуемый исходный материал (0,46 г, 34%) в виде твердого вещества.
П р и м е р 12. Гидрид натрия (60 мас./мас. дисперсия в минеральном масле, 0,021 г) добавлялся порциями к перемешиваемой смеси 4-[5-фтор-3-(3-оксо-2, 3- дигидро-4Н-1, 4-бензоксазин-7-илокси)фе-нил]-4-метокситетрагидропирана (0,19 г), метилиодида (0,109 г) и N-метилпирролидин-2-она (2 мл), и смесь перемешивалась при комнатной температуре в течение 1 ч. Смесь распределялась между этилацетатом и водой. Органическая фаза промывалась водой, сушилась (сульфатом магния) и выпаривалась. Остаток очищался с помощью хроматографии на колонке с использованием 9:1 о/о смеси метиленхлорида и диэтилового эфира в качестве элюента. Таким образом получался 4-[5-фтор-3(4-метил-3-оксо-2,3-дигидро-4Н-1,4-бензоксазин-7-ил-окси)фенил] -4 -метокситетрагидропиран (0,12 г, 67% ) в виде масла, которое кристаллизовалось при растирании со смесью гексана и диэтилового эфира, температура плавления 108-109о С.
4-[5-Фтор-3-(3-оксо-2,3-дигидро-4Н-1, 4- бензоксазин-7-илокси)фенил]-4-метокси-тетрагидропиран, используемый в качестве исходного материала, получался следующим образом.
Гидрид натрия (60 мас./мас. дисперсия в минеральном масле, 0,088 г) добавлялся порциями к перемешиваемой смеси этил 2-(5-фтор-2-нитрофенокси)ацетата (0,486 г) 4-(5-фтор-3-гидроксифенил)-4-метокситетрагидропирана (0,452 г) и N-метилпирролидин-2-она (10 мл), и смесь перемешивалась при комнатной температуре в течение 5 ч, а затем нагревалась до 60о С в течение 10 ч. Смесь охлаждалась до комнатной температуры и распределялась между диэтиловым эфиром и водой. Органическая фаза промывалась насыщенным водным раствором бикарбоната натрия и водой, сушилась (сульфатом магния) и выпаривалась. Остаток очищался с помощью хроматографии на колонке с использованием 9: 1 о/о смеси метиленхлорида и диэтилового эфира в качестве элюента. Таким образом получался 4-[5-фтор-3-(3-этоксикарбонилметокси-4-нитрофенокси)фенил] -4-метокситетрагид ропиран (0,32 г, 35%) в виде масла.
Смесь полученного таким образом продукта (0,315 г), палладиевого катализатора на древесном угле (10 мас./о, 0,1 г), метанола (5 мл) и этилацетата (3 мл) перемешивалась при комнатной температуре при давлении водородного газа в четыре атмосферы в течение 3 ч. Смесь фильтровалась и фильтр выпаривался. Таким образом получался требуемый исходный материала (0,19 г, 73%) в виде твердого вещества, которое использовалось без дальнейшей очистки.
П р и м е р 13. С использованием процедуры, описанной в примере 12, 4-[5-фтор-3-(3-оксо-2,3-дигидро-4Н-1,4-бензоксазин-7-илтио)фенил] -4-метоксит етрагидропиран (подвергался реакции с метилиодидом, давая 4-[5-фтор-3-(4-метил-3-оксо-2, 3-дигидро-4Н-бензотиазин-7-илтио)фенил] -4-мето к- ситетрагидропиран с выходом 41% температура плавления 131-133о С.
4-[5-Фтор-3-оксо2, 3-дигидро-4Н-1, 4- бензотиазин-7-илтио)фенил] -4-метокситетра-гидропиран, используемый в качестве исходного материала, получался следующим образом.
Раствор этилтиогликолята (13,2 г) в
бис(2-метоксиэтил)-эфире (50 мл) добавлялся по каплям к смеси 2,4-дифторнитробензола (15,9 г), моногидрата гидроокиси лития (4,83 г) и N-метилпирролидин-2-она (150 мл), которая охлаждалась на водяной
бане. Смесь перемешивалась при комнатной температуре в течение 45 мин. Добавлялась вода (200 мл), и смесь подкислялась по рН 5 добавлением разбавленной водной соляной кислоты. Смесь экстрагировалась
диэтиловым эфиром (3 х 150 мл). Объединенные экстракты промывались водой и солевым
раствором, сушилась (сульфатом магния) и выпаривались. Остаток очищался с помощью хроматографии на колонке
с
использованием 1:1 о/о смеси петролейного эфира (т.кип. 40-60о С) и диэтилового эфира в качестве элюента. Таким образом получался этил 2-(5-фтор-2-нитрофенилтио)ацетат (8,9 г, 29%) в
виде
масла, которое кристаллизовалось при растирании смесью гексана и диэтилового эфира.
Моногидрат гидроокиси лития (0,063 г) добавлялся порциями к перемешиваемой смеси этил 2-(5-фтор-2-нитрофенилтио)ацетата (0,401 г), 4-(5-фтор-3-меркаптофенил)-4-метокситетрагидропирана (Европейская патентная заявка N 04205110 пример 4 ее, 0,363 г) и N-метилпирролидин-2-она (4 мл). Смесь перемешивалась при температуре окружающей среды в течение 2 ч. Смесь распределялась между диэтиловым эфиром и водой. Органическая фаза промывалась водой и солевым раствором, сушилась (сульфатом магния) и выпаривалась. Остаток очищался с помощью хроматографии на колонке с использованием 19:1 o/o смеси метиленхлорида и диэтилового эфира в качестве элюента. Таким образом получался 4-[5-фтор-3(3-этоксикарбонил-метилтио-4-нитрофенилтио)фенил] -4-метокситетраг ид- ропиран (0,61 г, 87%) в виде масла, которое кристаллизовалось при растирании со смесью гексана и диэтилового эфира.
Цинк (0,715 г) добавлялся порциями к смеси полученного таким образом продукта (0,529 г), воды (1,5 мл) и уксусной кислоты (14 мл), и смесь нагревалась до 70о С в течение 30 мин. Смесь фильтровалась и фильтрат выпаривался. Остаток очищался с помощью хроматографии на колонке с использованием 1:1 o/o смеси метиленхлорида и диэтилового эфира в качестве элюента. Таким образом получался необходимый исходный материал в виде масла, которое кристаллизовалось при растирании с диэтиловым эфиром, давая твердое вещество (0,3 г, 67%), температура плавления 151-152о С.
П р и м е р 14. С использованием процедуры, описанной в примере 11, 7-бром-4-метил-2,3-дигидро-4Н-пиридо(3,2-b)(1,4-окса-зин-3-он подвергался реакции с 4-(5-фтор-3-меркаптофенил)-4-метоксимемтрагидропи- раном, давая 4-[5-фтор-3-(4-метил-3-оксо-2,3-дигидро-4Н-пиридо(3,2-b)(1,4)оксазин-7-илтио )фенил]-4-метокситетрагидропиран с выходом 4% температура плавления 127-128о С.
П р и м е р 15. Раствор 4-[5-фтор-3-(2,3-диметил-3-оксо-2,3-дигидро-4Н-1,4-бензо-ксазин-7-илтил)фени л] -4-метокситетрагид- ропирана (0,21 г) в ДМФ (2 мл) добавлялся по каплям к перемешиваемой суспензии гидрида натрия (50 мас./мас. дисперсия в минеральном масле, 0,03 г) в ДМФ (0,3 мл), и смесь перемешивалась при комнатной температуре в течение 20 мин. Добавлялся метилиодид (0,4 мл), и смесь перемешивалась в течение 1 ч. Смесь распределялась между диэтиловым эфиром и водой. Органическая фаза промывалась водой, сушилась (сульфатом магния) и выпаривалась. Остаток очищался с помощью хроматографии на колонке с использованием 1:1 о/о смеси гексана и этилацетата в качестве элюента. Таким образом получался 4-[5-фтор-3-(2,2,4-триметил-3-окси-2, 3-дигидро-4Н-1,4-бензо- ксазин-7-илтио)фенил]-4-метокситетрагид-ропиран (0,15 г, 70%), температура плавления 116-118о С.
4-[5-Фтор-3-(2,2-диметил-3-оксо-2,3-ди- гидро-4Н-1, 4-бензоксазин-7-илтио)фенил] -4-метокситетрагидропиран, используемый в качестве исходного материала, получался следующим образом.
Смесь 5-фтор-2-нитрофенола (3,14 г), метил 2-бром-2-метил-пропионата (3,6 г), карбоната калия (4,1 г) и ДМФ (20 мл) нагревалась до 120о С в течение 2 ч. Смесь распределялась между диэтиловым эфиром и водой. Органический слой промывался водой, сушился (сульфатом магния) и выпаривался. Остаток очищался хроматографией на колонке с использованием 19:1 o/o смеси гексана и этилацетата в качестве элюента. Таким образом получался метил 2-метил-2-(5-фтор-2-нитрофенокси)пропионат (1,5 г, 28%) в виде масла.
Смесь порции (1,33 г) полученного таким образом продукта, карбоната калия (1,3 г), 4-(5-фтор-3-меркаптофенил)-4-метокситетрагидропирана (1,2 г) и ДМФ (10 мл) перемешивалась и нагревалась до 80о С в течение 1,5 ч. Смесь охлаждалась до комнатной температуры и распределялась между диэтиловым эфиром и водой. Органическая фаза промывалась водой, сушилась (сульфатом магния) и выпаривалась. Остаток очищался с помощью хроматографии на колонке с использованием 3: 1 о/о смеси гексана и этилацетата в качестве элюента. Таким образом получался 4-[5-фтор-3-(3,2-метоксикарбонилпроп-2-ил)окси-4-нитро-фенилтио)фенил]-4-мет окситетрагидропиран (2,4 г, 89%) в виде масла.
Смесь порции (0,48 г) полученного таким образом продукта, 30% палладия на угле (0,4 г) и этилацетата (10 мл) перемешивалась в атмосфере водорода в течение 16 ч. Смесь фильтровалась и фильтрат выпаривался. остаток очищался с помощью хроматографии на колонке с использованием 1:1 o/o смеси гексана и этилацетата в качестве элюента. Таким образом получался требуемый исходный материал (0,24 г, 57%), температура плавления 130-133о С.
П р и м е р 16. Раствор (S)-(+)-4-[5-фтор-3-(2-метил-3-оксо-2,3-дигидро-4Н-1,4-бен-зоксазин-7-илтио) фенил]-4-метокситетра- гидропирана (0,18 г) в ДМФ (5 мл) добавлялся по каплям к перемешиваемой суспензии гидрида натрия (60 мас./мас. дисперсия в минеральном масле, 0,018 г) в ДМФ (2 мл), которая предварительно охлаждалась до 10о С. Смесь перемешивалась при комнатной температуре в течение 30 мин. Добавлялся метилиодид (0,077 г), смесь перемешивалась при комнатной температуре в течение 1 ч. Смесь распределялась между водой и этилацетатом. Органическая фаза промывалась водой, сушилась (сульфатом магния) и выпаривалась. Остаток очищался с помощью хроматографии на колонке с использованием 1:1 о/о смеси гексана и этилацетата в качестве элюента. Таким образом получался (S)-(+)-4-[5-фтор-3-(2,4-диметил-3-оксо-2,3-дигидро-4Н-1,4-бе- нзоксазин-7-илтио)фенил] -4-метокситетра-гидропиран (0,124 г, 66%), температура плавления 104-106о С.
Удельное вращение: (альфа)D +39о (метиленхлорид, с 1 г/100 мл, темп. 25о С).
(S)-(+)-4-[5-фтор-3-(2-метил-3-оксо-2,3-ди- гидро-4Н-1,4-бензоксазин-7-илтио)фенил] 4-метокситетрагидропиран, используемый в качестве исходного материала, получался следующим образом.
Смесь 5-фтор-2-нитрофенила (0,47 г), (R)-(+)-метил 2-хлорпропионата (0,37 г), карбоната калия (0,621 г) и ДМФ (10 мл) нагревалась до 60о С в течение 18 ч. Смесь распределялась между этилацетатом и водой. Органический слой промывался водой, сушился (сульфатом магния) и выпаривался. Таким образом получался (S)-(+)-метил 2-(5-фтор-2-нитрофенокси)пропионат (0,453 г, 62%), температура плавления 50-52о С.
Удельное вращение: (альфа)D +40,2о (метиленхлорид, с 1г/100 мл).
Смесь порции (0,4 г) полученного таким образом продукта, карбоната калия (0,33 г), 4-(5-фтор-3-меркаптофенил)-4-метокситет-рагидропирана (0,39 г) и ДМФ (5 мл) перемешивалась и нагревалась до 85о С в течение 3 ч. Смесь охлаждалась до комнатной температуры и распределялась между этилацетатом и водой. Органическая фаза промывалась водой, сушилась (сульфатом магния) и выпаривалась. Остаток очищался с помощью хроматографии на колонке с использованием 3: 1 о/о смеси гексана и этилацетата в качестве элюента. Таким образом получался (S)-(4[5-фтор-3-(3-(1-метоксикарбонил)этокси)-4-нитрофенилтио)фенил]-4-меток ситетрагидропиран (0,558 г, 75%) в виде масла.
Смесь порции (0,314 г) полученного таким образом продукта, железных опилок (1,135 г), гептагидрата сульфата железа (0,192 г) и метанола (25 мл) перемешивалась энергично и нагревалась до температуры дефлегмации в течение 4 ч. Смесь охлаждалась до комнатной температуры и фильтровалась. Остаток промывался метиленхлоридом. Объединенные фильтраты промывались водой, сушились (сульфатом магния) и выпаривались. Остаток очищался с помощью хроматографии на колонке с использованием 1: о/о смеси гексана и этилацетата в качестве элюента. Таким образом получался требуемый исходный материал (0,238 г, 84%) в виде маслянистого твердого вещества.
ЯМР Спектр (СДСl3, δ величины) 1,59 (д. 3Н), 1,89 (м. 4Н), 2.98 (с. 3Н), 3,8 (м. 4Н), 4,7 (кв. 1Н), 6,8-7,1 (м. 6Н), 8,4 (широкий максимум, 1Н).
П р и м е р 17. С использованием аналогичной процедуры, описанной в примере 16, (R)-(-)-4-[5-фтиор-3-(2-метил-3-оксо-2,3-ди- гидро-4Н,1,4-бензоксазин-7-илтио)фенил]-4-метокситетрагидропиран подвергался реакции с метилиодидом, давая (R)-(-)-4-[5-фтор-3-(2,4-диметил-3-оксо-2,3-дигидро-4Н-1,4-бензоксазин-7-илт ио)фенил] -4-меток-ситетрагидропиран с выходом 42% температура плавления 107-109о С.
Удельное вращение: (альфа)D 36,8о (метиленхлорида, с1 г/100 мл, темп. 25о С).
(R)-(-)-4-[5-фтор-3-(2-метил-3-оксо-2,3- дигидро-4Н-1, 4-бензоксазин-7-илтио)фенил] 4-метокситетрагидропиран, используемый в качестве исходного материала, получался с помощью той же процедуры, что описана в разделе примера 16, который касается получения исходных веществ, за исключением того, что вместо (R)-(+)-метил 2-хлорпропионата использовался (S)-(-)-метил 2-хлорпропионат. Таким образом получался требуемый исходный материал с выходом 50% температура плавления 147-149о С.
П р и м е р 18. Следующие ниже примеры иллюстрируют характерные фармацевтические дозированные формы, содержащие соединение формулы I, или
его фармацевтически приемлемую соль (здесь ниже соединение Х) для терапевтического или профилактического использования на людях: (а) Таблетки I мг/таблетку Соединение Х 100 Лактоза Фарм. Евр. 182,75
Кроскармелоза- натрий 12,9 Кукурузная крахмаль- ная паста (52 мас./о.паста) 2,25 Стеарат магния 3,0 (b) Таблетки II мг/таблетку Соединение Х 50 Лактоза Фарм. Евр. 223,75 Кроскармелоза- натрий 6,0
Кукурузный крахмал 15,0 Поливинилпирролидон (5 мас./о паста) 2,25 Стеарат магния 3,0 (с) Таблетки III мг/таблетку Соединение Х 1,0 Лактоза Фарм. Евр. 93,25 Кроскарбмеллоза- натрий 4,0 Кукурузная
крахмаль- ная паста (5 мас./о паста) 0,75 Стеарат магния 1,0 (d) Капсулы мг/капсулу Соединение Х 10 Лактоза Фарм. Евр. 488,5 Стеарат магния 1,5 (е) Инъекции I (50 мг/мл) Соединение Х 5,0 мас./о 1 М
раствор гидроокиси натрия 15,0 o/o 0,1 М соляная кислота (для доведения рН до 7,6) Полиэтиленгликоль 400 4,5 мас./о Вода для инъекции до 100% (f) Инъекции II (10 мг/мл) Соединение Х 1,0 мас./о Фосфат
натрия ВР 3,6 мас./о 0,1 М раствор гидроокиси натрия 15,0 об. Вода для инъекции до 100% (g) Инъекции III (1 мг/мл, бу-
ферирован-
ный до рН 6) Соединение Х 0,1 мас./о Фосфат натрия
ВР 2,26 мас./о Лимонная кислота 0,38 мас./о Полиэтиленгликоль 400 3,5 мас./о Вода для инъекции до 100% (h) Аэрозоль I мг/мл Соединение Х 10,0 Сорбитантриолеат 13,5 Трихлорфторметан 910,0
Дихлордифторметан 490,0 (i) Аэрозоль II мг/мл Соединение Х 0,2 Сорбитантриолеат 0,27 Трихлорфторметан 70,0 Дихлордифторметан 280,0 Дихлортетрафторэтан 1094,0 (j) Аэрозоль III мг/мл Соединение Х 2,5
Сорбитантриолеат 3,38 Трихлорфторметан 67,5 Дихлордифторметан 1086,0 Дихлортетрафторэтан 191,6 (k) Аэрозоль IV мг/мл Соединение Х 2,5 Соевый лецитин 2,7 Трихлорфторметан 67,5 Дихлордифторметан 1086,0
Дихлортетрафторэтан 191,6
Примечание.
Приведенные выше препаративные формы могут получаться с помощью общепринятых процедур, хорошо известных в фармацевтической отрасли техники. Таблетки (а)-(с) могут быть с энтерическим покрытием, нанесенным обычными средствами, например, для получения покрытия ацетатфталата целлюлозы. Аэрозольные препаративные формы (h)-(k) могут использоваться в сочетании со стандартными дозирующими аэрозольными баллончиками, а суспендирующие агенты сорбитантриолеат и соевый лецитин могут заменяться альтернативными суспендирующими агентами, такими как сорбитанмоноолеат, сорбитансесквиолеат, полисорбат 80, олеат полиглицерина или олеиновая кислота.
Реферат
Использование: в медицине в качестве лекарственных средств. Сущность изобретения: бициклические гетероциклические соединения ф-лы Q-A1-X1-ArC(OR1, R3)-R2, где Аr - прямая связь с Х или (1 - 3с) алкилен, X1 - окси, тио, сульфинил, сульфонил, Ar - фенилен, который может быть замещен галогеном, окси, амином, C1 - C4 - алкиламином, фтор - C1 - C4 - алкилом, R1 - C1 - C4 - алкил, C3 - C4 - алкенил, C3 - C4 - алкинил, R2 и R3 вместе образуют группу ф-лы A2 - X2 - A3, которая вместе с атомом углерода, к которому A2 - A3 присоединены, определяет кольцо, содержащее 5 или 6 кольцевых атомов, в которой A2 и A3 являются 1 - ЗС - алкиленом, Х - оксигруппа. Реагент 1: O-A1-X1-H. Реагент 2: ZAr-C(OR1,R3)R2, Z - замещенная группа. 2 с. и 8 з. п. ф-лы, 5 ил., 1 табл.
Формула
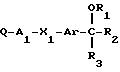
где Q 4Н-1,4-бензоксазинил, или 4Н-1, 4-бензотиазинил, или его соответствующие 2,3-дигидропроизводные, 4Н-3,1-бензоксазинил, или 4Н-3,1-бензотиазинил, или его соответствующие 1,2-дигидропроизводные, или 4Н-пиридо-[3,2-b] [1,4] -оксазинил, каждый из которых может необязательно нести один оксо- или тиоксозаместитель и до четырех других заместителей, выбранных из галогена, окси, циано, амино, С1 С4-алкила, С1 - С4-алкокси, фтор-С1 С4-алкила, С1 - С4-алкиламино и ди-(С1 С4-алкил)-амино;
А1 прямая связь с Х1 или С1 С3-алкилен;
Х1 окси, тио, сульфинил или сульфонил;
Аr фенилен, который может необязательно нести один или два заместителя, выбранные из галогено, окси, амино, С1 С4 алкила, С1 - С4-алкокси, С1 С4-алкиламино, ди-(С1 - С4-алкил)-амино и фтор-(С1 С4)-алкил;
R1 С1 С4-алкил, С3 С4-алкенил или С3 С4-алкинил;
R2 и R3 вместе образуют группу формулы -А2-Х2-А3-, которая вместе с атомом углерода, к которому А2 и А3 присоединены, определяет кольцо, содержащее 5 или 6 кольцевых атомов, где А2 и А3 одинаковые или различные, каждый С1 С3-алкилен, Х2-окси, причем кольцо может нести один или два С1 С4-алкильных заместителя,
или его приемлемые с фармацевтической точки зрения соли.

Комментарии