Ген-восстановитель rf4 для цитоплазматической мужской стерильности (cms) c-типа кукурузы, молекулярные маркеры и их применение - RU2603005C2
Код документа: RU2603005C2
Чертежи

















































































































Описание
ПРИТЯЗАНИЕ НА ПРИОРИТЕТ
По данной заявке испрашивается приоритет на дату подачи временной патентной заявки США с серийным номером 61/390526, поданной 6 октября 2010 года, и безусловной патентной заявки с серийным номером 13/244049, поданной 23 сентября 2011 года, обе "MAIZE CYTOPLASMIC MALE STERILITY (CMS) C-TYPE RESTORER RF4 GENE, MOLECULAR MARKERS AND THEIR USE".
ТЕХНИЧЕСКАЯ ОБЛАСТЬ
Настоящее изобретение относится к генам фертильности растений. В некоторых вариантах осуществления изобретение относится к Rf4, гену-восстановителю фертильности кукурузы. В конкретных вариантах осуществления изобретение относится к композициям и способам восстановления фертильности при цитоплазматической мужской стерильности (CMS-C) C-типа, например, с использованием молекулярных маркеров, сцепленных с геном Rf4, или находящихся в нем. Конкретные варианты осуществления относятся к способам использования конкретных последовательностей нуклеиновых кислот для идентификации растений, которые содержат восстановитель фертильности CMS-C, и получения гибридных семян. Некоторые конкретные варианты осуществления относятся к полипептидам, ассоциированным с восстановлением фертильности CMS-C.
УРОВЕНЬ ТЕХНИКИ
Развитие разведения гибридных растений сделало возможными значительные достижения с точки зрения качества и количества продуцируемых культур. Увеличенный выход и комбинирование желаемых характеристик, таких как устойчивость к заболеваниям и насекомым, толерантность к жаре и засухе, и варьирование состава растения, являются возможными, частично, благодаря методикам гибридизации. Методики гибридизации основаны на вкладе, вносимом пыльцой из мужского родительского растения, в женское родительское растение, что приводит к получению гибрида.
Растения могут самоопыляться, если пыльца из одного цветка переносится на тот же или другой цветок одного и того же растения. Растения могут перекрестно опыляться, если пыльца происходит из цветка из другого растения. Растения кукурузы (Zea mays) можно выводить способами как самоопыления, так и перекрестного опыления. Растения кукурузы имеют мужские цветки, которые расположены на метелке, и женские цветки, которые расположены на початке того же растения. Естественное опыление кукурузы происходит, когда пыльца из метелки достигает рылец, которые находятся наверху зарождающихся початков. Разработка гибридов кукурузы основана на системах мужской стерильности.
Разработка гибридов кукурузы требует разработки гомозиготных инбредных линий, скрещивания этих линий и оценки продуктов скрещивания. Чистосортное разведение и рекуррентная селекция являются двумя способами разведения, используемыми для разработки инбредных линий из популяций. Программы разведения комбинируют желаемые признаки двух или более инбредных линий или различных универсальных источников в депо разведения, из которого разрабатывают новые инбредные линии путем самоопыления и селекции желаемых фенотипов. Гибридный сорт кукурузы является результатом скрещивания двух таких инбредных линий, каждая из которых может иметь одну или несколько желаемых характеристик, отсутствующих в одной, или дополняющих другую. Новые инбредные растения скрещивают с другими инбредными линиями, и гибриды этих скрещиваний оценивают для определения тех из них, которые являются желательными. Гибридное потомство первого поколения обозначают F1. При выведении гибридов искомыми являются только гибриды F1. Гибрид F1, как правило, является более сильным, чем его инбредные родительские растения. Эта сила гибридов, называемая гетерозисом, как правило, приводит, например, к повышенному вегетативному росту и увеличенному выходу.
Гибридную кукурузу можно получать с помощью системы мужской стерильности, включающей удаление метелки вручную. Для получения гибридных семян мужскую метелку удаляют из растущих женских инбредных родительских растений, которые можно высевать по принципу различным образом чередующихся рядов с мужскими инбредными родительскими растениями. Следовательно, при условии, что существует достаточная изоляция от чужеродной пыльцы, початки женского инбредного растения будут оплодотворяться только пыльцой мужского инбредного растения. Полученные семена представляют собой гибридные семена F1.
Удаление метелок вручную является трудоемким и дорогостоящим. Удаление метелок вручную часто является неэффективным, например, поскольку варьирование условий окружающей среды при выведении растений может приводить к растениям, у которых происходит выметывание метелок в женском родительском растении после проведения удаления метелок вручную, или поскольку лицо, осуществляющее удаление метелок, не полностью удалило метелку из женского инбредного растения. Если удаление метелок является неэффективным, женское растение будет продуктивно сбрасывать пыльцу, и некоторые женские растения будут самоопыляться. Это приведет к тому, что вместе с гибридными, семенами, продуцированными нормально, будут собраны семена женского инбредного растения. Семена женского инбредного растения являются не настолько продуктивными, как семена F1. Кроме того, присутствие женских инбредных семян может привести к риску недостаточной сохранности зародышевой плазмы для производителя гибридных семян.
Метелки из женского инбредного растения также можно удалять с помощью устройства. Механическое удаление метелок является приблизительно настолько же надежным, как и удаление метелок вручную, однако является более быстрым и менее дорогостоящим. Однако большинство устройств для удаления метелок приводит к большему повреждению растений, чем удаление метелок вручную. Таким образом, в настоящее время не существует полностью удовлетворительной формы удаления метелок.
Генетическая мужская стерильность является альтернативным способом, который можно использовать при получении гибридных семян. Трудоемкого процесса удаления метелок можно избежать в некоторых генотипах с использованием инбредных растений с цитоплазматической мужской стерильностью (CMS). В отсутствие гена-восстановителя фертильности, инбредные растения CMS обладают мужской стерильностью в результате факторов, происходящих из цитоплазматического, а не ядерного генома. Таким образом, характеристикой мужской стерильности является то, что она наследуется исключительно через женское растение в растениях кукурузы, поскольку только женское растение предоставляет цитоплазму для оплодотворенных семян. Растения CMS оплодотворяют пыльцой другого инбредного растения, которое не обладает мужской стерильностью. Пыльца второго инбредного растения может обеспечивать или может не обеспечивать гены, которые приводят к наличию у гибридных растений мужской фертильности. Обычно семена нормальной кукурузы после удаления метелок и продуцированные с помощью CMS семена того же гибрида должны быть смешаны для обеспечения того, чтобы достаточная нагрузка пыльцой была доступна для оплодотворения, когда гибридные растения выращивают, и для обеспечения цитоплазматического разнообразия.
Недостатки CMS как системы продуцирования гибридных семян включают ассоциацию конкретных вариантов CMS с предрасположенностью к определенным заболеваниям культур. См., например, Beckett (1971) Crop Science 11:724-6. Эта проблема, в частности, препятствует применению варианта CMS-T в продуцировании гибридных семян кукурузы и обычно негативно отражается на применении CMS в кукурузе.
Цитоплазматическая мужская стерильность (CMS) представляет собой наследуемую по материнской линии неспособность продуцировать функциональную пыльцу. Было найдено более 40 источников CMS, и они были классифицированы на три основных группы по различным реакциям восстановления фертильности в кукурузе. Эти группы обозначают как CMS-T (Texas), CMS-S (USDA) и CMS-C (Charrua). Beckett (1971). В группе CMS-T для восстановления фертильности пыльцы требуется два доминантных гена: Rf1 и Rf2, которые расположены на хромосомах 3 и 9, соответственно. Duvick (1965) Adv. Genetics 13:1-56. S-цитоплазма восстанавливается с помощью одного гена, Rf3, который картирован на 2 хромосоме. Laughnan and Gabay (1978) "Nuclear and cytoplasmic mutations to fertility in S male-sterile maize", Maize Breeding and Genetics, pp. 427-446.
В предшествующих анализах было обнаружено, что, по сравнению с CMS-T и CMS-S, восстановление фертильности CMS-C является очень сложным. Duvick (1972), "Potential usefulness of new cytoplasmic male sterile and sterility system", Proceeding of the 27th annual corn and sorghum research conference, pp. 197-201, обнаружил, что полное восстановление фертильности CMS-C контролируется доминантным аллелем гена Rf4. Khey-Pour et al. (1981) также обнаружили, что этот ген является достаточным для восстановления CMS-C. Однако Josephson et al. (1978), "Genetics and inheritance of fertility restoration of male sterile cytoplasms in corn", Proceedings of the 33rd com and sorghum research conference 7:13, предположили, что полное восстановление фертильности CMS-C обуславливается взаимодополняющим действием доминантных аллелей двух генов: Rf4 и Rf5, которые с тех пор были картированы на хромосомах 8 и 5, соответственно. Sisco (1991) Crop Sci. 31: 1263-6. Между тем, Chen et al. (1979) Acta Agronom. Sin. 5(4):21-28, предположили, что два доминантных гена-восстановителя при CMS-C имеют дублирующие функции. Далее усложняя систему, Vidakovic (1988), Maydica 33:51-65, продемонстрировал существование трех доминантных и комплементарных генов для полного восстановления фертильности при CMS-C, добавив ген Rf6. Vidakovic et al, (1997a) Maize Genet. Coop. News Lett. 71:10; (1997b) Maydica 42:313-6, позднее сообщили, что эти взаимодополняющие гены, Rf4, Rf5 и Rf6, в действительности не были единственными генетическими механизмами для восстановления фертильности при CMS-C в кукурузе. Таким образом, механизмы восстановления фертильности при CMS-C остаются не проясненными. В результате трудно выбрать линии-восстановители для некоторых генотипически стерильных линий.
Для ускорения процесса введения гена или локусов количественных признаков (QTL) в элитный культивар или линию выведения путем обратного скрещивания особенно пригодны молекулярные маркеры. Маркеры, сцепленные с геном, можно использовать для селекции растений, обладающих желаемым признаком, и маркеры по всему геному можно использовать для селекции растений, генетически сходных с рекуррентным родительским растением (Young and Tanksley (1989) Theor. Appl. Genet. 77:95-101; Hospital et al. (1992) Genetics 132:1199-210).
Большинство генов-восстановителей фертильности растений было клонировано с помощью стратегии клонирования на основе картирования. На сегодняшний день, было выделено девять генов Rf из нескольких видов растений, включая кукурузу (Zea Mays L.) (Cui et al. (1996) Science 272:1334-6; Liu et al. (2001) Plant Cell 13:1063-78), петунию (Petunia hybrida) (Bentolila et al. (2002) Proc. Natl. Acad. Sci. USA 99:10887-92, хрен (Raphanus sativus L.) (Brown et al. (2003) Plant J. 35:262-72; Desloire et al. (2003) EMBO Rep. 4:1-7; Koizuka et al. (2003) Plant J. 34:407-15), сорго (Sorghum bicolor L.) (Klein et al. (2005) Theor. Appl. Genet. 111: 994-1012), рис (Oryza sativa L.) (Kazama и Toriyama (2003) FEBS Lett. 544:99-102; Akagi et al. (2004) Theor. Appl. Genet. 108: 1449-57; Komori et al. (2004) Plant J. 37:315-25; Wang et al. (2006) Plant Cell 18:676-87; и Fujii and Toriyama (2009) Proc. Natl. Acad. Sci. USA 106(23): 9513-8), и губастик (Mimulus guttatus) (Barr and Fishman (2010) Genetics 184:455-65).
Все из идентифицированных генов-восстановителей, за исключением Rf2 в кукурузе и Rf17 в рисе, кодируют различные белки с пентатрикопептидными повторами (PPR). Геномы растений кодируют несколько сотен белков PPR, многие из которых вовлечены в регуляцию экспрессии генов органелл. Lurin et al. (2004) Plant Cell 16:2089-103; и Schmitz-Linneweber and Small (2008) Trends Plant Sci. 12:663-70. Белок PPR содержит от 2 до 27 повторов по 35 аминокислот, называемых мотивами PPR. Small and Peeters, (2000) Trends Biochem. Sci. 25(2):46-7. Предсказано, что белки PPR связываются с РНК (Delannoy et al. (2007) Biochemical Society Transactions 35:1643-7), и многие белки PPR нацеливаются на митохондрии, где расположены ассоциированные с CMS гены и продукты. Lurin et al. (2004), выше. Данные указывают на то, что белки PPR связываются непосредственно с транскриптами CMS. Akagi et al. (2004), выше; Gillman et al. (2007) Plant J. 49:217-27; и Kazama et al. (2008) Plant J. 55:619-28. Белки Rf снижают экспрессию ассоциированных с CMS транскриптов путем изменения их характера процессинга (Kazama & Toriyama (2003), выше), снижения стабильности РНК (Wang et al. (2006), выше; и Ohta et al. (2010) Plant Cell Rep. 29:359-69), или предотвращения их трансляции (Kazama et al. (2008), выше).
Дополнительная информация, касающаяся генов-восстановителей фертильности из кукурузы, риса, петунии и хрена, может быть найдена в патентной заявке США с серийным номером № US2006/0253931, и в патентах США № 5981833; 5624842; 4569152; 6951970; 6392127; 7612251; 7314971; 7017375; 7164058 и 5644066.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем описании описано картирование локуса Rf4 кукурузы до небольшой области размером 12 т.п.н., расположенной в верхней части хромосомы 8. В этой области единственным вероятным кандидатом для Rf4 является ген, кодирующий фактор транскрипции bHLH. Путем клонирования локуса Rf4-bHLH из линий CMS-C, линий-невосстановителей и линий-восстановителей, был идентифицирован ряд различий в последовательности. На белковом уровне все из линий CMS-C и линий-невосстановителей имеют одну и ту же последовательность, и отличаются от аллелей-восстановителей (также идентичных друг другу) на 4 аминокислотных замены, включая консервативный гидрофильный остаток тирозина в домене bHLH (Y186), который заменен на гидрофобный остаток фенилаланина (F187) в линии-восстановителе.
Ген Rf4 кукурузы и кодируемый им полипептид представлены в настоящем описании, и кроме того, описаны молекулы нуклеиновых кислот, содержащие последовательность гена Rf4. Неожиданно, ген Rf4 не является геном белка с пентатрикопептидным повтором (PPR), как практически все другие гены-восстановители фертильности. Более того, показано, что восстановление фертильности в зародышевой плазме системы CMS-C/Rf4 по настоящему изобретению контролируется Rf4 в качестве единственного доминантного гена-восстановителя, что было неожиданным вследствие недавних работ нескольких групп. См. выше. Гидрофильный остаток тирозина в домене bHLH rf4-bHLH (Y186) кукурузы, который заменен на гидрофобный остаток фенилаланина (F187) в линиях восстановителей, является консервативным среди однодольных растений. Таким образом, идентификация гена Rf4 и маркеров гена Rf4 значительно способствовала разработке и широкому внедрению признака восстановления фертильности CMS-C в зародышевой плазме растений.
В вариантах осуществления мутация консервативного остатка тирозина в положении 186 rf4-bHLH на гидрофобный аминокислотный остаток (например, фенилаланин) ответственна за фенотип восстановителя в полипептиде Rf4-bHLH. Таким образом, в настоящем описании описаны гены Rf4-bHLH кукурузы или ортологи генов Rf4-bHLH кукурузы, которые кодируют гидрофобный аминокислотный остаток в этом положении (как определяют выравниванием последовательностей), где эти гены обеспечивают фенотип восстановителя CMS-C при включении в растение.
В настоящем описании описаны молекулярные маркеры нуклеиновых кислот, которые сцеплены (например, сцеплены; прочно сцеплены; или чрезвычайно прочно сцеплены) с геном Rf4 кукурузы или которые расположены в нем. В некоторых вариантах осуществления маркеры, которые сцеплены (например, сцеплены; прочно сцеплены; или чрезвычайно прочно сцеплены) с геном Rf4 кукурузы или которые расположены в нем, или саму последовательность гена Rf4 кукурузы, можно использовать для введения гена Rf4 кукурузы в организмы, например, растения (например, кукуруза и другие однодольные растения).
Также в настоящем описании описаны способы использования маркеров нуклеиновых кислот, которые сцеплены с геном Rf4 или расположены в нем, например и не ограничиваясь этим, для идентификации растений с функциональным геном-восстановителем для CMS C-типа; для введения Rf4 в новые генотипы растений (например, путем скрещивания с использованием маркера или генетической трансформации); и для получения гибридных семян от скрещиваний мужских растений, содержащих молекулярные маркеры нуклеиновых кислот, которые сцеплены с геном Rf4 или расположены в нем, и женских растений, несущих CMS C-типа.
Кроме того, описаны средства для восстановления фертильности кукурузы CMS-C, и средства для идентификации растений, имеющих ген восстановления фертильности кукурузы CMS-C. В некоторых примерах средства для восстановления фертильности кукурузы CMS-C могут представлять собой маркер, который сцеплен (например, сцеплен; прочно сцеплен; или чрезвычайно прочно сцеплен) с геном Rf4 кукурузы или который расположен в нем. В некоторых примерах средства для идентификации растений, имеющих ген восстановления фертильности кукурузы CMS-C, могут представлять собой зонд, который специфично гибридизуется с маркером, который сцеплен (например, сцеплен; прочно сцеплен; или чрезвычайно прочно сцеплен) с геном Rf4 или который расположен в нем.
Также в настоящем описании описаны способы, посредством которых можно получать гибридные семена путем скрещиваний мужского растения, содержащего молекулярные маркеры нуклеиновых кислот, которые сцеплены (например, сцеплены; прочно сцеплены; или чрезвычайно прочно сцеплены) или с геном Rf4 кукурузы или которые расположены в нем, и женского растения, имеющего CMS C-типа. Получение таких гибридных семян может приводить к экономии затрат вследствие ручного или механического устранения удаления метелок, и, кроме того, могут увеличить выход семян.
Кроме того, описаны способы использования молекул нуклеиновых кислот, описанных в настоящем описании, для идентификации гомологичных последовательностей Rf4 из видов растений, отличных от кукурузы (например, путем сравнения последовательностей). В некоторых вариантах осуществления систему CMS-C/Rf4 для получения гибридных семян создают способами инженерии в видах растений, отличных от кукурузы.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
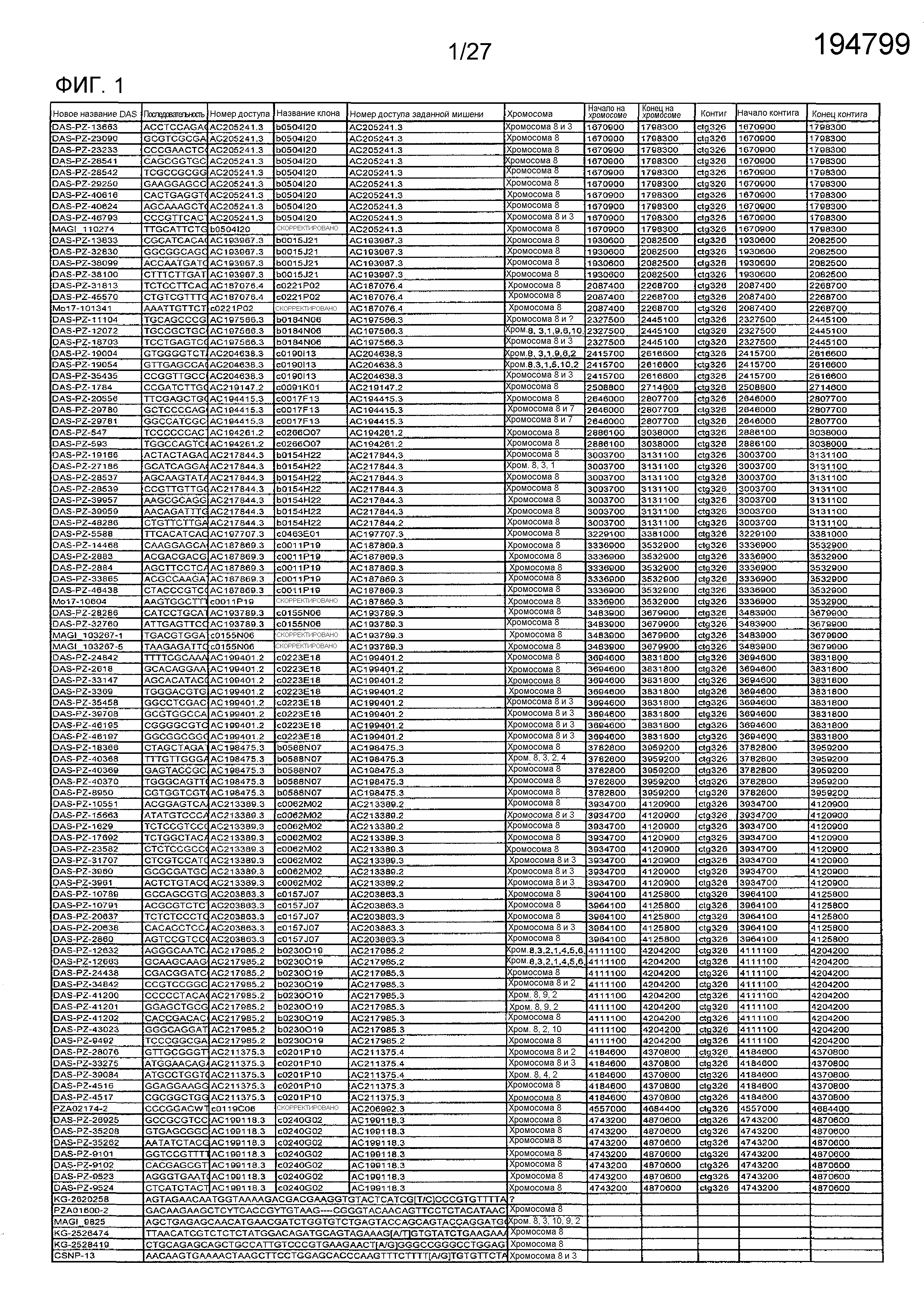
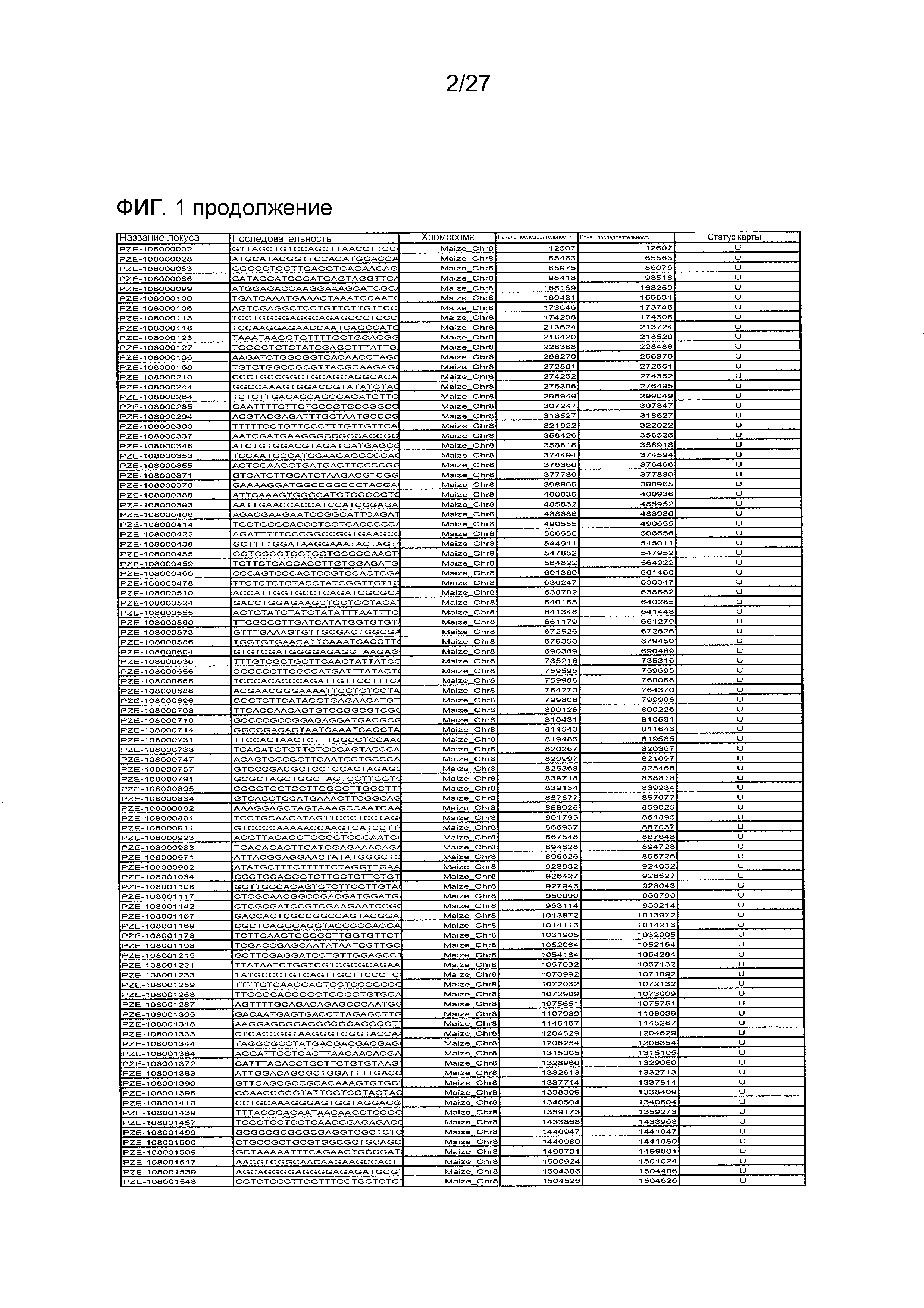
На ФИГ.1 представлено 197 маркеров SNP, определенных как находящиеся в области гена Rf4, и их положения на физической карте.
На ФИГ.2 представлены тридцать четыре случайным образом отобранных рекомбинантных растения с их фенотипическими данными и соответствующими генетическими данными по 27 SNP-маркерам.
На ФИГ.3 представлены относительные положения маркеров SNP для гена Rf4 и генов в пределах области размером 1,5 млн п.н. на 8 хромосоме.
На ФИГ.4 представлены относительные положения маркеров SNP для гена Rf4 и генов в пределах области размером 0,56 млн п.н. и в пределах области размером 100 т.п.н. на 8 хромосоме.
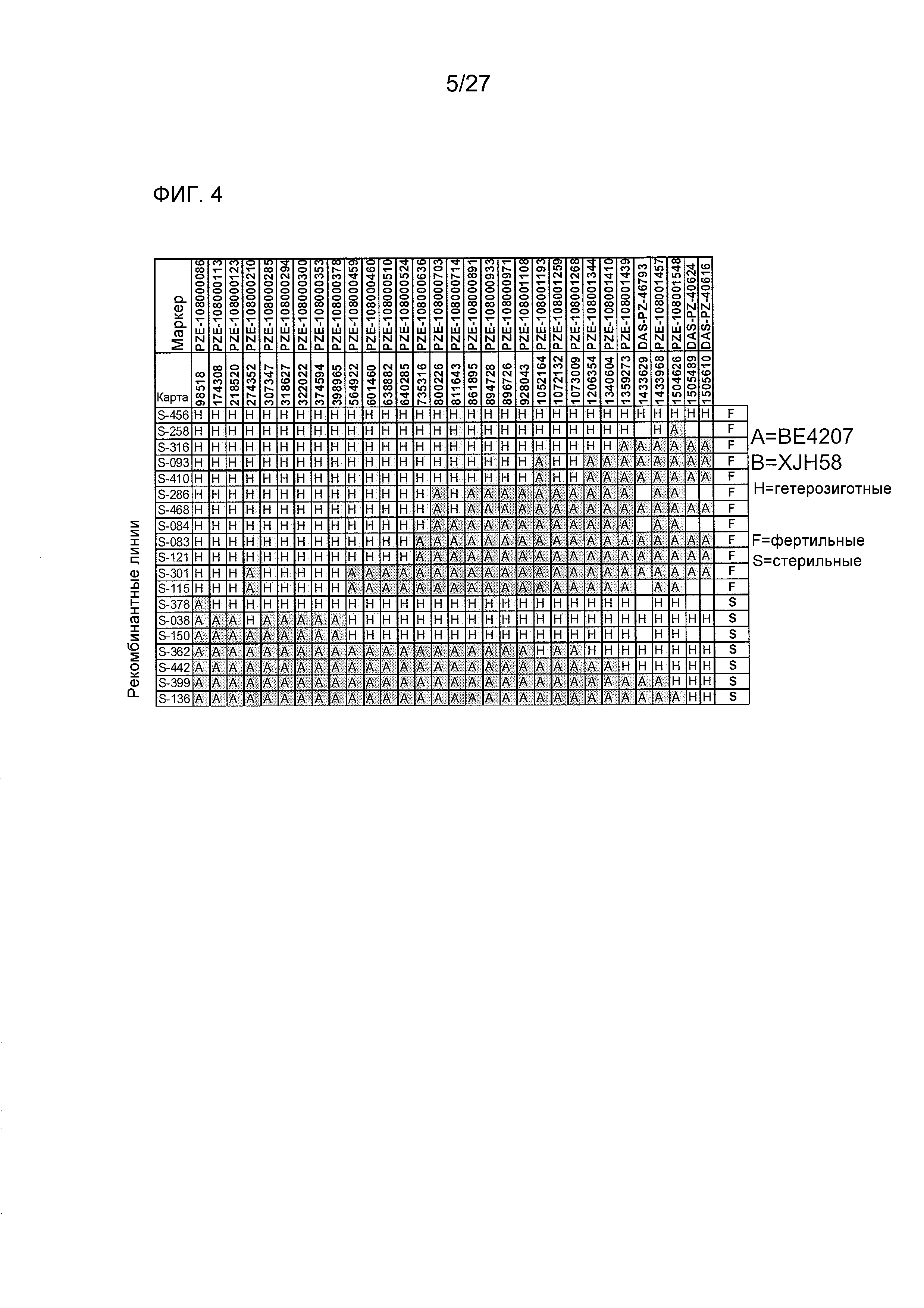
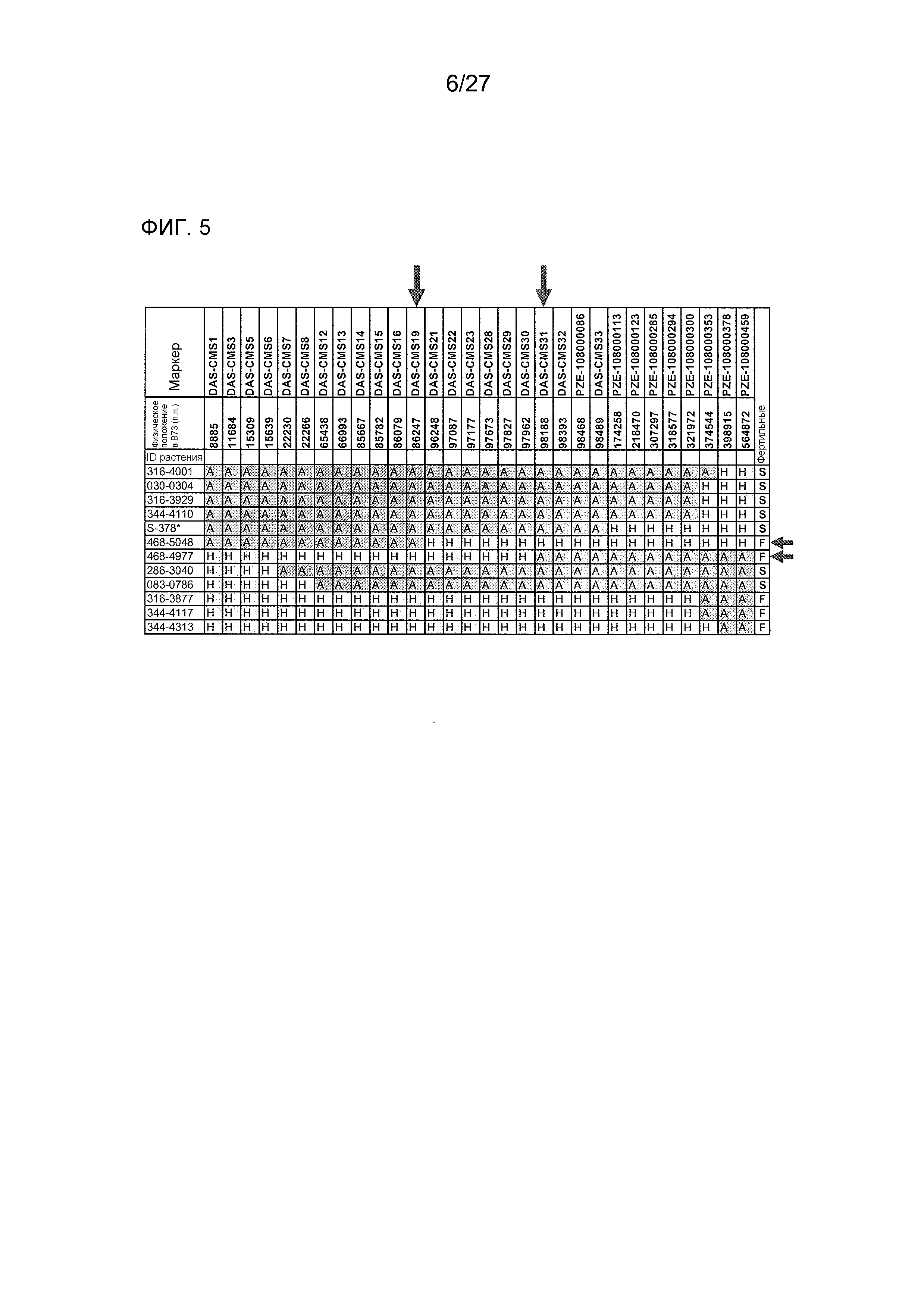
На ФИГ.5 представлено точное картирование Rf4 в области размером 12 т.п.н. Буквами указаны генотипы: A=гомозиготный по BE4207 (CMS); H=гетерозиготный. Стрелками указаны левый и правый пограничные маркеры Rf4, и два наиболее важных рекомбинантных растения.
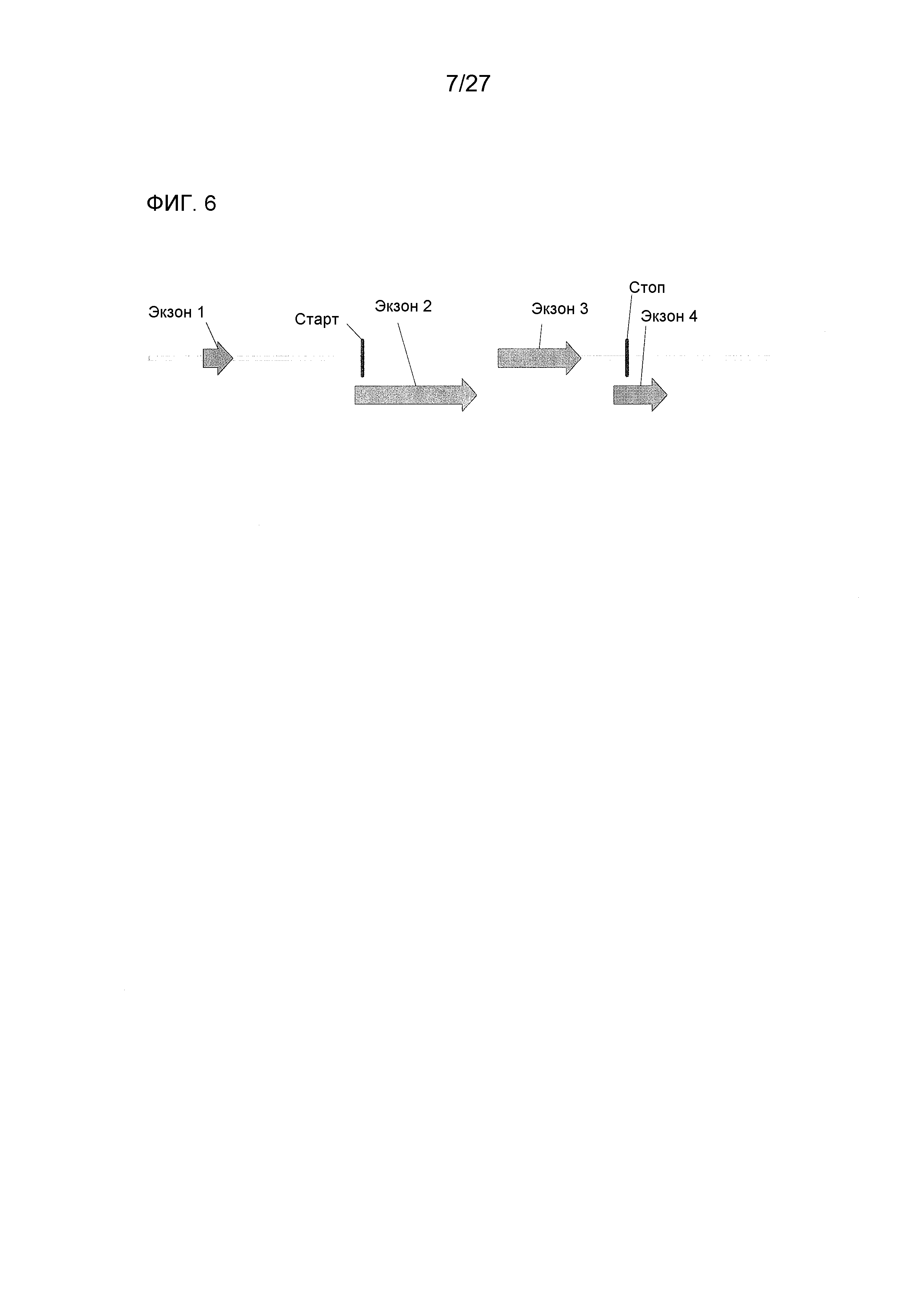
На ФИГ.6 представлено схематическое изображение геномной структуры аллеля Rf4-bHLH, демонстрирующее полную кодирующую область (от кодона инициации до стоп-кодона - 1,38 т.п.н.), 5'-UTR/промотор размером 1,1 т.п.н., и 3'-UTR/терминатор размером 0,75 т.п.н.
На ФИГ.7 представлено выравнивание последовательностей Rf4-bHLH из следующих генотипов кукурузы: B73; BE4207; B104; XJH58; BE9515; и MLW03. Положения кодона инициации трансляции, стоп-кодона и маркеров с DAS-CMS21 по DAS-CMS34, расположенных в гене, обозначены. Положения SNP и InDel затемнены.
На ФИГ.8 представлено выравнивание предсказанной последовательности кДНК Rf4-bHLH из следующих генотипов кукурузы: B73; BE4207; B104; XJH58; BE9515; и MLW03. Положения кодона инициации трансляции, стоп-кодона и маркеров для DAS-CMS22-25, 28-29 и 31, расположенных в кДНК, обозначены.
На ФИГ.9 представлено выравнивание предсказанных белковых последовательностей Rf4-bHLH. Положения консервативного домена bHLH, сигналов ядерной локализации (NLS) и положения соответствующих маркеров для DAS-CMS22, 23 и 28 обозначены. Замена Tyr на Phe в домене bHLH вызвана динуклеотидной заменой AC на TT в положении 747 (предсказанной последовательности кДНК B73), практически рядом с маркером DAS-CMS24 (см. ФИГ.8 и полиморфизм ID 54 в таблице 3).
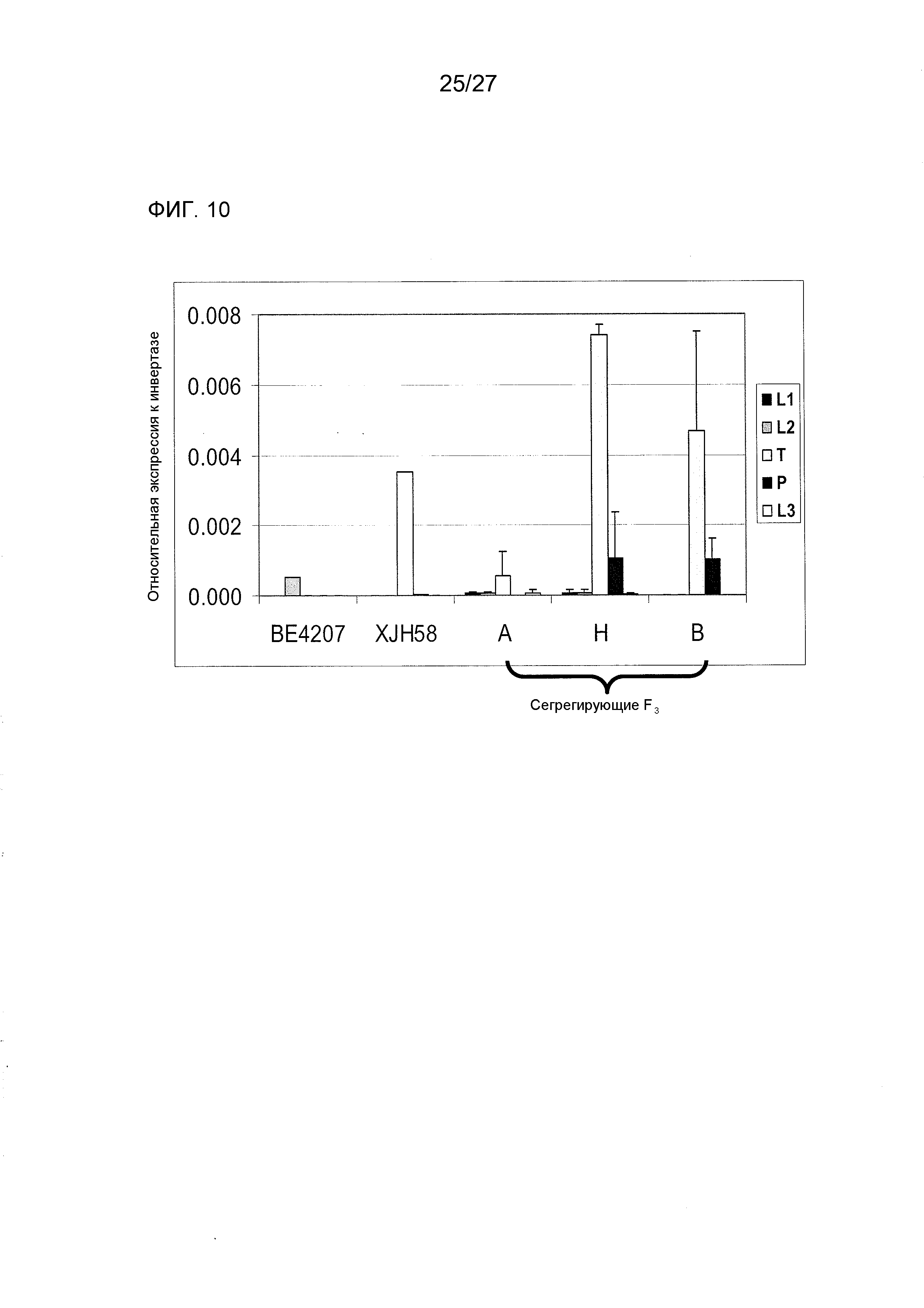
На ФИГ.10 представлены данные, демонстрирующие профили экспрессии Rf4-HLH. L1=5 - слабые листья, L2=7 - слабые листья, L3=9 - слабые листья, T = метелки с развивающимися пыльниками и пыльцой, P = сбрасываемая пыльца. A = гомозиготный по BE4207, H = гетерозиготный, B = гомозиготный по XJH58. Данные соответствуют средним значениям для трех растений каждого генотипа для сегрегирующих F3 и для 1 растения каждого из родительских растений. Планки погрешностей соответствуют стандартному отклонению.
На ФИГ.11 представлено выравнивание Rf4-bHLH кукурузы (из восстановителя XJH58 и невосстановителя BE4207) с их ортологами из других однодольных видов. Положение консервативного домена bHLH подчеркнуто. Четыре аминокислотных замены между Rf4-bHLH XJH58 и Rf4-bHLH BE4207 обозначены.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Последовательности нуклеиновых кислот, приведенные в прилагаемом списке последовательностей, представлены с использованием стандартных буквенных обозначений для нуклеотидных оснований, как определено в 37 C.F.R. § 1.822. Показана только одна цепь каждой последовательности нуклеиновой кислоты, однако следует понимать, что при любой отсылке на представленную цепь включается комплементарная цепь. Для простоты при описании гена или локуса ген может быть описан с помощью мутантной формы гена (например, Rf4, в противоположность rf4), даже несмотря на то, что истинная последовательность может представлять собой форму гена дикого типа в соответствующем положении в геноме. Тем не менее, понятно, что оба аллеля имеют различные последовательности, и из контекста понятно, какой аллель подразумевается. В прилагаемом списке последовательностей:
В SEQ ID NO: 1-197 представлены иллюстративные нуклеотидные последовательности маркеров, которые сцеплены (например, сцеплены; прочно сцеплены; или чрезвычайно прочно сцеплены) с геном Rf4 кукурузы или которые расположены в нем.
В SEQ ID NO: 198-211 представлены нуклеотидные последовательности в области приблизительно 0,56 млн п.н. в верхней части 8 хромосомы кукурузы, в которой аллель Rf4 был первоначально картирован. SEQ ID NO: 203 представляет собой аллель Rf4-bHLH.
SEQ ID NO: 212-216 представляют собой иллюстративные различия нуклеотидных последовательностей между линиями CMS (BE4207) и восстановителя (XJH58).
В SEQ ID NO: 217 представлена нуклеотидная последовательность интервала приблизительно 12 т.п.н. из сорта кукурузы B73, в котором был точно картирован аллель Rf4.
В SEQ ID NO: 218 представлена нуклеотидная последовательность аллеля rf4-bHLH из сортов кукурузы B73 и BE4207.
В SEQ ID NO: 219 представлена нуклеотидная последовательность аллеля bHLH из сорта кукурузы B104.
В SEQ ID NO: 220 представлена нуклеотидная последовательность аллеля Rf4-bHLH из сортов кукурузы XJH58, BE9515 и MLW03.
В SEQ ID NO: 221 представлена нуклеотидная последовательность предсказанной кДНК rf4-bHLH из сортов кукурузы B73 и B4207.
В SEQ ID NO: 222 представлена нуклеотидная последовательность предсказанной кДНК bHLH из сорта кукурузы B104.
В SEQ ID NO: 223 представлена нуклеотидная последовательность предсказанной кДНК Rf4-bHLH из сортов кукурузы XJH58, BE9515 и MLW03.
В SEQ ID NO: 224 представлена аминокислотная последовательность предсказанного полипептида rf4-bHLH кукурузы.
В SEQ ID NO: 225 представлена аминокислотная последовательность предсказанного полипептида Rf4-bHLH.
В SEQ ID NO: 226 представлена аминокислотная последовательность предсказанного полипептида rf4-bHLH Brachypodium distachyon.
В SEQ ID NO: 227 представлена аминокислотная последовательность предсказанного полипептида rf4-bHLH Sorghum bicolor.
В SEQ ID NO: 228 представлена аминокислотная последовательность предсказанного полипептида rf4-bHLH Oryza sativa.
В SEQ ID NO: 229 и 230 представлены сигналы ядерной локализации (NLS) в Rf4-bHLH.
СПОСОБ(Ы) ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
I. Обзор нескольких вариантов осуществления
В настоящем описании описаны конкретные варианты осуществления генов, влияющих на мужскую фертильность в растениях: Rf4 кукурузы и прочно сцепленные с ними генетические маркеры, которые могут быть пригодны в различных системах контроля мужской фертильности. Более того, полиморфизм, присущий описанным прочно сцепленным генетическим маркерам, позволяет растениеводу отслеживать конкретный аллель гена, Rf4 или rf4, в сегрегирующей популяции. Ген Rf4 был первоначально картирован на 8 хромосоме в трех популяциях, полученных скрещиванием четырех культиваров кукурузы: BE4207×BE9515; BE4207×LW03F; и BE4207×XJH58. Точное картирование и клонирование на основе картирования были продемонстрированы в качестве примера в популяции BE4207×XJH58, в конечном итоге локализовав ген Rf4 в пределах приблизительно 12 т.п.н.
Восстановление цитоплазматической мужской стерильности (CMS) является стандартной сельскохозяйственной практикой при получении гибридных семян в течение многих лет. Использование гена-восстановителя фертильности (Rf) при цитоплазматической мужской стерильности упрощает программы продуцирования и снижает общие затраты путем полного устранения ручного или машинного удаления метелок. Однако полное преимущество применений генетики восстановления фертильности для цитоплазматической мужской стерильности C-типа в кукурузе для получения гибридных семян не было осуществлено, поскольку предшествующие исследования генетики восстановления фертильности для цитоплазматической мужской стерильности C-типа в кукурузе привели к противоречивым результатам.
Ввиду практической важности цитоплазматической мужской стерильности и восстановления фертильности пыльцы при получении гибридных семян кукурузы и необходимости диверсификации источника цитоплазмы, описано точное картирование гена-восстановителя Rf4 кукурузы для CMS-C до очень небольшой области с использованием молекулярных маркеров с помощью способа генотипирования KASPar™ и идентификация гена Rf4 кукурузы с помощью клонирования на основе картирования. Было открыто, что Rf4 является единственным доминантным геном-восстановителем для CMS-C в трех инбредных растениях кукурузы: BE9515, MLW03 и XJH58.
Rf4 первоначально был картирован с использованием маркеров SSR и SNP до области приблизительно 5,0 млн п.н., начиная с маркера SSR umc-1075 до верхней части короткого плеча хромосомы 8. Была создана популяция для подтверждения F2 BE4207×XJH58 с 500 особями, и она была оценена в отношении фертильности в полевых условиях. Был проведен скрининг всего 197 маркеров SNP в популяции для подтверждения и было идентифицировано 104 рекомбинанта в пределах области размером 5,0 млн п.н. Путем сравнения фенотипических показателей и генотипических данных для информативных рекомбинантных линий, ген Rf4 кукурузы был положительно идентифицирован в пределах области приблизительно 0,56 млн п.н. (14 генов), и, вероятно, в пределах 100 т.п.н. (6 генов).
Таким образом, использование вариантов осуществления способов, описанных в настоящем описании, продемонстрировало, что ген Rf4 выбран из группы, состоящей из GRMZM2G 122853 (SEQ ID NO: 198); AC187051.4JFG005 (SEQ ID NO: 199); GRMZM2G122851 (SEQ ID NO: 200); GRMZM2G122850 (SEQ ID NO: 201); GRMZM2G582028 (SEQ ID NO: 202); GRMZM2G021276 (SEQ ID NO: 203); GRMZM2G381376 (SEQ ID NO: 204); GRMZM2G081127 (SEQ ID NO: 205); GRMZM2G085111 (SEQ ID NO: 206); GRMZM2G085038 (SEQ ID NO: 207); GRMZM2G317468 (SEQ ID NO: 208); GRMZM2G328030 (SEQ ID NO: 209); GRMZM2G029450 (SEQ ID NO: 210); и GRMZM2G077212 (SEQ ID NO: 211).
С использованием большой популяции для точного картирования размером приблизительно 5000 особей, локус Rf4 был картирован до небольшой области размером приблизительно 12 т.п.н., расположенной в верхней части 8 хромосомы. Тем самым, было продемонстрировано, что ген Rf4 выбран из группы, состоящей из перемещающегося генетического элемента растений [GRMZM2G582028 (SEQ ID NO: 202)] и фактора транскрипции основная спираль-петля-спираль (bHLH) (GRMZM2G021276 (SEQ ID NO: 203)). Среди этих двух генов единственным вероятным кандидатом для Rf4 является фактор транскрипции основная спираль-петля-спираль (bHLH), геном Rf4 является GRMZM2G021276 (SEQ ID NO: 203). Таким образом, в конкретных вариантах осуществления ген Rf4 представляет собой GRMZM2G021276 (SEQ ID NO: 203), который иногда называют в настоящем описании как Rf4-bHLH. Понятно, что ген Rf4 также может представлять собой последовательность ДНК, которая кодирует тот же полипептид, что и ген Rf4-bHLH кукурузы, например, кодирующую последовательность SEQ ID NO: 203.
Локус bHLH был клонирован из линии CMS BE4207 кукурузы; линии B104 кукурузы; и трех линий восстановителей кукурузы: XJH58, BE9515 и MLW03. Был идентифицирован ряд изменений последовательностей между различными инбредными растениями. Следует отметить, что три линии-восстановителя имеют идентичные последовательности ДНК Rf4-bHLH, в то время как B73 и BE4207 (которые не содержат функциональный восстановитель Rf4) являются идентичными. Последовательность B104 является более сходной с аллелем BE4207/B73, чем с аллелем-восстановителем. На белковом уровне все из BE4207, B73 и B104 имеют одинаковую последовательность и отличаются от генного продукта аллеля-восстановителя на 4 аминокислотных замены, включая замену гидрофобным фенилаланином консервативного гидрофильного тирозина в домене bHLH.
В соответствии с функцией Rf4 в восстановлении фертильности пыльцы, аллель-восстановитель Rf4-bHLH экспрессируется специфически в развивающихся метелках (с пыльниками и пыльцой) растений, которые восстанавливают CMS-C. В линии CMS кукурузы BE4207 не происходит ни появление пыльников, ни развитие функциональной пыльцы. В результате в листьях и мужских репродуктивных тканях из растений BE4207 была выявлена очень низкая экспрессия rf4-bHLH или отсутствие его экспрессии. Поскольку B73 (инбредное растение, которое ни содержит цитоплазму CMS-C, ни восстанавливает CMS-C) имеет значительную экспрессию rf4-bHLH, маловероятно, что восстановление фертильности является следствием различий в уровне экспрессии между аллелем-восстановителем (Rf4-bHLH) и аллелем-невосстановителем (rf4-bHLH).
Полагают, что восстановление мужской фертильности является следствием различий в аминокислотной последовательности между продуктами генов аллеля-восстановителя и аллеля-невосстановителя. В частности, Y186 rf4-bHLH кукурузы расположен в первой спирали (Carretero-Paulet et al. (2010) Plant Physiol. 153: 1398-412; и Pires and Dolan (2010) Mol. Biol. Evol. 27:862-74) в связывающем домене ДНК bHLH, и этот остаток является абсолютно консервативным в B73 (не CMS, не восстановитель), BE4207 (CMS, не восстановитель) и в ортологах сорго, риса и Brachypodium. В трех линиях восстановителей кукурузы этот гидрофильный остаток заменен гидрофобным фенилаланином (F187). Такая неконсервативная замена может значительно изменить структуру спирали в домене bHLH и повлиять на связывание ДНК и последующую транскрипцию гена. Ввиду вышесказанного, авторы изобретения предсказали, что аллель rf4 из B104 не восстанавливает фертильность CMS-C, поскольку bHLH B104 имеет идентичную белковую последовательность с rf4-bHLH B73 и BE4207, включая консервативный тирозин в положении 186.
В некоторых вариантах осуществления молекулярные маркеры на основе Rf4-bHLH или прочно сцепленные высокопроизводительные молекулярные маркеры, описанные в настоящем описании, можно использовать для идентификации генотипов восстановителя Rf4, интрогрессии Rf4 в новые генотипы в кукурузе и других растениях для мужской конверсии, и удаления Rf4 из женских растений CMS. Имея маркеры и ген Rf4, в настоящее время возможно надежно перенести Rf4 в элитную зародышевую плазму и увеличить масштаб использования системы CMS-C/Rf4 для получения гибридных семян. Полная реализация этой системы может обеспечить значительные финансовые преимущества для сельскохозяйственной промышленности и потребителей ее продукции.
II. Термины
Обратное скрещивание: способы обратного скрещивания можно использовать для введения последовательности нуклеиновой кислоты в растения. Способ обратного скрещивания широко используют в течение десятилетий для введения новых признаков в растения. Jensen, N., Ed. Plant Breeding Methodology, John Wiley & Sons, Inc., 1988. В типичном протоколе обратного скрещивания исходный представляющий интерес сорт (рекуррентное родительское растение) скрещивают со вторым сортом (нерекуррентное родительское растение), который имеет представляющий интерес ген, подлежащий переносу. Затем полученное потомство этого скрещивания вновь скрещивают с рекуррентным родительским растением, и этот процесс повторяют до тех пор, пока не получают растение, где по существу все из желаемых морфологических и физиологических характеристик рекуррентного растения не появятся в преобразованном растении, в дополнение к перенесенному гену из нерекуррентного родительского растения.
Сцепленные, прочно сцепленные и чрезвычайно прочно сцепленные: как используют в рамках изобретения, сцепление между генами или маркерами относится к явлению, когда гены или маркеры на хромосоме демонстрируют поддающуюся измерению вероятность совместной передачи особям следующего поколения. Чем ближе два гена или маркера друг к другу, тем ближе к (1) эта вероятность. Таким образом, термин "сцепленный" может относиться к одному или нескольким генам или маркерам, которые передаются совместно с геном с вероятностью более 0,5 (которая ожидается, исходя из независимого распределения, где маркеры/гены расположены на различных хромосомах). Поскольку близкое расположение двух генов или маркеров на хромосоме прямо связано с вероятностью того, что гены или маркеры будут передаваться совместно особям в следующем поколении, термин "сцепленный" также может относиться в настоящем описании к одному или нескольким генам или маркерам, которые расположены в пределах приблизительно 2,0 млн п.н. друг от друга на одной и той же хромосоме кукурузы. Таким образом, два "сцепленных" гена или маркера могут быть разделены приблизительно 2,1 млн п.н.; 2,00 млн п.н.; приблизительно 1,95 млн п.н.; приблизительно 1,90 млн п.н.; приблизительно 1,85 млн п.н.; приблизительно 1,80 млн п.н.; приблизительно 1,75 млн п.н.; приблизительно 1,70 млн п.н.; приблизительно 1,65 млн п.н.; приблизительно 1,60 млн п.н.; приблизительно 1,55 млн п.н.; приблизительно 1,50 млн п.н.; приблизительно 1,45 млн п.н.; приблизительно 1,40 млн п.н.; приблизительно 1,35 млн п.н.; приблизительно 1,30 млн п.н.; приблизительно 1,25 млн п.н.; приблизительно 1,20 млн п.н.; приблизительно 1,15 млн п.н.; приблизительно 1,10 млн п.н.; приблизительно 1,05 млн п.н.; приблизительно 1,00 млн п.н.; приблизительно 0,95 млн п.н.; приблизительно 0,90 млн п.н.; приблизительно 0,85 млн п.н.; приблизительно 0,80 млн п.н.; приблизительно 0,75 млн п.н.; приблизительно 0,70 млн п.н.; приблизительно 0,65 млн п.н.; приблизительно 0,60 млн п.н.; приблизительно 0,55 млн п.н.; приблизительно 0,50 млн п.н.; приблизительно 0,45 млн п.н.; приблизительно 0,40 млн п.н.; приблизительно 0,35 млн п.н.; приблизительно 0,30 млн п.н.; приблизительно 0,25 млн п.н.; приблизительно 0,20 млн п.н.; приблизительно 0,15 млн п.н.; приблизительно 0,10 млн п.н.; приблизительно 0,05 млн п.н.; приблизительно 0,025 млн п.н.; приблизительно 0,012 млн п.н.; и приблизительно 0,01 млн п.н. Конкретные примеры маркеров, которые "сцеплены" с Rf4, включают нуклеотидные последовательности в верхней части 8 хромосомы генома кукурузы, например, SEQ ID NO: 1-197; и маркеры, упоминаемые в настоящем описании как полиморфизмы ID №№ 1-106 (таблица 3).
Как используют в рамках изобретения, термин "прочно сцепленный" может относиться к одному или нескольким генам или маркерам, которые расположены в пределах приблизительно 0,5 млн п.н. друг от друга на одной и той же хромосоме кукурузы. Таким образом, два "прочно сцепленных" гена или маркера могут быть разделены приблизительно 0,6 млн п.н.; приблизительно 0,55 млн п.н.; 0,5 млн п.н.; приблизительно 0,45 млн п.н.; приблизительно 0,4 млн п.н.; приблизительно 0,35 млн п.н.; приблизительно 0,3 млн п.н.; приблизительно 0,25 млн п.н.; приблизительно 0,2 млн п.н.; приблизительно 0,15 млн п.н.; приблизительно 0,12 млн п.н.; приблизительно 0,1 млн п.н.; и приблизительно 0,05 млн п.н. Конкретные примеры маркеров, которые "прочно сцеплены" с Rf4, включают SEQ ID NO: 6-9; SEQ ID NO: 105; SEQ ID NO: 109; SEQ ID NO: 11; SEQ ID NO: 15; SEQ ID NO: 118-120; SEQ ID NO: 23; SEQ ID NO: 26; SEQ ID NO: 34; SEQ ID NO: 35; SEQ ID NO: 37; SEQ ID NO: 38; SEQ ID NO: 44; SEQ ID NO: 49; SEQ ID NO: 51; SEQ ID NO: 60; SEQ ID NO: 63; SEQ ID NO: 64; SEQ ID NO: 67; SEQ ID NO: 73; SEQ ID NO: 77; SEQ ID NO: 78; SEQ ID NO: 83; SEQ ID NO: 189-191; и SEQ ID NO: 97; и маркеры, упоминаемые в настоящем описании как полиморфизмы ID №№ 1-106 (таблица 3).
Как используют в рамках изобретения, термин "чрезвычайно прочно сцепленный" может относиться к одному или нескольким генам или маркерам, которые расположены в пределах приблизительно 100 т.п.н. друг от друга на одной и той же хромосоме кукурузы. Таким образом, два "чрезвычайно прочно связанных" гена или маркера могут быть разделены приблизительно 125 т.п.н.; приблизительно 120 т.п.н.; приблизительно 115 т.п.н.; приблизительно 110 т.п.н.; приблизительно 105 т.п.н.; 100 т.п.н.; приблизительно 95 т.п.н.; приблизительно 90 т.п.н.; приблизительно 85 т.п.н.; приблизительно 80 т.п.н.; приблизительно 75 т.п.н.; приблизительно 70 т.п.н.; приблизительно 65 т.п.н.; приблизительно 60 т.п.н.; приблизительно 55 т.п.н.; приблизительно 50 т.п.н.; приблизительно 45 т.п.н.; приблизительно 40 т.п.н.; приблизительно 35 т.п.н.; приблизительно 30 т.п.н.; приблизительно 25 т.п.н.; приблизительно 20 т.п.н.; приблизительно 15 т.п.н.; приблизительно 12 т.п.н.; приблизительно 10 т.п.н.; приблизительно 5 т.п.н.; и приблизительно 1 т.п.н. Конкретные примеры маркеров, которые "чрезвычайно прочно сцеплены" с Rf4, включают SEQ ID NO: 105; SEQ ID NO: 109; SEQ ID NO: 111; SEQ ID NO: 115; SEQ ID NO: 118-120; SEQ ID NO: 123; SEQ ID NO: 126; и SEQ ID NO: 134; и маркеры, упоминаемые в настоящем описании как полиморфизмы ID №№ 1-106 (таблица 3).
Сцепленные, прочно сцепленные и чрезвычайно прочно сцепленные генетические маркеры Rf4 могут быть пригодными в осуществляемых с помощью маркеров программах выведения для идентификации восстановителей для типов генов цитоплазматической мужской стерильности C-типа, и для выведения этого признака в сортах кукурузы.
Локус: как используют в рамках изобретения, термин "локус" относится к положению на геноме, который соответствует поддающейся измерению характеристике (например, признаку). Локус SNP определяют с помощью зонда, который гибридизуется с ДНК, находящейся в локусе.
Маркер: как используют в рамках изобретения, маркер относится к гену или нуклеотидной последовательности, которые можно использовать для идентификации растений, имеющих конкретный аллель, например, Rf4. Маркер может быть описан как изменение в данном геномном локусе. Генетический маркер может представлять собой короткую последовательность ДНК, такую как последовательность, окружающая изменение одной пары оснований (однонуклеотидный полиморфизм или "SNP"), или длинную последовательность, например, минисателлитный/простой повтор последовательности ("SSR"). "Маркерный аллель" относится к варианту маркера, который присутствует в конкретном растении.
Термин “маркер”, как используют в рамках изобретения, может относиться к клонированному сегменту хромосомной ДНК кукурузы (например, как определяют с помощью одной из SEQ ID NO: 1-197 или полиморфизмов ID №№ 1-106 (таблица 3)), и также может относиться или альтернативно относится к молекуле ДНК, которая комплементарна клонируемому сегменту хромосомной ДНК кукурузы (например, ДНК, комплементарная одной из SEQ ID NO: 1-197 или полиморфизмам ID №№ 1-106 (таблица 3)).
В некоторых вариантах осуществления присутствие маркера в растении можно выявлять с использованием зонда нуклеиновой кислоты. Зонд может представлять собой молекулу ДНК или молекулу РНК. РНК-зонды можно синтезировать с помощью средств, известных в данной области, например, с использованием молекулы ДНК-матрицы. Зонд может содержать всю или часть нуклеотидной последовательности маркера и дополнительную непрерывную нуклеотидную последовательность из генома кукурузы. Его называют в настоящем описании "непрерывным зондом". Дополнительную непрерывную нуклеотидную последовательность называют "вышележащей" или "нижележащей" относительно исходного маркера, в зависимости от того, расположена ли непрерывная нуклеотидная последовательность из хромосомы кукурузы на 5'- или 3'-стороне исходного маркера, как, в целом, понятно. Дополнительная непрерывная нуклеотидная последовательность может быть расположена между исходным маркером и областью размером 100 т.п.н. на 8 хромосоме генома кукурузы, которая расположена между положениями на карте 564922 и 601460. Таким образом, непрерывная нуклеотидная последовательность может быть расположена между исходным маркером и областью размером 12 т.п.н. на 8 хромосоме генома кукурузы, которая расположена между положениями на карте 86247 и 98188. Как общепризнано специалистами в данной области, способ получения дополнительной непрерывной нуклеотидной последовательности для включения в маркер, можно повторять практически без ограничений (он ограничен только длиной хромосомы), тем самым, идентифицируя дополнительные маркеры вдоль хромосомы кукурузы. Все из описанных выше маркеров можно использовать в некоторых вариантах осуществления настоящего изобретения.
Последовательность олигонуклеотидного зонда можно получать синтетически или путем клонирования. Подходящие клонирующие векторы хорошо известны специалистам в данной области. Олигонуклеотид может быть меченым или немеченым. Существует широкое множество способов мечения молекул нуклеиновых кислот, включая, например и не ограничиваясь ими: мечение радиоактивной меткой путем ник-трансляции; использование случайных праймеров; удлинение концов с помощью концевой дезокситрансферазы; или сходные с ними, где используемые нуклеотиды являются меченными, например, радиоактивным32P. Другие метки, которые можно использовать, включают, например и не ограничиваясь ими: флуорофоры; ферменты; субстраты ферментов; кофакторы ферментов; ингибиторы ферментов; и т.п. Альтернативно использование метки, которая обеспечивает поддающийся детекции сигнал, сама по себе или совместно с другими реакционноспособными веществами, можно заменять лигандами, с которыми связываются рецепторы, где рецепторы являются мечеными (например, описанными выше метками) для обеспечения поддающихся детекции сигналов, либо самостоятельно, либо совместно с другими реагентами. См., например, Leary et al. (1983) Proc. Natl. Acad. Sci. USA 80:4045-9.
Зонд может содержать нуклеотидную последовательность, которая не является непрерывной, для последовательности исходного маркера; этот зонд называют в настоящем описании "не являющимся непрерывным зондом". Последовательность не являющегося непрерывным зонда расположена достаточно близко к последовательности исходного маркера на геноме кукурузы, так что не являющийся непрерывным зонд является генетически сцепленным с тем же геном (например, Rf4). Например, в некоторых вариантах осуществления не являющийся непрерывным зонд может быть расположен в пределах 500 т.п.н.; 450 т.п.н.; 400 т.п.н.; 350 т.п.н.; 300 т.п.н.; 250 т.п.н.; 200 т.п.н.; 150 т.п.н.; 125 т.п.н.; 120 т.п.н.; 100 т.п.н.; 0,9 т.п.н.; 0,8 т.п.н.; 0,7 т.п.н.; 0,6 т.п.н.; 0,5 т.п.н.; 0,4 т.п.н.; 0,3 т.п.н.; 0,2 т.п.н.; или 0,1 т.п.н. от исходного маркера в геноме кукурузы.
Зонд может быть точной копией маркера, подлежащего выявлению. Зонд также может представлять собой молекулу нуклеиновой кислоты, содержащую, или состоящий из, нуклеотидную последовательность, которая по существу идентична клонированному сегменту хромосомной ДНК кукурузы (например, как определено в SEQ ID NO: 1-197 и полиморфизмах ID №№ 1-106 (таблица 3)). Как используют в рамках изобретения, термин "по существу идентичный" может относиться к нуклеотидным последовательностям, которые являются более чем на 85% идентичными. Например, по существу идентичная нуклеотидная последовательность может быть на 85,5%; 86%; 87%; 88%; 89%; 90%; 91%; 92%; 93%; 94%; 95%; 96%; 97%; 98%; 99%, или 99,5% идентична эталонной последовательности.
Зонд также может представлять собой молекулу нуклеиновой кислоты, которая является "специфично гибридизующейся" или "специфично комплементарной" точной копии маркера, подлежащего выявлению ("ДНК-мишень"). "Специфично гибридизующийся" и "специфично комплементарный" являются терминами, которые указывают на достаточную степень комплементарности, чтобы происходило стабильное и специфичное связывание между молекулой нуклеиновой кислоты и ДНК-мишенью. Молекула нуклеиновой кислоты не должна быть на 100% комплементарна ее последовательности-мишени, чтобы быть специфично гибридизующейся. Молекула нуклеиновой кислоты является специфично гибридизующейся, когда существует достаточная степень комплементарности, чтобы избежать неспецифического связывания нуклеиновой кислоты с не являющимися мишенями последовательностями в условиях, где специфичное связывание является желательным, например, в жестких условиях гибридизации.
Условия гибридизации, обеспечивающие конкретную степень жесткости, варьируют, в зависимости от выбранного способа гибридизации и композиции и длины гибридизующихся последовательностей нуклеиновых кислот. Как правило, температура гибридизации и ионная сила (особенно концентрация Na+ и/или Mg2+) буфера для гибридизации определяют жесткость гибридизации, хотя время промывания также влияет на жесткость. Вычисления, касающиеся условий гибридизации, требуемых для достижения конкретной степени жесткости, известны средним специалистам в данной области, и рассмотрены, например, в Sambrook et al. (ed.) Molecular Cloning: A Laboratory Manual, 2nd ed., vol. 1-3, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989, chapters 9 и 11; и Hames and Higgins (eds.) Nucleic Acid Hybridization, IRL Press, Oxford, 1985. Дальнейшая детальная инструкция и руководство, касающиеся гибридизации нуклеиновых кислот, могут быть найдены, например, в Tijssen, "Overview of principles of hybridization and the strategy of nucleic acid probe assays", Laboratory Techniques in Biochemistry and Molecular Biology-Hybridization with Nucleic Acid Probes, Part I, Chapter 2, Elsevier, NY, 1993; и Ausubel et ah, Eds., Current Protocols in Molecular Biology, Chapter 2, Greene Publishing and Wiley-Interscience, NY, 1995.
Как используют в рамках изобретения, "жесткие условия" охватывают условия, в которых гибридизация происходит, только если существует менее чем 25% несоответствие оснований между гибридизующейся молекулой ДНК-мишенью. "Условия жесткости" включают другие конкретные уровни жесткости. Таким образом, как используют в рамках изобретения, условия "умеренной жесткости" представляют собой условия, в которых молекулы с более чем 25% несоответствием последовательностей не будут гибридизоваться; условия "средней жесткости" представляют собой условия, в которых молекулы с более чем 15% несоответствием не будут гибридизоваться; и условия "высокой жесткости" представляют собой условия, в которых последовательности с более чем 10% несоответствием оснований не будут гибридизоваться. Условия "очень высокой жесткости" представляют собой условия, в которых последовательности с более чем 6% несоответствием не будут гибридизоваться.
В конкретных вариантах осуществления жесткие условия представляют собой гибридизацию при 65°C в 6× солевом натрий-цитратном буфере (SSC), 5× растворе Денхардта, 0,5% SDS и 100 г расщепленной ДНК семенников лосося, с последующими последовательными промываниями в течение 15-30 минут при 65°C в 2× буфере SSC и 0,5% SDS, а затем 1× буфере SSC и 0,5% SDS, и наконец, в 0,2× буфере SSC и 0,5% SDS.
Что касается всех рассмотренных выше зондов, зонд может содержать дополнительные последовательности нуклеиновых кислот, например, промоторы; сигналы транскрипции и/или последовательности векторов. Любой из рассмотренных выше зондов можно использовать для определения дополнительных маркеров, которые прочно сцеплены с геном, вовлеченным в восстановление фертильности кукурузы с цитоплазматической стерильностью C-типа (например, Rf4). Маркеры, идентифицированные таким образом, могут быть эквивалентными иллюстративным маркерам, указанным в настоящем описании и, таким образом, они находятся в объеме изобретения.
Выведение с помощью маркера: как используют в рамках изобретения, термин "выведение с помощью маркера" может относиться к подходу для выведения непосредственно одного или нескольких комплексных признаков (например, восстановитель фертильности CMS-C). В существующей практике, растениеводы предпринимают попытки к идентификации легко выявляемых признаков, таких как цвет цветка, вид оболочки семян, или варианты изоферментов, которые сцеплены с желаемым с сельскохозяйственной точки зрения признаком. Затем растениеводы наблюдают сельскохозяйственный признак в сегрегирующих выводимых популяциях путем наблюдения за сегрегацией легко выявляемого признака. Однако при выведении растений доступно очень мало из этих взаимосвязей сцепления.
Выведение с помощью маркеров обеспечивает экономичный по времени и затратам способ улучшения сортов растений. Несколько примеров применения выведения с помощью маркеров вовлекают использование маркеров изоферментов. См., например, Tanksley and Orton, eds. (1983) Isozymes in Plant Breeding and Genetics, Amsterdam: Elsevier. Одним примером является маркер изофермента, ассоциированный с геном устойчивости к нематодным паразитам в томате. Признак устойчивости, контролируемый геном, обозначаемым Mi, локализован на 6 хромосоме томата и очень прочно сцеплен с Aps1, изоферментом кислой фосфатазы. Использование маркера изофермента Aps1 для непрямой селекции по гену Mi обеспечило то преимущество, что сегрегацию в популяции стало возможно однозначно определять с помощью электрофоретических способов; маркер изофермента можно оценивать в ткани рассады, устраняя необходимость в поддержании растений до взрослого состояния; и кодоминантность аллелей маркера изофермента позволяет различение между гомозиготами и гетерозиготами. См. Rick (1983) в Tanksley and Orton, выше.
Функционально связанный: первая нуклеотидная последовательность функционально связана со второй последовательностью нуклеиновой кислоты, когда первая последовательность нуклеиновой кислоты находится в функциональной взаимосвязи со второй последовательностью нуклеиновой кислоты. Например, промотор функционально связан с кодирующей последовательностью, если промотор влияет на транскрипцию или экспрессию кодирующей последовательности. При рекомбинантной продукции, функционально связанные последовательности нуклеиновых кислот, как правило, являются непрерывными, и, когда это необходимо, объединяют две кодирующих белок области в одной рамке считывания (например, в полицистронной ORF). Однако нуклеиновые кислоты не должны быть соседними, чтобы быть функционально связанными.
Промотор: как используют в рамках изобретения, термин "промотор" относится к области ДНК, которая может лежать выше точки начала транскрипции, и которая может быть вовлечена в распознавание и связывание РНК-полимеразы и других белков для инициации транскрипции. Промотор может быть функционально связан с геном для экспрессии в клетке, или промотор может быть функционально связан с нуклеотидной последовательностью, кодирующей сигнальную последовательность, которая может быть функционально связана с геном, для экспрессии в клетке. "Промотор растений" может представлять собой промотор, способный инициировать транскрипцию в клетках растений. Примеры промоторов, находящихся контролем стадии развития, включают промоторы, которые предпочтительно инициируют транскрипцию в определенных тканях, таких как листья, корни, семена, волокна, сосудах ксилемы, трахеидах или склеренхиме. Такие промоторы обозначают как "предпочтительные для тканей". Промоторы, которые инициируют транскрипцию только в определенных тканях, называют "тканеспецифическими". "Специфичный к типу клеток" промотор, главным образом, запускает экспрессию в определенных типах клеток в одном или нескольких органах, например, сосудистых клетках в корнях или листьях. "Индуцируемый" промотор может представлять собой промотор, который может находиться под контролем условий окружающей среды. Примеры условий окружающей среды, которые могут инициировать транскрипцию с помощью индуцибельных промоторов, включают анаэробные условия или присутствие света. Тканеспецифические, предпочтительные для тканей, специфичные к типу клеток и индуцибельные промоторы составляют класс "неконститутивных" промоторов. "Конститутивный" промотор представляет собой промотор, который может быть активным в большинстве условий окружающей среды.
В некоторых вариантах осуществления настоящего изобретения можно использовать любой индуцибельный промотор. См. Ward et al. (1993) Plant Mol. Biol. 22:361-366. В случае индуцибельного промотора скорость транскрипции возрастает в ответ на индуцирующий агент. Иллюстративные индуцибельные промоторы включают, но не ограничиваются ими: промоторы системы ACEI, которые отвечают на медь; ген In2 из кукурузы, который отвечает на антидоты для бензолсульфонамидных гербицидов; репрессор Tet из Tn10; и индуцибельный промотор из гена стероидного гормона, транскрипционную активность которого может индуцировать глюкокортикостероидный гормон (Schena et al. (1991) Proc. Natl. Acad. Sci. USA 88:0421).
Иллюстративные конститутивные промоторы включают, но не ограничиваются ими: промоторы из вирусов растений, такие как промотор 35S из CaMV; промоторы из генов актина риса; промоторы убиквитина; pEMU; MAS; промотор гистона H3 кукурузы; и промотор ALS, фрагмент XbaI/NcoI, находящийся с 5'-стороны от структурного гена ALS3 Brassica napus (или нуклеотидная последовательность, сходная с указанным фрагментом XbaI/NcoI) (международная заявка PCT WO 96/30530).
Любой тканеспецифический или предпочтительный для ткани промотор также можно использовать в некоторых вариантах осуществления настоящего изобретения. Растения, трансформированные геном, функционально связанным с тканеспецифическим промотором, могут продуцировать белковый продукт трансгена исключительно, или предпочтительно, в конкретной ткани. Иллюстративные тканеспецифические или предпочтительные для тканей промоторы включают, но не ограничиваются ими: предпочтительный для корней промотор, такой как промотор из гена фазеолина; специфичный для листьев и индуцируемый светом промотор, такой как промотор из cab или rubisco; специфичный для пыльника промотор, такой как промотор из LAT52; специфичный для пыльцы промотор, такой как промотор из Zm13; и предпочтительный для микроспор промотор, такой как промотор из apg.
Идентичность последовательностей: термин "идентичность последовательностей" или "идентичность", как используют в рамках изобретения в контексте двух последовательностей нуклеиновых кислот или полипептидов, может относиться к остаткам в двух последовательностях, которые являются одинаковыми при выравнивании на максимальное соответствие на протяжении определенного окна сравнения.
Когда процент идентичности последовательностей используют в отношении белков, является общепризнанным, что остатки, которые не являются идентичными, часто отличаются посредством консервативных аминокислотных замен, где аминокислотные остатки замещают другие аминокислотные остатки со сходными химическими свойствами (например, заряд, гидрофобность или пространственные эффекты), и, таким образом, не изменяют функциональных свойств молекулы.
Таким образом, когда последовательности отличаются консервативными заменами, процентная идентичность последовательностей может быть скорректирована в направлении увеличения для поправки на консервативную природу замены в области неидентичного остатка. Последовательности, которые отличаются такими консервативными заменами, называют имеющими "сходство последовательностей" или "сходство". Способы осуществления этой коррекции хорошо известны средним специалистам в данной области. Как правило, такие способы вовлекают оценку консервативной замены как частичное, а не полное, несоответствие, тем самым увеличивая процентную идентичность последовательностей. Например, когда идентичной аминокислоте присваивается показатель от 0 до 1, и неконсервативной замене присваивается показатель 0, консервативной замене присваивается показатель от 0 до 1. Оценку консервативных замен можно проводить, например, как осуществлено в программе PC/GENE (Intelligenetics, Mountain View, CA).
Как используют в рамках изобретения, термин "процент идентичности последовательностей" может относиться к величине, определяемой путем сравнения двух оптимально выровненных последовательностей на протяжении окна сравнения, где часть последовательности в окне сравнения может содержать вставки или делеции (т.е. пропуски) по сравнению с эталонной последовательностью (которая не содержит вставки или делеции) для оптимального выравнивания двух последовательностей. Процент вычисляют путем определения количества положений, в которых идентичный нуклеотидный или аминокислотный остаток встречается в обеих последовательностях, с получением соответствующих друг другу положений, деления количества соответствующих друг другу положений на общее число положений в окне сравнения, и умножения результата на 100 с получением процента идентичности последовательностей.
Однонуклеотидный полиморфизм (SNP): как используют в рамках изобретения, термин "однонуклеотидный полиморфизм" может относиться к варьированию последовательности ДНК, возникающему, когда отдельный нуклеотид в геноме (или другой общей последовательности) отличается между представителями вида или парными хромосомами индивидуума.
В популяции SNP может быть приписана частота редкого аллеля - наиболее низкая аллельная частота в локусе, которую наблюдают в конкретной популяции. Она представляет собой просто наименьшую из двух аллельных частот однонуклеотидных полиморфизмов. Существует варьирование между популяциями человека, так что аллель SNP, который является распространенным в одной географической или этнической группе, может быть значительно более редким в другой.
Однонуклеотидные полиморфизмы могут находиться в кодирующих последовательностях генов, некодирующих областях генов, или в межгенных областях между генами. SNP в кодирующей последовательность необязательно изменяет аминокислотную последовательность белка, который продуцируется, вследствие вырожденности генетического кода. SNP, в котором обе формы приводят к одной и той же полипептидной последовательности, называют "синонимическими" (иногда называемыми молчащей мутацией). Если продуцируется отличающаяся полипептидная последовательность, ее называют "несинонимической". Несинонимическая замена может представлять собой либо миссенс-замену, либо нонсенс-замену, где миссенс-замена приводит к отличающейся аминокислоте, а нонсенс-замена приводит к преждевременному стоп-кодону. SNP, которые не являются кодирующими белок областями, тем не менее, могут иметь последствия для сплайсинга генов, связывания факторов транскрипции или последовательности некодирующей РНК. SNP обычно являются биаллельными и, таким образом, их легко анализировать в растениях и животных. Sachidanandam (2001) Nature 409:928-33.
InDel: как используют в рамках изобретения, термин "InDel" используют, главным образом, для описания инсерции или делеции в гене. Таким образом, "InDel" просто относится к конкретной мутации, которая может представлять собой либо инсерцию, либо делецию, либо их комбинацию.
Признак или фенотип: термины "признак" и "фенотип" используют в настоящем описании взаимозаменяемо. Для целей настоящего изобретения представляющим особый интерес признаком является восстановление фертильности CMS C-типа.
III. Ген-восстановитель CMS-C кукурузы Rf4 и его молекулярные маркеры
Предусматриваются молекулярные маркеры, которые сцеплены (например, прочно сцеплены) с геном-восстановителем CMS-C кукурузы Rf4. Идентифицированы сегменты ДНК, содержащие последовательности, вовлеченные в восстановление фертильности растений CMS-C. Эти сегменты расположены между маркерами, которые сцеплены (например, прочно сцеплены) с геном Rf4. Таким образом, также предусмотрены молекулы нуклеиновых кислот, содержащие ген Rf4. Идентифицированные сегменты и их маркеры описаны в настоящем описании, частично по их положению в конкретной области в верхней части хромосомы 8 кукурузы.
Положение идентифицированных сегментов и их маркеров, когда его выражают в качестве частот рекомбинации или единиц картирования, предусмотрено в настоящем описании в качестве общей информации. Варианты осуществления, описанные в настоящем описании, осуществляли в популяции кукурузы BE4207×XJH58. Однако положения конкретных сегментов и маркеров в качестве единиц маркеров выражены в отношении общедоступной геномной последовательности инбредного растения кукурузы B73 (B73 RefGen v1 или v2), которая может быть найдена во всемирной сети на www2.genome.arizona.edu/genomes/maize, или ftp.maizesequence.org/current/assembly/. Последовательности генов сортов кукурузы BE4207 и XJH58 еще недоступны. Ожидается, что числа, приведенные для конкретных сегментов и маркеров в качестве единиц картирования, могут варьировать от культивара к культивару и не являются частью основного определения сегментов и маркеров ДНК, и эти сегменты и маркеры ДНК иным образом описывают, например, по нуклеотидной последовательности.
Доминантный аллель гена Rf4 контролирует восстановление фертильности в системе CMS-C/Rf4. В вариантах осуществления ген Rf4 определяют как ген, выбранный из группы, состоящей из GRMZM2G122853 (SEQ ID NO: 198); AC187051.4_FG005 (SEQ ID NO: 199); GRMZM2G122851 (SEQ ID NO: 200); GRMZM2G122850 (SEQ ID NO: 201); GRMZM2G582028 (SEQ ID NO: 202); GRMZM2G021276 (SEQ ID NO: 203); GRMZM2G381376 (SEQ ID NO: 204); GRMZM2G081127 (SEQ ID NO: 205); GRMZM2G085111 (SEQ ID NO: 206); GRMZM2G085038 (SEQ ID NO: 207); GRMZM2G317468 (SEQ ID NO: 208); GRMZM2G328030 (SEQ ID NO: 209); GRMZM2G029450 (SEQ ID NO: 210); и GRMZM2G077212 (SEQ ID NO: 211). В конкретных вариантах осуществления ген Rf4 представляет собой Rf4-bHLH (SEQ ID NO: 203). Например, ген Rf4-bHLH представлен в SEQ ID NO: 220.
В некоторых вариантах осуществления изобретение также включает нуклеотидные последовательности, которые по существу идентичны Rf4-bHLH. Например, в некоторых вариантах осуществления молекула нуклеиновой кислоты представляет собой гомолог Rf4, который по меньшей мере приблизительно на 85% идентичен Rf4-bHLH. Гомолог Rf4 может быть на 86%; 87%; 88%; 89%; 90%; 91%; 92%; 93%; 94%; 95%; 96%; 97%; 98%; 99%, или 99,5% идентичен Rf4-bHLH. Такой гомолог Rf4 можно легко идентифицировать и выделять из полных или частичных генов, легкодоступных специалистам в данной области для множества организмов.
Некоторые варианты осуществления также включают функциональные варианты гена Rf4. Функциональные варианты Rf4 включают, например, последовательность Rf4-bHLH, содержащую одну или несколько нуклеотидных замен, делеций или вставок, где функциональный вариант восстанавливает мужскую фертильность в кукурузе CMS-C, как можно определять общепринятыми способами, хорошо известными специалистам в данной области. Например, способность конкретного варианта гена Rf4 восстанавливать мужскую фертильность кукурузы CMS-C можно определять путем общепринятого внесения мутации или фрагмента в растения, гомозиготные по стерильному аллелю rf4, с последующим стандартным наблюдением растений в отношении мужской стерильности. Функциональные варианты гена Rf4 можно создавать с помощью сайт-направленного мутагенеза, индуцируемой мутации или они могут встречаться в качестве аллельных вариантов (полиморфизмы, например, SNP). В конкретных примерах функциональный вариант Rf4 представляет собой последовательность Rf4-bHLH, содержащую одну или несколько нуклеотидных замен, делеций или вставок, так что вариант кодирует полипептид Rf4-bHLH, содержащий гидрофобную аминокислотную замену (например, Phe) для Y186 в домене bHLH.
Таким образом, в некоторых вариантах осуществления функциональные варианты гена Rf4 могут представлять собой мутации Rf4, или фрагменты, меньшие, чем полная последовательность Rf4, которые сохраняют свойства контроля мужской стерильности гена Rf4. Такие мутации и фрагменты, таким образом, считаются находящимися в объеме изобретения. Ввиду настоящего описания, специалист в данной области может легко определить, сохраняет ли мутация или фрагмент последовательности Rf4, указанной в настоящем описании, свойства гена Rf4.
В некоторых вариантах осуществления изобретение также включает полипептиды Rf4-bHLH (например, SEQ ID NO: 225) и полипептиды, которые по существу идентичны Rf4-bHLH. Например, в некоторых вариантах осуществления полипептид, который по существу идентичен Rf4-bHLH, может быть по меньшей мере приблизительно на 25% идентичен Rf4-bHLH и имеет гидрофобный аминокислотный остаток (например, Phe) в положении, соответствующем F187 SEQ ID NO: 225, при определении с помощью выравнивания последовательностей. В некоторых вариантах осуществления полипептид, который по существу идентичен Rf4-bHLH, может быть на 86%; 87%; 88%; 89%; 90%; 91%; 92%; 93%; 94%; 95%; 96%; 97%; 98%; 99%, или 99,5% идентичен Rf4-bHLH. Такие полипептиды, которые по существу идентичны Rf4-bHLH, можно легко идентифицировать и установить из полных или частичных геномов или библиотек кДНК, свободно доступных специалистам в данной области для множества организмов.
IV. Способы использования гена Rf4
Ген Rf4, описанный в настоящем описании, можно использовать в любом из множества способов, известных специалисту в данной области, для манипуляции геном, чтобы обеспечить желаемый эффект. Например и не ограничиваясь этим, ген Rf4 можно использовать для: внесения мутантной последовательности Rf4 в растение для обеспечения стерильности; внесения мутации в нативную последовательность Rf4; внесения антисмысловой молекулы нуклеиновой кислоты, нацеленной на ДНК или РНК Rf4, в растение для влияния на фертильность; использования образования шпилек; или связывания последовательности(ей) Rf4 с другими последовательностями нуклеиновой кислоты для контроля экспрессии продукта гена Rf4.
Например, в некоторых вариантах осуществления ген Rf4, определенный как выбранный из группы, состоящей из GRMZM2G122853 (SEQ ID NO: 198); AC187051.4_FG005 (SEQ ID NO: 199); GRMZM2G122851 (SEQ ID NO: 200); GRMZM2G122850 (SEQ ID NO: 201); GRMZM2G582028 (SEQ ID NO: 202); GRMZM2G021276 (SEQ ID NO: 203); GRMZM2G381376 (SEQ ID NO: 204); GRMZM2G081127 (SEQ ID NO: 205); GRZM2G085111 (SEQ ID NO: 206); GRMZM2G085038 (SEQ ID NO: 207); GRMZM2G317468 (SEQ ID NO: 208); GRMZM2G328030 (SEQ ID NO: 209); GRMZM2G029450 (SEQ ID NO: 210); и GRMZM2G077212 (SEQ ID NO: 211) можно использовать для облегчения использования системы мужской фертильности CMS-C/Rf4 совместно с другими генами или мутантами, влияющими на мужскую фертильность в кукурузе. Например, в конкретных вариантах осуществления ген Rf4-bHLH можно использовать для облегчения использования системы мужской фертильности CMS-C/Rf4 совместно с другими генами или мутантами, влияющими на мужскую фертильность в кукурузе.
В некоторых вариантах осуществления ген Rf4 можно вносить в растение кукурузы, которое является пригодным для применения в системе мужской фертильности, отличной от системы мужской фертильности CMS-C/Rf4. Альтернативно ген или мутантный ген, отличный от Rf4, можно вносить в растение кукурузы, которое пригодно для применения в системе мужской фертильности CMS-C/Rf4, так чтобы внесенный ген или мутантный ген можно было использовать для обеспечения дополнительного или дополняющего контроля фертильности. Конкретные примеры других генов мужской фертильности и мутаций в кукурузе включают: CMS-T/Rf1; CMS-T/Rf2; CMS-S/Rf2; ms1 (Singleton and Jones (1930) J. Hered. 21: 266-8); ms2 и ms3 (Eyster (1931) J. Hered. 22:99-102); ms5, ms7, ms8, ms9, ms10, ms11, ms12, ms13 и ms14 (Beadle (1932) Genetics 17:413-31); ms17 (Emerson (1932) Science 75:566); ms20 (Eyster (1934) Bibliographia Genetica 11:187-392); ms23 и ms24 (West and Albertsen (1985) MNL 59:87); ms25 и ms26 (Loukides et al. (1995) Am. J. Bot. 82:1017-23); ms27 и ms38 (Albertsen et al. (1996) MNL 70:30-1); ms28 (Golubovskaya (1979) MNL 53:66-70); ms29 и ms31 (Trimnell et al. (1998) MNL 72:37-38); ms30 (Albertsen et al. (1999) MNL 73:48); ms32, ms36 и ms37 (Trimnell et al. (1999) MNL 73:48-50); ms33 и ms34 (Patterson (1995) MNL 69:126-8); ms43 (Golubovskaya (1979) Int. Rev. Cytol. 58:247-90); ms45 (Albertsen et al. (1993) Proc. Annu. Corn Sorghum Ind. Res. Conf. 48:224-33) и ms48, ms49 и ms50 (Trimnell et al. (2002) MNL 76:38-9).
Когда последовательность нуклеиновой кислоты (например, Rf4) "вводят" в организм, такой как растение, способ или методология, используемые для введения молекулы нуклеиновой кислоты, содержащей конкретную последовательность, не являются существенными для изобретения, и его можно проводить с помощью любого способа или методологии, известных специалистам в данной области. Например, молекулу нуклеиновой кислоты можно вводить способами прямой трансформации, такими как опосредуемая Agrobacterium трансформация ткани растений; бомбардировка микроснарядами; электропорация; и т.д. Альтернативно молекулу нуклеиновой кислоты можно вводить путем скрещивания растения, имеющего конкретную нуклеотидную последовательность, с другим растением, так чтобы потомство имело нуклеотидную последовательность, включенную в их геном. Такие способы выведения хорошо известны специалисту в данной области. Способы выведения с помощью маркера, как описано в настоящем описании, могут значительно облегчать включение Rf4 путем таких скрещиваний.
В вариантах осуществления, где ген Rf4 вводят в организм, может быть желательным введение гена Rf4 таким образом, чтобы ген Rf4 был функционально связан с одной или несколькими регуляторными последовательностями, например, введение с использованием плазмиды, содержащей ген Rf4, функционально связанный с желаемыми регуляторными последовательностями. Регуляторные последовательности, пригодные для экспрессии гетерологичных последовательностей нуклеиновых кислот, хорошо известны в данной области, и включают, например и не ограничиваясь ими: промоторы (например, конститутивные промоторы; тканеспецифические промоторы; и специфические для стадии развития промоторы); последовательности терминации; энхансерные последовательности; последовательности субклеточного нацеливания; стабилизирующие или лидерные последовательности; и интроны.
В некоторых вариантах осуществления ген Rf4 можно вводить в организм с одной или несколькими дополнительными желаемыми последовательностями нуклеиновых кислот (например, генами). Дополнительные желаемые последовательности нуклеиновых кислот могут включать, например: гены, кодирующие чужеродные белки; агрономические гены; гены устойчивости к заболеваниям растений; гены, придающие устойчивость к паразитам растений; гены, придающие устойчивость к гербицидам; и гены, которые придают или вносят вклад в признак, являющийся положительным дополнением (например, модифицированный метаболизм жирных кислот; сниженное содержание фитатов; и модифицированный углеводный состав). Примеры всех из вышеупомянутых последовательностей нуклеиновых кислот известны специалистам в данной области.
Ген Rf4 также можно вводить в организм с одним или несколькими маркерными генами, функционально связанными с регуляторным элементом (например, промотором), который позволяет выделение трансформированных клеток, содержащих маркер, либо с помощью отрицательной селекции (т.е. ингибирования роста клеток, которые не содержат ген селективного маркера), либо с помощью положительной селекции (т.е. скрининга на продукт, кодируемый генетическим маркером). Многие гены селективных маркеров для трансформации хорошо известны в данной области и включают, например, гены, которые кодируют ферменты, которые осуществляют метаболическую детоксикацию селективного химического агента, который может представлять собой антибиотик или гербицид, или гены, которые кодируют измененную мишень, которая может быть нечувствительной к ингибитору. В данной области также известно Несколько способов положительной селекции. Примеры маркерных генов, пригодных для применения в клетках растений, могут включать, например и не ограничиваясь ими: ген неомицинфосфотрансферазы II (nptII) (Fraley et al. (1983) Proc. Natl. Acad. Sci. USA 80:4803); ген гигромицинфосфотрансферазы (Vanden Elzen et al. (1985) Plant Mol. Biol. 5:299); ген гентамицинацетилтрансферазы, ген стрептомицинфосфотрансферазы, аминогликозид-3'-аденилтрансферазы, и ген, определяющий устойчивость к блеомицину (см., например, Hayford et al. (1988) Plant Physiol. 86:1216; Jones et al. (1987) Mol. Gen. Genet. 210:86); Svab et al. (1990) Plant Mol. Biol. 14:197; и Hille et al. (1986) Plant Mol. Biol. 7:171); гены селективных маркеров, которые придают устойчивость к гербицидам, таким как глифосат, глюфосинат или бромксинил (см., например, Comai et al. (1985) Nature 317:741-744; Gordon-Kamm et al. (1990) Plant Cell 2:603-618; и Stalker et al. (1988) Science 242:419-423); ген дигидрофолатредуктазы мыши (Eichholtz et al. (1987) Somatic Cell Mol. Genet. 13:67); ген 5-енолпирувилшикимат-3-фосфатсинтетазы растений (Shah et al. (1986) Science 233:478); ген ацетолактатсинтетазы растений (Charest et al. (1990) Plant Cell Rep. 8:643).
Для другого класса маркерных генов, пригодных для трансформации растений, используется скрининг предположительно трансформированных клеток-растений, а не прямая генетическая селекция трансформированных клеток в отношении устойчивости к токсическому веществу, такому как антибиотик. Эти гены особенно пригодны для количественного определения или визуализации пространственного характера экспрессии гена в конкретных тканях, и их часто называют "репортерными генами", поскольку они могут быть слиты с геном или регуляторной последовательностью гена для исследования экспрессии гена. Широко используемые гены для скрининга трансформированных клеток включают ген β-глюкуронидазы (GUS), β-галактозидазы, люциферазы и хлорамфениколацетилтрансферазы. См., например, Jefferson (1987) Plant Mol. Biol. Rep. 5:387; Teeri et al. (1989) EMBO J. 8:343; Koncz et al. (1987) Proc. Natl. Acad. Sci U.S.A. 84:131; и DeBlock et al (1984) EMBO J. 3: 1681.
Недавно стали более доступными способы для визуализации активности GUS in vivo, которые не требуют разрушения ткани растений. Molecular Probes publication 2908, Imagene Green.TM., p. 1-4, 1993; и Naleway et al. (1991) J. Cell Biol. 115: 151a. Кроме того, гены, кодирующие флуоресцентные белки (например, GFP, EGFP, EBFP, ECFP и YFP) используют в качестве маркеров для экспрессии генов в прокариотических и эукариотических клетках. См. Chalfie et al. (1994) Science 263:802. В качестве маркеров для скрининга можно использовать флуоресцентные белки и мутации флуоресцентных белков.
В некоторых вариантах осуществления ген Rf4 кукурузы и фрагменты или сегменты гена Rf4 кукурузы, описанные в настоящем описании, можно использовать для идентификации гомологичных последовательностей Rf4 из организмов, отличных от кукурузы (например, путем сравнения последовательностей). Последовательности из организмов, отличных от кукурузы, которые являются гомологичными гену Rf4 кукурузы, можно идентифицировать и выделять хорошо известными способами, например, на основе их гомологии последовательности с Rf4-bHLH. Например, всю кодирующую последовательность Rf4-bHLH или ее часть можно использовать в качестве зонда, который специфично гибридизуется с другими последовательностями, присутствующими в совокупности клонированных фрагментов геномной ДНК (т.е. геномной библиотеке) из организма в соответствии со стандартными способами. Таким образом, в некоторых вариантах осуществления изобретение включает нуклеотидные последовательности, которые специфично гибридизуются с последовательностью Rf4-bHLH (например, SEQ ID NO: 220).
Альтернативно последовательности из организмов, отличных от кукурузы, которые гомологичны гену Rf4 кукурузы, можно идентифицировать и выделять путем сравнения последовательностей. Например, можно проводить поиск в полностью или частично отсеквенированном геноме организма в соответствии со стандартными способами с помощью последовательности Rf4-bHLH кукурузы (например, SEQ ID NO: 220) для идентификации генов в геноме организма, которые обладают высокой степенью идентичностью последовательности с Rf4 кукурузы, и, таким образом, вероятно являются гомологами Rf4.
Например, всю последовательность Rf4 кукурузы или ее часть (например, SEQ ID NO: 220) можно использовать в качестве "эталонной последовательности". Как правило, последовательности нуклеиновых кислот (например, клонированные или геномные фрагменты ДНК геномной библиотеки), которые сравнивают с эталонной последовательностью, включают "окно сравнения", которое представляет собой определенный непрерывный сегмент последовательности нуклеиновой кислоты. Окно сравнения может включать вставки или делеции (т.е. пропуски) по сравнению с эталонной последовательностью (которая не содержит вставок или делеций) для оптимального выравнивания двух последовательностей. Окно сравнения, как правило, имеет длину по меньшей мере 20 последовательно расположенных нуклеотидов, однако оно может иметь длину 30, 40, 50, 100 или 200 нуклеотидов или более. Для избежания высокого сходства с эталонной последовательностью вследствие включения делеций в окно сравнения полинуклеотидных последовательностей, может быть внесен "штраф за делецию", чтобы его вычитать из количества соответствующих друг другу нуклеотидов.
Способы выравнивания последовательностей для сравнения хорошо известны в данной области. Определение процентной идентичности последовательностей между любыми двумя последовательностями можно проводить с использованием доступных математических алгоритмов. Неограничивающими примерами таких математических алгоритмов являются алгоритм Myers and Miller (1988), CABIOS 4:11-7; алгоритм локального выравнивания Smith et al. (1981) Adv. Appl. Math. 2:482; алгоритм общего выравнивания Needleman and Wunsch (1970), J. Mol. Biol. 48:443-53; способ поиска для локального выравнивания Pearson and Lipman (1988), Proc. Natl. Acad. Sci. USA 85:2444-8; алгоритм Karlin and Altschul (1990), Proc. Natl. Acad. Sci. USA 87:2264, и Karlin and Altschul (1993) Proc. Natl. Acad. Sci. USA 90:5873-7.
Специалист в данной области может осуществлять эти математические алгоритмы на компьютере для сравнения последовательностей в целях определения идентичности последовательностей, или в целях поиска в базе данных, содержащей множество последовательностей (например, база данных геномов организмов) в зависимости от идентичности последовательности с эталонной последовательностью. Такие осуществления включают, но не ограничиваются ими, CLUSTAL в программе PC/Gene (Intelligenetics, Mountain View, CA); и программу ALIGN и GAP, BESTFIT, BLAST, FASTA и TFASTA в GCG Wisconsin Genetics Software Package, v.10 (Accelrys Inc., San Diego, CA). Выравнивание последовательностей с использованием этих программ можно проводить, используя их параметры по умолчанию. Альтернативно может быть желательной модификация параметров по умолчанию при некоторых поисках (например, изменение величины штрафа за делецию). Выбор конкретного компьютерного осуществления математических алгоритмов для вычисления идентичности последовательностей и выбор величин параметров для применения в выбранном алгоритме находятся на усмотрении специалиста в данной области.
В некоторых вариантах осуществления систему CMS-C/Rf4 для получения гибридных семян можно включать способами инженерии в сорт кукурузы, лишенный функционального гена-восстановителя Rf4, или вид растений, отличный от кукурузы, например, путем введения гена Rf4 в такой сорт кукурузы или вид растений.
Таким образом, в соответствии с некоторыми вариантами осуществления, ген Rf4, описанный в настоящем описании, можно использовать в способе получения гибридных семян. Способ получения гибридных семян может включать получение молекулы нуклеиновой кислоты, содержащей последовательность Rf4-bHLH кукурузы (например, SEQ ID NO: 220), или нуклеотидную последовательность, которая специфично гибридизуется с последовательностью Rf4-bHLH кукурузы. Затем эту молекулу нуклеиновой кислоты можно вводить в растительную клетку или растительную ткань, где растение, из которого получена растительная клетка или ткань растений, может представлять собой Zea mays, или другой вид растений. Затем из растительной клетки или ткани растений можно получать трансформированное целое растение, в которое введена молекула нуклеиновой кислоты. Затем растение с цитоплазматической мужской стерильностью можно опылять с помощью трансформированного цельного растения. Затем из растения с цитоплазматической мужской стерильностью можно получать семена, которые были опылены трансформированным цельным растением.
В конкретных вариантах осуществления функциональные варианты или гомологи гена Rf4-bHLH кукурузы можно использовать вместо последовательности Rf4-bHLH кукурузы (например, SEQ ID NO: 220), или нуклеотидной последовательности, которая специфично гибридизуется с последовательностью Rf4-bHLH кукурузы, в способе получения гибридных семян. Трансформированное цельное растение, которое получают, например, описанными выше способами, может быть способно продуцировать семена. Однако такие семена могут быть неспособны вырастать в фертильные растения. Таким образом, некоторые варианты осуществления способов получения гибридных семян вовлекают способы культивирования тканей растений. Такие способы являются стандартными и широко известны специалистам в данной области.
В вариантах осуществления, где систему CMS-C/Rf4 для получения гибридных семян вводят способами инженерии в виды растений, отличные от кукурузы, может быть необходимо также вводить молекулы нуклеиновых кислот, содержащие одну или несколько последовательность(ей) нуклеиновых кислот, вовлеченных в систему мужской стерильности CMS-C, в виды растений. Например, рецессивный аллель rf4-bHLH можно вводить для замены ортолога Rf4-bHLH в виде растений для получения растения с мужской стерильностью rf4/rf4, в которое можно вводить ген Rf4-bHLH для создания в виде способами инженерии системы CMS-C/Rf4 для получения гибридных семян.
В некоторых вариантах осуществления ген Rf4, описанный в настоящем описании, можно использовать в способе получения гибридных семян, включающем оплодотворение женского растения, имеющего признак мужской стерильности CMS C-типа пыльцой из мужского растения, содержащего ген Rf4. В этих и других вариантах осуществления можно использовать последовательность Rf4-bHLH кукурузы (например, SEQ ID NO: 220), нуклеотидную последовательность, которая специфично гибридизуется с последовательностью Rf4-bHLH кукурузы, или функциональные варианты или гомологи последовательности Rf4-bHH.
В некоторых вариантах осуществления способ получения гибридных семян включает получение первого растения, содержащего Rf4, например, путем обратного скрещивания; мутагенеза; трансформации; или гомологичной рекомбинации. Затем можно получать второе растение, имеющее признак мужской стерильности CMS C-типа, или создавать, например, путем обратного скрещивания; мутагенеза; или гомологичной рекомбинации. Затем второе растение можно скрещивать с первым растением с получением фертильных гибридных семян из второго растения. В вариантах осуществления первое растение может представлять собой мужское растение, а второе растение может представлять собой женское растение.
В конкретных примерах способов получения гибридных семян растение может представлять собой растение кукурузы. В следующих примерах можно использовать растения, отличные от кукурузы. Варианты осуществления способов получения гибридных семян в соответствии с изобретением применимы к любому растению, такому как растения, размножающиеся половым путем, включая растения, имеющие агрономическую ценность, например и не ограничиваясь ими: кукурузу; сою; люцерну; пшеницу; рапс; рис; сорго; сахарную свеклу; брахиподию; однодольные растения; двудольные растения; различные овощи, включая огурец, помидор, перец и т.д.; различные деревья, включая яблоко, грушу, персик, вишню, красное дерево, сосну, дуб и т.д.; и различные декоративные растения.
V. Способы применения молекулярных маркеров Rf4
Способы применения молекулярных маркеров нуклеиновых кислот, которые сцеплены с геном Rf4 или расположены в нем, для идентификации растений с функциональным геном-восстановителем для CMS C-типа могут приводить к экономии затрат для растениеводов, поскольку такие способы могут устранить потребность в скрещивании растений, содержащих функциональный ген-восстановитель, с линиями растений CMS, а затем фенотипировании потомства скрещивания.
Дополнительные маркеры можно идентифицировать в качестве эквивалента любому из иллюстративных маркеров, названных в настоящем описании (например, SEQ ID NO: 1-197 и полиморфизмы ID №№ 1-106 (таблица 3)), например, путем определения частоты рекомбинации между дополнительным маркером и иллюстративным названным маркером. При таком определении можно использовать усовершенствованный способ ортогональных контрастов на основе способа Mather (1931), The Measurement of Linkage in Heredity, Methuen & Co., London, с последующим тестом на максимальную вероятность для определения частоты рекомбинации. Allard (1956) Hilgardia 24:235-78. Если величина частоты рекомбинации меньше или равна 0,10 (т.е. 10%) в любом культиваре кукурузы, то дополнительный маркер считается эквивалентом конкретному эталонному маркеру для целей использования в настоящих описанных способах.
Средства для восстановления фертильности кукурузы CMS-C могут включать последовательность нуклеиновой кислоты из растения, выявление которой обеспечивает по меньшей мере убедительное указание на то, что растение, содержащее последовательность нуклеиновой кислоты, содержит функциональный восстановитель гена CMS-C. В некоторых примерах средство для восстановления фертильности кукурузы CMS-C представляет собой маркер, который сцеплен (например, сцеплен; прочно сцеплен; или чрезвычайно прочно сцеплен) с геном Rf4-bHLH или который расположен в нем.
Средства для идентификации растений кукурузы, имеющих ген для восстановления фертильности кукурузы CMS-C, может представлять собой молекулу, которая обеспечивает поддающийся детекции сигнал при добавлении к образцу, полученному из растения, имеющего ген для восстановления фертильности кукурузы CMS-C. Специфическая гибридизация нуклеиновых кислот представляет собой поддающийся детекции сигнал, и, таким образом, зонд нуклеиновой кислоты, который специфично гибридизуется с репортерным геном CMS-C, или отличающейся геномной последовательностью нуклеиновой кислоты, которая является индикатором присутствия функционального гена-восстановителя CMS-C, может быть средством для идентификации растений кукурузы, имеющих ген для восстановления фертильности кукурузы CMS-C. В некоторых примерах средства для идентификации растений, имеющих ген для восстановления фертильности кукурузы CMS-C, представляют собой зонд, который специфично гибридизуется с маркером, который сцеплен (например, сцеплен; прочно сцеплен; или чрезвычайно прочно сцеплен) с геном Rf4-bHLH кукурузы или который расположен в нем.
В некоторых вариантах осуществления маркеры, фланкирующие ген Rf4, можно использовать для переноса сегмента(ов) донорной родительской ДНК, которая однозначно содержит ген Rf4. В конкретных вариантах осуществления маркеры выбирают из группы маркеров, содержащей SEQ ID NO: 1-197 и полиморфизмы ID №№ 1-106 (таблица 3), или из маркеров, эквивалентных маркерам, выбранным из группы маркеров, содержащей SEQ ID NO: 1-197 и полиморфизмы ID №№ 1-106 (таблица 3). В некоторых вариантах осуществления способ использования маркеров, фланкирующих ген Rf4, для переноса сегмента(ов) донорной родительской ДНК, которая однозначно содержит ген Rf4, может включать анализ геномной ДНК двух родительских растений с помощью зондов, которые специфично гибридизуются с маркерами, сцепленными (например, сцепленными; прочно сцепленными; или чрезвычайно прочно сцепленными) с геном Rf4; половое скрещивание двух генотипов родительских растений с получением популяции потомков, и анализ этих потомков на присутствие маркеров, сцепленных (например, сцепленных; прочно сцепленных; или чрезвычайно прочно сцепленных) с геном Rf4; обратное скрещивание потомков, которые содержат маркеры, сцепленные (например, сцепленные; прочно сцепленные; или чрезвычайно прочно сцепленные) с геном Rf4, с реципиентным генотипом для получения популяции первого возвратного скрещивания, а затем продолжение программы обратного скрещивания до получения конечного потомства, которое содержит любой желаемый признак(и), проявляемый родительским генотипом и геном Rf4. В конкретных вариантах осуществления селекцию индивидуального потомства, полученного на каждой стадии скрещивания и обратного скрещивания, проводят с помощью анализа маркера Rf4 в каждом поколении. В некоторых вариантах осуществления анализ геномной ДНК двух родительских растений с помощью зондов, которые специфично гибридизуются с маркерами, сцепленными (например, сцепленными; прочно сцепленными; или чрезвычайно прочно сцепленными) с геном Rf4 показывает, что одно из родительских растений содержит меньше сцепленных маркеров, с которыми зонды специфично гибридизуются, или ни один из сцепленных маркеров, с которыми зонды специфично гибридизуются.
В некоторых вариантах осуществления маркеры, которые сцеплены (например, сцеплены; прочно сцеплены; или чрезвычайно прочно сцеплены) с геном Rf4-bHLH кукурузы или которые расположены в нем, или саму последовательность гена Rf4-bHLH кукурузы можно использовать для введения гена Rf4 кукурузы в растение путем генетической трансформации. В конкретных вариантах осуществления маркеры выбраны из группы маркеров, содержащих SEQ ID NO: 1-197 и полиморфизм ID №№ 1-106 (таблица 3), или из маркеров, эквивалентных маркерам, выбранным из группы маркеров, содержащей SEQ ID NO: 1-197 и полиморфизмы ID №№ 1-106 (таблица 3). В некоторых вариантах осуществления способ введения гена Rf4 кукурузы в растение кукурузы путем генетической рекомбинации может включать анализ геномной ДНК растения (например, растения кукурузы) с помощью зондов, которые специфично гибридизуются с маркерами, сцепленными (например, сцепленными; прочно сцепленными; или чрезвычайно прочно сцепленными) с геном Rf4, или с самим геном Rf4 для идентификации гена Rf4 в растении; выделение сегмента геномной ДНК растения, содержащего ген Rf4, например, путем экстракции геномной ДНК и расщепления геномной ДНК одним или несколькими ферментами - эндонуклеазами рестрикции; необязательно амплификацию выделенного сегмента ДНК; введение выделенного сегмента ДНК в клетку или ткань хозяйского растения кукурузы; и анализ ДНК хозяйского растения кукурузы с помощью зондов, которые специфично гибридизуются с маркерами, сцепленными (например, сцепленными; прочно сцепленными; или чрезвычайно прочно сцепленными) с геном Rf4, или с самим геном Rf4, для идентификации гена Rf4 в хозяйском растении кукурузы. В конкретных вариантах осуществления выделенный сегмент ДНК можно вводить в хозяйское растение кукурузы, так чтобы он стабильно встраивался в геном хозяйского растения кукурузы.
В некоторых вариантах осуществления маркеры, которые сцеплены (например, сцеплены; прочно сцеплены; или чрезвычайно прочно сцеплены) или с геном Rf4-bHLH кукурузы или расположены в нем, или саму последовательность гена Rf4-bHLH кукурузы можно использовать для введения гена Rf4 кукурузы в другие организмы, например, растения. В конкретных вариантах осуществления маркеры выбирают из группы маркеров, включающей SEQ ID NO: 1-197 и полиморфизмы ID №№ 1-106 (таблица 3), или из маркеров, эквивалентных маркерам, выбранным из группы маркеров, содержащей SEQ ID NO: 1-197 и полиморфизмы ID №№ 1-106 (таблица 3). В некоторых вариантах осуществления способ введения гена Rf4 кукурузы в организм, отличный от кукурузы, может включать анализ геномной ДНК растения (например, растения кукурузы) с помощью зондов, которые специфично гибридизуются с маркерами, сцепленными (например, сцепленными; прочно сцепленными; или чрезвычайно прочно сцепленными) с геном Rf4, или с самим геном Rf4, для идентификации гена Rf4 в растении; выделение сегмента геномной ДНК растения, содержащей ген Rf4, например, путем экстракции геномной ДНК и расщепления геномной ДНК одним или несколькими ферментами - эндонуклеазами рестрикции; необязательно амплификацию выделенного сегмента ДНК; введения выделенного сегмента ДНК в организм, отличный от кукурузы; и анализ ДНК организма, отличного от кукурузы, с помощью зондов, которые специфично гибридизуются с маркерами, сцепленными (например, сцеплены; прочно сцеплены; или чрезвычайно прочно сцеплены) с геном Rf4, или с самим геном Rf4 для идентификации гена Rf4 в организме. В конкретных вариантах осуществления выделенный сегмент ДНК можно вводить в организм, так чтобы он стабильно встраивался в геном организма.
В некоторых вариантах осуществления маркеры, которые сцеплены (например, сцеплены; прочно сцеплены; или чрезвычайно прочно сцеплены) или которые расположены в гене Rf4, или саму последовательность гена Rf4 можно использовать для идентификации растения с функциональным геном-восстановителем мужской стерильности CMS-C. В конкретных вариантах осуществления растение представляет собой растение кукурузы. В некоторых вариантах осуществления молекулы нуклеиновых кислот (например, геномную ДНК или мРНК) можно экстрагировать из растения. Затем экстрагированные молекулы нуклеиновых кислот можно контактировать с одним или несколькими зондами, которые специфично гибридизуются с маркерами, сцепленными (например, сцепленными; прочно сцепленными; или чрезвычайно прочно сцепленными) с геном Rf4, или с самим геном Rf4. Специфическая гибридизация одного или нескольких зондов с экстрагированными молекулами нуклеиновых кислот указывает на присутствие функционального гена-восстановителя для мужской стерильности CMS-C в растении.
В некоторых вариантах осуществления маркеры, которые сцеплены (например, сцеплены; прочно сцеплены; или чрезвычайно прочно сцеплены) с геном Rf4 или которые расположены в нем, или саму последовательность гена Rf4 можно использовать для получения гибридных семян. Получение гибридных семян в соответствии с такими способами может приводить к экономии затрат благодаря устранению ручного или механического удаления метелок, и, кроме того, может увеличить выход семян. В конкретных вариантах осуществления способ может включать скрещивание мужского растения, содержащего молекулярные маркеры нуклеиновых кислот, которые сцеплены (например, сцеплены; прочно сцеплены; или чрезвычайно прочно сцеплены) или с геном Rf4 или расположены в нем, и женского растения, имеющего фенотип мужской стерильности CMS C-типа.
VI. Организмы, содержащие ген Rf4
Некоторые варианты осуществления настоящего изобретения также относятся к организму, включающему молекулу нуклеиновой кислоты, содержащую последовательность Rf4-bHLH (например, SEQ ID NO: 220), последовательность нуклеиновой кислоты, которая специфично гибридизуется с последовательностью Rf4-bHLH, или функциональный вариант последовательности Rf4-bHLH. Подходящий организм может представлять собой любое подходящее растение, дрожжи или бактерию. В качестве неограничивающего примера, растение, содержащее упомянутые выше последовательности, может представлять собой растение, представляющее агрономическую ценность, например и не ограничиваясь ими: кукурузу; сою; люцерну; пшеницу; рапс; рис; сорго; свеклу; брахиподию; однодольные растения; двудольные растения; различные овощи, включая огурец, помидор, перец и т.д.; различные деревья, включающие яблоко, грушу, персик, вишню, красное дерево, сосну, дуб и т.д.; и различные декоративные растения. В конкретных вариантах осуществления организм может представлять собой растение, размножающееся половым путем. Несущее семена растение, которое содержит конкретную последовательность нуклеиновой кислоты, может продуцировать семена, которые содержат эту последовательность нуклеиновой кислоты.
Клетки растений, содержащие последовательность Rf4-bHLH (например, SEQ ID NO: 220), последовательность нуклеиновой кислоты, которая специфично гибридизуется с последовательностью Rf4-bHLH, или функциональным вариантом последовательности Rf4-bHLH, можно культивировать и поддерживать в качестве клеток культуры ткани растений, или в культуральную среду можно добавлять определенные растительные гормоны, известные в данной области, тем самым обеспечивая дифференцировку клеток культуры ткани растений и формирование нового сорта растений, который может быть фертильным или стерильным. Такие способы культивирования растений, пригодные в этих и других вариантах осуществления, являются стандартными и хорошо известны в данной области.
Некоторые варианты осуществления изобретения относятся к вирусу (например, бактериофагу или вирусу растений), содержащему последовательность Rf4-bHLH (например, SEQ ID NO: 220), последовательность нуклеиновой кислоты, которая специфично гибридизуется с последовательностью Rf4-bHLH, или функциональный вариант последовательности Rf4-bHLH.
Следующие примеры предоставлены для иллюстрации определенных конкретных признаков и/или вариантов осуществления. Примеры не следует истолковывать, как ограничивающие изобретение до конкретных проиллюстрированных признаков или вариантов осуществления.
ПРИМЕРЫ
Пример 1: Материалы и способы
Популяция для подтверждения
Линию мужской стерильности CMS C-типа, BE4207, и линию-восстановитель мужской стерильности, соответствующей CMS C-типа, XJH58, использовали в качестве родительских растений для получения потомства F1. Затем потомство F1 подвергали самоопылению для получения популяции F2. Популяцию F2, состоящую из 500 особей, использовали для идентификации гена Rf4 и маркеров, сцепленных (например, сцепленных; прочно сцепленных; или чрезвычайно прочно сцепленных) с геном Rf4.
Точное картирование популяции F3 BE4207/XJH58
Всего 5465 семян, отобранных из 15 гетерозиготных семейств F2 из популяции для подтверждения F2, сегрегирующей по различным фрагментам в области размером 4,2 млн п.н. в верхней части 8 хромосомы, высевали в рассаднике летом 2010 года в Arlington, Wisconsin. Образцы листьев собирали от 5104 проросших сеянцев для генотипирования.
Классификация по фертильности
500 растений в этой популяции F2 фенотипически классифицировали в зависимости от пыльцы, сбрасываемой с метелок. Растения, которые сбрасывали пыльцу, классифицировали как фертильные. Растения, которые не сбрасывали пыльцу, классифицировали как стерильные. Восстановление Rf4 в этой популяции было полным; не наблюдали частично фертильных растений.
Экстракция и количественное определение ДНК
8 полученных прокалыванием дыроколом фрагментов ткани листьев получали от каждого растения популяции F2, и ДНК экстрагировали с использованием BiocelTM 1800 (Agilent Inc., Santa Clara, CA). Использованный способ экстракции ДНК был следующим: (1) добавить одну гранулу из сплава вольфрама диаметром ~0,32 см в каждую пробирку; (2) добавить 300 мкл лизирующего буфера RLT (Qiagen Inc., Germantown, MD) в каждую пробирку; (3) закрыть и размалывать в течение 6 минут при 1500 ударов/минута в SPEX 2000 Geno/Grinder® (OPS Diagnostics, LLC, Lebanon, NJ); (4) центрифугировать образцы при 6000 об/мин в течение 5 минут; (5) открыть пробирки; следующие стадии проводят на BiocelTM 1800: (6) перенести 200 мкл супернатанта в 1,1-мл планшет для анализа с квадратными лунками с круглым дном, содержащий 10 мкл MagAttract® Suspension G Beads (Qiagen Inc.); (7) инкубировать в течение 2 минут; (8) встряхивать при 1200 об/мин в течение 40 секунд; (9) инкубировать в течение 2 минут; (10) поместить планшет для анализа на магнитную полку и позволить гранулам разделиться в течение 40 секунд; (11) удалить супернатант; (12) первое промывание - добавить промывочный буфер 190 RPWTM предварительно смешанный с РНКазой и изопропанолом, и встряхивать при 1200 об/мин в течение 40 секунд; (13) поместить планшет для анализа на магнитную полку и позволить гранулам разделиться в течение 20 секунд; (14) удалить супернатант; (15) второе промывание - добавить 190 мкл, промывочного буфера, представляющего собой 100% этанол, и встряхивать при 1200 об/мин в течение 40 секунд; (16) поместить планшет для анализа на магнитную полку и позволить гранулам разделяться в течение 20 секунд; (17) третье промывание - добавить 190 мкл промывочного буфера, представляющего собой 100% этанол; (18) встряхивать при 1200 об/мин в течение 40 секунд; (19) поместить планшет для анализа на магнитную полку и позволить гранулам разделиться в течение 20 секунд; (20) удалить супернатант; (21) инкубировать планшет в течение 5 минут при комнатной температуре; (22) добавить 100 мкл буфера для элюирования AETM (Qiagen Inc.); (23) встряхивать в течение 2 минут; (24) поместить планшет для анализа на магнитную полку и позволить гранулам разделиться в течение 30 секунд; и (25) перенести супернатант в чистый обозначенный планшет и закрыть. ДНК хранили при 4°C. ДНК количественно определяли с использованием PicoGreen® (Invitrogen Inc., Carlsbad, CA), и концентрацию доводили до 5-6 нг/мкл для применения в системе генотипирования KASParTM (KBioscience Inc., Hoddesdon, Великобритания).
Система генотипирования SNP KASParTM
Система конкурентного аллелеспецифического генотипирования с использованием ПЦР (KASParTM) представляет собой систему для выявления SNP, в которой используется технология, основанная на аллелеспецифическом удлинении олигонуклеотидов и резонансном переносе энергии флуоресценции (FRET) для генерирования сигнала. Для каждого SNP-маркера в анализе KASParTM требуется только два компонента: смесь для анализа (смесь трех немеченых праймеров: двух аллелеспецифических олигонуклеотидов и одного общего обратного локус-спсецифического олигонуклеотида); и реакционная смесь (другие компоненты, требуемые для ПЦР, включая универсальную флуоресцентную репортерную систему и Taq-полимеразу).
Для моделирования праймеров использовали систему KBioscience Laboratory Information Management System (KLIMSTM) (KBioscience Inc.), и олигонуклеотиды синтезировали с помощью технологии Integrated DNA Technology (Coralville, IA). Реакции KASParTM проводили в соответствии с рекомендацией изготовителя. ПЦР начинали с денатурации при 94°C в течение 15 минут, затем проводили 20 циклов по 10 секунд денатурации при 94°C, 5 секунд отжига при 57°C, а затем 10 секунд удлинения при 72°C, а за этими 20 циклами следовали 22 цикла с денатурацией в течение 10 секунд при 94°C, отжигом в течение 20 секунд при 57°C, а затем удлинением в течение 40 секунд при 72°C. Флуоресцентные сигналы после завершения реакций KASParTM считывали в спектрофотометре (Tecan GENiosTM, Mannedorf, Швейцария) с длиной волны возбуждения при 485 нм, и длиной волны испускания при 535 нм для флуорофора FAM; и длиной волны возбуждения 525 нм, и длиной волны испускания 560 нм для флуорофора VIC. Данные анализировали с использованием программного обеспечения KlustercallerTM (KBiosciences Inc.) для определения генотипов каждого SNP-маркера в популяции.
Экстракция РНК и ПЦР в реальном времени (RT-ПЦР)
Родительские растения и растения F3, сегрегирующие по области Rf4, выращивали в теплице. Ткани листьев собирали с растений, выращиваемых в течение 5 недель, 7 недель и 9 недель. Также собирали ткани метелок с развивающимися пыльниками/пыльцой и сбрасываемую пыльцу (в фертильных растениях). Тотальную РНК экстрагировали с использованием набора RNeasyTM Plant Mini Kit (Qiagen Inc.). кДНК синтезировали с использованием набора QuantiTectTM Reverse Transcription Kit (Qiagen Inc.). Для RT-ПЦР, специфичные к гену Rf4 праймеры, контрольные праймеры для инвертазы кукурузы, и зонды с двойным мечением красителями FAM или VIC и Minor Groove Binding Non Fluorescence QuencherTM I (MGBNFQ) синтезировали в Applied Biosystems (Foster City, CA). Для проведения 10-мкл реакций ПЦР использовали основную смесь для генотипирования TaqManTM (Applied Biosystems), и ПЦР проводили на LightCyclerTM 480 (Roche). Программа ПЦР включала: активацию в течение 10 минут при 95°C, затем 50 циклов при 95°C в течение 10 секунд и 58°C в течение 38 секунд. Флуоресцентные сигналы регистрировали в конце каждого цикла. Относительный уровень экспрессии вычисляли с использованием способа Delta CT с использованием инвертазы в качестве контроля.
Пример 2: Картирование гена Rf4
Анализ сегрегации фертильности
Соотношение сегрегации фертильности в популяции F2 составляло 3:1. Таблица 1. Результаты показали, что восстановление фертильности в системе CMS-C/Rf4 контролируется одним доминантным геном-восстановителем, Rf4.
Предварительное генетическое картирование Rf4 в популяции F2 с использованием SNP-маркеров.
101 SNP-маркер, расположенный вблизи верхней части 8 хромосомы кукурузы, использовали в скрининге родительских организмов с 5 различными популяциями для картирования Rf4, и было определено, что он находится в пределах области Rf4 размером 5,0 млн п.н. Набор из 12 маркеров был полиморфным во всех пяти популяциях, в то время как 27, в том числе 12 общих полиморфных маркеров, продемонстрировали полиморфизм между родительскими организмами популяции F2 BE4207×XJH58. 12 общих маркеров первоначально использовали для генотипирования всех 500 индивидуумов в популяции F2 для идентификации рекомбинантных линий в пределах области 5,0 млн п.н. Затем остальные 15 полиморфных маркеров использовали для генотипирования всех 104 рекомбинантных линий. Тридцать четыре случайным образом отобранных рекомбинанта представлены на ФИГ.2 с их фенотипическими данными и соответствующими генотипическими данными для 27 маркеров в качестве примеров. Более детальный анализ 42 наиболее информативных рекомбинантных линий показал, что ген Rf4 расположен в области приблизительно 1,505 млн п.н. в верхней части 8 хромосомы, определяемой SNP-маркером DAS-PZ-40624 (SEQ ID NO: 8). В этой области находится приблизительно 30 генов (данные не представлены).
Интересно и неожиданно, что, ввиду того факта, что все ранее идентифицированные гены-восстановители, за исключением Rf2 кукурузы и Rf17 риса, кодируют белки с пентатрикопептидными повторами (PPR), отсутствует предсказанный ген PPR в пределах области размером 1,505 млн п.н., содержащей Rf4, хотя существуют три гена PPR, расположенных на расстоянии 1,509, 4,288 и 4,748 млн п.н. соответственно. ФИГ.3.
Генетическое точное картирование Rf4 с информативными рекомбинантами и дополнительными SNP-маркерами
Для дальнейшего точного картирования расположения на хромосоме гена-восстановителя Rf4, 96 SNP-маркеров, расположенных в положении нуклеотидов от 12507 до 1504526 на 8 хромосоме, были отобраны для исследования родительских полиморфизмов. 28 SNP-маркеров были полиморфными среди двух картированных родительских растений. 93 рекомбинанта, включая некоторые потенциально информативные рекомбинанты, не включенные в предшествующий раунд скрининга, были отобраны для генотипирования с 28 маркерами. С использованием того же сравнения фенотип/генотип, которое описано выше, ген Rf4 был положительно картирован до области 0,56 млн п.н. с использованием 19 наиболее информативных рекомбинантов, определяемых растениями S-301 и S-115 и SNP-маркером PZE-108000459 (SEQ ID NO: 134) в качестве правой границы, как показано на ФИГ.4. Исходя из генотипических и фенотипических данных растения S-378 (стерильное), ген Rf4 может быть расположен в области менее 100 т.п.н., определяемой SNP-маркером PZE-108000086 (SEQ ID NO: 105). См. ФИГ.4. Таким образом, Rf4 был картирован до области 0,56 млн п.н., которая содержит приблизительно 14 генов, и далее был картирован до области менее 100 т.п.н., которая содержит шесть потенциальных генов. См. таблицу 2. Последовательность гена Rf4 выбрана из группы, состоящей из GRMZM2G122853 (SEQ ID NO: 198); AC187051.4_FG005 (SEQ ID NO: 199); GRMZM2G122851 (SEQ ID NO: 200); GRMZM2G122850 (SEQ ID NO: 201); GRMZM2G582028 (SEQ ID NO: 202); GRMZM2G021276 (SEQ ID NO: 203); GRMZM2G381376 (SEQ ID NO: 204); GRMZM2G081127 (SEQ ID NO: 205); GRMZM2G085111 (SEQ ID NO: 206); GRMZM2G085038 (SEQ ID NO: 207); GRMZM2G317468 (SEQ ID NO: 208); GRMZM2G328030 (SEQ ID NO: 209); GRMZM2G029450 (SEQ ID NO: 210); и GRMZM2G077212 (SEQ ID NO: 211).
Эти результаты согласуются с результатами, изложенными в постере под названием "Restoration of c-type cytoplasmic male sterility in maize: Fine-mapping of Rf4", недавно представленном Kohls et al. на 2010 Maize Genetics Conference. Kohls et al., согласно утверждению, картировали ген Rf4 до области 0,5 млн п.н. вблизи верхней части 8 хромосомы с использованием ограниченного количества маркеров. Однако генетические материалы, использованные Kohls et al., существенно отличались от генетических материалов, использованных в настоящей описываемой работе. Важно, что, Kohls et al. выявили значительный процент только полуфертильных особей Rf4, в то время как восстановление фертильности в настоящей популяции F2 было полным (не было выявлено полуфертильных особей). Кроме того, Rf4 использовали лучшее разрешение карты (<100 т.п.н. против 500 т.п.н.) для идентификации, а также для описания многих других полезных маркеров, включая маркеры, которые чрезвычайно прочно сцеплены с Rf4.
Результаты, представленные в настоящем описании, демонстрируют картирование локуса Rf4 до очень небольшого хромосомного фрагмента и идентификацию гена Rf4. В отличие от большинства генов Rf, клонированных до настоящего времени, Rf4 практически определенно не является геном PPR. Сцепленные молекулярные маркеры, описанные в настоящем описании (включая прочено сцепленные и чрезвычайно прочно сцепленные маркеры) можно использовать для облегчения селекции с помощью маркеров линий восстановителей в системе CMS-C/Rf4 и для обеспечения разработки гибридной кукурузы с использованием только этой системы или вместе с другими системами.
Пример 3: Точное картирование гена Rf4
Получали большую популяцию F3 BE4207/XJH58 из 5104 особей, происходящих из рекомбинантных линий, описанных выше, для точного картирования.
В популяции F2 Rf4 был картирован до области менее 100 т.п.н. в верхней части хромосомы 8. Однако в этой области не существует молекулярных маркеров, за исключением PZE-108000086 с SNP в нуклеотидном положении 98468. Было предпринято два подхода для идентификации полиморфизмов для дополнительных маркеров в этом интервале. В первом подходе моделировали эксперимент по улавливанию последовательностей NimbleGenTM (Roche Inc.) (Fu et al. (2010) Plant J. 62:898-909) для установления всех полиморфизмов в области приблизительно 6,0 млн п.н. в верхней части 8 хромосомы между линией CMS BE4207 и линией восстановителя XJH58, вместе с двумя дополнительными линиями восстановителей BE9515 и MLW03. Улавливание последовательности, секвенирование уловленных мишеней и проявление SNP проводили с помощью NimbleGenTM в соответствии с рекомендованной изготовителем методикой. Совместно с экспериментами по улавливанию NimbleGenTM, неповторяющиеся последовательности ДНК в области Rf4 (верхние 100 т.п.н. 8 хромосомы) устанавливали из генома B73, и конструировали ПЦР-праймеры для амплификации геномных фрагментов двух картированных родительских организмов, BE4207 и XJH58. Фрагменты ПЦР секвенировали из обоих родительских организмов и идентифицировали полиморфизмы (как SNP, так и InDel).
Исходя из результатов обоих экспериментов, было идентифицировано несколько тысяч SNP и InDel между линией CMS BE4207 и линией-восстановителем XJH58 в пределах уловленной области размером 6 млн п.н., включая 77 SNP и 29 InDel в первых 100 т.п.н. Таблица 3. Эксперимент по амплификации с использованием ПЦР был направлен на первые 100 т.п.н., с конкретным акцентом на двух экспрессируемых в этой области генах, гене пероксидазы растений (GRMZM2G122853 (SEQ ID NO: 198)) и гене фактора транскрипции основная спираль-петля-спираль (bHLH) (GRMZM2G021276 (SEQ ID NO: 203)). Секвенирование продуктов ПЦР идентифицировало 35 SNP и 24 InDel. Таблица 3. Примечательно, что большинство изменений, идентифицированных в фрагментах ПЦР, также были найдены в проекте улавливания последовательностей (50 из 59, или 84,7%). Взятые вместе, эти два способа открыли 106 уникальных изменений (полиморфизмы ID 1-106) между двумя картированными родительскими растениями, включающих 77 SNP и 29 InDel в заданной области Rf4 размером 100 т.п.н. Таблица 3.
Исходя из положения на физической карте и контекста последовательности, 33 уникальных изменения (24 SNP и 9 InDel) использовали для конструирования праймеров для высокопроизводительного генотипирования популяций для картирования F3 с использованием анализов KASParTM (таблица 3), по существу как описано в примере 1.
В примере 2 Rf4 был картирован до области менее 100 т.п.н. в верхней части 8 хромосомы кукурузы, определяемой SNP-маркером PZA108000086. Для картирования Rf4 до значительно меньшего интервала было выбрано четыре фланкирующих маркера (DAS-CMS1 и DAS-CMS3 слева, и PZE-108000378 и PZE-108000459 справа) для генотипирования всех 5104 растений F3 BE4207/XJH58. ФИГ.5. Растение S-378 было из F2 и являлось стерильным. ДНК из этого растения была сохранена для генотипирования с новыми маркерами. Было идентифицировано всего 307 рекомбинантов в пределах области Rf4 более 0,56 млн п.н. Эти растения были отобраны для оценки фертильности в полевых условиях и все фертильные растения подвергали самоопылению. Кроме того, дополнительные маркеры в пределах интервала 0,56 млн п.н. использовали для генотипирования ДНК из 307 рекомбинантов и растения S378 поколения F2, для дальнейшего определения участков рекомбинации. Точное картирование проводили путем сравнения фенотипических и генотипических данных информативных рекомбинантов. Данные 12 наиболее информативных рекомбинантов демонстрируют, что Rf4 ограничивается интервалом между DAS-CMS19 и DAS-CMS31, определяемым растениями 468-5048 и 468-4977. ФИГ.5.
С использованием генома B73 кукурузы в качестве эталона, DAS-CMS19 (-/T InDel; нуклеотидное положение 86247) и DAS-CMS31 (C/A SNP; нуклеотидное положение 98188) находятся на расстоянии приблизительно 12 т.п.н. друг от друга и располагаются в одном и том же клоне BAC; ZMMBBb0329M04 (номер доступа № AC187051). Последовательность интервала между DAS-CMS19 и DAS-CMS31 (в обоих B73 RefSeq v1 и v2) представлена в списке последовательностей в качестве SEQ ID NO: 217. Поскольку самая последняя версия B73 RefGen (v2) все еще имеет два непроясненных пропуска (нуклеотиды 88058-88157 и 94849-94948) между двумя маркерам, точная длина неизвестна. Однако эти пропуски, более вероятно, являются результатом трудности сборки вследствие повторяющихся последовательностей, а не истинными физическими пропусками, поскольку оба маркера располагаются в одном и том же клоне BAC, который отсеквенирован.
Пример 4: Охарактеризация гена Rf4 кукурузы
Rf4 кодирует фактор транскрипции bHLH
В геноме B73 интервал размером 12 т.п.н. между DAS-CMS19 и DAS-CMS31 содержит два предсказанных гена: GRMZM2G582028 (SEQ ID NO: 202) (нуклеотиды 93160-93850) и GRMZM2G021276 (SEQ ID NO: 203) (нуклеотиды 95823-98367). Первый фрагмент размером 9,4 т.п.н. (нуклеотиды 86247-95642) интервала размером 12 т.п.н. по большей части состоит из повторяющихся последовательностей, включающих GRMZM2G582028. GRMZM2G582028 аннотирован как новый перемещающийся элемент в B73 RefGen v2, и предсказано, что он кодирует небольшой белок из 68 аминокислот, который не имеет каких-либо значительных соответствий в базах данных белков. Более того, сама последовательность GRMZM2G582028 является в высокой степени повторяющейся, и множество идентичных или практически идентичных копий встречаются на всех 10 хромосомах кукурузы. Таким образом, маловероятно, чтобы GRMZM2G582028 был Rf4.
Оставшимся кандидатом для Rf4 является только другой предсказанный ген в этой области GRMZM2G021276. Этот ген кодирует фактор транскрипции основная спираль-петля-спираль (bHLH) из 365 аминокислот с консервативным доменом bHLH, расположенным приблизительно в средней части белка. Промотор/5'-UTR и полная кодирующая область, а также 3'-UTR размером 82 п.н., этого гена расположены в пределах интервала 12 т.п.н. с правым пограничным маркером (DAS-CMS31), находящимся в области 3'-UTR. Результаты BLAST указывают на то, что GRMZM2G021276 (в дальнейшем в настоящем описании обозначаемый как Rf4-bHLH) наиболее вероятно является однокопийным геном в геноме B73. Этот ген и его продукт ранее не были охарактеризованы.
Аллельные варианты Rf4-bHLH
Геномная последовательность B73 указывает на то, что ген Rf4-bHLH имеет 4 экзона и три интрона (ФИГ.6), включая интрон 1 размером 635 т.п.н., расположенный в 5'-UTR. Исходя из этой информации, моделировали ПЦР-праймеры для амплификации локуса Rf4-bHLH размером 3,2 т.п.н. из линии CMS BE4207, и трех линий восстановителей (XJH58, BE9515 и MLW03), а также из не являющегося CMS инбредного растения B104.
Результаты секвенирования указывают на то, что существуют существенное варьирование аллелей между различными инбредными растениями. ФИГ.7. Аллель-невосстановитель rf4-bHLH из BE4207 (CMS; не имеет функционального гена-восстановителя) идентичен аллелю B73, хорошо известного инбредного растения, которое не восстанавливает CMS-C. Интересно, что три известных линии восстановителей (XJH58, BE9515 и MLW03) имеют идентичный аллель (восстановитель) Rf4-bHLH, который отличается от аллеля B73/BE4207 (CMS). Линии восстановителей XJH58 и MLW03 обладают одним общим предком 2-3 поколения назад. Однако инбредное растение BE9515, которое не обладает общими предками с XJH58 или MLW03, также имеет идентичную последовательность Rf4-bHLH, указывая на то, что этот конкретный аллель, возможно, является консервативным среди линий, которые восстанавливают цитоплазму CMS-C. Между аллелем-восстановителем (Rf4-bHLH) и аллелем-невосстановителем CMS/B73 (rf4-bHLH) имеется 20 SNP и 16 InDel. ФИГ.7. Примечательно, что существует только один SNP C/T между аллелем CMS/B73 и аллелем-восстановителем в 5'-UTR/промоторной области размером 1,1 т.п.н. Когда сравнивают предсказанные кДНК из 6 аллелей, между аллелем CMS/B73 и аллелем-восстановителем имеется только 6 SNP и 2 InDel. ФИГ.8.
B104 представляет собой инбредную линию, которая не имеет цитоплазму CMS-C. Проводятся эксперименты для определения того, является ли B104 восстановителем фертильности CMS-C. Из 44 варьирований последовательности, выявленных в аллеле B104, 28 из них имеют ту же последовательность, что и аллель CMS/B73, 8 являются такими же, как и у гена-восстановителя, и 8 являются уникальными для B104 (ФИГ.7), указывая на то, что аллель B104 более сходен с аллелем CMS/B73. Интересны, что все из вариантов кДНК в B104 имеют ту же последовательность, что и аллель CMS/B73, за исключением уникальной делеции размером 12 п.н. (12 Cs), встречающейся только в 5'-UTR B104. ФИГ.8.
Выравнивание предсказанных белковых последовательностей Rf4-bHLH представлено на ФИГ.9. Как и ожидалось, все три линии-восстановителя имеют идентичные белковые последовательности, в то время как B73, BE4207 и B104 обладают идентичными белковыми последовательностями. Между двумя вариантами имеется только четыре аминокислотных изменения в линиях-восстановителях: замена His на Asn (H103 на N103; полиморфизм ID 52; DAS-CMS22), инсерция Ala (A130; полиморфизм ID 53; DAS-CMS23), замена Pro на Leu (P266 на L267; полиморфизм ID 62; DAS-CMS28), и замена Tyr на Phe (Y186 на F187; полиморфизм ID 54). Только замена Tyr на Phe встречается в консервативном домене bHLH. ФИГ.9.
Rf4-bHLH специфически экспрессируется в развивающихся метелках/пыльце
Профиль экспрессии Rf4-bHLH исследовали для получения дальнейших доказательств того, что этот фактор транскрипции участвует в восстановлении фертильности CMS-C. Тотальную РНК экстрагировали из двух картированных родительских организмов, BE4207 и XJH58, а также особей F3, происходящих из початка F2, сегрегирующего по первой области размером 0,56 млн п.н. 8 хромосомы. Специфичные для Rf4-bHLH олигонуклеотиды и контрольные олигонуклеотиды инфертазы (праймеры и зонды), смоделированные для RT-ПЦР, представлены в таблице 4.
Данные количественной ПЦР в реальном времени демонстрируют, что в родительских растениях-восстановителях XJH58, и в растениях F3, гомозиготных или гетерозиготных по аллелю-восстановителю, Rf4-bHLH демонстрирует наиболее высокую экспрессию в метелках с развивающимися пыльниками/пыльцой, слабую экспрессию в сбрасываемой пыльце и практически отсутствие экспрессии в листьях различных стадий развития. Эти профили экспрессии согласуются с ролью Rf4-bHLH в восстановлении фертильности пыльцы.
Следовательно, rf4-bHLH демонстрирует от очень низкой до отсутствия экспрессии в листьях, а также в развивающихся метелках, в родительском организме CMS BE4207, и в растениях F3, гомозиготных по аллелю-невосстановителю BE4207. ФИГ.10. Однако отсутствие экспрессии rf4-bHLH в развивающихся метелках растений, гомозиготных по аллелю-невосстановителю BE4207, наиболее вероятно, обусловлено самой CMS (ни активации пыльников, ни развития функциональной пыльцы), а не аллельным различием между XJH58 и BE4207. Это подтверждается тем фактом, что rf4-bHLH (аллель-невосстановитель), по-видимому, экспрессируется на значительном уровне в B73, поскольку существует 25 независимых клонов EST (например: номера доступа BT043393, BT064392 и т.д.), в частности, из этого инбредного растения в доступных базах данных EST. Как упоминалось ранее, инбредное растение B73 не восстанавливает CMS-C, и имеет идентичный аллель rf4-bHLH с инбредным растением CMS BE4207, который, безусловно, также не имеет функционального Rf4.
Пример 5: Охарактеризация гена Rf4-bHLH в других однодольных растениях
Ортологи Rf4-bHLH однодольных растений были получены из сорго (Sb03g011940), брахиподии (BRADI2G11260) и риса (Os01g11870), все из которых доступны в National Center for Biotechnology Information (NCBI). Эти ортологи сравнивали с последовательностями кукурузы. Как показано на ФИГ.11, остаток Tyr (Y186) в домене bHLH является консервативным среди всех видов, причем примечательным исключением является замена Phe (F187) в аллеле-восстановителе кукурузы. Другие три изменения расположены в различных вариабельных областях и, как правило, не являются настолько же консервативными при сравнении среди видов. ФИГ.11. Эти результаты указывают на то, что F187 в аллеле-восстановителе может играть ключевую роль в восстановлении фертильности цитоплазмы CMS-C.
Белковая последовательность bHLH кукурузы в высокой степени сходна с ортологами однодольных растений из Sorghum bicolor (Sb03g011940; 84% идентичность), Oryza sativa (Os01g18870; 64%), и Brachypodium distachyon (BRADI2G11260, 63%), и в меньшей степени с белками с доменом bHLH из двудольных видов (например, At2g31210 из Arabidopsis thaliana; 24%). Согласно Pires and Dolan (2010), выше, семейство белков растений bHLH можно подразделить на 26 подсемейств, исходя из гомологии последовательностей, идентифицированной среди 544 белков bHLH из девяти видов наземных растений (не включая кукурузу) и водорослей. Если бы он был включен в анализ, Rf4-bHLH из кукурузы был бы отнесен к подсемейству II, которое состоит из белка риса, OS01g18870 (описанного выше) и 10 других белков. Аналогично, Carretero-Paulet et al. (2010), выше, идентифицировали 32 подсемейства bHLH, и Rf4-bHLH кукурузы может быть отнесен к их подсемейству 9, которое также состоит из OS01g18870 и 10 других белков. Большинство представителей в подсемействе II Pires и Dolan, и подсемействе 9 Carretero-Paulet имеют одни и те же последовательности.
Rf4-bHLH представляет собой фактор транскрипции и его предполагаемым местом назначения является ядро. В действительности, несколько предсказывающих программ, включая PredictNLSTM, идентифицировали два устойчивых сигнала ядерной локализации (NLS) в Rf4-bHLH: 153-GRKRGRA-159 (SEQ ID NO: 229) и 229-KKRRRR-234 (SEQ ID NO: 230) (в соответствии с положением аминокислот Rf4-bHLH XJH58). ФИГ.9.
Все гены Rf, клонированные к настоящему времени, кодируют белки, нацеленные на митохондрии (Liu et al. (2001), выше; Akagi et al. (2004), выше; Fujii and Toriyama (2009), выше), и предположительно взаимодействуют непосредственно с транскриптами CMS. Однако ожидаемая ядерная локализация Rf4-bHLH делает маловероятным, что Rf4-bHLH нацелен на митохондрии и имеет прямое взаимодействие с транскриптами CMS-C. Вероятно, Rf4-bHLH функционирует выше, активируя и повышая экспрессию ядерного гена, который кодирует нацеленный на митохондрии белок, который в свою очередь приводит к препятствованию экспрессии транскрипта CMS-C, восстанавливая мужскую фертильность. Этот предполагаемый митохондриальный белок может быть представителем семейства белков PPR, или чем-то сходным с Rf2 кукурузы, RF17 риса, или является новым белком. Для идентификации прямых мишеней Rf4-bHLH можно использовать иммунопреципитацию хроматина, установление генной сети и другие молекулярные подходы.
Пример 6: Введение гена Rf4-bHLH в кукурузу CMS путем трансформации
Ген-восстановитель Rf4-bHLH (например, SEQ ID NO: 220) трансформируют в линию CMS кукурузы. Трансформированное растение кукурузы экспрессирует полипептид Rf4-bHLH SEQ ID NO: 225, и Rf4-bHLH является достаточным для восстановления мужской фертильности в цитоплазме CMS-C.
Реферат
Изобретение относится к области биохимии, в частности к способу идентификации растения, способного восстанавливать фертильность при цитоплазматической мужской стерильности С-типа, содержащего функциональный ген-восстановитель для цитоплазматической мужской стерильности С-типа кукурузы, включающему выделение молекул нуклеиновой кислоты из растения и скрининг выделенных молекул нуклеиновых кислот с использованием ПЦР в отношении молекулы нуклеиновой кислоты, содержащей нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-197 и маркеров, обозначаемых как полиморфизмы ID №№1-106 в таблице 3. Изобретение также относится к способу восстановления фертильности в кукурузе, предусматривающему стадии скрещивания, маркер-ассоциированной селекции, а также размножения растения кукурузы. Изобретение позволяет эффективно восстанавливать фертильность в кукурузе. 2 н. и 12 з.п. ф-лы, 11 ил., 4 табл., 6 пр.
Формула
выделение молекул нуклеиновой кислоты из растения; и
скрининг выделенных молекул нуклеиновых кислот способом, содержащим полимеразную цепную реакцию (ПЦР), в отношении молекулы нуклеиновой кислоты, содержащей нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-197 и маркеров, обозначаемых как полиморфизмы ID №№1-106 в таблице 3, где присутствие по меньшей мере одной молекулы нуклеиновой кислоты, содержащей нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-197 и маркеров, упоминаемых в качестве полиморфизмов ID №№1-106 в таблице 3, указывает на функциональный ген-восстановитель для цитоплазматической мужской стерильности С-типа кукурузы.
цитозин в положении, соответствующем тимину в положении 8885 8 хромосомы сорта кукурузы В73;
гуанин в положении, соответствующем аденину в положении 11684 8 хромосомы сорта кукурузы В73;
цитозин в положении, соответствующем аденину в положении 11883 8 хромосомы сорта кукурузы В73;
аденин в положении, соответствующем гуанину в положении 15309 8 хромосомы сорта кукурузы В73;
тимин в положении, соответствующем цитозину в положении 15639 8 хромосомы сорта кукурузы В73;
тимин в положении, соответствующем цитозину в положении 22230 8 хромосомы сорта кукурузы В73;
цитозин в положении, соответствующем тимину в положении 22266 8 хромосомы сорта кукурузы В73;
цитозин в положении, соответствующем гуанину в положении 44285 8 хромосомы сорта кукурузы В73;
тимин в положении, соответствующем цитозину в положении 44387 8 хромосомы сорта кукурузы В73;
делетированный нуклеотид в положении, соответствующем аденину в положении 45202 8 хромосомы сорта кукурузы В73;
GGT в положении, соответствующем положению 65438 8 хромосомы сорта кукурузы В73;
делетированный нуклеотид в положении, соответствующем аденину в положении 66993 8 хромосомы сорта кукурузы В73;
аденин в положении, соответствующем тимину в положении 85667 8 хромосомы сорта кукурузы В73;
делеция в положении, соответствующем CGG в положениях 85782-85784 8 хромосомы сорта кукурузы В73;
аденин в положении, соответствующем цитозину в положении 86079 8 хромосомы сорта кукурузы В73;
ТС в положении, соответствующем положению 86097 8 хромосомы сорта кукурузы В73;
тимин в положении, соответствующем гуанину в положении 86113 8 хромосомы сорта кукурузы В73;
тимин в положении, соответствующем положению 86247 8 хромосомы сорта кукурузы В73;
тимин в положении, соответствующем цитозину в положении 96248 8 хромосомы сорта кукурузы В73;
аденин в положении, соответствующем цитозину в положении 97087 8 хромосомы сорта кукурузы В73;
GCC в положении, соответствующем положению 97177 8 хромосомы сорта кукурузы В73;
ТТ в положении, соответствующем АС в положениях 97337-97338 8 хромосомы сорта кукурузы В73;
гуанин в положении, соответствующем цитозину в положении 97341 8 хромосомы сорта кукурузы В73;
гуанин в положении, соответствующем аденину в положении 97371 8 хромосомы сорта кукурузы В73;
цитозин в положении, соответствующем тимину в положении 97411 8 хромосомы сорта кукурузы В73;
GTT в положении, соответствующем положению 97452 8 хромосомы сорта кукурузы В73;
тимин в положении, соответствующем цитозину в положении 97673 8 хромосомы сорта кукурузы В73;
цитозин в положении, соответствующем тимину в положении 97827 8 хромосомы сорта кукурузы В73;
тимин в положении, соответствующем цитозину в положении 97962 8 хромосомы сорта кукурузы В73;
аденин в положении, соответствующем цитозину в положении 98188 8 хромосомы сорта кукурузы В73;
тимин в положении, соответствующем гуанину в положении 98393 8 хромосомы сорта кукурузы В73;
гуанин в положении, соответствующем тимину в положении 98489 8 хромосомы сорта кукурузы В73;
тимин в положении, соответствующем положению 98660 8 хромосомы сорта кукурузы В73.
скрещивание женского стерильного растения кукурузы, имеющего признак цитоплазматической мужской стерильности С-типа, с растением кукурузы, являющимся восстановителем мужской стерильности, имеющим признак способности восстанавливать фертильность при цитоплазматической мужской стерильности С-типа, получая растения кукурузы F1;
использование маркер-ассоциированной селекции для идентификации растения кукурузы F1, содержащего молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-197 и маркеров, обозначаемых как полиморфизмы ID №№1-106 в таблице 3; и
размножение идентифицированного растения кукурузы F1, указанное растение кукурузы F1 имеет признак восстановленной фертильности, тем самым, восстанавливая фертильность в кукурузе.
Документы, цитированные в отчёте о поиске
Способ получения растений с цитоплазматической мужской стерильностью и способ получения гибридных семян с мужской фертильностью
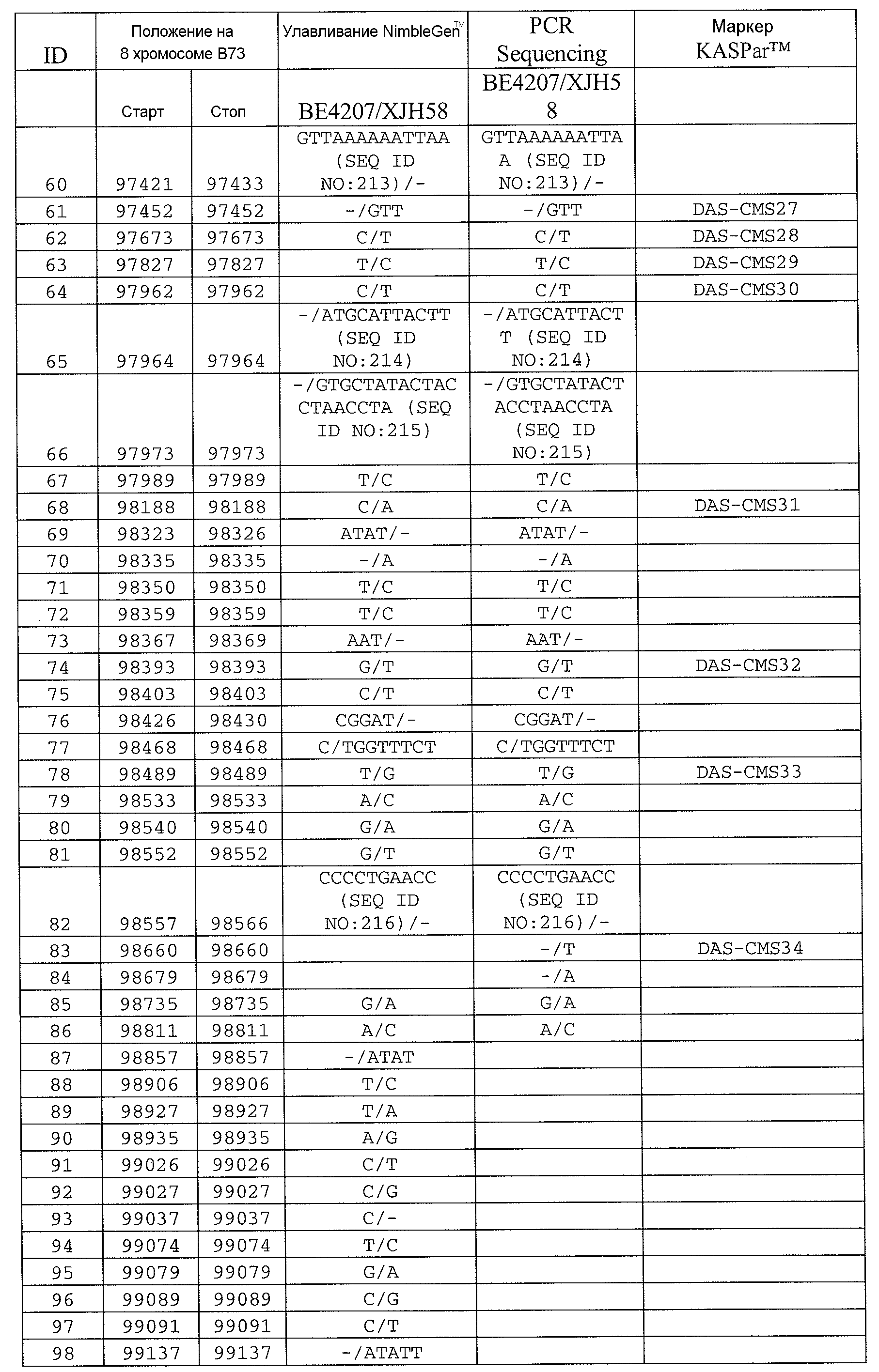


Комментарии