Способ получения растений с цитоплазматической мужской стерильностью и способ получения гибридных семян с мужской фертильностью - RU2139347C1
Код документа: RU2139347C1
Чертежи






Описание
Изобретение относится к способам улучшения растений, имеющих важное сельскохозяйственное и коммерческое значение, и в частности к новым трансгенным системам, основанным на использовании пластид, для получения растений с цитоплазматической мужской стерильностью и к применению таких растений для получения гибридных семян.
Открытие того факта, что скрещивание двух инбредных линий растений дает гибриды, имеющие повышенную продуктивность, вызвало большой интерес у селекционеров растений с точки зрения разработки экономичных способов получения гибридных семян. Обычно гибриды оказываются более продуктивными и более эффективными при утилизации питательных веществ, таких, как удобрения и вода. Гибриды первого поколения (F1) также имеют тенденцию проявлять повышенную устойчивость к стрессовым ситуациям в окружающей среде по сравнению с родительскими инбредными линиями и также могут проявлять желаемые характеристики устойчивости к болезням. Получая гибриды двух инбредных линий, также представляется возможным объединить характеристики, которые трудно или невозможно объединить другими путями.
Гетерозис является общим явлением у растений и животных и в течение многих лет находит промышленное применение при селекции растений. Промышленные гибриды в настоящее время являются доступными для многих важных в сельскохозяйственном отношении культурных видов, и разработки в этой области продолжаются в отношении тех культурных растений, получать гибриды которых можно надежным и экономически выгодным образом.
Чтобы получить гибридное потомство двух инбредных линий, должно произойти перекрестное опыление. Оно является препятствием для получения гибридов многих культурных растений, которые в естественных условиях являются самоопыляемыми, часто давая и пыльцу и яйцеклетку в одном и том же цветке. Для предотвращения самооплодотворения необходимо удалить или разрушить вырабатывающий пыльцу орган у одного из родителей. Это может быть осуществлено вручную путем эмаскуляции, т.е. удаления целого мужского цветка или удаления пыльников цветков, имеющих как мужские, так и женские функциональные органы в одном и том же цветке. Ручная эмаскуляция требует больших затрат труда и вследствие этого является дорогостоящей.
Родительские линии с мужской стерильностью для получения гибридных семян также могут быть получены при использовании химических веществ ("гаметоцидов"), которые предотвращают образование жизнеспособной пыльцы. Эти химические вещества также дороги и не являются полностью надежными вследствие различных ограничений при обработке растений химическими веществами.
Единообразное перекрестное опыление может также осуществляться при использовании растений с генетической мужской стерильностью в качестве материнских родительских растений, выращенных рядом с отцовскими родительскими растениями, производящими пыльцу. При использовании этого способа все семена, собранные с делянки материнских растений, получены в результате перекрестного опыления.
Отсутствие образования пыльцы (т.е. мужская стерильность) у растений может быть следствием ядерных мутаций или быть связано с цитоплазматическими факторами наследственности. Для получения гибридных семян цитоплазматическая мужская стерильность (ЦМС) является предпочтительной по сравнению с генетической ядерной мужской стерильностью, потому что характеристики ЦМС не подвергаются менделевскому расщеплению. См. Handson & Conde, Int'l. Rev. Cytol., 94:213-267 (1985). Например, генетическая ядерная мужская стерильность обычно кодируется одним рецессивным геном, поэтому для экспрессии мужского стерильного фенотипа требуется гомозиготность. Для распространения растений с генетической ядерной мужской стерильностью гомозиготные рецессивные стерильные мужские растения должны быть скрещены с изогенной мужской фертильной линией, гетерозиготной по гену мужской стерильности. Такие скрещивания приводят к образованию определенного процента мужских фертильных растений (50% в системе с одним геном), которые должны быть удалены с поля сразу же, как только может быть идентифицирована их фертильность, чтобы поддержать эффективность желаемой популяции с мужской стерильностью. Так же как и ручная эмаскуляция, удаление с поля мужских фертильных растений представляет собой тяжелый и дорогостоящий труд. Таким образом, расщепление ядерных генов сильно ограничивает пригодность генетической ядерной мужской стерильности для получения гибридных семян.
Недостатком генетической ядерной мужской стерильности является менделевское расщепление. В противоположность этому цитоплазматическая мужская стерильность экспрессируется во всем потомстве гибридного скрещивания между родителями ЦМС-инбредной линии и линии с мужской фертильностью. По этой причине для получения гибридных семян предпочтителен способ, основанный на использовании ЦМС- характеристик.
Встречающаяся в естественных условиях цитоплазматическая мужская стерильность обусловлена мутациями в митохондриальном геноме. Взаимосвязи между этими митохондриальными мутациями и цитоплазматической мужской стерильностью варьируют от вида к виду и до сих пор недостаточно хорошо поняты. У кукурузы, для которой наиболее хорошо охарактеризованы митохондриальные ЦМС-системы, цитоплазматическая мужская стерильность техасской линии с цитоплазматической мужской стерильностью (ЦМС-Т) вероятно связана с экспрессией 13-кДа-полипептида. См. Hansen, Ann. Rev. Genet., 25:461-486 (1991); Leving & Siedov, Plant. Molec. Biol., 19: 135-147 (1992). Было установлено, что этот полипептид представляет собой трансмембранный протеин, увеличивающий проницаемость клеточных мембран. Этот полипептид не оказывает выраженного вредного воздействия при нормальном делении вегетативных клеток, но в силу пока неизвестного механизма вызывает усиленную проницаемость мембран клеток тапетума (выстилающего слоя) и последующее нарушение образования пыльцы. Образование 13-кДа- полипептида кореллировало с чувствительностью кукурузы линии ЦМС-Т к патогенам растений, таким, как Bipolaris maydis и Phyllosticta maydis.
В программах по селекции растений, в которых используют ЦМС-цитоплазму естественного происхождения, для получения семян необходимы три инбредные линии: (1) линия с мужской цитоплазматической стерильностью, имеющая ЦМС-цитоплазму; (2) фертильная инбредная линия с нормальной цитоплазмой, изогенная ЦМС-линии по ядерным генам ("линия поддержания"); и (3) фертильная инбредная линия с нормальной цитоплазмой, несущая ген восстановления фертильности ("линия восстановления", которая не обязательно должна быть изогенной ЦМС- линии). ЦМС-линия рапространяется путем опыления растениями линии поддержания. Все растения, полученные от этого скрещивания, будут обладать мужской стерильностью, поскольку ЦМС-цитоплазма имеет происхождение от родительской материнской линии. Гибридные семена получают путем опыления второй инбредной линией, несущей ген-восстановитель фертильности (Rf). Если нет гена-восстановителя, то стерильные гибриды все же могут быть получены путем опыления различными инбредными линиями, не имеющими гена- восстановителя фертильности. Такие гибриды полезны для культурных растений, у которых используется вегетативная ткань (например, листья табака или цветки петуньи). Однако у большинства культурных растений полезной частью урожая являются семена, поэтому фертильность гибридов этих культур должна быть восстановлена.
Хотя цитоплазматическая мужская стерильность полезна для получения гибридных семян, ее полезность часто ограничена многочисленными практическими проблемами, связанными с естественной цитоплазматической мужской стерильностью. Эти проблемы включают невозможность идентифицировать ЦМС-цитоплазму или ядерные восстанавливающие аллели, а также сопряжены с нежелательными характеристиками, такими, как восприимчивость к болезням (как описано выше), пониженная фертильность и т.п. Каждая из этих проблем возникает из-за отсутствия понимания митохондриального механизма цитоплазматической мужской стерильности и восстановления фертильности.
Очевидно, что уровень цитоплазматической мужской стерильности мог бы быть существенно увеличен, если бы были разработаны ЦМС-системы, компоненты которых были бы полностью понятны и охарактеризованы и которыми можно было бы уверенно оперировать без риска получения вредных побочных эффектов.
Настоящее изобретение относится к новой ЦМС-системе, основанной на модификации пластидного генома, а не митохондриального генома, и применении трех трансгенов: гена пластидной мужской стерильности и двух ядерных генов, регулирующих экспрессию гена пластидной мужской стерильности.
Одним предметом настоящего изобретения является следующий способ получения цитоплазматически стерильных мужских растений. Сначала выбирают родительскую линию растения. Родительскую линию растения с трансгенной пластидой получают путем стабильной трансформации пластид в клетках родительской линии с помощью гена пластидной мужской стерильности (pms) и регенерации растения. Ген pms обладает способностью регулироваться кодируемым в ядре пластид-ориентированным регуляторным полипептидом. Когда подобная регуляция происходит в ткани пыльника, нарушается образование жизнеспособной пыльцы. В одном примере осуществления изобретения, названном в данном описании способом "убивания пыльцы", ген pms является неактивным геном, включающим кодирующую область, которая кодирует вещество, способное лишать нормальных функций или убивать пластиды, нарушая тем самым образование жизнеспособной пыльцы, соединенную для функционирования с нуклеотидной последовательностью-мишенью для активации экспрессии гена. В другом примере осуществления изобретения, названном в данном описании способом "истощения пыльцы", ген pms содержит основной ген пластидного генома, соединенный для функционирования нуклеотидной последовательностью-мишенью для предотвращения экспрессии гена. Этот ген замещает нативный пластидный ген и, предотвращая экспрессию гена, вызывает повреждение или гибель пластид, нарушая тем самым образование жизнеспособной пыльцы. Растения с трансгенными пластидами, содержащими ген pms, являются фертильными. Далее различные клетки родительской линии растения подвергают стабильной ядерной трансформации с помощью гена ядерной мужской стерильности (nms), который содержит специфичную для пыльника 5'-регуляторную нуклеотидную последовательность, соединенную для функционирования с кодирующей нуклеотидной последовательностью, которая кодирует вышеуказанный пластид-ориентированный "регуляторный" полипептид, способный проникать в пластиды и регулировать ген pms путем взаимодействия с нуклеотидной последовательностью-мишенью, либо путем активации экспрессии (способ "убивания пыльцы"), либо путем предотвращения экспрессии (способ "истощения пыльцы"). Растения регенерируют из клеток растения-родителя с трансформированными ядрами. Такие растения также являются фертильными. Цитоплазматически стерильные, мужские растения получают путем скрещивания родительского растения с трансгенными пластидами с родительским растением с трансгенными ядрами, получая таким образом полную систему для лишения функциональных способностей или уничтожения специфичных для пыльника пластид, что нарушает образование жизнеспособной пыльцы.
Другим предметом настоящего изобретения является способ получения гибридных семян с мужской фертильностью от двух родительских линий растения, одна из которых представляет собой описанную выше линию растения с цитоплазматической мужской стерильностью. В соответствии с этим способом получают родительские растения с цитоплазматической мужской стерильностью, как описано выше. Затем выбирают вторую родительскую линию растения. Из этой линии получают родительское растение, восстанавливающее мужскую фертильность, подвергая клетки второй родительской линии растения стабильной ядерной трансформации геном-"восстановителем мужской фертильности" (rmf). Ген rmf содержит нуклеотидную последовательность, кодирующую генный продукт-"восстановитель", способный к взаимодействию с геном nms либо путем блокирования экспрессии самого гена nms, либо путем блокирования экспрессии способного к активации токсичного гена pms. Растение регенерируют из клеток со стабильно трансформированными ядрами. Линию с цитоплазматической мужской стерильностью затем скрещивают с линией, восстанавливающей фертильность, вследствие чего экспрессия гена rmf предотвращает вышеуказанную регуляцию гена pms регуляторным полипептидом, восстанавливая тем самым мужскую фертильность в гибридных растениях.
Следующими предметами настоящего изобретения являются конструкции ДНК и трансгенные растения для практической реализации изобретения. Предложены растение с трансгенными ядрами, содержащими ген nms, и растение с трансгенными пластидами, содержащими ген pms, от одной и той же родительской линии. Также предложено растение с цитоплазматической мужской стерильностью, полученное путем скрещивания растения с трансгенными ядрами с растением с трансгенными пластидами. Предложено растение с трансгенными ядрами, содержащими ген rmf, являющееся растением второй родительской линии. Также предложены гибридные растения с мужской фертильностью, полученные путем скрещивания родительского растения с цитоплазматической мужской стерильностью с растением второй родительской линии, содержащим ген rmf.
Фиг. 1 - схематическая диаграмма предпочтительного осуществления способа "убивания пыльцы" для получения пластидной мужской стерильности
(ПМС) с использованием системы РНК-полимераза фага Т7/lac-репрессор:
Фиг. 1А - экспрессия генов мужской стерильности в клетках тапетума или микроспорах стерильных растений. Транскрибируют
ядерный ген nms ("Knms"), в цитоплазме рибосом транслируют кодируемый полипептид (РНК-полимеразу фага Т7) и импортируют в пластиды. Последующая транскрипция пластидного гена-киллера ("Kpms") от
промотора Т7lac вызывает гибель клеток (символ "+" обозначает положительный регулятор, т.е. РНК-полимеразу фага Т7, специфичную для промотора фага Т7).
Фиг. 1Б - экспрессия генов мужской стерильности в клетках тапетума или микроспорах фертильных гибридных растений.
lac-Репрессор, продукт ядерного гена- восстанавителя фертильности (Krmf), связывается в пластидах с промотором Kpms Т7/lac, предотвращая таким образом транскрипцию токсичного гена с помощью продукта гена Knms (белый символ "X" в черном кружке обозначает специфическое связывание lac-репрессора с lac-оператором на регуляторной последовательности Т7/lac).
Фиг. 2 - схематическая диаграмма предпочтительного осуществления способа "истощения пыльцы" для получения пластидной мужской
стерильности с использованием пластид-ориентированного lac- репрессора и ядерно-ориентированного tet-репрессора:
Фиг. 2А - экспрессия генов мужской стерильности в клетках тапетума или
микроспорах стерильных растений.
Транскрибируют ядерный ген nms ("Snms") и кодируемый lac-репрессор импортируют в пластиды, где он блокирует экспрессию основного гена (Spms), промотор которого содержит сайт связывания lac-репрессора. Отсутствие экспрессии основного гена Spms приводит к гибели клеток (белый символ "X" в черном кружке обозначает специфическое связывание lac- репрессора с последовательностью lac-оператора гена Spms).
Фиг. 2Б - экспрессия генов мужской стерильности в клетках тапетума фертильных гибридных растений.
Ген-восстанавитель фертильности (Srmf) кодирует ядерно-ориентированный репрессор, предотвращая транскрипцию ядерного гена Snms с помощью сайта связывания репрессора, созданного на гене Snms, позволяя тем самым осуществлять экспрессию генов Spms. (Белый символ "-" в черном кружке обозначает специфическое связывание ядерно-ориентированного репрессора с его сайтом связывания репрессора на гене Snms).
Фиг. 3 - полигенные экспрессирующие кластеры гена Kmps в пластидах, применяемые в способе "убивания пыльцы".
Показаны последовательности ДНК промоторов РТ7lac1 (последовательность I.D. N1) и РТ7lac2 (последовательность I.D. N 2) и терминаторов транскрипции ТТ7 (последовательность I.D. N 3) и Trps16T7 (последовательность I.D. N 4). Подчеркнуты места расположения рибосомных сайтов связывания RBS, промотора гена 10 фага Т7 (ф 10), lac-оператора и соответствующие сайты рестрикции. Кодон инициации трансляции, включенный в последовательность узнавания NcoI, выделен жирным шрифтом.
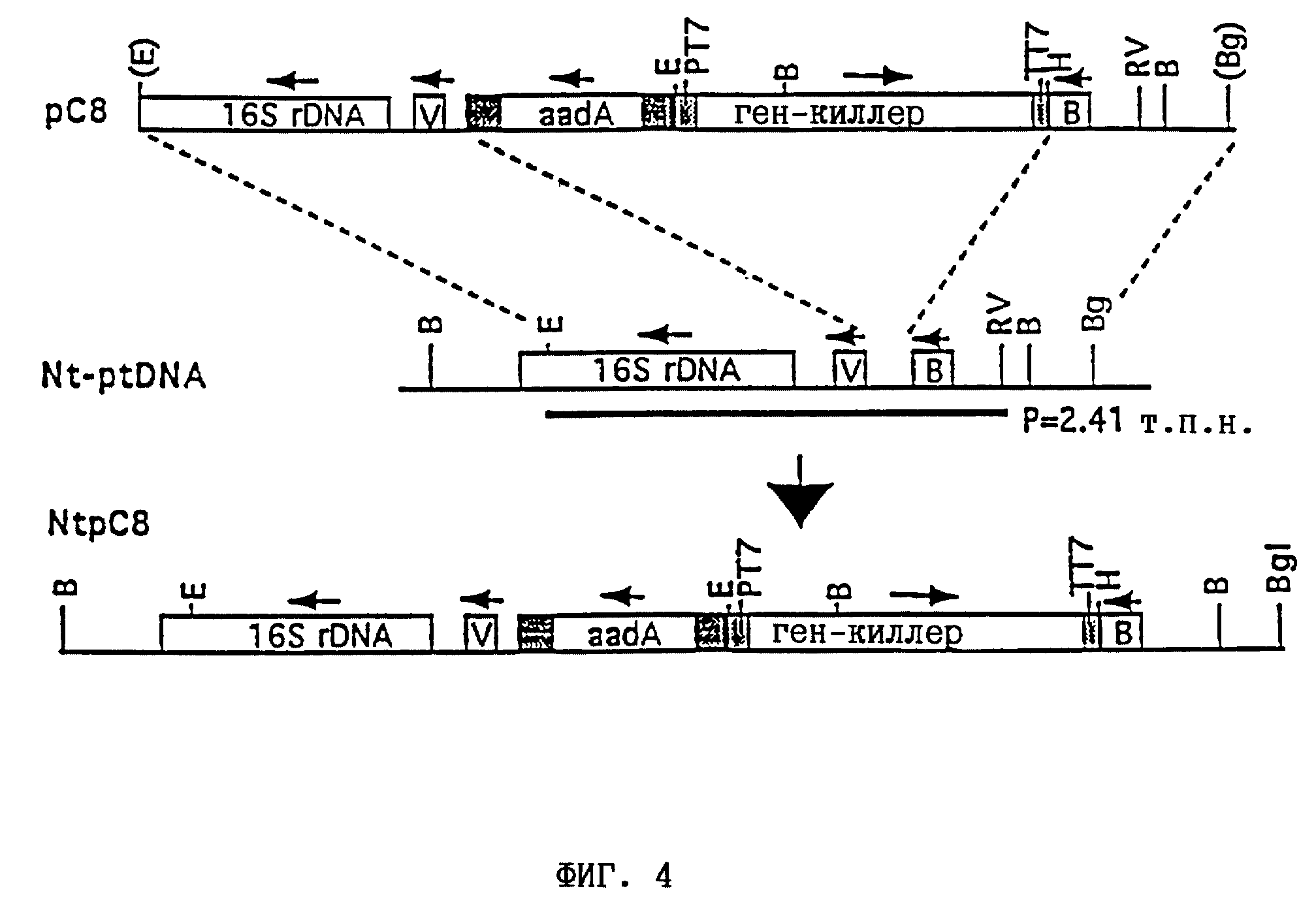
Фиг. 4 - интеграция гена Kpms в транскрипционно молчащую область генома пластиды путем сцепления с геном устойчивости к спектиномицину (aadA). Показаны пластидная область-мишень плазмиды pC8, являющаяся областью узнавания пластидного генома дикого типа (Nt-ptDNA), и область, содержащая интегрированный ген-киллер. Интеграция гена aadA и гена- "пассажира" происходит в результате двух гомологичных процессов рекомбинации, показанных между штриховыми линиями. Условные обозначения: 16SrDNA обозначает ген рРНК 16S; V обозначает ген trnV; В обозначает открытую рамку считывания ORF70B; РТ7 обозначает промотор РТ7lac1; ТТ7 обозначает терминатор ТТ7. Сайты рестрикции: E обозначает EcoRI; В обозначает BamHI; Bg обозначает BglII; H обозначает HindIII; RV обозначает EcoRV.
Фиг. 5 - гены ядерной мужской стерильности Knms (pZS233: нуклеотидная последовательность представляет собой последовательность I.D. N 5, аминокислотная последовательность представляет собой последовательность I.D. N 6; pZS243: нуклеотидная последовательность представляет собой последовательность I.D. N 7, аминокислотная последовательность представляет собой последовательность I. D. N 8). Показанные гены Knms экспрессируют как конститутивные гены с промотором вируса мозаики цветной капусты 35S (P35S; Timmermans и др., J. Biotechnol., 14: 333- 344, 1990), с транзитным пептидом, малой субъединицей RuBisCO (TP-SSU; Kanevski & Maliga, Proc. Natl. Acad. Sci. USA, 91: 1969-1973, 1994), РНК-полимеразой T7 (T7-RNAP; Studier и др., Meth. Enz. , 185: 60-89, 1990) и терминатором транскрипции вируса мозаики цветной капусты (T35S; Timmermans и др., 1990, см. выше). Также показаны аминокислотная последовательность транзитного пептида (штриховые линии) и слияние N-конца с Т7-РНК- полимеразой. Сайт процессинга обозначен зачерненным треугольником. Процессинг npeT7-RNAP дает T7-RNAP (РНК-полимеразу Т7) без дополнительных аминокислот при экспрессии из показанного вверху гена pZS233 и сохраняет 5 аминокислот зрелой малой субъединицы SSU, слитой с N-концом, при экспрессии из показанного внизу гена pZS243.
Фиг. 6 - ядерные гены-восстановители мужской фертильности Srmf (pZS253: нуклеотидная последовательность представляет собой последовательность I.D. N 9, аминокислотная последовательность представляет собой последовательность I. D. N 10; pZS263: нуклеотидная последовательность представляет собой последовательность I. D. N 11, аминокислотная последовательность представляет собой последовательность I.D. N 12). Показан конститутивный тест-ген с промотором вируса мозаики цветной капусты 35S (P35S; Timmermans и др., 1990, см. выше). TP-SSU обозначает транзитный пептид, малую субъединицу RuBisCO (Kanevski & Maliga, 1994, см. выше); lacI обозначает кодирующую область lac-репрессора (Farabaugh, Nature, 274: 765-769, 1978); T35S обозначает терминатор транскрипции вируса мозаики цветной капусты (Timmermans и др., 1990, см. выше). Также показаны аминокислотная последовательность транзитного пептида (штриховые линии) и слияние N-конца с РНК-полимеразой Т7. Сайт процессинга обозначен зачерненным треугольником. Процессинг npeT7-RNAP дает T7-RNAP (РНК-полимеразу Т7) без дополнительных аминокислот при экспрессии из показанного вверху гена pZS253 и сохраняет 5 аминокислот зрелой субъединицы SSU, слитой с N-концом, при экспрессии из показанного внизу гена pZS263.
Фиг. 7 - модифицированные последовательности промотора, применяемые для транскрипции генов Spms в способе "истощения пыльцы". Промоторы Prrnlac1 (последовательность I. D. N 13) и Prrnlac2 (последовательность I. D. N 14) имеют происхождение из промотора оперона pРНК, промотор PtrnVlac2 (последовательность I. D. N 15) имеет происхождение из гена trnV. Выделены подчеркиванием элементы промотора -10 и -35 и последовательность lac-оператора (жирный шрифт). Номера обозначают положение нуклеотида в геноме пластиды табака (Shinozaki и др., ЕМВО J., 5: 2043-2049, 1986).
Фиг. 8 - модифицированная последовательность промотора, применяемая для экспрессии кодирующих протеин генов Spms в способе "истощения пыльцы". Показанные промоторы являются производными промотора оперона pРНК и имеют лидерную последовательность либо лидера гена 10 фага Т7 (PrrnlacL1; последовательность I.D. N 16), либо лидера пластидного гена rbcL (PrrnlacL2; последовательность I. D. N 17). Выделены подчеркиванием элементы промотора -10 и -35 и последовательность lac-оператора (жирный шрифт). Номера обозначают положение нуклеотида в геноме пластиды табака (Shinozaki и др., 1986, см. выше).
Трансгенная ЦМС-система по настоящему изобретению основана на положении, что жизнеспособные функциональные хлоропласты в развивающейся ткани пыльника (в частности, в тапетуме или микроспорах) важны для образования жизнеспособной пыльцы. Трансгенная система из трех составляющих содержит ген пластидной мужской стерильности (pms), который регулируется двумя ядерными генами. Один из двух ядерных регуляторных генов является геном ядерной мужской стерильности (nms), предназначенным для экспрессии только в ткани пыльника. Ген nms кодирует пластид-ориентированный полипептид, регулирующий ген pms либо путем активации, либо путем инактивации гена pms, что приводит к трансформации пластид в выбранной ткани пыльника, у которой необходимо нарушить функцию или которую необходимо убить, предотвратив тем самым образование жизнеспособной пыльцы. Другой ядерный ген, ген-восстановитель мужской фертильности (rmf), кодирует генный продукт, который препятствует регуляции гена pms геном nms.
Подробное описание, приведенное ниже в разделах I-III, включает описание предпочтительных способов получения и применения конструкций ДНК и трансгенных растений по настоящему изобретению и практического применения способов по изобретению. В разделе I приведены общие способы конструирования систем ЦМС по данному изобретению, основанных на применении пластид (в некоторых случаях названных в данном описании как "пластидная мужская стерильность" или системы "пмс"). В разделах II и III приведены два предпочтительных примера применения пластид-трансгенной ЦМС-системы, способ "убивания пыльцы" и способ "истощения пыльцы" и описаны конструкции ДНК и другие компоненты, полезные для практического применения каждого из обоих предпочтительных примеров осуществления. Любые методы молекулярного клонирования или рекомбинантных ДНК, не описанные специально, осуществляют стандартным путем, как это описано в общих чертах, например, у Sambrook и др., в "DNA Cloning, A Laboratory Manual", Cold Spring Harbor Laboratory, 1989.
I.
Общие способы конструирования пластид-трансгенных ЦМС-систем и получения гибридных семян
Трансгенные ЦМС-системы по изобретению получают и применяют в соответствии с общими способами,
приведенными ниже для ядерной и пластидной трансформации высших растений, хранения родительских линий растений и получения гибридных семян.
A. Конструкции ДНК и способы стабильной
трансформации пластид геном pms и регенерации пластид-трансгенных растений
Способы и конструкции ДНК для стабильной, высокоэффективной трансформации пластид и экспрессии рекомбинантных
протеинов в пластидах известны в данной области техники. Для практического применения настоящего изобретения предпочтительны способы и конструкции, описанные в нижеприведенных ссылках: Svab и др.,
Proc. Natl. Acad. Sci. USA, 87: 8526-30 (1990); Svab & Maliga, Proc. Natl. Acad. Sci USA, 90: 913-17 (1993); Carrer и др., Mol. Gen. Genet. , 241: 49-56 (1993); Staub & Maliga, EMBO J.,
12: 601-06 (1993); и в заявках на патенты США с регистрационными номерами 08/111398 и 08/189256; во всех вышеуказанных документах описан уровень данной области техники для стабильной,
высокоэффективной пластидной трансформации и экспрессии рекомбинантных генов в пластидах.
Определения нижеприведенных понятий предназначены для пояснения способов пластидной трансформации, применяемых в соответствии с настоящим изобретением.
Гетероплазматический: относится к наличию смешанной популяции различных геномов пластид в одной пластиде или в популяции пластид, содержащихся в клетках или тканях растений.
Гомоплазматический: относится к чистой популяции геномов пластид, находящихся либо в пластиде, либо в клетках и тканях.
Трансформация пластид: стабильная интеграция трансформирующей ДНК в геном пластиды, которая передается в семена потомства растений, содержащих трансформированные пластиды.
Вышеупомянутые предпочтительные способы и конструкции для трансформации пластид основаны на использовании нелетальных средств селекции, которые придают селектируемый фенотип клеткам, содержащим трансформированные пластиды. Термины "селективный маркер" или "селектируемый маркер" относятся к фенотипу, который идентифицирует успешно трансформированную органеллу, клетку или ткань, если ген или аллель, кодирующие селективный маркер, включены в чужеродную ДНК, применяемую для трансформации. Обычно применяемые селективные маркеры включают устойчивость к антибиотикам, гербицидам или другим соединениям, которые могут быть летальными для клеток, органелл или тканей, в которых не происходит экспрессия резистентного гена или аллеля. Селекцию трансформантов осуществляют путем выращивания клеток или тканей в условиях давления отбора, т. е. в среде, содержащей антибиотик, гербицид или другое соединение. Если селективный маркер является "летальным" селективным маркером, то клетки, в которых происходит экспрессия селективного маркера, будут выживать, в то время как клетки, лишенные селективного маркера, будут погибать. Если селективный маркер является "нелетальным", то трансформанты (т.е. клетки, в которых происходит экспрессия селективного маркера) можно отличить от нетрансформантов с помощью определенных средств, однако и трансформанты и нетрансформанты будут выживать при воздействии давления отбора.
Селективный маркер может быть нелетальным на клеточном уровне, но селективным на уровне органелл; как, например, в случае селективного маркера, предпочтительного в данном описании для трансформации пластид. Например, антибиотик спектиномицин ингибирует трансляцию в пластидах, но не в цитоплазме. Чувствительные к спектиномицину пластиды не способны производить протеины, содержащие аппарат для фотосинтеза. В присутствии спектиномицина клетки, содержащие указанные пластиды, сохраняют жизнеспособность при их выращивании в фотогетеротропных условиях (т.е. при выдерживании в атмосфере экзогенного углерода), однако пластиды в этих условиях растут медленнее, и клетки или ткани обесцвечиваются добела, вместо того, чтобы становиться зелеными. Наоборот, пластиды, экспрессирующие селективный фенотип устойчивости к спектиномицину, размножаются с большей скоростью, и клетки, содержащие такие пластиды, имеют зеленый цвет. В смешанной популяции клеток, содержащей трансформированные и нетрансформированные пластиды, чувствительные не трансформированные пластиды будут иметь значительное численное превосходство и должны быть разбавлены в процессе пластидно/клеточного разделения в условиях давления отбора, и популяция пластид будет включать практически только трансформированные пластиды (гомоплазматические клетки или ткани, как определено выше). Таким образом, нелетальность селективного маркера относится к нелетальности на клеточном уровне, в то время как в селективной среде могут быть выращены чувствительные клетки или ткани, но устойчивые ткани легко отличимы от них.
Для пластидной трансформации требуется: (1) способ доставки ДНК через двойную мембрану пластиды; (2) интеграция гетерологичной ДНК без воздействия на нормальную функцию генома пластиды (выполняемой либо путем замещения существующего пластидного гена, либо путем инсерции дополнительных генов в соответствующие места в геноме пластиды); и (3) эффективный отбор трансформированного генома пластиды, предпочтительно путем применения летального селектируемого маркера доминантного типа, как описано выше у Svab & Maliga, 1993 (где описан ген aadA в качестве селектируемого гена-маркера для высокоэффективной трансформации хлоропластов табака).
Для введения ДНК в пластиды цветковых растений пригодны несколько методов, включающих (но не ограниченных ими) использование в качестве векторов Agrobacterium, обработку протопластов полиэтиленгиколем (ПЭГ), бомбардировку клеток или тканей микроснарядами, покрытыми ДНК, трансформирующей пластиду (в некоторых случаях в данном описании названную биобаллистической доставкой ДНК), и вырезание с помощью микропучков УФ-лазера временных отверстий. Другие способы включают применение геминивирусов в качестве векторов, обработку протопластов фосфатом кальция, электропорацию выделенных протопластов и перемешивание клеточной суспензии с микроузлами, покрытыми трансформирующей ДНК. Биобаллистический метод, описанный выше у Svab & Maliga, 1993, является предпочтительным для пластидной трансформации, поскольку он может быть применен в отношении широкого разнообразия растений и их тканей, включая виды или роды растений, не приспособленные к выращиванию в виде культуры клеток или протопластов или к регенерации. В альтернативном варианте примера осуществления, пригодном для растительных систем, где протопласты могут быть получены и регенерированы в целые растения, трансформация пластиды может быть осуществлена путем обработки протопластов полиэтиленгликолем (ПЭГ) в присутствии трансформирующей ДНК. Некоторые методы осуществления стабильной трансформации пластид в обработанных ПЭГ протопластах на растениях табака представлены у Golds и др., Bio/Technology, 11: 95-97, 1993.
Конструкции ДНК, пригодные для стабильной трансформации пластид геном pms (в некоторых случаях в данном описании названные либо как "трансформирующая ДНК", либо как "векторы-вставки"), включают следующие элементы: (1) последовательность ДНК, гомологичную области генома пластиды, подлежащей трансформации (в некоторых случаях в данном описании названной как "сегмент-мишень" или "фрагмент-мишень"), имеющую достаточную длину, чтобы гарантировать гомологичную рекомбинацию, необходимую для введения трансформирующей ДНК в геном пластиды, (2) нелетальный селектируемый ген-маркер, такой, как ген aadA, и (3) ген pms, причем оба гена соединены для функционирования с соответствующими 5'- и 3'- регуляторными областями для экспрессии в пластидах. Такие векторы обычно соединены в виде химерных генов, в которых каждая кодирующая область (т.е. кодирующая область для селектируемого гена-маркера и кодирующая область для гена pms) прилегает к соответствующим 5'- и 3'-регуляторным последовательностям. 5'- и 3'-регуляторные сегменты для кодирующего сегмента селектируемого маркера выбирают так, чтобы экспрессия селектируемого гена-маркера была эффективной, придавая тем самым нелетальный селектируемый фенотип. 5'- и 3'-регуляторные сегменты для гена pms выбирают, как описано выше, так, чтобы ген был способен активироваться и инактивироваться под контролем ядерных генов nms и rmf. К таким химерным генам с обеих сторон примыкают части сегмента-мишени.
Сегмент-мишень вектора-вставки должен быть достаточно большим для того, чтобы гарантировать гомологичную рекомбинацию между трансформирующей ДНК и геномом пластиды. Для достижения этого сегмент-мишень должен иметь длину по крайней мере 50 оснований и предпочтительно от 500 до 1500 оснований на каждой стороне ДНК, подлежащей включению в геном пластиды.
Сегмент-мишень выбирают так, чтобы трансформирующая ДНК не нарушала экспрессию соседних пластидных генов. Приемлемые сегменты-мишени могут быть идентифицированы специалистом в данной области техники на основе наличия обширной информации о картировании генома и информации о последовательности некоторых пластидных геномов в сочетании с пригодностью этой информации к другим пластидным геномам, что является результатом высокой степени консервативности пластидных геномов (Palmer, Trends in Genetics, 6: 115-120, 1990; Sugiura, Plant Mol. Biol., 19: 149-168, 1992).
В способе "истощения пыльцы" по настоящему изобретению сегмент-мишень содержит ген, который должен быть замещен, и при этом указанный ген полностью замещается без нарушения соседних генов в геноме пластиды. Замещение выполняют путем сцепления селектируемого гена-маркера в прямом направлении от замещаемого пластидного гена и отбора трансформантов, проявляющих селектируемый фенотип (см. Maliga и др., Phil. Trans. R. Soc. Lond. B, 342: 203-208, 1993).
В способе "убивания пыльцы" сегмент-мишень выбирают так, чтобы трансформирующую ДНК встроить в геном пластиды в транскрипционально молчащие области, не нарушая пластидные гены. Учитывая, что 3'-области пластидных генов неэффективны в качестве терминаторов транскрипции (Gruissem & Tonkyn, Critical Review in Plant Sciences, 12: 19-55, 1993), можно ожидать некоторую степень сквозного прочитывания (отсутствия терминации) транскрипции при встраивании трансформирующей ДНК почти в любом месте генома пластиды. Сайт встраивания в области инвертированного повтора между геном trnV и опероном rps12/7 особенно полезен с учетом этого факта, поскольку трансформирующую ДНК транскрибируют без существенного сквозного прочитывания транскрипции при ориентации по направлению к оперону rps12/7. Это отсутствие сквозного прочитывания транскрипции в сайте встраивания trnV-rpsl2/7, вероятно, является следствием того факта, что фланкирующие пластидные гены или опероны транскрибируются дивергентно (т.е. транскрибируются от противоположных цепочек, в противоположных направлениях). Следовательно, сегменты-мишени, ориентированные по направлению к сайтам между другими дивергентно транскрибируемыми генами, также могут быть пригодны для практического применения настоящего изобретения. Они включают сайты между trnL и ORF2280 в области инвертированного повтора и между trnS и ORF168 и trnW и petG в большой малокопийной области, но не ограничены ими. В другом варианте также могут быть пригодны сайты встраивания между двумя любыми генами тРНК, поскольку гены тРНК являются относительно эффективными терминаторами транскрипции (Stern & Gruissem, Cell, 51: 1145-57, 1987). Такой же результат может быть получен путем фланкирования сайтов встраивания терминаторами транскрипции, которые могут быть синтезированы или вырезаны из исходных генов и клонированы.
Селектируемый ген-маркер и ген pms могут быть взяты в виде полигенных экспрессирующих кластеров для встраивания в сегмент-мишень. Полигенный экспрессирующий кластер, как это используется в контексте данного описания, содержит 5'- и 3'-регуляторные сегменты, предпочтительно приспособленные для удобного смешения и перекрестного спаривания с помощью стандартных методик рекомбинантной ДНК. Полигенные экспрессирующие кластеры применяют для получения химерных генов pms и селектируемых генов-маркеров для составления векторов-вставок. Таким образом, векторы- вставки для трансформации пластид геном pms содержат по крайней мере еще один ген, который придает нелетальный селектируемый фенотип.
Полигенные экспрессирующие кластеры содержат 5'- и 3'- регуляторные сегменты для контроля экспрессии различных кодирующих сегментов. 5'- регуляторный сегмент контролирует уровень и специфичность экспрессии в пластидах, 3'-регуляторный сегмент придает стабильность мРНК. 5'- и 3'- регуляторные сегменты предпочтительно имеют происхождение из 5'- и 3'- регуляторных областей эндогенных пластидных генов, которые могут далее быть модифицированы. Также могут применяться другие 5'- и 3'- регуляторные области, в частности такие области, как полученные из E.coli, цианбактерий, фотосинтезирующих бактерий, бактериофагов и вирусов растений.
Для получения высоких уровней экспрессии протеина селектируемого гена-маркера и основного гена pms в пластидах пыльника в 5'-регуляторном сегменте могут быть использованы модифицированные нефотосинтезирующие промоторы. Активным промотором этого класса является промотор оперона рибосомальной РНК 16S (Prrn), описанный выше у Svab & Maliga, 1993, см. выше.
В дополнение к элементам промотора для направления транскрипции 5'-регуляторные сегменты могут содержать дополнительные способствующие экспрессии элементы для регуляции трансляции, такие, как рибосомальные сайты связывания, содержащиеся в 5'- нетранслируемых областях (UTR) пластидных генов, равно как и последовательности, кодирующие несколько N-концевых аминокислот пластидного гена.
Пример промотора оперона rrn, созданного для экспрессии гена aadA устойчивости к спектиномицину, описан выше у Svab & Maliga, 1993. Этот 5'- регуляторный сегмент содержит сегмент 5'-области rrn оперона, включающий элементы промотора -10 и -35, слитые с 18 нуклеотидами высокоэкспрессируемой нетранслируемой области rbcL, которая содержит рибосомный сайт связывания GGGUGGG. Этот 5'-регуляторный сегмент способен к направленной конститутивной экспрессии гена uidA в трансформированных пластидах. В другом примере тот же самый промотор, описанный выше у Carrer и др. 1993, был способен к направленной экспрессии гена kan.
Также было обнаружено, что экспрессия может быть улучшена путем включения в 5'-регуляторный сегмент полной лидерной последовательности rbcL в положение от -16 до +18 относительно сайта инициации трансляции. Принимая во внимание важность лидерных последовательностей мРНК (т.е. 5'-UTR и N-концевых кодирующих областей) для высокого уровня экспрессии протеина, другие соответствующие лидерные последовательности могут быть получены из других высокоэкспрессируемых генов, в частности из высокоэкспрессируемых вирусных генов (например, из омега- последовательности вирусного белка вируса табачной мозаики (ВТМ), нетранслируемых лидеров вируса мозаики люцерны (ВМЛ) RNA4 или вируса мозаики костра (ВМК) RNA3 и лидерной последовательности фага Т7 (см. фиг. 8 и пример 4)).
Пример 3'-регуляторных сегментов, пригодных для практического применения настоящего изобретения, описан выше у Staub & Maliga, 1993 и также в примере 1 (фиг. 3). Эти сегменты имеют происхождение из 3'- нетранслируемых областей различных пластидных генов и гена 10 фага T7.
Применяя конструкции, описанные выше, стабильные многоклеточные растения с трансформированными пластидами, содержащими ген pms, могут быть получены
следующим путем:
(1) включения гена pms в вектор-вставку, содержащий нелетальный селектируемый ген-маркер и соответствующий сегмент-мишень;
(2) доставки трансформирующей ДНК в
пластиду (предпочтительно биобаллистическим способом), способствуя таким образом интеграции трансформирующей ДНК без воздействия на нормальную функцию пластидного генома;
(3) выращивания
обработанных клеток или тканей в соответствующей селективной среде и повторного субклонирования до получения гомоплазматических клеток или тканей;
(4) идентификации гомоплазматических клеток
или тканей на основе экспрессии ими селектируемого фенотипа; и
(5) выращивания идентифицированных трансформантов до зрелых растений и оценки их потомства на сохранение селектируемого фенотипа
и присутствие гена pms.
Б. Способы получения ядерно-трансгенных растений, содержащих ген nms или ген rmf
Трансформация ядер клеток растений может быть осуществлена такими же
методами, как и описанные для трансформации пластид. Они включают, но не ограничены ими, использование в качестве векторов Agrobacterium, обработку протопластов ПЭГ, биобаллистичеcкую доставку ДНК,
использование микропучков УФ- лазера, геминивирусов в качестве векторов, обработку протопластов фосфатом кальция, электропорацию выделенных протопластов, смешение клеточных суспензий с микроузлами,
покрытыми трансформирующей ДНК, прямое поглощение ДНК, медиируемое липосомами поглощение ДНК и т.п. Такие методы описаны в данной области техники. См., например, Methods for Plant Molecular Biology,
Weissbach & Weissbach, ред., Academic Press, Inc., 1988; Methods in Plant Molecular Biology, Schuler & Zielinski, ред., Academic Press. Inc., 1989; Plant Molecular Biology Manual, Gelvin
Schilperoort, Verma, ред., Kluwer Academic Publishers, Dordrecht, 1993; и Methods in Plant Molecular Biology- A Laboratory Manual, Maliga, Klessig, Cashmore, Gruissem & Varner, ред., Cold
Spring Harbor Press (1994, в печати).
Способ трансформации зависит от растения, которое должно быть трансформировано. Метод биобаллистической доставки ДНК уже был описан для трансформации пластид, и он также может быть использован для ядерной трансформации. В другом примере осуществления изобретения применяют в качестве векторов Agrobacterium, способствующие эффективной трансформации ядер клеток растений.
В предпочтительном примере осуществления изобретения ген nms (а также описанный ниже ген rmf) вводят в ядра растений в бинарных векторах Agrobacterium. Такие векторы включают, но не ограничены ими, BIN19 (Bevan, Nucl. Acids Res., 12: 8711-8721, 1984) и их производные, векторы серий pBI (Jefferson и др., EMBO J., 6: 3901-3907, 1987) и бинарные векторы pGA482 и pGA492 (An, Plant Physiol., 81: 86-91, 1986). Новые серии бинарных векторов на основе Agrobacterium, семейства pPZP, предпочтительны для практического применения настоящего изобретения. Применение этого семейства векторов для трансформации растений описано у Svab и др., в Methods in Plant Molecular Biology-A Laboratory Manual, ред. Maliga, Klessig, Cashmore, Gruissen & Varner, Cold Spring Harbor Press (1994, в печати).
Применяя систему бинарных векторов Agrobacterium для трансформации, ген nms или rmf сцепляют с ядерным маркером устойчивости
к антибиотекам таким, как маркер устойчивости к канамицину или к гентамицину. Ген nms или ген rmf предпочтительно сцепляют с двумя различными маркерами устойчивости к антибиотеку так, что два гена
могут быть селектированы независимо друг от друга. Медиируемую Agrobacterium трансформацию ядер растений осуществляют в соответствии со следующей процедурой:
(1) встраивают ген nms или ген
rmf в отобранный бинарный вектор на основе Agrobacterium;
(2) осуществляют трансформацию путем совместного культивирования ткани растения (например, листовых дисков) с суспензией
рекомбинантной Agrobacterium с последующей инкубацией (например, в течение 2 дней) в среде для роста в отсутствие антибиотиков, используемой в качестве избирательной среды (см., например, Horsch и др.,
Science 227: 1229-1231, 1985);
(3) затем растительную ткань переносят в избирательную среду для идентификации трансформированной ткани; и
(4) выявленные трансформанты регенерируют в
целые растения.
Очевидно, что уровень экспрессии, а также тканеспецифичность экспрессии генов nms или rmf в трансформированных растениях, по-видимому, значительно варьируется в зависимости от места их встраивания в ядерный геном. Такая роль места встраивания хорошо известна в данной области техники; см. Weising и др. , Ann. Rev. Genet., 22: 421-477, 1988. По этой причине должно быть регенерировано несколько ядерных трансформантов, и они должны быть исследованы при скрещивании с линией AP с трансформированными пластидами (или "тест-линии" AP, у которой ген pms является репортерным геном, таким, как uidA, кодирующим β-глюкуронидазу (GUS)), для выявления трансформантов, экспрессирующих соответствующим образом ядерный трансген.
B. Получение и сохранение родительских линий и получение гибридных семян
В соответствии с описанными выше способами вводят три трансгена в отобранные линии растений следующим
образом. Выбирают родительскую линию, родителя A. Пластиды родительского растения A стабильно трансформируют геном pms и регенерируют растение с трансгенными пластидами (AP). Ядра другого
родительского растения A стабильно трансформируют геном nms и регенерируют растение с трансгенными ядрами (AN). Выбирают вторую родительскую линию B. Ядра родительской линии B стабильно
трансформируют геном rmf и регенерируют растение с трансгенными ядрами (BR).
Получив родительские линии AP, AN и BR, можно легко осуществить размножение семенами и получение гибридных семян. Все ядерно-трансформированные родительские линии подвергают инбридингу до получения гомозиготности. Линия AP с трансформированными пластидами является гомоплазматической. Все родительские линии обладают мужской фертильностью и могут сохраняться неограниченное время. Для получения потомства с цитоплазматической мужской стерильностью растение линии AN (мужское родительское растение) скрещивают с растением линии AP (женское родительское растение) с использованием различных методик (таких, как удаление мужских органов у AP или используя AN в качестве мужского родительского растения) для гарантии того, что семена получают в результате скрещивания, а не самооплодотворения. Такое потомство обладает мужской стерильностью, поскольку оно несет как ген pms, так и регуляторный ген nms, который приводит к повреждению или гибели пластид или клеток в выбранной ткани пыльника и следовательно к невозможности образовывать жизнеспособную пыльцу. Стабильную линию AS получают путем повторных обратных скрещиваний с линией AN, что позволяет получить гомозиготность по AN в цитоплазме линии AP.
Семена растений AS с мужской стерильностью могут быть размножены путем обратного скрещивания растений линии AS с родительскими растениями с трансформированными ядрами AN. Для получения семян линии AS растения этой линии AS могут быть высажены рядом с растениями линии AN чередующимися рядами и семена собраны отдельно для каждого ряда. Растения, выращенные из семян, полученных с ряда AS, будут обладать мужской стерильностью. Поскольку мужскую стерильность генерируют на уровне пластиды через трансгенные пластиды, то признак мужской стерильности одинаковым образом наследуется цитоплазматически без получения нежелательной мужской фертильности вследствие сегрегации ядерных генов.
Вторую родительскую линию, родителя B, применяют для получения гибридных семян. Если не требуются гибридные растения с мужской фертильностью, то выполняют простое скрещивание ASхB и потомство ASB должно наследовать признак ЦМС для получения растений, которые также обладают мужской стерильностью, поскольку потомство будет нести по крайней мере одну копию гена nms, но не гена rmf. Если, с другой стороны, желательно из гибридных семян вырастить мужские фертильные растения, то применяют ядерно-трансгенную родительскую линию BR. Для получения гибридных семян с мужской фертильностью растения AS могут быть высажены рядом с формирующими пыльцу растениями BR. Поскольку растения AS не имеют фертильной пыльцы, все семена, полученные на растениях AS, являются результатом оплодотворения пыльцой растений BR. Скрещивание AS с BR приводит к образованию гибридных семян ASBR, из которых будут вырастать растения с мужской фертильностью вследствие экспрессии гена rmf, который блокирует регуляторную активность продукта гена nms в отношении гена pms.
II. Способ "убивания пыльцы"
B одном из примеров осуществления изобретения, названном в
данном описании способом "убивания пыльцы", ген pms представляет собой неактивный ген, модифицированный таким образом, чтобы он мог быть активирован и необязательно инактивирован. Будучи
активированным, ген pms экспрессирует генный продукт, который является токсичным или летальным для пластид. Ген nms представляет собой специфичный для пыльника ядерный ген, который кодирует
пластид-ориентированный полипептид-активатор, способный проникать в пластиды и активировать токсичный ген pms, тем самым повреждая или убивая пластиды выбранной ткани пыльника. Ген rmf родителя B
кодирует генный продукт-"восстановитель", способный влиять на действие полипептида-активатора, предотвращая тем самым образование летального продукта гена pms. В предпочтительном примере осуществления
изобретения ген rmf кодирует пластид-ориентированный полипептид, способный проникать в пластиды и взаимодействовать там с полипептидом-активатором (например, путем взаимодействия с сайтом инактивации
гена pms, перекрывая тем самым действие полипептида- активатора). В другом примере осуществления ген rmf кодирует цитоплазматический генный продукт, который взаимодействует с предшественником
полипептида-активатора до его внедрения в пластиду (например, его мишенью являются ядра, и он ингибирует экспрессию гена nms).
Примером способа "убивания пыльцы" является система, в которой используют РНК-полимеразу фага T7 в качестве полипептида-активатора, lac-репрессор в качестве полипептида-восстановителя и токсичный для пластиды ген-"киллер", соединенный для функционирования с промотором T7/lac. В этом примере осуществления продукт гена nms содержит высокоспецифичную РНК-полимеразу бактериофага T7, слитую с транзитным пептидом пластиды (например, с таковым, представленным малой субъединицей RuBisCO) для направления полимеразы в компартмент стромы пластиды. РНК-полимераза T7 представляет собой относительно простую полимеразу, содержащую мономерный фермент с массой ≈100 кДа. Полимераза специфично связана с короткой (23 пары оснований) последовательностью промотора, причем указанная специфичность препятствует влиянию на экспрессию генов-хозяев. Кодирующая область пластид-ориентированной РНК-полимеразы T7 соединена для функционирования co специфичным для тапетума промотором, так что ген будет транскрибироваться только в клетках тапетума, вызывая гибель этих клеток. Система полимераза T7 с промотором T7/lac наиболее предпочтительна для применения в настоящем изобретении, поскольку не ожидается, что высокий уровень экспрессии полимеразы приведет к каким-либо вредным воздействиям на клетки растений (было обнаружено, что экспрессия полимеразы T7 на уровне, составляющем приблизительно 1% от общего содержания клеточного протеина, не оказывает вредного воздействия на рост дрожжей (Chen и др., Cell, 50:1047-1055,1987)).
Так, в этом примере осуществления родительская линия AN экспрессирует РНК-полимеразу T7, родительская линия AP содержит в пластидах неактивный ген pms, и потомство, полученное при скрещивании ANxAP, обладает цитоплазматической мужской стерильностью вследствие взаимодействия полимеразы фага T7 с промотором T7/lac, что активирует ген pms. Это потомство с мужской стерильностью, линию AS, применяют для получения гибридных семян, как описано выше. Для получения гибридов с мужской фертильностью родительскую линию AS скрещивают с родительской линией BR, в которой происходит экспрессия продукта гена rmf, т.е. пластид-ориентированного lac-репрессора. lac-Репрессор проникает в компартмент пластиды и связывается с последовательностью lac-оператора, включенной в промотор T7/lac, предотвращая тем самым с помощью РНК-полимеразы T7 транскрипцию гена pms (см. Dubendorff & Studier, J. Mol. Biol. , 219: 45-49, 1991). Таким образом, гибридное потомство ASBR будет обладать мужской фертильностью, причем эта фертильность восстанавливается благодаря экспрессии гена rmf.
Описанная выше система T7/lac более детально изложена в примерах 1-3 и схематически изображена на фиг. 1. На основе вышеприведенного описания системы T7/lac должно быть ясно, что для получения таких же эффектов могут применяться другие системы активатора и репрессора. Например, альтернативой для системы РНК-полимераза фага T7/lac-репрессор является система полимераза фага T3/lac-репрессор, описанная у Deuschle и др., Proc. Natl. Acad. Sci. USA, 86: 5400-5404, 1989.
Другой системой, пригодной для практического применения настоящего изобретения, является описанная ниже система репрессора и оператора тетрациклина, которая была приспособлена как к системам млекопитающих, так и к растительным системам (см. Gossen и др. Trends in Biotechnology, 12: 58-62, 1994).
A. Гены пластидной мужской стерильности для способа "убивания пыльцы"
B соответствии со способом "убивания пыльцы" по изобретению ген pms интродуцируют в пластиду в качестве неактивного гена под контролем последовательности-мишени, что позволяет экспрессировать ген
только в присутствии полипептида-активатора, кодируемого геном nms, компонентом другой родительской линии, несущей ЦМС. В этом примере осуществления кодирующая область гена pms кодирует генный продукт
(либо РНК, либо протеин), токсичный для пластид, в которых он вырабатывается. Поскольку пластиды являются местом многих важных метаболических и биохимических процессов у растения, включая фотосинтез
(в хлоропластах), синтез и накопление крахмала (в хлоропластах и амилопластах) и синтез аминокислот и липидов (обычно в пластидах), то в пластидах имеется много мишеней для действия токсичного для
пластиды генного продукта. Примеры возможных токсичных для пластиды систем включают, но не ограничены ими: сверхэкспрессию специфичных для пластид генных продуктов, экспрессию антисмысловой РНК или
рибозим, направленных к мРНК, кодирующим основные продукты пластидного гена, пост-транскрипциональную модификацию жизненно важных протеинов, например, AДФ-рибозилирование (Ueda & Hayaishi, Ann.
Rev. Biochem. , 54: 73-100, 1985) гетерологичных ДНКаз, РНКаз, протеаз и порообразующих протеинов, что делает мембраны пластид проницаемыми или иным образом разрушает системы пластидных мембран. Нужно
отметить, что токсичный генный продукт также может проникать (или быть транслоцированным) в цитоплазму, где он может оказывать токсическое действие. Конкретные примеры пригодных летальных полипептидов
включают следующие, но не ограничены ими:
Полипептид T-urf13 из митохондриального генома кукурузы ЦМС- Т. Как описано в разделе "Предпосылки создания изобретения", полипептид с молекулярной
массой 13 кДа, кодируемый геном urf13, повышает проницаемость биологических мембран, что приводит к появлению ЦМС-фенотипа во встречающихся в естественных условиях системах. Cм. Hanson, Ann. Rev.
Genet., 25: 461-86, 1991. Другие пригодные разрушающие мембрану протеины включают различные мембранные транспортные протеины из дрожжей, бактерий или млекопитающих (см., например, Ortiz и др. , EMBO
J., 11.: 3491-3499, 1992; Guranka и др., FASEB J., 3: 2583-2592, 1989).
Ген CytA токсина из Bacillus thuringiensis israeliensis, кодирующий гемолитический протеин, вызывающий гибель комаров. Экспрессия гена в клетках растений приводит к гибели клетки вследствие разрушения клеточных мембран (McLean и др., J. Bacteriol., 169: 1017-1023, 1987; Ellar и др., патент США 4918006, 1990), биологическая активность этого гена также может быть направлена на мембраны органелл, в том числе на мембраны пластид.
Cre-рекомбиназу из бактериофагов P1 и система Cre-lox для генерации сайт-специфичной рекомбинации и преобразований, которые могут привести к потере жизнеспособности клетки (van Haaren & Ow, Plant Mol. Biol., 23: 525- 533, 1993).
В этом примере осуществления настоящего изобретения кодирующая область гена pms также может кодировать РНК, способную ингибировать критическую для пластиды функцию, вызывая тем самым повреждение пластиды или ее гибель. Это может включать антисмысловые молекулы или рибозимы, конструирование и применение которых известны в данной области техники. Aнтисмысловые молекулы обычно предназначены для связывания с критической областью гена или мРНК, препятствуя таким образом транскрипции или трансляции или инициируя разложение РНК- мишени. Рибозимы включают область гибридизации, комплементарную части нуклеотидной последовательности РНК-мишени, и каталитическую область, которая расщепляет РНК-мишень в определенном месте.
В способе "убивания пыльцы" регулируемая последовательность-мишень гена pms содержит непластидный промотор, который специфично активируют пластид-ориентированным генным продуктом гена nms. В предпочтительном примере осуществления регулируемая последовательность-мишень гена pms также содержит сайт связывания репрессора, расположенный по отношению к промотору так, чтобы связывание специфичного репрессора с сайтом связывания репрессора препятствовало транскрипции гена, даже в присутствии полипептида-активатора (названное здесь как "контролирующее положение" относительно промотора и кодирующей области pms). Для практического применения настоящего изобретения предпочтительно является конструкция T7/lac-промотора, описанная выше у Dubendorff & Studier, J. Mol. Biol., 219: 45-49, 1991. Использование этой последовательности промотор/репрессор позволяет активировать ген pms с помощью пластид-ориентированной РНК- полимеразы T7 и деактивировать ген с помощью пластид-ориентированного lac-репрессора для восстановления мужской фертильности.
Другой регулируемой последовательностью-мишенью, пригодной для практического применения этого примера осуществления, является сайт связывания репрессора tet (tet-оператор), также описанный выше и ниже в связи со способом "истощения пыльцы". lac-Оператор или другие сайты связывания репрессора также приемлемы для систем, в которых применяют химерные полипептиды-активаторы, полученные из домена связывания репрессора и домена гетерологичного активатора.
Б. Гены ядерной мужской стерильности для способа "убивания пыльцы"
Гены ядерной мужской стерильности по настоящему изобретению содержат три элемента: (1) кодирующую область, которая кодирует полипептид-регулятор, трансляционно слитый с (2) пластидным транзитным
пептидом, дающим возможность полипептиду-регулятору, который должен быть транслоцирован в пластиды, осуществлять транскрипцию химерного гена, находясь под контролем (3) специфичного для пыльника
промотора.
Специфичность для пыльника придают ЦМС-системе по изобретению путем установления контроля над кодирующей областью гена nms специфичным для пыльника промотором. Специфичный для пыльника промотор представляет собой таковой, который направляет транскрипцию связанной кодирующей последовательности так, чтобы соответствующая матричная РНК присутствовала в ткани пыльника в концентрации, по крайней мере примерно в 100 раз превышающей таковую в других тканях.
Метаболически активный выстилающий слой (тапетум) пыльника осуществляет функцию питания микроспор, т.е. предшественников пыльцы. Было установлено, что удаление клеток тапетума приводит к ядерной мужской стерильности. Mariani и др., Nature, 347: 737-741, 1990; Mariani и др., Nature, 357: 384-387, 1992. Поэтому в предпочтительном примере осуществления настоящего изобретения применяют специфичные для тапетума промоторы. Специфичные для тапетума промоторы известны в данной области техники, их примеры даны у Mariani и др. , 1990, 1992, см. выше. В другом примере осуществления используют промоторы, специфичные для микроспор. Такие промоторы также известны в данной области техники (например, T52 и T59, описанные у Twell и др., Genes & Devel., 5: 496-507, 1991).
Ген nms может также содержать другие регуляторные сигналы. Например, в конструкцию также может быть включена последовательность, согласующая трансляцию в ядрах растений, а также соответствующие сигналы окончания транскрипции и трансляции ядерных генов растений.
Большинство пластидных протеинов кодируют в ядрах, транслируют в цитоплазму и после трансляции транспортируют в пластиду. Такие кодируемые в ядрах протеины синтезируют в виде предшественников с более высоким молекулярным весом, содержащих N-концевую расщепляемую последовательность, названную транзитным пептидом. Транзитный пептид необходим и достаточен для осуществления транспорта полипептида- предшественника через внешнюю мембрану пластиды (и, в зависимости от окончательного положения полипептида, в различные компартменты пластиды). Транзитные пептиды способны направлять поглощение и внутреннюю локализацию гетерологичных протеинов- "пассажиров", трансляционно слитых с ними. Общие положения см. у Theg & Scott, Trends in Cell Biology, 3: 186-190, 1993; см. также у Schnell & Blobel, J. Cell. Biol. , 120: 103-115, 1993; Kanefsky и др., Proc. Natl. Acad. Sci. USA, 91:1969-1973,1994).
Для практического применения настоящего изобретения используют транзитный пептид, направляющий транслокацию кодируемого в ядре полипептида- регулятора в строму пластиды, так как геномы пластиды, содержащие ген pms, локализованы в строме. В предпочтительном примере осуществления изобретения последовательность ДНК, кодирующую транзитный пептид предшественника (pre-SS) малой субъединицы рибулозо-1,5- бифосфаткарбоксилазы/оксигеназы (RuBisCO), включают в ген nms с целью экспрессии полипептида-предшественника, содержащего регуляторный полипептид, трансляционно слитый с транзитным пептидом pre-SS. Хотя транзитный пептид pre-SS приведен в данном описании в качестве примера, для специалистов в данной области техники должно быть ясно, что любой транзитный пептид, направляющий локализованный в строме кодируемый в ядре протеин, может быть пригоден для практического применения настоящего изобретения.
В способе "убивания пыльцы" ген nms кодирует пластид-ориентированный полипептид-активатор, способный активировать токсичный ген pms с помощью нуклеотидной последовательности-мишени, соединенной для функционирования с геном. Полипептиды-активаторы по изобретению включают полимеразы, ДНК-связывающие протеины, встречающиеся в естественных условиях и синтетические активаторы транскрипции, активаторы трансляции, другие пост-транскрипционные активаторы и т.п., но не ограничены ими. Применение полипептида-активатора для направленной экспрессии другой нуклеотидной последовательности продемонстрировано на примере РНК-полимеразы фага T7, как описано выше. См. патент США N 5122457, выданный на имя Reim и др., патент США 4952496, выданный на имя Studier и др. , а также обзор Studier и др., Meth. Enz., 185: 60-89, 1990.
Полипептид-активатор по изобретению может также содержать другие ДНК-связывающие протеины, необходимые для активации транскрипции специфичных промоторов (например, РНК-полимеразу фага T3). Кроме того, связывающий домен одного протеина может быть слит с доменом активации транскрипции другого протеина. Примером такого химерного протеина является активатор транскрипции tetR/VP16, описанный в обзоре Gossen и др., Trends in Biotech., 12: 58-62, 1994. Другие примеры химерных активаторов транскрипции включают активатор транскрипции LexA (связывающий домен)/Gal4-активатор транскрипции, описанный у Brent & Ptashne, Cell, 43: 729-736, 1985, и Gal4/VP16 (Carey и др., J. Mol. Biol. , 209: 423-432. 1989; Cress и др., Science, 251-87-90, 1991; Sadowski и др., Nature, 335: 563-564, 1988).
В настоящем изобретении также могут применяться активаторы трансляции. Прежде всего пригодны для этой цели лидерные последовательности и их специфичные активаторы трансляции, управляющие высоким уровнем экспрессии вирусных генов. Одним из примеров является активатор трансляции вируса мозаики цветной капусты (TAV), описанный у Flutterer & Hohn, EMBO J., 10: 3887-3896, 1991. В такой системе может быть сконструирован ген pms для кодирования дицистронного транскрипта, где, например, первый цистрон может представлять собой селектируемый ген-маркер, а второй цистрон может представлять собой пластидный летальный ген, причем оба транскрибированы в той же самой мРНК и от одного и того же промотора. Трансляция мРНК селектируемого маркера происходит без добавления других компонентов; однако летальная для пластиды мРНК не будет транслироваться до тех пор, пока присутствует TAV.
В. Гены-восстановители мужской фертильности для способа "убивания пыльцы"
Продукт гена rmf может препятствовать действию гена nms в любой из нескольких точек,
включающих, но не ограниченных ими: (1) в пластидах на гене pms, например, путем воздействия на транскрипцию или трансляцию токсичного для пластиды гена pms или путем дерепрессии основного гена pms,
который был инактивирован nms-кодируемым репрессором; (2) в пластидах, но не обязательно на гене pms, путем воздействия на зрелый регуляторный полипептид, или путем его разрушения; (3) в цитоплазме
путем воздействия на предшественника полипептида-регулятора или разрушения его до того, как он был транслоцирован в хлоропласты; и (4) в цитоплазме или в ядре путем воздействия на экспрессию гена nms
(например, с помощью репрессора транскрипции или трансляции).
Гены rmf по настоящему изобретению включают по крайней мере кодирующую область, которая кодирует продукт гена- восстановителя, соединенную для функционирования с соответствующими 5'- и 3'-регуляторными последовательностями для экспрессии вне ядерного генома. Регуляторные последовательности, необходимые для включения в ген rmf, зависят от точки действия полипептида-регулятора, для которой предназначено воздействие продукта гена rmf, как описано выше.
Специфичность для пыльника продукта гена rmf не является абсолютно необходимой для практического применения настоящего изобретения; ген rmf может быть экспрессирован в других тканях, во время его экспрессии в тканях пыльника, экспрессирующих ген nms. Однако специфичность для пыльника предпочтительна для практического применения настоящего изобретения ввиду того, что систематическая экспрессия гена rmf во всем растении может вызывать токсическое действие, которое часто наблюдают при экспрессии чужеродного гена в клетках-хозяевах. Более того, включение сильного специфичного для пыльника промотора в ген rmf, предпочтительно того же самого или сходного промотора с тем промотором, который применяли для гена nms, будет гарантировать высокий уровень экспрессии гена rmf и образования продукта гена rmf в том месте, где также происходит экспрессия гена nms. Следовательно, ген rmf по изобретению содержит кодирующую область полипептида- восстановителя, соединенную для функционирования со специфичным для пыльника промотором, таким, как описанный выше для гена nms.
Ген rmf также может содержать другие регуляторные сигналы. Например, в конструкцию может быть включена последовательность, согласующая трансляцию в ядрах растений, а также соответствующие сигналы окончания транскрипции и трансляции ядерных генов растений.
Если продуктом гена rmf является полипептид-восстановитель, предназначенный для компартмента стромы пластиды, то кодирующая область гена rmf должна быть сцеплена с последовательностью ДНК, кодирующей транзитный пептид стромы пластиды, такой, как транзитный пепетид pre-SS, описанный выше для гена nms. Последовательности ДНК, кодирующие другие транзитные пептиды для транслокации протеинов в строму пластиды, также известны в данной области техники и могут быть использованы при практическом применении данного аспекта изобретения.
В предпочтительном примере осуществления способа "убивания пыльцы" ген rmf кодирует пластид-ориентированный полипептид, который проникает в пластиды и влияет на действие кодируемого геном nms полипептида-регулятора, направляя регуляцию гена pms в противоположном направлении. Примером этого осуществления является ген rmf, который кодирует пластид- ориентированный lac-репрессорный полипептид. Ген pms содержит сайт связывания lac-репрессора, расположенный относительно активируемой нуклеотидной последовательности-мишени и области, кодирующей pms, так, что связывание lac-репрессора ингибирует транскрипцию гена pms, несмотря на присутствие кодируемого геном nms полипептида-активатора (например, РНК-полимеразы T7).
Как описано выше, в данной области техники известны многочисленные системы-репрессоры транскрипции и трансляции. Эти другие протеины-репрессоры также могут быть применены в качестве кодируемого геном rmf полипептида- восстановителя. Кроме того, также могут быть применены химерные протеины, содержащие ДНК-связывающие домены из одного полипептида и репрессорные домены из другого полипептида, как описано выше для полипептидов-активаторов.
В других примерах осуществления, где используется пластид-ориентированный полипептид-восстановитель, этот полипептид-восстановитель может представлять собой протеин, обладающий способностью специфично связываться с полипептидом- регулятором, препятствуя тем самым его действию на ген pms, их примерами являются пластид-ориентированные иммуноглобулины или их фрагменты, или другие специфические лиганды, связанные с системами репрессор-активатор, известные в данной области техники (например, фермент, генерирующий низкомолекулярный индуктор, который связывается с репрессором и делает его неактивным).
В другом примере осуществления, применимом как для способа "убивания пыльцы", так и для способа "истощения пыльцы", ген rmf кодирует цитоплазматический полипептид, препятствующий проникновению в пластиду кодируемого геном nms предшественника полипептида- регулятора. Протеины, которые могут быть использованы в этом примере осуществления, включают, но не ограничены ими, иммуноглобулины или их фрагменты, специфичные для предшественника полипептида-регулятора, и протеазы или другие ферменты, модифицирующие протеин, способные оказывать специфичное действие на предшественника полипептида-регулятора и делать его неспособным проникать через мембраны пластиды, или терминаторы трансляции, препятствующие трансляции мРНК, кодируемой геном nms.
В другом примере осуществления изобретения ген rmf кодирует ядерно- ориентированный полипептид, такой, как репрессор транскрипции или трансляции, способный проникать в ядро и препятствовать экспрессии гена nms.
Для практического воплощения этого примера по изобретению ген nms должен содержать сайт связывания репрессора для репрессора, кодируемого геном rmf. Касательно этого примера следует отметить, что ядра эукариот, в том числе ядра растений, содержат ряд протеинов, синтезируемых в цитоплазме и транслоцируемых в ядро под воздействием аминокислотных сигнальных последовательностей, входящих в указанные протеины. Такие сигналы локализации, способствующие достижению протеинами ядра, хорошо известны в данной области техники. См., например, Hall и др., Cell, 36: 1057- 1065, 1984 (где описано достижение бактериальной β-галактозидазой ядра дрожжей, посредством локализованной в ядре последовательности из гена MAT альфа 2 дрожжей).
III. Способ "истощения пыльцы"
В другом примере осуществления, названном в данном описании способом "истощения пыльцы", ген pms является гомологичным нативному гену пластиды, необходимому для выживания пластиды, который является
активным, но может быть модифицирован так, чтобы стать неактивируемым (т.е. репрессируемым). Нативный пластидный ген замещают модифицированным геном pms путем гомологичной рекомбинации так, чтобы
растения со стабильно трансформированными пластидами содержали только модифицированную форму гена. В этом примере осуществления ген nms представляет собой специфичный для пыльника ген, кодирующий
пластид-ориентированный полипептид- инактиватор, способный проникать в пластиды и блокировать экспрессию основного гена pms, тем самым повреждая или убивая пластиды выбранной ткани пыльника. Ген rmf
родителя B и в данном варианте кодирует генный продукт-"восстановитель", способный влиять на действие полипептида-инактиватора, позволяя тем самым сохранять активность основному гену pms. В
предпочтительном примере осуществления ген rmf кодирует ядерно-ориентированный полипептид, способный проникать в ядро и оказывать воздействие на экспрессию гена nms. В другом примере осуществления ген
rmf кодирует цитоплазматический генный продукт, влияющий на трансляцию мРНК, кодирующей полипептид-инактиватор, или транслокацию предшественника в пластиды.
Примером способа "истощения пыльцы" является система, в которой используют в качестве полипептида-инактиватора пластид- ориентированный lac-репрессор, в качестве продукта гена rmf ядерно-ориентированный tet-репрессор и основной пластидный ген, соединенный для функционирования с реквизитными 5'- и 3'- регуляторными последовательностями, необходимыми для его экспрессии в пластидах, под контролем по крайней мере одного сайта связывания lac-репрессора.
В этом примере осуществления родительская линия AN экспрессирует пластид-ориентированный полипептид - lac-репрессор, родительская линия AP содержит в пластидах активно модифицированный ген pms, и потомство ANxAP обладает цитоплазматической мужской стерильностью в результате связывания lac-репрессора с сайтом связывания lac-репрессора, что препятствует экспрессии основного гена pms. Для получения гибридов с мужской фертильностью в этом примере осуществления родительскую линию AS скрещивают с родительской линией BR, экспрессируя тем самым ядерно-ориентированный tet-репрессор, являющийся продуктом гена rmf.
Система tet- репрессора может оказаться особенно полезной для растений, поскольку уже было показано для трансгенных растений табака, что тетрациклиновый (tet) репрессор может подавлять транскрипцию промотора вируса мозаики цветной капусты, содержащего три сайта связывания tet-репрессора, находящихся в непосредственной близости к промотору бокса Хогнесса (ТАТА-бокса). Репрессия быстро обратима тетрациклином с фактором регуляции, равным нескольким сотням (Gatz и др., Plant J., 2: 397-404, 1992; Gatz & Quail, Proc. Natl. Acad. Sci. USA, 85: 1394-1397, 1988).
Описанный выше тетрациклиновый репрессор также может применяться в качестве продукта гена nms при практическом применении способа "истощения пыльцы" по изобретению. В этом примере осуществления полипептид-инактиватор содержит пластид- ориентированный tet-репрессор. Ген pms содержит по крайней мере один сайт связывания tet-репрессора, расположенный по отношению к внутренним регуляторным 5'- и 3'-областям так, что связывание tet-репрессора блокирует экспрессию гена pms. Как описано выше, мужскую фертильность гибридов восстанавливают путем трансформации родительской линии B геном rmf, кодирующим другой ядерно- ориентированный репрессор, такой, как lac-репрессор или другой tet-репрессор. Следует отметить, что, как описано выше, пластид- ориентированный репрессор и ядерно-ориентированный репрессор могут быть выбраны из двух различных семейств репрессоров (пластид- ориентированный lac-репрессор и ядерно-ориентированный tet- репрессор, или наоборот). Этот способ также может быть осуществлен с использованием одного и того же репрессора, трансляционно слитого либо с пластид-ориентированной последовательностью, либо с ядерно-ориентированной последовательностью. Однако для осуществления на практике изобретения предпочтительно применение двух различных репрессоров.
A. Гены пластидной мужской стерильности для способа "истощения пыльцы"
В способе "истощения пыльцы" по изобретению основной пластидный ген
замещают гомологичным геном, модифицированным так, чтобы он стал неактивируемым. Модифицированный ген стабильно интегрируют в геном пластиды путем гомологичной рекомбинации, как описано выше. Основные
пластидные гены, пригодные для практического применения этого примера осуществления изобретения, включают: оперон рибосомной РНК, ген рибосомного протеина rpsl6, ген trnV и ген гроВ. Поскольку в этом
варианте ген pms вводят в пластиду в активной форме, этот ген pms должен также содержать естественные пластидные промоторы и другие регуляторные последовательности, необходимые для экспрессии гена pms
в пластидах.
В предпочтительном примере осуществления ген pms содержит описанный выше сайт связывания lac-репрессора. Сайт связывания репрессора так расположен относительно естественных пластидных промоторных последовательностей, контролирующих транскрипцию гена pms, что связывание lac-репрессора ингибирует транскрипцию основного гена, тем самым вызывая повреждение пластиды или ее гибель. Фертильность может быть восстановлена с помощью механизма, влияющего на синтез пластид-ориентированного полипептида-деактиватора в ядре или цитоплазме. Другие сайты связывания репрессора, пригодные для этого примера осуществления изобретения, включают сайт связывания tet-репрессора, сайт связывания LexA (Brent & Ptashue, Cell, 43: 729-736, 1985), и сайт связывания Gal4, но не ограничены ими.
Б. Гены ядерной мужской стерильности для способа "истощения пыльцы"
В способе "истощения пыльцы" ген nms кодирует пластид-ориентированный
полипептид-"инактиватор", препятствующий экспрессии в пластиде основного гена pms. Полипептид-инактиватор может содержать репрессор транскрипции или трансляции, многочисленные примеры которых известны
в данной области техники. В предпочтительном примере осуществления lac- репрессорный протеин кодируется геном nms. Протеин проникает в хлоропласты и связывается с сайтом связывания lac-репрессора,
сцепляясь таким образом с геном pms, что связывание протеина- репрессора с сайтом связывания ингибирует транскрипцию гена pms, приводя тем самым к гибели пластиды.
Другие протеины-репрессоры транскрипции, пригодные для практического применения настоящего изобретения, включают описанный выше tet-репрессор, но не ограничены им. Также могут быть применены химерные протеины, содержащие ДНК-связывающий домен из одного полипептида и репрессорные домены из другого полипептида, как описано выше для полипептидов-активаторов.
B. Гены-восстановители
мужской фертильности для способа "истощения пыльцы"
Как описано выше, продукт гена rmf может препятствовать действию гена nms на любом из нескольких этапов между экспрессией гена nms и
воздействием полипептида, кодируемого геном nms, на ген pms. Гены- восстановители мужской фертильности по настоящему изобретению включают по крайней мере кодирующую область, которая кодирует продукт
гена- восстановителя, соединенную для функционирования с соответствующими 5'- и 3'-регуляторными последовательностями для экспрессии вне ядерного генома. Регуляторные последовательности, которые
необходимо включить в ген rmf, зависят от точки действия в полипептиде-регуляторе, с которой, как описано выше, должен взаимодействовать продукт гена rmf.
Как было отмечено ранее, специфичность для пыльника продукта гена rmf не является абсолютно необходимой, но предпочтительна для практического применения настоящего изобретения. Следовательно, ген rmf содержит кодирующую область для полипептида-восстановителя, действенным образом связанную со специфичным для пыльника промотором, таким, как описанные выше для гена nms.
Ген rmf также может включать другие регуляторные сигналы. Например, согласующая трансляцию ядерная последовательность растений также может быть включена в конструкцию наряду с соответствующими сигналами для окончания транскрипции и трансляции ядерных генов растений.
В наиболее предпочтительном для способа "истощения пыльцы" примере осуществления ген rmf кодирует ядерно-ориентированный полипептид, такой, как репрессор транскрипции, способный проникать в ядро и препятствовать экспрессии гена nms. Для практического применения этого примера осуществления изобретения ген nms должен содержать сайт связывания репрессора для кодируемого геном rmf репрессора. Касательно этого примера следует отметить, что ядра эукариот, в том числе ядра растений, содержат ряд протеинов, синтезируемых в цитоплазме и транслоцируемых в ядра под воздействием аминокислотных сигнальных последовательностей, входящих в указанные протеины. Такие сигналы локализации, способствующие достижению протеинами ядра, хорошо известны в данной области техники. См., например, Hall и др., Cell, 36: 1057-1065, 1984 (где описано достижение бактериальной β-галактозидазой ядра дрожжей посредством локализованной в ядре последовательности из гена MAT альфа 2 дрожжей).
В другом примере осуществления ген rmf кодирует цитоплазматический полипептид, препятствующий вхождению в пластиды кодируемого геном nms предшественника полипептида-регулятора. Протеины, которые могут быть использованы в этом примере осуществления, включают, но не ограничены ими, иммуноглобулины или их фрагменты, специфичные для предшественника полипептида-регулятора, и протеазы или другие модифицирующие протеин ферменты, способные оказывать специфичное действие на предшественника полипептида-регулятора и делать его неспособным проникнуть через мембраны пластиды, или терминаторы трансляции, препятствующие трансляции мРНК, кодируемой геном nms.
В примере осуществления с использованием воздействия на экспрессию гена nms для специалиста в данной области техники должно быть очевидно, что ген rmf может кодировать молекулу РНК, способную препятствовать транскрипции или трансляции гена nms или мРНК. Такая молекула мРНК может представлять собой антисмысловой олигонуклеотид, специфично связывающийся с критической областью гена nms или мРНК. В другом варианте молекула РНК может представлять собой рибозиму, способную связываться с выбранным местом на мРНК, кодируемой геном nms, расщепляя тем самым молекулу мРНК и препятствуя ее трансляции.
Система получения семян с трансгенной ЦМС по настоящему изобретению сходна по структуре с встречающимися в естественных условиях и обычными схемами, основанными на ЦМС. Однако системы по изобретению обладают существенным преимуществом над указанными системами, поскольку они составлены из элементов, полностью охарактеризованными на уровне последовательности ДНК, и в качестве основы для цитоплазматической мужской стерильности используют пластиды, а не митохондрии. В отличие от митохондрий и митохондриального генома пластидный геном хорошо охарактеризован, и способы генетического манипулирования с пластидами существенно лучше разработаны по сравнению с таковыми для митохондрий. В результате основанная на использовании пластид система ЦМС по изобретению практически лишена непредсказуемых вредных характеристик, свойственных системам ЦМС, основанным на использовании митохондрий, и применима для любой культуры, поддающейся исправлению путем применения технологии ядерной или пластидной трансформации. Поскольку применение такой технологии продолжает расширяться, включая новые виды культурных растений, новые способы достижения ЦМС по изобретению могут быть применены к этим культурам. Так, системы по настоящему изобретению позволяют получать гибридные семена, более рентабельные по цене, и позволяют получать гибриды культурных растений, для которых в настоящее время практическое получение гибридных семян не доступно. Такие культуры включают большинство сельскохозяйственных культур США, в том числе пшеницу и хлопчатник.
Следующие примеры представлены для более подробного описания изобретения. Эти примеры приведены только с целью иллюстрации и не ограничивают объем изобретения.
Пример 1.
Способ убивания пыльцы для получения пластидной мужской
стерильности: гены Kpms пластидной мужской стерильности
Способ "убивания пыльцы" по изобретению схематично показан на фиг. 1. В предпочтительном примере осуществления способа "убивания
пыльцы" пластидный ген- "киллер" (Kpms) экспрессируют от регулируемого T7/lac-промотора, содержащего промотор гена 10 фага T7 и оператор lacI, поэтому транскрипция может быть блокирована
lac-репрессором (Studier и др., 1990, см. выше; Dubendorf & Studier, 1991, см. выше). Последовательности промотора, приведенные на фиг. 3, являются модифицированными последовательностями
экспрессирующей плазмиды pET21d (Novagen). На фиг. 3 промотор PT7lac1 имеет лидерную последовательность нетранслируемого гена 10, включающую рибосомный сайт связывания (RBS). Промотор PT7lac2 имеет
лидерную последовательность и RBS пластидного гена rbcL. Оба промотора транскрибируют с сопоставимыми эффективностями. Однако мРНК, имеющие лидерную последовательность гена 10, транслируются
приблизительно в 2000 раз более эффективно, чем таковые, содержащие лидерную последовательность rbcL. Относительно низкий уровень трансляции является предпочтительным для способа "убивания пыльцы",
предотвращая летальное накопление токсичного генного продукта, получаемого от любой транскрипции низкого уровня, идущей от внешних промоторов. Такие редкие транскрипты при эффективной трансляции могут
оказывать вредное воздействие на ткани, не являющиеся мишенями.
Для стабилизации мРНК область, кодирующую ген Kpms, лигируют с модифицированным терминатором гена 10 фага T7 (TT7) или с терминатором Trpsl6T7, который содержит в виде тандема 3'-трейлерную последовательность пластидного гена рибосомного протеина rpsl6 и терминатор гена 10 фага T7 (фиг. 3).
Токсичные гены, пригодные для нарушения функции пластид, перечислены выше в подробном описании изобретения. Для удобства применения в виде полигенных экспрессирующих кластеров гены Kpms должны иметь: (I) сайт рестрикции NcoI, содержащий кодон инициации трансляции (ATG) и (II) сайт XbaI, расположенный непосредственно по ходу транскрипции кодирующей области. Однако также могут быть использованы другие стратегии клонирования, хорошо известные в данной области техники.
Для того, чтобы минимизировать возможность получения транскриптов от внешних промоторов, гены Kpms должны быть интегрированы в транскрипционно молчащую область пластидного генома. Наиболее приемлемым положением является положение между генами trnV и ORF70B, направляющими транскрипцию гена-киллера по направлению к оперонам rps12/7, как это схематично показано на фиг. 4 для вектора-вставки, обозначенного "pC8". Трансформацию и отбор пластидных трансформантов осуществляют в соответствии со стандартными протоколами (Svab & Maliga, 1993, см. выше).
Пример 2.
Способ убивания пыльцы для получения пластидной мужской стерильности: гены Knms ядерной
мужской стерильности
Способ "убивания пыльцы" для получения пластидной мужской стерильности зависит от транскрипции пластидного гена Kpms в клетках тапетума. Успех этой стратегии зависит от:
(I) синхронности развития и тканеспецифичности экспрессии гена Knms, кодирующего РНК-полимеразу T7 и (II) ориентации кодируемого полипептида по направлению к пластидам.
Синхронности развития гена Knms достигают при использовании промоторов, специфичных для тапетума или для микроспор. Пригодным для этой цели является промотор TA29, который временно транскрибируют в течение ранней стадии развития пыльника. Промотор TA29 применяли для получения экспрессии тапетум-специфичного гена и последующей мужской стерильности путем экспрессии химерной рибонуклеазы (Mariani и др., 1990, см. выше). Дополнительные промоторы, для которых характерна специфичность для пыльника, пригодные для экспрессии ядерного гена nms, могут быть получены из различных источников (см. обзор Goldberg и др., Plant Cell, 5: 1217-1229, 1993).
Показанную на фиг. 5 кодирующую область РНК-полимеразы фага T7 в гене Knms трансляционно сливают с транзитным пептидом кодируемого в ядре протеина хлоропласта, т. е. малой субъединицей RuBisCo (SSU). Когда ген Knms экспрессируют в ядре, транзитный пептид целенаправленно доставляет протеин в пластиды. После поступления в пластиды транзитный пептид отщепляют от предшественника протеина T7 (preT7RNAP), получая РНК-полимеразу T7 (T7RNAP) без каких-либо дополнительных аминокислот. Последовательность ДНК, кодирующая транзитный пептид SSU, и соединение слитого T7-протеина показаны на фиг. 5 (вверху). Процессинг preN7RNAP во втором гене (фиг. 5, нижняя последовательность) приводит к получению T7RNAP в пластидах. T7RNAP содержит пять аминокислот зрелой SSU. Протеины, кодируемые двумя генами, могут различаться с точки зрения эффективности их импорта и могут применяться для получения трансгенных растений, накапливающих различные уровни РНК-полимеразы T7.
Растения, экспрессирующие РНК-полимеразу T7, не имеют определенного фенотипа. Для облегчения идентификации растений, несущих ген Knms, этот ген сцепляют с селектируемым геном устойчивости к канамицину в бинарном векторе Agrobacterium (например, в векторе-плазмиде pBI121, Clonetech). В другом варианте плазмиды, которые несут гены Knms, смешивают с плазмидами, несущими селектируемый ген устойчивости к канамицину: например, с плазмидой pLGVneo1103 (Czernylowski и др. , DNA, 5: 101-103, 1986) или с плазмидой pFF19K (Timmermans и др. , 1990, см. выше). Для достижения одновременной интеграции обоих генов в одном и том же генетическом локусе применяют биобаллистическую трансформацию смешанной ДНК с последующей селекцией на устойчивость к канамицину. Косегрегация генов устойчивости к канамицину и полимеразы фага T7 доказывает, что оба гена интегрированы в одном и том же генетическом локусе.
Пример 3.
Способ убивания пыльцы для получения пластидной мужской стерильности: ядерные гены-восстановители Krmf мужской фертильности
Пластидная мужская стерильность представляет собой фенотипический
признак растений, несущих как пластидный ген Kpms, так и ядерный ген Knms. Восстановление мужской фертильности зависит от присутствия второго ядерного гена-восстановителя фертильности, Krmf,
предпочтительно применяемого в способе получения пластидной мужской стерильности путем "убивания пыльцы". Ген Krmf проявляет свое действие путем блокирования экспрессии пластидного гена Kpms (фиг. 1).
Эту регуляцию медиируют через область промотора гена Kpms.
Промоторы РТ7lac1 и РТ7lac2, показанные на фиг. 3, могут регулироваться: (I) положительно путем пластид-ориентированной РНК-полимеразы Т7 (вверху) и (II) отрицательно с помощью lac- репрессора. Восстановление мужской фертильности зависит от присутствия lac-репрессора в пластидах в концентрации, достаточной для того, чтобы блокировать активность продукта гена Knms.
Экспрессия гена Krmf до и во время экспрессии гена ядерной мужской стерильности, Knms, важна для полного восстановления мужской стерильности. Наиболее простым и эффективным путем достижения этого является экспрессия протеина, кодируемого lac-репрессором от конститутивного промотора, такого, как промотор 35S вируса мозаики цветной капусты, содержащего блок пыльника, в конструкции pTS24 (van der Meer и др., Plant Cell, 4: 253-262, 1992). В другом варианте транскрипция может быть направлена промотором специфичного для пыльника гена, который активируют перед экспрессией гена Knms. Промоторы, пригодные для запуска экспрессии ядерного гена-восстановителя, характеризующиеся специфичностью для пыльника, доступны из различных источников, как это описано в обзоре Goldberg и др., 1993, см. выше. Кроме того, восстановление ядерной мужской стерильности также может быть осуществлено с использованием одинаковых промоторов (ТА29) для экспрессии как индуцирующих стерильность, так и восстанавливающих фертильность трансгенов (Mariani и др. , 1992, см. выше).
Для направленной доставки lac-репрессора в пластиды его сливают с транзитным пептидом, являющимся малой субъединицей RuBisCo. Конструкция гена и последовательность ДНК и протеина критического транзитного пептида и слияние кодирующей области lacI показаны на фиг. 6 и описаны выше для гена Knms. Следует отметить, что на диаграмме на фиг. 6 показана экспрессия от конститутивного нетканеспецифичного промотора P35S (Timmerman и др., 1990, см. выше). Однако для специфичной для пыльника экспрессии должен быть использован производный промотор, содержащий блок пыльника (например, PTS24, van der Meer и др., 1992, см. выше).
При введении в ядерный геном ген Krmf сцепляют с селектируемым маркером устойчивости к гентамицину, кодируемым химерным геном aacC1 (Carrer и др., Plant Mol Biol., 17: 301-303, 1991). Способы трансформации идентичны таковым, описанным для гена Knms. Ген устойчивости к гентамицину, сцепленный с геном Krmf, легко отличим от гена устойчивости к канамицину, сцепленного с Knms, и от гена устойчивости к спектиномицину, сцепленного с пластидным геном Kpms.
Пример 4. Способ "истощения пыльцы" для получения пластидной мужской стерильности: гены Spms пластидной
мужской стерильности
Вследствие того, что для интактных органелл необходимо поддерживать биосинтез аминокислот и липидов, прекращение синтеза протеинов в пластидах приводит к гибели клетки.
Следовательно, блокирование экспрессии генов, необходимых для сохранения пластиды, также может быть использовано для дегенерации клеток тапетума или микроспор.
Гены пластидной мужской стерильности (Spms) в способе "истощения пыльцы" являются эндогенными пластидными генами, экспрессируемыми от промоторов химерных пластид с включенными в них сайтами связывания lac-репрессора. Эти промоторы в соматических клетках транскрибируются пластидной РНК-полимеразой. Однако, экспрессию пластидных генов в клетках тапетума предотвращают с помощью lac-репрессора, который конструируют так, чтобы он экспрессировался только в клетках тапетума, микроспорах или других клетках пыльника. рРНК-оперон представляет собой предпочтительную мишень для подавления в способе "истощения пыльцы". Модифицированные промоторы рРНК- оперона и промотор гена trnV с последовательностью lac-оператора показаны на фиг. 7. Эти промоторы применяют для замещения родственных промоторов эндогенных генов путем гомологичной рекомбинации. Производные промотора рРНК-оперона, модифицированные для экспрессии протеина, показаны на фиг. 8. Два промотора различаются своей лидерной последовательностью (рибосомным сайтом связывания). Из двух промоторов мРНК с лидерной последовательностью гена 10, по-видимому, должны транслироваться более эффективно.
Промоторы эндогенных генов замещают промоторами Spms путем сцепления с селектируемым геном устойчивости к спектиномицину (aadA) (Maliga и др., 1993). Гены Spms транскрибируют пластидной РНК-полимеразой во всех тканях кроме клеток тапетума, в которых пластид- ориентированный lac-репрессор получают из гена Snms. Пластид- ориентированный lac-репрессор блокирует транскрипцию от промоторов Spms, приводя к гибели клетки.
Пример 5.
Способ "истощения пыльцы" для получения пластидной мужской стерильности: гены Snms ядерной мужской стерильности
Как описано в примере 4, мужскую
стерильность пыльцы при использовании способа "истощения пыльцы" получают путем блокирования транскрипции эндогенного пластидного гена. Отсутствие транскрипции обусловлено аккумуляцией в пластидах
lac-репрессора и его связыванием с последовательностями lac- оператора в химерном промоторе гена Spms. Тканеспецифичную экспрессию lac-репрессора получают, применяя специфичные для пыльника промоторы,
как описано для гена Knms (пример 2). Однако промотор Snms чувствителен к репрессору тетрациклина (tet), поэтому экспрессии гена Snms можно препятствовать, используя ген Srmf, кодирующий
ядерно-ориентированный tet-репрессор (см. пример 6). Гены Snms генетически сцеплены с маркерами устойчивости к канамицину, как это описано для гена Knms (пример 2).
Пример 6
Способ "истощения пыльцы" для получения пластидной мужской стерильности: гены Srmf ядерной мужской стерильности
Восстановление мужской фертильности требует восстановления нормальной
активности гена Spms в пластидах клеток тапетума. Наилучшим образом это может быть достигнуто путем блокирования экспрессии ядерного гена Snms. Ген Snms экспрессируют от специфичного для пыльника
промотора, который также содержит копии палиндромного tet-оператора длиной 19 пар оснований. Ген-восстановитель фертильности системы, Srmf, кодирует tet-репрессор, мишенью которого является ядро, и
регулирует в прямом направлении 500-кратную экспрессию гена Snms. Эта система описана у Gatz и др., Plant J., 2: 397-404, 1992. Ген Srmf сцепляют с геном устойчивости к гентамицину так, чтобы растение
с этим геном можно было бы легко отличить от растений, несущих ген Spms (сцепленный с устойчивостью к спектиномицину) и гены Snms (сцепленные с устойчивостью к канамицину).
Реферат
Способы предназначены для использования в сельском хозяйстве. Система цитоплазматической мужской стерильности (ЦМС-система) включает три трансгена: ген пластидной мужской стерильности (pms), регулируемый геном ядерной мужской стерильности (nms), и ген-восстановитель мужской фертильноcти (rmf). Ген pms либо является неактивным геном, кодирующим токсичный генный продукт, либо является активно экспрессируемым геном, кодирующим основной генный продукт. Ген nms контролируется специфичным для пыльника промотором и кодирует плаcтид-ориентированный полипептид, который регулирует ген pms либо путем активации экспрессии неактивного токсичного гена pms, либо путем подавления экспрессии основного гена pms, что приводит к повреждению пластид и клеток или их гибели в ткани пыльника, предотвращая тем самым образование жизнеспособной пыльцы. Ген rmf кодирует генный продукт, который препятствует регуляции гена pms геном nms. 2 c. и. 29 з.п.ф-лы, 18 ил.


Комментарии