Замещенные хроманы - RU2718060C2
Код документа: RU2718060C2
Описание
Уровень техники изобретения
Настоящее изобретение относится к замещенным хромановым соединениям, которые являются модуляторами белка муковисцидозного трансмембранного регулятора проводимости (CFTR), полезными при лечении заболеваний и состояний, опосредованных и модулированных CFTR. Кроме того, изобретение относится к композициям, содержащим соединения по настоящему изобретению, и к способам их получения.
Муковисцидоз (CF), одно из наиболее распространенных аутосомно-рецессивных наследственных заболеваний среди представителей белой европеоидной расы, вызван потерей функции вследствие мутаций в гене муковисцидозного трансмембранного регулятора проводимости (CFTR), который расположен на хромосоме 7 (http://www.cff.org/AboutCF/; Rowe S.M et al. (2005); N Eng J Med. (352), 1992-2001). Приблизительно 1:3500 и 1:3000 младенцев, рожденных в Соединенных Штатах и в Европе, соответственно, страдают от CF, как результат ~75000 случаев заболевания во всем мире, ~30000 из которых приходятся на Соединенные Штаты Америки. Ежегодно диагностируют приблизительно 1000 новых случаев CF, причем более 75% пациентов диагностируется к 2-летнему возрасту. Почти половина больных CF в настоящее время составляет 18 лет и старше. Белок CFTR (Gregory, R. J. et al. (1990) Nature 347:382-386; Rich, D. P. et al. (1990) Nature 347:358-362; Riordan, J. R. et al. (1989) Science 245:1066-1073) представляет собой цАМФ/АТФ-опосредованный ионный канал, экспрессируемый в различных типах клеток, включая секреторные и абсорбирующие эпителиальные клетки. CFTR регулирует поток анионов хлорида и бикарбоната через клеточную мембрану, сохраняя электронейтральность и осмолярность через эпителиальную мембрану (Quinton, P. M. (1990), FASEB J. 4: 2709-2727). CFTR также отвечает за регуляцию активности других ионных каналов и белков (Guggino, W.B. et al. (2006), Nat RevsMolecular Cell Biology 7, 426-436).
Нарушения в функции CFTR приводят к дисбалансу жидкости, покрывающей поверхность дыхательных путей, что приводит к дегидратации слизи, воспалению, рецидивирующей бактериальной инфекции и необратимому повреждению легких, что приводит к преждевременной смерти пораженных заболеванием пациентов. Помимо респираторного заболевания, больные CF страдают от желудочно-кишечных проблем и недостаточности поджелудочной железы. Большинство мужчин (95%) с муковисцидозом бесплодны в результате азооспермии, вызванной измененными семявыносящими протоками; которые могут отсутствовать, атрофированы или фиброзные. Фертильность также снижается у женщин с муковисцидозом вследствие аномальной слизи цервикального канала.
Мутация F508del, наиболее часто встречающаяся приблизительно из 1900 идентифицированных полиморфизмов в CFTR, приводит к нарушению процессинга CFTR в эндоплазматическом ретикулуме (ER) (http://www.cftr2.org/index.php). Приблизительно 90% пациентов с CF имеют по меньшей мере одну копию мутации F508del (делеция фенилаланина в положении 508), и 50-60% пациентов являются гомозиготами по этой мутации. Нарушение процессинга CFTR приводит к ранней деградации CFTR, что приводит к снижению направленной миграции или отсутствию белка на мембране. Так как было обнаружено более 100 мутаций, вызывающих заболевание CF, они были классифицированы в соответствии с их фенотипическими последствиями и относятся к синтезу, созреванию, регуляции, проводимости, снижению количества функциональных белков и уменьшению числа из-за классификаций стабильности.
В настоящее время усилия по открытию лекарственного средства сфокусированы на разработке двух классов соединений для модуляции CFTR. Один класс, называемый корректоры, помогает преодолеть дефекты укладки мутированного белка CFTR, чтобы способствовать его созреванию, что приводит к более высокой экспрессии на клеточной поверхности. Другие классы соединений, называемые потенцирующие средства, помогают преодолеть дефектную регуляцию и/или проводимость белка, увеличивая вероятность открытия канала на поверхности мембраны.
Кроме того, поскольку модуляция мутаций белка CFTR для содействия правильному сворачиванию белка является полезной для CF, существуют другие заболевания, опосредованные CFTR. Например, синдром Шегрена (SS), аутоиммунное расстройство, приводящее к появлению симптомов ксеростомии (сухость во рту) и сухого кератоконъюнктивита (KCS, сухость глаз), может быть результатом нарушения регуляции выделения влаги железами по всему телу. Хроническая обструктивная болезнь легких (COLD) или хроническое обструктивное заболевание дыхательных путей (COAD), которая характеризуется прогрессивным и необратимым ограничением воздушного потока в дыхательных путях, является результатом ряда физиологических нарушений, включая гиперсекрецию слизи и нарушенную мукоцилиарную секрецию. Было предложено увеличение секреции анионов с помощью CFTR потенцирующих средств для преодоления этих фенотипических сложностей с синдромом Шегрена путем увеличения гидратации роговицы и преодоления ослабленной мукоцилиарной секреции при COAD (Bhowmik A, et al. (2009) Vol. 103(4), 496-502; Sloane P, et al. PLOS One (2012) Vol 7(6), 239809 (1-13)).
Соответственно, существует потребность в новых соединениях, способных модулировать CFTR. В частности, настоящее изобретение раскрывает соединения, которые могут действовать в качестве модуляторов CFTR для лечения муковисцидоза. Настоящее изобретение также относится к способам получения этих соединений, фармацевтическим композиция, содержащим эти соединения, и к способам лечения муковисцидоза путем введения соединений по настоящему изобретению.
Сущность изобретения
В одном аспекте настоящее изобретение относится к соединениям формулы (I)
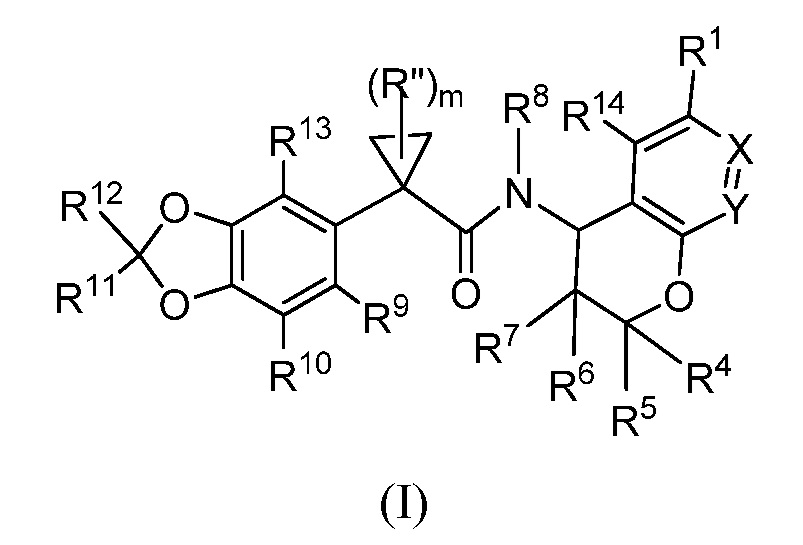
или их фармацевтически приемлемой соли, где:
X представляет собой CR2 и Y представляет собой CR3; или
X представляет собой N и Y представляет собой CR3; или
X представляет собой CR2 и Y представляет собой N;
m равно 0, 1, 2 или 3;
Rʺ представляют собой необязательные заместители в циклопропильном кольце и в каждом случае независимо представляют собой галоген, C1-C6 галогеналкил или C1-C6 алкил;
каждый R1 и R2 независимо представляют собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A, -C(O)OR1B, -NR1AR2A или -C(O)NR1AR2A;
каждый R1A и R2A в каждом случае независимо представляют собой водород, C1-C6 галогеналкил, G1A или C1-C6 алкил; где C1-C6 галогеналкил и C1-C6 алкил каждый необязательно замещены одним или двумя заместителями, независимо выбранными из группы, состоящей из -ORZA, -SRZA, -S(O)2RZA, -C(O)RZA, -C(O)ORZA, -C(O)N(RZA)2, -N(RZA)2, -N(RZA)C(O)RZB, -N(RZA)S(O)2RZB, -N(RZA)C(O)ORZB, -N(RZA)C(O)N(RZA)2, -CN и G1A; или R1A и R2A вместе с атомом азота, к которому они присоединены, образуют 4-6-членный гетероцикл, где 4-6-членный гетероцикл необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, C1-C6 алкила, C1-C6 галогеналкила, -ORj, и N(Rj)2; где
RZA в каждом случае независимо представляет собой водород, C1-C6 галогеналкил, C1-C6 алкил, G1A или -(C1-C6 алкиленил)-G1A; и
RZB в каждом случае независимо представляет собой C1-C6 галогеналкил, C1-C6 алкил, G1A или -(C1-C6 алкиленил)-G1A;
R1B представляет собой водород, C1-C6 галогеналкил или C1-C6 алкил;
R3 и R14 каждый независимо представляют собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OH или -O-(C1-C6 алкил);
R4 представляет собой водород, C1-C6 галогеналкил или C1-C6 алкил;
R5 представляет собой водород, -C(O)Ri, -C(O)OH, -C(O)O(C1-C6 алкил), -C(O)N(Rh)2, C1-C6 галогеналкил, C1-C6 алкил или G2A; где каждый C1-C6 галогеналкил и C1-C6 алкил необязательно замещены одним или двумя заместителями, независимо выбранными из группы, состоящей из -ORh, -OC(O)N(Rh)2, -C(O)Rh, -C(O)ORh, -C(O)N(Rh)2, -N(Rh)2, -N(Rh)C(O)Ri, -N(Rh)S(O)2Ri, -N(Rh)C(O)O(Ri), -N(Rh)C(O)N(Rh)2 и G2A; или
R4 и R5 вместе с атомом углерода, к которому они присоединены, образуют C3-C6 циклоалкил или 4-6-членный гетероцикл; где каждый C3-C6 циклоалкил и 4-6-членный гетероцикл необязательно замещен 1, 2 или 3 независимо выбранными группами Rp;
G2A, в каждом случае, независимо представляет собой циклоалкил, циклоалкенил, гетероцикл, арил или гетероарил, каждый из которых независимо является незамещенным или замещенным 1, 2 или 3 независимо выбранными группами Rq;
Rp и Rq, в каждом случае, каждый независимо представляют собой C1-C6 алкил, галоген, C1-C6 галогеналкил, -CN, оксо, NO2, -ORh, -OC(O)Ri, -OC(O)N(Rh)2, -SRh, -S(O)2Rh, -S(O)2N(Rh)2, -C(O)Rh, -C(O)ORh, -C(O)N(Rh)2, -C(O)N(Rh)S(O)2Rh, -N(Rh)2, -N(Rh)C(O)Ri, -N(Rh)S(O)2Ri, -N(Rh)C(O)O(Ri), -N(Rh)C(O)N(Rh)2 или GA, где каждый C1-C6 галогеналкил и C1-C6 алкил необязательно замещены одним или двумя заместителями, независимо выбранными из группы, состоящей из -ORh, -OC(O)Ri, -OC(O)N(Rh)2, -SRh, -S(O)2Rh, -S(O)2N(Rh)2, -C(O)Rh, -C(O)ORh, -C(O)N(Rh)2, -C(O)N(Rh)S(O)2Rh, -N(Rh)2, -N(Rh)C(O)Ri, -N(Rh)S(O)2Ri, -N(Rh)C(O)O(Ri), -N(Rh)C(O)N(Rh)2, -CN и GA;
Rh в каждом случае независимо представляет собой водород, C1-C6 галогеналкил, C1-C6 алкил или GA, где каждый C1-C6 галогеналкил и C1-C6 алкил необязательно замещены одним или двумя заместителями, независимо выбранными из группы, состоящей из -ORj, -OC(O)N(Rj)2, -SRj, -C(O)ORj, -C(O)N(Rj)2, -N(Rj)2, -CN и GA;
Ri в каждом случае независимо представляет собой C1-C6 галогеналкил, C1-C6 алкил или GA, где каждый C1-C6 галогеналкил и C1-C6 алкил необязательно замещены одним или двумя заместителями, независимо выбранными из группы, состоящей из -ORj, -OC(O)N(Rj)2, -SRj, -C(O)ORj, -C(O)N(Rj)2, -N(Rj)2, -CN и GA;
R6 представляет собой водород, галоген, C1-C6 галогеналкил или C1-C6 алкил;
R7 представляет собой водород, галоген, -ORj, -N(Rj)2, -N(Rj)C(O)Rk, C1-C6 галогеналкил, C1-C6 алкил, C2-C6 алкенил или -(C1-C6 алкиленил)-G3A;
R8 представляет собой водород, C1-C6 галогеналкил или C1-C6 алкил;
каждый R9, R10, и R13 независимо представляют собой водород, галоген, -ORj, C1-C6 галогеналкил или C1-C6 алкил;
каждый R11 и R12 независимо представляют собой водород, C1-C3 алкил или галоген;
G1A, G3A и GA, в каждом случае, каждый независимо представляют собой циклоалкил, циклоалкенил, гетероцикл, арил или гетероарил, каждый из которых является независимо незамещенным или замещенным 1, 2 или 3 независимо выбранными группами Rs; где
Rs в каждом случае независимо представляет собой C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, галоген, C1-C6 галогеналкил, -CN, оксо, NO2, -ORj, -OC(O)Rk, -OC(O)N(Rj)2, -SRj, -S(O)2Rj, -S(O)2N(Rj)2, -C(O)Rj, -C(O)ORj, -C(O)N(Rj)2, -N(Rj)2, -N(Rj)C(O)Rk, -N(Rj)S(O)2Rk, -N(Rj)C(O)O(Rk), -N(Rj)C(O)N(Rj)2, -(C1-C6 алкиленил)-ORj, -(C1-C6 алкиленил)-OC(O)Rk, -(C1-C6 алкиленил)-OC(O)N(Rj)2, -(C1-C6 алкиленил)-SRj, -(C1-C6 алкиленил)-S(O)2Rj, -(C1-C6 алкиленил)-S(O)2N(Rj)2, -(C1-C6 алкиленил)-C(O)Rj, -(C1-C6 алкиленил)-C(O)ORj, -(C1-C6 алкиленил)-C(O)N(Rj)2, -(C1-C6 алкиленил)-N(Rj)2, -(C1-C6 алкиленил)-N(Rj)C(O)Rk, -(C1-C6 алкиленил)-N(Rj)S(O)2Rk, -(C1-C6 алкиленил)-N(Rj)C(O)O(Rk), -(C1-C6 алкиленил)-N(Rj)C(O)N(Rj)2 или -(C1-C6 алкиленил)-CN;
Rj в каждом случае независимо представляет собой водород, C1-C6 алкил или C1-C6 галогеналкил; и
Rk в каждом случае независимо представляет собой C1-C6 алкил или C1-C6 галогеналкил.
Другой аспект настоящего изобретения относится к фармацевтическим композициям, содержащим соединения понастоящему изобретению или их фармацевтически приемлемые соли и фармацевтический носитель. Такие композиции можно вводить в соответствии со способом по настоящему изобретению, как правило, как часть схемы терапевтического лечения для лечения или профилактики состояний и заболеваний, связанных с активностью муковисцидозного трансмембранного регулятора проводимости. В конкретном аспекте фармацевтические композиции могут дополнительно содержать еще один или несколько терапевтически активных ингредиентов, подходящих для применения в комбинации с соединениями по настоящему изобретению. В более конкретном аспекте дополнительный терапевтически активный ингредиент представляет собой средство для лечения муковисцидоза.
Кроме того, соединения по настоящему изобретению или их фармацевтически приемлемые соли, полезные в фармацевтических композициях и способах лечения, описанных в настоящем документе, являются фармацевтически приемлемыми в том виде, как они получены и использованы.
Еще один аспект настоящего изобретения относится к способу корректировки дефектов укладки мутированного белка(ов) CFTR для содействия его созреванию, приводящему к более высокой экспрессии на клеточной поверхности. Способ является полезным для лечения или профилактики состояний и заболеваний, связанных с активностью муковисцидозного трансмембранного регулятора проводимости у млекопитающих. Более конкретно, способ является полезным для лечения или профилактики состояний и заболеваний, связанных с муковисцидозом, синдромом Шегрена, недостаточностью поджелудочной железы, хроническим обструктивным заболеванием легких или хроническим обструктивным заболеванием дыхательных путей.
Далее описываются соединения, композиции, содержащие соединения или их фармацевтически приемлемые соли, способы получения соединений и способы лечения или профилактики состояний и заболеваний путем введения соединений.
В конкретном аспекте соединения по настоящему изобретению или их фармацевтически приемлемые соли предусмотрены для использования при лечении муковисцидоза. В конкретном аспекте соединения по настоящему изобретению или их фармацевтически приемлемые соли предусмотрены для использования при лечении муковисцидоза, вызванного мутациями I, II, III, IV, V и/или VI класса.
Настоящее изобретение также относится к фармацевтическим композициям, содержащим соединение по настоящему изобретению или его фармацевтически приемлемые соли и подходящий фармацевтический носитель для применения в медицине. В конкретном аспекте фармацевтическая композиция предназначена для использования при лечении муковисцидоза.
В альтернативном варианте осуществления некоторые соединения по настоящему изобретению обладают корректирующей активностью.
В другом конкретном аспекте некоторые соединения по настоящему изобретению обладают повышенной активностью, кроме того, показывают слабое действие на экспрессию CYP3A4, что предполагает низкий потенциал взаимодействия с другими лекарственными средствами и, соответственно, может быть полезным для пациентов при комплексных терапиях.
Эти и другие задачи настоящего изобретения описаны в следующих ниже абзацах. Эти задачи не должны рассматриваться как ограничивающие объем изобретения.
Подробное описание изобретения
Настоящее изобретение представляет соединения формулы (I)
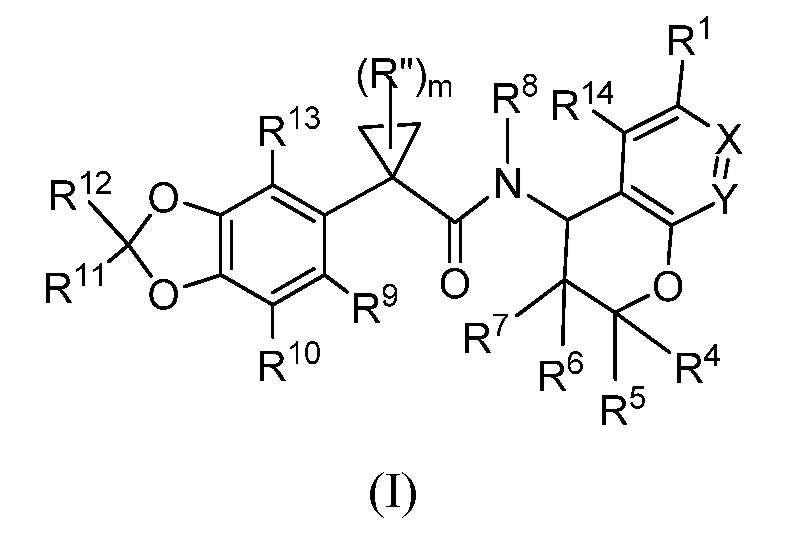
где R1, X, Y, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, m и Rʺ определены выше в разделе ʺСущность изобретенияʺ и ниже в разделе ʺПодробное описание изобретенияʺ. Кроме того, также включены композиции, содержащие такие соединения, и способы лечения состояний и заболеваний с использованием таких соединений и композиций.
Соединения, включенные в настоящее описание, могут содержать одну или несколько переменных, которые встречаются более одного раза в любом заместителе или в приведенных в настоящем описании формулах. Определение переменной в каждом случае не зависит от ее определения в другом случае. Кроме того, комбинации заместителей допустимы, только если такие комбинации приводят к образованию стабильных соединений. Стабильные соединения представляют собой соединения, которые могут быть выделены из реакционной смеси.
Определения
Следует заметить, что как используется в настоящем описании и в прилагаемой формуле изобретения формы единственного числа включают объекты во множественном числе, если контекст явно не диктует иное. Так, например, ссылка на ʺсоединениеʺ включает в себя одно соединение, а также одно или несколько одинаковых или различных соединений, ссылка на ʺнеобязательно фармацевтически приемлемый носительʺ относится к одному необязательно фармацевтически приемлемому носителю, а также к одному или нескольким фармацевтически приемлемым носителям и тому подобное.
Как используется в настоящем описании и прилагаемой формуле изобретения, если не указано иное, следующие термины имеют указанное значение:
Термин ʺалкенилʺ, как используется в настоящем описании, означает линейную или разветвленную углеводородную цепь, содержащую от 2 до 10 атомов углерода и содержащую по меньшей мере одну углерод-углеродную двойную связь. Термин ʺC2-C6 алкенилʺ означает алкенильную группу, содержащую 2-6 атомов углерода. Неограничивающие примеры C2-C6 алкенила включают бута-1,3-диенил, этенил, 2-пропенил, 2-метил-2-пропенил, 3-бутенил, 4-пентенил и 5-гексенил.
Термин ʺалкилʺ, как используется в настоящем описании, означает насыщенный углеводородный радикал с прямой или разветвленной цепью. В некоторых случаях число атомов углерода в алкильной группе указано с помощью префикса ʺCx-Cyʺ, где x является минимальным и y является максимальным числом атомов углерода в заместителе. Так, например, ʺC1-C6 алкилʺ означает алкильный заместитель, содержащий от 1 до 6 атомов углерода, и ʺC1-C3 алкилʺ относится к алкильному заместителю, содержащему от 1 до 3 атомов углерода. Типичные примеры C1-C6 алкила включают, но ими не ограничиваются, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 3,3-диметилбутил, 1,1-диметилпропил, 1,2-диметилпропил, 2,2-диметилпропил, 1-метилпропил, 2-метилпропил, 1-этилпропил и 1,2,2-триметилпропил.
Термин ʺалкиленʺ или ʺалкиленилʺ означает двухвалентный радикал, полученный из прямой или разветвленной насыщенной углеводородной цепи, например, 1-10 атомов углерода или 1-6 атомов углерода (C1-C6 алкиленил) или 1-4 атома углерода или 1-3 атомов углерода (C1-C3 алкиленил) или 2-6 атомов углерода (C2-C6 алкиленил). Примеры C1-C6 алкиленила включают, но ими не ограничиваются, -CH2-, -CH2CH2-, -C((CH3)2)-CH2CH2CH2-, -C((CH3)2)-CH2CH2, -CH2CH2CH2CH2- и -CH2CH(CH3)CH2-.
Термин ʺC2-C6 алкинилʺ, как используется в настоящем описании, означает углеводородный радикал с прямой или разветвленной цепью, содержащий от 2 до 6 атомов углерода и содержащий по меньшей мере одну тройную углерод-углеродную связь. Типичные примеры C2-C6 алкинила включают, но ими не ограничиваются, ацетиленил, 1-пропинил, 2-пропинил, 3-бутинил, 2-пентинил и 1-бутинил.
Термин ʺарилʺ, как используется в настоящем описании, означает фенил или бициклический арил. Бициклический арил представляет собой нафтил или фенил, конденсированный с моноциклическим циклоалкилом, или фенил, конденсированный с моноциклическим циклоалкенилом. Неограничивающие примеры арильных групп включают дигидроинденил, инденил, нафтил, дигидронафталенил и тетрагидронафталенил. Фенил и бициклические арилы (включая иллюстративные кольца) являются необязательно замещенными, если не указано иное. Фенил и бициклические арилы присоединены к исходному молекулярному фрагменту через любой атом углерода, содержащийся в бициклических кольцевых системах.
Термин ʺциклоалкилʺ, как используется в настоящем описании, относится к радикалу, который представляет собой моноциклический циклоалкил или бициклический циклоалкил. Моноциклический циклоалкил представляет собой карбоциклическую кольцевую систему, содержащую от трех до восьми атомов углерода, ноль гетероатомов и ноль двойных связей. Примеры моноциклического циклоалкила включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Бициклический циклоалкил представляет собой моноциклический циклоалкил, конденсированный с моноциклическим циклоалкильным кольцом. Моноциклическая и бициклическая циклоалкильные группы могут дополнительно содержать один или два алкиленовых мостика, каждый из которых состоит из одного, двух, трех или четырех атомов углерода в длину, и каждый мостик связывает два несмежных атома углерода кольцевой системы. Неограничивающие примеры мостиковых кольцевых систем включают бицикло[3.1.1]гептил, бицикло[2.2.1]гептил, бицикло[2.2.2]октил, бицикло[1.1.1]пентил, бицикло[3.2.2]нонил, бицикло[3.3.1]нонил, бицикло[4.2.1]нонил, трицикло[3.3.1.03,7]нонил (октагидро-2,5-метанопентален или норадамантил) и трицикло[3.3.1.13,7]декан (адамантил). Моноциклические и бициклические циклоалкилы, включая иллюстративные кольца, являются необязательно замещенными, если не указано иное. Моноциклический циклоалкил и бициклический циклоалкил присоединены к исходному молекулярному фрагменту посредством любого способного к замещению атома углерода, имеющегося в кольцевой системе.
Термин ʺC3-C6 циклоалкилʺ, как используется в настоящем описании, означает циклопропил, циклобутил, циклопентил и циклогексил, каждый из которых является необязательно замещенным, если не указано иное.
Термин ʺциклоалкенилʺ как используется в настоящем описании, относится к моноциклическому или бициклическому углеводородному кольцевому радикалу. Моноциклический циклоалкенил имеет четыре, пять, шесть, семь или восемь атомов углерода и ноль гетероатомов. Четырехчленные кольцевые системы имеют одну двойную связь, пяти- или шестичленные кольцевые системы имеют одну или две двойных связи и семи- или восьмичленные кольцевые системы имеют одну, две или три двойных связи. Типичные примеры моноциклических циклоалкенильных групп включают, но ими не ограничиваются, циклобутенил, циклопентенил, циклогексенил, циклогептенил и циклооктенил. Бициклический циклоалкенил представляет собой моноциклический циклоалкенил, конденсированный с моноциклической циклоалкильной группой, или моноциклический циклоалкенил, конденсированный с моноциклической циклоалкенильной группой. Моноциклическое и бициклическое циклоалкенильное кольцо может содержать один или два алкиленовых мостика, каждый из которых состоит из одного, двух или трех атомов углерода, и каждый связывает два несмежных атома углерода кольцевой системы. Типичные примеры бициклических циклоалкенильных групп включают, но ими не ограничиваются, 4,5,6,7-тетрагидро-3аН-инден, октагидронафталенил и 1,6-дигидропентален. Моноциклические и бициклические циклоалкенилы, включая иллюстративные кольца, необязательно являются замещенными, если не указано иное. Моноциклический циклоалкенил и бициклический циклоалкенил присоединены к исходному молекулярному фрагменту посредством любого способного к замещению атома, имеющегося в кольцевой системе.
Термин ʺгалоʺ или ʺгалогенʺ, как используется в настоящем описании, означает Cl, Br, I и F.
Термин ʺгалогеналкилʺ, как используется в настоящем описании, означает алкильную группу, как определено в настоящем описании, в которой один, два, три, четыре, пять или шесть атомов водорода замещены галогеном. Термин ʺC1-C6 галогеналкилʺ означает C1-C6 алкильную группу, как определено в настоящем описании, в которой один, два, три, четыре, пять или шесть атомов водорода замещены галогеном. Термин ʺC1-C3 галогеналкилʺ означает C1-C3 алкильную группу, как определено в настоящем описании, в которой один, два, три, четыре или пять атомов водорода замещены галогеном. Репрезентативные примеры C1-C6 галогеналкила включают, но ими не ограничены, хлорметил, 2-фторэтил, 2,2-дифторэтил, фторметил, 2,2,2-трифторэтил, трифторметил, дифторметил, пентафторэтил, 2-хлор-3-фторпентил, трифторбутил и трифторпропил.
Термин ʺгетероциклʺ или ʺгетероциклическийʺ, как используется в настоящем описании, означает радикал моноциклического гетероцикла и бициклического гетероцикла. Моноциклический гетероцикл представляет собой трех-, четырех-, пяти-, шести-, семи- или восьмичленное карбоциклическое кольцо, в котором по меньшей мере один атом углерода замещен гетероатомом, независимо выбранным из группы, состоящей из О, N и S. Трех- или четырехчленное кольцо содержит ноль или одну двойную связь и один гетероатом, выбранный из группы, состоящей из O, N и S. Пятичленное кольцо содержит ноль или одну двойную связь и один, два или три гетероатома, выбранных из группы, состоящей из O, N и S. Примеры пятичленных гетероциклических колец включают те, которые содержат в кольце: 1 O; 1 S; 1 N; 2 N; 3 N; 1 S и 1 N; 1 S, и 2 N; 1 O и 1 N; или 1 O и 2 N. Неограничивающие примеры 5-членных гетероциклических групп включают 1,3-диоксоланил, тетрагидрофуранил, дигидрофуранил, тетрагидротиенил, дигидротиенил, имидазолидинил, оксазолидинил, имидазолинил, изоксазолидинил, пиразолидинил, пиразолинил, пирролидинил, 2-пирролинил, 3-пирролинил, тиазолинил и тиазолидинил. Шестичленное кольцо содержит ноль, одну или две двойные связи и один, два или три гетероатома, выбранных из группы, состоящей из O, N и S. Примеры шестичленных гетероциклических колец включают те, которые содержат в кольце: 1 O; 2 O; 1 S; 2 S; 1 N; 2 N; 3 N; 1 S, 1 O, и 1 N; 1 S и 1 N; 1 S и 2 N; 1 S и 1 O; 1 S и 2 O; 1 O и 1 N; и 1 O и 2 N. Примеры 6-членных гетероциклических групп включают тетрагидропиранил, дигидропиранил, диоксанил, 1,4-дитианил, гексагидропиримидин, морфолинил, пиперазинил, пиперидинил, 1,2,3,6-тетрагидропиридинил, тетрагидротиопиранил, тиоморфолинил, тиоксанил и тритианил. Семь- и восьмичленные кольца содержат ноль, одну, две или три двойные связи и один, два или три гетероатома, выбранных из группы, состоящей из O, N и S. Репрезентативные примеры моноциклических гетероциклов включают, но ими не ограничиваются, азетидинил, азепанил, азиридинил, диазепанила, 1,3-диоксанил, 1,3-диоксоланил, 1,3-дитиоланил, 1,3-дитианил, имидазолинил, имидазолидинил, изотиазолинил, изотиазолидинил, изоксазолинил, изоксазолидинил, морфолинил, оксадиазолинил, оксадиазолидинил, оксазолинил, оксазолидинил, оксетанил, пиперазинил, пиперидинил, пиранил, пиразолинил, пиразолидинил, пирролинил, пирролидинил, тетрагидрофуранил, тетрагидропиридинил, тетрагидропиранил, тетрагидротиенил, тиадиазолинил, тиадиазолидинил, тиазолинил, тиазолидинил, тиоморфолинил, тиопиранил и тритианил. Бициклический гетероцикл представляет собой моноциклический гетероцикл, конденсированный с фенильной группой, или моноциклический гетероцикл, конденсированный с моноциклическим циклоалкилом, или моноциклический гетероцикл, конденсированный с моноциклическим циклоалкенилом, или моноциклический гетероцикл, конденсированный с моноциклическим гетероциклом. Репрезентативные примеры бициклических гетероциклов включают, но ими не ограничиваются, бензопиранил, бензотиопиранил, 2,3-дигидробензофуранил, 2,3-дигидробензотиенил, 2,3-дигидро-1Н-индолил, 3,4-дигидроизохинолин-2(1Н)-ил, 2,3,4,6-тетрагидро-1Н-пиридо[1,2-а]пиразин-2-ил, гексагидропирано[3,4-b][1,4]оксазин-1(5H)-ил. Моноциклический гетероцикл и бициклический гетероцикл могут дополнительно содержать один или два алкиленовых мостика, каждый из которых состоит не более чем из четырех атомов углерода и каждый связывает два несмежных атома кольцевой системы. Примеры такого мостикового гетероцикла включают, но ими не ограничиваются, азабицикло[2.2.1]гептил (включая 2-азабицикло[2.2.1]гепт-2-ил), 8-азабицикло[3.2.1]окт-8-ил, октагидро-2,5-эпоксипентален, гексагидро-2Н-2,5-метаноциклопента[b]фуран, гексагидро-1Н-1,4-метаноциклопента[с]фуран, аза-адмантан (1-азатрицикло[3.3.1.13,7]декан) и окса-адамантан (2-оксатрицикло[3.3.1.13,7]декан). Моноциклические и бициклические гетероциклы, включая иллюстративные кольца, являются необязательно замещенными, если не указано иное. Моноциклический и бициклический гетероциклы связаны с исходным молекулярным фрагментом через любой атом углерода или любой атом азота, содержащийся в кольцевых системах. Гетероатомы азота и серы в гетероциклических кольцах могут быть необязательно окислены (например, 1,1-диоксидотетрагидротиенил, 1,1-диоксидо-1,2-тиазолидинил, 1,1-диоксидотиоморфолинил)), и атомы азота могут быть необязательно кватернизованы.
Термин ʺ4-6-членный гетероциклʺ или ʺ4-6-членный гетероциклическийʺ, как используется в настоящем описании, означает 4, 5 или 6-членный моноциклический гетероцикл, как определено выше в настоящем описании. Примеры 4-6-членного гетероцикла включают азетидинил, пирролидинил, тетрагидрофуранил, тетрагидропиранил, пиперазинил, пиперидинил, тиоморфолинил и морфолинил. 4-6-членные гетероциклы, включая иллюстративные кольца, являются необязательно замещенными, если не указано иное.
Термин ʺ5-6-членный гетероциклʺ или ʺ5-6-членный гетероциклическийʺ, как используется в настоящем описании, означает 5 или 6-членный моноциклический гетероцикл, как определено выше в настоящем описании. Примеры 5-6-членного гетероцикла включают 1,3-диоксоланил, пирролидинил, 1,2-тиазолидинил, тетрагидрофуранил, тетрагидропиранил, пиперазинил, пиперидинил, тиоморфолинил и морфолинил. 5-6-членные гетероциклы, включая иллюстративные кольца, являются необязательно замещенными, если не указано иное.
Термин ʺгетероарилʺ, как используется в настоящем описании, означает моноциклический гетероарил и бициклический гетероарил. Моноциклический гетероарил представляет собой пяти- или шестичленное кольцо. Пятичленное кольцо содержит две двойные связи. Пятичленное кольцо может содержать один гетероатом, выбранный из O или S; или один, два, три или четыре атома азота и необязательно один атом кислорода или один атом серы. Шестичленное кольцо содержит три двойные связи и один, два, три или четыре атома азота. Репрезентативные примеры моноциклического гетероарила включают, но ими не ограничиваются, фуранил, имидазолил, изоксазолил, изотиазолил, оксадиазолил, 1,3-оксазолил, пиридинил, пиридазинил, пиримидинил, пиразинил, пиразолил, пирролил, тетразолил, тиадиазолил, 1,3-тиазолил, тиенил, триазолил и триазинил. Бициклический гетероарил включает моноциклический гетероарил, конденсированный с фенилом, или моноциклический гетероарил, конденсированный с моноциклическим циклоалкилом, или моноциклический гетероарил, конденсированный с моноциклическим циклоалкенилом, или моноциклический гетероарил, конденсированный с моноциклическим гетероарилом, или моноциклический гетероарил, конденсированный с моноциклическим гетероциклом. Репрезентативные примеры бициклических гетероарилов включают, но ими не ограничиваются, бензофуранил, бензотиенил, бензоксазолил, бензимидазолил, бензоксадиазолил, фталазинил, 2,6-дигидропирроло[3,4-с]пиразол-5(4H)-ил, 6,7- дигидропиразоло[1,5-a]пиразин-5(4H)-ил, 6,7-дигидро-1,3-бензотиазолил, имидазо[1,2-a]пиридинил, индазолил, индолил, изоиндолил, изохинолинил, нафтиридинил, пиридоимидазолил, хинолинил, 2,4,6,7-тетрагидро-5H-пиразоло[4,3-c]пиридин-5-ил, тиазоло[5,4-b]пиридин-2-ил, тиазоло[5,4-d]пиримидин-2-ил и 5,6,7,8-тетрагидрохинолин-5-ил. Моноциклические и бициклические гетероарилы, включая иллюстративные кольца, являются необязательно замещенными, если не указано иное. Моноциклические и бициклические гетероарилы соединены с исходным молекулярным фрагментом посредством любого способного к замещению атома углерода или любого способного к замещению атома азота, содержащихся в кольцевых системах. Атом азота в гетероарильных кольцах может быть необязательно окислен и может быть необязательно кватернизован.
Термин ʺ5-6-членный гетероарилʺ, как используется в настоящем описании, означает 5- или 6-членный моноциклический гетероарил, как описано выше. Примеры 5-6-членного гетероарила включают фуранил, тиенил, пиразолил, имидазолил, 1,2,4-оксадиазолил, 1,2,4-триазолил, 1,3-тиазолил, пиридинил, пиримидинил и пиразинил. 5-6-членные гетероарилы, включая иллюстративные кольца, являются необязательно замещенными, если не указано иное.
Термин ʺгетероатомʺ, как используется в настоящем описании, означает азот, кислород и серу.
Термин ʺоксоʺ, как используется в настоящем описании, означает группу =O.
Термин ʺмеченное радиоизотопомʺ относится к соединению по настоящему изобретению, в котором по меньшей мере один из атомов является радиоактивным атомом или радиоактивным изотопом, где радиоактивный атом или изотоп самопроизвольно испускает гамма-лучи или энергичные частицы, например, альфа-частицы или бета-частицы, или позитроны. Примеры таких радиоактивных атомов включают, но ими не ограничиваются,3H (тритий),14C,11C,15O,18F,35S,123I и125I.
Если фрагмент описывается как ʺзамещенныйʺ, то неводородный радикал находится на месте водородного радикала любого замещаемого атома этого фрагмента. Таким образом, например, замещенная гетероциклическая часть представляет собой гетероциклическую часть, в которой по меньшей мере один неводородный радикал находится на месте водородного радикала в гетероцикле. Следует признать, что если на фрагменте присутствуют более одного заместителя, то каждый не-водородный радикал может быть одинаковым или различным (если не указано иное).
Если фрагмент описан как ʺнеобязательно замещенныйʺ, фрагмент может быть или (1) незамещенным или (2) замещенным. Если фрагмент описан как необязательно замещенный вплоть до определенного количества неводородных радикалов, то фрагмент может быть или (1) незамещенным; или (2) замещенным вплоть до определенного количества неводородных радикалов, либо максимальным числом замещаемых положений на фрагменте, в любом случае, не больше этого числа. Таким образом, например, если фрагмент описан как гетероарил, необязательно замещенный вплоть до 3 неводородных радикалов, то любой гетероарил с меньшим числом чем 3 возможных для замещения положения может быть необязательно замещен столькими неводородными радикалами, сколько гетероарил имеет возможных к замещению положений. Например, тетразолил (который имеет только одно замещаемое положение) может быть необязательно замещен одним неводородным радикалом. Другой пример, если азот в аминогруппе описан как необязательно замещенный вплоть до 2 неводородными радикалами, то азот первичной аминогруппы будет необязательно замещен вплоть до 2 неводородными радикалами, тогда как азот вторичной аминогруппы будет необязательно замещен одним неводородным радикалом.
Если не указано иное, термины C1-C6 алкил, C1-C3 алкил, C1-C6 галогеналкил и C1-C3 галогеналкил не являются возможно замещенными.
Термины ʺлечитьʺ, и ʺлечениеʺ относятся к способу облегчения или устранения заболевания и/или его сопутствующих симптомов.
Термины ʺпредотвращатьʺ, ʺпредотвращениеʺ и ʺпрофилактикаʺ относятся к способу предотвращения начала заболевания и/или его сопутствующих симптомов или предотвращения развития заболевания у субъекта. Как используется в настоящем описании, термин ʺпредотвращатьʺ, ʺпредотвращениеʺ и ʺпрофилактикаʺ также включает замедление начала заболевания и/или его сопутствующих симптомов и уменьшение риска развития заболевания у субъекта.
Фраза ʺтерапевтически эффективное количествоʺ означает количество соединения или его фармацевтически приемлемой соли, достаточное для профилактики развития или в некоторой степени облегчения одного или нескольких симптомов состояния или заболевания, подвергаемого лечению, при введении отдельно или в сочетании с одним или несколькими дополнительными терапевтическими средствами для лечения конкретного субъекта или популяции субъекта. Например, у человека или другого млекопитающего терапевтически эффективное количество может быть определено экспериментально в лабораторных или клинических условиях или может быть количеством, требуемым в соответствии с рекомендациями Управления по контролю за продуктами питания и лекарствами США, или аналогичного иностранного органа для конкретного заболевания и субъекта, подлежащего лечению.
Термин ʺсубъектʺ в настоящем документе определен как относящийся к животным, таким как млекопитающие, включая, но не ограничиваясь ими, приматы (например, люди), коровы, овцы, козы, свиньи, лошади, собаки, кошки, кролики, крысы, мыши и тому подобное. В предпочтительных вариантах осуществления субъектом является человек.
Термин ʺодин или несколькоʺ означает от одного до четырех. В одном варианте осуществления это относится к одному или трем. В другом варианте осуществления это относится к одному-трем. В дополнительном варианте осуществления это относится к одному-двум. В еще одном варианте осуществления это относится к двум. В еще одном другом варианте осуществления оно относится к одному.
Как используется в настоящем описании, ʺмутация(и) I классаʺ относится к мутациям, которые нарушают синтез белка. Они приводят к введению преждевременного сигнала терминации трансляции (стоп-кодон) в мРНК. Укороченные белки CFTR нестабильны и быстро разлагаются, поэтому результатом этого является отсутствие белка на апикальной мембране. В частности, мутация(и) I класса относятся к мутации p.Gly542X (G542X), W1282X, c.489+1G>T (621+1G>T) или c.579+1G>T (711+1G>T). Более конкретно, мутация(и) I класса относятся к мутациям G542X; или W1282X.
Как используется в настоящем описании, ʺмутация(и) II классаʺ относится к мутациям, которые влияют на созревание белка. Это приводит к продуцированию неправильно свернутого белка CFTR и/или нарушению его транспорта к апикальной мембране. В частности, мутация(и) II класса относятся к мутациям p.Phe508del (F508del), p.Ile507del или p.Asn1303Lys (N1303K). Более конкретно, мутация(и) II класса относятся к мутациям F508del или N1303K.
Как используется в настоящем описании, ʺмутация(и) III классаʺ относится к мутациям, которые изменяют регуляцию канала CFTR. Мутированный белок CFTR правильно транспортируется к плазматической мембране и локализуется на плазматической мембране, но не может активироваться или он не может функционировать как хлоридный канал. В частности, мутация(и) III класса относятся к мутациям p.Gly551Asp (G551D), G551S, R553G; G1349D; S1251N, G178R, S549N. Более конкретно, мутация(и) III класса относятся к мутациям G551D, R553G, G1349D, S1251N, G178R или S549N.
Как используется в настоящем описании, ʺмутация(и) IV классаʺ относится к мутациям, которые влияют на проводимость ионов хлора. Белок CFTR правильно транспортируется к клеточной мембране, но генерирует пониженный поток хлоридов или ʺпропускающий дефектʺ (большинство представляет собой миссенс-мутации, располагающиеся в мембран-связанных доменах). В частности, мутация(и) IV класса относятся к мутациям p.Arg117His (R117H), R347P или p.Arg334Trp (R334W).
Как используется в настоящем описании, ʺмутация(и) V классаʺ относится к мутациям, которые снижают уровень нормально функционирующего CFTR на апикальной мембране или приводят к «дефекту проводимости» (например, частично аберрантные сплайсинговые мутации или неэффективный транспорт миссенс-мутаций). В частности, мутация(и) V класса относятся к мутациям c.1210-12T[5] (5T allele), c.S3140-26A>G (3272-26A>G), c.3850-2477C>T (3849+10kbC>T).
Как используется в настоящем описании, ʺмутация(и) VI классаʺ относится к мутациям, которые снижают стабильность CFTR, который присутствует или который влияет на регуляцию других каналов, что приводит к присущей нестабильности белка CFTR. Фактически, несмотря на функциональность, белок CFTR является неустойчивым на поверхности клетки, и он быстро удаляется и разрушается клеточным комплексом. В частности, мутация(и) VI класса относятся к Rescued F508del, 120del23, N287Y, 4326dellTC или 4279insA. Более конкретно, мутация(и) VI класса относятся к мутациям Rescued F508del.
Соединения
Соединения по настоящему изобретению имеют общую формулу (I), как описано выше.
Конкретными значениями переменных групп являются следующие. Такие значения могут использоваться, когда это необходимо, с любыми другими значениями, определениями, пунктами или вариантами осуществления, определенными выше в настоящем описании или ниже в настоящем описании.
В некоторых вариантах осуществления формулы (I) X представляет собой CR2 и Y представляет собой CR3. Таким образом, настоящее изобретение представляет соединения формулы (I-a) или их фармацевтически приемлемые соли

где R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, m и Rʺ являются такими, как определено в настоящем описании в разделе ʺСущность изобретенияʺ и вариантах осуществления, ниже.
В некоторых вариантах осуществления формулы (I) X представляет собой N и Y представляет собой CR3. Таким образом, настоящее изобретение представляет соединения формулы (I-b) или их фармацевтически приемлемые соли

где R1, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, m и Rʺ являются такими, как определено в настоящем описании в разделе ʺСущность изобретенияʺ и вариантах осуществления, ниже.
В некоторых вариантах осуществления формулы (I) X представляет собой CR2 и Y представляет собой N. Таким образом, настоящее изобретение представляет собой соединения формулы (I-с) или их фармацевтически приемлемые соли

где R1, R2, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, m и Rʺ являются такими, как определено в настоящем описании в разделе ʺСущность изобретенияʺ и вариантах осуществления, ниже.
В некоторых вариантах осуществления m равно 0, 1, 2 или 3.
В некоторых вариантах осуществления m равно 0.
В некоторых вариантах осуществления m равно 2.
В некоторых вариантах осуществления Rʺ, если присутствует, представляет собой галоген. В некоторых таких вариантах осуществления Rʺ представляет собой F.
В некоторых вариантах осуществления R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A, -C(O)OR1B, -NR1AR2A или -C(O)NR1AR2A.
В некоторых вариантах осуществления R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B. В некоторых таких вариантах осуществления R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил.
В некоторых вариантах осуществления R1 представляет собой водород, галоген, C1-C3 галогеналкил, C1-C3 алкил или -OR1A. В некоторых таких вариантах осуществления R1A представляет собой C1-C3 алкил.
В некоторых вариантах осуществления R1 представляет собой водород, C1-C3 алкил или -OR1A. В некоторых таких вариантах осуществления R1A представляет собой C1-C3 алкил.
В некоторых вариантах осуществления R1 представляет собой водород, CH3 или -OCH3.
В некоторых вариантах осуществления R1 представляет собой водород.
В некоторых вариантах осуществления R1 представляет собой галоген. В некоторых таких вариантах осуществления R1 представляет собой F или Cl. В некоторых таких вариантах осуществления R1 представляет собой F.
В некоторых вариантах осуществления R1 представляет собой -OR1A. В некоторых таких вариантах осуществления R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил. В некоторых таких вариантах осуществления R1A представляет собой C1-C3 алкил. В некоторых таких вариантах осуществления R1A представляет собой CH3.
В некоторых вариантах осуществления R1 представляет собой C1-C6 алкил. В некоторых таких вариантах осуществления R1 представляет собой C1-C3 алкил. В некоторых таких вариантах осуществления R1 представляет собой CH3.
В некоторых вариантах осуществления R1 представляет собой -C(O)OR1B. В некоторых таких вариантах осуществления R1B представляет собой водород или C1-C3 алкил. В некоторых таких вариантах осуществления R1B представляет собой водород или CH3. В некоторых таких вариантах осуществления R1B представляет собой водород. В некоторых таких вариантах осуществления R1B представляет собой CH3
В некоторых вариантах осуществления R2 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B. В некоторых таких вариантах осуществления R1A представляет собой водород, C1-C3 галогеналкил или C1-C3 алкил, где C1-C3 алкил необязательно замещен одним заместителем, выбранным из группы, состоящей из -ORZA, -C(O)OH и G1A; и R1B представляет собой водород или C1-C3 алкил. В некоторых таких вариантах осуществления G1A представляет собой фенил, необязательно замещенный 1, 2 или 3 группами Rs, где каждая Rs независимо представляет собой C1-C3 алкил, C1-C3 галогеналкил, галоген или -OCH3. В некоторых таких вариантах осуществления G1A представляет собой незамещенный фенил. В некоторых таких вариантах осуществления RZA представляет собой C1-C3 галогеналкил или C1-C3 алкил.
В некоторых вариантах осуществления R2 представляет собой водород, галоген, C1-C3 галогеналкил, C1-C3 алкил или -OR1A. В некоторых таких вариантах осуществления галоген представляет собой Br, F или Cl. В некоторых таких вариантах осуществления R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил, где C1-C3 алкил необязательно замещен одним -ORZA, где RZA представляет собой C1-C3 алкил.
В некоторых вариантах осуществления R2 представляет собой водород, галоген или -OR1A, где R1A представляет собой C1-C3 алкил или C1-C3 галогеналкил. В некоторых таких вариантах осуществления галоген представляет собой F или Cl.
В некоторых вариантах осуществления R2 представляет собой водород, F, CF3, CH3, -OCH3, -OCHF2, -OCH2CH2F или -OCH2CH2OCH3.
В некоторых вариантах осуществления R2 представляет собой водород.
В некоторых вариантах осуществления R2 представляет собой галоген. В некоторых таких вариантах осуществления галоген представляет собой F, Cl или Br. В некоторых таких вариантах осуществления галоген представляет собой F или Cl.
В некоторых вариантах осуществления R2 представляет собой C1-C6 галогеналкил. В некоторых вариантах осуществления R2 представляет собой C1-C3 галогеналкил. В некоторых таких вариантах осуществления R2 представляет собой CF3.
В некоторых вариантах осуществления R2 представляет собой C1-C6 алкил. В некоторых таких вариантах осуществления R2 представляет собой C1-C3 алкил. В некоторых таких вариантах осуществления R2 представляет собой CH3.
В некоторых вариантах осуществления R2 представляет собой -OR1A.
В некоторых вариантах осуществления R2 представляет собой -OR1A, где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил, где C1-C3 алкил необязательно замещен одним заместителем, выбранным из группы, состоящей из -ORZA, -C(O)OH и G1A. В некоторых таких вариантах осуществления G1A представляет собой фенил, необязательно замещенный 1, 2 или 3 группами Rs, где каждая Rs независимо представляет собой C1-C3 алкил, C1-C3 галогеналкил, галоген или -OCH3. В некоторых таких вариантах осуществления G1A представляет собой незамещенный фенил. В некоторых таких вариантах осуществления RZA представляет собой C1-C3 галогеналкил или C1-C3 алкил. В некоторых таких вариантах осуществления RZA представляет собой C1-C3 алкил.
В некоторых вариантах осуществления R2 представляет собой -OR1A, где R1A представляет собой -CHF2, -CH2CH2F или C1-C3 алкил, где C1-C3 алкил необязательно замещен одним -OCH3.
В некоторых вариантах осуществления R3 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OH или -O-(C1-C6 алкил).
В некоторых вариантах осуществления R3 представляет собой водород или галоген. В некоторых таких вариантах осуществления галоген представляет собой F или Cl. В некоторых таких вариантах осуществления галоген представляет собой F.
В некоторых вариантах осуществления R3 представляет собой водород.
В некоторых вариантах осуществления R3 представляет собой галоген. В некоторых таких вариантах осуществления галоген представляет собой F или Cl. В некоторых таких вариантах осуществления галоген представляет собой F.
В некоторых вариантах осуществления R4 представляет собой водород, C1-C6 галогеналкил или C1-C6 алкил; и R5 представляет собой водород, -C(O)Ri, -C(O)OH, -C(O)O(C1-C6 алкил), -C(O)N(Rh)2, C1-C6 галогеналкил, C1-C6 алкил или G2A.
В некоторых вариантах осуществления R4 представляет собой водород, C1-C6 галогеналкил или C1-C6 алкил; и R5 представляет собой водород, C1-C6 галогеналкил, C1-C6 алкил или G2A. В некоторых таких вариантах осуществления G2A представляет собой фенил, C3-C6 циклоалкил, 4-6-членный гетероцикл или 5-6-членный гетероарил. В некоторых таких вариантах осуществления G2A представляет собой фенил, циклопропил, циклогексил, азетидинил, тетрагидрофуранил или пиридинил. В некоторых таких вариантах осуществления G2A представляет собой фенил или циклогексил. В некоторых таких вариантах осуществления G2A представляет собой фенил. В некоторых таких вариантах осуществления G2A представляет собой моноциклический циклоалкил. В некоторых таких вариантах осуществления G2A представляет собой циклопропил, циклобутил, бицикло[1.1.1]пентил или циклогексил. В некоторых таких вариантах осуществления G2A представляет собой C3-C6 циклоалкил. В некоторых таких вариантах осуществления G2A представляет собой циклопропил или циклогексил. В некоторых таких вариантах осуществления G2A представляет собой циклогексил. В некоторых таких вариантах осуществления G2A представляет собой 5-6-членный гетероарил. В некоторых таких вариантах осуществления G2A представляет собой тиазолил или пиридинил. В некоторых таких вариантах осуществления G2A представляет собой пиридинил. В некоторых таких вариантах осуществления G2A представляет собой 4-6-членный гетероцикл. В некоторых таких вариантах осуществления G2A представляет собой азетидинил или тетрагидрофуранил.
В некоторых вариантах осуществления R4 представляет собой водород, C1-C6 галогеналкил или C1-C6 алкил; и R5 представляет собой водород, C1-C6 галогеналкил или C1-C6 алкил.
В некоторых вариантах осуществления R4 представляет собой водород, CH2F, CHF2, CF3, CH3 или CH2CH3; и R5 представляет собой водород, CH2F, CHF2, CH3 или CH2CH3.
В некоторых вариантах осуществления R4 представляет собой водород или C1-C3 алкил; и R5 представляет собой водород или C1-C3 алкил.
В некоторых вариантах осуществления R4 представляет собой водород; и R5 представляет собой водород.
В некоторых вариантах осуществления R4 представляет собой водород, C1-C3 галогеналкил или C1-C3 алкил; и R5 представляет собой G2A.
В некоторых вариантах осуществления R4 представляет собой водород или C1-C3 алкил; и R5 представляет собой G2A.
В некоторых вариантах осуществления R4 представляет собой водород и R5 представляет собой G2A.
В некоторых вариантах осуществления примеры G2A включают фенил, моноциклический циклоалкил (например, циклопропил, циклобутил, бицикло[1.1.1]пентил или циклогексил), 4-6-членный гетероцикл (например, азетидинил или тетрагидрофуранил) или 5-6-членный гетероарил (например, тиазолил или пиридинил).
В некоторых вариантах осуществления примеры G2A включают фенил, C3-C6 циклоалкил (например, циклопропил, циклогексил), 4-6-членный гетероцикл (например, азетидинил, тетрагидрофуранил) или 5-6-членный гетероарил (например, пиридинил).
В некоторых вариантах осуществления G2A представляет собой фенил, циклопропил, циклобутил, циклогексил, бицикло[1.1.1]пентил, азетидинил, тетрагидрофуранил, тиазолил или пиридинил.
В некоторых вариантах осуществления G2A представляет собой фенил, циклопропил, циклогексил, азетидинил, тетрагидрофуранил или пиридинил.
В некоторых вариантах осуществления G2A представляет собой фенил.
В некоторых вариантах осуществления G2A представляет собой моноциклический циклоалкил.
В некоторых вариантах осуществления G2A представляет собой C3-C6 циклоалкил.
В некоторых вариантах осуществления G2A представляет собой 4-6-членный гетероцикл.
В некоторых вариантах осуществления G2A представляет собой 5-6-членный гетероарил.
В некоторых вариантах осуществления G2A представляет собой фенил или циклогексил.
В некоторых вариантах осуществления G2A представляет собой циклопропил или циклогексил.
В некоторых вариантах осуществления G2A представляет собой циклогексил.
Каждый G2A, включая конкретные примеры, необязательно замещен 1, 2 или 3 независимо выбранными группами Rq.
В некоторых вариантах осуществления G2A, включая конкретные примеры, является незамещенным.
В некоторых вариантах осуществления G2A, включая конкретные примеры, замещен 1, 2 или 3 независимо выбранными группами Rq.
В некоторых вариантах осуществления G2A, включая конкретные примеры, замещен одной группой Rq.
В некоторых вариантах осуществления Rq, когда присутствует, представляет собой
C1-C6 алкил, где C1-C6 алкил необязательно замещен одной -OH;
галоген,
C1-C6 галогеналкил;
-ORh, где Rh представляет собой водород или C1-C3 алкил,
-C(O)Rh, где Rh представляет собой GA; и GA представляет собой необязательно замещенный 4-6-членный гетероцикл;
-C(O)ORh, где Rh представляет собой водород или C1-C6 алкил;
-C(O)N(Rh)2; где Rh, в каждом случае независимо представляет собой водород, необязательно замещенный циклоалкил, C1-C6 галогеналкил или C1-C6 алкил; где каждый C1-C6 галогеналкил и C1-C6 алкил необязательно замещен 1 или 2 заместителями, независимо выбранными из группы, состоящей из -ОН и необязательно замещенного циклоалкила;
--C(O)N(Rh)S(O)2Rh, где Rh представляет собой водород или C1-C6 алкил; или
-SO2Rh, где Rh представляет собой C1-C6 галогеналкил или C1-C6 алкил.
В некоторых вариантах осуществления Rq, когда присутствует, представляет собой
C1-C6 алкил, где C1-C6 алкил необязательно замещен одной -OH;
галоген,
C1-C6 галогеналкил;
-ORh, где Rh представляет собой водород или C1-C3 алкил,
-C(O)Rh, где Rh представляет собой GA; и GA представляет собой необязательно замещенный 4-6-членный гетероцикл;
-C(O)ORh, где Rh представляет собой водород или C1-C6 алкил;
-C(O)N(Rh)2; где Rh, в каждом случае независимо представляет собой водород, необязательно замещенный циклоалкил, C1-C6 галогеналкил или C1-C6 алкил; где каждый C1-C6 галогеналкил и C1-C6 алкил необязательно замещен 1 или 2 группами -ОН; или
-SO2Rh, где Rh представляет собой C1-C6 галогеналкил или C1-C6 алкил.
В некоторых вариантах осуществления Rq, когда присутствует, представляет собой -ORh, где Rh представляет собой C1-C3 алкил, или Rq представляет собой -C(O)ORh, где Rh представляет собой водород или C1-C6 алкил.
В некоторых вариантах осуществления одна из Rq представляет собой -C(O)ORh, где Rh представляет собой водород или C1-C6 алкил, или одна из Rq представляет собой -C(O)N(H)(Rh), где Rh представляет собой циклопентил, или Rh представляет собой C1-C6 алкил, который замещен 1 или 2 группами -ОН; и другие дополнительные группы Rq независимо выбраны из группы, состоящей из C1-C3 алкила, галогена и C1-C3 галогеналкила.
В некоторых вариантах осуществления Rq представляет собой -C(O)ORh, где Rh представляет собой водород или C1-C3 алкил. В некоторых таких вариантах осуществления Rh представляет собой водород. В некоторых таких вариантах осуществления Rh представляет собой C1-C3 алкил.
В некоторых вариантах осуществления G2A представляет собой


В некоторых вариантах осуществления G2A представляет собой

В некоторых вариантах осуществления G2A представляет собой

В некоторых вариантах осуществления G2A представляет собой

В некоторых вариантах осуществления R4 представляет собой водород, C1-C6 галогеналкил или C1-C6 алкил; и R5 представляет собой -C(O)OH, -C(O)O(C1-C6 алкил), -C(O)Ri или -C(O)N(Rh)2. В некоторых таких вариантах осуществления Ri представляет собой необязательно замещенный моноциклический гетероцикл. В некоторых таких вариантах осуществления один из Rh представляет собой водород или C1-C6 алкил, который необязательно замещен одной или двумя -ОН, и другой Rh представляет собой необязательно замещенный моноциклический гетероцикл, необязательно замещенный арил или C1-C6 алкил, который необязательно замещен одним или двумя заместителями независимо выбранныи из группы, состоящей из -ОН и необязательно замещенного фенила.
В некоторых вариантах осуществления R4 и R5, вместе с атомом углерода, к которому они присоединены, образуют C3-C6 циклоалкил или 4-6-членный гетероцикл.
В некоторых вариантах осуществления R4 и R5, вместе с атомом углерода, к которому они присоединены, образуют 4-6-членный гетероцикл. В некоторых таких вариантах осуществления 4-6-членный гетероцикл представляет собой азетидинил или пиперидинил.
В некоторых вариантах осуществления R4 и R5, вместе с атомом углерода, к которому они присоединены, образуют C3-C6 циклоалкил, необязательно замещенный 1 или 2 группами Rp.
В некоторых вариантах осуществления C3-C6 циклоалкил представляет собой незамещенный циклобутил или незамещенный циклопентил.
В некоторых вариантах осуществления 4-6-членный гетероцикл, образованный R4 и R5 и атом углерода, к которому они присоединены, необязательно замещен 1 или 2 группами Rp.
В некоторых вариантах осуществления Rp, когда присутствуют, каждый независимо представляют собой
C1-C6 алкил, где C1-C6 алкил необязательно замещен 1 или 2 группами -OH;
-C(O)Rh, где Rh представляет собой C1-C6 алкил;
C(O)ORh, где Rh представляет собой водород, C1-C6 алкил или -CH2-фенил; или
-SO2Rh, где Rh представляет собой C1-C6 галогеналкил или C1-C6 алкил.
В некоторых вариантах осуществления R6 представляет собой водород или C1-C3 алкил; и R7 представляет собой водород или C1-C3 алкил.
В некоторых вариантах осуществления R6 представляет собой водород и R7 представляет собой водород.
В некоторых вариантах осуществления R6 представляет собой водород или C1-C3 алкил; и R7 представляет собой -(C1-C6 алкиленил)-G3A. В некоторых таких вариантах осуществления R7 представляет собой -(CH2)-G3A.
В некоторых вариантах осуществления G3A представляет собой фенил, который необязательно замещен 1, 2 или 3 независимо выбранными группами Rs. В некоторых таких вариантах осуществления каждая Rs независимо представляет собой C1-C3 алкил, галоген, C1-C3 галогеналкил или -ORj, где Rj представляет собой водород или C1-C3 алкил. В некоторых таких вариантах осуществления каждая Rs независимо представляет собой -ORj, где Rj представляет собой C1-C3 алкил.
В некоторых вариантах осуществления R8 представляет собой водород, C1-C6 галогеналкил или C1-C6 алкил.
В некоторых вариантах осуществления R8 представляет собой водород.
В некоторых вариантах осуществления каждый R9, R10 и R13 независимо представляют собой водород, галоген, -ORj, C1-C6 галогеналкил или C1-C6 алкил.
В некоторых вариантах осуществления R9, R10 и R13 каждый независимо представляет собой водород или галоген.
В некоторых вариантах осуществления R9, R10 и R13 представляют собой водород.
В некоторых вариантах осуществления каждый R11 и R12 независимо представляют собой водород, C1-C3 алкил или галоген.
В некоторых вариантах осуществления R11 и R12 каждый независимо представляет собой водород или галоген. В некоторых таких вариантах осуществления галоген представляет собой F.
В некоторых вариантах осуществления R11 и R12 представляют собой водород, или R11 и R12 представляют собой галоген. В некоторых таких вариантах осуществления галоген представляет собой F.
В некоторых вариантах осуществления R11 и R12 представляют собой водород.
В некоторых вариантах осуществления R11 и R12 представляют собой галоген.
В некоторых вариантах осуществления R11 и R12 представляют собой F.
В некоторых вариантах осуществления R14 представляет собой водород или галоген.
В некоторых вариантах осуществления R14 представляет собой водород.
Различные варианты заместителей R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, m и Rʺ были рассмотрены выше. Эти варианты заместителей могут быть объединены для формирования различных вариантов осуществления изобретения. Все варианты осуществления настоящих соединений, образованные путем комбинирования вариантов заместителей, рассмотренных выше, находятся в пределах объема изобретения заявителя, и некоторые иллюстративные варианты осуществления настоящих соединений представлены ниже.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I), (Ia), (I-b) или (I-c), где R8 представляет собой водород; и m равно 0.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I), (Ia), (I-b) или (I-c), где R8 представляет собой водород; m равно 0, и R9, R10 и R13 каждый независимо представляет собой водород или галоген.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I), (Ia), (I-b) или (I-c), где R8 представляет собой водород; m равно 0, и R9, R10 и R13 представляют собой водород.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I), (Ia), (I-b) или (I-c), где R8 представляет собой водород; m равно 0, R9, R10 и R13 каждый независимо представляет собой водород или галоген; и R11 и R12 представляют собой водород, или R11 и R12 представляют собой галоген. В одном таком варианте осуществления галоген представляет собой F.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I), (Ia), (I-b) или (I-c), где R8 представляет собой водород; m равно 0, R9, R10 и R13 представляют собой водород, и R11 и R12 представляют собой галоген. В одном таком варианте осуществления R11 и R12 представляют собой F.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I), (Ia), (I-b) или (I-c), где R8 представляет собой водород; m равно 0, R9, R10 и R13 представляют собой водород, R11 и R12 представляют собой галоген, и R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил. В одном таком варианте осуществления R11 и R12 представляют собой F.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I), (Ia) или (I-c), где
R8 представляет собой водород;
m равно 0,
R9, R10 и R13 представляют собой водород,
R11 и R12 представляют собой галоген,
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил; и
R2 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой водород, C1-C3 галогеналкил или C1-C3 алкил, где C1-C3 алкил необязательно замещен одним заместителем, выбранным из группы, состоящей из -ORZA, -C(O)OH и G1A; и R1B представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления G1A представляет собой фенил, необязательно замещенный 1, 2 или 3 группами Rs, где каждая Rs независимо представляет собой C1-C3 алкил, C1-C3 галогеналкил, галоген или -OCH3. В одном таком варианте осуществления G1A представляет собой незамещенный фенил. В одном таком варианте осуществления RZA представляет собой C1-C3 галогеналкил или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I), (Ia) или (I-b), где
R8 представляет собой водород;
m равно 0,
R9, R10 и R13 представляют собой водород,
R11 и R12 представляют собой галоген,
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил; и
R3 представляет собой водород или галоген.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I), (Ia), (I-b) или (I-c), где
R8 представляет собой водород;
m равно 0,
R9, R10 и R13 представляют собой водород,
R11 и R12 представляют собой галоген, и
R14 представляет собой водород или галоген.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I), (Ia), (I-b) или (I-c), где
R4 представляет собой водород, C1-C6 галогеналкил или C1-C6 алкил;
R5 представляет собой водород, C1-C6 галогеналкил, C1-C6 алкил или G2A;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления G2A представляет собой фенил, C3-C6 циклоалкил, 5-6-членный гетероарил или 4-6-членный гетероцикл. В одном таком варианте осуществления G2A представляет собой фенил, циклопропил, циклогексил, пиридинил, тетрагидропиранил или азетидинил. В одном таком варианте осуществления G2A представляет собой фенил или циклогексил. В одном таком варианте осуществления G2A представляет собой фенил. В одном таком варианте осуществления G2A представляет собой циклогексил. Каждый G2A необязательно замещен 1, 2 или 3 независимо выбранными группами Rq.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I) или (Ia), где
R4 и R5 вместе с атомом углерода, к которому они присоединены, образуют C3-C6 циклоалкил или 4-6-членный гетероцикл; где каждый C3-C6 циклоалкил и 4-6-членный гетероцикл необязательно замещен 1, 2 или 3 независимо выбранными группами Rp;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления Rp, когда присутствуют, каждый независимо представляют собой
C1-C6 алкил, где C1-C6 алкил необязательно замещен 1 или 2 группами -OH;
-C(O)Rh, где Rh представляет собой C1-C6 алкил;
-C(O)ORh, где Rh представляет собой водород, C1-C6 алкил или -CH2-фенил; или
-SO2Rh, где Rh представляет собой C1-C6 галогеналкил или C1-C6 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I) или (I-a), где
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой водород или C1-C3 алкил;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой -(C1-C6 алкиленил)-G3A.
В одном таком варианте осуществления R7 представляет собой -(CH2)-G3A. В одном таком варианте осуществления G3A представляет собой фенил, необязательно замещенный 1, 2 или 3 независимо выбранными группами Rs. В одном таком варианте осуществления G3A представляет собой фенил, необязательно замещенный 1, 2 или 3 группами Rs, где каждая Rs независимо представляет собой C1-C3 алкил, C1-C3 галогеналкил, галоген или -ORj, где Rj представляет собой C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I), где
R8 представляет собой водород;
m равно 0,
R9, R10 и R13 представляют собой водород,
R11 и R12 представляют собой галоген,
R4 представляет собой водород, C1-C6 галогеналкил или C1-C6 алкил;
R5 представляет собой водород, C1-C6 галогеналкил, C1-C6 алкил или G2A;
R6 представляет собой водород или C1-C3 алкил;
R7 представляет собой водород или C1-C3 алкил; и
R14 и R3 каждый независимо представляет собой водород или галоген.
В одном таком варианте осуществления G2A представляет собой фенил, C3-C6 циклоалкил, 5-6-членный гетероарил или 4-6-членный гетероцикл. В одном таком варианте осуществления G2A представляет собой фенил, циклопропил, циклогексил, пиридинил, тетрагидропиранил или азетидинил. В одном таком варианте осуществления G2A представляет собой фенил или циклогексил. В одном таком варианте осуществления G2A представляет собой фенил. В одном таком варианте осуществления G2A представляет собой циклогексил. Каждый G2A необязательно замещен 1, 2 или 3 независимо выбранными группами Rq.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I), где
R8 представляет собой водород;
m равно 0,
R9, R10 и R13 представляют собой водород,
R11 и R12 представляют собой галоген,
R4 и R5 вместе с атомом углерода, к которому они присоединены, образуют C3-C6 циклоалкил или 4-6-членный гетероцикл; где каждый C3-C6 циклоалкил и 4-6-членный гетероцикл необязательно замещен 1, 2 или 3 независимо выбранными группами Rp;
R6 представляет собой водород или C1-C3 алкил;
R7 представляет собой водород или C1-C3 алкил; и
R14 и R3 каждый независимо представляет собой водород или галоген.
В одном таком варианте осуществления Rp, когда присутствуют, каждый независимо представляют собой
C1-C6 алкил, где C1-C6 алкил необязательно замещен 1 или 2 группами -OH;
-C(O)Rh, где Rh представляет собой C1-C6 алкил;
-C(O)ORh, где Rh представляет собой водород, C1-C6 алкил или -CH2-фенил; или
-SO2Rh, где Rh представляет собой C1-C6 галогеналкил или C1-C6 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I), где
R8 представляет собой водород;
m равно 0,
R9, R10 и R13 представляют собой водород,
R11 и R12 представляют собой галоген,
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой водород или C1-C3 алкил;
R6 представляет собой водород или C1-C3 алкил;
R7 представляет собой -(C1-C6 алкиленил)-G3A; и
R14 и R3 каждый независимо представляет собой водород или галоген.
В одном таком варианте осуществления R7 представляет собой -(CH2)-G3A. В одном таком варианте осуществления G3A представляет собой фенил, необязательно замещенный 1, 2 или 3 независимо выбранными группами Rs. В одном таком варианте осуществления G3A представляет собой фенил, необязательно замещенный 1, 2 или 3 группами Rs, где каждая Rs независимо представляет собой C1-C3 алкил, C1-C3 галогеналкил, галоген или -ORj, где Rj представляет собой C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-a), где R8 представляет собой водород; и m равно 0.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-a), где R8 представляет собой водород; m равно 0, и R9, R10 и R13 каждый независимо представляет собой водород или галоген.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-a), где R8 представляет собой водород; m равен 0, и R9, R10 и R13 представляют собой водород.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-a), где R8 представляет собой водород; m равно 0, R9, R10 и R13 каждый независимо представляет собой водород или галоген; и R11 и R12 представляют собой водород, или R11 и R12 представляют собой галоген. В одном таком варианте осуществления галоген представляет собой F.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-a), где R8 представляет собой водород; m равно 0, R9, R10 и R13 представляют собой водород, и R11 и R12 представляют собой галоген. В одном таком варианте осуществления R11 и R12 представляют собой F.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-a), где R8 представляет собой водород; m равно 0, R9, R10 и R13 представляют собой водород, R11 и R12 представляют собой галоген, и R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил. В одном таком варианте осуществления R11 и R12 представляют собой F.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-a), где
R8 представляет собой водород;
m равно 0,
R9, R10 и R13 представляют собой водород,
R11 и R12 представляют собой галоген,
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил; и
R2 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой водород, C1-C3 галогеналкил или C1-C3 алкил, где C1-C3 алкил необязательно замещен одним заместителем, выбранным из группы, состоящей из -ORZA, -C(O)OH и G1A; и R1B представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления G1A представляет собой фенил, необязательно замещенный 1, 2 или 3 группами Rs, где каждая Rs независимо представляет собой C1-C3 алкил, C1-C3 галогеналкил, галоген или -OCH3. В некоторых таких вариантах осуществления G1A представляет собой незамещенный фенил. В некоторых таких вариантах осуществления RZA представляет собой C1-C3 галогеналкил или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-a), где
R8 представляет собой водород;
m равно 0,
R9, R10 и R13 представляют собой водород,
R11 и R12 представляют собой галоген,
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил; и
R3 представляет собой водород или галоген.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-a), где
R8 представляет собой водород;
m равно 0,
R9, R10 и R13 представляют собой водород,
R11 и R12 представляют собой галоген, и
R14 представляет собой водород или галоген.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-a), где
R4 представляет собой водород, C1-C6 галогеналкил или C1-C6 алкил;
R5 представляет собой водород, C1-C6 галогеналкил, C1-C6 алкил или G2A;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления G2A представляет собой фенил, C3-C6 циклоалкил, 5-6-членный гетероарил или 4-6-членный гетероцикл. В одном таком варианте осуществления G2A представляет собой фенил, циклопропил, циклогексил, пиридинил, тетрагидропиранил или азетидинил. В одном таком варианте осуществления G2A представляет собой фенил или циклогексил. В одном таком варианте осуществления G2A представляет собой фенил. В одном таком варианте осуществления G2A представляет собой циклогексил. Каждый G2A необязательно замещен 1, 2 или 3 независимо выбранными группами Rq.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-a), где
R4 и R5 вместе с атомом углерода, к которому они присоединены, образуют C3-C6 циклоалкил или 4-6-членный гетероцикл; где каждый C3-C6 циклоалкил и 4-6-членный гетероцикл необязательно замещен 1, 2 или 3 независимо выбранными группами Rp;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления Rp, когда присутствуют, каждый независимо представляют собой
C1-C6 алкил, где C1-C6 алкил необязательно замещен 1 или 2 группами -OH;
-C(O)Rh, где Rh представляет собой C1-C6 алкил;
-C(O)ORh, где Rh представляет собой водород, C1-C6 алкил или -CH2-фенил; или
-SO2Rh, где Rh представляет собой C1-C6 галогеналкил или C1-C6 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-a), где
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой водород или C1-C3 алкил;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой -(C1-C6 алкиленил)-G3A.
В одном таком варианте осуществления R7 представляет собой -(CH2)-G3A. В одном таком варианте осуществления G3A представляет собой фенил, необязательно замещенный 1, 2 или 3 независимо выбранными группами Rs. В одном таком варианте осуществления G3A представляет собой фенил, необязательно замещенный 1, 2 или 3 группами Rs, где каждая Rs независимо представляет собой C1-C3 алкил, C1-C3 галогеналкил, галоген или -ORj, где Rj представляет собой C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-a), где
R8 представляет собой водород;
m равно 0,
R9, R10 и R13 представляют собой водород,
R11 и R12 представляют собой галоген,
R4 представляет собой водород, C1-C6 галогеналкил или C1-C6 алкил;
R5 представляет собой водород, C1-C6 галогеналкил, C1-C6 алкил или G2A;
R6 представляет собой водород или C1-C3 алкил;
R7 представляет собой водород или C1-C3 алкил; и
R14 и R3 каждый независимо представляет собой водород или галоген.
В одном таком варианте осуществления G2A представляет собой фенил, C3-C6 циклоалкил, 5-6-членный гетероарил или 4-6-членный гетероцикл. В одном таком варианте осуществления G2A представляет собой фенил, циклопропил, циклогексил, пиридинил, тетрагидропиранил или азетидинил. В одном таком варианте осуществления G2A представляет собой фенил или циклогексил. В одном таком варианте осуществления G2A представляет собой фенил. В одном таком варианте осуществления G2A представляет собой циклогексил. Каждый G2A необязательно замещен 1, 2 или 3 независимо выбранными группами Rq.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-a), где
R8 представляет собой водород;
m равно 0,
R9, R10 и R13 представляют собой водород,
R11 и R12 представляют собой галоген,
R4 и R5 вместе с атомом углерода, к которому они присоединены, образуют C3-C6 циклоалкил или 4-6-членный гетероцикл; где каждый C3-C6 циклоалкил и 4-6-членный гетероцикл необязательно замещен 1, 2 или 3 независимо выбранными группами Rp;
R6 представляет собой водород или C1-C3 алкил;
R7 представляет собой водород или C1-C3 алкил; и
R14 и R3 каждый независимо представляет собой водород или галоген.
В одном таком варианте осуществления Rp, когда присутствуют, каждый независимо представляют собой
C1-C6 алкил, где C1-C6 алкил необязательно замещен 1 или 2 группами -OH;
-C(O)Rh, где Rh представляет собой C1-C6 алкил;
-C(O)ORh, где Rh представляет собой водород, C1-C6 алкил или -CH2-фенил; или
-SO2Rh, где Rh представляет собой C1-C6 галогеналкил или C1-C6 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-a), где
R8 представляет собой водород;
m равно 0,
R9, R10 и R13 представляют собой водород,
R11 и R12 представляют собой галоген,
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой водород или C1-C3 алкил;
R6 представляет собой водород или C1-C3 алкил;
R7 представляет собой -(C1-C6 алкиленил)-G3A; и
R14 и R3 каждый независимо представляет собой водород или галоген.
В одном таком варианте осуществления R7 представляет собой -(CH2)-G3A. В одном таком варианте осуществления G3A представляет собой фенил, необязательно замещенный 1, 2 или 3 независимо выбранными группами Rs. В одном таком варианте осуществления G3A представляет собой фенил, необязательно замещенный 1, 2 или 3 группами Rs, где каждая Rs независимо представляет собой C1-C3 алкил, C1-C3 галогеналкил, галоген или -ORj, где Rj представляет собой C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-b), где R8 представляет собой водород; и m равно 0.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-b), где R8 представляет собой водород; m равно 0, и R9, R10 и R13 каждый независимо представляет собой водород или галоген.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-b), где R8 представляет собой водород; m равно 0, и R9, R10 и R13 представляют собой водород.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-b), где R8 представляет собой водород; m равно 0, R9, R10 и R13 каждый независимо представляет собой водород или галоген; и R11 и R12 представляют собой водород, или R11 и R12 представляют собой галоген. В одном таком варианте осуществления галоген представляет собой F.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-b), где R8 представляет собой водород; m равно 0, R9, R10 и R13 представляют собой водород, и R11 и R12 представляют собой галоген. В одном таком варианте осуществления R11 и R12 представляют собой F.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-b), где R8 представляет собой водород; m равно 0, R9, R10 и R13 представляют собой водород, R11 и R12 представляют собой галоген, и R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил. В одном таком варианте осуществления R11 и R12 представляют собой F.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-b), где
R8 представляет собой водород;
m равно 0,
R9, R10 и R13 представляют собой водород,
R11 и R12 представляют собой галоген,
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил; и
R3 представляет собой водород или галоген.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-b), где
R8 представляет собой водород;
m равно 0,
R9, R10 и R13 представляют собой водород,
R11 и R12 представляют собой галоген, и
R14 представляет собой водород или галоген.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-b), где
R4 представляет собой водород, C1-C6 галогеналкил или C1-C6 алкил;
R5 представляет собой водород, C1-C6 галогеналкил, C1-C6 алкил или G2A;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления G2A представляет собой фенил, C3-C6 циклоалкил, 5-6-членный гетероарил или 4-6-членный гетероцикл. В одном таком варианте осуществления G2A представляет собой фенил, циклопропил, циклогексил, пиридинил, тетрагидропиранил или азетидинил. В одном таком варианте осуществления G2A представляет собой фенил или циклогексил. В одном таком варианте осуществления G2A представляет собой фенил. В одном таком варианте осуществления G2A представляет собой циклогексил. Каждый G2A необязательно замещен 1, 2 или 3 независимо выбранными группами Rq.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-b), где
R8 представляет собой водород;
m равно 0,
R9, R10 и R13 представляют собой водород,
R11 и R12 представляют собой галоген,
R4 представляет собой водород, C1-C6 галогеналкил или C1-C6 алкил;
R5 представляет собой водород, C1-C6 галогеналкил, C1-C6 алкил или G2A;
R6 представляет собой водород или C1-C3 алкил;
R7 представляет собой водород или C1-C3 алкил; и
R14 и R3 каждый независимо представляет собой водород или галоген.
В одном таком варианте осуществления G2A представляет собой фенил, C3-C6 циклоалкил, 5-6-членный гетероарил или 4-6-членный гетероцикл. В одном таком варианте осуществления G2A представляет собой фенил, циклопропил, циклогексил, пиридинил, тетрагидропиранил или азетидинил. В одном таком варианте осуществления G2A представляет собой фенил или циклогексил. В одном таком варианте осуществления G2A представляет собой фенил. В одном таком варианте осуществления G2A представляет собой циклогексил. Каждый G2A необязательно замещен 1, 2 или 3 независимо выбранными группами Rq.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-b), где
R8 представляет собой водород;
m равно 0,
R9, R10 и R13 представляют собой водород,
R11 и R12 представляют собой галоген,
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой фенил, который замещен одним Rq; где Rq представляет собой -C(O)ORh, где Rh представляет собой водород или C1-C3 алкил;
R6 представляет собой водород или C1-C3 алкил;
R7 представляет собой водород или C1-C3 алкил;
R14 и R3 каждый независимо представляет собой водород или галоген; и
R1 представляет собой водород.
В одном таком варианте осуществления Rq представляет собой -C(O)ORh, где Rh представляет собой водород. В одном таком варианте осуществления Rq представляет собой -C(O)ORh, где Rh представляет собой C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-c), где R8 представляет собой водород; и m равно 0.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-c), где R8 представляет собой водород; m равно 0, и R9, R10 и R13 каждый независимо представляет собой водород или галоген.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-c), где R8 представляет собой водород; m равно 0, и R9, R10 и R13 представляют собой водород.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-c), где R8 представляет собой водород; m равно 0, R9, R10 и R13 каждый независимо представляет собой водород или галоген; и R11 и R12 представляют собой водород, или R11 и R12 представляют собой галоген. В одном таком варианте осуществления галоген представляет собой F.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-c), где R8 представляет собой водород; m равно 0, R9, R10 и R13 представляют собой водород, и R11 и R12 представляют собой галоген. В одном таком варианте осуществления R11 и R12 представляют собой F.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-c), где R8 представляет собой водород; m равно 0, R9, R10 и R13 представляют собой водород, R11 и R12 представляют собой галоген, и R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил. В одном таком варианте осуществления R11 и R12 представляют собой F.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-c), где
R8 представляет собой водород;
m равно 0,
R9, R10 и R13 представляют собой водород,
R11 и R12 представляют собой галоген,
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил; и
R2 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой водород, C1-C3 галогеналкил или C1-C3 алкил, где C1-C3 алкил необязательно замещен одним заместителем, выбранным из группы, состоящей из -ORZA, -C(O)OH и G1A; и R1B представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления G1A представляет собой фенил, необязательно замещенный 1, 2 или 3 группами Rs, где каждая Rs независимо представляет собой C1-C3 алкил, C1-C3 галогеналкил, галоген или -OCH3. В некоторых таких вариантах осуществления G1A представляет собой незамещенный фенил. В некоторых таких вариантах осуществления RZA представляет собой C1-C3 галогеналкил или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-c), где
R8 представляет собой водород;
m равно 0,
R9, R10 и R13 представляют собой водород,
R11 и R12 представляют собой галоген, и
R14 представляет собой водород или галоген.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-c), где
R4 представляет собой водород, C1-C6 галогеналкил или C1-C6 алкил;
R5 представляет собой водород, C1-C6 галогеналкил, C1-C6 алкил или G2A;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления G2A представляет собой фенил, C3-C6 циклоалкил, 5-6-членный гетероарил или 4-6-членный гетероцикл. В одном таком варианте осуществления G2A представляет собой фенил, циклопропил, циклогексил, пиридинил, тетрагидропиранил или азетидинил. В одном таком варианте осуществления G2A представляет собой фенил или циклогексил. В одном таком варианте осуществления G2A представляет собой фенил. В одном таком варианте осуществления G2A представляет собой циклогексил. Каждый G2A необязательно замещен 1, 2 или 3 независимо выбранными группами Rq.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-c), где
R8 представляет собой водород;
m равно 0,
R9, R10 и R13 представляют собой водород,
R11 и R12 представляют собой галоген,
R4 представляет собой водород, C1-C6 галогеналкил или C1-C6 алкил;
R5 представляет собой водород, C1-C6 галогеналкил, C1-C6 алкил или G2A;
R6 представляет собой водород или C1-C3 алкил;
R7 представляет собой водород или C1-C3 алкил; и
R14 представляет собой водород или галоген.
В одном таком варианте осуществления G2A представляет собой фенил, C3-C6 циклоалкил, 5-6-членный гетероарил или 4-6-членный гетероцикл. В одном таком варианте осуществления G2A представляет собой фенил, циклопропил, циклогексил, пиридинил, тетрагидропиранил или азетидинил. В одном таком варианте осуществления G2A представляет собой фенил или циклогексил. В одном таком варианте осуществления G2A представляет собой фенил. В одном таком варианте осуществления G2A представляет собой циклогексил. Каждый G2A необязательно замещен 1, 2 или 3 независимо выбранными группами Rq.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-c), где
R8 представляет собой водород;
m равно 0,
R9, R10 и R13 представляют собой водород,
R11 и R12 представляют собой галоген,
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой фенил, который замещен одним Rq; где Rq представляет собой -C(O)ORh, где Rh представляет собой водород или C1-C3 алкил;
R6 представляет собой водород или C1-C3 алкил;
R7 представляет собой водород или C1-C3 алкил;
R14 представляет собой водород или галоген;
R1 представляет собой водород; и
R2 представляет собой водород, галоген или -OR1A, где R1A представляет собой C1-C3 алкил или C1-C3 галогеналкил.
В одном таком варианте осуществления Rq представляет собой -C(O)ORh, где Rh представляет собой водород. В одном таком варианте осуществления Rq представляет собой -C(O)ORh, где Rh представляет собой C1-C3 алкил.
Один вариант осуществления относится к соединениям формулы (I-d)

где
X представляет собой CR2 и Y представляет собой CR3; или
X представляет собой N и Y представляет собой CR3; или
X представляет собой CR2 и Y представляет собой N;
R1 и R2, в каждом случае, каждый независимо представляют собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A, -C(O)OR1B, -NR1AR2A или -C(O)NR1AR2A;
каждый R1A и R2A в каждом случае независимо представляют собой водород, C1-C6 галогеналкил, G1A или C1-C6 алкил; где C1-C6 галогеналкил и C1-C6 алкил каждый необязательно замещены одним или двумя заместителями, независимо выбранными из группы, состоящей из -ORZA, -SRZA, -S(O)2RZA, -C(O)RZA, -C(O)ORZA, -C(O)N(RZA)2, -N(RZA)2, -N(RZA)C(O)RZB, -N(RZA)S(O)2RZB, -N(RZA)C(O)ORZB, -N(RZA)C(O)N(RZA)2, -CN и G1A; или R1A и R2A вместе с атомом азота, к которому они присоединены, образуют 4-6-членный гетероцикл, где 4-6-членный гетероцикл необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, C1-C6 алкила, C1-C6 галогеналкила, -ORj и N(Rj)2; где
RZA в каждом случае независимо представляет собой водород, C1-C6 галогеналкил, C1-C6 алкил, G1A или -(C1-C6 алкиленил)-G1A; и
RZB в каждом случае независимо представляет собой C1-C6 галогеналкил, C1-C6 алкил, G1A или -(C1-C6 алкиленил)-G1A;
R1B представляет собой водород, C1-C6 галогеналкил или C1-C6 алкил;
R3 и R14 каждый независимо представляет собой водород или галоген;
R4 представляет собой водород, C1-C6 галогеналкил или C1-C6 алкил;
R5 представляет собой водород, -C(O)Ri, -C(O)OH, -C(O)N(Rh)2, C1-C6 галогеналкил, C1-C6 алкил или G2A; где каждый C1-C6 галогеналкил и C1-C6 алкил необязательно замещены одним или двумя заместителями, независимо выбранными из группы, состоящей из -ORh, -OC(O)N(Rh)2, -C(O)Rh, -C(O)ORh, -C(O)N(Rh)2, -N(Rh)2, -N(Rh)C(O)Ri, -N(Rh)S(O)2Ri, -N(Rh)C(O)O(Ri), -N(Rh)C(O)N(Rh)2 и G2A; или
R4 и R5 вместе с атомом углерода, к которому они присоединены, образуют C3-C6 циклоалкил или 4-6-членный гетероцикл; где каждый C3-C6 циклоалкил и 4-6-членный гетероцикл необязательно замещен 1, 2 или 3 независимо выбранными группами Rp;
G2A, в каждом случае, независимо представляет собой циклоалкил, циклоалкенил, гетероцикл, арил или гетероарил, каждый из которых независимо является незамещенным или замещенным 1, 2 или 3 независимо выбранными группами Rq;
Rp и Rq, в каждом случае, каждый независимо представляют собой C1-C6 алкил, галоген, C1-C6 галогеналкил, -CN, оксо, NO2, -ORh, -OC(O)Ri, -OC(O)N(Rh)2, -SRh, -S(O)2Rh, -S(O)2N(Rh)2, -C(O)Rh, -C(O)ORh, -C(O)N(Rh)2, -N(Rh)2, -N(Rh)C(O)Ri, -N(Rh)S(O)2Ri, -N(Rh)C(O)O(Ri), -N(Rh)C(O)N(Rh)2 или GA, где каждый C1-C6 галогеналкил и C1-C6 алкил необязательно замещены одним или двумя заместителями, независимо выбранными из группы, состоящей из -ORh, -OC(O)Ri, -OC(O)N(Rh)2, -SRh, -S(O)2Rh, -S(O)2N(Rh)2, -C(O)Rh, -C(O)ORh, -C(O)N(Rh)2, -N(Rh)2, -N(Rh)C(O)Ri, -N(Rh)S(O)2Ri, -N(Rh)C(O)O(Ri), -N(Rh)C(O)N(Rh)2, -CN и GA;
Rh в каждом случае независимо представляет собой водород, C1-C6 галогеналкил, C1-C6 алкил или GA, где каждый C1-C6 галогеналкил и C1-C6 алкил необязательно замещены одним или двумя заместителями, независимо выбранными из группы, состоящей из -ORj, -OC(O)N(Rj)2, -SRj, -C(O)ORj, -C(O)N(Rj)2, -N(Rj)2, -CN и GA;
Ri в каждом случае независимо представляет собой C1-C6 галогеналкил, C1-C6 алкил или GA, где каждый C1-C6 галогеналкил и C1-C6 алкил необязательно замещены одним или двумя заместителями, независимо выбранными из группы, состоящей из -ORj, -OC(O)N(Rj)2, -SRj, -C(O)ORj, -C(O)N(Rj)2, -N(Rj)2, -CN и GA;
R6 представляет собой водород, галоген, C1-C6 галогеналкил или C1-C6 алкил;
R7 представляет собой водород, галоген, -ORj, -N(Rj)2, -N(Rj)C(O)Rk, C1-C6 галогеналкил, C1-C6 алкил, C2-C6 алкенил или -(C1-C6 алкиленил)-G3A;
R9, R10 и R13 каждый независимо представляет собой водород или галоген;
G1A, G3A и GA, в каждом случае, каждый независимо представляют собой циклоалкил, циклоалкенил, гетероцикл, арил или гетероарил, каждый из которых является независимо незамещенным или замещенным 1, 2 или 3 независимо выбранными группами Rs; где
Rs в каждом случае независимо представляет собой C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, галоген, C1-C6 галогеналкил, -CN, оксо, NO2, -ORj, -OC(O)Rk, -OC(O)N(Rj)2, -SRj, -S(O)2Rj, -S(O)2N(Rj)2, -C(O)Rj, -C(O)ORj, -C(O)N(Rj)2, -N(Rj)2, -N(Rj)C(O)Rk, -N(Rj)S(O)2Rk, -N(Rj)C(O)O(Rk), -N(Rj)C(O)N(Rj)2, -(C1-C6 алкиленил)-ORj, -(C1-C6 алкиленил)-OC(O)Rk, -(C1-C6 алкиленил)-OC(O)N(Rj)2, -(C1-C6 алкиленил)-SRj, -(C1-C6 алкиленил)-S(O)2Rj, -(C1-C6 алкиленил)-S(O)2N(Rj)2, -(C1-C6 алкиленил)-C(O)Rj, -(C1-C6 алкиленил)-C(O)ORj, -(C1-C6 алкиленил)-C(O)N(Rj)2, -(C1-C6 алкиленил)-N(Rj)2, -(C1-C6 алкиленил)-N(Rj)C(O)Rk, -(C1-C6 алкиленил)-N(Rj)S(O)2Rk, -(C1-C6 алкиленил)-N(Rj)C(O)O(Rk), -(C1-C6 алкиленил)-N(Rj)C(O)N(Rj)2 или -(C1-C6 алкиленил)-CN;
Rj в каждом случае независимо представляет собой водород, C1-C6 алкил или C1-C6 галогеналкил; и
Rk в каждом случае независимо представляет собой C1-C6 алкил или C1-C6 галогеналкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-d), где R9, R10 и R13 представляют собой водород.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-d), где R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-d), где
R9, R10 и R13 представляют собой водород; и
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-d), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород, C1-C6 галогеналкил или C1-C6 алкил;
R5 представляет собой водород, C1-C6 галогеналкил или C1-C6 алкил;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления R4 представляет собой водород, CH2F, CHF2, CH3 или CH2CH3; и R5 представляет собой водород, CH2F, CHF2, CH3 или CH2CH3.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-d), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой фенил, C3-C6 циклоалкил, 4-6-членный гетероцикл или 5-6-членный гетероарил; каждый из которых необязательно замещен 1, 2 или 3 независимо выбранными группами Rq;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-d), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой фенил, который необязательно замещен 1, 2 или 3 независимо выбранными группами Rq;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-d), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой фенил, который необязательно замещен 1, 2 или 3 группами Rq; где каждая Rq независимо представляет собой
C1-C6 алкил, где C1-C6 алкил необязательно замещен одной -OH;
галоген;
C1-C6 галогеналкил;
-ORh, где Rh представляет собой водород или C1-C3 алкил,
-C(O)Rh, где Rh представляет собой GA; где GA представляет собой 4-6-членный гетероцикл;
-C(O)ORh, где Rh представляет собой водород или C1-C6 алкил,
-C(O)N(Rh)2, где Rh в каждом случае независимо представляет собой водород, C3-C6 циклоалкил, C1-C6 галогеналкил или C1-C6 алкил; где каждый C1-C6 галогеналкил и C1-C6 алкил необязательно замещен 1 или 2 группами -ОН; или
-SO2Rh, где Rh представляет собой C1-C6 галогеналкил или C1-C6 алкил;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-d), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A, или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой фенил, который необязательно замещен 1, 2 или 3 группами Rq; где одна из Rq представляет собой -C(O)ORh, где Rh представляет собой водород или C1-C6 алкил, или одна из Rq представляет собой -C(O)N(H)(Rh), где Rh представляет собой циклопентил, или Rh представляет собой C1-C6 алкил, который замещен 1 или 2 группами -ОН; и другие дополнительные группы Rq независимо выбраны из группы, состоящей из C1-C3 алкила, галогена и C1-C3 галогеналкила;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-d), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой фенил, который замещен одним Rq; где Rq представляет собой -C(O)ORh, где Rh представляет собой водород или C1-C3 алкил;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В некоторых таких вариантах осуществления Rh представляет собой водород. В некоторых таких вариантах осуществления Rh представляет собой C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-d), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой


R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В некоторых таких вариантах осуществления Rh представляет собой водород. В некоторых таких вариантах осуществления Rh представляет собой C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-d), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой

R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В некоторых таких вариантах осуществления Rh представляет собой водород. В некоторых таких вариантах осуществления Rh представляет собой C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-d), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой

R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В некоторых таких вариантах осуществления Rh представляет собой водород. В некоторых таких вариантах осуществления Rh представляет собой C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-d), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой C3-C6 циклоалкил, который необязательно замещен 1, 2 или 3 группами Rq; где каждая Rq независимо представляет собой
C1-C6 алкил, где C1-C6 алкил необязательно замещен одной -OH;
галоген;
C1-C6галогеналкил;
-ORh, где Rh представляет собой водород или C1-C3 алкил,
-C(O)Rh, где Rh представляет собой GA; где GA представляет собой 4-6-членный гетероцикл;
-C(O)ORh, где Rh представляет собой водород или C1-C6 алкил,
-C(O)N(Rh)2, где Rh в каждом случае независимо представляет собой водород, C3-C6 циклоалкил, C1-C6 галогеналкил или C1-C6 алкил; где C1-C6 галогеналкил и C1-C6 алкил, каждый необязательно замещены 1 или 2 группами -ОН; или
-SO2Rh, где Rh представляет собой C1-C6 галогеналкил или C1-C6 алкил;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-d), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой циклопропил или циклогексил, каждый из которых необязательно замещен одним Rq; где Rq представляет собой
-ORh, где Rh представляет собой C1-C3 алкил, или
-C(O)ORh, где Rh представляет собой водород или C1-C6 алкил;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-d), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой циклогексил, который замещен одним Rq; где Rq представляет собой -C(O)ORh, где Rh представляет собой водород или C1-C3 алкил,
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления Rq представляет собой -C(O)ORh, где Rh представляет собой водород. В одном таком варианте осуществления Rq представляет собой -C(O)ORh, где Rh представляет собой C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-d), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой

R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления Rh представляет собой водород. В некоторых таких вариантах осуществления Rh представляет собой C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-d), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой 4-6-членный гетероцикл, который необязательно замещен 1, 2 или 3 независимо выбранными группами Rq;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления G2A представляет собой тетрагидрофуранил или азетидинил, каждый из которых необязательно замещен 1, 2 или 3 независимо выбранными группами Rq.
В некоторых таких вариантах осуществления G2A представляет собой тетрагидрофуранил или азетидинил, каждый из которых необязательно замещен 1, 2 или 3 группами Rq; где каждая Rq независимо представляет собой
C1-C6 алкил, где C1-C6 алкил необязательно замещен одной -OH;
галоген;
C1-C6галогеналкил;
-ORh, где Rh представляет собой водород или C1-C3 алкил,
-C(O)Rh, где Rh представляет собой GA; где GA представляет собой 4-6-членный гетероцикл;
-C(O)ORh, где Rh представляет собой водород или C1-C6 алкил,
-C(O)N(Rh)2, где Rh в каждом случае независимо представляет собой водород, C3-C6 циклоалкил, C1-C6 галогеналкил или C1-C6 алкил; где каждый C1-C6 галогеналкил и C1-C6 алкил необязательно замещен 1 или 2 группами -ОН; или
-SO2Rh, где Rh представляет собой C1-C6 галогеналкил или C1-C6 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-d), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой 5-6-членный гетероарил, который необязательно замещен 1, 2 или 3 независимо выбранными группами Rq;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления G2A представляет собой пиридинил, который необязательно замещен 1, 2 или 3 независимо выбранными группами Rq.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-d), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 и R5 вместе с атомом углерода, к которому они присоединены, образуют C3-C6 циклоалкил или 4-6-членный гетероцикл; где каждый C3-C6 циклоалкил и 4-6-членный гетероцикл необязательно замещен 1, 2 или 3 независимо выбранными группами Rp; и
каждый R6 и R7 независимо представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-d), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 и R5 вместе с атомом углерода, к которому они присоединены, образуют C3-C6 циклоалкил, который необязательно замещен 1 или 2 группами Rp; и
каждый R6 и R7 независимо представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления образованный C3-C6 циклоалкил представляет собой циклобутил или циклопентил, каждый из которых необязательно замещен 1 или 2 группами Rp. В одном таком варианте осуществления образованный C3-C6 циклоалкил представляет собой незамещенный циклобутил или незамещенный циклопентил.
В некоторых таких вариантах осуществления каждый Rp независимо представляет собой
C1-C6 алкил, где C1-C6 алкил необязательно замещен 1 или 2 группами -OH;
-C(O)Rh, где Rh представляет собой C1-C6 алкил;
-C(O)ORh, где Rh представляет собой водород, C1-C6 алкил или -CH2-фенил; или
-SO2Rh, где Rh представляет собой C1-C6 галогеналкил или C1-C6 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-d), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 и R5, вместе с атомом углерода, к которому они присоединены, образуют 4-6-членный гетероцикл, который необязательно замещен 1 или 2 группами Rp; и
каждый R6 и R7 независимо представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления образованный 4-6-членный гетероцикл представляет собой азетидинил, пиперидинил, каждый из которых необязательно замещен 1 или 2 независимо выбранными группами Rp.
В некоторых таких вариантах осуществления каждый Rp независимо представляет собой
C1-C6 алкил, где C1-C6 алкил необязательно замещен 1 или 2 группами -OH;
-C(O)Rh, где Rh представляет собой C1-C6 алкил;
-C(O)ORh, где Rh представляет собой водород, C1-C6 алкил или -CH2-фенил; или
-SO2Rh, где Rh представляет собой C1-C6 галогеналкил или C1-C6 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-d), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил; и
R5 представляет собой водород или C1-C3 алкил;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой -(C1-C6 алкиленил)-G3A.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-d), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил; и
R5 представляет собой водород или C1-C3 алкил;
R6 представляет собой водород или C1-C3 алкил;
R7 представляет собой -(CH2)-G3A, где G3A представляет собой фенил, который необязательно замещен 1, 2 или 3 группами Rs; и каждая группа Rs независимо представляет собой C1-C3 алкил, галоген, C1-C3 галогеналкил или -ORj, где Rj представляет собой водород или C1-C3 алкил.
В некоторых таких вариантах осуществления каждая Rs независимо представляет собой -ORj, где Rj представляет собой C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-e)

где R1, R2, R3, R4, R5, R6, R7, R9, R10, R13 и R14 являются такими, как определено в формуле (I-d).
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-e), где R9, R10 и R13 представляют собой водород.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-e), где R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-e), где
R9, R10 и R13 представляют собой водород; и
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-e), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород, C1-C6 галогеналкил или C1-C6 алкил;
R5 представляет собой водород, C1-C6 галогеналкил или C1-C6 алкил;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления R4 представляет собой водород, CH2F, CHF2, CH3 или CH2CH3; и R5 представляет собой водород, CH2F, CHF2, CH3 или CH2CH3.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-e), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой фенил, C3-C6 циклоалкил, 4-6-членный гетероцикл или 5-6-членный гетероарил; каждый G2A необязательно замещен 1, 2 или 3 независимо выбранными группами Rq.
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-e), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой фенил, необязательно замещенный 1, 2 или 3 независимо выбранными группами Rq;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-e), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой фенил, который необязательно замещен 1, 2 или 3 группами Rq; где каждая Rq независимо представляет собой
C1-C6 алкил, где C1-C6 алкил необязательно замещен одной -OH;
галоген;
C1-C6 галогеналкил;
-ORh, где Rh представляет собой водород или C1-C3 алкил,
-C(O)Rh, где Rh представляет собой GA; где GA представляет собой 4-6-членный гетероцикл;
-C(O)ORh, где Rh представляет собой водород или C1-C6 алкил,
-C(O)N(Rh)2, где Rh в каждом случае независимо представляет собой водород, C3-C6 циклоалкил, C1-C6 галогеналкил или C1-C6 алкил; где каждый C1-C6 галогеналкил и C1-C6 алкил необязательно замещен 1 или 2 группами -ОН; или
-SO2Rh, где Rh представляет собой C1-C6 галогеналкил или C1-C6 алкил;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-e), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой фенил, который необязательно замещен 1, 2 или 3 группами Rq; где одна из Rq представляет собой -C(O)ORh, где Rh представляет собой водород или C1-C6 алкил, или одна из Rq представляет собой -C(O)N(H)(Rh), где Rh представляет собой циклопентил, или Rh представляет собой C1-C6 алкил, который замещен 1 или 2 группами -ОН; и другие дополнительные группы Rq независимо выбраны из группы, состоящей из C1-C3 алкила, галогена и C1-C3 галогеналкила;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-e), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой фенил, который замещен одним Rq; где Rq представляет собой -C(O)ORh, где Rh представляет собой водород или C1-C3 алкил;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В некоторых таких вариантах осуществления Rh представляет собой водород. В некоторых таких вариантах осуществления Rh представляет собой C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-e), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой


R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В некоторых таких вариантах осуществления Rh представляет собой водород. В некоторых таких вариантах осуществления Rh представляет собой C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-e), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В некоторых таких вариантах осуществления Rh представляет собой водород. В некоторых таких вариантах осуществления Rh представляет собой C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-e), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой

R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В некоторых таких вариантах осуществления Rh представляет собой водород. В некоторых таких вариантах осуществления Rh представляет собой C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-e), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой C3-C6 циклоалкил, который необязательно замещен 1, 2 или 3 группами Rq; где каждая Rq независимо представляет собой
C1-C6 алкил, где C1-C6 алкил необязательно замещен одной -OH;
галоген;
C1-C6 галогеналкил;
-ORh, где Rh представляет собой водород или C1-C3 алкил,
-C(O)Rh, где Rh представляет собой GA; где GA представляет собой 4-6-членный гетероцикл;
-C(O)ORh, где Rh представляет собой водород или C1-C6 алкил,
-C(O)N(Rh)2, где Rh в каждом случае независимо представляет собой водород, C3-C6 циклоалкил, C1-C6 галогеналкил или C1-C6 алкил; где C1-C6 галогеналкил и C1-C6 алкил необязательно замещены 1 или 2 группами -OH; или
-SO2Rh, где Rh представляет собой C1-C6 галогеналкил или C1-C6 алкил;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-e), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой циклопропил или циклогексил, каждый из которых необязательно замещен одним Rq; где Rq представляет собой -ORh, где Rh представляет собой C1-C3 алкил, или Rq представляет собой -C(O)ORh, где Rh представляет собой водород или C1-C6 алкил;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-e), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой циклогексил, который замещен одним Rq; где Rq представляет собой -C(O)ORh, где Rh представляет собой водород или C1-C3 алкил,
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления Rh представляет собой водород. В одном таком варианте осуществления Rh представляет собой C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-e), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой

R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления Rh представляет собой водород. В некоторых таких вариантах осуществления Rh представляет собой C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-e), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой 4-6-членный гетероцикл, необязательно замещенный 1, 2 или 3 независимо выбранными группами Rq;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления G2A представляет собой тетрагидрофуранил или азетидинил, каждый из которых необязательно замещен 1, 2 или 3 независимо выбранными группами Rq.
В некоторых таких вариантах осуществления G2A представляет собой тетрагидрофуранил или азетидинил, каждый из которых необязательно замещен 1, 2 или 3 группами Rq; где каждая Rq независимо представляет собой
C1-C6 алкил, где C1-C6 алкил необязательно замещен одной -OH;
галоген;
C1-C6 галогеналкил;
-ORh, где Rh представляет собой водород или C1-C3 алкил,
-C(O)Rh, где Rh представляет собой GA; где GA представляет собой 4-6-членный гетероцикл;
-C(O)ORh, где Rh представляет собой водород или C1-C6 алкил,
-C(O)N(Rh)2, где Rh в каждом случае независимо представляет собой водород, C3-C6 циклоалкил, C1-C6 галогеналкил или C1-C6 алкил; где каждый C1-C6 галогеналкил и C1-C6 алкил необязательно замещен 1 или 2 группами -ОН; или
-SO2Rh, где Rh представляет собой C1-C6 галогеналкил или C1-C6 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-e), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой 5-6-членный гетероарил, необязательно замещенный 1, 2 или 3 независимо выбранными группами Rq;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления G2A представляет собой пиридинил, необязательно замещенный 1, 2 или 3 независимо выбранными группами Rq.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-e), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 и R5 вместе с атомом углерода, к которому они присоединены, образуют C3-C6 циклоалкил или 4-6-членный гетероцикл; где каждый C3-C6 циклоалкил и 4-6-членный гетероцикл необязательно замещен 1, 2 или 3 независимо выбранными группами Rp; и
каждый R6 и R7 независимо представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-e), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 и R5 вместе с атомом углерода, к которому они присоединены, образуют C3-C6 циклоалкил, который необязательно замещен 1 или 2 группами Rp; и
каждый R6 и R7 независимо представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления образованный C3-C6 циклоалкил представляет собой циклобутил или циклопентил, каждый из которых необязательно замещен 1 или 2 группами Rp. В одном таком варианте осуществления образованный C3-C6 циклоалкил представляет собой незамещенный циклобутил или незамещенный циклопентил.
В одном таком варианте осуществления каждый Rp независимо представляет собой
C1-C6 алкил, где C1-C6 алкил необязательно замещен 1 или 2 группами -OH;
-C(O)Rh, где Rh представляет собой C1-C6 алкил;
-C(O)ORh, где Rh представляет собой водород, C1-C6 алкил или -CH2-фенил; или
-SO2Rh, где Rh представляет собой C1-C6 галогеналкил или C1-C6 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-e), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 и R5, вместе с атомом углерода, к которому они присоединены, образуют 4-6-членный гетероцикл, который необязательно замещен 1 или 2 группами Rp; и
каждый R6 и R7 независимо представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления образованный 4-6-членный гетероцикл представляет собой азетидинил или пиперидинил, каждый из которых необязательно замещен 1 или 2 группами Rp.
В некоторых таких вариантах осуществления каждая Rp независимо представляет собой
C1-C6 алкил, где C1-C6 алкил необязательно замещен 1 или 2 группами -OH;
-C(O)Rh, где Rh представляет собой C1-C6 алкил;
-C(O)ORh, где Rh представляет собой водород, C1-C6 алкил или -CH2-фенил; или
-SO2Rh, где Rh представляет собой C1-C6 галогеналкил или C1-C6 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-e), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил; и
R5 представляет собой водород или C1-C3 алкил;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой -(C1-C6 алкиленил)-G3A.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-e), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил; и
R5 представляет собой водород или C1-C3 алкил;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой -(CH2)-G3A, где G3A представляет собой фенил, который необязательно замещен 1, 2 или 3 группами Rs; и каждая Rs независимо представляет собой C1-C3 алкил, галоген, C1-C3 галогеналкил или -ORj, где Rj представляет собой водород или C1-C3 алкил.
В некоторых таких вариантах осуществления каждая Rs независимо представляет собой -ORj, где Rj представляет собой C1-C3 алкил.
Один вариант осуществления относится к соединениям формулы (I-f)

где R1, R3, R4, R5, R6, R7, R9, R10, R13 и R14 являются такими, как определено в формуле (I-d).
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-f), где R9, R10 и R13 представляют собой водород.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-f), где R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-f), где
R9, R10 и R13 представляют собой водород; и
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-f), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород, C1-C6 галогеналкил или C1-C6 алкил;
R5 представляет собой водород, C1-C6 галогеналкил или C1-C6 алкил;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления R4 представляет собой водород, CH2F, CHF2, CH3 или CH2CH3; и R5 представляет собой водород, CH2F, CHF2, CH3 или CH2CH3.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-f), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой фенил, C3-C6 циклоалкил, 4-6-членный гетероцикл или 5-6-членный гетероарил; каждый из которых необязательно замещен 1, 2 или 3 независимо выбранными группами Rq;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-f), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой фенил, который необязательно замещен 1, 2 или 3 независимо выбранными группами Rq;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-f), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой фенил, который необязательно замещен 1, 2 или 3 группами Rq; где каждая Rq независимо представляет собой
C1-C6 алкил, где C1-C6 алкил необязательно замещен одной -OH;
галоген;
C1-C6 галогеналкил;
-ORh, где Rh представляет собой водород или C1-C3 алкил,
-C(O)Rh, где Rh представляет собой GA; где GA представляет собой 4-6-членный гетероцикл;
-C(O)ORh, где Rh представляет собой водород или C1-C6 алкил,
-C(O)N(Rh)2, где Rh в каждом случае независимо представляет собой водород, C3-C6 циклоалкил, C1-C6 галогеналкил или C1-C6 алкил; где C1-C6 галогеналкил и C1-C6 алкил, каждый необязательно замещен 1 или 2 группами -ОН; или
-SO2Rh, где Rh представляет собой C1-C6 галогеналкил или C1-C6 алкил;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-f), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой фенил, который необязательно замещен 1, 2 или 3 группами Rq; где одна из Rq представляет собой -C(O)ORh, где Rh представляет собой водород или C1-C6 алкил, или одна из Rq представляет собой -C(O)N(H)(Rh), где Rh представляет собой циклопентил, или Rh представляет собой C1-C6 алкил, который замещен 1 или 2 группами -ОН; и другие дополнительные группы Rq независимо выбраны из группы, состоящей из C1-C3 алкила, галогена и C1-C3 галогеналкила;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-f), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой фенил, который замещен одной Rq; где Rq представляет собой -C(O)ORh, где Rh представляет собой водород или C1-C3 алкил;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В некоторых таких вариантах осуществления Rh представляет собой водород. В некоторых таких вариантах осуществления Rh представляет собой C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-f), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой


R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В некоторых таких вариантах осуществления Rh представляет собой водород. В некоторых таких вариантах осуществления Rh представляет собой C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-f), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой

R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В некоторых таких вариантах осуществления Rh представляет собой водород. В некоторых таких вариантах осуществления Rh представляет собой C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-f), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой

R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В некоторых таких вариантах осуществления Rh представляет собой водород. В некоторых таких вариантах осуществления Rh представляет собой C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-f), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой C3-C6 циклоалкил, который необязательно замещен 1, 2 или 3 группами Rq; где каждая Rq независимо представляет собой
C1-C6 алкил, где C1-C6 алкил необязательно замещен одной -OH;
галоген;
C1-C6 галогеналкил;
-ORh, где Rh представляет собой водород или C1-C3 алкил,
-C(O)Rh, где Rh представляет собой GA; где GA представляет собой 4-6-членный гетероцикл;
-C(O)ORh, где Rh представляет собой водород или C1-C6 алкил,
-C(O)N(Rh)2, где Rh в каждом случае независимо представляет собой водород, C3-C6 циклоалкил, C1-C6 галогеналкил или C1-C6 алкил; где C1-C6 галогеналкил и C1-C6 алкил, каждый необязательно замещен 1 или 2 группами -ОН; или
-SO2Rh, где Rh представляет собой C1-C6 галогеналкил или C1-C6 алкил;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-f), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой циклопропил или циклогексил, каждый из которых необязательно замещен одним Rq; где Rq представляет собой ORh, где Rh представляет собой C1-C3 алкил, или Rq представляет собой -C(O)ORh, где Rh представляет собой водород или C1-C6 алкил;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-f), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой циклогексил, который замещен одним Rq; где Rq представляет собой -C(O)ORh, где Rh представляет собой водород или C1-C3 алкил,
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-f), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления Rh представляет собой водород. В некоторых таких вариантах осуществления Rh представляет собой C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-f), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой 4-6-членный гетероцикл, который необязательно замещен 1, 2 или 3 независимо выбранными группами Rq;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления G2A представляет собой тетрагидрофуранил или азетидинил; каждый из которых необязательно замещен 1, 2 или 3 независимо выбранными группами Rq.
В некоторых таких вариантах осуществления G2A представляет собой тетрагидрофуранил или азетидинил, каждый из которых необязательно замещен 1, 2 или 3 группами Rq; где каждая Rq независимо представляет собой
C1-C6 алкил, где C1-C6 алкил необязательно замещен одной -OH;
галоген;
C1-C6 галогеналкил;
-ORh, где Rh представляет собой водород или C1-C3 алкил,
-C(O)Rh, где Rh представляет собой GA; где GA представляет собой 4-6-членный гетероцикл;
-C(O)ORh, где Rh представляет собой водород или C1-C6 алкил,
-C(O)N(Rh)2, где Rh в каждом случае независимо представляет собой водород, C3-C6 циклоалкил, C1-C6 галогеналкил или C1-C6 алкил; где каждый C1-C6 галогеналкил и C1-C6 алкил необязательно замещен 1 или 2 группами -ОН; или
-SO2Rh, где Rh представляет собой C1-C6 галогеналкил или C1-C6 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-f), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой 5-6-членный гетероарил, который необязательно замещен 1, 2 или 3 независимо выбранными группами Rq;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления G2A представляет собой пиридинил, который необязательно замещен 1, 2 или 3 независимо выбранными группами Rq.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-f), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 и R5 вместе с атомом углерода, к которому они присоединены, образуют C3-C6 циклоалкил или 4-6-членный гетероцикл; где каждый C3-C6 циклоалкил и 4-6-членный гетероцикл необязательно замещен 1, 2 или 3 независимо выбранными группами Rp; и
каждый R6 и R7 независимо представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-f), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 и R5 вместе с атомом углерода, к которому они присоединены, образуют C3-C6 циклоалкил, который необязательно замещен 1 или 2 группами Rp; и
каждый R6 и R7 независимо представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления образованный C3-C6 циклоалкил представляет собой циклобутил или циклопентил, каждый из которых необязательно замещен 1 или 2 группами Rp. В одном таком варианте осуществления образованный C3-C6 циклоалкил представляет собой незамещенный циклобутил или незамещенный циклопентил.
В одном таком варианте осуществления каждый Rp независимо представляет собой
C1-C6 алкил, где C1-C6 алкил необязательно замещен 1 или 2 группами -OH;
-C(O)Rh, где Rh представляет собой C1-C6 алкил;
-C(O)ORh, где Rh представляет собой водород, C1-C6 алкил или -CH2-фенил; или
-SO2Rh, где Rh представляет собой C1-C6 галогеналкил или C1-C6 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-f), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 и R5, вместе с атомом углерода, к которому они присоединены, образуют 4-6-членный гетероцикл, который необязательно замещен 1 или 2 независимо выбранными группами Rp; и
каждый R6 и R7 независимо представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления образованный 4-6-членный гетероцикл представляет собой азетидинил или пиперидинил, каждый из которых необязательно замещен 1 или 2 группами Rp.
В некоторых таких вариантах осуществления каждый Rp независимо представляет собой
C1-C6 алкил, где C1-C6 алкил необязательно замещен 1 или 2 группами -OH;
-C(O)Rh, где Rh представляет собой C1-C6 алкил;
-C(O)ORh, где Rh представляет собой водород, C1-C6 алкил или -CH2-фенил; или
-SO2Rh, где Rh представляет собой C1-C6 галогеналкил или C1-C6 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-f), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил; и
R5 представляет собой водород или C1-C3 алкил;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой -(C1-C6 алкиленил)-G3A.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-f), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил; и
R5 представляет собой водород или C1-C3 алкил;
R6 представляет собой водород или C1-C3 алкил;
R7 представляет собой -(CH2)-G3A, где G3A представляет собой фенил, который необязательно замещен 1, 2 или 3 группами Rs; и каждая Rs независимо представляет собой C1-C3 алкил, галоген, C1-C3 галогеналкил или -ORj, где Rj представляет собой водород или C1-C3 алкил.
В некоторых таких вариантах осуществления каждая Rs независимо представляет собой -ORj, где Rj представляет собой C1-C3 алкил.
Один вариант осуществления относится к соединениям формулы (I-g)

где R1, R2, R4, R5, R6, R7, R9, R10, R13 и R14 являются такими, как определено в формуле (I-d).
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-g), где R9, R10 и R13 представляют собой водород.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-g), где R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-g), где
R9, R10 и R13 представляют собой водород; и
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-g), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород, C1-C6 галогеналкил или C1-C6 алкил;
R5 представляет собой водород, C1-C6 галогеналкил или C1-C6 алкил;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления R4 представляет собой водород, CH2F, CHF2, CH3 или CH2CH3; и R5 представляет собой водород, CH2F, CHF2, CH3 или CH2CH3.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-g), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой фенил, C3-C6 циклоалкил, 4-6-членный гетероцикл или 5-6-членный гетероарил; каждый из которых необязательно замещен 1, 2 или 3 независимо выбранными группами Rq
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-g), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой фенил, который необязательно замещен 1, 2 или 3 независимо выбранными группами Rq;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-g), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой фенил, который необязательно замещен 1, 2 или 3 группами Rq; где каждая Rq независимо представляет собой
C1-C6 алкил, где C1-C6 алкил необязательно замещен одной -OH;
галоген;
C1-C6 галогеналкил;
-ORh, где Rh представляет собой водород или C1-C3 алкил,
-C(O)Rh, где Rh представляет собой GA; где GA представляет собой 4-6-членный гетероцикл;
-C(O)ORh, где Rh представляет собой водород или C1-C6 алкил,
-C(O)N(Rh)2, где Rh в каждом случае независимо представляет собой водород, C3-C6 циклоалкил, C1-C6 галогеналкил или C1-C6 алкил; где C1-C6 галогеналкил и C1-C6 алкил каждый необязательно замещен 1 или 2 группами -ОН; или
-SO2Rh, где Rh представляет собой C1-C6 галогеналкил или C1-C6 алкил;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-g), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой фенил, который необязательно замещен 1, 2 или 3 группами Rq, где одна из Rq представляет собой -C(O)ORh, где Rh представляет собой водород или C1-C6 алкил, или одна из Rq представляет собой -C(O)N(H)(Rh), где Rh представляет собой циклопентил, или Rh представляет собой C1-C6 алкил, который замещен 1 или 2 группами -ОН; и другие дополнительные группы Rq независимо выбраны из группы, состоящей из C1-C3 алкила, галогена и C1-C3 галогеналкила;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-g), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой фенил, который замещен одним Rq; где Rq представляет собой -C(O)ORh, где Rh представляет собой водород или C1-C3 алкил;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В некоторых таких вариантах осуществления Rh представляет собой водород. В некоторых таких вариантах осуществления Rh представляет собой C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-g), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой


R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В некоторых таких вариантах осуществления Rh представляет собой водород. В некоторых таких вариантах осуществления Rh представляет собой C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-g), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой

R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В некоторых таких вариантах осуществления Rh представляет собой водород. В некоторых таких вариантах осуществления Rh представляет собой C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-g), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой

R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В некоторых таких вариантах осуществления Rh представляет собой водород. В некоторых таких вариантах осуществления Rh представляет собой C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-g), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой C3-C6 циклоалкил, который необязательно замещен 1, 2 или 3 группами Rq; где каждая Rq независимо представляет собой
C1-C6 алкил, где C1-C6 алкил необязательно замещен одной -OH;
галоген;
C1-C6 галогеналкил;
-ORh, где Rh представляет собой водород или C1-C3 алкил,
-C(O)Rh, где Rh представляет собой GA; где GA представляет собой 4-6-членный гетероцикл;
-C(O)ORh, где Rh представляет собой водород или C1-C6 алкил,
-C(O)N(Rh)2, где Rh в каждом случае независимо представляет собой водород, C3-C6 циклоалкил, C1-C6 галогеналкил или C1-C6 алкил; где каждый C1-C6 галогеналкил и C1-C6 алкил необязательно замещен 1 или 2 группами -ОН; или
-SO2Rh, где Rh представляет собой C1-C6 галогеналкил или C1-C6 алкил;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-g), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой циклопропил или циклогексил, каждый из которых необязательно замещен одним Rq; где Rq представляет собой -ORh, где Rh представляет собой C1-C3 алкил, или Rq представляет собой -C(O)ORh, где Rh представляет собой водород или C1-C6 алкил;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-g), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой циклогексил, который замещен одним Rq; где Rq представляет собой -C(O)ORh, где Rh представляет собой водород или C1-C3 алкил,
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-g), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой

R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления Rh представляет собой водород. В некоторых таких вариантах осуществления Rh представляет собой C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-g), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой 4-6-членный гетероцикл, необязательно замещенный 1, 2 или 3 независимо выбранными группами Rq;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления G2A представляет собой тетрагидрофуранил или азетидинил, каждый из которых необязательно замещен 1, 2 или 3 независимо выбранными группами Rq.
В некоторых таких вариантах осуществления G2A представляет собой тетрагидрофуранил или азетидинил, каждый из которых необязательно замещен 1, 2 или 3 группами Rq; где каждая Rq независимо представляет собой
C1-C6 алкил, где C1-C6 алкил необязательно замещен одной -OH;
галоген;
C1-C6 галогеналкил;
-ORh, где Rh представляет собой водород или C1-C3 алкил,
-C(O)Rh, где Rh представляет собой GA; где GA представляет собой 4-6-членный гетероцикл;
-C(O)ORh, где Rh представляет собой водород или C1-C6 алкил,
-C(O)N(Rh)2, где Rh в каждом случае независимо представляет собой водород, C3-C6 циклоалкил, C1-C6 галогеналкил или C1-C6 алкил; где каждый C1-C6 галогеналкил и C1-C6 алкил необязательно замещен 1 или 2 группами -ОН; или
-SO2Rh, где Rh представляет собой C1-C6 галогеналкил или C1-C6 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-g), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил;
R5 представляет собой G2A, где G2A представляет собой 5-6-членный гетероарил, необязательно замещенный 1, 2 или 3 независимо выбранными группами Rq;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления G2A представляет собой пиридинил, необязательно замещенный 1, 2 или 3 независимо выбранными группами Rq.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-g), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 и R5 вместе с атомом углерода, к которому они присоединены, образуют C3-C6 циклоалкил или 4-6-членный гетероцикл; где каждый C3-C6 циклоалкил и 4-6-членный гетероцикл необязательно замещен 1, 2 или 3 независимо выбранными группами Rp; и
каждый R6 и R7 независимо представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-g), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 и R5 вместе с атомом углерода, к которому они присоединены, образуют C3-C6 циклоалкил, который необязательно замещен 1 или 2 группами Rp; и
каждый R6 и R7 независимо представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления образованный C3-C6 циклоалкил представляет собой циклобутил или циклопентил, каждый из которых необязательно замещен 1 или 2 группами Rp. В одном таком варианте осуществления образованный C3-C6 циклоалкил представляет собой незамещенный циклобутил или незамещенный циклопентил.
В одном таком варианте осуществления каждый Rp независимо представляет собой
C1-C6 алкил, где C1-C6 алкил необязательно замещен 1 или 2 группами -OH;
-C(O)Rh, где Rh представляет собой C1-C6 алкил;
-C(O)ORh, где Rh представляет собой водород, C1-C6 алкил или -CH2-фенил; или
-SO2Rh, где Rh представляет собой C1-C6 галогеналкил или C1-C6 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-g), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 и R5, вместе с атомом углерода, к которому они присоединены, образуют 4-6-членный гетероцикл, который необязательно замещен 1 или 2 группами Rp; и
каждый R6 и R7 независимо представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления образованный 4-6-членный гетероцикл представляет собой азетидинил или пиперидинил, каждый из которых необязательно замещен 1 или 2 группами Rp.
В некоторых таких вариантах осуществления каждая Rp независимо представляет собой
C1-C6 алкил, где C1-C6 алкил необязательно замещен 1 или 2 группами -OH;
-C(O)Rh, где Rh представляет собой C1-C6 алкил;
-C(O)ORh, где Rh представляет собой водород, C1-C6 алкил или -CH2-фенил; или
-SO2Rh, где Rh представляет собой C1-C6 галогеналкил или C1-C6 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-g), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил; и
R5 представляет собой водород или C1-C3 алкил;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой -(C1-C6 алкиленил)-G3A.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-g), где
R9, R10 и R13 представляют собой водород;
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил; и R1B представляет собой водород или C1-C3 алкил;
R4 представляет собой водород или C1-C3 алкил; и
R5 представляет собой водород или C1-C3 алкил;
R6 представляет собой водород или C1-C3 алкил; и
R7 представляет собой -(CH2)-G3A, где G3A представляет собой фенил, который необязательно замещен 1, 2 или 3 группами Rs; где каждая Rs независимо представляет собой C1-C3 алкил, галоген, C1-C3 галогеналкил или -ORj, где Rj представляет собой водород или C1-C3 алкил.
В некоторых таких вариантах осуществления каждая Rs независимо представляет собой -ORj, где Rj представляет собой C1-C3 алкил.
Соединения, описанные в настоящем документе, могут содержать один или несколько асимметрично замещенных атомов и, таким образом, могут существовать в виде индивидуальных стереоизомеров (включая энантиомеры и диастереомеры) или их смесей. Например, некоторые варианты осуществления относятся к соединениям формулы (I-h)

где
R1 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил;
R2 представляет собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A или -C(O)OR1B; где R1A представляет собой водород, C1-C3 галогеналкил или C1-C3 алкил; где C1-C3 алкил необязательно замещен одним заместителем, выбранным из группы, состоящей из -ORZA, -C(O)OH и G1A; где G1A представляет собой фенил, который необязательно замещен 1, 2 или 3 группами Rs, где каждая Rs независимо представляет собой C1-C3 алкил, C1-C3 галогеналкил, галоген или -OCH3; и RZA представляет собой C1-C3 галогеналкил или C1-C3 алкил;
R1B представляет собой водород или C1-C3 алкил;
R3 и R14 каждый независимо представляет собой водород или галоген;
R4 представляет собой водород, C1-C3 галогеналкил или C1-C3 алкил;
R5 представляет собой G2A;
G2A представляет собой C3-C6 циклоалкил, 4-6-членный гетероцикл, фенил или 5-6-членный гетероарил, каждый из которых независимо является незамещенным или замещенным 1, 2 или 3 независимо выбранными группами Rq;
Rq, в каждом случае, независимо представляет собой C1-C6 алкил, галоген, C1-C6 галогеналкил, -CN, оксо, NO2, -ORh, -OC(O)Ri, -OC(O)N(Rh)2, -SRh, -S(O)2Rh, -S(O)2N(Rh)2, -C(O)Rh, -C(O)ORh, -C(O)N(Rh)2, -N(Rh)2, -N(Rh)C(O)Ri, -N(Rh)S(O)2Ri, -N(Rh)C(O)O(Ri), -N(Rh)C(O)N(Rh)2 или GA, где каждый C1-C6 галогеналкил и C1-C6 алкил необязательно замещены одним или двумя заместителями, независимо выбранными из группы, состоящей из -ORh, -OC(O)Ri, -OC(O)N(Rh)2, -SRh, -S(O)2Rh, -S(O)2N(Rh)2, -C(O)Rh, -C(O)ORh, -C(O)N(Rh)2, -N(Rh)2, -N(Rh)C(O)Ri, -N(Rh)S(O)2Ri, -N(Rh)C(O)O(Ri), -N(Rh)C(O)N(Rh)2, -CN и GA;
Rh в каждом случае независимо представляет собой водород, C1-C6 галогеналкил, C1-C6 алкил или GA, где каждый C1-C6галогеналкил и C1-C6 алкил необязательно замещены одним или двумя заместителями, независимо выбранными из группы, состоящей из -ORj, -OC(O)N(Rj)2, -SRj, -C(O)ORj, -C(O)N(Rj)2, -N(Rj)2, -CN и GA;
Ri в каждом случае независимо представляет собой C1-C6 галогеналкил, C1-C6 алкил или GA, где каждый C1-C6 галогеналкил и C1-C6 алкил необязательно замещены одним или двумя заместителями, независимо выбранными из группы, состоящей из -ORj, -OC(O)N(Rj)2, -SRj, -C(O)ORj, -C(O)N(Rj)2, -N(Rj)2, -CN и GA;
R6 представляет собой водород или C1-C3 алкил;
R7 представляет собой водород или C1-C3 алкил;
R9, R10 и R13 каждый независимо представляет собой водород или галоген;
GA, в каждом случае, независимо представляет собой циклоалкил, циклоалкенил, гетероцикл, арил или гетероарил, каждый из которых независимо является незамещенным или замещенным 1, 2 или 3 независимо выбранными группами Rs;
Rs в каждом случае независимо представляет собой C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, галоген, C1-C6 галогеналкил, -CN, оксо, NO2, -ORj, -OC(O)Rk, -OC(O)N(Rj)2, -SRj, -S(O)2Rj, -S(O)2N(Rj)2, -C(O)Rj, -C(O)ORj, -C(O)N(Rj)2, -N(Rj)2, -N(Rj)C(O)Rk, -N(Rj)S(O)2Rk, -N(Rj)C(O)O(Rk), -N(Rj)C(O)N(Rj)2, -(C1-C6 алкиленил)-ORj, -(C1-C6 алкиленил)-OC(O)Rk, -(C1-C6 алкиленил)-OC(O)N(Rj)2, -(C1-C6 алкиленил)-SRj, -(C1-C6 алкиленил)-S(O)2Rj, -(C1-C6 алкиленил)-S(O)2N(Rj)2, -(C1-C6 алкиленил)-C(O)Rj, -(C1-C6 алкиленил)-C(O)ORj, -(C1-C6 алкиленил)-C(O)N(Rj)2, -(C1-C6 алкиленил)-N(Rj)2, -(C1-C6 алкиленил)-N(Rj)C(O)Rk, -(C1-C6 алкиленил)-N(Rj)S(O)2Rk, -(C1-C6 алкиленил)-N(Rj)C(O)O(Rk), -(C1-C6 алкиленил)-N(Rj)C(O)N(Rj)2 или -(C1-C6 алкиленил)-CN;
Rj в каждом случае независимо представляет собой водород, C1-C6 алкил или C1-C6 галогеналкил; и
Rk в каждом случае независимо представляет собой C1-C6 алкил или C1-C6 галогеналкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-h), где R3, R14, R9, R10 и R13 представляют собой водород.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-h), где G2A представляет собой фенил, циклопропил, циклогексил, пиридинил, азетидинил или тетрагидрофуранил; каждый из которых необязательно замещен 1, 2 или 3 независимо выбранными группами Rq.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-h), где
G2A представляет собой фенил, пиридинил, циклопропил, циклогексил, пиридинил, азетидинил или тетрагидрофуранил; каждый из которых необязательно замещен 1, 2 или 3 независимо выбранными группами Rq; и R3, R14, R9, R10 и R13 представляют собой водород.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-h), где
R1 представляет собой водород, галоген, C1-C3 галогеналкил, C1-C3 алкил или -OR1A; где R1A представляет собой C1-C3 алкил; и
R2 представляет собой водород, галоген, C1-C3 галогеналкил, C1-C3 алкил или -OR1A; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил, где C1-C3 алкил необязательно замещен одним -ORZA, где RZA представляет собой C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-h), где
R1 представляет собой водород, галоген, C1-C3 галогеналкил, C1-C3 алкил или -OR1A; где R1A представляет собой C1-C3 алкил;
R2 представляет собой водород, галоген, C1-C3 галогеналкил, C1-C3 алкил или -OR1A; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил, где C1-C3 алкил необязательно замещен одним -ORZA, где RZA представляет собой C1-C3 алкил; и
R3, R14, R9, R10 и R13 представляют собой водород.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-h), где
R1 представляет собой водород, галоген, C1-C3 галогеналкил, C1-C3 алкил или -OR1A; где R1A представляет собой C1-C3 алкил;
R2 представляет собой водород, галоген, C1-C3 галогеналкил, C1-C3 алкил или -OR1A; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил, где C1-C3 алкил необязательно замещен одним -ORZA, где RZA представляет собой C1-C3 алкил;
R4 представляет собой водород;
R6 представляет собой водород; и
R7 представляет собой водород.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-h), где
R1 представляет собой водород, галоген, C1-C3 галогеналкил, C1-C3 алкил или -OR1A; где R1A представляет собой C1-C3 алкил;
R2 представляет собой водород, галоген, C1-C3 галогеналкил, C1-C3 алкил или -OR1A; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил, где C1-C3 алкил необязательно замещен одним -ORZA, где RZA представляет собой C1-C3 алкил;
R4 представляет собой водород;
R6 представляет собой водород;
R7 представляет собой водород; и
R3, R14, R9, R10 и R13 представляют собой водород.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-h), где
R1 представляет собой водород, CH3 или -OCH3;
R2 представляет собой водород, F, CF3, CH3, -OCHF2, -OCH2CH2F или -OCH2CH2OCH3;
R4 представляет собой водород;
R6 представляет собой водород;
R7 представляет собой водород; и
R3, R14, R9, R10 и R13 представляют собой водород.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-h), где
R1 представляет собой водород, галоген, C1-C3 галогеналкил, C1-C3 алкил или -OR1A; где R1A представляет собой C1-C3 алкил;
R2 представляет собой водород, галоген, C1-C3 галогеналкил, C1-C3 алкил или -OR1A; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил, где C1-C3 алкил необязательно замещен одним -ORZA, где RZA представляет собой C1-C3 алкил;
R4 представляет собой водород;
R6 представляет собой водород;
R7 представляет собой водород; и
G2A представляет собой фенил, замещенный 1, 2 или 3 группами Rq; где одна из групп Rq представляет собой C(O)ORh, где Rh представляет собой водород или C1-C6 алкил; или одна из групп Rq представляет собой -C(O)N(H)(Rh), где Rh представляет собой циклопентил, или Rh представляет собой C1-C6 алкил, который замещен 1 или 2 группами -ОН; и другие дополнительные группы Rq независимо выбраны из группы, состоящей из C1-C3 алкила, галогена и C1-C3 галогеналкила.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-h), где
R1 представляет собой водород, галоген, C1-C3 галогеналкил, C1-C3 алкил или -OR1A; где R1A представляет собой C1-C3 алкил;
R2 представляет собой водород, галоген, C1-C3 галогеналкил, C1-C3 алкил или -OR1A; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил, где C1-C3 алкил необязательно замещен одним -ORZA, где RZA представляет собой C1-C3 алкил;
R4 представляет собой водород;
R6 представляет собой водород;
R7 представляет собой водород;
R3, R14, R9, R10 и R13 представляют собой водород; и
G2A представляет собой фенил, замещенный 1, 2 или 3 группами Rq; где одна из групп Rq представляет собой C(O)ORh, где Rh представляет собой водород или C1-C6 алкил; или одна из групп Rq представляет собой -C(O)N(H)(Rh), где Rh представляет собой циклопентил, или Rh представляет собой C1-C6 алкил, замещенный 1 или 2 группами -ОН; и другие дополнительные группы Rq независимо выбраны из группы, состоящей из C1-C3 алкила, галогена и C1-C3 галогеналкила.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-h), где
R1 представляет собой водород, галоген, C1-C3 галогеналкил, C1-C3 алкил или -OR1A; где R1A представляет собой C1-C3 алкил;
R2 представляет собой водород, галоген, C1-C3 галогеналкил, C1-C3 алкил или -OR1A; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил, где C1-C3 алкил необязательно замещен одним -ORZA, где RZA представляет собой C1-C3 алкил;
R4 представляет собой водород;
R6 представляет собой водород;
R7 представляет собой водород; и
G2A представляет собой фенил или циклогексил; каждый из которых замещен одной C(O)ORh, где Rh представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-h), где
R1 представляет собой водород, галоген, C1-C3 галогеналкил, C1-C3 алкил или -OR1A; где R1A представляет собой C1-C3 алкил;
R2 представляет собой водород, галоген, C1-C3 галогеналкил, C1-C3 алкил или -OR1A; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил, где C1-C3 алкил необязательно замещен одним -ORZA, где RZA представляет собой C1-C3 алкил;
R4 представляет собой водород;
R6 представляет собой водород;
R7 представляет собой водород;
R3, R14, R9, R10 и R13 представляют собой водород; и
G2A представляет собой фенил или циклогексил; каждый из которых замещен одной C(O)ORh, где Rh представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-h), где
R1 представляет собой водород, галоген, C1-C3 галогеналкил, C1-C3 алкил или -OR1A; где R1A представляет собой C1-C3 алкил;
R2 представляет собой водород, галоген, C1-C3 галогеналкил, C1-C3 алкил или -OR1A; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил, где C1-C3 алкил необязательно замещен одним -ORZA, где RZA представляет собой C1-C3 алкил;
R4 представляет собой водород;
R6 представляет собой водород;
R7 представляет собой водород; и
G2A представляет собой фенил, замещенный одним C(O)ORh, где Rh представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления Rh представляет собой водород. В одном таком варианте осуществления Rh представляет собой C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-h), где
R1 представляет собой водород, галоген, C1-C3 галогеналкил, C1-C3 алкил или -OR1A; где R1A представляет собой C1-C3 алкил;
R2 представляет собой водород, галоген, C1-C3 галогеналкил, C1-C3 алкил или -OR1A; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил, где C1-C3 алкил необязательно замещен одним -ORZA, где RZA представляет собой C1-C3 алкил;
R4 представляет собой водород;
R6 представляет собой водород;
R7 представляет собой водород;
R3, R14, R9, R10 и R13 представляют собой водород; и
G2A представляет собой фенил, замещенный одним C(O)ORh, где Rh представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления Rh представляет собой водород. В одном таком варианте осуществления Rh представляет собой C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-h), где
R1 представляет собой водород, галоген, C1-C3 галогеналкил, C1-C3 алкил или -OR1A; где R1A представляет собой C1-C3 алкил;
R2 представляет собой водород, галоген, C1-C3 галогеналкил, C1-C3 алкил или -OR1A; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил, где C1-C3 алкил необязательно замещен одним -ORZA, где RZA представляет собой C1-C3 алкил;
R4 представляет собой водород;
R6 представляет собой водород;
R7 представляет собой водород; и
G2A представляет собой циклогексил, замещенный одним C(O)ORh, где Rh представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления Rh представляет собой водород. В одном таком варианте осуществления Rh представляет собой C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-h), где
R1 представляет собой водород, галоген, C1-C3 галогеналкил, C1-C3 алкил или -OR1A; где R1A представляет собой C1-C3 алкил;
R2 представляет собой водород, галоген, C1-C3 галогеналкил, C1-C3 алкил или -OR1A; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил, где C1-C3 алкил необязательно замещен одним -ORZA, где RZA представляет собой C1-C3 алкил;
R4 представляет собой водород;
R6 представляет собой водород;
R7 представляет собой водород;
R3, R14, R9, R10 и R13 представляют собой водород; и
G2A представляет собой циклогексил, замещенный одним C(O)ORh, где Rh представляет собой водород или C1-C3 алкил.
В одном таком варианте осуществления Rh представляет собой водород. В одном таком варианте осуществления Rh представляет собой C1-C3 алкил.
Один вариант осуществления относится к соединениям формулы (I-i)
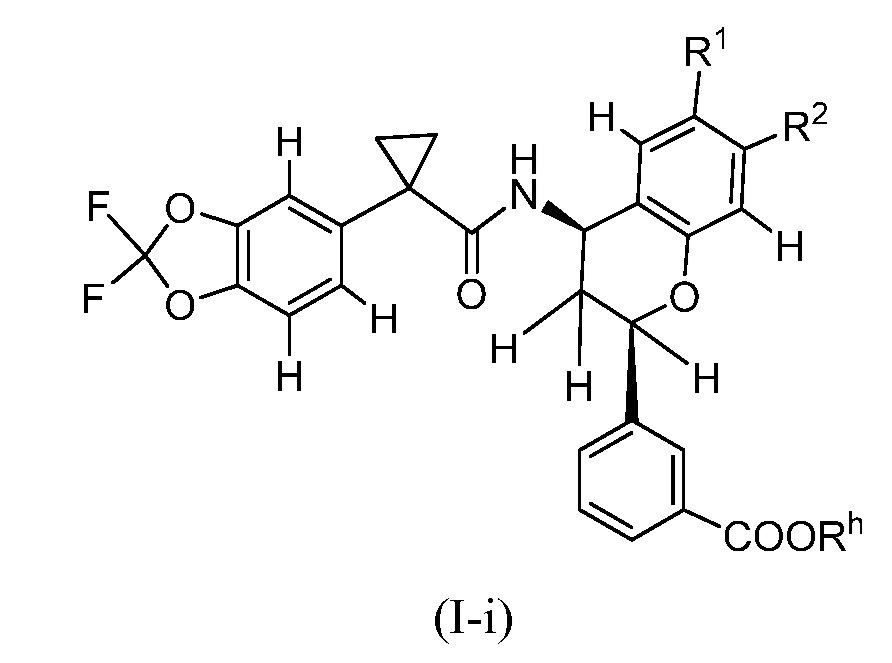
где
R1 представляет собой водород, галоген, C1-C3 галогеналкил, C1-C3 алкил или -OR1A; где R1A представляет собой C1-C3 алкил; и
R2 представляет собой водород, галоген, C1-C3 галогеналкил, C1-C3 алкил или -OR1A; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил, где C1-C3 алкил необязательно замещен одним -ORZA, и RZA представляет собой C1-C3 алкил; и
Rh представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-i), где
R1 представляет собой водород, C1-C3 алкил или -OR1A; где R1A представляет собой C1-C3 алкил; и
Rh представляет собой водород.
Один вариант осуществления относится к соединениям формулы (I-j)

где
R1 представляет собой водород, галоген, C1-C3 галогеналкил, C1-C3 алкил или -OR1A; где R1A представляет собой C1-C3 алкил; и
R2 представляет собой водород, галоген, C1-C3 галогеналкил, C1-C3 алкил или -OR1A; где R1A представляет собой C1-C3 галогеналкил или C1-C3 алкил, где C1-C3 алкил необязательно замещен одним -ORZA, и RZA представляет собой C1-C3 алкил; и
Rh представляет собой водород или C1-C3 алкил.
В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I-j), где
R1 представляет собой водород, C1-C3 алкил или -OR1A; где R1A представляет собой C1-C3 алкил; и
Rh представляет собой водород.
Один вариант осуществления относится к соединениям формулы (I), где
X представляет собой CR2 и Y представляет собой CR3; или
X представляет собой N и Y представляет собой CR3; или
X представляет собой CR2 и Y представляет собой N;
m равен 0, 1, 2 или 3;
Rʺ представляют собой необязательные заместители в циклопропильном кольце и в каждом случае каждый независимо представляют собой галоген, C1-C6 галогеналкил или C1-C6 алкил;
R1 и R2 каждый независимо представляют собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OR1A, -C(O)OR1B, -NR1AR2A или -C(O)NR1AR2A;
каждый R1A и R2A в каждом случае независимо представляют собой водород, C1-C6 галогеналкил, G1A или C1-C6 алкил; где каждый C1-C6 галогеналкил и C1-C6 алкил необязательно замещены одним или двумя заместителями, независимо выбранными из группы, состоящей из -ORZA, -SRZA, -S(O)2RZA, -C(O)RZA, -C(O)ORZA, -C(O)N(RZA)2, -N(RZA)2, -N(RZA)C(O)RZB, -N(RZA)S(O)2RZB, -N(RZA)C(O)ORZB, -N(RZA)C(O)N(RZA)2, -CN и G1A; или R1A и R2A вместе с атомом азота, к которому они присоединены, образуют 4-6-членный гетероцикл, где 4-6-членный гетероцикл необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, C1-C6 алкила, C1-C6 галогеналкила, -ORj и N(Rj)2; где
RZA в каждом случае независимо представляет собой водород, C1-C6 галогеналкил, C1-C6 алкил, G1A или -(C1-C6 алкиленил)-G1A; и
RZB в каждом случае независимо представляет собой C1-C6 галогеналкил, C1-C6 алкил, G1A или -(C1-C6 алкиленил)-G1A;
R1B представляет собой водород, C1-C6 галогеналкил или C1-C6 алкил;
R3 и R14 каждый независимо представляют собой водород, галоген, C1-C6 галогеналкил, C1-C6 алкил, -OH или -O-(C1-C6 алкил);
R4 представляет собой водород, C1-C6 галогеналкил или C1-C6 алкил;
R5 представляет собой водород, -C(O)Ri, -C(O)OH, -C(O)N(Rh)2, C1-C6 галогеналкил, C1-C6 алкил или G2A; где каждый C1-C6 галогеналкил и C1-C6 алкил необязательно замещены одним или двумя заместителями, независимо выбранными из группы, состоящей из -ORh, -OC(O)N(Rh)2, -C(O)Rh, -C(O)ORh, -C(O)N(Rh)2, -N(Rh)2, -N(Rh)C(O)Ri, -N(Rh)S(O)2Ri, -N(Rh)C(O)O(Ri), -N(Rh)C(O)N(Rh)2 и G2A; или
R4 и R5 вместе с атомом углерода, к которому они присоединены, образуют C3-C6 циклоалкил или 4-6-членный гетероцикл; где каждый C3-C6 циклоалкил и 4-6-членный гетероцикл необязательно замещен 1, 2 или 3 независимо выбранными группами Rp;
G2A, в каждом случае, независимо представляет собой циклоалкил, циклоалкенил, гетероцикл, арил или гетероарил, каждый из которых независимо является незамещенным или замещенным 1, 2 или 3 независимо выбранными группами Rq;
Rp и Rq, в каждом случае, каждый независимо представляют собой C1-C6 алкил, галоген, C1-C6 галогеналкил, -CN, оксо, NO2, -ORh, -OC(O)Ri, -OC(O)N(Rh)2, -SRh, -S(O)2Rh, -S(O)2N(Rh)2, -C(O)Rh, -C(O)ORh, -C(O)N(Rh)2, -N(Rh)2, -N(Rh)C(O)Ri, -N(Rh)S(O)2Ri, -N(Rh)C(O)O(Ri), -N(Rh)C(O)N(Rh)2 или GA, где каждый C1-C6 галогеналкил и C1-C6 алкил необязательно замещены одним или двумя заместителями, независимо выбранными из группы, состоящей из -ORh, -OC(O)Ri, -OC(O)N(Rh)2, -SRh, -S(O)2Rh, -S(O)2N(Rh)2, -C(O)Rh, -C(O)ORh, -C(O)N(Rh)2, -N(Rh)2, -N(Rh)C(O)Ri, -N(Rh)S(O)2Ri, -N(Rh)C(O)O(Ri), -N(Rh)C(O)N(Rh)2, -CN и GA;
Rh в каждом случае независимо представляет собой водород, C1-C6 галогеналкил, C1-C6 алкил или GA, где каждый C1-C6 галогеналкил и C1-C6 алкил необязательно замещены одним или двумя заместителями, независимо выбранными из группы, состоящей из -ORj, -OC(O)N(Rj)2, -SRj, -C(O)ORj, -C(O)N(Rj)2, -N(Rj)2, -CN и GA;
Ri в каждом случае независимо представляет собой C1-C6 галогеналкил, C1-C6 алкил или GA, где каждый C1-C6 галогеналкил и C1-C6 алкил необязательно замещены одним или двумя заместителями, независимо выбранными из группы, состоящей из -ORj, -OC(O)N(Rj)2, -SRj, -C(O)ORj, -C(O)N(Rj)2, -N(Rj)2, -CN и GA;
R6 представляет собой водород, галоген, C1-C6 галогеналкил или C1-C6 алкил;
R7 представляет собой водород, галоген, -ORj, -N(Rj)2, -N(Rj)C(O)Rk, C1-C6 галогеналкил, C1-C6 алкил, C2-C6 алкенил или -(C1-C6 алкиленил)-G3A;
R8 представляет собой водород, C1-C6 галогеналкил или C1-C6 алкил;
каждый R9, R10 и R13 независимо представляют собой водород, галоген, -ORj, C1-C6 галогеналкил или C1-C6 алкил;
каждый R11 и R12 независимо представляют собой водород, C1-C3 алкил или галоген;
G1A, G3A и GA, в каждом случае, каждый независимо представляют собой циклоалкил, циклоалкенил, гетероцикл, арил или гетероарил, каждый из которых является независимо незамещенным или замещенным 1, 2 или 3 независимо выбранными группами Rs; где
Rs в каждом случае независимо представляет собой C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, галоген, C1-C6 галогеналкил, -CN, оксо, NO2, -ORj, -OC(O)Rk, -OC(O)N(Rj)2, -SRj, -S(O)2Rj, -S(O)2N(Rj)2, -C(O)Rj, -C(O)ORj, -C(O)N(Rj)2, -N(Rj)2, -N(Rj)C(O)Rk, -N(Rj)S(O)2Rk, -N(Rj)C(O)O(Rk), -N(Rj)C(O)N(Rj)2, -(C1-C6 алкиленил)-ORj, -(C1-C6 алкиленил)-OC(O)Rk, -(C1-C6 алкиленил)-OC(O)N(Rj)2, -(C1-C6 алкиленил)-SRj, -(C1-C6 алкиленил)-S(O)2Rj, -(C1-C6 алкиленил)-S(O)2N(Rj)2, -(C1-C6 алкиленил)-C(O)Rj, -(C1-C6 алкиленил)-C(O)ORj, -(C1-C6 алкиленил)-C(O)N(Rj)2, -(C1-C6 алкиленил)-N(Rj)2, -(C1-C6 алкиленил)-N(Rj)C(O)Rk, -(C1-C6 алкиленил)-N(Rj)S(O)2Rk, -(C1-C6 алкиленил)-N(Rj)C(O)O(Rk), -(C1-C6 алкиленил)-N(Rj)C(O)N(Rj)2 или -(C1-C6 алкиленил)-CN;
Rj в каждом случае независимо представляет собой водород, C1-C6 алкил или C1-C6 галогеналкил; и
Rk в каждом случае независимо представляет собой C1-C6 алкил или C1-C6 галогеналкил.
Примеры соединений формулы (I) включают, но ими не ограничиваются:
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]бензойную кислоту;
3-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]бензойную кислоту;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2R,4R)-2-(3,4-диметоксифенил)-7-метокси-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2S,4S)-2-(3,4-диметоксифенил)-7-метокси-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид;
метил 3-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]бензоат;
метил 3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]бензоат;
метил 3-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]бензоат;
метил 3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]бензоат;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]бензойную кислоту;
3-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]бензойную кислоту;
метил 3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-6-метил-3,4-дигидро-2H-хромен-2-ил]бензоат;
метил 3-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-6-метил-3,4-дигидро-2H-хромен-2-ил]бензоат;
3-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-6-метил-3,4-дигидро-2H-хромен-2-ил]бензойную кислоту;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-6-метил-3,4-дигидро-2H-хромен-2-ил]бензойную кислоту;
3-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метил-3,4-дигидро-2H-хромен-2-ил]бензойную кислоту;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метил-3,4-дигидро-2H-хромен-2-ил]бензойную кислоту;
метил 3-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метил-3,4-дигидро-2H-хромен-2-ил]бензоат;
метил 3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метил-3,4-дигидро-2H-хромен-2-ил]бензоат;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-6-метокси-3,4-дигидро-2H-хромен-2-ил]бензойную кислоту;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2R,4R)-7-гидрокси-2-(3-метоксифенил)-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид;
метил 3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-6-метокси-3,4-дигидро-2H-хромен-2-ил]бензоат;
rac-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2R,4S)-7-метокси-2-(пиридин-3-ил)-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-гидрокси-3,4-дигидро-2H-хромен-2-ил]бензойную кислоту;
этил rel-3-[(2S,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2H-пирано[2,3-c]пиридин-2-ил]бензоат;
этил rel-3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2H-пирано[2,3-c]пиридин-2-ил]бензоат;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(дифторметокси)-3,4-дигидро-2H-хромен-2-ил]циклогексанкарбоновую кислоту;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(дифторметокси)-3,4-дигидро-2H-хромен-2-ил]бензойную кислоту;
rac-3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил]бензойную кислоту;
rac-3-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил]бензойную кислоту;
метил rac-3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил]бензоат;
rac-3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил]бензойную кислоту;
rac-3-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил]бензойную кислоту;
rac-метил 3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил]бензоат;
rac-метил 3-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил]бензоат;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]циклогексанкарбоновую кислоту;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-фтор-3,4-дигидро-2H-хромен-2-ил]циклогексанкарбоновую кислоту;
метил 3-[4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил]бензоат;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-фтор-3,4-дигидро-2H-хромен-2-ил]бензойную кислоту;
метил 3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-фтор-3,4-дигидро-2H-хромен-2-ил]бензоат;
rac-N-[(2R,4R)-2-циклопропил-7-метокси-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид;
rac-N-[(2R,4S)-2-циклопропил-7-метокси-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид;
4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2H-хромен-7-карбоновую кислоту;
3-({3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метил-3,4-дигидро-2H-хромен-2-ил]бензоил}амино)-1-метилциклопентанкарбоновую кислоту;
(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-2-(3-метоксифенил)-3,4-дигидро-2H-хромен-6-карбоновую кислоту;
метил 4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2H-хромен-7-карбоксилат;
метил (2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-2-(3-метоксициклогексил)-3,4-дигидро-2H-хромен-6-карбоксилат;
метил (2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-2-(3-метоксифенил)-3,4-дигидро-2H-хромен-6-карбоксилат;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метил-3,4-дигидро-2H-хромен-2-ил]-N-[(2R)-2,3-дигидроксипропил]бензамид;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2R,4R)-2-(3-{[(3R)-3-гидроксипирролидин-1-ил]карбонил}фенил)-7-метил-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метил-3,4-дигидро-2H-хромен-2-ил]-N-(3,3,3-трифтор-2-гидроксипропил)бензамид;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метил-3,4-дигидро-2H-хромен-2-ил]-N-(2-гидрокси-2-метилпропил)бензамид;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2R,4R)-2-(3-{[3-(гидроксиметил)пиперидин-1-ил]карбонил}фенил)-7-метил-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2R,4R)-2-(3-{[2-(гидроксиметил)морфолин-4-ил]карбонил}фенил)-7-метил-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метил-3,4-дигидро-2H-хромен-2-ил]-N-[(1-гидроксициклобутил)метил]бензамид;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2R,4R)-2-(3-{[3-(гидроксиметил)-3-метилазетидин-1-ил]карбонил}фенил)-7-метил-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид;
N-(7-бром-3,4-дигидро-2H-хромен-4-ил)-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид;
rac-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2R,4R)-7-метокси-2-(пиридин-3-ил)-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-{(2R)-2-[3-(гидроксиметил)фенил]-3,4-дигидро-2H-хромен-4-ил}циклопропанкарбоксамид;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-(7-метокси-3,4-дигидро-2H-хромен-4-ил)циклопропанкарбоксамид;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-(7-метокси-2-фенил-3,4-дигидро-2H-хромен-4-ил)циклопропанкарбоксамид;
N-[2-(3,4-дихлорфенил)-7-метокси-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[2-(3,4-диметоксифенил)-7-метокси-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид;
N-[2-(4-хлорфенил)-7-метокси-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-{2-[4-(трифторметил)фенил]-3,4-дигидро-2H-хромен-4-ил}циклопропанкарбоксамид;
N-[2-(2-хлорфенил)-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид;
N-[2-(3,4-дихлорфенил)-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-(2-фенил-3,4-дигидро-2H-хромен-4-ил)циклопропанкарбоксамид;
N-[2-(4-хлорфенил)-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[2-(3,4-диметоксифенил)-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид;
N-[2-(3-хлорфенил)-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[2-(4-фторфенил)-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[3-(3,4-диметоксибензил)-6-метокси-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид;
N-(3-бензил-3,4-дигидро-2H-хромен-4-ил)-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид;
N-[(4R)-2,2-диэтил-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид;
N-[(4R)-2,2-бис(фторметил)-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид;
N-[(4R)-7-хлор-2,2-диметил-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(4R)-8-фтор-2,2-бис(фторметил)-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(4R)-3,4-дигидроспиро[хромен-2,1'-циклопентан]-4-ил]циклопропанкарбоксамид;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(4R)-7-фтор-2,2-бис(фторметил)-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2S,4R)-2-(фторметил)-2-метил-7-(трифторметил)-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2R,4R)-2-(дифторметил)-2-метил-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2S,4R)-2-(дифторметил)-2-метил-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид;
N-[(2S,4R)-7-хлор-2-(дифторметил)-2-метил-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид;
N-[(2R,4R)-7-хлор-2-(дифторметил)-2-метил-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2S,4R)-2-метил-2-(трифторметил)-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(4R)-7-фтор-2,2-диметил-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид;
N-[(4R)-7-хлор-2,2-бис(фторметил)-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(4S)-6-фтор-2,2-диметил-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(4S)-6-фтор-3,4-дигидроспиро[хромен-2,1'-циклобутан]-4-ил]циклопропанкарбоксамид;
N-[(4R)-8-хлор-7-фтор-2,2-диметил-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[3-(3,4-диметоксибензил)-7-метокси-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид;
трет-бутил 4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-фтор-3,4-дигидро-1'H-спиро[хромен-2,4'-пиперидин]-1'-карбоксилат;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-(7-фтор-3,4-дигидроспиро[хромен-2,4'-пиперидин]-4-ил)циклопропанкарбоксамид;
метил 3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(2-метоксиэтокси)-3,4-дигидро-2H-хромен-2-ил]бензоат;
метил 3-[(2R,4R)-7-(бензилокси)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]бензоат;
3-[(2R,4R)-7-(карбоксиметокси)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]бензойную кислоту;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(2-метоксиэтокси)-3,4-дигидро-2H-хромен-2-ил]бензойную кислоту;
3-[(2R,4R)-7-(бензилокси)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]бензойную кислоту;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-{1'-[(2R)-2,3-дигидроксипропил]-7-фтор-3,4-дигидроспиро[хромен-2,4'-пиперидин]-4-ил}циклопропанкарбоксамид;
бензил 4'-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7'-фтор-3',4'-дигидро-1H-спиро[азетидин-3,2'-хромен]-1-карбоксилат;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[7-фтор-1'-(метилсульфонил)-3,4-дигидроспиро[хромен-2,4'-пиперидин]-4-ил]циклопропанкарбоксамид;
N-(1'-ацетил-7-фтор-3,4-дигидроспиро[хромен-2,4'-пиперидин]-4-ил)-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-(7'-фтор-3',4'-дигидроспиро[азетидин-3,2ʹ-хромен]-4'-ил)циклопропанкарбоксамид;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[7'-фтор-1-(метилсульфонил)-3',4'-дигидроспиро[азетидин-3,2ʹ-хромен]-4'-ил]циклопропанкарбоксамид;
N-(1-ацетил-7'-фтор-3',4'-дигидроспиро[азетидин-3,2ʹ-хромен]-4'-ил)-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(2-фторэтокси)-3,4-дигидро-2H-хромен-2-ил]бензойную кислоту;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[1'-(3-гидрокси-2,2-диметилпропаноил)-7-метокси-3,4-дигидроспиро[хромен-2,4'-пиперидин]-4-ил]циклопропанкарбоксамид;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(трифторметил)-3,4-дигидро-2H-хромен-2-ил]бензойную кислоту;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(трифторметил)-3,4-дигидро-2H-хромен-2-ил]циклогексанкарбоновую кислоту;
метил 4-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]бензоат;
4-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]бензойную кислоту;
метил rac-3-[(2R,4R)-7-хлор-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил]бензоат;
метил rac-3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-фтор-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил]бензоат;
rac-3-[(2R,4R)-7-хлор-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил]бензойную кислоту;
трет-бутил 3-[4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]азетидин-1-карбоксилат;
N-[2-(азетидин-3-ил)-7-метокси-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-{7-метокси-2-[1-(метилсульфонил)азетидин-3-ил]-3,4-дигидро-2H-хромен-4-ил}циклопропанкарбоксамид;
метил rac-3-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-фтор-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил]бензоат;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-8-фтор-3,4-дигидро-2H-хромен-2-ил]бензойную кислоту;
метил 4-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]бензоат;
4-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]бензойную кислоту;
4-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(дифторметокси)-3,4-дигидро-2H-хромен-2-ил]бензойную кислоту;
метил 4-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(дифторметокси)-3,4-дигидро-2H-хромен-2-ил]бензоат;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-(7-гидрокси-2,2-диметил-3,4-дигидро-2H-хромен-4-ил)циклопропанкарбоксамид;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[7-(дифторметокси)-2,2-диметил-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид;
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[7-метокси-2-(тетрагидрофуран-2-ил)-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид;
метил 4-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-гидрокси-3,4-дигидро-2H-хромен-2-ил]бензоат;
4-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-гидрокси-3,4-дигидро-2H-хромен-2-ил]бензойную кислоту;
4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидроспиро[хромен-2,1'-циклобутан]-3'-карбоновую кислоту;
этил rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2Н-хромен-2-карбоксилат;
метил rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2Н-хромен-2-карбоксилат;
этил rel-2-[(2S,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-5-карбоксилат;
2-[(4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-5-карбоновую кислоту;
rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-карбоновую кислоту;
этил rel-2-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-5-карбоксилат;
2-[(4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-5-карбоновую кислоту;
метил 4-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]-2-фторбензоат;
метил 4-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]-3-фторбензоат;
4-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]-2-фторбензойную кислоту;
этил rel-2-[(2S,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-4-карбоксилат;
этил rel-2-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-4-карбоксилат;
этил rel-2-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-4-карбоксилат;
rel-2-[(2S,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-4-карбоновую кислоту;
rel-2-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-4-карбоновую кислоту;
rel-2-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-4-карбоновую кислоту;
4-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]-3-фторбензойную кислоту;
метил rac-3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]бицикло[1.1.1]пентан-1-карбоксилат;
rac-3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]бицикло[1.1.1]пентан-1-карбоновую кислоту;
этил rac-6-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]пиридин-3-карбоксилат;
этил rac-6-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]пиридин-3-карбоксилат;
этил 3-[4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]циклобутанкарбоксилат;
3-[4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]циклобутанкарбоновую кислоту;
rac-6-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]пиридин-3-карбоновую кислоту;
rac-6-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]пиридин-3-карбоновую кислоту;
этил rel-2-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-4-карбоксилат;
rel-2-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-4-карбоновую кислоту;
этил rel-2-[(2S,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-4-карбоксилат;
rel-2-[(2S,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-4-карбоновую кислоту;
метил rel-6-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2Н-хромен-2-ил]пиридин-3-карбоксилат;
метил rel-6-[(2S,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2Н-хромен-2-ил]пиридин-3-карбоксилат;
метил rel-6-[(2S,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2Н-хромен-2-ил]пиридин-3-карбоксилат;
метил rel-6-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2Н-хромен-2-ил]пиридин-3-карбоксилат;
этил rac-(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2Н-хромен-2-карбоксилат;
rac-(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-карбоновую кислоту;
rel-6-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2Н-хромен-2-ил]пиридин-3-карбоновую кислоту;
rac-(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(2-гидроксиэтил)-7-метокси-N-пропил-3,4-дигидро-2H-хромен-2-карбоксамид;
rac-(2R,4R)-N-бензил-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(2-гидроксиэтил)-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид;
rac-(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(2-гидрокси-2-фенилэтил)-7-метокси-N-метил-3,4-дигидро-2H-хромен-2-карбоксамид;
rac-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2R,4R)-2-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-7-метокси-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид;
rac-(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(1-гидрокси-2-метилпропан-2-ил)-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид;
rac-(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(2-гидрокси-1-фенилэтил)-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид;
rac-(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(1,1-диоксидотетрагидро-2H-тиопиран-4-ил)-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид;
rac-(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-N-[3-(трифторметил)оксетан-3-ил]-3,4-дигидро-2H-хромен-2-карбоксамид;
rac-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-{(2R,4R)-2-[(4,4-дифторпиперидин-1-ил)карбонил]-7-метокси-3,4-дигидро-2H-хромен-4-ил}циклопропанкарбоксамид;
rac-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2R,4R)-7-метокси-2-(1,4-оксазепан-4-илкарбонил)-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид;
rac-(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-N-метил-N-(оксетан-3-ил)-3,4-дигидро-2H-хромен-2-карбоксамид;
rac-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2R,4R)-7-метокси-2-(морфолин-4-илкарбонил)-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид;
rac-(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-[2-гидрокси-1-(2-метоксифенил)этил]-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид;
rac-(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-[2-(3-гидроксифенил)этил]-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид;
rac-(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(1,3-дигидроксипропан-2-ил)-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид;
rac-(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(2-гидрокси-2,3-дигидро-1H-инден-1-ил)-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид;
rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(2-гидроксифенил)-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид;
rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(2-гидроксиэтил)-7-метокси-N-пропил-3,4-дигидро-2H-хромен-2-карбоксамид;
rac-(2R,4S)-N-бензил-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(2-гидроксиэтил)-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид;
rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(2-гидрокси-2-фенилэтил)-7-метокси-N-метил-3,4-дигидро-2H-хромен-2-карбоксамид;
rac-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-{(2R,4S)-2-[(4-гидроксипиперидин-1-ил)карбонил]-7-метокси-3,4-дигидро-2H-хромен-4-ил}циклопропанкарбоксамид;
rac-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2R,4S)-2-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-7-метокси-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид;
rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(2-гидрокси-2-метилпропил)-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид;
rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(1-гидрокси-2-метилпропан-2-ил)-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид;
rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(2-гидрокси-1-фенилэтил)-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид;
rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(1,1-диоксидотетрагидро-2H-тиопиран-4-ил)-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид;
rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-N-[3-(трифторметил)оксетан-3-ил]-3,4-дигидро-2H-хромен-2-карбоксамид;
rac-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-{(2R,4S)-2-[(4,4-дифторпиперидин-1-ил)карбонил]-7-метокси-3,4-дигидро-2H-хромен-4-ил}циклопропанкарбоксамид;
rac-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2R,4S)-7-метокси-2-(1,4-оксазепан-4-илкарбонил)-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид;
rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-N-метил-N-(оксетан-3-ил)-3,4-дигидро-2H-хромен-2-карбоксамид;
rac-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2R,4S)-7-метокси-2-(морфолин-4-илкарбонил)-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид;
rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-[2-гидрокси-1-(2-метоксифенил)этил]-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид;
rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-[2-(3-гидроксифенил)этил]-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид;
rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(1,3-дигидроксипропан-2-ил)-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид;
rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(2-гидрокси-2,3-дигидро-1H-инден-1-ил)-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид;
rac-1-{[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]карбонил}пирролидин-3-карбоновую кислоту;
4-[(2R,4R)-4-({[1-(6-бром-2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(дифторметокси)-3,4-дигидро-2H-хромен-2-ил]бензойную кислоту;
метил 4-((2R,4R)-4-(1-(6-бром-2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-7-метоксихроман-2-ил)бензоат; и
4-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(дифторметокси)-3,4-дигидро-2H-хромен-2-ил]-N-(метилсульфонил)бензамид.
Названия соединений присваивали с использованием алгоритма присвоения названия Name 2012 компании Advanced Chemical Development или алгоритма присвоения названия Struct=Name как части CHEMDRAW® ULTRA v. 12.0.2.1076.
Соединения по настоящему изобретению могут существовать в виде стереоизомеров, в которых присутствуют асимметричные или хиральные центры. Эти стереоизомеры представляют собой ʺRʺ или ʺSʺ в зависимости от конфигурации заместителей вокруг хирального атома углерода. Термины ʺRʺ и ʺSʺ, используемые в настоящей заявке, представляют собой конфигурации, как определено в IUPAC 1974 Recommendations for Section E, Fundamental Stereochemistry, in Pure Appl. Chem., 1976, 45: 13-30. В настоящем изобретении рассматриваются различные стереоизомеры и их смеси, и они конкретно включены в объем настоящего изобретения. Стереоизомеры включают энантиомеры и диастереомеры, а также смеси энантиомеров или диастереомеров. Отдельные стереоизомеры соединений по настоящему изобретению могут быть получены синтетически из коммерчески доступных исходных веществ, которые содержат асимметричные или хиральные центры, или путем получения рацемических смесей с последующим разделением способами, хорошо известными специалистам в данной области. Примером таких способов разделения является (1) присоединение смеси энантиомеров к хиральному вспомогательному веществу, разделение полученной смеси диастереомеров при помощи перекристаллизации или хроматографии и необязательное выделение оптически чистого продукта из вспомогательного вещества, как описано в Furniss, Hannaford, Smith, and Tatchell, "Vogel's Textbook of Practical Organic Chemistry", 5th edition (1989), Longman Scientific & Technical, Essex CM20 2JE, England, или (2) прямое разделение смеси оптических энантиомеров на хиральных хроматографических колонках или (3) методы фракционированной перекристаллизации.
Хиральные центры, из которых известна относительная, но не абсолютная конфигурация, могут быть обозначены произвольно, и полное название имеет префикс rel- (для относительной). Например, этил rel-3-[(2S,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2H-пирано[2,3-c]пиридин-2-ил]бензоат означает


Некоторые названия имеют префикс rac- (для рацемической), обозначая рацемические смеси двух энантиомеров в соотношении приблизительно 1:1.
Соединения по настоящему изобретению могут существовать в виде цис- или транс-изомеров, где заместители в кольце могут быть присоединены таким образом, что они находятся с одной и той же стороны от кольца (цис-) относительно друг друга или с противоположных сторон кольца относительно друг друга (транс-). Например, циклобутан может присутствовать в цис- или транс-конфигурации и может присутствовать в виде единственного изомера или в виде смеси цис- и транс-изомеров. Индивидуальные цис- или транс-изомеры соединений по настоящему изобретению могут быть получены синтетически из коммерчески доступных исходных веществ с использованием селективных превращений органических веществ или могут быть получены в единственной изомерной форме посредством очистки смесей цис- и транс-изомеров. Такие способы хорошо известны среднему специалисту в данной области и могут включать разделение изомеров при помощи перекристаллизации или хроматографии.
Следует понимать, что соединения по настоящему изобретению могут обладать таутомерными формами, а также геометрическими изомерами и что они также составляют один из аспектов изобретения.
Настоящее изобретение включает все фармацевтически приемлемые меченные изотопами соединения формулы (I), где один или несколько атомов замещены атомами, имеющими такой же атомный номер, но атомную массу или массовое число, отличающиеся от атомной массы или массового числа, которые преобладают в природе. Примеры изотопов, подходящих для включения в соединения по настоящему изобретению, включают изотопы водорода, как например,2H и3H, углерода, как например,11C,13C и14C, хлора, как например,36Cl, фтора, как например,18F, йода, как например,123I и125I, азота, как например,13N и15N, кислорода, как например,15О,17О и18О, фосфора, как например,32P, и серы, как например,35S. Некоторые меченные изотопами соединения формулы (I), например, соединения, включающие радиоактивный изотоп, используются в исследованиях распределения в тканях лекарственного средства и/или субстрата. Радиоактивные изотопы тритий, т.е.3H, и углерод-14, т.е.14С, особенно полезны для этой цели с точки зрения легкости их включения и быстрого способа детекции. Замещение более тяжелыми изотопами, таким как дейтерий, т.е.2H, может дать определенные терапевтические преимущества, являющиеся результатом большей метаболической стабильности, например, увеличенный период полужизни in vivo или уменьшенные требования к дозировкам, и, следовательно, может быть предпочтительным в некоторых случаях. Замещение позитрон-излучающими изотопами, например,11C,18F,15O и13N, может быть полезным в исследованиях степени занятости рецептора субстратом с использованием позитронно-эмиссионной томографии (ПЭТ). Меченые изотопами соединения формулы (I) могут быть получены, как правило, стандартными способами, известными специалистам в данной области, или способами, аналогичными способам, раскрытым в сопровождающих примерах, с использованием соответствующих меченных изотопом реагентов вместо немеченного реагента, используемого ранее.
Таким образом, рисунки структурных формул в настоящем описании могут представлять только одну из возможных таутомерных, геометрических или стереоизомерных форм. Следует понимать, что настоящее изобретение охватывает любую таутомерную, геометрическую или стереоизомерную форму и их смеси и не должно быть ограничено просто какой-либо одной таутомерной, геометрической или стереоизомерной формой, используемой в рамках рисунков структурных формул.
Соединения формулы (I) можно использовать в форме фармацевтически приемлемых солей. Фраза ʺфармацевтически приемлемая сольʺ означает такие соли, которые являются, в рамках здравого медицинского суждения, пригодными для использования в контакте с тканями человека и животных без излишней токсичности, раздражения, аллергической реакции и тому подобного, и соизмеримы с разумным отношением польза/риск.
Фармацевтически приемлемые соли описаны в S. M. Berge et al. J. Pharmaceutical Sciences, 1977, 66: 1-19.
Соединения формулы (I) могут содержать либо основную, либо кислотную функциональную группу, либо и ту и другую, и при необходимости могут быть превращены в фармацевтически приемлемую соль с использованием подходящей кислоты или основания. Соли могут быть получены in situ во время окончательного выделения и очистки соединений по настоящему изобретению.
Примеры кислотно-аддитивных солей включают, но ими не ограничиваются, ацетат, адипат, альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфорсульфонат, диглюконат, глицерофосфат, гемисульфат, гептаноат, гексаноат, фумарат, гидрохлорид, гидробромид, гидроиодид, 2-гидроксиэтансульфонат (изотионат), лактат, малат, малеат, метансульфонат, никотинат, 2-нафталинсульфонат, оксалат, пальмитоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, фосфат, глутамат, бикарбонат, п-толуолсульфонат и ундеканоат. Кроме того, основные азотсодержащие группы могут быть кватернизированы такими агентами, как низшие алкилгалогениды, такие как, но ими не ограничиваясь, метил, этил, пропил и бутил хлориды, бромиды и иодиды; диалкилсульфаты, такие как диметил, диэтил, дибутил и диамил сульфаты; длинноцепочечные галогениды, такие как, но ими не ограничиваясь, децил, лаурил, миристил и стеарил хлориды, бромиды и иодиды; арилалкилгалогениды, такие как бензил и фенетил бромиды, и другие. Таким образом, получают водо- или маслорастворимые или диспергируемые продукты. Примеры кислот, которые могут быть использованы для получения фармацевтически приемлемых кислотно-аддитивных солей, включают такие неорганические кислоты, как хлористоводородная кислота, бромистоводородная кислота, серная кислота и фосфорная кислота, и такие органические кислоты, как уксусная кислота, фумаровая кислота, малеиновая кислота, 4-метилбензолсульфоновая кислота, янтарная кислота и лимонная кислота.
Основные соли присоединения могут быть получены in situ во время окончательного выделения и очистки соединений по настоящему изобретению путем взаимодействия содержащей карбоновую кислоту группы с подходящим основанием, таким как, но ими не ограничиваясь, гидроксид, карбонат или бикарбонат фармацевтически приемлемого катиона металла, или аммиак или органический первичный, вторичный или третичный амин. Фармацевтически приемлемые соли включают, но ими не ограничиваются, катионы на основе щелочных металлов или щелочноземельных металлов, таких как, но ими не ограничиваясь, соли лития, натрия, калия, кальция, магния и алюминия и тому подобное, и нетоксичные четвертичные аммониевые и аминные катионы, включая аммоний, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, триэтиламин, диэтиламин, этиламин и тому подобное. Другие примеры органических аминов, используемых для образования основно-аддитивных солей, включают этилендиамин, этаноламин, диэтаноламин, пиперидин, пиперазин и тому подобное.
Термин ʺфармацевтически приемлемое пролекарствоʺ или ʺпролекарствоʺ, как используется в настоящем описании, представляет собой пролекарства соединений по настоящему изобретению, которые являются, в рамках здравого медицинского суждения, пригодными для использования при контакте с тканями человека и животных без излишней токсичности, раздражения, аллергической реакции и тому подобное, соответствующие разумному отношению польза/риск и эффективные при их предполагаемом использовании.
Настоящее изобретение относится к соединениям формулы (I), образованным синтетическими способами, или образованным in vivo биотрансформацией пролекарства.
Соединения, описанные в настоящем документе, могут существовать как в несольватированных, так и в сольватированных формах, включая гидратированные формы, такие как полугидраты. Как правило, сольватированные формы с фармацевтически приемлемыми растворителями, такими как вода и этанол, среди прочих, эквивалентны несольватированным формам для целей настоящего изобретения.
Общий синтез
Соединения, описанные в настоящем документе, в различных вариантах осуществления, включая соединения общей формулы (I) и конкретные примеры, могут быть получены с помощью методик, известных в данной области, например, посредством схем реакций, изображенных на схемах 1-9. Переменные R1, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, Rʺ, G2A, X, Y и m, используемые в следующих схемах, имеют значения, указанные в разделах ʺСущность изобретенияʺ и ʺПодробное описание изобретенияʺ, если не указано иное.
Сокращения, используемые в описаниях схем и конкретных примеров, имеют следующие значения: n-BuLi для н-бутиллития, DMF для N,N-диметилформамида, ДМСО для диметилсульфоксида, dppf для 1,1'-бис(дифенилфосфино)ферроцена, ВЭЖХ для высокоэффективной жидкостной хроматографии, ЖХ/МС для жидкостной хроматографии с масс-спектрометрией, преп-ВЭЖХ для препаративной высокоэффективной жидкостной хроматографии, MeOH для метанола, MTBE для метил-трет-бутилового эфира, ЯМР означает ядерный магнитный резонанс, SFC для сверхкритической флюидной хроматографии, TFA для трифторуксусной кислоты, и THF для тетрагидрофурана.
Соединения общей формулы (I) могут быть получены с использованием общей методики, как описано в схеме 1. Кислоты формулы (1) могут быть подвергнуты взаимодействию с аминами формулы (2) в присутствии 1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиний 3-оксида гексафторфосфата, и основания, такого как, но им не ограничиваясь, диизопропилэтиламин, в растворителе, таком как, но им не ограничиваясь, DMF и при температуре окружающей среды с получением амидов общей формулы (I).
Альтернативно, соединения общей формулы (I) могут быть получены путем (а) обработки кислот (1) оксалилхлоридом в присутствии каталитического количества DMF, и в растворителе, таком как, но этим не ограничиваясь, дихлорметан, при температуре окружающей среды для получения соответствующего хлорангидрида кислоты (3), и (b) взаимодействия хлорангидрида кислоты (3) с аминами (2) в присутствии основания, такого как, но этим не ограничиваясь, триэтиламин, в растворителе, таком как, но этим не ограничиваясь, дихлорметан, при температуре окружающей среды.
Схема 1

Необходимые амины формулы (2) могут быть получены любым из нескольких способов и синтетических промежуточных продуктов, выбранных специалистом в данной области, как проиллюстрировано на схемах 2-5. Рацемические амины общей формулы (2) могут быть получены из соответствующих хроманонов, как показано на схемах 2-5. Хроманоны (4) могут быть обработаны гидроксиламинами или алкоксиаминами, такими как метоксиамин, с получением оксимов формулы (5). Оксимная группа (5) может быть восстановлена с использованием методик, известных специалистам в данной области, например, с помощью гидрогенолиза в присутствии водорода и катализатора, такого как, но не ограничиваясь ими, платина на угле, или никель Ренея, или оксид платины (IV), с получением аминов общей формулы (2).
Альтернативно, хроманоны (4) могут быть обработаны восстанавливающим агентом, таким как, но этим не ограничиваясь, боргидрид натрия, с получением спиртов (6). Спирты (6) могут быть преобразованы в азиды общей формулы (7) путем активации сульфонилирующим агентом, таким как, но этим не ограничиваясь, метансульфоновый ангидрид, с последующим замещением нуклеофильным источником азида, таким как, но этим не ограничиваясь, азид тетрабутиламмония. Альтернативно, спирты (6) могут быть обработаны дифенилфосфорилазидом в присутствии основания, такого как, но им не ограничиваясь, 1,8-диазабицикло[5.4.0]ундец-7-ен, с получением азидов (7). Амины (2) могут быть получены путем восстановления азидов (7) путем обработки фосфиновым агентом, таким как, но им не ограничиваясь, трифенилфосфин, с соответствующим смешивающимся с водой органическим сорастворителем, таким как, но им не ограничиваясь, THF.
Схема 2

Хиральные амины могут быть получены способами синтеза, как показано на схемах 3 и 4. Хиральные амины формулы (8), (15) и (16) могут быть превращены в целевые соединения, описанные в настоящем документе, с использованием способов синтеза, описанных в схеме 1.
Хроманоны (4) могут быть обработаны источниками хирального гидрида, известными специалистам в данной области техники (Corey, E.J. et al. J.Org. Chem. 1988, 53, 2861; Kawanami, S. et al. Tetrahedron 2003, 59, 8411; Corey, E.J. et al. Tetrahedron Asymm. 2002, 13, 1347) с получением хиральных спиртов общей формулы (9). Спирты (9) могут быть превращены в азиды формулы (10) и затем в амины (8) с использованием реагентов и условий реакции, как описано в схеме 2.
Схема 3

Альтернативно, гидрохлоридные соли хиральных аминов могут быть получены в соответствии с общей методикой, описанной Ellman и соавторами (Tanuwidjaja, J.; Ellman, J.A. et al. J. Org. Chem. 2007, 72, 626), как показано на схеме 4. Хроманоны (4) можно конденсировать с хиральным сульфинамидом, таким как трет-бутансульфинамид, в присутствии кислоты Льюиса, такой как этоксид титана(IV), с получением промежуточных соединений N-сульфинилимина (11) и (12). Диастереомерная смесь (11) и (12) может быть разделена с помощью хроматографии. Соответствующие промежуточные соединения N-сульфинилимина (11) и (12) могут быть подвергнуты последующему восстановлению с помощью реагентов, таких как боргидрид натрия, с получением сульфинамидов общей формулы (13) и (14). Обработка сульфинамидов (13) и (14) HCl или ацетилхлоридом и метанолом дает гидрохлоридные соли аминов (15) и (16).
Схема 4

Стереоселективный гидрогенолиз оксимов формулы (17), где R5 представляет собой G2A, можно получить в присутствии восстанавливающего агента, такого как платина на угле или оксид платины(IV)/уксусная кислота, как показано на схеме 5. Восстановление обеспечивает избирательно один энантиомер формулы (18).
Схема 5

Спирты общей формулы (6) и (9), где R4, R6 и R7 представляют собой водород, и R5 представляет собой алкил или G2A, могут быть получены, как показано на схеме 6. Этаноны общей формулы (20) могут быть обработаны бис(триметилсилил)амидом лития в растворителе, таком как THF, при температуре приблизительно -78°С, с последующей обработкой альдегидами формулы (19) с получением гидроксикетонов формулы (21). Восстановление (21) восстанавливающим агентом, таким как, но им не ограничиваясь, боргидрид натрия, необязательно в присутствии комплексообразующего агента, такого как диэтилметоксиборан, дает диолы формулы (22). Циклизация диолов (22) может быть осуществлена в присутствии DBU при повышенной температуре (например, от приблизительно 60°С до приблизительно 90°С). Цис- и транс-изомеры могут быть получены с помощью колоночной хроматографии (23).
Схема 6

Хроманоны (4), где R4, R6 и R7 представляют собой водород, и R5 представляет собой алкил или G2A, могут быть получены, как показано на схеме 7. Этаноны общей формулы (20) могут взаимодействовать с бис(триметилсилил)амидом лития в растворителе, таком как THF, при температуре приблизительно -78°С, с последующей обработкой хлорангидридами кислоты формулы (24) с получением промежуточных соединений формулы (25). Циклизация (25) в присутствии основания, такого как карбонат калия, в растворителе, таком как, но им не ограничиваясь, DMF, при повышенной температуре (например, приблизительно 90°C до приблизительно 120°С) дает хроменоны (26). Преобразование хроменонов (26) в хроманоны (26А) может быть осуществлена путем a) восстановления (26) подходящим восстанавливающим агентом с получением соответствующего хроманола (23) и b) окисления хроманола с помощью окислителя, такого как, но им не ограничиваясь, реагент Джонса.
Схема 7

Хроманоны (4), где R4, R6 и R7 представляют собой водород, и R5 представляет собой алкил или G2A, могут быть получены, как показано на схеме 8. Гидроксиэтаноны (27) могут быть обработаны альдегидами (28) в присутствии основания, такого как гидроксид натрия, с получением промежуточных соединений (29). Циклизация (29)-(26A) может быть осуществлена обработкой концентрированной HCl при повышенной температуре (например, приблизительно 100°C).
Альтернативно, хроманоны (26А) могут быть получены в результате а) обработки гидроксиэтанонов (27) диизопропиламидом лития и альдегидами (28) с получением промежуточного продукта (30) и b) циклизацией (30) в присутствии трифторуксусного ангидрида и DBU.
Схема 8

Хиральные хроманоны (32), где R5 представляет собой арил или гетероарил, могут быть получены, как показано на схеме 9. Гидроксиэтаноны (27) могут быть обработаны 1,1-диметокси-N,N-диметилметанамином при повышенной температуре (приблизительно 100°C до приблизительно 120°C) или под действием микроволнового излучения для получения хроменонов (31). Обработка (31) арильной или гетероарильной бороновой кислотой (или ее сложными эфирами) в присутствии (S)-4-(трет-бутил)-2-(пиридин-2-ил)-4,5-дигидрооксазола, и катализатора, такого как бис(2,2,2-трифторацетокси)палладий, обеспечивает хиральные хроманоны (32).
Схема 9

Оптимальные условия реакции и время реакции каждой отдельной стадии могут изменяться в зависимости от конкретных используемых реагентов и заместителей, присутствующих в используемых реагентах. Если не указано иного, растворители, температуры и другие условия реакции могут быть легко выбраны специалистом в данной области. Конкретные процедуры приведены в разделе ʺПримеры синтезаʺ. Продукты реакции могут быть подвергнуты дальнейшей обработке обычным способом, например, путем удаления растворителя из остатка и дополнительной очистки в соответствии с общепринятыми в данной области методиками, такими как, но ими не ограничиваясь, кристаллизация, дистилляция, экстракция, растирание и хроматография. Если не указано иное, исходные материалы и реагенты являются либо коммерчески доступными, либо могут быть получены специалистом из коммерчески доступных материалов с использованием способов, описанных в химической литературе.
Обычные эксперименты, включая соответствующее манипулирование условиями реакции, реагентами и последовательностью пути синтеза, защиту любой химической функциональной группы, которая несовместима с условиями реакции, и снятие защиты в подходящем месте в последовательности реакции способа включены в объем изобретения. Подходящие защитные группы и способы защиты и снятия защиты с различных заместителей с использованием таких подходящих защитных групп хорошо известны специалистам в данной области техники; примеры которых можно найти в T. Greene and P. Wuts, Protecting Groups in Organic Synthesis (3rd ed.), John Wiley & Sons, NY (1999), которая включена в настоящее описание в качестве ссылки во всей своей полноте. Синтез соединений по настоящему изобретению может быть осуществлен способами, аналогичными способам, описанным в схемах синтеза, описанных выше и в конкретных примерах.
Исходные материалы, если они не являются коммерчески доступными, могут быть получены способами, выбранными из стандартных методов органической химии, способами, аналогичными способам синтеза известных структурно подобных соединений, или способами, аналогичными вышеописанным схемам или процедурам, описанным в разделе примеров синтеза.
Когда требуется оптически активная форма соединения по настоящему изобретению, она может быть получена осуществлением одной из процедур, описанных в настоящем документе, с использованием оптически активного исходного материала (полученного, например, путем асимметрической индукцией подходящей стадии реакции) или путем разделения смеси стереоизомеров соединения или промежуточных соединений с использованием стандартной процедуры (такой как хроматографическое разделение, перекристаллизация или ферментативное разделение).
Аналогичным образом, когда требуется чистый геометрический изомер соединения по настоящему изобретению, он может быть получен осуществлением одной из вышеуказанных процедур с использованием чистого геометрического изомера в качестве исходного материала или путем разделения смеси геометрических изомеров соединения по настоящему изобретению или промежуточных соединений с использованием стандартной процедуры, такой как хроматографическое разделение.
Фармацевтические композиции
Настоящее изобретение также относится к фармацевтическим композициям, содержащим терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли вместе с его фармацевтически приемлемым носителем, разбавителем или эксципиентом. Фраза ʺфармацевтическая композицияʺ относится к композиции, подходящей для введения при медицинском или ветеринарном применении.
Фармацевтические композиции, которые содержат соединение формулы (I), по отдельности или в сочетании с одним или несколькими дополнительными терапевтическими средствами, могут быть введены субъектам перорально, ректально, парентерально, интрацистернально, интравагинально, внутрибрюшинно, местно (в виде порошков, мазей или капель), буккально или в виде орального или назального спрея. Как используется в настоящем описании термин ʺпарентеральноʺ относится к способам введения, которые включают внутривенную, внутримышечную, внутрибрюшинную, интрастернальную, подкожную и внутрисуставную инъекцию и инфузию.
Термин ʺфармацевтически приемлемый носительʺ, как используется в настоящем описании, означает нетоксичный, инертный твердый, полутвердый или жидкий наполнитель, разбавитель, инкапсулирующий материал или вспомогательный состав любого типа. Некоторыми примерами материалов, которые могут служить в качестве фармацевтически приемлемых носителей, являются сахара, такие как, но не ограничиваясь этим, лактоза, глюкоза и сахароза; крахмалы, такие как, но не ограничиваясь этим, кукурузный крахмал и картофельный крахмал; целлюлоза и ее производные, такие как, но не ограничиваясь этим, натрийкарбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; порошкообразный трагакант; солод; желатин; тальк; эксципиенты, такие как, но не ограничиваясь этим, масло какао и воска для суппозиториев; масла, такие как, но не ограничиваясь этим, арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли; такой как пропиленгликоль; сложные эфиры, такие как, но не ограничиваясь этим, этилолеат и этиллаурат; агар; буферные агенты, такие как, но не ограничиваясь этим, гидроксид магния и гидроксид алюминия; альгиновая кислота; апирогенная вода; изотонический солевой раствор; раствор Рингера; этиловый спирт и фосфатные буферные растворы, а также другие нетоксичные совместимые смазывающие вещества, такие как, но не ограничиваясь этим, лаурилсульфат натрия и стеарат магния, а также красители, высвобождающие средства, покрывающие средства, подсластитель, вкусовые и ароматизирующие средства, консерванты и антиоксиданты могут также присутствовать в композиции, в соответствии с решением разработчика рецептур.
Фармацевтические композиции для парентеральной инъекции включают фармацевтически приемлемые стерильные водные или неводные растворы, дисперсии, суспензии или эмульсии, а также стерильные порошки для восстановления в стерильные инъекционные растворы или дисперсии непосредственно перед использованием. Примеры подходящих водных и неводных носителей, разбавителей, растворителей или наполнителей включают воду, этанол, полиолы (такие как глицерин, пропиленгликоль, полиэтиленгликоль и тому подобное), растительные масла (такие как оливковое масло), инъецируемые органические сложные эфиры (такие как этилолеат) и их подходящие смеси. Необходимая текучесть может поддерживаться, например, путем использования материалов покрытия, таких как лецитин, путем поддержания требуемого размера частиц в случае дисперсий и с помощью поверхностно-активных веществ.
Эти композиции могут также содержать адъюванты, такие как консерванты, смачивающие агенты, эмульгаторы и диспергирующие агенты. Защита от действия микроорганизмов может быть обеспечена включением различных антибактериальных и противогрибковых средств, например, парабена, хлорбутанола, фенола, сорбиновой кислоты и тому подобного. Может быть также желательным включить изотонические агенты, такие как сахара, хлорид натрия и тому подобное. Пролонгированная абсорбция пригодной к инъекции фармацевтической формы может быть реализована включением агентов, которые замедляют абсорбцию, таких как моностеарат алюминия и желатин.
В некоторых случаях для пролонгирования действия лекарственного средства желательно замедлить абсорбцию лекарственного средства при подкожной или внутримышечной инъекции. Это может быть достигнуто с помощью использования жидкой суспензии кристаллического или аморфного материала с низкой растворимостью в воде. Скорость абсорбции лекарственного средства, кроме того, зависит от скорости его растворения, которая, в свою очередь, может зависеть от величины кристаллов или кристаллической формы. Альтернативно, замедленная абсорбция введенной парентерально лекарственной формы достигается растворением или суспендированием лекарственного средства в масляном наполнителе.
Подходящие для инъекции депо-формы изготавливаются формированием микроинкапсулированных матриц лекарственного средства в биоразлагаемых полимерах, таких как полилактид-полигликолид. В зависимости от отношения лекарственного средства к полимеру и природы конкретного применяемого полимера скорость высвобождения лекарственного средства может контролироваться. Примеры других биоразлагаемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Пригодные для инъекции депо-составы также получают включением лекарственного средства в липосомы или микроэмульсии, которые являются совместимыми с тканями организма.
Составы для инъекций могут быть стерилизованы, например, фильтрованием через задерживающий бактерии фильтр, или введением стерилизующих средств в форме стерильных твердых композиций, которые могут быть растворены или диспергированы в стерильной воде или иной стерильной инъецируемой среде непосредственно перед использованием.
Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В некоторых вариантах осуществления твердые лекарственные формы могут содержать от 1% до 95% (мас./мас.) соединения формулы (I). В некоторых вариантах осуществления соединение формулы (I) может присутствовать в твердой лекарственной форме в диапазоне от 5% до 70% (мас./мас.). В таких твердых лекарственных формах активное соединение может быть смешано, по меньшей мере, с одним инертным, фармацевтически приемлемым эксципиентом или носителем, таким как цитрат натрия или дикальцийфосфат, и/или а) наполнителями или добавками, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и кремниевая кислота; b) связующими средствами, такими как карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и гуммиарабик; с) увлажнителями, такими как глицерин; d) разрыхлителями, такими как агар-агар, карбонат кальция, картофельный крахмах или маниоковый крахмал, альгиновая кислота, некоторые силикаты и карбонат натрия; е) замедляющими растворение средствами, такими как парафин; f) ускорителями абсорбции, такими как четвертичные аммониевые соединения; g) смачивающими средствами, такими как цетиловый спирт и моностеарат глицерина; h) абсорбентами, такими как каолин и бентонитовая глина, и i) смазывающими средствами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси. В случае применения капсул, таблеток и пилюль лекарственные формы также могут включать буферные средства.
Фармацевтический препарат может быть стандартной лекарственной формой. В такой форме препарат разделен на стандартные дозы, содержащие соответствующие количества активного компонента. Стандартная дозированная форма может представлять собой препарат в упаковке, причем упаковка содержит дискретные количества препарата, такие как упакованные таблетки, капсулы и порошки во флаконах или ампулах. Кроме того, стандартной дозированной формой может быть сама капсула, таблетка, облатка или лепешка, либо это может соответствующее число указанных форм в упаковке.. Количество активного компонента в стандартной дозе препарата можно варьировать или регулировать от 0,1 мг до 1000 мг, от 1 мг до 100 мг или от 1% до 95% (мас./мас.) стандартной дозы, в соответствии с конкретным применением и эффективностью активного компонента. Композиция, по желанию, может также содержать другие терапевтические средства.
Доза для введения субъекту может определяться эффективностью конкретного используемого соединения и состоянием субъекта, а также массой тела или площадью поверхности тела субъекта, подлежащего лечению. Величина дозы также будет определяться наличием, характером и степенью любых нежелательных побочных эффектов, которые сопровождают введение конкретного соединения у конкретного субъекта. При определении эффективного количества соединения, которое следует вводить при лечении или профилактике заболевания, подлежащего лечению, врач может оценить такие факторы, как уровни циркулирующего в плазме соединения, токсичность соединений и/или прогрессирование заболевания и тому подобное.
В отношении введения, соединения могут вводиться со скоростью, определяемой факторами, которые могут включать, но не ограничиваются этим, LD50 соединения, фармакокинетический профиль соединения, противопоказанные лекарственные средства и побочные эффекты соединения при различных концентрациях, применительно к массе и общему состоянию здоровья субъекта. Введение может осуществлено с помощью разовых или разделенных доз.
Соединения, используемые в фармацевтическом способе по настоящему изобретению, могут быть введены в начальной дозе от приблизительно 0,001 мг/кг до приблизительно 100 мг/кг ежедневно. В некоторых вариантах осуществления диапазон суточной дозы составляет от приблизительно 0,1 мг/кг до приблизительно 10 мг/кг. Однако дозы могут варьироваться в зависимости от потребностей субъекта, тяжести состояния, подвергаемого лечению, и используемого соединения. Определение надлежащей дозы для конкретной ситуации находится в компетенции практикующего врача. Лечение может быть начато с меньших доз, которые ниже оптимальной дозы соединения. После чего дозу повышают небольшими приращениями до тех пор, пока не будет достигнут оптимальный эффект в каждом случае. При желании, для удобства общая суточная доза может быть разделена и вводиться порциями в течение дня.
Твердые композиции подобного типа также можно использовать в качестве наполнителей в мягких и твердых желатиновых капсулах с использованием таких носителей, как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и тому подобное.
Твердые лекарственные формы в виде таблеток, драже, капсул, пилюль и гранул могут быть получены с покрытиями и оболочками, такими как энтеросолюбильные покрытия и другие покрытия, хорошо известные в области фармацевтического формулирования. Они могут, необязательно, содержать светонепроницаемые средства и также могут иметь такую композицию, которая делает возможным высвобождение активного ингредиента(ов) только или, предпочтительно, в определенной части кишечного тракта, необязательно, замедленным образом. Примеры заливочных композиций, которые могут быть использованы, включают полимерные вещества и воски.
Активные соединения также могут быть в микроинкапсулированной форме, если это необходимо, с одним или несколькими из вышеперечисленных носителей.
Жидкие лекарственные формы для перорального введения включают фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к активным соединениям, жидкие лекарственные формы могут содержать инертные разбавители, обычно используемые в уровне техники, такие как, например, вода или прочие растворители, солюбилизаторы и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, хлопковое, арахисовое, кукурузное, масло проростков, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот и сорбитана, и их смеси.
Помимо инертных разбавителей, композиции для перорального введения также могут включать адъюванты, такие как смачивающие средства, эмульгирующие и суспендирующие средства, подсластители, вкусовые и ароматизирующие добавки.
Суспензии, в дополнение к активным соединениям, могут содержать суспендирующие средства, такие как, например, этоксилированные изостеариловые спирты, полиоксиэтиленсорбит и сложные эфиры сорбитана, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар, трагакант и их смеси.
Композиции для ректального или вагинального введения представляют собой, предпочтительно, суппозитории, которые могут быть получены путем смешивания соединений с подходящими нераздражающими наполнителями или носителями, такими как масло какао, полиэтиленгликоль или суппозиторный воск, которые являются твердыми при комнатной температуре, но разжижаются при температуре тела и, поэтому, расплавляются в прямой кишке или полости влагалища и высвобождают активное соединение.
Соединения можно также вводить в виде липосом. Липосомы обычно могут быть получены из фосфолипидов или других липидных субстанций. Липосомы формируются моно- или мультиламеллярными гидратированными жидкими кристаллами, которые диспергированы в водной среде. Может быть использован любой нетоксичный, физиологически приемлемый и метаболизируемый липид, способный к формированию липосом. Настоящие композиции в липосомной форме могут содержать, в дополнение к соединению по настоящему изобретению, стабилизаторы, консерванты, эксципиенты и тому подобное. Примеры липидов включают, но не ограничиваются ими, природные и синтетические фосфолипиды и фосфатидилхолины (лецитин), используемые по отдельности или в совокупности.
Способы образования липосом были описаны, см. например, Prescott, Ed., Methods in Cell Biology, Volume XIV, Academic Press, New York, N.Y. (l976), p. 33 et seq.
Лекарственные формы для местного введения соединения, описанного в настоящем документе, включают порошки, спреи, мази и средства для ингаляции. Активное соединение смешивают в стерильных условиях с фармацевтически приемлемым носителем и любыми требуемыми консервантами, буферами или пропеллентами, при необходимости. Офтальмические составы, глазные мази, порошки и растворы также рассматриваются как входящие в объем настоящего изобретения.
Способы применения
Соединения и композиции с использованием любого количества и любого пути введения можно вводить субъекту для лечения или профилактики муковисцидоза, недостаточности поджелудочной железы, синдрома Шегрена (SS), хронической обструктивной болезни легких (COLD) или хронического обструктивного заболевания дыхательных путей (COAD).
Термин ʺвведениеʺ относится к способу контактирования соединения с субъектом. Таким образом, соединения могут быть введены путем инъекции, то есть внутривенно, внутримышечно, внутрикожно, подкожно, интрадуоденально, парентерально или внутрибрюшинно. Также, соединения, описанные в настоящем документе, могут быть введены путем ингаляции, например, интраназально. Кроме того, соединения могут быть введены трансдермально, местно и посредством имплантации. В некоторых вариантах осуществления соединения и композиции на их основе могут быть доставлены перорально. Соединения также могут быть доставлены ректально, буккально, интравагинально, через глаза или инсуффляцией. CFTR-модулированные заболевания и нарушения можно лечить профилактически, остро и длительно с использованием соединений или их фармацевтически приемлемых солей и их композиций в зависимости от природы нарушения или заболевания. Как правило, хозяин или субъект в каждом из этих способов является человеком, хотя другие млекопитающие могут также получать пользу от введения соединений или их фармацевтически приемлемых солей и их композиций, как указано выше.
Соединения по настоящему изобретению являются полезными в качестве модуляторов CFTR. Таким образом, соединения и композиции являются особенно полезными для лечения или уменьшения тяжести или прогрессирования заболевания, нарушения или состояния, в которые вовлечены гиперактивность или отсутствие активности CFTR. Таким образом, настоящее изобретение относится к способу лечения муковисцидоза, недостаточности поджелудочной железы, синдрома Шегрена (SS), хронической обструктивной болезни легких (COLD) или хронического обструктивного заболевания дыхательных путей (COAD) у субъекта, где способ включает стадию введения указанному субъекту терапевтически эффективного количества соединения формулы (I), (I-a), (I-b), (I-c), (I-d), (I-e), (I-f), (I-g), (I-h), (I-i) или (I-j) или его фармацевтически приемлемой соли или его предпочтительного варианта осуществления, как указано выше, с фармацевтически приемлемым носителем или без него. В частности, способ предназначен для лечения или профилактики муковисцидоза. В более конкретном варианте осуществления муковисцидоз вызывается мутациями I, II, III, IV, V и/или VI класса.
Один вариант осуществления относится к соединению по настоящему изобретению или его фармацевтически приемлемой соли, или фармацевтическим композициям, содержащим соединение по настоящему изобретению или его фармацевтически приемлемую соль для применения в медицине.
Один вариант осуществления относится к соединению формулы (I), (I-a), (I-b), (I-c), (I-d), (I-e), (I-f), (I-g), (I-h), (I-i) или (I-j) или его фармацевтически приемлемой соли, или фармацевтическим композициям, содержащим соединение по настоящему изобретению или его фармацевтически приемлемую соль, для применения при лечении муковисцидоза, недостаточности поджелудочной железы, синдрома Шегрена (SS), хронической обструктивной болезни легких (COLD) или хронического обструктивного заболевания дыхательных путей (COAD). В более конкретном варианте осуществления муковисцидоз вызывается мутациями I, II, III, IV, V и/или VI класса.
В одном варианте осуществления настоящее изобретение относится к фармацевтическим композициям, содержащим соединение по настоящему изобретению или его фармацевтически приемлемую соль и одно или несколько дополнительных терапевтических средств. В конкретном варианте осуществления дополнительное терапевтическое средство представляет собой средство для лечения муковисцидоза, отличное от соединения по настоящему изобретению. В более конкретном варианте осуществления муковисцидоз вызывается мутациями I, II, III, IV, V и/или VI класса.
Соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить в качестве единственного активного средства или их можно вводить совместно с одним или несколькими дополнительными терапевтическими средствами, включая другие соединения, которые демонстрируют такую же или подобную терапевтическую активность и которые, как установлено, являются безопасными и эффективными для такого комбинированного введения. Соединения по настоящему изобретению могут быть совместно введены субъекту. Термин ʺсовместное введениеʺ означает введение двух или нескольких различных терапевтических средств субъекту путем комбинирования в одной фармацевтической композиции или в отдельных фармацевтических композициях. Таким образом, совместное введение включает введение одновременно одной фармацевтической композиции, содержащей два или несколько терапевтических средств или введение двух или нескольких разных композиций одному и тому же субъекту в одно и то же или разное время.
Соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить совместно с терапевтически эффективным количеством одного или более дополнительных терапевтических средств для лечения опосредованного CFTR заболевания, где примеры терапевтических средств включают, но не ограничиваются ими, антибиотики (например, аминогликозиды, колистин, азтреонам, ципрофлоксацин и азитромицин), отхаркивающие средства (например, гипертонический раствор, ацетилцистеин, дорназа альфа и денуфозол), панкреатические ферментные добавки (например, панкреатин и панкрелипаза), ингибиторы блокатора эпителиальных натриевых каналов (ENaC), модуляторы CFTR (например, потенциаторы CFTR, корректоры CFTR) и амплификаторы CFTR. В одном варианте осуществления опосредуемое CFTR заболевание представляет собой муковисцидоз. В одном варианте осуществления соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить совместно с одним или несколькими дополнительными терапевтическими средствами, выбранными из группы, состоящей из модуляторов CFTR и амплификаторов CFTR. В одном варианте осуществления соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить совместно с одним или двумя модуляторами CFTR и одним амплификатором CFTR. В одном варианте осуществления соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить совместно с одним потенциатором, одним или несколькими корректорами, и одним амплификатором CFTR. В одном варианте осуществления соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить совместно с одним или несколькими модуляторами CFTR. В одном варианте осуществления соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить совместно с одним модулятором CFTR. В одном варианте осуществления соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить совместно с двумя модуляторами CFTR. В одном варианте осуществления соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить совместно с тремя модуляторами CFTR. В одном варианте осуществления соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить совместно с одним потенциатором и одним или несколькими корректорами. В одном варианте осуществления соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить совместно с одним потенциатором и двумя корректорами. В одном варианте осуществления соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить совместно с одним потенциатором. В одном варианте осуществления соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить совместно с одним или несколькими корректорами. В одном варианте осуществления соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить совместно с одним корректором. В одном варианте осуществления соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить совместно с двумя корректорами.
Примеры потенциаторов включают, но ими не ограничиваются, ивакафтор (VX-770), CTP-656, NVS-QBW251, FD1860293 и N-(3-карбамоил-5,5,7,7-тетраметил-4,7-дигидро-5H-тиено[2,3-c]пиран-2-ил)-1H-пиразол-5-карбоксамид. Примеры потенцирующих средств также раскрыты в публикациях: WO2005120497, WO2008147952, WO2009076593, WO2010048573, WO2006002421, WO2008147952, WO2011072241, WO2011113894, WO2013038373, WO2013038378, WO2013038381, WO2013038386 и WO2013038390; и завках США 14/271080 и 14/451619.
В одном из вариантов осуществления потенциатор может быть выбран из группы, состоящей из
ивакафтора (VX-770, N-(2,4-ди-трет-бутил-5-гидроксифенил)-4-оксо-1,4-дигидрохинолин-3-карбоксамид);
CTP-656;
NVS-QBW251;
FD1860293;
2-(2-фторбензамидо)-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-3-карбоксамида;
N-(3-карбамоил-5,5,7,7-тетраметил-4,7-дигидро-5H-тиено[2,3-c]пиран-2-ил)-1H-пиразол-5-карбоксамида;
2-(2-гидроксибензамидо)-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-3-карбоксамида
2-(1-гидроксициклопропанкарбоксамидо)-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-3-карбоксамида;
5,5,7,7-тетраметил-2-(2-(трифторметил)бензамидо)-5,7-дигидро-4H-тиено[2,3-c]пиран-3-карбоксамида;
2-(2-гидрокси-2-метилпропанамидо)-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-3-карбоксамида;
2-(1-(гидроксиметил)циклопропанкарбоксамидо)-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-3-карбоксамида;
2-(3-гидрокси-2,2-диметилпропанамидо)-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-3-карбоксамида;
N-(3-карбамоил-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-2-ил)-5-метил-1H-пиразол-3-карбоксамида;
N-(3-карбамоил-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-2-ил)-5-циклопропил-1H-пиразол-3-карбоксамида;
N-(3-карбамоил-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-2-ил)-5-изопропил-1H-пиразол-3-карбоксамида;
N-(3-карбамоил-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-2-ил)-5-(трифторметил)-1H-пиразол-3-карбоксамида;
5-трет-бутил-N-(3-карбамоил-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-2-ил)-1H-пиразол-3-карбоксамида;
N-(3-карбамоил-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-2-ил)-5-этил-1H-пиразол-3-карбоксамида;
N-(3-карбамоил-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-2-ил)-3-этил-4-метил-1H-пиразол-5-карбоксамида;
2-(2-гидроксипропанамидо)-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-3-карбоксамида;
N-(3-карбамоил-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-2-ил)-4-хлор-1H-пиразол-3-карбоксамида;
N-(3-карбамоил-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-2-ил)-1,4,6,7-тетрагидропирано[4,3-c]пиразол-3-карбоксамида;
4-бром-N-(3-карбамоил-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-2-ил)-1H-пиразол-3-карбоксамида;
N-(3-карбамоил-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-2-ил)-4-хлор-5-метил-1H-пиразол-3-карбоксамида;
N-(3-карбамоил-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-2-ил)-4-метил-1H-пиразол-3-карбоксамида;
2-(2-гидрокси-3,3-диметилбутанамидо)-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-3-карбоксамида;
2-[(2-гидрокси-4-метил-пентаноил)амино]-5,5,7,7-тетраметил-4H-тиено[2,3-c]пиран-3-карбоксамида;
5-(2-метокси-этокси)-1H-пиразол-3-карбоновой кислоты (3-карбамоил-5,5,7,7-тетраметил-4,7-дигидро-5H-тиено[2,3-c]пиран-2-ил)-амида;
N-(3-карбамоил-5,5,7,7-тетраметил-4H-тиено[2,3-c]пиран-2-ил)-4-(3-метоксипропил)-1H-пиразол-3-карбоксамида;
N-(3-карбамоил-5,5,7,7-тетраметил-4H-тиено[2,3-c]пиран-2-ил)-4-(2-этоксиэтил)-1H-пиразол-3-карбоксамида;
2-[[(2S)-2-гидрокси-3,3-диметил-бутаноил]амино]-5,5,7,7-тетраметил-4H-тиено[2,3-c]пиран-3-карбоксамида;
2-[[(2R)-2-гидрокси-3,3-диметил-бутаноил]амино]-5,5,7,7-тетраметил-4H-тиено[2,3-c]пиран-3-карбоксамида;
2-[(2-гидрокси-2,3,3-триметил-бутаноил)амино]-5,5,7,7-тетраметил-4H-тиено[2,3-c]пиран-3-карбоксамида;
[5-[(3-карбамоил-5,5,7,7-тетраметил-4H-тиено[2,3-c]пиран-2-ил)карбамоил]пиразол-1-ил]метила дигидрофосфата;
[3-[(3-карбамоил-5,5,7,7-тетраметил-4H-тиено[2,3-c]пиран-2-ил)карбамоил]пиразол-1-ил]метила дигидрофосфата;
N-(3-карбамоил-5,5,7,7-тетраметил-4H-тиено[2,3-c]пиран-2-ил)-4-(1,4-диоксан-2-ил)-1H-пиразол-3-карбоксамида;
5,5,7,7-тетраметил-2-[[(2S)-3,3,3-трифтор-2-гидрокси-2-метил-пропаноил]амино]-4H-тиено[2,3-c]пиран-3-карбоксамида; и
2-[[(2S)-2-гидроксипропаноил]амино]-5,5,7,7-тетраметил-4H-тиено[2,3-c]пиран-3-карбоксамида.
Неограничивающие примеры корректоров включают лумакафтор (VX-809), 1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-{1-[(2R)-2,3-дигидроксипропил]-6-фтор-2-(1-гидрокси-2-метилпропан-2-ил)-1H-индол-5-ил}циклопропанкарбоксамид(VX-661), VX-983, GLPG2665, VX-152, VX-440, FDL169, FDL304, FD2052160 и FD2035659. Примеры корректоров также раскрыты в публикациях: US20140274933 и WO2014160478; изавке США 62/073586.
В одном варианте осуществления корректор(ы) могут быть выбраны из группы, состоящей из
Лумакафтора (VX-809);
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-{1-[(2R)-2,3-дигидроксипропил]-6-фтор-2-(1-гидрокси-2-метилпропан-2-ил)-1H-индол-5-ил}циклопропанкарбоксамида(VX-661);
VX-983;
GLPG2665;
VX-152;
VX-440;
FDL169
FDL304;
FD2052160;
FD2035659;
rac-3-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)тетрагидро-2Н-пиран-2-ил]бензойной кислоты;
rac-4-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)тетрагидро-2Н-пиран-2-ил]бензойной кислоты;
3-[(2S,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)тетрагидро-2Н-пиран-2-ил]бензойной кислоты;
3-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)тетрагидро-2Н-пиран-2-ил]бензойной кислоты;
rac-3-[(2R,4S,6S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-6-фенилтетрагидро-2Н-пиран-2-ил]бензойной кислоты;
3-[(2S,4R,6R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-6-фенилтетрагидро-2Н-пиран-2-ил]бензойной кислоты;
3-[(2R,4S,6S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-6-фенилтетрагидро-2Н-пиран-2-ил]бензойной кислоты; и
4-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)тетрагидро-2Н-пиран-2-ил]бензойной кислоты.
В одном варианте осуществления дополнительным терапевтическим средством является амплификатор CFTR. Амплификаторы CFTR увеличивают действие известных модуляторов CFTR, таких как потенциаторы и корректоры. Примером амплификатора CFTR является PTI130. Примеры амплификаторов также раскрыты в публикациях: WO2015138909 и WO2015138934.
В одном варианте осуществления дополнительное терапевтическое средство представляет собой средство, которое снижает активность блокатора эпителиальных натриевых каналов (ENaC) либо непосредственно путем блокирования канала, либо опосредованно путем модуляции протеаз, что приводит к увеличению активности ENaC (например, серинпротеаз, протеазы, активирующие канал). Примеры таких средств включают камостат (ингибитор трипсиноподобный протеазы), QAU145, 552-02, GS-9411, INO-4995, Aerolytic, амилорид и VX-371. Дополнительные средства, которые снижают активность блокатора эпителиальных натриевых каналов (ENaC), могут быть найдены, например, в публикации PCT No WO2009074575 и патенте США No US8999976.
В одном варианте осуществления ингибитор ENaC представляет собой VX-371.
Настоящее изобретение также относится к наборам, которые содержат одно или несколько соединений и/или солей по настоящему изобретению и, необязательно, одно или несколько дополнительных терапевтических средств.
Настоящее изобретение также относится к способам применения соединений, солей, композиций и/или наборов по настоящему изобретению с одним или несколькими дополнительными терапевтическими средствами или без них, например, для модуляции белка муковисцидозного трансмембранного регулятора проводимости (CFTR), и лечения заболевания, поддающегося лечению, путем модуляции белка муковисцидозного трансмембранного регулятора проводимости (CFTR) (включая муковисцидоз, синдром Шегрена, недостаточность поджелудочной железы, хроническую обструктивную болезнь легких и хроническое обструктивное заболевание дыхательных путей).
Настоящее изобретение также относится к использованию одного или нескольких соединений и/или солей по настоящему изобретению при получении лекарственного средства. Лекарственное средство необязательно может содержать одно или несколько дополнительных терапевтических средств. В некоторых вариантах осуществления лекарственное средство является полезным для лечения муковисцидоза, синдрома Шегрена, недостаточности поджелудочной железы, хронической обструктивной болезни легких и хронического обструктивного заболевания дыхательных путей. В конкретном варианте осуществления лекарственное средство предназначено для использования при лечении кистозного фиброза. В более конкретном варианте осуществления муковисцидоз вызывается мутациями I, II, III, IV, V и/или VI класса.
Настоящее изобретение также относится к использованию одного или нескольких соединений и/или солей по настоящему изобретению при получении лекарственного средства для лечения муковисцидоза, синдрома Шегрена, недостаточности поджелудочной железы, хронической обструктивной болезни легких и хронического обструктивного заболевания дыхательных путей. Лекарственное средство необязательно может содержать одно или несколько дополнительных терапевтических средств. В конкретном варианте осуществления изобретение относится к использованию одного или нескольких соединений и/или солей по настоящему изобретению при получении лекарственного средства для лечения муковисцидоза. В более конкретном варианте осуществления муковисцидоз вызывается мутациями I, II, III, IV, V и/или VI класса.
Дополнительные преимущества изобретения заявителей будут очевидны для специалиста в данной области из прочтения этой патентной заявки.
Следующие примеры могут использоваться для иллюстративных целей и не должны рассматриваться как ограничивающие объем изобретения.
Примеры
Общие процедуры очистки с обращенной фазой:
Метод препаративной ЖХ/МС TFA1
Образцы очищали препаративной ВЭЖХ с обращенной фазой на колонке Phenomenex Luna C8(2) 5 мкм 100Å AXIA (50 мм×21,2 мм). Использовали градиент ацетонитрила (А) и 0,1% трифторуксусной кислоты в воде (В) при скорости потока 30 мл/мин (0-0,5 мин 5% А, 0,5-6,5 мин линейный градиент 5-100% A, 6,5-8,5 мин 100% A, 8,5-9,0 мин линейный градиент 100-5% A, 9,0-10 мин 5% A). Образец объемом 1,0 мл вводили непосредственно из потока проточного реактора в систему ВЭЖХ. Использовали специальную систему очистки, состоящую из следующих модулей: насосы Gilson 305 и 306; манометрический модуль Gilson 806; детектор Gilson UV/Vis 155; интерфейсный блок Gilson 506C; коллектор фракций Gilson FC204; активный сплиттер Agilent G1968D; масс-спектрометр Thermo MSQ Plus. Управление системой осуществляли с помощью комбинации программного обеспечения Thermo Xcalibur 2.0.7 и пользовательского приложения, написанного в компании Microsoft Visual Basic 6.0.
Метод препаративной ЖХ/МС TFA2
Образцы очищали препаративной ВЭЖХ на колонке Phenomenex Luna C8(2) 5 мкм 100Å AXIA (30 мм×75 мм). Использовали градиент ацетонитрила (А) и 0,1% трифторуксусной кислоты в воде (В) при скорости потока 50 мл/мин (0-1,0 мин 5% А, 1,0-8,5 мин линейный градиент 5-100% A, 8,5-11,5 мин 100% A, 11,5-12,0 мин линейный градиент 95-5% A). Образцы вводили в 1,5 мл ДМСО:MeOH (1:1). Использовали специальную систему очистки, состоящую из следующих модулей: препаративный насос Waters LC4000; диодно-матричный детектор Waters 996; автоматический дозатор Waters 717+; модуль Waters SAT/IN, испарительный детектор светорассеяния Alltech Varex III; интерфейсный блок Gilson 506C; и два коллектора фракций Gilson FC204. Систему контролировали с использованием программного обеспечения Waters Millennium32, автоматизированного с использованием разработанного Abbott приложения Visual Basic для управления коллектором фракций и отслеживания фракций. Фракции собирали на основе порога УФ-сигнала и отобранные фракции впоследствии анализировали с помощью проточного инжекционного анализа с масс-спектрометрией с использованием положительной APCI ионизации на Finnigan Navigator с использованием 70:30 MeOH:10 мМ NH4OH (водный раствор) со скоростью потока 0,8 мл/мин. Масс-спектры инжекционной петли получали с использованием Finnigan Navigator, использующего программное обеспечение Navigator 1.8, и жидкостного обработчика Gilson 215 для введения фракций, контролируемого разработанным Abbott приложением Visual Basic.
Метод препаративной ЖХ/МС TFA4
Образцы очищали препаративной ВЭЖХ с обращенной фазой на колонке Phenomenex Luna C8(2) 5 мкм 100Å AXIA (50 мм×21,2 мм). Использовали градиент ацетонитрила (А) и 0,1% трифторуксусной кислоты в воде (В) при скорости потока 30 мл/мин (0-0,1 мин 5% A, 0,1-0,5 мин линейный градиент 5-30% A, 0,5-6,5 мин линейный градиент 30-70% A, 6,5-7,0 мин линейный градиент 70-100% A, 7,0-8,5 мин 100% A, 8,5-9,0 мин линейный градиент 100-5% A, 9,0-10 мин 5% A). Образец объемом 1,0 мл вводили непосредственно из потока проточного реактора в систему ВЭЖХ. Использовали специальную систему очистки, состоящую из следующих модулей: насосы Gilson 305 и 306; манометрический модуль Gilson 806; детектор Gilson UV/Vis 155; интерфейсный блок Gilson 506C; коллектор фракций Gilson FC204; активный сплиттер Agilent G1968D; масс-спектрометр Thermo MSQ Plus. Управление системой осуществляли с помощью комбинации программного обеспечения Thermo Xcalibur 2.0.7 и пользовательского приложения, написанного в компании Microsoft Visual Basic 6.0.
Метод препаративной ЖХ/МС TFA6
Образцы очищали препаративной ВЭЖХ с обращенной фазой на колонке Phenomenex Luna C8(2) 5 мкм 100Å AXIA (50 мм×21,2 мм). Использовали градиент ацетонитрила (А) и 0,1% трифторуксусной кислоты в воде (В) при скорости потока 30 мл/мин (0-0,5 мин 15% A, 0,5-8,0 мин линейный градиент 15-100% A, 8,0-9,0 мин 100% A, 7,0-8,9 мин 100% A, 9,0-9,1 мин линейный градиент 100-15% A, 9,1-10 мин 15% A). Образец объемом 1,0 мл вводили непосредственно из потока проточного реактора в систему ВЭЖХ. Использовали специальную систему очистки, состоящую из следующих модулей: насосы Gilson 305 и 306; манометрический модуль Gilson 806; детектор Gilson UV/Vis 155; интерфейсный блок Gilson 506C; коллектор фракций Gilson FC204; активный сплиттер Agilent G1968D; масс-спектрометр Thermo MSQ Plus. Управление системой осуществляли с помощью комбинации программного обеспечения Thermo Xcalibur 2.0.7 и пользовательского приложения, написанного в компании Microsoft Visual Basic 6.0.
Метод препаративной ЖХ/МС TFA8
Образцы очищали препаративной ВЭЖХ с обращенной фазой на колонке Phenomenex Luna C8(2) 5 мкм 100Å AXIA (50 мм×21,2 мм). Использовали градиент ацетонитрила (А) и 0,1% трифторуксусной кислоты в воде (В) при скорости потока 30 мл/мин (0-0,5 мин 35% A, 0,5-8,0 мин линейный градиент 35-100% A, 8,0-9,0 мин 100% A, 7,0-8,9 мин 100% A, 9,0-9,1 мин линейный градиент 100-35% A, 9,1-10 мин 35% A). Образец объемом 1,0 мл вводили непосредственно из потока проточного реактора в систему ВЭЖХ. Использовали специальную систему очистки, состоящую из следующих модулей: насосы Gilson 305 и 306; манометрический модуль Gilson 806; детектор Gilson UV/Vis 155; интерфейсный блок Gilson 506C; коллектор фракций Gilson FC204; активный сплиттер Agilent G1968D; масс-спектрометр Thermo MSQ Plus. Управление системой осуществляли с помощью комбинации программного обеспечения Thermo Xcalibur 2.0.7 и пользовательского приложения, написанного в компании Microsoft Visual Basic 6.0.
Метод препаративной ЖХ/МС AA2
Образцы очищали препаративной ВЭЖХ на колонке Phenomenex Luna C8(2) 5 мкм 100Å AXIA (30 мм×75 мм). Использовали градиент ацетонитрила (А) и 10 мМ ацетата аммония в воде (В) при скорости потока 50 мл/мин (0-1,0 мин 5% A, 1,0-8,5 мин линейный градиент 5-100% A, 8,5-11,5 мин 100% A, 11,5-12,0 мин линейный градиент 95-5% A). Образцы вводили в 1,5 мл ДМСО:MeOH (1:1). Использовали специальную систему очистки, состоящую из следующих модулей: препаративный насос Waters LC4000; диодно-матричный детектор Waters 996; автоматический дозатор Waters 717+; модуль Waters SAT/IN, испарительный детектор светорассеяния Alltech Varex III; интерфейсный блок Gilson 506C; и два коллектора фракций Gilson FC204. Систему контролировали с использованием программного обеспечения Waters Millennium32, автоматизированного с использованием разработанного Abbott приложения Visual Basic для управления коллектором фракций и отслеживания фракций. Фракции собирали на основе порога УФ-сигнала и отобранные фракции впоследствии анализировали с помощью проточного инжекционного анализа с масс-спектрометрией с использованием положительной APCI ионизации на Finnigan Navigator с использованием 70:30 MeOH:10 мМ NH4OH (водный раствор) со скоростью потока 0,8 мл/мин. Масс-спектры инжекционной петли получали с использованием Finnigan Navigator, использующего программное обеспечение Navigator 1.8, и жидкостного обработчика Gilson 215 для введения фракций, контролируемого разработанным Abbott приложением Visual Basic.
Метод препаративной ЖХ/МС AA7
Образцы очищали препаративной ВЭЖХ с обращенной фазой на колонке Phenomenex Luna C8(2) 5 мкм 100Å AXIA (50 мм×21,2 мм). Использовали градиент ацетонитрила (А) и 0,1% ацетата аммония в воде (В) при скорости потока 30 мл/мин (0-0,5 мин 25% A, 0,5-8,0 мин линейный градиент 25-100% A, 8,0-9,0 мин 100% A, 7,0-8,9 мин 100% A, 9,0-9,1 мин линейный градиент 100-25% A, 9,1-10 мин 25% A). Образец объемом 1,0 мл вводили непосредственно из потока проточного реактора в систему ВЭЖХ. Использовали специальную систему очистки, состоящую из следующих модулей: насосы Gilson 305 и 306; манометрический модуль Gilson 806; детектор Gilson UV/Vis 155; интерфейсный блок Gilson 506C; коллектор фракций Gilson FC204; активный сплиттер Agilent G1968D; масс-спектрометр Thermo MSQ Plus. Управление системой осуществляли с помощью комбинации программного обеспечения Thermo Xcalibur 2.0.7 и пользовательского приложения, написанного в компании Microsoft Visual Basic 6.0.
Метод препаративной ЖХ/МС AA8
Образцы очищали препаративной ВЭЖХ с обращенной фазой на колонке Phenomenex Luna C8(2) 5 мкм 100Å AXIA (50 мм×21,2 мм). Использовали градиент ацетонитрила (А) и 0,1% ацетата аммония в воде (В) при скорости потока 30 мл/мин (0-0,5 мин 35% A, 0,5-8,0 мин линейный градиент 35-100% A, 8,0-9,0 мин 100% A, 7,0-8,9 мин 100% A, 9,0-9,1 мин линейный градиент 100-35% A, 9,1-10 мин 35% A). Образец объемом 1,0 мл вводили непосредственно из потока проточного реактора в систему ВЭЖХ. Использовали специальную систему очистки, состоящую из следующих модулей: насосы Gilson 305 и 306; манометрический модуль Gilson 806; детектор Gilson UV/Vis 155; интерфейсный блок Gilson 506C; коллектор фракций Gilson FC204; активный сплиттер Agilent G1968D; масс-спектрометр Thermo MSQ Plus. Управление системой осуществляли с помощью комбинации программного обеспечения Thermo Xcalibur 2.0.7 и пользовательского приложения, написанного в компании Microsoft Visual Basic 6.0.
Пример 1
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]бензойная кислота
К раствору соединения примера 6 (25 мг, 0,047 ммоль) в тетрагидрофуране (233 мкл) добавляли гидрат гидроксид лития (233 мкл 0,8 M раствор в воде). Полученную двухфазную смесь интенсивно перемешивали в течение 16 часов при комнатной температуре с последующим добавлением большего количества гидрата гидроксида лития (233 мкл 0,8 M раствора). Реакционную смесь перемешивали в течение дополнительных 5 часов при комнатной температуре, подкисляли добавлением 6 М HCl (0,040 мл) и полученную двухфазную смесь загружали непосредственно на картридж с силикагелем 4 г и элюировали смесью 30% этилацетат/гептан в течение 15 минут с получением указанного в заголовке соединения в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 8,20 (с, 1H), 8,06 (дд, J=7,9, 1,5 Гц, 1H), 7,71-7,61 (м, 1H), 7,48 (т, J=7,7 Гц, 1H), 7,13 (дд, J=8,2, 1,7 Гц, 1H), 7,09 (д, J=1,7 Гц, 1H), 7,01 (д, J=8,2 Гц, 1H), 6,96 (д, J=8,6 Гц, 1H), 6,52 (дд, J=8,6, 2,5 Гц, 1H), 6,45 (д, J=2,5 Гц, 1H), 5,49 (тд, J=9,9, 6,0 Гц, 1H), 5,40 (д, J=8,9 Гц, 1H), 5,33-5,22 (м, 1H), 3,76 (с, 3H), 2,58 (ддд, J=13,3, 5,9, 2,0 Гц, 1H), 1,82-1,72 (м, 2H), 1,69-1,63 (м, 1H), 1,09 (кв, J=2,8 Гц, 2H); МС (ESI-) m/z 522,1 (M-H)-.
Пример 2
3-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]бензойная кислота
К раствору соединения примера 5E (35 мг, 0,065 ммоль) в тетрагидрофуране (326 мкл) добавляли гидрат гидроксид лития (326 мкл 0,8 M раствора). Полученную двухфазную смесь интенсивно перемешивали в течение 16 часов при комнатной температуре с последующим добавлением большего количества гидрата гидроксида лития (326 мкл 0,8 M раствора). Реакционную смесь перемешивали в течение дополнительных 5 часов при комнатной температуре, подкисляли добавлением 6 М HCl (0,050 мл) и полученную двухфазную смесь загружали непосредственно на картридж с силикагелем 4 г и элюировали 30% этилацетат/гептан в течение 15 минут с получением указанного в заголовке соединения в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 8,13 (т, J=1,8 Гц, 1H), 8,12-8,04 (м, 1H), 7,72-7,61 (м, 1H), 7,51 (т, J=7,7 Гц, 1H), 7,20-7,11 (м, 2H), 7,04 (дд, J=8,4, 4,1 Гц, 2H), 6,53 (дд, J=8,5, 2,6 Гц, 1H), 6,45 (д, J=2,6 Гц, 1H), 5,60 (д, J=6,6 Гц, 1H), 5,01 (дд, J=5,5, 2,8 Гц, 1H), 4,84 (дд, J=11,6, 2,2 Гц, 1H), 3,76 (с, 3H), 2,35 (дт, J=14,4, 2,5 Гц, 1H), 2,16 (ддд, J=14,4, 11,4, 4,5 Гц, 1H), 1,70 (кв, J=3,7 Гц, 2H), 1,09 (кв, J=3,7 Гц, 2H); МС (ESI-) m/z 522,1 (M-H)-.
Пример 3
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2R,4R)-2-(3,4-диметоксифенил)-7-метокси-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
К 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоте (CAS 68015-98-5) (120 мг, 0,496 ммоль) в DMF (1239 мкл) добавляли HATU (1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиний 3-оксид гексафторфосфат) (245 мг, 0,644 ммоль). Смесь перемешивали в течение 5 минут при комнатной температуре и затем добавляли 2-(3,4-диметоксифенил)-7-метоксихроман-4-амин (156 мг, 0,496 ммоль), с последующим добавлением по каплям триэтиламина (276 мкл, 1,982 ммоль). Через 45 минут смесь гасили насыщенным водным раствором бикарбоната натрия и водный слой удаляли. Полученное масло растирали с водой и фильтровали с полученем 283 мг белого твердого вещества. Твердое вещество растворяли в дихлорметане и очищали с использованием картриджа с силикагелем 24 г с градиентом 5-50% этилацетат/гептан с получением 189 мг смеси двух диастереомеров. Смесь подвергали препаративной сверхкритической флюидной хроматографии, с поддержанием обратного давления при 100 бар, используя CHIRALPAK IA®, 21×250 мм, 5 микрон, с образцом в концентрации 20 мг/мл в метаноле с использованием 16% метанола в CO2 при скорости потока 70 мл/мин с временем удерживания 7,2 минуты, с получением указанного в заголовке соединения (111 мг, 0,206 ммоль, выход 41,5%) в виде белого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ 7,39 (д, J=1,6 Гц, 1H), 7,32 (д, J=8,4 Гц, 1H), 7,20 (дд, J=8,3, 1,7 Гц, 1H), 7,13 (д, J=9,1 Гц, 1H), 6,98-6,91 (м, 4H), 6,50 (дд, J=8,5, 2,6 Гц, 1H), 6,36 (д, J=2,5 Гц, 1H), 5,36-5,24 (м, 1H), 5,15 (дд, J=11,5, 1,9 Гц, 1H), 3,75 (д, J=1,4 Гц, 6H), 3,68 (с, 3H), 2,10 (кв, J=11,8 Гц, 1H), 1,99 (ддд, J=12,9, 6,2, 2,1 Гц, 1H), 1,53-1,46 (м, 1H), 1,37 (ддд, J=8,4, 5,8, 2,8 Гц, 1H), 1,05 (дтдд, J=12,7, 9,6, 6,4, 3,3 Гц, 2H); МС (ESI+) m/z 402 (M+H)+. Абсолютную стереохимию определяли методом рентгеноструктурного анализа.
Пример 4
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2S,4S)-2-(3,4-диметоксифенил)-7-метокси-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
К 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоте (120 мг, 0,496 ммоль) в DMF (1239 мкл) добавляли HATU (1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиний 3-оксид гексафторфосфат) (245 мг, 0,644 ммоль). Смесь перемешивали в течение 5 минут при комнатной температуре, и затем добавляли 2-(3,4-диметоксифенил)-7-метоксихроман-4-амин (156 мг, 0,496 ммоль), с последующим добавлением по каплям триэтиламина (276 мкл, 1,982 ммоль). Через 45 минут смесь гасили насыщенным водным раствором бикарбоната натрия, водный слой удаляли, полученное масло растирали с водой и фильтровали, получая 283 мг белого твердого вещества. Твердое вещество растворяли в дихлорметане и очищали с использованием картриджа с силикагелем 24 г с градиентом 5-50% этилацетат/гептан с получением 189 мг смеси двух диастереомеров. Смесь подвергали препаративной сверхкритической флюидной хроматографии, с поддержанием обратного давления при 100 бар, используя CHIRALPAK ® IA, 21×250 мм, 5 микрон, с образцом в концентрации 20 мг/мл в метаноле с использованием 16% метанола в CO2 при скорости потока 70 мл/мин с временем удерживания 4,5 минуты, с получением указанного в заголовке соединения (106 мг, 0,196 ммоль, выход 39,7%) в виде белого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ 7,39 (д, J=1,6 Гц, 1H), 7,32 (д, J=8,4 Гц, 1H), 7,20 (дд, J=8,3, 1,7 Гц, 1H), 7,13 (д, J=9,1 Гц, 1H), 6,98-6,91 (м, 4H), 6,50 (дд, J=8,5, 2,6 Гц, 1H), 6,36 (д, J=2,5 Гц, 1H), 5,36-5,24 (м, 1H), 5,15 (дд, J=11,5, 1,9 Гц, 1H), 3,75 (д, J=1,4 Гц, 6H), 3,68 (с, 3H), 2,10 (кв, J=11,8 Гц, 1H), 1,99 (ддд, J=12,9, 6,2, 2,1 Гц, 1H), 1,53-1,46 (м, 1H), 1,37 (ддд, J=8,4, 5,8, 2,8 Гц, 1H), 1,05 (дтдд, J=12,7, 9,6, 6,4, 3,3 Гц, 2H); МС (ESI+) m/z 402 (M+H)+.
Пример 5
метил 3-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]бензоат
Пример 5A
7-метокси-4H-хромен-4-он
1,1-Диметокси-N,N-диметилметанамин (1,0 мл, 7,53 ммоль) и 1-(2-гидрокси-4-метоксифенил)этанон (1,251 г, 7,53 ммоль) нагревали в микроволновой печи при 115°С в течение 15 секунд с получением красного раствора, который затвердевал при охлаждении. Твердое вещество растирали с гептаном с получением енаминового промежуточного продукта в виде красных кристаллов.1Н ЯМР (400 МГц, ДМСО-d6) δ 14,96 (с, 1H), 7,82 (дд, J=10,6, 1,6 Гц, 2H), 6,37 (дд, J=8,8, 2,6 Гц, 1H), 6,32 (д, J=2,5 Гц, 1H), 5,84 (д, J=12,0 Гц, 1H), 3,75 (с, 3H), 3,17 (с, 3H), 2,95 (с, 3H). Энамин растворяли в дихлорметане (40 мл) и обрабатывали HCl (4 мл) при кипении с обратным холодильником в течение одного часа. Водный слой удаляли и экстрагировали 3×40 мл дихлорметаном. Объединенные экстракты промывали насыщенным водным раствором бикарбоната натрия и сушили над сульфатом натрия, затем фильтровали и растворитель удаляли при пониженном давлении с получением указанного в заголовке соединения (0,854 г, 4,85 ммоль, выход 64,4%) в виде бледно-желтых кристаллов.1H ЯМР (400 МГц, ДМСО-d6) δ 8,22 (д, J=6,0 Гц, 1H), 7,94 (д, J=8,9 Гц, 1H), 7,13 (д, J=2,4 Гц, 1H), 7,06 (дд, J=8,9, 2,4 Гц, 1H), 6,27 (д, J=6,0 Гц, 1H), 3,90 (с, 3H); МС (ESI+) m/z 177 (M+H)+.
Пример 5B
(R)-метил 3-(7-метокси-4-оксохроман-2-ил)бензоат
В 4-мл сосуд загружали бис(2,2,2-трифторацетокси)палладий (9,44 мг, 0,028 ммоль), (S)-4-(трет-бутил)-2-(пиридин-2-ил)-4,5-дигидрооксазол (6,96 мг, 0,034 ммоль), гексафторофосфат(V) аммония (27,8 мг, 0,170 ммоль) и 3-метоксикарбонилфенилбороновую кислоту (204 мг, 1,135 ммоль), перемешивали в дихлорэтане (1,0 мл) в течение 5 минут, и наблюдали бледно-желтый цвет. К этой суспензии добавляли соединение из примера 5A (100 мг, 0,568 ммоль) и воду (0,051 мл, 2,84 ммоль) и боковые стороны сосуда промывали большим количеством дихлорэтана (1,0 мл). Сосуд закрывали и смесь перемешивали при 60°С в течение ночи. Смесь фильтровали через слой силикагеля и элюировали дихлорметаном, и затем этилацетатом. Растворитель удаляли и неочищенный материал хроматографировали с использованием картриджа с силикагелем 12 г с градиентом 5-50% этилацетат/гептан в течение 20 минут с получением указанного в заголовке соединения (133 мг, 0,426 ммоль, выход 75%) в виде белого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ 8,15 (т, J=1,8 Гц, 1H), 7,98 (дт, J=7,8, 1,4 Гц, 1H), 7,84 (дт, J=7,9, 1,5 Гц, 1H), 7,74 (д, J=8,5 Гц, 1H), 7,61 (т, J=7,8 Гц, 1H), 6,69 (д, J=8,6 Гц, 2H), 5,77 (дд, J=12,9, 2,9 Гц, 1H), 3,88 (с, 3H), 3,83 (с, 3H), 3,17 (дд, J=16,8, 13,0 Гц, 1H), 2,80 (дд, J=16,8, 3,0 Гц, 1H); МС (ESI+) m/z 313 (M+H)+.
Пример 5C
(R)-метил 3-(7-метокси-4-(метоксиимино)хроман-2-ил)бензоат
Соединение примера 5В (100 мг, 0,320 ммоль) и гидрохлорид O-метилгидроксиламина (29,4 мг, 0,352 ммоль) перемешивали в пиридине (640 мкл) при 60°С в течение ночи. Добавляли дополнительные 0,3 эквивалента (7 мг) амина и нагревали при 60°С в течение 12 часов. Смесь концентрировали, затем разбавляли этилацетатом, промывали насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида аммония, последовательно. Растворитель удаляли и сырой материал очищали, используя картридж с силикагелем 12 г, элюируя 5-20% этилацетатом/гептанами в течение 20 минут с получением указанного в заголовке соединения (107 мг, 0,313 ммоль) в виде светло-розового масла.1H ЯМР (400 МГц, CDCl3) δ 8,15 (т, J=1,9 Гц, 1H), 8,03 (дт, J=7,7, 1,5 Гц, 1H), 7,84 (д, J=8,8 Гц, 1H), 7,77-7,63 (м, 1H), 7,49 (т, J=7,7 Гц, 1H), 6,59 (дд, J=8,8, 2,6 Гц, 1H), 6,50 (д, J=2,5 Гц, 1H), 5,12 (дд, J=12,5, 3,1 Гц, 1H), 3,96 (с, 3H), 3,94 (с, 3H), 3,80 (с, 3H), 3,48 (дд, J=17,2, 3,1 Гц, 1H), 2,65 (дд, J=17,1, 12,5 Гц, 1H); МС (ESI+) m/z 342,0 (M+H)+.
Пример 5D
3-((2R)-4-амино-7-метоксихроман-2-ил)бензоат
Соединение примера 5C (50 мг, 0,146 ммоль) и метанол (10 мл) добавляли к Ra-Ni 2800, водной суспензии (150 мг, 1,150 ммоль) в 50 мл сосуде для реакций под давлением и перемешивали в течение 16 часов при давлении 30 фунт/кв. дюйм газообразного водорода и при температуре окружающей среды. Реакционную смесь фильтровали и растворитель удаляли. Остаток (44 мг) растворяли в метил-трет-бутиловом эфире. Добавляли по каплям HCl (4,0 М в диоксане, 0,3 мл) и полученную суспензию фильтровали с получением соли гидрохлорида указанного в заголовке соединения в виде смеси двух диастереомеров.1H ЯМР (400 МГц, ДМСО-d6) δ 8,48 (с, 6H), 8,06 (дт, J=6,1, 1,8 Гц, 2H), 7,97 (ддд, J=9,2, 3,1, 1,4 Гц, 2H), 7,74 (дд, J=7,7, 1,7 Гц, 2H), 7,60 (т, J=7,7 Гц, 2H), 7,55 (д, J=8,6 Гц, 1H), 7,45 (д, J=8,6 Гц, 1H), 6,65 (ддд, J=8,7, 6,3, 2,6 Гц, 2H), 6,55 (д, J=2,6 Гц, 1H), 6,52 (д, J=2,6 Гц, 1H), 5,51 (дд, J=11,9, 2,3 Гц, 1H), 5,33 (дд, J=11,8, 1,8 Гц, 1H), 4,75 (дд, J=11,0, 6,4 Гц, 1H), 4,45 (дд, J=5,0, 2,4 Гц, 1H), 3,89 (с, 3H), 3,89 (с, 3H), 3,77 (с, 3H), 3,76 (с, 3H), 2,61 (ддд, J=13,1, 6,5, 1,9 Гц, 1H), 2,46 (т, J=2,4 Гц, 1H), 2,31 (ддд, J=15,0, 11,9, 5,0 Гц, 1H), 2,08 (дт, J=13,0, 11,4 Гц, 1H); МС (ESI-) m/z 297,1 (M-NH3)-.
Пример 5E
метил 3-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]бензоат
К суспензии соединения примера 5D (90 мг, 0,257 ммоль) в 1,3 мл дихлорметана добавляли N,N-диизопропилэтиламин (135 мкл, 0,772 ммоль). После получения раствора, раствор 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбонил хлорида (полученного, как описано в примере 8D) (84 мг, 0,322 ммоль) в 1 мл дихлорметана добавляли по каплям при температуре окружающей среды и реакционную смесь перемешивали в течение 1 часа. Реакционную смесь разбавляли 5 мл метил-трет-бутилового эфира и гасили насыщенным водным раствором бикарбоната натрия. После перемешивания в течение 10 минут водный слой удаляли и органический слой промывали еще дважды насыщенным водным раствором бикарбоната натрия. Органическую фазу сушили над сульфатом натрия, затем концентрировали. Остаток хроматографировали, используя картридж с силикагелем 40 г с градиентом 10-20% метил-трет-бутиловый эфир/гептан в течение 3 минут, затем 20% метил-трет-бутиловый эфир/гептан в течение 17 минут, затем 20-30% метил-трет-бутиловый эфир/гептан в течение 10 минут, с получением указанного в заголовке соединение в качестве первого элюированного изомера, и соединение примера 6 в качестве второго элюированного изомера.1H ЯМР (500 МГц, CDCl3) δ 8,06 (т, J=1,8 Гц, 1H), 8,01 (д, J=7,9 Гц, 1H), 7,59 (дт, J=7,9, 1,4 Гц, 1H), 7,48 (т, J=7,7 Гц, 1H), 7,15 (дд, J=8,2, 1,7 Гц, 1H), 7,12 (д, J=1,7 Гц, 1H), 7,07-6,99 (м, 2H), 6,52 (дд, J=8,5, 2,6 Гц, 1H), 6,44 (д, J=2,5 Гц, 1H), 5,58 (д, J=6,6 Гц, 1H), 5,06-4,96 (м, 1H), 4,81 (дд, J=11,5, 2,1 Гц, 1H), 3,94 (с, 3H), 3,75 (с, 3H), 2,31 (дт, J=14,3, 2,5 Гц, 1H), 2,15 (ддд, J=14,4, 11,5, 4,6 Гц, 1H), 1,71-1,66 (м, 2H), 1,10-1,05 (м, 2H); МС (ESI-) m/z 536,1 (M-H)-. Относительную стереохимию подтверждали анализом Н ЯМР NOE.
Пример 6
метил 3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]бензоат
Указанное в заголовке соединение выделяли в виде второго элюированного изомера в результате колоночной хроматографии, как описано в примере 5E.1H ЯМР (500 МГц, CDCl3) δ 8,08 (с, 1H), 8,00 (д, J=7,7 Гц, 1H), 7,58 (дт, J=7,8, 1,4 Гц, 1H), 7,45 (т, J=7,7 Гц, 1H), 7,12 (дд, J=8,2, 1,7 Гц, 1H), 7,08 (д, J=1,7 Гц, 1H), 7,00 (д, J=8,2 Гц, 1H), 6,96 (дд, J=8,7, 1,0 Гц, 1H), 6,51 (дд, J=8,6, 2,6 Гц, 1H), 6,44 (д, J=2,6 Гц, 1H), 5,46-5,38 (м, 1H), 5,33 (д, J=8,8 Гц, 1H), 5,21 (дд, J=11,3, 1,9 Гц, 1H), 3,92 (с, 3H), 3,75 (с, 3H), 2,51 (ддд, J=13,3, 6,0, 2,0 Гц, 1H), 1,86-1,62 (м, 3H), 1,11-1,03 (м, 2H); МС (ESI-) m/z 536,1 (M-H)-.
Пример 7
метил 3-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]бензоат
Указанное в заголовке соединение (36 мг, 0,067 ммоль, выход 21,76%) собирали в качестве первого элюированного изомера из разделения двух изомеров, как описано в примере 8D.1H ЯМР (400 МГц, CDCl3) δ 8,05 (д, J=2,1 Гц, 1H), 8,01 (дт, J=7,9, 1,6 Гц, 1H), 7,62-7,57 (м, 1H), 7,47 (дд, J=8,7, 6,8 Гц, 1H), 7,22 (тд, J=7,7, 1,8 Гц, 1H), 7,18-7,10 (м, 3H), 7,03 (д, J=8,3 Гц, 1H), 6,93 (т, J=7,5 Гц, 2H), 5,63 (д, J=6,8 Гц, 1H), 5,05 (дт, J=6,8, 3,4 Гц, 1H), 4,84 (дд, J=11,3, 2,4 Гц, 1H), 3,94 (с, 3H), 2,32 (дт, J=14,4, 2,7 Гц, 1H), 2,19 (ддд, J=14,4, 11,3, 4,6 Гц, 1H), 1,72-1,66 (м, 2H), 1,12-1,05 (м, 2H); МС (ESI+) m/z 508 (M+H)+.
Пример 8
метил 3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]бензоат
Пример 8A
(R)-метил 3-(4-оксохроман-2-ил)бензоат
В 20 мл сосуд загружали бис(2,2,2-трифторацетокси)палладий (56,9 мг, 0,171 ммоль), (S)-4-(трет-бутил)-2-(пиридин-2-ил)-4,5-дигидрооксазол (41,9 мг, 0,205 ммоль), гексафторфосфат(V) аммония (167 мг, 1,026 ммоль) и 3-метоксикарбонилфенилбороновую кислоту (1231 мг, 6,84 ммоль). Реакционную смесь перемешивали в дихлорэтане (5 мл) в течение 5 минут и наблюдали бледно-желтый цвет. К суспензии добавляли 4H-хромен-4-он (CAS 11013-97-1) (500 мг, 3,42 ммоль) и воду (0,308 мл, 17,11 ммоль) и боковые стороны сосуда промывали большим количеством дихлорэтана (5 мл). Сосуд закрывали и смесь перемешивали при 60°C в течение 16 часов. Смесь фильтровали через слой силикагеля и целита и элюировали этилацетатом, получая раствор красного цвета. Растворитель удалили и неочищенный материал хроматографировали, используя 40 г картридж с силикагелем с градиентом 5-50% этилацетат/гептан в течение 40 минут с получением указанного в заголовке соединения (329 мг, 1,165 ммоль, выход 34,1%) в виде белого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ 8,16 (т, J=1,8 Гц, 1H), 7,98 (дт, J=7,7, 1,5 Гц, 1H), 7,84 (дт, J=7,9, 1,4 Гц, 1H), 7,81 (дд, J=7,8, 1,8 Гц, 1H), 7,65-7,58 (м, 2H), 7,17-7,10 (м, 2H), 5,80 (дд, J=13,1, 2,8 Гц, 1H), 3,88 (с, 3H), 3,28 (дд, J=16,8, 13,1 Гц, 1H), 2,88 (дд, J=16,8, 3,0 Гц, 1H); МС (ESI+) m/z 300 (M+NH4)+.
Пример 8B
(R)-метил 3-(4-(гидроксиимино)хроман-2-ил)бензоат
Соединение из примера 8A (200 мг, 0,708 ммоль) обрабатывали гидрохлоридом гидроксиламина (59,1 мг, 0,850 ммоль) и ацетатом натрия (69,7 мг, 0,850 ммоль) в этаноле (3542 мкл). Реакционную смесь перемешивали при температуре окружающей среды в течение 15 часов. Растворитель удаляли в потоке азота. Неочищенный материал промывали водой (2×2 мл) и сушили в потоке азота с получением указанного в заголовке соединения (210 мг, 0,706 ммоль, выход 100%) в виде белого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ 11,35 (с, 1H), 8,11 (т, J=1,8 Гц, 1H), 7,96 (дт, J=7,8, 1,4 Гц, 1H), 7,82 (тд, J=7,7, 7,2, 1,6 Гц, 2H), 7,59 (т, J=7,7 Гц, 1H), 7,31 (ддд, J=8,6, 7,3, 1,7 Гц, 1H), 7,04-6,97 (м, 2H), 5,32 (дд, J=11,8, 3,2 Гц, 1H), 3,87 (с, 3H), 3,40 (дд, J=17,0, 3,3 Гц, 1H), 2,72 (дд, J=17,0, 11,8 Гц, 1H); МС (ESI+) m/z 298 (M+H)+.
Пример 8C
метил 3-((2R)-4-аминохроман-2-ил)бензоат
Соединение из примера 8B (100 мг, 0,336 ммоль) и метанол (10 мл) добавляли к Ra-Ni 2800, водной суспензии (350 мг, 2,68 ммоль) в 50 мл сосуде для реакций под давлением и встряхивали в течение 16 часов при давлении 30 фунтов/кв.дюйм Н2 при температуре окружающей среды. Реакционную смесь фильтровали и растворитель удаляли при пониженном давлении с получением указанного в заголовке соединения (94 мг, 0,332 ммоль, выход 99%) в виде желтовато-коричневого порошка.1H ЯМР (400 МГц, ДМСО-d6) δ 8,06-8,01 (м, 1H), 7,91 (ддт, J=7,8, 2,7, 1,4 Гц, 1H), 7,71 (ддт, J=7,1, 3,4, 1,5 Гц, 1H), 7,59-7,53 (м, 1,5H), 7,33 (дд, J=7,7, 1,6 Гц, 0,5H), 7,12 (дтд, J=13,9, 7,4, 1,7 Гц, 1H), 6,95-6,83 (м, 1,5H), 6,78 (дд, J=8,2, 1,2 Гц, 0,5H), 5,41 (дд, J=7,6, 5,7 Гц, 0,5H), 5,29 (дд, J=11,6, 2,1 Гц, 0,5H), 4,17 (дд, J=11,2, 5,8 Гц, 0,5H), 3,95 (т, J=3,8 Гц, 0,5H), 3,87 (д, J=1,6 Гц, 3H), 2,36 (ддд, J=13,1, 5,7, 2,1 Гц, 1H), 2,09-2,05 (м, 1H), 1,93-1,84 (м, 2H)
Пример 8D
метил 3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]бензоат
К раствору 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоты (75 мг, 0,310 ммоль) в дихлорметане (774 мкл) добавляли одну четверть раствора оксалилхлорида (108 мкл, 1,239 ммоль) в 200 мкл дихлорметана, а затем 1 каплю DMF. Реакционную смесь интенсивно барботировали. Добавляли по каплям остаток раствора оксалилхлорида. Реакционную смесь перемешивали в течение 30 минут и растворитель удаляли в потоке азота. Остаток прогоняли 2×0,5 мл дихлорметаном, сушили в токе азота. Этот остаток растворяли в дихлорметане (774 мкл) и добавляли к смеси соединения из примера 8C (88 мг, 0,310 ммоль) и триэтиламина (129 мкл, 0,929 ммоль) в дихлорметане (774 мкл). Через 15 минут смесь гасили насыщенным водным раствором бикарбоната натрия, концентрировали и полученное масло очищали на 12 г картридже с силикагелем и элюировали с градиентом 5-100% этилацетат/гептан с получением 137 мг смеси двух диастереомеров. Смесь диастереомеров снова хроматографировали, используя 30% МТВЕ/гептаны с получением соединения примера 7 в качестве первого элюированного изомера и указанного в заголовке соединения в качестве второго элюированного изомера (36 мг, 0,066 ммоль, выход 21,30%)в виде прозрачной пены.1Н ЯМР (501 МГц, CDCl3) δ 8,08 (т, J=1,8 Гц, 1H), 8,00 (дт, J=7,7, 1,5 Гц, 1H), 7,59 (дт, J=7,8, 1,6 Гц, 1H), 7,45 (т, J=7,6 Гц, 1H), 7,18 (тд, J=7,9, 1,6 Гц, 1H), 7,13 (дд, J=8,2, 1,8 Гц, 1H), 7,10-7,06 (м, 2H), 7,01 (д, J=8,3 Гц, 1H), 6,93 (тд, J=7,6, 1,2 Гц, 1H), 6,90 (дд, J=8,1, 1,2 Гц, 1H), 5,50 (тд, J=10,6, 10,1, 6,2 Гц, 1H), 5,39 (д, J=8,9 Гц, 1H), 5,23 (дд, J=11,6, 1,9 Гц, 1H), 3,92 (с, 2H), 2,52 (ддд, J=13,2, 6,0, 2,0 Гц, 1H), 1,82 (дт, J=13,2, 11,3 Гц, 1H), 1,77-1,73 (м, 1H), 1,67-1,62 (м, 1H), 1,13-1,05 (м, 2H); МС (ESI+) m/z 508 (M+H)+.
Пример 9
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]бензойная кислота
К суспензии соединения примера 8D в тетрагидрофуране (164 мкл) и воды (82 мкл) добавляли гидроксид лития (2,124 мг, 0,089 ммоль). Реакционную смесь перемешивали при комнатной температуре. Через 2 часа добавляли дополнительное количество гидроксида лития (2,209 мг, 0,092 ммоль) и реакционную смесь перемешивали при температуре окружающей среды в течение 72 часов. Реакцию гасили 10 каплями 1 M HCl и этот неочищенный материал хроматографировали непосредственно с использованием картриджа с силикагелем 4 г с градиентом 5-100% этилацетат/гептан с получением указанного в заголовке соединения (15 мг, 0,030 ммоль, выход 61,7%) в виде белой пены.1Н ЯМР (500 МГц, CDCl3) δ 8,19 (т, J=1,7 Гц, 1H), 8,06 (дт, J=7,7, 1,4 Гц, 1H), 7,67 (д, J=7,6 Гц, 1H), 7,49 (т, J=7,7 Гц, 1H), 7,21-7,17 (м, 1H), 7,14 (дд, J=8,1, 1,8 Гц, 1H), 7,11 (д, J=1,6 Гц, 1H), 7,08 (д, J=7,6 Гц, 1H), 7,02 (д, J=8,2 Гц, 1H), 6,96-6,89 (м, 2H), 5,56 (дд, J=16,7, 9,4 Гц, 1H), 5,45 (д, J=8,9 Гц, 1H), 5,29 (д, J=11,3 Гц, 1H), 2,59 (ддд, J=13,1, 5,9, 1,9 Гц, 1H), 1,85-1,76 (м, 2H), 1,71-1,64 (м, 2H), 1,12-1,08 (м, 2H); МС (ESI+) m/z 494 (M+H)+.
Пример 10
3-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]бензойная кислота
Указанное в заголовке соединение получали с использованием условий, аналогичных условиям, описанным в примере 1, используя соединение из примера 7 вместо соединения из примера 6.1Н ЯМР (500 МГц, CDCl3) δ 8,12 (т, J=1,7 Гц, 1H), 8,08 (дт, J=7,8, 1,4 Гц, 1H), 7,65 (д, J=7,8 Гц, 1H), 7,51 (т, J=7,7 Гц, 1H), 7,22 (тд, J=7,7, 1,6 Гц, 1H), 7,19-7,12 (м, 3H), 7,03 (д, J=8,2 Гц, 1H), 6,97-6,91 (м, 2H), 5,65 (д, J=6,8 Гц, 1H), 5,06 (т, J=6,8 Гц, 1H), 4,87 (дд, J=11,3, 2,2 Гц, 1H), 2,35 (дт, J=14,3, 2,6 Гц, 1H), 2,20 (ддд, J=14,0, 11,2, 4,5 Гц, 1H), 1,71 (кв, J=3,6 Гц, 2H), 1,12-1,08 (м, 2H); МС (ESI+) m/z 494 (M+H)+.
Пример 11
метил 3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-6-метил-3,4-дигидро-2H-хромен-2-ил]бензоат
Пример 11A
(R)-метил 3-(6-метил-4-оксохроман-2-ил)бензоат
Смесь бис(2,2,2-трифторацетокси)палладия (51,9 мг, 0,156 ммоль), (S)-4-(трет-бутил)-2-(пиридин-2-ил)-4,5-дигидрооксазола (38,3 мг, 0,187 ммоль), гексафторофосфата(V) аммония (153 мг, 0,937 ммоль), (3-(метоксикарбонил)фенил)бороновой кислоты (1124 мг, 6,24 ммоль) и дихлорэтана (10 мл) в 20 мл сосуде перемешивали в течение 5 минут при конатной температуре, с последующим добавлением 6-метил-4H-хромен-4-она (CAS 314041-54-8, MFCD00218598, 500 мг, 3,12 ммоль) и воды (0,26 мл, 14 ммоль). Сосуд закрывали и смесь перемешивали при 60°С в течение ночи. Реакционную смесь фильтровали через слой целита и элюировали этилацетатом. Органические вещества промывали насыщенным солевым раствором и сушили над MgSO4. Растворитель удаляли в вакууме и неочищенный материал хроматографировали с использоанием картриджа с силикагелем 40 г, элюируя градиентом 5-40% этилацетата в гептане с получением указанного в заголовке соединения (410 мг, 44,3%).1Н ЯМР (501 МГц, ДМСО-d6) δ 8,33 (т, J=1,7 Гц, 1H), 8,17 (дт, J=7,7, 1,5 Гц, 1H), 8,02 (дт, J=7,7, 1,5 Гц, 1H), 7,83-7,74 (м, 2H), 7,62 (дд, J=8,5, 2,4 Гц, 1H), 7,23 (д, J=8,4 Гц, 1H), 5,93 (дд, J=12,9, 2,9 Гц, 1H), 4,07 (с, 3H), 3,42 (дд, J=16,8, 13,0 Гц, 1H), 3,04 (дд, J=16,8, 3,0 Гц, 1H), 2,49 (с, 3H); МС (ESI+) m/z 297 (M+H)+.
Пример 11B
(R)-метил 3-(4-(гидроксиимино)-6-метилхроман-2-ил)бензоат
Смесь соединения из примера 11A (390 мг, 1,316 ммоль), гидрохлорида гидроксиламина (183 мг, 2,63 ммоль), ацетата натрия (216 мг, 2,63 ммоль) в метаноле (10 мл) перемешивали при 60°С в течение 4 часов. Растворитель выпаривали под давлением и остаток растворяли в этилацетате, промывали насыщенным солевым раствором, сушили над MgSO4 и фильтровали. Растворитель удаляли при пониженном давлении с получением указанного в заголовке соединения (393 мг, выход 95%) в виде белого твердого вещества.1Н ЯМР (501 МГц, ДМСО-d6) δ 11,51 (с, 1H), 8,32 (т, J=1,7 Гц, 1H), 8,18 (дт, J=7,8, 1,5 Гц, 1H), 8,02 (дт, J=7,7, 1,3 Гц, 1H), 7,88-7,76 (м, 2H), 7,35 (дд, J=8,4, 2,2 Гц, 1H), 7,12 (д, J=8,3 Гц, 1H), 5,49 (дд, J=11,6, 3,1 Гц, 1H), 4,10 (с, 3H), 3,60 (дд, J=17,1, 3,3 Гц, 1H), 2,92 (дд, J=17,0, 11,6 Гц, 1H), 2,49 (с, 3H); МС (ESI+) m/z 312 (M+H)+.
Пример 11C
метил 3-((2R)-4-амино-6-метилхроман-2-ил)бензоат
Соединение из примера 11B (390 мг, 1,253 ммоль) добавляли к Ra-Ni 2800, водной суспензии (1,17 г) в 100 мл сосуде для реакций под давлением. Смесь загружали водородом при давлении 30 фунт/кв.дюйм и перемешивали при температуре окружающей среды в течение 16 часов. ЖХ/МС показал, что реакция завершилась. Смесь фильтровали и растворитель выпаривали при пониженном давлении. Остаток растворяли в трет-бутилэтиловом эфире с последующим добавлением 4 М HCl в диоксане (2 мл) по каплям. Осажденное белое твердое вещество собирали фильтрованием, промывали трет-бутилметиловым эфиром и сушили с получением соли гидрохлорида указанного в заголовке соединения (355 мг, 1,063 ммоль, выход 85%). ЖХ/МС m/z 281 (M-NH2)+.
Пример 11D
метил 3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-6-метил-3,4-дигидро-2H-хромен-2-ил]бензоат
К 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоте (332 мг, 1,372 ммоль) в CH2Cl2 (6 мл) добавляли несколько капель DMF, с последующим добавлением по каплям оксалилдихлорида (0,290 мл, 3,43 ммоль). Смесь перемешивали при комнатной температуре в течение 30 минут. ЖХ/МС с метанолом в качестве растворителя показала завершенный пик метилового эфира. Растворитель удаляли в вакууме, избыток оксалилхлорида удаляли посредством азеотропной смеси с дихлорэтаном и неочищенный материал в CH2Cl2 (4 мл) добавляли к соединению из примера 11C (340 мг, 1,143 ммоль) и пиридина (543 мг, 6,86 ммоль) в CH2Cl2 (6 мл). Смесь перемешивали при комнатной температуре в течение 2 часов и добавляли насыщенный водный раствор NaHCO3 и CH2Cl2. Фазы разделяли и водный слой экстрагировали CH2Cl2. Объединенные органические вещества сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка остатка хроматографией с использованием картриджа с силикагелем 40 г и элюирование 0-30% этилацетатом в гексане давало соединение примера 12 в качестве первого элюированного изомера и указанное в заголовке соединение в виде второго элюированного изомера (133 мг, 0,255 ммоль, выход 22,30%).1Н ЯМР (400 МГц, CDCl3) δ 8,07 (т, J=1,7 Гц, 1H), 7,99 (дт, J=8,0, 1,4 Гц, 1H), 7,58 (дт, J=7,8, 1,4 Гц, 1H), 7,44 (т, J=7,7 Гц, 1H), 7,18-7,06 (м, 2H), 7,05-6,92 (м, 2H), 6,88-6,72 (м, 2H), 5,53-5,29 (м, 2H), 5,19 (дд, J=11,5, 1,9 Гц, 1H), 3,92 (с, 3H), 2,53 (ддд, J=13,4, 5,9, 2,0 Гц, 1H), 2,26 (с, 3H), 1,86-1,67 (м, 2H), 1,61 (д, J=16,1 Гц, 1H), 1,17-1,00 (м, 2H); МС (ESI+) m/z 522 (M+H)+.
Пример 12
метил 3-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-6-метил-3,4-дигидро-2H-хромен-2-ил]бензоат
Указанное в заголовке соединение выделяли в качестве первого элюированного изомера в результате хроматографии, как описано в примере 11D (97 мг, выход 16,27%).1Н ЯМР (400 МГц, CDCl3) δ 8,05 (т, J=1,7 Гц, 1H), 8,00 (д, J=7,7 Гц, 1H), 7,61-7,56 (м, 1H), 7,47 (т, J=7,7 Гц, 1H), 7,19-7,12 (м, 2H), 7,05-6,99 (м, 2H), 6,93 (д, J=2,2 Гц, 1H), 6,81 (д, J=8,3 Гц, 1H), 5,62 (д, J=6,9 Гц, 1H), 5,01 (ддд, J=7,1, 4,6, 2,8 Гц, 1H), 4,80 (дд, J=11,2, 2,3 Гц, 1H), 3,94 (с, 3H), 2,34-2,23 (м, 4H), 2,17 (ддд, J=14,4, 11,1, 4,7 Гц, 1H), 1,74-1,64 (м, 2H), 1,13-1,04 (м, 2H); МС (ESI+) m/z 522 (M+H)+.
Пример 13
3-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-6-метил-3,4-дигидро-2H-хромен-2-ил]бензойная кислота
Смесь примера 12 (96 мг, 0,184 ммоль) и 2 M LiOH (2 мл) в метаноле (6 мл) перемешивали при 35°С в течение 4 часов. Растворитель удаляли при пониженном давлении и остаток растворяли в воде (2 мл), и значение рН доводили с помощью 2 М HCl до pH 1~2. Осажденное белое твердое вещество собирали фильтрованием, промывали водой и сушили с получением указанного в заголовке соединения (83 мг, выход 89%).1Н ЯМР (400 МГц, CDCl3) δ 8,10 (т, J=1,7 Гц, 1H), 8,06 (д, J=7,8 Гц, 1H), 7,64 (д, J=7,7 Гц, 1H), 7,49 (т, J=7,8 Гц, 1H), 7,20-7,13 (м, 2H), 7,06-6,99 (м, 2H), 6,93 (д, J=2,1 Гц, 1H), 6,82 (д, J=8,4 Гц, 1H), 5,65 (д, J=6,8 Гц, 1H), 5,01 (дт, J=7,0, 3,5 Гц, 1H), 4,83 (дд, J=11,2, 2,3 Гц, 1H), 2,31 (дт, J=14,4, 2,8 Гц, 1H), 2,26 (с, 3H), 2,18 (ддд, J=14,7, 11,1, 4,7 Гц, 1H), 1,74-1,66 (м, 2H), 1,14-1,04 (м, 2H); МС (ESI+) m/z 508(M+H)+.
Пример 14
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-6-метил-3,4-дигидро-2H-хромен-2-ил]бензойная кислота
Смесь примера 11D (35 мг, 0,067 ммоль) и 2 M LiOH (1 мл) в метаноле (4 мл) перемешивали при 35°С в течение 4 часов. Растворитель удаляли при пониженном давлении и остаток растворяли в воде (2 мл), и значение рН доводили с помощью 2 М HCl до pH 1~2. Осажденное белое твердое вещество собирали фильтрованием, промывали водой, и сушили с получением указанного в заголовке соединения (30 мг, выход 88%).1H ЯМР (400 МГц, CDCl3) δ 8,18 (т, J=1,7 Гц, 1H), 8,05 (дт, J=7,9, 1,3 Гц, 1H), 7,65 (дт, J=7,6, 1,4 Гц, 1H), 7,47 (т, J=7,7 Гц, 1H), 7,17-7,10 (м, 2H), 7,02 (д, J=8,6 Гц, 1H), 6,98 (дд, J=8,3, 2,1 Гц, 1H), 6,84 (д, J=2,0 Гц, 1H), 6,80 (д, J=8,3 Гц, 1H), 5,49 (тд, J=10,5, 9,8, 6,0 Гц, 1H), 5,42 (д, J=8,8 Гц, 1H), 5,25 (дд, J=11,6, 1,8 Гц, 1H), 2,59 (ддд, J=13,3, 5,9, 1,9 Гц, 1H), 2,26 (с, 3H), 1,85-1,75 (м, 2H), 1,68-1,58 (м, 1H), 1,18-1,04 (м, 2H); МС (ESI+) m/z 508 (M+H)+.
Пример 15
3-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метил-3,4-дигидро-2H-хромен-2-ил]бензойная кислота
Указанное в заголовке соединение получали с использованием условий, аналогичных условиям, описанным в примере 1, используя соединение из примера 17 вместо соединения из примера 6.1Н ЯМР (400 МГц, CDCl3) δ 8,17-7,97 (м, 2H), 7,66-7,40 (м, 2H), 7,20-6,95 (м, 4H), 6,74 (т, J=3,4 Гц, 2H), 5,64 (д, J=6,8 Гц, 1H), 4,93 (ддд, J=70,0, 8,8, 3,0 Гц, 2H), 2,32 (дт, J=14,4, 2,6 Гц, 1H), 2,28 (с, 3H), 2,17 (ддд, J=14,9, 11,1, 4,7 Гц, 1H), 1,70 (кв, J=3,9 Гц, 2H), 1,08 (кв, J=3,9 Гц, 2H); МС (ESI+) m/z 508 (M+H)+.
Пример 16
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метил-3,4-дигидро-2H-хромен-2-ил]бензойная кислота
Смесь примера 18E (130 мг, 0,249 ммоль) и 2 M LiOH (1 мл) в метаноле (4 мл) перемешивали при 35°С в течение 4 часов, растворитель удаляли под давлением и остаток растворяли в воде (2 мл), и доводили значение рН до 1-2 с помощью 2 М HCl. Осажденное белое твердое вещество фильтровали, промывали водой и сушили с получением указанного в заголовке соединения (114 мг, выход 90%).1Н ЯМР (400 МГц, CDCl3) δ 8,19 (с, 1H), 8,05 (д, J=7,7 Гц, 1H), 7,64 (д, J=7,6 Гц, 1H), 7,46 (т, J=7,7 Гц, 1H), 7,17-7,04 (м, 2H), 6,97 (дд, J=25,7, 7,9 Гц, 2H), 6,73 (д, J=9,0 Гц, 2H), 5,60-5,35 (м, 2H), 5,24 (д, J=11,3 Гц, 1H), 2,58 (дд, J=12,9, 5,9 Гц, 1H), 2,27 (с, 3H), 1,86-1,70 (м, 2H), 1,66 (д, J=11,9 Гц, 1H), 1,09 (кв, J=2,8 Гц, 2H); МС (ESI+) m/z 508 (M+H)+.
Пример 17
метил 3-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метил-3,4-дигидро-2H-хромен-2-ил]бензоат
Указанное в заголовке соединение (290 мг, выход 26,5%) выделяли в качестве первого элюированного изомера в результате разделения изомеров, как описано в примере 18E.1Н ЯМР (400 МГц, CDCl3) δ 8,05 (т, J=1,8 Гц, 1H), 8,01 (дт, J=7,7, 1,5 Гц, 1H), 7,58 (дт, J=7,5, 1,4 Гц, 1H), 7,47 (т, J=7,7 Гц, 1H), 7,19-7,10 (м, 2H), 7,03 (дд, J=8,2, 1,7 Гц, 2H), 6,75 (дд, J=6,2, 1,9 Гц, 2H), 5,61 (д, J=6,8 Гц, 1H), 5,01 (дт, J=7,1, 3,3 Гц, 1H), 4,81 (дд, J=11,3, 2,3 Гц, 1H), 3,94 (с, 3H), 2,34-2,29 (м, 1H), 2,29 (с, 3H), 2,16 (ддд, J=14,2, 11,3, 4,6 Гц, 1H), 1,73-1,65 (м, 2H), 1,11-1,03 (м, 2H). ); МС (ESI+) m/z 522 (M+H)+.
Пример 18
метил 3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метил-3,4-дигидро-2H-хромен-2-ил]бензоат
Пример 18A
Смесь 1-(2-гидрокси-4-метилфенил)этанона (2 мл, 14,12 ммоль) и 1,1-диметокси-N,N-диметилметанамина (2,063 мл, 15,53 ммоль) нагревали при 120°C в течение 2 часов, и затем охлаждали. Осажденное оранжевое твердое вещество отфильтровывали, промывали гептаном и сушили с получением промежуточного соединения (E)-3-(диметиламино)-1-(2-гидрокси-4-метилфенил)проп-2-ен-1-он, который растворяли в CH2Cl2 (120 мл) и обрабатывали концентрированной HCl (15 мл). Смесь кипятили с обратным холодильником в течение 2 часов, и ЖХ/МС показал, что реакция завершилась. Водный слой удаляли и экстрагировали CH2Cl2 (10 мл×2). Объединенную органическую фазу концентрировали с получением неочищенного оранжевоего твердого вещества. Очистка с помощью хроматографии на картридже с силикагелем 80 г, элюирование градиентом этилацетат в гептане при 5-40% давало указанное в заголовке соединение в виде белого твердого вещества (1,82 г, выход 80%).1Н ЯМР (400 МГц, CDCl3) δ 8,09 (д, J=8,1 Гц, 1H), 7,81 (д, J=5,7 Гц, 1H), 7,24 (с, 1H), 7,23-7,19 (м, 1H), 6,30 (д, J=6,1 Гц, 1H), 2,48 (с, 3H); МС (ESI+) m/z 161 (M+H)+.
Пример 18B
(R)-метил 3-(7-метил-4-оксохроман-2-ил)бензоат
В 20 мл сосуд загружали бис(2,2,2-трифторацетокси)палладий (0,353 г, 1,061 ммоль), (S)-4-(трет-бутил)-2-(пиридин-2-ил)-4,5-дигидрооксазол (0,260 г, 1,274 ммоль), гексафторфосфат(V) аммония (1,038 г, 6,37 ммоль) и (3-(метоксикарбонил)фенил)бороновую кислоту (3,82 г, 21,23 ммоль), перемешивали в дихлорэтане (10 мл) при комнатной температуре в течение 5 минут. К этой суспензии добавляли соединение из примера 18A (1,70 г, 10,61 ммоль) и воду (0,256 мл, 14,19 ммоль). Сосуд закрывали и смесь перемешивали при 60°С в течение ночи. Смесь фильтровали через слой целита и элюировали этилацетатом. Растворитель удаляли под давлением и неочищенный материал хроматографировали, используя 80 г картридж с силикагелем, элюируя градиентом 5-50% этилацетата в гептане с получением указанного в заголовке соединения (2,6 г, выход 83%).1Н ЯМР (400 МГц, CDCl3) δ 8,22-8,13 (м, 1H), 8,11-8,01 (м, 1H), 7,83 (д, J=8,3 Гц, 1H), 7,77-7,60 (м, 1H), 7,52 (т, J=7,7 Гц, 1H), 6,89 (д, J=6,8 Гц, 2H), 5,51 (дд, J=13,2, 2,9 Гц, 1H), 4,13 (с, 0H), 3,95 (д, J=1,0 Гц, 3H), 3,76 (с, 0H), 3,05 (ддд, J=16,8, 13,3, 1,0 Гц, 1H), 2,88 (ддд, J=16,8, 2,9, 0,9 Гц, 1H), 2,38 (с, 3H); МС (ESI+) m/z 297 (M+H)+.
Пример 18C
(R)-метил 3-(4-(метоксиимино)-7-метилхроман-2-ил)бензоат
Смесь соединения из примера 18B (1,2 г, 4,05 ммоль), ацетата натрия (0,664 г, 8,10 ммоль) и O-метилгидроксиламина, хлористоводородной кислоты (0,676 г, 8,10 ммоль) в метаноле (10 мл) перемешивали при 60°С в течение ночи. Растворитель выпаривали под давлением и остаток промывали водой, фильтровали и сушили с получением указанного в заголовке соединения (1,3 г, 4,00 ммоль, выход 99%) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 8,14 (д, J=1,9 Гц, 1H), 8,03 (дт, J=7,7, 1,5 Гц, 1H), 7,90-7,76 (м, 1H), 7,67 (дт, J=7,7, 1,5 Гц, 1H), 7,49 (т, J=7,7 Гц, 1H), 6,81 (дд, J=4,4, 2,6 Гц, 2H), 5,10 (дд, J=12,5, 3,1 Гц, 1H), 3,97 (с, 3H), 3,93 (с, 3H), 3,48 (дд, J=17,3, 3,1 Гц, 1H), 2,65 (дд, J=17,2, 12,5 Гц, 1H), 2,32 (с, 3H); МС (ESI+) m/z 326 (M+H)+.
Пример 18D
Метил 3-((2R)-4-амино-7-метилхроман-2-ил)бензоат
Соединение примера 18C (820 мг, 2,52 ммоль) добавляли к Ra-Ni 2800, водной суспензии (2,5 г) в 100 мл сосуде для реакций под давлением и загружали давлением 30 фунт/кв. дюйм водорода. Смесь перемешивали при температуре окружающей среды в течение 16 часов. Смесь фильтровали и растворитель удаляли под давлением. Остаток растворяли в трет-бутилэтиловом эфире с последующим добавлением по каплям 4 М HCl в диоксане (2 мл). Осажденное белое твердое вещество собирали с помощью фильтрования, промывали трет-бутилметиловым эфиром, и сушили с получением соли гидрохлорида указанного в заголовке соединения с цис-/транс-изомером приблизительно 1-1 (705 мг, 2,371 ммоль, выход 94%). ЖХ/МС m/z 281 (M-NH2)+.
Пример 18E
метил 3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метил-3,4-дигидро-2H-хромен-2-ил]бензоат
К 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоте (559 мг, 2,3 ммоль) в DMF (5 мл) добавляли HATU (1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиний 3-оксид гексафторфосфат,1196 мг, 3,15 ммоль). Смесь перемешивали в течение 10 минут при комнатной температуре, с последующим добавлением соединения из примера 18D (700 мг, 2,1 ммоль) и N-этил-N-изопропилпропан-2-амина (1,461 мл, 8,39 ммоль) последовательно. Смесь перемешивали при комнатной температуре в течение 2 часов. ЖХ/МС показал, что реакция завершилась. Добавляли дихлорметан (40 мл) и раствор промывали насыщенным солевым раствором (20 мл×2). Органический слой сушили над MgSO4 и концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на картридже с силикагелем 40 г, элюируя градиентом 0-25% этилацетата в гептане с получением соединения примера 17 в качестве первого элюированного изомера и указанного в заголовке соединения в качестве второго элюированного изомера (400 мг, выход 36,6%).1H ЯМР (400 МГц, CDCl3) δ 8,07 (д, J=1,9 Гц, 1H), 7,99 (дт, J=7,9, 1,4 Гц, 1H), 7,58 (дт, J=7,8, 1,5 Гц, 1H), 7,44 (т, J=7,7 Гц, 1H), 7,15-7,05 (м, 2H), 6,97 (дд, J=21,0, 8,0 Гц, 2H), 6,74 (д, J=9,5 Гц, 2H), 5,49-5,39 (м, 1H), 5,36 (д, J=8,7 Гц, 1H), 5,20 (дд, J=11,3, 1,9 Гц, 1H), 3,92 (с, 3H), 2,51 (ддд, J=13,2, 6,0, 2,0 Гц, 1H), 2,28 (с, 3H), 1,67-1,59 (м, 1H), 1,57 (д, J=1,1 Гц, 2H), 1,07 (тд, J=3,6, 2,2 Гц, 2H); МС (ESI+) m/z 522(M+H)+.
Пример 19
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-6-метокси-3,4-дигидро-2H-хромен-2-ил]бензойная кислота
Смесь соединения примера 21D (80 мг, 0,149 ммоль) и водный LiOH (2 M, 1 мл) в метаноле (4 мл) перемешивали при 35°С в течение 4 часов; ЖХ/МС показал, что реакция завершилась. Растворитель удаляли при пониженном давлении и добавляли воду (2 мл). К смеси добавляли 2 М HCl для доведения значения рН до 1-2. Белое твердое вещество собирали фильтрованием, промывали водой и сушили с получением указанного в заголовке соединения (55 мг, выход 70,6%),1H ЯМР (400 МГц, CDCl3) δ 8,18 (с, 1H), 8,05 (д, J=7,7 Гц, 1H), 7,65 (д, J=7,6 Гц, 1H), 7,47 (т, J=7,7 Гц, 1H), 7,17-7,11 (м, 2H), 7,02 (дд, J=8,3, 3,7 Гц, 1H), 6,83 (д, J=9,0 Гц, 1H), 6,75 (дд, J=8,8, 3,0 Гц, 1H), 6,59 (д, J=3,0 Гц, 1H), 5,49 (дт, J=18,5, 7,4 Гц, 2H), 5,22 (д, J=11,4 Гц, 1H), 3,74 (с, 3H), 2,66-2,49 (м, 1H), 1,79 (ддд, J=11,9, 6,8, 4,0 Гц, 2H), 1,69-1,63 (м, 1H), 1,11 (д, J=5,0 Гц, 2H); МС (ESI+) m/z 524 (M+H)+.
Пример 20
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2R,4R)-7-гидрокси-2-(3-метоксифенил)-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
Пример 20A
(R)-7-гидрокси-2-(3-метоксифенил)хроман-4-он
В 250-мл круглодонную колбу загружали (3-метоксифенил)бороновую кислоту (1,991 г, 13,11 ммоль), (S)-4-(трет-бутил)-2-(пиридин-2-ил)-4,5-дигидрооксазол (0,094 г, 0,463 ммоль), бис(2,2,2-трифторацетокси)палладий (0,128 г, 0,385 ммоль) и гексафторофосфат аммония (0,377 г, 2,313 ммоль), и добавляли дихлорэтан (15,42 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение 5 минут, после чего в суспензии наблюдался желтый цвет. К реакционной смеси добавляли 7-гидрокси-4H-хромен-4-он (CAS 59887-89-7, MFCD00209371, 1,25 г, 7,71 ммоль) и воду (0,694 мл, 38,5 ммоль) и использовали дополнительное количество дихлорэтана (10,28 мл) для промывки боковых стенок сосуда. Реакционную смесь перемешивали в течение 18 часов при 60°C, охлаждали до температуры окружающей среды, разбавляли дихлорметаном, и фильтровали через фильтр из диоксида кремния/целита, сначала используя 100% дихлорметан, а затем 20% этилацетат/80% дихлорметан для эффективного удаления бороновой кислоты. Объединенные фильтраты концентрировали и неочищенный материал загружали в колонку с силикагелем 40 г и элюировали 5-50% этилацетатом/гептанами в течение 25 минут с получением указанного в заголовке соединения в виде белого твердого вещества. ЖХ/МС m/z 271 (M+H)+.
Пример 20B
(R)-7-гидрокси-2-(3-метоксифенил)хроман-4-он O-метил оксим
Соединение примера 20A (1 г, 3,70 ммоль) растворяли в пиридине (3,70 мл) и добавляли O-метилгидроксиламина гидрохлорид (0,927 г, 11,10 ммоль). Полученную суспензию нагревали при температуре 60°C в течение 2 часов, охлаждали до комнатной температуры, и концентрировали при пониженном давлении. Неочищенный материал распределяли между насыщенным водным раствором хлорида аммония и метил-трет-бутиловым эфиром. Неочищенный материал, полученный в результате концентрации органического слоя, очищали, используя 40 г картриджа с силикагелем, элюируя 5-20% этилацетатом/гептанами в течение 30 минут с получением указанного в заголовке соединения (505 мг, 1,69 ммоль) в виде белого твердого вещества.1Н ЯМР (400 МГц, CDCl3) δ 7,80 (д, J=8,6 Гц, 1H), 7,31 (т, J=8,0 Гц, 1H), 7,13-6,96 (м, 2H), 6,98-6,82 (м, 1H), 6,48 (дд, J=8,7, 2,5 Гц, 1H), 6,43 (д, J=2,5 Гц, 1H), 5,91 (д, J=10,3 Гц, 1H), 5,03 (дд, J=12,4, 3,1 Гц, 1H), 3,95 (с, 3H), 3,83 (с, 3H), 3,43 (дд, J=17,3, 3,1 Гц, 1H), 2,66 (дд, J=17,3, 12,4 Гц, 1H); МС (ESI+) m/z 300,1 (M+H)+.
Пример 20C
(2R,4R)-4-амино-2-(3-метоксифенил)хроман-7-ол
Соединение из примера 20B (430 мг, 1,437 ммоль) растворяли в уксусной кислоте (5 мл), и добавляли оксид платины(IV) (48,9 мг, 0,215 ммоль). Полученную суспензию перемешивали в атмосфере водорода в течение 2 часов при комнатной температуре. К реакционной смеси добавляли на 15% больше катализатора и перемешивали еще 2 часа. Твердое вещество фильтровали и фильтрат концентрировали. Остаток растворяли в метил-трет-бутиловом эфире (4 мл). К раствору добавляли HCl (раствор 4M в диоксане, 0,718 мл, 2,87 ммоль). Полученное твердое вещество собирали фильтрованием и сушили до постоянной массы с получением гидрохлорида указанного в заголовке соединения (407 мг, 1,32 ммоль) в виде твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ 9,71 (с, 1H), 8,67 (д, J=5,3 Гц, 3H), 7,45 (д, J=8,5 Гц, 1H), 7,36 (т, J=7,8 Гц, 1H), 7,05-6,91 (м, 3H), 6,47 (дд, J=8,6, 2,4 Гц, 1H), 6,31 (д, J=2,3 Гц, 1H), 5,16 (д, J=11,6 Гц, 1H), 4,67 (дт, J=11,0, 5,8 Гц, 1H), 3,78 (с, 3H), 2,50-2,46 (м, 1H), 1,99 (кв, J=12,0 Гц, 1H); МС (ESI-) m/z 255,1 (M-NH2).
Пример 20D
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2R,4R)-7-гидрокси-2-(3-метоксифенил)-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
К 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоте (40 мг, 0,165 ммоль) в DMF (1 мл) добавляли HATU (1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиний 3-оксид гексафторфосфат) (82 мг, 0,215 ммоль). Смесь перемешивали в течение 5 минут, и добавляли соединение из примера 2°C (50,8 мг, 0,165 ммоль), с последующим добавлением N-этил-N-изопропилпропан-2-амина (0,115 мл, 0,661 ммоль). Смесь перемешивали при температуре окружающей среды в течение 2 часов, затем очищали с помощью хроматографии на 25 г силикагеля, элюируя градиентом 5-50% этилацетат в гептане с получением указанного в заголовке соединения (25 мг, 0,050 ммоль, выход 30,5%).1H ЯМР (400 МГц, ДМСО-d6) δ 9,30 (с, 1H), 7,38 (д, J=1,6 Гц, 1H), 7,32-7,27 (м, 2H), 7,19 (дд, J=8,3, 1,7 Гц, 1H), 7,07 (д, J=8,9 Гц, 1H), 6,98-6,92 (м, 2H), 6,88 (дд, J=8,1, 2,6 Гц, 1H), 6,85-6,80 (м, 1H), 6,34 (дд, J=8,3, 2,4 Гц, 1H), 6,18 (д, J=2,4 Гц, 1H), 5,27 (тд, J=9,9, 6,8 Гц, 1H), 5,16 (дд, J=10,8, 2,7 Гц, 1H), 3,75 (с, 3H), 2,09-1,95 (м, 2H), 1,49 (ддд, J=9,0, 5,4, 2,2 Гц, 1H), 1,41-1,30 (м, 1H), 1,10-0,98 (м, 2H); МС (ESI-) m/z 494 (M-H)-.
Пример 21
метил 3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-6-метокси-3,4-дигидро-2H-хромен-2-ил]бензоат
Пример 21A
(R)-метил 3-(6-метокси-4-оксохроман-2-ил)бензоат
В 20 мл сосуд загружали бис(2,2,2-трифторацетокси)палладий (0,377 г, 1,135 ммоль), (S)-4-(трет-бутил)-2-(пиридин-2-ил)-4,5-дигидрооксазол (0,278 г, 1,362 ммоль), гексафторфосфат(V) аммония (1,110 г, 6,81 ммоль) и (3-(метоксикарбонил)фенил)бороновую кислоту (3,06 г, 17,03 ммоль). Смесь перемешивали в дихлорэтане (5 мл) в течение 5 минут при комнатной температуре и наблюдали бледно-желтый цвет. К этой суспензии добавляли 6-метокси-4H-хромен-4-он (CAS 117408-98-7, 2,0 г, 11,35 ммоль) и воду (0,256 мл, 14,19 ммоль) и стенки сосуда промывали большим количеством дихлорэтана (5 мл). Сосуд закрывали и смесь перемешивали при 60°С в течение ночи. Реакционная смесь постепенно становилась черной, с осаждением Pd на стенках сосуда. Смесь фильтровали через слой силикагеля и целита и элюировали этилацетатом, получая раствор красного цвета. Фильтрат концентрировали при пониженном давлении и неочищенный материал хроматографировали, используя 40 г картридж с силикагелем, элюируя градиентом 5-50% этилацетат/гептан с получением указанного в заголовке соединения (1,85 г, 5,92 ммоль, выход 52,2%).1H ЯМР (400 МГц, CDCl3) δ 8,18 (т, J=1,7 Гц, 1H), 8,06 (дт, J=8,0, 1,4 Гц, 1H), 7,68 (дт, J=7,8, 1,5 Гц, 1H), 7,52 (т, J=7,8 Гц, 1H), 7,36 (д, J=3,1 Гц, 1H), 7,14 (дд, J=9,1, 3,1 Гц, 1H), 7,01 (д, J=9,0 Гц, 1H), 5,50 (дд, J=13,4, 3,0 Гц, 1H), 3,95 (с, 3H), 3,83 (с, 3H), 3,06 (дд, J=16,9, 13,4 Гц, 1H), 2,90 (дд, J=17,0, 3,0 Гц, 1H); МС (ESI+) m/z 329,9 (M+NH4)+.
Пример 21B
(R)-метил 3-(6-метокси-4-(метоксиимино)хроман-2-ил)бензоат
Смесь соединения из примера 21A (1,85 г, 5,92 ммоль), ацетата натрия (0,972 г, 11,85 ммоль) и O-метилгидроксиламина, хлористоводородной кислоты (0,989 г, 11,85 ммоль) в метаноле (10 мл) перемешивали при 60°С в течение ночи. Растворитель упаривали при пониженном давлении. Остаток растворяли в этилацетате, промывали водой и разделяли. Органические слои сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток хроматографировали на 80 г картридже с силикагелем, элюируя градиентом 5-40% этилацетат/гептан, с получением указанного в заголовке соединения (1,7 г, 4,98 ммоль, выход 84%) в виде белого твердого вещества. ЖХ/МС: TFA m/z 342 (M+H)+.
Пример 21C
метил 3-((2R,4R)-4-амино-6-метоксихроман-2-ил)бензоат
К соединению из примера 21B (1,5 г, 4,39 ммоль) в уксусной кислоте (10 мл) добавляли 5% платину (857 мг, 0,220 ммоль) на угле. Реакционную смесь загружали водородом 30 фунт/кв.дюйм и перемешивали при температуре окружающей среды в течение 24 часов, а затем фильтровали. Растворитель упаривали при пониженном давлении и остаток растворяли в трет-бутилметиловом эфире (10 мл). Добавляли по каплям HCl (4M в диоксане, 2,5 мл). Осажденное твердое вещество собирали с помощью фильтрования и сушили с получением соли гидрохлорида указанного в заголовке соединения (842 мг, выход 54,8%). ЖХ/МС: m/z 297 (M-NH2)+.
Пример 21D
метил 3-((2R,4R)-4-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-6-метоксихроман-2-ил)бензоат
Смесь 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоты (779 мг, 3,22 ммоль) и HATU (1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиний 3-оксид гексафторфосфат (1427 мг, 3,75 ммоль) в DMF (4 мл) перемешивали в течение 10 минут при комнатной температуре, и добавляли соединение из примера 21B (840 мг, 2,68 ммоль), с последующим добавлением N-этил-N-изопропилпропан-2-амина (1,868 мл, 10,72 ммоль). Смесь перемешивали при температуре окружающей среды в течение 2 часов. ЖХ/МС показал, что реакция завершилась. Очистка смеси с помощью хроматографии на 80 г картридже с силикагелем, элюирование градиентом 5-40% этилацетата в гептане, давали указанное в заголовке соединение (835 мг, выход 57,9%).1H ЯМР (400 МГц, CDCl3) δ 8,07 (т, J=1,8 Гц, 1H), 7,99 (дт, J=7,9, 1,5 Гц, 1H), 7,59 (д, J=7,7 Гц, 1H), 7,44 (т, J=7,8 Гц, 1H), 7,15-7,10 (м, 2H), 7,01 (д, J=8,0 Гц, 1H), 6,83 (д, J=9,0 Гц, 1H), 6,75 (дд, J=8,9, 3,0 Гц, 1H), 6,59 (д, J=2,9 Гц, 1H), 5,49-5,33 (м, 2H), 5,20-5,13 (м, 1H), 3,92 (с, 3H), 3,74 (с, 3H), 2,52 (ддд, J=13,4, 5,9, 1,9 Гц, 1H), 1,84-1,72 (м, 2H), 1,66-1,61 (м, 1H), 1,11-1,06 (м, 2H); МС (ESI+) m/z 537,9 (M+H)+.
Пример 22
rac-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2R,4S)-7-метокси-2-(пиридин-3-ил)-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
Пример 22A
(E)-1-(2-гидрокси-4-метоксифенил)-3-(пиридин-3-ил)проп-2-ен-1-он
К раствору 1-(2-гидрокси-4-метоксифенил)этанона (10 г, 60,2 ммоль) в 1 M водного NaOH (600 мл) добавляли никотинальдегид (16,95 мл, 181 ммоль). Смесь перемешивали в течение 16 часов при комнатной температуре. Смесь нейтрализовали с помощью добавления по каплям 1 М HCl (приблизительно 600 мл). Образовавшийся осадок собирали фильтрованием и растворяли в этилацетате и метаноле. Растворитель удаляли в вакууме и затем твердое вещество растирали с небольшим количеством метанола и фильтровали с получением указанного в заголовке соединения (4,6 г, 18,04 ммоль, выход 30,07%) в виде желтого твердого вещества.1Н ЯМР (400 МГц, CDCl3) δ 13,21 (с, 1 H), 8,80 (с, 1 H), 8,57 (д, J=4,4 Гц, 1 H), 7,73-7,89 (м, 3 H), 7,57 (д, J=16 Гц, 1 H), 7,30 (т, J=7,2 Гц, 1 H), 6,42-6,45(м, 2 H), 3,80 (с, 3 H); МС (ESI+) m/z 256 (M+H)+.
Пример 22B
7-метокси-2-(пиридин-3-ил)хроман-4-он
К раствору соединения из примера 22A (2,0 г, 7,83 ммоль) в 96% этаноле (100 мл) добавляли концентрированную HCl (10 мл, 120 ммоль) и воду (6 мл). Смесь нагревали (блокируют при 100°С) при кипячении с обратным холодильником в течение 72 часов и охлаждали. Растворитель удаляли в вакууме. Неочищенный материал очищали с помощью колоночной хроматографии на силикагеле, элюируя градиентом 2-3% метанол/дихлорметан, с получением указанного в заголовке соединения (1,5 г, 5,13 ммоль, выход 65,5%).1Н ЯМР (400 МГц, CDCl3) δ 9,06 (с, 1 H), 8,79 (с, 1 H), 8,42 (д, J=7,2 Гц, 1 H), 7,97 (с, 1 H), 7,88-7,90 (м, 1 H), 8,69-8,72 (м, 1 H), 6,56 (с, 1 H), 5,73 (д, J=10,4 Гц, 1 H), 3,89(с, 3 H), 2,98-3,00 (м, 2 H); МС (ESI+) m/z 256 (M+H)+.
Пример 22C
7-метокси-2-(пиридин-3-ил)хроман-4-он оксим
Раствор продукта из примера 22B (1,1 г, 4,31 ммоль) в метаноле (50 мл) обрабатывали гидрохлоридом гидроксиламина (0,359 г, 5,17 ммоль) и ацетатом натрия (0,424 г, 5,17 ммоль)). Смесь перемешивали при 40°C в течение 16 часов. Растворитель удаляли в вакууме. Неочищенный материал промывали водой (2×20 мл) и сушили в потоке азота с получением указанного в заголовке соединения (1,0 г, 3,31 ммоль, выход 77%) в виде коричневого твердого вещества. МС (ESI+) m/z 271 (M+H)+.
Пример 22D
7-метокси-2-(пиридин-3-ил)хроман-4-амин
Раствор соединения из примера 22C (500 мг, 1,850 ммоль) в растворе аммиака и метанола (7 M, 50 мл) обрабатывали никелем Ренея (109 мг, 1,850 ммоль). Смесь перемешивали при комнатной температуре в 5 атмосферах водорода в течение 5 часов. Смесь фильтровали и фильтрат концентрировали досуха. К остатку добавляли 1М хлористый водород в эфире. Осадок собирали с получением гидрохлоридной соли указанного в заголовке соединения (235 мг, 0,917 ммоль, выход 49,6%):1Н ЯМР (400 МГц, CD3OD) δ 8,72-8,95(м, 2 H), 8,40(с, 1 H), 7,87(с, 1 H), 7,39(т, J=8,8 Гц, 1 H), 6,69-6,73(м, 1 H), 6,60-6,62(м, 1 H), 5,43-5,51(м, 1 H), 4,61(с, 1 H), 3,78(д, J=2,4 Гц, 3 H), 2,14-2,78(м, 2 H); МС (ESI+): m/z 257 (M+H)+.
Пример 22E
rac-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2R,4S)-7-метокси-2-(пиридин-3-ил)-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
К раствору 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоты (45,5 мг, 0,188 ммоль) в дихлорметане (1 мл) добавляли половину раствора оксалилдихлорида (0,060 мл, 0,683 ммоль) в 1 мл дихлорметана, затем 1 каплю DMF. Реакционную смесь интенсивно барботировали, затем по каплям добавляли остаток раствора оксалилхлорида. Реакционную смесь перемешивали в течение 30 минут при комнатной температуре. Растворитель удаляли в потоке азота, затем отгоняли 2×1 мл дихлорметаном, сушили в потоке азота. Этот реагент растворяли в дихлорметане (1 мл) и добавляли к смеси продукта из примера 22D (50 мг, 0,171 ммоль) и триэтиламина (0,095 мл, 0,683 ммоль) в дихлорметане (1 мл). После 20 минут перемешивания при комнатной температуре, смесь гасили насыщенным водным раствором бикарбоната натрия. Водный слой удаляли и органическую фазу концентрировали. Полученное масло растворяли в дихлорметане и очищали на картридже с силикагелем 12 г, элюируя градиентом 5-100% этилацетат/гептан за 16 минут с получением неочищенного продукта (71 мг) в виде масла. Неочищенный продукт загружали на пластинки размером 2×0,25 мм и элюировали 100% этилацетатом. Желаемые фракции собирали и концентрировали с получением 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(7-метокси-2-(пиридин-3-ил)хроман-4-ил)циклопропанкарбоксамида (45 мг, 0,094 ммоль, выход 54,8%) в виде светлой пены. Этот материал далее очищали с помощью препаративной сверхкритической флюидной хроматографии, с поддержанием обратного давления при 100 бар с использованием CHIRALPAK® OD-H, 21×250 мм, 5 мкм, с образцом в концентрации 10 мг/мл в метаноле с использованием 16% метанола в CO2 при скорости потока 70 мл/мин с получением указанного в заголовке соединения (время удерживания=3,8 минуты, 18 мг, 0,037 ммоль, выход 21,94%) и соединения примера 57 (время удерживания=5,1 минут).1H ЯМР (400 МГц, ДМСО-d6) δ 8,57 (д, J=2,2 Гц, 1H), 8,55 (дд, J=4,7, 1,5 Гц, 1H), 7,77 (дт, J=8,0, 1,9 Гц, 1H), 7,53 (д, J=7,9 Гц, 1H), 7,43 (дд, J=5,5, 3,1 Гц, 2H), 7,32 (д, J=8,3 Гц, 1H), 7,21 (дд, J=8,4, 1,7 Гц, 1H), 7,02 (д, J=8,5 Гц, 1H), 6,52 (дд, J=8,5, 2,5 Гц, 1H), 6,46 (д, J=2,5 Гц, 1H), 5,30 (дд, J=9,5, 2,7 Гц, 1H), 4,88 (дт, J=8,6, 4,7 Гц, 1H), 3,70 (с, 3H), 2,20 (ддд, J=14,4, 9,7, 4,9 Гц, 1H), 2,10 (дт, J=14,1, 3,6 Гц, 1H), 1,40 (тд, J=12,8, 9,4 Гц, 2H), 1,04 (д, J=2,9 Гц, 2H); МС (ESI+) m/z 481 (M+H)+.
Пример 23
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-гидрокси-3,4-дигидро-2H-хромен-2-ил]бензойная кислота
Пример 23A
7-гидрокси-4H-хромен-4-он
1-(2,4-Дигидроксифенил)этанон (12,75 г, 84 ммоль) растворяли в триэтилортоформиате (80 мл, 480 ммоль), и концентрированную перхлорную кислоту (7 мл, 116 ммоль) добавляли по каплям в течение 5 минут. Во время добавления кислоты температура медленно повышалась, но не превышала 40°C. Постепенно формировался темно-красный цвет. Реакционную смесь перемешивали в течение 30 минут и затем разбавляли диэтиловым эфиром (300 мл), что привело к осаждению темно-красного твердого вещества. Твердое вещество фильтровали и промывали эфиром (50 мл) использовали без дополнительной очистки (представляет смесь перхлоратного комплекса указанного в заголовке соединения и непрореагировавшего исходного вещества). К 14 г неочищенной промежуточной смеси добавляли 150 мл воды и полученную суспензию перемешивали в течение 30 минут при комнатной температуре, в течение которого красное твердое вещество становилось коричневатого цвета. Полученное твердое вещество собирали фильтрованием и промывали водой (50 мл). Твердое вещество сушили до постоянной массы, получая указанное в заголовке соединение (5,31 г, 32,7 ммоль, 39%) в виде светло-пурпурного твердого вещества.1H ЯМР (500 МГц, ДМСО-d6) δ 10,78 (с, 1H), 8,15 (д, J=6,0 Гц, 1H), 7,88 (д, J=8,7 Гц, 1H), 6,92 (дд, J=8,7, 2,3 Гц, 1H), 6,85 (д, J=2,3 Гц, 1H), 6,22 (д, J=6,0 Гц, 1H); МС (ESI+) m/z 163 (M+H)+.
Пример 23B
(R)-метил 3-(7-гидрокси-4-оксохроман-2-ил)бензоат
В круглодонную колбу емкостью 250 мл загружали бис(2,2,2-трифторацетокси)палладий (0,308 г, 0,925 ммоль), (S)-4-(трет-бутил)-2-(пиридин-2-ил)-4,5-дигидрооксазол (0,227 г, 1,110 ммоль), гексафторофосфата(V) аммония (0,905 г, 5,55 ммоль), и 3- метоксикарбонилфенилбороновую кислоту (5,99 г, 33,3 ммоль), перемешивали в дихлорэтане (37 мл) в течение 5 минут и наблюдали бледно-желтый цвет. К этой суспензии добавляли соединение из примера 23A (3,0 г, 18,50 ммоль) и воду (1,667 мл, 93 ммоль) и дополнительное количество дихлорэтана (25 мл) использовали для ополаскивания стенок колбы. Реакционную смесь нагревали при 60°C. Реакционная смесь становилась все более темной, и осаждение черного Pd можно было наблюдать на стенках колбы. Реакционную смесь оставляли перемешиваться в течение ночи при той же температуре в течение всего времени реакции 18 часов. Реакция, по-видимому, прекращалась при ~50% конверсии, поэтому ее охлаждали до комнатной температуры, фильтровали через слой силикагель/целит, используя 100% дихлорметан до 90:10 дихлорметан:этилацетат. Смесь нагревали с метил-трет-бутиловым эфиром с получением не совсем белого твердого вещества, которое очищали с помощью ЖХ-МС и использовали без дополнительной очистки (2 г).1H ЯМР (400 МГц, ДМСО-d6) δ 10,63 (с, 1H), 8,12 (т, J=1,7 Гц, 1H), 7,97 (дт, J=7,5, 1,3 Гц, 1H), 7,82 (дд, J=8,1, 1,6 Гц, 1H), 7,67 (д, J=8,7 Гц, 1H), 7,60 (т, J=7,7 Гц, 1H), 6,54 (дд, J=8,6, 2,2 Гц, 1H), 6,40 (д, J=2,2 Гц, 1H), 5,71 (дд, J=12,8, 2,9 Гц, 1H), 3,88 (с, 3H), 3,12 (дд, J=16,8, 12,9 Гц, 1H), 2,76 (дд, J=16,7, 3,0 Гц, 1H); МС (ESI+) m/z=299,0 (M+H)+.
Пример 23C
(R)-метил 3-(7-гидрокси-4-(метоксиимино)хроман-2-ил)бензоат
Соединение из примера 23B (2 г, 6,70 ммоль) растворяли в 13 мл сухого пиридина. Добавляли O-метилгидроксиламина гидрохлорид (1,15 г, 13,77 ммоль), и полученную суспензию нагревали при 60°C в течение 3 часов. Растворитель удаляли при пониженном давлении и неочищенный остаток распределяли между этилацетатом и насыщенным раствором хлорида аммония в воде 1:1. Объединенные органические экстракты концентрировали и очищали на колонке с силикагелем 80 г, элюируя смесью 20% этилацетат/гептан, с получением указанного в заголовке соединения.1H ЯМР (400 МГц, CDCl3) δ 8,13 (д, J=2,1 Гц, 1H), 8,03 (дд, J=7,9, 1,8 Гц, 1H), 7,81 (дд, J=8,5, 1,5 Гц, 1H), 7,66 (д, J=7,7 Гц, 1H), 7,48 (т, J=7,7 Гц, 1H), 6,50 (дд, J=8,6, 2,6 Гц, 1H), 6,44 (д, J=2,5 Гц, 1H), 5,51 (д, J=9,5 Гц, 1H), 5,10 (дд, J=12,5, 3,1 Гц, 1H), 3,96 (с, 3H), 3,94 (д, J=1,4 Гц, 3H), 3,46 (дд, J=17,3, 3,2 Гц, 1H), 2,64 (дд, J=17,2, 12,4 Гц, 1H); МС (ESI+) m/z=300,1 (M+H)+.
Пример 23D
метил 3-((2R,4R)-4-амино-7-гидроксихроман-2-ил)бензоат
Соединение из примера 23C (200 мг, 0,611 ммоль) растворяли в уксусной кислоте (2,5 мл), и добавляли оксид платины(IV) (13,87 мг, 0,061 ммоль). Полученную суспензию перемешивали в атмосфере H2 в течение 18 часов при комнатной температуре. Реакционную смесь разбавляли этилацетатом и фильтровали через шприцевой фильтр. Фильтрат концентрировали и суспендировали в метил-трет-бутиловом эфире (6 мл) с последующим добавлением 2 эквивалентов HCl в диоксане и обрабатывали ультразвуком для обеспечения тонкой суспензии, затем перемешивали в течение ночи при комнатной температуре. Смесь концентрировали с получением соли гидрохлорида указанного в заголовке соединения (93 мг) в виде светло-оранжевого твердого вещества, которое использовали без дополнительной очистки.1H ЯМР (400 МГц, ДМСО-d6) δ 9,74 (с, 1H), 8,66 (ушир. с, J=5,5 Гц, 3H), 8,04 (д, J=1,8 Гц, 1H), 7,98 (д, J=7,8 Гц, 1H), 7,74 (д, J=7,8 Гц, 1H), 7,62 (т, J=7,7 Гц, 1H), 7,46 (д, J=8,6 Гц, 1H), 6,49 (дд, J=8,5, 2,4 Гц, 1H), 6,34 (д, J=2,4 Гц, 1H), 5,32 (д, J=11,6 Гц, 1H), 4,69 (дт, J=11,2, 5,6 Гц, 1H), 3,88 (с, 3H), 2,57-2,52 (м, 1H), 2,03-1,95 (м, 1H); МС (ESI-) m/z=283,0 (M-NH3)-.
Пример 23E
Метил 3-((2R,4R)-4-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-7-гидроксихроман-2-ил)бензоат
Указанное в заголовке соединение получали с использованием условий, описанных в примере 8D, используя соединение из примера 23D вместо соединения из примера 8С, для получения указанного в заголовке соединения.1H ЯМР (400 МГц, CDCl3) δ 8,06 (т, J=1,7 Гц, 1H), 7,99 (д, J=7,8 Гц, 1H), 7,56 (д, J=7,7 Гц, 1H), 7,44 (т, J=7,7 Гц, 1H), 7,11 (дд, J=8,2, 1,6 Гц, 1H), 7,07 (д, J=1,6 Гц, 1H), 7,00 (д, J=8,2 Гц, 1H), 6,92 (д, J=8,4 Гц, 1H), 6,43 (дд, J=8,5, 2,5 Гц, 1H), 6,38 (д, J=2,5 Гц, 1H), 5,40 (тд, J=10,2, 9,8, 6,0 Гц, 1H), 5,32 (д, J=8,9 Гц, 1H), 5,22-5,16 (м, 1H), 5,04 (д, J=2,6 Гц, 1H), 3,92 (с, 3H), 2,49 (ддд, J=13,3, 5,9, 2,0 Гц, 1H), 1,87-1,69 (м, 2H), 1,07 (кв, J=2,4 Гц, 2H); МС (ESI-): m/z=522,2 (M-H)-.
Пример 23F
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-гидрокси-3,4-дигидро-2H-хромен-2-ил]бензойная кислота
Гидрат гидроксида лития (16,16 мг, 0,385 ммоль) растворяли в 0,170 мл воды и полученный раствор добавляли к раствору соединения из примера 23E (48 мг, 0,064 ммоль) в тетрагидрофуране (257 мкл). Реакционную смесь интенсивно перемешивали при температуре окружающей среды в течение 15 часов. Неочищенный материал наносили непосредственно на картридж с силикагелем 12 г, элюируя смесью 10-50% этилацетат/гептан в течение 20 минут с получением указанного в заголовке соединения.1H ЯМР (400 МГц, CDCl3) δ 8,13 (с, 1H), 8,04 (д, J=7,7 Гц, 1H), 7,61 (д, J=7,7 Гц, 1H), 7,46 (т, J=7,7 Гц, 1H), 7,14-7,06 (м, 2H), 7,01 (д, J=8,2 Гц, 1H), 6,91 (д, J=8,4 Гц, 1H), 6,49-6,37 (м, 2H), 5,43 (кв, J=8,2, 7,0 Гц, 2H), 5,21 (д, J=11,1 Гц, 1H), 2,56-2,51 (м, 1H), 1,79-1,64 (м, 3H), 1,09 (кв, J=2,2 Гц, 2H); МС (ESI-) m/z 507,9 (M-H)-
Пример 24
этил rel-3-[(2S,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2H-пирано[2,3-c]пиридин-2-ил]бензоат
Пример 24A
метил 3-(3-(3-хлорпиридин-4-ил)-3-оксопропаноил)бензоат
Раствор метил 3-ацетилбензоата (2,278 г, 12,78 ммоль) в тетрагидрофуране (35 мл) при -78°C в атмосфере N2 обрабатывали 1 М лития бис(триметилсилил)амидом в тетрагидрофуране (28,1 мл, 28,1 ммоль) в атмосфере N2. После перемешивания при температуре -78°C в течение 15 минут, раствор 3-хлоризоникотиноил хлорида (2,25 г, 12,78 ммоль) в тетрагидрофуране (25 мл) добавляли по каплям. После перемешивания при температуре -78°C в течение 15 минут, смесь обрабатывали сразу 1 М HCl (50 мл) и оставляли нагреваться до комнатной температуры. Смесь разбавляли водой (200 мл) и перемешивали в течение 15 минут. Твердое вещество собирали фильтрованием, промывали водой, и сушили в вакууме при нагревании (60°С) с получением указанного в заголовке соединения (3,1 г, 9,76 ммоль, выход 76%).1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,84 (с, 1H), 8,73 (д, J=4,9 Гц, 1H), 8,57 (т, J=1,8 Гц, 1H), 8,36 (д, J=8,3 Гц, 1H), 8,22 (д, J=7,8 Гц, 1H), 7,79 (д, J=4,9 Гц, 1H), 7,74 (т, J=7,8 Гц, 1H), 7,11 (с, 1H), 3,91 (с, 3H).
Пример 24B
метил 3-(4-оксо-4H-пирано[2,3-c]пиридин-2-ил)бензоат
Смесь продукта из примера 24A (3,1 г, 9,76 ммоль) и K2CO3 (1,348 г, 9,76 ммоль) в N,N-диметилформамиде (30 мл) в атмосфере N2 нагревали до 95°C в течение 20 минут, нагревали до 110°C в течение 20 минут и нагревали до 120°C в течение 20 минут. Смесь охлаждали до температуры около 0°С, обрабатывали сразу 1 М HCl (15 мл), обрабатывали водой (150 мл) и перемешивали при комнатной температуре в течение 15 минут. Твердое вещество собирали фильтрованием, промывали водой и сушили в течение ночи при 60°С в вакууме с получением указанного в заголовке соединения (2,38 г, 8,46 ммоль, выход 87%).1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,27 (с, 1H), 8,68 (д, J=5,1 Гц, 1H), 8,59 (с, 1H), 8,39 (д, J=7,8 Гц, 1H), 8,17 (д, J=7,8 Гц, 1H), 7,90 (д, J=5,1 Гц, 1H), 7,75 (т, J=7,7 Гц, 1H), 7,25 (с, 1H), 3,92 (с, 3H); МС (ESI) m/z 282 (M+H)+.
Пример 24C
метил 3-(4-гидрокси-3,4-дигидро-2H-пирано[2,3-c]пиридин-2-ил)бензоат
Раствор соединения из примера 24B (1,2 г, 4,27 ммоль) в метаноле (7 мл) и CH2Cl2 (14 мл) обрабатывали фталоцианином кобальта(II) (0,122 г, 0,213 ммоль), обрабатывали NaBH4 (0,646 г, 17,07 ммоль), перемешивали при комнатной температуре в течение 20 минут, обрабатывали дополнительным количеством NaBH4 (приблизительно 0,3 г), перемешивали при комнатной температуре в течение 20 минут, гасили 1 M HCl (30 мл) и подщелачивали до значения pH приблизительно 8 с помощью твердого NaHCO3. Смесь экстрагировали этилацетатом (2 раза, 1-ый экстракт фильтровали через целит). Объединенные этилацетатные слои промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали, концентрировали и хроматографировали на силикагеле, элюируя с градиентом 50%-100% этилацетата в гептане с получением указанного в заголовке соединения.1H ЯМР (400 МГц, CDCl3) δ м.д. 8,36-8,16 (м, 2H), 8,11 (с, 1H), 8,04 (д, J=7,7 Гц, 1H), 7,65 (д, J=7,8 Гц, 1H), 7,54-7,46 (м, 2H), 5,27 (дд, J=11,9, 1,9 Гц, 1H), 5,11 (дд, J=10,9, 6,1 Гц, 1H), 3,94 (с, 3H), 2,57 (ддд, J=13,4, 6,2, 1,9 Гц, 1H), 2,16 (кв, J=11,9 Гц, 1H); МС (ESI) m/z 286 (M+H)+.
Пример 24D
метил 3-(4-оксо-3,4-дигидро-2H-пирано[2,3-c]пиридин-2-ил)бензоат
Раствор соединения из примера 24C (240 мг, 0,841 ммоль) в ацетоне (10 мл) обрабатывали по каплям реактивом Джонса до тех пор, пока не был израсходован исходный материал. Смесь концентрировали до объема 2 мл на роторном испарителе с минимальным нагревом. Остаток разделяли между этилацетатом и насыщенным раствором NaHCO3. Слои разделяли и водный слой экстрагировали этилацетатом. Объединенные этилацетатные слои промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали, концентрировали и хроматографировали на силикагеле, элюируя с градиентом 15%-50% этилацетата в гептанах с получением указанного в заголовке соединения.1H ЯМР (400 МГц, CDCl3) δ м.д. 8,63 (с, 1H), 8,41 (д, J=5,1 Гц, 1H), 8,18 (т, J=1,8 Гц, 1H), 8,12-8,07 (м, 1H), 7,71-7,67 (м, 2H), 7,55 (т, J=7,8 Гц, 1H), 5,60 (дд, J=13,2, 3,0 Гц, 1H), 3,95 (с, 3H), 3,16 (дд, J=17,1, 13,3 Гц, 1H), 3,01 (дд, J=17,0, 3,0 Гц, 1H); МС (ESI) m/z 284 (M+H)+.
Пример 24E
Раствор соединения из примера 24D (67 мг, 0,237 ммоль), (R)-(+)-2-метил-2-пропансульфинамид (43,0 мг, 0,355 ммоль) и этоксид титана(IV) (298 мкл, 1,419 ммоль) в 2-метил-тетрагидрофуране (1,5 мл) нагревали при 70°C в течение ночи. Смесь охлаждали и разделяли между водой и этилацетатом. Слои разделяли и водный слой экстрагировали этилацетатом. Объединенные этилацетатные слои промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали, концентрировали и хроматографировали на силикагеле, элюируя градиентом 0%-100% этилацетата в [9:1 CH2Cl2:этилацетат] с получением соединения примера 24E в качестве первого элюированного изомера и соединения примера 24F в качестве второго элюированного изомера.1H ЯМР (400 МГц, CDCl3) δ м.д. 8,56-8,49 (м, 1H), 8,35-8,29 (м, 1H), 8,15 (с, 1H), 8,07 (д, J=7,8 Гц, 1H), 7,78-7,72 (м, 1H), 7,67 (д, J=7,7 Гц, 1H), 7,50 (т, J=7,7 Гц, 1H), 5,32 (дд, J=12,8, 2,4 Гц, 1H), 4,40 (кв, J=7,2 Гц, 2H), 3,97 (дд, J=17,7, 2,8 Гц, 1H), 3,37 (дд, J=17,7, 12,8 Гц, 1H), 1,41 (т, J=7,1 Гц, 3H), 1,34 (с, 9H) ; МС (ESI) m/z 399 (M-H)-.
Пример 24F
Соединение примера 24F получали в качестве второго элюированного изомера в результате хроматографии неочищенного материала, как описано в примере 24E.1H ЯМР (500 МГц, CDCl3) δ м.д. 8,56-8,49 (м, 1H), 8,35-8,28 (м, 1H), 8,15 (с, 1H), 8,07 (дт, J=7,8, 1,4 Гц, 1H), 7,78-7,74 (м, 1H), 7,64 (д, J=7,8 Гц, 1H), 7,51 (т, J=7,8 Гц, 1H), 5,41 (дд, J=12,3, 2,8 Гц, 1H), 4,41 (кв, J=7,1 Гц, 2H), 4,26 (дд, J=17,3, 2,9 Гц, 1H), 3,16 (дд, J=17,3, 12,2 Гц, 1H), 1,42 (т, J=7,2 Гц, 3H), 1,36 (с, 9H); МС (ESI) m/z 399 (M-H)-.
Пример 24G
Раствор соединения из примера 24F (17 мг, 0,042 ммоль) в этаноле (1 мл) охлаждали до 0°C, обрабатывали NaBH4 (4 мг), перемешивали при 0°C в течение 15 минут и разделяли между водой и этилацетатом. Слои разделяли и водный слой экстрагировали этилацетатом. Объединенные этилацетатные слои промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали с получением соединения примера 24G.1H ЯМР (400 МГц, CDCl3) δ м.д. 8,35-8,15 (м, 2H), 8,11 (с, 1H), 8,05 (д, J=7,7 Гц, 1H), 7,71-7,67 (м, 1H), 7,65 (д, J=7,8 Гц, 1H), 7,51 (т, J=7,7 Гц, 1H), 5,29 (д, J=9,4 Гц, 1H), 4,89-4,81 (м, 1H), 4,41 (кв, J=7,1 Гц, 2H), 3,58 (д, J=8,3 Гц, 1H), 2,53 (ддд, J=13,8, 6,2, 1,9 Гц, 1H), 2,20 (дт, J=13,6, 11,5 Гц, 1H), 1,41 (т, J=7,1 Гц, 3H), 1,25 (с, 9H); МС (ESI) m/z 403 (M+H)+.
Пример 24H
этил rel-3-((2S,4S)-4-амино-3,4-дигидро-2H-пирано[2,3-c]пиридин-2-ил)бензоат гидрохлорид
Раствор соединения из примера 24G (17 мг, 0,042 ммоль) в этаноле (1 мл) обрабатывали 4 М HCl в диоксане (0,5 мл) и перемешивали при комнатной температуре в течение 20 минут. Смесь концентрировали досуха и высушивали в вакууме при нагревании при 60°C в течение 30 минут с получением соединения примера 24H.1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,26-9,06 (м, 3H), 8,60-8,34 (м, 2H), 8,09-7,97 (м, 3H), 7,78 (д, J=7,8 Гц, 1H), 7,65 (т, J=7,7 Гц, 1H), 5,60 (д, J=11,4 Гц, 1H), 5,04-4,92 (м, 1H), 4,35 (кв, J=7,1 Гц, 2H), 2,71-2,64 (м, 1H), 2,20 (кв, J=12,1 Гц, 1H), 1,34 (т, J=7,1 Гц, 3H); МС (ESI) m/z 299 (M+H)+.
Пример 24I
этил rel-3-[(2S,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2H-пирано[2,3-c]пиридин-2-ил]бензоат
Смесь продукта из примера 24H (14 мг, 0,042 ммоль), 1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоновой кислоты (10,13 мг, 0,042 ммоль) и O-(7-азабензотриазол-1-ил)-N,N,N',N'- тетраметилурония гексафторфосфата (17,49 мг, 0,046 ммоль) в тетрагидрофуране (1 мл) обрабатывали триэтиламином (17,49 мкл, 0,125 ммоль). Смесь перемешивали при комнатной температуре в течение 1 часа, разбавляли этилацетатом (30 мл), промывали 1 M HCl (10 мл), промывали насыщенным раствором NaHCO3 (10 мл), промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали. Остаток хроматографировали на силикагеле, элюируя градиентом 50%-100% [1:1 CH2Cl2:этилацетат] в гептанах с получением указанного в заголовке соединения.1H ЯМР (400 МГц, CDCl3) δ м.д. 8,25 (с, 1H), 8,17 (д, J=5,1 Гц, 1H), 8,06 (с, 1H), 8,03 (д, J=8,1 Гц, 1H), 7,59 (д, J=8,1 Гц, 1H), 7,47 (т, J=7,7 Гц, 1H), 7,17-7,02 (м, 4H), 5,57-5,45 (м, 2H), 5,34-5,26 (м, 1H), 4,39 (кв, J=7,1 Гц, 2H), 2,49 (ддд, J=13,5, 5,9, 1,9 Гц, 1H), 1,92 (кв, J=11,8 Гц, 1H), 1,81-1,62 (м, 2H), 1,40 (т, J=7,1 Гц, 3H), 1,19-1,08 (м, 2H); МС (ESI) m/z 523 (M+H)+.
Пример 25
этил rel-3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2H-пирано[2,3-c]пиридин-2-ил]бензоат
Пример 25A
Раствор соединения из примера 24E (10,6 мг, 0,026 ммоль) в этаноле (1 мл) охлаждали до 0°C, обрабатывали NaBH4 (4 мг), перемешивали при 0°C в течение 15 минут и разделяли между водой и этилацетатом. Слои разделяли и водный слой экстрагировали этилацетатом. Объединенные этилацетатные слои промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали с получением соединения примера 25A.1H ЯМР (400 МГц, CDCl3) δ м.д. 8,32-8,29 (м, 1H), 8,21 (д, J=5,0 Гц, 1H), 8,11 (с, 1H), 8,04 (д, J=8,0 Гц, 1H), 7,63 (д, J=7,8 Гц, 1H), 7,49 (т, J=7,7 Гц, 1H), 7,36 (д, J=4,9 Гц, 1H), 5,28 (дд, J=11,5, 2,1 Гц, 1H), 4,79 (тд, J=11,0, 6,0 Гц, 1H), 4,40 (кв, J=7,1 Гц, 2H), 3,35 (д, J=10,6 Гц, 1H), 2,95-2,85 (м, 1H), 2,16 (дт, J=13,7, 11,4 Гц, 1H), 1,41 (т, J=7,2 Гц, 3H), 1,32 (с, 9H); МС (ESI) m/z 403 (M+H)+.
Пример 25B
этил rel-3-((2R,4R)-4-амино-3,4-дигидро-2H-пирано[2,3-c]пиридин-2-ил)бензоат гидрохлорид
Раствор соединения из примера 25A (9,3 мг, 0,023 ммоль) в этаноле (1 мл) обрабатывали 4 М HCl в диоксане (0,5 мл) и перемешивали при комнатной температуре в течение 20 минут. Смесь концентрировали досуха и высушивали в вакууме при нагревании при 60°C в течение 30 минут с получением указанного в заголовке соединения.1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,11 (ушир, 3H), 8,48 (с, 1H), 8,39 (д, J=5,2 Гц, 1H), 8,06 (с, 1H), 8,05-7,98 (м, 1H), 7,95 (д, J=5,4 Гц, 1H), 7,78 (д, J=7,7 Гц, 1H), 7,65 (т, J=7,7 Гц, 1H), 5,57 (д, J=11,5 Гц, 1H), 5,01-4,90 (м, 1H), 4,35 (кв, J=7,1 Гц, 2H), 2,70-2,63 (м, 1H), 2,18 (кв, J=12,1 Гц, 1H), 1,34 (т, J=7,1 Гц, 3H); МС (ESI) m/z 299 (M+H)+.
Пример 25C
этил rel-3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2H-пирано[2,3-c]пиридин-2-ил]бензоат
Смесь продукта из примера 25B (7,7 мг, 0,023 ммоль), O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилуроний гексафторфосфата (9,62 мг, 0,025 ммоль) и 1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоновой кислоты (5,57 мг, 0,023 ммоль) в тетрагидрофуране (1 мл) обрабатывали триэтиламином (9,62 мкл, 0,069 ммоль). Смесь перемешивали при комнатной температуре в течение 1 часа, разбавляли этилацетатом (30 мл), промывали 1 M HCl (10 мл), промывали насыщенным раствором NaHCO3 (10 мл), промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали. Неочищенный продукт хроматографировали на силикагеле, элюируя градиентом 50%-100% [1:1 CH2Cl2:этилацетат] в гептанах с получением указанного в заголовке соединения.1H ЯМР (400 МГц, CDCl3) δ м.д. 8,26 (с, 1H), 8,17 (д, J=5,0 Гц, 1H), 8,06 (с, 1H), 8,03 (д, J=7,8 Гц, 1H), 7,58 (д, J=7,8 Гц, 1H), 7,47 (т, J=7,7 Гц, 1H), 7,15 (дд, J=8,2, 1,6 Гц, 1H), 7,10 (д, J=1,5 Гц, 1H), 7,06-7,02 (м, 2H), 5,52 (тд, J=10,8, 10,1, 6,0 Гц, 1H), 5,43 (д, J=8,9 Гц, 1H), 5,28 (дд, J=11,7, 1,9 Гц, 1H), 4,39 (кв, J=7,1 Гц, 2H), 2,50 (ддд, J=13,5, 6,0, 2,0 Гц, 1H), 1,89 (дт, J=13,3, 11,4 Гц, 1H), 1,80-1,63 (м, 2H), 1,40 (т, J=7,1 Гц, 3H), 1,17-1,08 (м, 2H); МС (ESI) m/z 523 (M+H)+.
Пример 26
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(дифторметокси)-3,4-дигидро-2H-хромен-2-ил]циклогексанкарбоновая кислота
Пример 26A
метил 3-((2R,4R)-4-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-7-(дифторметокси)хроман-2-ил)циклогексанкарбоксилат
Указанное в заголовке соединение (9,0 мг, 0,016 ммоль, выход 9,04%) выделяли в качестве второго элюированного соединения в результате очистки неочищенного продукта, как описано в примере 27E. ЖХ/МС m/z 580 (M+H)+.
Пример 26B
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(дифторметокси)-3,4-дигидро-2H-хромен-2-ил]циклогексанкарбоновая кислота
Смесь 26A (12 мг, 0,021 ммоль) и 2 M LiOH (0,5 мл) в метаноле (2 мл) перемешивали при 35°С в течение 4 часов. ЖХ/МС показала, что реакция завершилась. Растворитель удаляли и добавляли воду (1 мл). Значение рН смеси доводили с помощью 2 М HCl до значения pH 1~2. Осажденное белое твердое вещество собирали фильтрованием, промывали водой и сушили с получением указанного в заголовке соединения (10 мг, 0,018 ммоль, выход 85%).1H ЯМР (400 МГц, CDCl3) δ 7,21-7,10 (м, 2H), 7,07-6,92 (м, 2H), 6,64-6,58 (м, 1H), 6,54 (кв, J=2,1 Гц, 1H), 6,47-6,22 (м, 1H), 5,29 (дт, J=26,3, 8,2 Гц, 2H), 3,95 (т, J=12,4 Гц, 1H), 2,30 (д, J=58,5 Гц, 2H), 2,04 (д, J=12,1 Гц, 3H), 1,80-1,60 (м, 4H), 1,51-1,23 (м, 5H), 1,11 (д, J=3,5 Гц, 2H); МС (ESI-) m/z 564,2 (M-H)-.
Пример 27
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(дифторметокси)-3,4-дигидро-2H-хромен-2-ил]бензойная кислота
Пример 27A
7-(дифторметокси)-4H-хромен-4-он
К 7-гидрокси-4H-хромен-4-ону (CAS 59887-89-7, MFCD00209371, 2,0 г, 12,33 ммоль) и диэтил (бромдифторметил)фосфонату (4,38 мл, 24,67 ммоль) в ацетонитриле (40 мл) и воде (20,00 мл) добавляли 50% водный раствор гидроксида калия (8,30 г, 74,0 ммоль) по каплям через шприц при энергичном перемешивании. Во время добавления температура поднялась до максимальной температуры 38°С. После добавления, ЖХ/МС показал, что преобразование выполнено, с небольшим пиком побочного продукта. К смеси добавляли дополнительное количество воды. Смесь экстрагировали этилацетатом (3×20 мл). Объединенную органическую фазу промывали 1 M HCl (10 мл), сушили над MgSO4, фильтровали и концентрировали. Неочищенную смесь очищали на 80 г картридже с силикагелем, элюируя этилацетатом в гептане (5-40%) с получением указанного в заголовке соединения (1,31 г, 6,17 ммоль, выход 50,1%).1H ЯМР (500 МГц, CDCl3) δ 8,22 (д, J=8,7 Гц, 1H), 7,84 (д, J=6,1 Гц, 1H), 7,21-7,10 (м, 2H), 6,64 (т, J=72,5 Гц, 1H), 6,34 (д, J=6,0 Гц, 1H); ЖХ/МС m/z 213 (M+H)+.
Пример 27B
(R)-метил 3-(7-(дифторметокси)-4-оксохроман-2-ил)бензоат
Смесь (3-(метоксикарбонил)фенил)бороновой кислоты (901 мг, 5,01 ммоль), (S)-4-(трет-бутил)-2-(пиридин-2-ил)-4,5-дигидрооксазола (49,1 мг, 0,240 ммоль), бис(2,2,2-трифторацетокси)-палладия (66,6 мг, 0,200 ммоль) и гексафторофосфата аммония (196 мг, 1,20 ммоль) в (10 мл) дихлорэтане перемешивали при температуре окружающей среды в течение 5 минут и к этому добавляли соединение примера 27A (850 мг, 4,0 ммоль) и воду (0,36 мл, 20,0 ммоль). Смесь нагревали при температуре 60°C в течение ночи. Реакционную смесь разбавляли дихлорэтаном и фильтровали через слой целита. Смесь промывали насыщенным солевым раствором и концентрировали. Неочищенный материал загружали на 40 г картридж с силикагелем и элюировали 5-50% этилацетатом/гептаном с получением указанного в заголовке продуктав виде белого твердого вещества. Аналитическая хиральная SFC показала 93% э.и.1H ЯМР (501 МГц, CDCl3) δ 8,17 (т, J=1,8 Гц, 1H), 8,08 (дт, J=7,8, 1,4 Гц, 1H), 7,96 (д, J=8,5 Гц, 1H), 7,70-7,62 (м, 1H), 7,53 (т, J=7,7 Гц, 1H), 6,88-6,79 (м, 2H), 6,60 (т, J=72,8 Гц, 1H), 5,56 (дд, J=13,3, 2,9 Гц, 1H), 3,95 (с, 3H), 3,08 (дд, J=16,9, 13,4 Гц, 1H), 2,92 (дд, J=16,9, 2,9 Гц, 1H); МС (ESI+) m/z 349 (M+H)+.
Пример 27C
(R)-метил 3-(7-(дифторметокси)-4-(метоксиимино)хроман-2-ил)бензоат
Смесь соединения из примера 27B (410 мг, 1,177 ммоль), O-метилгидроксиламина гидрохлорида (197 мг, 2,354 ммоль) и ацетат натрия (193 мг, 2,354 ммоль) в метаноле (10 мл) нагревали при температуре 60°C в течение 4 часов. ЖХ/МС показал, что реакция завершилась. Растворитель выпаривали в вакууме и добавляли этилацетат (20 мл). Смесь промывали водой, сушили над MgSO4, и концентрировали в вакууме с получением указанного в заголовке соединения в виде белого твердого вещества (395 мг, 1,047 ммоль, выход 89%).1H ЯМР (400 МГц, CDCl3) δ 8,14 (т, J=1,6 Гц, 1H), 8,04 (дт, J=7,8, 1,3 Гц, 1H), 7,97-7,86 (м, 1H), 7,66 (дт, J=7,8, 1,4 Гц, 1H), 7,50 (т, J=7,7 Гц, 1H), 6,79-6,72 (м, 2H), 6,71 (с, 1H), 5,13 (дд, J=12,4, 3,0 Гц, 1H), 3,98 (с, 3H), 3,94 (с, 3H), 3,50 (дд, J=17,3, 3,1 Гц, 1H), 2,66 (дд, J=17,2, 12,5 Гц, 1H); МС (ESI+) m/z 378 (M+H)+.
Пример 27D
Метил 3-((2R,4R)-4-амино-7-(дифторметокси)хроман-2-ил)бензоат
Платину на угле, 5% загрузка (199 мг, 0,051 ммоль) добавляли к раствору соединения примера 27C (385 мг, 1,02 ммоль) в уксусной кислоте (5 мл) в 50 мл круглодонной колбе. В колбу загружали балонный водород и перемешивали в течение 48 часов при комнатной температуре. ЖХ/МС показал, что достигнуто только 60% преобразования. Реакционную смесь фильтровали и фильтрат концентрировали. Полученный остаток очищали на картридже с силикагелем 12 г, элюируя (95% этилацетат/5% метанол/2% триэтиламин) в гептане при градиенте 10-100% с получением указанного в заголовке соединения (63 мг, 34%), который содержал приблизительно 15% избыточного продукта метил 3-((2R,4R)-4-амино-7-(дифторметокси)хроман-2-ил)циклогексанкарбоксилата. Полученную смесь использовали без дополнительной очистки.1H ЯМР (400 МГц, CDCl3) δ 8,19-8,07 (м, 1H), 8,03 (дт, J=7,8, 1,4 Гц, 1H), 7,69-7,58 (м, 1H), 7,56-7,44 (м, 2H), 6,75 (дд, J=8,6, 2,4 Гц, 1H), 6,68 (д, J=2,1 Гц, 1H), 6,50-6,26 (м, 1H), 5,23 (дд, J=11,8, 1,9 Гц, 1H), 4,26 (дд, J=11,3, 5,8 Гц, 1H), 3,94 (с, 3H), 3,73-3,66 (м, 1H), 2,43 (ддд, J=13,4, 5,8, 1,9 Гц, 1H); МС (ESI+) m/z 333 (M-NH2)+.
Пример 27E
метил 3-((2R,4R)-4-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-7-(дифторметокси)хроман-2-ил)бензоат
Смесь 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоты (41,6 мг, 0,172 ммоль) и HATU (1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиний 3-оксид гексафторфосфат) (98 мг, 0,258 ммоль) в DMF (1 мл) перемешивали в течение 5 минут, и добавляли соединение из примера 27D (60 мг, 0,172 ммоль), с последующим добавлением N-этил-N-изопропилпропан-2-амина (0,120 мл, 0,687 ммоль). Смесь перемешивали при температуре окружающей среды в течение 2 часов и ЖХ/МС показала, что реакция была завершена. Неочищенный продукт очищали с помощью метода препаративной ЖХ TFA2 с получением указанного в заголовке соединения (43 мг, выход 43,7%) в качестве первого элюированного соединения и соединения примера 26A в качестве второго элюированного соединения.
Пример 27F
3-((2R,4R)-4-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-7-(дифторметокси)хроман-2-ил)бензойная кислота
Смесь соединения из примера 27E (40 мг, 0,07 ммоль) в метаноле (2 мл) и 2 M водный LiOH перемешивали при 35°С в течение 4 часов. ЖХ/МС показала, что реакция была завершена. Растворитель удаляли и добавляли воду (1 мл), и рН смеси доводили до значения рН 1~2 с помощью 2 М HCl. Осажденное белое твердое вещество собирали фильтрованием, промывали водой и сушили с получением указанного в заголовке соединения (32 мг, 0,057 ммоль, выход 82%).1H ЯМР (400 МГц, ДМСО-d6) δ 7,99 (с, 1H), 7,88 (д, J=7,9 Гц, 1H), 7,53 (д, J=7,7 Гц, 1H), 7,48-6,99 (м, 7H), 6,74 (д, J=8,2 Гц, 1H), 6,65 (с, 1H), 5,38 (д, J=10,8 Гц, 2H), 2,23-2,01 (м, 2H), 1,45 (ддд, J=44,1, 9,1, 3,1 Гц, 2H), 1,06 (д, J=3,7 Гц, 2H); МС (ESI-) m/z 558 (M-H)-.
Пример 28
rac-3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил]бензойная кислота
Раствор соединения примера 30 (23 мг, 0,043 ммоль) в тетрагидрофуране (1,5 мл) и метанола (1,5 мл) обрабатывали 1 M NaOH (15 капель). Смесь перемешивали при 50°C в течение 15 минут, нагревали до 60°C в течение 30 минут, охлаждали, разбавляли водой (10 мл), обрабатывали 1 М HCl (1 мл) и экстрагировали этилацетатом (30 мл). Этилацетатные слои промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали с получением указанного в заголовке соединения (22 мг, 0,042 ммоль, выход 98%).1H ЯМР (400 МГц, CDCl3) δ м.д. 8,17 (т, J=1,7 Гц, 1H), 8,06 (д, J=7,8 Гц, 1H), 7,67 (д, J=7,7 Гц, 1H), 7,47 (т, J=7,7 Гц, 1H), 7,35 (д, J=8,2 Гц, 1H), 7,11 (дд, J=8,2, 1,7 Гц, 1H), 7,07 (д, J=1,5 Гц, 1H), 7,02 (д, J=8,2 Гц, 1H), 6,41 (д, J=8,3 Гц, 1H), 5,48 (тд, J=9,8, 6,2 Гц, 1H), 5,39-5,29 (м, 2H), 3,89 (с, 3H), 2,58-2,51 (м, 1H), 1,85 (дт, J=13,3, 10,9 Гц, 1H), 1,78-1,62 (м, 2H), 1,13-1,05 (м, 2H); МС (ESI) m/z 523 (M+H)+.
Пример 29
rac-3-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил]бензойная кислота
Пример 29A
метил rac-3-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил]бензоат
Соединение примера 37G хроматографировали на силикагеле, элюируя градиентом 50%-65% [9:1 CH2Cl2:этилацетат] в гептане с получением указанного в заголовке соединения в качестве первого элюированного изомера.1HNMR (400 МГц, CDCl3) δ м.д. 8,06 (т, J=1,6 Гц, 1H), 8,02 (д, J=7,8 Гц, 1H), 7,61 (дт, J=7,7, 1,5 Гц, 1H), 7,47 (т, J=7,7 Гц, 1H), 7,40 (д, J=8,2 Гц, 1H), 7,15 (дд, J=8,1, 1,7 Гц, 1H), 7,12 (д, J=1,7 Гц, 1H), 7,05 (д, J=8,2 Гц, 1H), 6,41 (д, J=8,2 Гц, 1H), 5,50 (д, J=6,9 Гц, 1H), 5,00 (ддд, J=7,1, 4,4, 2,8 Гц, 1H), 4,96 (дд, J=11,5, 2,4 Гц, 1H), 3,94 (с, 3H), 3,88 (с, 3H), 2,29 (дт, J=14,4, 2,7 Гц, 1H), 2,19 (ддд, J=14,4, 11,3, 4,5 Гц, 1H), 1,68 (кв, J=3,4 Гц, 2H), 1,09 (кв, J=3,3 Гц, 2H); МС (ESI) m/z 537 (M-H)-.
Пример 29B
rac-3-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил]бензойная кислота
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 28, используя соединение из примера 29А вместо соединения из примера 30.1H ЯМР (400 МГц, CDCl3) δ м.д. 8,13 (с, 1H), 8,08 (д, J=7,8 Гц, 1H), 7,67 (д, J=7,6 Гц, 1H), 7,50 (т, J=7,7 Гц, 1H), 7,41 (д, J=8,2 Гц, 1H), 7,16 (д, J=8,9 Гц, 1H), 7,13 (с, 1H), 7,05 (д, J=8,1 Гц, 1H), 6,41 (д, J=8,2 Гц, 1H), 5,53 (д, J=6,9 Гц, 1H), 5,05-4,95 (м, 2H), 3,89 (с, 3H), 2,32 (д, J=14,6 Гц, 1H), 2,28-2,10 (м, 1H), 1,69 (кв, J=3,2 Гц, 2H), 1,10 (кв, J=3,3 Гц, 2H); МС (ESI) m/z 523 (M-H).
Пример 30
метил rac-3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил]бензоат
Соединение из примера 37G хроматографировали на силикагеле, элюируя градиентом 50-65% [9:1 CH2Cl2:этилацетат] в гептанах с получением указанного в заголовке соединения в качестве второго элюированного изомера.1H ЯМР (501 МГц, CDCl3) δ м.д. 8,08 (т, J=1,8 Гц, 1H), 8,00 (дт, J=7,8, 1,4 Гц, 1H), 7,62-7,59 (м, 1H), 7,44 (т, J=7,7 Гц, 1H), 7,34 (дд, J=8,3, 0,9 Гц, 1H), 7,09 (дд, J=8,2, 1,7 Гц, 1H), 7,05 (д, J=1,7 Гц, 1H), 7,01 (д, J=8,2 Гц, 1H), 6,40 (д, J=8,3 Гц, 1H), 5,46-5,39 (м, 1H), 5,32 (дд, J=11,2, 2,0 Гц, 1H), 5,26 (д, J=8,9 Гц, 1H), 3,92 (с, 3H), 3,88 (с, 3H), 2,48 (ддд, J=13,5, 6,2, 2,1 Гц, 1H), 1,86 (дт, J=13,5, 10,9 Гц, 1H), 1,75-1,68 (м, 1H), 1,68-1,61 (м, 1H), 1,12-1,04 (м, 2H); МС (ESI) m/z 537 (M-H)-.
Пример 31
rac-3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил]бензойная кислота
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 28, используя соединение из примера 33F вместо соединения из примера 30.1H ЯМР (400 МГц, CDCl3) δ м.д. 8,31 (с, 1H), 8,25 (д, J=4,3 Гц, 1H), 8,04 (д, J=7,7 Гц, 1H), 7,58-7,51 (м, 2H), 7,44 (т, J=7,7 Гц, 1H), 7,13 (дд, J=8,2, 1,5 Гц, 1H), 7,10 (д, J=1,3 Гц, 1H), 7,03-6,97 (м, 2H), 5,64-5,56 (м, 1H), 5,51 (д, J=9,1 Гц, 1H), 5,44 (д, J=11,2 Гц, 1H), 2,61 (ддд, J=13,5, 6,0, 2,0 Гц, 1H), 1,89-1,65 (м, 3H), 1,18-1,08 (м, 2H); МС (ESI) m/z 495 (M+H)+.
Пример 32
rac-3-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил]бензойная кислота
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 28, используя соединение из примера 34 вместо соединения из примера 30.1H ЯМР (400 МГц, CDCl3) δ м.д. 8,28 (с, 2H), 8,05 (д, J=7,6 Гц, 1H), 7,60 (дд, J=7,5, 1,8 Гц, 1H), 7,53 (д, J=7,7 Гц, 1H), 7,46 (т, J=7,7 Гц, 1H), 7,16 (дд, J=8,0, 1,7 Гц, 1H), 7,12 (д, J=1,6 Гц, 1H), 7,03 (д, J=8,2 Гц, 1H), 6,99 (дд, J=7,3, 5,0 Гц, 1H), 5,77 (д, J=6,8 Гц, 1H), 5,18-5,08 (м, 2H), 2,44 (дт, J=14,3, 2,6 Гц, 1H), 2,16 (ддд, J=15,0, 11,4, 4,6 Гц, 1H), 1,72 (кв, J=3,6 Гц, 2H), 1,12 (кв, J=3,7 Гц, 2H); МС (ESI) m/z 495 (M+H)+.
Пример 33
rac-метил 3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил]бензоат
Пример 33A
метил 3-(3-(2-хлорпиридин-3-ил)-3-оксопропаноил)бензоат
Раствор метил 3-ацетилбензоата (108 мг, 0,606 ммоль) в тетрагидрофуране (1 мл) добавляли к раствору 1 М литий бис(триметилсилил)амида в тетрагидрофуране с температурой -78°C (1,3 мл, 1,3 ммоль) в атмосфере N2. После перемешивания при -78°C в течение 15 минут, добавляли по каплям раствор 2-хлорникотиноилхлорида (107 мг, 0,606 ммоль) в тетрагидрофуране (1 мл). Смесь перемешивали при комнатной температуре в течение 15 минут и гасили 1 M HCl (приблизительно 2 мл). Смесь оставляли нагреваться до комнатной температуры и затем экстрагировали этилацетатом (приблизительно 30 мл). Этилацетатные слои промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали. Неочищенный продукт затвердевал при стоянии в течение ночи. Этот остаток обрабатывали 1:1 гептан:этилацетат и смесь разбавляли гептанами. Твердое вещество собирали фильтрованием, промывали 5:1 гептан:этилацетат, и сушили в вакууме с получением указанного в заголовке соединения (55,5 мг, 0,175 ммоль, выход 28,8%). МС (ESI) m/z 318 (M+H)+.
Пример 33B
метил 3-(4-оксо-4H-пирано[2,3-b]пиридин-2-ил)бензоат
Смесь продукта из примера 33A (3,06 г, 9,63 ммоль) и K2CO3 (1,331 г, 9,63 ммоль) в N,N-диметилформамиде (30 мл) нагревали при температуре 100°C в течение 30 минут, охлаждали до приблизительно 0°C, обрабатывали все сразу 1 М HCl (15 мл) и затем разбавляли водой (150 мл). Смесь перемешивали при комнатной температуре в течение 15 минут и твердое вещество собирали фильтрованием, промывали водой и сушили в вакууме с нагреванием при 60°С в течение 2 часов с получением указанного в заголовке соединения (2,53 г, 9,00 ммоль, выход 93%).1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,81 (дд, J=4,6, 2,0 Гц, 1H), 8,59 (т, J=1,8 Гц, 1H), 8,51 (дд, J=7,7, 2,1 Гц, 1H), 8,37 (дд, J=8,3, 1,7 Гц, 1H), 8,17 (дт, J=7,8, 1,3 Гц, 1H), 7,74 (т, J=7,8 Гц, 1H), 7,65 (дд, J=7,8, 4,7 Гц, 1H), 7,21 (с, 1H), 3,92 (с, 3H); МС (ESI) m/z 282 (M+H)+.
Пример 33C
метил 3-(4-оксо-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил)бензоат
Раствор соединения из примера 33B (0,49 г, 1,742 ммоль) в метаноле (3 мл) и CH2Cl2 (6 мл) обрабатывали фталоцианином кобальта(II) (0,050 г, 0,087 ммоль), обрабатывали NaBH4 (0,527 г, 13,94 ммоль), перемешивали при комнатной температуре в течение 10 минут, и разделяли между этилацетатом (30 мл) и 1 M HCl (15 мл). Смесь нейтрализовали насыщенным раствором NaHCO3. Слои разделяли и водный слой экстрагировали этилацетатом (2×25 мл). Объединенные этилацетатные слои промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали. Этот материал растворяли в CH2Cl2 (приблизительно 10 мл), обрабатывали хлорхроматом пиридиния (0,751 г, 3,48 ммоль) и перемешивали в течение 20 минут. Остаток распределяли между насыщенным раствором NaHCO3и CH2Cl2. Этот материал фильтровали через целит. Слои разделяли и водный слой экстрагировали CH2Cl2 (2 ×). Объединенные слои CH2Cl2 сушили (MgSO4), фильтровали, обрабатывали силикагелем (приблизительно 3 г) и концентрировали досуха. Хроматография остатка на силикагеле и элюирование градиентом 30%-100% этилацетата в гептанах давали указанное в заголовке соединение (115 мг, 0,406 ммоль, выход 23,30%).1H ЯМР (400 МГц, CDCl3) δ м.д. 8,52 (дд, J=4,9, 2,1 Гц, 1H), 8,29 (дд, J=7,6, 2,1 Гц, 1H), 8,20 (д, J=1,8 Гц, 1H), 8,07 (дт, J=7,8, 1,3 Гц, 1H), 7,73 (дт, J=7,8, 1,5 Гц, 1H), 7,52 (т, J=7,7 Гц, 1H), 7,14 (дд, J=7,6, 4,7 Гц, 1H), 5,69 (дд, J=12,9, 3,2 Гц, 1H), 3,94 (с, 3H), 3,13 (дд, J=16,9, 12,8 Гц, 1H), 3,00 (дд, J=16,9, 3,2 Гц, 1H); МС (ESI) m/z 284 (M+H)+.
Пример 33D
метил 3-(4-(метоксиимино)-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил)бензоат
Раствор соединения из примера 33C (115 мг, 0,406 ммоль) и O-метилгидроксиламина гидрохлорида (102 мг, 1,218 ммоль) в пиридине (1 мл) нагревали при температуре 60°C в течение 2 часов. Смесь охлаждали, концентрировали и разделяли между трет-бутилметиловым эфиром и водой. Слой трет-бутилметилового эфира выделяли и водный слой экстрагировали трет-бутилметиловым эфиром. Объединенные слои трет-бутилметилового эфира промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали, концентрировали и хроматографировали на силикагеле, элюируя градиентом 25%-100% этилацетата в гептанах, с получением указанного в заголовке соединения (99 мг, 0,317 ммоль, выход 78%).1H ЯМР (400 МГц, CDCl3) δ м.д. 8,31-8,26 (м, 2H), 8,17 (т, J=1,8 Гц, 1H), 8,03 (дт, J=7,8, 1,4 Гц, 1H), 7,73 (дт, J=7,8, 1,5 Гц, 1H), 7,49 (т, J=7,8 Гц, 1H), 7,01 (дд, J=7,4, 5,0 Гц, 1H), 5,30 (дд, J=12,1, 3,1 Гц, 1H), 4,01 (с, 3H), 3,93 (с, 3H), 3,53 (дд, J=17,2, 3,2 Гц, 1H), 2,71 (дд, J=17,2, 12,1 Гц, 1H); МС (ESI) m/z 313 (M+H)+.
Пример 33E
метил 3-(4-амино-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил)бензоат
Соединение из примера 33D (99 мг, 0,317 ммоль) и метанол (10 мл) добавляли к Ra-Ni 2800, водной суспензии (0,5 г, 3,83 ммоль) в 50 мл сосуде для реакций под давлением и взбалтывали в атмосфере H2 при давлении 30 фунтов на квадратный дюйм в течение 16 часов при комнатной температуре. Смесь фильтровали, и фильтрат концентрировали с получением указанного в заголовке соединения.
Пример 33F
rac-метил 3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил]бензоат
Указанное в заголовке соединение выделяли в качестве второго элюированного изомера из хроматографической колонки при его получении и очищали, используя процедуру, аналогичную описанной в примере 24I, используя соединение примера 33E вместо соединения примера 24H.1H ЯМР (400 МГц, CDCl3) δ м.д. 8,15 (дд, J=5,2, 2,0 Гц, 1H), 8,09 (т, J=1,8 Гц, 1H), 8,00 (дт, J=7,8, 1,4 Гц, 1H), 7,64 (дт, J=7,6, 1,5 Гц, 1H), 7,51-7,40 (м, 2H), 7,12 (дд, J=8,2, 1,7 Гц, 1H), 7,08 (д, J=1,6 Гц, 1H), 7,02 (д, J=8,2 Гц, 1H), 6,95 (дд, J=7,5, 4,8 Гц, 1H), 5,54 (тд, J=10,3, 6,2 Гц, 1H), 5,42-5,35 (м, 2H), 3,92 (с, 3H), 2,51 (ддд, J=13,4, 6,0, 2,0 Гц, 1H), 1,86 (дт, J=13,4, 11,3 Гц, 1H), 1,80-1,62 (м, 2H), 1,17-1,04 (м, 2H); МС (ESI) m/z 509 (M+H)+.
Пример 34
rac-метил 3-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил]бензоат
Указанное в заголовке соединение выделяли в качестве первого элюированного изомера из хроматографической колонки при получении и очищали, используя процедуру, аналогичную описанной в примере 24I, используя соединение примера 33E вместо соединения примера 24H.1H ЯМР (400 МГц, CDCl3) δ м.д. 8,19 (дд, J=4,8, 1,9 Гц, 1H), 8,05 (т, J=1,7 Гц, 1H), 8,01 (дт, J=7,9, 1,4 Гц, 1H), 7,61 (дт, J=7,9, 1,4 Гц, 1H), 7,54 (дд, J=7,5, 1,9 Гц, 1H), 7,46 (т, J=7,7 Гц, 1H), 7,16 (дд, J=8,2, 1,7 Гц, 1H), 7,12 (д, J=1,6 Гц, 1H), 7,05 (д, J=8,2 Гц, 1H), 6,95 (дд, J=7,5, 4,8 Гц, 1H), 5,61 (д, J=7,2 Гц, 1H), 5,13-5,03 (м, 2H), 3,93 (с, 3H), 2,32 (дт, J=14,5, 2,9 Гц, 1H), 2,19 (ддд, J=14,8, 10,9, 4,6 Гц, 1H), 1,70 (кв, J=3,6 Гц, 2H), 1,11 (кв, J=3,7 Гц, 2H); МС (ESI) m/z 509 (M+H)+.
Пример 35
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]циклогексанкарбоновая кислота
Пример 35A
метил 3-((2R,4R)-4-амино-7-метоксихроман-2-ил)циклогексанкарбоксилат
Указанное в заголовке соединение получали с использованием условий, описанных в примере 20C, используя соединение из примера 5C вместо соединения из примера 20B. Указанное в заголовке соединение было побочным продуктом восстановления фенильного кольца. Выделение указанного в заголовке соединения получали путем образования его гидрохлоридной соли, полученной добавлением HCl (2,0 эквивалента, 4 М в диоксане) к раствору неочищенного амина (30 мг) в метил-трет-бутиловом эфире (2 мл), что давало соли гидрохлорида указанного в заголовке соединения в виде бесцветного твердого вещества. Твердое вещество собирали фильтрованием и сушили до постоянной массы, получая указанное в заголовке соединение (15 мг, 0,047 ммоль, 53%).
Пример 35B
метил 3-((2R,4R)-4-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-7-метоксихроман-2-ил)циклогексанкарбоксилат
Указанное в заголовке соединение получали с использованием способов, аналогичных описанным в примере 20D, используя соединение примера 35A вместо соединения примера 20C.1H ЯМР (400 МГц, CDCl3) δ 7,18-7,11 (м, 2H), 7,02 (дд, J=8,2, 1,4 Гц, 1H), 6,87 (д, J=8,6 Гц, 1H), 6,43 (дд, J=8,6, 2,6 Гц, 1H), 6,31 (д, J=2,4 Гц, 1H), 5,31 (д, J=8,8 Гц, 1H), 5,27-5,11 (м, 1H), 3,89 (дд, J=11,4, 5,3 Гц, 1H), 3,73 (с, 3H), 3,67 (с, 3H), 2,39-0,83 (м, 14H); МС (ESI-) m/z 542,2 (M-H)-.
Пример 35C
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]циклогексанкарбоновая кислота
Указанное в заголовке соединение получали с использованием условий, аналогичных условиям, описанным в примере 1, используя соединение из примера 35В вместо соединения из примера 6.1H ЯМР (400 МГц, CDCl3) δ 7,20-7,07 (м, 2H), 7,02 (д, J=8,1 Гц, 1H), 6,87 (д, J=8,6 Гц, 1H), 6,43 (дд, J=8,6, 2,5 Гц, 1H), 6,31 (т, J=1,9 Гц, 1H), 5,34 (д, J=8,7 Гц, 1H), 5,30-5,14 (м, 1H), 3,91 (тд, J=11,5, 5,1 Гц, 1H), 3,73 (с, 3H), 2,41-1,03 (м, 16H); МС (ESI-) m/z 528,3 (M-H)-.
Пример 36
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-фтор-3,4-дигидро-2H-хромен-2-ил]циклогексанкарбоновая кислота
Пример 36A
метил 3-((2R,4R)-4-амино-7-фторхроман-2-ил)циклогексанкарбоксилат
Указанное в заголовке соединение выделяля в виде второго элюированного соединения в результате очистки соединения примера 39E (19 мг, выход 8,0%). ЖХ/МС m/z 532 (M+H)+.
Пример 36B
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-фтор-3,4-дигидро-2H-хромен-2-ил]циклогексанкарбоновая кислота
Соединение примера 36A (19 мг, 0,036 ммоль) и 2 M водный раствор NaOH (0,5 мл) в метаноле (2 мл) перемешивали при 35 (°С) в течение 2 часов. Растворитель удаляли и добавляли воду (1 мл). Значение рН смеси доводили с помощью 2 М HCl до значения pH 1~2. Осажденное белое твердое вещество собирали фильтрованием, промывали водой и сушили с получением указанного в заголовке соединения (14,5 мг, выход 83%).1H ЯМР (501 МГц, CDCl3) δ 7,16 (дт, J=8,2, 1,5 Гц, 1H), 7,12 (кв, J=1,7 Гц, 1H), 7,03 (д, J=8,0 Гц, 1H), 6,92 (т, J=7,5 Гц, 1H), 6,55 (тд, J=8,3, 2,6 Гц, 1H), 6,46 (ддт, J=10,1, 4,8, 2,6 Гц, 1H), 5,37-5,30 (м, 1H), 5,29-5,19 (м, 1H), 3,92 (д, J=11,4 Гц, 1H), 2,35 (с, 1H), 2,23 (дд, J=13,1, 6,2 Гц, 1H), 2,07-1,85 (м, 3H), 1,77-1,60 (м, 4H), 1,35 (дт, J=22,7, 14,4 Гц, 4H), 1,17-1,02 (м, 3H); МС (ESI+) m/z 517,9 (M+H)+.
Пример 37
метил 3-[4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил]бензоат
Пример 37A
метил 3-(3-(2,6-дихлорпиридин-3-ил)-3-оксопропаноил)бензоат
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 24А, используя 2,6-дихлорникотиноил хлорид вместо 3-хлоризоникотиноил хлорида.
Пример 37B
метил 3-(7-хлор-4-оксо-4H-пирано[2,3-b]пиридин-2-ил)бензоат
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 33В, используя соединение из примера 37А вместо соединения из примера 33А.
Пример 37C
метил 3-(7-метокси-4-оксо-4H-пирано[2,3-b]пиридин-2-ил)бензоат
Раствор KOtBu (889 мг, 7,92 ммоль) в метаноле (25 мл) обрабатывали соединением примера 37B (500 мг, 1,584 ммоль) и полученную суспензию перемешивали в течение 10 минут при 100°C. Смесь охлаждали на ледяной бане и сразу же гасили 1 M HCl (20 мл). Смесь разбавляли водой (80 мл) и смесь перемешивали в течение 5 минут. Твердое вещество собирали фильтрованием, промывали водой и сушили в вакууме при 60°C в течение 90 минут, получая указанное в заголовке соединение (420 мг, 1,349 ммоль, выход 85%).
Пример 37D
метил 3-(7-метокси-4-оксо-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил)бензоат
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 33С, используя соединение из примера 37С вместо соединения из примера 33В.1H ЯМР (400 МГц, CDCl3) δ м.д. 8,20 (т, J=1,8 Гц, 1H), 8,16 (д, J=8,5 Гц, 1H), 8,07 (дт, J=7,8, 1,5 Гц, 1H), 7,71 (дт, J=7,8, 1,6 Гц, 1H), 7,52 (т, J=7,8 Гц, 1H), 6,53 (д, J=8,5 Гц, 1H), 5,64 (дд, J=13,3, 3,1 Гц, 1H), 4,00 (с, 3H), 3,94 (с, 3H), 3,09 (дд, J=17,0, 13,3 Гц, 1H), 2,87 (дд, J=16,9, 3,1 Гц, 1H); МС (ESI) m/z 314 (M+H)+.
Пример 37E
метил 3-(7-метокси-4-(метоксиимино)-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил)бензоат
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 33D, используя соединение из примера 37D вместо соединения из примера 33С, получая указанное в заголовке соединение.1H ЯМР (400 МГц, CDCl3) δ м.д. 8,19-8,11 (м, 2H), 8,03 (дт, J=7,8, 1,4 Гц, 1H), 7,70 (дт, J=7,7, 1,4 Гц, 1H), 7,48 (т, J=7,7 Гц, 1H), 6,47 (д, J=8,5 Гц, 1H), 5,26 (дд, J=12,4, 3,1 Гц, 1H), 3,95 (с, 3H), 3,94 (с, 3H), 3,93 (с, 3H), 3,47 (дд, J=17,2, 3,2 Гц, 1H), 2,69 (дд, J=17,1, 12,3 Гц, 1H); МС (ESI) m/z 343 (M+H)+.
Пример 37F
метил 3-(4-амино-7-метокси-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил)бензоат
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 33Е, используя соединение из примера 37Е вместо соединения из примера 33D. МС (ESI) m/z 315 (M+H)+.
Пример 37G
метил 3-[4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил]бензоат
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 24I, используя соединение из примера 37F вместо соединения из примера 24Н. Неочищенный продукт хроматографировали на силикагеле, элюируя 30% этилацетатом в гептанах с получением указанного в заголовке соединения в виде смеси цис- и транс-изомеров.1H ЯМР (400 МГц, CDCl3) δ 8,10-8,05 (м, 1H), 8,04-7,97 (м, 1H), 7,64-7,58 (м, 1H), 7,50-7,38 (м, 1,5H), 7,37-7,32 (м, 0,5H), 7,17-6,97 (м, 3H), 6,43-6,38 (м, 1H), 5,50 (д, J=6,8 Гц, 0,5H), 5,47-5,38 (м, 0,5H), 5,32 (д, J=10,7 Гц, 0,5H), 5,26 (д, J=8,8 Гц, 0,5H), 5,03-4,93 (м, 1H), 3,94 (с, 1,5H), 3,92 (с, 1,5H), 3,88 (с, 3H), 2,48 (дд, J=12,8, 5,4 Гц, 0,5H), 2,29 (д, J=14,4 Гц, 0,5H), 2,19 (ддд, J=14,8, 11,6, 4,4 Гц, 0,5H), 1,93-1,79 (м, 0,5H), 1,77-1,57 (м, 2H), 1,13-1,05 (м, 2H).
Пример 38
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-фтор-3,4-дигидро-2H-хромен-2-ил]бензойная кислота
Смесь соединения из примера 39E (90 мг, 0,171 ммоль) и 2 M водного раствора NaOH (2 мл) в метаноле (6 мл) перемешивали при 35°С в течение 4 часов, растворитель удалили и добавляли воду (1 мл). Смесь доводили до значения pH 1-2 с помощью 2 М HCl и выпавшее в осадок белое твердое вещество промывали водой и сушили с получением указанного в заголовке соединения (64 мг, выход 73,1%).1H ЯМР (400 МГц, CDCl3) δ 8,19 (с, 1H), 8,07 (д, J=7,8 Гц, 1H), 7,64 (д, J=7,9 Гц, 1H), 7,48 (т, J=7,7 Гц, 1H), 7,18-7,07 (м, 2H), 7,02 (дт, J=8,5, 3,4 Гц, 2H), 6,71-6,52 (м, 2H), 5,61-5,44 (м, 1H), 5,40 (д, J=8,9 Гц, 1H), 5,35-5,22 (м, 1H), 2,58 (дд, J=13,2, 6,3 Гц, 1H), 1,79 (дд, J=12,6, 4,9 Гц, 2H), 1,71-1,61 (м, 1H), 1,10 (кв, J=2,2 Гц, 2H); МС (ESI+) m/z 511,9 (M+H)+.
Пример 39
метил 3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-фтор-3,4-дигидро-2H-хромен-2-ил]бензоат
Пример 39A
7-фтор-4H-хромен-4-он
Смесь 1-(4-фтор-2-гидроксифенил)этанона (1, г, 6,49 ммоль) и 1,1-диметокси-N,N-диметилметанамина (0,948 мл, 7,14 ммоль) нагревали при температуре 120°C в течение 2 часов и охлаждали. Осажденное оранжевое твердое вещество отфильтровывали, промывали гептаном и сушили с получением (E)-3-(диметиламино)-1-(4-фтор-2-гидроксифенил)проп-2-ен-1-она, который растворяли в дихлорметане (120 мл) и обрабатывали концентрированной HCl (15 мл). Смесь кипятили с обратным холодильником в течение 2 часов. Удалили водный слой и органический слой промывали насыщенным солевым раствором (50 мл×2). Органические вещества концентрировали и остаток очищали с помощью хроматографии на картридже с силикагелем 80 г, элюируя 5-30% этилацетатом в гептане с получением указанного в заголовке соединения (760 мг, выход 71,4%) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 8,23 (дд, J=9,6, 6,2 Гц, 1H), 7,83 (д, J=6,0 Гц, 1H), 7,19-7,08 (м, 2H), 6,33 (д, J=6,1 Гц, 1H); МС (ESI+) m/z 165 (M+H)+.
Пример 39B
(R)-метил 3-(7-фтор-4-оксохроман-2-ил)бензоат
Смесь бис(2,2,2-трифторацетокси)палладия (136 мг, 0,408 ммоль), (S)-4-(трет-бутил)-2-(пиридин-2-ил)-4,5-дигидрооксазола (100 мг, 0,490 ммоль), гексафторофосфата(V) аммония (399 мг, 2,449 ммоль), (3-(метоксикарбонил)фенил)бороновой кислоты (1102 мг, 6,12 ммоль) и дихлорэтана (10 мл) в сосуде (20 мл) перемешивали в течение 5 минут, и затем добавляли соединение из примера 39A (670 мг, 4,08 ммоль) и воду (0,256 мл, 14,19 ммоль). Сосуд закрывали и смесь перемешивали при 60°С в течение ночи. Смесь фильтровали через слой целита и элюировали этилацетатом. Органические слои удаляли в вакууме и неочищенный материал хроматографировали на картридже с силикагелем 80 г, элюируя этилацетатом в гептане с градиентом 5-40% с получением указанного в заголовке соединения (767 мг, выход 62,6%). ЖХ/МС m/z 300 (M+H)+.
Пример 39C
(R)-метил 3-(7-фтор-4-(метоксиимино)хроман-2-ил)бензоат
Смесь соединения из примера 39B (760 мг, 2,53 ммоль), ацетата натрия (415 мг, 5,06 ммоль) и O-метилгидроксиламина, хлористоводородной кислоты (423 мг, 5,06 ммоль) в метаноле (10 мл) перемешивали при 60°С в течение ночи. Растворитель удаляли под давлением и остаток растворяли в этилацетате и промывали водой, органические слои сушили над MgSO4, фильтровали и концентрировали под давлением. Остаток очищали с помощью хроматографии на картридже с силикагелем 80 г, элюируя этилацетатом в гептане с градиентом 5-35% с получением указанного в заголовке соединения (752 мг, выход 90%) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 8,13 (т, J=1,8 Гц, 1H), 8,04 (дт, J=7,9, 1,5 Гц, 1H), 7,92 (дд, J=8,7, 6,5 Гц, 1H), 7,66 (дт, J=7,8, 1,5 Гц, 1H), 7,50 (т, J=7,7 Гц, 1H), 6,77-6,62 (м, 2H), 5,13 (дд, J=12,4, 3,1 Гц, 1H), 3,98 (с, 3H), 3,94 (с, 3H), 3,49 (дд, J=17,2, 3,1 Гц, 1H), 2,66 (дд, J=17,2, 12,4 Гц, 1H); МС (ESI+) m/z 330 (M+H)+.
Пример 39D
метил 3-((2R,4R)-4-амино-7-фторхроман-2-ил)бензоат
К соединению из примера 39C (300 мг, 0,911 ммоль) в уксусной кислоте (10 мл) добавляли 5% платину на угле (355 мг, 0,091 ммоль). Смесь загружали водородом из баллона и перемешивали при температуре окружающей среды в течение 48 часов, ЖХ/МС показывала, что 2/3 исходного материала превращали в соединение, но было обнаружено восстановленное кольцо бензойной кислоты. Смесь продували азотом, разбавляли этилацетатом и фильтровали через слой целита. Фильтрат концентрировали при пониженном давлении и остаток растворяли в трет-бутилметиловом эфире, затем добавляли по каплям дополнительно 4 M HCl (1 мл). Осажденное белое твердое вещество собирали фильтрованием и сушили с получением указанного в заголовке соединения (153 мг, выход 49,6%), которое содержало приблизительно 12% метил 3-((2R,4R)-4-амино-7-фторхроман-2-ил)циклогексанкарбоксилата.
Пример 39E
метил 3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-фтор-3,4-дигидро-2H-хромен-2-ил]бензоат
Смесь 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоты (108 мг, 0,444 ммоль) и HATU (1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиний 3-оксид гексафторфосфат) (220 мг, 0,577 ммоль) в DMF (3 мл) перемешивали в течение 5 минут, с последующим добавлением соединения из примера 39D (150 мг, 0,48 ммоль), с последующим добавлением N-этил-N-изопропилпропан-2-амина (0,31 мл, 1,78 ммоль). Смесь перемешивали при температуре окружающей среды в течение 2 часов; ЖХ/МС показал, что реакция завершилась. Добавляли этилацетат (20 мл) и воду (10 мл). Смесь was partitioned. Органический слой промывали насыщенным водным раствором NaHCO3 и насыщенным солевым раствором, последовательно, сушили над MgSO4, фильтровали и концентрировали. Остаток очищали с помощью хроматографии на картридже с силикагелем 40 г, элюируя этилацетатом в гептане при градиенте 0-30% с получением указанного в заголовке соединения в качестве первого элюированного соединения (140 мг, выход 60,0%) и соединения примера 36А в качестве второго элюированного соединения.1H ЯМР (400 МГц, CDCl3) δ 8,13-7,91 (м, 2H), 7,57 (дт, J=7,8, 1,5 Гц, 1H), 7,45 (т, J=7,7 Гц, 1H), 7,14-6,99 (м, 4H), 6,69-6,58 (м, 2H), 5,44 (тд, J=10,1, 6,4 Гц, 1H), 5,33 (д, J=8,9 Гц, 1H), 5,23 (дд, J=11,5, 1,9 Гц, 1H), 3,93 (с, 3H), 3,48 (кв, J=7,0 Гц, 1H), 2,50 (ддд, J=13,4, 6,0, 2,0 Гц, 1H), 1,77-1,60 (м, 2H), 1,10-1,06 (м, 2H); МС (ESI+) m/z 525,9 (M+H)+;1H ЯМР и аналитическая хиральная SFC (5-30% метанол:CO2, 10 минут при 3 мл/мин 150 бар, колонка ChiralCel OJ-H) показали, что выделенный продукт представлял собой цис-стереоизомер с чистотой 94% э.и.
Пример 40
rac-N-[(2R,4R)-2-циклопропил-7-метокси-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид
Пример 40A
3-циклопропил-1-(2-гидрокси-4-метоксифенил)проп-2-ен-1-он
К раствору 1 М NaOH (300 мл) добавляли 1-(2-гидрокси-4-метоксифенил)этанон (5 г, 30,1 ммоль), с последующим добавлением циклопропанкарбальдегида (6,33 г, 90 ммоль). Смесь перемешивали в течение 48 часов при температуре окружающей среды. Значение рН смеси доводили до значения рН 5 с помощью 1 М HCl, экстрагировали этилацетатом (100 мл× 3), сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью колоночной хроматографии на силикагеле, элюируя градиентом 15-50% петролейный эфир:этилацетат, с получением указанного в заголовке соединения (1,5 г, 22,84%) в виде белого масла. МС (ESI+) m/z 219 (M+H)+.
Пример 40B
2-циклопропил-7-метоксихроман-4-он
К раствору соединения примера 40A (2 г, 9,16 ммоль) в 200 мл этанола и 10 мл воды добавляли концентрированную HCl (21 мл). Реакционную смесь кипятили с обратным холодильником в течение 16 часов. Этанол удаляли при пониженном давлении и добавляли 50 мл воды. Смесь экстрагировали этилацетатом (50 мл×2). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью колоночной хроматографии на силикагеле, элюируя градиентом 10-15% петролейный эфир:этилацетат с получением указанноегов заголовке соединения (1,4 г, 70,0%) в виде белого твердого вещества.1Н ЯМР (400 МГц, CDCl3) δ 7,80(с, J=8,8 Гц, 1 H), 6,56(дд, J=9,2 Гц, 2,4 Гц, 1H), 6,45(д, J=2,4 Гц, 1 H), 3,83(с, 3 H), 3,69-3,75(м, 1 H), 2,70-2,83(м, 2 H), 1,20-1,26(м, 1 H), 0,71-0,74(м, 2 H), 0,66-0,69(м, 1 H), 0,62-0,64(м, 1 H); МС (ESI+) m/z 219 (M+H)+.
Пример 40C
2-циклопропил-7-метоксихроман-4-он оксим
К раствору соединения из примера 40B (940 мг, 4,31 ммоль) в метаноле (20 мл) добавляли ацетат натрия (424 мг, 5,17 ммоль) и гидрохлорид гидроксиламина (359 мг, 5,17 ммоль). Смесь перемешивали при 40°C в течение 16 часов. Растворитель удаляли при пониженном давлении. Полученное белое твердое вещество собирали фильтрованием, промывали водой (30 мл) и сушили при пониженном давлении с получением указанного в заголовке соединения (980 мг, 86%) в виде белого твердого вещества. МС (ESI+) m/z 234 (M+H)+.
Пример 40D
2-циклопропил-7-метоксихроман-4-амин
Раствор соединения примера 4°C (500 мг, 2,144 ммоль) в растворе аммиака и метанола (50 мл) обрабатывали никелем (126 мг, 2,144 ммоль). Смесь перемешивали при комнатной температуре в атмосфере водорода в течение 5 часов. Смесь фильтровали и концентрировали досуха. К остатку добавляли 1М хлористый водород в эфире и затем органические слои концентрировали с получением гидрохлоридной соли кислоты указанного в заголовке соединения (480 мг, 1,761 ммоль, выход 82%).1Н ЯМР (400 МГц, CD3OD) δ: 7,25-7,29(м, 1 H), 6,43-6,46(м, 1H), 4,48-4,63(м, 1 H), 3,76(д, J=2,4 Гц, 3 H), 3,42-3,53(м, 1 H), 1,88-2,56(м, 2 H), 1,10-1,16(м, 1 H), 0,38-0,71(м, 4 H); МС (ESI+) m/z 203 (M-NH2)+.
Пример 40E
rac-N-[(2R,4R)-2-циклопропил-7-метокси-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид
К 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоте (142 мг, 0,587 ммоль) в дихлорметане (1,5 мл) добавляли половину раствора оксалилдихлорида (0,205 мл, 2,346 ммоль) в дихлорметане (1 мл), затем 1 каплю DMF. Реакционную смесь интенсивно барботировали, затем по каплям добавляли остаток раствора оксалилхлорида. Реакционную смесь перемешивали в течение 30 минут при комнатной температуре, затем растворитель удаляли в токе азота, затем отгоняли 2×1 мл дихлорметана, сушили в потоке азота. Промежуточное соединение обрабатывали дихлорметаном (1,5 мл) и добавляли к смеси продукта из примера 40D (150 мг, 0,587 ммоль) и триэтиламина (0,327 мл, 2,346 ммоль) в дихлорметане (1,5 мл). Смесь перемешивали при комнатной температуре в течение 20 минут. Смесь гасили насыщенным водным бикарбонатом и водный слой удаляли. Органическую фазу концентрировали и полученное масло растворяли в дихлорметане и очищали на картридже с силикагелем 24 г, элюируя градиентом 5-60% этилацетат/гептан за 20 минут, с получением 110 мг смеси диастереомеров. Смесь дополнительно очищали с помощью препаративной сверхкритической флюидной хроматографии, установленной для поддержания противодавления при 100 бар с использованием Lux Cellulose® (21×250 мм, 5 мкм), с образцом при концентрации 25 мг/мл в метаноле с использованием 16% метанола в CO2при скорости потока 70 мл/мин с получением указанного в заголовке соединения (время удерживания=4,4 минуты, 24 мг, 0,054 ммоль, выход 9,23%) и соединения примера 41 (время удерживания=3,7 минуты).1H ЯМР (400 МГц, ДМСО-d6) δ 7,38-7,32 (м, 2H), 7,29 (д, J=8,4 Гц, 1H), 7,16 (дд, J=8,4, 1,7 Гц, 1H), 6,96 (д, J=8,5 Гц, 1H), 6,43 (дд, J=8,5, 2,5 Гц, 1H), 6,33 (д, J=2,5 Гц, 1H), 4,93 (дт, J=8,3, 4,4 Гц, 1H), 3,67 (с, 3H), 3,37 (тд, J=9,2, 2,6 Гц, 1H), 1,89 (дт, J=14,0, 3,3 Гц, 1H), 1,81 (ддд, J=14,0, 9,6, 5,0 Гц, 1H), 1,41-1,31 (м, 2H), 1,08-0,97 (м, 3H), 0,60-0,46 (м, 2H), 0,36-0,28 (м, 1H), 0,14 (дт, J=9,5, 4,6 Гц, 1H); МС (ESI+) m/z 444 (M+H)+.
Пример 41
rac-N-[(2R,4S)-2-циклопропил-7-метокси-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид
Указанное в заголовке соединение (время удерживания=3,7 минуты, 21 мг, 0,047 ммоль, выход 8,07%) выделяли в результате препаративной сверхкритической флюидной хроматографии, как описано в примере 40E.1H ЯМР (400 МГц, ДМСО-d6) δ 7,38-7,32 (м, 2H), 7,29 (д, J=8,4 Гц, 1H), 7,16 (дд, J=8,4, 1,7 Гц, 1H), 6,96 (д, J=8,5 Гц, 1H), 6,43 (дд, J=8,5, 2,5 Гц, 1H), 6,33 (д, J=2,5 Гц, 1H), 4,93 (дт, J=8,3, 4,4 Гц, 1H), 3,67 (с, 3H), 3,37 (тд, J=9,2, 2,6 Гц, 1H), 1,89 (дт, J=14,0, 3,3 Гц, 1H), 1,81 (ддд, J=14,0, 9,6, 5,0 Гц, 1H), 1,41-1,31 (м, 2H), 1,08-0,97 (м, 3H), 0,60-0,46 (м, 2H), 0,36-0,28 (м, 1H), 0,14 (дт, J=9,5, 4,6 Гц, 1H); МС (ESI+) m/z 444 (M+H)+.
Пример 42
4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2H-хромен-7-карбоновая кислота
К суспензии продукта из примера 45 (25 мг, 0,058 ммоль) в тетрагидрофуране (193 мкл) и воды (97 мкл) добавляли гидроксид лития (2,8 мг, 0,117 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Растворитель удаляли в потоке азота и реакцию гасили 10 каплями 1 н HCl. Этот неочищенный материал хроматографировали непосредственно на 4 г картридже с силикагелем, элюируя градиентом 5-100% этилацетат/гептан с получением указанного в заголовке соединения (10 мг, 0,024 ммоль, выход 41,3%) в виде белого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ 7,45-7,37 (м, 3H), 7,31 (д, J=8,3 Гц, 1H), 7,23-7,18 (м, 2H), 7,12 (д, J=8,1 Гц, 1H), 5,11 (кв, J=7,9 Гц, 1H), 4,24-4,10 (м, 2H), 2,02-1,85 (м, 2H), 1,48 (ддд, J=9,8, 6,0, 2,9 Гц, 1H), 1,37 (ддд, J=8,6, 5,9, 2,9 Гц, 1H), 1,05 (дтдд, J=12,6, 9,3, 6,2, 3,3 Гц, 2H). МС (ESI+) m/z 418 (M+H)+.
Пример 43
3-({3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метил-3,4-дигидро-2H-хромен-2-ил]бензоил}амино)-1-метилциклопентанкарбоновая кислота
Пример 43A
этил 3-(3-((2R,4R)-4-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-7-метилхроман-2-ил)бензамидо)-1-метилциклопентанкарбоксилат
В 4 мл сосуде, добавляли 300 мкл исходного раствора, содержащего соединение примера 16 (0,13 M, 0,039 ммоль, 1,0 экв.) и диизопропилэтиламин (0,39 M, 0,12 ммоль, 3,0 эквивалента) в диметилацетамиде к исходному раствору, содержащему 2-(3H-[1,2,3]триазоло[4,5-b]пиридин-3-ил)-1,1,3,3-тетраметилизоурония гексафторфосфат(V) (0,15 M в диметилацетамиде, 300 мкл, 0,046 ммоль, 1,2 эквивалента). Добавляли исходный раствор этил 3-амино-1-метилциклопентанкарбоксилата (0,40 M в диметилацетамиде, 145 мкл, 0,058 ммоль, 1,5 эквивалента) и реакционную смесь перемешивали при комнатной температуре до полного завершения, как определяли ЖХ. Сосуд загружали непосредственно в автоматический дозатор Gilson GX-271 и очищали с использованием препаративного способа ЖХ TFA8 с получением указанного в заголовке соединения.
Пример 43B
3-({3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метил-3,4-дигидро-2H-хромен-2-ил]бензоил}амино)-1-метилциклопентанкарбоновая кислота
Соединение примера 43A растворяли в метаноле (1 мл). Добавляли исходный раствор гидроксида калия (4,0 M в воде, 100 мкл) и реакционную смесь нагревали при 50°C в течение 30 минут, после чего реакцию признавали завершенной при помощи ЖХ. Растворитель удаляли в потоке азота и остаток восстанавливали в ацетонитриле (600 мкл) и 4 М HCl в диоксане (400 мкл). Сосуд загружали непосредственно в автоматический дозатор Gilson GX-271 и очищали с использованием способа препаративной ЖХ TFA6, получая указанное в заголовке соединение (15,7 мг, выход 66%).1H ЯМР (400 МГц, 90°C, ДМСО-d6:D2O=9:1 (об/об)) δ 7,88-7,79 (м, 1H), 7,76 (дт, J=7,7, 1,5 Гц, 1H), 7,55 (дт, J=7,6, 1,4 Гц, 1H), 7,46 (т, J=7,7 Гц, 1H), 7,32 (д, J=1,6 Гц, 1H), 7,27-7,15 (м, 2H), 6,95-6,86 (м, 2H), 6,71 (дд, J=7,7, 1,7 Гц, 1H), 6,65-6,61 (м, 2H), 5,38-5,18 (м, 2H), 4,33 (п, J=7,7 Гц, 1H), 2,50-2,44 (м, 1H), 2,26-2,12 (м, 4H), 2,11-1,97 (м, 3H), 1,76-1,61 (м, 2H), 1,55-1,45 (м, 2H), 1,42-1,36 (м, 1H), 1,30 (с, 3H), 1,12-1,00 (м, 2H); МС (APCI+) m/z 633,5 (M+H)+.
Пример 44
(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-2-(3-метоксифенил)-3,4-дигидро-2H-хромен-6-карбоновая кислота
Указанное в заголовке соединение получали с использованием условий, аналогичных условиям, описанным в примере 1, используя соединение из примера 47Е вместо соединения из примера 6.1H ЯМР (400 МГц, CDCl3) δ 8,00-7,84 (м, 2H), 7,29 (т, J=7,9 Гц, 1H), 7,21 (д, J=8,3 Гц, 1H), 7,14 (с, 1H), 7,03 (д, J=8,2 Гц, 1H), 6,98-6,81 (м, 4H), 5,50 (кв, J=8,9 Гц, 1H), 5,40 (д, J=8,9 Гц, 1H), 5,26 (д, J=11,1 Гц, 1H), 3,81 (с, 3H), 2,61-2,46 (м, 1H), 1,92-1,74 (м, 2H), 1,63 (д, J=6,3 Гц, 1H), 1,16-1,07 (м, 2H), МС (ESI+) m/z 524 (M+H)+.
Пример 45
метил 4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2H-хромен-7-карбоксилат
В 50 мл сосуд для реакций под давлением загружали соединение из примера 56 (40 мг, 0,088 ммоль), Pd-dppf (Heraeus) (1,294 мг, 1,769 мкмоль), DMF (2 мл), метанол (2 мл) и триэтиламин (0,025 мл, 0,177 ммоль). Реакционную смесь несколько раз дегазировали аргоном, затем моноксидом углерода. Смесь нагревали при 100°С в течение 16 часов при давлении 70 фунт/квад.дюйм моноксида углерода. К реакционной смеси добавляли DMF (2 мл) и свежий катализатор, дегазировали аргоном и монооксидом углерода, и смесь нагревали в течение 16 часов при 100°С при давлении 70 фунт/кв.дюйм моноксид углерода. Растворитель удаляли при пониженном давлении с получением коричневого масла. Остаток гасили водой, получая коричневое твердое вещество. Водный слой удаляли и полученное твердое вещество растворяли в дихлорметане и хроматографировали на картридже с силикагелем 12 г, элюируя градиентом 5-100% этилацетат/гептан в течение 20 минут с получением указанного в заголовке соединения (32 мг, 0,074 ммоль, выход 84%) в виде белого твердого вещества.1H ЯМР (501 МГц, ДМСО-d6) δ 7,47-7,38 (м, 3H), 7,31 (д, J=8,3 Гц, 1H), 7,25-7,19 (м, 2H), 7,16 (дд, J=8,0, 1,0 Гц, 1H), 5,12 (тд, J=8,6, 6,0 Гц, 1H), 4,22 (ддд, J=11,2, 5,1, 3,7 Гц, 1H), 4,16 (ддд, J=11,5, 9,5, 2,9 Гц, 1H), 3,80 (с, 3H), 2,03-1,86 (м, 2H), 1,48 (ддд, J=9,9, 6,1, 3,1 Гц, 1H), 1,37 (ддд, J=9,2, 6,2, 3,2 Гц, 1H), 1,05 (дтдд, J=12,8, 9,4, 6,4, 3,4 Гц, 2H); МС (ESI+) m/z 432 (M+H)+.
Пример 46
метил (2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-2-(3-метоксициклогексил)-3,4-дигидро-2H-хромен-6-карбоксилат
Пример 46A
(2R,4R)-метил 4-амино-2-(3-метоксициклогексил)хроман-6-карбоксилат
Указанное в заголовке соединение получали из соединения примера 47D в качестве побочного продукта восстановления.
Пример 46B
метил (2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-2-(3-метоксициклогексил)-3,4-дигидро-2H-хромен-6-карбоксилат
Указанное в заголовке соединение получали в соответствии с получением соединения примера 47E, используя соединение примера 46A вместо соединения примера 47D (17 мг, 0,031 ммоль, выход 21,78%).1H ЯМР (501 МГц, CDCl3) δ 7,79 (дд, J=8,4, 2,2 Гц, 1H), 7,73 (дд, J=2,1, 1,1 Гц, 1H), 7,22 (дт, J=8,3, 1,3 Гц, 1H), 7,18 (д, J=1,7 Гц, 1H), 7,04 (д, J=8,2 Гц, 1H), 6,78 (дд, J=8,6, 1,7 Гц, 1H), 5,35 (д, J=8,9 Гц, 1H), 5,28 (тд, J=10,2, 9,0, 5,9 Гц, 1H), 4,03 (дддд, J=15,8, 11,7, 5,2, 1,6 Гц, 1H), 3,90 (с, 3H), 3,36 (д, J=3,6 Гц, 3H), 3,15 (ткв, J=11,0, 4,4 Гц, 1H), 2,30-2,26 (м, 1H), 2,11-2,05 (м, 1H), 1,83 (дддд, J=30,6, 10,1, 6,9, 3,5 Гц, 3H), 1,72-1,61 (м, 3H), 1,30-1,23 (м, 2H), 1,16-1,02 (м, 5H); МС (ESI+) m/z 544 (M+H)+.
Пример 47
метил (2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-2-(3-метоксифенил)-3,4-дигидро-2H-хромен-6-карбоксилат
Пример 47A
(R)-6-бром-2-(3-метоксифенил)хроман-4-он
В 20 мл сосуд загружали бис(2,2,2-трифторацетокси)палладий (0,295 г, 0,889 ммоль), (S)-4-(трет-бутил)-2-(пиридин-2-ил)-4,5-дигидрооксазол (0,218 г, 1,066 ммоль), гексафторфосфат(V) аммония (0,869 г, 5,33 ммоль) и (3-(метоксифенил)бороновую кислоту (2,70 г, 17,77 ммоль), перемешивали в дихлорэтане (5 мл) в течение 5 минут и наблюдали бледно-желтый цвет. К этой суспензии добавляли 6-бром-4H-хромен-4-он (CAS 51483-92-2) (2,0 г, 8,89 ммоль) и воду (0,256 мл, 14,19 ммоль) и боковые стороны сосуда промывали большим количеством дихлорэтана (5 мл). Сосуд закрывали и смесь перемешивали при 60°С в течение 16 часов. Смесь фильтровали через слой силикагеля и целит и элюировали этилацетатом с получением раствора светло-желтого цвета. Растворитель удаляли при пониженном давлении и неочищенный материал хроматографировали на 40 г картридже с силикагелем, элюируя градиентом 5-50% этилацетат/гептан с получением указанного в заголовке соединения (2,10 г, 6,30 ммоль, выход 70,9%).1H ЯМР (400 МГц, CDCl3) δ 8,04 (д, J=2,6 Гц, 1H), 7,58 (дд, J=8,9, 2,6 Гц, 1H), 7,35 (т, J=8,0 Гц, 1H), 7,08-6,87 (м, 4H), 5,45 (дд, J=13,1, 3,1 Гц, 1H), 3,84 (с, 3H), 3,07 (дд, J=17,0, 13,1 Гц, 1H), 2,91 (дд, J=17,0, 3,1 Гц, 1H).
Пример 47B
(R)-метил 2-(3-метоксифенил)-4-оксохроман-6-карбоксилат
В 250 мл сосуд из нержавеющей стали для реакций под давлением загружали соединение примера 47А (2,0 г, 6,00 ммоль), Pd-dppf (Heraeus) (0,088 г, 0,120 ммоль), метанол (20 мл) и триэтиламин (1,673 мл, 12,01 ммоль). Реактор несколько раз дегазировали аргоном, затем монооксидом углерода и реакционную смесь нагревали до 100°С в течение 16 часов при давлении 60 фунт/кв.дюйм монооксида углерода. К реакционной смеси добавляли DMF (2 мл) и свежий катализатор, дегазировали аргоном и монооксидом углерода, и смесь нагревали в течение 16 часов при 100°С при давлении 60 фунт/кв.дюйм монооксида углерода. Реакционную смесь фильтровали и растворитель удаляли при пониженном давлении. Неочищенный продукт очищали на картридже с силикагелем 40 г, элюируя смесью 5-30% гептана в этилацетате в течение 40 минут, с получением указанного в заголовке соединения (450 мг, 1,441 ммоль, выход 24,00%).1H ЯМР (400 МГц, CDCl3) δ 8,63 (д, J=2,2 Гц, 1H), 8,18 (дд, J=8,7, 2,3 Гц, 1H), 7,36 (дд, J=8,7, 7,2 Гц, 1H), 7,11 (д, J=8,7 Гц, 1H), 7,08-7,00 (м, 2H), 6,97-6,89 (м, 1H), 5,52 (дд, J=13,1, 3,0 Гц, 1H), 3,92 (с, 3H), 3,85 (с, 3H), 3,11 (дд, J=16,9, 13,0 Гц, 1H), 2,95 (дд, J=17,0, 3,1 Гц, 1H); МС (ESI+) m/z 313 (M+H)+.
Пример 47C
(R)-метил 4-(метоксиимино)-2-(3-метоксифенил)хроман-6-карбоксилат
Смесь соединения из примера 47B (450 мг, 1,441 ммоль), ацетат натрия (236 мг, 2,88 ммоль) и O-метилгидроксиламин соль соляной кислоты (120 мг, 1,441 ммоль) в метаноле (10 мл) перемешивали при 60°С в течение 16 часов. Растворитель упаривали при пониженном давлении и остаток растворяли в этилацетате, и промывали водой. Органическую фазу сушили над сульфатом магния, фильтровали и концентрировали. Неочищенный материал очищали способом препаративной ЖХ AA2 с получением указанного в заголовке соединения (204 мг, 0,598 ммоль, выход 41,5%).1H ЯМР (400 МГц, CDCl3) δ 8,63 (д, J=2,2 Гц, 1H), 7,95 (дд, J=8,6, 2,2 Гц, 1H), 7,33 (т, J=7,9 Гц, 1H), 7,06-6,97 (м, 3H), 6,94-6,85 (м, 1H), 5,09 (дд, J=12,3, 3,1 Гц, 1H), 4,01 (с, 3H), 3,91 (с, 3H), 3,83 (с, 3H), 3,54-3,46 (м, 1H), 2,70 (дд, J=17,2, 12,3 Гц, 1H); МС (ESI+) m/z 342 (M+H)+.
Пример 47D
(2R,4R)-метил 4-амино-2-(3-метоксифенил)хроман-6-карбоксилат
К смеси соединения из примера 47C (204 мг, 0,598 ммоль) в уксусной кислоте (3 мл) добавляли оксид платины(IV) (13,57 мг, 0,060 ммоль). Смесь продували водородом и перемешивали при температуре окружающей среды в течение 18 часов. Растворитель упаривали при пониженном давлении и остаток растворяли в этилацетате, и затем промывали водой. Органическую фазу сушили над сульфатом магния, фильтровали и концентрировали. Неочищенный материал очищали способом препаративной ЖХ AA2 с получением указанного в заголовке соединения (105 мг, 0,335 ммоль, выход 56,1%) в виде белого твердого вещества, ЖХ/МС m/z 297 (M-NH2)+; и соединения примера 46A (42 мг, 0,131 ммоль, выход 22,00%). ЖХ/МС m/z 303 (M-NH2)+.
Пример 47E
метил (2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-2-(3-метоксифенил)-3,4-дигидро-2H-хромен-6-карбоксилат
К 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоте (34,8 мг, 0,144 ммоль) в DMF (3 мл) добавляли HATU (1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиний 3-оксид гексафторфосфат) (82 мг, 0,215 ммоль). Смесь перемешивали в течение 5 минут, и затем добавляли соединение из примера 47D (45 мг, 0,144 ммоль), с последующим добавлением N-этил-N-изопропилпропан-2-амина (0,100 мл, 0,574 ммоль). Смесь перемешивали при температуре окружающей среды в течение 2 часов. Реакционную смесь очищали на картридже с силикагелем 12 г и элюировали градиентом 5-100% этилацетат/гептан в течение 20 минут с получением указанного в заголовке соединения (45 мг, 0,084 ммоль, выход 58,3%).1H ЯМР (400 МГц, CDCl3) δ 7,91-7,75 (м, 2H), 7,29 (д, J=7,8 Гц, 1H), 7,18 (дд, J=8,1, 1,7 Гц, 1H), 7,13 (д, J=1,7 Гц, 1H), 7,02 (д, J=8,2 Гц, 1H), 6,97-6,83 (м, 4H), 5,46 (тд, J=10,1, 6,0 Гц, 1H), 5,36 (д, J=8,9 Гц, 1H), 5,23 (дд, J=11,5, 2,0 Гц, 1H), 3,92 (с, 3H), 3,80 (с, 3H), 2,52 (ддд, J=13,3, 5,9, 2,1 Гц, 1H), 1,89-1,75 (м, 2H), 1,67-1,59 (м, 1H), 1,10 (дтд, J=9,5, 6,5, 3,2 Гц, 2H); МС (ESI+) m/z 537,9 (M+H)+.
Пример 48
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метил-3,4-дигидро-2H-хромен-2-ил]-N-[(2R)-2,3-дигидроксипропил]бензамид
Пример 48A
3-((2R,4R)-4-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-7-метилхроман-2-ил)-N-(((R)-2,2-диметил-1,3-диоксолан-4-ил)метил)бензамид
В 4 мл сосуде, 300 мкл исходного раствора, содержащего соединение примера 16 (0,13 М, 0,039 ммоль, 1,0 эквивалент) и диизопропилэтиламин (0,39 М, 0,12 ммоль, 3,0 эквивалента) В диметилацетамиде добавляли к исходному раствору, содержащему 2- (3H-[1,2,3]триазоло[4,5-b]пиридин-3-ил)-1,1,3,3-тетраметилизоурония гексафторфосфат(V) (0,15 M в диметилацетамиде, 300 мкл, 0,046 ммоль, 1,2 эквивалента). Добавляли исходный раствор (R)-(2,2-диметил-1,3-диоксолан-4-ил)метанамина (0,40 M в диметилацетамиде, 145 мкл, 0,058 ммоль, 1,5 эквивалента) и реакционную смесь перемешивали при комнатной температуре до полного завершения, как определяли ЖХ. Материал загружали непосредственно в автоматический дозатор Gilson GX-271 и очищали с использованием способа препаративной ЖХ TFA8 с получением указанного в заголовке соединения.
Пример 48B
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метил-3,4-дигидро-2H-хромен-2-ил]-N-[(2R)-2,3-дигидроксипропил]бензамид
Соединение примера 48A растворяли в ацетонитриле (3 мл). Добавляли трифторуксусную кислоту (100 мкл) и реакцию немедленно считали завершенной с помощью ЖХ. Материал загружали непосредственно в автоматический дозатор Gilson GX-271 и очищали с использованием способа препаративной ЖХ TFA8 с получением указанного в заголовке соединения (25,3 мг, выход 94%).1H ЯМР (400 МГц, 90°C, ДМСО-d6:D2O=9:1 (об/об)) δ 7,87 (т, J=1,7 Гц, 1H), 7,78 (дт, J=7,7, 1,5 Гц, 1H), 7,61-7,52 (м, 1H), 7,47 (т, J=7,7 Гц, 1H), 7,31 (д, J=1,6 Гц, 1H), 7,27-7,15 (м, 2H), 6,92 (д, J=7,7 Гц, 1H), 6,71 (дд, J=7,7, 1,7 Гц, 1H), 6,68-6,60 (м, 1H), 5,37-5,19 (м, 2H), 3,77-3,63 (м, 1H), 3,51-3,37 (м, 3H), 3,33-3,28 (м, 1H), 2,25-2,16 (м, 4H), 2,13-2,03 (м, 1H), 1,53-1,46 (м, 1H), 1,43-1,36 (м, 1H), 1,15-0,97 (м, 2H); МС (APCI+) m/z 581,5 (M+H)+.
Пример 49
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2R,4R)-2-(3-{[(3R)-3-гидроксипирролидин-1-ил]карбонил}фенил)-7-метил-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
В 4 мл сосуде, 300 мкл исходного раствора, содержащего соединение примера 16 (0,13 M, 0,039 ммоль, 1,0 эквивалент) и диизопропилэтиламин (0,39 M, 0,12 ммоль, 3,0 эквивалента) в диметилацетамиде добавляли к исходному раствору, содержащему 2-(3H-[1,2,3]триазоло[4,5-b]пиридин-3-ил)-1,1,3,3-тетраметилизоуроний гексафторфосфат(V) (0,15 M в диметилацетамиде, 300 мкл, 0,046 ммоль, 1,2 эквивалента). Добавляли исходный раствор (R)-пирролидин-3-ола (0,40 M в диметилацетамиде, 145 мкл, 0,058 ммоль, 1,5 эквивалента) и реакционную смесь перемешивали при комнатной температуре до полного завершения, как определяли ЖХ. Материал загружали непосредственно в автоматический дозатор Gilson GX-271 и очищали с использованием препаративной ЖХ AA8 с получением указанного в заголовке соединения (21,7 мг, выход 97%).1H ЯМР (400 МГц, 90°C, ДМСО-d6:D2O=9:1 (об/об)) δ 7,56-7,40 (м, 4H), 7,31 (д, J=1,6 Гц, 1H), 7,27-7,15 (м, 2H), 6,91 (д, J=8,0 Гц, 1H), 6,71 (дд, J=7,7, 1,7 Гц, 1H), 6,63 (д, J=1,6 Гц, 1H), 5,36-5,19 (м, 2H), 4,30 (с, 1H), 3,67-3,37 (м, 2H), 2,24-2,14 (м, 4H), 2,12-2,03 (м, 1H), 1,96 (дп, J=13,0, 5,3, 4,7 Гц, 1H), 1,83 (тт, J=9,2, 3,9 Гц, 1H), 1,54-1,46 (м, 1H), 1,43-1,36 (м, 1H), 1,11-0,98 (м, 2H); МС (APCI+) m/z 577,4 (M+H)+.
Пример 50
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метил-3,4-дигидро-2H-хромен-2-ил]-N-(3,3,3-трифтор-2-гидроксипропил)бензамид
Соединение примера 50 получали в соответствии со способом получения соединения примера 49, используя 3-амино-1,1,1-трифторпропан-2-ол вместо (R)-пирролидин-3-ола (23,1 мг, выход 97%).1H ЯМР (400 МГц, 90°С, ДМСО-d6:D2O=9:1 (об/об)) δ 7,90 (т, J=1,8 Гц, 1H), 7,88-7,76 (м, 1H), 7,60 (д, J=7,7 Гц, 1H), 7,51 (т, J=7,7 Гц, 1H), 7,34 (д, J=1,6 Гц, 1H), 7,30-7,18 (м, 2H), 6,94 (д, J=7,7 Гц, 1H), 6,79-6,71 (м, 1H), 6,66 (с, 1H), 5,39-5,22 (м, 2H), 4,25 (пд, J=7,5, 4,6 Гц, 1H), 3,67 (дд, J=13,9, 4,7 Гц, 1H), 3,44 (дд, J=14,0, 7,6 Гц, 1H), 2,25 (с, 4H), 2,15-2,05 (м, 1H), 1,57-1,49 (м, 1H), 1,45-1,37 (м, 1H), 1,17-1,00 (м, 2H); МС (APCI+) m/z 619,4 (M+H)+.
Пример 51
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метил-3,4-дигидро-2H-хромен-2-ил]-N-(2-гидрокси-2-метилпропил)бензамид
Соединение примера 51 получали в соответствии со способом получения соединения примера 49, используя 1-амино-2-метилпропан-2-ол вместо (R)-пирролидин-3-ола (19,1 мг, выход 86%).1H ЯМР (400 МГц, 90°C, ДМСО-d6:D2O=9:1 (об/об)) δ 7,90 (т, J=1,8 Гц, 1H), 7,81 (дт, J=7,6, 1,6 Гц, 1H), 7,62-7,56 (м, 1H), 7,50 (т, J=7,7 Гц, 1H), 7,34 (д, J=1,5 Гц, 1H), 7,29-7,20 (м, 2H), 6,94 (д, J=7,8 Гц, 1H), 6,74 (дд, J=7,6, 1,7 Гц, 1H), 6,66 (д, J=1,7 Гц, 1H), 5,39-5,22 (м, 2H), 3,32 (с, 2H), 2,29-2,19 (м, 4H), 2,16-2,05 (м, 1H), 1,56-1,49 (м, 1H), 1,46-1,38 (м, 1H), 1,17 (с, 6H), 1,12-1,01 (м, 2H); МС (APCI+) m/z 579,5 (M+H)+.
Пример 52
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2R,4R)-2-(3-{[3-(гидроксиметил)пиперидин-1-ил]карбонил}фенил)-7-метил-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
Соединение примера 52 получали в соответствии со способом получения соединения примера 49, используя пиперидин-3-илметанол вместо (R)-пирролидин-3-ола (23,0 мг, выход 99%).1H ЯМР (400 МГц, 90°С, ДМСО-d6:D2O=9:1 (об/об)) δ 7,55-7,39 (м, 3H), 7,38-7,17 (м, 4H), 6,94 (д, J=7,9 Гц, 1H), 6,78-6,70 (м, 1H), 6,70-6,61 (м, 1H), 5,38-5,20 (м, 2H), 4,22-3,71 (м, 2H), 3,40-3,32 (м, 1H), 3,03-2,91 (м, 1H), 2,78 (дд, J=13,0, 10,1 Гц, 1H), 2,28-2,15 (м, 4H), 2,15-2,01 (м, 2H), 1,84-1,74 (м, 1H), 1,74-1,59 (м, 2H), 1,56-1,48 (м, 1H), 1,48-1,36 (м, 2H), 1,36-1,22 (м, 1H), 1,17-1,00 (м, 2H); МС (APCI+) m/z 605,5 (M+H)+.
Пример 53
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2R,4R)-2-(3-{[2-(гидроксиметил)морфолин-4-ил]карбонил}фенил)-7-метил-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
Соединение примера 53 получали в соответствии со способом получения соединения примера 49, используя морфолин-2-илметанол вместо (R)-пирролидин-3-ола (16,5 мг, выход 70%).1H ЯМР (400 МГц, 90°С, ДМСО-d6:D2O=9:1 (об/об)) δ 7,55-7,44 (м, 4H), 7,38 (дт, J=7,1, 1,8 Гц, 1H), 7,34 (д, J=1,6 Гц, 1H), 7,29-7,20 (м, 2H), 6,94 (д, J=7,7 Гц, 1H), 6,76-6,70 (м, 1H), 6,66 (с, 1H), 5,36-5,23 (м, 2H), 4,11-3,92 (м, 1H), 3,92-3,75 (м, 2H), 3,58-3,35 (м, 4H), 3,19-3,05 (м, 1H), 2,94-2,84 (м, 1H), 2,27-2,16 (м, 4H), 2,13-2,05 (м, 1H), 1,56-1,49 (м, 1H), 1,46-1,39 (м, 1H), 1,15-1,02 (м, 2H); МС (APCI+) m/z 607,5 (M+H)+.
Пример 54
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метил-3,4-дигидро-2H-хромен-2-ил]-N-[(1-гидроксициклобутил)метил]бензамид
Соединение примера 54 получали в соответствии со способом получения соединения примера 49, используя 1-(аминометил)циклобутанол вместо (R)-пирролидин-3-ола (21,7 мг, выход 95%).1H ЯМР (400 МГц, 90°C, ДМСО-d6:D2O=9:1 (об/об)) δ 7,90 (т, J=1,7 Гц, 1H), 7,81 (дт, J=7,7, 1,5 Гц, 1H), 7,59 (дт, J=7,8, 1,5 Гц, 1H), 7,50 (т, J=7,7 Гц, 1H), 7,34 (д, J=1,5 Гц, 1H), 7,29-7,17 (м, 2H), 6,94 (д, J=7,9 Гц, 1H), 6,74 (дд, J=7,9, 1,8 Гц, 1H), 6,66 (д, J=1,6 Гц, 1H), 5,39-5,22 (м, 2H), 3,48 (с, 2H), 2,29-2,18 (м, 4H), 2,16-2,05 (м, 3H), 2,01-1,92 (м, 2H), 1,78-1,65 (м, 1H), 1,62-1,46 (м, 2H), 1,46-1,37 (м, 1H), 1,14-1,02 (м, 2H); МС (APCI+) m/z 591,5 (M+H)+.
Пример 55
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2R,4R)-2-(3-{[3-(гидроксиметил)-3-метилазетидин-1-ил]карбонил}фенил)-7-метил-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
Соединение примера 54 получали в соответствии со способом получения соединения примера 49, используя (3-метилазетидин-3-ил)метанол вместо (R)-пирролидин-3-ола, и очищали методом препаративной ЖХ AA7 (22,6 мг, выход 99%).1H ЯМР (400 МГц, 90°С, ДМСО-d6:D2O=9:1 (об/об)) δ 7,70-7,65 (м, 1H), 7,57 (ддт, J=11,8, 7,9, 1,6 Гц, 2H), 7,48 (т, J=7,6 Гц, 1H), 7,33 (д, J=1,6 Гц, 1H), 7,28-7,19 (м, 2H), 6,94 (д, J=7,9 Гц, 1H), 6,73 (дд, J=7,9, 1,7 Гц, 1H), 6,68-6,64 (м, 1H), 5,36-5,24 (м, 2H), 4,08-3,93 (м, 2H), 3,85-3,66 (м, 2H), 3,43 (с, 2H), 2,29-2,16 (м, 4H), 2,16-2,05 (м, 1H), 1,56-1,48 (м, 1H), 1,46-1,38 (м, 1H), 1,24 (с, 3H), 1,16-1,00 (м, 2H); МС (APCI+) m/z 591,5 (M+H)+.
Пример 56
N-(7-бром-3,4-дигидро-2H-хромен-4-ил)-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид
Пример 56A
7-бромхроман-4-он оксим
7-бромхроман-4-он (CAS 18442-22-3, 0,523 г, 2,303 ммоль) обрабатывали гидрохлоридом гидроксиламина (0,192 г, 2,76 ммоль) и ацетатом натрия (0,227 г, 2,76 ммоль) в этаноле (5 мл). Реакционную смесь перемешивали при температуре 30°C в течение 16 часов, затем при 100°C в течение 100 часов. Растворитель удаляли в потоке азота и неочищенный материал растирали с водой, фильтровали, промывали водой и сушили с получением указанного в заголовке соединения (0,429 г, 1,772 ммоль, выход 77%) в виде белого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ 11,36 (с, 1H), 7,70 (д, J=8,1 Гц, 1H), 7,17-7,09 (м, 2H), 4,20 (т, J=6,2 Гц, 2H), 2,83 (т, J=6,2 Гц, 2H).
Пример 56B
7-бромхроман-4-амин
Раствор соединения из примера 56A (360 мг, 1,487 ммоль) в тетрагидрофуране (20 мл) добавляли к Ra-Ni 2800, водной суспензии (194 мг, 1,487 ммоль) в 50 мл сосуде для реакций под давлением. Смесь встряхивали в течение 32 часов при давлении водорода 30 фунт/кв.дюйм и при комнатной температуре. Реакционную смесь фильтровали и растворитель удаляли с получением указанного в заголовке соединения.1H ЯМР (400 МГц, ДМСО-d6) δ 7,33 (д, J=8,2 Гц, 1H), 7,03 (дд, J=8,3, 2,1 Гц, 1H), 6,93 (д, J=2,2 Гц, 1H), 4,25 (ддд, J=11,2, 8,3, 2,9 Гц, 1H), 4,16 (ддд, J=10,8, 6,8, 3,4 Гц, 1H), 3,89 (д, J=5,7 Гц, 1H), 2,00 (дкв, J=9,1, 4,3 Гц, 1H), 1,75 (дтд, J=13,4, 6,4, 3,0 Гц, 1H).
Пример 56C
N-(7-бром-3,4-дигидро-2H-хромен-4-ил)-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид
К 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоте (80 мг, 0,330 ммоль) в DMF (826 мкл) добавляли HATU (1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиний 3-оксид гексафторфосфат) (163 мг, 0,429 ммоль). Смесь перемешивали в течение 5 минут, и затем добавляли соединение из примера 56B (75 мг, 0,330 ммоль), с последующим добавлением по каплям триэтиламина (184 мкл, 1,321 ммоль). Через 45 минут смесь гасили водой, водный слой удаляли, полученное масло растворяли в дихлорметане и очищали на картридже с силикагелем 12 г, элюируя градиентом 5-100% этилацетат/гептан, получая указанное в заголовке соединение (120 мг, 0,265 ммоль, выход 80%) в виде белого твердого вещества.1H ЯМР (501 МГц, ДМСО-d6) δ 7,39 (д, J=1,7 Гц, 1H), 7,36 (д, J=8,5 Гц, 1H), 7,31 (д, J=8,3 Гц, 1H), 7,19 (дд, J=8,3, 1,8 Гц, 1H), 7,01 (дд, J=8,3, 2,0 Гц, 1H), 6,96 (дд, J=8,2, 0,9 Гц, 1H), 6,91 (д, J=1,9 Гц, 1H), 5,01 (тд, J=8,2, 6,0 Гц, 1H), 4,20-4,09 (м, 2H), 1,97-1,84 (м, 2H), 1,48-1,42 (м, 1H), 1,36 (ддд, J=8,7, 5,9, 3,0 Гц, 1H), 1,04 (дтдд, J=12,7, 9,4, 6,3, 3,2 Гц, 2H); МС (ESI-) m/z 450 (M-H)-.
Пример 57
rac-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2R,4R)-7-метокси-2-(пиридин-3-ил)-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
Указанное в заголовке соединение выделяли в результате препаративной сверхкритической флюидной хроматографии с временем удерживания, равным 5,1 минуты, как описано в примере 22E.1H ЯМР (400 МГц, ДМСО-d6) δ 8,63 (д, J=2,3 Гц, 1H), 8,55 (дд, J=4,7, 1,6 Гц, 1H), 7,80 (дт, J=8,1, 1,9 Гц, 1H), 7,43 (дд, J=7,9, 4,8 Гц, 1H), 7,40 (д, J=1,7 Гц, 1H), 7,32 (д, J=8,3 Гц, 1H), 7,21 (дд, J=8,3, 1,8 Гц, 1H), 7,17 (д, J=8,9 Гц, 1H), 6,96 (д, J=8,3 Гц, 1H), 6,53 (дд, J=8,6, 2,6 Гц, 1H), 6,40 (д, J=2,5 Гц, 1H), 5,41-5,29 (м, 2H), 3,69 (с, 3H), 2,18-2,03 (м, 2H), 1,53-1,45 (м, 1H), 1,42-1,35 (м, 1H), 1,11-1,02 (м, 2H); МС (ESI+) m/z 481 (M+H)+.
Пример 58
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-{(2R)-2-[3-(гидроксиметил)фенил]-3,4-дигидро-2H-хромен-4-ил}циклопропанкарбоксамид
К раствору метил 3-((2R)-4-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)хроман-2-ил)бензоата (25 мг, 0,049 ммоль) в виде смеси диастереомеров из примера 8D в тетрагидрофуране (164 мкл) и метаноле (82 мкл) добавляли тетрагидроборат натрия (1,864 мг, 0,049 ммоль). Реакционную смесь перемешивали при комнатной температуре. Через 30 мин добавляли тетрагидроборат натрия (1,864 мг, 0,049 ммоль). Через 2 часа добавляли еще боргидрид натрия примерно каждые 8 часов в течение 48 часов. Реакцию гасили 2 мл водного раствора ацетата аммония, затем экстрагировали метил-трет-бутиловым эфиром и очищали на картридже с силикагелем 12 г, элюируя градиентом 5-100% этилацетат/гептан, с получением указанного в заголовке соединения (20 мг, 0,042 ммоль, выход 85%) в соотношении 6:4 смеси диастереомеров.1H ЯМР (500 МГц, CDCl3) δ 7,42-7,36 (м, 2H), 7,36-7,29 (м, 2H), 7,23-7,05 (м, 5H), 7,01 (дд, J=8,2, 5,6 Гц, 1H), 6,95-6,87 (м, 2H), 5,63 (д, J=7,0 Гц, 0,6H), 5,52-5,45 (м, 0,4H), 5,39 (д, J=8,9 Гц, 0,4H), 5,19 (дд, J=11,4, 1,9 Гц, 0,4H), 5,05 (ддд, J=7,3, 4,4, 2,9 Гц, 0,6H), 4,81 (дд, J=11,0, 2,4 Гц, 0,6H), 4,75-4,69 (м, 2H), 2,50 (ддд, J=13,2, 6,0, 2,0 Гц, 0,4H), 2,30 (дт, J=14,3, 2,8 Гц, 0,6H), 2,21 (ддд, J=14,2, 11,0, 4,7 Гц, 0,6H), 1,72-1,64 (м, 2,4H), 1,12-1,03 (м, 2H); МС (ESI+) m/z 480 (M+H)+.
Пример 59
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-(7-метокси-3,4-дигидро-2H-хромен-4-ил)циклопропанкарбоксамид
К раствору 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоты (40 мг, 0,165 ммоль) в DMF (413 мкл) добавляли HATU (1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиний 3-оксид гексафторфосфат) (82 мг, 0,215 ммоль). Смесь перемешивали в течение 5 минут, и затем добавляли 7-метоксихроман-4-амин, соль серной кислоты (45,8 мг, 0,165 ммоль), с последующим добавлением по каплям триэтиламина (92 мкл, 0,661 ммоль). Через 45 минут смесь гасили насыщенным водным бикарбонатом и водный слой удаляли. Полученное масло растирали в порошок с водой, получая розовое вязкое вещество, которое растворяли в дихлорметане и очищали на картридже с силикагелем 12 г, элюируя градиентом 5-50% этилацетата/гептана с получением указанного в заголовке соединения (61 мг, 0,151 ммоль, выход 92%) в виде белого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ 7,39 (д, J=1,7 Гц, 1H), 7,31 (д, J=8,4 Гц, 1H), 7,26 (д, J=8,4 Гц, 1H), 7,20 (дд, J=8,3, 1,8 Гц, 1H), 6,92 (д, J=8,5 Гц, 1H), 6,44 (дд, J=8,5, 2,6 Гц, 1H), 6,27 (д, J=2,5 Гц, 1H), 4,98 (кв, J=7,2 Гц, 1H), 4,18-4,04 (м, 2H), 3,66 (с, 3H), 1,94-1,83 (м, 2H), 1,45 (ддд, J=9,6, 5,8, 2,7 Гц, 1H), 1,36 (ддд, J=8,6, 5,6, 2,8 Гц, 1H), 1,11-0,97 (м, 2H); МС (ESI+) m/z 404 (M+H)+.
Пример 60
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-(7-метокси-2-фенил-3,4-дигидро-2H-хромен-4-ил)циклопропанкарбоксамид
В 4 мл сосуде, 300 мкл исходного раствора, содержащего 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновую кислоту (0,25 M, 0,073 ммоль, 1,0 эквивалент) и диизопропилэтиламин (0,74 M, 0,22 ммоль, 3,0 эквивалента) в диметилацетамиде добавляли к исходному раствору, содержащему 2-(3H-[1,2,3]триазоло[4,5-b]пиридин-3-ил)-1,1,3,3-тетраметилизоуроний гексафторфосфат(V) (0,30 M в диметилацетамиде, 300 мкл, 0,089 ммоль, 1,2 эквивалента). Добавляли основной раствор 7-метокси-2-фенил-хроман-4-иламина гидрохлорида (0,40 M в диметилацетамиде, 278 мкл, 0,111 ммоль, 1,5 эквивалента) и реакционную смесь перемешивали при 50°С до завершения реакции, как определяли ЖХ. Материал загружали непосредственно в автоматический дозатор Gilson GX-271 и очищали с использованием способа препаративной ЖХ TFA4, с получением указанного в заголовке соединения (27,1 мг, выход 76%).1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,44-7,25 (м, 7H), 7,25-7,12 (м, 2H), 6,95 (дд, J=8,6, 1,1 Гц, 1H), 6,52 (дд, J=8,5, 2,6 Гц, 1H), 6,36 (д, J=2,5 Гц, 1H), 5,38-5,27 (м, 1H), 5,22 (дд, J=11,3, 2,5 Гц, 1H), 3,69 (с, 3H), 2,19-1,93 (м, 2H), 1,50 (дт, J=8,5, 3,0 Гц, 1H), 1,44-1,32 (м, 1H), 1,12-1,00 (м, 2H); МС (APCI+) m/z 480,4 (M+H)+.
Пример 61
N-[2-(3,4-дихлорфенил)-7-метокси-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид
Соединение примера 61 (33,7 мг, выход 83%) получали в соответствии со способом, аналогичным способу, описанному в примере 60, используя 2-(3,4-дихлор-фенил)-7-метокси-хроман-4-иламин гидрохлорид вместо 7-метокси-2-фенил-хроман-4-иламина гидрохлорида.1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,69-7,63 (м, 2H), 7,49-7,39 (м, 1H), 7,37 (д, J=1,7 Гц, 1H), 7,30 (д, J=8,4 Гц, 1H), 7,21 (дд, J=8,3, 1,7 Гц, 1H), 7,15 (д, J=8,9 Гц, 1H), 6,95 (дд, J=8,5, 1,0 Гц, 1H), 6,54 (дд, J=8,6, 2,6 Гц, 1H), 6,41 (д, J=2,5 Гц, 1H), 5,38-5,17 (м, 2H), 3,69 (с, 3H), 2,16-1,95 (м, 2H), 1,50 (дт, J=8,8, 3,2 Гц, 1H), 1,42-1,33 (м, 1H), 1,15-0,99 (м, 2H); МС (APCI+) m/z 548,3 (M+H)+.
Пример 62
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[2-(3,4-диметоксифенил)-7-метокси-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
Соединение примера 62 гидрохлорид (39,4 мг, выход 98%) получали в соответствии со способом, аналогичным способу, описанному в примере 60, используя 2-(3,4-диметокси-фенил)-7-метокси-хроман-4-иламин вместо 7-метокси-2-фенил-хроман-4-иламина.1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,38 (д, J=1,7 Гц, 1H), 7,30 (д, J=8,3 Гц, 1H), 7,22 (дд, J=8,4, 1,7 Гц, 1H), 7,15 (д, J=8,9 Гц, 1H), 7,07-6,90 (м, 4H), 6,51 (дд, J=8,6, 2,6 Гц, 1H), 6,35 (д, J=2,5 Гц, 1H), 5,36-5,22 (м, 1H), 5,19-5,04 (м, 1H), 3,77-3,75 (м, 6H), 3,68 (с, 3H), 2,20-1,95 (м, 2H), 1,57-1,46 (м, 1H), 1,46-1,32 (м, 1H), 1,21-0,98 (м, 2H); МС (APCI+) m/z 540,4 (M+H)+.
Пример 63
N-[2-(4-хлорфенил)-7-метокси-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид
Соединение примера 63 (26,5 мг, выход 69%) получали в соответствии со способом, аналогичным способу, описанному в примере 60, используя 2-(4-хлор-фенил)-7-метокси-хроман-4-иламин гидрохлорид вместо 7-метокси-2-фенил-хроман-4-иламина гидрохлорида.1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,56-7,39 (м, 4H), 7,37 (д, J=1,7 Гц, 1H), 7,30 (д, J=8,3 Гц, 1H), 7,25-7,13 (м, 2H), 6,94 (дд, J=8,6, 1,0 Гц, 1H), 6,53 (дд, J=8,6, 2,6 Гц, 1H), 6,37 (д, J=2,5 Гц, 1H), 5,38-5,27 (м, 1H), 5,27-5,16 (м, 1H), 3,69 (с, 3H), 2,09-1,99 (м, 2H), 1,53-1,46 (м, 1H), 1,42-1,35 (м, 1H), 1,14-1,00 (м, 2H); МС (APCI+) m/z 514,2 (M+H)+.
Пример 64
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-{2-[4-(трифторметил)фенил]-3,4-дигидро-2H-хромен-4-ил}циклопропанкарбоксамид
Соединение примера 64 (34,8 мг, выход 91%) получали в соответствии со способом, аналогичным способу, описанному в примере 60, используя 2-(4-трифторметил-фенил)-хроман-4-иламин гидрохлорид вместо 7-метокси-2-фенил-хроман-4-иламина гидрохлорида.1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,78 (д, J=8,1 Гц, 2H), 7,66 (д, J=8,0 Гц, 2H), 7,38 (д, J=1,6 Гц, 1H), 7,29 (дд, J=8,5, 1,9 Гц, 2H), 7,25-7,12 (м, 2H), 7,12-7,03 (м, 1H), 6,98-6,90 (м, 1H), 6,90-6,78 (м, 1H), 5,49-5,33 (м, 2H), 2,21-2,01 (м, 2H), 1,55-1,48 (м, 1H), 1,44-1,35 (м, 1H), 1,11-1,03 (м, 2H); МС (APCI+) m/z 518,4 (M+H)+.
Пример 65
N-[2-(2-хлорфенил)-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид
Соединение примера 65 (35,8 мг, выход 99%) получали в соответствии со способом, аналогичным способу, описанному в примере 60, используя 2-(2-хлор-фенил)-хроман-4-иламин гидрохлорид вместо 7-метокси-2-фенил-хроман-4-иламина гидрохлорида. Неочищенный материал очищали с использованием способа препаративной ЖХ TFA1.1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,55 (дд, J=7,4, 1,9 Гц, 1H), 7,48-7,24 (м, 4H), 7,24-7,07 (м, 4H), 6,98-6,76 (м, 2H), 5,38 (дд, J=11,0, 2,2 Гц, 1H), 4,97 (т, J=3,8 Гц, 1H), 2,36 (д, J=14,0 Гц, 1H), 2,29-2,16 (м, 1H), 2,06-1,89 (м, 1H), 1,56-1,31 (м, 2H), 1,18-0,96 (м, 2H).
Пример 66
N-[2-(3,4-дихлорфенил)-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид
Соединение примера 66 (15,2 мг, выход 39%) получали в соответствии со способом, аналогичным способу, описанному в примере 60, используя 2-(3,4-дихлор-фенил)-хроман-4-иламин вместо 7-метокси-2-фенил-хроман-4-иламина гидрохлорида. Неочищенный материал очищали с использованием способа препаративной ЖХ TFA1.1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,64-7,51 (м, 2H), 7,43-7,28 (м, 2H), 7,24-7,01 (м, 5H), 6,94-6,76 (м, 2H), 5,39-5,28 (м, 0,5H), 5,26-5,23 (м, 0,5H), 5,19 (дд, J=8,6, 4,0 Гц, 0,5H), 4,99-4,86 (м, 0,5H), 2,31-1,98 (м, 2H), 1,55-1,38 (м, 2H), 1,11-0,99 (м, 2H); МС (APCI+) m/z 468,3 (M+H)+.
Пример 67
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-(2-фенил-3,4-дигидро-2H-хромен-4-ил)циклопропанкарбоксамид
Соединение примера 67 (15,2 мг, выход 45%) получали в соответствии со способом, аналогичным способу, описанному в примере 60, используя 2-фенил-хроман-4-иламин гидрохлорид вместо 7-метокси-2-фенил-хроман-4-иламина гидрохлорида. Неочищенный материал очищали с использованием способа препаративной ЖХ TFA1.1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,56-7,00 (м, 11H), 6,98-6,77 (м, 2H), 5,46-5,32 (м, 0,7H), 5,30-5,19 (м, 1H), 4,90 (т, J=3,9 Гц, 0,3H), 2,25-2,00 (м, 2H), 1,56-1,33 (м, 2H), 1,12-1,02 (м, 2H); МС (APCI+) m/z 450,4 (M+H)+.
Пример 68
N-[2-(4-хлорфенил)-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид
Соединение примера 68 (27,1 мг, выход 75%) получали в соответствии со способом, аналогичным способу, описанному в примере 60, используя 2-(4-хлор-фенил)-хроман-4-иламин гидрохлорид вместо 7-метокси-2-фенил-хроман-4-иламина гидрохлорида. Неочищенный материал очищали с использованием способа препаративной ЖХ TFA1.1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,59-7,40 (м, 4H), 7,38 (д, J=1,7 Гц, 1H), 7,34-7,25 (м, 2H), 7,22 (дд, J=8,3, 1,7 Гц, 1H), 7,19-7,10 (м, 1H), 7,10-7,00 (м, 1H), 6,93 (тд, J=7,5, 1,2 Гц, 1H), 6,80 (дд, J=8,2, 1,2 Гц, 1H), 5,46-5,32 (м, 1H), 5,32-5,21 (м, 1H), 2,19-2,00 (м, 2H), 1,55-1,48 (м, 1H), 1,43-1,35 (м, 1H), 1,14-1,00 (м, 2H); МС (APCI+) m/z 484,3 (M+H)+.
Пример 69
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[2-(3,4-диметоксифенил)-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
Соединение примера 69 (33,4 мг, выход 88%) получали в соответствии со способом, аналогичным способу, описанному в примере 60, используя 2-(3,4-диметокси-фенил)-хроман-4-иламин вместо 7-метокси-2-фенил-хроман-4-иламина гидрохлорида. Неочищенный материал очищали с использованием способа препаративной ЖХ TFA1.1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,31 (д, J=5,3 Гц, 1H), 7,29-7,07 (м, 3H), 7,07-6,91 (м, 3H), 6,91-6,72 (м, 3H), 5,37-5,27 (м, 0,5H), 5,14 (дд, J=11,1, 2,4 Гц, 0,5H), 5,06 (дд, J=9,3, 3,3 Гц, 0,5H), 4,94 (т, J=4,7 Гц, 0,5H), 3,82-3,72 (м, 6H), 2,26-2,07 (м, 2H), 1,59-1,32 (м, 2H), 1,14-0,98 (м, 2H); МС (APCI+) m/z 510,4 (M+H)+.
Пример 70
N-[2-(3-хлорфенил)-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид
Соединение примера 70 (31,0 мг, выход 86%) получали в соответствии со способом, аналогичным способу, описанному в примере 60, используя 2-(3-хлор-фенил)-хроман-4-иламин гидрохлорид вместо 7-метокси-2-фенил-хроман-4-иламина гидрохлорида. Неочищенный материал очищали с использованием способа препаративной ЖХ TFA1.1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,47-7,24 (м, 5H), 7,24-7,00 (м, 4H), 6,95-6,71 (м, 2H), 5,30 (дд, J=10,9, 6,1 Гц, 0,4H), 5,23 (дд, J=11,3, 2,4 Гц, 0,4H), 5,16 (дд, J=8,0, 4,5 Гц, 0,6H), 4,90 (т, J=4,9 Гц, 0,6H), 2,27-1,95 (м, 2H), 1,55-1,32 (м, 2H), 1,10-0,96 (м, 2H); МС (APCI+) m/z 484,3 (M+H)+.
Пример 71
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[2-(4-фторфенил)-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
Соединение примера 71 (32,8 мг, выход 95%) получали в соответствии со способом, аналогичным способу, описанному в примере 60, используя 2-(4-фтор-фенил)-хроман-4-иламин вместо 7-метокси-2-фенил-хроман-4-иламина гидрохлорида. Неочищенный материал очищали с использованием способа препаративной ЖХ TFA1.1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,51-7,35 (м, 2H), 7,31 (д, J=5,8 Гц, 1H), 7,27-7,01 (м, 6H), 6,96-6,73 (м, 2H), 5,32 (дд, J=11,1, 6,2 Гц, 0,5H), 5,22 (дд, J=11,4, 2,3 Гц, 0,5H), 5,15 (т, J=6,3 Гц, 0,5H), 4,93 (т, J=4,8 Гц, 0,5H), 2,27-2,02 (м, 2H), 1,55-1,37 (м, 2H), 1,07 (дд, J=7,0, 2,9 Гц, 2H); МС (APCI+) m/z 468,3 (M+H)+.
Пример 72
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[3-(3,4-диметоксибензил)-6-метокси-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
Исходный раствор 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоты и N,N-диизопропилэтиламина(0,218 М и 0,654 М в диметилацетамиде, соответственно, 284 мкл, 0,061 ммоль 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоты (1,0 эквивалент) и 0,18 ммоль N,N-диизопропилэтиламина (3,0 эквивалента)), 2-(3H-[1,2,3]триазоло[4,5-b]пиридин-3-ил)-1,1,3,3-тетраметилизоуроний гексафторфосфата(V) (0,26 M в диметилацетамиде, 284 мкл, 0,074 ммоль, 1,2 эквивалента), и 3-(3,4-диметокси-бензил)-6-метокси-хроман-4-иламина (Von P. Pfeiffer et al., Justus Liebigs Annalen der Chemie (1949), 564, 208-19) (0,40 M в диметилацетамиде, 232 мкл, 0,093 ммоль, 1,5 эквивалента) аспирировали из их соответствующих флаконов с исходным соединением, смешивали посредством PFA (перфторалкокси) смесительной трубки (внутренний диаметр 0,2 мм) и загружали в петлевой дозатор. Часть реакционной смеси впрыскивали в реактор проточного типа (катушка Хастеллой, внутренний диаметр 0,75 мм, внутренний объем 1,8 мл), установленный при 100°С, и пропускали через реактор при 180 мкл мин-1 (время пребывания 10 минут). После выхода из реактора реакционную смесь загружали непосредственно в петлевой дозатор и очищали с использованием способа препаративной ЖХ TFA1 с получением указанного в заголовке соединения (10,69 мг, выход 49%).1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,42 (д, J=8,9 Гц, 1H), 7,36 (д, J=1,6 Гц, 1H), 7,31 (д, J=8,3 Гц, 1H), 7,20 (дд, J=8,3, 1,8 Гц, 1H), 6,86 (д, J=8,1 Гц, 1H), 6,77-6,61 (м, 4H), 6,50 (д, J=2,9 Гц, 1H), 4,91-4,79 (м, 1H), 4,02-3,93 (м, 1H), 3,75 (с, 6H), 3,64 (с, 3H), 3,46 (с, 0H), 2,70-2,60 (м, 1H), 2,36-2,21 (м, 2H), 1,51-1,32 (м, 2H), 1,15-0,97 (м, 2H); МС (APCI+) m/z 554,1 (M+H)+.
Пример 73
N-(3-бензил-3,4-дигидро-2H-хромен-4-ил)-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид
Соединение примера 73 (5,56 мг, выход 19%) получали в соответствии со способом, аналогичным способу, описанному в примере 72, используя 3-бензил-хроман-4-иламин (Von P. Pfeiffer et al., Justus Liebigs Annalen der Chemie (1949), 564, 208-19) вместо 3-(3,4-диметокси-бензил)-6-метокси-хроман-4-иламина.1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,52-7,40 (м, 1H), 7,40-6,96 (м, 9H), 6,94-6,82 (м, 1H), 6,81-6,68 (м, 1H), 4,95-4,82 (м, 1H), 4,05-3,79 (м, 2H), 2,76-2,60 (м, 1H), 2,40-2,17 (м, 2H), 1,52-1,36 (м, 2H), 1,21-0,98 (м, 2H); МС (APCI+) m/z 464,2 (M+H)+.
Пример 74
N-[(4R)-2,2-диэтил-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид
Соединение примера 74 (2,9 мг, выход 11%) получали в соответствии со способом, аналогичным способу, описанному в примере 72, используя (4R)-2,2-диэтилхроман-4-амин (2S,3S)-2,3-дигидроксибутандикарбоновую кислоту (WO2010045402A1) вместо 3-(3,4-диметокси-бензил)-6-метокси-хроман-4-иламина.1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,40 (д, J=1,6 Гц, 1H), 7,31 (д, J=8,3 Гц, 1H), 7,23 (дд, J=8,3, 1,8 Гц, 1H), 7,16-7,05 (м, 1H), 7,05-6,94 (м, 1H), 6,89-6,77 (м, 1H), 6,75-6,66 (м, 1H), 5,16-5,03 (м, 1H), 1,87-1,73 (м, 2H), 1,64-1,32 (м, 6H), 1,16-1,07 (м, 1H), 1,07-0,99 (м, 1H), 0,90-0,76 (м, 7H); МС (APCI+) m/z 430,2 (M+H)+.
Пример 75
N-[(4R)-2,2-бис(фторметил)-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид
Соединение примера 75 (10,1 мг, выход 42%) получали в соответствии со способом, аналогичным способу, описанному в примере 72, используя (4R)-2,2-бис(фторметил)хроман-4-амин (2S,3S)-2,3-дигидроксибутандикарбоновую кислоту (WO2010045402A1) вместо 3-(3,4-диметокси-бензил)-6-метокси-хроман-4-иламина.1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,41 (д, J=1,6 Гц, 1H), 7,32 (д, J=8,3 Гц, 1H), 7,24 (дд, J=8,3, 1,8 Гц, 1H), 7,20-7,10 (м, 1H), 7,08-6,98 (м, 1H), 6,93 (тд, J=7,5, 1,2 Гц, 1H), 6,81 (дд, J=8,2, 1,1 Гц, 1H), 5,21-5,08 (м, 1H), 4,69-4,39 (м, 4H), 2,14-1,92 (м, 2H), 1,55-1,47 (м, 1H), 1,44-1,36 (м, 1H), 1,15-1,00 (м, 2H); МС (APCI+) m/z 438,2 (M+H)+.
Пример 76
N-[(4R)-7-хлор-2,2-диметил-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид
Соединение примера 76 (3,3 мг, выход 12%) получали в соответствии со способом, аналогичным способу, описанному в примере 72, используя (4R)-7-хлор-2,2-диметил-хроман-4-амин (2S,3S)-2,3-дигидроксибутандикарбоновую кислоту (WO2010045402A1) вместо 3-(3,4-диметокси-бензил)-6-метокси-хроман-4-иламина.1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,39 (д, J=1,7 Гц, 1H), 7,31 (д, J=8,3 Гц, 1H), 7,22 (дд, J=8,3, 1,8 Гц, 1H), 7,08-6,97 (м, 1H), 6,90 (дд, J=8,4, 2,2 Гц, 1H), 6,75 (д, J=2,1 Гц, 1H), 5,07 (т, J=9,1 Гц, 1H), 1,83 (д, J=9,1 Гц, 2H), 1,56-1,46 (м, 1H), 1,42-1,35 (м, 1H), 1,33 (с, 3H), 1,21 (с, 3H), 1,13-1,02 (м, 2H); МС (APCI+) m/z 436,1 (M+H)+.
Пример 77
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(4R)-8-фтор-2,2-бис(фторметил)-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
Соединение примера 77 (1,4 мг, выход 5%) получали в соответствии со способом, аналогичным способу, описанному в примере 72, используя (4R)-8-фтор-2,2-бис(фторметил)хроман-4-амин (2S,3S)-2,3-дигидроксибутандикарбоновую кислоту (WO2010045402A1) вместо 3-(3,4-диметокси-бензил)-6-метокси-хроман-4-иламина.1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,41 (д, J=1,7 Гц, 1H), 7,32 (д, J=8,3 Гц, 1H), 7,27-7,19 (м, 1H), 7,17-7,04 (м, 1H), 6,98-6,80 (м, 2H), 5,23-5,12 (м, 1H), 4,74-4,43 (м, 4H), 2,19-1,96 (м, 2H), 1,56-1,46 (м, 1H), 1,46-1,35 (м, 1H), 1,21-1,03 (м, 2H); МС (APCI+) m/z 456,1 (M+H)+.
Пример 78
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(4R)-3,4-дигидроспиро[хромен-2,1'-циклопентан]-4-ил]циклопропанкарбоксамид
Соединение примера 78 (2,9 мг, выход 10%) получали в соответствии со способом, аналогичным способу, описанному в примере 72, используя (4R)-спиро[хроман-2,1'-циклопентан]-4-амин (2S,3S)-2,3-дигидроксибутандикарбоновую кислоту (WO2010045402A1) вместо 3-(3,4-диметокси-бензил)-6-метокси-хроман-4-иламина.1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,39 (д, J=1,6 Гц, 1H), 7,31 (д, J=8,3 Гц, 1H), 7,28-7,17 (м, 2H), 7,15-7,05 (м, 1H), 7,05-6,95 (м, 1H), 6,90-6,78 (м, 1H), 6,66 (дд, J=8,1, 1,2 Гц, 1H), 5,11 (дд, J=11,6, 6,2 Гц, 1H), 2,06 (т, J=12,2 Гц, 1H), 1,86-1,46 (м, 10H), 1,44-1,35 (м, 1H), 1,13-1,02 (м, 2H); МС (APCI+) m/z 428,2 (M+H)+.
Пример 79
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(4R)-7-фтор-2,2-бис(фторметил)-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
Соединение примера 79 (4,2 мг, выход 15%) получали в соответствии со способом, аналогичным способу, описанному в примере 72, используя (4R)-7-фтор-2,2-бис(фторметил)хроман-4-амин гидрохлорид (WO2010045402A1) вместо 3-(3,4-диметокси-бензил)-6-метокси-хроман-4-иламина.1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,41 (д, J=1,6 Гц, 1H), 7,32 (д, J=8,3 Гц, 1H), 7,24 (дд, J=8,4, 1,7 Гц, 1H), 7,12-6,99 (м, 1H), 6,78 (тд, J=8,5, 2,6 Гц, 1H), 6,68 (дд, J=10,3, 2,6 Гц, 1H), 5,11 (дд, J=11,3, 6,4 Гц, 1H), 4,71-4,40 (м, 4H), 2,14-1,92 (м, 2H), 1,55-1,46 (м, 1H), 1,44-1,37 (м, 1H), 1,15-1,03 (м, 2H); МС (APCI+) m/z 456,1 (M+H)+.
Пример 80
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2S,4R)-2-(фторметил)-2-метил-7-(трифторметил)-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
Соединение примера 80 (7,64 мг, выход 25%) получали в соответствии со способом, аналогичным способу, описанному в примере 72, используя (2S,4R)-2-(фторметил)-2-метил-7-(трифторметил)хроман-4-амин гидрохлорид (WO2010045402A1) вместо 3-(3,4-диметокси-бензил)-6-метокси-хроман-4-иламина.1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,41 (д, J=1,6 Гц, 1H), 7,32 (д, J=8,3 Гц, 1H), 7,28-7,16 (м, 3H), 7,10-7,01 (м, 1H), 5,15 (дд, J=11,8, 6,4 Гц, 1H), 4,61-4,46 (м, 1H), 4,46-4,32 (м, 1H), 2,11 (дд, J=13,7, 6,4 Гц, 1H), 2,02-1,93 (м, 1H), 1,55-1,47 (м, 1H), 1,44-1,37 (м, 1H), 1,33 (д, J=2,0 Гц, 3H), 1,15-1,01 (м, 2H); МС (APCI+) m/z 488,1 (M+H)+.
Пример 81
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2R,4R)-2-(дифторметил)-2-метил-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
Соединение примера 81 (10,7 мг, выход 40%) получали в соответствии со способом, аналогичным способу, описанному в примере 72, используя (2R,4R)-2-дифторметил-2-метил-хроман-4-иламин гидрохлорид (WO2010045402A1) вместо 3-(3,4-диметокси-бензил)-6-метокси-хроман-4-иламина.1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,41 (д, J=1,7 Гц, 1H), 7,38 (д, J=8,7 Гц, 1H), 7,32 (д, J=8,4 Гц, 1H), 7,24 (дд, J=8,3, 1,7 Гц, 1H), 7,20-7,10 (м, 1H), 7,10-6,98 (м, 1H), 6,98-6,87 (м, 1H), 6,78 (дд, J=8,2, 1,1 Гц, 1H), 6,02 (т, J=55,1 Гц, 1H), 5,26-5,12 (м, 1H), 2,11-1,96 (м, 1H), 1,82 (дд, J=12,9, 6,0 Гц, 1H), 1,56-1,48 (м, 1H), 1,46-1,37 (м, 1H), 1,31 (с, 3H), 1,17-1,00 (м, 2H); МС (APCI+) m/z 438,1 (M+H)+.
Пример 82
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2S,4R)-2-(дифторметил)-2-метил-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
Соединение примера 82 (9,4 мг, выход 35%) получали в соответствии со способом, аналогичным способу, описанному в примере 72, используя (2S,4R)-2-дифторметил-2-метил-хроман-4-иламин гидрохлорид (WO2010045402A1) вместо 3-(3,4-диметокси-бензил)-6-метокси-хроман-4-иламина.1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,41 (д, J=1,6 Гц, 1H), 7,32 (д, J=8,3 Гц, 1H), 7,28-7,19 (м, 2H), 7,19-7,09 (м, 1H), 7,06-6,96 (м, 1H), 6,96-6,85 (м, 1H), 6,79 (дд, J=8,1, 1,1 Гц, 1H), 6,09 (т, J=54,8 Гц, 1H), 5,16 (дт, J=12,2, 6,5 Гц, 1H), 2,14 (дд, J=14,0, 6,2 Гц, 1H), 2,07-1,91 (м, 1H), 1,54-1,46 (м, 1H), 1,44-1,36 (м, 1H), 1,32 (с, 3H), 1,14-1,00 (м, 2H); МС (APCI+) m/z 438,1 (M+H)+.
Пример 83
N-[(2S,4R)-7-хлор-2-(дифторметил)-2-метил-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид
Соединение примера 83 (9,7 мг, выход 33%) получали в соответствии со способом, аналогичным способу, описанному в примере 72, используя (2S,4R)-7-хлор-2-дифторметил-2-метил-хроман-4-иламин гидрохлорид (WO2010045402A1) вместо 3-(3,4-диметокси-бензил)-6-метокси-хроман-4-иламина.1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,41 (д, J=1,6 Гц, 1H), 7,32 (д, J=8,3 Гц, 1H), 7,28-7,19 (м, 2H), 7,03 (дд, J=8,3, 1,0 Гц, 1H), 6,97 (дд, J=8,3, 2,1 Гц, 1H), 6,88 (д, J=2,0 Гц, 1H), 6,12 (т, J=54,7 Гц, 1H), 5,17-5,04 (м, 1H), 2,16 (дд, J=14,1, 6,3 Гц, 1H), 2,09-1,91 (м, 1H), 1,56-1,45 (м, 1H), 1,45-1,36 (м, 1H), 1,33 (с, 3H), 1,15-1,00 (м, 2H); МС (APCI+) m/z 472,1 (M+H)+.
Пример 84
N-[(2R,4R)-7-хлор-2-(дифторметил)-2-метил-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид
Соединение примера 84 (11,2 мг, выход 38%) получали в соответствии со способом, аналогичным способу, описанному в примере 72, используя (2R,4R)-7-хлор-2-дифторметил-2-метил-хроман-4-иламин гидрохлорид (WO2010045402A1) вместо 3-(3,4-диметокси-бензил)-6-метокси-хроман-4-иламина.1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,41 (д, J=1,6 Гц, 1H), 7,38 (д, J=8,7 Гц, 1H), 7,32 (д, J=8,3 Гц, 1H), 7,24 (дд, J=8,3, 1,7 Гц, 1H), 7,12-7,02 (м, 1H), 6,99 (дд, J=8,3, 2,1 Гц, 1H), 6,87 (д, J=2,0 Гц, 1H), 6,04 (т, J=55,0 Гц, 1H), 5,15 (дт, J=12,4, 6,4 Гц, 1H), 2,11-1,96 (м, 1H), 1,83 (дд, J=13,0, 6,1 Гц, 1H), 1,57-1,46 (м, 1H), 1,45-1,37 (м, 1H), 1,31 (с, 3H), 1,17-1,00 (м, 2H); МС (APCI+) m/z 472,1 (M+H)+.
Пример 85
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2S,4R)-2-метил-2-(трифторметил)-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
Соединение примера 85 (9,1 мг, выход 32%) получали в соответствии со способом, аналогичным способу, описанному в примере 72, используя (2S,4R)-2-метил-2-трифторметил-хроман-4-иламин гидрохлорид (WO2010045402A1) вместо 3-(3,4-диметокси-бензил)-6-метокси-хроман-4-иламина.1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,43 (д, J=1,5 Гц, 1H), 7,32 (д, J=8,3 Гц, 1H), 7,26 (дд, J=8,3, 1,7 Гц, 1H), 7,22-7,12 (м, 1H), 7,09-7,00 (м, 1H), 7,00-6,90 (м, 1H), 6,84 (дд, J=8,2, 1,1 Гц, 1H), 5,13 (дд, J=12,0, 6,2 Гц, 1H), 2,28 (дд, J=14,6, 6,1 Гц, 1H), 2,21-2,05 (м, 1H), 1,60-1,45 (м, 4H), 1,45-1,33 (м, 1H), 1,21-1,01 (м, 2H); МС (APCI+) m/z 456,1 (M+H)+.
Пример 86
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(4R)-7-фтор-2,2-диметил-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
Соединение примера 86 (4,1 мг, выход 15%) получали в соответствии со способом, аналогичным способу, описанному в примере 72, используя (R)-7-фтор-2,2-диметилхроман-4-амин (2S,3S)-2,3-дигидроксисукцинат (WO2010045402A1) вместо 3-(3,4-диметокси-бензил)-6-метокси-хроман-4-иламина.1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,39 (д, J=1,7 Гц, 1H), 7,31 (д, J=8,3 Гц, 1H), 7,22 (дд, J=8,3, 1,7 Гц, 1H), 7,09-6,97 (м, 1H), 6,69 (тд, J=8,6, 2,7 Гц, 1H), 6,52 (дд, J=10,6, 2,6 Гц, 1H), 5,07 (т, J=8,8 Гц, 1H), 1,83 (д, J=9,0 Гц, 2H), 1,56-1,45 (м, 1H), 1,44-1,35 (м, 1H), 1,33 (с, 3H), 1,21 (с, 3H), 1,19-0,99 (м, 2H); МС (APCI+) m/z 420,1 (M+H)+.
Пример 87
N-[(4R)-7-хлор-2,2-бис(фторметил)-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид
Соединение примера 87 (2,7 мг, выход 9%) получали в соответствии со способом, аналогичным способу, описанному в примере 72, используя (R)-7-хлор-2,2-бис-фторметил-хроман-4-иламин (2S,3S)-2,3-дигидрокси-янтарную кислоту (WO2010045402A1) вместо 3-(3,4-диметокси-бензил)-6-метокси-хроман-4-иламина.1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,41 (д, J=1,7 Гц, 1H), 7,32 (д, J=8,3 Гц, 1H), 7,24 (дд, J=8,4, 1,7 Гц, 1H), 7,05 (д, J=8,3 Гц, 1H), 6,98 (дд, J=8,4, 2,1 Гц, 1H), 6,90 (д, J=2,0 Гц, 1H), 5,11 (дд, J=11,2, 6,4 Гц, 1H), 4,71-4,40 (м, 4H), 2,15-1,93 (м, 2H), 1,56-1,45 (м, 1H), 1,45-1,34 (м, 1H), 1,15-1,02 (м, 2H); МС (APCI+) m/z 472,1 (M+H)+.
Пример 88
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(4S)-6-фтор-2,2-диметил-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
Соединение примера 88 (1,8 мг, выход 7%) получали в соответствии со способом, аналогичным способу, описанному в примере 72, используя (S)-6-фтор-2,2-диметил-хроман-4-иламин с (2R,3R)-2,3-дигидрокси-янтарной кислотой (WO2010045402A1) вместо 3-(3,4-диметокси-бензил)-6-метокси-хроман-4-иламина.1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,41 (д, J=1,7 Гц, 1H), 7,32 (д, J=8,3 Гц, 1H), 7,23 (дд, J=8,3, 1,7 Гц, 1H), 6,94 (тд, J=8,6, 3,3 Гц, 1H), 6,78-6,66 (м, 2H), 5,14-5,01 (м, 1H), 1,87-1,73 (м, 2H), 1,56-1,44 (м, 1H), 1,43-1,36 (м, 1H), 1,32 (с, 3H), 1,20 (с, 3H), 1,14-1,03 (м, 2H); МС (APCI+) m/z 420,1 (M+H)+.
Пример 89
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(4S)-6-фтор-3,4-дигидроспиро[хромен-2,1'-циклобутан]-4-ил]циклопропанкарбоксамид
Соединение примера 89 (2,0 мг, выход 8%) получали в соответствии со способом, аналогичным способу, описанному в примере 72, используя (S)-6-фторспиро[хроман-2,1'-циклобутан]-4-амин (2R,3R)-2,3-дигидроксисукцинат (WO2010045402A1) вместо 3-(3,4-диметокси-бензил)-6-метокси-хроман-4-иламина.1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,43 (д, J=1,6 Гц, 1H), 7,33 (д, J=8,3 Гц, 1H), 7,25 (дд, J=8,3, 1,7 Гц, 1H), 6,94 (тд, J=8,6, 3,2 Гц, 1H), 6,75 (дд, J=9,0, 4,8 Гц, 1H), 6,71-6,63 (м, 1H), 5,07 (дд, J=11,5, 5,9 Гц, 1H), 2,30-2,19 (м, 1H), 2,16-1,96 (м, 4H), 1,94-1,62 (м, 3H), 1,56-1,45 (м, 1H), 1,44-1,37 (м, 1H), 1,15-1,05 (м, 2H); МС (APCI+) m/z 432,1 (M+H)+.
Пример 90
N-[(4R)-8-хлор-7-фтор-2,2-диметил-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид
Соединение примера 90 (5,3 мг, выход 19%) получали в соответствии со способом, аналогичным способу, описанному в примере 72, используя (R)-8-хлор-7-фтор-2,2-диметил-хроман-4-иламин (WO2010045402A1) вместо 3-(3,4-диметокси-бензил)-6-метокси-хроман-4-иламина.1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,39 (д, J=1,7 Гц, 1H), 7,31 (д, J=8,3 Гц, 1H), 7,22 (дд, J=8,3, 1,8 Гц, 1H), 7,08-6,96 (м, 1H), 6,90 (т, J=8,8 Гц, 1H), 5,10 (т, J=9,1 Гц, 1H), 1,93-1,80 (м, 2H), 1,56-1,44 (м, 1H), 1,44-1,35 (м, 4H), 1,24 (с, 3H), 1,20-1,00 (м, 2H); МС (APCI+) m/z 454,1 (M+H)+.
Пример 91
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[3-(3,4-диметоксибензил)-7-метокси-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
Исходный раствор 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоты и N,N-диизопропилэтиламина(0,218 М и 0,654 М в диметилацетамиде, соответственно, 284 мкл, 0,061 ммоль 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоты (1,0 эквивалент) и 0,18 ммоль N,N-диизопропилэтиламина (3,0 эквивалента)), 2-(3H-[1,2,3]триазоло[4,5-b]пиридин-3-ил)-1,1,3,3-тетраметилизоуроний гексафторфосфат(V) (0,26 M в диметилацетамиде, 284 мкл, 0,074 ммоль, 1,2 эквивалента), и 3-(3,4-диметокси-бензил)-7-метокси-хроман-4-иламин (Von P. Pfeiffer et al., Justus Liebigs Annalen der Chemie (1949), 564, 208-19) (0,40 M в диметилацетамиде, 232 мкл, 0,093 ммоль, 1,5 эквивалента) смешивали в 4 мл сосуде при комнатной температуре. Реакцию считали завершенной с помощью ЖХ и реакционную смесь загружали непосредственно в петлевой дозатор и очищали, используя способ препаративной ЖХ TFA1, с получением указанного в заголовке соединения (9,9 мг, выход 29%).1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,38-7,24 (м, 3H), 7,19 (дд, J=8,3, 1,7 Гц, 1H), 6,90 (д, J=8,7 Гц, 1H), 6,86 (д, J=8,2 Гц, 1H), 6,73 (д, J=2,0 Гц, 1H), 6,65 (дд, J=8,1, 2,0 Гц, 1H), 6,48 (дд, J=8,6, 2,6 Гц, 1H), 6,27 (д, J=2,5 Гц, 1H), 4,80 (т, J=8,5 Гц, 1H), 4,00 (дд, J=11,3, 2,7 Гц, 1H), 3,74 (с, 5H), 3,67 (с, 3H), 2,68-2,56 (м, 1H), 2,35-2,19 (м, 2H), 1,48-1,36 (м, 2H), 1,14-1,07 (м, 1H), 1,03-0,97 (м, 1H); МС (APCI+) m/z 554,0 (M+H)+.
Пример 92
трет-бутил 4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-фтор-3,4-дигидро-1'H-спиро[хромен-2,4'-пиперидин]-1'-карбоксилат
Пример 92A
трет-бутил 7-фтор-4-гидроксиспиро[хроман-2,4'-пиперидин]-1'-карбоксилат
Раствор трет-бутил 7-фтор-4-оксоспиро[хроман-2,4'-пиперидин]-1'-карбоксилата (CAS# 936648-33-8, MFCD12912048) (500 мг, 1,491 ммоль) в метаноле (7 мл) охлаждали до 0°C, обрабатывали NaBH4 (113 мг, 2,98 ммоль) и перемешивали при комнатной температуре в течение 10 минут. Смесь концентрировали до объема приблизительно 2 мл и гасили 10% уксусной кислотой в воде (10 мл). Смесь экстрагировали этилацетатом (2 раза). Объединенные этилацетатные слои промывали насыщенным раствором NaHCO3, промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали, концентрировали и хроматографировали на силикагеле, элюируя градиентом 20%-100% этилацетата в гептанах, с получением указанного в заголовке соединения (0,5 г, 1,482 ммоль, выход 99%).1H ЯМР (400 МГц, CDCl3) δ м.д. 7,38 (дд, J=8,6, 6,7 Гц, 1H), 6,65 (тд, J=8,4, 2,5 Гц, 1H), 6,55 (дд, J=10,2, 2,5 Гц, 1H), 4,82 (т, J=6,7 Гц, 1H), 3,83 (ушир, 2H), 3,19 (дт, J=29,3, 13,2 Гц, 2H), 2,29 (с, 1H), 2,11 (дд, J=13,7, 6,0 Гц, 1H), 1,97-1,91 (м, 1H), 1,88 (дд, J=13,8, 7,9 Гц, 1H), 1,77 (дкв, J=13,7, 3,1 Гц, 1H), 1,65 (ддд, J=13,5, 11,8, 4,6 Гц, 1H), 1,56 (ддд, J=13,7, 11,9, 4,8 Гц, 1H), 1,46 (с, 9H).
Пример 92B
трет-бутил 4-азидо-7-фторспиро[хроман-2,4'-пиперидин]-1'-карбоксилат
Раствор продукта из примера 92A (0,5 г, 1,482 ммоль) в тетрагидрофуране (8 мл) охлаждали до 0°C и обрабатывали 1,8-диазабицикло[5.4.0]ундец-7-еном (0,447 мл, 2,96 ммоль), затем дифенилфосфорилазидом (0,544 мл, 2,52 ммоль). Смесь перемешивали при 0°C в течение 2 часов и затем при комнатной температуре в течение 2 дней. Смесь разделяли между трет-бутилметиловым эфиром (30 мл) и 1 M NaOH (10 мл). Слои разделяли и органический слой промывали 1 M NaOH (10 мл), промывали 1% водной лимонной кислотой (2×20 мл), промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали, концентрировали и хроматографировали на силикагеле, элюируя градиентом 10%-33% этилацетата в гептанах с получением указанного в заголовке соединения.1H ЯМР (400 МГц, CDCl3) δ м.д. 7,39-7,18 (м, 2H), 6,69 (тд, J=8,4, 2,6 Гц, 1H), 6,60 (дд, J=10,1, 2,6 Гц, 1H), 4,59 (т, J=6,8 Гц, 1H), 3,89 (с, 3H), 3,19 (дт, J=22,9, 12,3 Гц, 2H), 2,13 (дд, J=13,9, 6,0 Гц, 1H), 2,00 (дд, J=13,9, 7,6 Гц, 1H), 1,93 (дт, J=14,1, 2,9 Гц, 1H), 1,77 (дкв, J=13,9, 3,0 Гц, 1H), 1,72-1,52 (м, 2H), 1,47 (с, 9H).
Пример 92C
трет-бутил 4-амино-7-фторспиро[хроман-2,4'-пиперидин]-1'-карбоксилат
Раствор соединения из примера 92B (0,23 г, 0,635 ммоль) растворяли в тетрагидрофуране (5 мл), обрабатывали водой (0,5 мл), обрабатывали трифенилфосфином (0,333 г, 1,269 ммоль) и нагревали при 65°С в течение 1 часа. Смесь охлаждали и концентрировали. Остаток растворяли в трет-бутилметиловом эфире (20 мл), промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали, концентрировали и хроматографировали на силикагеле, элюируя градиентом 0%-100% [3:1 этилацетат:этанол] в этилацетате, затем элюировали смесью 75:25:2 этилацетат:этанол:насыщенный раствор NH4OH, с получением указанного в заголовке соединения (0,15 г, 0,446 ммоль, выход 70,3%).1H ЯМР (400 МГц, CDCl3) δ м.д. 7,41 (дд, J=8,6, 6,7 Гц, 1H), 6,64 (тд, J=8,4, 2,6 Гц, 1H), 6,54 (дд, J=10,2, 2,6 Гц, 1H), 4,01 (дд, J=10,9, 6,2 Гц, 1H), 3,94-3,77 (м, 2H), 3,31 (т, J=12,4 Гц, 1H), 3,07 (т, J=12,3 Гц, 1H), 2,07 (дд, J=13,4, 6,2 Гц, 1H), 1,85-1,61 (м, 6H), 1,54-1,41 (м, 10H).
Пример 92D
трет-бутил 4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-фтор-3,4-дигидро-1'H-спиро[хромен-2,4'-пиперидин]-1'-карбоксилат
Смесь продукта из примера 92C (0,15 г, 0,446 ммоль), O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфата (0,186 г, 0,490 ммоль) и 1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоновой кислоты (0,108 г, 0,446 ммоль) в тетрагидрофуране (2 мл) обрабатывали триэтиламином (0,124 мл, 0,892 ммоль) и перемешивали при комнатной температуре в течение 3 часов. Смесь разбавляли этилацетатом (30 мл), промывали 5% водной лимонной кислотой (20 мл), промывали насыщенным раствором NaHCO3 (10 мл), промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали, концентрировали и хроматографировали на силикагеле, элюируя градиентом 50%-100% [9:1 CH2Cl2:этилацетат] в гептанах, затем элюировали градиентом 0%-100% этилацетата в [9:1 CH2Cl2:этилацетат] с получением указанного в заголовке соединения (220 мг, 0,392 ммоль, выход 88%).1H ЯМР (400 МГц, CDCl3) δ м.д. 7,15 (дд, J=8,2, 1,8 Гц, 1H), 7,11 (д, J=1,7 Гц, 1H), 7,05-6,98 (м, 2H), 6,59 (тд, J=8,3, 2,6 Гц, 1H), 6,52 (дд, J=10,1, 2,6 Гц, 1H), 5,33 (д, J=8,9 Гц, 1H), 5,27-5,15 (м, 1H), 3,84 (с, 2H), 3,26 (т, J=12,3 Гц, 1H), 3,12-2,98 (м, 1H), 2,11 (дд, J=13,4, 6,3 Гц, 1H), 1,82 (д, J=12,6 Гц, 1H), 1,77-1,48 (м, 6H), 1,46 (с, 9H), 1,16-1,04 (м, 2H); МС (ESI) m/z 559 (M-H)-.
Пример 93
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-(7-фтор-3,4-дигидроспиро[хромен-2,4'-пиперидин]-4-ил)циклопропанкарбоксамид
Раствор соединения из примера 92D (210 мг, 0,375 ммоль) в трифторуксусной кислоте (2 мл) нагревали при температуре 60°C в течение 2 минут, концентрировали и разделяли между трет-бутилметиловым эфиром (30 мл) и 1 M NaOH (10 мл). Слой трет-бутилметилового эфира промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали с получением указанного в заголовке соединения.1H ЯМР (400 МГц, CDCl3) δ м.д. 7,14 (дд, J=8,2, 1,7 Гц, 1H), 7,11 (д, J=1,6 Гц, 1H), 7,04-6,98 (м, 2H), 6,58 (тд, J=8,4, 2,6 Гц, 1H), 6,52 (дд, J=10,2, 2,6 Гц, 1H), 5,33 (д, J=8,8 Гц, 1H), 5,26-5,18 (м, 1H), 3,14-3,04 (м, 1H), 2,94-2,79 (м, 3H), 2,14 (дд, J=13,4, 6,3 Гц, 1H), 1,85-1,46 (м, 8H), 1,14-1,05 (м, 2H); МС (ESI) m/z 461 (M+H)+.
Пример 94
метил 3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(2-метоксиэтокси)-3,4-дигидро-2H-хромен-2-ил]бензоат
К соединению из примера 23E (60 мг, 0,115 ммоль) и 2-метоксиэтанола (13,08 мг, 0,172 ммоль) в дихлорметане (2 мл) добавляли трифенилфосфин (60,1 мг, 0,229 ммоль), с последующим добавлением частями ди-трет-бутилазодикарбоксилата (52,8 мг, 0,229 ммоль). Смесь перемешивали при температуре окружающей среды в течение 2 часов. Растворитель удаляли в вакууме и остаток очищали на картридже с силикагелем, элюируя с градиентом 5-50% этилацетата в гептане с получением указанного в заголовке соединения (60 мг, 0,103 ммоль, выход 90%).1H ЯМР (400 МГц, CDCl3) δ 8,07 (т, J=1,7 Гц, 1H), 7,99 (дт, J=7,7, 1,4 Гц, 1H), 7,61-7,52 (м, 1H), 7,44 (т, J=7,7 Гц, 1H), 7,14-7,05 (м, 2H), 7,00 (д, J=8,2 Гц, 1H), 6,95 (д, J=8,6 Гц, 1H), 6,55 (дд, J=8,7, 2,5 Гц, 1H), 6,45 (д, J=2,5 Гц, 1H), 5,41 (тд, J=10,3, 9,8, 6,2 Гц, 1H), 5,31 (д, J=8,8 Гц, 1H), 5,20 (дд, J=11,2, 1,9 Гц, 1H), 4,11-4,02 (м, 2H), 3,92 (с, 3H), 3,72 (дд, J=5,6, 3,8 Гц, 2H), 3,43 (с, 3H), 2,50 (ддд, J=13,3, 6,1, 2,0 Гц, 1H), 1,85-1,70 (м, 2H), 1,65-1,59 (м, 1H), 1,06 (кв, J=2,4 Гц, 2H); МС (ESI-) m/z 580 (M-H)-.
Пример 95
метил 3-[(2R,4R)-7-(бензилокси)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]бензоат
Указанное в заголовке соединение получали с использованием условий, аналогичных условиям, описанным в примере 94, используя фенилметанол вместо 2-метоксиэтанола.1H ЯМР (400 МГц, CDCl3) δ 8,07 (т, J=1,7 Гц, 1H), 8,00 (дт, J=7,6, 1,4 Гц, 1H), 7,57 (дт, J=7,7, 1,5 Гц, 1H), 7,47-7,28 (м, 6H), 7,14-7,06 (м, 2H), 6,98 (дд, J=15,3, 8,4 Гц, 2H), 6,58 (дд, J=8,6, 2,5 Гц, 1H), 6,52 (д, J=2,5 Гц, 1H), 5,42 (тд, J=10,3, 9,8, 6,0 Гц, 1H), 5,33 (д, J=8,8 Гц, 1H), 5,24-5,16 (м, 1H), 5,01 (с, 2H), 3,92 (с, 3H), 2,50 (ддд, J=13,4, 6,1, 2,0 Гц, 1H), 1,83-1,71 (м, 2H), 1,66-1,61 (м, 1H), 1,07 (тд, J=3,6, 2,1 Гц, 2H); МС (ESI-) m/z 612 (M-H)-.
Пример 96
3-[(2R,4R)-7-(карбоксиметокси)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]бензойная кислота
Пример 96A
метил 3-((2R,4R)-4-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-7-(2-метокси-2-оксоэтокси)хроман-2-ил)бензоат
Указанное в заголовке соединение получали с использованием условий, аналогичных условиям, описанным в примере 94, используя метил 2-гидроксиацетат вместо 2-метоксиэтанола. ЖХ/МС m/z 596 (M+H)+.
Пример 96B
3-[(2R,4R)-7-(карбоксиметокси)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]бензойная кислота
Соединение примера 96A (60 мг, 0,10 ммоль) и гидроксид лития (24 мг, 1,0 ммоль) в метаноле (2 мл) и воду (0,5 мл) перемешивали при температуре окружающей среды в течение 1 часа и ЖХ/МС показал, что реакция завершилась. Очистка смеси с помощью способа препаративной ЖХ TFA2 давала указанное в заголовке соединение.1H ЯМР (400 МГц, ДМСО-d6) δ 8,00 (с, 1H), 7,91 (д, J=7,7 Гц, 1H), 7,65 (д, J=7,7 Гц, 1H), 7,52 (т, J=7,7 Гц, 1H), 7,39 (д, J=1,7 Гц, 1H), 7,31 (д, J=8,3 Гц, 1H), 7,24-7,11 (м, 2H), 6,96 (д, J=8,6 Гц, 1H), 6,51 (дд, J=8,6, 2,6 Гц, 1H), 6,35 (д, J=2,5 Гц, 1H), 5,42-5,25 (м, 2H), 4,61 (с, 2H), 2,16-1,94 (м, 2H), 1,53-1,32 (м, 2H), 1,05 (д, J=3,2 Гц, 2H), МС (ESI-) m/z 566 (M-H)-.
Пример 97
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(2-метоксиэтокси)-3,4-дигидро-2H-хромен-2-ил]бензойная кислота
Смесь соединения примера 94 (50 мг, 0,086 ммоль) и гидроксида лития (12,35 мг, 0,516 ммоль) в метаноле (2 мл) и воде (0,5 мл) перемешивали при температуре окружающей среды в течение 1 часа и ЖХ/МС показал, что реакция завершилась. Очистка реакционной смеси с помощью способа препаративной ЖХ AA2 давала указанное в заголовке соединение.1H ЯМР (501 МГц, CDCl3) δ 8,17 (с, 1H), 8,04 (с, 1H), 7,61 (с, 1H), 7,44 (с, 1H), 7,16-7,04 (м, 2H), 7,00 (д, J=8,2 Гц, 1H), 6,94 (д, J=8,6 Гц, 1H), 6,53 (д, J=8,6 Гц, 1H), 6,44 (с, 1H), 5,46 (с, 1H), 5,39 (д, J=8,8 Гц, 1H), 5,23 (с, 1H), 4,13-3,97 (м, 2H), 3,71 (т, J=4,7 Гц, 2H), 3,43 (с, 3H), 2,54 (с, 1H), 1,76 (д, J=9,6 Гц, 2H), 1,08 (д, J=3,3 Гц, 2H); МС (ESI-) m/z 566 (M-H)-.
Пример 98
3-[(2R,4R)-7-(бензилокси)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]бензойная кислота
Смесь соединения примера 95 (60 мг, 0,098 ммоль) и гидроксида лития (14,05 мг, 0,587 ммоль) в метаноле (2 мл) и воде (0,5 мл) перемешивали при температуре окружающей среды в течение 2 часов и ЖХ/МС показал, что реакция завершилась. Очистка реакционной смеси с помощью способа препаративной ЖХ AA2 давала указанное в заголовке соединение (43 мг, выход 73,3%).1H ЯМР (400 МГц, CDCl3) δ 8,15 (с, 1H), 8,01 (с, 1H), 7,55 (с, 1H), 7,45-7,30 (м, 6H), 7,09 (т, J=9,0 Гц, 2H), 7,02-6,84 (м, 2H), 6,51 (д, J=30,6 Гц, 2H), 5,41 (с, 2H), 5,16 (с, 1H), 4,97 (с, 2H), 2,52 (с, 1H), 1,75 (с, 2H), 1,26 (с, 1H), 1,07 (с, 2H); МС (ESI-) m/z 598 (M-H)-.
Пример 99
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-{1'-[(2R)-2,3-дигидроксипропил]-7-фтор-3,4-дигидроспиро[хромен-2,4'-пиперидин]-4-ил}циклопропанкарбоксамид
Раствор соединения из примера 93 (9,8 мг, 0,021 ммоль) в метаноле (0,3 мл) обрабатывали избытком (S)-глицидола (20 мг), перемешивали при комнатной температуре в течение 30 минут и нагревали при 65°С в течение 45 минут. Смесь охлаждали, разбавляли этилацетатом (2 мл), разбавляли гептанами (2 мл), и непосредственно хроматографировали на силикагеле, элюируя градиентом 0%-100% [3:1 этилацетат:метанол] в этилацетате, получая указанное в заголовке соединение (5,6 мг, 10,48 мкмоль, выход 49,2%).1H ЯМР (400 МГц, CDCl3) δ м.д. 7,18-7,10 (м, 2H), 7,07-6,97 (м, 2H), 6,60 (тд, J=8,4, 2,5 Гц, 1H), 6,52 (дд, J=10,2, 2,4 Гц, 1H), 5,37-5,29 (м, 1H), 5,21 (кв, J=8,7 Гц, 1H), 3,89-3,82 (м, 1H), 3,79-3,74 (м, 1H), 3,52 (дд, J=11,4, 4,0 Гц, 1H), 2,90-2,78 (м, 1H), 2,74-2,53 (м, 3H), 2,46 (дт, J=12,8, 3,4 Гц, 1H), 2,42-1,97 (м, 5H), 1,89 (д, J=13,9 Гц, 1H), 1,81-1,65 (м, 4H), 1,55 (дд, J=13,3, 10,5 Гц, 1H), 1,11 (дд, J=3,1, 1,6 Гц, 2H); МС (ESI) m/z 533 (M-H)-.
Пример 100
бензил 4'-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7'-фтор-3',4'-дигидро-1H-спиро[азетидин-3,2'-хромен]-1-карбоксилат
Пример 100A
бензил 3-(2-(4-фтор-2-гидроксифенил)-2-оксоэтил)-3-гидроксиазетидин-1-карбоксилат
Раствор диизопропиламина (1,573 мл, 11,04 ммоль) в тетрагидрофуране (11 мл) охлаждали до -10°C, обрабатывали по каплям 2,5 М н-BuLi в гексане (4,41 мл, 11,04 ммоль), перемешивали при -10°C в течение 5 минут, обрабатывали по каплям раствором 4'-фтор-2'-гидроксиацетофенона (0,81 г, 5,26 ммоль) в тетрагидрофуране (5 мл), перемешивали между -10°C и 0°C в течение 1 часа, охлаждали до -60°C, обрабатывали по каплям раствором бензил 3-оксоазетидин-1-карбоксилата (1,402 г, 6,83 ммоль) в тетрагидрофуране (5 мл) в течение 15 минут, перемешивали между -60°C и -50°C в течение 10 минут, обрабатывали 10% водным раствором KH2PO4 (50 мл) и оставляли нагреваться до комнатной температуры. Смесь экстрагировали этилацетатом (дважды). Объединенные этилацетатные слои промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали, концентрировали и хроматографировали на силикагеле, элюируя градиентом 20%-100% этилацетата в гептанах, с получением указанного в заголовке соединения (1,35 г, 3,76 ммоль, выход 71,5%).1H ЯМР (400 МГц, CDCl3) δ м.д. 12,08 (с, 1H), 7,72 (дд, J=8,8, 6,3 Гц, 1H), 7,40-7,26 (м, 5H), 6,71-6,63 (м, 2H), 5,10 (с, 2H), 4,11 (д, J=9,5 Гц, 2H), 3,95 (д, J=9,4 Гц, 2H), 3,79 (с, 1H), 3,50 (с, 2H); МС (ESI) m/z 342 (M+H)+.
Пример 100B
бензил 7'-фтор-4'-оксоспиро[азетидин-3,2'-хроман]-1-карбоксилат
Раствор соединения из примера 100A (1,25 г, 3,48 ммоль) в пиридине (2,81 мл, 34,8 ммоль) охлаждали до 0°C, обрабатывали по каплям трифторуксусным ангидридом (0,737 мл, 5,22 ммоль) в течение 20 минут, перемешивали при 0°C в течение 30 минут, обрабатывали по каплям дополнительным количеством трифторуксусного ангидрида (0,5 мл), перемешивали при 0°C в течение 30 минут, обрабатывали дополнительным количеством трифторуксусного ангидрида (0,7 мл), и перемешивали при комнатной температуре в течение 2 часов. Смесь разбавляли этанолом (10 мл), обрабатывали 1,8-диазабицикло[5.4.0]ундец-7-еном (6 мл), перемешивали при температуре 50°C в течение 5 минут, обрабатывали дополнительным количеством 1,8-диазабицикло[5.4.0]ундец-7-еном (1 мл), перемешивали при 50°C в течение 15 минут, и перемешивали при комнатной температуре в течение ночи. Смесь разбавляли трет-бутилметиловым эфиром (75 мл) и промывали водой (25 мл), промывали 1 M HCl (2×25 мл), промывали 1 M NaOH (2×25 мл), промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали, концентрировали и хроматографировали на силикагеле, элюируя с градиентом 15%-50% этилацетата в гептанах с получением указанного в заголовке соединения (0,54 г, 1,582 ммоль, выход 45,5%).1H ЯМР (400 МГц, CDCl3) δ м.д. 7,89 (дд, J=8,8, 6,5 Гц, 1H), 7,39-7,28 (м, 5H), 6,79 (тд, J=8,4, 2,4 Гц, 1H), 6,74 (дд, J=9,6, 2,3 Гц, 1H), 5,11 (с, 2H), 4,16 (д, J=9,7 Гц, 2H), 4,04 (д, J=9,7 Гц, 2H), 3,02 (с, 2H); МС (ESI) m/z 342 (M+H)+.
Пример 100C
бензил 7'-фтор-4'-гидроксиспиро[азетидин-3,2'-хроман]-1-карбоксилат
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 92А, используя соединение из примера 100В вместо трет-бутил 7-фтор-4-оксоспиро[хроман-2,4'-пиперидин]-1'-карбоксилата.1H ЯМР (400 МГц, CDCl3) δ м.д. 7,37-7,27 (м, 6H), 6,69 (тд, J=8,3, 2,5 Гц, 1H), 6,62 (дд, J=10,0, 2,6 Гц, 1H), 5,12 (с, 2H), 4,87-4,83 (м, 1H), 4,38 (д, J=9,5 Гц, 1H), 4,19 (д, J=9,5 Гц, 1H), 4,07 (д, J=9,5 Гц, 2H), 2,38 (дд, J=14,0, 4,9 Гц, 1H), 2,26 (дд, J=14,0, 4,6 Гц, 1H), 1,77 (с, 1H); МС (ESI) m/z 344 (M+H)+.
Пример 100D
бензил 4'-азидо-7'-фторспиро[азетидин-3,2'-хроман]-1-карбоксилат
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 92В, используя соединение из примера 10°C вместо соединения из примера 92А.1H ЯМР (400 МГц, CDCl3) δ м.д. 7,39-7,29 (м, 5H), 7,21 (дд, J=8,6, 6,3 Гц, 1H), 6,72 (тд, J=8,3, 2,6 Гц, 1H), 6,66 (дд, J=9,9, 2,5 Гц, 1H), 5,12 (с, 2H), 4,65 (т, J=4,8 Гц, 1H), 4,35 (д, J=9,6 Гц, 1H), 4,19 (д, J=9,6 Гц, 1H), 4,09-4,04 (м, 2H), 2,38 (дд, J=14,1, 4,6 Гц, 1H), 2,28 (дд, J=14,1, 4,9 Гц, 1H); МС (ESI) m/z 369 (M+H)+.
Пример 100E
бензил 4'-амино-7'-фторспиро[азетидин-3,2'-хроман]-1-карбоксилат
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 92С, используя соединение из примера 100D вместо соединения из примера 92В.1H ЯМР (400 МГц, CDCl3) δ м.д. 7,79 (ушир, 1H), 7,56 (ушир, 1H), 7,41-7,29 (м, 6H), 6,67 (тд, J=8,4, 2,6 Гц, 1H), 6,57 (дд, J=10,0, 2,6 Гц, 1H), 5,12 (с, 2H), 4,24-4,14 (м, 2H), 4,08 (д, J=9,4 Гц, 1H), 4,04 (дд, J=8,9, 5,4 Гц, 1H), 3,99 (д, J=9,3 Гц, 1H), 2,36 (дд, J=13,4, 5,3 Гц, 1H), 1,99 (дд, J=13,3, 9,0 Гц, 1H).
Пример 100F
бензил 4'-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7'-фтор-3',4'-дигидро-1H-спиро[азетидин-3,2'-хромен]-1-карбоксилат
Смесь продукта из примера 100E (86 мг, 0,251 ммоль), O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфата (201 мг, 0,528 ммоль) и 1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоновой кислоты (122 мг, 0,502 ммоль) в тетрагидрофуране (2 мл) обрабатывали триэтиламином (140 мкл, 1,005 ммоль), и перемешивали при комнатной температуре в течение 1 часа. Смесь разбавляли этилацетатом (30 мл), промывали 10% водной лимонной кислотой (10 мл), промывали насыщенным раствором NaHCO3 (10 мл), промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали, концентрировали и хроматографировали на силикагеле, элюируя градиентом 50%-100% [9:1 CH2Cl2:этилацетат] в гептанах с получением указанного в заголовке соединения (90 мг, 0,159 ммоль, выход 63,2%).1H ЯМР (400 МГц, CDCl3) δ м.д. 7,40-7,29 (м, 5H), 7,16-7,07 (м, 2H), 6,97 (дд, J=8,6, 6,2 Гц, 2H), 6,63 (тд, J=8,4, 2,6 Гц, 1H), 6,55 (дд, J=9,8, 2,6 Гц, 1H), 5,33-5,27 (м, 1H), 5,20-5,09 (м, 3H), 4,09-3,95 (м, 4H), 2,41 (дд, J=13,5, 5,7 Гц, 1H), 1,97 (дд, J=13,5, 9,1 Гц, 1H), 1,76-1,65 (м, 2H), 1,15-1,06 (м, 2H); МС (ESI) m/z 565 (M-H)-.
Пример 101
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[7-фтор-1'-(метилсульфонил)-3,4-дигидроспиро[хромен-2,4'-пиперидин]-4-ил]циклопропанкарбоксамид
Раствор соединения из примера 93 (11,1 мг, 0,024 ммоль) в CH2Cl2 (0,3 мл) обрабатывали триэтиламином (0,03 мл) и метансульфонилхлоридом (2 капли). Смесь перемешивали при комнатной температуре в течение 15 минут и разделяли между этилацетатом (30 мл) и 1 M HCl (10 мл). Слои разделяли. Этилацетатный слой промывали насыщенным раствором NaHCO3 (10 мл), промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали, концентрировали и хроматографировали на силикагеле, элюируя с градиентом 25%-100% этилацетата в гептанах с получением указанного в заголовке соединения (11,6 мг, 0,022 ммоль, выход 89%).1H ЯМР (400 МГц, CDCl3) δ м.д. 7,15 (дд, J=8,2, 1,7 Гц, 1H), 7,11 (д, J=1,6 Гц, 1H), 7,06-7,00 (м, 2H), 6,62 (тд, J=8,4, 2,6 Гц, 1H), 6,53 (дд, J=10,0, 2,6 Гц, 1H), 5,32 (д, J=8,7 Гц, 1H), 5,27-5,18 (м, 1H), 3,67-3,55 (м, 2H), 3,16 (дт, J=11,8, 7,4 Гц, 1H), 2,92 (тд, J=12,0, 2,9 Гц, 1H), 2,81 (с, 3H), 2,12 (дд, J=13,4, 6,3 Гц, 1H), 1,98 (д, J=14,0 Гц, 1H), 1,84-1,79 (м, 2H), 1,77-1,65 (м, 3H), 1,15-1,07 (м, 2H); МС (ESI) m/z 537 (M-H)-.
Пример 102
N-(1'-ацетил-7-фтор-3,4-дигидроспиро[хромен-2,4'-пиперидин]-4-ил)-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид
Раствор соединения из примера 93 (11,1 мг, 0,024 ммоль) в пиридине (0,3 мл) обрабатывали уксусным ангидридом (2 капли) и перемешивали при комнатной температуре в течение 30 минут. Смесь разделяли между трет-бутилметиловым эфиром (30 мл) и 1 M HCl (15 мл). Слои разделяли и слой трет-бутилметилового эфира промывали 1 M NaOH (10 мл), промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали, концентрировали и хроматографировали на силикагеле, элюируя с градиентом 25%-100% [3:1 этилацетат:этанол] в этилацетате, с получением указанного в заголовке соединения (10 мг, 0,020 ммоль, выход 83%).1H ЯМР (500 МГц, CDCl3) δ м.д. 7,15 (дт, J=8,1, 1,8 Гц, 1H), 7,11 (с, 1H), 7,02 (дд, J=16,6, 7,1 Гц, 2H), 6,61 (тд, J=8,4, 2,6 Гц, 1H), 6,53 (ддд, J=10,1, 5,2, 2,6 Гц, 1H), 5,33 (т, J=7,9 Гц, 1H), 5,25-5,18 (м, 1H), 4,36 (дд, J=18,9, 14,3 Гц, 1H), 3,65-3,51 (м, 1,5H), 3,35 (ддд, J=13,9, 12,1, 3,0 Гц, 0,5H), 3,17-3,09 (м, 0,5H), 2,89 (тд, J=12,8, 3,1 Гц, 0,5H), 2,14-2,06 (м, 4H), 1,89 (ддд, J=19,2, 14,1, 3,0 Гц, 1H), 1,79-1,47 (м, 6H), 1,14-1,06 (м, 2H); МС (ESI) m/z 501 (M-H)-.
Пример 103
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-(7'-фтор-3',4'-дигидроспиро[азетидин-3,2ʹ-хромен]-4'-ил)циклопропанкарбоксамид
Смесь продукта из примера 100F (81 мг, 0,143 ммоль), 10% Pd на угле (15 мг) и изопропиловый спирт (1 мл) перемешивали при комнатной температуре в атмосфере H2 с использованием баллона в течение 1 часа, нагревали при 60°C в течение 5 минут, и снова перемешивали при комнатной температуре в течение 15 минут. Смесь фильтровали и фильтрат концентрировали с получением указанного в заголовке соединения (63,2 мг, 0,146 ммоль, выход 102%).1H ЯМР (400 МГц, CDCl3) δ м.д. 7,15 (дд, J=8,2, 1,7 Гц, 1H), 7,12 (д, J=1,6 Гц, 1H), 7,02 (д, J=8,2 Гц, 1H), 6,97 (дд, J=8,5, 6,4 Гц, 1H), 6,60 (тд, J=8,4, 2,6 Гц, 1H), 6,54 (дд, J=9,9, 2,5 Гц, 1H), 5,32 (д, J=8,4 Гц, 1H), 5,21-5,13 (м, 1H), 3,85-3,72 (м, 2H), 3,65 (д, J=8,0 Гц, 1H), 3,57 (д, J=8,2 Гц, 1H), 2,52 (дд, J=13,4, 5,7 Гц, 1H), 1,90 (дд, J=13,4, 9,4 Гц, 1H), 1,75-1,65 (м, 2H), 1,15-1,06 (м, 2H); МС (ESI) m/z 433 (M+H)+.
Пример 104
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[7'-фтор-1-(метилсульфонил)-3',4'-дигидроспиро[азетидин-3,2ʹ-хромен]-4'-ил]циклопропанкарбоксамид
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 101, используя соединение из примера 103 вместо соединения из примера 93.1H ЯМР (400 МГц, CDCl3) δ м.д. 7,16 (дд, J=8,2, 1,7 Гц, 1H), 7,12 (д, J=1,6 Гц, 1H), 7,04 (д, J=8,2 Гц, 1H), 6,99 (дд, J=8,6, 6,3 Гц, 1H), 6,65 (тд, J=8,3, 2,5 Гц, 1H), 6,56 (дд, J=9,7, 2,5 Гц, 1H), 5,31 (д, J=8,0 Гц, 1H), 5,21-5,13 (м, 1H), 4,02 (д, J=8,8 Гц, 1H), 3,99 (с, 2H), 3,91 (д, J=8,7 Гц, 1H), 2,91 (с, 3H), 2,50 (дд, J=13,4, 5,7 Гц, 1H), 1,97 (дд, J=13,4, 9,5 Гц, 1H), 1,77-1,65 (м, 2H), 1,13 (с, 2H); МС (ESI) m/z 511 (M+H)+.
Пример 105
N-(1-ацетил-7'-фтор-3',4'-дигидроспиро[азетидин-3,2ʹ-хромен]-4'-ил)-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 102, используя соединение из примера 103 вместо соединения из примера 93, получая указанное в заголовке соединение.1H ЯМР (400 МГц, CDCl3) δ м.д. 7,18-7,11 (м, 2H), 7,01 (ддд, J=25,6, 8,4, 6,2 Гц, 2H), 6,65 (тд, J=8,4, 2,4 Гц, 1H), 6,56 (дт, J=9,7, 2,9 Гц, 1H), 5,38-5,28 (м, 1H), 5,23-5,14 (м, 1H), 4,16-3,98 (м, 4H), 2,47-2,40 (м, 1H), 2,01-1,93 (м, 1H), 1,89 (с, 3H), 1,77-1,64 (м, 2H), 1,17-1,07 (м, 2H); МС (ESI) m/z 475 (M+H)+.
Пример 106
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(2-фторэтокси)-3,4-дигидро-2H-хромен-2-ил]бензойная кислота
Пример 106A
метил 3-((2R,4R)-4-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-7-(2-фторэтокси)хроман-2-ил)бензоат
К соединению из примера 23E (65 мг, 0,124 ммоль) и 2-фторэтанола (11,93 мг, 0,186 ммоль) в CH2Cl2 (2 мл) добавляли трифенилфосфин (65,1 мг, 0,248 ммоль), с последующим добавлением ди-трет-бутил азодикарбоксилата (57,2 мг, 0,248 ммоль) в порции. Смесь перемешивали при температуре окружающей среды в течение 2 часов и ЖХ/МС показал, что реакция завершилась. Растворитель удалили и остаток очищали с помощью хроматографии на картридже с силикагелем 1 2 г, элюируя этилацетатом в гептане с градиентом 5-40% с получением указанного в заголовке соединения (63 мг, 90%). ЖХ/МС m/z 570 (M+H)+.
Пример 106B
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(2-фторэтокси)-3,4-дигидро-2H-хромен-2-ил]бензойная кислота
Соединение примера 106A (60 мг, 0,105 ммоль) и 2 M водного гидроксида лития (0,5 мл) в метаноле (2 мл) перемешивали при температуре окружающей среды в течение ночи. Растворитель удалили и к смеси добавляли воду (1 мл). Смесь доводили до значения pH 1~2 с помощью 2 М HCl. Осажденное белое твердое вещество собирали фильтрованием и сушили с получением указанного в заголовке соединения (43 мг, выход 74%).1H ЯМР (501 МГц, CDCl3) δ 8,19 (с, 1H), 8,05 (с, 1H), 7,64 (с, 1H), 7,50 (с, 1H), 7,16-7,04 (м, 2H), 7,00 (д, J=8,2 Гц, 1H), 6,94 (д, J=8,6 Гц, 1H), 6,53 (д, J=8,6 Гц, 1H), 6,45 (с, 1H), 5,50 (с, 1H), 5,39 (д, J=8,8 Гц, 1H), 5,28 (с, 1H), 4,78 (д, 1H), 4,66 (д, 1H), 4,18 (с, 1H), 4,12 (с, 1H), 2,6-2,55 (м, 2H), 1,76 (м, 2H), 1,08 (м, 2H); МС (ESI-) m/z 554 (M-H)-.
Пример 107
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[1'-(3-гидрокси-2,2-диметилпропаноил)-7-метокси-3,4-дигидроспиро[хромен-2,4'-пиперидин]-4-ил]циклопропанкарбоксамид
Пример 107A
1'-(3-гидрокси-2,2-диметилпропаноил)-7-метоксиспиро[хроман-2,4'-пиперидин]-4-он
К 3-гидрокси-2,2-диметилпропановой кислоте (112 мг, 0,952 ммоль) в DMF (4 мл) добавляли HATU (1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиний 3-оксид гексафторфосфат) (543 мг, 1,427 ммоль). Смесь перемешивали в течение 5 минут при комнатной температуре, с последующим последовательным добавлением 7-метоксиспиро[хроман-2,4'-пиперидин]-4-он, хлористоводородной кислоты (CAS 1031416-37-1, MFCD11973587) (270 мг, 0,952 ммоль) и N-этил-N-изопропилпропан-2-амина (0,663 мл, 3,81 ммоль). Смесь перемешивали при комнатной температуре в течение 2 часов. Очистка с помощью хроматографии на силикагеле, элюирование 5-50% этилацетата в гептане давала указанное в заголовке соединение (305 мг, выход 92%). ЖХ/МС m/z 348 (M+H)+.
Пример 107B
(E)-3-гидрокси-1-(7-метокси-4-(метоксиимино)спиро[хроман-2,4'-пиперидин]-1'-ил)-2,2-диметилпропан-1-он
Смесь соединения из примера 107A, O-метилгидроксиламина, хлористоводородной кислоты (144 мг, 1,727 ммоль) и ацетата натрия (142 мг, 1,727 ммоль) в метаноле (10 мл) перемешивали при 60°С в течение ночи. Растворитель удалили и остаток растворяли в этилацетате, и затем промывали водой. Органические слои сушили над MgSO4, фильтровали и концентрировали. Очистка с помощью способа препаративной ЖХ AA2 давала указанное в заголовке соединение (300 мг, выход 92%). ЖХ/МС m/z 377 (M+H)+.
Пример 107C
1-(4-амино-7-метоксиспиро[хроман-2,4'-пиперидин]-1'-ил)-3-гидрокси-2,2-диметилпропан-1-он
Соединение примера 107B (300 мг, 0,797 ммоль) и 5% платину (155 мг, 0,040 ммоль) в уксусной кислоте (5 мл) загружали водородом при давлении 30 фунт/кв.дюйм в течение 24 часов. Реакционную смесь фильтровали и растворитель удаляли при пониженном давлении. Остаток очищали с помощью способа препаративной ЖХ TFA2 с получением соли трифторуксусной кислоты указанного в заголовке соединения (110 мг, 0,316 ммоль, выход 39,6%). ЖХ/МС m/z 350 (M+2H)+.
Пример 107D
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[1'-(3-гидрокси-2,2-диметилпропаноил)-7-метокси-3,4-дигидроспиро[хромен-2,4'-пиперидин]-4-ил]циклопропанкарбоксамид
К 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоте (57,6 мг, 0,238 ммоль) в DMF (4 мл) добавляли HATU (1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиний 3-оксид гексафторфосфат) (123 мг, 0,324 ммоль). Смесь перемешивали в течение 5 минут при комнатной температуре, с последующим последовательным добавлением соединения примера 107C (100 мг, 0,216 ммоль) и N-этил-N-изопропилпропан-2-амина (0,151 мл, 0,865 ммоль). Смесь перемешивали при комнатной температуре в течение 2 часов. ЖХ/МС показал, что реакция завершилась. Очистка реакционной смеси с помощью хроматографии на картридже с силикагелем 24 г, элюируя 5-50% этилацетатом в гептане, давала указанное в заголовке соединение (35 мг, выход 28,3%).1H ЯМР (500 МГц, CDCl3) δ 7,14 (дд, J=8,2, 1,7 Гц, 1H), 7,11 (д, J=1,7 Гц, 1H), 7,02 (д, J=8,2 Гц, 1H), 6,94 (д, J=8,7 Гц, 1H), 6,49 (дд, J=8,6, 2,6 Гц, 1H), 6,36 (д, J=2,5 Гц, 1H), 5,35 (д, J=8,5 Гц, 1H), 5,23-5,11 (м, 1H), 4,15 (д, J=60,1 Гц, 2H), 3,75 (с, 3H), 3,50 (дд, J=9,9, 5,6 Гц, 2H), 3,27 (д, J=69,6 Гц, 2H), 2,56 (с, 1H), 2,12 (дд, J=13,4, 6,3 Гц, 1H), 1,93 (дкв, J=14,2, 2,6 Гц, 1H), 1,81-1,49 (м, 6H), 1,26 (д, J=1,9 Гц, 6H), 1,10 (тд, J=3,3, 1,8 Гц, 2H); МС (ESI+) m/z 573 (M+H)+.
Пример 108
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(трифторметил)-3,4-дигидро-2H-хромен-2-ил]бензойная кислота
Пример 108A
7-(трифторметил)-4H-хромен-4-он
Смесь 1-(2-гидрокси-4-(трифторметил)фенил)этанона (400 мг, 1,959 ммоль) и 1,1-диметокси-N,N-диметилметанамина (0,286 мл, 2,155 ммоль) нагревали при температуре 120°C в течение 2 часов, и охлаждали. Осажденное оранжевое твердое вещество собирали фильтрованием, промывали гептаном и сушили с получением (E)-3-(диметиламино)-1-(4-трифторметил-2-гидроксифенил)проп-2-ен-1-она, который растворяли в дихлорметане (120 мл) и обрабатывали концентрированной HCl (15 мл). Смесь кипятили с обратным холодильником в течение 2 часов. Водный слой удаляли и органический слой промывали насыщенным солевым раствором (50 мл × 2), и концентрировали. Остаток очищали с помощью хроматографии на 80 г картридже с силикагелем, элюируя 5-30% этилацетата в гептане с получением указанного в заголовке соединения (310 мг, выход 73,9%) в виде белого твердого вещества.
Пример 108B
(R)-метил 3-(4-оксо-7-(трифторметил)хроман-2-ил)бензоат
Смесь бис(2,2,2-трифторацетокси)палладия (46,6 мг, 0,140 ммоль), (S)-4-(трет-бутил)-2-(пиридин-2-ил)-4,5-дигидрооксазола (34,3 мг, 0,168 ммоль), гексафторофосфата(V) аммония (137 мг, 0,841 ммоль), (3-(метоксикарбонил)фенил)бороновой кислоты (504 мг, 2,80 ммоль) и дихлорэтана (5 мл) в сосуде (20 мл) перемешивали в течение 5 минут при комнатной температуре. К смеси добавляли соединение из примера 108A (300 мг, 1,41 ммоль) и воду (0,256 мл, 14,19 ммоль). Сосуд закрывали и смесь перемешивали при 60°С в течение ночи. Смесь фильтровали через слой целита и элюировали этилацетатом. Органические слои удаляли в вакууме и неочищенный материал хроматографировали с использованием 80 г картриджа с силикагелем, элюируя 5-40% этилацетата в гептане с получением указанного в заголовке соединения (230 мг, выход 46,9%).
Пример 108 C
(R)-метил 3-(4-(метоксиимино)-7-(трифторметил)хроман-2-ил)бензоат
Смесь соединения из примера 108B (230 мг, 2,53 ммоль), ацетата натрия (108 мг, 1,31 ммоль) и O-метилгидроксиламина, хлористоводородной кислоты (110 мг, 1,31 ммоль) в метаноле (10 мл) перемешивали при 60°С в течение ночи. Растворитель упаривали при пониженном давлении и остаток растворяли в этилацетате и промывали водой, сушили над MgSO4, фильтровали и концентрировали. Указанное в заголовке соединение (225 мг, выход 90%) переносили на следующую стадию без дополнительной очистки. ЖХ/МС m/z 380 (M+H)+.
Пример 108D
метил 3-((2R,4R)-4-амино-7-(трифторметил)хроман-2-ил)бензоат
К смеси соединения примера 108C (270 мг, 0,712 ммоль) и уксусной кислоте (30 мл) добавляли влажный 5% платина/углерод (90 мг, 0,190 ммоль) в 50 мл сосуде для реакций под давлением и перемешивали в течение 32 часов при давлении 30 фунт/кв.дюйм водорода и при температуре окружающей среды. Реакционную смесь фильтровали, и фильтрат концентрировали при пониженном давлении. Полученное масло очищали с помощью способа препаративной ЖХ TFA2 с получением указанного в заголовке соединения и метил 3-((2R,4R)-4-амино-7-(трифторметил)хроман-2-ил)циклогексанкарбоксилата.
Пример 108E
метил 3-((2R,4R)-4-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-7-(трифторметил)хроман-2-ил)бензоат
Смесь 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоты (76 мг, 0,313 ммоль) и HATU (1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиний 3-оксид гексафторфосфат) (162 мг, 0,427 ммоль) в DMF (4 мл) перемешивали в течение 5 минут при комнатной температуре, с последующим последовательным добавлением соединения примера 108D (150 мг, 0,48 ммоль) и N-этил-N-изопропилпропан-2-амина (0,198 мл, 1,14 ммоль). Смесь перемешивали при температуре окружающей среды в течение 2 часов. ЖХ/МС показал, что реакция завершилась. Очищали с помощью хроматографии на 12 г картридже с силикагелем, элюируя 5-40% этилацетата в гептане, с получением указанного в заголовке соединения (45 мг, выход 27,5%).1H ЯМР (400 МГц, CDCl3) δ 8,07 (т, J=1,9 Гц, 1H), 8,05-7,99 (м, 1H), 7,59 (дт, J=7,7, 1,6 Гц, 1H), 7,47 (т, J=7,7 Гц, 1H), 7,21-7,15 (м, 3H), 7,14-7,08 (м, 2H), 7,03 (д, J=8,2 Гц, 1H), 5,60-5,48 (м, 1H), 5,40 (д, J=9,0 Гц, 1H), 5,28 (дд, J=11,5, 2,0 Гц, 1H), 3,94 (с, 3H), 3,69-3,63 (м, 1H), 2,53 (ддд, J=13,5, 6,2, 2,1 Гц, 1H), 1,89-1,79 (м, 2H), 1,12 (тд, J=6,6, 3,2 Гц, 2H); МС (ESI-) m/z 574 (M-H)-
Пример 108F
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(трифторметил)-3,4-дигидро-2H-хромен-2-ил]бензойная кислота
Смесь соединения примера 108E (40 мг, 0,07 ммоль) и 2 M NaOH (0,2 мл) в метаноле (1 мл) перемешивали при 35°С в течение 2 часов и растворитель удаляли в вакууме. К остатку добавляли воду (0,5 мл) и значение pH доводили до 1~2. Осажденное твердое вещество собирали с помощью фильтрования, промывали водой и сушили с получением указанного в заголовке соединения (33 мг, 85%).1H ЯМР (400 МГц, CDCl3) δ 8,18 (с, 1H), 8,12-8,03 (м, 1H), 7,65 (д, J=7,8 Гц, 1H), 7,49 (т, J=7,8 Гц, 1H), 7,20-7,06 (м, 6H), 5,71-5,52 (м, 1H), 5,45 (д, J=9,0 Гц, 1H), 5,32 (д, J=10,9 Гц, 1H), 2,58 (дд, J=13,3, 6,0 Гц, 1H), 1,84-1,77 (м, 1H), 1,73-1,60 (м, 2H), 1,15-1,07 (м, 2H); МС (ESI-) m/z 560 (M-H)-.
Пример 109
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(трифторметил)-3,4-дигидро-2H-хромен-2-ил]циклогексанкарбоновая кислота
Пример 109A
метил 3-((2R,4R)-4-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-7-(трифторметил)хроман-2-ил)циклогексанкарбоксилат
К 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоте (52,2 мг, 0,215 ммоль) в DMF (1 мл) добавляли HATU (1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиний 3-оксид гексафторфосфат) (112 мг, 0,294 ммоль). Смесь перемешивали в течение 5 минут при комнатной температуре, с последующим последовательным добавлением метил 3-((2R,4R)-4-амино-7-(трифторметил)хроман-2-ил)циклогексанкарбоксилата (70 мг, 0,196 ммоль) и N-этил-N-изопропилпропан-2-амина (0,136 мл, 0,784 ммоль). Смесь перемешивали при температуре окружающей среды в течение 2 часов. ЖХ/МС показал, что реакция завершилась. Очистка с помощью хроматографии на 12 г картридже с силикагелем, элюирование 5-40% этилацетата в гептане, давало указанное в заголовке соединение (40 мг, 0,069 ммоль, выход 35,1%). МС (ESI+) m/z 581,9 (M+H)+.
Пример 109B
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(трифторметил)-3,4-дигидро-2H-хромен-2-ил]циклогексанкарбоновая кислота
Смесь соединения примера 109A (36 мг, 0,062 ммоль) и водный раствор NaOH (2 M, 0,2 мл) в метаноле (1 мл) перемешивали при 35°С в течение 2 часов. Растворитель удалили и добавляли воду (0,5 мл). Значение pH смеси доводили до 1~2. Осажденное твердое вещество собирали с помощью фильтрования, промывали водой, и сушили с получением указанного в заголовке соединения (28 мг, 80%),1H ЯМР (400 МГц, CDCl3) δ 7,21-6,97 (м, 6H), 5,49-5,24 (м, 2H), 3,98 (дт, J=11,4, 6,3 Гц, 1H), 2,38 (д, J=10,9 Гц, 1H), 2,25 (дд, J=13,2, 5,3 Гц, 2H), 2,10-1,86 (м, 3H), 1,72 (ддд, J=27,0, 10,1, 3,8 Гц, 4H), 1,58-1,41 (м, 2H), 1,35 (кв, J=12,8, 11,7 Гц, 2H), 1,12 (д, J=3,5 Гц, 2H),); МС (ESI+) m/z 567,9 (M+H)+.
Пример 110
метил 4-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]бензоат
Пример 110A
(R)-метил 4-(7-метокси-4-оксохроман-2-ил)бензоат
В 20 мл сосуд загружали бис(2,2,2-трифторацетокси)палладий (0,264 г, 0,795 ммоль), (S)-4-(трет-бутил)-2-(пиридин-2-ил)-4,5-дигидрооксазол (0,195 г, 0,954 ммоль), гексафторфосфат(V) аммония (0,777 г, 4,77 ммоль) и (4-(метоксикарбонил)фенил)бороновую кислоту (2,86 г, 15,89 ммоль). Реакционную смесь перемешивали в дихлорэтане (5 мл) в течение 5 минут и наблюдали суспензию бледно-коричневого цвета. К этой суспензии добавляли соединение из примера 5A (1,4 г, 7,95 ммоль) и воду (0,716 мл, 39,7 ммоль) и боковые стороны сосуда промывали большим количеством дихлорэтана (5 мл). Сосуд закрывали крышкой и смесь перемешивали при 60°С в течение ночи. Смесь фильтровали через слой силикагеля и целита и элюировали этилацетатом, получая раствор красного цвета. Растворитель удаляли при пониженном давлении и неочищенный материал хроматографировали, используя 24 г картридж с силикагелем с градиентом 5-60% этилацетат/гептаны в течение 20 минут, белое твердое вещество осаждалось в середине сбора фракций и закупоривало линию в ИК-детекторе. Выходную линию очищали и белое твердое вещество отфильтровывали, фильтрат концентрировали и снова хроматографировали, используя картридж 12 г, элюируя 100% дихлорметаном, с получением белого твердого вещества, которое объединяли с получением указанного в заголовке соединения (1,6 г, 5,12 ммоль, выход 64,5%)).1H ЯМР (400 МГц, ДМСО-d6) δ 8,02 (дд, J=8,4, 2,1 Гц, 2H), 7,75-7,72 (м, 1H), 7,70 (д, J=8,4 Гц, 2H), 6,72-6,66 (м, 2H), 5,77 (дд, J=12,9, 3,1 Гц, 1H), 3,87 (с, 3H), 3,83 (д, J=2,0 Гц, 3H), 3,14 (дд, J=16,8, 12,9 Гц, 1H), 2,82 (дд, J=16,7, 3,1 Гц, 1H); МС (ESI+) m/z 313 (M+H)+.
Пример 110B
(R)-метил 4-(7-метокси-4-(метоксиимино)хроман-2-ил)бензоат
Раствор соединения из примера 110A (0,6 г, 1,921 ммоль), O-метилгидроксиламина гидрохлорида (0,241 г, 2,88 ммоль) в пиридине (1,921 мл) в 20 мл сосуде перемешивали при температуре окружающей среды в течение 5 минут и при температуре 65°C в течение 1 часа. Растворитель удаляли при пониженном давлении. Неочищенный материал растворяли в 10% метаноле/дихлорметане и промывали водой. Органический слой отделяли и концентрировали в вакууме. Полученное белое твердое вещество промывали смесью 10% дихлорметан/гексан и собирали фильтрованием с получением указанных в заголовке соединений в виде белого твердого вещества (0,581 г, 1,702 ммоль, выход 89%).1H ЯМР (400 МГц, ДМСО-d6) δ 8,03-7,96 (м, 2H), 7,71 (д, J=8,7 Гц, 1H), 7,69-7,63 (м, 2H), 6,62 (дд, J=8,8, 2,5 Гц, 1H), 6,59 (д, J=2,5 Гц, 1H), 5,32 (дд, J=11,8, 3,2 Гц, 1H), 3,88 (с, 3H), 3,87 (с, 3H), 3,76 (с, 3H), 3,36 (д, J=3,4 Гц, 1H), 2,71 (дд, J=17,1, 11,9 Гц, 1H); МС (ESI+) m/z 342 (M+H)+.
Пример 110C
метил 4-((2R,4R)-4-амино-7-метоксихроман-2-ил)бензоат
К смеси соединения из примера 110B (580 мг, 1,69 ммоль) и уксусной кислоте (20 мл) добавляли платину (180 мг, 0,923 ммоль) в 50 мл сосуде для реакций под давлением и перемешивали в течение 32 часов при 30 фунт/кв.дюйм водорода и при температуре окружающей среды. Реакционную смесь фильтровали, и фильтрат концентрировали при пониженном давлении. Полученное масло очищали с помощью флэш-хроматографии на картридже 24 г и элюировали смесью 5-70% этилацетат/гептан в течение 20 минут с получением указанного в заголовке соединения (240 мг, 0,766 ммоль, выход 45,1%) в виде белого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ 8,06-7,97 (м, 2H), 7,64-7,57 (м, 2H), 7,47 (д, J=8,5 Гц, 1H), 6,52 (дд, J=8,6, 2,6 Гц, 1H), 6,38 (д, J=2,5 Гц, 1H), 5,29 (дд, J=11,9, 1,7 Гц, 1H), 4,07 (дд, J=11,0, 5,7 Гц, 1H), 3,87 (с, 3H), 3,70 (с, 3H), 2,28 (ддд, J=13,1, 5,7, 1,9 Гц, 1H), 1,72 (дт, J=13,0, 11,4 Гц, 1H); МС (ESI+) m/z 314 (M+H)+.
Пример 110D
метил 4-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]бензоат
К 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоте (83 мг, 0,345 ммоль) в DMF (1 мл) добавляли HATU (1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиний 3-оксид гексафторфосфат) (183 мг, 0,483 ммоль). Раствор перемешивали в течение 15 минут при комнатной температуре с последующим последовательным добавлением соединения из примера 11°C (108 мг, 0,345 ммоль) и триэтиламина (0,144 мл, 1,034 ммоль). Смесь перемешивали при температуре окружающей среды в течение 5 часов и добавляли воду (10 мл). Полученный белый осадок фильтровали и очищали с помощью флэш-хроматографии на картридже 12 г, элюируя смесью 5-60% этилацетат/гептан в течение 20 минут с получением указанного в заголовке соединения (126 мг, 0,234 ммоль, выход 68,0%) в виде белого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ 8,00-7,94 (м, 2H), 7,58-7,52 (м, 2H), 7,37 (д, J=1,7 Гц, 1H), 7,29 (д, J=8,3 Гц, 1H), 7,18 (дд, J=8,4, 1,7 Гц, 1H), 7,15 (д, J=8,9 Гц, 1H), 6,93 (дд, J=8,5, 1,1 Гц, 1H), 6,51 (дд, J=8,6, 2,6 Гц, 1H), 6,39 (д, J=2,5 Гц, 1H), 5,33 (кв, J=9,5, 8,4 Гц, 2H), 3,84 (с, 3H), 3,67 (с, 3H), 2,11-1,99 (м, 2H), 1,54-1,41 (м, 1H), 1,41-1,29 (м, 1H), 1,07-0,96 (м, 2H); МС (ESI-) m/z 536 (M-H)-.
Пример 111
4-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]бензойная кислота
К раствору соединения из примера 110D (81 мг, 0,151 ммоль) в этаноле (1 мл) и тетрагидрофурана (0,4 мл) добавляли 3 н. гидроксида натрия (0,201 мл, 0,603 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Реакцию гасили HCl (1 н, 1 мл) и добавляли воду (2 мл). Органические вещества удаляли под потоком азота с получением не совсем белого осадка. Осадок собирали фильтрованием, промывали водой, и затем очищали с помощью флэш-хроматографии на картридже с силикагелем 12 г и элюировали с градиентом 5-90% этилацетат/гептан в течение 20 минут с получением указанного в заголовке соединения (65 мг, 0,124 ммоль, выход 82%) в виде белого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ 12,93 (с, 1H), 7,95 (д, J=8,2 Гц, 2H), 7,51 (д, J=8,3 Гц, 2H), 7,37 (д, J=1,7 Гц, 1H), 7,29 (д, J=8,3 Гц, 1H), 7,21-7,12 (м, 2H), 6,93 (д, J=8,5 Гц, 1H), 6,50 (дд, J=8,6, 2,6 Гц, 1H), 6,39 (д, J=2,5 Гц, 1H), 5,39-5,28 (м, 2H), 3,67 (с, 3H), 2,04 (тд, J=7,9, 2,3 Гц, 2H), 1,51-1,43 (м, 1H), 1,41-1,33 (м, 1H), 1,03 (кв, J=2,6 Гц, 2H); МС (ESI+) m/z 522 (M-H)-.
Пример 112
метил rac-3-[(2R,4R)-7-хлор-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил]бензоат
Пример 112A
метил 3-(3-(6-хлор-2-фторпиридин-3-ил)-3-гидроксипропаноил)бензоат
Раствор метил 3-ацетилбензоата (1 г, 5,61 ммоль) в тетрагидрофуране (25 мл) охлаждали до -78°C, обрабатывали по каплям 1М бис(триметилсилил)амидом лития в тетрагидрофуране (7,30 мл, 7,30 ммоль), перемешивали при -78°C в течение 15 минут, обрабатывали по каплям раствором 6-хлор-2-фторникотинальдегида (0,895 г, 5,61 ммоль) в тетрагидрофуране (10 мл), перемешивали при температуре -78°C в течение 15 минут, обрабатывали насыщенным раствором NH4Cl (30 мл) и смеси давали нагреться до комнатной температуры. Смесь экстрагировали этилацетатом (30 мл) и слои разделяли. Водный слой экстрагировали этилацетатом (20 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали. Остаток хроматографировали на силикагеле и элюировали с градиентом 20%-100% этилацетата в гептанах с получением указанного в заголовке соединения (1,35 г, 4,00 ммоль, выход 71,2%).1H ЯМР (400 МГц, CDCl3) δ м.д. 8,56 (т, J=1,8 Гц, 1H), 8,28 (дт, J=7,7, 1,5 Гц, 1H), 8,15 (дт, J=7,9, 1,6 Гц, 1H), 8,10-8,05 (м, 1H), 7,59 (т, J=7,8 Гц, 1H), 7,30 (дд, J=7,8, 1,0 Гц, 1H), 5,53 (дт, J=9,4, 2,9 Гц, 1H), 3,96 (с, 3H), 3,89 (д, J=3,9 Гц, 1H), 3,55 (дд, J=18,0, 2,4 Гц, 1H), 3,29 (дд, J=18,0, 9,3 Гц, 1H); МС (ESI) m/z 338 (M+H)+.
Пример 112B
Раствор соединения примера 112A (1,35 г, 4,00 ммоль) в тетрагидрофуране (40 мл) в атмосфере N2 охлаждали до -78°C, обрабатывали 1 М диэтилметоксибораном в тетрагидрофуране (4,40 мл, 4,40 ммоль), перемешивали при температуре -78°C в течение 15 минут, обрабатывали NaBH4 (0,166 г, 4,40 ммоль), перемешивали при температуре -78°C в течение 30 минут, обрабатывали уксусной кислотой (4 мл) и оставляли нагреваться до комнатной температуры. Смесь концентрировали почти до сухости. Остаток разделяли между трет-бутилметиловым эфиром (приблизительно 30 мл) и 0,5 M NaOH (40 мл). Слои разделяли и органический слой промывали 1 M NaOH (дважды), промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали с получением указанного в заголовке соединения (1,38 г, 4,06 ммоль, выход 102%) в виде смеси изомеров. ЯМР основного изомера:1H ЯМР (400 МГц, CDCl3) δ м.д. 8,05-7,96 (м, 2H), 7,96-7,92 (м, 1H), 7,59-7,54 (м, 1H), 7,42 (т, J=7,7 Гц, 1H), 7,23 (д, J=7,7 Гц, 1H), 5,25 (т, J=6,2 Гц, 1H), 5,18-5,12 (м, 1H), 4,47 (с, 1H), 3,91 (с, 3H), 3,55 (с, 1H), 2,05-2,00 (м, 2H); МС (ESI) m/z 340 (M+H)+.
Пример 112C
метил rac-3-((2R,4R)-7-хлор-4-гидрокси-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил)бензоат
Раствор соединения из примера 112B (1,38 г, 4,06 ммоль) в 2-метил-тетрагидрофуране (40 мл) обрабатывали 1,8-диазабицикло[5.4.0]ундец-7-еном (приблизительно 3 мл) и нагревали при 75°С в течение 16 часов и затем нагревали при 80°С в течение 24 часов. Смесь охлаждали, разбавляли этилацетатом и промывали 10% раствором лимонной кислоты. Этот кислый водный слой экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали. Остаток хроматографировали на силикагеле и элюировали с градиентом 25%-100% этилацетата в гептанах с получением указанного в заголовке соединения в виде первого элюированного изомера.1H ЯМР (400 МГц, CDCl3) δ м.д. 8,08 (с, 1H), 8,00 (дт, J=7,8, 1,5 Гц, 1H), 7,85 (дд, J=7,8, 1,1 Гц, 1H), 7,65 (д, J=6,7 Гц, 1H), 7,46 (т, J=7,7 Гц, 1H), 6,99 (д, J=7,9 Гц, 1H), 5,35 (дд, J=11,9, 1,9 Гц, 1H), 5,12 (дд, J=10,0, 5,8 Гц, 1H), 3,92 (с, 3H), 2,55 (ддд, J=13,4, 6,0, 2,0 Гц, 1H), 2,11 (ддд, J=13,3, 12,0, 10,8 Гц, 1H).
Пример 112D
метил rac-3-((2R,4S)-7-хлор-4-гидрокси-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил)бензоат
Указанное в заголовке соединение выделяли в виде второго элюированного изомера в результате колоночной хроматографии, как описано в примере 112C.1H ЯМР (400 МГц, CDCl3) δ м.д. 8,07 (с, 1H), 7,98 (д, J=7,9 Гц, 1H), 7,66 (д, J=7,8 Гц, 1H), 7,63 (д, J=7,7 Гц, 1H), 7,43 (т, J=7,7 Гц, 1H), 6,95 (д, J=7,7 Гц, 1H), 5,53 (дд, J=11,9, 2,2 Гц, 1H), 4,87 (т, J=3,0 Гц, 1H), 3,90 (с, 3H), 3,25 (с, 1H), 2,32 (дт, J=14,7, 2,5 Гц, 1H), 2,12-2,03 (м, 1H).
Пример 112E
метил rac-3-((2R,4R)-4-азидо-7-хлор-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил)бензоат
Раствор соединения примера 112D (122 мг, 0,382 ммоль) в тетрагидрофуране (2 мл) в атмосфере N2 охлаждали до 0°C, обрабатывали 1,8-диазабицикло[5.4.0]ундец-7-еном (115 мкл, 0,763 ммоль), обрабатывали дифенилфосфорилазидом (140 мкл, 0,649 ммоль) и перемешивали в течение выходных при комнатной температуре. Смесь разделяли между этилацетатом и насыщенным раствором NaHCO3. Этилацетатный слой промывали 10% раствором лимонной кислоты, промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали. Остаток хроматографировали на силикагеле и элюировали с градиентом 10%-100% этилацетата в гептанах с получением указанного в заголовке соединения (104,7 мг, 0,304 ммоль, выход 80%).1H ЯМР (400 МГц, CDCl3) δ м.д. 8,12 (с, 1H), 8,05 (д, J=7,7 Гц, 1H), 7,75 (д, J=7,9 Гц, 1H), 7,69 (д, J=7,7 Гц, 1H), 7,50 (т, J=7,8 Гц, 1H), 7,06 (д, J=7,9 Гц, 1H), 5,40 (д, J=11,4 Гц, 1H), 4,85 (дд, J=11,3, 6,0 Гц, 1H), 3,94 (с, 3H), 2,65 (ддд, J=13,5, 6,0, 1,9 Гц, 1H), 2,33-2,17 (м, 1H); МС (ESI) m/z 345 (M+H)+.
Пример 112F
метил rac-3-((2R,4R)-4-амино-7-хлор-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил)бензоат
Раствор соединения примера 112E (104,7 мг, 0,304 ммоль) и трифенилфосфина (159 мг, 0,607 ммоль) в тетрагидрофуране (1 мл) и H2O (219 мкл, 12,15 ммоль) нагревали при 70°C в течение 2 часов. Добавляли 2-метил-тетрагидрофуран и реакционную смесь нагревали при 90°C так, что тетрагидрофуран удаляли из реакционной смеси и смесь нагревали при 90°C в течени ночи. Смесь охлаждали и распределяли между трет-бутилметиловым эфиром (20 мл) и 1 M HCl (5 мл). Слои разделяли и водный слой промывали трет-бутилметиловым эфиром. Водный слой, обработанный этилацетатом (20 мл), подщелачивали до значения pH> 7 с помощью 1 М NaOH и экстрагировали. Этилацетатный слой промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали с получением указанного в заголовке соединения (64 мг, 0,201 ммоль, выход 66,1%).1H ЯМР (501 МГц, CDCl3) δ м.д. 8,11 (т, J=1,8 Гц, 1H), 8,02 (дт, J=7,8, 1,4 Гц, 1H), 7,91 (дд, J=7,9, 1,1 Гц, 1H), 7,69 (д, J=7,9 Гц, 1H), 7,48 (т, J=7,7 Гц, 1H), 7,01 (д, J=7,9 Гц, 1H), 5,38 (дд, J=11,9, 2,0 Гц, 1H), 4,28 (дд, J=11,2, 5,6 Гц, 1H), 3,93 (с, 3H), 2,48 (ддд, J=13,5, 5,6, 2,0 Гц, 1H), 1,94 (дт, J=13,5, 11,6 Гц, 1H); МС (ESI) m/z 319 (M+H)+.
Пример 112G
метил rac-3-[(2R,4R)-7-хлор-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил]бензоат
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 100F, используя соединение из примера 112F вместо соединения из примера 100Е.1H ЯМР (400 МГц, CDCl3) δ м.д. 8,06 (д, J=1,7 Гц, 1H), 8,00 (д, J=7,9 Гц, 1H), 7,61 (д, J=7,7 Гц, 1H), 7,47-7,40 (м, 2H), 7,11 (дд, J=8,3, 1,6 Гц, 1H), 7,08 (д, J=1,6 Гц, 1H), 7,02 (д, J=8,1 Гц, 1H), 6,96 (д, J=7,9 Гц, 1H), 5,50 (тд, J=10,5, 10,1, 6,1 Гц, 1H), 5,38 (д, J=3,9 Гц, 1H), 5,36 (с, 1H), 3,92 (с, 3H), 2,50 (ддд, J=13,6, 6,1, 2,0 Гц, 1H), 1,84 (дт, J=13,6, 11,4 Гц, 1H), 1,77-1,63 (м, 2H), 1,16-1,06 (м, 2H); МС (ESI) m/z 543 (M+H)+.
Пример 113
метил rac-3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-фтор-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил]бензоат
Пример 113A
метил 3-(3-(2,6-дифторпиридин-3-ил)-3-гидроксипропаноил)бензоат
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 112А, используя 2,6-дифторникотинальдегид (CAS#155601-65-3) вместо 6-хлор-2-фторникотинальдегида.1H ЯМР (400 МГц, CDCl3) δ м.д. 8,87 (т, J=1,8 Гц, 1H), 8,59 (дт, J=7,9, 1,5 Гц, 1H), 8,54-8,49 (м, 1H), 8,47 (дт, J=8,0, 1,5 Гц, 1H), 7,90 (т, J=7,8 Гц, 1H), 7,21 (дд, J=8,1, 2,8 Гц, 1H), 5,86 (дт, J=9,3, 2,8 Гц, 1H), 4,27 (с, 3H), 4,18 (д, J=3,7 Гц, 1H), 3,85 (дд, J=18,0, 2,5 Гц, 1H), 3,61 (дд, J=18,0, 9,3 Гц, 1H); МС (ESI) m/z 339 (M+NH4)+.
Пример 113B
метил 3-(3-(2,6-дифторпиридин-3-ил)-1,3-дигидроксипропил)бензоат
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 112В, используя соединение из примера 113А вместо соединения из примера 112А. МС (ESI) m/z 341 (M+NH4)+.
Пример 113C
метил rac-3-((2R,4R)-7-фтор-4-гидрокси-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил)бензоат
Указанное в заголовке соединение выделяли в качестве первого элюированного изомера при получении с использованием способа, аналогичного способу, описанному в примере 112C, используя соединение примера 113B вместо соединения примера 112B.1H ЯМР (400 МГц, CDCl3) δ м.д. 8,09 (с, 1H), 8,03-7,95 (м, 2H), 7,65 (д, J=7,7 Гц, 1H), 7,47 (т, J=7,7 Гц, 1H), 6,59 (дд, J=8,1, 2,7 Гц, 1H), 5,36 (дд, J=11,9, 2,0 Гц, 1H), 5,17-5,08 (м, 1H), 3,92 (с, 3H), 2,60 (ушир, 1H), 2,56 (ддд, J=13,4, 6,1, 2,1 Гц, 1H), 2,12 (ддд, J=13,4, 12,0, 10,6 Гц, 1H); МС (ESI) m/z 304 (M+H)+.
Пример 113D
метил rac-3-((2R,4S)-7-фтор-4-гидрокси-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил)бензоат
Указанное в заголовке соединение выделяли в качестве второго элюированного изомера при получении с использованием способа, аналогичного способу, описанному в примере 112C, используя соединение примера 113B вместо соединения примера 112B.1H ЯМР (400 МГц, CDCl3) δ м.д. 8,14 (т, J=1,8 Гц, 1H), 8,03 (дт, J=7,7, 1,3 Гц, 1H), 7,80 (т, J=8,0 Гц, 1H), 7,70 (д, J=7,8 Гц, 1H), 7,48 (т, J=7,7 Гц, 1H), 6,61 (дд, J=8,0, 2,8 Гц, 1H), 5,55 (дд, J=12,0, 2,2 Гц, 1H), 4,90 (кв, J=3,3 Гц, 1H), 3,93 (с, 3H), 2,34 (дт, J=14,5, 2,5 Гц, 1H), 2,23 (д, J=4,0 Гц, 1H), 2,14 (ддд, J=14,9, 11,9, 3,4 Гц, 1H); МС (ESI) m/z 304 (M+H)+.
Пример 113E
метил rac-3-((2R,4R)-4-азидо-7-фтор-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил)бензоат
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 112Е, используя соединение из примера 113D вместо соединения из примера 112D.1H ЯМР (400 МГц, CDCl3) δ м.д. 8,13 (т, J=1,8 Гц, 1H), 8,06 (дт, J=7,8, 1,5 Гц, 1H), 7,88 (тд, J=8,0, 1,0 Гц, 1H), 7,70 (д, J=7,7 Гц, 1H), 7,51 (т, J=7,7 Гц, 1H), 6,66 (дд, J=8,2, 2,8 Гц, 1H), 5,41 (дд, J=11,8, 2,0 Гц, 1H), 4,84 (дд, J=11,1, 6,0 Гц, 1H), 3,94 (с, 3H), 2,66 (ддд, J=13,5, 6,0, 2,1 Гц, 1H), 2,26 (дт, J=13,4, 11,4 Гц, 1H); МС (ESI) m/z 329 (M+H)+.
Пример 113F
метил rac-3-((2R,4R)-4-амино-7-фтор-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил)бензоат
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 112F, используя соединение из примера 113Е вместо соединения из примера 112Е.1H ЯМР (400 МГц, CDCl3) δ м.д. 8,12 (с, 1H), 8,05-8,00 (м, 2H), 7,68 (д, J=7,6 Гц, 1H), 7,48 (т, J=7,7 Гц, 1H), 6,60 (дд, J=8,1, 2,9 Гц, 1H), 5,39 (д, J=12,1 Гц, 1H), 4,33-4,23 (м, 1H), 3,93 (с, 3H), 2,49 (ддд, J=13,1, 5,3, 1,4 Гц, 1H), 1,94 (дт, J=13,7, 11,6 Гц, 1H).
Пример 113G
метил rac-3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-фтор-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил]бензоат
Раствор соединения из примера 113F (3,5 мг, 0,012 ммоль) в CH2Cl2 (0,5 мл) обрабатывали 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбонилхлоридом (CAS# 1004294-65-8) (3,92 мг, 0,015 ммоль) и триэтиламином (4,84 мкл, 0,035 ммоль). Смесь перемешивали в течение ночи при комнатной температуре. Смесь разделяли между трет-бутилметиловым эфиром и 10% лимонной кислотой. Слои разделяли и слой трет-бутилметилового эфира промывали насыщенным раствором NaHCO3, промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали. Остаток хроматографировали на силикагеле и элюировали с градиентом 50%-100% [9:1 CH2Cl2:этилацетат] в гептане с получением указанного в заголовке соединения (1,7 мг, 3,23 мкмоль, выход 27,9%).1H ЯМР (400 МГц, CDCl3) δ м.д. 8,07 (с, 1H), 8,01 (д, J=7,8 Гц, 1H), 7,61 (д, J=7,7 Гц, 1H), 7,55 (т, J=8,0 Гц, 1H), 7,45 (т, J=7,7 Гц, 1H), 7,11 (дд, J=8,2, 1,6 Гц, 1H), 7,07 (д, J=1,6 Гц, 1H), 7,02 (д, J=8,2 Гц, 1H), 6,57 (дд, J=8,1, 2,8 Гц, 1H), 5,54-5,46 (м, 1H), 5,42-5,30 (м, 2H), 3,92 (с, 3H), 2,52 (ддд, J=13,7, 6,1, 2,1 Гц, 1H), 1,86 (дт, J=13,2, 11,1 Гц, 1H), 1,78-1,63 (м, 2H), 1,11 (кв, J=2,5 Гц, 2H); МС (ESI) m/z 525 (M-H)-.
Пример 114
rac-3-[(2R,4R)-7-хлор-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил]бензойная кислота
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 28, используя соединение из примера 112G вместо соединения из примера 30.1H ЯМР (400 МГц, CDCl3) δ м.д. 8,16 (с, 1H), 8,06 (д, J=8,2 Гц, 1H), 7,68 (д, J=7,7 Гц, 1H), 7,47 (т, J=7,8 Гц, 1H), 7,43 (дд, J=8,0, 1,1 Гц, 1H), 7,13 (дд, J=8,1, 1,7 Гц, 1H), 7,09 (д, J=1,7 Гц, 1H), 7,03 (д, J=8,2 Гц, 1H), 6,96 (д, J=8,0 Гц, 1H), 5,57 (тд, J=10,3, 6,0 Гц, 1H), 5,47-5,39 (м, 2H), 2,57 (ддд, J=13,5, 6,0, 2,0 Гц, 1H), 1,84 (дт, J=13,4, 11,3 Гц, 1H), 1,79-1,66 (м, 2H), 1,18-1,08 (м, 2H); МС (ESI) m/z 527 (M-H)-.
Пример 115
трет-бутил 3-[4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]азетидин-1-карбоксилат
Пример 115A
трет-бутил 3-(1-гидрокси-3-(2-гидрокси-4-метоксифенил)-3-оксопропил)азетидин-1-карбоксилат
Указанное в заголовке соединение получали, используя способом, аналогичный способу, описанному в примере 100A, используя 1-(2-гидрокси-4-метоксифенил)этанон вместо 4'-фтор-2'-гидроксиацетофенона, и используя трет-бутил 3-формилазетидин-1-карбоксилат вместо бензил 3-оксоазетидин-1-карбоксилата.1H ЯМР (400 МГц, CDCl3) δ м.д. 12,47 (с, 1H), 7,58 (д, J=8,8 Гц, 1H), 6,47-6,42 (м, 2H), 4,37-4,30 (м, 1H), 4,04-3,91 (м, 3H), 3,85 (с, 3H), 3,72 (дд, J=8,6, 5,6 Гц, 1H), 3,27 (д, J=3,6 Гц, 1H), 3,03 (дд, J=17,2, 2,6 Гц, 1H), 2,93 (дд, J=17,1, 9,0 Гц, 1H), 2,70-2,60 (м, 1H), 1,44 (с, 9H); МС (ESI) m/z 350 (M-H)-.
Пример 115B
трет-бутил 3-(7-метокси-4-оксохроман-2-ил)азетидин-1-карбоксилат
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 100В, используя соединение из примера 115А вместо соединения из примера 100А.1H ЯМР (400 МГц, CDCl3) δ м.д. 7,82 (д, J=8,8 Гц, 1H), 6,60 (дд, J=8,8, 2,3 Гц, 1H), 6,44 (д, J=2,3 Гц, 1H), 4,56 (кв, J=7,7 Гц, 1H), 4,15-3,99 (м, 4H), 3,84 (с, 3H), 2,91-2,81 (м, 1H), 2,57 (д, J=7,8 Гц, 2H), 1,46 (с, 9H); МС (ESI) m/z 665 (2M-H)-.
Пример 115C
трет-бутил 3-(7-метокси-4-(метоксиимино)хроман-2-ил)азетидин-1-карбоксилат
Раствор соединения из примера 115B (54 мг, 0,162 ммоль) и O-метилгидроксиламина гидрохлорида (40,6 мг, 0,486 ммоль) в пиридине (1 мл) нагревали при температуре 60°C в течение 90 минут и затем концентрировали для удаления пиридина. Остаток разделяли между этилацетатом (~ 30 мл) и водой (~ 10 мл). Слои разделяли и этилацетатный слой промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали с получением указанного в заголовке соединения (57 мг, 0,157 ммоль, выход 97%).1H ЯМР (400 МГц, CDCl3) δ м.д. 7,78 (д, J=8,8 Гц, 1H), 6,54 (дд, J=8,8, 2,5 Гц, 1H), 6,41 (д, J=2,6 Гц, 1H), 4,15 (ддд, J=12,1, 7,4, 3,1 Гц, 1H), 4,08-3,95 (м, 3H), 3,94 (с, 3H), 3,85 (ддд, J=8,9, 6,1, 2,8 Гц, 1H), 3,79 (с, 3H), 3,15 (дд, J=17,0, 3,0 Гц, 1H), 2,80 (квт, J=8,0, 5,6 Гц, 1H), 2,22 (дд, J=17,0, 12,0 Гц, 1H), 1,45 (с, 9H); МС (ESI) m/z 307 (M-tBu)+.
Пример 115D
трет-бутил 3-(4-амино-7-метоксихроман-2-ил)азетидин-1-карбоксилат
Указанное в заголовке соединение (в виде смеси цис- и транс-изомеров в соотношении 1:1) получали, используя способ, аналогичный способу, описанному в примере 33Е, используя соединение примера 115С вместо соединения примера 33D.1H ЯМР (400 МГц, CDCl3) δ м.д. 7,32 (д, J=8,5 Гц, 0,5H), 7,26 (с, 0,5H), 7,11 (д, J=8,4 Гц, 0,5H), 6,98 (с, 0,5H), 6,53 (дд, J=8,8, 2,6 Гц, 0,5H), 6,51 (дд, J=8,6, 2,5 Гц, 0,5H), 6,40 (д, J=2,5 Гц, 0,5H), 6,36 (д, J=2,5 Гц, 0,5H), 4,34 (тд, J=7,9, 4,6 Гц, 0,5H), 4,20 (дд, J=10,3, 7,6 Гц, 0,5H), 4,10-3,80 (м, 6H), 3,76 (с, 3H), 2,82-2,69 (м, 1H), 2,11 (ддд, J=13,1, 6,0, 1,7 Гц, 0,5H), 1,75-1,69 (м, 1H), 1,45 (с, 5H), 1,43 (с, 4H); МС (ESI) m/z 355 (M+H)+.
Пример 115E
трет-бутил 3-[4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]азетидин-1-карбоксилат
Используя способ, аналогичный способу, описанному в примере 100F, используя соединение примера 115D вместо соединения примера 100E, и неочищенный продукт хроматографировали на силикагеле, элюируя градиентом 5%-100% этилацетата в CH2Cl2, с получением указанного в заголовке соединения в виде смеси цис- и транс-изомеров в соотношении 1:1.1H ЯМР (400 МГц, CDCl3) δ м.д. 7,15 (дд, J=8,1, 1,7 Гц, 0,5H), 7,13-7,09 (м, 1H), 7,07 (д, J=1,7 Гц, 0,5H), 7,02 (д, J=8,2 Гц, 0,5H), 7,01-6,96 (м, 1H), 6,89 (д, J=8,6 Гц, 0,5H), 6,49-6,45 (м, 1H), 6,35-6,32 (м, 1H), 5,44 (д, J=6,5 Гц, 0,5H), 5,33 (д, J=8,7 Гц, 0,5H), 5,28-5,20 (м, 0,5H), 4,92 (ддд, J=6,8, 4,6, 2,4 Гц, 0,5H), 4,19 (ддд, J=11,6, 6,9, 1,6 Гц, 0,5H), 4,06-3,95 (м, 2H), 3,93-3,88 (м, 1H), 3,86-3,75 (м, 1,5H), 3,74 (с, 1,5H), 3,73 (с, 1,5H), 2,78-2,64 (м, 1H), 2,22 (ддд, J=12,9, 6,0, 1,6 Гц, 0,5H), 2,01 (дт, J=14,2, 2,2 Гц, 0,5H), 1,76-1,61 (м, 2H), 1,46 (с, 4,5H), 1,44 (с, 4,5H), 1,07 (дкв, J=11,6, 2,4, 2,0 Гц, 2H); МС (ESI) m/z 557(M-H)-.
Пример 116
N-[2-(азетидин-3-ил)-7-метокси-3,4-дигидро-2H-хромен-4-ил]-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропанкарбоксамид
Раствор соединения примера 115E (65,6 мг, 0,117 ммоль) в трифторуксусной кислоте (1 мл) нагревали при 55°С в течение 2 минут и концентрировали досуха. Остаток разделяли между 1 M NaOH (5 мл) и CH2Cl2 (25 мл). Водный слой экстрагировали CH2Cl2 (10 мл). Объединенные слои CH2Cl2 сушили (MgSO4), фильтровали и концентрировали с получением указанного в заголовке соединения (40 мг, 0,087 ммоль, выход 74,3%).1H ЯМР (400 МГц, CDCl3) δ м.д. 7,15 (дд, J=8,1, 1,6 Гц, 0,5H), 7,12-7,09 (м, 1H), 7,08 (д, J=1,7 Гц, 0,5H), 7,04-6,96 (м, 1,5H), 6,89 (дд, J=8,6, 1,0 Гц, 0,5H), 6,46 (ддд, J=8,6, 3,8, 2,6 Гц, 1H), 6,37 (д, J=2,6 Гц, 0,5H), 6,35 (д, J=2,6 Гц, 0,5H), 5,45 (д, J=6,7 Гц, 0,5H), 5,33 (д, J=8,8 Гц, 0,5H), 5,24 (тд, J=9,8, 8,7, 6,1 Гц, 0,5H), 4,91 (ддд, J=6,9, 4,7, 2,6 Гц, 0,5H), 4,23 (ддд, J=11,7, 7,0, 1,7 Гц, 0,5H), 3,90 (ддд, J=11,5, 7,0, 2,0 Гц, 0,5H), 3,86-3,55 (м, 4H), 3,74 (с, 1,5H), 3,74 (с, 1,5H), 3,01-2,87 (м, 1H), 2,21 (ддд, J=12,9, 6,2, 1,6 Гц, 0,5H), 1,97 (дт, J=14,3, 2,3 Гц, 0,5H), 1,75-1,60 (м, 2H), 1,12-1,01 (м, 2H); МС (ESI) m/z 459 (M+H)+.
Пример 117
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-{7-метокси-2-[1-(метилсульфонил)азетидин-3-ил]-3,4-дигидро-2H-хромен-4-ил}циклопропанкарбоксамид
Указанное в заголовке соединение в виде смеси цис и транс-изомеров в соотношении 1:1 получали с использованием способа, аналогичного способу, описанному в примере 101, используя соединение примера 116 вместо соединение примера 93 и неочищенный продукт хроматографировали на силикагеле, элюируя градиентом 5%-100% этилацетат в CH2Cl2.1H ЯМР (400 МГц, CDCl3) δ м.д. 7,16 (дд, J=8,1, 1,7 Гц, 0,5H), 7,13-7,10 (м, 1H), 7,07 (д, J=1,8 Гц, 0,5H), 7,05-6,97 (м, 1,5H), 6,90 (дд, J=8,6, 1,0 Гц, 0,5H), 6,51-6,47 (м, 1H), 6,32 (д, J=2,8 Гц, 0,5H), 6,31 (д, J=2,7 Гц, 0,5H), 5,44 (д, J=6,4 Гц, 0,5H), 5,34 (д, J=8,7 Гц, 0,5H), 5,28-5,21 (м, 0,5H), 4,92 (ддд, J=6,6, 4,6, 2,3 Гц, 0,5H), 4,22 (ддд, J=11,8, 6,0, 1,6 Гц, 0,5H), 4,04-3,82 (м, 4,5H), 3,74 (с, 1,5H), 3,74 (с, 1,5H), 2,90 (с, 1,5H), 2,89 (с, 1,5H), 2,87-2,77 (м, 1H), 2,22 (ддд, J=13,0, 6,1, 1,6 Гц, 0,5H), 2,01 (дт, J=14,1, 2,2 Гц, 0,5H), 1,76-1,63 (м, 2H), 1,12-1,04 (м, 2H); МС (ESI) m/z 535 (M-H)-.
Пример 118
метил rac-3-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-фтор-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил]бензоат
Пример 118A
метил rac-3-((2R,4S)-4-азидо-7-фтор-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил)бензоат
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 112Е, используя соединение из примера 113С вместо соединения из примера 112D.1H ЯМР (400 МГц, CDCl3) δ м.д. 8,13 (с, 1H), 8,04 (д, J=7,7 Гц, 1H), 7,74 (т, J=7,9 Гц, 1H), 7,68 (д, J=7,7 Гц, 1H), 7,50 (т, J=7,8 Гц, 1H), 6,66 (дд, J=8,1, 2,8 Гц, 1H), 5,46 (дд, J=11,7, 2,3 Гц, 1H), 4,75 (т, J=3,1 Гц, 1H), 3,93 (с, 3H), 2,31 (дт, J=14,4, 2,5 Гц, 1H), 2,19 (ддд, J=14,7, 11,6, 3,9 Гц, 1H); МС (ESI) m/z 329 (M+H)+.
Пример 118B
метил rac-3-((2R,4S)-4-амино-7-фтор-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил)бензоат
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 112F, используя соединение из примера 118А вместо соединения из примера 112Е.1H ЯМР (400 МГц, CDCl3) δ м.д. 8,13 (с, 1H), 8,02 (д, J=7,9 Гц, 1H), 7,75 (т, J=8,0 Гц, 1H), 7,69 (д, J=7,9 Гц, 1H), 7,48 (т, J=7,8 Гц, 1H), 6,59 (дд, J=8,0, 2,8 Гц, 1H), 5,57 (дд, J=10,5, 2,9 Гц, 1H), 4,15 (т, J=3,5 Гц, 1H), 3,93 (с, 3H), 2,21-2,07 (м, 2H); МС (ESI) m/z 303 (M+H)+.
Пример 118C
метил rac-3-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-фтор-3,4-дигидро-2H-пирано[2,3-b]пиридин-2-ил]бензоат
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 100F, используя соединение из примера 118В вместо соединения из примера 100Е.1H ЯМР (400 МГц, CDCl3) δ м.д. 7,97 (д, J=7,6 Гц, 1H), 7,93 (с, 0H), 7,58 (т, J=8,0 Гц, 1H), 7,44 (д, J=8,2 Гц, 1H), 7,39 (т, J=7,6 Гц, 1H), 7,18 (дд, J=8,1, 1,6 Гц, 1H), 7,15 (д, J=1,5 Гц, 1H), 7,06 (д, J=8,2 Гц, 1H), 6,44 (дд, J=8,2, 2,6 Гц, 1H), 5,89 (д, J=7,0 Гц, 1H), 5,09-4,96 (м, 2H), 3,94 (с, 3H), 2,28 (дт, J=14,4, 2,7 Гц, 1H), 2,12-1,99 (м, 1H), 1,75-1,63 (м, 2H), 1,19-1,05 (м, 2H); МС (ESI) m/z 525 (M-H)-.
Пример 119
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-8-фтор-3,4-дигидро-2H-хромен-2-ил]бензойная кислота
Пример 119A
8-фтор-4H-хромен-4-он
Указанное в заголовке соединение получали с использованием условий, аналогичных условиям, описанным в примере 39А, используя 1-(3-фтор-2-гидроксифенил)этанон вместо 1-(4-фтор-2-гидроксифенил)этанона.
Пример 119B
(R)-метил 3-(8-фтор-4-оксохроман-2-ил)бензоат
Указанное в заголовке соединение получали с использованием условий, аналогичных условиям, описанным в примере 39В, используя соединение из примера 119А вместо соединения из примера 39А.
Пример 119C
(R)-метил 3-(8-фтор-4-(метоксиимино)хроман-2-ил)бензоат
Указанное в заголовке соединение получали с использованием условий, аналогичных условиям, описанным в примере 39С, используя соединение из примера 119В вместо соединения из примера 39B.
Пример 119D
метил 3-((2R,4R)-4-амино-8-фторхроман-2-ил)бензоат
Указанное в заголовке соединение получали с использованием условий, аналогичных условиям, описанным в примере 39D, используя соединение из примера 119С вместо соединения из примера 39С.
Пример 119E
метил 4-((2R,4R)-4-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-8-фторхроман-2-ил)бензоат
Указанное в заголовке соединение получали с использованием условий, аналогичных условиям, описанным в примере 39Е, используя соединение из примера 119D вместо соединения из примера 39D.
Пример 119F
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-8-фтор-3,4-дигидро-2H-хромен-2-ил]бензойная кислота
Указанное в заголовке соединение получали с использованием условий, аналогичных условиям, описанным в примере 38, используя соединение из примера 119Е вместо соединения из примера 39Е.1H ЯМР (400 МГц, CDCl3) δ 8,17 (с, 1H), 8,05 (с, 1H), 7,67 (с, 1H), 7,47 (с, 1H), 7,19-7,05 (м, 3H), 7,02 (д, J=8,1 Гц, 1H), 6,86-6,81 (м, 2H), 5,56 (с, 1H), 5,37 (дд, J=46,4, 10,0 Гц, 2H), 2,58 (с, 1H), 1,82 (д, J=30,1 Гц, 2H), 1,66 (д, J=15,0 Гц, 1H), 1,10 (д, J=3,6 Гц, 2H); МС (ESI-) m/z=510 (M-H)-.
Пример 120
метил 4-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]бензоат
Пример 120A
(R)-метил 4-(4-оксохроман-2-ил)бензоат
Смесь бис(2,2,2-трифторацетокси)палладия (0,341 г, 1,026 ммоль), (S)-4-(трет-бутил)-2-(пиридин-2-ил)-4,5-дигидрооксазола (0,252 г, 1,232 ммоль), гексафторофосфата(V) аммония (1,004 г, 6,16 ммоль), метил 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензоата (4,04 г, 15,40 ммоль) и дихлорэтана (8 мл) в 20-мл сосуде перемешивали при комнатной температуре в течение 5 минут с последующим добавлением 4H-хромен-4-она (CAS 11013-97-1, 1,5 г, 10,26 ммоль) и воды (0,256 мл, 14,19 ммоль). Сосуд закрывали и смесь перемешивали при 60°С в течение ночи. Реакционная смесь постепенно становилась черной, с осаждением Pd на стенки сосуда. Смесь фильтровали через слой целита и элюировали этилацетатом с получением красного раствора, который промывали водой и сушили над MgSO4. После фильтрации, растворитель удаляли в вакууме. Неочищенный материал хроматографировали с использованием 100 г картридж с силикагелем, и элюировали градиентом 5-40% этилацетата в гептане с получением указанного в заголовке соединения (1,66 г, выход 57,3%).1H ЯМР (400 МГц, CDCl3) δ 8,16-8,06 (м, 2H), 7,94 (дд, J=8,0, 1,7 Гц, 1H), 7,62-7,47 (м, 3H), 7,14-7,02 (м, 2H), 5,56 (дд, J=13,1, 3,1 Гц, 1H), 3,94 (с, 3H), 3,13-2,86 (м, 2H); ЖХ/МС (ESI+)=283 (M+1)+.
Пример 120B
(R)-Метил 4-(4-(метоксиимино)хроман-2-ил)бензоат
Смесь соединения из примера 120A (1,65 г, 5,85 ммоль), ацетата натрия (0,959 г, 11,69 ммоль) и O-метилгидроксиламина, хлористоводородной кислоты (0,976 г, 11,69 ммоль) в метаноле (20 мл) перемешивали при 60°С в течение ночи. Растворитель удаляли при пониженном давлении и остаток растворяли в этилацетате и промывали водой. Органический слой сушили над MgSO4, фильтровали и концентрировали. Остаток промывали эфиром с получением указанного в заголовке соединения (1,758 г, выход 97%).1H ЯМР (400 МГц, CDCl3) δ 8,16-8,04 (м, 2H), 7,93 (дд, J=8,2, 1,7 Гц, 1H), 7,62-7,47 (м, 2H), 7,32-7,26 (м, 1H), 7,01-6,95 (м, 2H), 5,13 (дд, J=12,4, 3,2 Гц, 1H), 3,99 (с, 3H), 3,93 (с, 3H), 3,48 (дд, J=17,2, 3,2 Гц, 1H), 2,66 (дд, J=17,2, 12,3 Гц, 1H); МС (ESI+): m/z=312 (M+H)+.
Пример 120C
Метил 4-((2R,4R)-4-аминохроман-2-ил)бензоат
Соединение примера 120B (1,75 г, 5,62 ммоль) обрабатывали 5% платиной (0,05 эквивалент) на угле в уксусной кислоте (10 мл). Реакционную смесь перемешивали в течение 24 часов при комнатной температуре в атмосфере водорода (1 атмосфера). ЖХ/МС показала, что превращение составило более 95%, с небольшим превышением обнаруженного побочного продукта. Реакционную смесь фильтровали через слой целита и растворитель удаляли при пониженном давлении. К остатку добавляли трет-бутилметиловый эфир, затем добавляли по каплям 4 М HCl в растворе тетрагидрофурана (2 мл). Смесь перемешивали в течение 1 часа при комнатной температуре. Осажденное белое твердое вещество собирали с помощью фильтрования, промывали эфиром и сушили с получением соли гидрохлорида указанного в заголовке соединения (1,2 г, выход 66,8%).1H ЯМР (400 МГц, CDCl3) δ 8,08 (д, J=7,9 Гц, 2H), 7,50 (дд, J=23,2, 7,8 Гц, 3H), 7,20 (т, J=7,8 Гц, 1H), 7,07-6,84 (м, 2H), 5,22 (д, J=11,4 Гц, 1H), 4,36 (дд, J=10,8, 5,8 Гц, 1H), 3,93 (с, 3H), 2,46 (дд, J=13,2, 5,8 Гц, 1H), 2,00-1,85 (м, 1H); МС (ESI+) m/z=267 (M-NH2)+.
Пример 120D
Метил 4-((2R,4R)-4-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)хроман-2-ил)бензоат
К 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоте (300 мг, 1,239 ммоль) в DMF (2 мл) добавляли HATU (1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиний 3-оксид гексафторфосфат, 642 мг, 1,689 ммоль). Смесь перемешивали в течение 5 минут при комнатной температуре, с последующим добавлением соединения примера 12°C (319 мг, 1,0 ммоль) и N-этил-N-изопропилпропан-2-амина (0,785 мл, 4,50 ммоль). Смесь перемешивали при комнатной температуре в течение 2 часов, ЖХ/МС показал, что преобразование завершилось. Реакционную смесь непосредственно загружали на картридж с силикагелем 50 г, элюируя смесью 5-50% этилацетата в гептане с получением указанного в заголовке соединения (320 мг, выход 56,0%).1H ЯМР (400 МГц, CDCl3) δ 8,07-8,02 (м, 2H), 7,50-7,44 (м, 2H), 7,21-7,15 (м, 1H), 7,14-7,05 (м, 3H), 7,00 (д, J=8,2 Гц, 1H), 6,96-6,87 (м, 2H), 5,53-5,44 (м, 1H), 5,38 (д, J=8,8 Гц, 1H), 5,24 (дд, J=11,3, 1,9 Гц, 1H), 3,93 (с, 3H), 2,52 (ддд, J=13,3, 6,1, 2,1 Гц, 1H), 1,84-1,72 (м, 2H), 1,26 (с, 1H), 1,08 (тд, J=3,5, 2,1 Гц, 2H); МС (ESI-) m/z=506,1(M-H)-.
Пример 121
4-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]бензойная кислота
К соединению из примера 120D (300 мг, 0,591 ммоль) в метаноле (4 мл) и воде (1,0 мл) добавляли гидроксид лития (85 мг, 3,55 ммоль). Смесь перемешивали при 35°С в течение 4 часов. ЖХ/МС показал, что реакция завершилась. Растворитель удаляли при пониженном давлении. Добавляли к остатку воду (4 мл) и значение pH смеси доводили до pH 1~2 с помощью добавления 2 M HCl. Осажденное белое твердое вещество собирали фильтрованием, и сушили с получением указанного в заголовке соединения (252 мг, 0,511 ммоль, выход 86%).1H ЯМР (501 МГц, CDCl3) δ 8,11 (д, J=7,8 Гц, 2H), 7,47 (д, J=7,9 Гц, 2H), 7,17 (т, J=7,6 Гц, 1H), 7,13-6,98 (м, 4H), 6,90 (дд, J=13,1, 5,7 Гц, 2H), 5,49 (с, 1H), 5,42 (д, J=8,6 Гц, 1H), 5,23 (д, J=11,1 Гц, 1H), 2,53 (с, 1H), 1,76 (д, J=10,9 Гц, 2H), 1,66 (д, J=10,4 Гц, 1H), 1,08 (с, 2H); МС (ESI-) m/z=492 (M-H)-.
Пример 122
4-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(дифторметокси)-3,4-дигидро-2H-хромен-2-ил]бензойная кислота
К соединению из примера 123E (130 мг, 0,227 ммоль) в метаноле (2 мл) и воде (0,5 мл) добавляли гидроксид лития (32,6 мг, 1,360 ммоль). Смесь перемешивали при 35°С в течение 4 часов, ЖХ/МС показал, что преобразование завершилось. Растворитель удаляли при пониженном давлении и добавляли воду (2 мл). Значение pH смеси доводили до pH 1~2 с помощью добавления 2 M HCl. Осажденное белое твердое вещество собирали фильтрованием и сушили с получением указанного в заголовке соединения (110 мг, 0,197 ммоль, выход 87%).1H ЯМР (400 МГц, CDCl3) δ 8,17-8,03 (м, 2H), 7,49 (д, J=8,2 Гц, 2H), 7,16-6,99 (м, 4H), 6,73-6,67 (м, 2H), 6,38 (д, J=73,6 Гц, 1H), 5,48 (тд, J=10,4, 6,1 Гц, 1H), 5,36 (д, J=8,8 Гц, 1H), 5,31-5,21 (м, 1H), 2,52 (ддд, J=13,3, 6,0, 2,2 Гц, 1H), 1,86-1,71 (м, 2H), 1,68-1,60 (м, 1H), 1,10 (кв, J=3,7, 2,4 Гц, 2H); МС (ESI-) m/z=558 (M-H)-.
Пример 123
метил 4-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(дифторметокси)-3,4-дигидро-2H-хромен-2-ил]бензоат
Пример 123A
(R)-метил 4-(7-гидрокси-4-оксохроман-2-ил)бензоат
Смесь бис(2,2,2-трифторацетокси)палладия (271 мг, 0,816 ммоль), (S)-4-(трет-бутил)-2-(пиридин-2-ил)-4,5-дигидрооксазола (200 мг, 0,979 ммоль), гексафторофосфата(V) аммония (798 мг, 4,90 ммоль), (4-(метоксикарбонил)фенил)бороновой кислоты (2203 мг, 12,24 ммоль) и дихлорэтана (8 мл) в 20 мл сосуде перемешивали в течение 5 минут при комнатной температуре, с последующим добавлением 7-гидрокси-4H-хромен-4-она (CAS 59887-89-7, MFCD00209371, 1323 мг, 8,16 ммоль) и воды (256 мг, 14,19 ммоль). Сосуд закрывали и смесь перемешивали при 60°С в течение ночи. Реакционная смесь постепенно становилась черной, с осаждением Pd на стенки сосуда. Смесь фильтровали через слой целита и элюировали этилацетатом с получением красного раствора, который промывали насыщенным солевым раствором. Растворитель удаляли в вакууме и неочищенный материал хроматографировали с использованием 100 г картриджа с силикагелем, и элюировали градиентом 5-40% этилацетата в гептане с получением указанного в заголовке соединения (1,62 г, выход 66,6%).1H ЯМР (400 МГц, CDCl3) δ 8,15-8,04 (м, 2H), 7,87 (д, J=8,7 Гц, 1H), 7,60-7,49 (м, 2H), 6,62-6,45 (м, 2H), 5,87 (с, 1H), 5,53 (дд, J=12,8, 3,2 Гц, 1H), 3,94 (с, 3H), 3,07-2,80 (м, 2H); МС (ESI+) m/z=299 (M+H)+.
Пример 123B
(R)-метил 4-(7-гидрокси-4-(метоксиимино)хроман-2-ил)бензоат
Смесь соединения из примера 123A (960 мг, 3,22 ммоль), ацетата натрия (528 мг, 6,44 ммоль) и O-метилгидроксиламина, хлористоводородной кислоты (538 мг, 6,44 ммоль) в метаноле (10 мл) перемешивали при 60°С в течение ночи. Растворитель удаляли при пониженном давлении. Остаток растворяли в этилацетате и промывали водой. Органические слои сушили над MgSO4, фильтровали и концентрировали. Остаток промывали эфиром с получением указанного в заголовке соединения (810 мг, 2,475 ммоль, выход 77%).1H ЯМР (400 МГц, CDCl3) δ 8,15-8,03 (м, 2H), 7,81 (д, J=8,7 Гц, 1H), 7,58-7,43 (м, 2H), 6,50 (дд, J=8,6, 2,5 Гц, 1H), 6,45 (д, J=2,5 Гц, 1H), 5,21 (д, J=3,0 Гц, 1H), 5,12 (дд, J=12,2, 3,2 Гц, 1H), 3,95 (с, 3H), 3,93 (с, 3H), 3,45 (дд, J=17,2, 3,2 Гц, 1H), 2,63 (дд, J=17,2, 12,2 Гц, 1H); МС (ESI+) m/z 328 (M+H)+.
Пример 123C
Метил 4-((2R,4R)-4-амино-7-гидроксихроман-2-ил)бензоат
Смесь соединения из примера 123B (570 мг, 1,741 ммоль) обрабатывали 5% платиной (0,05 эквивалент) на угле в уксусной кислоте (5 мл). Реакционную смесь перемешивали при комнатной температуре в атмосфере водорода (1 атмосфера) в течение 24 часов, ЖХ/МС показал превращение свыше 95%. Смесь фильтровали через слой целита и растворитель удаляли при пониженном давлении. Остаток очищали с помощью способа препаративной ЖХ TFA2 с получением соли трифторуксусной кислоты указанного в заголовке соединения (300 мг, выход 44%). ЖХ/МС m/z 283 (M-NH2)+.
Пример 123D
метил 4-((2R,4R)-4-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-7-гидроксихроман-2-ил)бензоат
Смесь 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоты (162 мг, 0,668 ммоль) и HATU (1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиний 3-оксид гексафторфосфат, 380 мг, 1,0 ммоль) в DMF (2 мл) перемешивали в течение 5 минут при комнатной температуре, с последующим добавлением соединения примера 123C (200 мг, 0,334 ммоль) и N-этил-N-изопропилпропан-2-амина (0,466 мл, 2,67 ммоль). Смесь перемешивали при комнатной температуре в течение 2 часов, ЖХ/МС показал реакцию завершенной. Смесь загружали на картридж с силикагелем 25 г, элюируя смесью 5-50% этилацетата в гептане, с получением указанного в заголовке соединения (204 мг, выход 58,3%).1H ЯМР (400 МГц, CDCl3) δ 8,11-7,90 (м, 2H), 7,42 (д, J=8,0 Гц, 2H), 7,16-7,02 (м, 2H), 6,94 (дд, J=37,7, 8,3 Гц, 2H), 6,49-6,32 (м, 2H), 5,67 (с, 1H), 5,36 (дт, J=15,3, 8,7 Гц, 2H), 5,18 (д, J=10,7 Гц, 1H), 3,93 (с, 3H), 2,56-2,36 (м, 1H), 1,80-1,70 (м, 2H), 1,26 (д, J=2,2 Гц, 1H), 1,10-1,04 (м, 2H); МС (ESI-) m/z=521,9 (M-H)-.
Пример 123E
Метил 4-((2R,4R)-4-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-7-(дифторметокси)хроман-2-ил)бензоат
К соединению примера 123D (190 мг, 0,363 ммоль) и диэтил (бромoдифторметил)фосфонату (0,129 мл, 0,726 ммоль) в смеси ацетонитрила (2 мл) и воды (1 мл) добавляли 50% водный раствор гидроксида калия (244 мг, 2,178 ммоль) по каплям через шприц при энергичном перемешивании. После завершения добавления, ЖХ/МС показал, что превращение завершилось с небольшим пиком побочного продукта. К смеси добавляли дополнительное количество воды и смесь экстрагировали этилацетатом (3×20 мл). Объединенные органические экстракты промывали 1 M HCl (5 мл) и водой, сушили над MgSO4, фильтровали и концентрировали. Остаток очищали способом препаративной ЖХ TFA2 с получением указанного в заголовке соединения (150 мг, выход 72%).1H ЯМР (400 МГц, CDCl3) δ 8,09-8,00 (м, 2H), 7,49-7,41 (м, 2H), 7,15-6,99 (м, 4H), 6,75-6,66 (м, 2H), 5,50-5,40 (м, 1H), 5,33 (д, J=8,9 Гц, 1H), 5,25 (дд, J=11,3, 2,0 Гц, 1H), 3,93 (с, 3H), 2,50 (ддд, J=13,4, 6,1, 2,1 Гц, 1H), 1,84-1,71 (м, 2H), 1,65 (д, J=2,8 Гц, 1H), 1,11-1,06 (м, 2H); МС (ESI-) m/z=572 (M-H)-.
Пример 124
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-(7-гидрокси-2,2-диметил-3,4-дигидро-2H-хромен-4-ил)циклопропанкарбоксамид
Пример 124A
7-гидрокси-2,2-диметилхроман-4-он O-метилоксим
Смесь 7-гидрокси-2,2-диметилхроман-4-она (cas# 17771-33-4) (680 мг, 3,54 ммоль), ацетата натрия (580 мг, 7,08 ммоль) и O-метилгидроксиламина, хлористоводородной кислоты (591 мг, 7,08 ммоль) в метаноле (10 мл) перемешивали при 60°С в течение ночи. Растворитель упаривали при пониженном давлении. Полученный остаток растворяли в этилацетате и промывали насыщенным солевым раствором, сушили над MgSO4, и фильтровали. Растворитель удаляли при пониженном давлении с получением указанного в заголовке соединения (740 мг, 95%). ЖХ/МС (ESI+) m/z 222 (M+H)+.
Пример 124B
4-амино-2,2-диметилхроман-7-ол гидрохлорид
К соединению примера 124A (740 мг, 3,34 ммоль) и уксусной кислоте (10 мл) в 50 мл сосуде для реакций под давлением добавляли 5% влажную Pt/C (240 мг, 0,506 ммоль). Смесь перемешивали при давлении 30 фунтов на квадратный дюйм водорода и при комнатной температуре в течение 40 часов. Реакционную смесь фильтровали, и растворитель удалили. К полученному остатку добавляли диэтиловый эфир (10 мл) с последующим добавлением по каплям 4 н. HCl в диоксане (1 мл). Белое твердое вещество собирали фильтрованием и сушили с получением указанного в заголовке соединения (460 мг, 60%). ЖХ/МС (ESI+) m/z=177 (M-NH2)+.
Пример 124C
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-(7-гидрокси-2,2-диметил-3,4-дигидро-2H-хромен-4-ил)циклопропанкарбоксамид
К 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоте (CAS 68015-98-5) (485 мг, 2,0 ммоль) в N,N-диметилформамиде (4 мл) добавляли HATU (1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиний 3-оксид гексафторфосфат) (1142 мг, 3,00 ммоль). Смесь перемешивали при комнатной температуре в течение 5 минут, и добавляли соединение из примера 124B, с последующим добавлением N-этил-N-изопропилпропан-2-амина (1,395 мл, 8,01 ммоль). Смесь перемешивали при комнатной температуре в течение 2 часов. Смесь очищали с помощью хроматографии, элюируя градиентом 0-50% этилацетата в гептане с получением указанного в заголовке соединения (505 мг, 1,210 ммоль, выход 60,4%).1H ЯМР (400 МГц, CDCl3) δ 7,20-7,07 (м, 2H), 7,01 (д, J=8,2 Гц, 1H), 6,88 (дд, J=8,5, 1,0 Гц, 1H), 6,36 (дд, J=8,4, 2,5 Гц, 1H), 6,23 (д, J=2,6 Гц, 1H), 5,41-5,25 (м, 2H), 5,23-5,08 (м, 1H), 2,11 (дд, J=13,2, 6,2 Гц, 1H), 1,76-1,63 (м, 2H), 1,50 (дд, J=13,2, 10,5 Гц, 1H), 1,32 (с, 3H), 1,26 (с, 3H), 1,09 (тд, J=3,2, 1,5 Гц, 2H); МС (ESI+) m/z 417,7 (M+H)+.
Пример 125
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[7-(дифторметокси)-2,2-диметил-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
Соединение из примера 124C (150 мг, 0,359 ммоль) и диэтил (бромдифторметил)фосфонат (0,128 мл, 0,719 ммоль) в смеси ацетонитрила (10 мл) и воды (5 мл) охлаждали до <5°C на бане со льдом. Гидроксид калия (0,185 мл, 2,156 ммоль, 50% водный раствор) добавляли по каплям через шприц при энергичном перемешивании. Смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь разбавляли водой (5 мл) и экстрагировали метил-трет-бутиловым эфиром (3×10 мл). Объединенные экстракты промывали 1M HCl (5 мл) и очищали способом ЖХ/МС TFA1 с получением указанного в заголовке соединения (85 мг, 50,6%).1H ЯМР (400 МГц, CDCl3) δ 7,15 (дд, J=8,1, 1,7 Гц, 1H), 7,11 (д, J=1,6 Гц, 1H), 7,03 (дд, J=8,3, 1,2 Гц, 2H), 6,63-6,59 (м, 1H), 6,51 (д, J=2,4 Гц, 1H), 6,44, (1H), 5,35 (д, J=8,8 Гц, 1H), 5,26-5,17 (м, 1H), 2,12 (дд, J=13,2, 6,2 Гц, 1H), 1,76-1,64 (м, 2H), 1,52 (дд, J=13,2, 10,9 Гц, 1H), 1,35 (с, 3H), 1,29 (с, 3H), 1,15-1,05 (м, 2H); МС (ESI+) m/z=468 (M+H)+.
Пример 126
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[7-метокси-2-(тетрагидрофуран-2-ил)-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
Пример 126A
2-ацетил-5-метоксифенил тетрагидрофуран-2-карбоксилат
Оксалилхлорид (14,83 мл, 175 ммоль) добавляли по каплям через шприц к смеси тетрагидрофуран-2-карбоновой кислоты (18,5 г, 159 ммоль) и N,N-диметилформамида (0,116 г, 1,593 ммоль) в CH2Cl2 (100 мл) при 0°C в атмосфере азота. Смесь перемешивали в течение еще 1 часа и затем по каплям добавляли через шприц в смесь 1-(2-гидрокси-4-метоксифенил)этанона (CAS 552-41-0) (26,5 г, 159 ммоль) и триэтиламина (66,6 мл, 478 ммоль) в CH2Cl2 (100 мл) при 0°C. Полученную смесь перемешивали при комнатной температуре в течение приблизительно 3 часов. Реакционную смесь разбавляли этилацетатом, промывали насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток хроматографировали на силикагеле, элюируя 0-90% этилацетатом в гексане, получая указанное в заголовке соединение (36,5 г, 138 ммоль, выход 87%).1H ЯМР (400 МГц, CDCl3) δ 7,84 (д, J=8,8 Гц, 1H), 6,85 (дд, J=8,8, 2,5 Гц, 1H), 6,65 (д, J=2,5 Гц, 1H), 4,78 (дд, J=8,5, 5,4 Гц, 1H), 4,18-4,09 (м, 1H), 4,06-3,98 (м, 1H), 3,88 (с, 3H), 2,54 (с, 1H), 2,58-2,45 (м, 3H), 2,47-2,33 (м, 1H), 2,23-2,08 (м, 1H), 2,10-1,95 (м, 1H); МС (ESI+) m/z 265 (M+H)+.
Пример 126B
1-(2-гидрокси-4-метоксифенил)-3-(тетрагидрофуран-2-ил)пропан-1,3-дион
Раствор соединения примера 126A (18 г, 68,1 ммоль) в тетрагидрофуране (200 мл) в атмосфере N2 охлаждали до -70°C и обрабатывали 1М раствором бис(триметилсилил)амида лития в тетрагидрофуране (170 мл, 170 ммоль). Реакционную смесь перемешивали в течение 2 часов при комнатной температуре. Органический слой промывали насыщенным NH4Cl (3×20 мл), сушили Na2SO4, фильтровали и концентрировали с получением указанного в заголовке соединения (18 г, 54,5 ммоль, выход 80%). МС (ESI+) m/z 265 (M+H)+.
Пример 126C
7-метокси-2-(тетрагидрофуран-2-ил)-4H-хромен-4-он
Раствор соединения из примера 126B (10 г, 37,8 ммоль) в CH2Cl2 (100 мл) обрабатывали хлоридом железа(III) (18,41 г, 114 ммоль). Полученную суспензию перемешивали при комнатной температуре в течение ночи. Реакционную смесь фильтровали и концентрировали с получением указанного в заголовке соединения (9,32 г, 31,0 ммоль, выход 82%). МС (ESI+) m/z 247 (M+H)+.
Пример 126D
7-метокси-2-(тетрагидрофуран-2-ил)хроман-4-он
Соединение примера 126C (12 г, 48,7 ммоль) обрабатывали Pd/C (3,37 г) и триэтиламином (34,0 мл, 244 ммоль) в этилацетате (100 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Смесь фильтровали и растворитель удаляли в вакууме. Неочищенный материал очищали с помощью хроматографии на силикагеле, элюируя 0-90% этилацетатом в петролейном эфире с получением указанного в заголовке соединения (1,7 г, 6,85 ммоль, выход 14,05%).1H ЯМР (400 МГц, CDCl3) δ 7,83 (д, J=8,8 Гц, 1H), 6,59 (дд, J=8,8, 2,4 Гц, 1H), 6,46 (д, J=2,3 Гц, 1H), 4,45-4,38 (м, 1H), 4,20-4,12 (м, 1H), 3,98-3,91 (м, 1H), 3,85 (с, 3H), 3,89-3,82 (м, 1H), 2,79 (дд, J=16,9, 12,2 Гц, 1H), 2,71 (дд, J=16,8, 3,8 Гц, 1H), 2,17-2,08 (м, 1H), 2,02-1,86 (м, 3H); МС (ESI+) m/z 249 (M+H)+.
Пример 126E
7-метокси-2-(тетрагидрофуран-2-ил)хроман-4-он оксим
Продукт из примера 126D (700 мг, 2,82 ммоль) обрабатывали гидрохлоридом гидроксиламина (294 мг, 4,23 ммоль) и ацетатом натрия (347 мг, 4,23 ммоль) в метаноле (1 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение 3 часов. Смесь концентрировали досуха и остаток очищали при помощи хроматографии на силикагеле, элюируя 0-90% этилацетатом в петролейном эфире с получением указанного в заголовке соединения (742 мг, 2,82 ммоль, выход 100%). МС (ESI+) m/z 264 (M+H)+.
Пример 126F
7-метокси-2-(тетрагидрофуран-2-ил)хроман-4-амин гидрохлорид
Метанол (10 мл) обрабатывали в течение 1 минуты потоком газообразного NH3. Добавляли соединение примера 126E (0,742 г, 2,82 ммоль) с последующим добавлением никеля (0,165 г, 2,82 ммоль). Смесь перемешивали при комнатной температуре в 5 атмосферах H2 в течение 24 часов. Смесь фильтровали и фильтрат концентрировали досуха. Остаток обрабатывали HCl в диэтиловом эфире, затем концентрировали с получением указанного в заголовке соединения (0,762 г, 2,67 ммоль, выход 95%). МС (ESI+) m/z 233 (M-NH3)+.
Пример 126G
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[7-метокси-2-(тетрагидрофуран-2-ил)-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
Смесь соединения примера 126F (50,7 мг, 0,177 ммоль), 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоты (55,9 мг, 0,231 ммоль) и HATU (1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиний 3-оксид гексафторфосфат) (101 мг, 0,266 ммоль) в тетрагидрофуране (2 мл) в атмосфере N2 обрабатывали триэтиламином (99 мкл, 0,710 ммоль) и перемешивали в течение ночи при комнатной температуре. Смесь разделяли между метил-трет-бутиловым эфиром (30 мл) и 10% лимонной кислотой (15 мл). Слои разделяли и слой метил-трет-бутилового эфира промывали насыщенным раствором NaHCO3 (приблизительно 15 мл), промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали. Остаток очищали с помощью хроматографии на силикагеле, элюируя градиентом 50-100% [9:1 CH2Cl2:этилацетат] в гептане с получением указанного в заголовке соединения (67,9 мг, 0,143 ммоль, выход 81%).1H ЯМР (400 МГц, CDCl3) δ 7,18-7,07 (м, 2H), 7,05-6,98 (м, 1,5H), 6,93 (д, J=8,7 Гц, 0,5H), 6,50-6,43 (м, 1,5H), 6,40 (д, J=2,4 Гц, 0,5H), 5,70 (д, J=8,9 Гц, 0,5H), 5,46 (д, J=6,8 Гц, 0,5H), 5,31-5,22 (м, 0,5H), 5,03-4,95 (м, 0,5H), 4,10-3,83 (м, 2H), 3,82-3,65 (м, 4H), 2,29 (ддд, J=13,2, 6,2, 2,3 Гц, 0,5H), 2,10-1,83 (м, 4,5H), 1,77-1,57 (м, 3H), 1,15-1,00 (м, 2H); МС (ESI-) m/z 472 (M-H)-.
Пример 127
метил 4-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-гидрокси-3,4-дигидро-2H-хромен-2-ил]бензоат
Указанное в заголовке соединение получали, как описано в примере 123D.
Пример 128
4-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-гидрокси-3,4-дигидро-2H-хромен-2-ил]бензойная кислота
К соединению примера 127 (33 мг, 0,063 ммоль) в метаноле (2 мл) и воде (0,5 мл) добавляли гидроксид лития (15,10 мг, 0,630 ммоль). Смесь перемешивали при 35°С в течение 4 часов. Растворитель удаляли и добавляли воду (1 мл). Значение pH реакционной смеси доводили с помощью 2M HCl до приблизительно 1~2. Осажденное белое твердое вещество собирали фильтрованием и сушили с получением указанного в заголовке соединения (30 мг, выход 93%).1H ЯМР (400 МГц, ДМСО-d6) δ 9,38 (с, 1H), 7,96 (д, J=8,0 Гц, 2H), 7,51 (д, J=8,1 Гц, 2H), 7,38 (с, 1H), 7,31 (д, J=8,4 Гц, 1H), 7,19 (д, J=7,9 Гц, 1H), 7,12 (д, J=9,0 Гц, 1H), 6,84 (д, J=8,5 Гц, 1H), 6,37 (дд, J=8,5, 2,5 Гц, 1H), 6,21 (д, J=2,9 Гц, 1H), 5,30 (кв, J=8,8, 7,6 Гц, 2H), 2,08-1,97 (м, 2H), 1,49 (дт, J=8,8, 3,2 Гц, 1H), 1,40-1,33 (м, 1H), 1,06-1,00 (м, 2H); МС (ESI-) m/z=508(M-H)-.
Пример 129
4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидроспиро[хромен-2,1'-циклобутан]-3'-карбоновая кислота
Пример 129A
метил 7-метокси-4-оксоспиро[хроман-2,1'-циклобутан]-3'-карбоксилат
К 1-(2-гидрокси-4-метоксифенил)этанону (CAS 552-41-0) (500 мг, 3,01 ммоль) в метаноле (10 мл) добавляли метил 3-оксоциклобутанкарбоксилат (1157 мг, 9,03 ммоль) и пирролидин (0,754 мл, 9,03 ммоль) при комнатной температуре. Смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь экстрагировали CH2Cl2 и органический слой промывали водой, сушили над NaSO4, фильтровали и концентрировали. Очистка с помощью флэш-хроматографии на силикагеле, элюирование этилацетатом в гептане (0-30%) давало указанное в заголовке соединение (200 мг, 24%).
Пример 129B
метил 7-метокси-4-(метоксиимино)спиро[хроман-2,1'-циклобутан]-3'-карбоксилат
Смесь соединения из примера 129A (196 мг, 0,709 ммоль), ацетата натрия (116 мг, 1,419 ммоль) и O-метилгидроксиламина, хлористоводородной кислоты (118 мг, 1,419 ммоль) в метаноле (10 мл) перемешивали при 60°С в течение ночи. Растворитель упаривали при пониженном давлении и остаток растворяли в этилацетате и промывали солевым раствором. Органические слои сушили над MgSO4 и фильтровали. Растворитель удаляли под давлением с получением сырого продукта указанного в заголовке соединения (203 мг, 94%), который использовали без дальнейшей очистки.1H ЯМР (400 МГц, CDCl3) δ 7,75 (дд, J=8,9, 5,8 Гц, 1H), 6,51 (ддт, J=8,4, 5,6, 2,5 Гц, 1H), 6,42 (тд, J=6,1, 2,8 Гц, 1H), 3,96 (т, J=4,4 Гц, 3H), 3,75 (дт, J=32,6, 2,8 Гц, 6H), 2,95 (д, J=7,2 Гц, 2H), 2,56-2,28 (м, 4H); МС (ESI+) m/z 306 (M+H)+.
Пример 129C
метил 4-амино-7-метоксиспиро[хроман-2,1'-циклобутан]-3'-карбоксилат
К раствору соединения примера 129B (200 мг, 0,655 ммоль) в метаноле (10 мл) добавляли никель Ренея (1 г, 17,04 ммоль) в 50 мл сосуде для реакций под давлением. Смесь перемешивали при давлении 30 фунтов на квадратный дюйм водорода и при комнатной температуре в течение 52 часов. Реакционную смесь фильтровали и концентрировали досуха с получением указанного в заголовке соединения (150 мг, 83%). МС (ESI+) m/z 261 (M-NH2)+.
Пример 129D
метил 4-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-7-метоксиспиро[хроман-2,1'-циклобутан]-3'-карбоксилат
К 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил) циклопропанкарбоновой кислоте (34,9 мг, 0,144 ммоль) в N,N-диметилформамиде (4 мл) добавляли HATU (1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиний 3-оксид гексафторфосфат) (82 мг, 0,216 ммоль). Смесь перемешивали в течение 5 минут, и затем добавляли соединение примера 129C (40 мг, 0,144 ммоль), с последующим добавлением N-этил-N-изопропилпропан-2-амина (0,100 мл, 0,577 ммоль). Смесь перемешивали при комнатной температуре в течение 2 часов. Смесь очищали с помощью хроматографии, элюируя смесью 0-50% этилацетата в гептане с получением указанного в заголовке соединения (60 мг, выход 83%).1H ЯМР (400 МГц, CDCl3) δ 7,18-7,07 (м, 2H), 7,00 (д, J=8,1 Гц, 1H), 6,94 (дд, J=8,6, 0,9 Гц, 1H), 6,46 (дд, J=8,6, 2,6 Гц, 1H), 6,34 (д, J=2,5 Гц, 1H), 5,32 (д, J=8,5 Гц, 1H), 5,17-5,05 (м, 1H), 3,73 (д, J=9,6 Гц, 6H), 3,29 (тт, J=9,3, 7,7 Гц, 1H), 2,47-2,32 (м, 4H), 2,26 (дд, J=13,3, 5,8 Гц, 1H), 1,79 (дд, J=13,4, 8,4 Гц, 1H), 1,69 (т, J=3,6 Гц, 2H), 1,12-1,05 (м, 2H); МС (ESI-) m/z 500,2 (M-H)-.
Пример 129E
4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидроспиро[хромен-2,1'-циклобутан]-3'-карбоновая кислота
К раствору соединения из примера 129D (58 мг, 0,116 ммоль) в метаноле (4 мл) и воде (1 мл) добавляли гидроксид лития (27 мг, 1,16 ммоль). Смесь перемешивали при 35°С в течение 4 часов и растворитель удаляли при пониженном давлении, и затем добавляли воду (1 мл). Значение рН смеси доводили с помощью 2 н HCl до pH 1~2. Выпавшее в осадок белое твердое вещество собирали и промывали водой и сушили с получением указанного в заголовке соединения в виде твердого вещества (53 мг, 94%).1H ЯМР (400 МГц, CDCl3) δ 7,19-7,08 (м, 2H), 7,01 (т, J=7,9 Гц, 1H), 6,95-6,83 (м, 1H), 6,46 (ддд, J=8,6, 4,4, 2,5 Гц, 1H), 6,33 (дд, J=6,9, 2,5 Гц, 1H), 5,39 (дд, J=8,5, 5,6 Гц, 1H), 5,14 (дтд, J=17,2, 9,2, 8,6, 6,1 Гц, 1H), 3,73 (д, J=6,5 Гц, 3H), 3,31 (п, J=8,3 Гц, 1H), 2,91-2,58 (м, 1H), 2,52-2,28 (м, 4H), 1,84-1,64 (м, 3H), 1,14-1,05 (м, 2H); МС (ESI-) m/z=486,2 (M-H)-.
Пример 130
Этил rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2Н-хромен-2-карбоксилат
Пример 130A
этил 7-метокси-4-оксо-4H-хромен-2-карбоксилат
1-(2-гидрокси-4-метоксифенил)этанон (CAS 552-41-0) (10 г, 60,2 ммоль) растворяли в этаноле (175 мл). Добавляли диэтилоксалат (41,1 мл, 301 ммоль), затем 2,5 М раствор этоксида натрия в этаноле (94 мл, 241 ммоль). Смесь нагревали при температуре 75°C в течение 1 часа, охлаждали до комнатной температуры, подкисляли HCl (7,31 мл, 241 ммоль), затем концентрировали в вакууме. Это промежуточное соединение растворяли в CH2Cl2 (200 мл), обрабатывали концентрированной HCl (20 мл) и перемешивали при комнатной температуре в течение 3 часов. Органический слой выделяли и сушили над сульфатом натрия, фильтровали и концентрировали. Остаток растирали с метил трет-бутиловым эфиром и твердое вещество собирали фильтрованием с получением указанного в заголовке соединения в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ 7,94 (д, J=8,9 Гц, 1H), 7,22 (д, J=2,4 Гц, 1H), 7,10 (дд, J=8,9, 2,4 Гц, 1H), 6,88 (с, 1H), 4,40 (кв, J=7,1 Гц, 2H), 3,93 (с, 3H), 1,36 (т, J=7,1 Гц, 3H).
Пример 130B
этил 7-метокси-4-оксохроман-2-карбоксилат
Смесь соединения примера 130A (2,16 г, 8,70 ммоль), формиат аммония (1,646 г, 26,1 ммоль) и 10% Pd/C (0,695 г, 0,653 ммоль) в этаноле (40 мл) нагревали при 85°C в течение ночи в атмосфере N2 (баллон). Смесь охлаждали, фильтровали для удаления твердых веществ и концентрировали. Остаток очищали с помощью хроматографии на силикагеле, элюируя градиентом 50-100% CH2Cl2 в гептане с получением указанного в заголовке соединения (0,8 г, 3,20 ммоль, выход 36,7%).1H ЯМР (501 МГц, CDCl3) δ 7,81 (д, J=8,8 Гц, 1H), 6,61 (дд, J=8,8, 2,4 Гц, 1H), 6,56 (д, J=2,4 Гц, 1H), 5,06 (дд, J=8,5, 5,9 Гц, 1H), 4,27 (кв, J=7,1 Гц, 2H), 3,85 (с, 3H), 3,04-2,95 (м, 2H), 1,30 (т, J=7,1 Гц, 3H); МС (ESI+) m/z 251 (M+H)+.
Пример 130C
этил 7-метокси-4-(метоксиимино)хроман-2-карбоксилат
Раствор соединения примера 130B (0,8 г, 3,20 ммоль) и O-метилгидроксиламина гидрохлорида (0,801 г, 9,59 ммоль) в пиридине (10 мл) нагреваои при температуре 60°C в течение 75 минут, охлаждали, концентрировали и разделяли между этилацетатом и водой. Этилацетатный слой промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали с получением указанного в заголовке соединения (0,8 г, 2,86 ммоль, выход 90%).1H ЯМР (400 МГц, CDCl3) δ 7,78 (д, J=8,7 Гц, 1H), 6,56 (дд, J=8,7, 2,5 Гц, 1H), 6,53 (д, J=2,3 Гц, 1H), 4,70 (дд, J=9,9, 4,3 Гц, 1H), 4,27 (кв, J=7,1 Гц, 2H), 3,96 (с, 3H), 3,79 (с, 3H), 3,33 (дд, J=17,2, 4,3 Гц, 1H), 2,91 (дд, J=17,2, 10,0 Гц, 1H), 1,30 (т, J=7,1 Гц, 3H); МС (ESI+) m/z 280 (M+H)+.
Пример 130D
метил 4-амино-7-метоксихроман-2-карбоксилат и этил 4-амино-7-метоксихроман-2-карбоксилат
Раствор соединения примера 13°C в метаноле (20 мл) добавляли к Ra-Ni 2800, водной суспензии (6 г, 46,0 ммоль) в 50 мл сосуде для реакций под давлением и встряхивали в течение 4 часов при давлении водорода 30 фунт/кв.дюйм и при комнатной температуре. Смесь фильтровали и концентрировали с получением указанных в заголовке соединений. МС (ESI+) m/z 220 (M-NH3)+ для метилового эфира и m/z 235 (M-NH3)+ для этилового эфира.
Пример 130E
этил rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2Н-хромен-2-карбоксилат
Смесь соединения примера 130D (650 мг, 2,59 ммоль), 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоты (689 мг, 2,85 ммоль) и HATU (1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиний 3-оксид гексафторфосфат) (1475 мг, 3,88 ммоль) в N,N-диметилформамиде (20 мл) в атмосфере N2 обрабатывали триэтиламином (1082 мкл, 7,76 ммоль) и перемешивали при комнатной температуре в течение 90 минут. Смесь разделяли между метил-трет-бутиловым эфиром (30 мл) и 1 M HCl (15 мл). Слои разделяли и этилацетатный слой промывали последовательно насыщенным раствором NaHCO3 (10 мл) и насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали. Остаток очищали с помощью хроматографии на силикагеле, элюируя градиентом 10-100% этилацетата в гептане с получением указанного в заголовке соединения в качестве первого продукта элюирования. Этот продукт далее очищали с помощью хроматографии на силикагеле, элюируя градиентом 25-100% [9:1 CH2Cl2:этилацетат] в гептанах.1H ЯМР (400 МГц, CDCl3) δ 7,13 (дд, J=8,2, 1,7 Гц, 1H), 7,10 (д, J=1,6 Гц, 1H), 7,00 (д, J=8,1 Гц, 1H), 6,96 (д, J=8,4 Гц, 1H), 6,50 (дд, J=8,4, 2,5 Гц, 1H), 6,48 (д, J=2,5 Гц, 1H), 5,42 (д, J=6,9 Гц, 1H), 5,02-4,96 (м, 1H), 4,44 (дд, J=9,2, 3,5 Гц, 1H), 4,29 (кв, J=7,1 Гц, 2H), 3,75 (с, 3H), 2,31-2,18 (м, 2H), 1,74-1,65 (м, 2H), 1,33 (т, J=7,1 Гц, 3H), 1,12-1,04 (м, 2H); МС (ESI-) m/z 474 (M-H)-.
Пример 131
метил rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2Н-хромен-2-карбоксилат
Указанное в заголовке соединение выделяли в качестве второго элюированного изомера в результате первой хроматографии, как описано в примере 130E. Этот продукт далее очищали с помощью хроматографии на силикагеле, элюируя градиентом 25-100% [9:1 CH2Cl2:этилацетат] в гептанах.1H ЯМР (400 МГц, CDCl3) δ 7,15 (дд, J=8,2, 1,6 Гц, 1H), 7,12 (д, J=1,6 Гц, 1H), 7,02 (д, J=8,2 Гц, 1H), 6,98 (д, J=8,5 Гц, 1H), 6,52 (дд, J=8,5, 2,5 Гц, 1H), 6,49 (д, J=2,5 Гц, 1H), 5,44 (д, J=6,8 Гц, 1H), 5,02-4,96 (м, 1H), 4,48 (дд, J=9,7, 3,1 Гц, 1H), 3,84 (с, 3H), 3,76 (с, 3H), 2,36-2,29 (м, 1H), 2,22 (ддд, J=14,2, 9,7, 4,8 Гц, 1H), 1,71 (ткв, J=7,3, 4,2 Гц, 2H), 1,09 (п, J=6,1, 5,6 Гц, 2H); МС (ESI-) m/z 460 (M-H)-.
Пример 132
этил rel-2-[(2S,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-5-карбоксилат
Пример 132A
(E)-метил 2-(3-(трет-бутокси)-2-(2-гидроксибензоил)-3-оксопроп-1-ен-1-ил)тиазол-5-карбоксилат
Смесь трет-бутил 3-(2-гидроксифенил)-3-оксопропаноата (0,704 г, 2,98 ммоль, CAS# 936182-86-4, Biddle, et al., Journal of the American Chemical Society 2007, 129(13), p 3830-3831), метил 2-формилтиазол-5-карбоксилата (CAS# 1408075-35-3, 0,51 г, 2,98 ммоль), пиперидина (0,015 мл, 0,149 ммоль) и уксусной кислоты (8,53 мкл, 0,149 ммоль) в бензоле нагревали с обратным холодильником с использованием ловушки Дина-Старка в течение ночи. Смесь концентрировали и очищали с помощью хроматографии на силикагеле, элюируя градиентом 15-100% этилацетата в гептане с получением указанного в заголовке соединения (0,26 г, 0,668 ммоль, выход 22,41%).1H ЯМР (400 МГц, CDCl3) δ 11,66 (с, 1H), 8,33 (с, 1H), 7,85 (с, 1H), 7,53-7,46 (м, 2H), 7,09-7,06 (м, 1H), 6,87-6,82 (м, 1H), 3,90 (с, 3H), 1,45 (с, 9H); МС (ESI-) m/z 388 (M-H)-.
Пример 132B
метил 2-(4-оксохроман-2-ил)тиазол-5-карбоксилат
Раствор соединения из примера 132A (0,25 г, 0,642 ммоль) и 1-[3,5-бис(трифторметил)фенил]-3-[(1R,2R)-(-)-2-(диметиламино)циклогексил]тиомочевину (0,053 г, 0,128 ммоль) в толуоле (4 мл) перемешивали при комнатной температуре в течение 2 дней. Смесь обрабатывали DL-10-камфорсульфоновой кислотой (0,149 г, 0,642 ммоль) и нагревали при 95°C в течение 3 часов. Смесь охлаждали и разделяли между этилацетатом и насыщенным раствором NaHCO3. Этилацетатный слой промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали. Полученный остаток очищали с помощью хроматографии на силикагеле и элюировали градиентом 10-100% этилацетата в гептане с получением указанного в заголовке соединения (0,14 г, 0,484 ммоль, выход 75%).1H ЯМР (400 МГц, CDCl3) δ 8,38 (с, 1H), 7,95 (дд, J=7,8, 1,6 Гц, 1H), 7,58 (ддд, J=8,8, 7,3, 1,7 Гц, 1H), 7,16-7,10 (м, 2H), 5,86 (дд, J=10,3, 4,3 Гц, 1H), 3,94 (с, 3H), 3,33 (дд, J=17,0, 4,3 Гц, 1H), 3,24 (дд, J=17,0, 10,3 Гц, 1H); МС (ESI+) m/z 290 (M+H)+.
Пример 132C
этил rel-2-((S)-4-(((R)-трет-бутилсульфинил)имино)хроман-2-ил)тиазол-5-карбоксилат
Раствор соединения из примера 132B (70 мг, 0,242 ммоль), этоксида титана(IV) (331 мг, 1,452 ммоль) и (R)-(+)-2-метил-2-пропансульфинамида (44,0 мг, 0,363 ммоль) в тетрагидрофуране (1 мл) нагревали при 70°C в течение ночи. Смесь охлаждали и разделяли между этилацетатом (30 мл) и водой (15 мл). Твердое вещество удаляли с помощью фильтрования через диатомовую землю. Этилацетатный слой выделяли, промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали. Полученный остаток очищали с помощью хроматографии на силикагеле, элюируя градиентом 50-100% [9:1 CH2Cl2:этилацетат] в гептанах, затем элюировали градиентом 0-50% этилацетата в [9:1 CH2Cl2:этилацетат] с получением указанного в заголовке соединения (35,6 мг, 0,088 ммоль, выход 36,2%) в виде первого элюированного изомера. Стереохимия была назначена произвольно.1H ЯМР (400 МГц, CDCl3) δ 8,36 (с, 1H), 8,02 (д, J=8,1 Гц, 1H), 7,46 (т, J=7,7 Гц, 1H), 7,07 (дд, J=7,8, 3,7 Гц, 2H), 5,59 (дд, J=11,3, 3,3 Гц, 1H), 4,39 (кв, J=7,1 Гц, 2H), 4,05 (дд, J=17,5, 3,4 Гц, 1H), 3,56 (дд, J=17,5, 11,4 Гц, 1H), 1,40 (т, J=7,0 Гц, 3H), 1,33 (с, 9H); МС (ESI+) m/z 407 (M+H)+.
Пример 132D
этил rel-2-((2S,4S)-4-аминохроман-2-ил)тиазол-5-карбоксилат
Раствор соединения примера 132C (35,6 мг, 0,088 ммоль) в этаноле (2 мл) охлаждали до 0°C, обрабатывали NaBH4 (3,31 мг, 0,088 ммоль), перемешивали при 0°C в течение 15 минут, обрабатывали дополнительным количеством NaBH4 (5 мг), и перемешивали при 0°C в течение 75 минут. Реакционную смесь обрабатывали 4 М HCl в диоксане (219 мкл, 0,876 ммоль) и перемешивали при комнатной температуре в течение 40 минут. Смесь разделяли между водой (10 мл) и метил трет-бутиловым эфиром (30 мл). Водный слой подщелачивали твердым NaHCO3 и экстрагировали этилацетатом (30 мл). Этилацетатный слой промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали с получением указанного в заголовке соединения (26,2 мг, 0,086 ммоль, выход 98%). Стереохимия была назначена произвольно.1H ЯМР (400 МГц, CDCl3) δ 8,38 (с, 1H), 7,56 (д, J=7,8 Гц, 1H), 7,24 (т, J=7,7 Гц, 1H), 7,05 (т, J=7,3 Гц, 1H), 6,98 (д, J=8,2 Гц, 1H), 5,53 (дд, J=11,0, 2,3 Гц, 1H), 4,41 (кв, J=7,2 Гц, 2H), 4,35 (дд, J=10,6, 5,8 Гц, 1H), 2,83 (ддд, J=13,1, 5,6, 2,2 Гц, 1H), 2,09-1,99 (м, 1H), 1,42 (т, J=7,1 Гц, 3H); МС (ESI+) m/z 305 (M+H)+.
Пример 132E
этил rel-2-[(2S,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-5-карбоксилат
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 130Е, используя соединение из примера 132D вместо соединения из примера 130D.1H ЯМР (400 МГц, CDCl3) δ 8,24 (с, 1H), 7,21 (т, J=7,6 Гц, 1H), 7,15-7,10 (м, 3H), 7,01 (д, J=8,1 Гц, 1H), 6,99-6,96 (м, 1H), 6,94 (д, J=8,3 Гц, 1H), 5,56 (д, J=8,6 Гц, 1H), 5,53-5,45 (м, 2H), 4,38 (кв, J=7,1 Гц, 2H), 2,87 (ддд, J=13,4, 6,1, 2,8 Гц, 1H), 2,05-1,94 (м, 1H), 1,78-1,66 (м, 2H), 1,39 (т, J=7,1 Гц, 3H), 1,09 (д, J=3,0 Гц, 2H); МС (ESI-) m/z 527 (M-H)-.
Пример 133
2-[(4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-5-карбоновая кислота
Раствор соединения примера 132E (36 мг, 0,068 ммоль) в тетрагидрофуране (1 мл) разбавляли метанолом (1 мл) и затем обрабатывали 1 M NaOH (0,5 мл). Смесь перемешивали при комнатной температуре в течение 15 минут и подкисляли с помощью добавления 1 M HCl (2 мл). Смесь экстрагировали этилацетатом (30 мл). Слои разделяли и этилацетатный слой промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали с получением указанного в заголовке соединения (31 мг, 0,062 ммоль, выход 91%) в виде цис-транс-изомеров в соотношении 2:1. Стереохимия хирального центра, несущего аминогруппу, была произвольно определена как ʺSʺ.1H ЯМР (501 МГц, CDCl3) δ 8,46 (с, 0,35H), 8,36 (с, 0,65H), 7,28-7,21 (м, 1H), 7,19 (дд, J=8,2, 1,7 Гц, 0,35H), 7,17-7,12 (м, 2,65H), 7,05-6,98 (м, 2,35H), 6,96 (дд, J=8,2, 1,0 Гц, 0,65H), 5,63 (д, J=7,0 Гц, 0,35H), 5,59-5,49 (м, 1,95H), 5,28 (дд, J=10,0, 2,8 Гц, 0,35H), 5,14-5,10 (м, 0,35H), 2,91 (ддд, J=13,4, 6,0, 2,7 Гц, 0,65H), 2,67-2,58 (м, 0,35H), 2,35 (ддд, J=14,5, 10,2, 5,0 Гц, 0,35H), 2,01 (дт, J=13,3, 9,9 Гц, 0,65H), 1,82-1,68 (м, 2H), 1,17-1,08 (м, 2H); МС (ESI-) m/z 499 (M-H)-.
Пример 134
rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-карбоновая кислота
Раствор соединения из примера 130E в тетрагидрофуране (2 мл) разбавляли метанолом (2 мл) и затем обрабатывали 1 M NaOH (2 мл). Смесь перемешивали при комнатной температуре в течение 15 минут и подкисляли с помощью добавления 1 M HCl. Смесь экстрагировали этилацетатом (30 мл). Слои разделяли и этилацетатный слой промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали с получением указанного в заголовке соединения.1H ЯМР (400 МГц, CDCl3) δ 7,16 (дд, J=8,2, 1,6 Гц, 1H), 7,13 (д, J=1,5 Гц, 1H), 7,03 (д, J=8,1 Гц, 1H), 6,95 (д, J=8,5 Гц, 1H), 6,52 (дд, J=8,5, 2,5 Гц, 1H), 6,49 (д, J=2,4 Гц, 1H), 5,52 (д, J=7,1 Гц, 1H), 5,03 (кв, J=5,5 Гц, 1H), 4,58 (дд, J=7,9, 3,7 Гц, 1H), 3,76 (с, 3H), 2,38-2,23 (м, 2H), 1,78-1,70 (м, 2H), 1,16-1,08 (м, 2H); МС (ESI-) m/z 446 (M-H)-.
Пример 135
этил rel-2-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-5-карбоксилат
Пример 135A
этил rel-2-((R)-4-(((R)-трет-бутилсульфинил)имино)хроман-2-ил)тиазол-5-карбоксилат
Указанное в заголовке соединение выделяли в качестве второго элюированного изомера в результате хроматографической очистки, описанной в примере 132С. Стереохимия была назначена произвольно.1H ЯМР (400 МГц, CDCl3) δ 8,35 (с, 1H), 8,03 (дд, J=7,9, 1,5 Гц, 1H), 7,50-7,45 (м, 2H), 7,10-7,04 (м, 2H), 5,71 (дд, J=8,6, 4,2 Гц, 1H), 4,38 (кв, J=7,1 Гц, 1H), 4,15 (дд, J=17,1, 4,2 Гц, 1H), 3,66 (дд, J=17,1, 8,7 Гц, 1H), 1,40 (т, J=7,1 Гц, 3H), 1,36 (с, 9H); МС (ESI+) m/z 407 (M+H)+.
Пример 135B
этил rel-2-((2R,4R)-4-аминохроман-2-ил)тиазол-5-карбоксилат
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 132D, используя соединение из примера 135А вместо соединения из примера 132С. Стереохимия была назначена произвольно.1H ЯМР (400 МГц, CDCl3) δ 8,37 (с, 1H), 7,54 (д, J=7,7 Гц, 1H), 7,22 (т, J=7,2 Гц, 1H), 7,03 (т, J=7,0 Гц, 1H), 6,96 (дд, J=8,2, 0,9 Гц, 1H), 5,51 (дд, J=11,1, 2,4 Гц, 1H), 4,39 (кв, J=7,1 Гц, 2H), 4,33 (дд, J=10,6, 5,7 Гц, 1H), 2,81 (ддд, J=13,3, 5,7, 2,4 Гц, 1H), 2,01 (дт, J=13,2, 10,9 Гц, 1H), 1,40 (т, J=7,1 Гц, 3H); МС (ESI+) m/z 305 (M+H)+.
Пример 135C
этил rel-2-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-5-карбоксилат
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 130Е, используя соединение из примера 135В вместо соединения из примера 130D. Стереохимия была назначена произвольно.1H ЯМР (400 МГц, CDCl3) δ 8,24 (с, 1H), 7,21 (тд, J=7,9, 7,5, 1,1 Гц, 1H), 7,16-7,10 (м, 3H), 7,01 (д, J=8,1 Гц, 1H), 6,98 (дд, J=7,5, 1,1 Гц, 1H), 6,93 (дд, J=8,3, 1,0 Гц, 1H), 5,58-5,44 (м, 3H), 4,38 (кв, J=7,1 Гц, 2H), 2,87 (ддд, J=13,4, 6,1, 2,8 Гц, 1H), 2,00 (дт, J=13,4, 9,8 Гц, 1H), 1,78-1,65 (м, 2H), 1,39 (т, J=7,1 Гц, 3H), 1,13-1,05 (м, 2H); МС (ESI+) m/z 529 (M+H)+.
Пример 136
2-[(4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-5-карбоновая кислота
Указанное в заголовке соединение выделяли в виде цис-транс-изомеров в соотношении 2:1 с использованием способа, аналогичного способу, описанному в примере 133, используя соединение примера 135C вместо соединения примера 132E. Стереохимия хирального центра, несущего аминогруппу, была произвольно определена как ʺRʺ.1H ЯМР (400 МГц, CDCl3) δ 8,44 (с, 0,35H), 8,34 (с, 0,65H), 7,26-7,10 (м, 3,5H), 7,04-6,93 (м, 3,5H), 5,60 (д, J=6,9 Гц, 0,35H), 5,57-5,46 (м, 1,95H), 5,25 (дд, J=9,7, 2,1 Гц, 0,35H), 5,14-5,08 (м, 0,35H), 2,92-2,85 (м, 0,65H), 2,64-2,58 (м, 0,35H), 2,37-2,29 (м, 0,35H), 1,99 (дт, J=12,9, 9,7 Гц, 0,65H), 1,80-1,66 (м, 2H), 1,15-1,07 (м, 2H); МС (ESI-) m/z 499 (M-H)-.
Пример 137
метил 4-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]-2-фторбензоат
Пример 137A
(R)-метил 2-фтор-4-(7-метокси-4-оксохроман-2-ил)бензоат
В 20 мл сосуд загружали бис(2,2,2-трифторацетокси)палладий (84 мг, 0,253 ммоль), (S)-4-(трет-бутил)-2-(пиридин-2-ил)-4,5-дигидрооксазол (61,9 мг, 0,303 ммоль), гексафторфосфат(V) аммония (247 мг, 1,515 ммоль) и (3-фтор-4-(метоксикарбонил)фенил)бороновую кислоту (500 мг, 2,53 ммоль). Смесь перемешивали в дихлорэтане (10 мл) в течение 5 минут, и добавляли 7-метокси-4H-хромен-4-он (CAS 5751-52-0) (534 мг, 3,03 ммоль) и воду (0,256 мл, 14,19 ммоль). Смесь перемешивали при 60°С в течение ночи, фильтровали через слой диатомовой земли и элюировали и промывали этилацетатом с получением красного раствора. Растворитель удаляли в вакууме и неочищенный материал хроматографировали на картридже с силикагелем 24 г, элюируя этилацетатом в гептане при градиенте 0-40% с получением указанного в заголовке соединения (235 мг, 0,711 ммоль, 28,2%).1H ЯМР (400 МГц, CDCl3) δ 8,00 (т, J=7,7 Гц, 1H), 7,87 (д, J=8,8 Гц, 1H), 7,35-7,27 (м, 2H), 6,65 (дд, J=8,9, 2,4 Гц, 1H), 6,53 (д, J=2,4 Гц, 1H), 5,51 (дд, J=12,3, 3,6 Гц, 1H), 3,95 (с, 3H), 3,86 (с, 3H), 3,03-2,81 (м, 2H). МС (ESI+): m/z=331 (M+H)+
Пример 137B
(R)-метил 2-фтор-4-(7-метокси-4-(метоксиимино)хроман-2-ил)бензоат
Смесь соединения примера 137A (230 мг, 0,696 ммоль), ацетат натрия (114 мг, 1,393 ммоль) и O-метилгидроксиламина гидрохлорида (116 мг, 1,393 ммоль) в метаноле (10 мл) перемешивали при 60°С в течение 4 часов. Растворитель удаляли при пониженном давлении. Полученный остаток растворяли в этилацетате, промывали водой, сушили над MgSO4 и фильтровали. Растворитель удаляли при пониженном давлении. Полученное белое твердое вещество промывали диэтиловым эфиром с получением указанного в заголовке соединения (228 мг, 0,634 ммоль, выход 91%).1H ЯМР (400 МГц, CDCl3) δ 7,97 (дд, J=8,3, 7,4 Гц, 1H), 7,83 (д, J=8,8 Гц, 1H), 7,32-7,29 (м, 1H), 7,27 (с, 1H), 6,59 (дд, J=8,8, 2,6 Гц, 1H), 6,50 (д, J=2,5 Гц, 1H), 5,11 (дд, J=12,2, 3,2 Гц, 1H), 3,96 (с, 3H), 3,94 (с, 3H), 3,80 (с, 3H), 3,46 (дд, J=17,1, 3,2 Гц, 1H), 2,60 (дд, J=17,2, 12,1 Гц, 1H); МС (ESI+) m/z=360 (M+H)+.
Пример 137C
метил 4-((2R,4R)-4-амино-7-метоксихроман-2-ил)-2-фторбензоат, хлористоводородная кислота
Смесь соединения примера 137B (220 мг, 0,612 ммоль) и платину (119 мг, 0,031 ммоль) на угле в метаноле (6 мл) загружали водородом из баллона и перемешивали при комнатной температуре в течение 24 часов, ЖХ/МС показал приблизительно 50% превращения. Баллон наполняли вновь. Реакционную смесь загружали большим количеством платинового катализатора (0,05 эквивалента) и перемешивали в течение еще 24 часов, после чего ЖХ/МС показал превращение 95%. Реакционную смесь фильтровали через слой диатомовой земли и растворитель удаляли при пониженном давлении. К остатку по каплям добавляли 4 М HCl в диоксане. Выпавшее в осадок белое твердое вещество отфильтровывали и сушили с получением указанного в заголовке соединения (110 мг, 48,9%). МС (ESI+) m/z=315 (M-NH2)+.
Пример 137D
метил 4-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]-2-фторбензоат
К 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоте (87 мг, 0,359 ммоль) в N,N-диметилформамиде (4 мл) добавляли HATU (1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиний 3-оксид гексафторфосфат) (186 мг, 0,489 ммоль). Смесь перемешивали в течение 5 минут, и затем добавляли соединение примера 137C (120 мг, 0,326 ммоль), с последующим добавлением N-этил-N-изопропилпропан-2-амина (0,227 мл, 1,305 ммоль). Смесь перемешивали при комнатной температуре в течение 2 часов. Очистка с помощью хроматографии на силикагеле и элюирование градиентом 5-40% этилацетата в гептане давало указанное в заголовке соединение (120 мг, выход 66,2%).1H ЯМР (400 МГц, CDCl3) δ 7,94 (т, J=7,7 Гц, 1H), 7,24-7,17 (м, 2H), 7,12-7,03 (м, 2H), 7,00 (д, J=8,2 Гц, 1H), 6,95 (д, J=8,6 Гц, 1H), 6,52 (дд, J=8,7, 2,5 Гц, 1H), 6,44 (д, J=2,5 Гц, 1H), 5,38 (тд, J=10,0, 9,5, 5,8 Гц, 1H), 5,30 (д, J=8,6 Гц, 1H), 5,19 (дд, J=11,1, 2,0 Гц, 1H), 3,94 (с, 3H), 3,76 (с, 3H), 2,51 (ддд, J=13,4, 6,1, 2,2 Гц, 1H), 1,79-1,70 (м, 2H), 1,29-1,23 (м, 1H), 1,07 (д, J=3,8 Гц, 2H); МС (ESI-) m/z 554 (M-H)+.
Пример 138
метил 4-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]-3-фторбензоат
Указанное в заголовке соединение (115 мг, выход 66,2%) получали с использованием способов, аналогичных описанным в примерах 137A-137D, используя (2-фтор-4-(метоксикарбонил)фенил)бороновую кислоту вместо (3-фтор-4-(метоксикарбонил)фенил)бороновой кислоты.1H ЯМР (400 МГц, CDCl3) δ 7,83 (дд, J=8,1, 1,5 Гц, 1H), 7,72 (дд, J=10,7, 1,6 Гц, 1H), 7,57 (т, J=7,5 Гц, 1H), 7,12-7,06 (м, 2H), 7,01-6,95 (м, 2H), 6,53 (дт, J=8,7, 3,2 Гц, 1H), 6,43 (д, J=2,6 Гц, 1H), 5,51-5,45 (м, 1H), 5,42 (дт, J=10,2, 4,9 Гц, 1H), 5,30 (д, J=8,7 Гц, 1H), 3,94 (д, J=2,6 Гц, 3H), 3,76 (с, 3H), 2,53 (ддд, J=13,4, 6,2, 2,1 Гц, 1H), 1,82-1,69 (м, 2H), 1,27 (д, J=3,6 Гц, 1H), 1,07 (кв, J=2,4, 1,5 Гц, 2H); МС (ESI-) m/z=554 (M-H)-.
Пример 139
4-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]-2-фторбензойная кислота
К раствору соединения примера 137D (105 мг, 0,189 ммоль) в метаноле (2 мл) добавляли 4 н LiOH (0,5 мл). Смесь перемешивали при 35°С в течение 2 часов. Растворитель удаляли и к полученному остатку добавляли воду (0,5 мл). Значение рН смеси доводили с помощью 2 н HCl до значения pH 1~2. Полученное белое твердое вещество собирали фильтрованием и сушили с получением указанного в заголовке соединения (97 мг, выход 95%).1H ЯМР (501 МГц, CDCl3) δ 8,00 (с, 1H), 7,23 (д, J=9,5 Гц, 2H), 7,14-7,06 (м, 2H), 7,01 (дд, J=8,2, 4,6 Гц, 1H), 6,94 (д, J=8,5 Гц, 1H), 6,51 (дд, J=8,6, 2,5 Гц, 1H), 6,44 (д, J=2,6 Гц, 1H), 5,46-5,30 (м, 2H), 5,20 (д, J=11,1 Гц, 1H), 3,76 (с, 3H), 2,54 (д, J=12,6 Гц, 1H), 1,67 (с, 1H), 1,09 (д, J=3,5 Гц, 2H); МС (ESI-) m/z 540 (M-H)+.
Пример 140
этил rel-2-[(2S,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-4-карбоксилат
Пример 140A
этил 2-(1-гидрокси-3-(2-гидроксифенил)-3-оксопропил)тиазол-4-карбоксилат
Раствор диизопропиламина (923 мкл, 6,48 ммоль) в тетрагидрофуране (10 мл) охлаждали до -78°C в атмосфере N2, обрабатывали 2,5 М н-бутиллитием в гексане (2,246 мл, 5,62 ммоль), перемешивали при 0°C в течение 15 минут, обрабатывали 2'-гидроксиацетофеноном (286 мкл, 2,376 ммоль), перемешивали в течение 1 часа при температуре 0°C, охлаждали до -78°C, обрабатывали раствором этил 2-формилтиазол-4-карбоксилата (CAS # 73956-17-9) (400 мг, 2,160 ммоль) в тетрагидрофуране (5 мл), перемешивали при -78°C в течение 10 минут, гасили 10% водным раствором KH2PO4 (50 мл) и оставляли нагреваться до комнатной температуры. Смесь экстрагировали этилацетатом (дважды). Объединенные этилацетатные слои промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали. Остаток очищали с помощью хроматографии на силикагеле, элюируя градиентом 25-100% этилацетат в гептане с получением указанного в заголовке соединения (0,38 г, 1,183 ммоль, выход 54,8%).
Пример 140B
этил 2-(4-оксохроман-2-ил)тиазол-4-карбоксилат
Раствор 40% мас./мас. диэтилазодикарбоксилата в толуоле (0,619 мл, 1,360 ммоль) и трифенилфосфина (0,357 г, 1,360 ммоль) в тетрагидрофуране (10 мл) перемешивали при комнатной температуре в течение 15 минут. Раствор соединения примера 140A (0,38 г, 1,183 ммоль) в тетрагидрофуране (10 мл) добавляли по каплям в течение 10 минут. Смесь перемешивали при 0°C в течение 1 часа и затем при комнатной температуре в течение 30 минут. Реакция не протекала. В отдельном сосуде раствор трифенилфосфина (0,357 г, 1,360 ммоль) в тетрагидрофуране (10 мл) в атмосфере N2 охлаждали до 0°C и обрабатывали 40% мас./мас. диэтилазодикарбоксилатом в толуоле (0,619 мл, 1,360 ммоль) в течение 3 минут, перемешивали в течение 15 минут и переносили в исходную реакционную смесь по каплям в течение 15 минут. Смесь перемешивали при 0°C в течение 1 часа. Смесь концентрировали. Остаток очищали с помощью хроматографии на силикагеле, элюируя градиентом 10-100% этилацетата в гептане. Выделенный неочищенный продукт далее очищали хроматографией на силикагеле, элюируя градиентом [9:1 CH2Cl2:этилацетат] в гептане с получением указанного в заголовке соединения (70 мг, 0,231 ммоль, выход 19,52%).1H ЯМР (400 МГц, CDCl3) δ 8,24 (с, 1H), 7,96-7,92 (м, 1H), 7,56 (т, J=7,8 Гц, 1H), 7,14-7,08 (м, 2H), 5,88 (дд, J=11,7, 3,7 Гц, 1H), 4,44 (кв, J=7,1 Гц, 2H), 3,34 (дд, J=17,0, 3,7 Гц, 1H), 3,19 (дд, J=17,0, 11,7 Гц, 1H), 1,42 (т, J=7,1 Гц, 3H). ; МС (ESI+) m/z 304 (M+H)+, m/z 321 (M+NH4)+.
Пример 140C
этил rel-2-((S)-4-(((R)-трет-бутилсульфинил)имино)хроман-2-ил)тиазол-4-карбоксилат
Указанное в заголовке соединение выделяли в качестве первого элюированного изомера способом, аналогичным способу, описанному в примере 132C, используя соединение примера 140B вместо соединения примера 132B. Стереохимия была назначена произвольно.1H ЯМР (501 МГц, CDCl3) δ 8,26 (с, 1H), 8,07 (дд, J=8,0, 1,7 Гц, 1H), 7,48 (ддд, J=8,5, 7,3, 1,6 Гц, 1H), 7,12-7,07 (м, 2H), 5,66 (дд, J=12,7, 3,0 Гц, 1H), 4,48 (квд, J=7,1, 2,7 Гц, 2H), 4,14 (дд, J=17,5, 3,1 Гц, 1H), 3,38 (дд, J=17,5, 12,7 Гц, 1H), 1,45 (т, J=7,1 Гц, 3H), 1,35 (с, 9H); МС (ESI+) m/z 407 (M+H)+.
Пример 140D
этил rel-2-((2S,4S)-4-аминохроман-2-ил)тиазол-4-карбоксилат
Раствор соединения примера 14°C (31 мг, 0,076 ммоль) в этаноле (2 мл) охлаждали до 0°C, обрабатывали NaBH4 (8,66 мг, 0,229 ммоль), перемешивали при 0°C в течение 15 минут, и перемешивали при комнатной температуре в течение 1 часа. Смесь обрабатывали 4 М HCl в диоксане (191 мкл, 0,763 ммоль) и перемешивали при комнатной температуре в течение 40 минут. Смесь разделяли между водой (10 мл) и метил-трет-бутиловым эфиром (30 мл). Водный слой подщелачивали твердым NaHCO3 и экстрагировали этилацетатом (дважды, 2×30 мл). Объединенные этилацетатные слои промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали с получением указанного в заголовке соединения (20 мг, 0,066 ммоль, выход 86%). Стереохимия была назначена произвольно.1H ЯМР (501 МГц, CDCl3) δ 8,23 (с, 1H), 7,57 (д, J=7,5 Гц, 1H), 7,26-7,21 (м, 1H), 7,07-7,03 (м, 2H), 6,97 (дд, J=8,2, 1,1 Гц, 1H), 5,60 (дд, J=11,4, 2,2 Гц, 1H), 4,47 (кв, J=7,1 Гц, 2H), 4,36-4,30 (м, 1H), 2,88 (ддд, J=13,0, 5,6, 2,2 Гц, 1H), 1,45 (т, J=7,1 Гц, 3H); МС (ESI+) m/z 305 (M+H)+.
Пример 140E
этил rel-2-[(2S,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-4-карбоксилат
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 126G, используя соединение из примера 140D вместо соединения из примера 126F, и очищали при помощи хроматографии на силикагеле, элюируя градиентом 0-50% этилацетата в [9:1 CH2Cl2:этилацетат]. Стереохимия была назначена произвольно.1H ЯМР (500 МГц, CDCl3) δ 8,21 (с, 1H), 7,27-7,20 (м, 1H), 7,17 (дд, J=8,2, 1,7 Гц, 1H), 7,16-7,10 (м, 2H), 7,04 (д, J=8,2 Гц, 1H), 7,00 (тд, J=7,6, 1,1 Гц, 1H), 6,97 (дд, J=8,2, 1,0 Гц, 1H), 5,59 (дд, J=11,1, 2,4 Гц, 1H), 5,51 (тд, J=10,0, 6,2 Гц, 1H), 5,39 (д, J=8,9 Гц, 1H), 4,48 (кв, J=7,1 Гц, 2H), 2,97 (ддд, J=13,2, 6,0, 2,4 Гц, 1H), 1,94 (дт, J=13,2, 11,0 Гц, 1H), 1,81-1,77 (м, 1H), 1,72-1,68 (м, 1H), 1,46 (т, J=7,1 Гц, 3H), 1,15-1,09 (м, 2H); МС (ESI-) m/z 527 (M-H)-.
Пример 141
этил rel-2-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-4-карбоксилат
Пример 141A
этил rel-2-((R)-4-(((R)-трет-бутилсульфинил)имино)хроман-2-ил)тиазол-4-карбоксилат
Указанное в заголовке соединение выделяли в качестве второго элюированного изомера способом, аналогичным способу, описанному в примере 132C, используя соединение примера 140B вместо соединения примера 132B. Стереохимия была назначена произвольно.1H ЯМР (501 МГц, CDCl3) δ 8,23 (с, 1H), 8,06 (дд, J=8,4, 1,6 Гц, 1H), 7,48 (ддд, J=8,9, 7,6, 1,7 Гц, 1H), 7,11-7,06 (м, 2H), 5,74 (дд, J=10,1, 3,8 Гц, 1H), 4,46 (квд, J=7,1, 1,0 Гц, 2H), 4,28 (дд, J=17,1, 3,8 Гц, 1H), 3,48 (дд, J=17,2, 10,1 Гц, 1H), 1,45 (т, J=7,1 Гц, 3H), 1,35 (с, 9H); МС (ESI+) m/z 407 (M+H)+.
Пример 141B
этил rel-2-((2R,4R)-4-аминохроман-2-ил)тиазол-4-карбоксилат
и
этил rel-2-((2R,4S)-4-аминохроман-2-ил)тиазол-4-карбоксилат
Используя способ, аналогичный описанному в примере 140D, используя соединение из примера 141A вместо соединения из примера 140C, получали указанное в заголовке соединение в виде смеси цис- и транс-изомеров в соотношении 4:1. Стереохимия была назначена произвольно. ЯМР пиков основного цис-изомера:1H ЯМР (501 МГц, CDCl3) δ 8,23 (с, 1H), 7,57 (д, J=7,6 Гц, 1H), 7,26-7,21 (м, 1H), 7,05 (тд, J=7,6, 1,1 Гц, 1H), 6,97 (дд, J=8,2, 1,1 Гц, 1H), 5,60 (дд, J=11,4, 2,2 Гц, 1H), 4,47 (кв, J=7,1 Гц, 2H), 4,36-4,29 (м, 1H), 2,88 (ддд, J=13,1, 5,7, 2,2 Гц, 1H), 2,03-1,95 (м, 1H), 1,45 (т, J=7,1 Гц, 3H); МС (ESI+) m/z 305 (M+H)+.
Пример 141C
этил rel-2-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-4-карбоксилат
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 126G, используя соединение из примера 141В вместо соединения из примера 126F. Очистка с помощью хроматографии на силикагеле, элюирование градиентом 0-50% этилацетата в [9:1 CH2Cl2:этилацетат], давало указанное в заголовке соединение в виде первого элюированного изомера. Стереохимия была назначена произвольно.1H ЯМР (500 МГц, CDCl3) δ 8,23 (с, 1H), 7,30-7,25 (м, 1H), 7,22 (дд, J=8,2, 1,7 Гц, 1H), 7,20-7,17 (м, 2H), 7,04 (д, J=8,2 Гц, 1H), 7,03-6,98 (м, 2H), 5,62 (д, J=6,7 Гц, 1H), 5,30 (дд, J=11,2, 2,6 Гц, 1H), 5,14-5,09 (м, 1H), 4,49 (кв, J=7,1 Гц, 2H), 2,74 (дт, J=14,2, 2,8 Гц, 1H), 2,25 (ддд, J=14,3, 11,2, 4,9 Гц, 1H), 1,78 (ддд, J=10,0, 6,7, 3,4 Гц, 1H), 1,70 (ддд, J=9,9, 6,8, 3,6 Гц, 1H), 1,47 (т, J=7,1 Гц, 3H), 1,20 (ддд, J=10,3, 6,7, 3,6 Гц, 1H), 1,07 (ддд, J=9,7, 6,8, 3,3 Гц, 1H); МС (ESI+) m/z 529 (M+H)+.
Пример 142
этил rel-2-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-4-карбоксилат
Указанное в заголовке соединение выделяли в качестве второго элюированного изомера в результате хроматографии неочищенного материала, как описано в примере 141C. Стереохимия была назначена произвольно.1H ЯМР (400 МГц, CDCl3) δ 8,20 (с, 1H), 7,25-7,20 (м, 1H), 7,16 (дд, J=8,2, 1,7 Гц, 1H), 7,14-7,10 (м, 2H), 7,02 (д, J=8,2 Гц, 1H), 7,01-6,94 (м, 2H), 5,58 (дд, J=11,1, 2,4 Гц, 1H), 5,54-5,46 (м, 1H), 5,38 (д, J=8,9 Гц, 1H), 4,47 (кв, J=7,1 Гц, 2H), 2,96 (ддд, J=13,2, 6,0, 2,3 Гц, 1H), 1,93 (дт, J=13,1, 11,0 Гц, 1H), 1,78 (дд, J=10,1, 3,7 Гц, 1H), 1,69 (дд, J=9,5, 3,5 Гц, 1H), 1,45 (т, J=7,1 Гц, 3H), 1,15-1,07 (м, 2H); МС (ESI-) m/z 527 (M-H)-.
Пример 143
rel-2-[(2S,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-4-карбоновая кислота
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 152, используя соединение из примера 140Е вместо соединения из примера 151G. Стереохимия была назначена произвольно.1H ЯМР (500 МГц, CDCl3) δ 8,33 (с, 1H), 7,27-7,23 (м, 1H), 7,18 (дд, J=8,2, 1,6 Гц, 1H), 7,15-7,12 (м, 2H), 7,05 (д, J=8,2 Гц, 1H), 7,03-6,99 (м, 1H), 6,98 (д, J=8,2 Гц, 1H), 5,58 (дд, J=11,1, 1,7 Гц, 1H), 5,56-5,51 (м, 1H), 5,44 (д, J=8,8 Гц, 1H), 2,99 (дд, J=12,3, 5,0 Гц, 1H), 2,00-1,90 (м, 1H), 1,81 (дд, J=9,8, 3,2 Гц, 1H), 1,72 (дд, J=9,8, 3,1 Гц, 1H), 1,19-1,11 (м, 2H); МС (ESI-) m/z 499 (M-H)-.
Пример 144
rel-2-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-4-карбоновая кислота
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 152, используя соединение из примера 141С вместо соединения из примера 151G. Стереохимия была назначена произвольно.1H ЯМР (501 МГц, CDCl3) δ 8,32 (с, 1H), 7,29-7,25 (м, 1H), 7,20 (дд, J=8,2, 1,7 Гц, 1H), 7,18-7,15 (м, 2H), 7,03 (д, J=8,2 Гц, 1H), 7,02-6,98 (м, 2H), 5,63 (д, J=6,8 Гц, 0H), 5,29 (дд, J=10,5, 2,6 Гц, 1H), 5,15-5,11 (м, 1H), 2,69 (дт, J=14,3, 3,0 Гц, 1H), 2,33 (ддд, J=14,6, 10,7, 3,9 Гц, 2H), 1,77 (ддд, J=9,7, 6,5, 3,1 Гц, 1H), 1,72 (ддд, J=9,6, 6,3, 3,1 Гц, 1H), 1,17 (ддд, J=9,9, 6,5, 3,5 Гц, 1H), 1,09 (ддд, J=9,2, 6,4, 3,0 Гц, 1H); МС (ESI+) m/z 501 (M+H)+.
Пример 145
rel-2-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-4-карбоновая кислота
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 152, используя соединение из примера 142 вместо соединения из примера 151G.1H ЯМР (500 МГц, CDCl3) δ 8,33 (с, 1H), 7,27-7,23 (м, 1H), 7,18 (дд, J=8,2, 1,7 Гц, 1H), 7,16-7,12 (м, 2H), 7,05 (д, J=8,2 Гц, 1H), 7,04-7,00 (м, 1H), 6,98 (д, J=8,2 Гц, 1H), 5,57 (дд, J=11,0, 1,8 Гц, 1H), 5,56-5,51 (м, 1H), 5,43 (д, J=8,7 Гц, 1H), 2,99 (ддд, J=13,3, 5,8, 1,8 Гц, 1H), 2,00-1,90 (м, 1H), 1,83-1,78 (м, 1H), 1,75-1,70 (м, 1H), 1,18-1,11 (м, 2H); МС (ESI-) m/z 499 (M-H)-.
Пример 146
4-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]-3-фторбензойная кислота
Смесь соединения из примера 138 (100 мг, 0,180 ммоль) и 2 н водного LiOH (0,5 мл) в метаноле (2 мл) перемешивали при 35°С в течение 2 часов. Растворитель удаляли и добавляли воду (0,5 мл). Значение рН смеси доводили с помощью 2 н HCl до значения pH 1~2. Осажденное белое твердое вещество собирали фильтрованием и сушили с получением указанного в заголовке соединения (85 мг, выход 87%).1H ЯМР (500 МГц, CDCl3) δ 7,92 (ддд, J=18,8, 8,0, 1,5 Гц, 1H), 7,79 (тд, J=10,2, 1,6 Гц, 1H), 7,64 (дт, J=20,9, 7,5 Гц, 1H), 7,19-7,07 (м, 2H), 7,04-6,95 (м, 2H), 6,54 (ддд, J=8,6, 4,5, 2,5 Гц, 1H), 6,45 (дд, J=6,3, 2,5 Гц, 1H), 5,50 (дд, J=11,3, 2,0 Гц, 1H), 5,44 (тд, J=9,7, 6,1 Гц, 1H), 5,34 (д, J=8,8 Гц, 1H), 3,76 (д, J=1,6 Гц, 3H), 2,55 (ддд, J=13,4, 6,2, 2,1 Гц, 1H), 1,82-1,70 (м, 2H), 1,66 (ддд, J=9,7, 4,3, 2,0 Гц, 1H), 1,14-1,03 (м, 2H); МС (ESI-) m/z 540 (M-H)+.
Пример 147
метил rac-3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]бицикло[1.1.1]пентан-1-карбоксилат
Пример 147A
метил 3-(7-метокси-4-оксохроман-2-ил)бицикло[1.1.1]пентан-1-карбоксилат
Указанное в заголовке соединение получали и очищали, используя способы, аналогичные описанным в примере 129A, используя метил 3-формилбицикло[1.1.1]пентан-1-карбоксилат вместо метил 3-оксоциклобутанкарбоксилата.
Пример 147B
метил 3-[4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]бицикло[1.1.1]пентан-1-карбоксилат
Указанное в заголовке соединение получали и очищали, используя способы, аналогичные описанным в примере 129B, используя соединение из примера 147A вместо соединения из примера 129A (выход 73%).1H ЯМР (500 МГц, CDCl3) δ 7,76 (д, J=8,8 Гц, 1H), 6,52 (дд, J=8,8, 2,5 Гц, 1H), 6,40 (д, J=2,5 Гц, 1H), 4,06 (дд, J=11,2, 3,5 Гц, 1H), 3,96 (с, 3H), 3,79 (с, 3H), 3,69 (с, 3H), 3,06 (дд, J=17,0, 3,5 Гц, 1H), 2,43-2,28 (м, 1H), 2,13-2,01 (м, 6H); МС (ESI+) m/z=332 (M+H)+.
Пример 147C
метил rac-3-((2R,4R)-4-амино-7-метоксихроман-2-ил)бицикло[1.1.1]пентан-1-карбоксилат гидрохлорид
Соединение из примера 147B (150 мг, 0,453 ммоль) в уксусной кислоте загружали водородом из баллона и восстанавливали до амина с использованием 5% платины (177 мг, 0,045 ммоль) на угле в качестве катализатора и перемешивали в течение 18 часов при комнатной температуре. Реакционную смесь фильтровали через слой диатомовой земли и растворитель удаляли под давлением. К остатку добавляли метил-трет-бутиловый эфир (2 мл) с последующим медленным добавлением 4 М HCl в диоксане (0,5 мл). Осажденное белое твердое вещество собирали фильтрованием и сушили с получением указанного в заголовке соединения (105 мг, 0,309 ммоль, выход 68,3%). МС (ESI+) m/z=287 (M-NH2)+.
Пример 147D
метил rac-3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]бицикло[1.1.1]пентан-1-карбоксилат
К 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоте (78 мг, 0,324 ммоль) в N,N-диметилформамиде (2 мл) добавляли HATU (1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиний 3-оксид гексафторфосфат) (168 мг, 0,441 ммоль). Смесь перемешивали при комнатной температуре в течение 5 минут, с последующим добавлением соединения примера 147C (100 мг, 0,294 ммоль) и N-этил-N-изопропилпропан-2-амина (0,205 мл, 1,177 ммоль). Смесь перемешивали при комнатной температуре в течение 2 часов. Очищали с помощью хроматографии, элюируя 0-40% этилацетатом в гептане с получением указанного в заголовке соединения (68 мг, 43,8%).1H ЯМР (500 МГц, CDCl3) δ 7,19-7,12 (м, 2H), 7,03 (д, J=8,2 Гц, 1H), 6,86 (дд, J=8,5, 1,0 Гц, 1H), 6,44 (дд, J=8,6, 2,6 Гц, 1H), 6,32 (д, J=2,6 Гц, 1H), 5,32 (д, J=8,8 Гц, 1H), 5,26-5,17 (м, 1H), 4,07 (дд, J=11,9, 1,6 Гц, 1H), 3,73 (с, 3H), 3,69 (с, 3H), 2,21 (ддд, J=13,0, 6,2, 1,8 Гц, 1H), 2,08-1,99 (м, 6H), 1,97-1,84 (м, 1H), 1,74 (ддд, J=9,0, 5,4, 2,2 Гц, 1H), 1,69-1,63 (м, 1H), 1,08 (тдд, J=9,6, 6,2, 3,0 Гц, 2H); МС (ESI-) m/z 526 (M-H)+.
Пример 148
rac-3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]бицикло[1.1.1]пентан-1-карбоновая кислота
К соединению примера 147D (23 мг, 0,044 ммоль) в 4 мл сосуде добавляли метанол (1,5 мл) с последующим добавлением 4 н раствора LiOH в воде (0,5 мл). Смесь перемешивали при 35°С в течение 2 часов. Растворитель удаляли и добавляли воду (1 мл), с последующим добавлением 2 н раствора HCl для установления значения снижения рН до 1~2. Осажденное белое твердое вещество собирали фильтрованием и сушили с получением указанного в заголовке соединения (21,5 мг, 96%). 1H ЯМР (500 МГц, CDCl3) δ 7,17 (дд, J=8,2, 1,7 Гц, 1H), 7,15-7,05 (м, 2H), 7,03 (д, J=8,1 Гц, 1H), 6,86 (дд, J=8,5, 1,0 Гц, 1H), 6,47-6,41 (м, 1H), 6,32 (д, J=2,5 Гц, 1H), 5,33 (д, J=8,8 Гц, 1H), 5,27-5,15 (м, 1H), 4,08 (дд, J=11,7, 1,6 Гц, 1H), 3,74 (д, J=1,5 Гц, 3H), 2,22 (ддд, J=12,9, 6,2, 1,8 Гц, 1H), 2,11-2,02 (м, 6H), 1,74 (ддд, J=8,9, 5,4, 2,2 Гц, 1H), 1,65 (дпд, J=19,3, 7,6, 6,5, 3,1 Гц, 2H), 1,12-1,05 (м, 2H), МС (ESI-) m/z 512 (M-H)
Пример 149
этил rac-6-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]пиридин-3-карбоксилат
Пример 149A
трет-бутил 3-(2-гидроксифенил)-3-оксопропаноат
К раствору диизопропиламина (26,6 мл, 190 ммоль) в безводном тетрагидрофуране (100 мл) в атмосфере азота и при -78°C добавляли 1,6 М н-бутиллитий в гексане (110 мл, 176 ммоль). После полученную суспензию перемешивали некоторое время, добавляли раствор трет-бутилацетата (20,1 мл, 150 ммоль) в тетрагидрофуране (30 мл) в течение 15 минут. Затем, после того как раствор перемешивали при -78°C приблизительно 100 минут, к реакционной смеси в течение почти 20 минут добавляли раствор метилсалицилата (6,45 мл, 50,0 ммоль) в тетрагидрофуране (50 мл). Реакционную смесь оставляли нагреваться до комнатной температуры в течение ночи и реакционную смесь затем гасили 1 М водной лимонной кислотой (80 мл). Водную фазу отделяли и дважды экстрагировали этилацетатом. Объединенные органические фазы промывали насыщенным солевым раствором, концентрировали и хроматографировали на силикагеле (30-50% CH2Cl2/гептан) с получением очищенного материала и дополнительных фракций, которые еще не были очищены. Неочищенные фракции концентрировали и хроматографировали на силикагеле (элюировали 25-50% CH2Cl2/гептан). Целевые фракции из обеих колонок объединяли и концентрировали с получением указанного в заголовке соединения (9,55 г).1H ЯМР (500 МГц, CDCl3) δ м.д. 1,49 (с, 9H), 3,95 (с, 2H), 6,95 (ддд, J=8,0, 7,3, 1,1 Гц, 1H), 7,04 (дд, J=8,4, 1,1 Гц, 1H), 7,53 (ддд, J=8,4, 7,3, 1,7 Гц, 1H), 7,71 (дд, J=8,0, 1,7 Гц, 1H), 11,95 (с, 1H); МС (DCI) m/z 237 (M+H)+, 254 (M+NH4)+.
Пример 149B
трет-бутил 3-(5-бромпиридин-2-ил)-2-(2-гидроксибензоил)акрилат
Смесь соединения примера 149A (1,66 г, 7,0 ммоль), 5-бромпиколинальдегида (1,33 г, 7,15 ммоль), пиперидина (30 мкл, 0,30 ммоль) и уксусной кислоты (17,5 мкл, 0,31 ммоль) нагревали при легком кипении с обратным холодильником в безводном толуоле (30 мл), в круглодонной колбе с прикрепленным аппаратом Дина-Старка в течение 40 минут. Нагрев был увеличено до очень медленного азеотропа воды. Спустя час теплота восстанавливалась до слабого нагревания, добавляли молекулярные сита 3Å (3,5 г). После 30 минут кипячения с обратным холодильником реакционную смесь охлаждали до комнатной температуры. Сита отфильтровывали тщательной промывкой хлороформом и фильтрат концентрировали до темного сиропа, который хроматографировали на силикагеле (20% метил-трет-бутиловый эфир/гептан) с получением неочищенного твердого вещества, которое суспендировали в гептане. Указанное в заголовке соединение собирали фильтрованием, с промыванием гептаном, в виде желтого порошка (1,105 г).1H ЯМР (400 МГц, CDCl3) δ м.д. 1,41 (с, 9H), 6,74-6,79 (м, 1H), 7,00-7,04 (м, 1H), 7,28 (д, J=8,2 Гц, 1H), 7,40-7,45 (м, 2H), 7,68 (с, 1H), 7,76-7,80 (м, 1H), 8,40 (д, J=2,3 Гц, 1H), 11,73 (с, 1H); МС (ESI) m/z 406 (M+H)+.
Пример 149C
2-(5-бромпиридин-2-ил)хроман-4-он
Смесь соединения примера 149B (1,103 г, 2,72 ммоль) и 1-(3,5-бис(трифторметил)фенил)-3-((1R,2R)-2-(диметиламино)циклогексил)тиомочевины (170 мг, 0,41 ммоль) перемешивали в безводном толуоле (15 мл) в течение 3 часов при комнатной температуре и затем при 40°С в течение ночи. Добавляли (rac)-камфорсульфоновую кислоту (316 мг, 1,36 ммоль) и раствор нагревали при 90°C в течение двух суток и охлаждали до комнатной температуры. Реакционную смесь помещали на колонку с силикагелем и хроматографировали (20-35% метил-трет-бутиловый эфир/гептан) с получением указанного в заголовке соединения (414 мг).1H ЯМР (400 МГц, CDCl3) δ м.д. 3,11-3,15 (м, 2H), 5,57 (дд, J=7,7 Гц, 1H), 7,04-7,10 (м, 2H), 7,50-7,56 (м, 2H), 7,90 (дд, J=8,4, 2,4 Гц, 1H), 7,92-7,95 (м, 1H), 8,66-8,68 (м, 1H); МС (DCI) m/z 306 (M+H)+.
Пример 149D
этил 6-(4-оксохроман-2-ил)никотинат
К соединению примера 149C (410 мг, 1,35 ммоль) и дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладию(II) (49 мг, 0,068 ммоль) в 50 мл сосуде для реакций под давлением добавляли этанол (10 мл) и триэтиламин (0,377 мл, 2,70 ммоль). Реактор несколько раз дегазировали аргоном, затем заполняли монооксидом углерода и нагревали при 100°С в течение 16 часов при давлении 70 фунт/кв.дюйм. Образец концентрировали и фильтровали через силикагель (80% CH2Cl2/гептан), и фильтрат концентрировали и хроматографировали на силикагеле (60-100% CH2Cl2/гептан) с получением указанного в заголовке соединения в виде оранжевого твердого вещества (242 мг).1H ЯМР (400 МГц, CDCl3) δ м.д. 1,42 (т, J=7,1 Гц, 3H), 3,12 (дд, J=17,0, 11,6 Гц, 1H), 3,20 (дд, J=17,0, 4,0 Гц, 1H), 4,43 (кв, J=7,1 Гц, 2H), 5,67 (дд, J=11,6, 4,0 Гц, 1H), 7,05-7,13 (м, 2H), 7,54 (ддд, J=8,6, 7,2, 1,8 Гц, 1H), 7,74 (д, J=8,2 Гц, 1H), 7,94 (дд, J=7,8, 1,8 Гц, 1H), 8,38 (дд, J=8,2, 2,2 Гц, 1H), 9,20 (д, J=2,2 Гц, 1H); МС (DCI) m/z 298 (M+H)+.
Пример 149E
этил 6-(4-(этоксиимино)хроман-2-ил)никотинат
Смесь соединения примера 149D (239 мг, 0,80 ммоль), O-этилгидроксиламин гидрохлорида (117 мг, 1,20 ммоль) и ацетата калия (118 мг, 1,20 ммоль) нагревали в этаноле (3 мл) при 50°С в течение 90 минут и затем охлаждали до комнатной температуры, концентрировали и хроматографировали на силикагеле (30% метил-трет-бутиловый эфир/гептан) с получением указанного в заголовке соединения в виде оранжевого сиропа (262 мг).1H ЯМР (500 МГц, CDCl3) δ м.д. 1,31 (т, J=7,1 Гц, 3H), 1,42 (т, J=7,1 Гц, 3H), 2,75 (дд, J=17,2, 11,8 Гц, 1H), 3,71 (дд, J=17,2, 3,5 Гц, 1H), 4,21-4,26 (м, 2H), 4,43 (кв, J=7,1 Гц, 2H), 5,26 (дд, J=11,8, 3,5 Гц, 1H), 6,97-7,03 (м, 2H), 7,29 (ддд, J=8,2, 7,2, 1,7 Гц, 1H), 7,70-7,73 (м, 1H), 7,95 (дд, J=7,9, 1,7 Гц, 1H), 8,36 (дд, J=8,2, 2,1 Гц, 1H), 9,20 (дд, J=2,1, 0,8 Гц, 1H); МС (DCI) m/z 341 (M+H)+.
Пример 149F
этил 6-(4-аминохроман-2-ил)никотинат
Соединение примера 149E (259 мг, 0,76 ммоль) и этанол (25 мл) добавляли к Ra-Ni 2800, водной суспензии (2,6 г, 20 ммоль) в 50 мл сосуде для реакций под давлением и перемешивали или встряхивали в течение 16 часов в атмосфере водорода при давлении 30 фунтов/кв.дюйм и при комнатной температуре. Реакционную смесь фильтровали, концентрировали и хроматографировали на силикагеле (0-3% концентрированный водный NH4OH в ацетонитриле) с получением указанного в заголовке соединения в виде сиропа (119 мг). МС (ESI) m/z 299 (M+H)+.
Пример 149G
этил rac-6-((2R,4S)-4-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)хроман-2-ил)никотинат
1-(2,2-Дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновую кислоту (132 мг, 0,55 ммоль), карбонилдиимидазол (89 мг, 0,55 ммоль) и 1-гидрокси-7-азабензотриазол (8 мг, 0,06 ммоль) перемешивали в безводном ацетонитриле (1,3 мл) в течение 100 минут и затем переносили в сосуд, содержащий соединение примера 149F (115 мг, 0,39 ммоль), с промывкой ацетонитрилом (0,2 мл). Через несколько минут добавляли диизопропилэтиламин (50 мкл, 0,29 ммоль) и раствор перемешивали при комнатной температуре в течение 3,5 часов. Затем раствор концентрировали и хроматографировали на силикагеле (5-20% метил-трет-бутиловый эфир в 1:1 CH2Cl2/гептан) с получением указанного в заголовке соединения в виде первого элюированного изомера (84 мг), и соединения примера 150 (85 мг) в виде второго элюированного изомера.1H ЯМР (501 МГц, CDCl3) δ м.д. 1,04-1,12 (м, 2H), 1,42 (т, J=7,1 Гц, 3H), 1,66-1,73 (м, 2H), 2,23 (ддд, J=14,1, 10,3, 4,9 Гц, 1H), 2,47 (ддд, J=14,1, 4,1, 2,9 Гц, 1H), 4,43 (кв, J=7,1 Гц, 2H), 5,01-5,06 (м, 2H), 5,62 (д, J=7,4 Гц, 1H), 6,91-7,04 (м, 4H), 7,13-7,16 (м, 2H), 7,18 (дд, J=8,2, 1,7 Гц, 1H), 7,23 (ддд, J=8,6, 7,2, 1,7 Гц, 1H), 7,62 (д, J=8,2 Гц, 1H), 8,32 (дд, J=8,2, 2,1 Гц, 1H), 9,19-9,21 (м, 1H); МС (ESI) m/z 523 (M+H)+.
Пример 150
этил rac-6-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]пиридин-3-карбоксилат
Указанное в заголовке соединение получали в виде второго элюированного изомера в результате хроматографии, описанной в примере 149G.1H ЯМР (500 МГц, CDCl3) δ м.д. 1,04-1,11 (м, 2H), 1,43 (т, J=7,1 Гц, 3H), 1,64-1,68 (м, 1H), 1,73-1,77 (м, 1H), 1,84 (ддд, J=13,3, 10,9, 10,8 Гц, 1H), 2,78 (ддд, J=13,3, 6,2, 2,3 Гц, 1H), 4,43 (кв, J=7,1 Гц, 2H), 5,33 (дд, J=10,8, 2,3 Гц, 1H), 5,41 (д, J=8,9 Гц, 1H), 5,48-5,55 (м, 1H), 6,91-7,03 (м, 3H), 7,08-7,13 (м, 3H), 7,17-7,22 (м, 1H), 7,63 (д, J=8,2 Гц, 1H), 8,32 (дд, J=8,2, 2,1 Гц, 1H), 9,14 (дд, J=2,1, 0,8 Гц, 1H); МС (ESI) m/z 523 (M+H)+.
Пример 151
этил 3-[4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]циклобутанкарбоксилат
Пример 151A
этил 3-метиленциклобутанкарбоксилат
Смесь 3-метиленциклобутанкарбоновой кислоты (CAS# 15760-36-8) (2,06 г, 18,37 ммоль), этилиодида (1,782 мл, 22,05 ммоль) и Cs2CO3 (13,17 г, 40,4 ммоль) в N,N-диметилформамиде (100 мл) в атмосфере N2 перемешивали при комнатной температуре в течение ночи. Смесь медленно выливали в перемешиваемую с температурой 0°С смесь 0,2 M HCl (500 мл) и метил-трет-бутилового эфира (1000 мл). Слои разделяли и водный слой экстрагировали и слой метил-трет-бутилового эфира промывали водой (500 мл × 2), промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали с получением указанного в заголовке соединения (2,5 г, 17,83 ммоль, выход 97%).1H ЯМР (500 МГц, CDCl3) δ 4,83 (п, J=2,3 Гц, 2H), 4,19 (кв, J=7,1 Гц, 2H), 3,18-3,11 (м, 1H), 3,07-3,00 (м, 2H), 2,97-2,89 (м, 2H), 1,30 (т, J=7,1 Гц, 3H).
Пример 151B
этил 3-(гидроксиметил)циклобутанкарбоксилат
Раствор соединения примера 151A (2,5 г, 17,83 ммоль) в тетрагидрофуране (20 мл) обрабатывали комплексом боран-метилсульфид (4,46 мл, 8,92 ммоль) и смесь перемешивали при комнатной температуре в течение приблизительно 3 часов. Добавляли суспензию пербората натрия (1,751 г, 21,40 ммоль) в воде (15 мл) (сначала медленно), затем диоксан (15 мл). Смесь нагревали до 65°С в течение 2 часов и давали смеси медленно остыть до комнатной температуры в течение ночи. Смесь разделяли между этилацетатом (100 мл) и водой (50 мл). Слои разделяли и водный слой экстрагировали этилацетатом (50 мл). Объединенные этилацетатные слои промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали с получением указанного в заголовке соединения (2,8 г, 17,70 ммоль, выход 99%) в виде смеси цис- и транс-изомеров в соотношении 1:1. МС (DCI+) m/z 176 (M+NH4)+.
Пример 151C
этил 3-формилциклобутанкарбоксилат
Следуя способу, описанному в Kasar, et al. WO2012154204A1, 2012, раствор оксалилхлорида (3,10 мл, 35,4 ммоль) в CH2Cl2 (115 мл) охлаждали до -78°C в атмосфере N2, обрабатывали по каплям раствором диметилсульфоксида (5,02 мл, 70,8 ммоль) в CH2Cl2 (10 мл), с последующим добавлением раствора соединения примера 151B (2,8 г, 17,70 ммоль) в CH2Cl2 (40 мл). Смесь перемешивали при -78°C в течение 2 часов, обрабатывали триэтиламином (24,67 мл, 177 ммоль), перемешивали при -78°C в течение 20 минут, гасили насыщенным раствором NH4Cl (100 мл) и оставляли нагреваться до комнатной температуры. Слои разделяли и водный слой экстрагировали CH2Cl2 (дважды). Объединенные слои CH2Cl2 сушили (MgSO4), фильтровали и концентрировали. Остаток очищали с помощью хроматографии на силикагеле, элюируя градиентом 0-90% этилацетата в гептанах с получением указанного в заголовке соединения.
Пример 151D
этил 3-(4-оксохроман-2-ил)циклобутанкарбоксилат
Смесь 2'-гидроксиацетофенона (212 мг, 1,560 ммоль) и соединения примера 151C (203 мг, 1,300 ммоль) в этаноле (1 мл) обрабатывали пирролидином (107 мкл, 1,300 ммоль) и перемешивали при комнатной температуре в течение ночи. Смесь разделяли между этилацетатом (30 мл) и 1 M HCl (10 мл). Этилацетатный слой промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали. Остаток очищали с помощью хроматографии на силикагеле, элюируя градиентом 10-30% этилацетата в гептане с получением указанного в заголовке соединения (0,27 г, 0,984 ммоль, выход 76%).1H ЯМР (400 МГц, CDCl3) δ 7,93-7,88 (м, 1H), 7,55-7,47 (м, 1H), 7,07-6,99 (м, 2H), 4,49-4,37 (м, 1H), 4,24-4,14 (м, 2H), 3,23-3,04 (м, 1H), 2,83-2,74 (м, 0,5H), 2,70-2,57 (м, 2,5H), 2,52-2,24 (м, 4H), 1,33-1,27 (м, 3H); МС (ESI+) m/z 275 (M+H)+.
Пример 151E
этил 3-(4-(метоксиимино)хроман-2-ил)циклобутанкарбоксилат
Раствор соединения примера 151D (270 мг, 0,984 ммоль) и O-метилгидроксиламина гидрохлорида (247 мг, 2,95 ммоль) в пиридине (2 мл) нагревали при 65°C в течение 1 часа. Смесь охлаждали, концентрировали и разделяли между этилацетатом (50 мл) и водой (15 мл). Этилацетатный слой промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали, концентрировали и сушили в вакууме с получением указанного в заголовке соединения (0,27 г, 0,890 ммоль, выход 90%).1H ЯМР (400 МГц, CDCl3) δ 8,50 (тд, J=6,5, 3,1 Гц, 0,1H), 7,90 (ддд, J=7,9, 6,5, 1,5 Гц, 0,9H), 7,36-7,22 (м, 1H), 6,98-6,89 (м, 2H), 4,18 (дкв, J=14,2, 7,1 Гц, 2H), 4,08-3,95 (м, 4H), 3,22-2,99 (м, 1,5H), 2,78-2,65 (м, 0,5H), 2,62-2,21 (м, 5H), 1,34-1,25 (м, 3H); МС (ESI+) m/z 304 (M+H)+.
Пример 151F
этил 3-(4-аминохроман-2-ил)циклобутанкарбоксилат
Раствор соединения примера 151E (0,27 г, 0,890 ммоль) в этаноле (20 мл) добавляли к Ra-Ni 2800, водной суспензии (3 г, 23,00 ммоль) в 50 мл сосуде для реакций под давлением и перемешивали при комнатной температуре в атмосфере H2 в течение 16 часов при давлении 30 фунтов на квадратный дюйм. Смесь фильтровали для удаления твердых веществ и фильтрат концентрировали с получением указанного в заголовке соединения (230 мг, 0,835 ммоль, выход 94%) в виде смеси изомеров.1H ЯМР (400 МГц, CDCl3) δ 7,44 (т, J=7,4 Гц, 0,5H), 7,23 (дт, J=7,6, 1,6 Гц, 0,5H), 7,20-7,11 (м, 1H), 6,96-6,79 (м, 2H), 4,23-3,98 (м, 4H), 3,21-2,98 (м, 1H), 2,65 (дт, J=15,0, 7,4 Гц, 0,5H), 2,57-2,21 (м, 5H), 2,12 (дтд, J=12,8, 6,4, 1,7 Гц, 0,5H), 1,76 (ддд, J=7,6, 5,9, 3,1 Гц, 1H), 1,32-1,24 (м, 3H); МС (ESI+) m/z 259 (M-NH3)+.
Пример 151G
этил 3-[4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]циклобутанкарбоксилат
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 126G, используя соединение из примера 151F вместо соединения из примера 126F. Неочищенный материал очищали с помощью хроматографии на силикагеле, элюируя градиентом 15-50% этилацетата в гептанах с получением указанного в заголовке соединения.1H ЯМР (400 МГц, CDCl3) δ 7,20-7,07 (м, 3,5H), 7,06-6,98 (м, 1,5H), 6,91-6,77 (м, 2H), 5,55-5,50 (м, 0,5H), 5,39 (дд, J=8,7, 5,4 Гц, 0,5H), 5,36-5,26 (м, 0,5H), 5,05-4,98 (м, 0,5H), 4,22-3,99 (м, 2,5H), 3,74-3,64 (м, 0,5H), 3,15-2,96 (м, 1H), 2,69-2,53 (м, 0,5H), 2,51-2,14 (м, 4H), 1,96 (ддт, J=12,7, 7,8, 2,3 Гц, 0,5H), 1,80-1,66 (м, 1H), 1,34-1,23 (м, 3H), 1,14-1,04 (м, 2H), 0,93-0,81 (м, 3H); МС (ESI+) m/z 500 (M+H)+.
Пример 152
3-[4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]циклобутанкарбоновая кислота
Раствор соединения примера 151G (50 мг, 0,100 ммоль) в тетрагидрофуране (1,5 мл) разбавляли метанолом (1,5 мл), обрабатывали 1 M NaOH (1 мл) и перемешивали при комнатной температуре в течение 15 минут. Смесь обрабатывали 1 M HCl (5 мл) и экстрагировали этилацетатом (30 мл). Этилацетатный слой промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали с получением указанного в заголовке соединения (47 мг, 0,100 ммоль, выход 100%).1H ЯМР (400 МГц, CDCl3) δ 7,21-7,08 (м, 3,5H), 7,06-6,98 (м, 1,5H), 6,91-6,78 (м, 2H), 5,54 (д, J=6,8 Гц, 0,5H), 5,42 (дд, J=8,8, 2,3 Гц, 0,5H), 5,31 (с, 0,5H), 5,05-4,98 (м, 0,5H), 4,10-4,00 (м, 0,5H), 3,75-3,63 (м, 0,5H), 3,22-3,03 (м, 1H), 2,74-2,57 (м, 0,5H), 2,55-2,17 (м, 5H), 2,00-1,92 (м, 0,5H), 1,81-1,64 (м, 3H), 1,15-1,03 (м, 2H); МС (ESI+) m/z 472 (M+H)+.
Пример 153
rac-6-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]пиридин-3-карбоновая кислота
Соединение примера 149G (18 мг, 35 мкмоль) растворяли в безводом тетрагидрофуране (140 мкл) и метаноле (35 мкл), обрабатывали двумя каплями 3 М водного NaOH (приблизительно 40 мкл) и перемешивали при комнатной температуре в течение двух часов. Реакционную смесь концентрировали, подкисляли каплей концентрированной водной HCl и разделяли между насыщенным солевым раствором и метил-трет-бутиловым эфиром. Водную фазу отделяли и экстрагировали еще метил-трет-бутиловым эфиром. Объединенные органические фазы сушили (Na2SO4), фильтровали и концентрировали. Когда было обнаружено, что реакция была неполной, материал повторно подвергали условиям реакции, перемешивали в течение ночи и обрабатывали, как описано выше, с получением указанного в заголовке соединения (17 мг).1H ЯМР (501 МГц, CDCl3) δ м.д. 1,09-1,16 (м, 2H), 1,73-1,78 (м, 2H), 2,25-2,34 (м, 1H), 2,52-2,59 (м, 1H), 5,06-5,11 (м, 1H), 5,16 (ушир, 1H), 5,20-5,26 (м, 1H), 5,75 (д, J=7,2 Гц, 1H), 6,96-7,05 (м, 3H), 7,15-7,29 (м, 4H), 7,75 (д, J=7,6 Гц, 1H), 8,45 (д, J=7,3 Гц, 1H), 9,23-9,28 (м, 1H); МС (ESI) m/z 493 (M-H)-.
Пример 154
rac-6-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2Н-хромен-2-ил]пиридин-3-карбоновая кислота
Соединение примера 150 (18 мг, 35 мкмоль) растворяли в безводом THF (170 мкл) и метаноле (70 мкл), обрабатывали тремя каплями 3 M водного NaOH (приблизительно 70 мкл) и перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали, подкисляли каплей концентрированной водной HCl и разделяли между насыщенным солевым раствором и метил-трет-бутиловым эфиром. Водную фазу отделяли и экстрагировали еще метил-трет-бутиловым эфиром. Объединенные органические фазы сушили (Na2SO4), и фильтровали с помощью промывки метил-трет-бутиловым эфиром. Затем фильтровальный диск промывали метанолом, и фильтрат концентрировали с получением указанного в заголовке соединения (6 мг). МС (ESI) m/z=493 (M-H)-.
Пример 155
этил rel-2-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-4-карбоксилат
Пример 155A
этил 2-(1-гидрокси-3-(2-гидрокси-4-метоксифенил)-3-оксопропил)тиазол-4-карбоксилат
Использование способа, аналогичного способу, описанному в примере 140A, используя раствор 2'-гидрокси-4'-метоксиацетофенона (269 мг, 1,620 ммоль) в тетрагидрофуране вместо 2'-гидроксиацетофенона, и гашение насыщенным раствором NH4Cl вместо 10% водного раствора KH2PO4, давало указанное в заголовке соединение.1H ЯМР (501 МГц, CDCl3) δ 12,33 (с, 1H), 8,19 (с, 1H), 7,68 (д, J=9,0 Гц, 1H), 6,48 (дд, J=8,9, 2,5 Гц, 1H), 6,45 (д, J=2,5 Гц, 1H), 5,61 (ддд, J=8,7, 4,7, 2,7 Гц, 1H), 4,45 (кв, J=7,1 Гц, 2H), 4,30 (д, J=4,7 Гц, 1H), 3,90 (дд, J=17,9, 2,8 Гц, 1H), 3,87 (с, 3H), 3,49 (дд, J=17,8, 8,8 Гц, 1H), 1,43 (т, J=7,1 Гц, 3H); МС (ESI+) m/z 352 (M+H)+.
Пример 155B
этил 2-(7-метокси-4-оксохроман-2-ил)тиазол-4-карбоксилат
Раствор соединения примера 155A (0,38 г, 1,081 ммоль) и трифенилфосфина (0,567 г, 2,163 ммоль) в тетрагидрофуране (12 мл) охлаждали до 0°C, обрабатывали частями 40% мас./мас. диэтилазодикарбоксилата в толуоле (0,739 мл, 1,622 ммоль) в течение 20 минут, перемешивали при комнатной температуре в течение 1 часа, обрабатывали силикагелем (3 г) и концентрировали досуха. Эту суспензию силикагеля подвергали хроматографии на силикагеле, элюируя градиентом 15-50% этилацетата в гептане для получения неочищенного продукта. Неочищенный продукт далее очищали с помощью хроматографии на силикагеле, элюируя градиентом 50-100% [9:1 CH2Cl2:этилацетат] в гептанах с получением указанного в заголовке соединения (0,15 г, 0,450 ммоль, выход 41,6%).1H ЯМР (400 МГц, CDCl3) δ 8,26 (с, 1H), 7,90 (д, J=8,8 Гц, 1H), 6,68 (дд, J=8,8, 2,4 Гц, 1H), 6,57 (д, J=2,4 Гц, 1H), 5,89 (дд, J=11,5, 3,8 Гц, 1H), 4,46 (кв, J=7,1 Гц, 2H), 3,89 (с, 3H), 3,28 (дд, J=17,0, 3,8 Гц, 1H), 3,14 (дд, J=17,0, 11,6 Гц, 1H), 1,44 (т, J=7,1 Гц, 3H); МС (ESI+) m/z 334 (M+H)+.
Пример 155C
этил rel-2-((R)-4-(((S)-трет-бутилсульфинил)имино)-7-метоксихроман-2-ил)тиазол-4-карбоксилат
Указанное в заголовке соединение получали с использованием способа, аналогичного способу, описанному в примере 132C, используя соединение примера 155B вместо соединения примера 132B, и используя (S)-(-)-2-метил-2-пропансульфинамид вместо (R)-(+)-2-метил-2-пропансульфинамида. Очистка с помощью хроматографии на силикагеле, элюирование градиентом 0-100% [9:1 CH2Cl2:этилацетат] в [1:1 CH2Cl2:этилацетат], давало указанное в заголовке соединение в виде первого элюированного изомера. Это соединение содержало некоторые примеси и далее очищали с помощью хроматографии на силикагеле, элюируя градиентом 20-100% этилацетата в гептанах, с получением указанного в заголовке соединения.1H ЯМР (501 МГц, CDCl3) δ 8,26 (с, 1H), 8,01 (д, J=8,9 Гц, 1H), 6,67 (дд, J=9,0, 2,5 Гц, 1H), 6,54 (д, J=2,5 Гц, 1H), 5,66 (дд, J=12,6, 3,1 Гц, 1H), 4,48 (квд, J=7,1, 3,2 Гц, 2H), 4,06 (дд, J=17,4, 3,1 Гц, 1H), 3,88 (с, 3H), 3,34 (дд, J=17,4, 12,6 Гц, 1H), 1,45 (т, J=7,1 Гц, 3H), 1,34 (с, 9H); МС (ESI+) m/z 437 (M+H)+. Стереохимия была назначена произвольно.
Пример 155D
этил rel-2-((2R,4R)-4-амино-7-метоксихроман-2-ил)тиазол-4-карбоксилат
Используя способ, аналогичный способу, описанному в примере 140D, используя соединение примера 155C вместо соединения примера 140C, получали указанное в заголовке соединение. МС (ESI+) m/z 318 (M-NH3)+. Стереохимия была назначена произвольно.
Пример 155E
этил rel-2-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-4-карбоксилат
Используя способ, аналогичный способу, описанному в примере 126G, используя соединение примера 155D вместо соединения примера 126F, и очистку с помощью хроматографии на силикагеле, элюирование градиентом 0-50% этилацетата в [9:1 CH2Cl2:этилацетат], получали указанное в заголовке соединение.1H ЯМР (400 МГц, CDCl3) δ 8,19 (с, 1H), 7,17-6,97 (м, 4H), 6,57 (дд, J=8,6, 2,5 Гц, 1H), 6,48 (д, J=2,4 Гц, 1H), 5,55 (дд, J=10,8, 2,2 Гц, 1H), 5,46-5,37 (м, 1H), 5,31 (д, J=8,9 Гц, 1H), 4,47 (кв, J=7,1 Гц, 2H), 3,80 (с, 3H), 2,93 (ддд, J=13,3, 5,9, 2,2 Гц, 1H), 1,99-1,87 (м, 1H), 1,79-1,62 (м, 2H), 1,45 (т, J=7,1 Гц, 3H), 1,09 (м, 2H); МС (ESI-) m/z 557 (M-H)-.
Пример 156
rel-2-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-4-карбоновая кислота
Используя способ, аналогичный способу, описанному в примере 152, используя соединение примера 155Е вместо соединения примера 151G, получали указанное в заголовке соединение.1H ЯМР (400 МГц, CDCl3) δ 8,30 (с, 1H), 7,17-7,10 (м, 2H), 7,05-6,98 (м, 2H), 6,58 (дд, J=8,6, 2,2 Гц, 1H), 6,49 (д, J=2,2 Гц, 1H), 5,54 (д, J=10,9 Гц, 1H), 5,48-5,40 (м, 1H), 5,35 (д, J=8,5 Гц, 1H), 3,80 (с, 3H), 2,95 (дд, J=13,2, 5,8 Гц, 1H), 1,98-1,87 (м, 1H), 1,81-1,63 (м, 2H), 1,16-1,07 (м, 2H); МС (ESI-) m/z 529 (M-H)-.
Пример 157
этил rel-2-[(2S,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-4-карбоксилат
Пример 157A
этил rel-2-((S)-4-(((S)-трет-бутилсульфинил)имино)-7-метоксихроман-2-ил)тиазол-4-карбоксилат
Неочищенное указанное в заголовке соединение получали в качестве второго элюированного изомера в результате первой хроматографии, описанной в примере 155C. Этот материал далее очищали с помощью хроматографии на силикагеле, элюируя градиентом 20-100% этилацетата в гептанах с получением указанного в заголовке соединения.1H ЯМР (501 МГц, CDCl3) δ 8,23 (с, 1H), 8,02 (д, J=8,9 Гц, 1H), 6,65 (дд, J=8,9, 2,5 Гц, 1H), 6,53 (д, J=2,5 Гц, 1H), 5,73 (дд, J=10,1, 3,8 Гц, 1H), 4,52-4,40 (м, 2H), 4,20 (дд, J=17,1, 3,8 Гц, 1H), 3,88 (с, 3H), 3,41 (дд, J=17,1, 10,1 Гц, 1H), 1,45 (т, J=7,1 Гц, 3H), 1,32 (с, 9H); МС (ESI+) m/z 437 (M+H)+. Стереохимия была назначена произвольно.
Пример 157B
этил rel-2-((2S,4S)-4-амино-7-метоксихроман-2-ил)тиазол-4-карбоксилат
Используя способ, аналогичный способу, описанному в примере 140D, используя соединение примера 157А вместо соединения примера 140C, получали указанное в заголовке соединение.1H ЯМР (400 МГц, CDCl3) δ 8,21 (с, 1H), 7,44 (д, J=8,5 Гц, 1H), 6,61 (дд, J=8,6, 2,5 Гц, 1H), 6,50 (д, J=2,5 Гц, 1H), 5,56 (д, J=9,8 Гц, 1H), 4,45 (кв, J=7,1 Гц, 2H), 4,29-4,21 (м, 1H), 3,81 (с, 3H), 2,86-2,79 (м, 1H), 2,00-1,89 (м, 1H), 1,43 (т, J=7,1 Гц, 3H); МС (ESI+) m/z 318 (M-NH3)+.
Пример 157C
этил rel-2-[(2S,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-4-карбоксилат
Используя способ, аналогичный способу, описанному в примере 126G, используя соединение примера 157B вместо соединения примера 126F, и очистку с помощью хроматографии на силикагеле, элюирование градиентом 0-50% этилацетата в [9:1 CH2Cl2:этилацетат], получали указанное в заголовке соединение.1H ЯМР (400 МГц, CDCl3) δ 8,19 (с, 1H), 7,15-7,07 (м, 2H), 7,04-6,98 (м, 2H), 6,57 (дд, J=8,6, 2,6 Гц, 1H), 6,48 (д, J=2,5 Гц, 1H), 5,55 (дд, J=10,8, 1,8 Гц, 1H), 5,45-5,38 (м, 1H), 5,31 (д, J=8,6 Гц, 1H), 4,47 (кв, J=7,1 Гц, 2H), 3,80 (с, 3H), 2,93 (ддд, J=13,3, 6,0, 2,3 Гц, 1H), 1,99-1,86 (м, 1H), 1,82-1,64 (м, 2H), 1,45 (т, J=7,1 Гц, 3H), 1,14-1,05 (м, 2H); МС (ESI-) m/z 557 (M-H)-.
Пример 158
rel-2-[(2S,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2Н-хромен-2-ил]-1,3-тиазол-4-карбоновая кислота
Используя способ, аналогичный способу, описанному в примере 152, используя соединение примера 157C вместо соединения примера 151G, получали указанное в заголовке соединение.1H ЯМР (400 МГц, CDCl3) δ 8,29 (с, 1H), 7,17-6,97 (м, 4H), 6,57 (дд, J=8,6, 2,5 Гц, 1H), 6,49 (д, J=2,4 Гц, 1H), 5,53 (д, J=11,0 Гц, 1H), 5,48-5,39 (м, 1H), 5,34 (д, J=12,7 Гц, 1H), 3,80 (с, 3H), 2,94 (дд, J=12,1, 4,7 Гц, 1H), 2,00-1,87 (м, 1H), 1,81-1,66 (м, 2H), 1,15-1,06 (м, 2H); МС (ESI-) m/z 529 (M-H)-.
Пример 159
метил rel-6-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2Н-хромен-2-ил]пиридин-3-карбоксилат
Пример 159A
трет-бутил 3-(2-гидрокси-4-метоксифенил)-3-оксопропаноат
К раствору диизопропиламина (36,3 мл, 259 ммоль) в безводном тетрагидрофуране (130 мл) в атмосфере азота и при -78°C добавляли 1,6 M н-бутиллитий в гексане (150 мл, 240 ммоль). После перемешивания полученной суспензии в течение 15 минут добавляли раствор трет-бутилацетата (28,2 мл, 210 ммоль) в тетрагидрофуране (40 мл) в течение 15 минут. Затем, после того как раствор перемешивали при -78°С в течение 100 минут, к реакционной смеси добавляли раствор метил 4-метоксисалицилата (12,75 г, 70,0 ммоль) в THF (70 мл) в течение 20 минут. Реакционную смесь оставляли нагреваться до комнатной температуры в течение ночи, сосуд помещали на водяную баню и реакционную смесь гасили 1 М водной лимонной кислотой (110 мл). Водную фазу отделяли и дважды экстрагировали этилацетатом. Объединенные органические фазы промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и концентрировали. Полученный остаток хроматографировали на силикагеле (25-60% CH2Cl2/гептан) с получением неочищенного продукта, который хроматографировали на силикагеле (25-70% CH2Cl2/гептан) с получением указанного в заголовке соединения в виде светлого масла (4,88 г).1H ЯМР (400 МГц, CDCl3) δ м.д. 1,48 (с, 9H), 3,85 (с, 2H), 3,87 (с, 3H), 6,44-6,51 (м, 2H), 7,60 (д, J=8,8 Гц, 1H), 12,42 (с, 1H); МС (DCI) m/z 267 (M+H)+, 284 (M+NH2)+.
Пример 159B
трет-бутил 2-(5-бромпиридин-2-ил)-7-метокси-4-оксохроман-3-карбоксилат
Соединение примера 159A (799 мг, 3,0 ммоль), 5-бромпиколинальдегид (558 мг, 3,0 ммоль), пиперидин (30 мкл, 0,30 ммоль) и уксусную кислоту (18 мкл, 0,31 ммоль) перемешивали при комнатной температуре в безводном ацетонитриле (9,0 мл) и безводном метаноле (3,0 мл) в течение 4,5 часов и затем концентрировали. Остаток хроматографировали два раза на силикагеле (15% метил-трет-бутиловый эфир/гептан) с получением 836 мг смеси (E/Z)-трет-бутил 3-(5-бромпиридин-2-ил)-2-(2-гидрокси-4-метоксибензоил)акрилата и циклизированного продукта. Смесь перемешивали с пиперидином (30 мкл, 0,30 ммоль) в метаноле (6 мл) и ацетонитрилом (3 мл), и через один час добавляли воду (3 мл). Белый осадок собирали с помощью фильтрования и промывали 1:1 метанолом/водой, и также выделяли второй продукт. Оба продукта сушили в вакууме с получением указанного в заголовке соединения (836 мг).1H ЯМР (400 МГц, CDCl3) δ м.д. 1,40 (с, 9H), 3,84 (с, 3H), 4,22 (д, J=10,2 Гц, 1H), 5,80 (д, J=10,2 Гц, 1H), 6,48 (д, J=2,4 Гц, 1H), 6,62 (дд, J=8,8, 2,4 Гц, 1H), 7,43 (д, J=8,3 Гц, 1H), 7,83-7,89 (м, 2H), 8,67-8,68 (м, 1H); МС (DCI) m/z 434/436 (M+H)+.
Пример 159C
2-(5-бромпиридин-2-ил)-7-метоксихроман-4-он
Соединение примера 159B (792 мг, 1,8 ммоль) и (rac)-камфорсульфоновую кислоту (210 мг, 0,90 ммоль) нагревали в атмосфере азота в безводном толуоле (10 мл) при 85°C в течение ночи и доводили температуру до комнатной температуры. Реакционную смесь разбавляли гептаном (2 мл) и помещали непосредственно на силикагель для хроматографии (20% метил-трет-бутиловый эфир в 1:1 CH2Cl2/гептан) с получением указанного в заголовке соединения в виде белого порошка (350 мг). 1H ЯМР (501 МГц, CDCl3) δ м.д. 3,02-3,12 (м, 2H), 3,85 (с, 3H), 5,56 (дд, J=10,1, 5,4 Гц, 1H), 6,52 (д, J=2,4 Гц, 1H), 6,63 (дд, J=8,8, 2,4 Гц, 1H), 7,51 (д, J=8,3 Гц, 1H), 7,87 (д, J=8,8 Гц, 1H), 7,90 (дд, J=8,3, 2,3 Гц, 1H), 8,67 (д, J=2,3 Гц, 1H); МС (DCI) m/z 334/336 (M+H)+.
Пример 159D
метил 6-(7-метокси-4-оксохроман-2-ил)никотинат
К соединению примера 159C (349 мг, 1,044 ммоль) и дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладию(II) (15 мг, 0,021 ммоль) в 50 мл реакторе Hast C добавляли метанол (10 мл) и триэтиламин (0,29 мл, 2,1 ммоль). Реактор несколько раз дегазировали аргоном, затем заполняли монооксидом углерода и нагревали при 100°С в течение 11 часов при давлении 60 фунт/кв.дюйм. Образец концентрировали и разделяли между водой и метил-трет-бутиловым эфиром. Водную фазу отделяли и экстрагировали метил-трет-бутиловым эфиром и объединенные органические фазы снова промывали водой, затем насыщенным солевым раствором, сушили (Na2SO4), фильтровали, концентрировали и хроматографировали (25-50% метил-трет-бутиловый эфир/гептан) с получением неочищенного указанного в заголовке соединения (79 мг). 1H ЯМР (500 МГц, CDCl3) δ м.д. 3,07 (дд, J=17,0, 11,6 Гц, 1H), 3,12 (дд, J=17,0, 4,1 Гц, 1H), 3,86 (с, 3H), 3,97 (с, 3H), 5,65 (дд, J=11,6, 4,1 Гц, 1H), 6,56 (д, J=2,4 Гц, 1H), 6,64 (дд, J=8,8, 2,4 Гц, 1H), 7,72 (д, J=8,2 Гц, 1H), 7,88 (д, J=8,8 Гц, 1H), 8,38 (дд, J=8,2, 2,1 Гц, 1H), 9,20-9,21 (м, 1H); МС (DCI) m/z 314 (M+H)+.
Пример 159E
метил 6-(4-(этоксиимино)-7-метоксихроман-2-ил)никотинат
Неочищенный метил 6-(7-метокси-4-оксохроман-2-ил)никотинат из примера 159D (77 мг, <0,25 ммоль), O-этилгидроксиламин гидрохлорид (22 мг, 0,23 ммоль) и ацетат калия (36 мг, 0,37 ммоль) нагревали в этаноле (1 мл) при 50°С в течение 20 минут. Добавляли дополнительное количество O-этилгидроксиламин гидрохлорида (13 мг, 0,13 ммоль) и смесь нагревали при 50°C в течение еще 3 часов. Температуру суспензии доводили до комнатной температуры, концентрировали и хроматографировали на силикагеле (30% метил-трет-бутиловый эфир/гептан) с получением указанного в заголовке соединения в виде неочищенного твердого вещества (приблизительно 75 мг).1H ЯМР (400 МГц, CDCl3) δ м.д. 1,30 (т, J=7,1 Гц, 3H), 2,72 (дд, J=17,2, 11,8 Гц, 1H), 3,68 (дд, J=17,2, 3,5 Гц, 1H), 3,81 (с, 3H), 3,97 (с, 3H), 4,20 (д, J=7,1 Гц, 2H), 5,26 (дд, J=11,8, 3,5 Гц, 1H), 6,53 (д, J=2,5 Гц, 1H), 6,59 (дд, J=8,8, 2,5 Гц, 1H), 7,70 (д, J=8,2 Гц, 1H), 7,85 (д, J=8,8 Гц, 1H), 8,36 (дд, J=8,2, 2,1 Гц, 1H), 9,19-9,22 (м, 1H); МС (DCI) m/z 357 (M+H)+.
Пример 159F
метил 6-(4-амино-7-метоксихроман-2-ил)никотинат
Неочищенный метил 6-(4-(этоксиимино)-7-метоксихроман-2-ил)никотинат из примера 159E (72 мг, 0,2 ммоль) и метанол (10 мл) добавляли к Ra-Ni 2800, водной суспензии (700 мг, 5,4 ммоль) в 50 мл сосуде для реакций под давлением и встряхивали в течение 36 часов в атмосфере водорода при давлении 30 фунт/кв.дюйм и комнатной температуре. Образец фильтровали, концентрировали и хроматографировали на силикагеле (0-5% конц. водный NH4OH/ацетонитрил) с получением указанного в заголовке соединения в виде янтарного сиропа (38 мг); МС (DCI) m/z 315 (M+H)+.
Пример 159G
метил rel-6-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2Н-хромен-2-ил]пиридин-3-карбоксилат
Смесь 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновой кислоты (40 мг, 0,16 ммоль), карбонилдиимидазола (27 мг, 0,17 ммоль) и 1-гидрокси-7-азабензотриазола (2,4 мг, 18 мкмоль) перемешивали в безводном ацетонитриле (350 мкл) в течение 100 минут и затем переносили в сосуд, содержащий соединение примера 159F (приблизительно 37 мг, 0,12 ммоль), с промывкой ацетонитрилом (100 мкл). Через несколько минут добавляли диизопропилэтиламин (16 мкл, 92 мкмоль) и раствор перемешивали при комнатной температуре в течение четырех часов до концентрирования. Остаток хроматографировали на силикагеле (5-25% метил-трет-бутиловый эфир в 1:1 CH2Cl2/гептан) с получением смеси диастереомеров. Соответствующие фракции объединяли, концентрировали и подвергали препаративной сверхкритической флюидной хроматографии, с поддержанием максимального обратного давления 10 МПа с использованием колонки Whelk-O S.S (21×250 мм), с образцом в концентрации 5 мг/мл в метаноле, используя сорастворитель 15% метанола и 0,1% диэтиламина в CO2 при скорости потока 70 мл/мин, с получением соединения примера 159G (время удерживания=11,50 минут). Стереохимия была назначена произвольно.1H ЯМР (400 МГц, CD2Cl2) δ м.д. 1,04-1,09 (м, 2H), 1,60-1,64 (м, 2H), 2,16 (ддд, J=14,2, 10,4, 4,8 Гц, 1H), 2,44 (ддд, J=14,2, 3,8, 2,6 Гц, 1H), 3,75 (с, 3H), 3,93 (с, 3H), 4,92 (ддд, J=7,1, 4,8, 3,8 Гц, 1H), 5,01 (дд, J=10,4, 2,6 Гц, 1H), 5,56 (д, J=7,1 Гц, 1H), 6,46 (д, J=2,5 Гц, 1H), 6,51 (дд, J=8,5, 2,5 Гц, 1H), 7,00-7,07 (м, 2H), 7,15-7,22 (м, 2H), 7,62 (д, J=8,2 Гц, 1H), 8,30 (дд, J=8,2, 2,1 Гц, 1H), 9,14 (д, J=2,1 Гц, 1H); МС (ESI) m/z=537 (M-H)-.
Пример 160
метил rel-6-[(2S,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2Н-хромен-2-ил]пиридин-3-карбоксилат
Указанное в заголовке соединение (время удерживания=14,20 минут) выделяли в результате препаративной сверхкритической флюидной хроматографии, описанной в примере 159G. Стереохимия была назначена произвольно.1H ЯМР (400 МГц, CD2Cl2) δ м.д. 1,05-1,08 (м, 2H), 1,60-1,63 (м, 2H), 2,16 (ддд, J=14,1, 10,4, 4,8 Гц, 1H), 2,44 (ддд, J=14,1, 3,9, 2,7 Гц, 1H), 3,75 (с, 3H), 3,93 (с, 3H), 4,92 (ддд, J=7,1, 4,8, 3,9 Гц, 1H), 5,01 (дд, J=10,4, 2,7 Гц, 1H), 5,55 (д, J=7,1 Гц, 1H), 6,46 (д, J=2,6 Гц, 1H), 6,50 (дд, J=8,5, 2,6 Гц, 1H), 7,01-7,05 (м, 2H), 7,15-7,21 (м, 2H), 7,62 (д, J=8,2 Гц, 1H), 8,30 (дд, J=8,2, 2,2 Гц, 1H), 9,14-9,15 (м, 1H); МС (ESI) m/z 537 (M-H)-.
Пример 161
метил rel-6-[(2S,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2Н-хромен-2-ил]пиридин-3-карбоксилат
Указанное в заголовке соединение (время удерживания=16,19 минут) выделяли в результате препаративной сверхкритической флюидной хроматографии, описанной в примере 159G. МС (ESI) m/z 537 (M-H)-. Стереохимия была назначена произвольно.
Пример 162
метил rel-6-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2Н-хромен-2-ил]пиридин-3-карбоксилат
Указанное в заголовке соединение (время удерживания=19,80 минут) выделяли в результате препаративной сверхкритической флюидной хроматографии, описанной в примере 159G. МС (ESI) m/z 537 (M-H)-. Стереохимия была назначена произвольно.
Пример 163
этил rac-(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2Н-хромен-2-карбоксилат
Пример 163A
rac-(2R,4R)-этил 4-амино-7-метоксихроман-2-карбоксилат гидрохлорид
Раствор соединения из примера 13°C (1,5 г, 5,37 ммоль) в уксусной кислоте (5 мл) обрабатывали оксидом платины (IV) (0,244 г, 1,074 ммоль). Сосуд барботировали N2, затем реакционную смесь перемешивали под Н2 из баллона в течение ночи при комнатной температуре. Твердые вещества удаляли фильтрованием и фильтрат концентрировали. Полученное бесцветное масло растворяли в метил-трет-бутиловом эфире (10 мл) и подкисляли 3 M HCl в циклопентил метиловом эфире (0,326 мл, 10,74 ммоль). Смесь концентрировали и помещали под вакуумом в течение ночи при 50°С с получением указанного в заголовке соединения в соотношении 13:1 цис-транс. Только пики основного цис-изомера приведены только в ЯМР:1H ЯМР (501 МГц, ДМСО-d6) δ 7,44 (д, J=8,6 Гц, 1H), 6,56 (дд, J=8,6, 2,6 Гц, 1H), 6,43 (д, J=2,5 Гц, 1H), 4,87 (дд, J=10,6, 2,6 Гц, 1H), 4,30 (дд, J=9,8, 5,8 Гц, 1H), 4,20 (квд, J=7,1, 1,4 Гц, 2H), 3,72 (с, 3H), 2,46 (ддд, J=13,1, 5,7, 2,6 Гц, 1H), 1,94-1,85 (м, 1H), 1,24 (т, J=7,1 Гц, 3H).
Пример 163B
этил rac-(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2Н-хромен-2-карбоксилат
Раствор соединения примера 163A (2,1 г, 7,30 ммоль) и триэтиламина (3,05 мл, 21,89 ммоль) в CH2Cl2 (29 мл) при 0°C обрабатывали по каплям раствором 1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбонилхлорида (полученного, как описано в примере 8D) в CH2Cl2 (5 мл) и затем перемешивали в течение 30 минут при 0°С. Смесь распределяли между 1M HCl (10 мл) и CH2Cl2. Слои разделяли и водный слой экстрагировали CH2Cl2. Объединенные слои CH2Cl2концентрировали. Остаток очищали с помощью хроматографии на силикагеле, элюируя градиентом 0-40% этилацетата в гептанах с получением продукта, который представлял собой смесь цис- и транс-изомеров 14:1. 1,5 г этого продукта осаждали из этилацетата/гептанов с получением диастереомерно чистого указанного в заголовке соединения.1H ЯМР (400 МГц, CDCl3) δ 7,10 (д, J=8,1 Гц, 1H), 7,08 (с, 1H), 7,00 (д, J=8,2 Гц, 1H), 6,95 (д, J=8,5 Гц, 1H), 6,49 (дд, J=8,6, 2,5 Гц, 1H), 6,44 (д, J=2,4 Гц, 1H), 5,56 (д, J=8,3 Гц, 1H), 5,21 (кв, J=7,3 Гц, 1H), 4,71 (дд, J=8,0, 3,6 Гц, 1H), 4,22-4,07 (м, 2H), 3,74 (с, 3H), 2,53 (ддд, J=13,8, 6,0, 3,7 Гц, 1H), 1,99 (дт, J=15,1, 7,8 Гц, 1H), 1,74-1,68 (м, 1H), 1,66-1,61 (м, 1H), 1,26 (т, J=7,1 Гц, 3H), 1,13-1,02 (м, 2H); МС (ESI-) m/z 474 (M-H)-.
Пример 164
rac-(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-карбоновая кислота
Используя способ, аналогичный способу, описанному в примере 152, используя соединение примера 163B вместо соединения примера 151G, получали указанное в заголовке соединение.1H ЯМР (400 МГц, CDCl3) δ 7,14 (дд, J=8,1, 1,7 Гц, 1H), 7,12 (д, J=1,4 Гц, 1H), 7,02 (д, J=8,1 Гц, 1H), 6,93 (д, J=8,6 Гц, 1H), 6,51 (дд, J=8,6, 2,5 Гц, 1H), 6,47 (д, J=2,5 Гц, 1H), 5,48 (д, J=7,9 Гц, 1H), 5,21 (кв, J=7,7 Гц, 1H), 4,80 (дд, J=8,6, 3,5 Гц, 1H), 3,75 (с, 3H), 2,59 (ддд, J=13,6, 5,7, 3,5 Гц, 1H), 2,14-2,06 (м, 1H), 1,80-1,71 (м, 1H), 1,71-1,62 (м, 1H), 1,14-1,06 (м, 2H); МС (ESI-) m/z 446 (M-H)-.
Пример 165
rel-6-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2Н-хромен-2-ил]пиридин-3-карбоновая кислота
Пример 165A
(S)-N-(1-(2-гидрокси-4-метоксифенил)этилиден)-2-метилпропан-2-сульфинамид
Раствор 2'-гидрокси-4'-метоксиацетофенона (1 г, 6,02 ммоль) и (S)-(-)-2-метил-2-пропансульфинамида (0,802 г, 6,62 ммоль) в 2-метил-тетрагидрофуране (10 мл) обрабатывали этоксидом титана(IV) (5,15 г, 22,57 ммоль), нагревали при 90°C в атмосфере N2 в течение 2 часов, охлаждали и разделяли между этилацетатом и водой. Смесь фильтровали через диатомовую землю для удаления твердых веществ. Этилацетатный слой промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали, концентрировали и хроматографировали на силикагеле, элюируя градиентом 30-100% этилацетата в гептане, получали указанное в заголовке соединение (377 мг, 1,400 ммоль, выход 23,26%).1H ЯМР (400 МГц, CDCl3) δ 13,62 (с, 1H), 7,55 (д, J=8,9 Гц, 1H), 6,48-6,43 (м, 2H), 3,84 (с, 3H), 2,76 (с, 3H), 1,32 (с, 9H); МС (ESI+) m/z 435 (M+H)+; МС (ESI-) m/z 433 (M-H)-.
Пример 165B
метил rel-6-((S)-3-(((S)-трет-бутилсульфинил)имино)-1-гидрокси-3-(2-гидрокси-4-метоксифенил)пропил)никотинат
Раствор диизопропиламина (163 мкл, 1,143 ммоль) в тетрагидрофуране (2 мл) в атмосфере N2 при -20°C обрабатывали 2,5 M н-бутиллития в гексане (437 мкл, 1,091 ммоль) и перемешивали в течение 15 минут. В отдельном сосуде, раствор соединения примера 165A (140 мг, 0,520 ммоль) в тетрагидрофуране (2 мл) в атмосфере N2 при -20°C обрабатывали в течение 1 минуты раствором диизопропиламида лития. Полученную смесь перемешивали при -20°C в течение 1 часа, охлаждали до -78°C, обрабатывали раствором метил 6-формилникотината (86 мг, 0,520 ммоль) в тетрагидрофуране (1,5 мл), нагревали до 0°C, охлаждали до -30°C, обрабатывали раствором 10% уксусной кислоты в тетрагидрофуране (приблизительно 1,5 мл) и оставляли нагреваться до комнатной температуры. Смесь разделяли между этилацетатом и насыщенным раствором NaHCO3. Этилацетатный слой промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали, концентрировали и хроматографировали на силикагеле (этилацетат/гептаны) с получением указанного в заголовке соединения (52 мг, выход 23%) в качестве второго элюированного изомера.1H ЯМР (400 МГц, CDCl3) δ 13,25 (с, 1H), 9,19 (д, J=1,9 Гц, 1H), 8,22 (дд, J=8,2, 2,1 Гц, 1H), 7,57 (д, J=8,2 Гц, 1H), 7,38 (д, J=9,1 Гц, 1H), 6,40 (д, J=2,6 Гц, 1H), 6,28 (дд, J=9,1, 2,6 Гц, 1H), 5,34 (кв, J=5,1 Гц, 1H), 4,92 (д, J=5,2 Гц, 1H), 3,96 (с, 3H), 3,80 (с, 3H), 3,82-3,71 (м, 2H), 1,39 (с, 9H); МС (ESI+) m/z 435 (M+H)+. Стереохимия была назначена произвольно.
Пример 165C
метил rel-6-((R)-4-(((S)-трет-бутилсульфинил)имино)-7-метоксихроман-2-ил)никотинат
Раствор соединения примера 165B (52 мг, 0,120 ммоль) и трифенилфосфина (31,4 мг, 0,120 ммоль) в CH2Cl2 (1 мл) при 0°С обрабатывали по каплям 40% масс. раствором диэтилазодикарбоксилата в толуоле (54,5 мкл, 0,120 ммоль) в течение 3 минут, перемешивали при 0°C в течение 10 минут, перемешивали при комнатной температуре в течение 1 часа, концентрировали и непосредственно хроматографировали на силикагеле, элюируя этилацетатом в гептанах, с получением указанного в заголовке соединения (18 мг, 0,043 ммоль, выход 36,1%).1H ЯМР (400 МГц, CDCl3) δ 9,20-9,18 (м, 1H), 8,37 (дд, J=8,2, 2,1 Гц, 1H), 7,98 (д, J=8,9 Гц, 1H), 7,70 (д, J=8,2 Гц, 1H), 6,62 (дд, J=8,9, 2,5 Гц, 1H), 6,53 (д, J=2,5 Гц, 1H), 5,40 (дд, J=12,5, 3,0 Гц, 1H), 3,97 (с, 3H), 3,92 (дд, J=17,5, 3,1 Гц, 1H), 3,85 (с, 3H), 3,28 (дд, J=17,5, 12,5 Гц, 1H), 1,30 (с, 9H); МС (ESI+) m/z 417 (M+H)+. Стереохимия была назначена произвольно.
Пример 165D
метил rel-6-((2R,4R)-4-амино-7-метоксихроман-2-ил)никотинат
Раствор соединения примера 165C (17,4 мг, 0,042 ммоль) в метаноле (1 мл) охлаждали до 0°C, обрабатывали NaBH4 (4,74 мг, 0,125 ммоль), перемешивали при 0°C в течение 30 минут, обрабатывали 4 M HCl в диоксане (209 мкл, 0,836 ммоль), перемешивали при 0°C в течение 5 минут и затем перемешивали при температуре окружающей среды в течение 30 минут. Смесь разделяли между метил-трет-бутиловым эфиром (30 мл) и водой (15 мл). Водный слой подщелачивали до значения рН 8 твердым NaHCO3 и экстрагировали этилацетатом. Этилацетатный слой промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали с получением указанного в заголовке соединения (12 мг, 0,038 ммоль, выход 91%).1H ЯМР (501 МГц, CDCl3) δ 9,18 (д, J=1,5 Гц, 1H), 8,36 (дд, J=8,2, 2,1 Гц, 1H), 7,72 (д, J=8,2 Гц, 1H), 7,42 (д, J=8,6 Гц, 1H), 6,59 (д, J=8,5 Гц, 1H), 6,50 (д, J=2,5 Гц, 1H), 5,32 (д, J=10,8 Гц, 1H), 4,29 (с, 1H), 3,97 (с, 3H), 3,80 (с, 3H), 2,68 (дд, J=12,5, 4,0 Гц, 1H), 1,83 (кв, J=11,5 Гц, 1H). Стереохимия была назначена произвольно.
Пример 165E
метил rel-6-((2R,4R)-4-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-7-метоксихроман-2-ил)никотинат
Используя способ, аналогичный способу, описанному в примере 126G, используя соединение примера 165D вместо соединения примера 126F, и очистку с помощью хроматографии на силикагеле, элюирование градиентом 30-100% этилацетата в гептане, получали указанное в заголовке соединение.1H ЯМР (400 МГц, CDCl3) δ 9,14 (д, J=1,9 Гц, 1H), 8,31 (дд, J=8,2, 2,1 Гц, 1H), 7,61 (д, J=8,2 Гц, 1H), 7,10 (дд, J=8,2, 1,6 Гц, 1H), 7,06 (д, J=1,6 Гц, 1H), 7,01 (д, J=4,6 Гц, 1H), 6,99 (д, J=4,3 Гц, 1H), 6,53 (дд, J=8,6, 2,6 Гц, 1H), 6,47 (д, J=2,5 Гц, 1H), 5,43 (дт, J=9,4, 4,3 Гц, 1H), 5,36-5,30 (м, 2H), 3,98 (с, 3H), 3,77 (с, 3H), 2,76 (ддд, J=13,3, 6,1, 2,4 Гц, 1H), 1,85 (дт, J=13,3, 10,4 Гц, 1H), 1,77-1,62 (м, 2H), 0,92-0,80 (м, 2H); МС (ESI-) m/z 537 (M-H)-.
Пример 165F
rel-6-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2Н-хромен-2-ил]пиридин-3-карбоновая кислота
Используя способ, аналогичный способу, описанному в примере 152, используя соединение примера 165E вместо соединения примера 151G, получали указанное в заголовке соединение.1H ЯМР (400 МГц, CDCl3) δ 9,24 (с, 1H), 8,40 (д, J=8,2 Гц, 1H), 7,68 (д, J=8,2 Гц, 1H), 7,13 (дд, J=8,2, 1,5 Гц, 1H), 7,10 (д, J=1,5 Гц, 1H), 7,04-7,00 (м, 2H), 6,56 (дд, J=8,6, 2,5 Гц, 1H), 6,50 (д, J=2,4 Гц, 1H), 5,52-5,32 (м, 3H), 3,80 (с, 3H), 2,82 (ддд, J=13,4, 6,0, 1,9 Гц, 1H), 1,91-1,67 (м, 3H), 1,15-1,06 (м, 2H); МС (ESI-) m/z 523 (M-H)-.
Пример 166
rac-(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(2-гидроксиэтил)-7-метокси-N-пропил-3,4-дигидро-2H-хромен-2-карбоксамид
Исходный раствор соединения примера 164 и диизопропилэтиламин(0,089 M и 0,26 M в диметилацетамиде, соответственно, 344 мкл, 0,031 ммоль соединения примера 164 (1,0 эквивалент) и 0,092 ммоль диизопропилэтиламина (3,0 эквивалента)), 2-(3H-[1,2,3]триазоло[4,5-b]пиридин-3-ил)-1,1,3,3-тетраметилизоуроний гексафторфосфат(V) (0,11 M в диметилацетамиде, 344 мкл, 0,037 ммоль, 1,2 эквивалента), и 2-пропиламино-этанол (0,40 M в диметилацетамиде, 117 мкл, 0,046 ммоль, 1,5 эквивалента) аспирировали из их соответствующих флаконов с исходным соединением, смешивали посредством PFA смесительной трубки (внутренний диаметр 0,2 мм) и загружали в петлевой дозатор. Часть реакционной смеси впрыскивали в реактор проточного типа (катушка Хастеллой, внутренний диаметр 0,75 мм, внутренний объем 1,8 мл), установленный при 75°С, и пропускали через реактор при 180 мкл мин-1 (время пребывания 10 минут). После выхода из реактора, реакционную смесь загружали непосредственно в петлевой дозатор и очищали с использованием способа препаративной ЖХ TFA1 с получением указанного в заголовке соединения (11,4 мг, выход 70%).1H ЯМР (400 МГц, 120°С, ДМСО-d6:D2O=9:1 (об/об)) δ 7,27 (д, J=1,5 Гц, 1H), 7,25-7,12 (м, 2H), 6,95 (дд, J=8,5, 1,0 Гц, 1H), 6,46 (дд, J=8,5, 2,6 Гц, 1H), 6,29 (д, J=2,6 Гц, 1H), 5,11 (т, J=7,3 Гц, 2H), 3,69 (с, 3H), 3,60-3,18 (м, 6H), 2,23-2,11 (м, 1H), 2,11-1,96 (м, 1H), 1,74-1,33 (м, 4H), 1,14-0,90 (м, 2H), 0,82 (т, J=7,5 Гц, 3H); МС (APCI+) m/z 533,1 (M+H)+.
Пример 167
rac-(2R,4R)-N-бензил-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(2-гидроксиэтил)-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид
Соединение примера 167 получали в соответствии со способом получения соединения примера 166, используя 2-бензиламино-этанол вместо 2-пропиламино-этанола и очищали с использованием способа препаративной ЖХ TFA6 с получением указанного в заголовке соединения (7,3 мг, выход 41%).1H ЯМР (400 МГц, 120°С, ДМСО-d6:D2O=9:1 (об/об)) δ 7,35-7,12 (м, 8H), 6,96 (д, J=8,5 Гц, 1H), 6,47 (дд, J=8,5, 2,6 Гц, 1H), 6,36-6,09 (м, 1H), 5,23-5,05 (м, 2H), 4,73-4,36 (м, 2H), 3,68 (с, 3H), 3,59-3,46 (м, 3H), 3,47-3,23 (м, 1H), 2,30-1,95 (м, 2H), 1,55-1,34 (м, 2H), 1,13-0,97 (м, 2H); МС (APCI+) m/z 581,0 (M+H)+.
Пример 168
rac-(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(2-гидрокси-2-фенилэтил)-7-метокси-N-метил-3,4-дигидро-2H-хромен-2-карбоксамид
Соединение примера 168 получали в соответствии со способом получения соединения примера 166, используя 2-метиламин-1-фенил-этанол вместо 2-пропиламино-этанола, и очищали с использованием способа препаративной ЖХ TFA6 с получением указанного в заголовке соединения (15,5 мг, выход 87%).1H ЯМР (400 МГц, 120°С, ДМСО-d6:D2O=9:1 (об/об)) δ 7,42-7,12 (м, 8H), 6,94 (тд, J=8,5, 0,9 Гц, 1H), 6,46 (дт, J=8,5, 2,2 Гц, 1H), 6,28 (дд, J=11,6, 2,5 Гц, 1H), 5,05 (с, 2H), 4,80 (дд, J=7,2, 5,3 Гц, 1H), 3,69 (д, J=3,4 Гц, 3H), 3,63-3,36 (м, 2H), 2,92 (с, 3H), 2,17-1,90 (м, 2H), 1,44 (тдд, J=12,2, 7,3, 3,3 Гц, 2H), 1,05 (тт, J=5,2, 2,6 Гц, 2H); МС (APCI+) m/z 581,0 (M+H)+.
Пример 169
rac-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2R,4R)-2-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-7-метокси-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
Соединение примера 169 получали в соответствии со способом получения соединения примера 166, используя 2-пиперазин-1-ил-этанол вместо 2-пропиламино-этанола и очищали с использованием способа препаративной ЖХ TFA6 с получением указанного в заголовке соединения (15,2 мг, выход 73%).1H ЯМР (400 МГц, 120°С, ДМСО-d6:D2O=9:1 (об/об)) δ 7,27 (д, J=1,6 Гц, 1H), 7,24-7,14 (м, 2H), 6,94 (дд, J=8,6, 1,0 Гц, 1H), 6,48 (дд, J=8,6, 2,6 Гц, 1H), 6,31 (д, J=2,5 Гц, 1H), 5,20-5,07 (м, 2H), 3,91-3,72 (м, 6H), 3,68 (с, 3H), 3,29 (с, 4H), 3,25-3,19 (м, 2H), 2,24-2,11 (м, 1H), 2,11-1,95 (м, 1H), 1,55-1,34 (м, 2H), 1,15-0,99 (м, 2H); МС (APCI+) m/z 560,0 (M+H)+.
Пример 170
rac-(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(1-гидрокси-2-метилпропан-2-ил)-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид
Соединение примера 170 получали в соответствии со способом получения соединения примера 166, используя 2-амино-2-метил-пропан-1-ол вместо 2-пропиламино-этанола и очищали с использованием способа препаративной ЖХ TFA6 с получением указанного в заголовке соединения (5,6 мг, выход 35%).1H ЯМР (400 МГц, 90°С, ДМСО-d6:D2O=9:1 (об/об)) δ 7,31 (д, J=1,6 Гц, 1H), 7,28-7,15 (м, 2H), 6,93 (дд, J=8,5, 1,0 Гц, 1H), 6,49 (дд, J=8,6, 2,6 Гц, 1H), 6,40 (д, J=2,5 Гц, 1H), 5,09 (дд, J=9,3, 6,5 Гц, 1H), 4,54 (дд, J=10,0, 2,9 Гц, 1H), 3,70 (с, 3H), 3,45-3,30 (м, 2H), 2,23 (ддд, J=13,5, 6,3, 2,9 Гц, 1H), 1,91 (дт, J=13,5, 9,8 Гц, 1H), 1,55-1,33 (м, 2H), 1,21 (с, 3H), 1,17 (с, 3H), 1,14-0,97 (м, 2H); МС (APCI+) m/z 519,1 (M+H)+.
Пример 171
rac-(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(2-гидрокси-1-фенилэтил)-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид
Соединение примера 171 получали в соответствии со способом получения соединения примера 166, используя 2-амино-2-фенил-этанол вместо 2-пропиламино-этанола, и очищали с использованием способа препаративной ЖХ TFA6 с получением указанного в заголовке соединения (14,2 мг, выход 81%).1H ЯМР (400 МГц, 90°С, ДМСО-d6:D2O=9:1 (об/об)) δ 7,33 (д, J=4,4 Гц, 2H), 7,29-7,06 (м, 6H), 7,01-6,82 (м, 1H), 6,55-6,47 (м, 1H), 6,45 (д, J=2,5 Гц, 1H), 5,10 (дд, J=9,1, 6,2 Гц, 1H), 4,85 (тд, J=5,9, 2,7 Гц, 1H), 4,77-4,62 (м, 1H), 3,76-3,60 (м, 5H), 2,32-2,15 (м, 1H), 2,06-1,87 (м, 1H), 1,52-1,29 (м, 2H), 1,10-0,93 (м, 2H); МС (APCI+) m/z 567,0 (M+H)+.
Пример 172
rac-(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(1,1-диоксидотетрагидро-2H-тиопиран-4-ил)-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид
Соединение примера 172 получали в соответствии со способом получения соединения примера 166, используя 1,1-диоксотиан-4-амин вместо 2-пропиламино-этанола, и очищали с использованием способа препаративной ЖХ TFA6 с получением указанного в заголовке соединения (9,0 мг, выход 51%).1H ЯМР (400 МГц, 90°С, ДМСО-d6:D2O=9:1 (об/об)) δ 7,32 (д, J=1,7 Гц, 1H), 7,26 (д, J=8,2 Гц, 1H), 7,20 (дд, J=8,3, 1,7 Гц, 1H), 6,93 (д, J=8,6 Гц, 1H), 6,48 (дд, J=8,5, 2,6 Гц, 1H), 6,43 (д, J=2,5 Гц, 1H), 5,09 (дд, J=9,5, 6,2 Гц, 1H), 4,60 (дд, J=10,1, 3,0 Гц, 1H), 3,92 (п, J=7,3, 6,9 Гц, 1H), 3,70 (с, 3H), 3,24-2,96 (м, 4H), 2,29-2,17 (м, 1H), 2,14-1,86 (м, 5H), 1,53-1,36 (м, 2H), 1,13-0,99 (м, 2H).\; МС (APCI+) m/z 578,2 (M+H)+.
Пример 173
rac-(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-N-[3-(трифторметил)оксетан-3-ил]-3,4-дигидро-2H-хромен-2-карбоксамид
Соединение примера 173 получали в соответствии со способом получения соединения примера 166, используя 3-(трифторметил)оксетан-3-амин вместо 2-пропиламино-этанола, и очищали с использованием способа препаративной ЖХ TFA6 с получением указанного в заголовке соединения (2,3 мг, выход 13%).1H ЯМР (400 МГц, 90°C, ДМСО-d6:D2O=9:1 (об/об)) δ 7,32 (д, J=1,7 Гц, 1H), 7,28-7,14 (м, 2H), 6,94 (д, J=8,5 Гц, 1H), 6,51 (дд, J=8,5, 2,6 Гц, 1H), 6,46 (д, J=2,6 Гц, 1H), 5,12 (дд, J=9,6, 6,2 Гц, 1H), 4,82-4,60 (м, 5H), 3,71 (с, 3H), 2,30-2,18 (м, 1H), 2,07-1,87 (м, 1H), 1,54-1,34 (м, 2H), 1,15-0,97 (м, 2H); МС (APCI+) m/z 571,0 (M+H)+.
Пример 174
rac-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-{(2R,4R)-2-[(4,4-дифторпиперидин-1-ил)карбонил]-7-метокси-3,4-дигидро-2H-хромен-4-ил}циклопропанкарбоксамид
Соединение примера 174 получали в соответствии со способом получения соединения примера 166, используя 4,4-дифторпиперидин гидрохлорид вместо 2-пропиламино-этанола, и очищали с использованием способа препаративной ЖХ TFA6 с получением указанного в заголовке соединения (7,3 мг, выход 41%).1H ЯМР (400 МГц, 90°С, ДМСО-d6:D2O=9:1 (об/об)) δ 7,31 (д, J=1,8 Гц, 1H), 7,25 (д, J=8,3 Гц, 1H), 7,19 (дд, J=8,4, 1,8 Гц, 1H), 6,97 (д, J=8,5 Гц, 1H), 6,49 (дд, J=8,6, 2,6 Гц, 1H), 6,32 (д, J=2,5 Гц, 1H), 5,21-5,06 (м, 2H), 3,69 (д, J=0,9 Гц, 3H), 3,61 (с, 4H), 2,26-1,83 (м, 6H), 1,54-1,35 (м, 2H), 1,15-0,97 (м, 2H); МС (APCI+) m/z 551,0 (M+H)+.
Пример 175
rac-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2R,4R)-7-метокси-2-(1,4-оксазепан-4-илкарбонил)-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
Соединение примера 175 получали в соответствии со способом получения соединения примера 166, используя 1,4-оксазепан гидрохлорид вместо 2-пропиламино-этанола, и очищали с использованием способа препаративной ЖХ TFA6 с получением указанного в заголовке соединения (14,1 мг, выход 86%).1H ЯМР (400 МГц, 90°С, ДМСО-d6:D2O=9:1 (об/об)) δ 7,30 (д, J=1,7 Гц, 1H), 7,24 (д, J=8,3 Гц, 1H), 7,18 (дд, J=8,3, 1,7 Гц, 1H), 6,97 (д, J=8,6 Гц, 1H), 6,48 (дд, J=8,6, 2,6 Гц, 1H), 6,30 (д, J=2,5 Гц, 1H), 5,12 (т, J=7,2 Гц, 2H), 3,85-3,40 (м, 11H), 2,21-1,98 (м, 2H), 1,98-1,68 (м, 2H), 1,53-1,32 (м, 2H), 1,14-0,96 (м, 2H); МС (APCI+) m/z 531,0 (M+H)+.
Пример 176
rac-(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-N-метил-N-(оксетан-3-ил)-3,4-дигидро-2H-хромен-2-карбоксамид
Соединение примера 176 получали в соответствии со способом получения соединения примера 166, используя N-метилоксетан-3-амин вместо 2-пропиламино-этанола, и очищали с использованием способа препаративной ЖХ TFA6 с получением указанного в заголовке соединения (16,2 мг, выход >99%).1H ЯМР (400 МГц, 90°С, ДМСО-d6:D2O=9:1 (об/об)) δ 7,32 (д, J=1,7 Гц, 1H), 7,26 (д, J=8,3 Гц, 1H), 7,21 (дд, J=8,3, 1,7 Гц, 1H), 6,93 (д, J=8,6 Гц, 1H), 6,52 (дд, J=8,6, 2,6 Гц, 1H), 6,36 (д, J=2,5 Гц, 1H), 5,14 (дд, J=10,0, 6,0 Гц, 1H), 4,89 (дд, J=10,7, 2,8 Гц, 1H), 4,51-4,20 (м, 2H), 3,81-3,61 (м, 5H), 3,44 (д, J=6,5 Гц, 1H), 2,68 (с, 3H), 2,40-2,30 (м, 1H), 2,16-1,97 (м, 1H), 1,58-1,29 (м, 2H), 1,14-0,98 (м, 2H); МС (APCI+) m/z 517,1 (M+H)+.
Пример 177
rac-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2R,4R)-7-метокси-2-(морфолин-4-илкарбонил)-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
Соединение примера 177 получали в соответствии со способом получения соединения примера 166, используя морфолин вместо 2-пропиламино-этанола, и очищали с использованием способа препаративной ЖХ TFA6 с получением указанного в заголовке соединения (10,2 мг, выход 64%).1H ЯМР (400 МГц, 90°С, ДМСО-d6:D2O=9:1 (об/об)) δ 7,30 (д, J=1,8 Гц, 1H), 7,24 (д, J=8,3 Гц, 1H), 7,18 (дд, J=8,3, 1,7 Гц, 1H), 6,96 (дд, J=8,6, 1,0 Гц, 1H), 6,48 (дд, J=8,6, 2,6 Гц, 1H), 6,31 (д, J=2,6 Гц, 1H), 5,16-5,05 (м, 2H), 3,87 (с, 0H), 3,69 (с, 3H), 3,65-3,55 (м, 4H), 3,49 (с, 4H), 2,22-2,09 (м, 1H), 2,09-1,96 (м, 1H), 1,54-1,35 (м, 2H), 1,15-0,96 (м, 2H); МС (APCI+) m/z 517,1 (M+H)+.
Пример 178
rac-(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-[2-гидрокси-1-(2-метоксифенил)этил]-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид
Соединение примера 178 получали в соответствии со способом получения соединения примера 166, используя 2-амино-2-(2-метокси-фенил)-этанол вместо 2-пропиламино-этанола, и очищали с использованием способа препаративной ЖХ TFA6 с получением указанного в заголовке соединения (5,5 мг, выход 30%).1H ЯМР (400 МГц, 90°С, ДМСО-d6:D2O=9:1 (об/об)) спектр содержит диастереомерные пики δ 7,35-7,07 (м, 4H), 7,07-6,80 (м, 4H), 6,56-6,48 (м, 1H), 6,48-6,38 (м, 1H), 5,21-5,03 (м, 2H), 4,69 (ддд, J=16,6, 10,0, 3,0 Гц, 1H), 3,89-3,78 (м, 3H), 3,76-3,68 (м, 3H), 3,68-3,47 (м, 2H), 2,31-2,17 (м, 1H), 2,06-1,84 (м, 1H), 1,53-1,31 (м, 2H), 1,10-0,95 (м, 2H); МС (APCI+) m/z 597,0 (M+H)+.
Пример 179
rac-(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-[2-(3-гидроксифенил)этил]-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид
Соединение примера 179 получали в соответствии со способом получения соединения примера 166, используя 3-(2-аминоэтил)фенол гидрохлорид вместо 2-пропиламино-этанола, и очищали с использованием способа препаративной ЖХ TFA6 с получением указанного в заголовке соединения (11,8 мг, выход 68%).1H ЯМР (400 МГц, 90°С, ДМСО-d6:D2O=9:1 (об/об)) δ 7,30 (д, J=1,6 Гц, 1H), 7,27-7,13 (м, 2H), 7,06 (тд, J=7,3, 1,4 Гц, 1H), 6,93 (дд, J=8,6, 1,0 Гц, 1H), 6,66-6,55 (м, 3H), 6,48 (дд, J=8,6, 2,6 Гц, 1H), 6,39 (д, J=2,6 Гц, 1H), 5,15-5,01 (м, 1H), 4,57 (дд, J=10,0, 3,1 Гц, 1H), 3,70 (с, 3H), 3,30 (т, J=7,3 Гц, 2H), 2,66 (т, J=7,3 Гц, 2H), 2,28-2,14 (м, 1H), 1,96-1,80 (м, 1H), 1,55-1,32 (м, 2H), 1,16-0,97; МС (APCI+) m/z 567,0 (M+H)+.
Пример 180
rac-(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(1,3-дигидроксипропан-2-ил)-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид
Соединение примера 180 получали в соответствии со способом получения соединения примера 166, используя 2-амино-пропан-1,3-диол вместо 2-пропиламино-этанола, и очищали с использованием способа препаративной ЖХ TFA6 с получением указанного в заголовке соединения (11,3 мг, выход 71%).1H ЯМР (400 МГц, 90°С, ДМСО-d6:D2O=9:1 (об/об)) δ 7,32 (д, J=1,7 Гц, 1H), 7,28-7,15 (м, 2H), 6,92 (дд, J=8,6, 1,0 Гц, 1H), 6,49 (дд, J=8,6, 2,6 Гц, 1H), 6,41 (д, J=2,6 Гц, 1H), 5,10 (дд, J=9,8, 6,3 Гц, 1H), 4,62 (дд, J=10,5, 2,9 Гц, 1H), 3,77 (п, J=5,5 Гц, 1H), 3,70 (с, 3H), 3,60-3,37 (м, 4H), 2,32-2,18 (м, 1H), 2,01-1,84 (м, 1H), 1,55-1,34 (м, 2H), 1,15-0,97 (м, 2H); МС (APCI+) m/z 521,0 (M+H)+.
Пример 181
rac-(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(2-гидрокси-2,3-дигидро-1H-инден-1-ил)-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид
Соединение примера 181 получали в соответствии со способом получения соединения примера 166, используя 1-амино-индан-2-ол вместо 2-пропиламино-этанола, и очищали с использованием способа препаративной ЖХ TFA6 с получением указанного в заголовке соединения (11,3 мг, выход 70%).1H ЯМР (400 МГц, 90°С, ДМСО-d6:D2O=9:1 (об/об)) спектр содержит диастереомерные пики δ 7,34-6,77 (м, 8H), 6,57-6,44 (м, 1H), 6,41-6,31 (м, 1H), 5,20-5,06 (м, 2H), 4,86-4,73 (м, 1H), 4,52-4,36 (м, 1H), 3,72-3,62 (м, 3H), 3,15-3,01 (м, 1H), 2,92-2,79 (м, 1H), 2,44-2,26 (м, 1H), 2,15-1,96 (м, 1H), 1,56-1,36 (м, 2H), 1,15-0,96 (м, 2H); МС (APCI+) m/z 579,0 (M+H)+.
Пример 182
rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(2-гидроксифенил)-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид
Исходный раствор соединения примера 134 и диизопропилэтиламин(0,089 M и 0,26 M в диметилацетамиде, соответственно, 344 мкл, 0,031 ммоль соединения примера 134 (1,0 эквивалент) и 0,092 ммоль диизопропилэтиламина (3,0 эквивалента)), 2-(3H-[1,2,3]триазоло[4,5-b]пиридин-3-ил)-1,1,3,3-тетраметилизоуроний гексафторфосфат(V) (0,11 M в диметилацетамиде, 344 мкл, 0,037 ммоль, 1,2 эквивалента), и 2-аминофенол (0,40 M в диметилацетамиде, 117 мкл, 0,046 ммоль, 1,5 эквивалента) аспирировали из их соответствующих флаконов с исходным соединением, смешивали посредством PFA смесительной трубки (внутренний диаметр 0,2 мм) и загружали в петлевой дозатор. Часть реакционной смеси впрыскивали в реактор проточного типа (катушка Хастеллой, внутренний диаметр 0,75 мм, внутренний объем 1,8 мл), установленный при 75°С, и пропускали через реактор при 180 мкл мин-1 (время пребывания 10 минут). После выхода из реактора реакционную смесь загружали непосредственно в петлевой дозатор и очищали с использованием способа препаративной ЖХ TFA6 с получением указанного в заголовке соединения (5,7 мг, выход 34%).1H ЯМР (400 МГц, 90°С, ДМСО-d6:D2O=9:1 (об/об)) δ 7,93 (дд, J=8,1, 1,6 Гц, 1H), 7,32 (д, J=1,8 Гц, 1H), 7,28-7,13 (м, 2H), 7,05-6,91 (м, 2H), 6,88 (дд, J=8,1, 1,5 Гц, 1H), 6,79 (тд, J=7,7, 1,5 Гц, 1H), 6,54 (дд, J=8,5, 2,6 Гц, 1H), 6,49 (д, J=2,5 Гц, 1H), 4,96-4,90 (м, 1H), 4,81 (дд, J=8,4, 3,7 Гц, 1H), 3,73 (с, 3H), 2,31-2,07 (м, 2H), 1,53-1,33 (м, 2H), 1,15-0,97 (м, 2H); МС (APCI+) m/z 539,0 (M+H)+.
Пример 183
rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(2-гидроксиэтил)-7-метокси-N-пропил-3,4-дигидро-2H-хромен-2-карбоксамид
Соединение примера 183 получали в соответствии со способом получения соединения примера 182, используя 2-пропиламино-этанол вместо 2-аминофенола с получением указанного в заголовке соединения (9,6 мг, выход 59%).1H ЯМР (400 МГц, 120°С, ДМСО-d6:D2O=9:1 (об/об)) δ 7,25 (д, J=1,6 Гц, 1H), 7,22-7,12 (м, 2H), 6,95 (дд, J=8,4, 0,8 Гц, 1H), 6,45 (дд, J=8,5, 2,6 Гц, 1H), 6,30 (д, J=2,6 Гц, 1H), 5,05-4,86 (м, 2H), 3,68 (с, 3H), 3,63-3,20 (м, 6H), 2,15-1,91 (м, 2H), 1,70-1,45 (м, 2H), 1,45-1,31 (м, 2H), 1,13-0,89 (м, 2H), 0,82 (т, J=7,4 Гц, 3H); МС (APCI+) m/z 533,1 (M+H)+.
Пример 184
rac-(2R,4S)-N-бензил-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(2-гидроксиэтил)-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид
Соединение примера 184 получали в соответствии со способом получения соединения примера 182, используя 2-бензиламино-этанол вместо 2-аминофенола с получением указанного в заголовке соединения (7,4 мг, выход 41%).1H ЯМР (400 МГц, 120°С, ДМСО-d6:D2O=9:1 (об/об)) δ 7,39-7,11 (м, 8H), 6,96 (д, J=8,5 Гц, 1H), 6,47 (дд, J=8,5, 2,6 Гц, 1H), 6,31-6,20 (м, 1H), 5,15-5,07 (м, 1H), 4,99 (т, J=4,9 Гц, 1H), 4,64 (с, 2H), 3,68 (с, 3H), 3,56 (т, J=5,9 Гц, 2H), 3,49-3,31 (м, 2H), 2,20-1,97 (м, 2H), 1,41 (тд, J=11,4, 10,5, 8,1 Гц, 2H), 1,11-0,95 (м, 2H); МС (APCI+) m/z 581,0 (M+H)+.
Пример 185
rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(2-гидрокси-2-фенилэтил)-7-метокси-N-метил-3,4-дигидро-2H-хромен-2-карбоксамид
Соединение примера 185 получали в соответствии со способом получения соединения примера 182, используя 2-метиламин-1-фенил-этанол вместо 2-аминофенола с получением указанного в заголовке соединения (11,2 мг, выход 63%).1H ЯМР (400 МГц, 90°С, ДМСО-d6:D2O=9:1 (об/об)) δ 7,44-7,06 (м, 8H), 6,96 (т, J=7,8 Гц, 1H), 6,48 (дд, J=8,5, 2,5 Гц, 1H), 6,37-6,24 (м, 1H), 5,10-4,86 (м, 2H), 4,81 (т, J=6,4 Гц, 1H), 3,69 (с, 3H), 3,60-3,34 (м, 2H), 2,91 (д, J=23,4 Гц, 3H), 2,07-1,89 (м, 2H), 1,56-1,13 (м, 2H), 1,07-0,99 (м, 2H); МС (APCI+) m/z 581,0 (M+H)+.
Пример 186
rac-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-{(2R,4S)-2-[(4-гидроксипиперидин-1-ил)карбонил]-7-метокси-3,4-дигидро-2H-хромен-4-ил}циклопропанкарбоксамид
Соединение примера 186 получали в соответствии со способом получения соединения примера 182, используя пиперидин-4-ол вместо 2-аминофенола с получением указанного в заголовке соединения (6,8 мг, выход 42%).1H ЯМР (400 МГц, 120°С, ДМСО-d6:D2O=9:1 (об/об)) δ 7,26 (д, J=1,7 Гц, 1H), 7,22-7,12 (м, 2H), 6,94 (д, J=8,5 Гц, 1H), 6,45 (дд, J=8,5, 2,6 Гц, 1H), 6,30 (д, J=2,5 Гц, 1H), 5,05-4,91 (м, 2H), 3,86-3,73 (м, 3H), 3,68 (с, 3H), 3,26-3,11 (м, 2H), 2,14-1,91 (м, 2H), 1,83-1,66 (м, 2H), 1,39 (дт, J=11,7, 9,5 Гц, 4H), 1,11-0,97 (м, 2H); МС (APCI+) m/z 531,0 (M+H)+.
Пример 187
rac-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2R,4S)-2-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-7-метокси-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
Соединение примера 187 получали в соответствии со способом получения соединения примера 182, используя 2-пиперазин-1-ил-этанол вместо 2-аминофенола с получением указанного в заголовке соединения (15,9 мг, выход 77%).1H ЯМР (400 МГц, 120°С, ДМСО-d6:D2O=9:1 (об/об)) δ 7,27 (д, J=1,7 Гц, 1H), 7,22-7,13 (м, 2H), 7,03-6,92 (м, 1H), 6,48 (дд, J=8,5, 2,6 Гц, 1H), 6,34 (д, J=2,5 Гц, 1H), 5,03 (дд, J=8,1, 3,7 Гц, 1H), 4,97 (т, J=5,5 Гц, 1H), 3,93-3,74 (м, 6H), 3,69 (с, 3H), 3,31 (т, J=5,3 Гц, 4H), 3,27-3,20 (м, 2H), 2,21-1,92 (м, 2H), 1,54-1,31 (м, 2H), 1,13-0,97 (м, 2H); МС (APCI+) m/z 560,0 (M+H)+.
Пример 188
rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(2-гидрокси-2-метилпропил)-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид
Соединение примера 188 получали в соответствии со способом получения соединения примера 182, используя 1-амино-2-метил-пропан-2-ол вместо 2-аминофенола с получением указанного в заголовке соединения (9,0 мг, выход 56%).1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,31 (д, J=1,8 Гц, 1H), 7,28-7,13 (м, 2H), 6,97 (д, J=8,5 Гц, 1H), 6,50 (дд, J=8,5, 2,6 Гц, 1H), 6,45 (д, J=2,5 Гц, 1H), 4,89 (т, J=5,4 Гц, 1H), 4,61 (дд, J=8,6, 3,5 Гц, 1H), 3,71 (с, 3H), 3,19-3,00 (м, 2H), 2,22-1,95 (м, 2H), 1,51-1,32 (м, 2H), 1,13-0,97 (м, 8H); МС (APCI+) m/z 519,1 (M+H)+.
Пример 189
rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(1-гидрокси-2-метилпропан-2-ил)-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид
Соединение примера 189 получали в соответствии со способом получения соединения примера 182, используя 2-амино-2-метил-пропан-1-ол вместо 2-аминофенола с получением указанного в заголовке соединения (8,8 мг, выход 55%).1H ЯМР (400 МГц, 90°С, ДМСО-d6:D2O=9:1 (об/об)) δ 7,30 (д, J=1,7 Гц, 1H), 7,27-7,13 (м, 2H), 6,96 (д, J=8,6 Гц, 1H), 6,50 (дд, J=8,5, 2,6 Гц, 1H), 6,43 (д, J=2,5 Гц, 1H), 4,87 (т, J=5,3 Гц, 1H), 4,47 (дд, J=8,8, 3,4 Гц, 1H), 3,71 (с, 3H), 3,45-3,33 (м, 2H), 2,18-1,90 (м, 2H), 1,51-1,32 (м, 2H), 1,25 (с, 3H), 1,22 (с, 3H), 1,19-0,95 (м, 2H); МС (APCI+) m/z 519,1 (M+H)+.
Пример 190
rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(2-гидрокси-1-фенилэтил)-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид
Соединение примера 190 получали в соответствии со способом получения соединения примера 182, используя 2-амино-2-фенил-этанол вместо 2-аминофенола с получением указанного в заголовке соединения (11,4 мг, выход 65%).1H ЯМР (400 МГц, 90°С, ДМСО-d6:D2O=9:1 (об/об)) спектр содержит диастереомерные пики δ 7,37-6,91 (м, 9H), 6,57-6,43 (м, 2H), 4,95-4,80 (м, 2H), 4,74-4,53 (м, 1H), 3,76-3,59 (м, 5H), 2,21-1,93 (м, 2H), 1,51-1,31 (м, 2H), 1,12-0,94 (м, 2H); МС (APCI+) m/z 567,0 (M+H)+.
Пример 191
rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(1,1-диоксидотетрагидро-2H-тиопиран-4-ил)-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид
Соединение примера 191 получали в соответствии со способом получения соединения примера 182, используя 1,1-диоксотиан-4-амин вместо 2-аминофенола, с получением указанного в заголовке соединения (9,8 мг, выход 55%).1H ЯМР (400 МГц, 90°С, ДМСО-d6:D2O=9:1 (об/об)) δ 7,30 (д, J=1,7 Гц, 1H), 7,28-7,13 (м, 2H), 6,96 (д, J=8,6 Гц, 1H), 6,55-6,39 (м, 2H), 4,88 (т, J=5,4 Гц, 1H), 4,54 (дд, J=8,8, 3,5 Гц, 1H), 3,99 (п, J=7,2 Гц, 1H), 3,71 (с, 3H), 3,24-3,10 (м, 2H), 3,10-2,92 (м, 2H), 2,19-1,90 (м, 6H), 1,52-1,32 (м, 2H), 1,14-0,96 (м, 2H); МС (APCI+) m/z 579,0 (M+H)+.
Пример 192
rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-N-[3-(трифторметил)оксетан-3-ил]-3,4-дигидро-2H-хромен-2-карбоксамид
Соединение примера 192 получали в соответствии со способом получения соединения примера 182, используя 3-(трифторметил)оксетан-3-амин вместо 2-аминофенола с получением указанного в заголовке соединения (3,3 мг, выход 19%).1H ЯМР (400 МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,30 (д, J=1,7 Гц, 1H), 7,28-7,13 (м, 2H), 6,98 (д, J=8,6 Гц, 1H), 6,51 (дд, J=8,4, 2,6 Гц, 1H), 6,49-6,42 (м, 1H), 4,90 (т, J=5,2 Гц, 1H), 4,80 (д, J=7,9 Гц, 2H), 4,69 (д, J=8,6 Гц, 2H), 4,63 (дд, J=9,1, 3,4 Гц, 1H), 3,71 (с, 3H), 2,22-1,93 (м, 2H), 1,52-1,32 (м, 2H), 1,13-0,96 (м, 2H); МС (APCI+) m/z 571,0 (M+H)+.
Пример 193
rac-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-{(2R,4S)-2-[(4,4-дифторпиперидин-1-ил)карбонил]-7-метокси-3,4-дигидро-2H-хромен-4-ил}циклопропанкарбоксамид
Соединение примера 193 получали в соответствии со способом получения соединения примера 182, используя 4,4-дифторпиперидин гидрохлорид вместо 2-аминофенола, с получением указанного в заголовке соединения (9,8 мг, выход 58%).1H ЯМР (400 120°С, МГц, ДМСО-d6:D2O=9:1 (об/об)) δ 7,33-7,26 (м, 1H), 7,26-7,13 (м, 2H), 6,97 (д, J=8,5 Гц, 1H), 6,49 (дд, J=8,5, 2,6 Гц, 1H), 6,35 (д, J=2,5 Гц, 1H), 5,03 (дд, J=8,7, 3,4 Гц, 1H), 4,98 (т, J=5,1 Гц, 1H), 3,70 (с, 3H), 3,68-3,60 (м, 4H), 2,22-1,93 (м, 6H), 1,53-1,31 (м, 2H), 1,12-0,97 (м, 2H); МС (APCI+) m/z 551,0 (M+H)+.
Пример 194
rac-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2R,4S)-7-метокси-2-(1,4-оксазепан-4-илкарбонил)-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
Соединение примера 194 получали в соответствии со способом получения соединения примера 182, используя 1,4-оксазепан гидрохлорид вместо 2-аминофенола, с получением указанного в заголовке соединения (8,7 мг, выход 53%).1H ЯМР (400 МГц, 120°С, ДМСО-d6:D2O=9:1 (об/об)) δ 7,28 (д, J=1,5 Гц, 1H), 7,25-7,12 (м, 2H), 6,98 (д, J=8,5 Гц, 1H), 6,48 (дд, J=8,5, 2,6 Гц, 1H), 6,33 (д, J=2,6 Гц, 1H), 5,04-4,93 (м, 2H), 3,70 (с, 7H), 3,64-3,55 (м, 4H), 2,17-1,93 (м, 2H), 1,93-1,73 (м, 2H), 1,49-1,33 (м, 2H), 1,12-0,96 (м, 2H); МС (APCI+) m/z 531,0 (M+H)+.
Пример 195
rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-N-метил-N-(оксетан-3-ил)-3,4-дигидро-2H-хромен-2-карбоксамид
Соединение примера 195 получали в соответствии со способом получения соединения примера 182, используя N-метилоксетан-3-амин вместо 2-аминофенола с получением указанного в заголовке соединения (13,7 мг, выход 86%).1H ЯМР (400 МГц, 90°С, ДМСО-d6:D2O=9:1 (об/об)) δ 7,31 (д, J=1,7 Гц, 1H), 7,29-7,14 (м, 2H), 6,94 (д, J=8,6 Гц, 1H), 6,51 (дд, J=8,6, 2,6 Гц, 1H), 6,37 (д, J=2,6 Гц, 1H), 4,99-4,83 (м, 2H), 4,47-4,27 (м, 2H), 3,80-3,55 (м, 5H), 3,55-3,34 (м, 1H), 2,72-2,60 (м, 3H), 2,21 (д, J=5,8 Гц, 2H), 1,53-1,32 (м, 2H), 1,21-0,98 (м, 2H); МС (APCI+) m/z 517,1 (M+H)+.
Пример 196
rac-1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-[(2R,4S)-7-метокси-2-(морфолин-4-илкарбонил)-3,4-дигидро-2H-хромен-4-ил]циклопропанкарбоксамид
Соединение примера 196 получали в соответствии со способом получения соединения примера 182, используя морфолин вместо 2-аминофенола, с получением указанного в заголовке соединения (9,5 мг, выход 60%).1H ЯМР (400 МГц, 90°C, ДМСО-d6:D2O=9:1 (об/об)) δ 7,31 (д, J=1,7 Гц, 1H), 7,27-7,14 (м, 2H), 6,97 (д, J=8,4 Гц, 1H), 6,49 (дд, J=8,5, 2,6 Гц, 1H), 6,34 (д, J=2,6 Гц, 1H), 5,07-4,93 (м, 2H), 3,70 (с, 3H), 3,60 (тд, J=4,8, 1,6 Гц, 4H), 3,51 (т, J=4,9 Гц, 4H), 2,14-1,92 (м, 2H), 1,52-1,32 (м, 2H), 1,13-0,97 (м, 2H); МС (APCI+) m/z 517,1 (M+H)+.
Пример 197
rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-[2-гидрокси-1-(2-метоксифенил)этил]-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид
Соединение примера 197 получали в соответствии со способом получения соединения примера 182, используя 2-амино-2-(2-метокси-фенил)-этанол вместо 2-аминофенола с получением указанного в заголовке соединения (11,3 мг, выход 70%).1H ЯМР (400 МГц, 90°С, ДМСО-d6:D2O=9:1 (об/об)) спектр содержит диастереомерные пики δ 7,33-7,12 (м, 5H), 7,04-6,85 (м, 3H), 6,56-6,41 (м, 2H), 5,22-5,10 (м, 1H), 4,94-4,76 (м, 1H), 4,70-4,51 (м, 1H), 3,80 (д, J=17,0 Гц, 3H), 3,75-3,68 (м, 3H), 3,68-3,49 (м, 2H), 2,23-1,92 (м, 2H), 1,51-1,32 (м, 2H), 1,13-0,97 (м, 2H); МС (APCI+) m/z 597,0 (M+H)+.
Пример 198
rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-[2-(3-гидроксифенил)этил]-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид
Соединение примера 198 получали в соответствии со способом получения соединения примера 182, используя 3-(2-аминоэтил)фенол гидрохлорид вместо 2-аминофенола, с получением указанного в заголовке соединения (12,7 мг, выход 73%).1H ЯМР (400 МГц, 90°C, ДМСО-d6:D2O=9:1 (об/об)) δ 7,30 (д, J=1,7 Гц, 1H), 7,27-7,13 (м, 2H), 7,05 (т, J=7,7 Гц, 1H), 6,96 (д, J=8,5 Гц, 1H), 6,65-6,55 (м, 3H), 6,49 (дд, J=8,5, 2,6 Гц, 1H), 6,42 (д, J=2,6 Гц, 1H), 4,86 (т, J=5,1 Гц, 1H), 4,51 (дд, J=9,2, 3,4 Гц, 1H), 3,71 (с, 3H), 3,35 (т, J=7,3 Гц, 2H), 2,68 (т, J=7,3 Гц, 2H), 2,12 (дт, J=14,0, 4,1 Гц, 1H), 2,05-1,87 (м, 1H), 1,51-1,32 (м, 2H), 1,21-0,95 (м, 2H); МС (APCI+) m/z 567,0 (M+H)+.
Пример 199
rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(1,3-дигидроксипропан-2-ил)-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид
Соединение примера 199 получали в соответствии со способом получения соединения примера 182, используя 2-амино-пропан-1,3-диол вместо 2-аминофенола, с получением указанного в заголовке соединения (10,7 мг, выход 67%).1H ЯМР (400 МГц, 90°C, ДМСО-d6:D2O=9:1 (об/об)) δ 7,30 (д, J=1,7 Гц, 1H), 7,28-7,13 (м, 2H), 6,98 (д, J=8,5 Гц, 1H), 6,50 (дд, J=8,5, 2,6 Гц, 1H), 6,44 (д, J=2,5 Гц, 1H), 4,88 (т, J=4,9 Гц, 1H), 4,55 (дд, J=9,3, 3,3 Гц, 1H), 3,80 (h, J=5,3 Гц, 1H), 3,71 (д, J=1,0 Гц, 3H), 3,59-3,36 (м, 4H), 2,15 (дт, J=14,0, 4,2 Гц, 1H), 2,07-1,90 (м, 1H), 1,51-1,32 (м, 2H), 1,21-0,95 (м, 2H); МС (APCI+) m/z 521,0 (M+H)+.
Пример 200
rac-(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-N-(2-гидрокси-2,3-дигидро-1H-инден-1-ил)-7-метокси-3,4-дигидро-2H-хромен-2-карбоксамид
Соединение примера 200 получали в соответствии со способом получения соединения примера 182, используя 1-амино-индан-2-ол вместо 2-аминофенола, с получением указанного в заголовке соединения (11,3 мг, выход 70%).1H ЯМР (400 МГц, 90°C, ДМСО-d6:D2O=9:1 (об./об.)) спектр содержит диастереомерные пики δ 7,37-6,90 (м, 8H), 6,57-6,45 (м, 1H), 6,39 (дд, J=6,5, 2,6 Гц, 1H), 5,23 (д, J=5,3 Гц, 1H), 5,04-4,89 (м, 1H), 4,83-4,67 (м, 1H), 4,54-4,40 (м, 1H), 3,69 (д, 3H), 3,10 (дд, J=16,4, 5,2 Гц, 1H), 2,92-2,78 (м, 1H), 2,32-1,98 (м, 2H), 1,55-1,34 (м, 2H), 1,22-0,97 (м, 2H).; МС (APCI+) m/z 579,0 (M+H)+.
Пример 201
rac-1-{[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]карбонил}пирролидин-3-карбоновая кислота
Исходный раствор соединения примера 134 и диизопропилэтиламин(0,044 M и 0,13 M в диметилацетамиде, соответственно, 1,0 мл, 0,044 ммоль соединения примера 134 (1,0 эквивалент) и 0,13 ммоль диизопропилэтиламина (3,0 эквивалента)) и 2-(3H-[1,2,3]триазоло[4,5-b]пиридин-3-ил)-1,1,3,3-тетраметилизоуроний гексафторфосфат(V) (0,054 M в диметилацетамиде, 1,0 мл, 0,054 ммоль, 1,2 эквивалента) объединяли и перемешивали при комнатной температуре в течение 10 минут. Добавляли пирролидин-3-карбоновую кислоту (0,40 M в диметилацетамиде, 167 мкл, 0,067 ммоль, 1,5 эквивалента) и реакционную смесь перемешивали при 75°С в течение 30 минут. Реакционную смесь загружали непосредственно в петлевой дозатор и очищали с использованием способа препаративной ЖХ TFA6 с получением указанного в заголовке соединения (5,7 мг, выход 34%).1H ЯМР (400 МГц, 120°С, ДМСО-d6:D2O=9:1 (об/об)) спектр содержит диастереомерные пики δ 7,26 (с, 1H), 7,20-7,14 (м, 2H), 6,95 (д, J=8,5 Гц, 1H), 6,46 (дд, J=8,5, 2,6 Гц, 1H), 6,32 (т, J=2,5 Гц, 1H), 4,94 (с, 1H), 4,80 (дд, J=7,9, 4,2 Гц, 1H), 3,68 (с, 3H), 3,62-3,34 (м, 4H), 2,07 (д, J=39,1 Гц, 5H), 1,43-1,37 (м, 2H), 1,04-0,99 (м, 2H); МС (APCI+) m/z 545,4 (M+H)+.
Пример 202
4-[(2R,4R)-4-({[1-(6-бром-2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(дифторметокси)-3,4-дигидро-2H-хромен-2-ил]бензойная кислота
Пример 202A
(R)-метил 4-(4-((бензилокси)имино)-7-метоксихроман-2-ил)бензоат
Соединение примера 110A (29,52 г, 95 ммоль) растворяли в 190 мл сухого пиридина. Добавляля O-бензилгидроксиламин гидрохлорид (15,84 г, 99 ммоль) и раствор нагревали при 50°C в течение 16 часов. Реакционный сосуд охлаждали до комнатной температуры, концентрировали в вакууме, и разделяли между этилацетатом (300 мл) и насыщенным водным раствором хлорида аммония (150 мл). Органический слой промывали 1M HCl (3×100 мл) и насыщенным солевым раствором (100 мл), затем концентрировали и растирали с гептанами с получением твердой массы, которую фильтровали, затем измельчали в ступке с пестиком и сушили до постоянной массы, получая 35 г указанного в заголовке соединения, которое использовали без дополнительной очистки. Здесь приведены аналитические данные для основного изомера.1H ЯМР (501 МГц, CDCl3) δ 8,06 (д, J=8,3 Гц, 2H), 7,84 (д, J=8,8 Гц, 1H), 7,54-7,46 (м, 2H), 7,40-7,28 (м, 5H), 6,57 (дд, J=8,8, 2,5 Гц, 1H), 6,48 (д, J=2,5 Гц, 1H), 5,19 (д, J=2,0 Гц, 2H), 5,11 (дд, J=12,3, 3,2 Гц, 1H), 3,92 (с, 3H), 3,78 (с, 3H), 3,48 (дд, J=17,2, 3,2 Гц, 1H), 2,67 (дд, J=17,2, 12,2 Гц, 1H); МС (ESI+) m/z 418,1 (M+H)+.
Пример 202B
метил 4-((2R,4R)-4-амино-7-метоксихроман-2-ил)бензоат гидрохлорид
Соединение примера 202A (20 г 47,9 ммоль) растворяли в 300 мл уксусной кислоты и 5% влажной Pt/C (1,5 г влажной массы, 58,9% воды, 0,884 г или 4,42% сухого вещества) в 300-мл реакторе из нержавеющей стали. Свободное пространство над жидкостью заполняли аргоном и затем водородом под давлением 30 фунтов/кв.дюйм. Смесь встряхивали при комнатной температуре при давлении водорода 30 фунт/кв.дюйм в течение 18 часов. Реакцию контролировали с помощью ВЭЖХ в отношении исчезновения исходного материала. После достижени приблизительно 95% конверсии (18 часов, контролировали ЖХ-МС), реактор вентилировали и реакционную смесь фильтровали через мембрану 0,45 мкм GHP Acrodisc. Растворитель удаляли в вакууме с получением 60 г неочищенного материала. Неочищенный материал нагревали при 70°С в 250 мл смеси 4:1 метил-трет-бутиловый эфир:гептан до получения прозрачного раствора. HCl (3 М в циклопропилметиловом эфире, 47,9 мл, 144 ммоль) добавляли по каплям при той же температуре и из реакционной смеси выпадало белое твердое вещество. Сосуд оставляли охлаждаться до комнатной температуры в течение 1 часа и полученное не совсем белое твердое вещество удаляли фильтрованием с использованием фриттованной воронки. Твердое вещество промывали метил-трет-бутиловым эфиром (2×100 мл) и сушили в воронке. Полученное белое твердое вещество дополнительно нагревали при 70°С в толуоле (20 мл) в течение 30 минут для удаления дополнительных примесей. После охлаждения до комнатной температуры полученное твердое вещество фильтровали, используя фриттованную воронку, и промывали 75 мл толуола и 100 мл гептана, затем сушили до постоянной массы с получением 19,8 г указанного в заголовке соединения (выход 79%).1H ЯМР (400 МГц, ДМСО-d6) δ 8,67 (с, 3H), 8,08-7,95 (м, 2H), 7,58 (дд, J=8,4, 6,1 Гц, 3H), 6,62 (дд, J=8,7, 2,6 Гц, 1H), 6,50 (д, J=2,5 Гц, 1H), 5,33 (дд, J=11,8, 1,6 Гц, 1H), 4,70 (дд, J=11,1, 6,2 Гц, 1H), 3,84 (с, 3H), 3,70 (с, 3H), 2,60-2,50 (м, 1H), 1,96 (кв, J=11,8 Гц, 1H); МС (ESI+) m/z 297,1 (M-NH3)+.
Пример 202C
метил 1-(6-бром-2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксилат
1-(2,2-Дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновую кислоту (2 г, 8,26 ммоль) суспендировали в ацетонитриле (16,52 мл) и добавляли N-бромсукцинимид (1,911 г, 10,74 ммоль), затем хлорид железа (III) (0,670 г, 4,13 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь разбавляли этилацетатом и промывали водой, насыщенным тиосульфатом натрия и насыщенным солевым раствором, затем сушили над сульфатом натрия, затем концентрировали с получением темного неочищенного масла. Неочищенный материал растворяли в смеси 2:1 тетрагидрофурана и метанола (20 мл всего) и добавляли по каплям TMS-диазометан (2M в диэтиловом эфире, 5,37 мл, 10,74 ммоль). По завершении добавления ТСХ показала, что произошло полное превращение в метиловый эфир. Растворитель удаляли в вакууме и полученный неочищенный остаток очищали колоночной флэш-хроматографией, элюируя 0-10% этилацетат/гептаном в течение 20 минут на 40 г колонке с силикагелем с получением 1,56 г указанного в заголовке соединения в виде бесцветного масла.1H ЯМР (400 МГц, CDCl3) δ 7,29 (с, 1H), 7,04 (с, 1H), 3,64 (с, 3H), 1,78 (м, 2H), 1,21-1,09 (м, 2H).
Пример 202D
1-(6-бром-2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоновая кислота
Соединение примера 202C (1,354 г, 4,04 ммоль) растворяли в тетрагидрофуране (10,10 мл) и добавляли триметилсиланолат калия (0,778 г, 6,06 ммоль). Полученный светло-желтый раствор нагревали при 40°C в течение 2 часов. Колбу охлаждали до комнатной температуры и раствор перемешивали с 1 М HCl (10 мл) в течение 5 минут и разделяли между этилацетатом и водой. Органические экстракты сушили над сульфатом натрия, фильтровали и концентрировали с получением 1,25 г указанного в заголовке соединения в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 7,29 (с, 1H), 7,04 (с, 1H), 1,97-1,73 (м, 2H), 1,27 (ушир.с, 2H); МС (ESI+) m/z 338,3 (M+H2O)+.
Пример 202E
1-(6-бром-2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбонилхлорид
Соединение из примера 202D (1 г, 3,11 ммоль) растворяли в дихлорметане (7,79 мл). Полученный раствор обрабатывали оксалил дихлоридом (0,791 мл, 9,34 ммоль) и N,N-диметилформамидом (4,55 мг, 0,062 ммоль). Раствор перемешивали в течение 1 часа при комнатной температуре и концентрировали. Полученное неочищенное масло растворяли в 10 мл дихлорметана и концентрировали в вакууме. Полученный хлорангидрид кислоты сразу использовали в реакции амидного сочетания после получения соединения в виде раствора в 5 мл сухого дихлорметана.
Пример 202F
метил 4-((2R,4R)-4-(1-(6-бром-2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-7-метоксихроман-2-ил)бензоат
Раствор соединения примера 202B (1,092 г, 3,12 ммоль) в дихлорметане (15,61 мл) в 100 мл круглодонной колбе охлаждали до <5°C на бане со льдом, и добавляли триэтиламин (1,305 мл, 9,37 ммоль). Свежеприготовленный раствор соединения из примера 202E (1,06 г, 3,12 ммоль) в 2 мл дихлорметана добавляли по каплям через шприц и реакционную смесь перемешивали в течение 15 минут при той же температуре. Реакционную смесь разбавляли метил-трет-бутиловым эфиром (30 мл) и перемешивали с 1 М HCl (10 мл) в течение 5 минут при комнатной температуре. После стандартной водной обработки полученное неочищенное твердое вещество суспендировали в горячей смеси этилацетат/гептан (1:4, 10 мл) при температуре 75°C в течение 30 минут и затем охлаждали до комнатной температуры. Полученное белое твердое вещество собирали фильтрованием с использованием фриттованной воронки и сушили до постоянной массы с получением 1,25 г указанного в заголовке соединения.1H ЯМР (501 МГц, CDCl3) δ 8,07 (д, J=8,4 Гц, 2H), 7,60-7,43 (м, 2H), 7,33 (с, 1H), 7,12 (д, J=24,1 Гц, 2H), 6,55 (дд, J=8,6, 2,6 Гц, 1H), 6,47 (д, J=2,5 Гц, 1H), 5,47 (тд, J=9,7, 6,2 Гц, 1H), 5,32-5,16 (м, 2H), 3,96 (с, 3H), 3,79 (с, 3H), 2,56 (ддд, J=13,3, 6,1, 2,1 Гц, 1H), 1,93 (ушир.с, 1H), 1,83 (дт, J=13,4, 11,0 Гц, 2H), 1,12 (ушир.с, 2H); МС (ESI+) m/z 297,1 (M-Амид+H)+.
Пример 202G
метил 4-((2R,4R)-4-(1-(6-бром-2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-7-гидроксихроман-2-ил)бензоат
Соединение примера 202F (1 г, 1,622 ммоль) и тетрабутиламмония иодид (1,798 г, 4,87 ммоль) растворяли в 10 мл сухого дихлорметана и раствор охлаждали до <-20°C на бане ацетон-сухой лед. Раствор трихлорида бора (1M в дихлорметане, 4,87 мл, 4,87 ммоль) добавляли по каплям в течение 5 минут, и реакционную смесь выдерживали при той же температуре в течение 1 часа. Полученный раствор выливали в ледяную воду и экстрагировали дихлорметаном (3×20 мл). Объединенные экстракты концентрировали в вакууме до приблизительно 5 мл и затем разбавляли 20 мл метил-трет-бутилового эфира. Летучие вещества удаляли в вакууме и полученный неочищенный материал суспендировали с 15 мл метил-трет-бутилового эфира и концентрировали частично в вакууме с последующим добавлением метил-трет-бутилового эфира, снова концентрировали и суспендировали с метил-трет-бутиловым эфиром. Суспензию промывали водой (2×20 мл) и органический слой затем концентрировали в вакууме и фильтровали через 1-дюймовый слой силикагеля, элюируя метил-трет-бутиловым эфиром. Растворитель удаляли в вакууме с получением неочищенного белого твердого вещества, которое использовали без дополнительной очистки.1H ЯМР (501 МГц, CDCl3) δ 8,05 (д, J=8,4 Гц, 2H), 7,45 (д, J=8,1 Гц, 2H), 7,32 (с, 1H), 7,09 (ушир.с, 2H), 6,49 (д, J=0,7 Гц, 1H), 6,43 (с, 1H), 6,00-5,78 (ушир.с, 1H), 5,44 (кв, J=8,8 Гц, 1H), 5,29 (д, J=8,7 Гц, 1H), 5,20 (дд, J=11,3, 2,0 Гц, 1H), 3,95 (с, 3H), 2,53 (ддд, J=13,3, 6,0, 2,0 Гц, 1H), 1,93 (ушир.с, 1H), 1,81 (дт, J=13,1, 10,8 Гц, 2H), 1,11 (ушир.с, 2H); МС (ESI+) m/z 283,1 (M-Амид+H)+.
Пример 202H
4-((2R,4R)-4-(1-(6-бром-2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-7-(дифторметокси)хроман-2-ил)бензойная кислота
Соединение из примера 202G (0,980 г, 1,627 ммоль) суспендировали в ацетонитриле (8,13 мл). Суспензию охлаждали до <-25°C на бане ацетон-сухой лед и добавляли диэтил (бромдифторметил)фосфонат (0,434 мл, 2,440 ммоль), с последующим добавлением по каплям водного раствора гидроксида калия (4 М, 8,13 мл, 32,5 ммоль) с такой скоростью, чтобы температура поддерживалась ниже -15°С. После того, как добавление было завершено (2 минуты), реакционную смесь обрабатывали еще в течение 15 минут, после чего ее нагревали до комнатной температуры. Добавляли метанол (5 мл), и реакционную смесь нагревали при 40°C в течение 15 минут. Сосуд охлаждали до комнатной температуры, разбавляли 10 мл изопропилацетата и промывали KOH (2 M, 3×10 мл), 20 мл 1M HCl, и насыщенным солевыи раствором, затем сушат над сульфатом натрия, фильтровали и концентрировали. Остаток очищали с помощью колоночной флэш-хроматографии, элюируя 0-100% этилацетатом/гептанами в течение 20 минут на колонке с силикагелем 40 г с получением 275 мг указанного в заголовке соединения в виде белого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6; 90°С) δ 7,96 (д, J=8,2 Гц, 2H), 7,65 (с, 1H), 7,52 (д, J=8,1 Гц, 2H), 7,44 (с, 1H), 7,21 (д, J=8,5 Гц, 1H), 7,05 (т, J=72 Гц, 1H; CF2H) 7,01 (д, J=8,7 Гц, 1H), 6,72 (дд, J=8,5, 2,6 Гц, 1H), 6,63 (д, J=2,6 Гц, 1H), 5,46-5,30 (м, 2H), 2,22-1,95 (м, 2H), 1,68 (дт, J=9,7, 3,0 Гц, 1H), 1,57 (дт, J=8,7, 2,9 Гц, 1H), 1,08 (с, 2H); МС (ESI+) m/z=636,0 (M-H)-.
Пример 203
4-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(дифторметокси)-3,4-дигидро-2H-хромен-2-ил]-N-(метилсульфонил)бензамид
Смесь продукта из примера 122 (0,100 г, 0,178 ммоль), TBTU (O-(бензотриазол-1-ил)-N,N,N′,N′-тетраметилуроний тетрафторборат) (0,086 г, 0,268 ммоль) и триэтиламин (0,080 мл, 0,572 ммоль) в тетрагидрофуране (2 мл) перемешивали при комнатной температуре в течение 90 минут, в это время была видна мутная белая смесь. Смесь затем обрабатывали хлоридом лития (2,5 мг, 0,059 ммоль) и метансульфонамидом (22 мг, 0,228 ммоль), и реакционную смесь перемешивали в течение ночи при комнатной температуре. По истечении этого времени реакционную смесь концентрировали в вакууме и остаток очищали препаративной ВЭЖХ с обращенной фазой на колонке Phenomenex® Luna® C8(2) 5 мкм 100Å AXIA™ (30 мм×75 мм). Использовали градиент ацетонитрила (А) и 0,1% трифторуксусной кислоты в воде (В) при скорости потока 50 мл/мин (0-0,5 минуты 10% A, 0,5-7,0 минут линейный градиент 10-95% A, 7,0-10,0 минут 95% A, 10,0-12,0 минут линейный градиент 95-10% A), получая указанное в заголовке соединение в виде белого твердого вещества (45 мг, выход 40%).1H ЯМР (400 МГц, ДМСО-d6) δ 12,15 (с, 1H), 7,97 (д, J=8,3 Гц, 2H), 7,61-7,17 (м, 6H), 7,09-7,01 (м, 2H), 6,77-6,68 (м, 2H), 5,50-5,32 (м, 2H), 3,38 (с, 3H), 2,13-2,02 (м, 2H), 1,52-1,34 (м, 2H). 1,06 (м, 2H); МС (ESI+) m/z 636,9 (M+H)+.
ОПРЕДЕЛЕНИЕ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ
Клеточные анализы
Анализ экспрессии на поверхности клеток-пероксидаза хрена (CSE-HRP):
Клеточный анализ для измерения экспрессии на поверхности клеток F508delCFTR после коррекции с тестируемыми соединениями был разработан в эпителиальной клеточной линии легких человека (CFBE41o-) (Veit G et al, (2012) Mol Biol Cell. 23(21): 4188-4202). Это было достигнуто путем экспрессии мутации F508delCFTR вместе с пероксидазой хрена (HRP) в четвертой экзофациальной петле, а затем измерения активности HRP с использованием считывания данных люминесценции этих клеток, CFBE41o-F508delCFTR-HRP, которые инкубировали в течение ночи с тестируемыми соединениями корректорами. Вкратце, для этого первичного анализа клетки CFBE41o-F508delCFTR-HRP высевали в 384-луночные планшеты (Greiner Bio-one; Cat 781080) при плотности 4000 клеток/лунку вместе с доксициклином 0,5 мкг/мл, чтобы индуцировать экспрессию F508delCFTR-HRP и далее инкубировали при 37°C, 5% CO2 в течение 72 часов. Затем тестируемые соединения добавляли в требуемых концентрациях и далее инкубировали в течение 18-24 часов при 33°С. Максимальная тестируемая концентрация составляла 20 мкМ с 8-точечной концентрационной кривой с использованием 3-кратного разведения. Для определения одного EC50 готовили три параллельных планшета. Все планшеты содержали отрицательные контроли (диметилсульфоксид, ДМСО) и положительныйе контроли (3 мкМ 3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]бензойная кислота), а также концентрации реакции положительного контроля на планшете. После инкубации планшеты промывали 5× раз физиологическим раствором, забуференным фосфатом Дульбекко (DPBS) с последующим добавлением субстрата HRP, люминола (50 мкл) и измерением активности HRP с использованием считывания данных люминесценции на планшете-ридере EnVision® Multilabel Plate Reader (Perkin Elmer, серийный номер изделия 2104-0010). Исходные значения из эксперимента анализировали с помощью Accelrys® Assay Explorer v3.3.
Zʹ больше 0,5 использовали в качестве критерия контроля качества прохождения для планшетов.
Zʹ определяли как:
1-[3*SDПоложительный контроль+3*SDОтрицательный контроль/Абсолютный (СреднееПоложительный контроль-СреднееОтрицательный контроль)]
где "SD" представляет собой стандартное отклонение.
% Активности, измеренный в каждой из 8 тестируемых концентраций тестируемого соединения, нормировали на положительный контроль на планшете, используя следующую формулу:
% Активности=[(ответ тестируемого соединения-ответ ДМСО)/ (ответ положительного контроля-ответ ДМСО)]*100
Максимальный % активности, достигнутый для тестируемого соединения при любой тестируемой концентрации, представлен в таблице 1 вместе со значениями EC50, рассчитанными с использованием следующей общей сигмоидальной кривой и с использованием уравнения с переменным угловым коэффициентом Хилла (описанной как модель 42 в программном обеспечении Accelrys® Assay Explorer v3.3):
y=(a-d)/(1+(x/c)^b)+d
Общая сигмоидальная кривая с концентрацией, ответом, самым верхним значением эффекта, который наблюдался, самым низким значением эффекта, который наблюдался, EC50 и угловым коэффициентом Хилла.
Эта модель описывает сигмоидальную кривую с регулируемой базовой линией, a. Уравнение может использовать для аппроксимации кривой, где ответ либо увеличивается, либо уменьшается относительно независимой переменной ʺхʺ.
ʺxʺ представляет собой концентрацию тестируемого лекарственного средства.
ʺyʺ представляет собой ответ.
ʺaʺ представляет собой максимальный ответ, и ʺdʺ представляет минимальный ответ
ʺcʺ представляет собой точку перегиба кривой (EC50). Таким образом, ʺyʺ является промежуточным между более низкими и верхними асимптотами, когда x=c.
ʺbʺ представляет собой коэффициент наклона или коэффициент Хилла. Символ b является положительным, когда ответ возрастает с увеличением дозы и отрицательным, когда ответ уменьшается с увеличением дозы (ингибирование).
Таблица 1. Данные анализа CSE-HRP
Анализ проводимостибронхиальных эпителиальных клеток человека с помощью трансэпителиальной системы фиксации:
Клеточный анализ с использованием первичных бронхиальных эпителиальных клеток человека (hBE) использовали в качестве вторичного анализа для тестирования новых корректоров F508delCFTR на их активность в первичных hBE-клетках с мутацией F508del/F508del CFTR. В анализе использовали прибор TECC-24 (Transepithelial Clamp Circuit для 24 лунок), который измеряет функциональность мутированного канала путем измерения эквивалентного тока короткого замыкания (Ieq), генерируемого поляризованными эпителиальными клетками. Прибор работает путем измерения трансэпителиальной разности потенциалов (Vt) и трансэпителиального сопротивления (Rt) в формате открытого контура, а Ieq рассчитывали с использованием закона Ома (Ieq=Vt/Rt). Анализ проводили в 24-луночном формате, и все 24 лунки измеряли в одно и то же время, что дало более высокую пропускную способность для этого анализа.
Первичные бронхиальные эпителиальные клетки человека (hBE) от пациентов с F508del/F508delCFTR были увеличены от 1×106 до 250×106 клеток (Neuberger T, Burton B, Clark H and VanGoor F; Cystic Fibrosis, Methods in Mole Biol 741; eds. Amaral MD and Kunzelmann K, 2011). Для этой цели клетки, выделенные из пациентов, имеющих CF с гомозиготной мутацией, высевали на 24-луночные фильтрующие планшеты Corning (номер по каталогу 3378), которые покрывали кондиционированной средой 3Т3, и выращивали на границе раздела воздух-жидкость в течение 35 дней, с использованием Ultroser® G, дополненной дифференцированной средой. Слизь с апикальной поверхности удаляли за 72 часа до эксперимента, используя 3 мМ дитиотреитол (DTT) в фосфатно-буферном солевом растворе (PBS). Апикальную поверхность снова промывали за 24 часа до эксперимента с использованием PBS. Клетки инкубировали с желаемым дозозависимым эффектом соединений корректора в течение 18-24 часов при 37°C, 5% CO2. Соединения корректора добавляли только на базолатеральную сторону эпителиальных клеток.
В день измерения корректирующей активности на аппарате TECC, клетки были переведены в среду с бикарбонатом и без сыворотки модифицированную по Coon среду F-12 и давали уравновешиваться в течение 90 минут в свободном от CO2 инкубаторе. Во время измерения апикальную и базолатеральную стороны фильтра промывали средой F-12, модифицированной по Coon, (с 20 мМ 4-(2-гидроксиэтил)-1-пиперазинэтансульфокислотой (HEPES), pH 7,4 (с использованием 1 М трис(гидроксиметил)аминометана (Tris)), и измерения проводили при температуре 36,5°C. Трансэпителиальный потенциал (Vt) и трансэпителиальное сопротивление (Rt) измеряли с использованием трансэпителиального 24-канального токоизмерительного зажима (TECC-24). Измеряли текущие ответы на последовательное добавление бензамила (апикальное введение 6 мкМ, для ингибирования эпителиального ENaC канала), форсколин (апикальное и базолатеральное добавление 10 мкМ, для активации канала CFTR), контрольное потенцирующее средство (N-(3-карбамоил-5,5,7,7-тетраметил-4,7-дигидро-5Н-тиено[2,3-с]пиран-2-ил)-1Н-пиразол-5-карбоксамид, апикальное и базолатеральное 1 мкМ добавление; для усиления канала CFTR) и буметанид (базолатеральное добавление 20 мкМ; для ингибирования Na:2Cl:К котранспортера, косвенный показатель ингибирования секреции Cl-, управляемой каналом CFTR).
Все планшеты содержали отрицательный контроль (диметилсульфоксид, ДМСО), который в сочетании с контрольным потенцирующим средством (N-(3-карбамоил-5,5,7,7-тетраметил-4,7-дигидро-5Н-тиено[2,3-c]пиран-2-ил)-1Н-пиразол-5-карбоксамид) устанавливал нулевой ответ и положительные контроли (3 мкМ 3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]бензойной кислоты) в сочетании с контрольным потенцирующим средством устанавливал 100% ответ в результате измерения коррекции мутировавшего канала CFTR. Максимальный процент активности сообщается относительно положительного контрольного значения.
% Активности, измеренный в каждой из 6 тестируемых концентраций тестируемого соединения, нормировали на положительный контроль на планшете, используя следующую формулу:
% активности=[(ответ тестируемого соединения-ответ ДМСО)/ (ответ положительного контроля-ответ ДМСО)]*100
Следующий log(агонист) против ответа с использованием четырех переменных параметров наклона использовали для расчета EC50 (4 PL в программном обеспечении Prism v 5):
F(x)=D+(A-D)/(1+(x/C)^B)
где:
ʺxʺ представляет собой концентрацию тестируемого лекарственного средства.
ʺF(x)ʺ представляет собой ответ.
ʺAʺ представляет собой максимальный ответ, и ʺDʺ представляет минимальный ответ
ʺСʺ представляет собой точку перегиба кривой (EC50). Таким образом, ʺF(x)ʺ является промежуточным между более низкими и верхними асимптотами, когда x=C.
ʺBʺ представляет собой коэффициент наклона или коэффициент Хилла. Символ B является положительным, когда ответ возрастает с увеличением дозы и отрицательным, когда ответ уменьшается с увеличением дозы (ингибирование).
Максимальная процентная активность и значения EC50 для тестируемых соединений-корректоров представлены в таблице 2.
Таблица 2. Данные hBE-TECC
Индукция CYP3A4:
Криоконсервированные первичные гепатоциты человека оттаивали и культивировали в течение ночи перед обработкой. Культивируемые гепатоциты обрабатывали либо тестируемыми соединениями (10 мкМ), либо контрольным носителем (0,1% об./об. ДМСО), либо прототипическим индуктором CYP3A4 (рифампицин 10 мкМ) в течение 48 часов, со средой для культивирования, обновляемой каждые 24 часа. После обработки в течение 48 часов гепатоциты собирали для выделения РНК и обратной транскрипции, с последующим количественным определением мРНК CYP3A4 с использованием ОТ-ПЦР (полимеразной цепной реакции с обратной транскрипцией в реальном времени).
Уровень мРНК CYP3A4 использовали в качестве меры экспрессии CYP3A4 в гепатоцитах, который, как ожидали, не изменится в гепатоцитах, обработанных контрольным носителем (0,1% об/об ДМСО), но, как ожидали, будет значительно увеличен в гепатоцитах, обработанных прототипическим индуктором (рифампицин). Уровни мРНК CYP3A4, измеренные в гепатоцитах, обработанных соединением, выражали в виде процента от ответа положительного контроля (рифампицин 10 мкМ).
Кратность индукции=кратность обработанных/кратность контрольного носителя
% Положительного контроля=(Кратность индукции обработанных-1)/(Кратность индукции прототипического индуктора-1)
В гепатоцитах, обработанных тестируемым соединением, повышение уровня мРНК CYP3A4 менее чем на 20% от ответа положительного контроля (рифампицин) считается низким уровнем для индукции CYP3A4.
Таблица 3
Понятно, что приведенное выше подробное описание и прилагаемые примеры являются лишь иллюстративными и не должны рассматриваться как ограничения объема изобретения, который определен только прилагаемой формулой изобретения и ее эквивалентами. Различные изменения и модификации вариантов осуществления будут очевидны для специалистов в данной области. Такие изменения и модификации, включая без ограничения, относящиеся к химическим структурам, заместителям, производным, промежуточным соединениям, синтезам, препаратам или способам, или любые комбинации таких изменений и модификаций по применению изобретения, могут быть сделаны, не отклоняясь от его сущности и объема.
Реферат
Изобретение относится к соединению формулы (I) или к его фармацевтически приемлемой соли, где X представляет собой CRи Y представляет собой CR; или X представляет собой N и Y представляет собой CR; или X представляет собой CRи Y представляет собой N; m равен 0; Rи Rкаждый независимо представляют собой водород, галоген, C-Cгалогеналкил, C-Cалкил, -ORили -C(O)OR; каждый Rв каждом случае независимо представляет собой водород, C-Cгалогеналкил или C-Cалкил; где C-Cалкил замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из -OR, -C(O)ORи G; Rв каждом случае независимо представляет собой водород или C-Cалкил; и Rпредставляет собой водород или C-Cалкил; Rи Rкаждый независимо представляют собой водород, галоген, C-Cалкил или -O-(C-Cалкил); Rпредставляет собой водород, C-Cгалогеналкил или C-Cалкил; Rпредставляет собой водород, -C(O)R, -C(O)OH, -C(O)O(C-Cалкил), -C(O)N(R), C-Cгалогеналкил, C-Cалкил или G; или Rи Rвместе с атомом углерода, к которому они присоединены, образуют C-Cциклоалкил или 4-6-членный гетероцикл, в котором один гетероатом выбирают из N; где каждый 4-6-членный гетероцикл необязательно замещен 1 группой R; G, в каждом случае, независимо представляет собой циклоалкил, 4-6-членный гетероцикл, в котором один или два гетероатома выбраны из N, O или S, фенил или 5-6-членный гетероарил, содержащий 1, 2, 3 или 4 гетероатома, выбранных из N, O или S, каждый из которых независимо является незамещенным или замещенным 1 или 2 независимо выбранными группами R; Rи R, в каждом случае, каждый независимо представляют собой C-Cалкил, галоген, C-Cгалогеналкил, оксо, -OR, -S(O)R, -C(O)R, -C(O)OR, -C(O)N(R)или -C(O)N(R)S(O)R, где каждый C-Cгалогеналкил и C-Cалкил необязательно замещены одним или двумя заместителями, независимо выбранными из группы, состоящей из -OR; Rв каждом случае независимо представляет собой водород, C-Cгалогеналкил, C-Cалкил или G, где каждый C-Cгалогеналкил и C-Cалкил необязательно замещены одним или двумя заместителями, независимо выбранными из группы, состоящей из -ORи G; Rв каждом случае независимо представляет собой G; Rпредставляет собой водород; Rпредставляет собой водород или -(C-Cалкиленил)-G; Rпредставляет собой водород; каждый R, Rи Rнезависимо представляют собой водород или галоген; каждый Rи Rнезависимо представляют собой галоген; G, Gи G, в каждом случае, каждый независимо представляют собой циклоалкил, инденил, 3-7-членный гетероцикл, содержащий один, два, три или четыре гетероатома, независимо выбранных из группы, состоящей из О, N и S, или фенил, каждый из которых является независимо незамещенным или замещенным 1 или 2 независимо выбранными группами R; где Rв каждом случае независимо представляет собой C-Cалкил, C-Cгалогеналкил, оксо, -OR, -C(O)OR, галоген или -(C-Cалкиленил)-OR; Rв каждом случае независимо представляет собой водород или C-Cалкил. Изобретение также относится к фармацевтической композиции, обладающей модулирующей активностью в отношении белка муковисцидозного трансобменного регулятора проводимости (СFTR), на основе указанных соединений. Технический результат – получены новые соединения и фармацевтическая композиция на их основе, которые могут найти применение в медицине в качестве средств для лечения муковисцидоза. 17 н. и 49 з.п. ф-лы, 3 табл., 203 пр.
Формула


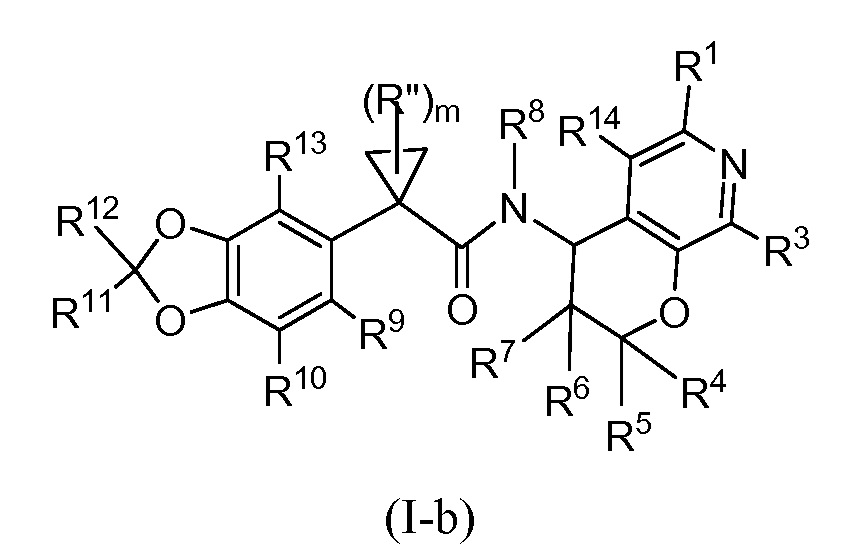
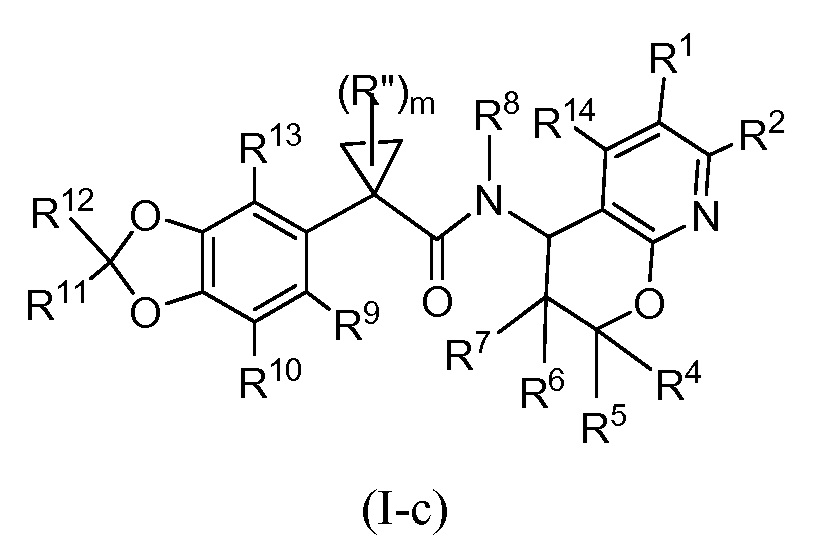
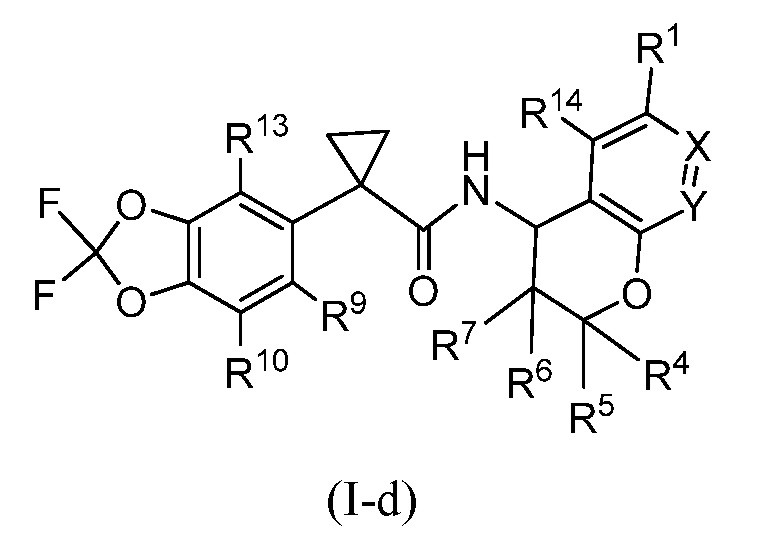


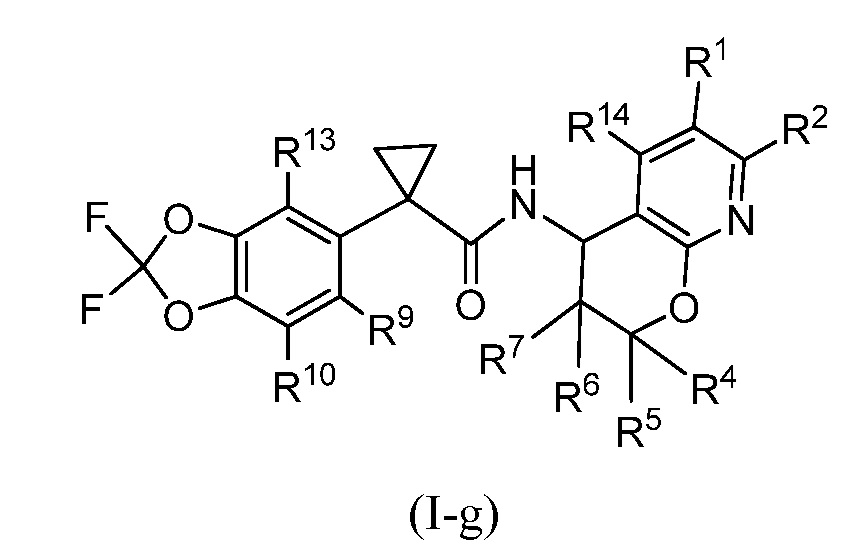



Документы, цитированные в отчёте о поиске
Модуляторы атф-связывающих кассетных транспортеров

Комментарии