Противоопухолевые соединения - RU2493147C2
Код документа: RU2493147C2
Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение касается новых противоопухолевых соединений, содержащих их фармацевтических композиций и их применения в качестве противоопухолевых агентов.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
В работе 1990 Gunasekera SP et al. сообщается о выделении нового полигидроксилированного лактона (+)-дискодермолида из глубоководной карибской губки Discodermia dissoluta (Gunasekera SP et al., J. Org. Chem. 1990, 55, 4912-4915, и J. Org. Chem. 1991, 56, 1346).

(+)-Дискодермолид
Было обнаружено, что это соединение является сильнодействующим антимитотическим агентом (Hung DT et al. Chem. Biol. 1996, 3, 287-293 и ter Haar E et al. Biochemistry 1996, 35, 243-250), способ действия которого аналогичен способу действия клинически доказанного противоракового агента паклитаксела (Schiff PB et al. Nature 1979, 277, 665-667). Оба природных продукта задерживают клеточный цикл на фазе M, промотируют образование микротрубочек и имеют аналогичные ингибирующие эффекты против злокачественной карциномы молочной железы (IC50 2,4 нМ и 2,1 нМ, соответственно).
С другой стороны, выделены некоторые редкие линейные дипептиды, содержащие N-ациленамидную функциональность, из миксобактерий, принадлежащих роду Chondromyces (Kunze B et al., J. Antibiot. 1994, 47, 881-886 и Jansen R et al., J. Org. Chem. 1999, 1085-1089). Конкретно, эти соединения представляют собой крокацины A, B, C и D и образуют группу ингибиторов транспорта электронов.

Крокацин А, R=Me
Крокацин В, R=H
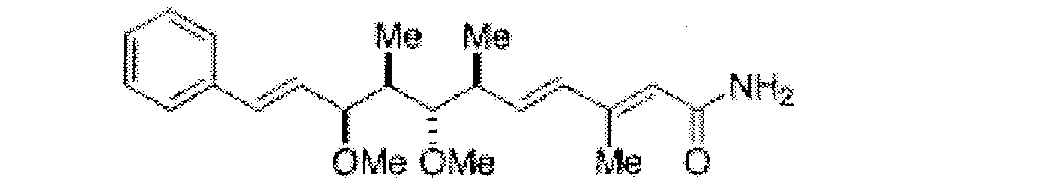
Крокацин С

Крокацин D
Крокацины A-D умеренно ингибируют рост некоторых грамм-положительных бактерий и являются сильнодействующими ингибиторами животных клеточных культур и некоторых дрожжей и грибов. Наиболее активным является крокацин D, который демонстрирует MIC 1,4 нг/мл против гриба Saccharomyces cerevisiae и сильную токсичность (IC50 0,06 мг/л) относительно культуры мышиных фибробластных клеток L929.
В работах Gudasheva et al. (Russian Journal of Bioorganic Chemistry, 2007, 44(4), 413-420 и Pharmaceutical Chemistry Journal, 2006, 40(7), 367-372) сообщается о модели дипептидных соединений на основе структуры эндогенного тетрапептида холесцистокинина-4 (CCK-4). В этом отношении, раскрыто, что производные L-триптофана демонстрируют анксиолитические свойства, и производные D-триптофана демонстрируют анксиогенные свойства. Два раскрытых Gudasheva et al. дипептидных соединения представляют собой следующие:
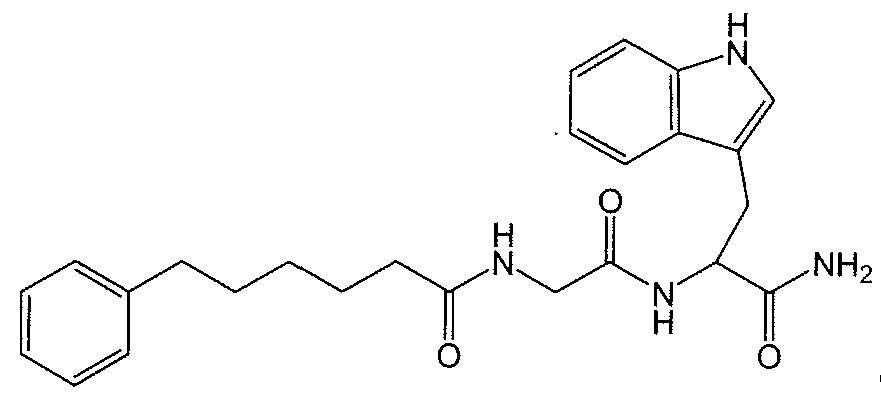
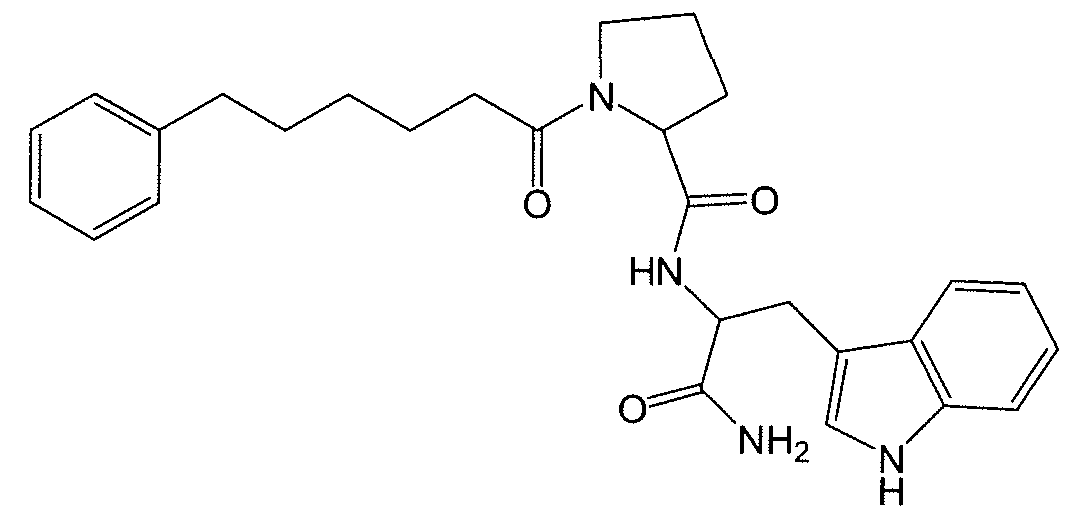
и в качестве промежуточных продуктов в синтезе соединений R и U раскрыты следующие соединения:




Рак является главной причиной смерти животных и людей. Огромные усилия предпринимались и все еще предпринимаются для получения противоопухолевого агента, активного и безопасного для введения пациентам, страдающим от рака. Проблемой, которую должно решить настоящее изобретение, является создание соединений, которые пригодны при лечении рака.
КРАТКОЕ СОДЕРЖАНИЕ ИЗОБРЕТЕНИЯ
В одном аспекте настоящее изобретение касается соединений общей формулы I или их фармацевтически приемлемых солей, таутомеров, пролекарств или стереоизомеров.
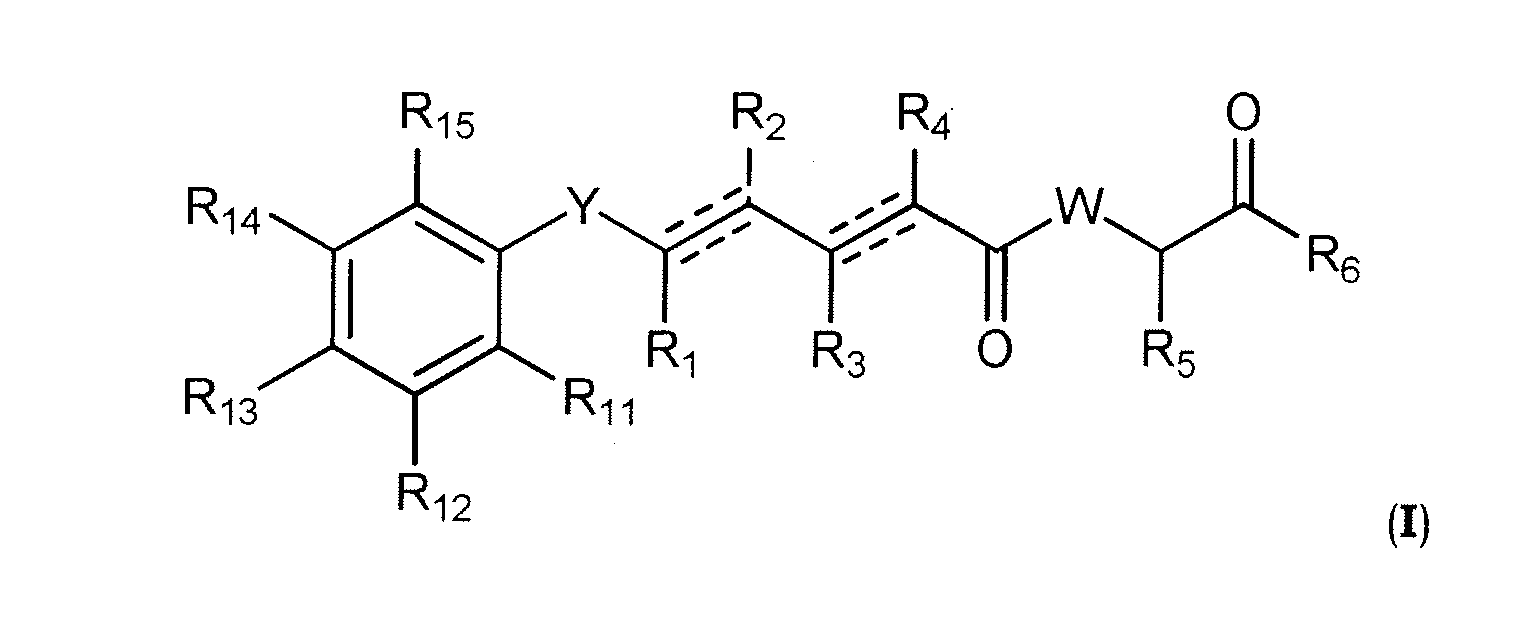
где Y выбран из -CHRay-, -CHRay-CHRby-, -CRay=CRby-, -C≡C-, -CHRay-CHRby-CHRcy-, -CHRay-CRby=CRcy- и -CHRay-C≡C-;
каждый Ray, Rby и Rcy независимо выбран из атома водорода, замещенного или незамещенного C1-C12 алкила, замещенного или незамещенного C2-C12алкенила и замещенного или незамещенного C2-C12алкинила;
каждый R1, R2, R3, R4 и R5 независимо выбран из атома водорода, замещенного или незамещенного C1-C12 алкила, замещенного или незамещенного C2-C12алкенила и замещенного или незамещенного C2-C12алкинила;
R6 выбран из NR8R9 и OR10;
W выбран из O и NR7;
R7 выбран из атома водорода, CORa, COORa, замещенного или незамещенного C1-C12 алкила, замещенного или незамещенного C2-C12алкенила и замещенного или незамещенного C2-C12алкинила; или R7 и R5 вместе с соответствующими атомами N и C, к которым они присоединены, могут образовывать замещенную или незамещенную гетероциклическую группу;
R8 выбран из атома водорода, CORa, COORa, замещенного или незамещенного C2-C12алкенила, замещенного или незамещенного C2-C12алкинила и замещенного или незамещенного C4-C12алкенинила;
R10 выбран из атома водорода, замещенного или незамещенного C2-C12 алкенила и замещенного или незамещенного C2-C12алкинила;
каждая пунктирная линия представляет необязательную дополнительную связь при условии, что присутствует одна или более дополнительных связей, но когда имеется тройная связь между атомами C, к которым присоединены R1 и R2, то R1 и R2 отсутствуют, и если имеется тройная связь между атомами C, к которым присоединены R3 и R4, то R3 и R4 отсутствуют;
R9 выбран из атома водорода, CORa, COORa, замещенного или незамещенного C2-C12алкенила, замещенного или незамещенного C2-C12алкинила и замещенного или незамещенного C4-C12алкенинила;
каждый R11, R12, R13, R14 и R15 независимо выбран из следующих групп: атом водорода, галоген, ORa, CORa, COORa, OCORa, OCOORa, OCONRaRb, CONRaRb, OS(O)Ra, OSO2Ra, OP(O)(Ra)ORb, OSiRaRbRc, NRaRb, NRaCORb, NRaCONRaRb, NRaS(O)Rb, NRaSO2Rb, NRaC(=NRa)NRaRb, SRa, S(O)Ra, SO2Ra, S(O)NRaRb, SO2NRaRb, S(O)ORa, SO2ORa, замещенный или незамещенный C1-C12алкил, замещенный или незамещенный C2-C12алкенил и замещенный или незамещенный C2-C12 алкинил; и каждый
Ra, Rb и Rc независимо выбран из следующих групп: атом водорода, замещенный или незамещенный C1-C12 алкил, замещенный или незамещенный C2-C12алкенил, замещенный или незамещенный C2-C12алкинил, замещенный или незамещенный арил и замещенная или незамещенная гетероциклическая группа.
В другом аспекте настоящее изобретение также касается соединения формулы I или его фармацевтически приемлемой соли, таутомера, пролекарства или стереоизомера для применения в качестве лекарственного средства.
В другом аспекте настоящее изобретение также касается соединения формулы I или его фармацевтически приемлемой соли, таутомера, пролекарства или стереоизомера для применения в качестве лекарственного средства для лечения рака.
Еще в одном аспекте настоящее изобретение также касается применения соединений формулы I или их фармацевтически приемлемых солей, таутомеров, пролекарств или стереоизомеров при лечении рака или при получении лекарственного средства для лечения рака.
Другие аспекты данного изобретения касаются способов лечения и соединений для применения в этих способах. Таким образом, настоящее изобретение также касается способа лечения любого млекопитающего, в особенности, человека, страдающего от рака, который включает введение страдающему индивидууму терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли, таутомера, пролекарства или стереоизомера.
Еще в одном аспекте настоящее изобретение также касается соединения формулы I или его фармацевтически приемлемой соли, таутомера, пролекарства или стереоизомера для применения в качестве противоракового агента.
В другом аспекте настоящее изобретение касается фармацевтических композиций, содержащих соединение формулы I или его фармацевтически приемлемую соль, таутомер, пролекарство или стереоизомер вместе с фармацевтически приемлемым носителем или разбавителем.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ
Настоящее изобретение касается соединений общей формулы I, которые определены выше.
В этих соединениях группы могут быть выбраны в соответствии со следующим указанием:
алкильные группы могут быть разветвленными или неразветвленными и предпочтительно имеют от 1 до примерно 12 атомов углерода. Один более предпочтительный класс алкильных групп имеет от 1 до примерно 6 атомов углерода. Еще более предпочтительны алкильные группы, имеющие 1, 2, 3 или 4 атомов углерода. Особо предпочтительными алкильными группами в соединениях по настоящему изобретению являются метил, этил, пропил, изопропил и бутил, в том числе трет-бутил, втор-бутил и изобутил. Другой предпочтительный класс алкильных групп имеет от 6 до примерно 10 атомов углерода; и еще более предпочтительно 7, 8 или 9 атомов углерода. Наиболее предпочтительными алкильными группами этого класса являются гептил, октил и нонил.
Предпочтительные алкенильные и алкинильные группы в соединениях по настоящему изобретению могут быть разветвленными или неразветвленными и имеют одну или более ненасыщенных связей и от 2 до примерно 12 атомов углерода. Один более предпочтительный класс алкенильных и алкинильных групп имеет от 2 до примерно 6 атомов углерода. Еще более предпочтительны алкенильные и алкинильные группы, имеющие 2, 3 или 4 атома углерода. Другой предпочтительный класс алкенильных и алкинильных групп имеет от 4 до примерно 10 атомов углерода, более предпочтительно от 6 до примерно 10 атомов углерода; и еще более предпочтительно 7, 8 или 9 атомов углерода.
Заявители определяют алкенинильную группу как алкильную группу, содержащую одну или более двойных связей и одну или более тройных связей, и предпочтительными алкенинильными группами являются группы, имеющие от 4 до примерно 12 атомов углерода. Один более предпочтительный класс алкенинильных групп имеет от 6 до примерно 10 атомов углерода.
Подходящие арильные группы в соединениях по настоящему изобретению включают соединения с одним или несколькими циклами, в том числе соединения с несколькими циклами, которые содержат отдельные и/или конденсированные арильные группы. Типичные арильные группы содержат от 1 до 3 отдельных или конденсированных циклов и от 6 до примерно 18 кольцевых атомов углерода. Предпочтительно, если арильные группы содержат от 6 до примерно 10 кольцевых атомов углерода. Особо предпочтительные арильные группы включают замещенный или незамещенный фенил, замещенный или незамещенный нафтил, замещенный или незамещенный бифенил, замещенный или незамещенный фенантрил и замещенный или незамещенный антрил.
Подходящие гетероциклические группы включают гетероароматические и гетероалициклические группы, содержащие от 1 до 3 отдельных или конденсированных циклов и от 5 до примерно 18 кольцевых атомов. Предпочтительно, если гетероароматические и гетероалициклические группы содержат от 5 до примерно 10 кольцевых атомов, наиболее предпочтительно 5, 6 или 7 кольцевых атомов. Подходящие гетероароматические группы в соединениях по настоящему изобретению содержат один, два или три гетероатома, выбранных из атомов N, O или S, и включают, например, кумаринил, в том числе 8-кумаринил, хинолил, в том числе 8-хинолил, изохинолил, пиридил, пиразинил, пиразолил, пиримидинил, фурил, пирролил, тиенил, тиазолил, изотиазолил, триазолил, тетразолил, изоксазолил, оксазолил, имидазолил, индолил, изоиндолил, индазолил, индолизинил, фталазинил, птеридинил, пуринил, оксадиазолил, тиадиазолил, фуразанил, пиридазинил, триазинил, циннолинил, бензимидазолил, бензофуранил, бензофуразанил, бензотиофенил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтиридинил и фуропиридил. Подходящие гетероалициклические группы в соединениях по настоящему изобретению содержат один, два или три гетероатома, выбранных из атомов N, O или S и включают, например, пирролидинил, тетрагидрофуранил, дигидрофуранил, тетрагидротиенил, тетрагидротиопиранил, пиперидил, морфолинил, тиоморфолинил, тиоксанил, пиперазинил, азетидинил, оксетанил, тиетанил, гомопиперидил, оксепанил, тиепанил, оксазепинил, диазепинил, тиазепинил, 1,2,3,6-тетрагидропиридил, 2-пирролинил, 3-пирролинил, индолинил, 2H-пиранил, 4H-пиранил, диоксанил, 1,3-диоксоланил, пиразолинил, дитианил, дитиоланил, дигидропиранил, дигидротиенил, дигидрофуранил, пиразолидинил, имидазолинил, имидазолидинил, 3-азабицикло[3.1.0]гексил, 3-азабицикло[4.1.0]гептил, 3H-индолил и хинолизинил.
Упоминаемые выше группы могут быть замещенными по одному или большему количеству доступных положений одной или большим количеством подходящих групп, таких как OR', =O, SR', SOR', SO2R', NO2, NHR', NR'R', =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR', OCOR', OCONHR', OCONR'R', CONHR', CONR'R', защищенная OH, замещенный или незамещенный C1-C12алкил, замещенный или незамещенный C2-C12алкенил, замещенный или незамещенный C2-C12алкинил, замещенный или незамещенный арил и замещенная или незамещенная гетероциклическая группа, где каждая из групп R' независимо выбрана из группы, включающей атом водорода, OH, NO2, NH2, SH, CN, галоген, COH, COалкил, CO2H, замещенный или незамещенный C1-C12алкил, замещенный или незамещенный C2-C12алкенил, замещенный или незамещенный C2-C12 алкинил, замещенный или незамещенный арил и замещенную или незамещенную гетероциклическую группу. В тех случаях, когда сами такие группы являются замещенными, заместители могут быть выбраны из приведенного выше списка.
Подходящие галогеновые заместители в соединениях по настоящему изобретению включают F, Cl, Br и I.
Подходящие защитные группы для OH хорошо известны специалистам в данной области. Широкий обзор защитных групп в органической химии дан Wuts, PGM и Greene TW в работах Protecting Groups in Organic Synthesis, 4-е издание, Wiley-Interscience, и Kocienski PJ в Protecting Groups, 3-е издание, Georg Thieme Verlag. В этих работах приведены разделы по защитным группам для OH. Все эти работы включены в виде ссылок во всей своей полноте. Примеры таких защищенных OH включают простые эфиры, силиловые простые эфиры, сложные эфиры, сульфонаты, сульфенаты и сульфинаты, карбонаты и карбаматы. В случае простых эфиров защитная группа для OH может быть выбрана из следующих групп: метил, метоксиметил, метилтиометил, (фенилдиметилсилил)метоксиметил, бензилоксиметил, п-метоксибензилоксиметил, [(3,4-диметоксибензил)окси]метил, п-нитробензилоксиметил, о-нитробензилоксиметил, [(R)-1-(2-нитрофенил)этокси]метил, (4-метоксифенокси)метил, гваяколметил, [(пара-фенилфенил)окси]метил, трет-бутоксиметил, 4-пентенилоксиметил, силоксиметил, 2-метоксиэтоксиметил, 2-цианоэтоксиметил, бис(2-хлорэтокси)метил, 2,2,2-трихлорэтоксиметил, 2-(триметилсилил)этоксиметил, метоксиметил, о-бис(2-ацетоксиэтокси)метил, тетрагидропиранил, фтористый тетрагидропиранил, 3-бромтетрагидропиранил, тетрагидротиопиранил, 1-метоксициклогексил, 4-метокситетрагидропиранил, 4-метокситетрагидротиопиранил, 4-метокситетрагидротиопиранил S,S-диоксид, 1-[{2-хлор-4-метил)фенил]-4-метоксипиперидин-4-ил, 1-(2-фторфенил)-4-метоксипиперидин-4-ил, 1-(4-хлорфенил)-4-метоксипиперидин-4-ил, 1,4-диоксан-2-ил, тетрагидрофуранил, тетрагидротиофуранил, 2,3,3a,4,5,6,7,7a-октагидро-7,8,8-триметил-4,7-метанобензофуран-2-ил, 1-этоксиэтил, 1-(2-хлорэтокси)этил, 2-гидроксиэтил, 2-бромэтил, 1-[2-(триметилсилил)этокси]этил, 1-метил-1-метоксиэтил, 1-метил-1-бензилоксиэтил, 1-метил-1-бензилокси-2-фторэтил, 1-метил-1-феноксиэтил, 2,2,2-трихлорэтил, 1,1-дианизил-2,2,2-трихлорэтил, 1,1,1,3,3,3-гексафтор-2-фенилизопропил, 1-(2-цианоэтокси)этил, 2-триметилсилилэтил, 2-(бензилтио)этил, 2-фенилселенилэтил, трет-бутил, циклогексил, 1-метил-1'-циклопропилметил, аллил, пренил, циннамил, 2-феналлил, пропаргил, п-хлорфенил, п-метоксифенил, п-нитрофенил, 2,4-динитрофенил, 2,3,5,6-тетрафтор-4-(трифторметил)фенил, бензил, п-метоксибензил, 3,4-диметоксибензил, 2,6-диметоксибензил, о-нитробензил, п-нитробензил, пентадиенилнитробензил, пентадиенилнитропиперонил, галогенбензил, 2,6-дихлорбензил, 2,4-дихлорбензил, 2,6-дифторбензил, п-цианобензил, фтористый бензил, 4-фторалкоксибензил, триметилсилилксилил, п-фенилбензил, 2-фенил-2-пропил, п-ациламинобензил, п-азидобензил, 4-азидо-3-хлорбензил, 2-трифторметилбензил, 4-трифторметилбензил, п-(метилсульфинил)бензил, п-силетанилбензил, 4-ацетоксибензил, 4-(2-триметилсилил)этоксиметоксибензил, 2-нафтилметил, 2-пиколил, 4-пиколил, 3-метил-2-пиколил N-оксидо, 2-хинолинилметил, 6-метокси-2-(4-метилфенил-4-хинолинметил, 1-пиренилметил, дифенилметил, 4-метоксидифенилметил, 4-фенилдифенилметил, п,п'-динитробензгидрил, 5-дибензосуберил, трифенилметил, трис(4-трет-бутилфенил)метил, α-нафтилдифенилметил, п-метоксифенилдифенилметил, ди(п-метоксифенил)фенилметил, три(п-метоксифенил)метил, 4-(4'-бромфенацилокси)фенилдифенилметил, 4,4',4”-трис(4,5-дихлорфталимидофенил)метил, 4,4',4"-трис(левулиноилоксифенил)метил, 4,4',4"-трис(бензоилоксифенил)метил, 4,4'-диметокси-3”-[N-(имидазолилметил)]тритил, 4,4'-диметокси-3”-[N-(имидазолилэтил)карбамоил]тритил, бис(4-метоксифенил)-1'-пиренилметил, 4-(17-тетрабензо[a,c,g,i]флуоренилметил)-4,4”-диметокситритил, 9-антрил, 9-(9-фенил)ксантенил, 9-фенилтиоксантил, 9-(9-фенил-10-оксо)антрил, 1,3-бензодитиолан-2-ил и 4,5-бис(этоксикарбонил)-[1,3]-диоксолан-2-ил, бензизотиазолил S,S-диоксидо. В случае силиловых простых эфиров защитная группа для OH может быть выбрана из следующих групп: триметилсилил, триэтилсилил, триизопропилсилил, диметилизопропилсилил, диэтилизопропилсилил, диметилгексилсилил, 2-норборнилдиметилсилил, трет-бутилдиметилсилил, трет-бутилдифенилсилил, трибензилсилил, три-п-ксилилсилил, трифенилсилил, дифенилметилсилил, ди-трет-бутилметилсилил, бис(трет-бутил)-1-пиренилметоксисилил, трис(триметилсилил)силил, (2-гидроксистирил)диметилсилил, (2-гидроксистирил)диизопропилсилил, трет-бутилметоксифенилсилил, трет-бутоксидифенилсилил, 1,1,3,3-тетраизопропил-3-[2-(трифенилметокси)этокси]дисилоксан-1-ил и фторсилил. В случае сложных эфиров защитная группа для OH может быть выбрана из следующих групп: формиат, бензоилформиат, ацетат, хлорацетат, дихлорацетат, трихлорацетат, трихлорацетамидат, трифторацетат, метоксиацетат, трифенилметоксиацетат, феноксиацетат, п-хлорфеноксиацетат, фенилацетат, дифенилацетат, 3-фенилпропионат, бисфторпропаноил, 4-пентеноат, 4-оксопентаноат, 4,4-(этилендитио)пентаноат, 5-[3-бис(4-метоксифенил)гидроксиметилфенокси]левулинат, пивалоат, 1-адамантоат, кротонат, 4-метоксикротонат, бензоат, п-фенилбензоат, 2,4,6-триметилбензоат, 4-бромбензоат, 2,5-дифторбензоат, п-нитробензоат, пиколинат, никотинат, 2-(азидометил)бензоат, 4-азидобутират, (2-азидометил)фенилацетат, 2-{[(тритилтио)окси]метил}бензоат, 2-{[(4-метокситритилтио)окси]метил}бензоат, 2-{[метил(тритилтио)амино]метил}бензоат, 2-{{[(4-метокситритил)тио]метиламино}метил}бензоат, 2-(аллилокси)фенилацетат, 2-(пренилоксиметил)бензоат, 6-(левулинилоксиметил)-3-метокси-2-нитробензоат, 6-(левулинилоксиметил)-3-метокси-4-нитробензоат, 4-бензилоксибутират, 4-триалкилсилилоксибутират, 4-ацетокси-2,2-диметилбутират, 2,2-диметил-4-пентеноат,2-йодбензоат, 4-нитро-4-метилпентаноат, o-(дибромметил)бензоат, 2-формилбензолсульфонат, 4-(метилтиометокси)бутират, 2-(метилтиометоксиметил)бензоат, 2-(хлорацетоксиметил)бензоат, 2-[(2-хлорацетокси)этил]бензоат, 2-[2-(бензилокси)этил]бензоат, 2-[2-(4-метоксибензилокси)этил]бензоат, 2,6-дихлор-4-метилфеноксиацетат, 2,6-дихлор-4-(1,1,3,3-тетраметилбутил)феноксиацетат, 2,4-бис(1,1-диметилпропил)феноксиацетат, хлордифенилацетат, изобутират, моносукциноат, (E)-2-метил-2-бутеноат, о-(метоксикарбонил)бензоат, α-нафтоат, нитрат, алкил N,N,N',N'-тетраметилфосфордиамидат и 2-хлорбензоат. В случае сульфонатов, сульфенатов и сульфинатов защитная группа для OH может быть выбрана из следующих групп: сульфат, аллилсульфонат, метансульфонат, бензилсульфонат, тозилат, 2-[(4-нитрофенил)этил]сульфонат, 2-трифторметилбензолсульфонат, 4-монометокситритилсульфенат, алкил 2,4-динитрофенилсульфенат, 2,2,5,5-тетраметилпирролидин-3-он-1-сульфинат, борат и диметилфосфинотиолил. В случае карбонатов защитная группа для OH может быть выбрана из следующих групп: метилкарбонат, метоксиметилкарбонат, 9-флуоренилметилкарбонат, этилкарбонат, бромэтилкарбонат, 2-(метилтиометокси)этилкарбонат, 2,2,2-трихлорэтилкарбонат, 1,1-диметил-2,2,2-трихлорэтилкарбонат, 2-(триметилсилил)этилкарбонат, 2-[диметил(2-нафтилметил)силил]этилкарбонат, 2-(фенилсульфонил)этилкарбонат, 2-(трифенилфосфонио)этилкарбонат, цис-[4-[[(метокситритил)сульфенил)окси]тетрагидрофуран-3-ил]оксикарбонат, изобутилкарбонат, трет-бутилкарбонат, винилкарбонат, аллилкарбонат, циннамилкарбонат, пропаргилкарбонат, п-хлорфенилкарбонат, п-нитрофенилкарбонат, 4-этокси-1-нафтилкарбонат, 6-бром-7-гидроксикумарин-4-илметилкарбонат, бензилкарбонат, о-нитробензилкарбонат, п-нитробензилкарбонат, п-метоксибензилкарбонат, 3,4-диметоксибензилкарбонат, антрахинон-2-илметилкарбонат, 2-дансилэтилкарбонат, 2-(4-нитрофенил)этилкарбонат, 2-(2,4-динитрофенил)этилкарбонат, 2-(2-нитрофенил)пропилкарбонат, алкил 2-(3,4-метилендиокси-6-нитрофенил)пропилкарбонат, 2-циано-1-фенилэтилкарбонат, 2-(2-пиридил)амино-1-фенилэтилкарбонат, 2-[N-метил-N-(2-пиридил)]амино-1-фенилэтилкарбонат, фенацилкарбонат, 3',5'-диметоксибензоинкарбонат, метилдитиокарбонат и S-бензилтиокарбонат. И в случае карбаматов защитная группа для OH может быть выбрана из диметилтиокарбамата, N-фенилкарбамата, N-метил-N-(o-нитрофенил)карбамата. Упоминание этих групп не следует интерпретировать как ограничение области изобретения, так как они упоминаются только в качестве иллюстрации защитных групп для OH, но специалистам в данной области могут быть известны дополнительные группы, обладающие указанной функцией, и следует понимать, что они также включены в настоящее изобретение.
Выражение "фармацевтически приемлемые соли, пролекарства" касается любой фармацевтически приемлемой соли, сложного эфира, сольвата, гидрата или любого другого соединения, которое после введения пациенту способно обеспечить (прямо или косвенно) соединение, которое здесь описано. Однако следует принять во внимание, что соли, не являющиеся фармацевтически приемлемыми, также попадают в область изобретения, так как они могут быть полезны при получении фармацевтически приемлемых солей. Получение солей и пролекарств можно осуществить способами, известными в данной области.
Например, фармацевтически приемлемые соли приведенных в описании соединений синтезируют общеизвестными химическими способами из исходного соединения, которое содержит основный или кислотный фрагмент. Обычно такие соли получают, например, взаимодействием свободных кислотных или основных форм этих соединений со стехиометрическим количеством подходящего основания или кислоты в воде или органическом растворителе или в смеси обоих растворителей. Обычно предпочтительными являются неводные среды, такие как эфир, этилацетат, этанол, изопропанол или ацетонитрил. Примеры кислотно-аддитивных солей включают аддитивные соли минеральных кислот, такие как, например, гидрохлорид, гидробромид, гидройодид, сульфат, нитрат, фосфат и аддитивные соли органических кислот, такие как, например, ацетат, трифторацетат, малеат, фумарат, цитрат, оксалат, сукцинат, тартрат, малат, манделат, метансульфонат и п-толуолсульфонат. Примеры аддитивных солей щелочей включают неорганические соли, такие как, например, соли натрия, калия, кальция и аммония и органические соли щелочей, такие как, например, соли этилендиамина, этаноламина, N,N-диалкиленэтаноламина, триэтаноламина и основные соли аминокислот.
Соединения по изобретению могут представлять собой свободные соединения или сольваты (например, гидраты) в кристаллическом виде, и предполагается, что обе формы входят в область настоящего изобретения. Методы сольватации обычно известны в данной области.
Любое соединение, которое является пролекарством соединения формулы I, соответствует области и духу изобретения. Используемое в данной заявке выражение "пролекарство" определено в описании как химическое соединение, подвергающееся химическому преобразованию, такому как замещение или добавление дополнительной химической группы, для изменения (с целью фармацевтического применения) некоторого из его физико-химических свойств, таких как растворимость или биодоступность, например, сложноэфирные и эфирные производные активного соединения, которые дают активное соединение как таковое после введения субъекту. Примеры хорошо известных способов получения пролекарств данного действующего соединения известны специалистам в данной области и могут быть обнаружены, например, в работе Krogsgaard-Larsen et al., Textbook of Drugdesign and Discovery, Taylor & Francis (April 2002).
Предполагается, что любое указанное в описании соединение представляет собой такое специфическое соединение, а также некоторые его вариации и формы. В частности, указанные в описании соединения могут иметь асимметрические центры и, следовательно, существовать в различных энантиомерных формах. Все оптические изомеры и стереоизомеры упоминаемых в описании соединений и их смеси считаются входящими в область настоящего изобретения. Таким образом, предполагается, что любое данное соединение, упоминаемое в описании, представляет собой рацемат или одну или более энантиомерных форм, одну или более диастереомерных форм, одну или более атропоизомерных форм или их смесь. В частности, соединения по настоящему изобретению, представленные описанной выше формулой I, могут включать энантиомеры, в зависимости от их асимметрии или диастереоизомеры. Возможна также стереоизомерия вокруг двойной связи, следовательно, в некоторых случаях молекула может существовать в виде (E)-изомера или {Z)-изомера. Если молекула содержит несколько двойных связей, то каждая двойная связь будет иметь собственную стереоизомерию, которая может быть такой же, как стереоизомерия других двойных связей молекулы, или отличаться. Отдельные изомеры и смеси изомеров попадают в область настоящего изобретения.
Кроме того, упоминаемые в описании соединения могут существовать в виде геометрических изомеров (например, цис- и транс-изомеров), таутомеров или атропоизомеров. Конкретно, выражение «таутомер» относится к одному из двух или большего количества структурных изомеров соединения, которые существуют в равновесии и легко превращаются из одной изомерной формы в другую. Обычными таутомерными парами являются амин-имин, амид-имид, кето-енол, лактам-лактим и др. Кроме того, предполагается, что любое упоминаемое в описании соединение представляет собой гидраты, сольваты, полиморфы и их смеси, если такие формы существуют в среде. Кроме того, упоминаемые в описании соединения могут существовать в виде изотопно меченных форм. Все геометрические изомеры, таутомеры, атропоизомеры, гидраты, сольваты, полиморфы и изотопно меченные формы упоминаемых в описании соединений и их смеси считаются включенными в область настоящего изобретения.
Для получения более краткого описания некоторые данные в описании количественные выражения не определяют с использованием выражения "примерно". Используется ли выражение "примерно" явно или нет, понятно, что каждое данное в описании количество, как считается, обозначает фактически данное значение, а также приближение к такому данному значению, которое специалист в данной области разумно подразумевает для такого данного значения (включая эквиваленты и приближения), исходя из условий эксперимента и/или измерения.
В соединениях общей формулы I особо предпочтительными Y являются -CHRay-, -CRay=CRby- и -CHRay-CRby=CRcy-, где Ray, Rby и Rcy такие, как определено выше.
Особо предпочтительными Ray, Rby и Rcy являются атом водорода и замещенный или незамещенный C1-C12алкил. Более предпочтительными Ray, Rby и Rcy являются атом водорода и замещенный или незамещенный C1-C6 алкил, и еще более предпочтительны атом водорода, замещенный или незамещенный метил, замещенный или незамещенный этил, замещенный или незамещенный пропил, замещенный или незамещенный изопропил и замещенный или незамещенный бутил, в том числе замещенный или незамещенный трет-бутил, замещенный или незамещенный изобутил и замещенный или незамещенный втор-бутил. Предпочтительными заместителями указанных групп являются OR', =O, SR', SOR', SO2R', NO2, NHR', NR'R', =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR', OCOR', OCONHR', OCONR'R', CONHR', CONR'R', защищенная OH, замещенный или незамещенный C1-C12 алкил, замещенный или незамещенный C2-C12 алкенил, замещенный или незамещенный C2-C12алкинил, замещенный или незамещенный арил и замещенная или незамещенная гетероциклическая группа, где каждая из групп R' независимо выбрана из группы, включающей атом водорода, OH, NO2, NH2, SH, CN, галоген, COH, COалкил, COOH, замещенный или незамещенный C1-C12 алкил, замещенный или незамещенный C2-C12 алкенил, замещенный или незамещенный C2-C12алкинил, замещенный или незамещенный арил и замещенную или незамещенную гетероциклическую группу. В тех случаях, когда сами такие группы являются замещенными, заместители могут быть выбраны из приведенного выше списка. Еще более предпочтительными заместителями упоминаемых выше групп являются OH, SCH3, SH, NH2, NHC(=NH)NH2, CONH2, COOH, фенил, п-, м- или о-гидроксифенил, индолил, в том числе 1-, 2- и 3-индолил, и имидазолил, в том числе 4- и 5-имидазолил. Атом водорода и метил являются наиболее предпочтительными группами Ray, Rby и Rcy. Конкретно, если Y обозначает -CHRay-, то особо предпочтительным Ray является метил, если Y обозначает -CRay=CRby-, то особо предпочтительным Ray является атом водорода и особо предпочтительным Rby является метил, и если Y обозначает -CHRay-CRby=CRcy-, то особо предпочтительным Ray является атом водорода или метил, особо предпочтительным Rbyявляется атом водорода и особо предпочтительным Rcy является метил.
Особо предпочтительными R1, R2, R3, R4 и R5 являются атом водорода и замещенный или незамещенный C1-C12алкил. Более предпочтительными R1, R2, R3, R4 и R5 являются атом водорода и замещенный или незамещенный C1-C6 алкил, и еще более предпочтительны атом водорода, замещенный или незамещенный метил, замещенный или незамещенный этил, замещенный или незамещенный пропил, замещенный или незамещенный изопропил и замещенный или незамещенный бутил, в том числе замещенный или незамещенный трет-бутил, замещенный или незамещенный изобутил и замещенный или незамещенный втор-бутил. Предпочтительными заместителями указанных групп являются OR', =O, SR', SOR', SO2R', NO2, NHR', NR'R', =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR', OCOR', OCONHR', OCONR'R', CONHR', CONR'R', защищенная OH, замещенный или незамещенный C1-C12алкил, замещенный или незамещенный C2-C12 алкенил, замещенный или незамещенный C2-C12алкинил, замещенный или незамещенный арил и замещенная или незамещенная гетероциклическая группа, где каждая из групп R' независимо выбрана из группы, включающей атом водорода, OH, NO2, NH2, SH, CN, галоген, COH, COалкил, COOH, замещенный или незамещенный C1-C12алкил, замещенный или незамещенный C2-C12алкенил, замещенный или незамещенный C2-C12алкинил, замещенный или незамещенный арил и замещенную или незамещенную гетероциклическую группу. В тех случаях, когда сами такие группы являются замещенными, заместители могут быть выбраны из приведенного выше списка. Еще более предпочтительными заместителями упоминаемых выше групп являются OH, SCH3, SH, NH2, NHC(=NH)NH2, CONH2, COOH, фенил, п-, м- или о-гидроксифенил, индолил, в том числе 1-, 2- и 3-индолил и имидазолил, в том числе 4- и 5-имидазолил. Атом водорода, метил, изопропил, трет-бутил и бензил являются наиболее предпочтительными R1, R2, R3, R4 и R5 группами. Конкретно, особо предпочтительными R1, R2, R3 и R4 являются атомы водорода и особо предпочтительными R5 являются метил, изопропил и трет-бутил.
Особо предпочтительным W является NR7, где R7 такой, как определено ранее. Особо предпочтительными R7 являются атом водорода и замещенный или незамещенный C1-C12алкил. Более предпочтительными R7являются атом водорода и замещенный или незамещенный C1-C6алкил; и еще более предпочтительны атом водорода, метил, этил, пропил, изопропил и бутил, в том числе трет-бутил. Наиболее предпочтительным является атом водорода.
В другом варианте особо предпочтительно, если R7 и R5 вместе с соответствующим атомом N и атомом C, к которым они присоединены, образуют замещенную или незамещенную гетероциклическую группу. В этом отношении предпочтительной гетероциклической группой является гетероалициклическая группа, содержащая один, два или три гетероатома, выбранных из атомов N, O или S, наиболее предпочтительно один атом N, и имеющая от 5 до примерно 10 кольцевых атомов, наиболее предпочтительно 5, 6 или 7 кольцевых атомов. Наиболее предпочтительной является пирролидиновая группа.
Особо предпочтительными R6 являются NR8R9 и OR10, где R8, R9 и R10 такие, как определено выше, и еще более предпочтительным R6 является NR8R9.
Особо предпочтительным R5 является атом водорода.
Особо предпочтительными R9 являются атом водорода, замещенный или незамещенный C2-C12алкенил, замещенный или незамещенный C2-C12алкинил и замещенный или незамещенный C4-C12алкенинил. Предпочтительный замещенный алкенил, замещенный алкинил и замещенный алкенинил могут представлять не только один, но два или более заместителей. Более предпочтительными алкенильными группами являются группы, имеющие от 6 до примерно 10 атомов углерода; и еще более предпочтительно 7, 8 или 9 атомов углерода. Наиболее предпочтительными алкенильными группами являются окта-1,6-диенил, окта-1,5-диенил, окта-1,4-диенил, окта-1,3-диенил, нона-1,7-диенил, нона-1,6-диенил, нона-1,5-диенил, нона-1,4-диенил, нона-1,3-диенил, гепта-1,5-диенил, гепта-1,4-диенил, гепта-1,3-диенил. С другой стороны, более предпочтительными алкинильными группами являются группы, имеющие от 6 до примерно 10 атомов углерода; и еще более предпочтительно 7, 8 или 9 атомов углерода. Наиболее предпочтительными алкинильными группами являются окт-7-инил, окт-6-инил, окт-5-инил, окт-4-инил, окт-3-инил, окт-2-инил, окт-1-инил, нон-8-инил, нон-7-инил, нон-6-инил, нон-5-инил, нон-4-инил, нон-3-инил, нон-2-инил, нон-1-инил, гепт-6-инил, гепт-5-инил, гепт-4-инил, гепт-3-инил, гепт-2-инил и гепт-1-инил. С другой стороны, более предпочтительными алкенинильными группами являются группы, имеющие от 6 до примерно 10 атомов углерода; и еще более предпочтительно 7, 8 или 9 атомов углерода. Наиболее предпочтительными алкенинильными группами являются окт-1-ен-7-инил, окт-1-ен-6-инил, окт-1-ен-5-инил, окт-1-ен-4-инил, окт-1-ен-3-инил, нон-1-ен-8-инил, нон-1-ен-7-инил, нон-1-ен-5-инил, нон-1-ен-5-инил, нон-1-ен-4-инил, нон-1-ен-3-инил, гепт-1-ен-6-инил, гепт-1-ен-5-инил, гепт-1-ен-4-инил и гепт-1-ен-3-инил. Предпочтительными заместителями для указанных алкенильных, алкинильных и алкенинильных групп являются OR', =O, SR', SOR', SO2R', NO2, NHR', NR'R', =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR', OCOR', OCONHR', OCONR'R', CONHR', CONR'R', защищенная OH, замещенный или незамещенный C1-C12алкил, замещенный или незамещенный C2-C12алкенил, замещенный или незамещенный C2-C12алкинил, замещенный или незамещенный арил и замещенная или незамещенная гетероциклическая группа, где каждая из групп R' независимо выбрана из группы, включающей атом водорода, OH, NO2, NH2, SH, CN, галоген, COH, COалкил, COOH, замещенный или незамещенный C1-C12алкил, замещенный или незамещенный C2-C12алкенил, замещенный или незамещенный C2-C12алкинил, замещенный или незамещенный арил и замещенную или незамещенную гетероциклическую группу. В тех случаях, когда сами такие группы являются замещенными, заместители могут быть выбраны из приведенного выше списка. Более предпочтительными заместителями для упоминаемых выше алкенильных, алкинильных и алкенинильных групп являются галоген, OR', =O, OCOR', OCONHR', OCONR'R', CONHR', CONR'R' и защищенная OH, где каждая из групп R' предпочтительно выбрана из атома водорода, замещенный или незамещенный C1-C12алкил, замещенный или незамещенный C2-C12алкенил, замещенный или незамещенный C2-C12алкинил и замещенный или незамещенный арил. Еще более предпочтительными заместителями для этих алкенильных, алкинильных и алкенинильных групп являются галоген, OR', =O, OCONHR', OCONR'R', CONHR', CONR'R' и защищенная OH, где защитная группа для OH предпочтительно выбрана из следующих групп: триметилсилил, триэтилсилил, триизопропилсилил, диметилизопропилсилил, диэтилизопропилсилил, диметилгексилсилил, 2-норборнилдиметилсилил, трет-бутилдиметилсилил, трет-бутилдифенилсилил, трибензилсилил, три-п-ксилилсилил, трифенилсилил, дифенилметилсилил, ди-трет-бутилметилсилил, бис(трет-бутил)-1-пиренилметоксисилил, трис(триметилсилил)силил, (2-гидроксистирил)диметилсилил, (2-гидроксистирил)диизопропилсилил, трет-бутилметоксифенилсилил, трет-бутоксидифенилсилил, 1,1,3,3-тетраизопропил-3-[2-(трифенилметокси)этокси]дисилоксан-1-ил и фторсилил, и где каждая из групп R' более предпочтительно выбрана из атома водорода, незамещенного C1-C6 алкила и замещенного или незамещенного арила. Наиболее предпочтительными заместителями для этих алкенильных, алкинильных и алкенинильных групп являются Cl, OH, =O, OCONH2, OCONHфенил и защищенная OH, где защитная группа для OH предпочтительно выбрана из следующих групп: триметилсилил, триэтилсилил, триизопропилсилил, диметилизопропилсилил, диэтилизопропилсилил, диметилгексилсилил, 2-норборнилдиметилсилил, трет-бутилдиметилсилил, трет-бутилдифенилсилил, трибензилсилил, три-п-ксилилсилил, трифенилсилил, дифенилметилсилил, ди-трет-бутилметилсилил, бис(трет-бутил)-1-пиренилметоксисилил, трис(триметилсилил)силил, (2-гидроксистирил)диметилсилил, (2-гидроксистирил)диизопропилсилил, трет-бутилметоксифенилсилил, трет-бутоксидифенилсилил, 1,1,3,3-тетраизопропил-3-[2-(трифенилметокси)этокси]дисилоксан-1-ил и фторсилил.
Особо предпочтительными R11, R12, R13, R14 и R15 являются атом водорода, ORa, OCORa и OSiRaRbRc, где Ra, Rb и Rc такие, как определено выше. Конкретно, особо предпочтительными R11, R14 и R15 являются атомы водорода, особо предпочтительными R12 являются атом водорода и ORa, и особо предпочтительными R13 являются атом водорода, ORa и OSiRaRbRc. Особо предпочтительными Ra, Rb и Rc являются атом водорода и замещенный или незамещенный C1-C12алкил. Еще более предпочтительными Ra, Rb и Rc являются атом водорода и замещенный или незамещенный C1-C6 алкил; и еще более предпочтительны атом водорода, метил, этил, пропил, изопропил и бутил, в том числе трет-бутил, причем наиболее предпочтительны атом водорода, метил и трет-бутил.
Особо предпочтительно наличие одной дополнительной связи между атомами C, к которым присоединены R1 и R2, и наличие одной или двух дополнительных связей между атомами C, к которым присоединены R3 и R4. Кроме того, стереохимия каждой двойной связи может соответствовать (E) или (Z). В область настоящего изобретения включены отдельные изомеры и смеси изомеров.
Более конкретно, предпочтительными соединениями общей формулы I являются также соединения, имеющие общую формулу IA или их фармацевтически приемлемые соли, таутомеры, пролекарства или стереоизомеры,

где Y выбран из -CHRay-, -CHRay-CHRby-, -CRay=CRby-, -C≡C-, -CHRay-CHRby-CHRcy-, -CHRay-CRby=CRcy- и -CHRay-C≡C-;
каждый Ray, Rby и Rcy независимо выбран из атома водорода, замещенного или незамещенного C1-C12алкила, замещенного или незамещенного C2-C12алкенила и замещенного или незамещенного C2-C12алкинила;
R5 выбран из атома водорода, замещенного или незамещенного C1-C12алкила, замещенного или незамещенного C2-C12алкенила и замещенного или незамещенного C2-C12алкинила;
R6 выбран из NR8R9 и OR10;
W выбран из O и NR7;
R7 выбран из атома водорода, CORa, COORa, замещенного или незамещенного C1-C12алкила, замещенного или незамещенного C2-C12алкенила и замещенного или незамещенного C2-C12 алкинила, или R7 и R5 вместе с соответствующими атомами N и C, к которым они присоединены, могут образовывать замещенную или незамещенную гетероциклическую группу;
каждый R8 и R9 независимо выбран из атома водорода, CORa, COORa, замещенного или незамещенного C2-C12 алкенила, замещенного или незамещенного C2-C12 алкинила и замещенного или незамещенного C4-C12 алкенинила;
R10 выбран из атома водорода, замещенного или незамещенного C2-C12алкенила и замещенного или незамещенного C2-C12алкинила;
каждый R12 и R13 независимо выбран из следующих групп: атом водорода, галоген, ORa, CORa, COORa, OCORa, OCOORa, OCONRaRb, CONRaRb, OS(O)Ra, OSO2Ra, OP(O)(Ra)ORb, OSiRaRbRc, NRaRb, NRaCORb, NRaCONRaRb, NRaS(O)Rb, NRaSO2Rb, NRaC(=NRa)NRaRb, SRa, S(O)Ra, SO2Ra, S(O)NRaRb, SO2NRaRb, S(O)ORa, SO2ORa, замещенный или незамещенный C1-C12алкил, замещенный или незамещенный C2-C12алкенил и замещенный или незамещенный C2-C12алкинил;
каждый Ra, Rb и Rc независимо выбран из следующих групп: атом водорода, замещенный или незамещенный C1-C12алкил, замещенный или незамещенный C2-C12алкенил, замещенный или незамещенный C2-C12алкинил, замещенный или незамещенный арил и замещенная или незамещенная гетероциклическая группа; и
каждая пунктирная линия представляет необязательную дополнительную связь при условии, что присутствует одна или более дополнительных связей.
В соединениях общей формулы IA особо предпочтительными Y являются -CHRay-, -CRay=CRby- и -CHRay-CRby=CRcy-, где Ray, Rby и Rcy такие, как определено выше.
Особо предпочтительными Ray, Rby и Rcy являются атом водорода и замещенный или незамещенный C1-C12алкил. Более предпочтительными Ray, Rby и Rcy являются атом водорода и замещенный или незамещенный C1-C6алкил, и еще более предпочтительны атом водорода, замещенный или незамещенный метил, замещенный или незамещенный этил, замещенный или незамещенный пропил, замещенный или незамещенный изопропил и замещенный или незамещенный бутил, в том числе замещенный или незамещенный трет-бутил, замещенный или незамещенный изобутил и замещенный или незамещенный втор-бутил. Предпочтительными заместителями указанных групп являются OR', =O, SR', SOR', SO2R', NO2, NHR', NR'R', =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR', OCOR', OCONHR', OCONR'R', CONHR', CONR'R', защищенная OH, замещенный или незамещенный C1-C12алкил, замещенный или незамещенный C2-C12алкенил, замещенный или незамещенный C2-C12алкинил, замещенный или незамещенный арил и замещенная или незамещенная гетероциклическая группа, где каждая из групп R' независимо выбрана из группы, включающей атом водорода, OH, NO2, NH2, SH, CN, галоген, COH, COалкил, COOH, замещенный или незамещенный C1-C12алкил, замещенный или незамещенный C2-C12алкенил, замещенный или незамещенный C2-C12алкинил, замещенный или незамещенный арил и замещенную или незамещенную гетероциклическую группу. В тех случаях, когда сами такие группы являются замещенными, заместители могут быть выбраны из приведенного выше списка. Еще более предпочтительными заместителями упоминаемых выше групп являются OH, SCH3, SH, NH2, NHC(=NH)NH2, CONH2, COOH, фенил, п-, м- или о-гидроксифенил, индолил, в том числе 1-, 2- и 3-индолил, и имидазолил, в том числе 4- и 5-имидазолил. Наиболее предпочтительными группами Ray, Rby и Rcy являются водород и метил. Конкретно, если Y обозначает -CHRay-, то особо предпочтительным Ray является метил, если Y обозначает -CRay=CRby-, то особо предпочтительным Ray является атом водорода и особо предпочтительным Rby является метил, и если Y обозначает -CHRay-CRby=CRcy-, то особо предпочтительными Ray являются атом водорода или метил, особо предпочтительным Rby является атом водорода и особо предпочтительным Rcy является метил.
Особо предпочтительным R5 является атом водорода и замещенный или незамещенный C1-C12алкил. Более предпочтительными R5 являются атом водорода и замещенный или незамещенный C1-C6алкил, и еще более предпочтительны атом водорода, замещенный или незамещенный метил, замещенный или незамещенный этил, замещенный или незамещенный пропил, замещенный или незамещенный изопропил и замещенный или незамещенный бутил, в том числе замещенный или незамещенный трет-бутил, замещенный или незамещенный изобутил и замещенный или незамещенный втор-бутил. Предпочтительными заместителями указанных групп являются OR', =O, SR', SOR', SO2R', NO2, NHR', NR'R', =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR', OCOR', OCONHR', OCONR'R', CONHR', CONR'R', защищенная OH, замещенный или незамещенный C1-C12алкил, замещенный или незамещенный C2-C12алкенил, замещенный или незамещенный C2-C12алкинил, замещенный или незамещенный арил и замещенная или незамещенная гетероциклическая группа, где каждая из групп R' независимо выбрана из группы, включающей атом водорода, OH, NO2, NH2, SH, CN, галоген, COH, COалкил, COOH, замещенный или незамещенный C1-C12алкил, замещенный или незамещенный C2-C12алкенил, замещенный или незамещенный C2-C12алкинил, замещенный или незамещенный арил и замещенную или незамещенную гетероциклическую группу. В тех случаях, когда сами такие группы являются замещенными, заместители могут быть выбраны из приведенного выше списка. Еще более предпочтительными заместителями упоминаемых выше групп являются OH, SCH3, SH, NH2, NHC(=NH)NH2, CONH2, COOH, фенил, п-, м- или о-гидроксифенил, индолил, в том числе 1-, 2- и 3-индолил, и имидазолил, в том числе 4- и 5-имидазолил. Наиболее предпочтительными группами R5 являются атом водорода, метил, изопропил, трет-бутил и бензил, и наиболее предпочтительны метил, изопропил и трет-бутил.
Особо предпочтительным W является NR7, где R7 такой, как определено ранее. Особо предпочтительными R7 являются атом водорода и замещенный или незамещенный C1-C12алкил. Более предпочтительными R7 являются атом водорода и замещенный или незамещенный C1-C6алкил; и еще более предпочтительны атом водорода, метил, этил, пропил, изопропил и бутил, в том числе трет-бутил. Наиболее предпочтительным является атом водорода.
В другом варианте особо предпочтительно, если R7 и R5 вместе с соответствующими атомами N и C, к которым они присоединены, образуют замещенную или незамещенную гетероциклическую группу. В этом отношении предпочтительной гетероциклической группой является гетероалициклическая группа, содержащая один, два или три гетероатома, выбранные из атомов N, O или S, наиболее предпочтительно один атом N, и имеющая от 5 до примерно 10 кольцевых атомов, наиболее предпочтительно 5, 6 или 7 кольцевых атомов. Наиболее предпочтительной является пирролидиновая группа.
Особо предпочтительными R6 являются NR8R9 и OR10, где R8, R9 и R10 такие, как определено выше, и еще более предпочтительным R6 является NR8R9.
Особо предпочтительным R8 является атом водорода.
Особо предпочтительными R9 являются атом водорода, замещенный или незамещенный C2-C12алкенил, замещенный или незамещенный C2-C12алкинил и замещенный или незамещенный C4-C12алкенинил. Предпочтительные замещенный алкенил, замещенный алкинил и замещенный алкенинил могут представлять не только один, но два и более заместителей. Более предпочтительными алкенильными группами являются группы, имеющие от 6 до примерно 10 атомов углерода; и еще более предпочтительно 7, 8 или 9 атомов углерода. Наиболее предпочтительными алкенильными группами являются окта-1,6-диенил, окта-1,5-диенил, окта-1,4-диенил, окта-1,3-диенил, нона-1,7-диенил, нона-1,6-диенил, нона-1,5-диенил, нона-1,4-диенил, нона-1,3-диенил, гепта-1,5-диенил, гепта-1,4-диенил, гепта-1,3-диенил. С другой стороны, более предпочтительными алкинильными группами являются группы, имеющие от 6 до примерно 10 атомов углерода; и еще более предпочтительно 7, 8 или 9 атомов углерода. Наиболее предпочтительными алкинильными группами являются окт-7-инил, окт-6-инил, окт-5-инил, окт-4-инил, окт-3-инил, окт-2-инил, окт-1-инил, нон-8-инил, нон-7-инил, нон-6-инил, нон-5-инил, нон-4-инил, нон-3-инил, нон-2-инил, нон-1-инил, гепт-6-инил, гепт-5-инил, гепт-4-инил, гепт-3-инил, гепт-2-инил и гепт-1-инил. С другой стороны, более предпочтительными алкенинильными группами являются группы, имеющие от 6 до примерно 10 атомов углерода; и еще более предпочтительно 7, 8 или 9 атомов углерода. Наиболее предпочтительными алкенинильными группами являются окт-1-ен-7-инил, окт-1-ен-6-инил, окт-1-ен-5-инил, окт-1-ен-4-инил, окт-1-ен-3-инил, нон-1-ен-8-инил, нон-1-ен-7-инил, нон-1-ен-6-инил, нон-1-ен-5-инил, нон-1-ен-4-инил, нон-1-ен-3-инил, гепт-1-ен-6-инил, гепт-1-ен-5-инил, гепт-1-ен-4-инил и гепт-1-ен-3-инил. Предпочтительными заместителями для указанных алкенильных, алкинильных и алкенинильных групп являются OR', =O, SR', SOR', SO2R', NO2, NHR', NR'R', =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR' OCOR', OCONHR', OCONR'R', CONHR', CONR'R', защищенная OH, замещенный или незамещенный C1-C12алкил, замещенный или незамещенный C2-C12алкенил, замещенный или незамещенный C2-C12алкинил, замещенный или незамещенный арил и замещенная или незамещенная гетероциклическая группа, где каждая из групп R' независимо выбрана из группы, включающей атом водорода, OH, NO2, NH2, SH, CN, галоген, COH, COалкил, COOH, замещенный или незамещенный C1-C12алкил, замещенный или незамещенный C2-C12алкенил, замещенный или незамещенный C2-C12 алкинил, замещенный или незамещенный арил и замещенную или незамещенную гетероциклическую группу. В тех случаях, когда сами такие группы являются замещенными, заместители могут быть выбраны из приведенного выше списка. Более предпочтительными заместителями для упоминаемых выше алкенильных, алкинильных и алкенинильных групп являются галоген, OR', =O, OCOR', OCONHR', OCONR'R', CONHR', CONR'R' и защищенная OH, где каждая из групп R' предпочтительно выбрана из следующих групп: атом водорода, замещенный или незамещенный C1-C12алкил, замещенный или незамещенный C2-C12алкенил, замещенный или незамещенный C2-C12алкинил и замещенный или незамещенный арил. Еще более предпочтительными заместителями для этих алкенильных, алкинильных и алкенинильных групп являются галоген, OR', =O, OCONHR', OCONR'R', CONHR', CONR'R' и защищенная OH, где защитная группа для OH предпочтительно выбрана из следующих групп: триметилсилил, триэтилсилил, триизопропилсилил, диметилизопропилсилил, диэтилизопропилсилил, диметилгексилсилил, 2-норборнилдиметилсилил, трет-бутилдиметилсилил, трет-бутилдифенилсилил, трибензилсилил, три-п-ксилилсилил, трифенилсилил, дифенилметилсилил, ди-трет-бутилметилсилил, бис(трет-бутил)-1-пиренилметоксисилил, трис(триметилсилил)силил, (2-гидроксистирил)диметилсилил, (2-гидроксистирил)диизопропилсилил, трет-бутилметоксифенилсилил, трет-бутоксидифенилсилил, 1,1,3,3-тетраизопропил-3-[2-(трифенилметокси)этокси]дисилоксан-1-ил и фторсилил, и где каждая из групп R' более предпочтительно выбрана из атома водорода, незамещенного C1-C6алкила и замещенного или незамещенного арила. Наиболее предпочтительными заместителями для этих алкенильных, алкинильных и алкенинильных групп являются Cl, OH, =O, OCONH2, OCONHфенил и защищенная OH, где защитная группа для OH предпочтительно выбрана из следующих групп: триметилсилил, триэтилсилил, триизопропилсилил, диметилизопропилсилил, диэтилизопропилсилил, диметилгексилсилил, 2-норборнилдиметилсилил, трет-бутилдиметилсилил, трет-бутилдифенилсилил, трибензилсилил, три-п-ксилилсилил, трифенилсилил, дифенилметилсилил, ди-трет-бутилметилсилил, бис(трет-бутил)-1-пиренилметоксисилил, трис(триметилсилил)силил, (2-гидроксистирил)диметилсилил, (2-гидроксистирил)диизопропилсилил, трет-бутилметоксифенилсилил, трет-бутоксидифенилсилил, 1,1,3,3-тетраизопропил-3-[2-(трифенилметокси)этокси]дисилоксан-1-ил и фторсилил.
Особо предпочтительными R12 и R13 являются атом водорода, ORa, OCORa и OSiRaRbRc, где Ra, Rb и Rc такие, как определено выше. Еще более предпочтительными R12 являются атом водорода и ORa, и более предпочтительными R13 являются атом водорода, ORa и OSiRaRbRc. Особо предпочтительными Ra, Rb и Rc являются атом водорода и замещенный или незамещенный C1-C12алкил. Еще более предпочтительными Ra, Rb и Rc являются атом водорода и замещенный или незамещенный C1-C6 алкил; и еще более предпочтительны атом водорода, метил, этил, пропил, изопропил и бутил, в том числе трет-бутил, притом что наиболее предпочтительны атом водорода, метил и трет-бутил.
Особо предпочтительным является наличие одной дополнительной связи между C1 и C2 и/или наличие одной или двух дополнительных связей между C3 и C4. Кроме того, стереохимия каждой двойной связи может соответствовать (E) или (Z). В область настоящего изобретения включены отдельные изомеры и смеси изомеров.
Соединения по изобретению можно получить синтетически, объединяя различные фрагменты, как показано на схеме A.
Схема А
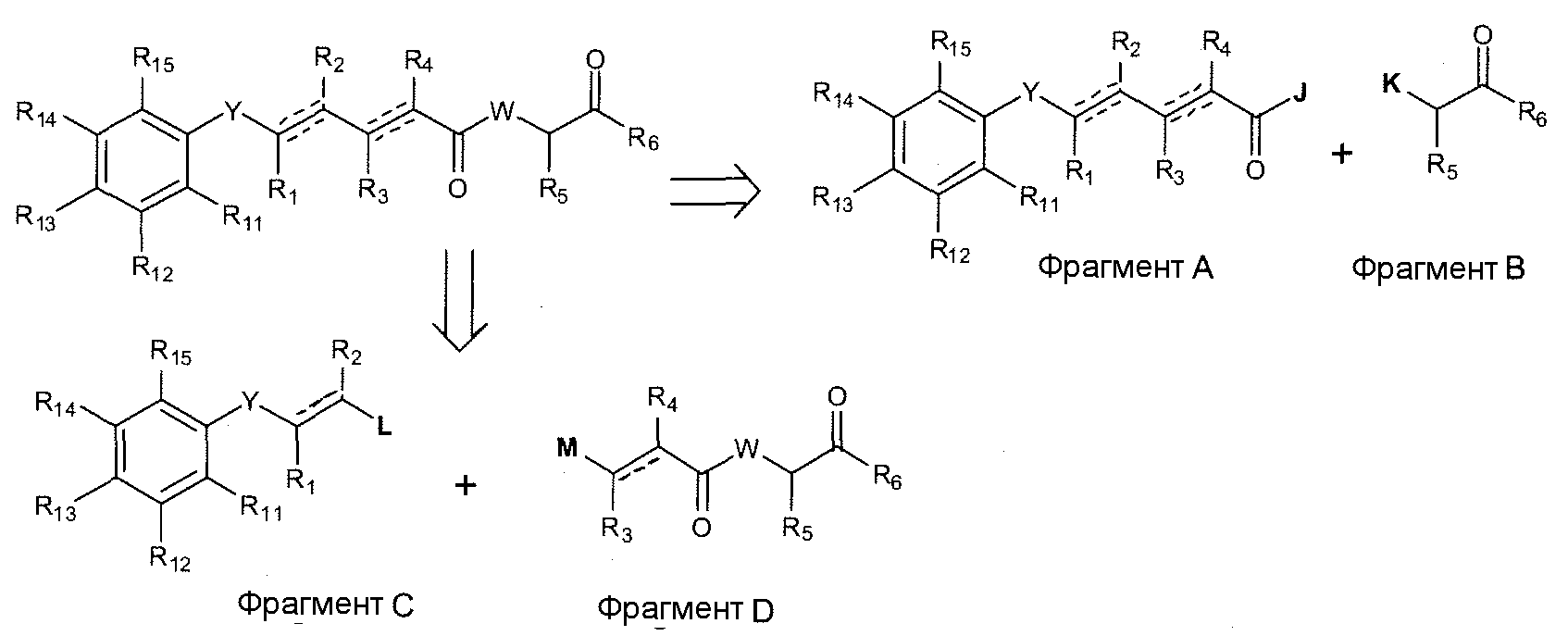
где R1, R2, R3, R4, R5, R6, R11, R12, R13, R14, R15, Y и W представляют собой желательные группы или подходящие защитные группы, которые требуются, и J, K, L и M представляют собой подходящие реакционные или уходящие группы.
Соединения по изобретению можно получить, следуя любой из следующих стратегий:
1) Соединение фрагментов A и B можно осуществить, следуя стандартным методикам органической химии (например, по работе Bodanszky M и Bodanszky A, The Practice of Peptide Synthesis, Springer-Verlag, 1993).
2) Соединение фрагментов C и D можно осуществить, следуя стандартным методикам металлоорганической химии (например, по работе R.B. Crabtree, "The Organometallic Chemistry of the Transition Metals", 2nd Ed., Wiley, Nueva York, 1994).
Фрагменты A, B, C и D можно независимо получить, следуя стандартным методикам органического синтеза.
Удаление защитных групп можно осуществить согласно методикам, известным в органическом синтезе (Greene и Wuts, Protective Groups in Organic Synthesis, 3-е изд., Wiley-Interscience; Burke and Danheiser, Handbook of Reagents for Organic Synthesis: Oxidizing and Reducing Agents, Wiley; Pla D et al. J. Org. Chem. 2005, 70, 8231).
Если необходимо, можно использовать подходящие защитные группы на заместителях для гарантии, что реактивные группы не будут затронуты. Синтез может предполагать использование заместителей-предшественников, которые можно преобразовать на подходящей стадии в желательный заместитель. Можно вводить или удалять из циклической структуры насыщенность или ненасыщенность как часть синтеза. Исходные материалы и реагенты можно модифицировать, как желательно, для гарантии синтеза предполагаемого соединения. Кроме того, из полученных соединений можно также синтезировать аналоги по обычным методикам синтетической органической химии, которые известны специалистам в данной области.
Упоминаемые выше синтетические способы можно модифицировать, как желательно для получения стереоспецифических соединений, а также смесей стереоизомеров. Можно синтезировать конкретные стереоизомеры или конкретные смеси различными способами, включающими использование стереоспецифических реагентов или введение в соединения хиральных центров во время синтеза. В ходе синтеза можно вводить один или более стереоцентров и также инвертировать имеющиеся стереоцентры. Кроме того, когда соединение синтезировано, можно разделить стереоизомеры стандартными методиками разделения, известными специалисту.
Важным отличительным признаком описанных выше соединений формулы I является их биологическая активность и, в частности, их цитотоксическая активность.
Данным изобретением авторы обеспечивают новые фармацевтические композиции соединений общей формулы I, которые обладают цитотоксической активностью, и их применение в качестве противоопухолевых агентов. Таким образом, настоящее изобретение также касается фармацевтических композиций, содержащих соединение по данному изобретению, его фармацевтически приемлемую соль, таутомер, пролекарство или стереоизомер с фармацевтически приемлемым носителем.
Выражение "носитель" относится к разбавителю, адъюванту, наполнителю или носителю, с которым применяют активный ингредиент. Подходящие фармацевтические носители описаны в "Remington's Pharmaceutical Sciences" by E. W. Martin, 1995.
Примеры фармацевтических композиций включают любые твердые (таблетки, пилюли, капсулы, гранулы и др.) или жидкие (растворы, суспензии или эмульсии) композиции для перорального, локального или парентерального применения.
Применение соединений или композиций по настоящему изобретению можно осуществлять любым подходящим способом, таким как внутривенное вливание, пероральное, внутрибрюшинное и внутривенное введение. Авторы предпочитают, чтобы время вливания составляло до 24 час, более предпочтительно 1-12 час и наиболее предпочтительно 1-6 час. Особо желательными являются короткие времена вливания, которые позволяют проводить лечение, не оставляя пациента в госпитале на ночь. Однако, если требуется, вливание может длиться от 12 до 24 час или даже дольше. Вливание можно проводить с подходящими интервалами, например, от 1 до 4 недель. Фармацевтические композиции, содержащие соединения по изобретению, можно доставлять в инкапсулированном виде в липосомах или наносферах, в виде препаратов с длительным высвобождением или другими стандартными способами доставки.
Надлежащая дозировка соединений варьируется в зависимости от конкретного препарата, способа применения и конкретного места, реципиента и опухоли, подлежащей лечению. Следует принимать во внимание другие факторы, такие как возраст, масса тела, пол, питание, время приема, скорость экскреции, состояние реципиента, комбинации лекарств, реакционную чувствительность и тяжесть заболевания. Введение можно выполнять непрерывно или периодически в пределах максимальной переносимой дозы.
Соединения и композиции по данному изобретению можно применять с другими лекарственными средствами, обеспечивая комбинационную терапию. Другие лекарственные средства могут составлять часть одной композиции или предоставляться в виде отдельной композиции для одновременного введения или в другое время.
Противоопухолевые активности этих соединений включают, но не ограниченны этим, рак легких, рак ободочной кишки и рак груди.
Примеры
ПРИМЕР 1: СИНТЕЗ ФРАГМЕНТОВ 12 и 13
Схема 1 представляет пример синтеза фрагментов 12 и 13.
Схема 1

Синтез промежуточного продукта 2

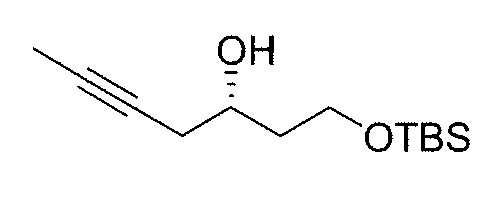
К раствору промежуточного продукта 1 (72,3 г, 0,39 моль) в безводном ДХМ (918 мл) при комнатной температуре добавляют частями 3-хлорпероксибензойную кислоту (m-CPBA) (100 г, 0,58 моль) и смесь перемешивают при комнатной температуре в течение 18 час. Белый осадок гасят насыщенным водным раствором NaHCO3, экстрагируют ДХМ (3×250 мл) и снова промывают насыщенным водным раствором NaHCO3 (3×250 мл). Органические слои объединяют, сушат над безводным Na2SO4 и концентрируют в вакууме. Полученное масло очищают на силикагеле (гексан-EtOAc 15:1), получая эпоксид в виде бесцветного масла (64,5 г, 82%). К раствору рацемического эпоксида (30 г, 0,15 моль) в безводном ТГФ (7,5 мл) добавляют (R,R)-(-)-N,N'-бис(3,5-ди-трет-бутилсалицилиден)-1,2-циклогександиаминокобальт(II) [(R,R)Co(II) комплекс] (448 мг, 0,74 ммоль), а затем AcOH (0,14 мл). Раствор охлаждают до 0°C и добавляют по капле воду (1,2 мл). Реакционной смеси дают нагреться до комнатной температуры и перемешивают в течение 18 час. После этого летучие материалы концентрируют в вакууме и сырой продукт загружают непосредственно на колонку с силикагелем. Флэш-хроматография с использованием смеси гексан/EtOAc (от 15:1 до 12:1) в качестве элюента дает хиральный эпоксид (+)-2 (13,6 г, выход: 46%) в виде бесцветного масла.
[α]D = +14,1 (c 1, CHCl3).
1H ЯМР (300 МГц, CDCl3) δ: 3,74 (т, 2H, J=6,3 Гц), 3,01 (м, 1H), 2,74 (т, 1H, J=4,6 Гц), 2,48 (дд, 1Н, J=5,1, 3,1 Гц), 1,70 (м, 2Н), 0,87 (с, 9Н), 0,04 (с, 6H).
13C ЯМР (75 МГц, CDCl3) δ: 60,2, 50,2, 47,3, 36,1, 26,1, 18,4, -5,2.
Синтез промежуточного продукта 3
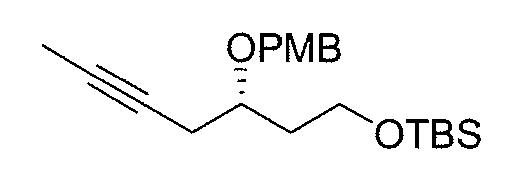
Пропин (10 мл, 0,176 моль) конденсируют при -78°С и растворяют в безводном ТГФ (165 мл). Добавляют по капле н-бутиллитий (75,1 мл, 0,188 моль) в атмосфере N2 в течение 30 мин и полученную белую суспензию перемешивают еще 30 мин при -78°С. Затем добавляют по капле раствор (+)(R)-2-[2-(трет-бутилдиметилилсилилокси)этил]оксирана 2 (23,7 г, 0,117 моль) в безводном ТГФ (125 мл), а затем добавляют BF3OEt2 (22,1 мл, 0,176 моль). Смесь перемешивают в течение 1 час при -78°С и еще час при -0°С. Реакционную смесь гасят насыщенным водным раствором NH4Cl (150 мл) и экстрагируют Et2O (3×150 мл). Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют. Флэш-хроматография (гексан/EtOAc от 10:1 до 1:1) дает спирт 3 (22,7 г, выход 80%) в виде бесцветного масла.
[α]D = +5,6 (с 0,1, CHCl3).
1H ЯМР (500 МГц, CDCl3) δ: 3,75-3,90 (м, 3H), 3,47 (д, 1H, J=2,7 Гц, ОН), 2,34 (м, 2Н), 1,79 (т, 3H, J=2,4 Гц), 1,75 (м, 2Н), 0,89 (с, 9H), 0,07 (с, 6H).
13C ЯМР (125 МГц, CDCl3) δ: 77,8, 75,8, 70,7, 62,4, 37,6, 27,6, 26,1, 18,3, 3,7, -5,3, -5,4.
MS (ES) m/z 243,2 [M+H]+, 265,2 [M+Na]+.
Синтез промежуточного продукта 4
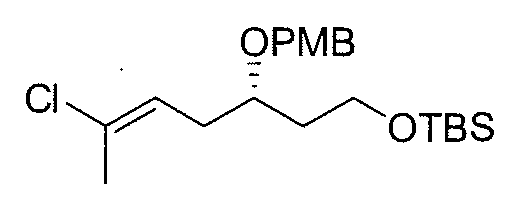
Поверх раствора 3 (41,8 г, 0,173 моль) и 18-краун-6-эфира (50,27 г, 0,190 моль) в безводном ТГФ (1190 мл) при -78°С в атмосфере N2 добавляют посредством капельной воронки 0,5N раствор KHMDS в толуоле (380 мл, 0,190 моль) за период 30 мин. Смесь перемешивают при данной температуре в течение 45 мин, а затем добавляют раствор 4-метоксибензилхлорида (PMBCl) (23,89 г, 0,176 моль) в безводном ТГФ (100 мл). Через 2 час при -78°C смесь гасят насыщенным водным раствором NH4Cl (600 мл). Органический слой отделяют и водную фазу тщательно экстрагируют EtOAc (3×500 мл). Объединенные органические слои промывают насыщенным водным раствором NaCl, сушат над безводным Na2SO4, фильтруют и концентрируют, получая 4 в виде желтого масла, которое используют на следующих стадиях без дополнительной очистки (61,3 г, выход: 99%).
1H ЯМР (300 МГц, CDCl3) δ: 7,25 (д, 2H, J=8,7 Гц), 6,90 (д, 2H, J=8,7 Гц), 4,45 (м, 2H), 3,80 (с, 3H), 3,65 (м, 3H), 2,40 (м, 2H), 1,82 (м, 2H), 1,79 (т, 3H, J=2,4 Гц), 0,92 (с, 9H), 0,05 (с, 6H).
Синтез промежуточного продукта 5
К раствору 4 (61,3 г, 0,169 моль) в безводном толуоле (2,1 л) добавляют в атмосфере N2 и при 0°C реагент Шварца (бис(циклопентадиенил)цирконий(IV) хлорид гидрид, Cp2ZrHCl) (130,3 г, 0,507 моль) и реакционную смесь перемешивают 5 мин при комнатной температуре. Реакционную температуру повышают до 50°C за период 20 мин и перемешивают при 50°C в течение 2,5 час. В течение этого времени реакционный раствор меняет цвет на оранжевый. Реакционную смесь охлаждают до 0°C и добавляют одной порцией N-хлорсукцинимид (58,45 г, 0,440 моль). Перемешивание продолжают в течение 30 мин при комнатной температуре и реакционную смесь разбавляют смесью гексан/EtOAc (95:5; 500 мл). Удаление твердого вещества посредством фильтрования и выпаривания летучих веществ дает 5 в виде желтого масла, которое используют без дополнительной очистки (15,1 г, выход: 86%).
[α]D = +20,5 (c 1, CHCl3).
1H ЯМР (300 МГц, CDCl3) δ: 7,25 (д, 2H, J=8,7 Гц), 6,87 (д, 2H, J=8,7 Гц), 5,64 (тд, 1H, J=7,8, 0,9 Гц), 4,45 (кв, 2H, J=11,1 Гц), 3,80 (с, 3H), 3,70 (м, 2H), 3,62 (м, 1H), 2,27 (т, 2H, J=6,9 Гц), 2,03 (с, 3H), 1,70 (м, 2H), 0,89 (с, 9H), 0,05 (с, 6H).
13C ЯМР (75 МГц, CDCl3) δ: 159,4, 130,9, 130,7, 129,6, 124,2, 114,0, 75,2, 71,4, 59,8, 55,5, 37,7, 33,8, 26,1, 21,2, 18,5, -5,1.
Синтез промежуточного продукта 6
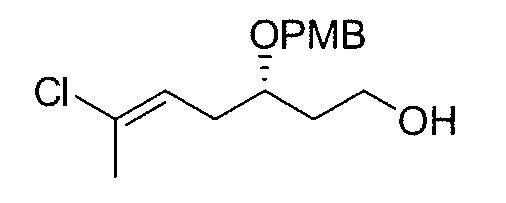
К раствору 5 (23 г, 0,058 моль) в безводном ТГФ (288 мл) в атмосфере N2 и при 0°C добавляют по капле раствор фторида тетрабутиламмония (TBAF) (115,3 мл, 0,115 моль) за период 20 мин (раствор становится красным). Реакционную смесь перемешивают при комнатной температуре в течение 2 час и затем гасят насыщенным водным раствором NH4Cl (200 мл). Слои разделяют и водную фазу тщательно экстрагируют EtOAc (3×150 мл). Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют. Флэш-хроматография (гексан/EtOAc от 4:1 до 1:1) дает 6 в виде бесцветного масла (11,9 г, выход: 73%).
1H ЯМР (300 МГц, CDCl3) δ: 7,25 (д, 2H, J=8,7 Гц), 6,86 (д, 2H, J=8,7 Гц), 5,62 (т, 1H, J=7,8 Гц), 4,45 (м, 2H), 3,80 (с, 3H), 3,70 (м, 3H), 2,35 (м, 2H), 2,03 (с, 3H), 1,75 (м, 2H).
Синтез промежуточного продукта 7
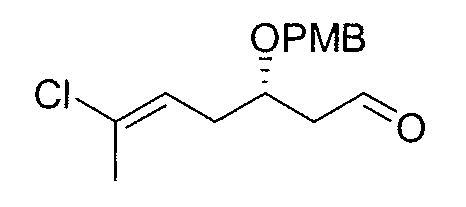
(Диацетоксийод)бензол (BAIB) (11,5 г, 35,7 ммоль) добавляют к раствору спирта 6 (9,2 г, 32,4 ммоль) и 2,2,6,6-тетраметилпиперидин 1-оксила (TEMPO) (515 мг, 3,3 ммоль) в безводном дихлорметане (92 мл). Реакционную смесь перемешивают при комнатной температуре в течение 20 час до тех пор, пока спирт не будет детектироваться (ТСХ), и затем гасят насыщенным водным раствором NH4Cl и экстрагируют ДХМ (3×100 мл). Объединенные органические фазы сушат над безводным Na2SO4, фильтруют и концентрируют. Остаток очищают методом флэш-хроматографии (гексан/EtOAc от 4:1 до 1:1), получая 7 в виде бесцветного масла (6,3 г, выход: 69%).
1H ЯМР (300 МГц, CDCl3) δ: 9,78 (с, 1H), 7,25 (д, 2H, J=8,7 Гц), 6,85 (д, 2H, J=8,7 Гц), 5,64 (т, 1H, J=7,8 Гц), 4,45 (кв, 2H, J=11,1 Гц), 4,02 (м, 1H), 3,80 (с, 3H), 2,60 (м, 2H), 2,35 (м, 2H), 2,03 (с, 3H).
13C ЯМР (75 МГц, CDCl3) δ: 201, 159,6, 132,1, 130,1, 129,7, 122,8, 114,1, 73,3, 71,5, 55,5, 48,3, 33,5, 21,3.
Синтез промежуточного продукта 8
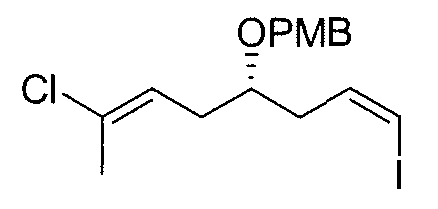
К суспензии йодметилтрифенилфосфоний йодида (15,6 г, 31 ммоль) в безводном ТГФ (126 мл) медленно добавляют при комнатной температуре 1M раствор NaHMDS в безводном ТГФ (31,27 мл, 31,27 моль). После перемешивания в течение 2 мин желтую смесь охлаждают до -78°C и затем добавляют раствор 7 (6,3 г, 22 ммоль) в безводном ТГФ (82 мл). Реакционную смесь перемешивают при -78°C в течение 2 час, и при комнатной температуре в течение 5 мин, разбавляют гексаном и фильтруют через слой Celite®. Слой Celite® промывают гексаном, объединенные фильтраты выпаривают при пониженном давлении и полученное масло очищают методом колоночной хроматографии (гексан/EtOAc от 12:1 до 8:1), получая 8 в виде желтого масла (5,6 г, выход: 62%).
1H ЯМР (300 МГц, CDCl3) δ: 7,25 (д, 2H, J=8,7 Гц), 6,85 (д, 2H, J=8,7 Гц), 6,25 (м, 2H) 5,64 (т, 1H, J=7,8 Гц), 4,42 (м, 2H), 3,80 (с, 3H), 3,55 (м, 1H), 2,40 (м, 2H), 2,25 (м, 2H), 2,03 (с, 3H).
Синтез промежуточного продукта 9
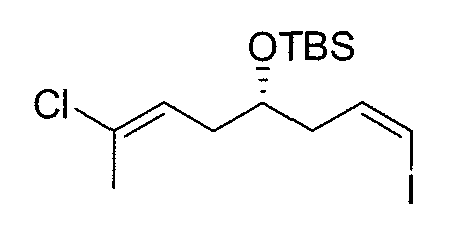
2,3-Дихлор-5,6-дициано-п-бензохинон (DDQ) (3,6 г, 16 ммоль) добавляют к раствору 8 (5 г, 12 ммоль) в ДХМ-H2O (20:1, 98 мл) в атмосфере N2 при комнатной температуре. Через 1,5 час (ТСХ, гексан/EtOAc 4:1, показывает отсутствие исходного материала) реакционную смесь гасят, выливая в Et2O (200 мл) и промывая 1M NaOH (3×50 мл) и насыщенным раствором соли (50 мл). Органическую фазу сушат над безводным Na2SO4, фильтруют и концентрируют. Хроматографическое отделение п-метоксибензальдегида упрощается при восстановлении до п-метоксибензилового спирта. С этой целью раствор полученного остатка в MeOH (98 мл) с NaBH4 (0,60 г, 16 ммоль) в атмосфере N2 выдерживают при комнатной температуре в течение 1 час. Затем реакционную смесь гасят, выливая в Et2O (100 мл) и промывая 1M HCl (40 мл) и насыщенным раствором соли (40 мл). Органическую фазу сушат над безводным Na2SO4, фильтруют и концентрируют. Полученное масло очищают на силикагеле (гексан/EtOAc от 10:1 до 4:1), получая вторичный спирт в виде бесцветного масла (2,8 г, выход: 80%).
К раствору вторичного спирта (2,8 г, 10 ммоль) в безводном ДХМ (38 мл) в атмосфере N2 и при 0°C добавляют по капле 2,6-лутидин (2,28 мл, 20 ммоль), а затем добавляют трет-бутилдиметилсилилтрифторметансульфонат (TBSOTf) (2,33 мл, 12 ммоль). Реакционную смесь перемешивают в течение 2 час. В этот момент сырой продукт гасят посредством 0,5M HCl (25 мл) и экстрагируют ДХМ (2×25 мл). Объединенные органические слои промывают насыщенным водным раствором NaHCO3 и насыщенным раствором соли. Органическую фазу сушат над Na2SO4, фильтруют и концентрируют. Флэш-хроматография (гексан/EtOAc от 100:1 до 20:1) дает 9 в виде бесцветного масла (3,14 г, выход: 80%).
1H ЯМР (300 МГц, CDCl3) δ: 6,25 (м, 2H) 5,64 (т, 1H, J=7,8 Гц), 3,82 (м, 1H), 2,38 (т, 2H, J=6,0 Гц), 2,20 (т, 2H, J=6,3 Гц), 2,03 (с, 3H), 0,86 (с, 9H), 0,05 (с, 6H).
13C ЯМР (75 МГц, CDCl3) δ: 137,7, 130,9, 124,3, 84,6, 70,6, 42,5, 36,6, 25,9, 21,3, 18,2, -4,4.
Синтез промежуточного продукта 10a

В перекрываемую трубку Шленка загружают йодид меди (I) (148 мг, 0,78 ммоль), карбонат калия (1,076 г, 7,78 ммоль) и Boc-трет-LeuCONH2 (полученный по методике, описанной в работе Pozdnev, V. F., Tetrahedron Letters 1995, 36, 7115-7118) (0,96 г, 4,15 ммоль), откачивают ее и заполняют N2. Добавляют N,N'-диметилэтилендиамин (DMEDA) (0,166 мл, 1,55 ммоль), винилйодид 9 (1,04 г, 2,59 ммоль) и безводный ДМФА (15 мл) в атмосфере N2. Трубку Шленка перекрывают, нагревают при 90°C в течение 18 час и охлаждают до комнатной температуры. Полученную смесь разбавляют EtOAc и гасят водой. Органический слой промывают водой и сушат над безводным Na2SO4. Растворитель удаляют при пониженном давлении и остаток очищают методом флэш-хроматографии на силикагеле (гексан/EtOAc, от 20:1 до 15:1). Промежуточный продукт 10a (670 мг, выход: 53%) получают в виде масла.
1H ЯМР (300 МГц, CDCl3) δ: 7,72 (д, 1H, J=9,9 Гц), 6,70 (т, 1H, J=9,6 Гц), 5,54 (т, 1H, J=7,8 Гц), 5,35 (д, 1H, J=9,0 Гц), 4,76 (кв, 1H, J=7,8 Гц), 3,89 (д, 1H, J=9,0 Гц), 3,73-3,68 (м, 1H), 2,12 (м, 4H), 1,98 (с, 3H), 1,40 (с, 9H), 0,97 (с, 9H), 0,84 (с, 9H), 0,02 (с, 3H), 0,01 (с, 3H).
13C ЯМР (75 МГц, CDCl3) δ: 168,9, 156,0, 131,1, 123,9, 122,6, 108,2, 79,9, 71,6, 62,5, 36,5, 34,8, 33,8, 28,1, 26,7, 25,9, 21,2, 18,3, -4,3, -4,4.
Синтез промежуточного продукта 10b
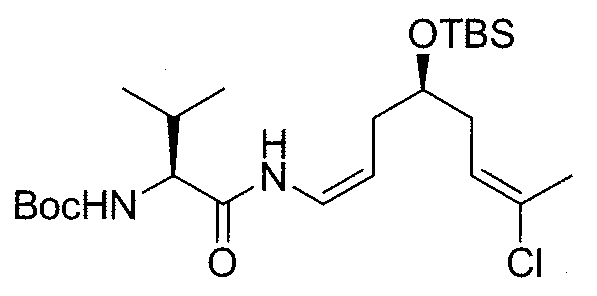
В перекрываемую трубку Шленка загружают йодид меди(I) (40,4 мг, 0,213 ммоль), карбонат калия (294 мг, 2,13 ммоль) и Boc-Val-CONH2 (полученный по методике, описанной в работе Pozdnev, V. F., Tetrahedron Letters 1995, 36, 7115-7118) (230 мг, 1,06 ммоль), откачивают ее и заполняют N2. Добавляют N,N'-диметилэтилендиамин (45 мкл, 0,426 ммоль), винил йодид 9 (283 мг, 0,71 ммоль) и безводный ДМФА (35 мл) в атмосфере N2. Трубку Шленка перекрывают, нагревают при 90°C в течение 16-18 час и охлаждают до комнатной температуры. Полученную смесь разбавляют EtOAc и гасят водой. Органический слой промывают водой и сушат над безводным Na2SO4. Растворитель удаляют при пониженном давлении и остаток очищают методом флэш-хроматографии на силикагеле (гексан/EtOAc, от 7:1 до 3:1). Промежуточный продукт 10b (270 г, выход: 77%) получают в виде масла.
1H ЯМР (300 МГц, CDCl3) δ: 7,80 (д, 1H, J=9,3 Гц), 6,79-6,73 (м, 1H), 5,58 (т, 1H, J=7,5 Гц), 5,02 (ушир.с, 1H), 4,85-4,76 (м, 1H), 3,93 (дд, 1H, J=8,4, 6,0 Гц), 3,80-3,73 (м, 1H), 2,12-2,22 (м, 5H), 2,02 (с, 3H), 1,45 (с, 9H), 0,98 (д, 3H, J=6,9 Гц), 0,93 (д, 3H, J=6,9 Гц), 0,89 (с, 9H), 0,07 (с, 3H), 0,06 (с, 3H).
Синтез промежуточного продукта 11a
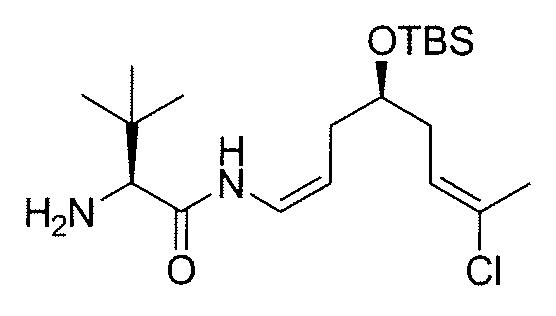
Раствор амино-защищенного производного 10a (670 мг, 1,33 ммоль) в этиленгликоле (30 мл) нагревают при 200°C в течение 15 мин. Затем реакционную смесь охлаждают при комнатной температуре, разбавляют ДХМ, гасят насыщенным раствором соли и выливают в воду. Добавляют несколько капель 3M NaOH до достижения рН раствора 14 и затем тщательно экстрагируют ДХМ. Объединенные органические фазы сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме, получая первичный амин 11a (510 мг, выход: 95%) в виде желтого масла, которое используют без дополнительной очистки.
1H ЯМР (CDCl3, 300 МГц) δ: 8,77 (д, 1H, J=9,9 Гц), 6,71 (т, 1H, J=9,6 Гц), 5,56 (т, 1H, J=7,8 Гц), 4,71 (м, 1H), 3,72 (м, 1H), 3,14 (с, 1H), 2,14 (м, 4H), 1,97 (с, 3H), 0,97 (с, 9H), 0,84 (с, 9H), 0,02 (с, 6H).
13C ЯМР (75 МГц, CDCl3) δ: 171,2, 131,0, 124,1, 122,5, 107,1, 71,5, 64,3, 36,2, 34,5, 33,8, 26,5, 26,0, 21,2, 18,2, -4,4, -4,5.
Синтез промежуточного продукта 11b

Раствор амино-защищенного производного 10b (255 мг, 0,52 ммоль) в этиленгликоле (15 мл) нагревают при 200°C в течение 15 мин. Затем реакционную смесь охлаждают при комнатной температуре, разбавляют ДХМ, гасят насыщенным раствором соли и выливают в воду. Добавляют несколько капель 3M NaOH до достижения pH раствора 14 и затем тщательно экстрагируют ДХМ. Объединенные органические фазы сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме, получая первичный амин 11b (170 мг, выход: 85%) в виде желтого масла, которое используют без дополнительной очистки.
1H ЯМР (300 МГц, CDCl3) δ: 9,27 (д, 1H, J=10,2 Гц), 6,76 (дд, 1H, J=9,6 Гц), 5,61 (т, 1H, J=7,8 Гц), 4,80-4,72 (м, 1H), 3,81-3,73 (м, 1H), 3,31 (д, 1H, J=3,6 Гц) 2,44-2,33 (м, 1H), 2,20-2,16 (м, 4H), 2,03 (с, 3H), 1,59 (ушир.с, 2H), 1,00 (д, 3H, J=6,9 Гц), 0,89 (с, 9H), 0,82 (д, 3H, J=6,9 Гц), 0,05 (с, 6H).
13C ЯМР (75 МГц, CDCl3) δ: 172,1, 131,1, 124,1, 122,5, 107,4, 71,5, 60,2, 36,2, 33,7, 30,8, 26,0, 21,3, 20,0, 18,3, 16,1, -4,3, -4,4.
Синтез промежуточного продукта 12a
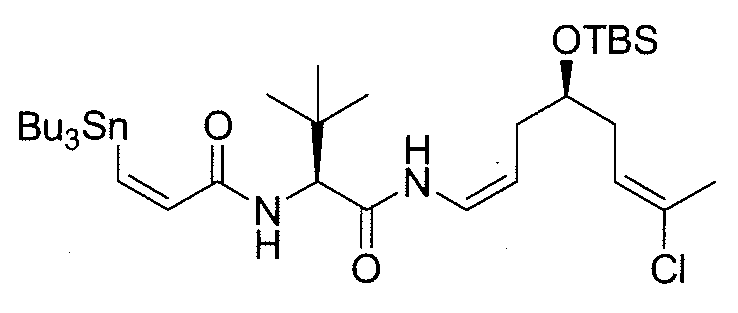
К раствору амина 11a (918 мг, 2,27 ммоль) в безводном ДХМ/ДМФА (10:1, 39,6 мл) добавляют в атмосфере N2 раствор (Z)-3-трибутилстаннилпропеноевой кислоты (1028 мг, 2,84 ммоль) в безводном ДХМ и затем охлаждают при 0°C. Добавляют к раствору диизопропилэтиламин (DIPEA) (0,6 мл, 3,4 ммоль), 1-гидрокси-7-азабензотриазол (HOAt) (310 мг, 2,27 ммоль) и N,N,N',N'-тетраметил-О-(7-азабензотриазол-1-ил)уроний гексафторфосфат (HATU) (860 мг, 2,27 ммоль) и через 30 мин удаляют холодную баню. Реакционную смесь перемешивают при комнатной температуре в течение 2 час, гасят насыщенным водным раствором NH4Cl, выливают в воду и экстрагируют ДХМ. Объединенные органические фазы сушат над безводным Na2SO4, фильтруют и концентрируют. Остаток очищают методом флэш-хроматографии (гексан/EtOAc от 20:1 до 15:1), получая амид 12a (1,11 г; выход: 66%) в виде масла.
1H ЯМР (300 МГц, CDCl3) δ: 7,63 (д, 1H, J=10,5 Гц), 6,97 (д, 1H, J=12,3 Гц), 6,75 (д, 1H, J=12,3 Гц), 6,72 (т, 1H, J=9,5 Гц), 6,50 (д, 1H, J=9,0 Гц), 5,56 (т, 1H, J=6,6 Гц), 4,83 (кв, 1H, J=9,0 Гц), 4,41 (д, 1H, J=9,6 Гц), 3,76 (м, 1H), 2,17 (м, 4H), 2,01 (с, 3H), 1,45 (м, 6H), 1,25 (м, 8H), 1,0 (с, 9H), 0,88 (с, 9H), 0,84 (м, 13H), 0,06 (с, 6H).
Синтез промежуточного продукта 12b
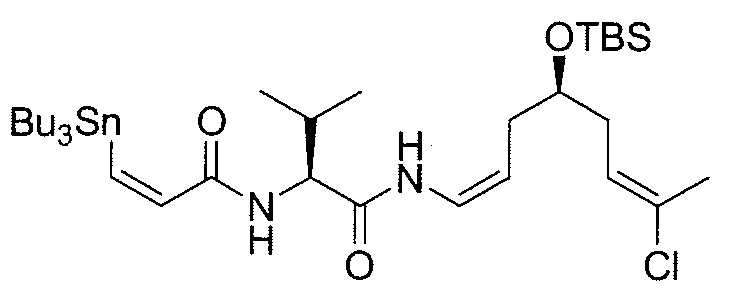
К раствору амина 11b (170 мг, 0,437 ммоль) в безводном ДХМ/ДМФА (10:1, 7,7 мл) добавляют в атмосфере N2 раствор (Z)-3-трибутилстаннилпропеноевой кислоты (197,2 мг, 0,546 ммоль) в безводном ДХМ и затем охлаждают при 0°C. Добавляют к раствору DIPEA (0,11 мл, 0,655 ммоль), HOAt (59,4 мг, 0,437 ммоль) и HATU (166 мг, 0,437 ммоль) и через 30 мин холодную баню удаляют. Реакционную смесь перемешивают при комнатной температуре в течение 2 час, гасят насыщенным водным раствором NH4Cl, выливают в воду и экстрагируют ДХМ. Объединенные органические фазы сушат над безводным Na2SO4, фильтруют и концентрируют. Остаток очищают методом флэш-хроматографии (гексан/EtOAc от 20:1 до 15:1), получая амид 12b (250 мг, выход: 78%) в виде белой пены.
1H ЯМР (300 МГц, CDCl3) δ: 7,94 (д, 1H, J=10,8 Гц), 7,00 (д, 1H, J=12,3 Гц), 6,75 (д, 1H, J=12,3 Гц), 6,72 (т, 1H, J=9,5 Гц), 6,50 (д, 1H, J=9,0 Гц), 5,56 (т, J=6,6 Гц, 1H), 4,83 (кв, 1H, J=9,0 Гц), 4,41 (т, 1H, J=9,0 Гц), 3,76 (м, 1H), 2,17 (м, 4H), 2,01 (с, 3H), 1,45 (м, 7H), 1,25 (м, 8H), 0,88 (с, 9H), 0,84 (м, 19H), 0,06 (с, 6H).
13C ЯМР (75 МГц, CDCl3) δ: 169,2, 166,8, 153,8, 136,2, 131,1, 123,9, 122,6, 108,7, 71,6, 59,2, 36,5, 33,7, 31,4, 29,5, 27,6, 26,1, 21,3, 19,5, 18,5, 14,0, 11,8, -4,3, -4,4.
Синтез промежуточного продукта 13а
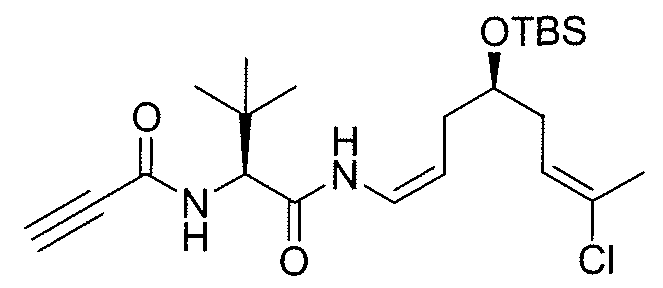
К раствору 11a (120 мг, 0,30 ммоль) и пропиоловой кислоты (23 мкл, 0,37 ммоль) в безводном ДХМ/ДМФА 10:1 (4,2 мл) добавляют при 0°C HATU (113 мг, 0,30 ммоль), HOAt (40 мг, 0,30 ммоль) и DIPEA (0,78 мкл, 0,44 ммоль). Реакционную смесь перемешивают при 0°C в течение 30 мин и 2 час при комнатной температуре. Затем сырую смесь обрабатывают насыщенным водным раствором NH4Cl и экстрагируют CH2Cl2. Объединенные фильтраты промывают H2O. После сушки и выпаривания растворителя при пониженном давлении сырой продукт очищают методом колоночной хроматографии (смесь этилацетат/гексаны), получая чистое соединение 13a (50 мг, выход; 40%).
1H ЯМР (300 МГц, CDCl3) δ: 8,20 (д, 1H, J=10,2 Гц), 6,83 (д, 1H, J=9,6 Гц), 6,72 (т, 1H, J=9,3 Гц), 5,55 (т, 1H, J=6,9 Гц), 4,88 (кв, 1H, J=8,7 Гц), 4,58 (д, 1H, J=9,6 Гц), 3,75 (м, 1H), 2,90 (с, 1H), 2,17 (м, 4H), 2,00 (с, 3H), 1,02 (с, 9H), 0,87 (с, 9H), 0,05 (с, 3H), 0,04 (с, 3H).
13C ЯМР (75 МГц, CDCl3) δ: 167,5, 152,1, 131,0, 124,1, 122,3, 109,4, 77,1, 74,8, 71,7, 60,9, 36,5, 35,7, 33,8, 26,7, 26,1, 21,2, 18,3, -4,3, -4,4.
Синтез промежуточного продукта 13b
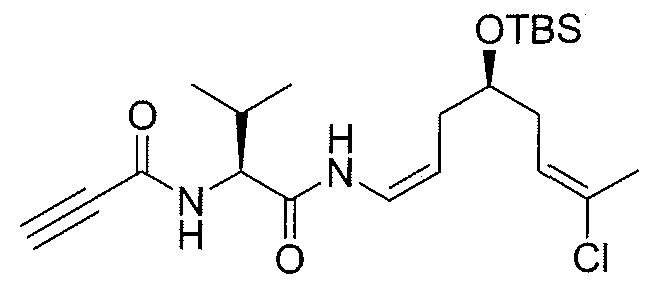
К раствору 11b (200 мг, 0,51 ммоль) и пропиоловой кислоты (39 мкл, 0,64 ммоль) в безводном ДХМ/ДМФА 10:1 (8 мл) добавляют при 0°C HATU (194 мг, 0,51 ммоль), HOAt (69 мг, 0,51 ммоль) и DIPEA (133 мкл, 0,76 ммоль). Реакционную смесь перемешивают при 0°C в течение 30 мин и 2 час при комнатной температуре. Затем сырую смесь обрабатывают насыщенным водным раствором NH4Cl и экстрагируют CH2Cl2. Объединенные фильтраты промывают H2O. После сушки и выпаривания растворителя при пониженном давлении сырой продукт очищают методом колоночной хроматографии (смесь этилацетат/гексаны), получая чистое соединение 13b (150 мг, выход: 67%).
1H ЯМР (300 МГц, CDCl3) δ: 7,02 (д, 1H, J=11,4 Гц), 6,75 (дд, 1H, J=10,8, 9,0 Гц), 6,53 (д, 1H, J=10,2 Гц), 5,58 (дд, 1H, J=9,0, 7,8 Гц), 4,87 (кв, 1H, J=7,8 Гц), 4,33 (дд, 1H, J=8,7, 6,3 Гц), 3,84-3,76 (м, 1H), 2,83 (с, 1H), 2,23-2,11 (м, 5H), 2,05-2,03 (м, 3H), 0,99 (д, 6H, J=6,9 Гц), 0,89 (с, 9H), 0,08 (с, 3H), 0,06 (с, 3H).
ПРИМЕР 2: СИНТЕЗ ФРАГМЕНТА 18
Схема 2 представляет пример синтеза фрагмента 18.
Схема 2

Синтез промежуточного продукта 14
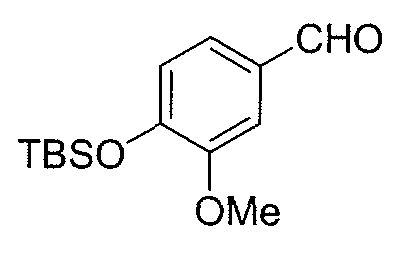
К раствору 4-гидрокси-3-метоксибензальдегида (1 г, 6,57 ммоль) в безводном ДХМ (14 мл) добавляют в атмосфере N2 и при 0°C имидазол (1,118 г, 8,21 ммоль) и трет-бутилдиметилсилилхлорид (1,084 г, 7,22 ммоль). Через 3 час при комнатной температуре реакционную смесь гасят 0,5N раствором HCl и разбавляют CH2Cl2 (100 мл). Объединенные органические слои промывают насыщенным водным раствором NaHCO3 и насыщенным раствором соли. Органическую фазу сушат над безводным Na2SO4, фильтруют и концентрируют, получая 1,71 г (выход: 98%) альдегида 14.
1H ЯМР (300 МГц, CDCl3) δ: 9,84 (с, 1H), 7,40-7,36 (м, 2H), 6,96 (д, 1H, J=7,8 Гц), 3,87 (с, 3H), 1,00 (с, 9H), 0,19 (с, 6H).
Синтез промежуточного продукта 15
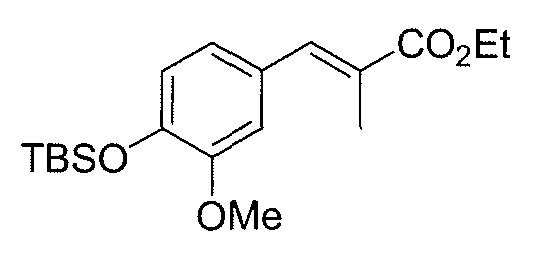
Поверх раствора альдегида 14 (1 г, 3,75 ммоль) в толуоле (20 мл) добавляют карбоэтоксиэтилиден-трифенилфосфоран (3,4 г, 9,38 ммоль) и смесь нагревают при 60°C в течение 2,5 час. Затем растворитель удаляют при пониженном давлении и полученное масло очищают методом колоночной хроматографии (гексан/EtOAc 12:1), получая 1,1 г (выход: 81%) сложноэфирного соединения 15.
1H ЯМР (300 МГц, CDCl3) δ: 7,62 (с, 1H), 6,96-6,85 (м, 3H), 4,26 (кв, 2H, J=7,2 Гц), 3,82 (с, 3H), 2,14 (с, 3H), 1,34 (т, 3H, J=7,2 Гц), 1,00 (с, 9H), 0,18 (с, 6H).
Синтез промежуточного продукта 16
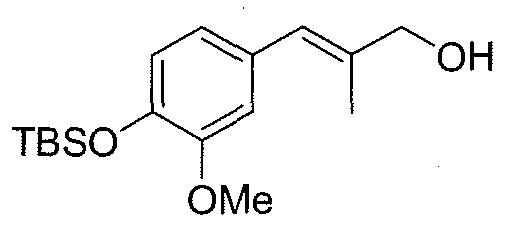
Поверх охлажденного до -78°C раствора сложного эфира 15 (640 мг, 1,746 ммоль) в безводном ТГФ (8,7 мл) добавляют в атмосфере N2, 1M диизобутилалюминийгидрид (DIBAL) в толуоле (3,84 мл, 3,84 ммоль) за период 10 мин и смесь перемешивают при -78°C. Через 4 час реакционную смесь гасят MeOH (0,16 мл) и добавляют насыщенный водный раствор натрий-калий тартрата (15 мл) и разбавляют EtOAc. Эту смесь перемешивают в течение 1 час и затем органический слой декантируют. Водный остаток экстрагируют дополнительным количеством EtOAc и объединенные органические слои сушат над безводным Na2SO4 и выпаривают растворитель. Полученное масло очищают методом колоночной хроматографии (гексан/EtOAc от 9:1 до 6:4), получая 360 мг (выход; 68%) спирта 16.
1H ЯМР (300 МГц, CDCl3) δ: 6,80-6,76 (м, 3H), 6,43 (ушир.с, 1H), 4,16 (д, 2H, J=3,3 Гц), 3,79 (с, 3H), 1,91 (с, 3H), 1,00 (с, 9H), 0,16 (с, 6H).
Синтез промежуточного продукта 17

Поверх раствора спирта 16 (270 мг, 0,875 ммоль) в этиловом эфире (4,4 мл) добавляют в атмосфере N2 MnO2 (1,141 г, 13,12 ммоль) и смесь перемешивают при комнатной температуре в течение 2 час. Эту смесь фильтруют на колонке с силикагелем, элюируя EtOAc и полученный раствор сушат при пониженном давлении, получая 256 мг (выход: 96%) альдегида 17.
1H ЯМР (300 МГц, CDCl3) δ: 9,54 (с, 1H), 7,18 (ушир.с, 1H), 7,109-7,081 (м, 2H), 6,92 (д, 1H, J=8,1 Гц), 3,86 (с, 3H), 2,10 (с, 3H), 1,00 (с, 9H), 0,19 (с, 6H).
Синтез промежуточного продукта 18
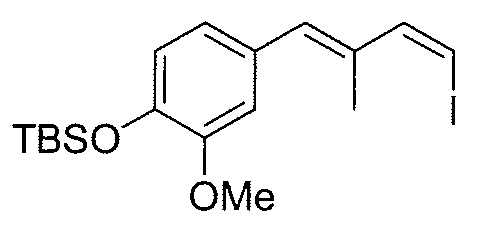
К суспензии йодметилтрифенилфосфиний йодида (Gilbert Stork, KZ. Tetrahedron letters 1989, 30 (17), 2173) (605 мг, 1,142 ммоль) в ТГФ (4,6 мл) медленно добавляют при комнатной температуре 1M раствор натрий гексаметилдисилазана (NaHMDS) (1,142 мл, 1,142 ммоль). После перемешивания в течение еще 2 мин раствор охлаждают до -78°C и добавляют раствор альдегида 17 (250 мг, 0,815 ммоль) в ТГФ (3 мл). Температуру поддерживают при -78°C в течение 2 час при перемешивании реакционной смеси. Добавляют гексан и полученную суспензию фильтруют через Celite® и промывают дополнительным количеством гексана. Фильтрат выпаривают при пониженном давлении и полученное масло очищают методом колоночной хроматографии (гексан/EtOAc от 100:0 до 20:1), получая 250 мг (выход: 71%) йодида 18.
1H ЯМР (300 МГц, CDCl3) δ: 6,92 (д, 1H, J=8,1 Гц), 6,83 (ушир.с, 3H), 6,66 (с, 1H), 6,25 (д, 1H, J=8,1 Гц) 3,82 (с, 3H), 2,18 (с, 3H), 1,00 (с, 9H), 0,18 (с, 6H).
ПРИМЕР 3: СИНТЕЗ ФРАГМЕНТА 22
Схема 3 представляет пример синтеза фрагмента 22.
Схема 3
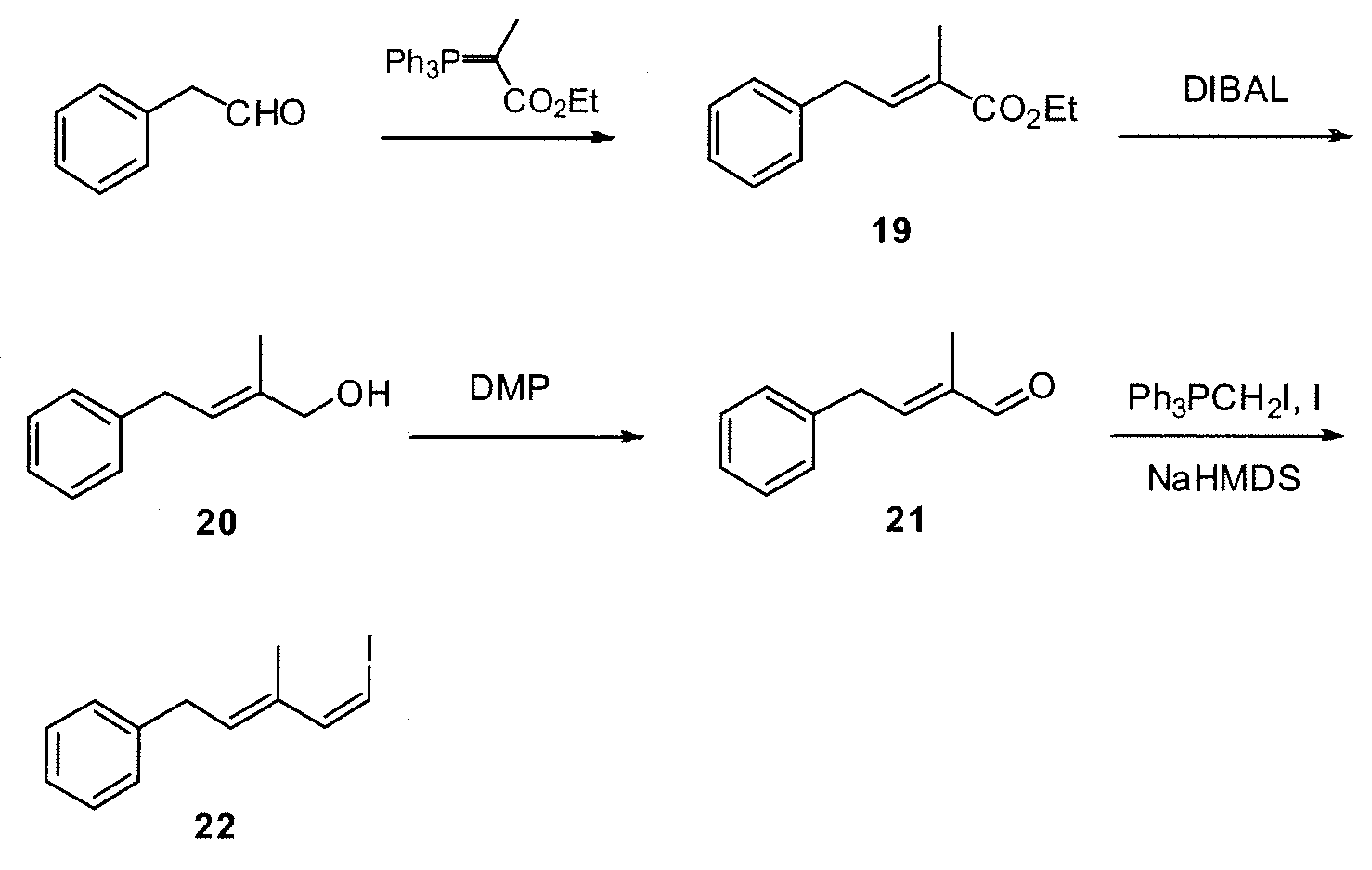
Синтез промежуточного продукта 19

Поверх раствора фенилацетальдегида (100 мг, 0,83 ммоль) в толуоле (5,0 мл) добавляют карбоэтоксиэтилиден-трифенилфосфоран (754 мг, 2,08 ммоль) и смесь перемешивают при комнатной температуре в течение 18 час. Затем удаляют растворитель при пониженном давлении и полученное масло очищают методом колоночной хроматографии (смесь этилацетат/гексаны), получая 150 мг (90% выход) чистого сложноэфирного соединения 19.
1H ЯМР (300 МГц, CDCl3) δ: 7,35-7,18 (м, 5H), 6,94 (т, 1H, J=7,5 Гц), 4,20 (кв, 2H, J=7,2 Гц), 3,54 (д, 2H, J=7,8 Гц), 1,97 (с, 3H), 1,29 (т, 3H, J=7,2 Гц).
Синтез промежуточного продукта 20

Поверх охлажденного до -78°C раствора сложного эфира 19 (150 мг, 0,73 ммоль) в безводном ТГФ (3,6 мл) добавляют в атмосфере N2, 1M диизобутилалюминий гидрид (DIBAL) в толуоле (1,62 мл, 1,62 моль) за 5 мин и смесь перемешивают при -78°C. Через 4 час реакционную смесь гасят посредством MeOH (0,7 мл), добавляют насыщенный водный раствор натрий-калий тартрата (4 мл) и разбавляют EtOAc (10 мл). Эту смесь перемешивают в течение 2 час и затем органический слой декантируют. Водный остаток экстрагируют дополнительным количеством EtOAc (2×15 мл), объединенные органические слои сушат (безводный Na2SO4) и выпаривают растворитель, получая 110 мг (выход: 92%) спирта 20, который используют без дополнительной очистки.
1H ЯМР (300 МГц, CDCl3) δ: 7,32 (м, 3H), 7,23 (м, 2H), 5,64 (т, 1H, J=6,3 Гц), 4,04 (с, 2H), 3,43 (д, 2H, J=7,2 Гц), 2,19 (ушир.с, 1H), 1,80 (с, 3H).
Синтез промежуточного продукта 21

Поверх раствора спирта 20 (96 мг, 0,59 ммоль) в дихлорметане (3,8 мл) добавляют в атмосфере N2 периодинан Десса-Мартина (DMP) (502 мг, 1,18 моль) и смесь перемешивают при комнатной температуре в течение 2 час. Эту смесь гасят насыщенным водным раствором NH4Cl (3 мл) и разбавляют дихлорметаном (5 мл). Органическую фазу сушат над безводным Na2SO4 и выпаривают при пониженном давлении. Очистка методом колоночной хроматографии (гексан/этилацетат 10:1) дает чистый альдегид 21 (75 мг, выход: 80%).
1H ЯМР (300 МГц, CDCl3) δ: 9,43 (с, 1H), 7,35-7,18 (м, 5H), 6,64 (т, 1H, J=7,2 Гц), 3,43 (д, 2H, J=7,2 Гц), 1,88 (с, 3H).
13C ЯМР (75 МГц, CDCl3) δ: 195,3, 152,4, 139,8, 138,4, 129,1, 128,7, 127,0, 62,2, 35,4.
Синтез промежуточного продукта 22
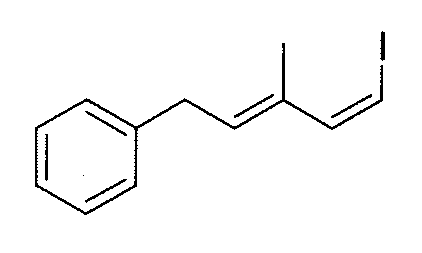
К суспензии йодметилтрифенилфосфиний йодида (Gilbert Stork, KZ. Tetrahedron letters, 1989, 30(17), 2173) (347 мг, 0,66 ммоль) в ТГФ (2,7 мл) медленно добавляют при комнатной температуре 1M раствор натрий гексаметилдисилазана (NaHMDS) (0,66 мл, 0,66 ммоль) в ТГФ. После перемешивания еще в течение 2 мин раствор охлаждают до -78°C и добавляют раствор альдегида 21 (75 мг, 0,47 ммоль) в ТГФ (1,75 мл).
Температуру поддерживают при -78°C в течение 2 час при перемешивании реакционной смеси. Добавляют гексан (25 мл) и полученную суспензию фильтруют через Celite® и промывают дополнительным количеством гексана (50 мл). Фильтрат выпаривают при пониженном давлении и полученное масло очищают методом колоночной хроматографии (гексан/EtOAc от 20:1 до 15:1), получая 82 мг (выход: 62%) йодида 22.
1H ЯМР (300 МГц, CDCl3) δ: 7,35-7,18 (м, 5H), 6,82 (д, 1H, J=8,4 Гц), 6,17 (дд, 1H, J=8,4 Гц), 5,90 (тт, 1H, J=7,5, 1,2 Гц), 3,50 (д, 2H, J=7,5 Гц), 2,03 (с, 3H).
ПРИМЕР 4: СИНТЕЗ ФРАГМЕНТА 26
Схема 4 представляет пример синтеза фрагмента 26.
Схема 4
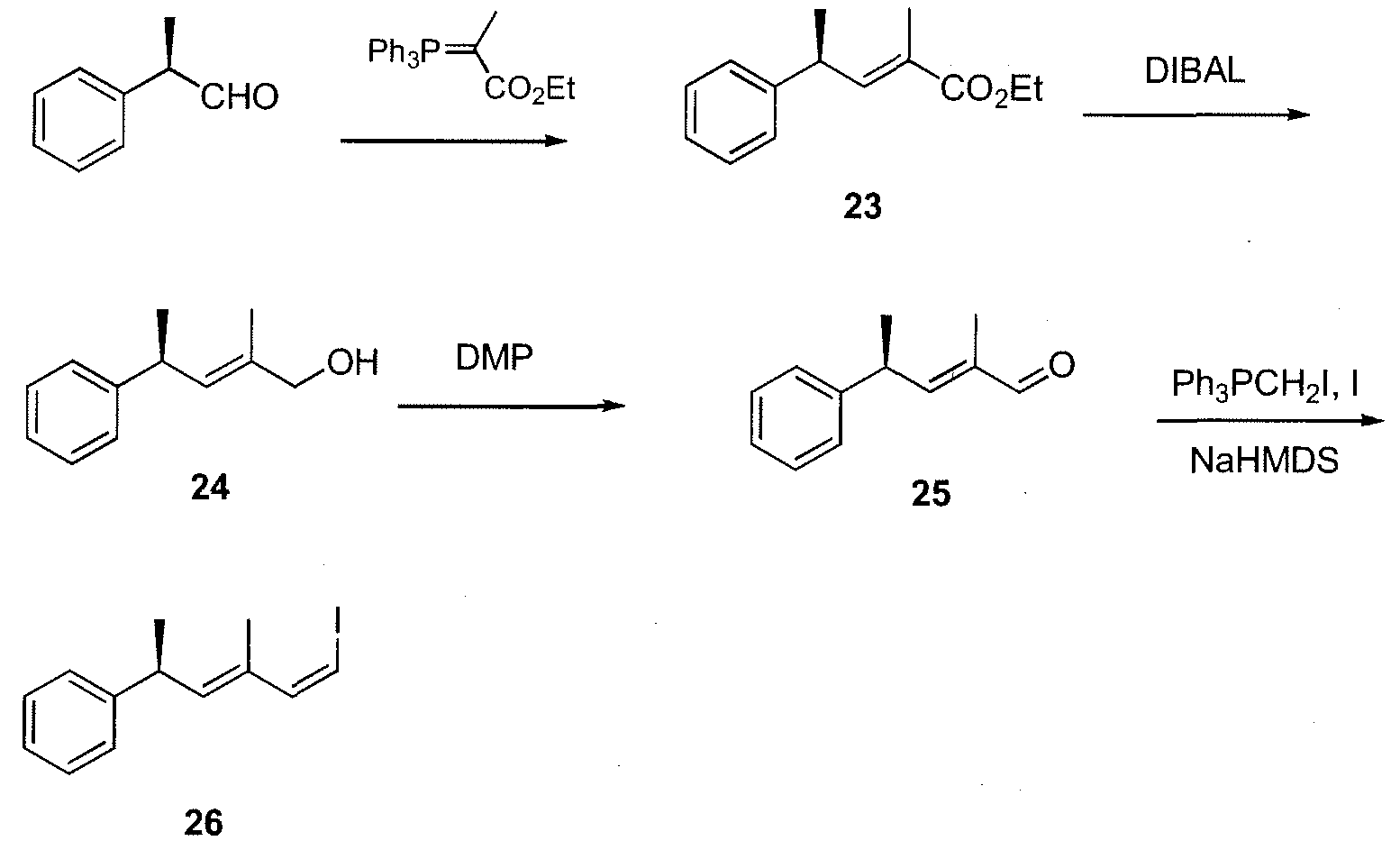
Синтез промежуточного продукта 23
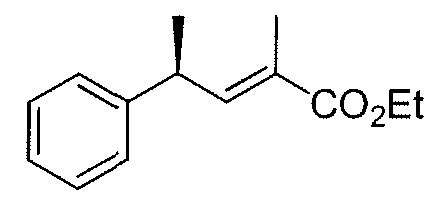
Поверх раствора (R)-2-фенилпропанала (полученного по методике, описанной в Tetrahedron Asymmetry 1998, 1929-1931) (80 мг, 0,59 ммоль) в толуоле (2,8 мл) добавляют карбоэтоксиэтилидентрифенилфосфоран (540 мг, 1,49 ммоль) и смесь перемешивают при комнатной температуре в течение 4 час. Затем растворитель удаляют при пониженном давлении и полученное масло очищают методом колоночной хроматографии (гексан/EtOAc 10:1), получая 70 мг (55% выход) сложноэфирного соединения 23.
1H ЯМР (300 МГц, CDCl3) δ: 7,34-7,19 (м, 5H), 6,87 (д.кв., 1H, J=9,9, 1,4 Гц), 4,18 (кв, 2H, J=7,1 Гц), 3,80 (м, 1H), 1,92 (д, 3H, J=1,4 Гц), 1,41 (д, 3H, J=7,0 Гц), 1,29 (т, 3H, J=7,1 Гц).
Синтез промежуточного продукта 24

Поверх охлажденного до -78°C раствора сложного эфира 23 (70 мг, 0,321 ммоль) в безводном ТГФ (1,6 мл) добавляют в атмосфере N2 1M диизобутилалюминийгидрид (DIBAL) в толуоле (0,71 мл, 0,71 ммоль) и смесь перемешивают при -78°C. Через 4 час реакцию гасят MeOH (0,4 мл), добавляют насыщенный водный раствор натрий-калий тартрата (1,5 мл) и разбавляют EtOAc (6 мл). Эту смесь перемешивают в течение 1 час и затем органический слой декантируют. Водный остаток экстрагируют дополнительным количеством EtOAc (2×6 мл), объединенные органические слои сушат (безводный Na2SO4) и выпаривают растворитель. Полученное масло очищают методом колоночной хроматографии (гексан/EtOAc 5:1), получая 40 мг (75% выход) спирта 24 в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ: 7,34-7,16 (м, 5H), 5,57 (дкв., 1H, J=9,4, 1,2 Гц), 4,00 (с, 2H), 3,71 (м, 1H), 1,75 (д, 3H, J=1,2 Гц), 1,35 (д, 3H, J=7,0 Гц).
13C ЯМР (75 МГц, CDCl3) δ: 146,7, 133,9, 131,4, 128,7, 127,1, 126,2, 68,9, 37,9, 22,3, 14,1.
Синтез промежуточного продукта 25
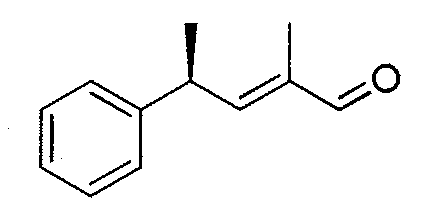
Поверх раствора спирта 24 (40 мг, 0,226 ммоль) в дихлорметане (1,5 мл) добавляют в атмосфере N2 периодинан Десс-Мартина (DMP) (193 мг, 0,454 моль) и смесь перемешивают при комнатной температуре в течение 2 час. Эту смесь гасят насыщенным водным раствором NaHCO3 (2 мл) и разбавляют дихлорметаном (5 мл). Органическую фазу сушат над безводным Na2SO4 и выпаривают при пониженном давлении. Очистка методом колоночной хроматографии (гексан/EtOAc 10:1) дает чистый альдегид 25 (18 мг, 50% выход) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ: 9,42 (с, 1H), 7,39-7,23 (м, 5H), 6,56 (дкв., 1H, J=9,7, 0,9 Гц), 4,00 (м, 1H), 1,83 (с, 3H), 1,47 (д, 3H, J=7,0 Гц).
13C ЯМР (75 МГц, CDCl3) δ: 195,6, 158,2, 143,8, 137,9, 129,1, 127,2, 127,1, 39,1, 21,1, 9,6.
Синтез промежуточного продукта 26
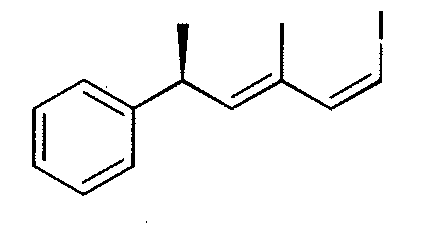
К суспензии йодметилтрифенилфосфиниййодида (Gilbert Stork, KZ. Tetrahedron letters, 1989, 30(17), 2173) (77 мг, 0,144 ммоль) в ТГФ (0,6 мл) медленно добавляют при комнатной температуре 1M раствор гексаметилдисилазана натрия (NaHMDS) в ТГФ (0,144 мл, 0,144 ммоль). После перемешивания еще в течение 2 мин раствор охлаждают до -78°C и добавляют раствор альдегида 25 (18 мг, 0,103 ммоль) в ТГФ (0,5 мл).
Температуру поддерживают при -78°C в течение 2 час при перемешивании реакционной смеси. Добавляют гексан (15 мл) и полученную суспензию фильтруют через Celite® и промывают дополнительным количеством гексана (30 мл).
Фильтрат выпаривают при пониженном давлении и полученное масло очищают методом колоночной хроматографии (гексан/EtOAc 10:1), получая 22 мг (72% выход) йодида 26 в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ: 7,34-7,17 (м, 5H), 6,73 (д, 1H, J=8,4 Гц), 6,14 (д, 1H, J=8,4 Гц), 5,83 (д, 1H, J=9,5 Гц), 3,79 (м, 1H), 1,95 (с, 3H), 1,40 (д, 3H, J=7,0 Гц).
13C ЯМР (75 МГц, CDCl3) δ: 145,9, 142,3, 139,1, 131,9, 128,7, 127,3, 127,2, 126,3, 38,4, 22,1, 16,0.
ПРИМЕР 5: СИНТЕЗ ФРАГМЕНТА 29
Схема 5 представляет пример синтеза фрагмента 29.
Схема 5
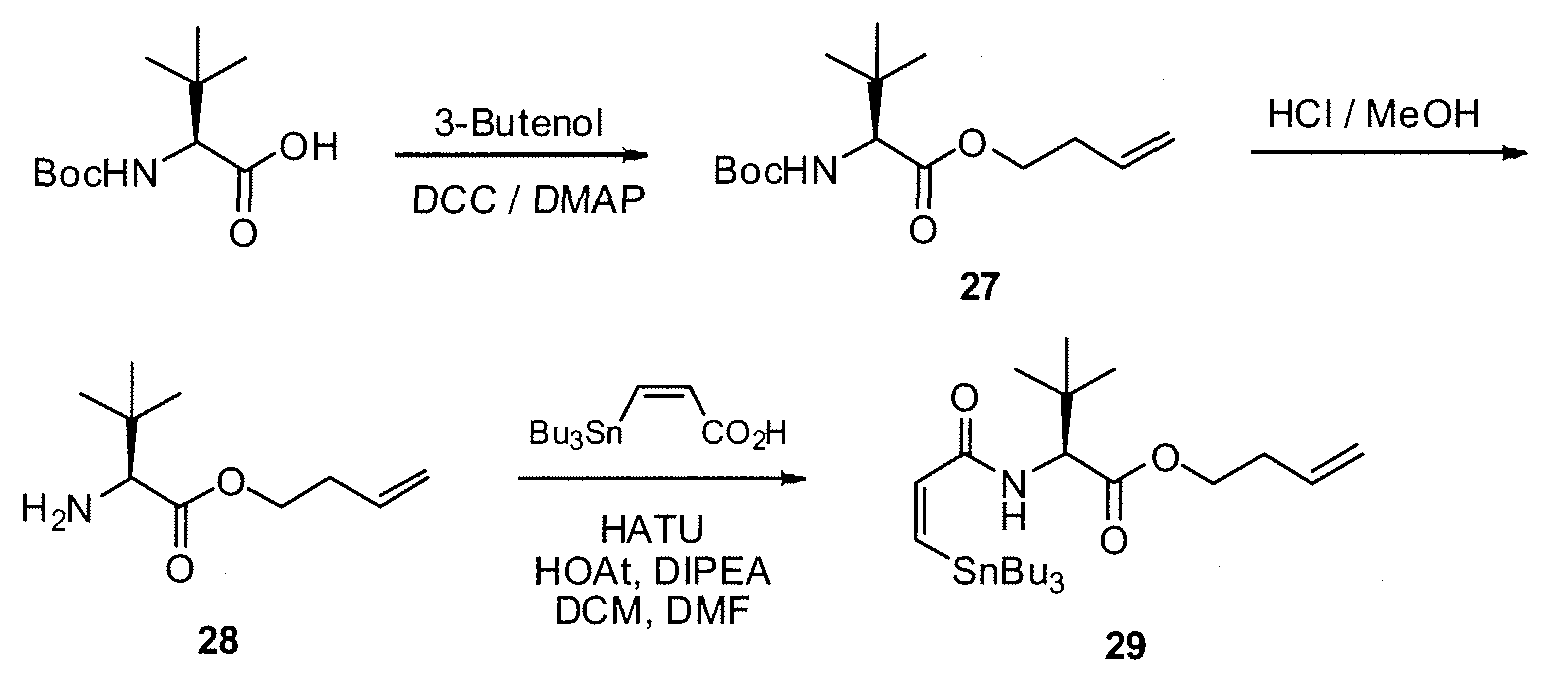
Синтез промежуточного продукта 27

К смеси L-Boc-трет-лейцина (300 мг, 1,3 ммоль) в безводном ДХМ (13 мл) и дициклогексилкарбодиимида (DCC) (295 мг, 1,43 ммоль) добавляют при 0°C в атмосфере N2 3-бутенол (0,3 мл, 3,9 ммоль) и диметиламинопиридин (DMAP) (15,9 мг, 0,13 ммоль). Реакционную смесь перемешивают в течение 5 мин при 0°C и 4 час при комнатной температуре. Органический растворитель выпаривают при пониженном давлении и полученное твердое вещество очищают методом колоночной хроматографии (гексан/EtOAc 10:1), получая 300 мг (выход: 81%) сложного эфира 27.
1H ЯМР (300 МГц, CDCl3) δ: 5,82-5,71 (м, 1H), 5,14-5,06 (м, 2H), 4,24-4,12 (м, 2H), 4,08 (д, 1H, J=9,8 Гц), 2,41 (кв, 2H, J=6,7 Гц), 1,43 (с, 9H), 0,96 (с, 9H).
Синтез промежуточного продукта 28
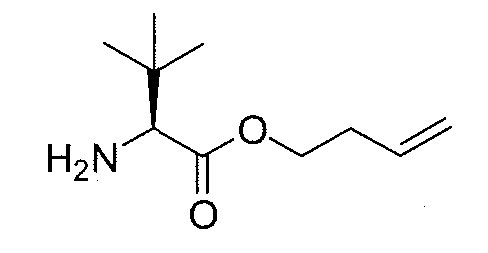
Раствор сложного эфира 27 (180 мг, 0,63 ммоль) в 1M HCl·MeOH (3,6 мл) перемешивают при комнатной температуре в течение 24 час. Органический растворитель выпаривают при пониженном давлении и полученное твердое вещество разводят в ДХМ и промывают H2O. Полученную органическую фазу сушат над безводным Na2SO4, фильтруют и растворитель выпаривают, получая 116 мг (выход: 100%) 28.
1H ЯМР (300 МГц, CDCl3) δ: 5,85-5,72 (м, 1H), 5,15-5,06 (м, 2H), 4,16 (т, 2H, J=6,7 Гц), 3,15 (с, 1H), 4,44-4,37 (м, 2H), 0,96 (с, 9H).
Синтез промежуточного продукта 29
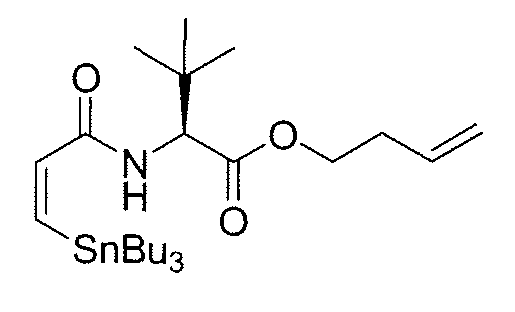
DIPEA (0,24 мл, 1,4 ммоль), HOAt (123,3 мг, 0,9 ммоль) и HATU (345 мг, 0,9 ммоль) добавляют к раствору 28 (168 мг, 0,9 ммоль) и (Z)-3-трибутилстаннилпропеноевой кислоты (393 мг, 1,2 ммоль) в ДХМ/ДМФА (10:1, 14 мл) при 0°C в атмосфере N2. Через 2 час холодную баню удаляют и реакционную смесь перемешивают при комнатной температуре в течение 1 час, гасят насыщенным водным раствором NH4Cl, выливают в воду и экстрагируют ДХМ. Объединенные органические фазы сушат над безводным Na2SO4, фильтруют и концентрируют. Остаток очищают методом флэш-хроматографии (гексан/EtOAc от 15:1 до 10:1), получая 29 (340 мг; выход: 72%).
1H ЯМР (300 МГц, CDCl3) δ: 7,01 (д, 1H, J=12,3 Гц), 6,75 (д, 1H, J=12,3 Гц), 6,03 (д, NH, J=9,73 Гц), 5,84-5,69 (м, 1H), 5,14-5,05 (м, 2H), 4,60 (д, 1H, J=9,76 Гц), 4,19-4,14 (м, 2H), 2,40 (кв, 2H, J=6,70 Гц), 1,48-1,40 (м, 6H), 1,31-1,19 (м, 6H), 0,96 (с, 9H), 0,93-0,83 (м, 15H).
ПРИМЕР 6
Схема 6 представляет синтез некоторых соединений по изобретению.
Схема 6

Синтез соединения 30

К раствору алкенилстаннана 12a (130 мг, 0,174 ммоль) и 18 (90 мг, 0,209 ммоль) в 1-метил-2-пирролидиноне (NMP) (1,75 мл) при 0°C добавляют тиофенкарбоксилат меди (CuTC) (49,6 мг, 0,261 ммоль). Реакционную смесь перемешивают при 0°C в течение 45 мин и 20 мин при комнатной температуре. Затем сырую смесь фильтруют через слой из нейтрального оксида алюминия, промывают смесью EtOAc/простой эфир 50:50 и объединенные фильтраты промывают 0,5N HCl (3×15 мл). Органический раствор сушат и выпаривают, получая сырой продукт, который очищают методом колоночной хроматографии (гексан/EtOAc от 8:1 до 1:1), получая триен 30 (65 мг, выход: 49%) в виде масла.
1H ЯМР (CDCl3, 300 МГц) δ: 7,64 (д, 1H, J=11,1 Гц), 7,33 (дд, 1Н, J=11,7, 11,4 Гц), 7,04 (дд, 1H, J=12,0, 11,1 Гц), 6,83-6,81 (м, 3H), 6,77-6,70 (м, 1Н), 6,45 (ушир.с, 1Н), 6,33 (д, 1H, J=11,7 Гц), 6,22 (д, 1H, J=9,0 Гц), 5,64 (д, 1H, J=11,4 Гц), 5,62-5,56 (м, 1H), 4,89-4,80 (м, 1H), 4,36 (д, 1H, J=9,3 Гц), 3,81 (с, 3H), 3,80-3,78 (м, 1H), 2,23-2,14 (м, 4H), 2,08 (с, 3H), 2,03 (с, 3H), 1,05 (с, 9H), 1,00 (с, 9H), 0,89 (с, 9H), 0,17 (с, 6H), 0,08 (с, 3H), 0,06 (с, 3H).
Синтез соединения 31
К раствору 30 (60 мг, 0,08 ммоль) в ТГФ (1,5 мл) добавляют в атмосфере N2 и при комнатной температуре 1M тетрабутиламмоний фторид (TBAF) в ТГФ (0,23 мл, 0,23 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 18 час и затем гасят насыщенным водным раствором NH4Cl и экстрагируют EtOAc. Объединенные органические фазы сушат над безводным Na2SO4, фильтруют и концентрируют. Остаток очищают методом флэш-хроматографии (гексан/EtOAc от 5:1 до 1:1), получая спирт 31 (25,4 мг; выход: 60%) в виде белого твердого вещества.
1H ЯМР (300 МГц, CDCl3) δ: 8,74 (д, 1H, J=10,2 Гц), 7,77-7,68 (м, 1H), 6,90-6,50 (м, 4H), 6,61-6,57 (м, 3H), 6,36 (д, 1H, J=9,0 Гц), 5,62 (м, 2H), 4,86 (кв, 1H, J=8,5 Гц), 4,37 (д, 1H, J=9,0 Гц), 3,90 (с, 3H), 3,77 (м, 1H), 2,67 (ушир.с, 1H), 2,20 (м, 4H), 2,09 (с, 3H), 2,07 (с, 3H), 1,05 (с, 9H).
ПРИМЕР 7
Схема 7 представляет синтез некоторых соединений по изобретению.
Схема 7
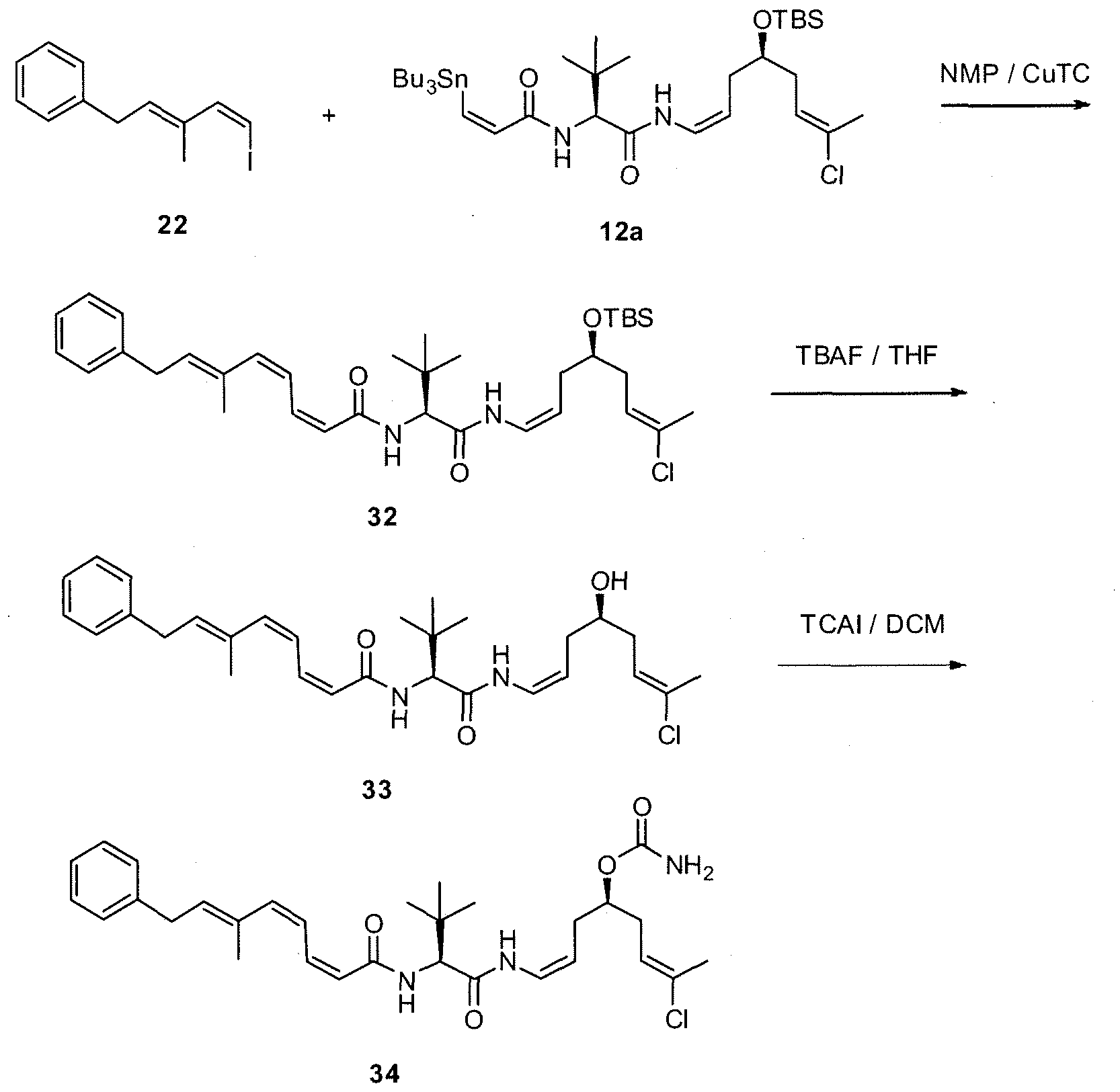
Синтез соединения 32

К раствору алкенилстаннана 12a (42 мг, 0,056 ммоль) и йодида 22 (20 мг, 0,067 ммоль) в 1-метил-2-пирролидиноне (NMP) (0,6 мл) добавляют при 0°C тиофенкарбоксилат меди (CuTC) (16 мг, 0,084 ммоль). Реакционную смесь перемешивают при 0°C в течение 45 мин и 20 мин при комнатной температуре. Затем сырую смесь фильтруют через слой из нейтрального оксида алюминия, промывают смесью EtOAc/Эфир 50:50 и объединенные фильтраты промывают 0,5N HCl (3×5 мл). Органический раствор сушат и выпаривают, получая сырой продукт, который очищают методом колоночной хроматографии (гексан/EtOAc от 12:1 до 6:1), получая триен 32 (15 мг, выход: 45%) в виде масла.
1H ЯМР (300 МГц, CDCl3) δ: 7,67 (д, 1H, J=10,8 Гц), 7,35-7,18 (м, 6H), 6,92 (т, 1H, J=11,4 Гц), 6,72 (т, 1H, J=10,8 Гц), 6,22 (м, 2H), 5,69 (т, 1H, J=7,5 Гц), 5,58 (м, 2H), 4,82 (кв, 1H, J=8,7 Гц), 4,35 (д, 1H, J=9,3 Гц), 3,75 (м, 1H), 3,49 (д, 2H, J=7,5 Гц), 2,15 (м, 4H), 2,02 (с, 3H), 1,91 (с, 3H), 1,02 (с, 9H), 0,88 (с, 9H), 0,06 (с, 3H), 0,05 (с, 3H).
Синтез соединения 33

К раствору 32 (15 мг, 0,024 ммоль) в ТГФ (0,5 мл) добавляют в атмосфере N2 и при комнатной температуре 1M TBAF в безводном ТГФ (0,05 мл, 0,05 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 18 час и затем гасят насыщенным водным раствором NH4Cl и экстрагируют EtOAc. Объединенные органические фазы сушат над безводным Na2SO4, фильтруют и концентрируют. Остаток очищают методом флэш-хроматографии (гексан/EtOAc от 3:1 до 1:2), получая спирт 33 (4 мг, выход; 35%).
1H ЯМР (300 МГц, CDCl3) δ: 8,76 (д, 1H, J=9,6 Гц), 7,35-7,17 (м, 6H), 6,96 (т, 1H, J=11,4 Гц), 6,76 (т, 1H, J=8,4 Гц), 6,21 (м, 2H), 5,69 (т, 1H, J=7,5 Гц), 5,61 (м, 2H), 4,87 (кв, 1H, J=8,1 Гц), 4,29 (д, 1H, J=9,3 Гц), 3,77 (м, 1H), 3,49 (д, 2H, J=7,2 Гц), 2,2 (м, 4H), 2,06 (с, 3H), 1,91 (с, 3H), 1,02 (с, 9H).
MS (ES) m/z 499 (M+1)+, 521 (M+Na)+.
Синтез соединения 34

К раствору 33 (3 мг, 0,006 ммоль) в дихлорметане (0,4 мл) добавляют при комнатной температуре, трихлорацетилизоцианат (TCAI) (1 мкл, 0,0072 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 30 мин и затем добавляют нейтральный оксид алюминия. Смесь перемешивают в течение 30 мин и затем пропитывают ею слой из оксида алюминия. Продукт вымывают, используя смесь ДХМ/MeOH 50:1. Фильтрат выпаривают в вакууме, получая сырой продукт, который очищают методом колоночной хроматографии (гексан/EtOAc от 3:1 до 2:1), получая соединение 34 (2 мг, выход: 63%).
1H ЯМР (300 МГц, CDCl3) δ: 8,55 (д, 1H, J=11,4 Гц), 7,35-7,17 (м, 6H), 6,96 (т, 1H, J=11,1 Гц), 6,82 (т, 1H, J=8,4 Гц), 6,32 (д, 1H, J=9,3 Гц), 6,22 (д, 1H, J=10,5 Гц), 5,68 (т, 1H, J=7,5 Гц), 5,62 (м, 2H), 4,81 (кв, 1H, J=8,1 Гц), 4,46 (м, 1H), 4,42 (д, 1H, J=9,3 Гц), 3,50 (д, 2H, J=7,2 Гц), 2,34 (м, 4H), 2,06 (с, 3H), 1,91 (с, 3H), 1,03 (с, 9H).
ПРИМЕР 8
Схема 8 представляет синтез некоторых соединений по изобретению.
Схема 8

Синтез соединения 35

К раствору 29 (25 мг, 0,05 ммоль) и 18 (31 мг, 0,06 ммоль) в NMP (0,5 мл) при 0°C, добавляют тиофенкарбоксилат меди (CuTC, 13,5 мг, 1,5 ммоль). Реакционную смесь перемешивают при 0°C в течение 45 мин и при комнатной температуре в течение часа. Затем сырую смесь фильтруют через слой из нейтрального оксида алюминия, промывают смесью EtOAc/эфир 50:50 (20 мл) и объединенные фильтраты промывают 0,5N HCl (3×10 мл).
После сушки и выпаривания растворителя при пониженном давлении сырой продукт очищают методом колоночной хроматографии (EtOAc/гексан от 10:1 до 5:1), получая чистый 35 (5 мг, выход: 18%).
1H ЯМР (300 МГц, CDCl3) δ: 7,38 (м, 1H), 7,04 (м, 1H), 6,83-6,81 (м, 3H), 6,46 (с, 1H), 6,32 (д, 1H, J=11,1 Гц), 6,03 (д, 1H, J=9,3 Гц), 5,77 (м, 1H), 5,64 (д, 1H, J=11,4 Гц), 5,16-5,07 (м, 2H), 4,55 (д, 1H, J=9,6 Гц), 4,18 (м, 2H), 3,81 (с, 3H), 2,42 (м, 2H), 2,08 (с, 3H), 1,00 (м, 18H), 0,16 (с, 3H), 0,06 (с, 3H).
Синтез соединения 36
Раствор 35 (4 мг, 0,007 ммоль) в 1M HCl·MeOH (1,2 мл) перемешивают при комнатной температуре в течение 2 час и 30 мин. Органический растворитель выпаривают при пониженном давлении и полученный сырой продукт очищают методом колоночной хроматографии (этилацетат/гексан 10:1-1:10), получая чистый 36 (1,8 мг, выход: 60%).
1H ЯМР (300 МГц, CDCl3) δ: 7,31-7,26 (м, 1H), 7,00-6,92 (м, 4H), 6,60-6,55 (м, 2H), 6,03 (д, 1H, J=9,0 Гц), 5,82-5,71 (м, 1H), 5,65 (д, 1H, J=10,5 Гц), 5,14-5,06 (м, 2H), 4,58 (д, 1H, J=9,5 Гц), 4,17-4,08 (м, 2H), 3,90 (с, 3H), 2,54-2,39 (м, 2H), 2,01 (с, 3H), 1,03 (с, 9H).
ПРИМЕР 9
Схема 9 представляет синтез некоторых соединений по изобретению.
Схема 9

Синтез соединения 37

К раствору 12a (42 мг, 0,056 ммоль) и йодида 26 (20 мг, 0,067 ммоль) в 1-метил-2-пирролидиноне (NMP) (0,6 мл) добавляют при 0°C, тиофенкарбоксилат меди (CuTC) (16 мг, 0,084 ммоль). Реакционную смесь перемешивают при 0°C в течение 45 мин и при комнатной температуре в течение 20 мин. Затем сырую смесь фильтруют через слой из нейтрального оксида алюминия, промывают смесью EtOAc/Et2O 50:50 и объединенные фильтраты промывают 0,5N HCl (3×5 мл). Органический раствор сушат и выпаривают, получая сырой продукт, который очищают методом колоночной хроматографии (гексан/EtOAc от 7:1 до 5:1), получая триен 37 (9 мг, 26% выход) в виде масла.
1H ЯМР (300 МГц, CDCl3) δ: 7,63 (д, 1H, J=10,5 Гц), 7,33-7,15 (м, 6H), 6,90 (т, 1H, J=11,6 Гц), 6,73 (т, 1H, J=10,1 Гц), 6,19 (м, 2H), 5,61 (м, 3H), 4,82 (кв, 1H, J=8,8 Гц), 4,34 (д, 1H, J=9,3 Гц), 3,76 (м, 2H), 2,16 (м, 4H), 2,02 (с, 3H), 1,85 (с, 3H), 1,37 (д, 3H, J=7,0 Гц), 1,03 (с, 9H), 0,88 (с, 9H), 0,07 (с, 3H), 0,05 (с, 3H).
13C ЯМР (75 МГц, CDCl3) δ: 168,4, 166,4, 146,2, 141,2, 139,9, 137,9, 131,6, 131,2, 128,7, 127,1, 126,3, 124,0, 123,7, 122,5, 120,3, 108,6, 71,6, 60,6, 38,8, 36,5, 35,1, 33,8, 29,9, 26,8, 26,1, 22,4, 21,3, 17,1, -4,3, -4,4.
Синтез соединения 38

К раствору 37 (9 мг, 0,014 ммоль) в ТГФ (0,3 мл) добавляют в атмосфере N2 и при комнатной температуре, 1M TBAF в ТГФ (0,028 мл, 0,028 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 7 час, затем гасят насыщенным водным раствором NH4Cl и экстрагируют EtOAc. Объединенные органические фазы сушат над безводным Na2SO4, фильтруют и концентрируют. Остаток очищают методом флэш-хроматографии (гексан/EtOAc от 3:1 до 1:1), получая спирт 38 (4,5 мг, 62,5% выход) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ: 8,80 (д, 1H, J=10,2 Гц), 7,34-7,19 (м, 6H), 6,91 (т, 1H, J=11,7 Гц), 6,76 (т, 1H, J=9,2 Гц), 6,34 (д, 1H, J=8,8 Гц), 6,19 (д, 1H, J=11,6 Гц), 5,62 (м, 3H), 4,85 (кв, 1H, J=8,2 Гц), 4,33 (д, 1H, J=9,2 Гц), 3,75 (м, 2H), 2,77 (ушир.с, 1H), 2,18 (м, 4H), 2,06 (с, 3H), 1,85 (с, 3H), 1,36 (д, 3H, J=7,0 Гц), 1,03 (с, 9H).
Синтез соединения 39

К раствору 38 (3 мг, 0,006 ммоль) в дихлорметане (0,5 мл) добавляют при комнатной температуре трихлорацетилизоцианат (TCAI) (1 мкл, 0,0069 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 30 мин и затем добавляют нейтральный оксид алюминия (44 мг). Смесь перемешивают в течение 30 мин и затем пропитывают ею слой из оксида алюминия. Продукт вымывают, используя смесь дихлорметан/MeOH 50:1. Фильтрат выпаривают при пониженном давлении, получая сырой продукт, который очищают методом колоночной хроматографии (гексан/EtOAc от 3:1 до 1:1), получая соединение 39 (1,6 мг, 50% выход) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ: 8,58 (д, 1H, J=10,8 Гц), 7,32-7,19 (м, 6H), 6,91 (т, 1H, J=11,6 Гц), 6,84 (т, 1H, J=9,0 Гц), 6,33 (д, 1H, J=9,8 Гц), 6,18 (д, 1H, J=10,7 Гц), 5,61 (м, 3H), 4,80 (кв, 1H, J=8,9 Гц), 4,45 (м, 1H), 4,40 (д, 1H, J=9,5 Гц), 3,77 (м, 1H), 2,34 (м, 4H), 2,07 (с, 3H), 1,86 (с, 3H), 1,36 (д, 3H, J=7,0 Гц), 1,04 (с, 9H).
MS (ES) m/z 578,2 [M+Na]+.
ПРИМЕР 10: БИОИССЛЕДОВАНИЯ ПО ДЕТЕКТИРОВАНИЮ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТИ
Цель данного исследования - оценка in vitro цитостатической активности (способности замедлять или задерживают рост опухолевых клеток) или цитотоксической активности (способности убивать опухолевые клетки) исследуемых образцов.
Клеточные линии
ОЦЕНКА ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТИ С ПРИМЕНЕНИЕМ SBR-КОЛОРИМЕТРИЧЕСКОГО ИССЛЕДОВАНИЯ
Исследование колориметрического типа с использованием реакции сульфородамина B (SRB) адаптировано для количественного определения роста и жизнеспособности клеток (по методике, описанной в работе Skehan P et al. J., Natl. Cancer Inst. 1990, 82, 1107-1112).
В данной форме исследования используют SBS-стандартные 96-луночные микропланшеты для клеточных культур (Faircloth et al., Methods in Cell Science, 1988, 11(4), 201-205; Mosmann et al., Journal of Immunological. Methods, 1983, 65(1-2), 55-63). Все клеточные линии, используемые в данном исследовании, производные разных типов рака человека, получают от American Type Culture Collection (ATCC).
Клетки выдерживают в среде Игла, модифицированной Дульбекко (DMEM), дополненной 10% эмбриональной бычьей сывороткой (FBS), 2 мМ L-глутамина, 100 U/мл пенициллина и 100 U/мл стрептомицина при 37°C, 5% CO2 и 98% влажности. Для экспериментов собирают клетки из субконфлюентных культур с помощью трипсинизации и ресуспендируют в свободной среде перед подсчетом и посевом.
Клетки высевают на 96-луночные микротитровальные планшеты, 5×103 клеток на лунку при аликвотах 150 мкл и позволяют прикрепиться к поверхности планшета в течение 18 час в среде без лекарственного средства. Один контрольный (необработанный) планшет для каждой клеточной линии фиксируют (как описано ниже) и используют для получения референсного значения в нулевой момент времени. Впоследствии добавляют к культурам исследуемые образцы при десяти серийных разведениях и аликвотах 50 мкл, от 10 до 0,00262 мкг/мл. Через 48 час воздействия оценивают противоопухолевый эффект SRB-методом. Кратко говоря, клетки дважды промывают PBS, фиксируют в течение 15 мин в 1% растворе глутаральдегида, ополаскивают дважды в PBS и окрашивают в 0,4% растворе SRB в течение 30 мин при комнатной температуре. Затем клетки ополаскивают несколько раз 1% раствором уксусной кислоты и сушат на воздухе. Затем экстрагируют SRB в 10 мМ раствором основания Trizma и измеряют абсорбцию в автоматическом спектрофотометрическом считывающем устройстве для планшетов при 490 нм. Жизнеспособность клеток выражают как процентную долю роста контрольных клеток. Конечный эффект тестируемого образца оценивают, применяя NCI-алгоритм (Boyd MR и Paull KD, Drug Dev. Res. 1995, 34, 91-104).
Используя среднее значение ± квадратичное отклонение для троекратно тестированных культур, автоматически получают кривую доза-реакция, применяя нелинейный регрессионный анализ. Рассчитывают три параметра сравнения (NCI алгоритм) посредством автоматической интерполяции; GI50 = концентрация, которая дает 50% ингибирование роста; TGI = полное ингибирование роста (цитостатический эффект) и LC50 = концентрация, которая дает 50% гибель клеток (цитотоксический эффект).
Таблица 1 иллюстрирует данные по биологической активности соединений по настоящему изобретению.
Реферат
Изобретение относится к соединениям общей формулы (I), где Y выбран из -CR=CR- и -CHR-CR=CR-; каждый R, Rи Rнезависимо выбран из атома водорода и незамещенного C-Cалкила; каждый R, R, R, Rи Rнезависимо выбран из атома водорода и незамещенного C-Cалкила; Rвыбран из NRRи OR; W выбран из NR; Rпредставляет собой атом водорода; Rпредставляет собой атом водорода; Rпредставляет собой незамещенный C-Cалкенил; Rпредставляет собой замещенный C-Cалкенил, который замещен в одной или более позициях галогеном, OR', OCONHR' и OH, защищенная простым силиловым эфиром, где R' представляет собой водород; каждый из R, R, R, Rи Rнезависимо выбран из атома водорода, OR, OSiRRR; и каждый R, Rи Rнезависимо выбран из атома водорода и незамещенного C-Cалкила. Также изобретение относится к фармацевтической композиции, обладающей цитотоксической активностью, содержащей указанные соединения, к применению соединений формулы (I) для получения лекарственного средства для лечения рака и к способам получения соединений формулы (I). Технический результат - соединения формулы (I), обладающие цитотоксической активностью. 6 н. и 17 з.п. ф-лы, 10 cxем, 2 табл., 10 пр.
Формула
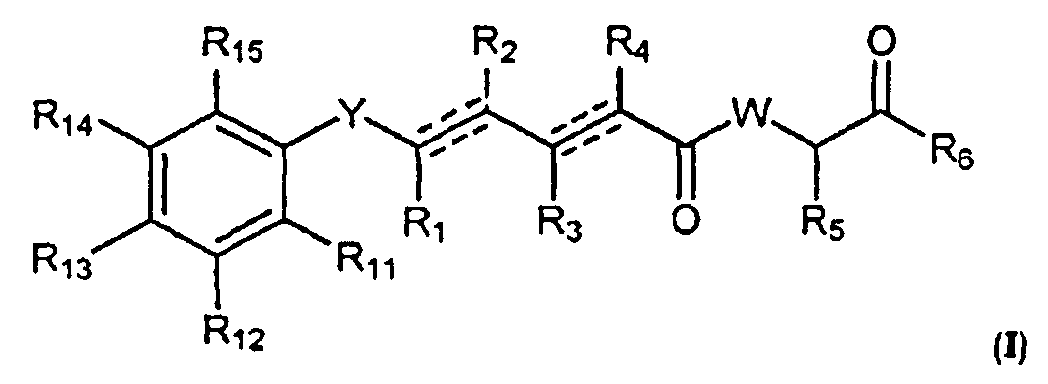
где Y выбран из -CRay=CRby- и -CHRay-CRby=CRcy-;
каждый Ray, Rby и Rcy независимо выбран из атома водорода и незамещенного С1-С12 алкила;
каждый R1, R2, R3, R4 и R5 независимо выбран из атома водорода и незамещенного C1-C12 алкила;
R6 выбран из NR8R9 и OR10;
W выбран из NR7;
R7 представляет собой атом водорода;
R8 представляет собой атом водорода;
R10 представляет собой незамещенный C2-C12 алкенил;
каждая пунктирная линия представляет необязательную дополнительную связь, при условии, что имеется одна или более дополнительных связей, но если имеется тройная связь между атомами C, к которым присоединены R1 и R2, то R1 и R2 отсутствуют, и если имеется тройная связь между атомами C, к которым присоединены R3 и R4, то R3 и R4 отсутствуют;
R9 представляет собой замещенный C2-C12 алкенил, который замещен в одной или более позициях галогеном, OR', OCONHR' и ОН, защищенная простым силиловым эфиром, где R' представляет собой водород;
каждый из R11, R12, R13, R14 и R15 независимо выбран из атома водорода, ORa, OSiRaRbRc; и
каждый Ra, Rb и Rc независимо выбран из атома водорода и незамещенного C1-C12 алкила; и
или его фармацевтически приемлемая соль, таутомер или стереоизомер.

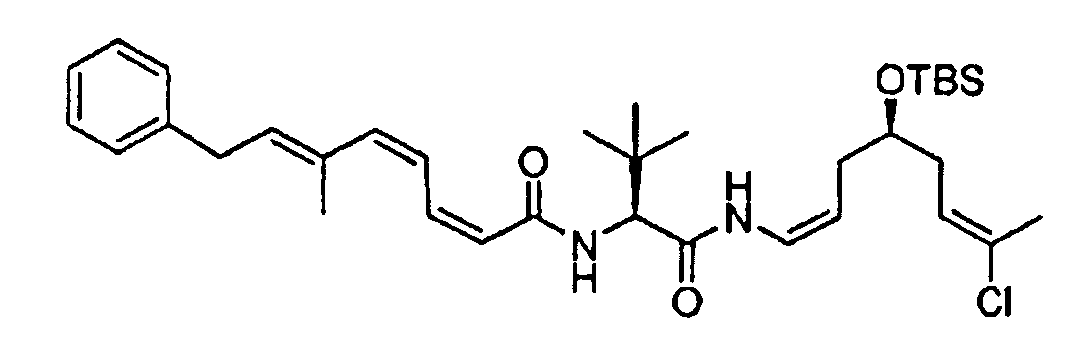
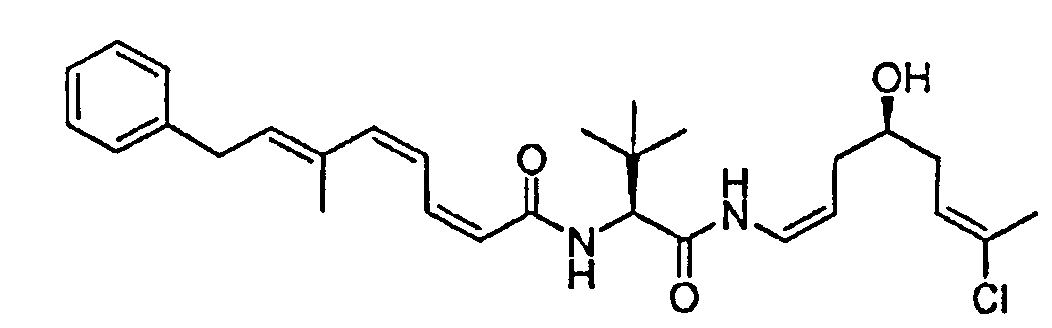
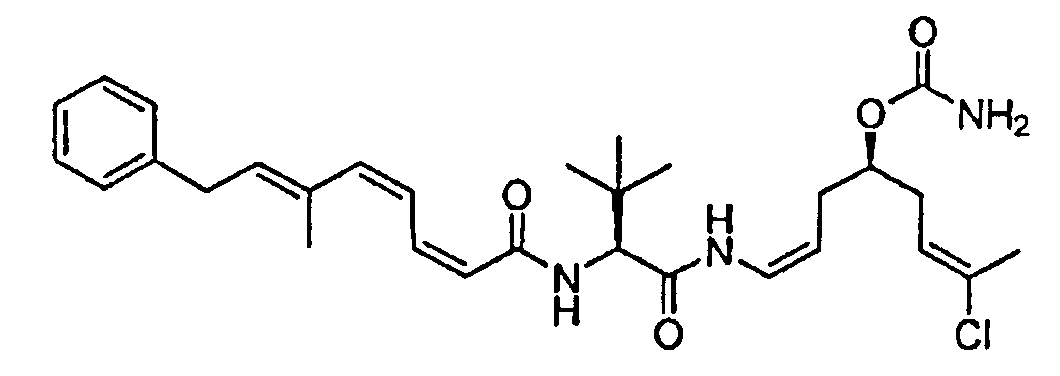
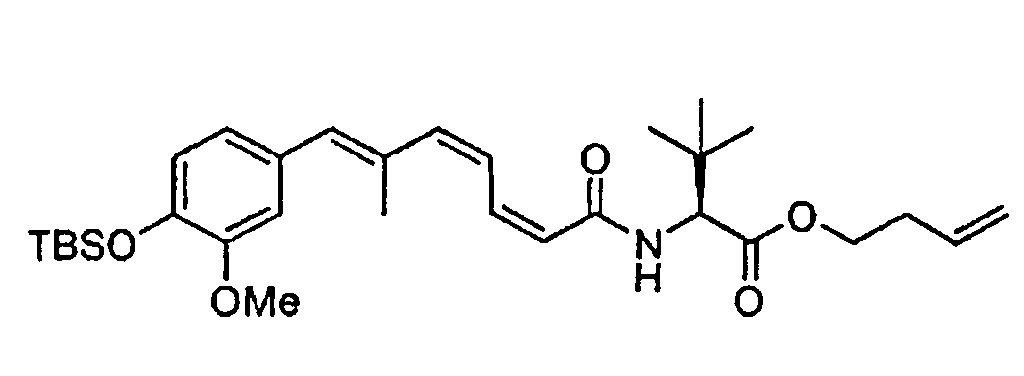

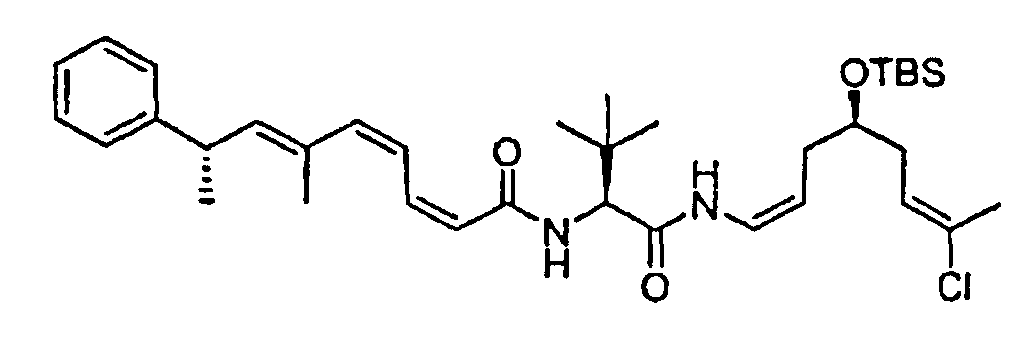


или его фармацевтически приемлемая соль, таутомер или стереоизомер.
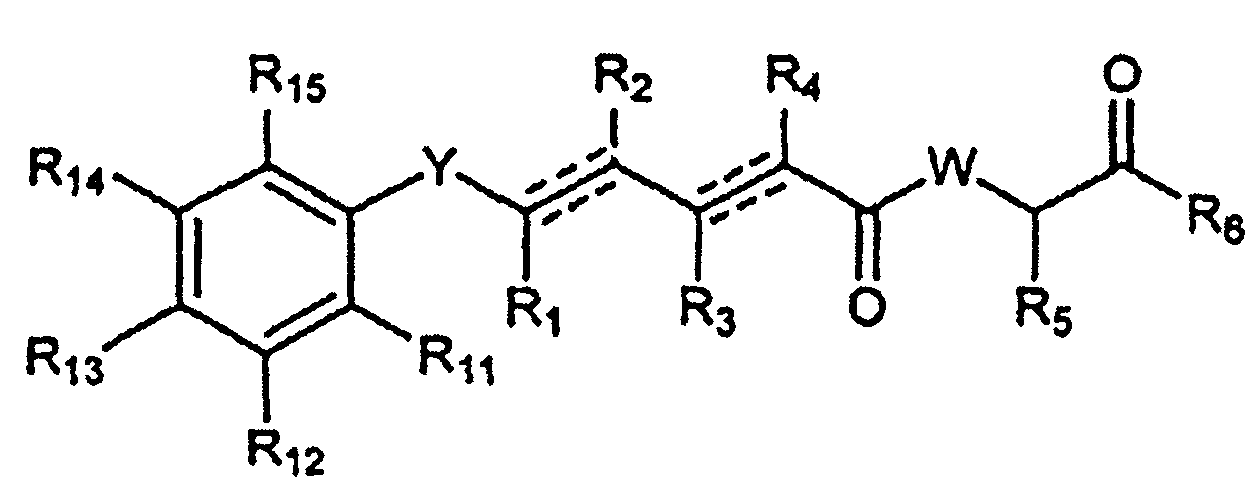
как определено по любому из пп.1-14, где Y, W и R1, R2, R3, R4, R5, R6, R11, R12, R13, R14 и R15 определены в любом из пп.1-14,
включающий взаимодействие фрагмента C и фрагмента D
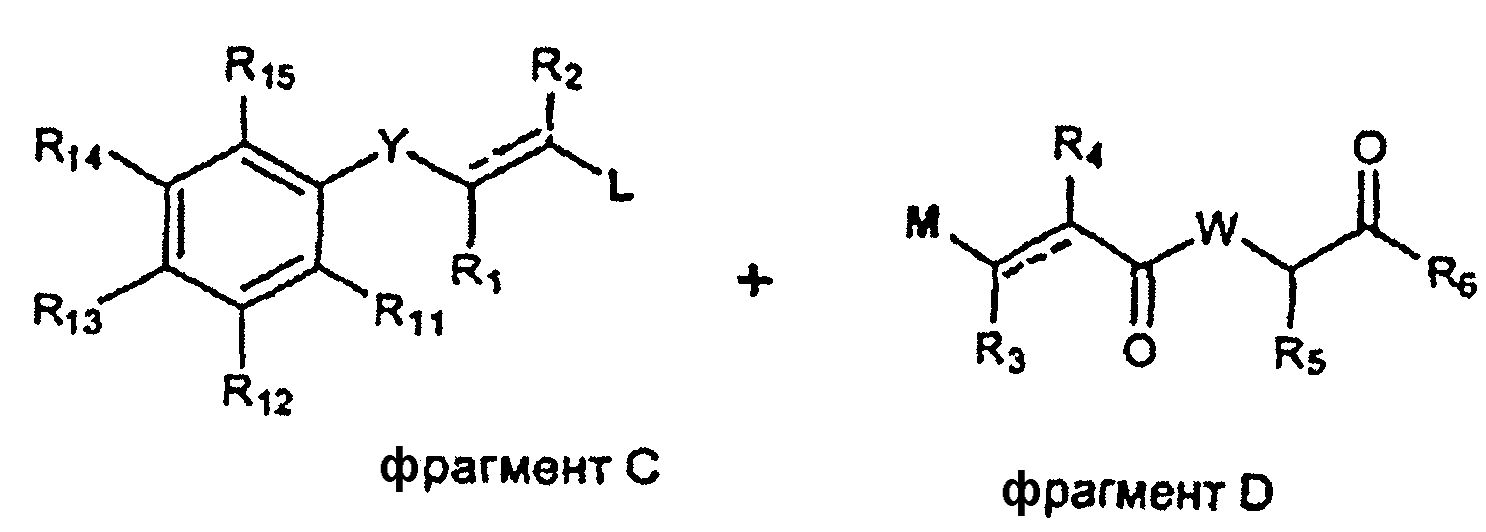
где Y, W и R1, R2, R3, R4, R5, R6, R11, R12, R13, R14 и R15 являются желаемыми группами или соответствующей защитной группой, если необходимо, и L и M являются соответствующими реакционноспособными или уходящими группами.
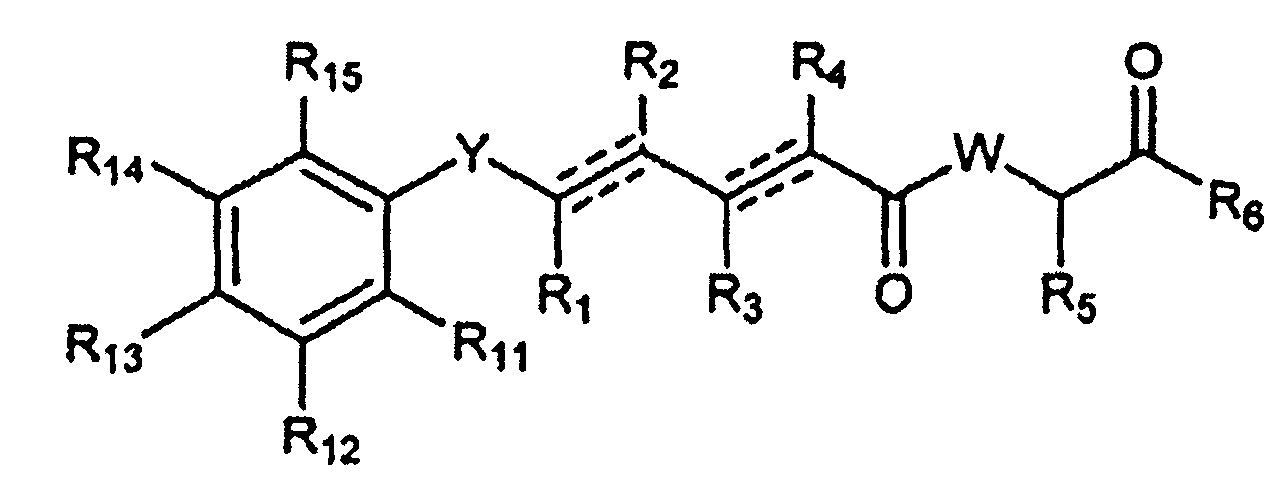
как определено по любому из пп.1-14, где Y, W и R1, R2, R3, R4, R5, R6, R11, R12, R13, R14 и R15 определены в любом из пп.1-14,
включающий взаимодействие фрагмента A и фрагмента B
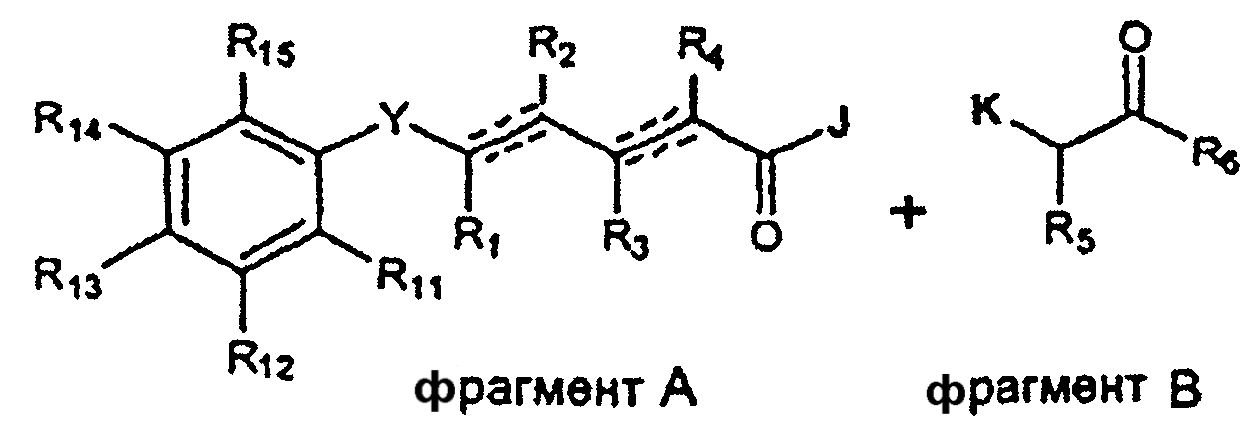
где Y и R1, R2, R3, R4, R5, R6, R11, R12, R13, R14 и R15 являются желаемыми группами или соответствующей защитной группой, если необходимо, и J и K являются соответствующими реакционноспособными или уходящими группами.
Документы, цитированные в отчёте о поиске
Способ индукции конечной дифференцировки

Комментарии