Применение антагонистов активируемых протеазой рецепторов 1 (par-1) для профилактики и/или лечения функциональных патологических состояний в области таза и промежности - RU2678309C1
Код документа: RU2678309C1
Чертежи








Описание
Область техники
Данное изобретение относится к антагонистам активируемых протеазой рецепторов 1 (англ. PAR-1) и, в частности, к ворапаксару (англ. Vorapaxar), атопаксару (англ. Atopaxar) и 3-(2-хлорфенил)-1-[4-(4-фторбензил)пиперазин-1-ил]пропенону или одной из их фармацевтически приемлемых солей, для профилактики и/или лечения функциональных патологических состояний в области таза и промежности.
Функциональные патологические состояния области таза и промежности включают в себя различные патологические состояния, затрагивающие область таза и промежности, за исключением злокачественных образований и любых подтвержденных инфекционных, метаболических или эндокринных заболеваний. К функциональным патологическим состояниям области таза и промежности относится синдром раздраженного мочевого пузыря, также называемый интерстициальным циститом, выявляемый, при отсутствии какой-либо подтвержденной инфекции мочевых путей или других объективных патологий, в виде хронической тазовой боли продолжительностью более 6 месяцев, иногда воспринимаемой как ощущения давления или дискомфорта, связанные с мочевым пузырем, и сопровождающейся по меньшей мере одним мочевым симптомом: постоянным сильным позывом к мочеиспусканию или поллакиурией. Данный синдром раздраженного мочевого пузыря очень часто сопровождается ноктурией (ночной полиурией). Поллакиурию определяют как аномально высокую частоту мочеиспускания более восьми актов мочеиспускания в течение 24 часов. Ноктурию определяют как потребность пациента в пробуждении ночью для опорожнения мочевого пузыря один или более раз. Диагностика синдрома раздраженного мочевого пузыря или интерстициального цистита основана на выяснении анамнеза и определении календаря мочеиспусканий. Клиническое обследование призвано исключить все другие причины болей в мочевом пузыре, при этом диагностика синдрома раздраженного мочевого пузыря является диагностикой методом исключения. При возникновении подозрения на синдром раздраженного мочевого пузыря ключевым обследованием для оценки и диагностики является цистоскопия под общей или местной анестезией. Обычно такое обследование позволяет подтвердить наличие гломеруляций слизистой оболочки мочевого пузыря с язвами Ханнера (англ. Hunner) или без таковых. В то же время, иногда на начальной стадии заболевания при отсутствии язв Ханнера цистоскопия может оказаться нормальной. В таком случае предусматривают наряду с этим выполнение биопсии мочевого пузыря и гидродистенции мочевого пузыря. Гидродистенция представляет собой растяжение мочевого пузыря водой, выполняемое под анестезией. Другие дополнительные обследования, диагностическая визуализация, оценка уродинамики, биологические, цитологические исследования являются необязательными в плане диагностики, однако полезны для постановки дифференциального диагноза, поскольку синдром интерстициального цистита остается диагностикой методом исключения.
По-видимому, существует две категории пациентов: пациенты с повреждением стенки мочевого пузыря и, в частности, с язвами Ханнера (20% случаев), и пациенты без таковых. Однако между этими различными клиническими проявлениями существует континуум. Трудно оценить точное число людей, страдающих этим заболеванием, которое, по всей вероятности, зачастую не диагностируется. Число случаев заболевания различается в разных странах. В странах Европы эти данные колеблются от одного заболевшего на 12500 человек до одного заболевшего на 1500 человек. В США распространенность заболевания исчисляется одним заболевшим приблизительно на 1500 человек. В то время как представители обоих полов могут страдать данным заболеванием, 90% пациентов с синдромом раздраженного мочевого пузыря составляют женщины. Этот синдром может поражать людей любого происхождения, однако число случаев заболевания выше в европейских и скандинавских странах.
Этиология синдрома раздраженного мочевого пузыря остается неясной. Различные исследования указывают на многофакторность его патофизиологии. Были предложены различные патогенные теории, хотя ни одна из этих этиологий не может быть признана единственно возможным причинным фактором. Наиболее вероятно, что вовлечения в патологический процесс и взаимодействия протекают между этими различными факторами.
- Инфекционный механизм: даже в случае, если анализы на бактерии, вирусы и грибы у пациентов, страдающих синдромом раздраженного мочевого пузыря, никогда не позволяли выявить инфекционную причину, ответственную за данное заболевание. Пациенты, страдающие синдромом раздраженного мочевого пузыря, зачастую имеют в анамнезе инфекцию мочевого пузыря, и у 50% пациентов болезнь начинается после появления инфекции. Однако вплоть до настоящего времени ни инфекционный, ни бактериальный, ни вирусный факторы не были определены в качестве причины заболевания, и противоинфекционные терапии были неэффективными. Рядом авторов было предложено инфицирование "атипичными" патогенными микроорганизмами. Было высказано предположение, что патогенные микроорганизмы, обнаруживаемые при синдроме раздраженного мочевого пузыря, не являются агентами, непосредственно ответственными за заболевание, однако их присутствие может обуславливать иммуноаллергическую реакцию, которая играет определенную роль для начала заболевания.
- Ухудшение проницаемости уротелия: слизистая оболочка мочевого пузыря покрыта слоем муцина, состоящего из большого числа гликозаминогликанов и гликопротеинов. Особенность этих гликозаминогликанов заключается в наличии у них отрицательного заряда, позволяющего им образовывать непроницаемый гидрофобный барьер. Соответственно, такой слой муцина препятствует проникновению мочи в уротелий. У пациентов, страдающих синдромом раздраженного мочевого пузыря, этот слой является поврежденным. В результате потенциально токсичные вещества попадают в мышечный слой стенки мочевого пузыря и деполяризуют чувствительные нервные волокна, приводя к появлению симптомов синдрома раздраженного мочевого пузыря.
- Реакция мастоцитов; клетки мастоцитов были обнаружены в стенке мочевого пузыря от 30 до 65% пациентов, страдающих синдромом раздраженного мочевого пузыря. Мастоциты содержат цитоплазматические гранулы, содержащие в себе такие вещества, как гистамин, лейкотриены, простагландины и триптазы. Все эти вещества принимают участие в воспалительной реакции. При синдроме раздраженного мочевого пузыря отечность, фиброз и неоваскуляризация могут быть обусловлены высвобождением этих медиаторов, транспортируемых клетками мастоцитов. Активация мастоцитов зависит от вещества Р, и исследования под электронным микроскопом показали увеличение нервных окончаний, богатых веществом Р, при контакте с мастоцитами. В целом, по-видимому, такие клетки мастоцитов играют важную роль при синдроме раздраженного мочевого пузыря. Несмотря на то что четкая первичная или вторичная роль мастоцитов в этиологии синдрома раздраженного мочевого пузыря в настоящее время остается предметом дискуссий, множество исследований направлены на получение информации относительно роли активации этих клеток и их ответственности в симптоматике.
- Нейронный механизм: этот механизм представляет собой процесс, посредством которого нервные волокна управляют секрецией локальных медиаторов воспаления. При синдроме раздраженного мочевого пузыря имеет место увеличение симпатической иннервации и активация пуринергической нейротрансмиссии. Наличие локального нейрогенного воспаления могло быть причиной каскада цепных реакций. Такой механизм описан при синдроме раздраженного мочевого пузыря и других болезненных синдромах, таких как фибромиалгия, синдром раздраженного кишечника. Основным компонентом такого механизма является вещество Р. Эта теория основана на присутствии высокой концентрации вещества Р и большого числа нервных волокон, содержащих вещество Р, в стенке мочевого пузыря пациентов, страдающих синдромом раздраженного мочевого пузыря. Что примечательно, было показано, что концентрация вещества Р в моче пропорциональна уровню боли.
- Аутоиммунный механизм: 5% пациентов с синдромом раздраженного мочевого пузыря страдают аутоиммунным заболеванием: волчанкой, тиреоидитом, склеродермией, полиартритом, синдромом Гужеро-Шегрена. Некоторые исследования приводят доводы в пользу иммунных изменений при синдроме раздраженного мочевого пузыря. Тем не менее, аутоиммунный механизм или точная роль аутоиммунного механизма при синдроме раздраженного мочевого пузыря остаются дискуссионными. Ухудшение уротелиальной проницаемости может приводить к воспалительным, аутоиммунным реакциям, возможно, обуславливающим патогенез синдрома раздраженного мочевого пузыря. Наличие ядерного фактора каппа-В, активированного при биопсии мочевого пузыря у пациентов с таким синдромом, подтверждает эту теорию. Этот фактор также обнаружен при других аутоиммунных заболеваниях, включая ревматоидный артрит, воспалительные заболевания желудочно-кишечного тракта и бронхиальную астму. Однако ни одно из этих исследований не было доказательным, а изменения иммунной реакции не являются специфическими и могут быть лишь вторичными по отношению к ухудшению ткани мочевого пузыря.
Симптоматика синдрома раздраженного мочевого пузыря является полной и, прежде всего, характеризуется болезненными симптомами, топография боли - подлобковая, мочепузырная (везикальная) с распространением в сторону уретры, но также может затрагивать влагалище, промежность, прямую кишку, таз, крестец… Боль определяют как жжение, постоянную "грызущую" боль, чувство давления или дискомфорта. Боль в той или иной степени провоцируется заполнением мочевого пузыря и иногда ослабевает при его опорожнении. Пациенты просыпаются ночью от боли и позывов к мочеиспусканию. Боль приходит приступообразно, с очень болезненными периодами, длящимися несколько дней, и периодами, когда боль становится более терпимой, однако она всегда присутствует.
Постоянным мочевым симптомом является сильный стойкий позыв к мочеиспусканию. Он может сопровождаться дневной и ночной поллакиурией. Может присутствовать экстренная или острая потребность в мочеиспускании, но это встречается, главным образом, - и такой диагноз следует исключить - в случае гиперактивного мочевого пузыря, когда такие экстренные потребности являются безболезненными. Зачастую пациенты, страдающие синдромом раздраженного мочевого пузыря, жалуются не столько на какую-либо действительную острую потребность, а в значительно большей степени - на постоянное желание опорожнить мочевой пузырь, переходящее от простого дискомфорта к действительной боли, которая ослабевает при мочеиспускании. Это облегчение, происходящее при мочеиспускании, является основной причиной желания таких пациентов опорожнить их мочевой пузырь и приводит к волнениям из-за неотложного недержания мочи. Если потребность не может быть облегчена, дискомфорт или боль обычно усиливаются без какого-либо истечения мочи, которое, с другой стороны, могло произойти из-за неотложного недержания мочи. Это характерно для большинства пациентов, страдающих синдромом раздраженного мочевого пузыря, однако можно иметь синдром раздраженного мочевого пузыря и сопутствующее неотложное недержание мочи, что усложняет диагностическую оценку.
Клинический синдром гиперактивного мочевого пузыря может иметь несколько причин: неврологическую причину (медуллярная травма, болезнь Паркинсона, множественный склероз…), психо-поведенческую причину, либо он может быть неясного происхождения в пределах сферы нозологии функциональных патологических состояний области таза и промежности. Клинический синдром гиперактивного мочевого пузыря может сопровождаться либо не сопровождаться неингибированными сокращениями детрузора, являющегося мышцей мочевого пузыря. Однако не каждое сокращение детрузора сопровождается непроизвольным истечением мочи. Некоторые сокращения, вероятно, большая часть сокращений, происходят на фоне закрытого сфинктера мочеиспускательного канала. С точки зрения физиопатологии, такая ситуация может быть эквивалентна инфравезикальной обструкции мочевых путей. Со временем может произойти прогрессивная гипертрофия гладкомышечных пучков. При цистоскопии в зависимости от частоты, амплитуды и длительности таких сокращений на стенке мочевого пузыря будет наблюдаться образование трабекул большего или меньшего объема, возможно даже приводя к мультидивертикулярному мочевому пузырю. С течением времени внутри таких гипертрофированных мышечных пучков может произойти дегенерация волокон, замещающая гладкомышечные волокна наслоениями коллагена и волокнистой ткани. Мочевой пузырь будет становиться все менее эластичным, его емкость будет уменьшаться и его сократительная способность станет менее эффективной. Соответственно, этот процесс может привести к мочевому пузырю небольшой емкости, который будет неэластичным и несокращающимся (или по меньшей мере обладающим недостаточной сократительной способностью). Синдром гиперактивного мочевого пузыря, имеющий переменные проявления, сочетается с неотложными недержаниями мочи, сопряженными или не сопряженными с недержанием и/или дневной или ночной поллакиурией. Отсутствует единственный симптом, который являлся бы патогномичным для гиперактивного мочевого пузыря, скорее, имеется совокупность симптомов, которые могут указывать на эту патологию: наличие совокупности трех симптомов может в достаточной мере свидетельствовать о гиперактивности.
Неотложные недержания мочи или острые потребности соответствуют срочной потребности в мочеиспускании, сопровождающейся боязнью подтекания. Они могут сопровождаться, а могут и не сопровождаться неотложным мочеиспусканием, которое пациент не может контролировать или отсрочить, вследствие чего происходит подтекание из-за острой потребности.
В числе функциональных патологических состояний области таза и промежности следует упомянуть недержание.
Недержание мочи определяют как непреднамеренное или непроизвольное выделение мочи через мочеиспускательный канал. Этим расстройством страдают как мужчины, так и женщины, и причины зачастую являются многофакторными. Уровень распространения данного расстройства составляет около 3 миллионов человек во Франции. Особенно часто оно встречается у пожилых людей. Удержание мочи требует нормального функционирования тазового дна, целостности сфинктера и нервного регулирования их и детрузора. Любое ухудшение одной из этих структур может привести к недержанию. Традиционно различают несколько форм недержания:
- недержание мочи при напряжении, характеризующееся истечением мочи при физической активности, кашле и чихании без какого-либо предшествующего позыва;
- неотложное недержание мочи, характеризующееся истечением мочи, сопровождающимся или непосредственно предваряемым неотложным (империтивным) позывом к мочеиспусканию, приводящее к мочевыделению, которое не может быть отсрочено или сдержано;
- смешанное недержание мочи, объединяющее два предшествующих типа недержания;
- энурез, особенно часто встречающийся у детей, характеризующийся непроизвольным мочеиспусканием в ночное время.
Помимо ощущения дискомфорта недержание мочи может иметь психологические (тревожность, депрессия) и социальные (замыкание в себе) последствия. Факторы, способствующие недержанию мочи, включают в себя возраст, стресс, чрезмерную полноту, неврологические расстройства, инфекции, выпадение или ослабление мышц сфинктера или тазового дна, например, после хирургии органов брюшной полости или родов.
Анальное недержание представляет собой непроизвольное выделение газов и/или жидких и/или твердых фекалий, при этом недержание кала исключает выделение газов. Анальное недержание беспокоит не только людей пожилого возраста, но также и людей любого возраста, при этом женщины страдают этим расстройством значительно чаще, чем мужчины. Роды и наступление менопаузы являются факторами, способствующими возникновению этого вида недержания. Другие факторы риска включают в себя некоторые травмы или хирургические вмешательства в области анального сфинктера. Однако недержание может также проистекать из некоторых неврологических патологий (апоплексия, диабет, множественный склероз…), из некоторых хирургических анальных процедур или врожденного дефекта развития. Недержание кала может также сопровождаться выпадением прямой кишки или может быть симптомом другого заболевания, например, такого как онкологическое заболевание.
Хроническая боль в области таза и промежности, в том числе синдром раздраженного мочевого пузыря, представляет собой боль, характеризующуюся хроническим течением (более шести месяцев), отсутствием злокачественной патологии и ее топографией: область таза и промежности. Имеется основное несоответствие между выраженностью жалобы пациента и отсутствием факторов поражения, типичных для подтверждения жалобы. Половина пациентов жалуется на изолированную тазовую боль, четверть пациентов также страдают синдромом раздраженного кишечника, 10% пациентов страдают клиническим синдромом гиперактивного мочевого пузыря, а оставшиеся 15% аккумулируют все три синдрома. Очень часто существуют взаимосвязи между всеми болезненными патологиями: синдромом раздраженного мочевого пузыря, вестибулодинией, синдромом раздраженного кишечника, тазовой болью, фибромиалгией и миофасциальным болевым синдромом. Пациенты жалуются на аллодинию, то есть боль, вызываемую воздействием, которое обычно не причиняет боль. Существует предрасположенность, способствующая проявлению боли в случае фибромиалгии, синдрома хронической усталости, мигрени, комплексного регионального болевого синдрома, тревоги, депрессии. Синдром раздраженного мочевого пузыря приобретает здесь свое наибольшее значение, поскольку он может скрывать истинные заболевания стенки мочевого пузыря с непереносимостью к заполнению мочевого пузыря, но он также может скрывать гиперчувствительность мочевого пузыря, основная причина которой необязательно находится внутри мочевого пузыря.
Как и в случае большинства заболеваний, точные причины возникновения которых неизвестны, отсутствуют методы лечения, позволяющие устранить синдром раздраженного мочевого пузыря. Однако некоторые терапевтические подходы позволяют оказать помощь пациентам за счет облегчения симптомов. На ранней стадии заболевания изменение образа жизни и уход за собой могут улучшить симптомы и должны применяться по мере возможности. Кроме того, следует способствовать профилактике стрессовых ситуаций для сдерживания обострения симптомов, вызванных стрессом. Также может быть предложена физиотерапия с использованием подходящих мануальных техник.
На фармакологическом уровне можно применять лекарственные средства, по существу, воздействующие на боль и воспаление и непосредственно на поврежденную стенку мочевого пузыря для ее защиты или восстановления. Нестероидные противовоспалительные средства могут облегчить боль и воспаление, однако обычно их недостаточно, и они не оказывают длительного эффекта. В большинстве случаев они хорошо переносятся, однако могут вызывать нежелательные побочные реакции. Как правило, можно использовать все обезболивающие лекарственные средства. Парацетамол и опиатсодержащие обезболивающие средства, производные морфина могут быть эффективны сами по себе или в сочетании с другими обезболивающими средствами. Трициклические антидепрессанты, вводимые в более низких дозах, чем при лечении депрессии, также воздействуют на боль. Может оказаться эффективным введение антигистаминных препаратов, локальная секреция гистамина мастоцитами, возможно, играет частичную роль при воспалении. Можно также вводить полисульфат пентозана; он является полисахаридом, имеющим структуру, аналогичную структуре гликозаминогликанов, и выводится с мочой и, как предполагают, восстанавливает поврежденный слой.
Гидродистенция может приносить пациентам облегчение в течение нескольких недель, однако эффекты постепенно ослабевают с повторными процедурами, и их повторение способствует риску начала нарушения растяжимости. Могут быть предложены инстилляции различных продуктов; преимуществом местной терапии является прямое воздействие продукта при контакте со слизистой оболочкой и уменьшение системного воздействия. Инстилляция представляет собой терапевтический метод, при котором раствор вводят в естественный канал или полость тела для промывки, дезинфекции и лечения этого канала или этой полости. Для введения раствора в мочевой пузырь используют катетер. Среди таких продуктов, обладающих доказанной эффективностью - гепарин, имеющий противовоспалительные и защитные свойства и способствующий временному укреплению поврежденного гликопротеинового слоя. Из-за отсутствия каких-либо достаточно надежных исследований сложно должным образом оценить преимущества и риски такого лечения. По-видимому, оно позволяет улучшить состояние лишь выборки пациентов. Для уменьшения боли можно также вводить малыми дозами в мочевой пузырь местные анестезирующие средства, такие как лидокаин. Диметилсульфоксид обладает эффективностью против боли, в частности, в сочетании с кортикостероидами, гепарином и/или местным анестезирующим средством. Как правило, в начале лечения получают хорошие результаты, но инстилляции необходимо повторять, как и в случае большинства других лекарственных средств. Однако этот продукт очень болезненно переносится некоторыми пациентами, у которых он вызывает ожоги и может даже отягчать симптомы в начале лечения. Гиалуроновая кислота или хондроитинсульфат, обладающие восстановительным действием на поврежденную стенку мочевого пузыря, подтвердили свою эффективность у некоторых пациентов.
Инстилляция продуктов в мочевой пузырь может приносить облегчение и в силу этого может быть предложена несмотря на недостатки, заключающиеся в необходимости катетеризации мочевого пузыря с рисками его повреждения и сепсиса.
Хирургическое вмешательство следует рассматривать лишь в качестве крайней меры лечения, когда все прочие способы лечения не увенчались успехом, а симптомы становятся все в большей степени инвалидизирующими. Хирургическая операция является достаточно тяжелой, травматичной и нередко обеспечивает лишь минимальное улучшение. Различные возможные процедуры варьируются от частичной цистэктомии до наиболее радикальной полной цистэктомии с уретрэктомией (удалением мочеиспускательного канала).
Таким образом, предложено множество способов лечения для оказания помощи при синдроме раздраженного мочевого пузыря, однако эффективность таких способов лечения является умеренной в исследованиях с небольшим числом пациентов, не всегда входящих в состав проспективных рандомизированных исследований. Из этого совершенно очевидно, что способы лечения, предлагаемые для лиц, страдающих данным синдромом, далеки от совершенства. Таким образом, существует значительная потребность в медицинском лечении и, соответственно, потребность в новых лекарственных средствах, обладающих минимальными возможными побочными эффектами, поскольку предназначены для физиологически ослабленных лиц.
Рецепторы PAR (активируемые протеазой рецепторы) являются семиспиральными рецепторами, сопряженными с тримерными G-белками: различают PAR1 рецепторы, состоящие из 425 аминокислот, PAR2 рецепторы с 397 аминокислотами, PAR3 рецепторы, состоящие из 374 аминокислот, и PAR4 рецепторы с 385 аминокислотами. Тромбин активирует PAR1, PAR3 и PAR4 рецепторы расщеплением их внеклеточной N-концевой области между аргинином 41 и серином 42. Расщепленный пептид не обладает специфической активностью, новая N-концевая область рецептора выполняет функцию агониста, укладываясь к поверхности клеток и взаимодействуя с внеклеточными доменами.
PAR1 рецептор играет ключевую роль в активации тромбоцитов при низких концентрациях тромбина, тогда как PAR4 реагирует при высоких концентрациях. Была определена роль PAR1 в области сосудистой биологии и атеротромбоза. Антагонисты PAR1 предложены в качестве новых, перспективных антитромботических средств, действующих при пероральном применении. Можно упомянуть ворапаксар, атопаксар, для которых получены многообещающие клинические данные (Capodanno et al. 2012). Ворапаксар получил регистрацию FDA (англ. Food and Drug Administration - Управление по контролю за продуктами питания и лекарственными средствами) в 2014 для показания "уменьшение тромботических явлений у пациентов с инфарктом миокарда или заболеванием периферических артерий в анамнезе". Атопаксар в настоящее время не подлежит дальнейшей разработке в качестве ингибитора агрегации тромбоцитов.
На стенке мочевого пузыря PAR1 и PAR2 экспрессируются на уротелиальных клетках и клетках детрузора (Saban et al. 2007).
Исследования показали значительное вовлечение PAR2 в сократительную способность мочевого пузыря (Nakahara et al. 2004).
В ходе исследований на различных животных продемонстрировано, что активация PAR тромбином индуцирует воспаление мочевого пузыря (De Garavilla et al. 2007; Saban et al. 2007).
Авторы изобретения показали, что селективный антагонист PAR1 рецепторов формирует терапевтический подход нового типа к лечению воспаления и сопутствующей боли при функциональных патологических состояниях в области таза и промежности и, в частности, при синдроме раздраженного мочевого пузыря.
Неожиданно авторы изобретения обнаружили, что ворапаксар, атопаксар и 3-(2-хлорфенил)-1-[4-(4-фторбензил)пиперазин-1-ил]пропенон или одна из их фармацевтически приемлемых солей позволяют защищать мочевой пузырь, при этом эффективно снижая его миогенные сократительные реакции.
Ворапаксар описан в Заявке на патент WO 03089428: он представляет собой этил-N-[(3R,3aS,4S,4aR,7R,8aR,9aR)-4-[(Е)-2-[5-(3-фторфенил)-2-пиридил]винил]-3-метил-1-оксо-3а,4,4а,5,6,7,8,8а,9,9а-декагидро-3Н-бензо[f]изобензофуран-7-ил]карбамат.
Атопаксар представляет собой бромгидрат [(1-(3-трет-бутил-4-метокси-5-морфолинофенил)-2-(5,6-диэтоксифтор-1 -имино-1,3-дигидро-2Н-изоиндол-2-ил)этанона.
3-(2-Хлорфенил)-1-[4-(4-фторбензил)пиперазин-1 -ил]пропенон, представленный формулой:

его фармацевтически приемлемые соли и их применение в качестве ингибитора агрегации тромбоцитов для лечения и профилактики артериального или венозного тромбоза, стабильной стенокардии, нарушений сердечного ритма, инфаркта миокарда, гипертонии, сердечной недостаточности, апоплексии, острых коронарных синдромов, для ингибирования пролиферации гладкомышечных клеток (рестеноза), для лечения и профилактики воспалительных заболеваний, заболеваний легких, заболеваний желудочно-кишечного тракта, развития фиброза у пациентов, страдающих хронической печеночной недостаточностью, кожными заболеваниями, для лечения и профилактики пролиферации эндотелия, фибробластов, кардиофибробластов, глиальных клеток, гладкомышечных клеток или злокачественных клеток - описаны в патентном документе WO 2007/147824.
Согласно настоящему изобретению, термин "фармацевтически приемлемый" относится к химическим соединениям и композициям, которые не оказывают какого-либо неблагоприятного, аллергического воздействия или другой нежелательной реакции при введении человеку. При использовании в данном контексте термин "фармацевтически приемлемый наполнитель" включает в себя любой разбавитель, адъювант или наполнитель, такой как консерванты, заполнители, разрыхлители, увлажнители, эмульгаторы, диспергаторы, антибактериальные или противогрибковые средства, или агенты, позволяющие осуществлять отсроченные абсорбцию и резорбцию в желудочно-кишечном тракте. Применение таких сред и носителей хорошо известно специалистам в данной области техники.
Фармацевтически приемлемые соли для терапевтического применения соединения по настоящему изобретению включают в себя известные нетоксичные соли соединения по изобретению, такие как соли, полученные из неорганических и органических кислот. В качестве примеров следует упомянуть соли, полученные из таких неорганических кислот, как соляная, бромистоводородная, фосфорная, серная кислоты, и соли, полученные из таких органических кислот, как уксусная, трифторуксусная, пропионовая, янтарная, фумаровая, яблочная, винная, лимонная, аскорбиновая, малеиновая, глутаминовая, бензойная, салициловая кислоты, толуолсульфокислота, метансульфокислота, стеариновая, молочная кислоты.
Эти соли могут быть синтезированы из соединения по изобретению, содержащего основную часть, и соответствующих кислот в соответствии с общепринятыми химическими способами.
Сольваты, подходящие для терапевтического применения соединения по настоящему изобретению, включают в себя обычные сольваты, такие как образуются на последней стадии при получении соединения по изобретению за счет присутствия растворителей. В качестве примера можно упомянуть сольваты, образующиеся в результате присутствия воды или этанола.
Ворапаксар, атопаксар и 3-(2-хлорфенил)-1-[4-(4-фторбензил)пиперазин-1-ил]пропенон являются селективными антагонистами PAR1.
Антагонистами PAR1, известными в настоящее время, являются N3-циклопропил-7-([4-(1-метилэтил)фенил]метил)-7Н-пирроло[3,2-f]хиназолин-1,3-диамин (SCH-79797), ворапаксар (SCH-530348), атопаксар (Е5555) и SCH-602539.
Предметом изобретения является применение антагониста PAR1 в качестве лекарственного средства для профилактики и/или лечения функциональных патологических состояний в области таза и промежности.
Предметом изобретения является применение ворапаксара в качестве лекарственного средства для профилактики и/или лечения функциональных патологических состояний в области таза и промежности.
Предметом изобретения является применение атопаксара в качестве лекарственного средства для профилактики и/или лечения функциональных патологических состояний в области таза и промежности.
Предметом изобретения является применение 3-(2-хлорфенил)-1-[4-(4-фторбензил)пиперазин-1-ил]пропенона в качестве лекарственного средства для профилактики и/или лечения функциональных патологических состояний в области таза и промежности.
Предметом изобретения является применение антагониста PAR1 в качестве лекарственного средства для профилактики и/или лечения синдрома раздраженного мочевого пузыря.
Предметом изобретения является применение ворапаксара в качестве лекарственного средства для профилактики и/или лечения синдрома раздраженного мочевого пузыря.
Предметом изобретения является применение атопаксара в качестве лекарственного средства для профилактики и/или лечения синдрома раздраженного мочевого пузыря.
Предметом изобретения является применение 3-(2-хлорфенил)-1-[4-(4-фторбензил)пиперазин-1-ил]пропенона в качестве лекарственного средства для профилактики и/или лечения синдрома раздраженного мочевого пузыря.
Предметом изобретения является применение антагониста PAR1 в качестве лекарственного средства для профилактики и/или лечения синдрома гиперактивного мочевого пузыря.
Предметом изобретения является применение ворапаксара в качестве лекарственного средства для профилактики и/или лечения синдрома гиперактивного мочевого пузыря.
Предметом изобретения является применение атопаксара в качестве лекарственного средства для профилактики и/или лечения синдрома гиперактивного мочевого пузыря.
Предметом изобретения является применение 3-(2-хлорфенил)-1-[4-(4-фторбензил)пиперазин-1-ил]пропенона в качестве лекарственного средства для профилактики и/или лечения синдрома гиперактивного мочевого пузыря.
Еще одним предметом изобретения является применение антагониста PAR1 у пациентов, страдающих недержанием мочи и/или анальным недержанием или недержанием кала.
Еще одним предметом изобретения является применение ворапаксара у пациентов, страдающих недержанием мочи и/или анальным недержанием или недержанием кала.
Еще одним предметом изобретения является применение атопаксара у пациентов, страдающих недержанием мочи и/или анальным недержанием или недержанием кала.
Еще одним предметом изобретения является применение 3-(2-хлорфенил)-1-[4-(4-фторбензил)пиперазин-1-ил]пропенона у пациентов, страдающих недержанием мочи и/или анальным недержанием или недержанием кала.
Еще одним предметом изобретения является применение антагониста PAR1 у пациентов с хронической болью в области таза и промежности.
Еще одним предметом изобретения является применение ворапаксара у пациентов с хронической болью в области таза и промежности.
Еще одним предметом изобретения является применение атопаксара у пациентов с хронической болью в области таза и промежности.
Еще одним предметом изобретения является применение 3-(2-хлорфенил)-1-[4-(4-фторбензил)пиперазин-1-ил]пропенона у пациентов с хронической болью в области таза и промежности.
Настоящее изобретение также относится к фармацевтической композиции, содержащей антагонист PAR1 в качестве активного ингредиента и по меньшей мере один фармацевтически приемлемый наполнитель, для применения ее в качестве лекарственного средства для профилактики и/или лечения функциональных патологических состояний в области таза и промежности, в частности, синдрома раздраженного мочевого пузыря, синдрома гиперактивного мочевого пузыря, хронической боли в тазово-брюшинной области. Настоящее изобретение также относится к фармацевтической композиции, содержащей антагонист PAR1 в качестве активного ингредиента и по меньшей мере один фармацевтически приемлемый наполнитель, для применения ее в качестве лекарственного средства у пациентов, страдающих недержанием мочи и/или анальным недержанием или недержанием кала.
Фармацевтические композиции по настоящему изобретеию могут быть приготовлены для введения человеку. Композиции по настоящему изобретению можно вводить перорально, сублингвально (подъязычно), подкожно, внутримышечно, внутривенно, чрескожно, местно или ректально. При этом активный ингредиент может вводиться человеку в стандартных формах для введения в смеси с общепринятыми фармацевтическими субстратами. Подходящие стандартные формы для введения включают формы для перорального введения, такие как таблетки, капсулы, порошки, гранулы и растворы или пероральные суспензии, формы для подъязычного и защечного введения, формы для подкожного или чрескожного введения, местного введения, внутримышечного, внутривенного, интраназального и интраокулярного введения, формы для внутрипузырного (интравезикального) введения, интрамурального (внутристеночного) или ректального введения.
При приготовлении твердой композиции в форме таблетки основной активный ингредиент смешивают с фармацевтическим носителем, таким как желатин, крахмал, лактоза, стеарат магния, тальк, аравийская камедь, диоксид кремния или тому подобное. Таблетки могут быть покрыты сахарозой или другими подходящими материалами, или они могут быть обработаны таким образом, чтобы иметь продленное или отсроченное высвобождение, а также непрерывное высвобождение заранее определенного количества активного ингредиента.
Капсулированный препарат готовят путем смешивания активного ингредиента с разбавителем и засыпания полученной смеси в твердые или мягкие капсулы.
Препарат в форме сиропа или эликсира может содержать активный ингредиент вместе с подсластителем, антисептиком, улучшителем вкуса и подходящим красителем.
Диспергируемые в воде порошки или гранулы могут содержать активный ингредиент в смеси с диспергирующими или увлажняющими агентами либо суспендирующими агентами, а также с улучшителями вкуса или подсластителями.
Для ректального введения применяют гели, крема, порошки, суспензии, растворы, пены или суппозитории, которые готовят с использованием связующих, плавящихся при ректальной температуре, например, масла какао или полиэтиленгликолей.
Для парентерального введения (внутривенного, внутримышечного, внутри кожного, подкожного), интраназального, интраокулярного, внутрипузырного введения или интрамурального введения применяют водные суспензии, изотонические растворы или стерильные, инъекционные растворы, содержащие фармакологически совместимые диспергирующие агенты и/или увлажняющие агенты.
Активный ингредиент также может быть приготовлен в форме микрокапсул необязательно с одним или более дополнительным субстратом.
Подходящие рецептуры для выбранной формы введения известны специалистам в данной области и описаны, например, в работе: Remington, The Science and Practice of Pharmacy, 19th Edition, 1995, Mack Publishing Company.
Предпочтительно, фармацевтическая композиция настоящего изобретения предназначена для местного введения: используют термин внутрипузырное введение, фармацевтическая композиция настоящего изобретения предназначено для применения в форме для внутрипузырного введения. В ряду внутрипузырных способов лечения предпочтение отдается везикальной (мочепузырной) инстилляции и/или интрамуральной инъекции, то есть введению в толщу стенки мочевого пузыря.
Дозирование антагониста PAR1 в композициях по изобретению можно отрегулировать с получением количества вещества, эффективного для получения требуемого терапевтического ответа для конкретной композиции при данном способе введения. Эффективная доза соединения по изобретению варьируется в зависимости от многочисленных параметров, таких как выбранный способ введения, вес пациента, возраст, пол, тип патологии, тип применяемого лечения (лечений) и чувствительность пациента, подлежащего лечению. Таким образом, оптимальная доза должна быть определена специалистом в зависимости от параметров, считающихся релевантными. Хотя эффективные дозы могут варьироваться в широких диапазонах, суточные дозы могут составлять от 0,1 мг до 1000 мг через каждые 24 часа и, предпочтительно, от 1 до 200 мг для взрослого пациента с массой тела около 70 кг при приеме за один или более раз.
Следующие примеры позволяют лучше понять изобретение без ограничения его объема.
Описание примеров осуществления изобретения
Пример 1
Воздействие 3-(2-хлорфенил)-1-[4-(4-фторбензил)пиперазин-1-ил]пропенона на модели изолированного мочевого пузыря крысы (Shimizu et al., Biol. Pharm. Bull. 34(7):1122-1125, 2011)
Цель эксперимента: Оценить роль 3-(2-хлорфенил)-1-[4-(4-фторбензил)пиперазин-1-ил]пропенона на амплитуду сокращения мочевого пузыря под действием трипсина и TFLLR (англ. Thr-Phe-Leu-Leu-Arg-NH2). Опыт проводили параллельно на не использовавшихся ранее в опытах мочевых пузырях и на мочевых пузырях, подвергнутых процедуре воспаления. Влияние соединения по изобретению сравнивали с таковым референсного антагониста PAR1: соединения SCH203099, (Ahn et al. Biochem. Pharmacol. 60(10:1425-1434, 2000).
Протокол
Чтобы вызвать воспаление мочевого пузыря крысам делали билатеральные инъекции циклофосфамида (использовались самки крыс линии Wistar Han весом от 250 до 275 г в день эксперимента, полученные из корпорации Charles River laboratory, Франция) внутрибрюшинно в дозе 150 мг/кг при конечном объеме 5 мл/кг.
Оценку боли проводили через 2 часа после введения циклофосфамида.
В случае не использовавшихся ранее в опытах крыс (циклофосфамид не вводили) либо спустя 24 часа после введения циклофосфамида животных анестезировали пентобарбиталом (60 мг/кг) и умерщвляли. Быстро извлекали мочевой пузырь и помещали его в модифицированный раствор Кребса-Хенселейта, насыщенный кислородом, имеющий следующий состав (мМ): NaCl - 114; KCI - 4,7; CaCl2 - 2,5; MgSO4 - 1,2; KH2PO4 - 1,2; NaHCO3 - 25 и глюкоза - 11,7 (рН 7,4 с 95% O2 и 5% CO2). Мочевой пузырь очищали от соединительной ткани, взвешивали, удаляли дистальные и проксимальные части и разрезали его в продольном направлении на две одинаковые полоски. К этим полоскам прикрепляли шелковую нить и погружали их в систему для исследования изолированного органа емкостью 10 мл (компания ЕМКА Technologies), содержащую раствор Кребса-Хенселейта, насыщенный кислородом в смеси с CO2 при соотношении O2/CO2 95%:5%, поддерживаемый при температуре 37°С. Полоски мочевого пузыря были соединены шелковой нитью с изометрическими датчиками (модель IT50, ЕМКА Technologies), соединенными в свою очередь с усилителями (ЕМКА Technologies). Сократительные реакции регистрировали при помощи программного обеспечения IOX2® (ЕМКА Technologies).
В течение начального периода стабилизации по меньше мере 90 минут каждые 15 минут выполняли операции полоскания и натяжения каждой полоски мочевого пузыря, откорректированной до 1,0 г. Затем полоски подвергали воздействию 50 мМ KCI, чтобы проверить их жизнеспособность. Если амплитуда сокращения полосок составляла менее 1,0 г, ткани отбраковывали и не включали в эксперимент. После второй стабилизации и промывки продолжительностью по меньшей мере 45 минут концентрацию соединения по изобретению, или препарата сравнения (SCH203099), или носителя инкубировали в течение 30 минут. Строили кривую зависимости концентрация-аккумулятивный отклик для селективного агониста PAR1, для TFLLR (от 0,1 мкМ до 0,1 мМ) или для трипсина (от 10 Ед. до 10000 ВАЕЕ Ед/мл).
Результаты
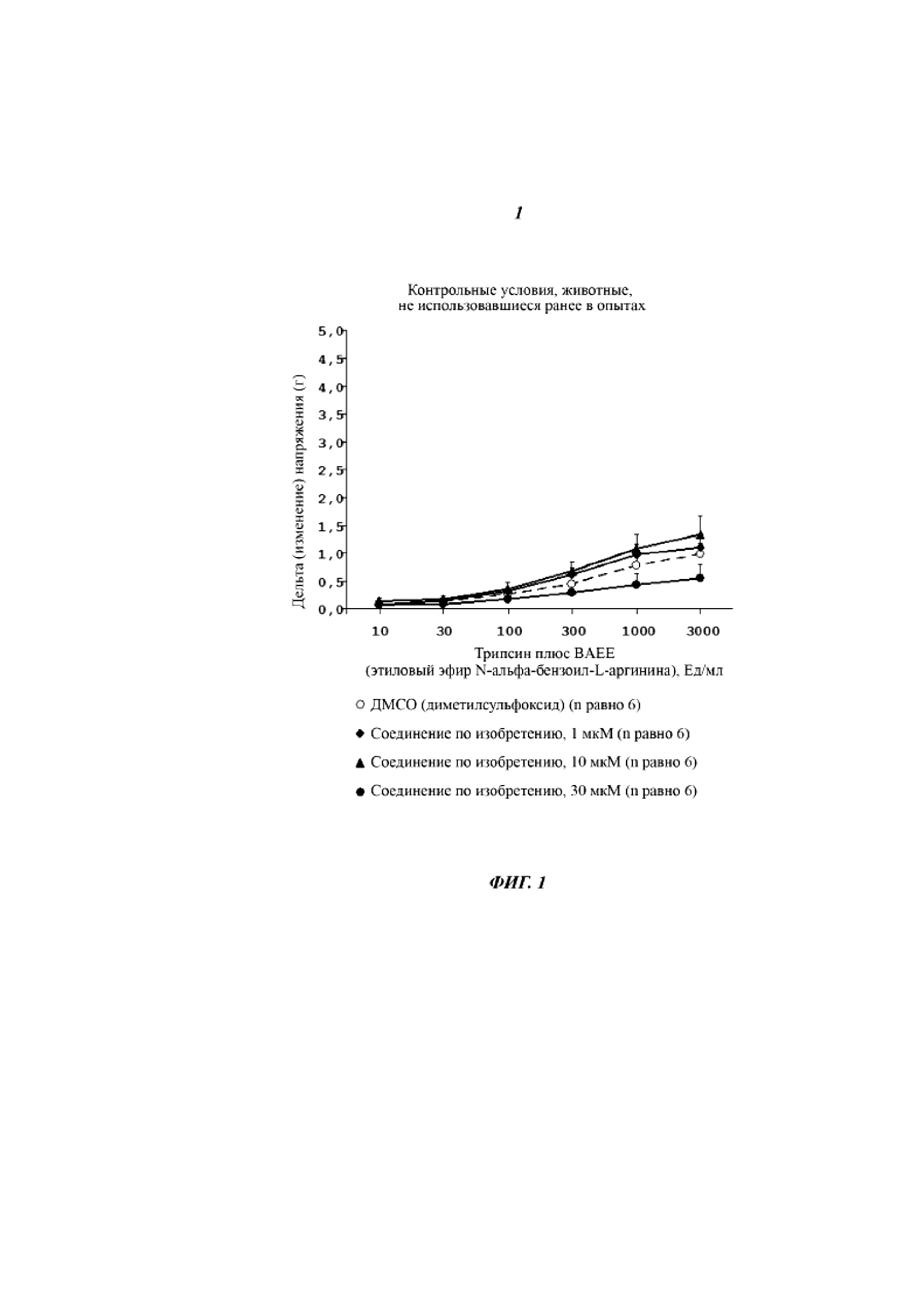
В присутствии 3000 ВАЕЕ (англ. Benzoyl Arginine Ethyl-Ester - этиловый эфир N-альфа-бензоил-L-аргинина) Ед/мл трипсина воспаление увеличивало сократительную способность мочевого пузыря благодаря активации PAR в 2,5 раза. Амплитуда сокращения составляла 0,99 плюс/минус 0,20 г для группы, не использовавшейся ранее в опытах, получающей носитель, по сравнению с 2,73 плюс/минус 0,34 г для группы, получающей носитель, обработанной циклофосфамидом.
Соединение по изобретению антагонизирует индуцированное трипсином сокращение мочевого пузыря только при высоких концентрациях у животных, не использовавшихся ранее в опытах, как показано на Фиг. 1. Амплитуда сокращения мочевого пузыря уменьшалась вдвое в случае соединения по изобретению при концентрации 30 мкМ по сравнению с носителем (0,55 плюс/минус 0,24 г против 0,99 плюс/минус 0,20 г) и ничего не наблюдалось при других концентрациях соединения по изобретению.
Соединение по изобретению оказывало зависимое от концентрации антагонистическое действие на индуцированное трипсином сокращение мочевого пузыря в условиях воспаления (Фиг. 2). При концентрации до 3 мкМ соединение по изобретению, по-видимому, является неактивным, при 10 мкМ соединение по изобретению уменьшает сокращение мочевого пузыря на 35% (1,76 плюс/минус 0,30 г против 2,73 плюс/минус 0,34 г). При концентрации 30 мкМ соединение по изобретению уменьшает сокращение мочевого пузыря приблизительно на 70% (0,92 плюс/минус 0,17 г против 2,73 плюс/минус 0,34 г).
Препарат сравнения (SCH203099) антагонизировал индуцированное трипсином сокращение мочевого пузыря только при высоких концентрациях у животных, не использовавшихся ранее в опытах (Фиг. 3). Амплитуда сокращения мочевого пузыря сокращалась вдвое в присутствии 10 мкМ SCH203099 по сравнению с наполнителем (0,48 плюс/минус 0,11 г против 0,99 плюс/минус 0,20 г) и не наблюдалось никакого эффекта при других концентрациях SCH203099.
Соединение SCH203099 оказывало зависимое от концентрации антагонистическое действие на индуцированное трипсином сокращение мочевого пузыря в условиях воспаления (Фиг. 4). Уменьшение на 25% наблюдалось в случае 3 мкМ SCH203099 (2,05 плюс/минус 0,53 г против 2,73 плюс/минус 0,34 г), уменьшение на 35% наблюдалось в присутствии 10 мкМ SCH203099 (1,77 плюс/минус 0,38 г против 2,73 плюс/минус 0,34 г) и 30 мкМ SCH203099 уменьшало сокращение мочевого пузыря на 60% (1,04 плюс/минус 0,16 г против 2,73 плюс/минус 0,34 г).
В присутствии 100 мкМ TFLLR воспаление увеличивало сократимость мочевого пузыря благодаря активации PAR1 в 2 раза. Амплитуда сокращения составляла 0,59 плюс/минус 0,14 г для группы, не использовавшейся ранее в опытах, получающей носитель, против 1,10 плюс/минус 0,18 г для группы, получающей носитель, обработанной циклофосфамидом.
Соединение по изобретению оказывает зависимое от концентрации антагонистическое действие на индуцированное TFLLR сокращение мочевого пузыря у животных, не использовавшихся ранее в опытах. При концентрации 1 мкМ соединение по изобретению, по-видимому, является неактивным, при 3 мкМ наблюдалось сокращение мочевого пузыря на 45% (0,33 плюс/минус 0,05 г против 0,59 плюс/минус 0,14 г). При концентрации 10 мкМ соединение по изобретению уменьшало сокращение мочевого пузыря на 70% (0,18 плюс/минус 0,04 г против 0,59 плюс/минус 0,14 г). При концентрации 30 мкМ соединение по изобретению полностью устраняло сокращение мочевого пузыря (0,00 плюс/минус 0,04 г против 0,59 плюс/минус 0,14 г) даже при релаксации ткани во время эксперимента (Фиг. 5).
Соединение по изобретению также оказывает зависимое от концентрации антагонистическое действие на индуцированное TFLLR сокращение мочевого пузыря в условиях воспаления (Фиг. 6). При концентрации до 3 мкМ отсутствует однозначный эффект (уменьшение только на 10%), при концентрации 10 мкМ соединение по изобретению уменьшало сокращение мочевого пузыря на 60% (0,45 плюс/минус 0,13 г против 1,10 плюс/минус 0,18 г) и при 30 мкМ соединение по изобретению уменьшало сократительную реакцию на 90% (0,11 плюс/минус 0,04 г против 1,10 плюс/минус 0,18 г).
Препарат сравнения (SCH203099) антагонизировал индуцированное TFLLR сокращение мочевого пузыря только при высоких концентрациях у животных, не использовавшихся ранее в опытах (Фиг. 7). Амплитуда сокращения мочевого пузыря уменьшалась вдвое в присутствии 10 мкМ SCH203099 по сравнению с наполнителем (0,26 плюс/минус 0,07 г против 0,59 плюс/минус 0,14 г), и не наблюдалось никакого эффекта при других концентрациях SCH203099.
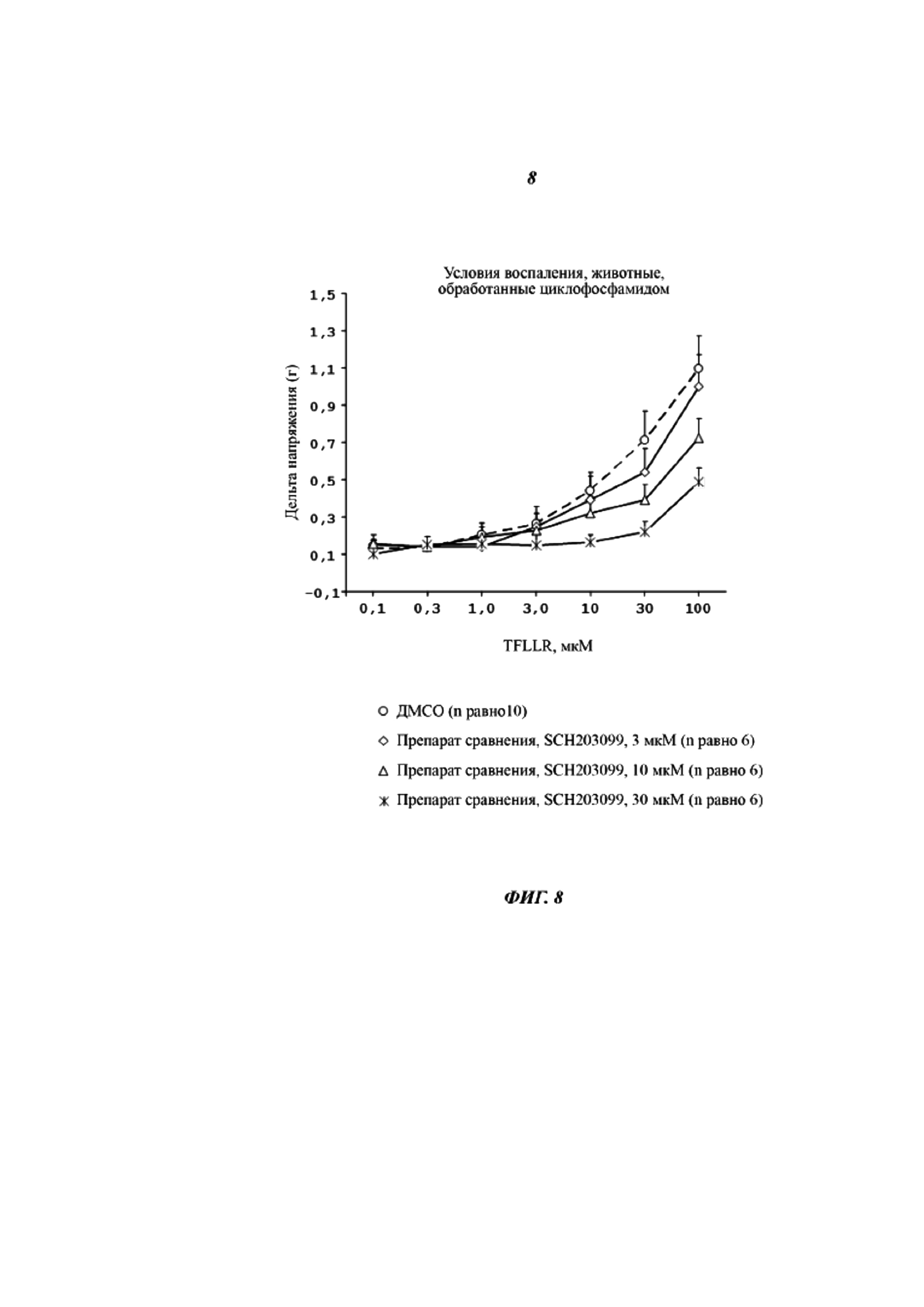
Соединение SCH203099 оказывает зависимое от концентрации антагонистическое действие на индуцированное TFLLR сокращение мочевого пузыря в условиях воспаления (Фиг. 8). При концентрации 3 мкМ SCH203099 не наблюдалось однозначного эффекта (10% уменьшение). Уменьшение на 35% было отмечено в присутствии 10 мкМ SCH203099 (0,73±0,10 г против 1,10 плюс/минус 0,18 г), и 30 мкМ SCH203099 уменьшало сокращение мочевого пузыря на 55% (0,49 плюс/минус 0,08 г против 1,10 плюс/минус 0,18 г).
Подводя итог, индуцированные трипсином сокращения мочевого пузыря аналогичным образом антагонизируются препаратом сравнения (SCH203099) и соединением по изобретению. С другой стороны, в случае сокращений мочевого пузыря, индуцированных агонистом PAR1, соединение по изобретению оказывает более сильное воздействие на воспаленные мочевые пузыри.
Таким образом, авторы изобретения неожиданно показали, что соединение по изобретению эффективно уменьшает усиленные сократительные реакции воспаленного и/или гиперактивного мочевого пузыря, то есть соединение по изобретению, по-видимому, представляет особый интерес в случаях синдрома раздраженного мочевого пузыря, а также в случае синдрома гиперактивного мочевого пузыря.
Пример 2
Воздействия ворапаксара и атопаксара на модели изолированного мочевого пузыря крысы
Целью данного исследования было оценить воздействия ворапаксара и атопаксара на амплитуду сокращения мочевого пузыря, индуцированного трипсином и TFLLR.
Опыты проводили на не использовавшихся ранее в опытах мочевых пузырях. Протокол был таким же, как протокол, описанный в Примере 1.
Результаты, полученные для ворапаксара
В присутствии трипсина при 3000 ВАЕЕ Ед/мл, воспаление увеличивает сократимость мочевого пузыря в два раза. Амплитуда сокращения увеличивалась от 0,93 плюс/минус 0,10 г до 1,97 плюс/минус 0,14 г. Ворапаксар при концентрации 3 мкМ антагонизирует индуцированное трипсином сокращение мочевого пузыря у животных, не использовавшихся ранее в опытах, как показано на Фиг. 9. Амплитуда сокращения мочевого пузыря антагонизируется в присутствии 3 мкМ ворапаксара по сравнению с носителем (0,79 плюс/минус 0,14 г против 1,04 плюс/минус 0,16 г, соответственно). Уменьшение эффективности при концентрации 10 мкМ обусловлено низкой растворимостью соединения. Это подтверждено при концентрации 30 мкМ.
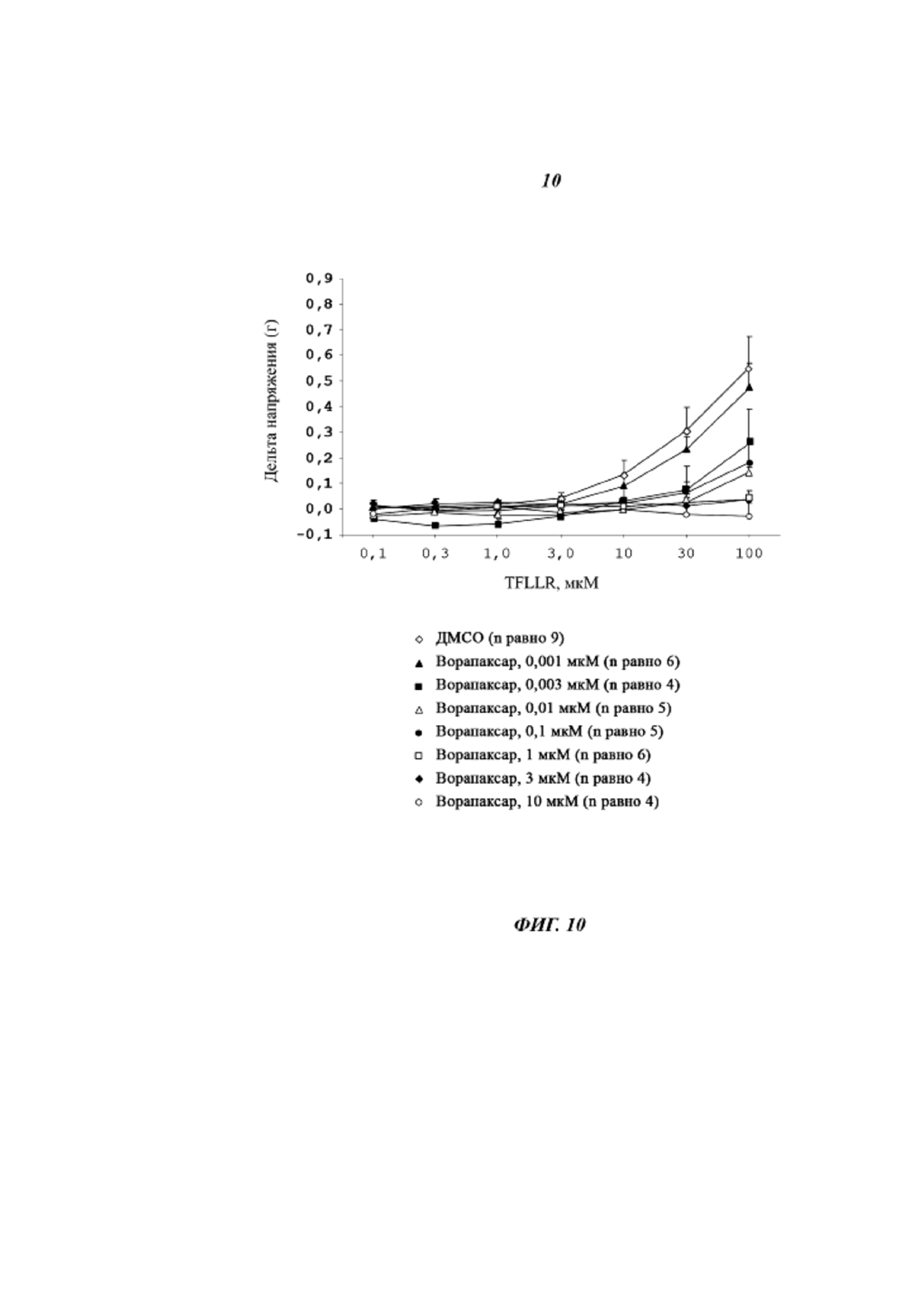
В присутствии 100 мкМ TFLLR сократимость мочевого пузыря при активации PAR1 увеличивается. Амплитуда сокращения составляет 0,57 плюс/минус 0,11 г. Ворапаксар оказывает зависящее от концентрации антагонистическое действие на индуцированное TFLLR сокращение мочевого пузыря у животных, не использовавшихся ранее в опытах (Фиг. 10). При концентрации 3 нМ ворапаксар индуцирует уменьшение приблизительно на 50% сокращения мочевого пузыря (0,31 плюс/минус 0,12 г против 0,57 плюс/минус 0,11 г). При концентрации 10 нМ ворапаксар уменьшает сокращение мочевого пузыря на 75% (0,14 плюс/минус 0,02 г против 0,57 плюс/минус 0,11 г). Начиная с 1 мкМ ворапаксар полностью устраняет сокращение мочевого пузыря (0,04 плюс/минус 0,03 г. плюс/минус 0,57 плюс/минус 0,11 г), как показано на Фиг. 10.
Результаты, полученные для атопаксара
В присутствии 3000 ВАЕЕ Ед/мл трипсина амплитуда сокращения увеличивается более, чем в два раза (0,76 плюс/минус 0,08 г против 1,93 плюс/минус 0,09 г). Атопаксар оказывает зависящее от концентрации антагонистическое действие на индуцированное трипсином сокращение мочевого пузыря у животных, не использовавшихся ранее в опытах, как показано на Фиг. 11. При концентрации 1 мкМ атопаксар индуцирует небольшое уменьшение сокращения мочевого пузыря (1,02 плюс/минус 0,20 г против 1,17 плюс/минус 0,10 г). При концентрации 3 мкМ атопаксар вызывает уменьшение сокращения мочевого пузыря на 38% (0,74 плюс/минус 0,19 г против 1,17 плюс/минус 0,10 г). При концентрации 10 мкМ атопаксар уменьшает сокращение мочевого пузыря на 70% (0,36 плюс/минус 0,15 г против 1,17 плюс/минус 0,10 г) и полностью устраняет сокращение при 30 мкМ (Фиг. 11).
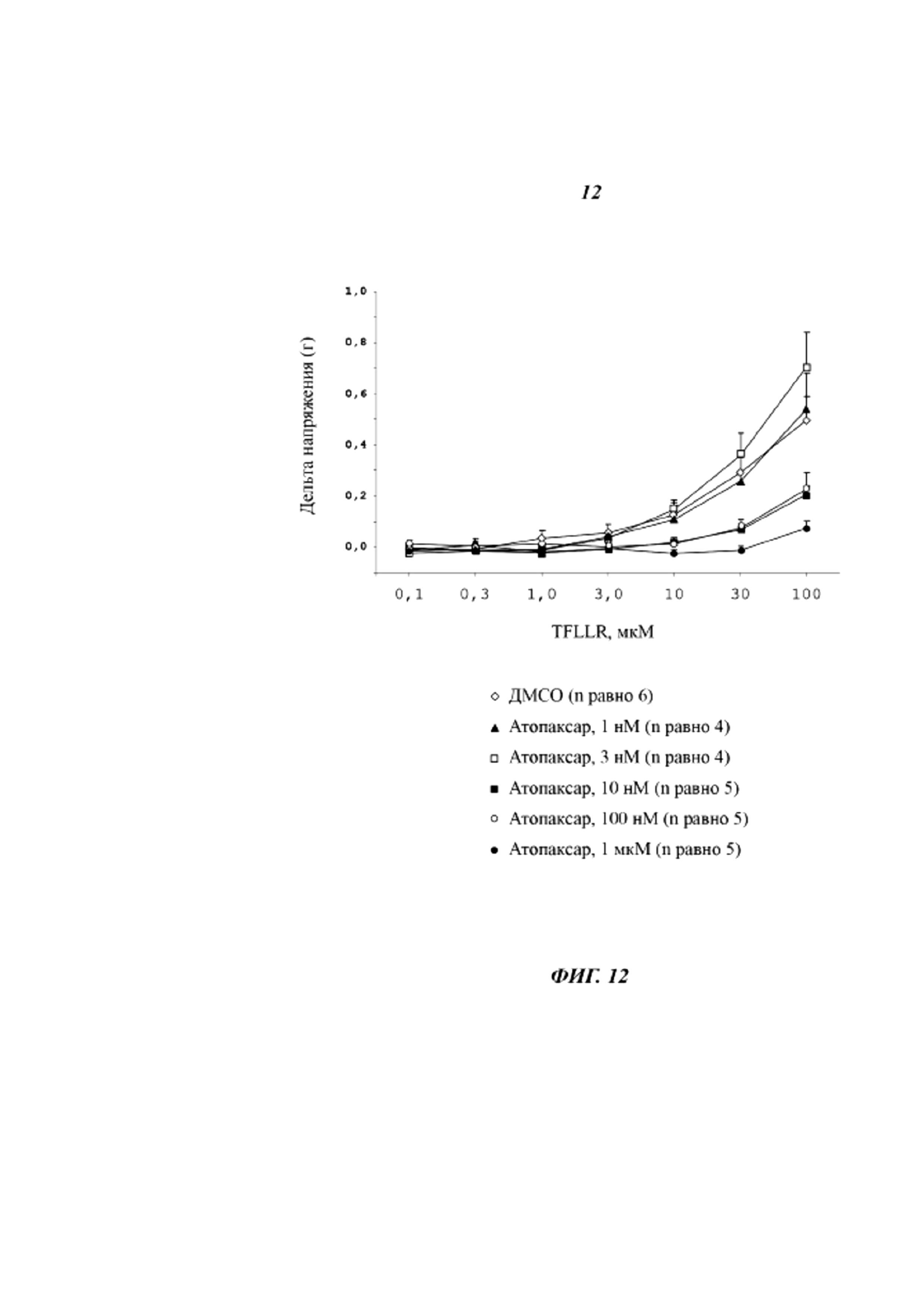
В присутствии 100 мкМ TFLLR сократимость мочевого пузыря увеличивается при активации PAR1. Амплитуда сокращения достигает 0,50 плюс/минус 0,09 г. Атопаксар оказывает зависящее от концентрации антагонистическое действие на индуцированное TFLLR сокращение мочевого пузыря у животных, не использовавшихся ранее в опытах, начиная с 10 нМ (Фиг. 12). При концентрации 10 нМ атопаксар индуцирует уменьшение сокращения мочевого пузыря более чем на 50% (0,21 плюс/минус 0,03 г против 0,50 плюс/минус 0,09 г). При концентрации атопаксара 1 мкМ сокращение мочевого пузыря практически полностью устраняется с уменьшением более чем на 80% (0,08 плюс/минус 0,03 г против 0,50 плюс/минус 0,09 г), как показано на Фиг. 12.
В заключение, ворапаксар и атопаксар предупреждают сокращения мочевого пузыря в физиологических условиях. Таким образом, авторы изобретения показали, что антагонисты PAR1 эффективно уменьшают сократительные реакции, то есть они, по-видимому, представляют особый интерес в случае функциональных патологических состояний в области таза и промежности и, в частности, при синдроме раздраженного мочевого пузыря.
Реферат
Группа изобретений относится к медицине. Предложено применение антагониста PAR1, выбранного из ворапаксара, атопаксара, 3-(2-хлорфенил)-1-[4-(4-фторбензил)пиперазин-1-ил]пропенона и их фармацевтически приемлемых солей в качестве лекарственного средства для профилактики и/или лечения функционального патологического состояния в области таза и промежности, выбранного из группы синдром раздраженного мочевого пузыря, синдром гиперактивного мочевого пузыря, хронической боли в области таза и промежности и недержания мочи, и фармацевтическая композиция того же назначения на основе указанных соединений. Технический результат состоит в снижении усиленных сократительных реакций воспалённого или гиперактивного мочевого пузыря. 2 н. и 13 з.п. ф-лы, 12 ил.
Формула
Документы, цитированные в отчёте о поиске
Химерный полипептид, селективно взаимодействующий с родственным ему рецептором хемокина, фармацевтическая композиция и применение химерного полипептида (варианты)

Комментарии