Химерный полипептид, селективно взаимодействующий с родственным ему рецептором хемокина, фармацевтическая композиция и применение химерного полипептида (варианты) - RU2430113C2
Код документа: RU2430113C2
Чертежи






























































Описание
Область, к которой относится изобретение
Изобретение, в целом, относится к рецепторам, сопряженным с G-белками (GPCR), в частности к агонистам и антагонистам GPCR, применению этих соединений и их фармацевтических композиций, например, при лечении, модуляции и/или профилактике физиологических состояний, связанных с GPCR, таких как лечение состояний, в которых играют роль рецепторы хемокинов, например сепсиса, артрита, воспаления и аутоиммунных заболеваний.
Уровень техники
Множество гормонов, нейромедиаторов и биологически активных веществ контролирует, регулирует или корректирует функции живых организмов посредством специфических рецепторов, расположенных на мембранах клеток. Многие из этих рецепторов опосредуют передачу внутриклеточных сигналов путем активации белков, связывающих нуклеотид гуанин (G-белков), к которым рецептор присоединяется. Такие рецепторы в целом называются рецепторами, сопряженными с G-белками («GPCR»). Связывание специфической сигнальной молекулы с GPCR может вызвать изменение конформации рецептора, в результате чего возникает форма, способная связываться с G-белком и активировать его, тем самым инициируя каскад внутриклеточных событий, который в конечном счете приводит к биологическому ответу. Как правило, GPCR взаимодействуют с G-белками для регуляции синтеза внутриклеточных вторичных мессенджеров, таких как цАМФ, инозитолфосфаты, диацилглицерин и ионы кальция.
Хемокины представляют собой аттрактанты для лейкоцитов и участвуют в иммунных процессах, связанных с миграцией лейкоцитов. Перемещение лейкоцитов высоко координировано, и распад основных контролирующих механизмов может привести к врожденной чрезмерной активации иммунитета, такой как синдромы системного воспалительного ответа или аутоиммунные заболевания. Индуцированная хемокинами передача сигналов опосредуется GPCR, и, по определению, ее отличительным признаком является хемотаксис лейкоцитов. Кроме того, хемокины индуцируют клеточные ответы, которые не связаны с миграцией лейкоцитов, например выживание клетки, взаимодействие вируса с хозяином, рост и метастазирование опухоли, органогенез и ангиогенез.
GPCR играют жизненно важную роль в процессах передачи сигналов, которые контролируют клеточный метаболизм, рост и подвижность клеток, адгезию, воспаление, передачу сигналов нейронами и свертывание крови. Белки GPCR также играют очень важную роль в качестве мишеней для ряда сигнальных молекул, которые контролируют, регулируют или корректируют функции живых организмов. GPCR вовлечены в развитие самых различных расстройств, как хорошо известно в данной области техники. Разработка новых модуляторов GPCR, например агонистов, частичных агонистов, обратных агонистов и антагонистов, может найти терапевтическое применение при лечении расстройств, связанных с GPCR, включая сепсис, артрит, воспаление и аутоиммунные заболевания.
Сущность изобретения
Настоящее изобретение основано на открытии модифицированных пептидов, названных пепдуцинами, которые содержат остаток, проникающий в клетку или связывающийся с мембраной, соединенный с пептидом, полученным из первой внутриклеточной петлевой структуры GPCR. Пепдуцины можно рассматривать как химерные пептиды/полипептиды, и пепдуцины являются агонистами и/или антагонистами передачи сигналов от рецептора к G-белку. Эти композиции проявляют селективность по отношению к родственному им рецептору.
Таким образом, изобретение относится к композиции пепдуцинов, где химерный полипептид включает первый домен первой внутриклеточной петли (i1-петли) GPCR или ее фрагмента и второй домен, соединенный с первым доменом. Второй домен является природным или искусственным гидрофобным остатком, проникающим в клетки и/или связывающимся с мембраной. Предпочтительно, первый домен не содержит природной внеклеточной части GPCR. Желательно, чтобы пепдуцины по изобретению связывались с родственным GPCR, из которого получен первый домен.
Первый домен (первая внутриклеточная петля (i1-петля) рецептора, сопряженного с G-белком (GPCR), или ее фрагмент) содержит аминокислотную последовательность рецептора лютеинизирующего гормона; рецептора фолликулостимулирующего гормона; рецептора тиреотропного гормона; рецептора кальцитонина; рецептора глюкагона; рецептора глюкагоноподобного пептида типа 1 (GLP-1); метаботропного глутаматного рецептора; рецептора паратгормона; рецептора вазоактивного интестинального пептида; рецептора секретина; рецептора рилизинг-фактора гормона роста (GRF); рецепторов, активируемых протеазой (PAR); рецепторов холецистокинина; рецепторов соматостатина; рецепторов меланокортина; рецепторов АДФ; рецепторов аденозина; рецепторов тромбоксанов; рецептора фактора активации тромбоцитов; адренергических рецепторов; рецепторов серотонина; рецепторов хемокинов; рецепторов нейропептидов; опиоидных рецепторов; рецепторов паратгормона (PTH); или рецептора вазоактивного интестинального пептида (ВИП).
Например, первый домен (первая внутриклеточная петля (i1-петля) рецептора, сопряженного с G-белком (GPCR), или ее фрагмент) содержит аминокислотную последовательность активируемого протеазой рецептора (PAR) или рецептора хемокинов. Активируемый протеазой рецептор может представлять собой, например, PAR1, PAR2, PAR3 или PAR4. Рецептор хемокинов может представлять собой CC или рецептор CXC, такой как CCR1, CCR2, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8 или CCR9; или CXCR1, CXCR2, CXCR3, CXCR4, CXCR5, CXCR6 или CX3CR1 соответственно. Еще в одном варианте осуществления первый домен (первая внутриклеточная петля (i1-петля) рецептора, сопряженного с G-белком (GPCR), или ее фрагмент) может быть доменом, например, рецепторов холецистокининов A и B (CCKA, CCKB); соматостатина-2 (SSTR2); меланокортина-4 (MC4R); рецептора глюкагоноподобного пептида типа 1 (GLP-1R); рецептора АДФ P2Y12; или «атипичных» рецепторов хемокинов, таких как NK1, NK2, рецепторов GRP/бомбезина, FPR1, FPRL-1, C3aR или C5aR. В конкретном варианте осуществления пепдуцины по изобретению включают пепдуцины рецепторов хемокинов PAR2, CXCR1, CXCR2, CXCR4 и CCR5.
Второй домен (гидрофобный остаток, проникающий в клетки и/или связывающийся с мембраной) прикреплен к N-концу, C-концу, аминокислоте между C-концевой и N-концевой аминокислотой, или и к N-концу, и к C-концу первого домена. Желательно, чтобы гидрофобным остатком, проникающим в клетки и/или связывающимся с мембраной, являлся липид, такой как жирная кислота с неразветвленной цепью, например остаток нонаноил (C9); каприл (C10); ундеканоил (C11); лаурил (C12); тридеканоил (C13); миристил (C14); пентадеканоил (C15); пальмитил (C16); фитанил (C16 с замещенным метилом); гептадеканоил (C17); стеарил (C18); нонадеканоил (C19); арахидил (C20); гениэйкозанил (C21); бегенил (C22); труцизанил (C23); и лигноцерил (C24). Гидрофобный остаток, проникающий в клетки и/или связывающийся с мембраной, может быть присоединен к химерному полипептиду посредством, например, амидных связей, сульфгидрильных групп, аминов, спиртов, фенольных групп или связей углерод-углерод. Конкретные варианты осуществления в качестве гидрофобного остатка содержат пальмитил или литохолевую кислоту (или ее соли). Другие гидрофобные остатки, проникающие в клетки и/или связывающиеся с мембраной, включают холестерин, фосфолипиды, стероиды, сфингозин, церамид, октилглицин, 2-циклогексилаланин, бензолилфенилаланин, C1 или C2 ацильные группы или C3-C8 жирные кислоты.
Изобретение также относится к фармацевтическим композициям, содержащим композиции пепдуцинов по изобретению и фармацевтически приемлемый носитель, и к наборам, содержащим, в одном или более контейнерах, эти фармацевтические композиции.
Изобретение относится к способам лечения, снижения тяжести или профилактики сепсиса, например, у млекопитающего путем введения пепдуцина, включающего первый домен первой внутриклеточной петли (i1-петли) рецептора, сопряженного с G-белком (GPCR), или ее фрагмента, и второй домен, соединенный с первым доменом. Второй домен является природным или искусственным гидрофобным остатком, проникающим в клетки, связывающимся с мембраной. У индивидуума диагностирован сепсис, или индивидуум подвергается риску развития сепсиса.
Композиции также можно использовать для лечения, снижения тяжести или профилактики воспаления и/или ингибирования ангиогенеза. Способы лечения или профилактики воспаления и/или ингибирования ангиогенеза осуществляются путем введения пепдуцина, ингибирующего хемокины, включающего химерный полипептид, содержащий первый домен первой внутриклеточной петли (i1-петли) рецептора, сопряженного с G-белком (GPCR), или ее фрагмента, и второй домен, соединенный с первым доменом, где второй домен является природным или искусственным гидрофобным остатком, проникающим в клетки, связывающимся с мембраной.
Композиции также можно использовать для лечения или снижения тяжести онкологического заболевания. Способы лечения или снижения тяжести онкологического заболевания осуществляются путем введения пепдуцина, включающего химерный полипептид, содержащий первый домен первой внутриклеточной петли (i1-петли) рецептора, сопряженного с G-белком (GPCR), или ее фрагмента, и второй домен, соединенный с первым доменом, где второй домен является природным или искусственным гидрофобным остатком, проникающим в клетки, связывающимся с мембраной.
Композиции также можно использовать для лечения или снижения тяжести тромбоза, например коронарного, артериального и венозного (такого как тромбоз глубоких вен или брыжеечных вен) тромбоза. Способы лечения или профилактики тромбоза осуществляются путем введения пепдуцина, включающего химерный полипептид, содержащий первый домен первой внутриклеточной петли (i1-петли) рецептора, сопряженного с G-белком (GPCR), или ее фрагмента, и второй домен, соединенный с первым доменом, где второй домен является природным или искусственным гидрофобным остатком, проникающим в клетки, связывающимся с мембраной.
Изобретение также относится к способам лечения или профилактики воспалительного расстройства, где индивидууму вводят пепдуцин, содержащий первый домен первой внутриклеточной петли (i1-петли) рецептора, сопряженного с G-белком (GPCR), или ее фрагмента, и второй домен, соединенный с первым доменом, где второй домен является природным или искусственным гидрофобным остатком, проникающим в клетки, связывающимся с мембраной. Подходящие для лечения воспалительные расстройства могут включать хронические обструктивные заболевания легких (COPD), анкилозирующий спондилит, шейный артрит, фибромиалгию, реперфузионное повреждение, ишемию кишки, ювенильный ревматоидный артрит, люмбосакральный артрит, остеоартрит, остеопороз, псориатический артрит, ревматическое заболевание, ревматоидный артрит, экзему, псориаз, дерматит, увеит и конъюнктивит, астму и бронхит, язвы, гингивит, болезнь Крона, атрофический гастрит, вариолоформный гастрит, язвенный колит, целиакию, региональный илеит, язвенную болезнь, повышение температуры, раздражение мочевого пузыря и цистит, воспалительные неврологические заболевания центральной или периферической нервной системы, рассеянный склероз, воспалительные нейропатии и неврологические осложнения СПИДа, аутоиммунное воспаление или хирургическую травму. Композиции, описанные в данном документе, предотвращают, обращают или уменьшают тяжесть сепсиса и связанной с ним патологии, такой как диссеминированное внутрисосудистое свертывание (ДВС), фибринолиз и/или системные воспалительные реакции (SIRS).
Композиции пепдуцина по изобретению можно использовать для активации или ингибирования активности широкого диапазона GPCR. Пепдуцины по изобретению включают пепдуцины, которые действуют на рецепторы хемокинов CXC, включая CXCR1, CXCR2, CXCR3, CXCR4, CXCR5, CXCR6 и CX3CR1; рецепторы хемокинов CC, включая CCR1, CCR2, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8 и CCR9; активируемые протеазой рецепторы (PAR), например, PAR1, PAR2, PAR4; рецепторы холецистокининов A и B (CCKA, CCKB), рецептор соматостатина типа 2 (SSTR2), рецептор меланокортина типа 4 (MC4R), рецептор глюкагоноподобного пептида типа 1 (GLP-1R), рецепторы сфингозин-1-фосфата (S1P), например подтипов S1P1 и S1P3, рецепторы EDG, рецепторы эндотелина (ET), например подтипов ET-1, ET-2, ET-3, ETA, ETB, рецепторы EDG, например подтипов EDG-1, EDG-2, EDG-3, EDG-4, EDG-5, EDG-6 и рецептор АДФ P2Y12. Кроме того, в объем изобретения включены пепдуцины «атипичных» рецепторов хемокинов, таких как NK1, NK2, GRP/рецепторы бомбезина, FPR1, FPRL-1, C3aR и C5aR. В конкретном варианте осуществления пепдуцины по изобретению включают пепдуцины рецепторов хемокинов PAR2, CXCR1, CXCR2, CXCR4 и CCR5.
Введение предпочтительно осуществляют системно, например внутривенно, например, в случаях системного воспаления, COPD и/или сепсиса. Альтернативно, композиции вводят подкожно, перорально, интраназально (например, для лечения астмы) или местно, например в форме липкого пластыря или крема, пены, мази (например, для облегчения симптомов дерматита, псориаза или других воспалительных заболеваний кожи).
Краткое описание чертежей
Фиг.1 представляет собой схему, показывающую топологию GPCR. На этой фигуре изображена i1-петля.
Фиг.2 представляет собой схему, показывающую последовательность i1-петли CXCR1 и CXCR2, в том числе трансмембранные фланкирующие области, которые выровнены, чтобы проиллюстрировать сходство строения.
Фиг.3 представляет собой таблицу, содержащую рецепторы хемокинов, на которые могут действовать пепдуцины по изобретению, соответствующие им лиганды и соответствующие типы клеток, в которых могут быть обнаружены рецепторы.
Фиг.4 представляет собой таблицу, содержащую дополнительные рецепторы хемокинов, на которые могут действовать пепдуцины по изобретению, соответствующие им лиганды и соответствующие типы клеток, в которых могут быть обнаружены рецепторы.
Фиг.5 представляет собой линейный график, показывающий реакцию животных на лечение пепдуцином в момент CLP в эксперименте, подробно описанном в примере 1.
Фиг.6 представляет собой линейный график, показывающий результаты эксперимента, подробно описанного в примере 2, демонстрируя результаты лечения пепдуцином, начатом через восемь часов после CLP.
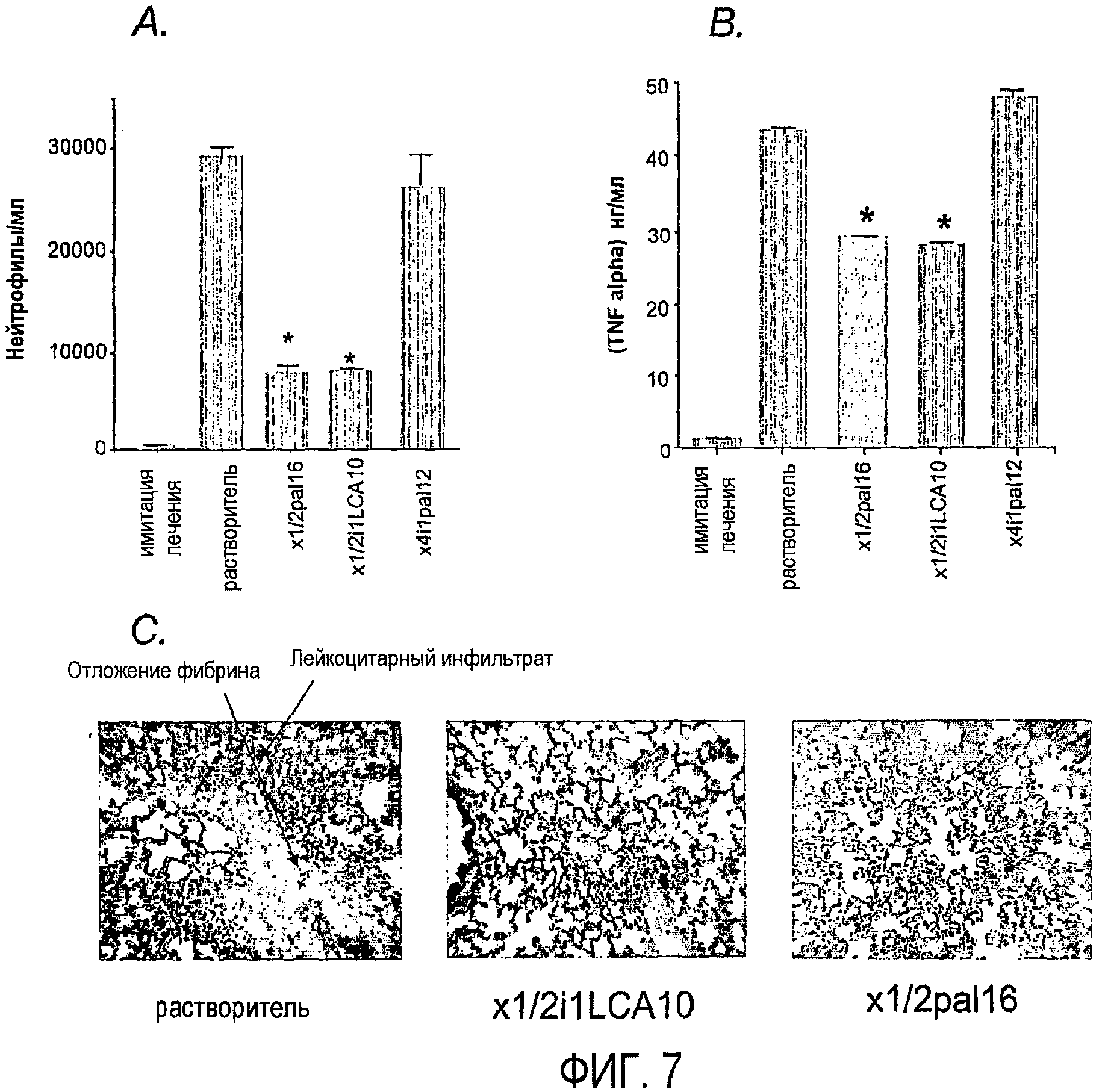
Фиг.7A-C изображают ингибирование инфильтрации лейкоцитами легкого; и выделение ФНО-α и отложение фибрина в легком после лечения пепдуцином, что более подробно описано в примере 3. Фиг.7A и 7B представляют собой гистограммы и фиг.7C - микрофотографии.
Фиг.8A-D являются гистограммами, показывающими укорочение времени кровотечения после лечения пепдуцином мышей с сепсисом.
Фиг.9 представляет собой график, показывающий, как хемотаксис нейтрофилов человека ингибируется лечением пепдуцином, что более подробно показано в примере 5.
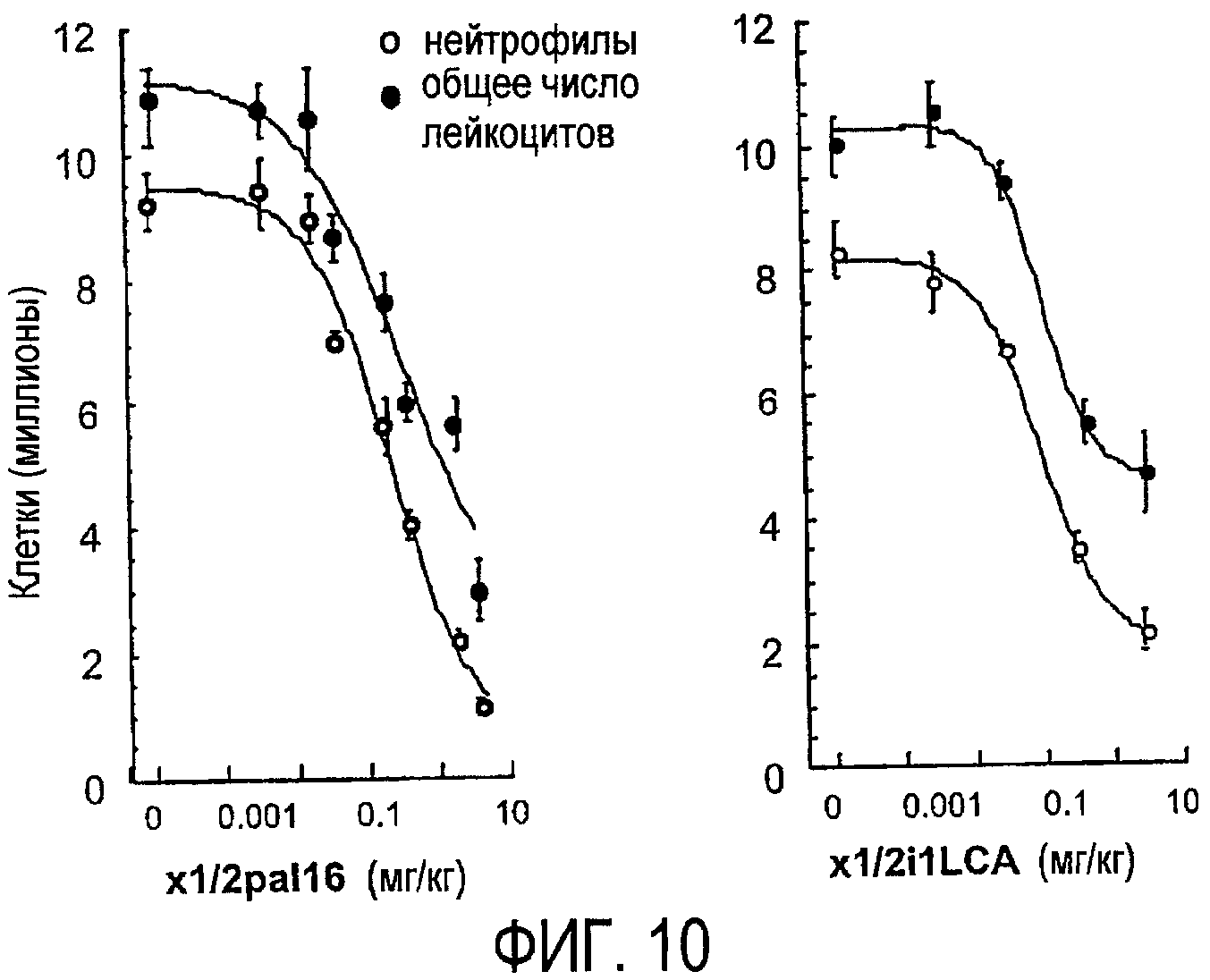
Фиг.10 представляет собой график, показывающий, как хемотаксис лейкоцитов in vivo ингибируется обработкой пепдуцином, что более подробно показано в примере 6.
Фиг.11 представляет собой линейный график, показывающий результаты эксперимента, который более подробно описан в примере 7.
Фиг.12 представляет собой график, показывающий, как пепдуцины по изобретению избирательно ослабляют воспаление путем демонстрации ингибирования хемотаксиса нейтрофила человека, что более подробно показано в примере 8.
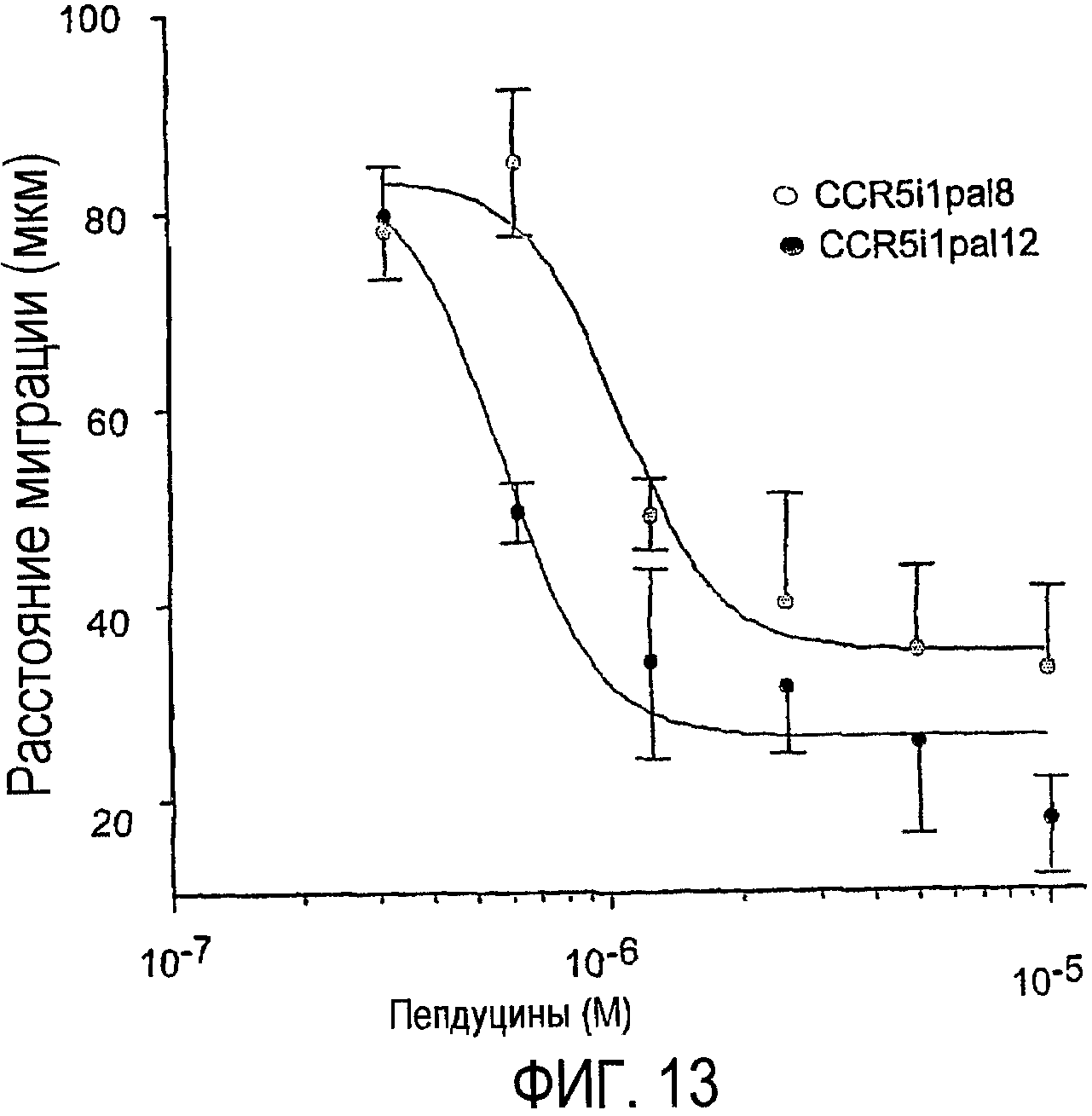
Фиг.13 представляет собой график, показывающий, как пепдуцины по изобретению избирательно ослабляют воспаление путем демонстрации ингибирования хемотаксиса моноцитов человека, что более подробно показано в примере 9.
Фиг.14 представляет собой схему, показывающую последовательность i1-петли CXCR4, включая трансмембранные фланкирующие области, которые могут использоваться в пепдуцинах по изобретению.
Фиг.15 представляет собой схему, показывающую последовательность i1-петли CCR1, включая трансмембранные фланкирующие области, которые могут использоваться в пепдуцинах по изобретению.
Фиг.16 представляет собой схему, показывающую последовательность i1-петли CCR2, включая трансмембранные фланкирующие области, которые могут использоваться в пепдуцинах по изобретению
Фиг.17 представляет собой схему, показывающую последовательность i1-петли CCR4, включая трансмембранные фланкирующие области, которые могут использоваться в пепдуцинах по изобретению
Фиг.18 представляет собой схему, показывающую последовательность i1-петли CCR5, включая трансмембранные фланкирующие области, которые могут использоваться в пепдуцинах по изобретению
Фиг.19 представляет собой схему, показывающую последовательность i1-петли PAR1, включая трансмембранные фланкирующие области, которые могут использоваться в пепдуцинах по изобретению
Фиг.20 представляет собой схему, показывающую последовательность i1-петли EDG, включая трансмембранные фланкирующие области, которые могут использоваться в пепдуцинах по изобретению.
Фиг.21 представляет собой схему, показывающую последовательность i1-петли NK1-R, включая трансмембранные фланкирующие области, которые могут использоваться в пепдуцинах по изобретению.
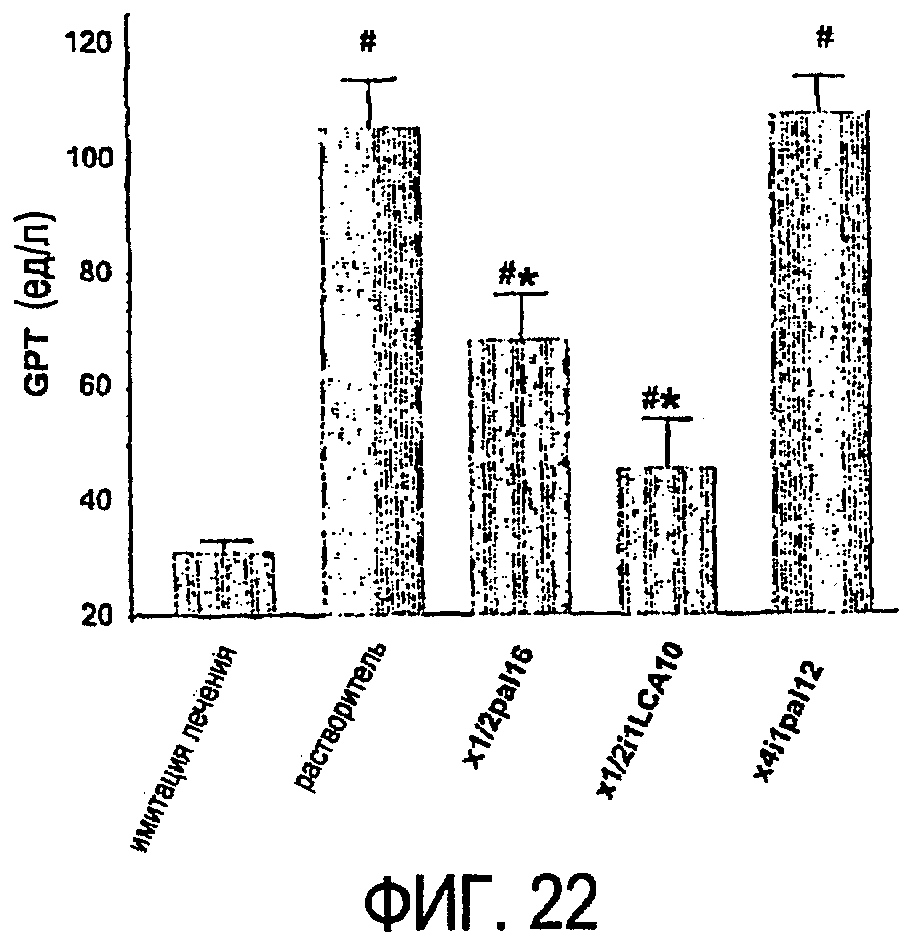
Фиг.22 представляет собой гистограмму, показывающую результаты эксперимента, который более подробно описан в примере 10.
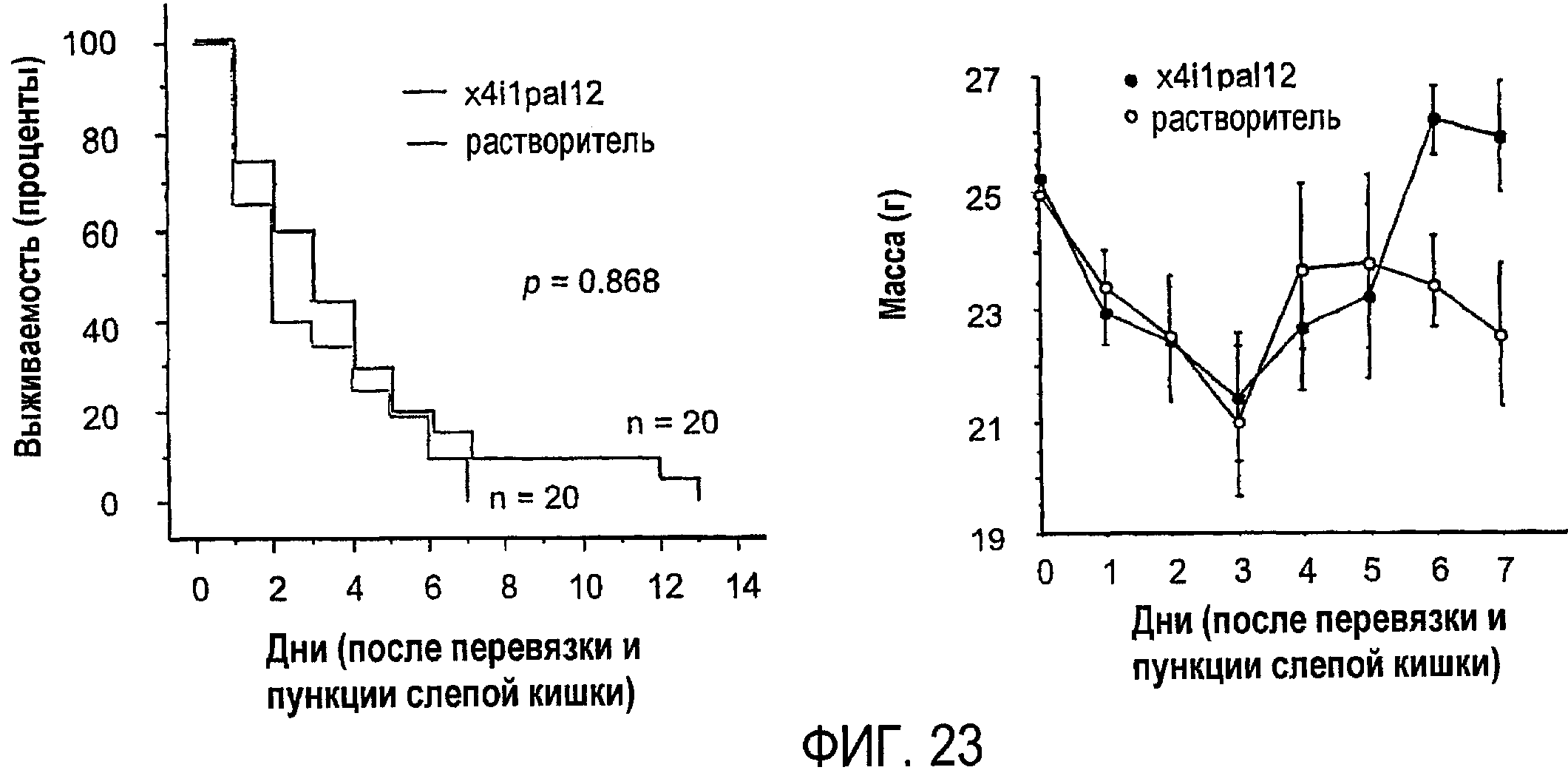
Фиг.23 представляет собой график, показывающий результаты эксперимента, который более подробно описан в примере 11.
Фиг.24A представляет собой гистограмму, показывающую клетки HEK, которые подвергли транзиентной трансфекции PAR1 и/или PAR4 и дали возможность мигрировать в течение 24 часов по направлению к 0,5 мкМ TFLLRN (SEQ ID NO. 33) или 500 мкМ AYPGKF (SEQ ID SEQ NO. 34) в присутствии или в отсутствие 300 нМ P4pal-i1; фиг.24B представляет собой график, показывающий тромбоциты человека, инкубированные в течение 2 минут 3 мкМ P4pal-i1 или буфером (необработанные) перед добавлением 160 мкМ AYPGKF; фиг.24C представляет собой график, показывающий тромбоциты человека, инкубированные в течение 2 минут 3 мкМ P4pal-i1 или буфером (необработанные) перед добавлением 13 мкМ SFLLRN; и фиг.24D представляет собой график, показывающий тромбоциты, инкубированные в течение 2 минут 1 мкМ RWJ-56110, 5 мкМ P4pal-i1 или 1 мкМ RWJ-56110 плюс 5 мкМ P4pal-i1 перед добавлением 3 нМ тромбина (T). Данные, проиллюстрированные на этих фигурах, являются результатами эксперимента, который подробно описан в примере 12.
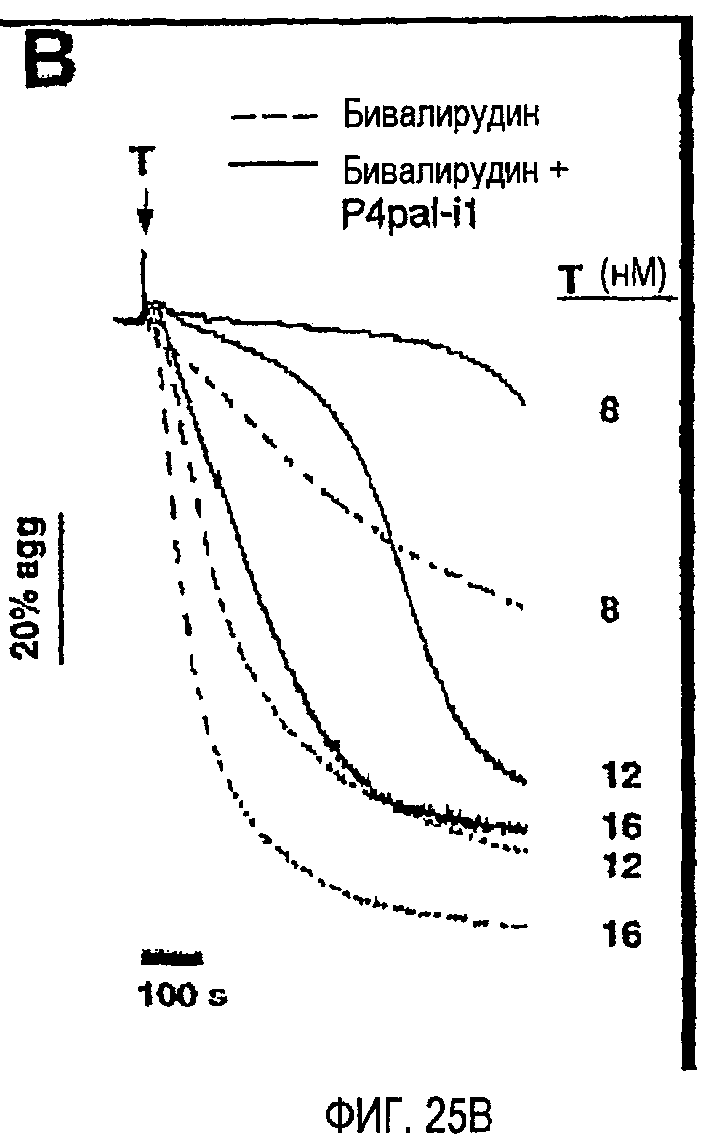
Фиг.25A представляет собой график, иллюстрирующий комбинацию блокирования зависимой от тромбина агрегации бивалирудином и P4pal-i1; тромбоциты человека перед добавлением 20 пМ-20 нМ тромбина инкубировали в течение 2 минут буфером (необработанные), бивалирудином (200 нм), RWJ-56110 (1 мкМ) и/или PAR1-Ab (74 мкг/мл), как указано; фиг.25B представляет собой график, иллюстрирующий тромбоциты, инкубированные в течение 2 минут 200 нМ бивалирудином плюс или минус 5 мкМ P4pal-i1 перед добавлением указанных концентраций тромбина. Данные, проиллюстрированные на этих фигурах, являются результатами эксперимента, который подробно описан в примере 13.
Фиг.26 представляет собой гистограмму, иллюстрирующую блокирование окклюзии сонных артерий у морских свинок комбинацией бивалирудина плюс P4pal-i1. Морским свинкам вводили бивалирудин, P4pal-i1 и/или P1pal-7 (n=3-5 для каждой экспериментальной группы) за 5 минут до повреждения сонной артерии FeCl3, как описано в примере 14. Внизу фигуры приведены значения Р по сравнению с введением растворителя.
Фиг.27 представляет собой график, иллюстрирующий, как i1-петля пепдуцинов блокирует хемотаксическую миграцию клеток рака молочной железы и рака яичников. Кондиционированные среды готовили из NIH3T3. Исследование хемотаксиса (20 ч) выполняли, используя 48-луночный микрохемотаксический планшет (Neuroprobe), оборудованный 8-миллиметровыми пористыми фильтрами из нитроцеллюлозы для клеток рака яичников человека OVCAR-4 и клеток рака молочной железы человека MDA-MB-231. Данные выражены в виде индекса хемотаксиса, который является отношением между расстоянием миграции по направлению к кондиционированной среде NIH3T3 и миграции по направлению к среде RPMI.
Подробное описание изобретения
Определения
Для удобства здесь приведены определенные термины, использованные в описании, примерах и прилагаемой формуле изобретения.
«Лечение» включает любой эффект, например, уменьшение, снижение, коррекцию или устранение, который приводит к улучшению состояния, заболевания, расстройства и так далее или его симптома.
«Фрагмент GPCR» включает пептиды, имеющие часть последовательности белка GPCR, которая меньше, чем полноразмерная природная аминокислотная последовательность GPCR. «Выделенный фрагмент GPCR» включает пептиды, имеющие часть последовательности белка GPCR, которая меньше полноразмерной последовательности и не содержит природных фланкирующих областей. Выделенные фрагменты GPCR лишены одной или более аминокислот, которые в природной молекуле непосредственно примыкают к ссылочному фрагменту.
«Выделенный внутриклеточный фрагмент GPCR» включает пептиды, имеющие аминокислотную последовательность внутриклеточной i1-петли белка GPCR и не содержащие последовательности внеклеточной i1-петли или последовательности трансмембранной спирали, примыкающей к внутриклеточной петле. «Выделенный внеклеточный фрагмент GPCR» включает пептиды, имеющие аминокислотную последовательность внеклеточной петли белка GPCR и не содержащие аминокислоты внутриклеточной петли или трансмембранной последовательности фланкирующих областей внеклеточной петли.
«Связанные» означает «соединенные». Например, пептид и остаток, проникающий в клетку или связывающийся с мембраной, присоединены в пепдуцине друг к другу посредством связи, то есть ковалентной связи. Предпочтительно, связь представляет собой лабильную связь, такую как тиоловая или сложноэфирная связь. Соединения пепдуцина, имеющие лабильную связь, обладают преимуществом меньшего накопления в тканях организма по сравнению с соединениями с устойчивой связью. Сниженное накопление в тканях организма после введения индивиду ослабляет неблагоприятные побочные эффекты у индивида.
«Агонист GPCR» включает композиции, которые активируют GPCR, имитируя действие эндогенной сигнальной молекулы, специфической для этого рецептора. «Антагонист GPCR» включает композиции, которые ингибируют активность GPCR. Активность GPCR измеряется способностью связываться с эффектором сигнальной молекулы, таким как G-белок. «Активированный GPCR» представляет собой GPCR, который способен к взаимодействию с G-белком и к его активации. Ингибированный рецептор обладает ослабленной способностью связывать внеклеточный лиганд и/или продуктивно взаимодействовать с G-белком и активировать его.
«Остатки, проникающие в клетку», включают соединения или функциональные группы, которые опосредуют перенос вещества из внеклеточного пространства во внутриклеточный компартмент клетки. Остатки, проникающие в клетку, переносят связанное вещество (например, пептид GPCR или его фрагмент по изобретению) в цитоплазму или к цитоплазматическому пространству клеточной мембраны. Например, остаток, проникающий в клетку, является гидрофобным остатком. Гидрофобный остаток представляет собой, например, пептид со смешанной последовательностью или гомополимерный пептид, такой как полилейцин или полиаргинин, длиной по меньшей мере приблизительно 11 аминокислот. Вещество может быть пептидом, таким как фрагмент GPCR, или пептидомиметиком по изобретению. Остаток, проникающий в клетку, может содержать по меньшей мере 10 смежных аминокислот, например, 1-15 аминокислот трансмембранного спирального домена GPCR.
«Остатки, связывающиеся с мембраной», включают соединения или функциональные группы, которые присоединяются к мембране клетки или связываются с мембраной. Таким образом, остаток, связывающийся с мембраной, приводит вещество (то есть фрагмент GPCR или пептидомиметик по изобретению), с которым соединен остаток, связывающийся с мембраной, в непосредственную близость с мембраной клетки-мишени. Мембрана клетки является эукариотической или прокариотической. Желательно, чтобы остаток, связывающийся с мембраной, представлял собой гидрофобный остаток. Гидрофобный остаток может содержать пептид со смешанной последовательностью или гомополимерный пептид, такой как полилейцин или полиаргинин, длиной менее 10 аминокислот.
Остаток, связывающийся с мембраной, может содержать по меньшей мере от 1 до 7 смежных аминокислот трансмембранного спирального домена GPCR. Предпочтительно, остаток, связывающийся с мембраной, представляет собой по меньшей мере 10 смежных аминокислот (но менее 16 аминокислот) трансмембранного домена GPCR; более предпочтительно, остаток, связывающийся с мембраной, представляет собой по меньшей мере 15 смежных аминокислот трансмембранного домена GPCR. Остатки, связывающиеся с мембраной, также включают холестерин, фосфолипиды, стероиды, сфингозин, церамид, октилглицин, 2-циклогексилаланин или бензолилфенилаланин. Другие остатки, связывающиеся с мембраной, включают C1 или C2 ацильные группы или остаток C3-C8 жирных кислот, такой как пропионил (C3); бутанил (C4); пентанил (C5); каприл (C6); гептанил (C7); и каприлил (С8). Остаток, связывающийся с мембраной, может быть присоединен к C-концевой аминокислоте, N-концевой аминокислоте или к аминокислоте, находящейся между N-концевой и C-концевой аминокислотами фрагмента GPCR в пепдуцине.
«Фармацевтически или фармакологически приемлемый» включают молекулярные объекты и композиции, которые не вызывают неблагоприятную, аллергическую или другую вредную реакцию при введении животному или человеку соответственно. «Фармацевтически приемлемый носитель» включает любые и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые средства, изотонические средства и средства, замедляющие всасывание, и тому подобное. Применение таких сред и средств для фармацевтических активных веществ известно в данной области техники. Рассматривается применение в терапевтических композициях любых стандартных сред или средств, за исключением тех, которые несовместимы с активным ингредиентом. В композиции также могут быть включены дополнительные активные ингредиенты.
«Малые молекулы» включают композиции, имеющие молекулярную массу менее приблизительно 5 кДа и наиболее предпочтительно менее приблизительно 4 кДа. Малые молекулы могут быть нуклеиновыми кислотами, пептидами, полипептидами, пептидомиметиками, углеводами, липидами или другими органическими или неорганическими молекулами. Библиотеки химических и/или биологических смесей, таких как экстракты грибов, бактерий или водорослей, известны в данной области техники и могут подвергаться скринингу в любом испытании по изобретению.
«Молекулы-мишени» включают молекулы, с которыми белок GPCR связывается или взаимодействует в природе, например молекулу на поверхности клетки, которая экспрессирует белок, взаимодействующий с GPCR; молекулу на поверхности второй клетки; молекулу во внеклеточной среде; молекулу, связанную с внутренней поверхностью мембраны клетки; или цитоплазматическую молекулу. Молекула-мишень GPCR может быть не-GPCR молекулой или пептидом GPCR по изобретению. В одном варианте осуществления молекула-мишень GPCR представляет собой компонент пути передачи сигнала, который облегчает передачу внеклеточного сигнала, такого как сигнал, сгенерированный при связывании соединения с мембраносвязанным GPCR, через клеточную мембрану и в клетку. Мишень может быть вторым межклеточным белком, обладающим каталитической активностью, или белком, который облегчает ассоциацию молекул, расположенных далее по ходу передачи сигнала, с GPCR.
«Комбинированное лечение» включает введение пепдуцина по изобретению и по меньшей мере второго средства как части конкретного режима лечения, предназначенного для обеспечения благоприятного эффекта от совместного действия этих терапевтических средств. Благоприятный эффект комбинации включает, но не ограничивается этим, фармакокинетическое или фармакодинамическое совместное действие, которое является результатом комбинации терапевтических средств. Введение этих терапевтических средств в комбинации обычно выполняют в течение определенного периода времени (обычно минуты, часы, дни или недели, в зависимости от выбранной комбинации). Может предполагаться, но, как правило, не предполагается, что «комбинированное лечение» включает введение двух или более этих терапевтических средств как части отдельных режимов монотерапии, что случайно и произвольно приводит к комбинациям по настоящему изобретению. Предполагается, что «комбинированное лечение» включает последовательное введение этих терапевтических средств, то есть такое, где каждое терапевтическое средство вводят в различное время, а также введение этих терапевтических средств или по меньшей мере двух из терапевтических средств по существу одновременно. По существу одновременное введение может быть достигнуто, например, путем введения субъекту одной капсулы, содержащей фиксированное соотношение каждого терапевтического средства, или множества отдельных капсул для каждого из терапевтических средств. Последовательное или по существу одновременное введение каждого терапевтического средства может быть произведено любым подходящим путем, включая, но не ограничиваясь этим, пероральные пути, внутривенные пути, внутримышечные пути и прямое всасывание через ткани слизистой оболочки. Терапевтические средства могут быть введены одним путем или различными путями. Например, первое терапевтическое средство из выбранной комбинации может быть введено внутривенной инъекцией, в то время как другие терапевтические средства из комбинации могут быть введены перорально. Альтернативно, например, все терапевтические средства могут быть введены перорально, или все терапевтические средства могут быть введены внутривенной инъекцией. Последовательность, в которой вводят терапевтические средства, не является критичной. «Комбинированное лечение» также может относиться к введению терапевтических средств, как описано выше, в дополнительной комбинации с другими биологически активными ингредиентами и нелекарственными способами лечения (например, операцией или лучевой терапией). Если комбинированное лечение дополнительно включает нелекарственное лечение, нелекарственное лечение можно проводить в любое подходящее время, пока достигается благоприятный эффект от совместного действия комбинации терапевтических средств и нелекарственного лечения. Например, в соответствующих случаях, благоприятный эффект все еще достигается, если нелекарственное лечение временно отделено от введения терапевтических средств, возможно, на несколько дней или даже недель.
Под «гомологичной аминокислотной последовательностью» понимается аминокислотная последовательность, то есть последовательность пепдуцина по изобретению, которая отличается от ссылочной аминокислотной последовательности только одной или несколькими (например, 1, 2, 3, 4 или 5) консервативными аминокислотными заменами или одной или несколькими (например, 1, 2, 3, 4 или 5) неконсервативными аминокислотными заменами, делециями или включениями, расположенными в положениях, в которых они не оказывают неблагоприятного влияния на активность полипептида. Предпочтительно, такая последовательность по меньшей мере на 75%, 80%, 85%, 90% или 95% идентична ссылочной аминокислотной последовательности.
Гомологичная аминокислотная последовательность включает пептидные последовательности, которые идентичны или по существу идентичны ссылочной аминокислотной последовательности. Под «аминокислотной последовательностью, по существу идентичной» понимается последовательность, которая по меньшей мере на 90%, предпочтительно на 95%, более предпочтительно на 97% и наиболее предпочтительно на 99% идентична ссылочной аминокислотной последовательности и которая предпочтительно отличается от ссылочной последовательности, если вообще отличается, по большей части консервативными аминокислотными заменами.
Консервативные аминокислотные замены, как правило, включают замены аминокислотами того же самого класса. Эти классы включают, например, (a) аминокислоты, имеющие незаряженные полярные боковые цепи, такие как аспарагин, глутамин, серин, треонин и тирозин; (b) аминокислоты, имеющие основные боковые цепи, такие как лизин, аргинин и гистидин; (c) аминокислоты, имеющие кислые боковые цепи, такие как аспарагиновая кислота и глутаминовая кислота; и (d) аминокислоты, имеющие неполярные боковые цепи, такие как глицин, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан и цистеин.
Гомологию, как правило, измеряют, используя программное обеспечение для анализа последовательностей (например, Sequence Analysis Software Package от Genetics Computer Group, University of Wisconsin Biotechnology Center, 1710 University Avenue, Madison, WI53705). Схожие аминокислотные последовательности выравнивают, чтобы получить максимальную степень гомологии (то есть идентичности). С этой целью может потребоваться искусственно ввести в последовательность пропуски. Как только оптимальное выравнивание достигнуто, степень гомологии (то есть идентичности) устанавливается путем регистрации всех положений, в которых аминокислоты обеих последовательностей идентичны, по отношению к общему количеству положений.
Факторы сходства включают схожий размер, форму и электрический заряд. Одним из особенно предпочтительных способов определения сходства аминокислот является матрица PAM25O, описанная Dayhoff et al, 5 Atlas of Protein Sequence and Structure 345-352 (1978 & Suppl.), приведенная в данном документе посредством ссылки. Показатель сходства сначала вычисляется как сумма показателей сходства попарно выровненных аминокислот. Вставки и делеции при вычислении процента гомологии и идентичности игнорируются. Соответственно, при вычислении не используются штрафы за пропущенную позицию. Предварительный показатель затем нормализуют путем деления геометрического среднего показателей соединения-кандидата и ссылочной последовательности. Геометрическое среднее представляет собой квадратный корень произведения этих показателей. Нормализованный предварительный показатель представляет собой процент гомологии.
Предпочтительно, гомологичная последовательность представляет собой последовательность, которая по меньшей мере на 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%o, 90% или 95% идентична ссылочной аминокислотной последовательности. Полипептиды, имеющие последовательность, гомологичную одной из последовательностей, указанных в настоящем описании, например в таблице 3, включают природные аллельные варианты, а также мутантные разновидности и варианты или любые другие искусственные варианты, которые аналогичны по функции, например пептидомиметикам.
Настоящая заявка является родственной по отношению к находящейся в процессе одновременного рассмотрения заявке на патент США No. 10/251703, озаглавленной «G Protein Coupled Receptor Agonists And Antagonists And Methods Of Activating And Inhibiting G Protein Coupled Receptors Using The Same», содержимое этой заявки на патент приведено в данном документе посредством ссылки в полном объеме.
Настоящее изобретение основано на открытии модифицированных пептидов, названных пепдуцинами, которые содержат остаток, проникающий в клетку или связывающийся с мембраной, соединенный с пептидом, полученным из i1-петли GPCR. Пепдуцины можно считать химерными пептидами/полипептидами, и они являются агонистами и/или антагонистами передачи сигналов от рецептора к G-белку и проявляют селективность по отношению к родственному им рецептору.
Пепдуцины по изобретению содержат остаток GPCR, полученный из первой внутриклеточной петли (i1) GPCR или ее фрагмента, и проникающий в клетки или связывающийся с мембраной остаток, который распределяет конъюгат в двойном слое липидов и поперек этого слоя клеток-мишеней; и способы их применения при лечении состояний, опосредованных GPCR. Остаток, проникающий в клетку, является, например, гидрофобной областью фрагмента GPCR. Проникающий в клетки или связывающийся с мембраной остаток фиксирует конъюгат в двойном слое липидов (или на поверхности клетки), увеличивая эффективную молярность конъюгата вблизи внутриклеточного рецептора, например у области контакта рецептора и G-белка. Экзогенный остаток GPCR пепдуцина нарушает взаимодействия G-белка рецептора и приводит к активации и/или ингибированию (то есть агонистической или антагонистической активности).
Пепдуцины действуют как средства, модулирующие рецепторы, путем нацеливания на внутриклеточную поверхность рецептора. Например, пепдуцины по настоящему изобретению включают антагонисты на основе PAR1 и PAR4 для антигемостатических и антитромбических эффектов в условиях in vivo. Поскольку тромбин представляет собой самый мощный активатор тромбоцитов, мишенями были выбраны PAR1 (Vu et al. Cell 64, 1057 (1991)) и PAR4 (Xu et al. Proc. Natl. Acad. Sci. (USA) 95, 6642 (1998); Covic et al. Biochemistry 39, 5458 (2000); и Covic et al. Thromb. Haemost. 87, 722 (2002)). Антагонисты этих двух рецепторов применимы для профилактики тромботических и пролиферативных осложнений острых коронарных синдромов, включая сепсис.
Реперфузионное повреждение возникает, когда после длительного периода ишемии кровоток восстанавливается. Реперфузионное повреждение является распространенной причиной осложнений и летальных исходов при таких состояниях, как инфаркт миокарда, инсульт, ишемия кишки и искусственное кровообращение, для которого часто нет никакого специфичного лечения. Пепдуцины по изобретению вводят внутривенно, чтобы создать существенную защиту против экспериментального реперфузионного повреждения сердечной мышцы.
Инфаркт миокарда, причиной которого служит ограниченное снабжение сердечной мышцы артериальной кровью, является ведущей причиной сердечной недостаточности и смерти. Таким образом, экстренное восстановление нормального кровообращения критически значимо для профилактики необратимого повреждения тканей сердца при гипоксии. Восстановление нормального кровотока может произойти естественным или искусственным путем после лечения инфаркта миокарда (ИМ) специфическими лекарственными средствами. Во многих случаях, однако, реперфузия подвергшейся инфаркту области запускает воспалительную реакцию, которая облегчает повреждение клеток сердца и тем самым ослабляет положительный эффект восстановленного кровообращения. Доказано, что большой вклад в эту патологическую воспалительную реакцию вносят лейкоциты, мигрировавшие в те области тканей, подвергшихся реперфузии, где имеется гипоксия.
В настоящее время трансплантация органов стала распространенной процедурой - в США в 2001 году выполнено более чем 22000 трансплантаций; чаще всего трансплантируют почки, печень и сердце. Большое количество трансплантаций, проводимых в настоящее время, отчасти объясняется способностью иммуномодуляторов контролировать острое отторжение. Основными механизмами острого отторжения после трансплантации служит позднее начало функционирования трансплантата, вызванное реперфузионным повреждением, и реакция «хозяин против трансплантата». Применение иммунодепрессантов успешно подавляет острое отторжение, и аллотрансплантат обычно длительно остается жизнеспособным, даже при том, что дозы иммунодепрессанта снижают до очень низких.
Однако иммунодепрессанты подавляют все иммунологические реакции, что сделало бурно протекающую инфекцию ведущей причиной смерти у реципиентов трансплантатов. Иммунодепрессанты также обладают выраженной токсичностью. Самые тяжелые осложнения, вызванные препаратами для лечения реципиентов трансплантатов, включают нефротоксичность, нейротоксичность, впервые выявленный после трансплантации сахарный диабет, гиперлипидемию и артериальную гипертензию. Эти побочные эффекты частично обусловлены повсеместной экспрессией молекулярных мишеней для иммунодепрессантов, используемых в настоящее время. Стратегии лечения с использованием пепдуцинов по настоящему изобретению способны прицельно воздействовать на реперфузионное повреждение и последующую инфильтрацию мононуклеарными клетками, основную причину острого отторжения.
Тяжелый сепсис представляет собой ведущую причину экстренных госпитализаций и часто служит осложнением у пациентов, которых лечат от других заболеваний. В начале сепсиса наличие бактерий и бактериальных продуктов, таких как эндотоксин, стимулирует иммунные защитные механизмы. Неспособность удалить вторгшихся возбудителей приводит к гиперактивным воспалительным реакциям, которые называют синдромом системной воспалительной реакции (SIRS), опосредуемым цитокинами и хемокинами. Хемокины при воспалении рассматриваются как терапевтические мишени. CXCR1 и CXCR2 представляет собой важные рецепторы хемокинов, ответственные за активацию нейтрофилов, эндотелия, эпителия, макрофагов и других клеток. У мышей передача сигналов посредством IL-8 невозможна из-за генетической делеции их единственного рецептора IL-8, CXCR2, что защищает мышей от развития сепсиса.
У людей контакт с высокими системными уровнями IL-8 приводит к дисфункции эндотелия и утрате нормального противосвертывающего состояния эндотелия. Расстройства коагуляции развиваются у 30-50% больных сепсисом, и развитие явного диссеминированного внутрисосудистого свертывания (ДВС) является плохим прогностическим признаком. Антагонистическое действие CXCR1/2, CXCR4 контролируется удалением стареющих нейтрофилов и удерживает незрелые лейкоциты в костном мозге. CXCR4 также играет решающую роль в механизмах миграции лимфоцитов и раковых клеток, но функции CXCR4 и его лиганда, SDF-1α, при остром воспалении остаются неизвестными.
За исключением введения антибиотиков, лечение сепсиса и септического шока в значительной степени ограничивается вспомогательными мероприятиями. В настоящее время для лечения сепсиса не доступны специфические терапевтические вмешательства, направленные против рецепторов хемокинов, хотя малые молекулы ингибиторов, направленные против CXCR1/2, могут защищать от реперфузионного повреждения и повреждения легких. Пепдуцины по изобретению можно использовать, чтобы прервать развившееся системное воспаление и повреждение сосудов, а также предотвратить активацию каскада свертывания крови, не нарушая защиты организма.
PAR человека включают PAR1 (номер доступа в Genbank AF019616); PAR2 (номер доступа в Genbank XM_003671); PAR3 (номер доступа в Genbank NM_004101); и PAR4 (номер доступа в Genbank NM_003 950.1), последовательности которых тем самым включены посредством ссылки.
Механизм двух сайтов связывания, посредством которого пепдуцины и активируют и ингибируют передачу сигнала от рецептора к G-белку, описан в данном документе, но изобретатели не предполагают, что их изобретение ограничено этим механизмом или теорией, на которой он базируется. Механизм объясняет двухфазную активацию и ингибирование агонистов и ингибирование антагонистов. Пепдуцины с помощью своей гидрофобной связи быстро преобразуют плазменную мембрану и достигают высокоэффективной молярности у перимембранозной поверхности раздела. Пепдуцин-агонист сначала занимает сайт высокой аффинности на внутриклеточной поверхности GPCR. Связавшийся агонист либо стабилизирует, либо индуцирует активированное состояние рецептора на сопряжение с G-белком (белками). После того как этот первый сайт становится насыщенным, более высокие концентрации пепдуцина начинают занимать второй, обладающий более низкой аффинностью, ингибиторный сайт, который блокирует передачу сигнала к G-белку доминирующим способом, возможно путем имитирования взаимодействий основного состояния GPCR (например, i1-петли рецептора) с G-белком. Ингибирование пепдуцинами-антагонистами совпадает с ингибиторной фазой агонистов, таким образом, антагонисты также могут связываться с сайтом более низкой аффинности. Экзогенная активация или ингибирование рецепторов пепдуцинами могут отражать потенциальный способ димеризации, посредством которого один рецептор отдает свои внутриклеточные петли смежному рецептору. Существует несколько примеров рецепторных димеров, которые дают начало различным свойствам передачи сигналов (Milligan, Science 288, 65-67 (2000)), в том числе цитокин/GPCR, такой как рецептор EPO (Guillard et al, J. Biol. Chem. (2001) 276, 2007-2013), однако механизм(ы) межрецепторной модуляции неизвестен.
Природный GPCR представляет собой молекулу поверхности клетки, которая пронизывает мембрану клетки по меньшей мере один раз. Например, многие из природных GPCR пронизывают мембрану клетки семь раз и содержат несколько внутриклеточных доменов. Выделенный фрагмент GPCR по изобретению включает домен первой внутриклеточной петли GPCR. Внутриклеточная часть выбрана из домена первой внутриклеточной петли рецептора цитокина GPCR, сопряженного с G-белком с одним трансмембранным доменом, или его фрагмента, или домена первой внутриклеточной петли мультиполипептида-GPCR, такого как рецептор GPIb/V/IX или рецептор коллагена.
Изобретение также относится к растворимым пепдуцинам, в которых второй домен (остаток, проникающий в клетки или связывающийся с мембраной) необязательно включает природные, последовательно расположенные аминокислоты трансмембранного домена, расположенного рядом с внеклеточным или внутриклеточным фрагментом. Например, конструкция может содержать по меньшей мере 3, но менее 16 последовательных аминокислот трансмембранного спирального домена GPCR. Трансмембранный домен не является трансмембранным доменом 1-7 CXCR4, трансмембранным доменом 1-7 рецептора CCKA или трансмембранным доменом 2 рецептора CCR5. В варианте осуществления второй домен включает 1-15 последовательных аминокислот природного трансмембранного спирального домена, непосредственно прилежащего к внеклеточному или внутриклеточному фрагменту.
Помимо пепдуцинов, основанных на пептиде, изобретение относится к композициям, в которых фрагмент GPCR содержит пептидомиметик. Например, изобретение относится к соединениям пепдуцина, в которых одна или более пептидных связей заменены альтернативным типом ковалентной связи, который не чувствителен к действию пептидаз («миметик пептида» или «пептидомиметик»). Там, где протеолитическое расщепление пептидов после инъекции индивиду становится проблемой, замена особенно чувствительной пептидной связи нерасщепляемым пептидомиметиком делает полученный в результате пептид более стабильным и, таким образом, более эффективным в качестве терапевтического средства. Такие миметики и способы их встраивания в пептиды известны в данной области техники. Аналогично, замена остатка L-аминокислоты (например, D-аминокислотой) делает пептид менее чувствительным к протеолизу.
Пепдуциновые соединения по изобретению могут быть синтезированы как retro-inverso изомеры, которые включают пептиды с обратной последовательностью и хиральностью. См., например, Jameson et al. Nature 368:744-746 (1994) и Brady et al. Nature 368:692-693 (1994). Конечным результатом объединения D-энантиомеров и обратного синтеза является взаимозамена положений карбонильных групп и аминогрупп в каждой амидной связи, хотя положение групп боковых цепей при каждом альфа-атоме углерода сохраняется. Например, если модель пептида представляет собой пептид, образованный из L-аминокислот, имеющий последовательность ABC, то у retro-inverso аналога пептида, образованного из D-аминокислот, последовательность будет CBA. Методики синтеза цепи D-аминокислот с образованием retro-inverso пептидов хорошо известны в данной области техники.
Также можно использовать аминоконцевые блокирующие группы, такие как трет-бутилоксикарбонил, ацетил, теил, сукцинил, метоксисукцинил, суберил, адипил, азелаил, данзил, бензилоксикарбонил, флуоренилметоксикарбонил, метоксиазелаил, метоксиадипил, метоксисуберил и 2,4-динитрофенил. Блокирование заряженных амино- и карбоксиконца пептидов будет давать дополнительное преимущество - усиление проникновения пептидов через гидрофобную клеточную мембрану и поступления в клетку.
Выделенный фрагмент GPCR может быть получен из последовательности GPCR класса А или GPCR класса B. Выделенный фрагмент GPCR представляет собой фрагмент любого известного или неизвестного GPCR, включая, но не ограничиваясь этим, активируемые протеазой рецепторы (PAR, например, рецептор тромбина), рецептор лютеинизирующего гормона, рецептор фолликулостимулирующего гормона, рецептор тиреотропного гормона, рецептор кальцитонина, рецептор глюкагона, рецептор глюкагоноподобного пептида типа 1 (GLP-1), метаботропный глутаматный рецептор, рецептор паратгормона, рецептор вазоактивного интестинального пептида (ВИП), рецептор секретина, рецептор рилизинг-фактора гормона роста (GRF), рецепторы холецистокинина, рецепторы соматостатина, рецепторы меланокортина, нуклеотидные рецепторы (например, рецепторы АДФ), рецепторы аденозина, рецепторы тромбоксанов, рецепторы фактора активации тромбоцитов, адренергические рецепторы, рецепторы 5-гидрокситриптамина (5-HT) (серотонина), рецепторы хемокинов (например, CXCR4, CCR5), рецепторы нейропептидов, опиоидные рецепторы, рецептор эритропоэтина и рецептор паратгормона (PTH).
В предпочтительных вариантах осуществления GPCR представляет собой активируемый протеазой рецептор, пептидный рецептор или нуклеотидный рецептор. В конкретных вариантах осуществления GPCR представляет собой рецептор PAR1, PAR2, PAR3 или PAR4. В других вариантах осуществления GPCR представляет собой рецептор глюкагоноподобного пептида, нуклеотидный рецептор, такой как рецептор АДФ P2Y-12, рецептор ожирения MC4, рецептор CXCR (например, CXCR4) или рецепторы хемокинов CCR5, CCKA или CCKB.
Выделенный фрагмент GPCR может включать фрагмент GPCR, который представляет собой менее 50 последовательных аминокислот GPCR и не содержит природный внеклеточный лиганд GPCR. Например, фрагмент может состоять из 3-30 последовательных аминокислот GPCR. В предпочтительных вариантах осуществления фрагмент GPCR содержит фрагмент GPCR из 7-24 (включительно) последовательных аминокислот. Например, фрагмент включает 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или 24 последовательных аминокислот GPCR.
Необязательно, аминокислотная последовательность GPCR отличается от природной аминокислотной последовательности. Например, отдельные остатки данного домена, например трансмембранной спирали, внеклеточной или внутриклеточной петли, мутированы или замещены модифицированной аминокислотой (аминокислотами) для улучшения активности пепдуцина. Предпочтительно, аминокислотная последовательность такого аналога GPCR отличается исключительно консервативными аминокислотными заменами, то есть заменой одной аминокислоты другой из того же класса, или неконсервативными заменами, делециями или вставками, расположенными в положениях, которые не нарушают функцию белка.
Остаток GPCR пепдуцинов по настоящему изобретению получают из любых клеток человека или другого организма (например, морской свинки, крысы, мыши, цыпленка, кролика, свиньи, овцы, рогатого скота, обезьяны, вируса, грибов, насекомых, растений, бактерий и так далее), например клетки селезенки, нервной клетки, клетки глии, бета-клетки поджелудочной железы, клетки костного мозга, мезангиальной клетки, клетки Лангерганса, эпидермальной клетки, эпителиальной клетки, эндотелиальной клетки, фибробласта, фиброцита, мышечной клетки, жировой клетки, иммуноцита (например, макрофага, Т-клетки, В-клетки, натуральной киллерной клетки, тучной клетки, нейтрофила, базофила, эозинофила, моноцита и т.д.), мегакариоцита, синовиальной клетки, хондроцита, остеоцита, остеобласта, остеокласта, клетки молочной железы, гепатоцита или интерстициальных клеток или клеток-предшественниц, их стволовых или раковых клеток и тому подобное; и из любых тканей, содержащих такие клетки, например головного мозга, различных частей головного мозга (например, обонятельной луковицы, миндалины, базальных ганглиев, гиппокампа, таламуса, гипоталамуса, субталамического ядра, коры головного мозга, продолговатого мозга, мозжечка, затылочного полюса, лобной доли, скорлупы, хвостатого ядра, мозолистого тела, черного вещества), спинного мозга, гипофиза, желудка, поджелудочной железы, почки, печени, половых органов, щитовидной железы, желчного пузыря, костного мозга, надпочечника, кожи, мышцы, легкого, пищеварительного тракта, кровеносного сосуда, сердца, тимуса, селезенки, подчелюстной железы, периферической крови, лейкоцита периферической крови, кишечника, предстательной железы, яичка, семенника, яичника, плаценты, матки, кости, сустава, тонкой кишки, толстой кишки, скелетной мышцы и тому подобное, в частности головного мозга и различных частей головного мозга.
Проникающие в клетку остатки включают липид, холестерин, фосфолипид, стероид, сфингозин, церамид или остаток жирной кислоты. Остаток жирной кислоты может быть, например, любой жирной кислотой, которая содержит по меньшей мере восемь атомов углерода. Например, жирная кислота может представлять собой остаток нонаноила (C9); каприла (C10); ундеканоила (C11); лаурила (C12); тридеканоила (C13); миристила (С14); пентадеканоила (С15); пальмитила (C16); фитанила (C16 с замещенным метилом); гептадеканоила (C17); стеарила (C18); нонадеканоила (C19); арахидила (C20); гениэйкозанила (C21); бегенила (C22); труцизанила (C23); или лигноцерила (C24). Проникающий в клетку остаток также может включать мультимеры (например, композицию, содержащую более одной единицы) октилглицина, 2-циклогексилаланина или бензолилфенилаланина. Проникающий в клетку остаток содержит незамещенный или замещенный галогеном (например, хлором) остаток бифенила. Замещенные бифенилы связаны со сниженным накоплением в тканях организма, по сравнению с соединениями, содержащими незамещенный бифенил. Сниженное накопление в тканях организма после введения индивидууму связано с ослабленными неблагоприятными побочными эффектами у индивидуума.
Предпочтительно, остаток, проникающий в клетку, представляет собой природный или искусственный остаток пальмитила. Пепдуцины с остатками жирных кислот длиннее C15, например, пальмитилом, имеют неожиданно большую продолжительность существования in vivo и приемлемы для подкожного введения. В другом варианте осуществления пепдуцины, имеющие остатки короче C15, например миристила, представляются подходящими для кратковременных применений, например, хирургических применений и внутривенного введения.
Остаток, проникающий в клетку или связывающийся с мембраной, может быть присоединен к C-концевой аминокислоте, N-концевой аминокислоте или к аминокислоте, находящейся между N-концевой и C-концевой аминокислотами фрагмента GPCR.
Также в пределы изобретения входит композиция, которая включает полипептид, имеющий аминокислотную последовательность SEQ ID NO: 1-14, или ее части, связанные с остатком, проникающим в клетки или связывающимся с мембранами. В частности, подходящие пепдуцины по изобретению включают перечисленные ниже в таблице 1.


Композиции используются для лечения, профилактики или ослабления (уменьшения тяжести) одного или более симптомов, связанных с заболеваниями и состояниями, характеризующимися отклоняющейся от нормы активностью GPCR. Такие заболевания и состояния включают тромбоз, инфаркт, инсульт, избыточное кровотечение, астму, воспаление, боль, воспалительную боль, висцеральную боль, нейрогенную боль, артрит, диабет, ВИЧ-инфекцию, тревогу, депрессию, легочную недостаточность и различные типы злокачественных опухолей. Такие способы осуществляются путем контакта с клеткой, которая патологически сверхэкспрессирует GPCR, пепдуцина-антагониста GPCR. Например, способ предусматривает введение индивидууму, например человеку, которому показано такое лечение или профилактика, пепдуцина в количестве, достаточном для уменьшения тяжести патологии у индивида. Настоящее изобретение также относится к фармацевтическим композициям, содержащим любую из композиций пепдуцина и фармацевтически приемлемый носитель. Изобретение также относится к наборам, содержащим фармацевтические композиции. Кроме того, изобретение относится к способам лечения патологического состояния у млекопитающего путем введения любого полипептида по изобретению.
Конструкции также используются для ингибирования роста и миграции опухоли. Инвазия клеток рака молочной железы представляет собой сложный процесс, в котором имеют место миграция клеток, протеолитические модификации базальных мембран ткани и разложение внеклеточного матрикса матриксными металлопротеазами (MMP). Вызванная MMP1 активация PAR1 играет критическую роль в инвазии клеток рака молочной железы и образовании опухоли (Boire et al. Cell, 120(3), 303 (2005)). Пепдуцин-антагонист i1-петли PAR1, например, P1i1pall1, используется в отдельности или как адъювантное лечение рака, например, при введении с соединением доцетаксела, таким как Taxotere®. Предпочтительно, достигается синергичный противоопухолевый эффект. Влияние внутриклеточного ингибирования PAR1 доказано с использованием клеточной линии метастатического рака молочной железы человека MDA-MB-231. Эффективность пепдуцина в отдельности и в комбинированном лечении, например, вместе с таксотером проанализирована с использованием исследования MTT и мышиной модели ксенотрансплантата. IC50 пепдуцина P1i1pall1 и таксотера определена после введения композиций по отдельности или вместе. Методика Isobologram и метод комбинационного индекса (CI) использованы для определения степени синергизма количественно. Данные, полученные с помощью ксенотрансплантатов, использованы для определения, были ли у мышей, получавших P1i1pall1 и таксотер, темпы роста опухоли ниже по сравнению с мышами, которые получали только таксотер. Соединения уменьшают рост и миграцию опухоли на всех стадиях развития опухоли, например ранних стадиях развития опухоли, а также на более поздних стадиях развития опухоли.
Например, как показано на фиг.27, пепдуцины i1-петли на основании рецепторов хемокинов CXCR1/2 (x1/2pal-i1) и CXCR4 (x4pal-i1) блокируют хемотаксическую миграцию рака молочной железы и яичников.
Определенные пепдуцины по изобретению представляют собой ингибиторы активации тромбоцитов. Ингибитор содержит выделенный фрагмент активируемого протеазой рецептора и остаток, проникающий в клетки, соединенный с полипептидом GPCR. В некоторых вариантах осуществления активируемый протеазой рецептор представляет собой рецептор тромбина, рецептор трипсина, рецептор фактора свертывания крови Xa, рецептор активированного белка C, рецептор триптазы или рецептор плазмина. Рецептор тромбина предпочтительно представляет собой PAR-4 или PAR-1.
Изобретение также относится к способу ингибирования агрегации тромбоцитов путем контакта тромбоцитов с композицией выделенного фрагмента активируемого протеазой рецептора, связанного с остатком, проникающим в клетки, как описано выше. Например, активируемый протеазой рецептор представляет собой рецептор тромбина, такой как рецептор PAR-1 или рецептор PAR-4. Также в объем изобретения входит способ ингибирования образования тромба у млекопитающего путем введения млекопитающему композиции по изобретению, которая включает выделенный фрагмент рецептора тромбина, связанный с остатком, проникающим в клетки.
Способы по изобретению осуществляют путем инфузии в просвет сосуда, например яремной вены, периферической вены, или периваскулярное пространство, ингибирующих композиций по изобретению. Периферическая вена может представлять собой, например, вену, расположенную в конечностях, таких как кисть, запястье или ступня. В некоторых вариантах осуществления композицию вводят в легкие млекопитающего, например, в виде аэрозоля. В других вариантах осуществления композицию по изобретению вводят посредством инъекции. В различных вариантах осуществления инъекцию можно производить в брюшную полость млекопитающего, субдермально или подкожно. Композиция по изобретению также может быть введена чрескожно. В других вариантах осуществления композицию по изобретению вводят вагинально или ректально. Композиция может быть введена путем имплантирования материала для тампонирования раны или суппозитория, который покрыт или пропитан композицией по изобретению.
Ингибиторы образования тромба или агрегации тромбоцитов используются в медицинских устройствах, например, в качестве покрытия. Например, аваскулярное эндопротезное устройство, например, сетка, стент или катетер, включает ингибитор образования тромба, который является выделенным фрагментом рецептора тромбина, связанным с остатком, проникающим в клетку. Композицией пропитывают устройство, и композиция диффундирует в ткани организма при контакте с тканью или при имплантации устройства; альтернативно, устройство покрывают пепдуцином.
Пепдуцины также используются для ингибирования миграции и инвазии опухолевых клеток путем контакта опухолевой клетки с выделенным фрагментом активируемого протеазой рецептора, связанным с остатком, проникающим в клетки. Активируемый протеазой рецептор представляет собой рецептор PAR-4, PAR-2 или PAR-1. Способы ингибирования метастазов опухолевых клеток осуществляют путем контакта опухолевой клетки с выделенным фрагментом активированного рецептора протеазы, связанного с остатком, проникающим в клетки. Опухолевая клетка представляет собой клетку меланомы, клетку рака молочной железы, клетку рака почки, клетку рака предстательной железы, клетку рака легкого, клетку рака толстой кишки, клетку опухоли центральной нервной системы (ЦНС), клетку рака печени, клетку рака желудка, клетку саркомы, лейкозную клетку или клетку лимфомы.
Симптомы астмы ослабляются при введении пепдуцина, основанного на GPCR тромбина или трипсина/триптазы. Соответственно, способ подавления астмы осуществляется путем введения композиции, содержащей выделенный фрагмент GPCR тромбина или трипсина/триптазы, связанный с остатком, проникающим в клетки. Предпочтительно, рецептор трипсина/триптазы представляет собой рецептор PAR-1, PAR-2 или PAR-4. В различных вариантах осуществления композицию вводят в просвет сосуда, такого как периферическая вена, вводят в легкие млекопитающего, например, ингаляцией (например, в виде аэрозоля), или вводят чрескожным путем.
Ингибиторы активации тромбоцитов включают выделенный фрагмент активируемого нуклеотидами GPCR, такого как рецептор P2Y12, связанный остатком, проникающим в клетки. Такие композиции могут использоваться в способах ингибирования агрегации тромбоцитов.
Еще один аспект изобретения относится к способу ингибирования образования тромба у млекопитающего путем введения млекопитающему композиции, включающей выделенный фрагмент активируемого нуклеотидами рецептора, связанный с остатком, проникающим в клетки. В некоторых вариантах осуществления рецептор тромбина представляет собой рецептор P2Y12. Способ может быть осуществлен путем инфузии в просвет сосуда, например яремной вены, периферической вены, ингибирующей композиции по изобретению. Периферическая вена может быть, например, веной, расположенной в конечностях, таких как кисть, запястье или стопа. В некоторых вариантах осуществления композицию вводят в легкие млекопитающему, например, в виде аэрозоля. В других вариантах осуществления композицию по изобретению вводят путем инъекции. В различных вариантах осуществления инъекцию можно производить в брюшную полость млекопитающего, субдермально или подкожно. В других вариантах осуществления композицию по изобретению вводят чрескожно. Композиция может быть введена путем имплантирования материала для тампонирования раны или суппозитория, который покрыт или пропитан композицией по изобретению.
Еще один аспект изобретения относится к сосудистому эндопротезному устройству, которое включает ингибитор образования тромба, который является выделенным фрагментом нуклеотидного рецептора, связанным с остатком, проникающим в клетки. В различных вариантах осуществления устройство может быть, например, стентом или катетером. В некоторых вариантах осуществления устройство пропитывают или покрывают ингибитором.
Детали одного или более вариантов осуществления изобретения изложены ниже в сопровождающем описании. Хотя для практического осуществления или тестирования настоящего изобретения могут использоваться любые методы и материалы, подобные или эквивалентные описанным в данном документе, сейчас описаны предпочтительные методы и материалы. Другие особенности, объекты и преимущества изобретения станут очевидными из описания. В описании и прилагаемой формуле изобретения формы единственного числа также включают множественное число, если из контекста явно не следует обратного. Если не указано иного, все технические и научные термины, использованные в данном документе, имеют то же значение, которое обычно подразумевает средний специалист в той области техники, к которой принадлежит данное изобретение. В случае конфликта преимущественную силу будет иметь настоящее описание, включая определения. Кроме того, материалы, методы и примеры являются исключительно иллюстративными и не предназначены для ограничения изобретения. Все патенты и публикации, цитированные в этом описании, включены в данный документ посредством ссылки.
Рецепторы, сопряженные с G-белками
Рецепторы, сопряженные с G-белками, представляют собой внутримембранные белки, которые образуют большое надсемейство рецепторов. Семейство рецепторов, сопряженных с G-белками (GPCR), включает по меньшей мере 250 членов (Strader et al. FASEB J., 9:745-754,1995; Strader et al. Annu. Rev. Biochem., 63:101-32, 1994). Подсчитано, что один процент генов человека может кодировать GPCR. Многие GPCR имеют общую молекулярную архитектуру и общий механизм передачи сигналов. Исторически, GPCR были разделены на шесть семейств, которые первоначально считались неродственными, три из которых обнаруживаются у позвоночных. В недавней работе было идентифицировано несколько новых семейств GCPR и сделано предположение об общем эволюционном происхождении всех их.
Многие GPCR имеют общий структурный мотив из семи трансмембранных спиральных доменов. Некоторые GPCR, однако, не имеют семи трансмембранных спиральных доменов и могут представлять собой трансмембранные рецепторы, однократно пронизывающие мембрану.
Однократно пронизывающие мембрану GPCR включают рецепторы цитокинов, таких как эритропоэтин, EGF, инсулин, инсулиноподобные факторы роста I и II, и TGF.
Семейства GPCR включают Класс А - родопсиноподобные, Класс B - секретиноподобные, Класс C - метаботропный глутамата/феромонов, Класс D - феромонов грибов, Класс E - рецепторы цАМФ (Dictyostelium) и семейство завитых/сглаженных. Предполагаемые семейства включают белки альбинизма глаза, рецепторы запахов дрозофилы, растительные Mlo-рецепторы, хеморецепторы нематод и вомероназальные рецепторы (V1R & V3R).
Класс А, родопсиноподобных рецепторов, включает: рецепторы аминов: ацетилхолина, альфа-адренорецепторы, бета-адренорецепторы, рецепторы допамина, гистамина, серотонина, октопамина и следов амина; рецепторы пептидов: ангиотензина, бомбезина, брадикинина, анафилатоксина C5a, Fmet-leu-phe, APJ-подобные, интерлейкина-8, рецепторы хемокинов (хемокина C-C, хемокина C-X-C, рецепторы BONZO (CXC6R), хемокина C-X3-C и хемокина XC), рецепторы CCK, рецепторы эндотелина, рецепторы меланокортина, рецепторы нейропептида Y, рецепторы нейротензина, опиоидные рецепторы, рецепторы соматостатина, рецепторы тахикининов (вещества P (NK1), вещества K (NK2), нейромедина K (NK3), тахикининоподобные типа 1 и тахикининоподобные типа 2), вазопрессиноподобные рецепторы (вазопрессина, окситоцина и конопрессина), галаниноподобные рецепторы (галанина, аллатостатина и GPCR 54), рецепторы, подобные активируемым протеиназой (например, тромбина), орексин & нейропептида FF, рецепторы уротензина II, рецепторы адреномедуллина (G10D), gpr37/эндотелина В-подобные рецепторы, рецепторы, подобные рецептору хемокинов и рецепторы нейромедина U; рецепторы белковых гормонов: фолликулостимулирующего гормона, лютропина-хориогонадотропного гормона, тиреотропина и гонадотропина; рецепторы (род)опсина; обонятельные рецепторы; рецепторы простаноидов: простагландина, простациклина и тромбоксана; нуклеотидоподобные рецепторы: аденозина и пуриноцепторы; рецепторы Cannabis; рецепторы фактора активации тромбоцитов; рецепторы гонадотропин-рилизинг гормона; тиротропин-рилизинг гормона и стимулятора секреции гормона роста и подобного стимулятору гормона роста; рецепторы мелатонина; рецепторы вирусов; рецепторы лизосфинголипидов & LPA (EDG); рецептор лейкотриена B4: рецептор лейкотриена B4 BLT1 и рецептор лейкотриена B4 BLT2; и класс А сиротские/другие рецепторы: тромбоцитарные рецепторы АДФ & KI01, SREB, протоонкоген Mas, RDC1, ORPH, LGR-подобные (гормональные рецепторы), GPR, GPR45-подобные, цистеиниллейкотриена, Mas-связанные рецепторы (MRG) и GP40-подобные рецепторы.
Класс B (семейство рецептора секретина или «семейство 2») GPCR является менее крупной, но структурно и функционально разнообразной группой белков, которая включает рецепторы полипептидных гормонов (кальцитонин, высвобождающий гормон кортикотропина, гастроингибирующий пептид, глюкагон, глюкагоноподобный пептид-1, -2, рилизинг-гормон гормона роста, паратгормон, PACAP, секретин, вазоактивный интестинальный полипептид, диуретический гормон, EMR1, латрофилин), молекулы, которые, как считали, опосредуют межклеточные взаимодействия на плазматической мембране (специфичный для головного мозга ингибитор ангиогенеза (BAI)) и группа белков дрозофилы (Methuselah-подобные белки), которые регулируют ответы на стресс и продолжительность жизни.
Класс C метаботропных рецепторов глутамата/феромонов включает метаботропный рецептор глутамата, метаботропный рецептор глутамата группы I, метаботропный рецептор глутамата группы II, метаботропный рецептор глутамата группы III, другой метаботропный рецептор глутамата, внеклеточный рецептор, чувствительный к кальцию, предположительные рецепторы феромонов, ГАМК-B, ГАМК-B подтипа 1, ГАМК-B подтипа 2 и «сиротские» рецепторы GPRC5.
GPCR потенциально могут быть мультиполипептидными рецепторами, такими как GPIb-V-IX или рецептор коллагена, который передает сигнал изнутри наружу посредством G-белков.
Хотя клонированы сотни генов или кДНК рецепторов, сопряженных с G-белком, считается, что все еще существует много неописанных рецепторов, сопряженных с G-белками, которые еще не распознаны как GPCR.
GPCR играют жизненно важную роль в процессах передачи сигналов, которые контролируют клеточный метаболизм, рост и подвижность клеток, адгезию, воспаление, передачу сигналов нейронами и коагуляцию крови. Белки рецептора, сопряженного с G-белком, также играют очень важную роль в качестве мишеней для множества сигнальных молекул, которые контролируют, регулируют или корректируют функции живых организмов. Разновидностями сигналов могут быть эндогенные молекулы (например, нейромедиаторы или гормоны), экзогенные молекулы (например, ароматные вещества), или, в случае визуальной передачи, свет.
Например, к GPCR относятся рецепторы биогенных аминов, например, допамина, эпинефрина, гистамина, глутамата (метаботропный эффект), ацетилхолина (мускариновый эффект) и серотонина; рецепторы липидных медиаторов воспаления, таких как простагландины, фактор активации тромбоцитов и лейкотриены; рецепторы пептидных гормонов, таких как кальцитонин, анафилатоксин C5a, фолликулостимулирующий гормон, гонадолиберин, нейрокинин, окситоцин; рецепторы протеаз, таких как тромбин, трипсин, триптаза, активированный белок C и фактор Vlla/Xa; и рецепторы для сенсорных сигнальных медиаторов, например фотопигменты сетчатки и молекул, стимулирующих обонятельные луковицы. Каждая молекула специфична для белка рецептора, посредством чего определяется специфичность отдельных физиологически активных веществ (включая специфические клетки-мишени и органы-мишени), специфические фармакологические действия, специфическая сила действия, время действия и т.д. Таким образом, GPCR представляют собой основную мишень для действия и разработки лекарственных средств.
После связывания с лигандом GPCR регулируют внутриклеточные пути передачи сигналов путем активации белков, связывающих нуклеотид гуанин (G-белки). Строение домена GPCR у членов семейства GPCR консервативно. Доменные границы трансмембранных спиральных доменов, доменов внутриклеточный петли и внеклеточных доменов GPCR известны в данной области техники. Строение некартированного GPCR определяется путем сравнения с прототипом GPCR, родопсином, с использованием известных способов, например, как описано Palczewski et al., Science 289:739 (2000), тем самым включенным посредством ссылки.
Одной из характерных особенностей большинства GPCR является то, что в первичной структуре находятся семь кластеров остатков гидрофобных аминокислот, или трансмембранных областей (ТМ, 7 трансмембранных областей обозначаются как TM1, TM2, TM3, TM4, TM5, TM6 и TM7), которые проходят через мембрану клетки (пронизывают) в каждой области (фиг.1). Считается, что домены представляют собой трансмембранные альфа-спирали, связанные тремя внутриклеточными петлями (i1, i2 и i3), тремя внеклеточными петлями (e1, e2 и e3), и аминоконцевой (N-) и карбоксиконцевой (C-) домены (Palczewski et al., Science 289, 739-45 (2000)). Большинство GPCR имеют единичные консервативные остатки цистеина в каждой из первых двух внеклеточных петель, которые образуют дисульфидные связи, которые, как полагают, стабилизируют функциональную структуру белка. Известно, что эти структуры, подробно описанные выше, часто встречаются среди белков рецептора, сопряженного с G-белком, и что аминокислотная последовательность, соответствующая области, которая проходит через мембрану (пронизывающая мембрану область или трансмембранная область), и аминокислотная последовательность вблизи пронизывающей мембрану области часто высоко консервативны среди рецепторов. Таким образом, из-за высокой степени гомологии в GPCR, идентификация новых GPCR, а также идентификация внутриклеточных и внеклеточных частей таких новых членов легко выполнима для специалистов в данной области техники.
Считается, что у рецепторов, сопряженных с G-белком, сайты связывания для малых лигандов содержат гидрофильное углубление, расположенное около внеклеточной поверхности, которая образована несколькими трансмембранными доменами GPCR. Гидрофильное углубление окружено гидрофобными остатками рецепторов, сопряженных с G-белком. Постулировано, что гидрофильная сторона каждой трансмембранной спирали рецептора, сопряженного с G-белком, обращена вовнутрь и образует сайт связывания полярных лигандов. TM3 был вовлечен в несколько GPCR как имеющий сайт связывания лигандов, который включает остаток аспартата TM3. Серины TM5, аспарагин TM6 и фенилаланины или тирозины TM6 или TM7 также участвуют в связывании лиганда. Сайт связывания лигандов для рецепторов пептидных гормонов и рецепторов с другими крупными лигандами, такими как гликопротеины (например, лютеинизирующий гормон, фолликулостимулирующий гормон, хорионический гонадотропин человека, тиреотропный гормон (тиреотропин)), и классов рецепторов Ca2+/глутамат/ГАМК (гамма-аминомасляная кислота), вероятно, находятся во внеклеточных доменах и петлях.
Ключевым событием для перехода от неактивного к активному рецептору являются индуцированные лигандом конформационные изменения трансмембранных спиралей 3 (TM3) и 6 (TM6) GPCR, у которых есть 7 трансмембранных спиралей (Gether and Kolbilka, J. Biol. Chem. 273,17979-17982 (1998)). Эти спиральные перемещения, в свою очередь, изменяют конформацию внутриклеточных петель рецептора, способствуя активации сопряженных гетеротримерных G-белков. Исследования мутагенеза (Cotecchia et al, J. Biol. Chem. 267:1633-1639 (1992); Kostenis et al, Biochemistry 36:1487-1495 (1997); Kjelsberg et al, J. Biol. Chem. 267:1430-1433 (1992)), показали, что третья внутриклеточная петля (i3) опосредует значительную часть связывания рецептора и G-белка. Также было показано, что i3-петли, экспрессируемые в виде минигенов, прямо конкурируют с адренергическими рецепторами за связывание Gq (Luttrel et al, Science 259:1453-1457 (1993)), или могут активировать G-белки как растворимые пептиды в бесклеточных условиях (Okamoto et al, Cell 67, 723-730 (1991)).
Одним из конкретных классов GPCR являются активируемые протеазой рецепторы (PAR). Активируемые протеазой рецепторы (PAR) являются членами суперсемейства рецепторов, сопряженных с G-белками, которые начинают передачу клеточных сигналов за счет протеолитической активности внеклеточных сериновых протеаз. PAR активируются после протеолитического расщепления аминоконца рецептора эндогенными протеазами, включая тромбин (PAR-1, -3 и -4) и трипсин/триптазу (PAR-2 и -4). Из них PAR2 (Nystedt et al, Proc. Natl. Acad. Sci. (USA) 91:9208-9212 (1994)) является рецептором, активируемым трипсином/триптазой, который играет важную роль в воспалении и боли, и PAR4 (Xu et al., Proc. Natl. Acad. Sci. (USA) 95:6642-6646 (1998); Kahn et al, Nature (London) 394:690-694 (1998)) является вторым рецептором тромбина, который играет уникальную роль в агрегации тромбоцитов (Covic et al, Biochemistry 39, 5458-5467 (2000)).
Поскольку в воспаленных дыхательных путях присутствуют и тромбин, и трипсин, и триптаза, PAR, вероятно, играют основную роль в воспалении дыхательных путей. Knight et al, J. Allergy Clin. Immunol. 108:797-803 (2001).
В дополнение к его основной роли в гемостазе, тромбин активирует различные типы клеток, такие как тромбоциты и гладкомышечные клетки сосудов посредством протеолитического расщепления специфических рецепторов на поверхности клеток (PAR), прототипом которых является PAR-1. Активация рецептора тромбина, вероятно, играет ключевую роль в сердечно-сосудистых нарушениях, таких как тромбоз, атеросклероз и рестеноз, а также в качестве антагониста рецептора тромбина обладает потенциальной применимостью для лечения этих заболеваний. Chackalamannil, Curr. Opin. Drug Discov. Devel. 4:417-27 (2001).
Полагают, что тромбин участвует в утрате функции после повреждения центральной нервной системы (ЦНС) млекопитающих. Показано, что снижение числа рецепторов PAR-1 увеличивает выживание нейронов после травмы ЦНС, и посттравматическую токсичность тромбина можно подавить путем соответствующей модуляции рецептора PAR-1. Friedmann et al, Neuroimmunol., 121:12-21 (2001).
PAR также вовлечены в ряд других заболеваний или показаний, включая различные злокачественные опухоли, клеточную пролиферацию и боль.
Домены GPCR
Большинство GPCR характеризуется семью кластерами гидрофобных аминокислотных остатков или трансмембранных областей (ТМ, 7 трансмембранных областей обозначены как TM1, TM2, TM3, TM4, TM5, TM6 и TM7), которые расположены в первичной структуре и проходят через (пронизывают) мембрану клетки (фиг.1A). Считается, что ТМ области представляют собой трансмембранные альфа-спирали, связанные тремя внутриклеточными петлями (i1, i2 и i3), тремя внеклеточными петлями (e1, e2 и e3). GPCR также имеют аминоконцевой (N)- и карбоксиконцевой (C)- домены (Palczewski et al, Science 289, 739-45 (2000)). Последовательности между трансмембранными областями соответствуют петлям GPCR, и местоположение петли внутри клетки определяет, является ли она внутриклеточной или внеклеточной петлей. У большинства GPCR имеются единичные консервативные остатки цистеина в каждой из первых двух внеклеточных петель, образующие дисульфидные связи, которые, как полагают, стабилизируют функциональную структуру белка. Схематичное изображение трансмембранных и петлевых областей GPCR PAR1 представлено на фигуре 1A.
Одним из примеров GPCR является рецептор CXCR4, показанный в таблице 2 как SEQ ID NO:15. Семь подчеркнутых последовательностей соответствуют семи трансмембранным областям GPCR. Таким образом, последовательность IFLPTIYSIIFLTGIVGNGLVILV (SEQ ID NO:16) соответствует первой трансмембранной области (TM1).

Выделенный фрагмент GPCR представляет собой любую часть GPCR, которая меньше белка полной длины. Пептид, содержащий выделенный фрагмент GPCR, может содержать аминокислотную последовательность N-конца и/или C-конца последовательности GPCR, отличающейся от природной аминокислотной последовательности. Пептид, содержащий выделенную трансмембранную последовательность GPCR, может содержать только последовательность, соответствующую этой трансмембранной области GPCR, или он также может содержать аминокислотные последовательности c N-конца и/или C-конца трансмембранной последовательности, которые не являются природными фланкирующими последовательностями (то есть не являются последовательностями петли, которые в природной последовательности GPCR являются смежными с этой областью).
Таким образом, пептид, содержащий выделенную трансмембранную область рецептора CXCR4, является любым пептидом, который содержит любую или все из смежных аминокислот подчеркнутой области последовательности, приведенной в таблице 2. Такой пептид не содержит ни одной природной (не подчеркнутой) фланкирующей последовательности, которая соответствует последовательностям петли, которые являются смежными с ТМ областью в природной последовательности GPCR.
Аналогичным образом, пептид, содержащий выделенную (внутриклеточную или внеклеточную) область петли рецептора CXCR4, представляет собой любой пептид, который содержит любую или все смежные аминокислоты не подчеркнутой области последовательности, приведенной в таблице 2. Такой пептид не содержит ни одной из природных трансмембранных последовательностей, показанных как подчеркнутые фланкирующие последовательности в таблице 2, которые в природной последовательности GPCR являются смежными с этой областью петли.
Пептид, содержащий выделенный внеклеточный домен или выделенный внутриклеточный домен, может включать аминокислотную последовательность любой (внеклеточной или внутриклеточной) петли и/или N- или C-концевой домен. Такой пептид не содержит любой последовательности трансмембранной области, которая в природной последовательности GPCR является смежной с этим внеклеточным доменом или внутриклеточным доменом.
Фармацевтические композиции
Пепдуцины (также называемые в данном документе «активными соединениями») по изобретению и их производные, фрагменты, аналоги и гомологи, могут входить в состав фармацевтических композиций, подходящих для введения. Такие композиции, как правило, содержат пепдуцин и фармацевтически приемлемый носитель.
Фармацевтическую композицию по изобретению готовят таким образом, чтобы она была совместима с предполагаемым путем ее введения. Примеры путей введения включают парентеральное, например внутривенное (например, в периферическую вену, такую как обнаруженные в конечностях), интраперитонеальное, внутрикожное, подкожное, субдермальное, пероральное, интраназальное, аэрозольное (например, ингаляция), чрескожное (то есть местное), через слизистую, влагалищное, внутриматочное и ректальное (например, суппозитории) введение. Инъекционные растворы, содержащие активные соединения по настоящему изобретению, могут быть введены в просвет сосуда (например, аорты или яремной вены). Альтернативно, активные соединения по настоящему изобретению могут быть введены с помощью устройства, например стента или катетера, пропитанного или покрытого активными соединениями.
Растворы или суспензии, используемые для введения (например, парентерального), могут включать следующие компоненты: стерильный разбавитель, такой как вода для инъекций, физиологический раствор, нелетучие масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные средства, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие средства, такие как этилендиаминтетрауксусная кислота (ЭДТА); буферы, такие как ацетаты, цитраты или фосфаты, и средства для регулирования тоничности, такие как хлорид натрия или глюкоза. pH можно регулировать кислотами или основаниями, такими как гидроксид натрия или соляная кислота. Препарат фармацевтической композиции по настоящему изобретению может быть заключен в ампулы, одноразовые шприцы или флаконы из стекла или пластмассы, содержащие несколько доз.
Фармацевтические композиции, подходящие для инъекционного применения, включают стерильные водные растворы (при условии растворимости в воде) или дисперсии и стерильные порошки для приготовления стерильных инъекционных растворов или дисперсии непосредственно перед применением. Подходящие для внутривенного введения носители включают физиологический раствор, бактериостатическую воду, Cremophor EL (BASF, Parsippany, N.J.) или забуференный фосфатом физиологический раствор (PBS). Во всех случаях композиция должна быть стерильной и должна быть жидкостью до степени, которая легко вводится шприцом. Она должна быть стабильной при условиях изготовления и хранения и должна предохраняться против загрязняющего действия микроорганизмов, таких как бактерии и грибы. Носитель может быть растворителем или диспергирующей средой, содержащей, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль, и тому подобное) и подходящие их смеси. Соответствующая текучесть может поддерживаться, например, при помощи покрытия, такого как лецитин, путем поддерживания требуемого размера частиц в случае дисперсии и при помощи поверхностно-активных веществ. Предохранения от действия микроорганизмов можно достигать за счет различных антибактериальных и противогрибковых средств, например парабенов, хлорбутанола, фенола, аскорбиновой кислоты, тимеросала и тому подобное. Во многих случаях будет предпочтительно включать в композиции изотонические средства, например сахара, многоатомные спирты, такие как маннит, сорбит, хлорид натрия. Пролонгированная абсорбция инъекционных композиций может быть обеспечена за счет включения в композиции средства, которое задерживает абсорбцию, например моностеарат алюминия и желатин.
Стерильные инъекционные растворы могут быть приготовлены путем объединения активного соединения в необходимом количестве с подходящим растворителем в отдельности или с комбинацией ингредиентов, перечисленных выше, при необходимости, с последующей стерилизацией фильтрованием. Как правило, дисперсии получают, объединяя активное соединение со стерильным растворителем, который содержит основную диспергирующую среду и другие необходимые ингредиенты из перечисленных выше. В случае стерильных порошков для приготовления стерильных инъекционных растворов, способами их получения являются вакуумная сушка и лиофилизация, которые позволяют получить порошок активного ингредиента плюс любой дополнительный желаемый ингредиент из их раствора, предварительно подвергнутого стерилизации фильтрованием.
Пероральные композиции, как правило, содержат инертный разбавитель или пищевой носитель. Они могут быть заключены в желатиновые капсулы или спрессованы в таблетки. Для цели перорального терапевтического введения активное соединение может быть объединено с эксципиентами и использоваться в форме таблеток, пастилок или капсул. Пероральные композиции также могут быть приготовлены с использованием жидкого носителя для применения в качестве жидкости для полоскания рта, где соединением в жидком носителе полощется рот, а затем его выплевывают или проглатывают. В виде части композиции могут быть включены фармацевтически совместимые связующие и/или вспомогательные вещества. Таблетки, пилюли, капсулы, пастилки и тому подобное могут содержать любой из следующих ингредиентов или соединений аналогичной природы: связующее, такое как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; эксципиент, такой как крахмал или лактоза, разрыхлитель, такой как альгиновая кислота, Primogel или кукурузный крахмал; смазывающее вещество, такое как стеарат магния или Sterotes; скользящее вещество, такое как коллоидный диоксид кремния; подсластитель, такой как сахароза или сахарин; или ароматическое вещество, такое как мята, метилсалицилат или апельсиновый ароматизатор.
Для введения путем ингаляции или интраназального введения соединения вводят в форме аэрозольной струи из контейнера, находящегося под давлением, или распылителя, который содержит подходящий газ-вытеснитель, например такой газ, как диоксид углерода, или аэрозольного аппарата (например, для введения в легкие).
Системное введение также можно осуществлять через слизистую или через кожу. Для введения через слизистую или через кожу в препарате используют пенетранты, соответствующие барьеру, через который необходимо проникнуть. Такие пенетранты известны в данной области техники и включают, например, для введения через слизистую, детергенты, соли желчных кислот и производные фусидовой кислоты. Введение через слизистую можно осуществлять с помощью назальных аэрозолей или суппозиториев. Для введения через кожу из активных соединений готовят мази, бальзамы, гели или кремы, как известно в данной области техники.
Активные соединения также могут быть приготовлены в форме суппозиториев (например, с обычными основами для суппозиториев, такими как масло какао и другие глицериды), суппозиториев с покрытием или лекарственной клизмы для ректального введения. Активные соединения могут быть аналогично приготовлены для внутривлагалищного или внутриматочного введения. Активные соединения также могут быть введены в виде пропитки или покрытия на материале для тампонирования раны (например, для уменьшения кровотечения).
В одном из вариантов осуществления готовят препарат из активных соединений с носителями, которые будут предохранять эти соединения от быстрого выведения из организма, такой как препарат с контролируемым высвобождением, включая имплантаты и микроинкапсулированные системы доставки. Могут использоваться биоразлагаемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Способы получения таких препаратов будут очевидны специалистам в данной области техники. Материалы также можно приобрести у Alza Corporation and Nova Pharmaceuticals, Inc. В качестве фармацевтически приемлемых носителей также могут использоваться суспензии липосом (включая липосомы, нацеленные на инфицированные клетки моноклональными антителами к вирусным антигенам). Их можно получить методами, известными специалистам в данной области техники, например, как описано в патенте США № 4522811.
Особенно эффективно составлять пероральные или парентеральные композиции в виде стандартной лекарственной формы для простоты введения и постоянства доз. Стандартная лекарственная форма, как используется в данном документе, относится к физически дискретным единицам, которые соответствуют единичным дозам для субъекта, который будет подвергаться лечению; каждая единица содержит заданное количество активного соединения, вычисленное с тем, чтобы оказать желаемый терапевтический эффект, совместно с необходимым фармацевтическим носителем. Описание стандартной лекарственной формы по изобретению основано и прямо зависит от специфических особенностей активного соединения и конкретного терапевтического эффекта, который будет достигнут, и от ограничений, свойственных технике получения соединений, таких как активное соединение для лечения индивидуумов.
Пепдуцины и пептиды GPCR могут быть введены для лечения различных расстройств в форме фармацевтических композиций. Принципы и особенности приготовления таких композиций, а также руководство по выбору компонентов представлены, например, в Remington: The Science And Practice Of Pharmacy 19th ed. (Alfonso R. Gennaro, et al., editors) Mack Pub. Co., Easton, Pa.: 1995; Drug Absorption Enhancement: Concepts, Possibilities, Limitations, And Trends, Harwood Academic Publishers, Langhorne, Pa., 1994; and Peptide And Protein Drug Delivery (Advances In Parenteral Sciences, Vol. 4), 1991, M. Dekker, New York. Композиция по настоящему изобретению может также содержать более одного активного соединения, если это необходимо, для лечения по конкретному показанию, предпочтительно соединений с взаимодополняющей активностью, которые не оказывают неблагоприятного влияния друг на друга. Альтернативно, или в дополнение, композиция может содержать средство, которое усиливает ее функцию, такое как, например, цитотоксическое средство, цитокин, химиотерапевтическое средство или ингибитор роста. Такие молекулы соответственно присутствуют в комбинации в количестве, эффективном для предназначенной цели. Активные ингредиенты также могут быть заключены в микрокапсулы, полученные, например, методами коацервации или поверхностной полимеризации, например, микрокапсулы из гидроксиметилцеллюлозы или желатиновые микрокапсулы и микрокапсулы из поли(метилметакрилата), соответственно, в коллоидные системы доставки препаратов (например, липосомы, микросферы альбумина, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии.
Композиции, которые используются для введения invivo, должны быть стерильными, что достигается фильтрованием через стерильные фильтрационные мембраны.
Могут быть получены препараты с длительным высвобождением. Подходящие примеры препаратов с длительным высвобождением включают полупроницаемые матрицы твердых гидрофобных полимеров, содержащих антитело, причем матрицы находятся в форме изделий определенной формы, например, пленок или микрокапсул. Примеры матриц с длительным высвобождением включают полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поли(виниловый спирт)), полилактиды (патент США № 3773919), сополимеры L-глутаминовой кислоты и этил-L-глутамата, неразлагаемый сополимер этилена и винилацетата, разлагаемые сополимеры молочной кислоты и гликолевой кислоты, такие как LUPRON DEPOT™ (микросферы для инъекций, состоящие из сополимера молочной кислоты и гликолевой кислоты и леупролида ацетата), и поли-D-(-)-3-гидроксимасляная кислота. Хотя полимеры, такие как полимеры этилена-винилацетата и молочной кислоты и гликолевой кислоты, позволяют высвобождать молекулы в течение 100 дней, определенные гидрогели высвобождают белки за более короткое время.
Для контролируемого высвобождения активных соединений могут использоваться различные технологии. Известны устройства, например стенты или катетеры, которые имеют монолитный слой или покрытие, включающее гетерогенный раствор и/или дисперсию активного средства в полимерном веществе, где скорость диффузии терапевтического средства ограничена, поскольку средство диффундирует сквозь полимер к границе раздела полимера и жидкости и высвобождается в окружающую жидкость. Активное соединение может быть растворено или диспергировано в подходящем полимерном материале, таком, что после растворения вещества остаются дополнительные поры или каналы. Матричное устройство, как правило, тоже обладает ограниченной диффузией, но каналы и другая внутренняя геометрия устройства также играют роль в высвобождении средства в жидкость. Каналы могут быть ранее существовавшими или создаваться при высвобождении средства или других растворимых субстанций.
В устройствах, подверженных эрозии или разложению, активное соединение обычно иммобилизовано в полимере. Активные соединения могут быть растворены и/или диспергированы по всему полимерному материалу. Полимерный материал может с течением времени подвергаться гидролитическому разложению за счет гидролиза лабильных связей, что делает возможной эрозию полимера жидкостью и высвобождение активного соединения в жидкость. У гидрофильных полимеров, как правило, скорость эрозии быстрее, чем у гидрофобных полимеров. Считается, что гидрофобным полимерам свойственна почти исключительно поверхностная диффузия активного вещества, эрозия распространяется от поверхности внутрь. Полагают, что у гидрофильных полимеров вода может проникать через поверхность полимера, делая возможным гидролиз лабильных связей под поверхностью, что может привести к гомогенной или объемной эрозии полимера.
Фармацевтические композиции могут быть заключены в контейнер, упаковку или распылитель вместе с инструкциями по введению.
Технология пепдуцинов по настоящему изобретению позволяет использовать самые разнообразные внутриклеточные рецепторные структуры как для создания новых терапевтических средств, так и для описания механизмов связывания рецептора с G-белком в условиях in vivo. Также может оказаться, что пепдуцины, открытые в соответствии с этой стратегией, являются более селективными до такой степени, что основной мишенью пепдуцинов станет рецептор, а не G-белок. Кроме того, многие рецепторы, идентифицированные геномными и генетическими методами как важные при различных болезненных процессах, не имеют известных лигандов - так называемые сиротские рецепторы. Могут быть получены пепдуцины-агонисты и антагонисты, приспособленные к этим рецепторам, что может оказаться полезным в определении того, какие пути передачи сигналов активируются сиротскими рецепторами в контексте их природного окружения. Таким образом, в постгеномную эру, пепдуциновая технология может оказаться широко применимой в «нацеливании» на мембранные белки и может открыть новые экспериментальные пути в системах, до этого не поддававшихся традиционным молекулярным методам.
Соединения по изобретению и другое фармакологически активное средство могут быть введены пациенту одновременно, последовательно или в комбинации. Следует понимать, что при использовании комбинации по изобретению соединение по изобретению и другое фармакологически активное средство могут находиться в одном и том же фармацевтически приемлемом носителе и поэтому вводиться одновременно. Они могут находиться в отдельных фармацевтических носителях, таких как стандартные пероральные лекарственные формы, которые принимаются одновременно. Термин «комбинация» дополнительно относится к случаю, когда соединения предоставляют в отдельных лекарственных формах и вводят последовательно.
Соединения по изобретению могут быть введены пациентам (животным и людям), которым требуется такое лечение, в дозах, которые обеспечат оптимальную фармацевтическую эффективность. Следует понимать, что доза, требуемая для использования в любом конкретном применении, будет меняться от пациента к пациенту, не только в зависимости от выбранного конкретного соединения или композиции, но и пути введения, характера состояния, которое подвергается лечению, возраста и состояния пациента, получаемых параллельно препаратов или специальных диет, которым следует пациент, и других факторов, которые известны специалистам в данной области техники, поэтому в конечном счете, подходящая доза будет определяться по усмотрению лечащего врача.
При лечении состояния подходящий уровень дозы, как правило, будет составлять приблизительно 0,001-50 мг на кг массы тела пациента в сутки, которые можно вводить за один раз или в несколько приемов. Предпочтительно, уровень дозы составляет от приблизительно 0,01 до приблизительно 25 мг/кг в сутки; более предпочтительно от приблизительно 0,05 до приблизительно 10 мг/кг в сутки. Например, подходящий уровень дозы составляет около 0,001-10 мг/кг в сутки, предпочтительно около 0,005-5 мг/кг в сутки и особенно предпочтительно около 0,01-1 мг/кг в сутки.
Например, больным с острым инфарктом миокарда подходящий пепдуцин (например, x1/2pal-i1) можно немедленно вводить внутривенно в виде болюсного введения, за чем следуют дополнительные внутривенные инъекции один или два раза в день в течение 2-3 дней после инфаркта миокарда. Доза может составлять приблизительно 0,1-0,5 мг/кг.
Следует понимать, что количество соединения по изобретению, требуемого для использования при любом лечении, будет меняться в зависимости не только от выбранных конкретных соединений или композиций, но и от пути введения, природы состояния, которое подвергается лечению, возраста и состояния пациента, и, в конечном счете, будет определяться по усмотрению лечащего врача.
Композиции и комбинации лекарственных средств по изобретению могут быть введены в комбинации с рядом фармацевтических эксципиентов, включая стабилизаторы, носители и/или композиции для инкапсуляции, как описано в данном документе.
Водные композиции по настоящему изобретению содержат эффективное количество пептидов по изобретению, растворенных или диспергированных в фармацевтически приемлемом носителе или водной среде.
«Фармацевтически или фармакологически приемлемые» включают молекулярные объекты и композиции, которые при введении животному или человеку, по обстоятельствам, не вызывают побочную, аллергическую или другую неблагоприятную реакцию. «Фармацевтически приемлемый носитель» включает любые и все растворители, диспергирующую среду, покрытия, антибактериальные и противогрибковые средства, изотонические средства и средства, замедляющие всасывание, и тому подобное. Применение таких сред и средств для фармацевтических активных веществ известно в данной области техники. За исключением случаев, когда какая-нибудь стандартная среда или средство несовместимо с активным ингредиентом, его применение в терапевтических композициях рассматривается. В композиции также могут быть включены дополнительные активные ингредиенты.
Препараты для введения человеку должны отвечать стандартам стерильности, пирогенности, общей безопасности и чистоты, как требует Office of Biologies standards FDA.
Композиции и комбинации лекарственных средств по изобретению, как правило, составляют для парентерального введения, например, составляют для инъекционного введения внутривенным, внутримышечным, подкожным, внутрь пораженных тканей или даже интраперитонеальным путем. Препарат водной композиции, который содержит композицию по изобретению или активный компонент или ингредиент, будет известен специалистам в данной области техники в свете настоящего раскрытия. Как правило, такие композиции могут быть получены для инъекций, либо в виде жидких растворов, либо суспензий; также могут быть получены твердые формы, подходящие для получения растворов или суспензий перед инъекцией путем добавления жидкости; кроме того, препараты могут быть эмульгированными.
Фармацевтические формы, подходящие для инъекционного применения, включают стерильные водные растворы или дисперсии; композиции включают масло сезама, масло арахиса или водный пропиленгликоль; и стерильные порошки для приготовления непосредственно перед инъекцией стерильных инъекционных растворов или дисперсий. Во всех случаях форма должна быть стерильной и должна быть жидкостью до такой степени, которая легко вводится шприцем. Форма должна быть стабильной при условиях изготовления и хранения и должна быть предохранена против заражающего действия микроорганизмов, таких как бактерии и грибы.
Растворы активных соединений в виде свободных оснований или фармакологически приемлемых солей могут быть получены в воде, соответственно смешанной с поверхностно-активным веществом, таким как гидроксипропилцеллюлоза. Дисперсия также может быть приготовлена в глицерине, жидких полиэтиленгликолях и их смесях, и в маслах. При обычных условиях хранения и применения эти препараты содержат консервант для подавления роста микроорганизмов.
Терапевтические или фармакологические композиции по настоящему изобретению, как правило, содержат эффективное количество компонента (компонентов) комбинированного лечения, растворенного или диспергированного в фармацевтически приемлемой среде. Фармацевтически приемлемая среда или носители включают все и любые растворители, диспергирующую среду, покрытия, антибактериальные и противогрибковые средства, изотонические средства и средства, замедляющие всасывание, и тому подобное. Применение таких сред и средств для фармацевтических активных веществ известно в данной области техники. В терапевтические композиции по настоящему изобретению также могут быть включены дополнительные активные ингредиенты.
Приготовление фармацевтических или фармакологических композиций станет ясным для специалистов в данной области техники в свете настоящего раскрытия. Как правило, из таких композиций могут быть приготовлены лекарственные формы для инъекций, либо в виде жидких растворов, либо суспензий; твердые формы, подходящие для приготовления перед инъекцией раствора или суспензии; таблетки или другие твердые формы для перорального введения; капсулы с отсроченным высвобождением; или любые другие формы, применяемые в настоящее время, включая кремы, лосьоны, жидкости для полоскания рта, средства для ингаляции и тому подобное.
Стерильные инъекционные растворы получают путем добавления необходимого количества активных соединений к подходящему растворителю с различными другими ингредиентами, перечисленными выше, в случае необходимости, и последующей стерилизации фильтрованием. Как правило, дисперсии получают путем добавления различных стерилизованных активных ингредиентов в стерильный растворитель, который содержит основную диспергирующую среду и требуемые другие ингредиенты из тех, что перечислены выше. В случае стерильных порошков для приготовления стерильных инъекционных растворов, предпочтительными способами получения являются методы вакуумной сушки и лиофилизации, которые позволяют получить порошок активного ингредиента плюс дополнительный желаемый ингредиент из их раствора, предварительно стерилизованного фильтрованием.
Также рассматривается приготовление более концентрированных или высококонцентрированных растворов для внутримышечных инъекций. При этом предпочтительно применение в качестве растворителя ДМСО, поскольку это приводит к очень быстрому проникновению, созданию высоких концентраций активного соединения (соединений) или средства (средств) на малой площади.
Использование стерильных композиций, таких как жидкости на основе солевого раствора, хирургами, врачами или работниками здравоохранения для очистки конкретного участка операционного поля также может быть особенно полезным. Терапевтические композиции по настоящему изобретению также могут воссоздаваться в форме жидкостей для полоскания рта или вместе с противогрибковыми реактивами. Также предусмотрены формы для ингаляций. Терапевтические композиции по изобретению также могут быть приготовлены в формах, подходящих для местного применения, таких как кремы и лосьоны.
Подходящие консерванты для применения в таком растворе включают хлорид бензалкония, хлорид бензетония, хлорбутанол, тимеросал и тому подобное. Подходящие буферы включают борную кислоту, бикарбонаты натрия и калия, бораты натрия и калия, карбонаты натрия и калия, ацетат натрия, бифосфат натрия и тому подобное, в количестве, достаточном для поддержания pH приблизительно 6-8 и предпочтительно, приблизительно 7-7,5. Подходящими средствами для поддержания тоничности являются декстран 40, декстран 70, декстроза, глицерин, хлорид калия, пропиленгликоль, хлорид натрия и тому подобное, так что эквивалент хлорида натрия в глазном растворе находится в диапазоне 0,9 плюс или минус 0,2%. Подходящие антиоксиданты и стабилизаторы включают бисульфит натрия, метабисульфит натрия, тиосульфит натрия, тиомочевину и тому подобное. Подходящее смачиватели и осветлители включают полисорбат 80, полисорбат 20, полоксамер 282 и тилоксапол. Подходящие загустители включают декстран 40, декстран 70, желатин, глицерин, гидроксиэтилцеллюлозу, гидроксиметилпропилцеллюлозу, ланолин, метилцеллюлозу, вазелин, полиэтиленгликоль, поливиниловый спирт, поливинилпирролидон, карбоксиметилцеллюлозу и тому подобное.
После приготовления композиции терапевтические средства вводят способом, совместимым с лекарственной формой, и в таком количестве, которое фармакологически эффективно. Композиции легко вводятся в виде ряда лекарственных форм, таких как описанный выше тип инъекционных растворов, однако также могут использоваться капсулы, высвобождающие лекарственное средство, и тому подобное.
В этом контексте количество активного ингредиента и объем композиции, которые будут вводить, зависят от животного-хозяина, подвергаемого лечению. Точное количество активного соединения, требуемое для введения, зависит от мнения практика и является индивидуальным для каждого индивидуума.
Для диспергирования активных соединений, как правило, используется минимально требуемый объем композиции. Подходящие режимы введения также поддаются изменению, но должны быть типизированы путем первоначального введения соединения и мониторинга результатов, а затем введения дополнительных контролируемых доз с дальнейшими интервалами. Например, для парентерального введения должен быть приготовлен соответственно забуференный и при необходимости изотонический водный раствор, который будет использоваться для внутривенного, внутримышечного, подкожного или даже интраперитонеального введения. Одна доза может быть растворена в 1 мл изотонического раствора NaCl и либо добавлена к 1000 мл жидкости для гиподермолиза, либо введена в предложенное место для инфузии (см. например, Remington's Pharmaceutical Sciences 15th Edition, pages 1035-1038 and 1570-1580).
В определенных вариантах осуществления активные соединения могут быть введены перорально. Это предполагается для средств, которые обычно устойчивы, или им придана устойчивость к протеолизу пищеварительными ферментами. Предполагается, что такие соединения включают химически разработанные или модифицированные средства; правовращающие пептиды; и композиции пептидов и липосом в капсулах с отсроченным высвобождением, чтобы избежать разложения пептидазами и липазами.
Фармацевтически приемлемые соли включают кислотно-аддитивные соли, которые образованы с неорганическими кислотами, такими как, например, хлористоводородная, бромистоводородная, борная, фосфорная, серная или фосфорные кислоты, или с такими органическими кислотами, как уксусная, щавелевая, винная, малеиновая, фумаровая, лимонная, янтарная, мезиловая, миндальная, янтарная, бензойная, аскорбиновая, метансульфоновая, α-кетоглутаровая, α-глицерофосфорная, глюкоза-1-фосфорная и тому подобное. Соли, образованные со свободными карбоксильными группами, также могут быть получены из неорганических оснований, таких как, например, гидроксиды натрия, калия, аммония, кальция, магния или трехвалентного железа, и таких органических оснований, как изопропиламин, триметиламин, гистидин, прокаин и тому подобное. Другие примеры фармацевтически приемлемых солей включают четвертичные производные соединений формулы (I), такие как соединения, кватернизованные соединениями Rx-T, где Rx представляет собой C1-6 алкил, фенил-C1-6 алкил или С5-7 циклоалкил, и T представляет собой радикал, соответствующий аниону кислоты. Подходящие примеры Rx включают метил, этил и н- и изопропил; и бензил, и фенетил. Подходящие примеры T включают галогенид, например хлорид, бромид или йодид. Другие примеры фармацевтически приемлемых солей также включают внутренние соли, такие как N-оксиды.
Носитель также может быть растворителем или диспергирующей средой, содержащей, например, воду, этанол, многоатомный спирт (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и тому подобное), подходящие их смеси и растительные масла. Соответствующая текучесть может поддерживаться, например, при помощи покрытия, такого как лецитин, путем сохранения необходимого размера частиц в случае дисперсии, и при помощи поверхностно-активных веществ. Для предупреждения действия микроорганизмов можно использовать различные антибактериальные и противогрибковые средства, например парабены, хлорбутанол, фенол, сорбиновую кислоту, тимеросал и тому подобное. Во многих случаях предпочтительно включать изотонические средства, например сахара или хлорид натрия. Пролонгированное всасывание инъекционных композиций может быть обеспечено применением в композициях средств, задерживающих всасывание, например, моностеарата алюминия и желатина.
Стерильные инъекционные растворы получают путем добавления активных соединений в необходимом количестве к подходящему растворителю, при необходимости, с перечисленными выше различными другими ингредиентами, и последующей стерилизации фильтрованием. Как правило, дисперсии получают путем добавления различных стерилизованных активных ингредиентов в стерильный растворитель, который содержит основную диспергирующую среду и необходимые другие ингредиенты из перечисленных выше. В случае стерильных порошков для приготовления стерильных инъекционных растворов предпочтительными способами получения являются методы вакуумной сушки и лиофилизации, которые позволяют получить порошок активного ингредиента плюс любой дополнительный желаемый ингредиент из их раствора, предварительно стерилизованного фильтрованием.
Также рассматривается приготовление более концентрированных или высококонцентрированных растворов для прямой инъекции, в которых предусматривается применение в качестве растворителя ДМСО, что приводит к очень быстрому проникновению, созданию высоких концентраций активных соединений на малой площади.
После приготовления композиции растворы вводят способом, совместимым с лекарственной формой, и в таком количестве, которое фармакологически эффективно. Композиции легко вводятся в виде ряда лекарственных форм, таких как описанный выше тип инъекционных растворов, однако также могут использоваться капсулы, высвобождающие лекарственное средство, и тому подобное.
Для парентерального введения в водном растворе, например, в случае необходимости, раствор должен быть соответственно забуферен, и жидкий разбавитель сначала делают изотоничным с достаточным количеством физиологического раствора или глюкозы. Эти конкретные водные растворы особенно подходят для внутривенного, внутримышечного, подкожного и интраперитонеального введения. В этой связи стерильные водные среды, которые могут использоваться, станут известны специалистам в данной области техники в свете настоящего раскрытия.
Помимо соединений, составленных для парентерального введения, такого как внутривенная или внутримышечная инъекция, другие фармацевтически приемлемые формы включают, например, таблетки или другие твердые лекарственные формы для перорального введения; композиции липосом; капсулы с отсроченным высвобождением; и любую другую форму, используемую в настоящее время, включая кремы.
Дополнительные композиции, подходящие для других способов введения, включают суппозитории. Для суппозиториев традиционные связующие и носители могут включать, например, полиалкиленгликоли или триглицериды; такие суппозитории могут быть получены из смесей, содержащих активный ингредиент в пределах от 0,5% до 10%, предпочтительно 1-2%.
Композиции для перорального применения включают такие обычно используемые наполнители, как, например, фармацевтические сорта маннита, лактозы, крахмала, стеарата магния, сахарина натрия, целлюлозы, карбоната магния и тому подобное. Эти композиции имеют форму растворов, суспензий, таблеток, пилюль, капсул, композиций с отсроченным высвобождением или порошков.
В определенных вариантах осуществления пероральные фармацевтические композиции содержат инертный разбавитель или усвояемый пищевой носитель, или они могут быть заключены в твердые или мягкие желатиновые капсулы, или они могут быть спрессованы в таблетки, или они могут быть включены непосредственно в пищевые продукты диеты. Для перорального терапевтического введения активные соединения могут быть объединены с эксципиентами и использоваться в форме проглатываемых таблеток, буккальных пластинок, пастилок, капсул, эликсиров, суспензий, сиропов, вафель и тому подобное. Такие композиции и препараты должны содержать по меньшей мере 0,1% активного соединения. Процентное содержание композиций и препаратов может, конечно, меняться, и может оказаться удобным процентное содержание от приблизительно 2 до приблизительно 75 мас.% единицы или предпочтительно 25-60%. Количество активных соединений в таких терапевтически применимых композициях таково, что будет получена соответствующая доза.
Таблетки, пастилки, пилюли, капсулы и тому подобное также могут содержать следующее: связующее, такое как трагакантовая камедь, гуммиарабик, кукурузный крахмал или желатин; эксципиенты, такие как дикальцийфосфат; разрыхлитель, такой как кукурузный крахмал, картофельный крахмал, альгиновая кислота и тому подобное; смазывающее вещество, такое как стеарат магния; и может быть добавлен подсластитель, такой как сахароза, лактоза или сахарин, или ароматическое вещество, такое как мята, винтергриновое масло или вишневый ароматизатор. Если стандартной дозированной формой является капсула, она может содержать, в дополнение к веществам вышеупомянутого типа, жидкий носитель. Различные другие вещества могут присутствовать в качестве покрытий или веществ, в других отношениях модифицирующих физическую форму дозированной формы. Например, таблетки, пилюли или капсулы могут быть покрыты шеллаком, сахаром или и тем, и другим. Сироп эликсира может содержать активные соединения сахарозы в качестве подсластителя, консерванты - метил- и пропилпарабены, краситель и ароматическое вещество, такое как вишневый или апельсиновый ароматизатор.
Фармацевтические композиции по настоящему изобретению могут использоваться в форме фармацевтического препарата, например, в твердой, полутвердой или жидкой форме, который в качестве активного ингредиента содержит одно или несколько соединений по изобретению, в смеси с органическим или неорганическим носителем или эксципиентом, подходящим для наружного, энтерального или парентерального применения. Активный ингредиент может быть смешан, например, с обычными нетоксичными, фармацевтически приемлемыми носителями для таблеток, шариков, капсул, суппозиториев, растворов, эмульсий, суспензий и любой другой формы, подходящей для применения. Носителями, которые могут использоваться, являются вода, глюкоза, лактоза, гуммиарабик, желатин, маннит, крахмальная паста, трисиликат магния, тальк, кукурузный крахмал, кератин, коллоидный диоксид кремния, картофельный крахмал, мочевина и другие носители, подходящие для применения в производстве препаратов в твердой, полутвердой или жидкой форме, и, кроме того, могут использоваться вспомогательные средства, стабилизаторы, загустители и красители, и ароматические вещества. Активное соединение включают в фармацевтическую композицию в количестве, достаточном для оказания желаемого эффекта на состояние или болезненный процесс.
Для получения твердых композиций, таких как таблетки, основной активный ингредиент смешивают с фармацевтическим носителем, например традиционными ингредиентами для таблетирования, такими как кукурузный крахмал, лактоза, сахароза, сорбит, тальк, стеариновая кислота, стеарат магния, дикальцийфосфат или камеди, и другими фармацевтическими разбавителями, например водой, для образования твердой композиции для приготовления лекарственной формы, содержащей гомогенную смесь соединения по изобретению или ее нетоксичную фармацевтически приемлемую соль. Если данные композиции для приготовления лекарственной формы называются гомогенными, это означает, что активный ингредиент равномерно диспергирован по всей композиции так, что композицию можно легко разделить на стандартные дозированные лекарственные формы, такие как таблетки, пилюли и капсулы. Затем эту твердую композицию для приготовления лекарственной формы разделяют на стандартные дозированные лекарственные формы типа, описанного выше, содержащие от 0,1 до приблизительно 500 мг активного ингредиента по изобретению. Таблетки или пилюли новой композиции могут быть покрыты или иначе компаундированы для получения лекарственной формы, имеющей преимущество длительного действия. Например, таблетка или пилюля могут содержать внутренний дозированный и внешний дозированный компонент, последний образует оболочку над первым. Эти два компонента могут быть разделены кишечно-растворимым слоем, который предотвращает распад в желудке и позволяет внутреннему компоненту интактным проникнуть в двенадцатиперстную кишку или замедляет высвобождение. Для таких кишечно-растворимых слоев или покрытий можно использовать различные вещества, такие вещества включают ряд полимерных кислот и смесей полимерных кислот с такими веществами, как шеллак, цетиловый спирт и ацетат целлюлозы.
Жидкие формы для перорального или инъекционного введения, в которые могут быть включены композиции по изобретению, включают водный раствор, сиропы с соответствующими ароматизаторами, водные или масляные суспензии и эмульсии с приемлемыми маслами, такими как хлопковое масло, масло сезама, кокосовое масло или масло арахиса, или с солюбилизирующим средством, или эмульгатором, подходящим для внутривенного введения, а также эликсиры и подобные фармацевтические растворители. Подходящие диспергирующие или суспендирующие средства для водных суспензий включают синтетические и природные камеди, такие как трагакантовая камедь, гуммиарабик, альгинат, декстран, натрийкарбоксиметилцеллюлоза, метилцеллюлоза, поливинилпирролидон или желатин.
Композиции для ингаляции или инсуффляции включают растворы и суспензии в фармацевтически приемлемых, водных или органических растворителях или их смесях и порошки. Жидкие или твердые композиции могут содержать подходящие фармацевтически приемлемые эксципиенты, как изложено выше. Предпочтительно композиции вводят пероральным или назальным респираторным путем для местного или системного действия. Композиции, предпочтительно в стерильных фармацевтически приемлемых растворителях, могут быть распылены при помощи инертных газов. Распыленные растворы можно вдыхать непосредственно из распыляющего устройства, или распыляющее устройство может быть присоединено к маске, палатке или аппарату искусственной вентиляции легких с непостоянным положительным давлением. Раствор, суспензия или порошковые композиции можно вводить, предпочтительно перорально или через нос, из устройств, которые подают композицию подходящим способом.
Для лечения клинических состояний и заболеваний, отмеченных выше, соединение по настоящему изобретению может быть введено перорально, местно, парентерально, с аэрозолем для ингаляции или ректально в стандартной дозированной форме, содержащей обычные нетоксичные фармацевтически приемлемые носители, вспомогательные вещества и растворители. Термин «парентеральный», как используется в данном документе, включает подкожные инъекции, внутривенные, внутримышечные, интрастернальные инъекции или методы инфузии.
Скрининг и способы обнаружения
Композиция по изобретению может использоваться для скрининга лекарственных средств или соединений, которые модулируют активность или экспрессию GPCR, а также для лечения расстройств, характеризующихся недостаточной или избыточной продукцией белка GPCR или продукцией форм белка GPCR со сниженной или аберрантной активностью по сравнению с белком GPCR дикого типа.
Изобретение относится к способу (также называемому в данном документе «скрининговым анализом») для идентификации модуляторов, то есть соединений-кандидатов или тестируемых соединений или средств (например, пептидов, пептидомиметиков, малых молекул или других лекарственных средств), которые связываются с GPCR или оказывают стимулирующее или ингибирующее действие на, например, экспрессию белка GPCR или активность GPCR. Изобретение также включает соединения, идентифицированные в скрининговых анализах, описанных в данном документе.
Изобретение относится к анализу для скрининга соединений-кандидатов или тестируемых соединений, которые связываются с мембраносвязанной формой комплекса пепдуцина-GPCR или его биологически активной части, или модулируют ее активность. Тестовые соединения по изобретению могут быть получены с использованием любого из многочисленных подходов в методах комбинаторных библиотек, известных в данной области техники, включая, например, биологические библиотеки; пространственно адресуемые библиотеки с параллельной твердой фазой или фазой раствора; методы синтетических библиотек, требующих деконволюции; метод библиотеки «одна гранула-одно соединение»; и синтетические методы библиотеки с использованием отбора аффинной хроматографией. Биологический библиотечный подход ограничивается библиотеками пептидов, в то время как другие четыре подхода применимы к пептиду, непептидному олигомеру или библиотекам малых молекул. См., например, Lam, 1997'. Anticancer Drug Design 12: 145.
Примеры способов синтеза молекулярных библиотек могут быть обнаружены в данной области техники, например в: DeWitt, et al, 1993. Proc. Natl. Acad. Sci. U.S.A. 90: 6909; Erb, et al, 1994. Proc. Natl. Acad. Sci. U.S.A. 91: 11422; Zuckermann, et al, 1994. J. Med. Chem. 37: 2678; Cho, et al, 1993. Science 261: 1303; Carrell, et al, 1994. Angew. Chem. Int. Ed. Engl. 33: 2059; Carell, et al, 1994. Angew. Chem. Int. Ed. Engl. 33: 2061; и Gallop, et al, 1994. J. Med. Chem. 37: 1233.
Библиотеки соединений могут находиться в растворе (например, Houghten, 1992. Biotechniques 13: 412-421) или на гранулах (Lam, 1991. Nature 354: 82-84), на стружках (Fodor, 1993. Nature 364: 555-556), бактериях (Ladner, патент США № 5223409), спорах (Ladner, патент США № 5233409), плазмидах (Cull, et al, 1992. Proc. Natl. Acad. Sci. USA 89: 1865-1869) или на фагах (Scott and Smith, 1990. Science 249: 386-390; Devlin, 1990. Science 249: 404-406; Cwirla, et al., 1990. Proc. Natl. Acad. Sci. U.S.A. 87: 6378-6382; Felici, 1991. J. Mol. Biol. 222: 301-310; Ladner, патент США № 5233409).
Анализ представляет собой клеточный анализ, в котором клетка, которая экспрессирует мембраносвязанную форму GPCR или его биологически активную часть на поверхности клетки, плюс пепдуцин, контактирует с тестируемым соединением, и определяется способность тестируемого соединения связываться с GPCR и вытеснять определенный пепдуцин. Тестируемое соединение может связываться с внеклеточной поверхностью, трансмембранными доменами или внутриклеточными поверхностями GPCR-мишени и ингибировать или усиливать активацию пепдуцином GPCR. Клетка, например, происходит от млекопитающего или является клеткой дрожжей. Определить способность тестируемого соединения вытеснять пепдуцин с белка GPCR можно, например, путем связывания пепдуцина с радиоизотопной или ферментной меткой, так чтобы связывание тестируемого соединения вытесняло пепдуцин из GPCR или его биологически активной части. Альтернативно, тестовые соединения могут быть прямо или косвенно помечены125I,35S,14C или3H, и пепдуцин может вытеснять меченное радиоактивным изотопом тестируемое соединение из GPCR, и свободное меченное радиоактивным изотопом тестируемое соединение обнаруживают прямым измерением радиоизлучения или подсчетом сцинтилляций. Альтернативно, тестовые соединения могут быть помечены ферментом, например пероксидазой хрена, щелочной фосфатазой или люциферазой, и ферментную метку выявляют по усилению или ослаблению превращения соответствующего субстрата в продукт после добавления пепдуцина.
В другом варианте осуществления анализ представляет собой клеточный анализ, предусматривающий контакт с клеткой, экспрессирующей мембраносвязанную форму белка GPCR или его биологически активную часть на поверхности клетки, с тестируемым соединением и измерение способности тестируемого соединения модулировать (например, стимулировать или ингибировать) связывание, активность пепдуцина по отношению к GPCR.
Определение способности тестируемой молекулы взаимодействовать с молекулой-мишенью GPCR может быть достигнуто одним из способов, описанных выше для определения прямого связывания. В одном из вариантов осуществления определение способности тестируемой молекулы ингибировать взаимодействие пептида GPCR с молекулой-мишенью GPCR может быть выполнено путем измерения активности комплекса мишени GCPR-пепдуцина. Например, активность молекулы-мишени может быть определена по ингибированию пептидом GPCR индукции второго клеточного мессенджера мишени GPCR (то есть внутриклеточного Ca2+, диацилглицерина, IP3 и т.д.), обнаружению каталитической/ферментативной активности, зависящей от активации или ингибирования GPCR, обнаружению индукции или ингибирования репортерного гена (содержащего чувствительный к GPCR регулирующий элемент, оперативно связанный с нуклеиновой кислотой, кодирующей определимый маркер, например люциферазу), или обнаружению клеточного ответа, например выживания клетки, дифференцировки клетки или пролиферации клетки.
Альтернативно, анализ по изобретению представляет собой бесклеточный анализ, предусматривающий контакт пептида GPCR или его биологически активной части с тестируемым соединением, и определение способности тестируемого соединения связываться или модулировать (например стимулировать или ингибировать) активность белка GPCR или его биологически активной части.
Связывание тестируемого соединения с GPCR может быть определено либо прямо, либо косвенно, как описано выше. Например, анализ предусматривает контактирование пепдуцина плюс GPCR или его биологически активной части с известным соединением, которое связывается с GPCR, чтобы образовать смесь для анализа, контактирование смеси для анализа с тестируемым соединением и определение способности тестируемого соединения взаимодействовать с белком GPCR, где определение способности тестируемого соединения взаимодействовать с белком GPCR включает определение способности тестируемого соединения избирательно связываться с GPCR или его биологически активной частью по сравнению с известным соединением.
Определение способности тестируемого соединения модулировать активность GPCR может быть выполнено, например, путем определения способности пептида GPCR связываться с молекулой-мишенью GPCR одним из способов, описанных выше для определения прямого связывания. Альтернативно, определение способности тестируемого соединения модулировать активность пептида GPCR может быть выполнено путем определения способности пептида GPCR далее модулировать молекулу-мишень GPCR. Например, каталитическая/ферментативная активность молекулы-мишени на подходящем субстрате может быть определена, как описано выше.
Бесклеточный анализ предусматривает контактирование пептида GPCR или его биологически активной части с известным соединением, которое связывается с GPCR, чтобы образовать смесь для анализа, контактирование смеси для анализа с тестируемым соединением и определение способности тестируемого соединения взаимодействовать с GPCR, где определение способности тестируемого соединения взаимодействовать с GPCR включает определение способности пептида GPCR избирательно связываться с молекулой-мишенью GPCR или модулировать ее активность.
Бесклеточные анализы по изобретению можно использовать как для растворимой формы, так и мембраносвязанной формы белка GPCR. В случае бесклеточных анализов мембраносвязанной формы белка GPCR может оказаться желательным использовать солюбилизирующее средство, такое, что мембраносвязанная форма белка GPCR удерживается в растворе. Примеры таких солюбилизирующих средств включают неионогенные детергенты, такие как н-октилглюкозид, н-додецилглюкозид, н-додецилмальтозид, октаноил-N-метилглюкамид, деканоил-N-метилглюкамид, Triton® X-100, Triton® X-114, Thesit®, изотридециполи(этиленгликолевый эфир)n, N-додецил-N,N-диметил-3-аммонио-1-пропансульфонат, 3-(3-холамидопропил)диметиламминиол-1-пропансульфонат (CHAPS) или 3-(3-холамидопропил)диметиламминиол-2-гидрокси-1-пропансульфонат (CHAPSO).
Может быть желательным иммобилизовать или пептид GPCR, или его молекулу-мишень для облегчения разделения форм, образовавших и не образовавших комплекса одного или обоих белков, а также для приспособления автоматизации анализа. Связывание тестируемого соединения с белком GPCR или взаимодействие белка GPCR с пепдуцином в присутствии и в отсутствие соединения-кандидата, может быть выполнено в любом сосуде, подходящем для содержания реагентов. Примеры таких сосудов включают микротитровальные планшеты, пробирки и микроцентрифужные пробирки. В одном из вариантов осуществления может быть добавлен слитый белок, который добавляет домен, позволяющий одному или обоим белкам связаться с матрицей. Например, слитые пептиды GST-GPCR или слитые белки GST-мишени могут адсорбироваться на гранулах глутатиона-сефарозы (Sigma Chemical, St. Louis, MO) или обработанных глутатионом микротитровальных планшетах, которые затем объединяют с тестируемым соединением или с тестируемым соединением и либо не адсорбированным белком-мишенью, либо пептидом GPCR, и смесь инкубируют при условиях, способствующих образованию комплекса (например, при физиологических значениях концентрации соли и pH). После инкубации бусинки или лунки микротитровального планшета промывают для удаления любых несвязанных компонентов, матрицу в случае гранул иммобилизуют, комплекс определяют либо прямо, либо косвенно, например, как описано, см. выше. Альтернативно, комплексы могут диссоциировать из матрицы, и уровень связывания пептида GPCR или активность определяют, используя стандартные методы.
Другие методы иммобилизации белков на матрицах также используют в скрининговых анализах по изобретению. Например, или пептид GPCR, или его молекулу-мишень можно иммобилизовать, используя конъюгацию биотина и стрептавидина. Биотинилированный пептид GPCR или молекулы-мишени могут быть получены методами с использованием биотина-NHS (N-гидроксисукцинимида), известных в технике (например, набор для биотинилирования, Pierce Chemicals, Rockford, Ill), и иммобилизованы в лунках 96-луночных планшетов, покрытых стрептавидином (Pierce Chemical). Альтернативно, антитела, реагирующие с пептидом GPCR или молекулами-мишенями, но которые не вмешиваются в связывание пептида GPCR с родственным ему GPCR, могут быть дериватизированы на лунках планшета, и несвязанные мишени или пептид GPCR удерживаются за счет конъюгации с антителами. Методы обнаружения таких комплексов, помимо описанных выше для GST-иммобилизованных комплексов, включают иммунологический анализ комплексов с использованием антител, реагирующих с пептидом GPCR или молекулой-мишенью, а также ферментные анализы, которые основаны на выявлении ферментативной активности, связанной с пептидом GPCR или молекулой-мишенью.
Модуляторы экспрессии белка GPCR идентифицируются методом, в котором клетка контактирует с соединением-кандидатом, и определяется экспрессия мРНК GPCR или белка в клетке. Уровень экспрессии мРНК GPCR или белка в присутствии соединения-кандидата сравнивается с уровнем экспрессии мРНК GPCR или белка в отсутствие соединения-кандидата. После этого соединение-кандидат можно идентифицировать как модулятор экспрессии мРНК GPCR или белка на основе этого сравнения. Например, если экспрессия мРНК GPCR или белка выше (то есть статистически значимо выше) в присутствии соединения-кандидата, чем в его отсутствие, соединение-кандидат идентифицируют как стимулятор экспрессии мРНК GPCR или белка. Альтернативно, если экспрессия мРНК GPCR или белка ниже (статистически значимо ниже) в присутствии соединения-кандидата, чем в его отсутствие, соединение-кандидат идентифицируют как ингибитор экспрессии мРНК GPCR или белка. Уровень экспрессии мРНК GPCR или белка в клетках может быть определен способами, описанными в данном документе для обнаружения мРНК GPCR или белка.
Пептидные последовательности, обсуждаемые в данном документе, приведены в следующей таблице 3.




Пептидная часть пепдуцина, например от i1-петли, может иметь любую подходящую длину, которая приводит к намеченным благоприятным эффектам, как правило 5-15, или, например, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30.
Способы получения соединений пепдуцинов по изобретению иллюстрируются следующими схемами синтеза и примером (примерами). Следующие схемы, примеры и биологические данные приведены для иллюстрации изобретения, но не для того, чтобы ограничить объем или сущность изобретения.
Получение и определение характеристик композиций пепдуцинов
Синтез стандартными методами Fmoc твердофазного синтеза и получение пальмитилированных пептидов пепдуцинов выполняли, как в целом описано Covic et al. PNAS 99:643-648 (2002). Пепдуцины очищали до >95% чистоты путем C8 или C4 хроматографии с обращенными фазами и растворяли в ДМСО.
Время кровотечения определяли у взрослых самцов мышей CF-1 в возрасте 6-8 недель, анестезированных с помощью интраперитонеальной инъекции ксилазина (10 мг/кг) плюс кетамин (50 мг/кг). Во внутреннюю яремную вену вводили катетер 0,28×1,52 мм и выполняли инфузию P1pal-12 (3 мкмоль/л), P4pal-10 (3 мкмоль/л) или только растворителя (ДМСО) в течение 1 мин в общем объеме 100 мкл. Экспериментатору не сообщали, какое вещество он вводит. Через 5 мин хвосты были ампутированы на расстоянии 2 мм от кончика хвоста. Хвосты погружали в лабораторный стакан с забуференным фосфатом физиологическим раствором, температура которого поддерживалась на уровне 37°C, визуально наблюдали за кровотечением и определяли его время. Если кровотечение возобновлялось в течение 5 минут, это регистрировали как повторное кровотечение и учитывали как признак нестабильного гемостаза, как описано ранее. Law et al, Nature 401, 808 (1999). Максимальное время кровотечения составляло 10 минут, после чего хвост каутеризировали.
ПРИМЕР 1
Чтобы продемонстрировать, насколько эффективно сепсис можно лечить пепдуцинами по настоящему изобретению, самкам мышей CF-1 в возрасте 6-8 недель вводили 2,5 мг/кг препарата пепдуцина в 20% ДМСО или растворитель (20% ДМСО). Момент времени, выбранный для лечения, совпадал с индукцией несмертельного сепсиса путем перевязки и пункции слепой кишки (CLP). После начальной дозы 2,5 мг/кг, мыши подкожно вводили пепдуцин, 1 мг/кг (или растворитель) каждый день в течение шести дней. *: Через шесть дней 4 мышей из группы, получавшей растворитель, забили; #: одну мышь из группы, получавшей пепдуцин ×1/2i1LCA10, забили на 6-й день, и всех оставшихся в живых мышей забили на 17-й день. Результаты показаны на фиг.5. На левом графике отображены мыши, получавшие ×1/2pal16, ×1/2i1LCA10 или растворитель (20% ДМСО) в момент CLP. На правом графике отображен ежедневный мониторинг массы мышей. У мышей, получавших растворитель, наблюдали выраженную потерю массы тела, в то время как мыши, получавшие пепдуцины, набирали массу после первоначального снижения.
ПРИМЕР 2
Существует лишь несколько сообщений, в которых лечение сепсиса оказалось достаточным, даже после начала синдрома системного воспалительного ответа. Для демонстрации того, что сепсис можно эффективно лечить пепдуцинами по настоящему изобретению, даже если с начала сепсиса прошло много времени, мышей лечили 5,0 мг/кг препарата пепдуцина в 40% ДМСО или вводили растворитель (40% ДМСО). Моментом времени, выбранным для лечения, было восемь часов после индукции несмертельного сепсиса путем перевязки и пункции слепой кишки (CLP). После начальной дозы 5,0 мг/кг пепдуцина, мышам делали инъекции 2,5 мг/кг пепдуцина (или растворителя) подкожно каждый день со 2-го по 3-й день и 1,0 мг/кг с 3-го по 6-й день. Через восемь часов после CLP у мышей уже проявлялись симптомы системного заболевания, характерные для сепсиса, например взъерошенный мех, сниженная подвижность, сниженное потребление пищи и воды, закрытые, воспаленные глаза. Результаты показаны на фиг.6. На левом графике, *: двух мышей, получавших растворитель, забили в день 6. Мышей, которые выжили в эксперименте, забили в день 17. На правом графике изображена масса тела мышей, которую проверяли каждый день.
ПРИМЕР 3
Для демонстрации благоприятного эффекта лечения пепдуцином воспалительных расстройств мышей лечили пепдуцинами по изобретению. Результаты показаны на фиг.7. Синдром респираторного ответа взрослых (ARDS) возникает вследствие избыточной инфильтрации нейтрофилами легких и их активации, что ведет к отложению фибрина. Сепсис может вызвать ARDS, который имеет высокую летальность. Графики А и В. Мышей забивали через 24 часа после CLP и выполняли BAL. После окраски по Гимзе подсчитывали число нейтрофилов; измеряли TNF с помощью ELISA. *p<0,02 при сравнении с группой, получавшей растворитель. С. Гистология легких. Мыши были забиты через 48 часов после CLP.
ПРИМЕР 4
Этот пример демонстрирует, как лечение пепдуцинами можно использовать для облегчения еще одного аспекта сепсиса. Системные воспалительные реакции, расстройство коагуляции и фибринолиза при ДВС опосредуются несколькими провоспалительными цитокинами. Изменения времени кровотечения и увеличение уровня D-димера, который является продуктом избыточного нерегулируемого фибринолиза, являются признаком диссеминированного внутрисосудистого свертывания, приводящего к распространенному выпадению фибрина в кровотоке, что вносит свой вклад в полиорганную недостаточность и смерть у больных сепсисом. Результаты показаны на фиг.8. A. Время кровотечения измеряли через 24 часа после CLP и непосредственно после начала лечения. Время кровотечения у мышей. получавших растворитель, было укороченным, в то время как у мышей, получавших пепдуцин i1-петли ×1/2i1LCA10 или пепдуцин i3-петли ×1/2pal16, время кровотечения было нормальным. B. Уровни D-димера измеряли через 48 часов после CLP. Как суррогатный маркер количества выпавшего фибрина, после CLP D-димер был повышен, более высокий уровень наблюдали у мышей, которым вводили растворитель, чем у мышей, получавших CXCR2 пепдуцин. С. Время кровотечения у мышей, лечение которых начато через 8 часов после CLP. D. Уровни D-димера у мышей, лечение которых начато через 8 часов после CLP.
ПРИМЕР 5
Для демонстрации благоприятного эффекта лечения пепдуцином воспалительных расстройств были выполнены исследования хемотаксиса на модифицированных 48-луночных планшетах для микрохемотаксиса. 1 mio нейтрофилов/мл позволяли мигрировать к хемоаттрактанту, находившемуся в нижних лунках. Нейтрофилы предварительно обрабатывали либо 0,2% ДМСО, либо пепдуцинами в указанных концентрациях. N=3. Результаты показаны на фиг.9.
ПРИМЕР 6
Для демонстрации благоприятного эффекта лечения пепдуцином воспалительных расстройств in vivo были выполнены исследования хемотаксиса у мышей. Мышам вводили 1 мл 3% тиогликолята внутрибрюшинно. Тиогликолят стимулирует секрецию перитонеальными макрофагами цитокинов, после чего в брюшную полость мигрируют лейкоциты. Пепдуцины вводили внутривенно в указанных дозах. Через 4 часа клетки собирали с помощью перитонеального лаважа, окрашивали по Гимзе и подсчитывали при увеличении ×40. N=60. Результаты показаны на фиг.10.
ПРИМЕР 7
Было показано, что SDF-1α и CXCR4 участвуют в выходе незрелых нейтрофилов из костного мозга. Высокие уровни экспрессии и активации CXCR4 приводят к возвращению стареющих нейтрофилов в костный мозг, в то время как хемокины, действующие на рецепторы CXCR2 нейтрофилов, то есть KC, Gro-α или IL-8, увеличивают мобилизацию нейтрофилов. Кровь брали через 1, 3, 5, 7 и 17 дней после CLP и подсчитывали число лейкоцитов. У мышей, получавших растворитель, число лейкоцитов вначале снижалось. Однако через 3 дня сепсиса содержание периферических лейкоцитов у этих мышей становилось высоким и оставалось высоким до конца эксперимента. У мышей, которых лечили ×1/2pal16 и ×1/2i1LCA10, содержание лейкоцитов оставалось в пределах нормы. У мышей, которых лечили ×4i1pal12, содержание лейкоцитов повышалось немедленно, но уменьшалось через 5 дней после CLP до очень низкого. Это наблюдение согласуется с предыдущими сообщениями, где либо блокирование CXCR4, либо стимуляция CXCR2 приводили к нейтрофилии периферической крови мышей. Увеличение лейкоцитов в периферической крови после лечения ×4i1pal12 свидетельствует, что блокада CXCR2 предотвращает нейтрофилию периферической крови. Результаты показаны на фиг.11.
ПРИМЕР 8
Исследования хемотаксиса выполняли на модифицированных 48-луночных планшетах для микрохемотаксиса. 1 mio нейтрофилов/мл позволяли мигрировать к хемоаттрактанту, находившемуся в нижних лунках. Нейтрофилы предварительно обрабатывали либо 0,2% ДМСО, либо пепдуцинами в указанных концентрациях. N=3. На фиг.12 показано, что пепдуцины i1-петли по изобретению обладают мощным и селективным противовоспалительным действием.
ПРИМЕР 9
Исследования хемотаксиса выполняли на модифицированных 48-луночных планшетах для микрохемотаксиса. 1 mio нейтрофилов/мл позволяли мигрировать по направлению к Rantes - лиганду для CCR1, CCR3 и CCR5 (20 нг/мл), находившемуся в нижних лунках. Нейтрофилы предварительно обрабатывали либо 0,2% ДМСО, либо пепдуцинами в указанных концентрациях. N=3. На фиг.13 показано, что пепдуцины i1-петли по изобретению обладают мощным и селективным противовоспалительным действием.
ПРИМЕР 10
Поскольку исход у больных с SIRS часто определяется органной недостаточностью, исследовали функцию печени. Мышей забивали через 24 часа после CLP и измеряли уровень в плазме ALT - фермента, уровень которого увеличивается при потере функции печени. У мышей, которым была проведена имитация лечения, то есть разрез брюшной стенки без перевязки и пункции слепой кишки, повышения уровня ALT не наблюдалось. У мышей, получавших растворитель и ×4pal12, уровень ALT повысился; у мышей, которых лечили ×1/2pal16 и ×1/2LCA10 повышение наблюдалось, но оно было значительно слабее, чем у мышей, получавших растворитель. Результаты приведены на фиг.22, они показывают, что пепдуцины CXCR2 могут использоваться для улучшения функции печени.
ПРИМЕР 11
CLP выполняли у самок мышей CF-1 в возрасте 6-8 недель. На правом графике изображены результаты лечения мышей ×4pal12 или растворителем (20% ДМСО) в момент CLP. После начальной дозы 2,5 мг/кг животные получали 1 мг/кг пепдуцина или растворителя подкожно каждый день в течение 6 дней. На левом графике показаны результаты ежедневных проверок массы тела мышей. Результаты приведены на фиг.23.
ПРИМЕР 12
Был разработан более селективный пепдуцин PAR4 на основе первой внутриклеточной петли (i1) рецептора. Поскольку i1-петля находится на противоположной стороне рецептора по отношению к петле i3, пепдуцин i1-петли на основе PAR4 проявляет пониженное перекрестное ингибирование PAR1 или отсутствие такого ингибирования. PAR4 экспрессируется на HEK-клетках в отдельности или в комбинации с PAR1. Пепдуцин i1 PAR4, P4pal-i1, полностью блокирует реакцию хемотаксиса, опосредованную PAR4 на клетках HEK, и предотвращает агрегацию тромбоцитов на его пептидный лиганд, AYPGKF (SEQ ID NO: 34), как показано на фиг.24A-B. P4pal-i1 обладает селективностью по отношению к PAR4 и не ингибирует реакцию хемотаксиса, опосредованную PAR1, и, по-видимому, не ингибирует агрегацию тромбоцитов на пептидный лиганд SFLLRN (SEQ ID NO: 35), как видно на фиг.24А и С. P4pal-i1 не ингибирует PAR1 даже после ко-экспрессии с PAR4 - это указывает на то, что если PAR1 и PAR4 образуют комплекс, связь пепдуцина i1 с PAR4, по-видимому, не влияет на передачу сигналов от PAR1. Подобным образом, при использовании в отдельности P4pal-i1 оказывал лишь незначительное воздействие на агрегацию тромбоцитов на 3 нМ тромбина, поскольку тромбин также активирует PAR1 (фигура 24D). Однако при использовании в комбинации с антагонистом PAR1, RWJ-56110, P4pal-i1 отчетливо ингибировал агрегацию под действием 3 нМ тромбина. Таким образом, «нацеливание» либо на PAR1, либо на PAR4 по отдельности оказывает ограниченное влияние на агрегацию под действием тромбина, в то время как одновременное ингибирование и PAR1, и PAR4 эффективно блокирует реакцию на тромбин, тем самым ослабляя или ингибируя тромбоз.
ПРИМЕР 13
Исследовали влияние бивалирудина на реакции тромбоцитов, опосредованные PAR1 и PAR4, и оценивали влияние ингибирования взаимодействий тромбина-PAR1 в комбинации с блокадой PAR4 на агрегацию тромбоцитов. Для предотвращения связывания тромбина с сайтом Hir на PAR1, использовали бивалирудин (также известный как Hirulog®, Angiomax™), который связывается с тромбином с наномолярной аффинностью. Несмотря на его широкое применение при лечении пациентов с острыми коронарными синдромами, влияния бивалирудина на PAR1 и PAR4-зависимую активацию тромбоцитов не были определены до изобретения. Бивалирудин в отдельности или бивалирудин плюс RWJ-56110 давали схожий EC50 (10-11 нм) активации тромбином PAR4-зависимой агрегации как PAR1-Ab (фиг.25A). При концентрациях, превышающих 11 нМ, тромбин восстанавливал полную активацию PAR4-зависимой агрегации, даже когда к RWJ-56110 добавляли антитело, блокирующее PAR1, плюс бивалирудин. Эти данные свидетельствуют, что ни одно из веществ, блокирующих Hir, не предотвращает полностью взаимодействие активной зоны тромбина с PAR4 тромбоцитов. Однако добавление пепдуцина PAR4, P4pal-i1, к обработанным бивалирудином тромбоцитам сильно задерживало начало и снижало степень агрегации даже при очень высоких концентрациях тромбина (12-16 нМ) (фиг.25B). Эти данные выявили механизм, в котором тромбин, присоединенный к Hir-мотиву PAR1, увеличивает активацию PAR4, но при достаточно высоких концентрациях тромбина PAR4 активируется тромбином, если дальнейшее распространение сигнала не заблокировано пепдуцином PAR4.
ПРИМЕР 14
Артериальный тромбоз у морских свинок предотвращается комбинацией бивалирудина и пепдуцина PAR4. Использовали стандартную модель повреждения сонной артерии для оценки эффективности одновременного введения бивалирудина и пепдуцина PAR4 при артериальном тромбозе у морских свинок. В отличие от мышей, тромбоциты которых лишены PAR1, морские свинки разделяют функциональное подобие с тромбоцитами человека и экспрессируют и PAR1, и PAR4. Согласуясь с более ранними результатами использования гирудина, бивалирудин в отдельности (0,18 мг/кг) увеличивал среднее время окклюзии артерии с 13 минут до 20 минут, хотя это не было статистически значимым (фиг.26). P4pal-i1 (0,13 мг/кг) увеличивал время окклюзии приблизительно в той же степени. Совместное введение бивалирудина плюс P4pal-i1 создавало статистически значимую (p=0,0001) защиту против острой артериальной окклюзии. Как было продемонстрировано с RWJ-58259, блокада только PAR1 пепдуцином PAR1, P1pal-7, создавало только частичную защиту от артериального тромбоза. По сравнению с P4pal-i1, добавление к P1pal-7 бивалирудина не давало дополнительного продления времени артериальной окклюзии. Вместе, эти полученные in vivo данные указывают, что PAR4 также должен быть заблокирован для достижения существенной защиты против тромбоза.
Эти эксперименты поддерживают более ранние наблюдения, сделанные с PAR1 и пепдуцинами-антагонистами PAR4 и блокирующими антителами, что «нацеливание» только на PAR1, а не на PAR4 может иметь ограниченный терапевтический эффект. Как альтернативная терапевтическая стратегия предотвращение взаимодействия мотива Hir PAR1 с тромбином имеет двойную выгоду: прямое ингибирование PAR1 и косвенное ингибирование PAR4. Впервые эти данные показывают, что широко используемое антитромбическое средство, бивалирудин, эффективно блокирует активацию тромбином и PAR1, и PAR4-зависимой агрегации тромбоцитов. В комбинации с пепдуцином PAR4, но не пепдуцином PAR1 бивалирудин способен предотвратить острый артериальный тромбоз.
ПРИМЕР 15
Пепдуцины по изобретению используют для прерывания развившегося системного воспаления и сосудистого повреждения, а также для предотвращения активации каскада свертывания крови, не нарушая систему защиты организма. i1-пепдуцины по изобретению, например, основанные на CXCR1/2, не вызывают перекрестного ингибирования CXCR4. i1-пепдуцины полностью блокируют реакции хемотаксиса, опосредованные родственными рецепторами на нейтрофилах мыши и человека. x1/2LCA-i1 является селективным для рецепторов CXCR1/2 IL-8 и не ингибирует миграцию лейкоцитов человека и мыши по направлению к SDF-1α. Аналогично, ×1/2LCA-i1 не ингибирует CXCR4, даже при ко-экспрессии с CXCR1 или CXCR2. Эти данные свидетельствуют, что, если рецепторы CXCR1 и CXCR4 образуют комплекс, связь i1-пепдуцина CXCR1 не влияет на передачу сигналов от CXCR4.
Оценивали влияния пепдуцинов CXCR1/2 и CXCR4 на гомеостаз нейтрофилов при нормальных условиях при сравнении с провоспалительными условиями у мышей. Миграцию лейкоцитов вначале оценивали на модели тиогликолятного перитонита. ×1/2pal-i3 и x1/2LCA-i1-пепдуцины полностью ингибировали миграцию нейтрофилов в брюшную полость со значениями IC50 0,03 мг/кг и 0,15 мг/кг соответственно. Наоборот, у мышей, которым вводили антагонист CXCR4, x4pal-i1 (EC50 ~0,1 мг/кг), количество перитонеальных нейтрофилов существенно увеличилось.
Продолжительные эффекты пепдуцинов хемокинов на количество периферических лейкоцитов оценивали на здоровых мышах, не подвергавшихся лечению. Пепдуцины вводили один раз в сутки подкожно (2,5 мг/кг в 1-й день, 1,0 мг/кг со 2-го по 6-й день) и измеряли уровень циркулирующих лейкоцитов в течение недели. У здоровых мышей ни ×1/2pal-i3, ни ×1/2LCA-il не меняли количество лейкоцитов по сравнению с мышами, которым вводили растворитель. Напротив, ×4pal-i1 вызывал лейкоцитоз периферической крови, что согласуется с предыдущими исследованиями. Влияния пепдуцинов хемокинов на количество лейкоцитов в периферической крови у мышей, подвергшихся перевязке и пункции слепой кишки (CLP), было очень похожим. У мышей, которым вводили растворитель, вначале наблюдали лейкопению через 24 часа после CLP, затем лейкоцитоз на 3-й день. Введение ×1/2pal-i3 или ×1/2LCA-i1 один раз в сутки сохраняло уровень лейкоцитов в пределах нормы у мышей после CLP, в то время как ×4pal-i1 усиливал лейкоцитоз в 1-й день и лейкопению на 7-й день. Вместе эти данные указывают, что рецепторы CXCR2 и CXCR4 играют антагонистическую роль в гомеостазе нейтрофилов как при нормальных, так и при провоспалительных состояниях у мышей.
Пепдуцины рецептора хемокинов тестировали на способность защищать или потенциально обращать прогрессирование смертельного перитонита CLP у мышей. В первой серии экспериментов пепдуцины вводили немедленно после процедуры CLP в дозе 2,5 мг/кг. Последующие дозы составляли 1 мг/кг до дня 6, после которого лечение прекращали. Ни одна из мышей не получала терапию антибиотиками. Очень существенное уменьшение летальности при сепсисе наблюдали и для ×1/2LCA-i1, и для ×1/2pal-i3 пепдуцинов. Поразительно, но за 17-дневный период наблюдения погибло только 1/34 получавших пепдуцин мышей, в то время как 17/17 нелеченых мышей погибли к 9-му дню. Несмотря на прекращение лечения пепдуцином CXCR1/2 в день 6, выживание после этого оставалось почти 100%.
Диагноз сепсиса часто ставится несвоевременно, и профилактическое введение средств затруднено, поэтому лечение пепдуцинами задерживали до 8 часов после процедуры CLP. Даже при запоздалом лечении было замечено очень существенное снижение летальности по сравнению с нелечеными мышами. Общая выживаемость составляла 26/30 при отсроченном лечении пепдуцином CXCR1/2, в отличие от 0/20 у нелеченых мышей. Введение пепдуцина CXCR4, ×4pal-i1, не влияло на выживаемость. Мыши, которых лечили CXCR1/2, увеличивали массу тела, были активными и поддерживали нормальное поведение отыскивания после 1-го дня, даже когда лечение пепдуцином задерживали на 8 ч.
Блокада передачи сигналов через CXCR1/2 пепдуцинами обращала развитие нескольких критериев развившегося SIRS у мышей с сепсисом. Во-первых, исследовали влияние пепдуцинов CXCR1/2 на системные уровни KC, мышиного ортолога IL-8. У нелеченых мышей уровень KC поднимался в течение 16 ч после CLP и оставался повышенным по меньшей мере 48 ч. После введения пепдуцинов CXCR1/2 в момент времени 8 ч, системный уровень KC быстро падал и оставался низким. У многих нелеченых мышей уже через 24 ч после CLP развивалась одышка и гипоксемия, что хорошо коррелировало с летальностью. Во время сепсиса бактериальный эндотоксин стимулирует секрецию IL-8 эпителием легких, что приводит к миграции и активации лейкоцитов. Возникающее в результате скопление лейкоцитов по краю участка воспаления приводит к повреждению легких. Число лейкоцитов в промывных водах бронхов нелеченых мышей повышалось в 100 раз уже через 4 ч после CLP и затем повышалось в 200-300 раз после 8 ч. Лечение ×1/2pal-i3 или ×1/2LCA-i1 через 8 ч быстро приводило к тому, что число нейтрофилов в промывных водах бронхов быстро падало и оставалось низким. Гистологическое исследование легких, изъятых через 48 ч у нелеченых мышей, выявляло коллапс альвеол, лейкоцитарную инфильтрацию и обширные отложения фибрина. ×1/2pal-i3 и ×1/2LCA-i1 создавали существенную защиту против отложений фибрина, и альвеолы выглядели гистологически нормальными. Пепдуцины CXCR1/2 также полностью блокировали миграцию лейкоцитов через стимулированные LPS монослои эпителиальных и эндотелиальных клеток. Сходным образом, пепдуцины CXCR1/2 предотвращали IL-8-зависимый хемотаксис макрофагов человека, но не моноцитов, как ожидалось. Пепдуцины CXCR1/2 значительно ингибируют in vivo миграцию макрофагов мышей в полость брюшины. Вместе эти данные свидетельствуют, что пепдуцины проявляют свои терапевтические эффекты за счет блокирования рецепторов CXCR1/2 на клетках многих типов.
Печеночная недостаточность является частым осложнением тяжелого сепсиса. Лечение пепдуцинами CXCR1/2 сразу после CLP уменьшало повреждение печени, о чем свидетельствовало снижение на 52-87% уровней ферментов печени (АСЕ, ALT), в то время как пепдуцин CXCR4, ×4pal-i1, не оказывал никакого эффекта. Если лечение пепдуцином CXCR1/2 было начато через 8 часов после CLP, повышение уровней в плазме АСТ и ALT прекращалось к моменту времени 16 ч, и затем уровни падали почти до нормальных. Вместе эти данные указывают, что блокада передачи сигналов от CXCR1/2 пепдуцинами приводит к обратному развитию некоторых критериев развившегося SIRS у мышей с сепсисом, свидетельствуя, что этот подход полезен при лечении запущенного заболевания.
Спонтанные кровотечения и образование тромбов наблюдали у многих нелеченых мышей с CLP, что согласуется с развитием диссеминированного внутрисосудистого свертывания (ДВС). Поэтому за системной активацией тромбоцитов наблюдали, измеряя число тромбоцитов и уровни D-димера, маркера увеличенного образования фибрина и последующего фибринолиза, который происходит во время ДВС. Пепдуцины CXCR1/2 создавали существенную защиту против тромбоцитопении через 24 ч, даже когда лечение пепдуцином откладывалось до 8 часов после CLP. Уровни D-димера сильно повышались через 48 ч после процедуры CLP у нелеченых мышей. Однако лечение мышей ×1/2pal-i3 и ×1/2LCA-i1 приводило к существенному снижению уровней D-димера. Если лечение пепдуцином CXCRl/2 откладывали до 8 часов после процедуры CLP, уровни D-димера все равно снижались на 60-70%. Эти данные представляют собой первую демонстрацию того, что коагулопатия, которая развивается при явном сепсисе, ослабляется блокадой CXCR2.
Недавние исследования с использованием мышей, лишенных функционального рецептора CXCR2, показали увеличение выживания на модели сепсиса CLP, однако летальность была в 3-4 раза выше, чем наблюдавшаяся в исследовании заявителей. Снижение летальности после лечения пепдуцином, связанное с влиянием делеции CXCR2, могло произойти из-за нескольких факторов. CXCR2 (-/-) мыши лишены CXCR2 на протяжении всей своей жизни и имеют дополнительные дефекты в своей адаптивной иммунной системе, вследствие чего у них трудно различить острые CXCR2-специфические эффекты и компенсационные механизмы, являющиеся результатом аномального миелопоэза. Используемые мыши CF-1 являются беспородными животными дикого типа, что могло бы предоставить преимущество выживания в ситуации тяжелой иммуногенной нагрузки, вызванной CLP. Заслуживает внимания то, что анти-CXCR1/2 пепдуцины не подавляют миграцию лейкоцитов по направлению к другим хемокинам, таким как бактериальный fMLP, поэтому влияния пепдуцинов следует считать иммуномодуляторными, а не иммуносупрессивными. Кроме того, применение пепдуциновой технологии помогает подтвердить результаты генетического нокаута и позволяет лучше понять этиологию и лечение сложных заболеваний, таких как сепсис.
ЭКВИВАЛЕНТЫ
Специалистам в данной области техники будут ясны многочисленные эквиваленты для конкретных процедур, описанных в данном документе, или они смогут выявить такие эквиваленты, применяя не более чем обычное экспериментирование. Такие эквиваленты считаются включенными в объем изобретения и защищены нижеследующей формулой изобретения. В изобретении могут быть сделаны различные замены, переделки и модификации, не отступая от сущности и объема изобретения, определенных формулой изобретения. Другие аспекты, преимущества и модификации включены в объем изобретения. Содержимое всех ссылок, выданных патентов и опубликованных заявок на патент, процитированных по всей этой заявке, тем самым включены посредством ссылки. Для изобретения и его вариантов осуществления могут быть выбраны подходящие компоненты, процессы и способы из тех патентов, заявок на патент и других документов.
Реферат
Изобретение относится к области биотехнологии, конкретно к рецепторам, сопряженным с G-белками (GPCR), и может быть использовано в медицине. Химерный полипептид содержит первый домен, который является первой внутриклеточной петлей (i1-петлей) рецептора хемокина, и второй домен, соединенный с первым доменом, где второй домен является природным или искусственным гидрофобным остатком, проникающим в клетки и связывающимся с мембраной. Полученный полипептид используют при лечении заболевания или состояния, характеризующегося патологической активностью рецептора хемокина. Изобретение позволяет получить химерный полипептид, который селективно взаимодействует с родственным ему рецептором хемокина. 4 н. и 9 з.п. ф-лы, 27 ил., 3 табл.
Формула
i) первый домен, который является первой внутриклеточной петлей (i1-петлей) рецептора хемокина, где указанная i1-петля имеет аминокислотную последовательность, выбранную из группы, состоящей из ILYSRVGRSVTD (SEQ ID NO:18), YSRVGRSVTD (SEQ ID NO:19), YQKKLRSMTD (SEQ ID NO:24), MGYQKKLRSMTD (SEQ ID NO:25), KRLKSMTD (SEQ ID NO:26) и LINCKRLKSMTD (SEQ ID NO:27), и
ii) второй домен, соединенный с первым доменом, где второй домен является природным или искусственным гидрофобным остатком, проникающим в клетки, связывающимся с мембраной,
где химерный полипептид селективно взаимодействует с родственным ему рецептором хемокина.

Комментарии