Способы и композиции для лечения болезней мозга - RU2664471C2
Код документа: RU2664471C2
Чертежи

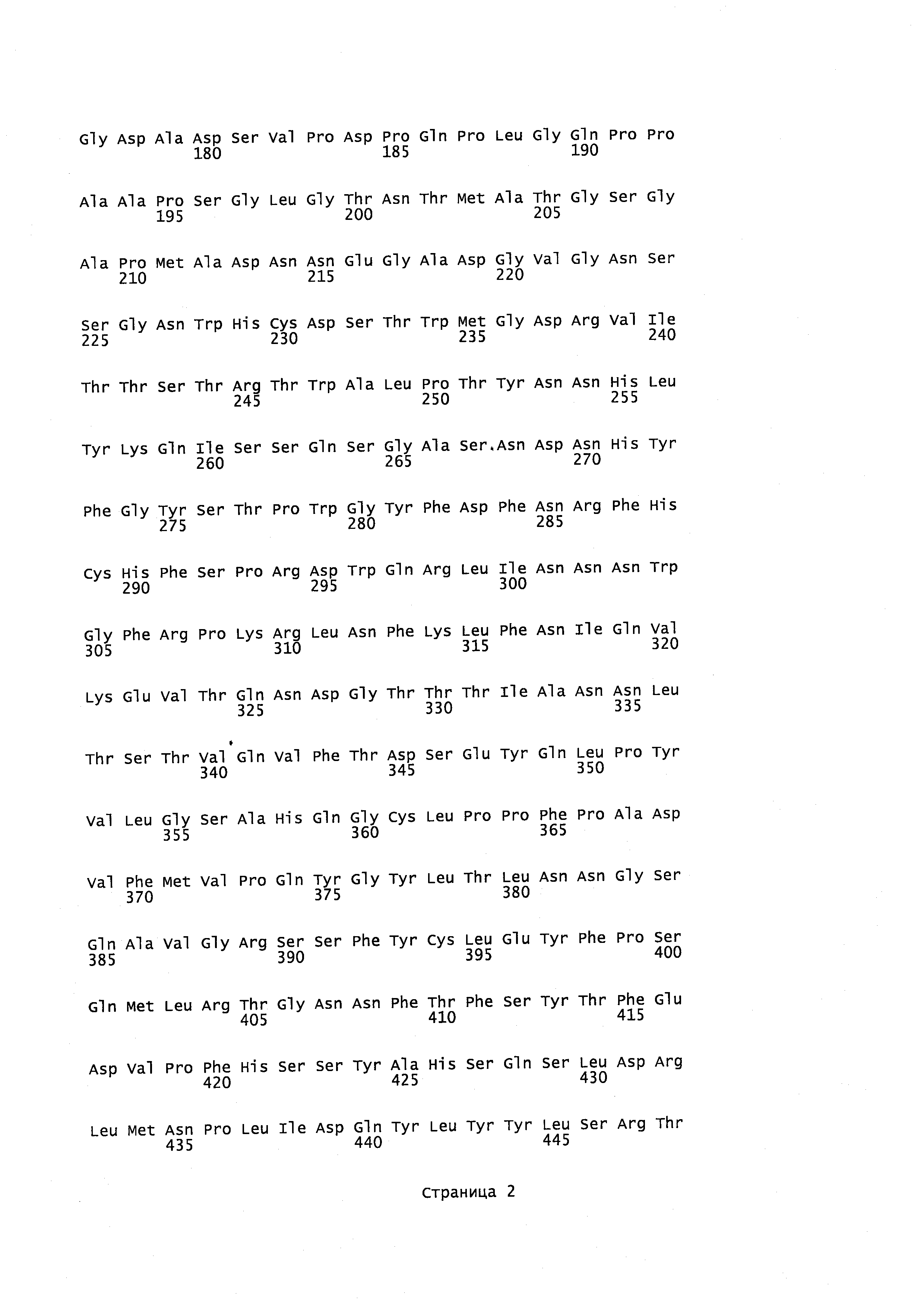








































Описание
Область техники, к которой относится изобретение
Настоящее раскрытие предоставляет способы лечения болезни или доставки терапевтического средства млекопитающему, включающие введение в мозжечково-мозговую цистерну и/или желудочек млекопитающего rAAV частицы, содержащей вектор, включающий нуклеиновую кислоту, кодирующую терапевтический белок, вставленную между парой AAV инвертированных концевых повторов, таким образом, что клетки, имеющие доступ к спинномозговой жидкости (CSF), экспрессируют терапевтическое средство и в некоторых вариантах осуществления секретируют терапевтическое средство в CSF для распространения в мозге.
Уровень техники
В настоящее время перенос генов получил широкое признание как мощное средство для анализа биологических событий и хода развития болезней на клеточном и молекулярном уровне. В последние годы применению генной терапии для лечения болезней человека, врожденных (например, дефицита аденозин дезаминазы (ADA)) или приобретенных (например, рака или инфекционной болезни), уделяется значительное внимание. С появлением усовершенствованных методов переноса генов и установлением постоянно расширяющейся библиотеки болезней, связанных с дефектными генами, генная терапия быстро развивается от теории лечения до практического дела.
Согласно сложившимся представлениям, генная терапия определяется как процедура, при которой экзогенный ген вводится в клетки пациента для того, чтобы исправить врожденную генетическую ошибку. Несмотря на то, что более 4500 болезней человека в настоящее время классифицируются как генетические, специфические мутации в геноме человека установлены для относительно немногих из этих болезней. Еще недавно эти редкие генетические болезни представляли эксклюзивные мишени для попыток генной терапии. Соответственно, в настоящее время большинство из одобренных Национальным институтом здоровья (NIH) протоколов генной терапии направлены на введение функциональной копии дефектного гена в соматические клетки индивидуума, имеющего известную врожденную генетическую ошибку. Только недавно исследователи и клиницисты начали принимать во внимание, что большая часть раков человека, отдельные формы сердечно-сосудистых болезней и многие дегенеративные заболевания также имеют важные генетические составляющие, и при разработке новых видов генной терапии следует рассматривать "генетические нарушения." Поэтому в последнее время генная терапия широко определяется как коррекция фенотипа болезни посредством введения новой генетической информации в «пораженный» организм.
При генной терапии in vivo вносимый ген вводится в клетки организма реципиента in situ, говоря другими словами, вводится реципиенту. Генная терапия in vivo была исследована на нескольких животных моделях. В некоторых последних публикациях сообщалось о возможности прямой передачи генов in situ в органы и ткани, такие как мышца, гематопоэтические стволовые клетки, артериальная стенка, нервная система и легкие. Также сообщалось о прямой инъекции ДНК в скелетную мышцу, сердечную мышцу и инъекции ДНК-липидных комплексов в сосудистую сеть с получением обнаружимого уровня экспрессии введенного генного продукта(ов) in vivo.
Лечение болезней центральной нервной системы, например, наследственных генетических заболеваний мозга, остается трудноразрешимой проблемой. Примерами подобных болезней являются лизосомные болезни накопления и болезнь Альцгеймера. В совокупности, распространенность лизосомных болезней накопления (LSD) составляет 1 на 10000 рождений по всему миру, и в 65% случаев наблюдается значительная вовлеченность в процесс центральной нервной системы (ЦНС). Дефицитные при таких заболеваниях протеины при внутривенной доставке не преодолевают гематоэнцефалический барьер или, при доставке непосредственно в мозг, не распространяются широко. Таким образом, имеется необходимость совершенствования терапии дефицитов ЦНС.
Раскрытие изобретения
Настоящее изобретение предоставляет способ доставки терапевтического средства (например, протеина или нуклеиновой кислоты) в центральную нервную систему млекопитающего, включающий введение в мозжечково-мозговую цистерну млекопитающего rAAV частицы, содержащей AAV капсидный белок и вектор, включающий нуклеиновую кислоту, кодирующую терапевтическое средство, вставленную между парой AAV инвертированных концевых повторов, с целью эффективного инфицирования клеток млекопитающего, контактирующих со спинномозговой жидкостью (CSF), для того, чтобы клетки экспрессировали терапевтическое средство у млекопитающего.
Настоящее изобретение предоставляет способ лечения болезни у млекопитающего, включающий введение в мозжечково-мозговую цистерну млекопитающего rAAV частицы, содержащей AAV капсидный белок и вектор, включающий нуклеиновую кислоту, кодирующую терапевтическое средство (например, терапевтическую нуклеиновую кислоту или нуклеиновую кислоту, кодирующую протеин), вставленную между парой AAV инвертированных концевых повторов, с целью эффективного инфицирования клеток млекопитающего, контактирующих со спинномозговой жидкостью (CSF), для того, чтобы клетки экспрессировали терапевтическое средство для лечения болезни.
В некоторых вариантах осуществления AAV частица является rAAV2 частицей. Использованный в описании термин AAV2/1 подразумевает AAV2 ITR и AAV1 капсид, термин AAV2/2 обозначает AAV2 ITR и AAV2 капсид, термин AAV2/4 обозначает AAV2 ITR и AAV4 капсид и т.д. В некоторых вариантах осуществления AAV частица обозначает rAAV8 частицу. В некоторых вариантах осуществления AAV частица представляет собой rAAV9 частицу. В некоторых вариантах осуществления AAV частица представляет собой rAAVrh10 частицу. В некоторых вариантах осуществления rAAV капсид обладает, по меньшей мере, 80% гомологией с AAV2 капсидным белком VP1, VP2 и/или VP3. В некоторых вариантах осуществления rAAV2 капсид обладает 100% гомологией с AAV2 капсидом VP1, VP2 и/или VP3. В некоторых вариантах осуществления rAAV капсид обладает, по меньшей мере, 80% гомологией с AAV4 капсидным белком VP1, VP2 и/или VP3. В некоторых вариантах осуществления rAAV4 капсид обладает 100% гомологией с AAV4 капсидом VP1, VP2 и/или VP3. В некоторых вариантах осуществления rAAV капсид обладает, по меньшей мере, 80% гомологией с AAV9 капсидным белком VP1, VP2 и/или VP3. В некоторых вариантах осуществления rAAV9 капсид обладает 100% гомологией с AAV9 капсидом VP1, VP2 и/или VP3.
В некоторых вариантах осуществления rAAV частица является rAAV2 частицей, которая инфицирует эпендимные клетки, не являющиеся клетками грызунов, на уровне больше на 20%, чем уровень инфекционности AAV4, например, на уровне больше на 50%,или 100%, 1000% или 2000%, чем уровень инфекционности AAV4.
В некоторых вариантах осуществления клетка экспрессирует терапевтическое средство и секретирует терапевтическое средство в CSF. В некоторых вариантах осуществления клетка является эпендимной клеткой, пиальной (клеткой мягкой мозговой оболочки), эндотелиальной или менингеальной клеткой. Кроме того, в некоторых вариантах осуществления способ дополнительно включает введение rAAV в желудочек мозга приматов, не относящихся к человеческому роду, субарахноидальное пространство и/или интратекальное пространство.
Настоящее изобретение предоставляет способ доставки нуклеиновой кислоты в клетку мозга млекопитающего, включающий введение в клетку мозга AAV частицы, содержащей вектор, включающий нуклеиновую кислоту, вставленную между парой AAV инвертированных концевых повторов, тем самым доставляя нуклеиновую кислоту в клетку мозга. В некоторых вариантах осуществления rAAV представляет собой rAAV2 частицу, которая инфицирует клетку мозга на уровне инфекционности на 20% больше, чем уровень инфекционности AAV4, например, на уровне инфекционности больше, чем на 50% или 100%, 1000% или 2000%, чем уровень инфекционности AAV4.
В некоторых вариантах осуществления болезнь является лизосомной болезнью накопления (LSD). В некоторых вариантах осуществления LSD представляет собой детский или поздний детский цероидный липофусциноз, нейропатию Гоше, юношескую болезнь Баттена, болезнь Фабри, метахроматическую лейкодистрофию MLD, болезнь Санфилиппо А, болезнь Хантера, болезнь Краббе, болезнь Моркио, болезнь Помпе, болезнь Ниманна-Пика тип С, болезнь Тэя-Сакса, болезнь Гурлера (MPS-I Н), болезнь Санфилиппо В, болезнь Марото-Лами, болезнь Ниманна-Пика тип А, цистиноз, болезнь Гурлера-Шейе (MPS-I H/S), мукополисахаридоз (MPS VII), синдром Шейе (MPS-I S), детскую болезнь Баттена, GM1 ганглиозидоз, муколипидоз типа II/III или болезнь Сандхоффа. В некоторых вариантах осуществления болезнь представляет собой поздний младенческий неврональный цероид-липофусциноз (LINCL). В некоторых вариантах осуществления болезнь является нейродегенеративной болезнью, такой как болезнь Альцгеймера, болезнь Хантингтона, боковой амиотрофически склероз (ALS), врожденная спастическая гемиплегия, первичный латеральный склероз, спинальная мышечная атрофия, болезнь Кеннеди, полиглутаминное повторное заболевание или болезнь Паркинсона.
В некоторых вариантах осуществления млекопитающее является млекопитающим, не относящимся к грызунам, таким как примат, лошадь, овца, коза, свинья или собака. В некоторых вариантах осуществления примат является человеком.
В некоторых вариантах осуществления терапевтичекое средство является терапевтической нуклеиновой кислотой. В некоторых вариантах осуществления терапевтичекое средство является белком.
В некоторых вариантах осуществления данная нуклеиновая кислота кодирует лизосомальную гидролазу. В некоторых вариантах осуществления нуклеиновая кислота кодирует ТРР1.
В некоторых вариантах осуществления терапевтический белок является защитной изоформой белка АроЕ. Использованный в описании термин "защитная изоформа АроЕ" применяется для того, чтобы отличить АроЕ изоформы, снижающие риск развития болезни Альцгеймера, по меньшей мере, на 5%, например, на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100% или больше.
В некоторых вариантах осуществления защитная изоформа АроЕ имеет, по меньшей мере, примерно 80% гомологию с АроЕ ε2. В некоторых вариантах осуществления защитная изоформа АроЕ имеет 100% гомологию с АроЕ ε2.
В некоторых вариантах осуществления rAAV частица вводится в 1-3 местоположения в мозге, например в одно, два или три места в мозге.
Краткое описание чертежей
Фигура 1А - выравнивание AAV2 (SEQ ID NO: 1) и AAV4 (SEQ ID NO: 2) белков, и Фигура 1В - выравнивание AAV2 (SEQ ID NO: 3) и AAV4 (SEQ ID NO: 4) нуклеотидов исходя из последовательности AAV2 (NC_001401) и AAV4 (NC_001829).
Фигура 2 предоставляет иллюстрацию "перекрестной коррекции (кросс-коррекции)" между клетками. Sands и Davidson, Mol Ther 13(5):839-849, 2006.
Фигура 3. Сверху: Иммуногистохимическое окрашивание человеческого ТРР1 после опосредованной AAV2 доставки собаке с моделью LINCL, при которой имеется дефицит собачьего ТРР1. Слева, леченая собака. Справа - нелеченое животное с дефицитом. Сравнение резко-положительного окрашивания слева с фоновым окрашиванием на правой панели. Внизу: Вестерн-блоттинг ТРР1, показывающий наличие человеческого ТРР1 у нелеченой собаки с LINCL с дефицитом. И у нормальной собаки и у собаки с дефицитом наблюдается отсутствие полосы, поскольку у них не экспрессируется человеческий ТРР1.
Фигура 4А. Микрофотографии, показывающие характерную автофлуоресценцию, отражающую патологическое накопление липофусцина при неврональном цероид-липофусцинозе. Левая панель, автофлуоресценция у собаки с LINCL, которую лечили AAV2.TPP1. Правая панель, автофлуоресценция у контрольных, нелеченых собак с LINCL. Следует отметить уменьшение автофлуоресценции при использовании терапии.
Фигура 4В. MRI-сканы нелеченых собак с LINCL (верхняя левая), нелеченой нормальной собаки (верхняя правая) и двух собак, леченых AAV.TPP1 (нижние панели). Объемы доставленного вектора показаны на нижней левой панели. Концентрация (титр) вируса составляла приблизительно 1e13 геномов/мл.
Фигура 4С. Объемное восстановление желудочков собак, изображенных на 4В (левые панели). График на правой панели показывает объемы изображений, представленных на левых панелях. Следует отметить экстенсивное уменьшение объема желудочка даже при этих низких дозах вектора (указаны в подписи к фигуре 4В).
Фигура 4D. Иммуногистохимическое окрашивание разных участков мозга показывает широкое распространение белка ТРР1 после AAV.TPP1 переноса гена в желудочковую систему собаки с LINCL. Верхние панели представляют собой фронтальные срезы мозга собаки; вставки внизу справа показывают, где проходит фронтальный срез на продольном срезе. Нижние панели - иммуногистохимически окрашенные срезы, взятые из этих участков. Взятые вместе, результаты показывают широкое распространение фермента.
Фигура 5. Активность фермента huTPP1 в CSF после AAV.TPP1 доставки уменьшается вскоре после переноса вирусного гена. Левая панель: ТРР1 активность в CSF у леченых животных Со и S превышает уровни нормальной активности довольно скоро после AAV.TPP1 переноса гена, и затем быстро снижается до необнаружимых уровней. Животные N, Ро и Pi являются нормальными или гетерозиготными собаками и показаны только для сравнения диапазона уровней ТРР1 активности у клинически нормальных собак.
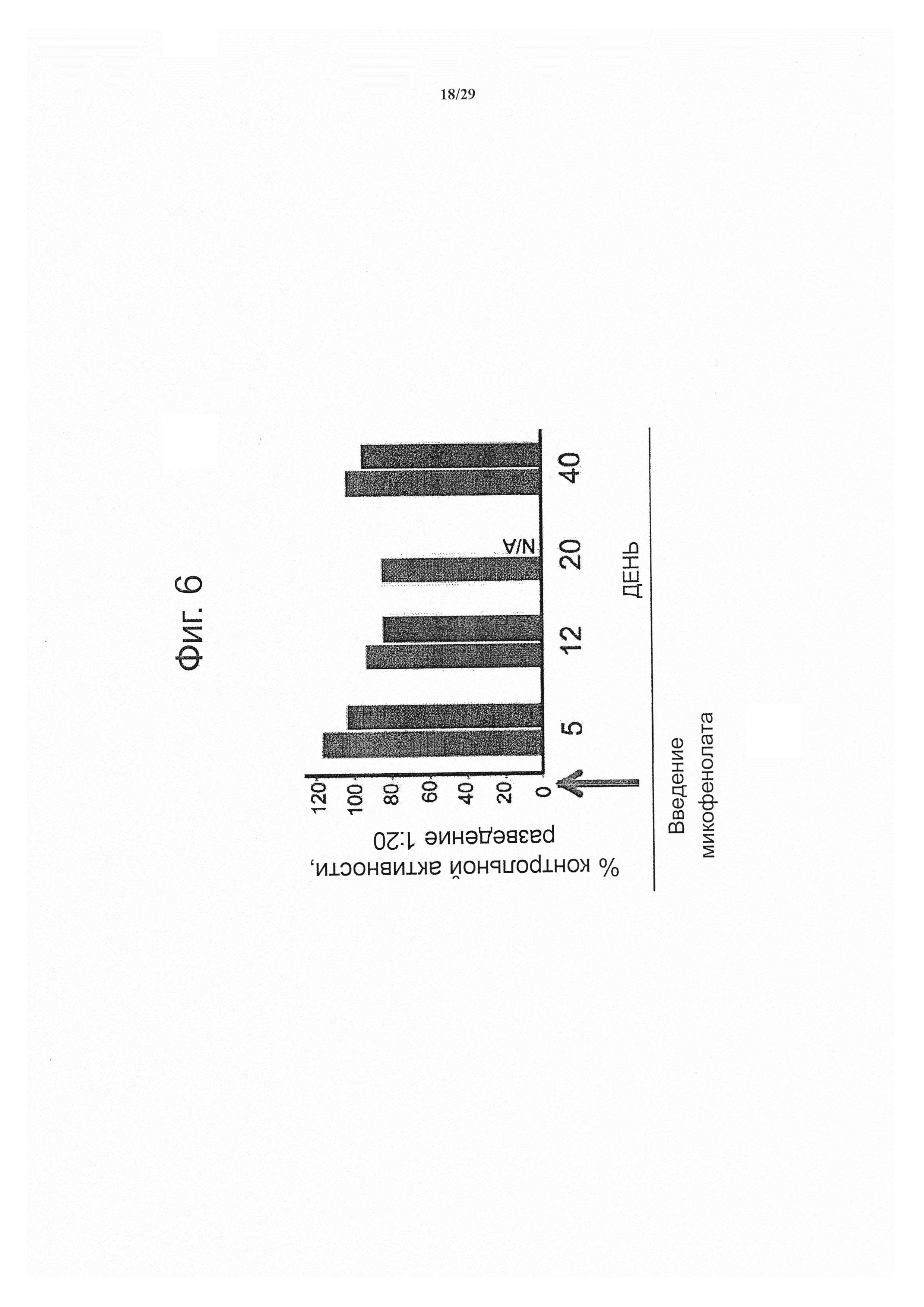
Фигура 6 показывает результаты предварительной обработки микофенолатом для обеспечения длительной активности.
Фигура 7. Введение микофенолата во время уменьшения активности фермента или до переноса гена значительно повышает продолжительность экспрессии ТРР1 у собаки после AAV.TPP1 доставки в эпендиму. Левый и правый верхние графики: Ферментативная активность в зависимости от времени. Также показано время введения микофенолата. Следует отметить высокие и длительные уровни после восстановления от потери экспрессии у животных SR и В и очень высокие устойчивые уровни у животного F. Таким образом, предварительная обработка микофенолатом у животных, не имеющих рекомбинантного белка, помогает обеспечивать устойчивую экспрессию гена в трансфектированных клетках мозга. Нижний график: Увеличение верхнего правого графика с целью показать, что фермент присутствует на уровнях выше исходных уровней и близко к нормальным уровням или выше (0,1-0,4 пмоль/мг).
Фигура 8. Длительная экспрессия фермента в CSF повышает интерстициальные (внутритканевые) уровни фермента. Ферментативная активность в разных участках мозга превышает нормальную.
Фигура 9А и 9В. Иммуногистохимическое окрашивание в разных участках мозга показывает широкое распространение ТРР1 белка после переноса гена AAV.TPP1 в желудочковую систему собаки с LINCL. На рисунке из атласа мозга собаки линией обведены подвергнутые исследованию области, которые также показаны в увеличенном виде. Вместе взятые данные показывают широкое распространение фермента.
Фигура 10. Генная терапия AAV.TPP1 задерживает появление фенотипических проявлений болезни (появление первой красной линии слева в противовес первой синей линии слева) и прогрессирование болезни (расстояние между красными линиями в противовес расстоянию между синими линиями). Продолжительность жизни у некоторых собак увеличивалась почти вдвое, другие все еще остаются под наблюдением.
Фигура 11. На животных с длительной секрецией ТРР1 из эпендимной клетки было продемонстрировано подтверждение ферментативной активности в периферических органах и твердой мозговой оболочке. У двух животных, BG и SR, наблюдалась заметная ферментативная активность в твердой мозговой оболочке, а также в печени.
Фигура 12. Подход, примененный для получения клинического результата у собаки с LINCL, был использован в отношении приматов. Макаки-резус получали внутрижелудочковую инъекцию AAV2.TPP1 (1.5 мл 1е13 векторных геномов (vg)/мл), после чего была измерена ТРР1 активность в стволе мозга (медулла; левый график) и CSF (правый график), спустя 3 месяца после переноса гена. Это нормальные обезьяны с нормальными уровнями ТРР1 активности (отмеченный интервал - Контроль). У всех, кроме одного животного, ферментативная активность превышает активность у нормальных обезьян. Доказательство активности ТРР1 в мозге обезьяны через 3 месяца после переноса гена с использованием иммуногистохимического окрашивания против рекомбинантного человеческого ТРР1, экспрессированного из AAV вектора.
Фигура 13 показывает вестибулярное поле (ствол мозга) у приматов, не относящихся к человеческому роду.
Фигура 14 показывает аминокислотную последовательность человеческого ТРР1.
Фигура 15 показывает последовательность нуклеиновых кислот человеческого ТРР1.
Фигура 16 показывает аминокислотную последовательность ТРР1 Масаса mulatta.
Фигура 17 показывает аминокислотную последовательность ТРР1 Масаса fascicularis.
Осуществление изобретения
Аденоассоциированный вирус (AAV) - это небольшой непатогенный вирус семейства парвовирусов. AAV отличается от других членов этого семейства тем, что его репликация зависит от вируса-помощника. При отсутствии вируса-помощника AAV может интегрироваться локус-специфическим образом в q-плечо хромосомы 19. Геном AAV приблизительно 5 kb состоит из одного сегмента одноцепочечной ДНК с полярностью плюс или минус. Концами генома являются короткие инвертированные концевые повторы, которые могут сворачиваться в шпилечные структуры и служат в качестве начала репликации вирусной ДНК. По конструкции вирион парвовируса не имеет оболочки, и его икосаэдрический капсид составляет приблизительно 20 нм в диаметре.
В настоящее время идентифицированы многочисленные серологически отличные AAV и более дюжины выделены у людей или приматов. Геном AAV2 составляет 4680 нуклеотидов в длину и содержит две открытые рамки считывания (ORF). Левая ORF кодирует неструктурные Rep белки, Rep 40, Rep 52, Rep 68 и Rep 78, которые вовлечены в регуляцию репликации и транскрипции в дополнение к продуцированию одноцепочечных геномов потомства. Кроме того, два из Rep белков связаны с предпочтительной интеграцией AAV геномов в участок q-плеча хромосомы 19 человека. Также показано, что Rep68/78 обладает NTP-связывающей активностью, а также ДНК- и РНК-геликазной активностью. Белки Rep обладают клеточным сигналом внутриядерной Локализации, а также имеют некоторое количество сайтов возможного фосфорилирования. Мутация одного из этих киназных сайтов приводила к потере репликационной активности.
Концами генома являются короткие инвертированные концевые повторы (ITR), обладающие возможностью сворачиваться в Т-образные шпилечные структуры, которые служат в качестве начала ДНК-репликации. В пределах ITR участка описаны два элемента, являющиеся главными для функционирования ITR, повторный мотив GAGC и сайт концевого разрешения (trs). Показано, что повторный мотив связывается с Rep, когда ITR представляет собой линейную или шпилечную конформацию. Это связывание предназначено для положения Rep68/78 для расщепления при trs, которое происходит сайт- и цепь-специфическим образом. В дополнение к их роли в репликации, эти два элемента, по-видимому, являются главными в вирусной интеграции. Содержащийся в хромосоме 19 локус интеграции представляет собой Rep-связывающий сайт вместе с соседним trs. Показано, что эти элементы являются функциональными и необходимы для локус-специфической интеграции.
Вирион AAV является икосаэдрической, не имеющей оболочки частицей, приблизительно 25 нм в диаметре, состоящей из трех родственных белков, называемых VP1, VP2 и VP3. Правая ORF кодирует капсидные белки VP1, VP2 и VP3. Эти белки обнаруживаются в соотношении 1:1:10, соответственно, и все происходят от правой ORF. Капсидные белки отличаются друг от друга использованием альтернативного сплайсинга и необычным инициирующим кодоном. Делеционный анализ показывает, что удаление или изменение VP1, который транслируется из подвергнутого альтернативному сплайсингу транскрипта, приводит к уменьшенному выходу инфекционных частиц. Мутации в области, кодирующей VP3, приводят к неспособности продуцировать какое-либо одноцепочечное потомство ДНК или инфекционные частицы. AAV частица является вирусной частицей, содержащей AAV капсидный белок. AAV капсидный полипептид может кодировать полный VP1, VP2 и VP3 полипептид. Частица может быть частицей, содержащей AAV2 и другие AAV капсидные белки (т.е., химерный белок, такой как AAV4 и AAV2). Изменения в аминокислотной последовательности AAV2 капсидного белка предусматриваются настоящим документом, поскольку полученная в результате вирусная частица, содержащая AAV2 капсид, остается антигенно или иммунологически отличной от AAV4, что можно в рабочем порядке установить с помощью стандартных методов. В частности, например, для установления является ли вирусная частица антигенно или иммунологически отличной от AAV4 могут использоваться ELISA и вестерн-блоттинг. Кроме того, AAV2 вирусная частица предпочтительно сохраняет тропизм к ткани, отличный от AAV4.
Частица AAV2 является вирусной частицей, содержащей AAV2 капсидный белок. AAV2 капсидный полипептид, кодирующий полный VP1, VP2 и VP3 полипептид, может в целом иметь гомологию (или идентичность), по меньшей мере, около 63% с полипептидом, имеющим аминокислотную последовательность, кодированную нуклеотидами, установленными в SEQ ID NO: 1 (AAV2 капсидный белок). Капсидный белок может обладать гомологией, по меньшей мере, около 70%, примерно 75% гомологией, 80% гомологией, 85% гомологией, 90% гомологией, 95% гомологией, 98% гомологией, 99% гомологией, или даже 100% гомологией с белком, установленным в SEQ ID NO: 1. Капсидный белок может обладать идентичностью около 70%, идентичностью около 75%, 80% идентичностью, 85% идентичностью, 90% идентичностью, 95% идентичностью, 98% идентичностью, 99% идентичностью или даже 100% идентичностью с белком, установленным в SEQ ID NO: 1. Частица может быть частицей, содержащей другой AAV и AAV2 капсидный белок, т.е. химерным белком. Изменения в аминокислотной последовательности AAV2 капсидного белка предусматриваются настоящим документом, поскольку полученная в результате вирусная частица, содержащая AAV2 капсид, остается антигенно или иммунологически отличной от AAV4, что можно в рабочем порядке установить с помощью стандартных методов. В частности, например, для установления является ли вирусная частица антигенно или иммунологически отличной от AAV4 могут использоваться ELISA и вестерн-блоттинг. Кроме того, AAV2 вирусная частица предпочтительно сохраняет тропизм к ткани, отличный от AAV4, например, как проиллюстрировано в примерах в данном документе, в то время как AAV2 химерная частица, содержащая, по меньшей мере, один AAV2 белок оболочки, может иметь тропизм к ткани, отличный от тропизма AAV2 частицы, состоящей только из AAV2 белков оболочки.
Как показано на Фигурах 1А и 1В, последовательность AAV2 капсида и последовательность AAV4 капсида являются примерно на 60% гомологичными. В некоторых вариантах осуществления AAV2 капсид содержит последовательность (или состоит из последовательности), которая является гомологичной, по меньшей мере, на 65% с аминокислотной последовательностью, установленной в SEQ ID NO: 1.
В некоторых вариантах осуществления изобретение дополнительно предоставляет AAV2 частицу, содержащую, т.е., инкапсулирующую вектор, содержащий пару AAV2 инвертированных концевых повторов. Нуклеотидная последовательность AAV2 ITRs известна в данной области техники. Кроме того, частица может быть частицей, содержащей и AAV4 и AAV2 капсидный белок, т.е. химерным белком. Более того, частица может быть частицей, инкапсулирующей вектор, содержащий пару AAV инвертированных концевых повторов от других AAV (например, AAV1-AAV9 и AAVrh10). Вектор, инкапсулированный в частицу, может кроме того содержать экзогенную нуклеиновую кислоту, вставленную между инвертированными концевыми повторами.
Следующие характерные черты AAV делают его приемлемым вектором для генного переноса. Показано, что AAV векторы in vitro устойчиво интегрируют в клеточный геном; обладают широким спектром хозяев; подвергают трансдукции и делящиеся и неделящиеся клетки in vitro и in vivo и поддерживают высокие уровни экспрессии трансдуцированных генов. Вирусные частицы являются термически стабильными, устойчивыми к растворителям, детергентам, изменениям рН, температуры, при этом, чтобы их сконцентрировать, используют градиент хлорида цезия CsCl или другие способы. Настоящее изобретение предоставляет способы введения AAV частиц, рекомбинантных AAV векторов и рекомбинантных AAV вирионов. Например, AAV2 частица является вирусной частицей, содержащей AAV2 капсидный белок, или AAV4 частица является вирусной частицей, содержащей AAV4 капсидный белок. Рекомбинантный AAV2 вектор представляет собой нуклеиновокислотный конструкт, содержащий, по меньшей мере, одну уникальную нуклеиновую кислоту AAV2. Рекомбинантный AAV2 вирион представляет собой частицу, содержащую рекомбинантный AAV2 вектор. Для того, чтобы рассматриваться в пределах термина "AAV2 ITRs", нуклеотидная последовательность должна сохранять один или оба признака, описанных в этом документе, которые отличают AAV2 ITR от AAV4 ITR: (1) три (а не четыре, как в AAV4) "GAGC" повтора и (2) в AAV2 ITR Rep сайте связывания четвертый нуклеотид в первых двух "GAGC" повторах представляет собой С, а не Т.
Промотор, предназначенный для управления экспрессией белка, или последовательности, кодирующей другой агент, который должен быть доставлен, может быть любым желаемым промотором, выбранным в соответствии с известными соображениями, такими как уровень экспрессии нуклеиновой кислоты, функционально связанной с промотором, и тип клетки, в которой вектор должен использоваться. Промоторы могут быть экзогенными или эндогенными промоторами. Промоторы могут включать, например, известные активные промоторы, такие как SV40 или индуцибельные промоторы металлотионеина, или AAV промотор, такой как AAV р5 промотор. Дополнительные примеры промоторов включают промоторы, происходящие из генов актина, генов иммуноглобулина, цитомегаловируса (CMV), аденовируса, вируса папилломы крупного рогатого скота, аденовирусных промоторов, таких как основной поздний аденовирусный промотор, индуцибельный промотор теплового шока, промотор респираторно-синцитиального вируса, вируса саркомы рауса (RSV) и т.д.
Вектор AAV может дополнительно содержать экзогенную (гетерологичную) нуклеиновую кислоту, функционально связанную с промотором. "Гетерологичная нуклеиновая кислота" подразумевает, что любая гетерологичная или экзогенная нуклеиновая кислота может быть вставлена в вектор для переноса в клетку, ткань или организм. Нуклеиновая кислота может кодировать полипептид или белок или антисмысловую РНК, например. "Функционально связанный" означает, что промотор может способствовать экспрессии гетерологичной нуклеиновой кислоты, как известно в данной области" техники, например, означает соответствующую ориентацию промотора относительно гетерологичной нуклеиновой кислоты. Кроме того, гетерологичная нуклеиновая кислота предпочтительно имеет все соответствующие последовательности для экспрессии нуклеиновой кислоты, как известно в данной области техники, для того, чтобы функционально кодировать, т.е., обеспечивать экспрессию нуклеиновой кислоты. Нуклеиновая кислота может включать, например, последовательности, контролирующие экспрессию, такие как энхансер, и необходимые сайты обработки информации, такие как сайты связывания рибосом, сайты сплайсинга РНК, сайты полиаденилирования и транскрипционные терминаторные последовательности. Нуклеиновая кислота может кодировать более, чем один генный продукт, ограниченный только размером нуклеиновой кислоты, которая может быть упакована.
Гетерологичная нуклеиновая кислота может кодировать полезные белки, которые заменяют недостающие или дефектные белки, необходимые субъекту, которому перенесен вектор, или может кодировать цитотоксический полипептид, который может нацеливаться, например, на раковые клетки или другие клетки, гибель которых могла бы быть полезна субъекту. Гетерологичная нуклеиновая кислота также может кодировать антисмысловые РНК, которые могут связываться и тем самым инактивировать мРНК, продуцируемые субъектом, которые кодируют вредные белки. В одном варианте осуществления антисмысловые полинуклеотиды могут продуцироваться из гетерологичной экспрессионной кассеты в AAV вирусном конструкте, причем экспрессионная кассета содержит последовательность, которая способствует экспрессии, специфической для данного типа клеткок.
Примеры гетерологичных нуклеиновых кислот, которые могут быть введены в клетку или субъекту, в качестве части настоящего AAV вектора, могут включать, но не ограничиваются этим, нуклеиновые кислоты, кодирующие терапевтические средства, такие как лизосомальные гидролазы; факторы некроза опухолей (TNF), такие как TNF-альфа; интерфероны, такие как интерферон-альфа, интерферон-бета и интерферон-гамма; интерлейкины, такие как IL-1, IL-1бета и интерфероны со 2-ого по 14-ый; GM-CSF; аденозиндезаминаза; секретируемые факторы, такие как факторы роста; ионные каналы; химиотерапевтические средства; лизосомальные белки; антиапоптотические продукты гена; белки, способствующие выживанию нейронов, такие как глутаматные рецепторы и факторы роста; факторы роста клеток, такие как лимфокины; растворимый CD4; фактор VIII; фактор IX; Т-клеточные рецепторы; LDL рецептор; АроЕ; АроС; альфа-1 антитрипсин; орнитинтранскарбамилаза (ОТС); муковисцидозный трансмембранный рецептор (CFTR); инсулин; Fc рецепторы для антигенсвязывающих доменов антител, таких как иммуноглобулины; и антисмысловые последовательности, ингибирующие репликацию вирусов, такие как антисмысловые последовательности, которые ингибируют репликацию вирусов гепатита В или вируса гепатита ни А ни В. Кроме того, нуклеиновая кислота может кодировать более, чем один генный продукт, ограниченный только размером нуклеиновой кислоты, которая может быть упакована.
Частица AAV2 - это вирусная частица, содержащая AAV2 капсидный белок. Изменения в аминокислотной последовательности AAV2 капсидного белка предусматриваются в описании, при условии, что полученная в результате вирусная частица, содержащая AAV2 капсид, остается антигенно или иммунологически отличной от AAV4, что можно определить обычным способом с помощью стандартных методов. В частности, например, ELISA и вестерн-блоттинг могут использоваться для определения, является ли вирусная частица антигенно или иммунологически отличной от других AAV серотипов.
Использованный в описании термин "полипептид" имеет отношение к полимеру, состоящему из аминокислот, и включает полноразмерные белки и их фрагменты. Таким образом, "белок" и "полипептид" часто используются в описании взаимозаменяемым образом. С помощью известных параметров могут быть выбраны нейтральные замены. Специалистам в данной области техники понятно, что изобретение также включает полипептиды, имеющие небольшие изменения в аминокислотных последовательностях или других свойствах. Такие изменения могут возникать в естественных условиях в виде аллельных вариантов (например, вследствие генетического полиморфизма) или могут являться результатом вмешательства человека (например, посредством мутагенеза клонированных последовательностей ДНК), таким как вызванные точковые мутации, делеции, вставки и замены. Особенно предпочтительными являются незначительные изменения в аминокислотной последовательности, такие как консервативные аминокислотные замены, небольшие внутриклональные делеции или вставки, и дополнения или делеции на концах молекул. Эти модификации могут приводить к изменениям в аминокислотной последовательности, обеспечить молчащие мутации, модифицировать сайт рестрикции или обеспечить другие специфические мутации.
Настоящий метод обеспечивает способ доставки нуклеиновой кислоты в клетку, включающий введение в клетку AAV частицы, содержащей вектор, содержащий нуклеиновую кислоту, вставленную между парой AAV инвертированных концевых повторов, тем самым доставляющий нуклеиновую кислоту в клетку. Введение в клетку может осуществляться любыми способами, включая простое контактирование частицы, необязательно содержащейся в необходимой жидкости, такой как среда для культуры ткани, или забуференный физиологический раствор, с клетками. Частица может находиться в контакте с клетками в течение любого желаемого промежутка времени и, как правило, частицу вводят и оставляют на неопределенный срок. Для подобных in vitro методов, вирус может быть введен в клетку с помощью обычных методов трансдукции, известных в данной области техники и приведенных в описании в качестве примеров. Титры (концентрация) вируса, предназначенного для введения, могут варьировать, в частности, в зависимости от типа клеток, но будут типичными титрами, которые используются для AAV трансдукции в целом. В дополнение к этому могут использоваться титры, обычно используемые для трансдукции определенных клеток в настоящих примерах. Клетки могут включать любые желательные клетки людей, а также других крупных (не грызунов) млекопитающих, таких как приматы, лошади, овцы, козы, свиньи и собаки.
Конкретнее, настоящее изобретение предоставляет способ доставки нуклеиновой кислоты в клетку, контактирующую с циркулирующей CSF, такую как эпендимная клетка, пиальная клетка, менингиальная клетка, эндотелиальная клетка мозга, включающий введение в клетку AAV частицы, содержащей вектор, включающий нуклеиновую кислоту, вставленную между парой AAV инвертированных концевых повторов, и таким образом обеспечивающий доставку нуклеиновой кислоты в клетку.
Настоящее изобретение дополнительно предоставляет способ доставки нуклеиновой кислоты в клетку субъекта, включающий введение субъекту AAV частицы, содержащей нуклеиновую кислоту, вставленную между парой AAV инвертированных концевых повторов, таким образом, доставляя нуклеиновую кислоту в клетку субъекта.
Также предоставляется способ доставки нуклеиновой кислоты в эпендимную клетку, пиальную или другую менингеальную клетку у субъекта, включающий введение субъекту AAV частицы, содержащей нуклеиновую кислоту, вставленную между парой AAV инвертированных концевых повторов, таким образом доставляя нуклеиновую кислоту в эпендимную, пиальную или другую менингеальную клетку у субъекта.
В некоторых вариантах осуществления аминокислотная последовательность, которая нацеливается на эндотелий сосудов мозга, нацеливается на эндотелий сосудов мозга у субъекта, имеющего заболевание, например, лизосомную болезнь накопления.
В некоторых вариантах осуществления аминокислотная последовательность, которая нацеливается на эндотелий сосудов мозга, нацеливается на эндотелий сосудов мозга у субъекта, не имеющего лизосомной болезни накопления.
В некоторых вариантах осуществления вирусный вектор содержит нуклеиновокислотную последовательность, кодирующую терапевтическое средство. В некоторых вариантах осуществления терапевтическим средством является ТРР1.
Некоторые варианты осуществления настоящего раскрытия предоставляют клетку, содержащую вирусный вектор, описанный в данном документе.
Некоторые варианты осуществления настоящего раскрытия предоставляют способ лечения болезни у млекопитающего, включающий введение млекопитающему вирусного вектора или клетки, как описано в данном документе.
В некоторых вариантах осуществления млекопитающее является человеком.
В некоторых вариантах осуществления болень является лизосомной болезнью накопления (LSD). В некоторых вариантах осуществления LSD представляет собой детский или поздний детский цероидный липофусциноз, нейропатию Гоше, юношескую болезнь Баттена, болезнь Фабри, метахроматическую лейкодистрофию (MLD), болезнь Санфилиппо А, позднюю детскую болезнь Баттена, болезнь Хантера, болезнь Краббе, болезнь Моркио, болезнь Помпе, болезнь Ниманна-Пика типа С, болезнь Тэя-Сакса, болезнь Гурлера (MPS-I Н), болезнь Санфилиппо В, болезнь Марото-Лами, болезнь Ниманна-Пика типа А, цистиноз, болезнь Гурлера-Шейе (MPS-I H/S), мукополисахаридоз (MPS VII), синдром Шейе (MPS-I S), детскую болезнь Баттена, GM1 ганглиозидоз, муколипидоз типа II/III или болезнь Сандхоффа.
В некоторых вариантах осуществления болезнь является нейродегенеративной болезнью. В некоторых вариантах осуществления нейродегенеративная болезнь представляет собой болезнь Альцгеймера, болезнь Хантингтона, ALS, врожденную спастическую гемиплегию, первичный латеральный склероз, спинальную мышечную атрофию, болезнь Кеннеди, полиглутаминовую повторную болезнь или болезнь Паркинсона.
Некоторые варианты осуществления настоящего раскрытия предоставляют способ доставки средства в центральную нервную систему субъекта, включающий введение в CSF вирусного вектора, описанного в данном документе, в результате чего подвергнутая трансдукции эпендимная клетка, пиальная, эндотелиальная и/или другие менингеальные клетки экспрессируют терапевтическое средство и доставляют средство в центральную нервную систему субъекта. В некоторых вариантах осуществления вирусный вектор трансдуцирует эпендимные, пиальные, эндотелиальные и/или другие менингеальные клетки.
Некоторые варианты осуществления настоящего раскрытия предоставляют вирусный вектор или клетку, как описано в этом документе, для применения в терапевтических способах лечения.
Некоторые варианты осуществления настоящего раскрытия предоставляют применение вирусного вектора или клетки, как описано в этом документе, для приготовления медикамента, пригодного для лечения болезни, например, лизосомной болезни накопления, у млекопитающего.
Вектор может дополнительно содержать лизосомальный фермент (например, лизосомальную гидролазу), секретируемый белок, ядерный белок или цитоплазматический протеин. Использованный в описании термин "секретируемый белок" включает какой-либо секретируемый белок, или секретируемый естественным образом или модифицированный так, чтобы содержать сигнальную последовательность, в результате чего он мог бы секретироваться.
Некоторые варианты осуществления настоящего раскрытия предоставляют использование вирусного вектора или клетки, как описано в этом документе, для приготовления медикамента, пригодного для лечения болезни, например, болезни Альцгеймера, у млекопитающего.
Вектор может дополнительно содержать защитную изоформу АроЕ белка. Использованный в описании термин "секретируемый белок" включает любой секретируемый белок, или секретируемый естественным образом или модифицированный так, чтобы содержать сигнальную последовательность, в результате чего он мог бы секретироваться. Нуклеиновая кислота является "функционально связанной", когда она поставлена в функциональную зависимость от другой нуклеиновокислотной последовательности. В общем, "функционально связанные" означает, что ДНК последовательности, будучи соединенными, являются смежными. Однако, энхансеры не должны быть смежными. Соединение осуществляется путем лигирования в удобных сайтах рестрикции. Если таких сайтов не имеется, используются синтетические олигонуклеотидные адапторы или линкеры в соответствии с обычной практикой. В дополнение к этому, несколько копий нуклеиновой кислоты, кодирующей ферменты, могут быть соединены вместе в экспрессионный вектор. Несколько таких нуклеиновых кислот могут разделяться линкерами.
Настоящее раскрытие также предоставляет клетку млекопитающего, содержащую описанный здесь вектор. Клетка может быть человеческой клеткой и может быть клеткой мозга. Клетка может относиться к популяции стволовых клеток или популяции клеток-предшественников.
Настоящее раскрытие предоставляет способ лечения болезни, такой как генетическое заболевание или рак у млекопитающего путем введения полинуклеотида, полипептида, экспрессионного вектора или клетки, описанной здесь. Генетическая болезнь или рак может быть лизосомной болезнью накопления (LSD), такой как детский или поздний детский цероидный липофусциноз, нейропатия Гоше, юношеская болезнь Баттена, болезнь Фабри, метахроматическая лейкодистрофия (MLD), болезнь Санфилиппо А, поздняя детская болезнь Баттена, болезнь Хантера, болезнь Краббе, болезнь Моркио, болезнь Помпе, болезнь Ниманна-Пика типа С, болезнь Тэя-Сакса, болезнь Гурлера (MPS-I Н), болезнь Санфилиппо В, болезнь Марото-Лами, болезнь Ниманна-Пика типа А, цистиноз, болезнь Гурлера-Шейе (MPS-I H/S), мукополисахаридоз (MPS VII), синдром Шейе (MPS-I S), детская болезнь Баттена, GM1 ганглиозидоз, муколипидоз типа II/III или болезнь Сандхоффа.
Генетическая болезнь может быть нейродегенеративным заболеванием, таким как болезнь Хантингтона, ALS, врожденная спастическая гемиплегия, первичный латеральный склероз, спинальная мышечная атрофия, болезнь Кеннеди, болезнь Альцгеймера, полиглутаминное повторное заболевание или болезнь Паркинсона.
Некоторые аспекты раскрытия относятся к полинуклеотидам, полипептидам, векторам и созданным методами генетической инженерии клеткам (модифицированным in vivo) и их использованию. В частности, раскрытие имеет отношение к способу генотерапии или протеинотерапии, который также дает возможность системной доставки терапевтически эффективной дозы терапевтического средства.
Согласно одному аспекту предоставляется клеточная экспрессирующая система для экспрессии терапевтического средства у млекопитающего-реципиента. Экспрессирующая система (также именуемая в настоящем документе "генетически модифицированная клетка") включает клетку и экспрессионный вектор для экспрессии терапевтического средства. Экспрессионные векторы включают, но не ограничиваются этим, вирусы, плазмиды и другие носители для доставки гетерологичного генетического материала в клетки. Соответственно, термин "экспрессионный вектор" при использовании в описании относится к носителю, предназначенному для доставки гетерологичного генетического материала в клетку. В частности, экспрессионный вектор является рекомбинантным аденовирусным вектором, вектором аденоассоциированного вируса или лентивирусным или ретровирусным вектором.
Кроме того, экспрессионный вектор содержит промотор для управления транскрипцией гетерологичного гена. Промотор может быть индуцибельным промотором (описанным ниже). Экспрессирующая система подходит для введения млекопитающему-реципиенту. Экспрессирующая система может содержать множество неиммортализованных генетически модифицированных клеток, при этом каждая клетка содержит, по меньшей мере, один рекомбинантный ген, кодирующий, по меньшей мере, одно терапевтическое средство.
Клеточная экспрессирующая система формируется in vivo. Согласно еще одному аспекту предоставляется способ лечения млекопитающего-реципиента in vivo. Способ включает введение экспрессионного вектора для экспрессии гетерологичного продукта гена в клетку пациента in situ, например, посредством внутривенного введения. Для формирования экспрессионной системы in vivo, экспрессионный вектор для экспрессии терапевтического средства вводится внутривенно (i.v.) млекопитающему-реципиенту in vivo, в тех случаях, когда вектор перемещается по сосудистой сети в мозг.
Согласно еще одному аспекту предоставляется способ лечения млекопитающего-реципиента in vivo. Способ включает введение целевого белка пациенту in vivo.
Экспрессионный вектор для экспрессии гетерологичного гена может включать индуцибельный промотор для управления транскрипцией продукта гетерологичного гена. Соответственно, доставка терапевтического средства in situ находится под управлением условий, воздействию которых подвергается клетка, и которые вызывают транскрипцию гетерологичного гена.
Млекопитающее-реципиент может иметь состояние, которое поддается воздействию генной заместительной терапии. При использовании в описании "генная заместительная терапия" относится к введению реципиенту экзогенного генетического материала, кодирующего терапевтическое средство, и последующей экспрессии введенного генетического материала in situ. Таким образом, "состояние, которое поддается воздействию генной заместительной терапии," включает такие состояния, как генетические болезни (т.е., болезненное состояние, которое вызвано одним или более дефектами генов), приобретенные патологии (т.е., патологическое состояние, которое не вызвано врожденным дефектом), злокачественные заболевания и профилактические процессы (т.е. предотвращение болезни илии нежелательного медицинского состояния). Соответственно, при использовании в описании термин "терапевтическое средство" относится к какому-либо агенту или материалу, оказывающему благоприятное воздействие на млекопитающего-реципиента. Таким образом, "терапевтическое средство" включает и терапевтические и профилактические молекулы, имеющие нуклеиновую кислоту или белковые компоненты.
Согласно одному варианту осуществления млекопитающее-реципиент имеет генетическое заболевание, а экзогенный генетический материал содержит гетерологичный ген, кодирующий терапевтическое средство, предназначенное для лечения болезни. В еще одном варианте осуществления млекопитающее-реципиент имеет приобретенную патологию, а экзогенный генетический материал содержит гетерологичный ген, кодирующий терапевтическое средство, предназначенное для лечения патологии. Согласно другому варианту осуществления пациент имеет онкологическое заболевание, а экзогенный генетический материал содержит гетерологичный ген, кодирующий противоопухолевое средство. В еще одном варианте осуществления у пациента наблюдается нежелательное медицинское состояние, а экзогенный генетический материал содержит гетерологичный ген, кодирующий терапевтическое средство, предназначенное для лечения данного состояния.
Использованные в описании термины "защитная изоформа АроЕ," "лизосомальный фермент," "секретируемый белок," "ядерный белок" или "цитоплазматический белок" включает варианты или биологически активные или неактивные фрагменты этих полипептидов. "Вариантом" одного из полипептидов является полипептид, который является не совсем идентичным нативному белку. Такой вариант белка может быть получен в результате изменения аминокислотной последовательности путем вставки, делеции или замены одной или более аминокислот. Аминокислотная последовательность белка может быть модифицирована, например, заменой, с целью создания полипептида, имеющего практически такие же или улучшенные свойства по сравнению с нативным полипептидом. Замена может быть консервативной заменой. "Консервативная замена" - это замена аминокислоты другой аминокислотой, имеющей сходную боковую цепь. Консервативной заменой может быть замена аминокислотой, которая приводит к минимальному изменению заряда аминокислоты или размера боковой цепи аминокислоты (альтернативно, размера, заряда или характера химической группы в пределах боковой цепи), вследствие чего целый пептид сохраняет свою пространственную конформацию, но обладает измененной биологической активностью. Например, обычными консервативными заменами являются замены Asp на Glu, Asn или Gln; His на Lys, Arg или Phe; Asn на Gln, Asp или Glu и Ser на Cys, Thr или Gly. Для замены других аминокислот обычно используется аланин. 20 основных аминокислот могут быть сгруппированы следующим образом: аланин, валин, лейцин, изолейцин пролин, фенилаланин, триптофан и метионин - имеют неполярные боковые цепи; глицин, серии, треонин, цистин, тирозин, аспарагин и глутамин - имеют незаряженные полярные боковые цепи; аспартат и глутамат - имеют кислые боковые цепи; и лизин, аргинин и гистидин - имеют основные боковые цепи.
Замены аминокислот достигаются путем изменения кодонов соответствующей последовательности нуклеиновых кислот. Известно, что такие полипептиды можно получить, основываясь на замене некоторых аминокислот другими аминокислотами в структуре полипептида, для того, чтобы модифицировать или улучшить биологическую активность. Например, путем замены альтернативных аминокислот можно получить небольшие конформационные изменения полипетида, что приведет в результате к повышенной активности. Альтернативно, замены аминокислот в некоторых полипептидах могут использоваться для получения остатков, которые затем могут связываться с другими молекулами с целью получения конъюгатов пептида с молекулой, которые сохраняют соответствующие свойства исходного полипептида, использующиеся для других целей.
Можно использовать индекс гидрофобности аминокислот при наделении полипептида интерактивной биологической функцией, при этом обнаружено, что некоторые аминокислоты могут заменять другие аминокислоты, имеющие сходные индексы гидрофобности, и по-прежнему сохранять сходную биологическую активность. Альтернативно, замена подобных аминокислот может быть сделана, исходя из гидрофильности, в частности, когда биологическую функцию, которую нужно придать полипептиду, предполагается использовать в иммунологических вариантах осуществления. Наибольшая локальная средняя гидрофильность "белка", в силу того, что она определяется гидрофильностью смежных с ним аминокислот, коррелирует с его иммуногенностью. Соответственно, следует отметить, что замены могут быть сделаны исходя из гидрофильности, определенной для каждой аминокислоты.
При использовании индекса гидрофильности или индекса гидрофобности, который определяет значения для каждой аминокислоты, предпочтительно проводить замены аминокислот, когда эти значения составляют ±2, причем ±1 являются особенно предпочтительными, а ±0,5 являются наиболее предпочтительными заменами.
Вариант белка имеет, по меньшей мере, 50%, по меньшей мере, примерно 80%, или даже, по меньшей мере, примерно 90%, но менее чем 100%, гомологию или идентичность последовательности смежных аминокислот с аминокислотной последовательностью соответствующего нативного белка.
Аминокислотная последовательность варианта полипептида в основном соответствует нативной последовательности аминокислот полипептида. При использовании в описании "в основном соответствует" относится к последовательности полипептида, который будет вызывать биологический ответ, практически такой же, как ответ, вызываемый нативным белком. Такой ответ может составлять, по меньшей мере, 60% от уровня ответа, вызываемого нативным белком, и даже может составлять, по меньшей мере, 80% от уровня ответа, вызываемого нативным белком.
Вариант может содержать аминокислотные остатки, не присутствующие в нативном белке, или делеции относительно соответствующего нативного белка. Вариант также может быть укороченным "фрагментом" по сравнению с соответствующим нативным белком, т.е., только частью полноразмерного белка. Варианты белка также включают пептиды, имеющие, по меньшей мере, одну D-аминокислоту.
Вариант белка может экспрессироваться из изолированной последовательности ДНК, кодирующей вариант белка. "Рекомбинантный" - это пептид или нуклеиновая кислота, созданная с помощью генно-инженерных методов. Следует отметить, что в данной области техники хорошо известно, что, вследствие избыточности генетического кода, отдельные нуклеотиды в кодоне могут быть легко заменены, при этом в результате будет получена все-таки идентичная аминокислотная последовательность.
Настоящее раскрытие предоставляет способы лечения болезни у млекопитающего путем введения экспрессионного вектора в клетку или пациенту. Что касается методов генной терапии, средний специалист в области молекулярной биологии и генотерапии способен определить, не проводя лишних экспериментов, подходящие дозировки и способы введения экспрессионного вектора, используемого в новых способах настоящего раскрытия.
Согласно одному варианту осуществления клетки трансформируются или иным способом генетически модифицируются in vivo. Клетки млекопитающего-реципиента претерпевают трансформацию (т.е., подвергаются трансдукции или трансфекции) in vivo вектором, содержащим экзогенный генетический материал, предназначенный для экспрессирования гетерологичного (например, рекомбинантного) гена, кодирующего терапевтическое средство, причем терапевтическое средство доставляется in situ.
При использовании в описании "экзогенный генетический материал" имеет отношение к нуклеиновой кислоте или олигонуклеотиду, природному или синтетическому, который в естественных условиях не обнаруживается в клетках; или если он в естественных условиях обнаруживается в клетках, тогда он не транскрибируется или не экспрессируется клетками в биологически значимом количестве. Таким образом, "экзогенный генетический материал" включает, например, нуклеиновую кислоту неприродного происхождения, которая может транскрибироваться в антисмысловую РНК, а также "гетерологичный ген" (т.е., ген, кодирующий белок, который не экспрессируется или экспрессируется на биологически несущественных уровнях в клетке природного происхождения того же самого типа).
В некоторых вариантах осуществления у млекопитающего-реципиента имеется состояние, поддающееся генной заместительной терапии. При использовании в описании "генная заместительная терапия" относится к введению реципиенту экзогенного генетического материала, кодирующего терапевтическое средство, и последующей экспрессии введенного генетического материала in situ. Таким образом, "состояние, поддающееся генной заместительной терапии" включает такие состояния, как генетические заболевания (т.е., болезненное состояние, которое вызвано одним или более дефектами генов), приобретенные патологии (т.е., патологическое состояние, которое не вызвано врожденным дефектом), злокачественные заболевания и профилактические процессы (т.е., предотвращение болезни или нежелательного медицинского состояния). Соответственно, использований в описании термин "терапевтическое средство" относится к средству или материалу, который оказывает благоприятное воздействие на млекопитающего-реципиента. Таким образом, "терапевтическое средство" включает как терапевтические, так и профилактические молекулы, имеющие в составе нуклеиновую кислоту (например, антисмысловую РНК) и/или белковые компоненты.
Альтернативно, состояние, поддающееся генной заместительной терапии, может иметь отношение к профилактическому процессу, т.е., процессу, связанному с предотвращением болезни или нежелательного медицинского состояния. Таким образом, текущее раскрытие включает применение экспрессирующей системы клетки для доставки терапевтического средства, обладающего профилактическим действием (т.е., профилактического средства) млекопитающему-реципиенту.
В итоге, термин "терапевтическое средство" включает, но не ограничивается этим, средства, связанные с перечисленными выше состояниями, а также их функциональными эквивалентами. Использований в описании термин "функциональный эквивалент" относится к молекуле (например, пептиду или белку), которая оказывает такое же или улучшенное благоприятное воздействие на млекопитающее-реципиента как терапевтическое средство, функциональным эквивалентом которого считается данная молекула.
Раскрытые выше терапевтические средства и состояния, поддающиеся генной заместительной терапии, имеют чисто иллюстративный характер и не предназначаются для ограничения рамок текущего раскрытия. Считается, что выбор подходящего терапевтического средства для лечения известного состояния находится в рамках компетенции специалиста в данной области техники и не требует чрезмерного экспериментирования.
AAV векторы
В одном варианте осуществления вирусный вектор раскрытия является AAV вектором. Вектор "AAV" имеет отношение к аденоассоциированному вирусу и может использоваться в отношении собственно существующего в природе вируса дикого типа или его производных. Термин охватывает все подтипы, серотипы и псевдотипы, как природные, так и рекомбинантные формы, за исключением случаев, когда требуется иное. Использованный в описании термин "серотип" имеет отношение к AAV, который определяется и отличается от других AAV на основании реакционной способности капсидного белка с определенной антисывороткой, например, существует восемь известных серотипов AAV приматов: с AAV-1 по AAV-9 и AAVrh10. Например, серотип AAV2 используется в отношении AAV, который содержит капсидные белки, кодированные геном «кэпа» AAV2, и геном, содержащий 5' и 3' ITR последовательности из того же самого AAV2 серотипа. Например, в данном описании rAAV1 может использоваться в отношении AAV, имеющего и капсидные белки и 5'-3' ITRs от одного и того же серотипа, или он может относиться к AAV, имеющему капсидные белки от одного серотипа и 5'-3' ITRs от другого AAV серотипа, например, капсид от AAV серотипа 2 и ITRs от AAV серотипа 5. Для каждого примера, проиллюстрированного в документе, при описании строения и получения вектора описывается серотип капсида и 5'-3' ITR последовательностей. Аббревиатура "rAAV" относится к рекомбинантному аденоассоциированному вирусу, также называемому рекомбинантным AAV вектором (или "rAAV вектором").
"AAV вирус" или "AAV вирусная частица" относится к вирусной частице, состоящей, по меньшей мере, из одного AAV капсидного белка (предпочтительно, все капсидные белки AAV дикого типа) и инкапсулированного полинуклеотида. Если частица содержит гетерологичный полинуклеотид (т.е., полинуклеотид, отличающийся от генома AAV дикого типа, такой как трансген, предназначенный для доставки в клетку млекопитающего), как правило, она называется "rAAV".
В одном варианте осуществления AAV экспрессионные векторы создаются с помощью известных методов, чтобы, по меньшей мере, обеспечить функционально связанные компоненты в направлении транскрипции, контролирующие элементы, включая участок инициации транскрипции, интересующую ДНК и участок терминации транскрипции. Контролирующие элементы выбирают так, чтобы они были функциональными в клетках млекопитающего. Полученный в рузультате конструкт, содержащий функционально связанные компоненты, фланкируют (5' и 3') функциональными AAV ITR последовательностями.
Под "инвертированными концевыми повторами аденоассоциированного вируса" или "AAV ITR" имеются в виду принятые в данной области участки, обнаруженные на каждом конце AAV генома, которые функционируют вместе в цис как точки начала ДНК репликации и как сигналы упаковки для вируса. AAV ITR, вместе с AAV rep кодирующим участком, обеспечивают эффективное «вырезание» и освобождение, и интеграцию нуклеотидной последовательности, размещенной между двумя фланкирующими ITR в геноме клетки млекопитающего.
Последовательности нуклеотидов AAV ITR участков известны. При использовании в описании "AAV ITR" необязательно имеет представленную нуклеотидную последовательность дикого типа, но может быть изменен, например, путем вставки, делеции или замены нуклеотидов. В дополнение к этому, AAV ITR может происходить из любого из нескольких AAV серотипов, включая, без ограничения, AAV1, AAV2, AAV3, AAV4, AAV5, AAV7 и т.д. Кроме того, 5' и 3' ITRs, которые фланкируют выбранную нуклеотидную последовательность в AAV векторе, необязательно являются идентичными или происходят от одного и того же AAV серотипа или изолята, при условии, что они функционируют как предназначено, т.е., создается возможность для «вырезания» и освобождения представляющей интерес последовательности от генома клетки-хозяина или вектора, и создается возможность интеграции гетерологичной последовательности в геном клетки-реципиента, когда AAV Rep продукты гена присутствуют в клетке.
В одном варианте осуществления AAV ITRs могут происходить из любого из нескольких AAV серотипов, включая, без ограничения, AAV1, AAV2, AAV3, AAV4, AAV5, AAV7 и т.д. Кроме того, 5' и 3' ITR, которые фланкируют выбранную нуклеотидную последовательность в AAV экспрессионном векторе, необязательно являются идентичными или происходят от одного и того же AAV серотипа или изолята, при условии, что они функционируют как предназначено, т.е. создается возможность для «вырезания» и освобождения представляющей интерес последовательности от генома клетки-хозяина или вектора, и создается возможность интеграции гетерологичной последовательности в геном клетки-реципиента, когда AAV Rep продукты гена присутствуют в клетке.
В одном варианте осуществления AAV капсиды могут происходить от AAV2. Подходящие для использования в AAV векторах ДНК молекулы содержат примерно менее, чем 5 тысяч пар нуклеотидов (kb), примерно менее, чем 4,5 kb, примерно менее, чем 4 kb, примерно менее, чем 3.5 kb, примерно менее, чем 3 kb, примерно менее, чем 2,5 kb и известны в данной области техники.
В одном варианте осуществления выбранная нуклеотидная последовательность является функционально связанной с контролирующими элементами, которые управляют ее транскрипцией или экспрессией у субъекта in vivo. Такие контролирующие элементы могут содержать контролирующие последовательности, обычно связанные с выбранным геном. Альтернативно, могут использоваться гетерологичные контролирующие последовательности. Подходящие гетерологичные контролирующие последовательности обычно включают последовательности, происходящие от последовательностей, кодирующих гены млекопитающих или вирусные гены. Примеры включают, но не ограничиваются этим, ранний промотор SV40, промотор вируса опухоли молочной железы мышей LTR; основной поздний промотор аденовируса (Ad MLP); промотор вируса простого герпеса (HSV), промотор цитомегаловируса (CMV), такой как CMV предранняя промоторная область (CMVIE), промотор вируса саркомы Рауса (RSV), pol II промоторы, pol III промоторы, синтетические промоторы, гибридные промоторы и тому подобные. В дополнение к этому, последовательности, происходящие от невирусных генов, таких как мышиный ген металлотионеина, также найдут применение в данном изобретении. Такие промоторные последовательности коммерчески доступны, например, от компании Stratagene (San Diego, Calif.).
В одном варианте осуществления находят себе применение и гетерологичные промоторы и другие контролирующие элементы, такие как CNS-специфические и индуцибельные промоторы, энхансеры и тому подобное. Примеры гетерологичных промоторов включают CMV промотор. Примеры ЦНС-специфических промоторов включают промоторы, выделенные из генов основного миелинового белка (МВР), глиального фибриллярного кислого белка (GFAP) и нейрон-специфической энолазы (NSE). Примеры индуцибельных промоторов включают элементы ДНК, реагирующие на экдизон, тетрациклин, гипоксию и ауфин.
В одном варианте осуществления AAV экспрессионный вектор, который содержит представляющую интерес молекулу ДНК, связанную AAV ITRs, может быть создан непосредственно путем вставки выбранной последовательности(ей) в AAV геном, который имеет основные AAV открытые рамки считывания ("ORF"), вырезанные оттуда. Другие участки AAV генома также могут быть удалены, при условии, что достаточная часть ITR сохраняется для обеспечения функций репликации и упаковывания. Такие конструкты могут быть созданы с помощью известных в данной области техники методов.
Альтернативно, AAV ITRs могут быть вырезаны из вирусного генома или из AAV вектора, содержащего то же самое, и соединены с 5' и 3' выбранного нуклеиновокислотного конструкта, который присутствует в другом векторе, используя стандартные методы лигирования. Например, лигирование может осуществляться в 20 мМ Tris-Cl рН 7,5, 10 мМ MgCl2, 10 мМ DTT, 33 мкг/мл BSA, 10 мМ-50 мМ NaCl, и либо 40 мкМ АТР, 0,01-0,02 (Weiss) единиц Т4 ДНК лигазы при 0°С (для лигирования по "липким концам") либо 1 мМ АТР, 0,3-0,6 (Weiss) единиц Т4 ДНК лигазы при 14°С (для лигирования по "липким концам"). Межмолекулярное лигирование по "липким концам" обычно осуществляется при концентрациях 30-100 мкг/мл общей ДНК (5-100 нМ общая конечная концентрация). AAV - векторы, которые содержат ITR.
В дополнение к этому, химерные гены могут быть получены синтетическим способом так, чтобы они включали AAV ITR последовательности, расположенные в порядке 5' и 3' одной или более выбранных последовательностей нуклеиновых кислот. Для экспрессии последовательности химерного гена в клетках ЦНС млекопитающего могут использоваться предпочтительные кодоны. Полная химерная последовательность собирается из перекрывающихся олигонуклеотидов, полученных с помощью стандартных методов.
Для получения rAAV вирионов экспрессионный вектор AAV вводится в подходящую клетку-хозяина с помощью известных методов, например, трансфекции. В данной области техники известен целый ряд методов трансфекции. Смотри, например, Sambrook et al. (1989) Molecular Cloning, a laboratory manual, Cold Spring Harbor Laboratories, New York. В частности, подходящие методы траснфекции включают соосаждение фосфатом кальция; прямую микроинъекцию в культивируемые клетки; электропорацию; опосредованный липосомами перенос гена, трансдукцию, опосредованную липидами, и доставку нуклеиновой кислоты с помощью высокоскоростной бомбардировки микрочастицами.
В одном варианте осуществления подходящая клетка-хозяин для продуцирования вирионов rAAV включает микроорганизмы, дрожжевые клетки, клетки насекомых и клетки млекопитающих, которые могут использоваться в качестве реципиентов геторологичной ДНК молекулы. Термин включает потомство первоначальной клетки, которая была трансфектирована. Таким образом, "клетка-хозяин" при использовании в описании в основном относится к клетке, которая не была трансфектирована экзогенной последовательностью ДНК. При применении на практике настоящего открытия можно использовать клетки устойчивой линии человека 293, (доступные, например, из Американской коллекции типовых культур под порядковым номером АТСС CRL1573), В частности, линия клеток человека 293 - это линия человеческих эмбриональных клеток почки, которые были трансформированы фрагментами ДНК аденовируса типа 5 и экспрессируют аденовирусные гены Е1а и E1b. Линия клеток 293 легко поддается трансфекции и обеспечивает в частности удобную платформу для продуцирования rAAV вирионов.
Под "AAV rep кодирующей областью" подразумевается принятый в данной области участок AAV-генома, кодирующий белки репликации Rep 78, Rep 68, Rep 52 и Rep 40. Показано, что эти Rep продукты экспрессии обладают множеством функций, включая узнавание, связывание и внесение разрыва (никование) AAV начала ДНК репликации, активность ДНК-геликазы и модулирование транскрипции с AAV (или других гетерологичных) промоторов. Продукты Rep экспрессии все вместе необходимы для репликации AAV генома. Подходящие гомологи AAV rep кодирующей области включают rep ген человеческого вируса герпеса 6 (HHV-6), о котором также известно, что он опосредует AAV-2 ДНК репликацию.
Под "AAV cap кодирующей областью" подразумевается принятый в данной области участок AAV-генома, кодирующий капсидные белки VP1, VP2 и VP3, или их функциональные гомологи. Эти Сар продукты экспрессии обеспечивают функции упаковывания, которые все вместе требуются для упаковки вирусного генома.
В одном варианте осуществления AAV хелперные функции привносятся в клетку-хозяина путем трансфекции клетки-хозяина AAV хелперным конструктом или до или одновременно с трансфекцией AAV экспрессионного вектора. AAV хелперные конструкты используются для обеспечения, по меньшей мере, временной экспрессии AAV rep и/или cap генов для дополнения недостающих AAV функций, необходимых для продуктивной инфекции AAV. AAV хелперные конструкты не имеют AAV ITR и сами не могут ни воспроизводиться, ни упаковываться. Эти конструкты могут быть в форме плазмиды, фага, транспозона, космиды, вируса или вириона. Описан целый ряд AAV хелперных конструктов, такие как обычно используемые плазмиды pAAV/Ad и pIM29+45, кодирующие продукты экспрессии и Rep и Сар. Описан целый ряд других векторов, которые кодируют продукты экспрессии Rep и/или Сар.
Способы доставки вирусных векторов включают введение инъекционным путем AAV2 в CSF. В общем, rAAV вирионы могут быть введены в ЦНС при помощи методов трансдукции in vivo или in vitro. При проведении трансдукции in vitro желательная клетка-реципиент извлекается из субъекта, трансдуцируется rAAV вирионами и возвращается субъекту. Альтернативно, могут использоваться сингенные или ксеногенные клетки, в тех случаях, когда такие клетки не генерируют несоответствующий иммунный ответ у субъекта.
Подходящие методы доставки и введения субъекту клеток, подвергнутых трансдукции, описаны. Например, клетки могут быть трансдуцированы in vitro путем объединения рекомбинантных AAV вирионов с клетками ЦНС, например, в подходящей среде, а скрининг клеток, содержащих представляющую интерес ДНК, может быть проведен при помощи общеизвестных методов, таких как саузерн-блоттинг и/или ПЦР, или с использованием селективных маркеров. Затем, трансдуцированные клетки могут быть включены в состав фармацевтических композиций, описанных ниже более подробно, и такая композиция вводится субъекту с помощью различных методов, например, с помощью трансплантации, внутримышечной, внутривенной, подкожной и внутрибрюшинной инъекции.
В одном варианте осуществления фармацевтические композиции содержат соответствующий генетический материал для продуцирования терапевтически эффективного количества интересующей нуклеиновой кислоты, т.е., количества, достаточного для уменьшения или облегчения симптомов рассматриваемого болезненного состояния или количества, достаточного для обеспечения желаемого эффекта. Фармацевтические композиции также содержат фармацевтически приемлемый эксципиент. Такой эксципиент включает любое фармацевтическое средство, которое как таковое не вызывает продуцирования антител, вредных для индивидуума, получившего композицию, и введение которого не вызывает неспецифическую токсичность. Фармацевтически приемлемые эксципиенты включают, но не ограничиваются этим, сорбитол, Твин 80 и такие жидкости как вода, физиологический раствор, глицерин и этанол. В состав могут входить фармацевтически приемлемые соли, например, соли неорганических кислот, такие как гидрохлориды, гидробромиды, фосфаты, сульфаты и тому подобное; и соли органических кислот, такие как ацетаты, пропионаты, малонаты, бензоаты и тому подобное. Кроме того, в несущих средах могут присутствовать вспомогательные вещества, такие как увлажняющие или эмульгирующие вещества, буферные вещества для регулирования рН и тому подобное. Всестороннее обсуждение фармацевтически приемлемых эксципиентов доступно в Remington's Pharmaceutical Sciences (Mack Pub. Co., N.J. 1991).
Должно быть понятно, что более чем один трансген может экспрессироваться при посредстве доставленного вирусного вектора. Альтернативно, отдельные векторы, каждый из которых экспрессирует один или более различных трансгенов, также могут доставляться в ЦНС, как описано в данном документе. Более того, также предполагается, что вирусные векторы, доставленные способами настоящего раскрытия, могут сочетаться с другими подходящими композициями и способами лечения.
Как ясно специалистам в данной области техники, принимая во внимание идеи этого подробного описания, эффективное количество вирусного вектора, которое должно добавляться, может быть определено эмпирически. Введение может осуществляться в виде одной дозы, в течение длительного времени или периодически на всем протяжении курса лечения. Методы определения наиболее эффективных дозировок и способов введения хорошо известны специалистам в данной области техники и изменяются в зависимости от вирусного вектора, состава лечения, клеток-мишеней, субъекта, подвергающегося лечению. Может осуществляться однократное введение или многократные введения, при этом величину дозы и схему дозирования выбирает лечащий врач.
В некоторых вариантах осуществления rAAV вводится в дозе примерно 1-5 мл при концентрации 1×105 - 1×1016vg/мл. В некоторых вариантах осуществления rAAV вводится в дозе примерно 1-3 мл при концентрации 1×107 - 1×1014vg/мл. В некоторых вариантах осуществления rAAV вводится в дозе примерно 1-2 мл при концентрации 1×108 - 1×1013vg/мл.
Композиции, включающие rAAV частицы, должны содержать эффективное количество rAAV частиц в носителе, причем эффективное количество может быть легко определено специалистом в данной области техники. В большинстве случаев rAAV частицы могут составлять примерно от 1% до 95% (вес/вес) композиции, или даже больше или меньше при необходимости. Количество, предназначенное для введения, будет зависеть от таких факторов, как возраст, вес и физическое состояние животного или человека, которого необходимо лечить. Эффективные дозировки могут быть установлены средним специалистом в данной области техники путем проведения обычных испытаний и построения кривых доза-эффект. Субъект подвергается лечению путем введения rAAV частиц в виде одной или более доз. Могут вводиться многократные дозы в силу того, что требуется поддерживать достаточную ферментативную активность.
Носители (основы) включают воду, водный физиологический раствор, искусственную спинномозговую жидкость, и кроме того, могут использоваться другие известные вещества в сочетании с субъектом изобретения. Для приготовления лекарственной формы очищенную композицию можно выделить, лиофилизировать и стабилизировать. Затем композиция может быть отрегулирована до подходящей концентрации, необязательно в сочетании с противовоспалительным средством, и упакована для использования.
ТРР1 белок
В некоторых вариантах осуществления вводимая нуклеиновая кислота кодирует ТРР1 (ТРР1 имеет значительную идентичность с ТРР1 дикого типа) и/или вариант, мутант или фрагмент ТРР1. Аминокислотная последовательность ТРР1 человека показана на фигуре 14, а последовательность нуклеиновых кислот предоставлена на фигуре 15. Фигура 16 показывает аминокислотную последовательность ТРР1 Масаса mulatta, и фигура 17 показывает аминокислотную последовательность ТРР1 Масаса fascicularis. В некоторых вариантах осуществления ТРР1 белок может иметь примерно 70% гомологию, примерно 75% гомологию, 80% гомологию, 85% гомологию, 90% гомологию, 95% гомологию, 98% гомологию, 99% гомологию или даже 100% гомологию с белком, представленным на фигурах 14, 16 или 17. ТРР1 белок может иметь примерно 70% идентичность, примерно 75% идентичность, 80% идентичность, 85% идентичность, 90% идентичность, 95% идентичность, 98% идентичность, 99% идентичность или даже 100% идентичность с белком, представленным на фигурах 14, 16 или 17.
Мутантный белок имеет отношение к белку, который кодирует ген, имеющицй мутацию, например, бессмысленную или нонсенс-мутацию в ТРР1. Термин "нуклеиновая кислота" имеет отношение к дезоксирибонуклеотидам или рибонуклеотидам и их полимерам или в одноцепочечной или двухцепочечной форме, состоящей из мономеров (нуклеотидов), содержащих сахар, фосфат и основание, пуриновое или пиримидиновое. Кроме специально ограниченных случаев, термин включает нуклеиновые кислоты, содержащие известные аналоги природных нуклеотидов, которые обладают сходными способностями к связыванию, как эталонная нуклеиновая кислота, и метаболизируются способом, сходным с нуклеотидами природного происхождения. Если не указано иное, определенная нуклеотидная последовательность включает ее консервативно модифицированные варианты (например, замены вырожденного кодона) и комплементарные последовательности, а также точно указанную последовательность. В частности, замены вырожденного кодона могут достигаться путем получения последовательностей, в которых третье положение одного или более выбранных (или всех) кодонов замещено смешанными основаниями и/или остатками дезоксиинозина.
"Фрагмент нуклеиновой кислоты" представляет собой часть молекулы нуклеиновой кислоты. Дезоксирибонуклеиновая кислота (ДНК) в большинстве организмов является генетическим материалом, тогда как рибонуклеиновая кислота (RNA) участвует в переносе информации, содержащейся в ДНК, в белки. Настоящим изобретением также рассматриваются фрагменты и варианты раскрытых нуклеотидных последовательностей и кодируемых ими белков, а также белков неполной длины. Под "фрагментом" или "участком" подразумевается полная длина или длина, меньшая, чем полная, нуклеотидной последовательности, кодирующей полипептид или белок, или аминокислотной последовательности полипептида или белка. В некоторых вариантах осуществления фрагмент или часть является биологически функциональным (т.е., сохраняет 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 99% или 100% ферментативной активности ТРР1 дикого типа).
"Вариант" молекулы представляет собой последовательность, которая в основном аналогична последовательности нативной молекулы. Что касается нуклеотидных последовательностей, варианты включают такие последовательности, которые из-за вырожденности генетического кода, кодируют идентичную аминокислотную последовательность нативного белка. Природные аллельные варианты, такие как эти, можно идентифицировать с помощью методов молекулярной биологии, например, используя полимеразную цепную реакцию (PCR) и методы гибридизации. Варианты нуклеотидных последовательностей также включают нуклеотидные последовательности, полученные синтетическим путем, например, с применением сайт-направленного мутагенеза, которые кодируют нативный белок, а также такие, которые кодируют полипептид, имеющий аминокислотные замены. Как правило, варианты нуклеотидной последовательности изобретения будут иметь, по меньшей мере, 40%, 50%, 60%, вплоть до 70%, например, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, вплоть до 79%, в общем, по меньшей мере, 80%, например, 81%-84%, по меньшей мере, 85%, например, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, вплоть до 98% идентичность последовательности с нативной (эндогенной) нуклеотидной последовательностью. В некоторых вариантах осуществления вариант является биологически функциональным (т.е., сохраняет 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 99% или 100% ферментативной активности ТРР1 дикого типа).
"Консервативно модифицированные варианты" отдельных нуклеиновокислотных последовательностей относятся к таким нуклеиновокислотным последовательностям, которые кодируют идентичные или практически идентичные аминокислотные последовательности. Из-за вырожденности генетического кода тот или иной белок кодируется большим количеством функционально идентичных нуклеиновых кислот. Например, кодоны CGT, CGC, CGA, CGG, AGA и AGG кодируют аминокислоту аргинин. Таким образом, в каждом положении, в котором кодоном определяется аргинин, кодон может быть заменен любым из соответствующих описанных кодонов без замены кодируемого полипептида. Такие изменения нуклеиновых кислот представляют собой "молчащие вариации", которые являются одной из разновидностей "консервативно модифицированных вариаций". Каждая последовательность нуклеиновой кислоты в настоящем документе, которая кодирует полипептид, также описывает каждую возможную молчащую вариацию нуклеиновой кислоты, за исключением тех случаев, когда указано иное. Специалисту в данной области техники известно, что каждый кодон в нуклеиновой кислоте (за исключением кодона ATG, который, как правило, является единственным кодоном для метионина) может быть изменен с получением функционально идентичной молекулы с помощью стандартных методов. Таким образом, каждая "молчащая вариация" нуклеиновой кислоты, которая кодирует полипептид, подразумевается в каждой описанной последовательности.
Термин "по существу идентичная" полинуклеотидная последовательность означает, что полинуклеотид содержит последовательность, имеющую, по меньшей мере, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78% или 79% или, по меньшей мере, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88% или 89% или, по меньшей мере, 90%, 91%, 92%, 93% или 94% или даже, по, меньшей мере, 95%, 96%, 97%, 98% или 99% идентичность последовательности по сравнению с исходной последовательностью при применении одной из программ выравнивания, использующих стандартные параметры. Специалисту в данной области техники понятно, что эти значения могут быть соответствующим образом отрегулированы для установления соответствующей идентичности белков, кодированных двумя нуклеотидными последовательностями, принимая во внимание вырождение кодона, сходство аминокислот, расположение рамки считывания и тому подобное. По существу идентичность аминокислотных последовательностей в этих целях в большинстве случаев означает идентичность последовательностей, по меньшей мере, на 70%, по меньшей мере, 80%, 90%, или даже, по меньшей мере, на 95%.
Термин "по существу идентичный" в контексте пептида показывает, что пептид содержит последовательность, идентичную, по меньшей мере, на 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78% или 79% или на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88% или 89%, или, по меньшей мере, на 90%, 91%, 92%, 93% или 94% или даже на 95%, 96%, 97%, 98% или 99%, эталонной последовательности в пределах точно установленного окна сравнения. Показатель того, что последовательности двух пептидов являются по существу идентичными, указывает на то, что один пептид способен иммунологически реагировать с антителами, индуцированными ко второму пептиду. Таким образом, пептид является по существу идентичным со вторым пептидом, например, в том случае, когда два пептида отличаются только консервативной заменой.
Аполипопротеин Е (АроЕ)
Существует несколько разных изоформ человеческого аполипопротеина Е (АроЕ), наличие некоторых из этих изоформ в мозге увеличивает риск развития болезни Альцгеймера (AD), в то время как наличие других изоформ снижает риск развития AD. Наличие изоформы АроЕ ε4 является сильным фактором генетического риска спорадической AD с поздним началом. (Casellano et al., Sci Transl Med, 3(89):89ra57 (29 June 2011).) Аллель АроЕ ε4 сильно увеличивает риск AD и снижает возраст начала болезни. С другой стороны, наличие аллеля АроЕ ε2, по-видимому, уменьшает риск AD. Можно предположить, что изоформы человеческого АроЕ избирательно влияют на выведение или синтез амилоида-β (Аβ) in vivo.
В некоторых вариантах осуществления вводимая нуклеиновая кислота кодирует АроЕ (АроЕ, который по существу идентичен АроЕ дикого типа) или вариант, мутант и/или фрагмент АроЕ. В некоторых вариантах осуществления нуклеиновая кислота кодирует АроЕ ε2, АроЕ ε2, который по существу идентичен АроЕ ε2 дикого типа и/или вариант, мутант или фрагмент АроЕ ε2.
Иммуносупрессорные средства
В некоторых вариантах осуществления млекопитающему также вводится иммуносупрессорное средство. В некоторых вариантах осуществления иммуносупрессорное средство является противовоспалительным средством. В некоторых вариантах осуществления противовоспалительным средством является микофенолат.В некоторых вариантах осуществления противовоспалительное средство вводится до введения rAAV частиц. В некоторых вариантах осуществления противовоспалительное средство вводится одновременно с введением rAAV частиц. В некоторых вариантах осуществления противовоспалительное средство вводится после введения rAAV частиц.
В некоторых вариантах осуществления противовоспалительное средство вводится парентерально, например, с помощью внутримышечной или подкожной инъекции в подходящей основе. Тем не менее, также являются приемлемыми другие способы введения, такие как пероральный, интраназальный или внутрикожный способ доставки. В некоторых вариантах осуществления приготавливают композицию, содержащую rAAV частицу и противовоспалительное средство, и противовоспалительное средство и rAAV частица одновременно вводятся в мозжечково-мозговую цистерну млекопитающего и/или в желудочек мозга млекопитающего, субарахноидальное пространство и/или интратекальное пространство.
Способы введения генетического материала в клетки
Для получения генетически модифицированной клетки в клетку in vivo вводится экзогенный генетический материал (например, кДНК, кодирующая один или более терапевтических белков) с помощью таких методов переноса генетического материала, как трансфекция или трансдукция. Специалисту в данной области техники известны различные экспрессионные векторы (т.е. носители, способствующие доставке экзогенного генетического материала в клетку-мишень).
При использовании в описании термин "трансфекция клеток" относится к «приобретению» клеткой нового генетического материала путем внедрения дополнительной ДНК. Таким образом, трансфекция имеет отношение к внесению нуклеиновой кислоты в клетку с помощью физических или химических методов. Специалистам в данной области техники известно несколько методов трансфекции, включая: со-осаждение ДНК фосфатом кальция; DEAE-декстран; электропорация; опосредованная катионными липосомами трансфекция и бомбардировка вольфрамовыми микрочастицами. Со-осаждение ДНК фосфатом стронция является другим возможным. методом трансфекции.
В отличие от этого "трансдукция клеток" относится к процессу переноса нуклеиновой кислоты в клетку с помощью ДНК или РНК вируса. РНК вирус (т.е., ретровирус), переносящий нуклеиновую кислоту в клетку, в данном документе называется трансдуцирующий химерный ретровирус. Экзогенный генетический материал, содержащийся в ретровирусе, встраивается в геном трансдуцируемой клетки. Клетка, которая трансдуцируется химерным ДНК вирусом (например, аденовирусом, несущим кДНК, кодирующую терапевтическое средство), не будет иметь экзогенного генетического материала, «встроенного» в ее геном, однако будет способна экспрессировать экзогенный генетический материал, который экстрахромосомно сохраняется внутри клетки.
В большинстве случаев экзогенный генетический материал включает гетерологичный ген (обычно в форме кДНК, содержащей экзоны, кодирующие терапевтический белок) вместе с промотором для контроля транскрипции нового гена. Промотор обычно имеет специфическую нуклеотидную последовательность, необходимую для инициации транскрипции. Необязательно, экзогенный генетический материал, кроме того, включает дополнительные последовательности (т.е., энхансеры) необходимые для получения транскрипционной активности желательного гена. В соответствии с целью этого обсуждения "энхансер" является просто какой-либо нетранслируемой последовательностью ДНК, которая «действует» рядом с кодирующей последовательностью (в цис) с целью изменения уровня базальной транскрипции, диктуемого промотором. Экзогенный генетический материал может быть введен в геном клетки непосредственно «ниже» промотора так, что промотор и кодирующая последовательность являются функционально связанными для того, чтобы обеспечивать транкрипцию кодирующей последовательности. Ретровирусный экспрессионный вектор может включать элемент экзогенного промотора для контроля транскрипции «вставленного» экзогенного гена. Такие экзогенные промоторы включают как конститутивные, так и индуцибельные промоторы.
Конститутивные промоторы природного происхождения контролируют экспрессию основных клеточных функциональных элементов. В результате, ген под контролем конститутивного промотора экспрессируется при любых условиях клеточного роста. Примеры конститутивных промоторов включают промоторы для следующих генов, которые кодируют некоторые конститутивные или базовые функциональные элементы (функции "домашнего хозяйства"): гипоксантин фосфорибозил трансферазу (HPRT), дигидрофолатредуктазу (DHFR), аденозиндезаминазу, фосфоглицеринкиназу (PGK), пируваткиназу, фосфоглицеринмутазу, промотор актина и другие конститутивные промоторы, известные специалистам в данной области техники. В дополнение к этому многие вирусные промоторы конститутивно функционируют в эукариотических клетках. Сюда включаются ранний и поздний промоторы SV40; длинные концевые повторы (LTRs) вируса лейкоза Молони и других ретсровирусов; и промотор тимидинкиназы вируса простого герпеса, среди многих других. Соответственно, любой из вышеперечисленных конститутивных промоторов может использоваться для контроля транскрипции гетерологичной генной вставки.
Гены, находящиеся под контролем индуцибельных промоторов экспрессируются только или в большей степени в присутствии индуцирующего агента, (например, транскрипция под контролем промотора металлотионеина существенно увеличивается в присутствии некоторых ионов металлов). Индуцибельные промоторы включают респонсивные элементы (RE), которые стимулируют транскрипцию, когда их индуцирующие факторы связаны. Например, существуют RE для сывороточных факторов, стероидных гормонов, ретиноевой кислоты и циклического АМФ. Промоторы, содержащие определенные RE, можно выбрать, чтобы получить индуцируемый ответ, и в некоторых случаях собственно RE может быть присоединен к другому промотору, таким образом, придавая свойство индуцибельности рекомбинантному гену. Таким образом, путем выбора подходящего промотора (конститутивного в противовес индуцибельному; сильного в противовес слабому) можно контролировать как наличие, так и уровень экспрессии терапевтического средства в генетически модифицированной клетке. Если ген, кодирующий терапевтическое средство находится под контролем индуцибельного промотора, доставка терапевтического средства in situ инициируется воздействием на генетически модифицированную клетку in situ условий, обеспечивающих транскрипцию терапевтического средства, например, при помощи внутрибрюшинной инъекции специфических индукторов индуцибельных промоторов, контролирующих транскрипцию средства. Например, in situ экспрессия генетически модифицированными клетками терапевтического средства, кодированного геном под контролем промотора металлотионеина, увеличивается при контактировании генетически модифицированных клеток с раствором, содержащим подходящие (т.е., индуцирующие) ионы металлов in situ. Соответственно, количество терапевтического средства, которое производится in situ, регулируется такими контролирующими факторами, как: (1) характер промотора, используемого для прямой транскрипции введенного гена, (т.е., является ли промотор конститутивным или индуцибельным, сильным или слабым); (2) число копий экзогенного гена", которые введены в клетку; (3) количество трансдуцированных/трансфектированных клеток, которые введены (например, имплантированы) пациенту; (4) размер имплантата (например, трансплантат или инкапсулированная экспрессирующая система); (5) количество имплантатов; (6) промежуток времени, в течение которого трансдуцированные/трансфектированные клетки или имплантаты остаются на месте; и (7) скорость (уровень) выработки терапевтического средства генетически модифицированной клеткой. Выбор и оптимизация этих факторов для доставки терапевтически эффективной дозы конкретного терапевтического средства входит в сферу компетенции среднего специалиста в данной области без чрезмерного экспериментирования, с учетом раскрытых выше факторов и клинического профиля пациента.
В дополнение, по меньшей мере, к одному промотору и, по меньшей мере, одной гетерологичной нуклеиновой кислоте, кодирующей терапевтическое средство, экспрессионный вектор может содержать ген селекции (отбора), например, ген устойчивости к неомицину, для облегчения селекции (отбора) клеток, подвергнутых трансфекции или трансдукции экспрессионным вектором. Альтернативно, клетки подвергаются трансфекции двумя или более экспрессионными векторами, по меньшей мере, одним вектором, содержащим ген(ы), кодирующий терапевтическое средство(а), и другим вектором, содержащим ген селекции. Выбор подходящего промотора, энхансера, гена селекции и/или сигнальной последовательности (описанной ниже) входит в сферу компетенции среднего специалиста в данной области без чрезмерного экспериментирования.
Терапевтическое средство может быть нацелено для доставки во внеклеточное, внутриклеточное или мембранное местоположение. Если желательно, чтобы продукт гена секретировался из клетки, создается экспрессионный вектор, включающий подходящую "сигнальную" последовательность для секреции продукта терапевтического гена из клетки во внеклеточную среду. Если желательно, чтобы продукт гена удерживался в клетке, эта сигнальная последовательность для секреции не включается. Аналогичным образом, может быть сконструирован экспрессионный вектор, включающий сигнальные последовательности "удержания" для «заякоривания» терапевтического средства в цитоплазматической мембране клетки. Например, все мембранные белки имеют гидрофобные трансмембранные участки, которые останавливают перемещение белка в мембрану и не позволяют белку секретироваться. Конструкция экспрессионного вектора, включающего сигнальные последовательности для нацеливания продукта гена на конкретное местоположение, входит в сферу компетенции среднего специалиста в данной области без необходимости чрезмерного экспериментирования.
Пример 1
Методы переноса генов у крупных млекопитающих
Лизосомные болезни накопления (LSD) составляют большой класс наследственных метаболических нарушений. Большинство LSD возникает в результате отсутствия лизосомальных ферментов, что приводит к повреждению органа и часто к дегенерации центральной нервной системы (ЦНС). Поздний младенческий нейрональный цероидный липофусциноз (LINCL) является аутосомно-рецессивной нейродегенеративной болезнью, вызванной мутациями в связанном с нейрональным цероид-липофусцинозом (CLN) гене 2 (CLN2), который кодирует лизосомальную протеазу трипептидил пептидазу 1 (ТРР1). LINCL клинически характеризуется нормальным рождением и ранним развитием, началом судорожных припадков к 18-24 месяцам, прогрессирующим снижением двигательных и когнитивных способностей и преждевременной смертью. Данная болезнь является результатом отсутствия ТРР1, который является растворимым лизосомальным ферментом с М-6-Р (маннозо-6-фосфатным рецептором).
В настоящее время имеется в наличии ферментозаместительная терапия (ERT) для лизосомных болезней накопления, затрагивающих периферические ткани, которая, однако, не применяется для пациентов с поражением центральной нервной системы (ЦНС). В последних исследованиях изучался вопрос о том, является ли доставка фермента посредством спинномозговой жидкости возможным альтерантивным путем доставки в ЦНС при LINCL (Chang et al., Molecular Therapy 16:649-656, 2008). У мышей, подвергнутых лечению, было отмечено уменьшение невропатологии и уменьшение тремора в покое в сравнении с мышами, которых обрабатывали разбавителем.
В настоящей работе было исследовано, можно ли осуществить эффективную доставку вектора, для того, чтобы достичь устойчивых уровней фермента в спинномозговой жидкости (CSF), посредством инъекции в мозг. Исследования были проведены на модели LINCL собаки. Собаки с LINCL являются нормальными при рождении, однако около 7-месячного возраста у них развивается неврологические симптомы, тестируемое нарушение познавательных способностей примерно в ~5-6 месяцев, судорожные припадки в 10-11 месяцев и наблюдается прогрессирующая потеря зрения. Мутация гена CLN2 у собак с LINCL делает белок ТРР1 нефункциональным, причем белок ТРР1 не обнаруживается. При прогрессировании болезни уменьшается объем ткани мозга, приводя к увеличению пространства желудочков в мозге. Неврологические симптомы включают ухудшение способности сохранять равновесие и нарушение двигательных функций, потерю зрения и тремор.
Щенкам с LINCL назначали генотерапию в трехмесячном возрасте. Для генной терапии был создан AAV2-CLN2 (смотри WO 2012/135857), который вводили в одно место (боковой желудочек) или в два места (боковой желудочек плюс мозжечково-мозговую цистерну млекопитающего) в мозге. Иглы помещали в желудочек, или в желудочек и мозговую цистерну, и медленно впрыскивали вектор в течение нескольких минут. Наряду с тем, что значительная часть ТРР1, выработанного внутри клетки, оставалась в этой клетке, часть секретировалась и поглощалась расположенными рядом клетками. Это свойство секреции и поглощения называется "перекрестной коррекцией (кросс-коррекцией)" (фигура 2). Кросс-коррекция является ценной в контексте генотерапии в том аспекте, что если CLN2 ген переносится в стратегически расположенные клетки в мозге LINCL, тогда это может создать возможность для кросс-коррекции многих окружающих клеток.
В настоящем исследовании проблема доставки в целом терапевтического вектора использует преимущество потока CSF в мозге путем нацеливания на клетки, выстилающие желудочки, и клетки, составляющие мягкие мозговые оболочки. AAV2-CLN2 вводили в одно место (боковой желудочек) или в два места (боковой желудочек и мозжечково-мозговую цистерну млекопитающего) в мозге. ТРР1 экспрессия наблюдалась у Cln2-/- собак после AAV доставки (фигура 3). Было отмечено значительное положительное влияние на объем желудочка. Было также оценено действие AAV.TPP1 на автофлуоресценцию (фигура 4А). Фигура 4В показывает T1-MPI изображения нелеченых и леченых собак. Фигура 4С показывает эффекты AAV.TPP1 на собаках с LINCL. Фигура 4D показывает распределение huTPP1 после введения AAV2/2-huCLN2.
У нелеченых пораженных болезнью собак пространство желудочков увеличивалось до 10 раз по сравнению с размером у нормальных собак, тогда как AAV2-CLN2 генная терапия уменьшала этот эффект. Кроме того, наблюдалось широкое распределение фермента, а также клиническая польза (продолжительность жизни и клиническое исследование). В отсутствие лечения пораженные собаки демонстрировали признаки болезни во всех 22 тестах к возрасту 30 недель. Животные достигали конечной стадии болезни и подвергались эвтаназии в возрасте от 45 до 48 недель. У собак, получавших генотерапию AAV2-CLN2, начало каждого из этих признаков болезни было отсрочено или предотвращено.
Увеличение ТРР1 активности наблюдалось в CSF после комбинированной доставки в цистерну и желудочек.
Таким образом, у собаки с LINCL перенос гена AAV2-CLN2 приводил к восполнению белка ТРР1 во многих областях мозга, и результаты показали, что AAV2-CLN2 перенос гена обеспечивал существенные терапевтические эффекты, уменьшал или задерживал развитие симптомов и улучшал качество жизни собак с LINCL.
Активность huTPP1 в CSF понижалась вскоре после инъекции (фигура 5). Наблюдалось широкое распространение фермента, однако уровни были низкие во время умерщвления через 6-8 месяцев после генотерапии. Постулируется, что падение активности было результатом иммунного ответа на человеческий фермент у собак. Для того, чтобы ингибировать понижение активности было введено противовоспалительное средство (микофенолат). Результаты показали, что противовоспалительное средство не ингибировало ферментативную активность huTPP1 и было эффективно для увеличения промежутка времени, в течение которого отмечалась ферментативная активность (фигура 6) и наблюдались устойчивые уровни ферментативной активности.
Высокая caTPP1 активность в CSF наблюдалась по ходу времени после AAV2caCLN2 внутрижелудочковой инъекции и ранней обработки микофенолатом (фигура 7).
Увеличение ТРР1 ферментативной активности наблюдалось во многих тканях через два месяца после введения (фигура 8, 9А и 9В).
Фигура 10 показывает начало клинических проявлений у собак с LINCL. Активность caTPP1 наблюдалась в мягких мозговых оболочках и периферической ткани, такой как печень (фигура 11).
Таким образом, изобретатели продемонстрировали трансформацию пендимальных клеток AAV2/2, при которой собачий фермент ТРР1 продуцировался и двигался с CSF, и что обработка инъекцией микофеолата pro rot caCLN2 может предотвратить иммуно-ответ у собак.
Пример 2
Исследования на приматах, не относящихся к человеческому роду
Используя методы, подобные описанным выше, изобретатели обнаружили, что AAVeGFP трансдуцировал эпендиму в мозге приматов, не принадлежащих к человеческому роду. Оценку in vivo AAV2/2.TPP1 доставки в мозг макаки-резуса осуществляли путем инъекции AAV.TPP1 в желудочек или мозжечково-мозговую цистерну млекопитающего. Через 4-12 недель извлекали ткани и оценивали ТРР1 активность в CSF или лизатах тканей (Фигура 12). У приматов, не принадлежащих к человеческому роду, активность наблюдалась в вестибулярном поле (ствол мозга) (фигура 13). Таким образом, клетки, выстилающие желудочек, обеспечили источник рекомбинантного фермента для широкого распространения в ЦНС.
Все публикации, патенты и, патентные заявки включаются в описание путем отсылки. В то время как в вышеизложенном подробном описании это изобретение описывается в отношении определенных предпочтительных вариантов их осуществления и многие подробности излагаются в целях иллюстрации, специалистам в данной области техники понятно, что изобретение может подвергаться дополнительным вариантам осуществления и что некоторые из деталей, описанных в данном документе, могут значительно варьировать без отклонения от основных принципов изобретения.
Термины в контексте описания изобретения относятся как к единственному, так и множественному числу, если в описании не указано иначе или это явно не противоречит контексту. Термины "содержащий," "имеющий," "включая" следует рассматривать как неограничивающие термины (т.е., означающие "включая, но не ограничиваясь этим"), если не указано иначе. Перечисление в описании диапазонов значений служит только для сокращенного обозначения каждого отдельного значения, попадающего в указанный диапазон, если в описании не указано иначе, и каждое отдельное значение включается в подробное описание, как если бы оно было индивидуально перечислено в описании. Все методы, описанные здесь, могут выполняться в любом подходящем порядке, если в описании не указано иначе или иным образом явно не противоречит контексту. Использование всех примеров или характерного стиля (например, "такой как"), приведенных в данном документе, предназначается только для лучшего разъяснения изобретения и не ставит рамок, ограничивающих изобретение, если не заявлено иное. Никакую формулировку в данном подробном описании не следует рассматривать в качестве указания на какой-либо незаявленный элемент как существенный для применения на практике изобретения.
В этом документе описаны варианты осуществления данного изобретения, включая наилучший способ, известный изобретателям для выполнения изобретение. Изменения этих вариантов осуществления станут очевидными для средних специалистов в данной области техники после прочтения вышеизложенного описания. Изобретатели рассчитывают, что специалисты в данной области техники будут применять такие изменения по необходимости, и изобретатели предполагают, что изобретение может применяться на практике иначе, чем описано в данном документе. Соответственно, это изобретение включает все модификации и эквиваленты предмета, изложенного в прилагаемых пунктах формулы изобретения, как установлено действующим законодательством. Более того, любая комбинация описанных выше элементов во всех возможных вариантах включается изобретением, если не указано иное или иначе явно не вступает в противоречие с контекстом.
Реферат
Изобретение относится к биотехнологии. Раскрыты биотехнологические способы лечения болезни или доставки терапевтического средства млекопитающему. В мозжечково-мозговую цистерну и/или желудочек млекопитающего вводят rAAV частицы, содержащие вектор, включающий нуклеиновую кислоту, кодирующую терапевтический белок, вставленную между парой AAV инвертированных концевых повторов, таким образом, что клетки, имеющие доступ к спинномозговой жидкости (CSF), экспрессируют терапевтическое средство и в некоторых вариантах осуществления секретируют терапевтическое средство в CSF для распространения в мозге. Изобретение расширяет арсенал средств доставки лекарств в нервную систему. 4 н. и 18 з.п. ф-лы, 17 ил., 2 пр.
Формула
Документы, цитированные в отчёте о поиске
Генная терапия бокового амиотрофического склероза и других заболеваний спинного мозга

Комментарии