Тромболитические средства - RU2142799C1
Код документа: RU2142799C1
Чертежи




Описание
Область техники
Данное изобретение относится к тромболитическому средству, которое может применяться перорально, причем указанное средство включает
6-амидино-2-нафтил 4-[(4,5-дигидро-1H-имидазол-2- ил)амино]бензоат или его фармацевтически приемлемую соль присоединения кислоты.
Предшествующий уровень техники
Сгусток,
образованный коагуляцией крови в сердце или кровеносном сосуде, называется тромбом, и патологический процесс, связанный с образованием указанного тромба, называют тромбозом. Тромбоз включает ряд
патологических состояний, таких как церебральный инфаркт, инфаркт миокарда, легочный инфаркт и т.д.
Образование тромба изначально является механизмом, который служит для предотвращения возможного кровотечения из поврежденной части кровеносного сосуда, когда он повреждается по каким-либо причинам. Образование тромба тесно связано с изменением компонентов крови, аномальным кровообращением и изменениями свойств стенок кровеносных сосудов. А именно, когда кровеносный сосуд по некоторым причинам повреждается, тромбоциты прилипают к поврежденному месту и агрегируют, образуя агрегированную массу, которая препятствует кровотечению через него. Кроме того, тромбоциты, агрегируя друг с другом, выделяют вещества, которые активируют факторы коагуляции (факторы свертывания), присутствующие в крови, ускоряя образование тромба, ведущее к образованию более плотных тромбов. Существует ряд факторов коагуляции, которые составляют сложный механизм активации, по которому взаимодействие протекает каскадным путем благодаря активации одного фермента другим (система свертывания крови). Некоторые факторы коагуляции также непосредственно активируются ранами или повреждениями тканей, и коагуляция происходит разнообразными путями. Однако в крови присутствует много веществ, которые подавляют развитие коагуляции, тем самым подавляя усиление аномальной коагуляции. Как следствие, образуются сгустки крови, но они лизируются ферментами (фибринолитические ферменты), которые растворяют сгустки крови, когда гемостатическое действие (кровоостанавливающее действие) становится больше не нужным и кровеносный сосуд возвращается в первоначальное состояние (фибринолитическая система).
Таким образом, образование тромба включает ряд факторов. Однако факторами, которые наиболее тесно связаны с образованием тромба, являются тромбоциты, коагуляционные факторы, фибринолитические факторы и т.п., и разработаны и разрабатываются лекарственные средства, воздействующие на вышеупомянутые компоненты крови, и их используют для лечения тромбоза, который вызывается присутствием аномальных тромбов.
Способы лечения тромбоза грубо подразделяются на две группы по механизму действия: противотромбовая (антитромбозная) терапия, которая препятствует образованию тромбов, и тромболитическая терапия, которая растворяет образовавшиеся тромбы.
Противотромбовая терапия, кроме того, классифицируется на две: противотромбоцитная терапия и антикоагуляционная терапия.
Противотромбоцитная терапия предназначается для подавления функции тромбоцитов, вовлеченных в ранние стадии образования тромба, и разработаны лекарственные средства, такие как классический аспирин и многие другие лекарственные средства, которые могут быть применены перорально. Сейчас их используют для предотвращения рецидива церебрального инфаркта, инфаркта миокарда, и т. д., для предотвращения окклюзии после различных хирургических операций с искусственным кровообращением, для предотвращения рестеноза после пластической операции на сосудах, и т.п. Таким образом, их используют скорее как профилактические лекарственные средства против образования тромба, чем как терапевтические лекарственные средства. С их применением связана проблема наличия индивидуального колебания (изменения) в проявлении эффективности, и тенденции к кровотечению из-за необходимости пролонгированного введения.
Антикоагуляционная терапия предназначена для ингибирования образования тромбов путем подавления факторов коагуляции и классифицируется на лекарственные средствам для ингибирования активности факторов коагуляции, на лекарственные средства для подавления образования факторов коагуляции. К первым относятся гепарин, ингибиторы ферментов и т.п. Поскольку они являются инъекционными препаратами, они проявляют антикоагуляционную активность при внутривенном введении. Однако их следует применять под наблюдением врача и, кроме того, при этом возникает проблема, связанная с тенденцией к кровотечению и т. п. Последняя представляет способ, который подавляет образование факторов коагуляции путем противодействия витамину K, который требуется для продуцирования факторов коагуляции in vivo и, тем самым, для ингибирования общей коагуляционной способности. Варфарин является представительным примером используемого лекарственного средства. Хотя варфарин может применяться перорально и его применяют в случае хронических заболеваний, которые требуют применения на протяжении продолжительного периода времени, проблема возникновения сильного кровотечения остается в качестве побочного действия.
Способом, который лечит тромбоз по механизму действия, отличному от механизма действия противотромбовой терапии, является тромболитическая терапия. Цель данной терапии состоит не в подавлении механизма образования тромбов, а в реканализации (восстановления просвета) кровообращения путем растворения тромба в кровеносном сосуде и тем самым в устранении окклюзии (закупорки) кровеносного сосуда.
Полагают, что ее механизм действия заключается в активировании плазминогена, предшественника факторов, модулирующих фибринолитическую систему, в плазмин, который растворяет тромб путем разложения образующего тромб фибрина в кровеносном сосуде, приводя тем самым к реканализации закупоренного места. Поскольку лекарственные средства, используемые в тромболитической терапии, являются известными эндогенными веществами, такими как активатор тканевого плазминогена (t-PA), урокиназа (UK) и т.д., которые являются активирующими плазминоген факторами, которые активируют плазминоген в плазмин, микробиологически получаемыми веществами, такими как стафилокиназа, стрептокиназа, и т. д., и их рекомбинатной формой. Они все являются инъекционными препаратами и никаких таких лекарственных средств для орального применения неизвестно.
Полагают, что t-PA и т.д. обычно полезны для внутривенного введения. Однако они имеют короткие периоды полувыведения и быстро удаляются из печени. Кроме того, поскольку могут существовать ингибиторы, присутствующие in vivo, требуется введение большой дозы, необходимой для тромболитической активности, чтобы оказать действие в участке сгустков. Сообщается, что такое временное введение большой дозы тромболитического лекарственного средства заметно повышает системную активность тромболиза, и таким образом, с одной стороны, ожидается канализация закупоренного места, в то время как, с другой стороны, образованный плазмин разлагает фибриноген и другие факторы коагуляции, и повреждает стенки кровеносного сосуда, тем самым обнаруживая симптомы кровотечения. Местное введение тромболитического лекарственного средства против коронарного тромбоза при инфаркте миокарда является действительно очень эффективным способом лечения, но введение катетера в кровеносный сосуд представляет собой специальную технику и представляет большую нагрузку на пациента. Кроме того, уже сообщалось при исследованиях на животных и в клинических случаях, что хотя введение тромболитического средства временно канализирует оккюдированное место, легко может происходить реокклюзия.
По вышеупомянутым причинам желательно разработать лекарственное средство, которое имеет активность, направленную на растворение тромба, являющегося непосредственной причиной тромбоза и образованного в кровеносном сосуде; которое не проявляет серьезных побочных действий, таких как кровотечение, проблема, ассоциируемая с обычными тромболитическими средствами и т. п. ; которое можно применять перорально с тем, чтобы облегчить нагрузку на пациента.
Сущность изобретения
В результате интенсивного исследования, направленного на достижение вышеупомянутой цели, настоящим изобретением неожиданно было установлено, что 6-амидино-2-нафтил 4-[(4,
5-дигидро-1H-имидазол-2- ил)амино] бензоат имеет превосходную тромболитическую активность, что и составляет настоящее изобретение. Таким образом, данное изобретение относится к тромболитическому
средству, которое может вводиться перорально, и указанное средство включает вышеупомянутое соединение данного изобретения или его фармацевтически приемлемую соль присоединения кислоты. Соединение
данного изобретения является известным соединением, которое полезно в качестве антитрипсинового средства, антиплазминового средства, средства против калликреина (anti-kallikrein), противотромбинового
средства и противокомплементного средства, как сообщается в не прошедшей экспертизу японской патентной публикации N 61 ('86)-33173. Однако, как очевидно из фармакологических исследований, упоминаемых
ниже, активность соединения данного изобретения растворять тромб путем активирования фибринолитической системы обнаружена впервые настоящим изобретением и тромболитическое средство, включающее
соединение данного изобретения и его фармацевтически приемлемую соль присоединения кислоты является полезным для заболеваний, которые вызываются образованием тромба. Таким образом, его можно
использовать в качестве лекарственного средства для лечения венозного тромбоза, инфаркта миокарда, эмболии легких, церебральной эмболии, медленно прогрессирующего церебрального тромбоза и
тромботической эмболии, связанной с сосудистой хирургией и экстракорпоральным кровообращением, а также для улучшения нарушений кровообращения, улучшения различных состояний, ассоциированных с
хронической закупоркой кровотока предсердия, для лечения тромбоза и эмболии, ассоциированной с ишемическими цереброваскулярными нарушениями, и лечения тромбоза и эмболии в целом.
Область промышленного применения
Как очевидно из нижеследующих фармакологических исследований, которые показывают, что соединение данного изобретения растворяет тромб путем активации
фибринолитической системы, соединение данного изобретения может использоваться в качестве лекарственного средства для лечения венозного тромбоза, инфаркта миокарда, эмболии легких, церебральной
эмболии, медленно прогрессирующего церебрального тромбоза и тромботической эмболии, связанной с сосудистой хирургией и экстракорпоральным кровообращением, а также для улучшения нарушений
кровообращения, улучшения различных состояний, ассоциированных с хронической закупоркой кровотока предсердия, для лечения тромбоза и эмболии, ассоциированной с ишемическими цереброваскулярными
нарушениями, и лечения тромбоза и эмболии в целом.
Различные фармакологические исследования иллюстрируются ниже для соединения данного изобретения (мезилат 6-амидино-2-нафтил-4- [(4, 5-дигидро-1H-имидазол-2-ил)амино]-бензоата).
(1) Эффект смертности мышей на летальных моделях тромбоза (сосудов) легких
В эксперименте используют мышей мужской особи линии ddY,
которых подвергают голоданию в течение шести часов. Мышам орально вводят 10 мг/кг соединения данного изобретения. Контрольной группе дают воду орально. Спустя шесть часов, чтобы вызвать тромбоз,
внутривенно в хвостовую вену мышам вводят 10 единиц/мышь тромбина. Выживаемость или гибель животных оценивают через 16 часов после введения тромбина. Результат воздействия данного соединения на
понижение смертности выражают в коэффициенте выживаемости. Результаты представлены в табл. 1 (см. в конце описания).
(2) Определение плазминподобной активности в плазме с
использованием синтетического субстрата
В эксперименте используют крыс мужской особи линии SD, которых подвергают голоданию на протяжении ночи. Крысам орально вводят 30 мг/кг соединения
данного изобретения. Затем периодически отбирают кровь в виде крови с добавлением цитрата натрия из нисходящей аорты и затем кровь центрифугируют, чтобы получить плазму. Контрольной группе дают
орально воду и плазму получают аналогичным способом.
Полученную плазму инкубируют с 0,1 М боратным буфером, pH 8,5 и 0,1 мМ Boc-Val-Leu-Lys-MCA при 37oC в течение 30 минут. Реакцию прерывают добавлением 15% уксусной кислоты и затем измеряют интенсивность флуоресценции, чтобы определить плазминподобную активность.
В результате этого группа, которой дают соединение данного изобретения, демонстрирует заметное увеличение в плазминподобной активности до 0,968 нмоль/мин/мл по сравнению с 0,358 нмоль/мин/мл для контрольной группы.
(3)
Определение (t-PA)-подобной активности активатора тканевого плазминогена с использованием синтетического субстрата
Плазму, полученную при исследовании в вышеупомянутом примере 2, инкубируют с
0,1 М боратным буфером, pH 8,5 и 0,1 мМ Phy-Gly-Arg-MCA при 37oC в течение 30 минут. Реакцию прерывают добавлением 15% уксусной кислоты и затем измеряют интенсивность флуоресценции, чтобы
определить t-PA-подобную активность.
В результате этого группа, которой дают соединение данного изобретения, демонстрирует заметное повышение t-PA-подобной активности до 1,351 нмоль/мин/мл по сравнению с 0,648 нмоль/мин/мл для контрольной группы.
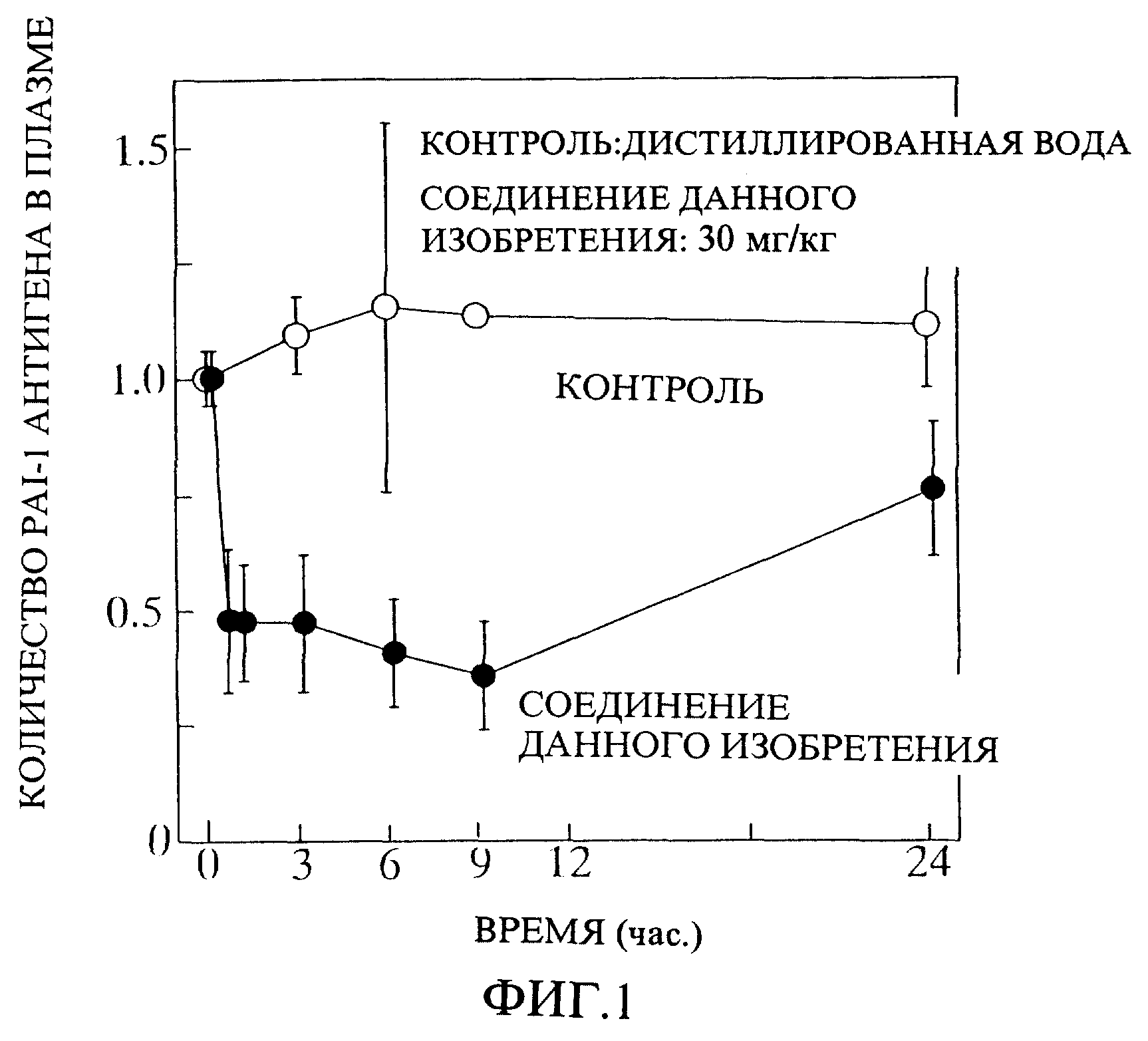
(4) Определение количества антигена ингибитора-1 активатора плазминогена (PAI-1) в плазме
В эксперименте
используют крыс мужской особи линии SD, которых подвергают голоданию на протяжении ночи. Крысам орально дают 30 мг/кг соединения данного изобретения. Периодически берут пробы крови в виде крови с
добавлением цитрата натрия из нисходящей аорты и затем кровь центрифугируют, чтобы получить плазму.
Сто мкл раствора моноклонального антитела к PAI-1 в 10 мМ карбонатом буфере предварительно наносят в 96-луночный титрационный микропланшет и планшет оставляют при 4oC на 16 часов. После промывания планшета четыре раза 10 мМ фосфатным буфером, содержащим 0,1% Твин 20, добавляют стандартный раствор и образцы плазмы. После выдерживания планшета при комнатной температуре в течение двух часов промывку повторяют снова четыре раза и добавляют 100 мкл поликлонального антитела фермент-меченого PAI-1, и планшет инкубируют при комнатной температуре в течение двух часов. После четырехкратной промывки для удаления избытка антитела добавляют 100 мкл цитратного буфера, содержащего 10 мг о-фенилендиамина и 0,1% пероксида водорода, и выдерживают при 30oC в течение 30 минут до появления окраски. После прерывания реакции путем добавления 50 мкл 2 N серной кислоты измеряют поглощение при 405 нм, используя спектрофотометр для прочтения микропланшетов, чтобы определить количество PAI-1 антигена в образцах плазмы. Результат представлен на фиг. 1.
В контрольном механизме тромболиза большую часть t-PA, выделяемого в кровь, быстро ингибируют его ингибитором, PAI-1, чтобы лишить его активности, и, поэтому уменьшение количества PAI-1, приводит к повышенной активности тромболиза. Как следует из фиг. 1, соединение данного изобретения явно вызывает понижение концентрации PAI-1, ингибирующего фактора фибринолиза, в крови.
(5) Определение времени активированного парциального тромбопластина (АРТТ)
К 100 мкл реагента для определения времени активированного парциального тромбопластина (Platerin A-Auto),
предварительно растворенного в дистиллированной воде, добавляют 100 мкл образца плазмы, полученного в примере 4 вышеупомянутого исследования, и оставляют при 37oC приблизительно на три
минуты. Затем добавляют 100 мкл 0,25 М хлорида кальция, который предварительно нагревают до 37oC, и с помощью прибора для измерения коагуляции (KC-10A, Amerung) определяют время, прошедшее
до образования сгустков фибрина.
Результат не показал никакого удлинения АРТТ, поскольку у группы, которой давали соединение данного изобретения, коагуляция происходит через 20,3 секунд по сравнению с 20,2 секундами для контрольной группы.
В дальнейшем было проведено исследование по пероральному введению человеку.
(6) Определение времени
активированного парциального тромбопластина (АРТТ) у человека
Соединение данного изобретения дают перорально здоровым индивидуумам, и у них периодически берут кровь, чтобы получить плазму.
К 100 мкл реагента для определения времени активированного парциального тромбопластина (Platerin A-Auto), предварительно растворенного в дистиллированной воде, добавляют 100 мкл образца плазмы, полученного как указано выше, и выдерживают при 37oC в течение приблизительно трех минут. Затем добавляют предварительно нагретые до 37oC 100 мкл 0,25 М хлорида натрия и с помощью прибора для измерения коагуляции определяют время, прошедшее до образования сгустков фибрина. Результат не указывает на удлинение АРТТ, поскольку у группы, которой давали соединение данного изобретения, коагуляция происходит через 18,4 секунды по сравнению с 18,5 секундами для контрольной группы.
(7) Определение количества человеческого PAI-1 антигена
Когда
количество PAI-1 антигена измеряют способом, аналогичным способу в примере 4 данного исследования, используя плазму, полученную в примере 6 вышеупомянутого исследования, то в плазме наблюдается
заметное уменьшение количества PAI-1 антигена. Результат представлен на фиг. 2.
(8) Определение количества человеческого PIC антигена
Когда определяют количество антигена
комплекса плазмин-ингибитор альфа2-плазмин, используя in vitro диагностический "PIC Тест" (поставляемый Teijin), для плазмы, полученной в вышеупомянутом примере 6 исследования, наблюдается
положительное увеличение количества PIC. Результат представлен на фиг.3.
При тромболизе фибринолитическая реакция, которая опосредована активатором плазминогена (PA) и плазмином, играет важную роль. Ингибитор a2-плазмина (a2-PI) является физиологически наиболее важным ингибирующим фактором плазмина и служит в качестве регулирующего фактора при тромболизе. Поскольку PIC почти не встречается в плазме нормальных индивидуумов и образуется, когда плазмин продуцируется in vivo, повышенное количество PIC указывает на усиление системной фибринолитической системы.
Таким образом, соединение данного изобретения при введении орально демонстрирует очень сильную активность тромболиза.
Кроме того, для того чтобы доказать эффективность тромболитической активности соединения данного изобретения, сравнивают эффективность (действенность) указанного соединения и антикоагулянта, гепарина, используя экспериментальную модель, в которой в кровеносном сосуде были предварительно образованы тромбы.
(9) Сравнительный тест с антикоагулянтом (гепарин) на модели тромбоза у крыс
Сравнительный тест на
эффективность действия соединения данного изобретения с антикоагулянтом, гепарином, проводят путем сжатия (сдавливания) сонной артерии крысы в условиях анестезии, используя модель тромбоза, которая
продуцирует тромбы в месте сдавливания (см. Wessler Stanford, et al., J. Appl. Physiol. 14(6): 943-946 (1959)). Эта экспериментальная модель представляет модель, используемую для демонстрации
эффективности t-PA и UK, которые используют в качестве тромболитических средств.
В этом эксперименте используют самцов-крыс линии SD. Сонные вены крыс обнажают под анестезией и затем легируют проволокой диаметром 2 мм. Пятьсот единиц/мл тромбина инъецируют в кровеносный сосуд, получая тромбиновый тромб в легированном сосуде. Спустя 5 минут после образования тромба проволоку удаляют и открытые сосуды зашивают. После восстановления рефлекса выпрямления вводят перорально 100 мг/кг соединения данного изобретения. Антикоагулянт - гепарин - вводят внутривенно. Спустя 3 часа после введения лекарственных средств крыс умерщвляют и сонную вену, которая продуцировала тромб, экстирпируют (полностью удаляют). Подсчитывают остаточные тромбы в экстирпированном кровеносном сосуде по следующей шкале, чтобы оценить эффективность лекарственных средств. Результаты представлены в табл. 2 (см. в конце описания).
Критерий:
Оценка 0 Тромб отсутствует
Оценка 1 Микротромб
Оценка 2 Несколько маленьких тромботических масс
Оценка 3 Несколько больших тромботических масс
Оценка 4 Тромботические массы, которые превращаются в
кровяные сгустки
Исходя из вышеупомянутых результатов видно, что соединение данного изобретения очень эффективно против тех тромбов, на которые антикоагулянты не действуют.
Было также подтверждено, что соединение данного изобретения при оральном введении здоровым индивидуумам не вызывает каких-либо аномалий в субъективных симптомах объективных симптомах или лабораторных результатах испытаний и что оно безопасно при применении.
Краткое описание фигур
Фиг. 1 демонстрирует изменения в количестве PAI-1 антигена в крови крысы после орального
применения соединения данного изобретения. Горизонтальная ось обозначает время (часы) после введения, а вертикальная ось обозначает отношение концентрации PAI-1 в крови относительно значения,
установленного при 1,0 концентрации PAI-1 в крови сразу после введения.
Фиг. 2 демонстрирует изменения в количестве PAI-1 антигена в крови человека после орального применения соединения данного изобретения. Горизонтальная ось обозначает время (часы) после введения, а вертикальная ось обозначает количество (нг/мл) PAI-1 антигена в крови.
Фиг.3 демонстрирует изменения в количестве PIC антигена в крови человека после орального применения соединения данного изобретения. Горизонтальная ось обозначает время (часы) после введения, и вертикальная ось обозначает количество (нг/мл) PIC антигена в крови.
Соединение данного изобретения обычно вводят в виде фармацевтических композиций. Примеры вышеупомянутых композиций включают таблетки, порошки, капсулы, сиропы или водные растворы. Для композиций, предназначенных для орального введения, обычно используемыми добавками могут быть такие, как наполнители, смазки, дезинтегранты, смачивающие вещества и т.д. Жидкости, предлагаемые для орального применения, могут быть в форме водных растворов, маслянистых растворов, растворов, эмульсий, сиропов, эликсиров, и т.д. или они могут выпускаться в виде сухих сиропов, которые разбавляются водой или любым другим подходящим растворителем перед использованием. Вышеупомянутые жидкости могут содержать обычные добавки, такие как суспендирующий агент, ароматизатор, разбавитель или эмульгирующий агент. Соединение может также использоваться в виде суппозитория для ректального применения. В суппозитории можно использовать в качестве основы любые подходящие вещества, такие как масло какао, лауриновое масло, макрогол, глицерожелатин, Witepsol, стеарат натрия, или их смесь и при необходимости могут добавляться эмульгирующие средства, суспендирующие средства, консерванты и т.п.
Наилучший способ выполнения изобретения
Соединение данного изобретения можно вводить млекопитающим (включая человека-пациента) в
форме лекарственных средств для перорального введения или для ректального введения. Для цели лечения различных заболеваний у человека, вызванных тромбом, доза находится в диапазоне 100-1000 мг/день/на
человека, предпочтительно 200-800 мг/день/на человека и более предпочтительно 400-700 мг/день/на человека, но ее можно регулировать соответствующим образом в зависимости от тяжести заболевания,
возраста и веса пациента и т. д.
Реферат
Изобретение может быть использовано в фармации и медицине для лечения тромбоза и инфаркта миокарда. Заявлены: тромболическое средство, активизирующее фибринолиз средство, применение 6-амидино-2-нафтил-4-[(4,5-дигидро-1Н-имидазол-2-ил)амино]бензоата или его фармацевтически приемлемой соли присоединения кислоты (I) в качестве указанных средств и способы лечения тромбоза и инфаркта миокарда. Тромболитическое и активизирующее фибринолиз средства содержат эффективное количество (I). Способы лечения заключаются во введении пациенту эффективного количества средства. Средства могут дополнительно содержать фармацевтически приемлемые носители. Заявленные средства и способы лечения позволяют растворить тромбы в кровеносных сосудах и тем самым устранить их закупорку. Средства могут быть введены перорально, что создает преимущества перед известными препаратами такого действия, вводимыми через катетер в кровеносный сосуд. 6 с. и 6 з.п.ф-лы, 3 ил., 2 табл.

Комментарии