Амидсодержащие производные 2-оксиндола, способ их получения и применения - RU2685501C1
Код документа: RU2685501C1
Чертежи
Описание
Область техники
Изобретение относится к областям органической химии, а именно химии гетероциклических соединений, медицинской химии, фармакологии и офтальмологии. Предлагаемые соединения могут найти применение в качестве гипотензивных и антиоксидантных препаратов для лечения глаукомы и других заболеваний глаз, а также глазных заболеваний сопровождающихся окислительным стрессом.
Уровень техники
Мелатонин - эпифизарный гормон, является одним из регуляторов циркадных ритмов у многих животных, усиливает эффективность функционирования иммунной системы, обладает выраженными антиоксидантными, нейропротекторными свойствами, а также способен снижать внутриглазное давление. Сейчас во многих странах выпускаются препараты гормона мелатонина (N-ацетил-5-метокситриптамин). Его известная лекарственная форма Melaxen используется при нарушении сна у больных с нарушением мозгового кровообращения, при аутоиммунной терапии, при лечении гипертонии, для профилактики сердечно-сосудистых заболеваний, при комплексной противопухолевой терапии и нейродегенеративных заболеваний. Широкому внедрению мелатонина в медицинскую практику мешают его быстрый метаболизм и нестабильность на свету. Однако, несмотря на все его положительные свойства, как и большинство эндогенных молекул, мелатонин действует не селективно, поскольку имеет множество сайтов связывания в организме человека. У животных выделяют 3 подтипа мелатониновых рецепторов: трансмембранные GPCR рецепторы МТ1 и МТ2 подтипы и низкоафинный рецептор МТ3, который, согласно некоторым исследованиям, представляет собой фермент - хинонредуктазу 2, а также ядерные рецепторы ROR/RZR. Мелатонин также обладает антиоксидантным действием, которые, согласно некоторым исследованиям, связаны с механизмом перехватывания активных форм кислорода в организме.
Поэтому необходим дизайн и синтез селективных лигандов по отношению к каждому сайту связывания мелатонина. В основу модификации мелатонина в том числе может входить замена центрального индольного ядра на, например, оксиндольный, который значительно стабильнее. Кроме того, селективность действия будущего лиганда легко достигается путем введения различных заместителей в основное ядро.
Учитывая большой потенциал селективных лигандов мелатониновых рецепторов различных подтипов, дизайн новых аналогов мелатонина, разработка способа синтеза и их синтез, а также изучение их активности является актуальной задачей. Так, настоящее изобретение относится к амид-содержащим аналогам 2-оксиндола (индолинона, оксиндола, индолин-2-она).
M.S. Volkova et al. (Synthesis of novel receptor ligands via an unusual Knoevenagel condensation, Bioorganic & Medicinal Chemistry Letters, 2012, v. 22, 7578-7581) описывает производные 2-оксиндола, такие как (5-ацетамидо-2-оксиндол-3-ил)ацетонитрил, (5-ацетамидо-3-гидрокси-2-оксиндол-3-ил)ацетонитрил и прочие, как ингибиторы МТ3 подтипа мелатониновых рецепторов. Описывается также способ их получения путем конденсации нитро-изатинов с цианоуксусной кислотой с последующим восстановлением и одновременным ацилированием нитро-группы. Однако по этому способу невозможно получить производные 2-оксиндола с заместителями, отличными от NC(O)R, где R означает С1-С4-алкил, поскольку восстановление с одновременным ацилированием нитро-группы проводится в среде карбоновой кислоты в присутствии ангидрида соответствующей кислоты. Соответственно набор карбоновых кислот с соответствующими ангидридами сильно ограничивает ряд перспективных лигандов МТ3 подтипа мелатониновых рецепторов. Данные о прочей биологической активности полученных соединений не представлены.
Silva B.N.M et al. (Synthesis of Novel Isatin-Type 5'-(4-Alkyl/Aryl-1H-1,2,3-triazoles) via 1,3-Dipolar Cycloaddition Reactions, Journal of Brazilian Chemical Society, 2013, v. 24, No. 2, 179-183) описывает способ получение 5-амино-спиро[1,3-диоксолан-2,3'-индол]-2'(1'Н)-она путем каталитического восстановления 5-нитро-спиро[1,3-диоксолан-2,3'-индол]-2'(1'Н)-она, который в свою очередь был получен действием этиленгликоля в присутствии п-толуолсульфокислоты на 5-нитроизатин с азеотропной отгонкой воды. Однако выделение продукта проводилось путем экстракции продукта из реакционной смеси. Предлагаемый способ получения отличается тем, что выделение проводится осаждением продукта добавлением воды в реакционную смесь, а затем промывные воды дополнительно экстрагируются, при этом выход целевого соединения значительно повышается. Получаемый продукт также промывается диэтиловым эфиром, что позволяет получить более чистый продукт.
Наиболее близким по уровню техники к предлагаемому изобретению являются соединения сходной структуры, предложенные в работе M.S. Volkova (Synthesis of novel receptor ligands via an unusual Knoevenagel condensation, Bioorganic & Medicinal Chemistry Letters, 2012, v. 22, 7578-7581), используемые в качестве лигандов МТ3. Однако предлагаемое изобретение позволяет значительно расширить круг получаемых производных с ростом вероятности нахождения более селективных аналогов и аналогов с большей биологической активностью. Кроме того, предлагаемый способ получения позволяет значительно увеличить выход целевых соединений. Крайне важным отличием является наличие дополнительного свойства, а именно выраженной антиоксидантной активности у новых соединений.
Раскрытие изобретения
Задачей настоящего изобретения является синтез производных индолинона с повышенной аффинностью по отношению к мелатониновым рецепторам по сравнению с эндогенным лигандом, и более выраженной способностью снижать внутриглазное давление по сравнению с существующими лекарственными препаратами, а также с выраженным антиоксидантным действием.
Изобретение относится к соединениям общей формулы (I), способу их получения и их применению в качестве лекарственных средств при терапии офтальмологических заболеваний, в качестве лигандов МТ1, МТ2 и МТ3 подтипов мелатониновых рецепторов, в качестве ингибиторов МТ3 подтипа мелатониновых рецепторов, а также в качестве антиоксидантных средств. Кроме того, предлагается применение соединений формулы (I) в качестве активного компонента фармацевтической композиции, которая может быть использована для лечения различных офтальмологических заболеваний, в частности глаукомы, в связи с их способностью снижать внутриглазное давление (ВГД), а также заболеваний, связанных с окислительным стрессом, в связи с их выраженной антиоксидантной активностью.
Предложены соединения общей формулы (I), его стереоизомеры и фармацевтически приемлемые соли:
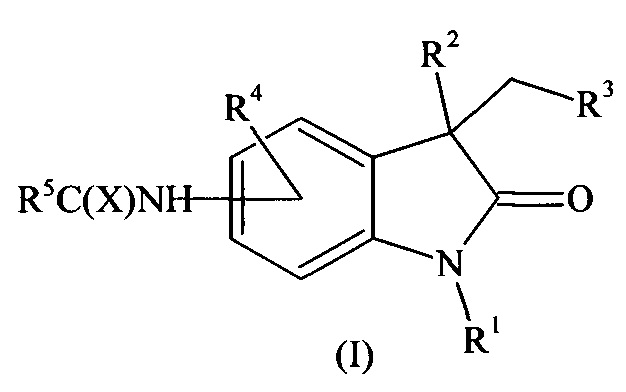
где:
R1 означает Н, бензил, С1-С4-алкил,
R2 означает Н, ОН, OR6,
R3 означает СООН, CN,
R4 означает Н, ОС1-С4-алкил, галоген, С1-С4-алкил, СООС1-С4-алкил, NHC(X)R7,
R5 означает С3-С6-циклоалкил, C5-С6-арил, C5-С6-гетероарил, NHC1-С4-алкил, NHC1-С4-галоидалкил, NHC3-С6-циклоалкил, NHC5-С6-арил, NHC5-С6-гетероарил, OC5-С6-арил, где C5-С6-гетероарил означает 5-6-членный арил с 1 или 2 гетероатомами, выбранными из группы О, N, S,
R6 означает С1-С4-алкил, С(O)С1-С4-алкил,
R7 означает С1-С4-алкил, С1-С4-галоидалкил, ОС1-С4-алкил, С3-С6-циклоалкил, С5-С6-арил, C5-С6-гетероарил, NHC1-С4-алкил, NHC1-С4-галоидалкил, NHC3-С6-циклоалкил, NHC5-С6-арил, NHC5-С6-гетероарил, OC5-С6-арил, где C5-С6-гетероарил означает 5-6-членный арил с 1 или 2 гетероатомами, выбранными из группы О, N, S,
X означает О, S.
Предлагается способ получения соединений формулы (I) согласно схеме (1):

где R1-R7, X имеют вышеуказанные значения.
Предлагаемый способ включает стадии, описанные ниже. Все значения эквивалентов (экв.) реагентов указаны по отношению к 1 экв. исходного соединения (1), (2), (3), (4) или (5), в зависимости от стадии.
На первой (i) стадии производится защита карбонильной группы в положении 3 изатинов общей формулы (1). Для этого смешивают соединение (1), диол - этиленгликоль (не менее 12 экв.) и каталитическое количество п-толуолсульфокислоты (ПТСК, не менее 0,1 экв.) и в среде высококипящего растворителя (минимальное используемое кол-во растворителя равно объему диола), образующего азеотропную смесь с водой, кипятят при перемешивании с азеотропной отгонкой воды. После прекращения выделения воды реакционную смесь остужают до комнатной температуры, добавляют холодную воду в количестве, равном количеству использованного растворителя. Выпавший осадок отфильтровывают и промывают водой и сушат на воздухе. Таким образом, получают продукт с общей формулой (2). В качестве высококипящего растворителя, образующего азеотропную смесь с водой используют, например, толуол или ксилол.
Для защиты карбонильной группы также можно использовать другие диолы, например, такие как 1,3-пропандиол, 2,2-диметил-1,3-пропандиол и их гомологи. В качестве катализаторов помимо ПТСК могут быть использованы орто- и мета-толуолсульфокислоты, метилсульфокислота, бензолсульфокислота, трифторметансульфокислота и прочие.
Для увеличения выхода продукта (2) водную фракцию дополнительно экстрагируют подходящим растворителем. После удаления растворителя в вакууме, сухой остаток растирают с диэтиловым эфиром, отфильтровывают и сушат на воздухе и объединяют с первой порцией продукта (2).
На второй (ii) стадии проводят восстановление полученного продукта (кеталя) с формулой (2) водородом (давление 3-10 атм.) в присутствии подходящего катализатора для восстановления нитро-группы (например, Pd/C, Pd/Ni, Re-Ni и т.д.) в среде безводного протонного растворителя, например этилацетата при комнатной температуре. Гидрирование может проводиться как в большом объеме, так и в проточном реакторе, при этом в обоих случаях количество растворителя подбирается таким образом, чтобы соединение формулы (2) полностью растворилось; гидрирование проводиться до исчезновения следов исходного соединения, за чем следят методом тонкослойной хроматографии. После прекращения гидрирования растворитель удаляют в вакууме, и полученный сухой остаток полностью растворяют в безводном тетрагидрофуране. К полученному раствору добавляют органическое основание в качестве перехватчика выделяющейся кислоты (1,05-1,10 экв.), например триэтиламин или пиперидин. Затем небольшими порциями при интенсивном перемешивании вносят ацилирующий агент (1,05-1,10 экв.) с общими формулами (R5C(O))2O или R5C(O)Hal, или R5NCS, или R5NCO при комнатной температуре, не допуская нагревания реакционной смеси. После полного прибавления ацилирующего агента, реакционная смесь перемешивается при комнатной температуре еще 10-15 минут, затем добавляют холодную воду в количестве, равном количеству использованного растворителя (тетрагидрофурана), и проводят экстракцию подходящим растворителем. После удаления растворителя в вакууме, получают продукт с общей формулой (3).
На третьей (iii) стадии производится кислотный гидролиз соединения (3). Для этого готовят смесь соединения (3) с водным ацетоном (на 0,1 г соединения (3) - 3-5 мл ацетона), затем при перемешивании добавляют концентрированную соляную кислоту (не менее 12 экв.). Не допуская испарения и выветривания хлороводородной кислоты, т.е. в герметично закрытом сосуде, смесь перемешивается при комнатной температуре в течение 24-96 часов. Затем реакционную смесь выливают в лед (количество льда приблизительно равно общему объему реакционной смеси). Если продукт плохо растворим в воде, то образующийся осадок отфильтровывают, промывают 1-2 раза небольшим количеством холодной воды и сушат на воздухе. Если продукт хорошо растворим в воде, то выделение проводят методом экстракции подходящим растворителем. Таким образом, получают продукт с общей формулой (4).
На четвертой (iv) стадии проводят конденсацию соединения (4) с СН-кислотными соединениями общей формулы CH2(COOH)R3. Для этого соединение (4) и СН-кислотное соединение (1,1-1,5 экв.) растворяют в пиридине, а затем при перемешивании при комнатной температуре вносят в реакционную смесь каталитическое количество органического основания - амин (0,05-0,15 экв.), например, пиперидина. Полученную смесь кипятят при интенсивном перемешивании до окончания реакции. За окончанием реакции следят при помощи тонкослойной хроматографии до исчезновения исходного соединения (4). В среднем время прохождения реакции составляет от 2 до 60 часов. После окончания реакции смесь остужают до комнатной температуры, добавляют насыщенный хлороводородом диоксан (1-2 экв.) и перемешивают при комнатной температуре в течение 5-10 минут. Затем добавляют холодную воду в количестве, равном количеству использованного растворителя (пиридина), и экстрагируют подходящим растворителем. После концентрирования в вакууме, получают продукт с общей формулой (5), т.е. соединение формулы (I), где R2 означает ОН, R1, R3-R5 и X имеют вышеуказанные значения.
В последующем при необходимости осуществляют одну из двух модификаций полученного продукта (стадия (v) или (vi)):
(v) дегидратация соединения с последующим восстановлением двойной С=С связи. Продукт (5) полностью растворяют в безводном тетрагидрофуране и небольшими порциями при интенсивном перемешивании добавляют ацилирующий агент (1,05-1,50 экв.) с общей формулой (R6)2O, R6Cl или (R6)2SO4 и прочих агентов, пригодных для модификации гидрокси-группы. После полного прибавления, раствор перемешивают при комнатной температуре еще в течение 10-15 минут, добавляют холодную воду в количестве, равном количеству использованного растворителя и экстрагируют подходящим растворителем. После концентрирования в вакууме получают продукт с общей формулой (6), т.е. соединение формулы (I), где R2 означает OR6; R1, R3-R5, R7 и X имеют вышеуказанные значения.
(vi) модификация гидроксильной группы. Продукт (5) кипятят в растворе концентрированной соляной кислоты (не менее 12 экв.) до окончания реакции. За окончанием реакции следят при помощи тонкослойной хроматографии до исчезновения исходного соединения (5). В среднем время прохождения реакции составляет от 2 до 60 часов. После окончания реакции, смесь остужают до комнатной температуры, и промежуточный продукт выделяют фильтрованием с последующей промывкой водой 1-2 раза и сушкой на воздухе. Далее промежуточное соединение полностью растворяют в подходящем для гидрирования растворителе и проводят восстановление двойной связи путем каталитического гидрирования под действием водорода (давление 1-5 атм.), например, с использованием таких катализаторов как Pd, Pt, Ni-Ra и прочих катализаторов гидрирования двойной С=С связи. В качестве растворителя может быть использован любой растворитель, в котором промежуточный продукт полностью растворим, например, этилацетат, метанол, этанол и прочие. Гидрирование может проводиться как в большом объеме, так и в проточном реакторе, при этом в обоих случаях количество растворителя подбирается таким образом, чтобы соединение формулы (2) полностью растворилось; гидрирование проводиться до исчезновения следов исходного соединения, за чем следят методом тонкослойной хроматографии. Таким образом, получают продукт с общей формулой (6), т.е. соединение формулы (I), где R2 означает Н; R1, R3-R7 и X имеют вышеуказанные значения.
Вышеописанная схема для получения соединений формулы (I) может включать дополнительную стадию (vii) нитрования с одновременным удалением диоксалановой защиты в соединении (3), в котором R4=Н, с последующим повторением стадий (ii)-(vii). Таким образом, получают продукт с общей формулой (1), где R4=NHC(X)R7.
Реакция проводиться под действием нитрата калия или натрия в среде концентрированной серной кислоты. Для этого готовят раствор соединения (3) в концентрированной серной кислоте, затем остужая его до 0-5°С. К охлажденному раствору медленно при интенсивном перемешивании небольшими порциями добавляют нитрующий агент (нитрат калия или нитрат натрия, 1,1-1,5 экв.), не допуская нагревания смеси выше 5°С. После полного прибавления прекращают охлаждение смеси и продолжают перемешивание в течение 10-60 минут. Затем реакционную смесь выливают при перемешивании в лед (в количестве, достаточном для того, чтобы образовавшийся после раствор имел температуру не выше 30°С, на 1 мл серной кислоты приходится 2,5-5 г льда). Если продукт плохо растворим в воде, то образующийся осадок отфильтровывают, промывают 1-3 раза небольшим количеством холодной воды и сушат на воздухе. Если продукт хорошо растворим в воде, то выделение проводят методом экстракции подходящим растворителем.
В качестве подходящего для экстракции растворителя могут быть использованы, например, этилацетат, хлороформ, дихлорметан, бензол, толуол, диэтиловый эфир и прочие растворители, несмешивающиеся с водой.
Фармацевтически приемлемые кислотно-аддитивные соли могут быть образованы с неорганическими кислотами и органическими кислотами, например, соли ацетата, аспартата, бензоата, бесилата, бромида/гидробромида, бикарбоната/карбоната, бисульфата/сульфата, камфорсульфоната, хлорида/гидрохлорида, хлортеофиллината, цитрата, этандисульфоната, фумарата, глюцептата, глюконата, глюкуроната, гиппурата, гидройодида/йодида, изетионата, лактата, лактобионата, лаурилсульфата, малата, малеата, малоната, манделата, мезилата, метилсульфата, нафтоата, напсилата, никотината, нитрата, октадеканоата, олеата, оксалата, пальмитата, памоата, фосфата/гидрофосфата/дигидрофосфата, полигалактуроната, пропионата, стеарата, сукцината, сульфосалицилата, тартрата, тозилата и трифтораацетата.
Неорганические кислоты, из которых соли могут быть получены, включают, например, хлористоводородную кислоту, бромистоводородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и т.п.
Органические кислоты, из которых соли могут быть получены, включают, например, уксусную кислоту, пропионовую кислоту, гликолевую кислоту, щавелевую кислоту, малеиновую кислоту, малоновую кислоту, янтарную кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, толуолсульфоновую кислоту, сульфосалициловую кислоту и т.п.
Фармацевтически приемлемые соли настоящего изобретения могут быть синтезированы из основного или кислотного фрагмента, посредством общепринятых химических методов. Обычно, такие соли могут быть получены посредством взаимодействия свободных кислотных форм этих соединений со стехиометрическим количеством соответствующего основания (такого как гидроксид, карбонат, бикарбонат или т.п. Na, Са, Mg или K), или посредством взаимодействия свободных основных форм этих соединений со стехиометрическим количеством соответствующей кислоты. Такие реакции обычно проводят в воде или в органическом растворителе, или в смеси из обоих. Обычно, использование неводных сред, таких как эфир, этилацетат, этанол, изопропанол или ацетонитрил является желательным там, где это практически осуществимо. Перечни дополнительных подходящих солей могут быть найдены, например, в "Remington's Pharmaceutical Sciences", 20th ed., Mack Publishing Company, Easton, Pa., (1985); и в "Handbook of Pharmaceutical Salts: Properties, Selection, and Use" by Stahl and Wermuth (Wiley-VCH, Weinheim, Germany, 2002).
Предлагается применение соединения формулы (I) в качестве лиганда мелатониновых рецепторов, в частности в качестве ингибитора МТ3 подтипа мелатониновых рецепторов.
Предлагается применение соединения формулы (I) в качестве лекарственного средства для лечения заболеваний, опосредованных малетониновыми рецепторами, в том числе офтальмологических заболеваний.
Предлагается фармацевтическая композиция соединения формулы (I), которая может содержать эффективное количество соединения формулы (I) (вплоть до 75 масс %, предпочтительно вплоть до 30 масс %, более предпочтительно вплоть до 10 масс %, еще более предпочтительно до 0,1-0,5 масс %), а остальное - дополнительные фармацевтически приемлемые добавки: разбавители, растворители, стабилизаторы, регуляторы рН, буферы, антиоксиданты, консерванты, соединения, пролонгирующие действие препарата и др., например, выбранные из группы: вода, бензалкония хлорид, натрия гидрофосфат, натрия дигидрофосфата, натрия хлорид, натрия цитрат, натрия эдетат, натрия бисульфит, натрия тиосульфат, натрия карбонат, магния стеарат, маннитол, бензалкония хлорид, хлоргексидин, фенилэтиловый спирт, борная кислота, гиэтеллоза (гидроксиэтилцеллюлоза), гидроксиметилцеллюлоза, натрия гидроксид, лимонная кислота, полиэтиленгликоль, глицерин, декстроза, декстран 40, декстран 70, поливинилпирролидон, твин-80, крахмал, лактоза и прочие фармацевтически приемлемые носители и компоненты. Композиция может быть представлена в виде глазных капель, геля, мази, полимерной матрицы со включенным активным веществом и т.д. Композиция может также включать активное вещество в форме быстрого или замедленного/пролонгированного высвобождения, что может быть достигнуто методами известными специалистам в данной области. Предлагаемые фармацевтические композиции могут применяться для лечения заболеваний, опосредованных мелатониновыми рецепторами, в том числе офтальмологических заболеваний.
Офтальмологическими заболеваниями, при которых возможно применение предлагаемых соединений формулы (I), включают, но не ограничиваются следующими: заболевания, связанные с состоянием повышенного внутриглазного давления, например, глаукома, заболевания, связанные с окислительным стрессом, например, увеит.
Настоящее изобретение также относится к способу лечения пациента, страдающего заболеваниями, опосредованными мелатониновыми рецепторами, в том числе офтальмологическими, заключающемуся во введении терапевтически эффективного количества фармацевтической композиции нуждающемуся в этом пациенту. При этом введение осуществляется единоразово или через определенные промежутки времени таким образом, чтобы достигалась эффективная концентрация активного соединения в организме, которая позволяет получить необходимый биологический ответ. При этом частота и длительность использования зависит от характера и степени выраженности заболевания, а также может зависеть от индивидуальной чувствительности к препарату, веса, возраста и др. факторов.
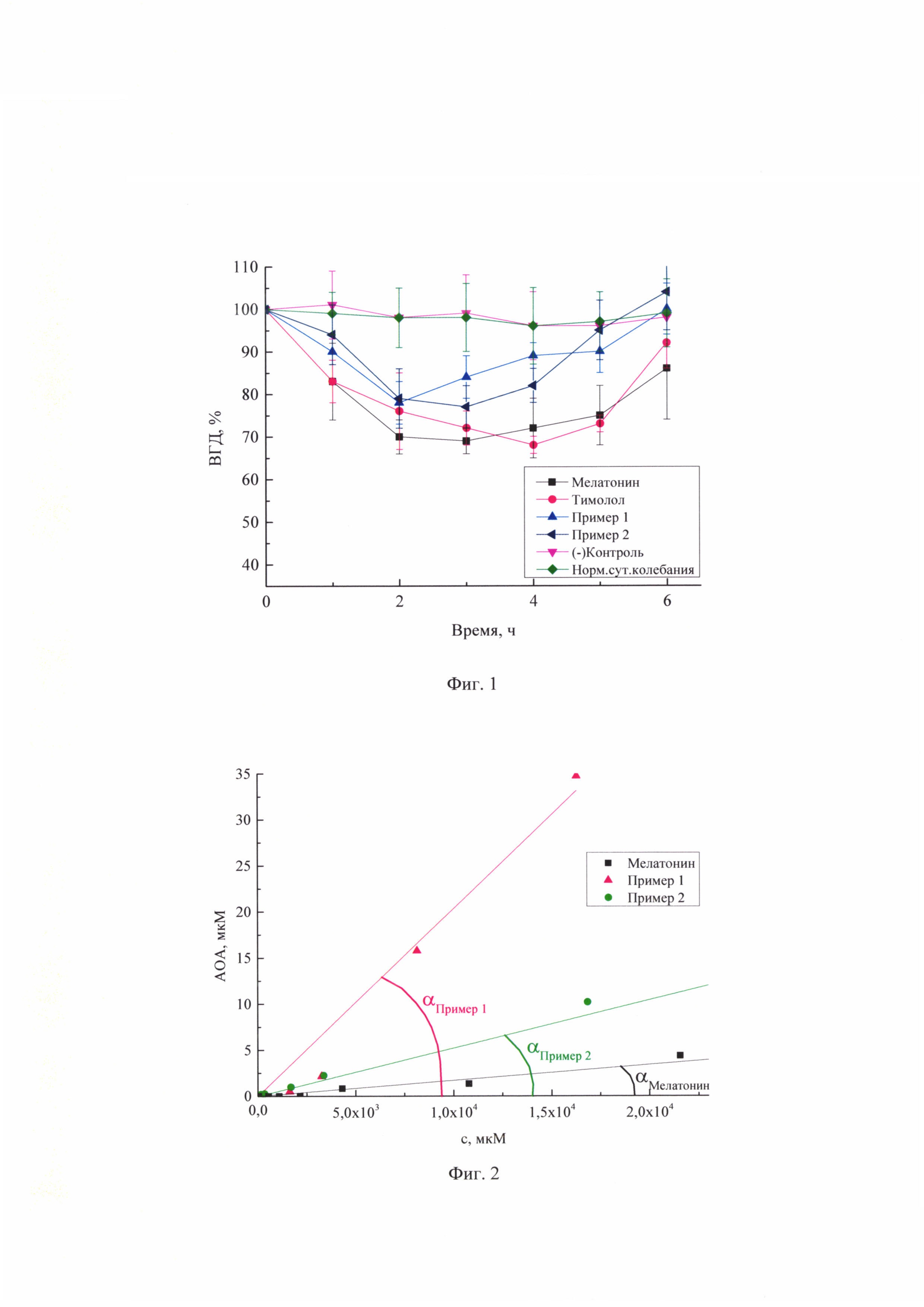
Краткое описание чертежей
На фиг. 1 представлена зависимость среднего снижения ВГД у нормотензивных кроликов под действием тимолола (






На фиг. 2 представлена зависимость АОА мелатонина (



Осуществление изобретения
Изобретение иллюстрируется следующими примерами:
Получение интермедиатов.
Синтез нитро-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-онов
(соединений формулы (2) на схеме (1))
Интермедиат 1
5'-нитро-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
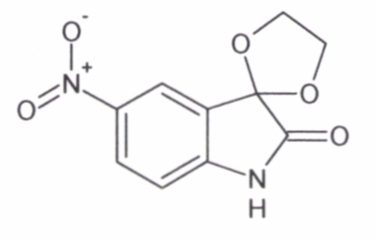
В колбу, снабженную насадкой Дина-Старка, поместили раствор 1 г (0,005 моль) 5-нитро-изатина, 4,6 мл (0,08 моль) этиленгликоля, 0,08 г (0,00004 моль) п-толуолсульфокислоты в толуоле (12 мл). Смесь кипятили до прекращения выделения воды (6 часов). Затем реакционную смесь остужают до комнатной температуры, добавили воду (12 мл). Выпавший осадок отфильтровывают и промывают водой и сушат на воздухе, Водную фракцию экстрагировали этилацетатом (3×15 мл), органические вытяжки объединяли, сшили над безводным сульфатом натрия. После удаления растворителя в вакууме, сухой остаток растирали с диэтиловым эфиром, отфильтровывали и сушили на воздухе. Полученный сухой продукт объединяли с первой фракцией осадка. Таким образом, был получен 5'-нитро-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 69% (0,85 г).
Т. пл. (эксп.)=215°С.
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 4,35 (с., 4Н), 7,05 (д., J=8,59, 1Н), 8,16 (д., J=2,27, 1Н), 8,27 (дд., J=2,40, J=8,59, 1Н), 11,16 (с., 1Н).
Интермедиат 2
7'-нитро-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
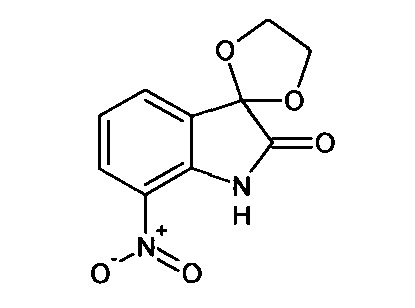
Синтез проводили аналогично интермедиату 1, используя 3 г (0,016 моль) 7-нитро-изатина, получали 7'-нитро-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 64% (2,37 г).
Т. пл. (эксп.)=207-208°С.
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 4,30-4,40 (м., 4Н), 7,24 (дд., J=7,20, J=8,59, 1H), 7,77 (дд., J=0,63, J=7,20, 1H), 8,12 (дд., J=1,01, J=8,59, 1H), 11,17 (с., 1Н).
ЯМР13С (ДМСО-d6, м.д.), основные сигналы: 66,38; 123,25; 126,90; 131,58.
ИК (KBr, см-1): 1119; 1322; 1346 (СН2); 1465; 1528; 1630 (NO2); 1762 (С=O); 3219 (NH).
Масс-спектр (электронный удар, 70 eV), m/z (I, %): 236 (41, М+), 219 (96), 208 (46), 191 (100), 175 (22), 161 (20), 147 (29), 131 (11), 117 (58), 106 (12), 90 (29), 75 (26), 63 (30), 43 (19), 30 (60).
Интермедиат 3
5'-метокси-7'-нитро-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он

Синтез проводили аналогично интермедиату 1, используя 3 г (0,014 моль) 5-метокси-7-нитро-изатина, получали 5'-метокси-7'-нитро-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 75% (2,68 г).
Т. пл. (эксп.)=170-172°С.
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 3,83 (с., 3Н), 4,28-4,40 (м., 4Н), 7,47 (д., J=2,15, 1H), 7,53 (д.,1=2,40, 1Н), 11,04(с.,1Н).
ЯМР13С (ДМСО-d6, м.д.): 56,76; 66,48; 100,10; 108,88; 120,51; 130,10; 131,90; 132,97; 155,21; 174,91.
ИК (KBr, см-1): 1272, 1546; 1485 (NO2), 1770 (С=O), 2847 (ОСН3), 3253 (NH).
Масс-спектр (электронный удар, 70 eV), m/z (I, %): 222 (83), 205 (68), 194 (41), 175 (58), 164 (38), 147 (37), 132 (21), 104 (65), 93 (47), 76 (35), 62 (32), 50 (31), 30 (100), 15 (70).
Интермедиат 4
5'-бром-7'-нитро-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
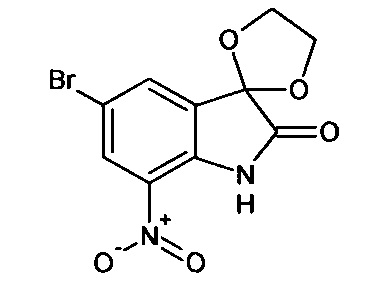
Синтез проводили аналогично интермедиату 1, используя 3 г (0,011 моль) 5-бром-7-нитро-изатина, получали 5'-бром-7'-нитро-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 82% (2,86 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 4.20 (с., 4Н), 7,66 (д., J=2,20, 1Н), 7,99 (д., J=2,20, 1H), 11,63 (с., 1Н).
Интермедиат 5
5'-нитро-7'-метил-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
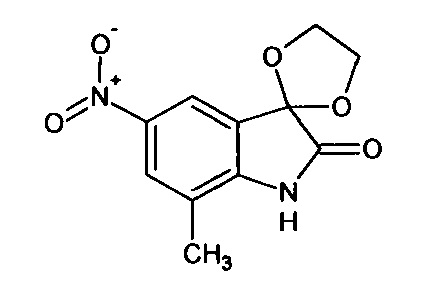
Синтез проводили аналогично интермедиату 1, используя 3 г (0,014 моль) 5-нитро-7-метил-изатина, получали 5'-нитро-7'-метил-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 76% (2,77 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 2,64 (с., 3Н); 3,98 (с., 4Н), 7,38 (д., J=2,20, 1H), 7,56 (д., J=2,20, 1H), 10,64 (с., 1Н).
Интермедиат 6
5-метоксикарбонил-7-нитро-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
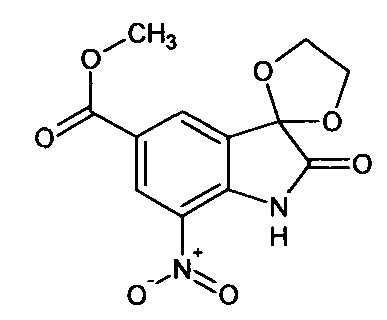
Синтез проводили аналогично интермедиату 1, используя 3 г (0,012 моль) 5-метоксикарбонил-7-нитро-изатина, получали 5'-метоксикарбонил-7'-нитро-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 54% (1,91 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 3,98 (с., 3Н), 4,46 (с., 4Н), 7,13 (с., 1H); 7,86 (с., 1H), 11,60 (с.,1Н).
Интермедиат 7
N-аллил-5'-нитро-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
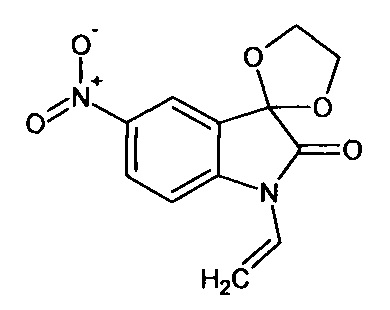
Синтез проводили аналогично интермедиату 1, используя 3 г (0,014 моль) N-аллил-5-нитро-изатина, получали N-аллил-5'-нитро-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 36% (1,30 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 4,02 (д., J=14,18, 1Н), 4,12 (д, J=8,44, 1Н), 4,22 (с., 4Н), 6,80-6,90 (м., 1Н), 7,05 (д., J=8,59, 1H), 8,16 (д., J=2,27, 1H), 8,27 (дд., J=2,40, J=8,59, 1Н).
Интермедиат 8
N-бензил-5'-нитро-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он

Синтез проводили аналогично интермедиату 1, используя 3 г (0,011 моль) N-бензил-5 -нитро-изатина, получали N-бензил-5'-нитро-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 55% (1,91 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 2,02 (с., 2Н), 4,22 (с., 4Н), 7,05 (д., J=8,59, 1Н), 7,32-7,42 (м., 2Н), 7,47-7,58 (м., 2Н), 7,64-7,77 (м., 1Н), 8,16 (д., J=2,27, 1Н), 8,27 (дд., J=2,40, J=8,59, 1Н).
Интермедиат 9
N-метил-5'-нитро-спиро[1,3-диюксалан-2,3'-индол]-2'(1'Н)-он
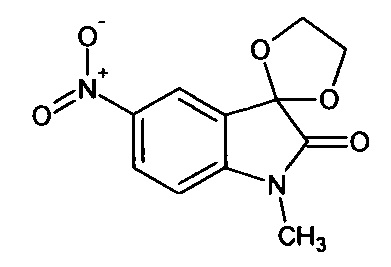
Синтез проводили аналогично интермедиату 1, используя 3 г (0,015 моль) N-метил-5-нитро-изатина, получали N-метил-5'-нитро-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 48% (1,75 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 2,02 (с., 3H), 4,22 (с., 4Н), 7,05 (д., J=8,59, 1Н), 8,16 (д., J=2,27, 1Н), 8,27 (дд., J=2,40, J=8,59, 1Н).
Интермедиат 10
5'-нитро-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
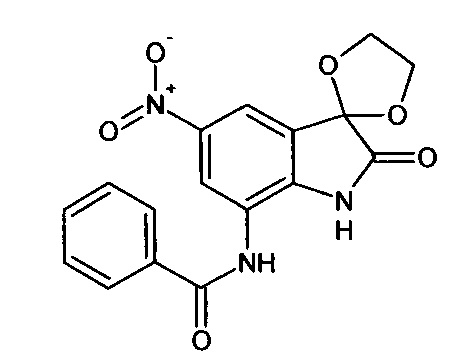
Синтез проводили аналогично интермедиату 1, используя 3 г (0,010 моль) 5-нитро-7-бензоиламино-изатина (интермедиат 78), получали 5'-нитро-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 50% (1,71 г).
ЯМР1Н (ДМСО-с16, м.д., J, Гц): 3,98 (с., 4Н), 6,68-6,78 (м., 2Н), 7,31 (м., 2Н), 7,59 (д., J=2,67, 1H), 7,87 (д., J=2,83, 1H), 7,91 (м., 1H), 10,20 (с., 1Н), 10,64 (с., 1Н).
Интермедиат 11
5'-нитро-7'-ацетиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
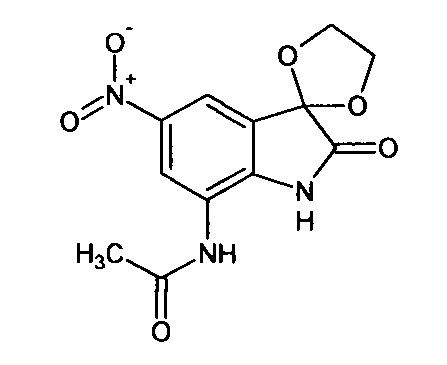
Синтез проводили аналогично интермедиату 1, используя 3 г (0,012 моль) 5-нитро-7-ацетиламино-изатина (интермедиат 79), получали 5'-нитро-7'-ацетиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 55% (1,94 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 2,02 (с., 3H), 3,98 (с., 4Н), 7,59 (д., J=2,67, 1Н), 7,87 (д., J=2,83, 1Н), 10,20 (с., 1Н), 10,64 (с., 1Н).
Интермедиат 12
5'-нитро-7'-метоксикарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он

Синтез проводили аналогично интермедиату 1, используя 3 г (0,011 моль) 5-нитро-7-метоксикарбониламино-изатина (интермедиат 79), получали 5'-нитро-7'-метоксикарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 50% (1,75 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 3,12 (с., 3H), 3,98 (с., 4Н), 7,59 (д., J=2,67, 1Н), 7,87 (д., J=2,83, 1H), 10,20 (с., 1Н), 10,64 (с., 1Н).
Интермедиат 13
5'-нитро-7'-циклопропилкарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
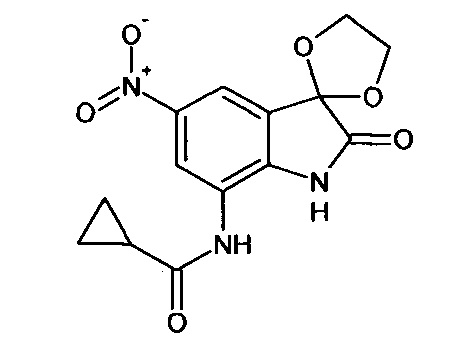
Синтез проводили аналогично интермедиату 1, используя 3 г (0,011 моль) 5-нитро-7-циклопропилкарбониламино-изатина (интермедиат 80), получали 5'-нитро-7'-циклопропилкарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 45% (1,57 г).
ЯМР1H (ДМСО-d6, м.д., J, Гц): 0,73-0.83 (м., 2Н), 1,01-1,11 (м., 2Н), 2,46-2,54 (м., 1H), 3,98 (с., 4Н), 7,59 (д., J=2,67, 1Н), 7,87 (д., J=2,83, 1Н), 10,20 (с., 1Н), 10,64 (с., 1H).
Интермедиат 14
5'-нитро-7'-(3-пиридин)аминокарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он

Синтез проводили аналогично интермедиату 1, используя 3 г (0,009 моль) 5-нитро-7-(3-пиридин)аминокарбониламино-изатина (интермедиат 81), получали 5'-нитро-7'-(3-пиридин)аминокарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 68% (2,31 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 3,98 (с., 4Н), 7,32-7,42 (м., 2Н), 7,59 (д., J=2,67, 1Н), 7,87 (д., J=2,83, 1Н), 8,01 (м., 2Н), 10,20 (с., 1Н), 10,33 (с., 1H), 10,64 (с., 1Н).
Интермедиат 15
5'-нитро-7'-фениламинокарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
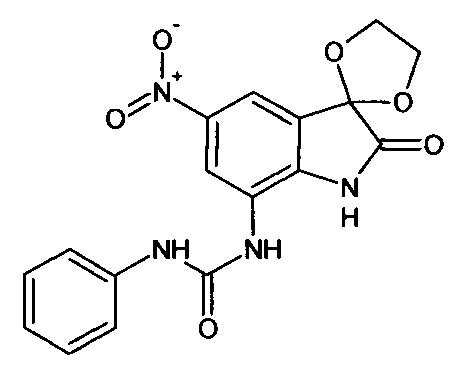
Синтез проводили аналогично интермедиату 1, используя 3 г (0,009 моль) 5-нитро-7-фениламинокарбониламино-изатина (интермедиат 82), получали 5'-нитро-7'-фениламинокарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 70% (2,38 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 3,98 (с., 4Н), 6,68-6,78 (м., 2Н), 7,31 (м., 2Н), 7,59 (д., J=2,67, 1H), 7,87 (д., J=2,83, 1Н), 7,91 (м., 1Н), 10,20 (с., 1H), 10,33 (с., 1H), 10,64 (с., 1H).
Восстановление нитро-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-онов
Интермедиат 16
5'-амино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
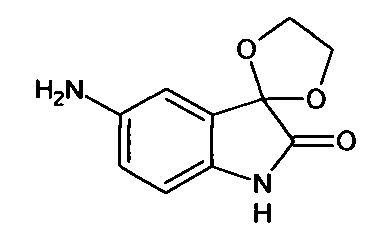
Раствор 0,2 г (0,0008 моль) 5'-нитро-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 1) в этилацетате (40 мл) подвергли гидрированию в поточном реакторе гидрирования H-Cube (Венгрия): скорость потока 1 мл/мин, давление Н2 3 атм., катализатор Pd/C (10%). После полного гидрирования растворитель был удален в вакууме роторного испарителя, был получен 5'-амино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 95% (0,17 г).
Т. пл. (эксп.)=203°С.
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 4,15-4,25 (м., 2Н), 4,27-4,37 (м., 2Н), 6,58 (с., 1H), 6,51 (с., 1H), 6,57-6,59 (м., 1H), 9,96 (с., 1H).
Интермедиат 17
7'-амино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
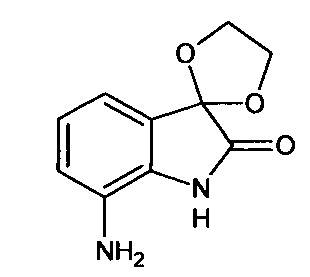
Синтез проводили аналогично интермедиату 16, используя 0,2 г (0,0008 моль) 7'-нитро-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 2), получали 7'-амино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 95% (0,17 г).
Т. пл. (эксп.)=205-210°С.
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 4,16-4,24 (м, 2Н), 4,28-4,36 (м., 2Н), 4,94 (с., 2Н), 6,66 (д., J=7,33, 1H), 6,64 (д., J=8,08, 1Н), 6,77 (т., J=7,70, 1Н), 9,95 (с., 1Н).
ЯМР13С(ДМСО-d6, м.д.): 113,09; 117,71; 123,57; 125,12; 128,14; 132,81; 174,72.
ИК (KBr, см-1): 1005; 1193; 1286; 1720 (С=O); 3062 (NH); 3330; 3391 (NH2).
Масс-спектр (электронный удар, 70 eV), m/z (I, %): 206 (66, М+), 189 (5), 178 (100), 161 (9), 147 (8), 133 (49), 117 (19), 106 (84), 105 (61), 79 (25), 52 (23), 45 (19), 29 (28).
Интермедиат 18
5'-метокси-7'-амино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
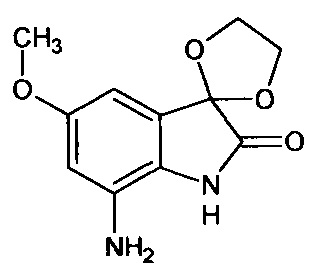
Синтез проводили аналогично интермедиату 16, используя 0,2 г (0,0007 моль) 5'-метокси-7'-нитро-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 3), получали 5'-метокси-7'-амино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 95% (0,17 г). ЯМР1Н (ДМСО-d6, м.д., J, Гц): 3,83 (с., 3H), 4,16-4,24 (м, 2Н), 4,28-4,36 (м., 2Н), 4,94 (с., 2Н),. 7,47 (д., 1H; J=2,15), 7,53 (д., 1H, J=2,40), 11,04 (с., 1Н).
Интермедиат 19
5'-бром-7'-амино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он

Синтез проводили аналогично интермедиату 16, используя 0,2 г (0,0006 моль) 5'-бром-7'-нитро-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 4), получали 5'-бром-7'-амино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 95% (0,16 г). ЯМР1Н (ДМСО-d6, м.д., J, Гц): 4,16-4,24 (м, 2Н), 4,28-4,36 (м., 2Н), 4,94 (с., 2Н),. 7,66 (д., J=2,20, 1Н), 7,99 (д., J=2,20, 1H), 11,63 (с., 1Н).
Интермедиат 20
5'-амино-7'-метил-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он

Синтез проводили аналогично интермедиату 16, используя 0,2 г (0,0008 моль) 5'-нитро-7'-метил-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 5), получали 5'-амино-7'-метил-спиро[1,3-диоксалан-2,3'-индол]-2'(ГН)-он с выходом 95% (0,17 г). ЯМР (ДМСО-с1б, м.д., J, Гц): 2,52 (с., 3H), 4,16-4,24 (м, 2Н), 4,28-4,36 (м., 2Н), 4,94 (с., 2Н),. 7,38 (д., J=2,20, 1Н), 7,56 (д., J=2,20, 1Н), 10,64 (с., 1Н).
Интермедиат 21
5'-метоксикарбонил-7'-амино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
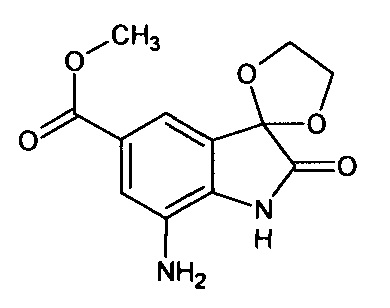
Синтез проводили аналогично интермедиату 16, используя 0,2 г (0,0007 моль) 5'-метоксикарбонил-7'-нитро-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 6), получали 5'-метоксикарбонил-7'-амино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 96% (0,17 г).
ЯМР1'Н (ДМСО-d6, м.д., J, Гц): 2,36 (с., 3H), 4,16-4,24 (м, 2Н), 4,28-4,36 (м., 2Н), 4,94 (уш.с., 2Н), 7,13 (с., 1H); 7,86 (с., 1H), 11,60 (с., 1Н).
Интермедиат 22
N-аллил-5'-амино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
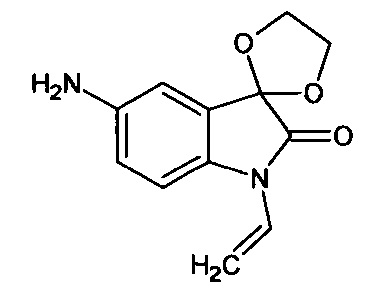
Синтез проводили аналогично интермедиату 16, используя 0,2 г (0,0008 моль) N-аллил-5'-нитро-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 7), получали N-аллил-5'-амино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 94% (0,17 г). ЯМР1Н (ДМСО-d6, м.д., J, Гц): 4,02 (д., J=14,18, 1Н), 4,12 (д, J=8,44, 1H), 3,58-4,16 (с., 4Н), 4,94 (уш.с., 2Н), 6,80-6,90 (м., 1H), 7,05 (д., J=8,59, 1Н), 8,16 (д., J=2,27, 1Н), 8,27 (дд., J=2,40, J=8,59, 1H).
Интермедиат 23
N-бензил-5'-амино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
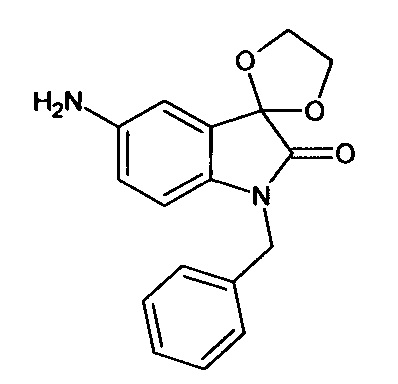
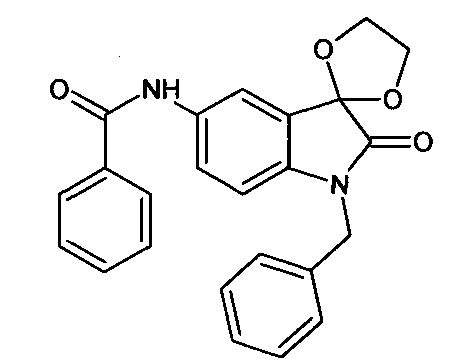
Синтез проводили аналогично интермедиату 16, используя 0,2 г (0,0006 моль) N-бензил-5'-нитро-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 8), получали N-бензил-5'-амино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 95% (0,17 г). ЯМР1Н (ДМСО-d6, м.д., J, Гц): 2,02 (с., 2Н), 3,57-4,09 (с., 4Н), 4,94 (уш.с., 2Н), 7,05 (д., J=8,59, 1H), 7,32-7,42 (м., 2Н), 7,47-7,58 (м., 2Н), 7,64-7,77 (м., 1H), 8,16 (д., J=2,27, 1H), 8,27 (дд., J=2,40, J=8,59, 1Н).
Интермедиат 24
N-метил-5'-амино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
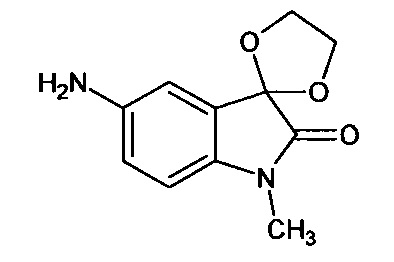
Синтез проводили аналогично интермедиату 16, используя 0,2 г (0,0008 моль) N-метил-5'-нитро-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 9), получали N-метил-5'-амино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 98% (0,17 г). ЯМР1Н (ДМСО-d6, м.д., J, Гц): 2,02 (с., 3H), 3,68-4,15 (с., 4Н), 4,94 (уш.с., 2Н), 7,05 (д., J=8,59, 1Н), 8,16 (д., J=2,27, 1H), 8,27 (дд., J=2,40, J=8,59, 1Н).
Интермедиат 25
5'-амино-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
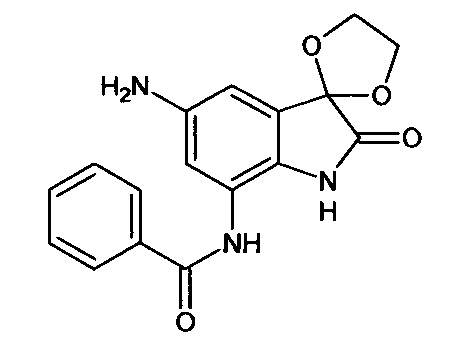
Синтез проводили аналогично интермедиату 16, используя 0,2 г (0,0006 моль) 5'-нитро-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 10), получали 5'-амино-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 95% (0,17 г).
ЯМР1H (ДМСО-d6, м.д., J, Гц): 3,58-4,16 (м., 4Н), 4,91 (уш.с., 2Н), 6,68-6,78 (м., 2Н), 7,31 (м., 2Н), 7,59 (д., J=2,67, 1Н), 7,87 (д., J=2,83, 1Н), 7,91 (м., 1H), 10,20 (с., 1H), 10,64 (с., 1Н).
Интермедиат 26
5'-амино-7'-ацетиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он

Синтез проводили аналогично интермедиату 16, используя 0,2 г (0,0007 моль) 5'-нитро-7,-ацетиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 11), получали 5'-амино-7'-ацетиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(ГН)-он с выходом 98% (0,18 г).
ЯМР1H (ДМСО-d6, м.д., J, Гц): 2,02 (с., 3H), 3,56-4,14 (м., 4Н), 4,93 (уш.с., 2Н), 7,59 (д., J=2,67, 1H), 7,87 (д., J=2,83, 1H), 10,20 (с., 1Н), 10,64 (с., 1Н).
Интермедиат 27
5'-амино-7'-метоксикарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
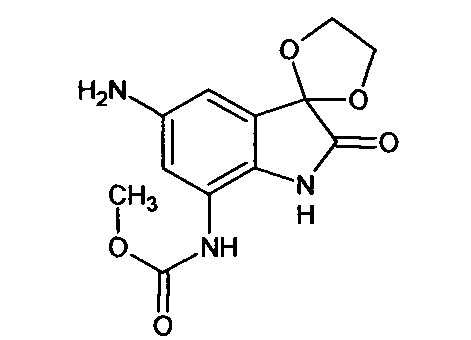
Синтез проводили аналогично интермедиату 16, используя 0,2 г (0,0006 моль) 5'-нитро-7'-метоксикарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 12), получали 5'-амино-7'-метоксикарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 97% (0,18 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 3,12 (с., 3H), 3,54-4,10 (м., 4Н), 4, 92 (уш.с., 2Н), 7,59 (д., J=2,67, 1Н), 7,87 (д., J=2,83, 1Н), 10,20 (с., 1Н), 10,64 (с., 1Н).
Интермедиат 28
5'-амино-7'-циклопропилкарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
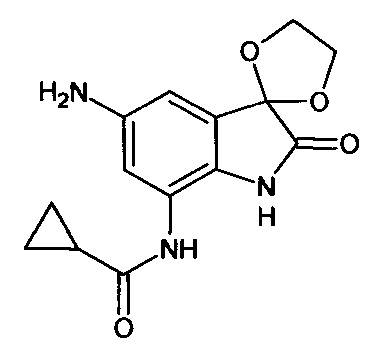
Синтез проводили аналогично интермедиату 16, используя 0,2 г (0,0006 моль) 5'-нитро-7'-циклопропилкарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 13), получали 5'-амино-7'-циклопропилкарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 95% (0,17 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 0,73-0.83 (м., 2Н), 1,01-1,11 (м., 2Н), 2,46-2,54 (м., 1Н), 3,54-4,14 (м., 4Н), 4, 89 (уш.с., 2Н), 7,59 (д., J=2,67, 1H), 7,87 (д., J=2,83, 1Н), 10,20 (с., 1H), 10,64 (с., 1Н).
Интермедиат 29
5'-амино-7'-(3-пиридин)аминокарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
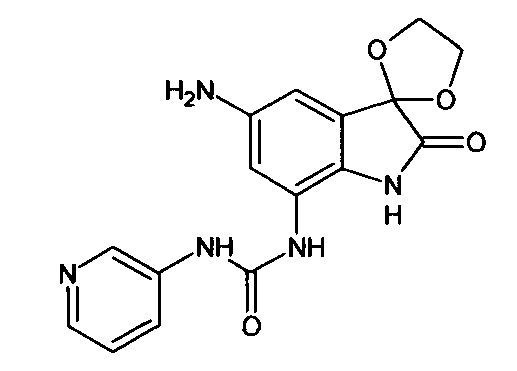
Синтез проводили аналогично интермедиату 16, используя 0,2 г (0,0005 моль) 5'-нитро-7'-(3-пиридин)аминокарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 14), получали 5'-амино-7'-(3-пиридин)аминокарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 95% (0,17 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 3,58-4,16 (м., 4Н), 4,88 (уш.с., 2Н), 7,32-7,42 (м., 2Н), 7,59 (д., J=2,67, 1H), 7,87 (д., J=2,83, 1Н), 8,01 (м., 2Н), 10,20 (с., 1H), 10,33 (с., 1Н), 10,64 (с., 1Н).
Интермедиат 30
5'-амино-7'-фениламинокарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
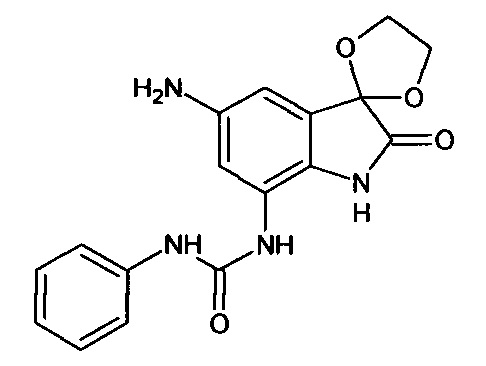
Синтез проводили аналогично интермедиату 16, используя 0,2 г (0,0005 моль) 5'-нитро-7'-фениламинокарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 15), получали 5'-амино-7'-фениламинокарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 98% (0,18 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 3,80-4,16 (м., 4Н), 4,94 (уш.с., 2Н), 6,68-6,78 (м., 2Н), 7,31 (м., 2Н), 7,59 (д., J=2,67, 1Н), 7,87 (д., J=2,83, 1H), 7,91 (м., 1Н), 10,20 (с., 1H), 10,33 (с., 1Н), 10,64 (с., 1H).
Ацилирование амино-спиро [1,3-диоксалан-2,3'-индол]-2'(1'Н)-онов (синтез соединений формулы (3) на схеме)
Интермедиат 31
5'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он

К раствору 0.2 г (0,001 моль) 5'-амино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'H)-она (интермедиат 16) и 0,14 мл (0,001 моль) триэтиламина в безводном тетрагидрофуране (6 мл) было медленно прикапано 0,11 мл (0,001 моль) бензоилхлорида. После полного прибавления, реакционную смесь перемешивали в течение 10 минут, затем добавляли 6 мл холодной воды. Продукт выделяли экстракцией этилацетатом (3×15 мл), органические вытяжки объединяли, сушили над безводным сульфатом натрия. После удаления растворителя в вакууме, был получен 5'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 70% (0,21 г).
Т. пл. (эксп.)=210°С.
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 4,23-4,32 (м., 2Н), 4,34-4,42 (м., 2Н), 6,84 (д., J=8,34, 1Н), 7,47-7,60 (м., 3H), 7,67 (дд., J=2,15, J=8,34, 1Н), 7,84 (д., J=1,89, 1Н), 7,91-8,00 (м., 2H), 10,21 (с., 1Н), 10,43 (с., 1H).
ЯМР13С (ДМСО-d6, м.д.): 65,93; 110,90; 118,47; 124,18; 124,99; 128,01; 128,86; 132,00; 134,67; 135,23; 139,08; 165,71; 175,01.
Масс-спектр (электронный удар, 70 eV), m/z (I, %): 310 (18, М+), 282 (64), 238 (1), 210 (2), 177 (16), 133 (33), 106 (13), 105 (100), 77 (78), 51 (13), 28 (4).
Интермедиат 32
5'-(2-фуроил)амино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он

Синтез проводили аналогично интермедиату 31, используя 0,2 г (0,001 моль) 5'-амино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 16) и 0,09 мл (0,001 моль) 2-фуроилхлорида, получили 5'-(2-фуроил)амино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 65% (0,17 г).
Т. пл. (эксп.)=169°С.
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 4,20-4,30 (м., 2Н), 4,30-4,40 (м., 2Н), 6,68 (дд., J=1,59, J=3,30, 1Н), 6,82 (д., J=8,44, 1H), 7,29 (д., J=3,06, 1H), 7,63 (дд., J=1,96, J=8,44, 1H), 7,77 (д., J=1,59, 1H), 7,91 (уш.с., 1H), 10.14 (с., 1H), 10.42 (с., 1H).
ЯМР13C (ДМСО-d6, м.д.): 65,92; 102,25; 110,95; 112,59; 115,00; 118,44; 124,19; 125,02; 133,98; 139,15; 146,12; 147,89; 156,51; 174,96. ИК (KBr, см-1): 1200, 1212, 1655, 1736, 3127, 3278.
Масс-спектр (электронный удар, 70 eV), m/z (I, %): 300 (15, М+), 272 (50), 228 (2), 200 (2), 177 (13), 144 (6), 133 (30), 105 (16), 95 (100), 52 (9), 39 (26), 29 (10).
Интермедиат 33
7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он

Синтез проводили аналогично интермедиату 31, используя 0,2 г (0,001 моль) 7'-амино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 17) и 0,17 мл (0,001 моль) бензоилхлорида, получили 7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 65% (0,20 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 3,60-4,15 (м., 4Н), 7,06 (т., J=7,34, 1H), 7,34 (д., J=7,09, 1H), 7,44-7,62 (м., 3H), 8,00 (д., J=7,09, 2Н), 8,89 (д., J=5,14, 1Н), 9,96 (с., 1H), 10,53 (с., 1H).
Интермедиат 34
7'-ацетиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он

Синтез проводили аналогично интермедиату 31, используя 0,2 г (0,001 моль) 7-амино-изатина (интермедиат 17) и 0,10 мл (0,001 моль) уксусного ангидрида, получали 7'-ацетиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 55% (0,13 г). ЯМР1Н (ДМСО-d6, м.д., J, Гц): 2,02 (с., 3H), 3,98 (с., 4Н), 7,06 (т., J=7,34, 1H), 7,34 (д., J=7,09, 1Н), 8,00 (д., J=7,09, 1Н), 10,20 (с., 1H), 10,64 (с., 1Н).
Интермедиат 35
7'-метоксикарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
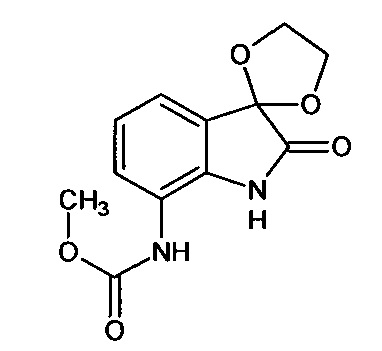
Синтез проводили аналогично интермедиату 31, используя 0,2 г (0,001 моль) 7-амино-изатина (интермедиат 17) и 0,08 мл (0,001 моль) метил хлорформата, получали 7'-метоксикарбониламино-спиро[1,3-Диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 60% (0,15 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 3,12 (с., 3H), 3,98 (с., 4Н), 7,06 (т., J=7,34, 1H), 7,34 (д., J=7,09, 1Н), 8,00 (д., J=7,09, 1H), 10,20 (с., 1Н), 10,64 (с., 1Н).
Интермедиат 36
7'-циклопропи лкарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
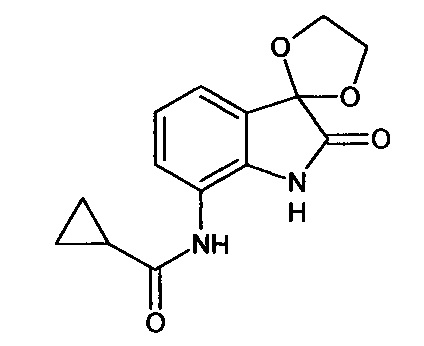
Синтез проводили аналогично интермедиату 31, используя 0,2 г (0,001 моль) 7-амино-изатина (интермедиат 17) и 0,09 мл (0,001 моль) циклопропилкарбонил хлорида, получали 7'-циклопропилкарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 55% (0,15 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 0,73-0.83 (м., 2Н), 1,01-1,11 (м., 2Н), 2,46-2,54 (м., 1Н), 3,98 (с., 4Н), 7,06 (т., J=7,34, 1H), 7,34 (д., J=7,09, 1Н), 8,00 (д., J=7,09, 1Н), 10,20 (с., 1H), 10,64 (с., 1H).
Интермедиат 37
7'-(3-пиридин)аминокарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он

Синтез проводили аналогично интермедиату 31, используя 0,2 г (0,001 моль) 7-амино-изатина (интермедиат 17) и 0,12 г (0,001 моль) пиридин-3-изоцианата, получали 7'-(3-пиридин)аминокарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 68% (0,22 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 3,98 (с., 4Н), 7,32-7,42 (м., 2Н), 7,06 (т., J=7,34, 1Н), 7,34 (д., J=7,09, 1Н), 8,00 (д., J=7,09, 2Н), 8,08 (м., 1H), 10,20 (с., 1H), 10,33 (с., 1Н), 10,64 (с., 1H).
Интермедиат 38
7'-фениламинокарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
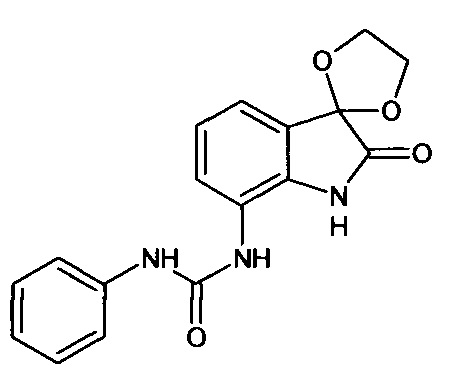
Синтез проводили аналогично интермедиату 31, используя 0,2 г (0,001 моль) 7-амино-изатина (интермедиат 17) и 0,11 мл (0,001 моль) фенилизоцианата, получали 7'-фениламинокарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 70% (0,22 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 3,98 (с., 4Н), 6,68-6,78 (м., 2Н), 7,31 (м., 2Н), 7,06 (т., J=7,34, 1Н), 7,34 (д., J=7,09, 1Н), 7,91 (м., 1Н), 8,00 (д., J=7,09, 1H), 10,20 (с., 1H), 10,33 (с., 1H), 10,64 (с., 1Н).
Интермедиат 39
N-аллил-5'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
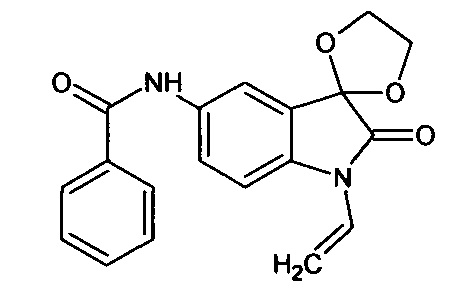
Синтез проводили аналогично интермедиату 31, используя 0,2 г (0,0009 моль) N-аллил-5'-амино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 22) и 0,10 мл (0,0009 моль) бензоилхлорида, получили N-аллил-5'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 75% (0,22 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 3,62-4,10 (м., 4Н), 4, 22 (д., J=14,18, 1H), 4,44 (д, J=8,44, 1H), 6,80-6,90 (м., 1H), 7,45-7,60 (м., 3H), 7,63-7,74 (м., 1Н), 7,81 (дд., J=8,30, J=14,20, 1Н), 7,85-8,05 (м., 3H), 10,26 (с., 1Н).
Интермедиат 40
N-бензил-5'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
Синтез проводили аналогично интермедиату 31, используя 0,2 г (0,0007 моль) N-бензил-5'-амино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 23) и 0,08 мл (0,0007 моль) бензоилхлорида, получили N-бензил-5'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 73% (0,20 г). ЯМР1Н (ДМСО-d6, м.д., J, Гц): 2,02 (с., 2Н), 3,57-4,09 (с., 4Н), 6,80-6,90 (м., 1Н), 7,05 (д., J=8,59, 1H), 7,32-7,42 (м., 2Н), 7,47-7,62 (м., 5Н), 7,65-7,77 (м., 2Н), 8,16 (д., J=2,27, 1Н), 8,27 (дд., J=2,40, J=8,59, 1H), 10,26 (с., 1Н).
Интермедиат 41
N-метил-5'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
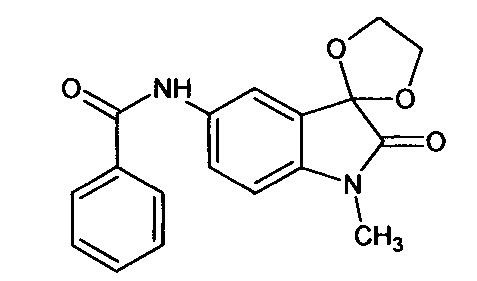
Синтез проводили аналогично интермедиату 31, используя 0,2 г (0,0009 моль) N-метил-5'-амино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 24) и 0,11 мл (0,0009 моль) бензоилхлорида, получили N-метил-5'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 70% (0,21 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 3,17 (с., 3H), 3,55-4,16 (м., 4Н), 6,80-6,90 (м., 1Н), 7,45-7,60 (м., 3H), 7,63-7,74 (м., 1Н), 7,85-8,05 (м., 3H), 10,26 (с., 1H).
Интермедиат 42
5'-метокси-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
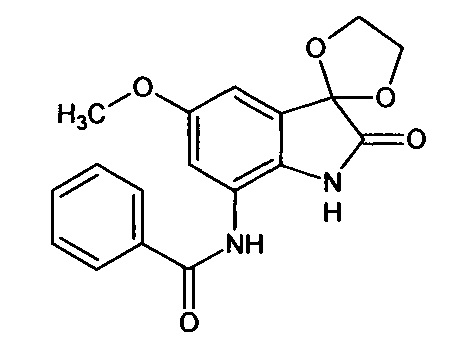
Синтез проводили аналогично интермедиату 31, используя 0,2 г (0,0008 моль) 5'-метокси-7'-амино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 18) и 0,10 мл (0,0008 моль) бензоилхлорида, получили 5'метокси-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 60% (0,17 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 3,45 (с., 3H), 3,58-4,16 (м., 4Н), 6,80-6,90 (м., 1H), 7,34-7,56 (м., 3H), 7,59 (д., J=2,67, 1Н), 7,63-7,80 (м., 1Н), 7,88 (д., J=2,71, 1Н), 10,26 (с., 1Н), 10, 53 (с., 1H).
Интермедиат 43
5'-бромо-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
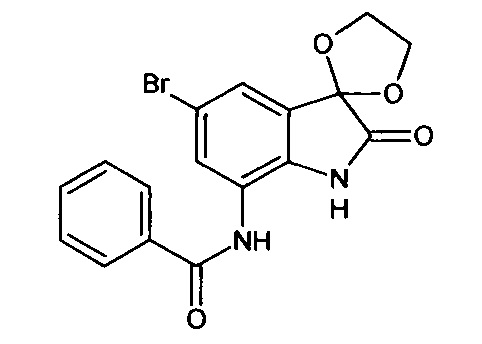
Синтез проводили аналогично интермедиату 31, используя 0,2 г (0,0007 моль) 5'-бромо-7'-амино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 19) и 0,09 мл (0,0007 моль) бензоилхлорида, получили 5'-бромо-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 80% (0,22 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 3,60-4,15 (м., 4Н), 6,80-6,90 (м., 1Н), 7,34-7,56 (м., 3H), 7,59 (д., J=2,67, 1Н), 7,63-7,80 (м., 1Н), 7,88 (д., J=2,71, 1Н), 10,26 (с., 1H), 10, 53 (с., 1Н).
Интермедиат 44
5'-бензоиламино-7'-метил-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
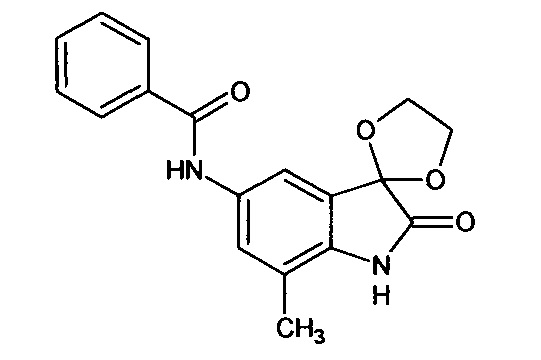
Синтез проводили аналогично интермедиату 31, используя 0,2 г (0,0009 моль) 5'-амино-7'-метил-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 20) и 0,11 мл (0,0009 моль) бензоилхлорида, получили 5'-бензоиламино-7'-метил-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 75% (0,22 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 2,31 (с., 1Н), 3,57-4,10 (м., 4Н), 6,80-6,90 (м., 1H), 7,34-7,56 (м., 3H), 7,59 (д., J=2,67, 1H), 7,63-7,80 (м., 1H), 7,88 (д., J=2,71, 1Н), 10,26 (с., 1H), 10, 53 (с., 1H).
Интермедиат 45
5'-метоксикарбонил-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
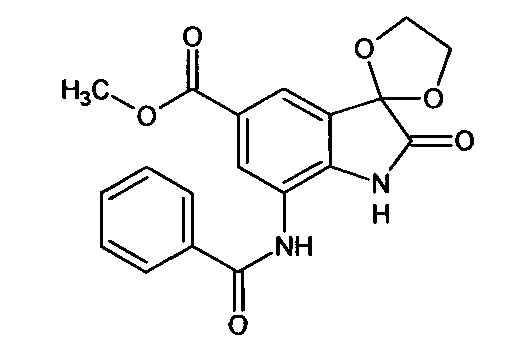
Синтез проводили аналогично интермедиату 31, используя 0,2 г (0,0008 моль) 5'-метоксикарбонил-7'-амино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 21) и 0,09 мл (0,0008 моль) бензоилхлорида, получили 5'-метоксикарбонил-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 70% (0,20 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 3,22 (с., 3H), 3,66-4,18 (м., 4Н), 6,80-6,90 (м., 1Н), 7,34-7,56 (м., 3H), 7,59 (д., J=2,67, 1Н), 7,63-7,80 (м., 1Н), 7,88 (д., J=2,71, 1H), 10,26 (с., 1Н), 10, 53 (с., 1H).
Интермедиат 46
5'-циклопропилкарбоинламино-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
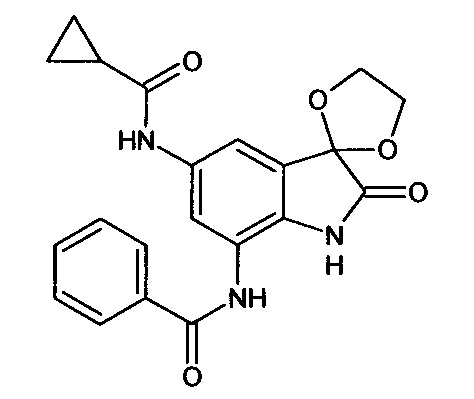
Синтез проводили аналогично интермедиату 31, используя 0,2 г (0,0006 моль) 5'-амино-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 25) и 0,06 мл (0,0006 моль) циклопропилкарбонилхлорида, получили 5'-циклопропилкарбоинламино-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 60% (0,15 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 0,73-0.83 (м., 2Н), 1,01-1,11 (м., 2Н), 2,46-2,54 (м., 1Н), 3,56-4,10 (м., 4Н), 6,80-6,90 (м., 1Н), 7,34-7,56 (м., 3H), 7,59 (д., J=2,67, 1Н), 7,63-7,80 (м., 1Н), 7,88 (д., J=2,71, 1H), 10,26 (с., 1H), 10,33 (с., 1Н), 10, 53 (с., 1Н).
Интермедиат 47
5'-метиламинотиокарбониламино-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
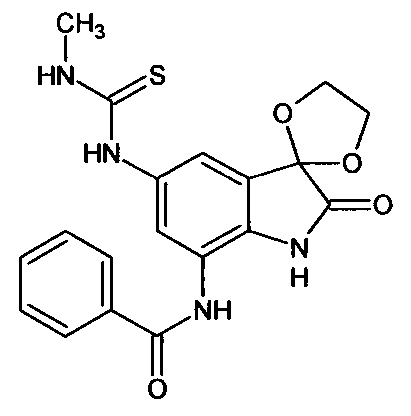
Синтез проводили аналогично интермедиату 31, используя 0,2 г (0,0006 моль) 5'-амино-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 25) и 0,04 мл (0,0006 моль) метилизотиоцианата, получили 5'-метиламинотиокарбониламино-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 75% (0,18 г). ЯМР1Н (ДМСО-d6, м.д., J, Гц): 3,17 (с., 3H), 3,55-4,15 (м., 4Н), 6,68-6,78 (м., 2Н), 7,31 (м., 2Н), 7,59 (д., J=2,67, 1Н), 7,87 (д., J=2,83, 1H), 7,91 (м., 1H), 10,20 (с., 1Н), 10,33-10,42 (м., 2Н), 10,53 (с., 1H).
Интермедиат 48
5'-трифторметиламинокарбониламино-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он

Синтез проводили аналогично интермедиату 31, используя 0,2 г (0,0006 моль) 5'-амино-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 25) и 0,05 мл (0,0006 моль) трифторметилизоцианата, получили 5'-трифторметиламинокарбониламино-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 75% (0,21 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 3,66-4,22 (м., 4Н), 6,80-6,90 (м., 1Н), 7,34-7,56 (м., 3H), 7,59 (д., J=2,67, 1H), 7,63-7,80 (м., 1H), 7,88 (д., J=2,71, 1Н), 10,26 (с., 1H), 10,33-10,39 (м.,2Н), 10, 53 (с., 1Н).
Интермедиат 49
5'-циклопропиламинокарбониламино-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
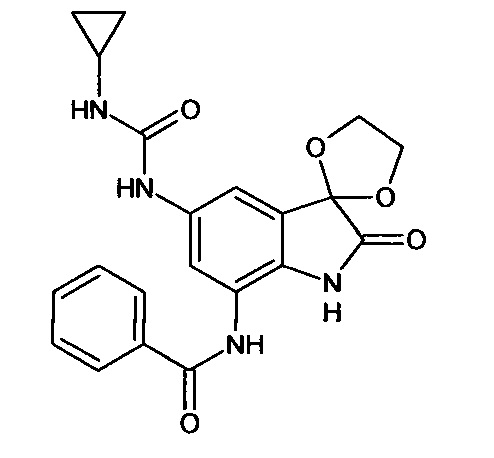
Синтез проводили аналогично интермедиату 31, используя 0,2 г (0,0006 моль) 5'-амино-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 25) и 0,06 мл (0,0006 моль) циклопропилизоцианата, получили 5'-циклопропиламинокарбониламино-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 70% (0,18 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 0,73-0.83 (м., 2Н), 1,01-1,11 (м., 2Н), 2,46-2,54 (м., 1H), 3,56-4,12 (м., 4Н), 6,80-6,90 (м., 1H), 7,34-7,56 (м., 3H), 7,59 (д., J=2,67, 1Н), 7,63-7,80 (м., 1H), 7,88 (д., J=2,71, 1Н), 10,26 (с., 1Н), 10,33 (с., 1Н), 10, 53 (с., 1H).
Интермедиат 50
5'-трифторацетиламино-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
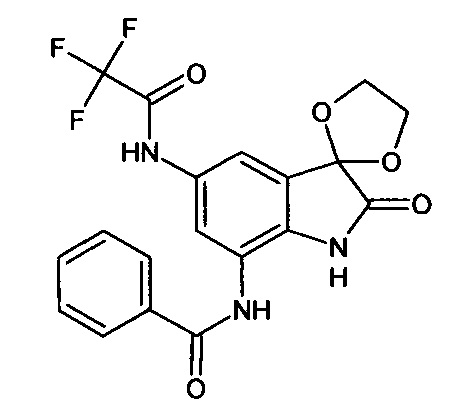
Синтез проводили аналогично интермедиату 31, используя 0,2 г (0,0006 моль) 5'-амино-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 25) и 0,09 мл (0,0006 моль) трифторацетангидрида, получили 5'-трифторацетиламино-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 80% (0,21 г). ЯМР1H (ДМСО-d6, м.д., J, Гц): 3,54-4,10 (м., 4Н), 6,80-6,90 (м., 1H), 7,34-7,56 (м., 3H), 7,59 (д., J=2,67, 1H), 7,63-7,80 (м., 1Н), 7,88 (д., J=2,71, 1Н), 10,26 (с., 1Н), 10,33 (с., 1Н), 10, 53 (с., 1Н).
Интермедиат 51
5'-бензоиламино-7'-ацетиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
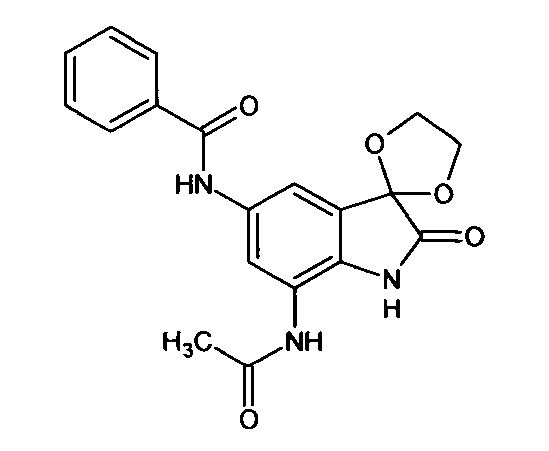
Синтез проводили аналогично интермедиату 31, используя 0,2 г (0,0008 моль) 5'-амино-7'-ацетиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 26) и 0,09 мл (0,0008 моль) бензоилхлорида, получили 5'-бензоиламино-7'-ацетиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 85% (0,24 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 2,07 (с., 1H), 3,56-4,10 (м., 4Н), 6,80-6,90 (м., 1H), 7,34-7,56 (м., 3H), 7,59 (д., J=2,67, 1H), 7,63-7,80 (м., 1Н), 7,88 (д., J=2,71, 1Н), 10,26 (с., 1H), 10,33 (с., 1Н), 10, 53 (с., 1H).
Интермедиат 52
5'-феноксикарбониламино-7'-ацетиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
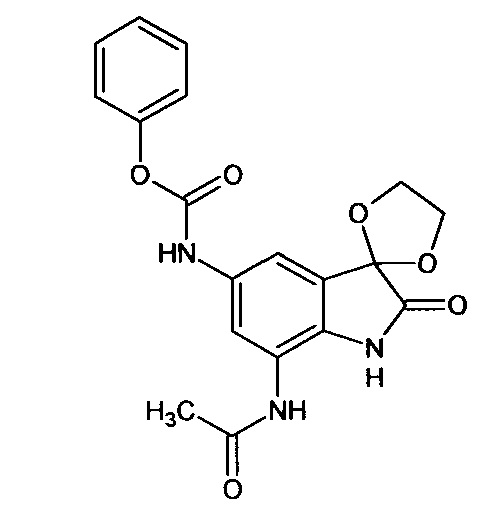
Синтез проводили аналогично интермедиату 31, используя 0,2 г (0,0008 моль) 5'-амино-7'-ацетиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 26) и 0,10 мл (0,0008 моль) феноксикарбонилхлорида, получили 5'-феноксикарбониламино-7'-ацетиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 75% (0,22 г). ЯМР1H (ДМСО-d6, м.д., J, Гц): 2,07 (с., 3H), 3,56-4,18 (м., 4Н), 6,80-6,90 (м., 1Н), 7,34-7,56 (м., 3H), 7,59 (д., J=2,67, 1H), 7,63-7,80 (м., 1Н), 7,88 (д., J=2,71, 1H), 10,26 (с., 1H), 10,33 (с.ДН), 10, 53 (с., 1Н).
Интермедиат 53
5'-(2-тиофен)карбониламино-7'-метоксикарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
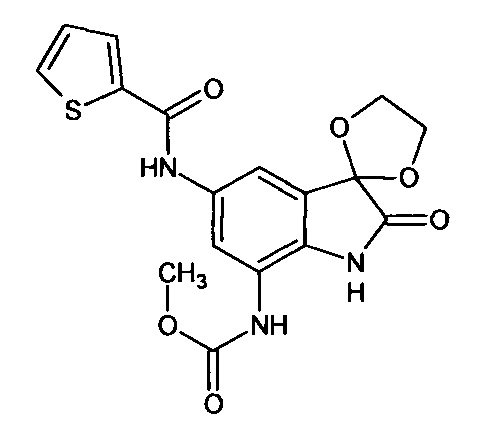
Синтез проводили аналогично интермедиату 31, используя 0,2 г (0,0007 моль) 5'-амино-7'-метоксикарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 27) и 0,08 мл (0,0007 моль) (2-тиофен)карбонилхлорида, получили 5'-(2-тиофен)карбониламино-7'-метоксикарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 65% (0,18 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 3,17 (с., 3H), 3,55-4,12 (м., 4Н), 6,68 (дд., J=1,71, J=3,42, 1Н), 7,31 (д., J=3,42, 1Н), 7,59 (д., J=2,67, 1H), 7,87 (д., J=2,83, 1H), 7,91 (д., J=0,86, 1H), 10,20 (е., 1H), 10,33 (c., 1H), 10,53 (с, 1H).
Интермедиат 54
5'-(2-пиридин)карбониламино-7'-циклопропилкарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
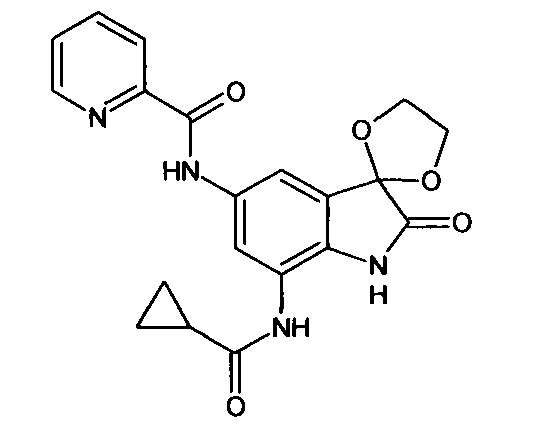
Синтез проводили аналогично интермедиату 31, используя 0,2 г (0,0007 моль) 5'-амино-7'-циклопропилкарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 28) и 0,13 г (0,0007 моль) (2-пиридин)карбонилхлорида, получили 5'-(2-пиридин)карбониламино-7'-циклопропилкарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 75% (0,20 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 0,73-0.83 (м., 2Н), 1,01-1,11 (м., 2Н), 2,46-2,54 (м., 1Н), 3,55-4,16 (м., 4Н), 6,68 (дд., J=1,71, J=3,42, 1Н), 7,31 (д., J=3,42, 1H), 7,59 (д., J=2,67, 1H), 7,87 (д., J=2,83, 1H), 7,91-8,16 (м., 5H), 10,20 (с., 1H), 10,33 (с., 1Н), 10,53 (с., 1H).
Интермедиат 55
5',7'-бис(фениламинокарбониламино)-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
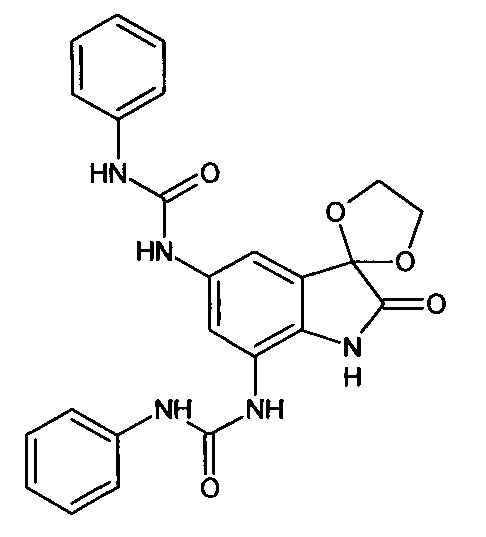
Синтез проводили аналогично интермедиату 31, используя 0,2 г (0,0006 моль) 5'-амино-7'-фениламинокарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 30) и 0,07 мл (0,0007 моль) фенилизоцианата, получили 5',7'-бис(фениламинокарбониламино)-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 80% (0,22 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 3,66-4,25 (м., 4Н), 6,80-6,90 (м., 2Н), 7,34-7,56 (м., 6Н), 7,59 (д., J=2,67, 1H), 7,63-7,80 (м., 2Н), 7,88 (д., J=2,71, 1H), 10,26-10,30 (м., 2Н), 10,33-10,39 (м., 2Н), 10, 53 (с., 1Н).
Интермедиат 56
5',7'-бис((3-пири дин)аминокарбониламино)-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он
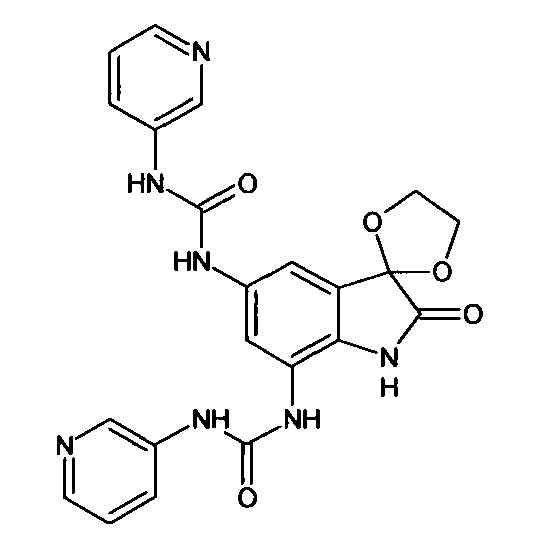
Синтез проводили аналогично интермедиату 31, используя 0,2 г (0,0006 моль) 5'-амино-7'-(3-пиридин)аминокарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 29) и 0,07 г (0,0007 моль) (3-пиридин)изоцианата, получили 5',7'-бис((3-пиридин)аминокарбониламино)-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-он с выходом 85% (0,23 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 3,56-4,16 (м., 4Н), 7,43-7,55 (м., 4Н), 7,59 (д., J=2,67, 1Н), 7,69-7,81 (м., 4Н), 7,88 (д., J=2,71, 1H), 10,26-10,30 (м., 2Н), 10,33-10,39 (м., 2Н), 10, 53 (с., 1Н).
Снятие диоксалановой защитной группы
(синтез соединений формулы (4) на схеме)
Интермедиат 57
5-бензоиламино-изатин
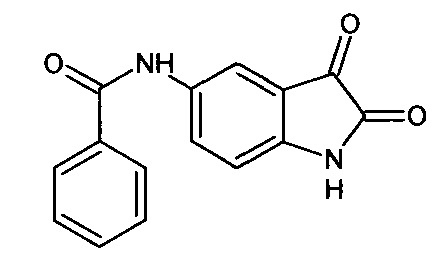
В круглодонной колбе растворяли 0,23 г (0,0007 моль) 5'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'H)-она (интермедиат 31) в 4 мл водного ацетона (75%). Затем к раствору прибавляли раствор концентрированной соляной кислоты (1 мл), после реакционную смесь перемешивали при комнатной температуре в течение 24 часов. После окончания реакции (судили с помощью тонкослойной хроматографии), реакционная смесь была вылита в стакан, содержащий 5 г мелко расколотого льда, выпавший осадок отфильтровали, промыли небольшим количеством холодной воды и высушили на воздухе. Таким образом, был получен 5-бензоиламино-изатин с выходом 63% (0,12 г).
Т. пл. (эксп.)=310°С.
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 6,91 (д., J=8,07, 1Н), 7,45-7,65 (м., 3H), 7,82-8,03 (м., 4Н), 10,31 (с., 1Н), 11,00 (с., 1Н).
ЯМР13С (ДМСО-d6, δ, м.д.): 112,73; 117,09; 118,09; 128,07; 128,90; 130,66; 132,15; 134,93; 135,02; 147,03; 160,11; 165,95; 185,00.
ИК (KBr, см-1): 1642, 1733, 1757, 3299, 3372.
Масс-спектр (электронный удар, 70 eV), m/z (I, %): 266 (19, М+), 238 (13), 210 (1), 181 (0,5), 161 (1), 133 (7), 105 (100), 77 (71), 51 (23), 29 (1,5).
Интермедиат 58
5-(2-фуроил)амино-изатин
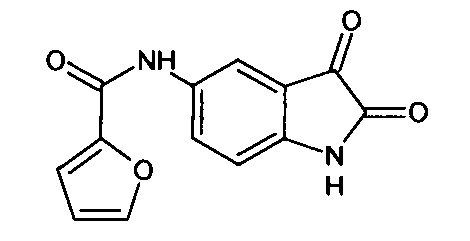
Синтез проводили аналогично интермедиату 57, используя 1 г (0,003 моль) 5'-(2-фуроил)амино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 32), получали 5-(2-фуроил)амино-изатин с выходом 44% (0,38 г).
Т.пл. (эксп.)=297-299°С.
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 6,70 (с., 1Н), 6,01 (д., J=8,09, 1Н), 7,32 (с., 1Н), 7,80-8,00 (м., 3H), 10,30 (с., 1H), 11,01 (с., 1Н).
ЯМР13С (ДМСО-d6, δ, м.д.): 112,68; 112,75; 115,38; 117,12; 118,09; 130,67; 134,24; 146,26; 147,08; 147,69; 156,66; 160,07; 184,94.
ИК (KBr, см-1): 1727, 1739, 1768, 3107, 3302.
Масс-спектр (электронный удар, 70 eV), m/z (I, %): 256 (86, М+), 228 (99), 200 (9), 171 (20), 144 (18), 112 (17), 95 (100), 79 (6), 39 (29), 29 (9).
Интермедиат 59
7-бензоиламино-изатин
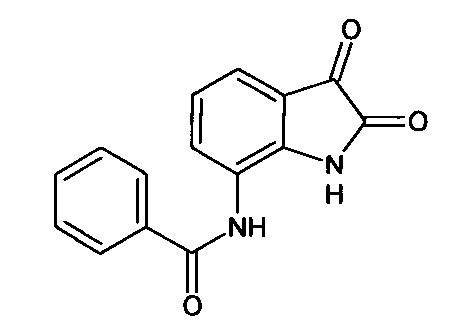
Синтез проводили аналогично интермедиату 57, используя 1 г (0,003 моль) 7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'H)-она (интермедиат 33), получали 7'-бензоиламино-изатин с выходом 60% (0,51 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 7,06 (т., J=7,34, 1Н), 7,34 (д., J=7,09, 1Н), 7,44-7,62 (м., 3H), 8,00 (д., J=7,09, 2Н), 8,89 (д., J=5,14, 1H), 9,96 (с., 1Н), 10,53 (с., 1H).
Интермедиат 60
N-аллил-5-бензоиламино-изатин

Синтез проводили аналогично интермедиату 57, используя 1 г (0,003 моль) N-аллил-5'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 39) получали N-аллил-5'-бензоиламино-изатин с выходом 65% (0,56 г).
ЯМР1H (ДМСО-d6, м.д., J, Гц): 4, 22 (д., J=14,18, 1Н), 4,44 (д, J=8,44, 1Н), 6,80-6,90 (м., 1Н), 7,45-7,60 (м., 3H), 7,63-7,74 (м., 1Н), 7,81 (дд., J=8,30, J=14,20, 1H), 7,85-8,05 (м., 3H), 10,26 (с., 1Н).
Интермедиат 61
N-бензил-5-бензоиламино-изатин

Синтез проводили аналогично интермедиату 57, используя 1 г (0,003 моль) N-бензил-5'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 40), получали N-бензил-5'-бензоиламино-изатин с выходом 60% (0,53 г). ЯМР1Н (ДМСО-d6, м.д., J, Гц): 2,02 (с., 2Н), 6,80-6,90 (м., 1H), 7,05 (д., J=8,59, 1H), 7,32-7,42 (м., 2Н), 7,47-7,62 (м., 5Н), 7,65-7,77 (м., 2Н), 8,16 (д., J=2,27, 1H), 8,27 (дд., J=2,40, J=8,59, 1Н), 10,26 (с., 1H).
Интермедиат 62
N-метил-5-бензоиламино-изатин
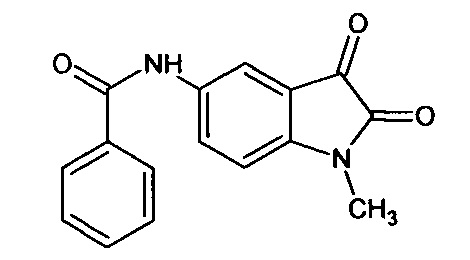
Синтез проводили аналогично интермедиату 57, используя 1 г (0,003 моль) N-метил-5'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 41), получали N-метил-5'-бензоиламино-изатин с выходом 66% (0,57 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 3,17 (с., 3H), 6,80-6,90 (м., 1Н), 7,45-7,60 (м., 3H), 7,63-7,74 (м., 1H), 7,85-8,05 (м., 3H), 10,26 (с., 1Н).
Интермедиат 63
5-метокси-7-бензоиламино-изатин

Синтез проводили аналогично интермедиату 57, используя 1 г (0,003 моль) 5'-метокси-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 42), получали 5'-метокси-7'-бензоиламино-изатин с выходом 68% (0,59 г). ЯМР1Н (ДМСО-d6, м.д., J, Гц): 3,45 (с., 3H), 6,80-6,90 (м., 1H), 7,34-7,56 (м., 3H), 7,59 (д., J=2,67, 1Н), 7,63-7,80 (м., 1Н), 7,88 (д., J=2,71, 1H), 10,26 (с., 1Н), 10, 53 (с., 1Н).
Интермедиат 64
5-бромо-7-бензоиламино-изатин
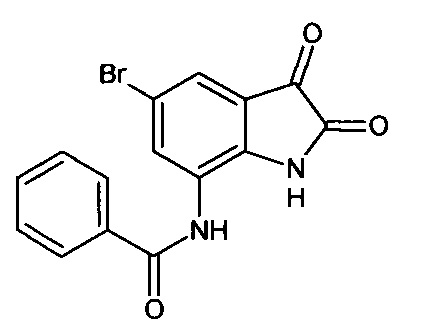
Синтез проводили аналогично интермедиату 57, используя 1 г (0,003 моль) 5'-бромо-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 43), получали 5'-бромо-7'-бензоиламино-изатин с выходом 65% (0,58 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 6,80-6,90 (м., 1H), 7,34-7,56 (м., 3H), 7,59 (д., J=2,67, 1H), 7,63-7,80 (м., 1Н), 7,88 (д., J=2,71, 1H), 10,26 (с., 1Н), 10, 53 (с., 1Н).
Интермедиат 65
5-бензоиламино-7-метил-изатин
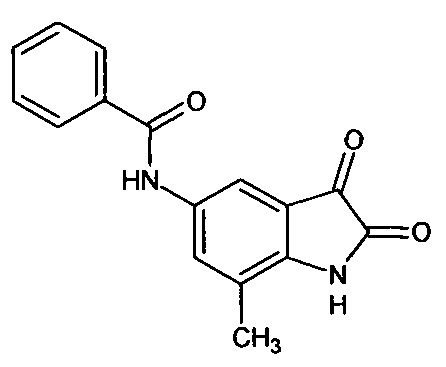
Синтез проводили аналогично интермедиату 57, используя 1 г (0,003 моль) 5'-бензоиламино-7'-метил-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 44), получали 5'-бензоиламино-7'-метил-изатин с выходом 67% (0,58 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 2,31 (с., 1H), 6,80-6,90 (м., 1H), 7,34-7,56 (м., 3H), 7,59 (д., J=2,67, 1Н), 7,63-7,80 (м., 1H), 7,88 (д., J=2,71, 1Н), 10,26 (с., 1Н), 10, 53 (с., 1H).
Интермедиат 66
5-метоксикарбонил-7-бензоиламино-изатин
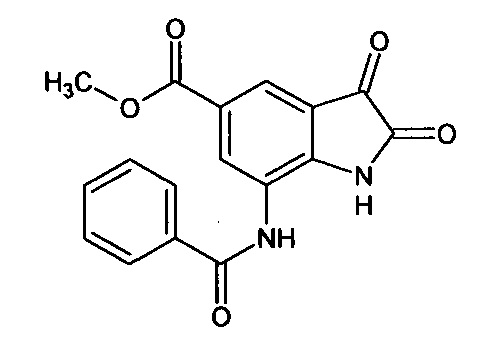
Синтез проводили аналогично интермедиату 57, используя 1 г (0,003 моль) 5'-метоксикарбонил-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 45), получали 5'-метоксикарбонил-7'-бензоиламино-изатин с выходом 70% (0,62 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 3,22 (с., 3H), 6,80-6,90 (м., 1Н), 7,34-7,56 (м., 3H), 7,59 (д., J=2,67, 1Н), 7,63-7,80 (м., 1H), 7,88 (д., J=2,71, 1H), 10,26 (с., 1Н), 10, 53 (с., 1H).
Интермедиат 67
5-циклопропилкарбоинламино-7-бензоиламино-изатин

Синтез проводили аналогично интермедиату 57, используя 1 г (0,003 моль) 5'-цикл опропилкарбоинламино-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 46), получали 5'-циклопропилкарбоинламино-7'-бензоиламино-изатин с выходом 65% (0,58 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 0,73-0.83 (м., 2Н), 1,01-1,11 (м., 2Н), 2,46-2,54 (м., 1H), 6,80-6,90 (м., 1H), 7,34-7,56 (м., 3H), 7,59 (д., J=2,67, 1H), 7,63-7,80 (м., 1Н), 7,88 (д., J=2,71, 1H), 10,26 (с., 1H), 10,33 (с., 1Н), 10, 53 (с., 1Н).
Интермедиат 68
5-метиламинотиокарбониламино-7-бензоиламино-изатин
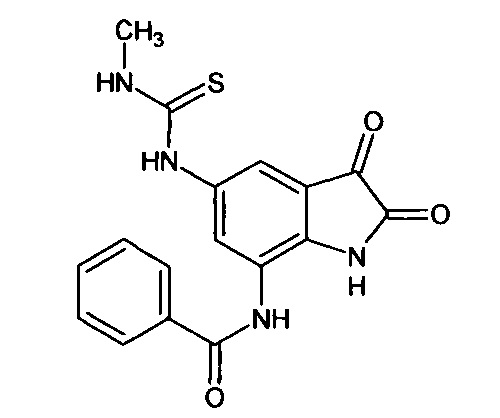
Синтез проводили аналогично интермедиату 57, используя 1 г (0,003 моль) 5'-цикл опропилкарбоинламино-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 47), получали 5'-циклопропилкарбоинламино-7'-бензоиламино-изатин с выходом 60% (0,53 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 3,17 (с., 3H), 6,68-6,78 (м., 2Н), 7,31 (м., 2Н), 7,59 (д., J=2,67, 1H), 7,87 (д., J=2,83, 1Н), 7,91 (м., 1Н), 10,20 (с., 1H), 10,33-10,42 (м., 2Н), 10,53 (с., 1Н).
Интермедиат 69
5-трифторметиламинокарбониламино-7-бензоиламино-изатин
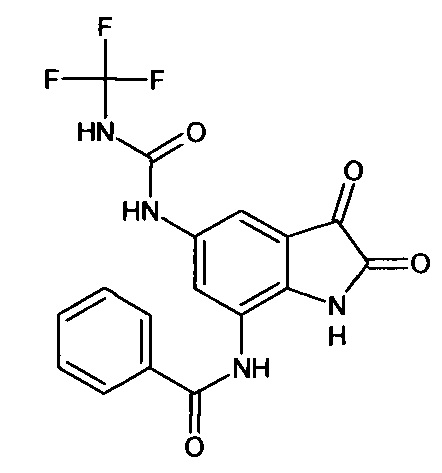
Синтез проводили аналогично интермедиату 57, используя 1 г (0,002 моль) 5'-трифторметиламинокарбониламино-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 48), получали 5'-трифторметиламинокарбониламино-7'-бензоиламино-изатин с выходом 65% (0,58 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 6,80-6,90 (м., 1H), 7,34-7,56 (м., 3H), 7,59 (д., J=2,67, 1H), 7,63-7,80 (м., 1Н), 7,88 (д., J=2,71, 1Н), 10,26 (с., 1Н), 10,33-10,39 (м., 2Н), 10, 53 (с., 1Н).
Интермедиат 70
5-циклопропиламинокарбониламино-7-бензоиламино-изатин
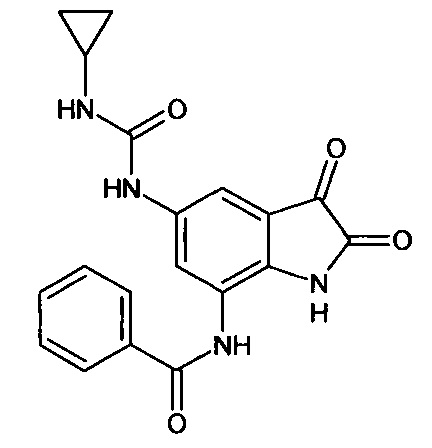
Синтез проводили аналогично интермедиату 57, используя 1 г (0,002 моль) 5'-циклопропиламинокарбониламино-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 49), получали 5'-циклопропиламинокарбониламино-7'-бензоиламино-изатин с выходом 65% (0,58 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 0,73-0.83 (м., 2Н), 1,01-1,11 (м., 2Н), 2,46-2,54 (м., 1Н), 6,80-6,90 (м., 1Н), 7,34-7,56 (м., 3H), 7,59 (д., J=2,67, 1H), 7,63-7,80 (м., 1Н), 7,88 (д., J=2,71, 1Н), 10,26 (с., 1H), 10,33 (с., 1Н), 10, 53 (с., 1Н).
Интермедиат 71
5-трифторацетиламино-7-бензоиламино-изатин

Синтез проводили аналогично интермедиату 57, используя 1 г (0,002 моль) 5'-трифторацетиламино-7'-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 50), получали 5'-трифторацетиламино-7'-бензоиламино-изатин с выходом 65% (0,58 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 6,80-6,90 (м., 1Н), 7,34-7,56 (м., 3H), 7,59 (д., J=2,67, 1Н), 7,63-7,80 (м., 1Н), 7,88 (д., J=2,71, 1Н), 10,26 (с., 1Н), 10,33 (с.,1Н), 10, 53 (с., 1Н).
Интермедиат 72
5-бензоиламино-7-ацетиламино-изатин
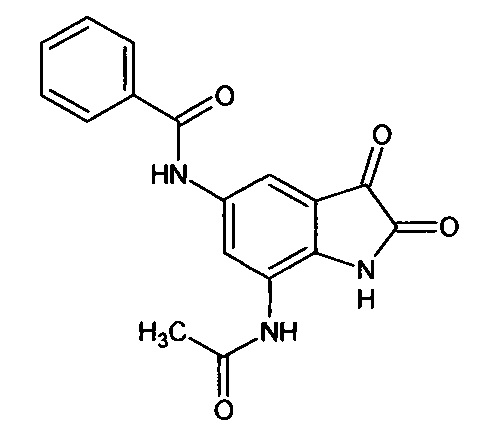
Синтез проводили аналогично интермедиату 57, используя 1 г (0,003 моль) 5'-бензоиламино-7'-ацетиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 51), получали 5'-бензоиламино-7'-ацетиламино-изатин с выходом 67% (0,59 г). ЯМР1Н (ДМСО-d6, м.д., J, Гц): 2,07 (с., 1H), 6,80-6,90 (м., 1Н), 7,34-7,56 (м., 3H), 7,59 (д., J=2,67, 1Н), 7,63-7,80 (м., 1Н), 7,88 (д., J=2,71, 1H), 10,26 (с., 1H), 10,33 (с., 1Н), 10, 53 (с., 1H).
Интермедиат 73
5-феноксикарбониламино-7-ацетиламино-изатин
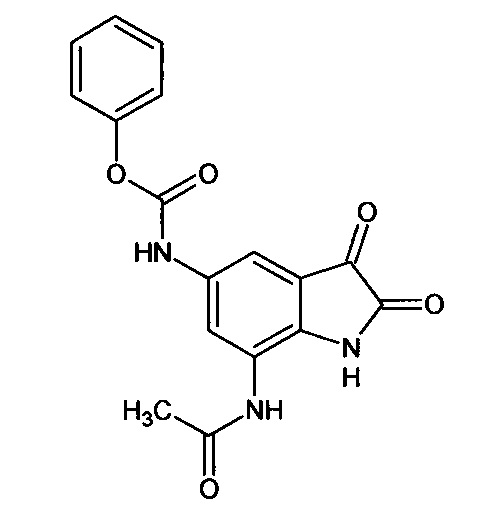
Синтез проводили аналогично интермедиату 57, используя 1 г (0,003 моль) 5'-феноксикарбониламино-7'-ацетиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 52), получали 5'-феноксикарбониламино-7'-ацетиламино-изатин с выходом 63% (0,56 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 2,07 (с., 3H), 6,80-6,90 (м., 1Н), 7,34-7,56 (м., 3H), 7,59 (д., J=2,67, 1Н), 7,63-7,80 (м., 1H), 7,88 (д., J=2,71, 1Н), 10,26 (с., 1H), 10,33 (с., 1Н), 10, 53 (с., 1H).
Интермедиат 74
5-(2-тиофен)карбониламино-7-метоксикарбониламино-изатин
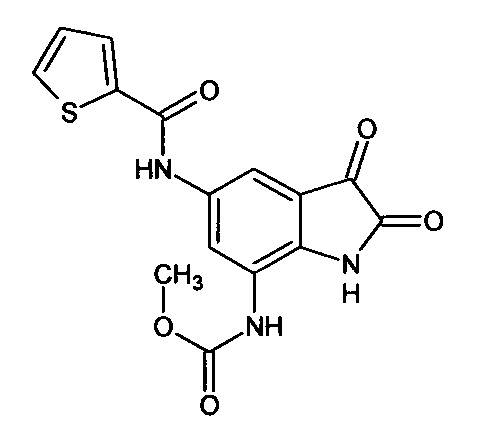
Синтез проводили аналогично интермедиату 57, используя 1 г (0,003 моль) 5'-(2-тиофен)карбониламино-7'-метоксикарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 53), получали 5'-(2-тиофен)карбониламино-7'-метоксикарбониламино-изатин с выходом 65% (0,58 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 3,17 (с., 3H), 6,68 (дд., J=1,71, J=3,42, 1H), 7,31 (д., J=3,42, 1Н), 7,59 (д., J=2,67, 1H), 7,87 (д., J=2,83, 1H), 7,91 (д., J=0,86, 1H), 10,20 (с., 1H), 10,33 (с., 1Н), 10,53 (с., 1H).
Интермедиат 75
5-(2-пиридин)карбониламино-7-циклопропилкарбониламино-изатин
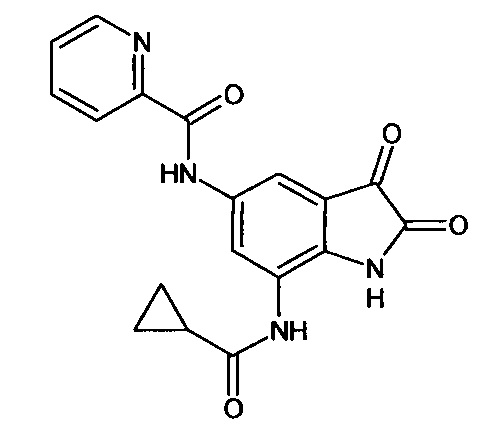
Синтез проводили аналогично интермедиату 57, используя 1 г (0,003 моль) 5'-(2-пиридин)карбониламино-7'-циклопропилкарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 54), получали 5'-(2-пиридин)карбониламино-7'-циклопропилкарбониламино-изатин с выходом 67% (0,60 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 0,73-0.83 (м., 2Н), 1,01-1,11 (м., 2Н), 2,46-2,54 (м., 1H), 6,68 (дд., J=1,71, J=3,42, 1H), 7,31 (д., J=3,42, 1Н), 7,59 (д., J=2,67, 1H), 7,87 (д., J=2,83, 1H), 7,91-8,16 (м., 5H), 10,20 (с., 1Н), 10,33 (с., 1Н), 10,53 (с., 1Н).
Интермедиат 76
5,7-бис(фениламинокарбониламино)-изатин

Синтез проводили аналогично интермедиату 57, используя 1 г (0,002 моль) 5',7'-бис(фениламинокарбониламино)-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 55), получали 5',7'-бис(фениламинокарбониламино)-изатин с выходом 65% (0,59 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 6,80-6,90 (м., 2Н), 7,34-7,56 (м., 6Н), 7,59 (д., J=2,67, 1H), 7,63-7,80 (м., 2Н), 7,88 (д., J=2,71, 1Н), 10,26-10,30 (м., 2Н), 10,33-10,39 (м., 2Н), 10, 53 (с., 1Н).
Интермедиат 77
5,7-бис((3-пиридин)аминокарбониламино)-изатин
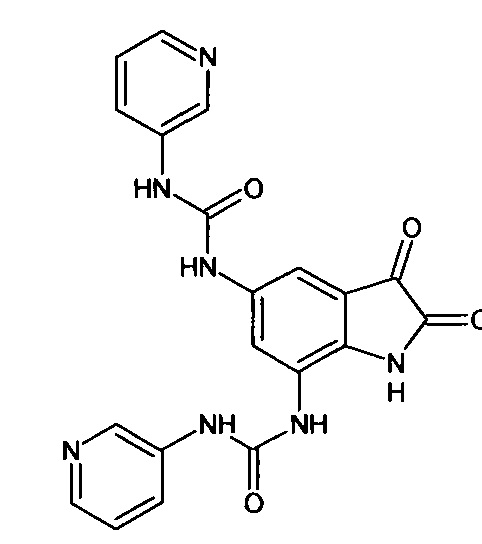
Синтез проводили аналогично интермедиату 57, используя 1 г (0,002 моль) 5',7'-бис((3-пиридин)аминокарбониламино)-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 56), получали 5',7'-бис((3-пиридин)аминокарбониламино)-изатин с выходом 70% (0,63 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 7,43-7,55 (м., 4Н), 7,59 (д., J=2,67, 1H), 7,69-7,81 (м., 4Н), 7,88 (д., J=2,71, 1H), 10,26-10,30 (м., 2Н), 10,33-10,39 (м., 2Н), 10, 53 (с., 1Н).
Нитрование изатинов с одновременным удалением диоксалановой защиты (синтез соединений формулы (1) на схеме, где R4=NHC(X)R7)
Интермедиат 78
5-нитро-7-бензоиламино-изатин
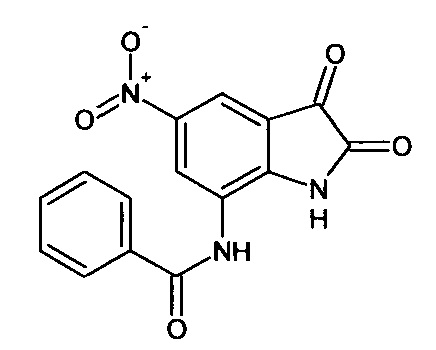
В круглодонной колбе в 2 мл концентрированной серной кислоты при перемешивании вносят 0,09 г (0,0003 моль) 7-бензоиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 33), полученный раствор охлаждают до 0°С. Затем небольшими порциями при постоянном перемешивании, не допуская нагревания реакционной смеси выше 5°С, вносят 0,044 г (0,0004 моль) нитрата калия. После полного прибавления охлаждение прекратили и перемешивали реакционную смесь еще в течение 30 минут. Затем ее вылили в мелко колотый лед (5 г) при перемешивании. Продукт был выделен методом экстракции этилацетатом (3*7 мл). После удаления растворителя в вакууме был получен 5-нитро-7-бензоиламино-изатин с выходом 65% (0,06 г). ЯМР1Н (ДМСО-d6, м.д., J, Гц): 6,68-6,78 (м., 2Н), 7,31 (м., 2Н), 7,59 (д., J=2,67, 1Н), 7,87 (д., J=2,83, 1H), 7,91 (м., 1Н), 10,20 (с., 1H), 10,64 (с., 1H).
Интермедиат 79
5-нитро-7-ацетиламино-изатин
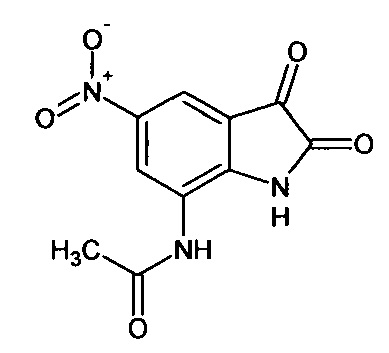
Синтез проводили аналогично интермедиату 78, используя 0,1 г (0,0004 моль) 7'-ацетиламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 34), получали 5-нитро-7-ацетиламино-изатин с выходом 55% (0,06 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 2,02 (с., 3H), 7,59 (д., J=2,67, 1Н), 7,87 (д., J=2,83, 1H), 10,20 (с., 1Н), 10,64 (с., 1H).
Интермедиат 80
5-нитро-7-метоксикарбониламино-изатин

Синтез проводили аналогично интермедиату 78, используя 0,1 г (0,0004 моль) 7'-метоксикарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 35), получали 5-нитро-7-метоксикарбониламино-изатин с выходом 55% (0,06 г). ЯМР1H (ДМСО-d6, м.д., J, Гц): 3,12 (с., 3H), 7,59 (д., J=2,67, 1Н), 7,87 (д., J=2,83, 1Н), 10,20 (с., 1H), 10,64 (с., 1H).
Интермедиат 81
5-нитро-7-циклопропилкарбониламино-изатин
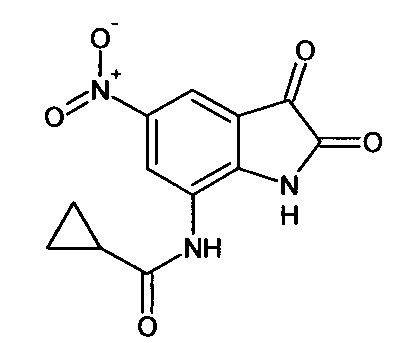
Синтез проводили аналогично интермедиату 78, используя 0,1 г (0,0004 моль) 7'-циклопропилкарбониламино-спиро[1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 36), получали 5-нитро-7-циклопропилкарбониламино-изатин с выходом 60% (0,06 г). ЯМР1Н (ДМСО-d6, м.д., J, Гц): 0,73-0.83 (м., 2Н), 1,01-1,11 (м., 2Н), 2,46-2,54 (м., 1Н), 7,59 (д., J=2,67, 1Н), 7,87 (д., J=2,83, 1H), 10,20 (с., 1H), 10,64 (с., 1Н).
Интермедиат 82
5-нитро-7-(3-пиридин)аминокарбониламино-изатин
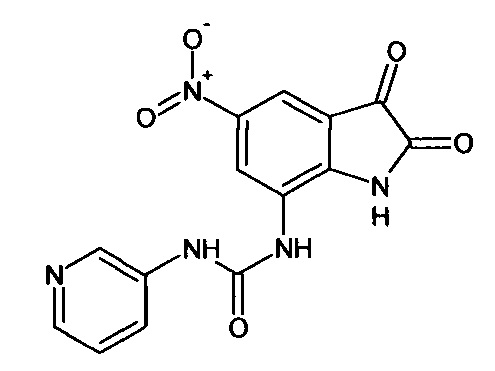
Синтез проводили аналогично интермедиату 78, используя 0,1 г (0,0003 моль) 7'-(3-пиридин)аминокарбониламино-спиро [1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 37), получали 5-нитро-7-(3-пиридин)аминокарбониламино-изатин с выходом 63% (0,06 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 7,32-7,42 (м., 2Н), 7,59 (д., J=2,67, 1Н), 7,87 (д., J=2,83, 1H), 8,01 (м., 2Н), 10,20 (с., 1Н), 10,33 (с., 1H), 10,64 (с., 1H).
Интермедиат 83
5-нитро-7-фениламинокарбониламино-изатин
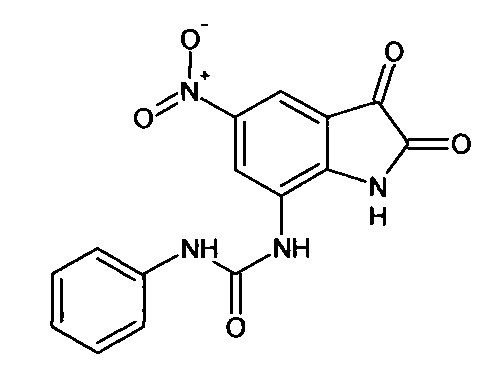
Синтез проводили аналогично интермедиату 78, используя 0,1 г (0,0003 моль) 7'-фениламинокарбониламино-спиро [1,3-диоксалан-2,3'-индол]-2'(1'Н)-она (интермедиат 38), получали 5-нитро-7-фениламинокарбониламино-изатин с выходом 58% (0,06 г). ЯМР1Н (ДМСО-d6, м.д., J, Гц): 6,68-6,78 (м., 2Н), 7,31 (м., 2Н), 7,59 (д., J=2,67, 1H), 7,87 (д., J=2,83, 1Н), 7,91 (м., 1Н), 10,20 (с., 1H), 10,33 (с., 1Н), 10,64 (с., 1Н).
Синтез соединений формулы (I)
Пример 1. (5-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил
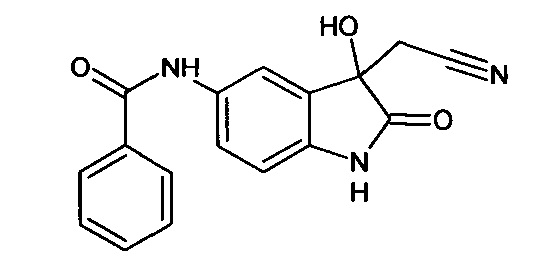
В кругло донной колбе, снабженной обратным холодильником, растворяли 0,1 г (0,0004 моль) 5-бензоламино-изатина и 0,03 г (0,0004 моль) цианоуксусной кислоты в пиридине (2 мл). Затем к реакционной смеси прибавляли 0,05 мл пиперидина и кипятили в течение 3 часов. Об окончании реакции судили с помощью тонкослойной хроматографии. Затем реакционную смесь охладили до комнатной температуры, медленно прибавили 2 мл насыщенного раствора хлороводорода в 1,4-диоксане, не допуская перегревания смеси. К получившейся смеси добавили 2 мл холодной воды. Продукт был получен путем экстракции этилацетатом (5*7 мл). Органические вытяжки были объединены, высушены над безводным сульфатом натрия, растворитель был удален в вакууме. (5-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил был получен с выходом 61% (0,07 г).
Т. пл. (эксп.)=173-176°С.
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 2,94 (д., J=16,51, 1H), 3,04 (д., J=16,14, 1Н), 6,66 (с., 1Н), 6,80-6,90 (м., 1H), 7,45-7,60 (м., 3H), 7,63-7,74 (м., 1H), 7,85-8,05 (м., 3H), 10,26 (с., 1H), 10,53 (с., 1Н).
ЯМР13С (ДМСО-d6, δ, м.д.): 26,67; 72,82; 110,34; 117,43; 118,00; 122,83; 128,04; 128,83; 130,37; 131,94; 134,36; 135,34; 137,86; 165,68; 177,24.
Масс-спектр (электронный удар, 70 eV), m/z (I, %): 307 (22, М+), 289 (6), 267 (6), 239 (2), 202 (0.5), 174 (1), 133 (2), 105 (100), 77 (45), 51 (5), 14 (1).
Пример 2. (5-(2-фуроил)амино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил
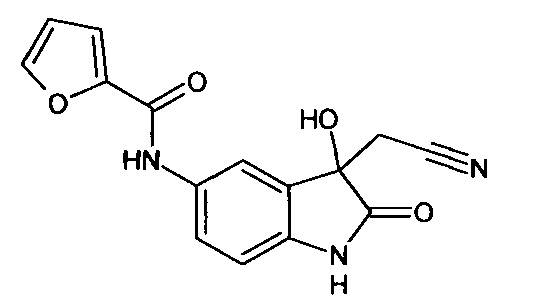
Синтез проводили аналогично примеру 1, используя 0,1 г (0,0004 моль) 5-(2-фуроил)амино-изатина, получали (5-(2-фуроил)амино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил с выходом 50% (0,06 г).
Т.пл. (эксп.)=298-300°С.
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 2,94 (д., J=16,63, 1Н), 3,03 (д., J=16,63, 1H), 6,65 (уш.с., 1Н), 6,68 (дд., J=1,71, J=3,42, 1H), 6,84 (д., J=8,44, 1Н), 7,31 (д., J=3,42, 1H), 7,64 (дд., J=1,96, J=8,44, 1H), 7,87 (д., J=1,83, 1H), 7,91 (д., J=0,86, 1Н), 10,20 (с., 1H), 10,53 (с., 1Н).
ЯМР13С (ДМСО-d6, δ, м.д.): 26,63; 72,76; 110,37; 112,56; 114,91; 117,46; 118,01; 122,84; 130,41; 133,63; 137,93; 146,07; 147,99; 156,60; 177,23.
ИК (KBr, см-1): 1557, 1724, 2268, 2852, 3240, 3305.
Масс-спектр (электронный удар, 70 eV), m/z (I, %): 297 (66, М+), 279 (9), 257 (65), 229 (23), 189 (13), 174 (5), 133 (10), 105 (12), 95 (100), 79 (29), 52 (18), 43 (20), 39 (33), 28 (18).
Пример 3. (7-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил
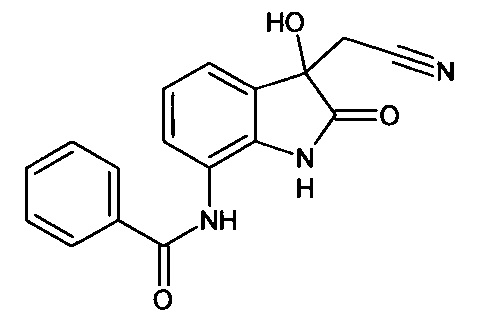
Синтез проводили аналогично примеру 1, используя 0,1 г (0,0004 моль) 7-бензоиламино-изатина, получали (7-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил с выходом 40% (0,05 г).
Т. пл. (эксп.)=115-120°С.
ЯМР1H (ДМСО-d6, м.д., J, Гц): 2,96 (д., J=16,63, 1Н), 3,07 (д., J=16,51, 1Н), 7,06 (т., J=7,34, 1Н), 7,34 (д., J=7,09, 1H), 7,44-7,62 (м., 3H), 8,00 (д., J=7,09, 2Н), 8,89 (д., J=5,14 1H), 9,96 (с., 1Н), 10,53 (с., 1H).
ЯМР13С (ДМСО-d6, δ, м.д.): 26,67; 72,82; 110,34; 117,43; 118,00; 122,83; 128,04; 128,83 130,37; 131,94; 134,36; 135,34; 137,86; 165,68; 177,24.
Масс-спектр (электронный удар, 70 eV), m/z (I, %): 307 (32), 267 (4), 242 (2), 202 (1), 19: (1), 161 (3), 129 (1), 105 (100), 77 (45), 51 (6).
Пример 4. (N-аллил-5-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил
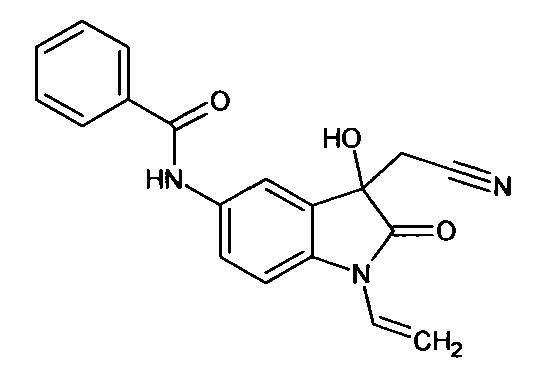
Синтез проводили аналогично примеру 1, используя 0,1 г (0,0003 моль) N-аллил-5-бензоиламино-изатина, получали (N-аллил-5-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил с выходом 50% (0,06 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 2,94 (д., J=16,51, 1Н), 3,04 (д., J=16,14, 1Н), 4, 22 (д., J=14,18, 1Н), 4,44 (д, J=8,44, 1Н), 6,66 (с., 1Н), 6,80-6,90 (м., 1Н), 7,45-7,60 (м., 3H), 7,63-7,74 (м., 1H), 7,81 (дд., J=8,30, J=14,20, 1H), 7,85-8,05 (м., 3H), 10,26 (с., 1Н).
Пример 5. (N-бензил-5-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил
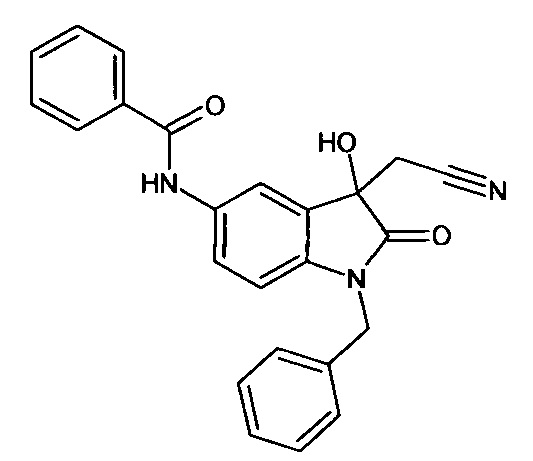
Синтез проводили аналогично примеру 1, используя 0,1 г (0,0003 моль) N-бензил-5-бензоиламино-изатина, получали (N-бензил-5-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил с выходом 60% (0,07 г). ЯМР1Н (ДМСО-d6, м.д., J, Гц): 2,94 (д., J=16,51, 1H), 3,04 (д., J=16,14, 1Н), 4,91 (с., 2Н), 6,66 (с., 1Н), 6,80-6,90 (м., 1H), 7,34-7,60 (м., 5Н), 7,63-7,80 (м., 2Н), 7,81-7,85 (м., 2Н), 7,87-8,05 (м., 3H), 10,26 (с., 1Н).
Пример 6. (N-метил-5-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил
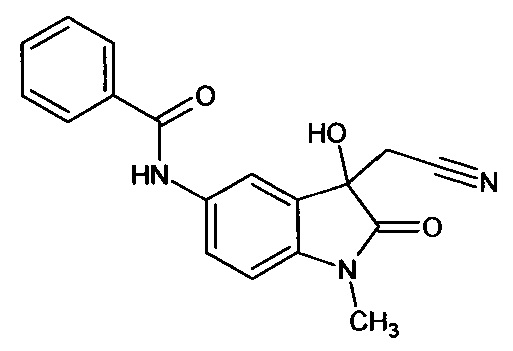
Синтез проводили аналогично примеру 1, используя 0,1 г (0,0004 моль) N-метил-5-бензоиламино-изатина, получали (N-метил-5-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил с выходом 48% (0,06 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 2,94 (д., J=16,51, 1H), 3,04 (д., J=16,14, 1H), 3,17 (с., 3H), 6,66 (с., 1Н), 6,80-6,90 (м., 1H), 7,45-7,60 (м., 3H), 7,63-7,74 (м., 1Н), 7,85-8,05 (м., 3H), 10,26 (с., 1H).
Пример 7. (5-бензоиламино-2-оксиндол-3-ил)ацетонитрил

В круглодонной колбе, снабженной обратным холодильником, кипятили 0,3 г (0,001 моль) (5-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрила (продукт примера 1) в растворе концентрированной соляной кислоты (2 мл) в течение 10 часов. После окончания реакции (контроль методом ТСХ, до исчезновения исходного) реакционную смесь охладили до комнатной температуры. Промежуточный продукт выделяли фильтрованием, промывали холодной водой и сушили на воздухе (масса сухого остатка составила 0,27 г). Далее промежуточный продукт полностью растворяли в этилацетате (5 мл) и проводили каталитическое восстановление двойной связи под действием водорода в поточном реакторе гидрирования H-Cube (Венгрия): скорость потока 1 мл/мин, давление Н2 2 атм., катализатор Pd/C (10%). После полного гидрирования растворитель был удален в вакууме роторного испарителя, был (5-бензоиламино-2-оксиндол-3-ил)ацетонитрил с выходом 90% (0,26 г). ЯМР1Н (ДМСО-d6, м.д., J, Гц): 2,77 (д., J=17,00, 1Н), 3,09 (д., J=16,96, 1H), 3,62-3,66 (м, 1H), 6,80-6,90 (м., 1Н), 7,45-7,60 (м., 3H), 7,63-7,74 (м., 1Н), 7,85-8,05 (м., 3H), 10,26 (с., 1Н), 10,53 (с., 1Н).
Пример 8. (5-бензоиламино-3-метокси-2-оксиндол-3-ил)ацетонитрил
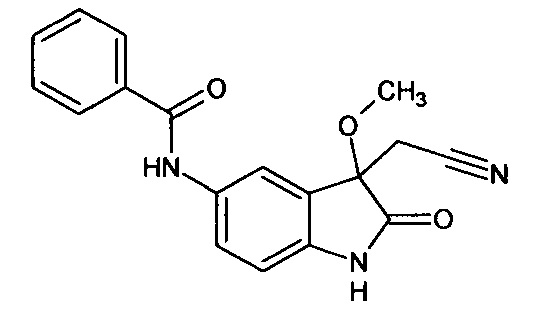
В круглодонной колбе растворили 0,2 г (0,0006 моль) (5-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрила (продукт примера 1) в безводном тетрагидрофуране (5 мл). Затем небольшими порциями при интенсивном перемешивании при комнатной температуре добавили (Me)2SO4 (0,07 мл, 0,0007 моль). После полного прибавления, раствор перемешивали при комнатной температуре еще в течение 15 минут, затем добавили холодную воду (5 мл) и экстрагировали этилацетатом (3*5 мл). Органические вытяжки объединяли, сушили над безводным сульфатом натрия. После концентрирования в вакууме роторного испарителя получали (5-бензоиламино-3-метокси-2-оксиндол-3-ил)ацетонитрил с выходом 85% (0,18 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 2,94 (д., J=16,51, 1H), 3,04 (д., J=16,14, 1Н), 3,26 (с., 3H), 6,80-6,90 (м., 1Н), 7,45-7,60 (м., 3H), 7,63-7,74 (м., 1Н), 7,85-8,05 (м., 3H), 10,26 (с., 1Н), 10,53 (с., 1Н).
Пример 9. (5-бензоиламино-3-ацетокси-2-оксиндол-3-ил)ацетонитрил
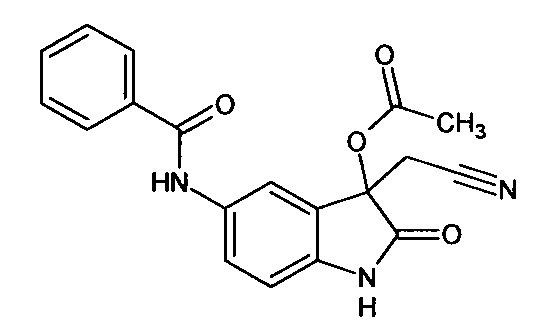
Синтез проводили аналогично примеру 7, используя 0,1 г (0,0003 моль) (5-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрила и 0,05 мл (0,0005 моль) уксусного ангидрида в качестве ацилирующего агента, и получали (5-бензоиламино-3-ацетокси-2-оксиндол-3-ил)ацетонитрил с выходом 77% (0,09 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 2,05 (с., 3H), 2,94 (д., J=16,51, 1Н), 3,04 (д., J=16,14, 1Н), 6,80-6,90 (м., 1Н), 7,45-7,60 (м., 3H), 7,63-7,74 (м., 1Н), 7,85-8,05 (м., 3H), 10,26 (с., 1H), 10,53 (с., 1H).
Пример 10. (5-бензоиламино-3-гидрокси-2-оксиндол-3-ил)уксусная кислота
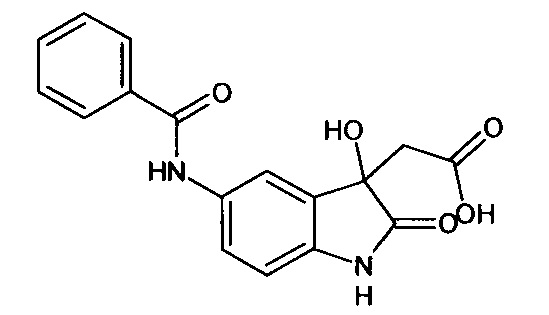
Синтез проводили аналогично примеру 1, используя 0,1 г (0,0003 моль) 5-бензоиламино-изатина и 0,03 г (0,0003 моль) малоновой кислоты в качестве СН-кислотного соединения, получали (5-бензоиламино-3-гидрокси-2-оксиндол-3-ил)уксусную кислоту с выходом 63% (0,10 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 2,94 (д., J=16,51, 1H), 3,04 (д., J=16,14, 1Н), 4,91 (с., 2Н), 6,66 (с., 1Н), 6,80-6,90 (м., 1Н), 7,34-7,60 (м., 5Н), 7,63-7,80 (м., 2Н), 7,81-7,85 (м., 2Н), 7,87-8,05 (м., 3H), 10,26 (с., 1H), 12, 15 (уш.с., 1Н).
Пример 11. (5-метокси-7-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил
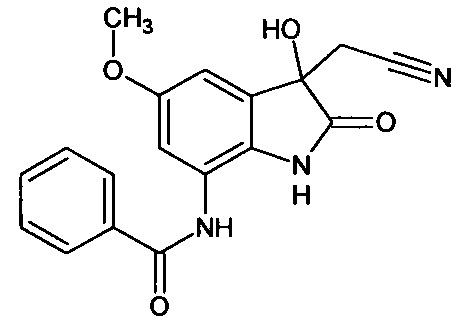
Синтез проводили аналогично примеру 1, используя 0,1 г (0,0003 моль) 5-метокси-7-бензоиламино-изатина, получали (5-метокси-7-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил с выходом 48% (0,05 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 2,94 (д., J=16,51, 1H), 3,04 (д., J=16,14, 1Н), 3,45 (с., 3H), 6,66 (с., 1Н), 6,80-6,90 (м., 1Н), 7,34-7,56 (м., 3H), 7,59 (д., J=2,67, 1H), 7,63-7,80 (м., 1Н), 7,88 (д., J=2,71, 1Н), 10,26 (с., 1Н), 10, 53 (с., 1H).
Пример 12. (5-бромо-7-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил
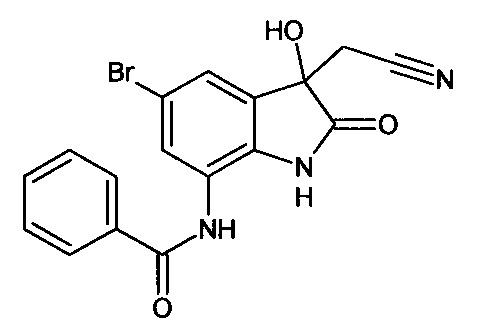
Синтез проводили аналогично примеру 1, используя 0,1 г (0,0003 моль) 5-бромо-7-бензоиламино-изатина, получали (5-бромо-7-бензои ламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил с выходом 68% (0,08 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 2,94 (д., J=16,51, 1Н), 3,04 (д., J=16,14, 1Н), 6,66 (с., 1Н), 6,80-6,90 (м., 1H), 7,34-7,56 (м., 3H), 7,59 (д., J=2,67, 1H), 7,63-7,80 (м., 1Н), 7,88 (д., J=2,71, 1Н), 10,26 (с., 1H), 10, 53 (с., 1Н).
Пример 13. (5-бензоиламино-7-метил-3-гидрокси-2-оксиндол-3-ил)ацетонитрил

Синтез проводили аналогично примеру 1, используя 0,1 г (0,0004 моль) 5-бензоиламино-7-метил-изатина, получали (5-бензоиламино-7-метил-3-гидрокси-2-оксиндол-3-ил)ацетонитрил с выходом 47% (0,05 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 2,31 (с., 1H), 2,94 (д., J=16,51, 1Н), 3,04 (д., J=16,14, 1Н), 6,66 (с., 1H), 6,80-6,90 (м., 1Н), 7,34-7,56 (м., 3H), 7,59 (д., J=2,67, 1Н), 7,63-7,80 (м., 1Н), 7,88 (д., J - 2,71, 1Н), 10,26 (с., 1H), 10, 53 (с., 1H).
Пример 14. (5-бензоиламино-7-ацеамидо-3-гидрокси-2-оксиндол-3-ил)ацетонитрил
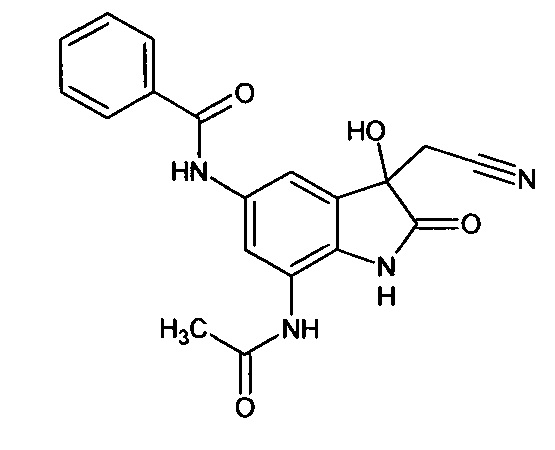
Синтез проводили аналогично примеру 1, используя 0,1 г (0,0003 моль) 5-бензоиламино-7-ацетамидо-изатина, получали (5-бензоиламино-7-ацетамидо-3-гидрокси-2-оксиндол-3-ил)ацетонитрил с выходом 65% (0,07 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 2,07 (с., 1H), 2,94 (д., J=16,51, 1Н), 3,04 (д., J=16,14, 1H), 6,66 (с., 1H), 6,80-6,90 (м., 1H), 7,34-7,56 (м., 3H), 7,59 (д., J=2,67, 1Н), 7,63-7,80 (м., 1H), 7,88 (д., J=2,71, 1H), 10,26 (с., 1Н), 10,33 (с., 1Н), 10, 53 (с., 1H).
Пример 15. (5-циклопропилкарбониламино-7-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил

Синтез проводили аналогично примеру 1, используя 0,1 г (0,0003 моль) 5-циклопропилкарбониламино-7-бензоиламино-изатина, получали (5-циклопропилкарбониламино-7-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил с выходом 70% (0,08 г). ЯМР1Н (ДМСО-d6, м.д., J, Гц): 0,73-0.83 (м., 2Н), 1,01-1,11 (м., 2Н), 2,46-2,54 (м., 1Н), 2,94 (д., J=16,51, 1Н), 3,04 (д., J=16,14, 1Н), 6,66 (с., 1Н), 6,80-6,90 (м., 1Н), 7,34-7,56 (м., 3H), 7,59 (д., J=2,67, 1H), 7,63-7,80 (м., 1H), 7,88 (д., J=2,71, 1Н), 10,26 (с., 1Н), 10,33 (с., 1Н), 10, 53 (с., 1Н).
Пример 16. (5-(2-тиофенкарбонил)амино-7-метоксикарбониламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил
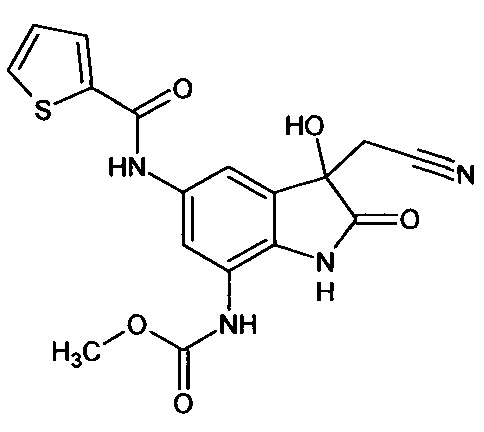
Синтез проводили аналогично примеру 1, используя 0,1 г (0,0003 моль) 5-(2-тиофенкарбонил)амино-7-метоксикарбониламино-изатина, получали (5-(2-тиофенкарбонил)амино-7-метоксикарбониламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил с выходом 68% (0,08 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 2,94 (д., J=16,63, 1H), 3,03 (д., J=16,63, 1H), 3,17 (с., 3H), 6,65 (с., 1Н), 6,68 (дд., J=1,71, J=3,42, 1Н), 7,31 (д., J=3,42, 1Н), 7,59 (д., J=2,67, 1H), 7,87 (д., J=2,83, 1H), 7,91 (д., J=0,86, 1H), 10,20 (с., 1H), 10,33 (с., 1Н), 10,53 (с., 1H).
Пример 17. (5-(2-пиридинкарбонил)амино-7-циклопропилкарбониламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил
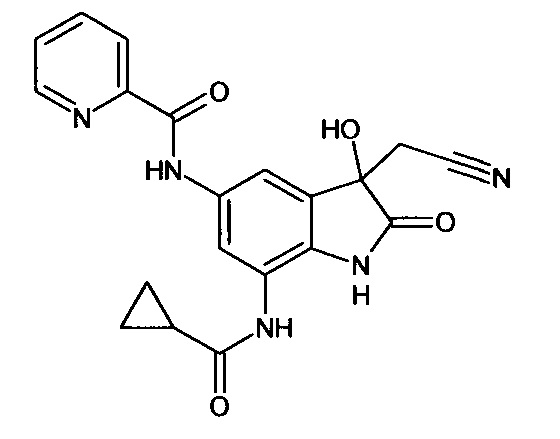
Синтез проводили аналогично примеру 1, используя 0,1 г (0,0003 моль) 5-(2-пиридинкарбонил)амино-7-циклопропилкарбониламино-изатина, получали (5-(2-пиридинкарбонил)амино-7-циклопропилкарбониламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил с выходом 72% (0,08 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 0,73-0.83 (м., 2Н), 1,01-1,11 (м., 2Н), 2,46-2,54 (м., 1Н), 2,94 (д., J=16,63, 1Н), 3,03 (д., J=16,63, 1Н), 6,65 (с., 1Н), 6,68 (дд., J=1,71, J=3,42, 1H), 7,31 (д., J=3,42, 1Н), 7,59 (д., J=2,67, 1H), 7,87 (д., J=2,83, 1H), 7,91-8,16 (м., 5H), 10,20 (с., 1H), 10,33 (с., 1Н), 10,53 (с., 1H).
Пример 18. (5-метиламинотиокарбониламино-7-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил
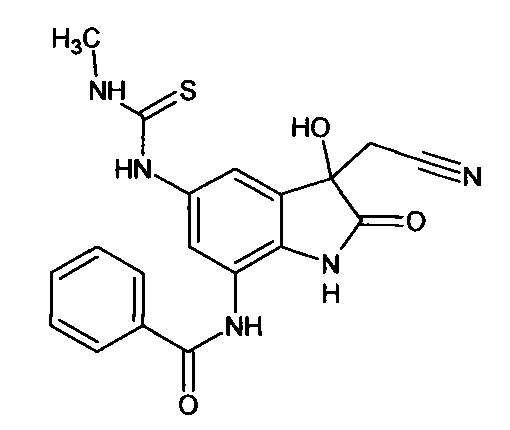
Синтез проводили аналогично примеру 1, используя 0,1 г (0,0003 моль) 5-метиламинотиокарбониламино-7-бензоиламино-изатина, получали (5-метил аминотиокарбониламино-7-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил с выходом 60% (0,07 г).
ЯМР1H (ДМСО-d6, м.д., J, Гц): 2,94 (д., J=16,63, 1H), 3,03 (д., J=16,63, 1Н), 3,17 (с., 3H), 6,65 (с., 1Н), 6,68-6,78 (м., 2Н), 7,31 (м., 2Н), 7,59 (д., J=2,67, 1H), 7,87 (д., J=2,83, 1Н), 7,91 (м., 1Н), 10,20 (с., 1H), 10,33-10,42 (м., 2Н), 10,53 (с., 1H).
Пример 19. (5-трифторметиламинокарбониламино-7-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил
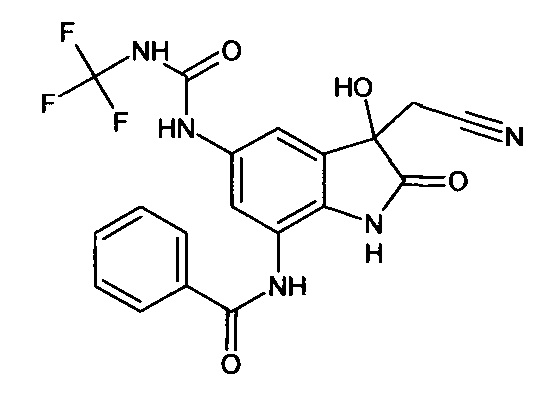
Синтез проводили аналогично примеру 1, используя 0,1 г (0,0002 моль) 5-трифторметиламинокарбониламино-7-бензоиламино-изатина, получали (5-трифторметиламинокарбониламино-7-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил с выходом 70% (0,08 г).
ЯМР1H (ДМСО-d6, м.д., J, Гц): 2,94 (д., J=16,51, 1Н), 3,04 (д., J=16,14, 1Н), 6,66 (с., 1H), 6,80-6,90 (м., 1H), 7,34-7,56 (м., 3H), 7,59 (д., J=2,67, 1H), 7,63-7,80 (м., 1Н), 7,88 (д., J=2,71, 1H), 10,26 (с., 1Н), 10,33-10,39 (м., 2Н), 10, 53 (с., 1Н).
Пример 20. (5-циклопропиламинокарбониламино-7-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил

Синтез проводили аналогично примеру 1, используя 0,1 г (0,0003 моль) 5-циклопропиламинокарбониламино-7-бензоиламино-изатина, получали (5-циклопропиламинокарбониламино-7-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил с выходом 50% (0,06 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 0,73-0.83 (м., 2Н), 1,01-1,11 (м., 2Н), 2,46-2,54 (м., 1Н), 2,94 (д., J=16,51, 1H), 3,04 (д., J=16,14, 1H), 6,66 (с., 1Н), 6,80-6,90 (м., 1H), 7,34-7,56 (м., 3H), 7,59 (д., J=2,67, 1Н), 7,63-7,80 (м., 1Н), 7,88 (д., J=2,71, 1Н), 10,26 (с., 1Н), 10,33-10,39 (м.,2Н), 10, 53 (с., 1Н).
Пример 21. (5,7-бис(фениламинокарбониламино)-3-гидрокси-2-оксиндол-3-ил)ацетонитрил
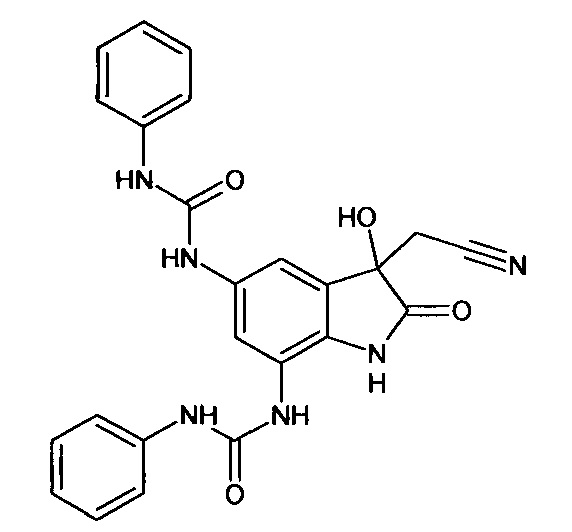
Синтез проводили аналогично примеру 1, используя 0,1 г (0,0002 моль) 5,7-бис(фениламинокарбониламино)-изатина, получали (5,7-бис(фениламинокарбониламино)-3-гидрокси-2-оксиндол-3-ил)ацетонитрил с выходом 55% (0,06 г).
ЯМР1H (ДМСО-d6, м.д., J, Гц): 2,94 (д., J=16,51, 1Н), 3,04 (д., J=16,14, 1Н), 6,66 (с., 1H), 6,80-6,90 (м., 2Н), 7,34-7,56 (м., 6Н), 7,59 (д., J=2,67, 1H), 7,63-7,80 (м., 2Н), 7,88 (д., J=2,71, 1H), 10,26-10,30 (м., 2Н), 10,33-10,39 (м.,2Н), 10, 53 (с., 1Н).
Пример 22. (5,7-бис((3-пиридин)аминокарбониламино)-3-гидрокси-2-оксиндол-3-ил)ацетонитрил
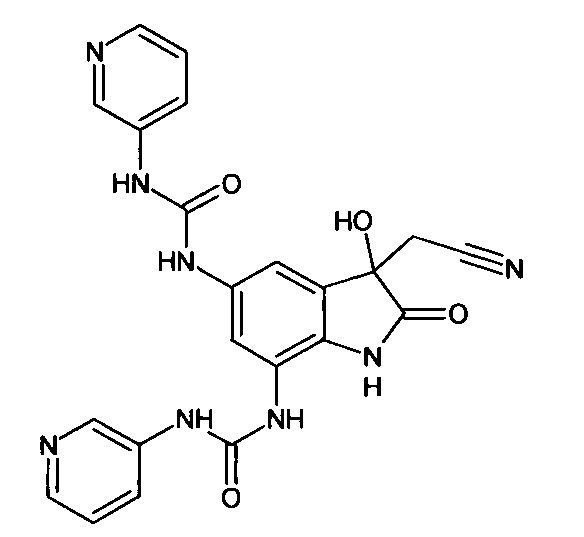
Синтез проводили аналогично примеру 1, используя 0,1 г (0,0002 моль) 5,7-бис((2-пиридин)аминокарбониламино)-изатина, получали (5,7-бис((2-пиридин)аминокарбониламино)-3-гидрокси-2-оксиндол-3-ил)ацетонитрил с выходом 54% (0,06 г).
ЯМР1Н (ДМСО-d6, м.д., J, Гц): 2,94 (д., J=16,51, 1H), 3,04 (д., J=16,14, 1H), 6,66 (с., 1Н), 7,43-7,55 (м., 4Н), 7,59 (д., J=2,67, 1H), 7,69-7,81 (м., 4Н), 7,88 (д., J=2,71, 1H), 10,26-10,30 (м., 2Н), 10,33-10,39 (м., 2Н), 10, 53 (с., 1Н).
Пример 23. (5-фенилоксикарбониламино-7-ацеамидо-3-гидрокси-2-оксиндол-3-ил)ацетонитрил
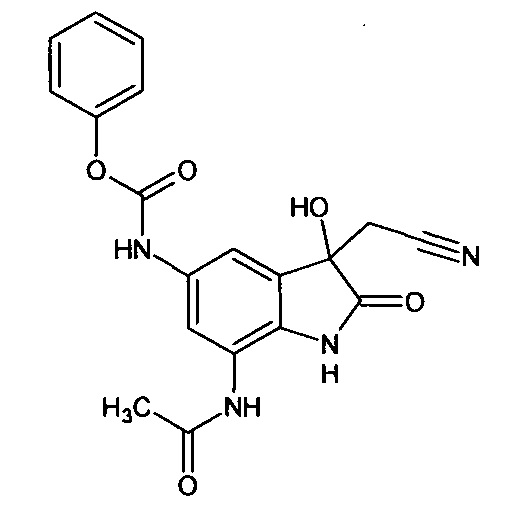
Синтез проводили аналогично примеру 1, используя 0,1 г (0,0003 моль) 5-фенилоксикарбониламино-7-ацетамидо-изатина, получали (5-фенилоксикарбониламино-7-ацетамидо-3-гидрокси-2-оксиндол-3-ил)ацетонитрил с выходом 65% (0,07 г). ЯМР1Н (ДМСО-d6, м.д., J, Гц): 2,07 (с., 3H), 2,94 (д., J=16,51, 1Н), 3,04 (д., J=16,14, 1H), 6,66 (с., 1Н), 6,80-6,90 (м., 1H), 7,34-7,56 (м., 3H), 7,59 (д., J=2,67, 1H), 7,63-7,80 (м., 1Н), 7,88 (д., J=2,71, 1Н), 10,26 (с., 1H), 10,33 (с., 1Н), 10, 53 (с., 1Н).
Пример 24. (5-трифторметилкарбониламино-7-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил
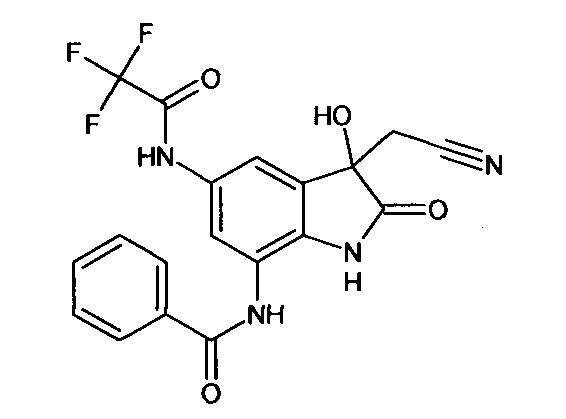
Синтез проводили аналогично примеру 1, используя 0,1 г (0,0003 моль) 5-трифторметилкарбониламино-7-бензоиламино-изатина, получали (5-трифторметилкарбониламино-7-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил с выходом 70% (0,08 г).
ЯМР1H (ДМСО-d6, м.д., J, Гц): 2,94 (д., J=16,51, 1Н), 3,04 (д., J=16,14, 1Н), 6,66 (с., 1H), 6,80-6,90 (м., 1Н), 7,34-7,56 (м., 3H), 7,59 (д., J=2,67, 1H), 7,63-7,80 (м., 1Н), 7,88 (д., J=2,71, 1H), 10,26 (с., 1H), 10,33 (с.,1Н), 10, 53 (с., 1Н).
Пример 25. (5-метоксикарбонил-7-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил
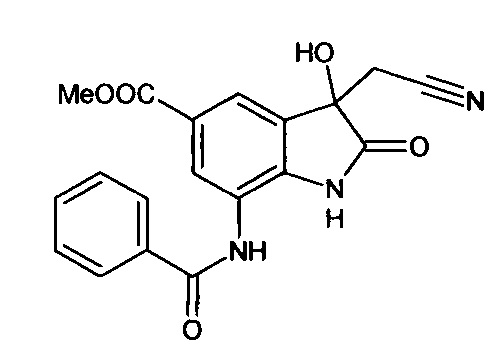
Синтез проводили аналогично примеру 1, используя 0,1 г (0,0003 моль) 5-метоксикарбонил-7-бензоиламино-изатина, получали (5-метоксикарбонил-7-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил с выходом 70% (0,08 г). ЯМР1Н (ДМСО-d6, м.д., J, Гц): 2,94 (д., J=16,51, 1H), 3,04 (д., J=16,14, 1Н), 3,22 (с., 3H), 6,66 (с., 1Н), 6,80-6,90 (м., 1Н), 7,34-7,56 (м., 3H), 7,59 (д., J=2,67, 1Н), 7,63-7,80 (м., 1Н), 7,88 (д., J=2,71, 1Н), 10,26 (с., 1Н), 10, 53 (с., 1Н).
Пример 26. Гидрохлорид (5-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрила
В круглодонной колбе к раствору 0,5 г (0,002 моль) (5-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрила (пример 1) в тетрагидрофуране (15 мл) при охлаждении на ледяной бане по каплям при интенсивном перемешивании добавляют насыщенный раствор хлороводорода в диэтиловом эфире (0,75 мл). После полного прибавления охлаждение прекращают и реакционную смесь перемешивают еще в течение 10 минут. Затем раствор концентрируют в вакууме и получают гидрохлорид (5-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрила с количественным выходом.
Пример 27. (5-Бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетат натрия В круглодонной колбе к раствору 0,5 г (0,002 моль) (5-бензоиламино-3-гидрокси-2-оксиндол-3-ил)уксусной кислоты (пример 10) в тетрагидрофуране (15 мл) при охлаждении на ледяной бане по каплям при интенсивном перемешивании добавляют насыщенный раствор гидроксида натрия в метаноле (0,28 мл). После полного прибавления охлаждение прекращают и реакционную смесь перемешивают еще в течение 10 минут. Затем раствор концентрируют в вакууме и получают (5-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетат натрия с количественным выходом.
Фармацевтические композиции в соответствии с заявленным изобретением могут быть представлены в виде глазных капель, геля, мази, полимерной матрицы со включенным активным веществом и проч.
Заявленное изобретение иллюстрируется, но не ограничивается, следующими примерами фармацевтических композиций.
Пример 28. Фармацевтическая композиция, содержащая (5-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил в виде глазных капель.
Приготовление глазных капель осуществляют стандартным способом приготовления глазных капель, путем смешивания всех входящих в их состав компонентов до получения однородной массы, растворимой в воде. Полученные глазные капли соответствуют требованиям к фармацевтическому средству.
Указанные компоненты глазных капель берут в следующем соотношении в масс. %:
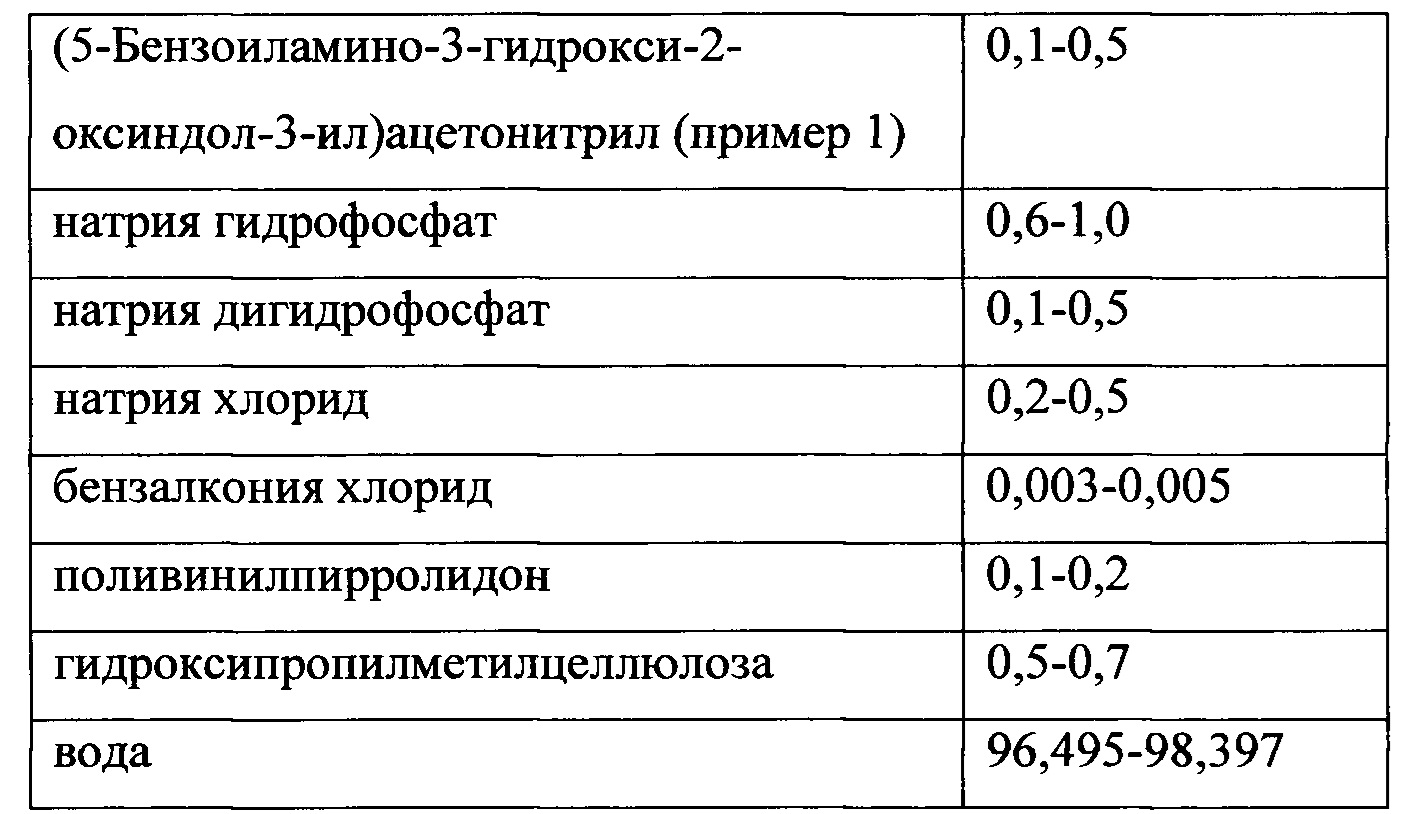
При этом рН полученного раствора должен составлять 7,4.
Пример 29. Фармацевтическая композиция (5-фуроиламино-3-гидрокси-2-оксиндол-3-ил)ацтеонитрила
Получение аналогично примеру 28, но в качестве активного компонента использован (5-фуроиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил.
РАСЧЕТНЫЕ ИССЛЕДОВАНИЯ
Для подтверждения возможности связывания соединений формулы (I) с мелатониновыми рецепторами было проведено молекулярное моделирование (докинг) взаимодействия соединений формулы (I) с активным центром МТ3 подтипа мелатониновых рецепторов.
Для проведения процедуры докинга и расчета аффинности соединений формулы (I) была использована кристаллическая структура МТ3 подтипа мелатониновых рецепторов (PDB ID 4GQI, http://www.rcsb.org/pdb/explore/explore.do?structureId=4GQI), известная из уровня техники, а именно описанная в работе M.S. Volkova (Synthesis of novel receptor ligands via an unusual Knoevenagel condensation, Bioorganic & Medicinal Chemistry Letters, 2012, v. 22, 7578-7581). Подготовка лигандов и макромолекулы проводилась с использованием программного обеспечения ACD/Labs (Version 10.04, Advanced Chemistry Development, Inc.), AutoDockTools (ADT Version 1.5.6, The Scripps Research Institute), визуализация - The PyMOL Molecular Graphics System (Version 1.74, Schrodinger, LLC). Расчет энергии связывания проводился с использованием ПО AutoDock Vina (Version 1.1.2, Trott О., Olson A.J. AutoDock Vina: improving the speed and accuracy of the docking with a new scoring function, efficient optimization and multithreading, Journal of Computational Chemistry, 2010, pp 455-461) и AutoDock4 (Version 4.2.6, The Scripps Research Institute). Для сравнения эффективности связывания использовались константы связывания К лигандов, расчет которых проводился по уравнению (1):
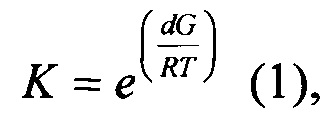
где dG - энергия связывания (Дж), R - универсальная газовая постоянная (8,31 Дж/(моль*К), Т - температура (298 К) (табл. 1).


Таким образом, по результатам расчетов константы связывания можно заключить, что предложенные соединения формулы (I) демонстрируют более сильное сродство к МТ3 подтипу мелатониновых рецепторов по сравнению с эндогенным лигандом (мелатонином) и, предположительно, будут оказывать более сильный биологический ответ и/или пролонгированное действие.
Результаты, полученные с помощью докинга, были подтверждены экспериментально. Новые производные индолинона формулы (I) эффективно снижают ВГД, что подтверждается в экспериментах in vivo, показанных ниже.
ИЗУЧЕНИЕ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ СОЕДИНЕНИЙ ФОРМУЛЫ (I)
Способность мелатонина, (5-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонирила и (5-фуроиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрила снижать внутриглазное давление оценивали на нормотензивных кроликах породы шиншилла, самцах, массой около 2 кг. Для этого вышеуказанные соединения растворяли в ДМСО, а затем разбавляли 0,05 М фосфатным буфером (рН 7,4) до концентрации 1 мг/мл (0,1 масс %). Для измерения биологической активности (снижение внутриглазного давления) проводили однократную инсталляцию 1 капли (0,05 мл) полученного раствора тестируемого соединения в оба глаза животного (отрицательный контроль - носитель - раствор 0,05 М фосфатного буфера с таким же содержанием ДМСО, как и в растворе тестируемого соединения). Для контроля суточных колебаний проводили измерение ВГД у группы животных, не получавших лечения. В качестве положительного контроля был использован раствор Тимолола (0,1 масс %). Проводили измерение внутриглазного давления до закапывания и далее после закапывания в течение 6 часов с интервалом в 1 час., а также через 24 часа после инсталляции. Измерения проводили с помощью автоматического аппланационного тонометра для ветеринарии Tonovet (Icare, Финляндия). Оценку гипотензивного действия каждого вещества и положительного/отрицательного контроля проводили в группе из 3 животных (6 глаз) (таблица 2). В следующий опыт животных брали после перерыва не менее чем в 7 дней. Животных содержали в индивидуальных клетках со свободным доступом к пище и воде. Все исследования на животных проводились в соответствии с заявлением Ассоциации исследований в области зрения и офтальмологии (ARVO) об использовании животных в офтальмологических исследованиях и директиве Европейского совета по сообществам (86/609/ЕЕС). Все процедуры были одобрены местным этическим комитетом НИИ глазных болезней им. Гельмгольца.

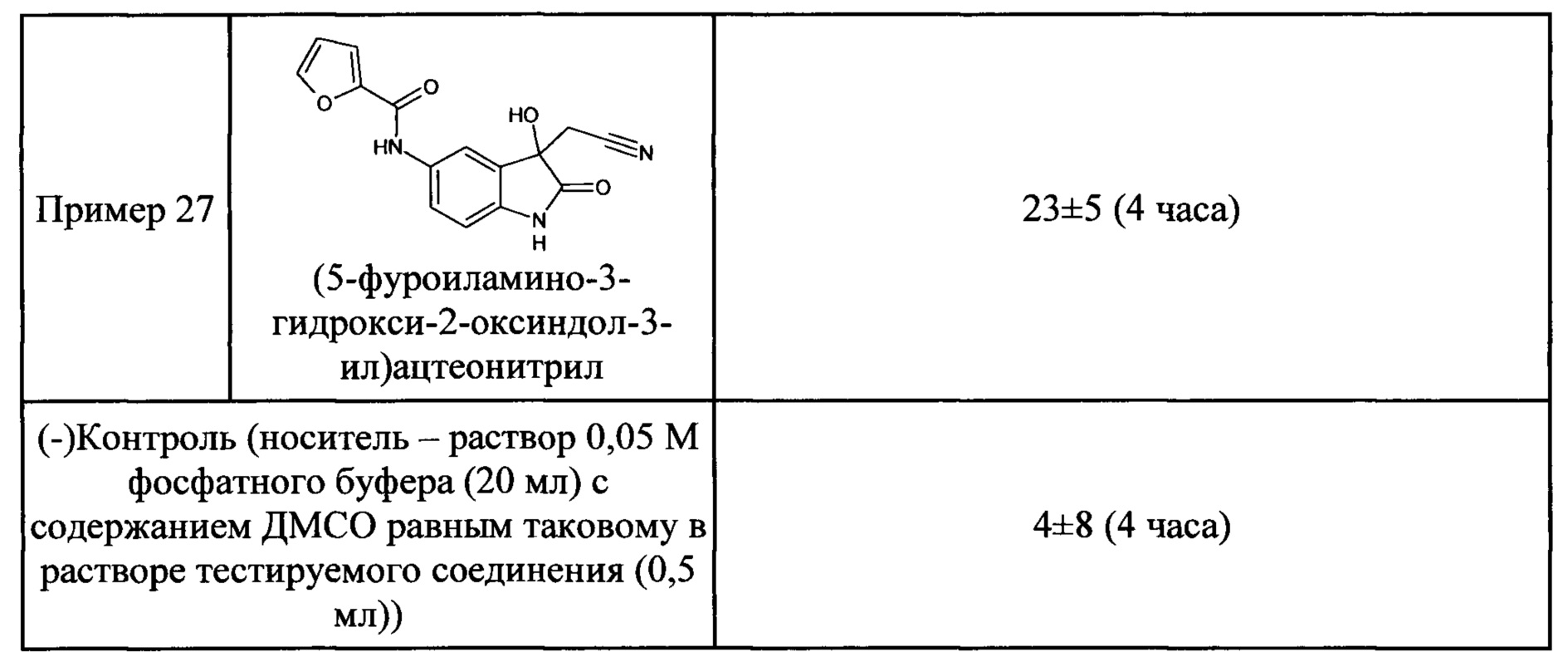
*n=6, P=0,95, в качестве интервала указано стандартное отклонение
Из приведенного графика (фиг. 2) видно, что в точках максимума снижения ВГД значения биологической активности для исследованных производных (5-бензоиламино-3-гидрокси-2-оксинжол-3-ил)ацетонитрил и (5-фуроиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрил) пересекаются с учетом величины стандартного отклонения со значениями для рефференсных соединений (Мелатонин и Тимолол) и все значения снижений ВГД достоверно отличаются от таковых для контрольных групп ((-)Контроль и норм. сут. колеб.). Это говорит о возможности применения группы предложенных соединений формулы (I) в качестве средств влияющих (а именно, снижающих) на внутриглазное давление, в частности в качестве антиглаукомных препаратов.
ИЗУЧЕНИЕ АНТИОКСИДАНТНОЙ АКТИВНОСТИ СОЕДИНЕНИЙ ФОРМУЛЫ (I)
Значительным преимуществом соединений формулы (I) перед препаратами для снижения ВГД, в том числе перед Тимололом, является наличие у них выраженной антиоксидантной активности. Окислительный стресс является важным звеном патогенеза глаукомы, поскольку приводит к гибели нейронов сетчатки и развитию глаукомной оптической нейропатии [Нестеров А.П. Глаукома, Москва: Медицина, 1995.]. По свидетельству как отечественных, так и зарубежных исследователей, включение антиоксидантов в комплексную терапию глаукомы существенно повышает эффективность лечения [Рациональная фармакотерапия в офтальмологии, ред. Е.А. Егоров, (2004) Медицина, М.; Moreno МС., Campanelli J, Sande Р et al. Retinal oxidative stress induced by high intraocular pressure. Free Radic Biol Med 2004; 37:803-812.]. Использование соединений формулы (I) позволит достичь более высоких результатов в терапии глаукомы и одновременно уменьшить количество применяемых пациентом препаратов.
Оценку антиоксидантной активности (АОА) (5-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрила и (5-фуроиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрила проводили по изменению параметров кинетики хемилюминесценции в модельной системе гемоглобин-H2O2-люминол [Гулидова О.В, Любицкий О.Б., Клебанов Г.И., Чеснокова Н.Б. Изменение антиокислительной активности слезной жидкости при экспериментальной ожоговой болезни глаз. Бюллетень экспериментальной биологии и медицины. 1999;128(11):571-574. doi.org/10.1007/bf02433426]. Кинетику регистрировали с помощью хемилюминометра "Биотокс-7" (АНО "Инженерный Центр - Экология", Россия).
Основными параметрами кинетики ХЛ являются: величина латентного периода, светосумма, максимальная интенсивность ХЛ. В настоящей работе в качестве параметра, характеризующего АОА синтезированных соединений, был выбран период полной защиты Лм от окисления, который отражает латентный период ХЛ.
Введение в модельную систему антиоксидантов (АО) приводит к торможению свободнорадикального окисления люминола. Это проявляется в увеличении латентного периода ХЛ. Прямопропорциональная зависимость изменения латентного периода ХЛ (t/t0) от концентрации вещества, добавленного в систему, позволяет легко выразить АОА исследуемого вещества через молярную концентрацию другого (стандартного) антиоксиданта. Концентрация стандарта, добавление которого в модельную систему приводит к такому же изменению латентного периода ХЛ, как при добавлении исследуемого вещества данной концентрации, является эквивалентной величиной при представлении результатов. В качестве стандартного антиоксиданта был использован водорастворимый аналог витамина Е - Тролокс (6-гидрокси-2,5,7,8-тетраметилхроман-2-карбоновая кислота, Sigma-Aldrich, Германия).
Полученные экспериментальные данные могут быть аппроксимированы прямой линией методом МНК (фиг. 2).
Для расчета АОА исследуемых веществ находились соответствующие значения констант изменения латентного периода тестируемых веществ (Kt) и эталонного АО тролокса (KtT). АОА выражалась через конечную концентрацию тролокса (СэквТ). Окончательный результат представляется в единицах эквивалентной концентрации тролокса, которая рассчитывается с учетом предварительного разбавления (D) (уравнения 2, 3) [Любицкий О.Б. - Определение антиоксидантной активности биологических жидкостей хемилюминесцентным методом Москва: Канд. дис. РГМУ.. 1999 г.].
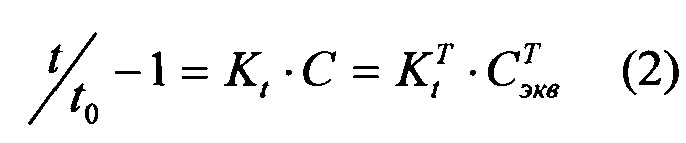
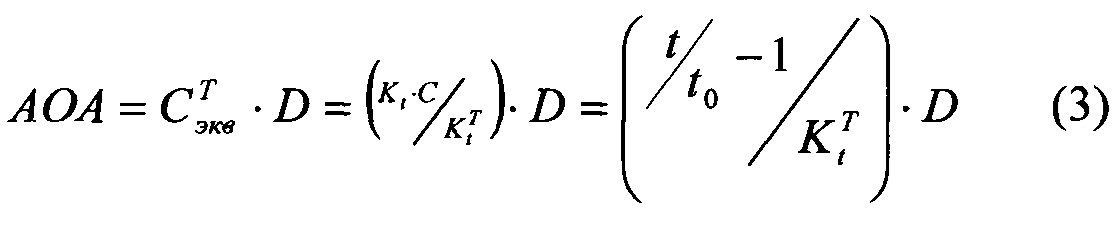
Чем больше значение коэффициента Kt в линейном уравнении (3) для конкретного вещества, тем большее увеличение латентного периода наблюдается с увеличением концентрации добавленного вещества и, следовательно, больше его антиоксидантный эффект. Для сравнения АОА тестируемых веществ использовался тангенс угла наклона зависимости АОА от концентрации исследуемого вещества α (фиг. 2).
В литературе имеется много работ, посвященных успешному применению при терапии глаукомы мелатонина - мощного природного антиоксиданта [Korkmaz A., Reiter R.J., Topal Т., Manchester L.C., Oter S., Tan D.X. Melatonin: an established antioxidant worthy of use in clinical trials // Mol Med. 2009. Vol. 15. №1-2. P. 43-50.; Rosenstein R.E., Pandi-Perumal S.R., Srinivasan V., Spence D.W., Brown G.M., Cardinali D. Melatonin as a therapeutic tool in ophthalmology: implications for glaucoma and uveitis. J Pineal Res. 2010; 49(1):1-13.].
На фиг. 2 видно, что АОА (5-бензоиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрила (пример 1) и (5-фуроиламино-3-гидрокси-2-оксиндол-3-ил)ацетонитрила (пример 2) многократно превышает активность мелатонина.
Таким образом, соединения формулы (I) обладают сразу двумя свойствами, которые делают их перспективными кандидатами для создания препаратов для лечения глаукомы и других заболеваний глаз, сопровождающихся окислительным стрессом в связи с их способностью снижать ВГД и их выраженной антиоксидантной активностью.
Реферат
Группа изобретений относится к амидсодержащим производным 2-оксиндола общей формулы (I), где Rозначает Н, бензил, C-С-алкил, Rозначает Н, ОН, OR, Rозначает СООН, CN, Rозначает Н, ОС-С-алкил, галоген, C-C-алкил, СООС-С-алкил, NHC(X)R, Rозначает C-С-арил, C-С-гетероарил, NHC-С-алкил, NHC-С-галоидалкил, NHC-С-циклоалкил, NHC-С-арил, NHC-С-гетероарил, OC-С-арил, где C-С-гетероарил содержит 1 или 2 гетероатома, выбранные из О, N, S, Rозначает C-С-алкил, С(O)C-С-алкил, Rозначает С-С-алкил, С-С-галоидалкил, ОС-С-алкил, С-С-циклоалкил, C-С-арил, C-С-гетероарил, NHC-С-алкил, NHC-С-галоидалкил, NHC-С-циклоалкил, NHC-С-арил, NHC-С-гетероарил, OC-С-арил, где C-С-гетероарил содержит 1 или 2 гетероатома, выбранные из О, N, S, X означает О, S, способу получения данных соединений и их применению в качестве лекарственных средств, в качестве компонента фармацевтической композиции для лечения офтальмологических заболеваний, а также способу лечения офтальмологических заболеваний с использованием фармацевтической композиции на основе соединений формулы (I). 5 н. и 27 з.п. ф-лы, 2 ил.., 2 табл., 29 пр.
Формула
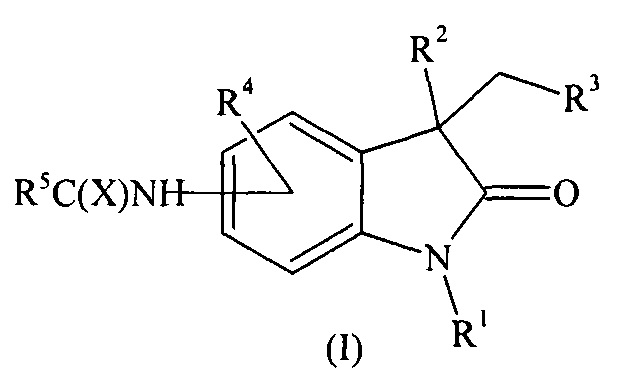
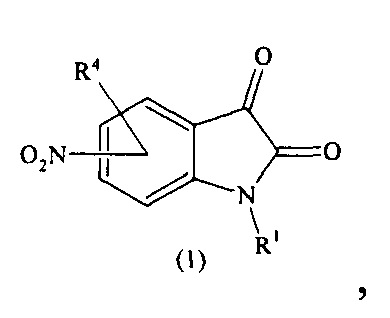
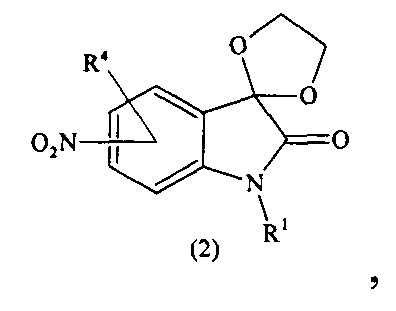
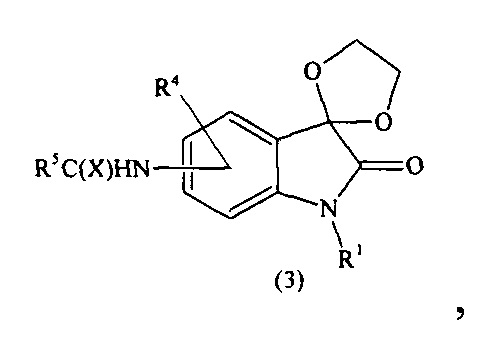

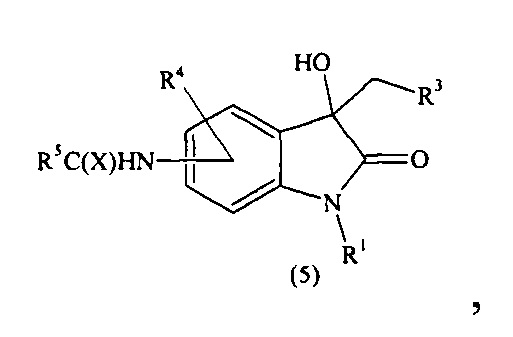
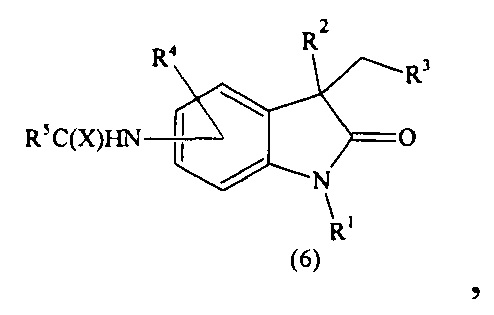
Документы, цитированные в отчёте о поиске
Производные индолинона, обладающих свойствами лигандов мелатонинового рецептора и их применение

Комментарии