Противоопухолевые комбинации с ингибиторами mtor, герцептином и/или hki-272 - RU2451524C2
Код документа: RU2451524C2
Чертежи



Описание
Настоящее изобретение относится к применению комбинаций герцептина с ингибитором mTOR и/или HKI-272 для лечения новообразований, связанных с избыточной экспрессией или амплификацией HER2.
CCI-779 представляет собой сложный эфир рапамицина по положению 42 и 3-гидрокси-2-(гидроксиметил)-2-метилпропионовой кислоты, сложный эфир рапамицина, который проявляет значительное ингибирующее действие на рост опухолей как в моделях in vitro, так и в моделях in vivo. Указанное соединение в настоящее время известно в общем случае под названием темсиролимус. Получение и применение сложных оксиэфиров рапамицина, включая темсиролимус, описано в Патентах США 5,362,718 и 6,277,983.
Темсиролимус проявляет цитостатические, в противоположность цитотоксическим, свойства, и может отсрочивать время прогрессирования опухолей или время рецидива опухоли. Считают, что механизм действия темсиролимуса такой же, как и механизм действия сиролимуса. Темсиролимус связывается и образует комплекс с цитоплазматическим белком FKBP, который ингибирует фермент mTOR («мишень рапамицина млекопитающих», также известный как FKBP12-rapamycin associated protein [FRAP]. ассоциированный с рапамицином белок). Ингибирование активности mTOR-киназы ингибирует множество путей сигнальной трансдукции, включая стимулируемую цитокином пролиферацию клеток, трансляцию мРНК с образованием некоторых ключевых белков, регулирующих фазу G1 клеточного цикла, и IL-2-индуцироваппую транскрипцию, приводя к ингибированию развития клеточного цикла от фазы G1 до фазы S. Механизм действия темсиролимуса, приводящий к блокированию фазы G1 - S, является новым для противоракового лекарства.
Метастатический paк молочной железы (МРМЖ) по существу неизлечим при помощи традиционной терапии, а медиана выживаемости пациентов с МРМЖ составляет примерно 2 года с момента подтверждения метастазирования. Как следствие, целями лечения являются облегчение симптомов у пациента и одновременно с этим попытка сохранить (или улучшить, в некоторых случаях) качество жизни. Увеличение продолжительности жизни остается очевидной целью, особенно при раке молочной железы, связанном с избыточной экспрессией или амплификацией онкогена HER2.
Герцептин® (трастузумаб) представляет собой одобренное Управлением по контролю за продуктами и лекарствами (FDA) терапевтическое моноклональное антитело для лечения метастатического рака молочной железы с избыточной экспрессией белка HER2. Описано мышиное моноклональное антитело [см. Патент США 5,705,151]. Указанный документ описывает молекулу мышиного антитела MAb4D5, гуманизированного для того, чтобы улучшить его клиническую эффективность путем снижения иммуногенности и обеспечения его способности поддерживать эффекторные функции человека. WO 92/22653. Более поздние документы описывают разработку лиофилизированного состава, содержащего непроцессированное гуманизированное антитело huMAb4D5-8, описанное в WO 92/22653. Герцептин в настоящее время одобрен Управлением по контролю за продуктами и лекарствами (FDA) для лечения метастатического рака молочной железы с избыточной экспрессией HER2, (1) в качестве единственного средства после предварительного лечения метастатического рака молочной железы одним или более курсами химиотерапии, и (2) в сочетании с паклитакселом у пациентов без предшествующего химиотерапевтического лечения метастатического рака молочной железы. Кроме того, имеются данные, что добавление герцептина к адъювантной или неоадъювантной химиотерапии таксанами благотворно влияет на пациентов с ранними стадиями рака молочной железы.
HKI-272, (Е)-N-{4-[3-хлор-4-(2-пиридинилметокси)анилино]-3-циано-7-этокси-6-хинолинил)-4-(диметиламино)-2-бутенамид, описан в качестве многообещающего потенциального противоракового лекарства для лечения рака молочной железы и других HER-2-зависимых видов рака. Поскольку он также ингибирует со сходной силой РЭФР-киназу, HKI-272 можно применять для лечения опухолей с избыточной экспрессией одновременно HER-2 и РЭФР, и он может быть более эффективным, чем специфический антагонист РЭФР или HER-2. S.К.Rabindran et al. "Antitumor Activity of HKI-272, an Orally Active, Irreversible Inhibitor of the HER-2 Tyrosine Kinase", Cancer Research 64, 3958-3965, June 1, 2004. См. Патент США №6,288,082: Патент США №6,297,258.
Таким образом, существует необходимость в усовершенствованной противоопухолевой терапии.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На Фиг.1 представлено трехмерное контурное изображение с плоскостью при 0%, представляющей аддитивное взаимодействие, и пиками и минимумами, представляющими области синергизма или антагонизма, соответственно, между герцептином и HKI-272 а клетках линии ВТ474 [HER-2+ (амплифицированный); АТСС НТВ-20].
На Фиг.2 представлено трехмерное контурное изображение с плоскостью при 0%, представляющей аддитивное взаимодействие, и пиками и минимумами, представляющими области синергизма или антагонизма, соответственно, между герцептином и HKI-272 в клетках линии MCF-7 [HER-2-, EGFR-; аденокарцинома; АТСС НТВ22].
На Фиг.3 представлено трехмерное контурное изображение с плоскостью при 0%, представляющей аддитивное взаимодействие, и пиками и минимумами, представляющими области синергизма или антагонизма, соответственно, между герцептином и HKI-272 в клетках линии MDA-MB-361 [HER-2+ (неамплифицированный); аденокарцинома; АТСС НТВ 27].
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Согласно настоящему изобретению, предложено применение комбинаций, содержащих герцептин, ингибитор mTOR и/или HKI-272, для лечения новообразований. Таким образом, настоящее изобретение предлагает совместное применение герцептина и ингибитора mTOR, совместное применение герцептина и HKI-272, совместное применение ингибитора mTOR и HKI-272, или совместное применение герцептина, ингибитора mTOR и HKI-272. Кроме того, настоящее изобретение предлагает продукты, содержащие герцептин в сочетании с ингибитором mTOR и/или HKI-272, полученные для одновременного, раздельного или последовательного применения при лечении новообразований у млекопитающего. Настоящее изобретение также применимо в качестве адъювантной и/или неоадъювантной терапии на ранних стадиях рака молочной железы. В нижеприведенном подробном описании в качестве иллюстрации использован темсиролимус. Однако темсиролимус в описанных в настоящем описании способах, комбинациях и продуктах можно заменить другими ингибиторами mTOR.
Указанные способы, комбинации и продукты можно применять для лечения ряда новообразований, связанных с избыточной экспрессией или амплификацией HER2, включая, например, различные виды рака легкого, включая бронхоальвеолярную карциному и немелкоклеточный рак легкого, различные виды рака молочной железы, различные виды рака предстательной железы, миелому, рак головы и шеи, или переходно-клеточную карциному; мелкоклеточную и крупноклеточную нейроэндокринную карциному шейки матки.
Согласно одному из вариантов реализации, сочетание темсиролимуса и герцептина особенно хорошо подходит для лечения метастатического рака молочной железы. Согласно другому варианту реализации, сочетание герцептина с ингибитором mTOR и/или HKI-272 хорошо подходит для лечения опухолей молочной железы, почек, мочевого пузыря, полости рта, гортани, пищевода, желудка, кишечника, яичников и легкого, а также поликистоза почек.
Используемый здесь термин ингибитор mTOR обозначает соединение или лиганд, или его фармацевтически приемлемую соль, которое ингибирует репликацию клеток путем блокирования развития клеточного цикла от фазы G1 до S. Указанный термин включает нейтральное трициклическое соединение рапамицин (сиролимус) и другие рапамициновые соединения, включая, например, производные рапамицина, аналоги рапамицина, другие макролидные соединения, ингибирующие активность mTOR, и все соединения, входящие в нижеприведенное определение термина «рапамицин». В указанный термин включены соединения, сходные по структуре с «рапамицином», например, соединения с аналогичной макроциклической структурой, модифицированные для улучшения их терапевтической активности. В способе согласно настоящему изобретению также можно применять FK-506.
Используемый здесь термин рапамицин обозначает класс иммуносупрессорных соединений, содержащих основное ядро рапамицина, как показано ниже.
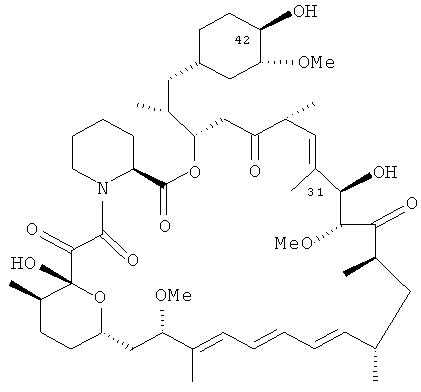
Рапамицины согласно настоящему изобретению включают соединения, химически или биологически модифицированные как производные рапамицинового ядра, с сохранением иммуносупрессорных свойств. Соответственно, термин рапамицин включает рапамицин, сложные эфиры, простые эфиры, карбаматы, оксимы, гидразоны и гидроксиламины рапамицина, а также рапамицины, в которых функциональные группы рапамицинового ядра модифицированы, например, путем восстановления или окисления. Также в термин рапамицин включены фармацевтически приемлемые соли рапамицинов.
Также термин рапамицин включает сложные эфиры по положениям 42 и/или 31 и простые эфиры рапамицина, как это описано в нижеследующих патентах, полностью включенных в настоящее описание посредством ссылок: алкиловые сложные эфиры (Патент США №4,316,885); аминоалкиловые сложные эфиры (Патент США №4,650,803); фторированные сложные эфиры (Патент США №5,100,883); амидные сложные эфиры (Патент США №5,118,677); карбаматные сложные эфиры (Патент США №5,118, 678); силиловые сложные эфиры (Патент США №5,120,842); аминодисложные эфиры (Патент США №5,162,333); сульфонатные и сульфатные сложные эфиры (Патент США №5,177,203); сложные эфиры (Патент США №5,221,670); алкоксисложные эфиры (Патент США №5,233,036); О-арильные, -алкильные, -алкенильные, и -алкинильные простые эфиры (Патент США №5,258,389); карбонатные сложные эфиры (Патент США №5,260,300); арилкарбонил- и алкоксикарбонил- карбаматы (Патент США №5,262,423); карбаматы (Патент США №5,302,584); сложные оксиэфиры (Патент США №5,362,718); стерически затрудненные сложные эфиры (Патент США №5,385,908); гетероциклические сложные эфиры (Патент США №5,385,909); гемдизамещенные сложные эфиры (Патент США №5,385,910); аминоалкановых кислот сложные эфиры (Патент США №5,389,639); фосфорилкарбаматные сложные эфиры (Патент США №5,391,730); карбаматные сложные эфиры (Патент США №5,411,967); карбаматные сложные эфиры (Патент США №5,434,260); амидинокарбаматные сложные эфиры (Патент США №5,463,048); карбаматные сложные эфиры (Патент США №5,480,988); карбаматные сложные эфиры (Патент США №5,480,989); карбаматные сложные эфиры (Патент США №5,489,680); стерически затрудненные сложные эфиры N-оксидов (Патент США №5,491,231); биотиновые сложные эфиры (Патент США №5,504,091); O-алкильные простые эфиры (Патент США №5,665,772); и сложные ПЭГ-эфиры рапамицина (Патент США №5,780,462). Получение указанных сложных и простых эфиров раскрыто в перечисленных выше патентах.
Кроме того, определение термина рапамицин включает простые и сложные эфиры рапамицина по положению 27, раскрытые в Патенте США №5,256,790. Также описаны С-27 кетоновые рапамицины, восстановленные до соответствующего спирта, который, в свою очередь, превращен в соответствующий простой или сложный эфир. Получение указанных сложных и простых эфиров раскрыто в перечисленных выше патентах. Также включены оксимы, гидразоны и гидроксиламины рапамицина, раскрытые в Патентах США №№5,373,014, 5,378,836, 5,023,264 и 5,563,145. Получение указанных оксимов, гидразонов и гидроксиламинов раскрыто в перечисленных выше патентах. Получение 42-оксорапамицина раскрыто в патенте США №5,023,263.
Используемый здесь термин CCI-779 обозначает сложный эфир рапамицина по положению 42 и 3-гидрокси-2-(гидроксиметил)-2-метилпропионовой кислоты (темсиролимус), и включает его пролекарства, производные, фармацевтически приемлемые соли и аналоги.
Примеры рапамицина включают, например, рапамицин, 32-дезоксирапамицин, 16-пент-2-инилокси-32-дезоксирапамицин, 16-пент-2-инилокси-32(S)-дигидрорапамицин, 16-пент-2-инилокси-32(S)-дигидро-40-O-(2-гидроксиэтил)-рапамицин, 40-O-(2-гидрокcиэтил)-рапамицин, сложный эфир рапамицина по положению 42 и 3-гидрокси-2-(гидроксиметил)-2-метилпропионовой кислоты (CCI-779), 40-[3-гидрокси-2-(гидроксиметил)-2-метилпропионат]-рапамицин, или их фармацевтически приемлемые соли, как это раскрыто в Патенте США №5,362,718, АВТ578, или 40-(тетразолил)-рапамицин, 40-эпи-(тетразолил)-рапамицин, например, как это раскрыто в Международной публикации WO 99/15530, или аналоги рапамицина, как это раскрыто в Международных публикациях WO 98/02441 и WO 01/14387, например, АР23573. Согласно другому варианту реализации, указанное соединение представляет собой CerticanТМ (эверолимус, 2-O-(2-гидрокси) этилрапамицин, Novartis, Патент США №5,665,772).
Используемый здесь термин «HKI-272» относится к соединению, содержащему следующее ядро,

или к его производному, или к его фармацевтически приемлемой соли. Подходящие производные могут включать, например сложный эфир, простой эфир или карбамат. Структура ядра, HKI-272, имеет химическое наименование (E)-N-{4-[3-xлор-4-(2-пиридинилметокси)анилино]-3-циано-7-этокси-6-хинолинил}-4-(диметиламино)-2-бутенамид.
Согласно одному из вариантов реализации, настоящее изобретение также предлагает применение замещенных 3-цианохинолиов, имеющих следующую структуру:

где
R1 представляет собой галоген;
R2 представляет собой пиридинил, тиофен, пиримидин, тиазол или фенил, возможно замещенный не более чем тремя заместителями;
R3 представляет собой -О- или -S-;
R4 представляет собой метил или CH2CH2OCH3;
R5 представляет собой этил или метил; и
n равно 0 или 1.
Указанные соединения, представителем которых является HKI-272, характеризуются способностью действовать как сильные ингибиторы HER-2. См., например, Патент США №6,288,082 и Патент США №6,297,258. Указанные соединения и их получение подробно описаны в опубликованной заявке на Патент США №2005/0059678. Для удобства, во всем настоящем описании использован термин HKI-272. Однако следует понимать, что соединение предложенной выше структуры может заменять собой HKI-272 в комбинациях с ингибитором mTOR и/или герцептином, подробно описанных ниже.
Следующую стандартную методику фармакологического анализа можно применять для определения того, является ли исследуемое соединение ингибитором mTOR, как это определено в настоящем описании. Обработка клеток, стимулированных фактором роста, ингибитором mTOR, таким как рапамицин, полностью блокирует фосфорилирование серина-389, о чем свидетельствует вестерн-блоттинг, и таким образом, является хорошим тестом на ингибирование mTOR. Соответственно, цельноклеточные лизаты из клеток, стимулированных фактором роста (например, ИФР1) в культуре в присутствии ингибитора mTOR не должны демонстрировать полосу на акриламидном геле, способном выявлять антитело, специфическое для серина-389 в p70s6K.
Предпочтительно, чтобы ингибитор mTOR, применяемый в противоопухолевых комбинациях согласно настоящему изобретению, представлял собой рапамицин, и более предпочтительно, чтобы указанный ингибитор mTOR представлял собой рапамицин, темсиролимус или 42-O-(2-гидрокси)этилрапамицин. Получение 42-O-(2-гидрокси)этилрапамицина описано в Патенте США №5,665,772.
Получение темсиролимуса описано в Патенте США №5,362,718. Региоспецифический синтез темсиролимуса описан в Патенте США №6,277,983, который включен в настоящее описание посредством ссылки. Другой региоспецифический способ синтеза темсиролимуса описан в публикации патента США №2005-0033046-А1, опубликованной 10 февраля 2005 г. (Заявка №10/903,062, дата подачи 30 июля 2004 г.), и в ее дубликате, Международной публикации WO 2005/016935, опубликованной 7 апреля 2005 г.
Герцептин, а также способы его получения и приготовления составов, его содержащих, описаны, см, например, Патент США №6,821,515; Патент США №6,399,063 и Патент США №6,387,371. Герцептин коммерчески доступен от Genentech. Используемый в настоящем описании термин «герцептин» включает трастузумаб, измененные формы и производные трастузумаба. Термин «герцептин» включает средства, мишенью которых является тот же эпитоп рецептора Неr-2, который является мишенью трастузумаба. Указанный эпитоп известен из работы H.S. Cho et al., Structure of the extracellular region of HER2 alone and in complex with the Herceptin Fab, Nature 421 (2003), pp.756-760.
HKI-272, а также способы его получения и приготовления составов, его содержащих, также описаны, см., например, опубликованную заявку на патент США №2005/0059578; Патент США №6,002,008 также можно использовать для получения замещенных соединений 3-хинолина, применяемых согласно настоящему изобретению, указанный патент включен в настоящее описание посредством ссылки. Кроме способов, описанных в указанных документах, в WO-9633978 и WO-9633980 описаны способы, подходящие для получения указанных соединений. Хотя в указанных способах описано получение некоторых хиназолинов, их также можно применять для получения соответствующих замещенных 3-цианохинолинов, и указанные документы включены к настоящее описание посредством ссылок.
Используемый в соответствии с настоящим изобретением термин «лечение» обозначает лечение млекопитающего, имеющего новообразование, путем введения указанному млекопитающему эффективного количества двух- или трехкомпонентной комбинации, компоненты которой выбирают среди ингибитора mTOR, герцептина и или HKI-272, с целью ингибирования развития новообразования, роста опухоли у указанного млекопитающего, устранения новообразования, продления срока жизни млекопитающего или временного облегчения симптомов у указанного млекопитающего.
Используемый в соответствии с настоящим изобретением термин «введение» по отношению к введению ингибитора mTOR. с герцептином и/или HKI-272 обозначает или непосредственное введение ингибитора mTOR, или введение пролекарства, производного или аналога, который может образовывать эффективное количество ингибитора mTOR в организме, совместно с герцептином и/или HKI-272 непосредственно, или с введением пролекарства, производного или аналога, который может образовывать эффективное количество герцептина или HKI-272 в организме.
Применение комбинации ингибитора mTOR (например, темсиролимуса), герцептина и/или HKI-272 также предполагает возможность применения таких комбинаций указанных средств, в которых одно, два или три средства применяют в субтерапевтически эффективной дозировке. Субтерапевтически эффективную дозировку легко может определить любой специалист в данной области, руководствуясь изложенными в настоящем описании принципами. В одном из вариантов реализации, субтерапевтически эффективная дозировка представляет собой такую дозировку, которая эффективна в более низкой дозе при использовании в комбинированной схеме согласно настоящему изобретению, по сравнению с дозировкой, эффективной при использовании активных средств по отдельности. Кроме того, настоящее изобретение предлагает использование одного или более активных средств, входящих в комбинацию согласно настоящему изобретению, в супратерапевтическом количестве, т.е. в более высокой дозе в комбинации, чем при использования отдельно. В указанном варианте реализации другой активный компонент(компоненты) можно использовать в терапевтическом или в субтерапевтическом количестве.
Комбинации согласно настоящему изобретению могут быть реализованы в форме наборов компонентов. Поэтому настоящее изобретение включает продукт, содержащий ингибитор mTOR, герцептин и/или HKI-272 в виде комбинированного препарата для одновременного, раздельного или последовательного введения при лечении новообразования у млекопитающего, нуждающегося в указанном лечении. Согласно одному из вариантов реализации, указанный продукт содержит темсиролимус и герцептин в виде комбинированного препарата для одновременного, раздельного или последовательного введения при лечении новообразования у млекопитающего, нуждающегося в указанном лечении. Возможно, указанный продукт дополнительно содержит HKI-272. HKI-272 может быть в форме отдельного состава, например, для перорального введения. Согласно другому варианту реализации, указанный продукт содержит темсиролимус и HKI-272 в виде комбинированного препарата для одновременного, раздельного или последовательного введения при лечении новообразования у млекопитающего, нуждающегося в указанном лечении. Возможно, указанный продукт дополнительно содержит герцептин. Согласно еще одному варианту реализации, указанный продукт содержит герцептин и HKI-272. Возможно, указанный продукт дополнительно содержит ингибитор mTOR. Согласно одному из вариантов реализации, указанное новообразование представляет собой метастатический рак молочной железы.
Согласно одному из вариантов реализации, предложена фармацевтическая упаковка лекарства, содержащая курс лечения новообразования у одного отдельного млекопитающего, отличающаяся тем, что указанная упаковка содержит единицы ингибитора mTOR в виде разовых дозированных форм и единицы герцептина в виде разовых дозированных форм, возможно, дополнительно в сочетании с единицами HKI-272 в виде разовых дозированных форм. Согласно другому варианту реализации, предложена фармацевтическая упаковка лекарства, содержащая курс лечения новообразования у одного отдельного млекопитающего, отличающаяся тем, что указанная упаковка содержит единицы ингибитора mTOR в виде разовых дозированных форм и единицы HKI-272 в виде разовых дозированных форм, возможно, дополнительно в сочетании с единицами герцептина в виде разовых дозированных форм. Согласно еще одному из вариантов реализации, предложена фармацевтическая упаковка лекарства, содержащая курс лечения новообразования у одного отдельного млекопитающего, отличающаяся тем, что указанная упаковка содержит единицы герцептина в виде разовых дозированных форм и единицы HKI-272 в виде разовых дозированных форм, возможно, дополнительно в сочетании с единицами ингибитора mTOR в виде разовых дозированных форм. Согласно одному из вариантов реализации, описанная упаковка лекарства содержит курс лечения метастатического рака молочной железы у одного отдельного млекопитающего.
Указанные составы можно вводить перорально, внутривенно, респираторно (например, интраназально или интрабронхиально), путем инфузии, парентерально (помимо в/в, такими способами, как инъекция в пораженную область, внутрибрюшинная и подкожная инъекции), внутрибрюшинно, трансдермально (включая все способы введения через поверхность тела и внутренних оболочек полостей тела, включая ткани эпителия и слизистых оболочек), и вагинально (включая внутриматочное введение). Также возможны другие способы введения, такие как введение посредством липосом; наружное, назальное, сублингвальное, уретральное, интратекальное, введение в глаз или ухо, введение посредством имплантатов, ректальное, интраназальное.
Хотя компоненты согласно настоящему изобретению можно вводить одинаковым путем, продукт или упаковка согласно настоящему изобретению может содержать рапамицин, такой как темсиролимус, для введения путем, отличным от пути введения герцептила или HKI-272, например, один или более компонентов можно вводить перорально, тогда как. один или более других компонентов вводят впутривенно. Согласно одному из вариантов реализации, темсиролимус приготовлен в форме для перорального введения, HKI-272 приготовлен в форме для перорального введения, а герцептин приготовлен в форме для внутривенного введения. Согласно другому варианту реализации, как темсиролимус, так и герцептин приготовлены в форме для внутривенного введения. Согласно еще одному из вариантов реализации, все компоненты подготовлены в форме для перорального введения. Как вариант, другие активные компоненты можно вводить тем же самым, или другими путями, что и ингибитор mTOR (например, темсиролимус) или герцептин. Другие варианты очевидны для специалиста в данной области и рассматриваются как входящие в объем изобретения.
Комбинацию ингибитора mTOR с герцептином можно вводить без добавления HKI-272. Согласно одному из вариантов реализации, это единственные активные противоопухолевые средства, применяемые в данной схеме лечения. Согласно другому варианту реализации, комбинацию ингибитор mTOR/герцептин вводят в сочетании с HKI-272.
Комбинацию ингибитора mTOR с HKI-272 можно вводить без добавления герцептина. Согласно другому варианту реализации, комбинацию ингибитор mTOR/HKI-272 вводят в сочетании с герцептином. Согласно одному из вариантов реализации, указанные двух- и трехкомпонентные комбинации являются единственными активными противоопухолевыми средствами, применяемыми в данной схеме лечения. Согласно другому варианту реализации, указанные двух- и трехкомпонентные комбинации можно применять, дополнительно сочетая их с другими активными средствами.
Комбинацию герцептина с HKI-272 можно вводить без добавления ингибитора mTOR. Согласно другому варианту реализации, комбинацию герцептин/HKI-272 вводят в сочетании с ингибитором mTOR. Согласно одному из вариантов реализации, указанные двух- и трехкомпонентные комбинации являются единственными активными противоопухолевыми средствами, применяемыми в данной схеме лечения. Согласно другому варианту реализации, указанные двух- и трехкомпонентные комбинации можно применять, дополнительно сочетая их с другими активными средствами.
Как это является типичным при лечении онкологических заболеваний, режимы дозирования тщательно контролирует лечащий врач, руководствуясь многочисленными факторами, включая тяжесть заболевания, улучшение состояния, любые токсические явления, связанные с лечением, возраст и общее состояние здоровья пациента. Предполагают, что режимы дозирования можно изменять в зависимости от пути введения.
Планируют, что исходные дозировки для в/в инфузии ингибитора mTOR (например, темсиролимуса) могут составлять от примерно 5 до примерно 175 мг, или от примерно 5 до примерно 25 мг, при введении по еженедельному режиму дозирования. Планируют, что пероральная дозировка ингибитора mTOR, применяемая согласно настоящему изобретению, может составлять от 10 мг/неделю до 250 мг/неделю, от примерно 20 мг/неделю до примерно 150 мг/неделю, от примерно 25 мг/неделю до примерно 100 мг/неделю, или от примерно 30 мг/неделю до примерно 75 мг/неделю. Для рапамицина планируемая пероральная дозировка может составлять от 0,1 мг/день до 25 мг/день. Точные дозировки будет определять терапевт, осуществляющий введение, руководствуясь своим опытом при лечении конкретного пациента.
Также возможны другие режимы дозирования и их варианты, их можно определить на основе терапевтических руководств. Предпочтительно, чтобы ингибитор mTOR вводили путем в/в инфузии или перорально, предпочтительно в виде таблеток или капсул.
Для герцептина рассматривают единичные дозы и множественные дозы. Согласно одному из вариантов реализации, единичную ударную дозу герцептина вводят в виде 90-минутной внутривенной инфузии в диапазоне примерно 4-5 мг/кг в 1-й день, после чего вводят повторные дозы примерно 2 мг/кг еженедельно, начиная с 8-го дня. Как правило, 3 недели составляют 1 цикл. Между циклами предусмотрен перерыв от 1 до 2 или 3 недель. Герцептин также можно назначать в дозе 6 мг/кг один раз в каждые 3-4 недели. Кроме того, герцептин можно назначать после завершения химиотерапии в качестве поддерживающей терапии.
Для HKI-272 желательным является, чтобы соединение согласно настоящему изобретению было приготовлено в виде разовой дозы. Подходящие формы разовых доз включают таблетки, капсулы и порошки в пакетиках или флаконах. Указанные формы разовых доз могут содержать от 0,1 до 300 мг соединения согласно настоящему изобретению, и предпочтительно от 2 до 100 мг. Еще более предпочтительные разовые дозировочные формы содержат от 5 до 50 мг соединения согласно настоящему изобретению. Соединения согласно настоящему изобретению можно вводить в диапазоне дозировок от примерно 0,01 до 100 мг/кг, предпочтительно в диапазоне дозировок от 1 до 10 мг/кг. Согласно одному из вариантов реализации, указанные соединения вводят перорально от 1 до 6 раз в сутки, более обычно от 1 до 4 раз в сутки. Как вариант, указанные соединения можно вводить другим подходящим путем, например, внутривенно. Согласно еще одному из вариантов реализации, указанные соединения вводят один раз в неделю, В некоторых случаях дозирование HKI-272 можно отложить или прервать на короткий период (например, 1, 2 или 3 недели) во время прохождения курса лечения. Указанную задержку или перерыв можно осуществлять один раз или более на протяжении курса лечения. Эффективное количество может быть известно специалисту в данной области; оно также зависит от формы, в которой находится соединение. Специалист в данной области может традиционным путем выполнить экспериментальные исследования для определения биоактивности соединения в биоанализах, и таким образом определить, какую дозу следует вводить.
Указанные схемы лечения при необходимости можно повторять или изменять. Также возможно применение других режимов дозирования и вариантов, их можно определить на основе терапевтических руководств.
Например, согласно одному из вариантов реализации, схема дополнительно включает введение таксана, например, доцетаксела и паклитаксела [например, суспензии паклитаксела, связанного с наночастицами альбумина, которая является коммерчески доступной под названием Abraxane]. Паклитаксел также можно входить по еженедельной схеме лечения, в дозах 60-100 мг/м2, вводимых в течение 1 часа, еженедельно, или 2-3 недель с последующей неделей перерыва. Согласно одному из вариантов реализации, паклитаксел вводят внутривенно в течение 3 часов в дозе 175 мг/м2, возможно с последующим введением цисплатина в дозе 75 мг/м2; или паклитаксел вводят внутривенно в течение 24 часов в дозе 135 мг/м2, возможно с последующим введением цисплатина в дозе 75 мг/м2. Пациентам, ранее получавшим лечение от карциномы, паклитаксел можно вводить в других дозировках и по другим схемам лечения. Однако оптимальная схема лечения еще не полностью разработана.
По рекомендованной схеме лечения паклитаксел вводят в дозе 135 мг/м2 или 175 мг/м2 внутривенно в течение 3 часов каждые 3 недели. При необходимости или желании указанные дозы можно изменять.
В комбинацию с ингибитором mTOR и герцептином могут быть включены также другие активные средства, включая, например, химиотерапевтические средства, такие как алкилирующие средства; гормональные средства (т.е. эстрамустин, амоксифен, торемифен, анастрозол или летрозол); антибиотики (т.е. пликамицин, блеомицин, митоксантрон, идарубицин, дактиномицин, митомицин или даунорубицин); антимитотические средства (т.е. винбластин, винкристин, тенипозид или винорелбин, коммерчески доступный под названием Navelbine); ингибиторы топоизомеразы (т.е. топотекан, иринотекан, этопозид или доксорубицин, например, CAELYX или Doxil, пегилированный липосомальный доксорубицин, гидрохлорид); и другие средства (т.е. гидроксимочевина, алтретамин, ритуксимаб, паклитаксел, доцетаксел, L-аспарагиназа или гемтузумаб озогамицин); биохимические модуляторы, иматиниб, ингибиторы РЭФР, такие как EKB-569 или другие ингибиторы мультикиназы, например, такие, мишенью которых являются серин/треонин и тирозинкиназы рецепторов как в клетке опухоли, так и в сосудистой сети опухоли, или иммуномодуляторы (т.е. интерфероны, ИЛ-2, или БЦЖ). Примеры подходящих интерферонов включают интерферон α, интерферон β, интерферон γ и их смеси.
Согласно одному из вариантов реализации, комбинацию ингибитора mTOR и герцептина можно дополнительно сочетать с противоопухолевыми алкилирующими средствами, например, такими, которые описаны в патенте US 2002-0198137 A1. Противоопухолевые алкилирующие средства ориентировочно классифицируют в соответствии со структурой или реакционноспособным остатком на несколько групп, включающих азотистые иприты, такие как MUSTARGEN (мехлорэтамин), циклофосфамид, ифосфамид, мелфалан и хлорамбуцил; азидины и эпоксиды, такие как тиотепа, митомицин С, диангидрогалактитол и дибромдульцитол; сульфинаты, такие как бусульфан; нитрозомочевины, такие как бис-хлорэтил-нитрозомочевина (БХНМ), хлорэтил-циклогексил-нитрозомочевина (CCNU) и метилциклогексил-хлорэтил-нитрозомочевина (MeCCNU); производные гидразина и триазина, такие как прокарбазин, дакарбазин и темозоломид; стрептозоцин, мелфалан, хлорамбуцил, кармустин, мехлорэтамин, ломустин; и соединения платины. Соединения платины представляют собой содержащие платину средства, взаимодействующие предпочтительно по положению N7 с остатками гуанина и аденина с образованием ряда монофункциональных и бифункциональных аддуктов. (Johnson S.W, Stevenson J.P, O'Dwyer P.J. Cisplatin and Its Analogues. In Cancer Principles & Practice of Oncology 6th Edition. ed. DeVita V.T, Hellman S., Rosenberg S.A. Lippincott Williams & Wilkins. Philadelphia 2001. p.378). Указанные соединения включают цисплатин, карбоплатин, соединения платины IV и многоядерные комплексы платины.
Ниже приведены типичные примеры алкилирующих средств согласно настоящему изобретению. Мехлорэтамин коммерчески доступен в форме средства для инъекции (MUSTARGEN). Циклофосфамид коммерчески доступен в форме средства для инъекций (циклофосфамид, лиофилизированный CYTOXAN, или NEOSAR) и в форме таблеток для перорального приема (циклофосфамид или CYTOXAN). Ифосфамид коммерчески доступен в форме средства для инъекций (IFEX). Мелфалан коммерчески доступен в форме средства для инъекций (ALKERAN) и в форме таблеток для перорального приема (ALKERAN). Хлорамбуцил коммерчески доступен в форме таблеток для перорального приема (LEUKERAN). Тиотепа коммерчески доступен в форме средства для инъекций (тиотепа или THIOPLEX). Митомицин коммерчески доступен в форме средства для инъекций (митамицин или MUTAMYCIN). Бусульфан коммерчески доступен в форме средства для инъекций (BUSULFEX) и в форме таблеток для перорального приема (MYLERAN). Ломустин (CCNU) коммерчески доступен в форме капсул для перорального приема (CEENU). Кармустин (БХНМ) коммерчески доступен в форме внутричерепного имплантата (GLIADEL) и в форме средства для инъекций (BICNU). Прокарбазин коммерчески доступен в форме капсул для перорального приема (MATULANE). Темозоломид коммерчески доступен в форме капсул для перорального приема (TEMODAR). Цисплатин коммерчески доступен в форме средства для инъекций (цисплатин, PLATINOL, или PLATINOL-AQ). Карбоплатин коммерчески доступен в форме средства для инъекций (PARAPLATIN). Оксалиплатин коммерчески доступен под названием ELOXATIN.
Согласно другому варианту реализации, комбинация согласно настоящему изобретению может дополнительно включать лечение при помощи противоопухолевого антиметаболита, как это описано в публикации патента США №.2005-0187184 А1 или US 2002-0183239 А1. Используемый в соответствии с настоящим изобретением термин «антиметаболит» обозначает вещество, обладающее структурой, похожей на структуру важного природного интермедиата (метаболита) в биохимическом пути, ведущем к синтезу ДНК или РНК, которое может взаимодействовать с активным центром указанного пути, но оказывает ингибирующее действие на завершение указанного пути (т.е. на синтез ДНК или РНК). Более конкретно, антиметаболиты, как правило, действуют благодаря (1) конкуренции с метаболитами за каталитический или регуляторный участок ключевого фермента в синтезе ДНК или РНК, или (2) замещения метаболита, который обычно включается в состав ДНК или РНК, и таким образом, образования ДНК или РНК, неспособной поддерживать репликацию. Основные группы антиметаболитов включают (1) аналоги фолиевой кислоты, которые являются ингибиторами дигидрофолатредуктазы (ДГФР); (2) аналоги пурина, которые имитируют природные пурины (аденин или гуанин), но отличаются по структуре настолько, что конкурентно или необратимо ингибируют процессинг ДНК или РНК в ядре; и (3) аналоги пиримидина, которые имитируют природные пиримидины (цитозин, тимидин и урацил), но отличаются по структуре настолько, что конкурентно или необратимо ингибируют процессинг ДНК или РНК в ядре.
Ниже приведены типичные примеры антиметаболитов согласно настоящему изобретению. 5-фторурацил (5-ФУ; 5-фтор-2,4(1Н,3Н)-пиримидиндион) коммерчески доступен в форме крема для местного применения (FLUOROPLEX или EFUDEX), раствора для местного применения (FLUOROPLEX или EFUDEX), и в форме средства для инъекций, содержащего 50 мг/мл 5-фторурацила (ADRUCIL или фторурацил). Флоксуридин (2'-дезокси-5-фторуридин) коммерчески доступен в форме средства для инъекций, содержащего 500 мг/флакон флоксуридина (FUDR или флоксуридин). Тиогуанин (2-амино-1,7-дигидро-6-Н-пурин-6-тион) коммерчески доступен в форме таблеток по 40 мг для перорального приема (тиогуанин). Цитарабин (4-амино-1-(бета)-D-арабинофуранозил-2(1H)-пиримидинон) коммерчески доступен в форме липосомального средства для инъекций, содержащего 10 мг/мл цитарабина (DEPOCYT)
или в форме жидкого средства для инъекций, содержащего от 1 мг до 1 г/флакон или 20 мг/мл (цитарабин или CYTOSAR-U). Флударабин (2-фтор-9-(5-O-фосфоно-(бета)-D-арабинофуранозил-9-H-пурин-6-амин) коммерчески доступен в форме жидкого средства для инъекций, содержащего 50 мг/флакон (FLUDARA). 6-меркаптопурин (1,7-дигидро-6Н-пурин-6-тион) коммерчески доступен в форме таблеток по 50 мг для перорального приема (PURINETHOL). Метотрексат (МТХ; N-[4-[[(2,4-диамино-6-птepидинил)мeтил]мeтилaминo]бeнзoил]-L-глyтaминoвaя кислота) коммерчески доступен в форме жидкого средства для инъекций, содержащего от 2,5 до 25 мг/мл и от 20 мг до 1 г/флакон (метотрексат натрия или FOLEX) в форме таблеток по 2,5 мг для перорального приема (метотрексат натрия). Гемцитабин (2'-дезокси-2',2'-дифторцитидина моногидрохлорид ((бета)-изомер)) коммерчески доступен в форме жидкого средства для инъекций, содержащего от 200 мг до 1 г/флакон (GEMZAR). Капецитабин (5'-дезокси-5-фтор-N-[(пентилокси)карбонил]-цитидин) коммерчески доступен в форме таблеток для перорального приема по 150 или 500 мг (XELODA). Пентостатин ((R)-3-(2-дезокси-(бета)-D-эритро-пентофуранозил)-3,6,7,8-тетрагидроимидазо[4,5-dо][1,3]диазепин-8-ол) коммерчески доступен в форме жидкого средства для инъекций, содержащего 10 мг/флакон (NIPENT). Триметрексат (2,4-диамино-5-метил-6-[(3,4,5-триметоксианилино)метил]хиназолина моно-D-глюкуронат) коммерчески доступен в форме жидкого средства для инъекций, содержащего от 25 до 200 мг/флакон (NEUTREXIN). Кладрибин (2-хлор-6-амино-9-(2-дезокси-(бета)-D-эритро-пентофуранозил)пурин) коммерчески доступен в форме жидкого средства для инъекций, содержащего 1 мг/мл (LEUSTATIN).
Термин «биохимический модулятор» широко известен и понятен специалистам в данной области, он обозначает средство, назначаемое в качестве вспомогательного в противораковой терапии, которое служит для усиления противоопухолевой активности, а также для противодействия побочным эффектам активного средства, например, антиметаболита. Лейковорин и левофолинат представляют собой средства, обычно применяемые в качестве биохимических модуляторов при терапии метотрексатом и 5-ФУ. Лейковорин (5формил5,6,7,8-тетрагидрофолиевая кислота) коммерчески доступен в форме жидкого средства для инъекций, содержащего от 5 до 10 мг/мл или от 50 до 350 мг/флакон (лейковорин кальция или WELLCOVORIN) в форме таблеток для перорального приема по 5-25 мг (лейковорин кальция). Левофолинат (фармакологически активный изомер 5-формилтетрагидрофолиевой кислоты) коммерчески доступен в форме средства для инъекций, содержащего от 25 до 75 мг левофолината (ISOVORIN) или в форме таблеток для перорального приема по 2,5-7,5 мг (ISOVORIN).
Согласно другому варианту реализации, комбинация согласно настоящему изобретению дополнительно включает активное средство, выбираемое среди ингибиторов киназы. Особенно предпочтительными являются ингибиторы мультикиназы, мишенью которых являются серин/треонин и тирозинкиназы рецепторов как в клетке опухоли, так и в сосудистой сети опухоли. Примерами подходящих ингибиторов киназ являются Сорафениб (BAY 43-9006, Bayer, коммерчески доступный под названием NEXAVAR), который получил статус ускоренного рассмотрения («Fast Track») в Управлении по контролю за продуктами и лекарствами для лечения метастатического почечно-клеточного рака. Другим подходящим ингибитором фарнезилтрансферазы является Зарнестра (R115777, типифарниб). Еще одним подходящим соединением является сунитиниб (SUTENT). Другие подходящие соединения, мишенью которых являются Ras/Raf/MEK и/или МАР-киназы включают, например, авастин, ISIS 5132, и ингибиторы МЕК, такие как CI-1040
или PD 0325901.
Согласно настоящему описанию, субтерапевтически эффективные количества герцептина и темсиролимуса можно применять для достижения терапевтического эффекта при введении в комбинации. Например, герцептин можно назначать в дозировках от 5 до 50% и ниже, от 10 до 25% и ниже, или от 15 до 20% и ниже, при назначении совместно с темсиролимусом. Например, конечная дозировка герцептина может составлять примерно от 8 до 40 мг, или примерно от 80 до 30 мг, или от 8 до 25 мг. Полагают, что субтерапевтически эффективные количества герцептина уменьшают побочные эффекты лечения герцептином. Кроме того, настоящее одно или более активных средств в комбинации согласно настоящему изобретению в супратерапевтическом количестве, т.е. в более высокой дозировке в комбинации по сравнению с применением в отдельности. Согласно указанному варианту реализации, другие активные средства можно применять в терапевтическом или субтерапевтическом количестве.
Ингибитор mTOR, герцептин, HKI-272 или другие активные соединения, применяемые в комбинации и продуктах согласно настоящему изобретению, можно использовать для приготовления составов любым подходящим способом. Например, составы для перорального применения, содержащие ингибитор mTOR (и, возможно, другие активные соединения), подходящие для комбинации, и продукты согласно настоящему изобретению, могут быть приготовлены в виде любых общеупотребительных форм для перорального введения, включая таблетки, капсулы, трансбуккальные формы, пастилки, леденцы, а также жидкости, суспензии или растворы для приема внутрь. Капсулы могут содержать смеси активного соединения(ий) с инертными наполнителями и/или разбавителями, такими как фармацевтически приемлемые крахмалы (например, кукурузный, картофельный или маниоковый крахмал), сахара, искусственные подсластители, порошкообразные целлюлозы, такие как кристаллическая и микрокристаллическая целлюлозы, мука, желатин, камеди и т.д. Подходящие таблетированные составы могут быть приготовлены способами непосредственного прессования, влажного гранулирования или сухого гранулирования, в них могут быть использованы фармацевтически приемлемые разбавители, связующие вещества, смазывающие вещества, дезинтегранты, поверхностно-активные вещества (включая сурфактанты), суспендирующие или стабилизирующие средства, включая, но не ограничиваясь этим, стеарат магния, стеариновую кислоту, тальк, лаурилсульфат натрия, микрокристаллическую целлюлозу, карбоксиметилцеллюлозу кальция, поливинилпирролидон, желатин, альгиновую кислоту, гуммиарабик, ксантановую камедь, цитрат натрия, комплексные силикаты, карбонат кальция, глицин, декстрин, сахарозу, сорбит, фосфат дикальция, сульфат кальция, лактозу, каолин, маннит, хлорид натрия, тальк, сухие крахмалы и сахарную пудру. Предпочтительные ПАВы включают неионогенные и анионные ПАВы. Типичные примеры ПАВ включают, но не ограничены этим, полоксамер 188, хлорид бензалкония, стеарат кальция, цетостеариловый спирт, цетомакроголовый эмульсионный воск, сложные эфиры сорбитана, коллоидный диоксид кремния, фосфаты, додецилсульфат натрия, алюмосиликат магния и триэтаноламин. В составах для перорального введения согласно настоящему описанию можно применять стандартные составы со стандартной задержкой высвобождения или составы с замедленным высвобождением, чтобы изменять абсорбцию активного соединения(ий). Составы для перорального введения могут также включать в себя введение активного компонента с водой или фруктовым соком, включающим, если это необходимо, соответствующие солюбилизаторы или эмульгаторы. Предпочтительные составы для перорального введения сложного эфира рапамицина по положению 42 и 3-гидрокси-2-(гидроксиметил)-2-метилпропионовой кислоты описаны в публикации патента США №2004/0077677 А1, опубликованной 22 апреля 2004 г.
В некоторых случаях может быть желательно вводить указанные соединения непосредственно в дыхательные пути в форме аэрозоля.
Указанные соединения также можно вводить парентерально или внутрибрюшинно. Растворы или суспензии указанных активных соединений в форме свободного основания или фармацевтически приемлемой соли можно приготовить на воде, соответствующим образом смешанной с поверхностно-активным веществом, таким как гидроксипропилцеллюлоза. Также можно приготовить дисперсии в глицерине, жидких полиэтиленгликолях и их смесях с маслами. При обычных условиях хранения и применения указанные составы содержат консервант для предотвращения роста микроорганизмов.
Лекарственные формы, подходящие для введения путем инъекций, включают стерильные водные растворы или дисперсии, и стерильные порошки для приготовления стерильных водных растворов или дисперсий для инъекций непосредственно перед использованием. Во всех приведенных случаях лекарственная форма должна быть стерильной и должна быть достаточно текучей для легкого введения ее посредством шприца. Она также должна быть стабильной в условиях производства и хранения, и ее следует предохранять от контаминации микроорганизмами, такими как бактерии и грибы. Носитель может представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль), их подходящие смеси, и растительные масла. Подходящие составы для инъекционного введения сложного эфира рапамицина по положению 42 и 3-гидрокси-2-(гидроксиметил)-2-метилпропионовой кислоты описаны в публикации патента США №2004/0167152 А1, опубликованной 26 августа 2004 г.
Для целей настоящего изобретения следует считать, что трансдермальное введение включает все виды введения через поверхность тела и внутренние оболочки полостей тела, включая ткани эпителия и слизистые оболочки. Подобное введение можно осуществлять с использованием самих указанных соединений или их фармацевтически приемлемых солей, в форме лосьонов, кремов, пен, пластырей, суспензий, растворов и суппозиториев (ректальных и вагинальных).
Трансдермальное введение можно осуществлять с использованием пластыря, содержащего активное соединение и носитель, инертный по отношению к активному соединению, нетоксичный при нанесении на кожу, и обеспечивающий доступность средства для системной абсорбции в кровоток через кожу. Носитель может иметь различные формы, такие как кремы и мази, пасты, гели и окклюзионые устройства. Кремы и мази могут представлять собой вязкие жидкости или полутвердые эмульсии, типа «масло-в-воде» или типа «вода-в-масле». Также подходят для применения пасты, состоящие из абсорбирующих порошков, диспергированных в нефтепродукте или гидрофильном нефтепродукте, содержащем активный компонент. Для введения активного компонента в кровоток можно применять многочисленные окклюзионные устройства, такие как покрытый полупроницаемой мембраной резервуар, содержащий активный компонент с носителем или без него, или основа, содержащая активный компонент. В литературе известны и другие окклюзионные устройства.
Суппозиторные составы могут быть приготовлены из традиционных материалов, включая кокосовое масло, с добавлением или без добавления восков для изменения температуры плавления суппозитория, и глицерин. Также можно использовать водорастворимые суппозиторные основы, такие как полиэтиленгликоли различного молекулярного веса.
При использовании согласно настоящему изобретению, схемы применения комбинаций можно назначать одновременно или же назначать по чередующейся схеме, при которой ингибитор mTOR назначают в другое время при прохождении курса химиотерапии, чем герцептин. Указанная разница во времени может составлять от нескольких минут, часов, дней, недель, или более длительное время между введением, по меньшей мере, двух средств. Таким образом, термин «комбинация» (или «комбинированный») должен обозначать не введение в одно и то же время или в единой дозе, а то, что каждый из компонентов вводят в течение выбранного периода лечения. Указанные средства также можно вводить различными путями.
Фармацевтические упаковки/наборы:
Настоящее изобретение включает продукт или фармацевтчиескую упаковку, содержащую курс противоопухолевого лечения для одного отдельного млекопитающего, включающую один или более контейнеров, содержащих одну, от одной до четырех, или более единиц ингибитора mTOR (например, темсиролимуса) в виде разовых дозированных форм и возможно одну, от одной до четырех, или более, единиц герцептина, и возможно другое активное средство.
Согласно другому варианту реализации, фармацевтические упаковки содержат курс противоопухолевого лечения для одного отдельного млекопитающего, включающий контейнер, содержащий единицу рапамицина в виде разовой дозированной формы, контейнер, содержащий единицу герцептина, и возможно контейнер с другим активным средством. Согласно другим вариантам реализации, рапамицин представляет собой рапамицин, сложный эфир (включая сложный эфир по положению 42), простой эфир (включая простой эфир по положению 42), оксим, гидразон или гидроксиламин рапамицина. Согласно другому варианту реализации, рапамицин представляет собой 42-O-(2-гидрокси)этилрапамицин.
Согласно другому варианту реализации, рапамицин представляет собой темсиролимус, и указанная упаковка включает один или более контейнеров, содержащих одну, от одной до четырех, или более единиц темсиролимуса с описанными здесь компонентами.
Согласно некоторым вариантам реализации, составы согласно настоящему изобретению находятся в упаковках в форме, готовой к введению. Согласно другим вариантам реализации, составы согласно настоящему изобретению находятся в упаковках в концентрированной форме, возможно, совместно с разбавителем, необходимым для приготовления конечного раствора для введения. Согласно еще одним вариантам реализации, указанный продукт содержит соединение, применяемое согласно настоящему изобретению, в твердом виде, и возможно отдельный контейнер с подходящим растворителем или носителем для соединения, применяемого согласно настоящему изобретению.
Согласно еще одним вариантам реализации, вышеописанные упаковки/наборы включают другие компоненты, например, инструкции по разбавлению, смешиванию и/или введению продукта, другие контейнеры, шприцы, иглы и т.д. Другие подобные компоненты упаковок/наборов могут быть очевидны для специалиста в данной области.
Следующие примеры иллюстрируют применение комбинаций согласно настоящему изобретению. Подразумевается, что по причинам, известным специалистам в данной области, можно произвести изменения или модификации, например, в рецептуре компонентов, путях их введения и дозировке.
ПРИМЕР 1: КОМБИНИРОВАННЫЙ РЕЖИМ ВВЕДЕНИЯ ТЕМСИРОЛИМУСА (CCI-779) И ГЕРЦЕПТИНА ДЛЯ ЛЕЧЕНИЯ НОВООБРАЗОВАНИЙ
Дозирование начинают в 1-й день 1-го месяца с еженедельным внутривенным (в/в) введением темсиролимуса и герцептина (в/в) в дозировках, предложенных ниже.
Темсиролимус и герцептин можно вводить одновременно, последовательно или в различные дни.
Темсиролимус вводят в/в еженедельно в течение 30 минут, при помощи встроенного фильтра и автоматического дозирующего насоса. Как вариант, за 30 минут перед инфузией темсиролимуса вводят антигистаминный препарат (дифенгидрамин, от 25 до 50 мг в/в, или его эквивалент).
Ударную дозу герцептина вводят в/в один раз в неделю в течение 90 минут. Вводят еженедельные дозы, которые составляют, как правило, половинное количество от ударной дозы. Например, за ударной дозой 4 мг/кг обычно следуют еженедельные дозы в 2 мг/кг. Указанные количества можно регулировать. Согласно одному из вариантов реализации, введение ударной дозы не требуется, и на протяжении всего курса лечения вводят одинаковые дозы.
Допустимы корректировки и/или задержки в ведении доз темсиролимуса и/или герцептина. Например, лечение можно продолжать в соответствии с настоящим описанием в течение шести месяцев, с еженедельным введением темсиролимуса. Герцептин можно вводить еженедельно циклами, например, по три недели. Обычно между циклами предусмотрен перерыв от 2 до 3 недель. В некоторых случаях введение темсиролимуса можно отложить или приостановить на короткий период (например, 1, 2 или 3 недели) во время проведения курса лечения. Аналогично, цикл лечения герцептином можно сократить на одну или более недель, продлить на одну или более недель, отложить или исключить интервал между циклами. Подобную задержку или приостановку можно осуществлять один или более раз на протяжении курса лечения.
ПРИМЕР 2: КОМБИНИРОВАННЫЙ РЕЖИМ ВВЕДЕНИЯ HKI-272 И ТЕМСИРОЛИМУСА (CCI-779) ДЛЯ ЛЕЧЕНИЯ НОВООБРАЗОВАНИЙ Дозирование начинают в 1-й день 1-го месяца с ежедневным введением HKI-272 и еженедельным внутривенным (в/в) введением темсиролимуса в дозировках, предложенных ниже.
В 1-й день 1-го месяца вводят HKI-272 перорально перед введением темсиролимуса. Темсиролимус вводят после введения HKI-272, предпочтительно в течение 30 минут.
Темсиролимус вводят в/в еженедельно в течение 30 минут, при помощи встроенного фильтра и автоматического дозирующего насоса. Как вариант, за 30 минут перед инфузией темсиролимуса вводят антигистаминный препарат (дифенгидрамин, от 25 до 50 мг в/в, или его эквивалент).
После этого принимают HKI-272 перорально один раз в день вместе с пищей, предпочтительно утром.
Допустимы корректировки и/или задержки доз HKI-272 и темсиролимуса. Например, лечение можно продолжать в соответствии с настоящим описанием в течение шести месяцев, с ежедневным введением HKI-272 и еженедельным введением темсиролимуса. Однако, в некоторых случаях введение одного или обоих лекарств можно отложить или приостановить на короткий период (например, 1, 2 или 3 недели) во время проведения курса лечения. Подобную задержку или приостановку можно осуществлять один или более раз на протяжении курса лечения.
ПРИМЕР 3: КОМБИНИРОВАННЫЙ РЕЖИМ ВВЕДЕНИЯ HKI-272, ТЕМСИРОЛИМУСА (CCI-779) И ГЕРЦЕПТИНА ДЛЯ ЛЕЧЕНИЯ НОВООБРАЗОВАНИЙ
Дозирование начинают в 1-й день 1-го месяца с ежедневным введением HKI-272 и еженедельным внутривенным (в/в) введением темсиролимуса и герцептина (в/в) в дозировках, предложенных ниже.
В 1-й день 1-го месяца вводят HKI-272 перорально перед введением темсиролимуса. Темсиролимус и герцептин вводят после введения HKI-272, предпочтительно в течение 30 минут.
Темсиролимус вводят в/в еженедельно в течение 30 минут, при помощи встроенного фильтра и автоматического дозирующего насоса. Как вариант, за 30 минут перед инфузией темсиролимуса вводят антигистаминный препарат (дифенгидрамин, от 25 до 50 мг в/в, или его эквивалент).
Ударную дозу герцептина вводят в/в еженедельно в течение 90 минут. Вводят еженедельные дозы, которые составляют, как правило, половинное количество от ударной дозы. Например, после ударной дозы 4 мг/кг обычно вводят еженедельные дозы в 2 мг/кг. Указанные количества можно регулировать. Согласно одному из вариантов реализации, введение ударной дозы не требуется, и на протяжении всего курса лечения вводят одинаковые дозы. После этого вводят HKI-272 перорально один раз в день вместе с пищей, предпочтительно утром.
Допустимы корректировки и/или перерывы в введении доз HKI-272, темсиролимуса и/или герцептина. Например, лечение можно продолжать согласно настоящему описанию в течение шести месяцев, с ежедневным введением HKI-272 и еженедельным введением темсиролимуса. Герцептин можно вводить еженедельно циклами, например, по три недели. Обычно между циклами предусмотрен перерыв от 2 до 3 недель. Однако, в некоторых случаях введение HKI-272 и/или темсиролимуса можно отложить или приостановить на короткий период (например, 1, 2 или 3 недели) во время проведения курса лечения. Подобные перерывы или приостановку можно осуществлять один или более раз на протяжении курса лечения.
Аналогично, цикл лечения герцептином можно сократить на одну или более недель, продлить на одну или более недель, отложить или исключить интервал между циклами. Подобную задержку или приостановку можно осуществлять один или более раз на протяжении курса лечения.
ПРИМЕР 4; КОМБИНИРОВАННЫЙ РЕЖИМ ВВЕДЕНИЯ HKI-272 И ГЕРЦЕПТИНА ДЛЯ ЛЕЧЕНИЯ НОВООБРАЗОВАНИЙ
Противоопухолевую активность комбинации HKI-272 и герцептина подтверждает фармакологический тест in vitro, проведенный по стандартной методике. Ниже кратко описана использованная методика и полученные результаты.
Комбинацию тестировали на трех линиях клеток рака молочной железы с различными генотипами. Более конкретно, линия ВТ474 [HER-2+(амплифицированный); АТСС НТВ-20] проявляет высокую чувствительность как к HKI-272, так и к герцептину. Линия MDA-MB-361 [HER-2+ (неамплифицированный); аденокарцинома; АТСС НТВ 27] содержит более низкие уровни HER-2 без амплификации и проявляет меньшую чувствительность как к герцептину, так и к HKI-272. Линия MCF-7 [HER-2-, EGFR-; аденокарцинома; АТССНТВ22] не содержит HER-2 и проявляет устойчивость как к герцептину, так и к HKI-272.
Клетки каждой из указанных линий клеток инкубировали в присутствии различных концентраций (0,0041, 0,012, 0,037, 0,11, 0,33, 0,1, 3 мк/мл) каждого из лекарств.
Указанные клетки выдерживали в питательной среде RPMI-1640 (Life Technologies, Inc., Gaithersburg, Md.), дополненной 10% фетальной бычьей сыворотки (FBS, Life Technologies) и 50 мкг/мл гентамицина (Life Technologies) в атмосфере 7% СO2 при 37°С. Клетки помещали на планшеты микротитратора на 96 ячеек (12,000 клеток/ячейка для клеток ВТ474, 6000 клеток/ячейка для клеток MCF-7 и 10,000 клеток/ячейка для клеток MDA-MB-361) в 100 мкл питательной среды RPMI-1640, содержащей 5% FBS и 50 мкг/мл гентамицина, и инкубировали в течение ночи при 37°С. Разведения исследуемого соединения готовили в той же питательной среде, в конечной концентрации 2Х, и добавляли 100 мкл полученного лекарственного разведения в каждую ячейку, содержащую клетки.
Серийные разведения одного из соединений готовил в присутствии фиксированной дозы второго соединения. Как вариант, применяли серийные разведения методом «шахматной доски». Клетки культивировали в присутствии лекарств в течение трех дней. В качестве контроля использовали необработанные клетки. Процент выживших клеток определяли при помощи сульфородамина В (SRB, Sigma-Aldrich, St Louis, Mo.), красителя, связывающегося с белком. Клеточный белок осаждали в каждой ячейке путем добавления 50 мкл 50% холодной трихлоруксусной кислоты. Спустя 1 час планшеты тщательно промывали водой и высушивали. Добавляли красящий реагент SRB (0,4% SRB в 1% уксусной кислоте, 80 мкл на ячейку) и выдерживали планшеты при комнатной температуре в течение десяти минут. Затем планшеты тщательно промывали 1% уксусной кислотой и высушивали. Связавшийся с клетками краситель растворяли в 10 мМ Трис (150 мкл) и измеряли поглощение на длине волны 540 нм на спектрофотометре для чтения микропланшетов. Концентрацию исследуемого соединения, вызывающую определенный процент ингибирования роста, определяли, строя график выживаемости клеток (по отношению к необработанным клеткам) в зависимости от дозы соединения.
Модель для изучения взаимодействий между лекарствами была описана Prichard и Shipman [Antiviral Research. 14: 181-206 (1990); Prichard, MN, et al., 1993. MacSynergy II. Version 1.0. User's manual. University of Michigan, Ann Arbor.]. Описанная модель представляет собой трехмерную модель: по одной оси для каждого лекарства, и третья ось для биологического эффекта. Теоретические аддитивные взаимодействия вычисляли на основании индивидуальных кривых доза - отклик, исходя из диссимилярных участков аддитивной модели (зависимость Блисса). Рассчитанную аддитивную поверхность, представляющую предполагаемую цитотоксичность, рассчитывали исходя из экспериментально полученной поверхности, чтобы выявить области повышенной токсичности (синергизм) или сниженной токсичности (антагонизм). Полученная поверхность имела вид горизонтальной плоскости с 0% ингибирования над вычисленной аддитивной поверхностью, в случае аддитивного взаимодействия. Пики и минимумы, отклоняющиеся от указанной плоскости, указывали на синергизм и антагонизм, соответственно. Для автоматического выполнения всех вычислений использовали программное обеспечение MacSynergy II, на основе Microsoft Excel. Указанная программа табличных вычислений рассчитывает теоретические аддитивные взаимодействия, определяет местоположение и количественное значение синергических или антагонистических взаимодействий, которые являются значимыми с 95% доверительной вероятностью. Полученные результаты наносили на трехмерный график или на контурный график с плоскостью при 0%, представляющей аддитивное взаимодействие, и пиками и минимумами, представляющими области синергизма или антагонизма, соответственно, между двумя лекарствами.
Для целей настоящего исследования был модифицирован способ Притчарда-Шипмана (Pritchard and Shipman), чтобы сделать возможным определение эффектов комбинаций при различных уровнях статистической значимости (значения p 0,05, 0,01, 0,001). Значимым считается значение p, равное 0,05. Также был модифицирован способ оценки статистической изменчивости в рамках каждого эксперимента. Изменчивость определяли среди всех комбинаций данного соединения, тогда как в исходном варианте изменчивость оценивали отдельно для каждой комбинации соединения. Полагали, что модифицированный подход дает лучшую оценку изменчивости. В общем случае, единичные точки синергизма илиантагонизма не считали показателями ни синергической, ни антагонистической активности. Таким образом, представленные единичными точками пики или минимумы исключали из анализа. Более того, пики или минимумы, наблюдаемые только при одной концентрации одного из соединений, также исключали, если при соседних концентрациях, граничащих с указанной, не наблюдалось синергизма или антагонизма. Наконец, все эксперименты повторяли, по меньшей мере, дважды, и определение синергизма или антагонизма проводили, изучая все полученные данные.
На Фиг.1-3 представлены результаты, полученные в одной серии экспериментов. Для клеток MDA-MB-361 обнаружена область антагонизма при концентрации герцептина 0,11-3 мкг/мл и концентрации HKI-272 0,012 мкг/мл с доверительной вероятностью 95%. Для клеток MCF7 обнаружена область синергизма при концентрации герцептина 0,037-0,33 мкг/мл и концентрации HKI-272 0,11 мкг/мл с доверительной вероятностью 95%. Для клеток ВТ474 обнаружена область антагонизма при концентрации герцептина 0,33-1 мкг/мл и концентрации HKI-272 0,11 мкг/мл с доверительной вероятностью 95%. При повторных расчетах с доверительной вероятностью 99% статистически значимых областей синергизма или антагонизма не обнаружено. На основании вышеописанных критериев взаимодействие комбинации герцептина и HKI-272 считают аддитивным во всем диапазоне концентраций.
Результаты указанных фармакологических тестов согласно стандартной методике, полученные в многочисленных независимых экспериментах, показывают, что комбинации с HKI-272 не проявляют значительного антагонизма или синергизма, а демонстрируют аддитивное взаимодействие во всем диапазоне концентраций. Указанные данные свидетельствуют в пользу применения указанных комбинаций для лечения связанных с HER2+ видов рака. Поскольку указанные комбинации содержат по меньшей мере два активных противоопухолевых средства, применение указанных комбинаций также предусматривает применение таких комбинаций каждого из средств, в которых одно или оба средства применяют в субтерапевтически эффективных дозировках, таким образом, уменьшая токсичность, связанную с отдельным химиотерапевтическим средством.
Все патенты, публикации патентов, статьи и другие документы, ссылки на которые имеются в настоящем описании, включены в настоящее описание посредством ссылок. Специалисту в данной области должно быть очевидно, что можно осуществлять модификации конкретных вариантов реализации, описанных в настоящей заявке, не выходя за рамки объема настоящего изобретения.
Реферат
Группа изобретений относится к медицине, а именно к онкологии, и может быть использована для лечения новообразования, связанного с избыточной экспрессией или амплификацией рецептора 2 эпидермального фактора роста (HER2). Способ по изобретению включает введение эффективного количества комбинации активных компонентов, содержащей герцептин и CCI-779 (темсиролимус). Также группа изобретений касается вариантов применения комбинации герцептина и CCI-779 для приготовления противоопухолевого лекарственного средства. Использование изобретений позволяет повысить эффективность лечения рака, связанного с избыточной экспрессией или амплификацией HER2. 7 н. и 23 з.п. ф-лы, 3 ил., 4 пр.
Формула
Документы, цитированные в отчёте о поиске
Противоопухолевая композиция, содержащая производные таксана

Комментарии