Соединения, образующие комплексы - RU2619939C2
Код документа: RU2619939C2
Чертежи
Описание
ОБЛАСТЬ ТЕХНИКИ
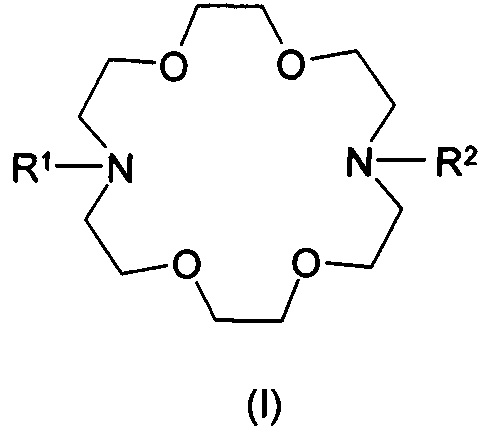
Настоящее изобретение относится к соединениям общей формулы
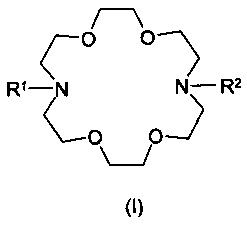
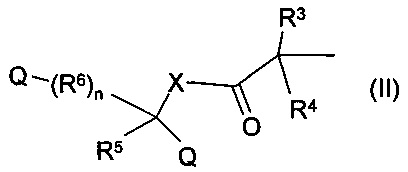
получению и применению этих соединений с целью профилактики и лечения отравлений тяжелыми металлами. В частности, настоящее изобретение относится к соединению формулы (I), которое содержит структуру 1,4,10,13-тетраокса-7,16-диазациклооктадекан (сокращенно базовая структура криптофикс) и в котором каждый из двух атомов азота замещен одинаковыми или различными группами общей формулы
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Как следствие загрязнения окружающей среды, из-за интенсивной индустриализации и потребления, большое количество ядовитых соединений может накапливаться в организме человека и в окружающей среде. Из этих соединений наиболее важными соединениями являются свинец (Pb) и ртуть (Hg), которые могут накапливаться в жировых тканях и вызывать тяжелое острое или смертельное отравление. Радиоактивный стронций (Sr) и цезий (Cs) выбрасываются в окружающую среду в результате ядерных катастроф (Three-miles Island, New York 1979; Chernobyl, USSR: 1986; Fukusima, Japan: 2011, Csilleberc, Hungary: 2011) и причиняют экологический, медицинский и социальный ущерб, накапливаются в костях и приводят к длительному отравлению.
Для удаления вышеуказанных отравляющих соединений могут быть применены так называемые "хелатообразующие" соединения, которые выводят токсичные металлы из организма. В большинстве случаев эти соединения не оказывают специфического воздействия. Например, в случае этилендиаминтетрауксусной кислоты (ЭДТА) или диэтиленгликоль-триамин-пентауксусной кислоты комплексы кальция являются более стабильными, чем комплексы стронция, как описано в строках 15-18 первого абзаца на стр. 3 патента Венгрии №209389.
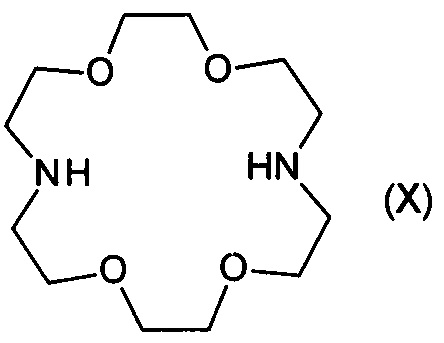
Так как эти комплексы не являются специфическими, при их применении также могут быть выведены важные металлы (например, кальций и магний). Поэтому в патенте Венгрии №209386 для выведения стронция из организма были предложены более конкретные макроциклические соединения, производные так называемых «криптандов». Параметры молекулярной структуры макроциклических соединений определяют, какой ион связан с соединениями сильнее всего, таким образом, для специфичного удаления различных ионов токсичных металлов необходимы комплексообразующие соединения, значительно лучше связывающие ионы токсичных металлов.
Патент Венгрии №209386 раскрывает комплексообразующие агенты, основанные на соединении криптофикса, избирательно связывающем стронций. Одним из этих соединений является соединение формулы
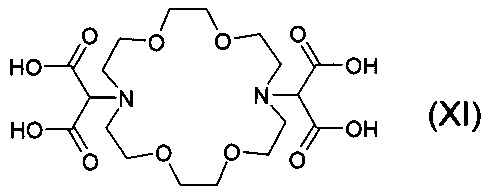
(7,16-бис-малонат)-1,4,10,13-тетраокса-7,16-диазациклооктадекан-бис-малоновая кислота, которое получали также в форме комплекса с Са. Соединение формулы (XI) проявило более сильную активность со стронцием, чем с кальцием в физико-химических и in vivo опытах на мышах. В экспериментах in vivo стронций, вводимый искусственно в различных количествах, может быть селективно удален с помощью соединения формулы (XI), добавленного внутривенно, предотвращая таким образом его накопление в костях, в то время как кальций остается.
Кроме того, эксперименты in vitro показали аффинность с другими ионами токсичных металлов, что усилило удобство применения этого соединения. Эффективность данного соединения показана на примерах 18 и 19 патента Венгрии №209386. В этих примерах соль соединения формулы (XI) вводили внутривенно в организм крыс в количестве 50-100 мкмоль/килограмм массы тела. Учитывая, что молекулярная масса комплексов и солей соединения формулы (XI) составляет 550-650, разовая доза, оказывающая превосходный эффект для взрослого пациента-человека (масса тела 70 кг) может составлять 4-4,5 г. Согласно последней строке второго столбца на странице 3, и в строках 1-2 из первой колонки на странице 4 описания патента Венгрии №209389 соли соединения (XI) вводили внутривенно в концентрации 100-500 мг/л в экспериментах на животных. Еще один недостаток соединения формулы (XI) в том, что суб-структура малоновой кислоты легко декарбоксилируется и комплекс стронция полученного соединения не растворим и выпадает в осадок из водной среды, что может предотвратить выведение иона стронция из тела (организма). В ходе другого разложения соединения малоновая кислота отщепляется от соединения, которое является сильным цитотоксином. Причиной этой особенности является то, что его структура аналогична структуре янтарной кислоты, которая играет ключевую роль в клеточном дыхании и, следовательно, ингибирует функцию фермента сукцинатдегидрогеназы. Тенденция декарбоксилирования может увеличиваться в присутствии других тяжелых металлов, имеющих свойства кислоты Льюиса, такие как свинец (Pb) или олово (Sn), что подтверждается нашими экспериментальными результатами, измеренными масс-спектрометром. Декарбоксилирование также уменьшает комплексообразующий эффект.
Поэтому возникла идея приготовить комплексообразующие агенты, селективность которых подобна селективности соединения формулы (XI), но более эффективные, более растворимые в воде, и не превращающиеся в токсичные соединения в процессе их случайного метаболизма в организме и являющиеся стабильными при хранении. Эти соединения позволят уменьшить размер применяемой дозы. Поскольку эти соединения обычно применяют при катастрофах, они должны храниться в большом количестве и в течение длительного времени.
Сам факт того, что соединения обладают в 1,5-2 раза более эффективной комплексообразующей способностью, чем уже известные, существенно снижает расходы по подготовке к катастрофам. С другой стороны, также важно, что комплексообразующие соединения не связывают существенно и не выводят из организма микроэлементы, важные для живых существ, такие как цинк и медь.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является предложение комплексообразующих соединений общей формулы (I), содержащих структуру 1,4,10,13-тетраокса-7,16-диазациклооктадекан (сокращенно базовая структура криптофикс), и в которых каждый из двух атомов азота замещен одинаковыми или различными группами общей формулы (II). Эти соединения являются пригодными для достижения вышеупомянутых целей.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
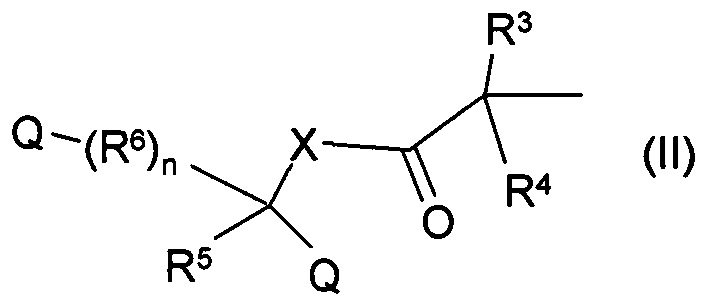
Наиболее общим воплощением настоящего изобретения является соединение общей формулы (I), где R1 и R2 являются одинаковыми или различными группами в соответствии с общей формулой
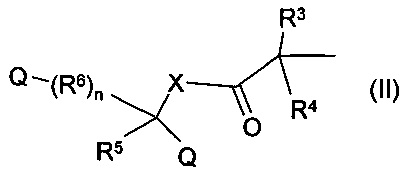
где n составляет 0, 1 или 2, Q представляет собой карбоксильную группу, X представляет собой атом кислорода, серы или атом азота, при этом заместитель атома азота представляет собой атом водорода или линейную или разветвленную С1-6-алкильную группу, R3, R4 и R5 являются одинаковыми или различными группами, представляющими собой водород, атом галогена, линейную или разветвленную с C1-6-алкильную группу, C1-6-алкиленовую группу, C1-6-алкинильную группу, арильную, аралкильную или гетероарильную группу, насыщенную или ненасыщенную циклоалкильную группу, замещенную или незамещенную гетероарильную группу, содержащую один или более атомов серы, кислорода или азота, и которая содержит один или несколько одинаковых или различных заместителей, возможно, эти заместители предпочтительно представляют собой C1-6-алкильную группу, атом галогена, линейную или разветвленную C1-6-алкильную группу, C1-6-алкиленовую группу, С1-6-алкинильную группу, арильную, аралкильную или гетероарильную группу, насыщенную или ненасыщенную циклоалкильную группу, замещенную или незамещенную гетероарильную группу, замещенную или незамещенную гетероарильную группу, содержащую один или несколько атомов серы, кислорода или азота, и которая содержит один или несколько одинаковых или различных заместителей, гидроксильную группу, алкоксигруппу, аминогруппу, карбоксильную группу, алкоксикарбонильную группу или карбамоильную группу, возможно R5 и R6 вместе образуют двойную связь,
R6 представляет собой насыщенную или ненасыщенную C1-С2-алкильную группу, которая содержит в качестве заместителей, возможно один или более одинаковых или различных атомов галогена, линейную или разветвленную С1-6-алкильную группу, C1-6-алкиленовую группу, С1-6-алкинильную группу, арильную, аралкильную или гетероарильную группу, насыщенную или ненасыщенную циклоалкильную группу, замещенную или незамещенную гетероарильную группу, содержащую один или несколько атомов серы, кислорода или азота, при этом заместители возможно содержат один или несколько дополнительных одинаковых или различных заместителей, предпочтительно представляющими собой атом галогена или линейную или разветвленную C1-6-алкильную группу, C1-6-алкиленовую группу, C1-6-алкинильную группу, арильную, аралкильную или гетероарильную группу, насыщенную или ненасыщенную циклоалкильную группу, замещенную или незамещенную гетероциклическую группу, содержащей один или несколько атомов серы, кислорода или азота, гидроксильной группой, алкоксигруппой, карбоксильной группой, алкоксикарбонильной группой, или карбамоильной группой, и возможно R6 является группой общей формулы
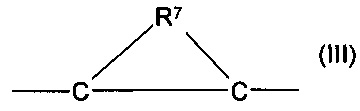
где два атома углерода, и R7 вместе образуют незамещенное или замещенное 3-7-членное кольцо, являющееся насыщенным или ненасыщенным циклоалкильным кольцом или изолированным или конденсированным 3-7-членным насыщенным или ненасыщенным гетероциклическим соединением, содержащим один или более гетероатомов, предпочтительно серы, кислорода или азота, или изолированной или конденсированной арильной группой или гетероарильной группой, содержащей один или более атомов серы, кислорода или азота, где в качестве заместителей группы формулы (III) содержатся один или несколько различных заместителей, предпочтительно атомы галогена, гидроксильная группа, алкоксигруппа, аминогруппа, карбоксильная группа, алкоксикарбонильная группа, карбамоильная группа, и, возможно R5 и R6 вместе образуют незамещенное или замещенное 3-7-членное кольцо, которое является насыщенным или ненасыщенным циклоалкильным кольцом или изолированным или конденсированным 3-7-членным насыщенным или ненасыщенным гетероциклическим соединением, содержащим один или несколько гетероатомов, предпочтительно серу, кислород или азот, которое содержит в качестве заместителя в циклической группе один или несколько атомов галогена, гидроксильную группу, C1-6-алкильную группу, С1-6-алкиленовую группу, C1-6-алкинильную группу, алкоксигруппу, аминогруппу, карбоксильную группу, алкоксикарбонильную группу или карбамоильную группу и их соли и/или комплексы.
Согласно воплощениям настоящего изобретения, где R1 и R2 являются различными, n, X, R3, R4, R5, R6 и R6 могут быть частично одинаковыми или полностью различными в этих двух группах. В этом случае соединение является асимметричным.
Согласно воплощениям настоящего изобретения, где R1 и R2 являются одинаковыми, n, X, R3, R4, R5, R6 и R6 являются одинаковыми, таким образом соединение является симметричным.
Мы обнаружили, что соединения по настоящему изобретению являются высоко селективными и эффективными в связывании иона стронция, а также ионов олова и свинца.
Поскольку не существует подходящего аналитического метода для измерения комплексообразующих свойств этих соединений с достаточной точностью, мы определили комплексообразующие константы по сравнению с комплексами ионов кальция квантово-химическими расчетами высокого уровня.
Расчеты проводили с помощью программного обеспечения Gaussian09 на B3LYP/LANL2DZ теоретическом уровне. В ходе расчетов были также выполнены расчеты частоты, из которых также были определены термодинамические данные.
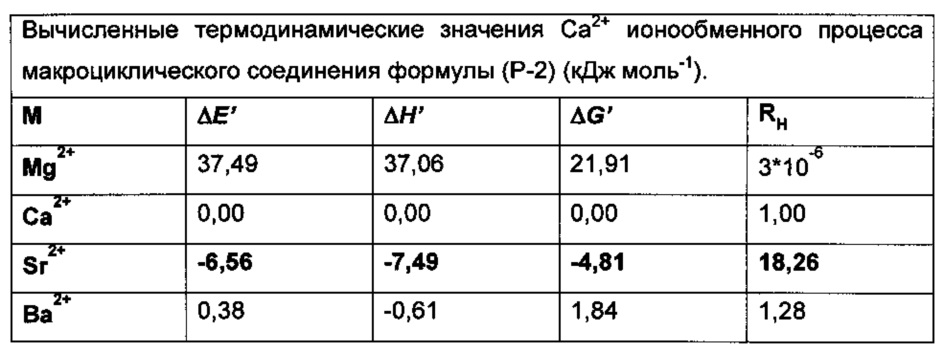
В соответствии с результатами, представленными в Таблицах 1-3 соединения по настоящему изобретению связывают ион стронция значительно более селективно, чем соединения формулы (XI).
Способности связывать ионы для каждого из ионов сравнивали со способностью связывать кальций, что продемонстрировано посредством RH (относительная комплексообразующая тенденция).
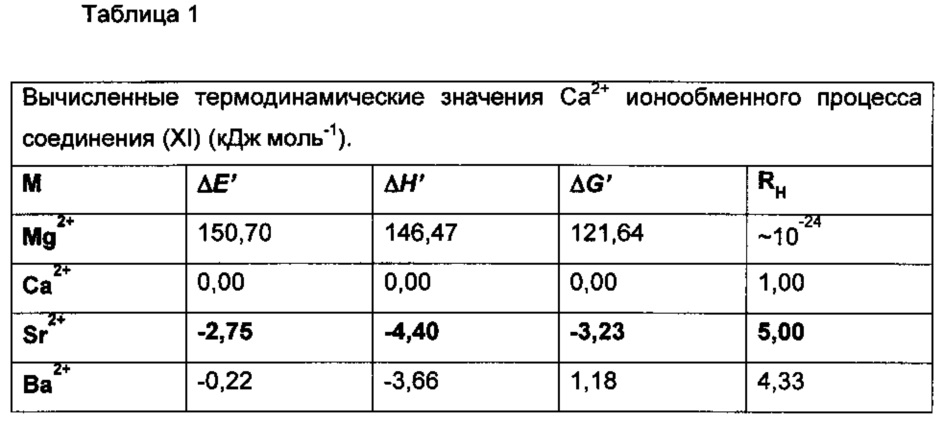
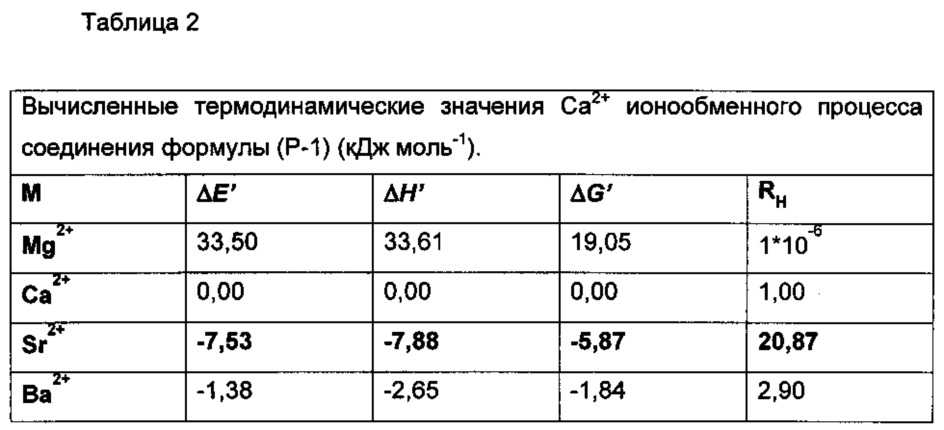
Таблица 3
Связывающая аффинность стронция соединений формулы
и
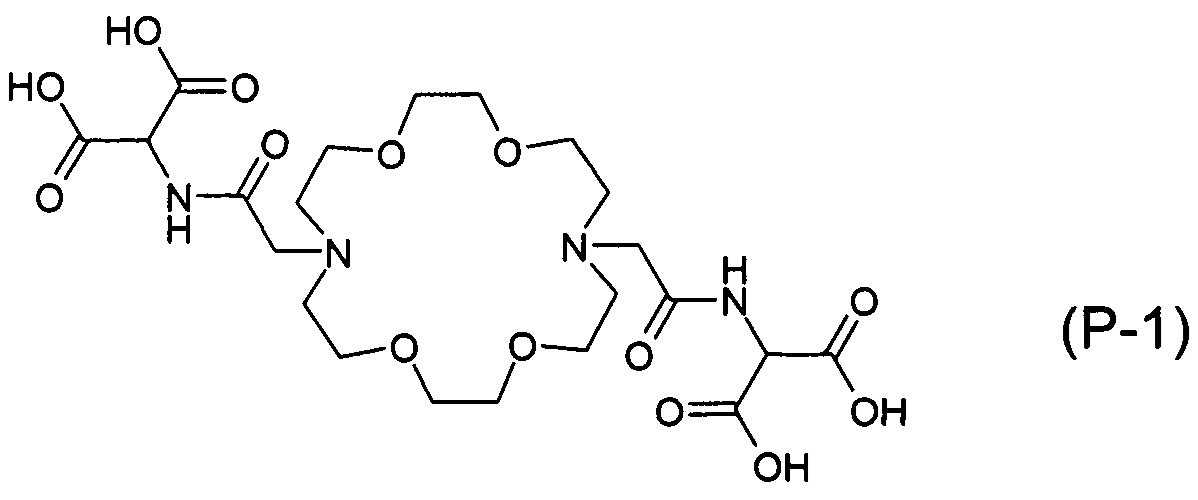
по настоящему изобретению в случае (Р-1) является более чем четырехкратной (RH=20,87), в случае (Р-2) примерно четырехкратной (RH=18,26) по сравнению с аффинностью соединения формулы (XI) (RH=5,00).
Это означает, что при применении соединений по настоящему изобретению количество активного ингредиента, которое должно быть сохранено, равно одной четвертой от количества, которое должно быть сохранено, в других случаях, и нагрузка на организм в процессе лечения, уменьшится в такой же степени, при достижении такого же терапевтического эффекта. Более того, в случае случайного разложения соединений предпочтительных воплощений настоящего изобретения продуктами деградации являются амино- или гидрокси- кислоты, безвредные для организма.
Термодинамические данные (ΔЕ, ΔН, ΔG) были рассчитаны с помощью математических уравнений из значений Е, Н и G рассчитанных на квантово-химической основе:
ΔE[complex-M]=E[complex-M]+Е[CaCl2⋅6H2O]-{Е[complex-Са]+Е[MCl2⋅6H2O]}
ΔH[complex-M]=H[complex-M]+Н[CaCl2⋅6H2O]-{Н[complex-Са]+Н[MCl2⋅6H2O]}
ΔG[complex-М]=G[complex-M]+G[CaCl2⋅6H2O]-{G[complex-Ca]+G[MCl2⋅6H2O]}
Относительная константа комплексообразования (RG) по сравнению с ионом Са2+ может быть рассчитана по следующей формуле:
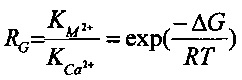
Так как формирование фактора ожидаемо вызывает потерю коэффициентов энтропии, то использовали следующее уравнение, которое является более практичным из-за колебаний расчетного коэффициента энтропии:
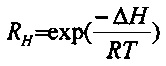
Согласно более предпочтительному воплощению настоящего изобретения, существуют соединения, представленные общей формулой (I), где заместители R1 и R2 являются одинаковыми или различными группами общей формулы (II), где n представляет собой 0, 1 или 2, X представляет собой атом кислорода или незамещенный или замещенный атом азота, и заместитель атома азота представляет собой атом водорода или метильную группу, значения заместителей R3, R4, R5, R6 являются такими, как определено выше, и их соли и/или комплексы.
Согласно другому воплощению настоящего изобретения существуют соединения, представленные общей формулой (I), где заместители R1 и R2, являются одинаковыми или различными группами общей формулы (II), где n представляет собой 0, 1 или 2, Q представляет собой карбоксильную группу, X представляет собой атом кислорода или незамещенный или замещенный атом азота, а заместитель атома азота представляет собой атом водорода или метильную группу, значения заместителей R3, R4, R5, R6 такие, как определено выше, и их соли, и/или комплексы.
Согласно другому предпочтительному воплощению настоящего изобретения существуют соединения, представленные общей формулой (I) и их соли и/или комплексы, где заместители R1 и R2 являются одинаковыми или различными группами общей формулы (II), где n представляет собой 0, 1 или 2, Q представляет собой карбоксильную группу, X представляет собой атом кислорода или незамещенный или замещенный атом азота, и заместитель атома азота представляет собой атом водорода или метильную группу, заместители R3, R4, R5 являются одинаковыми или различными группами, представляющими собой атом водорода, атом галогена, линейную или разветвленную C1-6-алкильную группу, арильную или аралкильную группу, R6 обозначает незамещенную или замещенную метиленовую группу, которая может быть замещена одним или несколькими одинаковыми или различными заместителями, атомами галогена, линейной или разветвленной С1-6-алкильной группой, C1-6-алкиленовой группой, C1-6-алкинильной группой, арильной, аралкильной или гетероарильной группой, насыщенной или ненасыщенной циклоалкильной группой, замещенной или незамещенной гетероарильной группой, содержащей один или несколько атомов серы, кислорода или азота, возможно R5 и один заместитель R6 вместе образуют незамещенное или замещенное 3-7-членное кольцо.
Согласно более предпочтительному воплощению настоящего изобретения заместители R1 и R2 общей формулы (I) являются идентичными, в группах общей формулы (II) п представляет собой 0, 1 или 2, Q представляет собой карбоксильную группу, X представляет собой незамещенный или замещенный атом азота, где заместитель атома азота представляет собой атом водорода или метильную группу, R3, R4, R5 являются одинаковыми или различными, представляют собой атом водорода, атом галогена, линейную или разветвленную C1-6-алкильную группу, арильную или аралкильную группу, R6 обозначает незамещенную или замещенную метиленовую группу, которая может быть замещена одним или несколькими одинаковыми или различными заместителями, атомами галогена, или линейной или разветвленной C1-6-алкильной группой, C1-6-алкиленовой группой, C1-6-алкинильной группой, арильной, аралкильной или гетероарильной группой, насыщенной или ненасыщенной циклоалкильной группой, замещенной или незамещенной гетероциклической группой, содержащую один или несколько атомов серы, кислорода или азота, возможно R5 и один заместитель R6 вместе образуют незамещенное или замещенное 3-7-членное кольцо или в наиболее выгодном случае R6 обозначает незамещенную или замещенную метиленовую группу, которая может быть замещена одним или несколькими одинаковыми или различными заместителями, линейную или разветвленную C1-6-углеродную группу, алкильную группу, С1-6-алкиленовую группу, C1-6-алкинильную группу.
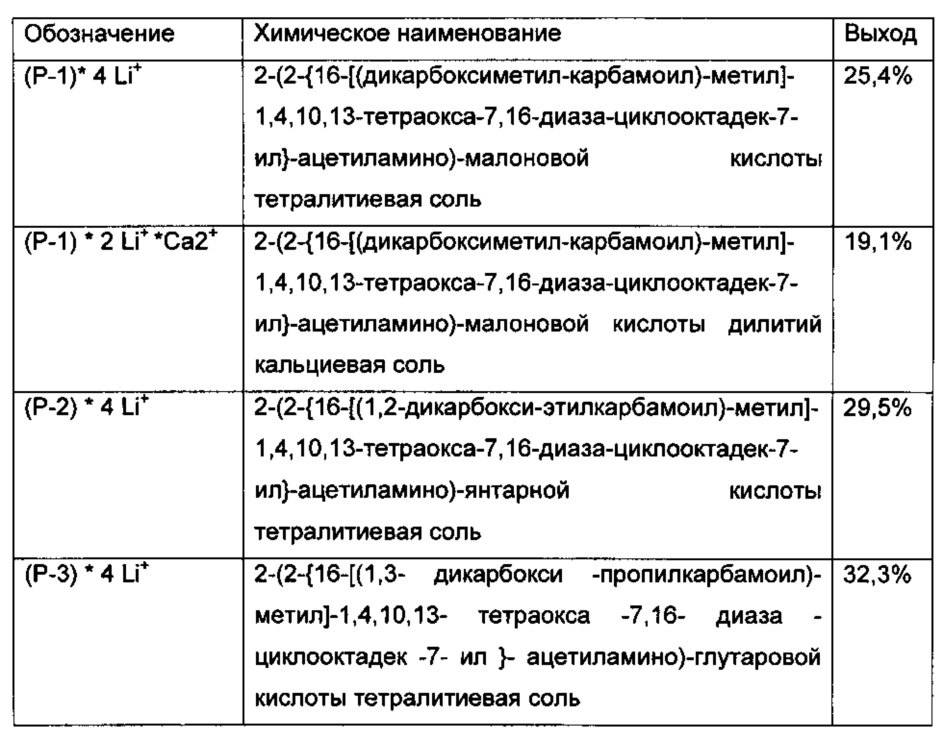
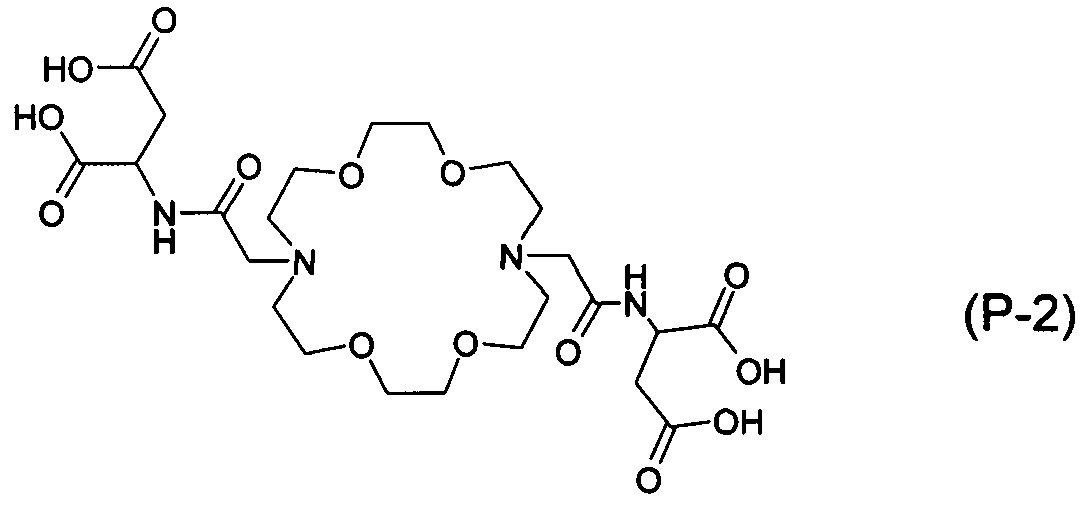
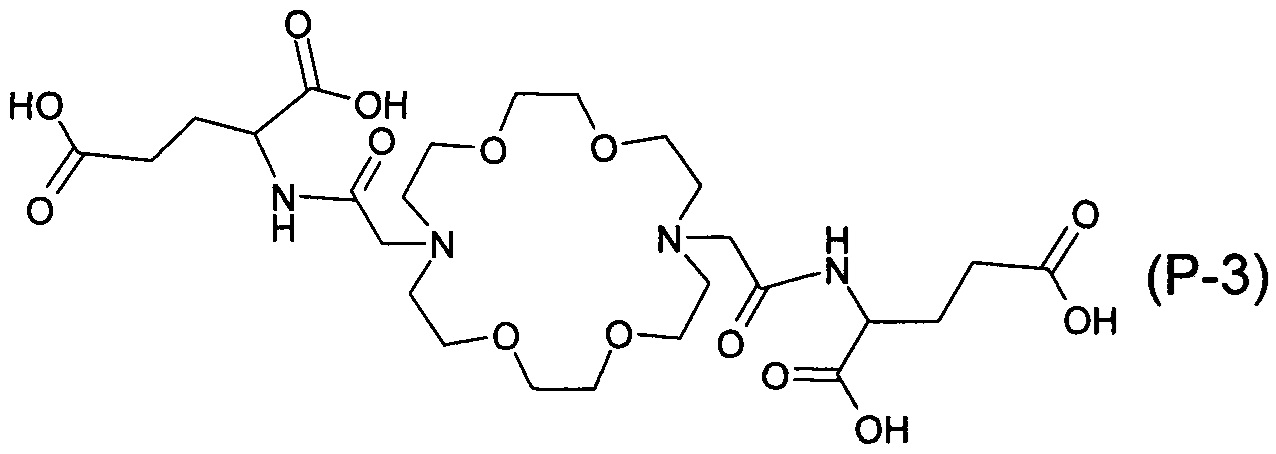
Наиболее предпочтительными воплощениями настоящего изобретения являются соединения 2-(2-{16-[(дикарбоксиметил-карбамоил)-метил]-1,4,10,13-тетраокса-7,16-диаза-циклооктадек-7-ил}-ацетиламино)-малоновой кислоты: 2-(2-{16-[(1,2-дикарбокси-этилкарбамоил)-метил]-1,4,10,13-тетраокса-7,16-диаза-циклооктадек-7-ил}-ацетиламино)-янтарной кислоты: и 2-(2-{16-[(1,3-дикарбокси-пропилкарбамоил)-метил]-1,4,10,13-тетраокса-7,16-диаза-циклооктадек-7-ил}-ацетиламино)-глутаровой кислоты формулы:
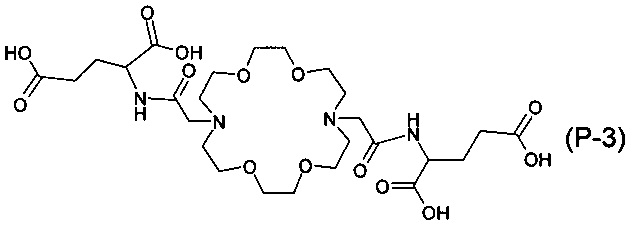
или их соли или комплексы.
Комплексы по настоящему изобретению предпочтительно являются комплексами ионов кальция, магния, стронция, ртути и свинца соединений общей формулы (I). Соединения по настоящему изобретению имеют кислые карбоксильные группы и основные аминогруппы, таким образом они образуют соли с аммиаком, аминами, а также с органическими или неорганическими кислотами. Другими объектами настоящего изобретения являются комплексные соединения, являющиеся также солями, образованными с кислотами или с основаниями, например, такими как комплексы стронция, в которых карбоксильные группы находятся в форме натриевой соли или такие комплексы, где атом азота образует соль с органической или неорганической кислотой. Соли, образованные либо с кислотами, либо с основаниями, являются более стабильными, могут лучше обрабатываться и являются менее гигроскопичными, чем соединения, не стабилизированные образованием соли.
Компоненты органических кислот кислотно-аддитивных солей соединений формулы (I), являются предпочтительно насыщенными или ненасыщенными, замещенными или незамещенными алифатическими карбоновыми кислотами, например такими как муравьиная кислота, уксусная кислота, пропионовая кислота, масляная кислота, изомасляная кислота, стеариновая кислота, декановая кислота, себациновая кислота, оротовая кислота, пальмитиновая кислота, памовая кислота, замещенными карбоновыми кислотами, такими как карбоновые кислоты, замещенные атомами галогена, например, хлоруксусная кислота, дихлоруксусная кислота, трифторуксусная кислота, или оксокислотами, такими как 2-оксо-глутаровая кислота, пировиноградная кислота, ди-и-поликарбоновыми кислотами, такими как щавелевая кислота, адипиновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, малоновая кислота, ароматическими карбоновыми кислотами, такими как бензойная кислота, салициловая кислота, ацетилсалициловая кислота, 4-аминосалициловая кислота, алифатическими или ароматическими сульфокислотами, такими как метан-, этансульфоновая кислота, гидрокси-этансульфоновая кислота, циклогексил-сульфоновая кислота (цикламовая кислота), додецилсульфоновая кислота, этан-1,2-дисульфокислота, п-толуолсульфоновая кислота, нафталинсульфоновая кислота, нафталин-2-сульфоновая кислота, нафталин-1,5-дисульфокислота, углеводами с карбоксильной функциональностью, такими как глюкогептоноиковая глюкогептоноевая кислота, D-глюконовая кислота, D-глюкуроновая кислота, гидроксикислотами, такими как аскорбиновая кислота, (+)-L-молочная кислота, (±)-DL-молочная кислота, яблочная кислота, аминокислотами, такими как L-аспарагиновая кислота, предпочтительно незамещенная С1-С4-карбоновая кислота или карбоновая кислота, замещенная атомами галогена, такая как уксусная кислота, дихлоруксусная кислота, дифторуксусная кислота, наиболее предпочтительно трифторуксусная кислота. В качестве соединений, образующих неорганические соли применяют, например, азотную кислоту, серную кислоту, бромистый водород, фосфорную кислоту в виде соли или в кислой форме.
В описании настоящего изобретения значение терминов является следующим: линейные или разветвленные C1-6-алкильные группы представляют собой, например, метильную, этильную, пропильную, изопропильную, бутильную, трет-бутильную, гексильную группы, С1-6-алкиленовые группы представляют собой группы, имеющие одну или несколько изолированных или сопряженных двойных связей, например, 2-пропенильная, изобутенильная группы, C1-6-алкинильные группы являются группами, имеющими одну или несколько изолированных или сопряженных двойных связей, или тройных связей, например, пропаргильными группами. Арильные группы представляют собой замещенные или незамещенные, изолированные или конденсированные ароматические изоциклические соединения, такие как фенильная и нафтильная группы. Аралкильные группы представляют собой изоциклические группы, связанные со структурой через алкилен, например, метиленовую группу. Гетероарильные группы представляют собой соединения, содержащие по меньшей мере один гетероатом, такой как пиридильная, пиразонильная, имидазолильная, пиразолильная, оксазолильная, тиофенильная группы или конденсированные гетероарильные группы, такие как пуринильные группы. Насыщенные или ненасыщенные циклоалкильные группы представляют собой такие группы, как циклопропильная, циклобутильная, циклогексильная, циклогептильная или их производные, содержащие по меньшей мере одну двойную связь. Замещенные или незамещенные гетероциклические соединения представляют собой группы, полученные из циклических соединений, содержащих по меньшей мере один элемент кольца, содержащий, такой как азетидинил, оксиранил, диоксоланил, морфолинил группы. Алкокси группы представляют собой группы, где алкильная группа присоединена к атому углерода соединения через атом кислорода. Аминогруппы могут быть первичными, вторичными или третичными аминогруппами по настоящему изобретению. Алкоксикарбонильные группы представляют собой такие сложные эфиры, в которых спиртовой компонент является алкильной или аралкильной группой, такими группами являются, например, этоксикарбонильная, метоксикарбонильная или бензилоксикарбонильная группы. Карбамоильные группы могут иметь один или два заместителя. Атомы галогена представляют собой атом хлора, брома, йода или фтора. Углеродсодержащей кислотой является карбоновая кислота.
Другой аспект настоящего изобретения представляет собой получение соединений общей формулы (I), где R1 и R2 являются такими, как определено выше, и синтезированных следующим образом:
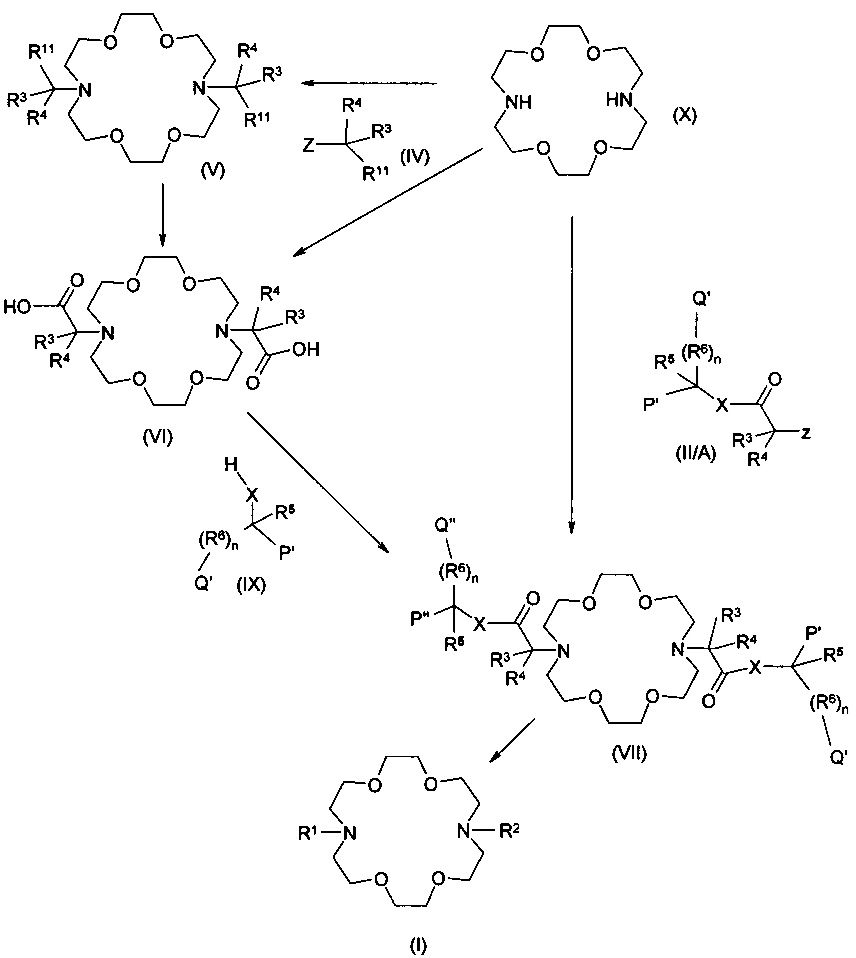
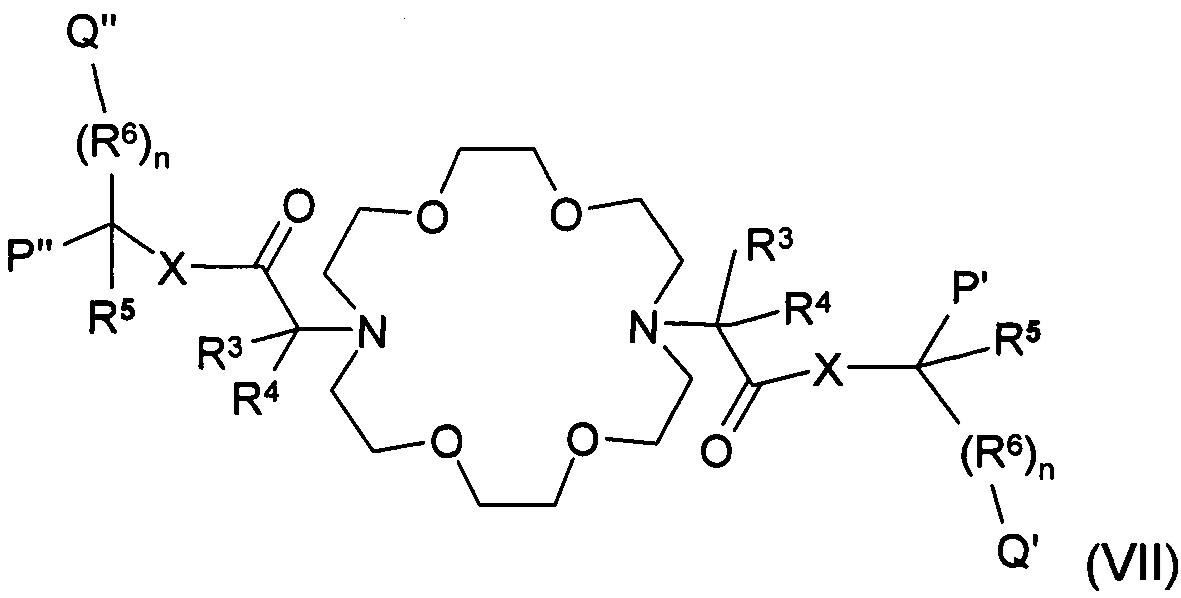
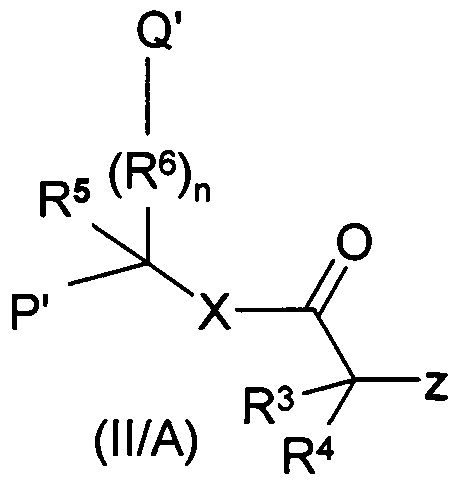
Еще один аспект настоящего изобретения представляет собой получение соединений общей формулы (I), где R1 и R2 являются такими, как определено выше, отличающиеся тем, что соединение формулы (X) взаимодействует с соединением общей формулы из (II/А), при этом значение R3, R4, R5,R6, n и X является таким, как определено выше для группы (II), и при этом Qʹ и Рʹ представляют собой карбоксильные группы, Z представляет собой замещаемую группу, предпочтительно атом галогена, например, атом брома, йода или хлора, или алифатическую или ароматическую сульфонилоксигруппу, такую как тосилокси или мезилокси группу, или
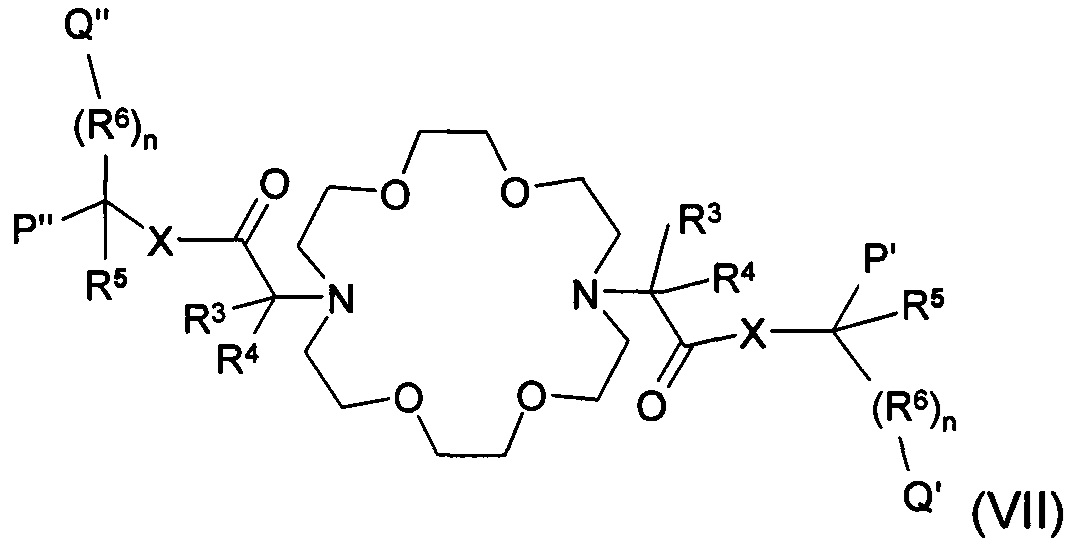
Рʹ, Pʺ, Qʹ и Qʺ группы соединения общей формулы (VII) представляют собой трансформированные карбоксильные группы, где значение R3, R4, R5,R6, n и X общей формулы (VII), является таким, как определено выше для группы (II), и Рʹ, Pʺ,Qʹ и Qʺ группы представляют собой одинаковые или различные защищенные карбоксильные группы, такие как сложные эфиры, амидные или цианогруппы, или
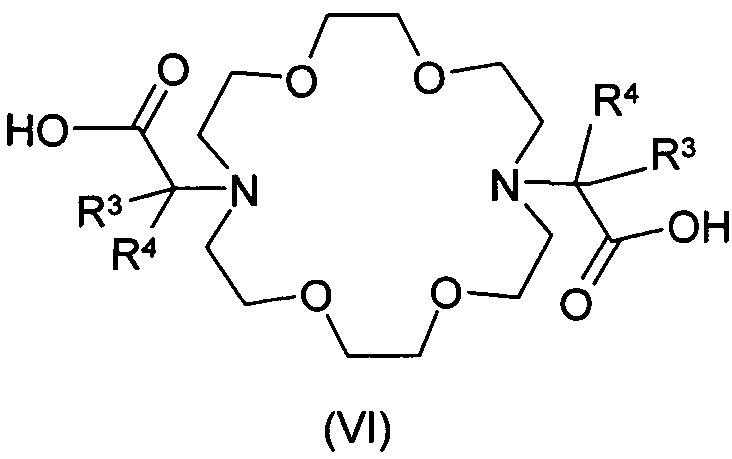
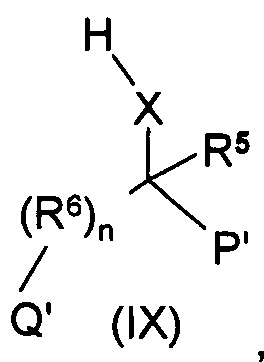
соединение формулы (VI), где значение R3, R4 является таким, как определено выше для группы (II), взаимодействует с соединением общей формулы (IX), где Рʹ и Qʹ группы представляют собой карбоксильные группы, или
соединение формулы (VI), где значение R3, R4 является таким, как определено выше для группы (II), взаимодействует с соединением общей формулы (IX), где Рʹ и Qʹ группы являются идентичными или различными защищенными карбоксильными группами, такими как сложные эфиры, амидные, Рʹ и/или Qʹ представляют собой цианогруппы, затем с карбоксильных групп снимают защиту с полученного соединения общей формулы (VII), а затем
полученное таким образом соединение общей формулы (I) превращают в комплекс и/или в форму соли, если это необходимо.
Более конкретно, можно действовать следующим образом:
а.)
Соединение формулы (X) взаимодействует с соединением общей формулы (II/А), при этом значение R3, R4, R5, R6, n и X является таким, как определено выше для группы (II), Рʹ и Qʹ группы имеют защищенные карбоксильные группы, такие как сложные эфиры, амидные или Рʹ и/или Qʹ представляют собой цианогруппы, Z представляет собой замещаемую группу, предпочтительно атом галогена, например, атом брома, йода или хлора, или алифатическую или ароматическую сульфонилокси группу, такую как тозилокси или мезилоксигруппа. Затем защитные группы с карбоксильных групп полученного соединения общей формулы (VII) удаляют и получают соединение общей формулы (I), или
b.)
Соединение формулы (X) взаимодействует с соединением общей формулы (II/А), где Qʹ и Рʹ представляют собой карбоксильные группы, и таким образом получают соединение общей формулы (I).
В качестве альтернативы мы можем принять, что соединение формулы (X) взаимодействует с соединением общей формулы (IV), где значение R3 и R4 определено выше, Z представляет собой замещаемую группу, предпочтительно атом галогена, например, атом брома, йода или хлора, или алифатическую или ароматическую сульфонилоксигруппу, например тозилокси, бензолсульфонилокси или мезилоксигруппу. Группа R11 представляет собой защищенную карбоксильную группу, такую как сложный эфир, амидную или цианогруппу. Группы R11 полученного таким образом соединения общей формулы (V) преобразуют в карбоксильные группы. Полученное соединение формулы (VI) взаимодействует с соединением общей формулы (IX), где R5, R6 и X такие, как определено выше, Рʹ и Qʹ группы представляют собой защищенные карбоксильные группы, такие как сложные эфиры, амидные группы, или Рʹ и/или Qʹ представляют собой цианогруппы. Затем защитные группы полученного соединения общей формулы (VII) удаляют и получают соединение общей формулы (I).
Кроме того, соединение формулы (X) может взаимодействовать с соединением общей формулы (IV), где R3, R4 и Z такие, как определено выше, R11 обозначает карбоксильную группу. В этом случае мы получаем соединение формулы (VI) в одну стадию.
В случае когда соединение формулы взаимодействует с соединением общей формулы (IX), где Qʹ и Рʹ представляют собой карбоксильные группы, продукт реакции представляет собой соединение общей формулы (I).
Полученное соединение общей формулы (I) может быть превращено в соль и/или комплекс, если это необходимо.
В случае получения соединений общей формулы (I), имеющих асимметричную структуру, мы можем также принять, что соединение формулы (I), где оба R1 и R2 представляют собой атомы водорода, взаимодействует с 0,5-1,5 моль эквивалента соединения общей формулы (II/А), где значение R3, R4, R5, R6, R7, Q, n и X является таким, как определено выше для группы общей формулы (II), Y представляет собой замещаемую группу, предпочтительно атом брома, йода, или хлора, или активированный сложный эфир, например, сульфонилоксигруппу, предпочтительно мезилокси, тозилокси или бензолсульфонилоксигруппу, затем предпочтительно взаимодействует с дальнейшими 0,5-1,5 моль эквивалента соединения общей формулы (II/А), отличающимся от другого соединения, используемого на первой стадии, полученное соединение общей формулы (I), где значение R1 и R2 является таким, как определено выше, выделяют из реакционной смеси, при необходимости очищают и возможно преобразуют в соль и/или форму комплекса.
Реакция может быть проведена таким образом, что карбоксильные группы соединения формулы (II/А) применяют до взаимодействия с защитными группами, которые группы удаляют после реакции.
Реакция может быть проведена в присутствии органических или неорганических оснований, предпочтительно в присутствии карбоната калия или натрия или триэтиламина.
Группа X соединения общей формулы (II/А) может являться атомом серы, кислорода или азота, как определено выше. С точки зрения реакции N-алкилирования группа X может являться любым из них, потому что они не участвуют в реакции.
Соединения общей формулы (II/А) могут быть получены аналогичным образом, а именно амино, гидроксил или меркаптодикарбоновая кислота или их производные с защищенными карбоксильными функциями взаимодействуют с незамещенным или замещенным хлоро, бромо или йодо галогенидом уксусной кислоты, предпочтительно с хлоридом в присутствии основания, в нейтральном растворителе и температуру реакционной смеси поддерживают при температуре от -20 до 100°С, предпочтительно от 40 до 80°С. Ацилирование амино, меркапто и гидроксильных кислот хорошо известно из уровня техники, это часть известна специалисту в данной области техники.
Карбоксильные группы обычно защищены в форме сложного эфира, предпочтительно алкильных сложных эфиров, например, применяют трет-бутиловые сложные эфиры или бензиловые эфиры. Эти группы алкиловых эфиров могут быть удалены путем гидролиза, бензиловые эфиры с помощью гидрогенизации. Эти способы хорошо известны из уровня техники и являются частью знаний специалиста в данной области, также как и гидролиз других защитных групп, такие как трансформации амидной группы, циано групп, и ортоэфиров до карбоксильных групп.
В экспериментальной части показаны, в частности, три различных пути синтеза общей формулы (I), при этом кислотные группы являются карбоксильными группами:
Путь синтеза А:
Путь синтеза В:
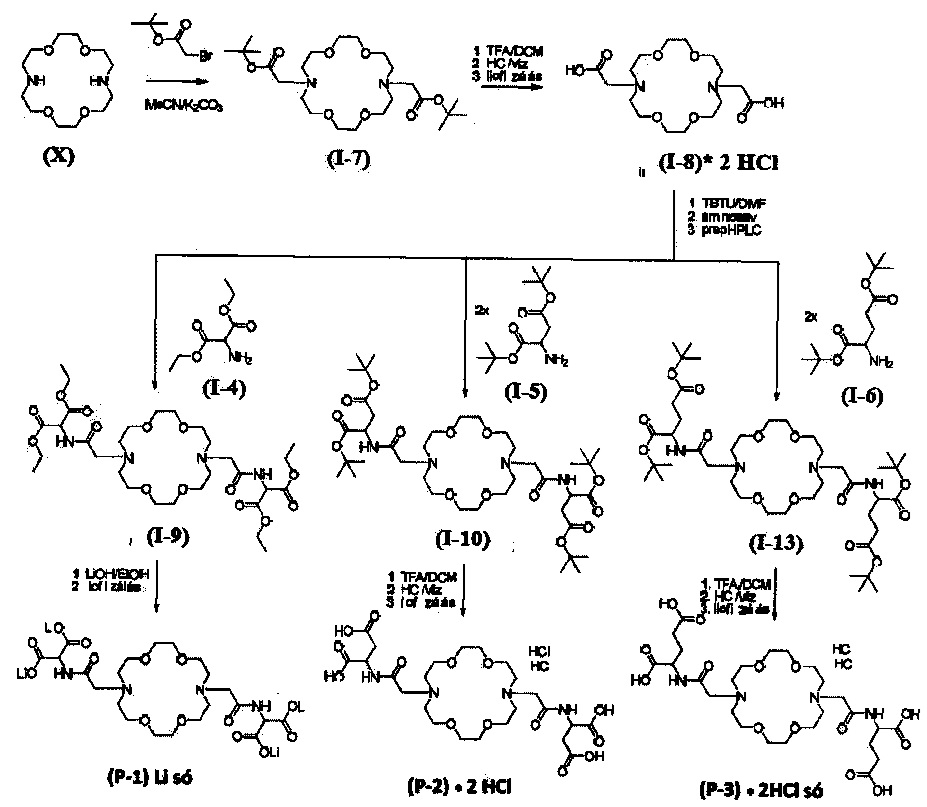
Путь синтеза С:
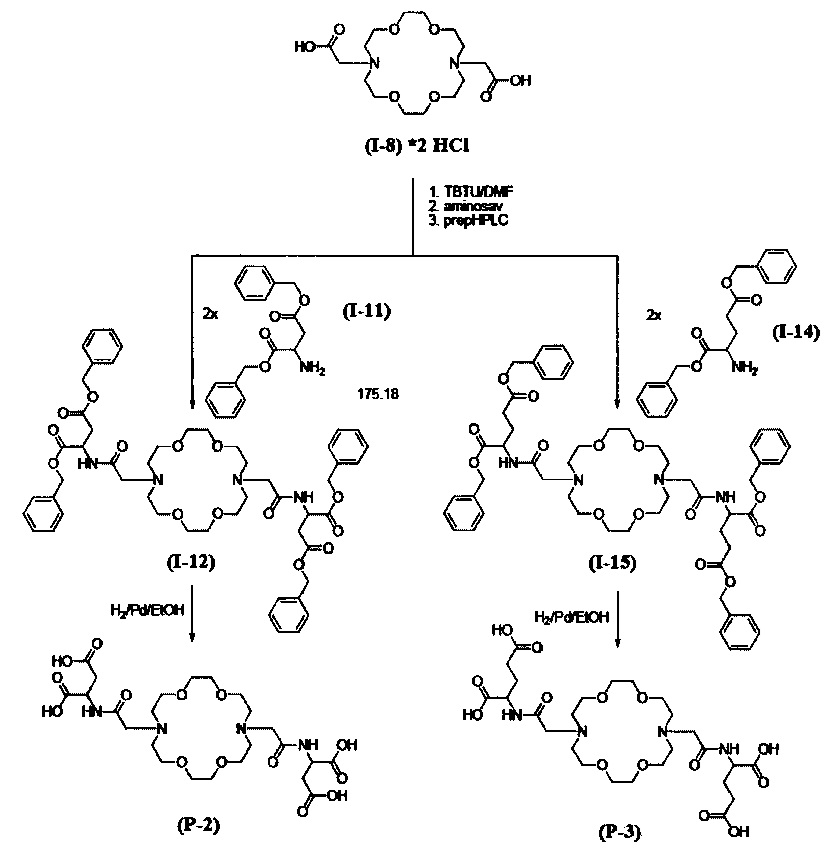
Соединения общей формулы (II/А), которые могут быть применены для синтеза соединений общей формулы (I), также могут быть получены таким образом, что карбоксильные группы в применяемой аминодикарбоновой кислоте защищены бензильной или другими алкильными группами перед реакцией, и эти группы удаляют после реакции. Реакция N-ацилирования может быть предпочтительно проведена с применением кислых галогенидов или кислых ангидридов. Реакция может быть проведена в присутствии органического или неорганического основания, предпочтительно в присутствии карбоната калия или натрия или триэтиламина, при температуре от -20 до +100°С, предпочтительно, от +20 до +50°С.
Соединение криптофикс формулы (X) может быть алкилировано с полученными таким образом соединениями общей формулы (II/А) или с соединением общей формулы (IV). Реакция также может быть проведена таким образом, чтобы реагенты взаимодействовали в присутствии органического или неорганического основания, предпочтительно в присутствии карбоната калия, натрия, цезия или триэтиламина, в органическом неполярном или полярном, апротонном или протонном растворителе, предпочтительно в тетрагидрофуране, ацетонитриле или диметилформамиде при температуре от -20 до +100°С, предпочтительно от +50 до +80°С.
Если алкилирование проводят с альфа-галогенкарбоновой кислотой, то результатом является соединение формулы (IV) или соединение общей формулы (I).
Применение соединений формулы (II/А), имеющих защищенные карбоксильные группы, приводит к соединению общей формулы (VII), тогда как в случае применения защищенного соединения общей формулы (IV) получают соединение общей формулы (V).
Соединение общей формулы (VI) может быть получено из соединения общей формулы (V) таким образом, что соединение общей формулы (V) взаимодействует в водном или безводном, апротонном или протонном растворителе, предпочтительно в дихлорэтане с сильной органической или неорганической кислотой, предпочтительно с трифторуксусной кислотой, при температуре от -20 до +100°С, предпочтительно при комнатной температуре, если группа R11 представляет собой, например, сложноэфирную группу.
Соединение общей формулы (VII) может быть получено также таким образом, что соединение общей формулы (VI) подвергают взаимодействию с соединением общей формулы (IX) в присутствии органических или неорганических оснований, предпочтительно в присутствии триэтиламина, в органическом полярном или неполярном растворителе, предпочтительно в тетрагидрофуране, ацетонитриле, диметилформамиде, и в присутствии конденсирующих агентов TBTU (O-(бензотриазол-1-ил)-N,N,Nʹ,Nʹ-тетраметилурония тетрафторборат), HATU (O-(7-азабензотриазол-1-ил)-N,N,Nʹ,Nʹ-тетраметилурония гексафторфосфат), TATU (2-(1Н-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат), ВОР ((бензотриазол-1-илокси)трис(диметиламино) фосфония гексафторфосфат), РуВОР ((бензотриазол-1-ил-окситрипиррол идинофосфоний гексафторфосфат)), НОВТ (гидробензотриазол) в интервале температур между -20-+100°С, предпочтительно между +50-+80°С. Реакция также может быть проведена в присутствии других сочетающих агентов, таких как дициклогексилкарбодиимид или изобутилхлорформиат.
Соединение общей формулы (I) также может быть получено из соединения общей формулы (VII), где Qʺ, Qʹ, Рʺ и Рʹ группы означают эфирную группу с кислотным или щелочным гидролизом. В случае щелочного гидролиза или трансформации до соли металла, реакция может быть проведена таким образом, что соединение общей формулы (VII) взаимодействует в присутствии неорганического основания, предпочтительно в присутствии карбоната лития калия, натрия или кальция, в органическом полярном или неполярном, апротонном или протонном растворителе, или, возможно, в водном растворителе, предпочтительно в спиртах в интервале температур от -20 до +100°С, предпочтительно от +50 до +80°С.
При испарении растворителя получают соль, или в качестве альтернативы, ее осаждают с помощью антирастворителя. В качестве альтернативы можно кристаллизовать соли из выпаренной реакционной смеси, или кислота может быть получена при подкислении реакционной смеси.
Сложные эфиры в соответствии с общей формулой (VII) можно превратить в кислоту с помощью реакции с кислотой, предпочтительно соляной кислотой в водном или безводном, полярном и неполярном, апротонном и протонном растворителе, предпочтительно в диэтиловом эфире, при температуре от -20 до +100°С, предпочтительно при комнатной температуре.
В особых случаях группа сложного эфира может быть удалена восстановлением. Если Qʺ, Qʹ, Рʺ и Рʹ формулы (VII) представляют собой бензил, или любой другим тип групп, которые могут быть удалены восстановлением, то реакция может быть проведена в водном или безводном, неполярном или полярном, апротонном или протонном растворителе, предпочтительно в спиртах при температуре от -20 до +100°С, предпочтительно при комнатной температуре, с применением катализаторов переходных металлов, предпочтительно Pd или Ni-Ренея катализатора. В качестве источника водорода могут также быть применены элементарный водород, формиат аммония, муравьиная кислота и гидразин.
Процессы, описанные выше, хорошо известны специалистам в данной области техники. В качестве органических неполярных растворителей могут также быть применены например насыщенные или ненасыщенные углеводороды или их смеси, например гексан, гептан, толуол, диэтиловый эфир.
В качестве полярного апротонного растворителя также могут быть применены метиленхлорид, тетрагидрофуран, диметилформамид, ацетонитрил, диметилсульфоксид. В качестве протонного растворителя могут быть применены вода, алифатические спирты, такие как метанол, этанол, пропанол, 2-пропанол и подобные. Выбор подходящих растворителей является частью общих знаний специалиста в данной области техники.
Другим объектом настоящего изобретения является один из ключевых промежуточных продуктов соединений общей формулы (VII), где значение n, X, R3, R4, R5 и R6 является таким, как определено в п. 1, Qʹ, Qʺ, Рʹ и Рʺ представляют собой одинаковые или различные защищенные карбоксильные группы, предпочтительно сложный эфир, замещенные или незамещенные амидные группы или цианогруппы.
Мы хотели проверить результаты расчетов для соединений по настоящему изобретению с помощью измерений, а также тот факт, являются ли указанные соединения лучшими комплексообразующими агентами, чем декорпорол формулы (XI).
Несколько различных способов были безуспешно применены для измерения комплексообразующей способности иона Са и иона Sr и соотношения между ними. По данным информационного материала Sr ионоселективный электрод не является селективным для Са. Мы не смогли найти различия между Са и Sr комплексами при применении 1Н и 13С спектров. Поскольку ядра Са и Sr не являются ЯМР (ядерно-магнитный резонанс) активными, поэтому они не могут быть проверены.
Таким образом, измерения Ca-Sr ионоселективности проводили с помощью AGILENT 6140 Octapol МС (масс-спектрометр), оборудованного AGILENT 1200 ВЭЖХ (высокоэффективная жидкостная хромотография).
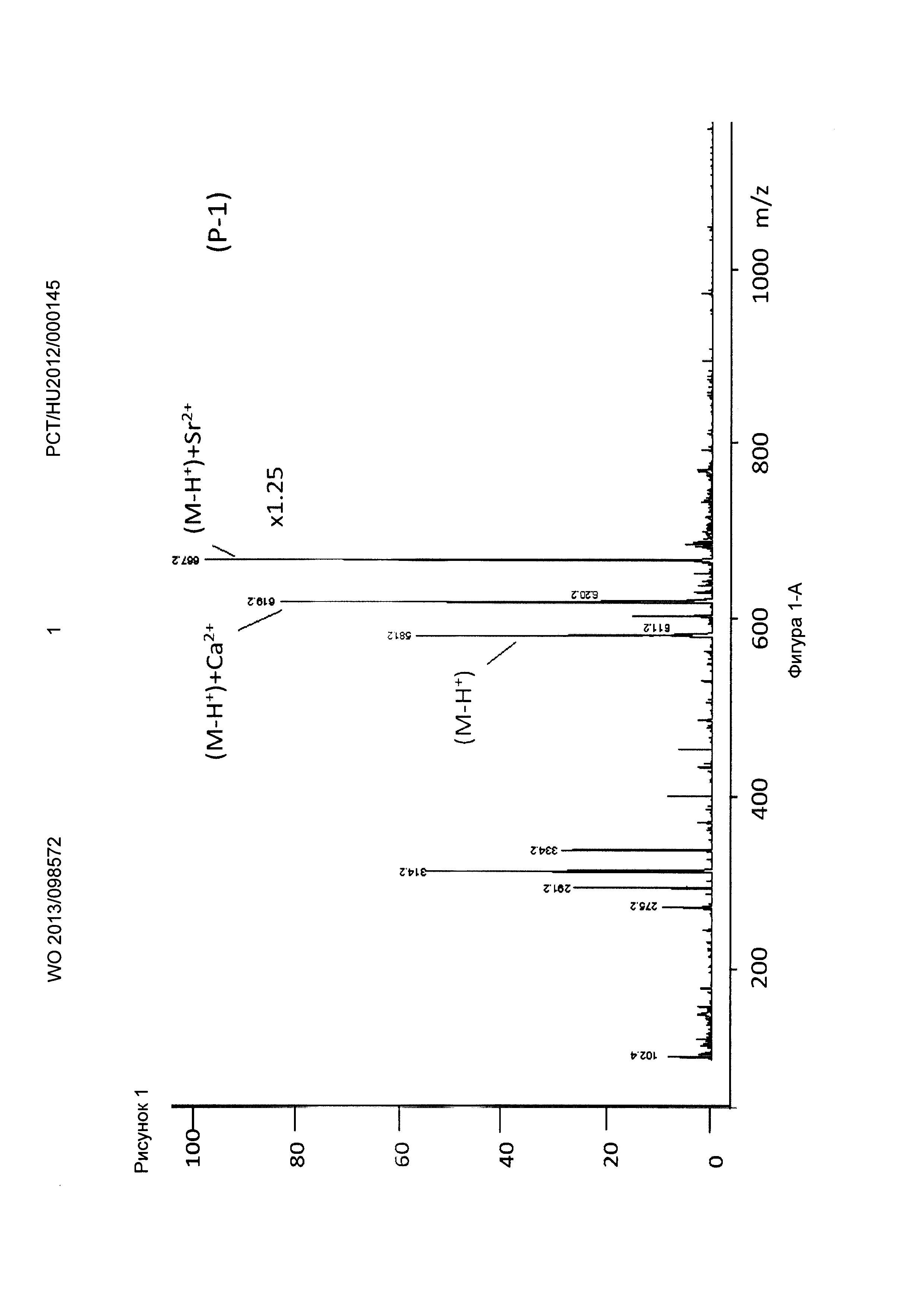
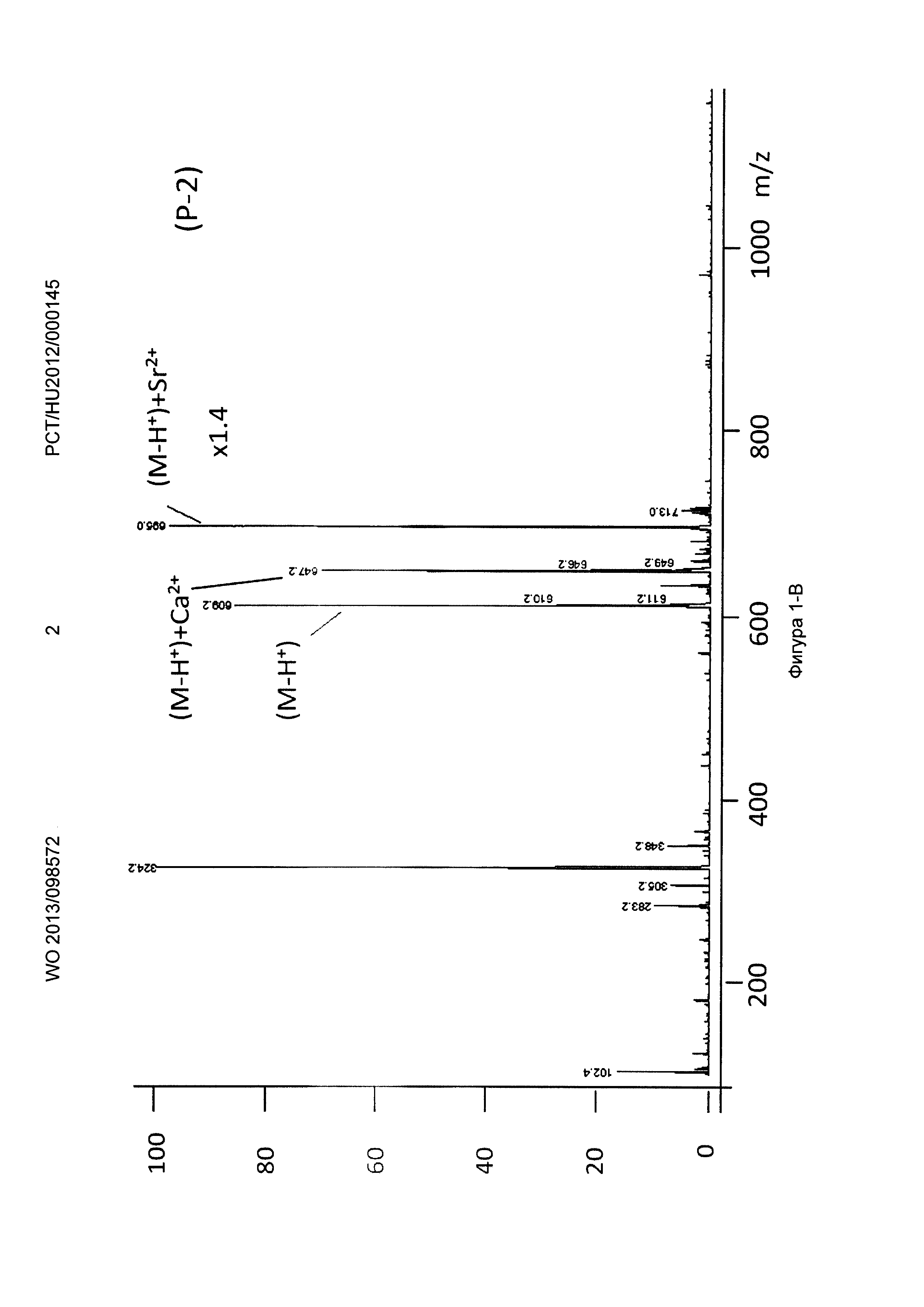
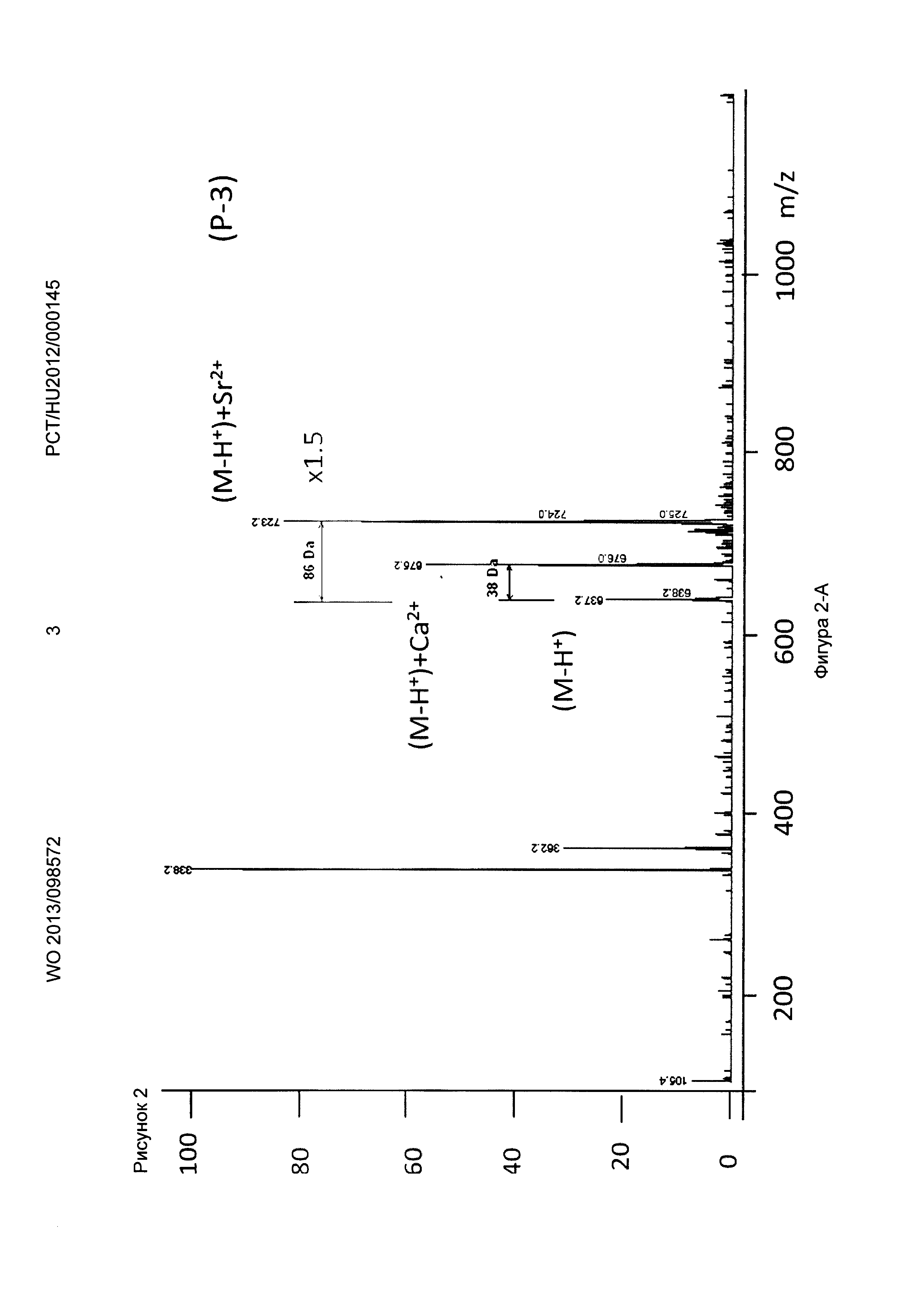
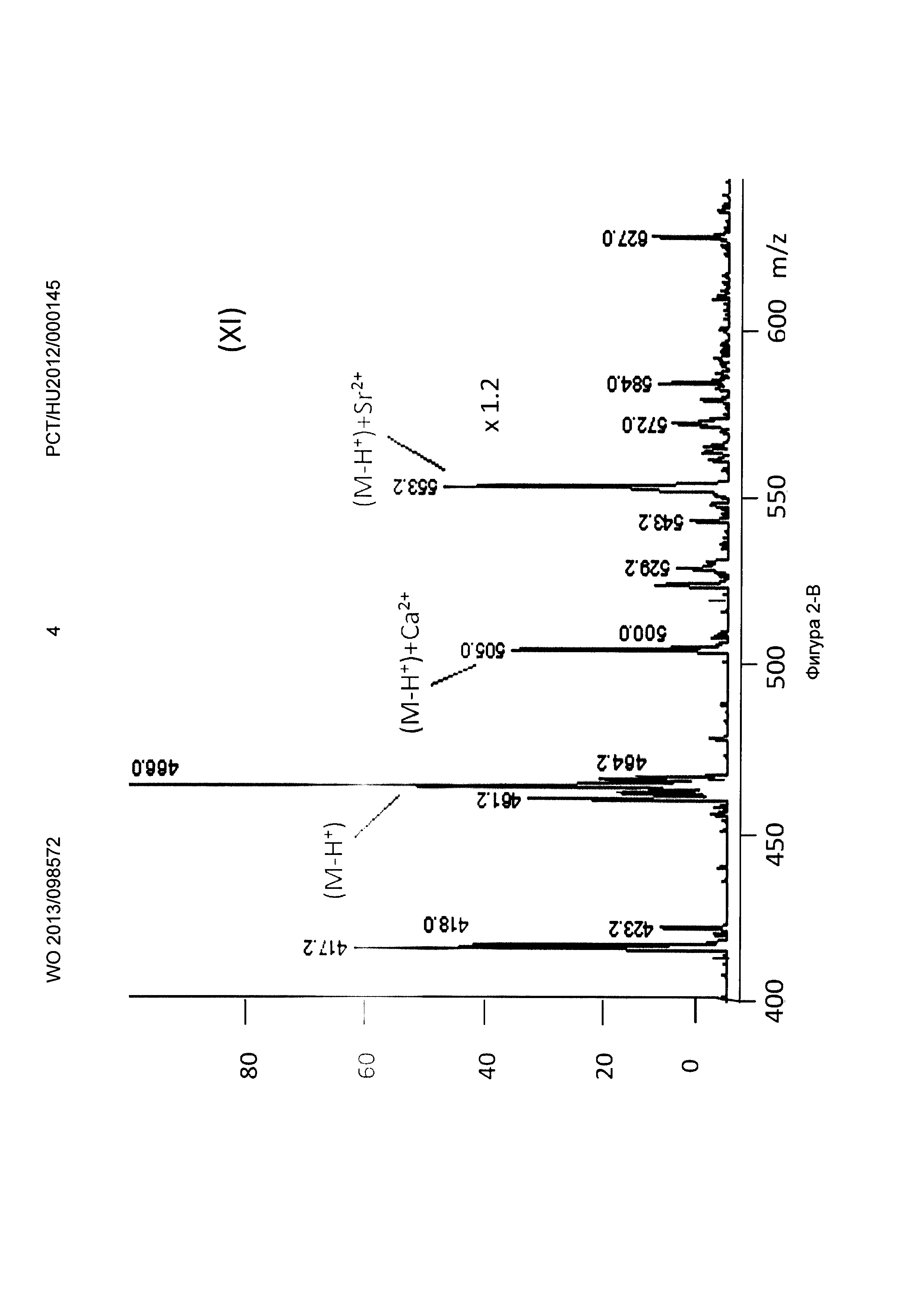
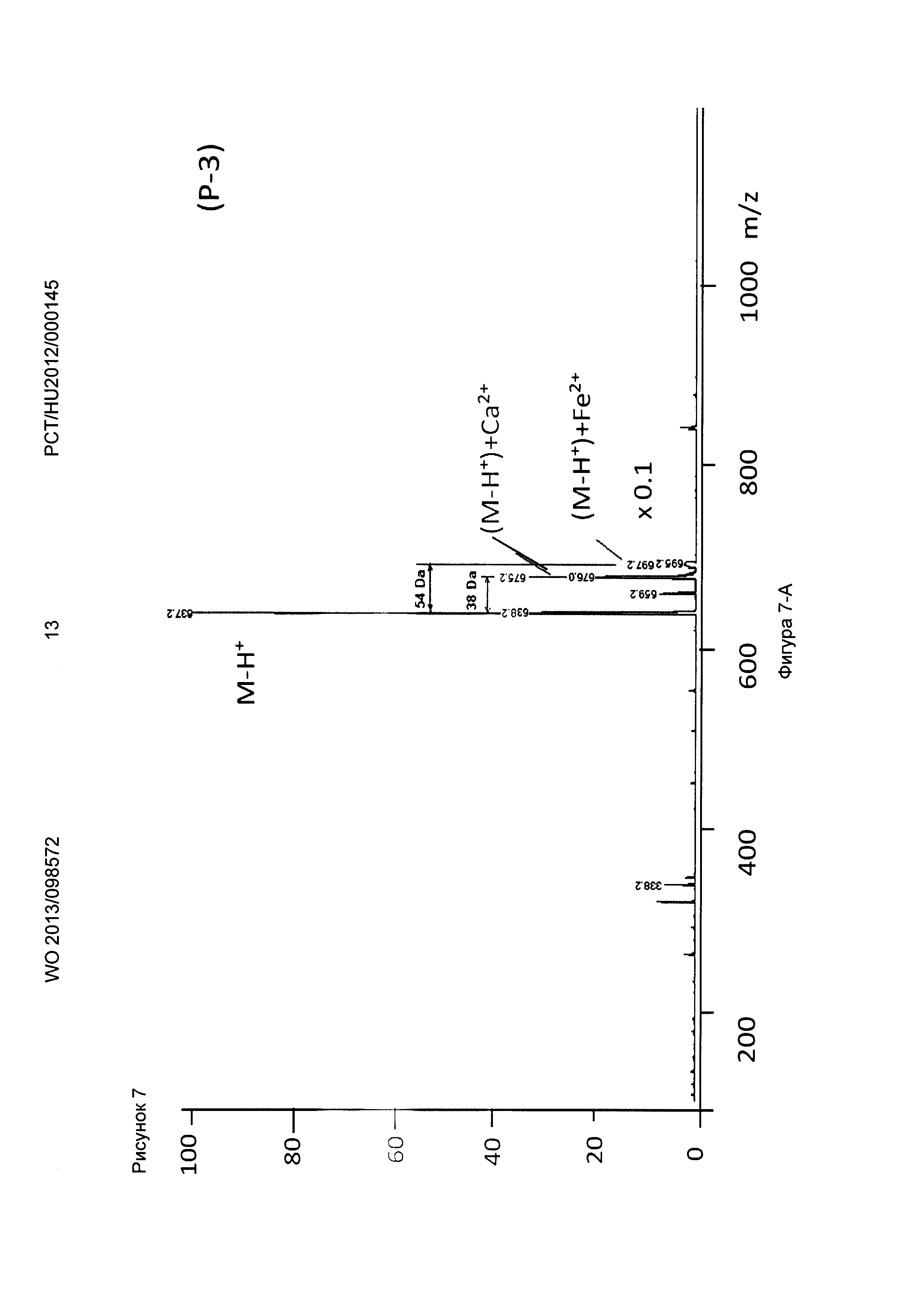
Ионизацию осуществляли с помощью оборудования для ионизации распылением в электрическом поле (ESI, MM-FS) для мягкой ионизации с положительной детекцией. Во время измерений к маточным растворам добавляли различные комплексообразующие соединения формул (Р-1), (Р-2), (Р-3), приготовленные с продуктами синтеза, показанными выше, и декорпорол формулы (XI) добавляли к маточным растворам, затем растворы измеряли масс-спектрометрией. В полученных спектрах Sr и Са комплексы и свободные комплексообразующие соединения могут быть четко отделены, что показывает, что Sr связывающая способность трех комплексообразующих соединений по настоящему изобретению превышает способность декорпорола формулы (XI) следующим образом:

Пики свободных комплексообразующих соединений формул (Р-1), (Р-2) и (Р-3) были значительно меньше, чем пики МС Sr комплексов. Их скорость была ниже в случае декорпорола, что показывает его худшую комплексообразующую способность. То есть значительное количество декорпорола не образует комплексные соединения, но перегружает организм как балласт.
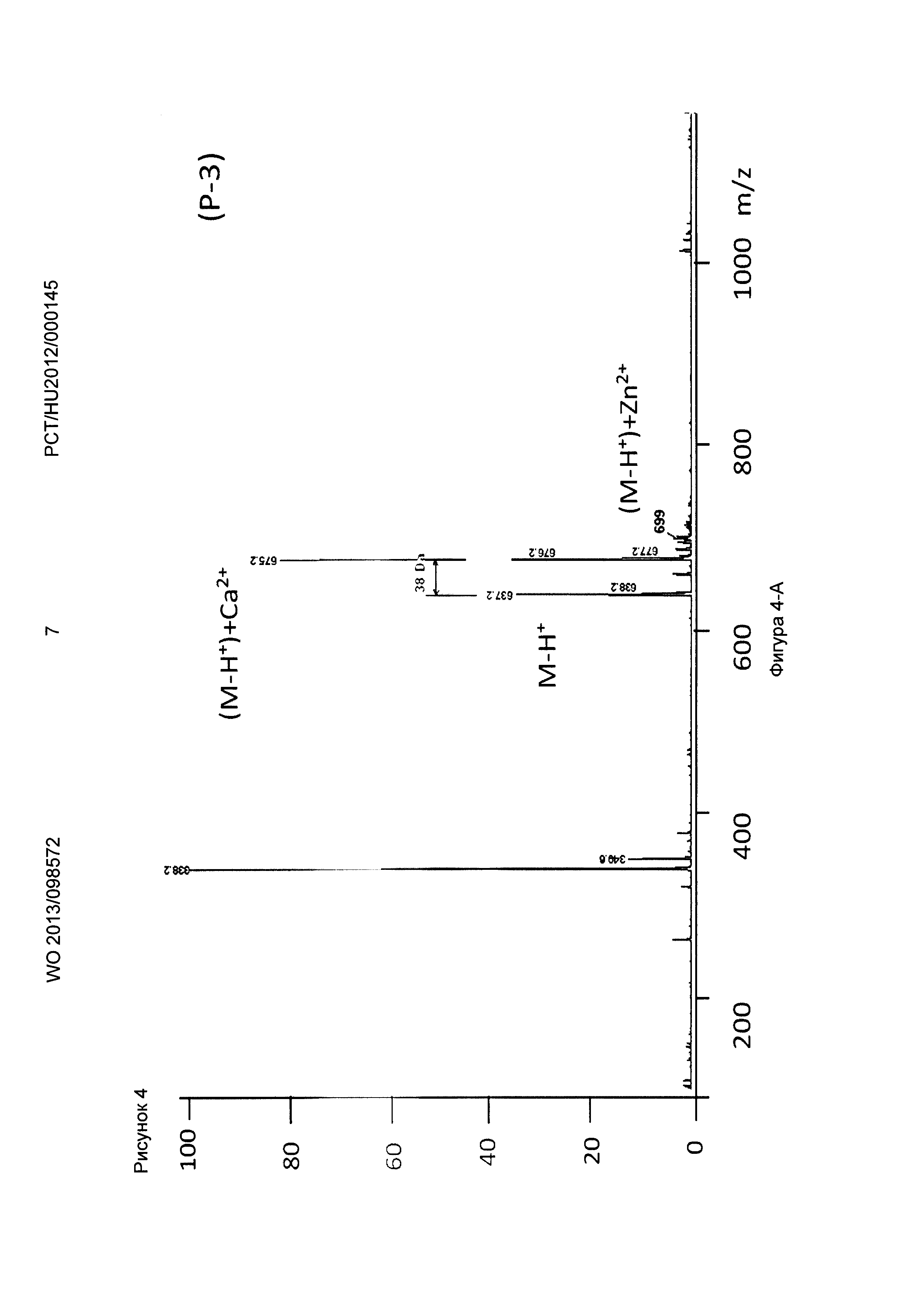
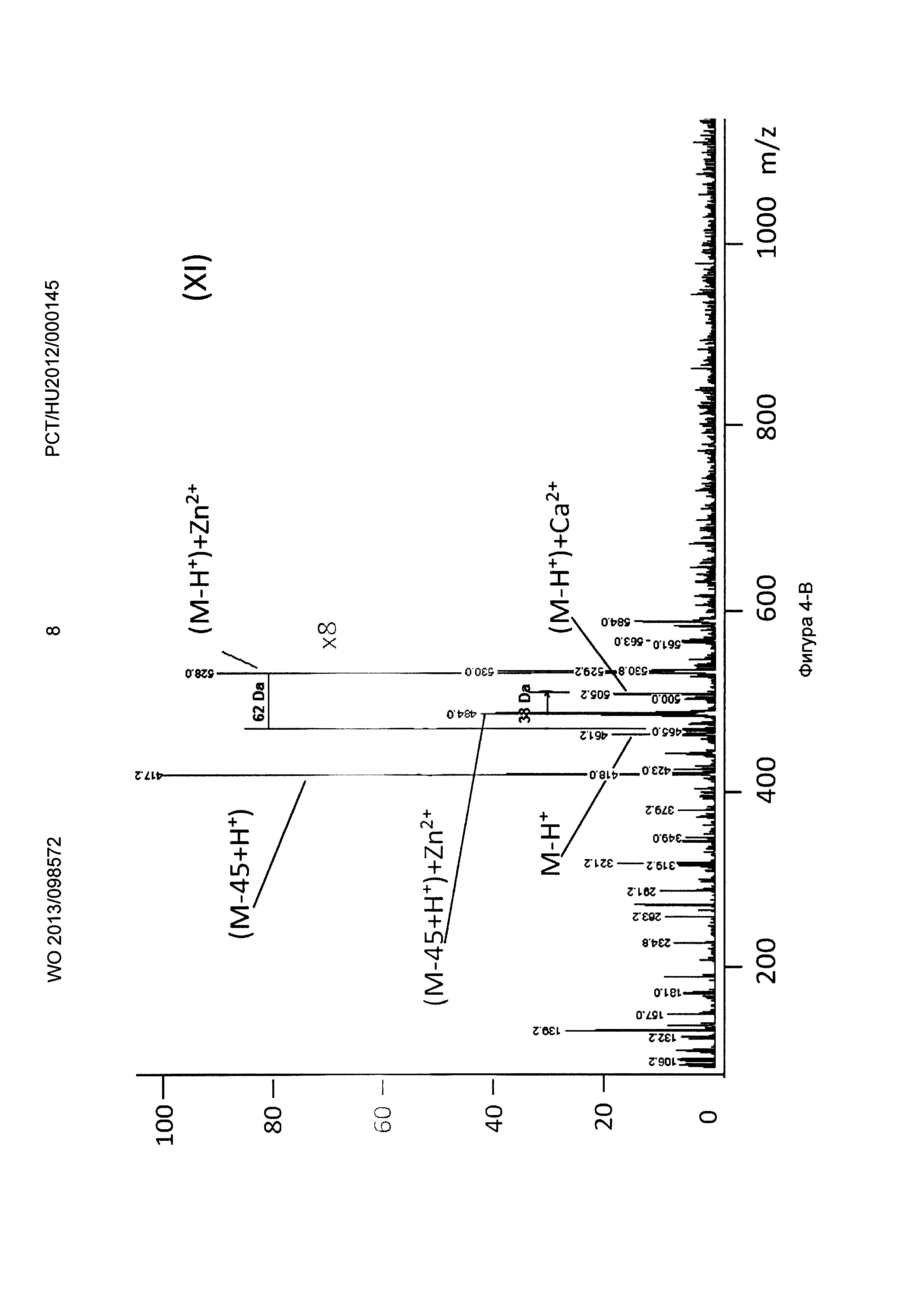
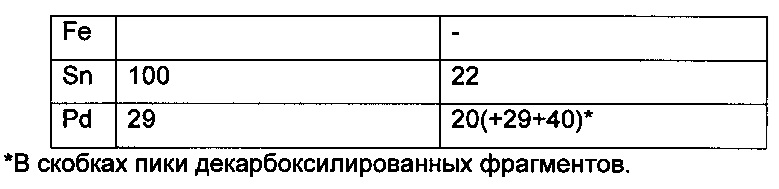
Декарбоксилирование, характерное для декорпорола, также было показано в процессе измерений. Эксперименты с различными ионами металлов показали, что соединение (Р-3) по настоящему изобретению связывает токсичные металлы (Sr2+, Sn2+, Pd2+) значительно лучше, чем физиологически важные металлы (Zn2+, Fe2+, Са2+). Поведение Декорпорола аналогично, но он связывает олово и палладий значительно меньше, и в этом случае количество декарбоксилированного декорпорола значительно выше, в то время как соединение формулы (Р-3) не подвергается декарбоксилированию.
Декорпорол связывает ионы Zn сильнее, чем ионы Са, что может привести к снижению ионов Zn до опасной степени.
Способности связывания ионов металла соединения формулы (Р-3) и декорпорола являются следующими:

Метаболические свойства соединений формул (Р-1), (Р-2) и (Р-3), по-видимому, лучше, потому что полное или частичное расщепление боковой цепи высвобождает аминокислоты или гидроксикислоты, которые уже присутствуют в организме. Кроме того, растворимость комплексообразующих соединений формул (Р-1), (Р-2) и (Р-3) лучше по сравнению с декорпоролом за счет более полярных групп.
Поэтому композиции по настоящему изобретению являются подходящими для удаления токсичных металлов из организма пациентов, нуждающихся в таком лечении, в то время как основные ионы металлов, такие как медь, цинк и кальций не выводятся из организма.
Еще одним аспектом настоящего изобретения является фармацевтическая композиция, содержащая соединение общей формулы (I) в качестве активного ингредиента, где значение R1 и R2 является таким, как определено выше, и фармацевтически приемлемые соли и/или их комплексы, помимо обычных агентов-носителей.
Наиболее предпочтительное воплощение настоящего изобретения включает в качестве активного ингредиента соединение (Р-2), (Р-1) или (Р-3), или их соль и/или комплекс. В соответствии с предпочтительным воплощением настоящего изобретения фармацевтическая композиция содержит 0,01-95 масс. %, предпочтительно 1-50 масс. %, практически 5-30 масс. % активного ингредиента.
Фармацевтические композиции по настоящему изобретению приемлемы для перорального, парентерального, ректального или местного применения. Фармацевтические композиции могут быть твердыми или жидкими и пригодны для перорального, парентерального, ректального или местного применения.
Пероральные твердые композиции могут представлять собой порошки, капсулы, таблетки, покрытые пленкой таблетки, микрокапсулы и т.д., которые могут содержать в качестве носителя связующие вещества, например желатин, сорбит, поливинилпирролидон и т.д., разбавители, такие как лактоза, глюкоза, крахмал, фосфат калия и т.п., вспомогательные вещества, такие как стеарат магния, тальк, полиэтиленгликоль, диоксид кремния и т.д., смачивающие агенты, такие как лаурилсульфат натрия и т.п. Пероральные жидкие композиции могут представлять собой растворы, суспензии или эмульсии, которые могут содержать в качестве носителя суспендирующие агенты, например, желатин, карбоксиметилцеллюлозу и т.д., эмульгаторы, такие как моноолеат сорбитана и т.д.; растворители, такие как вода, масла, глицерин, пропиленгликоль, этанол; консерванты, такие как р-гидроксибензойной кислоты метиловый или пропиловый эфир и т.д. Парентеральные композиции обычно представляют собой стерильный раствор активного ингредиента. Вышеупомянутые и другие фармацевтические формулировки известны, смотри, например, справочник Remingtonʹs Pharmaceutical Sciences, edition 18, Mack Publishing Co., Easton, USA (1990).
В большинстве случаев указанная фармацевтическая композиция содержит стандартные лекарственные формы. Типичная суточная доза для взрослого пациента составляет 0,1-3000 мг соединения общей формулы (I) или его фармацевтически активной соли и/или комплекса на основе 1 кг массы тела. Суточная доза может быть введена в одной или в нескольких частях. Доза зависит от нескольких факторов и определяется лечащим врачом.
Фармацевтическая композиция, содержащая соединение общей формулы (I) или его соли и/или комплексы, и один или несколько носителей может быть получена путем смешивания активного ингредиента и одного или нескольких носителей, затем смесь формируют до фармацевтической композиции известным способом. Подходящие способы известны из литературы, например из вышеупомянутого справочника Remingtonʹs Pharmaceutical Sciences.
- Преимуществом настоящего изобретения является то, что соединения общей формулы (I) связывают токсичные металлы, такие как палладий, стронций, олово, свинец сильнее, чем декорпорол, тем самым уменьшая эффективные дозы и снижая нагрузку на выделительные системы организма.
- Растворимость в воде соединений общей формулы (I) лучше, чем растворимость ранее известных соединений. Могут быть получены более концентрированные инфузионные растворы, необходимое количество соединения может быть введено более быстро человеку, который в этом нуждается.
- Соли соединения общей формулы (I) легко получают, очищают и они более устойчивы, чем нейтральная форма этих соединений согласно предшествующему уровнем техники.
- В ходе метаболизма соединений общей формулы (I) по настоящему изобретению образуются гидроксикислоты и аминокислоты, которые не являются токсичными.
- Согласно испытаниям они более эффективно связывают вредные ионы чем декорпорол.
- Руководству катастроф (управлению по чрезвычайным ситуациям) необходимо финансировать хранение меньшего количества соединений.
Наше изобретение продемонстрировано, в частности, в приведенных ниже Примерах, не ограничивающих объем изобретения:
На Фигурах свойства связывания ионов металла комплексных соединений по настоящему изобретению и декорпорола (XI), измеренные с помощью ВЭЖХ-МС оборудования показаны следующим образом:
Рисунок 1, Фигура 1-А: Соединение (Р-1) Са2+ и Sr2+ ионы.
Рисунок 1, Фигура 1-В: Соединение (Р-2) Са2+ и Sr2+ ионы.
Рисунок 2, Фигура 2-А: Соединение (Р-3) Са2+ и Sr2+ ионы.
Рисунок 2, Фигура 2-В: Декорпорол (XI) Са2+ и Sr2+ ионы.
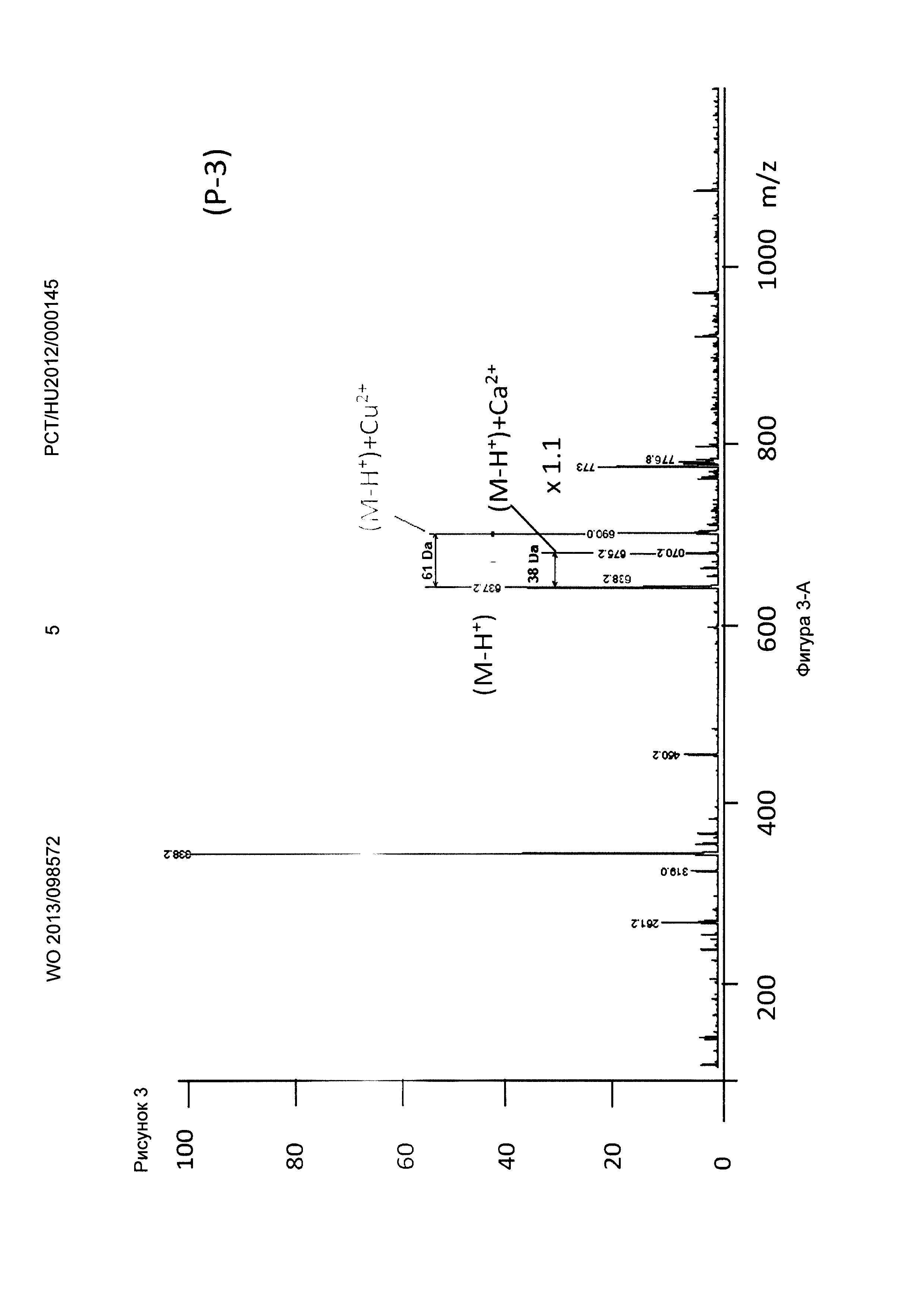
Рисунок 3, Фигура 3-А: Соединение (Р-3) Са2+ и Cu2+ ионы.
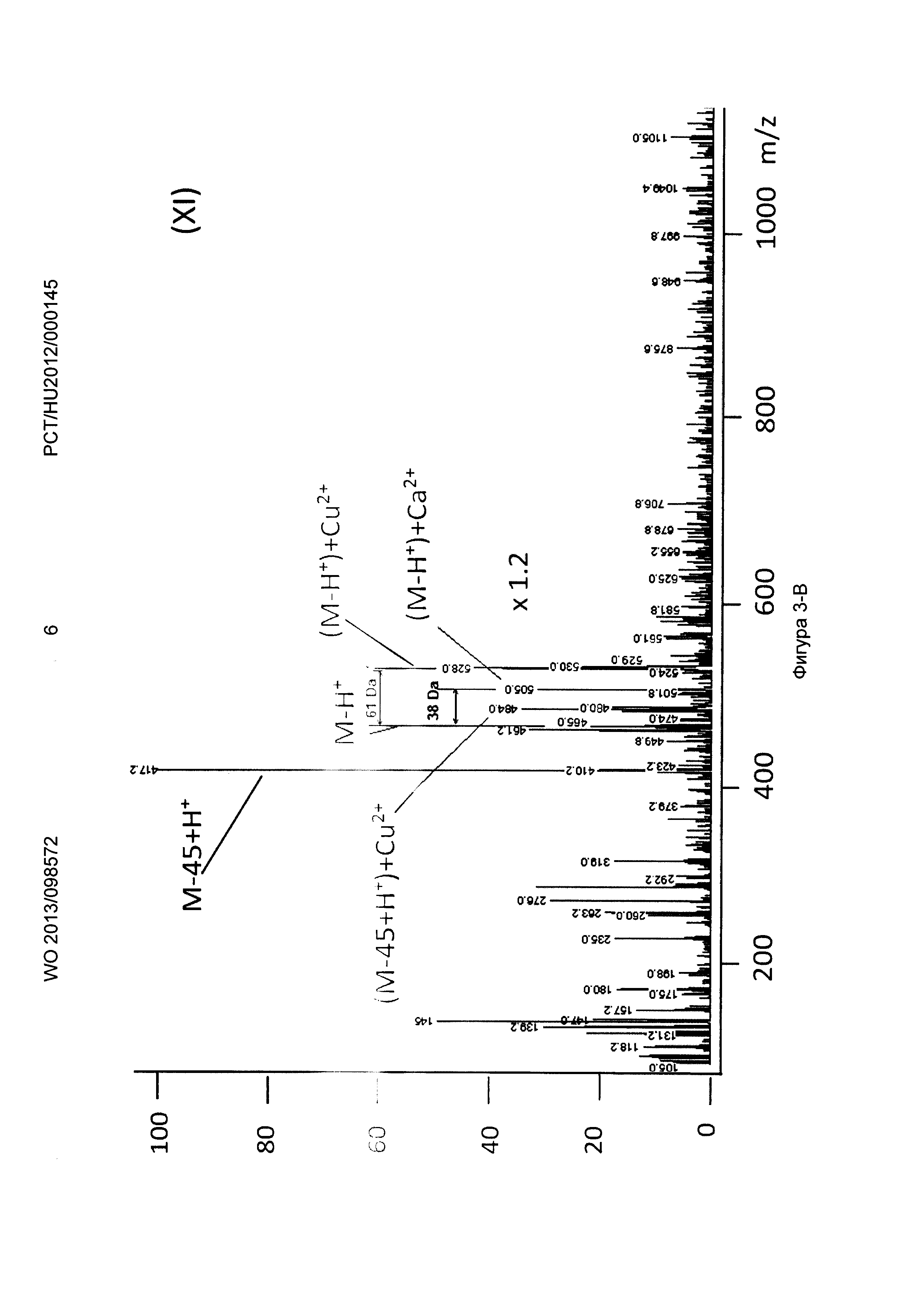
Рисунок 3, Фигура 3-В: Декорпорол (XI) Са2+ и Cu2+ ионы.
Рисунок 4, Фигура 4-А: Соединение (Р-3) Са2+ и Zn2+ ионы.
Рисунок 4, Фигура 4-В: Декорпорол (XI) Са2+ и Zn2+ ионы.
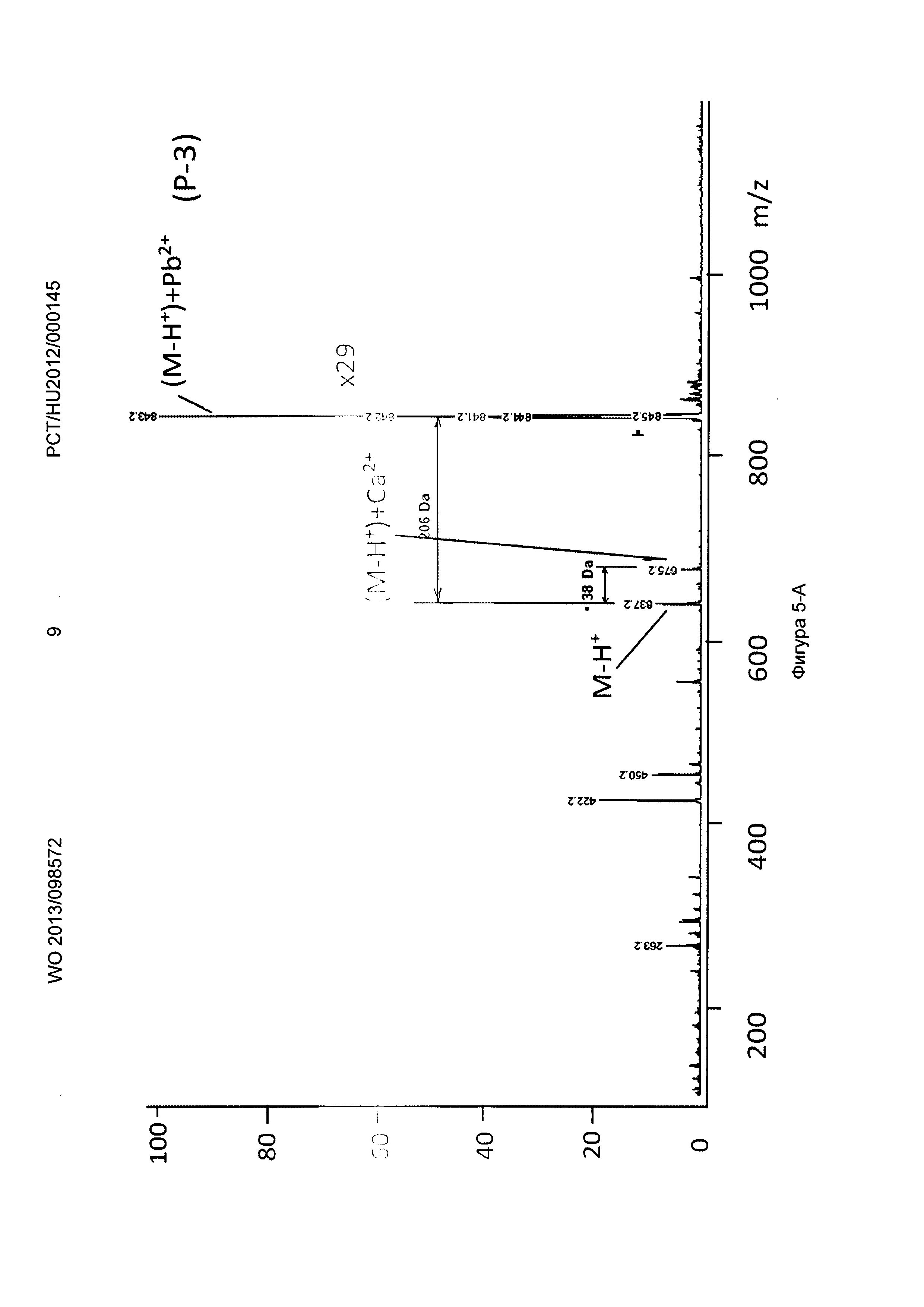
Рисунок 5, Фигура 5-А: Соединение (Р-3) молекула Са2+ и Pb2+ ионы.
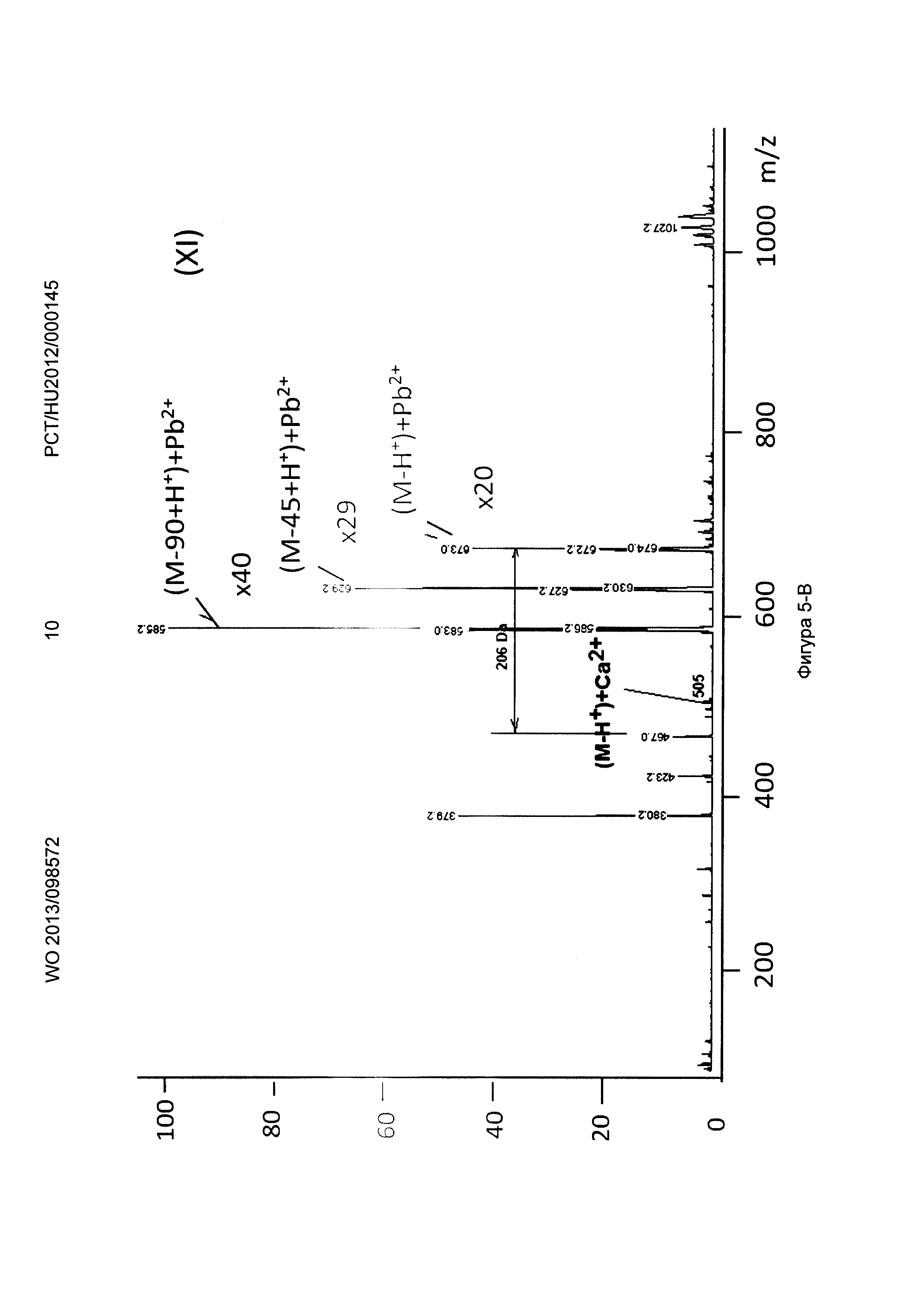
Рисунок 5, Фигура 5-В: Декорпорол (XI) Са2+ и Pb2+ ионы.
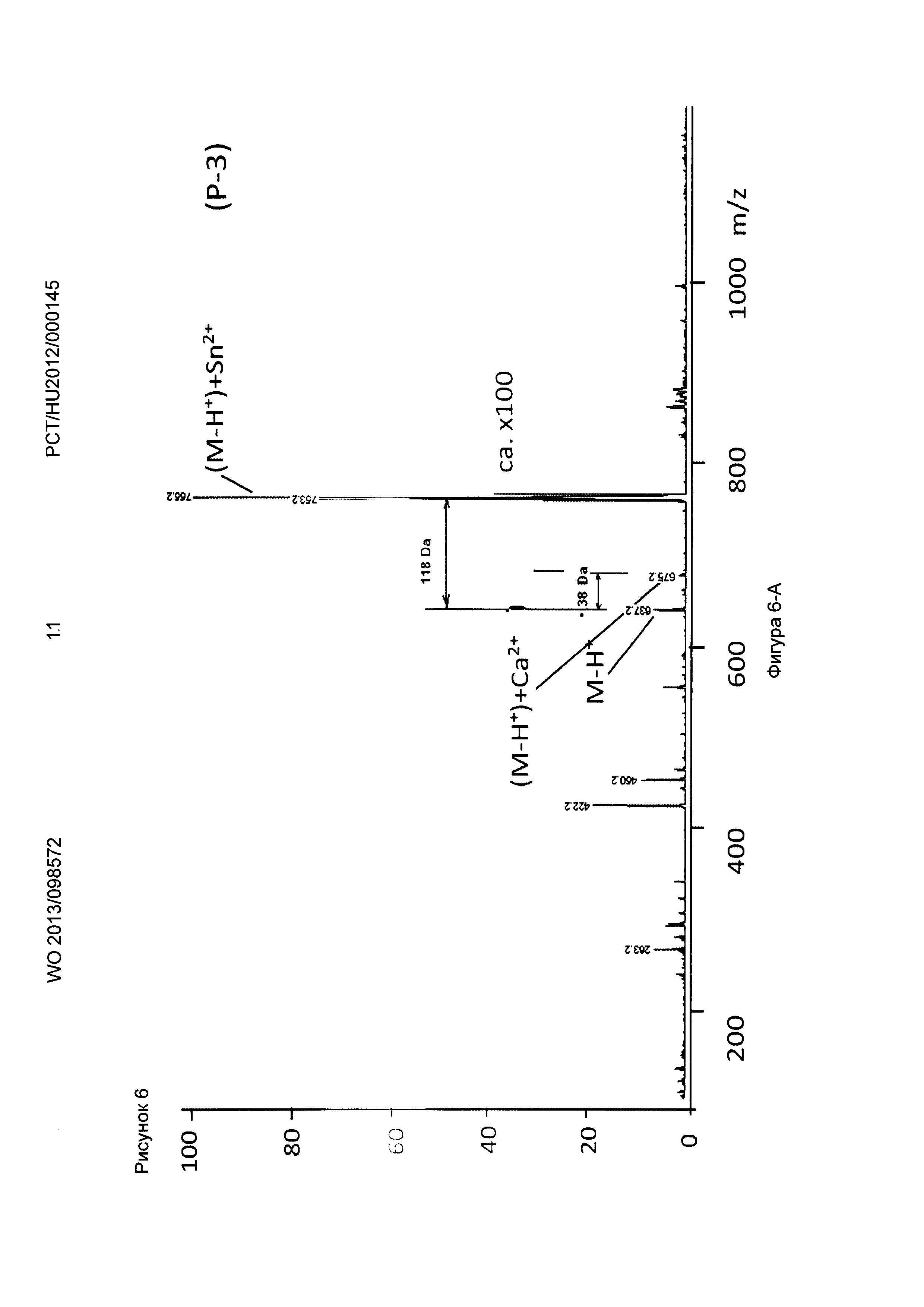
Рисунок 6, Фигура 6-А: Соединение (Р-3) Са2+ и Sn2+ ионы.
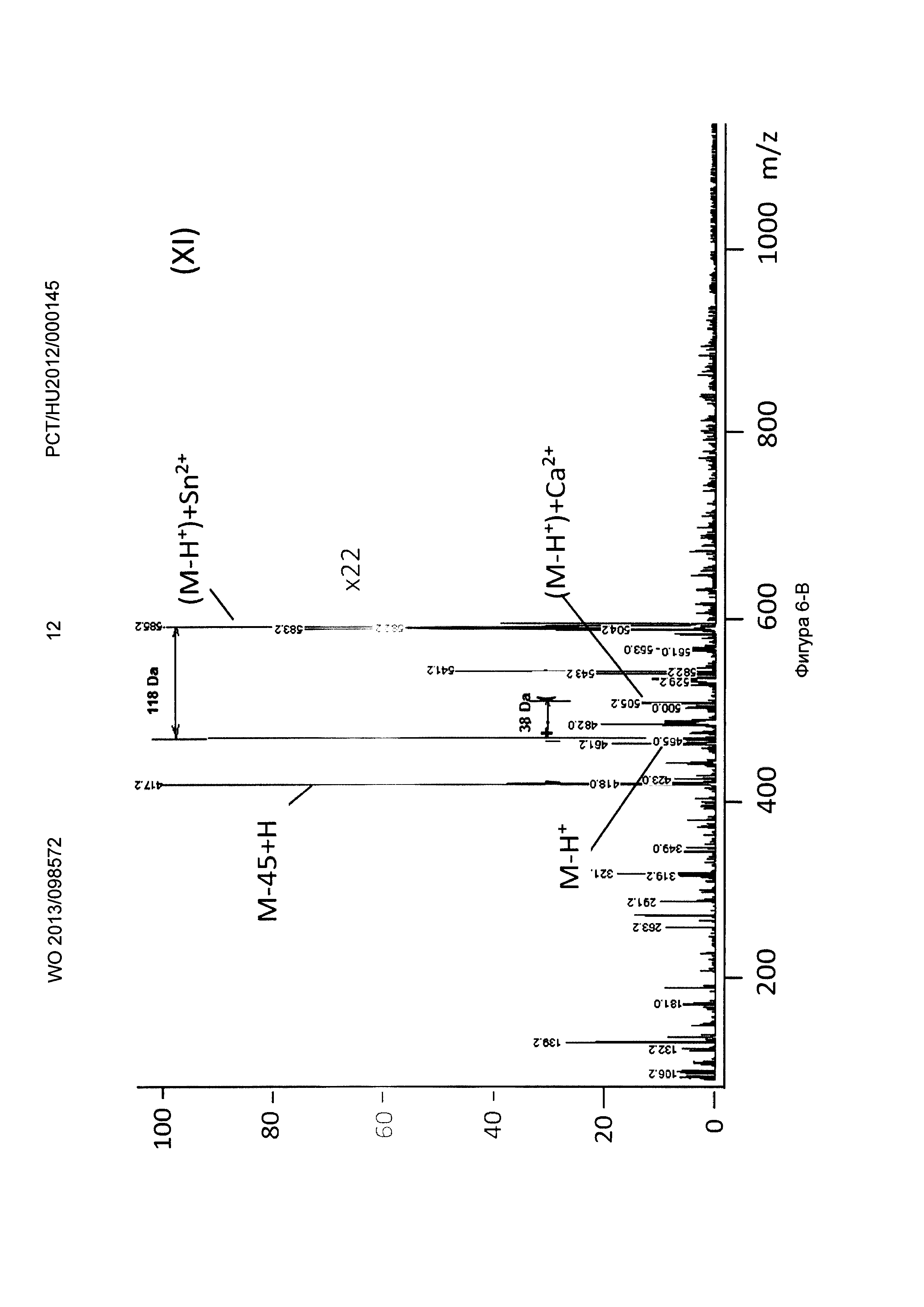
Рисунок 6, Фигура 6-В: Декорпорол (XI) Са2+ и Sn2+ ионы.
Рисунок 7, Фигура 7-А: Соединение (Р-3) Са2+ и Fe2+ ионы.
Получение и тестирование их, в частности, показано в примерах ниже, не ограничивая формул изобретения примерами.
Общие способы
Для того чтобы следить за ходом реакций и для аналитического исследования продуктов применяли ВЭЖХ устройство AGILENT 1200, которое было оборудовано кроме обычного УФ-детектора также AGILENT 6140 Quadrupol MS детектором (квадрупольная масс-спектрометрия). Структуры соединений были определены при помощи оборудования Bruker Avance 400 МГц ЯМР. Для очистки продукта применяли два различных способа. Соединения, полученные в большем количестве и имеющие защитные группы, очищали с помощью автоматизированной флэш-хроматографии на колонке, содержащей 120 г обычного силикагеля (Кизельгель 60 (Kiesel gel 60); 0,063-0,100 мМ). Образец выпаривали на поверхности силикагеля, имеющего объем в три раза выше, чем объем соединения с применением дихлорметана. В ходе процесса скорость гептана и этилацетата, используемых в качестве элюента, была изменена в соответствии с заранее написанной программой градиента, которая отличалась от вещества к веществу. Для обнаружения применяли УФ-детектор. Для очистки конечных промежуточных соединений применяли препаративную ВЭЖХ, снабженную УФ-детектором, и примененная 250×50 мм колонка ВЭЖХ была заполнена наполнителем с обращенной фазой 10 мкм Phenomenex GEMINI.
Препаративные примеры:
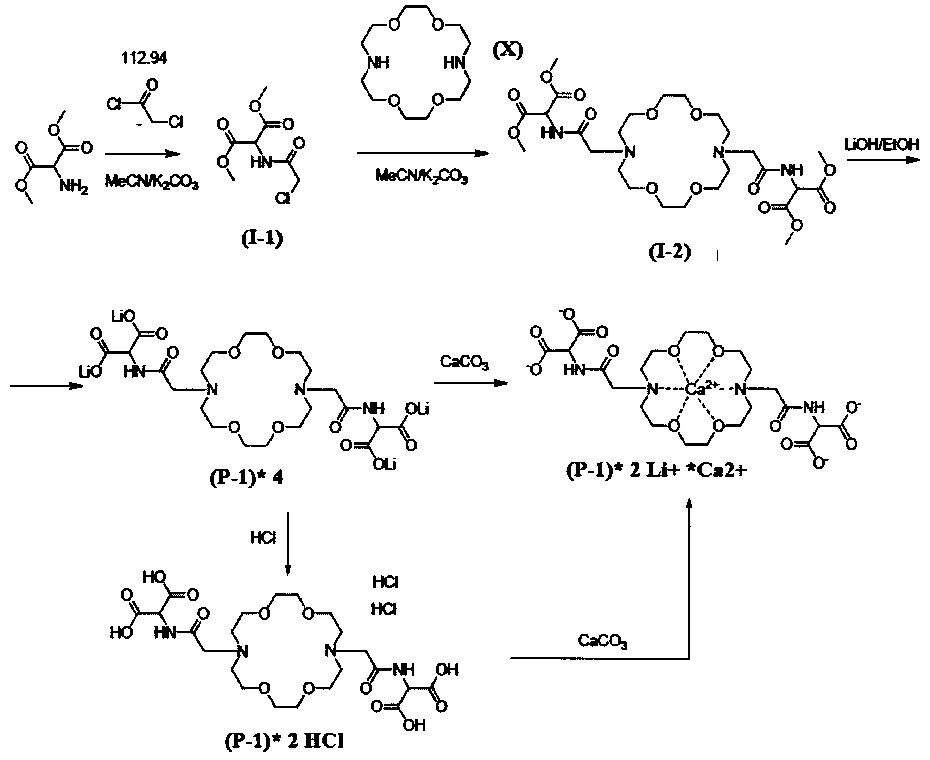
Путь синтеза А
Пример А. 1.
Получение диметилового эфира 2-(2-хлор-ацетиламино)-малоновой кислоты (I-1) (общая Формула II/А)
В 200 мл ацетонитрила суспендировали 18,3 г диметиламиномалонат гидрохлорида в присутствии 20,58 мл триэтиламина, по каплям добавляли 12,07 мл хлорацетилхлорида в течение 10 минут при интенсивном перемешивании. Смесь перемешивали в течение дополнительных десяти минут, затем выпаривали и растворяли в смеси этилацетата (300 мл) и насыщенного раствора карбоната натрия (100 мл). Органическую фазу промывали один раз 100 мл насыщенного раствора карбоната натрия, затем дважды 50 мл насыщенного раствора хлорида натрия, затем сушили над сульфатом магния, фильтровали, промывали этилацетатом и упаривали в вакууме. Продукт 21,1 г (белый кристаллический продукт, 90,1%).
Пример А. 2.
Получение диметилового эфира 2-[2-(16-{[(бис-метоксикарбонил-метил)-карбамоил]-метил}-1,4,10,13-тетраокса-7,16-диаза-циклооктадек-7-ил)-аиетиламино]-малоновой кислоты (I-2) (Общая Формула VII)
В 150 мл ацетонитрила суспендировали 5,0 г криптофикса (X), 10,46 г диметилового эфира 2-(2-хлор-ацетиламино) малоновой кислоты (I-1) и 5,26 г карбоната калия и выдерживали при интенсивном перемешивании в течение 3 дней при 80°С. Ход реакции контролировали с помощью ВЭЖХ-МС (HPLC-MS). После того, как степень конверсии достигла 70%, реакционную смесь упаривали и растворяли в смеси 200 мл этилацетата и 60 мл насыщенного раствора карбоната калия. Органическую фазу промывали один раз 60 мл насыщенного раствора карбоната натрия, а затем 50 мл насыщенного раствора хлорида натрия, затем сушили над сульфатом магния, фильтровали, промывали этилацетатом и упаривали в вакууме. Получали 16 г сырого продукта. Сырой продукт очищали на силикагеле со смесью дихлорметан: метанол (DCM:MeOH). Полученный продукт 5,2 г (белое масло, 40,4%).
Пример А. 3.
Получение тетралитиевой соли 2-(2-{16-[(дикарбоксиметил-карбамоил)-метил]-1,4,10,13-тетраокса-7,16-диаза-циклооктадек-7-ил}-ацетиламино)-малоновой кислоты / (Р-1)* 4 Li+/ (Общая Формула I)
В 50 мл метанола суспендировали 5,0 г соединения формулы (1-2), полученного согласно примеру А. 2., и 1,49 г LiOH при интенсивном перемешивании и выдерживали при 68°С в течение часа. Ход реакции контролировали с помощью ВЭЖХ-МС. Реакционную смесь выпаривали и остаток суспендировали в эфире и фильтровали. Получали 4,5 г продукт (сырой продукт коричневого цвета). Сырой продукт очищали препаративной ВЭЖХ в смеси MeCN:вода. Полученный раствор лиофилизировали. Таким образом получали 3,9 г указанного продукта (грязно-белый продукт, 70%).
Пример А. 4.
Получение дилитий кальциевой соли 2-(2-{16-[(дикарбоксиметил-карбамоил)-метил]-1,4,10,13-тетраокса-7,16-диаза-циклооктадек-7-ил}-аиетиламино)-малоновой кислоты / (Р-1)*2 Li+*Са2+ / (Общая формула I)
В 50 мл метанола суспендировали 3,0 г соединения формулы /(Р-1)*4 Li /, полученного согласно примеру А. 3., и 2,48 г карбоната кальция и выдерживали при 50°С при интенсивном перемешивании в течение часа. Продукт отфильтровывали и сушили. Получали 3,6 г продукта (коричневый, 90%).
Пример А. 5.
Получение дигидрохлоридной соли 2-(2-{16-[(дикаобоксиметил-карбамоил)-метил]-1,4,10,13-тетраокса-7,16-диаза-циклооктадек-7-ил}-ацетиламино)- малоновой кислоты / (Р-1)*2 HCl / (Общая Формула I)
В 20 мл эфира суспендировали 1,2 г соединения формулы / (Р-1)* 4 Li / полученного согласно примеру А. 3. и добавляли при интенсивном перемешивании 1,2 мл диоксана, содержащего HCl. Выпавший в осадок продукт отфильтровывали, промывали эфиром и сушили. Таким образом, получали 1,2 г указанного сильно гигроскопичного продукта (выход: 85%).
Пример А. 6.
Получение дикальциевой соли 2-(2-{16-[(дикарбоксиметил-карбамоил)-метил]-1,4,10,13-тетраокса-7,16-диаза-циклооктадек-7-ил}-ацетиламино)-малоновой кислоты / (Р-1)*2 Са2+*/ (Общая Формула (I))
В 10 мл метанола суспендировали 0,4 г дигидрохлоридной соли /(Р-1) * 2 HCl/, полученного согласно примеру А. 5., и 0,5 г карбоната кальция и выдерживали при 50°С в течение часа при интенсивном перемешивании.
Выпавший в осадок продукт отфильтровывали, промывали эфиром и сушили. Таким образом, получали 0,6 г указанного грязно-белого кристаллического продукта.
Применяя аналогичные синтезы мы получили следующие производные с следующими выходами
Путь синтеза В
Пример В. 1.
Получение трет-бутилового эфира (16-трет-бутоксикарбонилметил-1,4,10,13-тетраокса-7,16-диаза-циклооктадек-7-ил)-уксусной кислоты (I-7) (Общая Формула V)
В 150 мл ацетонитрила суспендировали 5,0 г криптофикса формулы (X), 8,18 г трет-бутилового эфира бромуксусной кислоты и 5,26 г карбоната калия и затем выдерживали при 80°С в течение 2 дней при интенсивном перемешивании. Ход реакции контролировали с помощью ВЭЖХ-МС. После того, как степень превращения достигла 100%, реакционную смесь выпаривали и растворяли в смеси 200 мл этилацетата и 60 мл насыщенного раствора карбоната натрия. Органическую фазу промывали один раз 60 мл насыщенного раствора карбоната натрия и 50 мл насыщенного раствора хлорида натрия, затем сушили над сульфатом натрия и фильтровали, промывали этилацетатом, затем упаривали в вакууме. Таким образом получали 6,6 г сырого продукта. Сырой продукт очищали на диоксиде кремния в смеси дихлорметан-метанол. Таким образом получали 5,6 г указанного белого масла. (Выход 60,2%).
Пример В. 2.
Получение дигидрохлорида (16-карбоксиметил-1,4,10,13-тетраокса-7,16-диаза- циклооктадек-7-ил)-уксусной кислоты / (I-8)*2HCl / (Общая формула VI)
В 70 мл дихлорметана (DCM) растворяли 5,6 г трет-бутилового производного формулы (I-7), полученного согласно примеру В. 1. и к раствору добавляли 50 мл трифторуксусной кислоты при интенсивном перемешивании. Смесь выдерживали при комнатной температуре в течение часа. Ход реакции контролировали с помощью ВЭЖХ-МС. После того, как степень превращения достигла 100%, реакционную смесь выпаривали досуха. Остаток разбавляли 100 мл воды и затем добавляли 5 мл 1Н раствора соляной кислоты, после чего лиофилизировали. Таким образом, получали 4,2 г указанного маслянистого продукта.
Пример В. 3.
Получение диэтилового эфира 2-[2-(16-{[(бис-этоксикарбонил-метил)-карбамоил]-метил}-1,4,10,13-тетраокса-7,16-диаза-ииклооктадек-7-ил)-ацетиламино]-малоновой кислоты (I-9) (Общая Формула VII)
В 20 мл диметилформамида растворяли 1,0 г соединения, полученного согласно примеру В. 2. / (I-8)*2HCl / и в присутствии 1,14 г диизопропил-этиламина к смеси добавляли 1,42 г N,N,Nʹ,Nʹ-тетраметил-O-(бензотриазол-1-ил) урония тетрафторбората (TBTU). После 30 минут перемешивания к смеси добавляли 0,85 г диэтил-1-аминомалоната формулы (I-4) и перемешивание продолжали еще в течение дня при комнатной температуре. Ход реакции контролировали с помощью ВЭЖХ-МС. После того, как преобразование достигло 80-90%, реакционную смесь упаривали и очищали препаративной ВЭЖХ, затем лиофилизировали. Таким образом получали 4,4 г указанного продукта.
ЯМР 1Н (ppm): 1,19 (OEt, 12Н, t, 7,0 Гц); 2,76 (NCH2, 8Н, t, 5,6 Гц); 3,20 (NCH2CO, 4Н, s); 3,53 (ОСН2, 16Н, m); 4,15 (OEt, 8Н, q, 7 Гц); 5,05 (СН, 2Н, d, 4 Гц); 8,42 (NH, 2Н, d, 4 Гц);
ВЭЖХ-МС (М+Н+): 693,1 Да
Пример В. 4.
Получение тетоалитиевой соли 2-(2-{16-[(дикарбоксиметил-карбамоил)-метил]-1,4,10,13-тетраокса-7,16-диаза-циклооктадек-7-ил}-ацетиламино)-малоновой кислоты / (Р-1)*4 Li+/ (Общая формула I)
В 20 мл этанола растворяли 0,6 г этилового эфира соединения формулы (I-9), полученного согласно примеру В. 3. и к раствору добавляли 0,16 г гидроксида лития и перемешивали в течение 30 минут при 40°С. Ход реакции контролировали с помощью ВЭЖХ-МС. Реакционную смесь упаривали, разбавляли водой, затем лиофилизировали. Таким образом получали 0,4 г указанного соединения.
ЯМР 1Н (ppm): 2,75 (NCH2, 8Н, m); 3,20 (NCH2CO, 4Н, s); 3,30 (ОСН2, 16Н, m); 4,84 (СН, 2Н, d, 4 Гц); 8,38 (NH, 2Н, d, 4 Гц);
ВЭЖХ-МС (М+Н+): 581,1 Да
Пример В. 5.
Получение ди-трет-бутилового эфира 2-(2-{16-[(1,2-бис-трет-бутоксикарбонил-этил карбамоил)-метил]-1,4,10,13-тетраокса-7,16-диаза-циклооктадек-7-ил}-ацетиламино)-янтарной кислоты (1-10) (Общая Формула VII)
В 20 мл диметилформамида растворяли 1,0 г соединения формулы / (I-8)*2HCl /, полученного согласно примеру В. 2. и в присутствии 1,14 г диизопропил-этиламина добавляли 1,42 г N,N,Nʹ,Nʹ-тетраметил-O-(бензотриазол-1-ил) урония тетрафторбората (TBTU). После 30 минут перемешивания добавляли 1,20 г ди-трет-бутил-аспартата формулы (I-5) и смесь перемешивали в течение дополнительного дня при комнатной температуре. Ход реакции контролировали с помощью ВЭЖХ-МС. После того, как преобразование достигло 80-90%, реакционную смесь очищали с помощью препаративной ВЭЖХ, затем лиофилизировали. Таким образом получали 120 мг указанного продукта.
ЯМР 1Н (ppm): 1,44 (tBu, 36Н, s); 2,65 (СН, 2Н, m); 2,75 (СН2, 8Н, m); 3,16 (NCH2C0, 4Н, s); 3,30 (ОСН2, 8Н, m); 3,54 (ОСН2, 8Н, m); 4,52 (СН2, 4Н, d); 8,20 (NH, 2Н, d, 4 Гц);
ВЭЖХ-МС(М+Н+): 833,1 Да
Пример В. 6.
Получение дигидрохлоридной соли 2-(2-{16-[(1,2-дикарбокси-этилкарбамоил)-метил]-1,4,10,13-тетраокса-7,16-диаза-циклооктадек-7-ил}-ацетиламино)-янтарной кислоты / (Р-2)*2HCl/ (Общая формула I)
В 5 мл дихлорметана растворяли 120 мг трет-бутилового эфира формулы (1-10), полученного согласно примеру В. 5., и добавляли 5 мл трифторуксусной кислоты, затем перемешивали в течение 30 минут. Ход реакции контролировали с помощью ВЭЖХ-МС. Реакционную смесь упаривали, разбавляли водой и добавляли 2 мл раствора 1 Н соляной кислоты, затем лиофилизировали. Таким образом получали 60 мг указанного соединения.
ЯМР 1Н (ppm): 2,65 (СН, 2Н, m);2,75 (СН2, 8Н, m); 3,30 (ОСН2, 12Н, m, перекрывается с водой); 3,54 (ОСН2, 8Н, m); 4,5 (СН2, 4Н, d); 8,10 (NH, 2Н, d, 4 Гц);
ВЭЖХ-МС (М+Н+): 609,1 Да
Пример В. 7.
Получение ди-трет-бутилового эфира 2-(2-{16-[(1,3-бис-трет-бутоксикарбонил-пропил каобамоил)-метил]-1,4,10,13-тетраокса-7,16-диаза-циклооктадек-7-ил}-ацетиламино) аспарагиновой кислоты (I-13) (Общая Формула VII)
В 20 мл диметилформамида растворяли 1,0 г соединения формулы / (I-8) * 2HCl /, полученного согласно примеру В. 2., и в присутствии 1,14 г диизопропил-этиламин добавляли 1,42 г N,N,Nʹ,Nʹ-тетраметил-О-(бензотриазол-1-ил) урония тетрафторбората (TBTU). После 30 минут перемешивания к смеси добавляли 1,26 г ди-трет-бутил-глютамината формулы (I-6) и перемешивали в течение одного дня при комнатной температуре. Ход реакции контролировали с помощью ВЭЖХ-МС.
После того, как преобразование достигало 80-90%, реакционную смесь очищали препаративной ВЭЖХ, затем лиофилизировали. Таким образом получали 800 мг названного продукта.
ЯМР 1Н (ppm): 1,44 (tBu, 36Н, s); 1,32 (СН2, 2Н, m); 1,97 (СН2, 2Н, m); 2,23 (СН, 2Н, m); 2,72 (СН2, 8Н, m); 3,11 (NCH2C0, 4Н, s); 3,30 (ОСН2, 8Н, m, под водой); 3,53 (ОСН2, 8Н, m); 4,18 (СН2, 2Н, m); 7,93 (NH, 2Н, d, 4 Гц);
ВЭЖХ-МС (М+Н+): 861,1 Да
Пример В. 8.
Получение дигидрохлоридной соли 2-(2-{16-[(1,3-дикарбокси-пропилкарбамоил)-метил]-1,4,10,13-тетраокса -7,16- диаза-циклооктадек-7-ил}-ацетиламино) глутаровой кислоты / (Р-3)*2HCl / (Общая Формула I)
В 5 мл дихлорметана растворяли 800 мг трет-бутилового эфира соединения формулы (I-13), полученного в соответствии с примером В. 7. и к смеси добавляли 5 мл трифторуксусной кислоты и перемешивали в течение 30 минут при комнатной температуре. Ход реакции контролировали с помощью ВЭЖХ-МС. Реакционную смесь упаривали, разбавляли водой и добавляли 2 мл 1 Н соляной кислоты, затем лиофилизировали. Таким образом получали 420 мг указанного соединения.
ЯМР 1Н (ppm): 1,34 (СН2, 2Н, m); 2,02 (СН2, 2Н, m); 2,23 (СН, 2Н, m); 3,1-3,5 (ОСН2, 24Н, m); 4,05 (СН2, 2Н, m); 8,00 (NH, 2Н, d, 4 Гц); 9,5; 13;
ВЭЖХ-МС (М+Н+): 637,0 Да
Путь синтеза С
Пример С. 1.
Получение дибензилового эфира 2-(2-{16-[(1.2-бис-бензилоксикарбонил-этилкарбамоил)-метил]-1,4,10,13-тетраокса-7,16-диаза-циклооктадек-7-ил}-ацетамино) янтарной кислоты (I-12) (Общая формула VII)
В 20 мл диметилформамида растворяли 1,0 г соединения формулы / (I-8)*2HCl /, полученного согласно примеру В. 2., и в присутствии 1,14 г диизопропил-этиламин добавляли 1,42 г N,N,Nʹ,Nʹ-тетраметил-О-(бензотриазол-1-ил) урония тетрафторборат (TBTU). После 30 минут перемешивания добавляли 1,56 г дибензил-аспартат тозилатной соли формулы (I-11), и смесь перемешивали в течение одного дня при комнатной температуре. Ход реакции контролировали с помощью ВЭЖХ-МС. После того, как преобразование достигало 80-90%, реакционную смесь очищали препаративной ВЭЖХ, а затем лиофилизировали. Таким образом получали 110 мг указанного соединения.
ЯМР 1Н (ppm): 2,54 (СН, 2Н, m, ДМСО); 2,75 (СН2, 8Н, m); 3,16 (NCH2CO, 4Н, s); 3,30 (ОСН2, 8Н, m, также вода); 3,50 (ОСН2, 8Н, m); 4,50 (СН2, 4Н, d); 7,41 (Ph, 20h, m); 8,20 (NH, 2Н, d, 4 ГЦ);
ВЭЖХ-МС (М+Н+): 970,2 Да
Пример С. 2.
Получение 2-(2-{16-[(1,2-дикарбокси-этил карбамоил)-метил]-1,4,10,13-тетраокса-7,16-диаза-циклооктадек-7-ил}-ацетиламино)-янтарной кислоты (Р-2) (Общая Формула I)
В 10 мл этанола растворяли 110 мг бензилового эфира соединения формулы (I-12), полученного в соответствии с примером С. 1., и к смеси добавляли 50 мг Pd (С). Смесь перемешивали в течение 18 часов при давлении 4 бар водорода при комнатной температуре. Ход реакции контролировали с помощью ВЭЖХ-МС. Реакционную смесь выпаривали. Таким образом получали 100 мг указанных соединений.
ЯМР 1Н (ppm): 2,65 (СН, 2Н, m); 2,75 (СН2, 8Н, m); 3,30 (ОСН2, 12Н, m, перекрывается с водой); 3,54 (ОСН2, 8Н, m); 4,5 (СН2, 4Н, d); 8,10 (NH, 2Н, d, 4 Гц);
ВЭЖХ-МС (М+Н+): 609,1 Да
Пример С. 3.
Получение дибензилового эфира 2-(2-{16-[(1,3-бис-бензилоксикарбонил-пропилкарбамоил)-метил]-1,4,10,13-тетраокса-7,16-диаза-циклооктадек-7-ил}-ацетиламино)-глутаровой кислоты (I-15) (Общая формула VII)
В 20 мл диметилформамида растворяли 1,0 г соединения формулы / (I-8)*2HCl /, полученного согласно примеру В.2., и в присутствии 1,14 г диизопропил-этиламина к смеси добавляли 1,42 г N,N,Nʹ,Nʹ-тетраметил-О-(бензотриазол-1-ил) урония тетрафторбората (TBTU). После 30 минут перемешивания добавляли 1,6 г дибензил-глутаминовой кислоты тозилатной соли формулы (I-14) и смесь перемешивали в течение одного дополнительного дня. Ход реакции контролировали с помощью ВЭЖХ-МС. После того, как преобразование достигало 80-90%, реакционную смесь очищали препаративной ВЭЖХ, затем лиофилизировали. Таким образом получали 800 мг указанного соединения.
ЯМР 1Н (ppm): 1,82 (СН2, 2Н, m); 2,12 (СН2, 2Н, m); 2,50 (СН, 2Н, m, ДМСО); 3,2-3,5 (24Н, вода); 4,12 (СН2, 2Н, m); 4,44 (СН2, 2Н, m);7,41 (Ph, 20h, m); 8,00 (NH, 2Н, d, 4 Гц);
ВЭЖХ-МС (М+Н+): 998,2 Да
Пример С. 4.
Получение 2-(2-{16-[(1,3-дикарбокси-пропилкарбамоил)-метил]-1,4,10,13-тетраокса-7,16-диаза-циклооктадек-7-ил}-ацетиламино)-пентадиоевой кислоты (Р-3) (Общая Формула I)
В 5 мл дихлорметана растворяли 800 мг бензилового эфира соединения формулы (I-15), полученного согласно примеру С. 3., и к смеси добавляли 5 мл трифторуксусной кислоты, затем перемешивали в течение 30 минут при комнатной температуре. Ход реакции контролировали с помощью ВЭЖХ-МС. Реакционную смесь упаривали, разбавляли водой и добавляли 2 мл 1 Н соляной кислоты, затем лиофилизировали. Таким образом, получали 500 мг указанного соединения.
ЯМР 1Н (ppm): 1,34 (СН2, 2Н, m); 2,02 (СН2, 2Н, m); 2,23 (СН, 2Н, m); 3,1-3,5 (ОСН2, 24Н, m, вода); 4,05 (СН2, 2Н, m); 8,00 (NH, 2Н, d, 4 Гц); 9,5; 13;
ВЭЖХ-MS (М+Н+): 637,0 Да
Аналитические испытания
Измерение селективности к металлу
Несколько различных способов были безуспешно опробованы для измерения комплексообразующей способности иона Са и иона Sr и соотношения между ними. По данным информационных материалов электрод, селективный для Sr не селективен для Са. Мы не смогли найти различий между Са и Sr комплексами, используя 1Н and 13С спектры. Так как Са и Sr ядра не являются ЯМР активными, то это нельзя проверить.
Измерение Ca-Sr ионоселективности было выполнено на Agilent 6140 Octapol MS (масс-спектрометр), снабженном Agilent 1200 ВЭЖХ. Ионизацию осуществляли с помощью оборудования для ионизации распылением в электрическом поле (ESI, MM-FS) для мягкой ионизации с положительной детекцией. Применяемая напряженность поля составляла 10000 В, температура спрея 220°С, фрагментор (Fragmentor): 70; Порог: 500, величина шага 0,2 Да; время задержки переключения ионизации (Ionization Switch Delay): О мс; время задержки переключения полярности (Polarity Switch Delay): 300 мс; Усиление: 1:0; интервал масс: 100-1200 Да. Был применен газообразный азот. Эти параметры были получены путем оптимизации. Применяемая ВЭЖХ колонка представляла собой WATERS ACQUITY UPLC колонку длиной 30 мм с внутренним диаметром 2,1 мм и наполнителем С18 (размер 1,8 мкм). Количество инъецируемых образцов изменялось от 2 до 10 мкл. Элюенты, примененные из-за соответствующей ионизации, были следующими:
Элюент А: 0,395 г NH4HC03, растворенного в 1 л воды +50 мл MeCN.
Элюент В: MeCN
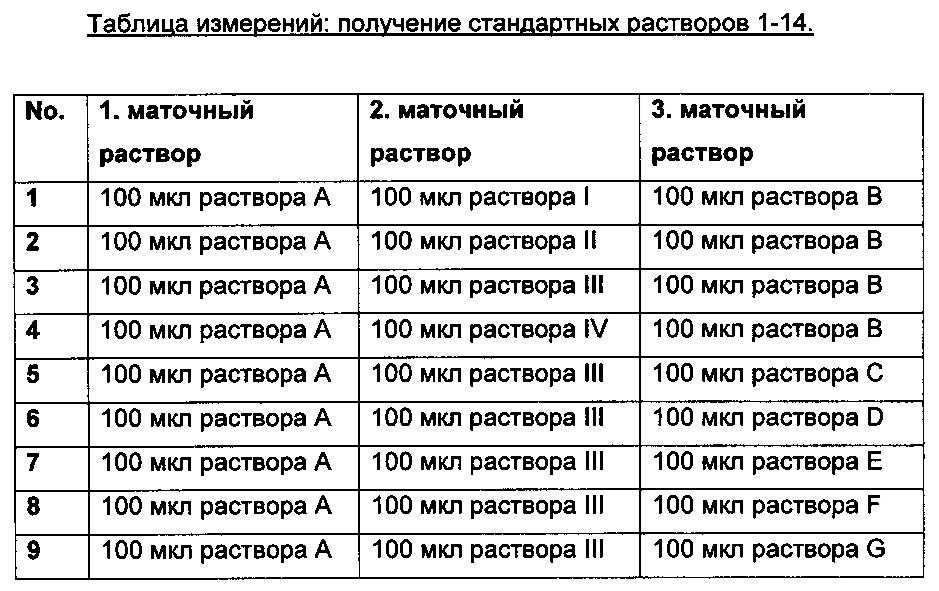
Составы примененных маточных растворов
Раствор А: 0,1 М Са ионный маточный раствор: 222,1 мг (2 ммоль) безводного CaCl2 растворяют в 20 мл дистиллированной воды.
Раствор В: 0,1 М Sr ионный маточный раствор: 533,5 мг (2 ммоль) SrCl2⋅6H2O растворяют в 20 мл дистиллированной воды.
Раствор С: 0,1 М Cu ионный маточный раствор: 500,0 мг (2 ммоль) CuSO4⋅5H2O растворяют в 20 мл дистиллированной воды.
Раствор D: 0,1 М Zn ионный маточный раствор: 272,5 мг (2 ммоль) ZnCl2 растворяют в 20 мл дистиллированной воды.
Раствор Е: 0,1 М Sn ионный маточный раствор: 379,6 мг (2 ммоль) SnCl2 растворяют в 20 мл дистиллированной воды.
Раствор F: 0,1 М Pb ионный маточный раствор: 217,0 мг (2 ммоль) Pb(OOCCF3)2 растворяют в 5 мл дистиллированной воды.
Раствор G: 0,1 М Fe ионный маточный раствор: 360,0 мг (2 ммоль) Fe(NO3)2 растворяют в 20 мл дистиллированной воды.
Из соединений по настоящему изобретению тестировали следующие соединения:
2-(2-{16-[(дикарбоксиметил-карбамоил)-метил]-1,4,10,13-тетраокси-7,16-диаза-циклооктадек-7-ил}-ацетамино)-малоновой кислоты тетралитиевая соль / (P-1)*4Li+ /: В аналитической части ее называют здесь и далее (Р-1). Соль (Р-1)*4Li+ получали согласно примеру В. 4.
2-(2-{16-[(1,2-дикарбокси-этилкарбамоил)-метил]-1,4,10,13-тетраокси-7,16-диаза-циклооктадек-7-ил}-ацетиламино)-янтарная кислота (Р-2), полученная согласно примеру С. 2.
2-(2-{16-[(1,3-дикарбокси-пропилкарбамоил)-метил]-1,4,10,13-тетраокси-7,16-диаза-циклооктадек-7-ил}-ацетиламино)-пентадиоевая кислота (Р-3), полученная согласно примеру С. 4.
Кроме того, декорпорол формулы (XI) был проверен как стандарт.
Раствор I: 1. Комплексообразующий маточный раствор (1,5 мМ): 2,1 мг соединения / (P-1)*4Li+ /: (3.01 мкмоль) растворяли в 2 мл дистиллированной воды.
Раствор II: 2. Комплексообразующий маточный раствор (1,5 мМ): 2,0 мг соединения (Р-2) (2,89 мкмоль) растворяли в 2 мл дистиллированной воды.
Раствор III: 3. Комплексообразующий маточный раствор (1,5 мМ): 2,2 мг соединения (Р-3) (3,10 мкмоль) растворяли в 2 мл дистиллированной воды.
Раствор IV: 4. Комплексообразующий маточный раствор (1,5 мМ; декорпорол, LB-145 / формулы (XI) /: 2,0 мг соединения LB-145 (3,4 мкмоль) растворяли в 2 мл дистиллированной воды.
Получение стандартных растворов
100 мкл маточного раствора А и 100 мкл растворов I, II, III или IV добавляли к 100 мкл раствора B-G в соответствии с Таблицей ниже и количество таким образом полученных образцов доводили до 1 мл, затем инъецировали в ВЭЖХ.

Результаты масс-спектрометрических измерений
Новые соединения, кроме декорпорола, выходили с фронтом на ВЭЖХ-хроматограмме (t0=0,5-0,6 минут, нет задержки), но этот факт не влиял на результаты масс-спектрометрических тестов. Минимальное время задержки 0,75 минут было зарегистрировано в тестах с декорпоролом. Мы регистрировали свободное комплексообразующее соединение (М+Н+ DA), аддитивный продукт кальция (М-Н++38 Да) и стронциевый комплекс (М-Н++86 Да) в каждом случае. Из-за очень схожих химических свойств иона Са и иона стронция мы предположили, что они одинаково ведут себя в процессе ионизации, таким образом мы определили селективность по сравнению с ионом Са с помощью отношения средних масс-спектрометрических сигналов аддитивного продукта Са к аддитивного продукта Sr. В случае измерений ионов физиологически важных и токсичных металлов применяли соединение формулы (Р-3). Сигнал соответствующего аддитивного продукта иона металла всегда был хорошо отделен от сигнала материнского соединения и от сигнала аддитивного продукта Са.
Применяя декорпорол (XI) и его аддитивные продукты, мы детектировали существенное декарбоксилирование (М-45+Н+) продуктов и в некоторых случаях мы детектировали двойные декарбоксилированные производные (М-90+Н+) тоже. Этот процесс хорошо известен и приводит к медленной деградации декорпорола. Монодекарбоксилированные и двойные-декарбоксилированные производные являются основными загрязнителями декорпорола и обладают очень плохой растворимостью в воде, таким образом при определенной концентрации комплексы могут выпадать в осадок.
Соединения по настоящему изобретению связывают ион стронция сильнее, чем декорпорол. Самым сильным было соединение формулы (Р-3), самым слабым - соединение формулы (Р-1). Соединение формулы (Р-3) не связывало важные ионы Zn и Fe, и связывало ион Cu немного сильнее, чем ион Са. Соединение формулы (Р-3) связывает рассматриваемые токсичные ионы металлов Sn и Рb очень сильно. Это очень важный результат, потому что новые соединения могут выводить ионы токсичных металлов из организма очень эффективно, в то же время не выводя физиологически важные ионы. Эффект декорпорола был таким же, с двумя исключениями. Хорошее связывание было выявлено только один раз в случае иона Zn, что является результатом подобной структуры для ЭДТА. Декорпорол связывает ион Сu немного сильнее, чем соединение формулы (Р-3), но эта разница не является существенной. Однако нужно заметить, что в случае иона Pb существует очень сильный декарбоксилирующий процесс. В масс-спектрометрических тестах не только сигнал монодекарбоксилированного производного, но и сигнал дважды-декарбоксилированного производного были выше, чем сигнал комплекса декорпорол-Pb. Возможно это является результатом влияния кислоты Льюиса на ион Pb и таким образом это тоже может приводить к существенной декомпозиции при физиологических условиях.
Таблица X. Способность связывать ион Sr для комплексообразующих соединений (Р-1), (Р-2), (Р-3) и декорпорола

Таблица X. Ионосвязывающая способность соединения (Р-3) и декорпорола

Выводы:
1. Комплексообразующие соединения формул (Р-1), (Р-2) и (Р-3) связывают ион Sr сильнее, чем ион Са.
2. Комплексообразующие соединения формул (Р-2) и (Р-3) связывают ион Sr сильнее, чем Декорпорол.
3. Сигналы МС свободных комплексообразующих соединений (Р-1), (Р-2) и (Р-3) были существенно ниже, чем сигналы соответствующих Sr комплексов. Соотношение было хуже всего в случае декорпорола, что указывает на его худшую комплексообразующую способность.
4. Декарбоксилирование декорпорола, которое происходило даже при нормальных обстоятельствах, ухудшает его комплексообразующую способность. Подобный декарбоксилирующий процесс невозможен в случае комплексообразующих соединений формул (Р-1), (Р-2) и (Р-3) из-за химической структуры.
5. Комплексообразующее соединение (Р-3) связывает рассмотренные токсические металлы (Sr2+, Sn2+, Pd2+), затем физиологически важные металлы (Zn2+, Fe2+, Са2+). Декорпорол обладает сходной способностью, исключая то, что он связывает важный ион Zn сильнее, чем Са, что может быть опасным.
6. Комплексообразующие соединения формулы (Р-3) слабо связывают ион Сu2+, лучше, чем ион Са, что возможно не подвергает опасности запас иона Сu в организме, но соединение формулы (Р-3) может быть пригодно для выведения избыточного количества иона Сu в случае отравления.
7. Метаболические свойства комплексообразующих соединений (Р-1), (Р-2) и (Р-3) гораздо лучше, потому что в случае частичного или полного расщепления боковых цепей образуются аминокислоты, уже присутствующие в организме.
8. Из-за полярных функциональных групп растворимость комплексообразующих соединений формулы (Р-1), (Р-2) и (Р-3) лучше, чем растворимость декорпорола.
Реферат
Настоящее изобретение относится к соединениям, образующим комплексы, общей формулы,а также их применению и получению. Технический результат: получены новые соединения формулы (I), а также их комплексы, которые могут применяться для получения фармацевтической композиции для профилактики и лечения отравления стронцием, оловом или свинцом. 9 н. и 4 з.п. ф-лы, 9 табл., 18 пр., 13 ил.
Формула
Документы, цитированные в отчёте о поиске
Производные 1,4,10,13-тетраокса-7,16-диазациклооктадекана, обладающие свойством выводить радиоактивные изотопы из живого организма, и фармацевтическая композиция для выведения из организма радиоактивных изотопов
Способ получения соли 1, 4, 10, 13-тетраокса-7,16-диазациклооктадекан-n,n'-дималоновой кислоты

Комментарии