Соединения на основе платины и липидов и наночастицы - RU2679896C2
Код документа: RU2679896C2
Чертежи









Описание
Родственные заявки
[0001] По этой заявке испрашивается приоритет по одному или нескольким 35 U.S.C. § 119(a)-119(d) заявки на патент Индии № 1781/DEL/2013, поданной 14 июня 2013, полностью включенной в настоящее описание в качестве ссылки.
Область техники
[0002] Настоящее раскрытие относится к области нанотехнологии и терапий рака. В частности, настоящее раскрытие относится к соединениям на основе платины, включающим платиновую часть, линкерную часть и липидную часть, и их соответствующим наночастицам. Раскрытие также относится к синтезу указанных соединений на основе платины и наночастиц и композициям, включающим указанные соединения на основе платины/наночастицы. Раскрытие также относится к способам лечения рака путем использования указанных соединений на основе платины, наночастиц и композиций.
Уровень техники
[0003] Использование нанотехнологии при раке представляет явление всемирного масштаба. Хотя имеется несколько сообщений о наночастицах в терапии рака, но во всех случаях имеются различные недостатки, такие как токсичность, неблагоприятная кинетика высвобождения лекарственного средства, низкая устойчивость в кровотоке и так далее.
[0004] Липидные наночастицы (например, доксил - пегилированная липосомная композиция гидрохлорида доксорубицина) и наночастицы комплексов альбумина (например, абраксан - комплекс паклитаксела и альбумина) используют для людей, и показано, что они имеют улучшенный профиль системной токсичности и облегчают решение некоторых проблем композиций (Ferrari M., Nature Rev. Cancer, 2005, 5: 161). Химиотерапевтические средства на основе платины используют как первоочередную терапию более чем при 70% всех онкозаболеваний. Цисплатин испытывает быстрое образование цис-[Pt(NH3)2Cl(OH2)]+ и цис-[Pt(NH3)2(OH2)]2+, приводящее к нефротоксичности. Далее, гидратация как карбоплатина, так и оксалиплатина происходит существенно медленнее, что приводит к пониженной эффективности. В последнее время имеет место существенный прогресс, когда Dhar et al. (PNAS, 2008, 105, 17356) получили комплекс платины (IV) (c,t,c-[Pt(NH3)2(O2CCH2CH2CH2CH2CH3)2Cl2], который является достаточно гидрофобным для инкапсуляции в наночастицах PLGA-b-PEG. Однако в таком случае пролекарство должно процессироваться в цисплатин внутриклеточно. Кроме того, другие стратегии, основанные на конъюгации платины с полимерами (например, комплекс дендримера полиамидоамина и платины), приводят к 200-550-кратному снижению токсичности по сравнению со свободным цисплатином. Это является результатом сильных связей, образовавшихся между полимером и платиной (J. Pharm. Sci., 2009, 98, 2299). Другим примером является AP5280 - платина, связанная с сополимером N-(2-гидроксипропил)метакриламида, который менее эффективен, чем карбоплатин. В данном случае платина удерживается хелатообразователем аминомалоновой кислотой, соединенной с COOH-концом глицина тетрапептидного спейсера (Clin. Can. Res., 2004, 10, 3386; Eur. J. Can., 2004, 40, 291).
[0005] Далее, в WO 2010/091192 A2 (Sengupta et al.) раскрыты наночастицы биосовместимого конъюгированного полимера, включающего главную цепь сополимера, множество боковых цепей, ковалентно связанных с указанной главной цепью, и множество соединений платины, диссоциированно соединенных с указанной главной цепью. Раскрытие также относится к дикарбониллипидным соединениям, в которых соединение платины диссоциированно соединено с дикарбонильным соединением.
[0006] Однако с наночастицами, используемыми в настоящее время, связаны различные недостатки. Настоящее раскрытие способствует преодолению недостатков уровня техники и относится к устойчивым, эффективным и безопасным наночастицам в химиотерапии рака.
Сущность изобретения
[0007] В одном аспекте раскрытие относится к соединению, включающему (a) платиновую часть и (b) липид, соединенный с указанной платиновой частью. В некоторых вариантах осуществления соединение имеет формулу (VIII)
Q-линкер-липид (VIII),
где
Q представляет собой часть, содержащую платину, и линкер имеет по меньшей мере одну связь с атомом платины.
[0008] Раскрытие также относится к способу получения молекул Pt-липид, раскрытых в настоящем описании. Соответственно, в одном аспекте раскрытие относится к способу получения соединения, включающего (а) платиновую часть и липид, соединенный с указанной платиновой частью, включающему конъюгацию липида с платиновой частью для получения указанного соединения.
[0009] Раскрытие также относится к частицам, таким как наночастицы, включающим одну или несколько молекул Pt-липид, раскрытых в настоящем описании. Таким образом, в одном аспекте раскрытие относится к частице, например, но без ограничения, наночастице, включающей соединение на основе платины, при этом соединение на основе платины включает (а) платиновую часть и (b) липид, соединенный с указанной платиновой частью.
[0010] Раскрытие также относится к фармацевтической композиции, включающей соединение, раскрытое выше, или наночастицу, раскрытую выше, или их комбинацию, вместе с фармацевтически приемлемым эксципиентом; и способу устранения или лечения рака, причем указанный способ включает стадию введения пациентпациенту соединения, раскрытого выше, или наночастицы, раскрытой выше, или композиции, раскрытой выше.
Краткое описание чертежей
[0011] Для того, чтобы изобретение можно было легко понять и использовать на практике, далее будет сделана ссылка на примеры вариантов осуществления, которые иллюстрируются путем обращения к прилагаемым фигурам. Фигуры включены вместе с подробным описанием ниже и образуют часть описания и служат для дополнительного пояснения вариантов осуществления и пояснения различных принципов и преимуществ в соответствии с настоящим раскрытием.
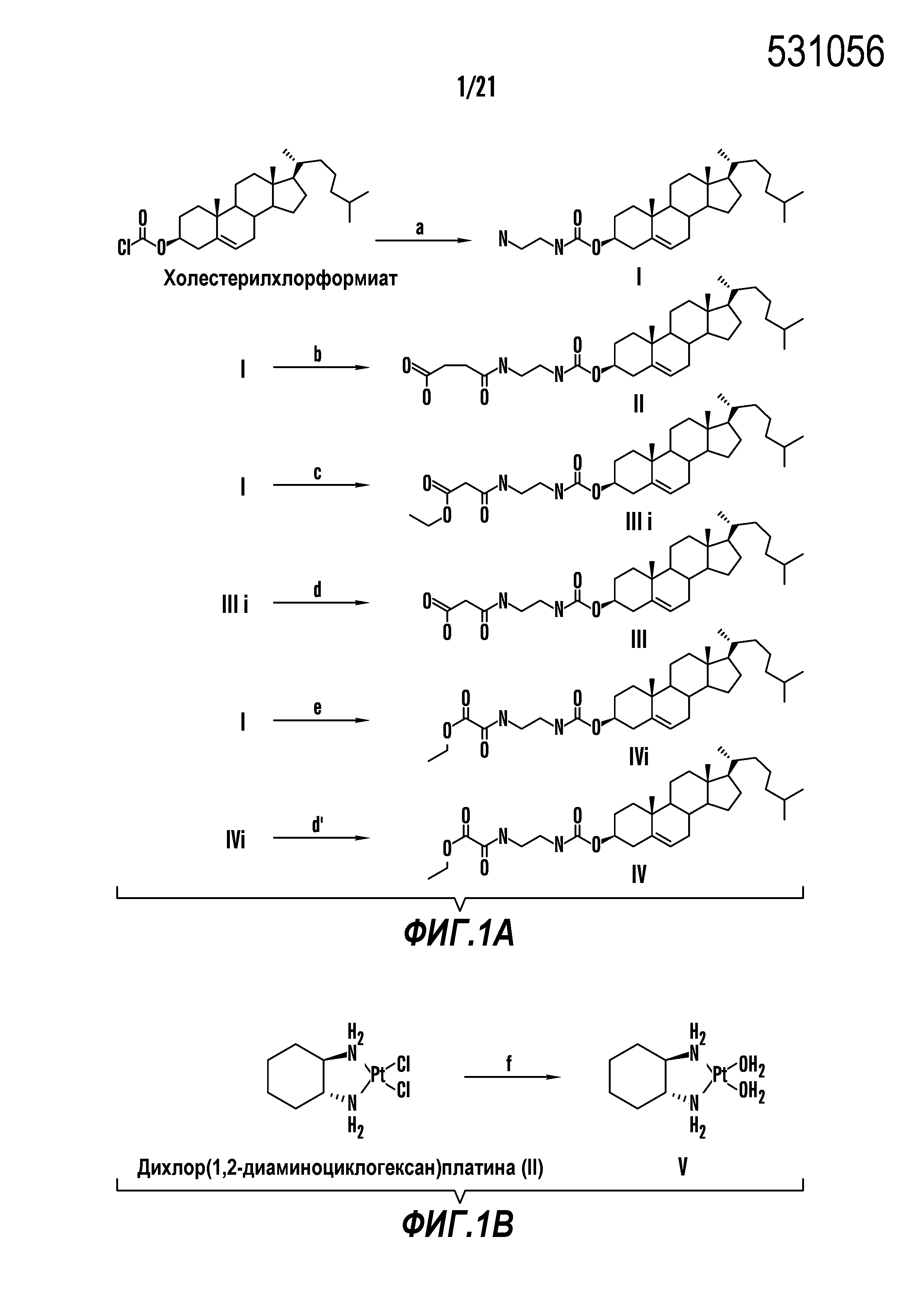
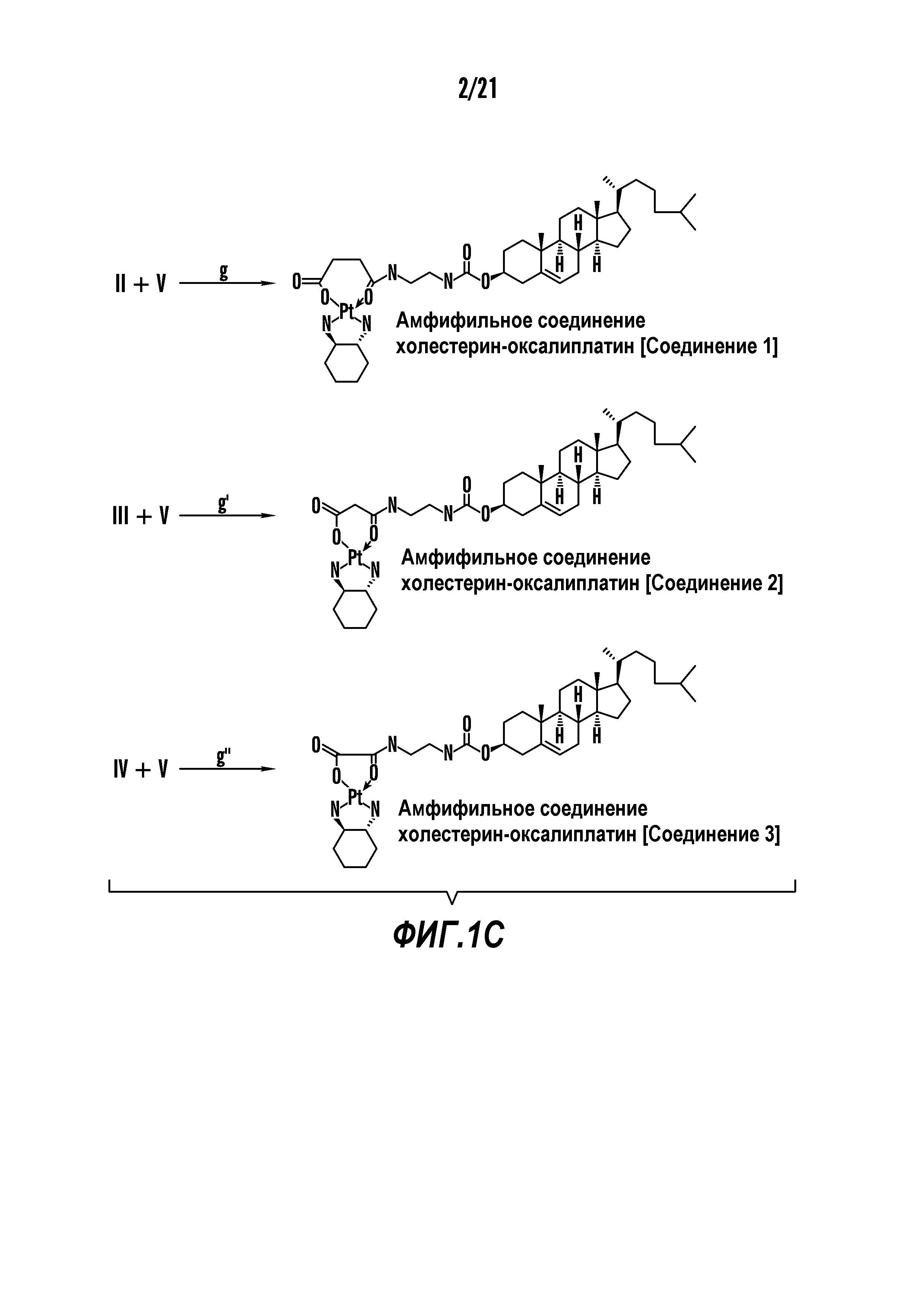
[0012] Фиг. 1A-1C отображают процедуру синтеза соединений холестерин-оксалиплатин (формула I) с карбаматной связью (соединения 1, 2 и 3). Реагенты и условия: a) этилендиамин (20 экв.), сухой DCM, 0°C-комнатная температура (RT), 24 часа; b) янтарный ангидрид, DCM, пиридин, RT, 24 часа; c) моноэтиловый эфир малоновой кислоты, DCM, EDCl, HOBt, RT, 24 часа; d, d') LiOH, ТГФ, H2O, 3 часа, RT; e) моноэтиловый эфир щавелевой кислоты, DCM, EDCl, HOBt, RT, 24 часа; f) AgNO3, H2O, RT, 24 часа; g, g', g'') ДМФА, H2O, RT, 24 часа.
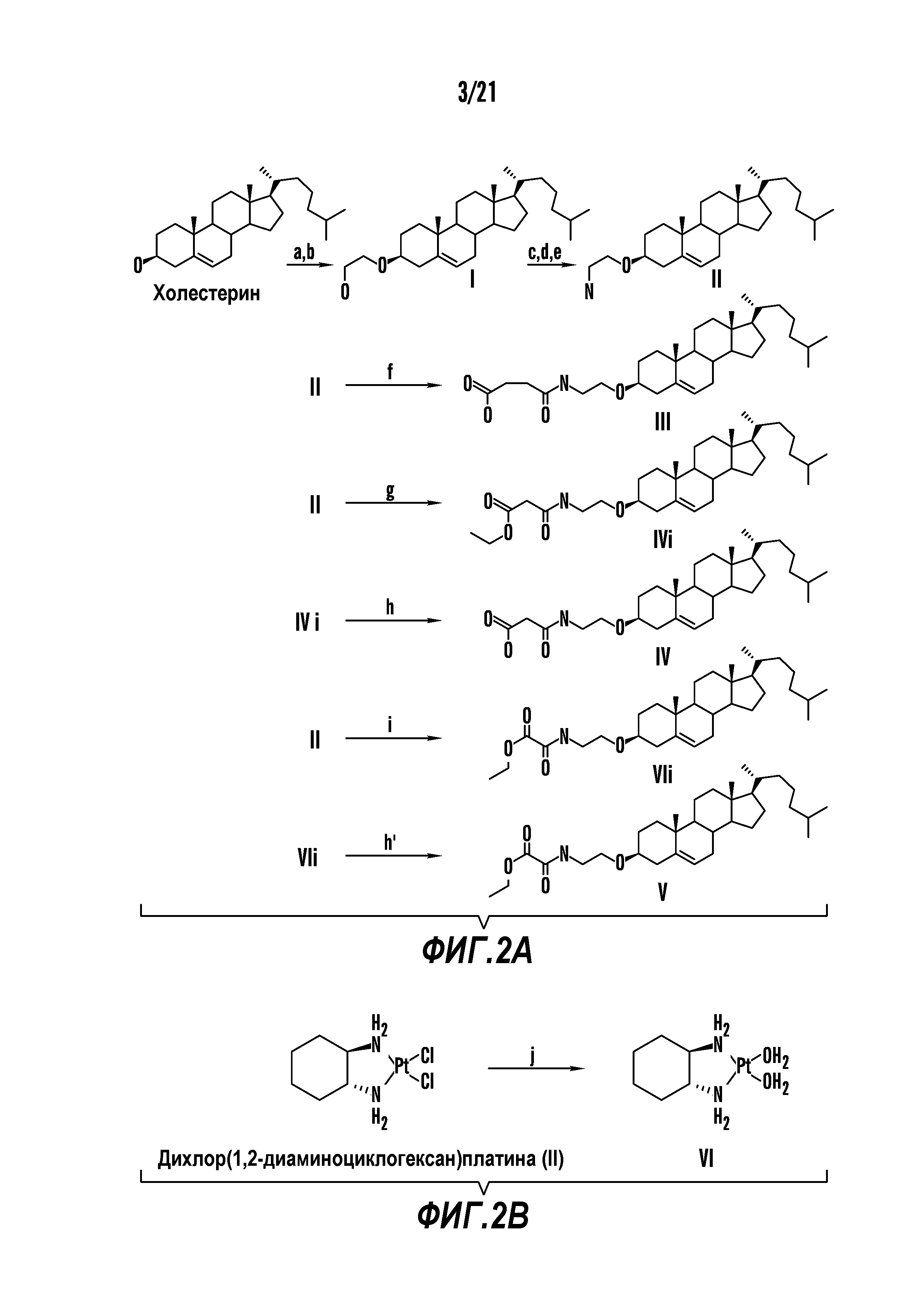
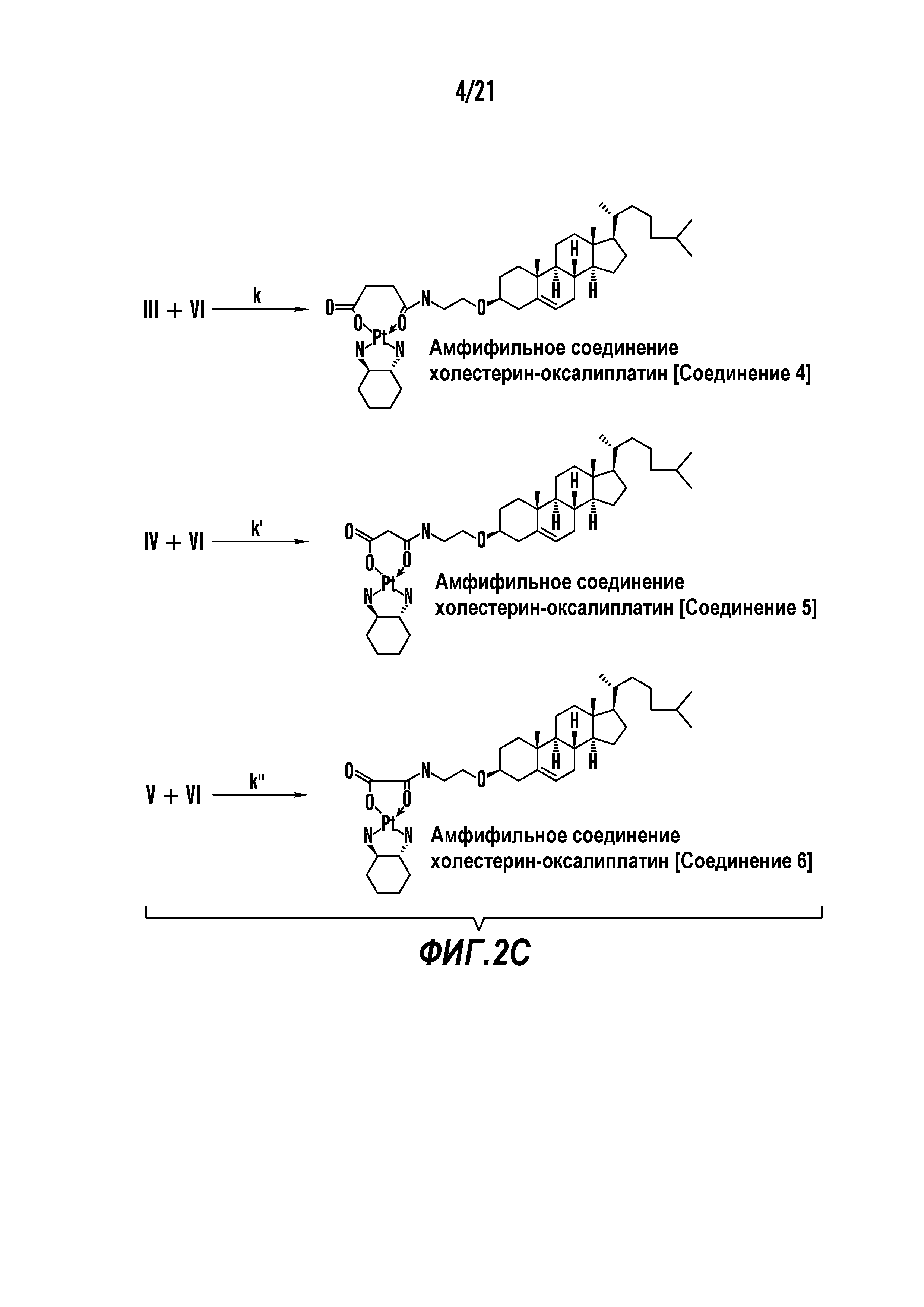
[0013] Фиг. 2A-2Cотображают процедуру синтеза соединений холестерин-оксалиплатин (формула I) с простой эфирной связью (соединения 6, 4 и 5). Реагенты и условия: a) TsCl, сухой DCM, пиридин, RT, 6 часов; b) этиленгликоль, диоксан, кипячение с обратным холодильником, 4 часа; c) TsCl, DCM, пиридин, RT, 6 часов; d) NaN3, ДМФА, 3 часа, RT; e) PPh3, ТГФ, H2O, RT, 4 часа; f) янтарный ангидрид, DCM, пиридин, RT, 24 часа; g) моноэтиловый эфир малоновой кислоты, DCM, EDCl, HOBt, RT, 24 часа; h,h') LiOH, ТГФ, H2O, 3 часа, RT; i) моноэтиловый эфир щавелевой кислоты, DCM, EDCl, HOBt, RT, 24 часа; j) AgNO3, H2O, RT, 24 часа; k,k',k'') ДМФА, H2O, RT, 24 часа.
[0014] Фиг. 3A-3E отображают процедуру синтеза соединений формулы III. Фиг. 3A представляет синтез соединения 32 (при этом R=холестерин или другой липид). Фиг. 3Bпредставляет синтез соединения 33 (при этом R=холестерин или другой липид). Фиг. 3C представляет синтез соединения 34 (при этом R=холестерин или другой липид). Фиг. 3D представляет синтез соединения 35 (при этом R=холестерин или другой липид). Фиг. 3E представляет синтез соединения 36 (при этом R=холестерин или другой липид).
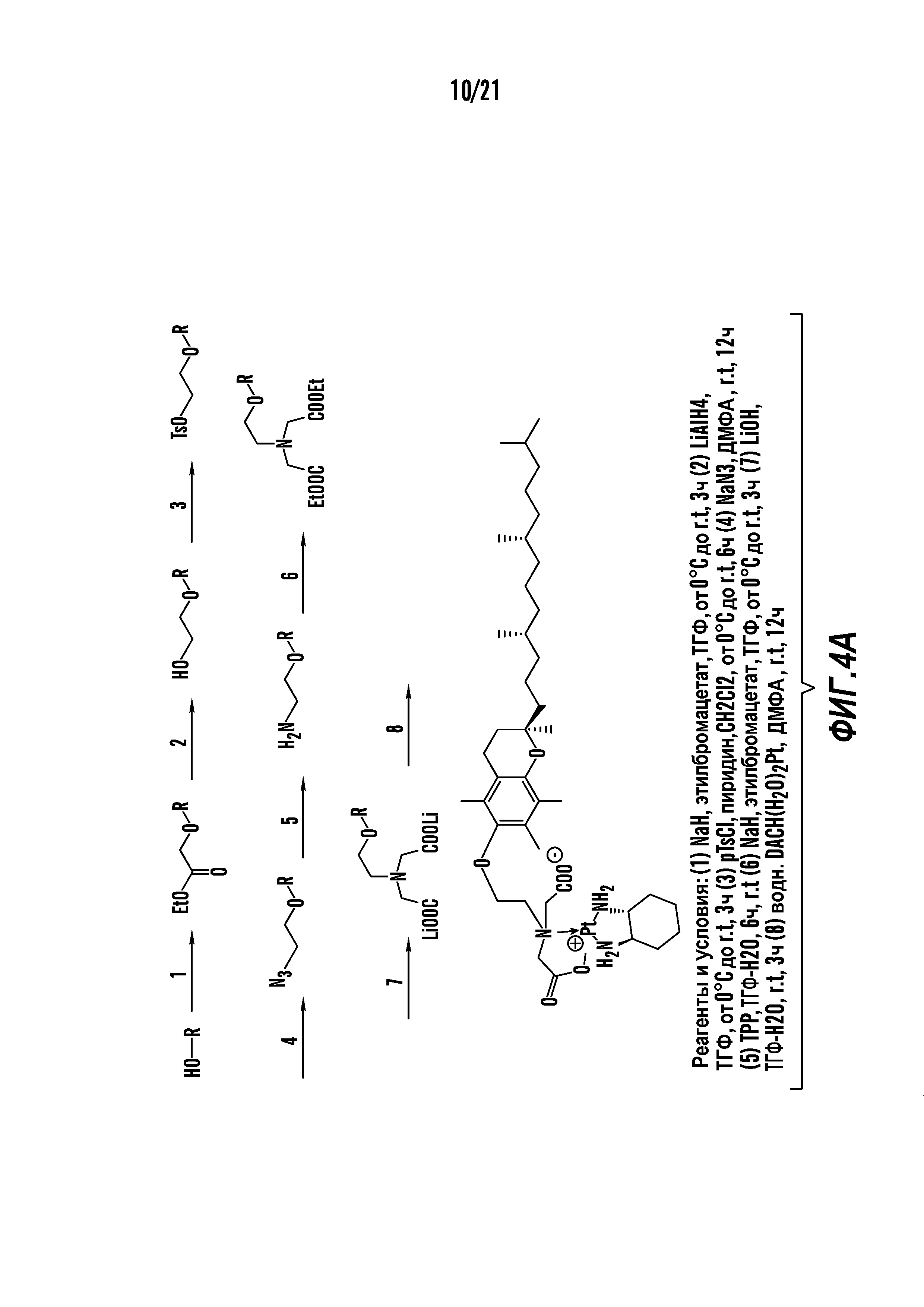
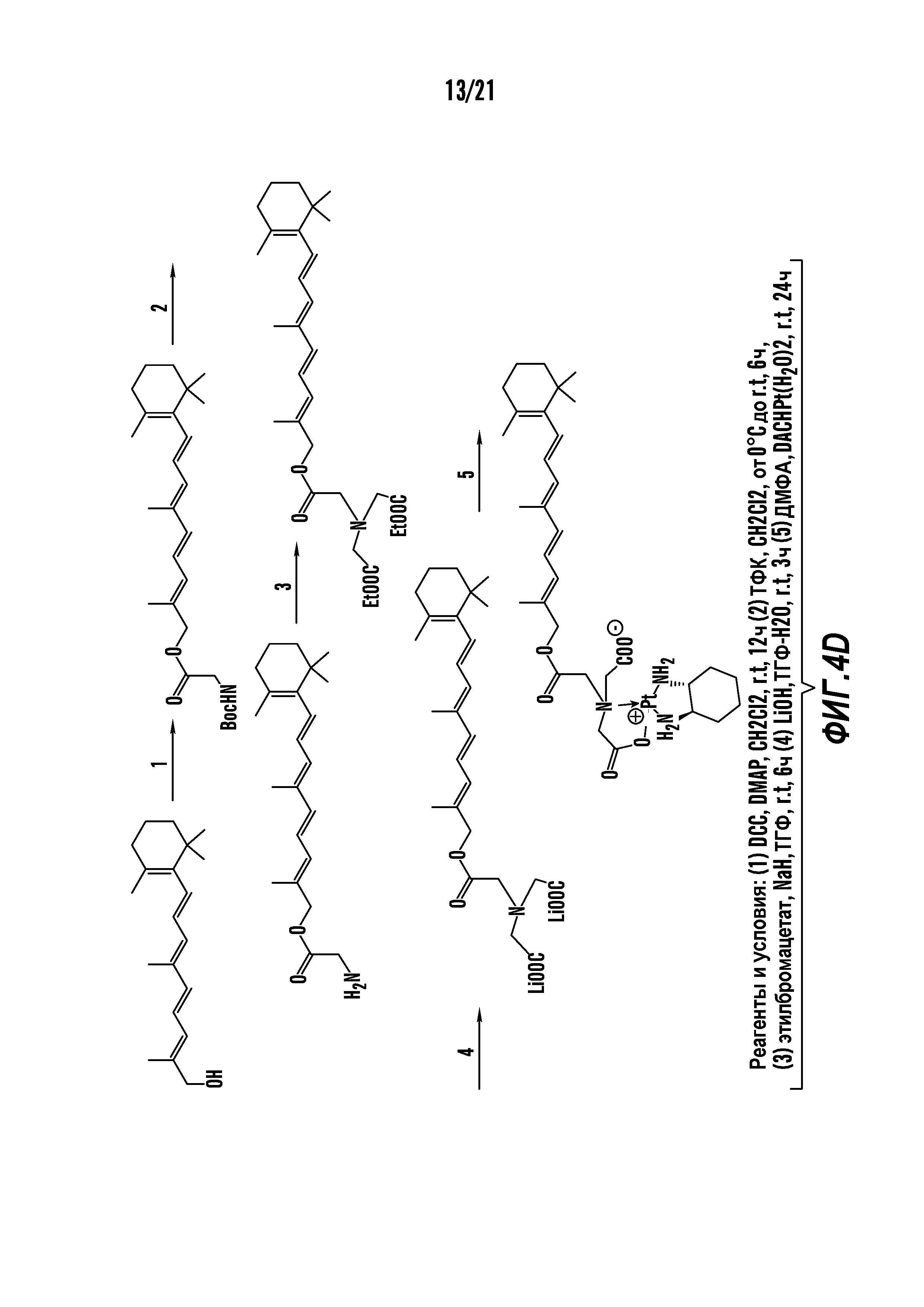
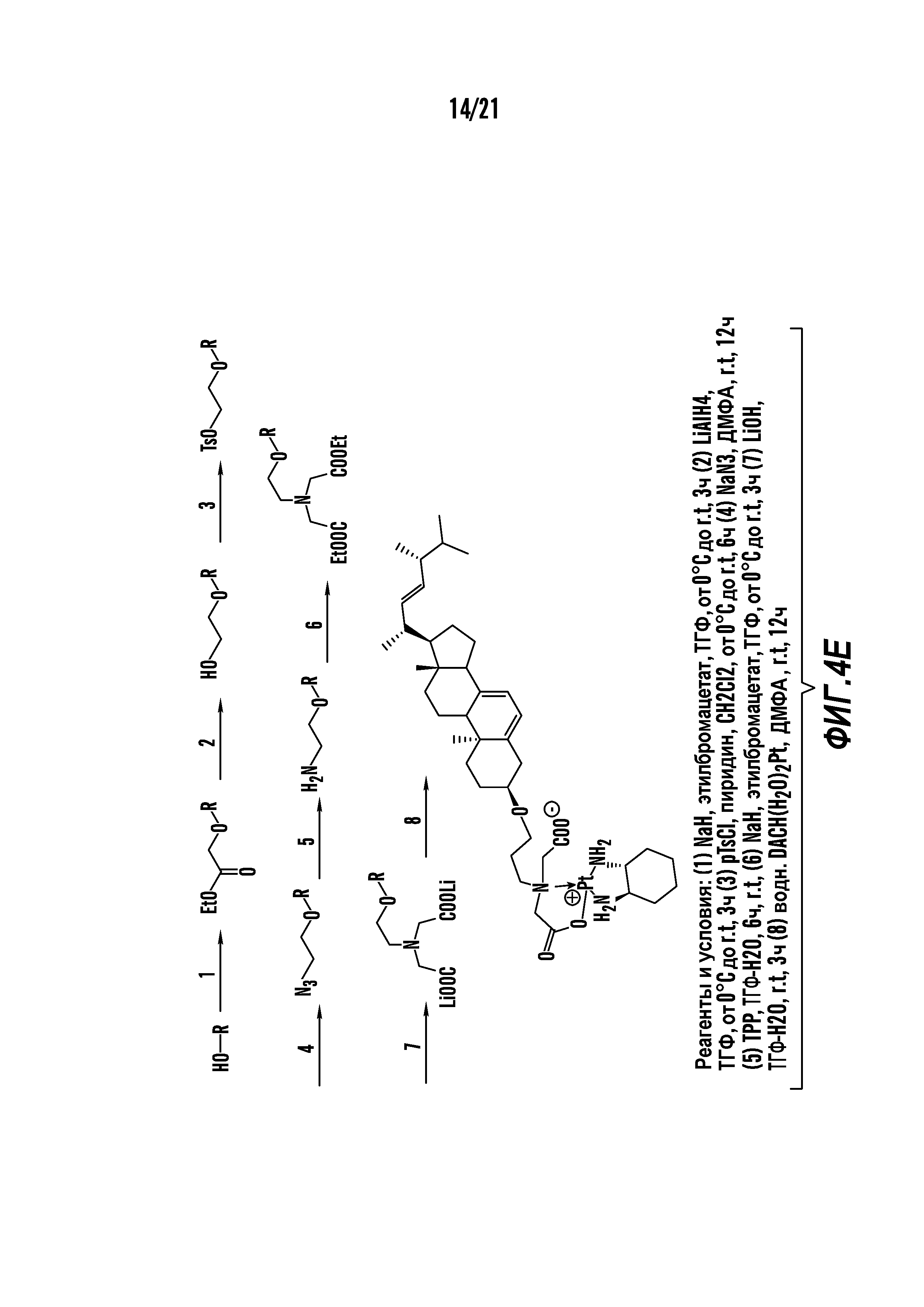
[0015] Фиг. 4A-4E отображают процедуру синтеза соединений формулы II. Фиг. 4A представляет синтез соединения 38. Фиг. 4Bпредставляет синтез соединения 39. Фиг. 4Cпредставляет синтез соединения 40. Фиг. 4D представляет синтез соединения 41. Фиг. 4E представляет синтез соединения 42.
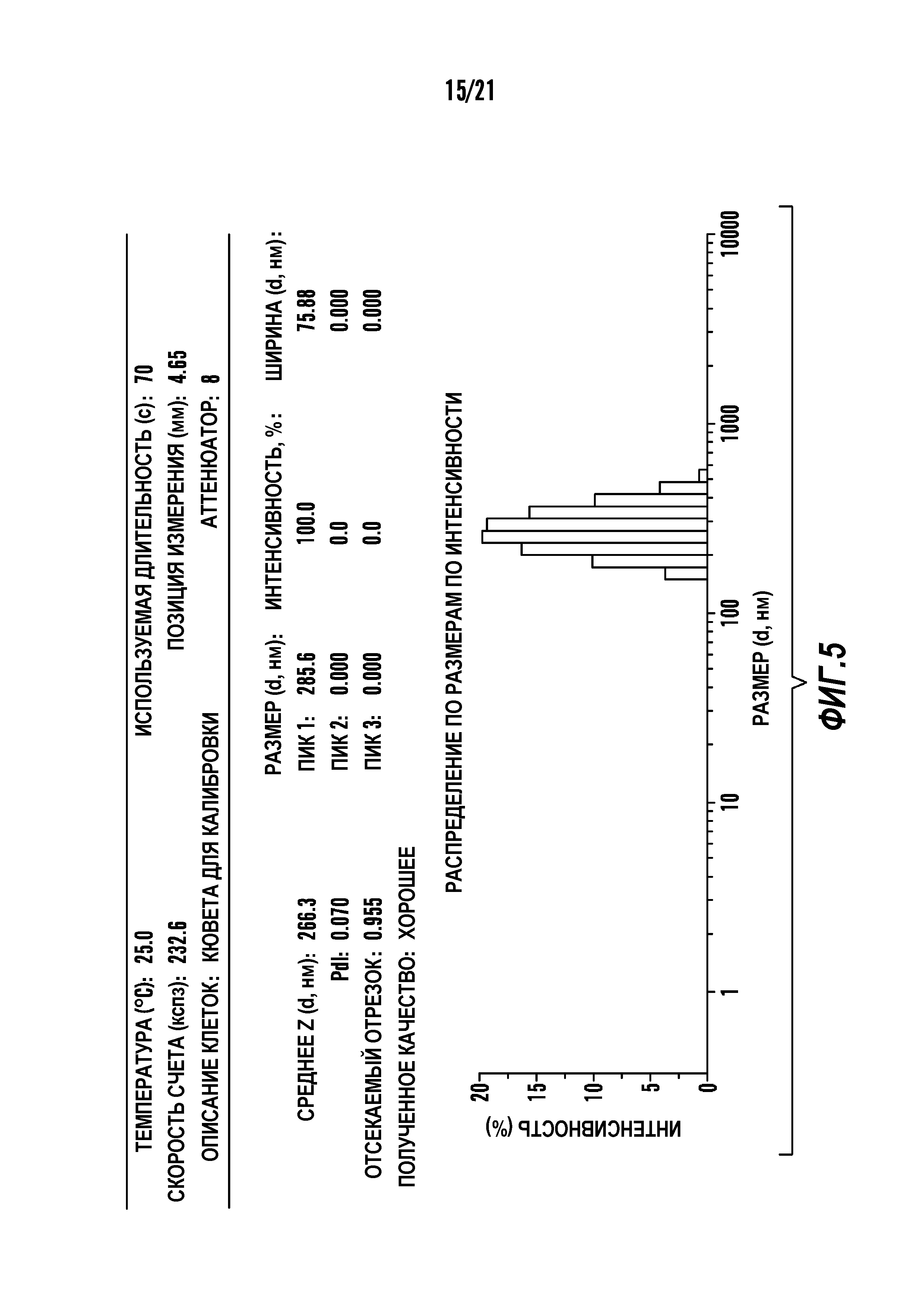
[0016] Фиг. 5 отображает физико-химические свойства наночастиц. Представлен график DLS, который показывает распределение частиц по размеру.
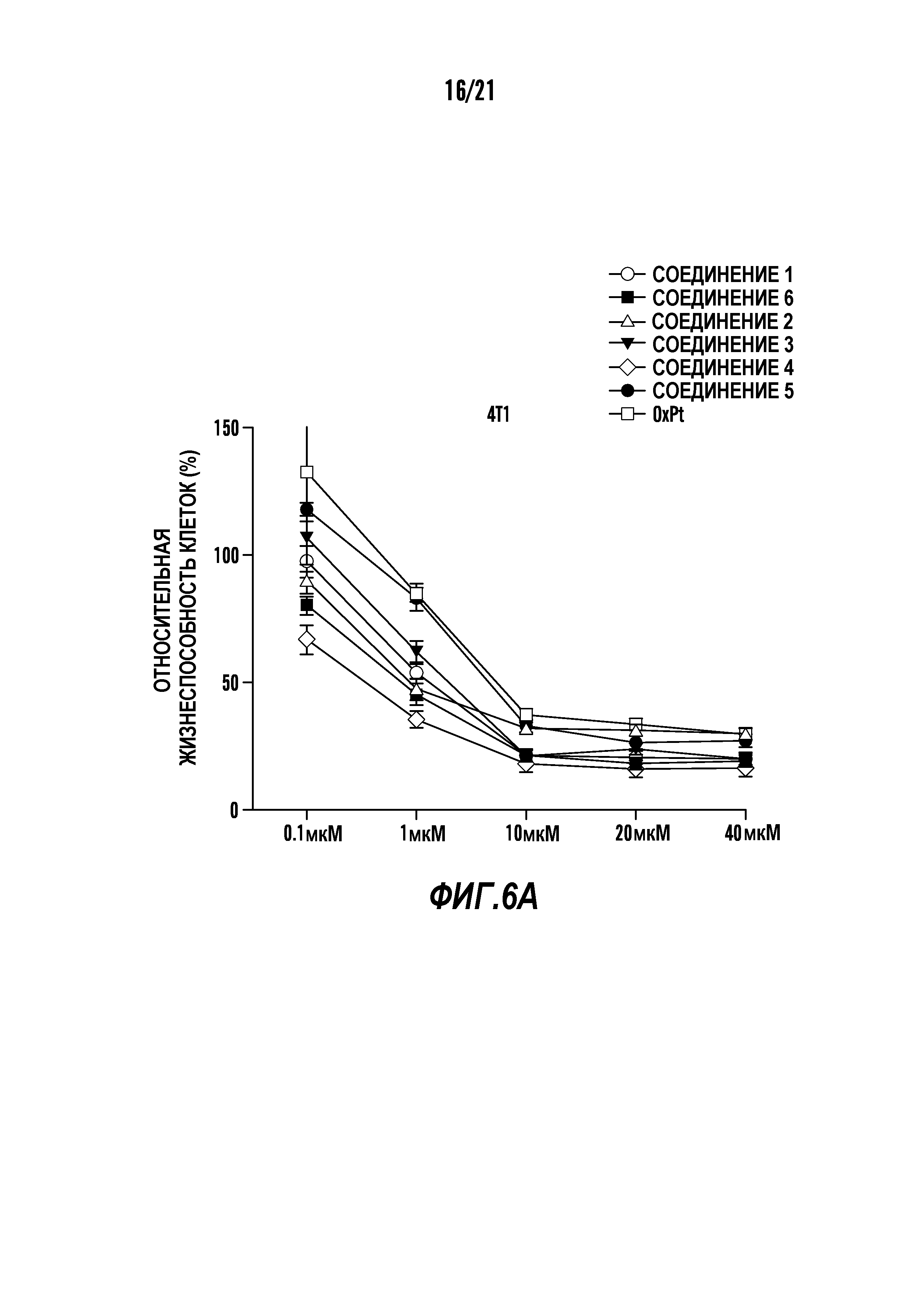
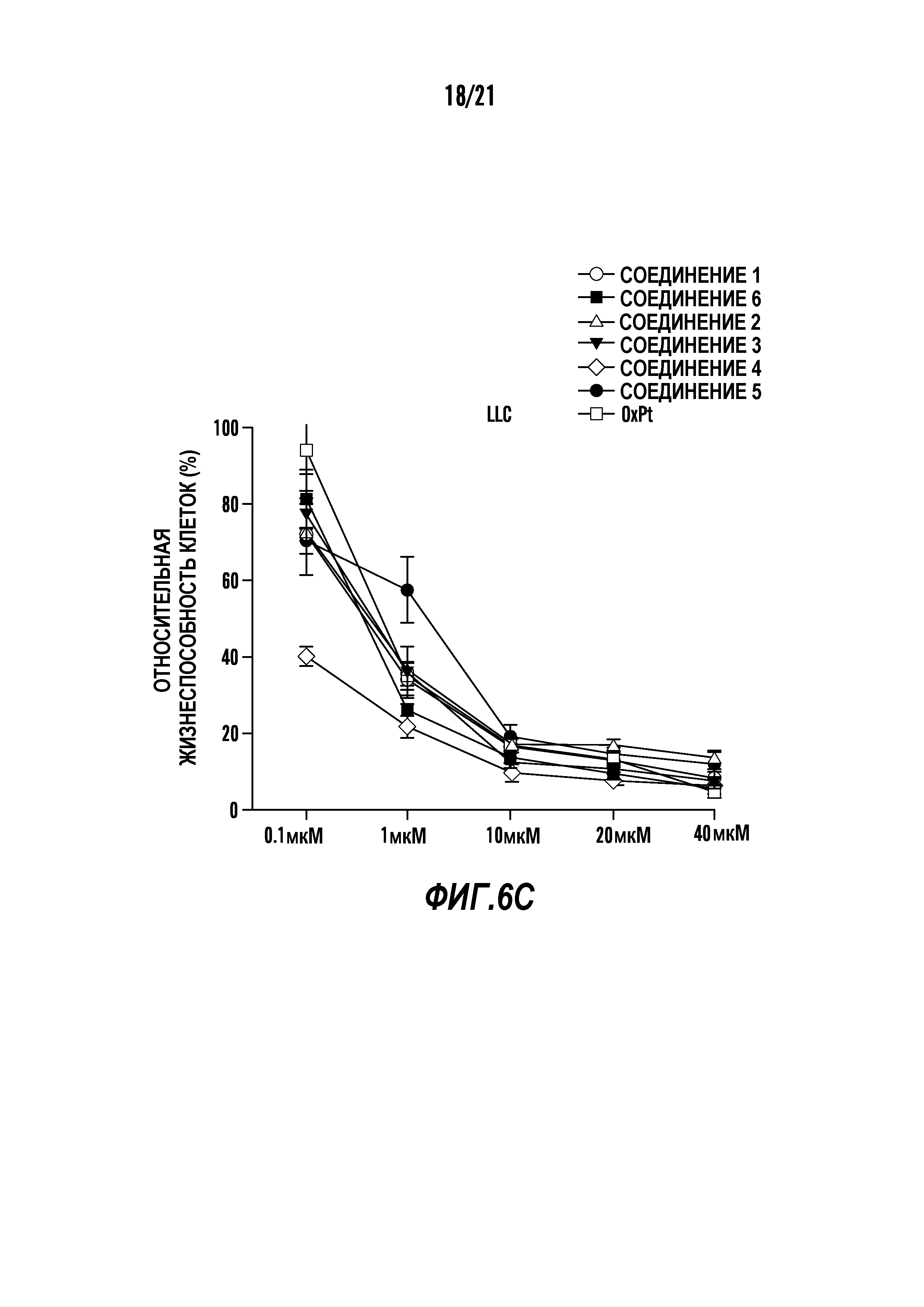
[0017] Фиг. 6A-6Cотображают определение свойств in-vitro композиций наночастиц синтезированных соединений холестерин-оксалиплатин. Графики показывают влияние концентрации различных композиций наночастиц холестерин-оксалиплатина и оксалиплатина (контроль) на жизнеспособность раковых клеток 4T1 (клеточная линия рака молочной железы) (фиг. 6A), HeLa (клеточная линия цервикального рака) (фиг. 6B) и LLC (клеточная линия рака легких) (фиг. 6C)при измерении с использованием анализа с MTT. Ось x отображает эквивалентные концентрации платины.
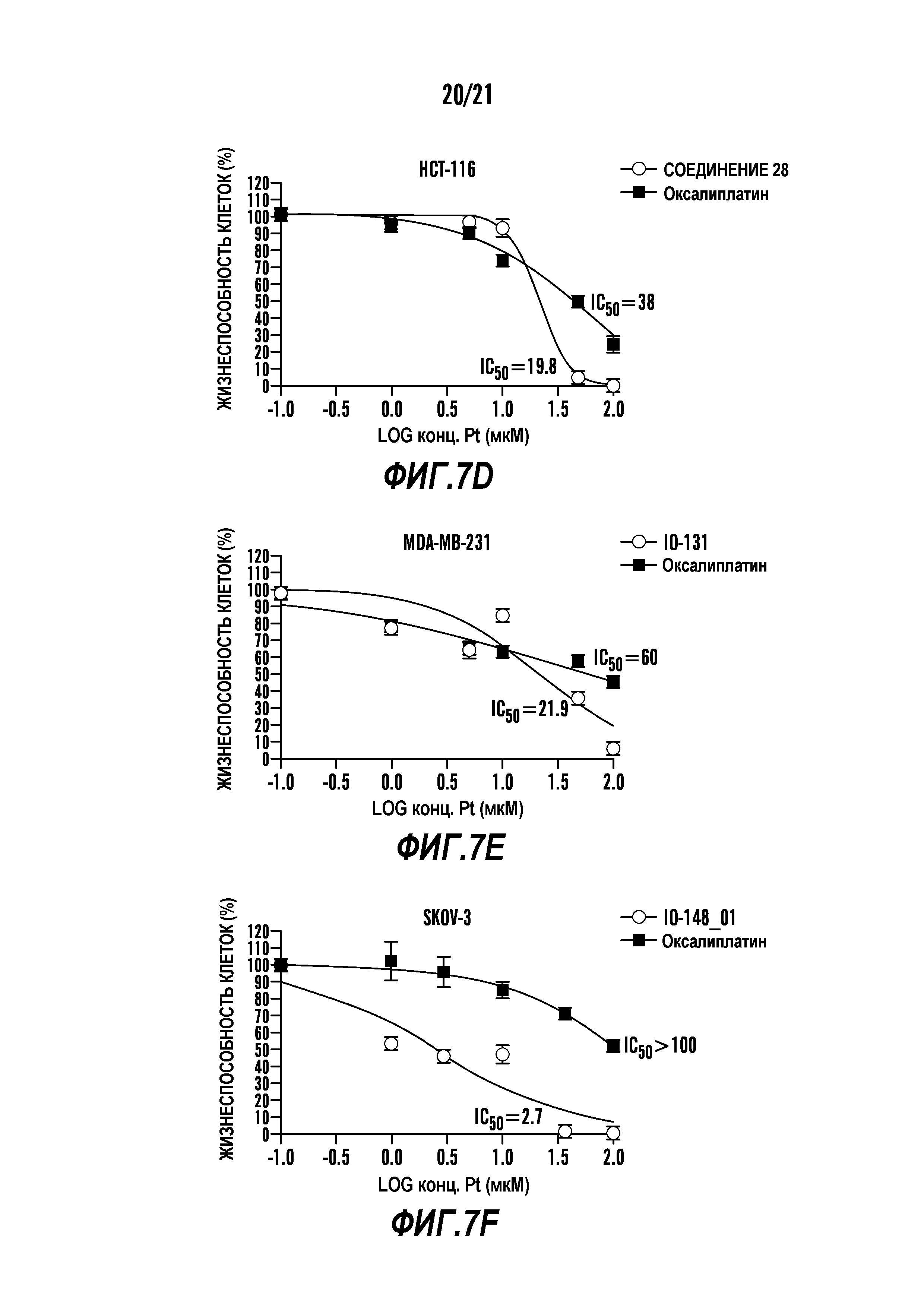
[0018] Фигуры 7A-7Fпоказывают результаты анализа с MTT для некоторых примеров соединений, раскрытых в настоящем описании. Графики представляют анализ с MTT на активность примеров соединений, проверенных на различных клеточных линиях рака человека. Анализ с MTT показывает снижение жизнеспособности клеток в случае различных примеров испытанных соединений. Величины IC50 соединения/оксалиплатина при испытании на клеточных линиях указаны сбоку в соответствующих обозначениях кривой жизнеспособности клеток.
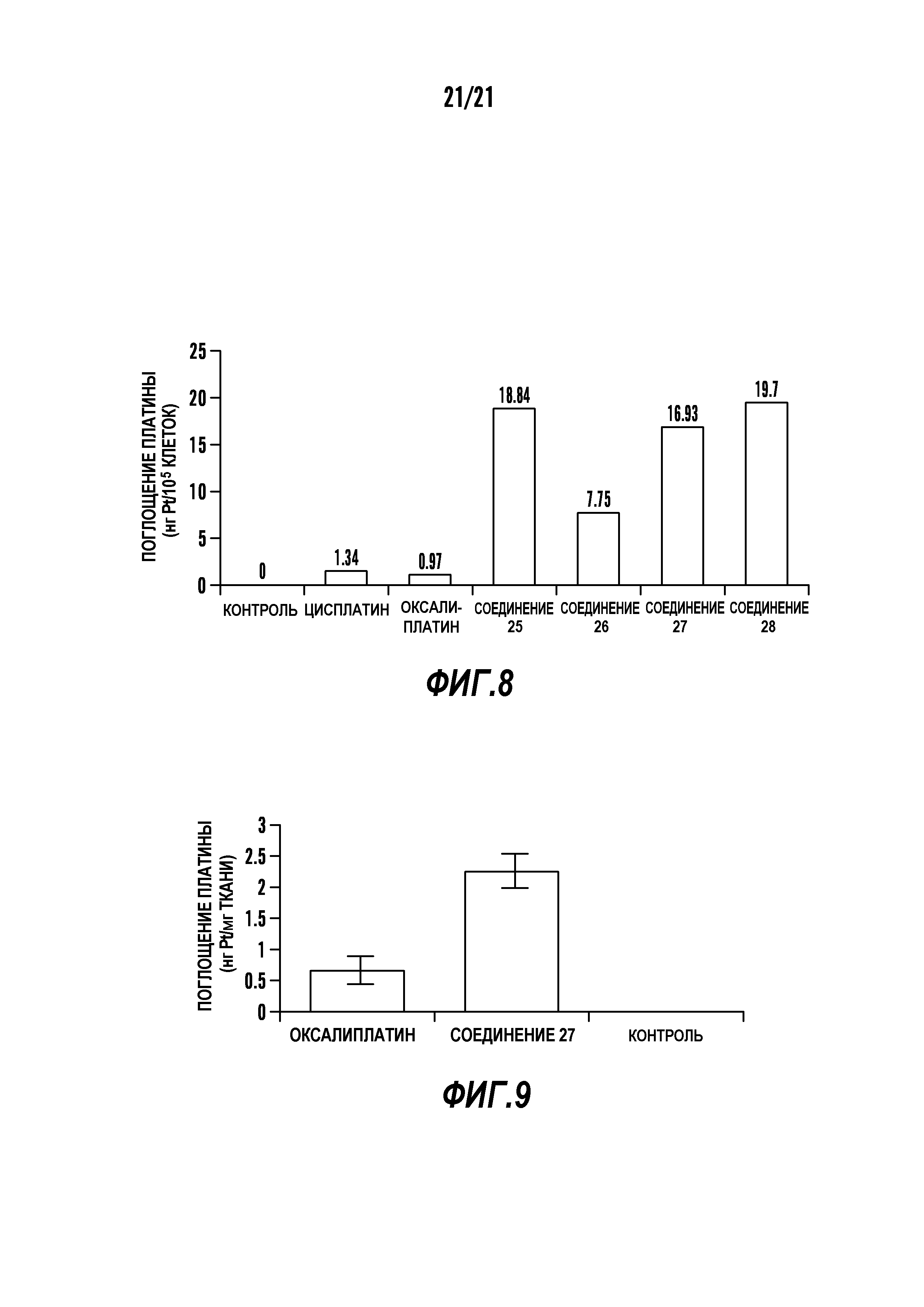
[0019] Фигура 8 показывает захват клетками соединений платины. Клетки инкубируют с соединениями платины в концентрации 50 мкM в течение 5 часов. Количество платины, накопленной в клетках, измеряют ААС (АAS) и выражают в нг накопленной платины на 105 клеток.
[0020] Фигура 9 показывает распределение платины в опухолях. Общее содержание платины в опухолях измеряют AAС и выражают в нг накопленной платины на мг опухоли.
Подробное описание
[0021] В некоторых вариантах осуществления раскрыты соединения на основе платины, которые включают (a) платиновую часть; (b) по меньшей мере один линкер, соединенный с указанной платиновой частью; и (c) липид, соединенный с указанным линкером.
[0022] В соединениях, раскрытых в настоящем описании, платиновая часть соединяется с молекулой липида или непосредственно или через молекулу-линкер. В некоторых вариантах осуществления платиновая часть соединяется с молекулой липида через молекулу-линкер. Например, присутствие линкера может обеспечить, в случае карбаматной и/или простой эфирной связи, соединение дикарбонилсодержащей молекулы (для соединения с платиновой частью) и молекулы липида. В некоторых других вариантах осуществления настоящего раскрытия платиновая часть непосредственно соединяется с молекулой липида. Все возможные молекулы-линкеры, обеспечивающие карбаматную и/или простую эфирную связь, образуют часть настоящего раскрытия.
[0023] В некоторых вариантах осуществления соединение на основе платины, раскрываемое в настоящем описании, представляет собой соединение формулы (VIII):
Q-линкер-липид (VII),
где
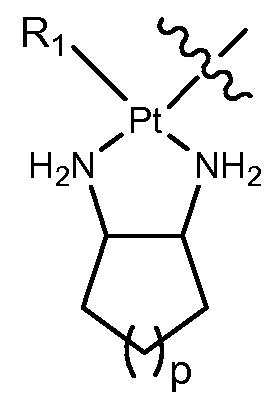
Q представляет собой часть, содержащую платину, и линкер имеет по меньшей мере одну связь с атомом платины.
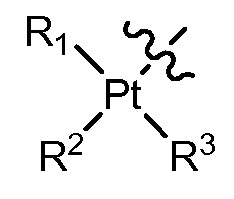
[0024] В некоторых вариантах осуществления различных аспектов, описанных в настоящем описании, Q представляет собой

[0025] В некоторых вариантах осуществления различных аспектов, описанных в настоящем описании, Q представляет собой
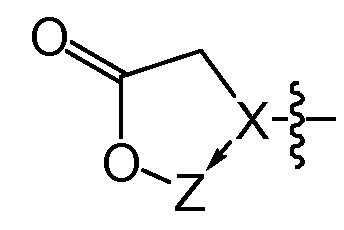
[0026] В некоторых вариантах осуществления различных аспектов, описанных в настоящем описании, Q представляет собой
[0027] В некоторых вариантах осуществления различных аспектов, описанных в настоящем описании, Q представляет собой

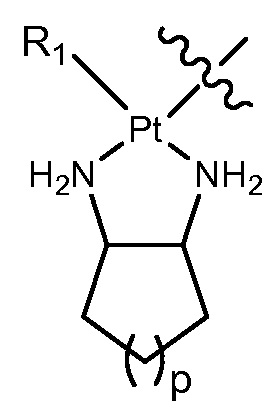
[0028] В некоторых вариантах осуществления различных аспектов, раскрытых в настоящем описании, платина координирована с удаляемой группой через уникальную ковалентную связь O-Pt-монокарбоксилато и координационную связь =O→Pt. Кроме того, в настоящем раскрытии также раскрываются соединения на основе платины, в которых платина координирована с удаляемой группой через уникальную(ые) ковалентную(ые) связь(и) O-Pt-монокарбоксилато или дикарбоксилато.
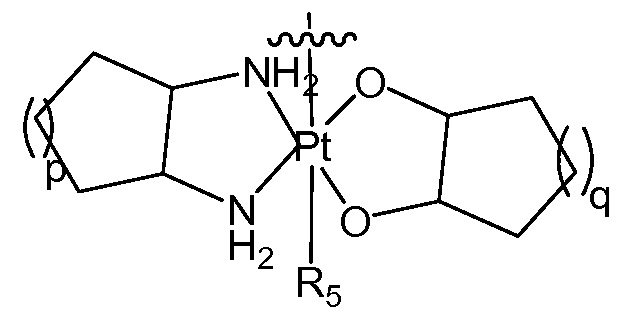
[0029] В некоторых вариантах осуществления различных аспектов, раскрытых в настоящем описании, платиновая часть представляет собой соединение платины (II) или платины (IV). В некоторых вариантах осуществления соединение платины (II) выбирают из группы, включающей DACH-платину, цисплатин, оксалиплатин, карбоплатин, параплатин, сартраплатин и их различные комбинации. В некоторых вариантах осуществления содержащее платину соединение представляет собой соединение Pt(II), соединение Pt(IV) или галогенсодержащее соединение платины. В предпочтительном варианте осуществления соединения платины представляют собой оксалиплптин.
[0030] В некоторых вариантах осуществления Z представляет собой

[0031] В некоторых вариантах осуществления Z представляет собой
[0032] В некоторых вариантах осуществления Z представляет собой
[0033] В некоторых вариантах осуществления Z представляет собой

[0034] В некоторых вариантах осуществления Z представляет собой
[0035] В некоторых вариантах осуществления Z представляет собой

[0036] В одном варианте осуществления Z представляет собой
[0037] В некоторых вариантах осуществления соединение платины (II) включает по меньшей мере два атома азота, где указанные атомы азота непосредственно соединены с платиной. В другом варианте осуществления два атома азота соединены друг с другом через необязательно замещенный линкер, например, ациклический или циклический линкер. Циклический линкер обозначает соединяющую часть, которая включает по меньшей мере одну циклическую структуру. Циклические линкеры могут представлять собой арил, гетероарил, циклил или гетероциклил.
[0038] В некоторых вариантах осуществления Q представляет собой
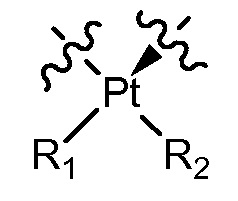

[0039] В некоторых вариантах осуществления Q представляет собой
[0040] В некоторых вариантах осуществления Q представляет собой
[0041] В некоторых вариантах осуществления Q представляет собой

[0042] В некоторых вариантах осуществления Q представляет собой

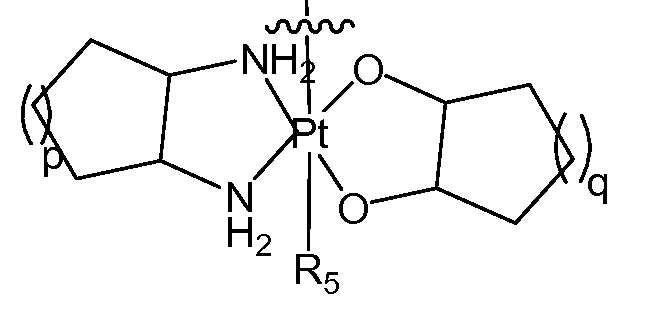
[0043] В некоторых вариантах осуществления Q представляет собой
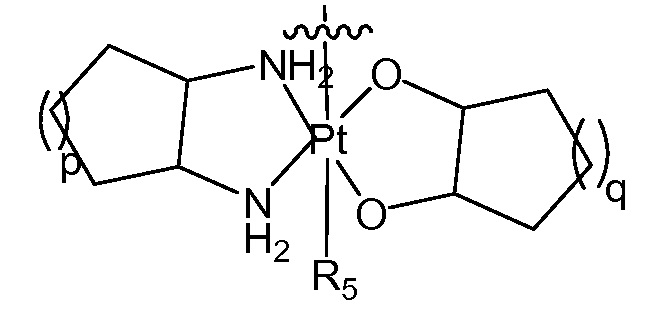
[0044] В одном варианте осуществления Q представляет собой
[0045] Термин «липид» используется в обычном смысле и включает соединения с различной длиной цепи, от такой короткой как примерно 2 атома углерода, до такой длинной как примерно 28 атомов углерода. Кроме того, соединения могут быть насыщенными или ненасыщенными и линейными или разветвленными или в форме неконденсированных или конденсированных циклических структур. Примеры липидов включают, но не ограничиваются перечисленным, жиры, воски, стерины, желчные кислоты, жирорастворимые витамины (такие как A, D, E и K), моноглицериды, диглицериды, фосфолипиды, гликолипиды, сульфолипиды, аминолипиды, хромолипиды (липохромы), глицерофосфолипиды, сфинголипиды, преноллипиды, сахаролипиды, поликетиды и жирные кислоты.
[0046] Липид можно выбрать без ограничения из группы, состоящей из стероидов, жирных кислот, жирных спиртов, глицеролипидов (например, моноглицеридов, диглицеридов и триглицеридов), фосфолипидов, глицерофосфолипидов, сфинголипидов, преноллипидов, сахаролипидов, поликетидов и их любых комбинаций. Липид может представлять собой полиненасыщенные жирную кислоту или спирт. Термин «полиненасыщенная жирная кислота» или «полиненасыщенный жирный спирт», используемый в настоящем описании, обозначает жирную кислоту или спирт с двумя или больше углерод-углеродными двойными связями в их углеводородной цепи. Липид также может представлять собой высшую ненасыщенную жирную кислоту или высший ненасыщенный жирный спирт. Термин «высшая ненасыщенная жирная кислота» или «высший ненасыщенный жирный спирт», используемый в настоящем описании, обозначает жирные кислоту или спирт с по меньшей мере 18 атомами углерода с по меньшей мере 3 двойными связями. Липид может представлять собой омега-3 жирную кислоту. Термин «омега-3 жирная кислота», используемый в настоящем описании, обозначает полиненасыщенную жирную кислоту, в которой первая двойная связь имеет место в третьей углерод-углеродной связи с конца, противоположного кислотной группе.
[0047] В некоторых вариантах осуществления липид можно выбрать из группы, состоящей из дикаприлата/дикапрата 1,3-пропандиола; 10-ундеценовой кислоты; 1-дотриаконтанола; 1-гептакозанола; 1-нонакозанола; 2-этилгексанола; андростанов; арахиновой кислоты; арахидоновой кислоты; арахидилового спирта; бегеновой кислоты; бегенилового спирта; капмула MCM C10; каприновой кислоты; капринового спирта; каприлового спирта; каприловой кислоты; эфира насыщенного жирного спирта C12-C18 каприловой/каприновой кислоты; триглицерида; церамидфосфорилхолина (сфингомиелина SPH); церамидфосфорилэтаноламина (сфингомиелина Cer-PE); церамидфосфорилглицерина; церопластовой кислоты; церотиновой кислоты; церилового спирта; цетеарилового спирта; цетета-10; цетилового спирта; холанов; холестанов; холестерина; цис-11-эйкозеновой кислоты; цис-11-октадеценовой кислоты; цис-13-докозеновой кислоты; клуитилового спирта; коэнзима Q10 (CoQ10); дигомо-γ-линоленовой (кислоты); докозагексаеновой кислоты; яичного лецитина; эйкозапентаеновой кислоты; эйкозеновой кислоты; элаидиновой кислоты; элаидолиноленилового спирта; элаидолинолеилового спирта; элаидилового спирта; эруковой кислоты; эруцилового спирта; эстранов; дистеарата этиленгликоля (EGDS); геддовой кислоты; геддилового спирта; дистеарата глицерина (тип I) EP (прецирола ATO 5); трикаприлата/капрата глицерина; трикаприлата/капрата глицерина (CAPTEX®355 EP/NF); глицерилмонокаприлата (капмула MCM C8 EP); глицерилтриацетата; глицерилтрикаприлата; глицерилтрикаприлата/капрата/лаурата; глицерилтрикаприлата/трикапрата; глицерилтрипальмитата (трипальмитина); генатриаконтиловой кислоты; генэйкозилового спирта; генэйкозиловой кислоты; гептакозиловой кислоты; гептадекановой кислоты; гептадецилового спирта; гексатриаконтиловой кислоты; изостеариновой кислоты; изостеарилового спирта; лакцеровой кислоты; лауриновой кислоты; лаурилового спирта; лигноцериновой кислоты; лигноцерилового спирта; линоэлаидиновой кислоты; линолевой кислоты; линоленового спирта; линолеилового спирта; маргариновой кислоты; меда; мелиссиновой кислоты; мелиссилового спирта; монтановой кислоты; монтанилового спирта; мирицилового спирта; миристиновой кислоты; миристолеиновой кислоты; миристилового спирта; неодекановой кислоты; неогептановой кислоты; неононановой кислоты; нервоновой кислоты; нонакозиловой кислоты; нонадецилового спирта; нонадециловой кислоты; олеиновой кислоты; олеилового спирта; пальмитиновой кислоты; пальмитолеиновой кислоты; пальмитолеилового спирта; пеларгоновой кислоты; пеларгонового спирта; пентакозиловой кислоты; пентадецилового спирта; пентадециловой кислоты; фосфатидной кислоты (фосфадидата, PA); фосфатидилхолина (лецитина, PC); фосфатидилэтаноламина (цефалина, PE); фосфатидилинозита (PI); фосфатидилинозитбифосфата (PIP2); фосфатидилинозитфосфата (PIP); фосфатидилинозиттрифосфата (PIP3); фосфатидилсерина (PS); полиглицерил-6-дистеарата; прегнанов; дикапрата пропиленгликоля; дикаприлокапрата пропиленгликоля; псилловой кислоты; рецинолевой кислоты; рецинолеилового спирта; сапиеновой кислоты; соевого лецитина; стеариновой кислоты; стеаридоновой кислоты; стеарилового спирта; трикозиловой кислоты; тридецилового спирта; тридециловой кислоты; триолеина; ундецилового спирта; ундециленовой кислоты; ундециловой кислоты; вакценовой кислоты; α-линоленовой кислоты; γ-линоленовой кислоты; соли жирной кислоты 10-ундеценовой кислоты, адапалена, арахидовой кислоты, арахидоновой кислоты, бегеновой кислоты, масляной кислоты, каприновой кислоты, каприловой кислоты, церотовой кислоты, цис-11-эйкозановой кислоты, цис-11-октадеценовой кислоты, цис-13-докозеновой кислоты, докозагексаеновой кислоты, эйкозапентаеновой кислоты, эландиновой кислоты, эруковой кислоты, гениэйкозиловой кислоты, гептакозиловой кислоты, гептадекановой кислоты, изостеариновой кислоты, лауриновой кислоты, лигноцериновой кислоты, линоэдаидиновой кислоты, линолевой кислоты, монтановой кислоты, миристиновой кислоты, миристолеиновой кислоты, неодекановой кислоты, неогептановой кислоты, неононановой кислоты, нонадециловой кислоты, олеиновой кислоты, пальмитиновой кислоты, пальмитолеиновой кислоты, пеларгоновой кислоты, пентакозиловой кислоты, пентадециловой кислоты, рецинолеиновой кислоты (например, рецинолеата цинка), сапиеновой кислоты, стеариновой кислоты, трикозиловой кислоты, тридециловой кислоты, ундециленовой кислоты, ундециловой кислоты, вакценовой кислоты, валериановой кислоты, α-линоленовой кислоты, γ-линоленовой кислоты; и их любых комбинаций.
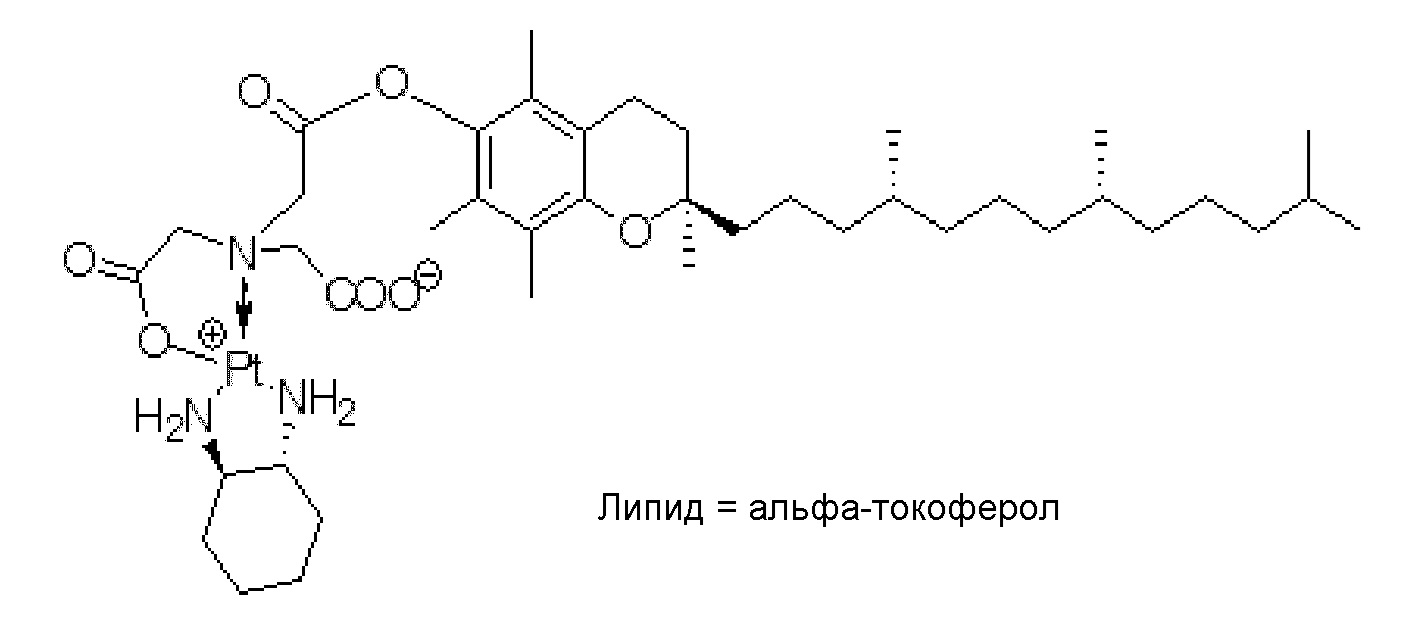
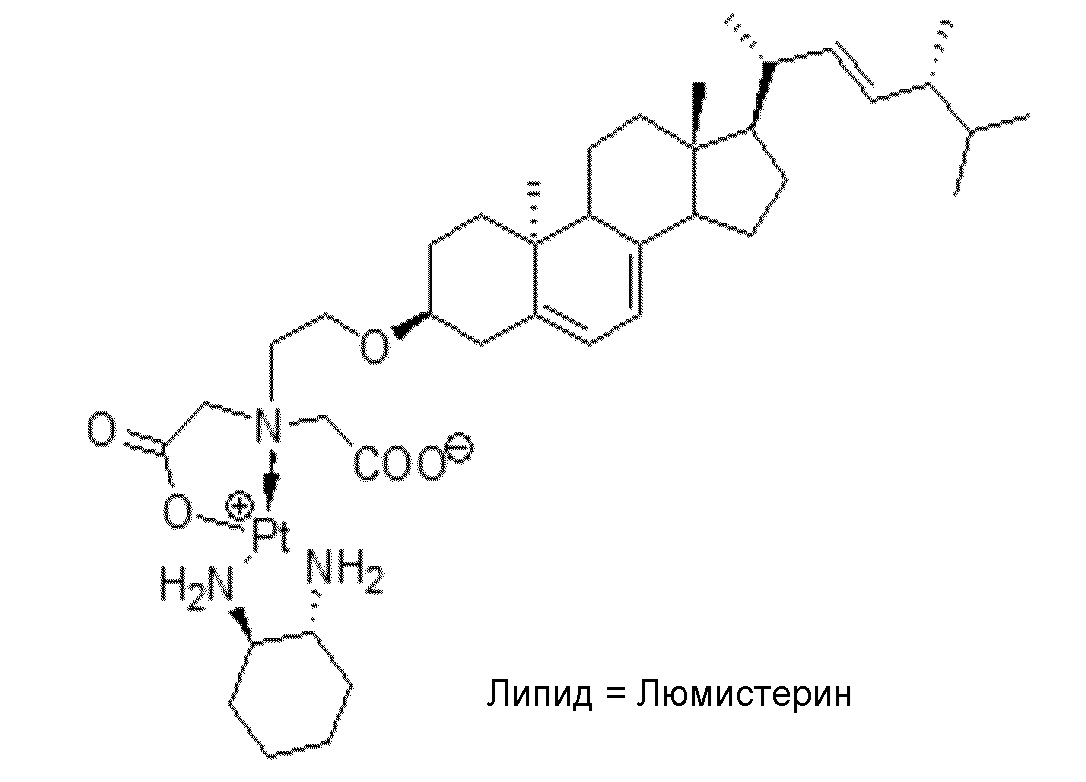
[0048] В некоторых вариантах осуществления липид представляет собой холестерин или альфа-токоферол.
[0049] Используемый в настоящем описании термин «линкер» обозначает органическую группу, которая соединяет две части соединения. Линкеры обычно включают прямую связь или атом, такой как атом кислорода или серы, звено, такое как NR1, C(O), C(O)NH, C(O)O, NHC(O)O, OC(O)O, SO, SO2, SO2NH, или цепь атомов, такую как замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, арилалкил, арилалкенил, арилалкинил, гетероарилалкил, гетероарилалкенил, гетероарилалкинил, гетероциклоалкил, гетероциклоалкенил, гетероциклоалкинил, арил, гетероарил, гетероциклил, циклоалкил, циклоалкенил, алкиларилалкил, алкиларилалкенил, алкиларилалкинил, алкениларилалкил, алкениларилалкенил, алкениларилалкинил, алкиниларилалкил, алкиниларилалкенил, алкиниларилалкинил, алкилгетероарилалкил, алкилгетероарилалкенил, алкилгетероарилалкинил, алкенилгетероарилалкил, алкенилгетероарилалкенил, алкенилгетероарилалкинил, алкинилгетероарилалкил, алкинилгетероарилалкенил, алкинилгетероарилалкинил, алкилгетероциклоалкил, алкилгетероциклоалкенил, алкилгетероциклоалкинил, алкенилгетероциклоалкил, алкенилгетероциклоалкенил, алкенилгетероциклоалкинил, алкинилгетероциклоалкил, алкинилгетероциклоалкенил, алкинилгетероциклоалкинил, алкиларил, алкениларил, алкиниларил, алкилгетероарил, алкенилгетероарил, алкинилгетероарил, где одна или несколько метиленовых групп могут прерываться или оканчиваться O, S, S(O), SO2, NR1, C(O), C(O)NH, C(O)O, NHC(O)O, OC(O)O, SO2NH, расщепляемой соединяющей группой, замещенным или незамещенным арилом, замещенным или незамещенным гетероарилом, замещенной или незамещенной гетероциклической группой; где R1 представляет собой водород, ацил, алифатическую или замещенную алифатическую группу.
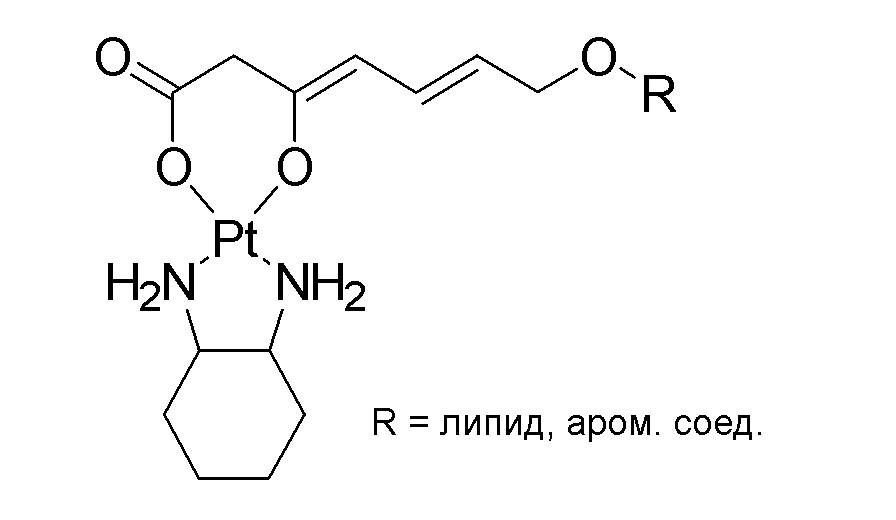
[0050] В некоторых вариантах осуществления линкер представляет собой разветвленный линкер. Место разветвления разветвленного линкера может представлять собой по меньшей мере трехвалентный атом, но может быть четырехвалентным, пятивалентным или шестивалентным атомом или группой, представляющей такие несколько валентностей. В некоторых вариантах осуществления местом разветвления является -N, -N(Q)-C, -O-C, -S-C, -SS-C, -C(O)N(Q)-C, -OC(O)N(Q)-C, -N(Q)C(O)-C или -N(Q)C(O)O-C; при этом Q представляет собой, независимо при каждом появлении, H или необязательно замещенный алкил. В некоторых вариантах осуществления местом разветвления является глицерин или его производное.
[0051] Соединяющая группа, способная расщепляться, представляет собой группу, которая достаточно устойчива вне клетки, но которая после проникновения в клетку-мишень расщепляется с высвобождением двух частей, которые линкер удерживает вместе. В предпочтительном варианте осуществления способная расщепляться соединяющая группа расщепляется по меньшей мере в 10 раз или, предпочтительнее по меньшей мере в 100 раз быстрее в клетке-мишени или при первом стандартном условии (которое можно, например, выбрать для имитации или представления условий внутри клетки), чем в крови или сыворотке пациента или при втором стандартном условии (которое можно, например, выбрать для имитации или представления условий в крови или сыворотке).
[0052] Соединяющие группы, способные расщепляться, чувствительны к агентам расщепления, например, pH, окислительно-восстановительному потенциалу или присутствию разрушающих молекул. Как правило, агенты расщепления являются более доминирующими или обнаруживают уровни активности более высокие в клетках, чем в сыворотке или крови. Примеры таких разрушающих агентов включают окислительно-восстановительные агенты, которые выбирают для определенных субстратов или которые не имеют специфичности к субстрату, включая, например, окислительные или восстановительные ферменты или восстановители, такие как меркаптаны, присутствующие в клетках, которые могут разрушать редокс-расщепляемую соединяющую группу путем восстановления; эстеразы; амидазы; эндосомы или агенты, которые могут создавать кислую среду, например, вещества, которые приводят рН к 5 или ниже; ферменты, которые могут гидролизовать или разрушать расщепляемую кислотой соединяющую группу путем действия как обычная кислота, пептидазы (которые могут быть субстратспецифическими) и протеазы и фосфатазы.
[0053] Линкер может включать расщепляемую соединяющую группу, которая может расщепляться определенным ферментом. Тип расщепляемой соединяющей группы, включенной в линкер, может зависеть от клетки, которая является мишенью. Например, лиганды, имеющие мишенью печень, могут быть соединены с катионными липидами через линкер, который включает сложноэфирную группу. Клетки печени богаты эстеразами, и поэтому линкер будет расщепляться более эффективно в клетках печени, чем в типах клеток, которые не богаты эстеразами. Другие типы клеток, богатых эстеразами, включают клетки легкого, коркового вещества почек и яичка. Линкеры, которые содержат пептидные связи, можно использовать, когда типы клеток-мишеней богаты пептидазами, такие как клетки печени и синовиоциты.
[0054] В некоторых вариантах осуществления расщепляемая соединяющая группа расщепляется по меньшей мере в 1,25, 1,5, 1,75, 2, 3, 4, 5, 10, 25, 50 или 100 раз быстрее в клетке (или в условиях in vitro, выбранных для имитации условий внутри клетки) по сравнению с кровью или сывороткой (или в условиях in vitro, выбранных для имитации условий вне клетки). В некоторых вариантах осуществления расщепляемая соединяющая группа расщепляется менее, чем на 90%, 80%, 70%, 60%, 50%, 40%, 30%, 20%, 10%, 5% или 1% в крови (или в условиях in vitro, выбранных для имитации условий вне клетки) по сравнению с расщеплением в клетке (или в условиях in vitro, выбранных для имитации условий внутри клетки).
[0055] Примеры расщепляемых соединяющих групп включают, но не ограничиваются перечисленным, редокс-расщепляемые соединяющие группы (например, -S-S- и -C(R)2-S-S-, где R представляет собой H или C1-C6-алкил, и по меньшей мере один R представляет собой C1-C6-алкил, такой как CH3 или CH2CH3); расщепляемые соединяющие группы на основе фосфатов (например, -O-P(O)(OR)-O-, -O-P(S)(OR)-O-, -O-P(S)(SR)-O-, -S-P(O)(OR)-O-, -O-P(O)(OR)-S-, -S-P(O)(OR)-S-, -O-P(S)(ORk)-S-, -S-P(S)(OR)-O-, -O-P(O)(R)-O-, -O-P(S)(R)-O-, -S-P(O)(R)-O-, -S-P(S)(R)-O-, -S-P(O)(R)-S-, -O-P(S)(R)-S-, -O-P(O)(OH)-O-, -O-P(S)(OH)-O-, -O-P(S)(SH)-O-, -S-P(O)(OH)-O-, -O-P(O)(OH)-S-, -S-P(O)(OH)-S-, -O-P(S)(OH)-S-, -S-P(S)(OH)-O-, -O-P(O)(H)-O-, -O-P(S)(H)-O-, -S-P(O)(H)-O-, -S-P(S)(H)-O-, -S-P(O)(H)-S- и -O-P(S)(H)-S-, где R представляет собой необязательно замещенный линейный или разветвленный C1-C10-алкил); расщепляемые кислотой соединяющие группы (например, гидразоны, сложные эфиры и эфиры аминокислот, -C=NN- и -OC(O)-); расщепляемые соединяющие группы на основе сложного эфира (например, -C(O)O-); расщепляемые соединяющие группы на основе пептидов (например, соединяющие группы, которые расщепляются в клетках ферментами, такими как пептидазы и протеазы, например, - NHCHRAC(O)NHCHRBC(O)-, где RA и RB представляют собой группы R двух соседних аминокислот). Расщепляемая соединяющая группа на основе пептида включает две или больше аминокислот. В некоторых вариантах осуществления расщепляемая соединяющая группа на основе пептида включает аминокислотную последовательность, которая является субстратом для пептидазы или протеазы, обнаруженной в клетках.
[0056] В некоторых вариантах осуществления расщепляемая кислотой соединяющая группа может расщепляться в кислой среде с рН примерно 6,5 или ниже (например, примерно 6,5, 6,0, 5,5, 5,0 или ниже) или такими агентами, как ферменты, которые могут действовать как обычная кислота.
[0057] Линкеры по настоящему изобретению включают части, включающие две или больше углеродсодержащих молекул, таких как, например, этилендиамин, этиленгликоль, бета-аланин и полиэтиленгликоль (ПЭГ) с молекулярной массой примерно 44 - примерно 200 кД. Кроме того, из настоящего раскрытия следует иметь в виду, что платиновая часть и/или липид могут быть модифицированы для включения функциональных групп для соединения с молекулой-линкером.
[0058] В некоторых вариантах осуществления различных аспектов, раскрываемых в настоящем описании, линкер представляет собой -X-CH2-X2-X1-, где X представляет собой NH; X1 представляет собой C(O)O, C(O)NH, O(CH2)-O, NH или O; X2 представляет собой (CH2)n или C(O); и n равен 0, 1, 2, 3, 4 или 5.
[0059] В некоторых вариантах осуществления линкер представляет собой -(CH2)nO-, -(CH2)nNHC(O)O-, -(CH2)nOC(O)NH-, -(CH2)nC(O)NH(CH2)mO-, -(CH2)nO(CH2)mO-, -(CH2)nO(O)-, -(CH2)nNHC(O)(CH2)mO- или -(CH2)nC(O)O-; и n и m независимо равны 0, 1, 2, 3, 4 или 5.
[0060] В еще некоторых других вариантах осуществления линкер представляет собой -X3-X4X5-X6-, где X3 представляет собой CH, CH2 или O; и X4, X5 и X6 независимо являются одинаковыми или различными и представляют собой -CH2O- или O.
[0061] В еще некоторых других вариантах осуществления линкер представляет собой -CH2O-.
[0062] В некоторых вариантах осуществления линкер выбирают из группы, состоящей из связи, -O-, NHCH2CH2NHC(O)-, -NHCH2CH2NHC(O)O-, -NHCH2CH2-, -NHCH2CH2O-, -NHCH2C(O)-, -NHCH2C(O)O-, -NHCH2C(O)OCH2CH2CH2-, -NHCH2C(O)OCH2CH2CH2O-, -NHCH2C(O)NH-, -CH2CH2-, -CH2CH2O-, -CH2CH2NHC(O)-, -CH2CH2NHC(O)O-, -CH2CH2O-, -CH2C(O)NHCH2CH2-, -CH2C(O)NHCH2CH2O-, -CH2CH2OCH2CH2-, -CH2CH2OCH2CH2O-, -CH2C(O)-, -CH2C(O)O-, -CH2CH2CH2-, --CH2CH2CH2O-, =CH-CH=CH2-, =CH-CH=CHCH2O-, -CH=CHCH2-, -CH=CHCH2O-, -OCH2CH2O-, -CH2-, -CH2O-, -NHC(O)CH2-, -NHC(O)CH2O-, -C(O)CH2-, -C(O)CH2O-, -OC(O)CH2-, -OC(O)CH2O-, -C(O)CH2CH2C(O)NHCH2CH2-, -OC(O)CH2CH2C(O)NHCH2CH2-, -C(O)CH2CH2C(O)NHCH2CH2O-, -OC(O)CH2CH2C(O)NHCH2CH2O-, -C(O)CH2CH2C(O)NHCH2CH2NHC(O)-, -OC(O)CH2CH2C(O)NHCH2CH2NHC(O)-, -C(O)CH2CH2C(O)NHCH2CH2NHC(O)O-, -OC(O)CH2CH2C(O)NHCH2CH2NHC(O)O- и их любых комбинаций.
[0063] В некоторых вариантах осуществления соединения на основе платины, раскрываемые в настоящем описании, представлены формулой (I)

где
X представляет собой NH;
X1выбирают из группы, включающей COOH, CONH2, O-(CH2)n-OH, NH2 и OH;
X2представляет собой (CH2)n или CO;
X3 выбирают из группы, включающей(CH2)n, CH2-NH и C4H8;
X4 представляет собой CO или -CH-CH3;
Z представляет собой содержащее платину соединение, в котором платина образует часть цикла формулы I; и
N равен 0, 1 или 2.
[0064] В некоторых других вариантах осуществления соединения на основе платины, раскрываемые в настоящем описании, представлены формулой (II)
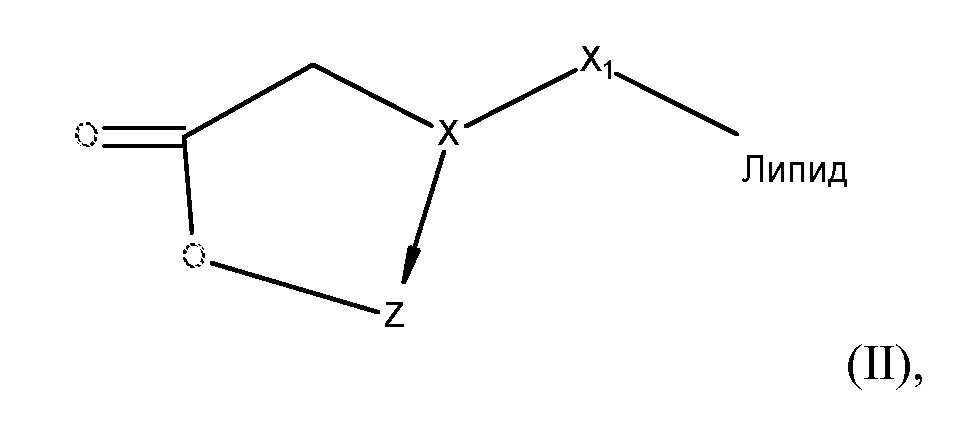
где
X представляет собой NH или N-CH2COO-;
X1 выбирают из группы, включающей -(CH2)nOH, -(CH2)nNHCOOH, -(CH2)nCONH(CH2)nOH, (CH2)nO(CH2)nOH, (CH2)nC=O, -(CH2)nNHCO(CH2)nOH и (CH2)n-COOH;
Z представляет собой содержащее платину соединение, в котором платина образует часть цикла формулы II; и
N равен 0, 1 или 2.
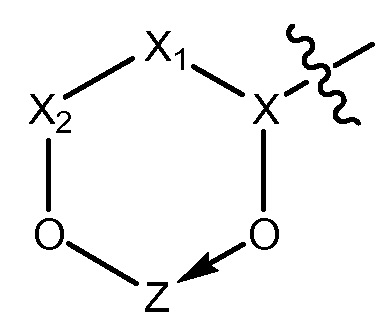
[0065] В некоторых вариантах осуществления соединения на основе платины, раскрываемые в настоящем описании, представлены формулой (III)

где
X выбирают из группы, включающей S+, C, S+=O, N+H и P=O;
X1 выбирают из группы, включающей -CH, -CH2и -CH2O;
X2 равен C=O;
X3 выбирают из CH, CH2 или O;
X4, X5, X6 выбирают из -CH2O или O;
Z представляет собой содержащее платину соединение, в котором платина образует часть цикла формулы III.
[0066] В некоторых вариантах осуществления соединения на основе платины, раскрываемые в настоящем описании, представлены формулой (IV):

где
X представляет собой CH2OH;
X1 представляет собой (CH2)n;
X2 представляет собой C=O;
Z представляет собой содержащее платину соединение, в котором платина образует часть цикла формулы IV; и
N равен 0, 1 или 2.
[0067] Примеры соединений формулы (I) включают, но не ограничиваются перечисленным, следующие соединения:

Соединение 1
Соединение 2
Соединение 3

Соединение 4

Соединение 5

Соединение 6
Соединение 7
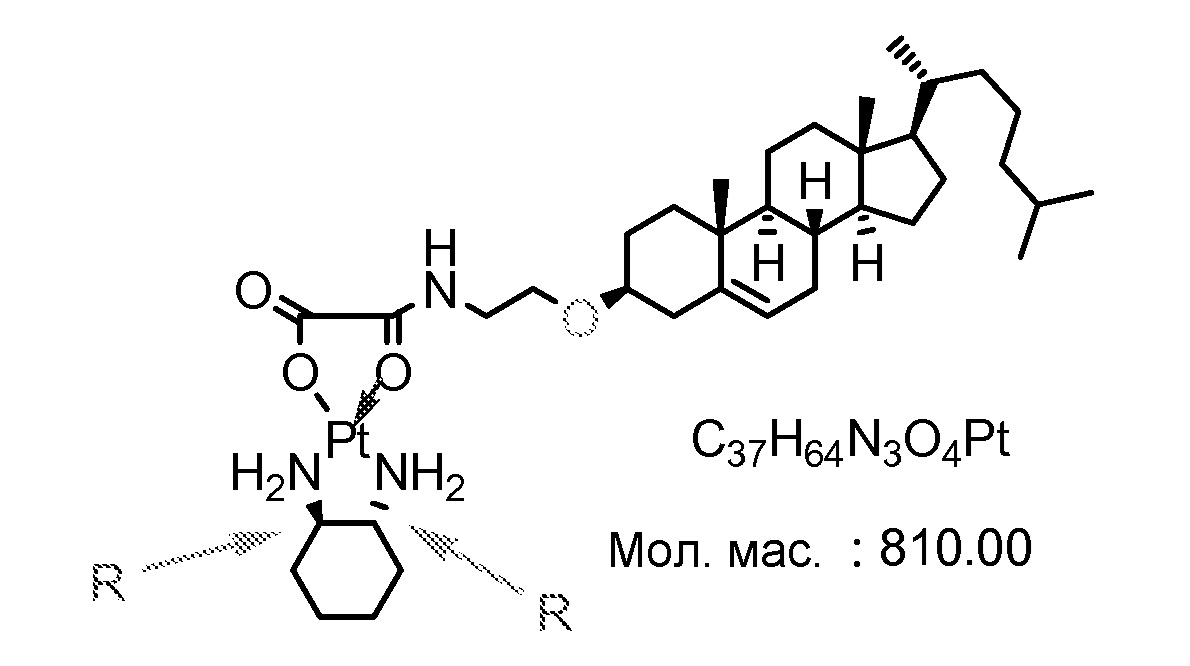
Соединение 8

Соединение 9

Соединение 10
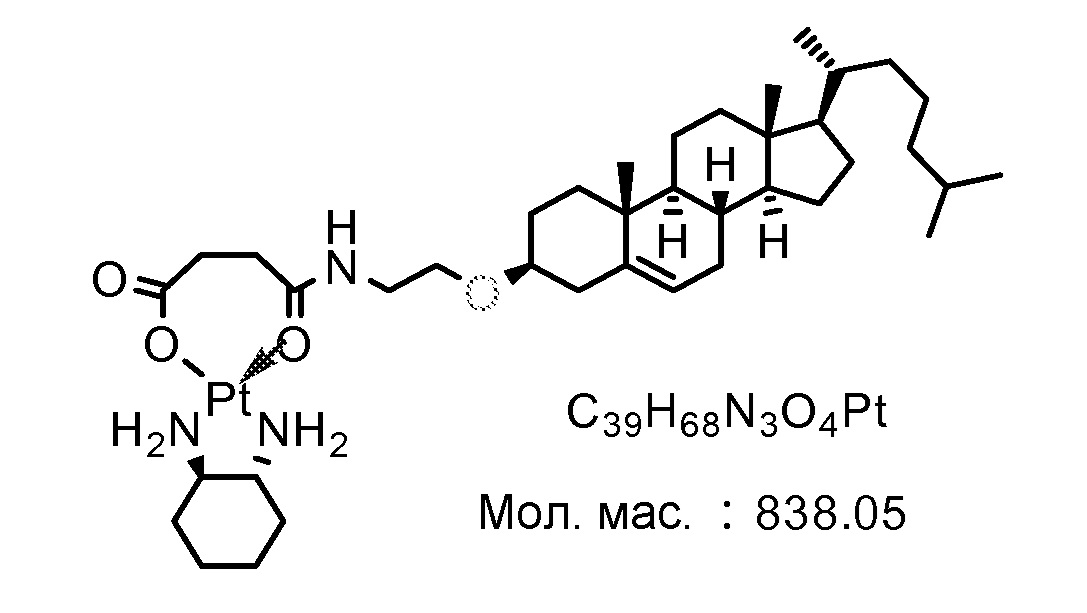
Соединение 11
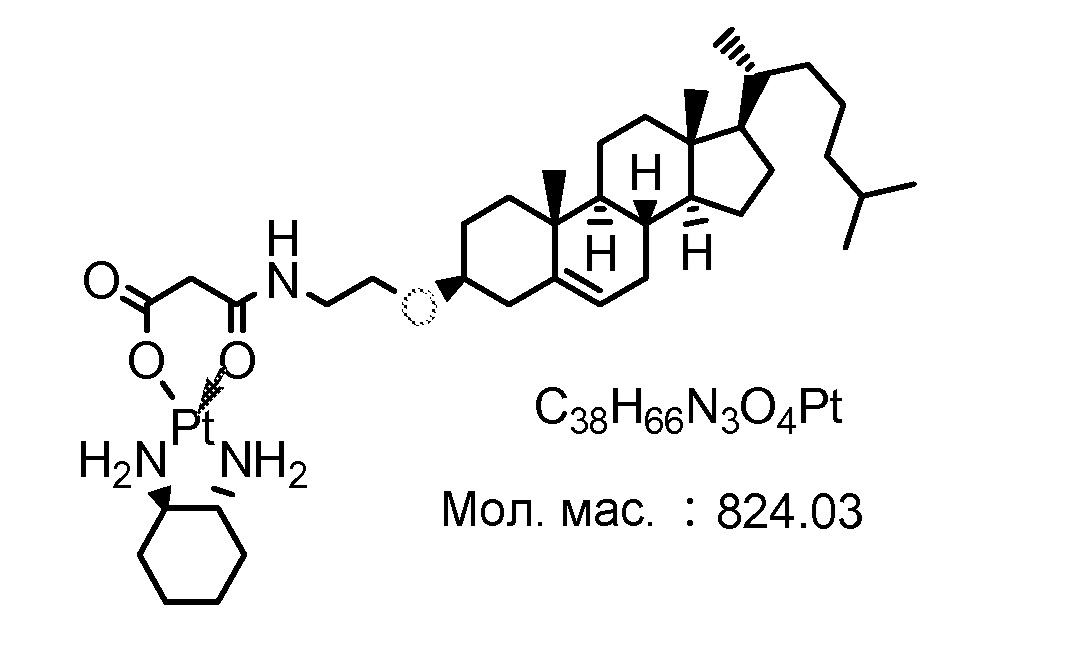
Соединение 12
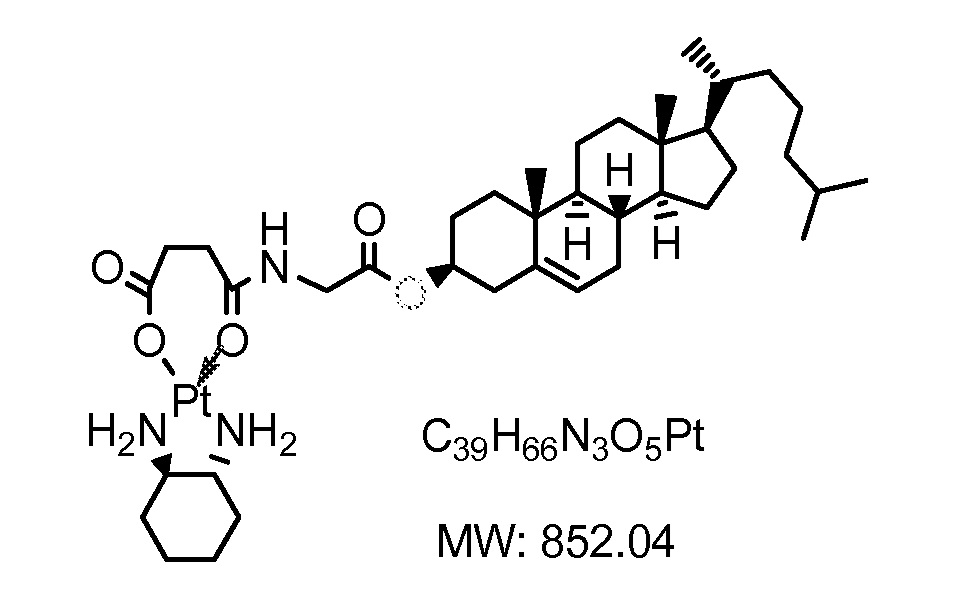
Соединение 13
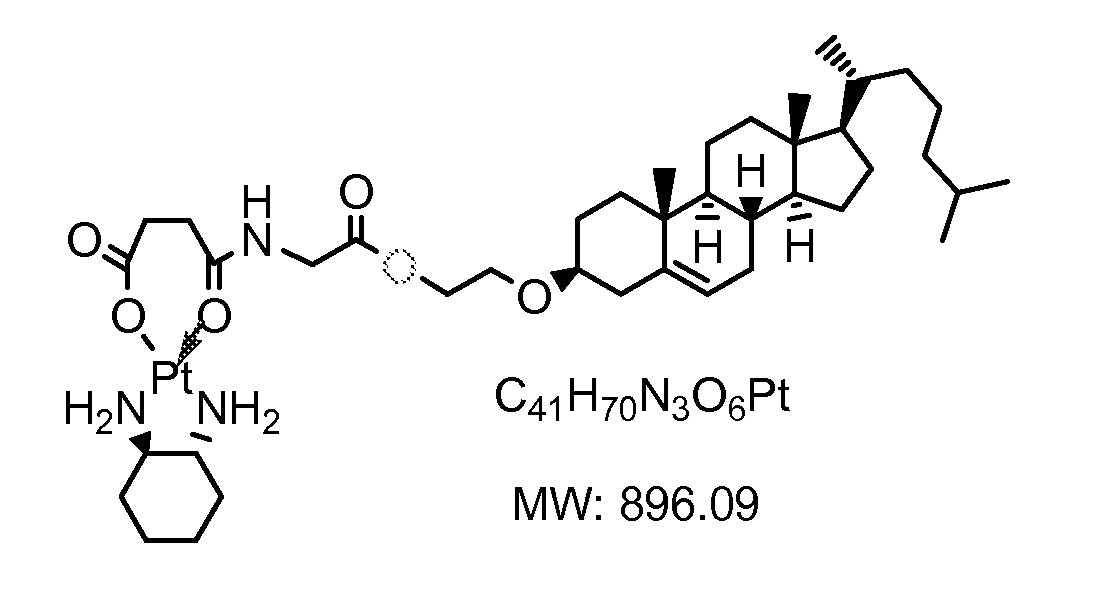
Соединение 14

Соединение 15

Соединение 16
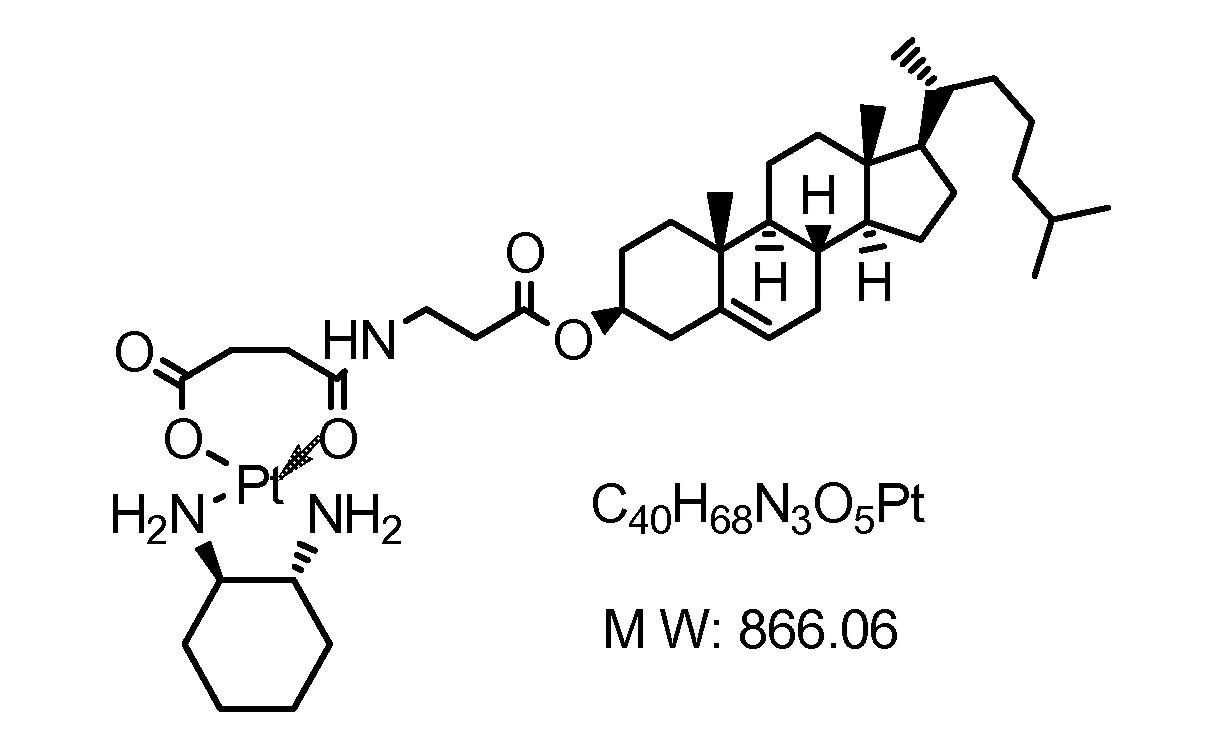
Соединение 17
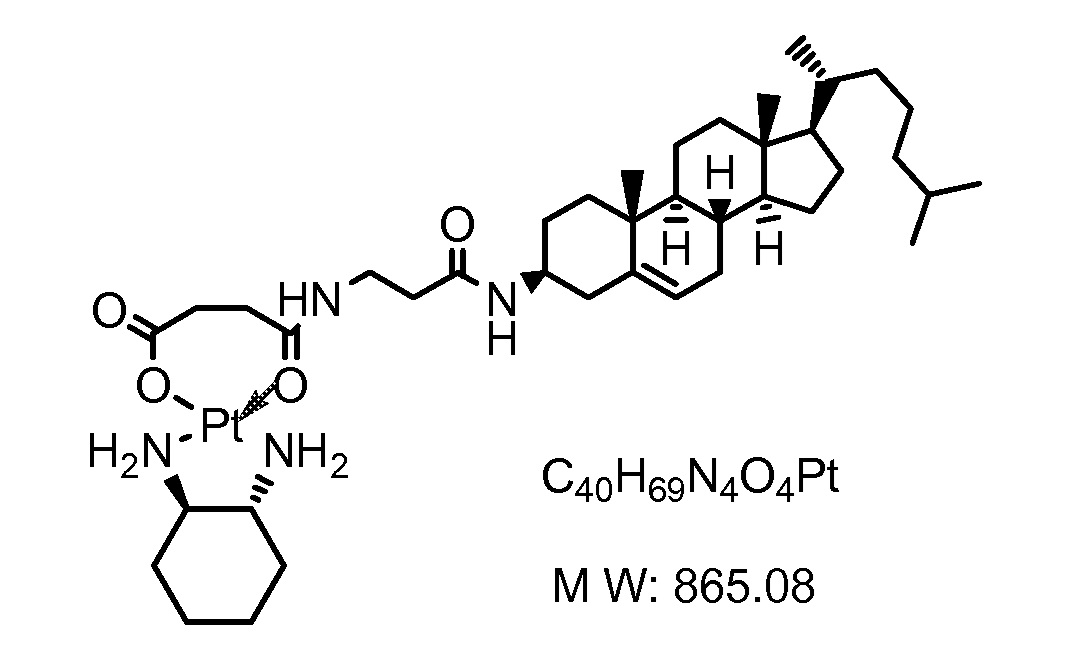
Соединение 18
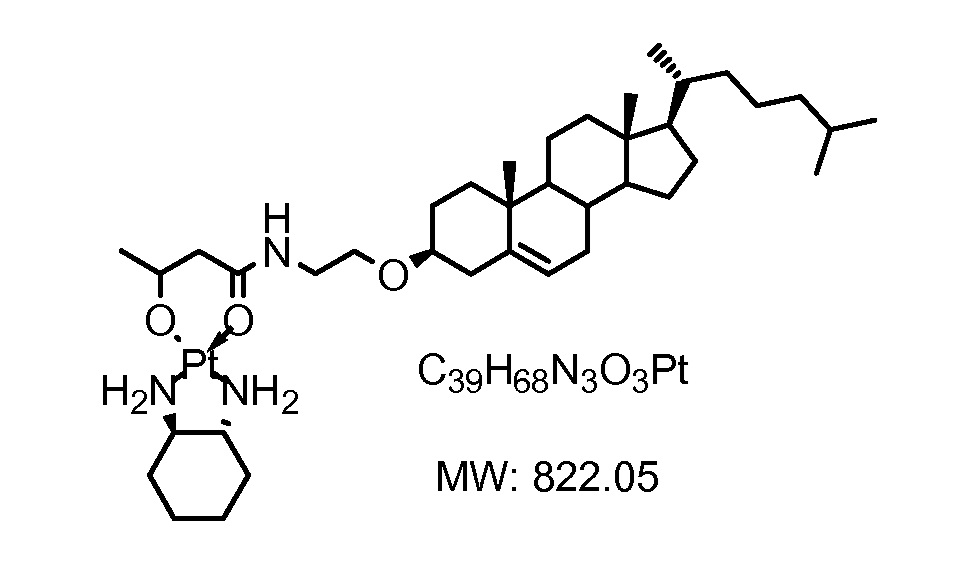
Соединение 19

Соединение 20
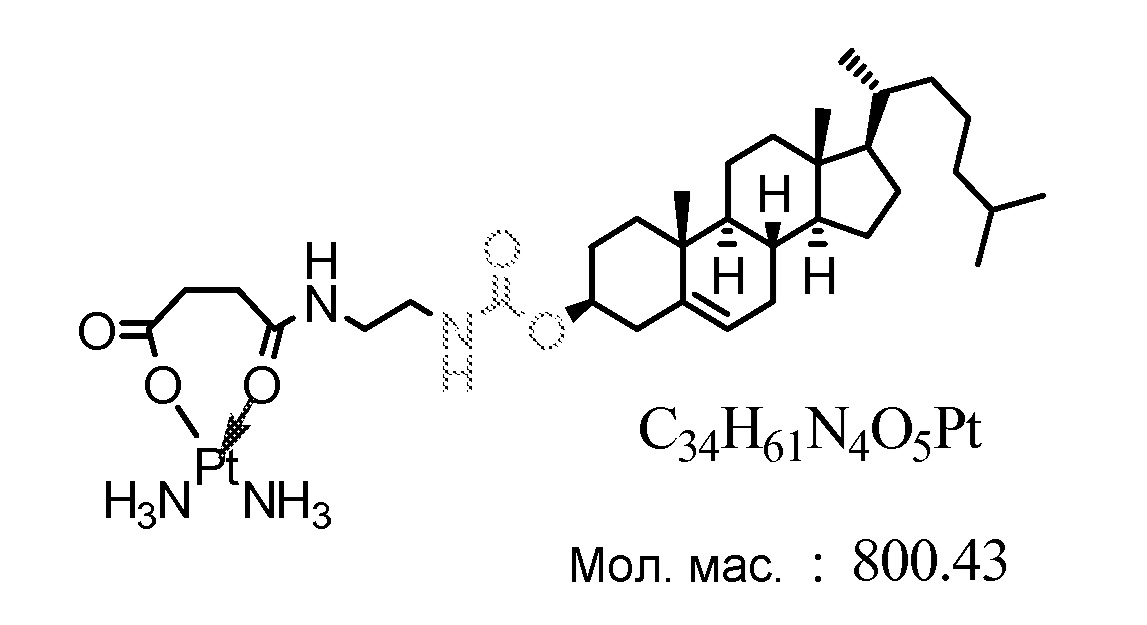
Соединение 21
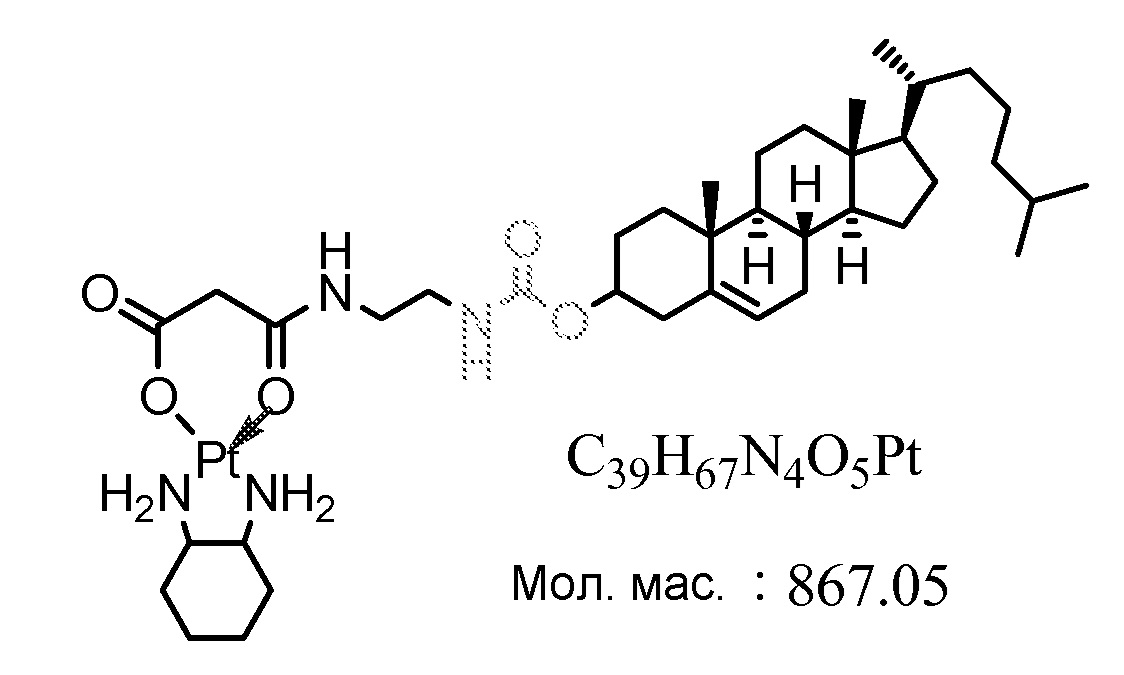
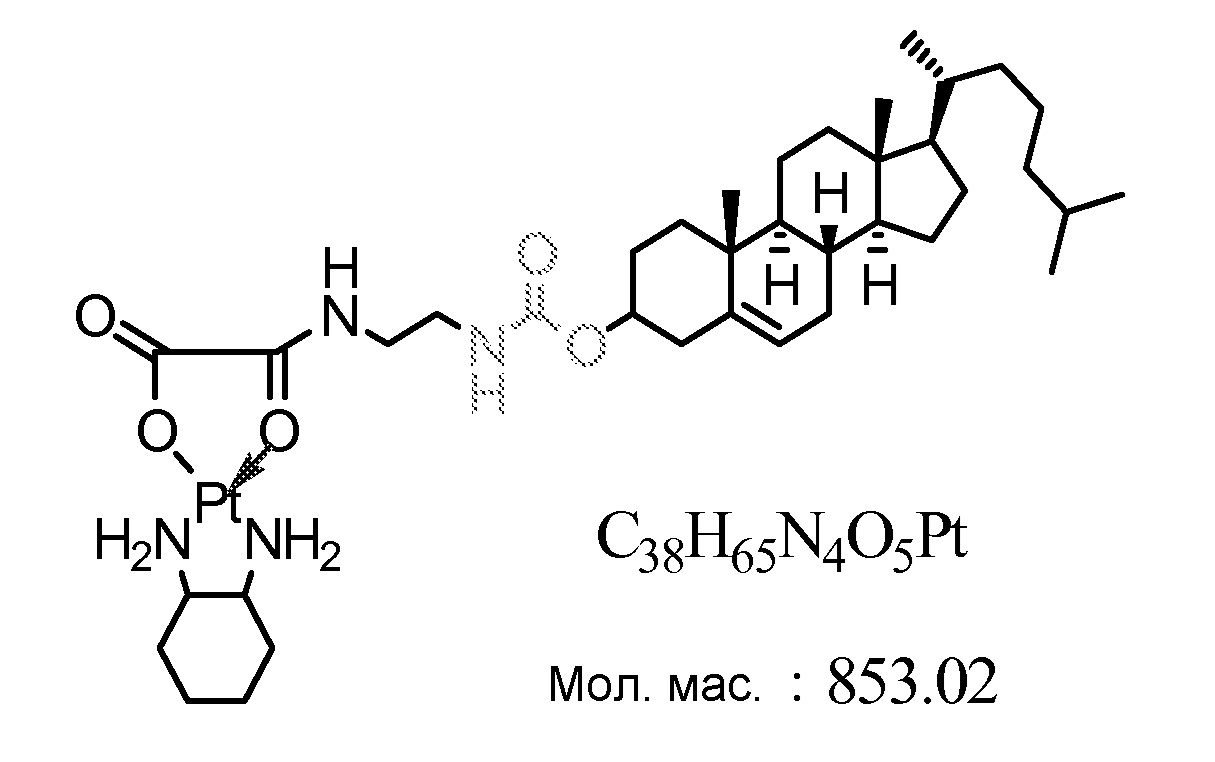
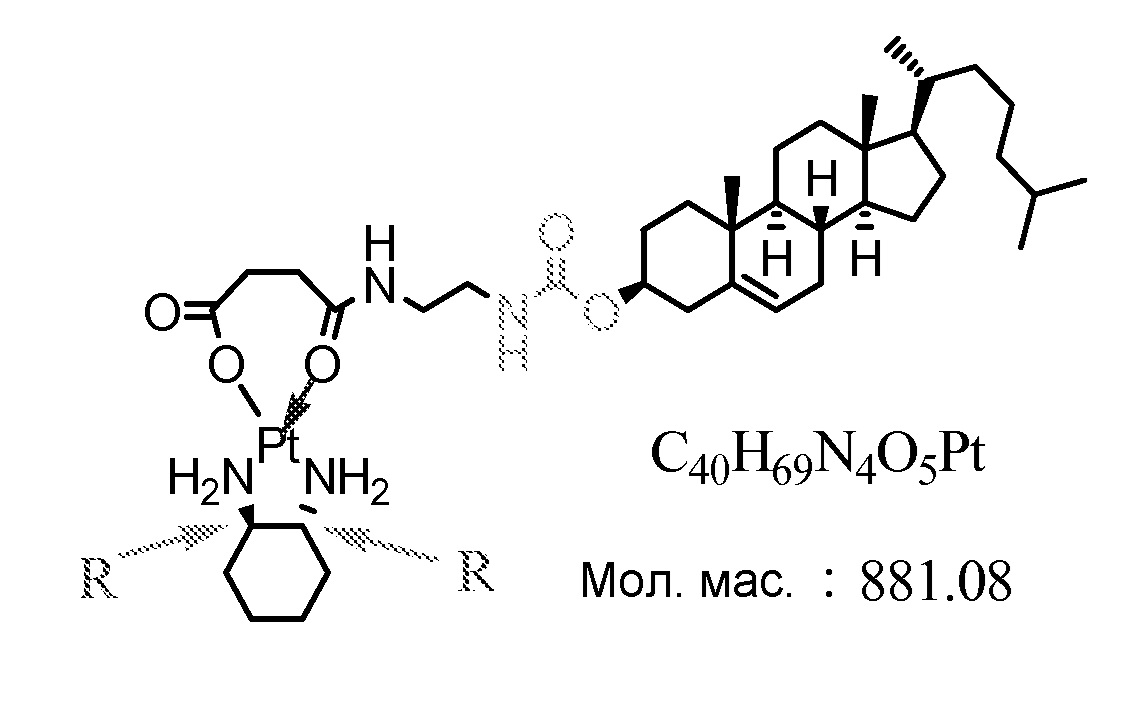
[0068] Примеры соединений формулы (II) включают, но не ограничиваются перечисленным, следующие соединения:

Соединение 25

Соединение 26
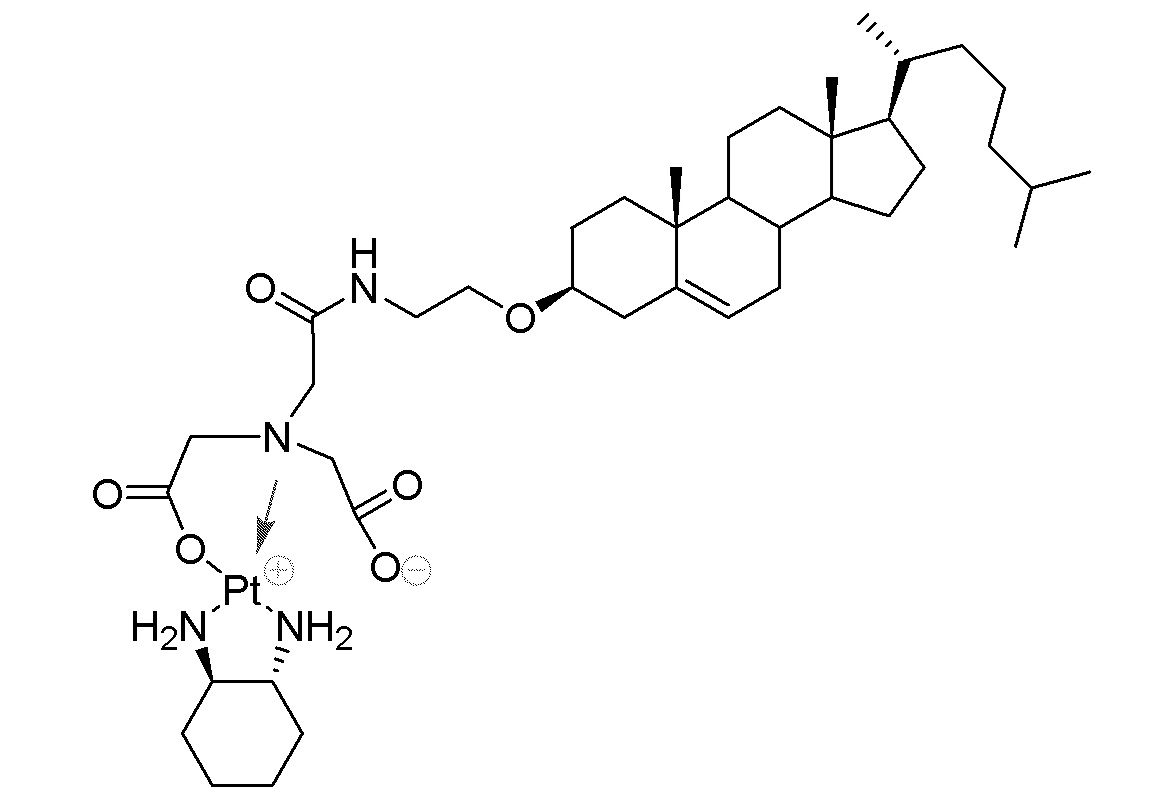
Соединение 27
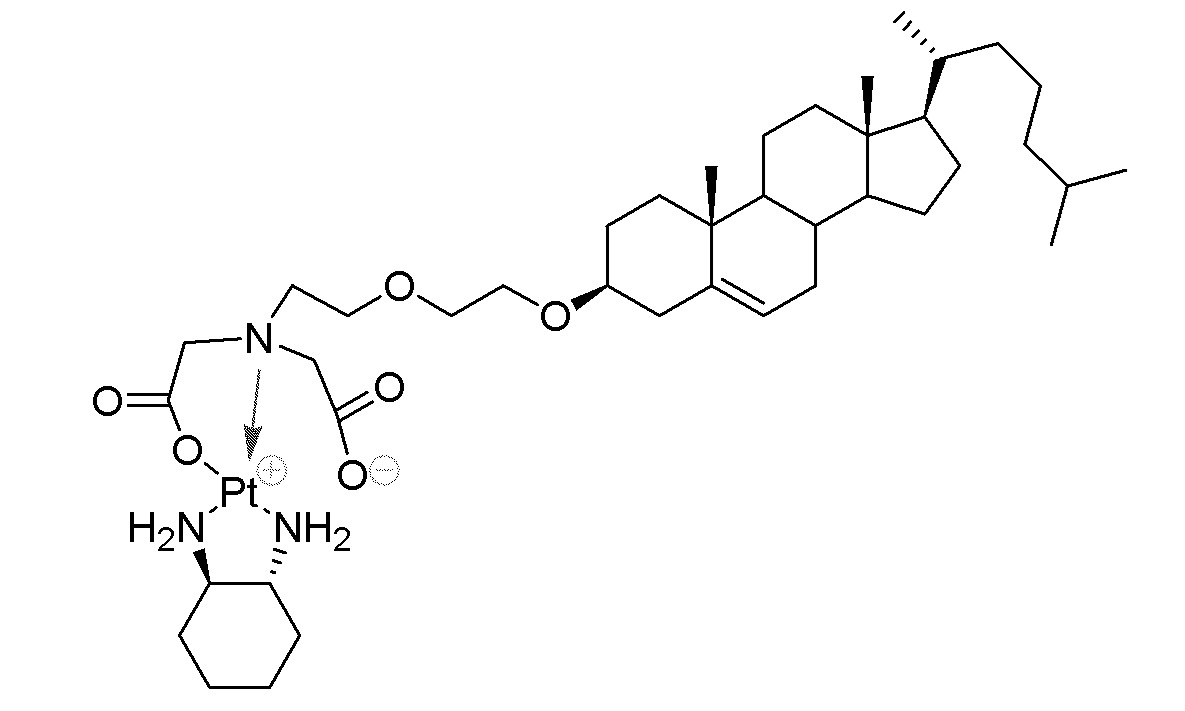
Соединение 28
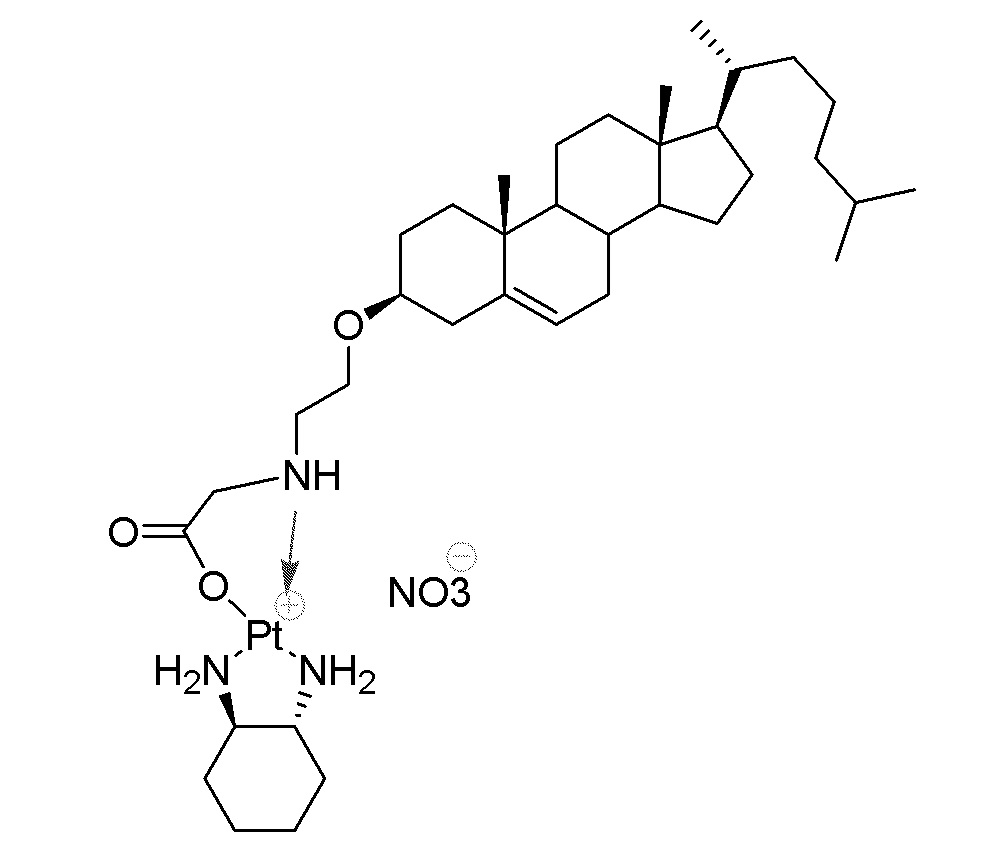
Соединение 29

Соединение 38
Соединение 39

Соединение 40

Соединение 41
Соединение 42
[0069] Примеры соединений формулы (III) включают, но не ограничиваются перечисленным, следующие соединения:

Соединение 66
Соединение 67

Соединение 68

Соединение 69

Соединение 70

Соединение 72

Соединение 71
[0070] Примеры соединений формулы (IV) включают, но не ограничиваются перечисленным, следующие соединения:

Соединение 22
[0071] Раскрытие также относится к следующим соединениям:
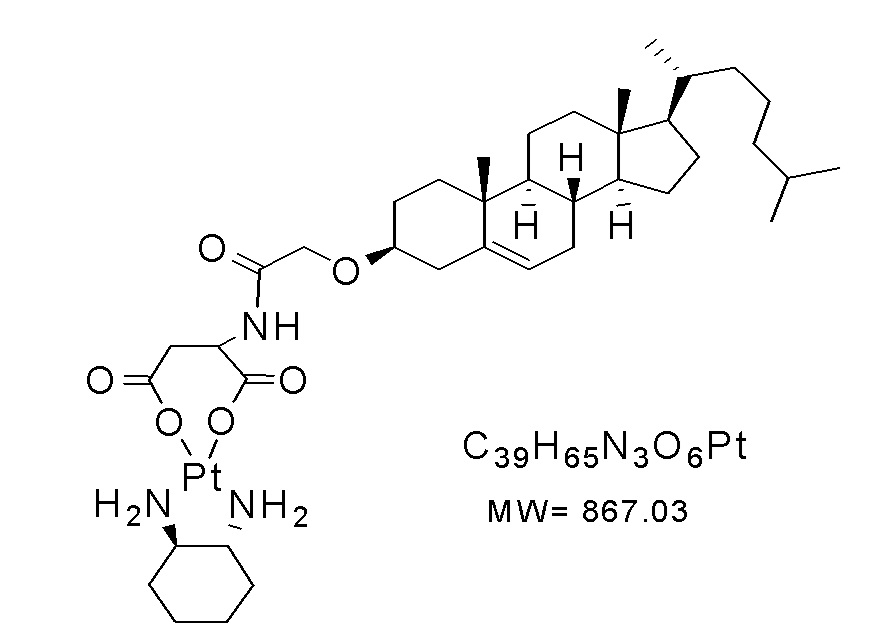
Соединение 23
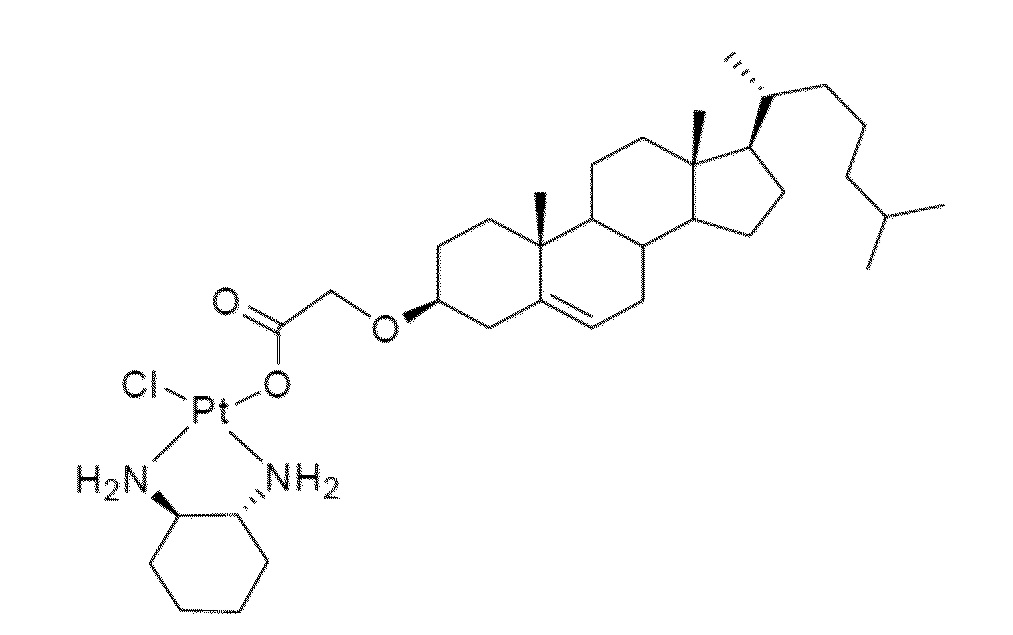
Соединение 30
[0072] В некоторых вариантах осуществления платиновая часть комплексов на основе платины по настоящему раскрытию представляет собой соединение платины (IV). Указанные комплексы с соединенями платины (IV) представлены далее.
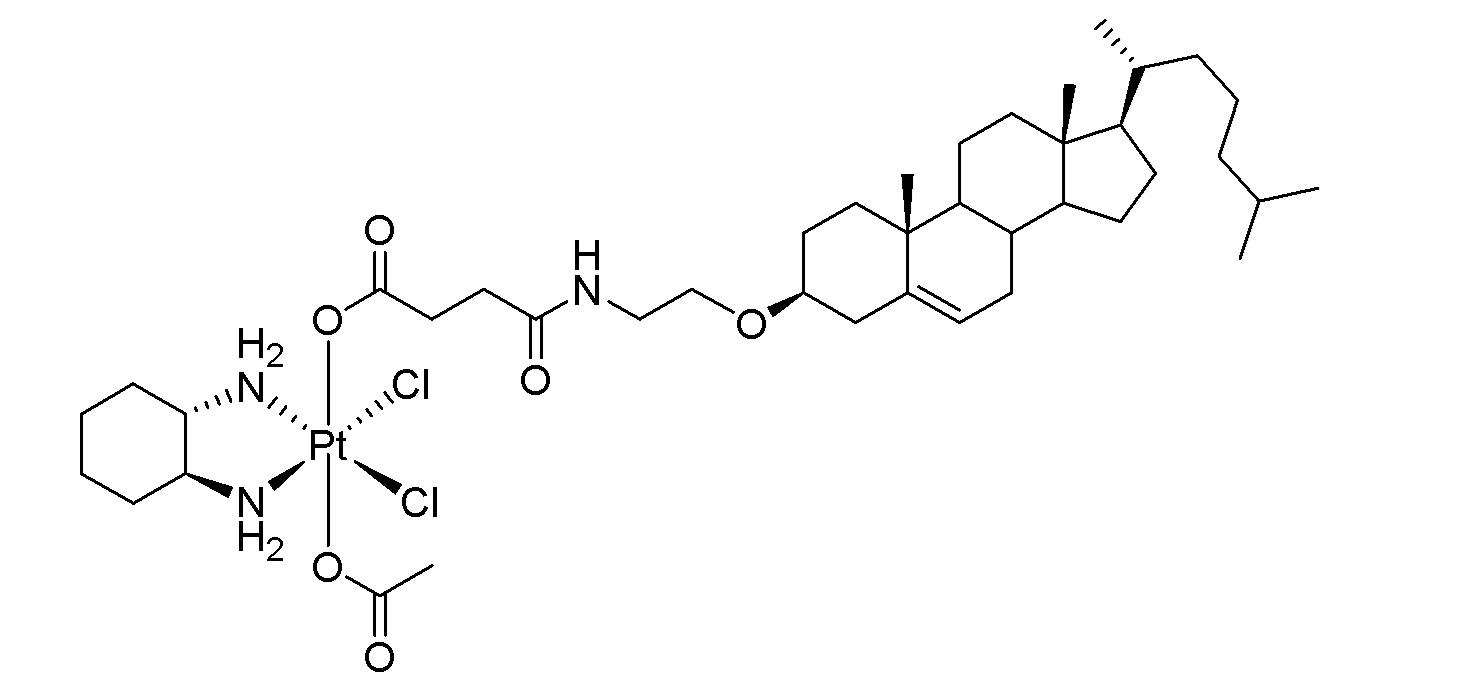
Соединение 96

Соединение 97
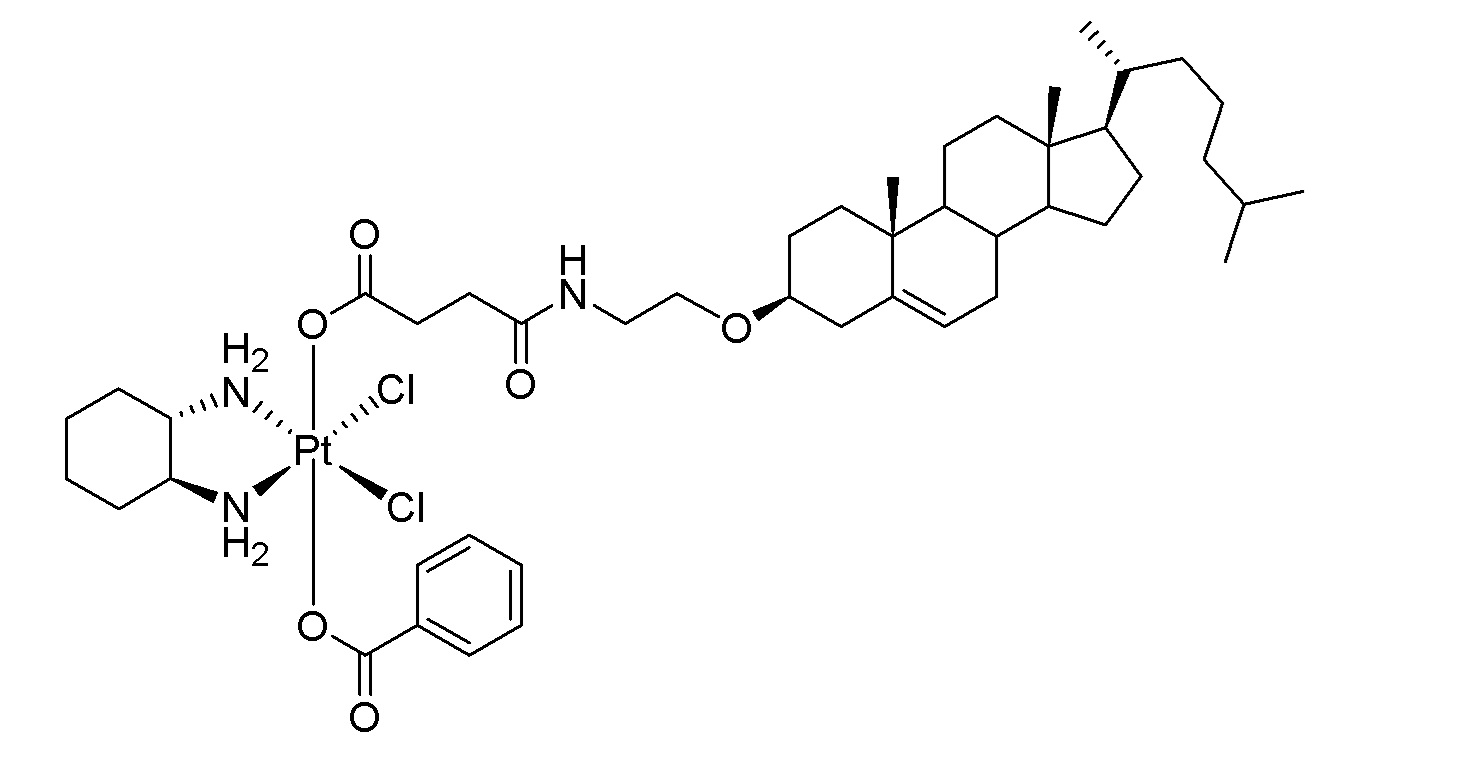
Соединение 98

Соединение 99
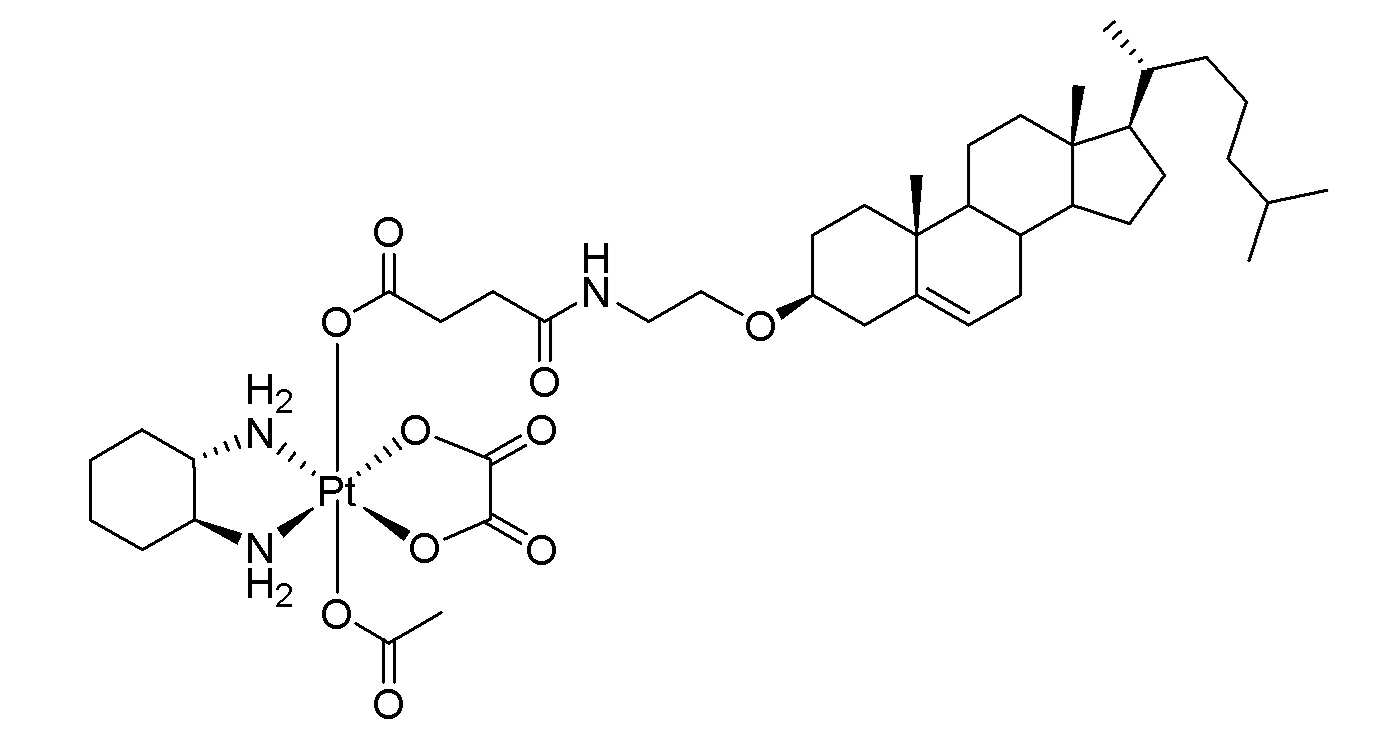
Соединение 100
[0073] В некоторых вариантах осуществления различных аспектов, раскрываемых в настоящем описании, раскрытие относится к соединению платины (II) формулы (V)
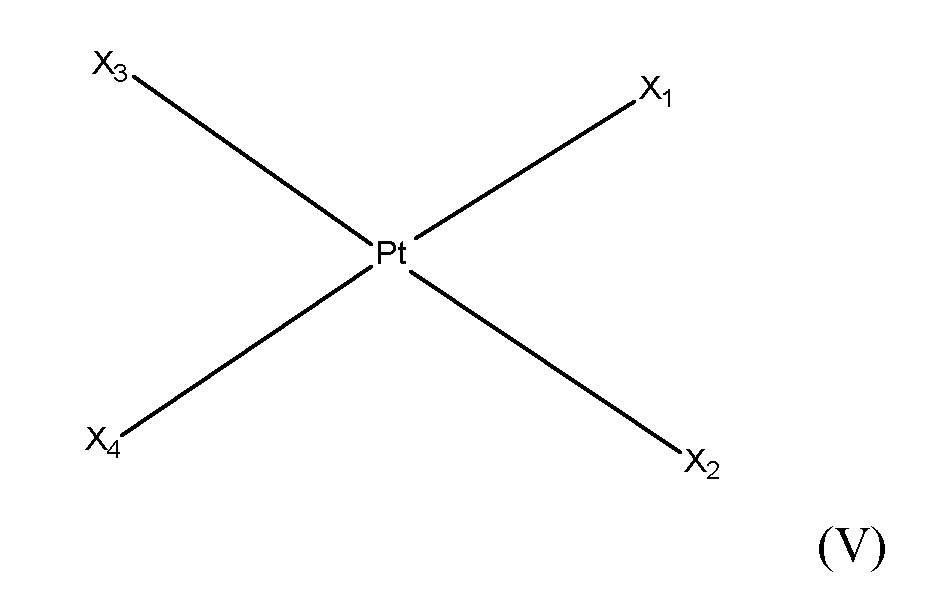
где
X1, X2, X3 и X4выбирают независимо из группы, состоящей из O, P, S, Se, Cl, N, C, O-A, O-B, DACH, галогенидов и хелатированной или нехелатированной дикарбоксилато-соединяющей группы и их любых комбинаций;
при этом A и B выбирают независимо из группы, состоящей из C, P, S, N и их любых комбинаций; и
при этом X4 является необязательным.
[0074] В некоторых вариантах осуществления различных аспектов, раскрываемых в настоящем описании, соединение платины (II) формулы (V) выбирают из группы, включающей соединения 43-65 и 73-85 и соединение 95. В предпочтительном варианте осуществления соединение Pt(II) представляет собой DACH-Pt.
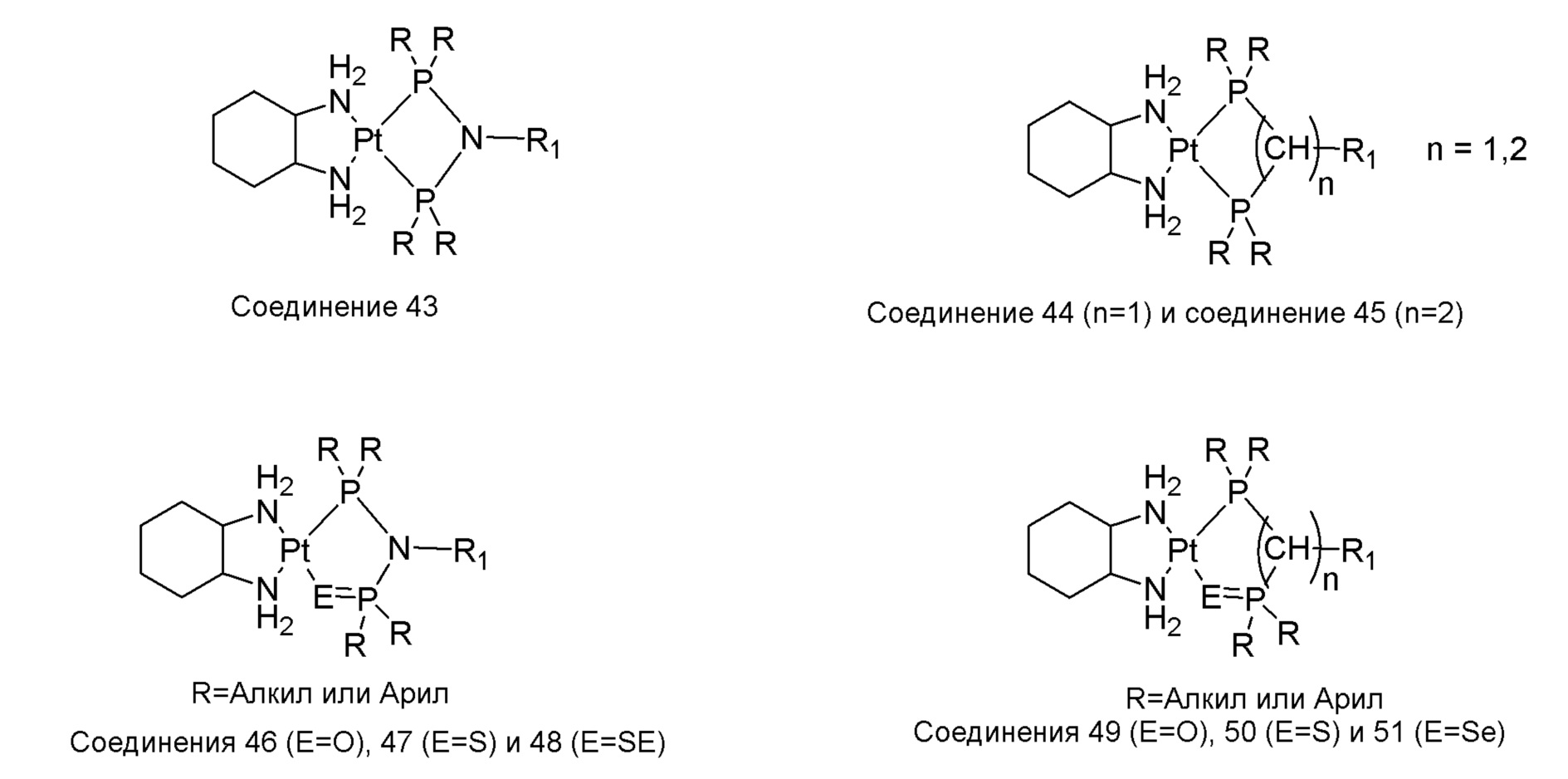





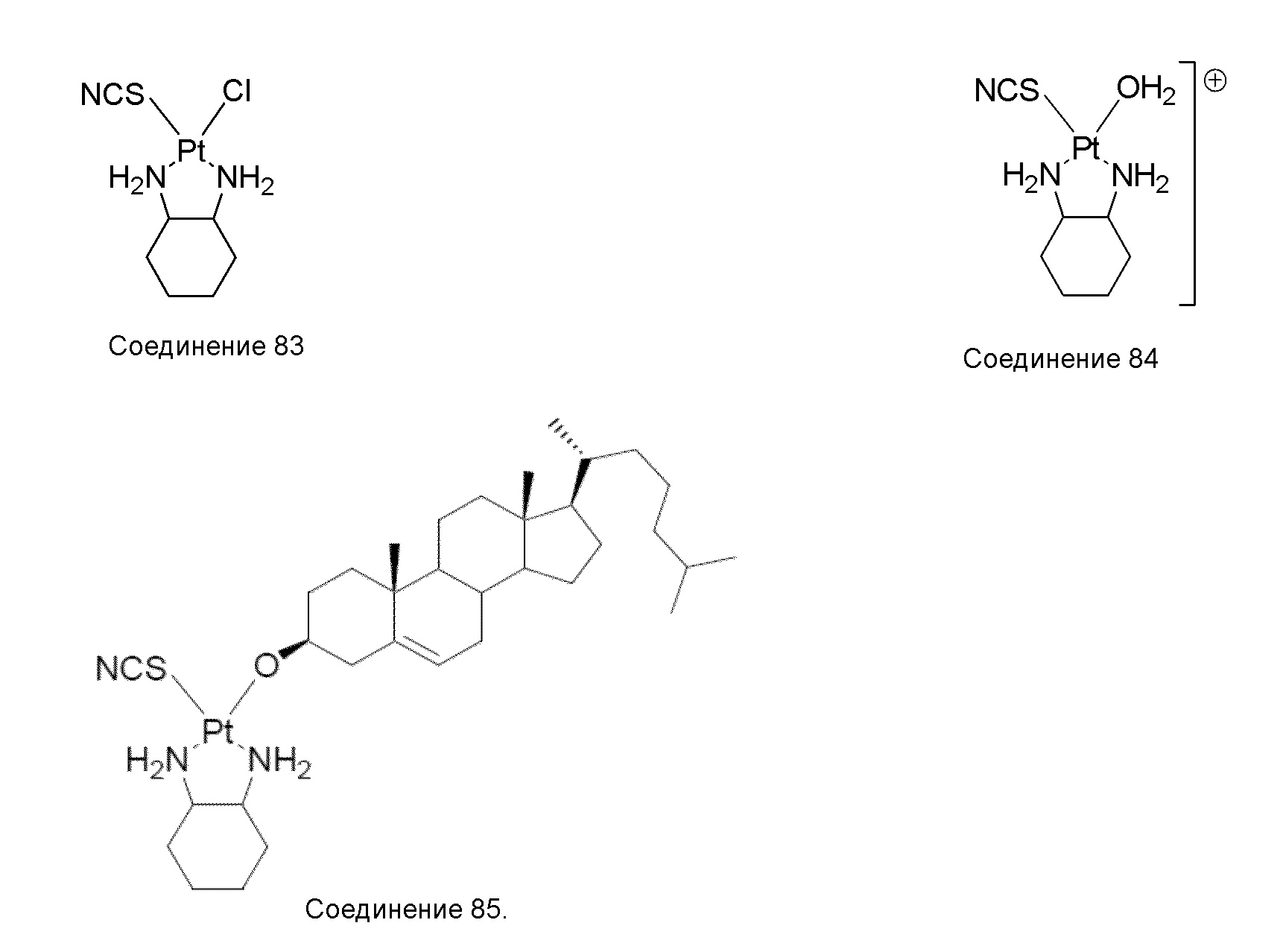
[0075] В указанных выше соединениях R1 представляет собой -линкер-липид, и n равен 1, если не указано иное.
[0076] В еще одном варианте осуществления соединение (II) [соединение 95] также охватывается настоящим раскрытием.
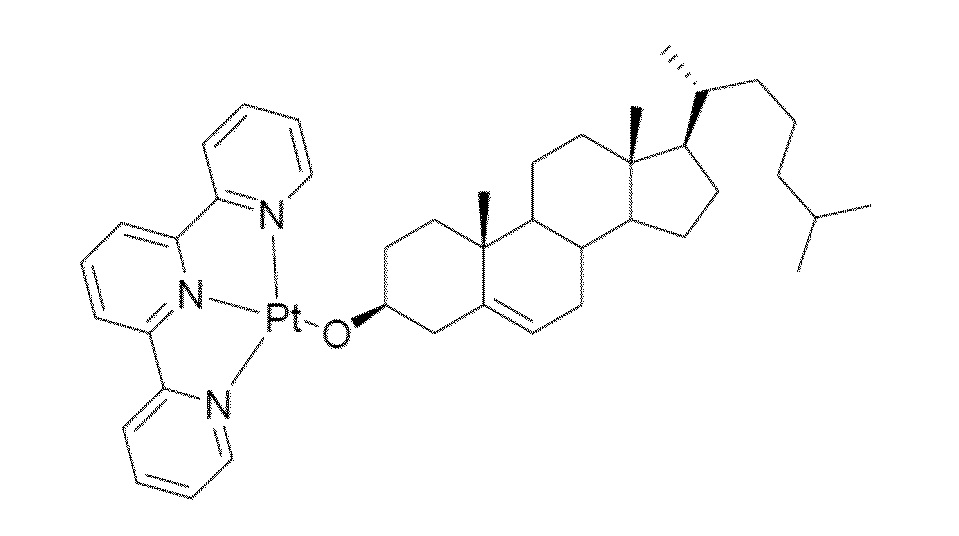
Соединение 95
[0077] Синтез некоторых примеров соединений формулы (V) описывается в разделе «Примеры».
[0078] Без желания привязываться к какой-либо теории, соединения, раскрытые в настоящем описании, показывают более высокое поглощение платины в раковых клетках относительно цисплатина и оксалиплатина. Как видно на фиг. 8, поглощение цисплатина и оксалиплатина в клетках MDA-MB-231 схоже. Однако все испытанные примеры соединений показывают более высокое поглощение (~7-20-кратное). Такие результаты показывают, что при введении платины в эквивалентных концентрациях поглощение в раковых клетках соединений, приведенных как примеры, существенно выше по сравнению с цисплатином или оксалиплатином. В некоторых вариантах осуществления соединения, раскрытые в настоящем описании, в эквивалентной дозировке имеют большее примерно на 25%, примерно на 50%, примерно на 75%, примерно 1-кратное, примерно 5-кратное, примерно 10-кратное, примерно 15-кратное, примерно 20-кратное, примерно 25-кратное или более высокое поглощение платины в раковых клетках относительно цисплатина или оксалиплатина.
[0079] Кроме того, соединения, раскрытые в настоящем описании, также имеют более высокое, чем цисплатин и оксалиплатин, накопление платины в ткани, такой как, но без ограничения, опухоль, при дозировке в эквивалентном количестве. Например, соединения, раскрытые в настоящем описании, имеют большее примерно на 25%, примерно на 50%, примерно на 75%, примерно 1-кратное, примерно 5-кратное, примерно 10-кратное, примерно 15-кратное, примерно 20-кратное, примерно 25-кратное или более высокое накопление платины в ткани относительно цисплатина или оксалиплатина при дозировке в эквивалентных количествах.
[0080] Настоящее раскрытие относится к синтезу ряда наночастиц на основе платины, в которых диаминоциклогексил-Pt (DACH-Pt) имеет монокарбоксилированную ковалентную связь через карбоксильную группу и координационную связь с кислородом амида. Используют дикарбонилсодержащие молекулы (дикарбоновые кислоты), такие как янтарная кислота, малоновая кислота и щавелевая кислота, которые в конечном итоге образуют семи-, шести- и пятичленные циклы с платиной (II), соответственно. Линкер между платиносодержащим циклом и холестерином способствует образованию связей, выбранных из группы, включающей карбаматную связь (соединения 1, 2, 3), простую эфирную связь (соединения 6, 4, 5) или подобные связи или их любые комбинации. Поэтому некоторые из вариантов осуществления настоящего раскрытия относятся к соединениям, представленным главной цепью липил-линкер-дикарбонил. Такие молекулы используются для образования через ковалентные и/или координационные связи комплексных соединений платины, таких как DACH-Pt, оксалиплатин, цисплатин, содержащих платину карбенов или других платинатов и соединений платины.
[0081] Одно из вариантов осуществления настоящего раскрытия также относится к некоторым вариантам соединений на основе платины, таким как рацематы, диастереомеры и т.п. (например, соединениям 1-6).
[0082] В одном из вариантов осуществления настоящего раскрытия может использоваться любая молекула, которая имеет две карбонильные группы. В одном варианте осуществления дикарбонилсодержащая молекула представляет собой дикарбоновую кислоту, такую как, например, янтарная кислота, малоновая кислота или щавелевая кислота.
[0083] Раскрытие также относится к частицам, включающим одно или несколько соединений на основе платины, описанных в настоящем описании. Как правило, частица, раскрываемая в настоящем описании, может быть любой конфигурации или формы, например, сферической, стержневидной, эллиптической, цилиндрической, капсулы или диска; и такие частицы могут являться частью сетки или скопления.
[0084] В некоторых вариантах осуществления частица представляет собой микрочастицу или наночастицу. Используемый в настоящем описании термин «микрочастица» относится к частице размером примерно 1 мкм - примерно 1000 мкм. Используемый в настоящем описании термин «наночастица» относится к частице размером примерно 0,1 нм - примерно 1000 нм. Как правило, частицы имеют любой размер от нм до миллиметров. В некоторых вариантах осуществления частицы имеют размер, колеблющийся от приблизительно 5 нм до приблизительно 5000 нм. В некоторых вариантах осуществления частицы имеют средний диаметр от приблизительно 50 нм до приблизительно 2500 нм. В некоторых вариантах осуществления частицы имеют средний диаметр от приблизительно 100 нм до приблизительно 2000 нм. В некоторых вариантах осуществления частицы имеют средний диаметр от приблизительно 150 нм до приблизительно 1700 нм. В некоторых вариантах осуществления частицы имеют средний диаметр от приблизительно 200 нм до приблизительно 1500 нм. В некоторых вариантах осуществления частицы имеют средний диаметр примерно 260 нм. В одном варианте осуществления частицы имеют средний диаметр от приблизительно 30 нм до приблизительно 150 нм. В некоторых вариантах осуществления частица имеет средний диаметр от приблизительно 100 нм до приблизительно 1000 нм, от приблизительно 200 нм до приблизительно 800 нм, от приблизительно 200 нм до приблизительно 700 нм или от приблизительно 300 нм до приблизительно 700 нм.
[0085] В некоторых вариантах осуществления частица имеет средний размер примерно 50 - примерно 1000 нм. В другом варианте осуществления наночастицы по настоящему изобретению находятся в интервале примерно 50 - примерно 500 нм. В другом варианте осуществления наночастицы по настоящему изобретению находятся в интервале примерно 50 - примерно 500 нм (фигура 5). В одном варианте осуществления частица имеет размер примерно 500 нм.
[0086] Специалисту в данной области техники следует иметь в виду, что частицы обычно показывают распределение частиц по размерам вблизи указанного «размера». Если не указано иное, термин «размер частицы», используемый в настоящем описании, относится к типу распределения частиц по размерам, т.е., величине, которая встречается наиболее часто в распределении по размерам. Способы измерения размера частиц известны специалистам, например, динамическое светорассеяние (такое как фотоннокорреляционная спектроскопия, лазерная дифракция, лазерное светорассеяние под малыми углами (LALLS) и лазерное светорассеяние под средними углами (MALLS)), методы светозатемнения (такие как анализ по Культеру), или другие методы (такие как реология и оптическая или электронная микроскопия).
[0087] В некоторых вариантах осуществления частицы могут быть, по существу, сферическими. «По существу, сферические» означает, что отношение длин самой длинной оси к самой короткой перпендикулярной оси на поперечном срезе частицы меньше чем или равно примерно 1,5. По существу, сферические не требуют линии симметрии. Кроме того, частицы могут иметь поверхностное структурирование, такое как линии или зубцы, которые меньше по масштабу, когла сравниваются с общим размером частицы, и еще являются сферическими. В некоторых вариантах осуществления отношение длин самой длинной и самой короткой осей частицы составляет меньше или равно примерно 1,5, меньше или равно примерно 1,45, меньше или равно примерно 1,4, меньше или равно примерно 1,35, меньше или равно примерно 1,30, меньше или равно примерно 1,25, меньше или равно примерно 1,20, меньше или равно примерно 1,15¸ меньше или равно примерно 1,1. Без желания привязываться к какой-либо теории, поверхностный контакт сводится к минимуму в частицах, которые по существу являются сферическими, что минимизирует нежелательную агломерацию частиц при хранении. Многие кристаллы или хлопья имеют плоские поверхности, которые могут создать большие площади поверхностного контакта, где может происходить агломерация за счет ионных или неионных взаимодействий. Сфера допускает контакт на значительно меньшей площади.
[0088] В некоторых вариантах осуществления частицы имеют, по существу, одинаковый размер. В частицах с широким распределением по размерам, когда имеются как относительно крупные, так и мелкие частицы, для более мелких частиц имеется возможность проникать в бреши между более крупными частицами, причем посредством этого создается множество новых поверхностей контакта. Широкое распределение по размерам может привести к более крупным сферам за счет создания возможности для многих контактов для укрупнения связыванием. Частицы, описанные в настоящем описании, имеют узкое распределение по размерам, посредством чего минимизируются возможности для укрупнения за счет контактов. «Узким распределением по размерам» обозначается распределение по размерам, при котором отношение объемного диаметра 90-ой процентили мелких сферических частиц к объемному диаметру 10-ой процентили меньше или равно 5. В некоторых вариантах осуществления отношение объемного диаметра 90-ой процентили мелких сферических частиц к объемному диаметру 10-ой процентили меньше или равно 4,5, меньше или равно 4, меньше или равно 3,5, меньше или равно 3, меньше или равно 2,5, меньше или равно 2, меньше или равно 1,5, меньше или равно 1,45, меньше или равно 1,40, меньше или равно 1,35, меньше или равно 1,3, меньше или равно 1,25, меньше или равно 1,20, меньше или равно 1,15 или меньше или равно 1,1.
[0089] Геометрическое стандартное отклонение (GSD) также можно использовать для того, чтобы показать узкое распределение по размерам. Вычисления GSD включают определение эффективного критического диаметра (ECD) в накоплении менее 15,9% и 84,1%. GSD равно квадратному корню отношения ECD меньше 84,17% к ECD меньше 15,9%. GSD соответствует узкому распределению по размерам, когда GSD<2,5. В некоторых вариантах осуществления GSD меньше 2, меньше 1,75 или меньше 1,5. В одном варианте осуществления GSD меньше 1,8.
[0090] Кроме соединений платины, раскрытых в настоящем описании, частица может включать солипиды и/или стабилизаторы. Солипиды могут быть включены в частицы с различной целью, например, для предотвращения окисления липидов, для стабилизации двойного слоя, для уменьшения агрегации во время образования или для прсоединения лигандов к поверхности частицы. Может присутствовать любое число солипидов и/или других компонентов, включая амфипатические, нейтральные, катионные, анионные липиды и поддающиеся программированию конденсированные липиды. Такие липиды и/или компоненты могут использоваться по отдельности или в комбинации. Один или несколько компонентов частицы могут включать лиганд, например, нацеливающий лиганд.
[0091] В некоторых вариантах осуществления частица также включает фосфолипид. Без ограничений, фосфолипиды могут быть природного происхождения, такие как яичный желток или соевые фосфолипиды, или синтетического или полусинтетического происхождения. Фосфолипиды могут быть частично очищены или фракционированы для включения чистых фракций или смесей фосфатидилхолинов, фосфатидилхолинов с определенными ацильными группами, имеющими 6-22 атома углерода, фосфатидилэтаноламинов, фосфатидилинозитов, фосфатидных кислот, фосфатидилсеринов, сфингомиелина или фосфатидилглицеринов. Подходящие фосфолипиды включают, но не ограничиваются перечисленным, фосфатидилхолин, фосфатидилглицерин, лецитин, β,γ-дипальмитоил-α-лецитин, сфингомиелин, фосфатидилсерин, фосфатидную кислоту, хлорид N-(2,3-ди(9-(Z)-октадеценилокси))проп-1-ил-N,N,N-триметиламмония, фосфатидилэтаноламин, лизолецитин, лизофосфатидилэтаноламин, фосфатидилинозит, цефалин, кардиолипин, цереброзиды, дицетилфосфат, диолеоилфосфатидилхолин, дипальмитоилфосфатидилхолин, дипальмитоилфосфатидилглицерин, диолеоилфосфатидилглицерин, пальмитоилолеоилфосфатидилхолин, дистеароилфосфатидилхолин, стеароилпальмитоилфосфатидилхоли, дипальмитоилфосфатидилэтаноламин, дистеароилфосфатидилэтаноламин, димиристоилфосфатидилсерин, диолеилфосфатидилхолин, димиристоилфосфатидилхолин (DMPC), диолеилфосфатидилэтаноламин (DOPE), пальмитоилолеоилфосфатидилхолин (POPC), яичный фосфатидилхолин (EPC), дистеароилфосфатидилхолин (DSPC), диолеоилфосфатидилхолин (DOPC), дипальмитоилфосфатидилхолин (DPPC), диолеоилфосфатидилглицерин (DOPG), дипальмитоилфосфатидилглицерин (DPPG), -фосфатидилэтаноламин (POPE), диолеоилфосфатидилэтаноламин, 4-(N-малеимидометил)циклогексан-1-карбоксилат (DOPE-mal), 1-стеароил-2-олеоилфосфатидилхолин (SOPC), 1,2-дистеароил-sn-глицем-3-фосфоэтаноламин (DSPE) и их любые комбинации. Также можно использовать липиды, несодержащие фосфор. Они включают, например, стеариламин, додециламин, ацетилпальмитат, амиды жирных кислот и подобные соединения. Также можно использовать другие лишенные фосфора соединения, такие как сфинголипиды, семейства гликосфинголипидов, диацилглицерины и β-ацилоксикислоты.
[0092] В некоторых вариантах осуществления фосфолипид в частице выбирают из группы, включающей 1,2-дидеканоил-sn-глицеро-3-фофохолин; 1,2-диэрукоил-sn-глицеро-3-фосфат (натриевая соль); 1,2-диэрукоил-sn-глицеро-3-фосфохолин; 1,2-диэрукоил-sn-глицеро-3-фофоэтаноламин; 1,2-диэрукоил-sn-глицеро-3-[фосфо-rac-(1-глицерин)] (натриевая соль); 1,2-дилинолеоил-sn-глицеро-3-фосфохолин; 1,2-дилауроил-sn-глицеро-3-фосфат (натриевая соль); 1,2-дилауроил-sn-глицеро-3-фосфохолин; 1,2-дилауроил-sn-глицеро-3-фофоэтаноламин; 1,2-дилауроил-sn-глицеро-3-[фосфо-rac-(1-глицерин)] (натриевая соль); 1,2-дилауроил-sn-глицеро-3-[фосфо-rac-(1-глицерин) (аммониевая соль); 1,2-дилауроил-sn-глицеро-3-фосфосерин (натриевая соль); 1,2-димиристоил-sn-глицеро-3-фосфат (натриевая соль); 1,2-димиристоил-sn-глицеро-3-фосфохолин; 1,2-димиристоил-sn-глицеро-3-фофоэтаноламин; 1,2-димиристоил-sn-глицеро-3-[фосфо-rac-(1-глицерин)] (натриевая соль); 1,2-димиристоил-sn-глицеро-3-[фосфо-rac-(1-глицерин)] (аммониевая соль); 1,2-димиристоил-sn-глицеро-3-[фофо-rac-(1-глицерин)] (натриевая/аммониевая соль); 1,2-димиристоил-sn-глицеро-3-фосфосерин (натриевая соль); 1,2-диолеоил-sn-глицеро-3-фосфат (натриевая соль); 1,2-диолеоил-sn-глицеро-3-фосфохолин; 1,2-диолеоил-sn-глицеро-3-фофоэтаноламин; 1,2-диолеоил-sn-глицеро-3-[фосфо-rac-(1-глицерин)] (натриевая соль); 1,2-диолеоил-sn-глицеро-3-фосфосерин (натриевая соль); 1,2-дипальмитоил-sn-глицеро-3-фосфат (натриевая соль); 1,2-дипальмитоил-sn-глицеро-3-фосфохолин; 1,2-дипальмитоил-sn-глицеро-3-фофоэтаноламин; 1,2-дипальмитоил-sn-глицеро-3-[фосфо-rac-(1-глицерин)] (натриевая соль); 1,2-дипальмитоил-sn-глицеро-3-[фосфо-rac-(1-глицерин)] (аммониевая соль); 1,2-дипальмитоил-sn-глицеро-3-фосфосерин (натриевая соль); 1,2-дистеароил-sn-глицеро-3-фосфат (натриевая соль); 1,2-дистеароил-sn-глицеро-3-фосфохолин; 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин; 1,2-дистеароил-sn-глицеро-3-[фосфо-rac-(1-глицерин)] (натриевая соль); 1,2-дистеароил-sn-глицеро-3-[фосфо-rac-(1-глицерин)] (аммониевая соль); 1,2-дистеароил-sn-глицеро-3-фосфосерин (натриевая соль); яичный PC; гидрированный яичный PC; гидрированный соевый PC; 1-миристоил-sn-глицеро-3-фосфохолин; 1-пальмитоил-sn-глицеро-3-фосфохолин; 1-стеароил-sn-глицеро-3-фосфохолин; 1-миристоил-2-пальмитоил-sn-глицеро 3-фосфохолин; 1-миристоил-2-стеароил-sn-глицеро-3-фосфохолин; 1-пальмитоил-2-миристоил-sn-глицеро-3-фосфохолин; 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфохолин; 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфоэтаноламин; 1-пальмитоил-2-олеоил-sn-глицеро-3-[фосфо-rac-(1-глицерин)] (натриевая соль); 1-пальмитоил-2-стеароил-sn-глицеро-3-фосфохолин; 1-стеароил-2-миристоил-sn-глицеро-3-фосфохолин; 1-стеароил-2-олеоил-sn-глицеро-3-фосфохолин и 1-стеароил-2-пальмитоил-sn-глицеро-3-фосфохолин. В некоторых вариантах осуществления фосфолипид представляет собой SPOC, яичный PC или гидрированный соевый PC (HSPC). В одном варианте осуществления фосфолипидом в композиции является HSPC.
[0093] В некоторых вариантах осуществления частица также включает полиэтиленгликоль (ПЭГ). ПЭГ может быть включен в композицию сам по себе или конъюгированным с компонентом, присутствующим в частице. Например, ПЭГ может быть конъюгирован с соединением на основе платины или с компонентом частицы солипид/стабилизатор. В некоторых вариантах осуществления ПЭГ конъюгирован с компонентом частицы солипид/стабилизатор. Без ограничений, ПЭГ может быть конъюгирован с любым солипидом. Например, ПЭГ, конъюгированный с солипидом, может быть выбран из группы, включающей ПЭГ, конъюгированный с диацилглицеринами и диалкилглицеринами, ПЭГ, конъюгированный с фосфатидилэтаноламином, ПЭГ, конъюгированный с фосфатидной кислотой, ПЭГ, конъюгированный с церамидами (см. патент США № 5885613), ПЭГ, конъюгированный с диалкиламинами, ПЭГ, конъюгированный с 1,2-диацилоксипропан-3-аминами, и ПЭГ, конъюгированный с 1,2-дистеароил-sn-глицем-3-фосфоэтаноламином (DSPE), и их любых комбинаций. В некоторых вариантах осуществления ПЭГ, конъюгированный с липидом, представляет собой 1,2-дистеароил-sn-глицем-3-фосфоэтаноламин-N-[амино(полиэтиленгликоль)-2000] (DSPE-PEG2000).
[0094] В некоторых вариантах осуществления частица также включает поверхностно-активное вещество. Поверхностно-активные вещества находят широкое применение в таких композициях, как эмульсии (включая микроэмульсии) и липосомы. Наиболее обычным способом классификации и расположения по свойствам многих различных типов поверхностно-активных веществ, как природных, так и синтетических, является использование гидрофильно-липофильного баланса (ГЛБ). Природа гидрофильной группы (также известной как «голова») обеспечивает наиболее применимый способ распределения по категориям различных поверхностно-активных веществ, используемых в композициях (Rieger, в Pharmaceutical Dosage Forms, Marcel Dekker, Inc., New York, N.Y., 1988, p. 285).
[0095] Если молекула поверхностно-активного вещества не ионизирована, его классифицируют как неионогенное поверхностно-активное вещество. Неионогенные поверхностно-активные вещества находят широкое применение в фармацевтических и косметических продуктах и могут применяться в широком интервале значений рН. Как правило, величины их ГЛБ колеблются от 2 до приблизительно 18, в зависимости от их строения. Неионогенные поверхностно-активные вещества включают неионогенные сложные эфиры, такие как эфиры этиленгликоля, эфиры пропиленгликоля, эфиры глицерина, полиглицериловые эфиры, эфиры сорбитана, эфиры сахарозы и этоксилированные сложные эфиры. В этот класс также включены неионогенные алканоламиды и простые эфиры, такие как этоксилаты жирных спиртов, пропоксилированные спирты и этоксилированные/пропоксилированные блоксополимеры. Поверхностно-активные вещества, содержащие полиоксиэтиленовые цепи, являются наиболее применимыми членами класса неионогенных поверхностно-активных веществ.
[0096] Если молекула поверхностно-активного вещества имеет отрицательный заряд при растворении или диспергировании в воде, поверхностно-активное вещество классифицируют как анионогенное. Анионогенные поверхностно-активные вещества включают карбоксилаты, такие как мыла, ациллактилаты, ациламиды аминокислот, эфиры серной кислоты, такие как алкилсульфаты и этоксилированные алкилсульфаты, сульфонаты, такие как алкилбензолсульфонаты, ацилизэтионаты, ацилтаураты и сульфосукцинаты и фосфаты. Наиболее важными членами класса анионогенных поверхностно-активных веществ являются алкилсульфаты и мыла.
[0097] Если молекула поверхностно-активного вещества имеет положительный заряд при растворении или диспергировании в воде, поверхностно-активное вещество классифицируют как катионогенное. Катионогенные поверхностно-активные вещества включают соли четвертичного аммония и этоксилированные амины. Соли четвертичного аммония являются самыми применимыми членами этого класса.
[0098] Если молекула поверхностно-активного вещества имеет способность иметь или положительный или отрицательный заряд, поверхностно-активное вещество классифицируют как амфотерное. Амфотерные поверхностно-активные вещества включают производные акриловой кислоты, замещенные алкиламиды, N-алкилбетаины и фосфатиды.
[0099] Имеется обзор применения поверхностно-активных веществ в лекарственных продуктах, препаратах и эмульсиях (Rieger, в Pharmaceutical Dosage Forms, Marcel Dekker, Inc., New York, N.Y., 1988, p. 285).
[00100] В некоторых вариантах осуществления частица также может включать катионный липид. Примеры катионных липидов включают, но не ограничиваются перечисленным, хлорид N,N-диолеил-N,N-диметиламмония (DODAC), бромид N,N-дистеарил-N,N-диметиламмония (DDAB), хлорид N-(1-(2,3-диолеилокси)пропил)-N,N,N-триметиламмония (DOTAP), хлорид N-(1-(2,3-диолеилокси)пропил)-N,N,N-триметиламмония (DOTMA), N,N-диметил-2,3-диолеилокси)пропиламин (DODMA), 1,2-дилинолеилокси-N,N-диметиламинопропан (DLinDMA), 1,2-дилиноленилокси-N,N-диметиламинопропан (DLenDMA), 1,2-дилинолеилкарбамоилокси-3-диметиламинопропан (DLin-C-DAP), 1,2-дилинолеилокси-3-(диметиламино)ацетоксипропан (DLin-DAC), 1,2-дилинолеилокси-3-морфолинопропан (DLin-MA), 1,2-дилинолеоил-3-диметиламинопропан (DLinDAP), 1,2-дилинолеилтио-3-диметиламинопропан (DLin-S-DMA), 1-линолеоил-2-линолеилокси-3-диметиламинопропан (DLin-2-DMAP), соль хлорид 1,2-дилинолеилокси-3-триметиламинопропана (DLin-TMA.C1), соль хлорид 1,2-дилинолеоил-3-триметиламинопропана (DLin-TAP.C1), 1,2-дилинолеилокси-3-(N-метилпиперазино)пропан (DLin-MPZ) или 3-(N,N-дилинолеиламино)-1,2-пропандиол (DLinAP), 3-(N,N-диолеиламино)-1,2-пропандиол (DOAP), 1,2-дилинолеилоксо-3-(2-N,N-диметиламино)этоксипропан (DLin-EG-DMA), 1,2-дилиноленилокси-N,N-диметиламинопропан (DLinDMA), 2,2-дилинолеил-4-диметиламинометил-[1,3]-диоксолан (DLin-K-DMA) или их аналоги, (3aR,5s,6aS)-N,N-диметил-2,2-ди((9Z,12Z)-октадека-9,12-диенил)тетрагидро-3aH-циклопента[d][1,3]диоксол-5-амин (ALN100), (6Z,9Z,28Z,31Z)-гептатриаконта-6,9,28,31-тетраен-19-ил-4-(диметиламино)бутаноат (MC3), 1,1′-(2-(4-(2-((2-(бис(2-гидроксидодецил)амино)этил)(2-гидроксидодецил)амино)этил)пиперазин-1-ил)этилазандиил)дидодекан-2-oл (Tech Gi) или их смесь.
[00101] В некоторых вариантах осуществления частица также включает некатионный липид. Некатионный липид может представлять собой анионный липид или нейтральный липид, включая, но без ограничения перечисленным, дистеароилфосфатидилхолин (DSPC), диолеоилфосфатидилхолин (DOPC), дипальмитоилфосфатидилхолин (DPPC), диолеоилфосфатидилглицерин (DOPG), дипальмитоилфосфатидилглицерин (DPPG), диолеоилфосфатидилэтаноламин (DOPE), пальмитоилолеоилфосфатидилхолин (POPC), пальмитоилолеоилфосфатидилэтаноламин (POPE), 4-(N-малеимидометил)циклогексан-1-карбоксилат диолеоилфосфатидилэтаноламина (DOPE-mal), дипальмитоилфосфатидилэтаноламин (DPPE), димиристоилфосфоэтаноламин (DMPE), дистеароилфосфатидилэтаноламин (DSPE), 16-O-монометил-PE, 16-O-диметил-PE, 18-1-транс-PE, 1-стеароил-2-олеоилфосфатидилэтаноламин (SOPE), холестерин или их смеси.
[00102] В частицы, раскрытые в настоящем описании, также могут быть включены конъюгированные липиды, которые ингибируют агрегацию частиц. Такие липиды включают, но не ограничиваются перечисленным, полиэтиленгликоль(ПЭГ)-липид, включая, без ограничения, ПЭГ-диацилглицерин (DAG), ПЭГ-диалкилоксипропил (DAA), ПЭГ-фосфолипид, ПЭГ-церамид (Cer) или их смеси. Конъюгат ПЭГ-DAA может представлять собой, например, ПЭГ-дилаурилоксипропил (C12), ПЭГ-димиристилоксипропил (C14), ПЭГ-дипальмитилоксипропил (C16) или ПЭГ-дистеарилоксипропил (C18). Конъюгированный липид, который предотвращает агрегацию частиц, может составлять от 0,01 мол.% до приблизительно 20 мол.% или примерно 2 мол.% всего липида, присутствующего в частице.
[00103] В некоторых вариантах осуществления частица находится в форме липосомы, везикулы или эмульсии. Используемый в настоящем описании термин «липосома» охватывает любую ячейку, заключенную в слое липида. Липосомы могут иметь одну или несколько липидных оболочек. Липосомы могут характеризоваться типом оболочки и размером. Мелкие униламеллярные везикулы (SUV) имеют одну оболочку и типично колеблются в диаметре от 0,02 до 0,05 мкм; крупные униламеллярные везикулы (LUV) типично превышают 0,05 мкм. Олиголамеллярные крупные везикулы и мультиламеллярные везикулы имеют несколько, обычно концентрических, слоев оболочки и типично составляют в диаметре больше 0,1 мкм. Липосомы с несколькими неконцентрическими оболочками, т.е., несколькими более меликими везикулами, содержащимися в более крупной везикуле, называют мультивезикулярными везикулами.
[00104] Для того, чтобы образовать липосому, липидные молекулы включают удлиненные неполярные (гидрофобные) части и полярные (гидрофильные) части. Гидрофобные и гидрофильные части молекулы предпочтительно располагаются на двух концах удлиненной молекулярной структуры. Когда такие липиды диспергируются в воде, они спонтанно образуют двухслойные оболочки, называемые ламеллами. Ламеллы состоят из двух однослойных листов липидных молекул, причем их неполярные (гидрофобные) поверхности обращены друг к другу и их полярные (гидрофильные) поверхности обращены к водной среде. Оболочки, образованные липидами, заключают в себе часть водной фазы подобно тому, как клеточная мембрана заключает в себе содержимое клетки. Таким образом, бислой липосомы имеет сходство с клеточной мембраной без белковых компонентов, присутствующих в клеточной мембране.
[00105] Липосомную композицию можно получить различными способами, известными в технике. См., например, патенты США № 4235871, № 4897355 и № 5171678; опубликованные заявки PCT WO 96/14057 и WO 96/37194; Felgner P. L. et al., Proc. Natl. Acad. Sci., USA (1987) 8:7413-7417; Bangham et al., M. Mol. Biol. (1965), 23: 238; Olson et al., Biochim. Biophys. Acta (1979), 557: 9; Szoka et al., Proc. Natl. Acad. Sci. (1978), 75: 4194; Mayhew et al., Biochim. Biophys. Acta (1984), 775:169, Kim et al., Biochim. Biophys. Acta (1983), 728:339, и Fukunaga et al., Endocrinol. (1984) 115:757, включенные в данное описание в качестве ссылок.
[00106] Липосомы можно получить, по существу, однородными по размерам в выбранном интервале размеров. Один из эффективных способов калибрования включает выдавливание водной суспензии липосом через ряд поликарбонатных мембран с порами выбранного однородного размера; размер пор мембраны будет соответствовать приблизительно самым большим размерам липосом, получаемых выдавливанием через мембрану. См., например, патент США № 4737323, включенный в данное описание в качестве ссылки.
[00107] Частицы также могут находиться в форме эмульсии. Эмульсии типично представляют собой гетерогенные системы одной жидкости, диспергированной в другой в форме капель (Idson, в Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 199; Rosoff, в Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., Volume 1, p. 245; Block в Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 2, p. 335; Higuchi et al., в Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, Pa., 1985, p. 301). Эмульсии часто являются двухфазными системами, включающими две несмешивающиеся жидкие фазы, смешанные до однородного состояния и диспергированные одна в другой. Вообще, эмульсии могут быть вида вода-в-масле (w/o) или масло-в-воде (o/w). Когда водная фаза мелко разделена на и диспергирована в виде мельчайших капель в объемной масляной фазе, полученную композицию называют эмульсией типа вода-в-масле (w/o). С другой стороны, когда маляная фаза мелко разделена на и диспергирована в виде мельчайших капель в объемной водной фазе, полученную композицию называют эмульсией типа масло-в-воде (o/w). Эмульсии могут содержать другие компоненты, кроме дисперсных фаз, и конъюгат, раскрытый в настоящем описании, может присутствовать в виде раствора или в водной фазе или в масляной фазе или сам по себе в виде отдельной фазы. Фармацевтические эксципиенты, такие как эмульгаторы, стабилизаторы, красители и антиоксиданты, при необходимости также могут присутствовать в эмульсиях. Фармацевтические эмульсии также могут представлять собой множественные эмульсии, которые состоят из больше чем двух фаз, такие как, например, в случае эмульсий масло-в-воде-в-масле (o/w/o) и вода-в-масле-в-воде (w/o/w). Такие комплексные композиции часто дают некоторые преимущества, которые простые бинарные эмульсии не дают. Множественные эмульсии, в которых отдельные масляные капли эмульсии o/w содержат в себе мелкие капли воды, составляют эмульсию w/o/w. Подобным образом, система масляных капель, заключенная в каплях воды, стабилизированных в непрерывной масляной фазе, дает эмульсию o/w/o.
[00108] Эмульсии характеризуются низкой термодинамической устойчивостью или ее отсутствием. Часто дисперсная или дискретная фаза эмульсии будет диспергирована в сплошной или непрерывной фазе и сохраняться в такой форме с помощью эмульгаторов или за счет вязкости композиции. Любая из фаз эмульсии может быть полутвердой или твердой, как в случае основ для мазей и кремов типа эмульсии. Другие способы стабилизации эмульсий влекут за собой использование эмульгаторов, которые могут быть включены в любую фазу эмульсии. Эмульгаторы вообще могут быть разделены на четыре категории: синтетические поверхностно-активные вещества, встречающиеся в природе эмульгаторы, абсорбционные базы и мелкодиспергированные твердые вещества (Idson, в Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 199).
[00109] Синтетические поверхностно-активные вещества, также известные как поверхностно-активные компоненты, находят широкое применение при получении эмульсий и описаны в литературе (Rieger, в Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 285; Idson, в Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), Marcel Dekker, Inc., New York, N.Y., 1988, volume 1, p. 199). Поверхностно-активные вещества обычно являются амфифильными и включают гидрофильную и гидрофобную часть. Соотношение гидрофильного и гидрофобного характера поверхностно-активного вещества называется гидрофильно-липофильным балансом (ГЛБ) и является ценным инструментом при характеризации и выборе поверхностно-активных веществ при получении композиций. Поверхностно-активные вещества можно классифицировать на основании природы гидрофильной группы: неионогенные, анионогенные, катионогенные и амфотерные (Rieger, в Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 285).
[00110] Встречающиеся в природе эмульгаторы, используемые в эмульсионных композициях, включают ланолин, пчелиный воск, фосфатиды, лецитин и аравийскую камедь. Абсорбционные базы обладают гидрофильными свойствами, так что они могут впитывать воду с образованием эмульсий w/o, еще сохраняя свою полутвердую консистенцию, например, безводный ланолин и гидрофильный вазелин. Мелкодисперсные твердые вещества также используют как хорошие эмульгаторы, в особенности, в комбинации с поверхностно-активными веществами и в вязких препаратах. Они включают полярные неорганические твердые вещества, такие как гидроксиды тяжелых металлов, ненабухающие глины, такие как бентонит, аттапульгит, гекторит, каолин, монтромориллонит, коллоидный силикат алюминия и коллоидный алюмосиликат магния, пигменты и неполярные твердые вещества, такие как уголь, или глицерилтристеарат.
[00111] Множество материалов, необразующих эмульсии, также могут быть включены в эмульсионные композиции и вносить вклад в свойства эмульсий. Они включают, но не ограничиваются перечисленным, жиры, масла, воски, жирные кислоты, жирные спирты, эфиры жирных кислот, увлажняющие вещества, гидрофильные коллоиды, консерванты и антиоксиданты (Block, в Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 335; Idson, в Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 199).
[00112] Гидрофильные коллоиды или гидроколлоиды включают встречающиеся в природе смолы и синтетические полимеры, такие как полисахариды (например, аравийскую камедь, агар, альгиновую кислоту, каррагенан, гуаровую камедь, камедь карайи и трагакант), производные целлюлозы (например, карбоксиметилцеллюлозу и карбоксипропилцеллюлозу), и синтетические полимеры (например, карбомеры, простые эфиры целлюлозы и карбоксивиниловые полимеры). Они диспергируются или растворяются в воде с образованием коллоидных растворов, которые стабилизируют эмульсии путем образования прочных межфазных пленок вокруг капель дисперсной фазы и путем повышения вязкости непрерывной фазы.
[00113] Так как эмульсии часто содержат ряд ингредиентов, таких как углеводы, белки, стерины и фосфатиды, которые могут легко поддерживать рост микробов, такие композиции обычно включают консерванты. Широко используемые консерванты, включаемые в эмульсионные композиции, включают метилпарабен, пропилпарабен, соли четвертичного аммония, хлорид бензалкония, эфиры п-гидроксибензойной кислоты и борную кислоту. В эмульсионные композиции также обычно добавляют антиоксиданты для прдеотвращения ухудшения качества композиции. Используемые антиоксиданты могут представлять собой акцепторы свободных радикалов, такие как токоферолы, алкилгаллаты, бутилированный гидроксианизол, бутилированный гидрокситолуол, или восстановители, такие как аскорбиновая кислота и метабисульфит натрия, и синергисты антиоксидантов, такие как лимонная кислота, винная кислота и лецитин.
[00114] Применения эмульсионных композиций дерматологическими, пероральными и парентеральными путями и способы их получения рассматриваются в литературе (Idson, в Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 199). Эмульсионные композиции для пероральной доставки широко используются из-за легкости получения, а также эффективности с точки зрения абсорбции и биодоступности (Rosoff, в Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 245; Idson, в Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 199).
[00115] Примеры поверхностно-активных веществ для включения в частицы, раскрытые в настоящем описании, включают, но не ограничиваются перечисленным, ионогенные поверхностно-активные вещества, неионогенные поверхностно-активные вещества, Brij 96, полиоксиэтиленолеиловые эфиры, полиглицериновые эфиры жирных кислот, монолаурат тетраглицерина (ML310), моноолеат тетраглицерина (MO310), моноолеат гексаглицерина (PO310), пентаолеат гексаглицерина (PO500), монокапрат декаглицерина (MCA750), моноолеат декаглицерина (MO750), секвиоолеат декаглицерина (SO750), декаолеат декаглицерина (DAO750), по отдельности или в комбинации с вторичными поверхностно-активиыми веществами. Вторичное поверхностно-активиое вещество, обычно короткоцепной спирт, такой как этанол, 1-пропанол и 1-бутанол, служит для повышения межфазной текучести путем проникания в пленку поверхностно-активного вещества и создания в результате разупорядоченной пленки из-за пустого пространства, образовавшегося между молекулами поверхностно-активного вещества. Однако можно получить микроэмульсии без использования вторичного поверхностно-активного вещества, и в технике известны несодержащие спирт самоэмульгирующиеся микроэмульсионные системы. Водная фаза типично, но без ограничения, может представлять собой воду, водный раствор лекарственного средства, глицерин, ПЭГ300, ПЭГ400, полиглицерины, пропиленгликоли и производные этиленгликоля. Масляная фаза может включать, но не ограничиваться указанным, такие материалы, как каптекс 300, каптекс 355, капмул MCM, эфиры жирных кислот, среднецепные (C8-C12) моно-, ди- и триглицериды, полиоксиэтилированные глицерилэфиры жирных кислот, жирные спирты, полигликолизированные глицериды, насыщенные полигликолизированные глицериды C8-C10, растительные масла и силиконовое масло.
[00116] Микроэмульсии представляют особый интерес с точки зрения солюбилизации лекарственных средств и усиленной абсорбции лекарственных средств. Микроэмульсии на основе липидов (как o/w, так и w/o) предложены для усиления пероральной биодоступности лекарственных средств, включая пептиды (см., например, пат. США №№ 6191105; 7063860; 7070802; 7157099; Constantinides et al., Pharmaceutical Research, 1994, 11, 1385-1390; Ritschel, Meth. Find. Exp. Clin. Pharmacol., 1993, 13, 205). Микроэмульсии дают преимущества улучшенной растворимости лекарственных средств, защиты лекарственного средства от ферментативного гидролиза, возможного усиления абсорбции лекарственного средства из-за вызванных поверхностно-активным веществом изменений в текучести и проницаемости мембран, легкости получения, простоты перорального введения в твердых лекарственных формах, улучшенной клинической эффективности и пониженной токсичности (см., например, пат. США №№ 6191105; 7063860; 7070802; 7157099; Constantinides et al., Pharmaceutical Research, 1994, 11, 1385; Ho et al., J. Pharm. Sci., 1996, 85, 138-143). Часто микроэмульсии могут образовываться спонтанно, когда их компоненты соединяют при температуре окружающей среды. Это может быть особенно выгодно, когда получают препараты термолабильных лекарственных средств. Микроэмульсии также эффективны при трансдермальной доставке активных компонентов как в косметических, так и фармацевтических применениях. Ожидается, что микроэмульсионные композиции и препараты по настоящему изобретению будут способствовать повышенному системному всасыванию соединений на основе платины в желудочно-кишечном тракте, а также улучшать локальное клеточное поглощение соединений на основе платины, раскрытых в настоящем описании.
[00117] Без желания привязываться к какой-либо теории, наночастицы, раскрытые в настоящем описании, имеют более высокое поглощение платины в раковых клетках относительно цисплатина и оксалиплатина. В некоторых вариантах осуществления наночастицы, раскрытые в настоящем описании, имеют бльшее примерно на 25%, примерно на 50%, примерно на 75%, примерно 1-кратное, примерно 5-кратное, примерно 10-кратное, примерно 15-кратное, примерно 20-кратное, примерно 25-кратное или более высокое поглощение платины в раковых клетках относительно цисплатина или оксалиплатина в эквивалентных дозах.
[00118] Кроме того, наночастицы, раскрытые в настоящем описании, также имеют более высокое накопление платины в ткани, такой как, но без ограничения, опухоль, относительно цисплатина и оксалиплатина при дозировке в эквивалентном количестве. Например, наночастицы, раскрытые в настоящем описании, имеют бльшее примерно на 25%, примерно на 50%, примерно на 75%, примерно 1-кратное, примерно 5-кратное, примерно 10-кратное, примерно 15-кратное, примерно 20-кратное, примерно 25-кратное или более высокое накопление платины относительно цисплатина или оксалиплатина при дозировке в эквивалентных количествах.
[00119] Конструкция и синтез оксалиплатиновой наночастицы основаны на ее соотношении структура-активность. В настоящем раскрытии описывается синтез различных амфифильных соединений на основе платины химией с обменом функциональных групп. В конкретном варианте осуществления для получения карбаматной связи используют хлоформиат холестерина в качестве исходного материала, к которому добавляют (а) этилендиамин (линкер), и получают холестерин, конъюгированный с этилендиамином, где одна аминная группа этилендиамина образует карбаматную связь с холестерином и одна аминная группа свободна (фигура 1A). На следующей стадии свободный амин взаимодействует с одной из карбоксильных групп янтарного ангидрида (b) (дикарбонильное производное, которое способно образовывать семичленные циклические молекулы) с образованием амидной связи, и остается другая свободная карбоксильная группа для координации платины (фигура 1A). Дихлордиаминоплатину (II) [изомер RR] гидратируют нитратом серебра в течение ночи, и получают акватированный оксалиплатин (фигура 1B), который образует аддукт с промежуточным соединением II/III/IV (как отображено на фигуре 1A) через образование ковалентной монокарбоксилато связи и другой координационной связи амид-кислород (фигура 1C).
[00120] Подобным образом, в еще одном варианте осуществления синтез амфифильных соединений платины с простой эфирной связью суммирован на фигуре 2, при этом сначала трансформируют молекулу холестерина в промежуточное соединение I путем обмена функциональной группы (фигура 2A). Полученное промежуточное соединение I превращают в промежуточное соединение II, которое в свою очередь ведет к конечному аддукту через реакционные стадии, схожие с использованными для синтеза карбаматной связи, описанными выше. Подобным образом, в случае синтеза шести- и пятичленных циклических молекул, описанных выше, используют моноэтиловые эфиры малоновй кислоты и щавелевой кислоты для синтеза амфифильных соединений платины как с карбаматной связью, так и с простой эфирной связью, соответственно (фигуры 1A и 2A), с последующим удалением этилэфирной защитной группы.
[00121] После синтеза конечные платиновые аддукты включают в наночастицы с помощью различных солипидов, выбранных из соевого PC, DOPE, DOPC и т.д., и стабилизаторов, выбранных из DSPE-ПЭГ-OMe и т.д. Затем выполняют характеризацию всех промежуточных соединений методом1H ЯМР, и осуществляют характеризацию конечной амфифильной молекулы с оксалиплатином с использованием1H ЯМР и MALDI-TOF, соответственно.
[00122] Без желания привязываться к какой-либо теории, композиции наночастиц по настоящему раскрытию показывают существенную эффективность киллинга раковых клеток. Примеры наночастиц испытывали на различных линиях раковых клеток и наблюдали, что соединения показывают существенно большую эффективность киллинга клеток, чем контрольные соединения, такие как общеизвестные платиновые лекарственные средства оксалиплатин, цисплатин, карбоплатин, параплатин и сартраплатин.
[00123] Соответственно, в другом аспекте в настоящем описании описывается способ лечения рака. Вообще способ включает введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединений на основе платины, раскрытых в настоящем описании.
[00124] Выражение «терапевтически эффективное количество», используемое в настоящем описании, обозначает такое количество соединения, материала или композиции, включающей соединение по настоящему изобретению, которое эффективно для получения некоторого желательного терапевтического эффекта по меньшей мере в субпопуляции клеток у животного при разумном соотношении выгода/риск, приемлемом при любом лечении лекарственными средствами. Определение терапевтически эффективного количества возможно для специалистов в данной области техники. Вообще терапевтически эффективное количество может изменяться в связи с историей болезни пациента, возрастом, состоянием здоровья, полом, а также тяжестью и типом заболевания у пациента и назначением других средств, облегчающих заболевание или расстройство, от которого лечат.
[00125] Как правило, количество активных соединений составляет 0,1-95 мас.% препарата, предпочтительно, 0,2-20 мас.% в препаратах для парентерального примененияи, предпочтительно, от 1 до 50 мас.% в препаратах для перорального введения.
[00126] Токсичность и терапевтическую эффективность можно определить стандартными фармацевтическими процедурами в клеточных культурах или на подопытных животных, например, в случае определения LD50 (доза, летальная для 50% популяции) и ED50 (доза, терапевтически эффективная для 50% популяции). Отношение доз токсического и терапевтического действия представляет собой терапевтический индекс и может быть выражено как отношение LD50/ED50. Предпочтительны композиции, которые показывают большие терапевтические индексы. Используемый в настоящем описании термин ED обозначает эффективную дозу и используется в связи с животными моделями. Термин EC обозначает эффективную концентрацию и используется в связи с моделями in vitro.
[00127] Данные, полученные из анализов клеточных культур и исследований на животных, можно использовать при определении интервала дозировок для применения людьми. Дозировка таких соединений предпочтительно находится в интервале концентраций в кровотоке, которые включают ED50 с небольшой токсичностью или нетоксичную. Дозировка может изменяться в таком интервале в зависимости от используемой лекарственной формы и используемого пути введения.
[00128] Терапевтически эффективную дозу сначала можно установить из анализов клеточных культур. На животных моделях можно установить дозу для достижения интервала концентраций в плазме в кровотоке, который включает IC50 (т.е., концентрацию терапевтического средства, при которой достигается полумаксимальное ингибирование симптомов), определенную на клеточной культуре. Уровни в плазме можно измерить, например, методом высокоэффективной жидкостной хроматографии. Действие любой определенной дозировки можно контролировать подходящим биоанализом.
[00129] Дозировка может быть определена врачом и подогнана так, как необходимо для обеспечения наблюдаемого действия лечения. Как правило, композиции вводят так, чтобы средство поступало в дозе от 1 мкг/кг до 150 мг/кг, 1 мкг/кг - 100 мг/кг, 1 мкг/кг - 50 мг/кг, 1 мкг/кг - 20 мг/кг, 1 мкг/кг - 10 мг/кг, 1 мкг/кг - 1мг/кг, 100 мкг/кг - 100 мг/кг, 100 мкг/кг - 50 мг/кг, 100 мкг/кг - 20 мг/кг, 100 мкг/кг - 10 мг/кг, 100 мкг/кг - 1мг/кг, 1 мг/кг - 100 мг/кг, 1 мг/кг - 50 мг/кг, 1 мг/кг - 20 мг/кг, 1 мг/кг - 10 мг/кг, 10 мг/кг - 100 мг/кг, 10 мг/кг - 50 мг/кг или 10 мг/кг - 20 мг/кг. Следует иметь в виду, что приведенные в данном случае интервалы включают все промежуточные интервалы, например, интервал 1 мг/кг - 10 мг/кг включает 1 мг/кг - 2 мг/кг, 1 мг/кг - 3 мг/кг, 1 мг/кг - 4 мг/кг, 1 мг/кг - 5 мг/кг, 1 мг/кг - 6 мг/кг, 1 мг/кг - 7 мг/кг, 1 мг/кг - 8 мг/кг, 1 мг/кг - 9 мг/кг, 2 мг/кг - 10 мг/кг, 3 мг/кг - 10 мг/кг, 4 мг/кг - 10 мг/кг, 5 мг/кг - 10 мг/кг, 6 мг/кг - 10 мг/кг, 7 мг/кг - 10 мг/кг, 8 мг/кг - 10 мг/кг, 9 мг/кг - 10 мг/кг и т.п. Также следует иметь в виду, что интервалы, промежуточные для приведенных выше, также входят в объем изобретения, например, в интервале 1 мг/кг - 10 мг/кг доза колеблется, например, как 2 мг/кг - 8 мг/кг, 3 мг/кг - 7 мг/кг, 4 мг/кг - 6 мг/кг и т.п.
[00130] В некоторых вариантах осуществления композиции вводят в такой дозировке, что средство имеет концентрацию in vivo менее 500 нM, менее 400 нM, менее 300 нM, менее 250 нM, менее 200 нM, менее 150 нM, менее 100 нM, менее 50 нM, менее 25 нM, менее 20 нM, менее 10 нM, менее 5 нM, менее 1 нM, менее 0,5 нM, менее 0,1 нM, less менее 0,05 нМ, менее 0,01 нM, менее 0,005 нM, менее 0,001 нM через 15 мин, 30 мин, 1 час, 1,5 часа, 2 часа, 2,5 час, 3 час, 4 час, 5 час, 6 час, 7 час, 8 час, 9 час, 10 час, 11 час, 12 час или более со времени введения.
[00131] Что касается длительности и повторяемости лечения, то специалисты в клиниках обычно контролируют пациентов для того, чтобы определить, когда лечение дает терапевтическую выгоду, и определить, повышать ли или понижать дозировку, повышать или понижать частоту введения, прервать лечение, продолжать лечение или сделать другие изменения в схеме лечения. Схема применения лекарственного средства может изменяться от одного раза в неделю до ежедневного, в зависимости от ряда клинических факторов, таких как чувствительность пациента к полипептидам. Нужную дозу можно вводить каждый день или каждый третий, четвертый, пятый или шестой день. Нужную дозу можно вводить один раз или разделить на субдозы, например, 2-4 субдозы, и вводить периодически, например, с соответствующими интервалами через день или по другой соответствующей схеме. Такие субдозы можно вводвть в виде стандартных лекарственных форм. В некоторых вариантах осуществления аспектов, описанных в настоящем описании, введение является постоянным, например, одна или несколько доз ежесуточно на протяжении недель или месяцев. Примерами схем приема лекарственных средств являются введение ежедневно, дважды в день, три раза в день или четыре или более раз в день на протяжении 1 недели, 2 недель, 3 недель, 4 недель, 1 месяца, 2 месяцев, 3 месяцев, 4 месяцев, 5 месяцев или 6 месяцев или долее.
[00132] В некоторых вариантах осуществления соединение на основе платины можно вводить пациенту в комбинации с фармацевтически активным средством, например, вторым терапевтическим средством. Примеры фармацевтически активного средства включают, но не ограничиваются перечисленным, средства, указанные в Harrison’s Principles of Internal Medicine, 13th Edition, Eds. T.R. Harrison et al., McGraw-Hill N.Y., NY; Physicians Desk Reference, 50th Edition, 1997, Oradell New Jersey, Medical Economics Co.; Pharmacological Basis of Therapeutics, 8th Edition, Goodman and Gilman, 1990; и фармакопеи Соединенных Штатов, The National Formulary, USP XII NF XVII, 1990, включенных в данное описание в качестве ссылок. Соединение на основе платины и второе терапевтическое средство можно вводить пациенту в единой фармацевтической композиции или в различных фармацевтических композициях (в одно и то же время или в различное время).
[00133] Используемый в настоящем описании термин «вводить» относится к помещению композиции в организм пациента способом или путем, который приводит по меньшей мере к частичной локализации композиции в нужном месте так, что получают нужный эффект. Соединение или композицию, описанные в настоящем описании, можно вводить любым соответствующим путем, известным в технике, включая, но не ограничиваясь указанным, пероральный или парентеральные пути, включая внутривенное, внутримышечное, подкожное, трансдермальное, через дыхательные пути (аэрозоль), легочное, назальное, ректальное и местное (в том числе, трансбуккальное и сублингвальное) введение.
[00134] Примеры типов введения включают, но не ограничиваются указанным, инъекцию, инфузию, инстилляцию, ингаляцию или глотание. «Инъекция» включает, без ограничения, внутривенную, внутримышечную, интраартериальную, интратекальную, интравентрикулярную, интракапсулярную, интраорбитальную, интракардиальную, интрадермальную, интраперитонеальную, транстрахеальную, подкожную, субкутикулярную, внутрисуставную, субкапсулярную, субарахноидальную, интраспинальную, интрацереброспинальную и интрастемальную инъекцию и инфузию. В некоторых вариантах осуществления композиции вводят внутривенной инъекцией или инфузией.
[00135] Используемый в настоящем описании термин «рак (онкозаболевание)» относится к неконтролируемому росту клеток, которые могут препятствовать нормальному функционированию органов и систем организма. Онкозаболевания, которые мигрируют из их первоначального местоположения и задевают жизненно важные органы, могут в итоге привести к смерти пациента через функциональное разрушение пораженных органов. Метастаз представляет собой раковую клетку или группу раковых клеток, отделенную от первоначального местоположения опухоли в результате диссеминации раковых клеток из первичной опухоли в другие части организма. Во время диагностики массы первичной опухоли пациент может быть проверен на наличие транзитных метастазов, например, раковых клеток в процессе диссеминации. Используемый в настоящем описании термин «рак» включает, но не ограничивается указанным, следующие типы рака: рак молочной железы, рак желчных протоков, рак мочевого пузыря, рак головного мозга, в том числе, глиобластомы и медуллобластомы; цервикальный рак; хориокарциному; рак толстой кишки; эндометриальный рак; эзофагеальный рак, рак желудка; гематологические новообразования, включая острый лимфоцитарный и миелоидный лейкоз; T-клеточный острый лимфрбластный лейкоз/лимфому; лейкемический ретикулез; хронический миелоидный лейкоз, множественную миелому; СПИД-ассоциированные лейкозы и Т-клеточный лейкоз-лимфому взрослых; внутриэпителиальные новообразования, включая болезнь Боуэна и болезнь Педжета; рак печени; рак легких; лимфомы, включая болезнь Ходжкина и лимфоцитарные лимфомы; нейробластомы; оральный рак, включая плоскоклеточный рак; рак яичников, включая онкозаболевания, возникающие в эпителиальных клетках, стромальных клетках, половых клетках и мезенхимных клетках; панкреатический рак; рак предстательной железы; ректальный рак; саркомы, включая лейомиосаркому, рабдомиосаркому, липосаркому, фибросаркому и остеосаркому; рак кожи, включая меланому, карциному клеток Меркеля, саркому Капоши, базально-клеточную карциному и плоскоклеточный рак; тестикулярный рак, включая зародышевые опухоли, такие как семинома, не-семинома (тератомы, хориокарциномы), стромальные опухоли и опухоли половых клеток; рак щитовидной железы, включая аденокарциному щитовидной железы и медуллярную карциному; и рак почек, включая аденокарциному и опухоль Вильмса. Примеры рака включают, но не ограничиваются перечисленным, карциному, включая аденокарциному, лимфому, бластому, меланому, саркому и лейкоз. Более конкретные примеры таких онкозаболеваний включают плоскоклеточный рак, мелкоклеточный рак легких, не-мелкоклеточный рак легких, рак желудочно-кишечного тракта, ходжкинскую и не-ходжкинскую лимфому, панкреатический рак, глиобластому, цервикальный рак, рак яичников, рак печени, такой как карцинома печени и гепатома, рак мочевого пузыря, рак молочной железы, рак толстой кишки, колоректальный рак, эндометриальный рак, рак слюнных желез, рак почек, такой как почечно-клеточный рак и опухоли Вильмса, базально-клеточную карциному, меланому, рак предстательной железы, рак вульвы, рак щитовидной железы, тестикулярный рак, эзофагеальный рак и различные типа рака головы и шеи. Специалисту будут известны другие виды рака.
[00136] Используемый в настоящем описании термин «рак» включает, но не ограничивается пееречисленным, солидные опухоли и опухоли, переносимые кровью. Термин «рак» относится к болезни кожи, тканей, органов, костей, хрящей, крови и сосудов. Термин «рак» также охватывает первичные и метастатические онкозаболевания. Примеры онкозаболеваний, которые можно лечить соединениями по изобретению, включают, но не ограничиваются перечисленным, карциному, включая карциному мочевого пузыря, молочной железы, толстой кишки, почек, легких, яичников, поджелудочной железы, желудка, шейки матки, щитовидной железы и кожи, включая плоскоклеточную карциному; опухоли кроветворной системы лимфоидной линии дифференцировки, включая, но не ограничиваясь перечисленным, лейкоз, острый лимфоцитарный лейкоз, острый лимфобластный лейкоз, B-клеточную лимфому, T-клеточную лимфому, лимфому Ходжкина, не-ходжкинскую лимфому, лейкемический ретикулез и лимфому Беркитта; опухоли кроветворной системы миелоидной линии дифференцировки, включая, но не ограничиваясь перечисленным, острый и хронический миелоидный лейкоз и промиелоцитарный лейкоз; опухоли мезенхимного происхождения, включая, но не ограничиваясь перечисленным, фибросаркому, рабдомиосаркому и остеосаркому; другие опухоли, включая меланому, семиному, тетратокарциному, нейробластому и глиому; опухоли центральной и периферической нервной системы, включая, но не ограничиваясь перечисленным, астроцитому, нейробластому, глиому и шванномы; и другие опухоли, включая, но не ограничиваясь перечисленным, ксенодерму, пигментоз, кератоактантому, фолликулярный рак щитовидной железы и тератокарциному. Способы, раскрытые в настоящем описании, применимы для лечения пациентов, которых предварительно лечили от рака, а также тех, кого ранее не лечили от рака. Действительно, способы и композиции по данному изобретению можно использовать при лечения рака первой лииии и второй линии.
[00137] Используемый в настоящем описании термин «предраковое состояние» имеет свое обычное значение, т.е., нерегулируемый рост без метастазирования, и включает различные формы гиперплазии и доброкачественной гипертрофии. Соответственно, «предраковое состояние» представляет собой заболевание, синдром или обнаружение того, что может привести к раку, если оставить без лечения. Это генерализованное состояние с существенно возросшим риском рака. Предопухолевое паталогическое изменение представляет собой морфологически измененную ткань, в которой более вероятно появление рака, чем в его соответственно нормальном аналоге. Примеры предопухолевых состояний включают, но не ограничиваются перечисленным, оральную лейкоплакию, лучевой кератоз (солярный кератоз), пищевод Барретта, атрофический гастрит, доброкачественную гиперплазию предстательной железы, предраковые полипы толстой и прямой кишки, желудочную эпителиальную дисплазию, синдром наследственного неполипозного рака толстой кишки (HNPCC), дисплазию мочевого пузыря, предраковые состояния шейки матки и цервикальную дисплазию.
[00138] В некоторых вариантах осуществления рак выбирают из группы, включающей рак молочной железы; рак яичников; глиому; рак желудочно-кишечного тракта; рак предстательной железы; карциному, карциному легких, гепатоцеллюлярную карциному, тестикулярный рак; цервикальный рак; эндометриальный рак; рак мочевого пузыря; рак головы и шеи; рак легких; гастроэзофагеальный рак и гинекологический рак.
[00139] В некоторых вариантах осуществления способы, описанные в настоящем описании, относятся к лечению пациента, имеющего рак, или диагностированного как имеющего рак. Пациенты, имеющие рак, могут быть идентифицированы врачом с использованием существующих методов диагностики рака. Симпотомы и/или осложнения рака, которые характеризуют такие состояния и способствуют установлению диагноза, хорошо известны в технике и включают, но не ограничиваются перечисленным, рост опухоли, ухудшенное функционирование органа или ткани, включающих раковые клетки, и т.д. Тесты, которые могут помочь диагностировать, например, рак, включают, но не ограничиваются перечисленным, биопсию тканей и гистологическую проверку. Семейный анамнез рака или наличие факторов риска (например, табачных продуктов, облучения и т.д.) также могут помочь определить, может ли пациент иметь рак, или при установлении диагноза рака.
[00140] В некоторых вариантах осуществления способ также включает совместное назначение пациенту одной или нескольких дополнительных противораковых терапий. В некоторых вариантах осуществления дополнительную терапию выбирают из группы, включающей операцию, химиотерапию, лучевую терапию, термотерапию, иммунотерапию, гормональную терапию, лазерную терапию, антиангиогенную терапию и их любые комбинации. В некоторых вариантах осуществления дополнительная терапия включает введение пациенту противоракового средства. В некоторых вариантах осуществления способ включает совместное введение пациенту конъюгата и противоракового или химиотерапевтического средства. Используемый в настоящем описании термин «противораковое средство» относится к любому соединению (включая его аналоги, производные, пролекарства и фармацевтически приемлемые соли) или композиции, которые можно использовать для лечения рака. Противораковые соединения для использования в настоящем изобретении включают, но не ограничиваются перечисленным, ингибиторы топоизомеразы I и II, алкилирующие агенты, ингибиторы микротрубочек (например, таксол) и ингибиторы ангиогенеза. Примеры противораковых соединений включают, но не ограничиваются перечисленным, паклитаксел (таксол), доцетаксел; гермицитибин; альдеслейкин; алемтузумаб; алитретиноин; аллопуринол; альтретамин; амифостин; анастрозол; триоксид мышьяка; аспарагиназу; живую БЦЖ; капсулы бексаротена; бексаротен гель; блеомицин; бусульфан внутривенный; бусульфанорал; калустерон; капецитабин; платинат; кармустин; кармустин с имплантом Polifeprosan; целекоксиб; хлорамбуцил; кладрибин; циклофосфамид; цитарабин; липосомальный цитарабин; дакарбазин; дактиномицин; актиномицин D; дарбепоэтин альфа; липосомальный даунорубицин; даунорубицин; дауномицин; денилейкин дифтитокс; дексразоксан; доцетаксел; доксорубицин; липосомальный доксорубицин; дромостанолона пропионат; В-раствор Эллиота; эпирубицин; эпоэтин альфа; эстрамустин; этопозида фосфат; этопозид (VP-16); экземестан; филграстим; флоксуридин (интраартериальный); флударабин; флюороурацил (5-FU); фулвестрант; гемтузумаб озогамицин; гозерелина ацетат; гидроксимочевину; ибритумомаб тиуксетан; идарубицин; ифосфамид; имитимиба мезилат; интерферон альфа-2a; интерферон альфа-2b; иринотекан; летрозол; лейковорин; левамизол; ломустин (CCNU); мехлортамин (нитрогенмустард); мегестрола ацетат; мелфалан (L-PAM); меркаптопурин (6-MP); месну; метотрексат; метокссален; митомицин C; митотан; митоксантрон; нандролона фенилпропионат; нофетумомаб; LOddC; опрелвекин; памидронат; пегадемазу; пегаспаргазу; пегфилграстим; пентостатин; пипоброман; пликамицин; митрамицин; порфимер натрий; прокарбазин; квинакрин; расбуриказу; ритуксимаб; саграмостим; стрептозоцин; телбувидин (LDT); тальк; тамоксифен; темозоломид; тенипозид (VM-26); тестолактон; тиогуанин (6-TG); тиотепу; топотекан; торемифен; тозитомомаб; трастузумаб; третиноин (ATRA); урацилмустард; валрубицин; валторцитабин (моновал LDC); винбластин; винорелбин; золедронат и их любые смеси. В некоторых вариантах осуществления противораковое средство представляет собой конъюгат паклитаксел-углевод, например, конъюгат паклитаксел-глюкоза, описанный в пат. США № 6218367, включенном в данное описание в качестве ссылки.
[00141] Способ по изобретению особенно применимы в комбинации со способами лечения рака, которые включают введение второго лекарственного средства, которое действует в другой фазе клеточного цикла.
[00142] Для введения пациенту соединения на основе платины и/или частицы, включающие указанные соединения на основе платины, предлагаются в фармацевтически приемлемых композициях. Соответственно, раскрытие также относится к фармацевтическим композициям, включающим соединения на основе платины или частицы, раскрытые в настоящем описании. Такие фармацевтически приемлемые композиции включают терапевтически эффективное количество одного или нескольких фармацевтически приемлемых носителей (добавок) и/или разбавителей. Указанные фармацевтические композиции по настоящему изобретению составляют конкретно для введения в твердой или жидкой форме, в том числе, композиций, приспособленных для следующего: (1) перорального введения, например, в форме жидкостей (водные или неводные растворы или суспензии), лепешек, драже, капсул, пилюль, таблеток (например, предназначенных для трансбуккальной, сублингвальной и системной абсорбции), болюсов, порошков, гранул, паст для нанесения на язык; (2) парентерального введения, например, подкожной, внутримышечной, внутривенной или эпидуральной инъекцией, в виде, например, стерильного раствора или суспензии, или композиции с пролонгированным высвобождением; (3) местного применения, например, в виде крема, мази или пэтча с регулируемым высвобождением, или спрея, наносимого на кожу; (4) интравагинального или интраректального введения, например, в виде крема или пенки; (5) сублингвального введения; (6) введения в глаза; (7) трансдермального введения; (8) трансмукозного введения или (9) назального введения. Кроме того, соединения по настоящему раскрытию можно имплантировать пациенту или впрыскивать с использованием системы доставки лекарственного средства.
[00143] Используемый в настоящем описании термин «фармацевтически приемлемый» относится к таким соединениям, материалам, композициям и/или лекарственным формам, которые, в рамках здравого медицинского суждения, подходят для применения в контакте с тканями людей и животных без чрезмерной токсичности, раздражения, аллергической реакции или иной проблемы или осложнения, соразмерно с разумным соотношением выгода/риск.
[00144] Используемый в настоящем описании термин «фармацевтически приемлемый носитель» обозначает фармацевтически приемлемый материал, композицию или среду, такую как жидкий или твердый наполнитель, разбавитель, эксципиент, вспомогательный материал для изготовления (например, смазывающее вещество, тальк, стеарат магния, кальция или цинка или стеариновая кислота) или материал, инкапсулирующий растворитель, включенный в носитель или переносчик соединения у пациента из одного органа или части организма в другой орган или часть организма. Каждый носитель должен быть «приемлемым» в смысле совместимости с другими ингредиентами композиции и безвредным для пациента. Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают (1) сахара, такие как лактоза, глюкоза и сахароза; (2) крахмалы, такие как кукурузный крахмал и картофельный крахмал; (3) целлюлозу и ее производные, такие как натрийкарбоксиметилцеллюлоза, метилцеллюлоза, этилцеллюлоза, микрокристаллическая целлюлоза и ацетат целлюлозы; (4) порошок трагаканта; (5) солод; (6) желатин; (7) лубриканты, такие как стеарат магния, лаурилсульфат магния и тальк; (8) эксципиенты, такие как масло какао и воски для суппозиториев; (9) масла, такие как арахисовое масло, хлопковое масло, подсолнечное масло, сезамовое масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль (ПЭГ); (12) сложные эфиры, такие как этилолеат и этиллаурат; (13) агар; (14) буферирующие вещества, такие как гидроксид магния и гидроксид алюминия; (15) альгиновую кислоту; (16) апирогенную воду; (17) изотоничный физиологический раствор; (I8) раствор Рингера; (19) этиловый спирт; (20) pH-буферные растворы; (21) сложные полиэфиры, поликарбонаты и/или полиангидриды; (22) наполнители, такие как полипептиды и аминокислоты; (23) сывороточный компонент, такой как сывороточный альбумин, HDL и LDL; (22) спирты C2-C12, такие как этанол; и (23) другие нетоксичные совместимые вещества, используемые в фармацевтических препаратах. Смачивающие вещества, красители, антиадгезивы, вещества для покрытия, подслащивающие вещества, корригенты, отдушки, консерванты и антиоксиданты также могут присутствовать в препарате. Термины, такие как «эксципиент», «носитель», «фармацевтически приемлемый носитель» или подобные, используются в настоящем описании как взаимозаменяемые.
[00145] В некоторых вариантах осуществления фармацевтическая композиция, включающая соединение на основе платины, может представлять собой парентеральную лекарственную форму. Так как введение парентеральных лекарственных форм обычно обходит природную защиту пациентов от примесей, парентеральные лекарственные формы предпочтительно являются стерильными или их можно стерилизовать перед введением пациенту. Примеры парентеральных лекарственных форм включают, но не ограничиваются перечисленным, готовые растворы для инъекции, сухие продукты, готовые к растворению или суспендированию в фармацевтически приемлемой среде для инъекции, суспензии, готовые для инъекции, и эмульсии. Кроме того, для введения пациенту можно получить парентеральные лекарственные формы с регулируемым высвобождением, включая, но не ограничиваясь указанным, лекарственные формы типа DUROS® и со сбросом дозы.
[00146] Подходящие среды, которые можно использовать для получения парентеральных лекарственных форм композиции, описанной в настоящем описании, хорошо известны специалистам в данной области техники. Примеры включают, без ограничения, стерильную воду; воду для инъекций по USP; физиологический раствор; раствор глюкозы; водные среды, такие как, но без ограничения, инъекция хлорида натрия, инъекция Рингера, инъекция декстрозы, инъекция декстрозы и хлорида натрия и инъекция Рингера с лактатом; смешивающиеся с водой среды, такие как, но без ограничения, этиловый спирт, полиэтиленгликоль и пропиленгликоль; и неводные среды, такие как, но без ограничения, кукурузное масло, хлопковое масло, арахисовое масло, сезамовое масло, этилолеат, изопропилмиристат и бензилбензоат. Соединения, которые изменяют или модифицируют растворимость фармацевтически приемлемой соли, также могут быть включены в парентеральные лекарственные формы по раскрытию, включая обычные парентеральные лекарственные формы и парентеральные лекарственные формы с регулируемым высвобождением.
[00147] Также можно получить фармацевтические композиции, подходящие для перорального введения, например, в виде дискретных лекарственных форм, таких как, но без ограничения, таблетки (включая, без ограничения, таблетки с насечкой или с покрытием), пилюли, капсулы, жевательные таблетки, порошки в пакетиках, облатки, пастилки, аэрозольные спреи или жидкости, такие как, но без ограничения, сиропы, эликсиры, растворы или суспензии в водной жидкости, неводной жидкости, эмульсии масло-в-воде или эмульсии вода-в-масе. Такие композиции содержат предварительно установленное количество фармацевтически приемлемой соли раскрытых соединений и могут быть получены методами фармации, хорошо известными специалистам в данной области техники. См. для общего представления Remington: The Science and Practice of Pharmacy, 21st Ed., Lippincott, Williams and Wilkins, Philadelphia PA. (2005).
[00148] Обычные лекарственные формы обеспечивают быстрое или немедленное высвобождение лекарственного средства из препарата. В зависимости от фармакологии и фармакокинетики лекарственного средства, применение обычных лекарственных форм может привести к широким флуктуациям концентрации лекарственного средства в крови пациента и других тканях. Такие флуктуации могут влиять на ряд параметров, таких как частота приема дозы, начало действия, длительность действия, поддержание терапевтических уровней в крови, токсичность, побочное действие и т.п. Выгодно можно использовать препараты с регулируемым высвобождением для регулирования начала действия лекарственного средства, длительности действия, уровней в плазме в пределах терапевтического окна и максимальных уровней в крови. В частности, лекарственные формы или препараты с регулируемым или пролонгированным высвобождением можно использовать для уверенности в том, что максимальная эффективность лекарственного средства достигается, причем в то же время минимизируются возможные вредные действия и заботы о безопасности, которые могут иметь место как из-за заниженной дозы (т.е., поступления ниже минимальных терапевтических уровней), так и из-за превышения уровня токсичности для лекарственного средства. В некоторых вариантах осуществления композиция, описанная в настоящем описании, может вводиться в препарате с пролонгированным высвобождением.
[00149] Фармацевтические продукты с регулируемым высвобождением создаются с целью улучшения лекарственной терапии по сравнению с достигнутой их аналогами с нерегулируемым высвобождением. В идеале использование оптимально созданного препарата с регулируемым высвобождением при лечении лекарственными средствами характеризуется минимумом лекарственного средства, используемого для лечения или борьбы с состоянием за минимальный период времени. Преимущества препаратов с регулируемым высвобождением включают 1) пролонгированную активность лекарственного средства; 2) уменьшенную частоту приема; 3) улучшенное соблюдение больным режима и схемы лечения; 4) применение меньше лекарственного средства в целом; 5) снижение местного или системного побочного действия; 6) минимизацию накопления лекарственного средства; 7) уменьшение флуктуаций уровня в крови; 8) улучшение эффективности лечения; 9) уменьшение потенцирования или потери активности лекарственного средства и 10) увеличение скорости борьбы с заболеваниями или состяниями. Kim, Cherng-ju, Controlled Release Dosage Form Design, 2 (Technomic Publishing, Lancaster, Pa.: 2000).
[00150] Большинство препаратов с регулируемым высвобождением создают для высвобождения сначала лекарственного средства (активного ингредиента) в количестве, которое быстро производит желательное терапевтическое действие, и постепенного и длительного высвобождения лекарственного средства в других количествах для поддержания такого уровня терапевтического или профилактического действия в течение протяженного периода времени. Для того, чтобы поддерживать такой постоянный уровень лекарственного средства в организме, лекарственное средство должно высвобождаться из лекарственной формы в степени, которая будет возмещать количество лекарственного средства, претерпевающего метаболизм и выведенного из организма. Регулируемое высвобождение активного ингредиента можно стимулировать различными условиями, включающими, но без ограничения, рН, ионную силу, осмотическое давление, температуру, ферменты, воду и другие физиологические условия или соединения.
[00151] Ряд известных лекарственных форм, препаратов и устройств с регулируемым или пролонгированным высвобождением можно адаптировать для использования с солями и композицями по данному изобретению. Примеры включают, но не ограничиваются перечисленным, препараты и устройства, описанные в пат. США №№ 3845770; 3916899; 3536809; 3598123; 4008719; 5674533; 5059595; 5591 767; 5120548; 5073543; 5639476; 5354556; 5733566 и 6365185 B1, включенных в данное описание в качестве ссылок. Такие лекарственные формы можно использовать для обеспечения постепенного или регулируемого высвобождения одного или нескольких активных ингредиентов с использованием, например, гидроксипропилметилцеллюлозы, других полимерных матриц, гелей, проницаемых мембран, осмотических систем (таких как OROS® (Alza Corporation, Mountain View, Calif. USA)) или их комбинаций, и получать желательный профиль высвобождения в различных пропорциях.
[00152] Воплощения различных аспектов, описанных в настоящем описании, можно определить в любом из приведенных далее нумерованных пунктах.
1. Соединение, включающее
платиновую часть и
липид, соединенный с указанной платиновой частью.
2. Соединение по пункту 1, при этом соединение включает карбонильную часть.
3. Соединение по пункту 2, при этом карбонильная часть представляет собой карбоновую кислоту, выбранную из группы, состоящей из янтарной кислоты, малоновой кислоты, щавелевой кислоты, кетокислоты и их любых комбинаций.
4. Соединение по любому из пунктов 1-3, в котором атом платины или платиновая часть конъюгированы с указанным липидом через ковалентную связь, координационную связь или их комбинацию.
5. Соединение по любому из пунктов 1-4, при этом соединение включает по меньшей мере один линкер между платиновой частью и липидом.
6. Соединение по любому из пунктов 1-5, при этом соединение представляет собой соединение формулы (VIII)
Q-линкер-липид (VIII),
в которой
Q представляет собой
(i)
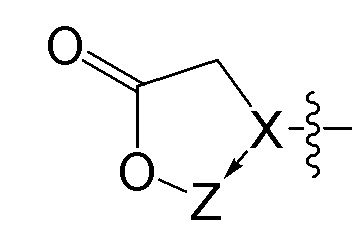
(ii)
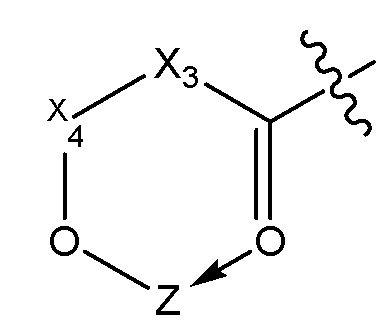
(iii)
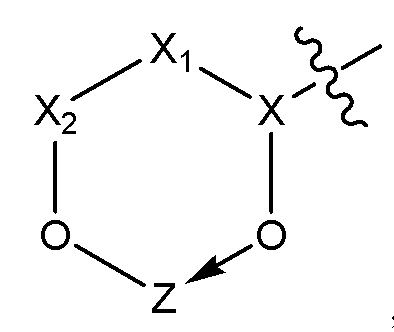
(iv)
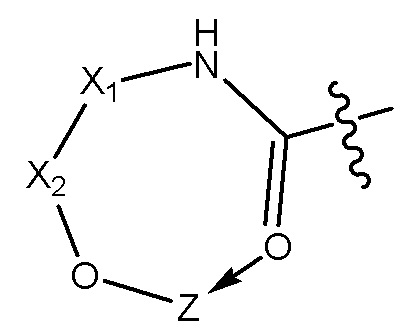
(v)

(vi)

7. Соединение по пункту 6, где Z представляет собой

8. Соединение по пункту 7, где Z представляет собой
9. Соединение по пункту 8, при этом p равен 2.
10. Соединение по любому из пунктов 1-9, при этом линкер выбирают из группы, состоящей из
(i) -X-CH2-X2-X1-, где X представляет собой NH; X1 представляет собой C(O)O, C(O)NH, O(CH2)-O, NH или O; X2 представляет собой (CH2)n или C(O); и n равен 0, 1, 2, 3, 4 или 5;
(ii) -(CH2)nO-, -(CH2)nNHC(O)O-, -(CH2)nOC(O)NH-, -(CH2)nC(O)NH(CH2)mO-, -(CH2)nO(CH2)mO-, -(CH2)nO(O)-, -(CH2)nNHC(O)(CH2)mO- или -(CH2)nC(O)O-; где n и m равны независимо 0, 1, 2, 3, 4 или 5;
(iii) -X3-X4X5-X6-, где X3 представляет собой CH, CH2 или O; и X4, X5 и X6 независимо являются одинаковыми или различными и представляют собой-CH2O- или O; и
(iv) любых комбинаций (i)-(iii).
11. Соединение по любому из пунктов 1-10, при этом линкер выбирают из группы, состоящей из связи, этилендиамина, этиленгликоля, диэтиленгликоля, 1,3-пропандиола, глицина, бета-аланина, -O-, -CH2O-NHCH2CH2NHC(O)-, -NHCH2CH2NHC(O)O-, -NHCH2CH2-, -NHCH2CH2O-, -NHCH2C(O)-, -NHCH2C(O)O-, -NHCH2C(O)OCH2CH2CH2-, -NHCH2C(O)OCH2CH2CH2O-, -NHCH2C(O)NH-, -CH2CH2-, -CH2CH2O-, -CH2CH2NHC(O)-, -CH2CH2NHC(O)O-, -CH2CH2O-, -CH2C(O)NHCH2CH2-, -CH2C(O)NHCH2CH2O-, -CH2CH2OCH2CH2-, -CH2CH2OCH2CH2O-, -CH2C(O)-, -CH2C(O)O-, -CH2CH2CH2-, --CH2CH2CH2O-, =CH-CH=CH2-, =CH-CH=CHCH2O-, -CH=CHCH2-, -CH=CHCH2O-, -OCH2CH2O-, -CH2-, -CH2O-, -NHC(O)CH2-, -NHC(O)CH2O-, -C(O)CH2-, -C(O)CH2O-, -OC(O)CH2-, -OC(O)CH2O-, -C(O)CH2CH2C(O)NHCH2CH2-, -OC(O)CH2CH2C(O)NHCH2CH2-, -C(O)CH2CH2C(O)NHCH2CH2O-, -OC(O)CH2CH2C(O)NHCH2CH2O-, -C(O)CH2CH2C(O)NHCH2CH2NHC(O)-, -OC(O)CH2CH2C(O)NHCH2CH2NHC(O)-, -C(O)CH2CH2C(O)NHCH2CH2NHC(O)O-, -OC(O)CH2CH2C(O)NHCH2CH2NHC(O)O- и их любых комбинаций.
12. Соединение по любому из пунктов 1-11, при этом липид выбирают из жиров, восков, стеринов, стероидов, желчных кислот, жирорастворимых витаминов, моноглицеридов, диглицеридов, фосфолипидов, гликолипидов, сульфолипидов, аминолипидов, хромолипидов, глицерофосфолипидов, сфинголипидов, преноллипидов, сахаролипидов, поликетидов и жирных кислот или их любой комбинации, предпочтительно, стеринов, выбранных из холестерина, хлорформиата холестерина или их производных и их любых комбинаций.
13. Соединение по пункту 12, при этом липид представляет собой холестерин или альфа-токоферол.
14. Соединение по любому из пунктов 1-13, при этом соединение представлено
(i) формулой I:
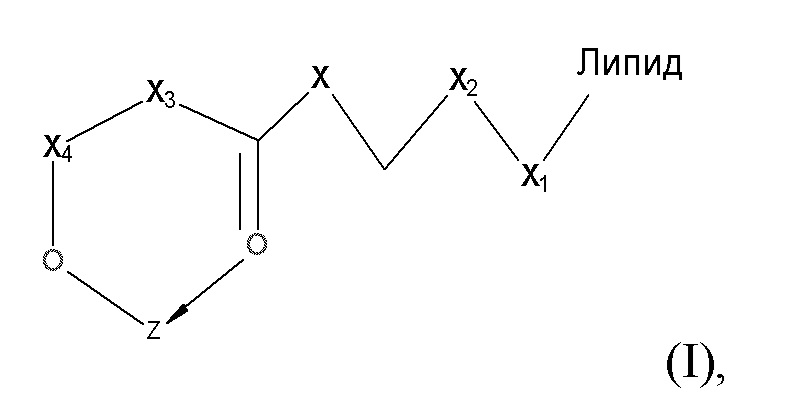
где
X представляет собой NH;
X1 выбирают из группы, включающей COOH, CONH2, O-(CH2)n-OH, NH2 и OH;
X2 представляет собой (CH2)n или CO;
X3 выбирают из группы, включающей (CH2)n, CH2-NH и C4H8;
X4 представляет собой CO или -CH-CH3; и
Z представляет собой содержащее платину соединение, при этом платина образует часть цикла формулы I; и
n равен 0, 1 или 2;
(ii) формулой II:

где
X представляет собой NH или N-CH2COO-;
X1 выбирают из группы, включающей -(CH2)nOH, -(CH2)nNHCOOH, -(CH2)nCONH(CH2)nOH, (CH2)nO(CH2)nOH, (CH2)nC=O, -(CH2)nNHCO(CH2)nOH и (CH2)n-COOH;
Z представляет собой содержащее платину соединение, при этом платина образует часть цикла формулы II; и
n равен 0, 1 или 2;
(iii) формулой III:
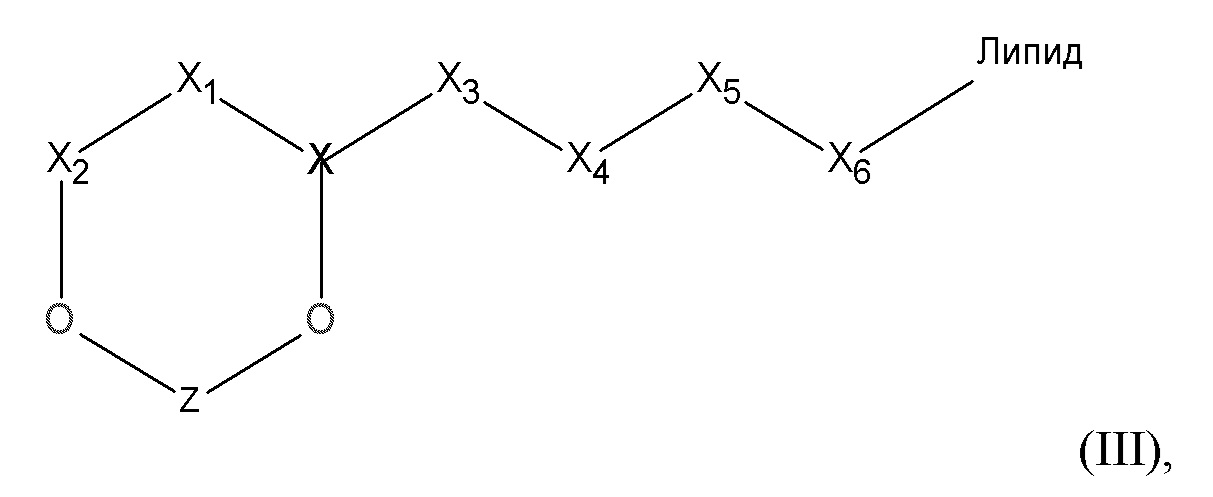
где
X выбирают из группы, включающей S+, C, S+=O, N+H и P=O;
X1 выбирают из группы, включающей -CH, -CH2и -CH2O;
X2 представляет собой C=O;
X3 выбирают из CH, CH2 или O;
X4, X5, X6 выбирают из -CH2O или O; и
Z представляет собой содержащее платину соединение, при этом платина образует часть цикла формулы III;
(iv) формулой IV:
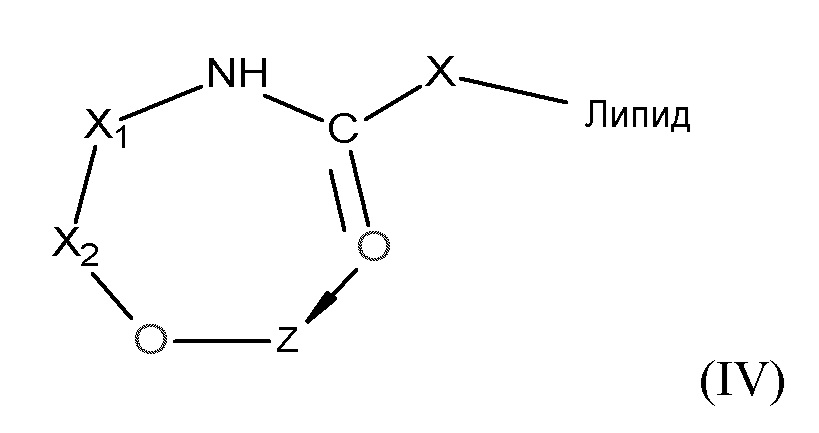
где
X представляет собой CH2OH;
X1 представляет собой (CH2)n;
X2 представляет собой C=O;
Z представляет собой содержащее платину соединение, при этом платина образует часть цикла формулы IV; и
n равен 0, 1 или 2;
(v) формулой VI:
(vi) формулой VII

15. Соединение формулы (V)

где
X1, X2, X3 и X4 выбирают независимо из группы, состоящей из O, P, S, Se, Cl, N, C, O-A, O-B, DACH, галогенидов и хелатированной или нехелатированной дикарбоксилато соединяющей группы и их любых комбинаций;
при этом A и B выбирают независимо из группы, состоящей из C, P, S, N и их любых комбинаций; и
при этом X4 является необязательным.
16. Способ получения соединения, включающего
платиновую часть и
липид, соединенный с указанной платиной,
причем указанный способ включает конъюгацию липида с платиновой частью с образованием указанного соединения.
17. Способ по пункту 16, также включающий
(a) взаимодействие липида с линкером с образованием первого соединения;
(b) необязательно, взаимодействие первого соединения со стадии (a) с карбонильной частью с образованием второго соединения; и
(c) конъюгацию первого соединения со стадии (a) или второго соединения со стадии (b) с платиновой частью с образованием указанного соединения.
18. Способ по пункту 16 или 17, при этом соединение представляет собой соединение по любому из пунктов 1-15.
19. Наночастица, содержащая соединение, включающее
(a) платиновую часть и
(b) липид, связанный с указанной платиновой частью.
20. Наночастица по пункту 19, при этом соединение представляет собой соединение по любому из пунктов 1-15.
21. Наночастица по пункту 19 или 20, при этом наночастица также включает солипид и/или стабилизатор.
22. Наночастица по пункту 21, при этом отношение соединения к солипиду и/или стабилизатору колеблется от 99:1 дo 1:99 (масс./масс.), (моль/моль) или (об./об.).
23. Наночастица по пункту 21, при этом наночастица включает соевый фосфатидилхолин и 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоль)-2000] как солипиды, и при этом отношение соединения к солипидам колеблется от приблизительно 1:1:0,01 до приблизительно 1:4:3.
24. Фармацевтическая композиция, включающая наночастицу по любому из пунктов 19-23.
25. Фармацевтическая композиция, включающая соединение по любому из пунктов 1-15.
26. Фармацевтическая композиция по пункту 24 или 25, в которой эксципиент выбран из группы, включающей гранулирующие агенты, связующие, лубриканты, диспергирующие агенты, подслащивающие вещества, глиданты, антиадгезивы, антистатики, поверхностно-активные вещества, антиоксиданты, камеди, средства для покрытия, красители, корригенты, пластификаторы, консерванты, суспендирующие вещества, эмульгаторы, растительный целлюлозный материал, агенты сферонизации и их любую комбинацию.
27. Фармацевтическая композиция по любому из пунктов 24-26, при этом композицию включают в лекарственную форму, выбранную из группы, состоящей из инъекции, таблетки, лиофилизованного порошка, липосомальной суспензии и их любых комбинаций.
28. Способ лечения или устранения рака у пациента, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения по любому из пунктов 1-15 или наночастиц по любому из пунктов 19-23.
29. Способ по пункту 28, при этом рак выбирают из группы, включающей рак молочной железы, головы и шеи, яичников, тестикулярный рак, рак предстательной железы, полости рта и пищевода, желудочно-кишечного тракта, печени, желчного пузыря, легких, меланому, рак кожи, саркому, рак крови, головного мозга, глиобластому, опухоли нейроэктодермального происхождения и их любые комбинации.
30. Способ по пункту 28 или 29, при этом указанное введение является внутривенным введением, внутрисуставным введением, введением в панкреатодуоденальную артерию, интраперитонеальным введением, гепатопортальным введением, внутримышечным введением или их любыми комбинациями.
31. Наночастица по любому из пунктов 19-23, при этом наночастица имеет повышенное клеточное поглощение платины в раковых клетках по сравнению с цисплатином или оксалиплатином.
32. Наночастица по любому из пунктов 19-23 и 31, при этом наночастица имеет большее накопление платины в опухоли по сравнению с цисплатином или оксалиплатином в дозировке, эквивалентной количеству цисплатина или оксалиплатина.
33. Соединение по любому из пунктов 1-15, при этом соединение имеет повышенное клеточное поглощение платины в раковых клетках по сравнению с цисплатином или оксалиплатином.
34. Соединение по любому из пунктов 1-15 и 33, при этом соединение имеет большее накопление платины в опухоли по сравнению с цисплатином или оксалиплатином в дозировке, эквивалентной количеству цисплатина или оксалиплатина.
35. Способ получения наночастицы:
а) предоставление соединения платины, при этом соединение платины включает платиновую часть и липид, соединенный с указанной платиновой частью; и
b) взаимодействие соединения с солипидом в присутствии растворителя с образованием наночастицы.
36. Способ по пункту 35, при этом соединение платины получают согласно способу по любому из пунктов 16-18.
37. Способ по пункту 35 или 36, при этом растворитель выбирают из группы, включающей хлороформ, метанол, дихлорметан, этанол и их любые комбинации.
38. Способ по любому из пунктов 35-37, при этом солипид выбирают из группы, включающей соевый фосфатидилхолин (полностью гидрированный), 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоль)-2000], диолеоилфосфатидилхолин (DOPC), DSPE-PEG-OMe, диолеоилфосфатидилэтаноламин (DOPE) и их любую комбинацию.
39. Способ по пунктам 35-38, при этом стадия (b) также включает стадии сушки, инкубации и необязательного добавления стабилизатора.
40. Способ по пункту 39, при этом стабилизатор выбирают из группы, состоящей из DSPE-ПЭГ-OMe, DSPE-ПЭГ-NH2, ПЭГ, неорганической соли, углевода и их любых комбинаций.
41. Способ по пункту 40, при этом неорганическую соль выбирают из группы, включающей хлорид аммония, хлорид калия, хлорид натрия, динатрийгидрофосфат, дигидрофосфат натрия и их любую комбинацию.
42. Способ по пункту 40 или 41, при этом углевод выбирают из группы, включающей глюкозу, декстрозу и их любые комбинации.
43. Способ по любому из пунктов 35-42, при этом солипид представляет собой соевый фосфатидилхолин и 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоль)-2000].
44. Способ по любому из пунктов 35-43, при этом отношение соединения платины и солипидов составляет от приблизительно 1:1:0,01 до приблизительно 1:4:3.
Некоторые избранные определения
[00153] Для удобства некоторые термины, используемые в настоящем описании, примерах и прилагаемой формуле изобретения, собраны в данном разделе. Если не указано иное или не следует явно из контекста, приведенные далее термины и выражения включают значения, указанные ниже. Если иное не указано явно или не очевидно из контекста, термины и выражения, следующие ниже, не исключают значение, которое термин или выражение имеет в области техники, к которой относится. Определения даются в помощь описанию определенных вариантов осуществления и не предназначены для ограничения изобретения, описанного в заявке, поскольку объем изобретения ограничивается только формулой изобретения. Кроме того, если контекст не требует иного, термины в единственном числе будут включать множественное число и термины во множественном числе будут включать единственное число.
[00154] Если не определено иное, все технические и научные термины, используемые в настоящем описании, имеют те значения, какие им обычно придают специалисты в области техники, к которой относится изобретение. Хотя любые известные методы, устройства и материалы могут использоваться при практическом осуществлении или при проверке изобретения, методы, устройства и материалы в этом отношении описываются в настоящем описании.
[00155] Используемый в настоящем описании термин «включающий» или «включает» используется при обращении к композициям, методам и их соответствующему(им) компоненту(ам), которые существенны для изобретения, еще открытым для включения элементов, точно не определенных как существенные или нет.
[00156] Термины в единственном числе включают множественные референты, если контекст явно не указывает иное.
[00157] Все числа, иные, чем в рабочих примерах, или указанные в других случаях, выражающие количества ингредиентов или условия реакции, используемые в настоящем описании, следует понимать как видоизмененные во всех случаях термином «примерно». Термин «примерно», когда используется в связи с процентами, может обозначать среднее ±5% величины, о которой идет речь. Например, примерно 100 означает от 95 до 105.
[00158] Хотя способы и материалы, схожие или эквивалентные описанным в настоящем описании, можно использовать при парктическом осуществлении или при проверке данного изобретения, подходящие способы и материалы описаны ниже. Термин «включает» означает «заключает в себе». Аббревиатура «e.g.» происходит от латинского exempli gratia и используется в настоящем описании для указания на неограничивающий пример. Таким образом, аббревиатура «e.g.» является синонимом термина «например».
[00159] Термины «уменьшенный», «сниженный», «уменьшение», «снижение» или «ингибировать» все используются в настоящем описании обычно для обозначения снижения с помощью статистически значимой величины. Однако, для того, чтобы избежать неопределенности, «уменьшенный», «уменьшение», «снижение» или «ингибировать» обозначают снижение по меньшей мере на 10% по сравнению с исходным уровнем, например, снижение по меньшей мере примерно на 20% или по меньшей мере примерно на 30%, или по меньшей мере примерно на 40%, или по меньшей мере примерно на 50%, или по меньшей мере примерно на 60%, или по меньшей мере примерно на 70%, или по меньшей мере примерно на 80%, или по меньшей мере примерно на 90%, или до и включая снижение на 100% (например, отсутствие уровня по сравнению с эталонным образцом), или любое снижение в интервале 10-100% по сравнению с исходным уровнем.
[00160] Термины «повышенный», «повышать» или «усиливать» или «активировать» все используются в настоящем описании обычно для обозначения возрастания с помощью статистически значимой величины; для того, чтобы избежать какой-либо неопределенности, термины «повышенный», «повышать» или «усиливать» или «активировать» обозначают возрастание по меньшей мере на 10% по сравнению с исходным уровнем, например, возрастание по меньшей мере примерно на 20%, или по меньшей мере примерно на 30%, или по меньшей мере примерно на 40%, или по меньшей мере примерно на 50%, или по меньшей мере примерно на 60%, или по меньшей мере примерно на 70%, или по меньшей мере примерно на 80%, или по меньшей мере примерно на 90% или до и включая возрастание на 100% или любое возрастание в интервале 10-100% по сравнению с исходным уровнем, или по меньшей мере примерно 2-кратное, или по меньшей мере примерно 3-кратное, или по меньшей мере примерно 4-кратное, или по меньшей мере примерно 5-кратное, или по меньшей мере примерно 10-кратное возрастание, или любое возрастание между 2-кратным м 10-кратным или больше по сравнению с исходным уровнем.
[00161] Термин «статистически значимое» или «значимо» относится к статистической значимости и обычно обозначает по меньшей мере два стандартных отклонения (2SD) от исходного уровня. Термин относится к статистическому основанию, что существует различие. Он определяется как вероятность принятия решения отклонить нулевую гипотезу, когда нулевая гипотеза фактически справедлива.
[00162] Используемые в настоящем описании термины «лечить», «лечение», «лечащий» или «облегчение симптомов» относятся к терапиям, когда целью является реверсия, смягчение, облегчение, ингибирование, замедление или остановка развития или тяжести состояния, связанного с заболеванием или расстройством, например, раком. Термин «лечение» включает уменьшение или смягчение по меньшей мере одного вредного эффекта или симптома состояния, заболевания или расстройства, связанного с раком. Лечение, как правило, является «эффективным», если ослаблен один или несколько симптомов или клинических маркеров. С другой стороны, лечение является «эффективным», если ослаблено или остановлено развитие заболевания. Иными соловами, «лечение» включает не только улучшение по симптомам или маркерам, но также остановку или по меньшей мере замедление развития или ухудшения симптомов по сравнению с тем, что можно было бы ожидать в отсутствие лечения. Выгода или желательные клинические результаты включают, но не ограничиваются перечисленным, ослабление одного или нескольких симптомов, уменьшение длительности заболевания, стабилизацию статуса (т.е., отсутствие ухудшения) заболевания, задержку или замедление развития заболевания, ослабление или временное облегчение болезненного состояния, ремиссию (частичную или полную) и/или снижение смертности, выявляемые или невыявляемые. Термин «лечение» заболевания также включает обеспечение ослабления симптомов или побочных эффектов заболевания (включая паллиативное лечение).
[00163] Используемый в настоящем описании термин «устранение справляться» или «устранение» относится к предупреждению появления у пациента заболевания или расстройства, снижению риска смерти из-за заболевания или расстройства, отсрочке начала заболевания или расстройства, ингибированию развития заболевания или расстройства, частичному или полному излечению от заболевания или расстройства и/или вредного действия, которое может быть связано с указанным заболеванием или расстройством, получению желательного фармакологического и/или физиологического действия (действие может быть профилактическим в смысле полного или частичного предупреждения расстройства или заболевания или состояния или его симптома и/или может быть терапевтическим в смысле частичного или полного излечения от заболевания или расстройства и/или вредного действия, которое может быть связано с заболеванием или расстройством), облегчению заболевания или расстройства (т.е., стремлению добиться регрессии заболевания или расстройства). Кроме того, настоящее раскрытие также предусматривает лечение указанного заболевания путем введения терапевтической композиции по настоящему раскрытию.
[00164] Термины «пациент» и «индивидуум» используются в настоящем описании как взаимозаменяемые и обозначают человека или животное. Как правило, животное является позвоночным, таким как примат, грызун, домашнее животное или охотничье-промысловое животное. Приматы включают шимпанзе, cynomologous обезьян, паукообразных обезьян и макаков, например, макака резус. Грызуны включают мышей, крыс, сурков, хорьков, кроликов и хомяков. Домашние и охотничье-промысловые животноые включают коров, лошадей, свиней, оленей, бизона, буйвола, кошачьих, например, домашнюю кошку, собачьих, например, собаку, лису, волка, птиц, например, кур, эму, страуса, и рыб, например, радужную форель, зубатку полосатую и лосося. Пациент или пациент включает любое подмножество из вышеуказанных, например, всех из названных выше, но исключая одну или несколько групп или видов, таких как люди, приматы или грызуны. В некоторых вариантах осуществления пациентом является млекопитающее, например, примат, например, человек. Термины «пациент» и «пациент» используются в настоящем описании как взаимозаменяемые.
[00165] Предпочтительно пациент является млекопитающим. Млекопитающее может представлять собой человека, примата, не являющегося человеком, мышь, крысу, собаку, кошку, лошадь или корову, но не ограничивается приведенными примерами. Млекопитающие иные, чем люди, могут выгодно использоваться как пациенты, которые представляют собой животные модели рака. Кроме того, способы, описанные в настоящем описании, можно использовать для лечения одомашненных животных и/или комнатных животных. Пациент может представлять собой особь мужского пола или женского пола. Пациент может представлять собой пациента, которого ранее диагностировали или идентифицировали как страдающего от рака, но не нуждающегося в лечении, которое уже получил.
[00166] Описание вариантов осуществления раскрытия не предполагает, что раскрытие исчерпывается или ограничивается точно раскрытой формой. Кроме того, что описаны конкретные воплощения и примеры раскрытия с целью пояснения, в объеме раскрытия возможны различные эквивалентные модификации, которые будут понятны специалистам в данной области техники. Например, в то время как стадии способа и действия приводятся в определенном порядке, в альтернативных вариантах осуществления действия могут выполняться в другом порядке, или действия могут выполняться, по существу, одновременно. Указания по раскрытию, приведенные в настоящем описании, могут применяться к другим процедурам или способам в соответствующем случае. Различные воплощения, описанные в настоящем описании, можно комбинировать и получить другие воплощения. Аспекты раскрытия при необходимости можно модифицировать и использовать композиции, действия и концепции вышеуказанных ссылок и применить для получения еще дополнительных вариантов осуществления раскрытия. Такие и другие изменения можно сделать для раскрытия с учетом подробного описания. Предполагается, что все такие модификации включены в объем прилагаемой формулы изобретения.
[00167] Конкретные детали любого из вышеописанных вариантов осуществления можно комбинировать или заменять на детали из других вариантов осуществления. Кроме того, хотя преимущества, связанные с некоторыми воплощениями раскрытия, описаны в контексте этих вариантов осуществления, другие воплощения также могут показывать такие преимущества, и не все воплощения обязательно должны показывать такие преимущества, чтобы соответствовать объему раскрытия.
Примеры
[00168] Приведенные далее примеры иллюстрируют некоторые воплощения и аспекты изобретения. Для специалистов в данной области техники будет очевидно, что можно выполнить различные модификации, дополнения, замены и т.п. без отхода от сущности и объема изобретения, и такие модификации и варианты охватываются объемом изобретения, определенным в формуде изобретения, которая следует далее. Следующие примеры никоим образом не ограничивают изобретение.
Пример 1. Синтез соединений холестерин-оксалиплатин [формула I] с карбаматной связью
[00169] Комплексы холестерин-оксалиплатин, включающие карбаматную связь, синтезируют так, как описано далее (фигура 1).
[00170] Часть A (фиг. 1A).(Стадия a). В 250-мл круглодонную колбу к примерно 50 мл сухого DCM (дихлорметан) добавляют этилендиамин (примерно 22,2 мл, 30 экв.). Реакционную колбу охлаждают на ледяной бане до приблизительно 0°C. В реакционную колбу при энергичном перемешивании добавляют по каплям из капельной воронки в течение примерно 30 - примерно 45 минут раствор твердого холестерилхлорформиата (примерно 5,0 г, 11,14 ммоль) в еще 50 мл сухого DCM. Полученный раствор перемешивают при комнатной температуре (25°C) в течение ночи (примерно 8 часов - 12 часов). Затем раствор добавляют в хлороформ (примерно 100 мл) и последовательно промывают примерно один раз - 3 раза водой (3×50 мл) и рассолом (1×50 мл). Полученный органический слой сушат над безводным сульфатом натрия, фильтруют, и растворитель из фильтрата удаляют испарением на роторном испарителе. Остаток после очистки колоночной хроматографией на силикагеле 60-120 меш с использованием смеси 1% метанола-хлороформ (об./об.) в качестве элюента дает 4,12 г (78%) чистого промежуточного соединения I [фигура 1, часть A]. (Rf=0,2 с использованием смеси 10% метанола-хлороформ, об./об., в качестве проявляющего растворителя при TCХ).
[00171] Характеризацию промежуточного соединения (I) выполняют протонным ЯМР, и результаты следующие:1H ЯМР (500 МГц, CDCl3) δ 5,30 (с, 1H, -C=CH), 5,05 (с, 1H, -O-CO-NH), 4,42 (с, 1H, -CH-O-), 3,18 (с, 2H, -HN-CH2-CH2-), 2,79 (с, 2H, -O-CO-NH-CH2), 2,35-0,60 (м, 45H, главная цепь холестерина).
[00172] (Стадия b). Промежуточное соединение I, полученное на стадии (a) (примерно 1,0 г, 2,12 ммоль) и янтарный ангидрид (примерно 1,04 г, 10,57 экв.) вместе растворяют в сухом DCM (примерно 20 мл) и перемешивают при комнатной температуре (25°C) в течение периода времени, колеблющегося от приблизительно 15 минут до 30 минут. Добавляют по каплям пиридин (примерно 3,41 мл, 20 экв.), и реакционную смесь перемешивают в течение ночи (примерно 8 часов - 12 часов). Затем реакционную смесь разбавляют примерно 50 мл хлороформа и промывают примерно три раза 0,1N HCl (3×100 мл) и рассолом (1×100 мл). Полученный органический слой сушат над безводным сульфатом натрия, фильтруют, и растворитель из фильтрата удаляют испарением на роторном испарителе, затем остаток очищают хроматографией на силикагеле, и получают примерно 1,06 г (87%) промежуточного соединения II. (Rf=0,2 с использованием смеси 20% метанола-хлороформ, об./об., в качестве проявляющего растворителя при ТСХ).
[00173] Характеризацию промежуточного соединения (II) выполняют протонным ЯМР, и результаты следующие:1H ЯМР (500 МГц, CDCl3) δ 6,72 (с, 1H, NH), 5,32 (с, 1H, -C=CH), 5,09 (с, 1H, NH), 4,42 (с, 1H, CH-O-), 3,35-3,18 (м, 4H, -CO-NH-CH2, CO2H-CH2-), 2,65 (с, 2H, -O-CO-NH-CH2-), 2,48 (с, 2H, -NH-CO-CH2-), 2,25-0,62 (м, 43H, главная цепь холестерина). ESIMS m/z=572 [M+1]+ для C34H56N2O5.
[00174] (Стадия c). В 50-мл одногорлую круглодонную колбу загружают примерно 0,15 мл (1,27 ммоль) моноэтилмалоната вместе с примерно 185 мг (1,37 ммоль) HOBt и примерно 263 мг (1,37 ммоль) EDCl. Добавляют примерно 7 мл сухого DCM, и реакционную смесь непрерывно перемешивают в течение периода времени примерно 20 минут - 30 минут в атмосфере N2. К реакционной смеси при 0°C добавляют примерно 500 мг (1,06 ммоль) промежуточного соединения I, полученного на стадии (a) [пример 1], растворенного в примерно 5 мл сухого DCM (20 мл). Добавляют по каплям DIPEA (N,N-диизопропилэтиламин) до тех пор, пока рН реакционной смеси не станет щелочным. Реакционную смесь перемешивают при комнатной температуре (примерно 20°C - 25°C) в течение ночи (примерно 8 часов - 12 часов). Затем реакционную смесь промывают примерно три раза 0,1 N HCl (1×30 мл), насыщенным раствором NaHCO3 (1×50 мл) и рассолом (1×30 мл). Полученный органический слой сушат над безводным Na2SO4, и выполняют упаривание на роторном испарителе. Выполняют очистку колоночной хроматографией (1,5% хлороформа-метанол), что приводит к выходу примерно 530 мг (85%) промежуточного продукта IIIi. (Rf=0,6 с использованием смеси 10% метанола-хлороформ, об./об., в качестве проявляющего растворителя при ТСХ).
[00175] Характеризацию промежуточного продукта IIIi, полученного выше, выполняют протонным ЯМР, и результаты следующие:1H ЯМР (500 МГц, CDCl3) δ 7,34 (с, 1H, -CH2-NH-CO-), 5,30 (с, 1H, -CH2-CH=C-), 4,90 (с, 1H, -OCO-NH-CH2-), 4,42 (с, 1H, -CH-OCO-), 4,14 (м, 2H, -OCH2-CH3), 3,48-3,27 (м, 6H), 2,37-0,61 (м, 46H, главная цепь холестерина).
[00176] (Стадия d). В 50-мл одногорлой круглодонной колбе примерно 1,03 г (1,75 ммоль) промежуточного соединения, полученного на стадии (c) [пример 1], растворяют в смеси ТГФ:H2O (15 мл:5 мл), и смесь перемешивают в течение примерно 5 минут при комнатной температуре (примерно 20°C - 25°C). К полученной реакционной смеси добавляют примерно 146 мг (3,50 ммоль) LiOH (гидроксид лития), и смесь перемешивают еще в течение примерно 2-3 часов при комнатной температуре (примерно 25°C). По завершении реакции смесь разбавляют хлороформом (примерно 100 мл) и подкисляют примерно 50 мл разбавленной HCl (0,1 N). Полученный органический слой промывают раствором NaHCO3 (примерно 50 мл) и сушат над безводным Na2SO4.Выполняют очистку колоночной хроматографией (4% метанола-хлороформ), которая дает примерно 631 мг (64%) промежуточного соединения III. (Rf=0,4 с использованием смеси 20% метанола-хлороформ, об./об., в качестве проявляющего растворителя при ТСХ).
[00177] (Стадия e). В 50-мл одногорлую круглодонную колбу загружают примерно 0,12 мл (1,27 ммоль) моноэтилоксалата вместе с примерно 185 мг (1,37 ммоль) HOBt и примерно 263 мг (1,37 ммоль) EDCl. Добавляют примерно 7 мл сухого DCM, и реакционную смесь перемешивают в течение периода времени примерно 20 минут - примерно 30 минут в атмосфере N2. К реакционной смеси при 0°C добавляют примерно 500 мг (1,06 ммоль) промежуточного соединения I, полученного на стадии (a) [пример 1], растворенного в примерно 5 мл сухого DCM (примерно 20 мл). Добавляют по каплям DIPEA до тех пор, пока pH реакционной смеси не станет щелочным. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь промывают 0,1 N HCl (1×30 мл), насыщенным раствором NaHCO3 (1×50 мл) и рассолом (1×30 мл). Полученный органический слой сушат над безводным Na2SO4 и упаривают на роторном испарителе. Выполняют очистку колоночной хроматографией (1,5% метанола-хлороформ), которая дает примерно 570 мг (94%) промежуточного продукта IVi. (Rf=0,6 с использованием смеси 10% метанола-хлороформ, об./об., в качестве проявляющего растворителя при ТСХ).
[00178] Характеризацию полученного выше промежуточного продукта IVi выполняют протонным ЯМР, и результаты следующие:1H ЯМР (500 МГц, CDCl3) δ 7,40 (с, 1H, -CO-NH-CH2-), 5,28 (с, 1H, -CH=C-), 4,30 (к, J=7,1 Гц, 2H, -O-CH2-CH3), 3,52 (д, J=3,7 Гц, 2H, -O-CH2-CH2-), 3,46 (д, J=4,2 Гц, 2H, -NH-CH2-CH2-), 3,11 (т, J=11,0 Гц, 1H, -O-CH-CH2-), 2,33-0,55 (м, 47H, главная цепь холестерина).
[00179] (Стадия d’). В 50-мл одногорлой круглодонной колбе примерно 500 мг (,87 ммоль) промежуточного соединения, полученного на стадии (e) [пример 1], растворяют в смеси ТГФ:H2O (15 мл:5 мл) и перемешивают в течение примерно 5 минут при комнатной температуре. К полученной реакционной смеси добавляют примерно 75 мг (1,75 ммоль) LiOH, и смесь перемешивают еще в течение примерно 2 часов при комнатной температуре. По завершении реакции смесь разбавляют хлороформом (примерно 50 мл) и подкисляют примерно 50 мл разбавленной HCl (0,1 N). Органический слой промывают раствором NaHCO3 (50 мл) и сушат над безводным Na2SO4.Выполняют очистку колоночной хроматографией (4% метанола-хлороформ), которая дает примерно 180 мг (38%) промежуточного соединения IV. (Rf=0,2 с использованием смеси 10% метанола-хлороформ, об./об., в качестве проявляющего растворителя при ТСХ).
[00180] Часть B (фиг. 1B).(Стадия f). Дихлор(1,2-диаминоциклогексан)платину(II) (примерно 300 мг, 0,79 ммоль) частично растворяют в примерно 40,0 мл H2O. К раствору добавляют нитрат серебра (примерно 340 мг, 1,58 ммоль), и полученную смесь перемешивают при комнатной температуре в течение периода времени примерно 24 часа. Когда смесь станет молочно-белой, хлорид серебра удаляют центрифугированием при примерно 12000 об/мин в течение примерно 30 минут. В итоге фильтрацией через фильтр 0,2 мкм получают акватированный оксалиплатин V.
[00181] Часть C (фиг. 1C).(Стадия g). Синтез соединения 1. Промежуточное соединение II (примерно 407 мг, 0,71 ммоль), полученное на стадии b (пример 1, часть A), растворяют в примерно 1,5 мл ДМФА. К раствору добавляют примерно 40,0 мл акватированного оксалиплатина V (0,09 ммоль), полученного на стадии f (пример 1, часть B) и перемешивают в течение примерно 24 часов. Лиофилизация реакционной смеси дает соединение холестерин-оксалиплатин - соединение 1.
[00182] Результаты характеризации (протонный ЯМР и МС MALDI-TOF) соединения 1 следующие:1H ЯМР (500 МГц, CDCl3) δ 6,65 (с, 1H, NH), 5,30 (с, 1H, -C=CH), 5,01 (с, 1H, NH), 4,42 (с, 1H, CH-O-), 3,42 (с, 2H, Pt-NH2-CH-), 3,38-3,18 (м, 4H, -CO-NH-CH2, CO2H-CH2-), 2,65 (с, 2H, -O-CO-NH-CH2-), 2,48 (с, 2H, -NH-CO-CH2-), 2,30-0,58 (м, 55H, главная цепь холестерина и аминоциклогексан). МС MALDI-TOF=880,4784 [M]+ для C40H69N4O5Pt.
[00183] Стадия (g’). Синтез соединения 2. Промежуточное соединение III (примерно 58 мг, 0,11 ммоль), полученное на стадии d (пример 1, часть A), растворяют в примерно 1,5 мл ДМФА. К раствору добавляют примерно 8,0 мл акватированного оксалиплатина V (0,11 ммоль), полученного на стадии f (пример 1, часть B), и реакционную смесь перемешивают в течение примерно 24 часов. Лиофилизация реакционной смеси дает соединение холестерин-оксалиплатин - соединение 2.
[00184] Результаты характеризации (протонный ЯМР и МС MALDI-TOF) соединения 2 следующие:1H ЯМР (500 МГц, CDCl3) δ 7,41 (с, H, -CO-NH-CH2-), 5,40 (с, 1H, -CH2-CH=C-), 5,07 (с, 1H, -OCO-NH-CH2-), 4,49 (м, 1H, -CH-OCO-), 3,48-3,27 (м, 6H), 2,88 (с, 1H, -CH-NH2), 2,81 (с, 1H, -CH-NH2), 2,30-0,51 (м, 46H, главная цепь холестерина и аминоциклогексан). МС MALDI-TOF=886,5048 [M]+ для C39H67N4O5Pt.
[00185] Стадия (g’’). Синтез соединения 3. Промежуточное соединение IV (примерно 57 мг, 0,11 ммоль), полученное на стадии d’ (пример 1, часть A), растворяют в примерно 1,5 мл ДМФА. К раствору добавляют примерно 8,0 мл акватированного оксалиплатина V (0,11 ммоль), полученного на стадии f (пример 1, часть B), и реакционную смесь перемешивают в течение примерно 24 часов. Лиофилизация реакционной смеси дает соединение холестерин-оксалиплатин - соединение 3.
[00186] Результаты характеризации (протонный ЯМР и МС MALDI-TOF) соединения 3 следующие:1H ЯМР (500 МГц, CDCl3) δ 7,84 (с, 1H, -O-CO-NH-CH2-), 5,31 (с, 1H, -CH=C-), 4,89 (с, 1H, -CO-NH-CH2-), 4,44 (с, 1H, -O-CH-CH2-), 3,48-3,40 (м, 2H, -CO-NH-CH2-), 3,37-3,28 (м, 2H, -O-CO-NH-CH2-), 2,91 (с, 1H, NH2-CH-CH2-), 2,83 (с, 1H, NH2-CH-CH2-), 2,33-0,56 (м, 55H, главная цепь холестерина и протоны циклогексанового цикла). МС MALDI-TOF=853.4823 [M]+ для C38H65N4O5Pt.
Пример 2. Синтез соединений холестерин-оксалиплатин [формула I] с простой эфирной связью
[00187] Комплексы холестерин-оксалиплатин, включающие простую эфирную связь, синтезируют так, как описано далее (фигура 2).
[00188] Часть A (фиг. 2A): (Стадии a-e). Синтез промежуточного амина (II). Стадии a-e выполняют так, как описано в примере 3 (стадии 1-5; синтез соединения 25).
[00189] (Стадия f). В 100-мл одногорлой круглодонной колбе промежуточное соединение II, полученное после стадий (a-e) [пример 2, часть A] (амин, 500 мг, 1,164 ммоль), растворяют в DCM (примерно 10 мл) в атмосфере N2 и перемешивают при комнатной температуре в течение периода времени, колеблющегося от приблизительно пяти минут до приблизительно десяти минут. Реакционную смесь охлаждают до приблизительно 0°C, к реакционной смеси добавляют янтарный ангидрид (примерно 570 мг, 5,82 ммоль), затем пиридин (примерно 1,88 мл, 23,3 ммоль), и реакционную смесь снова перемешивают в течение примерно 24 часов при комнатной температуре.
[00190] По завершении процесса перемешивания (контролируют ТСХ) реакционную смесь разбавляют CH2Cl2 (примерно 20 мл) и промывают 0,1N HCl (примерно 500 мл, до полного удаления пиридина) с последующей сушкой над Na2SO4. Органический слой концентрируют в вакууме и очищают хроматографией на силикагеле, что дает требуемое промежуточное соединение III с выходом 95% (примерно 585 мг).
[00191] Характеризацию промежуточного соединения III выполняют протонным ЯМР, и результаты следующие:1H ЯМР (500 МГц, CDCl3) δ 6,18 (с, 1H, -CO-NH-CH2-), 5,28 (с, 1H, -CH=C-), 3,49 (д, J=4,4 Гц, 2H, -O-CH2-CH2-), 3,38 (д, J=4,4 Гц, 2H, -NH-CH2-CH2-), 3,11 (т, J=11,1 Гц, 1H, -O-CH-CH1-), 2,63 (т, J=6,4 Гц, 2H, -NH-CO-CH2-), 2,47 (т, J=6,4 Гц, 2H, HOOC-CH2-), 2,31-0,55 (м, 43H, главная цепь холестерина).
[00192] (Стадия g). В 50-мл одногорлую круглодонную колбу загружают примерно 0,07 мл (0,64 ммоль) моноэтилмалоната с примерно 74 мг (0,64 ммоль) HOBt и примерно 134 мг (0,69 ммоль) EDCl. Добавляют примерно 7 мл сухого DCM, и реакционную смесь непрерывно перемешивают в течение периода времени примерно 20 минут - 30 минут в атмосфере N2. К реакционной смеси при примерно 0°C добавляют примерно 250 мг (0,58 ммоль) промежуточного соедиения II, полученного после стадий (a-e) [пример 2, часть A], растворенного в примерно 5 мл сухого DCM (20 мл). Добавляют по каплям DIPEA до тех пор, пока pH реакционной смеси не станет щелочным. Реакционную смесь постоянно перемешивают при примерно комнатной температуре в течение ночи и последовательно промывают примерно 3-4 раза 0,1N HCl (1×30 мл), насыщенным раствором NaHCO3 (1×50 мл) и рассолом (1×30 мл). Органический слой сушат над безводным Na2SO4, и осуществляют выпаривание в роторном испарителе. Выполняют очистку колоночной хроматографией (1,5% метанола-хлороформ), что дает примерно 290 мг (чистота 92%) промежуточного соедиения IVi (Rf=0,5 с использованием смеси 5% метанола-хлороформ, об./об., в качестве проявляющего растворителя при ТСХ).
[00193] Характеризацию промежуточного продукта IVi, полученного выше, выполняют протонным ЯМР, и результаты следующие:1H ЯМР (500 МГц, CDCl3) δ 7,27 (с, 1H, -CO-NH-CH2-), 5,28 (с, 1H, -CH=C-), 4,13 (к, J=7,1 Гц, 2H, -O-CH2-CH3), 3,49 (д, J=4,0 Гц, 2H, -O-CH2-CH2-), 3,40 (д, J=4,8 Гц, 2H, -NH-CH2-CH2-), 3,25 (с, 2H, -CO-CH2-CO-), 3,10 (т, J=10,9 Гц, 1H, -O-CH-CH2-), 2,34-0,55 (м, 46H, главная цепь холестерина).
[00194] (Стадия h). В 25-мл одногорлой круглодонной колбе примерно 250 мг (0,46 ммоль) промежуточного соединения IVi, полученного на стадии (g) [пример 2], растворяют в смеси ТГФ:H2O (9 мл:3 мл), и смесь перемешивают в течение примерно 5 минут при комнатной температуре. К реакционной смеси добавляют примерно 58 мг (1,38 ммоль) LiOH, и смесь перемешивают еще в течение примерно 3 часов при комнатной температуре (примерно 20°C - 25°C). По завершении реакции смесь разбавляют хлороформом (примерно 50 мл) и подкисляют примерно 10 мл разбавленной HCl (0,1 N). Органический слой промывают раствором NaHCO3 (примерно 20 мл) и сушат над безводным Na2SO4.Выполняют очистку колоночной хроматографией (4% метанола-хлороформ), что дает примерно 228 мг (96%) промежуточного соединения IV. (Rf=0,4 с использованием смеси 20% метанола-хлороформ, об./об., в качестве проявляющего растворителя при ТСХ).
[00195] (Стадия i). В 50-мл одногорлую круглодонную колбу загружают примерно 0,06 мл (10,64 ммоль) моноэтилоксалата вместе с примерно 74 мг (0,64 ммоль) HOBt и примерно 145 мг (0,76 ммоль) EDCl. Добавляют примерно 7 мл сухого DCM, и реакционную смесь перемешивают в течение периода времени примерно 20 минут - примерно 30 минут в атмосфере N2. К реакционной смеси при 0°C добавляют примерно 250 мг (0,58 ммоль) промежуточного соединения II, полученного после стадий (a-e), растворенного в примерно 5 мл сухого DCM (20 мл). Добавляют по каплям DIPEA до тех пор, пока pH реакционной смеси не станет щелочным. Реакционную смесь перемешивают при комнатной температуре в течение ночи и затем последовательно промывают 0,1 N HCl (1×30 мл), насыщенным раствором NaHCO3 (1×50 мл) и рассолом (1×30 мл). Органический слой сушат над безводным Na2SO4 и выпаривают на роторном испарителе. Выполняют очистку колоночной хроматографией (1,5% метанола-хлороформ), что дает примерно 128 мг (41%) промежуточного соединения VIi. (Rf=0,5 с использованием смеси 10% метанола-хлороформ, об./об., в качестве проявляющего растворителя при ТСХ).
[00196] Характеризацию промежуточного продукта VIi, полученного выше, выполняют протонным ЯМР, и результаты следующие:1H ЯМР (500 МГц, CDCl3) δ 7,40 (с, 1H, -CO-NH-CH2-), 5,28 (с, 1H, -CH=C-), 4,30 (к, J=7,1 Гц, 2H, -O-CH2-CH3), 3,52 (д, J=3,7 Гц, 2H, -O-CH2-CH2-), 3,46 (д, J=4,2 Гц, 2H, -NH-CH2-CH2-), 3,11 (т, J=11,0 Гц, 1H, -O-CH-CH2-), 2,33-0,55 (м, 47H, главная цепь холестерина).
[00197] Стадия (h’). В 25-мл одногорлой круглодонной колбе примерно 128 мг (0,22 ммоль) промежуточного соединения, полученного выше на стадии (i) [пример 2], растворяют в смеси ТГФ:H2O (3 мл:1 мл) и перемешивают в течение примерно 5 минут при комнатной температуре. К полученной реакционной смеси добавляют примерно 18 мг (0,45 ммоль) LiOH, и реакционную смесь перемешивают еще в течение примерно 2 часов при комнатной температуре. По завершении реакции реакционную смесь разбавляют хлороформом (примерно 15 мл), а затем подкисляют примерно 10 мл разбавленной HCl (0,1 N). Органический слой промывают раствором NaHCO3 (примерно 20 мл) и сушат над безводным Na2SO4.Выполняют очистку колоночной хроматографией (4% метанола-хлороформ), что дает примерно 79 мг (66% чистого) промежуточного соединения V. (Rf=0,2 с использованием смеси 10% метанола-хлороформ, об./об., в качестве проявляющего растворителя при ТСХ).
[00198] Часть B (фиг. 2B). Стадия (j). Дихлор(1,2-диаминоциклогексан)платину(II) (примерно 300 мг, 0,79 ммоль) частично растворяют в примерно 40,0 мл H2O. К раствору добавляют нитрат серебра (примерно 340 мг, 1,58 ммоль), и полученную реакционную смесь перемешивают при комнатной температуре в течение примерно 24 часов. После того, как смесь станет молочно-белой, хлорид серебра удаляют центрифугированием при примерно 12000 об/мин в течение примерно 30 минут. В итоге фильтрацией через фильтр 0,2 мкм получают акватированный оксалиплатин VI.
[00199] Часть C (фиг. 2C).Стадия (k). Синтез соединения 4. Промежуточное соединение III (примерно 69 мг, 0,13 ммоль), полученное на стадии (f) (пример 2, часть A) растворяют в примерно 1,5 мл ДМФА. Затем добавляют примерно 10 мл акватированного оксалиплатина VI (0,13 ммоль), полученного на стадии (j) (пример 2, часть B), и реакционную смесь перемешивают в течение примерно 24 часов. Лиофилизация реакционной смеси дает соединение холестерин-оксалиплатин - соединение 4.
[00200] Результаты характеризации (протонный ЯМР и МС MALDI-TOF) соединения 4 следующие:1H ЯМР (500 МГц, CDCl3) δ 6,12 (с, 1H, -CO-NH-CH2-), 5,30 (д, J=4,9 Гц, 1H, -CH=C-), 3,50 (т, J=4,8 Гц, 2H, -O-CH2-CH2-), 3,43-3,35 (м, 2H, -NH-CH2-CH2-), 3,17-3,05 (м, 1H, -O-CH-CH2-), 2,91 (с, 1H, NH2-CH-), 2,84 (с, 1H, NH2-CH-), 2,65 (дд, J=7,6, 5,1 Гц, 2H, -O-CO-CH2-CH2), 2,56-2,46 (м, 2H, -NH-CO-CH2-), 2,30-0,56 (м, 55H, главная цепь холестерина и протоны циклогексанового цикла). МС MALDI-TOF=837,5227 [M]+ для C39H68N3O4Pt.
[00201] Стадия (k’). Синтез соединения 5. Промежуточное соединение IV (27 мг, 0,05 ммоль), полученное на стадии h (пример 2, часть A), растворяют в примерно 1,5 мл ДМФА. Затем добавляют примерно 10 мл акватированного оксалиплатина VI (0,13 ммоль), полученного на стадии j (пример 2, часть B), и реакционную смесь перемешивают в течение примерно 24 часов. Лиофилизация реакционной смеси дает соединение холестерин-оксалиплатин - соединение 5.
[00202] Результаты характеризации (протонный ЯМР и МС MALDI-TOF) соединения 5 следующие:1H ЯМР (500 МГц, CDCl3) δ 6,52 (с, 1H, -CO-NH-CH2-), 5,28 (д, J=5,0 Гц, 1H, -CH=C-), 3,51 (т, J=4,5 Гц, 2H, -O-CH2-CH2-), 3,41 (м, 2H, -NH-CH2-CH2-), 3,27 (с, 2H, -CO-CH2-CO-), 3,17-3,02 (м, 1H, -O-CH-CH2-), 2,89 (с, 1H, NH2-CH-), 2,82 (с, 1H, NH2-CH-), 2,30-0,56 (м, 55H, главная цепь холестерина и протоны циклогексанового цикла). МС MALDI-TOF=823,5242 [M]+ для C38H66N3O4Pt.
[00203] Стадия (k’’). Синтез соединения 6. Промежуточное соединение V (26 мг, 0,05 ммоль), полученное на стадии h’ (пример 2, часть A), растворяют в примерно 1,5 мл ДМФА. Затем добавляют примерно 5 мл акватированного оксалиплатина VI (0,05 ммоль), полученного на стадии е (пример 2, часть B), и реакционную смесь перемешивают в течение примерно 24 часов. Лиофилизация реакционной смеси дает соединение холестерин-оксалиплатин - соединение 6.
[00204] Результаты характеризации (протонный ЯМР и МС MALDI-TOF) соединения 6 следующие:1H ЯМР (500 МГц, CDCl3) δ 7,96 (с, 1H, -CO-NH-CH2-), 5,28 (с, 1H, -CH=C-), 3,61-3,42 (м, 4H, -OCH2-CH2-, -NH-CH2-CH2), 3,18-3,02 (м, 1H, -OCH-CH2-), 2,90 (с, 1H, NH2-CH-), 2,82 (с, 1H, NH2-CH-), 2,31-0,56 (м, 55H, главная цепь холестерина и протоны циклогексанового цикла). МС MALDI-TOF=809,5258 [M]+ для C37H64N3O4Pt.
[00205] Синтетическими процедурами, подобными процедурам, описанным выше, получают соединения 7-21, используя необходимые карбоновые кислоты, линкерные молекулы, липидные и платиновые части.
Пример 3. Синтез соединений формулы II
Синтез соединения 25
[00206] Стадия 1. К охлажденному на льду раствору холестерина 1.01 (примерно 10 г, 0,026 моль) в CH2Cl2 (примерно 45 мл) добавляют пиридин (примерно 15 мл) и перемешивают в течение примерно 15 минут. К полученному раствору добавляют п-тололсульфонилхлорид (примерно 9,8 г, 0,052 моль) и перемешивают в течение примерно 6 час при примерно 0°C, и затем проводят контроль ТСХ. По завершении реакции реакционную смесь разбавляют CHCl3 (примерно 20 мл) и последовательно промывают примерно 1 N HCl (3×50 мл) и рассолом (примерно 20 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме, получают промежуточное соединение 1.02, и указанное промежуточное соединение непосредственно используют в следующей реакции без дополнительной очистки.
[00207] Стадия 2. К раствору тозилированного холестерина 1.02 (примерно 10 г, 0,018 моль) в диоксане (примерно 45 мл) добавляют этиленгликоль (примерно 15 мл) и кипятят с обратным холодильником в течение примерно 4 час. Контролируют ТСХ. По завершении реакции реакционную смесь экстрагируют этилацетатом и последовательно промывают водой (примерно 3×50 мл) и рассолом (примерно 20 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме, очищают на колонке, и получают промежуточное соединение 1.03.
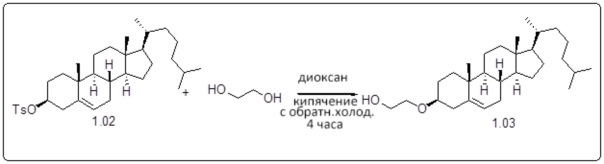
[00208] Стадия 3: К охлажденному на льду раствору холестерилэтиленгликоля 1.03 (примерно 6,95 г, 16,13 ммоль) в дихлорметане (примерно 15 мл) в атмосфере азота добавляют пиридин (примерно 13 мл) и перемешивают в течение примерно 15 минут. К полученному раствору добавляют п-тололсульфонилхлорид (примерно 3,7 г, 19,35 моль) и перемешивают в течение примерно 5 час при примерно 0°C, и затем проводят контроль ТСХ. По завершении реакции реакционную смесь разбавляют CHCl3 (примерно 20 мл) и последовательно промывают примерно 1 N HCl (3×50 мл) и рассолом (примерно 20 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме, очищают хроматографией на силикагеле, и получают промежуточное соединение 1.04.

[00209] Стадия 4. В 50-мл круглодонной колбе соединение 1.04 (примерно 6 г, 10,26 ммоль) растворяют в ДМФА (примерно 20 мл) в атмосфере азота и перемешивают в течение примерно 30 минут для получения прозрачного раствора (при необходимости греют). К полученному раствору добавляют азид натрия (примерно 3,4 г, 51,33 ммоль) перемешивают в течение примерно 18 час при комнатной температуре, и проводят контроль ТСХ. По завершении реакции реакционную смесь концентрируют в вакууме для удаления ТГФ, очищают флэш-хроматографией, и получают промежуточное соединение 1.05.

[00210] Стадия 5. К раствору азида 1.05 (примерно 3 г, 7,6 ммоль) в сухом ДМФА (примерно 15 мл) в атмосфере азота добавляют TPP (примерно 1,5 г, 15,2 ммоль). Реакционную смесь перемешивают в течение примерно 6 час при комнатной температуре, и к реакционной смеси добавляют примерно 2 мл воды. Реакционную смесь перемешивают еще в течение примерно 6 час, и проводят контроль ТСХ. По завершении реакции реакционную смесь концентрируют при пониженном давлении, очищают хроматографией на силикагеле с использованием в качестве элюента смеси метанол/хлороформ, и получают промежуточный амин 1.06.

[00211] Стадия 6. При охлаждении льдом к раствору амина 1.06 (примерно 300 мг, 0,698 ммоль) в ТГФ (примерно 5 мл) добавляют по частям NaH (примерно 120 мг, 2,094 ммоль) в течение примерно 10 минут. Полученный раствор перемешивают в течение примерно 20 минут, добавляют этилбромацетат и перемешивают в течение примерно 6 час при комнатной температуре. По завершении реакции реакционную смесь охлаждают до приблизительно 0°C, реакцию гасят водой, и соединение экстрагируют этилацетатом (примерно 2×20 мл). Органический слой сушат над безводным Na2SO4, концентрируют, очищают хроматографией на силикагеле, и получают промежуточный диэфир 1.07 с выходом примерно 52%.

[00212] Стадия 7. В 50-мл одногорлой круглодонной колбе растворяют диэфир соединение 1.07 (примерно 218 мг, 0,363 ммоль) в смеси ТГФ/вода (примерно 4 мл при соотношении примерно 3:1) и охлаждают до приблизительно 0°C. К полученному охлажденному раствору добавляют LiOH (примерно 34 мг, 1,45 ммоль) и перемешивают при комнатной температуре в течение еще 6 час. По завершении реакции реакционную смесь концентрируют при пониженном давлении для удаления ТГФ, и водный слой промывают этилацетатом. Водный слой лиофилизуют, и получают твердую дилитиевую соль 1.08 с количественным выходом.
[00213] Стадия 8. Синтез of DACH-Pt(H2O)2. В 50-мл одногорлой круглодонной колбе растворяют дихлор(1,2-диаминоциклогексан)платина 1.09 (примерно 200 мг, 0,526 ммоль) в примерно 20,0 мл H2O. К полученной суспензии добавляют нитрат серебра (примерно 178,7 мг, 1,052 ммоль), и реакционную смесь перемешивают при комнатной температуре в течение примерно 24 час. Молочно-белый раствор центрифугируют, раствор фильтруют через шприц с фильтром 0,22 мкм, и получают акватированный DACH-Pt 1.10 с количественным выходом (примерно 10 мг/мл).

[00214] Стадия 9. В 100-мл одногорлой круглодонной колбе растворяют промежуточное соединение 1.08 (примерно 202 мг, 0,363 ммоль) в примерно 1,0 мл воды. К полученному раствору добавляют DACHPt(H2O)2 (примерно 13,8 мл), полученный на предыдущей стадии, и смесь перемешивают еще в течение 12 час. Твердый остаток отфильтровывают и промывают водой (примерно 20 мл). Белый твердый остаток лиофилизуют и растворяют в избытке метанола, раствор фильтруют и концентрируют при пониженном давлении, и получают амфифильное соединение холестерин-оксалиплатин - соединение 25 с выходом примерно 85%.
Синтез соединения 26
[00215] Стадия 1. К охлажденному на льду раствору этилендиамина (примерно 22,2 мл) в CH2Cl2 (примерно 40 мл) добавляют по каплям, в течение примерно 45 мин, раствор соединения 1.11 (примерно 5 г) в CH2Cl2 (примерно 50 мл), и реакционную смесь перемешивают при той же температуре в течение примерно 1 часа и затем перемешивают при комнатной температуре еще в течение примерно 20 час. По завершении реакции (контроль методом ТСХ) реакцию гасят водой, реакционную смесь экстрагируют дихлорметаном (примерно 4×50 мл), и объединенный органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной хроматографией с использованием в качестве элюента смеси метанол-хлороформ, и получают промежуточное соединение 1.12.
[00216] Стадия 2. В 50-мл одногорлой круглодонной колбе в атмосфере азота растворяют амин 1.12 (примерно 300 мг, 0,634 ммоль) в ТГФ (примерно 5 мл). Реакционную смесь охлаждают на ледяной бане до приблизительно 0°C, и по частям, в течение примерно 10 минут, добавляют NaH (примерно 130 мг, 3,17 ммоль). Полученный раствор перемешивают в течение примерно 20 минут, и добавляют этилбромацетат. Реакционную смесь перемешивают в течение примерно 2 час при комнатной температуре, и проводят контроль ТСХ. По завершении перемешивания реакционную смесь охлаждают до приблизительно 0°C, реакцию гасят холодной водой (примерно 5 мл), смесь экстрагируют этилацетатом (примерно 2×20 мл), экстракт сушат над безводным Na2SO4 и затем концентрируют. Остаток очищают колоночной хроматографией с использованием в качестве элюента смеси метанол-хлороформ, и получают промежуточное соединение 1.13.

[00217] Стадия 3. В 50-мл одногорлой круглодонной колбе диэфир 1.13 (примерно 1,7 г, 2,63 ммоль) растворяют в смеси ТГФ/вода (примерно 3:1) (примерно 16 мл). Реакционную смесь охлаждают на ледяной бане до приблизительно 0°C, и к реакционной смеси добавляют LiOH (примерно 130 мг, 5,27 ммоль). Полученный раствор перемешивают в течение примерно 6 час при комнатной температуре, и проводят контроль ТСХ. По завершении реакции реакционную смесь концентрируют при пониженном давлении для удаления ТГФ и разбавляют водой (примерно 5 мл). Водный слой последовательно промывают этилацетатом и CH2Cl2 и лиофилизуют, и получают промежуточное соединение 1.14 с количественным выходом.
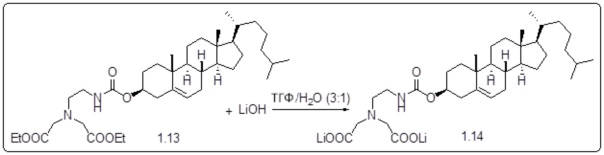
[00218] Стадия 4. В 100-мл одногорлой круглодонной колбе промежуточное соединение 1.14 растворяют в примерно 1,0 мл воды. К полученному раствору добавляют DACHPt(H2O)2 и перемешивают еще 12 час. Полученный твердый остаток отфильтровывают, промывают водой и лиофилизуют. Остаток растворяют в избытке метанола, раствор фильтруют и концентрируют при понидженнои давлении, и получают амфифильное соединение холестерин-оксалиплатин - соединение 26.
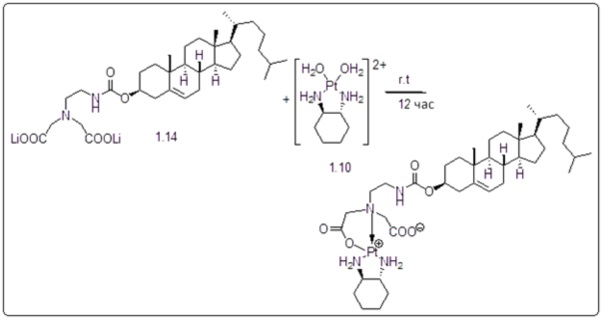
Синтез соединения 27
[00219] Стадия 1. В 50-мл одногорлой круглодонной колбе в атмосфере азота растворяют BocHNCH2COOH (примерно 370 мг, 2,08 ммоль) в CH2Cl2 (примерно 10 мл). К реакционной смеси последовательно добавляют твердый EDCl (примерно 400 мг, 2,08 ммоль) иHOBT (примерно 285 мг, 2,08 ммоль). Добавляют DIPEA для того, чтобы сделать раствор щелочным, и реакционную смесь перемешивают еще в течение 20 минут. К такому активированному кислотой раствору добавляют амин 1.06 (примерно 450 мг, 1,04 ммоль), смесь перемешивают при комнатной температуре в течение примерно 12 час, и проводят контроль ТСХ. По завершении этого реакцию гасят водой, реакционную смесь экстрагируют хлороформом, и экстракт сушат над безводным Na2SO4 и затем концентрируют. Остаток очищают хроматографией на силикагеле с использованием в качестве элюента смеси метанол-хлороформ, и получают промежуточное соединение 1.15.

[00220] Стадия 2. В 50-мл одногорлой круглодонной колбе амин 1.15 с защитной Вос-группой (примерно 600 мг, 0,99 ммоль) растворяют в CH2Cl2, и колбу охлаждают до приблизительно 0°C. К полученному раствору добавляют ТФК, и смесь перемешивают в течение примерно 3 часов при той же температуре. По завершении этого реакционную смесь концентрируют на роторном испарителе, и сырой продукт реакции 1.16 используют в следующей реакции без дополнительной очистки.

[00221] Стадия 3. В 50-мл одногорлой круглодонной колбе в атмосфере азота сырой амин 1.16 (примерно 400 мг, 0,821 ммоль) растворяют в ТГФ (примерно 10 мл). Раствор охлаждают на ледяной бане до приблизительно 0°C, и по частям, в течение примерно 10 минут, добавляют твердый NaH (примерно 160 мг, 4,10 ммоль). Полученный раствор перемешивают еще в течение 20 минут, и добавляют этилбромацетат. По завершении этого реакционную смесь охлаждают до приблизительно 0°C, реакцию гасят водой, смесь экстрагируют этилацетатом, и экстракт сушат над безводным Na2SO4 и затем концентрируют в вакууме. Остаток очищают хроматографией на силикагеле с использованием в качестве элюента смеси метанол-хлороформ, и получают промежуточное соединение 1.17.
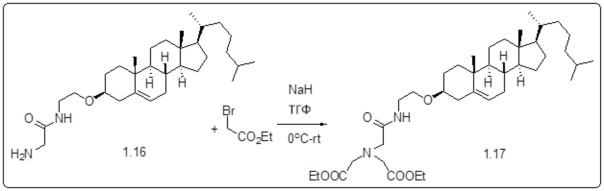
[00222] Стадия 4. В 50-мл одногорлой круглодонной колбе при примерно 0°C диэфир 1.17 (примерно 200 мг, 0,303 ммоль) растворяют в смеси ТГФ/вода (примерно 3:1) (примерно 4 мл). К реакционной смеси добавляют твердый LiOH (примерно 15 мг, 0,606 ммоль), и реакционную смесь перемешивают в течение примерно 6 часов при комнатной температуре. По завершении этого реакционную смесь концентрируют и разбавляют водой (примерно 4 мл). Водный слой последовательно промывают этилацетатом и дихлорметаном и лиофилизуют, и получают твердый порошок соли кислоты 1.18 с количественным выходом.

[00223] Стадия 5. В 100-мл одногорлой круглодонной колбе растворяют промежуточное соединение 1.18 в примерно 1,0 мл воды. К полученному раствору добавляют DACHPt(H2O)2 и перемешивают еще в течение 12 часов. Твердый осадок отфильтровывают, промывают водой и затем лиофилизуют. Осадок растворяют в избытке метанола, раствор фильтруют и концентрируют при пониженном давлении, и получают амфифильное соединение холестерин-оксалиплатин - соединение 27.
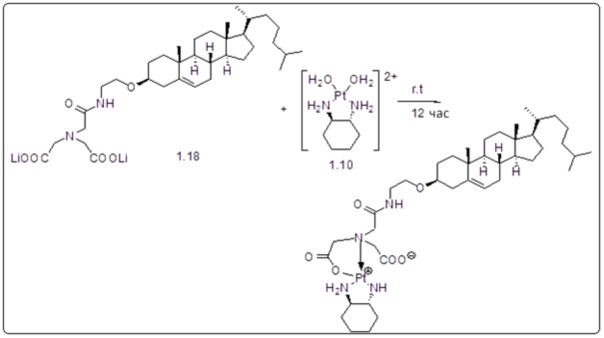
Синтез соединения 28
[00224] Стадия 1. К раствору промежуточного соединения 1.02 (примерно 6 г, 0,011 моль) в диоксане (примерно 30 мл) добавляют диэтиленгликоль (примерно 20 мл), и смесь кипятят с обратным холодильником в течение примерно 4 часов. По завершении этого реакцию гасят водой (примерно 20 мл), и смесь экстрагируют этилацетатом. Органический слой последовательно промывают водой (примерно 3×50 мл) и рассолом (примерно 20 мл) и сушат над безводным Na2SO4.Объединенный органический слой концентрируют при пониженном давлении, остаток очищают хроматографией на силикагеле с использованием в качестве элюента смеси метанол-хлороформ, и получают промежуточное соединение 1.19.
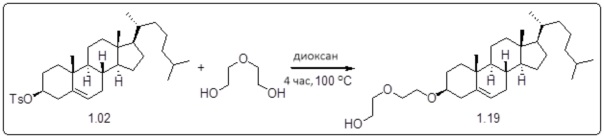
[00225] Стадия 2. К охлажденному льдом раствору холестерилового спирта 1.19 (примерно 5 г, 10,54 ммоль) и п-толуолсульфонилхлорида (примерно 4 г, 21,09 ммоль) в DCM (примерно 25 мл) в атмосфере азота добавляют пиридин (примерно 13 мл). Раствор перемешивают в течение примерно 5 часов при примерно 0°C, и проводят контроль ТСХ. По завершении этого раствор разбавляют CHCl3 (примерно 20 мл) и последовательно промывают примерно 10% раствором сульфата меди (II) (примерно 3×50 мл) и рассолом (примерно 20 мл). Органический слой сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле с использованием в качестве элюента смеси этилацетат/гексан, и получают промежуточное соединение 1.20.
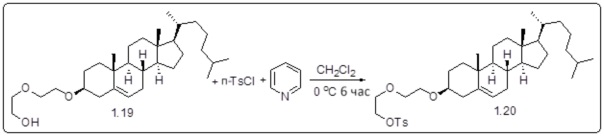
[00226] Стадия 3. В 50-мл круглодонной колбе в атмосфере азота растворяют тозилсодержащее соединение 1.20 (примерно 3 г, 4,76 ммоль) в ДМФА (примерно 15 мл) и перемешивают в течение примерно 30 минут, и получают прозрачный раствор (при необходимости греют). К полученному раствору добавляют твердый азид натрия (примерно 1,55 г, 23,84 ммоль), смесь перемешивают в течение примерно 18 час при комнатной температуре, и проводят контроль ТСХ. По завершении этого реакционную смесь разбавляют водой (примерно 50 мл) и экстрагируют этилацетатом (примерно 3×20 мл). Органический слой последовательно промывают водой (примерно 2×20 мл) и рассолом (примерно 20 мл). Объединенный органический слой сушат над безводным Na2SO4, концентрируют при пониженном давлении, остаток очищают флэш-хроматогшрафией, и получают промежуточное соединение 1.21.
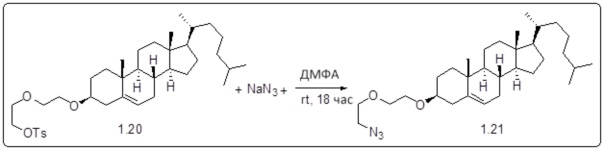
[00227] Стадия 4. К раствору азида 1.21 (примерно 1 г, 2,01 ммоль) в сухом ДМФА (примерно 10 мл) в атмосфере азота добавляют трифенилфосфин (TPP) (примерно 1,04 г, 4,02 ммоль). Реакционную смесь перемешивают в течение примерно 6 часов при комнатной температуре, и к ней добавляют воду (примерно 1 мл). Полученный раствор перемешивают еще в течение 6 часов при той же температуре, и проводят контроль методом ТСХ. По завершении этого органический растворитель удаляют в вакууме, остаток очищают хроматографией на силикагеле с использованием в качестве элюента смеси метанол/хлороформ, и получают промежуточный амин 1.22.
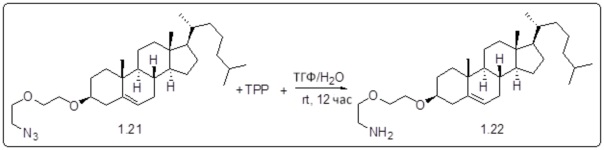
[00228] Стадия 5. При охлаждении льдом к раствору амина 1.22 (примерно 800 мг, 1,68 ммоль) в ТГФ (примерно 10 мл) в атмосфере азота добавляют NaH (примерно 200 мг, 5,02 ммоль) в течение примерно 10 минут. Полученный раствор перемешивают в течение примерно 20 минут, добавляют этилбромацетат (примерно 0,78 мл, 6,72 ммоль), и смесь перемешивают еще в течение 6 часов при комнатной температуре. По завершении этого реакционную смесь охлаждают до приблизительно 0°C, реакцию гасят водой, и смесь экстрагируют этилацетатом (примерно 2×20 мл). Объединенный органический слой сушат над безводным Na2SO4, концентрируют, остаток очищают хроматографией на силикагеле, и получают промежуточный диэфир 1.23.

[00229] Стадия 6. В 50-мл одногорлой круглодонной колбе при примерно 0°C растворяют диэфир 1.23 (примерно 220 мг, 0,340 ммоль) в смеси ТГФ/вода (примерно 3:1) (примерно 4 мл). К реакционной смеси добавляют твердый LiOH (примерно 20 мг, 0,640 ммоль) и перемешивают в течение примерно 6 часов при комнатной температуре. По завершении этого реакционную смесь концентрируют и разбавляют водой (примерно 4 мл). Водный слой последовательно промывают этилацетатом и дихлорметаном и лиофилизуют, и получают твердый порошок соли кислоты 1.24 с количественным выходом.

[00230] Стадия 7. В 50-мл одногорлой круглодонной колбе дилитиевую соль 1.24 растворяют в воде (примерно 1,0 мл). К полученному раствору добавляют DACHPt(H2O)2 и перемешивают в течение еще 12 часов и затем фильтруют. Раствор лиофилизуют, и получают амфифильное соединение холестерин-оксалиплатин - соединение 28.

Синтез соединения 29
[00231] Стадия 1. При охлаждении льдом к раствору амина (примерно 300 мг, 0,673 ммоль) в ТГФ (примерно 10 мл) в атмосфере азота в течение примерно 10 минут добавляют NaH (примерно 108 мг, 2,692 ммоль). Полученный раствор перемешивают в течение примерно 20 минут, и добавляют этилбромацетат (примерно 0,1 мл, 0,874 ммоль). Полученный раствор перемешивают еще в течение 6 часов при комнатной температуре, и проводят контроль ТСХ. По завершении этого реакционную смесь охлаждают до приблизительно 0°C, реакцию гасят водой, и смесь экстрагируют этилацетатом (примерно 2×15 мл). Объединенный органический слой сушат над безводным Na2SO4, концентрируют, остаток очищают хроматографией на силикагеле, и получают промежуточный диэфир 1.25.
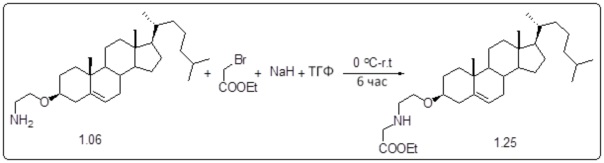
[00232] Стадия 2. В 50-мл одногорлой круглодонной колбе при примерно 0°C растворяют диэфир 1.25 (примерно 200 мг, 0,388 ммоль) в смеси ТГФ/вода (примерно 3:1) (примерно 4 мл). К реакционной смеси добавляют твердый LiOH (примерно 38 мг, 1,55 ммоль) и перемешивают в течение примерно 6 часов при комнатной температуре. По завершении этого реакционную смесь концентрируют и разбавляют водой (примерно 4 мл). Водный слой подкисляют раствором NaHSO4, экстрагируют дихлорметаном (примерно 3×10 мл) и затем концентрируют, и получают порошок твердой кислоты с хорошим выходом 1.26.

[00233] Стадия 3. В 50-мл одногорлой круглодонной колбе кислоту 1.26 (примерно 70 мг, 0,143 ммоль) растворяют в примерно 1,0 мл ДМФА. К полученному раствору добавляют DACH-Pt(H2O)2 и перемешивают в течение еще 12 часов. Реакционную смесь лиофилизуют, и получают амфифильное соединение холестерин-оксалиплатин - соединение 29.
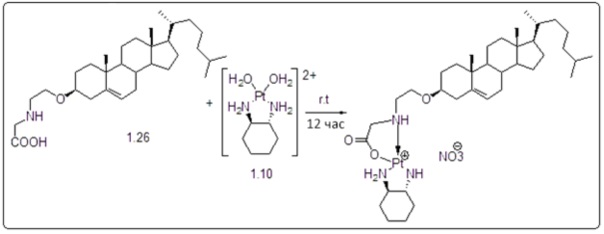
Синтез соединений 38, 39, 40, 41 и 42
[00234] Способы синтеза соединений 38, 39, 40, 41 и 42 схожи со способом синтеза соединения 25. В указанных соединениях изменяется липидная часть. В соединениях 38-42 присутствуют различные липидные части (R), указанные далее.
Соединение 38:

Соединение 39:
Соединение 40:

Соединен. 41:

Соединение 42:
[00235] Пути синтеза указанных соединений 38-42 приводятся на фигуре 4.
Модифицированный синтез соединения 25

[00236] Стадия 1. При охлаждении льдом к раствору холестерина 1.01 (примерно 10 г, 0,026 моль) в CH2Cl2 (примерно 45 мл) добавляют пиридин (примерно 15 мл) и перемешивают в течение примерно 15 минут. К полученному раствору добавляют п-толуолсульфонилхлорид (примерно 9,8 г, 0,052 моль), перемешивают в течение примерно 6 час при 0°C, и затем проводят контроль ТСХ. По завершении этого реакционную смесь разбавляют CHCl3 (примерно 20 мл) и последовательно промывают примерно 1 N HCl (3×50 мл) и рассолом (примерно 20 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме, получают промежуточное соединение 1.02, и указанное промежуточное соединение непосредственно используют в следующей реакции без дополнительной очистки.

[00237] Стадия 2. К раствору тозилированного холестерина 1.02 (примерно 10 г, 0,018 моль) в диоксане (примерно 45 мл) добавляют этиленгликоль (примерно 15 мл), и смесь кипятят с обратным холодильником в течение примерно 4 час. Проводят контроль ТСХ. По завершении этого реакционную смесь экстрагируют этилацетатом и последовательно промывают водой (примерно 3×50 мл) и рассолом (примерно 20 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме, остаток очищают на колонке, и получают промежуточное соединение 1.03.

[00238] Стадия 3. При охлаждении льдом к раствору холестерилэтиленгликоля 1.03 (примерно 6,95 г, 16,13 ммоль) в дихлорметане (примерно 15 мл) в атмосфере азота добавляют пиридин (примерно 13 мл), и смесь перемешивают в течение примерно 15 минут. К полученному раствору добавляют п-толуолсульфонилхлорид (примерно 3,7 г, 19,35 ммоль), перемешивают в течение примерно 5 час при примерно 0°C, и проводят контроль ТСХ. По завершении этого реакционную смесь разбавляют CHCl3 (примерно 20 мл) и последовательно промывают примерно 1 N HCl (3×50 мл) и рассолом (примерно 20 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме, остаток очищают хроматографией на силикагеле, и получают промежуточное соединение 1.04.

[00239] Стадия 4. В 50-мл круглодонной колбе в атмосфере азота растворяют соединение 1.04 (примерно 6 г, 10,26 ммоль) в ДМФА (примерно 20 мл) и перемешивают в течение примерно 30 минут для получения прозрачного раствора (при необходимости греют). К полученному раствору добавляют азид натрия (примерно 3,4 г, 51,33 ммоль), перемешивают в течение примерно 18 час при комнатной температуре, и проводят контроль ТСХ. По завершении этого реакционную смесь концентрируют в вакууме для удаления ТГФ, остаток очищают флэш-хроматографией, и получают промежуточное соединение 1.05.

[00240] Стадия 5. К раствору азида 1.05 (примерно 3 г, 7,6 ммоль) в сухом ДМФА (примерно 15 мл) в атмосфере азота добавляют TPP (примерно 1,5 г, 15,2 ммоль). Реакционную смесь перемешивают в течение примерно 6 час при комнатной температуре, и к реакционной смеси добавляют примерно 2 мл воды. Реакционную смесь перемешивают еще в течение примерно 6 час, и проводят контроль ТСХ. По завершении этого реакционную смесь концентрируют при пониженном давлении, остаток очищают хроматографией на силикагеле с использованием в качестве подвижной фазы смеси метанол/хлороформ, и получают промежуточный амин 1.06.
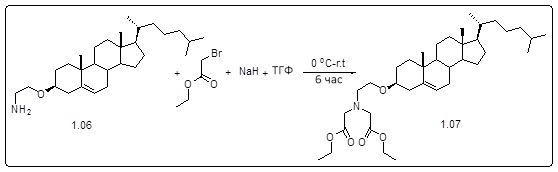
[00241] Стадия 6. При охлаждении льдом к раствору амина 1.06 (примерно 300 мг, 0,698 ммоль) в ТГФ (примерно 5 мл) в течение примерно 10 минут добавляют NaH (примерно 120 мг, 2,094 ммоль). Полученный раствор перемешивают в течение примерно 20 минут, добавляют этилбромацетат, и смесь перемешивают в течение примерно 6 час при комнатной температуре. По завершении этого реакционную смесь охлаждают до приблизительно 0°C, реакцию гасят водой, и смесь экстрагируют этилацетатом (примерно 2×20 мл). Органический слой сушат над безводным Na2SO4, концентрируют, остаток очищают хроматографией на силикагеле, и получают промежуточный диэфир 1.07 с выходом примерно 52%.1H ЯМР (500 МГц, CDCl3)δ: 5,34 (дд, J=8,1, 5,5 Гц, 1H), 4,19 (к, J=7,1 Гц, 4H), 3,73-3,61 (м, 6H), 3,14 (дт, J=15,5, 5,5 Гц, 1H), 3,02 (т, J=5,4 Гц, 2H), 2,28-0,64 (м, 49H, главная цепь холестерина).

[00242] Стадия 7. В 50-мл одногорлой круглодонной колбе растворяют диэфир соединение 1.07 (примерно 218 мг, 0,363 ммоль) в смеси ТГФ/вода (примерно 4 мл в соотношении примерно 3:1) и охлаждают до приблизительно 0°C. К такому охлажденному раствору добавляют LiOH (примерно 34 мг, 1,45 ммоль), и смесь перемешивают при комнатной температуре в течение последующих 6 час. По завершении этого реакционную смесь концентрируют при пониженном давлении для удаления ТГФ, и водный слой промывают этилацетатом. Водный слой лиофилизуют, и получают твердую дилитиевую соль 1.08 с количественным выходом.
[00243] Стадия 8. Синтез DACH-Pt(H2O)2

[00244] В 50-мл одногорлой круглодонной колбе растворяют дихлор(1,2-диаминоциклогексан)платина 1.09 (примерно 200 мг, 0,526 ммоль) в примерно 20,0 мл H2O. К полученной суспензии добавляют нитрат серебра (примерно 178,7 мг, 1,052 ммоль), и реакционную смесь перемешивают при комнатной температуре в течение примерно 24 час. Молочно-белый раствор центрифугируют, раствор фильтруют через шприц с фильтром 0,22 мкм, и получают акватированный DACH-Pt 1.10 с количественным выходом (примерно 10 мг/мл).

[00245] Стадия 9. В 100-мл одногорлой круглодонной колбе промежуточное соединение 1.08 (примерно 202 мг, 0,363 ммоль) растворяют в примерно 1,0 мл воды. К полученному раствору добавляют DACHPt(H2O)2 (примерно 13,8 мл), полученный на предыдущей стадии, и смесь перемешивают в течение последующих 12 час. Твердый осадок отфильтровывают и промывают водой (примерно 20 мл). Белый твердый осадок лиофилизуют и растворяют в избытке метанола, фильтруют и концентрируют при пониженном давлении, и получают амфифильное соединение холестерин-оксалиплатин - соединение 25 с выходом примерно 85%.1H ЯМР соединения 25: (500 МГц, CDCl3) δ: 5,36 (с, 1H), 3,71 (с, 4H), 3,64 (м, 2H), 3,16 (м, 1H), 2,86-2,78 (м, 2H), 2,36-0,62 (57H, главная цепь холестерина).13C ЯМР IO-125_01 (125 МГц, CD2Cl2-CD3OD) δ: 183,13, 182,80, 171,64, 171,35, 140,13, 122,08, 79,93, 56,73, 56,17, 50,19, 42,22, 39,75, 39,41, 38,87, 38,66, 37,00, 36,71, 36,11, 35,75, 32,16, 31,84, 29,54, 28,24, 28,13, 28,08, 27,90, 24,34, 24,19, 24,13, 23,72, 22,31, 22,06, 20,97, 18,97, 18,94, 18,32, 11,44; ИК соединения 25 (KBr): 3416,28, 3162,69, 2933,20, 1654,62, 1599,66, 1455,99, 1377,89, 1317,14, 1174,44, 1091,51, 1061,62; МС MALDI-TOF соединения 25 C39H67N3O5Pt (m/z)=853,644 (M)+;195Pt соединения 25 (108 МГц, CD2Cl2-MeOD) -2316,5 и -2341,82; элементный анализ: вычислено-найдено для C39H67N3O5Pt C- 52,63 (54,91), H - 7,93 (7,92), N - 4,21 (4,93).
Модифицированный синтез соединения 26
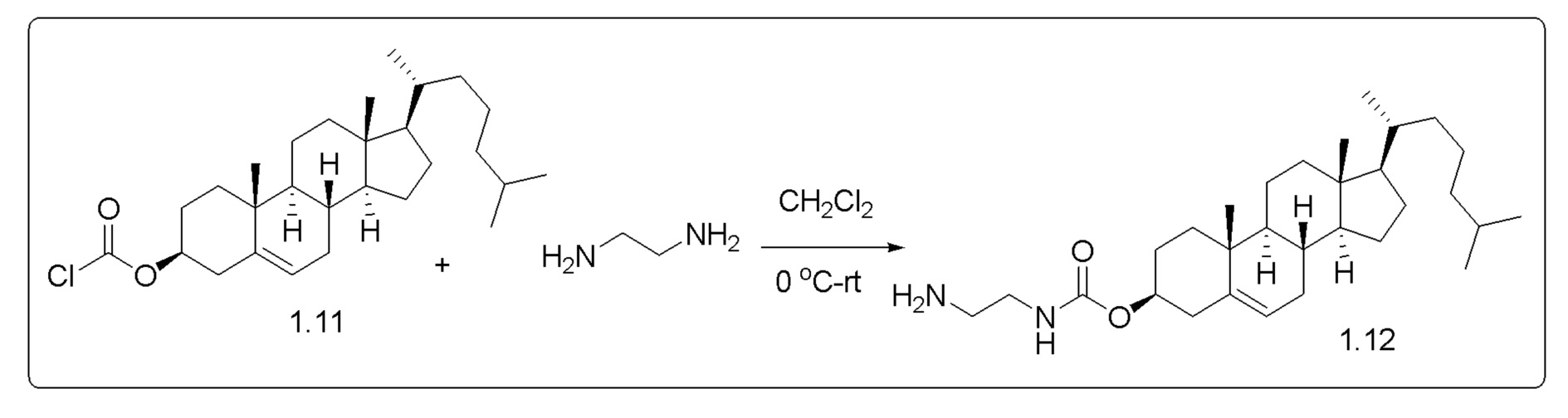
[00246] Стадия 1. При охлаждении льдом к раствору этилендиамина (примерно 22,2 мл) в CH2Cl2 (примерно 40 мл) по каплям, в течение примерно 45 мин, добавляют раствор соединения 1.11 (примерно 5 г) в CH2Cl2 (примерно 50 мл), и реакционную смесь перемешивают при той же температуре в течение примерно 1 часа и затем перемешивают при комнатной температуре еще в течение примерно 20 час. По завершении реакции (контроль методом ТСХ) реакционную смесь гасят водой и экстрагируют дихлорметаном (примерно 4×50 мл), и объединенный органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной хроматографией с использованием в качестве подвижной фазы смеси метанол-хлороформ, и получают промежуточное соединение 1.12.
1H ЯМР (500 МГц, CDCl3)δ: 5,30 (с, 1H), 5,05 (с, 1H), 4,42 (с, 1H), 3,18 (с, 2H), 2,79 (с, 2H), 2,35-0,60 (м, 45H, главная цепь холестерина).

[00247] Стадия 2. В 50-мл одногорлой круглодонной колбе в атмосфере азота амин 1.12 (примерно 300 мг 0,634 ммоль) растворяют в ТГФ (примерно 5 мл). Реакционную смесь охлаждают на ледяной бане до приблизительно 0°C, и по частям, в течение примерно 10 минут, добаляют NaH (примерно 130 мг, 3,17 ммоль). Полученный раствор перемешивают в течение примерно 20 минут, и добавляют этилбромацетат. Реакционную смесь перемешивают в течение примерно 2 час при комнатной температуре, и проводят контроль ТСХ. По завершении этого реакционную смесь охлаждают до приблизительно 0°C, реакцию гасят холодной водой (примерно 5 мл), смесь экстрагируют этилацетатом (примерно 2×20 мл), и экстракты сушат над безводным Na2SO4 и затем концентрируют. Остаток очищают колоночной хроматографией с использованием в качестве подвижной фазы смеси метанол-хлороформ, и получают промежуточное соединение 1.13.
[00248]1H ЯМР (500 МГц, CDCl3) δ: 5,85 (с, 1H), 5,39 (д, J=4,9 Гц, 1H), 4,50 (м, 1H), 4,25-4,15 (м, 4H), 3,63 (м, 4H), 3,30 (ушс, 2H), 2,98 (ушс, 2H), 2,44-0,71 (м, 49H, главная цепь холестерина).
[00249]13C ЯМР (500 МГц, CDCl3) δ: 171,32, 156,37, 140,00, 122,28, 74,14, 60,79, 56,66, 56,09, 55,16, 53,36, 49,97, 42,28, 39,71, 39,49, 38,57, 37,00, 36,54, 36,15, 35,77, 31,88, 31,85, 28,21, 28,14, 27,99, 24,26, 23,79, 22,80, 22,55, 21,01, 19,32, 18,68, 14,19, 11,83.
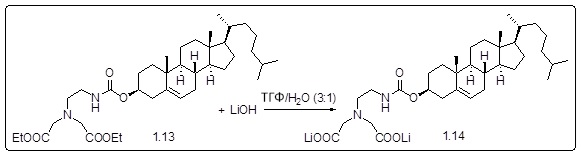
[00250] Стадия 3. В 50-мл одногорлой круглодонной колбе диэфир 1.13 (примерно 1,7 г, 2,63 ммоль) растворяют в смеси ТГФ/вода (примерно 3:1) (примерно 16 мл). Реакционную смесь охлаждают на ледяной бане до приблизительно 0°C, и к реакционной смеси добавляют LiOH (примерно 130 мг, 5.27 ммоль). Полученный раствор перемешивают в течение примерно 6 час при комнатной температуре, и проводят контроль ТСХ. По завершении этого реакционную смесь концентрируют при пониженном давлении для удаления ТГФ и разбавляют водой (примерно 5 мл). Водный слой последовательно промывают этилацетатом и CH2Cl2 и лиофилизуют, и получают промежуточное соединение 1.14 с количественным выходом.
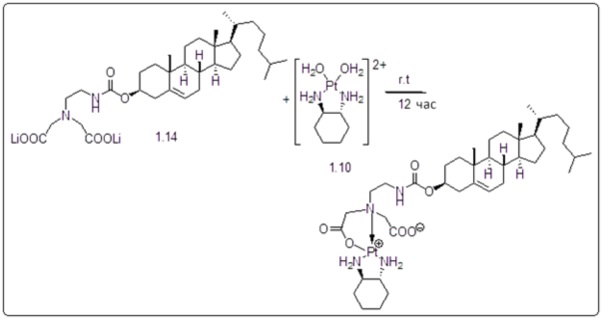
[00251] Стадия 4. В 100-мл одногорлой круглодонной колбе промежуточное соединение 1.14 растворяют в примерно 1,0 мл воды. К полученному раствору добавляют DACHPt(H2O)2 и перемешивают в течение последующих 12 час. Полученный твердый осадок отфильтровывают, промывают водой и лиофилизуют. Осадок растворяют в избытке метанола, фильтруют и концентрируют при пониженном давлении, и получают амфифильное соединение холестерин-оксалиплатин - соединение 26.1H ЯМР соединения 26 (500 МГц, CDCl3) δ: 5,40 (с, 1H), 4,89 (ушс, 1H), 4,52 (м, 1H), 3,61 (с, 4H), 3,40-3,28 (м, 2H), 2,73-2,66 (м, 2H), 2,44-0,60 (57H, главная цепь холестерина).13C ЯМР соединения 26 (125 МГц, CD2Cl2-CD3OD) δ: 186,87, 186,49, 175,25, 174,91, 161,48, 161,24, 143,69, 126,49, 79,20, 60,62, 60,04, 53,92, 46,19, 43,62, 43,38, 42,4, 42,32, 40,86, 40,46, 40,05, 39,68, 36,13, 35,80, 35,73, 33,97, 32,10, 31,96, 31,87, 28,21, 28,14, 27,70, 26,58, 26,32, 23,09, 22,51, 15,66; ИК соединения 26 (KBr): 3403,74, 2931,27, 1665,23, 1632,45, 1444,42, 1382,71, 1131,05; МС MALDI-TOF соединения 26 C40H68N4O6Pt (m/z)=896,5292 (M)+;195Pt соединения 26 (108 МГц, MeOD) -2280,34 и -2305,06; элементный анализ: вычислено-найдено для C40H68N4O6Pt C - 51,96 (53,62), H - 7,82 (7,65), N - 5,39 (6,25).
Модифицированный синтез соединения 27

[00252] Стадия 1. В 50-мл одногорлой круглодонной колбе в атмосфере азота BocHNCH2COOH (примерно 370 мг, 2,08 ммоль) растворяют в CH2Cl2 (примерно 10 мл). К реакционной смеси последовательно добавляют твердый EDCl (примерно 400 мг, 2,08 ммоль) иHOBT (примерно 285 мг, 2,08 ммоль). Добавляют DIPEA для того, чтобы сделать раствор щелочным, и реакционную смесь перемешивают в течение последующих 20 минут. К полученному раствору активированной кислоты добавляют амин 1.06 (примерно 450 мг, 1,04 ммоль), смесь перемешивают при комнатной температуре в течение примерно 12 час, и проводят контроль ТСХ. По завершении этого реакцию гпсят водой, смесь экстрагируют хлороформом, экстракт сушат над безводным Na2SO4 и затем концентрируют. Остаток очищают хроматографией на силикагеле с использованием в качестве подвижной фазы смеси метанол-хлороформ, и получают промежуточное соединение 1.15.
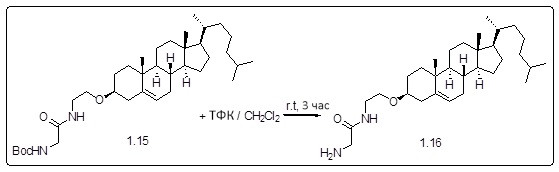
[00253] Стадия 2. В 50-мл одногорлой круглодонной колбе амин с защитной Вос-группой 1.15 (примерно 600 мг, 0,99 ммоль) растворяют в CH2Cl2, и колбу охлаждают до приблизительно 0°C. К полученному раствору добавляют ТФК, и смесь перемешивают в течение примерно 3 часов при той же температуре. По завершении этого реакционную смесь концентрируют выпариванием на роторном испарителе, и сырой продукт реакции 1.16 используют в следующей реакции без дополнительной очистки.
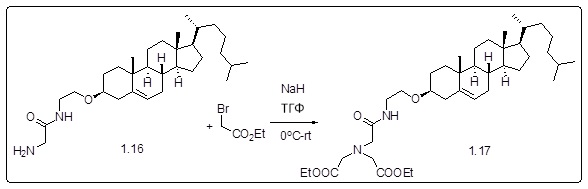
[00254] Стадия 3. В 50-мл одногорлой круглодонной колбе в атмосфере азота сырой амин 1.16 (примерно 400 мг, 0,821 ммоль) растворяют в ТГФ (примерно 10 мл). Раствор охлаждают на ледяной бане до приблизительно 0°C, и по частям, в течение примерно 10 минут, добавляют твердый NaH (примерно 160 мг, 4,10 ммоль). Полученный раствор перемешивают еще в течение 20 минут, и добавляют этилбромацетат. По завершении этого реакционную смесь охлаждают до приблизительно 0°C, реакцию гасят водой, смесь экстрагируют этилацетатом, сушат над безводным Na2SO4 и затем концентрируют в вакууме. Остаток очищают хроматографией на силикагеле с использованием в качестве подвижной фазы смеси метанол-хлороформ, и получают промежуточное соединение 1.17.1H ЯМР (500 МГц, CDCl3) δ: 5,33-5,29 (м, 1H), 4,19-4,12 (к, J=7,25 Гц, 4H), 3,56-3,49 (м, 6H), 3,43 (дд, J=11,6, 5,9 Гц, 2H), 3,39 (с, 2H), 3,14 (м, 1H), 2,44-0,71 (м, 50H, главная цепь холестерина).13C ЯМР (500 МГц, CDCl3) δ: 170,90, 170,66, 140,77, 121,54, 79,15, 66,33, 60,85, 58,82, 56,70, 56,09, 55,57, 50,12, 42,25, 39,71, 39,45, 39,35, 38,95, 37,14, 36,79, 36,12, 35,71, 31,87, 31,83, 28,26, 28,16, 27,93, 24,22, 23,75, 22,74, 22,49, 21,00, 19,29, 18,65, 14,15, 11,79.

[00255] Стадия 4. В 50-мл одногорлой круглодонной колбе при примерно 0°C диэфир 1.17 (примерно 200 мг, 0,303 ммоль) растворяют в смеси ТГФ/вода (примерно 3:1) (примерно 4 мл). К реакционной смеси добавляют твердый LiOH (примерно 15 мг, 0,606 ммоль) и перемешивают в течение примерно 6 часов при комнатной температуре. По завершении этого реакционную смесь концентрируют и разбавляют водой (примерно 4 мл). Водный слой последовательно промывают этилацетатом и дихлорметаном и лиофилизуют, и получают порошок твердой соли кислоты 1.18 с количественным выходом.

[00256] Стадия 5. В 100-мл одногорлой круглодонной колбе промежуточное соединение 1.18 растворяют в 1 мл воды. К полученному раствору добавляют DACHPt(H2O)2, и смесь перемешивают в течение последующих 12 часов. Твердый осадок отфильтровывают и промывают водой и затем лиофилизуют. Осадок растворяют в избытке метанола, раствор фильтруют и концентрируют при пониженном давлении, и получают амфифильное соединение холестерин-оксалиплатин - соединение 27.1H ЯМР соединения 27 (500 МГц, CDCl3-CD3OD) δ: 5,28 (с, 1H), 4,11 (д, J=14,1 Гц, 1H), 3,65-3,25 (м, 8H), 3,17-3,05 (м, 1H), 2,44-0,60 (57H, главная цепь холестерина).13C ЯМР соединения 27 (125 МГц, ДМСО-d6) δ: 180,1, 168,19, 166,47, 140,36, 121,06, 78,25, 65,47, 63,65, 61,23, 61,14, 60,31, 56,09, 55,48, 49,50, 41,76, 38,54, 36,57, 36,19, 35,56, 35,09, 31,32, 31,27, 28,88, 27,94, 27,68, 27,30, 23,77, 23,08, 22,58, 22,31, 20,51, 18,98, 18,46, 11,59; ИК соединения 27 (KBr): 3447,72, 3245,64, 2935,69, 1617,40, 1392,53, 1096,25; МС MALDI-TOF соединения 27 C41H70N4O6Pt (m/z)=910,6240 (M)+;195Pt соединения 27 (108 МГц, MeOD) -2260,12 и -2271,67; элементный анализ: вычислено-найдено для C41H70N4O6Pt C - 52,85 (54,11), H - 7,77 (7,75), N - 5,26 (6,16).
Пример 4. Синтез соединений формулы III
Синтез соединения 31
[00257] Стадия 1. В 50-мл одногорлой круглодонной колбе кетокислоту с защитной ацетонидной группой (примерно 121,5 мг, 0,854 ммоль) растворяют в примерно 2 мл безводного ТГФ, и смесь охлаждают до приблизительно -78°C. К полученному раствору добавляют LiHMDS (примерно 0,85 мл 1 ммолярного раствора в толуоле, 5 эквив.), и смесь перемешивают в течение примерно 15 минут при той же температуре. К полученному раствору добавляют тозилсодержащее соединение 1.04 (примерно 100 мг, 0,171 ммоль) в ТГФ (примерно 2 мл), и смесь снова перемешивают в течение примерно 2 часов при примерно -78°C. По завершении этого реакционную смесь охлаждают до приблизительно 0°C, реакцию гасят водой, и смесь экстрагируют этилацетатом (примерно 2×15 мл). Органический слой сушат над безводным Na2SO4, концентрируют, остаток очищают хроматографией на силикагеле, и получают промежуточный диэфир 1.27.

[00258] Стадия 2. Соединение с защитной ацетонидной группой 1.27 растворяют в примерно 1 мл ТГФ в 50-мл одногорлой круглодонной колбе, и при примерно 0°C добавляют HCl (примерно 1 M). Реакционную смесь перемешивают в течение примерно 3 часов при комнатной температуре, и проводят контроль ТСХ. По завершении этого реакционную смесь разбавляют водой (примерно 5 мл) и экстрагируют этилацетатом (примерно 20 мл). Органический слой сушат над безводным Na2SO4, концентрируют, остаток очищают хроматографией на силикагеле, и получают промежуточное соединение 1.28.

[00259] Стадия 3. В 50-мл одногорлой круглодонной колбе гидроксикислоту A растворяют в ДМФА (примерно 1 мл), и смесь перемешивают при комнатной температуре в течение примерно 30 минут. К реакционной смеси при комнатной температуре добавляют акватированный DACH, и смесь перемешивают в течение примерно 24 часов и затем лиофилизуют. Твердый осадок промывают водой (примерно 5 мл) и лиофилизуют, и получают конечный продукт платиновый аддукт соединение 31.

Синтез соединения 32
[00260] Стадия 1.В 50-мл одногорлой круглодонной колбе промежуточный спирт 1.03 растворяют в примерно 5 мл безводного CH2Cl2 и охлаждают до приблизительно 0°C. К полученному раствору добавляют РСС (хлорхромат пиридиния), реакционную смесь перемешивают при комнатной температуре в течение 3 часов, и затем реакцию контролируют ТСХ. По завершении этого реакционную смесь концентрируют, остаток очищают хроматографией на силикагеле, и получают промежуточный альдегид.
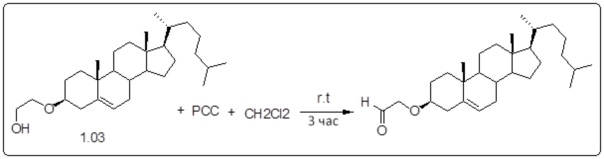
[00261] Стадия 2.В 50-мл одногорлой круглодонной колбе соль TPP (трифосфат натрия) растворяют в ТГФ, и смесь охлаждают до приблизительно 0°C. К полученному раствору добавляют н-BuLi, и реакционную смесь перемешивают в течение примерно 1 часа. К полученному раствору постепенно добавляют полученный на предыдущей стадии альдегид в ТГФ (примерно 5 мл). Полученный раствор перемешивают еще в течение 3 часов при примерно 0°C, и развитие реакции контролируют ТСХ. По завершении этого реакцию гасят водой, и реакционную смесь экстрагируют этилацетатом. Объединенный полученный органический слой концентрируют, и остаток очищают хроматографией на силикагеле.
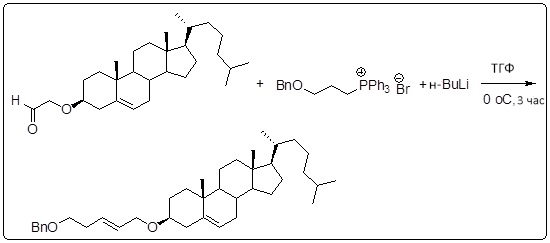
[00262] Стадия 3.В 50-мл одногорлой круглодонной колбе растворяют жидкий аммиак в ТГФ при примерно -78°C. К полученному раствору постепенно, в течение примерно 20 минут, добавляют металлический натрий. К полученному синему раствору в течение примерно 10 минут добавляют в ТГФ соединение с защитной бензильной группой. Полученный раствор перемешивают в течение примерно 3 часов при той же температуре, и развитие реакции контролируют ТСХ. По завершении этого реакцию гасят водой, реакционную смесь оставляют на примерно 12 часов при комнатной температуре, затем гасят хлоридом аммония, экстрагируют этилацетатом, и наконец экстракт концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле.

[00263] Стадия 4.В 50-мл одногорлой круглодонной колбе при примерно 0°C гидроксисоединение растворяют в CH2Cl2. К полученному раствору добавляют твердый периодинан Десса-Мартина (DMP), смесь перемешивают в течение примерно 3 часов, и контролируют реакцию ТСХ. По завершении этого реакцию гасят водой, и реакционную смесь экстрагируют CH2Cl2. Затем органический слой концентрируют, и остаток очищают хроматографией на силикагеле.
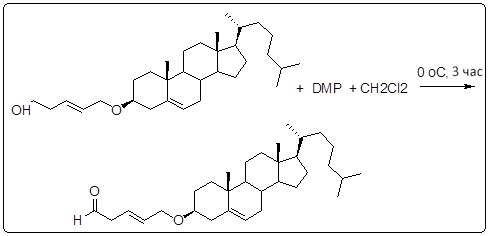
[00264] Стадия 5.В 50-мл одногорлую круглодонную колбу при примерно -78°C загружают диизопропиламид лития (LDA). К нему добавляют трет-бутилацетат в ТГФ, и смесь перемешивают в течение примерно 0,5 часов. К полученному раствору постепенно добавляют полученный на предыдущей стадии альдегид в ТГФ (примерно 5 мл). Полученный раствор перемешивают еще в течение 2 часов при примерно -78°C, и реакцию контролируют ТСХ. По завершении этого реакцию гасят водой, и реакционную смесь экстрагируют этилацетатом. Объединенный органический слой концентрируют, и остаток очищают хроматографией на силикагеле.

[00265] Стадия 6.В 50-мл одногорлой круглодонной колбе при примерно 0°C гидроксисоединение растворяют в CH2Cl2. К полученному раствору добавляют твердый периодинан Десса-Мартина (DMP), смесь перемешивают в течение примерно 3 часов, и реакцию контролируют ТСХ. По завершении этого реакцию гасят водой, и реакционную смесь экстрагируют CH2Cl2. Полученный органический слой концентрируют, и остаток очищают хроматографией на силикагеле.

[00266] Стадия 7. В 50-мл одногорлой круглодонной колбе трет-бутиловый эфир растворяют в ТГФ, и раствор охлаждают до приблизительно 0°C. К охлажденному раствору добавляют примерно 1 (M) HCl, и реакционную смесь перемешивают в течение примерно 2 часов при той же температуре. По завершении реакции соединение экстрагируют этилацетатом, и экстракт концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле.

[00267] Стадия 8. В 50-мл одногорлой круглодонной колбе гидроксислоту растворяют в ДМФА (примерно 1 мл), и смесь перемешивают при комнатной температуре в течение примерно 30 минут. К реакционной смеси при комнатной температуре добавляют акватированный DACH, и реакционную смесь перемешивают при комнатной температуре в течение примерно 24 часов и затем лиофилизуют. Твердый остаток промывают водой (примерно 5 мл) и лиофилизуют, и получают конечный продукт платиновый аддукт соединение 32.
Синтез соединения 33
[00268] Стадия 1.В 50-мл одногорлой круглодонной колбе промежуточный спирт 1.03 растворяют в примерно 5 мл безводного CH2Cl2, и раствор охлаждают до приблизительно 0°C. К полученному раствору добавляют PCC, реакционную смесь перемешивают при комнатной температуре в течение примерно 3 часов, и развитие реакции контролируют ТСХ. По завершении этого реакционную смесь концентрируют, затем выполняют очистку хроматографией на силикагеле, и получают промежуточный альдегид.

[00269] Стадия 2.В 50-мл одногорлой круглодонной колбе при примерно -78°C получают раствор LDA в ТГФ. К полученному раствору добавляют 1,3-диоксинон в ТГФ, и реакционную смесь перемешивают в течение примерно 0,5 часов. К полученному раствору постепенно добавляют полученный ранее альдегид в ТГФ (примерно 5 мл), полученный раствор перемешивают еще в течение 2 часов при примерно -78°C, и реакцию контролируют ТСХ. По завершении этого реакцию гасят водой, и реакционную смесь экстрагируют этилацетатом. Объединенный органический слой концентрируют, и затем выполняют очистку хроматографией на силикагеле.
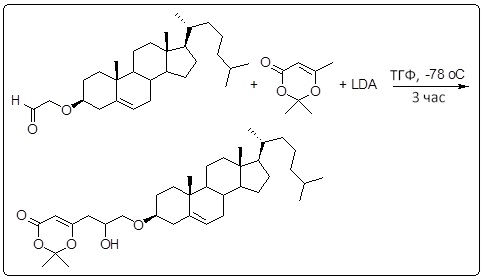
[00270] Стадия 3. В 50-мл одногорлой круглодонной колбе при примерно 0°C соединение с защитной ацетонидной группой растворяют в ТГФ. К полученному раствору добавляют 1 (M) HCl, и реакционную смесь перемешивают в течение примерно 2 часов при той же температуре. По завершении реакции соединение экстрагируют этилацетатом, и экстракт концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле.

[00271] Стадия 4. В 50-мл одногорлой круглодонной колбе гидроксикилоту растворяют в ДМФА (примерно 1 мл), и раствор перемешивают при комнатной температуре в течение примерно 30 минут. К реакционной смеси при комнатной температуре добавляют акватированный DACH-Pt(H2O), и реакционную смесь перемешивают при комнатной температуре еще в течение 24 часов и затем лиофилизуют. Твердый остаток промывают водой (примерно 5 мл), затем лиофилизуют, и получают продукт реакции платиновый аддукт соединение 33.

Синтез соединения 34 [где R=холестерин или другой липид]
[00272] Стадия 1. При охлаждении льдом к раствору холестерина 1.01 в CH2Cl2 добавляют пиридин и перемешивают в течение примерно 15 минут. К полученному раствору добавляют п-толуолсульфонилхлорид и перемешивают еще в течение 6 час при примерно 0°C. По завершении этого реакционную смесь разбавляют CHCl3 и последовательно промывают примерно 1 N HCl и рассолом. Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме, получают промежуточное соединение 1.02, и промежуточное соединение используют в следующей реакции без дополнительной очистки.

[00273] Стадия 2. К раствору сырого тозилхолестерина 1.02 в диоксане добавляют 1,3-пропандиол, и реакционную смесь кипятят с обратным холодильником в течение примерно 4 часов. По завершении этого реакционную смесь экстрагируют этилацетатом, и экстракт последовательно промывают водой и рассолом. Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме, наконец остаток очищают на колонке с силикагелем, и получают промежуточный спирт.

[00274] Стадия 3. При охлаждении льдом к раствору спирта в CH2Cl2 добавляют пиридин и перемешивают в течение примерно 15 минут. К полученному раствору добавляют п-толуолсульфонилхлорид, и реакционную смесь перемешивают еще в течение 6 час при примерно 0°C. По завершении этого реакционную смесь разбавляют CHCl3 и последовательно промывают примерно 1 N HCl и рассолом. Органический слой сушат над безводным Na2SO4 и затем концентрируют в вакууме. Остаток очищают на колонке с силикагелем, и получают промежуточное тозилсодержащее соединение.
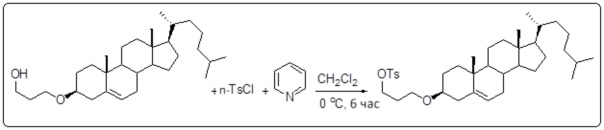
[00275] Стадия 4.В 50-мл одногорлой круглодонной колбе при примерно 0°C в атмосфере азота метил-3-меркаптопропионат растворяют в ДМФА (примерно 10 мл). К реакционной смеси добавляют карбонат калия, а затем добавляют тозилсодержащее соединение. Смесь перемешивают при комнатной температуре в течение последующих 24 часов. По завершении этого реакцию гасят водой, и реакционную смесь экстрагируют этилацетатом. Органический слой сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток окончательно очищают хроматографией на силикагеле, и получают промежуточный сульфид.
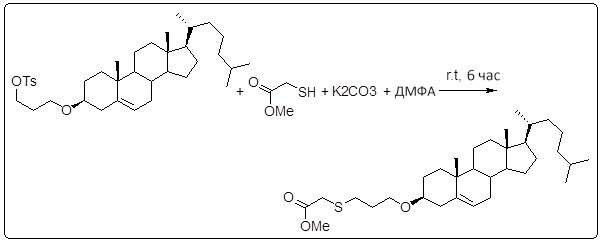
[00276] Стадия 5. В 50-мл одногорлой круглодонной колбе эфир растворяют в смеси ТГФ/вода, и смесь охлаждают до приблизительно 0°C. К полученному раствору добавляют LiOH, и смесь перемешивают при комнатной температуре в течение последующих 3 часов. По завершении этого реакционную смесь концентрируют при пониженном давлении для удаления ТГФ и затем экстрагируют этилацетатом. Органический слой сушат над безводным Na2SO4, концентрируют, наконец остаток очищают хроматографией на силикагеле, и получают промежуточную кислоту.

[00277] Стадия 6. В 50-мл одногорлой круглодонной колбе промежуточную кислоту, полученную на предыдущей стадии, растворяют в CH2Cl2, и смесь охлаждают до приблизительно 0°C. К полученному раствору добавляют м-хлорпербензойную кислоту (м-CPBA) (примерно 0,9 эквивалентов), реакционную смесь перемешивают при той же температуре (т.е., при 0°C) в течение примерно 1 часа, и развитие реакции контролируют ТСХ. По завершении этого реакцию гасят водой, и затем реакционную смесь экстрагируют CH2Cl2. Органический слой сушат над безводным Na2SO4, концентрируют, остаток очищают хроматографией на силикагеле, и получают частично окисленное промежуточное соединение.
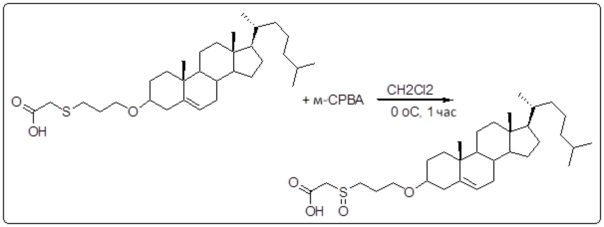
[00278] Стадия 7. В 50-мл одногорлой круглодонной колбе промежуточную кислоту растворяют в ДМФА, и смесь перемешивают при комнатной температуре в течение примерно 15 минут. К полученному раствору добавляют DACHPt(H2O)2, и реакционную смесь перемешивают в течение еще 24 часов. Раствор лиофилизуют, и получают амфифильное соединение 34 с хорошим выходом.

Синтез соединения 35 [где R=холестерин или другой липид]
[00279] Стадии 1-5. В качестве исходного реагента берут промежуточный сульфид, полученный во время синтеза соединения 34 (стадии 4 и 5).
[00280] Стадия 6. В 50-мл одногорлой круглодонной колбе вышеуказанный промежуточный сульфид растворяют в CH2Cl2, и смесь охлаждают до приблизительно 0°C. К полученному раствору добавляют м-CPBA (примерно 1,8 эквивалентов), реакционную смесь перемешивают при той же температуре в течение 1 часа, и развитие реакции контролируют ТСХ. По завершении этого реакцию гасят водой, и реакционную смесь экстрагируют CH2Cl2. Органический слой сушат над безводным Na2SO4, концентрируют, остаток очищают хроматогрфией на силикагеле, и получают в итоге окисленное промежуточное соединение.

[00281] Стадия 7. В 50-мл одногорлой круглодонной колбе промежуточную кислоту растворяют в ДМФА и перемешивают при комнатной температуре в течение примерно 15 минут. К полученному раствору добавляют DACHPt(H2O)2, и реакционную смесь перемешивают еще в течение 24 часов. Раствор лиофилизуют, и получают амфифильное соединение 35 с хорошим выходом.
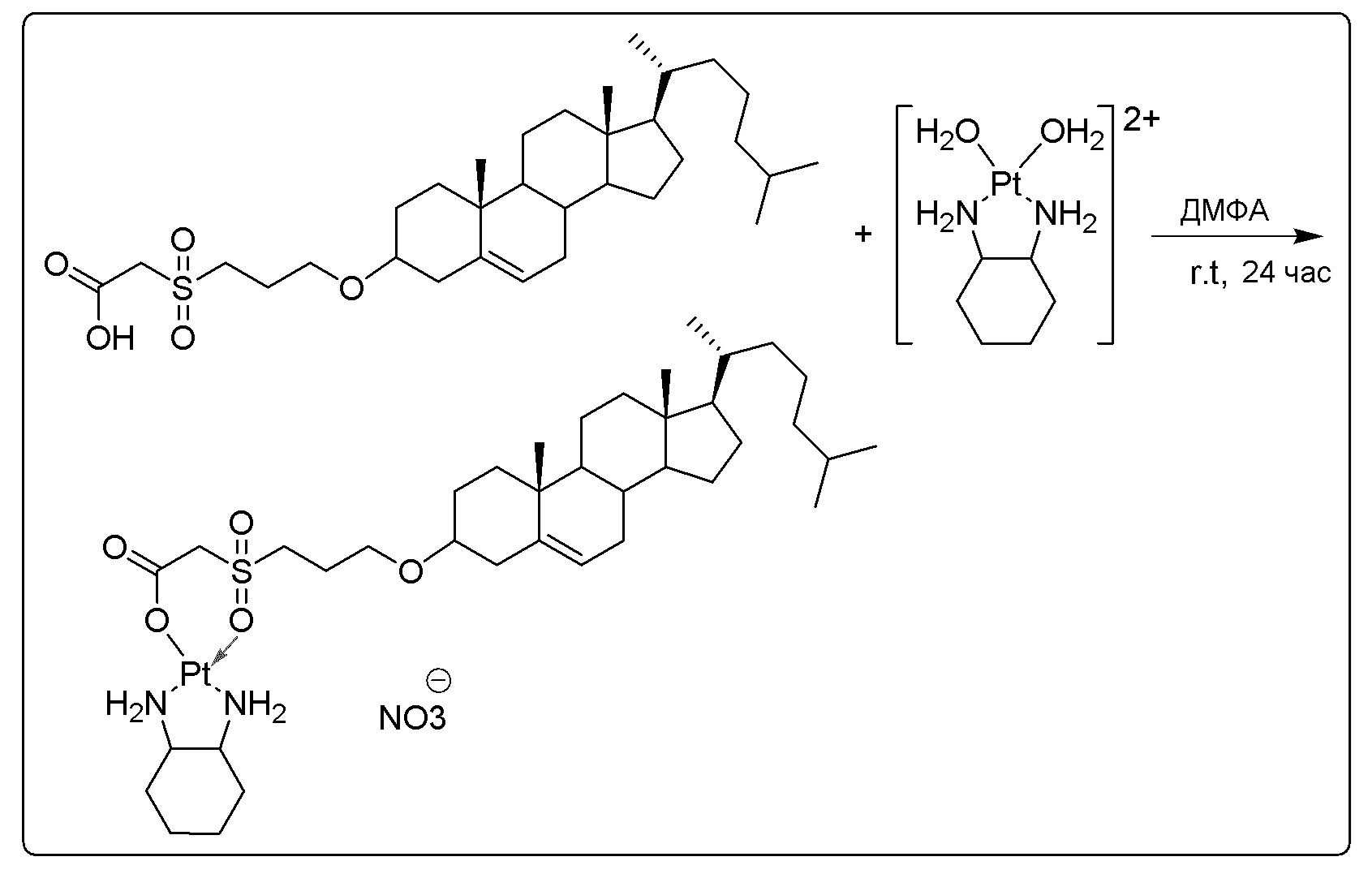
Синтез соединения 36 [где R=холестерин или другой липид]
[00282] Стадии 1-3. В качестве исходного реагента берут промежуточное тозилсодержащее соединение, полученное во время синтеза соединения 34 (стадия 3).
[00283] Стадия 4. В 50-мл одногорлую круглодонную колбу в атмосфере азота загружают промежуточное тозилсодержащее соединение в ДМФА (примерно 20 мл) и перемешивают в течение примерно 30 минут для получения прозрачного раствора (при необходимости осуществляют нагревание). К полученному раствору добавляют азид натрия, смесь перемешивают в течение примерно 18 часов при комнатной температуре, и используют ТСХ для контроля за развитием реакции. По завершении реакции реакционную смесь разбавляют водой, соединение экстрагируют этилацетатом, экстракт концентрируют в вакууме, остаток очищают флэш-хроматографией, и получают промежуточный азид.
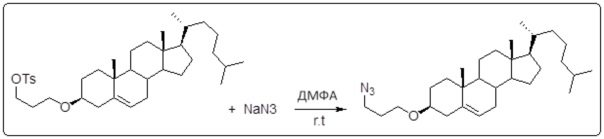
[00284] Стадия 5. К раствору азида в сухом ДМФА в атмосфере азота добавляют трифенилфосфин (TPP). Реакционную смесь перемешивают в течение примерно 6 часов при комнатной температуре, и к ней добавляют воду. Реакционную смесь снова перемешивают при той же температуре еще в течение 6 часов, и используют ТСХ для контроля за развитием реакции. По завершении реакции органический растворитель удаляют в вакууме, остаток очищают хроматографией на силикагеле с использованием в качестве элюента смеси метанол/хлороформ, и получают промежуточный амин.

[00285] Стадия 6. При охлаждении льдом к раствору амина в ТГФ в атмосфере азота в течение примерно 10 минут добавляют NaH. Полученный раствор перемешивают в течение примерно 20 минут, и затем добавляют этилбромацетат. Реакционную смесь перемешивают еще в течение 6 часов при комнатной температуре, и используют ТСХ для контроля за развитием реакции. По завершении реакции реакционную смесь охлаждают до приблизительно 0°C, гасят водой и затем экстрагируют этилацетатом. Органический слой сушат над безводным Na2SO4, концентрируют, остаток очищают хроматографией на силикагеле, и получают промежуточный эфир.
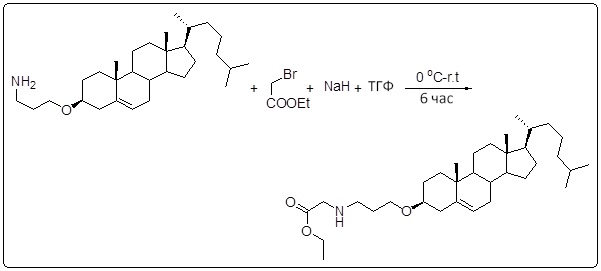
[00286] Стадия 7. В 50-мл одногорлой круглодонной колбе эфир растворяют в смеси ТГФ/вода, и смесь охлаждают до 0°C. К полученному раствору добавляют LiOH, и реакционную смесь перемешивают при комнатной температуре в течение примерно 3 часов. По завершении реакции реакционную смесь концентрируют при пониженном давлении для удаления ТГФ, и остаток экстрагируют этилацетатом. Органический слой сушат над безводным Na2SO4, концентрируют, окончательно очищают хроматографией на силикагеле, и получают промежуточную кислоту.

[00287] Стадия 8. В 50-мл одногорлой круглодонной колбе кислоту растворяют в CH2Cl2, и смесь охлаждают до приблизительно 0°C. К полученному раствору добавляют м-CPBA (примерно 0,8 эквивалента), смесь перемешивают при той же температуре в течение примерно 1 часа, и развитие реакции контролируют ТСХ. По завершении реакции реакционную смесь гасят водой и экстрагируют CH2Cl2. Органический слой сушат над безводным Na2SO4, концентрируют, остаток очищают хроматографией на силикагеле, и получают промежуточнвй N-оксид.
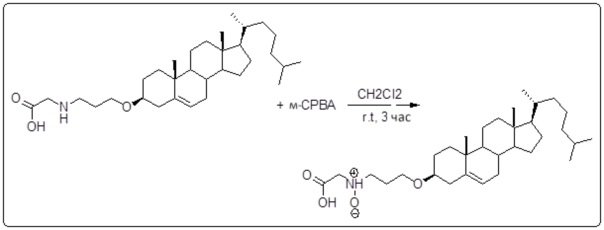
[00288] Стадия 9. В 50-мл одногорлой круглодонной колбе промежуточнвй N-оксид растворяют в ДМФА, и смесь перемешивают при комнатной температуре в течение примерно 15 минут. К полученному раствору добавляют DACHPt(H2O)2, и реакционную смесь перемешивают в течение примерно 24 часов. Раствор лиофилизуют, и получают соединение 36 с хорошим выходом.

Пример 5. Синтез соединения 30
[00289] Стадия 1. В 50-мл одногорлой круглодонной колбе в атомсфере азота холестерин 1.01 (примерно 1,0 г, 2,59 ммоль) растворяют в 5 мл безводного ТГФ, и раствор охлаждают до приблизительно 0°C. К полученному раствору добавляют NaH (примерно 414 мг, 10,344 ммоль), и смесь перемешивают в течение примерно 30 минут при той же температуре т.e., при 0°C). К полученному раствору добавляют этилбромацетатe (примерно 0,45 мл, 3,885 ммоль) в ТГФ (примерно 2 мл), и реакционную и смесь снова перемешивают в течение примерно 2 часов при комнатной температуре. По завершении этого реакционную смесь охлаждают до приблизительно 0°C, реакцию гасят водой, и затем смесь экстрагируют этилацетатом (примерно 2×15 мл). Полученный органический слой сушат над безводным Na2SO4, концентрируют, остаток очищают хроматографией на силикагеле, и получают промежуточный эфир 1.29.

[00290] Стадия 2. В 50-мл одногорлой круглодонной колбе при примерно 0°C эфир 1.29 (примерно 220 мг, 0,465 ммоль) растворяют в смеси ТГФ/вода (примерно 3:1) (примерно 4 мл). К реакционной смеси добавляют твердый LiOH (примерно 33 мг, 1,39 ммоль), и смесь перемешивают в течение примерно 6 часов при комнатной температуре. По завершении реакции реакционную смесь подкисляют насыщенным раствором NaHSO4 до pH 3 и затем экстрагируют CHCl3 (примерно 3×10 мл). Органический слой сушат над безводным Na2SO4, концентрируют на роторном испарителе, остаток очищают хроматографией на силикагеле, и получают чистую промежуточную кислоту 1.30.
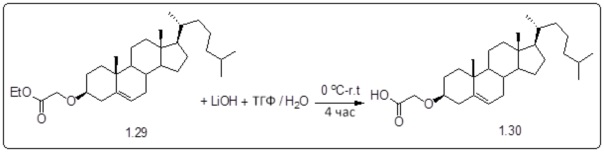
[00291] Стадия 3. В 50-мл одногорлой круглодонной DACH(Cl)2Pt (примерно 50 мг, 0,131 ммоль) растворяют в ДМФА (примерно 5 мл) и перемешивают в течение примерно 10 минут. К реакционной смеси при комнатной температуре добавляют AgNO3 (примерно 22 мг, 0,131 ммоль), и смесь перемешивают в течение примерно 24 часов. По завершении реакции осадок твердого AgCl удаляют центрифугированием с последующей фильтрацией через шприц с фильтром 0,2 мкм, и получают монохлорсодержащее соединение 1.31.
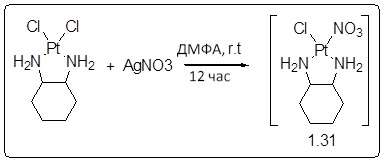
[00292] Стадия 4. В 50-мл одногорлой круглодонной колбе кислоту 1.30 растворяют в ДМФА (примерно 1 мл) и перемешивают при комнатной температуре в течение примерно 30 минут. К реакционной смеси при комнатной температуре добавляют монохлор-DACH-платина 1.31, и смесь перемешивают в течение примерно 24 часов. Твердый осадок промывают водой (примерно 5 мл), лиофилизуют, и получают конечный продукт реакции платиновый аддукт соединение 30.
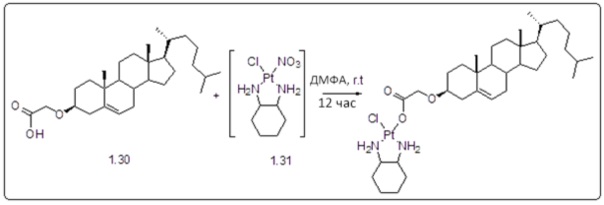
Пример 6. Синтез примеров соединений
Синтез соединения 63


[00293] Экспериментальная процедура. Соединение A (1,0 ммоль) растворяют в 10 мл ТГФ. К полученному раствору добавляют сульфоуксусную кислоту (3,0 ммоль), и полученный раствор перемешивают в течение 24 час при RT. Проводят контроль ТСХ, после этого к реакционной смеси добавляют воду, и непрореагировавший А экстрагируют с использованием этилацетата. Водный слой используют на следующей стадии.
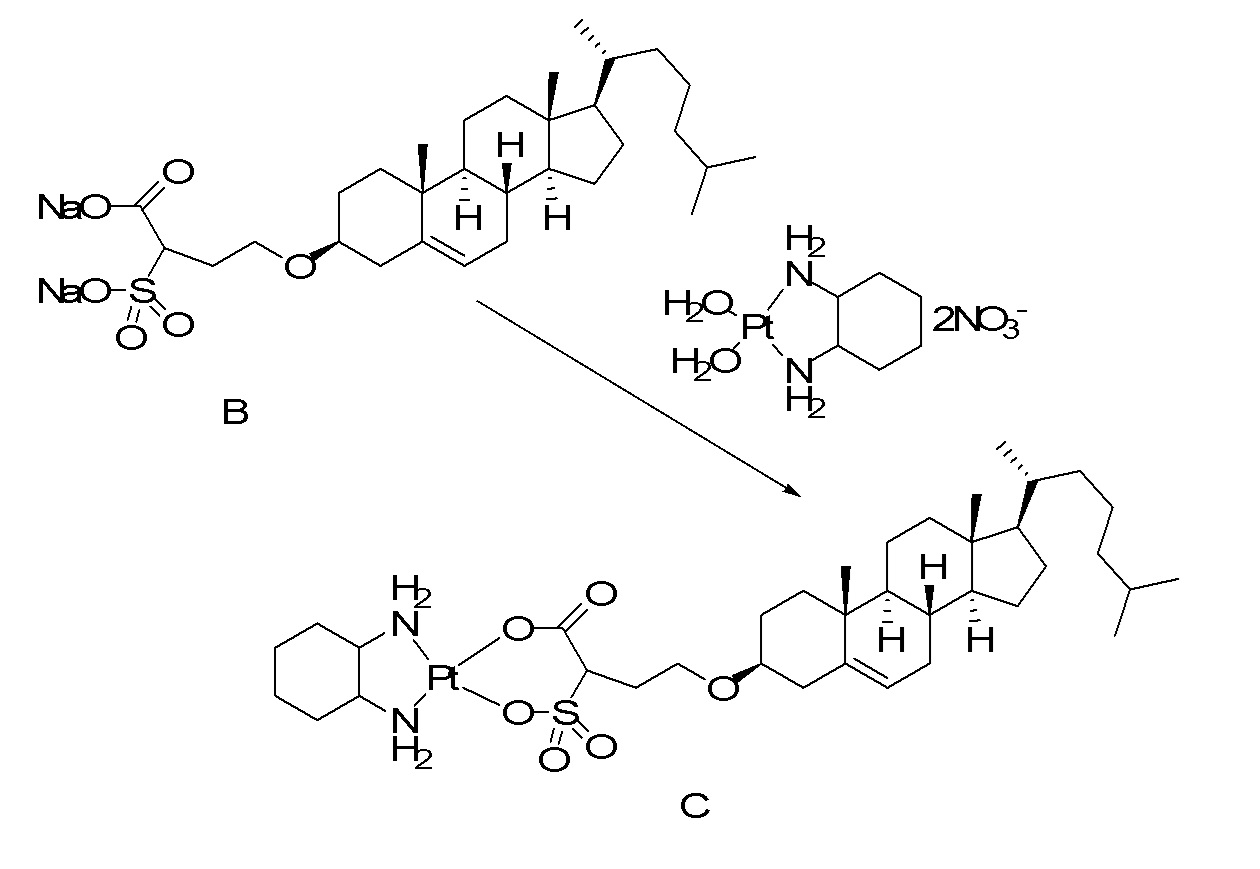
[00294] Экспериментальная процедура. В 50-мл одногорлую RBF загружают акватированный DACH-платина (0,1 ммоль, 3 мл 10 мг/мл раствора). Добавляют по каплям раствор соединения B (0,09 ммоль) в 10 мл воды, полученный раствор перемешивают при комнатной температуре в течение 24 час, и в это время появляется осадок. Осадок промывают водой и сушат в вакууме, и получают соединение C.
Синтез соединения 64

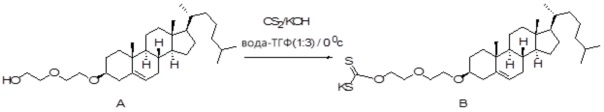
[00295] Экспериментальная процедура. В 25-мл одногорлой RBF соединение B (1,0 ммоль) (синтезированное согласно процедуре, описанной для соединения 64a) растворяют в 10 мл ТГФ. К полученному раствору добавляют селен (1,0 ммоль), и полученный раствор перемешивают в течение 24 час при RT. Проводят контроль методом ТСХ, после этого к реакционной смеси добавляют воду, и непрореагировавший А экстрагируют с использованием этилацетата. Водный слой используют на следующей стадии.
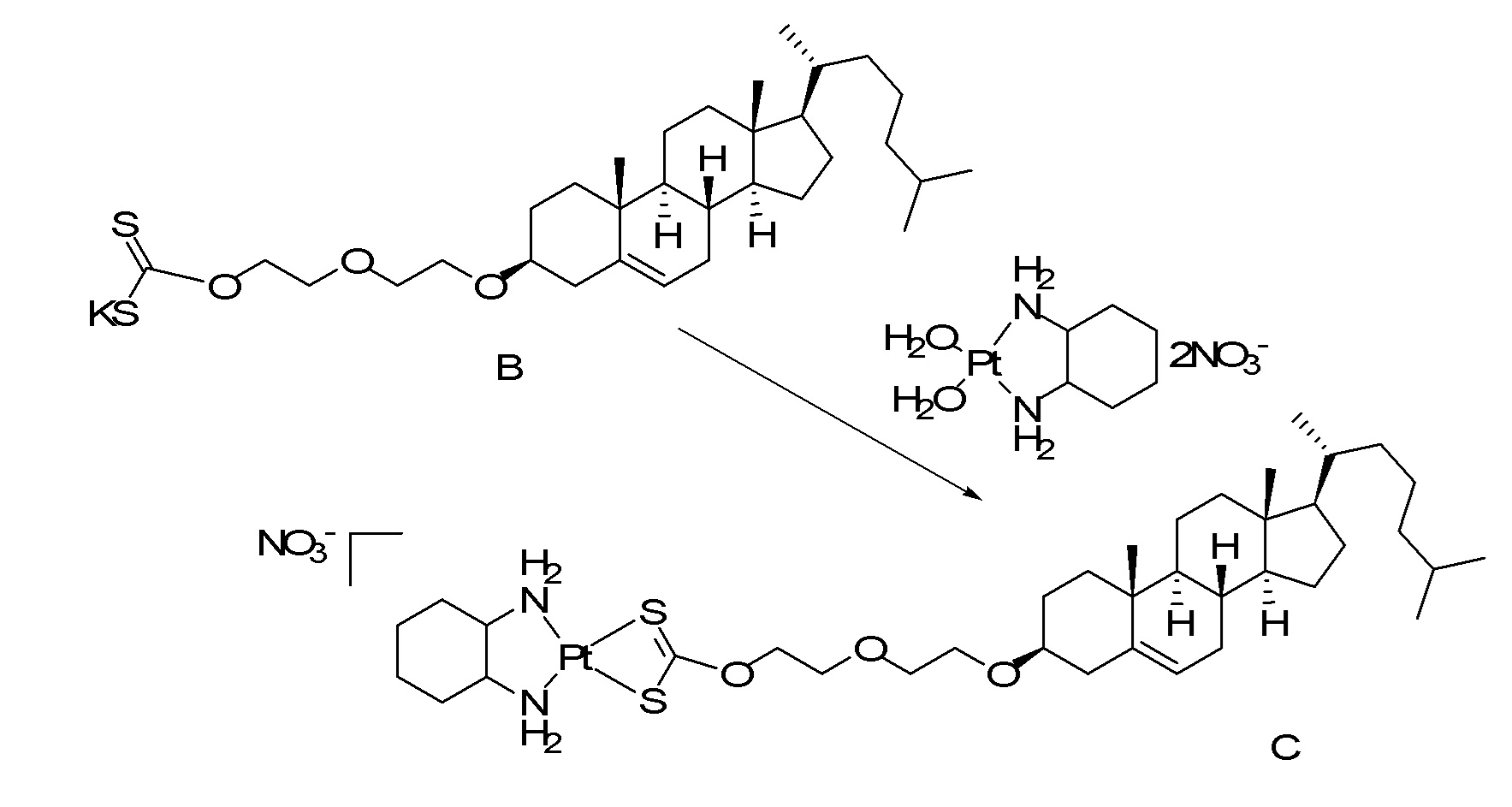
[00296] Экспериментальная процедура. В 50-мл одногорлую RBF загружают акватированный DACH-платина (3 мл 10 мг/мл раствора, 0,1 ммоль). Добавляют по каплям раствор соединения B (0,09 ммоль) в 10 мл ТГФ, и полученный раствор перемешивают при комнатной температуре в течение 24 час. Проводят контроль ТСХ. ТГФ выпаривают, и получают светло-желтый осадок. Осадок промывают водой, сушат в вакууме, и получают соединение C.
Синтез соединения 65
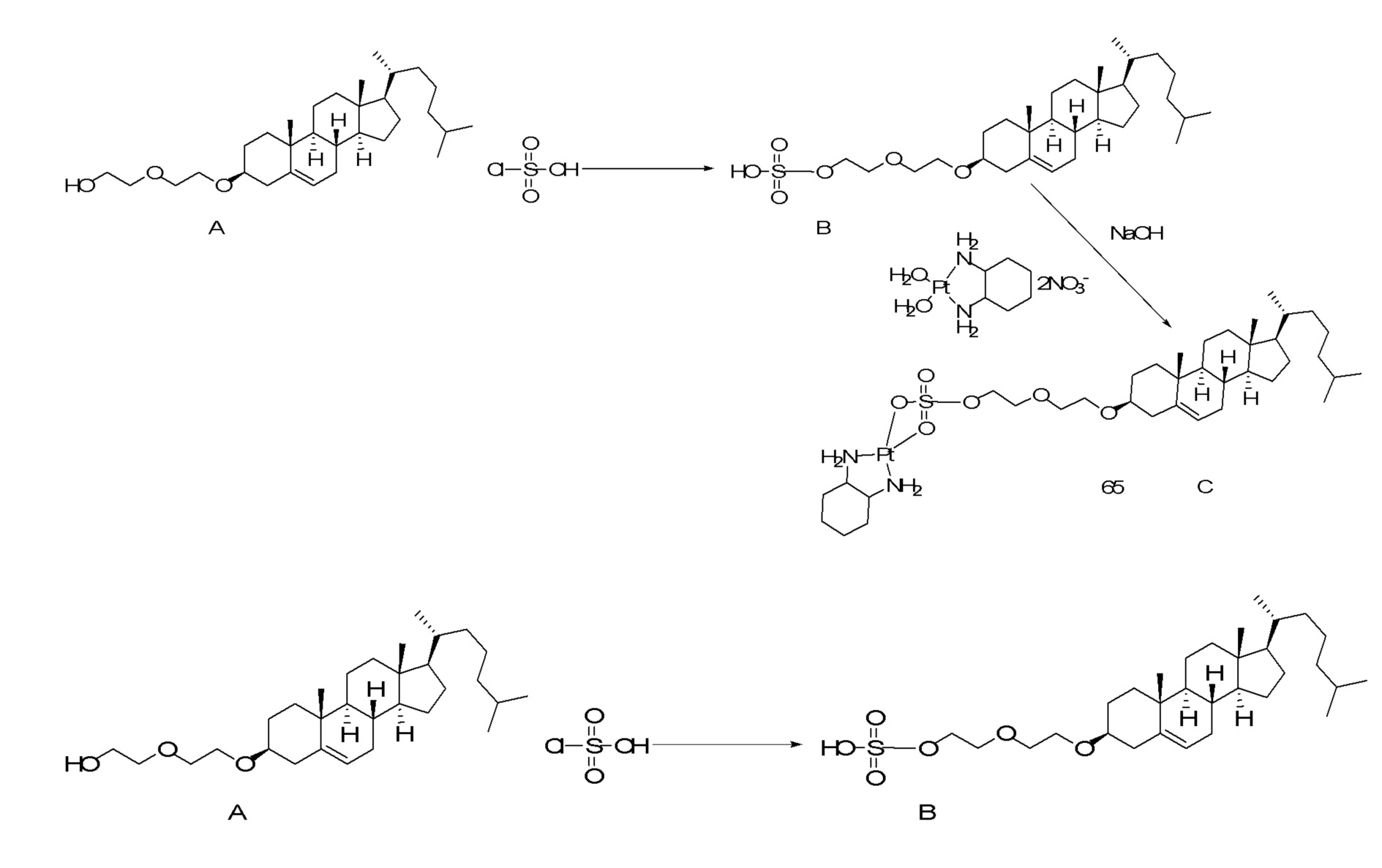
[00297] Экспериментальная процедура. В 25-мл одногорлой RBF растворяют соединение B (1,0 ммоль) (синтезированное согласно процедуре, описанной для соединения 46a) в 10 мл CCl4. К полученному раствору при 0°C добавляют по каплям хлорсульфоновую кислоту (1,0 ммоль), и полученный раствор перемешивают в течение 24 при RT. Проводят контроль ТСХ, после этого выпаривают CCl4 в вак., добавляют 50 мл воды, продукт реакции экстрагируют хлороформом, и получают B в виде белого порошка.
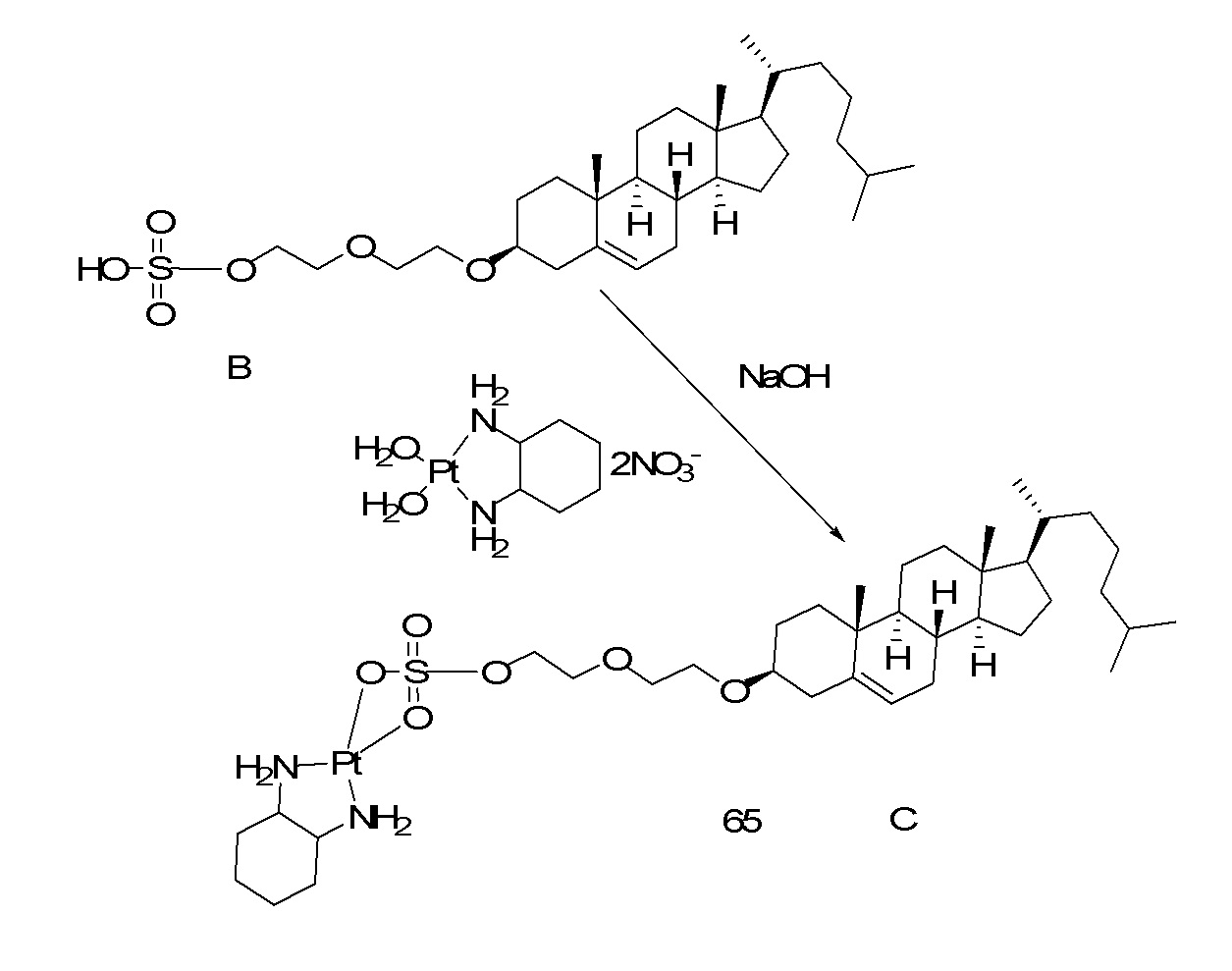
[00298] Экспериментальная процедура. В RBF при 0°C B (0,13 ммоль) в 5 мл смеси вода:ТГФ (1:3) обрабатывают 0,13 ммоль гидроксида натрия, и полученный раствор перемешивают в течение 15 мин. ТГФ выпаривают, и водный слой добавляют по каплям к раствору акватированного платинадиаминоциклогексана (0,13 ммоль в 15 мл воды). Во время реакции образуется белый осадок. Реакционную смесь центрифугируют, осадок промывают водой, и получают С в виде белого порошка.
Синтез соединения 37
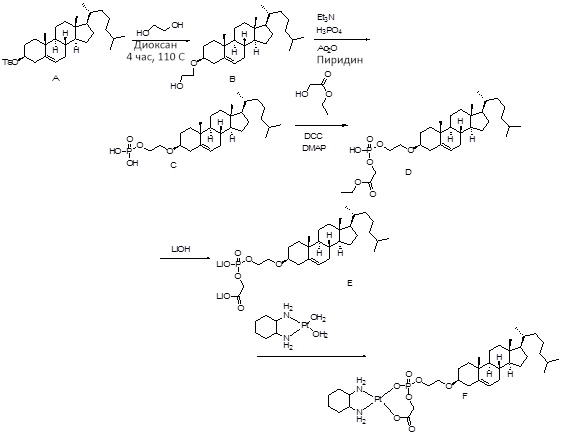

[00299] Экспериментальная процедура. В 25-мл одногорлой RBF соединение B (1,0 ммоль) (синтезированное согласно процедуре, описанной для соединения 69) перемешивают с фосфорной кислотой (H3PO3) (1,0 ммоль), пиридином (5 ммоль) и триэтиламином (Et3N) (2 ммоль) до тех пор, пока не получат прозрачный раствор. Добавляют уксусный ангидрид (2 ммоль), и реакционную смесь перемешивают в течение 4 час при 80°C. После израсходования всего B, как показывает ТСХ, к реакционной смеси добавляют 5 мл воды. Соединение C экстрагируют промывкой хлороформом (25 мл × 3). Растворитель удаляют в вакууме, и получают C.
[00300] Все последующие стадии до F выполняют согласно процедуре, описанной для получения IO-180_01.
Синтез соединения 55
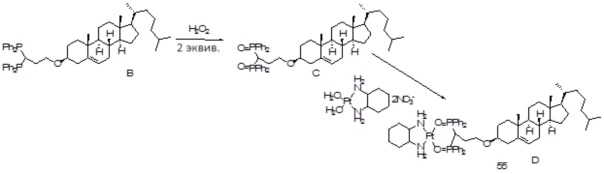

[00301] Экспериментальная процедура.Соединение A (соединение A синтезируют согласно процедуре, описанной в синтезе соединения 69). В 25-мл одногорлой RBF дифенилфосфинометан (DPPM) (5,0 ммоль) растворяют в 30 мл ТГФ. К полученному раствору добавляют н-бутиллитий (5,2 ммоль), и полученный раствор перемешивают в течение 15 мин при 0°C. К вышеуказанному раствору добавляют холестерилбромид (A) (4,0 ммоль), и реакционную смесь перемешивают в течение 16 час. Проводят контроль ТСХ, после этого к реакционной смеси добавляют воду, и соединение экстрагируют с использованием этилацетата. Объединенный органический слой концентрируют в вакууме. Остаток очищают колоночной хроматографией.
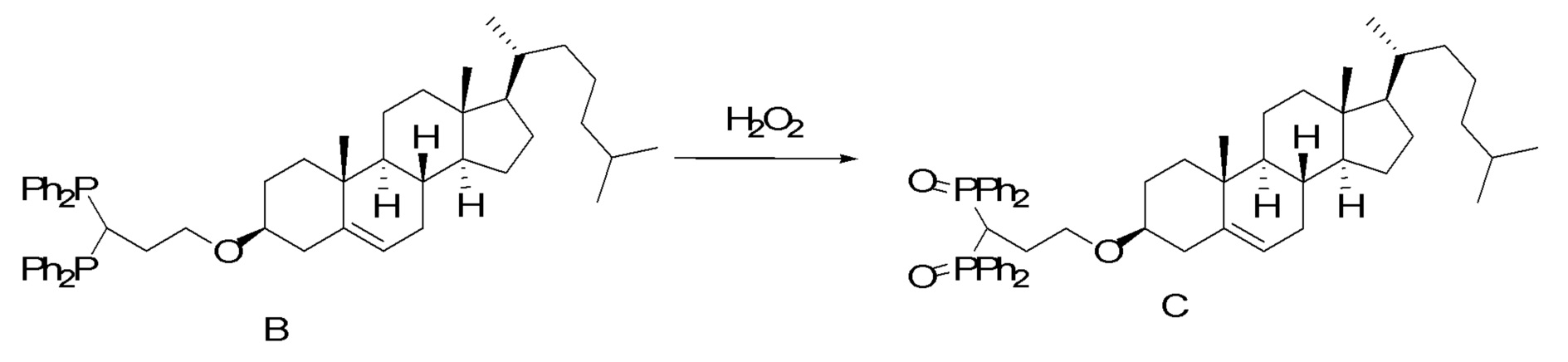
[00302] Экспериментальная процедура. В 25-мл одногорлой RBF соединение B (1,0 ммоль) растворяют в 30 мл ТГФ. К полученному раствору добавляют пероксид водорода (2,2 ммоль, 35% раствор), и полученный раствор перемешивают в течение 24 час при RT. Проводят контроль ТСХ, по его завершении к реакционной смеси добавляют воду, и соединение экстрагируют с использованием этилацетата. Объединенный органический слой концентрируют в вакууме. Остаток очищают колоночной хроматографией.

[00303] Экспериментальная процедура. В 50-мл одногорлую RBF загружают акватированный DACH-платина (3 мл 10 мг/мл раствора, 0,1 ммоль). Добавляют по каплям раствор соединения C (0,09 ммоль) в 10 мл ТГФ, и полученный раствор перемешивают при комнатной температуре в течение 24 час. Проводят контроль ТСХ. ТГФ выпаривают, и получают желтый осадок. Желтый осадок промывают водой, сушат в вакууме, и получают соединение E.
Синтез соединения 52

[00304] Экспериментальная процедура. В 50-мл одногорлой RBF A (синтез A описан при получении лиганда соединения 25) (1 ммоль) растворяют 10 мл сухого ТГФ. Добавляют Ph2PCl (2 ммоль) и триэтиламин (2 ммоль). Реакционную смесь перемешивают в атмосфере азота в течение 12 час при RT. Растворитель выпаривают, выполняют колоночную хроматографию, и получают F.
[00305] Синтез F-H схож с описанием синтеза соединения 55.
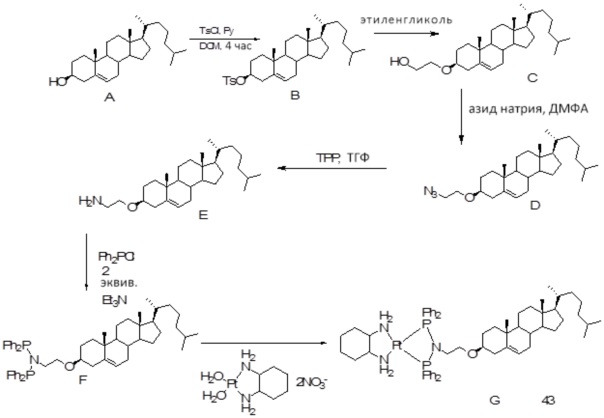

[00306] Экспериментальная процедура. В 50-мл одногорлой RBF A (синтез описан при получении лиганда соединения 25) (1 ммоль) растворяют в 10 мл сухого ТГФ. Добавляют Ph2PCl (2 ммоль) и триэтиламин (2 ммоль). Реакционную смесь перемешивают в атмосфере азота в течение 12 час при RT. Растворитель выпаривают, выполняют колоночную хроматографию, и получают F.
[00307] Синтез соединения (G, 43) схож с синтезом соединения 44.
Синтез соединений 46, 47 и 48
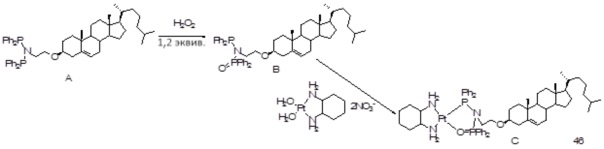
[00308] Экспериментальная процедура. Синтез соединения (C, 46) схож с синтезом соединения 49.

[00309] Экспериментальная процедура. Синтез соединения (C, 47) схож с синтезом соединения 50.
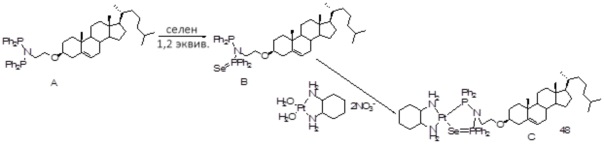
[00310] Экспериментальная процедура. Синтез соединения (C, 48) схож с синтезом соединения 50.
Синтез соединений 44 и 49

[00311] Экспериментальная процедура. Соединение A (соединение A синтезируют согласно процедуре, описанной при синтезе соединения 69). В 25-мл одногорлой RBF дифенилфосфинометан (DPPM) (5,0 ммоль) растворяют в 30 мл ТГФ. К полученному раствору добавляют н-бутиллитий (5,2 ммоль), и полученный раствор перемешивают в течение 15 мин при 0°C. К полученному выше раствору добавляют холестерилбромид (A) (4,0 ммоль), и реакционную смесь перемешивают в течение 16 час. Проводят контроль ТСХ, по завершении к реакционной смеси добавляют воду, и соединение экстрагируют с использованием этилацетата. Объединенный органический слой концентрируют в вакууме. Остаток очищают колоночной хроматографией.

[00312] Синтез соединения 44. В 25-мл одногорлой RBF соединение B (1,0 ммоль) растворяют в 30 мл ТГФ. К полученному раствору добавляют акватированный Pt(DACH) (1 ммоль в 10 мл воды), и полученный раствор перемешивают в течение 24 час при RT. ТГФ выпаривают, и получают соединение 44 в виде выпавшего в осадок вещества.
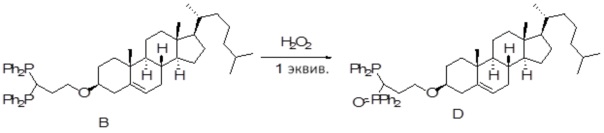
[00313] Экспериментальная процедура. В 25-мл одногорлой RBF соединение B (1,0 ммоль) растворяют в 30 мл ТГФ. К полученному раствору добавляют пероксид водорода (1,2 ммоль, 35% раствор), и полученный раствор перемешивают в течение 24 час при RT. Проводят контроль ТСХ, по завершении к реакционной смеси добавляют воду, и соединение экстрагируют с использованием этилацетата. Объединенный органический слой концентрируют в вакууме. Остаток очищают колоночной хроматографией.
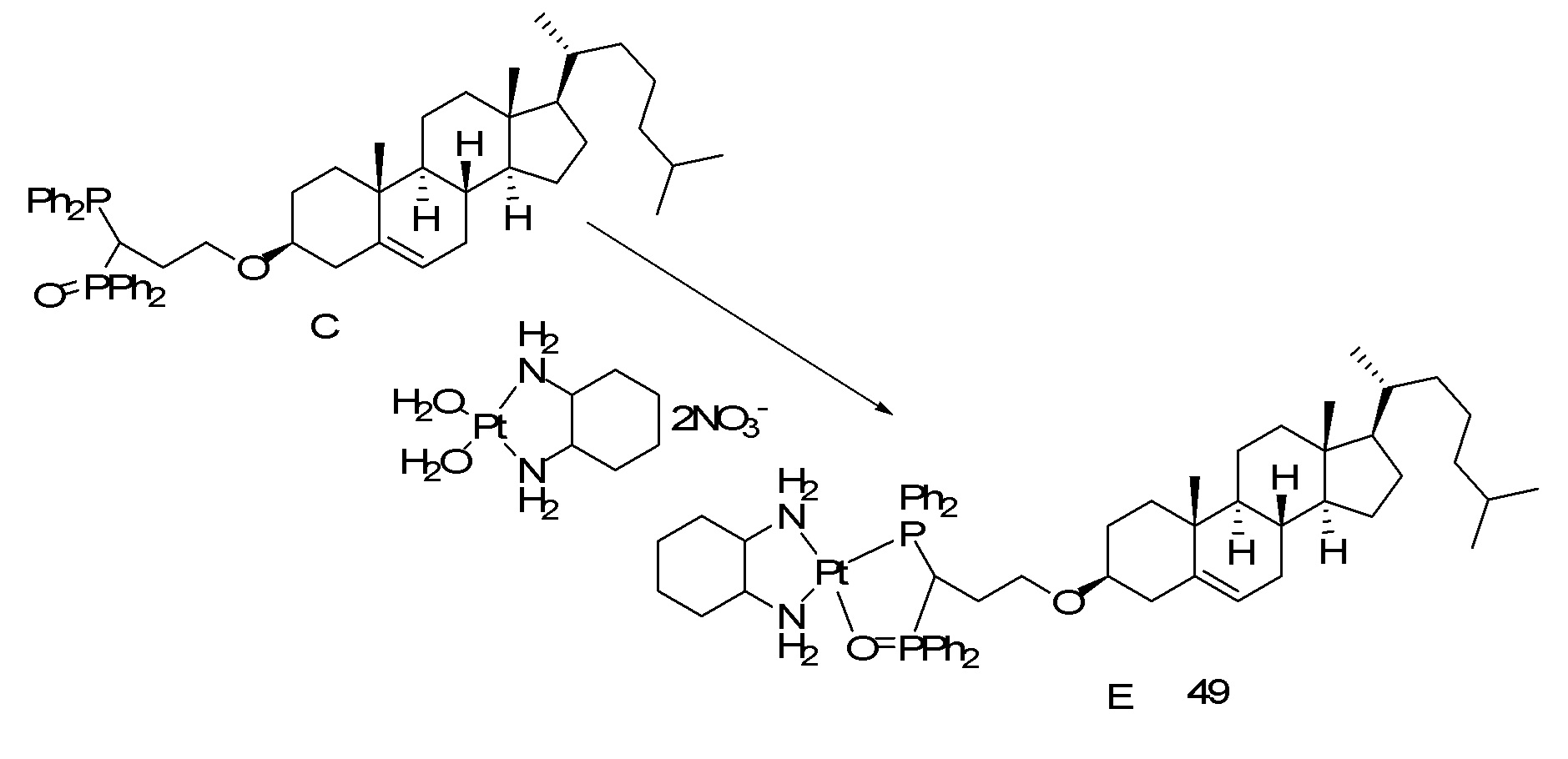
[00314] Экспериментальная процедура. В 50-мл одногорлую RBF загружают акватированный DACH-платина (3 мл 10 мг/мл раствора, 0,1 ммоль). Добавляют по каплям раствор соединения C (0,09 ммоль) в 10 мл ТГФ, и полученный раствор перемешивают при комнатной температуре в течение 24 час. Проводят контроль ТСХ. ТГФ выпаривают, и получают светло-желтый осадок. Выпавшее в осадок вещество промывают водой и сушат в вакууме, и получают соединение E.
Синтез соединения 50

[00315] Экспериментальная процедура. В 25-мл одногорлой RBF соединение B (1,0 ммоль) растворяют в 30 мл ТГФ. К полученному раствору добавляют серу (1,0 ммоль), и полученный раствор перемешивают в течение 24 час при RT. Проводят контроль ТСХ, по завершении к реакционной смеси добавляют воду, и соединение экстрагируют с использованием этилацетата. Объединенный органический слой концентрируют в вакууме. Соединение D очищают колоночной хроматографией.
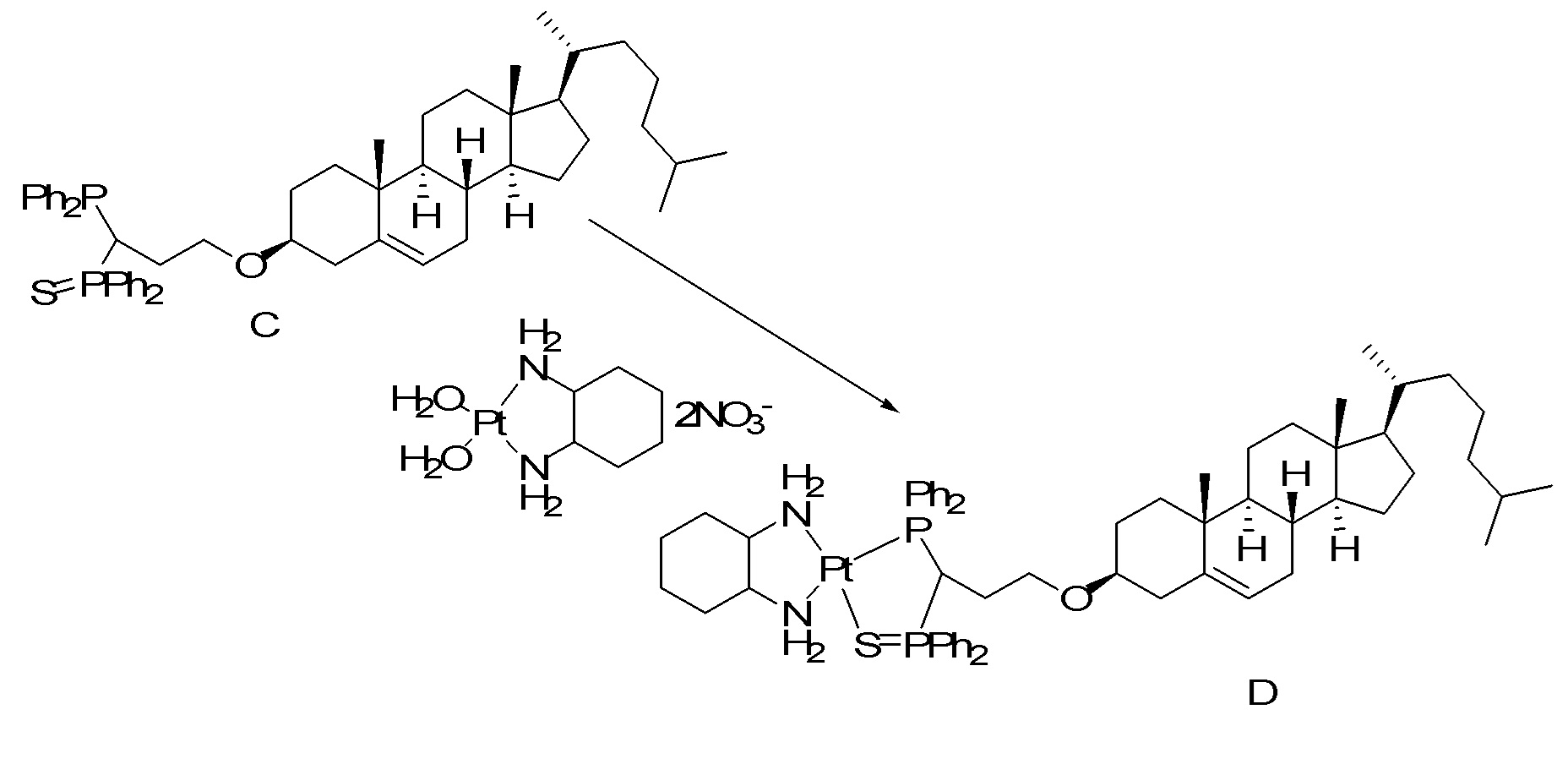
[00316] Экспериментальная процедура. В 50-мл одногорлую RBF загружают акватированный DACH-платина (3 мл 10 мг/мл раствора, 0,1 ммоль). Добавляют по каплям раствор соединения C (0,09 ммоль) в 10 мл ТГФ, и полученный раствор перемешивают при комнатной температуре в течение 24 час. Проводят контроль ТСХ. ТГФ выпаривают, и получают светло-желтый осадок. Выпавшее в осадок вещество промывают водой и сушат в вакууме, и получают D.
Синтез соединения 51

[00317] Экспериментальная процедура. В 25-мл одногорлой RBF соединение B (1,0 ммоль) растворяют в 30 мл ТГФ. К полученному раствору добавляют селен (1,0 ммоль), и полученный раствор перемешивают в течение 24 час при RT. Проводят контроль методом ТСХ, по завершении к реакционной смеси добавляют воду, и соединение экстрагируют с использованием этилацетата. Объединенный органический слой концентрируют в вакууме. Соединение D очищают колоночной хроматографией.
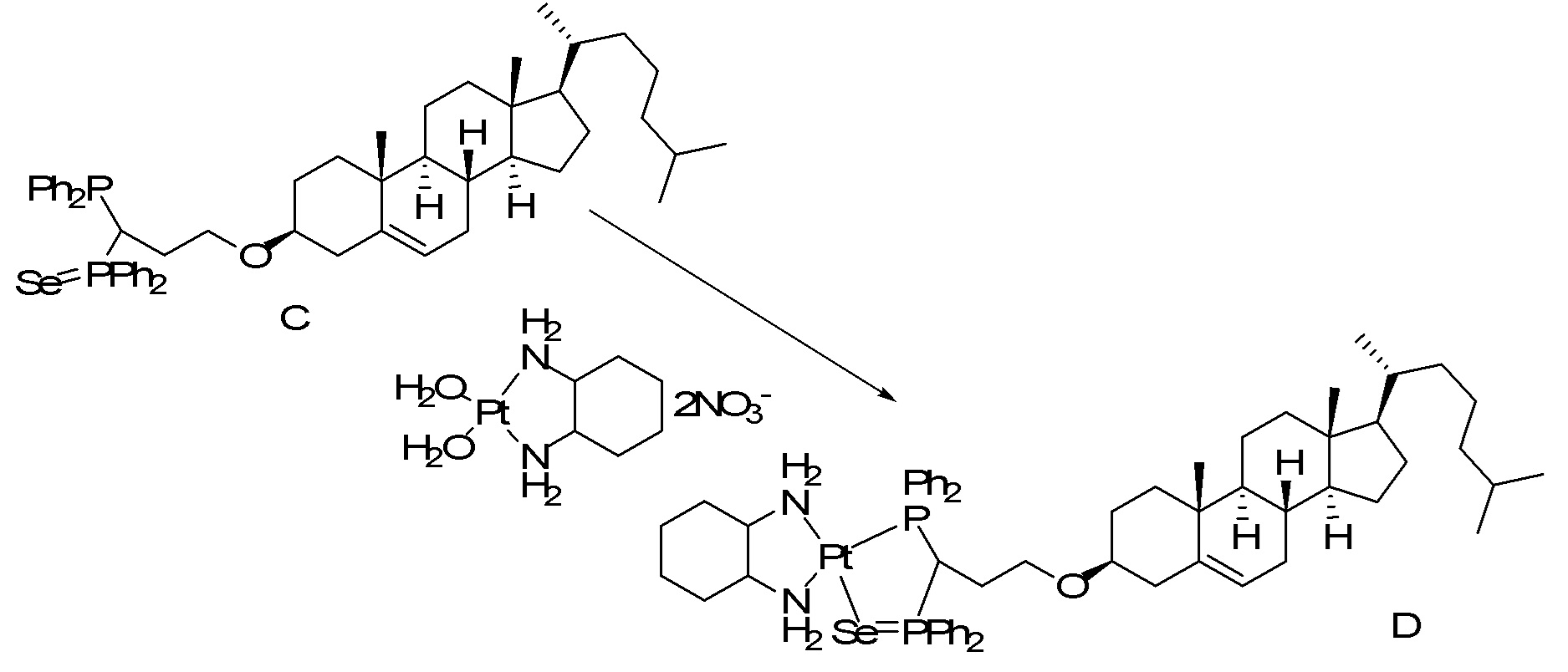
[00318] Экспериментальная процедура. В 25-мл одногорлую RBF загружают акватированный DACH-платина (3 мл 10 мг/мл раствора, 0,1 ммоль). Добавляют по каплям раствор соединения C (0,09 ммоль) в 10 мл ТГФ, и полученный раствор перемешивают при комнатной температуре в течение 24 час. Проводят контроль ТСХ. ТГФ выпаривают, и получают светло-желтый осадок. Выпавшее в осадок вещество промывают водой и сушат в вакууме, и получают соединение D.
Синтез соединения 54
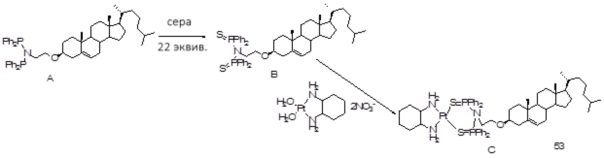
[00319] Экспериментальная процедура. Процедура такая же, как для соединения 50, используют два эквивалента серы.
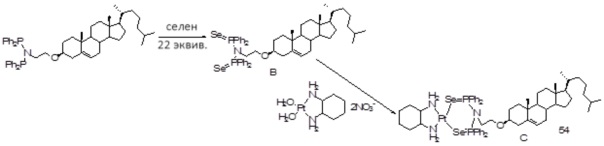
[00320] Экспериментальная процедура. Процедура такая же, как для соединения 51, используют два эквивалента селена.
Синтез соединения 57

[00321] Экспериментальная процедура. Процедура такая же, как для соединения 50, используют два эквивалента серы.
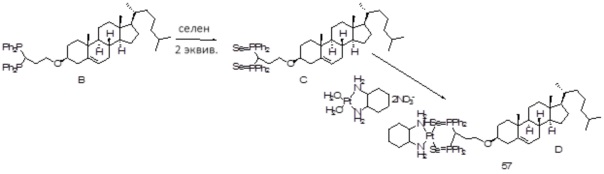
[00322] Экспериментальная процедура. Процедура такая же, как для соединения 51, используют два эквивалента селена.
Синтез соединений 58, 59, 60
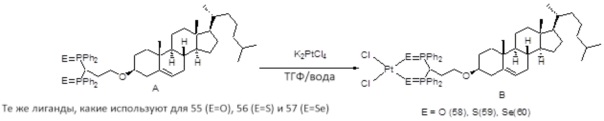
[00323] Экспериментальная процедура. В 50-мл одногорлую RBF загружают K2PtCl4 (3 мл 10 мг/мл раствора, 0,1 ммоль). Добавляют по каплям раствор соединения A (0,1 ммоль) в 10 мл ТГФ, и полученный раствор перемешивают при комнатной температуре в течение 24 час. Проводят контроль ТСХ. ТГФ выпаривают, и получают светло-желтый осадок. Выпавшее в осадок вещество промывают водой и сушат в вакууме, и получают соединение D.
Синтез соединений 61 и 62

[00324] Экспериментальная процедура. В 50-мл одногорлую RBF загружают соединение B (1 ммоль, в 10 мл ДМФА). Добавляют нитрат серебра (2 ммоль), и смесь перемешивают в течение 24 час. Выпавшее в осадок белое вещество отделяют фильтрацией. К фильтрату добавляют по каплям раствор соединения C (1 ммоль) в 10 мл воды, и полученный раствор перемешивают при комнатной температуре в течение 24 час. Проводят контроль ТСХ. ДМФА выпаривают, и получают светло-желтый осадок. Выпавшее в осадок вещество промывают водой и сушат в вакууме, и получают соединение 61/62.
Синтез соединения 78

[00325] Соединение A (0,5 ммоль) растворяют в 20 мл воды, и добавляют нитрат серебра (1 ммоль). Реакционную смесь перемешивают в течение 24 час, фильтруют, и добавляют ДМСО (0,5 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2 час, и получают желтое выпавшее в осадок вещество как соединение 78.
Схема синтеза для получения соединения 79

Схема синтеза для получения соединения 80

Схема синтеза для получения соединения 81

Схема синтеза для получения соединения 82
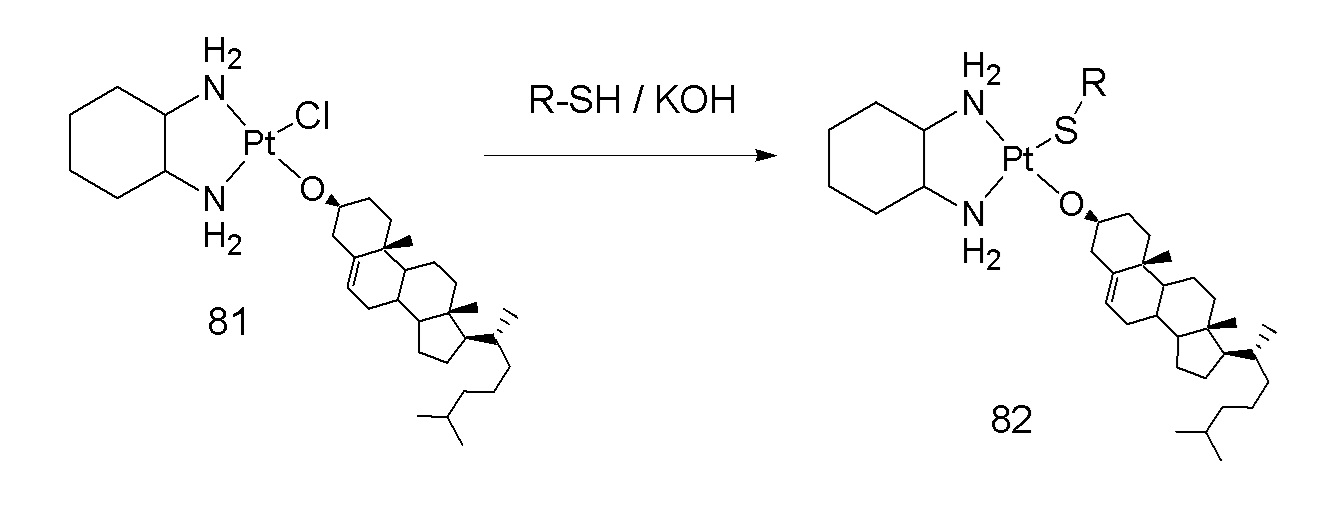
Схема синтеза для получения соединения 83
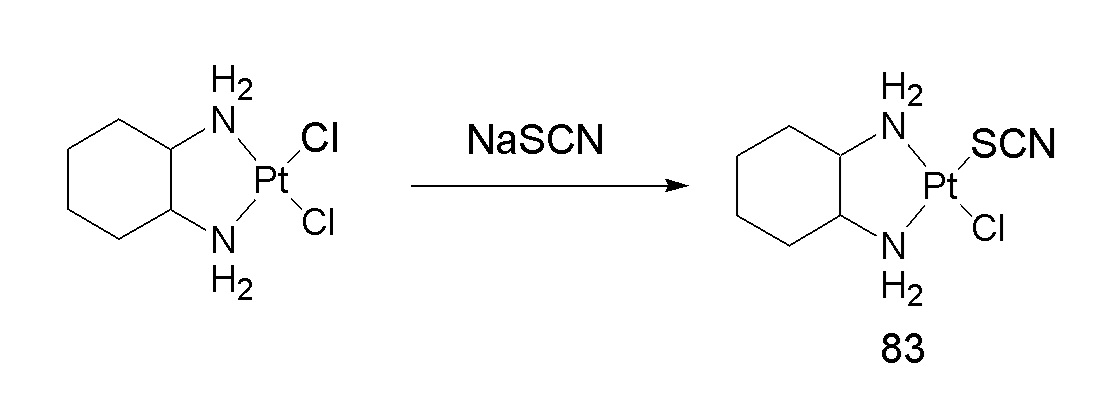
Схема синтеза для получения соединения 84

Схема синтеза для получения соединения 85

Схема синтеза для получения соединения 95

[00326] Соединение A (1 ммоль) растворяют в 50-мл rb в 10 мл ТГФ. Добавляют AgBF4 (1 ммоль), и смесь перемешивают при комнатной температуре в течение 24 час. Осадок отфильтровывают, и к фильтрату по каплям добавляют раствор соединения B (1 ммоль) в 10 мл воды. После 24-час перемешивания при RT ТГФ выпаривают, полученный осадок отфильтровывают и промывают водой, и получают соединение 95.
Пример 7. Синтез других примеров соединений
Синтез IO-131


[00327] Экспериментальная процедура. К раствору тозилированного холестерина A (7,4 ммоль) в диоксане (50 мл) добавляют этиленгликоль (35 мл), и смесь кипятят с обратным холодильником в течение 4 час. Проводят контроль методом ТСХ. По завершении реакционную смесь концентрируют в вакууме для удаления диоксана, и затем ее экстрагируют этилацетатом, и экстракт последовательно промывают водой (3×50 мл) и рассолом (20 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме, и выполняют очистку на колонке.
[00328] Экспериментальная процедура. К раствору холестерилэтиленгликоля B (4,5 ммоль) в 5 мл DCM добавляют трифенилфосфин (TPP) (9 ммоль) и четырехбромистый углерод (9 ммоль). Реакционную смесь перемешивают в течение 6 час при rt, и проводят контроль ТСХ. По завершении реакционную смесь разбавляют CHCl3 (20 мл) и последовательно промывают водой (3×50 мл) и рассолом (20 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме, загружают во флэш-колонку, и получают чистое соединение (C).

[00329] Экспериментальная процедура. В 25-мл одногорлой RBF метил-3-меркаптопропионат C (5,0 ммоль) растворяют в 30 мл ДМФА. К полученному раствору добавляют карбонат калия (20,0 ммоль), и полученный раствор перемешивают в течение 15 минут при RT. К полученному выше раствору добавляют холестерилбромид (B) (4,0 ммоль), и реакционную смесь перемешивают в течение 16 час. Проводят контроль ТСХ, по завершении к реакционной смеси добавляют воду, и соединение экстрагируют с использованием этилацетата. Объединенный органический слой концентрируют в вакууме. Остаток очищают колоночной хроматографией.

[00330] Экспериментальная процедура. В 50-мл одногорлой RBF соединение D (1,87 ммоль) растворяют в 60 мл DCM. К полученному раствору добавляют м-CPBA (1,31 ммоль), и полученный раствор перемешивают в течение 3 час при 0°C. Проводят контроль методом ТСХ, по завершении к реакционной смеси добавляют воду, и соединение экстрагируют с использованием хлороформа. Объединенный органический слой концентрируют в вакууме, и остаок подвергают колоночной хроматографии.1H ЯМР (CDCl3): 0,66 (с), 0,84-0,47 (м), 1,82-1,97 (м), 2,21 (м), 2,35 (м), 2,84 (м), 2,98 (м), 3,16 (т), 3,21 (м), 3,89 (ушс), 5,33 (ушс).13C ЯМР (CDCl3): 11,81, 18,68, 19,32, 21,03, 22,52, 22,78, 23,78, 24,25, 26,96, 27,97, 28,18, 31,84, 35,74, 36,15, 36,79, 37,05, 38,78, 38,91, 39,47, 39,72, 42,27, 47,18, 50,10, 52,14, 53,25, 53,29, 56,11, 56,71, 79,71, 121,90, 140,40, 171,74. Масс-ESI: 571,4 (M+Na); ИК (KBr) (ν, cм-1): 418 (сл), 668 (ср), 750 (ср), 1020 (ср), 1104 (сл), 1134 (сл), 1178 (сл), 1259 (ср), 1275 (ср), 1455 (ср), 1732 (ср), 2933 (с), 3612 (ср), 3723 (ср), 3852 (ср).
[00331] Экспериментальная процедура. В 50-мл одногорлой RBF эфир E(0,17 ммоль) растворяют в 3 мл смеси ТГФ/H2O (3:1), и раствор охлаждают на ледяной бане до 0°C. К такому охлажденному на льду раствору добавляют KOH(0,19 ммоль в 2 мл), перемешивают при RT в течение 12 час, и проводят контроль ТСХ. По завершении ТГФ выпаривают, и остаток экстрагируют с использованием хлороформа. Водный слой используют на следующей стадии.

[00332] Экспериментальная процедура. В 50-мл одногорлую RBF загружают акватированный DACH-платина (3 мл 10 мг/мл раствора). Добавляют по каплям раствор соли A (0,09 ммоль) в 10 мл воды, и полученный раствор перемешивают при комнатной температуре в течение 24 час. Выпавшее в осадок белое вещество отделяют и промывают 30 мл воды, и получают чистое соединение (G). ИК (KBr) (ν, cм-1): 415 (оч.сл.), 797 (сл), 1024 (ср), 1107 (ср), 1259 (сл), 1377 (ср), 1466 (оч.сл.), 1588 (оч.ср.), 2933 (с), 3176 (оч.сл.), 3440 (оч.сл.).195Pt ЯМР (CDCl3): -2893.
Синтез IO-148_01

Синтез промежуточного тозилсодержащего соединения IO-148_01
[00333] Экспериментальная процедура. При охлаждении льдом к раствору холестерина A (10 г, 25,883 ммоль) в CH2Cl2 (150 мл) добавляют по каплям пиридин (10,5 мл, 129,415 ммоль), и смесь перемешивают в течение 15 минут. К полученному выше раствору добавляют п-толуолсульфонилхлорид B (14,75 г, 77,649 ммоль) и перемешивают в течение 2 час в темноте. Проводят контроль ТСХ, и по завершении реакции органическую фазу промывают 0,1 N раствором HCl (5×50 мл) и водой (2×50 мл); органический слой сушат над безводным Na2SO4 и концентрируют в вакууме.
Синтез промежуточного гликоля IO-148_01

[00334] Экспериментальная процедура. К раствору тозилированного холестерина A (10 г, 18,48 ммоль) в диоксане (50 мл) добавляют этиленгликоль (35 мл), и смесь кипятят с обратным холодильником в течение 4 час. Проводят контроль ТСХ. По завершении реакционную смесь концентрируют в вакууме для удаления диоксана, затем ее экстрагируют этилацетатом, и экстракт последовательно промывают водой (3×50 мл) и рассолом (20 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме, и выполняют очистку на колонке.
Синтез промежуточного тозилсодержащего гликоля IO-148_01
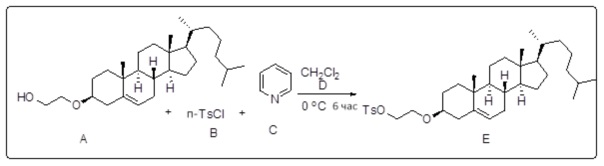
[00335] Экспериментальная процедура. При охлаждении льдом к раствору холестерилэтиленгликоля A (6 г, 13,93 ммоль) в 30 мл DCM в атмосфере азота добавляют п-толуолсульфонилхлорид B (3,25 г, 16,71 ммоль) и перемешивают в течение 15 минут. К полученному раствору добавляют пиридин (12 мл), смесь перемешивают в течение 6 час при 0°C, и проводят контроль ТСХ. По завершении реакционную смесь разбавляют CHCl3 (20 мл) и последовательно промывают насыщенным раствором CuSO4 (3×50 мл) и рассолом (20 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме.
Синтез промежуточного азида IO-148_01
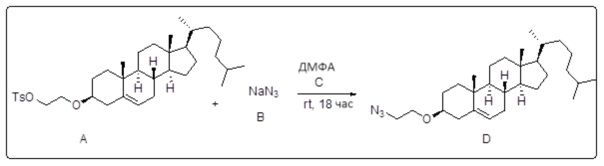
[00336] Экспериментальная процедура. К соединению A (7 г, 11,97 ммоль) в атмосфере азота добавляют 20 мл ДМФА, перемешивают в течение 30 минут для получения прозрачного раствора, и при необходимости смесь греют. К полученному раствору в один прием добавляют азид натрия B (1,5 г, 23,95 ммоль), смесь перемешивают в течение 18 час при rt, и проводят контроль ТСХ. По завершении реакцию гасят водой, и смесь экстрагируют этилацетатом. Органический слой промывают водой, и объединенный органический слой концентрируют в вакууме.
Синтез промежуточного амина IO-148_01
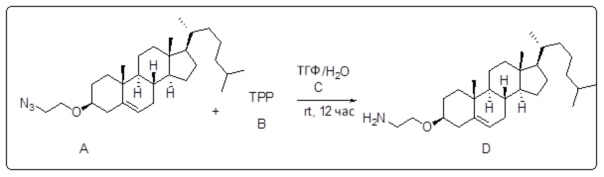
[00337] Экспериментальная процедура. К азиду A (5 г, 10,97 ммоль) в атмосфере азота добавляют сухой ТГФ (20 мл), и добавляют TPP (5,74 г, 21,94 ммоль). Реакционную смесь перемешивают в течение 6 час. Затем к реакционной смеси добавляют 2 мл воды, и реакционную смесь выдерживают при той же температуре в течение ночи. Проводят контроль ТСХ, и по завершении реакционную смесь концентрируют в вакууме и непосредственно загружают в колонку.
Синтез N-моноалкильного промежуточного соединения IO-148_01
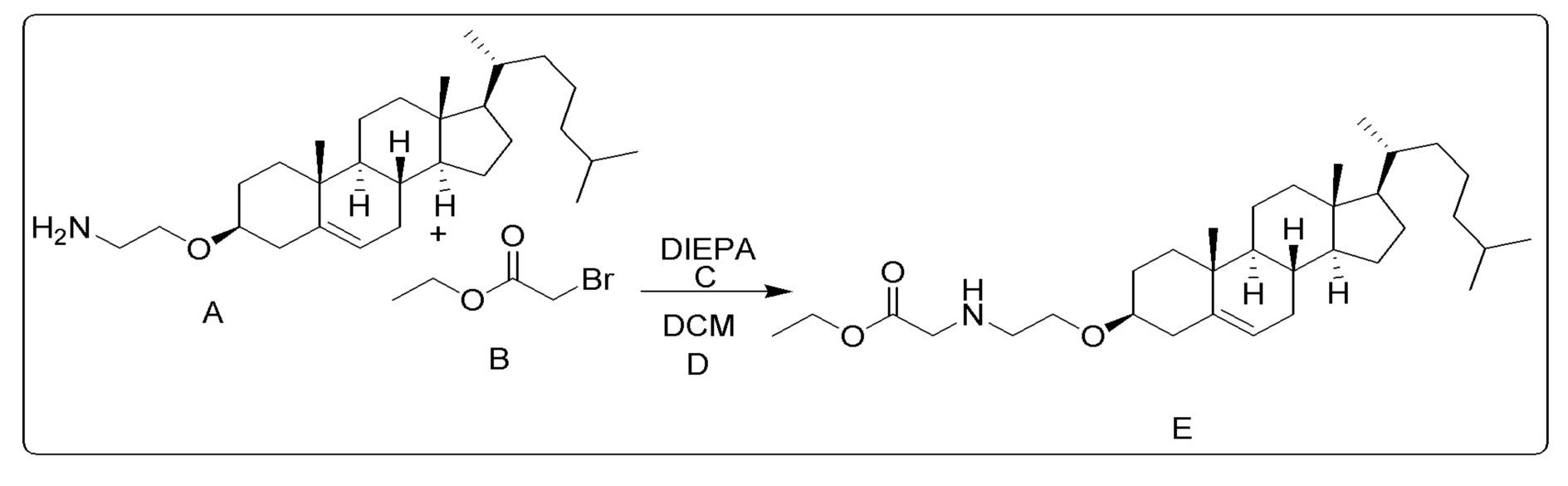
[00338] Экспериментальная процедура. В 50-мл одногорлой колбе R.B в атмосфере азота при 0°C амин A (200 мг, 0,465 ммоль) растворяют в безводном DCM (40 мл). К полученному раствору при охлаждении добавляют по каплям DIEPA (0,06 мл, 0,372 ммоль), и смесь перемешивают при той же температуре в течение 20 минут. К полученной выше смеси по каплям, в течение 1 часа, добавляют раствор этилбромацетата (0,03 мл, 0,279 ммоль) в 10 мл DCM. Реакцию контролируют с использованием ТСХ. По завершении реакционную смесь непосредственно концентрируют в вакууме и подвергают колоночной хроматографии.
Синтез N-оксида промежуточного соединения IO-148_01
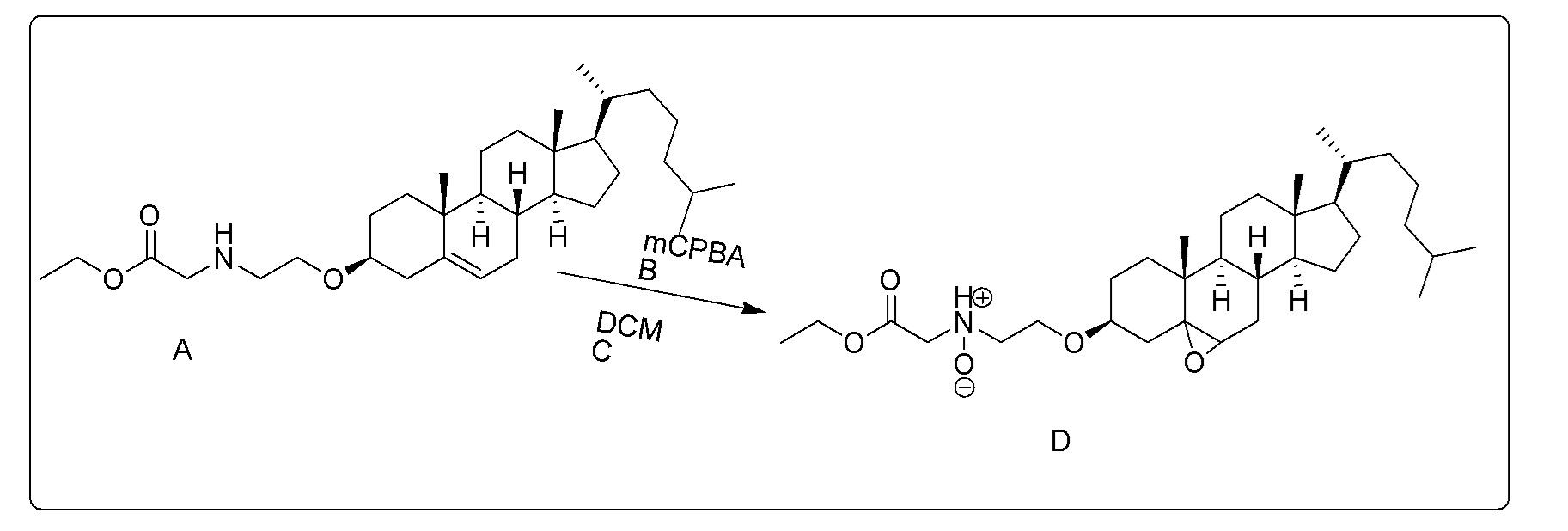
[00339] Экспериментальная процедура. В 50-мл одногорлой колбе R.B в атмосфере азота при 0°C эфир A (100 мг, 0,193 ммоль) растворяют в безводном CH2Cl2 (10 мл). К полученному раствору при охлаждении добавляют по каплям раствор м-CPBA (16,72 мг, 0,135 ммоль) в DCM (2 мл), и смесь перемешивают при той же температуре в течение 2 час. Реакцию контролируют с использованием ТСХ. По завершении реакцию гасят NaHCO3, смесь экстрагируют CHCl3, экстракт сушат над безводным сульфатом натрия, концентрируют, и остаток непосредственно подвергают колоночной хроматографии.
Синтез лиганда IO-148_01

[00340] Экспериментальная процедура. В 50-мл одногорлой колбе R.B N-оксид промежуточного соединения A (100 мг, 0,188 ммоль) растворяют в (безводной) смеси ТГФ/H2O (4 мл) при 0°C. К полученному раствору при охлаждении добавляют LiOH.H2O (8 мг, 0,188 ммоль), и смесь перемешивают при той же температуре в течение 1 часа. Реакцию контролируют с использованием ТСХ. По завершении реакционную смесь концентрируют в вакууме для удаления ТГФ. Остаток разбавляют водой (10 мл) и промывают DCM и этилацетатом.
Синтез IO-148_01
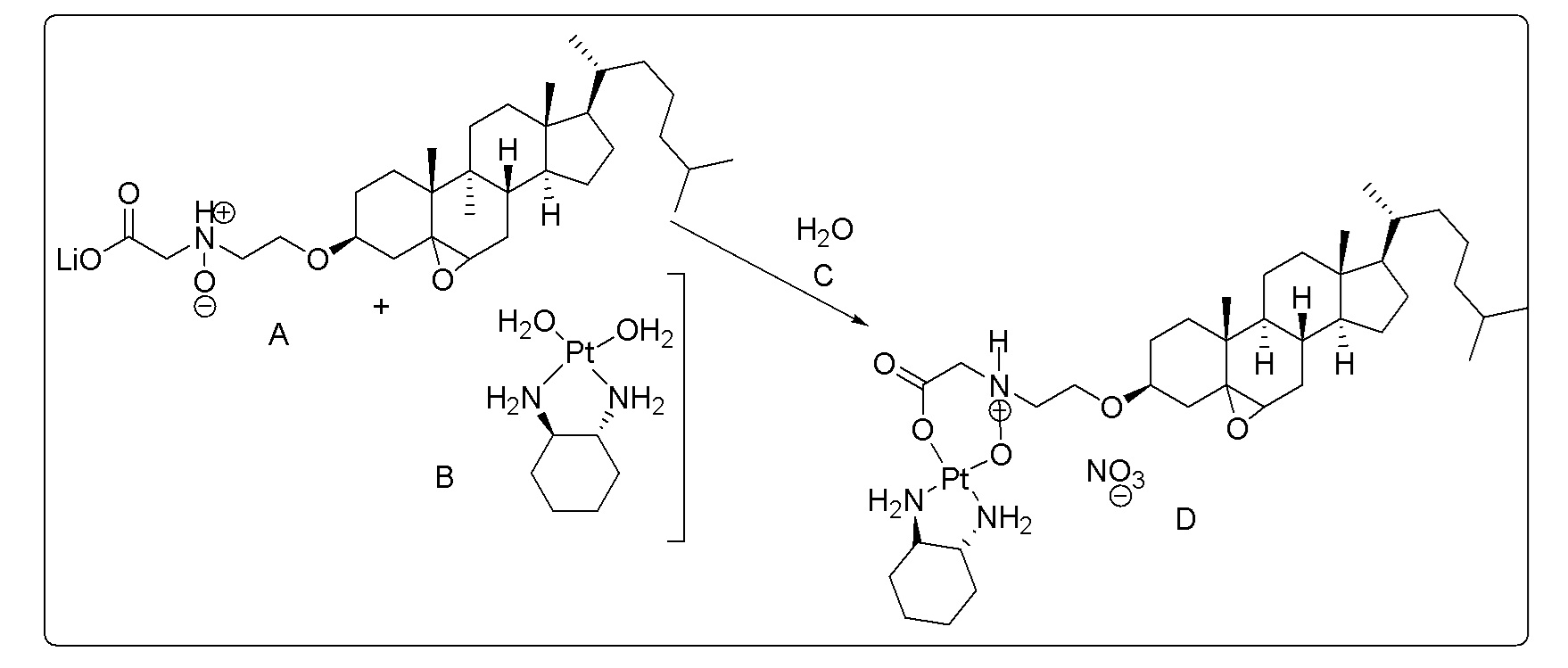
[00341] Экспериментальная процедура. В 50-мл одногорлую RBF загружают акватированный DACH-платина (70 мг, 0,188 ммоль, 10 мг/мл раствор). К полученному выше раствору добавляют по каплям раствор лиганда A (100 мг, 0,188 ммоль) в 10 мл воды. Полученный раствор перемешивают в течение 3 час при комнатной температуре. По завершении растворения реакционную смесь центрифугируют для отделения выпавшего в осадок вещества. Выпавшее в осадок вещество дважды промывают водой (10 мл) и лиофилизуют, и получают IO-148_01. ESIMS m/z=827,4.
Синтез IO-148_02
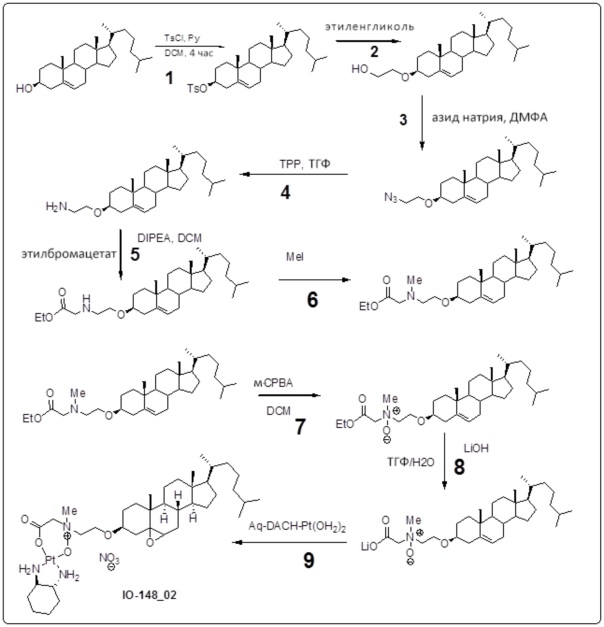
[00342] Стадии 1-5 схожи с получением IO-148_01.
[00343] Стадия 6. Синтез N-метилпромежуточного соединения IO-148_02

[00344] Экспериментальная процедура. В 50-мл одногорлой колбе R.B в атмосфере азота при 0°C эфир A (1 г, 1,93 ммоль) растворяют в ацетонитриле. К полученному выше раствору добавляют метилиодид (273 мг, 1,93 ммоль). Реакцию контролируют с использованием ТСХ. По завершении реакционную смесь непосредственно концентрируют в вакууме и подвергают колоночной хроматографии.
[00345] Стадия 7. Синтез N-оксида промежуточного соединения IO-148_02
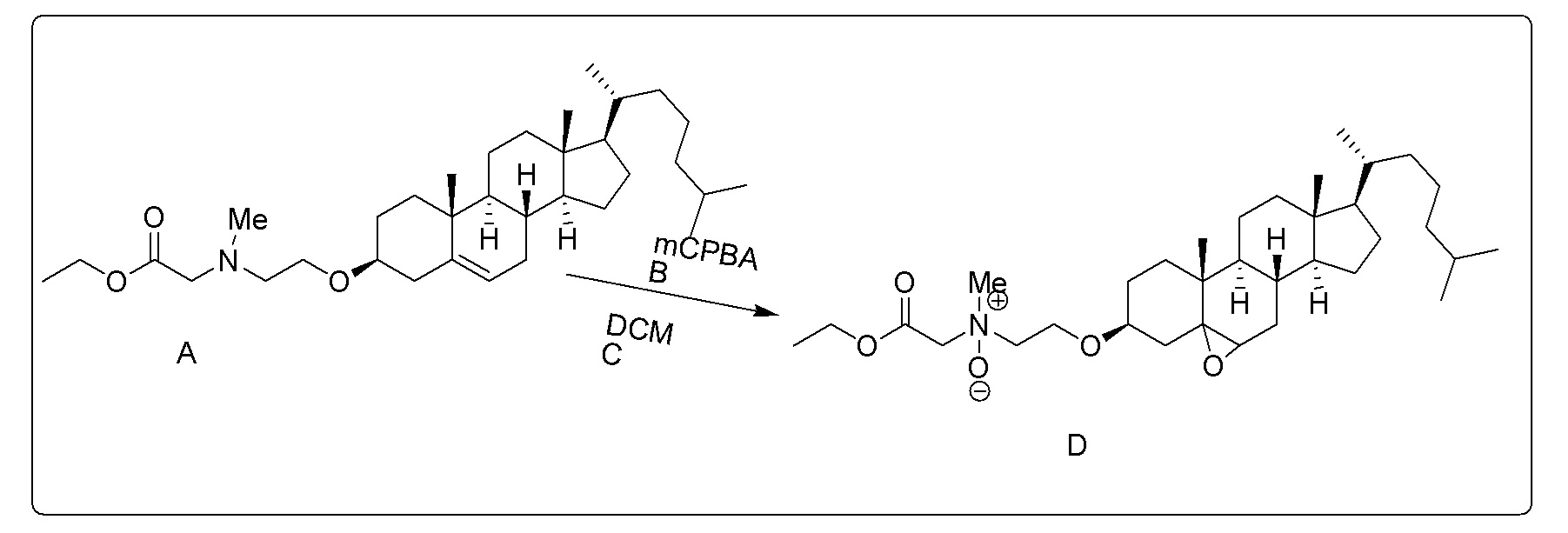
[00346] Экспериментальная процедура. В 50-мл одногорлой колбе R.B в атмосфере азота при 0°C эфир A (100 мг, 0,193 ммоль) растворяют в безводном CH2Cl2 (10 мл). К полученному раствору при охлаждении добавляют по каплям раствор м-CPBA (16,72 мг, 0,135 ммоль) в DCM (2 мл), и смесь перемешивают при той же температуре в течение 2 час. Реакцию контролируют с использованием ТСХ. По завершении реакцию гасят NaHCO3, смесь экстрагируют CHCl3, экстракт сушат над безводным сульфатом натрия, концентрируют и непосредственно подвергают колоночной хроматографии.
[00347] Стадия 8. Синтез конечного лиганда IO-148_02

[00348] Экспериментальная процедура. В 50-мл одногорлой колбе R.B N-оксид промежуточного соединения A (100 мг, 0,188 ммоль) растворяют в смеси безводный ТГФ/H2O (4 мл) при 0°C. К полученному раствору при охлаждении добавляют LiOH.H2O (8 мг, 0,188 ммоль), и смесь перемешивают при той же температуре в течение 1 часа. Реакцию контролируют с использованием ТСХ. По завершении реакции смесь концентрируют в вакууме для удаления ТГФ. Остаток разбавляют водой (10 мл) и промывают DCM и этилацетатом.
[00349] Стадия 9. Синтез IO-148_02
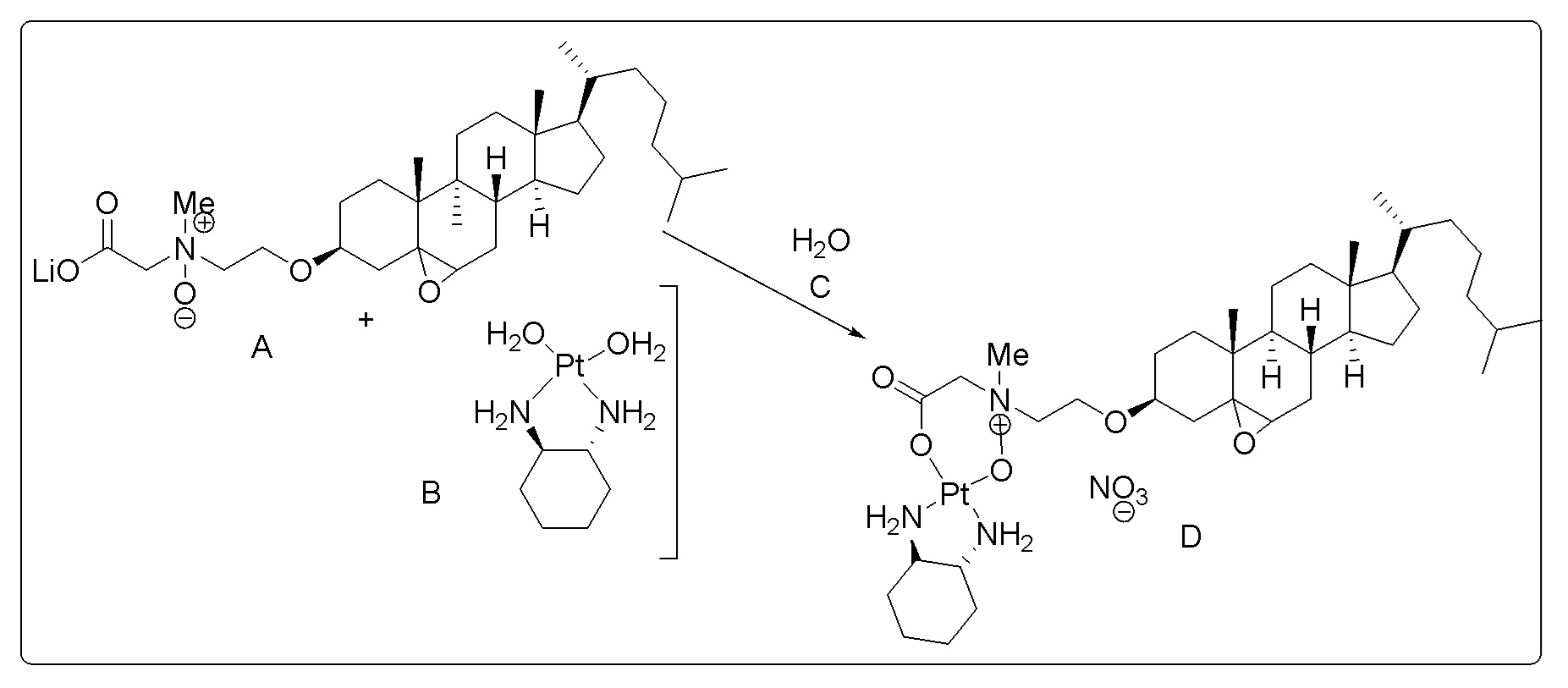
[00350] Экспериментальная процедура. В 50-мл одногорлую RBF загружают акватированный DACH-платина (70 мг, 0,188 ммоль, 10 мг/мл раствор). К полученному выше раствору добавляют по каплям раствор лиганда A (100 мг, 0,188 ммоль) в 10 мл воды. Полученный раствор перемешивают в течение 3 час при комнатной температуре. По завершении перемешивания реакционную смесь центрифугируют для отделения выпавшего в осадок вещества. Выпавшее в осадок вещество дважды промывают водой (10 мл) и лиофилизуют, и получают IO-148_01.
Синтез IO-183_01

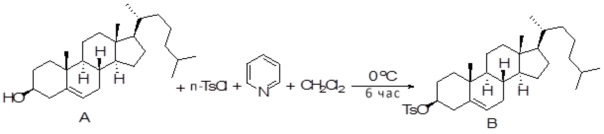
[00351] Экспериментальная процедура. При охлаждении льдом к раствору холестерина A (5 г, 12,93 ммоль) в CH2Cl2 (35 мл) добавляюют пиридин (5,22 мл) и перемешивают в течение 15 минут. К полученному раствору добавляют п-толуолсульфонилхлорид B (6,15 г, 32,31 ммоль), смесь перемешивают в течение 6 час при 0 oC, и проводят контроль ТСХ. По завершении этого реакционную смесь разбавляют CHCl3 (20 мл) и последовательно промывают 1N HCl (3×50 мл) и рассолом (20 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Все соединение используют в следующей реакции без очистки.
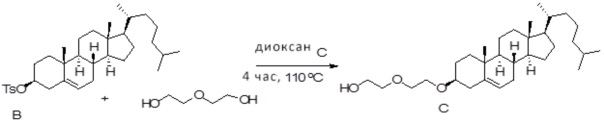
[00352] Экспериментальная процедура. К раствору тозилированного холестерина A (10 г, 18,49 ммоль) в диоксане (30 мл) добавляют диэтиленгликоль (10 мл), и смесь кипятят с обратным холодильником в течение 4 час. Проводят контроль методом ТСХ. По завершении этого реакционную смесь экстрагируют, и экстракт последовательно промывают водой (3×50 мл) и рассолом (20 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме, и выполняют очистку на колонке. (Выход 38%).

[00353] Экспериментальная процедура. В 100-мл одногорлой RBF в атмосфере азота NaH (594 мг) растворяют в ТГФ (10 мл). Реакционную смесь охлаждают на ледяной бане до 0°C, и к смеси постепенно добавляют раствор C (2,35 г, 4,95 ммоль) в ТГФ (15 мл). Полученный раствор перемешивают в течение 1 часа, постепенно добавляют этилбромацетат, смесь перемешивают в течение 6 час при комнатной температуре, и проводят контроль методом ТСХ. По завершении этого реакционную смесь охлаждают до 0°C, реакцию гасят водой, и смесь экстрагируют этилацетатом. Органический слой промывают водой и рассолом, сушат над Na2SO4 и концентрируют, и соединение очищают колоночной хроматографией. (Выход 46%). 1H ЯМР (CDCl3): 0,66 (с), 0,81-2,41 (м), 3,2 (ушс), 3,6-3,8 (м), 4,36 (с), 5,33 (с). 13C ЯМР (CDCl3): 11,83, 18,68, 19,34, 21,03, 22,53, 22,39, 23,79, 24,26, 27,58, 28,21, 29,67, 31,84, 31,91, 35,35, 36,15, 36,82, 37,15, 38,89, 39,68, 39,75, 42,28, 50,12, 56,11, 56,73, 67,01, 68,76, 70,11, 70,95, 71,41, 79,64, 121,67, 140,74, 172,69.
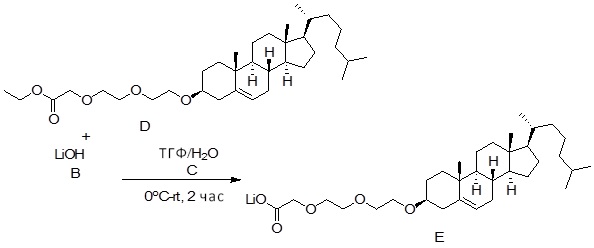
[00354] Экспериментальная процедура. В 100-мл одногорлой RBF эфир D (0,15 g, 0,28 ммоль) растворяют в 2 мл смеси ТГФ/H2O (3:1), и раствор охлаждают на ледяной бане до °C. К такому охлажденному раствору добавляют LiOH (12 мг, 0,28 ммоль), смесь перемешивают при rt в течение 2 час, и проводят контроль ТСХ. По завершении реации ТГФ удаляют на роторном испарителе. К реакционной смеси добавляют хлороформ. Соединение экстрагируют водой. Затем после обработки на роторном испарителе всю реакционную смесь используют в следующей реакции.

[00355] Экспериментальная процедура. В 50-мл одногорлой RBF DACH-платина (78 мг, 0,139 ммоль) растворяют в 5 мл воды для ВЭЖХ. К полученному выше раствору добавляют нитрат серебра (47 мг, 0,278 ммоль). Полученный раствор перемешивают при rt, защищая от света. Через 24 часа выпавший в осадок AgI отфильтровывают. Фильтрат используют на следующей стадии.

[00356] Экспериментальная процедура. В 100-мл одногорлой RBF соль E (150 мг, 0,263 ммоль) растворяют в 40 мл воды для ВЭЖХ, полученный раствор перемешивают в течение 5 мин при комнатной температуре, к этому раствору добавляют DACH(OH2)2-платина B, и смесь перемешивают при rt, защищая от света, в течение 24 час. Выпавшее в осадок вещество отфильтровывают на бумажном фильтре и совместно промывают водой для ВЭЖХ, метанолом для ВЭЖХ и ацетоном для ВЭЖХ и сушат. (Выход 45%). ESIMS m/z=1395,7 [M + Na]+ для C72H124N2O10P. 1H ЯМР: (500 МГц, CDCl3): 5,96 (ушс), 5,32 (с), 4,96 (ушс), 3,92 (к), 3,61 (с), 3,15 (м), 2,57 (м), 2,37 (м), 2,21 (т), 1,91 (м), 1,48 (м), 1,32 (м), 1,24 (м), 1,11 (м), 0,98 (с), 0,90 (д), 0,85 (дд), 0,66 (с) м.д. 13C ЯМР (500 МГц, CDCl3): 177,22, 140,86, 121,56, 79,58, 70,70, 70,37, 70,31, 70,07, 67,26, 62,24, 56,75, 56,17, 50,15, 42,30, 39,77, 39,50, 39,08, 37,23, 36,85, 36,18, 35,79, 32,04, 31,94, 31,88, 28,36, 28,22, 27,98, 24,62, 24,28, 23,85, 22,79, 22,54, 21,06, 19,38, 18,71, 11,85 м.д. ИК: 418 (сл), 668 (уш, с), 749 (ср), 1110 (с), 1260 (с), 1640 (с), 2064 (сл), 2933 (ср), 3446 (уш, с).
Синтез IO-183_02
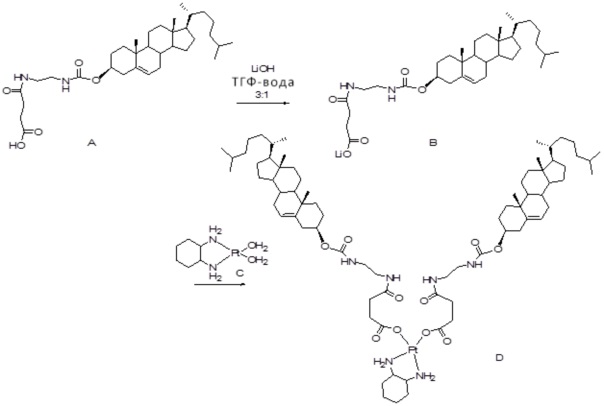
[00357] Стадия 1

[00358] Экспериментальная процедура. Соединение A (полученное процедурой согласно реф. PNAS; 109, 2012; 11294) (200 мг, 0,349 ммоль) растворяют в смеси 2,5 мл ТГФ и 0,8 мл воды. К раствору добавляют 16 мг of LiOH и перемешивают в течение 24 час при RT. Образуется белая суспензия. ТГФ упаривают в вак., и добавляют 40 мл воды для растворения белого остатка. Водный раствор промывают хлороформом. Водный слой используют на следующей стадии.
[00359] Стадия 2
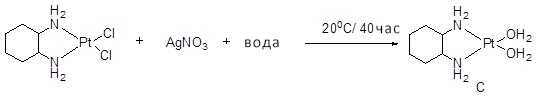
[00360] Экспериментальная процедура. В 25-мл RB загружают 0,17 ммоль дихлорида циклогексилдиаминплатины, 0,34 ммоль нитрата серебра и 7 мл воды, и смесь перемешивают в течение 48 час при комантной темп. Раствор центрифугируют (4000 об/мин; 10 мин), и белый осадок отфильтровывают с помощью шприца с фильтром (25 мм/ 0,20 мкм) и промывают 2 мл водыe. Фильтрат используют в следующей реакции.
[00361] Стадия 3

[00362] Экспериментальная процедура. Раствор соединения B (0,26 ммоль) в 20 мл воды добавляют по каплям к C (0,13 ммоль) в воде (10 мл). Реакция продолжается при комнатной температуре в течение 20 час. Белое выпавшее в осадок вещество отделяют фильтрацией. Осадок промывают водой (10 мл), и получают D в виде белого порошка.1H ЯМР (CDCl3+CD3OD): 0,66 (с), 0,84-2,5 (ушм), 3,32 (ушд), 4,45 (ушс), 5,34 (ушс).13C (CDCl3+CD3OD) ЯМР: 11,68, 18,53, 19,15, 20,89, 22,36, 22,62, 23,7, 24,12, 24,32, 27,84, 28,02, 29,53, 35,65, 36,03, 36,41, 38,36, 38,42, 39,27, 39,36, 39,58, 40,27, 42,16, 49,56, 49,88, 56,02, 56,55, 62,44, 74,46, 122,42, 139,63, 156,91, 174,20, 180,89. ESIMS: 1475,4 (M+Na); ИК: 418 (ср), 584 (ср), 799 (с), 1027 (ср), 1260 (с), 1454 (ср), 1535 (с), 1643 (с), 1700 (уш, с), 2928 (с), 3418 (уш, с).
Синтез IO-147_02
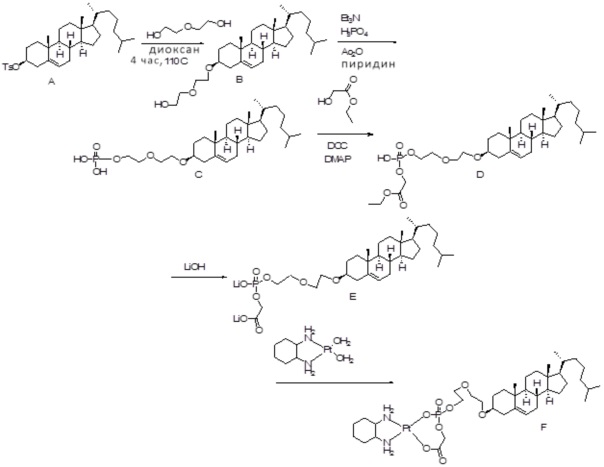
Синтез IO-147_02
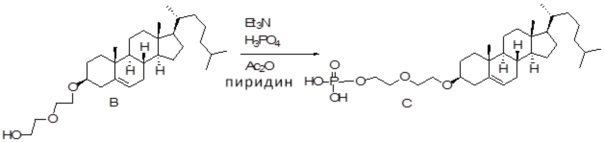
[00363] Экспериментальная процедура. В круглодонную колбу (RBF) загружают соединение B (синтез описан при получении соединения IO-183_01) (1 ммоль), фосфорную кислоту (1 ммоль), пиридин (5 ммоль) и триэтиламин (2 ммоль), и смесь перемешивают до тех пор, пока не образуется прозрачный раствор. Добавляют по каплям уксусный ангидрид (2 ммоль), и реакционную смесь перемешивают в течение 3 час при 80°C. Смесь охлаждают до комнатной температуры, и добавляют воду. Соединение экстрагируют диэтиловым эфиром, экстракт концентрируют в вакууме, и получают соединение C. Остальные реакции для получения F схожи с описанными для синтеза IO-180_01.
Синтез IO-173_01
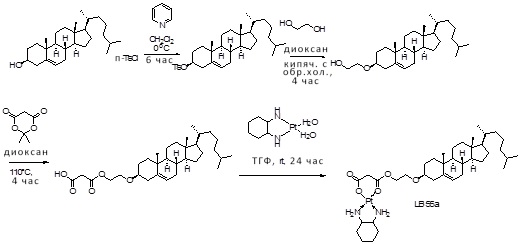
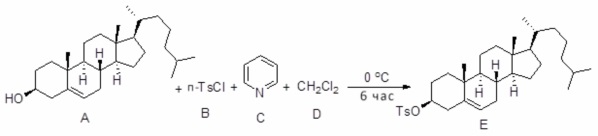
[00364] Экспериментальная процедура. При охлаждении льдом к раствору холестерина A (5 г, 12,93 ммоль) в CH2Cl2 (35 мл) добавляют пиридин (5,22 мл) и перемешивают в течение 15 минут. К полученному раствору добавляют п-толуолсульфонилхлорид B (6,15 г, 32,31 ммоль), смесь пеермешивают в течение 6 час при 0°C, и проводят контроль ТСХ. По завершении этого реакционную смесь разбавляют CHCl3 (2, 0 мл) и последовательно промывают 1 N HCl (3×50 мл) и рассолом (20 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Все соединение используют в следующей реакции без очистки.
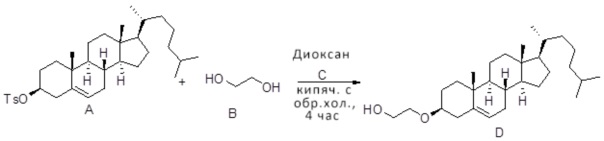
[00365] Экспериментальная процедура. К раствору тозилированного холестерина A (10 г, 0,018 mol) в диоксане (25 мл) добавляют этиленгликоль (15 мл), и смесь кипятят с обратным холодильником в течение 4 час. Проводят контроль ТСХ. По завершении этого реакционную смесь экстрагируют этилацетатом, и экстракт последовательно промывают водой (3×50 мл) и рассолом (20 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме, и остаток очищают хроматографией на силикагеле. (Выход=37%).
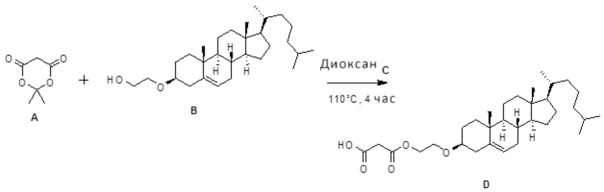
[00366] Экспериментальная процедура. Смесь соединения B (1829 мг, 4,25 ммоль) и кислоты Мельдрума A (612 мг, 4,25 ммоль) в безводном 1,4-диоксане (40 мл) греют при 110°C в течение 4 час. После охлаждения до комнатной температуры реакционную смесь обрабатывают этилацетатом и водой. Органический экстракт сушат над Na2SO4 и концентрируют с использованием роторного испарителя, и остаток очищают хроматографией на силикагеле. (Выход=26%).1H ЯМР (500 МГц, CDCl3): 5,33 (с), 4,26 (с), 3,68 (с), 3,42 (с), 3,17 (с), 2,32 (д), 2,17 (с), 1,99 (м), 1,86 (м), 1,48 (м), 1,33 (м), 1,24 (м), 1,11 (м), 0,98 (м), 0,90 (м), 0,85 (м), 0,66 (с) м.д.13C ЯМР (500 МГц, CDCl3): 169,85, 167,25, 140,57, 121,84, 79,70, 65,43, 65,27, 56,73, 56,13, 50,13, 42,29, 40,48, 39,74, 39,49, 38,86, 37,13, 36,80, 36,16, 35,76, 31,91, 31,85, 29,67, 28,21, 27,98, 24,26, 23,80, 22,79, 22,54, 21,04, 19,33, 18,89, 11,84 м.д.
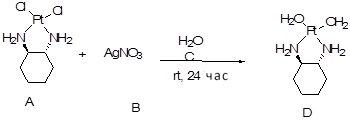
[00367] Экспериментальная процедура. В 50-мл одногорлой RBF DACH-платина A (100 мг, 0,263 ммоль) растворяют в 10 мл воды для ВЭЖХ. К полученному выше раствору добавляют нитрат серебра (89 мг, 0,526 ммоль). Полученный раствор перемешивают при rt, защищая от света. Через 24 часа выпавший в осадок AgI отфильтровывают. Фильтрат используют на следующей стадии.
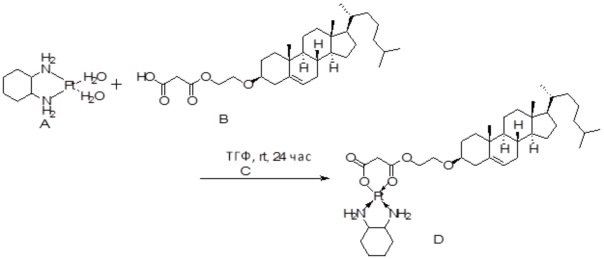
[00368] Экспериментальная процедура. В 50-мл одногорлой RBF кислоту B (136 мг, 0,263 ммоль) растворяют в 15 мл сухого ТГФ. К полученному выше раствору добавляют по каплям, защищая от света, DACH(OH2)2-платина A (95 мг, 0,263 ммоль), и смесь перемешивают в течение 24 час. Затем выпаривают весь ТГФ. Выпавшее в осадок вещество отфильтровывают, водную часть лиофилизуют. ESIMS (M 824)
Синтез IO-173_03

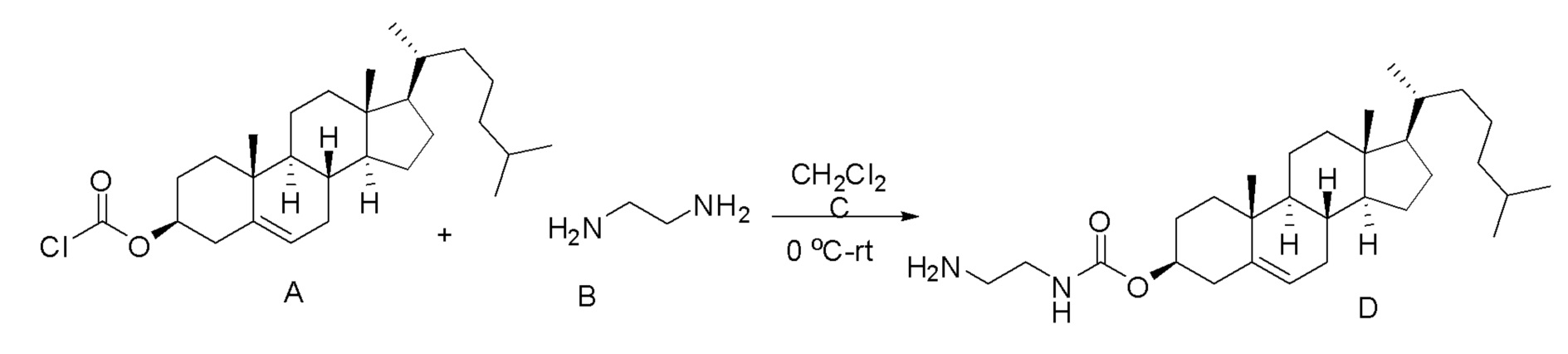
[00369] Экспериментальная процедура. При охлаждении льдом к раствору этилендиамина B (22,2 мл) в 40 мл DCM добавляют по каплям раствор соединения A (5 г) в DCM (50 мл) в течение 45 мин, и смесь перемешивают при той же температуре в течение 1 часа и еще при rt в течение 20 час. Проводят контроль ТСХ, и после этого гасят реакцию водой (4×100 мл), органический слой экстрагируют DCM (2×50 мл), сушат над безводным Na2SO4 и концентрируют в вакууме, и остаток очищают хроматографией на силикагеле. Выход 90%.

[00370] Экспериментальная процедура. Смесь соединения А (2,74 г, 5,8 ммоль) и кислоты Мельдрума A (661 мг, 5,8 ммоль) в безводным 1,4-диоксане (20 мл) греют при 110°C в течение 4 час. После охлаждения до комнатной температуры реакционную смесь обрабатывают этилацетатом и водой. Органический экстракт сушат над Na2SO4 и концентрируют с использованием роторного испарителя. Остаток очищают колоночной хроматографией на силикагеле. Выход 50%.
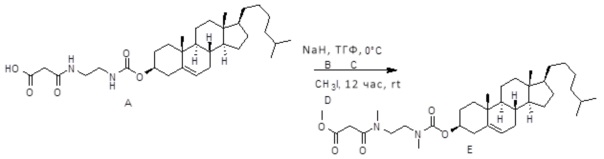
[00371] Экспериментальная процедура. В 50-мл одногорлой R.B в атмосфере азота гидрид натрия (620 мг, 15,516 ммоль) растворяют в ТГФ (5 мл). Реакционную смесь охлаждают на ледяной бане до 0°C, к реакционной смеси добавляют по каплям в течение 10 минут раствор холестерина A (2,82 г, 5,172 ммоль) в ТГФ (10 мл), и перемешивают раствор в течение 30 мин. К полученному раствору постепенно добавляют метилиодид (2,42 г, 15,516 ммоль), смесь перемешивают в течение 6 час при комнатной температуре, и проводят контроль ТСХ. По завершении этого реакционную смесь охлаждают до 0°C, гасят водой, смесь экстрагируют этилацетатом, экстракт сушат над безводным Na2SO4, концентрируют, остаток очищают хроматографией на силикагеле, и получают эфир Е с выходом 40%.
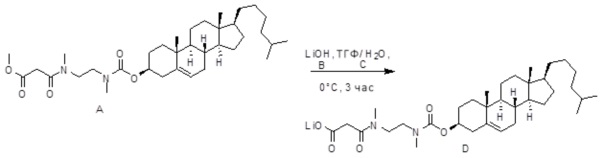
[00372] Экспериментальная процедура. В 50-мл одногорлой RBF эфир A (0,154 г, 0,263 ммоль) растворяют в 2 мл смеси ТГФ/H2O (3:1), и раствор охлаждают на ледяной бане до 0°C. К такому охлажденному раствору добавляют LiOH B (11 мг, 0,263 ммоль), смесь перемешивают при rt в течение 3 час, и проводят контроль ТСХ. По завершении реакции ТГФ удаляют на роторном испарителе. К реакционной смеси добавляют хлороформ. Соединение экстрагируют водой. Затем после обработки на роторном испарителе всю реакционную смесь используют в последующей реакции.
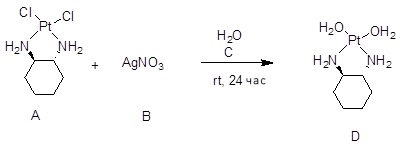
[00373] Экспериментальная процедура. В 50-мл одногорлой RBF DACH-платина A (100 мг, 0,263 ммоль) растворяют в 10 мл воды для ВЭЖХ. К полученному выше раствору добавляют нитрат серебра (88 мг, 0,526 ммоль). Полученный раствор перемешивают при rt, защищая от света. Через 24 часа выпавший в осадок AgCl отфильтровывают. Фильтрат используют на следующей стадии.
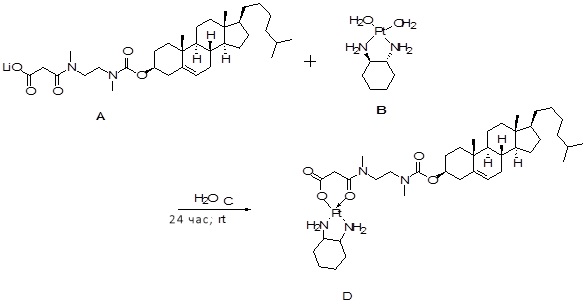
[00374] Экспериментальная процедура. В 100-мл одногорлой RBF кислоту A (154 мг, 0,263 ммоль) растворяют в 20 мл воды для ВЭЖХ, полученный раствор перемешивают в течение 5 мин при комнатной температуре, к раствору добавляют DACH(OH2)2-платина B, и раствор перемешивают при rt, защищая от света, в течение 24 час. Выпавшее в осадок вещество отфильтровывают на бумажном фильтре и совместно промывают водой для ВЭЖХ, метанолом для ВЭЖХ и ацетоном для ВЭЖХ и сушат. (Выход 47%).
Синтез IO-176_01
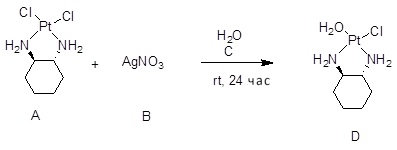
[00375] Экспериментальная процедура. В 50-мл одногорлой RBF DACH-платина A (100 мг, 0,263 ммоль) растворяют 20 мл воды для ВЭЖХ. К полученному выше раствору добавляют нитрат серебра (44 мг, 0,263 ммоль). Полученный раствор перемешивают при rt, защищая от света. Через 24 часа выпавший в осадок AgCl отфильтровывают. Фильтрат используют на следующей стадии.

[00376] Экспериментальная процедура. В 100-мл одногорлой RBF кислоту A (такой же лиганд, как LB 55c) (154 мг, 0,263 ммоль) растворяют в 20 мл воды для ВЭЖХ, полученный раствор перемешивают в течение 5 мин при комнатной температуре, к раствору добавляют DACH(OH2)2-платина B (0,263 ммоль), и раствор перемешивают при rt, защищая от света, в течение 24 час. Выпавшее в осадок вещество отфильтровывают на бумажном фильтре и совместно промывают водой для ВЭЖХ, метанолом для ВЭЖХ и ацетоном для ВЭЖХ и сушат. (Выход 40%).
Синтез IO-179_01

[00377] Стадия-1

[00378] Экспериментальная процедура. В 50-мл одногорлой RBF аминометилфосфиновую кислоту A (0,77 ммоль) смешивают с 2 мл сухого пиридина. К смеси добавляют холестерин (0,77 ммоль) и DMAP (0,77 ммоль), и полученный раствор перемешивают в течение 16 час при RT. Полученный раствор подкисляют разбавленной серной кислотой, и соединение С экстрагируют путем промывки хлороформом.
[00379] Стадия-2

[00380] Экспериментальная процедура. В 25-мл одногорлой RBF C (0,13 ммоль) растворяют в 1 мл ТГФ. К полученному раствору при 0°C добавляют KOH (0,26 ммоль) в 1 мл воды. Образуется ppt (преципитат) промежуточного соединения. Добавляют 2 мл воды для растворения ppt, и полученный раствор перемешивают в течение 2 час при RT. Реакционную смесь промывают хлороформом, и водный слой используют на следующей стадии.
[00381] Стадия 3

[00382] Экспериментальная процедура. В 50-мл одногорлой RBF E (0,13 ммоль) растворяют в 5 мл воды. При RT добавляют D (0,13 ммоль) в 15 мл воды, и полученный раствор перемешивают в течение 24 час при RT. Во время реакции образуется белый осадок. Реакционную смесь центрифугируют, осадок промывают водой и затем лиофилизуют, и получают F в виде белого порошка.
Синтез IO-179_02
[00383] Стадия-1
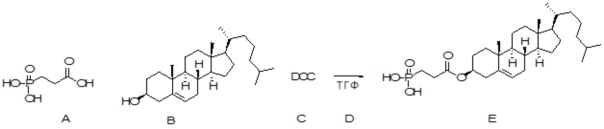
[00384] Экспериментальная процедура. В 50-мл одногорлой RBF фосфопропионовую кислоту A (0,77 ммоль, 119 мг) растворяют в 5 мл сухого ТГФ. При 0°C добавляют холестерин (200 мг, 0,52 ммоль) и DCC (160 мг, 0,77 ммоль), и полученный раствор перемешивают в течение 16 час при RT. Во время реакции образуется белый осадок. Белый ppt отделяют фильтрацией и промывают 5 мл ТГФ. Растворитель выпаривают, остаток промывают гексаном, и получают продукт реакции в виде 150 мг белого порошка.1H ЯМР (CDCl3): 0,67-2,66 (м), 4,22 (с), 5,36 (с), 8,18 (ушс).13C ЯМР(CDCl3): 11,83, 18,74, 19,23, 21,04, 22,55, 22,81, 23,97, 24,28, 24,71, 27,43, 28,00, 28,24, 29,84, 31,82, 31,94, 33,32, 35,85, 36,21, 36,39, 36,96, 39,49, 39,73, 40,13, 42,31, 49,96, 56,23, 56,67, 122,88, 139,48, 176,78 (д). ESIMS(-ve тип): 521,3(M-H).
[00385] Стадия-2

[00386] Экспериментальная процедура. В 25-мл одногорлой RBF растворяют A (69 мг, 0,13 ммоль) в 1 мл ТГФ. При 0°C добавляют B (15 мг, 0,26 ммоль) в 1 мл воды. Образуется ррt промежуточного соединения. Добавляют 2 мл воды для растворения ppt, и полученный раствор перемешивают в течение 2 час при RT. Реакционную смесь промывают хлороформом, и водный слой используют на следующей стадии.
[00387] Стадия 3
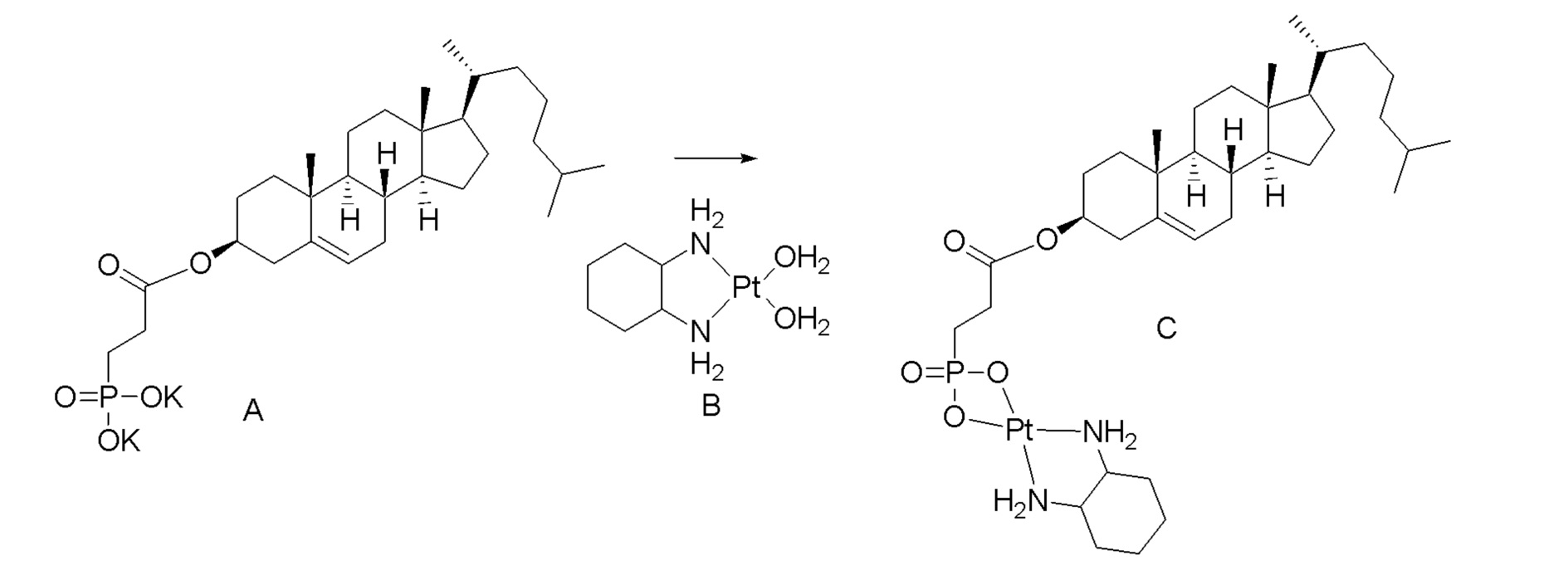
[00388] Экспериментальная процедура. В 100-мл одногорлой RBF растворяют B (0,13 ммоль) в 5 мл воды. При RT добавляют A (0,13 ммоль) в 15 мл воды, полученный раствор перемешивают в течение 2 час при RT. Во время реакции образуется белый осадок. Реакционную смесь центрифугируют, осадок промывают водой и затем лиофилизуют, и получают 50 мг белого порошка.
Синтез IO-179_03
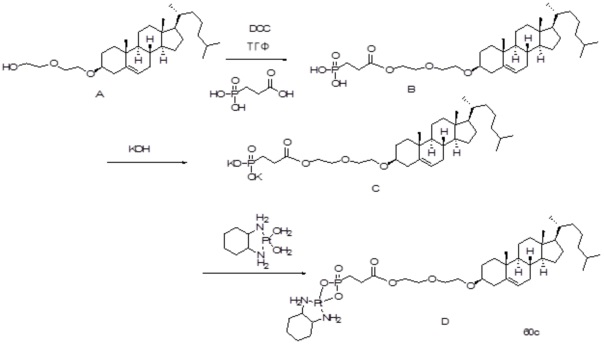
[00389] Экспериментальная процедура. Соединение A получают согласно процедуре, описанной при получении IO-183_01. Все последующие стадии выполняют согласно получению IO-179_02.
Синтез IO-180_01


[00390] Экспериментальная процедура. В 50-мл одногорлой RBF A (такое же соединение, как продукт со стадии 1 60b) (1 ммоль) растворяют в 25 мл сухого ТГФ. При 0°C добавляют этилгликолят (1 ммоль), DCC (1 ммоль) и DMAP (0,1 ммоль), и полученный раствор перемешивают в течение 16 час при RT. Соединение, выделенное в виде пасты, отверждают колоночной хроматографией на силикагеле.

[00391] Экспериментальная процедура. В 25-мл одногорлой RBF B (0,13 ммоль) растворяют в 3 мл ТГФ. При 0°C добавляют LiOH (0,26 ммоль) в 1 мл воды. Реакционную смесь перемешивают в течение 4 час при RT. Реакционную смесь промывают хлороформом, и водный слой используют на следующей стадии.
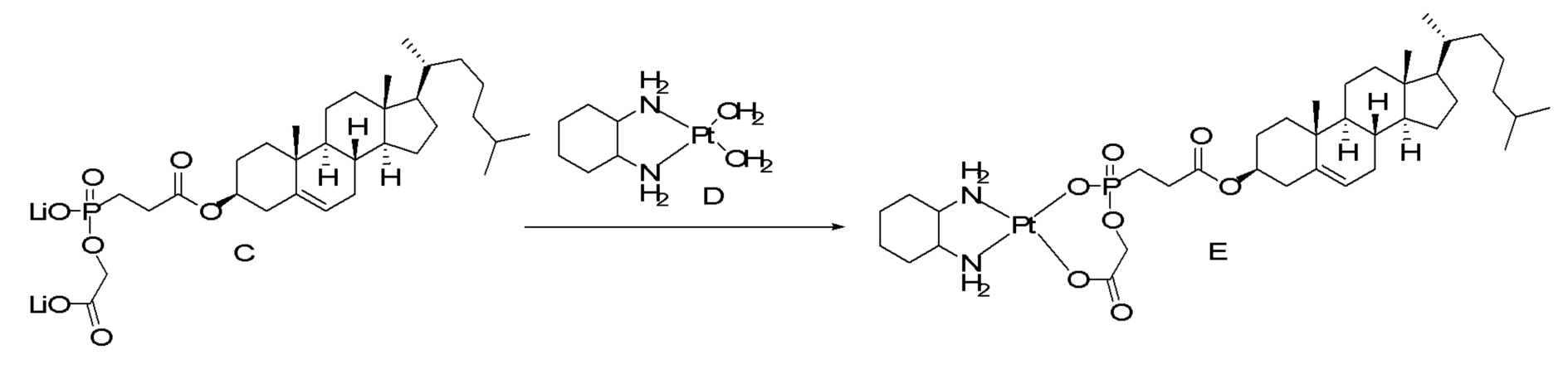
[00392] Экспериментальная процедура. В 100-мл одногорлой RBF D (0,13 ммоль) растворяют в 5 мл воды. При RT добавляют по каплям раствор C (0,13 ммоль) в 15 мл воды, и полученный раствор перемешивают в течение 20 час при RT. Во время реакции выпадает белый осадок. Реакционную смесь центрифугируют, осадок промывают водой и затем лиофилизуют, и получают Е в виде белого порошка.
Синтез IO-180_02

[00393] Экспериментальная процедура. В 50-мл одногорлой RBF A (такое же соединение, как продукт со стадии 1 60а) (1 ммоль) растворяют в 25 мл сухого ТГФ. При 0°C добавляют этилгликолят (1 ммоль), DCC (1 ммоль) и DMAP (0,1 ммоль), и полученный раствор перемешивают в течение 16 час при RT. Соединение, выделенное в виде пасты, отверждают колоночной хроматографией на силикагеле.

[00394] Экспериментальная процедура. В 25-мл одногорлой RBF B (0,13 ммоль) растворяют в 3 мл ТГФ. При 0°C добавляют LiOH (0,26 ммоль) в 1 мл воды. Реакционную смесь перемешивают в течение 4 час при RT. Реакционную смесь промывают хлороформом, и водный слой используют на следующей стадии.

[00395] Экспериментальная процедура. В 100-мл одногорлой RBF D (0,13 ммоль) растворяют в 5 мл воды. При RT добавляют C (0,13 ммоль) в 15 мл воды, и полученный раствор перемешивают в течение 20 час при RT. Во время реакции образуется белый осадок. Реакционную смесь центрифугируют, осадок промывают водой и затем лиофилизуют, и получают Е в виде белого порошка.
Синтез IO-180_03

[00396] Экспериментальная процедура. Cсоединение E получают, следуя процедуре, схожей с процедурой, описанной для получения IO-180_01.
Синтез IO-184_01
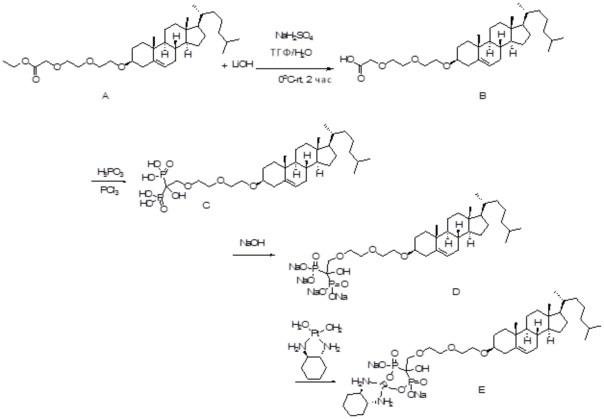
[00397] Стадия 1

[00398] Экспериментальная процедура. В 100-мл одногорлой RBF эфир A (1,272 g, 2,27 ммоль) растворяют в 20 мл смеси ТГФ/H2O (3:1), и раствор на ледяной бане охлаждают до 0°C. К такому охлажденному раствору добавляют LiOH (136 мг, 5,67 ммоль), смесь перемешивают при rt в течение ночи, и проводят контроль ТСХ. По завершении этого реакционную смесь экстрагируют этилацетатом, и экстракт последовательно промывают раствором дигидросульфата натрия (40 мл) и рассолом (20 мл). Органический слой сушат над безводным Na2SO4 и концентрируют в вакууме, выполняют очистку на колонке, и получают 1 г чистого B в виде белого порошка.
[00399] Стадия 2
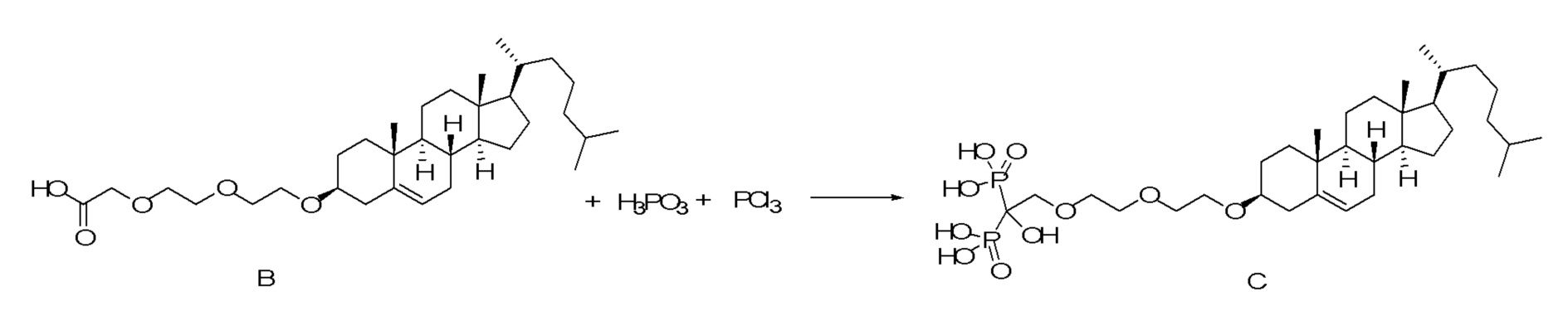
[00400] Экспериментальная процедура. Смесь B (532 мг, 1 ммоль) и H3PO3(2 ммоль) греют при 60°C в атмосфере N2 до тех пор, пока не получат однородную смесь. Добавляют по каплям PCl3 (1 ммоль), и смесь перемешивают при 60°C в течение 2 час. Полученную смесь охлаждают до комнатной температуры и экстрагируют водой. Водный раствор лиофилизуют, и получают соединение C.
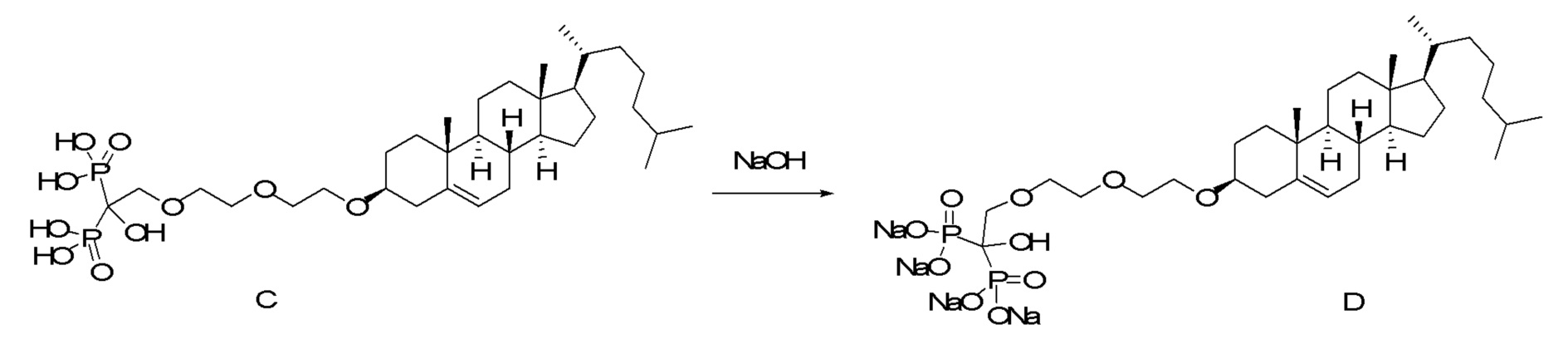
[00401] Экспериментальная процедура. В 25-мл одногорлой RBF C (0,13 ммоль) растворяют в 1 мл ТГФ. При 0°C добавляют гидроксид натрия (0,54 ммоль) в 2 мл воды. Полученный раствор перемешивают в течение 2 час при RT. Реакционную смесь промывают хлороформом, и водный слой используют на следующей стадии.
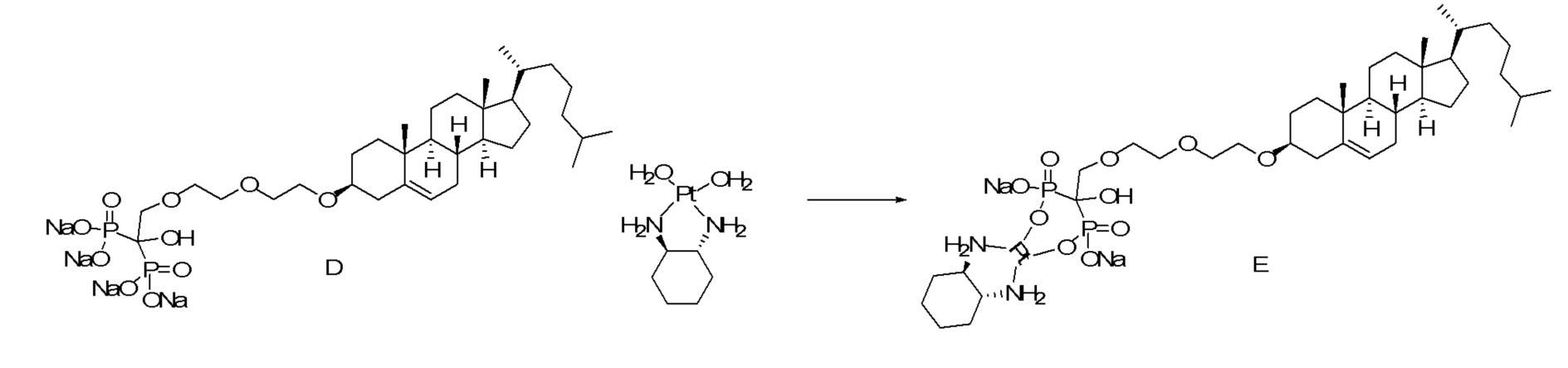
[00402] Экспериментальная процедура. В 100-мл одногорлой RBF акватированный диаминоциклогексан платины (0,13 ммоль) растворяют в 15 мл воды. При RT добавляют D (0,13 ммоль) в 5 мл воды, и полученный раствор перемешивают в течение 2 час при RT. Во время реакции образуется белый осадок. Реакционную смесь центрифугируют, выпавшее в осадок вещество промывают водой, и получают E в виде белого порошка.
Синтез IO-190_01
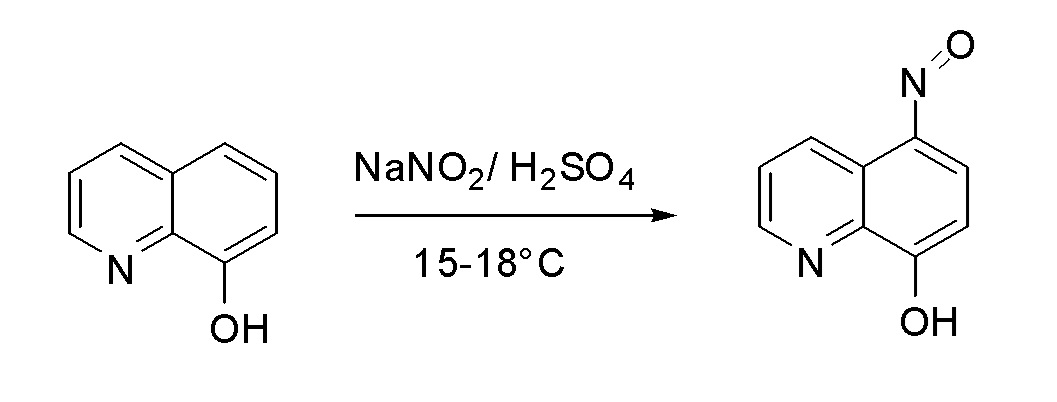
[00403] 8-Гидроксихинолин (7,34 г, 0,05 mol) при непрерывном перемешивании при 15-18°C растворяют в смеси 66,7 мл дистиллированной воды и 3 мл концентрированной серной кислоты. К реакционной смеси при 15-18°C добавляют по каплям в течение 30-40 мин раствор нитрита натрия (3,67 г) в дистиллированной воде (6,78 мл), и смесь выдерживают при такой температуре в течение 3 час. Реакционную смесь нейтрализуют 40% раствором гидроксида натрия. Затем смесь подкисляют ледяной уксусной кислотой до pH 3,0-4,0. Полученное выпавшее в осадок желтое вещество отфильтровывают, промывают дистиллированной водой и сушат. Выход 6,7 г (89,5%).
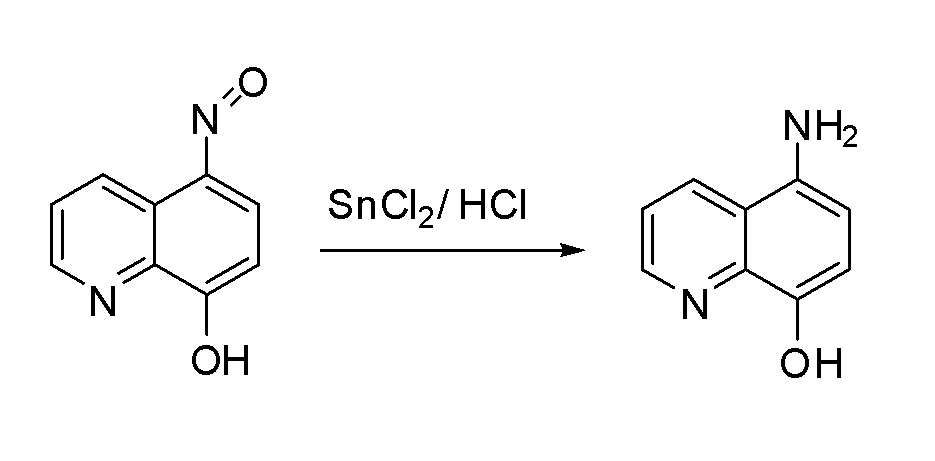
[00404] Подогревают 0,174 г (0,01 моль) 5-нитрозо-8-гидроксихинолина в 25 мл концентрированной соляной кислоты. К такой смеси постепенно, небольшими порциями, добавляют металлическое олово (Sn) (0,236 г, 0,02 моль). Реакционную смесь кипятят с обратным холодильником в течение 6 час на кипящей водяной бане. Реакционную смесь охлаждают до комнатной температуры. К реакционной смеси постепенно добавляют 20% раствор гидроксида натрия, и получают осадок. 5-Амино-8-гидроксихинолин экстрагируют эфиром. Выход 0,154 г (79,87%).
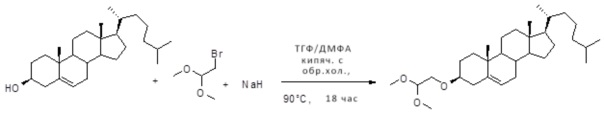
[00405] Холестерин (1 г, 2,6 ммоль) растворяют в 40 мл смеси ТГФ/ДМФА (1:1), добавляют 60% гидрид натрия (масс./масс.) в минеральном масле (0,6 г, 15,5 ммоль), и затем смесь перемешивают в течение 10 мин. Добавляют по каплям 2-бром-1,1-диметоксиэтан (1,21 мл, 7,8 ммоль), и смесь перемешивают при 90°C при кипячении с обратным холодильником в течение 18 час. Смесь охлаждают, и добавляют смесь CH2Cl2/MeOH (1:1) для удаления избытка NaH. После этого растворитель удаляют в вакууме, остаток растворяют в EtOAc, раствор промывают несколько раз водой, сушат над Na2SO4, фильтруют и концентрируют. Сырой продукт очищают колоночной флэш-хроматографией на силикагеле с использованием смеси 2-10% P.E. в EtOAc, и получают продукт в виде белого твердого вещества, выход 1,23 г, 94%.

[00406] К раствору ацеталя холестерина (0,5 г, 1 ммоль) в 10 мл CH2Cl2 добавляют смесь трифторуксусная кислота/вода (1:1) (2,5 мл, 16,2 ммоль), и смесь перемешивают при комнатной температуре в течение 6 час. Смесь нейтрализуют 1 N раствором NaOH и дважды экстрагируют CH2Cl2. Экстракт сушат над Na2SO4, фильтруют и концентрируют, и получают продукт в виде белого твердого вещества.
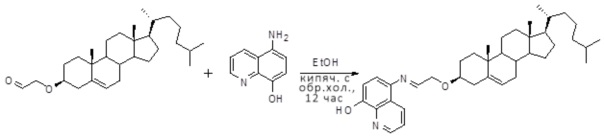
[00407] Получают продукт реакции путем кипячения с обратным холодильником стехиометрических количеств альдегида (0,429 г, 1 ммоль) и амина (0,160 г, 1 ммоль) в абсолютном этаноле (15 мл) в течение ночи в присутствии каталитического количества трифторуксусной кислоты. Нужный продукт выпадает в осадок после охлаждения реакционной смеси, и затем его извлекают фильтрацией и промывают холодным этанолом. Выход 0,4 г, 70%.
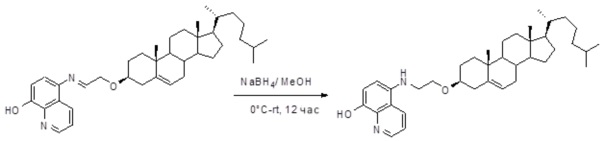
[00408] При комнатной температуре в инертной атмосфере борогидрид натрия (0,875 г, 23,12 ммоль) добавляют по частям к раствору комплекса холестерина с хинолином (0,617 г, 1,08 ммоль) в смеси C2H5OH:ТГФ (1:1). После 6-часового перемешивания при комнатной температуре растворитель выпаривают, остаток промывают крепким рассолом и экстрагируют DCM, и получают светло-желтое кристаллическое твердое вещество. Выход 384 мг (62%).

[00409] В 100-мл одногорлой RBF комплекс холестерина с хинолином (0,151 г, 0,263 ммоль) растворяют в 3 мл ТГФ и охлаждают до 0°C на ледяной бане. К такому охлажденному на льду раствору добавляют LiOH (11 мг, 0,263 ммоль) в 1 мл H2O, смесь перемешивают при rt в течение 2 час, и проводят контроль методом ТСХ. По завершении реакции ТГФ удаляют на роторном испарителе. К реакционной смеси добавляют хлороформ. Соединение экстрагируют водой. Затем всю реакционную смесь используют в следующей реакции после обработки на роторном испарителе.
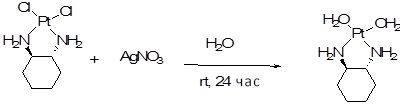
[00410] В 50-мл одногорлой RBF DACH-платина (100 мг, 0,263 ммоль) растворяют в 10 мл воды для ВЭЖХ. К полученному выше раствору добавляют нитрат серебра (89 мг, 0,526 ммоль). Полученный раствор перемешивают при rt, защищая от света. Через 24 часа отфильтровывают выпавший в осадок AgCl. Фильтрат используют на следующей стадии.

[00411] В 100-мл одногорлой RBF литиевую соль комплекса холестерина с хинолином (161 мг, 0,263 ммоль) растворяют в 20 мл воды для ВЭЖХ, полученный раствор перемешивают в течение 5 мин при комнатной температуре, к полученному раствору добавляют DACH(OH2)2-платина, и смесь перемешивают при rt, защищая от света, в течение 24 час. Выпавшее в осадок вещество отфильтровывают на бумажном фильтре и совместно промывают водой для ВЭЖХ, метанолом для ВЭЖХ и ацетоном для ВЭЖХ и сушат. (Выход 60%).
Синтез соединений IO-185_01, IO-186_01, IO-187_01, IO-188_01, IO-189_01, IO-183_03, IO-183_04, IO-180_04

[00412] Синтез акватированного цисплатина (B). В 25-мл RB загружают 0,17 ммоль дихлорида диаминплатины (A), 0,34 ммоль нитрата серебра, добавляют 7 мл воды и перемешивают в течение 48 час при комнатной темп. Раствор центрифугируют (4000 об/мин; 10 мин), и выпавшее в осадок белое вещество отфильтровывают в шприце с фильтром (25 мм/0,20 мкм). Белое вещество промывают 2 мл воды. Фильтрат используют в следующей реакции.

[00413] Синтез IO-185. Процедура схожа с процедурой, описанной для соединения 25.
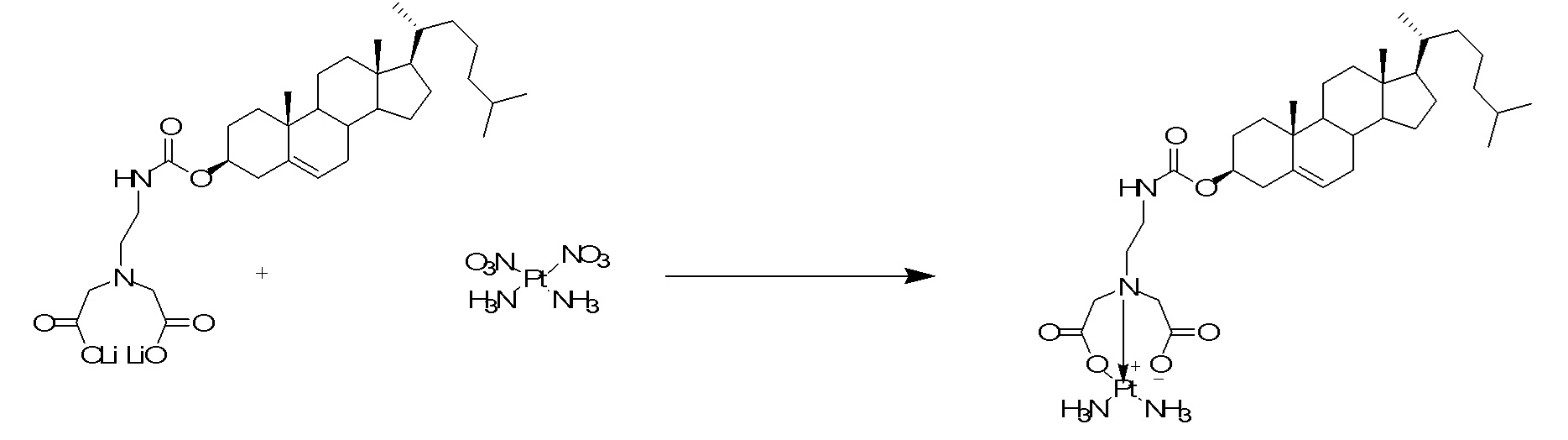
[00414] Синтез IO-186.Процедура схожа с процедурой, описанной для соединения 26.
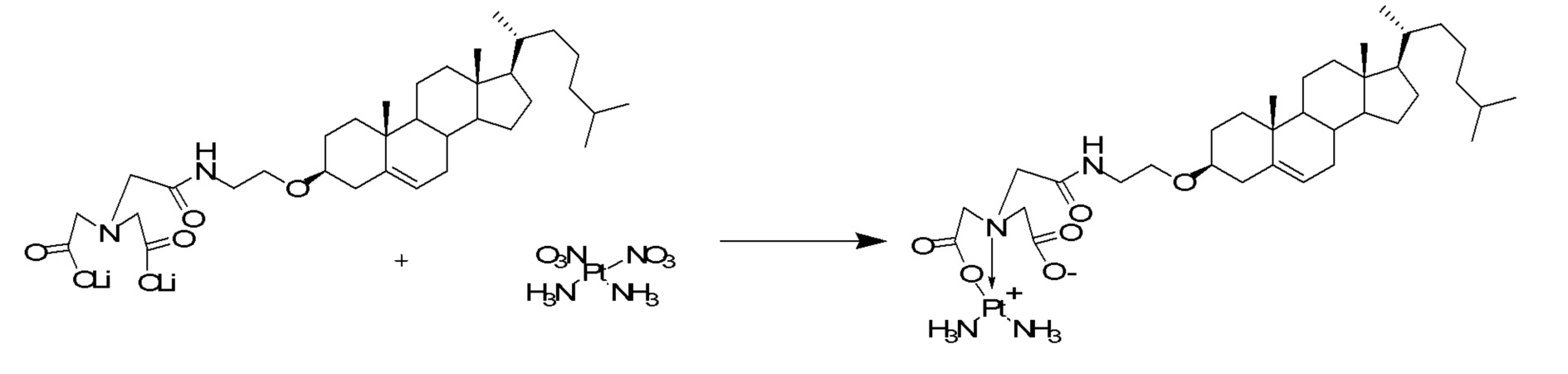
[00415] Синтез IO-187.Процедура схожа с процедурой, описанной для соединения 27.

[00416] Синтез IO-188. Процедура схожа с процедурой, описанной для соединения 28.
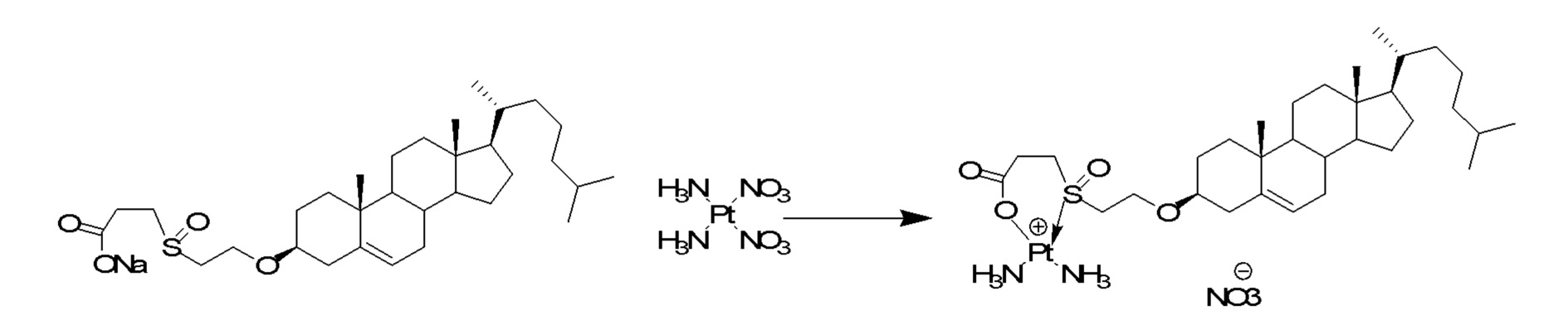
[00417] Синтез IO-189.Процедура схожа с процедурой, описанной для соединения IO-131.

[00418] Синтез IO-183_03. Процедура схожа с процедурой, описанной для соединения IO-183_01.
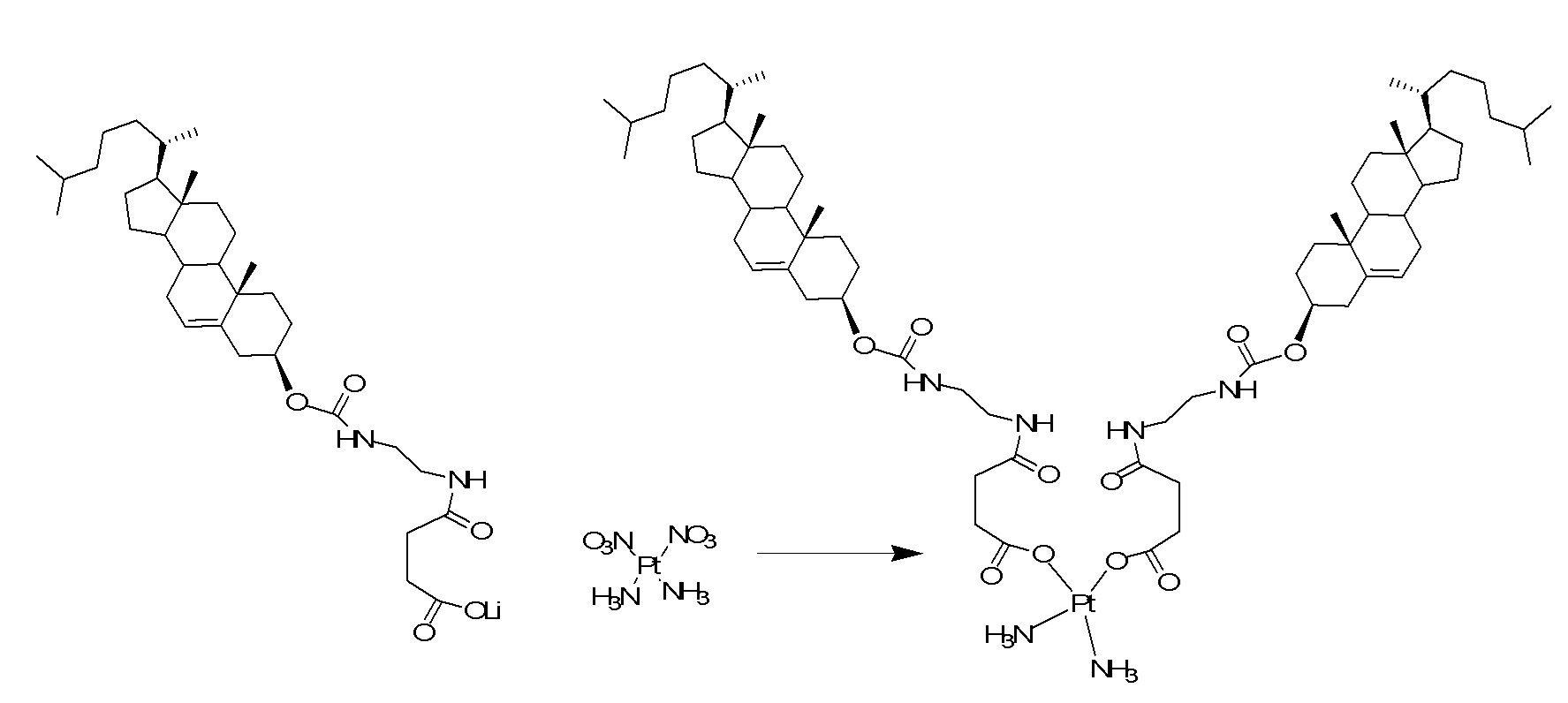
[00419] Синтез IO-183_04.Процедура схожа с процедурой, описанной для соединения IO-183_02.
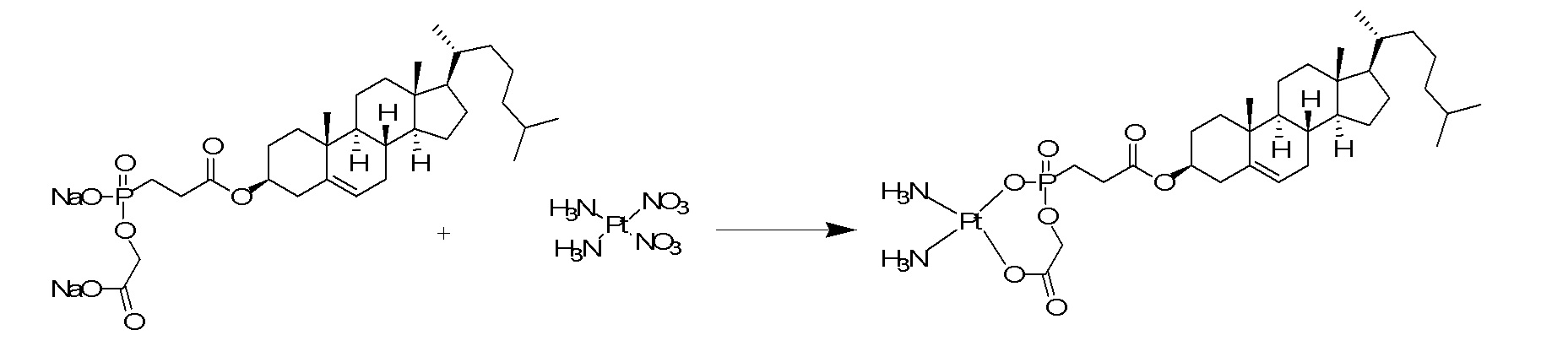
[00420] Синтез IO-180_04.Процедура схожа с процедурой, описанной для соединения IO-180_01.
Пример 8. Получение наночастиц на основе липидов
[00421] В качестве солипидов выбирают соевый фосфатидилхолин (полностью гидрированный, HSPC), 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоль)-2000] (аммониевая соль) (DSPE-PEG-OMe) и холестерин. Липосомные наночастицы получают путем растворения соединений холестерин-оксалиплатин-липид на основе платины по настоящему раскрытию (как полученных в примерах 1 и 2) и солипидов (HSPC, DSPE-PEG-OMe и холестерина) в молярных соотношениях 1:2:0,05:0,5, соответственно, в смеси дихлорметана и метанола в стеклянном сосуде. Органический растворитель удаляют в слабом токе не содержащего влаги азота, и затем оставшуюся сухую пленку липида выдерживают в высоком вакууме в течение примерно 8 часов. К высушенной в вакууме липидной пленке добавляют буфер 300 мосм (сахароза и динатрийгидрофосфат), и смесь оставляют для гидратации при 60°C на 1 час. Сосуд встряхивают с течение примерно 2-3 минут при комнатной температуре и иногда встряхивают в водяной бане при 45°C для получения мультиламеллярных везикул (МLV). Небольшие униламеллярные везикулы (SUV) получают, пропуская МLV через экструдер последовательно через мембрану 400 мкм, 200 мкм 100 мкм. Размер полученных наночастиц измеряют прибором DLS (Malvern).
Пример 9. Культивирование клеток in vitro и анализы жизнеспособности клеток
[00422] Для исследования в анализах жизнеспособности клеток используют клеточную линию рака молочной железы (4T1), клеточную линию цервикального рака (HeLa) и клеточную линию рака легких Льюиса (LLC). Клетки 4T1 культивируют в среде RPMI1640 с добавлением 10% FBS, 50 единица.мл−1 пенициллина и 50 единица.мл−1 стрептомицина-пенициллина. Клетки HeLa и LLC культивируют в среде DMEM с добавлением 10% FBS, 50 единица.мл−1 пенициллина и 50 единица.мл−1 стрептомицина-пенициллина. Трипсинизированные культивированные раковые клетки высевают в 96-луночные планшеты с плоскодонными лунками при плотности 3000 клеток на лунку за день до обработки лекарственными средствами. На другой день клетки в планшетах обрабатывают различными концентрациями препаратов наночастиц (полученных так, как в примере 3) с оксалиплатином в качестве контроля. Затем планшеты инкубируют в течение примерно 48 час в атмосфере с 5% CO2 при примерно 37°C. Добавляют примерно 10 мкл реагента MTT (10 мг/мл), и проводят инкубацию в течение 2 часов. Среду удаляют, и преципитат растворяют в примерно 100 мкл смеси ДМСО-метанол 1:1. Поглощение образца растворенного преципитата измеряют на ридере BioRad Elisa при 550 нм. Затем из полученных данных по поглощению вычисляют относительную жизнеспособность клеток.
[00423] Композиции наночастиц по настоящему раскрытию показывают существенную эффективность лизиса раковых клеток (фигура 6). Указанные наночастицы испытывают на различных линиях раковых клеток, описанных выше, и наблюдают, что соединения с координацией шестичленного цикла с платиной (соединение 2, соединение 5) имеют схожую эффективность лизиса при сравнении с оксалиплатином (котроль). Другие соединения (соединение 1, соединение 6, соединение 3 и соединение 4) с координаций с платиной пяти- или семичленного цикла имеют бóльшую эффективность лизиса, чем оксалиплатин. Наиболее важно, что среди таких четырех соединений соединение 4 показывает существенно лучшую эффективность лизиса раковых клеток, чем контрольный оксалиплатин.
[00424] В заключение, настоящее раскрытие относится к различным амфифильным соединениям на основе платины, раскрытым выше. Указанные соединения имеют общую главную цепь платина-линкер-липид. Кроме того, раскрытие также относится к карбенам, и конкретнее, содержащим платину карбенам, при этом указанные содержащие платину карбены также используются как платиновая часть в амфифильных соединениях на основе платины. Различные амфифильные соединения на основе платины по настоящему раскрытию демонстрируют существенно улучшенную эффективность при лечении рака и поэтому могут использоваться в качестве успешных альтернатив при лечении рака.
Пример 10. Биоанализы
[00425] Культивирование клеток. Клетки млекопитающих выращивают в специфических культуральных средах с добавлением 10% сыворотки плода коровы (FBS) и антибиотиков в увлажненной атмосфере, содержащей 5% CO2, при 37°C.
[00426] Анализ клеток на жизнеспособность. Действие супрамолекулярных платиновых конъюгатов на жизнеспособность раковых клеток измеряют с использованием анализа с МТТ. Клетки в 100 мкл культуральных сред высевают в 96-луночные планшеты (3000-5000 клеток/лунка) и оставляют для прилипания на ночь в увлажненной атмосфере, содержащей 5% CO2, при 37°C. К клеткам добавляют свежие среды (100 мкл), содержащие различные концентрации соединений, и проводят инкубацию в течение 72 часов. После инкубации определяют жизнеспособность клеток с использованием анализа с МТТ. Анализом с МТТ измеряют жизнеспособность клеток через оценку активной митохондриальной дегидрогеназы, которая превращает МТТ в пурпурные кристаллы нерастворимого в воде формазана. Строят графики жизнеспособности клеток в виде кривых зависимости от дозы с использованием подбора кривых.
[00427] Оценивают in vitro действие примеров содинений (соединение 25, 26, 27, 28, 31, 48) в сравнении с оксалиплатином на клеточные линии рака молочной железы (MDA-MB-231), рака яичников (SKOV-3), цервикального рака (HeLa) и колоректального рака (SW-620 и HCT-116). Результаты показывают существенное подавление жизнеспособности клеток в интервале концентраций 0-25 мкM для всех испытываемых примеров соединений, показывая дозовую зависимость (фиг. 7A-7F). Величины IC50 для отдельных примеров соединений ниже, чем оксалиплптина, что показывает более высокую эффективность таких соединений в отношении раковых клеток человека.
[00428] Поглощение клетками соединений платины. Клетки MDA-MB-231 (1×106) высевают в 2 мл среды на лунку 6-луночного планшета и выращивают в течение 24 час. Добавляют требуемый объем соединений для достижения конечной концентрации 50 мкМ платинового эквивалента на лунку. Клетки после добавления соединений инкубируют в течение 5 час, затем дважды промывают PBS, собирают трипсинизацией, ресуспендируют в PBS и считают. Клетки центрифугируют, и осадки хранят при -80°C до дальнейшей обработки. Клеточные осадки гидролизуют 100 мкл азотной кислоты при 70°C в течение 4 часов. После гидролиза образцы разбавляют 2% HCl, и определяют количество накопленной платины с использованием атомно-абсорбционной спектроскопии (AAС). Анализ подтверждают с использованием линейной стандартной кривой, полученной из серийных разведений удостоверенного исходного платинового эталона, и поглощение клетками платины выражают в нг платины на 1×105 клеток.
[00429] Результаты показывают, что поглощение цисплатина и оксалиплатина в клетках MDA-MB-231 схожи, в то время как все испытанные примеры соединений показывают более высокое поглощение (~7-20-кратное) (фиг. 8). Такие результаты показывают, что при введении в эквивалентных концентрациях платины поглощение соединений-примеров в раковых клетках значительно выше по сравнению с цисплатином или оксалиплатином.
[00430] Измерение платины в опухолях у мышей. Клетки рака молочной железы 4T1 имплантируют подкожно мышам Balb/c в день 0. Мышей с опухолями обрабатывают оксалиплатином и соединением 27 в дозе, эквивалентной 8 мг/кг платины (n=3), на 9 день после имплантации опухоли. Взвешивают приблизительно 40 мг опухоли, измельчают в мелкий порошок пестиком в ступке с жидким азотом и гидролизуют в течение ночи в азотной кислоте при 110°C в качественных автоклавах для достижения гомогенности. После обработки кислотой каждый образец разбавляют 2% HCl и анализируют методом атомно-абсорбционной спектрофотометрии (AAС) для измерения поглощения, связанного с содержанием платины. Анализ подтверждают с использованием линейной стандартной кривой, полученной из серийных разведений удостоверенного исходного платинового эталона. Среднюю концентрацию платины приводят в нг платины на миллиграмм ткани.
[00431] Как видно на фиг. 9, имеет место более высокое накопление платины (определенное количественно на грамм ткани с использованием атомно-абсорбционной спектрофотометрии) в опухолях мышей, обработанных соединением 27, по сравнению с опухолями мышей, получивших эквивалентное количество оксалиплатина. Такие результаты предполагают, что усиленное поглощение платины, связанное с соединениями-примерами, может привести к усиленному лизису клеток в опухолях.
[00432] Все патенты и другие публикации, указанные в описании, и примеры включены в данное описание только как ссылки для всех целей. Такие публикации приводятся только в случае их раскрытия до даты регистрации настоящей заявки. В этом отношении ничто не следует истолковывать как признание, что авторы изобретения не имеют права датировать задним числом такое раскрытие на основании предыдущего изобретения или по какой-либо другой причине. Все утверждения в отношении даты или представления о содержании таких документов основаны на информации, доступной для заявителей, и не составляют какое-либо допущение в отношении правильности даты или содержания таких документов.
[00433] Хотя в настоящем описании приводятся и подробно описаны предпочтительные воплощения, для специалистов в данной области техники будет очевидно, что можно осуществить различные модификации, дополнения, замены и т.п. без отхода от сущности изобретения, и поэтому рассматриваются как входящие в объем изобретения, определенный в формуле изобретения, которая следует далее. Кроме того, в степени, еще не обозначенной, специалистам в данной области техники следует иметь в виду, что любое из различных вариантов осуществления, описанных и поясненных в настоящем описании, также может быть модифицировано для включения особенностей, показанных в других вариантах осуществления, раскрытых в настоящем описании.
Реферат
Изобретение относится к соединению формулы (VIII): Q-линкер-липид (VIII), в которой Q представляет собой (i), где X представляет собой NH или N(CHCOO); и Z представляет собой содержащее платину соединение, при этом платина образует часть цикла; (ii), где X обозначает S, C, S=O, NH или P=O; Xобозначает –CH-, -CH-или -CHO-; Xпредставляет собой C=O; и Z представляет собой содержащее платину соединение, при этом платина образует часть цикла; (iii), где Xпредставляет собой (CH); Xпредставляет собой C=O; Z представляет собой содержащее платину соединение, при этом платина образует часть цикла; и n равен 0, 1 или 2; (iv), где R, Rи Rпредставляют собой независимо галоген, амино, алкиламино, диалкиламино, гидроксил, тиол, тиоалкил, O-ацил, -линкер-липид или их комбинацию; или (v), где R, R, R, Rи Rпредставляют собой независимо галоген, амино, алкиламино, диалкиламино, гидроксил, тиол, тиоалкил, O-ацил, -линкер-липид или их комбинацию. Значения линкера и липида такие, как указано в формуле изобретения. Также предложены способ получения соединения формулы (VIII), наночастица, фармацевтическая композиция, способ лечения или устранения рака, способ получения наночастицы. Предлагаемые соединения показывают более высокое поглощение платины в раковых клетках относительно цисплатина и оксалиплатина и могут быть использованы для лечения или устранения рака. 6 н. и 26 з.п. ф-лы, 28 ил., 1 табл., 10 пр.
Формула
Документы, цитированные в отчёте о поиске
Платиновые фармацевтические средства
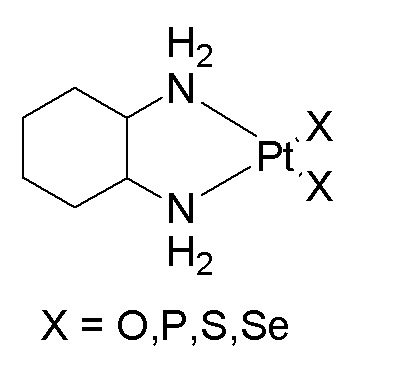
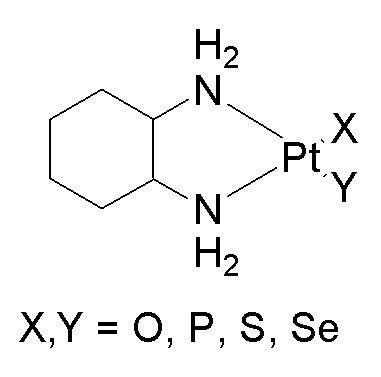



Комментарии