Пролекарство производного аминокислоты - RU2739318C2
Код документа: RU2739318C2
Описание
ОБЛАСТЬ ТЕХНИКИ
[0001] Настоящее изобретение относится к пролекарствам производных (1R,2R,3R,5R,6R)-2-амино-6-фтор-3-алкоксибицикло[3.1.0]гексан-2,6-дикарбоновой кислоты и производных (1S,2R,3R,5R,6S)-2-амино-3-алкоксибицикло[3.1.0]гексан-2,6-дикарбоновой кислоты, пригодным в качестве лекарственных средств. Более конкретно, настоящее изобретение относится к пролекарствам производных (1R,2R,3R,5R,6R)-2-амино-6-фтор-3-алкоксибицикло[3.1.0]гексан-2,6-дикарбоновой кислоты и производным (1S,2R,3R,5R,6S)-2-амино-3-алкоксибицикло[3.1.0]гексан-2,6-дикарбоновой кислоты, которые представляют собой соединения, действующие в качестве антагонистов рецепторов mGlu2 и mGlu3, принадлежащих к подгруппе 2 рецепторов метаботропного глутамата (mGlu), и являющиеся эффективными для лечения или предупреждения, например, расстройств настроения (включая депрессию и биполярное расстройство), тревожного расстройства, когнитивных расстройств, нарушений развития, болезни Альцгеймера, болезни Паркинсона, двигательных нарушений, ассоциированных с мышечной ригидностью, расстройств сна, хореи Хантингтона, расстройств питания, наркотической зависимости, эпилепсии, инфаркта головного мозга, ишемии головного мозга, недостаточности головного мозга, отека головного мозга, нарушений спинного мозга, травмы головы, воспаления и иммунных заболеваний. Настоящее изобретение также относится к открытию, что пролекарства соединений (активные формы), выступающие в качестве антагонистов рецепторов mGlu2 и mGlu3, повышают способность к пероральному всасыванию и увеличивают экспозицию активных форм in vivo.
УРОВЕНЬ ТЕХНИКИ
[0002] Рецепторы метаболического глутамата подразделяют на 3 группы согласно гомологии последовательностей, механизмам передачи сигнала и фармакологическим свойствам. Среди них рецепторы метаботропного глутамата (рецепторы mGlu2 и mGlu3) группы 2 представляют собой сопряженные с G-белком рецепторы, которые связываются с аденилциклазой и подавляют стимулируемое фосфохолином накопление циклического аденозинмонофосфата (cAMP) (непатентный документ 1). Также рецепторы метаботропного глутамата группы 2 существуют в основном в пресинапсах глутаматергической нервной системы и выполняют функцию ауторецепторов, таким образом, подавляя чрезмерное высвобождение глутаминовой кислоты (непатентные документы 2 и 3). Считается, что соединения, являющиеся антагонистами рецепторов метаботропного глутамата группы 2, могут быть эффективными для лечения или предупреждения острых и хронических нейропсихиатрических заболеваний и неврологических заболеваний. Производные (1R,2R,3R,5R,6R)-2-амино-6-фтор-3-алкоксибицикло[3.1.0]гексан-2,6-дикарбоновой кислоты и производные (1S,2R,3R,5R,6S)-2-амино-3-алкоксибицикло[3.1.0]гексан-2,6-дикарбоновой кислоты представляют собой соединения, имеющие выраженный антагонистический эффект на рецепторы метаботропного глутамата группы 2. Например, в качестве такого соединения описано MGS0039. Его антагонистическая активность составляет 20 нМ (рецептор mGlu2) и 24 нМ (рецептор mGlu3) и сообщалось, что 1 мг/кг соединения достаточно для снижения времени неподвижности, как и в случае существующих антидепрессантов, в испытании принудительного плавания на крысах в качестве моделей депрессии на животных. Кроме того, сообщалось, что соединение также сокращает время неподвижности, как и в случае существующих антидепрессантов, в испытании подвешивания за хвост у мышей (непатентный документ 4). Также сообщалось, что (1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-фторфенил)метокси]бицикло[3.1.0]гексан-2,6-дикарбоновая кислота, (1R,2R,3R,5R,6R)-2-амино-3-[(3,4-дифторфенил)метокси]-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновая кислота и (1R,2R,3R,5R,6R)-2-амино-6-фтор-3-пропоксибицикло[3.1.0]гексан-2,6-дикарбоновая кислота, которые представляют собой производные (1R,2R,3R,5R,6R)-2-амино-6-фтор-3-алкоксибицикло[3.1.0]гексан-2,6-дикарбоновой кислоты, обладают антагонистической активностью, составляющей 500 нМ или менее, против рецепторов mGlu2 (патентный документ 1 и непатентный документ 5).
Однако способность к пероральному всасыванию у производных (1R,2R,3R,5R,6R)-2-амино-6-фтор-3-алкоксибицикло[3.1.0]гексан-2,6-дикарбоновой кислоты и производных (1S,2R,3R,5R,6S)-2-амино-3-алкоксибицикло[3.1.0]гексан-2,6-дикарбоновой кислоты у обезьян является низкой. Это указывает на возможность того, что способность к пероральному всасыванию у человека также может быть низкой.
Существует в основном два подхода к повышению способности соединений проходить через мембрану (например, способности к пероральному всасыванию). Один из них представляет собой способ изменения непосредственно их химических структур, а другой представляет собой способ разработку способов составления без изменения их химических структур. Первый способ охватывает присоединение небольшой модифицирующей группы, такой как алкильная группа или ацильная группа, к реакционноспособному заместителю, такому как карбоксигруппа или аминогруппа соединений, для преобразования их в пролекарства.
Соединения, предпочтительные в качестве вышеупомянутых пролекарств, представляют собой соединения, которые существуют стабильно в формах пролекарств до всасывания, демонстрируют улучшенное всасывания после преобразования в пролекарства и конвертируются в активные формы химическим или ферментативным путем и быстро в тонком кишечнике, печени и/или плазме в процессе и/или после всасывания.
Однако трудно разработать идеальные пролекарства, которые удовлетворяют всем вышеупомянутым условиям. Например, пролекарства, имеющие сложноэфирную связь, с большей вероятностью будут гидролизоваться, что может оказать значительное влияние на химическую стабильность до всасывания. Что касается пролекарств, имеющих амидную связь, значительное изменение физических свойств соединений может оказать значительное влияние на способность проходить через мембрану, такую как способность к пероральному всасыванию. Кроме того, амидная связь с меньшей вероятностью будет гидролизоваться, что может оказать значительное влияние на биотрансформацию соединений в активные формы и концентрации в плазме. Более того, трудно предсказать фармакокинетический профиль пролекарств, поскольку ферменты, контролирующие биотрансформацию пролекарств в активные формы, являются субстрат-специфическими и, в частности, например, пространственное стерическое препятствие, вследствие добавления заместителя для образования пролекарств может препятствовать реакции ферментов. По этим причинам, нелегко повысить концентрации активных форм в плазме путем оценки возможного улучшения способности пролекарств проникать через мембраны (например, способности к пероральному всасыванию) и их преобразования в активные формы. Существуют предшествующие сообщения о повышении концентрации активных форм в плазме посредством пролекарств, имеющих сложноэфирную связь(и) на 6-карбоновой кислоте или как 2-карбоновой кислоте, так и 6-карбоновой кислоте производного 2-аминобицикло[3.1.0]гексан-2,6-дикарбоновой кислоты, которое представляет собой соединение, выступающее в качестве антагониста рецепторов mGlu2 и mGlu3 (патентные документы 2, 3, 4 и 5 и непатентный документ 6). Однако в этих документах ни описано, ни предложено повышение концентрации активных форм в плазме посредством пролекарственных соединений, имеющих сложноэфирную связь только на 2-карбоновой кислоте. Более того, в литературе ни описано, ни предложено повышение концентрации активных форм в плазме посредством пролекарств активных форм по настоящему изобретению.
СПИСОК ЛИТЕРАТУРЫ
Патентные документы
[0003] Патентный документ 1: WO03/061698
Патентный документ 2: WO05/000791
Патентный документ 3: WO2012/068041
Патентный документ 4: WO2012/068067
Патентный документ 5: WO2013/062680
Непатентные документы
[0004] Непатентный документ 1: Trends Pharmacol. Sci., 14, 13-20, 1993
Непатентный документ 2: Neuropharmacol., 40, 20-27, 2001
Непатентный документ 3: Eur. J. Pharmacol., 356, 149-157, 1998
Непатентный документ 4: Neuropharmacol., 2004, 46 (4), 457-67
Непатентный документ 5: J. Med. Chem., 2004, 47, 4570-4587
Непатентный документ 6: Bioorg. Med. Chem., 2006, 14, 4193-4207
Сущность изобретения
Техническая проблема
[0005] Задачей настоящего изобретения является предоставление лекарственных средств, которые обладают эффектом лечения или предупреждения, например, расстройств настроения (включая депрессию и биполярное расстройство), тревожного расстройства, когнитивных расстройств, нарушений развития, болезни Альцгеймера, болезни Паркинсона, двигательных нарушений, ассоциированных с мышечной ригидностью, расстройств сна, хореи Хантингтона, расстройств питания, наркотической зависимости, эпилепсии, инфаркта головного мозга, ишемии головного мозга, недостаточности головного мозга, отека головного мозга, нарушений спинного мозга, травмы головы, воспаления и иммунных заболеваний, и являются в высокой степени активными пероральными лекарственными средствами-антагонистами рецепторов метаботропного глутамата группы 2.
Решение проблемы
[0006] Авторы настоящего изобретения провели тщательные и глубокие исследования сложноэфирных производных (1R,2R,3R,5R,6R)-2-амино-6-фтор-3-алкоксибицикло[3.1.0]гексан-2,6-дикарбоновой кислоты и сложноэфирных производных (1S,2R,3R,5R,6S)-2-амино-3-алкоксибицикло[3.1.0]гексан-2,6-дикарбоновой кислоты и в результате обнаружили, что пролекарства производных (1R,2R,3R,5R,6R)-2-амино-6-фтор-3-алкоксибицикло[3.1.0]гексан-2,6-дикарбоновой кислоты и производных (1S,2R,3R,5R,6S)-2-амино-3-алкоксибицикло[3.1.0]гексан-2,6-дикарбоновой кислоты, обладающие антагонистической активностью против рецепторов метаботропного глутамата группы 2 являются стабильными в испытании стабильности в растворах, имитирующих желудок и тонкий кишечник, и конвертируются в активные формы во фракциях S9 печени. Посредством экспериментов на животных с использованием активных форм и пролекарств в качестве исследуемых лекарственных средств, авторы изобретения также обнаружили, что этот тип пролекарства повышает экспозицию активных форм in vivo. Эти данные привели к осуществлению настоящего изобретения.
Настоящее изобретение подробно описано ниже. Варианты осуществления настоящего изобретения (далее, соединения согласно вариантам осуществления называют "соединениями по изобретению") описаны ниже.
(1) Соединение, соответствующее формуле (I-A):
[0007] [Формула 1]

где
R1 обозначает C1-6 алкильную группу, гетероарильную группу (гетероарильная группа необязательно замещена одним атомом галогена) или имеет следующую формулу (IIIA):
[Формула 2]

где Rx обозначает атом водорода, атом галогена, C1-6 алкильную группу или C1-6 алкоксигруппу (каждая из C1-6 алкильной группы и C1-6 алкоксигруппы необязательно замещена посредством от одного до трех атомов галогена), и
Ry обозначает атом водорода, атом фтора, C1-6 алкильную группу или C1-6 алкоксигруппу (каждая из C1-6 алкильной группы и C1-6 алкоксигруппы необязательно замещена посредством от одного до трех атомов галогена),
R1' обозначает атом водорода или C1-6 алкильную группу,
или R1 и R1' необязательно образуют C3-8 циклоалкан вместе с атомом углерода, соседним с ними,
R2 обозначает C3-6 алкильную группу (C3-6 алкильная группа необязательно замещена одной аминогруппой), C3-8 циклоалкильную группу (C3-8 циклоалкильная группа необязательно замещена посредством от одной до трех C1-6 алкильных групп), C3-8 циклоалкоксигруппу (C3-8 циклоалкоксигруппа необязательно замещена посредством от одной до трех C1-6 алкильных групп и C3-8 циклоалкоксигруппа необязательно имеет C1-5 алкиленовую группу, связывающую два различных атома углерода в кольце), адамантильную группу (адамантильная группа необязательно замещена посредством от одной до трех C1-6 алкильных групп) или фенильную группу,
R3 обозначает атом водорода или C1-6 алкильную группу, и
R4 обозначает атом водорода или атом фтора,
или его фармацевтически приемлемая соль.
(2) Соединение согласно (1), где R4 представляет собой атом фтора, или его фармацевтически приемлемая соль.
(3) Соединение согласно (2), где R2 представляет собой C3-6 алкильную группу, C3-8 циклоалкильную группу (C3-8 циклоалкильная группа необязательно замещена посредством от одной до трех C1-6 алкильных групп), C3-8 циклоалкоксигруппу (C3-8 циклоалкоксигруппа необязательно замещена посредством от одной до трех C1-6 алкильных групп и C3-8 циклоалкоксигруппа необязательно имеет C1-5 алкиленовую группу, связывающую два различных атома углерода в кольце), адамантильную группу (адамантильная группа необязательно замещена посредством от одной до трех C1-6 алкильных групп) или фенильную группу, или его фармацевтически приемлемая соль.
(4) Соединение согласно (2) или (3), где
R1 представляет собой этильную группу, 4-фторфенильную группу, 3,4-дифторфенильную группу, 4-фтор-3-метоксифенильную группу, 4-(трифторметил)фенильную группу, 3-фторфенильную группу, 4-метилфенильную группу, 6-хлорпиридин-2-ильную группу, 6-хлорпиридин-3-ильную группу, 5-хлорпиридин-2-ильную группу или 2-метилпропильную группу,
R1' обозначает атом водорода или метильную группу,
или R1 и R1' необязательно образуют циклопентан вместе с атомом углерода, соседним с ними,
R2 обозначает любую структуру из следующей группы формул (IIIB):
[0008] [Формула 3]

и
R3 представляет собой атом водорода или C1-6 алкильную группу, или его фармацевтически приемлемая соль.
(5) Соединение согласно (1), где R4 представляет собой атом водорода, или его фармацевтически приемлемая соль.
(6) Соединение согласно (5), где
R1 представляет собой этильную группу, 4-фторфенильную группу, 3,4-дифторфенильную группу, 4-фтор-3-метоксифенильную группу, 4-(трифторметил)фенильную группу, 3-фторфенильную группу, 4-метилфенильную группу, 6-хлорпиридин-2-ильную группу, 6-хлорпиридин-3-ильную группу, 5-хлорпиридин-2-ильную группу или 2-метилпропильную группу,
R1' обозначает атом водорода или метильную группу,
или R1 и R1' необязательно образуют циклопентан вместе с атомом углерода, соседним с ними,
R2 обозначает любую структуру из следующей группы формул (IIIB):
[0009] [Формула 4]

и
R3 представляет собой атом водорода или C1-6 алкильную группу, или его фармацевтически приемлемая соль.
(7) Соединение согласно (5) или (6), где R1 представляет собой 4-фторфенильную группу или 3,4-дифторфенильную группу, или его фармацевтически приемлемая соль.
(8) Соединение согласно любому из (5)-(7), где
R1 представляет собой 4-фторфенильную группу,
R1' представляет собой атом водорода, и
R2 обозначает любую структуру из следующей группы формул (IIIb):
[0010] [Формула 5]

или его фармацевтически приемлемая соль.
(9) Соединение согласно любому из (5)-(8), где R3 представляет собой метильную группу, или его фармацевтически приемлемая соль.
(10) Соединение, соответствующее формуле (I):
[0011] [Формула 6]

где
R1 обозначает этильную группу, 4-фторфенильную группу или 3,4-дифторфенильную группу,
R2 обозначает любую структуру из следующей группы формул (IIIa):
[0012] [Формула 7]

и
R3 обозначает атом водорода или C1-6 алкильную группу,
или его фармацевтически приемлемая соль.
(11) Соединение согласно (10), где R2 обозначает любую структур из следующей группы формул (IIIa'):
[Формула 8]
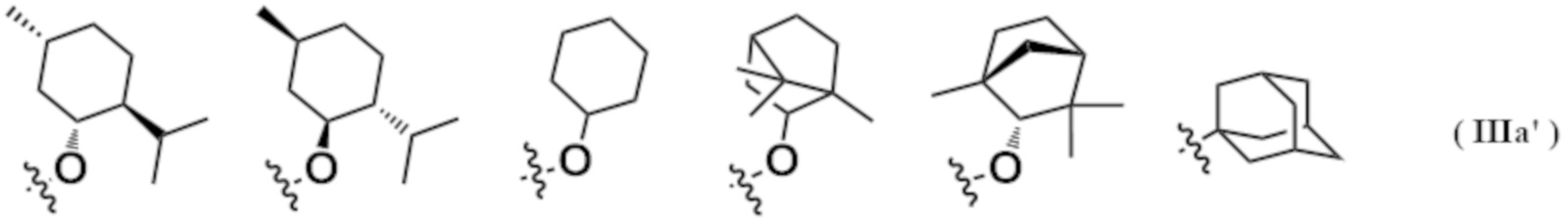
или его фармацевтически приемлемая соль.
(12) Соединение согласно (10), где R2 обозначает любую структуру из следующей группы формул (IIIb):
[0013] [Формула 9]

или его фармацевтически приемлемая соль.
(13) Соединение согласно любому из (10)-(12), где R3 представляет собой метильную группу, или его фармацевтически приемлемая соль.
(14) Соединение согласно (1), где соединение представляет собой любое из следующих соединений:
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-фторфенил)метокси]-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-фторфенил)метокси]-2-({[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]метокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-3-[(3,4-дифторфенил)метокси]-6-фтор-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-3-[(3,4-дифторфенил)метокси]-6-фтор-2-({[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]метокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-2-({(1R)-1-[({[(1R,2S,5R)-5-метил-2-(пропан-2-ил)циклогексил]окси}карбонил)окси]этокси}карбонил)-3-пропоксибицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-2-({1-[({[(1S,2R,5S)-5-метил-2-(пропан-2-ил)циклогексил]окси}карбонил)окси]этокси}карбонил)-3-пропоксибицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-фторфенил)метокси]-2-({1-[({[(1S,2R,4S)-1,7,7-триметилбицикло[2.2.1]гептан-2-ил]окси}карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-пропокси-2-({1-[({[(1S,2R,4S)-1,7,7-триметилбицикло[2.2.1]гептан-2-ил]окси}карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-фторфенил)метокси]-2-({1-[({[(1R,2S,4R)-1,7,7-триметилбицикло[2.2.1]гептан-2-ил]окси}карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)-3-{[4-(трифторметил)фенил]метокси}бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(3-фторфенил)метокси]-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-3-[(6-хлорпиридин-2-ил)метокси]-6-фтор-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(1R)-1-(4-фтор-3-метоксифенил)этокси]-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-3-[(5-хлорпиридин-2-ил)метокси]-6-фтор-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-3-[(6-хлорпиридин-3-ил)метокси]-6-фтор-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-метилфенил)метокси]-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-(3-метилбутокси)-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-3-(циклопентилокси)-6-фтор-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(3-фторфенил)метокси]-2-({(1R)-1-[({[(1R,2S,5R)-5-метил-2-(пропан-2-ил)циклогексил]окси}карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-3-[(6-хлорпиридин-2-ил)метокси]-6-фтор-2-({(1R)-1-[({[(1R,2S,5R)-5-метил-2-(пропан-2-ил)циклогексил]окси}карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-2-({[(2,2-диметилпропаноил)окси]метокси}карбонил)-6-фтор-3-[(4-фторфенил)метокси]бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-2-{[(бензоилокси)метокси]карбонил}-6-фтор-3-[(4-фторфенил)метокси]бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-2-({[(циклогексанкарбонил)окси]метокси}карбонил)-6-фтор-3-[(4-фторфенил)метокси]бицикло[3.1.0]гексан-6-карбоновая кислота, и
(1S,2R,3R,5R,6S)-2-амино-3-[(4-фторфенил)метокси]-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
или его фармацевтически приемлемая соль.
(15) Соединение согласно (1), где соединение представляет собой любое из следующих соединений:
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-фторфенил)метокси]-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-фторфенил)метокси]-2-({[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]метокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-3-[(3,4-дифторфенил)метокси]-6-фтор-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-3-[(3,4-дифторфенил)метокси]-6-фтор-2-({[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]метокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-2-({(1R)-1-[({[(1R,2S,5R)-5-метил-2-(пропан-2-ил)циклогексил]окси}карбонил)окси]этокси}карбонил)-3-пропоксибицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)-3-{[4-(трифторметил)фенил]метокси}бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(3-фторфенил)метокси]-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-3-[(6-хлорпиридин-2-ил)метокси]-6-фтор-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(1R)-1-(4-фтор-3-метоксифенил)этокси]-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-3-[(5-хлорпиридин-2-ил)метокси]-6-фтор-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-3-[(6-хлорпиридин-3-ил)метокси]-6-фтор-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-метилфенил)метокси]-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-(3-метилбутокси)-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-3-(циклопентилокси)-6-фтор-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
и
(1S,2R,3R,5R,6S)-2-амино-3-[(4-фторфенил)метокси]-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
или его фармацевтически приемлемая соль.
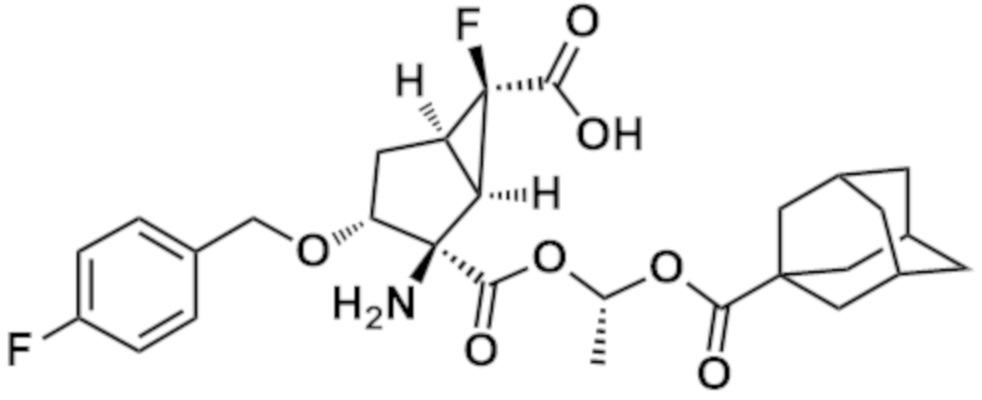
(16) Соединение согласно любому из (1)-(4) или (10)-(13), где соединение представляет собой следующее соединение:
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-фторфенил)метокси]-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
или его фармацевтически приемлемая соль.
[Формула 10]
(17) Соединение согласно любому из (1)-(4) или (10)-(13), где соединение представляет собой следующее соединение:
(1R,2R,3R,5R,6R)-2-амино-3-[(3,4-дифторфенил)метокси]-6-фтор-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
или фармацевтически приемлемая соль.
[Формула 11]

(18) Соединение согласно любому из (1)-(4) или (10)-(13), где соединение представляет собой следующее соединение:
(1R,2R,3R,5R,6R)-2-амино-6-фтор-2-({(1R)-1-[({[(1R,2S,5R)-5-метил-2-(пропан-2-ил)циклогексил]окси}карбонил)окси]этокси}карбонил)-3-пропоксибицикло[3.1.0]гексан-6-карбоновая кислота,
или его фармацевтически приемлемая соль.
[Формула 12]

(19) Лекарственное средство, содержащее соединение согласно любому из (1)-(18) или его фармацевтически приемлемую соль.
(20) Средство для предупреждения или лечения состояния, выбранного из группы, состоящей из расстройств настроения (включая депрессию и биполярное расстройство), тревожного расстройства, когнитивных расстройств, нарушений развития, болезни Альцгеймера, болезни Паркинсона, расстройств сна, хореи Хантингтона, расстройств питания, наркотической зависимости, эпилепсии, инфаркта головного мозга, ишемии головного мозга, отека головного мозга, травмы головы, воспаления и иммунных заболеваний, содержащее соединение согласно любому из (1)-(18) или его фармацевтически приемлемую соль.
Преимущественные эффекты изобретения
[0014] Пролекарство производного аминокислоты по настоящему изобретению имеет повышенную способность к прохождению через мембраны, такую как способность к пероральному всасыванию, и конвертируется в активную форму (II)-A, (II)-1, (II)-2 или (II)-3 вскоре после всасывания. Активная форма демонстрирует аффинность в отношении рецепторов метаботропного глутамата группы 2 и обладает антагонистическим эффектом.
[0015] [Формула 13]

где R1, R1' и R4 являются такими, как определено выше.
[0016]
[Формула 14]

[0017] [Формула 15]

[0018] [Формула 16]

Описание вариантов осуществления
[0019] Варианты осуществления настоящего изобретения описаны непосредственно ниже.
[0020] Значения терминов и выражений, используемых в настоящем описании, являются следующими:
"C1-6 алкильная группа" означает линейную или разветвленную алкильную группу, содержащую от одного до шести атомов углерода, и ее примеры могут включать такие группы, как метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, изобутильная группа, втор-бутильная группа, трет-бутильная группа, н-пентильная группа, изопентильная группа, неопентильная группа, трет-пентильная группа, 1-этилпропильная группа, н-гексильная группа, изоoгексильная группа и неогексильная группа.
"C3-6 алкильная группа" означает линейную или разветвленную алкильную группу, имеющую от трех до шести атомов углерода, и ее примеры могут включать такие группы, как н-пропильная группа, изопропильная группа, н-бутильная группа, изобутильная группа, втор-бутильная группа, трет-бутильная группа, н-пентильная группа, изопентильная группа, неопентильная группа, трет-пентильная группа, 1-этилпропильная группа, н-гексильная группа, изогексильная группа и неогексильная группа.
"Гетероарильная группа" означает моноциклическую ароматическую гетероциклическую группу, и ее примеры могут включать такие группы, как пиридильная группа, пиридазинильная группа, пиримидинильная группа, пиразинильная группа, пиридонильная группа, тиенильная группа, пирролильная группа, тиазолильная группа, изотиазолильная группа, пиразолильная группа, имидазолильная группа, фурильная группа, оксазолильная группа, изоксазолильная группа, оксадиазолильная группа, 1,3,4-тиадиазолильная группа, 1,2,3-триазолильная группа, 1,2,4-триазолильная группа и тетразолильная группа.
"Атом галогена" относится к атому фтора, атому хлора, атому брома или атому йода.
"C1-6 алкоксигруппа" относится к линейной или разветвленной алкоксигруппе, имеющей от одного до шести атомов углерода, и ее примеры могут включать такие группы, как метоксигруппа, этоксигруппа, пропоксигруппа, бутоксигруппа, пентилоксигруппа, гексилоксигруппа, изопропоксигруппа, изобутоксигруппа, трет-бутоксигруппа, втор-бутоксигруппа, изопентилоксигруппа, неопентилоксигруппа, трет-пентилоксигруппа и 1,2-диметилпропоксигруппа.
"C3-8 циклоалкильная группа" относится к циклопропильной группе, циклобутильной группе, циклопентильной группе, циклогексильной группе, циклогептильной группе или циклооктильной группе.
"C3-8 циклоалкан" относится к циклопропану, циклобутану, циклопентану, циклогексану, циклогептану или циклооктану.
"C3-8 циклоалкоксигруппа" относится к циклопропоксигруппе, циклобутоксигруппе, циклопентилоксигруппе, циклогексилоксигруппе, циклогептилоксигруппе или циклооктилоксигруппе.
Примером "C1-5 алкилена" может быть метилен, этилен, метилметилен, триметилен, метилэтилен, диметилметилен, тетраметилен, этилэтилен и пентаметилен.
В случае когда ʺC3-8 циклоалкоксигруппаʺ, определенная выше, представляет собой C3-8 циклоалкоксигруппу, которая имеет C1-5 алкиленовую группу, связывающую два различных атома углерода в кольце, ее примером может быть бицикло[2.2.1]гептан-2-ил.
[0021] "Фармацевтически приемлемая соль", как используют в настоящем описании, охватывает соли с неорганическими кислотами, такими как серная кислота, хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота и азотная кислота; соли с органическими кислотами, такими как уксусная кислота, бензойная кислота, щавелевая кислота, молочная кислота, яблочная кислота, виннокаменная кислота, фумаровая кислота, малеиновая кислота, лимонная кислота, малоновая кислота, миндальная кислота, глюконовая кислота, галактаровая кислота, глюкогептоновая кислота, гликолевая кислота, глутаминовая кислота, трифторуксусная кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, камфоросульфоновая кислота и нафталин-2-сульфоновая кислота; соли с одним или несколькими ионами металлов, такими как ион лития, ион натрия, ион калия, ион кальция, ион магния, ион цинка и ион алюминия; и соли с аммиаком или аминами, такими как аргинин, лизин, пиперазин, холин, диэтиламин, 4-фенилциклогексиламин, 2-аминоэтанол и бензатин. Эти соли можно получать путем конвертирования из свободных форм общепринятым путем.
[0022] Предпочтительные варианты осуществления соединений по изобретению являются следующими:
В соединениях R2 предпочтительно представляет собой любую структуру из следующей группы формул (IIIB):
[0023] [Формула 17]

Альтернативно в соединениях согласно другому варианту осуществления R2 представляет собой любую структуру из следующей группы формул (IIIa):
[0024] [Формула 18]

В соединениях R2 более предпочтительно представляет собой любую структуру из следующей группы формул (IIIa'):
[0025] [Формула 19]

В соединениях согласно следующим альтернативным вариантам осуществления R2, кроме того, предпочтительно представляет собой любую структур следующей группы формул (IIIb):
[0026] [Формула 20]

В соединениях R3 предпочтительно представляет собой атом водорода или метильную группу, более предпочтительно метильную группу.
Когда R3 представляет собой C1-6 алкильную группу, конфигурация R3 в соединениях предпочтительно представляет собой конфигурацию, соответствующую следующей формуле (IVa):
[0027] [Формула 21]
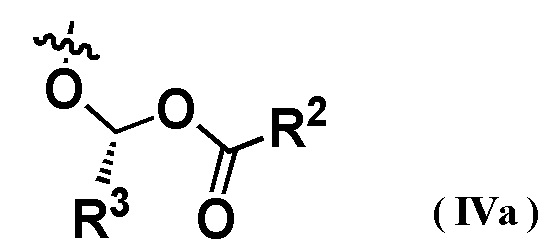
Когда R3 представляет собой метильную группу, конфигурация R3 в соединениях предпочтительно представляет собой конфигурацию, соответствующую следующей формуле (IVb):
[0028] [Формула 22]

Предпочтительные примеры соединений по изобретению включают следующие соединения или их фармацевтически приемлемые соли:
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-фторфенил)метокси]-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-фторфенил)метокси]-2-({[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]метокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-3-[(3,4-дифторфенил)метокси]-6-фтор-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-3-[(3,4-дифторфенил)метокси]-6-фтор-2-({[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]метокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-2-({(1R)-1-[({[(1R,2S,5R)-5-метил-2-(пропан-2-ил)циклогексил]окси}карбонил)окси]этокси}карбонил)-3-пропоксибицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-2-({1-[({[(1S,2R,5S)-5-метил-2-(пропан-2-ил)циклогексил]окси}карбонил)окси]этокси}карбонил)-3-пропоксибицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-фторфенил)метокси]-2-({1-[({[(1S,2R,4S)-1,7,7-триметилбицикло[2.2.1]гептан-2-ил]окси}карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-пропокси-2-({1-[({[(1S,2R,4S)-1,7,7-триметилбицикло[2.2.1]гептан-2-ил]окси}карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-фторфенил)метокси]-2-({1-[({[(1R,2S,4R)-1,7,7-триметилбицикло[2.2.1]гептан-2-ил]окси}карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)-3-{[4-(трифторметил)фенил]метокси}бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(3-фторфенил)метокси]-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-3-[(6-хлорпиридин-2-ил)метокси]-6-фтор-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(1R)-1-(4-фтор-3-метоксифенил)этокси]-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-3-[(5-хлорпиридин-2-ил)метокси]-6-фтор-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-3-[(6-хлорпиридин-3-ил)метокси]-6-фтор-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-метилфенил)метокси]-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-(3-метилбутокси)-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-3-(циклопентилокси)-6-фтор-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(3-фторфенил)метокси]-2-({(1R)-1-[({[(1R,2S,5R)-5-метил-2-(пропан-2-ил)циклогексил]окси}карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-3-[(6-хлорпиридин-2-ил)метокси]-6-фтор-2-({(1R)-1-[({[(1R,2S,5R)-5-метил-2-(пропан-2-ил)циклогексил]окси}карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-2-({[(2,2-диметилпропаноил)окси]метокси}карбонил)-6-фтор-3-[(4-фторфенил)метокси]бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-2-{[(бензоилокси)метокси]карбонил}-6-фтор-3-[(4-фторфенил)метокси]бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-2-({[(циклогексанкарбонил)окси]метокси}карбонил)-6-фтор-3-[(4-фторфенил)метокси]бицикло[3.1.0]гексан-6-карбоновая кислота, и
(1S,2R,3R,5R,6S)-2-амино-3-[(4-фторфенил)метокси]-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота.
Более предпочтительные примеры соединений по изобретению включают следующие соединения или их фармацевтически приемлемые соли:
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-фторфенил)метокси]-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-фторфенил)метокси]-2-({[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]метокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-3-[(3,4-дифторфенил)метокси]-6-фтор-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-3-[(3,4-дифторфенил)метокси]-6-фтор-2-({[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]метокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-2-({(1R)-1-[({[(1R,2S,5R)-5-метил-2-(пропан-2-ил)циклогексил]окси}карбонил)окси]этокси}карбонил)-3-пропоксибицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)-3-{[4-(трифторметил)фенил]метокси}бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(3-фторфенил)метокси]-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-3-[(6-хлорпиридин-2-ил)метокси]-6-фтор-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(1R)-1-(4-фтор-3-метоксифенил)этокси]-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-3-[(5-хлорпиридин-2-ил)метокси]-6-фтор-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-3-[(6-хлорпиридин-3-ил)метокси]-6-фтор-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-метилфенил)метокси]-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-6-фтор-3-(3-метилбутокси)-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
(1R,2R,3R,5R,6R)-2-амино-3-(циклопентилокси)-6-фтор-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота,
и
(1S,2R,3R,5R,6S)-2-амино-3-[(4-фторфенил)метокси]-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота.
[0029] Когда соединения по изобретению образуют гидраты или сольваты, такие гидраты и сольваты также входят в объем настоящего изобретения. Также в объем настоящего изобретения входят фармацевтически приемлемые соли гидратов или сольватов соединений по изобретению.
[0030] Соединения по изобретению охватывают все формы, такие как энантиомеры, диастереомеры, равновесные соединения, их смеси в любых соотношениях и рацематы.
Соединения по изобретению также охватывают соединения, в которых один или несколько атомов водорода, атомов углерода, атомов азота, атомов кислорода или атомов фтора заменены их радиоизотопами или стабильными изотопами. Эти меченые соединения являются пригодными, например, в исследованиях метаболизма и фармакокинетики, или в биологических анализах, в которых их используют в качестве лигандов рецепторов.
Соединения по изобретению можно комбинировать с одним или несколькими фармацевтически приемлемыми носителями, эксципиентами или разбавителями для составления фармацевтических препаратов. Примеры носителей, эксципиентов и разбавителей включают воду, лактозу, декстрозу, фруктозу, сахарозу, сорбит, маннит, полиэтиленгликоль, пропиленгликоль, крахмал, камедь, желатин, альгинат, силикат кальция, фосфат кальция, целлюлозу, водный сироп, метилцеллюлозу, поливинилпирролидон, алкилпарагидроксибензоаты, тальк, стеарат магния, стеариновую кислоту, глицерин и различные масла, такие как кунжутное масло, оливковое масло и соевое масло.
После смешения с такими носителями, эксципиентами или разбавителями и при необходимости обычными добавками, такими как наполнители, связующие вещества, разрыхлители, регуляторы pH или солюбилизаторы, соединения по изобретению можно составлять обычными фармацевтическими способами в пероральные или парентеральные лекарственные средства, такие как таблетки, пилюли, капсулы, гранулы, порошки, растворы, эмульсии, суспензии, мази, инъекционные средства или кожные пластыри, и особенно составлять в качестве пролекарств антагонистов рецепторов метаботропного глутамата группы 2.
Соединения по изобретению можно вводить перорально или парентерально взрослым пациентам в количестве от 0,01 до 500 мг в качестве единственной дозы или разделенными дозами в сутки, однако пероральное введение является предпочтительным с точки зрения простоты лечения и эффективности лекарственного средства. Эту дозировка и количество доз можно увеличивать или уменьшать в зависимости от типа заболевания, подлежащего лечению, возраста, возраста, массы тела и симптома пациентов и т.д.
[0031] Соединения по изобретению (I-A) и (I) не влияют на рецепторы метаботропного глутамата группы 2. Однако каждое из соединений по изобретению (I-A) и (I) гидролизуется in vivo ферментативно или химически в соединение (II)-A, (II)-1, (II)-2 или (II)-3, которое имеет выраженное действие на рецепторы метаботропного глутамата группы 2. Таким образом, соединения по изобретению выполняют функции лекарственных средств, которые действуют на рецепторы метаботропного глутамата группы 2.
Таким образом, соединения по изобретению действуют в качестве пролекарств, которые повышают способность к прохождению через мембрану (например, способность к пероральному всасыванию) активной формы (II)-A, (II)-1, (II)-2 или (II)-3, обладающей антагонистическим эффектом на рецепторы метаботропного глутамата группы 2 и повышают экспозицию активной формы in vivo, таким образом, выступая в качестве средств для предупреждения или лечения состояний, в которые, как считается, вовлечены рецепторы метаботропного глутамата группы 2, такие как расстройства настроения (включая депрессию и биполярное расстройство), тревожное расстройство, когнитивные расстройства, нарушения развития, болезнь Альцгеймера, болезнь Паркинсона, двигательные расстройства, ассоциированные с мышечной ригидностью, расстройства сна, хорея Хантингтона, расстройства питания, наркотическая зависимость, эпилепсия, инфаркт головного мозга, ишемия головного мозга, недостаточность головного мозга, отек головного мозга, нарушения спинного мозга, травма головы, воспаление и иммунные заболевания.
[0032] Репрезентативный процесс получения соединений по изобретению, соответствующих (I-B) и (I), представлен на схеме A ниже. Представленный ниже процесс является примером способов получения соединений по изобретению и ни в коем случае не предназначен для ограничения объема настоящего изобретения. В следующем примере способа получения соединения могут образовывать соли, которые не препятствуют реакции. Активные формы, соответствующие (II)-B и (II), можно получать способом получения, описанным в WO03/061698 или WO2011/061935.
Схема A
[0033] [Формула 23]

[0034] где обозначения являются такими, как определено выше.
[0035] Стадия 1: соединения (II)-B и (II) можно преобразовать в соединение (1) посредством обычной защиты аминогруппы соединения (II) аллилоксикарбонильной группой (см. Protective Groups in Organic Synthesis, fourth edition, John Wiley & Sons, Inc.). Это преобразование можно проводить, например, путем реакции с аллилхлорформиатом в инертном растворителе, таком как углеводородный растворитель (например, бензол, толуол, гексан), галогенированный растворитель (например, дихлорметан, хлороформ, тетрахлорметан), растворитель в виде простого эфира (например, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан), амидный растворитель (например, N,N-диметилформамид, N-метил-2-пирролидинон), диметилсульфоксид, вода или любая их смесь, в присутствии или в отсутствие органического основания (например, триэтиламин, пиридин, N-метилморфолин, диизопропилэтиламин, 4-(N,N-диметиламино)пиридин, 2,6-ди-трет-бутилпиридин) или неорганического основания (например, карбонат калия, карбонат натрия, бикарбонат натрия).
[0036] Стадия 2: соединение (1) можно подвергать реакции с аллилхлорформиатом в инертном растворителе, таком как галогенированный растворитель (например, дихлорметан), растворитель в виде простого эфира (например, тетрагидрофуран) или диметилсульфоксид, в присутствии органического основания (например, трибутиламин, триэтиламин, диизопропилэтиламин, пиридин, N-метилморфолин), а затем преобразовать в соединение (2) путем присоединения N,N-диметил-4-аминопиридина. Альтернативно соединение (1) также можно преобразовать в соединение (2) путем реакции карбоксигруппы соединения (1) с аллиловым спиртом посредством обычной этерификации (см. Comprehensive Organic Transformations, Second Edition, 1999, John Wiley & Sons, Inc.).
[0037] Стадия 3: соединение (2) можно преобразовать в соединение (3) посредством реакции с соединением формулы L-CH(R3)-O-C(O)-R2 (где L представляет собой уходящую группу, такую как атом галогена, п-толуолсульфонилоксигруппа, метансульфонилоксигруппа или трифторметансульфонилоксигруппа) в присутствии или в отсутствие подходящего активатора, такого как йодид натрия, в инертном растворителе, таком как углеводородный растворитель (например, бензол, толуол, гексан, циклогексан), галогенированный растворитель (например, дихлорметан, хлороформ, тетрахлорметан), растворитель в виде простого эфира (например, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан), амидный растворитель (например, N,N-диметилформамид, N-метил-2-пирролидинон), диметилсульфоксид, вода или любая их смесь, в присутствии неорганического основания (например, гидрид натрия, гидрид калия, карбонат калия, карбонат натрия, бикарбонат натрия, карбонат цезия, бикарбонат цезия, гидроксид натрия, гидроксид калия), амида металла (например, бис(триметилсилил)амид лития, диизопропиламид лития, амид натрия), органического основания (например, триэтиламин, пиридин, диизопропилэтиламин, 4-(N,N-диметиламино)пиридин, 2,6-ди-трет-бутилпиридин) или основания (например, трет-бутоксид калия). Предпочтительно, соединение (2) можно преобразовать в соединение (3) посредством реакции с с соединением, соответствующим формуле Cl-CH(R3)-O-C(O)-R2 или Br-CH(R3)-O-C(O)-R2, в смешанном растворителе из хлороформа и воды в присутствии карбоната калия и сульфата тетрабутиламмония при температуре от комнатной температуры до 80°C в течение от 2 часов до 1 суток.
[0038] Стадия 4: соединение (3) можно преобразовать в соединение (I), соединение по изобретению, посредством обычного удаления защитной группы (см. Protective Groups in Organic Synthesis, fourth edition, John Wiley & Sons, Inc.). Это преобразование можно проводить, например, путем удаления защитной группы из аллильной группы и аллилоксикарбонильной группы в присутствии палладиевого катализатора с нулевой валентностью, такого как тетракис(трифенилфосфин)палладий(0) и реагента для регенерации металлического катализатора, такого как 1,3-диметилбарбитуровая кислота, например, в инертном растворителе, таком как углеводородный растворитель (например, бензол, толуол, гексан), галогенированный растворитель (например, дихлорметан, хлороформ, тетрахлорметан), простой эфирный растворитель (например, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан) или любая их смесь. Предпочтительно, соединение (3) можно преобразовать в соединения по изобретению (I-B) и (I) посредством реакции, проводимой в хлороформе в присутствии тетракис(трифенилфосфин)палладия(0) и 1,3-диметилбарбитуровой кислоты при температуре от комнатной температуры до 50°C в течение от 2 до 8 часов.
[0039] Репрезентативный способ получения соединений, соответствующих (II)-C, которые являются активными формами соединений по изобретению, соответствующих (I-C), представлен на схеме B ниже. Приведенный ниже способ является примером способа получения для соединений по изобретению и ни в коем случае не предназначен для ограничения объема настоящего изобретения. В приведенном ниже примере способа получения соединения могут образовывать соли, которые не препятствуют реакции.
Схема B
[Формула 24]
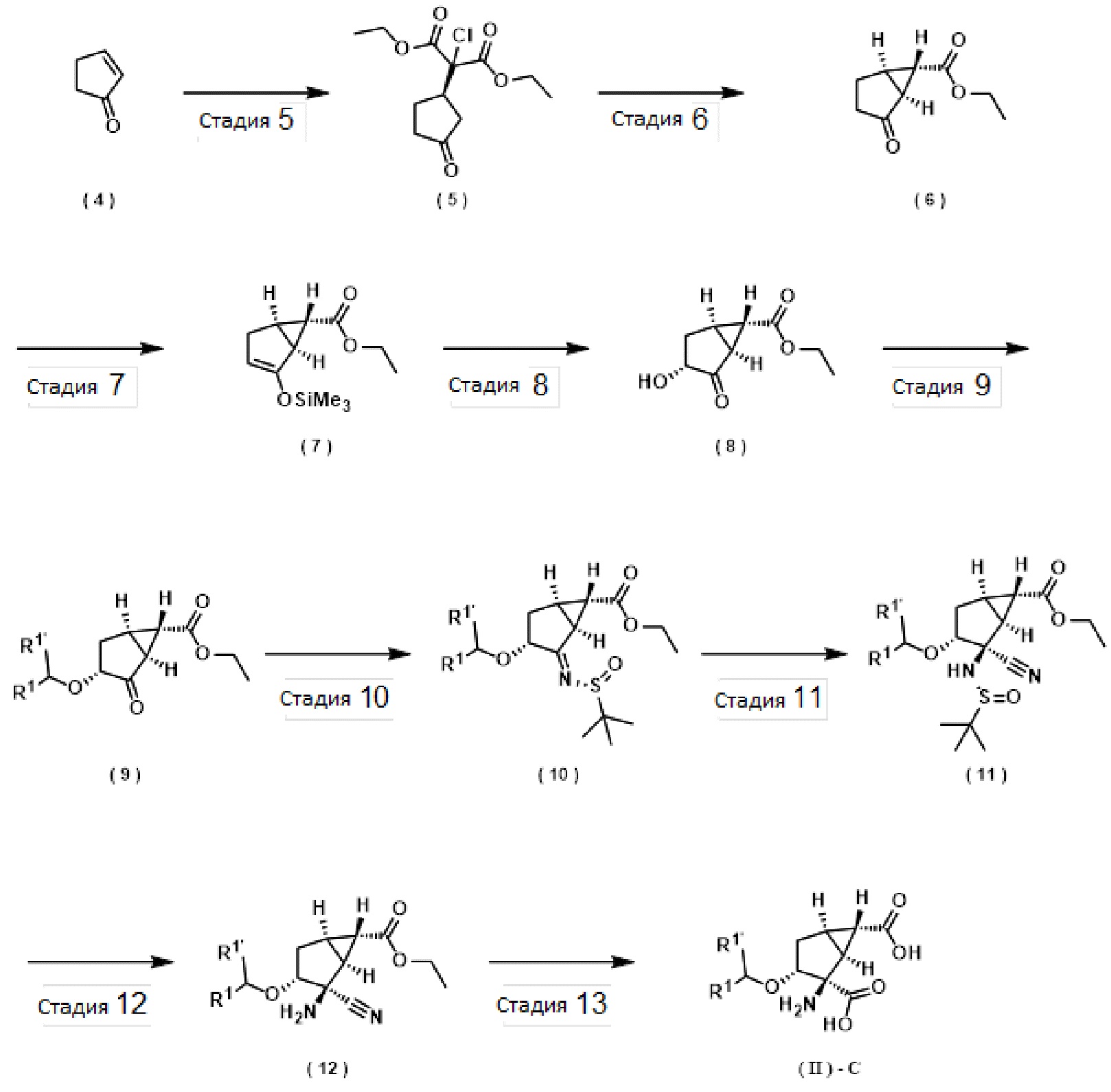
[0040] где обозначения являются такими, как определено выше.
[0041] В способе получения, показанному в рамках настоящего изобретения, соединение (4) можно преобразовать в оптически активное соединение по изобретению (6) за 2 стадии посредством каталитической асимметричной реакции присоединения Майкла и последующей реакции циклизации, вовлекающей удаление этоксикарбонила. Соединение (6) также можно синтезировать в соответствии со следующими работами (см. Tetrahedron Asymmetry, 1997, 511-514; Chem. Eur. J., 2006, 12, 568-575; J. Org. Chem., 2008, 73, 3078-3087; и Tetrahedron Asymmetry, 2010, 1486-1493).
[0042] Стадия 5: соединение (4) можно преобразовать в соединение (5) посредством асимметричной реакции присоединения Майкла. Например, суспензию, содержащую асимметричный катализатор, приготавливают в инертном растворителе, таком как углеводородный растворитель (например, бензол, толуол, гексан), галогенированный растворитель (например, дихлорметан, хлороформ, тетрахлорметан, бензотрифторид), растворитель на основе простого эфира (например, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан), амидный растворитель (например, N,N-диметилформамид, N-метил-2-пирролидинон), диметилсульфоксид или любая их смесь, в присутствии или в отсутствие вспомогательного реагента (например, алюмогидрид лития, (R)-(+)-1,1-би-2-нафтол, молекулярные сита 4A), а затем соединение (4) можно преобразовать в соединение (5) посредством реакции с диэтилхлормалонатом в присутствии или в отсутствие органического основания (например, триэтиламин, пиридин, N-метилморфолин, диизопропилэтиламин, 4-(N,N-диметиламино)пиридин, 2,6-ди-трет-бутилпиридин, трет-бутоксид калия) или неорганического основания (например, карбонат калия, карбонат натрия, бикарбонат натрия) и т.д. Предпочтительно, суспензию, содержащую асимметричный катализатор, получают посредством реакции при от 0 до 70°C в течение от 30 минут до 1 суток в тетрагидрофуране в присутствии алюмогидрида лития и (R)-(+)-1,1-би-2-нафтола, а затем соединение (4) можно преобразовать в соединение по изобретению (5) посредством реакции с диэтилхлормалонатом в присутствии молекулярных сит 4A и карбоната натрия при температуре от 0 до 70°C в течение от 30 минут до 1 суток (см. Angew. Chem., Int. Ed. Engl., 1996, 35, 104-106; и Tetrahedron, 2002, 58, 2585-2588).
[0043] Стадия 6: соединение (5) можно преобразовать в соединение (6) посредством реакции циклизации, вовлекающей удаление этоксикарбонила. Это преобразование можно проводить, например, посредством реакции с неорганической солью (например, хлорид лития, хлорид натрия, цианид натрия, цианид калия, бромид натрия, йодид лития, йодид натрия, карбонат лития, карбонат калия, карбонат натрия, фосфат натрия) или органической солью (например, ацетат тетраметиламмония), в инертном растворителе, таком как спиртовой растворитель (например, метанол, этанол, 2-пропанол, трет-бутиловый спирт, 2,2,2-трифторэтанол, 1,1,1,3,3,3-гексафтор-2-пропанол), углеводородный растворитель (например, бензол, толуол, гексан), галогенированный растворитель (например, дихлорметан, хлороформ, тетрахлорметан, бензотрифторид), растворитель в виде простого эфира (например, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан), амидный растворитель (например, N,N-диметилформамид, N-метил-2-пирролидинон), диметилсульфоксид, вода или любая их смесь, в присутствии или в отсутствие кислоты (например, уксусная кислота, лимонная кислота, муравьиная кислота). Предпочтительно, соединение (5) можно преобразовать в соединение по изобретению (6) посредством реакции с хлоридом лития в растворителе на основе N-метил-2-пирролидинона в присутствии уксусной кислоты при температуре от 0 до 180°C в течение от 30 минут до 1 суток (см. J. Org. Chem., 1978, 43, 138-147; и Org. Process Res. Dev., 2012, 16, 129-140).
[0044] Стадия 7: соединение (6) можно преобразовать в соединение (7) посредством реакции с силилирующим агентом. Это преобразование можно проводить, например, посредством реакции с органическим основанием (например, триэтиламин, диизопропилэтиламин, N-метилморфолин, диазабициклоундецен, диазабициклононен, пиридин), основанием на основе амида металла (например, диизопропиламид лития, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия), основанием на основе гидрида щелочного металла (например, гидрид натрия, гидрид калия) и силилирующим агентом (например, хлортриметилсилан, бромтриметилсилан, йодтриметилсилан, триметилсилилтрифторметансульфонат) в инертном растворителе, таком как углеводородный растворитель (например, бензол, толуол, гексан), галогенированный растворитель (например, дихлорметан, хлороформ, тетрахлорметан, бензотрифторид), растворитель на основе простого эфира (например, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан), амидный растворитель (например, N,N-диметилформамид, N-метил-2-пирролидинон), диметилсульфоксид, вода или любая их смесь, в присутствии или в отсутствии вспомогательного реагента (например, йодид натрия, йодид калия, йодид тетрабутиламмония, бромид натрия, бромид калия). Предпочтительно, соединение (6) можно преобразовать в соединение по изобретению (7) посредством реакции с триэтиламином и триметилсилилтрифторметансульфонатом в растворителе толуоле при от -20 до 80°C в течение от 30 минут до 1 суток (см. J. Med. Chem., 2000, 43, 4893-4909; и Bioorg. Med. Chem., 2002, 10, 433-436).
[0045] Стадия 8: соединение (7) можно преобразовать в соединение (8) посредством реакции с окислителем. Это преобразование можно проводить, например, посредством реакции с перкислотой (например, 3-хлорпербензойная кислота, пербензойная кислота, монопероксифталевая кислота, магниевая соль монопероксифталевой кислоты, перуксусная кислота); пероксидом водорода в присутствии катализатора (например, метилтриоксорений или трис(цетилпиридиний)пероксовольфрамофосфат (PCWP)); пероксидом водорода в присутствии нитрильного соединения (например, трихлорацетонитрил или ацетонитрил); пероксидом водорода в присутствии нитрильного соединения (например, трихлорацетонитрил или ацетонитрил) и кетонового соединения (например, ацетон); оконом (2KHSO5⋅KHSO4⋅K2SO4) в присутствии кетонового соединения (например, ацетон); или окислителем, таким как диметилдиоксиран, трет-бутилгидропероксид, тетроксид осмия и N-метилморфолин-N-оксид, тетраацетат свинца, йодосилбензол и комплекс трифторид бора-диэтиловый эфир, хромилхлорид, или озон, в инертном растворителе, таком как углеводородный растворитель (например, бензол, толуол, гексан), галогенированный растворитель (например, дихлорметан, хлороформ, тетрахлорметан, бензотрифторид), растворитель на основе простого эфира (например, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан), амидный растворитель (например, N,N-диметилформамид, N-метил-2-пирролидинон), диметилсульфоксид, ацетонитрил, вода или любая их смесь, в присутствии или в отсутствие вспомогательного реагента (например, бикарбонат натрия, бикарбонат калия, карбонат калия, карбонат натрия, гидроксид кальция, дигидрофосфат калия, гидрофосфат калия, дигидрофосфат натрия, гидрофосфат натрия, пиридин, уксусная кислота) (см. Organic Reactions, 2003, 62, 1-356). Предпочтительно, соединение (7) можно преобразовать в соединение по изобретению (8) посредством реакции с метилтриоксорением и пероксидом водорода в растворителе ацетонитрили в присутствии пиридина и уксусной кислоты при от -20 до 80°C в течение от 30 минут до 1 суток.
[0046] Стадия 9: соединение (8) можно преобразовать в соединение (9) посредством реакции с алкилирующим средством. Это преобразование можно проводить посредством реакции с соединением, соответствующим формуле R1R5CHOC(=NH)CCl3, в инертном растворителе, таком как углеводородный растворитель (например, бензол, толуол, гексан, циклогексан), галогенированный растворитель (например, дихлорметан, хлороформ, тетрахлорметан), растворитель на основе простого эфира (например, тетрагидрофуран, тетрагидропиран, диэтиловый эфир, 1,2-диметоксиэтан), амидный растворитель (например, N,N-диметилформамид, N-метил-2-пирролидинон), диметилсульфоксид, вода или любая их смесь, в присутствии кислоты Брэнстеда (например, трифторметансульфоновая кислота, бистрифторметанфторметансульфонимид, трифторуксусная кислота, хлористоводородная кислота, перхлорная кислота) или кислоты Льюиса (например, комплекс трифторид бора-диэтиловый эфир, хлорид цинка, хлорид олова, триметилсилилтрифторметансульфонат, трифторметансульфонат скандия(III), трифторметансульфонат иттербия(III)). Соединение, соответствующее формуле R1R5CHOC(=NH)CCl3, можно получать посредством реакции спирта, соответствующего формуле R1R5CHOH, с трихлорацетонитрилом в присутствии основания в соответствии с описанными в литературе способами (см. J. Chem. Soc., Perkin Trans. 1, 1985, 2247-2250; и Tetrahedron Lett., 1996, 37, 1481-1484). Предпочтительно, соединение (8) можно преобразовать в соединение (9) посредством реакции с соединением, соответствующим формуле R1R5CHOC(=NH)CCl3, в растворителе тетрагидропиране в присутствии трифторметансульфоновой кислоты при от -20 до 50°C в течение от 30 минут до 1 суток (см. J. Chem. Soc., Chem. Commun. 1981, 1240-1241; и J. Chem. Soc., Perkin Trans. 1, 1985, 2247-2250).
Альтернативно преобразование можно проводить посредством реакции с соединением, соответствующим формуле R1R5CH-X, в присутствии или в отсутствие подходящего активатора, такого как йодид тетрабутиламмония, в инертном растворителе, таком как углеводородный растворитель (например, бензол, толуол, гексан, циклогексан), галогенированный растворитель (например, дихлорметан, хлороформ, тетрахлорметан), растворитель на основе простого эфира (например, тетрагидрофуран, тетрагидропиран, диэтиловый эфир, 1,2-диметоксиэтан), амидный растворитель (например, N,N-диметилформамид, N-метил-2-пирролидинон), диметилсульфоксид, вода или любая их смесь, в присутствии неорганического основания (например, гидрид натрия, гидрид калия, карбонат калия, карбонат натрия, карбонат цезия, бикарбонат калия, бикарбонат натрия, гидроксид натрия, гидроксид калия, оксид серебра(I), карбонат серебра(I), трифторметансульфонат серебра(I)), основания на основе амида металла (например, диизопропиламид лития, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия), органического основания (например, триэтиламин, диизопропилэтиламин, N-метилморфолин, диазабициклоундецен, диазабициклононен, пиридин, 4-диметиламинопиридин) или алкоксидного основания (например, трет-бутоксид калия, трет-пентоксид натрия, трет-пентоксид калия). В этом контексте X обозначает уходящую группу, отличную от OC(=NH)CCl3, например, атом хлора, атом брома, атом йода, п-толуолсульфонилоксигруппу, п-бромбензолсульфонилоксигруппу, п-хлорбензолсульфонилоксигруппу, п-нитробензолсульфонилоксигруппу, бензолсульфонилоксигруппу, метансульфонилоксигруппу или трифторметансульфонилоксигруппу. Предпочтительно, соединение (8) можно преобразовать в соединение (9) посредством реакции с соединением, соответствующим формуле R1R5CH-Cl, в растворителе хлороформе в присутствии карбоната серебра(I), трифторметансульфоната серебра(I) и йодид тетрабутиламмония при от -20 до 50°C в течение от 30 минут до 1 суток.
[0047] Стадия 10: соединение (9) можно преобразовать в соединение (10) посредством реакции дегидратирующей конденсации с оптически активным сульфинамидом. Это преобразование можно проводить, например, посредством реакции с (R)-2-метил-2-сульфинамидом в инертном растворителе, таком как спиртовой растворитель (например, метанол, этанол, 2-пропанол, трет-бутиловый спирт, 2,2,2-трифторэтанол, 1,1,1,3,3,3-гексафтор-2-пропанол), углеводородный растворитель (например, бензол, толуол, гексан), галогенированный растворитель (например, дихлорметан, хлороформ, тетрахлорметан, бензотрифторид), растворитель на основе простого эфира (например, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан), амидный растворитель (например, N,N-диметилформамид, N-метил-2-пирролидинон), диметилсульфоксид, вода или любая их смесь, в присутствии кислоты Льюиса (например, изопропоксид титана(IV), метоксид титана(IV), этоксид титана(IV), пропоксид титана(IV), бутоксид титана(IV)). Предпочтительно, соединение (9) можно преобразовать в соединение по изобретению (10) посредством реакции с (R)-2-метил-2-сульфинамидом в растворителе тетрагидрофуране в присутствии этоксида титана(IV) при от 0 до 80°C в течение от 30 минут до 1 суток.
[0048] Стадия 11: соединение (10) можно преобразовать в соединение (11) посредством реакции присоединения циано (см. Chem. Rev., 2011, 111, 6947-6983). Это преобразование можно проводить, например, посредством реакции присоединения с цианирующим агентом (например, триметилсилилцианид, цианистоводородная кислота, цианид натрия, цианид калия, ацетонцианогидрин, диэтилцианофосфонат, цианид диэтилалюминия, трет-бутилдиметилсилилцианид, цианид трибутилолова) в инертном растворителе, таком как спиртовой растворитель (например, метанол, этанол, 2-пропанол, трет-бутиловый спирт, 2,2,2-трифторэтанол, 1,1,1,3,3,3-гексафтор-2-пропанол), углеводородный растворитель (например, бензол, толуол, гексан), галогенированный растворитель (например, дихлорметан, хлороформ, тетрахлорметан, бензотрифторид), растворитель на основе простого эфира (например, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан), амидный растворитель (например, N,N-диметилформамид, N-метил-2-пирролидинон), диметилсульфоксид, вода или любая их смесь, в присутствии или в отсутствие неорганического основания (например, фторид цезия, фторид калия, фторид натрия), основания на основе амида металла (например, диизопропиламид лития, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия), органического основания (например, триэтиламин, диизопропилэтиламин, N-метилморфолин, диазабициклоундецен, диазабициклононен, пиридин, 4-диметиламинопиридин) или алкоксидного основания (например, трет-бутоксид калия, трет-пентоксид натрия, трет-пентоксид калия). Предпочтительно, соединение (10) можно преобразовать в соединение по изобретению (11) посредством реакции с триметилсилилцианидом в растворителе тетрагидрофуране в присутствии фторида цезия при от -20 до 80°C в течение от 30 минут до 1 суток.
[0049] Стадия 12: соединение (11) можно преобразовать в соединение (12) посредством реакции с кислотным катализатором. Это преобразование можно проводить, например, посредством реакции с кислотой Брэнстеда (например, трифторметансульфоновая кислота, бистрифторметанфторметансульфонимид, трифторуксусная кислота, хлористоводородная кислота, перхлорная кислота) или кислотой Льюиса (например, комплекс трифторид бора-диэтиловый эфир, хлорид цинка, хлорид олова, триметилсилилтрифторметансульфонат, трифторметансульфонат скандия(III), трифторметансульфонат иттербия(III)) в инертном растворителе, таком как спиртовой растворитель (например, метанол, этанол, 2-пропанол, трет-бутил спирт, 2,2,2-трифторэтанол, 1,1,1,3,3,3-гексафтор-2-пропанол), углеводородный растворитель (например, бензол, толуол, гексан, циклогексан), галогенированный растворитель (например, дихлорметан, хлороформ, тетрахлорметан), растворитель на основе простого эфира (например, тетрагидрофуран, тетрагидропиран, диэтиловый эфир, 1,2-диметоксиэтан), амидный растворитель (например, N,N-диметилформамид, N-метил-2-пирролидинон), диметилсульфоксид, вода или любая их смесь. Предпочтительно, соединение (11) можно преобразовать в соединение (12) посредством реакции с раствором хлористоводородная кислота/этанол в растворителе тетрагидрофуране при от -20 до 50°C в течение от 30 минут до 1 суток.
[0050] Стадия 13: соединение (12) можно преобразовать в соединение (II)-C посредством реакции с пероксидом водорода и основанием (например, гидроксид лития, гидроксид натрия, гидроксид калия, карбонат калия, карбонат натрия, гидроксид аммония, фосфат натрия) или их водным раствором в присутствии инертного растворителя (например, диметилсульфоксид). Предпочтительно, соединение (12) можно преобразовать в соединение (II)-C посредством реакции с пероксидом водорода и водным раствором гидроксида натрия в присутствии диметилсульфоксид при от 0 до 100°C в течение от 30 минут до 1 суток (см. Synthesis, 1989, 949-950; и Bull. Chem. Soc. Jpn., 1981, 54, 793-799).
[0051] Репрезентативный способ получения соединений по изобретению, соответствующих (I-C), представлен на схеме C ниже. Представленный ниже способ является примером способов получения соединений по изобретению и никоим образом не ограничивает объем настоящего изобретения. В следующем примере способов получения соединения могут образовывать соли, которые не препятствуют реакции.
Схема C
[Формула 25]

[0052] где обозначения являются такими, как определено выше.
[0053] Стадия 14: соединение (II)-C можно преобразовать в соединение (13) посредством обычной защиты аминогруппы соединения (II)-C аллилоксикарбонильной группой (см. Protective Groups in Organic Synthesis, fourth edition, John Wiley & Sons, Inc.). Это преобразование можно проводить, например, посредством реакции с аллилхлорформиатом в инертном растворителе, таком как углеводородный растворитель (например, бензол, толуол, гексан), галогенированный растворитель (например, дихлорметан, хлороформ, тетрахлорметан), растворитель на основе простого эфира (например, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан), амидный растворитель (например, N,N-диметилформамид, N-метил-2-пирролидинон), диметилсульфоксид, вода или любая их смесь, в присутствии или в отсутствие органического основания (например, триэтиламин, пиридин, N-метилморфолин, диизопропилэтиламин, 4-(N,N-диметиламино)пиридин, 2,6-ди-трет-бутилпиридин) или неорганической соли (например, карбонат калия, карбонат натрия, бикарбонат натрия).
[0054] Стадия 15: соединение (13) можно подвергать реакции с аллилхлорформиатом в инертном растворителе, таком как галогенированный растворитель (например, дихлорметан), растворитель на основе простого эфира (например, тетрагидрофуран) или диметилсульфоксид, в присутствии органического основания (например, трибутиламин, триэтиламин, диизопропилэтиламин, пиридин, N-метилморфолин), а затем преобразовать в соединение (14) посредством присоединения N,N-диметил-4-аминопиридина. Альтернативно соединение (13) также можно преобразовать в соединение (14) посредством реакции карбоксигруппы соединения (13) с аллиловым спиртом посредством обычной этерификации (см. Comprehensive Organic Transformations, Second Edition, 1999, John Wiley & Sons, Inc.).
[0055] Стадия 16: соединение (14) можно преобразовать в соединение (15) посредством реакции с соединением формулы L-CH(R3)-O-C(O)-R2 (где L представляет собой уходящую группу, такую как атом галогена, п-толуолсульфонилоксигруппа, метансульфонилоксигруппа или трифторметансульфонилоксигруппа) в присутствии или в отсутствие подходящего активатора, такого как йодид натрия, в инертном растворителе, таком как углеводородный растворитель (например, бензол, толуол, гексан, циклогексан), галогенированный растворитель (например, дихлорметан, хлороформ, тетрахлорметан), растворитель на основе простого эфира (например, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан), амидный растворитель (например, N,N-диметилформамид, N-метил-2-пирролидинон), диметилсульфоксид, вода или любая их смесь, в присутствии неорганического основания (например, гидрид натрия, гидрид калия, карбонат калия, карбонат натрия, бикарбонат натрия, карбонат цезия, бикарбонат цезия, гидроксид натрия, гидроксид калия), амида металла (например, бис(триметилсилил)амид лития, диизопропиламид лития, амид натрия), органического основания (например, триэтиламин, пиридин, диизопропилэтиламин, 4-(N,N-диметиламино)пиридин, 2,6-ди-трет-бутилпиридин) или основания (например, трет-бутоксид калия). Предпочтительно, соединение (14) можно преобразовать в соединение (15) посредством реакции с соединением, соответствующим формуле Cl-CH(R3)-O-C(O)-R2 или Br-CH(R3)-O-C(O)-R2, в смешанном растворителе из хлороформа и воды в присутствии карбоната калия и гидросульфата тетрабутиламмония при температуре от комнатной температуры до 80°C в течение от 2 часов до 1 суток.
[0056] Стадия 17: соединение (15) можно преобразовать в соединение по изобретению (I-C) посредством обычного удаления защитной группы (см. Protective Groups in Organic Synthesis, fourth edition, John Wiley & Sons, Inc.). Это преобразование можно проводить, например, посредством удаления защитной группы из аллильной группы и аллилоксикарбонильной группы в присутствии палладиевого катализатора с нулевой валентностью, такого как тетракис(трифенилфосфин)палладий(0) и реагента для регенерации металлического катализатора, такого как 1,3-диметилбарбитуровая кислота, в инертном растворителе, например, таком как углеводородный растворитель (например, бензол, толуол, гексан), галогенированный растворитель (например, дихлорметан, хлороформ, тетрахлорметан), растворитель на основе простого эфира (например, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан) или любая их смесь. Предпочтительно, соединение (15) можно преобразовать в соединение по изобретению (I-C) посредством реакции, проводимой в хлороформе в присутствии тетракис(трифенилфосфин)палладия(0) и 1,3-диметилбарбитуровой кислоты при температуре от комнатной температуры до 50°C в течение от 2 до 8 часов.
[0057] Настоящее изобретение более подробно описано ниже с помощью примеров и тестов, которые не предназначены для ограничения объема изобретения и могут быть модифицированы при условии, что не происходит отклонения от объема изобретения.
[0058] "Grace", использованная при очистке колоночной хроматографией в примерах ниже представляет собой кассету Reveleris Silica Flash Cartridge от W.R. Grace & Co. Использованная "YMC C18" представляет собой YMC-DispoPack AT ODS-25 от YMC Co., Ltd.
[0059] Колонки от Daicel Corp., скорости потока, и время анализа и разделения, использованные для разделения диастереомеров хиральной колоночной хроматографией в приведенных ниже примерах представлены ниже.
CHIRAL PAK IC-3: размер частиц: 3 мкм, внутренний диаметр: 4,6 мм, длина: 150 мм, скорость потока: 1,0 мл/мин.
CHIRAK PAK ID-3: размер частиц: 3 мкм, внутренний диаметр: 4,6 мм, длина: 150 мм, скорость потока: 1,0 мл/мин.
CHIRAK PAK AY-3: размер частиц: 3 мкм, внутренний диаметр: 4,6 мм, длина: 150 мм, скорость потока: 1,0 мл/мин.
CHIRAL PAK IC: размер частиц: 5 мкм, внутренний диаметр: 20 мм, длина: 250 мм, скорость потока: 10 мл/мин.
CHIRAL PAK ID: размер частиц: 5 мкм, внутренний диаметр: 20 мм, длина: 250 мм, скорость потока: 10 мл/мин.
[0060] В примерах получения и примерах ниже очистку препаративной высокоэффективной жидкостной хроматографией (ВЭЖХ) проводили в следующих условиях:
Устройство: Trilution LC from Gilson, Inc.
Колонка: YMC-Actus Triant from YMC Co., Ltd., 5,0 мкм, 50×30 мм
Растворитель: раствор A; вода, содержащая 0,1% трифторуксусную кислоту, раствор B; ацетонитрил, содержащий 0,1% трифторуксусную кислоту, или раствор A; вода, содержащая 0,1% муравьиную кислоту, раствор B; ацетонитрил, содержащий 0,1% муравьиную кислоту
Градиент: 0 мин (раствор A/раствор B=90/10), 11 мин (раствор A/раствор B=20/80), от 12 до 13,5 мин (раствор A/раствор B=5/95)
Скорость потока: 40 мл/мин
[0061] Показания приборов, представленные в примерах ниже, были получены с использованием следующих устройств.
Спектр MS: LCMS-IT-TOF (двойной источник ESI/APCI) (Shimadzu Corp.), 1290 Infinity и 6130 Quadrupole LC/MS (Agilent Technologies, Inc.)
Спектр ЯМР [1H-ЯМР]: 600 МГц; JNM-ECA600 (JEOL Ltd.), 400 МГц; AVENCEIIIHD 400 (Bruker Corp.)
Рентгеноструктурный анализ: R-AXIS RAPID II (Rigaku Corp.)
Сокращения, использованные в примерах для демонстрации спектров ядерного магнитного резонанса (NMR) являются следующими:
с: синглет, д: дублет, т: триплет, кв: квартет, секст: секстет, дд: двойной дублет, ддд: дублет дублет дублет, дт: дублет триплет, тд: триплет дублет, квд: квартет дублет, м: мультиплет, ушир.: уширенный, J: константа связывания, Гц: Герц, ХЛОРОФОРМ-d: дейтерированный хлороформ, DMSO-d6: дейтерированный диметилсульфоксид, MeOH-d4: дейтерированный метанол
[0062] В справочном примере и примерах ниже, наименования соединениям были даны с использованием ACD/Name 2015 (ACD/Labs 2015, Advanced Chemistry Development Inc.).
[0063] В справочном примере и примерах, термины и реагенты, приведенные ниже, обозначены следующим образом:
MgSO4 (сульфат магния), Na2SO4 (безводный сульфат натрия), NaHCO3 (бикарбонат натрия), NH4Cl (хлорид аммония), DMF (N,N-диметилформамид), EtOAc (этилацетат), CHCl3 (хлороформ), THF (тетрагидрофуран), MeOH (метанол), EtOH (этанол), IPA (изопропиловый спирт), H2O (вода), Pd(PPh3)4[тетракис(трифенилфосфин)палладий(0)], рассол (насыщенный солевой раствор), HCl (хлористоводородная кислота).
[0064] Пример 1 Синтез (1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-фторфенил)метокси]-2-({(1R)-1-[({[(1R,2S,5R)-5-метил-2-(пропан-2-ил)циклогексил]окси}карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновой кислоты
[0065] [Формула 26]

[0066] (1) (1R,2R,3R,5R,6R)-6-фтор-3-[(4-фторфенил)метокси]-2-({[(проп-2-ен-1-ил)окси]карбонил}амино)бицикло[3.1.0]гексан-2,6-дикарбоновая кислота
[0067] [Формула 27]

К раствору соединения (II)-1 (1,5 г, 4,58 ммоль) (см. WO03/061698) в 1,4-диоксане (9,2 мл) добавляли насыщенный водный раствор NaHCO3 (16 мл, 18,32 ммоль) и смесь перемешивали при комнатной температуре в течение 10 минут. Капельно добавляли аллилхлорформиат (0,96 мл, 9,17 ммоль) и смесь перемешивали при комнатной температуре в течение 18 часов. Раствор подщелачивали добавлением воды и насыщенного водного раствора NaHCO3, а затем промывали EtOAc. Затем раствор подкисляли добавлением к водному слою 2 M хлористоводородной кислоты, а затем проводили экстракцию с использованием EtOAc. Затем органический слой сушили над Na2SO4. Нерастворимые вещества отфильтровывали, фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,9 г) (коричневое аморфное вещество).
1H ЯМР (600 МГц, DMSO-d6) δ м.д. 2,05-2,11 (1H, м), 2,13-2,21 (1H, м), 2,31-2,37 (1H, м), 2,51-2,52 (1H, м), 2,68-2,74 (1H, м), 3,31 (1H, с), 4,05-4,10 (1H, м), 4,39-4,52 (3 H, м), 4,57-4,64 (1H, м), 5,16-5,24 (1H, м), 5,28-5,36 (1H, м), 5,84-5,96 (1H, м), 7,12-7,17 (2H, м), 7,29-7,34 (2H, м), 8,14 (1H, с)
MS m/z: 434 [M+Na]+
[0068] (2) (1R,2R,3R,5R,6R)-6-фтор-3-[(4-фторфенил)метокси]-6-{[(проп-2-ен-1-ил)окси]карбонил}-2-({[(проп-2-ен-1-ил)окси]карбонил}амино)бицикло[3.1.0]гексан-2-карбоновая кислота
[0069] [Формула 28]

К раствору соединения (0,95 г, 2,31 ммоль), полученного на стадии (1), и N-метилморфолина (0,38 мл, 3,46 ммоль) в THF (10 мл), капельно добавляли аллилхлорформиат (0,36 мл, 3,46 ммоль) при 0°C и смесь перемешивали в течение 30 минут. Добавляли N,N-диметил-4-аминопиридин (0,070 г, 0,58 ммоль) и смесь нагревали до комнатной температуры и перемешивали 2,5 часов. Раствор подкисляли добавлением воды и 2 M хлористоводородной кислоты, а затем проводили экстракцию с использованием EtOAc. Органический слой сушили над Na2SO4. Нерастворимые вещества отфильтровывали, фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,0 г) (коричневое аморфное вещество).
1H ЯМР (600 МГц, ХЛОРОФОРМ-d) δ м.д. 2,20-2,28 (1H, м), 2,35-2,47 (2H, м), 2,91-3,07 (1H, м), 3,83-3,92 (1H, м), 4,43-4,69 (6H, м), 5,11-5,37 (5H, м), 5,83-5,96 (2H, м), 6,95-7,03 (2H, м), 7,20-7,24 (2H, м)
MS m/z: 474 [M+Na]+
[0070] (3) (1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-фторфенил)метокси]-2-({(1R)-1-[({[(1R,2S,5R)-5-метил-2-(пропан-2-ил)циклогексил]окси}карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота (Пример 1)
[0071] [Формула 29]

К раствору соединения (0,30 г, 0,66 ммоль), полученного на стадии (2) в DMF (3,3 мл) добавляли K2CO3 (0,096 г, 0,70 ммоль) и 18-краун-6 (0,15 мл, 0,70 ммоль). Добавляли (1R)-1-хлорэтил (1R,2S,5R)-5-метил-2-(пропан-2-ил)циклогексилкарбонат (см. WO2013/180271) (0,42 г, 1,59 ммоль) и смесь перемешивали при комнатной температуре в течение 18 часов. Реакционный раствор капельно добавляли к насыщенному водному раствору NH4Cl, а затем проводили экстракцию с использованием EtOAc. Органический слой промывали рассолом. После сушки над Na2SO4 нерастворимые вещества отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (Grace 12g, н-гексан/EtOAc=от 95/5 до 60/40) и (Grace 12g, н-гексан/EtOAc=от 95/5 до 80/20) с получением бесцветного масла (0,31 г). Это масло растворяли в CHCl3 (2,3 мл). К раствору добавляли 1,3-диметилбарбитуровую кислоту (0,072 г, 0,46 ммоль) и Pd(PPh3)4 (0,013 г, 0,01 ммоль) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор концентрировали при пониженном давлении и остаток очищали обращено-фазовой колоночной хроматографией на силикагеле (YMC C18 12g, H2O/MeCN=от 95/5 до 5/95). Фракцию концентрировали. К полученному остатку добавляли MeOH и смесь перемешивали при комнатной температуре в течение 1 часа. Затем полученные кристаллы собирали фильтрацией с получением указанного в заголовке соединения (0,097 г) (бесцветное твердое вещество).
1H ЯМР (600 МГц, DMSO-d6) δ м.д. 0,69-0,90 (10H, м), 0,92-1,08 (1H, м), 1,32-1,46 (5H, м), 1,62 (2H, ушир. д, J=11,6 Гц), 1,79-2,06 (5H, м), 2,21-2,27 (1H, м), 2,29-2,36 (1H, м), 3,66-3,78 (1H, м), 4,39-4,48 (2H, м), 4,55 (1H, ушир. д, J=11,6 Гц), 6,64-6,73 (1H, м), 7,09-7,22 (2H, м), 7,22-7,36 (2H, м)
MS m/z: 576 [M+Na]+
[0072] Пример 2 (1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-фторфенил)метокси]-2-({(1S)-1-[({[(1R,2S,5R)-5-метил-2-(пропан-2-ил)циклогексил]окси}карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота
[0073] [Формула 30]

Указанное в заголовке соединение (0,018 г) получали (бесцветное твердое вещество) по той же методике, что и в примере 1-(3), с использованием соединения (0,30 г, 0,66 ммоль), полученного согласно примеру 1-(2), и (1S)-1-хлорэтил (1R,2S,5R)-5-метил-2-(пропан-2-ил)циклогексилкарбоната (см. WO2013/180271) (0,42 г, 1,59 ммоль).
1H ЯМР (600 МГц, DMSO-d6) δ м.д. 0,65 (3H, д, J=7,0 Гц), 0,73-0,86 (7 H, м), 0,93-1,01 (2H, м), 1,23-1,32 (1H, м), 1,39-1,45 (4H, м), 1,53-1,61 (2H, м), 1,71-1,79 (1H, м), 1,89-1,97 (2H, м), 2,04-2,12 (1H, м), 2,10-2,20 (1H, м), 2,22-2,29 (1H, м), 2,48-2,49 (2H, м), 3,64-3,70 (1H, м), 4,36-4,44 (2H, м), 4,49-4,53 (1H, м), 6,64 (1H, кв, J=5,4 Гц), 7,09 (2H, с), 7,26-7,30 (2H, м)
MS m/z: 576 [M+Na]+
[0074] Пример 3 (1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-фторфенил)метокси]-2-({(1R)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота
[0075] [Формула 31]

Указанное в заголовке соединение (0,093 г) получали (бесцветное твердое вещество) по той же методике, что и в примере 1-(3), с использованием соединения (0,20 г, 0,44 ммоль), полученного согласно примеру 1-(2) и (1S)-1-хлорэтил трицикло[3.3.1.13,7]декан-1-карбоксилата (см. WO2013/180271) (0,32 г, 1,33 ммоль).
1H ЯМР (600 МГц, DMSO-d6) δ м.д. 1,40-1,45 (3H, м), 1,55 (3H, ушир. д, J=11,6 Гц), 1,63 (3H, ушир. д, J=12,0 Гц), 1,68-1,80 (6H, м), 1,86-1,91 (3H, м), 2,00-2,05 (1H, м), 2,12 (1H, дд, J=7,8, 2,5 Гц), 2,19-2,25 (1H, м), 2,27-2,33 (1H, м), 2,51-2,53 (1H, м), 3,71-3,76 (1H, м), 4,43-4,51 (1H, м), 4,54 (1H, д, J=12,0 Гц), 6,86 (1H, кв, J=5,4 Гц), 7,12-7,17 (2H, м), 7,29-7,33 (2H, м)
MS m/z: 532 [M-H]-
[0076] Пример 4 (1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-фторфенил)метокси]-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота
[0077] [Формула 32]

Указанное в заголовке соединение (0,153 г) получали (бесцветное твердое вещество) по той же методике, что и в примере 1-(3), с использованием соединения (0,20 г, 0,44 ммоль), полученного согласно примеру 1-(2) и (1R)-1-хлорэтил трицикло[3.3.1.13,7]декан-1-карбоксилата (см. WO2013/180271) (0,32 г, 1,33 ммоль). Абсолютную конфигурацию полученного соединения (пример 4) определяли рентгеноструктурным анализом.
1H ЯМР (600 МГц, DMSO-d6) δ м.д. 1,40 (3H, д, J=5,4 Гц), 1,57-1,71 (6H, м), 1,74-1,80 (6H, м), 1,88-2,00 (5H, м), 2,18-2,26 (1H, м), 2,29-2,38 (1H, м), 2,40-2,48 (1H, м), 3,70-3,77 (1H, м), 4,45 (1H, д, J=11,6 Гц), 4,56 (1H, д, J=11,6 Гц), 6,76 (1H, кв, J=5,4 Гц), 7,13-7,18 (2H, м), 7,27-7,32 (2H, м)
MS m/z: 532 [M-H]-
[0078] Пример 5 (1R,2R,3R,5R,6R)-2-амино-2-[(1-{[(циклогексилокси)карбонил]окси}этокси)карбонил]-6-фтор-3-[(4-фторфенил)метокси]бицикло[3.1.0]гексан-6-карбоновая кислота
[0079] [Формула 33]
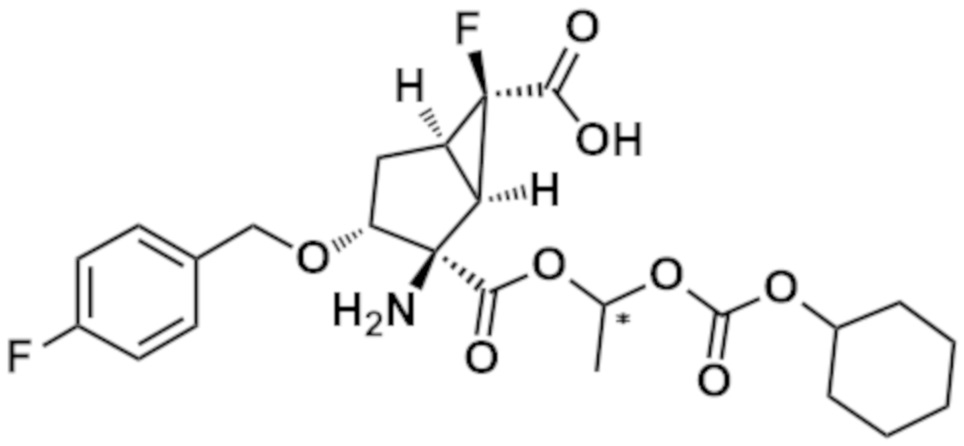
Указанное в заголовке соединение (0,023 г) получали (бесцветное твердое вещество) по той же методике, что и в примере 1-(3), с использованием соединения (0,30 г, 0,66 ммоль), полученного согласно примеру 1-(2), и 1-хлорэтилциклогексилкарбоната (0,24 мл, 1,33 ммоль).
1H ЯМР (600 МГц, DMSO-d6) δ м.д. 1,14-1,47 (10 H, м), 1,56-1,66 (2H, м), 1,70-1,76 (1H, м), 1,78-1,84 (1H, м), 1,98-2,04 (1H, м), 2,09-2,13 (1H, м), 2,16-2,23 (1H, м), 2,26-2,33 (1H, м), 3,70-3,74 (1H, м), 4,42-4,58 (3H, м), 6,73 (1H, кв, J=5,4 Гц), 7,10-7,15 (2H, м), 7,28-7,32 (2H, м)
MS m/z: 520 [M+Na]+
[0080] Пример 6 дигидрохлорид (1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-фторфенил)метокси]-2-{[(L-валилокси)метокси]карбонил}бицикло[3.1.0]гексан-6-карбоновой кислоты
[0081]
[Формула 34]

Бесцветное аморфное вещество (0,091 г) получали по той же методике, что и в примере 1-(3), с использованием соединения (0,15 г, 0,34 ммоль), полученного согласно примеру 1-(2), и хлорметил N-(трет-бутоксикарбонил)-L-валината (0,27 г, 1,03 ммоль). Это аморфное вещество растворяли в CHCl3 (1,2 мл). К раствору капельно добавляли 4 M раствор HCl в диоксане (0,12 мл) при комнатной температуре и смесь перемешивали в течение 4 часов. Полученное твердое вещество собирали фильтрацией с получением указанного в заголовке соединения (40 мг) (светло-желтое твердое вещество).
1H ЯМР (600 МГц, MeOH-d4) δ м.д. 1,01 (6H, д, J=7,0 Гц), 2,20-2,27 (1H, м), 2,42-2,53 (3H, м), 2,58-2,64 (1H, м), 3,69 (1H, д, J=4,5 Гц), 4,16-4,20 (1H, м), 4,56 (2H, с), 6,01 (1H, д, J=6,2 Гц), 6,13 (1H, д, J=5,8 Гц), 7,09-7,14 (2H, м), 7,35-7,39 (2H, м), 7,91 (1H, с)
MS m/z: 457 [M+H]+
[0082] Пример 7 (1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-фторфенил)метокси]-2-({[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]метокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота
[0083]
[Формула 35]

Указанное в заголовке соединение (52 мг) получали (бесцветное твердое вещество) по той же методике, что и в примере 1-(3), с использованием соединения (0,1 г, 0,22 ммоль), полученного согласно примеру 1-(2), и хлорметилтрицикло[3.3.1.13,7]декан-1-карбоксилата (0,055 г, 0,24 ммоль).
1H ЯМР (600 МГц, DMSO-d6) δ м.д. 1,51-1,55 (3H, м), 1,59-1,64 (3H, м), 1,68-1,73 (6H, м), 1,87 (3H, br с), 1,95-2,00 (1H, м), 2,09 (1H, дд, J=7,6, 2,7 Гц), 2,13-2,19 (1H, м), 2,29 (1H, дд, J=13,2, 7,4 Гц), 2,47 (1H, ушир. д, J=8,7 Гц), 2,52-2,57 (1H, м), 3,70-3,75 (1H, м), 4,46 (1H, д, J=12,0 Гц), 4,57 (1H, д, J=12,0 Гц), 5,75 (1H, д, J=5,8 Гц), 5,83 (1H, д, J=5,8 Гц), 7,15 (2H, т, J=8,4 Гц), 7,30 (2H, т, J=6,7 Гц)
MS m/z: 520 [M+H]+
[0084] Пример 8 Синтез (1R,2R,3R,5R,6R)-2-амино-3-[(3,4-дифторфенил)метокси]-6-фтор-2-({(1R)-1-[({[(1R,2S,5R)-5-метил-2-(пропан-2-ил)циклогексил]окси}карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновой кислоты
[0085]
[Формула 36]

[0086] (1) (1R,2R,3R,5R,6R)-3-[(3,4-дифторфенил)метокси]-6-фтор-2-({[(проп-2-ен-1-ил)окси]карбонил}амино)бицикло[3.1.0]гексан-2,6-дикарбоновая кислота
[0087] [Формула 37]
Указанное в заголовке соединение (1,7 г) (светло-желтое аморфное вещество) получали из соединения (II)-2 (1,5 г, 3,97 ммоль) (см. WO03/061698) по той же методике, что и в примере 1-(1).
1H ЯМР (600 МГц, DMSO-d6) δ м.д. 2,06-2,12 (1H, м), 2,15-2,23 (1H, м), 2,37 (1H, дд, J=13,6, 7,4 Гц), 2,69-2,73 (1H, м), 3,32 (2H, ушир. с), 4,00-4,10 (1H, м), 4,38-4,53 (3H, м), 4,57-4,63 (1H, м), 5,15-5,24 (1H, м), 5,27-5,36 (1H, м), 5,82-5,96 (1H, м), 7,09-7,16 (1H, м), 7,29-7,42 (2H, м), 8,16 (1H, с)
MS m/z: 452 [M+Na]+
[0088] (2) (1R,2R,3R,5R,6R)-3-[(3,4-дифторфенил)метокси]-6-фтор-6-{[(проп-2-ен-1-ил)окси]карбонил}-2-({[(проп-2-ен-1-ил)окси]карбонил}амино)бицикло[3.1.0]гексан-2-карбоновая кислота
[0089] [Формула 38]

Указанное в заголовке соединение (1,8 г) получали (коричневое аморфное вещество) по той же методике, что и в примере 1-(2), с использованием соединения (1,7 г, 3,96 ммоль), полученного на стадии (1) в качестве исходного материала.
1H ЯМР (600 МГц, DMSO-d6) δ м.д. 2,14-2,45 (3H, м), 2,77 (1H, ушир. д, J=7,0 Гц), 4,06-4,20 (1H, м), 4,39-4,72 (7H, м), 5,14-5,36 (4H, м), 5,84-5,97 (2H, м), 7,01-7,45 (3H, м), 8,20 (1H, ушир. с)
MS m/z: 492 [M+Na]+
[0090] (3) (1R,2R,3R,5R,6R)-2-амино-3-[(3,4-дифторфенил)метокси]-6-фтор-2-({(1R)-1-[({[(1R,2S,5R)-5-метил-2-(пропан-2-ил)циклогексил]окси}карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота (пример 8)
[0091] [Формула 39]

Указанное в заголовке соединение (135 мг) получали (бесцветное твердое вещество) по той же методике, что и в примере 1-(3), с использованием соединения (0,30 г, 0,64 ммоль), полученного на стадии (2) и (1R)-1-хлорэтил (1R,2S,5R)-5-метил-2-(пропан-2-ил)циклогексилкарбоната (0,40 г, 1,53 ммоль).
1H ЯМР (600 МГц, DMSO-d6) δ м.д. 0,73 (3H, д, J=7,0 Гц), 0,78-0,89 (7 H, м), 0,92-1,06 (2H, м), 1,30-1,47 (5H, м), 1,59-1,64 (2H, м), 1,79-1,86 (1H, м), 1,88-1,93 (1H, м), 1,98-2,05 (2H, м), 2,22-2,27 (1H, м), 2,35 (1H, дд, J=13,4, 7,6 Гц), 2,51-2,53 (1H, м), 3,72-3,78 (1H, м), 4,39-4,63 (3H, м), 6,67 (1H, кв, J=5,4 Гц), 7,09-7,12 (1H, м), 7,27-7,31 (1H, м), 7,39 (1H, дт, J=10,7, 8,5 Гц)
MS m/z: 594 [M+Na]+
[0092] Пример 9 (1R,2R,3R,5R,6R)-2-амино-3-[(3,4-дифторфенил)метокси]-6-фтор-2-({(1S)-1-[({[(1R,2S,5R)-5-метил-2-(пропан-2-ил)циклогексил]окси}карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота
[0093] [Формула 40]

Указанное в заголовке соединение (19 мг) получали (бесцветное твердое вещество) по той же методике, что и в примере 1-(3), с использованием соединения (0,30 г, 0,64 ммоль), полученного согласно примеру 8-(2), и (1S)-1-хлорэтил (1R,2S,5R)-5-метил-2-(пропан-2-ил)циклогексилкарбоната (0,40 г, 1,53 ммоль).
1H ЯМР (600 МГц, DMSO-d6) δ м.д. 0,66 (3H, д, J=6,6 Гц), 0,73-0,90 (7 H, м), 0,94-1,03 (2H, м), 1,21-1,34 (2H, м), 1,38-1,53 (4H, м), 1,53-1,66 (2H, м), 1,69-1,81 (1H, м), 1,91-2,03 (2H, м), 2,10-2,24 (2H, м), 2,27-2,34 (1H, м), 3,70-3,74 (1H, м), 4,36-4,49 (2H, м), 4,53-4,59 (1H, м), 6,68 (1H, кв, J=5,0 Гц), 7,11 (1H, ушир. с), 7,30-7,38 (2H, м)
MS m/z: 594 [M+Na]+
[0094] Пример 10 (1R,2R,3R,5R,6R)-2-амино-3-[(3,4-дифторфенил)метокси]-6-фтор-2-({(1R)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота
[0095] [Формула 41]
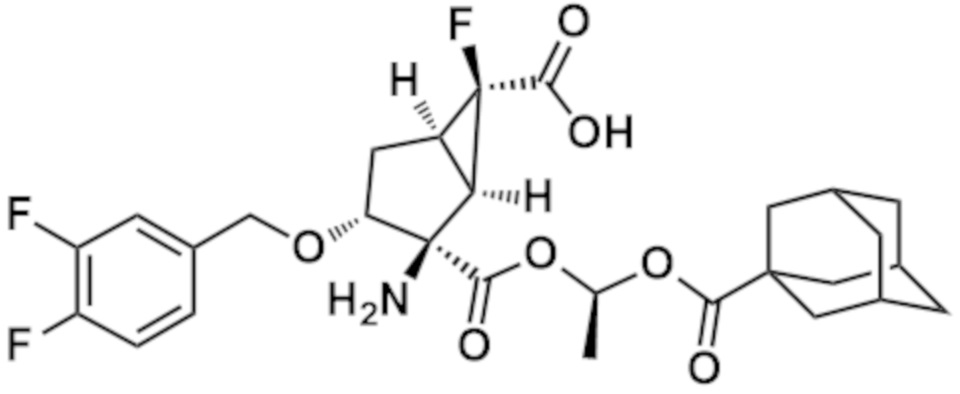
Указанное в заголовке соединение (149 мг) получали (бесцветное твердое вещество) по той же методике, что и в примере 1-(3), с использованием соединения (0,20 г, 0,42 ммоль), полученного согласно примеру 8-(2) и (1S)-1-хлорэтилтрицикло[3.3.1.13,7]декан-1-карбоксилата (0,31 г, 1,28 ммоль).
1H ЯМР (600 МГц, MeOH-d4) δ м.д. 1,55 (3H, д, J=5,4 Гц), 1,64 (3H, ушир. д, J=12,0 Гц), 1,74 (3H, ушир. д, J=12,0 Гц), 1,77-1,82 (6H, м), 1,89-1,95 (3H, м), 2,24-2,32 (2H, м), 2,39-2,44 (1H, м), 2,50 (1H, дд, J=13,2, 7,4 Гц), 4,05-4,09 (1H, м), 4,52 (2H, с), 7,01-7,04 (1H, м), 7,11-7,15 (1H, м), 7,19-7,25 (1H, м), 7,28-7,33 (1H, м)
MS m/z: 550 [M-H]-
[0096] Пример 11 (1R,2R,3R,5R,6R)-2-амино-3-[(3,4-дифторфенил)метокси]-6-фтор-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота
[0097] [Формула 42]

Указанное в заголовке соединение (123 мг) получали (бесцветное твердое вещество) по той же методике, что и в примере 1-(3), с использованием соединения (0,20 г, 0,42 ммоль), полученного согласно примеру 8-(2), и (1R)-1-хлорэтилтрицикло[3.3.1.13,7]декан-1-карбоксилата (0,31 г, 1,28 ммоль).
1H ЯМР (600 МГц, MeOH-d4) δ м.д. 1,48 (3H, д, J=5,8 Гц), 1,70-1,80 (6H, м), 1,90 (6H, ушир. с), 2,00 (3H, ушир. с), 2,18-2,21 (1H, м), 2,25-2,29 (1H, м), 2,42-2,48 (1H, м), 2,52-2,58 (1H, м), 4,06-4,11 (1H, м), 4,49-4,56 (2H, м), 6,92 (1H, д, J=7,8 Гц), 7,10-7,14 (1H, м), 7,21-7,28 (2H, м)
MS m/z: 550 [M-H]-
[0098] Пример 12 (1R,2R,3R,5R,6R)-2-амино-3-[(3,4-дифторфенил)метокси]-6-фтор-2-({[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]метокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота
[0099]
[Формула 43]
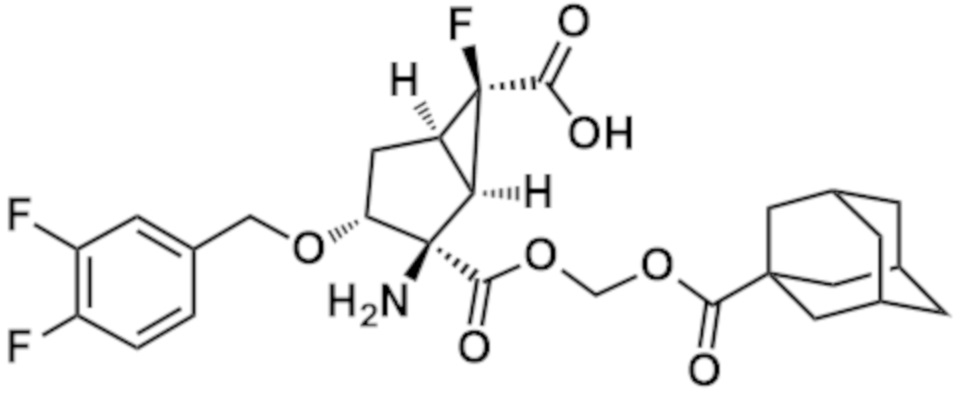
Указанное в заголовке соединение (61 мг) (бесцветное аморфное вещество) получали по той же методике, что и в примере 1-(3), с использованием соединения (0,20 г, 0,42 ммоль), полученного согласно примеру 8-(2), и хлорметилтрицикло[3.3.1.13,7]декан-1-карбоксилата (0,19 г, 0,85 ммоль).
1H ЯМР (600 МГц, DMSO-d6) δ м.д. 1,50 (3H, ушир. д, J=11,1 Гц), 1,60 (3H, ушир. д, J=12,0 Гц), 1,66-1,69 (6H, м), 1,84 (3H, ушир. с), 1,94-1,99 (1H, м), 2,05-2,12 (1H, м), 2,12-2,17 (1H, м), 2,30 (1H, дд, J=13,6, 7,4 Гц), 3,68-3,74 (1H, м), 4,45 (1H, д, J=12,0 Гц), 4,56 (1H, д, J=12,0 Гц), 5,73 (1H, д, J=5,8 Гц), 5,84 (1H, д, J=5,8 Гц), 7,08-7,11 (1H, м), 7,26-7,31 (1H, м), 7,34-7,41 (1H, м)
MS m/z: 538 [M+H]+
[0100] Пример 13 Синтез (1R,2R,3R,5R,6R)-2-амино-6-фтор-2-({(1R)-1-[({[(1R,2S,5R)-5-метил-2-(пропан-2-ил)циклогексил]окси}карбонил)окси]этокси}карбонил)-3-пропоксибицикло[3.1.0]гексан-6-карбоновой кислоты
[0101] [Формула 44]

(1) (1R,2R,3R,5R,6R)-6-фтор-2-({[(проп-2-ен-1-ил)окси]карбонил}амино)-3-пропоксибицикло[3.1.0]гексан-2,6-дикарбоновая кислота
[0102] [Формула 45]

Указанное в заголовке соединение (3,4 г) (светло-желтое аморфное вещество) получали по той же методике, что и в примере 1-(1), с использованием соединения (II)-3 (3,0 г, 11,48 ммоль) (см. WO03/061698) в качестве исходного материала.
1H ЯМР (600 МГц, DMSO-d6) δ м.д. 0,80 (3H, т, J=7,4 Гц), 1,40 (2H, sxt, J=7,0 Гц), 2,02-2,07 (1H, м), 2,07-2,15 (1H, м), 2,32 (1H, дд, J=14,0, 9,1 Гц), 2,63-2,70 (1H, м), 3,26-3,37 (2H, м), 3,47-3,55 (1H, м), 3,86-3,93 (1H, м), 4,46 (1H, ушир. д, J=4,5 Гц), 5,18 (1H, д, J=9,9 Гц), 5,31 (1H, д, J=16,9 Гц), 5,86-5,95 (1H, м)
MS m/z: 368 [M+Na]+
[0103] (2) (1R,2R,3R,5R,6R)-6-фтор-6-{[(проп-2-ен-1-ил)окси]карбонил}-2-({[(проп-2-ен-1-ил)окси]карбонил}амино)-3-пропоксибицикло[3.1.0]гексан-2-карбоновая кислота
[0104] [Формула 46]

Указанное в заголовке соединение (1,8 г) получали по той же методике, что и в примере 1-(2), с использованием соединения (1,7 г, 4,95 ммоль), полученного на стадии (1), в качестве исходного материала.
1H ЯМР (600 МГц, DMSO-d6) δ м.д. 0,80 (3H, т, J=7,4 Гц), 1,40 (2H, sxt, J=7,4 Гц), 2,08-2,27 (2H, м), 2,32-2,42 (1H, м), 2,70-2,86 (1H, м), 3,33-3,36 (2H, м), 3,39-3,55 (1H, м), 3,86-4,04 (1H, м), 4,36-4,75 (4H, м), 5,08-5,39 (4H, м), 5,82-5,97 (2H, м)
MS m/z: 408 [M+Na]+
[0105] (3) (1R,2R,3R,5R,6R)-2-амино-6-фтор-2-({(1R)-1-[({[(1R,2S,5R)-5-метил-2-(пропан-2-ил)циклогексил]окси}карбонил)окси]этокси}карбонил)-3-пропоксибицикло[3.1.0]гексан-6-карбоновая кислота (пример 13)
[0106] [Формула 47]
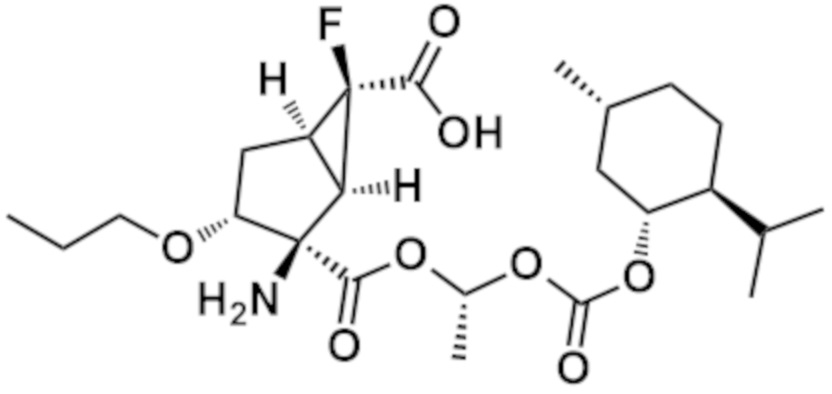
Указанное в заголовке соединение (46 мг) получали (бесцветное твердое вещество) по той же методике, что и в примере 1-(3), с использованием соединения (0,30 г, 0,78 ммоль), полученного на стадии (2) и (1R)-1-хлорэтил (1R,2S,5R)-5-метил-2-(пропан-2-ил)циклогексилкарбоната (0,49 г, 1,87 ммоль).
1H ЯМР (600 МГц, DMSO-d6) δ м.д. 0,74 (3H, д, J=7,0 Гц), 0,78-0,89 (10 H, м), 0,95-1,07 (2H, м), 1,32-1,48 (7 H, м), 1,59-1,64 (2H, м), 1,80-1,86 (1H, м), 1,90-2,00 (3H, м), 2,15-2,20 (1H, м), 2,33 (1H, дд, J=13,2, 7,4 Гц), 3,30 (1H, дт, J=9,1, 6,6 Гц), 3,43 (1H, дт, J=9,1, 6,6 Гц), 3,56-3,64 (1H, м), 4,41-4,47 (1H, м), 6,65-6,68 (1H, м)
MS m/z: 488 [M+H]+
[0107] Пример 14 (1R,2R,3R,5R,6R)-2-амино-6-фтор-2-({(1S)-1-[({[(1R,2S,5R)-5-метил-2-(пропан-2-ил)циклогексил]окси}карбонил)окси]этокси}карбонил)-3-пропоксибицикло[3.1.0]гексан-6-карбоновая кислота
[0108] [Формула 48]

Указанное в заголовке соединение (100 мг) (бесцветное твердое вещество) получали по той же методике, что и в примере 1-(3), с использованием соединения (0,30 г, 0,78 ммоль), полученного согласно примеру 13-(2), и (1S)-1-хлорэтил (1R,2S,5R)-5-метил-2-(пропан-2-ил)циклогексилкарбоната (0,49 г, 1,87 ммоль).
1H ЯМР (600 МГц, DMSO-d6) δ м.д. 0,75 (3H, д, J=7,0 Гц), 0,77-0,91 (10 H, м), 0,98-1,09 (2H, м), 1,32-1,52 (7 H, м), 1,60-1,66 (2H, м), 1,82-1,88 (1H, м), 1,94-2,00 (2H, м), 2,08 (1H, дд, J=8,0, 2,5 Гц), 2,13 (1H, ддд, J=13,2, 8,0, 5,8 Гц), 2,29 (1H, дд, J=13,2, 7,4 Гц), 3,28 (1H, дт, J=9,1, 6,6 Гц), 3,43 (1H, дт, J=9,1, 6,6 Гц), 3,56-3,62 (1H, м), 4,46 (1H, td, J=10,8, 4,3 Гц), 6,67 (1H, кв, J=5,4 Гц)
MS m/z: 488 [M+H]+
[0109] Пример 15 Синтез (1R,2R,3R,5R,6R)-2-амино-6-фтор-2-({1-[({[(1S,2R,5S)-5-метил-2-(пропан-2-ил)циклогексил]окси}карбонил)окси]этокси}карбонил)-3-пропоксибицикло[3.1.0]гексан-6-карбоновой кислоты
[0110]
[Формула 49]

[0111] (1) 1-хлорэтил (1S,2R,5S)-5-метил-2-(пропан-2-ил)циклогексилкарбонат
[0112] [Формула 50]

Раствор D-ментола (5,0 г, 31,99 ммоль) и пиридина (2,6 мл, 31,99 ммоль) в CHCl3 (36 мл) охлаждали до -60°C на бане ацетон-сухой лед и капельно добавляли 1-хлорэтилкарбонохлоридат (3,67 мл, 33,59 ммоль) в течение 10 минут. Смесь перемешивали при -60°C в течение 30 минут, а затем переносили на ледяную баню. Температуру повышали до 0°C и добавляли воду. Органический слой отделяли, затем промывали рассолом и сушили над MgSO4. Нерастворимые вещества отфильтровывали, фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (Grace 12g, н-гексан/EtOAc=от 100/0 до 90/10) с получением указанного в заголовке соединения (7,7 г) (бесцветное масло).
1H ЯМР (600 МГц, ХЛОРОФОРМ-d) δ м.д. 0,81 (3H, дд, J=10,3, 7,0 Гц), 0,85-0,95 (7 H, м), 1,03-1,13 (2H, м), 1,39-1,54 (2H, м), 1,66-1,74 (2H, м), 1,84 (3H, дд, J=5,8, 2,1 Гц), 1,91-1,99 (1H, м), 2,06-2,15 (1H, м), 4,60 (1H, квд J=10,7, 4,3 Гц), 6,44 (1H, квд J=5,8, 1,7 Гц)
[0113] (2) 2-{1-[({[(1S,2R,5S)-5-метил-2-(пропан-2-ил)циклогексил]окси}карбонил)окси]этил} 6-проп-2-ен-1-ил (1R,2R,3R,5R,6R)-6-фтор-2-({[(проп-2-ен-1-ил)окси]карбонил}амино)-3-пропоксибицикло[3.1.0]гексан-2,6-дикарбоксилат
[0114] [Формула 51]

К раствору соединения (0,56 г, 1,47 ммоль), полученного согласно примеру 13-(2) в DMF (7 мл), добавляли соединение (0,77 г, 2,94 ммоль), полученное на стадии (1), K2CO3 (0,30 г, 2,20 ммоль) и NaI (0,44 г, 2,94 ммоль), и смесь перемешивали при 50°C в течение 3,5 часов. Реакционный раствор охлаждали до комнатной температуры, а затем разделяли добавлением воды. Водный слой экстрагировали EtOAc. Затем органические слои объединяли и промывали 5% рассолом и рассолом. После сушки над MgSO4 нерастворимые вещества отфильтровывали, фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (Grace 12g, н-гексан/EtOAc=от 100/0 до 60/40) с получением указанного в заголовке соединения (0,40 г) в качестве смеси диастереомеров (бесцветное масло).
1H ЯМР (600 МГц, ХЛОРОФОРМ-d) δ м.д. 0,77-0,95 (15 H, м), 1,50-1,58 (7 H, м), 1,66-1,71 (2H, м), 1,93-2,02 (1H, м), 2,08-2,16 (1H, м), 2,20-2,27 (1H, м), 2,31-2,38 (1H, м), 2,40-2,48 (1H, м), 2,90-3,03 (1H, м), 3,29-3,34 (1H, м), 3,46-3,53 (1H, м), 3,73-3,78 (1H, м), 4,53-4,71 (5H, м), 5,20-5,35 (5H, м), 5,87-5,95 (2H, м), 6,81-6,94 (1H, м)
[0115] (3) Разделение 2-{1-[({[(1S,2R,5S)-5-метил-2-(пропан-2-ил)циклогексил]окси}карбонил)окси]этил} 6-проп-2-ен-1-ил (1R,2R,3R,5R,6R)-6-фтор-2-({[(проп-2-ен-1-ил)окси]карбонил}амино)-3-пропоксибицикло[3.1.0]гексан-2,6-дикарбоксилата
[0116] [Формула 52]
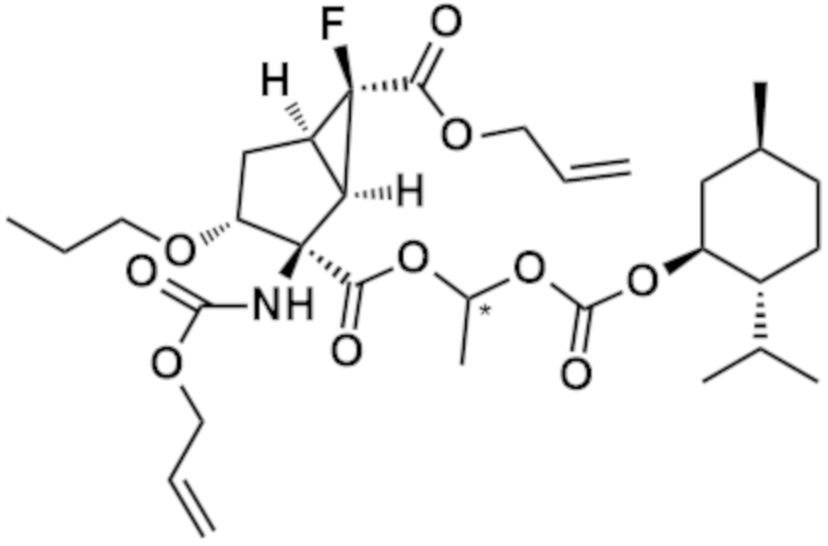
Соединение, полученное согласно примеру 15(2), разделяли хиральной колоночной хроматографией (CHIRALPAK ID, н-гексан/IPA=7:3) с получением фракции 1-го пика в виде соединения примера 15(3)-A (0,14 г) и фракции 2-го пика в виде соединения примера 15(3)-B (0,20 г) (оба представляли собой бесцветное масло).
Время удержания: пример 15(3)-A; 3,22 мин, пример 15(3)-B; 5,72 мин (CHIRAL PAK ID-3, н-гексан/IPA=7:3).
[0117] (4) (1R,2R,3R,5R,6R)-2-амино-6-фтор-2-({1-[({[(1S,2R,5S)-5-метил-2-(пропан-2-ил)циклогексил]окси}карбонил)окси]этокси}карбонил)-3-пропоксибицикло[3.1.0]гексан-6-карбоновая кислота (примеры 15-A и 15-B)
[0118] [Формула 53]

К раствору соединения примера 15(3)-A (0,14 г, 0,23 ммоль) в CHCl3 (2,3 мл) добавляли 1,3-диметилбарбитуровую кислоту (0,036 г, 0,23 ммоль) и Pd(PPh3)4 (0,004 г, 0,0035 ммоль) и смесь перемешивали при комнатной температуре в течение 20 минут. Реакционный раствор концентрировали при пониженном давлении. К полученному остатку добавляли MeCN (5 мл) и смесь перемешивали при комнатной температуре в течение 1,5 часов. Полученные кристаллы собирали фильтрацией с получением указанного в заголовке соединения примера 15-A (0,090 г) (бесцветное твердое вещество). Аналогичным образом получали указанное в заголовке соединение примера 15-B (0,13 г) (бесцветное твердое вещество) из соединения примера 15(3)-B (0,20 г, 0,33 ммоль).
Пример 15-A
1H ЯМР (400 МГц, DMSO-d6) δ м.д. 0,74-0,91 (13 H, м), 0,95-1,12 (2H, м), 1,33-1,51 (7 H, м), 1,60-1,68 (2H, м), 1,79-1,90 (1H, м), 1,94-2,05 (2H, м), 2,06-2,19 (2H, м), 2,27-2,36 (1H, м),3,29 (1H, дт, J=9,1, 6,7 Гц), 3,44 (3H, дт, J=9,1, 6,7 Гц), 3,56-3,66 (1H, м), 4,45 (1H, тд, J=10,9, 4,4 Гц), 6,74 (1H, кв, J=5,4 Гц)
MS m/z: 488 [M+H]+
Пример 15-B
1H ЯМР (400 МГц, DMSO-d6) δ м.д. 0,73 (3H, д, J=7,0 Гц),0,76-0,91 (10 H, м), 0,96-1,09 (2H, м), 1,30-1,50 (7 H, м), 1,57-1,67 (2H, м), 1,72-1,82 (1H, м), 1,92-1,99 (3H, м), 2,12-2,23 (1H, м), 2,28-2,40 (1H, м), 3,30 (1H, дт, J=9,1, 6,5 Гц), 3,44 (1H, дт, J=9,1, 6,5 Гц), 3,56-3,62 (1H, м), 4,46 (1H, тд, J=10,9, 4,3 Гц), 6,69 (1H, кв, J=5,5 Гц)
MS m/z: 488 [M+H]+
[0119] Пример 16 Синтез (1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-фторфенил)метокси]-2-({1-[({[(1S,2R,5S)-5-метил-2-(пропан-2-ил)циклогексил]окси}карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновой кислоты
[0120] [Формула 54]

[0121] (1) 2-{1-[({[(1S,2R,5S)-5-метил-2-(пропан-2-ил)циклогексил]окси}карбонил)окси]этил} 6-проп-2-ен-1-ил (1R,2R,3R,5R,6R)-6-фтор-3-[(4-фторфенил)метокси]-2-({[(проп-2-ен-1-ил)окси]карбонил}амино)бицикло[3.1.0]гексан-2,6-дикарбоксилат
[0122]
[Формула 55]

Указанное в заголовке соединение (0,41 г) получали в виде смеси диастереомеров (бесцветное масло) по той же методике, что и в примере 15-(2), с использованием соединения (0,41 г, 0,93 ммоль), полученного согласно примеру 1-(2), и соединения (0,48 г, 1,85 ммоль), полученного согласно примеру 15-(1) в качестве исходных материалов.
1H ЯМР (600 МГц, ХЛОРОФОРМ-d) δ м.д. 0,70-1,14 (12 H, м), 1,19-1,71 (7 H, м), 1,88-2,28 (2H, м), 2,34-2,46 (2H, м), 2,87-3,03 (1H, м), 3,39-3,45 (1H, м), 3,79-3,86 (1H, м), 4,44-4,72 (7 H, м),5,00-5,10 (1H, м), 5,20-5,36 (4H, м), 5,85-5,95 (2H, м), 6,84-6,95 (1H, м), 6,99-7,06 (2H, м), 7,25-7,27 (2H, м)
MS m/z: 700 [M+Na]+
[0123] (2) Разделение 2-{1-[({[(1S,2R,5S)-5-метил-2-(пропан-2-ил)циклогексил]окси}карбонил)окси]этил} 6-проп-2-ен-1-ил (1R,2R,3R,5R,6R)-6-фтор-3-[(4-фторфенил)метокси]-2-({[(проп-2-ен-1-ил)окси]карбонил}амино)бицикло[3.1.0]гексан-2,6-дикарбоксилата
[0124]
[Формула 56]

Соединение, полученное согласно примеру 16(1), разделяли хиральной колоночной хроматографией (CHIRALPAK ID, н-гексан/EtOH=4:1) с получением фракции 1-го пика в виде соединения примера 16(2)-A (0,11 г) и фракции 2-го пика в виде соединения примера 16(2)-B (0,15 г) (оба представляли собой бесцветное масло).
Время удержания: пример 16(2)-A; 2,92 мин, пример 16(2)-B; 4,30 мин. (CHIRAL PAK ID-3, н-гексан/EtOH=8:2)
[0125] (3) (1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-фторфенил)метокси]-2-({1-[({[(1S,2R,5S)-5-метил-2-(пропан-2-ил)циклогексил]окси}карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота (примеры 16-A и 16-B)
[0126] [Формула 57]

Указанные в заголовках соединения примера 16-A (0,058 г) и примера 16-B (0,076 г) получали (оба представляли собой бесцветные твердые вещества) по той же методике, что и в примере 15-(4), с использованием соединений примера 16(2)-A (0,10 г, 0,15 ммоль) и примера 16(2)-B (0,13 г, 0,20 ммоль), полученных на стадии (2), в качестве исходных материалов, соответственно.
Пример 16-A
1H ЯМР (400 МГц, DMSO-d6) δ м.д. 0,75 (3H, д, J= 6,9 Гц), 0,78-1,10 (7 H, м), 1,28-1,44 (2H, м), 1,47 (3H, д, J=5,5 Гц) 1,58-1,67 (2H, м), 1,78-1,90 (2H, м), 2,00-2,07 (2H, м), 2,14 (1H, дд, J=7,8, 2,8 Гц), 2,18-2,26 (1H, м), 2,32 (1H, дд, J=13,3, 7,4 Гц), 3,71-3,79 (1H, м), 4,37-4,50 (2H, м), 4,58 (1H, д, J=12 Гц), 6,75 (1H, кв, J=5,5 Гц), 7,09-7,16 (2H, м), 7,29-7,36 (2H, м)
MS m/z: 554 [M+H]+
Пример 16-B
1H ЯМР (400 МГц, DMSO-d6) δ м.д. 0,72 (3H, д, J=7,0 Гц), 0,80-0,92 (7 H, м), 0,97-1,10 (2H, м), 1,29-1,52 (4H, м), 1,56-1,68 (2H, м), 1,71-1,82 (1H, м), 1,92-2,02 (3H, м), 2,19-2,40 (2H, м), 3,68-3,77 (1H, м), 4,41-4,51 (2H, м), 4,56 (1H, д, J=12,0 Гц), 6,70 (1H, кв, J=5,4 Гц), 7,11-7,20 (2H, м), 7,27-7,34 (2H, м)
MS m/z: 554 [M+H]+
[0127] Пример 17 Синтез (1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-фторфенил)метокси]-2-({1-[({[(1S,2R,4S)-1,7,7-триметилбицикло[2.2.1]гептан-2-ил]окси}карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновой кислоты
[0128]
[Формула 58]

(1) 1-хлорэтил (1S,2R,4S)-1,7,7-триметилбицикло[2.2.1]гептан-2-ил карбонат
[0129] [Формула 59]
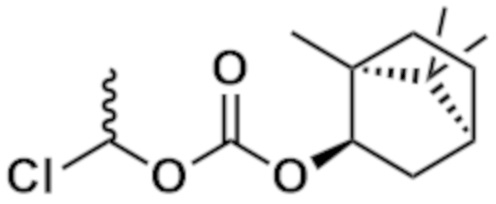
Указанное в заголовке соединение (8,2 г) (бесцветное масло) получали по той же методике, что и в примере 15(1), с использованием (-)-борнеола (5,0 г, 32,41 ммоль) в качестве исходного материала.
1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 0,87-0,93 (9 H, м), 1,13 (1H, ддд, J=13,9, 12,4, 3,5 Гц), 1,23-1,38 (2H, м), 1,69-1,88 (5H, м), 1,89-1,99 (1H, м), 2,35-2,46 (1H, м), 4,85-4,92 (1H, м), 6,43 (1H, кв, J=5,8 Гц)
MS m/z: 283 [M+Na]+
[0130] (2) 6-проп-2-ен-1-ил 2-{1-[({[(1S,2R,4S)-1,7,7-триметилбицикло[2.2.1]гептан-2-ил]окси}карбонил)окси]этил} (1R,2R,3R,5R,6R)-6-фтор-3-[(4-фторфенил)метокси]-2-({[(проп-2-ен-1-ил)окси]карбонил}амино)бицикло[3.1.0]гексан-2,6-дикарбоксилат
[0131]
[Формула 60]

Указанное в заголовке соединение (0,41 г) получали в виде смеси диастереомеров (бесцветное масло) по той же методике, что и в примере 15-(2), с использованием соединения (0,40 г, 0,89 ммоль), полученного согласно примеру 1-(2), и соединения (0,46 г, 1,77 ммоль), полученного согласно примеру 17-(1), в качестве исходных материалов.
1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 0,83-0,97 (9H, м), 1,01-1,14 (1H, м), 1,20-1,40 (2H, м), 1,52 (3H, д, J=5,4 Гц), 1,62-1,78 (2H, м), 1,86-1,96 (1H, м), 2,23-2,47 (5H, м), 2,94-3,05 (1H, м), 3,84 (1H, тд, J=7,8, 4,8 Гц), 4,45-4,71 (6H, м), 4,75-4,91 (1H, м), 5,05 (1H, с), 5,19-5,37 (4H, м), 5,84-5,97 (2H, м), 6,88 (1H, кв, J=5,5 Гц), 7,04 (2H, м), 7,26 (2H, м)
[0132] (3) Разделение 6-проп-2-ен-1-ил 2-{1-[({[(1S,2R,4S)-1,7,7-триметилбицикло[2.2.1]гептан-2-ил]окси}карбонил)окси]этил} (1R,2R,3R,5R,6R)-6-фтор-3-[(4-фторфенил)метокси]-2-({[(проп-2-ен-1-ил)окси]карбонил}амино)бицикло[3.1.0]гексан-2,6-дикарбоксилата
[0133]
[Формула 61]

Соединение (0,41 г, 0,93 ммоль), полученное согласно примеру 17(2), разделяли хиральной колоночной хроматографией (CHIRALPAK IC, н-гексан/IPA=6:4) с получением фракции 1-го пика в виде соединения примера 17(3)-A (0,20 г) и фракции 2-го пика в виде соединения примера 17(3)-B (0,15 г) (оба представляли собой бесцветное масло).
Время удержания: пример 17(3)-A; 4,57 мин, пример 17(3)-B; 5,84 мин. (CHIRAL PAK IC-3, н-гексан/IPA=6:4)
[0134] (4) (1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-фторфенил)метокси]-2-({1-[({[(1S,2R,4S)-1,7,7-триметилбицикло[2.2.1]гептан-2-ил]окси}карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота (примеры 17-A и 17-B)
[0135] [Формула 62]

Указанное в заголовке соединение примера 17-A (0,098 г) и примера 17-B (0,072 г) (оба представляли собой бесцветное твердое вещество) получали по той же методике, что и в примере 15-(4), с использованием соединения примера 17(3)-A (0,18 г, 0,27 ммоль) и соединения примера 17(3)-B (0,13 г, 0,20 ммоль), полученного согласно примеру 17(3) в качестве исходных материалов, соответственно.
Пример 17-A
1H ЯМР (400 МГц, DMSO-d6) δ м.д. 0,78-0,86 (9 H, м), 0,97 (1H, дд, J=13,9, 3,4 Гц), 1,13-1,21 (1H, м), 1,23-1,32 (1H, м), 1,43 (3H, д, J=5,4 Гц), 1,63-1,81 (3H, м), 1,97-2,05 (2H, м), 2,20-2,37 (3H, м), 3,69-3,77 (1H, м), 4,45 (1H, д, J=11,6 Гц), 4,55 (1H, д, J=11,6 Гц), 4,70-4,75 (1H, м), 6,69 (1H, кв, J=5,4 Гц), 7,12-7,18 (2H, м), 7,26-7,32 (2H, м)
MS m/z: 552 [M+H]+
Пример 17-B
1H ЯМР (400 МГц, DMSO-d6) δ м.д. 0,73 (3H, с), 0,82 (6H, с), 1,02 (1H, дд, J=13,8, 3,4 Гц), 1,11-1,30 (2H, м), 1,47 (3H, д, J=5,5 Гц), 1,62- 1,78 (3H, м), 1,99-2,07 (1H, м), 2,10-2,34 (4H, м), 3,69-3,76 (1H, м), 4,46 (1H, д, J=12,2 Гц), 4,55 (1H, д, J=12,2 Гц), 4,64-4,72 (1H, м), 6,75 (1H, кв, J=5,5 Гц), 7,08-7,16 (2H, м), 7,29-7,34 (2H, м)
MS m/z: 552 [M+H]+
[0136] Пример 18 Синтез (1R,2R,3R,5R,6R)-2-амино-6-фтор-3-пропокси-2-({1-[({[(1S,2R,4S)-1,7,7-триметилбицикло[2.2.1]гептан-2-ил]окси}карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновой кислоты
[0137]
[Формула 63]
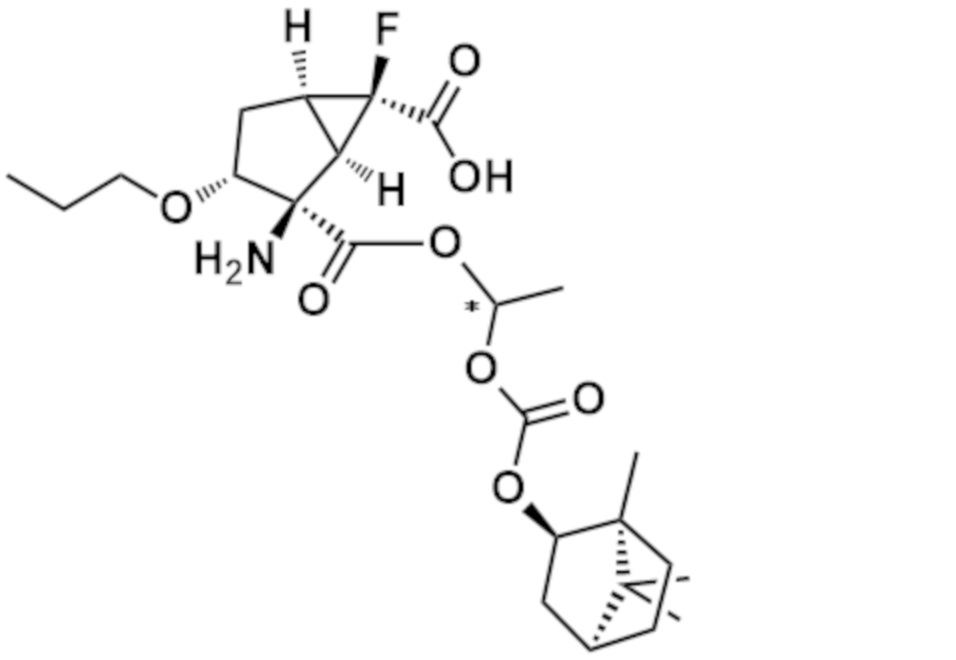
(1) 6-Проп-2-ен-1-ил 2-{1-[({[(1S,2R,4S)-1,7,7-триметилбицикло[2.2.1]гептан-2-ил]окси}карбонил)окси]этил} (1R,2R,3R,5R,6R)-6-фтор-2-({[(проп-2-ен-1-ил)окси]карбонил}амино)-3-пропоксибицикло[3.1.0]гексан-2,6-дикарбоксилат
[0138] [Формула 64]

Указанное в заголовке соединение (0,44 г) получали в виде смеси диастереомеров (бесцветное масло) по той же методике, что и в примере 15-(2), с использованием соединения (0,40 г, 0,94 ммоль), полученного согласно примеру 13-(2), и соединения (0,49 г, 1,89 ммоль), полученного согласно примеру 17-(1) в качестве исходных материалов.
1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 0,84-0,91 (12 H, м), 1,07-1,14 (1H, м), 1,23-1,35 (2H, м), 1,49-1,59 (6H, м), 1,67-1,79 (2H, м), 1,89-1,97 (1H, м), 2,22-2,48 (4H, м), 2,96 (1H, ушир. с), 3,27-3,34 (1H, м), 3,44-3,53 (1H, м), 3,72-3,79 (1H, м), 4,51-4,71 (4H, м), 4,82-4,87 (1H, м), 5,16-5,36 (4H, м), 5,84-5,96 (2H, м), 6,84-6,91 (1H, м)
MS m/z: 632 [M+Na]+
[0139] (2) Разделение 6-проп-2-ен-1-ил 2-{1-[({[(1S,2R,4S)-1,7,7-триметилбицикло[2.2.1]гептан-2-ил]окси}карбонил)окси]этил} (1R,2R,3R,5R,6R)-6-фтор-2-({[(проп-2-ен-1-ил)окси]карбонил}амино)-3-пропоксибицикло[3.1.0]гексан-2,6-дикарбоксилата
[0140] [Формула 65]

Соединение, полученное согласно примеру 18(1), разделяли хиральной колоночной хроматографией (CHIRALPAK IC, н-гексан/IPA=40:60) с получением фракции 1-го пика в виде соединения примера 18(2)-A (0,17 г) и фракции 2-го пика в виде соединения примера 18(2)-B (0,12 г) (оба представляли собой бесцветное масло).
Время удержания: пример 18(2)-A; 3,42 мин, пример 18(2)-B; 4,26 мин (CHIRAL PAK IC-3, н-гексан/IPA=2:3)
[0141] (3) (1R,2R,3R,5R,6R)-2-амино-6-фтор-3-пропокси-2-({1-[({[(1S,2R,4S)-1,7,7-триметилбицикло[2.2.1]гептан-2-ил]окси}карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота (примеры 18-A и 18-B)
[0142] [Формула 66]

Указанные в заголовке соединения примера 18-A (0,089 г) и примера 18-B (0,064 г) (оба представляли собой бесцветное твердое вещество) получали по той же методике, что и в примере 15-(4), с использованием соединения примера 18(2)-A (0,16 г, 0,27 ммоль) и соединения примера 18(2)-B (0,11 г, 0,19 ммоль), полученного на стадии (2), в качестве исходных материалов, соответственно.
Пример 18-A
1H ЯМР (400 МГц, DMSO-d6) δ м.д. 0,81 (3H, с), 0,84 (6H, д, J=3,7 Гц), 0,95 (1H, дд, J=13,8, 3,5 Гц), 1,10-1,19 (1H, м), 1,22-1,31 (1H, м), 1,47 (3H, д, J=5,4 Гц), 1,62-1,80 (3H, м), 2,02-2,08 (1H, м), 2,11-2,36 (4H, м), 3,70-3,77 (1H, м), 4,48 (1H, д, J=12,0 Гц), 4,56 (1H, д, J=12,0 Гц), 4,68-4,77 (1H, м), 6,74 (1H, кв, J=5,4 Гц), 7,09-7,18 (2H, м), 7,29-7,36 (2H, м)
MS m/z: 486 [M+H]+
Пример 18-B
1H ЯМР (400 МГц, DMSO-d6) δ м.д. 0,77 (3H, с), 0,84 (6H, д, J=7,8 Гц), 1,03 (1H, дд, J=13,8, 3,4 Гц), 1,14-1,32 (2H, м), 1,42 (3H, д, J=5,3 Гц), 1,65-1,79 (3H, м), 1,96-2,05 (2H, м), 2,20-2,38 (3H, м), 3,69-3,78 (1H, м), 4,45 (1H, д, J=11,6 Гц), 4,55 (1H, д, J=11,6 Гц), 4,73-4,78 (1H, м), 6,69 (1H, кв, J=5,3 Гц), 7,11-7,19 (2H, м), 7,26-7,33 (2H, м)
MS m/z: 486 [M+H]+
[0143] Пример 19 (1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-фторфенил)метокси]-2-({1-[({[(1R,2S,4R)-1,7,7-триметилбицикло[2.2.1]гептан-2-ил]окси}карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота
[0144] [Формула 67]

[0145] (1) 1-хлорэтил (1R,2S,4R)-1,7,7-триметилбицикло[2.2.1]гептан-2-илкарбонат
[0146] [Формула 68]

Указанное в заголовке соединение (4,2 г) (бесцветное масло) получали по той же методике, что и в примере 15(1), с использованием (+)-борнеола (2,5 г, 16,21 ммоль) в качестве исходного материала.
1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 0,87-0,93 (9 H, м), 1,13 (1H, ддд, J=16,0, 12,4, 3,5 Гц), 1,23-1,38 (2H, м), 1,69-1,83 (2H, м), 1,83-1,88 (3H, м), 1,89-1,99 (1H, м), 2,35-2,46 (1H, м), 4,85-4,92 (1H, м), 6,41-6,47 (1H, м)
MS m/z: 283 [M+Na]+
[0147] (2) 6-проп-2-ен-1-ил 2-{1-[({[(1R,2S,4R)-1,7,7-триметилбицикло[2.2.1]гептан-2-ил]окси}карбонил)окси]этил} (1R,2R,3R,5R,6R)-6-фтор-3-[(4-фторфенил)метокси]-2-({[(проп-2-ен-1-ил)окси]карбонил}амино)бицикло[3.1.0]гексан-2,6-дикарбоксилат
[0148] [Формула 69]

Указанное в заголовке соединение (0,34 г) получали в виде смеси диастереомеров (бесцветное масло) по той же методике, что и в примере 15-(2), с использованием соединения (0,40 г, 0,89 ммоль), полученного согласно примеру 1-(2), и соединения (0,46 г, 1,77 ммоль), полученного согласно примеру 19-(1), в качестве исходных материалов.
1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 0,83-0,90 (9 H, м), 1,05-1,13 (1H, м), 1,20-1,35 (2H, м), 1,47-1,55 (3H, м), 1,66-1,79 (2H, м), 1,87-1,96 (1H, м), 2,22-2,29 (1H, м), 2,30-2,46 (3H, м), 2,90-3,04 (1H, м), 3,81-3,88 (1H, м), 4,45-4,71 (6H, м), 4,80-4,87 (1H, м), 5,03-5,14 (1H, м), 5,15-5,36 (4H, м), 5,84-5,96 (2H, м), 6,89 (1H, кв, J=5,4 Гц), 7,03 (2H, м), 7,23-7,30 (2H, м)
MS m/z: 698 [M+Na]+
[0149] (3) Разделение 6-проп-2-ен-1-ил 2-{1-[({[(1R,2S,4R)-1,7,7-триметилбицикло[2.2.1]гептан-2-ил]окси}карбонил)окси]этил} (1R,2R,3R,5R,6R)-6-фтор-3-[(4-фторфенил)метокси]-2-({[(проп-2-ен-1-ил)окси]карбонил}амино)бицикло[3.1.0]гексан-2,6-дикарбоксилата
[0150] [Формула 70]

Соединение (0,34 г, 0,50 ммоль), полученное согласно примеру 19(2), разделяли хиральной колоночной хроматографией (CHIRALPAK ID, н-гексан/EtOH=84:16) с получением фракции 1-го пика в виде соединения примера 19(3)-A (0,085 г, бесцветное масло) и компонента, содержащего фракцию 2-го пика. Компонент, содержащий фракцию 2-го пика, далее очищали хиральной колоночной хроматографией (CHIRALPAK AS-H, н-гексан/EtOH=80:20) с получением соединения примера 19(3)-B (0,098 г) (бесцветное масло).
Время удержания: пример 19(3)-A; 3,51 мин, пример 19(3)-B; 4,25 мин. (CHIRAL PAK ID-3, н-гексан/EtOH=4:1)
[0151] (4) (1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-фторфенил)метокси]-2-({1-[({[(1R,2S,4R)-1,7,7-триметилбицикло[2.2.1]гептан-2-ил]окси}карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота (примеры 19-A и 19-B)
[0152] [Формула 71]
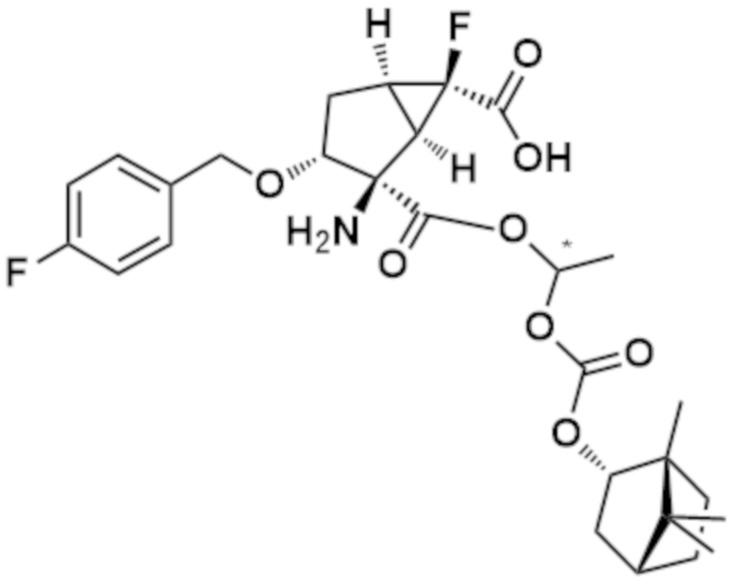
Указанные в заголовке соединения примера 19-A (0,044 г) и примера 19-B (0,056 г) (оба представляли собой бесцветные твердые вещества) по той же методике, что и в примере 15-(4), с использованием соединений примера 19(3)-A (0,076 г, 0,11 ммоль) и соединения примера 19(3)-B (0,085 г, 0,13 ммоль), полученного согласно примеру 19(3), в качестве исходных материалов, соответственно.
Пример 19-A
1H ЯМР (400 МГц, DMSO-d6) δ м.д.0,77-0,88 (12 H, м), 0,98 (1H, дд, J=13,9, 3,4 Гц), 1,13-1,33 (2H, м), 1,40 (2H, секст, 7,1 Гц), 1,49 (3H, д, 5,4 Гц), 1,63-1,83 (3H, м), 1,96-2,03 (2H, м),2,15-2,23 (1H, м), 2,25-2,38 (3H, м), 3,26-3,33 (1H, м), 3,39-3,47 (1H, м), 3,54-3,64 (1H, м), 4,70-4,76 (1H, м), 6,66-6,71 (1H, м)
MS m/z: 552 [M+H]+
Пример 19-B
1H ЯМР (400 МГц, DMSO-d6) δ м.д. 0,76-0,90 (12 H, м), 1,04 (1H, дд, J=13,7, 3,3 Гц), 1,16-1,32 (2H, м), 1,41 (2H, секст, J=7,1 Гц), 1,50 (3H, д, J=5,4 Гц), 1,64-1,84 (3H, м), 1,97-2,06 (1H, м), 2,06-2,21 (2H, м), 2,25-2,36 (2H, м), 3,22-3,32 (1H, м), 3,39-3,47 (1H, м), 3,58-3,66 (1H, м), 4,71-4,78 (1H, м), 6,70-6,75 (1H, м)
MS m/z: 552 [M+H]+
[0153] Пример 20 Синтез (1R,2R,3R,5R,6R)-2-амино-6-фтор-3-пропокси-2-({1-[({[(1R,2S,4R)-1,7,7-триметилбицикло[2.2.1]гептан-2-ил]окси}карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновой кислоты
[0154] [Формула 72]

[0155] (1) 6-проп-2-ен-1-ил 2-{1-[({[(1R,2S,4R)-1,7,7-триметилбицикло[2.2.1]гептан-2-ил]окси}карбонил)окси]этил} (1R,2R,3R,5R,6R)-6-фтор-2-({[(проп-2-ен-1-ил)окси]карбонил}амино)-3-пропоксибицикло[3.1.0]гексан-2,6-дикарбоксилат
[0156] [Формула 73]

Указанное в заголовке соединение (0,24 г) получали в виде смеси диастереомеров (бесцветное аморфное вещество) по той же методике, что и в примере 15-(2), с использованием соединения (0,40 г, 0,94 ммоль), полученного согласно примеру 13-(2), и соединения (0,49 г, 1,89 ммоль), полученного согласно примеру 19-(1), в качестве исходных материалов.
1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 0,84-0,92 (12 H, м), 1,03-1,13 (1H, м), 1,22-1,35 (2H, м), 1,47-1,57 (6H, м), 1,67-1,79 (2H, м), 1,90-1,97 (1H, м), 2,21-2,48 (4H, м), 2,91-3,01 (1H, м), 3,27-3,33 (1H, м), 3,47-3,53 (1H, м), 3,72-3,78 (1H, м), 4,50-4,71 (4H, м), 4,83-4,88 (1H, м), 5,17-5,36 (4H, м), 5,84-5,96 (2H, м), 6,87 (1H, кв, J=5,3 Гц)
MS m/z: 610 [M+H]+
[0157] (2) Разделение 6-проп-2-ен-1-ил 2-{1-[({[(1R,2S,4R)-1,7,7-триметилбицикло[2.2.1]гептан-2-ил]окси}карбонил)окси]этил} (1R,2R,3R,5R,6R)-6-фтор-2-({[(проп-2-ен-1-ил)окси]карбонил}амино)-3-пропоксибицикло[3.1.0]гексан-2,6-дикарбоксилата
[0158] [Формула 74]
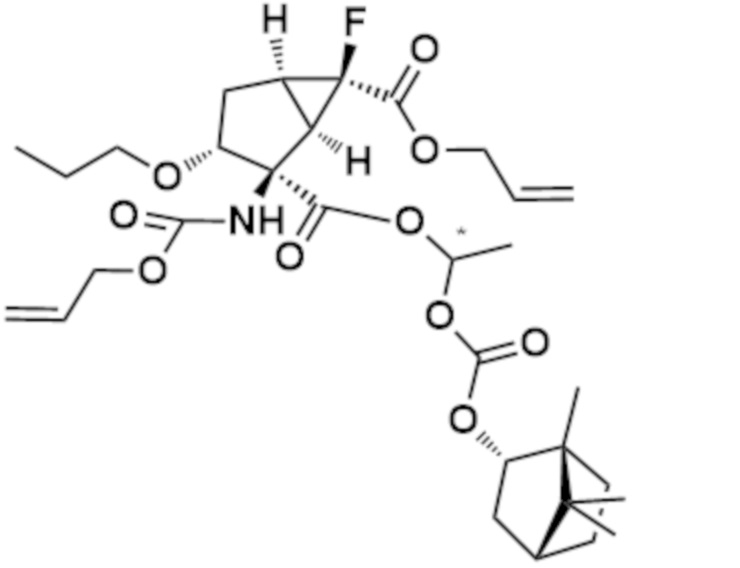
Соединение (0,24 г, 0,40 ммоль), полученное согласно примеру 20(1), разделяли хиральной колоночной хроматографией (CHIRALPAK ID, н-гексан/EtOH=85:15) с получением фракции 1-го пика в виде соединения примера 20(2)-A (0,056 г, бесцветное масло) и фракции 2-го пика в виде соединения примера 20(2)-B (0,10 г, бесцветное аморфное вещество).
Время удержания: пример 20(2)-A; 3,83 мин, пример 20(2)-B; 4,47 мин. (CHIRAL PAK ID-3, н-гексан/IPA=85:15)
[0159] (3) (1R,2R,3R,5R,6R)-2-амино-6-фтор-3-пропокси-2-({1-[({[(1R,2S,4R)-1,7,7-триметилбицикло[2.2.1]гептан-2-ил]окси}карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота (пример 20)
[0160] [Формула 75]

Указанное в заголовке соединение примера 20 (0,019 г) (бесцветное твердое вещество) получали по той же методике, что и в примере 15-(4), с использованием соединения примера 20(2)-A (0,056 г, 0,092 ммоль), полученного на стадии (2), в качестве исходного материала.
1H ЯМР (400 МГц, DMSO-d6) δ м.д. 0,77-0,89 (12 H, м), 1,00 (1H, дд, J=13,9, 3,3 Гц), 1,13-1,23 (1H, м), 1,24-1,33 (1H, м), 1,36-1,47 (2H, м), 1,50 (3H, д, J=5,5 Гц), 1,66-1,83 (3H, м), 1,97-2,22 (3H, м), 2,26-2,36 (2H, м), 3,24-3,32 (1H, м), 3,40-3,46 (1H, м), 3,56-3,63 (1H, м), 4,74 (1H, м, J=9,6, 2,3 Гц), 6,72 (1H, кв, J=5,3 Гц)
MS m/z: 486 [M+H]+
[0161] Пример 21 Синтез (1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-фторфенил)метокси]-2-({1-[({[(1R,2R,4S)-1,3,3-триметилбицикло[2.2.1]гептан-2-ил]окси}карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновой кислоты
[0162] [Формула 76]

[0163] (1) 1-Хлорэтил (1R,2R,4S)-1,3,3-триметилбицикло[2.2.1]гептан-2-илкарбонат
[0164] [Формула 77]

Указанное в заголовке соединение (6,2 г) (бесцветное масло) получали по той же методике, что и в примере 15(1), с использованием (+)-фенхола (5,0 г, 32,41 ммоль) в качестве исходного материала.
1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 0,86 (3H, д, J=7,8 Гц), 1,10-1,17 (7 H, м), 1,22 (1H, дд, J=10,4, 1,5 Гц), 1,42-1,54 (1H, м), 1,56-1,62 (1H, м), 1,67-1,81 (3H, м), 1,85 (3H, д, J=5,7 Гц), 4,25-4,34 (1H, м), 6,41-6,47 (1H, м)
MS m/z: 283 [M+Na]+
[0165] (2) 6-проп-2-ен-1-ил 2-{1-[({[(1R,2R,4S)-1,3,3-триметилбицикло[2.2.1]гептан-2-ил]окси}карбонил)окси]этил} (1R,2R,3R,5R,6R)-6-фтор-3-[(4-фторфенил)метокси]-2-({[(проп-2-ен-1-ил)окси]карбонил}амино)бицикло[3.1.0]гексан-2,6-дикарбоксилат
[0166] [Формула 78]

Указанное в заголовке соединение (0,29 г) получали в виде смеси диастереомеров (бесцветное аморфное вещество) по той же методике, что и в примере 15-(2), с использованием калиевой соли (0,40 г, 0,81 ммоль) соединения, полученного согласно примеру 1-(2), и соединения (0,42 г, 1,63 ммоль), полученного согласно примеру 21-(1), в качестве исходных материалов.
1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 0,79-0,90 (3H, м), 1,00-1,12 (7 H, м), 1,15-1,22 (1H, м), 1,41-1,58 (5H, м), 1,62-1,77 (3H, м), 2,20-2,28 (1H, м), 2,36-2,45 (2H, м), 2,96 (1H, ушир. с), 3,79-3,85 (1H, м), 4,20-4,26 (1H, м), 4,44-4,71 (6H, м), 5,04 (1H, ушир. с), 5,19-5,36 (4H, м), 5,85-5,95 (2H, м), 6,80-6,93 (1H, м), 7,02 (2H, т, J=8,7 Гц), 7,25-7,28 (2H, м)
MS m/z: 676 [M+H]+
[0167] (3) Разделение 6-проп-2-ен-1-ил 2-{1-[({[(1R,2R,4S)-1,3,3-триметилбицикло[2.2.1]гептан-2-ил]окси}карбонил)окси]этил} (1R,2R,3R,5R,6R)-6-фтор-3-[(4-фторфенил)метокси]-2-({[(проп-2-ен-1-ил)окси]карбонил}амино)бицикло[3.1.0]гексан-2,6-дикарбоксилата
[0168]
[Формула 79]

Соединение (0,19 г, 0,28 ммоль), полученное согласно примеру 21(2), разделяли хиральной колоночной хроматографией (CHIRALPAK ID, н-гексан/EtOH=85:15) с получением фракции 1-го пика в виде соединения примера 21(3)-A (0,061 г) и фракции 2-го пика в виде соединения примера 21(3)-B (0,042 г) (оба представляли собой бесцветное масло).
Время удержания: пример 21(3)-A; 3,43 мин, пример 21(3)-B; 4,60 мин (CHIRAL PAK ID-3, н-гексан/EtOH=85:15)
[0169] (4) (1R,2R,3R,5R,6R)-2-амино-6-фтор-3-[(4-фторфенил)метокси]-2-({1-[({[(1R,2R,4S)-1,3,3-триметилбицикло[2.2.1]гептан-2-ил]окси}карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновая кислота (пример 21)
[0170] [Формула 80]

Указанное в заголовке соединение примера 21 (0,024 г) (бесцветное твердое вещество) получали по той же методике, что и в примере 15-(4), с использованием соединения примера 21(3)-B (0,042 г, 0,063 ммоль), полученного согласно примеру 21(3), в качестве исходного материала.
1H ЯМР (400 МГц, DMSO-d6) δ м.д. 0,77 (3H, с), 0,97-1,21 (8 H, м), 1,37-1,48 (4H, м), 1,52-1,66 (4H, м), 1,70 (1H, ушир. д, J=3,3 Гц), 1,91-2,05 (3H, м), 2,17-2,37 (2H, м), 3,72 (1H, м), 4,18 (1H, д, J=1,6 Гц), 4,45 (1H, д, J=11,6 Гц), 4,55 (1H, д, J=11,9 Гц), 6,69 (1H, кв, J=5,5 Гц), 7,12-7,19 (2H, м), 7,26-7,32 (2H, м)
MS m/z: 552 [M+H]+
[0171] Получение активных форм с (II)-4 по (II)-14
[0172] [Формула 81]

Структурные формулы, названия и показания приборов (1H ЯМР и определенные данные спектра MS) активной формы соединений, синтезированных с использованием подхода в соответствии со способом получения, описанным в WO03/061698 или WO2011/061935 (соединения № с (II)-4 по (II)-13) и активной формы соединения, синтезированного с использованием подхода в соответствии со способом получения, описанным в примере 38 (соединение № (II)-14) представлены в таблице A.
[Таблица A]
[0173] Структурные формулы, названия и показания приборов (1H-ЯМР и определенные данные спектра MS) соединений, синтезированных аналогично примеру 4 с использованием соответствующих активных форм, описанных в [таблице A] в качестве исходных материалов представлены в таблице B (примеры № 22-30).
[Таблица B]
[0173] Структурные формулы, названия и показания приборов (1H-ЯМР и определенные данные спектра MS) соединений, синтезированных аналогично примеру 1 с использованием соответствующих активных форм, описанных в [таблице A] в качестве исходных материалов представлены в таблице С (примеры № 31-34).
[Таблица C]
[0175] Структурные формулы, названия и показания приборов (1H-ЯМР и определенные данные спектра MS) соединений, синтезированных аналогично примеру 1 представлены в таблице D (примеры № 35-37), за исключением того, что стадии, соответствующие примеру 1-(2), проводили с использованием известного соединения хлорметилциклогексанкарбоксилата, хлорметилбензоата или хлорметил 2,2-диметилпропаноата вместо (1R)-1-хлорэтил (1R,2S,5R)-5-метил-2-(пропан-2-ил)циклогексилкарбоната.(1R,2R,3R,5R,6R)-2-амино-2-({(1S)-1-[(2,2-диметилпропаноил)окси]этокси}карбонил)-6-фтор-3-[(4-фторфенил)метокси]бицикло[3.1.0]гексан-6-карбоновую кислоту, (1R,2R,3R,5R,6R)-2-амино-2-{[(1S)-1-(бензоилокси)этокси]карбонил}-6-фтор-3-[(4-фторфенил)метокси]бицикло[3.1.0]гексан-6-карбоновую кислоту и (1R,2R,3R,5R,6R)-2-амино-2-({(1S)-1-[(циклогексанкарбонил)окси]этокси}карбонил)-6-фтор-3-[(4-фторфенил)метокси]бицикло[3.1.0]гексан-6-карбоновую кислоту можно синтезировать аналогичным образом.
[Таблица D]
[0176] Пример 38 Синтез (1S,2R,3R,5R,6S)-2-амино-3-[(4-фторфенил)метокси]-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновой кислоты
[0177] [Формула 82]

[0178] (1) Синтез диэтилхлор[(1R)-3-оксоциклопентил]пропандиоата
[0179]
[Формула 83]

К раствору алюмогидрида лития (230 мг, 6,061 ммоль) в THF (20 мл), добавляли раствор (R)-(+)-1,1-би-2-нафтола (3,72 г, 13,0 ммоль) в THF (25 мл) при от 1 до 4°C. Смесь перемешивали при комнатной температуре в течение 50 минут, добавляли молекулярные сита 4A (10,00 г), карбонат натрия (280 мг, 2,642 ммоль) и диэтил 2-хлорпропандиоат (130,35 г, 612 ммоль). Смесь перемешивали при 40°C в течение 30 минут, капельно добавляли циклопент-2-ен-1-он (60,00 г, 730,8 ммоль) и полученную смесь перемешивали при 40°C в течение 4 часов. Нерастворимые вещества отфильтровывали при комнатной температуре, фильтрат концентрировали при пониженном давлении с получением смеси, содержащей указанное в заголовке соединение (202,39 г) (коричневое масло). Смесь, содержавшую указанное в заголовке соединение, использовали в следующей реакции без очистки. Оптическая чистота составляла 90,85% ee в анализе посредством хиральной колоночной хроматографии. Время удержания: (R)-форма; 6,58 мин, (S)-форма; 15,38 мин (CHIRAL PAK AY-3, скорость потока: 1,0 мл/мин, н-гексан/EtOH=90/10)
1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 1,24-1,37 (6H, м), 1,88-2,07 (1H, м), 2,12-2,30 (2H, м), 2,32-2,46 (2H, м), 2,47-2,58 (1H, м), 3,16-3,32 (1H, м), 4,22-4,40 (4H, м)
MS m/z: 277 [M+H]+
[0180] (2) Синтез этил (1S,5R,6S)-2-оксобицикло[3.1.0]гексан-6-карбоксилата
[0181] [Формула 84]

К раствору соединения (202,39 г, 612 ммоль), полученного согласно примеру 38(1), в N-метил-2-пирролидиноне (630 г) добавляли хлорид лития (51,89 г, 1,224 моль) и уксусную кислоту (36,75 г, 612 ммоль) при от 7 до 12°C, смесь перемешивали при 125°C в течение 4 часов. Реакционный раствор охлаждали до комнатной температуры и добавляли толуол и 10% солевой раствор, а затем проводили разделение жидкость-жидкость. Органический слой промывали два раза 10% солевым раствором. Органический слой сушили над безводным сульфатом натрия, а затем фильтровали. Фильтрат концентрировали при пониженном давлении, а затем подвергали азеотропной перегонке два раза с использованием IPA. К остатку добавляли IPA (30 мл) и смесь нагревали до 50°C. Нагревание смешанного раствора останавливали. Затем добавляли н-гептан (30 мл) и смесь охлаждали льдом при перемешивании. Выпавшие в осадок твердые вещества собирали фильтрацией. Твердые вещества промывали ледяным смешанным растворителем из IPA и н-гептана (1/1, 45 мл), а затем сушили аэрацией с использованием азота с получением указанного в заголовке соединения (53,87 г) в виде одного энантиомера (светло-коричневое твердое вещество). Оптическая чистота составляла >99% ee в анализе хиральной колоночной хроматографией. Подтверждали, что спектральные данные согласовывались со спектральными данными соединения, полученного описанным в литературе способом (см. J. Med. Chem., 2000, 43, 4893-4909). Время удержания: (1S,5R,6S)-форма; 8,52 мин, (1R,5S,6R)-форма; 9,87 мин (CHIRAL PAK AY-3, скорость потока: 1,0 мл/мин, н-гексан/EtOH=90/10).
1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 1,27 (3H, т, J=7,1 Гц), 1,99-2,18 (4H, м), 2,19-2,26 (1H, м), 2,27-2,31 (1H, м), 2,49-2,54 (1H, м), 4,16 (2H, кв, J=7,1 Гц)
MS m/z:169[M+H]+
[0182] (3) Синтез этил (1S,5R,6S)-2-[(триметилсилил)окси]бицикло[3.1.0]hex-2-енe-6-карбоксилата
[0183] [Формула 85]

К раствору этил (1S,5R,6S)-2-оксобицикло[3.1.0]гексан-6-карбоксилата (5,0 г, 29,73 ммоль), полученного согласно примеру 38(2), в толуоле (23,1 мл) капельно добавляли триэтиламин (6,22 мл, 44,59 ммоль) и триметилсилилтрифлат (7,93 г, 35,67 ммоль) при охлаждении льдом, и смесь перемешивали в течение 1 часа. Добавляли воду (60 мл) и смесь перемешивали в течение 30 минут. После разделения органического и водного слоев полученный органический слой промывали насыщенным водным раствором бикарбоната натрия (20 мл) и рассолом (20 мл) в указанном порядке. Органический слой сушили над безводным сульфатом натрия, а затем фильтровали. Фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения (9,91 г, 28,7 ммоль). Соединение использовали непосредственно в следующей реакции без дальнейшей очистки.
1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 0,22 (9 H, с), 1,21-1,27 (3H, м), 2,08-2,19 (1H, м), 2,20-2,28 (1H, м), 2,28-2,41 (2H, м), 2,52-2,66 (1H, м), 4,11 (2H, кв, J=7,2 Гц), 4,30-4,39 (1H, м)
[0184] (4) Синтез этил (1S,3R,5R,6S)-3-гидрокси-2-оксобицикло[3.1.0]гексан-6-карбоксилата
[0185] [Формула 86]
К суспензии метилтриоксорения (VII) (35,8 мг, 0,144 ммоль) в ацетонитриле (28,7 мл), охлажденной ледяной водой, капельно добавляли уксусную кислоту (173 мг, 2,87 ммоль), пиридин (68,2 мг, 0,86 ммоль) и 30% водный раствор пероксида водорода (4,99 мл, 48,9 ммоль). Капельно добавляли раствор этил (1S,5R,6S)-2-[(триметилсилил)окси]бицикло[3.1.0]гекс-2-ен-6-карбоксилата (6,91 г, 28,7 ммоль), полученного согласно примеру 38(3), в ацетонитриле (5,0 мл). Смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли метилтриоксорений (VII) (17,9 мг, 0,0719 ммоль) и смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли раствор карбоната натрия (609 мг, 5,75 ммоль) в воде (5,0 мл) и раствор пентагидрата тиосульфата натрия (12,5 г, 50,3 ммоль) в воде (50 мл) при охлаждении ледяной водой и смесь перемешивали в течение 10 минут. Реакционную смесь экстрагировали этилацетатом (100 мл) два раза. К полученному органическому слою добавляли безводный сульфат натрия и смесь оставляли стоять при комнатной температуре в течение 14 часов. После фильтрации фильтрат концентрировали при пониженном давлении. К остатку добавляли изопропиловый эфир (50 мл) и смесь перемешивали. Выпавшие в осадок твердые вещества собирали фильтрацией с получением указанного в заголовке соединения (3,26 г) (бесцветное твердое вещество).
1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δм.д. 1,22-1,33 (3H, м), 1,94-2,11 (1H, м), 2,20-2,27 (1H, м), 2,33-2,39 (1H, м), 2,48-2,56 (1H, м), 2,61-2,69 (1H, м), 3,90-4,02 (1H, м), 4,12-4,22 (3H, м)
MS m/z:185[M+H]+
[0186] (5) Синтез этил (1S,3R,5R,6S)-3-[(4-фторфенил)метокси]-2-оксобицикло[3.1.0]гексан-6-карбоксилата
[0187] [Формула 87]

К раствору этил (1S,3R,5R,6S)-3-гидрокси-2-оксобицикло[3.1.0]гексан-6-карбоксилата (0,53 г, 2,88 ммоль), полученного согласно примеру 38(4), и (4-фторфенил)метил 2,2,2-трихлорэтанимидата (1,25 г, 4,60 ммоль) в тетрагидропиране (3,0 мл) капельно добавляли трифторметансульфоновую кислоту (0,065 мл, 0,575 ммоль) при охлаждении льдом и смесь перемешивали в течение 1 часа. К реакционному раствору добавляли воду, а затем проводили экстракцию этилацетатом. Затем органический слой промывали рассолом. Полученный органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (Biotage SNAP Ultra 50g, гексан:этилацетат=От 100:0 до 35:65) с получением указанного в заголовке соединения (0,59 г) (бесцветное масло).
1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 1,23-1,29 (3H, м), 2,06-2,20 (2H, м), 2,24-2,35 (1H, м), 2,40-2,53 (2H, м), 3,76 (1H, т, J=8,3 Гц), 4,08-4,18 (2H, м), 4,56 (1H, д, J=11,6 Гц), 4,83 (1H, д, J=11,7 Гц), 6,97-7,06 (2H, м), 7,31 (2H, т, J=6,1 Гц)
MS m/z:315 [M+Na]+
[0188] (6) Синтез этил (1S,3R,5R,6S)-3-[(4-фторфенил)метокси]-2-{[(R)-2-метилпропан-2-сульфинил]имино}бицикло[3.1.0]гексан-6-карбоксилата
[0189] [Формула 88]

К раствору этил (1S,3R,5R,6S)-3-[(4-фторфенил)метокси]-2-оксобицикло[3.1.0]гексан-6-карбоксилата (1,00 г, 3,42 ммоль), полученного согласно примеру 38(5), и (R)-(+)-2-метил-2-пропансульфинамида (0,83 г, 6,84 ммоль) в тетрагидрофуране (6,8 мл), добавляли этоксид титана(IV) (2,12 мл, 10,26 ммоль) и смесь перемешивали при 70°C в течение 2 часов. Добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию хлороформом. Полученный органический слой сушили над безводным сульфатом магния и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (Biotage SNAP Ultra 50g, гексан:этил ацетат=от 100:0 до 30:70) с получением указанного в заголовке соединения (0,829 г) (бесцветное масло).
1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 1,14-1,31 (12 H, м), 1,81-1,87 (1H, м), 2,02-2,09 (1H, м), 2,33-2,48 (2H, м), 3,64-3,69 (1H, м), 3,97 (1H, т, J=7,9 Гц), 4,08-4,17 (2H, м), 4,49-4,62 (1H, м), 4,92 (1H, д, J=11,7 Гц), 6,99-7,05 (2H, м), 7,24-7,30 (2H, м)
MS m/z: 396 [M+H]+
[0190] (7) Синтез этил (1S,3R,5R,6S)-2-циано-3-[(4-фторфенил)метокси]-2-{[(R)-2-метилпропан-2-сульфинил]амино}бицикло[3.1.0]гексан-6-карбоксилата
[0191] [Формула 89]

К раствору этил (1S,3R,5R,6S)-3-[(4-фторфенил)метокси]-2-{[(R)-2-метилпропан-2-сульфинил]имино}бицикло[3.1.0]гексан-6-карбоксилата (0,83 г, 2,09 ммоль), полученного согласно примеру 38(6), в тетрагидрофуране (4,2 мл) добавляли фторид цезия (1,59 г, 10,5 ммоль) и триметилсилилцианид (0,623 г, 6,28 ммоль) при охлаждении льдом и смесь перемешивали в течение 2 часов. Добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию хлороформом. Органический слой отделяли, а затем концентрировали при пониженном давлении. К остатку добавляли смешанный раствор гексан:этилацетат=9:1 и смесь перемешивали. Затем преципитат собирали фильтрацией с получением указанного в заголовке соединения (0,77 г) (бесцветное твердое вещество).
1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 1,19 (9 H, с), 1,24 (3H, т, J=7,2 Гц), 1,69 (1H, т, J=3,0 Гц), 2,06-2,17 (2H, м), 2,25-2,33 (1H, м), 2,51 (1H, дд, J=6,6, 2,9 Гц), 3,48-3,59 (2H, м), 4,06-4,16 (2H, м), 4,52-4,63 (2H, м), 7,05 (2H, т, J=8,7 Гц), 7,31-7,37 (2H, м)
MS m/z: 445 [M+Na]+
[0192] (8) Синтез этил (1S,2S,3R,5R,6S)-2-амино-2-циано-3-[(4-фторфенил)метокси]бицикло[3.1.0]гексан-6-карбоксилата
[0193] [Формула 90]

К раствору этил (1S,3R,5R,6S)-2-циано-3-[(4-фторфенил)метокси]-2-{[(R)-2-метилпропан-2-сульфинил]амино}бицикло[3.1.0]гексан-6-карбоксилата (0,77 г, 1,81 ммоль), полученного согласно примеру 38(7), в тетрагидрофуранк (1,8 мл) добавляли раствор 2 моль/л хлористоводородной кислоты в этаноле (4,5 мл, 9,00 ммоль) при охлаждении льдом и смесь перемешивали при комнатной температуре в течение 4 часов. Добавляли насыщенный водный раствор бикарбоната натрия, а затем проводили экстракцию хлороформом. Водный и органический слои разделяли и полученный органический слой концентрировали при пониженном давлении. К остатку добавляли изопропиловый эфир и смесь перемешивали с получением указанного в заголовке соединения (0,51 г) (бесцветное твердое вещество).
1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 1,24 (3H, т, J=7,2 Гц), 1,75 (1H, т, J=3,1 Гц), 1,92-2,11 (4H, м), 2,27-2,34 (2H, м), 3,34 (1H, дд, J=9,1, 6,7 Гц), 4,07-4,15 (2H, м), 4,51 (1H, д, J=11,9 Гц), 4,60 (1H, д, J=12,0 Гц), 7,04 (2H, т, J=8,7 Гц), 7,31 (2H, дд, J=8,4, 5,5 Гц)
MS m/z: 319 [M+H]+
[0194] (9) Синтез (1S,2R,3R,5R,6S)-2-амино-3-[(4-фторфенил)метокси]бицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (соединение № II-15)
[0195] [Формула 91]
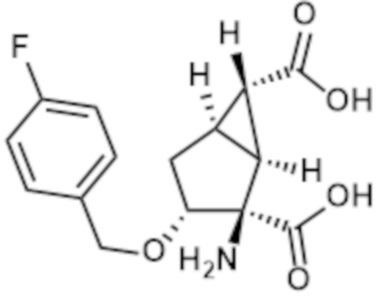
К раствору гидроксида натрия (1,47 г, 7,36 ммоль) в воде (5,9 мл), капельно добавляли 30% водный раствор пероксида водорода (0,081 мл, 0,79 ммоль) и раствор этил (1S,2S,3R,5R,6S)-2-амино-2-циано-3-[(4-фторфенил)метокси]бицикло[3.1.0]гексан-6-карбоксилата (0,16 г, 0,53 ммоль), полученного согласно примеру 38(8), в диметилсульфоксиде (0,53 мл), при охлаждении льдом. Температуру повышали до комнатной температуры и смесь перемешивали в течение 1 часа. Температуру повышали до 100°C и реакционную смесь перемешивали в течение 5 часов. Реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь доводили приблизительно до pH=1 посредством 4M хлористоводородной кислоты, перемешивали в течение 1 часа, а затем концентрировали при пониженном давлении. Остаток очищали препаративной ВЭЖХ, и фракцию, содержавшую представляющее интерес соединение, концентрировали при пониженном давлении. К затвердевшему остатку добавляли EtOH и смесь перемешивали. Затем преципитат собирали фильтрацией с получением указанного в заголовке соединения (соединение № II-15) (0,046 г) (бесцветное твердое вещество).
1H ЯМР (400 МГц, DMSO-d6) δ м.д. 1,65-1,73 (1H, м), 1,73-1,81 (1H, м), 1,85 (1H, дд, J=7,2, 2,8 Гц), 2,05-2,20 (2H, м), 3,42-3,71 (1H, м), 4,32 (1H, д, J=11,5 Гц), 4,48 (1H, д, J=11,4 Гц), 7,07-7,18 (2H, м), 7,34 (2H, дд, J=8,6, 5,7 Гц)
MS m/z: 310 [M+H]+
[0196] (10) Синтез (1S,2R,3R,5R,6S)-3-[(4-фторфенил)метокси]-2-({[(проп-2-ен-1-ил)окси]карбонил}амино)бицикло[3.1.0]гексан-2,6-дикарбоновой кислоты
[0197] [Формула 92]

К смеси (1S,2R,3R,5R,6S)-2-амино-3-[(4-фторфенил)метокси]бицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (0,49 мг, 1,58 ммоль), полученной согласно примеру 38(9), 1,4-диоксана (3,2 мл) и насыщенного водного раствора бикарбоната натрия (5,6 мл) капельно добавляли аллилхлорформиат (0,34 мл, 3,17 ммоль) при комнатной температуре и смесь перемешивали в течение 3 часов. Добавляли воду и этилацетат и смесь перемешивали в течение 10 минут. Затем органический и водный слои разделяли и полученный водный слой доводили до pH 1 добавлением 2 M хлористоводородной кислоты, а затем проводили экстракцию этилацетатом. Органический слой сушили над безводным сульфатом натрия, затем фильтровали и концентрировали при пониженном давлении с получением смеси, содержащей указанное в заголовке соединение (0,53 г) (аморфное). Смесь использовали в следующей реакции без дальнейшей очистки.
MS m/z: 394 [M+H]+
[0198] (11) Синтез (1S,2R,3R,5R,6S)-3-[(4-фторфенил)метокси]-6-{[(проп-2-ен-1-ил)окси]карбонил}-2-({[(проп-2-ен-1-ил)окси]карбонил}амино)бицикло[3.1.0]гексан-2-карбоновой кислоты
[0199] [Формула 93]
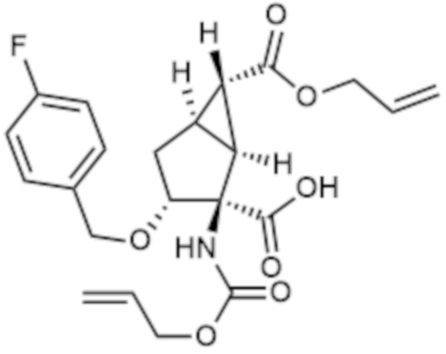
К раствору (1S,2R,3R,5R,6S)-3-[(4-фторфенил)метокси]-2-({[(проп-2-ен-1-ил)окси]карбонил}амино)бицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (0,050 г, 0,12 ммоль), полученной согласно примеру 38(10), в тетрагидрофуране (0,64 мл) добавляли 4-диметиламинопиридин (3,88 мг, 0,032 ммоль), 4-метилморфолин (0,021 мл, 0,19 ммоль) и аллилхлорформиат (0,015 мл, 0,14 ммоль) при комнатной температуре и смесь перемешивали в течение 4 часов. Добавляли насыщенный водный раствор хлорида аммония, а затем проводили экстракцию хлороформом. Полученный органический слой концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (Biotage SNAP Ultra 50g, хлороформ:метанол=от 100:0 до 90:10) с получением указанного в заголовке соединения (0,018 г) (коричневое аморфное вещество).
MS m/z: 434 [M+H]+
[0200] (12) Синтез 6-проп-2-ен-1-ил 2-[(1S)-1-{[(3R,5S)-трицикло[3.3.1.13,7]декан-1-карбонил]окси}этил] (1S,2R,3R,5R,6S)-3-[(4-фторфенил)метокси]-2-({[(проп-2-ен-1-ил)окси]карбонил}амино)бицикло[3.1.0]гексан-2,6-дикарбоксилата
[0201] [Формула 94]

К раствору в диметилсульфоксиде (3,3 мл) (1S,2R,3R,5R,6S)-3-[(4-фторфенил)метокси]-6-{[(проп-2-ен-1-ил)окси]карбонил}-2-({[(проп-2-ен-1-ил)окси]карбонил}амино)бицикло[3.1.0]гексан-2-карбоновой кислоты (0,14 г, 0,33 ммоль), полученной согласно примеру 38(11), добавляли карбонат калия (0,067 г, 0,48 ммоль) при комнатной температуре, и смесь перемешивали в течение 10 минут. Затем добавляли (1R)-1-хлорэтил трицикло[3.3.1.13,7]декан-1-карбоксилат (0,16 г, 0,65 ммоль) и смесь перемешивали в течение 16 часов. Реакционную смесь разбавляли этилацетатом и промывали насыщенным водным раствором хлорида аммония и рассолом. Полученный остаток очищали колоночной хроматографией на силикагеле (Biotage SNAP Ultra 10g, гексан:этилацетат=от 95:5 до 30:70) с получением указанного в заголовке соединения (0,15 г) (светло-желтое масло).
1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 1,48 (3H, д, J=5,4 Гц), 1,55 (2H, д, J=4,4 Гц), 1,62-1,75 (6H, м), 1,82-1,91 (6H, м), 1,95-2,18 (5H, м), 2,23-2,33 (1H, м), 2,57 (1H, дд, J=6,9, 3,0 Гц), 4,39-4,62 (6H, м), 5,15-5,36 (5H, м), 5,83-5,95 (2H, м), 6,91 (1H, кв, J=5,4 Гц), 6,99-7,06 (2H, м), 7,20-7,25 (2H, м).
MS m/z: 662 [M+Na]+
[0202] Пример 38 Синтез (1S,2R,3R,5R,6S)-2-амино-3-[(4-фторфенил)метокси]-2-({(1S)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновой кислоты
[0203] [Формула 95]

К раствору 6-проп-2-ен-1-ил 2-[(1S)-1-{[(3R,5S)-трицикло[3.3.1.13,7]декан-1-карбонил]окси}этил] (1S,2R,3R,5R,6S)-3-[(4-фторфенил)метокси]-2-({[(проп-2-ен-1-ил)окси]карбонил}амино)бицикло[3.1.0]гексан-2,6-дикарбоксилата (0,14 г, 0,21 ммоль), полученного согласно примеру 38(12), в хлороформе (0,73 мл) добавляли 1,3-диметилбарбитуровую кислоту (0,034 г, 0,22 ммоль) и тетракис(трифенилфосфин)палладий(0) (2,5 мг, 0,002 ммоль) при комнатной температуре и смесь перемешивали в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (YMC C18 12g, вода:ацетонитрил=от 95:5 до 5:95). Фракцию, содержавшую указанное в заголовке соединение, концентрировали. К полученному остатку добавляли изопропиловый эфир и смесь перемешивали. Преципитат собирали фильтрацией с получением указанного в заголовке соединения (0,021 г) (бесцветное твердое вещество).
1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 1,46 (3H, д, J=5,4 Гц), 1,64-1,76 (7 H, м), 1,87 (6H, с), 1,96-2,05 (5H, м), 2,10-2,19 (1H, м), 2,23-2,33 (1H, м), 3,59-3,69 (1H, м), 4,42 (2H, с), 6,88 (1H, кв, J=5,4 Гц), 7,00 (2H, т, J=8,1 Гц), 7,20 (2H, т, J=6,4 Гц)
MS m/z: 514 [M-H]-
[0204] Пример 39 Синтез (1S,2R,3R,5R,6S)-2-амино-3-[(4-фторфенил)метокси]-2-({(1R)-1-[({[(1R,2S,5R)-5-метил-2-(пропан-2-ил)циклогексил]окси}карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-6-карбоновой кислоты
[0205]
[Формула 96]

Указанное в заголовке соединение (пример № 39) (0,010 г) получали (бесцветное твердое вещество) по той же методике, что и в примере 38(12) и пример 38(13), с использованием (1S,2R,3R,5R,6S)-3-[(4-фторфенил)метокси]-6-{[(проп-2-ен-1-ил)окси]карбонил}-2-({[(проп-2-ен-1-ил)окси]карбонил}амино)бицикло[3.1.0]гексан-2-карбоновой кислоты (0,20 г, 0,46 ммоль), полученной согласно примеру 38(11), и (1R)-1-хлорэтил (1R,2S,5R)-5-метил-2-(пропан-2-ил)циклогексилкарбоната (0,29 г, 1,11 ммоль).
1H ЯМР (400 МГц, DMSO-d6) δ м.д. 0,67-1,13 (13 H, м), 1,28-1,52 (3H, м), 1,56-1,77 (4H, м), 1,77-2,03 (4H, м), 2,17-2,29 (2H, м), 3,45-3,66 (1H, м), 4,33-4,54 (3H, м), 6,63-6,69 (1H, м), 7,11-7,37 (4H, м)
MS m/z: 534 [M-H]-
[0206] Справочный пример 1 Синтез ((1S,2R,3R,5R,6S)-2-амино-3-[(4-фторфенил)метокси]-6-({(1R)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-2-карбоновой кислоты
[0207] [Формула 97]

[0208] (1) Синтез (1S,2R,3R,5R,6S)-3-[(4-фторфенил)метокси]-5'-оксо-3'-{[(проп-2-ен-1-ил)окси]карбонил}спиро[бицикло[3.1.0]гексан-2,4'-[1,3]оксазолидин]-6-карбоновой кислоты
[0209] [Формула 98]
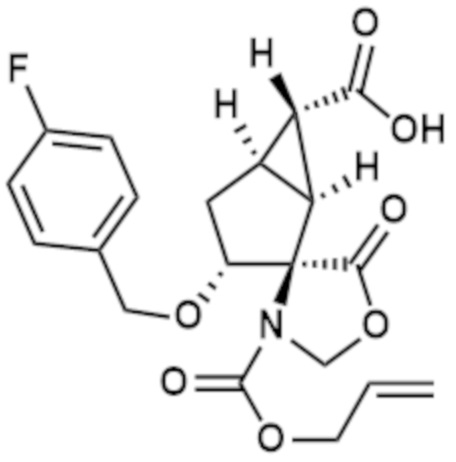
К раствору (1S,2R,3R,5R,6S)-3-[(4-фторфенил)метокси]-2-({[(проп-2-ен-1-ил)окси]карбонил}амино)бицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (0,096 г, 0,24 ммоль), полученной согласно примеру 38(10), в толуоле (2,3 мл) добавляли 37% формалин (0,06720 мл, 0,8968 ммоль) и моногидрат толуолсульфоновой кислоты (2,32 мг, 0,012 ммоль) и смесь перемешивали при 120°C в течение 4 часов, а затем перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь концентрировали при пониженном давлении с получением смеси, содержавшей указанное в заголовке соединение (0,19 г) (светло-желтое аморфное вещество). Смесь использовали в следующей реакции без дальнейшей очистки.
MS m/z: 404 [M-H]-
[0210] (2) Синтез 3'-проп-2-ен-1-ил 6-{(1R)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этил} (1S,2R,3R,5R,6S)-3-[(4-фторфенил)метокси]-5'-оксо-3'H-spiro[бицикло[3.1.0]гексан-2,4'-[1,3]оксазолидин]-3',6-дикарбоксилата
[0211] [Формула 99]

К раствору (1S,2R,3R,5R,6S)-3-[(4-фторфенил)метокси]-5'-оксо-3'-{[(проп-2-ен-1-ил)окси]карбонил}спиро[бицикло[3.1.0]гексан-2,4'-[1,3]оксазолидин]-6-карбоновой кислоты (0,19 г, 0,476 ммоль), полученной согласно (1), в диметилсульфоксиде (1,6 мл) добавляли карбонат калия (0,714 ммоль) при комнатной температуре и смесь перемешивали в течение 10 минут. Затем добавляли (1R)-1-хлорэтил трицикло[3.3.1.13,7]декан-1-карбоксилат (0,16 г, 0,65 ммоль) и смесь перемешивали в течение 16 часов. Реакционную смесь разбавляли этилацетатом и промывали насыщенным водным раствором хлорида аммония и рассола. Полученный остаток очищали колоночной хроматографией на силикагеле (Biotage SNAP Ultra 10п, гексан:этилацетат=от 95:5 до 50:50) с получением смеси, содержавшей указанное в заголовке соединение (0,088 г) (коричневое масло).
1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 1,41-1,47 (3H, м), 1,63-2,10 (15 H, м), 2,17-2,45 (5H, м), 4,01-4,21 (1H, м), 4,21-4,39 (1H, м), 4,45-4,62 (3H, м), 5,12-5,36 (4H, м), 5,84-5,94 (1H, м), 6,75-6,89 (1H, м), 6,90-7,08 (2H, м), 7,11-7,24 (2H, м)
[0212] (3) Синтез ((1S,2R,3R,5R,6S)-2-амино-3-[(4-фторфенил)метокси]-6-({(1R)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этокси}карбонил)бицикло[3.1.0]гексан-2-карбоновой кислоты
[0213] [Формула 100]

К раствору 3'-проп-2-ен-1-ил 6-{(1R)-1-[(трицикло[3.3.1.13,7]декан-1-карбонил)окси]этил} (1S,2R,3R,5R,6S)-3-[(4-фторфенил)метокси]-5'-оксо-3'H-спиро[бицикло[3.1.0]гексан-2,4'-[1,3]оксазолидин]-3',6-дикарбоксилата (0,088 г, 0,14 ммоль), полученного согласно (2), в хлороформе (1,4 мл) добавляли 1,3-диметилбарбитуровую кислоту (0,23 г, 0,14 ммоль) и тетракис(трифенилфосфин)палладий(0) (0,2 мг, 0,0001 ммоль) при комнатной температуре и смесь перемешивали в течение 3 часов. Реакционный раствор концентрировали при пониженном давлении. Затем добавляли ацетонитрил (2,0 мл) и смесь перемешивали при комнатной температуре. Преципитат собирали фильтрацией и сушили с получением указанного в заголовке соединения (0,014 г) (бесцветное твердое вещество).
1H ЯМР (400 МГц, DMSO-d6) δ м.д. 1,38 (3H, д, J=5,4 Гц), 1,61-2,02 (18 H, м), 2,07-2,20 (2H, м), 3,53-3,61 (1H, м), 4,31 (1H, д, J=11,5 Гц), 4,48 (1H, д, J=11,6 Гц), 6,64-6,70 (1H, м), 7,10-7,18 (2H, м), 7,31-7,39 (2H, м)
MS m/z: 516[M+H]+
[0214] Тест 1: тест связывания [35S]GTPγS
Клетки CHO, стабильно экспрессирующие рецепторы метаботропного глутамата mGluR2 и mGluR3 человека культивировали при 37°C в 5% CO2 с использованием модифицированной способом Дульбекко среде Игла [1% пролин, 1 мМ пируват натрия, 1 мМ янтарная кислота, 1 мМ динатрийсукцинат, 100 единиц/мл пенициллина, 100 мкг/мл стрептомицина, 400 (mGluR2) или 300 (mGluR3) мкг/мл гигромицина B, 2 мМ L-глутамин (добавленный непосредственно перед применением)], содержавшей 10% подвергнутую диализу эмбриональную телячью сыворотку. Клетки в состоянии смыкания монослоя промывали PBS(-), а затем диссоциировали с использованием клеточного скребка и центрифугировали при 1000 об/мин в течение 5 минут при 4°C для выделения клеток. Полученный осадок суспендировали в 20 мМ буфере HEPES (pH 7,4) (mGluR2) или 20 мМ буфере HEPES, содержавшем 1 мМ EDTA (pH 7,4) (mGluR3), и суспензия гомогенизировали в гомогенизаторе Teflon(R), а затем центрифугировали при 48000×g в течение 20 минут при 4°C, вновь получая осадок. Полученный осадок подвергали двум дополнительным циклам промывания и центрифугирования, а затем гомогенизировали буфером, описанным выше, с получением неочищенной мембранной фракции. Неочищенную мембранную фракцию разбавляли буфером для теста связывания (конечная концентрация: 20 мМ HEPES, 100 мМ NaCl, 10 мМ MgCl2, 10 мкM GDP, 10 мкг/мл сапонина, 0,1% BSA) (mGluR2) или (конечная концентрация: 20 мМ HEPES, 1 мМ EDTA, 100 мМ NaCl, 10 мМ MgCl2, 10 мкM GDP, 10 мкг/мл сапонина, 0,1% BSA) (mGluR3). К неочищенной мембранной фракции, содержавшей 10 мкг белком мембраны/анализ, добавляли каждое из соединений с (II)-1 по (II)-15 и смесь инкубировали при 30°C в течение 20 минут. Затем добавляли глутамат (конечная концентрация: 20 (mGluR2) или 1 (mGluR3) мкМ) и [35S]GTPγS (конечная концентрация: 0,15 нМ) и смесь инкубировали при 30°C в течение 1 часа. Раствор, инкубированный таким образом, фильтровали путем откачивания на фильтр Whatman GF/C, и фильтр промывали 1000 мкл ледяного 20 мМ буфера HEPES (pH 7,4) (mGluR2) или 20 мМ буфера HEPES, содержавшего 1 мМ EDTA (pH 7,4) (mGluR3). К полученному фильтру добавляли сцинтилляционный коктейль и количественно определяли радиоактивность связывания с мембраной с использованием жидкостного сцинтилляционного счетчика. Остаточную радиоактивность в отсутствие глутамата определяли ка неспецифическое связывание, и отличие от остаточной радиоактивности в присутствии глутамата определяли как специфическое связывание. Из процентного ингибирования специфического связывания при различных концентрациях соединений с (II)-1 по (II)-15, строили кривую ингибирования с использованием нелинейного анализа. Из кривой ингибирования вычисляли концентрации, в которых соединения с (II)-1 по (II)-15 ингибировали специфическое связывание на 50% (IC50). Результаты представлены в следующей таблице 1.
[0215] [Таблица 1]
[0216] Испытание 2: Испытание стабильности в растворе
Тест для определения стабильности соединений по изобретению (I-A) или (I) в растворе хлористоводородной кислоты (pH 1,2) и 20 мМ фосфатном буфере (pH 6,5) проводили в соответствии со следующим способом.
Соединение растворяли в растворе хлористоводородной кислоты (pH 1,2), содержавшем хлористоводородную кислоту и хлорид натрия, или в 20 мМ фосфатном буфере (pH 6,5), содержавшем гидрофосфат натрия, дигидрофосфат натрия и хлорид натрия, для получения раствора с концентрацией приблизительно 50 мкг/мл (близкая к насыщенной концентрации, когда соединение не растворялось). Раствор инкубировали при 37°C в течение 1 часа и концентрацию соединения до и после инкубации количественно определяли высокоэффективной жидкостной хроматографией для вычисления процентного остатка соединения. Соединения, имеющие низкую растворимость, оценивали как неприменимые.
Процентный остаток соответствующих соединений в растворе хлористоводородной кислоты (pH 1,2) и 20 мМ фосфатном буфере (pH 6,5) представлен в следующей таблице 2.
[0217]
[Таблица 2]
NA; неприменимо вследствие низкой растворимости
Как продемонстрировано выше, соединения по изобретению были в высокой степени стабильными в растворах, имитирующих желудок и тонкий кишечник, так что можно было предположить, что они будут существовать в качестве пролекарственной форме в пищеварительном тракте.
[0218] Испытание 3: Испытание процентного образования соединения (II)-A или (II) во фракциях печени S9
Процентное образование соединения (II)-A или (II) во фракциях печени S9 подтверждали для соединения по изобретению (I-A) или (I) в соответствии со следующим способом.
Каждое соединение по изобретению добавляли в натрий-калий-фосфатный буфер (0,25 моль/л, pH 7,4), содержавший фракцию S9 печени (человек: XenoTech, LLC/H0620.S9/партия 0810471, обезьяна: XenoTech, LLC/P2000.S9/партия 0910273), и смесь инкубировали (37°C) в течение 15 минут в присутствии кофактора. Конечную концентрацию соединения по изобретению и концентрацию белка в реакционной смеси доводили до 1 мкмоль/л и 1 мг белка/мл, соответственно. После инкубации реакции завершали добавлением двух объемов диметилсульфоксида. Белок удаляли центрифугированием (2150×g, 4°C, 10 мин). Полученный супернатант подвергали анализу жидкостной хроматографией-тандемной масс-спектрометрией (LC-MS/MS).
Анализируемое соединение элюировали в режиме линейного градиента с использованием Shimadzu Shim-pack XR-ODS (2,2 мкм, 30 мм x 3,0 мм I.D.) в качестве колонки для разделения и раствора 0,1% муравьиная кислота/ацетонитрил (скорость потока: 1,3 мл/мин) в качестве подвижной фазы. Анализ MS/MS соединения по изобретению (I-A) или (I), и соединения (II)-A или (II) проводили с использованием системы Triple TOF 5600 или Triple Quad 5500 с интерфейсом TurbolonSpray (обе являются продуктами AB SCIEX) в режиме детектирования либо положительных, либо отрицательных ионов.
Процентное образование соединения (II)-A или (II) во фракциях S9 печени представлено в следующей таблице 3 в отношении соединений по изобретению.
[0219]
[Таблица 3]
Соединение по изобретению (I-A) или (I) конвертировалось в соединение (II)-A или (II), таким образом, позволяя сделать предположение о конвертировании пролекарств в их активные формы в печени как человека, так и обезьяны.
[0220] Испытание 4: Измерение концентраций соединения (II)-A или (II) в плазме обезьян при пероральном введении
Концентрации соединения (II)-A или (II) в плазме после перорального введения соединения (II)-A или (II), и соединения по изобретению (I-A) или (I) количественно определяли следующим способом.
Соединение (II)-A или (II), и соединение по изобретению (I-A) или (I) вводили перорально самцам яванского макака (натощак) в дозе 1 мг/кг соединения (II)-A или (II) (носитель: 0,5% раствор метилцеллюлозы; вводимый в дозе 5 мл/кг).
До перорального введения и через 0,5 часа, 1 час, 2 часа, 4 часа, 8 часов и 24 часа после перорального введения приблизительно 0,6 мл крови отбирали из подкожной вены предплечья (антикоагулянт: EDTA-2K). Плазму, собранную центрифугированием (2000×g, 4°C, 15 мин) хранили замороженной при -30°C до применения для анализа. В случае анализа 50 мкл образца плазмы размораживали в условиях охлаждения льдом и после добавления 200 мкл смеси ацетонитрил/метанол, содержавшей внутреннее стандартное вещество полученную смесь перемешивали и центрифугировали (3639×g, 4°C, 10 мин) для удаления белка. Полученный супернатант подвергали анализу LC-MS/MS. Нижний предел количественного определения для соединения (II)-A или (II) составлял 1 нг/мл для всех образцов.
Данные максимальной концентрации в плазме (Cmax) и биодоступности (BA) для соединения (II)-A или (II) после перорального введения репрезентативных соединений обезьянам представлены в следующей таблице 4. BA вычисляли, исходя из концентрации соединения (II)-A или (II) в плазме после внутривенного введения соединения (II)-A или (II).
[0221] [Таблица 4]
Пероральное введение соединения по изобретению (I-A) или (I) значительно повышало экспозицию соединения (II)-A или (II), демонстрируя превосходный эффект пролекарства.
Промышленная применимость
[0222] Было обнаружено, что соединения по изобретению являются в высокой степени полезными в качестве пролекарств соединений (II)-A или (II), которые имеют выраженное действие на рецепторы метаботропного глутамата группы 2. Таким образом, соединения по изобретению или их фармацевтически приемлемые соли можно использовать в качестве средств для предупреждения или лечения состояний, контролируемых антагонистами рецепторов метаботропного глутамата группы 2, таких как расстройства настроения (включая депрессию и биполярное расстройство), тревожное расстройство, когнитивные расстройства, нарушения развития, болезнь Альцгеймера, болезнь Паркинсона, двигательные расстройства, ассоциированные с мышечной ригидностью, расстройства сна, хорея Хантингтона, расстройства питания, наркотическая зависимость, эпилепсия, инфаркт головного мозга, ишемия головного мозга, недостаточность головного мозга, отек головного мозга, нарушения спинного мозга, травма головы, воспаление и иммунные заболевания.
Реферат
Изобретение относится к соединению, соответствующему формуле (I-A) или формуле (I), или его фармацевтически приемлемой соли, которые могут применяться как лекарственное средство, обладающее антагонистическим действием в отношении рецепторов метаботропного глутамата группы 2. В формуле (I-A) R1обозначает C1-6алкильную группу, пиридильную группу, необязательно замещенную одним атомом галогена, или формулу (IIIA), где Rxобозначает атом водорода, атом галогена, C1-6алкильную группу или C1-6алкоксигруппу, где каждая из C1-6алкильной группы и C1-6алкоксигруппы необязательно замещена посредством от одного до трех атомов галогена, и Ryобозначает атом водорода, атом фтора, C1-6алкильную группу или C1-6алкоксигруппу, где каждая из C1-6алкильной группы и C1-6алкоксигруппы необязательно замещена посредством от одного до трех атомов галогена, R1'обозначает атом водорода или C1-6алкильную группу, или R1и R1'необязательно образуют C3-8циклоалкан вместе с атомом углерода, соседним с ними, R2обозначает C3-6алкильную группу, C3-8циклоалкильную группу, необязательно замещенную посредством от одной до трех C1-6алкильных групп, C3-8циклоалкоксигруппу, необязательно замещенную посредством от одной до трех C1-6алкильных групп и необязательно имеющую C1-5алкиленовую группу, связывающую два различных атома углерода в кольце, адамантильную группу, необязательно замещенную посредством от одной до трех C1-6алкильных групп, или фенильную группу, R3обозначает атом водорода или C1-6алкильную группу, R4обозначает атом водорода или атом фтора. Изобретение относится также к лекарственному средству, обладающему антагонистическим действием в отношении рецепторов метаботропного глутамата группы 2, которое содержит указанные соединения, и к средству для предупреждения или лечения состояния, в которое вовлечены рецепторы метаботропного глутамата группы 2. 4 н. и 15 з.п. ф-лы, 8 табл., 39 пр.
Формула











Документы, цитированные в отчёте о поиске
Производные 6-фторбицикло[3.1.0]гексана




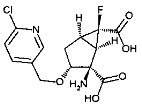










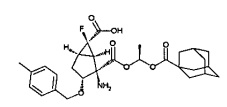


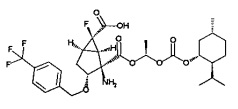



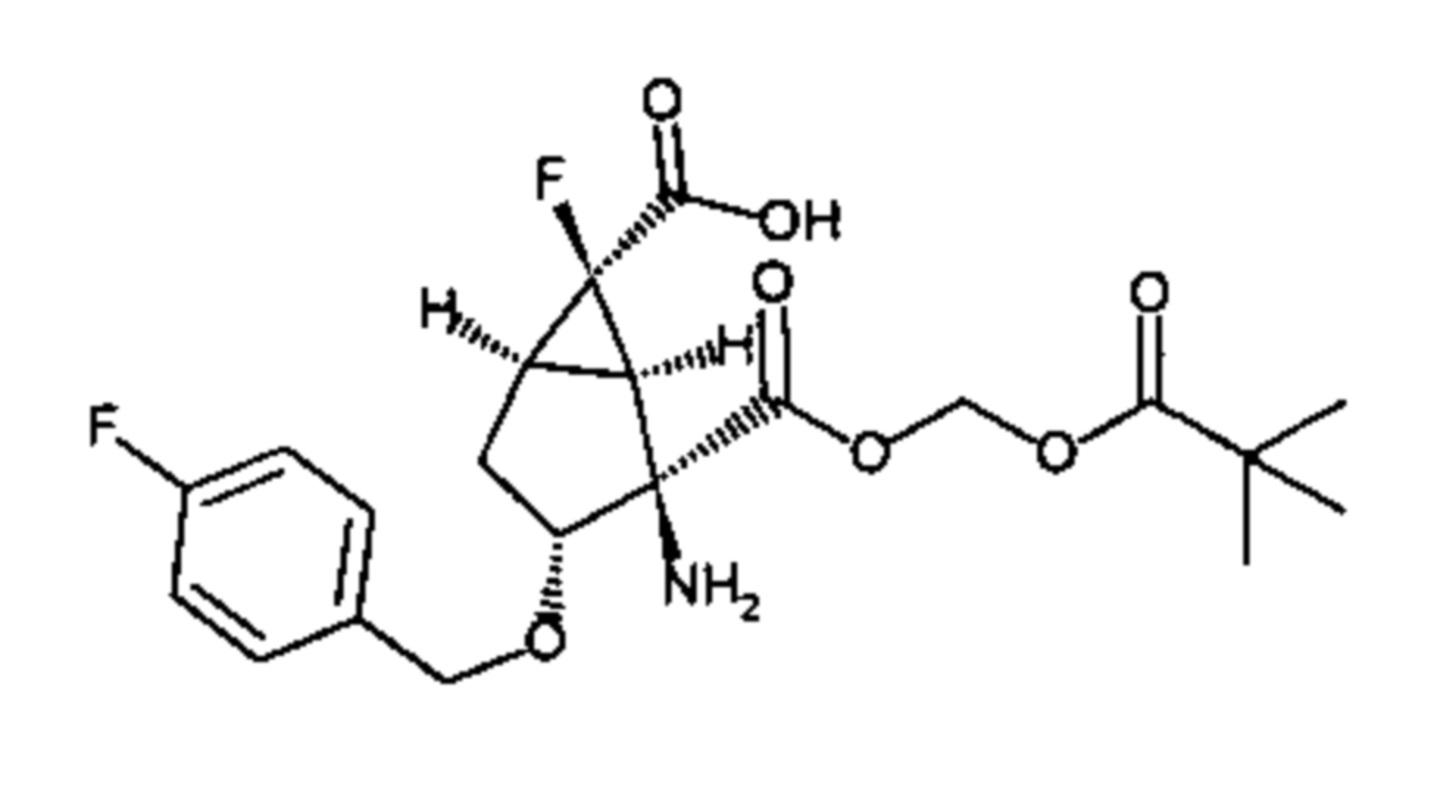



Комментарии