Производные 6-фторбицикло[3.1.0]гексана - RU2315622C2
Код документа: RU2315622C2
Чертежи


Описание
Область техники
Настоящее изобретение относится к производным 2-амино-3-алкокси-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты, которые могут применяться в области фармацевтики. Более конкретно настоящее изобретение относится к новым производным 2-амино-3-алкокси-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты, эффективным для лечения и профилактики психических заболеваний, таких как шизофрения, тревожность и связанные с ней заболевания, биполярное расстройство и эпилепсия, а также неврологических заболеваний, таких как лекарственная зависимость, когнитивные расстройства познавательной способности, болезнь Альцгеймера, хорея Гентингтона, болезнь Паркинсона, дискинезия, связанная с тугоподвижностью мышц, церебральная ишемия, церебральная недостаточность, миелопатия и травма головы.
Настоящее изобретение также связано с тем открытием, что соединения, действующие как антагонисты mGluR2 и mGluR3, которые принадлежат ко II подгруппе метаботропных глутаматных рецепторов (mGluR), обладают терапевтическим и профилактическим действием на депрессивные симптомы.
Предпосылки создания изобретения
В последние годы проводились успешные исследования по клонированию гена глутаматного рецептора, в результате которых было обнаружено, что глутаматные рецепторы имеют удивительно большое количество подтипов. В настоящее время глутаматные рецепторы в основном подразделяют на два вида: "ионотропные рецепторы со структурой ионного канала" и "метаботропные рецепторы, сопряженные с G-белком" (Science, 258, 597-603, 1992). Далее, ионотропные рецепторы подразделяют на три следующие фармакологические группы: N-метил-D-аспарагиновая кислота (NMDA), α-амино-3-гидрокси-5-метилизоксазол-4-пропионат (АМРА) и каинат (Science, 258, 597-603, 1992), тогда как метаботропные рецепторы подразделяют на 8 групп (от типа 1 до типа 8) (J. Neurosci., 13, 1372-1378, 1993; Neuropharmacol., 34, 1-26, 1995).
Метаботропные глутаматные рецепторы подразделяют также на три фармакологические группы. Среди них рецепторы группы II (mGluR2/mGluR3) связываются с аденилатциклазой и ингибируют форсколин-стимулированную аккумуляцию циклического аденозинмонофосфата (цАМФ) (Trends Pharmacol. Sci., 14, 13 (1993)).Следовательно, можно сделать вывод, что соединения, действующие как антагонисты метаботропных глутаматных рецепторов группы II, можно использовать для лечения и профилактики острых и хронических психических и неврологических заболеваний.
Целью настоящего изобретения является разработка лекарственного средства, которое можно использовать для лечения и профилактики таких психических заболеваний, как шизофрения, тревожность и связанные с ней заболевания, биполярное расстройство и эпилепсия, а также неврологических заболеваний, таких как лекарственная зависимость, расстройства познавательной способности, болезнь Альцгеймера, хорея Гентингтона, болезнь Паркинсона, дискинезия, связанная с тугоподвижностью мышц, церебральная ишемия, церебральная недостаточность, миелопатия и травма головы, причем лекарственное средство действует как антагонист метаботропных глутаматных рецепторов группы II.
С другой стороны, известно, что селективные ингибиторы обратного захвата серотонина (SSRI), ингибиторы обратного захвата норадреналина и т.п. являются антидепрессантами, однако эти ингибиторы разрабатываются не на основе этиологических соображений. Следовательно, пациенты, для которых такие лекарственные средства не являются эффективными, вероятно, продолжают страдать от симптомов депрессии и имеют пониженное качество жизни. Таким образом, существует потребность в разработке лекарственного средства, основанного на этиологических соображениях, которое направлено на устранение исходной причины депрессивных симптомов.
Другой целью настоящего изобретения является разработка нового типа антидепрессанта, эффективного для лечения и профилактики симптомов депрессии в тех случаях, когда существующие средства не являются эффективными.
Описание изобретения
В результате экстенсивных и интенсивных исследований, направленных на производные 2-амино-3-алкокси-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты, авторы настоящего изобретения открыли новые производные 2-амино-3-алкокси-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты, обладающие антагонистическим эффектом по отношению к метаботропным глутаматным рецепторам группы II. Кроме того, авторы настоящего изобретения провели эксперименты на животных с целью тестирования соединений, обладающих антагонистическим эффектом по отношению к метаботропным глутаматным рецепторам группы II, и в результате обнаружили, что такие соединения являются высокоэффективными для лечения депрессивных симптомов.
А именно, настоящее изобретение относится к антидепрессанту, содержащему в качестве активного ингредиента соединение, обладающее антагонистическим эффектом по отношению к метаботропным глутаматным рецепторам группы II, а также к новому производному 2-амино-3-алкокси-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты, обладающему антагонистическим эффектом по отношению к метаботропным глутаматным рецепторам группы II.
Одно воплощение настоящего изобретения направлено на антидепрессант, содержащий в качестве активного ингредиента соединение, обладающее антагонистическим эффектом по отношению к метаботропным глутаматным рецепторам группы II.
Другое воплощение настоящего изобретения направлено на производное 2-амино-3-алкокси-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты формулы [I]:

где
каждый из R1 и R2, которые могут быть одинаковыми или различными, означает гидроксильную группу, С1-10-алкоксильную группу, феноксигруппу, нафтилоксигруппу, С1-6-алкоксильную группу, которая замещена одной или двумя фенильными группами, С1-6-алкокси-С1-6-алкоксильную группу, гидрокси-С2-6-алкоксильную группу, аминогруппу, аминогруппу, замещенную одной или двумя одинаковыми или различными С1-6-алкильными группами, аминогруппу, замещенную одной или двумя одинаковыми или различными С1-6-алкокси-С1-6-алкильными группами, аминогруппу, замещенную одной или двумя одинаковыми или различными гидрокси-С2-6-алкильными группами, аминогруппу, замещенную одной или двумя одинаковыми или различными С1-6-алкоксикарбонил-С1-6-алкильными группами, или остаток природной или неприродной аминокислоты, представленный формулой NR6-CHR7-A-CO2R8 (где каждый из R6 иR7, которые могут быть одинаковыми или различными, означает атом водорода, гидрокси-С1-6-алкильную группу, гидроксикарбонил-С1-6-алкильную группу, С1-10-алкильную группу, фенильную группу, фенил-С1-6-алкильную группу, гидроксифенильную группу, гидроксифенил-С1-6-алкильную группу, нафтильную группу, нафтил-С1-6-алкильную группу, (ароматический гетероциклил)-С1-6-алкильную группу, С1-6-алкокси-С1-6-алкильную группу, амино-С2-6-алкильную группу, гуанидино-С2-6-алкильную группу, меркапто-С2-6-алкильную группу, С1-6-алкилтио-С1-6-алкильную группу или аминокарбонил-С1-6-алкильную группу, или R6 и R7 могут вместе означать группу, способную образовывать метиленовую группу, этиленовую группу или пропиленовую группу, или могут вместе образовывать циклическую аминогруппу; R8 означает атом водорода или защитную группу для карбоксильной группы; и А означает одинарную связь, метиленовую группу, этиленовую группу или пропиленовую группу);
R3 означает С1-10-ацильную группу, С1-6-алкокси-С1-6-ацильную группу, гидрокси-С2-10-ацильную группу, С1-6-алкоксикарбонил-С1-6 - ацильную группу, гидроксикарбонил-С1-6-ацильную группу или аминокислотный остаток, представленный формулой R9-NH-A-CHR7-CO (где R7 и А такие, определены как указано выше, а R9 означает атом водорода или защитную группу для аминогруппы); и каждый из R4 и R5, которые могут быть одинаковыми или различными, означает атом водорода, С1-10-алкильную группу, С2-10-алкенильную группу, фенильную группу, нафтильную группу, 5-членный гетероароматический цикл, содержащий один или несколько гетероатомов, или фенильную группу, замещенную 1-5 заместителями, выбранными из группы, состоящей из атома галогена, С1-10-алкильной группы, С1-10-алкоксильной группы, трифторметильной группы, фенильной группы, гидроксикарбонильной группы, аминогруппы, нитрогруппы, цианогруппы и феноксигруппы, или R4 и R5 вместе могут образовывать циклическую структуру или его фармацевтически приемлемую соль или гидрат.
Далее приводятся определения используемых в данном описании терминов и выражений.
Термин "С1-10-алкоксильная группа" относится к линейной или разветвленной алкоксильной группе, содержащей от 1 до 10 атомов углерода. Примеры включают метоксильную группу, этоксигруппу, пропоксигруппу, изопропоксигруппу, бутоксигруппу, изобутоксигруппу, трет-бутоксигруппу, пентилоксигруппу и изопентилоксигруппу.
Подразумевается, что фраза "С1-6-алкоксильная группа, замещенная одной или двумя фенильными группами" означает линейную алкильную группу, содержащую от 1 до 6 атомов углерода, или разветвленную алкильную группу, содержащую от 3 до 6 атомов углерода, причем каждая из указанных алкильных групп замещена одной или двумя фенильными группами. Примеры включают бензильную группу, дифенилметильную группу, 1-фенилэтильную группу и 2-фенилэтильную группу.
Подразумевается, что термин "С1-6-алкокси-С1-6 алкоксильная группа" означает С1-6-алкоксильную группу, замещенную С1-6-алкоксильной группой. Примеры включают метоксиэтоксигруппу, этоксиэтоксигруппу, пропоксиэтоксигруппу, изопропоксиэтоксигруппу, бутоксиэтоксигруппу, изобутоксиэтоксигруппу, трет-бутоксиэтоксигруппу, пентилоксиэтоксигруппу, изопентилоксиэтоксигруппу, метоксипропоксигруппу, этоксипропоксигруппу, пропоксипропоксигруппу, изопропоксипропоксигруппу, бутоксипропоксигруппу, изобутоксипропоксигруппу, трет-бутоксипропоксигруппу, пентилоксипропоксигруппу и изопентилоксипропоксигруппу.
Подразумевается, что термин "гидрокси-С2-6-алкоксильная группа" означает С2-6-алкоксильную группу, замещенную, по меньшей мере, одной гидроксильной группой. Примеры включают 2-гидроксиэтоксигруппу, 3-гидроксипропоксигруппу и 2,3-дигидроксипропоксигруппу.
Фраза "аминогруппа, замещенная одной или двумя одинаковыми или различными С1-6-алкильными группами" относится, например, к N-метиламиногруппе, N,N-диэтиламиногруппе или N-бутил-N-изопропиламиногруппе.
Фраза "аминогруппа, замещенная одной или двумя одинаковыми или различными С1-6-алкокси-С1-6-алкильными группами" относится, например, к N-3-метоксипропиламиногруппе, N, N-бис(2-этоксибутил)аминогруппе или N-(2-бутоксиэтил)-N-(1-этоксипропил)аминогруппе.
Фраза "аминогруппа, замещенная одной или двумя одинаковыми или различными гидрокси-С2-6 -алкильными группами" относится, например, к N-4-гидроксибутиламиногруппе, N,N-бис(3-гидроксипентил)аминогруппе или N-(2-гидроксиэтил)-N-(1-гидроксипентил)аминогруппе.
Фраза "аминогруппа, замещенная одной или двумя одинаковыми или различными С1-6-алкоксикарбонил-С1-6-алкильными группами" относится, например, к N-(3-этоксикарбонилпропил)аминогруппе, N, N-бис(2-метоксикарбонилэтил)аминогруппе или N-(3-пропоксикарбонилпропил)-N-(2-метоксибутил)аминогруппе.
Подразумевается, что термин "гидрокси-С1-6-алкильная группа" означает С1-6-алкильную группу, замещенную, по меньшей мере, одной гидроксильной группой. Примеры включают гидроксиметильную группу, 1-гидроксиэтильную группу, 2-гидроксиэтильную группу, 3-гидроксипентильную группу и 2-гидрокси-2-метилбутильную группу.
Подразумевается, что термин "гидроксикарбонил-С1-6-алкильная группа" означает С1-6-алкильную группу, замещенную, по меньшей мере, одной гидроксикарбонильной группой. Примеры включают гидроксикарбонилметильную группу, 4-гидроксикарбонилбутильную группу, 2-гидроксикарбонилэтильную группу и 3-гидроксикарбонилпропильную группу.
Термин "С1-10-алкильная группа" относится к линейной алкильной группе, содержащей от 1 до 10 атомов углерода, к разветвленной алкильной группе, содержащей от 3 до 10 атомов углерода, или к циклической алкильной группе, содержащей от 3 до 10 атомов углерода. Примеры линейной алкильной группы включают метильную группу, этильную группу, пропильную группу, бутильную группу, пентильную группу, гексильную группу, гептильную группу, октильную группу, нонильную группу и децильную группу. Примеры разветвленной алкильной группы включают изопропильную группу, изобутильную группу, трет-бутильную группу, изопентильную группу, 1-этилпропильную группу, изогексильную группу, 2-этилбутильную группу, изогептильную группу, изооктильную группу, изононильную группу, изодецильную группу, циклопропилметильную группу, 2-(циклопропил)этильную группу, циклобутилметильную группу и циклопентилметильную группу. Примеры циклической алкильной группы включают циклопропильную группу, циклобутильную группу, циклопентильную группу и циклогексильную группу.
Термин "фенил-С1-6-алкильная группа" относится, например, к бензильной группе, 2-фенилэтильной группе, 2-фенилпропильной группе или 1-метил-2-фенилпентильной группе.
Термин "гидроксифенил-С1-6-алкильная группа" относится, например, к 4-гидроксибензильной группе, 2-(4-гидроксифенил)этильной группе, 3-(4-гидроксифенил)пропильной группе или 4-(4-гидроксифенил)бутильной группе.
Термин "нафтил-С1-6-алкильная группа" относится, например, к 1-нафтилметильной группе, 2-нафтилметильной группе, 2-(1-нафтил)этильной группе или 2-(2-нафтил)этильной группе.
Подразумевается, что термин "(ароматический гетероциклил)- С1-6-алкильная группа" означает С1-6-алкильную группу, присоединенную к ароматической гетероциклической структуре, такой как индольный цикл или имидазольный цикл. Примеры включают индол-3-илметильную группу и 1Н-имидазол-4-илметильную группу.
Подразумевается, что термин "С1-6-алкокси-С1-6-алкильная группа" означает С1-6-алкильную группу, замещенную, по меньшей мере, одной С1-6-алкоксигруппой. Примеры включают 2-метоксиэтильную группу, 3-этоксипентильную группу и 3-пропоксибутильную группу.
Термин "амино-С2-6-алкильная группа" относится, например, к 2-аминоэтильной группе, 3-аминопропильной группе, 4-аминобутильной группе, 5-аминопентильной группе или 6-аминогексильной группе.
Термин "гуанидин-С2-6-алкильная группа" относится, например, к 2-гуанидинэтильной группе, 3-гуанидинпропильной группе, 4-гуанидинбутильной группе, 5-гуанидинпентильной группе или 6-гуанидингексильной группе.
Термин "меркапто-С2-6-алкильная группа" относится, например, к меркаптометильной группе, 2-меркаптоэтильной группе или 3-меркаптопропильной группе.
Термин "С1-6-алкилтио-С1-6-алкильная группа" относится, например, к метилтиометильной группе, 2-метилтиоэтильной группе, 3-метилтиопропильной группе, 4-метилтиобутильной группе, 5-метилтиопентильной группе или 6-метилтиогексильной группе.
Подразумевается, что термин "аминокарбонил-С1-6 -алкильная группа" означает С1-6-алкильную группу, замещенную, по меньшей мере, одной аминокарбонильной группой. Примеры включают аминокарбонилметильную группу, 2-аминокарбонилэтильную группу, 2-аминокарбонилпропильную группу и 4-аминокарбонилбутильную группу.
Выражение "защитная группа для карбоксильной группы" относится, например, к С1-10-алкильной группе, фенил-С1-6-алкильной группе, нитробензильной группе или метоксибензильной группе (см. E. Wünsch, "Synthese von Peptide" in "Houben-Weyl Methoden der Organishen Chemie". Vol.XV/1,2 and E. Gross, J. Meienhofer, "The Peptides". Vol.1-5).
Термин "С1-10-ацильная группа" относится к линейной или разветвленной ацильной группе, содержащей от 1 до 10 атомов углерода. Примеры включают формильную группу, ацетильную группу, 1-метилпропаноильную группу и гексаноильную группу.
Подразумевается, что термин "С1-6-алкокси-С1-6 -ацильная группа" означает С1-6-ацильную группу, замещенную, по меньшей мере, одной С1-6-алкоксильной группой. Примеры включают 3-этоксибутаноильную группу, 3-изопропоксипентаноильную группу и 4-этоксигексаноильную группу.
Подразумевается, что термин "гидрокси-С2-10-ацильная группа" означает С2-10-ацильную группу, замещенную, по меньшей мере, одной гидроксильной группой. Примеры включают 4-гидроксибутаноильную группу и 2-(гидроксиметил)бутаноильную группу.
Термин "С1-6 -алкоксикарбонил-С1-6-ацильная группа" относится, например, к 3-метоксикарбонилпропаноильной группе или 4-этоксикарбонилбутаноильной группе.
Термин "гидроксикарбонил-С1-6-ацильная группа" относится, например, к 3-гидроксикарбонил-2-метилбутаноильной группе или 5-гидроксикарбонилпропаноильной группе.
Выражение "защитная группа для аминогруппы" относится, например, к С1-10-ацильной группе, С1-6-алкокси-С1-6-ацильной группе, бензилоксикарбонильной группе, нитробензилоксикарбонильной группе или метоксибензилоксикарбонильной группе (см. E. Wünsch, "Synthese von Peptide" in "Houben-Weyl Methoden der Organishen Chemie", Vol.XV/1,2 and E. Gross, J. Meienhofer. "The Peptides". Vol.1-5).
Термин "С2-10-алкенильная группа" относится к линейной алкенильной группе, содержащей от 2 до 10 атомов углерода, к разветвленной алкенильной группе, содержащей от 3 до 10 атомов углерода, или к циклической алкенильной группе, содержащей от 5 до 10 атомов углерода, причем каждая из указанных алкенильных групп содержит, по меньшей мере, одну двойную связь. Примеры включают 2-пропенильную группу, 1-метил-2-бутенильную группу, 2-пентенильную группу, 2-метил-2-гексенильную группу и 2-циклопентенильную группу.
Подразумевается, что выражение "5-членный гетероатомный цикл, содержащий один или несколько гетероатомов" означает ароматический 5-членный цикл, содержащий один или несколько гетероатомов. Примеры включают тиофен, пиррол, фуран, пиразол, изоксазол, изотиазол, имидазол, оксазол, тиазол, оксадиазол и тиадиазол.
Термин "остаток природной или неприродной аминокислоты" относится к таким остаткам, как глицин, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, тирозин, триптофан, гистидин, серин, треонин, цистеин, метионин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, лизин, орнитин или аргинин, причем предпочтительными являются остатки природных аминокислот.
Подразумевается, что определение "фенильная группа, замещенная 1-5 заместителями, выбранными из группы, состоящей из атома галогена, С1-10-алкильной группы, С1-10-алкоксильной группы, трифторметильной группы, фенильной группы, гидроксикарбонильной группы, аминогруппы, нитрогруппы, цианогруппы и феноксигруппы" означает фенильную группу, замещенную 1-5 заместителями, выбранными из группы, состоящей из атома фтора, атома хлора, атома брома, атома иода, С1-10-алкильной группы, циклической С3-10-алкильной группы, С1-10-алкоксильной группы, циклической С3-10-алкоксильной группы, трифторметильной группы, фенильной группы, гидроксикарбонильной группы, аминогруппы, нитрогруппы, цианогруппы и феноксигруппы. Фенильная группа, замещенная одним заместителем, включает, например, 2-фторфенильную группу, 3-фторфенильную группу, 4-фторфенильную группу, 2-хлорфенильную группу, 3-хлорфенильную группу, 4-хлорфенильную группу, 2-бромфенильную группу, 3-бромфенильную группу, 4-бромфенильную группу, 2-иодфенильную группу, 3-иодфенильную группу, 4-иодфенильную группу, 2-метилфенильную группу, 3-метилфенильную группу, 4-метилфенильную группу, 2-этилфенильную группу, 3-этилфенильную группу, 4-этилфенильную группу, 2-изопропилфенильную группу, 3-изопропилфенильную группу, 4-изопропилфенильную группу, 2-циклопропилфенильную группу, 3-циклопропилфенильную группу, 4-циклопропилфенильную группу, 2-циклогексилфенильную группу, 3-циклогексилфенильную группу, 4-циклогексилфенильную группу, 2-метоксифенильную группу, 3-метоксифенильную группу, 4-метоксифенильную группу, 2-изопропоксифенильную группу, 3-изопропоксифенильную группу, 4-изопропоксифенильную группу, 2-циклобутилоксифенильную группу, 3-циклобутилоксифенильную группу, 4-циклобутилоксифенильную группу, 2-циклогексилоксифенильную группу, 3-циклогексилоксифенильную группу, 4-циклогексилоксифенильную группу, 2-трифторметилфенильную группу, 3-трифторметилфенильную группу, 4-трифторметилфенильную группу, 2-фенилфенильную группу, 3-фенилфенильную группу, 4-фенилфенильную группу, 2-гидроксикарбонилфенильную группу, 3-гидроксикарбонилфенильную группу, 4-гидроксикарбонилфенильную группу, 2-аминофенильную группу, 3-аминофенильную группу, 4-аминофенильную группу, 2-нитрофенильную группу, 3-нитрофенильную группу, 4-нитрофенильную группу, 2-цианофенильную группу, 3-цианофенильную группу, 4-цианофенильную группу, 2-феноксифенильную группу, 3-феноксифенильную группу или 4-феноксифенильную группу. Фенильная группа, замещенная двумя заместителями, включает, например, 2,3-дифторфенильную группу, 2, 4-дифторфенильную группу, 2,5-дифторфенильную группу, 2,6-дифторфенильную группу, 3,4-дифторфенильную группу, 3,5-дифторфенильную группу, 2,3-дихлорфенильную группу, 2,4-дихлорфенильную группу, 2, 5-дихлорфенильную группу, 2,6-дихлорфенильную группу, 3,4-дихлорфенильную группу, 3,5-дихлорфенильную группу, 2,3-дибромфенильную группу, 2,4-дибромфенильную группу, 2,5-дибромфенильную группу, 2, 6-дибромфенильную группу, 3,4-дибромфенильную группу, 3,5-дибромфенильную группу, 2,3-дииодфенильную группу, 2,4-дииодфенильную группу, 2,5-дииодфенильную группу, 2,6-дииодфенильную группу, 3, 4-дииодфенильную группу, 3,5-дииодфенильную группу, 3-хлор-4-фторфенильную группу, 4-хлор-3-фторфенильную группу, 3-бром-4-фторфенильную группу, 4-бром-3-фторфенильную группу, 4-бром-3-хлорфенильную группу, 3-бром-4-хлорфенильную группу, 3-хлор-4-метилфенильную группу, 4-хлор-3-метилфенильную группу, 3-фтор-4-метилфенильную группу, 4-фтор-3-метилфенильную группу, 3-фтор-4-метоксифенильную группу, 4-фтор-3-метоксифенильную группу, 3-бром-4-метоксифенильную группу, 4-бром-3-метоксифенильную группу, 3-хлор-4-феноксифенильную группу, 4-хлор-3-феноксифенильную группу, 3-хлор-4-нитрофенильную группу, 4-хлор-3-нитрофенильную группу, 4-бром-3-нитрофенильную группу, 3-бром-4-нитрофенильную группу, 3-амино-4-бромфенильную группу, 4-амино-3-бромфенильную группу, 3-бром-4-гидроксикарбонилфенильную группу, 4-бром-3-гидроксикарбонилфенильную группу, 4-фтор-3-гидроксикарбонилфенильную группу, 3-фтор-4-гидроксикарбонилфенильную группу, 4-фтор-3-гидроксикарбонилфенильную группу, 3-циано-4-фторфенильную группу, 3-циано-4-фторфенильную группу, 4-циано-3-метилфенильную группу, 3-циано-4-метилфенильную группу, 3-циано-4-метоксифенильную группу, 4-циано-3-метоксифенильную группу. Фенильная группа, замещенная тремя заместителями, включает, например, 2,3,4-трифторфенильную группу, 3,4,5-трифторфенильную группу, 3,4,5-трихлорфенильную группу, 3,5-дихлор-4-метоксифенильную группу или 3,5-дибром-4-метоксифенильную группу. Фенильная группа, замещенная четырьмя заместителями, включает, например, 2,5-дибром-3,4-диметоксифенильную группу или 3,4-дибром-2,5-диметоксифенильную группу. Фенильная группа, замещенная пятью заместителями, включает, например, 2,3,4,5,6-пентафторфенильную группу.
Определение "R4 и R5 могут вместе образовывать циклическую структуру" охватывает, например, циклопропильную группу, циклобутильную группу, циклопентильную группу, циклогексильную группу, циклогептильную группу, циклооктильную группу, циклопентенильную группу, циклогексенильную группу, циклогептенильную группу, циклооктенильную группу, оксациклобутильную группу, оксациклопентильную группу, оксациклогексильную группу, оксациклогептильную группу, оксациклооктильную группу, азациклобутильную группу, азациклопентильную группу, азациклогексильную группу, азациклогептильную группу, азациклооктильную группу.
Кроме того, в данном описании термин "фармацевтически приемлемая соль" относится, например, к соли минеральной кислоты, такой как серная кислота, хлористоводородная кислота или фосфорная кислота, или к соли органической кислоты, такой как уксусная кислота, щавелевая кислота, молочная кислота, винная кислота, фумаровая кислота, малеиновая кислота, метансульфоновая кислота или бензолсульфоновая кислота, к соли амина, такого как триметиламин или метиламин, или к соли иона металла, такого как ион натрия, ион калия или ион кальция.
Соединение формулы [I] имеет пять ассиметрических атомов углерода в бицикло[3.1.0]гексановом кольце. Предпочтительными для настоящего изобретения конфигурациями являются оптически активные формы, абсолютные структуры которых представлены формулами [II] и [III], однако соединения по изобретению могут присутствовать в виде энантиомеров или в виде смеси энантиомеров, включая рацемат. А именно, соединение настоящего изобретения включает все оптически активные формы, представленные нижеследующими формулами [II] и [III], а также смеси энантиомеров, включая рацематы, и смеси диастереомеров.

Соединение настоящего изобретения также может присутствовать в виде гидрата или сольвата с органическим растворителем.
Кроме того, если соединения формул [I], [II] или [III], где один или оба из R1 и R2 отличаются от гидроксильной группы, или R3 отличается от атома водорода, представляют собой сложноэфирные или амидные производные, то такие производные не оказывают влияния на метаботропные глутаматные рецепторы группы II. Однако такие сложноэфирные и амидные производные гидролизуются в организме и в результате превращаются в производные 2-амино-3-алкокси-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты, способные воздействовать на метаботропные глутаматные рецепторы группы II. Таким образом, данные сложноэфирные и амидные производные являются крайне полезными, так как они служат пролекарствами.
Соединение настоящего изобретения, представленное формулой [I], может быть получено по приведенным ниже схемам получения. В данных схемах R1, R2, R3, R4, R5, R6, R7, R8 и R9 определены, как указано выше; R10 означает арил- или алкилсульфонильную группу, такую как мезильная группа, фенилсульфонильная группа, тозильная группа или трифторметилсульфонильная группа, бензоильную группу или 4-нитробензоильную группу; каждый из R11, R12, R13 и R14, которые могут быть одинаковыми или различными, означает С1-10-алкоксигруппу, феноксигруппу, нафтилоксигруппу, С1-6-алкоксигруппу, которая замещена одной или двумя фенильными группами, С1-6-алкокси-С1-6-алкоксигруппу или гидрокси-С2-6-алкоксигруппу; и R15 означает аминогруппу, аминогруппу, в которой один или два атома водорода замещены одинаковыми или различными С1-6-алкильными группами, аминогруппу, в которой один или два атома водорода замещены одинаковыми или различными С1-6-алкокси-С1-6 -алкильными группами, аминогруппу, в которой один или два атома водорода замещены одинаковыми или различными гидрокси-С2-6-алкильными группами, аминогруппу, в которой один или два атома водорода замещены одинаковыми или различными С1-6-алкоксикарбонил-С1-6-алкильными группами, или NR6-CHR7-A-CO2R8.
Вначале по приведенной ниже схеме можно получить промежуточное соединение (6), требующееся для синтеза соединения [I] настоящего изобретения.

Стадия 1: В инертном растворителе и в присутствии основания, соединение (1), например, можно подвергнуть взаимодействию с трифторметансульфонирующим агентом, таким как трифторметансульфоновый ангидрид или N-фенил-бис(трифторметансульфонимид), с получением соединения (2). Примеры подходящего для использования инертного растворителя включают углеводородные растворители, такие как бензол, толуол и гексан, галогенированные растворители, такие как дихлорметан, хлороформ и четыреххлористый углерод, растворители - простые эфиры, такие как тетрагидрофуран, диэтиловый эфир и 1,2-диметоксиэтан, а также ацетонитрил, или их смеси. Примеры подходящего для использования основания включают амины, такие как триэтиламин, N-метилморфолин, диизопропилэтиламин и пиридин, неорганические основания, такие как гидрид калия и гидрид натрия, амиды металлов, такие как диизопропиламид лития, бис(триметилсилил)амид калия и гексаметилдисилазан лития, а также алкоголяты металлов, такие как метилат натрия и трет-бутилат калия.
Стадия 2: В инертном растворителе и в присутствии катализатора на основе переходного металла соединение (2), например, можно подвергнуть взаимодействию с монооксидом углерода и R2OH в присутствии органического основания, такого как триэтиламин, N-метилморфолин, диизопропилэтиламин или пиридин, или неорганического основания, такого как карбонат калия или бикарбонат натрия, с получением соединения (3) (см. Tetrahedron Letters 26, 1109 (1985)). В данном описании катализатор на основе переходного металла включает, например, реагент на основе палладия с нулевой валентностью, который может быть получен в реакционной системе с использованием двухвалентного палладия, такого как ацетат палладия (II), и лиганда, такого как трифенилфосфин или 2,2'-бис(дифенилфосфин)-1,1-бинафтил (BINAP). Альтернативно можно непосредственно использовать палладиевый реагент с нулевой валентностью, такой как тетракис(трифенилфосфин)палладий(0). Примеры пригодного для использования инертного растворителя включают углеводородные растворители, такие как бензол, толуол и гексан, простые эфиры, такие как тетрагидрофуран, диэтиловый эфир и 1,2-диметоксиэтан, а также ацетонитрил, N,N-диметилформамид или их смеси.
Стадия 3: В инертном растворителе соединение (3), например, может быть окислено до диола через обычное образование диола с использованием тетраоксида осмия или т.п. (см. M. Hudlicky, "Oxidation in Organic Chemistry") или через асимметричное цис-дигидроксилирование по Шарплесу (Sharpless) с использованием AD-mix в качестве реагента (Sharpless AD) (см. Tetrahedron Asymmetry 4, 133 (1993), J. Org. Chem. 57, 2768 (1992), J. Org. Chem. 61, 2582 (1996)) с получением в результате соединения (4). Примеры подходящего для использования инертного растворителя включают спиртовые растворители, такие как трет-бутиловый спирт, углеводородные растворители, такие как бензол, толуол и гексан, простые эфиры, такие как тетрагидрофуран, диэтиловый эфир и 1,2-диметоксиэтан, а также ацетонитрил, ацетон, N,N-диметилформамид, воду или их смеси.
Стадия 4: Соединение (4), например, можно подвергнуть взаимодействию с тионилхлоридом в инертном растворителе, таком как углеводородный растворитель (например, бензол, толуол, гексан), галогенированный растворитель (например, дихлорметан, хлороформ, четыреххлористый углерод), простой эфир (например, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан), ацетонитрил или любая смесь указанных растворителей, в присутствии или в отсутствие органического основания (например, триэтиламина, N-метилморфолина, диизопропилэтиламина, пиридина) или неорганического основания (например, карбоната калия, бикарбоната натрия). После данной реакции проводят окисление, используя традиционный окисляющий агент, такой как пероксид водорода, OXONE® или трихлорид рутения/метапериодат натрия (см. M. Hudlicky, "Oxidation in Organic Chemistry"), в инертном растворителе, таком как углеводородный растворитель (например, бензол, толуол, гексан), галогенированный растворитель (например, дихлорметан, хлороформ, четыреххлористый углерод), простой эфир (например, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан), ацетонитрил, ацетон, вода или любая смесь указанных растворителей, получая в результате соединение (5).
Стадия 5: Соединение (5), например, можно подвергнуть взаимодействию с азидом натрия в инертном растворителе, таком как простой эфир (например, тетрагидрофуран), кетон (например, ацетон), N,N-диметилформамид, вода или любая смесь указанных растворителей, затем гидролизу с получением соединения (6) (см. J. Am. Chem. Soc. 110, 7538 (1988)).
Промежуточное соединение (9), требующееся для синтеза соединения настоящего изобретения, имеющее относительную стереохимическую конфигурацию, представленную формулой [III], можно получить из соединения (7), имеющего нижеследующую относительную конфигурацию из возможных для промежуточного соединения (6).

Стадия 6: Гидроксильная группа соединения (7), в котором R1 и R2 отличаются от гидроксильной группы, может, например, взаимодействовать с трифторметансульфонирующим агентом, таким как трифторметансульфоновый ангидрид или N-фенил-бис(трифторметансульфонамид), или с алкил- или арилсульфонирующим агентом, таким как хлорангидрид метансульфоновой кислоты, хлорангидрид бензолсульфоновой кислоты или хлорангидрид толуолсульфоновой кислоты, в инертном растворителе, таком как углеводородный растворитель (например, бензол, толуол, гексан, циклогексан), галогенированный растворитель (например, дихлорметан, хлороформ, четыреххлористый углерод), простой эфир (например, тетрагидрофуран, диэтиловый эфир, 1, 2-диметоксиэтан), амид (например, N,N-диметилформамид, N-метил-2-пирролидон), диметилсульфоксид или любая смесь указанных растворителей, в присутствии неорганического основания (например, гидрида натрия, гидрида калия, карбоната калия, карбоната натрия, гидроксида натрия, гидроксида калия), амида металла (например, бис(триметилсилил)амида лития, диизопропиламида лития, амида натрия), органического основания (например, триэтиламина, пиридина, диизопропилэтиламина, 4-(N,N-диметиламино)пиридина, 2,6-ди-трет-бутилпиридина) или основания (например, трет-бутилата калия), с образованием соединения (8).
Стадия 7: Соединение (8), например, может взаимодействовать с гидроксидом щелочного металла, таким как гидроксид калия или гидроксид натрия, нитритом, таким как нитрит калия (см. Tetrahedron Lett., 3183 (1975)), или супероксидом калия (см. Tetrahedron Lett., 34, 8029 (1993)) в инертном растворителе, таком как углеводородный растворитель (например, бензол, толуол, гексан, циклогексан), галогенированный растворитель (например, дихлорметан, хлороформ, четыреххлористый углерод), простой эфир (например, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан), амид (например, N,N-диметилформамид, N-метил-2-пирролидон), спиртовой растворитель (например, диметилсульфоксид, метанол, этанол), вода или любая смесь указанных растворителей, в присутствии или при отсутствии краун-эфира, с образованием в результате промежуточного соединения (9).
Альтернативно, соединение (7) можно непосредственно превратить в соединение (9) по реакции Митцунобу (Mitsunobu), используя производное бензойной кислоты в присутствии дегидроконденсирующего агента, такого как диэтилазодикарбоксилат, и трифенилфосфина (см. D. L. Hughes, OR, 42, 335 (1992)).
Промежуточное соединение (6) можно превратить в соединение [1] настоящего изобретения, используя нижеприведенные стадии 8, 9 и 10.

Стадия 8: Гидроксильная группа соединения (6), в котором R1 и R2 отличаются от гидроксильной группы, может, например, взаимодействовать с соединением формулы R4R5CHX (где Х означает 2,2, 2-трихлорацетимидоилоксигруппу) в инертном растворителе, таком как углеводородный растворитель (например, бензол, толуол, гексан, циклогексан), галогенированный растворитель (например, дихлорметан, хлороформ, четыреххлористый углерод), простой эфир (например, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан), или любая смесь указанных растворителей, в присутствии катализатора - кислоты Брэнстеда (например, трифторметансульфоновой кислоты, трифторуксусной кислоты, хлористого водорода) или катализатора - кислоты Льюиса (например, комплекса трифторид бора/диэтиловый эфир, хлорида цинка, хлорида олова, триметилсилил/трифторметансульфоната), с образованием в результате соединения (10) (см. J. Chem. Soc. Perkin Trans. 1, 2247 (1985), Synthesis, 568 (1987)).
Альтернативно, гидроксильная группа соединения (6), в котором R1 и R2 отличаются от гидроксильной группы, может, например, взаимодействовать с соединением формулы R4R5CHX (где Х отличается от 2,2,2-трихлорацетимидоилоксигруппы) в инертном растворителе, таком как углеводородный растворитель (например, бензол, толуол, гексан), галогенированный растворитель (например, дихлорметан, хлороформ, четыреххлористый углерод), простой эфир (например, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан), амид (например, N,N-диметилформамид, N-метил-2-пирролидинон), диметилсульфоксид, или любая смесь указанных растворителей, в присутствии неорганического основания (например, гидрида натрия, гидрида калия, карбоната калия, карбоната натрия, гидроксида натрия, гидроксида калия), амида металла (например, бис(триметилсилил)амида лития, диизопропиламида лития, амида натрия), органического основания (например, триэтиламина, диизопропилэтиламина, 4-(N, N-диметиламино)пиридина, 2,6-ди-трет-бутилпиридина) или основания (например, трет-бутилата калия), с образованием в результате соединения (10). В данном случае Х представляет собой уходящую группу и означает атом галогена, тозилсульфонат, трифторметансульфонат, толилсульфонат и другие.
Стадия 9: Соединение (10) может быть превращено в соединение (11) настоящего изобретения, например, путем обычного восстановления азидной группы, примером которого является реакция Штаудингера, с использованием триэтилфосфита, триметилфосфина, трибутилфосфина, трифенилфосфина или т.п., в инертном растворителе, таком как углеводородный растворитель (например, бензол, толуол, гексан), галогенированный растворитель (например, дихлорметан, хлороформ, четыреххлористый углерод), простой эфир (например, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан), ацетонитрил, ацетон, вода или любая смесь указанных растворителей (см. Bull. Chem. Soc. Fr., 815 (1985)); гидрирования в присутствии металлического катализатора, такого как палладий/уголь или палладиевая чернь, в инертном растворителе, таком как спирт (например, этанол, метанол), сложный эфир (например, этилацетат), N,N-диметилформамид, вода или любая смесь указанных растворителей; или путем гидридного восстановления аминоборгидридом лития или т.п. (см. A. F. Abdel-Magid, "Reductions in Organic Synthesis").
Стадия 10: Фрагменты COR1 и COR2 в соединении (11) можно превратить в карбоновые кислоты путем обычного гидролиза (см. T. W. Greene, P. G. M. Wuts, "Protective Groups in Organic Synthesis") с получением соединения (I) настоящего изобретения.
Соединения (13) и (14) настоящего изобретения, которые представляют собой производное сложного моноэфира или моноамида, можно получить из соединения (11) или (12), используя нижеследующие стадии 11 и 12.

Стадия 11: Фрагмент COR1 в соединении (11) можно превратить в карбоновую кислоту путем традиционного гидролиза в течение короткого периода времени или при низкой температуре (см. T. W. Greene, P. G. M. Wuts, "Protective Groups in Organic Synthesis") с получением соединения (13) настоящего изобретения.
Стадия 12: Фрагмент карбоновой кислоты по 6 атому углерода соединения (12) может быть подвергнут традиционной этерификации (см. T. W. Greene, P. G. M. Wuts, "Protective Groups in Organic Synthesis") или традиционному образованию амидной связи, как в случае аминокислот, в присутствии соединения, представленного формулой R15-H (см. Е. Gross. J. Meienhofer, "The Peptides" and J. P. Greenstein, M. Witntz, "Chemistry of the Amino Acides) с образованием сложноэфирной или амидной связи, с получением в результате соединения (14) настоящего изобретения.
Амидные производные (17) и (22) можно получить из соединения (15) или (18), используя нижеследующие стадии 13, 14, 15, 16, 17 и 18.

Стадия 13: Аминогруппа соединения (15) может, например, взаимодействовать с соединением формулы R3X или R3OR3 в инертном растворителе, таком как углеводородный растворитель (например, бензол, толуол, гексан), галогенированный растворитель (например, дихлорметан, хлороформ, четыреххлористый углерод), простой эфир (например, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан), амид (например, N, N-диметилформамид, N-метил-2-пирролидинон), диметилсульфоксид или любая смесь указанных растворителей, в присутствии или отсутствие органического основания, такого как триэтиламин, пиридин, морфолин, диизопропилэтиламин, 4-(N,N-диметиламино)пиридин или 2,6-ди-трет-бутилпиридин, с образованием в результате соединения (16). В вышеприведенной формуле Х представляет собой уходящую группу и включает, например, атом галогена, этоксикарбонилоксигруппу или феноксикарбонилоксигруппу. Альтернативно, соединение (16) может быть получено путем традиционного образования амидной связи с использованием соединения формулы R3ОН (см. E. Gross, J. Meienhofer, "The Peptides" and J. P. Greenstein, M. Witntz, "Chemistry of the Amino Acides", Vol.2).
Стадия 14: Можно провести традиционное удаление защитных групп (см. T. W. Greene, P. G. M. Wuts, "Protective Groups in Organic Synthesis") с соединения 16 для превращения его сложноэфирных фрагментов в карбоновые кислоты и, если R3 означает COCHR6NHR7, для удаления защитной группы R7 с получением аминогруппы, получая в результате 2-амидное производное (17).
Стадия 15: Сложноэфирную связь по 6 атому углерода соединения (18) можно подвергнуть обычному гидролизу в течение короткого периода времени или при низкой температуре (см. T. W. Greene, P. G. M. Wuts, "Protective Groups in Organic Synthesis") с получением в результате соединения (19).
Стадия 16: Фрагмент карбоновой кислоты соединения (19) может быть подвергнут обычному образованию амидной связи, как в случае аминокислот, в присутствии соединения, представленного формулой R15-H (см. E. Gross, J. Meienhofer, "The Peptides" and J. P. Greenstein, M. Witntz, "Chemistry of the Amino Acides"), с получением в результате соединения (20).
Стадия 17 : Соединение (20) может быть превращено в соединение (21), например, путем обычного восстановления азидной группы, примером которого является реакция Штаудингера, с использованием триэтилфосфита, триметилфосфина, трибутилфосфина, трифенилфосфина или т.п., в инертном растворителе, таком как углеводородный растворитель (например, бензол, толуол, гексан), галогенированный растворитель (например, дихлорметан, хлороформ, четыреххлористый углерод), простой эфир (например, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан), ацетонитрил, ацетон, вода или любая смесь указанных растворителей (см. Bull. Chem. Soc. Fr., 815 (1985)); гидрирования в присутствии металлического катализатора, такого как палладий/уголь или палладиевая чернь, в инертном растворителе, таком как спирт (например, этанол, метанол), сложный эфир (например, этилацетат), N,N-диметилформамид, вода или любая смесь указанных растворителей; или путем гидридного восстановления аминоборгидридом лития или т.п. (см. A. F. Abdel-Magid, "Reductions in Organic Synthesis").
Стадия 18: Сложноэфирную связь соединения (21) можно подвергнуть обычному гидролизу (см. T. W. Greene, P. G. M. Wuts, "Protective Groups in Organic Synthesis") с получением в результате соединения (22) настоящего изобретения.
В данном описании подразумевается, что фраза "соединение, обладающее антагонистическим эффектом по отношению к метаботропным глутаматным рецепторам группы II" относится к соединению, которое демонстрирует дозо-зависимый ингибиторный эффект в пробе на рецепторное связывание и обладает сродством к mGluR2/R3, равным сродству глутаминовой кислоты или превышающим его, как определено с использованием mGluR2- и mGluR3-экспрессирующих клеток согласно Mol. Pharmacol., 53, 228-233 (1998), и которое противодействует ингибиторному эффекту, оказываемому глутаминовой кислотой на стимулированные форсколином уровни цАМФ, как определено с помощью набора для анализа цАМФ. Альтернативно, подразумевается, что данная фраза относится к соединению, которое оказывает антагонистическое действие на индуцированное глутаминовой кислотой связывание GTPγS, как определено с помощью анализа связывания GTPγS.
Соединение настоящего изобретения может входить в состав фармацевтической композиции в сочетании с одним или несколькими фармацевтически приемлемыми носителями, наполнителями и разбавителями. Примеры таких носителей, наполнителей и разбавителей включают воду, лактозу, декстрозу, фруктозу, сахарозу, сорбит, маннит, полиэтиленгликоль, пропиленгликоль, крахмал, камедь, желатин, альгинат, силикат кальция, фосфат кальция, целлюлозу, водный сироп, метилцеллюлозу, поливинилпирролидон, алкилпарагидроксибензоаты, тальк, стеарат магния, стеариновую кислоту, глицерин, а также различные масла, такие как кунжутное масло, оливковое масло и соевое масло.
После смешивания с указанными носителями, наполнителями или разбавителями и, при необходимости, с традиционно используемыми добавками, такими как наполнители, связующие средства, разрыхлители, регуляторы рН и солюбилизаторы, соединение настоящего изобретения может быть обработано с помощью общепринятых методов с получением пероральных или парентеральных препаратов, таких как таблетки, пилюли, капсулы, гранулы, порошки, растворы, эмульсии, суспензии, мази, растворы для инъекций или кожные пластыри, и особо определяется как антагонист метаботропных глутаматных рецепторов группы II.
Хотя соединение настоящего изобретения можно вводить взрослым пациентам перорально или парентерально в количестве от 0,01 до 500 мг один раз или несколько раз в день, пероральное введение является предпочтительным по причине простоты лечения и эффективности лекарственного средства. Следует отметить, что вводимое количество соединения может быть увеличено или уменьшено в соответствии с типом заболевания, подлежащего лечению, возрастом, массой тела, состоянием пациента и другие.
Краткое описание чертежей
Фиг.1 и 2 представляют собой графики, демонстрирующие время неподвижности в тесте принудительного плавания, измеренное для крыс, которым вводили соответственно известный антагонист метаботропных глутаматных рецепторов группы II LY341495 (Journal of Medicinal Chemistry 1998, 41, 358-378) и соединение 34 настоящего изобретения для оценки антидепрессивного действия данных соединений.
Наилучший способ осуществления изобретения
Далее настоящее изобретение описывается более подробно с помощью нижеприведенных примеров и тестовых примеров, которые не предназначены для ограничения объема данного изобретения.
Ссылочный пример 1
Синтез 2-бензилового эфира 6-этилового эфира (1R,2R,3R,5R,6R)-2-азид-3-гидрокси-6-фторбицикло[3.1.0]гексан-2, 6-дикарбоновой кислоты
(1) Раствор диизопропиламина (7,83 г) в тетрагидрофуране (84 мл) охлаждают до 0° и к нему добавляют 2,47М раствора бутиллития в гексане (28,8 мл), после чего перемешивают 15 минут. Затем этот раствор охлаждают до -62°С, по каплям добавляют раствор этилового эфира (1R,5R,6R)-6-фтор-2-оксобицикло[3.1.0]гексан-6-карбоновой кислоты (12,0 г) в тетрагидрофуране (40 мл), поддерживая температуру в интервале от -62 до -58°С. Через 1 час по каплям добавляют раствор N-фенил-бис(трифторметансульфонимида) (25,3 г) в тетрагидрофуране (84 мл) в течение 15 минут, поддерживая температуру в интервале от -62 до -60°С. Реакционный раствор оставляют нагреваться до комнатной температуры и затем перемешивают еще 1 час. Добавляют насыщенный водный раствор бикарбоната натрия, затем реакционную смесь экстрагируют диэтиловым эфиром. Органический слой промывают водой и насыщенным водным раствором хлорида натрия, после чего сушат над безводным сульфатом магния. Осушающее средство отфильтровывают, фильтрат концентрируют при пониженном давлении и полученный остаток очищают колоночной хроматографией (силикагель: Wako gel C200 (Wako Pure Chemical Industry LTD.) элюирующий растворитель: гексан/этилацетат = 20/1). Полученный в результате этиловый эфир (1R,5R,6R)-6-фтор-2-трифторметансульфонилоксибицикло[3.1.0]гекс-2-ен-6-карбоновой кислоты сразу растворяют в N,N-диметилформамиде (195 мл). К данному раствору добавляют ацетат палладия (389 мг), трифенилфосфин (910 мг), бензиловый спирт (12,5 г) и триэтиламин (11,7 г) и перемешивают в атмосфере моноксида углерода при комнатной температуре в течение 4,5 часов. После добавления 1 н. хлористоводородной кислоты реакционную смесь дважды экстрагируют диэтиловым эфиром. Объединенные органические слои промывают насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, после чего сушат над безводным сульфатом магния. Осушающее средство отфильтровывают, фильтрат концентрируют при пониженном давлении и полученный остаток очищают колоночной хроматографией (силикагель: Wako gel C200, элюирующий растворитель: гексан/этилацетат = от 10/1 до 1/1), получая 2-бензиловый эфир 6-этиловый эфир (1R,5R,6R)-6-фторбицикло[3.1.0]гекс-2-ен-2,6-дикарбоновой кислоты (6,42 г).
Т.пл. 90-91°С
(2) К 2-бензиловому, 6-этиловому эфиру (1R,5R,6R)-6-фторбицикло[3.1.0]гекс-2-ен-2,6-дикарбоновой кислоты (6,36 г), суспендированному в трет-бутаноле (150 мл) и воде (150 мл), добавляют AD-mix-β (29,3 г, Aldlich) и метансульфонамид (5,96 г), после чего перемешивают 5 дней при 4°С. После добавления бисульфита натрия реакционную смесь перемешивают при комнатной температуре 15 минут, разбавляют водой и затем экстрагируют три раза этилацетатом. Объединенные органические слои промывают насыщенным водным раствором хлорида натрия, после чего сушат над безводным сульфатом магния. Осушающее средство отфильтровывают, фильтрат концентрируют при пониженном давлении и полученный остаток очищают колоночной хроматографией (силикагель: Wako gel C200, элюирующий растворитель: гексан/этилацетат = от 10/1 до 3/2), получая 2-бензиловый эфир 6-этиловый эфир (1R,2R,3R,5R,6R)-6-фтор-2,3-дигидроксибицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (4,21 г).
1H ЯМР (300 МГц, CDCl3) δ (м.д.); 1,29 (3H, т, J=7,2 Гц), 2,06-2,21 (2H, м), 2,30 (1H, дд, J=7,6, 2,6 Гц), 2,47 (1H, дд, J=7,6, 13,2 Гц), 2,50 (1H, дд, J=1,2, 9,2 Гц), 4,02 (1H, c), 4,24 (2H, кв, J=7, 2 Гц), 4,34-4,46 (1Н, м), 5,23 (1H, д, J=12,5 Гц), 5,28 (1H, д, J=12,5 Гц), 7,27-7,42 (5H, м).
МС (ESI) (Pos) m/z; 361 (M+Na)+.
[α]D29=-45,8° (С=0,202%, хлороформ).
(3) Раствор 2-бензилового эфира 6-этилового эфира (1R,2R,3R,5R,6R)-6-фтор-2,3-дигидроксибицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (3,96 г) в дихлорметане (20 мл) охлаждают до 4°С и к нему добавляют тионилхлорид (1,70 мл), после чего перемешивают 13 часов при 40°С. Растворитель и избыток реагентов отгоняют при пониженном давлении, затем полученный остаток растворяют в четыреххлористом углероде (12 мл), ацетонитриле (12 мл) и воде (20 мл). К данному раствору добавляют метапериодат натрия (3,76 г) и гидрат трихлорида рутения (500 мг) и перемешивают при комнатной температуре в течение 20 минут. После добавления воды реакционную смесь экстрагируют три раза диэтиловым эфиром. Объединенные органические слои промывают насыщенным водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Осушающее средство отфильтровывают, фильтрат концентрируют при пониженном давлении и полученный остаток очищают колоночной хроматографией (силикагель: Wako gel C200, элюирующий растворитель: гексан/этилацетат = от 5/1 до 2/1), получая 1-этиловый эфир 1b-бензиловый эфир (1R,1aR,1bS,4aR, 5aR)-1-фтор-3,3-диоксотетрагидро-2,4-диокса-3λ6-тиациклопропа[а]пентален-1,1b-дикарбоновой кислоты (4,11 г).
1H ЯМР (300 МГц, CDCl3) δ (м.д.); 1,29 (3H, т, J=7,2 Гц), 2,53-2,61 (1H, м), 2,72 (1H, ддд, J=0,9, 7,6, 15,2 Гц), 2,78-2,89 (1H, м), 2,83 (1H, дд, J=2,3, 7,2 Гц), 4,19-4,31 (2H, м), 5,26 (1H, д, J=12,1 Гц), 5,33 (1H, д, J=12,1 Гц), 5,45 (1H, дт, J=3,8, 7,6 Гц), 7,28-7,43 (5H, м).
МС (ESI) (ионизация электрораспылением) (Pos) m/z; 423 (M+Na)+.
[α]D30=+31,3° (С=0,203%, хлороформ).
(4) К 1-этиловому, 1b-бензиловому эфиру (1R,1aR,1bS,4aR,5aR)-1-фтор-3,3-диоксотетрагидро-2,4-диокса-3λ6 -тиациклопропа[а]пентален-1,1b-дикарбоновой кислоты (3,73 г), растворенному в N,N-диметилформамиде (37 мл) и воде (3,7 мл), добавляют азид натрия (1,09 г), после чего перемешивают 14 часов при 50°С. Растворитель отгоняют при пониженном давлении, полученный остаток растворяют в диэтиловом эфире (187 мл) и воде (5,2 мл). К данному раствору добавляют 20% серную кислоту (15 мл) и перемешивают при комнатной температуре в течение 8 часов. После добавления воды реакционную смесь экстрагируют три раза диэтиловым эфиром. Объединенные органические слои промывают насыщенным водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Осушающее средство отфильтровывают, фильтрат концентрируют при пониженном давлении и полученный остаток очищают колоночной хроматографией (силикагель: Wako gel C200, элюирующий растворитель: гексан/этилацетат = от 5/1 до 1/1), получая 2-бензиловый эфир 6-этиловый эфир (1R,2R,3R,5R, 6R)-2-азид-3-гидрокси-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (3,02 г).
1H ЯМР (300 МГц, CDCl3) δ (м.д.); 1,32 (3H, т, J=7,2 Гц), 2,18-2,54 (5H, м), 4,22-4,36 (1Н, м), 4,26 (2H, кв, J=7,2 Гц), 5,27 (1H, д, J=12,2 Гц), 5,35 (1H, д, J=12,2 Гц), 7,31-7,45 (5H, м).
МС (ESI) (Pos) m/z; 386 (M+Na)+.
[α]D30=-50,2° (С=0,212%, хлороформ).
Пример 1
Синтез (1R,2R,3R,5R, 6R)-2-амино-3-метокси-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты
(1) 2-Бензиловый эфир, 6-этиловый эфир (1R,2R,3R,5R,6R)-2-азид-3-гидрокси-6-фторбицикло[3.1.0]гексан-2, 6-дикарбоновой кислоты (500 мг) растворяют в дихлорметане (0,5 мл). К данному раствору добавляют 2,6-ди-трет-бутилпиридин (158 мг) и метилтрифторметансульфонат (113 мг) и перемешивают при комнатной температуре в течение 4 дней. Реакционную смесь выливают в 1н. хлористоводородную кислоту и экстрагируют три раза диэтиловым эфиром. Объединенные органические слои промывают насыщенным водным раствором хлорида натрия, после чего сушат над безводным сульфатом магния. Осушающее средство отфильтровывают, фильтрат концентрируют при пониженном давлении и полученный остаток очищают колоночной хроматографией (силикагель: Wako gel C200, элюирующий растворитель: гексан/этилацетат = 9/1), получая 2-бензиловый эфир 6-этиловый эфир (1R,2R,3R,5R,6R)-2-азид-3-метокси-6-фторбицикло[3.1.0]гексан-2, 6-дикарбоновой кислоты (42,0 мг).
1H ЯМР (300 МГц, CDCl3) δ (м.д.); 1,32 (3Н, т, J=7,2 Гц), 2,20-2,50 (4H, м), 3,32 (3H, c), 3,78-3,86 (1H, м), 4,26 (2Н, кв, J=7,2 Гц), 5,26 (1H, д, J=12,3 Гц), 5,34 (1H, д, J=12,3 Гц), 7,30-7,42 (5H, м).
МС (ESI) (Pos) m/z; 361 (M+Na)+.
(2) 2-Бензиловый эфир, 6-этиловый эфир (1R,2R,3R,5R,6R)-2-азид-3-метокси-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (280 мг) растворяют в уксусной кислоте (4 мл) и воде (1 мл). К данному раствору добавляют 10% палладий/уголь (28 мг) и перемешивают в атмосфере водорода при комнатной температуре в течение 18 часов. Катализатор отфильтровывают, после чего фильтрат концентрируют при пониженном давлении. Полученный остаток затем растворяют в 10% хлористоводородной кислоте (8 мл) и нагревают с обратным холодильником в течение 1,5 часов. Растворитель отгоняют при пониженном давлении, после чего полученный остаток очищают на ионообменной смоле (смола AG 50W-X8 (Н-тип), элюирующий растворитель: вода, 50% водный раствор тетрагидрофурана, 10% водный раствор пиридина), получая (1R,2R,3R,5R, 6R)-2-амино-3-метокси-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновую кислоту (137 мг).
Пример 2
Синтез 2-бензилового эфира 6-этилового эфира (1R, 2R,3R,5R,6R)-2-амино-3-(4-фторбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты и (1R,2R,3R,5R,6R)-2-амино-3-(4-фторбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты
(1) Гидрид натрия (79,0 мг, 60% в масле) дважды промывают гексаном и суспендируют в диэтиловом эфире (1,9 мл), затем по каплям добавляют 4-фторбензиловый спирт (2,50 г), растворенный в диэтиловом эфире (2,9 мл). После перемешивания в течение 20 минут при комнатной температуре добавляют по каплям трихлорацетонитрил (2,70 г), охлаждая на льду с солью. Перемешивание продолжают при данной температуре 15 минут, на льду 15 минут, на водяной бане 20 минут и затем при комнатной температуре 20 минут. Реакционный раствор концентрируют при пониженном давлении, затем к полученному остатку добавляют пентан (1,9 мл) и метанол (75 мкл) и энергично перемешивают при комнатной температуре в течение 15 минут. Неорганические соли отфильтровывают, затем фильтрат концентрируют при пониженном давлении, получая неочищенный 4-фторбензил-2,2,2-трихлорацетимидат (5,28 г).
Неочищенный 4-фторбензил-2,2,2-трихлорацетимидат (3,40 г) и 2-бензиловый эфир 6-этиловый эфир (1R,2R,3R,5R,6R)-2-азид-3-гидрокси-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (3,04 г) растворяют в дихлорметане (9,2 мл) и циклогексане (18,4 мл). Данный раствор охлаждают на бане со льдом, затем добавляют трифторметансульфоновую кислоту (110 мкл). После перемешивания при комнатной температуре в течение 16 часов неорганические соли отфильтровывают и добавляют насыщенный водный раствор бикарбоната натрия, охлаждая на льду. Реакционную смесь дважды экстрагируют хлороформом, затем объединенные органические слои промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом магния. Осушающее средство отфильтровывают, фильтрат концентрируют при пониженном давлении и полученный остаток очищают колоночной хроматографией (силикагель: Wako gel C200, элюирующий растворитель: гексан/этилацетат = от 10/1 до 5/1), получая 2-бензиловый эфир 6-этиловый эфир (1R,2R,3R,5R,6R)-2-азид-3-(4-фторбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (1,94 г).
1H ЯМР (200 МГц, CDCl3) δ (м.д.); 1,32 (3Н, т, J=7,0 Гц), 2,20-2,42 (4H, м), 3,96-4,06 (1Н, м), 4,27 (2H, кв, J=7,0 Гц), 4,40 (1H, д, J=11,5 Гц), 4,59 (1H, д, J=11,5 Гц), 5,20 (1H, д, J=12,1 Гц), 5,34 (1H, д, J=12,1 Гц), 6,92-7,37 (9H, м).
МС (ESI) (Pos) m/z; 494 (M+Na)+.
(2) 2-Бензиловый эфир 6-этиловый эфир (1R,2R,3R,5R,6R)-2-азид-3-(4-фторбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (521 мг) растворяют в тетрагидрофуране (16 мл) и воде (1,6 мл). К данному раствору добавляют раствор 1М триметилфосфина в тетрагидрофуране (1,20 мл) и перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь разбавляют диэтиловым эфиром, промывают насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, затем сушат над безводным сульфатом натрия. Осушающее средство отфильтровывают, фильтрат концентрируют при пониженном давлении и полученный остаток очищают колоночной хроматографией (силикагель: Wako gel C200, элюирующий растворитель: гексан/этилацетат = 2/1), получая 2-бензиловый эфир 6-этиловый эфир (1R,2R,3R,5R, 6R)-2-амино-3-(4-фторбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (338 мг).
(3) К 2-бензиловому эфиру 6-этиловому эфиру (1R,2R,3R,5R, 6R)-2-амино-3-(4-фторбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (1,94 г), растворенному в тетрагидрофуране (6 мл) и воде (3 мл), добавляют гидрат гидроксида лития (72,0 мг), затем перемешивают при комнатной температуре в течение 31 часа. Растворитель отгоняют при пониженном давлении, после чего полученный остаток очищают на ионообменной смоле (смола AG 50W-X8 (Н-тип), элюирующий растворитель: вода, 50% водный раствор тетрагидрофурана, 10% водный раствор пиридина), получая (1R,2R,3R,5R,6R)-2-амино-3-(4-фторбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновую кислоту (195 мг).
Пример 3
Синтез 2-бензилового эфира 6-этилового эфира (1R,2R,3R,5R, 6R)-2-амино-3-((R*)-1-(нафтален-2-ил)этокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты, 2-бензилового эфира 6-этилового эфира (1R,2R,3R,5R, 6R)-2-амино-3-((S*)-1-(нафтален-2-ил)этокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты, (1R,2R,3R,5R,6R)-2-амино-3-((R*)-1-(нафталин-2-ил)этокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты и (1R,2R,3R,5R,6R)-2-амино-3-((S*)-1-(нафталин-2-ил)этокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты
(1) Гидрид натрия (23,0 мг, 60% в масле) дважды промывают гексаном и суспендируют в тетрагидрофуране (0,8 мл), затем по каплям добавляют 1-(нафталин-2-ил)этанол (1,00 г), растворенный в тетрагидрофуране (1,2 мл). После перемешивания в течение 20 минут при комнатной температуре добавляют по каплям трихлорацетонитрил (0,58 мл), охлаждая на льду с солью. Перемешивание продолжают при данной температуре 20 минут, на льду 20 минут, на водяной бане 30 минут и затем при комнатной температуре 50 минут. Реакционный раствор концентрируют при пониженном давлении, затем к полученному остатку добавляют пентан (5 мл), метанол (19 мкл) и тетрагидрофуран (0,5 мл) и энергично перемешивают при комнатной температуре в течение 10 минут. Неорганические соли отфильтровывают, затем фильтрат концентрируют при пониженном давлении, получая неочищенный 1-(нафталин-2-ил)этил-2,2,2-трихлорацетимидат (1,84 г).
Неочищенный 1-(нафталин-2-ил)этил-2,2,2-трихлорацетимидат (590 мг) и 2-бензиловый эфир 6-этиловый эфир (1R,2R,3R,5R, 6R)-2-азид-3-гидрокси-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (450 мг) растворяют в дихлорметане (1,5 мл) и циклогексане (3,0 мл), после чего добавляют трифторметансульфоновую кислоту (17 мкл). После перемешивания при комнатной температуре в течение 1 часа неорганические соли отфильтровывают и при охлаждении на льду добавляют насыщенный водный раствор бикарбоната натрия. Реакционную смесь дважды экстрагируют хлороформом, затем объединенные органические слои промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. Осушающее средство отфильтровывают, фильтрат концентрируют при пониженном давлении и полученный остаток очищают колоночной хроматографией (силикагель: Wako gel C200, элюирующий растворитель: гексан/этилацетат = от 13/1 до 5/1) и (силикагель: M.S. GEL SIL D-75-60A (Dokai Chemical Industries Co., Ltd.), элюирующий растворитель: гексан/этилацетат = 13/1), получая 2-бензиловый эфир 6-этиловый эфир (1R,2R,3R,5R, 6R)-2-азид-3-((R*)-1-(нафталин-2-ил)этокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (271 мг, значение Rf: 0,55, элюирующий растворитель: гексан/этилацетат = 3/1, ТСХ: силикагель 60F254) и 2-бензиловый эфир 6-этиловый эфир (1R,2R,3R,5R,6R)-2-азид-3-((S*)-1-(нафталин-2-ил)этокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (301 мг, значение Rf: 0,49, элюирующий растворитель: гексан/этилацетат = 3/1, ТСХ: силикагель 60F254).
2-бензиловый эфир 6-этиловый эфир (1R,2R,3R,5R, 6R)-2-азид-3-((R*)-1-(нафталин-2-ил)этокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты:
1H ЯМР (200 МГц, CDCl3) δ (м.д.); 1,26 (3H, т, J=7,3 Гц), 1,35 (3H, д, J=6,6 Гц), 1,92-2,37 (4H, м), 3,85-3,95 (1H, м), 4,20 (2H, кв, J=7,3 Гц), 4,77 (1H, кв, J=6,6 Гц), 5,27 (1H, д, J=12,2 Гц), 5,47 (1H, д, J=12,2 Гц), 7,31-7,85 (12H, м).
МС (ESI) (Pos) m/z; 540 (M+Na)+.
2-бензиловый эфир 6-этиловый эфир (1R,2R,3R,5R,6R)-2-азид-3-((S*)-1-(нафталин-2-ил)этокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты:
1H ЯМР (200 МГц, CDCl3) δ (м.д.); 1,27 (3H, т, J=7,3 Гц), 1,40 (3H, д, J=6,4 Гц), 2,24-2,49 (4H, м), 3,91-4,01 (1H, м), 4,22 (2H, кв, J=7,3 Гц), 4, 61 (1H, кв, J=6,4 Гц), 5,12 (1H, д, J=12,3 Гц), 5,32 (1H, д, J=12,3 Гц), 7,31-7,83 (12H, м).
МС (ESI) (Pos) m/z; 540 (M+Na)+.
(2) Исходя из 2-бензилового эфира 6-этилового эфира (1R,2R,3R,5R,6R)-2-азид-3-((R*)-1-(нафталин-2-ил)этокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (266 мг) и 2-бензилового эфира 6-этилового эфира (1R,2R,3R,5R, 6R)-2-азид-3-((S*)-1-(нафталин-2-ил)этокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (238 мг) повторяют процедуру, приведенную в примере 2(2), получая 2-бензиловый эфир 6-этиловый эфир (1R, 2R,3R,5R,6R)-2-амино-3-((R*)-1-(нафталин-2-ил)этокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (164 мг) и 2-бензиловый эфир 6-этиловый эфир (1R,2R,3R,5R, 6R)-2-амино-3-((S*)-1-(нафталин-2-ил)этокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (153 мг) соответственно.
(3) Исходя из 2-бензилового эфира 6-этилового эфира (1R,2R,3R, 5R,6R)-2-амино-3-((R*)-1-(нафталин-2-ил)этокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (158 мг) и 2-бензилового эфира 6-этилового эфира (1R,2R,3R,5R, 6R)-2-амино-3-((S*)-1-(нафталин-2-ил)этокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (148 мг) повторяют процедуру, приведенную в примере 2(3), получая (1R,2R,3R,5R, 6R)-2-амино-3-((R*)-1-(нафталин-2-ил)этокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновую кислоту (96,0 мг) и (1R,2R,3R,5R,6R)-2-амино-3-((S*)-1-(нафталин-2-ил)этокси)-6-фторбицикло[3.1.0]гексан-2, 6-дикарбоновую кислоту (72,0 мг).
Пример 4
Синтез (1R,2R,3R,5R,6R)-2-амино-3-пропилокси-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты
(1) (1R,2R,3R,5R,6R)-2-амино-3-(2-пропенилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновую кислоту (40 мг) растворяют в воде (1 мл). К данному раствору добавляют 10% палладий/уголь (4 мг) и перемешивают в атмосфере водорода при комнатной температуре в течение 2 дней. Катализатор отфильтровывают, фильтрат концентрируют при пониженном давлении, затем добавляют тетрагидрофуран (1 мл) и нагревают с обратным холодильником в течение 1 часа. Реакционную смесь перемешивают при комнатной температуре еще 3 часа, фильтруют для удаления всех твердых веществ и затем очищают на ионообменной смоле (смола AG 50W-X8 (Н-тип), элюирующий растворитель: вода, 50% водный раствор тетрагидрофурана, 10% водный раствор пиридина), получая (1R,2R,3R,5R, 6R)-2-амино-3-пропилокси-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновую кислоту (30 мг).
Пример 5
Синтез (1R,2R,3R,5R, 6R)-2-амино-3-циклопентилокси-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты
(1) Исходя из неочищенного 2-циклопентенил-2,2,2-трихлорацетимидата (375 мг), полученного из 2-циклопентен-1-ола и 2-бензилового эфира 6-этилового эфира (1R,2R,3R,5R,6R)-2-азид-3-гидрокси-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (650 мг), повторяют процедуру, приведенную в примере 2(1), получая 2-бензиловый эфир 6-этиловый эфир (1R,2R,3R,5R,6R)-2-азид-3-(2-циклопентилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (339 мг).
1H ЯМР (200 МГц, CDCl3) δ (м.д.); 1,32 (3H, т, J=7,3 Гц), 1,90-2,52 (8H, м), 3,94-4,14 (1H, м), 4,27 (2H, кв, J=7,3 Гц), 4,52-4,79 (1H, м), 5,15-5,41 (2H, м), 5,58-5,82 (1H, м), 5,88-6,04 (1H, м), 7, 30-7,46 (5H, м).
МС (ESI) (Pos) m/z; 452 (M+Na)+.
(2) 2-Бензиловый эфир 6-этиловый эфир (1R,2R,3R,5R, 6R)-2-азид-3-(2-циклопентилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (331 мг) растворяют в уксусной кислоте (18 мл) и воде (6 мл). К данному раствору добавляют 10% палладий/уголь (39 мг) и перемешивают в атмосфере водорода при комнатной температуре в течение 24 часов. Катализатор отфильтровывают, фильтрат концентрируют при пониженном давлении. Полученный остаток растворяют в тетрагидрофуране (7,36 мл) и воде (3,53 мл), затем добавляют гидрат гидроксида лития (80 мг) и перемешивают при комнатной температуре 4 часа. Растворитель отгоняют при пониженном давлении, полученный остаток очищают на ионообменной смоле (смола AG 50W-X8 (Н-тип), элюирующий растворитель: вода, 50% водный раствор тетрагидрофурана, 10% водный раствор пиридина), получая (1R,2R,3R,5R, 6R)-2-амино-3-циклопентилокси-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновую кислоту (61 мг).
Пример 6
Синтез диэтилового эфира (1R,2R,3R,5R, 6R)-2-амино-3-(3-нитробензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты, диэтилового эфира (1R,2R,3R,5R,6R)-2-амино-3-(3-аминобензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты и (1R,2R,3R,5R,6R)-2-амино-3-(3-аминобензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты
(1) Исходя из неочищенного 3-нитробензил-2,2,2-трихлорацетимидата (562 мг), полученного из 3-нитробензилового спирта и диэтилового эфира (1R,2R,3R,5R,6R)-2-азид-3-гидрокси-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (380 мг) повторяют процедуру, приведенную в примере 2(1), получая диэтиловый эфир (1R,2R,3R,5R,6R)-2-азид-3-(3-нитробензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (279 мг).
1H ЯМР (200 МГц, CDCl3) δ (м.д.); 1,32 (3H, т, J=7,2 Гц), 1,34 (3H, т, J=7,2 Гц), 2,22-2,42 (2H, м), 2,50 (2H, дд, J=2,7, 7,8 Гц), 3,94-4,10 (1H, м), 4,20-4,46 (4H, м), 4,58 (1H, д, J=12,1 Гц), 4,80 (1H, д, J=12,1 Гц), 7,44-7,66 (2H, м), 8,03-8,24 (2H, м).
МС (ESI) (Pos) m/z; 452 (M+Na)+.
(2) Исходя из диэтилового эфира (1R,2R,3R,5R, 6R)-2-азид-3-(3-нитробензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (275 мг), повторяют процедуру, приведенную в примере 2(2), получая диэтиловый эфир (1R,2R,3R,5R, 6R)-2-амино-3-(3-нитробензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (120 мг).
(3) Диэтиловый эфир (1R,2R,3R,5R, 6R)-2-амино-3-(3-нитробензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (120 мг) растворяют в уксусной кислоте (0,21 мл). К данному раствору добавляют порошкообразный цинк (101 мг) и перемешивают при комнатной температуре в течение 3 часов. Реакционную смесь фильтруют для удаления всех твердых веществ, затем добавляют охлажденный на льду насыщенный раствор бикарбоната натрия. Реакционную смесь дважды экстрагируют этилацетатом, затем объединенные органические слои промывают 0,5М водным раствором карбоната натрия и насыщенным водным раствором хлорида натрия, после чего сушат над безводным сульфатом магния. Осушающее средство отфильтровывают, фильтрат концентрируют при пониженном давлении и полученный остаток очищают колоночной хроматографией (силикагель: Wako gel C200, элюирующий растворитель: хлороформ/этанол = 30/1), получая диэтиловый эфир (1R,2R,3R,5R,6R)-2-амино-3-(3-аминобензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (96 мг).
(4) Исходя из диэтилового эфира (1R,2R,3R,5R,6R)-2-амино-3-(3-аминобензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (90 мг) повторяют процедуру, приведенную в примере 2(3), получая (1R, 2R,3R,5R,6R)-2-амино-3-(3-аминобензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновую кислоту (60 мг).
Пример 7
Синтез 2,6-диэтилового эфира (1R,2R,3S,5R,6R)-2-азид-3-гидрокси-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты
(1) 2,6-Диэтиловый эфир (1R,2R,3R,5R,6R)-2-азид-3-гидрокси-6-фторбицикло[3.1.0]гексан-2, 6-дикарбоновой кислоты (120 мг) растворяют в дихлорметане (20 мл). К данному раствору добавляют по каплям ангидрид трифторметансульфонофой кислоты (78 мкл) в дихлорметане (0,4 мл) при -75°С в атмосфере азота и перемешивают на льду в течение 1,5 часов. По каплям добавляют пиридин (48 мкл) и ангидрид трифторметансульфонофой кислоты (39 мкл) в дихлорметане (0,2 мл) при -75°С, затем перемешивают на льду в течение 25 минут. После добавления эфира (10 мл) реакционную смесь фильтруют для удаления всех твердых веществ. Фильтрат концентрируют при пониженном давлении и полученный остаток очищают колоночной хроматографией (силикагель: Wako gel C200, элюирующий растворитель: гексан/этилацетат = 5/1), получая 2,6-диэтиловый эфир (1R,2R,3R,5R, 6R)-2-азид-3-трифторметансульфонилокси-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (166 мг).
1H ЯМР (200 МГц, CDCl3) δ (м.д.); 1,35 (3H, т, J=7,0 Гц), 1,38 (3H, т, J=7,0 Гц), 2,35-2,50 (2H, м), 2,62-2,86 (2H, м), 4,31 (2H, кв, J=7,0 Гц), 4,27-4,55 (2H, м), 4,94-5,10 (1H, м).
МС (FAB) (Pos) m/z; 434 (M+Na)+.
[α]D26=-31,2° (С=0,43%, хлороформ).
(2) 2,6-Диэтиловый эфир (1R,2R,3R,5R, 6R)-2-азид-3-трифторметансульфонилокси-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (701 мг) растворяют в N,N-диметилформамиде (6,9 мл). К данному раствору добавляют нитрит калия (688 мг) и 18-краун-6 (428 мг), затем перемешивают в атмосфере азота при комнатной температуре в течение 1,5 дней и затем при 45°С в течение 3,5 дней. После добавления воды реакционную смесь дважды экстрагируют этилацетатом. Объединенные органические слои промывают насыщенным водным раствором хлорида натрия, после чего сушат над безводным сульфатом натрия. Осушающее средство отфильтровывают, фильтрат концентрируют при пониженном давлении и полученный остаток очищают колоночной хроматографией (силикагель: Wako gel C200, элюирующий растворитель: гексан/этилацетат = 5/1), получая 2, 6-диэтиловый эфир (1R,2R,3S,5R,6R)-2-азид-3-гидрокси-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (388 мг).
1H ЯМР (200 МГц, CDCl3) δ (м.д.); 1,34 (3H, т, J=7,0 Гц), 1,36 (3H, т, J=7,0 Гц), 2,16 (1H, дд, J=2,9 Гц, 14,9 Гц), 2,17-2,30 (1H, м), 2,44 (1H, дд, J=3,1 Гц, 8,1 Гц), 2,61 Гц (1H, дд, J=12,3 Гц, 16,0 Гц), 2,80-2,99 (1H, м), 4,29 (2H, кв, J=7,0 Гц), 4,34 (2H, кв, J=7,0 Гц), 4,48-4,64 (1H, м).
МС (ESI) (Pos) m/z; 324 (M+Na)+.
[α]D25=+6,4° (С=0,96%, хлороформ).
Пример 8
Синтез 2,6-диэтилового эфира (1R,2R,3R,5R,6R)-2-амино-3-(3,4-дихлорбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты и 2-этилового эфира (1R,2R,3S,5R,6R)-2-амино-3-(3,4-дихлорбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты
(1) Исходя из неочищенного 3,4-дихлорбензил-2,2, 2-трихлорацетимидата (3,17 г), полученного из 3,4-дихлорбензилового спирта, и диэтилового эфира (1R,2R,3S,5R,6R)-2-азид-3-гидрокси-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (1,98 г) повторяют процедуру, приведенную в примере 2(1), получая диэтиловый эфир (1R,2R,3R,5R,6R)-2-азид-3-(3,4-дихлорбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (1,16 г).
1H ЯМР (200 МГц, CDCl3) δ (м.д.); 1,31 (3H, т, J=7,3 Гц), 1,33 (3H, т, J=7,3 Гц), 2,22-2,52 (4H, м), 3,91-4,05 (1H, м), 4,29 (2H, кв, J=7,3 Гц), 4,18-4,44 (2H, м), 4,42 (1H, д, J=11,9 Гц), 4,64 (1H, д, J=11,9 Гц), 7,06-7,14 (1H, м), 7,34-7,50 (2H, м).
МС (ESI) (Pos) m/z; 482 (M+Na)+.
[α]D28=-12,6° (С=1,14%, хлороформ).
(2) Исходя из диэтилового эфира (1R,2R,3R,5R,6R)-2-азид-3-(3,4-дихлорбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (1,11 г) повторяют процедуру, приведенную в примере 2(2), получая диэтиловый эфир (1R,2R,3R,5R,6R)-2-амино-3-(3,4-дихлорбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (878 мг).
(3) 2-Этиловый эфир (1R,2R,3R,5R,6R)-2-амино-3-(3,4-дихлорбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (150 мг) растворяют в тетрагидрофуране (3,5 мл) и воде (1,7 мл). К данному раствору добавляют гидрат гидроксида лития (17,8 г) и перемешивают на льду 2 часа. После добавления 1 н. хлористоводородной кислоты (0,45 мл) реакционную смесь разбавляют водой до общего объема 50 мл и очищают на ионообменной смоле (смола AG 50W-X8 (Н-тип), элюирующий растворитель: вода, 50% водный раствор тетрагидрофурана, 10% водный раствор пиридина), получая 2-этиловый эфир (1R,2R, 3R,5R,6R)-2-амино-3-(3,4-дихлорбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (107 мг).
Пример 9
Синтез гидрохлорида 6-этилового эфира (1R,2R,3S,5R,6R)-2-амино-3-(3,4-дихлорбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты
(1) Исходя из диэтилового эфира (1R,2R,3R,5R, 6R)-2-амино-3-(3,4-дихлорбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (304 мг) повторяют процедуру, приведенную в примере 2(3), получая (1R,2R,3R,5R,6R)-2-амино-3-(3, 4-дихлорбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновую кислоту (195 мг).
(2) (1R,2R,3R,5R,6R)-2-амино-3-(3,4-дихлорбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновую кислоту (114 мг) растворяют в этаноле (1,1 мл). К данному раствору добавляют тионилхлорид (88 мкл) при комнатной температуре в атмосфере азота и затем перемешивают при 50°С в течение 1 часа. Реакционную смесь фильтруют для удаления всех твердых веществ и фильтрат концентрируют при пониженном давлении. К полученному остатку добавляют изопропиловый эфир (1,38 мл), затем смесь перемешивают при комнатной температуре в течение 17 часов и фильтруют, собирая твердые вещества. Твердые вещества промывают изопропиловым эфиром, получая гидрохлорид 6-этилового эфира (1R,2R,3S,5R,6R)-2-амино-3-(3, 4-дихлорбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (114 мг).
Пример 10
Синтез гидрохлорида (1R,2R,3S,5R, 6R)-2-[(2'S)-(2'-аминопропионил)амино]-3-(3,4-дихлорбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты
(1) N-трет-бутоксикарбонил-L-аланин (316 мг) растворяют в дихлорметане (6,9 мл). К данному раствору добавляют N-метилморфолин (184 мкл) и изобутилхлорформат (218 мкл) при -14°С в атмосфере азота и перемешивают 1 минуту. Диэтиловый эфир (1R,2R,3S,5R, 6R)-2-амино-3-(3,4-дихлорбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (691 мг) растворяют в дихлорметане (6,9 мл) и добавляют по каплям к реакционной смеси, затем перемешивают при комнатной температуре 30 минут. Реакционный раствор дважды промывают 1н. хлористоводородной кислотой и сушат над безводным сульфатом натрия. Осушающее средство отфильтровывают, фильтрат концентрируют при пониженном давлении и полученный остаток очищают колоночной хроматографией (силикагель: Wako gel C200 (Wako Pure Chemical Industry LTD.), элюирующий растворитель: гексан/этилацетат = 2/1), получая диэтиловый эфир (1R,2R,3R,5R,6R)-2-[(2'S)-(2'-трет-бутоксикарбониламинопропионил)амино]-3-(3,4-дихлорбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (902 мг).
1H ЯМР (200 МГц, CDCl3) δ (м.д.); 1,25 (3H, т, J=7,1 Гц), 1,28 (3H, т, J=7,1 Гц), 1,34 (3H, д, J=7,0 Гц), 1,39 (9H, c), 2,18-2,31 (1H, м), 2,32-2,54 (2H, м), 3,08 (1H, дд, J=2, 9 Гц, 7,9 Гц), 3,86-4,04 (1H, м), 4,06-4,16 (5H, м), 4,42 (1H, д, J=11,6 Гц), 4,65 (1H, д, J=11,6 Гц), 4,76-4,96 (1H, м), 7,06-7,24 (1H, м), 7,12 (1H, дд, J=2,0 Гц, 8,1 Гц), 7,39 (1H, д, J=2,0 Гц), 7, 40 (1H, д, J=8,1 Гц).
МС (ESI) (Nega) m/z: 630 (M-H)-.
[α]D24=-33,6° (С=0,42%, хлороформ).
(2) Диэтиловый эфир (1R,2R,3R,5R,6R)-2-[(2'S)-(2'-трет-бутоксикарбониламинопропионил)амино]-3-(3,4-дихлорбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (45,5 мг) растворяют в тетрагидрофуране (6 мл). К данному раствору добавляют 2,5М водный раствор гидроксида лития (6 мл) и перемешивают при комнатной температуре 2 дня. Реакционный раствор экстрагируют три раза этилацетатом и объединенные органические слои сушат над безводным сульфатом натрия. Осушающее средство отфильтровывают, фильтрат концентрируют при пониженном давлении, получая неочищенный 6-литий-2-этиловый эфир (1R,2R,3R,5R,6R)-2-[(2'S)-(2'-трет-бутоксикарбониламинопропионил)амино]-3-(3,4-дихлорбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (470 мг).
Неочищенный 6-литий-2-этиловый эфир (1R,2R,3R,5R,6R)-2-[(2'S)-(2'-трет-бутоксикарбониламинопропионил)амино]-3-(3,4-дихлорбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (375 мг) растворяют в воде (7,5 мл). К данному раствору при комнатной температуре добавляют гидрат гидроксида лития (135 мг) и затем перемешивают при 45°С 8 дней. Реакционный раствор промывают десять раз этилацетатом, доводят до рН 2 с помощью 1н. хлористоводородной кислоты при охлаждении на льду и затем экстрагируют три раза этилацетатом. Объединенные органические слои промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. Осушающее средство отфильтровывают, фильтрат концентрируют при пониженном давлении.
При охлаждении на льду к полученному остатку добавляют 4М раствор хлористого водорода в этилацетате (4,6 мл), затем перемешивают при комнатной температуре в течение 15 часов. Осажденные твердые вещества собирают фильтрацией и промывают этилацетатом, получая гидрохлорид (1R,2R,3S,5R,6R)-2-[(2'S)-(2'-аминопропионил)амино]-3-(3,4-дихлорбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (138 мг).
Пример 11
Синтез (1R,2R,3R,5R,6R)-2-амино-3-(3,4-дихлорбензилокси)-6-[(1'S)-(1'-гидроксикарбонил-3'-метилбутилкарбамоил)]-6-фторбицикло[3.1.0]гексан-2-карбоновой кислоты
(1) Диэтиловый эфир (1R,2R,3R,5R,6R)-2-азид-3-(3,4-дихлорбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (854 мг) и гидрохлорид этилового эфира лейцина (464 мг) растворяют в N,N-диметилформамиде (8,5 мл). К данному раствору добавляют N-метилморфолин (261 мкл) при комнатной температуре, затем добавляют 1-гидроксибензотриазол (378 мг) и 1-этил-3-(3-диметиламинопропл)карбодиимид (464 мг) при охлаждении на льду. Перемешивание продолжают при комнатной температуре в течение 12 часов. После добавления этилацетата реакционную смесь промывают 1 н. хлористоводородной кислотой и насыщенным водным раствором хлорида натрия, затем сушат над безводным сульфатом натрия. Осушающее средство отфильтровывают, фильтрат концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией (силикагель: Wako gel C200, элюирующий растворитель: гексан/этилацетат = 8/1), получая этиловый эфир (1R,2R,3R,5R, 6R)-2-азид-3-(3,4-дихлорбензилокси)-6-[(1'S)-(1'-этоксикарбонил-3'-метилбутилкарбамоил)]-6-фторбицикло[3.1.0]гексан-2-карбоновой кислоты (998 мг).
1H ЯМР (200 МГц, CDCl3) δ (м.д.); 0,96 (6H, д, J=5,5 Гц), 1,29 (3H, т, J=7,0 Гц), 1,30 (3H, т, J=7,0 Гц), 1,52-1,80 (3H, м), 2,26-2,57 (4H, м), 3,86-4,02 (1H, м), 4,22 (2H, кв, J=7,0 Гц), 4,10-4,38 (2H, м), 4, 42 (1H, д, J=12,2 Гц), 4,50-4,66 (1H, м), 4,65 (1H, д, J=12,2 Гц), 6,79 (1H, д, J=8,1 Гц), 7,11 (1H, дд, J=2,0 Гц, 8,1 Гц), 7,38 (1H, д, J=2,0 Гц), 7,40 (1H, д, J=8,1 Гц).
МС (ESI) (Nega) m/z: 571 (M-H)-.
[α]D28=-20,0° (С=0,39%, хлороформ).
(2) Исходя из этилового эфира (1R, 2R,3R,5R,6R)-2-азид-3-(3,4-дихлорбензилокси)-6-[(1'S)-(1'-этоксикарбонил-3'-метилбутилкарбамоил)]-6-фторбицикло[3.1.0]гексан-2-карбоновой кислоты (996 мг) повторяют процедуру, приведенную в примере 2(2), получая этиловый эфир (1R,2R,3R,5R,6R)-2-амино-3-(3,4-дихлорбензилокси)-6-[(1'S)-(1'-этоксикарбонил-3'-метилбутилкарбамоил)]-6-фторбицикло[3.1.0]гексан-2-карбоновой кислоты.
1H ЯМР (200 МГц, CDCl3) δ (м.д.); 0,96 (6Н, д, J=5,9 Гц), 1,29 (6H, т, J=7,1 Гц), 1,52-1,77 (3H, м), 1,85 (2H, c), 2,10-2,28 (2H, м), 2,36-2,48 (2H, м), 3,69-3,87 (1H, м), 4,21 (2H, кв, J=7,1 Гц), 4,15-4,36 (2H, м), 4,45 (1H, д, J=12,1 Гц), 4,64 (1H, д, J=12,1), 4,55-4,69 (1H, м), 6,77 (1H, дд, J=3,4, 8,0), 7,10 (1H, дд, J=1,8 Гц, 8,4 Гц), 7,38 (1H, д, J=1,8 Гц), 7,39 (1H, д, J=8,4 Гц).
МС (ESI) (Nega) m/z: 545 (M-H)-.
[α]D22=+2,4° (С=0,65%, хлороформ).
(3) Исходя из этилового эфира (1R,2R,3R,5R,6R)-2-амино-3-(3,4-дихлорбензилокси)-6-[(1'S)-(1'-этоксикарбонил-3'-метилбутилкарбамоил)]-6-фторбицикло[3.1.0]гексан-2-карбоновой кислоты (400 мг) повторяют процедуру, приведенную в примере 2(3), получая (1R,2R,3R,5R,6R)-2-амино-3-(3, 4-дихлорбензилокси)-6-[(1'S)-(1'-гидроксикарбонил-3'-метилбутилкарбамоил)]-6-фторбицикло[3.1.0]гексан-2-карбоновую кислоту (250 мг).
В нижеследующей табл. приведены химические структуры и физические данные для соединений, полученных в примерах 1-11, а также для соединений, полученных подобным способом.


















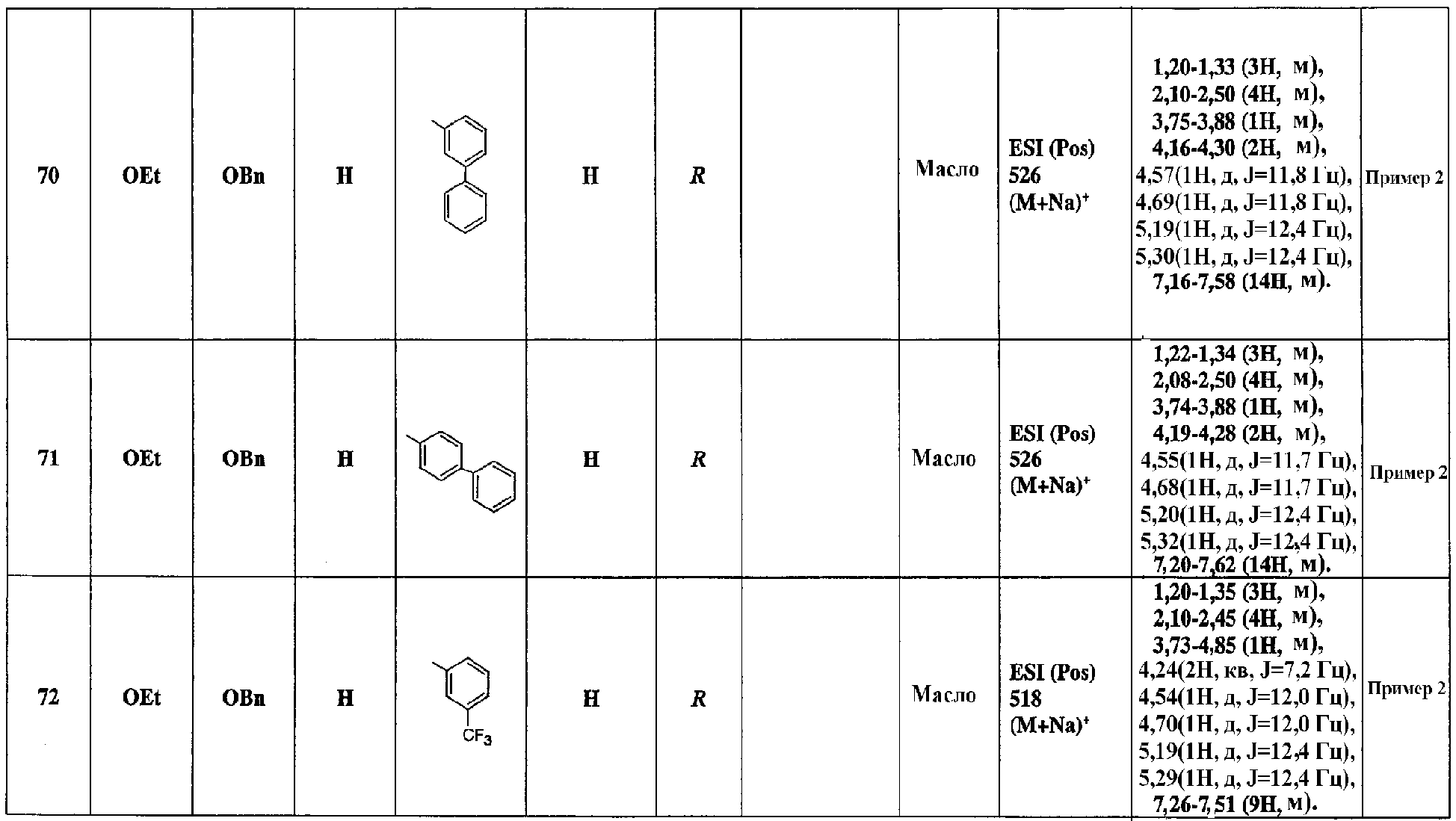



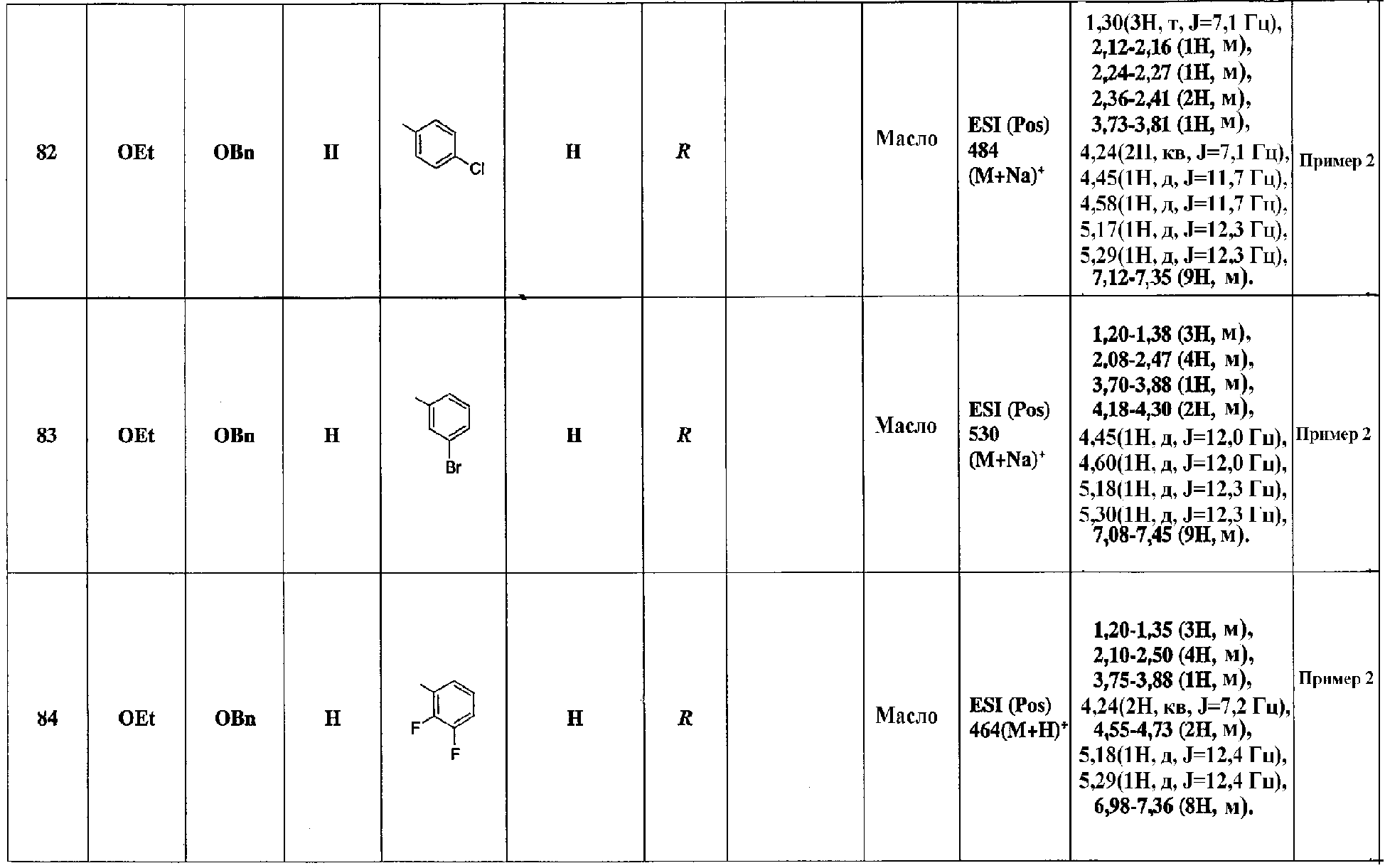










Тестовый пример 1 (Антагонистическое действие тестируемых лекарственных средств на аккумуляцию цАМФ в клетках СНО, модифицированных с получением стабильной экспрессии метаботропного глутаматного рецептора mGluR2)
Используя модифицированную по Дульбекко среду Игла, содержащую 10% диализированной фетальной бычьей сыворотки [1% пролина, 50 ед/мл пенициллина, 50 мкг/мл стрептомицина, 2 мМ L-глутамин (добавляемый перед использованием)], клетки яичника китайского хомячка (СНО), модифицированные с получением стабильной экспрессии метаботропного глутаматного рецептора mGluR2, высевают в 96-луночные планшеты в соотношении 1,26Ч104 клеток/лунку/0,32 см2/150 мкл и выращивают при 37°С, в атмосфере 5% СО2, в течение 2 дней. Среду затем заменяют на среду, не содержащую L-глутамина, и через 4 часа супернатант удаляют отсасыванием. Порциями по 150 мкл добавляют ЗФР(+)-IBMX (10 мМ ЗФР(-), 1 мМ MgCl2, 1 мМ CaCl2, 1 мМ IBMX (изобутилметилксантин)) и планшеты инкубируют 20 минут при 37°С в атмосфере 5% СО2. Супернатант вновь удаляют отсасыванием, добавляют ЗФР(+)-IBMX, содержащий 10-5М форсколина, 30 мкМ глутаминовой кислоты и от 10-10 до 10-4М тестируемого лекарственного средства, порциями по 60 мкл и планшеты инкубируют 15 минут 37°С в атмосфере 5% СО2 для исследования антагонистического эффекта, оказываемого тестируемыми лекарственными средствами на индуцированное глутаминовой кислотой ингибирование форсколин-стимулированной аккумуляции цАМФ (контрольные эксперименты проводят без добавления тестируемых лекарственных средств (Tanabe et al., Neuron, 8, 169-179 (1992)). Реакцию останавливают, добавляя охлажденный на льду этанол (100 мкл), супернатант полностью собирают в отдельные планшеты, упаривают досуха, используя испаритель при нормальной температуре и затем хранят при -20°С. В высушенных образцах определяют уровни цАМФ, используя набор EIA для определения цАМФ (Amersham). Значение контрольных образцов вычитают из каждого измеренного значения уровня цАМФ. Для каждого тестируемого лекарственного средства определяют значение IC50, т.е. концентрации, необходимой для достижения 50% подавления ингибиторного эффекта, оказываемого 30 мкМ глутаминовой кислотой на уровень цАМФ, стимулированный 10-5М форсколина.
Соединения настоящего изобретения, представленные формулой [I], где каждый из R1 и R2 означает гидроксильную группу, а R3 означает атом водорода, т.е. соединения 1-58 в таблице, демонстрируют сильный антагонистический эффект (IC50=500 нМ или менее), как определено с помощью данного тестового примера. Например, соединения 1, 6, 22, 28, 34, 42 и 52 имеют значения IC50, составляющие 229 нМ, 131 нМ, 29,1 нМ, 40,8 нМ, 20,0 нМ, 22,7 нМ и 24, 4 нМ соответственно.
Тестовый пример 2 (Влияние тестируемых лекарственных средств на связывание [H3]MGS0008 с рецептором в клетках СНО, модифицированных с получением стабильной экспрессии метаботропного глутаматного рецептора mGluR2)
Используя модифицированную по Дульбекко среду Игла, содержащую 10% диализированной фетальной бычьей сыворотки [1% пролина, 50 ед./мл пенициллина, 50 мкг/мл стрептомицина, 2 мМL-глутамин (добавляемый перед использованием)], клетки СНО, модифицированные с получением стабильной экспрессии метаботропного глутаматного рецептора mGluR2, высевают в колбы Т-225 и выращивают при 37°С в атмосфере 5% СО2. После достижения слияния клетки дважды промывают ЗФР(-), соскабливают скребком для клеток и центрифугируют при 4°С, 1000 g в течение 15 минут для того, чтобы собрать клетки. Полученный осадок хранят при -80°С. Осадок оттаивают перед использованием и суспендируют в 50 мМ буфере Tris-HCl (рН 7,4). Суспензию гомогенизируют гомогенизатором 20 секунд и затем центрифугируют 20 минут при 4°С и 48000 g, получая осадок. Осадок снова суспендируют в вышеуказанном буфере, гомогенизируют, инкубируют 15 минут при 37°С и затем центрифугируют 20 минут при 4°С и 48000 g. Полученный осадок дважды дополнительно промывают, используя центрифугирование, и затем гомогенизируют в буфере 50 мМ Tris-HCl (2 мМ MgCl2, рН 7,4), получая мембранную фракцию. Анализ рецепторного связывания проводят при концентрации мембран в интервале от 50 до 200 мкг/0,5 мл. После добавления тестируемого лекарственного средства и 3 нМ [H3]MGS0008, мембранную фракцию инкубируют 1 час при 25°С. Реакцию останавливают фильтрацией с отсасыванием на фильтре Whatman GF/C (предварительно пропитанным 0,3% полиэтиленимином) с помощью коллектора клеток Brandel. После фильтрации с отсасыванием фильтр промывают три раза охлажденным на льду буфером 50 мМ Tris-HCl (2 мМ MgCl2, рН 7,4, 3 мл). Полученный таким образом фильтр обрабатывают 10 мл Aquasol-2 и оставляют стоять 6 часов или дольше, после чего измеряют флуоресцентную активность, используя жидкий сцинтилляционный счетчик Beckman LS6000. Неспецифическое связывание определяют в присутствии 10 мкМ LY354740 и вычитают его из каждого измеренного уровня связывания. Для каждого тестируемого лекарственного средства определяют значение IC50, концентрации, необходимой для достижения 50% ингибирования индуцированного растворителем уровня связывания [H3 ]MGS0008.
Соединения настоящего изобретения, представленные формулой [I], где каждый из R1 и R2 означает гидроксильную группу, а R3 означает атом водорода, т.е. соединения 1-58 в таблице демонстрируют высокую связывающую активность по отношению к рецепторам mGluR2 (IC50=100 нМ или менее), как определено с помощью данного тестового примера.
Тестовый пример 3 (Оценка антидепрессивного действия на крыс с помощью теста принудительного плавания)
(1) В данном эксперименте используют самцов крыс SD (масса тела: 220-240 г, Charles River Japan).
(2) Тестируют следующие лекарственные средства:
LY341495 (Journal of Medicinal Chemistry 1998, 41, 358-378): (2S)-2-амино-2-((1S,2S)-2-карбоксициклопроп-1-ил)-3-(9-ксантил)пропионовая кислота; и соединение 34: (1R,2R,3R,5R,6R)-2-амино-3-(3,4-дихлорбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновая кислота.
(3) Тест принудительного плавания проводят в соответствии с методом, описанным Porsolt et al., с некоторыми модификациями (European Journal of Pharmacology 1978, 47, 379-391). А именно,
крыс помещают в цилиндр, содержащий воду глубиной 30 см, и заставляют плавать в течение 15 минут. Через 24 часа крыс заставляют снова плавать в течение 5 минут (фактический эксперимент). Чтобы оценить антидепрессивное действие тестируемых средств в данном эксперименте, измеряют время неподвижности для каждой крысы.
Опытные группы получают две внутрибрюшинные инъекции (за 24 часа и за 1 час до фактического эксперимента) LY341495 или соединения 34 в 1/15М фосфатном буфере с дозировкой 0,3 мг/кг, 1 мг/кг или 3 мг/кг. Группа, получающая растворитель, получает внутрибрюшинно только 1/15М фосфатный буфер.
(4) Символы * и ** на фиг.1 и 2 обозначают статистическую значимость при Р<0,05 и Р<0,01 по тесту Даннетта, соответственно, при сравнении с группой, получающей 1/15М фосфатный буфер. Таким образом, из фиг.1 и 2 видно, что при сравнении с группой, получающей растворитель, опытные группы, получающие внутрибрюшинные инъекции тестируемых лекарственных средств, LY341495 и соединения 34, демонстрируют значительное дозозависимое уменьшение времени неподвижности и, следовательно, превосходное антидепрессивное действие. Данный факт свидетельствует о том, что соединение, являющееся антагонистом метаботропных глутаматных рецепторов группы II, может применяться в качестве антидепрессанта.
Тестовый пример 4
Получение сложноэфирных производных соединения 34
Были получены следующие соединения:
Соединение А: 6-бензиловый эфир (1R, 2R,3R,5R,6R)-2-амино-3-(3,4-дихлорбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты, гидрохлорид.
Соединение В: 6-этиловый эфир (1R,2R,3R,5R,6R)-2-амино-3-(3, 4-дихлорбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (соединение 60).
Соединение С: 6-н-дециловый эфир (1R,2R,3R,5R,6R)-2-амино-3-(3, 4-дихлорбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты.
Соединение D: 6-н-гептиловый эфир (1R,2R,3R,5R,6R)-2-амино-3-(3, 4-дихлорбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты.
Соединение Е: 6-(6-метилгептиловый) эфир (1R,2R,3R,5R,6R)-2-амино-3-(3, 4-дихлорбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты.
Синтез:
Соединение В (гидрохлорид 6-этилового эфира соединения 34) получали в примере 9 описания.
Соединение А, где R1 представляет собой бензилоксигруппу, получали способом, аналогичным способу примера 9, как описано ниже:
Соединение А: к соединению 34 (140 мг), суспендированному в бензиловом спирте (1,0 мл), при охлаждении льдом добавляли хлористый тионил (105 мкл) и перемешивали реакционную смесь при 50°С в течение 64 часов. Реакционную смесь охлаждали до комнатной температуры и добавляли к ней гексан. Смесь перемешивали в течение 2 часов и фильтровали для отделения твердого продукта. Твердый продукт промывали диизопропиловым эфиром и гексаном с получением гидрохлорида 6-бензилового эфира (1R,2R,3R,5R,6R)-2-амино-3-(3,4-дихлорбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (127 мг).
1H-ЯМР (300 МГц, CD3OD, ТМС); 2,30-2,61 (м, 4Н), 3,95-4,05 м, 1Н), 4, 46 (д, J=11,8 Гц, 1Н), 4,58 (д, J=11,8 Гц, 1Н), 5,23 (с, 2Н), 7,28 (дд, J=8,2, 1,9 Гц, 1Н), 7,33-7, 41 (м, 5Н), 7,45 (д, J=8,2 Гц, 1Н), 7,53 (д, J=1,9 Гц, 1Н).
МС (ESI) (отриц,) м/z: 466 (М-Н)-.
Соединение С: к соединению 34 (200 мг), суспендированному в деканоле (2 мл), при охлаждении льдом добавляли хлористый тионил (150 мкл) и перемешивали реакционную смесь при 50°С в течение 25 часов. После охлаждения растворитель удаляли отгонкой при пониженном давлении и затем получившийся остаток очищали колоночной хроматографией на обращенной фазе (Wakogel 50C18 (произведен Wako Pure Chemical Industries Ltd.): проявляющий растворитель: вода с переходом к 70% водному раствору ацетонитрила) с получением 6-н-децилового эфира (1R,2R,3R,5R,6R)-2-амино-3-(3,4-дихлорбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (207 мг).
1H-ЯМР (300 МГц, CD3OD, ТМС); 0,87-0,92 (м, 3Н), 1,23-1,41 (м, 14Н), 1,60-1,71 (м, 2Н), 2/31-2,65 (м, 2Н), 3,97-4,07 (м, 1Н), 4,19 (т, J=6,6 Гц, 2Н), 4,47 (д, J=12,0 Гц, 1Н), 4,59 (д, J=12,0 Гц, 1Н), 7,28 (дд, J=8,0, 2,3 Гц, 1Н), 7,45 (д, J=8,0 Гц, 1Н), 7,54 (д, J=2,3 Гц, 1Н).
МС (ESI)(отриц,) м/2: 516 (М-Н)-
Соединение D: к соединению 34 (1,60 г), суспендированному в 1-гептаноле (16 мл), при охлаждении льдом добавляли хлористый тионил (1,0 мл) и перемешивали реакционную смесь при 70°С в течение 5 часов. После охлаждения смеси 1-гептанол удаляли отгонкой при пониженном давлении. К остатку добавляли этанол (16 мл) и пропиленоксид (16 мл), после чего следовало нагревание и кипячение с обратным холодильником в течение двух часов. После охлаждения реакционный раствор разбавляли диизопропиловым эфиром и фильтровали для отделения твердого продукта. Твердый продукт промывали этилацетатом с получением 6-н-гептилового эфира (1R,2R/3R,5R,6R)-2-амино-3-(3,4-дихлорбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты (1,05 г).
1H-ЯМР (300 МГц, CD3OD, ТМС); 0,90 (3Н, т, J=6,5 Гц), 1,26-1,42 (8Н, м), 1,59-1,72 (2Н, м), 2,31-2,40 (2Н, м), 2,48 (1Н, дд, J=13,3, 7,4 Гц), 2,50-2,66 (1Н, м), 3,98-4,03 (1Н, м), 4,19 (2Н, т, J=6,5 Гц), 4,47 (1Н, д, J=12,0 Гц), 4,59 (1Н, д, J=12,0 Гц), 7,28 (1Н, дд, J-8,2, 1Н), 7,45 (1Н, д, J=2,0 Гц).
MC (ESI) (отриц,) м/z: 476(M+H)+
Соединение Е: к соединению 34 (1,00 г), суспендированному в 6-метил-1-гептаноле (10 мл), при охлаждении льдом добавляли хлористый тионил (0,4 мл) и перемешивали реакционную смесь при 80°С в течение 6 часов. После охлаждения нерастворимые компоненты отфильтровывали и затем фильтрат концентрировали при пониженном давлении. Получившийся остаток очищали колоночной хроматографией на обращенной фазе (Wakogel 50C18: проявляющий растворитель: вода с переходом к 70% водному раствору ацетонитрила). Получившийся твердый продукт перекристаллизовывали из воды с получением (1R,2R,3R,5R,6R)-2-амино-3-(3, 4-дихлорбензилокси)-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты 6-(6-метилгептилового) эфира (557 мг).
1H-ЯМР (300 МГц, CD3OD, ТМС); 0,89 (6Н, д, J=6,7 Гц), 1,15-1,39 (6Н, м), 1,47-1,71 (3Н, м), 2,33-2,65 (4Н, м), 4,02 (1Н, м), 4,19 (2Н, т, J=6,5 Гц), 4,48 (1Н, д, J=12,1 Гц), 4,60 (1Н, д, J=12,1 Гц), 7,29 (1Н, дд, J=8/2, 2,0 Гц), 7,46 (1Н, д, J=8,2 Гц), 7,54 (1Н,д, J=2,0 Гц).
МС (ESI)(отриц.) m/z: 488 (М-Н)-
Определение экспонированного in vivo количества по концентрации в плазме крови крыс
Крыс CD(SD) ISG в возрасте семи недель (масса тела: 240-280 г, самцы, Charles River, Япония) подвергали акклиматизации в течение 2 дней и использовали для данного эксперимента. Тестируемые соединения представляли собой соединение 34 и его эфиры, образованные по карбоксильной кислотной группе (соединения А-Е, как пояснено ниже). Каждое тестируемое соединение растворяли в 0,03 н. хлороводородной кислоте, содержащей 10% HP-β-CD, с получением концентрации 2 мг/мл, и вводили данный раствор крысам перорально в количестве 10 мг/кг. Спустя один или два часа собирали кровь из хвостовой вены в пробирку для сбора крови (содержащую ЭДТА) и немедленно центрифугировали (10000 x g, 4°С, 10 минут) для получения образцов плазмы крови. Образцы плазмы крови хранили замороженными при -80°С или ниже. К расплавленным образцам плазмы крови при охлаждении льдом добавляли раствор в метаноле вещества - внутреннего стандарта, и смесь депротеинизировали и центрифугировали (10000 x g, 4°С, 10 минут) для определения концентрации соединения 34 в супернатанте каждого образца с использованием ЖХ/МС/МС.
Результаты, полученные для концентрации соединения 34 в плазме крови, представлены в нижеследующей таблице. Как показано в табл.2, концентрация соединения 34 в плазме крови значительно возрастала при его введении в виде сложноэфирных соединений, и экспонированное in vivo количество увеличивалось.
Таблица 2
Таким образом, подтверждена полезность пролекарства, образованного соединениями по настоящему изобретению, в которых карбоксильная кислотная группа этерифицирована.
Применение в промышленности
Настоящее изобретение демонстрирует, что антагонисты метаботропных глутаматных рецепторов способны воздействовать на депрессивные симптомы, и, следовательно, оно может предоставить новый тип антидепрессанта.
Кроме того, одно воплощение настоящего изобретения, т.е. производное 2-амино-3-алкокси-6-фторбицикло[3.1.0]гексан-2,6-дикарбоновой кислоты, или его фармацевтически приемлемая соль или гидрат, является мощным антагонистом метаботропных глутаматных рецепторов. Таким образом, настоящее изобретение также может предоставить лекарственное средство, эффективное для лечения и профилактики психических нарушений, таких как шизофрения, тревожность и связанные с ней заболевания, биполярное расстройство и эпилепсия, а также неврологических заболеваний, таких как лекарственная зависимость, расстройства познавательной способности, болезнь Альцгеймера, хорея Гентингтона, болезнь Паркинсона, дискинезия, связанная с тугоподвижностью мышц, церебральная ишемия, церебральная недостаточность, миелопатия и травма головы.
Реферат
Изобретение относится к области медицины и фармацевтики и касается производных 2-амино-3-алкокси-6-фторбицикло[3.1.0]-гексан-2,6-дикарбоновой кислоты, фармацевтической композиции на их основе, обладающей антагонистическим действием на группу II метаботропных глутаматных рецепторов, лекарственного средства, обладающего антагонистическим действием на группу II метаботропных глутаматных рецепторов, и применения производных 2-амино-3-алкокси-6-фторбицикло[3.1.0]-гексан-2,6-дикарбоновой кислоты для лечения депрессивных синдромов. Изобретение обеспечивает повышение эффективности лечения. 6 н. и 13 з.п. ф-лы, 2 ил., 2 табл.
Формула




Комментарии