Активный компонент, фармацевтическая композиция и лекарственный препарат для терапии вич и спида - RU2716257C1
Код документа: RU2716257C1
Чертежи
Описание
Данное изобретение относится к активному компоненту фармацевтической композиции, представляющему собой микронизированные кристаллы моноклинной симметрии натрий {[4-({[4-бром-3-(3-хлор-5-цианофенокси)-2-фторфенил]ацетил}амино)-3-хлорфенил]-сульфонил}(пропаноил)азанида со средним диаметром частиц ≤130 мкм и методам его применения в терапии вируса иммунодефицита человека (ВИЧ) и синдрома приобретенного иммунного дефицита (СПИД).
ВИЧ поражает клетки иммунной системы, имеющие на своей поверхности рецепторы CD4: Т-хелперы, моноциты, макрофаги, клетки Лангерганса, дендритные клетки, клетки микроглии. В результате работа иммунной системы угнетается, и развивается СПИД, организм больного теряет возможность защищаться от инфекций и опухолей, возникают вторичные оппортунистические заболевания, которые не характерны для людей с нормальным иммунным статусом. Без врачебного вмешательства ВИЧ вызывает смерть пациента в среднем через 9-11 лет после заражения (в зависимости от подтипа вируса) [https://ru.wikipedia.org/wiki/Вирус_иммунодефицита_человека].
Согласно глобальной статистике [http://www.lenoblspid.ru/news24/postid/own_news/1166] в 2015 г во всем мире: жили с ВИЧ 36,7 миллиона человек, 2,1 миллиона человек были инфицированы ВИЧ, 1,1 миллиона человек умерли от болезней, обусловленных СПИДом, 78 миллионов человек были инфицированы ВИЧ с момента начала эпидемии, из них 35 миллионов человек умерли от болезней, обусловленных СПИДом, с момента начала эпидемии.
По состоянию на декабрь 2015 года 17 миллионов человек, живущих с ВИЧ, имели доступ к антиретровирусной терапии, в то время как в июне 2015 года это число составляло 15,8 миллиона, а в 2010 году - 7,5 миллиона человек. В 2015 году 46% всех взрослых, живущих с ВИЧ, имели доступ к лечению, в то время как в 2010 году этот показатель составлял 23%.
С 2010 года число новых случаев инфицирования ВИЧ снизилось на 6%. Во всем мире число людей, инфицированных ВИЧ в 2015 году, составило 2,1 миллиона человек, а в 2010 году это число составляло 2,2 миллиона.
По сравнению с пиковым показателем в 2005 году число смертей, связанных со СПИДом, снизилось на 45%, и в 2015 году число людей, умерших в связи со СПИДом, во всем мире составило 1,1 миллиона человек. Для сравнения в 2005 году это число составляло 2 миллиона.
ВИЧ можно ослаблять с помощью комбинированной антиретровирусной терапии (APT), состоящей из трех или более антиретровирусных препаратов. APT не излечивает эти инфекции, но контролирует репликацию вирусов в организме человека и содействует укреплению иммунной системы и восстановлению ее способностей бороться с инфекциями. При проведении APT продолжительность жизни пациента может быть продлена до 70-80 лет [http://www.who.int/mediacentre/factsheets/fs360/ru/].
В последние годы значительное внимание медицинских химиков и фармакологов в качестве препаратов для APT привлекают ненуклеозидные ингибиторы обратной транскриптазы (NNRTIs) [Zhan P. et al. HIV-1 NNRTIs: structural diversity, pharmacophore similarity, and implications for drug design. Med. Res. Rev. 2013 Jun; 33 Suppl 1: El-72. doi: 10.1002/med.20241. Epub 2011 Apr 26.].
Известны NNRTIs и фармацевтические композиции, включающие эти NNRTIs. В частности известна натриевая соль 2-[4-бром-3-(3-хлор-5-цианофенокси)-2-фторфенил]-N-(2-хлор-4-пропионилсульфамоилфенил)-ацетамида (Ib) и ее 9 полиморфных кристаллические форм, а также на их основе фармацевтические композиции для лечения или профилактики опосредуемых ВИЧ заболеваний [ЕА 019340 (2014)].
В патенте ЕА 019340 приведены примеры фармацевтических композиции, включающих в качестве активного компонента любую из 9-ти кристаллических полиморфных форм соединения формулы Ib в смеси по меньшей мере с одним фармацевтически приемлемым носителем, разбавителем или инертным наполнителем. Однако в патентных примерах не конкретизирована какая из полиморфных кристаллических форм соединения формулы Ib используется в качестве активного компонента и отсутствуют данные по свойствам и эффективности приведенных композиций и ГЛФ.
Предметом данного изобретения является активный компонент фармацевтических композиций, представляющий собой микронизированные кристаллы моноклинной симметрии (МКМС) натрий {[4-({[4-бром-3-(3-хлор-5-цианофенокси)-2-фторфенил]ацетил}амино)-3-хлорфенил]-сульфонил}(пропаноил)азанида формулы Ib со средним диаметром частиц ≤130 мкм и методы его применения в терапии вируса иммунодефицита человека (ВИЧ) и синдрома приобретенного иммунного дефицита (СПИД).
Термин "МКМС" это сокращенное обозначение названия "микронизированные кристаллы моноклинной симметрии".
Термин «микронизированные кристаллы» относится к кристаллам, в том числе кристаллам органических веществ, с микронным средним диаметром частиц.
Термин «кристаллы моноклинной симметрии» это кристаллы, элементарная ячейка которых строится на трех векторах а, b и с, имеющих разную длину, с двумя прямыми и одним непрямым углом между ними. Таким образом, форма ячейки определяется четырьмя параметрами: длинами базовых векторов а, b и с и углом β отличающимся от прямого угла. Объем ячейки равен произведению a⋅b⋅c⋅sinβ
Термин «фармацевтическая композиция» обозначает композицию, включающую в себя активные компоненты и необязательно, по крайней мере, один компонент, выбранный из группы, состоящей из фармацевтически приемлемых и фармакологически совместимых инертных наполнителей, разбавителей, носителей, вспомогательных и распределяющих средств, средств доставки, таких как консерванты, стабилизаторы, наполнители, измельчители, увлажнители, эмульгаторы, суспендирующие агенты, загустители, подсластители, отдушки, ароматизаторы, антибактериальные агенты, фунгициды, лубриканты, регуляторы пролонгированной доставки, выбор и соотношение которых зависит от природы и способа назначения и дозировки. Примерами суспендирующих агентов являются этоксилированный изостеариловый спирт, полиоксиэтилен, сорбитол и сорбитовый эфир, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, а также смеси этих веществ. Защита от действия микроорганизмов может быть обеспечена с помощью разнообразных антибактериальных и противогрибковых агентов, например, таких как парабены, хлорбутанол, сорбиновая кислота и подобные им соединения. Композиция может включать также изотонические агенты, например, сахара, хлористый натрий и им подобные. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного начала, например, моностеарат алюминия и желатин. Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол, полиспирты, а также их смеси, растительные масла (такие, как оливковое масло) и инъекционные органические сложные эфиры (такие, как этилолеат). Примерами наполнителей являются лактоза, молочный сахар, цитрат натрия, карбонат кальция, фосфат кальция и им подобные. Примерами измельчителей и распределяющих средств являются крахмал, альгиновая кислота и ее соли, силикаты. Примерами лубрикантов являются стеарат магния, лаурилсульфат натрия, тальк, а также полиэтиленгликоль с высоким молекулярным весом.
Противовирусная фармацевтическая композиция может быть в виде самых разнообразных перорально вводимых лекарственных форм и носителей, в том числе в форме таблеток, таблеток с покрытием, твердых и мягких желатиновых капсул, растворов, эмульсий, сиропа или суспензии. Противовирусная фармацевтическая композиция по настоящему изобретению является эффективной при введении в виде суппозитория. Наиболее удобным способом введения обычно является пероральный с использованием обычной суточной схемы приема лекарственных доз, который можно регулировать в зависимости от тяжести заболевания и реакции пациента на противовирусное и противоопухолевое лекарство.
Противовирусная фармацевтическая композиция с одним или несколькими обычными эксципиентами, носителями или разбавителями может быть представлены в форме фармацевтических композиций и их единичных доз. Фармацевтические композиции и стандартные лекарственные формы могут состоять из обычных ингредиентов в обычных пропорциях с или без дополнительных активных соединений и лекарственных форм. Противовирусная композиция может содержать любое соответствующее эффективное количество активного ингредиента, соразмерное с назначенной суточной дозой. Противовирусная композиция может быть использована в виде твердых веществ, таких как таблетки или заполненные капсулы, в виде полутвердых порошков, препаратов с замедленным высвобождением или жидкостей, таких как суспензии, эмульсии или заполненные капсулы для перорального применения; или в форме суппозиториев для ректального или вагинального введения. Типичный препарат будет содержать примерно от 5% вес. до 95% вес. активного соединения или соединения. Термин «препарат» или «лекарственная форма» предназначен для включения как твердых, так и жидких композиций активного соединения, и специалисту в данной области техники будет понятно, что активный ингредиент может существовать в виде различных препаратов в зависимости от требуемой дозы и фармакокинетических параметров.
Препараты в твердой форме включают порошки, таблетки, пилюли, капсулы, суппозитории и диспергируемые гранулы. Твердый носитель может представлять собой одно или несколько веществ, которые могут также действовать как разбавители, корригенты, солюбилизаторы, смазывающие вещества, суспендирующие агенты, связующие вещества, консерванты, дезинтегрирующих таблетки агентов или инкапсулирующий материал. В порошках носитель обычно представляет собой тонко измельченное твердое вещество, которое представляет собой смесь с тонкоизмельченным активным компонентом. В таблетках активный компонент обычно смешивают с носителем, имеющим необходимую связывающую способность, в подходящих пропорциях и спрессовывают в желаемую форму желаемого размера. Подходящие носители включают, но не ограничиваются ими, карбонат магния, стеарат магния, тальк, сахар, лактозу, пектин, декстрин, крахмал, желатин, трагакант, метилцеллюлозу, натрийкарбоксиметилцеллюлозу, легкоплавкий воск, масло какао и тому подобное. Препараты в твердой форме могут содержать в дополнение к активному компоненту красители, ароматизаторы, стабилизаторы, буферы, искусственные и природные подсластители, диспергаторы, загустители, солюбилизирующие агенты и тому подобное.
Жидкие составы также пригодны для перорального введения. Жидкие лекарственные формы представляют собой эмульсии, сиропы, эликсиры и водные суспензии. Они включают твердые формы препаратов, которые предназначены для превращения в жидкие препараты непосредственно перед использованием. Эмульсии могут быть приготовлены в растворах, например, в водных растворах пропиленгликоля или могут содержать эмульгаторы, такие как лецитин, моноолеат сорбита или гуммиарабик. Водные суспензии могут быть приготовлены диспергированием тонко измельченного активного компонента в воде с вязкими материалами, такими как природные или синтетические камеди, смолы, метилцеллюлоза, натрийкарбоксиметилцеллюлоза и другими хорошо известными суспендирующими агентами.
Противовирусная фармацевтическая композиция может быть приготовлена для введения в виде суппозиториев. Низкоплавкий воск, такой как смесь глицеридов жирных кислот или масло какао, сначала расплавляют и активный компонент гомогенно диспергируют, например, перемешиванием. Расплавленную гомогенную смесь затем выливают в формы удобного размера, дают остыть и затвердеть.
Противовирусная фармацевтическая композиция может быть приготовлена для вагинального введения. Применение суппозиториев, тампонов, кремов, гелей, паст, пен или спреев, содержащих в дополнение к активному ингредиенту такие носители, которые известны в данной области.
Предметом данного изобретения является активный компонент фармацевтчиеских композиций, представляющий собой микронизированные кристаллы моноклинной симметрии (МКМС) натрий {[4-({[4-бром-3-(3-хлор-5-цианофенокси)-2-фторфенил]ацетил}амино)-3-хлорфенил]-сульфонил}(пропаноил)азанида формулы Ib со средним диаметром частиц ≤130 мкм.
Настоящее изобретение также относится к противовирусной фармацевтической композиции, содержащей в качестве активного компонента МКМС формулы Ib со средним диаметром частиц ≤130 мкм, в комбинации с фармацевтически приемлемыми эксципиентами (вспомогательными веществами).
Предпочтительной является фармацевтическая композиция, в которой используется кристаллы моноклинной симметрии соединения Ib, относящиеся к моноклинной пространственной группе Р21/с с параметрами элементарной ячейки а=15.0637(4)



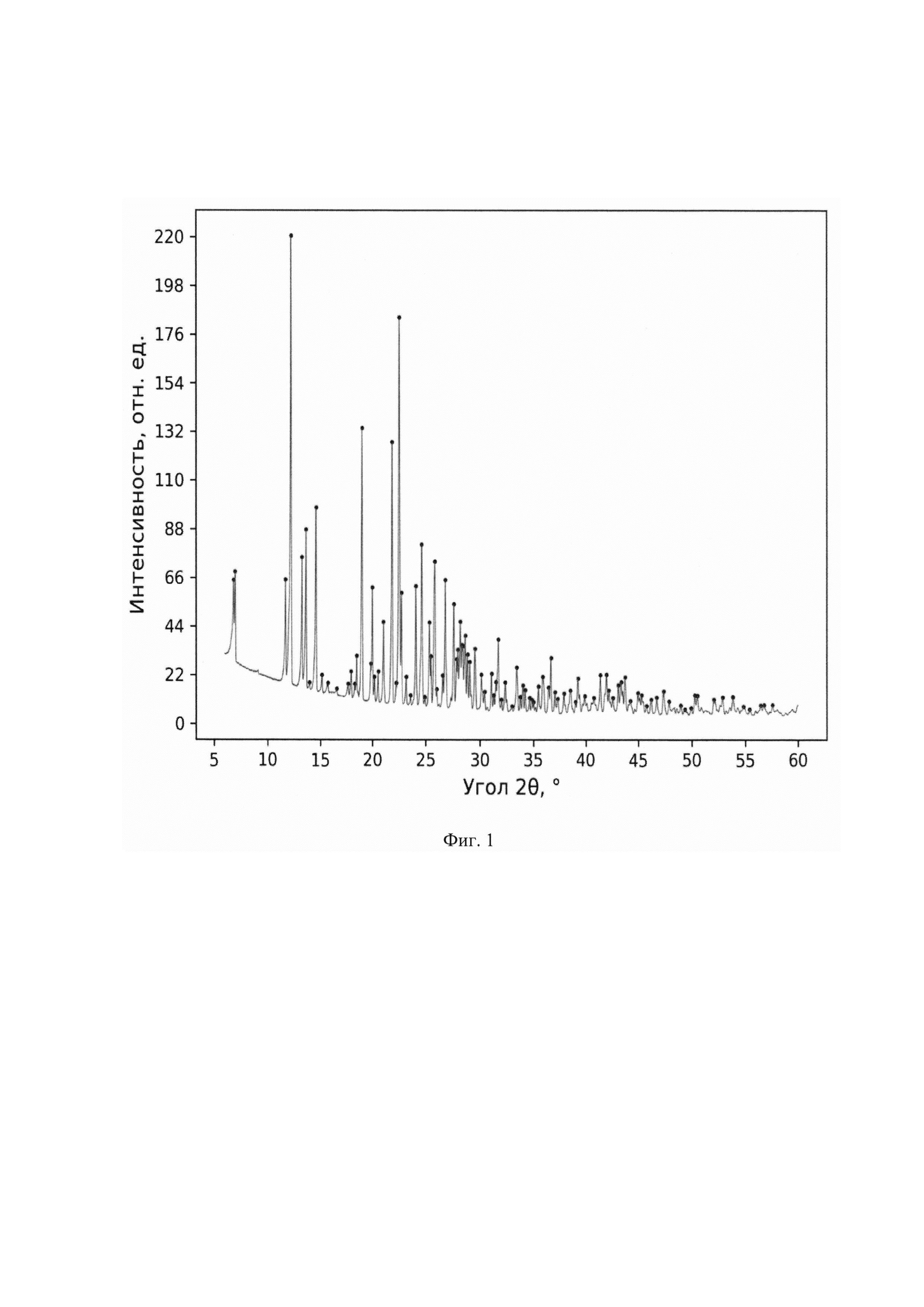
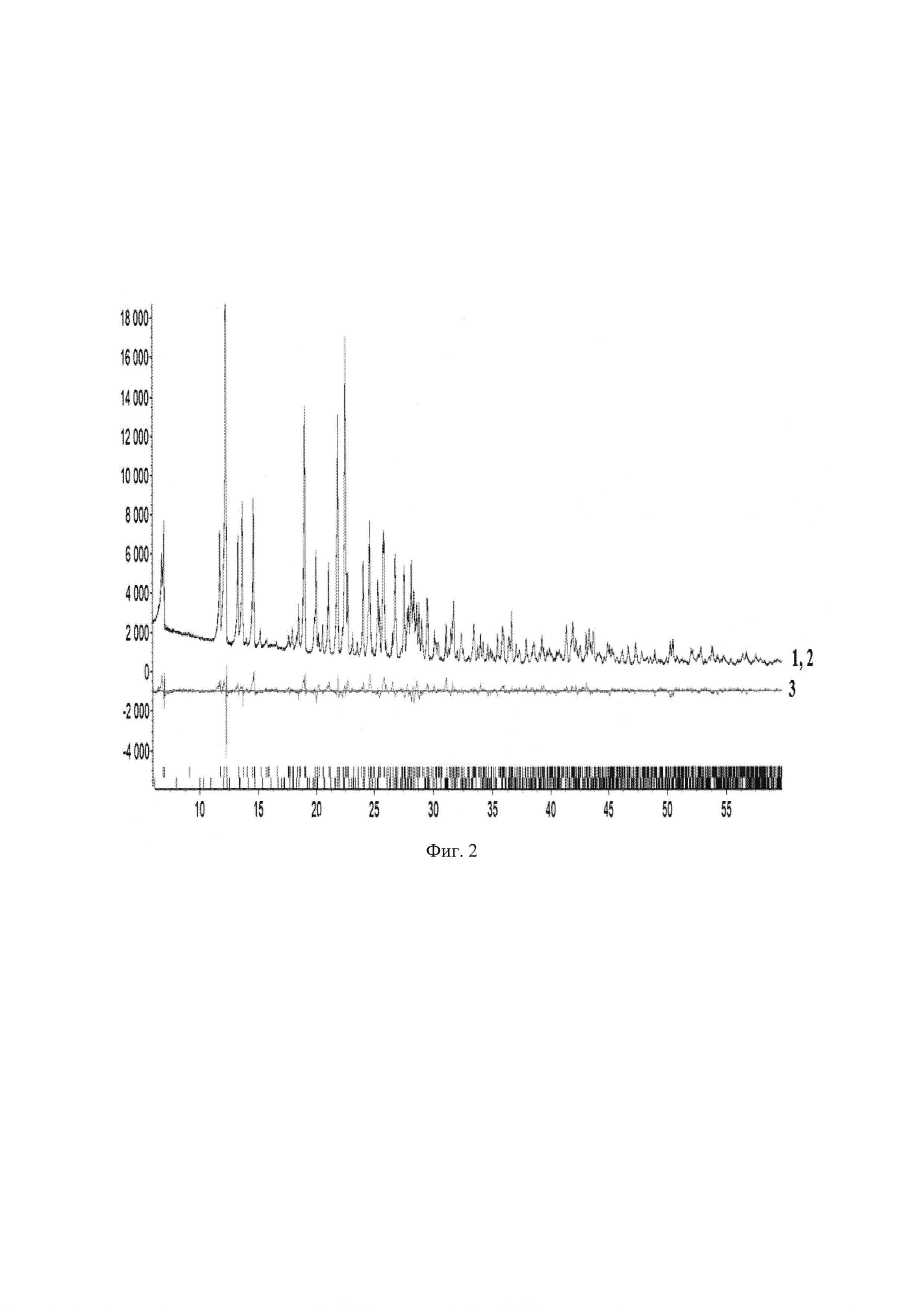
Характеристики кристаллических образцов соединения Ib получены на основаниии рентгенофазовых исследований. На дифрактограммах образцов наблюдаются пики, положение которых отвечает единственной моноклинной фазе (Фиг. 1 и 2, табл. 1).

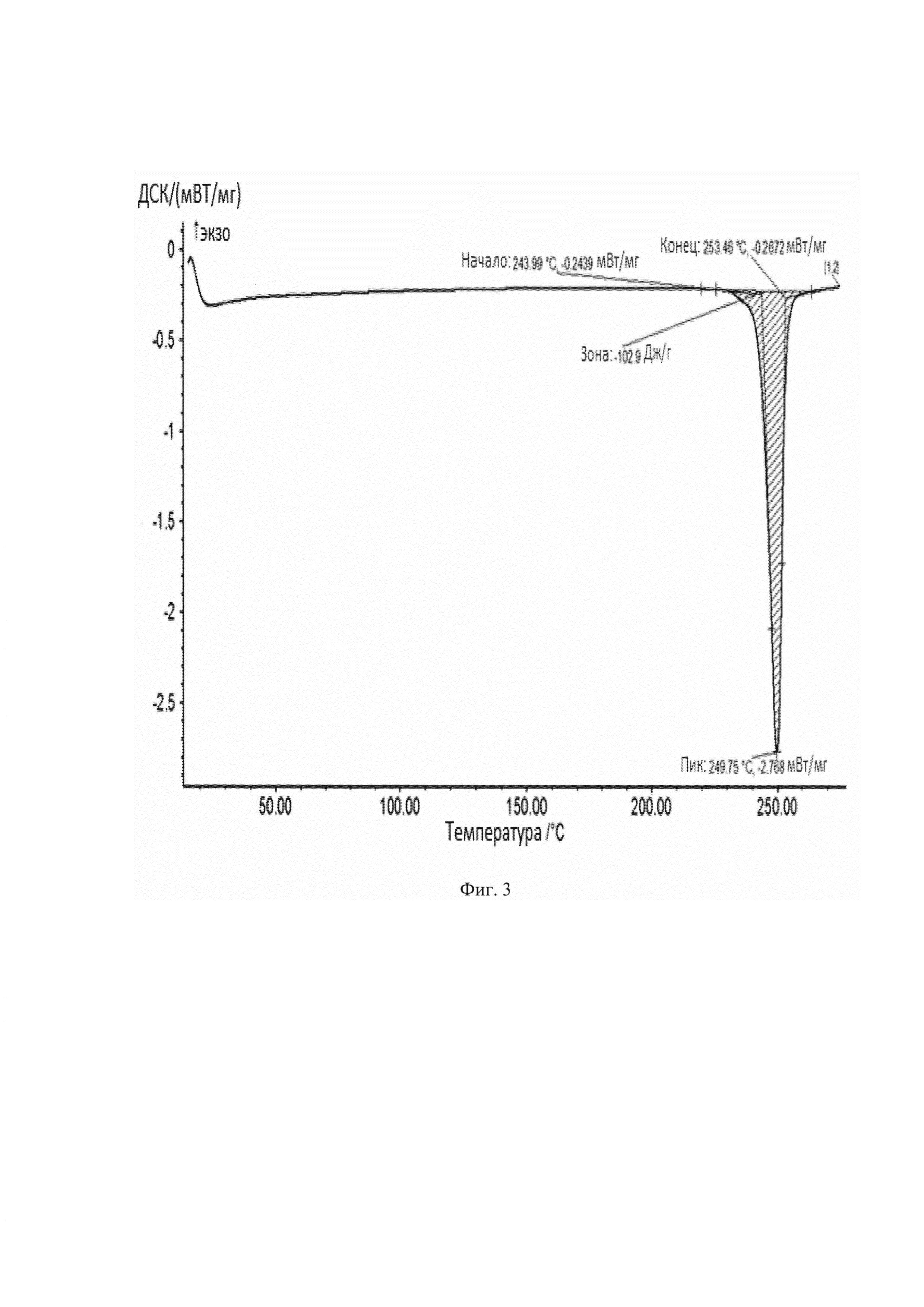
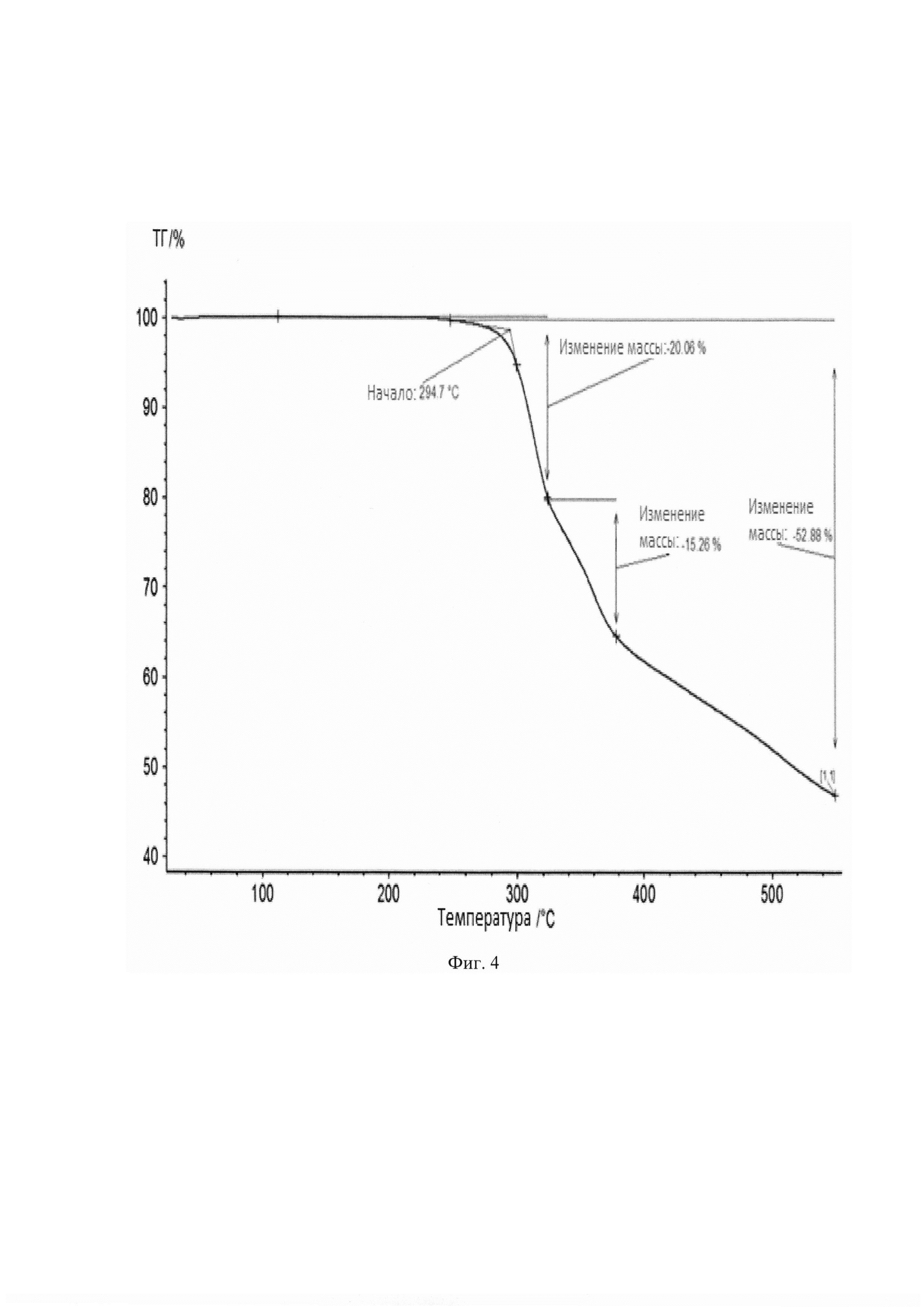
Температура плавления кристаллов моноклинной симметрии соединения формулы 1b (т.пл.=~250°С) определена с помощью дифференциальной сканирующей калориметрии (DSC), при этом начало плавления ~244°С, окончание плавления ~253,5°С и тепловой эффект плавления 102.9 Дж/г (Фиг. 3). Температура разложения этого продукта 294,7°С, найденная в результате термогравиметрического анализа (Фиг. 4).
Предпочтительной является также фармацевтическая композиция, в которой в качестве активного компонента используют МКМС формулы Ib с диаметром частиц от 10 мкм до 130 мкм, а в качестве эксципиентов используют по крайней мере моногидрат лактозы, кроскармеллозой натрия, поливинилпирролидон (повидон) и стеарат магния.
Более предпочтительной является фармацевтическая композиция, содержащая 10,0% МКМС формулы Ib, 81,7% моногидрата лактозы, 5,1% кроскармеллозы натрия, 2,4% повидона и 0,8% стеарата магния.
Более предпочтительной является также фармацевтическая композиция, содержащая 15,1% МКМС формулы Ib, 76,2% моногидрата лактозы, 5,4% кроскармеллозы натрия, 2,5% повидона и 0,8% стеарата магния.
Предметом изобретения является новый лекарственный препарат, представляющий собой твердую пероральную лекарственную форму, содержащую 20 мг, 40 мг или 80 мг МКМС формулы Ib со средним диаметром частиц от 10 до 130 мкм в комбинации с эксципиентами.
Предметом изобретения является новый лекарственный препарат, представляющий собой капсулу, содержащую 20 мг, 40 мг или 80 мг МКМС формулы Ib со средним диаметром частиц от 10 до 130 мкм в комбинации с моногидратом лактозы, кроскармеллозой натрия, повидоном и стеаратом магния.
Более предпочтительным является препарат, представляющий собой твердую желатиновую капсулу №1 с корпусом белого цвета и крышечкой красного цвета, содержащую 20,7 мг или 40 мг МКМС формулы Ib со средним диаметром частиц от 10 до 130 мкм в комбинации с 337,196 мг моногидрата лактозы, 21,168 мг кроскармеллозы натрия, 9,800 мг повидона и 3,136 мг стеарата магния.
Другим вариантом изобретения является препарат, представляющий собой твердую желатиновую капсулу №4 с корпусом белого цвета и крышечкой красного цвета, содержащую 20,7 мг или 40 мг МКМС формулы Ib со средним диаметром частиц от 10 до 130 мкм в комбинации с 104,380 мг моногидрата лактозы, 7,390 мг кроскармеллозы натрия, 3,430 мг повидона и 1,100 мг стеарата магния.
Авторы неожиданно обнаружили, что использование в фармацевтической композиции и ГЛФ (готовой лекарственной формы) с МКМС формулы Ib со средним диаметром частиц от 10 до 130 мкм приводит к значительному улучшению фармакологических свойств этих препаратов. В частности использование в ГЛФ моноклинной формы Ib и ее микронизированная грануляция до среднего диаметра частиц до ≤130 мкм приводит к заметному улучшению фармакологических параметров (Табл. 2) ГЛФ при их РО введении собакам.

AUC - фармакокинетический параметр, характеризующий суммарную концентрацию лекарственного препарата в плазме крови в течение всего времени наблюдения.
AUClast - площадь под кривой "концентрация - время" от момента введения препарата до определения последней поддающейся количественному измерению концентрации.
Клинические исследования на здоровых добровольцах препарата, представляющего собой капсулы, содержащие эксципиенты и 10 мг МКМС формулы Ib со средним диаметром частиц 100 мкм в дозах 10,20, 30,40 и 80 мг/сутки показали, что период полувыведения препарата Ib варьировался от 0,5 ч до 3 ч при дозах 10 и 20 мг (CV>70%) и от 1 ч до 3 ч при дозе 30 мг (CV=35%). При постоянном приеме препарата концентрация активного метаболита Ia в плазме нарастала, достигая максимальной в среднем через 9,8 дней дозирования при дозе 10 мг/сутки, 7,5 дней - при дозе 20 мг/сутки и 6,7 дней - при дозе 30 мг мг/сутки. Период полувыведения метаболита Ia из плазмы в среднем составил 7,5 дней при дозах 20 и 30 мг/сутки и 8,9 дней при дозе 10 мг/сутки.

При многократном приеме препарата в дозе 10 мг/сутки Cmax=5,5 нг/мл (день 1) и Cmax=75 нг/мл (день 14) активного метаболита Ia в плазме и Cmax=825 нг/мл (день 14) в форменных элементах крови (ФЭК). При многократном приеме препарата в дозе 20 мг/сутки Cmax=12,7 нг/мл (день 1) и Cmax=164 нг/мл (день 14) активного метаболита Ia в плазме и Cmax=1041 нг/мл (день 14) в ФЭК. При многократном приеме препарата в дозе 80 мг/сутки Cmax=250 нг/мл активного метаболита формулы Ia в плазме и период полувыведения Т1/2=122 часа.
При многократном еженедельном приеме препарата, содержащего МКМС формулы Ib со средним диаметром частиц 100 мкм в здоровых добровольцах в дозе 41,4 мг/неделя, 82,8 мг/неделя, 124,2 мг/неделя максимальная концентрация активного метаболита Ia на первой неделе достигается примерно через 5,5 часа после приема препарата и имеет значение Cmax=34,5 нг/мл, 63,6 нг/мл и 117,1 нг/мл соответственно, а через неделю (168 ч) - концентрация активного метаболита а имеет значение 26,1 нг/мл, 36,9 нг/мл и 57,2 нг/мл соответственно.
Исследование эффективности, безопасности и подбора оптимальной дозировки МКМС формулы Ib у ВИЧ-1-инфицированных пациентов, ранее не получавших лечения. В исследовании использовали капсулы, содержащие 10 мг микронизированной моноклинной формы VM-1500 со средним диаметром частиц 100 мкм. Исследовались дозы 20 мг/сутки (60 пациентов) и 40 мг/сутки (60 пациентов) МКМС формулы Ib в сравнении с 600 мг/сутки Эфавирензом (30 пациентов). Было установлено, что группы терапии МКМС формулы Ib не различались между собой по эффективности (р=0.804) и были близки по эффективности с группой Эфавиренз (р=0.714). Препарат, содержащий МКМС формулы Ib в дозах 20 и 40 мг не уступал по эффективности препарату Эфавиренз в отношении снижения вирусной нагрузки до уровня <400 копий/мл за период 12 недель. Между группами терапии МКМС формулы Ib 20 мг и Эфавиренз 600 мг наблюдалась тенденция к статистическому различию по частоте достижения снижения вирусной нагрузки 10 раз и более (р=0.053). Группы терапии статистически не различались по частоте достижения неопределяемого уровня РНК ВИЧ-1 на неделе 36 (р=0.408). Преимущество группы МКМС формулы Ib 20 мг над группой Эфавиренза 600 мг было статистически значимым (р=0.0237).
Развитие резистентности ВИЧ-1 при применении МКМС формулы Ib в дозах 20 мг и 40 мг Эфавиренза не установлено. Серьезных нежелательных явлений при применении МКМС формулы Ib у пациентов не наблюдалось.
Предметом данного изобретения является также применение фармацевтической композиции по данному изобретению для профилактики и лечения вируса имунодефицита человека (ВИЧ) и синдрома приобретенного имунодефицита (СПИД).
Предметом данного изобретения является также применение лекарственного препарата по данному изобретению для профилактики и лечения вируса имунодефицита человека (ВИЧ) и синдрома приобретенного имунодефицита (СПИД).
Предметом данного изобретения является также способ лечения субъекта, инфицированного ВИЧ путем перорального введения пациенту фармацевтической композиции или лекарственного препарата по данному изобретению.
Предметом данного изобретения является также способ лечения субъекта, путем перорального введения пациенту один раз в день препарата по данному изобретению, содержащего от 20 мг до 41,4 мг МКМС формулы Ib.
Предметом данного изобретения является также способ лечения субъекта, путем перорального введения пациенту один раз в неделю препарата по данному изобретению, содержащего от 41,4 мг до 207 мг МКМС формулы Ib.
Способы профилактики и лечения ВИЧ-инфекции у субъектов, раскрытый здесь, включает введение новой пероральной лекарственной формы, раскрытой здесь (в частности, капсулы) субъекту, обычно человеку, обычно один раз в день.
В некоторых вариантах осуществления раскрытые здесь способы включают повторные введения с интервалами одного раза в день. Например, в некоторых вариантах осуществления раскрытые здесь способы включают введение новых пероральных лекарственных форм, раскрытых здесь ежедневно или один раз в неделю.
Предметом данного изобретения является также способ профилактики ВИЧ-инфекции у субъектов, имеющих риск заражения, путем введения пациенту фармацевтической композиции или лекарственного препарата по по данному изобретению.
Предметом данного изобретения является также способ профилактики ВИЧ-инфекции у субъектов, имеющих риск заражения, путем одноразового введения пациенту препарата (фармацевтической композиции или лекарственного препарата), по данному изобретению.
В некоторых вариантах осуществления раскрытые здесь способы включают введение до и/или после события, которое могло бы подвергнуть человека воздействию ВИЧ или которое в противном случае увеличило бы риск заражения ВИЧ человеком, например, в качестве предварительной профилактики и/или как постконтактная профилактика. Примеры событий, которые могут повысить риск заражения ВИЧ, включают, без ограничения, использование презервативов во время анального контакта с ВИЧ-положительным партнером или партнером неизвестного ВИЧ-статуса; анальный секс с более чем 3 половыми партнерами; секс с партнером-мужчиной и диагностика инфекций, передаваемых половым путем; и отсутствие последовательного использования презервативов с сексуальным партнером, который, как известно, является ВИЧ-положительным.
В некоторых вариантах осуществления, например, при введении в виде предварительной профилактики, новые твердые пероральные лекарственные формы, раскрытые здесь, вводят от 2 до 72 часов, от 2 до 48 часов, от 2 до 24 часов или от 2 до 12 часов до события, которое увеличивает риск человека (например, до секса или другого заражения ВИЧ). В некоторых вариантах осуществления твердые пероральные лекарственные формы, раскрытые здесь, вводят в течение 72 часов, 60 часов, 48 часов, 24 часов, 12 часов, 9 часов, 6 часов, 4 часов, 3 часов, 2 часов или 1 часа до события, которое повысит риск заражения ВИЧ (например, до секса или другого заражения ВИЧ).
В некоторых вариантах осуществления новые твердые пероральные лекарственные формы, раскрытые здесь, вводятся до события, которое увеличивает риск заражения ВИЧ человеком, их вводят ежедневно до события. В некоторых вариантах осуществления, когда твердые пероральные лекарственные формы, раскрытые здесь, вводят до события, которое увеличило бы риск заражения ВИЧ человеком, их вводят от одного до трех раз до события.
В некоторых вариантах осуществления, например, при введении в качестве части схемы профилактики, новые твердые пероральные лекарственные формы, раскрытые здесь, вводят от 2 до 48 часов, от 2 до 36 часов, от 2 до 24 часов или от 2 до 12 часов после события, которое повысит риск заражения ВИЧ (например, после полового контакта или другого заражения вирусом ВИЧ).
В некоторых вариантах осуществления, например, при профилактике, новые твердые пероральные лекарственные формы, раскрытые здесь, вводят в течение 7 дней, 14 дней, 21 дня, 28 дней, 30 дней или 45 дней после события, которое увеличивает индивидуальный риск приобретения ВИЧ (например, после секса или другого воздействия ВИЧ).
В некоторых вариантах осуществления, например, при профилактике, новые твердые пероральные лекарственные формы, раскрытые здесь, вводят в течение 30 дней после события, которое увеличивает индивидуальный риск заражения ВИЧ (например, после секса или другого воздействия ВИЧ). В некоторых вариантах осуществления твердые пероральные лекарственные формы, описанные здесь, вводят менее 1 часа, 2 часа, 3 часа, 4 часа, 5 часов, 6 часов, 7 часов, 8 часов, 9 часов, 12 часов, 18 часов, 24 часов, 36 часов или 48 часов после события, которое увеличило бы риск заражения человека (например, после секса или другого воздействия ВИЧ). В некоторых других вариантах осуществления твердые пероральные лекарственные формы, раскрытые здесь, вводят в течение 1 дня, 2 дней, 3 дней, 4 дней или 5 дней после события, которое увеличило бы риск заражения человека (например, после секса или другого воздействия ВИЧ). В некоторых вариантах осуществления, когда новые твердые пероральные лекарственные формы, раскрытые здесь, вводятся после события, которое увеличило бы риск заражения ВИЧ человеком, они назначаются ежедневно. В некоторых вариантах осуществления, когда новые твердые пероральные лекарственные формы, раскрытые здесь, вводят после события, которое увеличивает риск заражения ВИЧ человеком, их вводят от одного до трех раз после события. В некоторых вариантах осуществления, когда твердые пероральные лекарственные формы, раскрытые здесь, вводят после события, которое увеличивает риск заражения ВИЧ человеком, их вводят один раз после события.
Настоящее изобретение далее будет описано в связи с определенными вариантами осуществления, которые не предназначены для ограничения его объема. Напротив, настоящее изобретение охватывает все альтернативы, модификации и эквиваленты, которые могут быть включены в объем формулы изобретения. Таким образом, следующие примеры, которые включают в себя конкретные варианты, иллюстрируют, но не ограничивают настоящее изобретение.
Изобретение иллюстрируется следующими чертежами:
Фиг. 1 - Дифрактограмм образца кристаллического образца соединения 1b.
Фиг. 2 - Моделирование дифрактограммы кристаллического образца соединения 1b методом Паули. Синей линией обозначена экспериментальная дифрактограмма (1), красной - расчетная (2) и серой - разностная кривая (3).
Фиг. 3 - Кривая ДСК кристаллов моноклинного симметрии соединения 1b.
Фиг. 4 - Кривая термограммы кристаллов моноклинного симметрии соединения 1b.
Пример 1. Микронизированные кристаллы моноклинной симметрии натрий {[4-({[4-бром-3-(3-хлор-5-цианофенокси)-2-фторфенил]ацетил}амино)-3-хлорфенил]-сульфонил}(пропаноил)азанида (МКМС формулы Ib).
Растворяют 3,0 кг соединения Ib при 60°С-70°С в смеси 14 л изопропанол и л воды. Полученный раствор фильтруют горячим через слой целита. К фильтрату добавляют 30 л н-бутилацетата, раствор нагревают до кипения и отгоняют при 400±50 мм рт.ст. из смеси 30±2 л легкокипящие компоненты при этом происходит образование суспензии и температура кубового остатка поднимается до 80°С, вакуум снимают, нагревают полученную суспензию до 100-110°С и фильтруют. Осадок на фильтре отфильтровывают и промывают на фильтре 10 л н-бутилацетата, подогретого до 60±5°С. Полученный продукт сушат 24 ч на воздухе, а затем 24 ч при 45°С и остаточном давлении 50±10 мбар в сушильном шкафу. Получают 2,82±0,1 кг (94%) МКМС формулы Ib со средним диаметром частиц 95 мкм - 130 мкм и т.пл 247,67°С (Фиг. 3), представляющего собой по данным РФА кристаллы моноклинной симметрии (Фиг. 1 и 2, табл. 1) со следующими параметрами элементарной ячейки: кристаллографическая группа - Р21/с, объем элементарной ячейки - 2623.79(12) А3. Параметры решетки: а=15.0637(4) A, b=25.2592(6) А, с=6.89727(19) А, В=91.216(2)°, полученными после уточнения дифрактограмм методом Паули.
МКМС формулы Ib со среднимо диаметром частиц 40 мкм получали дополнительным измельчением МКМС формулы Ib со средним диаметром частиц 95 мкм- 130 мкм с использованием ультрацентробежной мельницы ZM 200 (производитель «Retsch GmbH», Германия), а МКМС формулы Ib со среднимо диаметром частиц 10 мкм получали дополнительным измельчением МКМС формулы Ib со средним диаметром частиц 95 мкм - 130 мкм с использованием спирально-струйной мельницы ALPINE Aeroplex -100 AS (Hosokawa Micron Corporation, Япония).
Пример 2. Рентгенофазовый анализ кристаллических образцов соединения Ib.
Съемка образцов проводилась на порошковом рентгеновском дифрактометре Bruker D8 Advance Vario, оснащенном рентгеновской трубкой с медным внодом и Ge(III)-монохроматором (CuKα1) и позиционно-чувствительным детектором LynxEye, в установках на просвет.Интервал съемки составил 4.5-60° для всех образцов, шаг 0.01° 2θ. Описание дифрактограмм производилось в программном комплексе Bruker Topas5. Установлено, что на дифрактограммах образцов наблюдаются пики (Табл. 1, фиг. 1 и 2, табл.1) с положениями, соответствующими моноклинной пространственной группе Р21/с с параметрами элементарной ячейки а=15.0637(4)



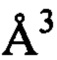
Пример 3. Дифференциальная сканирующая калориметрия (ДСК) кристаллических образцов моноклинной формы соединения Ib.
ДСК образцов проводилась на приборе DSC 204 Fl Phoenix (NETZSCH, Германия) по следующей программе: 3 нагрева от 20 до 200°С со скоростью 10 К/мин в токе аргона. Длительность одной программы 3 часа 7 минут (Total time на скрине). Общая длительность работы прибора (с учетом базовой линии) 6 часов 14 минут. На кривой ДСК образца (фиг. 3) присутствует пик плавления при -250°С (начало процесса 244°С, окончание процесса 253,5°С), тепловой эффект плавления составляет 102.9 Дж/г.
Пример 4. Термогравиметрический анализ кристаллических образцов моноклинной формы соединения Ib.
Анализ был проведен на приборе TG 209 F1 Libra (NETZSCH, Германия) по следующей программе: нагрев от 30 до 550°С со скоростью 10 К/мин в токе аргона (Фиг. 4). Температура начала разложения для образца составила 294.7°С, общая потеря массы составила 52.9% (с учетом погрешности прибора). Длительность одной программы 1 час 43 минуты (Total time на скрине).
Пример 5. Фармацевтическая композиция и препарат, представляющий собой твердую желатиновую капсулу.
Для получения фармацевтической композиции все компоненты предварительно просеивают, после чего 0,214 кг повидона-КЗО помещают в емкость с 0,856 кг очищенной воды. Получают 1,070 кг увлажнителя. Смешивают 0,453 кг МКМС формулы Ib со средним диаметром частиц от 10 до 130 мкм, 7,367 кг моногидрата лактозы и 0,274 кг кроскармеллоза натрия в миксере DIOSNA V 25. К полученной смеси прибавляют при перемешивании 1,070 кг предварительно приготовленного раствора увлажнителя. Полученный гранулят сушат в сушилке с псевдоожиженным слоем DIOSNA MIDI LAB ХР. Сухой гранулят просеивают на вибрационном грохоте ГР 50, отсевки гранулята измельчают на роторной ударной мельнице SR300. Получают гранулятов. В зависимости от количества полученного гранулята рассчитывают количество кроскармеллозы натрия и магния стеарата (в случае отсутствия потерь на операции получения гранулята количество кроскармеллозы натрия - 2,073 кг, магния стеарата - 0,753 кг). Полученный гранулят помещают в смеситель RRM 100/200 и перемешивают в течение 20 минут, прибавляют кроскармеллозу натрия, проводят перемешивание в течение 5 минут. Затем прибавляют стеарат магния, перемешивают 1 минуту и получают фармацевтическую композицию для капсулирования, представляющую собой порошок белого или почти белого цвета, содержащий от 18,50 мг до 21,50 мг МКМС формулы Ib, считая на среднюю массу содержимого капсулы. Полученную композицию капсулируют на капсульной машине AFT-Lab ACG в твердые желатиновые капсулы №1 с корпусом белого цвета и крышечкой красного цвета. Получают капсулы, содержащие 20,7 мг МКМС формулы Ib в комбинации с 337,196 мг моногидрата лактозы (Лактоза 200 М), 21,168 мг кроскармеллозы натрия (Вивасол), 9,800 мг повидона-КЗО (Повидон, Kollidon 30) и 3,136 мг стеарата магния (Магний стеарат ST-V). Средняя масса содержимого капсул: 392 мг (от 362,6 мг до 421,4 мг); средняя масса наполненных капсул: 468 мг (от 434,90 мг до 503,10 мг).
Аналогично получают капсулы, содержащие 10 мг, 41,4 мг, 82,8 мг и 103,5 мг МКМС формулы Ib со средним диаметром частиц от 10 до 130 мкм, а также капсулы содержащие МКМС формулы Ib со средним диаметром частиц более 130 мкм.
Пример 6. Фармакокинетические исследования готовых лекарственных форм в виде капсул, содержащих МКМС формулы Ib со средним диаметром частиц от 100 мкм до 200 мкм в собаках породы Бигль.
Исследование проведено на 9-ти 7-8 месячных самцах собак породы Бигль весом 12,5-15.2 кг, в трех экспериментальных группах по 3 собаки в группе. До введения капсул, содержащих 20,7 мг МКМС формулы Ib, собаки были лишены корма не менее чем за 8 ч, и воды не менее чем за 1 ч. После введения препаратов свободный питьевой режим разрешался через 2 ч, кормление - через 10 ч. Плазму крови собирали перед введением препарата (0) и через 15, 30 мин, 1, 1.5, 2, 3, 4, 6, 8, 10, 12, 24, 36, 48, 72, 96 и 168 ч после введения. Объем отбираемой крови у одной собаки в одной временной точке составлял не более 1 мл, суммарно - не более 18 мл за неделю, что не превышало рекомендуемых 7,5% (64 мл) от общего объема крови у собак.
Кровь собирали в объеме 1 мл в каждой временной точке у каждого животного из латеральной подкожной вены голени в пробирки, содержащие антикоагулянт 100 мкл 0,5М ЭДТА. Плазму отделяли центрифугированием крови при 10000 об/мин в течение 10 мин, переносили в заранее промаркированные пробирки эппендорф и замораживали на -70°С до анализа. Образцы плазмы крови хранили на сухом льду.
Анализ образцов плазмы крови проводили ВЭЖХ-МС/МС методом с нижним пределом количественного определения активного метаболита Ia - 0.5 нг/мл.
Основные фармакокинетические характеристики капсул, содержащих, МКМС формулы Ib в форме микронизированной грануляции со средним диаметром частиц 100 мкм (группа 1), 130 мкм (группа 2) и 200 мкм (группа 3), представлены в таблице 2.
Пример 7. Фармакокинетические исследования готовых лекарственных форм в здоровых добровольцах.
В здоровых добровольцах фармакокинетика готовых лекарственных форм исследовалась аналогично изложенному выше в примере 5. В результате клинических исследований на здоровых добровольцах препарата, представляющего собой капсулы (по примеру 4), содержащие эксципиенты и 10 мг МКМС формулы Ib со средним диаметром частиц 100 мкм в дозах 10,20, 30, 40 и 80 мг/сутки, было установлено, что период полувыведения пролекарства Ib варьировался от 0,5 ч до 3 ч при дозах 10 и 20 мг (CV>70%) и от 1 ч до 3 ч при дозе 30 мг (CV=35%). В отличие от пролекарства Ib, активный метаболит Ia продемонстрировал накопление в крови при многократном приеме препарата и длительный период полувыведения. Динамика изменения концентрации метаболита Ia в крови оценивалась по его содержанию в плазме и ФЭК. Обнаружено, что в ФЭК концентрация метаболита была на порядок выше, чем в плазме.
При постоянном приеме препарата концентрация активного метаболита Ia в плазме нарастала, достигая максимальной в среднем через 9,8 дней дозирования при дозе 10 мг/сутки, 7,5 дней - при дозе 20 мг/сутки и 6,7 дней - при дозе 30 мг мг/сутки. Период полувыведения метаболита Ia из плазмы в среднем составил 7,5 дней при дозах 30 и 20 мг/сутки, при дозе 10 мг/сутки - 8,9 дней.
При многократном приеме препарата в дозе 10 мг/сутки Cmax=5,5 нг/мл (день 1) и Cmax=75 нг/мл (день 14) активного метаболита 1а в плазме и Cmax=825 нг/мл (день 14) в форменных элементах крови (ФЭК). При многократном приеме препарата в дозе 20 мг/сутки Cmax=12,7 нг/мл (день 1) и Cmax=164 нг/мл (день 14) активного метаболита Ia в плазме и Cmax=1041 нг/мл (день 14) в ФЭК. При многократном приеме препарата в дозе 80 мг/сутки Cmax=250 нг/мл активного метаболита Ia в плазме и период полувыведения Т1/2=122 часа.
При многократном еженедельном приеме препарата, содержащей МКМС формулы Ib со средним диаметром частиц 100 мкм в здоровых добровольцах в дозе 41,4 мг/неделя, 82,8 мг/неделя 124,2 мг/неделя максимальная концентрация активного метаболита Ia на первой неделе достигается примерно через 5,5 часа после приема препарата и имеет значение 34,5 нг/мл, 63,6 нг/мл и 117,1 нг/мл соответственно, а через неделю - концентрация активного метаболита Ia имеет значение 26,1 нг/мл, 36,9 нг/мл и 57,2 нг/мл соответственно.
Пример 8. Исследование эффективности готовых лекарственных форм в инфицированных ВИЧ пациентах.
Исследование эффективности, безопасности и подбора оптимальной дозировки МКМС формулы Ib у ВИЧ-1-инфицированных пациентов, ранее не получавших лечения. В исследовании использовали капсулы (по примеру 4), эксципиенты и содержащие 10 мг МКМС формулы Ib со средним диаметром частиц 100 мкм. Исследовались дозы 20,7 мг/сутки (60 пациентов) и 41,4 мг/сутки (60 пациентов) МКМС формулы Ib в сравнении с 600 мг/сутки Эфавирензом (30 пациентов). Было установлено, что группы терапии МКМС формулы Ib не различались между собой по эффективности (р=0.804) и были близки по эффективности с группой Эфавиренз (р=0.714). Препарат с МКМС формулы Ib в дозах 20 и 40 мг не уступал по эффективности препарату Эфавиренз в отношении снижения вирусной нагрузки до уровня<400 копий/мл за период 12 недель. На неделе 12 значение вирусной нагрузки снизилось на -2.8±0.7 в группе МКМС формулы Ib 20 мг и на -2.7±1.0 в группе Эфавиренз 600 мг.На неделе 24 изменения составили уже -3.3-0.7 и -3.3±0.8, соответственно. Между группами терапии МКМС формулы Ib 20 мг и Эфавиренз 600 мг наблюдалась тенденция к статистическому различию по частоте достижения снижения вирусной нагрузки 10 раз и более (р=0.053). Группы терапии статистически не различались по частоте достижения неопределяемого уровня РНК ВИЧ-1 на неделе 36 (р=0.408). Преимущество группы МКМС формулы Ib 20 мг над группой Эфавиренза 600 мг было статистически значимым (р=0.0237).
Развитие резистентности ВИЧ-1 при применении МКМС формулы Ib и Эфавиренза исследованных дозах не установлено. Серьезных нежелательных явлений при применении МКМС формулы Ib у пациентов не наблюдалось.
Реферат
Изобретение относится к микронизированным кристаллам моноклинной симметрии (МКМС) со средним диаметром частиц ≤130 мкм натрий {[4-({[4-бром-3-(3-хлор-5-цианофенокси)-2-фторфенил]ацетил}амино)-3-хлорфенил]-сульфонил}(пропаноил)азанида - формулы Ib, натрий {[4-({[4-бром-3-(3-хлор-5-цианофенокси)-2-фторфенил]ацетил}амино)-3-хлорфенил]-сульфонил}(пропаноил)азаниду формулы Ib. Кристаллы являются активным компонентом фармацевтической композиции и лекарственного средства для применения в терапии вируса иммунодефицита человека (ВИЧ) и синдрома приобретенного иммунного дефицита (СПИДа). Микронизированные кристаллы соединения формулы Ibимеют следующие характеристики кристалла:и показатели порошковой рентгенограммы, обладающей межплоскостными расстояниями (D) и относительной интенсивностью (I=I/I×100) дифракционных максимумов образца моноклинной фазы в области углов 2θ 6°-30°:МКМС с указанной моноклинной кристаллической структурой имеют показатели DSC в пределах 244-253,5°С с пиком 250°С. Средний размер диаметра частиц от 10 до 130 мкм. Фармацевтическая композиция имеет твердую форму и содержит дополнительно в качестве эксципиентов по крайней мере моногидрат лактозы, кроскармеллозу натрия, повидон и стеарат магния. Лекарственный препарат используют в виде пероральной формы. Сравнительные данные по использованию микронизированных и немикронизированных частиц (Ib и Iа соответственно) показывают, что микронизированные частицы увеличивают время экспозиции соединения Ib в плазме крови. 4 н. и 13 з.п. ф-лы, 4 ил., 2 табл., 8 пр.
Формула


Документы, цитированные в отчёте о поиске
Фармацевтическая наносуспензия для терапии вич-инфекции

Комментарии