Ацил-гидразоновые и оксадиазоловые соединения, фармацевтические композиции, содержащие их, и их применение - RU2664327C2
Код документа: RU2664327C2
Чертежи




Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к ацил-гидразонам, полученным из 3,4,5-триметоксифенил-гидразида, для лечения заболеваний, связанных с клеточной пролиферацией (таких как лейкозы, опухоли, воспаление и другие пролиферативные заболевания). Более конкретно, настоящее изобретение относится к соединениям, обладающим ингибирующей активностью против тубулина, которые благодаря этому могут быть пригодны при лечении острого лимфобластного лейкоза (ALL). Настоящее изобретение дополнительно относится к получению новых ацил-гидразонов и оксадиазолов из 3,4,5-триметоксифенил-гидразида.
УРОВЕНЬ ТЕХНИКИ
Рак представляет собой заболевание, характеризующееся пролиферацией и неконтролируемым распространением в организме патологических форм человеческих клеток. Неопластические клетки отличаются от нормальных клеток высокой инвазивной способностью, которой они обладают, снижением их функции, снижением дифференцировки и способностью к метастазированию по причине низкой адгезии между ними (Rang, H.P.; Dale, M.M.; Ritter, J.M; Moore, P.K. Farmacologia. 5 изд. Rio de Janeiro: Elsevier, 2004. 703 c.). В 2009 году количество новых случаев заболевания раком молочной железы, по оценкам, составило в Бразилии 49000, раком предстательной железы - 47000, раком легких - 27000, раком ободочной и прямой кишки - 25000, раком желудка - 23000 и раком шейки матки - 19000 в 2009 году (INCA, Instituto Nacional do Cáncer [Национальный институт онкологии]. Информация доступна на сайте:
Лейкоз представляет собой один из нескольких типов рака и возникает за счет неопластической пролиферации лимфоидных или миелоидных гематопоэтических клеток в результате мутации одной стволовой клетки, потомство которой образует клон лейкозных клеток. Возникают многочисленные генетические изменения для злокачественного преобразования, в том числе неприемлемая экспрессия онкогенов и снижение функции генов-онкосупрессоров (Bain В.J. Diagnystico em leucemias. Rio de Janeiro: Elsevier, 2003, Cap. 1, 01-56), которые могут быть связаны с генетическими факторами или рисками (такими как курение, воздействие радиации или химических веществ, таких как бензол) (INCA, Instituto Nacional do Cancer [Национальный институт онкологии] - Leucemia - prеvеncao genŭtica, outros fatores de risco [Лейкоз - предупреждение, генетические и другие факторы риска], информация доступна на сайте:
Острый лимфобластный лейкоз (ALL) обусловлен неконтролируемой пролиферацией незрелых лимфоидных клеток-предшественников в костном мозге, приводя к очень быстрому накоплению неопластических клеток Plasschaert, S.; Van Der Kolk, D.; De Bont, E.; Vellenga, E.; Kamps, W.; De Vries, E. Breast Cancer Resistance Protein (BCRP) in Acute Leukemia. Leukemia & Lymphoma, 2004, 45, 649-654). На его долю приходится 80% случаев острого лейкоза в детстве (Laks, D.; Longhi, F., Bernardes, W.M.; Ramos, G.P.C. J Pediatr, 2003, 79, 149-158) и 50% всех гематопоэтических злокачественных заболеваний (Downing, James R.; Shannon, Kevin M. Acute leukemia: A pediatric perspective. Cancer Cell, 2002, 2, 437-445). У взрослых ALL возникает относительно редко, насчитывая 2-3% гематопоэтических злокачественных заболеваний (Downing, James R.; Shannon, Kevin M. Acute leukemia: A pediatric perspective. Cancer Cell, 2002, 2, 437-445); однако в этом случае прогноз гораздо хуже, чем для детей, поскольку этот лейкоз поражает мультипотентные стволовые клетки, что приводит к гораздо более агрессивному лейкозу (Greaves, M.F. Stem cell origins of leukaemia and curability. British Journal of Cancer, 1993, 67, 413-423).
Выполнено достаточное количество исследований применения соединений из природных источников в качестве химиотерапии. Пример представляет собой антинеопластический паклитаксел (Taxol™), один из наиболее важных когда-либо открытых противоопухолевых природных продуктов, впервые описанный в 1971 г. (Wani, M.С.; Taylor, H.L.; Wall, M.Ε.; Coggon, P.; McPhail, A.T. Plant antitumor agents. VI. Isolation and structure of taxol, a novel antileukemic and antitumor agent from Taxus brevifolia. Journal of the American Chemical Society, 1971, 93, 2325-2327), и который был одобрен FDA для клинического применения лишь спустя долгое время (в 1992 г.). Другой пример представляет собой винкристин, алкалоид, используемый в терапии острого лейкоза и других типов опухолей, который действует таким же образом, что и паклитаксел, связываясь с тубулином, вмешиваясь в образование (полимеризацию) или реорганизацию (деполимеризацию) микротрубочек (Goodman е Gilman. As bases farmacolygicas da terapkutica, 10е изд., под ред. Мс Graw Hill. 2006).
Наиболее широко распространенные химиотерапевтические агенты в современной терапии лейкоза включают даунорубицин, доксорубицин, дексаметазон, винкристин, метотрексат и меркаптопурин (Plasschaert, S.; Van Der Kolk, D.; De Bont, E.; Vellenga, E.; Kamps, W.; De Vries, E. Breast Cancer Resistance Protein (BCRP) in Acute Leukemia. Leukemia & Lymphoma, 2004, 45, 649-654). Эти лекарства обеспечивают терапевтическое преимущество, но и значительную токсичность для организма и нормальных клеток из-за их роли в инициации апоптоза и ингибировании клеточной пролиферации (Herr, I.; Debatin, К.М. Cellular stress response and apoptosis in cancer therapy. Blood 2001, 98, 2603-2614; и Leszczyniecka, M.; Roberts, T.; Dent, P.; Grant, S.; Fisher, P.B. Differentiation therapy of human cancer: basic science and clinical applications. Pharmacology & Therapeutics, 2001, 90, 105-156). Антинеопластические агенты также взаимодействуют с нормальными тканями, которые имеют быстро делящиеся клетки, что может вызывать множество нежелательных эффектов, таких как снижение выработки защитных клеток в организме, слабое заживление ран, алопеция, повреждение желудочно-кишечного эпителия, бесплодие и тератогенность (Rang, H.P.; Dale, M.M.; Ritter, J.M; Moore, P.K. Farmacologia. 5 изд. Rio de Janeiro: Elsevier, 2004. 703 с.).
Несмотря на недавние достижения в изучении рака, в 2008 году в Бразилии зарегистрировано 5686 смертей от лейкоза, а прогноз на 2010 год составил 9580 новых случаев этого заболевания (INCA, Instituto Nacional do Cancer [Национальный институт онкологии]. Информация доступна на сайте:
В недавно выполненном исследовании ученый Wang и его коллеги (Wang, Ζ.; Lu, Y.; Seibel, W.; Miller, D.D.; Li, W. Identifying Novel Molecular Structures for Advanced Melanoma by Ligand-Based Virtual Screening. Journal of Chemical Information and Modeling, 2009, 49, 1420-1427) исследовали новые противоопухолевые соединения на основе структуры соединения LY-1-100, которое обладает подтвержденным механизмом действия и аффинностью к микротрубочкам (колхицин-связывающий сайт), но низкой селективностью.
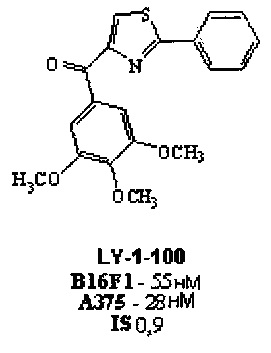
Структуры выбрали с помощью виртуального отбора на основе лигандов, получив 14 новых молекул с высокой структурной схожестью с исходным соединением (LY-1-100). Теоретические результаты, полученные исследователями, выявили, что триметоксилированное кольцо соединения LY-1-100 должно быть сохранено для обеспечения противоопухолевой активности, а триазольное кольцо, по-видимому, не является важным и может быть заменено структурой N-метилен-гидразина, что дает структуру ацил-гидразонов. Хотя результаты испытания этих соединений в клетках мышей B16F1 и А375 (in vitro) не показали улучшения эффективности и селективности от исходного соединения, эти результаты были очень многообещающими и указали некоторые основные структурные компоненты для анти-меланомной активности (Wang, Ζ.; Lu, Y.; Seibel, W.; Miller, D.D.; Li, W. Identifying Novel Molecular Structures for Advanced Melanoma by Ligand-Based Virtual Screening. Journal of Chemical Information and Modeling, 2009, 49, 1420-1427).


В этом отношении ацил-гидразоны представляют собой интересный класс соединений с противоопухолевой активностью. Поэтому настоящее изобретение относится к получению ацил-гидразонов, особенно полученных из 3,4,5-триметоксифенил-гидразида, для лечения заболеваний, связанных с клеточной пролиферацией (таких как лейкозы, опухоли, воспаление и другие пролиферативные заболевания).
В патентной заявке PI 0112674-1 (н-[5-[[[5-алкил-2-оксазолил]метил]тио]-2-тиазолил]карбоксамидные ингибиторы циклин-зависимых киназ) описаны соединения и их энантиоморфы, диастереомеры, сольваты и фармацевтически приемлемые соли в качестве ингибиторов протеинкиназ, приходных для лечения пролиферативных заболеваний, таких как рак, воспаление и артрит. Синтезированные соединения также могут быть пригодны для лечения болезни Альцгеймера, алопеции в результате химиотерапии и сердечно-сосудистых заболеваний. Соединения, описанные в заявке PI 0112674-1, представляют собой более сложные структуры, чем соединения, представленные в рамках настоящего изобретения.
Соединения упоминаемой публикации патентной заявки № U.S. 20040138272 (производные 1,4-замещенного циклогексана) могут быть применимы для предупреждения клеточной пролиферации при злокачественных заболеваниях за счет ингибирования киназ Rho, применимы для восстановления центральной и периферической нервной системы за счет инициации роста и регенерации аксонов. Механизм действия соединений в публикации U.S. 20040138272 отличается от механизма, предложенного для структур настоящего изобретения.
Ингибиторы циклинзависимых киназ (cdk), пригодные для модулирования прогрессирования клеточного цикла, предложены в патентной заявке PI 0418095-0 (ингибитор циклинзависимых киназ, композиции и способы, относящиеся к ним). Такие соединения применимы для лечения пациентов с расстройствами, связанными с избыточной клеточной пролиферацией. Соединения, описанные в PI 0418095-0, представляют собой ацил-гидразоны, отличные от соединений, предложенных в рамках настоящего изобретения, с более сложным способом синтеза.
В патентной заявке PI 0508364-8 (производные 4-бензимидазол-2-ил-пиридазин-3-она) описаны соединения и их физиологически переносимые соли, которые обладают активностью в качестве ингибиторов киназ, в частности, киназы CDK2 (циклинзависимой киназы 2). Соединения PI 0508364-8 отличаются от соединений, предложенных в рамках настоящего изобретения, с более сложным синтезом.
В публикации заявки на патент США № U.S. 20070066610 (ацил-гидразоны как модуляторы киназы) описаны ацил-гидразоны как ингибиторы тирозинкиназ, включая c-Met, рецептор тирозинкиназы, который регулирует клеточную пролиферацию, морфогенез и подвижность. Ацил-гидразоны, описанные в U.S. 20070066610, отличаются от соединений, описанных в рамках настоящего изобретения, с более сложным синтезом. Кроме того, цель действия описанных соединений отличается от предложенных в настоящем документе.
Опубликованная заявка на патент США 20080194562 (производные пиразола для ингибирования Cdk и Gsk) относится к синтезу пиразольных соединений, которые ингибируют или модулируют активность циклин-зависимых киназ (CDK) и киназной гликоген-синтазы (GSK), а также к их применению при лечении или профилактике заболеваний или состояний, опосредованных киназой. Описаны также фармацевтические составы, содержащие соединения и химические промежуточные вещества. Соединения документа U.S. 20080194562 отличаются от предложенных в рамках настоящего изобретения.
Ацил-гидразоны также описаны в литературе по их выраженному инсектицидному действию и способности стимулировать рост растений (Robinson, В. Fischer indole synthesis. Chem. Rev., 1963, 4, 373-401); по применению при лечении туберкулеза (Vigorita, M.G.; Ottana, R.; Zappala, C; Maccari, R.; Pizzimenti, F.C; Gabbrielli, G. Halogenated isoniazid derivatives as possible antimycobacterial and anti-HIV agents - III. Farmaco, 1994, 49, 775-781); a также в качестве бактериологических и бактериостатических агентов (Samus, N.M.; Tsapkov, V.I.; Kuracheva, S.Α.; Burdenko, T.A. Synthesis and antimicrobial activity of coordination compounds of 3d-elements with some hydrazones derived by using 5-nitro-2-furaldehyde. Khimiko-Farmatsevticheskii Zhurnal, 1994, 28, 41-44).
Учитывая все вышесказанное, было выполнено исследование ацил-гидразонов и их оксадиазоловых производных, полученных с помощью неклассической стратегии биоизостеризма замыкания кольца, с целью разработки новых химиотерапевтических агентов. Оксадиазолы представляют собой важный класс гетероциклических соединений с широким рядом биологической активности, такой как противовирусная, антинеопластическая, фунгицидная активность и ингибирование тирозиназы и катепсина K (Kumar, D.; Sundaree, S.; Johnson, E.O.; Shah, K. An efficient synthesis and biological study of novel indolyl-1,3,4-oxadiazoles as potent anticancer agents. Bioorganic & Medicinal Chemistry Letters, 2009, 19, 4492-4494). Кроме того, они представляют собой известные биоизостеры амидов и сложных эфиров, которые могут значительно способствовать увеличению фармакологической активности, участвуя в водородных связях как рецепторы (Guimaraes, С.R.W.; Boger, D.L; Jorgensen, W.L. Elucidation of Fatty Acid Amide Hydrolase Inhibition by Potent α-Ketoheterocycle Derivatives from Monte Carlo Simulations. Journal of the American Chemical Society, 2005, 127, 17377-17384).
Таким образом, определенные ацил-гидразоны и их аналоги, полученные по способам настоящего изобретения, подробно описанным ниже, а также их применение при лечении лейкоза, опухолей и других пролиферативных заболеваний, таких как воспаление, представляют собой значительный экономический и социальный интерес.
ЦЕЛИ ИЗОБРЕТЕНИЯ
Цель настоящего изобретения заключается в получении синтетических соединений, производных 3,4,5-триметоксифенил-гидразида (гидразонов и оксадиазолов), и всех аналогов, и тому подобных, с помощью простого синтетического способа, а также в применении этих соединений для лечения заболеваний, связанных с клеточной пролиферацией (таких как лейкозы, в частности, острый лимфобластный лейкоз - ALL, опухоли, воспаление и другие пролиферативные заболевания). В настоящем изобретении описаны также способы определения биологической активности этих соединений.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к классу ацил-гидразонов, в частности тех, которые получены из 3,4,5-триметоксифенил-гидразида, а также к аналогичным соединениям оксадиазола и к другим похожим и родственным соединениям, и к фармацевтическому применению всех этих соединений при лечении различных заболеваний, связанных с клеточной пролиферацией, таких как лейкоз, включая острый лимфобластный лейкоз (ALL), опухоли и воспаление. В настоящем изобретении описаны также способы, используемые для определения биологической активности всех этих соединений.
Были получены ацил-гидразоны с такой же активностью, что и соединения, используемые в качестве стандарта в указанных экспериментах (колхицин). Более высокая селективность соединений, описанных в настоящем документе, представляет собой важную характеристику, связанную с меньшим количеством побочных эффектов, чем у лекарств, используемых в настоящее время в клинической практике. Синтезированные ацил-гидразоны, более конкретно соединения 02 и 07, демонстрируют значительную противолейкозную активность, что свидетельствует о потенциальном применении 02 и 07 в качестве прототипов лекарств или лекарств для лечения лейкозов, в частности острого лимфобластного лейкоза (ALL), опухолей и других пролиферативных заболеваний, таких как воспаление.
Определение механизма действия большинства активных соединений было выполнено с помощью ДНК-микрочипов и последующих испытаний, указанных для чипа, в дополнение к исследованиям селективности в лимфоцитах здорового человека.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1 иллюстрирует (А) обзор насыщения генного набора, обозначенного как «REACTOME POST CHAPERONIN TUBULIN FOLDING PATHWAY», показывающий насыщение в контрольных образцах HL-60 по сравнению с образцами, обработанными соединением 07 (р=0,002, FDR q-значение = 0,168), и (В) значения экспрессии 16 генов, которые представляют собой часть набора генов в (А), представленные синими квадратами (более низкая экспрессия) и красными квадратами (более высокая экспрессия).
Фигура 2 иллюстрирует, что Соединение 07 вызывает остановку клеточного цикла в клетках G2/M. Клетки Jurkat, обработанных в течение 18 часов 125 нМ раствором соединения 07 или ДМСО, подвергали анализу клеточного цикла после окрашивания йодидом пропидия и анализу проточной цитометрии.
Фигура 3 иллюстрирует результаты вестерн-блоттинга для различных белковых экстрактов, регулирующих клеточный цикл, полученных из клеток Jurkat, обработанных 125 нМ раствором соединения 07 (F8) или носителем (ДМСО).
Фигура 4 иллюстрирует, что соединение 07 представляет собой мощный инициатор апоптоза клеток Jurkat. В целом, эти результаты позволяют предположить, что соединение 07 ускоряет остановку клеточного цикла и апоптоз, в основном за счет Chk2 и Rb. Клетки Jurkat, обработанные в течение 18 часов 125 нМ раствором соединения 07 или ДМСО, дважды окрашивали аннексином V/йодидом пропидия и анализировали проточной цитометрией.
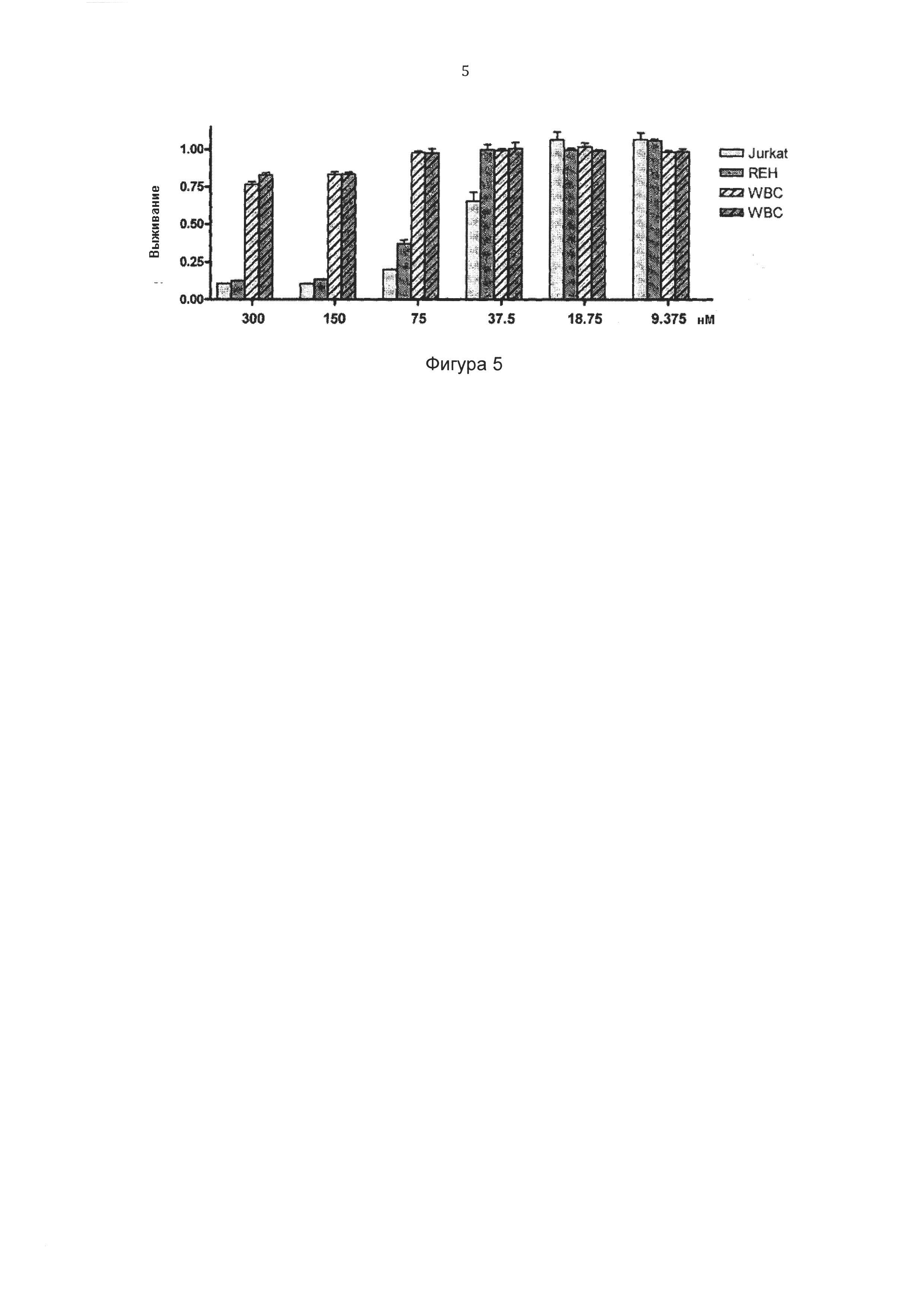
Фигура 5 иллюстрирует влияние соединения 07 на человеческие лимфоциты (WBC) и лейкозные клетки Jurkat и HEK через 48 часов. Пролиферацию нормальных лимфоцитов стимулировали фитогемагглютинином. Показан процент выживших клеток, обработанных соединением 07, по отношению к вышившим клеткам, обработанным носителем (ДМСО).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение включает получение и механизм действия синтетических ацил-гидразонов и их аналогов, а также родственных соединений, которые могут быть применимы при лечении лейкозов, в частности острого лимфобластного лейкоза (ALL), опухолей и других пролиферативных расстройств, таких как воспаление.
В соответствии с одним из аспектов настоящего изобретения описана структура соединения (I):

где кольцо В представляет собой:



Дополнительно описаны также синтетические аналоги оксадиазола, в соответствии со структурой III:

где Кольцо В представляет собой:

Новые ацил-гидразоны настоящего изобретения были получены по реакции конденсации между 3,4,5-триметоксифенил-гидразидом и различными альдегидами, с использованием этанола в качестве растворителя при дефлегмации, в соответствии с реакцией:
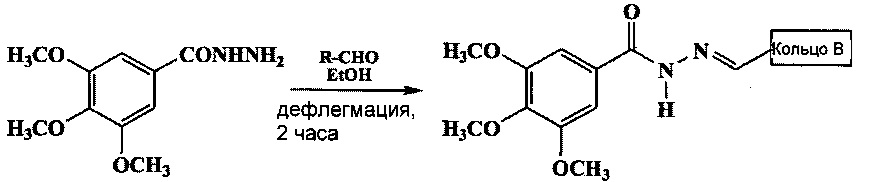
где Кольцо В представляет собой:

В Таблице 1 показаны выходы, полученные при синтезе, а также экспериментальные температуры плавления новых 3,4,5-триметоксифенил-гидразонов.

Структура соединения 02 была ранее опубликована в качестве промежуточного продукта реакции при получении оксадиазола (Mazzone, G.; Bonina, F.; Formica, F. Some aroylhydrazones of halobenzaldehydes and halo-substituted 2,5-diaryl-1,3,4-oxadiazoles. Farmaco, Edizione Scientifica, 1978, 33(12), 963-71), а соединение 07 ранее исследовали в качестве ингибитора МАО (моноамин-оксидазы) (Mazzone, G.; Arrigo Reina, R. 3,4,5-Trimethoxybenzoyl hydrazides and their anti-MAO [monoamine oxidase] activity. Bollettino delle Sedute della Accademia Gioenia di Scienze Naturali in Catania, 1971, 70(8), 689-702). Исследовательской группой авторов настоящего изобретения ранее была также опубликована химическая характеристика обоих соединений (02 и 07) в исследовании, в котором была выполнена оценка активности этих и других соединений в качестве ингибиторов крузаина из Trypanosoma cruzi, однако соединения 02 и 07 не демонстрируют ингибирующую активность в отношении этого белка (Borchhardt, Deise M.; Mascarello, Alessandra; Chiaradia, Louise Domeneghini; Nunes, Ricardo J.; Oliva, Glaucius; Yunes, Rosendo Α.; Andricopulo, Adriano D. Biochemical evaluation of a series of synthetic chalcone and hydrazide derivatives as novel inhibitors of cruzain from Trypanosoma cruzi. Journal of the Brazilian Chemical Society, 2010, 27(1), 142-150). Однако применение соединений 02 и 07 для лечения лейкоза ранее не было описано в данной области техники, и оно входит в рамки настоящего изобретения.
Дополнительные ацил-гидразоны (полученные для содействия обсуждению биологических испытаний) были синтезированы по реакции между гидразином и различными фенил-альдегидами, по такому же способу, как описан выше для получения гидразидов, в соответствии со следующей реакцией:

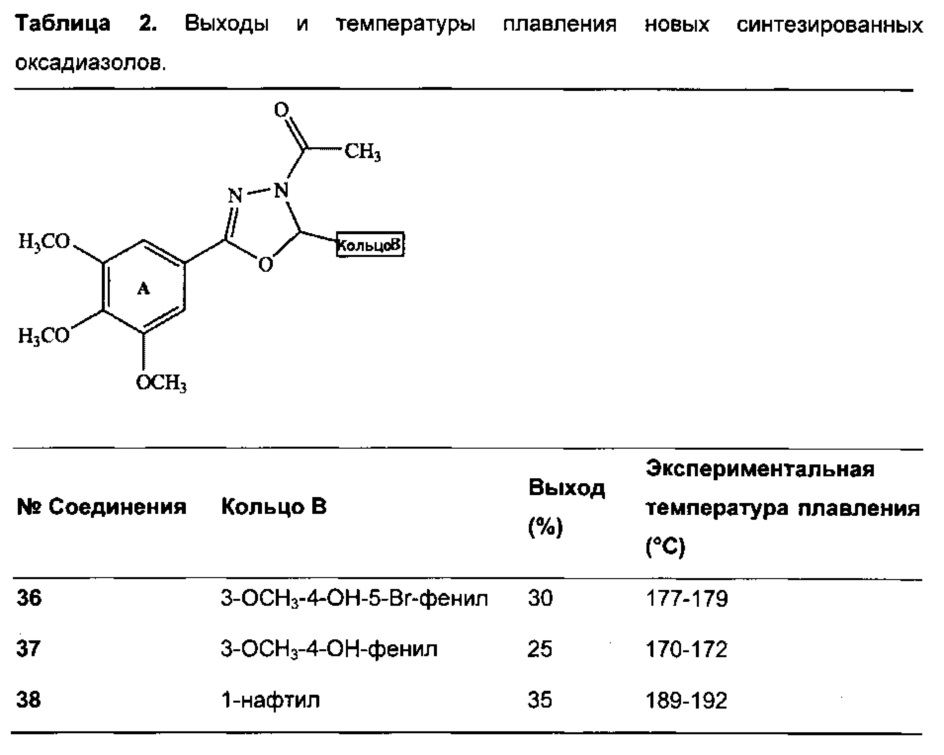
Были также получены новые синтетически оксадиазоловые аналоги 3,4,5-триметоксифенил-гидразонов, по их реакции с уксусным ангидридом, в соответствии со следующей реакцией:

В Таблице 2 показаны выходы, полученные при синтезе, а также экспериментальные температуры плавления оксадиазолов.
В настоящем изобретении описано также определение механизма действия синтезированных ацил-гидразонов и их аналогов, а также похожих соединений, содержащих оксадиазол. Настоящее изобретение относится также к применению всех таких соединений в качестве прототипа лекарств или лекарств для лечения лейкозов, в частности острого лимфобластного лейкоза (ALL), опухолей и других заболеваний, связанных с клеточной пролиферацией, таких как воспаление.
Ацил-гидразоны, описанные в настоящем документе, селективно действуют на лейкозные клетки с активностью в наномолярном диапазоне, по сравнению с их активностью в лимфоцитах здорового человека, как будет описано ниже в форме примера. В настоящем документ показана значимость биологических результатов, новых для исследуемых соединений.
В другом варианте реализации настоящего изобретения представлены фармацевтические составы, содержащие соединения, описанные выше, в комбинации со вспомогательными веществами, носителями и фармацевтически приемлемыми адъювантами.
При использовании в настоящем документе, применение термина «фармацевтически приемлемый» означает нетоксичное, инертное твердое, жидкое, полутвердое вспомогательное вещество, разбавитель, вспомогательную композицию любого типа или просто стерильную водную среду, такую как солевой раствор. Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, представляют собой сахара, такие как лактоза, глюкоза и сахароза, крахмалы, такие как кукурузный крахмал и картофельный крахмал, целлюлоза и ее производные, такие как натрия карбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы, циклодекстрин, масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль, многоатомные спирты, такие как глицерин, сорбит, маннит и полиэтилен; сложные эфиры, такие как этиллаурат, этилолеат; агар; буферные агенты, такие как гидроксид алюминия и гидроксид магния; альгиновая кислота; апирогенная вода; изотонический солевой раствор, раствор Рингера; этиловый спирт и фосфатные буферные растворы, а также другие нетоксичные совместимые вещества, используемые в фармацевтических составах.
В частности, фармацевтические или ветеринарные составы, содержащие соединения настоящего изобретения, могут быть предназначены для введения любым типом введения, особенно парентеральным введением.
В частности, композиции настоящего изобретения могут содержать любой тип вспомогательного вещества, используемого в производстве лекарств в любой из представленных выше фармацевтических форм, такой как абсорбенты, разбавители, связующие вещества, средства для улучшения распадаемости таблеток, смазывающие вещества, глиданты, пластификаторы, агенты для покрытий, агенты, образующие матрицу для контролируемого высвобождения, растворители и со-растворители, увлажняющие агенты, эмульгаторы, поверхностно-активные вещества, загустители, агенты тоничности, смачивающие вещества, отмучивающие агенты, агенты для вытеснения воздуха, подщелачивающие или подкисляющие агенты, консерванты, антиоксиданты, бактерициды, бактериостаты, хелатирующие агенты, красители и подсластители.
Абсорбенты, пригодные для композиций настоящего изобретения, могут представлять собой любое вещество, добавляемое для абсорбирования воды, присутствующей в экстрактах, или для осаждения некоторых летучих соединений, таких как эссенции. Не ограничивающие примеры таких вспомогательных веществ представляют собой фосфат кальция, каолин, карбонат магния, бентонит и тальк.
Композиции настоящего изобретения могут содержать в качестве растворителя любой инертный материал, добавляемый к рецептуре для обеспечения возможности получения таблеток или наполненных капсул с соответствующим объемом и для обеспечения свойств текучести и прессуемости, необходимых для производства, например, но не ограничиваясь этим, лактозу, трехосновной фосфат кальция, крахмал, маннит, сульфат кальция, микрокристаллическую целлюлозу (Microcel, Avicel), двухосновной фосфат кальция (Encompress, Ditab), оксид магния, карбонат магния, тальк, каолин, карбонат кальция, декстрозу, фруктозу, лактозу, аспартам, целлюлозу, мальтозу, маннит, гуаровую камедь, сорбит, крахмал и сахарозу.
Подходящие связывающие вещества для композиций настоящего изобретения могут представлять собой агенты, используемые для ускорения адгезии частиц при гранулировании и прессовании твердых лекарственных форм, и могут также использоваться в композициях настоящего изобретения, например, карбопол, повидон, ксантановая камедь, гуммиарабик, альгиновая кислота, прессуемый сахар, КМЦ-Na, этилцеллюлоза, желатин, метилцеллюлоза, повидон (ПВП), крахмал, прежелатинизированный крахмал и жидкая глюкоза в растворе, дисперсии или порошке.
Дезагреганты или средства для улучшения распадаемости таблеток, пригодные для композиций настоящего изобретения, могут представлять собой любой компонент, используемый для ускорения распадаемости и/или растворения фармацевтической формы в биологических жидкостях, например, альгиновую кислоту, крахмал, альгинат натрия, КМЦ-Na, микрокристаллическую целлюлозу, кроскармеллозу натрия (Ac-Di-sol), натрия крахмалгликолят (Explotab) и кросповидон (Kollidon CL).
Смазывающие вещества, пригодные для композиций настоящего изобретения могут представлять собой, например, стеарат магния, стеарат кальция, стеариновую кислоту, тальк и гидрогенированное растительное масло (например, Lubritab).
Глиданты, пригодные для композиций настоящего изобретения, могут представлять собой, например, коллоидный диоксид кремния (Aerosil 200) и тальк.
Пластификаторы, пригодные для композиций настоящего изобретения, могут быть использованы с полимерами для модификации их температуры фазового перехода и для облегчения коалесценции образованных пленок на гранулах, таблетках или пеллетах. Не ограничивающие примеры таких агентов представляют собой глицерин, триэтилцитрат, дибутилфталат, силикон и ППГ.
Агенты для покрытий, используемые для покрытия композиций настоящего изобретения в форме таблеток, гранул, капсул или пеллет, могут представлять собой, например, ацетат-фталат целлюлозы, этилцеллюлозу, геллановую камедь, мальтодекстрин, метакрилаты, метилцеллюлозу, микрокристаллическую целлюлозу, шеллак, каррагенановую камедь, воски, шеллаки, желатин, производные целлюлозы (метил- или этилцеллюлозу, ацетат-фталат целлюлозы, гидроксипропилметилцеллюлозу, ацетат целлюлозы), сополимеры акриловых и метакриловых эфиров (Eudragit типа L100, RS 30D, RS РМ, S100, среди прочих), поливиниловый спирт (ПВС) и поливинилацетат.
Агенты для образования матрицы для контролируемого высвобождения, которые могут быть использованы в композициях настоящего изобретения для получения пролонгированного и/или контролируемого высвобождения активного вещества, могут представлять собой ГПМЦ, КМЦ-Na, ксантановую камедь, Carbopol, различные типы Eudragit, агар-агар, полиоксиэтиленовые производные (ПОЭ), циклодекстриновые наносферы и наночастицы любой природы.
В композициях настоящего изобретения также могут быть использованы растворители и со-растворители, такие как этанол, кукурузное масло, хлопковое масло, глицерин, изопропиловый спирт, минеральное масло, олеиновая кислота, арахисовое масло, очищенная вода, вода для инъекций, среди прочих.
Увлажняющие агенты, пригодные для композиций настоящего изобретения, могут представлять собой любое вещество, добавляемое для снижения поверхностного натяжения на поверхности раздела жидкости/твердого вещества, например, лаурилсульфат натрия (SLS), докузат натрия и полисорбаты 20, 60, 80 (Tween 20, 60, 80).
Эмульгирующие агенты, пригодные для композиций настоящего изобретения, могут представлять собой, например, глицерил-моностеарат, цетиловый спирт и желатин, а также вспомогательные вещества, такие как КМЦ-Na, МЦ, альгинат и пектин.
Для композиций настоящего изобретения подходят также поверхностно-активные вещества, такие как, например, хлорид бензалкония, ноноксинол 10, октоксинол 9, полисорбат 80 и лаурилсульфат натрия.
Загустители, пригодные для композиций настоящего изобретения, могут представлять собой любое вещество, используемое для увеличения густоты мазей, например, цетиловый спирт, белый воск, желтый воск, стеариловый спирт, парафин, микрокристаллическая целлюлоза и воск цетиловых эфиров.
Агенты тоничности, пригодные для композиций настоящего изобретения, могут представлять собой любое вещество, используемое для получения растворов, имеющих такие же осмотические характеристики, как и биологические жидкости, для их введения окулярным, назальным, парантеральным путем, такие как NaCl (0,9%), маннит (5,07%) и декстроза (5,51%).
Увлажнители, пригодные для композиций настоящего изобретения, могут представлять собой глицерин, пропиленгликоль и сорбит.
Отмучивающие агенты, пригодные для композиций настоящего изобретения, могут представлять собой любую жидкость, используемую в качестве агента для облегчения процесса измельчения частиц лекарства при производстве эмульсий, масляных основ, среди прочего, например, минеральное масло (жидкий петролатум), глицерин, технологический пропиленгликоль, ПЭГ 400, хлопковое масло, касторовое масло и полисорбат 80 (Tween® 80).
Агенты для вытеснения воздуха, пригодные для композиций настоящего изобретения, могут быть использованы для вытеснения воздуха из герметично закрытых емкостей или из жидких композиций для увеличения их стабильности, например, азот (N2) и диоксид углерода (CO2).
Подщелачивающие или подкисляющие агенты, такие как лимонная кислота, аммиак, уксусная кислота, карбонат аммония, фумаровая кислота, диэтаноламин, хлороводородная кислота (HCl), моноэтаноламин, винная кислота, гидроксид калия (КОН), борная кислота, гидроксид натрия (NaOH), бикарбонат натрия, борат натрия и триэтаноламин, - также пригодны для композиций настоящего изобретения.
Консерванты, которые могут быть использованы в композициях настоящего изобретения, представляют собой, например, противогрибковые агенты, такие как бензойная кислота, бензоат натрия, бутилпарабен натрия, метилпарабен (Nipagin), пропилпарабен (Nipasol), этилпарабен, пропионат натрия и антибактериальные средства, такие как хлорид бензалкония, хлорид бензетония, бензиловый спирт, цетилпиридиний, хлорбутанол и хлорид фенола.
Антиоксиданты, пригодные для композиций настоящего изобретения, могут быть выбраны из группы, включающей бутилированный гидроксианизол (БГА), бутилированный гидрокситолуол (БГТ), β-токоферол, аскорбиновую кислоту, аскорбил-пальмитат, метабисульфит натрия, этилендиаминтетрауксусную кислоту (ЭДТК), лимонную кислоту, цистеин, глутатион, витамин С, метабисульфит натрия, цистеин и тиосульфат натрия.
Композиции настоящего изобретения могут дополнительно содержать в качестве буферных агентов цитратный буфер, фосфатный буфер и боратный буфер. В качестве красителей, вкусовых добавок и ароматизаторов могут быть использованы, например, ваниль, ментол, коричное масло, анисовое масло и какао. Подсластители могут включать, например, аспартам, декстрозу (глюкозу), маннит, сорбит, сахарин, цикламат натрия, сахар, ацесульфам калия, стевиозид и сукралозу.
Композиции настоящего изобретения могут дополнительно содержать вспомогательные вещества, такие как бактерициды, бактериостаты, антиоксиданты, консерванты, буферы, стабилизаторы, регуляторы pH, регуляторы осмолярности, противопенные агенты и поверхностно-активные вещества, а также остатки агентов инактивации или антигенов фракционирования, компонентов питательной среды и растворителей, обычно используемых в производстве лекарственных средств. Примеры этих типов компонентов представлены в книге «The Handbook of Pharmaceutical Excipients» (RAYMOND С. Rowe, Publisher, The Pharmaceutical Press). Возможны различные способы введения композиций, описанных в настоящем документе. Конкретный выбранный способ зависит от конкретного выбранного активного ингредиента, дозы, необходимой для терапевтической эффективности, и пациента, которому вводят указанную композицию.
В другом варианте реализации настоящего изобретения описано применение соединений и композиций, описанных в настоящем документе, для лечения заболеваний, связанных с клеточной пролиферацией, таких как острый лимфобластный лейкоз (ALL), опухоли и воспаление.
В другом варианте реализации настоящего изобретения представлены способы лечения заболеваний, связанных с клеточной пролиферацией, таких как острый лимфобластный лейкоз (ALL), опухоли и воспаление, с помощью соединений и композиций, описанных в настоящем документе, для лечения заболеваний, связанных с клеточной пролиферацией, таких как острый лимфобластный лейкоз (ALL), опухоли и воспаление.
ПРИМЕРЫ
Далее настоящее изобретение будет описано с помощью иллюстративных примеров.
Пример 1. Общий способ получения 3,4,5-триметоксифенил-гидразонов 01-29
Для синтеза 3,4,5-триметоксифенил-гидразонов 01-29 использовали методику, описанную ученым Troeberg и коллегами (Troeberg, L; Chen, X.; Flaherty, T.M.; Morty, R.Ε.; Cheng, M.; Hua, H.; Springer, С; McKerrow, J.H.; Kenyon, G.L.; Lonsdale-Eccles, J.D.; Coetzer, T.H.T.; Cohen, F.E. Chalcone, acyl hydrazide, and related amides kill cultured Trypanosoma brucei brucei. Molecular Medicine, 2000, 6, 660-669). В 100 мл / 1-горлую реакционную колбу поместили 3,4,5-триметоксифенил-гидразид (2 ммоль), полученный так, как описано в Примере 2, в органическом растворителе: ацетоне, этилацетате, этиловом эфире, этаноле, метаноле (20 мл) и соответствующий альдегид (2 ммоль). Смесь нагревали с дефлегматором в течение от 1 до 10 часов. Затем раствор отфильтровали, а твердое вещество перекристаллизовали в органическом растворителе.
Пример 2. Общий способ получения 3,4,5-триметоксифенил-гидразида, используемого для получения 3,4,5-триметоксифенил-гидразонов 01-29
Для синтеза 3,4,5-триметоксифенил-гидразида, используемого для получения ацил-гидразонов 01-29, использовали уже описанную методику (Chida, A.S.; Vani, P.V.S.N.; Chandrasekharam, M.; Srinivasan, R.; Singh, Α.Κ. Synthesis of 2,3-dimethoxy-5-methyl-1,4-benzoquinone: a key fragment in coenzyme-Q series. Synthetic communications, 31, 657-660, 2001), которую выполнили за две стадии:
Получение сложного эфира: В 1000 мл / 1-горлую реакционную колбу поместили галловую кислоту (50 г, 0,294 моль) с диметилсульфатом (178,1 г, 1,413 моль), безводным карбонатом калия (175,5 г, 1,293 моль) и TBAI (тетрабутиламмония йодид) (1 г) в органическом растворителе, которым может быть этанол, этиловый эфир, этилацетат, ацетон, петролейный эфир (375 мл) и нагревали с дефлегматором в течение от 1 до 12 часов. Полученное твердое вещество отфильтровали и промыли тем же органическим растворителем (3×50 мл). Сложный эфир получили в форме аморфного твердого вещества кремового цвета с выходом 78%; т.пл.: 84°C (лит. т.пл. 82-83°C). ЯМР1Н (CDCl3): 1.60 (s, 3Н, СН3), 3.92 (s, 9Н, ОСН3), 7.33 (s, 2Н, Ar).
Получение гидразида: В 1000 мл / 1-горлую реакционную колбу поместили сложный эфир, полученный на первой стадии (48 г, 0,212 моль) с 99% раствором гидразин-гидрата (N2H4⋅H2O) (77,6 г, 1,54 моль) и органическим растворителем, которым может быть этанол, этилацетат, дихлорметан, ацетон, метанол (200 мл). Смесь нагревали с дефлегматором в течение от 1 до 5 часов и выдерживали в течение ночи только при механическом перемешивании при температуре от 0 до 50°C. Полученное твердое вещество отфильтровали и перекристаллизовали в метаноле с получением 3,4,5-триметоксифенил-гидразида в виде белых кристаллов с выходом 85%; т.пл.: 162-163°C (лит. т.пл. 168°C). ЯМР1Н (CDCl3): 3.80 (s, 3Н, ОСН3), 3.90 (s, 6Н, ОСН3), 7.18 (s, 2Н, Ar), 9.55 (NH).
Пример 3. Общий способ получения фенил-гидразонов 30-35
Для синтеза фенил-гидразонов 30-35 использовали методику, описанную ученым Troeberg и коллегами (Troeberg, L.; Chen, X.; Flaherty, T.M.; Morty, R.E.; Cheng, M.; Hua, H.; Springer, С; McKerrow, J.H.; Kenyon, G.L.; Lonsdale-Eccles, J.D.; Coetzer, T.H. T.; Cohen, F.E. Chalcone, acyl hydrazide, and related amides kill cultured Trypanosoma brucei brucei. Molecular Medicine, 2000, 6, 660-669), таким же образом, как описано для получения 3,4,5-триметоксифенил-гидразонов.
Пример 4. Общий способ получения оксадиазолов 36-38
Для синтеза оксадиазолов 36-38 использовали методику, описанную ученым Jin и коллегами (Jin, L.; Chen, J.; Song, В.; Chen, Ζ.; Yang, S.; Li, Q.; Hu, D.; Xu, R. Bioorg Med Chem, 2006, 16, 5036-5040). В 100 мл / 1-горлой реакционной колбе смешали соответствующий 3,4,5-триметоксифенил-гидразон (1 ммоль) и уксусный ангидрид (10 мл). Смесь нагревали с дефлегматором в течение от 1 до 10 часов, а затем охладили добавлением молотого льда и оставили на ночь при температуре от 0 до 60°C для осаждения продукта. Полученное твердое вещество отфильтровали, промыли водой и перекристаллизовали с органическим растворителем/водой.
ИНФРАКРАСНЫЕ (ИК) СПЕКТРАЛЬНЫЕ ДАННЫЕ И ДАННЫЕ ЯДЕРНОГО МАГНИТНОГО РЕЗОНАНСА (ЯМР)1Н и13С ДЛЯ НОВЫХ СОЕДИНЕНИЙ
*δ м.д. относительно ТМС, мультиплетность (J в Гц). Растворитель CDCl3.
05 -1Н ЯМР (ДМСО-d6) δ 3.73 (s, 3Н,п-ОСН3), 3.86 (s, 6Н, м-ОСН3), 3.89 (s, 3Н, м-ОСН3), 7.22 (s, 2Н, Н2, Н6), 7.34 (s, 1Н, Η6'), 7.60 (s, 1Н, Η2'), 8.31 (s, 1H, HC=N), 10.08 (1H, OH), 11.66 (s, 1H, NH).13C ЯМР (ДМСО-d6) δ 56.78 (м-ОСН3), 60.81 (п-OCH3), 85.17 (C3'), 105.84 (C2, C6), 109.72 (C6'), 128.28 (C1), 129.31 (С1'), 130.75 (C2'), 141.03 (C4), 147.35 (C=N), 147.97 (C5'), 149.00 (C4'), 153.36 (C3, C5), 163.16 (C=O). ИК λmax/см-1 3382 (N-H), 1636, 1228 (C=O), 1565 (C=N), 1290, 1045 (C-O), 2999, 2839, 1585, 1490, 1334, 1137, 997 (Ar) (KBr).

17 -1Н ЯМР (ДМСО-d6) δ 3.74 (s, 3Н, п-ОСН3), 3.88 (s, 6Н, м-ОСН3), 7.23 (s, 2Н, Н2, Н6), 7.53 (s, 1Н, Н2'), 7.66 (m, 1Н, Η4'), 8.02 (s, 1Н, ΝΗ5'), 8.43 (s, 1H, HC=N), 11.37 (s, 1H, NH).13C ЯМР (ДМСО-d6) δ 56.76 (м-OCH3), 60.81 (п-ОСН3), 105.71 (C2, C6), 129.51 (C1), 131.94 (С1'), 132.16 (C2'), 135.37 (C4'), 145.45 (C=N), 153.35 (C3, C5), 162.29 (C=O). ИК λmax/см-1 3212 (N-H), 1623, 1234 (C=O), 1580 (C=N), 1280, 1054 (C-O), 2994, 2941, 2838, 1503, 1456, 1411, 1344, 1125, 1006, 844 (Ar) (KBr).

21 -1H ЯМР (ДМСО-d6) δ 3.71 (s, 3Н, п-ОСН3), 3.79 (s, 6H, o-OCH3), 3.85 (s, 6H, м-OCH3), 6.72 (d, J=8.0 Гц, 2H, Η3', Η5'), 7.23 (s, 2H, H2, H6), 7.34 (t, J=8.0 Гц, 1H, Η4'), 8.60 (s, 1H, HC=N), 11.52 (s, 1H, NH).13C ЯМР (ДМСО-d6) δ 56.72 (м-ОСН3), 56.78 (o-OCH3), 60.76 (п-OCH3), 105.08 (C3', C5'), 105.76 (C2, C6), 111.75 (С1'), 129.37 (C1), 131.87 (C4'), 140.88 (C4), 143.92 (C=N), 153.31 (C3, C5), 159.38 (C2', C6'), 162.81 (C=O). ИК λmax/см-1 3186 (N-H), 1644, 1240 (C=O), 1586 (C=N), 1258, 1068 (C-O), 3002, 2928, 2838, 1502, 1473, 1417, 1378, 1342, 1121, 1007, 783 (Ar) (KBr).
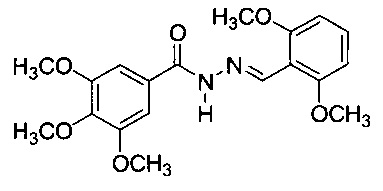
26 -1H ЯМР (ДМСО-d6) δ 3.42 (s, 3Н, п-ОСН3), 3.85 (s, 6H, м-ОСН3), 6.89 (d, J=8.6 Гц, 1H, Η5'), 7.25 (s, 2H, H2, H6), 7.42 (d, J=8.6 Гц, 1H, Η6'), 7.78 (s, 1H, Η3'), 8.61 (s, 1H, HC=N), 11.26 (s, 1H, NH), 12.01 (1H, ОН). ИК λmax/см-1 3220 (N-H), 1653, 1228 (C=O), 1588 (C=N), 1275, 1099 (C-O), 3004, 2941, 2834, 1550, 1503, 1479, 1463, 1416, 1352, 1335, 1189, 1011, 992, 951, 839, 760 (Ar) (KBr).
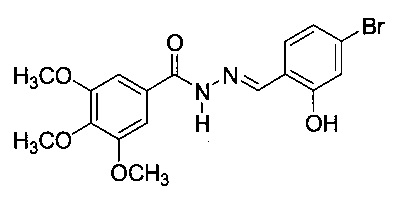
29 -1Н ЯМР (ДМСО-d6) δ 3.72 (s, 3Н, п-ОСН3), 3.85 (s, 6Н, м-ОСН3), 7.22 (s, 2Н, Н2, Н6), 7.82 (d, J=8.6 Гц, 1Н, Н5'), 8.02 (d, J=8.6 Гц, 1Н, Н6'), 8.15 (s, 1Н, Н2'), 8.51 (s, 1Н, HC=N), 11.96 (s, 1Н, NH).13С ЯМР (ДМСО-d6) δ 56.65 (м-ОСН3), 60.73 (п-ОСН3), 105.96 (С2, С6), 126.29 (С2'), 127.98 (С1'), 128.88 (С1), 132.31 (CF3), 132.91 (С4'), 133.01 (С5'), 134.82 (С6'), 141.27 (С4), 145.61 (C=N), 153.40 (С3, С5), 163.50 (С=O). ИК λmax/см-1 3182 (N-H), 1655, 1242 (С=O), 1587 (C=N), 1269, 1039 (С-О), 3008, 2938, 2838, 1506, 1480, 1417, 1336, 1316, 1173, 1121, 1006, 958, 666 (Ar) (KBr).

36 -1Н ЯМР (ДМСО-d6) δ 2.36 (s, 3Н, СН3), 3.85 (s, 3Н, п-ОСН3), 3.91 (s, 3Н, м-ОСН3), 3.92 (s, 6Н, м-ОСН3), 6.00 (s, 1Н, ОН), 6.99 (s, 1Н, Н2'), 7.06 (s, 1Н, Н6'), 7.11 (s, 2Н, Н2, Н6), 7.26 (s, 1Н, HC-N).13С ЯМР (ДМСО-d6) δ 21.75 (СН3), 56.56 (м-ОСН3), 61.25 (п-ОСН3), 91.52 (C-N), 104.44 (С2, С6), 117.93 (С5'), 119.37 (С2'), 122.52 (С6'), 136.02 (С1', С1), 139.24 (С4'), 141.49 (С4), 152.90 (С3'), 153.64 (С3, С5), 155.84 (C=N), 168.32 (С=O). ИК λmax/см-1 1766, 1238 (С=O), 1667, 1582 (C=N), 1254, 1047 (С-О), 1177 (С-N), 3445 (ОН), 1130, 621 (С-Br), 3004, 2941, 2838, 1466, 1416, 1366, 1306, 1190, 998, 858 (Ar (KBr).

37 -1Н ЯМР (ДМСО-d6) δ 2.35 (s, 3Н, СН3), 3.82 (s, 3Н, п-ОСН3), 3.90 (s, 3Н, м-ОСН3), 3.92 (s, 6Н, м-ОСН3), 6.97 (s, 1Н, Н2'), 7.06 (m, 1Н, Н5'), 7.10 (s, 2Н, Н2, Н6), 7.25 (s, 1Н, HC-N), 7.44 (m, 1Н, Н6'); сигнал, соответствующий группе ОН, не наблюдали.13С ЯМР (ДМСО-d6) δ 21.54 (СН3), 56.27 (м-ОСН3), 56.33 (м-ОСН3), 61.02 (п-ОСН3), 91.14 (C-N), 104.22 (C2, С6), 109.77 (С2'), 119.16 (С5'), 128.09 (С6'), 136.402 (С1', С1), 141.24 (С4'), 141.96 (С4), 151.78 (С3'), 153.42 (С3, С5), 155.60 (C=N), 168.10 (С=O). ИК λmax/см-1 1767, 1243 (С=O), 1665, 1581 (C=N), 1250, 1043 (С-О), 1177 (C-N), 3445 (ОН), 1129, 644 (С-Br), 2967, 2945, 2838, 1507, 1466, 1417, 1365, 1036, 1287, 1197, 1083, 997, 958, 861, 699 (Ar) (KBr).

38 -1Н ЯМР (ДМСО-d6) δ 2.47 (s, 3Н, СН3), 3.87 (s, 9Н, ОСН3), 7.08 (s, 2Н, Н2, Н6), 7.26 (s, 1Н, HC-N), 7.26 (m, 1Н, Н2'), 7.48 (t, J=8.0 Гц, 1Н, Н3'), 7.55 (t, J=8.0 Гц, 1Н, Η7', Н8'), 7.62 (t, J=8.0 Гц, 1Н, Н7'), 7.76 (m, 1Н, Н4'), 7.92 (d, J=8.0 Гц, 1Н, Н6'), 8.22 (d, J=8.0 Гц, 1Н, Н9').13С ЯМР (ДМСО-d6) δ 21.57 (СН3), 56.28 (м-ОСН3), 60.98 (п-ОСН3), 91.17 (C-N), 104.27 (С2, С6), 119.61 (С1), 123.04 (С2'), 125.07 (С9'), 125.20 (С3'), 126.05 (С7'), 126.95 (С8'), 128.95 (С4'), 130.51 (С6'), 130.61 (С10'), 130.79 (С5'), 134.04 (С1'), 141.11 (С4), 153.29 (С3, С5), 155.83 (C=N), 168.26 (С=O). ИК λmax/см-1 1731, 1243 (С=O), 1669, 1587 (C=N), 1254, 1039 (С-О), 1124 (C-N), 2997, 2941, 2827, 1509, 1465, 1416, 1369, 1332, 1191, 1006, 980, 847, 784, 699 (Ar) (KBr).

Пример 5. Влияние соединений на клеточные линии острого лимфобластного лейкоза (ALL)
a. Разбавление и хранение соединений: Все соединения повторно суспендировали в ДМСО с концентрацией исходного раствора 20 мМ и хранили при -20°C. Для испытания цитотоксичности выполнили разбавление исходных растворов в культуральной среде (RPMI-1640 плюс 10% фетальной бычьей сыворотки, 100 МЕ/мл пенициллина и 100 пг/мл стрептомицина), непосредственно перед добавлением в клетки.
b. Анализы in vitro чувствительности/устойчивости клеток к соединениям по способу МТТ: Клеточные линии REH и Jurkat хранили в среде RPMI-1640 с 10% FBS (фетальная бычья сыворотка), 100 МЕ/мл пенициллина, 100 пг/мл стрептомицина и инкубировали при 37°C и 5% CO2. Анализы цитотоксичности выполнили в соответствии со способом, описанным в литературе (Pieters, R.; et al. In vitro drug sensitivity of cells from children with leukemia using the MTT assay with improved culture conditions. Blood, 1990, 76, 2327-2336; Pieters, R.; et al. Relation of cellular drug resistance to long-term clinical outcome in childhood acute lymphoblastic leukaemia. Lancet, 1991, 338, 399-403 e Kaspers, G. J.; et al. In vitro cellular drug resistance and prognosis in newly diagnosed childhood acute lymphoblastic leukemia. Blood, 1997, 90, 2723). Клетки повторно суспендировали при концентрации 3,75 105 клеток/мл в культуральной среде так, как описано. Восемьдесят микролитров этой суспензии высеяли в планшеты с 96 крулодонными лунками, содержащими 20 микролитров различных концентраций соединения или только носителя. Каждую обработку выполнили в трех экземплярах. Через 48 часов инкубации при 37°C и 5% CO2 добавили 20 мкл раствора МТТ (5 мг/мл 1×PBS), затем выполнили последующую инкубацию в течение 4 часов и 30 минут при 37°C и 5% CO2. В течение этих 4 часов и 30 минут МТТ (желтоватый) метаболизировался до формазановой соли (голубоватого цвета) живыми клетками. После этого добавили 100 мкл додецилсульфата натрия (SDS) 10% + 0,1 M HCl, чтобы растворить кристаллы формазана. После инкубации в течение ночи выполнили считывание поглощения при 570 нм. Рассчитали процент клеток, выживших после такой обработки, относительно количества клеток, вышивших в среде без добавления рассматриваемых соединений («отрицательный контроль»).
с. Определение IC50: IC50 определяют как концентрацию соединения, при которой достигается 50% от максимального ингибирования. После считывания поглощения построили кривые выживания и получили значения IC50 с помощью программы GraphPad Prism.
РЕЗУЛЬТАТЫ: ДЕЙСТВИЕ АЦИЛ-ГИДРАЗОНОВ И ОКСАДИАЗОЛОВ НА ЛИНИИ ЛЕЙКОЗНЫХ В- И Т-КЛЕТОК (HEK И JURKAT СООТВЕТСТВЕННО)
Цитотоксический эффект синтезированных соединений на лейкозные клетки человека Jurkat и HEK исследовали с помощью анализа выживаемости клеток (МТТ) в соответствии со способами, описанными учеными Pieters et al (Pieters, R.; et al. In vitro drug sensitivity of cells from children with leukemia using the MTT assay with improved culture conditions. Blood, 1990, 76, 2327-2336; и Pieters, R.; et al. Relation of cellular drug resistance to long-term clinical outcome in childhood acute lymphoblastic leukaemia. Lancet, 1991, 338, 399-403), и Kaspers et al (Kaspers, G. J.; et al. In vitro cellular drug resistance and prognosis in newly diagnosed childhood acute lymphoblastic leukemia, Blood, 1997 90, 2723). Результаты представлены в Таблице 3.


Для анализа влияния метокси-групп в кольце А ацил-гидразонов 01-29 авторы изобретения испытали серию комплементарных ацил-гидразонов (30-35). Ни одно из соединений в этой серии не показало активности против клеток в выполненном скрининге, подтверждая таким образом необходимость триметоксилированного кольца для противолейкозной активности.
В третьей попытке, в поиске соединений, коррелирующих с активными соединениями, были испытаны циклические производные 3,4,5-триметоксифенил-гидразонов, 1,3,4-оксадиазолы (36-38). Как и в случае комплементарных ацил-гидразонов (30-35), ни один из 1,3,4-оксадиазолов (36-38) не продемонстрировал активность. Объяснение этих результатов может быть жесткость колец, усиленная циклизацией, которая предотвращает взаимодействие молекулы с мишенью.
Так, соединения 02, 07, 09, 10, 11 и 16 были выбраны для определения их IC50; значения представлены в Таблице 4.
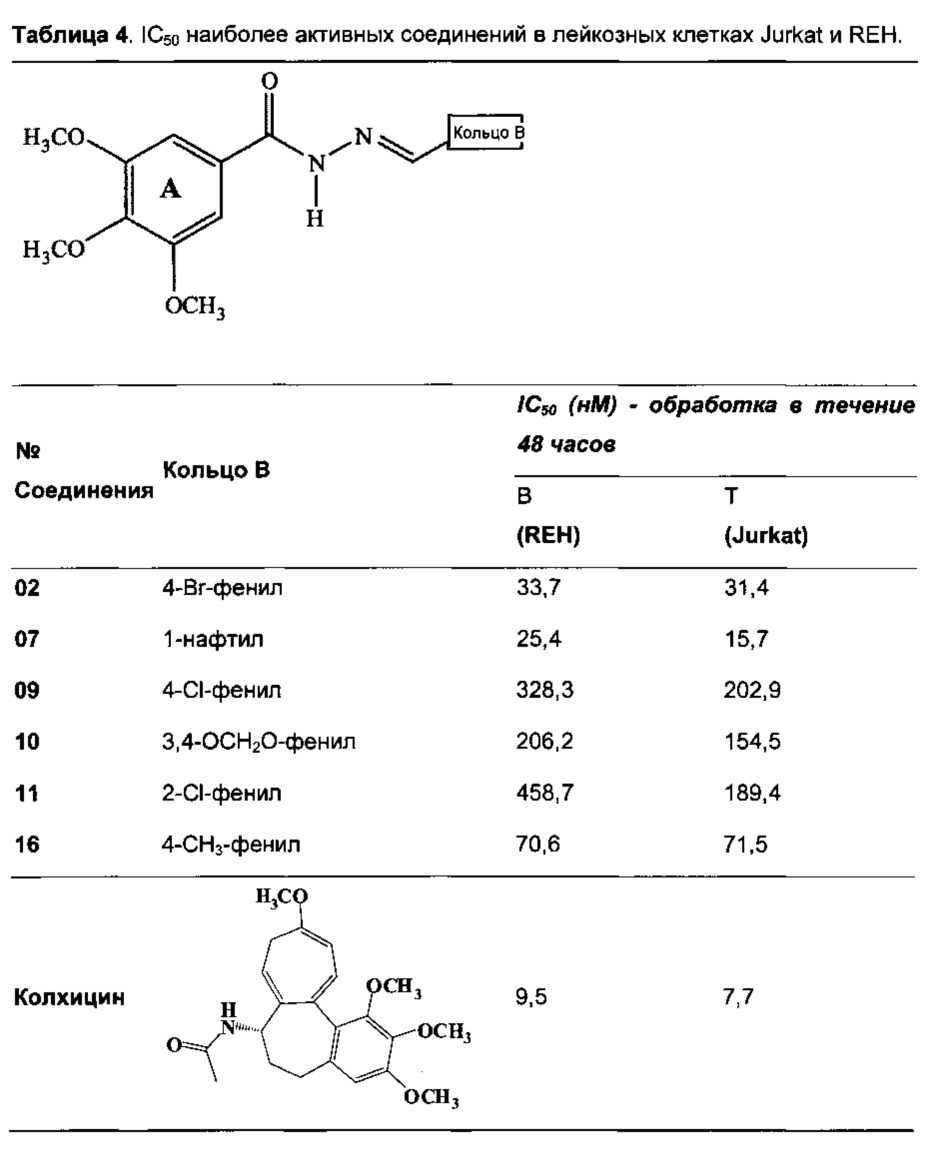
Ацил-гидразоны 02 и 07 показали превосходные результаты со значениями IC50 33,7 нМ и 25,4 нМ для лейкозного штамма REH и 31,4 нМ и 15,7 нМ для Jurkat.
Пример 6. Эксперименты для определения механизма действия соединений с помощью ДНК-микрочипов:
Перед экспериментами клетки инкубировали в течение 12 часов в свежей среде. Два миллиона клеток из лейкозной клеточной линии HL60, в трех экземплярах, обрабатывали дозой 125 нМ соединения 07 или носителем диметилсульфоксидом (ДМСО) в течение 6 часов, в среде DMEM с добавлением 10% фетальной бычьей сыворотки. По окончании этого периода клетки выделили быстрым центрифугированием и лизировали в растворе гуанидина из набора для выделения РНК RNAspin Mini (GE).
a. Очистка РНК и получение биотинилированного образца: Общую РНК экстрагировали из клеток с помощью набора для выделения РНК RNAspin Mini (GE) по инструкциям производителя. В целом использовали 100 нг РНК для приготовления биотинилированных комплементарных образцов РНК (Bio-кРНК) с помощью синтеза кДНК, с последующей амплификацией посредством in vitro транскрипции, используя набор для синтеза и амплификации кДНК GeneChip WT (Affymetrix) по рекомендациям производителя.
b. Олигонуклеотидные микрочипы и матрицы гибридизации: Образец кДНК каждой реплики гибридизовали в олигонуклеотидном микрочипе матрицы человеческого генома GeneChip Human Gene 1.0 ST (Affymetrix). Гибридизацию и последующие промывания, а также визуализацию микрочипов выполнили по рекомендациям производителя.
c. Анализ данных: результаты гибридизации на микрочипе считывали с помощью сканера генных чипов Affymetrix 3000-7G. Данные анализировали на платформе Bioconductor. Для получения значений генной экспрессии авторы изобретения использовали алгоритм iterPLIER+16 на генном уровне с помощью программы Affymetrix Expression Console. Гены, дифференциально экспрессированные в ответ на соединение 07, получили регрессионным анализом, используя пакет LIMMA и критерий кратности изменения (FC)>1,5, и p<0,05. Указанный перечень дифференциально экспрессированных генов анализировали с помощью СМар (http://www.broad.mit.edu/смар/) для определения возможных механизмов действия, родственных с действием известных соединений (Lamb, J., Crawford E.D. The Connectivity Map: Using Gene-Expression Signatures to Connect Small Molecules, Genes and Disease Science 2006, 313, 1929-1935).
Для определения того, совместно ли регулируются данные компоненты генного набора (набор генов) в экспериментальных данных на микрочипе, использовали анализ экспрессии набора генов (GSEA; http://www.broadinstitute.org/gsea/). Алгоритм GSEA создает перечень генов, представленных на микрочипах, расположенных с дифференциальной экспрессией между двумя экспериментальными группами (обработанной соединением 07 и контрольной). В этом случае гены, которые подавляются соединением 07, расположены в верхней части перечня, тогда как гены, которые индуцируются, расположены внизу. Затем алгоритм находит в этом перечне гены, которые образуют определенный генный пул. Если эти гены значительно и чрезмерно представлены в верхней части указанного списка, то можно сказать, что весь ген репрессируется соединением 07. В противоположной ситуации весь ген индуцируется при обработке лекарством. Генные наборы, анализированные с помощью GSEA, приобрели из нескольких общедоступных баз данных (BioCarta, Signaling Pathway Database, Signaling Gateway, Signal Transduction Knowledge Environment, Human Protein Reference Database, GenMAPP, KEGG, Gene Ontology, Sigma-Aldrich Pathways, Gene Arrays Bioscience Corp., Human Cancer Genome Anatomy Consortium и NetAffx). Рассматривали средние значения экспрессии для групп образцов, относящихся к одному и тому же гену, используя 1000 перестановок в качестве параметра для q-значения уровня ложноположительных результатов (FDR). Генные наборы, содержащие менее 5 и более 500 компонентов, не рассматривали.
РЕЗУЛЬТАТЫ: МЕХАНИЗМ ДЕЙСТВИЯ, ПРЕДЛОЖЕННЫЙ ПО ИСПЫТАНИЯМ С ДНК-МИКРОЧИПАМИ
Для определения механизма действия этих соединений авторы изобретения выбрали соединение 07 для анализа генной экспрессии на ДНК-биочипе. В результате этих испытаний получили ряд данных (алгоритм), который затем интерпретировали с помощью Connectivity Maps (CMap) (www.broadinstitute.org/cmap) и анализа GSEA.
Обработка клеток HL-60 соединением 07 привела к репрессии транскрипции 102 генов и к активации транскрипции 353 генов (FC>1,5, p<0,05).
Результаты, полученные анализом генной экспрессии на микрочипе для клеток, обработанных исследуемым соединением 07, анализировали в СМар. Гены, дифференциально экспрессированные в клетках под действием соединения 07, были поперечно связаны с серией перечней генов, восприимчивых к различным лекарствам. Эти перечни составляют часть базы данных СМар. Объединив данные для лекарства, сгруппированные с помощью системы АТС (Anatomical Therapeutic Chemical; http://www.whocc.no/atcddd/), установили, что эффект соединения 07 наиболее близок к эффекту лекарств группы Р02СА, которые представляют собой производные бензимидазола (например, албендазол, мебендазол, фенбендазол, тиабендазол), используемые в качестве противогельминтных средств. Результаты анализа соединения 07 в СМар представлены ниже в Таблице 5а.
Механизм действия этих лекарств предположительно обусловлен ингибированием тубулина, и недавно они были описаны как потенциальные кандидаты для лечения лейкозов (Spagnuolo РА, et al, The anthelmintic flubendazole inhibits microtubule function through a mechanism distinct from Vinca alkaloids and displays preclinical activity in leukemia and myeloma. Blood 2010; 115(23):4824-33) и солидных опухолей (Doudican Ν, et al, Mebendazole induces apoptosis via Bcl-2 inactivation in chemoresistant melanoma cells. Mol Cancer Res 2008; 6(8): 1308-315; Gupta K, et al; antifungal antimitotic compound benomyl inhibits brain microtubule polymerization and dynamics and cancer cell proliferation at mitosis, by binding to a novel site in tubulin. Biochemistry 2004; 43(21):6645-6655).


Сравнив с данными других перестановок, которые представляют собой часть платформы СМар, учитывая только данные для клеточной линии HL-60, эффект соединения 07 был наиболее близким с эффектом танеспимицина (насыщение=0,699, p<0,001), который представляет собой лекарство, ингибирующее Hsp90. Hsp90 представляет собой шаперон, который взаимодействует и сочетается с тубулином (С Garnier, et al, Heat-shock protein 90 (hsp90) binds in vitro to tubulin dimer and inhibits microtubule formation. Biochem Biophys Res Commun 1998, 250(2):414-9; Redmond Τ et al; Immunofluorescence colocalization of the 90-kDa heat-shock protein and microtubules in interphase and mitotic mammalian cells. Eur J Celi Biol 1989; 50(1):66-75; Sanchez ER et al; Evidence that the 90-kilodalton heat shock protein is associated with tubulin-containing complexes in L cell cytosol and in intact PtK cells. Mol Endocrinol 1988; 2(8):756-60; Czar MJ et al; Immunofluorescence localization of the 90-kDa heat-shock protein to cytoskeleton Eur J Cell Biol 1996;. 70 (4):322-30), защищая его от денатурации и сохраняя его совместимость для полимеризации (F Weis et al state, The 90-kDa heat tubulin shock protein Hsp90 protects against thermal denaturation. J Biol Chem 2010; 285(13):9525-34). Этот результат позволяет предположить, что, подобно танеспимицину, соединение 07 может влиять на процесс сборку тубулина или дестабилизировать уже сформированные микротрубочки.


Для развития клеточных процессов необходима непрерывная цитоскелетная реорганизация, следовательно, полимеризация и деполимеризация тубулина. Ингибиторы тубулина могут действовать двумя путями: (1) ингибируя полимеризацию тубулина или (2) стабилизируя тубулин таким образом, чтобы ингибировать деполимеризацию. Анализ GSEA показал, что соединение 07 вызывает резкое снижение экспрессии набора генов тубулина и тубулин-специфичных шаперонов (Фигура 1), что типично для соединений, ингибирующих полимеризацию тубулина. Ингибирование полимеризации тубулина приводит к накоплению свободного тубулина (не полимеризованного) в клеточной цитоплазме. Свободный цитоплазматический тубулин отрицательно саморегулирует экспрессию мРНК тубулина за счет подавления образования новой мРНК тубулина и ускорения разложения существующей мРНК (Caron JM, et al; autoregulation of tubulin synthesis in hepatocytes and fibroblasts. Celi J Biol 1985; 101:1763-72). Напротив, соединения, которые стабилизируют волокна тубулина, приводят к увеличению экспрессии тубулина.
Пример 7. Влияние соединения 07 на развитие клеток в клеточном цикле, активацию регуляторов клеточного цикла и инициацию апоптоза:
Перед экспериментами клетки инкубировали в течение 12 часов в свежей среде. Два миллиона клеток из линии Jurkat инкубировали в течение 12 часов, 18 часов, 24 часов и 30 часов в среде RPMI-640 с добавлением 10% фетальной бычьей сыворотки (FCS) и 0,2% пенициллина/стрептомицина (PS) с концентрацией 125 нМ соединения 07 или ДМСО (носитель).
а. Скрининговые анализы клеточного цикла: Клетки, обработанные или не обработанные соединением 07, фиксировали в 70% этаноле в течение 2 часов, промывали в PBS и инкубировали в течение 15 минут при 37°C в 1 мл 0,1% Triton X-100 с 0,2 мг/мл РНКазы и 20 мкг/мл йодида пропидия в PBS. 20000 клеток собрали в проточный цитометр FACSCalibur с количественной оценкой красной флуоресценции, исключив все клеточные агрегаты по стандартной ширине относительно площади пика красной флуоресценции. Обратную свертку данных для получения процента клеток в каждой фазе клеточного цикла выполнили с помощью программы ModFit v2.0.
b. Анализы для количественной оценки апоптоза с помощью метки аннексином V/PI: Клетки, обработанные или не обработанные соединением 07, промыли PBS и пометили аннексином V из набора для анализа апоптоза (Invitrogen). Вкратце, клетки повторно суспендировали в соответствующем буфере, содержащем кальций, и инкубировали в течение 15 минут с аннексином V-FITC и 5 мкг/мл йодида пропидия. 10000 клеток собрали на проточном цитометре FACSCalibur, исключая дебрис по прямому угловому светорассеянию против стандартного углового светорассеяния, с количественной оценкой зеленой и красной флуоресценции.
с. Испытание вестерн-блоттинга для анализа экспрессии и фосфорилирования регуляторных белков клеточного цикла. Клетки, обработанные или не обработанные соединением 07, лизировали в буфере, содержащем 50 мМ Tris с pH 7,7, 150 мМ NaCl, 5 мМ ЭДТК, 1% коктейля ингибитора фосфатазы I производства Sigma, 1% коктейля ингибитора фосфатазы II производства Sigma, 1% коктейля ингибитора протеазы II производства Sigma, 1% Igepal, 0,1% SDS, 0,5% дезоксихолата натрия и 1 мМ фенилметилсульфонил фторида (PMSF). После инкубации в течение 30 минут на льду и 3 циклов замораживания и оттаивания, экстракты центрифугировали при 10000 об./мин. в течение 20 минут при 4°C для осаждения мембранного дебриса. С надосадочной жидкостью авторы изобретения выполнили количественное определение белка с помощью реагента Bradford (Biorad). Образцы кипятили в течение 5 минут, затем добавили β-меркаптоэтанол, а 100 мкг белка подвергли электрофорезу в 10% геле акриламида : бисакриламида (39:1) с SDS и выполнили электрофоретический перенос на 0,45 мкм нитроцеллюлозную мембрану (Schleicher & Schuell). Иммунологический анализ выполнили инкубацией указанной мембраны с антителами из набора Cell Cycle / Checkpoint Antibody Sampler №9917 (Cell Signaling Technology) и набора Cyclin Dependent Kinase Inhibitor Antibody Sampler №9867 (Cell Signaling Technology) по инструкциям производителя. Обработку результатов выполнили с помощью набора Super Signal West Pico Chemiluminiscent Substrate (Pierce) с последующим проявлением на рентгеновской пленке.
РЕЗУЛЬТАТЫ: СОЕДИНЕНИЕ 07 ВЫЗЫВАЕТ ОСТАНОВКУ КЛЕТОЧНОГО ЦИКЛА BG2 И ГИБЕЛЬ КЛЕТОК ЗА СЧЕТ АПОПТОЗА
В анализе клеточного цикла клеток Jurkat, которые обрабатывали соединением 07, были получены результаты, согласующиеся с ингибированием тубулина. Клетки Jurkat, обработанные соединением 07, продемонстрировали остановку клеточного цикла на стадии G2/M (Фигура 2).
Исследовали изменения экспрессии и состоянии фосфорилирования различных белков, регулирующих клеточный цикл. Как показано на Фигуре 3, через 12 часов обработки соединением 07 можно обнаружить фосфорилирование Chk2 в Thr68. Фосфорилирование остатка Thr68 осуществляется мутированным фактором атаксии-телеангиэктазии (ATM) и приводит к активации Chk2 и последующему фосфорилированию ряда нисходящих мишеней, включая cdc25, BRCA1, р53 и E2F, которые представляют собой важные контрольные факторы (контрольные точки) клеточного цикла, восстановления повреждения ДНК и инициации апоптоза в ответ на повреждение ДНК (Falck J, et al, The ATM-Chk2-Cdc25A checkpoint pathway guards against radioresistant DNA synthesis. Nature 2001, 410(6830): 842-7; Matsuoka S, et al; Linkage of ATM to cell cycle regulation by the Chk2 protein kinase. Science 1998, 282(5395): 1893-7; Lee JS et al; hCdsl-mediated phosphorylation of BRCA1 regulates the DNA damage response. Nature 2000: 404(6774) 201-4; Hirao A et al, DNA damage-induced activation of p53 by the checkpoint kinase Chk2. Science 2000, 287(5459): 1824-7; С Stevens et al, Chk2 activates E2F-1 in response to DNA damage. Nat Cell Biol 2003: 5(5): 401-9). Отсутствие обнаруживаемых количеств p53 в вестерн-блоттинге (Фигура 3) можно объяснить низкой экспрессией р53 в клетках Jurkat (Vigorito Ε, et al;. Contributions of p53 and PMA to gamma-irradiation induced apoptosis in Jurkat cells. Hematol Cell Ther 1999, 41 (4): 153-61).
Обработка Соединением 07 приводит к подавлению экспрессии CDK4 и, в меньшей степени, CDK6, более короткой изоформы CDK2 и более крупной изоформы CDK9 (Фигура 3). Комплексы D/CDK4/CDK6 циклина и циклина E/cdk2 фосфорилируют и инактивируют Rb, обеспечивая возможность развития клеточного цикла. Уменьшение CDK2, CDK4 и CDK6 в клетках, обработанных соединением 07, снижает инактивацию Rb, который затем может выполнять свои функции ингибирования развития клеточного цикла и инициации апоптоза.
Пример 8. Влияние соединения 07 на здоровые лимфоциты человека и колониеобразование по оценке его селективности: a) In vitro анализы чувствительности/устойчивости клеток к соединению 07 по способу МТТ: для испытания соединения 07 против нормальных лимфоцитов, человеческую кровь, полученную от доноров, разделили в градиенте фиколла, а мононуклеарные клетки выращивали в количестве 200000 клеток на лунку в 80 микролитрах среды RPMI-1640 (содержащей 10% FBS, 100 МЕ/мл пенициллина и 100 мкг/мл стрептомицина) и 20 микролитрах раствора фитогемагглютинина (Cultilab) в каждой лунке для стимулирования Т-лимфоцитов. Соединение 07 добавляли в серийных разбавлениях (50%) от 300 до 1 нм. В качестве контроля выполнили параллельные испытания с клетками из лейкозных клеточных линий Jurkat и REH, а также эксперименты с колхицином с такими же концентрациями, что и соединение 07. Цитотоксичность оценили через 48 часов по способу МТТ, как описано выше. b) Эксперименты колониеобразования: Цитотоксичность соединения 07 оценили также в анализе колониеобразование гематопоэтических клеток. Использовали набор «HSC-CFU complete with Еро» производства Miltenyi (№ по каталогу 130-091-280) по рекомендациям производителя. Клетки костного мозга, полученные от здоровых доноров, выращивали в полутвердой метилцеллюлозной среде с добавлением фетальной бычьей сыворотки, бычьего сывороточного альбумина, различных факторов роста (GM-CSF, G-CSF, SCF, IL-3, IL-6, Еро) и соединения 07, для которого оценивали действие на кроветворение. Через две недели выращивания при 37°C и 5% CO2, выполнили оценку количества колоний гранулоцитов (CFU-G), макрофагов (CFU-M), гранулоцитов / макрофагов (CFU-GM), эритроидов (BFU-E и CFU-E) и смешанных колоний (CFU-GEMM).
РЕЗУЛЬТАТЫ: СЕЛЕКТИВНОСТЬ СОЕДИНЕНИЯ 07
Соединение 07 испытали на здоровых и зрелых Т-лимфоцитах, стимулированных фитогемагглютинином, для оценки его действия против нормальных клеток. В качестве положительного контроля использовали колхицин. Результаты представлены в Таблице 6.

При концентрации 300 нМ соединение 07 имеет токсичность 5% по сравнению с контрольным образцом, тогда как колхицин при той же концентрации вызывает 37% ингибирование жизнеспособности лимфоцитов Т.
Дозозависимый анализ соединения 07 против лейкозных клеток по сравнению с нормальными лимфоцитами, стимулированными фитогемагглютинином (Фигура 5) показывает, что концентрации, которые до 10 раз выше, чем цитотоксическая доза для лейкозных клеток, не влияют на нормальные лимфоциты, стимулированные фитогемагглютинином. Это указывает на то, что соединение 07 может действовать в лейкозных клетках, не ухудшая нормальную иммунную функцию пациентов.
Для определения влияния соединения 07 на кроветворение, авторы изобретения выполнили такой же анализ колониеобразования клеток костного мозга, выращенных в полутвердой метилцеллюлозной среде с факторами роста. Как показано в Таблице 7, соединение 07 в концентрациях, очень близких к IC50 (20 нМ), демонстрирует ингибирующую активность на образование эритроцитов, сравнимую с ингибитором PI3K, который в этом анализе использовали в качестве положительного контроля. Соединение 07 обладает также ингибирующей активностью против гранулоцитов и макрофагов, хотя и в меньшей степени, чем ингибитор PI3K. В концентрации 200 нМ, что соответствует 10-кратному значению IC50 для средних линий ALL, соединение 07 полностью ингибирует кроветворение.

Как описано выше, было получено пять новых 3,4,5-триметоксифенил-гидразонов и три новых 3,4-оксадиазола. Все ацил-гидразоны и оксадиазолы, синтезированные и входящие в рамки настоящего изобретения, были оценены в штаммах лейкозных клеток Jurkat и HEK, и соединения 02 и 07 продемонстрировали превосходную противолейкозную активность, аналогичную стандартному соединению (колхицин). Механизм действия соединения 07 определили с помощью ДНК-микрочипов, показавших его ингибирующую активность в отношении тубулина, с активацией Chk2 и Rb, остановкой клеточного цикла на фазе G2/M и инициацией гибели клеток за счет апоптоза. Последующие испытания показали 10-кратную селективность соединения 07 в отношении лейкозных клеток, по сравнению с его действием в здоровых лимфоцитах человека.
Таким образом, 3,4,5-триметоксифенил-гидразоны и родственные соединения, а также их аналоги, содержащие оксадиазолы, представленные в настоящем изобретении, обладают значительным потенциалом в качестве прототипов лекарств, предшественников лекарств или лекарств для лечения различных заболеваний, связанных с клеточной пролиферацией, таких как лейкозы, включая острый лимфобластный лейкоз (ALL), опухоли и воспаление.
Описание настоящего изобретения было представлено для целей иллюстрации и детализации будущих применений. Однако настоящее изобретение не имеет ограничивающего характера в отношении изобретений, описанных и представленных на примерах в настоящем документе. Изменения и модификации, согласующиеся с представленным выше описанием, а также с опытом и знаниями в соответствующей области, входят в рамки настоящего изобретения. Законно предполагается, что настоящее изобретение включает в свои рамки все его модификации и вариации, в соответствии с представленным описанием и формулой изобретения.
Реферат
Изобретение относится к соединениям, характеризующимся структурной формулой I, в которых кольцо В представляет собой заместитель, выбранный из группы, содержащей 3-ОСНСН-4-ОН-фенил и 2-OH-4-Br-фенил, а также к применению указанных соединений, в которых кольцо В представляет собой заместитель, выбранный из группы, содержащей фенил, 4-Br-фенил, 4-NO-фенил, 3-ОСН-фенил, 1-нафтил, 2-нафтил, 4-Cl-фенил, 3-ОСНСН-4-ОН-фенил и 2-ОН-4-Br-фенил, в лечении рака. Изобретение относится также к содержащим эти соединения фармацевтическим композициям для лечения заболевания, связанного с клеточной пролиферацией, где указанное заболевание выбрано из острого лимфобластного лейкоза (ALL), опухолей и воспаления. Изобретение относится также к применению конкретных соединений формул Ia и IIa в лечении заболевания, связанного с клеточной пролиферацией. Механизм действия наиболее активных соединений определяли с помощью ДНК-микрочипов и последующих испытаний, указанных чипом, а также в испытаниях селективности в здоровых лимфоцитах человека. 6 н. и 2 з.п. ф-лы, 5 ил., 8 табл., 8 пр.
Формула





Документы, цитированные в отчёте о поиске
1,3,4-оксадиазол-2-оны в качестве модуляторов ppar-дельта, фармацевтические композиции на их основе и способ лечения

Комментарии