Циклическое углеводородное соединение - RU2676328C2
Код документа: RU2676328C2
Описание
Область изобретения
[0001] Настоящее изобретение относится к циклическому углеводородному соединению, используемому в качестве терапевтического средства для лечения аритмии и фармацевтического средства, содержащего указанное соединение.
Уровень техники
[0002] Фибрилляция предсердий является аритмией, при которой предсердие возбуждается при частоте от 300 до 500 раз в минуту, и эта волна возбуждения передается на желудочковый узел таким образом, что активация желудочков становится нерегулярной. Уровень заболеваемости фибрилляцией предсердий в Японии оценивается приблизительно от 0,5 до 1% от общей численности населения. В последние годы, в результате увеличения численности пожилого населения и увеличения числа пациентов с заболеваниями, связанными с образом жизни, в частности, с артериальной гипертонией в Японии и в других странах, уровень заболеваемости фибрилляцией предсердий имеет тенденцию к повышению. Поскольку фибрилляция предсердий может быть связана с кардиогенной эмболией мозга, помимо вероятности возникновения сердечной недостаточности, сопровождаемой сердцебиением или снижением функции сердца, необходимость лечения является очень высокой.
Кроме того, фибрилляция предсердий представляет собой прогрессирующую аритмию, и симптомы фибрилляции предсердий повторяются, вследствие чего количество приступов постепенно увеличивается, а период времени возникновений продлевается. Таким образом, фибрилляция предсердий постепенно приобретает хроническую форму. В обстоятельствах, при которых скорость хронизации фибрилляции предсердий составляет приблизительно от 5 до 10% в год, и существует опасение, что вероятность развития сердечной недостаточности или инсульта увеличивается в связи с хронизацией фибрилляции предсердий, сообщается, что фармацевтическое действие обычных антиаритмических препаратов снижается или становится недействительным (непатентный документ 1). Тем не менее, не существует антиаритмического препарата, способного полностью подавлять фибрилляцию предсердий, которая переходит в хроническую форму, и метод катетерной аблации, который эффективен в качестве нефармакологической терапии, также имеет недостатки применения или трудности, связанные с процедурой. Таким образом, нельзя сказать, что метод катетерной аблации является терапевтическим методом в качестве терапии первой линии. Как было описано выше, пока еще не обнаружен эффективный метод терапии фибрилляции предсердий и, таким образом, существует потребность в разработке терапевтического средства против фибрилляции предсердий, который является безопасным и высокоэффективным.
[0003] Для фармакологического лечения фибрилляции предсердий, используются блокаторы натриевых каналов (в основном препарат класса I по классификации Вогана Вильямса (Vaughan Williams)) или блокаторы кальциевых каналов (в основном препарат класса III по классификации Vaughan Williams), обладающие эффектом удлинения миокардиального рефрактерного периода, для предотвращения фибрилляции предсердий или в качестве препарата для поддержания синусового ритма. Поскольку эти обычные антиаритмические лекарственные средства действуют на ионные каналы как миокарда предсердий, так и миокарда желудочков, присутствует не только эффект удлинения рефрактерного периода предсердий, но и побочные эффекты, такие как подавление функции левого желудочка вследствие отрицательного инотропного эффекта и аритмогенного эффекта, вызванного эффектом удлинения интервала QT. В последние годы, в связи с разработкой средства для лечения фибрилляции предсердий, осуществляли поиск лекарственных средств, при этом ионные каналы, такие как IKur и IKAch, которые экспрессированы или функционируют конкретно в предсердии, используются в качестве мишени, и были разработаны фармацевтические продукты, которые предназначены для устранения недостатков обычных лекарств (непатентный документ 2).
[0004] В патентном документе 1, ясно описано, что осельтамивир, который известен как противогриппозный препарат, его активный метаболит или его конъюгат с глюкуроновой кислотой обладает эффектом подавления фибрилляции предсердий относительно модели фибрилляции предсердий.
[0005]

Перечень ссылок
Патентный документ
[0006] Патентный документ 1: JP 2012-236814 A
Непатентные документы
[0007] Непатентный документ 1: The American Journal of Cardiology, ELSEVIER, (German), 1998, Vol. 81, p. 1450-1454
Непатентный документ 2: Circulation: Arrhythmia and Electrophysiology, American Heart Association, (USA), 2011, Vol. 4, p. 94-102
Сущность изобретения
Задачи, решаемые изобретением
[0008] Тем не менее, в отношении указанных соединений, также существует проблема в том, что устойчивые вирусы экспрессируются в зависимости от способа использования этих соединений, и, таким образом, желательно разделение эффекта подавления фибрилляции предсердий и противовирусной активности. Кроме того, существует также проблема стабильности в живом организме.
Таким образом, задачей настоящего изобретения является получение новых соединений, обладающих превосходным эффектом подавления аритмии, включая фибрилляцию предсердий, и используемых в качестве фармацевтического продукта, не обладающего противовирусным эффектом.
Средства решения задачи
[0009] В связи с этим авторы настоящего изобретения синтезировали различные соединения и исследовали эти соединения с использованием эффективного рефрактерного периода предсердий мелких животных в качестве индикатора. Таким образом, авторы настоящего изобретения обнаружили, что соединения, представленные следующей общей формулой (I), демонстрируют превосходное эффективное действие удлинения рефрактерного периода предсердий, и применимы в качестве профилактического или терапевтического средства для лечения аритмических заболеваний, включая фибрилляцию предсердий, обладают слабой антинейраминидазной активностью, которая является механизмом противовирусного действия осельтамивира, а также обладают удовлетворительной стабильностью. Таким образом, авторы настоящего изобретения осуществили настоящее изобретение.
[0010] То есть, настоящее изобретение относится к следующим пунктам [1]-[12].
[0011] [1] Соединение, представленное следующей общей формулой (I), его фармацевтически приемлемая соль или его сольват:
[0012]
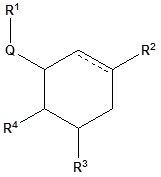
[0013] где пунктирная линия обозначает одинарную связь или двойную связь;
R1 представляет собой необязательно замещенную С1-6 алкильную группу;
Q представляет собой атом кислорода, атом серы или NR5;
R5 представляет собой атом водорода, необязательно замещенную C1-6 алкильную группу или необязательно замещенное неароматическое гетероциклическое кольцо, образованное путем объединения с R1 и соседним атомом азота;
R2 представляет собой -(C=O)-R6, -CHR6R7 или -CH2OR8;
R6 представляет собой необязательно замещенную С1-6 алкильную группу, необязательно замещенную арильную группу или необязательно замещенную гетероарильную группу;
R7 представляет собой гидроксильную группу или необязательно замещенную C1-6 алкоксигруппу;
R8 представляет собой необязательно замещенную С1-6 алкильную группу;
R3 и R4, которые могут быть одинаковыми или различными, каждый представляет собой аминогруппу, азидную группу или -X-R9;
R9 представляет собой атом водорода, необязательно замещенную C1-6 алкильную группу, -(C=O)-R10 или -(C=O)-NR11R12;
R10 представляет собой необязательно замещенную С1-6 алкильную группу, необязательно замещенную C1-6 алкоксигруппу, необязательно замещенную арильную группу или необязательно замещенную гетероарильную группу;
R11 и R12, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или необязательно замещенную С1-6 алкильную группу;
X представляет собой атом кислорода или NR13; и
R13 представляет собой атом водорода, необязательно замещенную C1-6 алкильную группу, или необязательно замещенное неароматическое гетероциклическое кольцо, образованное путем объединения с R9 и соседним атомом азота,
при условии, что любой из R3 и R4 представляет собой аминогруппу.
[2] Соединение в соответствии с пунктом [1], его фармацевтически приемлемая соль или его сольват, где в приведенной выше общей формуле (I), пунктирная линия обозначает двойную связь.
[3] Соединение, представленное общей формулой (II), его фармацевтически приемлемая соль или его сольват:
[0014]
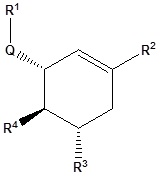
[0015] где каждый из заместителей определен как в вышеуказанной общей формуле (I).
[4] Соединение по любому из пунктов [1]-[3], его фармацевтически приемлемая соль или его сольват, где заместитель, которой представляет собой С1-6 алкильную группу, арильную группу, гетероарильную группу, С1-6 алкоксигруппу или неароматическое гетероциклическое кольцо, содержит от одного до пяти заместителей, выбранных из атома галогена, гидроксильной группы, цианогруппы, нитрогруппы, С1-6 алкильной группы, С2-6 алкенильной группы, C1-6 алкоксигруппы, ацильной группы, карбоксильной группы, С1-6 алкилкарбониламиногруппы, С1-6 алкоксикарбонильной группы, карбамоильной группы, сульфамоильной группы, C1-6 алкилсульфанильной группы, С1-6 алкилсульфенильной группы, С1-6 алкилсульфонильной группы, аминогруппы, C1-6 алкиламиногруппы, С1-6 диалкиламиногруппы, арильной группы, гетероарильной группы и неароматической гетероциклической кольцевой группы.
[5] Соединение в соответствии с любым из пунктов [1]-[4], его фармацевтически приемлемая соль или его сольват, где Q представляет собой атом кислорода.
[6] Соединение в соответствии с любым из пунктов [1]-[5], его фармацевтически приемлемая соль или его сольват, где R3 представляет собой аминогруппу и R4 представляет собой -NH (C=O)-R10 или -NH-(C=O)-NR11R12.
[7] Лекарственное средство, содержащее соединение в соответствии с любым из пунктов [1]-[6], его фармацевтически приемлемую соль или его сольват.
[8] Лекарственное средство в соответствии с пунктом [7], где средство представляет собой терапевтическое средство для лечения аритмии.
[9] Композиция лекарственного средства, содержащая:
соединение в соответствии с любым из пунктов [1]-[6], его фармацевтически приемлемую соль или его сольват; и
фармацевтически приемлемый носитель.
[10] Соединение в соответствии с любым из пунктов [1]-[6], его фармацевтически приемлемая соль или его сольват, для применения для лечения аритмии.
[11] Применение соединения в соответствии с любым из пунктов [1]-[6], его фармацевтически приемлемой соли или его сольвата, для производства терапевтического средства для лечения аритмии.
[12] Способ лечения аритмии, содержащий введение эффективного количества соединения в соответствии с любым из пунктов [1]-[6], его фармацевтически приемлемой соли или его сольвата, пациенту, нуждающемуся в таком лечении.
Положительный эффект изобретения
[0016] Соединение по настоящему изобретению демонстрирует превосходное эффективное действие удлинения рефрактерного периода предсердний, также имеет высокую степень безопасности и применимо в качестве средства, подавляющего аритмические заболевания, включая фибрилляцию предсердий, и профилактического или терапевтического средства для их профилактики или лечения.
Подробное описание изобретения
[0017] Соединение (I) по настоящему изобретению отличается тем, что R2 представляет собой ацильную группу, гидроксиметильную группу или алкоксиметильную группу.
[0018] В настоящем описании примеры "атома галогена" включают атом фтора, атом хлора, атом брома и атом йода. "Атом галогена" предпочтительно представляет собой атом фтора или атом хлора.
[0019] В настоящем описании "Cn1-n2" указывает на то, что количество атомов углерода в заместителе составляет от n1 до n2.
[0020] В настоящем описании термин "C1-6 алкильная группа" обозначает линейную алкильную группу, содержащую от 1 до 6 атомов углерода, или разветвленную или циклическую алкильную группу, содержащую от 3 до 6 атомов углерода. Примеры С1-6 алкильной группы, включают метильную группу, этильную группу, н-пропильную группу, изопропильную группу, 1-этилпропильную группу, н-бутильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу, 1-этилбутильную группу, н-пентильную группу, н-гексильную группу, циклопропильную группу, циклобутильную группу, циклопентильную группу и циклогексильную группу. В общей формуле (I) "C1-6 алкильная группа", в определении необязательно замещенной C1-6 алкильной группы, представленной R1, предпочтительно представляет собой С4-6 алкильную группу, более предпочтительно, 1-этилпропильную группу или н-пентильную группу и, особенно предпочтительно, 1-этилпропильную группу. "C1-6-алкильная группа", в определении необязательно замещенной C1-6алкильной группы, представленной R6, предпочтительно представляет собой С4-6 алкильную группу и, более предпочтительно, представляет собой н-бутильную группу, трет-бутильную группу, н-пентильную группу или циклогексильную группу. "C1-6 алкильная группа", в определении необязательно замещенной C1-6 алкильной группы, представленной R5, R8, R9, R11, R12 или R13, предпочтительно представляет собой C1-4 алкильную группу и, более предпочтительно, метильную группу или этильную группу. "C1-6 алкильная группа", в определении необязательно замещенной C1-6 алкильной группы, представленной R10, предпочтительно представляет собой C1-4 алкильную группу, более предпочтительно, метильную группу, этильную группу, н-пропильную группу, изопропильную группу, втор-бутильную группу или трет-бутильную группу и, особенно предпочтительно, метильную группу, втор-бутильную группу или трет-бутильную группу.
[0021] В настоящем описании термин "С2-6 алкенильная группа" обозначает линейную алкенильную группу, имеющую от 2 до 6 атомов углерода, или разветвленную или циклическую алкенильную группу, содержащую от 3 до 6 атомов углерода. Примеры С2-6 алкенильной группы включают винильную группу, 1-пропенильную группу, 2-пропенильную группу, изопропенильную группу, 2-метил-1-пропенильную группу, 1-бутенильную группу, 2-бутенильную, 3-бутенильную группу, 1-пентенильную группу, 2-пентенильную группу, 1-гексенильную группу, 2-гексенильную группу, 1-циклогексенильную группу, 2-циклогексенильную группу и 3-циклогексенильную группу.
[0022] В настоящем описании термин "арильная группа" обозначает моноциклическую или полициклическую ароматическую углеводородную группу, имеющую от 6 до 10 атомов углерода. Примеры арильной группы включают фенильную группу, 1-нафтильную группу и 2-нафтильную группу. В общей формуле (I), "арильная группа", в определении необязательно замещенной арильной группы, представленной R6 или R10, предпочтительно представляет собой фенильную группу.
[0023] В настоящем описании термин "гетероарильная группа" обозначает моноциклическую или полициклическую ароматическую гетероциклическую группу, содержащую от одного до трех атомов кислорода, атомов азота или серы, и положение связывания не имеет особых ограничений до тех пор, пока оно является химически стабильным. Примеры гетероарильной группы включают пирролильную группу, фурильную группу, тиенильную группу, пиразолильную группу, имидазолильную группу, оксазолильную группу, изоксазолильную группу, тиазолильную группу, изотиазолильную группу, оксадиазолильную группу, тиадиазолильную группу, триазолильную группу, пиридильную группу, пиридазинильную группу, пиримидинильную группу, пиразинильную группу, хинолильную группу, изохинолильную группу, бензимидазолильную группу, индолильную группу, бензизоксазолильную группу, бензоксазолильную группу, бензизотиазолильную группу и бензотиазолильную группу. В общей формуле (I) "гетероарильная группа", в определении необязательно замещенной гетероарильной группы, представленной R6 или R10, предпочтительно представляет собой 5-6-членную моноциклическую гетероарильню группу и, более предпочтительно, пирролильную группу, фурильную группу, тиенильную группу, оксазолильную группу или тиазолильную группу.
[0024] В настоящем описании термин "C1-6 алкоксигруппа" обозначает группу, в которой "C1-6 алкильная группа", описанная выше, связана через один атом кислорода. Примеры C1-6 алкоксигруппы включают метоксигруппу, этоксигруппу, н-пропокси группу, изопропокси группу, н-бутокси группу, втор-бутокси группу, изобутокси группу, трет-бутокси группу, н-пентокси группу, н-гексокси группу, циклопропокси группу, циклобутокси группу, циклопентокси группу и циклогексокси группу. В общей формуле (I) "C1-6 алкоксигруппа", в определении необязательно замещенной C1-6 алкоксигруппы, представленной R7 или R10, предпочтительно представляет собой C1-4 алкоксигруппу и, более предпочтительно, представляет собой метоксигруппу или этоксигруппу.
[0025] В настоящем описании термин "неароматическое гетероциклическое кольцо" обозначает 3-10-членное неароматическое гетероциклическое кольцо, которое содержит один или два или больше атомов азота, или не содержит или содержит один атом кислорода или атом серы. Примеры неароматического гетероциклического кольца включают азетидиновое кольцо, пирролидиновое кольцо, пиперидиновое кольцо, пиперазиновое кольцо, гексаметилениминовое кольцо, гептаметилениминовое кольцо, гомопиперазиновое кольцо, 2,5-диазабицикло[2.2.1]гептановое кольцо, морфолиновое кольцо и тиоморфолиновое кольцо. В общей формуле (I) "неароматическое гетероциклическое кольцо" в случае, когда R5 или R13 объединяется вместе с R1 или R9 и соседним атомом азота с образованием необязательно замещенного неароматического гетероциклического кольца, предпочтительно представляет собой азетидиновое кольцо, морфолиновое кольцо или пирролидиновое кольцо и, более предпочтительно, представляет собой азетидиновое кольцо или пирролидиновое кольцо.
[0026] В настоящем описании выражение "необязательно замещенный" означает или "незамещенный" или имеющий от одного до пяти и, предпочтительно, от одного до трех одинаковых или различных заместителей в замещаемых положениях. В настоящем описании, когда алкильная группа C1-6, арильная группа, гетероарильная группа, С1-6алкоксигруппа или неароматическое гетероциклическое кольцо, необязательно, имеет заместитель, примеры заместителя включают атом галогена, гидроксильную группу, цианогруппу, нитрогруппу, С1-6 алкильную группу, С2-6 алкенильную группу, C1-6 алкоксильную группу, ацильную группу, карбоксильную группу, С1-6 алкилкарбониламиногруппу, C1-6 алкоксикарбонильную группу, карбамоильную группу, сульфамоильную группу, C1-6 алкилсульфанильную группу, С1-6 алкилсульфенильную группу, С1-6 алкилсульфонильную группу, аминогруппу, C1-6 алкиламиногруппу, С1-6 диалкиламиногруппу, арильную группу, гетероарильную группу и неароматическую гетероциклическую кольцевую группу, и они являются дополнительно необязательно замещенными.
[0027] C1-6 алкил или C1-6 алкоксигруппа, которая имеет заместитель, предпочтительно представляет собой C1-6 алкил или C1-6 алкоксигруппу, имеющую от одного до пяти и, предпочтительно, от одного до трех заместителей, выбранных из атомов галогена, цианогрупп, гидроксильных групп и C1-6-алкоксигрупп.
[0028] Арил, гетероарил или неароматическое гетероциклическое кольцо, которое имеет заместитель, предпочтительно представляет собой арил, гетероарил или неароматический гетероцикл, который имеет от одного до пяти и, предпочтительно, от одного до трех заместителей, выбранных из C1-6 алкильных групп, атомов галогена, цианогрупп, гидроксильных групп или C1-6 алкоксигрупп.
[0029] Более предпочтительные примеры в общей формуле (I) по настоящему изобретению включают следующие пункты от <1> до <5> и любые их сочетания. Сочетание всех перечисленных ниже пунктов от <1> до <5> является особенно предпочтительным.
<1> R1 предпочтительно представляет собой С4-6 алкильную группу, более предпочтительно, 1-этилпропильную группу, н-пентильную группу или н-гексильную группу и, особенно предпочтительно, 1-этилпропильную группу.
[0030] <2> R2 представляет собой предпочтительно -(C=O)-R6, и R6 предпочтительно представляет собой н-бутильную группу, втор-бутильную группу, трет-бутильную группу, бензильную группу, фенетильную группу, необязательно замещенную арильную группу или необязательно замещенную гетероарильную группу. Арильная группа или гетероарильная группа, предпочтительно представляет собой фенильную группу или 5-6-членную моноциклическую гетероарильную группу и, более предпочтительно, фенильную группу, пирролильную группу, фурильную группу, тиенильную группу, оксазолильную группу, или тиазолильную группу, и заместитель, представляющий собой, предпочтительно, одну С1-6 алкильную группу или атом галогена или незамещенную группу, является предпочтительным.
[0031] <3> R3 и R4 представляют собой предпочтительно аминогруппу, -NH-(C=O)-R10 или -NH-(C=O)-NR11R12. То есть, Х представляет собой предпочтительно -NR13-, R13 предпочтительно представляет собой атом водорода, и R9 представляет собой предпочтительно -(C=O)-R10 или -(C=O)-NR11R12. R3 представляет собой, особенно предпочтительно, аминогруппу, и R4 представляет собой, особенно предпочтительно, -NH-(C=O)-R10 или -NH-(C=O)-NR11R12. R10 предпочтительно представляет собой C1-6 алкильную группу и, более предпочтительно, метильную группу, этильную группу, н-пропильную группу, изопропильную группу, втор-бутильную группу или трет-бутильную группу. Относительно R11 и R12, сочетание, в котором любой из R11 и R12 представляет собой атом водорода, а другой его представляет собой C1-6 алкильную группу, и C1-6 алкильная группа, предпочтительно, представляет собой C1-4 алкильную группу и, особенно предпочтительно, метильную группу или этильную группу.
<4> Q предпочтительно представляет собой атом кислорода.
<5> Пунктирная линия предпочтительно обозначает двойную связь.
[0032] Конкретные примеры особенно предпочтительных соединений общей формулы (I) по настоящему изобретению включают следующие соединения:
N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-(тиофен-2-карбонил)-3-циклогексен-1-ил]ацетамид (пример 1);
N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-(тиофен-2-карбонил)-3-циклогексен-1-ил]ацетамид гидрохлорид (пример 2);
N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-(5-метилфуран-2-карбонил)-3-циклогексен-1-ил]ацетамид (пример 3);
N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-(5-метилтиофен-2-карбонил)-3-циклогексен-1-ил]ацетамид (пример 4);
N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-(4-фторбензоил)-3-циклогексен-1-ил]ацетамид (пример 5);
N-[(1R,2R,6S)-6-амино-4-бензоил-2-(1-этилпропокси)-3-циклогексен-1-ил]ацетамид гидрохлорид (пример 6);
N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-фенилацетил-3-циклогексен-1-ил]ацетамид (пример 7);
N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-(фуран-2-карбонил)-3-циклогексен-1-ил]ацетамид (пример 8);
N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-(1-метил-1H-пиррол-2-карбонил)-3-циклогексен-1-ил]ацетамид (пример 9);
N-[(1R,2R,6S)-6-амино-4-(2,2-диметилпропионил)-2-(1-этилпропокси)-3-циклогексен-1-ил]ацетамид (пример 10);
N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-(тиазол-2-карбонил)-3-циклогексен-1-ил]ацетамид (пример 11);
N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-пентаноил-3-циклогексен-1-ил]ацетамид гидрохлорид (пример 12);
N-[(1R,2R,6S)-6-амино-4-бензоил-2-(1-этилпропокси)-3-циклогексен-1-ил]-2,2-диметилпропионамид (пример 17);
N-[(1S,5R,6R)-6-амино-3-бензоил-5-(1-этилпропокси)-3-циклогексен-1-ил]ацетамид (пример 18);
N-[(1S,5R,6R)-6-амино-5-(1-этилпропокси)-3-(тиофен-2-карбонил)-3-циклогексен-1-ил]ацетамид (пример 21);
N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-(тиофен-2-карбонил)-3-циклогексен-1-ил]-3-метилбутиламид (пример 25);
[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-(тиофен-2-карбонил)циклогексен-3-ил]-3-этилмочевина (пример 27);
N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-гептаноил-3-циклогексен-1-ил]ацетамид (пример 28);
N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-(тиофен-3-карбонил)-3-циклогексен-1-ил]ацетамид (пример 29);
N-[(1R,2R,6S)-6-амино-4-циклогексанкарбонил-2-(1-этилпропокси)-3-циклогексен-1-ил]ацетамид гидрохлорид (пример 30); и
N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-(5-метокситиофен-2-карбонил)-3-циклогексен-1-ил]ацетамид гидрохлорид (пример 31).
[0033] В настоящем описании, структурная формула соединения, для удобства, может представлять конкретный изомер; тем не менее, настоящее изобретение включает все изомеры, такие как геометрические изомеры, оптические изомеры, обусловленные асимметричными атомами углерода, стерические изомеры и таутомерные изомеры и смеси изомеров, которые существуют исходя из структуры соединения. Таким образом, структурная формула соединения не должна ограничиваться формулой, описанной для удобства, и может относится к любому из изомеров или их смеси. Соответственно, соединение по настоящему изобретению может иметь асимметричный атом углерода в молекуле, и может представлять собой оптический изомер и рацемат; однако соединение не ограничивается каким-либо одним из них и все они включены в настоящее изобретение.
[0034] Кроме того, настоящее изобретение включает фармацевтически приемлемую соль соединения по настоящему изобретению. Конкретные их примеры включают соли присоединения кислоты, образованные с неорганическими кислотами, например гидрохлорид, гидробромид, гидроиодид, сульфат, нитрат и фосфат, соли присоединения кислоты, образованные с органическими кислотами, например, формиат, ацетат, трихлорацетат, трифторацетат, пропионат, оксалат, малонат, сукцинат, фумарат, малеат, лактат, малат, тартрат, цитрат, метансульфонат, этансульфонат, п-толуолсульфонат, аспартат и глутамат; соли, образованные с неорганическими основаниями, такие как соли натрия, соли калия, соли магния, соли кальция и соли алюминия; соли, образованные с органическими основаниями, такие как метиламин, этиламин, этаноламин, лизин и орнитин; и соли аммония.
[0035] Кроме того, настоящее изобретение также включает фармацевтически приемлемые пролекарства соединения по настоящему изобретению. Фармацевтически приемлемое пролекарство означает соединение, которое подвергается ферментативному окислению, восстановлению или гидролизу в физиологических условиях в живом организме и превращается в соединение (I) по настоящему изобретению. Примеры группы, которая образует пролекарства, включают группы, описанные в Prog. Med., 5, 2157-2161 (1985) или "Iyakuhin no Kaihatsu (Development of Pharmaceutical Products)" (Hirokawa Shoten Co., 1990) Vol. 7, Molecular Design, 163-198.
[0036] Кроме того, настоящее изобретение также включает гидраты, различные сольваты и кристаллические полиморфизмы соединения по настоящему изобретению и его фармацевтически приемлемой соли. Тем не менее, аналогично, не существует каких-либо ограничений, и настоящее изобретение может включать как любую кристаллическую форму, так и смесь кристаллических форм.
Кроме того, настоящее изобретение включает соединения, полученные путем мечения соединения по настоящему изобретению, например, изотопом (например,2H,3H,14C,35S или125I).
[0037] Соединение по настоящему изобретению, и его фармацевтически приемлемая соль, может быть получено путем использования различных известных способов синтеза. В отношении введения заместителей или превращения функциональных групп, в случае, когда присутствует реакционноспособный заместитель, такой как аминогруппа, гидроксильная группа или карбоксильная группа, целевое соединение можно также получить путем введения защитной группы в соответствующий заместитель при необходимости, и удалением защитной группы после того, как желаемое взаимодействие завершается. Выбор защитной группы, введение защитной группы и удаление защитной группы могут быть соответствующим образом выбраны из, например, способов, описанных в Greene and Wuts "Protective Groups in Organic Synthesis (Third Edition)" (WILEY) и осуществлены.
[0038] Примеры способа получения соединения общей формулы (I) по настоящему изобретению включают способы, описанные в следующих схемах 1-3. Тем не менее, способ получения соединения по настоящему изобретению не ограничивается указанными способами. Исходное вещество, указанное на каждой схеме, является коммерчески доступным, или может быть получен способом, описанным в ссылочном примере или способом, известным из предшествующего уровня техники.
[0039] (Схема 1)

[0040] где R1, R3, R4, R6 и Q определены как в описанной выше общей формуле (I), и R14 представляет собой C1-6 алкильную группу.
Соединение (I-а) по настоящей заявке, описанное выше, может быть синтезировано в соответствии со схемой 1.
[0041] (Способ 1)
Соединение (2) может быть получено путем гидролиза сложного эфира соединения (1). Реакция гидролиза может быть выполнена в общих условиях, и может быть осуществлена, например, таким способом, при котором соединение (1) растворяют в, например, метаноле, этаноле, тетрагидрофуране (ТГФ), диоксане или ацетоне, и затем добавляют водный раствор гидроксида щелочного металла, такого как гидроксид лития, гидроксид натрия или гидроксид калия, и взаимодействие осуществляют в течение 0,5-100 часов при температуре в диапазоне от 0°C до комнатной температуры.
[0042] В частности, соединение (1) является коммерчески доступным или может быть синтезировано в соответствии с известным способом, например, способом, описанным в JP 2006-36770 A или в документе (Journal of American Chemical Society, (USA), 1997, Vol. 119, p. 691-697).
[0043] (Способ 2)
Соединение (3) может быть получено путем амидирования по Вайнребу соединения (2) с N,O-диметилгидроксиламином или его гидрохлоридом. Реакция амидирования по Вайнребу может быть осуществлена, например, таким способом, при котором соединение (2), растворяют в, например, дихлорметане, хлороформе, N,N-диметилформамиде (ДМФ) или ТГФ, затем добавляют конденсирующий агент, такой как дициклогексилкарбодиимид (DCC), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC⋅HCl), гексафторфосфат (бензотриазол-1-илокси)трипирролидинофосфония (РуВОР) или гексафторфосфат 2-(1H-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония (HATU), потом добавляют N,O-диметилгидроксиламин или его гидрохлорид, и взаимодействие осуществляют в течение 0,5-100 часов при температура в диапазоне от 0°C до температуры кипения в присутствии или в отсутствии основания, такого как пиридин, триэтиламин или N,N-диизопропилэтиламин.
[0044] (Способ 3)
Соединение (Ia), могут быть получено путем взаимодействия соединения (3) с металлорганическим реагентом, таким как алкиллитиевый реагент, ариллитиевый реагент, гетероариллитиевый реагент или реактив Гриньяра, в неактивном растворителе. Эта реакция может быть проведена, например, таким способом, при котором соединение (3) растворяют в, например, ТГФ или диэтиловом эфире, затем добавляют органический реагент металла, который является коммерчески доступным или получают отдельно общим способом, и взаимодействие осуществляют в течение 0,5-24 часов при температуре в диапазоне от -78°C до комнатной температуры.
[0045] (Схема 2)
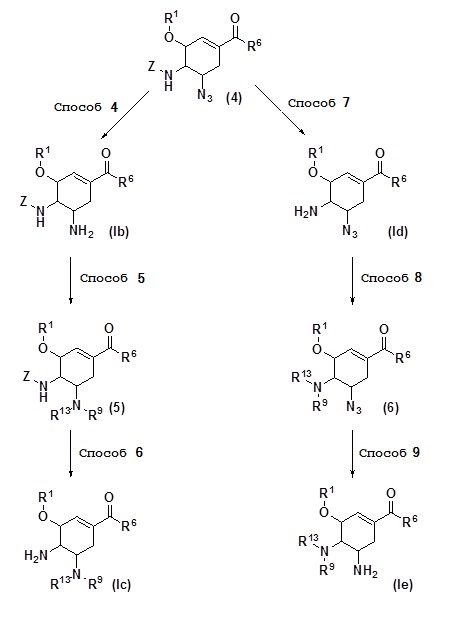
[0046] где R1, R6, R9 и R13 имеют те же значения, как описано выше, и Z представляет собой защитную группу.
Соединение (Ib), соединение (Iс), соединение (Id) и соединение (Ie), согласно настоящему изобретению, описанные выше, могут быть синтезированы в соответствии со схемой 2.
[0047] (Способ 4)
Соединение (Ib) может быть получено восстановлением по Штаундигеру соединения (4), которое может быть получено в соответствии со схемой 1. Восстановление по Штаудингеру может быть осуществлено, например, таким способом, при котором соединение (4) растворяют в смешанном растворителе, содержащем воду с, например, ТГФ, метанолом или этанолом, затем добавляют трифенилфосфин и взаимодействие осуществляют в течение 0,5-48 часов при температуре в диапазоне от комнатной температуры до 100°C.
[0048] (Способ 5)
Соединение (5) может быть получено путем реакции восстановительного аминирования соединения (Ib) с альдегидной группой или кетоновой группой, или могут быть получены путем ацилирования соединения (Ib) ангидридом кислоты, хлорангидридом или изоцианатом один раз или два раза по мере необходимости. Реакция восстановительного аминирования может быть осуществлена, например, таким способом, при котором соединение (5) растворяют в растворителе, таком как метанол, этанол, диэтиловый эфир, ТГФ, хлороформ, дихлорметан, бензол или толуол, затем добавляют альдегидную группу или кетоновую группу, взаимодействие осуществляют в присутствии или в отсутствии дегидратирующего агента, такого как молекулярное сито или сульфат магния, с получением основания Шиффа, потом добавляют восстанавливающий агент, такой как боргидрид натрия, цианоборгидрид натрия или триацетоксиборгидрид натрия, и взаимодействие осуществляют в течение 0,5-48 часов при температуре в диапазоне от 0 до 100°C в присутствии или в отсутствии кислотного катализатора, такого как уксусная кислота. Реакцию ацилирования можно проводить, например, таким способом, при котором соединение (5) растворяют в растворителе, таком как хлороформ, дихлорметан, ТГФ, бензол или толуол, затем добавляют ангидрид кислоты, хлорангидрид кислоты или изоцианат и взаимодействие осуществляют в течение 0,5-48 часов при температуре в диапазоне от 0 до 100°C в присутствии или в отсутствии основания, такого как триэтиламин, N,N-диизопропилэтиламин, пиридин или 4-диметиламинопиридин.
[0049] (Способ 6)
Соединение (Ic) может быть получено путем удаления защитной группы из соединения (5). Способ удаления защитной группы с аминогруппы может быть соответствующим образом выбран из известных способов, в зависимости от типа защитной группы. В случае, когда защитная группа Z представляет собой трет-бутоксикарбонильную группу, удаление защитной группы может быть осуществлено, например, таким способом, при котором соединение (5) растворяют в, например, метаноле, этаноле, 2-пропаноле, тетрагидрофуране, ацетонитриле, диоксане, этилацетате, дихлорметане или хлороформе, затем добавляют раствор соляной кислоты или трифторуксусную кислоту и взаимодействие осуществляют в течение 0,5-30 часов при температуре в диапазоне от 0 до 100°C.
[0050] (Способ 7)
Соединение (Id) может быть получено удалением защитной группы с соединения (4). В этом способе используется метод, аналогичный описанному в способе 6, представленному на схеме 2.
[0051] (Способ 8)
Соединение (6) может быть получено путем реакции восстановительного аминирования соединения (Id) с альдегидной группой или кетоновой группой или может быть получено путем ацилирования соединения (Id) с ангидридом кислоты или хлорангидридом кислоты. В этом способе используется метод, аналогичный описанному в способе 5, представленному на схеме 2.
[0052] (Способ 9)
Соединение (I-е) может быть получено восстановлением соединения (6) по Штаудингеру. В этом способе используется метод, аналогичный описанному в способе 4, представленному на схеме 2.
[0053] (Схема 3)
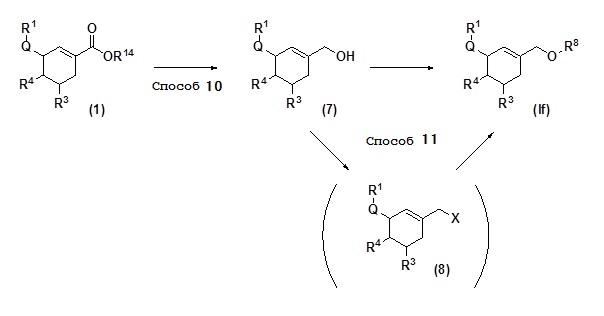
[0054] где R1, R3, R4, Q, R8 и R14 определены так, как описано выше, и X представляет собой атом галогена.
Соединение (If) по настоящему изобретению, описанное выше, может быть синтезировано в соответствии со схемой 3.
[0055] (Способ 10)
Соединение (7) может быть получено восстановлением сложноэфирной группы соединения (1) с, например, гидридом диизобутилалюминия (DIBAL). Реакция восстановления может быть осуществлена, например, таким способом, при котором соединение (1), растворяют в растворителе, таком как диэтиловый эфир, ТГФ, хлороформ или дихлорметан, затем добавляют восстанавливающий агент, такой как DIBAL, и взаимодействие осуществляют в течение 0,5-24 часов при температуре в диапазоне от -78°C до комнатной температуры.
[0056] (Способ 11)
Соединение (If) может быть получено путем алкилирования соединения (7) или может быть получено путем галогенирования соединения (7) посредством, например, реакции Аппеля, с получением соединения (8), и последующей этерификацией соединения (8) с алкоксидом металла.
Реакция алкилирования соединения (7) может быть выполнено, например, таким способом, при котором соединение (7) растворяют в растворителе, таком как диэтиловый эфир, ТГФ или ДМФ, затем добавляют металлическое основание, такого как гидрид натрия, и взаимодействие осуществляют в течение 0,5-24 часов при температуре в диапазоне от 0 до 100°C в присутствии алкилгалогенида, такого как иодметан или иодэтан, и в присутствии или в отсутствии соли четвертичного аммония, такого как иодид тетрабутиламмония.
Реакция галогенирования, исходя из соединения (7) в соединение (8), может быть выполнена, например, таким способом, при котором соединение (7) растворяют в растворителе, таком как дихлорметан или хлороформ, затем добавляют тетрахлорид углерода, трифосген или тетрабромид углерода в присутствии трифенилфосфина, и взаимодействие осуществляют в течение 0,5-24 часов при температуре в диапазоне от 0 до 100°C. Реакция этерификации соединения (8) может быть выполнена, например, таким способом, при котором соединение (8) растворяют в растворителе, таком как метанол или этанол, затем добавляют метилат натрия или этилат натрия, и взаимодействие осуществляют в течение 0,5-24 часов при температуре в диапазоне от 0 до 100°C.
[0057] (Схема 4)

[0058] где R1, R3, R4, R6 и Q определены так, как описано выше, и R15 представляет собой C1-6 алкильную группу, которые необязательно замещены.
Соединение (Ig) и соединение (Ih) по настоящему изобретению, описанные выше, могут быть синтезированы в соответствии со схемой 4.
[0059] (Способ 12)
Соединение (Ig) может быть получено путем восстановления соединения (1) методом Луше. Восстановление по Луше может быть осуществлено, например, таким способом, при котором соединение (1), растворяют в растворителе, таком как метанол или этанол, затем добавляют восстанавливающий агент, такой как боргидрид натрия, в присутствии соли лантаноидного металла, такого как хлорид церия (III), и взаимодействие осуществляют в течение 0,5-24 часов при температуре в диапазоне от -40°C до комнатной температуры.
[0060] (Способ 13)
Соединение (I) может быть получено путем алкилирования соединения (Ig). В этом способе используется метод, аналогичный описанному в способе 11, представленному на схеме 3.
[0061] (Схема 5)

[0062] где R1, R2, R3, R4, and Q определены так, как описано выше.
Соединение (Ij) по настоящему изобретению, описанное выше, может быть синтезировано в соответствии со схемой 4.
[0063] (Способ 14)
Соединение (Ij) может быть получено путем реакции каталитического гидрирования соединения (II) или реакции гидридного восстановления соединения (II) с гидридом металла. Каталитическая реакция гидрирования может быть осуществлена, например, таким способом, при котором соединение (Ii), растворяют в растворителе, таком как метанол, этанол, этилацетат или ТГФ, добавляют затем катализатор, такой как палладий, гидроксид палладия, или оксид платины (катализатор Адамса), и взаимодействие осуществляют в течение 0,5-48 часов при давлении 1-5 атм и при температуре в диапазоне от комнатной температуры до 100°C в атмосфере водорода. Реакция гидридного восстановления может быть осуществления, например, таким способом, при котором соединение (Ii) растворяют в растворителе, таком как ТГФ, дихлорметан или хлороформ, затем добавляют гидрид металла, такой как боргидрид натрия или алюмогидрид лития, и взаимодействие осуществляют в течение 0,5-48 часов при температуре в диапазоне от 0 до 100°C.
[0064] Соединения общей формулы (I), получаенные таким образом, обладают, как описано ниже в Примере исследования, превосходным эффективным действием удлинения рефрактерного периода предсердний, незначительной анти-нейраминидазной активностью и высокой безопасностью. Таким образом, соединение по настоящему изобретению используются в качестве средства для дефибрилляции и профилактического или терапевтического средства против аритмии, например, фибрилляции предсердий или флаттера предсердий.
[0065] Композиция фармацевтического средства, содержащая соединение по настоящему изобретению или его фармацевтически приемлемую соль в качестве активного ингредиента, может быть получена с использованием одного или нескольких видов соединения по настоящему изобретению и фармацевтически приемлемого носителя, эксципиента или другой добавки, которую обычно используют для получения лекарственного препарата, в соответствии с обычно используемым способом. Введение может быть осуществлено с использованием любой формы для перорального введения, например, таблетки, пилюли, капсулы, гранулы, порошки или жидкости, и для парентерального введения посредством инъекции (например, внутривенной инъекции или внутримышечной инъекции), свечей, трансназальных средств, чресслизистых средств, чрескожных средств или ингаляционных средств. Количество вводимого средства соответственно определяется в соответствии с конкретным случаем при рассмотрении, например, болезни или симптома, подлежащего лечению, возраста, массы тела и пола субъекта, которому вводят средство. Обычно, в случае перорального введения, количество вводимого соединения по настоящему изобретению взрослому человеку (масса: около 60 кг) в день составляет соответственно приблизительно 1 мг - 1000 мг, предпочтительно, приблизительно от 3 мг до 300 мг и, более предпочтительно, приблизительно от 10 мг до 200 мг, и это количество вводят однократно или в 2-х - 4-х разделенных дозах. Кроме того, в случае внутривенного введения, в зависимости от симптома, обычно, количество вводимого соединения по настоящему изобретению для взрослого человека в сутки составляет соответственно приблизительно от 0,01 мг до 100 мг, предпочтительно, от приблизительно 0,01 мг до приблизительно 50 мг, и более предпочтительно, от приблизительно 0,01 мг до приблизительно 20 мг на килограмм массы, и это количество вводят один раз или в нескольких разделенных дозах в день. Кроме того, композиция фармацевтического средства, содержащая соединение по настоящему изобретению, может, соответственно, содержать другие антиаритмические средства или биологически активные вещества различных типов, при условии, что это не противоречит цели настоящего изобретения.
[0066] Примеры твердых композиций для перорального введения в соответствии с настоящим изобретением, включают таблетки, порошки и гранулы. Такие твердые композиции могут быть получены путем смешивания одного или нескольких видов активных ингредиентов, по крайней мере с одним инертным наполнителем, таким как, лактоза, маннит, глюкоза, гидроксипропилцеллюлоза, тонкокристаллическая целлюлоза, крахмал, поливинилпирролидон или метасиликат алюминат магния. Твердая композиция может содержать добавку, другую, чем инертное вспомогательное вещество, например, смазывающий агент, диспергирующий агент, стабилизирующий агент, солюбилизирующий агент или средство, способствующее растворению, в соответствии с общим способом. Таблетки или пилюли могут иметь, например, сахарное покрытие, или иметь растворимые в желудке или в кишечнике пленочные покрытия из сахарозы, желатина, фталата гидроксипропилцеллюлозы или гидроксипропилметилцеллюлозы, при необходимости.
[0067] Жидкая композиция для перорального введения может быть в виде, например, эмульсии, раствора, суспензии, сиропа или эликсира, который является фармацевтически приемлемым и может содержать обычно используемый инертный разбавитель, например, очищенная вода или этанол. Композиция, кроме инертного разбавителя, может также содержать добавку, например, вспомогательный агент, такой как смачивающий агент или суспендирующий агент, подсластитель, вкусовой агент, ароматический агент или антисептическое средство.
[0068] Инъекции для парентерального введения могут быть в виде стерильного водного или неводного раствора, суспензии или эмульсии. Водорастворимый раствор или суспензия могут содержать, например, в качестве разбавителя, дистиллированную воду для инъекций и физиологический раствор. Водонерастворимый раствор или суспензия может содержать, например, в качестве разбавителя, пропиленгликоль, полиэтиленгликоль, растительное масло, такое как оливковое масло, спирт, такой как этанол, или полисорбат 80. Такая композиция может дополнительно содержать вспомогательный агент, такой как антисептическое вещество, смачивающее вещество, эмульгатор, диспергирующий агент, стабилизирующий агент, солюбилизирующий агент или вещество, способствующее растворению. Они могут быть стерилизованы, например, путем фильтрации через фильтр, задерживающий бактерии, включением дезинфицирующего средства или облучением. Кроме того, стерильная твердая композиция может быть получена и растворяться в стерильной воде или стерильном растворителе для инъекций перед использованием, и полученный раствор может быть также использован.
Примеры
[0069] В дальнейшем настоящее изобретение будет описано с помощью примеров. Тем не менее, настоящее изобретение не ограничивается этими примерами.
[0070] Ссылочный пример 1
Трет-бутиловый эфир N-[(1S,5R,6R)-6-ацетиламино-5-(1-этилпропокси)-3-(метоксиметилкарбамоил)-3-циклогексен-1-ил]карбаминовой кислоты
[0071]

[0072] (3R,4R,5S)-4-Ацетиламино-5-трет-бутилкарбониламино-3-(1-этилпропокси)-1-циклогексен-1-карбоновую кислоту (1,69 г) растворяли в DMF (20 мл), последовательно добавляли HATU (2,0 г), гидрохлорид N,O-диметилгидроксиламина (643 мг) и N,N-диизопропилэтиламин (1,70 г), и реакционную смесь перемешивали в течение ночи при комнатной температуре. Растворитель отгоняли при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле (20-20% метанол/хлороформ) с получением указанного в заголовке соединения (1,72 г) в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ: 0,90 (3H, т, J=7,4 Гц), 0,91 (3H, т, J=7,4 Гц), 1,42 (9H, с), 1,43-1,55 (4H, м), 1,99 (3H, с), 2,37-2,50 (1H, м), 2,60-2,70 (1H, м), 3,23 (3H, с), 3,29-3,36 (1H, м), 3,65 (3H, с), 3,76-3,93 (2H, м), 4,08-4,18 (1H, м), 5,18 (1H, д, J=8,6 Гц), 5,70 (1H, д, J=9,0 Гц), 6,09-6,15 (1H, м).
ESI-MS Обнаружено: m/z 428 (M+H)+
[0073] Ссылочный пример 2
N-[(1R,2R,6S)-6-азидо-2-(1-этилпропокси)-4-гидроксиметил-3-циклогексен-1-ил]ацетамид
[0074]

[0075] Этиловый эфир (3R,4R,5S)-4-ацетиламино-5-азидо-3-(1-этилпропокси)-1-циклогексен-1-карбоновой кислоты (100 мг) растворяли в дихлорметане (3 мл), 1 моль/л DIBAL (раствор гексана) (740 мкл) добавляли по каплям с охлаждением при -78°C, и реакционную смесь перемешивали в течение 110 минут при той же самой температуре. Добавляли 1 моль/л DIBAL (раствор гексана) (147 мкл), реакционную смесь перемешивали в течение 30 минут при той же самой температуре, и затем ее температуру повышали до -40°C в течение 2-х часов. К реакционной смеси добавляли метанол (1 мл) и насыщенный водный раствор соли Рошеля (1 мл), температуру смеси повышали до значения комнатной температуры, а затем полученную смесь экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (25-100% этилацетат/гексан) с получением указанного в заголовке бесцветного твердого вещества (54 мг).
1H-ЯМР (CDCl3) δ: 0,89 (3H, т, J=7,6 Гц), 0,90 (3H, т, J=7,6 Гц), 1,38-1,58 (4H, м), 2,04 (3H, с), 2,04-2,19 (1H, м), 2,46 (1H, дд, J=5,6, 17,1 Гц), 3,24-3,43 (2H, м), 4,04 (2H, с), 4,27 (1H, тд, J=5,9, 10,6 Гц), 4,41 1H, д, J=8,2 Гц), 5,60-5,73 (2H, м).
ESI-MS Обнаружено: 297 (M+H)+
[0076] Ссылочный пример 3
Трет-бутиловый эфир N-[(1S,5R,6R)-6-ацетиламино-3-бензоил-5-(1-этилпропокси)-3-циклогексен-1-ил]карбаминовой кислоты
[0077]

[0078] Соединение по ссылочному примеру 1 (2,14 г) растворяли в ТГФ (42 мл), 1,08 моль/л фениллития (раствор циклогексана-диэтилового эфира) (18,5 мл) добавляли по каплям с охлаждением при -78°C, и реакционную смесь перемешивали в течение 2 часов при той же самой температуре и в течение 1 часа при -60°C. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония, температуру смеси повышали до значения комнатной температуры, и затем смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (17-50% этилацетат/гексан) с получением указанного в заголовке бесцветного твердого вещества (1,25 г).
1H-ЯМР (CDCl3) δ: 0,82 (3H, т, J=6,6 Гц), 0,87 (3H, т, J=6,6 Гц), 1,38-1,54 (4H, м), 1,44 (9H, с), 2,00 (3H, с), 2,25-2,40 (1H, м), 3,02 (1H, дд, J=4,9, 17,7 Гц), 3,21-3,30 (1H, м), 3,79-3,94 (1H, м), 3,97-4,05 (1H, м), 4,10-4,24 (1H, м), 5,04 (1H, д, J=9,0 Гц), 5,90 (1H, д, J=9,2 Гц), 6,33-6,36 (1H, м), 7,38-7,47 (2H, м), 7,50-7,58 (1H, м), 7,69 (2H, д, J=7,0 Гц).
ESI-MS Обнаружено: 445 (M+H)+
[0079] Ссылочный пример 4
Трет-бутиловый эфир N-[(1S,5R,6R)-6-ацетиламино-5-(1-этилпропокси)-3-пентаноил-3-циклогексен-1-ил]карбаминовой кислоты
[0080]

[0081] Соединение по ссылочному примеру 1 (150 мг) растворяли в ТГФ (2 мл), по каплям добавляли 2,6 моль/л н-бутиллития (раствор гексана) (840 мкл) с охлаждением при -78°C, и реакционную смесь перемешивали в течение 2 часов при той же самой температуре. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония, температуру смеси повышали до значения комнатной температуры, и затем смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (20-100% этилацетат/гексан) с получением указанного в заголовке бесцветного твердого вещества (121 мг).
1H-ЯМР (CDCl3) δ: 0,84-0,97 (9H, м), 1,26-1,38 (2H, м), 1,42 (9H, с), 1,45-1,64 (8H, м), 1,99 (3H, с), 2,06-2,22 (1H, м), 2,79 (1H, дд, J=5,3, 17,6 Гц), 3,35 (1H, т, J=5,7 Гц), 3,68-3,82 (1H, м), 3,95-4,12 (2H, м), 4,92 (1H, д, J=9,0 Гц), 5,77 (1H, д, J=9,0 Гц), 6,33 (1H, с).
ESI-MS Обнаружено: 425 (M+H)+
[0082] Ссылочный пример 5
Трет-бутиловый эфир N-[(1R,2R,6S)-6-азидо-2-(1-этилпропокси)-4-(метоксиметилкарбамоил)-3-циклогексен-1-ил]карбаминовой кислоты
[0083]

[0084] (3R,4R,5S)-5-азидо-4-трет-бутоксикарбониламино-3-(1-этилпропокси)-1-циклогексен-1-карбоновую кислоту (3,2 г) растворяли в DMF (87 мл) добавляли и PyBOP (5,4 г) и N,O-диметил гидроксиламин гидрохлорид (1,3 г). После охлаждения льдом, добавляли триэтиламин (3,6 мл), и реакционную смесь перемешивали в течение 3 часов при комнатной температуре. Растворитель отгоняли при пониженном давлении. К полученному остатку добавляли насыщенный водный раствор гидрокарбоната натрия и воду, и реакционную смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (15-75% этилацетат/гексан) с получением указанного в заголовке бесцветного твердого вещества (3,4 г).
1H-ЯМР (CDCl3) δ: 0,89 (3H, т, J=7,3 Гц), 0,91 (3H, т, J=7,6 Гц), 1,44-1,59 (4H, м), 1,46 (9H, с), 2,29-2,43 (1H, м), 2,74 (1H, дд, J=5,5, 17,0 Гц), 3,23 (3H, с), 3,24-3,34 (2H, м), 3,64 (3H, с), 4,06-4,22 (1H, м), 4,30-4,42 (1H, м), 4,78-4,90 (1H, м), 6,10-6,13 (1H, м).
ESI-MS Обнаружено: m/z 446 (M+Cl)-
[0085] Ссылочный пример 6
Трет-бутиловый эфир N-[(1R,2R,6S)-6-азидо-4-бензоил-2-(1-этилпропокси)-3-циклогексен-1-ил]карбаминовой кислоты
[0086]

[0087] Соединение по ссылочному примеру 5 (1,9 г) растворяли в ТГФ (60 мл), 1,04 моль/л фениллития (раствор циклогексана-диэтилового эфира) (11,6 мл) добавляли по каплям с охлаждением при -78°C, и реакционную смесь перемешивали в течение 2 часов при той же самой температуре. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония, температуру смеси повышали до значения комнатной температуры и затем смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Полученный остаток суспендировали в смеси этанол/вода (1:1) (200 мл), и затем собирали фильтрацией и промывали смесью этанол/вода (1:1) (50 мл) с получением указанного в заголовке твердого вещества желтого цвета (1,7 г).
1H-ЯМР (CDCl3) δ: 0,83 (3H, т, J=7,3 Гц), 0,90 (3H, т, J=7,3 Гц), 1,37-1,59 (4H, м), 1,47 (9H, с), 2,20-2,39 (1H, м), 3,09 (1H, дд, J=6,0, 17,2 Гц), 3,15-3,32 (2H, м), 4,17-4,40 (1H, м), 4,48-4,67 (1H, м), 4,85-5,07 (1H, м), 6,31-6,38 (1H, м), 7,39-7,48 (2H, м), 7,50-7,59 (1H, м), 7,64-7,74 (2H, м).
ESI-MS Обнаружено: m/z 463 (M+Cl)-
[0088] Ссылочный пример 7
Трет-бутиловый эфир N-[(1R,2R,6S)-6-ацетиламино-4-бензоил-2-(1-этилпропокси)-3-циклогексен-1-ил]карбаминовой кислоты
[0089]

[0090] Соединение в соответствии с примером 15 (116 мг) растворяли в дихлорметане (6 мл), добавляли уксусный ангидрид (33 мкл), триэтиламин (80 мкл), и 4-диметиламинопиридин (7 мг) при охлаждении льдом, и реакционную смесь перемешивали в течение 10 минут при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония, и затем экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (0-10% метанол/хлороформ) с получением указанного в заголовке бесцветного твердого вещества (120 мг).
1H-ЯМР (CDCl3) δ: 0,83 (3H, т, J=7,4 Гц), 0,90 (3H, т, J=7,4 Гц), 1,31-1,62 (4H, м), 1,45 (9H, с), 1,97 (3H, с), 2,26-2,47 (1H, м), 2,98 (1H, дд, J=4,5, 18,2 Гц), 3,21-3,41 (1H, м), 3,71-3,91 (1H, м), 3,95-4,06 (1H, м), 4,09-4,32 (1H, м), 4,57-4,74 (1H, м), 6,32-6,36 (1H, м), 6,40 (1H, д, J=8,6 Гц), 7,37-7,50 (2H, м), 7,50-7,59 (1H, м), 7,62-7,74 (2H, м).
ESI-MS Обнаружено: m/z 445 (M+H)+
[0091] Ссылочный пример 8
Трет-бутиловый эфир N-[(1R,2R,6S)-6-азидо-2-(1-этилпропокси)-4-(тиофен-2-карбонил)-3-циклогексен-1-ил]карбаминовой кислоты
[0092]

[0093] Указанное в заголовке аморфное соединение светло-желтого цвета (1,49 г) получали способом, аналогичным описанному в ссылочном примере 6, используя соединение по ссылочному примеру 5 (1,5 г) и 2-тиэниллитий (2,1 мл).
1H-ЯМР (CDCl3) δ: 0,90 (3H, т, J=7,3 Гц), 0,92 (3H, т, J=7,3 Гц), 1,47 (9H, с), 1,49-1,58 (4H, м), 2,22-2,39 (1H, м), 3,03 (1H, дд, J=5,4, 17,9 Гц), 3,13-3,27 (1H, м), 3,27-3,38 (1H, м), 4,23-4,37 (1H, м), 4,53-4,65 (1H, м), 4,89-5,00 (1H, м), 6,51-6,56 (1H, м), 7,13 (1H, дд, J=3,8, 4,9 Гц), 7,61-7,70 (2H, м).
ESI-MS Обнаружено: m/z 469 (M+Cl)-
[0094] Ссылочный пример 9
N-[(1R,2R,6S)-6-азидо-4-этоксиметил-2-(1-этилпропокси)-3-циклогексен-1-ил]ацетамид
[0095]
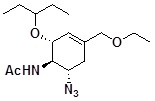
[0096] Соединение по ссылочному примеру 2 (100 мг) растворяли в ТГФ (2 мл), гидрид натрия (16 мг) добавляли при охлаждении льдом, и реакционную смесь перемешивали в течение 15 минут при той же самой температуре. Иодэтан (63 мг) добавляли при комнатной температуре, и реакционную смесь перемешивали в течение 1 часа при 60°C. Добавляли иодэтан (63 мг) при комнатной температуре, и реакционную смесь перемешивали в течение 17 часов при 60°C. Добавляли гидрид натрия (16 мг) при охлаждении льдом, и реакционную смесь перемешивали в течение 5 минут при той же самой температуре. Добавляли иодэтан (63 мг) при комнатной температуре, и реакционную смесь перемешивали в течение 4 часов при температуре 60°C. ТГФ отгоняли при пониженном давлении, добавляли насыщенный водный раствор хлорида аммония и воду, и затем экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (25-75% этилацетат/гексан) с получением указанного в заголовке твердого вещества желтого цвета(67 мг).
1H-ЯМР (CDCl3) δ: 0,89 (6H, т, J=7,4 Гц), 1,20 (3H, т, J=7,1 Гц), 1,41-1,57 (4H, м), 2,03 (3H, с), 2,03-2,14 (1H, м), 2,50 (1H, дд, J=5,9, 17,4 Гц), 3,22-3,33 (1H, м), 3,34-3,42 (1H, м), 3,45 (2H, q, J=7,1 Гц), 3,85 (2H, с), 4,23 (1H, тд, J=5,9, 10,5 Гц), 4,38 (1H, д, J=8,6 Гц), 5,60-5,70 (2H, м).
ESI-MS Обнаружено: 325 (M+H)+
[0097] Ссылочный пример 10
[(3R,4R,5S)-5-азидо-4-этиламино-3-(1-этилпропокси)циклогексен-1-ил]тиофен-2-ил-метанон
[0098]

[0099] Соединение в соответствии с примером 20 (164 мг) растворяли в дихлорметане (10 мл), добавляли сульфат магния (118 мг) и ацетальдегид (41 мкл) при охлаждении льдом, и реакционную смесь перемешивали в течение 1 часа при той же самой температуре. Растворитель и оставшийся ацетальдегид отгоняли один раз при пониженном давлении, затем к полученному остатку добавляли дихлорметан (10 мл), добавляли уксусную кислоту (84 мкл) и триацетоксиборгидрид натрия (415 мг) при охлаждении льдом, и реакционную смесь перемешивали в течение 0,5 часа при комнатной температуре. К реакционному раствору добавляли насыщенный водный раствор гидрокарбоната натрия, и затем экстрагировали хлороформом. Органический слой промывали насыщенным солевым раствором и потом сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (20-50% этилацетат/гексан) с получением указанного в заголовке маслянистого вещества желтого цвета (165 мг).
1H-ЯМР (CDCl3) δ: 0,92 (3H, т, J=7,3 Гц), 0,93 (3H, т, J=7,3 Гц), 1,16 (3H, т, J=7,1 Гц), 1,45-1,68 (5H, м), 2,30-2,45 (1H, м), 2,74 (1H, дд, J=8,4, 10,4 Гц), 2,79-2,97 (2H, м), 3,03 (1H, дд, J=5,6, 17,9 Гц), 3,31-3,38 (1H, м), 3,53-3,64 (1H, м), 3,96-4,04 (1H, м), 6,55-6,59 (1H, м), 7,13 (1H, дд, J=3,8, 4,9 Гц), 7,64-7,70 (2H, м).
ESI-MS Обнаружено: 363 (M+H)+
[0100] Ссылочный пример 11
N-[(1R,2R,6S)-6-азидо-2-(1-этилпропокси)-4-(тиофен-2-карбонил)-3-циклогексен-1-ил]-N-этилацетамид
[0101]

[0102] Указанное в заголовке маслянистое вещество желтого цвета (69 мг) получали способом, аналогичным описанному в ссылочном примере 7, используя соединение по ссылочному примеру 10 (61 мг).
1H-ЯМР (CDCl3) δ: 0,84 (3H, т, J=7,5 Гц), 0,89 (3H, т, J=7,4 Гц), 1,31 (3H, т, J=7,2 Гц), 1,39-1,51 (4H, м), 2,14 (3H, с), 2,19-2,33 (1H, м), 2,90-3,07 (2H, м), 3,21-3,30 (1H, м), 3,34-3,57 (2H, м), 4,82-4,99 (1H, м), 5,05-5,14 (1H, м), 6,52-6,56 (1H, м), 7,13 (1H, дд, J=3,8, 4,9 Гц), 7,65-7,68 (2H, м).
ESI-MS Обнаружено: m/z 405 (M+H)+
[0103] Ссылочный пример 12
[(1R,2R,6S)-6-азидо-2-(1-этилпропокси)-4-(тиофен-2-карбонил)циклогексен-3-ил]-3-этилмочевина
[0104]
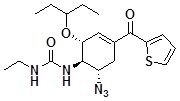
[0105] Соединение в соответствии с примером 20 (164 мг) растворяли в ТГФ (10 мл), добавляли этилизоцианат (157 мг), и реакционную смесь перемешивали в течение 15 часов при 50°C. Растворитель отгоняли при пониженном давлении, к полученному остатку добавляли этилацетат, и применяли ультразвуковую стимуляцию. Затем осажденное твердое вещество собирали фильтрацией, и полученное твердое вещество промывали гексаном и сушили при пониженном давлении с получением указанного в заголовке твердого вещества светло-желтого цвета (129 мг).
1H-ЯМР (CDCl3) δ: 0,90 (3H, т, J=7,4 Гц), 0,91 (3H, т, J=7,4 Гц), 1,16 (3H, т, J=7,2 Гц), 1,44-1,57 (4H, м), 2,31-2,44 (1H, м), 3,07 (1H, дд, J=5,6, 17,7 Гц), 3,18-3,41 (4H, м), 4,18-4,31 (1H, м), 4,58 (1H, д, J=7,3 Гц), 4,66 (1H, д, J=6,8 Гц), 4,74 (1H, ушир.с), 6,53-6,57 (1H, м), 7,14 (1H, дд, J=3,9, 4,9 Гц), 7,65-7,70 (2H, м).
ESI-MS Обнаружено: m/z 406 (M+H)+
[0106] Ссылочный пример 13
Трет-бутиловый эфир N-[(1S,5R,6R)-6-ацетиламино-5-(1-этилпропокси)-3-гидроксиметил-3-циклогексен-1-ил]карбаминовой кислоты
[0107]
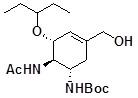
[0108] (3R,4R,5S)-4-ацетиламино-5-трет-бутилкарбониламино-3-(1-этилпропокси)-1-циклогексен-1-карбоновую кислоту (200 мг) растворяли в дихлорметане (2 мл), добавляли триэтиламин (63 мг), добавляли при охлаждении льдом этилхлорформиат (62 мг) и реакционную смесь перемешивали в течение 80 минут при той же самой температуре. Осажденную соль удаляли фильтрованием, затем полученный фильтрат охлаждали до -40°C, медленно добавляли раствор боргидрида натрия (39 мг) в смешанном растворителе, состоящем из ТГФ (1,6 мл) и метанола (0,4 мл), и реакционную смесь перемешивали в течение 1 часа при той же самой температуре. Температуру реакционного раствора повышали до 0°C и перемешивали в течение 10 минут, добавляли насыщенный водный раствор хлорида аммония, и потом экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (0-15% метанол/хлороформ) с получением указанного в заголовке бесцветного аморфного вещества (191 мг).
1H-ЯМР (CDCl3) δ: 0,83-0,92 (6H, м), 1,42 (9H, с), 1,44-1,56 (4H, м), 1,71 (1H, ушир.с), 1,98 (3H, с), 2,03-2,20 (1H, м), 2,35 (1H, дд, J=5,1, 17,2 Гц), 3,30-3,37 (1H, м), 3,71-3,93 (2H, м), 3,94-4,13 (3H, м), 5,30 (1H, д, J=9,0 Гц), 5,67 (1H, с), 5,99 (1H, ушир. с).
ESI-MS Обнаружено: m/z 371 (M+H)+
[0109] Ссылочный пример 14
Трет-бутиловый эфир N-[(1S,5R,6R)-6-ацетиламино-5-(1-этилпропокси)-3-формил-3-циклогексен-1-ил]карбаминовой кислоты
[0110]

[0111] Соединение по ссылочному примеру 13 (926 мг) растворяли в хлороформе (13 мл), добавляли химически обработанный продукт оксида марганца (IV) (2,2 г), и реакционную смесь перемешивали в течение 20 часов при 40°C. Реакционный раствор разбавляли хлороформом и фильтровали через целит, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (1-10% метанол/хлороформ) с получением указанного в заголовке бесцветного твердого вещества (636 мг).
1H-ЯМР (CDCl3) δ: 0,89 (3H, т, J=7,4 Гц), 0,93 (3H, т, J=7,4 Гц), 1,43 (9H, с), 1,47-1,65 (4H, м), 1,99 (3H, с), 2,03-2,23 (1H, м), 2,74 (1H, дд, J=5,2, 17,9 Гц), 3,33-3,42 (1H, м), 3,72-3,87 (1H, м), 4,03-4,18 (2H, м), 4,96 (1H, д, J=9,3 Гц), 5,80 (1H, д, J=8,1 Гц), 6,59-6,63 (1H, м), 9,50 (1H, с).
ESI-MS Обнаружено: m/z 369 (M+H)+
[0112] Ссылочный пример 15
Трет-бутиловый эфир N-[(1R,2R,6S)-6-ацетиламино-2-(1-этилпропокси)-4-(тиофен-2-карбонил)-3-циклогексен-1-ил]карбаминовой кислоты
[0113]

[0114] Соединение по ссылочному примеру 8 (198 мг) растворяли в смеси ТГФ/вода (4:1) (11 мл), добавляли трифенилфосфин (150 мг) при комнатной температуре, реакционную смесь нагревали и перемешивали в течение ночи при 40°C. Растворитель отгоняли при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле (0-8% метанол/хлороформ) с получением желтой аморфной формы трет-бутилового эфира N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-(тиофен-2-карбонил)-3-циклогексен-1-ил]карбаминовой кислоты (171 мг).
Полученный трет-бутиловый эфир N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-(тиофен-2-карбонил)-3-циклогексен-1-ил]карбаминовой кислоты (171 мг) растворяли в дихлорметане (8 мл), последовательно добавляли триэтиламин (85 мл), 4-диметиламинопиридин (10 мг) и уксусный ангидрид (51 мг) при охлаждении льдом, и реакционную смесь перемешивали в течение 15 минут при той же самой температуре. Добавляли насыщенный водный раствор хлорида аммония, и затем экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (0-7% метанол/хлороформ) с получением указанного в заголовке аморфного вещества желтого цвета (172 мг).
1H-ЯМР (CDCl3) δ: 0,90 (3H, т, J=7,4 Гц), 0,92 (3H, т, J=7,4 Гц), 1,43 (9H, с), 1,47-1,59 (4H, м), 1,97 (3H, с), 2,31-2,46 (1H, м), 2,93 (1H, дд, J=4,5, 18,1 Гц), 3,33-3,45 (1H, м), 3,82 (1H, дд, J=8,8, 18,7 Гц), 4,00-4,07 (1H, м), 4,13-4,28 (1H, м), 4,68 (1H, д, J=9,0 Гц), 6,42 (1H, д, J=8,6 Гц), 6,51-6,55 (1H, м), 7,13 (1H, дд, J=3,8, 4,9 Гц), 7,62-7,69 (2H, м).
ESI-MS Обнаружено: m/z 451 (M+H)+
[0115] Пример 1
N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-(тиофен-2-карбонил)-3-циклогексен-1-ил]ацетамид
[0116]

[0117] Соединение по ссылочному примеру 1 (5,0 г) растворяли в ТГФ (100 мл), добавляли по каплям приблизительно 1 моль/л 2-тиэниллития (раствор ТГФ) (47 мл) с охлаждением при -78°C, и реакционную смесь перемешивали в течение 1,5 часов при той же самой температуре. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония, температуру смеси повышали до значения комнатной температуры, и затем смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (15-100% этилацетат/гексан) с получением твердой желтого цвета формы трет-бутилового эфира N-[(1S,5R,6R)-6-ацетиламино-5-(1-этилпропокси)-3-(тиофен-2-карбонил)-3-циклогексен-1-ил]карбаминовой кислоты (4,3 г).
Полученный трет-бутиловый эфир N-[(1S,5R,6R)-6-ацетиламино-5-(1-этилпропокси)-3-(тиофен-2-карбонил)-3-циклогексен-1-ил]карбаминовой кислоты (2,06 г) растворяли в дихлорметане (40 мл), добавляли по каплям трифторуксусную кислоту (6,8 мл) при охлаждении льдом, и реакционную смесь перемешивали в течение 13 часов при комнатной температуре. Реакционный раствор отгоняли один раз при пониженном давлении, к полученному остатку добавляли насыщенный водный раствор гидрокарбоната натрия, и затем экстрагировали хлороформом. Органический слой промывали насыщенным солевым раствором, и затем сушили над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (2-22% метанол/хлороформ) с получением указанного в заголовке твердого вещества светло-желтого цвета (1,33 г).
1H-ЯМР (CDCl3) δ: 0,89 (3H, т, J=7,3 Гц), 0,90 (3H, т, J=7,3 Гц), 1,43-1,58 (6H, м), 2,07 (3H, с), 2,16-2,30 (1H, м), 2,96 (1H, дд, J=5,0, 17,1 Гц), 3,26-3,40 (2H, м), 3,56-3,66 (1H, м), 4,23-4,32 (1H, м), 5,59 (1H, д, J=8,1 Гц), 6,50-6,55 (1H, м), 7,13 (1H, дд, J=3,9, 4,9 Гц), 7,64-7,70 (2H, м).
ESI-MS Обнаружено: m/z 351 (M+H)+
[0118] Пример 2
N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-(тиофен-2-карбонил)-3-циклогексен-1-ил]ацетамид гидрохлорид
[0119]

[0120] Соединение в соответствии с примером 1 (1,27 г) растворяли в смешанном растворе ацетонитрила (20 мл) и метанола (2 мл), добавляли по каплям 4 моль/л раствора хлористого водорода в диоксане (1,81 мл) при охлаждении льдом, и реакционную смесь перемешивали в течение 10 минут при комнатной температуре. После того, как реакционный раствор оставляли отстаиваться еще в течение 15 минут при той же самой температуре, осажденное твердое вещество собирали фильтрацией, промывали ацетонитрилом и сушили при пониженном давлении с получением указанного в заголовке бесцветного твердого вещества (1,35 г).
1H-ЯМР (DMSO-d6) δ: 0,80 (3H, т, J=7,2 Гц), 0,82 (3H, т, J=7,3 Гц), 1,36-1,50 (4H, м), 1,91 (3H, с), 2,45-2,55 (1H, м), 2,90 (1H, дд, J=5,3, 17,0 Гц), 3,35-3,46 (2H, м), 3,81-3,92 (1H, м), 4,30 (1H, д, J=8,4 Гц), 6,55 (1H, ушир. с), 7,28 (1H, дд, J=3,8, 5,0 Гц), 7,79 (1H, дд, J=1,0, 3,8 Гц), 8,08 (1H, дд, J=1,0, 5,0 Гц), 8,13-8,20 (3H, м).
ESI-MS Обнаружено: m/z 351 (M+H)+
[0121] Пример 3
N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-(5-метилфуран-2-карбонил)-3-циклогексен-1-ил]ацетамид
[0122]

[0123] 2-Метилфуран (288 мг) растворяли в ТГФ (5 мл), добавляли по каплям 2,65 моль/л н-бутиллития (раствор гексана) (1,05 мл) с охлаждением при -78°C, реакционную смесь перемешивали в течение 30 минут при комнатной температуре. К реакционному раствору добавляли раствор ТГФ (1 мл) соединения по ссылочному примеру 1 (100 мг) с охлаждением при -78°C, и реакционную смесь перемешивали в течение 2 часов при той же самой температуре. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония, температуру смеси повышали до значения комнатной температуры, и затем смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (15-100% этилацетат/гексан) с получением бесцветной твердой формы трет-бутилового эфира N-[(1S,5R,6R)-6-ацетиламино-5-(1-этилпропокси)-3-(5-метилфуран-2-карбонил)-3-циклогексен-1-ил]карбаминовой кислоты (91 мг).
Полученный трет-бутиловый эфир N-[(1S,5R,6R)6-ацетиламино-5-(1-этилпропокси)-3-(5-метилфуран-2-карбонил)-3-циклогексен-1-ил]карбаминовой кислоты (85 мг) растворяли в дихлорметане (5 мл), добавляли по каплям трифторуксусную кислоту (422 мкл) при охлаждении льдом, и реакционную смесь перемешивали в течение 15 часов при комнатной температуре. Реакционный раствор отгоняли один раз при пониженном давлении, к полученному остатку добавляли насыщенный водный раствор гидрокарбоната натрия, и затем экстрагировали хлороформом. Органический слой промывали насыщенным солевым раствором и затем сушили над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на базовом силикагеле (2-22% метанол/хлороформ) с получением указанного в заголовке твердого вещества светло-желтого цвета (46 мг).
1H-ЯМР (CDCl3) δ: 0,91 (3H, т, J=7,4 Гц), 0,92 (3H, т, J=7,4 Гц), 1,47-1,57 (6H, м), 2,06 (3H, с), 2,15-2,27 (1H, м), 2,40 (3H, с), 2,94 (1H, дд, J=5,2, 17,5 Гц), 3,25-3,35 (2H, м), 3,55-3,65 (1H, м), 4,23-4,29 (1H, м), 5,54 (1H, д, J=8,2 Гц), 6,16 (1H, д, J=3,5 Гц), 6,62-6,66 (1H, м), 7,10 (1H, д, J=3,5 Гц).
ESI-MS Обнаружено: m/z 349 (M+H)+
[0124] Пример 4
N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-(5-метилтиофен-2-карбонил)-3-циклогексен-1-ил]ацетамид
[0125]
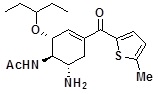
[0126] Указанное в заголовке твердое вещество светло-желтого цвета (132 мг) получали способом, аналогичным описанному в примере 3, используя соединение по ссылочному примеру 1 (150 мг), 2-метилтиофен (517 мг) и 2,65 моль/л н-бутиллития (раствор гексана) (5,05 ммоль).
1H-ЯМР (CD3OD) δ: 0,89 (6H, т, J=7,4 Гц), 1,46-1,58 (4H, м), 2,04 (3H, с), 2,33-2,46 (1H, м), 2,55 (3H, с), 2,95 (1H, дд, J=5,6, 17,3 Гц), 3,25-3,45 (2H, м), 3,94 (1H, дд, J=8,6, 11,0 Гц), 4,24 (1H, д, J=8,2 Гц), 6,51-6,55 (1H, м), 6,91 (1H, д, J=3,7 Гц), 7,59 (1H, д, J=3,7 Гц).
ESI-MS Обнаружено: m/z 365 (M+H)+
[0127] Пример 5
N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-(4-фторбензоил)-3-циклогексен-1-ил]ацетамид
[0128]

[0129] Соединение по ссылочному примеру 1 (270 мг) растворяли в ТГФ (4 мл), добавляли по каплям 1,0 моль/л бромида 4-фторфенилмагния (раствор ТГФ) (5,68 ммоль) при охлаждении льдом, и реакционную смесь перемешивали в течение 1,5 часов при той же самой температуре. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония, и реакционную смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (25-100% этилацетат/гексан) с получением бесцветной аморфной формы трет-бутилового эфира N-[(1S,5R,6R]-6-ацетиламино-5-(1-этилпропокси)-3-(4-фторбензоил)-3-циклогексен-1-ил) карбаминовой кислоты (56 мг).
Полученный трет-бутиловый эфир N-[(1S,5R,6R]-6-ацетиламино-5-(1-этилпропокси)-3-(4-фторбензоил)-3-циклогексен-1-ил) карбаминовой кислоты (50 мг) растворяли в дихлорметане (1 мл), добавляли по каплям трифторуксусную кислоту (161 мкл) при охлаждении льдом, и реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционный раствор отгоняли один раз при пониженном давлении, к полученному остатку добавляли насыщенный водный раствор гидрокарбоната натрия, и затем экстрагировали хлороформом. Органический слой промывали насыщенным солевым раствором и затем сушили над безводным сульфатом натрия, растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на базовом силикагеле (5-25% метанол/хлороформ) с получением указанного в заголовке твердого вещества светло-желтого цвета (19 мг).
1H-ЯМР (DMSO-d6) δ: 0,73 (3H, т, J=6,3 Гц), 0,78 (3H, т, J=6,3 Гц), 1,26-1,45 (4H, м), 1,51 (2H, ушир. с), 1,86 (3H, с), 1,99-2,19 (1H, м), 2,67-2,88 (2H, м), 3,21-3,29 (1H, м), 3,48-3,61 (1H, м), 4,04 (1H, д, J=8,4 Гц), 6,17-6,20 (1H, м), 7,29-7,39 (2H, м), 7,70-7,80 (3H, м).
ESI-MS Обнаружено: m/z 363 (M+H)+
[0130] Пример 6
N-[(1R,2R,6S)-6-амино-4-бензоил-2-(1-этилпропокси)-3-циклогексен-1-ил]ацетамид гидрохлорид
[0131]

[0132] Соединение по ссылочному примеру 3 (1,0 г) растворяли в 2-пропаноле (8 мл), добавляли концентрированную соляную кислоту (413 мкл), и реакционную смесь перемешивали в течение 6 часов при 80°C. Реакционный раствор охлаждали льдом, и осажденные кристаллы собирали фильтрацией с получением указанного в заголовке бесцветного твердого вещества (773 мг).
1H-ЯМР (CD3OD) δ: 0,81 (3H, т, J=7,4 Гц), 0,87 (3H, т, J=7,4 Гц), 1,37-1,57 (4H, м), 2,05 (3H, с), 2,45-2,61 (1H, м), 3,13 (1H, дд, J=5,7, 17,4 Гц), 3,29-3,41 (1H, м), 3,53-3,67 (1H, м), 4,00-4,10 (1H, м), 4,32 (1H, д, J=8,4 Гц), 6,44 (1H, м), 7,44-7,55 (2H, м), 7,57-7,66 (1H, м), 7,68-7,77 (2H, м).
ESI-MS Обнаружено: m/z 345 (M+H)+
[0133] Пример 7
N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-фенилацетил-3-циклогексен-1-ил]ацетамид
[0134]

[0135] Указанное в заголовке бесцветное аморфное вещество (56 мг) получали способом, аналогичным описанному в примере 5, используя соединение по ссылочному примеру 1 (150 мг) и 0,93 моль/л хлорида бензилмагния (раствор ТГФ) (3,51 ммоль).
1H-ЯМР (CD3OD) δ: 0,89 (3H, т, J=7,4 Гц), 0,92 (3H, т, J=7,4 Гц), 1,45-1,59 (4H, м), 2,01 (3H, с), 2,12-2,25 (1H, м), 2,88 (1H, дд, J=5,4, 17,1 Гц), 3,16-3,31 (1H, м), 3,39-3,47 (1H, м), 3,81 (1H, дд, J=8,6, 11,0 Гц), 4,01 (1H, д, J=15,3 Гц), 4,09 (1H, д, J=15,3 Гц), 4,19-4,25 (1H, м), 6,88-6,93 (1H, м), 7,16-7,32 (5H, м).
ESI-MS Обнаружено: m/z 359 (M+H)
[0136] Пример 8
N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-(фуран-2-карбонил)-3-циклогексен-1-ил]ацетамид
[0137]

[0138] Указанное в заголовке твердое вещество светло-желтого цвета (55 мг) получали способом, аналогичным описанному в примере 3, используя соединение по ссылочному примеру 1 (150 мг), фуран (358 мг) и 2,65 моль/л н-бутиллития (раствор гексана) (4,21 ммоль).
1H-ЯМР (CDCl3) δ: 0,91 (3H, т, J=7,6 Гц), 0,92 (3H, т, J=7,6 Гц), 1,46-1,59 (4H, м), 2,00 (2H, ушир. с), 2,07 (3H, с), 2,20-2,34 (1H, м), 2,96 (1H, дд, J=4,7, 17,3 Гц), 3,28-3,41 (2H, м), 3,64 (1H, дд, J=8,5, 18,8 Гц), 4,31 (1H, д, J=8,4 Гц), 5,75-5,84 (1H, м), 6,54 (1H, дд, J=1,6, 3,5 Гц), 6,72-6,78 (1H, м), 7,19 (1H, д, J=3,5 Гц), 7,63 (1H, д, J=1,6 Гц).
ESI-MS Обнаружено: m/z 335 (M+H)+
[0139] Пример 9
N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-(1-метил-1H-пиррол-2-карбонил)-3-циклогексен-1-ил]ацетамид
[0140]

[0141] Указанное в заголовке твердое вещество светло-желтого цвета (58 мг) получали способом, аналогичным описанному в примере 3, используя соединение по ссылочному примеру 1 (300 мг), 1-метилпиррол (626 мг) и трет-бутиллитий (раствор пентана) (7,02 ммоль).
1H-ЯМР (CDCl3) δ: 0,89 (3H, т, J=7,2 Гц), 0,90 (3H, т, J=7,2 Гц), 1,44-1,64 (6H, м), 2,06 (3H, с), 2,15-2,28 (1H, м), 2,90 (1H, дд, J=5,0, 17,5 Гц), 3,23-3,36 (2H, м), 3,55-3,68 (1H, м), 3,92 (3H, с), 4,22 (1H, д, J=8,6 Гц), 5,55 (1H, д, J=7,9 Гц), 6,12 (1H, дд, J=2,6, 4,0 Гц), 6,33-6,38 (1H, м), 6,81-6,90 (2H, м).
ESI-MS Обнаружено: m/z 348 (M+H)+
[0142] Пример 10
N-[(1R,2R,6S)-6-амино-4-(2,2-диметилпропионил)-2-(1-этилпропокси)-3-циклогексен-1-ил]ацетамид
[0143]

[0144]
Указанное в заголовке твердое вещество светло-желтого цвета (40 мг) получали способом, аналогичным описанному в примере 1, используя соединение по ссылочному примеру 1 (200 мг) и трет-бутиллитий (2,33 ммоль).
1H-ЯМР (CDCl3) δ: 0,89 (3H, т, J=7,6 Гц), 0,91 (3H, т, J=7,6 Гц), 1,25 (9H, с), 1,43-1,57 (4H, м), 2,04 (3H, с), 2,17-2,32 (1H, м), 2,50-2,80 (3H, м), 3,23-3,36 (2H, м), 3,69 (1H, дд, J=8,5, 18,8 Гц), 4,17 (1H, д, J=8,8 Гц), 6,12 (1H, ушир. с), 6,19-6,25 (1H, м).
ESI-MS Обнаружено: m/z 325 (M+H)+
[0145] Пример 11
N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-(тиазол-2-карбонил)-3-циклогексен-1-ил]ацетамид
[0146]

[0147]
Указанное в заголовке твердое вещество желтого цвета (73 мг) получали способом, аналогичным описанному в примере 3, используя соединение по ссылочному примеру 1 (200 мг), тиазол (438 мг) и н-бутиллитий (4,68 ммоль).
1H-ЯМР (CD3OD) δ: 0,90 (3H, т, J=7,7 Гц), 0,93 (3H, т, J=7,6 Гц), 1,47-1,60 (4H, м), 2,03 (3H, с), 2,18-2,34 (1H, м), 2,88-3,00 (2H, м), 3,38-3,47 (1H, м), 3,77 (1H, дд, J=9,1, 10,4 Гц), 4,22 (1H, д, J=8,8 Гц), 7,89-7,94 (2H, м), 8,03 (1H, д, J=3,1 Гц).
ESI-MS Обнаружено: m/z 352 (M+H)+
[0148] Пример 12
Гидрохлорид N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-пентаноил-3-циклогексен-1-ил]ацетамида
[0149]

[0150] Соединение по ссылочному примеру 4 (100 мг) растворяли в этилацетате (2 мл), 4 моль/л соляной кислоты (раствор этилацетата) (2 мл) добавляли при охлаждении льдом, и реакционную смесь перемешивали в течение 2 часов при комнатной температуре. Реакционный раствор отгоняли один раз при пониженном давлении и затем разбавляли гексаном, и осажденные кристаллы собирали фильтрованием с получением указанного в заголовке твердого вещества светло-желтого цвета (85 мг).
1H-ЯМР (CD3OD) δ: 0,85-0,98 (11H, м), 1,29-1,39 (2H, м), 1,50-1,62 (6H, м), 2,04 (3H, с), 2,23-2,35 (1H, м), 2,93 (1H, дд, J=5,3, 17,2 Гц), 3,42-3,53 (2H, м), 3,90-3,98 (1H, м), 4,29-4,35 (1H, м), 6,79-6,83 (1H, м).
ESI-MS Обнаружено: m/z 361 (M+H)+
[0151] Пример 13
N-[(1R,2R,6S)-6-амино-4-бензоил-2-(1-этилпропокси)-3-циклогексен-1-ил]ацетамид
[0152]

[0153] Насыщенный водный раствор гидрокарбоната натрия добавляли к соединению в соответствии с примером 6 (457 мг), и реакционную смесь экстрагировали смешанным раствором хлороформа и метанола (10:1). Органический слой промывали насыщенным солевым раствором и затем сушили над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (2-10% метанол/хлороформ) с получением указанного в заголовке бесцветного твердого вещества (413 мг).
1H-ЯМР (CDCl3) δ: 0,83 (3H, т, J=7,4 Гц), 0,88 (3H, т, J=7,4 Гц), 1,38-1,54 (4H, м), 1,56 (2H, ушир. с), 2,06 (3H, с), 2,14-2,28 (1H, м), 3,01 (1H, дд, J=5,3, 17,8 Гц), 3,19-3,29 (1H, м), 3,35 (1H, тд, J=5,3, 10,2 Гц), 3,53-3,65 (1H, м), 4,27 (1H, д, J=8,6 Гц), 5,55 (1H, д, J=7,9 Гц), 6,32-6,36 (1H, м), 7,39-7,47 (2H, м), 7,50-7,58 (1H, м), 7,68-7,74 (2H, м).
ESI-MS Обнаружено: m/z 345 (M+H)+
[0154] Пример 14
[(3R,4R,5S)-4-амино-5-азидо-3-(1-этилпропокси)-1-циклогексен-1-ил]фенилметанон
[0155]

[0156] Соединение по ссылочному примеру 6 (300 мг) растворяли в дихлорметане (7 мл), добавляли по каплям трифторуксусную кислоту (1,56 мл) при охлаждении льдом, и реакционную смесь перемешивали в течение 25 часов при комнатной температуре. Реакционный раствор отгоняли один раз при пониженном давлении, к полученному остатку добавляли насыщенный водный раствор гидрокарбоната натрия, и затем экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия, растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (0-10% метанол/хлороформ) с получением указанного в заголовке маслянистого вещества темно-коричневого цвета (230 мг).
1H-ЯМР (CDCl3) δ: 0,84 (3H, т, J=7,3 Гц), 0,91 (3H, т, J=7,4 Гц), 1,35-1,77 (6H, м), 2,30-2,43 (1H, м), 3,00 (1H, дд, J=8,6, 10,7 Гц), 3,10-3,30 (2H, м), 3,54 (1H, тд, J=5,8, 10,7 Гц), 3,88-3,97 (1H, м), 6,35-6,40 (1H, м), 7,39-7,48 (2H, м), 7,51-7,59 (1H, м), 7,64-7,75 (2H, м).
ESI-MS Обнаружено: m/z 329 (M+H)+
[0157] Пример 15
Трет-бутиловый эфир N-[(1R,2R,6S)-6-амино-4-бензоил-2-(1-этилпропокси)-3-циклогексен-1-ил]карбаминовой кислоты
[0158]

[0159] Соединение по ссылочному примеру 6 (300 мг) растворяли в смеси ТГФ/вода (4:1) (10 мл), добавляли трифенилфосфин (230 мг) при комнатной температуре, реакционную смесь нагревали в течение 18 часов при 40°C. ТГФ отгоняли при пониженном давлении, добавляли хлороформ и воду, и затем экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия, растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (0-10% метанол/хлороформ) с получением указанного в заголовке твердого вещества желтого цвета(274 мг).
1H-ЯМР (CDCl3) δ: 0,83 (3H, т, J=7,3 Гц), 0,90 (3H, т, J=7,4 Гц), 1,47 (9H, с), 1,36-1,62 (6H, м), 2,11-2,27 (1H, м), 3,01 (1H, дд, J=4,1, 17,7 Гц), 3,17-3,41 (3H, м), 4,12-4,26 (1H, м), 4,59-4,73 (1H, м), 6,30-6,37 (1H, м), 7,38-7,48 (2H, м), 7,49-7,58 (1H, м), 7,66-7,77 (2H, м).
ESI-MS Обнаружено: m/z 403 (M+H)+
[0160] Пример 16
N-[(1R,2R,6S)-6-амино-4-бензоил-2-(1-этилпропокси)-3-циклогексен-1-ил]бензамид
[0161]

[0162] Соединение в соответствии с примером 14 (94 мг) растворяли в дихлорметане (6 мл), добавляли бензоил хлорид (37 мкл) и триэтиламин (80 мкл) при охлаждении льдом, и реакционную смесь перемешивали в течение 2,5 часов при комнатной температуре. К реакционному раствору добавляли насыщенный водный раствор гидрокарбоната натрия, и затем экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия, растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (5-35% этилацетат/гексан) с получением светло-желтой твердой формы N-[(1R,2R,6S)-6-азидо-4-бензоил-2-(1-этилпропокси)-3-циклогексен-1-ил]бензамида (97 мг).
Полученный N-[(1R,2R,6S)-6-азидо-4-бензоил-2-(1-этилпропокси)-3-циклогексен-1-ил]бензамид (97 мг) растворяли в смеси ТГФ/вода (4:1) (5 мл), добавляли трифенилфосфин (74 мг) при комнатной температуре, реакционную смесь нагревали в течение 18 часов при 40°C. ТГФ отгоняли при пониженном давлении, полученный остаток разбавляли хлороформ, и затем сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле (0-10% метанол/хлороформ) с получением указанного в заголовке твердого вещества желтого цвета (58 мг).
1H-ЯМР (CDCl3) δ: 0,74 (3H, т, J=7,4 Гц), 0,81 (3H, т, J=7,4 Гц), 1,3554-1,54 (4H, м), 1,63 (2H, ушир. с), 2,20-2,36 (1H, м), 3,05 (1H, дд, J=5,4, 17,8 Гц), 3,21-3,31 (1H, м), 3,54 (1H, тд, J=5,4, 10,2 Гц), 3,71-3,85 (1H, м), 4,50 (1H, д, J=8,1 Гц), 6,34 (1H, д, J=7,7 Гц), 6,37-6,42 (1H, м), 7,40-7,49 (4H, м), 7,49-7,59 (2H, м), 7,70-7,77 (2H, м), 7,77-7,84 (2H, м).
ESI-MS Обнаружено: m/z 407 (M+H)+
[0163] Пример 17
N-[(1R,2R,6S)-6-амино-4-бензоил-2-(1-этилпропокси)-3-циклогексен-1-ил]-2, 2-диметилпропионамид
[0164]

[0165] Указанное в заголовке бесцветное твердое вещество (95 мг) получали способом, аналогичным описанному в примере 16, используя соединение в соответствии с примером 14 (112 мг) и пивалоилхлорид (46 мкл).
1H-ЯМР (CDCl3) δ: 0,82 (3H, т, J=7,4 Гц), 0,86 (3H, т, J=7,4 Гц), 1,25 (9H, с), 1,35-1,57 (6H, м), 2,13-2,30 (1H, м), 2,98 (1H, дд, J=4,2, 17,2 Гц), 3,17-3,28 (1H, м), 3,39-3,58 (2H, м), 4,38 (1H, д, J=7,0 Гц), 5,78 (1H, д, J=6,2 Гц), 6,32-6,37 (1H, м), 7,38-7,47 (2H, м), 7,49-7,58 (1H, м), 7,67-7,75 (2H, м).
ESI-MS Обнаружено: m/z 387 (M+H)+
[0166] Пример 18
N-[(1S,5R,6R)-6-амино-3-бензоил-5-(1-этилпропокси)-3-циклогексен-1-ил]ацетамид
[0167]

[0168] Соединение по ссылочному примеру 7 (116 мг) растворяли в дихлорметане (4 мл), добавляли по каплям трифторуксусную кислоту (581 мкл) при охлаждении льдом, и реакционную смесь перемешивали в течение 18 часов при комнатной температуре. Реакционный раствор отгоняли один раз при пониженном давлении, к полученному остатку добавляли насыщенный водный раствор гидрокарбоната натрия, и затем экстрагировали хлороформом. Органический слой промывали насыщенным солевым раствором и затем сушили над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (0-10% метанол/хлороформ) с получением указанного в заголовке бесцветного твердого вещества (73 мг).
1H-ЯМР (CDCl3) δ: 0,85 (3H, т, J=7,4 Гц), 0,91 (3H, т, J=7,4 Гц), 1,38-1,65 (6H, м), 2,03 (3H, с), 2,32-2,46 (1H, м), 2,94-3,06 (2H, м), 3,26-3,36 (1H, м), 3,87-3,95 (1H, м), 4,09-4,22 (1H, м), 6,17 (1H, д, J=7,7 Гц), 6,35-6,41 (1H, м), 7,39-7,48 (2H, м), 7,50-7,59 (1H, м), 7,64-7,73 (2H, м).
ESI-MS Обнаружено: m/z 345 (M+H)+
[0169] Пример 19
N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-(гидроксифенилметил)-3-циклогексен-1-ил]ацетамид
[0170]

[0171] Хлорид пентагидрата церия (III) (811 мг) растворяли в этаноле (3 мл), реакционный раствор разбавляли ТГФ (9 мл), добавляли соединение в соответствии с примером 13 (300 мг) и боргидрид натрия (82 мг) при -15°C, и реакционную смесь перемешивали в течение 1,5 часов при той же самой температуре. К реакционному раствору добавляли воду, и реакционную смесь экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия, растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на базовом силикагеле (2-22% метанол/хлороформ) с получением указанного в заголовке бесцветного твердого вещества (80 мг).
1H-ЯМР (CD3OD) δ: 0,84-0,94 (6H, м), 1,41-1,57 (4H, м), 1,72-1,90 (1H, м), 1,99 (3H, с), 2,23 (1H, дд, J=5,5, 16,7 Гц), 2,66-2,81 (1H, м), 3,32-3,41 (1H, м), 3,57-3,70 (1H, м), 3,97 (1H, д, J=8,4 Гц), 5,03-5,08 (1H, м), 5,79-5,83 (1H, м), 7,21-7,38 (5H, м).
ESI-MS Обнаружено: m/z 381 (M+Cl)-
[0172] Пример 20
[(3R,4R,5S)-4-амино-5-азидо-3-(1-этилпропокси)-3-циклогексен-1-ил]тиофен-2-ил-метанон
[0173]

[0174] Указанное в заголовке соединение (301 мг) в виде аморфного вещества желтого цвета получали способом, аналогичным описанному в примере 18, используя соединение по ссылочному примеру 8 (400 мг) и трифторуксусную кислоту (2 мл).
1H-ЯМР (CDCl3) δ: 0,93 (3H, т, J=7,6 Гц), 0,94 (3H, т, J=7,4 Гц), 1,44-1,82 (6H, м), 2,30-2,46 (1H, м), 3,00 (1H, дд, J=8,6, 10,8 Гц), 3,10 (1H, дд, J=4,9, 17,1 Гц), 3,29-3,40 (1H, м), 3,55 (1H, тд, J=5,7, 10,8 Гц), 3,91-4,00 (1H, м), 6,54-6,59 (1H, м), 7,14 (1H, дд, J=3,8, 4,9 Гц), 7,63-7,71 (2H, м).
ESI-MS Обнаружено: m/z 335 (M+H)+
[0175] Пример 21
N-[(1S,5R,6R)-6-амино-5-(1-этилпропокси)-3-(тиофен-2-карбонил)-3-циклогексен-1-ил]ацетамид
[0176]
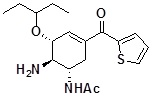
[0177] Указанное в заголовке твердое вещество белого цвета (112 мг) получали способом, аналогичным описанному в примере 18, используя соединение по ссылочному примеру 15 (198 мг) и трифторуксусная кислота (28,4 мкл).
1H-ЯМР (CD3OD) δ: 0,85-0,97 (6H, м), 1,42-1,71 (4H, м), 1,99 (3H, с), 2,17-2,37 (1H, м), 2,70-2,85 (1H, м), 2,85-2,97 (1H, м), 3,36-3,49 (1H, м), 3,97-4,11 (2H, м), 6,54-6,60 (1H, м), 7,15-7,22 (1H, м), 7,71-7,77 (1H, м), 7,83-7,89 (1H, м).
ESI-MS Обнаружено: m/z 351 (M+H)+
[0178] Пример 22
N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-(тиофен-2-карбонил)-3-циклогексен-1-ил]-N-этилацетамид
[0179]

[0180] Указанное в заголовке маслянистое вещество желтого цвета (24 мг) получали способом, аналогичным описанному в примере 15, используя соединение по ссылочному примеру 11 (93 мг).
1H-ЯМР (DMSO-d6) δ: 0,69-0,89 (6H, м), 1,11-1,28 (3H, м), 1,29-1,57 (6H, м), 2,05 (3H, ушир. с), 2,15-2,40 (1H, м), 2,59-2,84 (1H, м), 3,00-3,24 (1H, м), 3,23-3,47 (3H, м), 3,48-3,70 (1H, м), 4,20-4,36 (0,5H, м), 4,76-4,91 (0,5H, м), 6,42-6,54 (1H, м), 7,16-7,26 (1H, м), 7,67-7,78 (1H, м), 7,90-8,02 (1H, м).
ESI-MS Обнаружено: m/z 379 (M+H)+
[0181] Пример 23
N-[(1R,2R,6S)-6-амино-4-этоксиметил-2-(1-этилпропокси)-3-циклогексен-1-ил]ацетамид
[0182]

[0183] Указанное в заголовке твердое вещество желтого цвета (51 мг) получали способом, аналогичным описанному в примере 15, используя соединение по ссылочному примеру 9 (65 мг).
1H-ЯМР (CDCl3) δ: 0,84-0,93 (6H, м), 1,20 (3H, т, J=7,0 Гц), 1,43-1,59 (6H, м), 1,89-2,06 (1H, м), 2,04 (3H, с), 2,42 (1H, дд, J=4,2, 17,2 Гц), 3,09-3,19 (1H, м), 3,25-3,35 (1H, м), 3,46 (2H, q, J=7,0 Гц), 3,57-3,69 (1H, м), 3,86 (2H, с), 3,95-4,04 (1H, м), 5,40-5,50 (1H, м), 5,62-5,69 (1H, м).
ESI-MS Обнаружено: 299 (M+H)+
[0184] Пример 24
N-[(1R,2S,6R)-2-амино-6-(1-этилпропокси)-4-(гидроксифенилметил)циклогексил]ацетамид
[0185]
[0186] Катализатор Адамса (49 мг) добавляли к раствору этанола (6 мл) соединения в соответствии с примером 13 (150 мг) и реакционную смесь перемешивали в течение 1,5 часов при комнатной температуре в токе водорода (1 атм). Реакционный раствор разбавляли этанолом и фильтровали через целит, растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на базовом силикагеле (2-22% метанол/гексан/хлороформ) с получением указанного в заголовке вещества в виде диастереоизомерной смеси (84 мг).
ESI-MS Обнаружено: m/z 349 (M+H)+
[0187] Пример 25
N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-(тиофен-2-карбонил)-3-циклогексен-1-ил]-3-метилбутирамид
[0188]

[0189] Указанное в заголовке твердое вещество желтого цвета (65 мг) получали способом, аналогичным описанному в примере 16, используя соединение в соответствии с примером 20 (135 мг) и изовалерилхлорид (54 мкл).
1H-ЯМР (CDCl3) δ: 0,89 (6H, т, J=7,3 Гц), 1,00 (6H, д, J=6,2 Гц), 1,41-1,56 (4H, м), 1,60 (2H, ушир. с), 2,05-2,33 (4H, м), 2,95 (1H, дд, J=5,3, 17,4 Гц), 3,29-3,39 (2H, м), 3,57-3,69 (1H, м), 4,30 (1H, д, J=8,4 Гц), 5,52 (1H, д, J=7,1 Гц), 6,50-6,56 (1H, м), 7,13 (1H, дд, J=3,9, 4,9 Гц), 7,64-7,70 (2H, м).
ESI-MS Обнаружено: 393 (M+H)+
[0190] Пример 26
[(3R,4R,5S)-5-амино-4-этиламино-3-(1-этилпропокси)циклогексен-1-ил]тиофен-2-ил-метанон
[0191]

[0192] Указанное в заголовке аморфное вещество желтого цвета (23 мг) получали способом, аналогичным описанному в примере 15, используя соединение по ссылочному примеру 10 (90 мг).
1H-ЯМР (CDCl3) δ: 0,92 (3H, т, J=7,6 Гц), 0,93 (3H, т, J=7,6 Гц), 1,14 (3H, т, J=7,1 Гц), 1,44-1,69 (8H, м), 2,13-2,27 (1H, м), 2,56 (1H, дд, J=8,2, 9,8 Гц), 2,66-3,04 (3H, м), 3,26-3,39 (1H, м), 3,97-4,05 (1H, м), 6,55-6,59 (1H, м), 7,12 (1H, дд, J=3,8, 4,9 Гц), 7,63-7,68 (2H, м).
ESI-MS Обнаружено: 337 (M+H)+
[0193] Пример 27
[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-(тиофен-2-карбонил)циклогексен-3-ил]-3-этилмочевина
[0194]

[0195] Указанное в заголовке аморфное вещество желтого цвета (54 мг) получали способом, аналогичным описанному в примере 15, используя соединение по ссылочному примеру 12 (90 мг).
1H-ЯМР (CDCl3) δ: 0,89 (3H, т, J=7,4 Гц), 0,93 (3H, т, J=7,4 Гц), 1,15 (3H, т, J=7,2 Гц), 1,39-1,67 (4H, м), 1,70 (2H, ушир. с), 2,18-2,32 (1H, м), 2,97 (1H, дд, J=5,1, 17,2 Гц), 3,10-3,40 (5H, м), 4,15 (1H, д, J=7,7 Гц), 4,81 (1H, д, J=6,6 Гц), 5,43 (1H, ушир. с), 6,51-6,54 (1H, м), 7,14 (1H, дд, J=4,0, 4,8 Гц), 7,66-7,70 (2H, м).
ESI-MS Обнаружено: 380 (M+H)+
[0196] Пример 28
N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-гептаноил-3-циклогексен-1-ил]ацетамид
[0197]

[0198] Соединение по ссылочному примеру 1 (304 мг) растворяли в ТГФ (4 мл), добавляли по каплям 2,3 моль/л н-гексиллития (раствор гексана) (3,1 мл) с охлаждением при -78°C, и реакционную смесь перемешивали в течение 2 часов при той же самой температуре. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония, температуру смеси повышали до значения комнатной температуры, и затем смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия, растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (20-70% этилацетат/гексан) с получением бесцветной твердой формы трет-бутилового эфира N-[(1R,2R,6S)-6-ацетиламино-5-(1-этилпропокси)-3-гептаноил-3-циклогексен-1-ил]карбаминовой кислоты (154 мг). Полученный трет-бутиловый эфир N-[(1R,2R,6S)-6-ацетиламино-5-(1-этилпропокси)-3-гептаноил-3-циклогексен-1-ил]карбаминовой кислоты (153 мг) растворяли в дихлорметане (9 мл), добавляли трифторуксусную кислоту (756 мкл) и реакционную смесь перемешивали в течение 15 часов при комнатной температуре. Реакционный раствор отгоняли один раз при пониженном давлении, к полученному остатку добавляли насыщенный водный раствор гидрокарбоната натрия, и затем экстрагировали хлороформом. Органический слой промывали насыщенным солевым раствором и затем сушили над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (9-33% метанол/хлороформ) с получением указанного в заголовке твердого вещества светло-желтого цвета (55 мг).
1H-ЯМР (CDCl3) δ: 0,81-1,00 (9H, м), 1,20-1,37 (8H, м), 1,45-1,71 (4H, м), 1,96-2,11 (1H, м), 2,05 (3H, с), 2,58-2,68 (2H, м), 2,79 (1H, дд, J=5,1, 17,7 Гц), 3,18-3,30 (1H, м), 3,30-3,41 (1H, м), 3,41-3,54 (1H, м), 4,29 (1H, д, J=8,6 Гц), 5,65 (1H, д, J=7,9 Гц), 6,62 (1H, м).
ESI-MS Обнаружено: 425 (M+H)+
[0199] Пример 29
N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-(тиофен-3-карбонил)-3-циклогексен-1-ил]ацетамид
[0200]
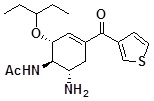
[0201] Соединение по ссылочному примеру 1 (300 мг) растворяли в ТГФ (2 мл), около 0,3 моль/л 3-тиенил магний иодид (раствор ТГФ) (11,6 мл) добавляли по каплям с охлаждением при -5°C, и реакционную смесь перемешивали в течение 1 часа при той же самой температуре. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония, температуру смеси повышали до значения комнатной температуры, и затем смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (30-80% этилацетат/гексан) с получением желтого цвета твердой формы трет-бутилового эфира N-[(1S,5R,6R)-6-ацетиламино-5-(1-этилпропокси)-3-(тиофен-3-карбонил)-3-циклогексен-1-ил]карбаминовой кислоты (90 мг).
Полученный трет-бутиловый эфир N-[(1S,5R,6R)-6-ацетиламино-5-(1-этилпропокси)-3-(тиофен-3-карбонил)-3-циклогексен-1-ил]карбаминовой кислоты (90 мг) растворяли в дихлорметане (5 мл), добавляли по каплям трифторуксусную кислоту (445 мкл), и реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционный раствор отгоняли один раз при пониженном давлении, к полученному остатку добавляли насыщенный водный раствор гидрокарбоната натрия, и реакционную смесь экстрагировали смешанным растворителем, полученным путем добавления небольшого количества метанола в хлороформ. Органический слой промывали насыщенным солевым раствором и затем сушили над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (9-33% метанол/хлороформ) с получением указанного в заголовке твердого вещества светло-желтого цвета (55 мг).
1H-ЯМР (CDCl3) δ: 0,88 (3H, т, J=7,3 Гц), 0,90 (3H, т, J=7,3 Гц), 1,40-1,66 (6H, м), 2,07 (3H, с), 2,13-2,30 (1H, м), 2,98 (1H, дд, J=5,0, 18,3 Гц), 3,23-3,41 (2H, м), 3,60 (1H, дд, J=8,6, 18,3 Гц), 4,28 (1H, д, J=9,7 Гц), 5,58 (1H, д, J=6,2 Гц), 6,51-6,44 (1H, м), 7,34 (1H, дд, J=2,8, 5,0 Гц), 7,48 (1H, д, J=5,0 Гц), 7,88-7,93 (1H, м).
ESI-MS Обнаружено: m/z 351 (M+H)+
[0202] Пример 30
N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-(5-метокситиофен-2-карбонил)-3-циклогексен-1-ил]ацетамид гидрохлорид
[0203]
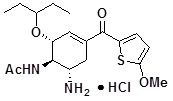
[0204] Коричневая твердая форма трет-бутилового эфира N-[(1S,5R,6R)-6-ацетиламино-5-(1-этилпропокси)-3-(5-метокситиофен-2-карбонил)-3-циклогексен-1-ил]карбаминовой кислоты (366 мг) получали способом, аналогичным описанному в примере 3, используя соединение по ссылочному примеру 1 (500 мг), 2-метокситиофен (801 мг) и 2,65 моль/л н-бутиллития (раствор гексана) (5,85 ммоль).
Полученный трет-бутиловый эфир N-[(1S,5R,6R)-6-ацетиламино-5-(1-этилпропокси)-3-(5-метокситиофен-2-карбонил)-3-циклогексен-1-ил]карбаминовой кислоты (316 мг) растворяли в 2-пропаноле (2 мл), добавляли концентрированную соляную кислоту (48 мг), реакционную смесь нагревали в течение 3 часов при 80°C. После охлаждения до комнатной температуры смесь разбавляли этилацетатом (2 мл) и осажденные кристаллы собирали фильтрацией с получением указанного в заголовке твердого вещества коричневого цвета (244 мг).
1H-ЯМР (CD3OD) δ: 0,90 (3H, т, J=7,4 Гц), 0,91 (3H, т, J=7,4 Гц), 1,47-1,61 (4H, м), 2,05 (3H, с), 2,45-2,58 (1H, м), 2,98 (1H, дд, J=5,5, 17,2 Гц), 3,40-3,50 (1H, м), 3,58 (1H, дт, J=5,1, 16,6 Гц), 4,00 (3H, с), 4,01-4,10 (1H, с), 4,31 (1H, д, J=8,6 Гц), 6,42 (1H, д, J=4,4 Гц), 6,45-6,49 (1H, м), 7,59 (1H, д, J=4,4 Гц).
ESI-MS Обнаружено: m/z 381 (M+H)+
[0205] Пример 31
N-[(1R,2R,6S)-6-амино-4-циклогексанкарбонил-2-(1-этилпропокси)-3-циклогексен-1-ил]ацетамид гидрохлорид
[0206]

[0207] Соединение по ссылочному примеру 14 (300 мг) растворяли в ТГФ (8 мл), 2,0 моль/л хлорида циклогексилмагния (раствор диэтилового эфира) (1,63 ммоль) добавляли по каплям при охлаждении льдом, и реакционную смесь перемешивали в течение 2 часов при комнатной температуре. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония и затем экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия, растворитель отгоняли при пониженном давлении. Полученный остаток (351 мг) растворяли в дихлорметане (7 мл), добавляли периодинан Десса-Мартина (656 мг), и реакционную смесь перемешивали в течение 2,5 часов при комнатной температуре. К реакционному раствору добавляли насыщенный водный раствор гидрокарбоната натрия и водный раствор тиосульфата натрия и затем экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия, растворитель отгоняли при пониженном давлении. Полученный остаток (316 мг) растворяли в 2-пропаноле (2 мл), добавляли концентрированную соляную кислоту (51 мг), реакционную смесь нагревали в течение 24 часов при 40°C. После охлаждения до комнатной температуры смесь разбавляли этилацетатом (2 мл) и осажденные кристаллы собирали фильтрованием с получением указанного в заголовке твердого вещества коричневого цвета (85 мг).
1H-ЯМР (CD3OD) δ: 0,90 (3H, т, J=7,4 Гц), 0,95 (3H, т, J=7,4 Гц), 1,17-1,47 (6H, м), 1,47-1,62 (4H, м), 1,66-1,84 (4H, м), 2,03 (3H, с), 2,17-2,33 (1H, м), 2,92 (1H, дд, J=5,2, 17,3 Гц), 3,02-3,17 (1H, м), 3,40-3,55 (2H, м), 3,88-4,00 (1H, м), 4,31 (1H, д, J=8,4 Гц), 6,81-6,85 (1H, м), 8,28 (1H, д, J=8,6 Гц).
ESI-MS Обнаружено: m/z 351 (M+H)+
[0208] Пример 32
N-[(1R,2R,6S)-6-амино-2-(1-этилпропокси)-4-(гидрокситиофен-2-ил-метил)-3-циклогексен-1-ил]ацетамид
[0209]

[0210] Указанное в заголовке бесцветное твердое вещество (70 мг) получали в виде диастереоизомерной смеси способом, аналогичным описанному в примере 19, используя соединение в соответствии с примером 1 (300 мг).
1H-ЯМР (CDCl3) δ: 0,85-0,95 (6H, м), 1,41-1,44 (2H, м), 1,45-1,56 (5H, м), 1,89-2,01 (1H, м), 2,03 (1,5H, с), 2,07 (1,5H, с), 2,10-2,36 (1H, м), 2,95 (0,5H, дд, J=5,0, 18,1 Гц), 3,04-3,16 (0,5H, м), 3,26-3,39 (1,5H, м), 3,54-3,67 (1H, м), 4,06 (0,5H, д, J=7,3 Гц), 4,29 (0,5H, д, J=8,1 Гц), 5,32-5,37 (0,5H, м), 5,47 (0,5H, д, J=7,9 Гц), 5,57 (0,5H, д, J=8,2 Гц), 5,85-5,95 (0,5H, м), 6,49-6,54 (0,5H, м), 6,92-7,01 (1,5H, м), 7,10-7,17 (0,5H, м), 7,63-7,71 (1H, м).
ESI-MS Обнаружено: m/z 353 (M+H)+
[0211] Пример 33
N-[(1R,2S,4S,6S)-2-амино-6-(1-этилпропокси)-4-(тиофен-2-карбонил)циклогексил]ацетамид; и
N-[(1R,2S,4R,6S)-2-амино-6-(1-этилпропокси)-4-(тиофен-2-карбонил)циклогексил]ацетамид
[0212]

[0213] Соединение в соответствии с примером 1 (500 мг) растворяли в этаноле (5 мл), добавляли 5% палладий на угле (содержащий 55% воды) (347 мг) и реакционную смесь перемешивали при комнатной температуре в атмосфере водорода. Нерастворимое вещество фильтровали через целит, и затем реакционный растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на базовом силикагеле (2-22% метанол/хлороформ) с получением высокополярного диастереомера 1 (189 мг) и низкополярного диастереомера 2 (211 мг) указанного в заголовке соединения.
(Диастереомер 1):1H-ЯМР (CDCl3) δ: 0,88 (3H, т, J=7,4 Гц), 0,90 (3H, т, J=7,4 Гц), 1,41-1,67 (6H, м), 1,69-1,87 (2H, м), 2,02 (3H, с), 2,05-2,19 (2H, м), 2,81-2,91 (1H, м), 3,21-3,33 (1H, м), 3,68-3,87 (3H, м), 5,39-5,49 (1H, м), 7,15 (1H, дд, J=4,8, 3,2 Гц), 7,66 (1H, д, J=4,8 Гц), 7,74 (1H, д, J=3,2 Гц).
ESI-MS Обнаружено: m/z 353 (M+H)+
(Диастереомер 2):1H-ЯМР (CDCl3) δ: 0,85 (3H, т, J=7,6 Гц), 0,87 (3H, т, J=7,6 Гц), 1,33-1,70 (8H, м), 2,05 (3H, с), 2,09-2,30 (2H, м), 3,05-3,31 (4H, м), 3,59-3,72 (1H, м), 5,51 (1H, д, J=7,1 Гц), 7,16 (1H, дд, J=3,8, 4,9 Гц), 7,67 (1H, дд, J=1,0, 4,9 Гц), 7,73 (1H, дд, J=1,0, 3,8 Гц).
ESI-MS Обнаружено: m/z 353 (M+H)+
[0214] Пример исследования 1
Эффект подавления фибрилляции предсердий может быть подтвержден путем оценки эффекта удлинения эффективного рефрактерного периода предсердия (AERP) при введении соединения в модель электростимуляции предсердия животного в соответствии с патентным документом 1. Для репрезентативных соединений по настоящему изобретению эффект удлинения AERP оценивали с использованием крыс посредством приведенного ниже примера исследований.
Самцов крыс линии SD подвергали внутрибрюшинной анестезии с помощью раствора пентобарбитала натрия (50 мг/кг). Катетер вводили в артерию нижней правой конечности и артериальное давление измеряли с использованием датчика блока усиления через преобразователь давления. Кроме того, измеряли электрокардиограмму (отведение II) в блоке усиления биоэлектрического сигнала с помощью электродов, закрепленных на четырех лапах, через предварительный усилитель для электрокардиограммы и вычисляли частоту сердечных сокращений по зубцам электрокардиограммы с помощью блока измерения мгновенного значения. Кровяное давление, сердечный ритм и электрокардиограмму направляли в HEM и регистрировали. Затем иссекали фаренгиальный сегмент и осуществляли катеризацию трахеи, и потом осуществляли искусственную вентиляцию легких с использованием аппарата искусственной вентиляции легких внутренним воздухом помещения с суммарным объемом 10 мл/кг и частотой 60 раз/мин. Кроме того, MAP-регистрирующий и стимулирующий катетер для мелких животных вводили в правое предсердие через шейную вену и получали MAP электрокардиограмму для исследования предсердий. Измеряли пороговое значение возбуждения предсердий в ответ на электростимуляцию при электростимуляции, применяемой при базовом цикле 120 мс и длительности 6 мс, с использованием электрода катетера, введенного в предсердие, и измеряли эффективный рефрактерный период предсердия (AERP) при применении стимуляция в два раза превышающей пороговое значение (около 1,0 в) (базовый цикл: 120 мс, длительность: 6 мс, количество раз стимуляции: 10 раз). В данном случае осуществляли дополнительную анестезию пентобарбиталом, по мере необходимости, с проверкой глубины анестезии с целью облегчения степени боли у животного, таким образом, чтобы поддерживать состояние глубокой анестезии.
При оценке лекарственных средств, введения препарата осуществляли в дозе 10 мг/кг/10 мин, а затем оценивали изменения частоты сердечных сокращений (HR), среднее артериальное давление (МВР) и AERP с интервалом 5 минут. Оценку осуществляли для трех примеров для каждой группы.
[0215] Результаты указанных исследований приведены в таблице 1.
[0216]
[0217] Как представлено в таблице 1, было обнаружено, что соединение по настоящему изобретению обладает аналогичным, или более высоким, осельтамивиру уровнем эффекта удлинения AERP, и обладает значительным эффектом подавления фибрилляции предсердий.
Кроме того, когда, на основании метода Sugiyama и другие (Journal of Pharmacological Sciences, 2005, Vol. 98, p. 315-318), электрод-катетер дополнительно вводили в модель для исследования из пищевода и применяли высокочастотную электростимуляцию к предсердию, направленную на вызывание фибрилляции предсердий, соединение по настоящему изобретению подавляло фибрилляцию предсердий.
[0218] Пример исследования 2
Исследовали ингибирующее действие репрезентативных соединений по настоящему изобретению в отношении нейраминидазы (H1N1) посредством следующего примера исследования.
Для исследования использовали набор EnzyChrom Neuraminidase Assay Kit (BioAssay Systems) и Recombinant Influenza A Virus H1N1 Neuraminidase (R&D Systems).
Для осуществления измерения, для каждого образца реакции, смешивали 30 мкл аналитического буфера, 55 мкл субстрата, 1 мкл кофакторов, 1 мкл фермента, 0,5 мкл красителя и 15 нг нейраминидазы, и в 96-луночный титрационный микропланшет вводили 80 мкл смешанной жидкости и 20 мкл раствора исследуемого вещества для измерения и перемешивали. Планшеты оставляли отстаиваться в течение 50 минут при 37°C, защищая от света, и измеряли оптическую плотность при 570 нм с помощью абсорбциометра (VersaMax, Molecular Divices).
В данном случае, контрольную группу, не содержащую исследуемое вещество, определяли в качестве группы с высоким контролем (HC), и контрольную группу, не содержащую нейраминидазу, определяли в качестве группы с низким контролем (LC).
[0219] Исследуемое вещество получали в виде раствора ДМСО, имеющего концентрацию, равную 1000-кратной концентрации измерения, разводили 1000-кратно чистой водой на момент измерения и указанный раствор использовали в качестве раствора исследуемого вещества для проведения измерений.
[0220] Вычисляли степень ингибирования нейраминидазы (%) в соответствии со следующим уравнением.
[0221] Степень ингибирования (%) = 100 - 100 * (OD (соединение) - OD (LC))/(OD (НС) - OD (LC))
OD (HC): оптическая плотность в группе с высоким контролем (OD 570 нм)
OD (LC): оптическая плотность в группе с низким контролем (OD 570 нм)
[0222] Кроме того, выполняли определение активности ингибирования каждого из исследуемых соединений при концентрациях 0,001 нМ, 0,01 нМ, 0,1 нМ, 1,10 нМ, 100 нМ и 1000 нМ, и вычисляли значение IC50 с использованием формулы аппроксимации кривой AssayExplorer (Symyx Technologies, Inc.) (Model 08: сигмоидальная кривая ингибирования).
[0223] Результаты этих исследований представлены в таблице 2.
[0224]
[0225] Из таблицы 2 следует, что соединение по настоящему изобретению практически не демонстрируют эффект ингибирования нейраминидазы и не обладает противовирусным действием.
Реферат
Изобретение относится к соединению, представленному следующей общей формулой (I), или к его фармацевтически приемлемой соли, которые могут быть использованы для лечения аритмии, к лекарственному средству и к фармацевтической композиции, содержащим заявленное соединение или его фармацевтически приемлемую соль, а также к применению заявленного соединения или его фармацевтически приемлемой соли.(I)В формуле (I) пунктирная линия обозначает одинарную связь или двойную связь, Q представляет собой атом кислорода, атом серы или NR, а R-Rимеют значения, указанные в формуле изобретения. 4 н. и 6 з.п. ф-лы, 2 табл., 50 пр.
Формула


Документы, цитированные в отчёте о поиске
Замещенные 2-аминоциклоалканкарбоксамиды и их применение в качестве ингибиторов цистеиновой протеазы

Комментарии